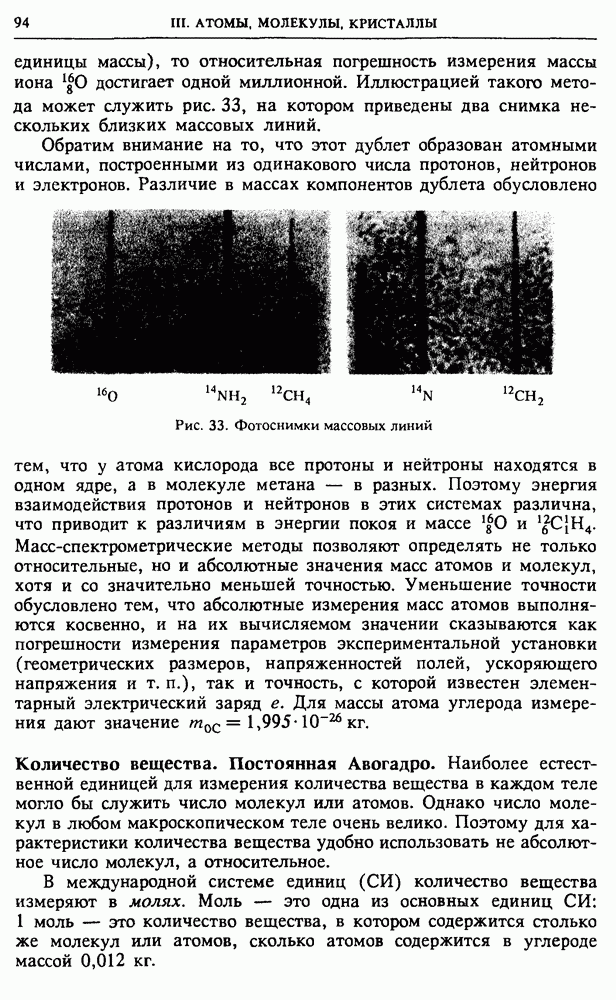
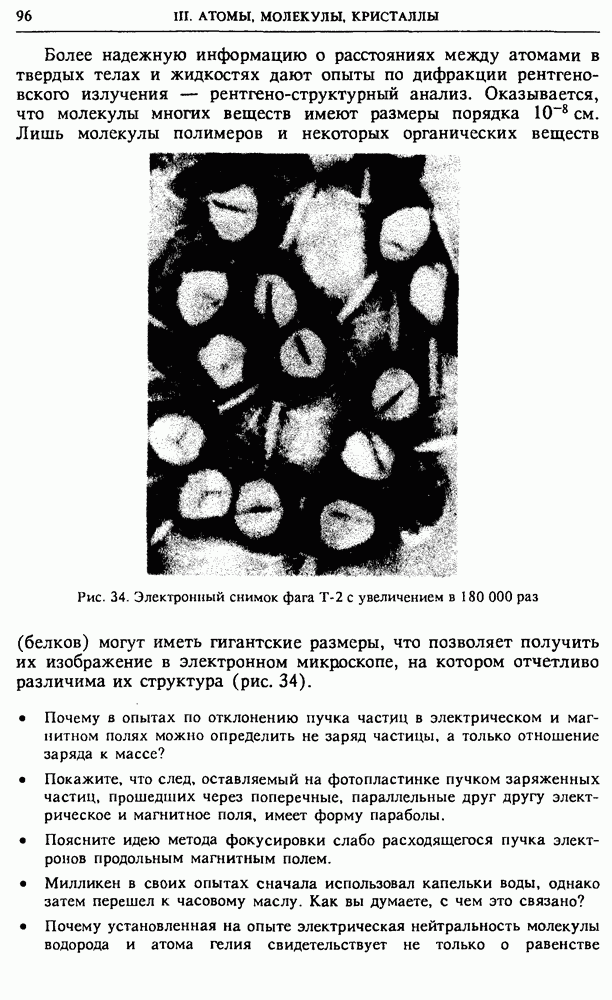
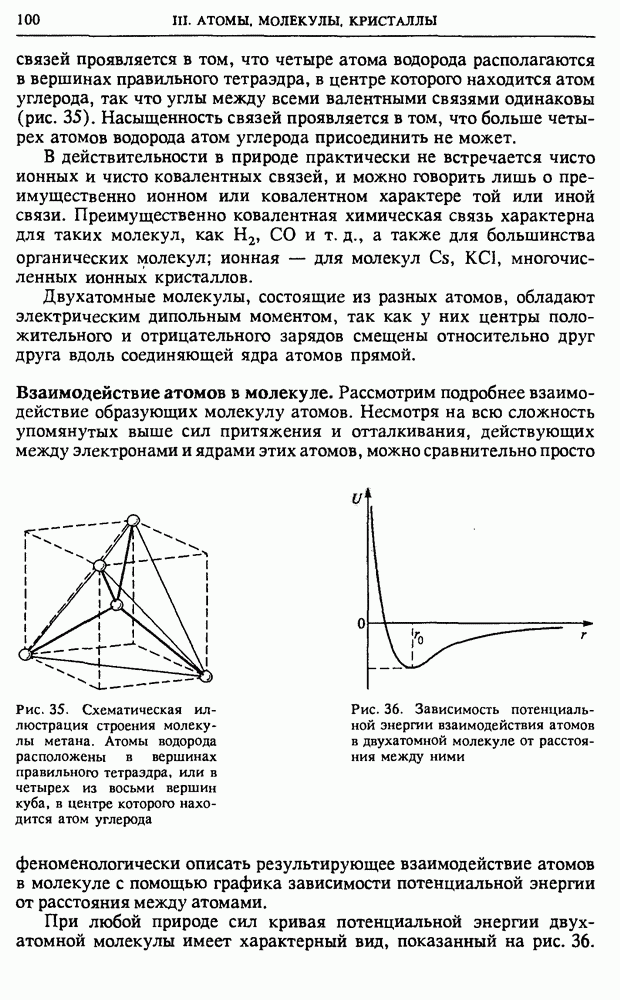
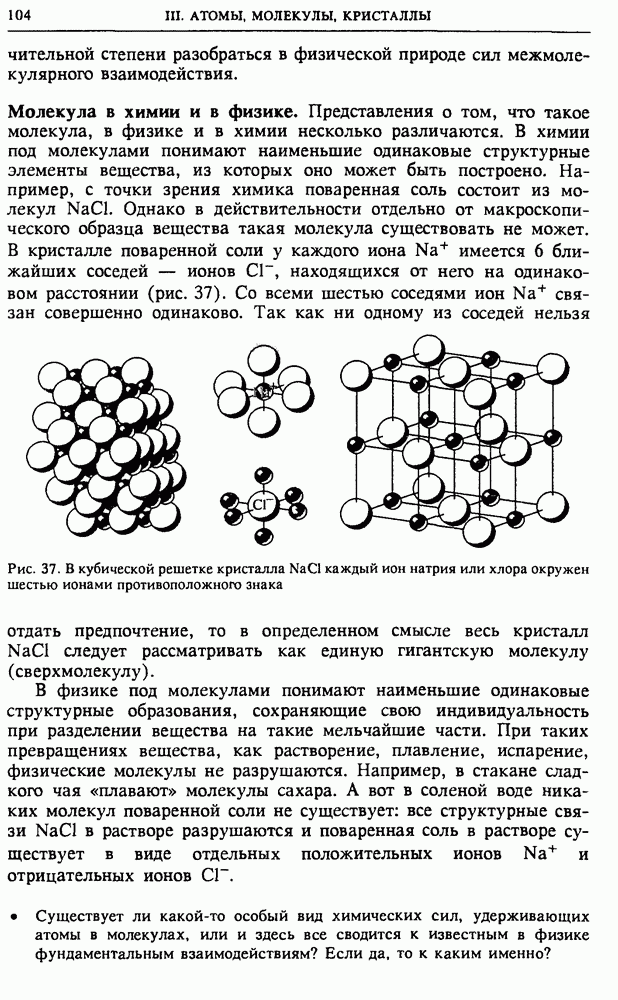
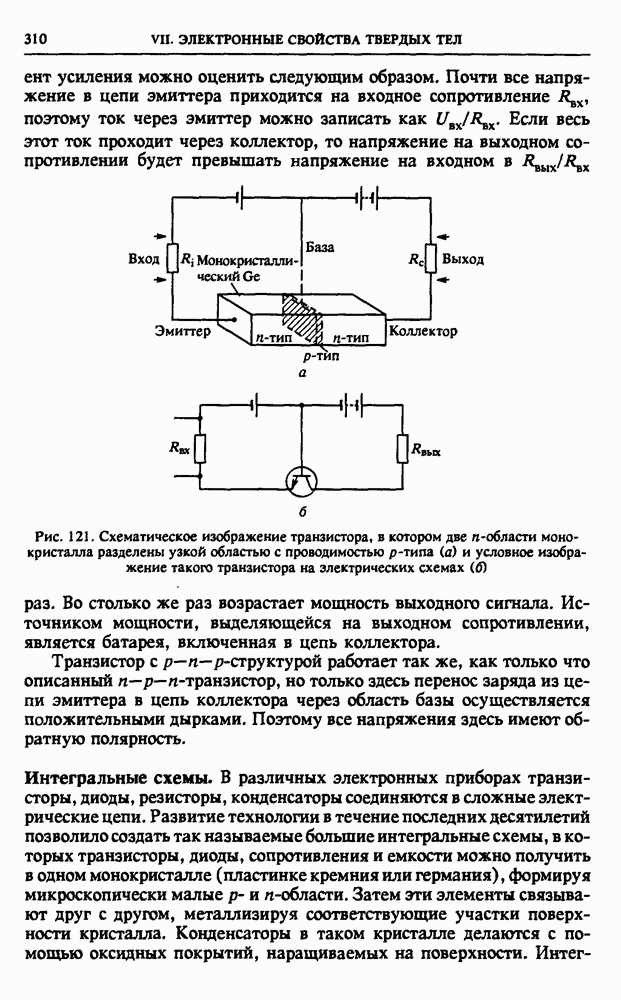
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 24. Статистическая природа необратимости тепловых процессов
Термодинамический подход не позволяет вскрыть внутреннюю природу необратимости реальных процессов в макроскопических системах. Опираясь на эксперимент, он только фиксирует факт необратимости (второй закон термодинамики). Молекулярно-кинетический подход позволяет проанализировать причины такой необратимости реальных процессов и определенной направленности энергетических превращений в природе.
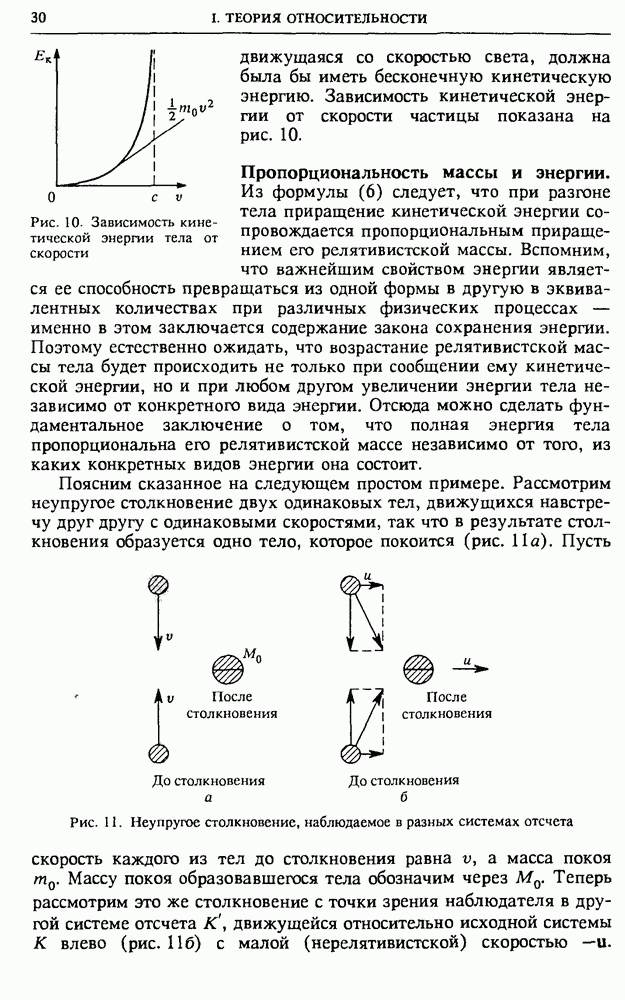
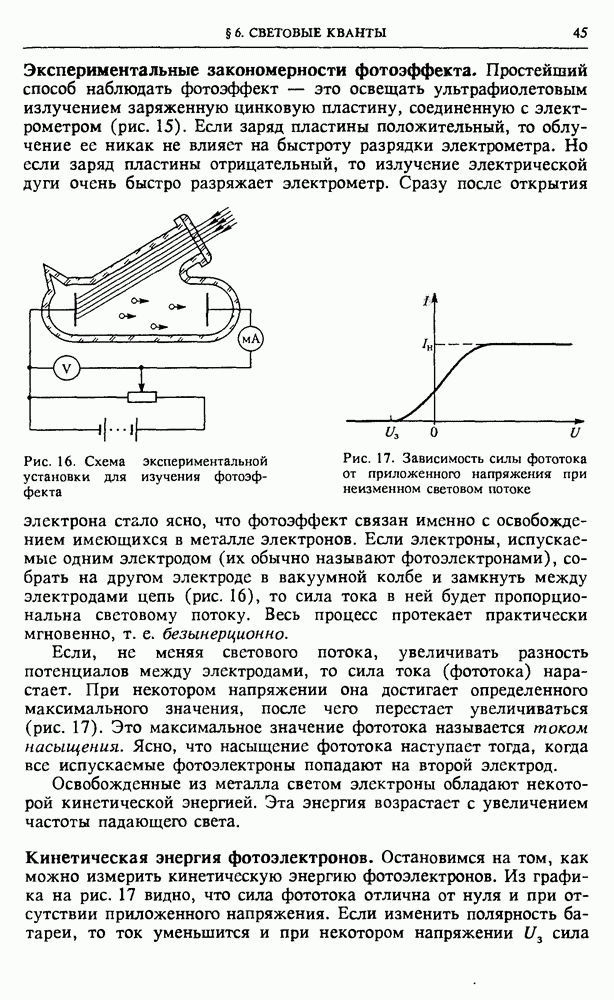
Гипотетический вечный двигатель. Рассмотрим с точки зрения молекулярно-кинетической теории модель гипотетического «вечного» двигателя второго рода, изображенную на рис. 79. Предположим, что этот вечный двигатель работает следующим образом: газ самопроизвольно собирается в левой половине цилиндра, после чего поршень подвигают вплотную к газу. При таком перемещении внешние силы работы не совершают, так как собравшийся в левой половине газ не оказывает давления на поршень. Затем подводим к газу теплоту и заставляем его изотермически расширяться до
прежнего объема. При этом газ совершает работу за счет подводимой теплоты. После того как поршень перейдет в крайнее правое положение, будем ждать, пока газ снова не соберется самопроизвольно в левой половине сосуда, и затем повторяем все снова. В результате получилась периодически действующая машина, которая совершает работу только за счет получения теплоты от окружающей среды.

Рис. 79. Один из вариантов «вечного» двигателя второго рода
Молекулярно-кинетическая теория позволяет сразу объяснить, почему такое устройство не будет работать. Как мы видели, вероятность того, что газ, содержащий большое число молекул, хотя бы один раз самопроизвольно соберется в одной половине сосуда, ничтожно мала. И уж совершенно невозможно себе представить, чтобы это могло повторяться раз за разом по мере работы машины.
О необратимых процессах. Теперь можно указать, какой смысл вкладывается в понятие необратимого процесса: процесс является необратимым, если обратный процесс в действительности почти никогда не происходит. Строгого запрета для такого процесса нет — он просто слишком маловероятен, чтобы его можно было наблюдать на опыте. Так, рассмотренный пример вечного двигателя второго рода основывался на предположении о возможности самопроизвольного сосредоточения газа в одной половине сосуда. Такой процесс является обратным для процесса расширения газа в пустоту. Расширение газа в пустоту представляет собой один из наиболее ярких примеров необратимых процессов — обратный процесс в макроскопической системе никогда не наблюдался.
Таким образом, с точки зрения представлений статистической механики второй закон термодинамики утверждает, что в природе в макроскопических системах процессы развиваются в таком направлении, когда менее вероятные состояния системы заменяются на более вероятные. Такая интерпретация второго закона термодинамики была впервые предложена Больцманом.
При рассмотрении флуктуаций плотности идеального газа было выяснено, что состояния газа, при которых распределение молекул близко к равномерному, встречаются гораздо чаще, чем далекие от равновесия состояния с сильно неравномерным распределением молекул. Другими словами, состояния с неравномерным распределением молекул по объему, при которых число молекул в правой и левой половинах сосуда сильно различаются, имеют гораздо меньшую вероятность, чем состояния с почти равномерным распределением, близким к равновесному. Итак, необратимый процесс приближения
к равновесию — это переход к наиболее вероятному макроскопическому состоянию.
Необратимые процессы и разрушение порядка. Сказанное выше о природе необратимости реальных процессов можно сформулировать и несколько иначе. Можно сказать, что необратимый переход к равновесию — это переход от в сильной степени упорядоченных неравновесных состояний к менее упорядоченным, хаотическим состояниям.
При расширении газа в пустоту начальное состояние, когда газ занимает часть предоставленного ему объема, является в значительной мере упорядоченным, в то время как конечное состояние теплового равновесия, когда газ равномерно распределен по всему объему сосуда, является совершенно неупорядоченным.
Другой пример — направленный пучок молекул газа, входящий в откачанный сосуд. Установление равновесного максвелловского распределения молекул по скоростям представляет собой необратимый процесс перехода системы из упорядоченного состояния, когда все молекулы имеют почти одинаковые по модулю и направлению скорости, в конечное состояние, характеризующееся полной хаотичностью движения молекул.
С этой точки зрения легко понять устанавливаемую вторым законом термодинамики определенную направленность энергетических превращений в замкнутой системе. Когда тело получает некоторое количество теплоты за счет совершения механической работы, то это означает необратимое превращение кинетической энергии упорядоченного макроскопического движения в кинетическую энергию хаотического движения молекул. Превращение теплоты в работу, наоборот, означает превращение энергии беспорядочного движения молекул в энергию упорядоченного движения макроскопического тела — такой самопроизвольный переход, как мы видели, в принципе возможен, но исключительно маловероятен.
Флуктуации как отклонения от второго закона термодинамики. Необратимый характер процессов перехода в состояние теплового равновесия, устанавливаемый вторым законом термодинамики, справедлив только для больших макроскопических систем. С термодинамической точки зрения изолированная система, пришедшая в состояние теплового равновесия, не может самопроизвольно выйти из этого состояния. Однако статистическая механика допускает существование флуктуаций, которые фактически представляют собой самопроизвольные отклонения системы от равновесия.
Как уже отмечалось, чем больше частиц в системе, тем меньше относительная величина флуктуаций любого макроскопического параметра, и для достаточно большой системы флуктуациями вообще можно пренебречь. Именно поэтому для таких систем справедлив второй закон термодинамики, в котором утверждается возрастание
энтропии в замкнутых системах. При статистическом определении энтропии второй закон утрачивает абсолютный характер и превращается в статистический закон: за каким-либо заданным состоянием замкнутой системы будут следовать состояния, более вероятные если не с необходимостью, то в подавляющем большинстве случаев.
В системах с небольшим числом частиц относительная величина флуктуаций велика, т. е. самопроизвольные отклонения какой-либо величины от ее среднего значения могут быть сравнимы с самим средним значением. Такая система часто самопроизвольно выходит из состояния равновесия, и второй закон термодинамики здесь неприменим. Характерный пример нарушения второго закона термодинамики в достаточно малых системах — броуновское движение, при котором взвешенная в жидкости макроскопическая частица получает кинетическую энергию от молекул окружающей среды, хотя температура среды не выше, чем температура самой броуновской частицы.
• Как статистическая механика объясняет необратимость реальных тепловых процессов?
• Приведите примеры явлений, в которых наблюдается самопроизвольный выход системы из состояния термодинамического равновесия.
• Почему упорядоченные состояния характеризуются меньшей вероятностью по сравнению с неупорядоченными?
Статистическая гипотеза. Неизбежность тепловых процессов в природе приводит к тому, что статистическая механика систем многих частиц не исчерпывается законами обычной механики (хотя и опирается на них), а требует обязательного введения дополнительной статистической гипотезы в той или иной форме, например в виде предположения о равной вероятности различных микросостояний замкнутой системы.
Но в тех случаях, когда тепловые процессы оказываются несущественными, определенную информацию о свойствах термодинамической системы можно получить, опираясь только на механические представления. Тепловые процессы практически отсутствуют в условиях тепловой изоляции при наличии механического равновесия. В этих случаях протекающие явления обратимы и можно использовать модель адиабатического процесса.
Покажем, например, как можно получить уравнение адиабаты для одноатомного идеального газа, основываясь на существовании адиабатических инвариантов в механических системах. Напомним (см. кн. 1), что адиабатическим инвариантом называется характеризующая механическую систему величина, сохраняющаяся при медленном изменении внешних параметров. В частности, для шарика, упруго отражающегося от двух параллельных стенок, которые медленно сближаются или раздвигаются, адиабатическим инвариантом является произведение расстояния между стенками на модуль скорости шарика.
В механической модели идеального газа как совокупности одноатомных молекул, упруго отражающихся от стенок сферического сосуда, адиабатическим инвариантом при медленном изменении объема V сосуда будет произведение характерного линейного размера (радиуса)  сосуда на модуль
сосуда на модуль  скорости молекулы. В отсутствие теплообмена такая механическая модель адекватно описывает реальный адиабатический процесс сжатия или расширения. При этом сохраняет свой смысл и указанный адиабатический инвариант:
скорости молекулы. В отсутствие теплообмена такая механическая модель адекватно описывает реальный адиабатический процесс сжатия или расширения. При этом сохраняет свой смысл и указанный адиабатический инвариант:  Поскольку радиус
Поскольку радиус  пропорционален
пропорционален  а модуль скорости
а модуль скорости  пропорционален
пропорционален  то
то

или

Легко видеть, что это совпадает с полученным выше уравнением адиабаты в переменных Т и V для одноатомного идеального газа, поскольку в этом случае 
• При каких условиях к системам из большого числа частиц применимы чисто механические представления, не опирающиеся на статистическую гипотезу?
• Получите уравнение адиабаты идеального газа, рассматривая сосуд цилиндрической формы, объем которого изменяется при медленном перемещении поршня.
| << Предыдущий параграф | Следующий параграф >> |
- I. ТЕОРИЯ ОТНОСИТЕЛЬНОСТИ
- § 2. Релятивистская кинематика
- § 3. Преобразования Лоренца
- § 4. Релятивистская динамика
- § 5. Примеры релятивистского движения частиц
- II. ЗАКОНЫ МИКРОМИРА. ЧАСТИЦЫ И ВОЛНЫ
- § 6. Световые кванты
- § 7. Границы применимости классической физики
- § 8. Свет — частицы или волны?
- § 9. Законы движения в квантовой физике
- III. АТОМЫ, МОЛЕКУЛЫ, КРИСТАЛЛЫ
- § 10. Строение атома
- § 11. Измерения в атомной физике
- § 12. Молекулы
- § 13. Кристаллы
- IV. ОСНОВЫ ТЕРМОДИНАМИКИ
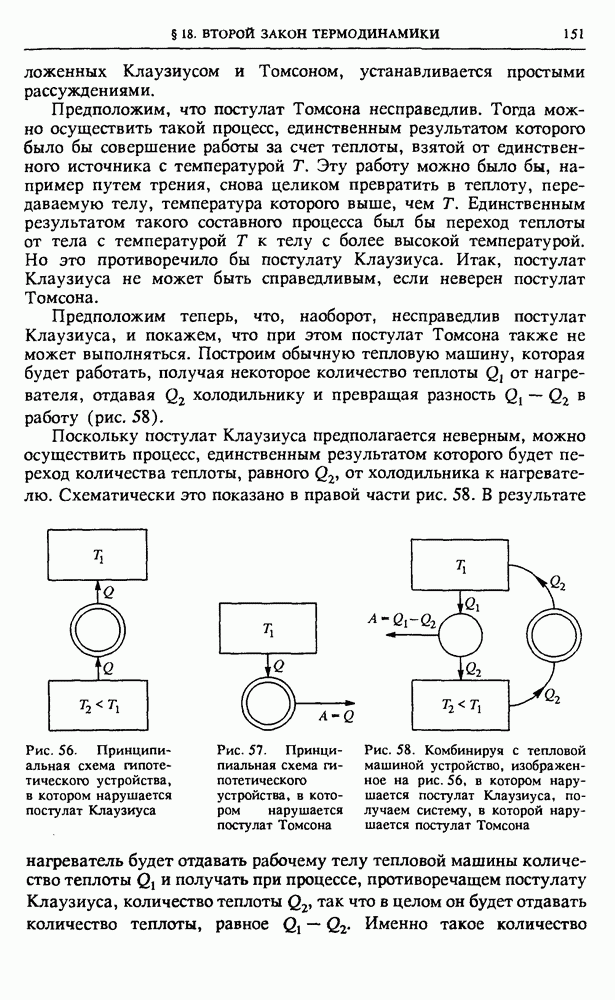
- § 14. Основные понятия термодинамики
- § 15. Уравнение состояния газа
- § 16. Первый закон термодинамики
- § 17. Примеры применения первого закона термодинамики
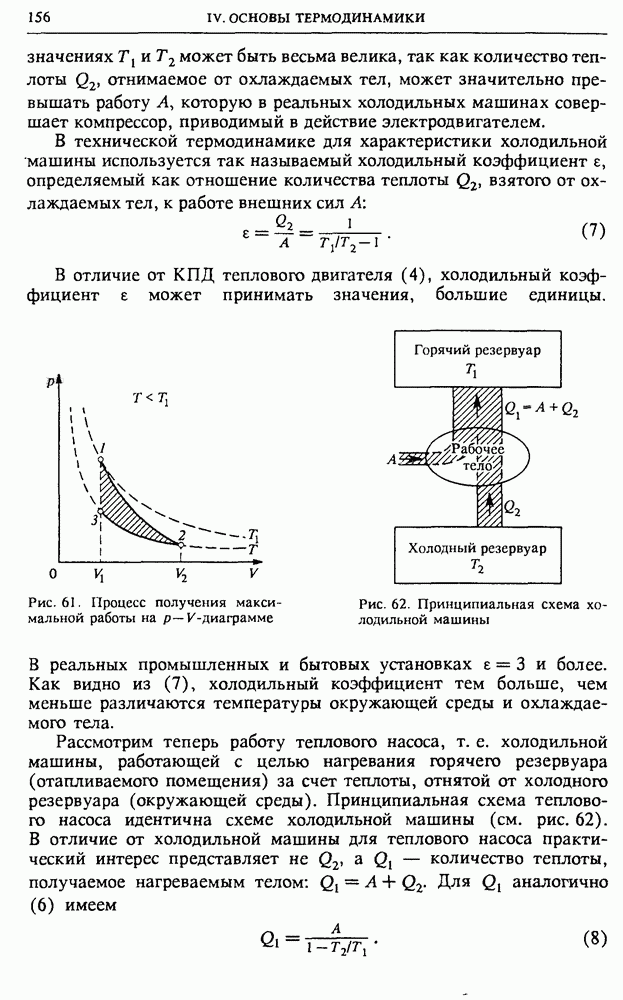
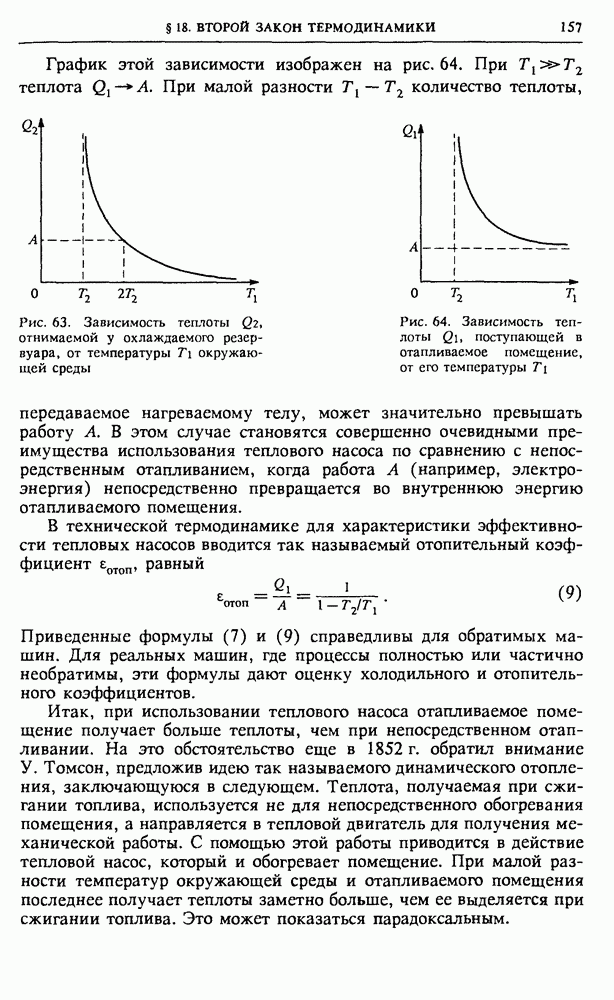
- § 18. Второй закон термодинамики
- § 19. Методы термодинамики и их применения
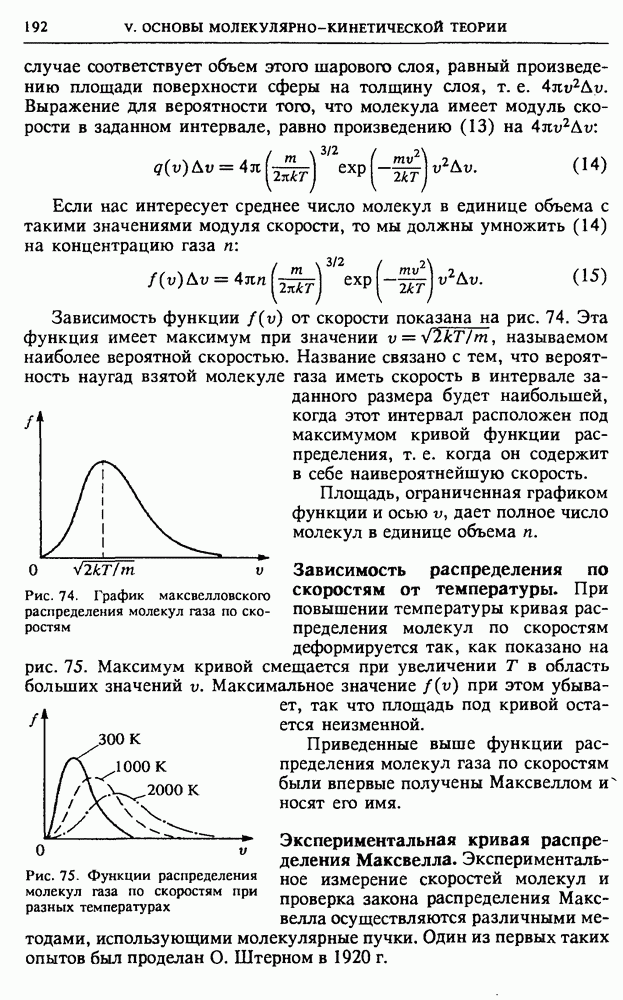
- V. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
- § 20. Экспериментальные основания статистической механики
- § 21. Молекулярно-кинетическая теория идеального газа
- § 22. Статистические распределения
- § 23. Тепловое равновесие в статистической механике
- § 24. Статистическая природа необратимости тепловых процессов
- § 25. Газы, жидкости, фазовые переходы
- § 26. Реальные газы. Уравнение Ван-дер-Ваальса
- § 27. Фазовые переходы
- VI. АТОМЫ И ИЗЛУЧЕНИЕ
- § 28. Излучение света атомами
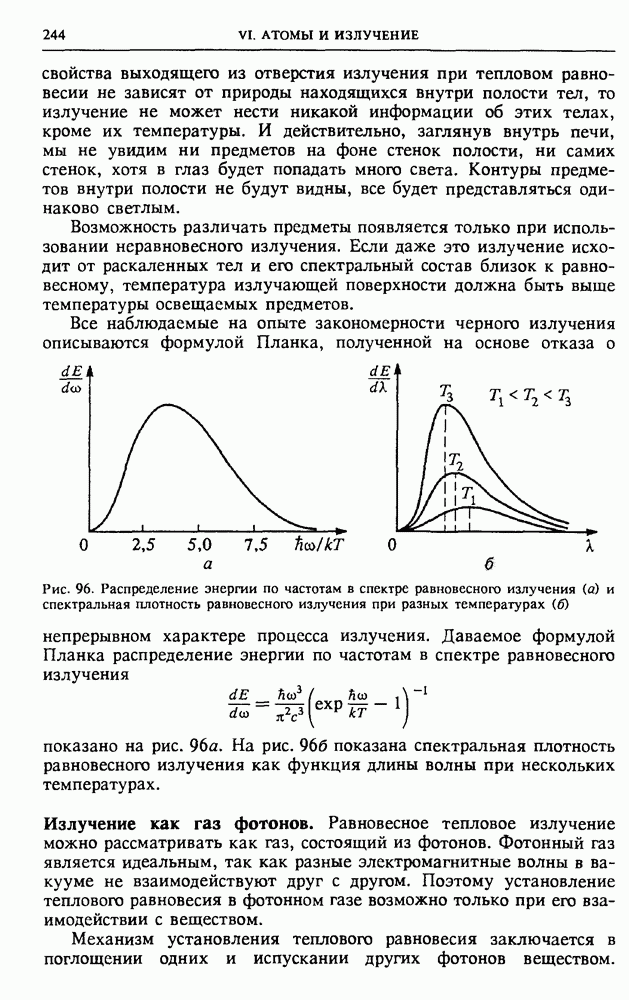
- § 29. Излучение света нагретыми телами
- § 30. Вынужденное излучение. Квантовые усилители и генераторы света
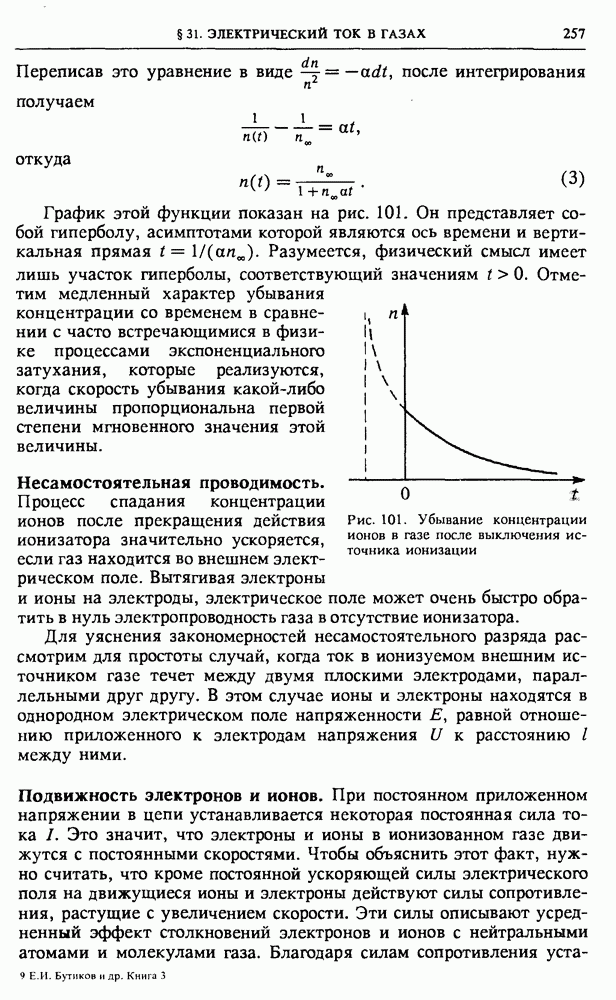
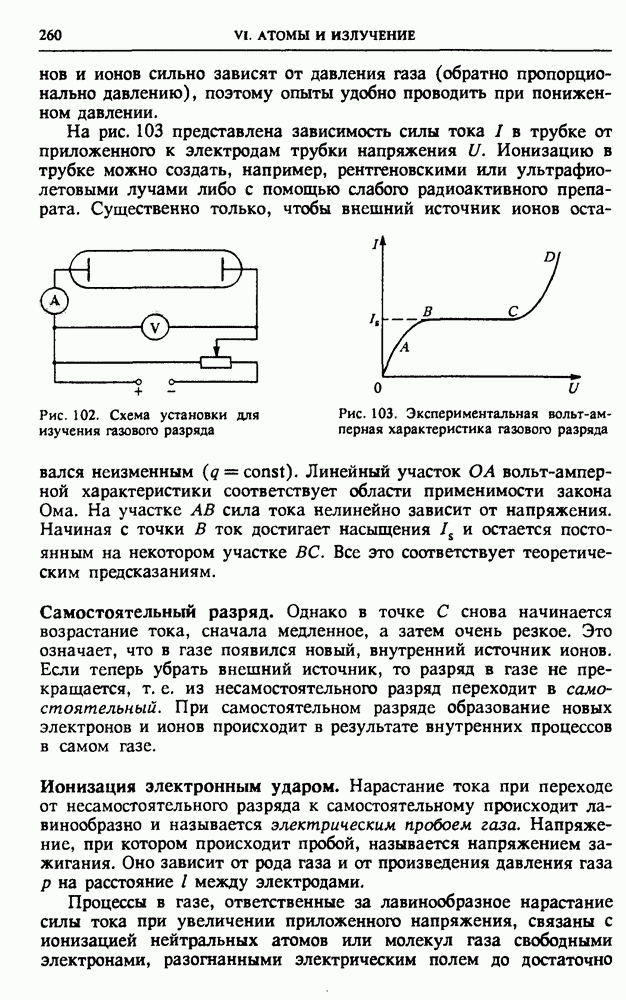
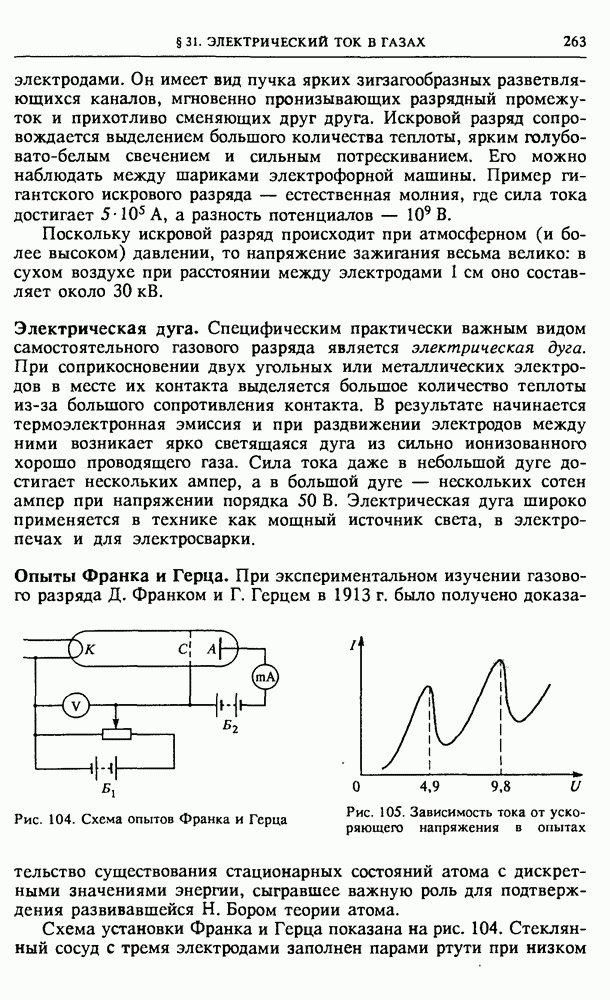
- § 31. Электрический ток в газах
- § 32. Электрический ток в жидкостях
- § 33. Плазма
- VII. ЭЛЕКТРОННЫЕ СВОЙСТВА ТВЕРДЫХ ТЕЛ
- § 34. Электронная структура кристаллов
- § 35. Электронные свойства металлов
- § 36. Электронные свойства полупроводников
- § 37. Полупроводниковые приборы
- VIII. АТОМНОЕ ЯДРО И ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
- § 38. Строение атомного ядра
- § 39. Радиоактивность. Ядерные реакции
- § 40. Элементарные частицы