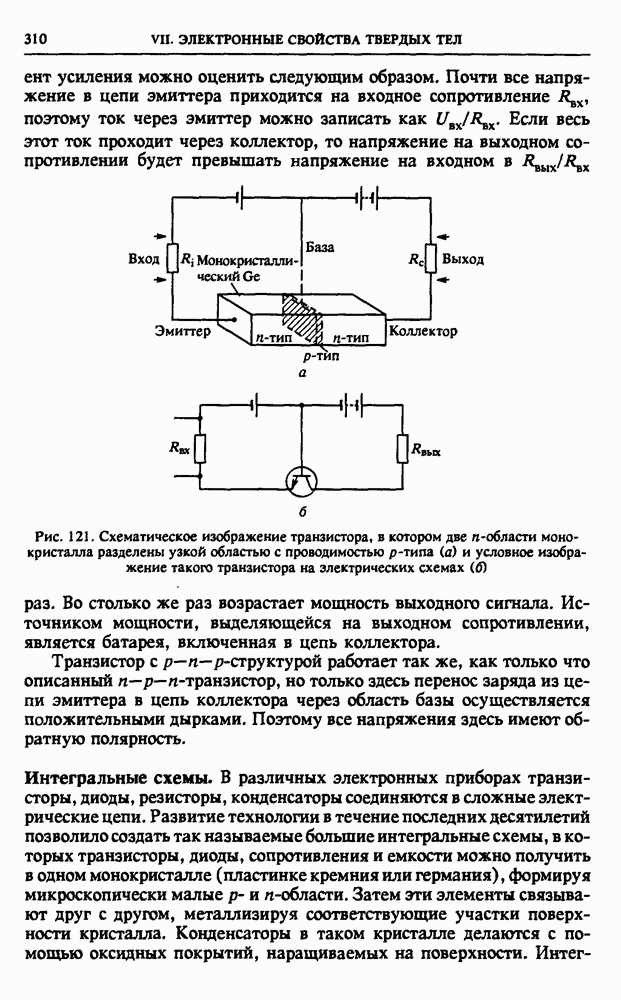
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 16. Первый закон термодинамики
В состоянии равновесия термодинамическая система характеризуется определенными значениями макроскопических параметров. Эти параметры связаны между собой уравнением состояния.
Функция состояния. Любой внутренний параметр является функцией внешних параметров и температуры. В этом случае говорят, что он представляет собой функцию состояния. Функциями состояния можно считать любые характеризующие систему физические величины, значения которых не зависят от предыстории и полностью определяются состоянием системы в данный момент времени.
Внутренняя энергия как функция состояния. Одной из важнейших функций состояния термодинамической системы является ее внутренняя энергия, природа которой в термодинамике не конкретизируется. Внутренняя энергия рассматривается в термодинамике как особая форма энергии, способная к превращениям в другие формы, например, в механическую — кинетическую или потенциальную — энергию. Когда система оказывается в данном состоянии, ее внутренняя энергия принимает соответствующее этому состоянию значение независимо от того, из какого другого состояния и каким способом система перешла в данное состояние. Это характерное для данного состояния значение внутренней энергии зависит только от внешних параметров и от температуры.
Зависимость внутренней энергии от температуры у всех встречающихся в окружающем мире термодинамических систем такова, что с ростом температуры внутренняя энергия также увеличивается.
Работа и теплота как формы изменения внутренней энергии. При взаимодействии термодинамической системы с окружающей средой происходит обмен энергией. При этом можно выделить два принципиально различных способа передачи энергии от системы к внешним телам (или наоборот). Первый способ изменения внутренней энергии связан с совершением работы действующими на систему внешними силами. Здесь работа понимается в том же смысле,
как в механике и электродинамике. В термодинамике работа выражается через макроскопические параметры, например как произведение давления на изменение объема.
Второй способ изменения внутренней энергии, не связанный с совершением работы, называется теплопередачей. При первом способе изменение внутренней энергии равно работе внешних сил над системой. При втором способе полученное системой количество внутренней энергии называется теплотой.
Подчеркнем, что понятие работы пришло в термодинамику из механики и электродинамики. В отличие от этого понятие теплоты возникает в самой термодинамике и не имеет аналогов в механике и электродинамике. Важно, что и работа, и теплота — это физические величины, характеризующие процессы, в которых изменяется внутренняя энергия термодинамической системы, в то время как внутренняя энергия характеризует ее состояние. Поэтому имеет физический смысл понятие энергии, запасенной системой, но нельзя говорить, что система запасла какое-то количество работы или теплоты. Или, другими словами, можно говорить о совершенной работе и переданной теплоте, но не имеет смысла говорить о содержащейся в системе работе или теплоте. Это значит, что ни теплота, ни работа не являются, в отличие от внутренней энергии, функциями состояния.
Работа в термодинамике. Рассмотрим подробнее некоторые вопросы, связанные с процессами совершения работы и теплообмена. Получим формулу, позволяющую рассчитать работу, совершаемую при медленном изменении объема какой-либо термодинамической системы, например газа, находящегося в сосуде, закрытом подвижным поршнем (рис. 49). Пусть приложенная к поршню внешняя сила  медленно перемещает поршень из положения 1 в близкое положение 2 так, чтобы силу
медленно перемещает поршень из положения 1 в близкое положение 2 так, чтобы силу  можно было считать постоянной. Совершаемая силой
можно было считать постоянной. Совершаемая силой  работа А равна произведению силы на перемещение
работа А равна произведению силы на перемещение 


Рис. 49. К вычислению работы при изменении объема
Если движение поршня происходит без ускорения, то сила  уравновешивается силой давления газа на поршень:
уравновешивается силой давления газа на поршень:

где  — площадь поршня. При подстановке
— площадь поршня. При подстановке  из (2) в выражение (1) возникает произведение
из (2) в выражение (1) возникает произведение  характеризующее изменение
характеризующее изменение  занимаемого газом объема V. Так как объем V уменьшается, то
занимаемого газом объема V. Так как объем V уменьшается, то

Теперь выражение (1) для работы действующей на поршень внешней силы принимает вид

Когда внешняя сила сжимает газ, т. е.  ее работа положительна. И наоборот, когда газ расширяется, медленно передвигая поршень, работа удерживающей поршень внешней силы
ее работа положительна. И наоборот, когда газ расширяется, медленно передвигая поршень, работа удерживающей поршень внешней силы  отрицательна
отрицательна 
Наряду с работой внешней силы можно рассматривать работу силы, с которой газ давит на поршень. Эту работу принято называть работой, совершаемой газом, или работой газа. Очевидно, что работа газа А отличается от работы А внешней силы  только знаком:
только знаком:

Адиабатические процессы. Если сжатие или расширение газа происходит без теплообмена с окружающей средой, то изменение  его внутренней энергии
его внутренней энергии  равно работе внешней силы:
равно работе внешней силы:

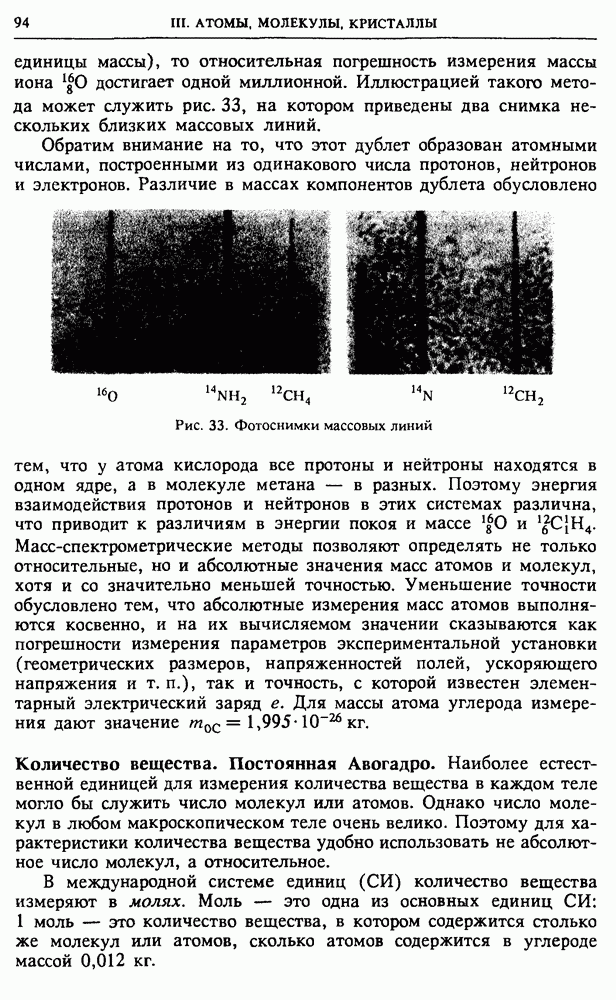
Учитывая соотношение (5), это выражение можно записать и таким образом:

Когда газ расширяется без теплообмена с окружением, он совершает положительную работу  за счет своей внутренней энергии
за счет своей внутренней энергии  запас которой при этом убывает
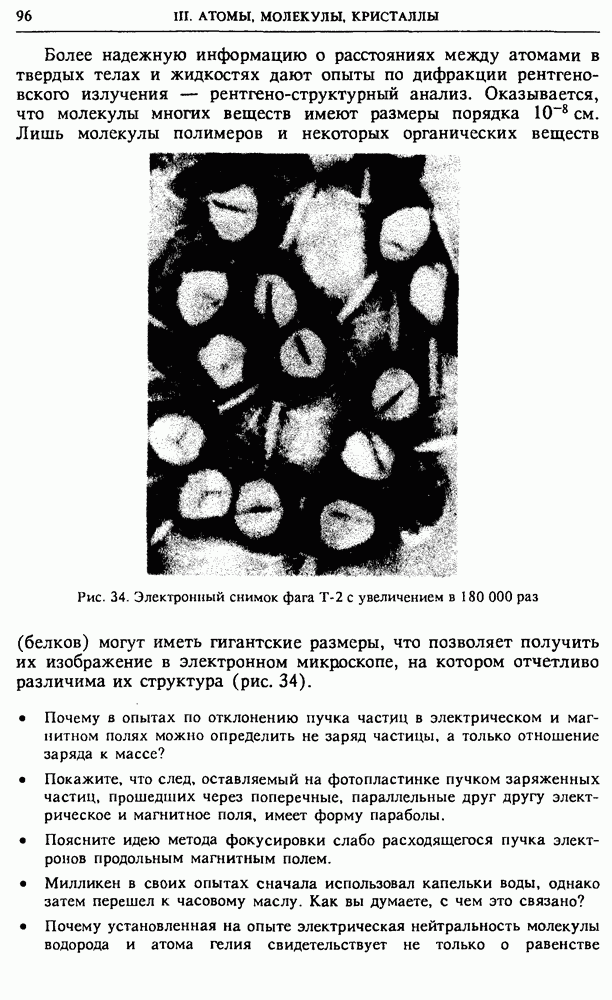
запас которой при этом убывает 
Процессы, происходящие в отсутствие теплообмена с окружающей средой, называются адиабатическими (адиабатными). Для практической реализации таких процессов нужны определенные условия: либо заключить систему в оболочку с низкой теплопроводностью, либо проводить процесс достаточно быстро, чтобы внутренняя энергия не успела заметным образом измениться из-за теплообмена. В этом случае говорят об адиабатической изоляции системы.
Работа внешних электрических сил. Внешние силы, совершающие работу над системой, могут иметь электромагнитную природу. Если в системе есть свободные электрические заряды, то при приложении внешнего электрического поля силы поля совершают работу, когда происходит перемещение этих зарядов. Например, если заряд  перемещается из точки с потенциалом
перемещается из точки с потенциалом  в точку с потенциалом
в точку с потенциалом  то силы поля совершают работу
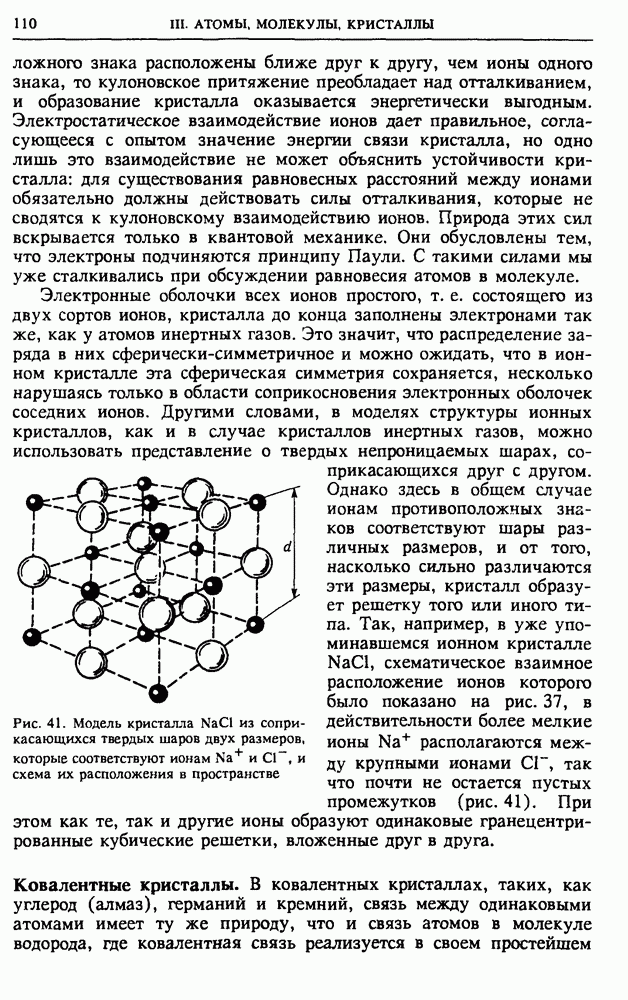
то силы поля совершают работу

где  разность потенциалов между конечной и начальной точками. Работа внешних электрических сил в отсутствие теплообмена связана с изменением внутренней энергии системы тем же соотношением (6). Здесь также в некоторых случаях удобно говорить не о работе внешних сил над системой, а о работе самой системы над внешними телами. Так, при зарядке аккумулятора естественно говорить о работе внешних сил, за счет которой происходит увеличение внутренней энергии. Однако при разрядке аккумулятора, когда он используется в качестве источника питания в какой-либо электрической цепи, естественно говорить о работе, совершаемой самим аккумулятором, а не внешними силами, хотя эти величины, как и прежде, отличаются только знаком.
разность потенциалов между конечной и начальной точками. Работа внешних электрических сил в отсутствие теплообмена связана с изменением внутренней энергии системы тем же соотношением (6). Здесь также в некоторых случаях удобно говорить не о работе внешних сил над системой, а о работе самой системы над внешними телами. Так, при зарядке аккумулятора естественно говорить о работе внешних сил, за счет которой происходит увеличение внутренней энергии. Однако при разрядке аккумулятора, когда он используется в качестве источника питания в какой-либо электрической цепи, естественно говорить о работе, совершаемой самим аккумулятором, а не внешними силами, хотя эти величины, как и прежде, отличаются только знаком.
Теплота. Перейдем к более подробному обсуждению теплообмена. Чтобы он происходил, нужно привести систему в контакт с телами, имеющими другую температуру. Передача внутренней энергии при теплообмене происходит от системы в окружающую среду, если температура системы выше, чем у окружения, и наоборот, система получает энергию, если ее температура ниже, чем у окружения. Процесс теплопередачи происходит до тех пор, пока существует разность температур. Если в процессе теплопередачи не совершается работа, то изменение внутренней энергии равно переданному системе количеству теплоты 

Процесс теплопередачи может происходить не только при непосредственном соприкосновении тел, но и через излучение. Именно таким путем Земля получает энергию Солнца.
В той или иной мере теплообмен происходит практически во всех макроскопических процессах. Представление об адиабатическом процессе — это некоторая идеализация.
Первый закон термодинамики. В середине XIX века исследованиями многих ученых, в первую очередь немецкого врача Р. Майера, английского физика Дж. Джоуля и немецкого физика Г. Гельмгольца была твердо установлена эквивалентность теплоты и работы, т. е. возможность их сравнения и измерения в одних и тех же единицах. Тем самым была заложена основа для обобщения закона сохранения энергии на тепловые процессы и для формирования общего понятия энергии как физической величины.
Согласно закону сохранения энергии, энергия не возникает и не исчезает: она только переходит из одной формы в другую или от одной физической системы к другой. Первый закон термодинамики математически выражает количественную сторону закона сохранения и превращения энергии. Его можно сформулировать следующим образом.
Изменение внутренней энергии системы  в результате процесса перехода из начального состояния в конечное равно сумме совершаемой над системой внешними силами работы А и полученного системой количества теплоты
в результате процесса перехода из начального состояния в конечное равно сумме совершаемой над системой внешними силами работы А и полученного системой количества теплоты 

Содержание первого закона термодинамики можно выразить и таким образом:

— сообщенное системе количество теплоты равно сумме изменения внутренней энергии и совершенной системой работы. Естественно, что эти формулировки эквивалентны, так как  в силу соотношения (5).
в силу соотношения (5).
Приведенные формулировки первого закона равнозначны утверждению о невозможности вечного двигателя, т. е. машины, совершающей работу без затрат энергии.
Квазистатические процессы на p-V-диаграмме. Процесс перехода системы из данного начального состояния в определенное конечное состояние можно осуществить различными способами. При этом совершаемая над системой работа А и передаваемое ей количество теплоты  зависят от способа перехода. Разумеется, их сумма, равная изменению энергии системы, во всех случаях будет одна и та же.
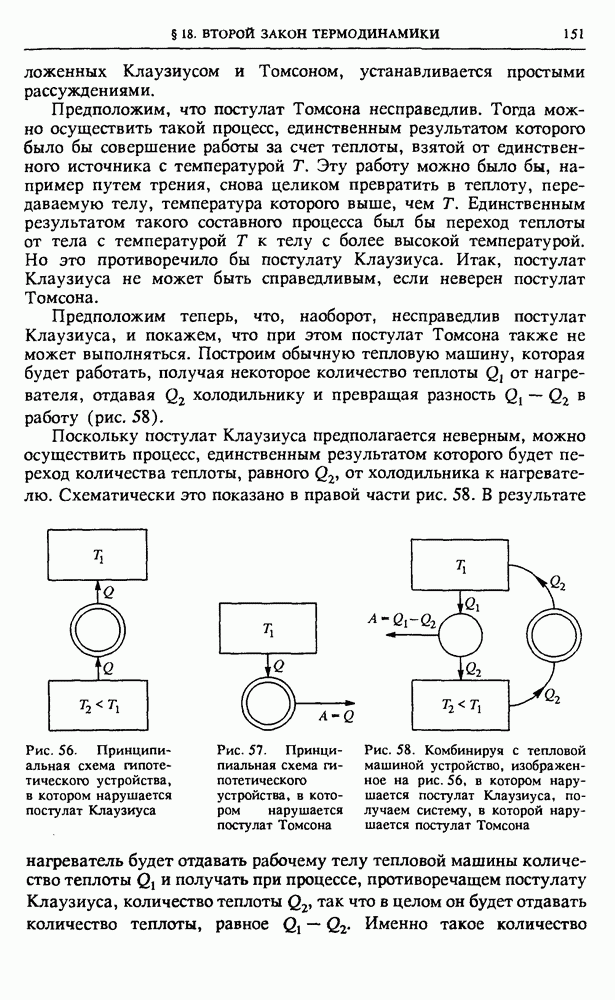
зависят от способа перехода. Разумеется, их сумма, равная изменению энергии системы, во всех случаях будет одна и та же.

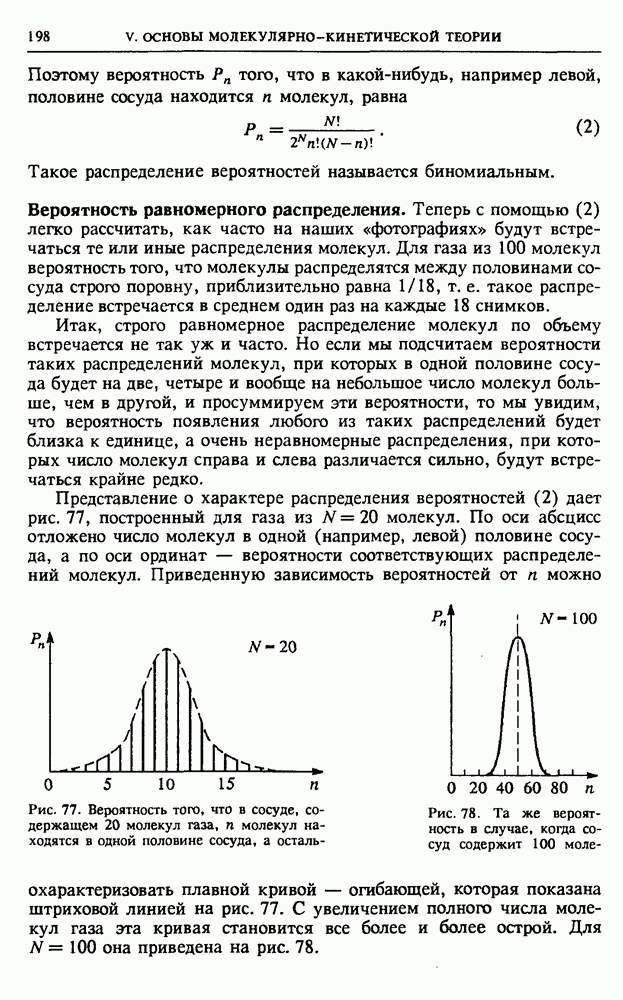
Рис. 50.  -диаграмма идеального газа
-диаграмма идеального газа
Поясним это на примере простейшей термодинамической системы — идеального газа. Равновесное состояние одного моля идеального газа характеризуется заданием двух параметров, например давления и объема. Третий параметр — температура находится при этом из уравнения состояния Менделеева—Клапейрона. Поэтому состояние моля идеального газа можно изобразить точкой на двумерной диаграмме (рис. 50), а квазистатический процесс, представляющий собой последовательность равновесных состояний, — непрерывной линией. Работа  , совершаемая газом при изменении его объема на малую величину
, совершаемая газом при изменении его объема на малую величину  равна произведению давления на изменение объема:
равна произведению давления на изменение объема:

Из рис. 50 видно, что эта работа численно равна площади заштрихованной полоски высотой  и шириной
и шириной  Поэтому работа, совершаемая газом при расширении из состояния 1 в состояние 2 по пути а, равна площади криволинейной трапеции, ограниченной графиком
Поэтому работа, совершаемая газом при расширении из состояния 1 в состояние 2 по пути а, равна площади криволинейной трапеции, ограниченной графиком
процесса и осью абсцисс. Работа, совершаемая внешними силами над газом при этом процессе, как уже отмечалось, отличается от работы газа только знаком. Теперь легко видеть, что работы внешних сил, совершаемые при расширении газа из состояния I в состояние
2 по путям  различны. Но изменение внутренней энергии газа
различны. Но изменение внутренней энергии газа  не зависит от пути перехода. Следовательно, сообщаемые газу при этих процессах количества теплоты, как следует из (10), будут также различны.
не зависит от пути перехода. Следовательно, сообщаемые газу при этих процессах количества теплоты, как следует из (10), будут также различны.
Теплоемкость. Получаемое системой в ходе квазистатического процесса количество теплоты характеризуется физической величиной — теплоемкостью. Теплоемкостью называется отношение переданного системе на участке процесса количества теплоты  к происшедшему на этом участке изменению температуры системы
к происшедшему на этом участке изменению температуры системы 

Количество теплоты, получаемое системой при изменении ее температуры на  будет неодинаковым для различных процессов. Поэтому будет разной и теплоемкость. Таким образом, теплоемкость является характеристикой не самого вещества, а определенного процесса с данным веществом.
будет неодинаковым для различных процессов. Поэтому будет разной и теплоемкость. Таким образом, теплоемкость является характеристикой не самого вещества, а определенного процесса с данным веществом.
С помощью первого закона термодинамики можно получить выражение для теплоемкости при разных процессах. Для этого удобно воспользоваться первым законом в форме (11). Применяя (11) к малому участку процесса и рассматривая системы, у которых выражение для совершаемой работы имеет вид (12), получим

Изохорический процесс. Вычислим с помощью (14) теплоемкости одного моля идеального газа при различных процессах. Для изохорического процесса, при котором объем газа остается неизменным,  находим
находим

Теплоемкость  получила название молярной теплоемкости при постоянном объеме. Она характеризует процесс нагревания газа в закрытом сосуде.
получила название молярной теплоемкости при постоянном объеме. Она характеризует процесс нагревания газа в закрытом сосуде.
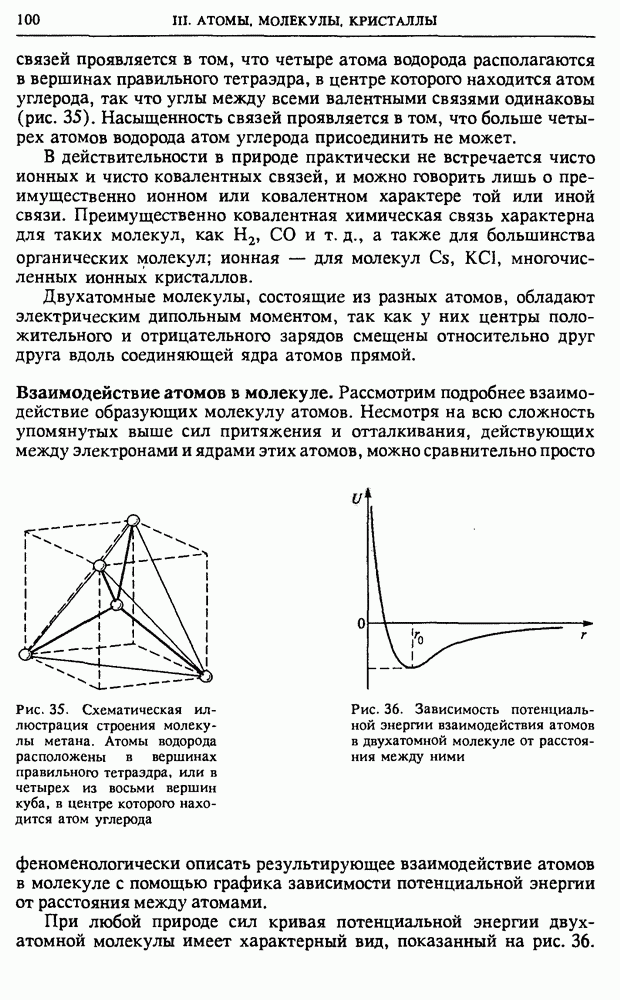
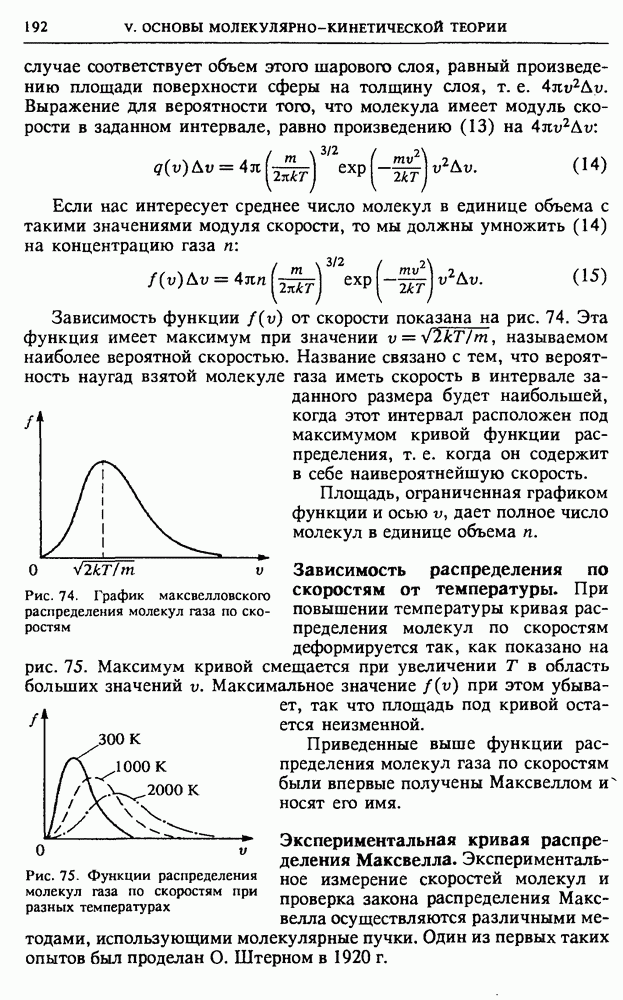
Изобарический процесс. Когда газ заключен в цилиндр с вертикальными стенками, закрытый сверху поршнем с грузом, то нагревание газа будет происходить при постоянном давлении (рис. 51). Такое изобарическое нагревание сопровождается расширением газа,
при котором он, поднимая поршень с грузом, совершает работу. Поэтому теплоемкость газа при постоянном давлении  больше, чем теплоемкость при постоянном объеме
больше, чем теплоемкость при постоянном объеме  Из уравнения состояния одного моля идеального газа
Из уравнения состояния одного моля идеального газа  при постоянном давлении
при постоянном давлении  находим
находим  Теперь с помощью (14) получаем
Теперь с помощью (14) получаем


Рис. 51. Изобарическое нагревание газа
Соотношение (16) называется уравнением Майера.
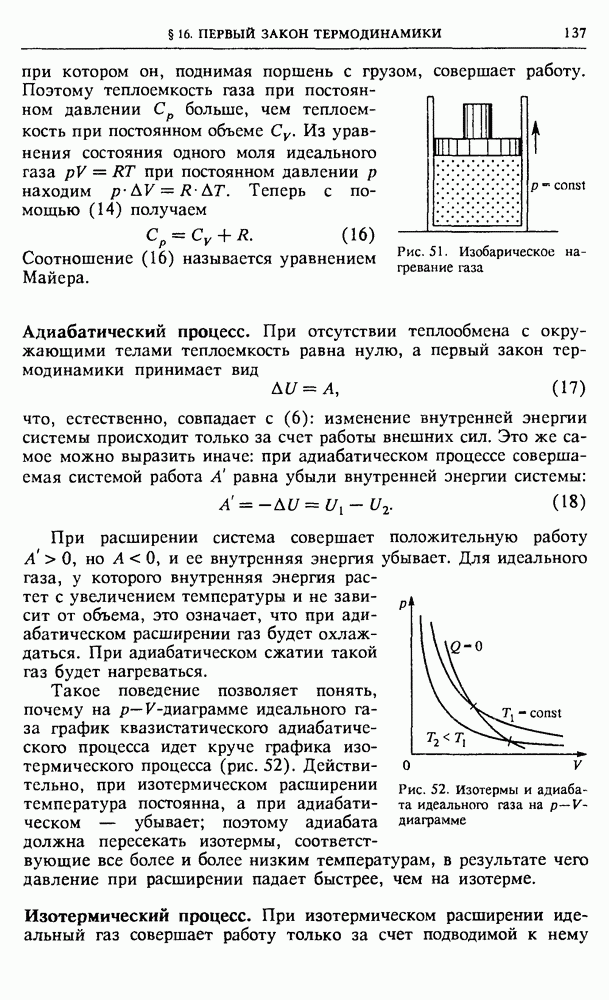
Адиабатический процесс. При отсутствии теплообмена с окружающими телами теплоемкость равна нулю, а первый закон термодинамики принимает вид

что, естественно, совпадает с (6): изменение внутренней энергии системы происходит только за счет работы внешних сил. Это же самое можно выразить иначе: при адиабатическом процессе совершаемая системой работа А равна убыли внутренней энергии системы:

При расширении система совершает положительную работу  но
но  и ее внутренняя энергия убывает. Для идеального газа, у которого внутренняя энергия растет с увеличением температуры и не зависит от объема, это означает, что при адиабатическом расширении газ будет охлаждаться. При адиабатическом сжатии такой газ будет нагреваться.
и ее внутренняя энергия убывает. Для идеального газа, у которого внутренняя энергия растет с увеличением температуры и не зависит от объема, это означает, что при адиабатическом расширении газ будет охлаждаться. При адиабатическом сжатии такой газ будет нагреваться.

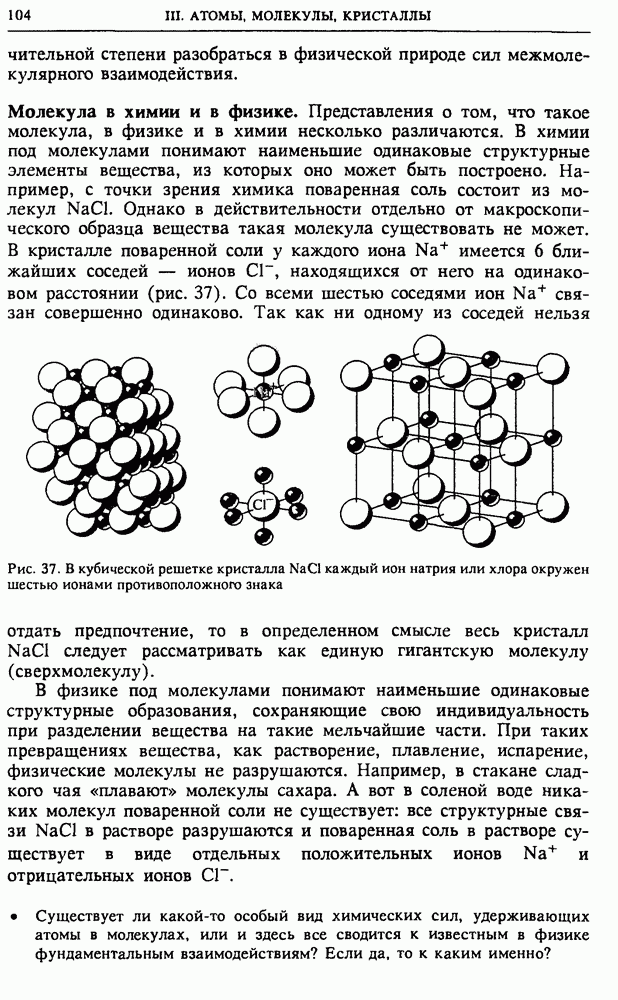
Рис. 52. Изотермы и адиабата идеального газа на  -диаграмме
-диаграмме
Такое поведение позволяет понять, почему на  -диаграмме идеального газа график квазистатического адиабатического процесса идет круче графика изотермического процесса (рис. 52). Действительно, при изотермическом расширении температура постоянна, а при адиабатическом — убывает; поэтому адиабата должна пересекать изотермы, соответствующие все более и более низким температурам, в результате чего давление при расширении падает быстрее, чем на изотерме.
-диаграмме идеального газа график квазистатического адиабатического процесса идет круче графика изотермического процесса (рис. 52). Действительно, при изотермическом расширении температура постоянна, а при адиабатическом — убывает; поэтому адиабата должна пересекать изотермы, соответствующие все более и более низким температурам, в результате чего давление при расширении падает быстрее, чем на изотерме.
Изотермический процесс. При изотермическом расширении идеальный газ совершает работу только за счет подводимой к нему
теплоты, так что его внутренняя энергия во время такого процесса не меняется:

При изотермическом сжатии идеальный газ совершает отрицательную работу. При этом теплота от него отводится: 
Тепловой двигатель. Тепловыми двигателями называют машины, которые преобразуют выделяющуюся при сжигании топлива внутреннюю энергию в механическую. Первые разные по конструкции и назначению паровые машины появились на рубеже XVII—XVIII веков в Англии и Франции. Спустя полстолетия И. Ползуновым в России и  Уаттом в Англии были созданы универсальные паровые машины, пригодные для различных нужд. Их появление произвело настоящую техническую революцию, что дало основание образно назвать последовавшее за этим столетие «веком пара».
Уаттом в Англии были созданы универсальные паровые машины, пригодные для различных нужд. Их появление произвело настоящую техническую революцию, что дало основание образно назвать последовавшее за этим столетие «веком пара».
Во второй половине XIX века появились двигатели внутреннего сгорания, получившие особенно большое распространение. Наиболее совершенными оказались так называемые четырехтактные двигатели, разработанные немецким конструктором И. Отто.
Применим первый закон термодинамики к анализу работы тепловой машины. Несмотря на большое разнообразие, все тепловые двигатели имеют общий принцип действия. Назначение любого периодически действующего теплового двигателя состоит в совершении механической работы за счет использования внутренней энергии, о чем кратко, но не совсем точно говорят как о превращении теплоты в работу.

Рис. 53. Принципиальная схема тепловой машины
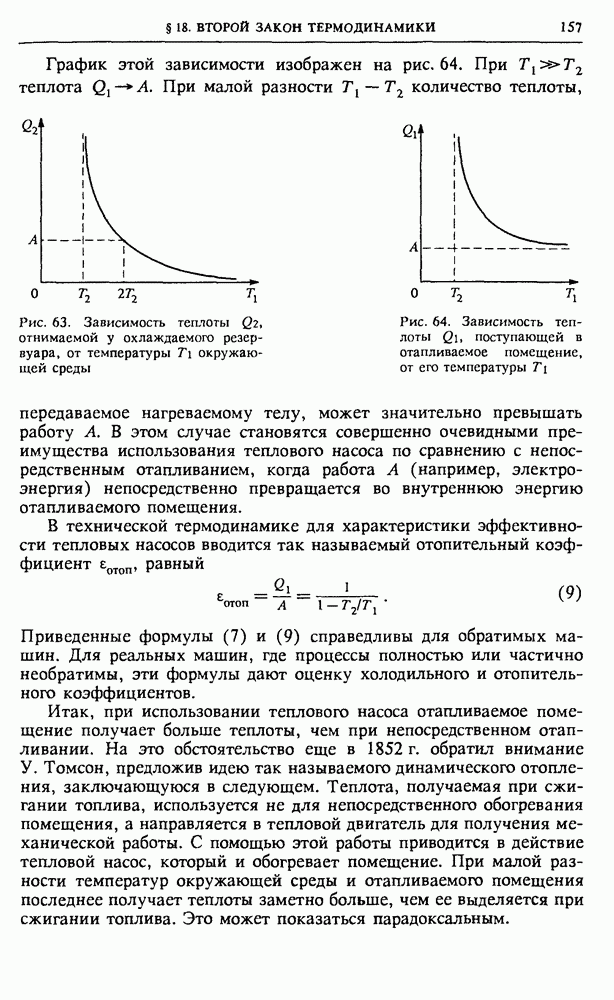
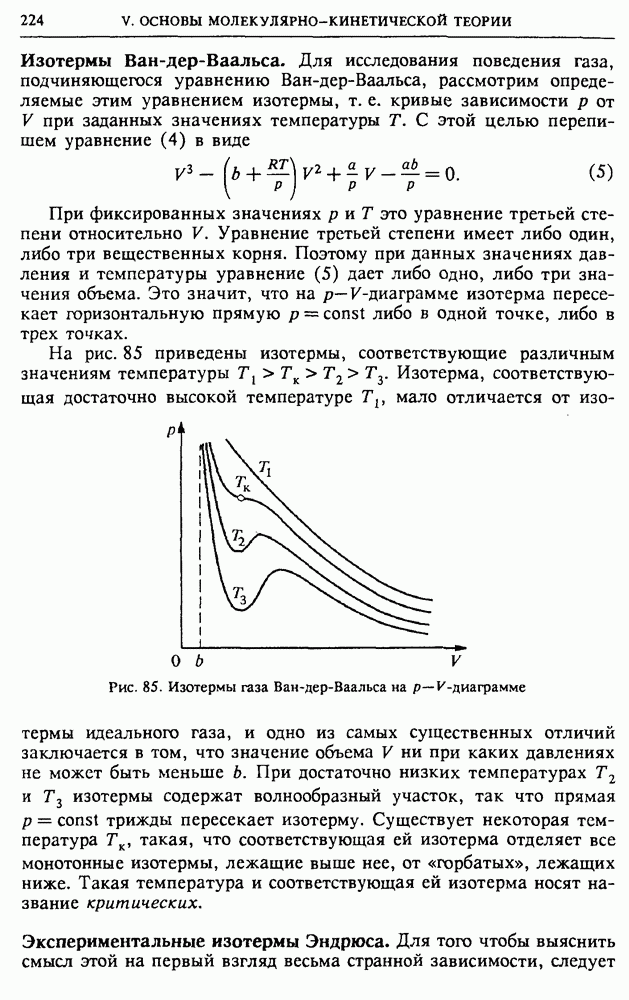
Принципиальная схема любой тепловой машины, если отвлечься от ее конструктивных особенностей, выглядит так, как показано на рис. 53. Ее обязательными элементами являются два тепловых резервуара: нагреватель с некоторой температурой  и холодильник с температурой
и холодильник с температурой  меньшей температуры нагревателя. Роль холодильника может выполнять окружающая среда. Если просто привести нагреватель в тепловой контакт с холодильником, то внутренняя энергия нагревателя будет передаваться холодильнику путем теплопередачи без совершения работы. Для совершения механической работы обязательно должно быть промежуточное звено — так называемое рабочее тело, в качестве которого может быть использован, например, газ в
меньшей температуры нагревателя. Роль холодильника может выполнять окружающая среда. Если просто привести нагреватель в тепловой контакт с холодильником, то внутренняя энергия нагревателя будет передаваться холодильнику путем теплопередачи без совершения работы. Для совершения механической работы обязательно должно быть промежуточное звено — так называемое рабочее тело, в качестве которого может быть использован, например, газ в
цилиндре, закрытом поршнем. У периодически действующей машины все процессы с рабочим телом повторяются, так что оно периодически возвращается в исходное состояние.
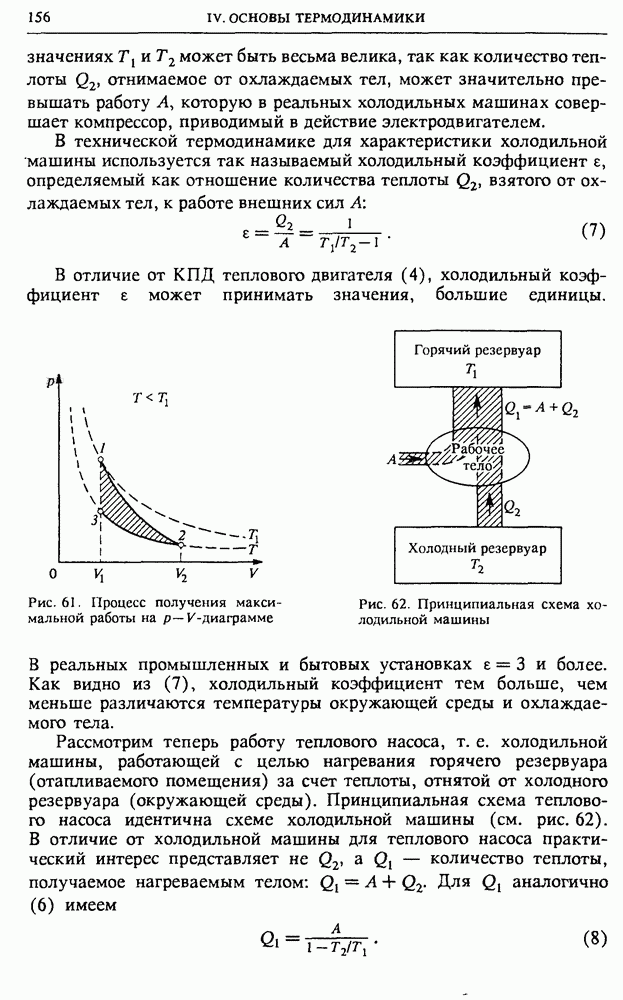
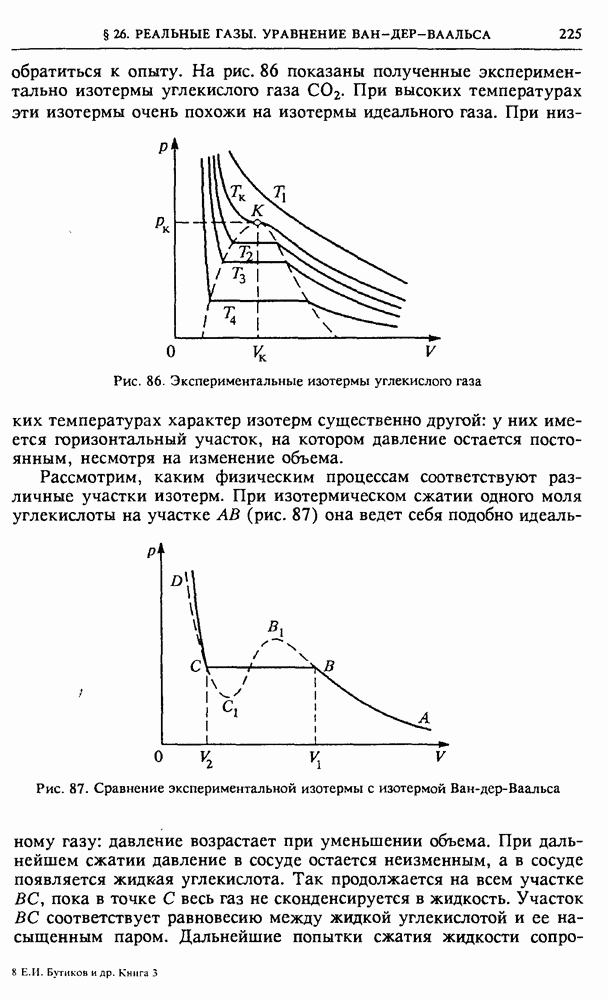
Цикл тепловой машины. Механическая работа совершается при расширении газа в цилиндре, при котором он проходит через ряд состояний вдоль некоторой кривой а на рис. 54. Для того чтобы рабочее тело вернулось в исходное состояние 1, газ в цилиндре нужно сжать, для чего над ним придется совершить работу. Но эта работа обязательно должна быть меньше, чем работа, совершенная газом при расширении. На  -диаграмме работа газа равна площади криволинейной трапеции под кривой а. Чтобы при сжатии газа совершилась меньшая работа, кривая сжатия
-диаграмме работа газа равна площади криволинейной трапеции под кривой а. Чтобы при сжатии газа совершилась меньшая работа, кривая сжатия  должна лежать ниже кривой а: сжатие газа должно происходить при более низких температурах, чем расширение.
должна лежать ниже кривой а: сжатие газа должно происходить при более низких температурах, чем расширение.

Рис. 54. Цикл теплового двигателя на  -диаграмме
-диаграмме
Разность площадей под кривыми а и  т. е. площадь, ограниченная замкнутой кривой
т. е. площадь, ограниченная замкнутой кривой  равна работе А, совершаемой рабочим телом за цикл. На основании первого закона термодинамики эта работа равна разности между теплотой
равна работе А, совершаемой рабочим телом за цикл. На основании первого закона термодинамики эта работа равна разности между теплотой  полученной рабочим телом за цикл от нагревателя, и теплотой
полученной рабочим телом за цикл от нагревателя, и теплотой  отданной им холодильнику, ибо рабочее тело после совершения цикла возвращается в исходное состояние, так что его внутренняя энергия принимает исходное значение:
отданной им холодильнику, ибо рабочее тело после совершения цикла возвращается в исходное состояние, так что его внутренняя энергия принимает исходное значение:

КПД тепловой машины. Отношение совершенной за цикл работы А к количеству теплоты  полученному за цикл от нагревателя, называется коэффициентом полезного действия тепловой машины
полученному за цикл от нагревателя, называется коэффициентом полезного действия тепловой машины  :
:

Максимально выгодной была бы тепловая машина, у которой вся полученная теплота  превращалась бы в работу:
превращалась бы в работу:  Однако на основании опыта установлено, что это невозможно.
Однако на основании опыта установлено, что это невозможно.
К обсуждению КПД тепловой машины мы еще вернемся при изучении второго закона термодинамики.
• Что такое функция состояния термодинамической системы? Какие физические величины, характеризующие систему, можно рассматривать как функции состояния?
• Поясните, почему внутренняя энергия термодинамической системы является функцией состояния.
• Что такое теплота и работа? Какова их связь с внутренней энергией? Поясните сходство и различие этих физических величин.
• Можно ли говорить о количестве теплоты или работы, запасенной системой? Являются ли теплота и работа функциями состояния системы?
• Пусть на рис. 49 слева от поршня цилиндр сообщается с атмосферой. Что в этом случае следует понимать под силой  работа которой равна
работа которой равна  Чему равна эта сила, если давление газа в цилиндре равно
Чему равна эта сила, если давление газа в цилиндре равно  а давление атмосферы равно
а давление атмосферы равно  ?
?
• Поясните, почему работа газа при изменении его объема отличается знаком от работы внешней силы, действующей на поршень. Почему это утверждение справедливо только при достаточно медленном равномерном движении поршня?
• Пусть газ в условиях адиабатической изоляции совершает отрицательную работу. Что при этом происходит с его внутренней энергией?
Покажите, что первый закон термодинамики в форме (10) или (11) эквивалентен утверждению о невозможности вечного двигателя.
• Поясните, почему точка на р—К-диаграмме полностью характеризует состояние определенного количества идеального газа. Чему соответствует любая кривая на такой диаграмме?
• Как по графику некоторого процесса на р—К-диаграмме можно определить совершаемую системой работу? В каком случае работа положительна? отрицатицательна?
• Почему теплоемкость некоторого количества вещества зависит от происходящего с ним процесса? Объясните, почему теплоемкость при постоянном давлении  всегда больше теплоемкости при постоянном объеме
всегда больше теплоемкости при постоянном объеме 
Чему равно значение теплоемкости для адиабатического процесса? Можно ли провести с идеальным газом такой процесс, при котором теплоемкость будет отрицательной?
• Объясните, почему на  -диаграмме идеального газа адиабата идет круче изотермы.
-диаграмме идеального газа адиабата идет круче изотермы.
• Объясните устройство и принцип действия теплового двигателя.
• Поясните, почему работа, совершаемая тепловым двигателем за один цикл, изображается на  -диаграмме площадью, охватываемой замкнутой кривой этого цикла.
-диаграмме площадью, охватываемой замкнутой кривой этого цикла.
• Что такое КПД теплового двигателя? Чем определяется его значение?
| << Предыдущий параграф | Следующий параграф >> |
- I. ТЕОРИЯ ОТНОСИТЕЛЬНОСТИ
- § 2. Релятивистская кинематика
- § 3. Преобразования Лоренца
- § 4. Релятивистская динамика
- § 5. Примеры релятивистского движения частиц
- II. ЗАКОНЫ МИКРОМИРА. ЧАСТИЦЫ И ВОЛНЫ
- § 6. Световые кванты
- § 7. Границы применимости классической физики
- § 8. Свет — частицы или волны?
- § 9. Законы движения в квантовой физике
- III. АТОМЫ, МОЛЕКУЛЫ, КРИСТАЛЛЫ
- § 10. Строение атома
- § 11. Измерения в атомной физике
- § 12. Молекулы
- § 13. Кристаллы
- IV. ОСНОВЫ ТЕРМОДИНАМИКИ
- § 14. Основные понятия термодинамики
- § 15. Уравнение состояния газа
- § 16. Первый закон термодинамики
- § 17. Примеры применения первого закона термодинамики
- § 18. Второй закон термодинамики
- § 19. Методы термодинамики и их применения
- V. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
- § 20. Экспериментальные основания статистической механики
- § 21. Молекулярно-кинетическая теория идеального газа
- § 22. Статистические распределения
- § 23. Тепловое равновесие в статистической механике
- § 24. Статистическая природа необратимости тепловых процессов
- § 25. Газы, жидкости, фазовые переходы
- § 26. Реальные газы. Уравнение Ван-дер-Ваальса
- § 27. Фазовые переходы
- VI. АТОМЫ И ИЗЛУЧЕНИЕ
- § 28. Излучение света атомами
- § 29. Излучение света нагретыми телами
- § 30. Вынужденное излучение. Квантовые усилители и генераторы света
- § 31. Электрический ток в газах
- § 32. Электрический ток в жидкостях
- § 33. Плазма
- VII. ЭЛЕКТРОННЫЕ СВОЙСТВА ТВЕРДЫХ ТЕЛ
- § 34. Электронная структура кристаллов
- § 35. Электронные свойства металлов
- § 36. Электронные свойства полупроводников
- § 37. Полупроводниковые приборы
- VIII. АТОМНОЕ ЯДРО И ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
- § 38. Строение атомного ядра
- § 39. Радиоактивность. Ядерные реакции
- § 40. Элементарные частицы