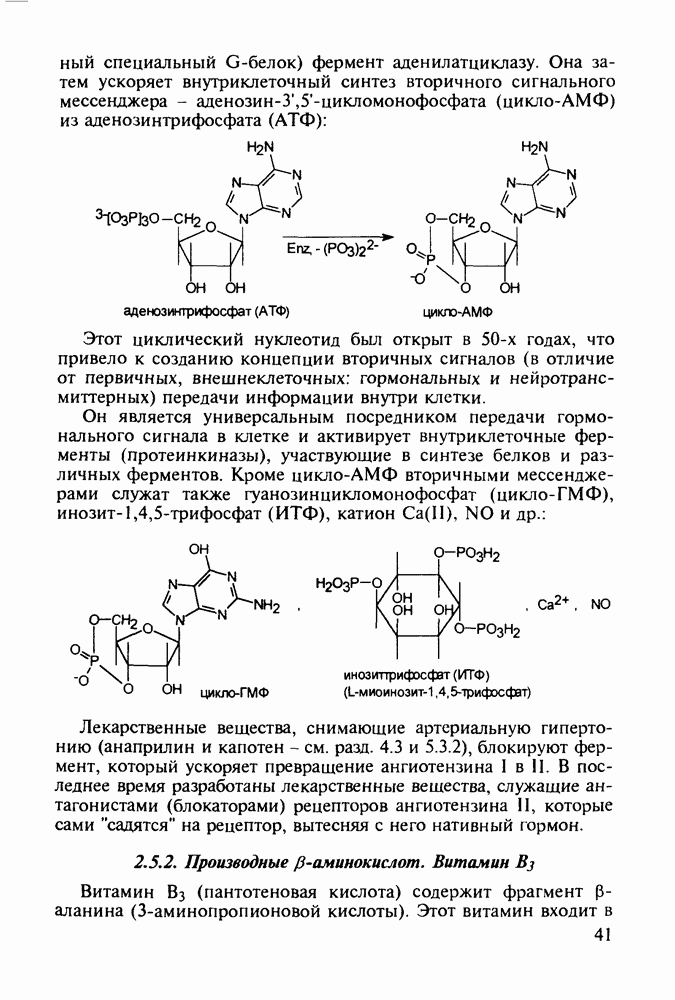
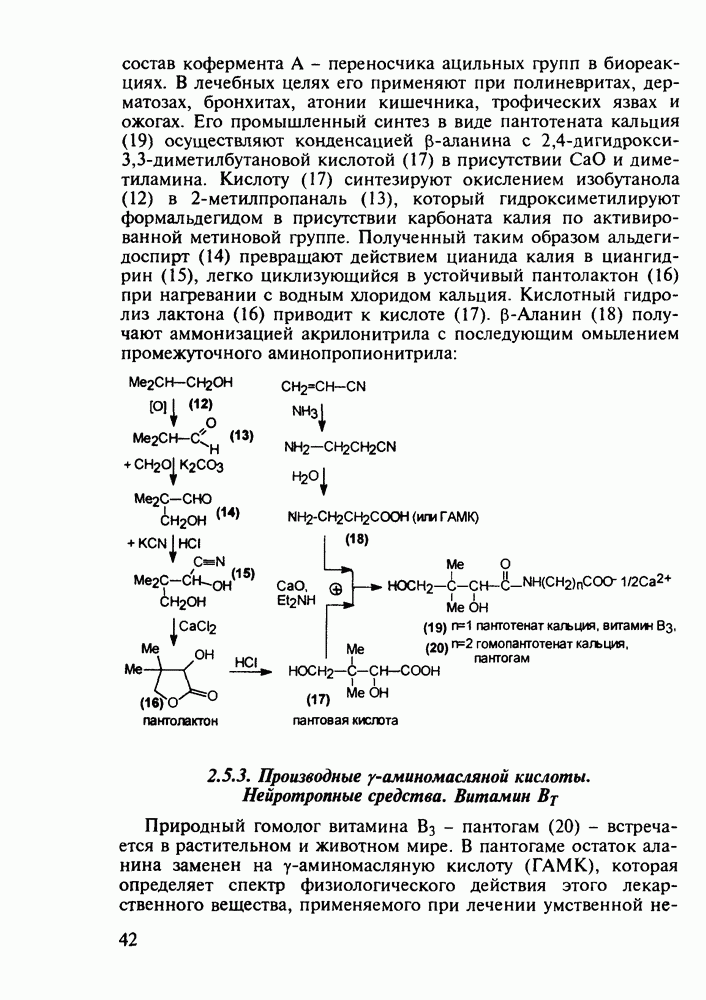
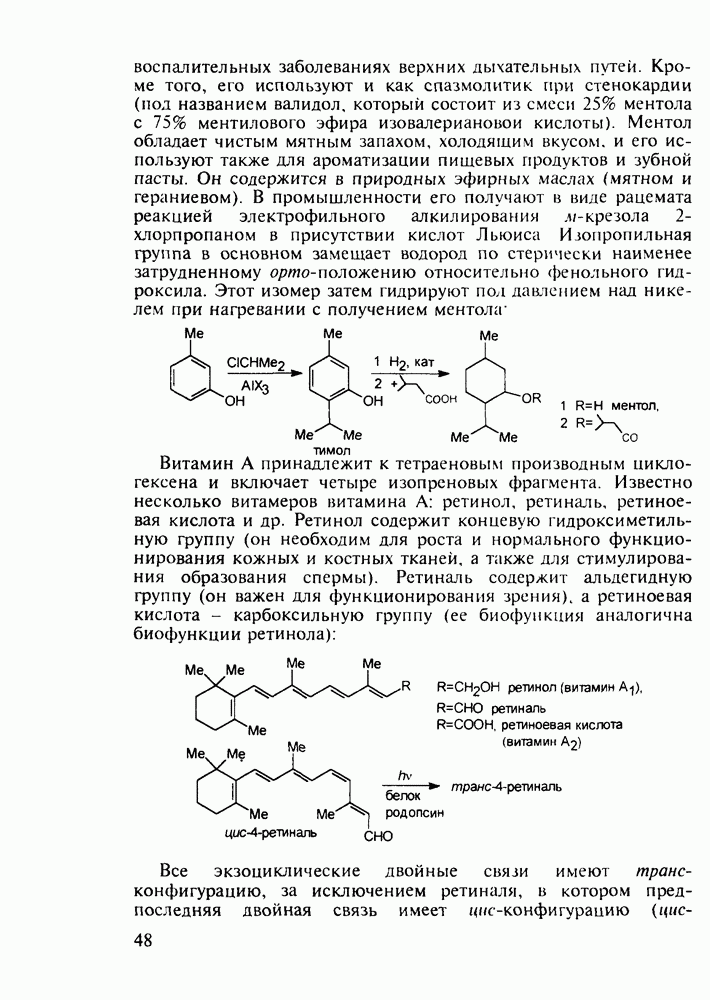
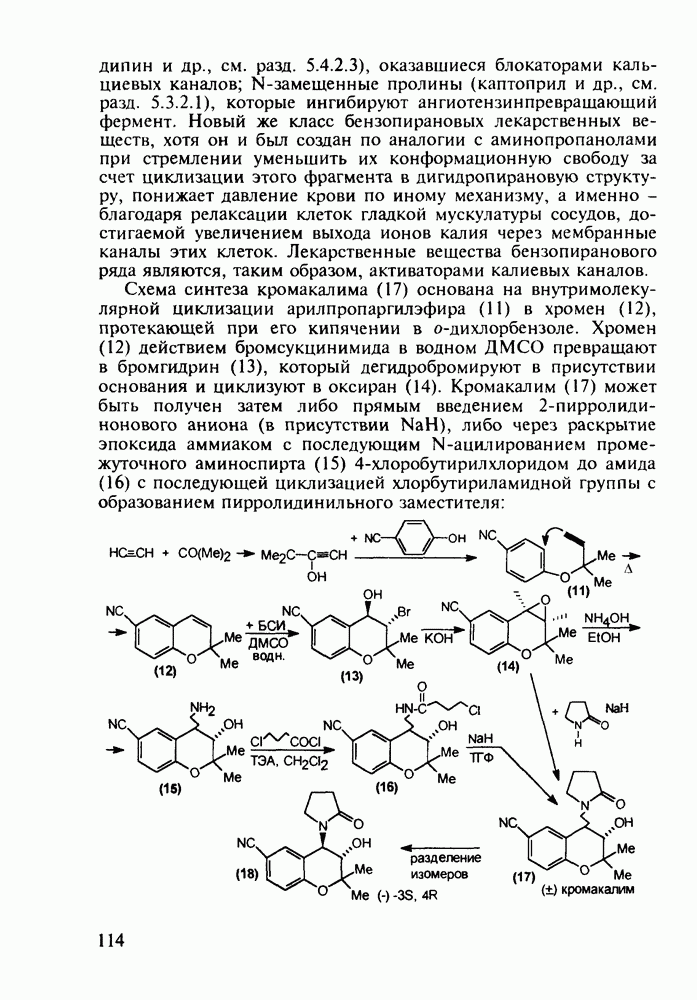
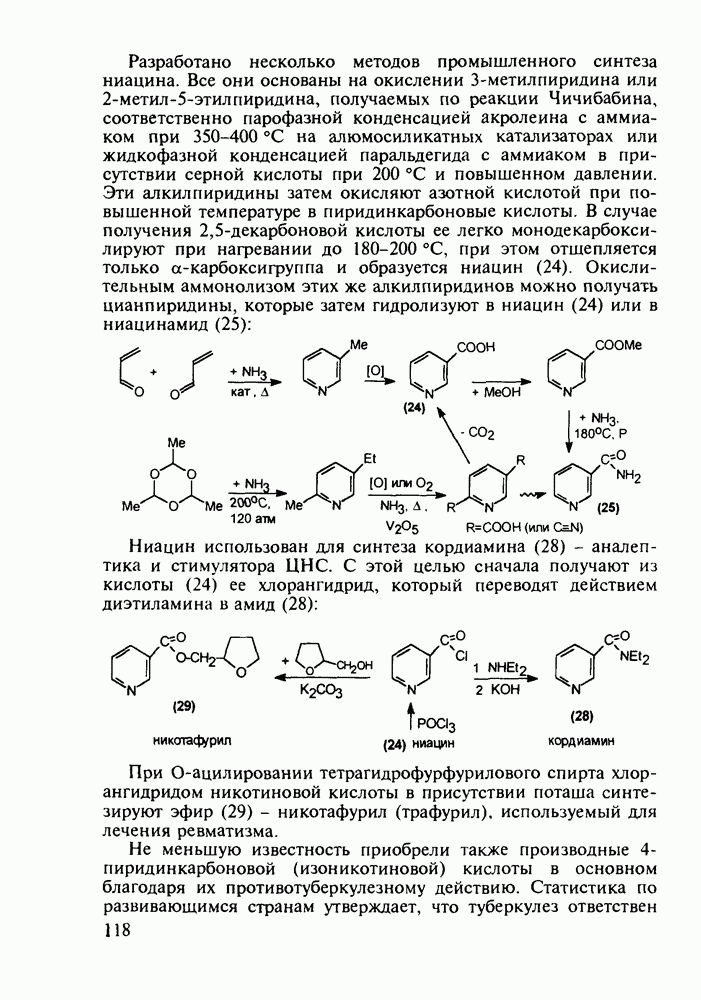
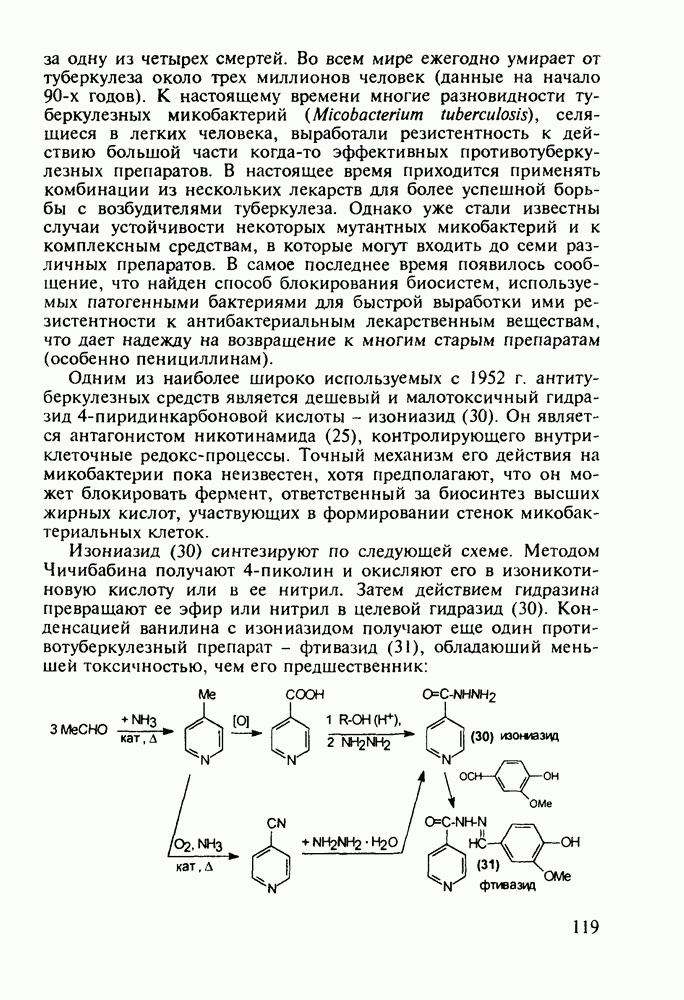
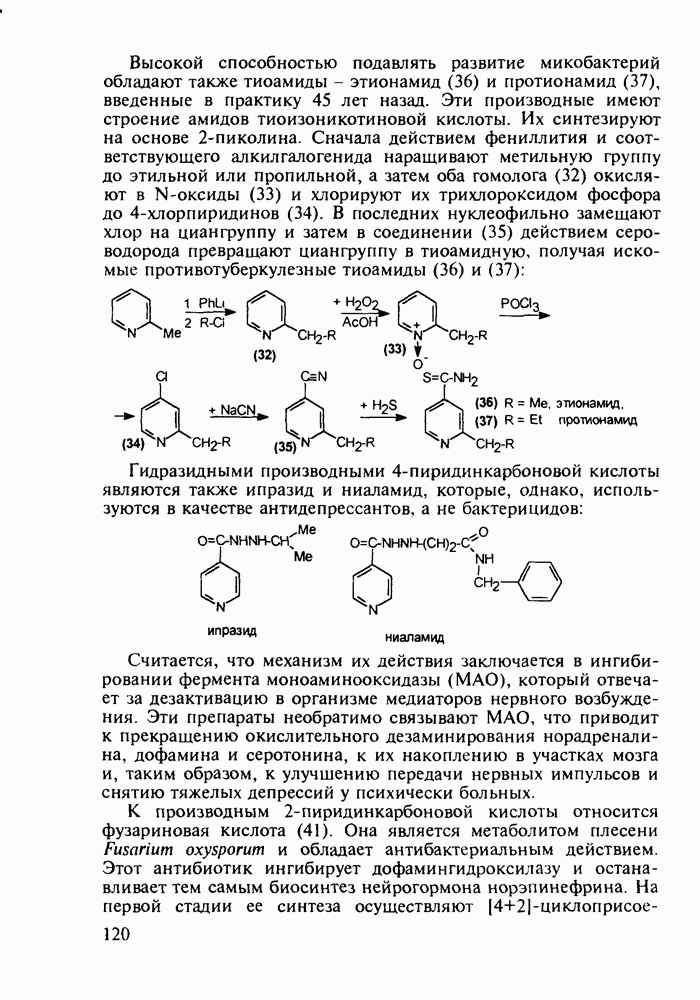
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
5.4.3. Анальгетики и транквилизаторы пиперидинового ряда
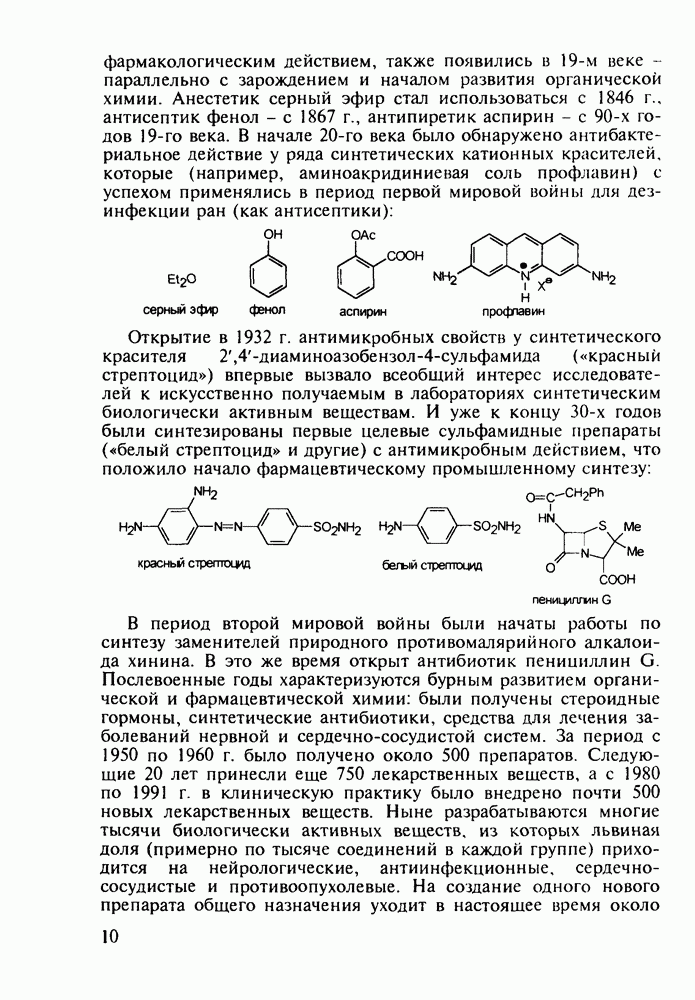
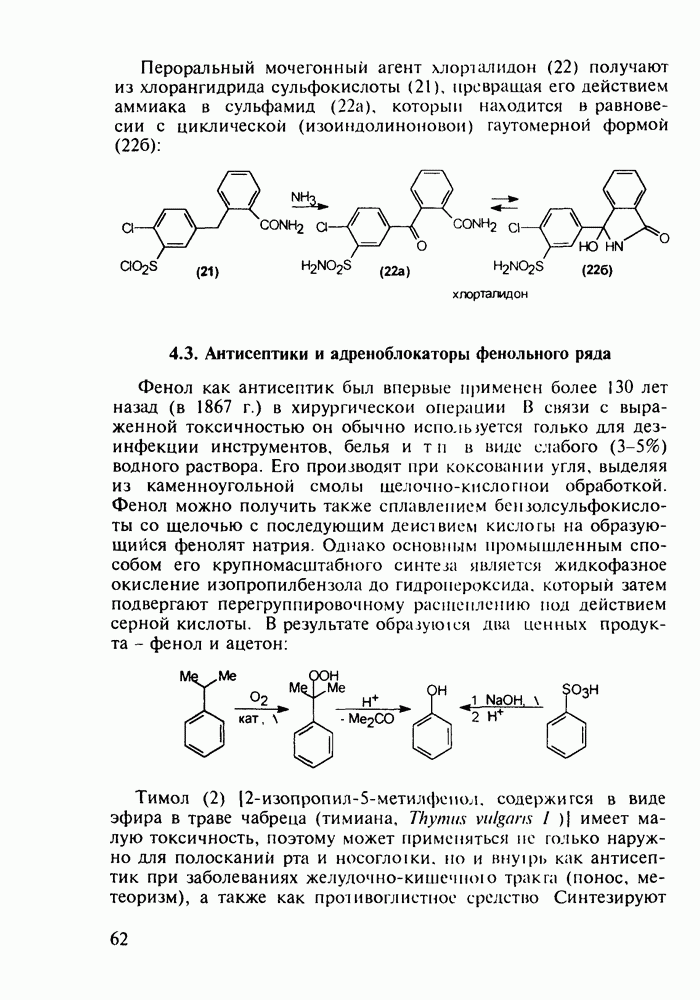
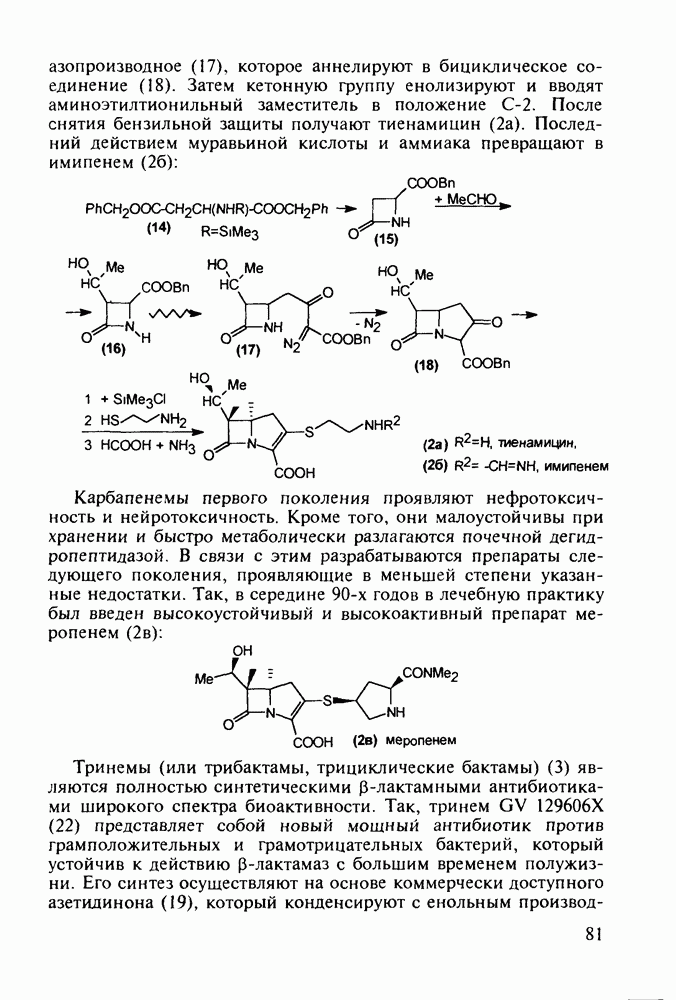
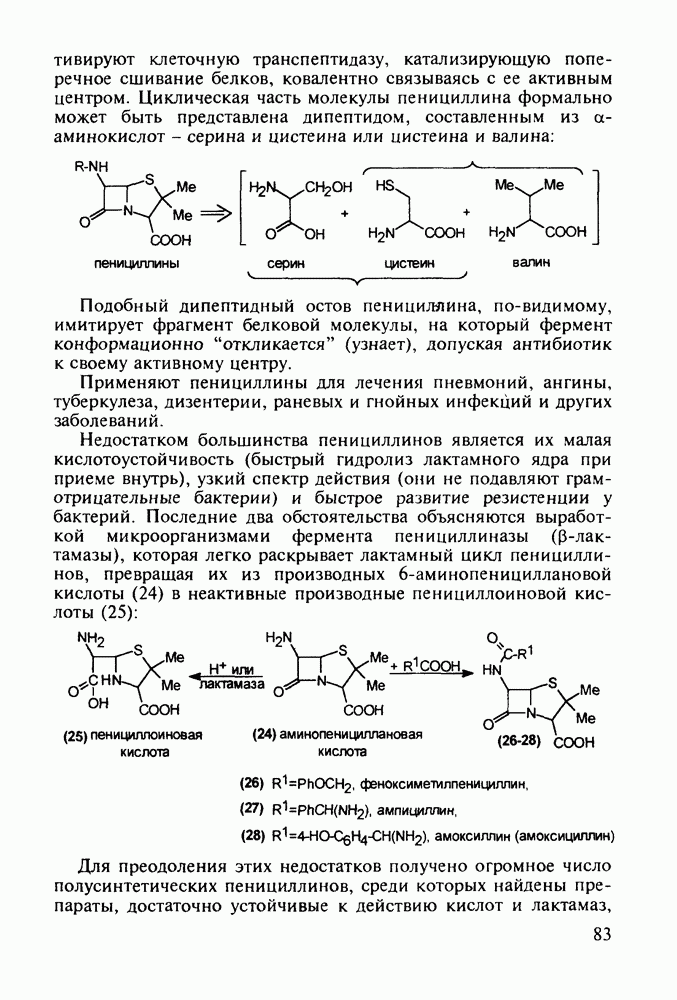
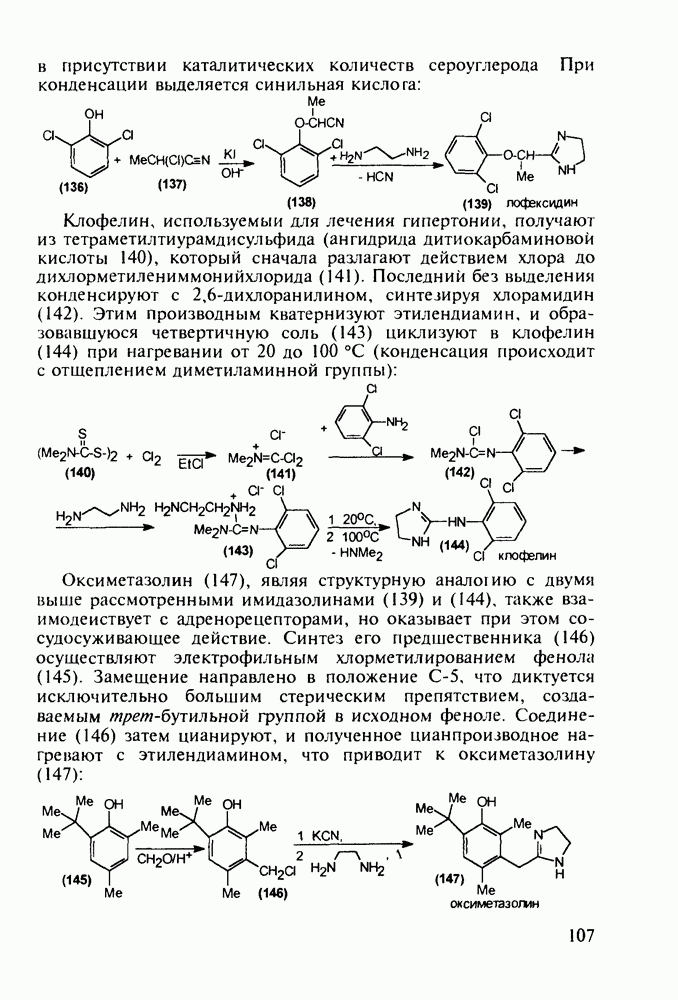
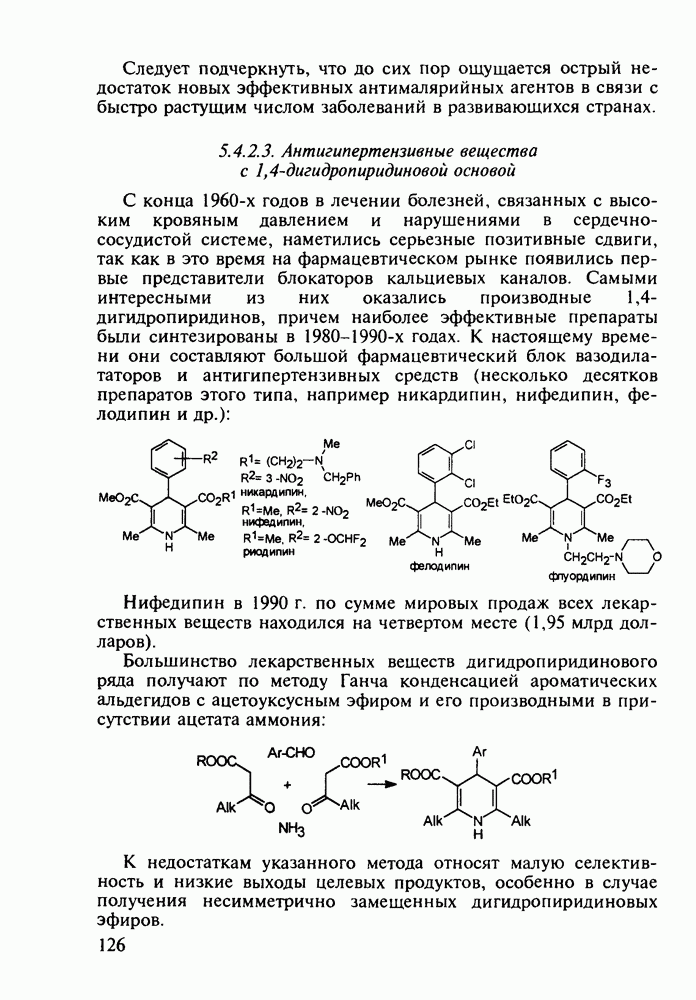
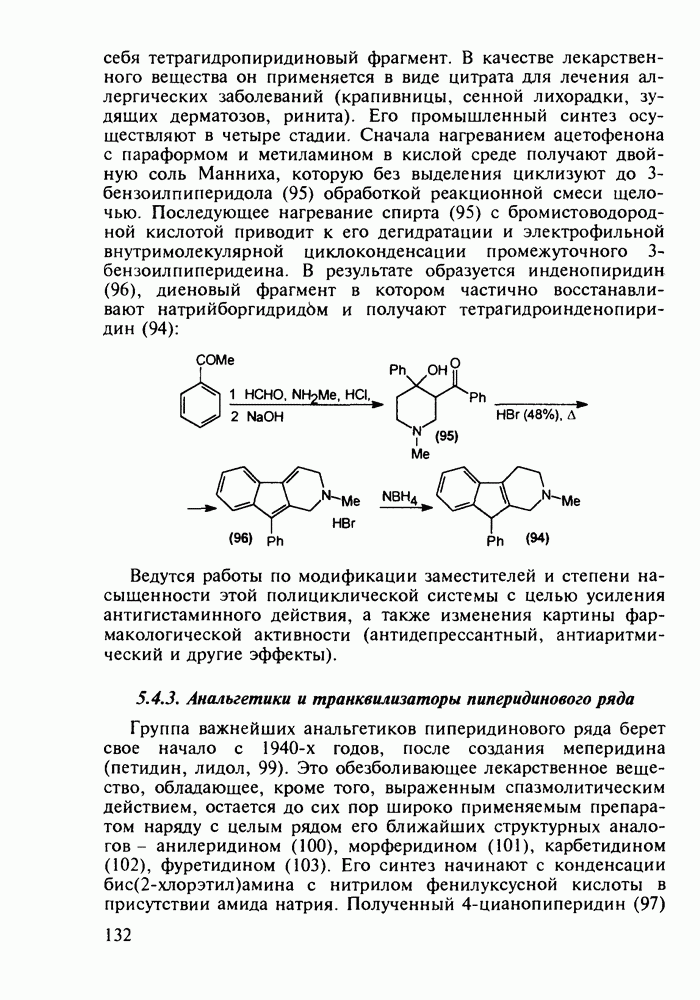
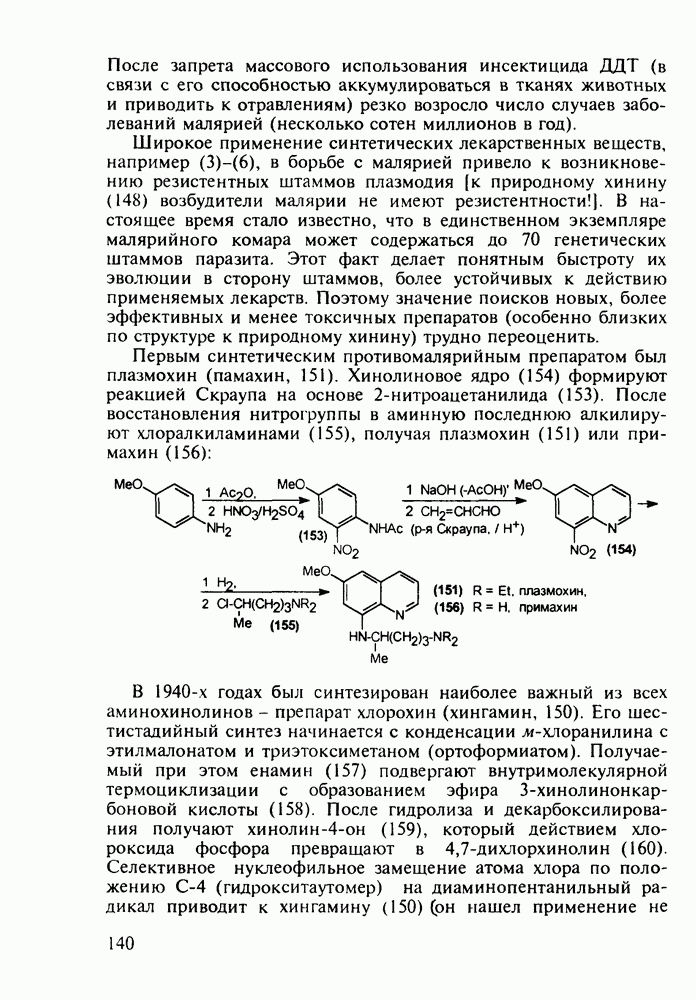
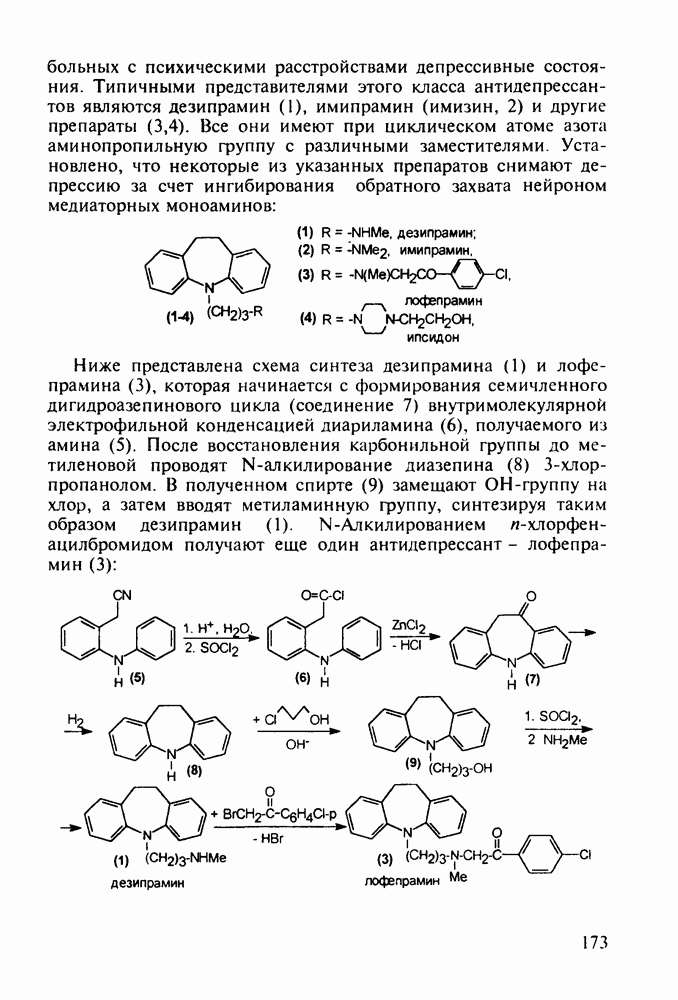
Группа важнейших анальгетиков пиперидинового ряда берет свое начало с 1940-х годов, после создания меперидина (петидин, лидол, 99). Это обезболивающее лекарственное вещество, обладающее, кроме того, выраженным спазмолитическим действием, остается до сих пор широко применяемым препаратом наряду с целым рядом его ближайших структурных аналогов - анилеридином (100), морферидином (101), карбетидином (102), фуретидином (103). Его синтез начинают с конденсации бис(2-хлорэтил)амина с нитрилом фенилуксусной кислоты в присутствии амида натрия. Полученный 4-цианопиперидин (97)
гидролизуют до кислоты, которую превращают в хлорангидрид (98). Этерификацией последнего получают меперидин (99):

Обнаружение анальгетической активности у большой серии производных 4-фенилпиперидина, синтезированных на основе идеи упрощения структуры известного природного анальгетика морфина, привело к правилу Беккета-Кейзи, оказавшемуся, несмотря на свою упрощенность, полезным на определенном этапе создания фармакологического блока морфиноподобных анальгетиков, особенно в 1960— 1970-х годах. В соответствии с этим правилом, при “конструировании” потенциального анальгетика опиоидного типа (взаимодействующего с рецептором морфина) необходимо, чтобы его структура включала-1) четвертичный атом углерода; 2) ароматическое кольцо при этом атоме; 3) третичный атом азота на расстоянии, эквивалентном двум атомам углерода  -конфигурации, считая от указанного четвертичного атома углерода:
-конфигурации, считая от указанного четвертичного атома углерода:

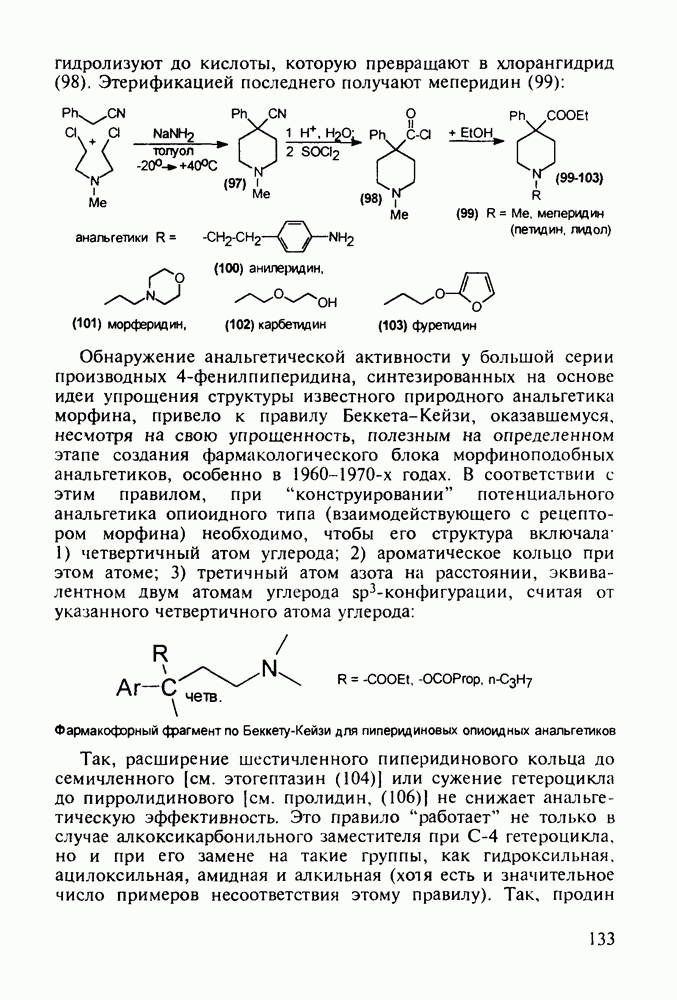
Так, расширение шестичленного пиперидинового кольца до семичленного [см. этогептазин (104)] или сужение гетероцикла до пирролидинового [см. пролидин, (106)] не снижает анальгетическую эффективность. Это правило “работает” не только в случае алкоксикарбонильного заместителя при С-4 гетероцикла, но и при его замене на такие группы, как гидроксильная, ацилоксильная, амидная и алкильная (хотя есть и значительное число примеров несоответствия этому правилу). Так, продин
(105), пролидин (106) и промедол (107) являются эффективными анальгетиками:

Однако сохранение высокого уровня анальгетической активности требует наличия метильной группы в  -положении гетероцикла. Установлена зависимость уровня биоактивности от абсолютной конфигурации асимметрических центров в молекуле анальгетика: например, а-продин (105), имеющий
-положении гетероцикла. Установлена зависимость уровня биоактивности от абсолютной конфигурации асимметрических центров в молекуле анальгетика: например, а-продин (105), имеющий  -метильный и
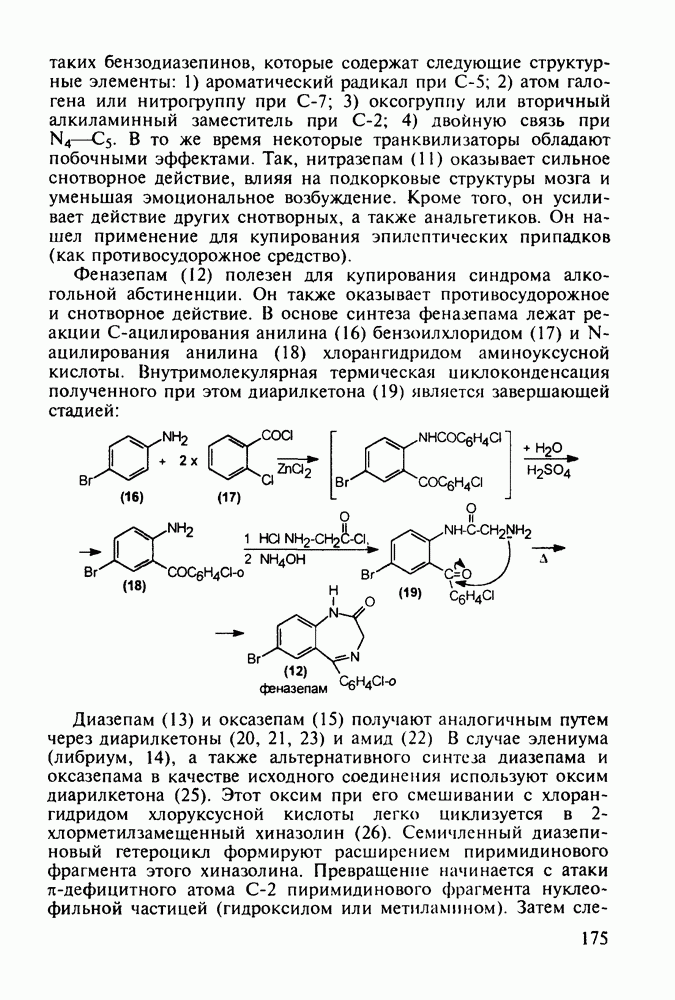
-метильный и  -фенильный радикалы в
-фенильный радикалы в  -диэкваториальном положении, обладает наибольшей активностью.
-диэкваториальном положении, обладает наибольшей активностью.
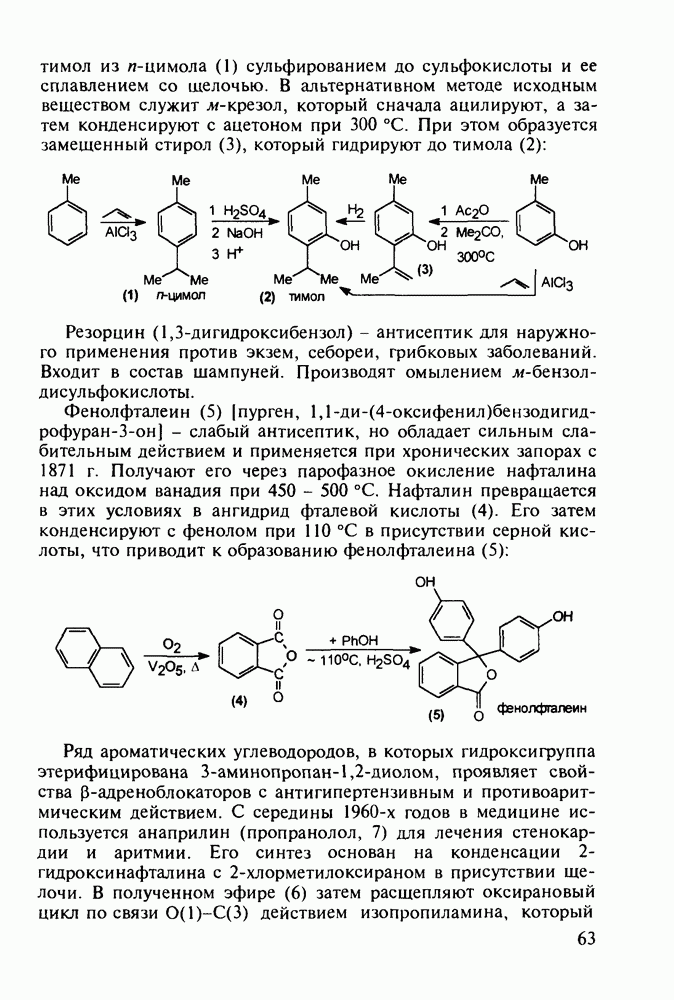
Этогептазин (104) получают последовательным алкилированием фенилацетонитрила через производные (108) и (109). Соединение (109) термически циклизуют и превращают циангруппу в этоксикарбонильную:

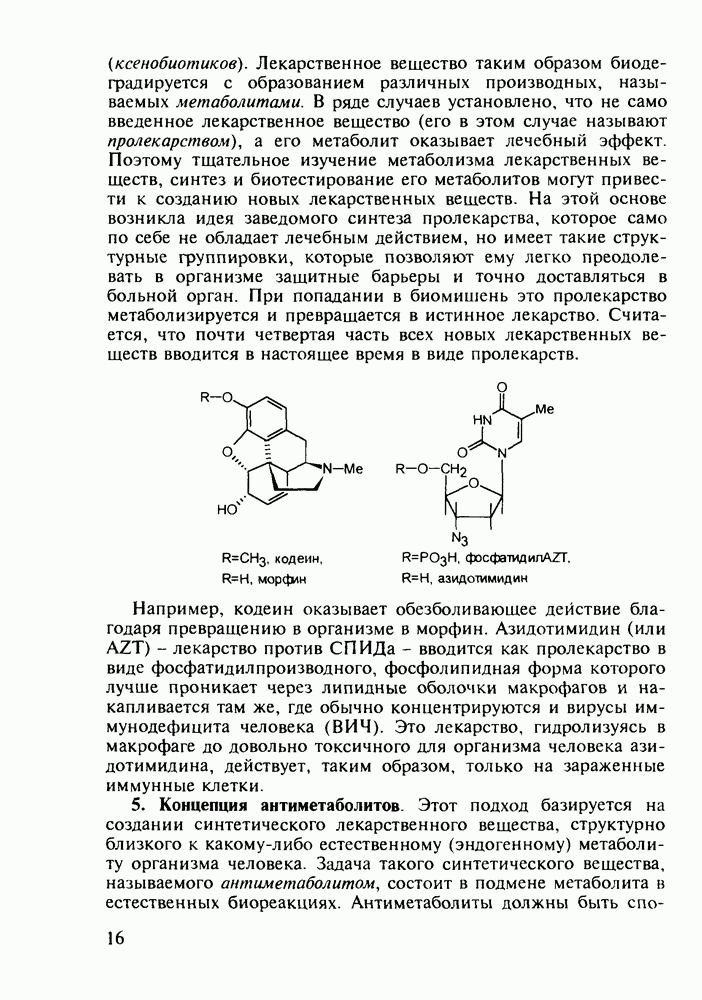
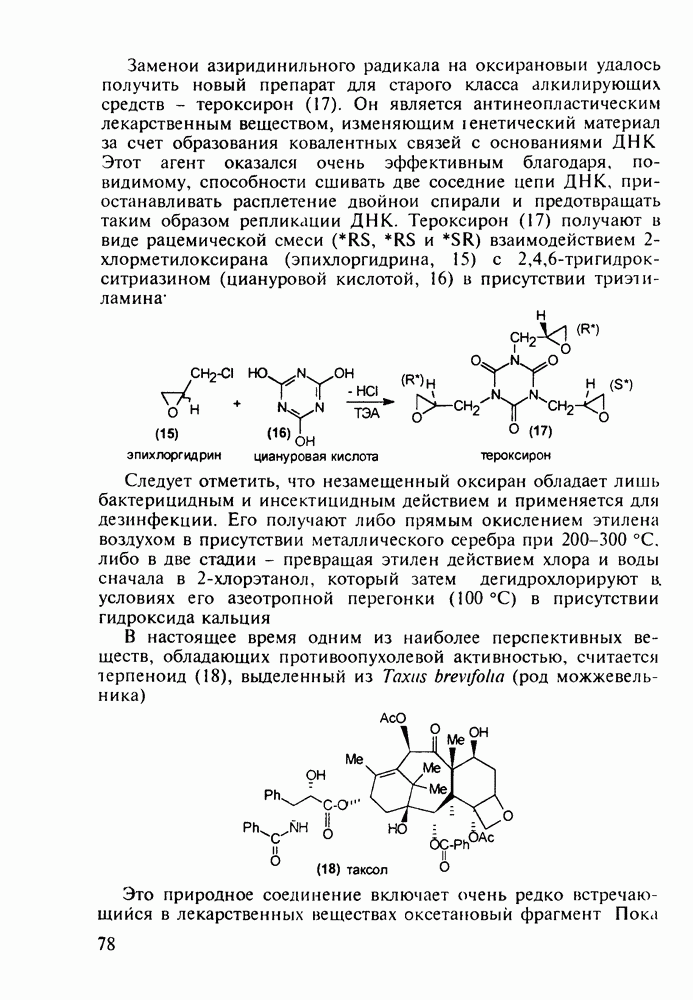
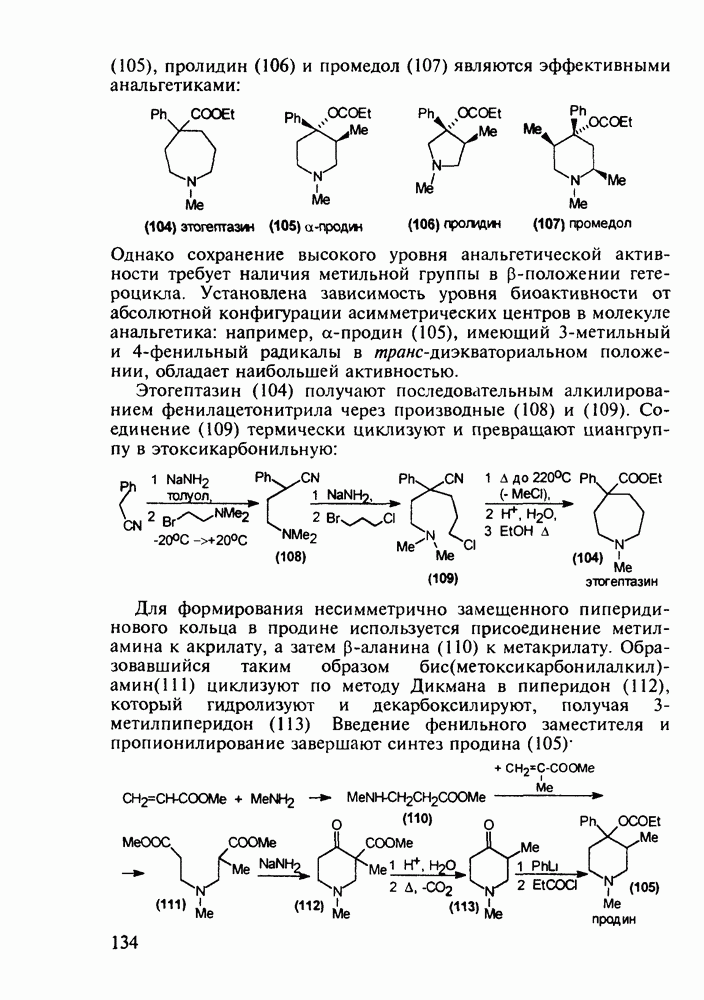
Для формирования несимметрично замещенного пиперидинового кольца в продине используется присоединение метиламина к акрилату, а затем  -аланина (110) к метакрилату. Образовавшийся таким образом бис(метоксикарбонилалкил)-амин(111) циклизуют по методу Дикмана в пиперидон (112), который гидролизуют и декарбоксил ируют, получая 3-метилпиперидон (113) Введение фенильного заместителя и пропионилирование завершают синтез продина (105)
-аланина (110) к метакрилату. Образовавшийся таким образом бис(метоксикарбонилалкил)-амин(111) циклизуют по методу Дикмана в пиперидон (112), который гидролизуют и декарбоксил ируют, получая 3-метилпиперидон (113) Введение фенильного заместителя и пропионилирование завершают синтез продина (105)

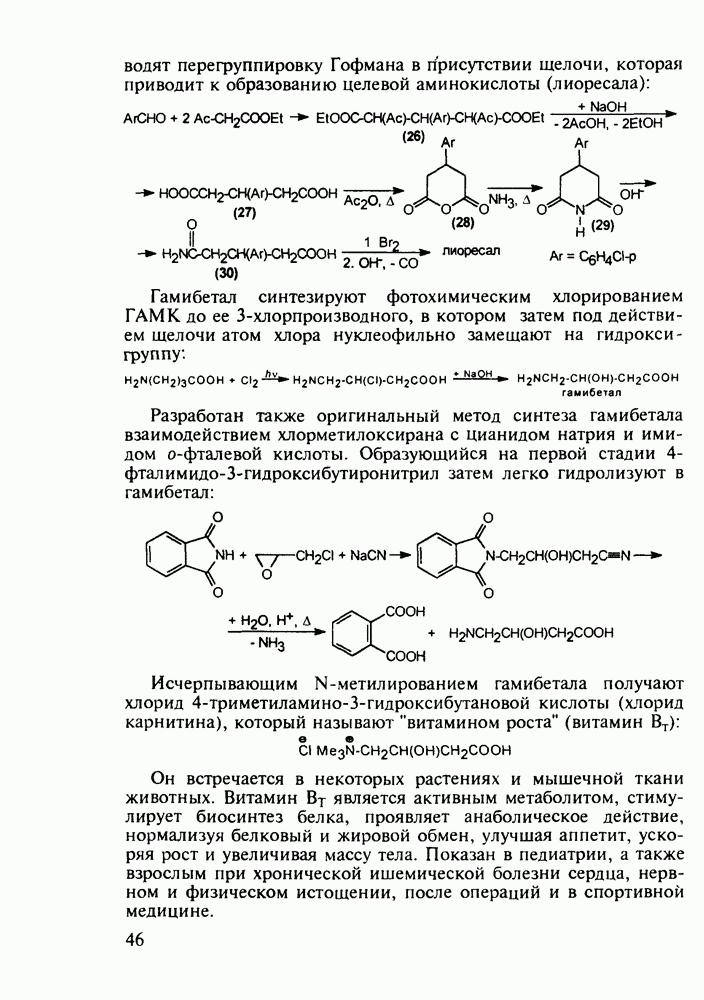
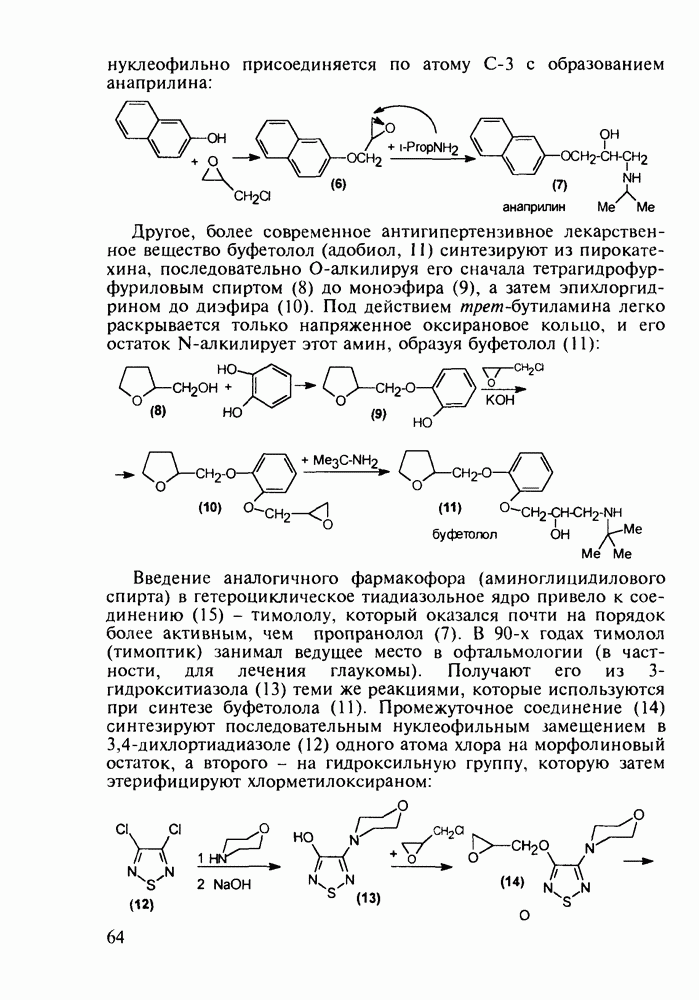
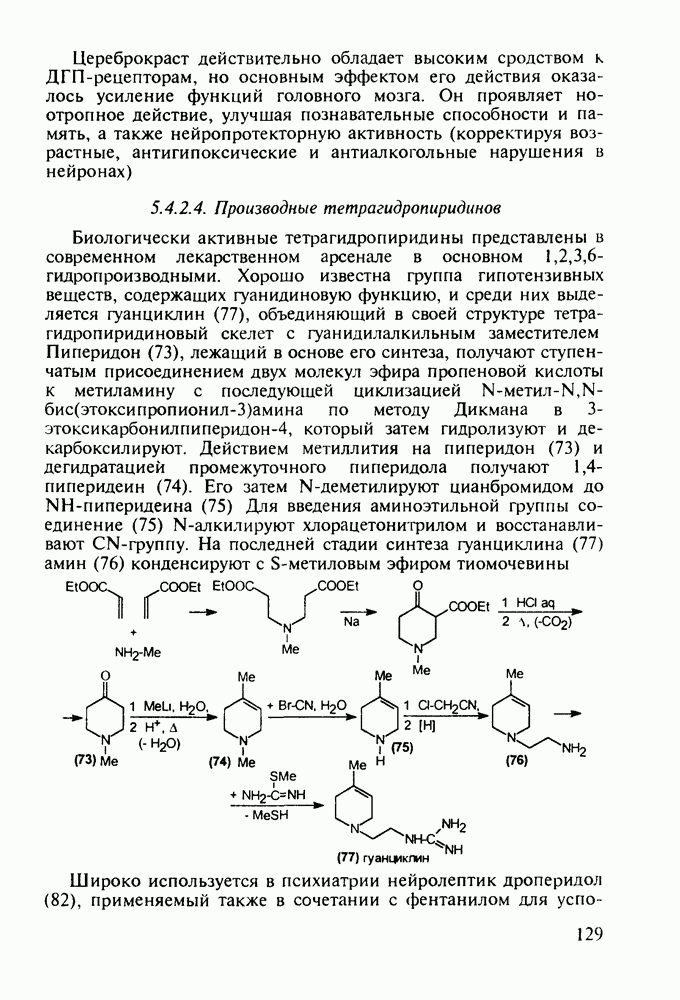
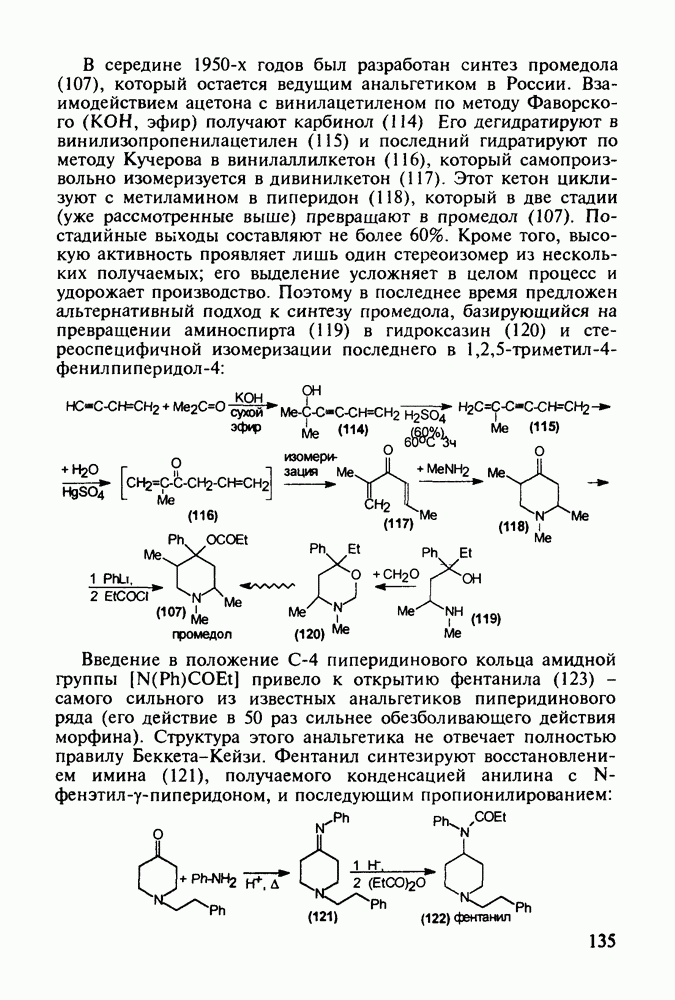
В середине 1950-х годов был разработан синтез промедола (107), который остается ведущим анальгетиком в России. Взаимодействием ацетона с винилацетиленом по методу Фаворского (КОН, эфир) получают карбинол (114) Его дегидратируют в винилизопропенилацетилен (115) и последний гидратируют по методу Кучерова в винилаллилкетон (116), который самопроизвольно изомеризуется в дивинилкетон (117). Этот кетон циклизуют с метиламином в пиперидон (118), который в две стадии (уже рассмотренные выше) превращают в промедол (107). Постадийные выходы составляют не более 60%. Кроме того, высокую активность проявляет лишь один стереоизомер из нескольких получаемых; его выделение усложняет в целом процесс и удорожает производство. Поэтому в последнее время предложен альтернативный подход к синтезу промедола, базирующийся на превращении аминоспирта (119) в гидроксазин (120) и стереоспецифичной изомеризации последнего в 1,2,5-триметил-4-фенилпиперидол-4:

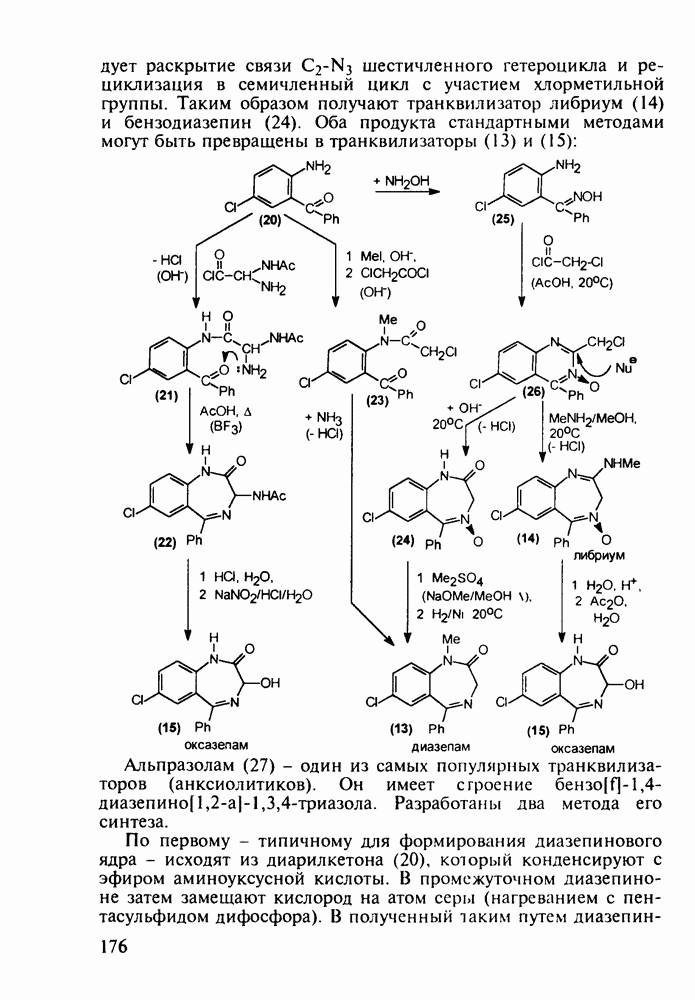
Введение в положение  пиперидинового кольца амидной группы
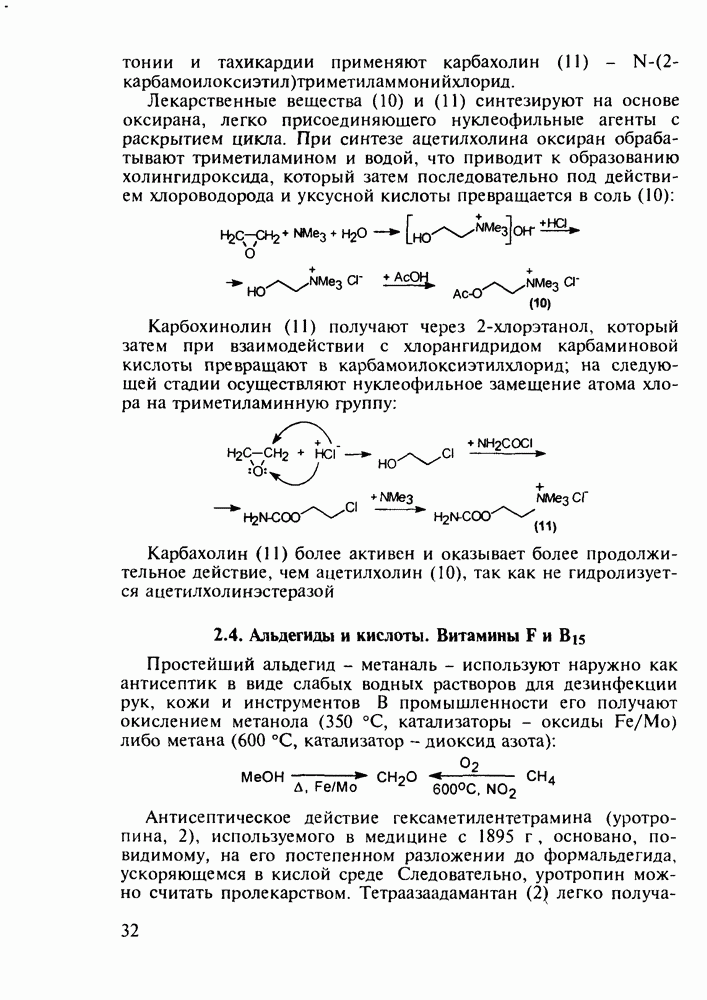
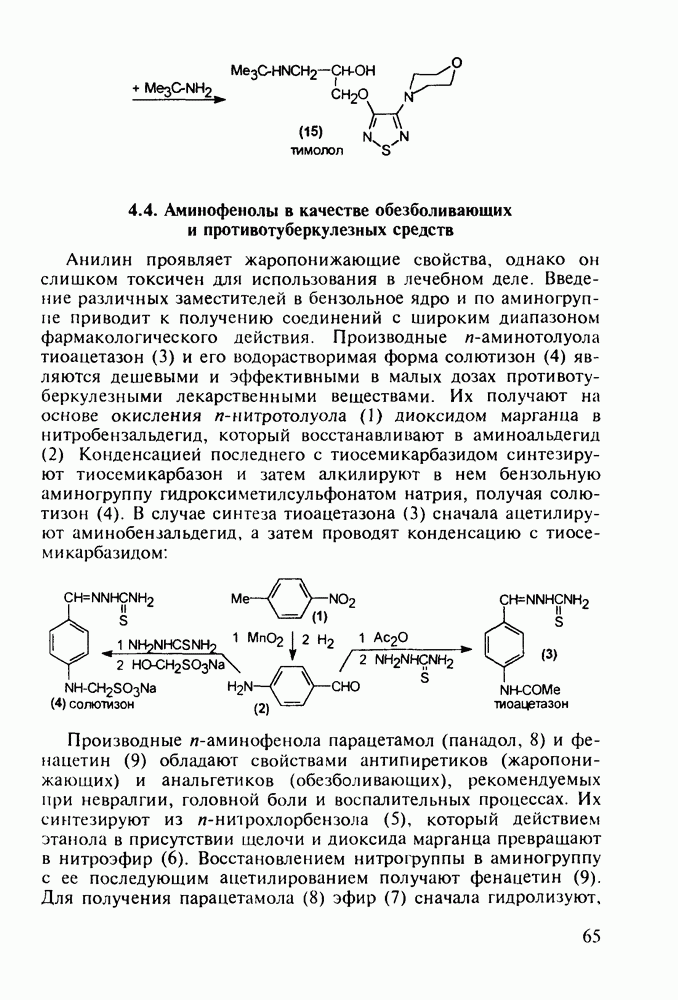
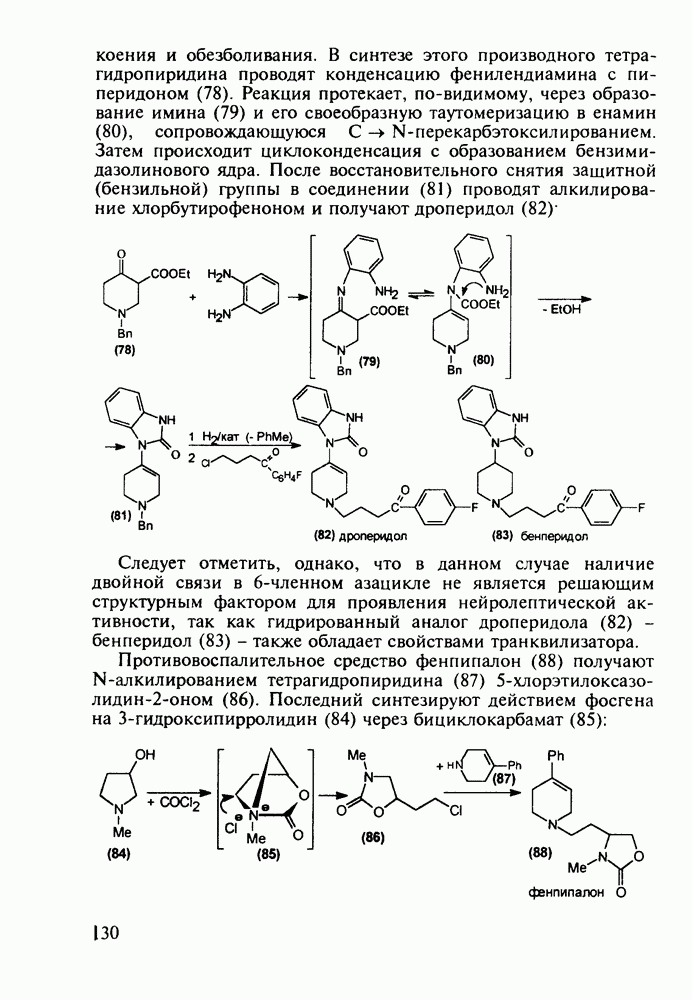
пиперидинового кольца амидной группы  привело к открытию фентанила (123) - самого сильного из известных анальгетиков пиперидинового ряда (его действие в 50 раз сильнее обезболивающего действия морфина). Структура этого анальгетика не отвечает полностью правилу Беккета-Кейзи. Фентанил синтезируют восстановлением имина (121), получаемого конденсацией анилина с N-фенэтил-у-пиперидоном, и последующим пропионилированием:
привело к открытию фентанила (123) - самого сильного из известных анальгетиков пиперидинового ряда (его действие в 50 раз сильнее обезболивающего действия морфина). Структура этого анальгетика не отвечает полностью правилу Беккета-Кейзи. Фентанил синтезируют восстановлением имина (121), получаемого конденсацией анилина с N-фенэтил-у-пиперидоном, и последующим пропионилированием:

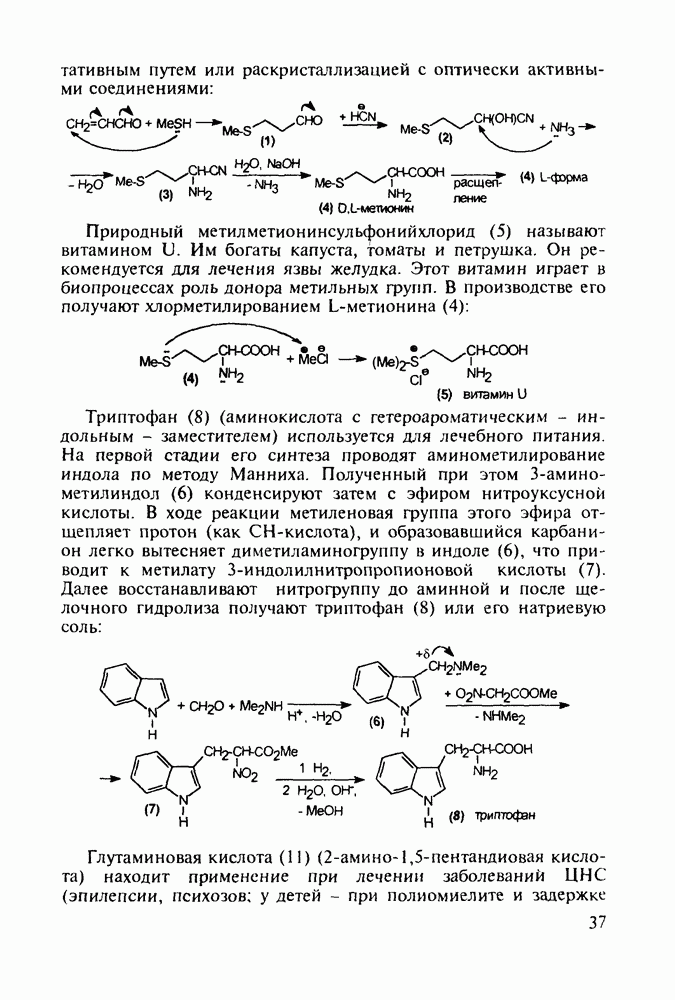
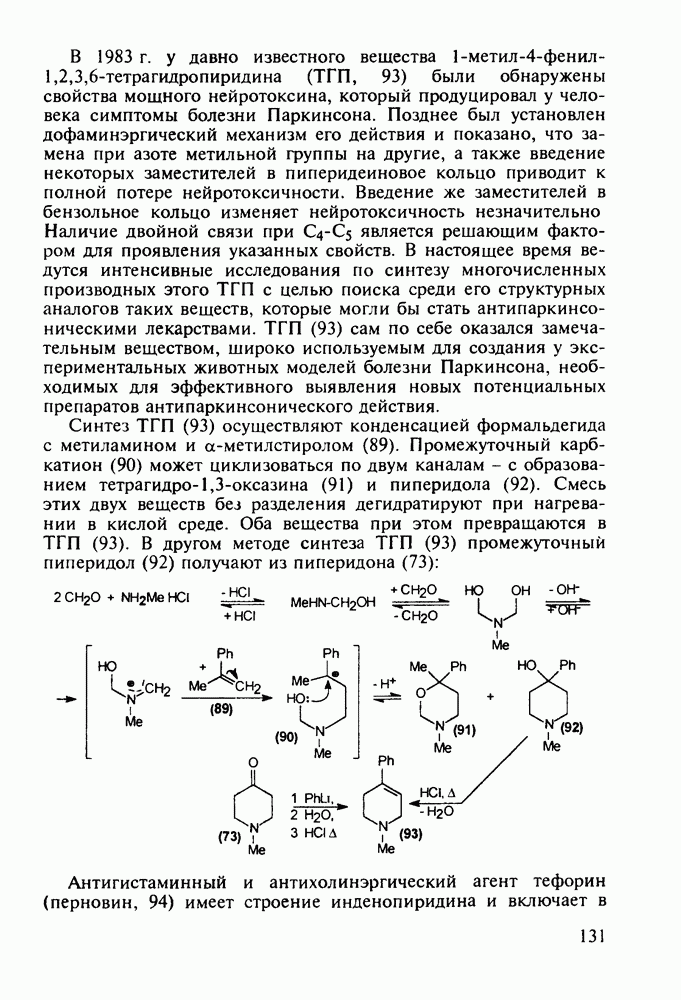
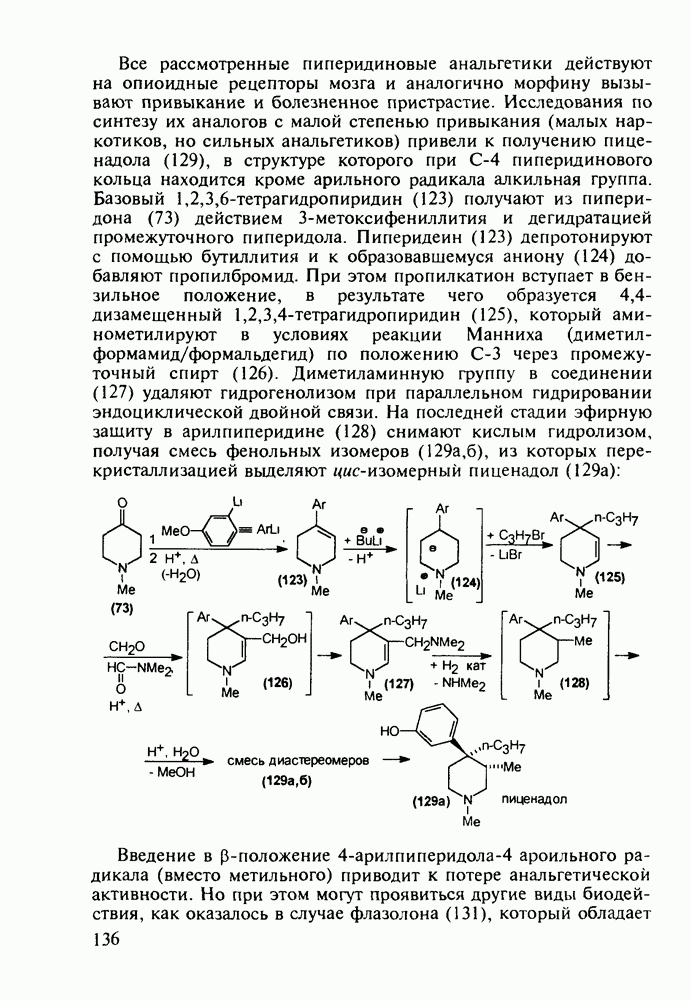
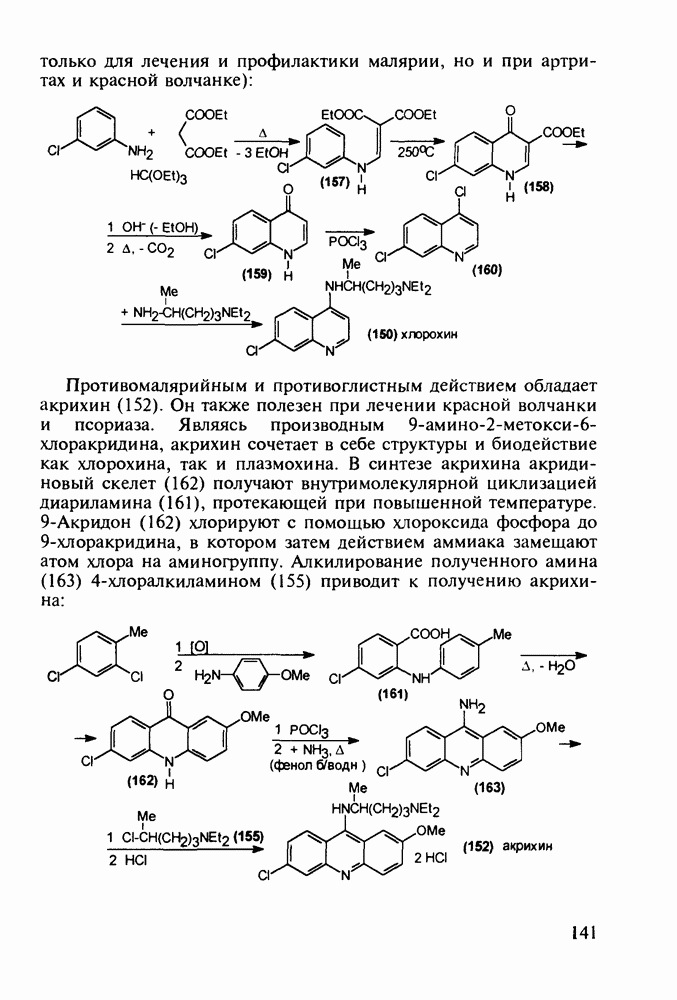
Все рассмотренные пиперидиновые анальгетики действуют на опиоидные рецепторы мозга и аналогично морфину вызывают привыкание и болезненное пристрастие. Исследования по синтезу их аналогов с малой степенью привыкания (малых наркотиков, но сильных анальгетиков) привели к получению пиценадола (129), в структуре которого при  пиперидинового кольца находится кроме арильного радикала алкильная группа. Базовый 1,2,3,6-тетрагидропиридин (123) получают из пиперидона (73) действием 3-метоксифениллития и дегидратацией промежуточного пиперидола. Пиперидеин (123) депротонируют с помощью бутиллития и к образовавшемуся аниону (124) добавляют пропилбромид. При этом пропилкатион вступает в бензильное положение, в результате чего образуется 4,4-дизамещенный 1,2,3,4-тетрагидропиридин (125), который аминометилируют в условиях реакции Манниха (диметил-формамид/формальдегид) по положению
пиперидинового кольца находится кроме арильного радикала алкильная группа. Базовый 1,2,3,6-тетрагидропиридин (123) получают из пиперидона (73) действием 3-метоксифениллития и дегидратацией промежуточного пиперидола. Пиперидеин (123) депротонируют с помощью бутиллития и к образовавшемуся аниону (124) добавляют пропилбромид. При этом пропилкатион вступает в бензильное положение, в результате чего образуется 4,4-дизамещенный 1,2,3,4-тетрагидропиридин (125), который аминометилируют в условиях реакции Манниха (диметил-формамид/формальдегид) по положению  через промежуточный спирт (126). Диметиламинную группу в соединении (127) удаляют гидрогенолизом при параллельном гидрировании эндоциклической двойной связи. На последней стадии эфирную защиту в арилпиперидине (128) снимают кислым гидролизом, получая смесь фенольных изомеров
через промежуточный спирт (126). Диметиламинную группу в соединении (127) удаляют гидрогенолизом при параллельном гидрировании эндоциклической двойной связи. На последней стадии эфирную защиту в арилпиперидине (128) снимают кислым гидролизом, получая смесь фенольных изомеров  из которых перекристаллизацией выделяют цис-изомерный пиценадол (129 а):
из которых перекристаллизацией выделяют цис-изомерный пиценадол (129 а):
 (128)
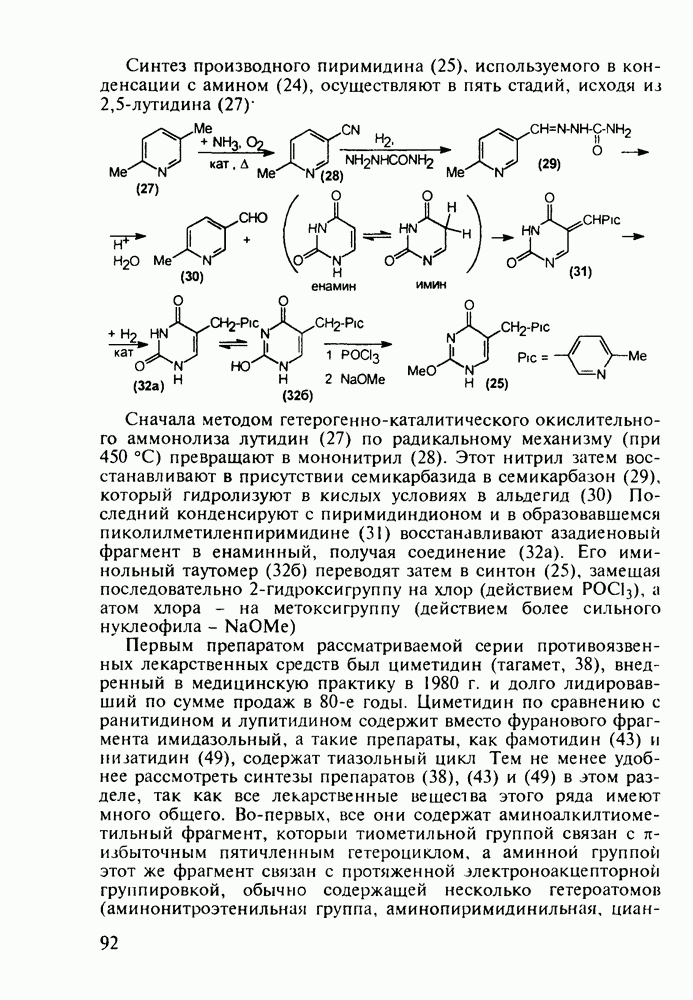
(128)
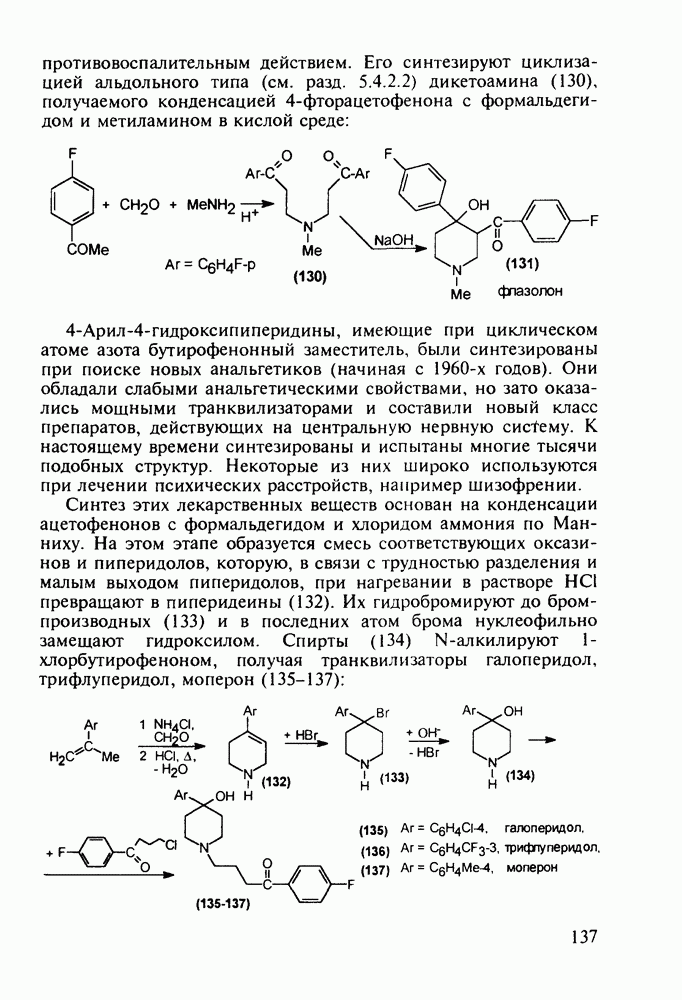
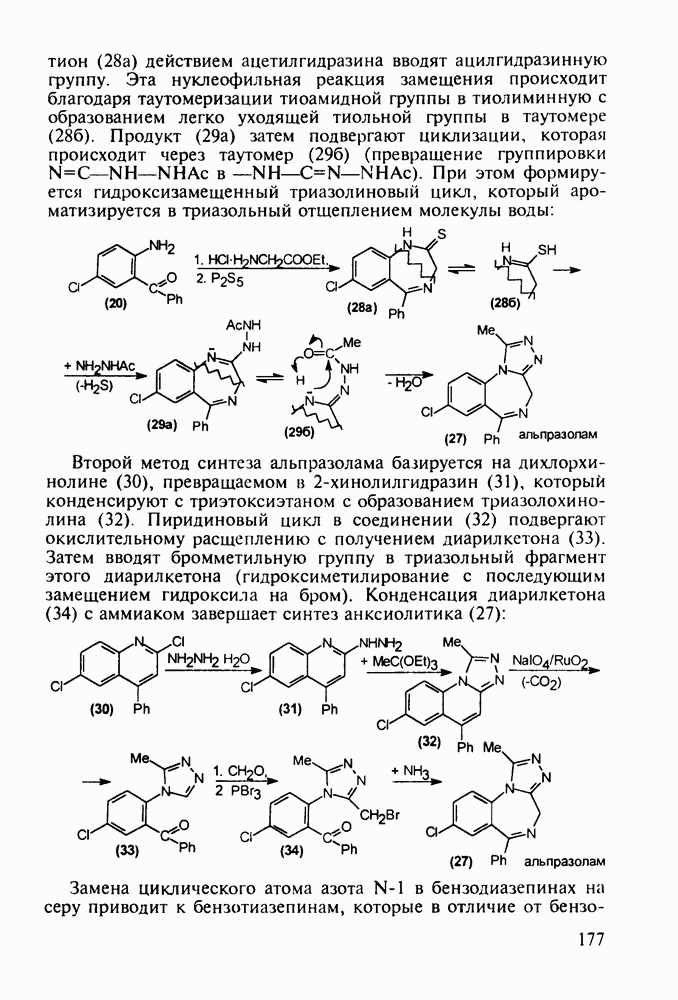
Введение в  -положение 4-арилпиперидола-4 ароильного радикала (вместо метильного) приводит к потере анальгетической активности. Но при этом могут проявиться другие виды биодействия, как оказалось в случае флазолона (131), который обладает
-положение 4-арилпиперидола-4 ароильного радикала (вместо метильного) приводит к потере анальгетической активности. Но при этом могут проявиться другие виды биодействия, как оказалось в случае флазолона (131), который обладает
противовоспалительным действием. Его синтезируют циклизацией альдольного типа (см. разд. 5.4.2.2) дикетоамина (130), получаемого конденсацией 4-фторацетофенона с формальдегидом и метиламином в кислой среде:

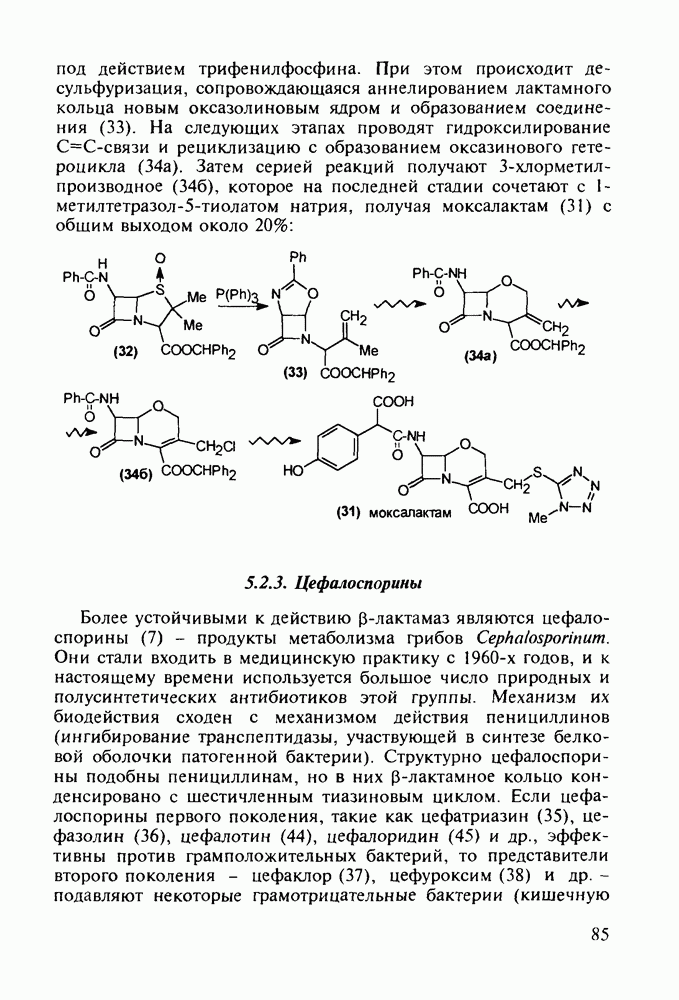
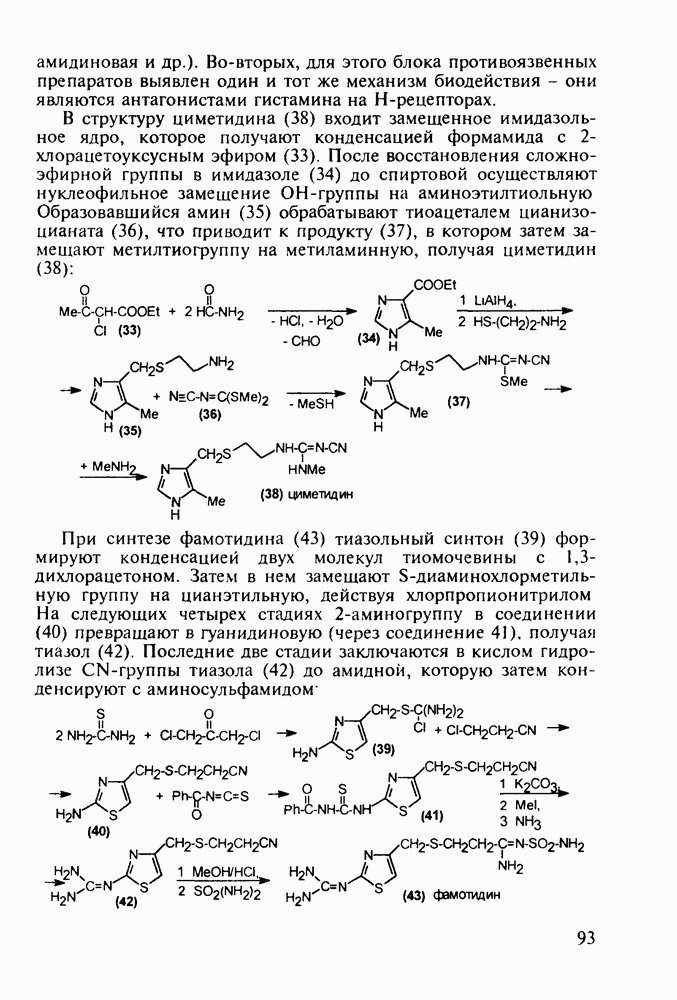
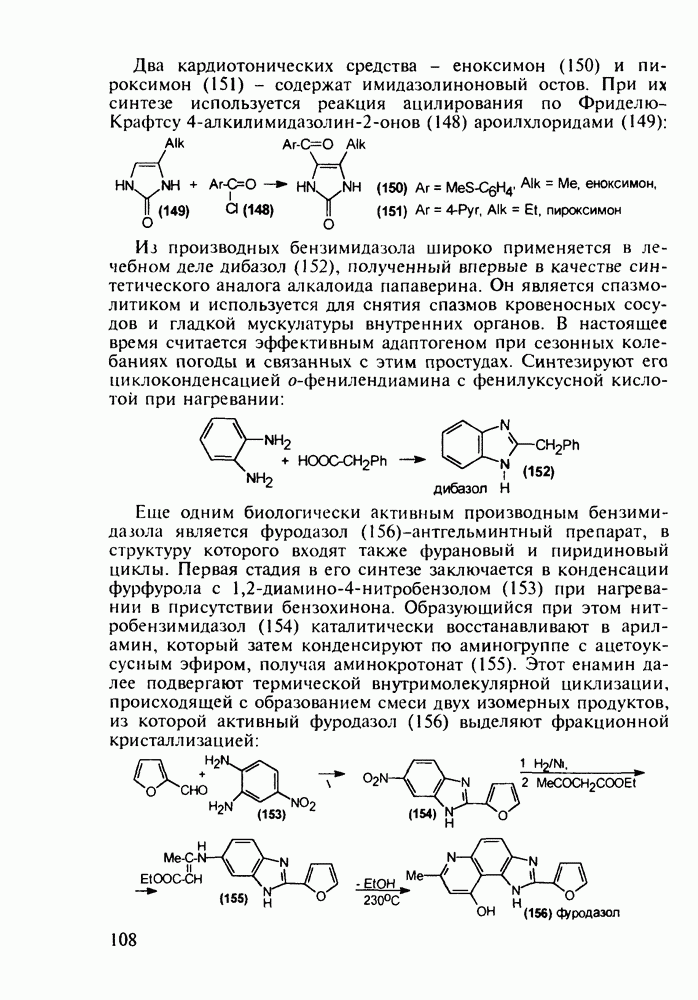
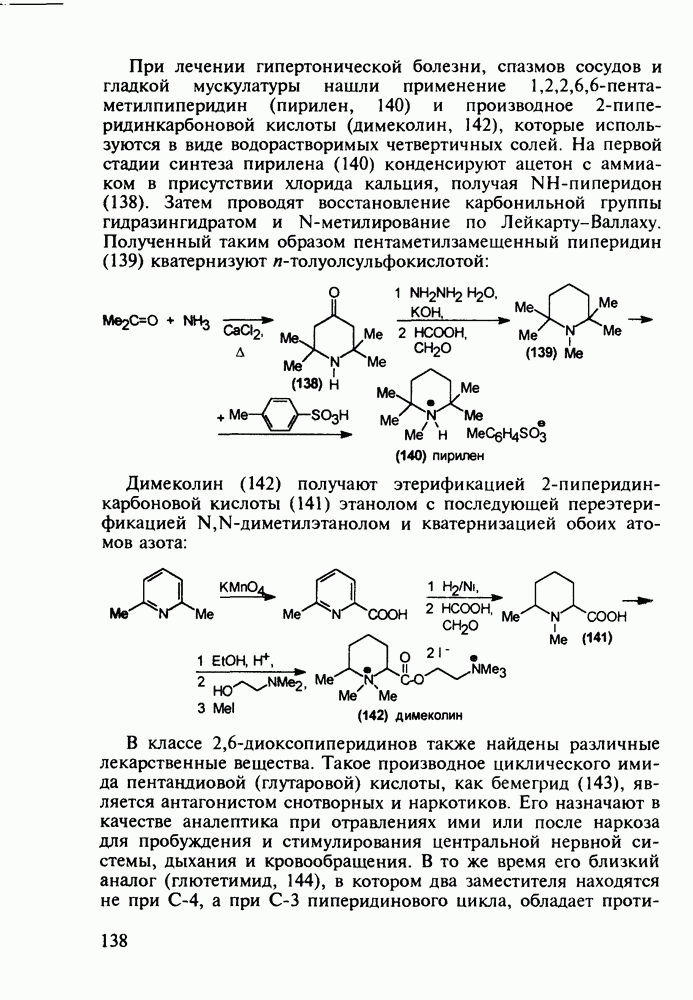
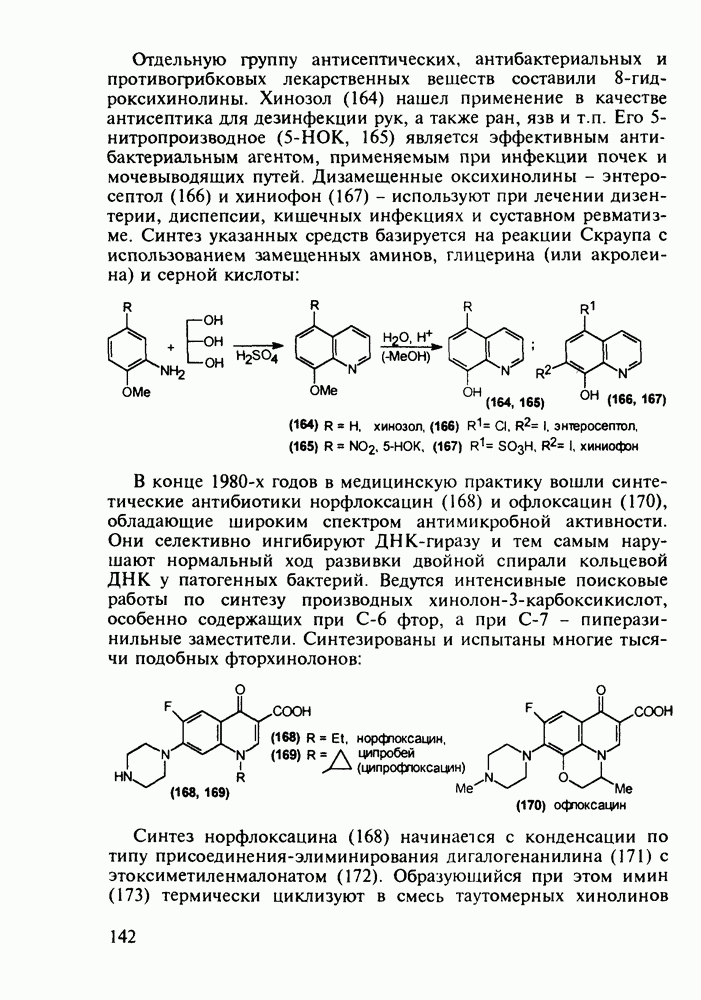
4-Арил-4-гидроксипиперидины, имеющие при циклическом атоме азота бутирофенонный заместитель, были синтезированы при поиске новых анальгетиков (начиная с 1960-х годов). Они обладали слабыми анальгетическими свойствами, но зато оказались мощными транквилизаторами и составили новый класс препаратов, действующих на центральную нервную систему. К настоящему времени синтезированы и испытаны многие тысячи подобных структур. Некоторые из них широко используются при лечении психических расстройств, например шизофрении.
Синтез этих лекарственных веществ основан на конденсации ацетофенонов с формальдегидом и хлоридом аммония по Манниху. На этом этапе образуется смесь соответствующих оксазинов и пиперидолов, которую, в связи с трудностью разделения и малым выходом пиперидолов, при нагревании в растворе  превращают в пиперидеины (132). Их гидробромируют до бромпроизводных (133) и в последних атом брома нуклеофильно замещают гидроксилом. Спирты
превращают в пиперидеины (132). Их гидробромируют до бромпроизводных (133) и в последних атом брома нуклеофильно замещают гидроксилом. Спирты  -хлорбутирофеноном, получая транквилизаторы галоперидол, трифлуперидол, моперон (135-137):
-хлорбутирофеноном, получая транквилизаторы галоперидол, трифлуперидол, моперон (135-137):

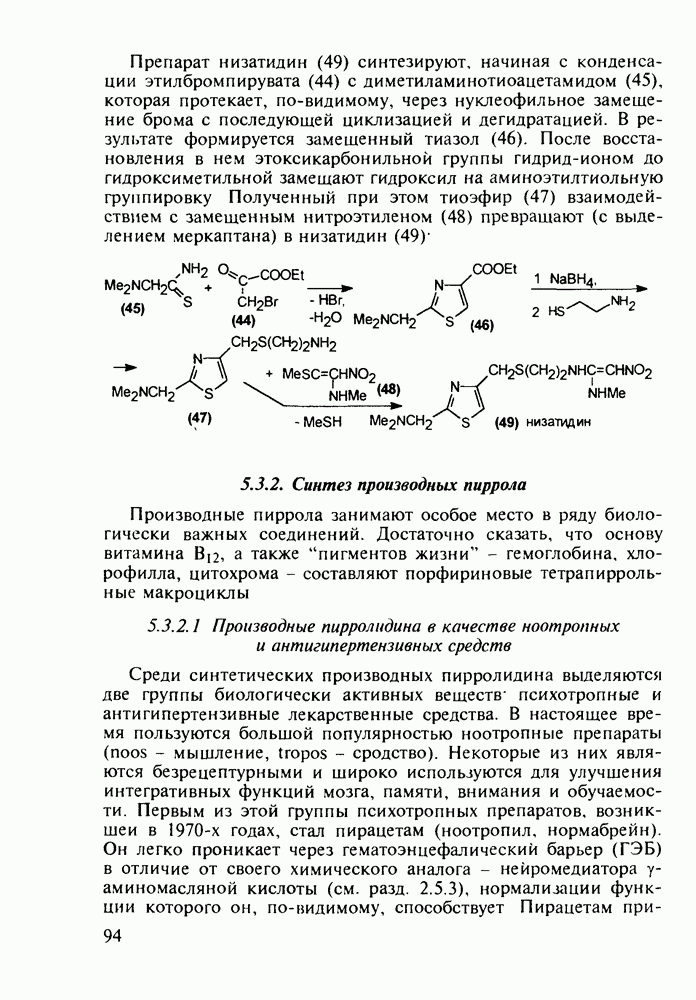
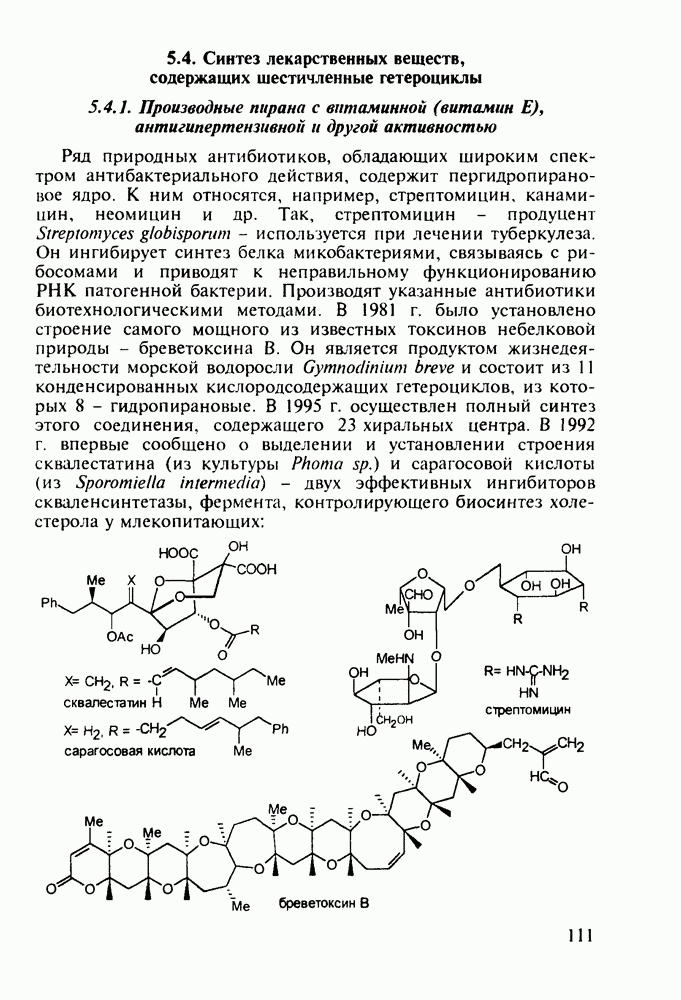
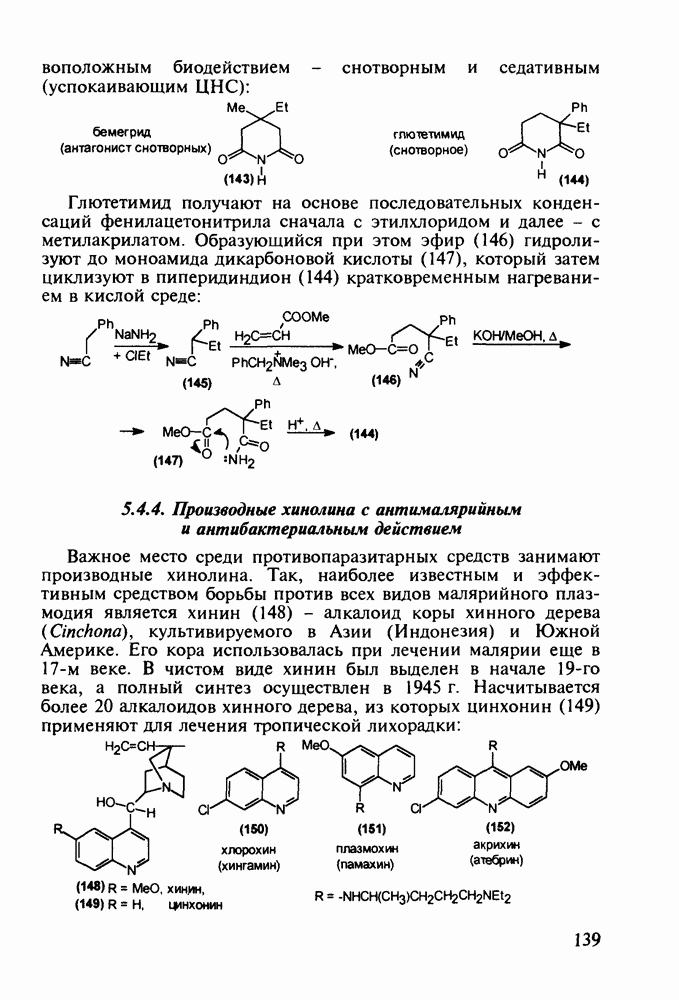
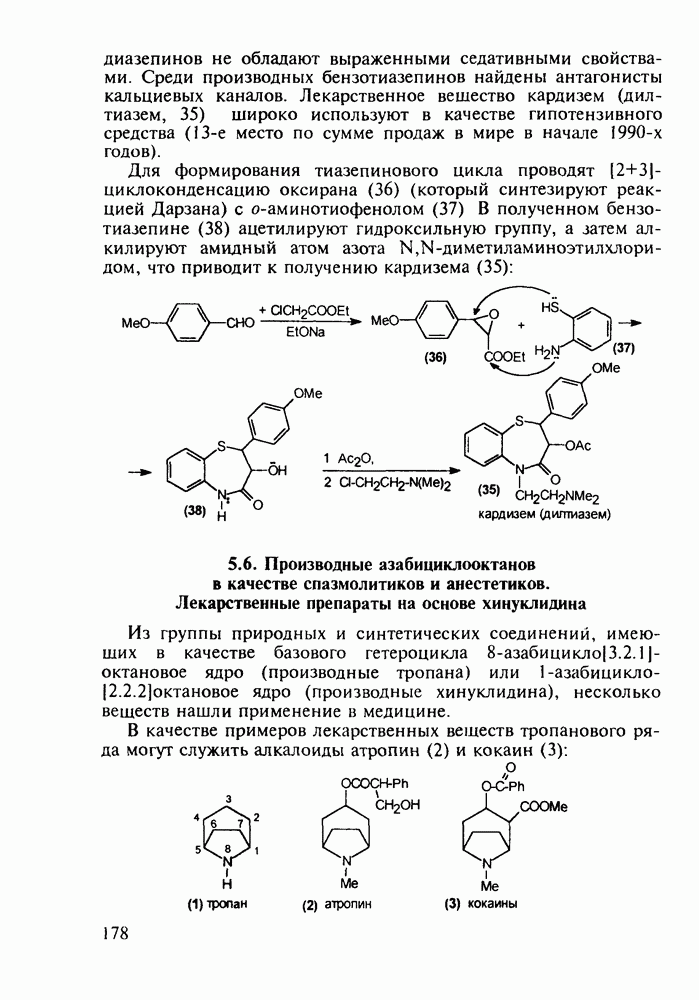
При лечении гипертонической болезни, спазмов сосудов и гладкой мускулатуры нашли применение 1,2,2,6,6-пента-метилпиперидин (пирилен, 140) и производное 2-пиперидинкарбоновой кислоты (димеколин, 142), которые используются в виде водорастворимых четвертичных солей. На первой стадии синтеза пирилена (140) конденсируют ацетон с аммиаком в присутствии хлорида кальция, получая NH-пиперидон (138). Затем проводят восстановление карбонильной группы гидразингидратом и N-метилирование по Лейкарту-Валлаху. Полученный таким образом пентаметилзамещенный пиперидин (139) кватернизуют  -толуолсульфокислотой:
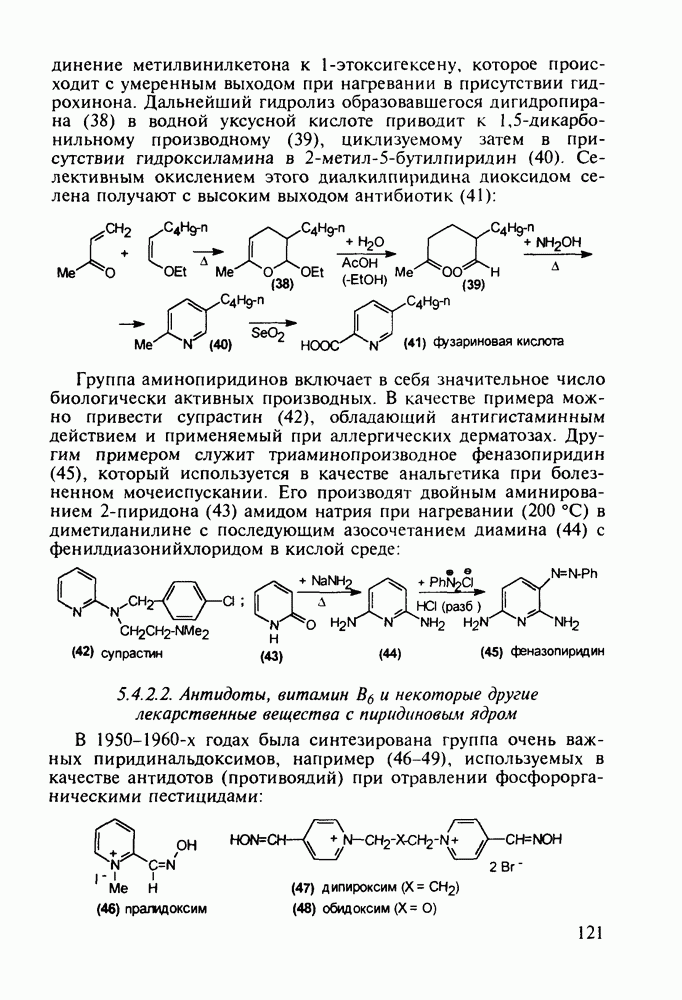
-толуолсульфокислотой:

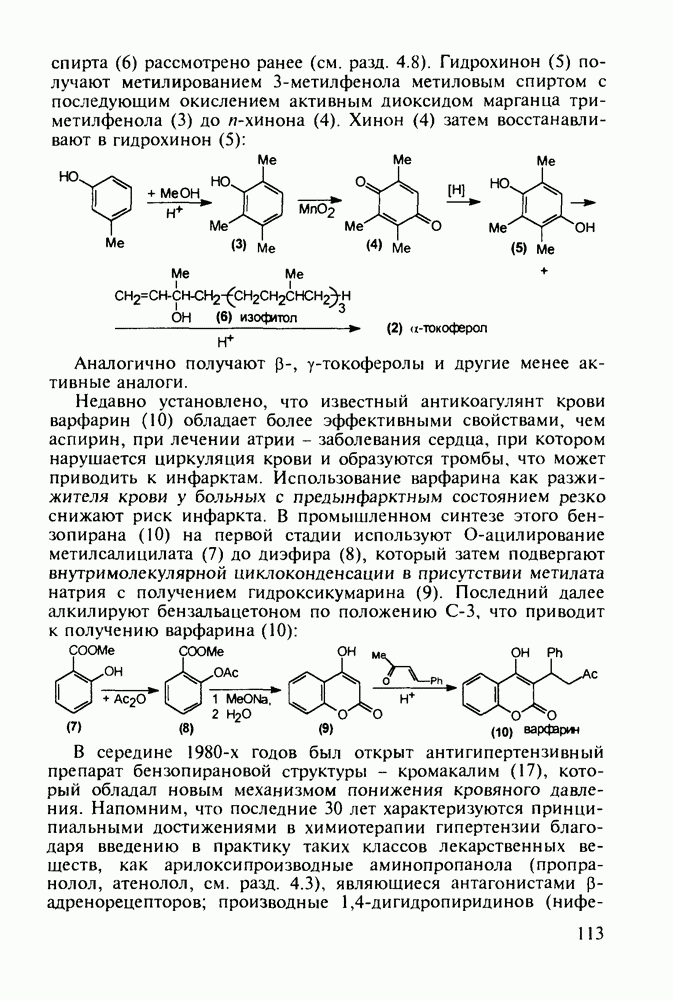
Димеколин (142) получают этерификацией 2-пиперидин-карбоновой кислоты (141) этанолом с последующей переэтерификацией  -диметилэтанолом и кватернизацией обоих атомов азота:
-диметилэтанолом и кватернизацией обоих атомов азота:

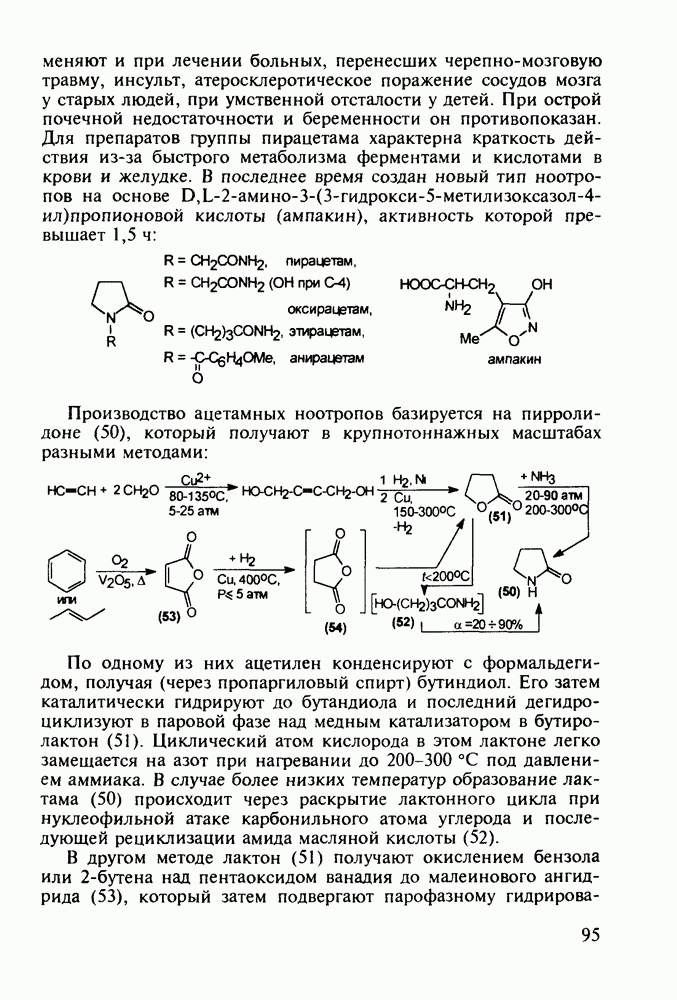
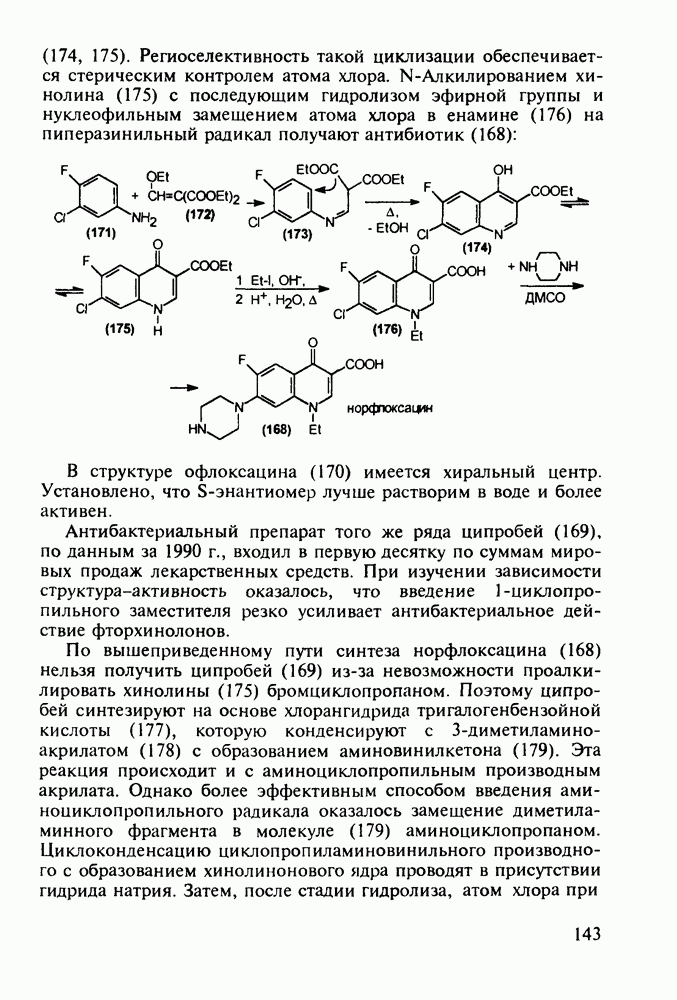
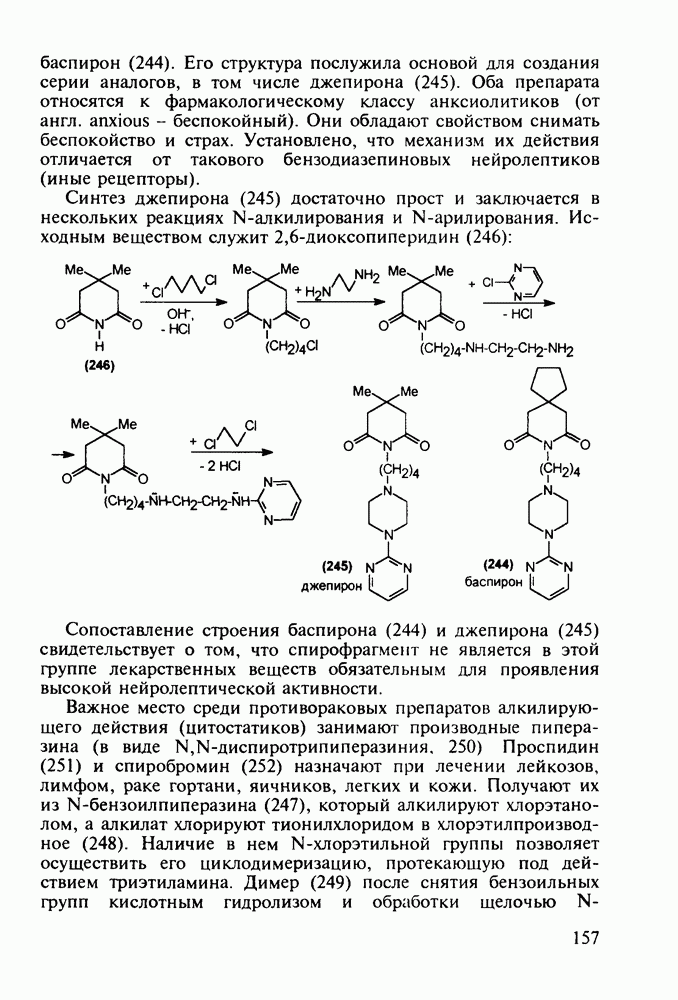
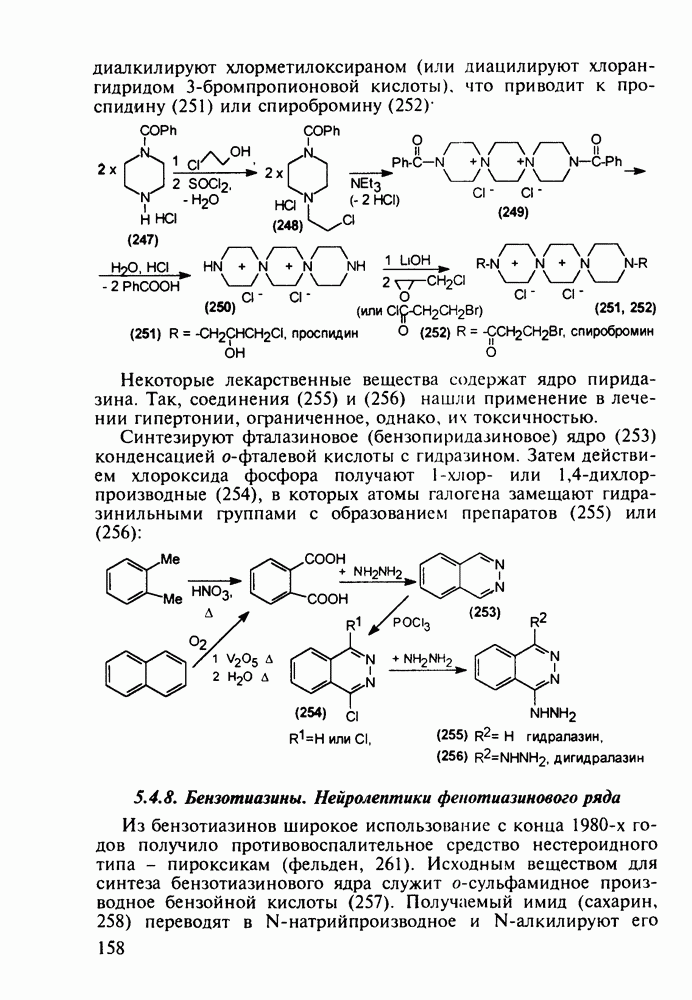
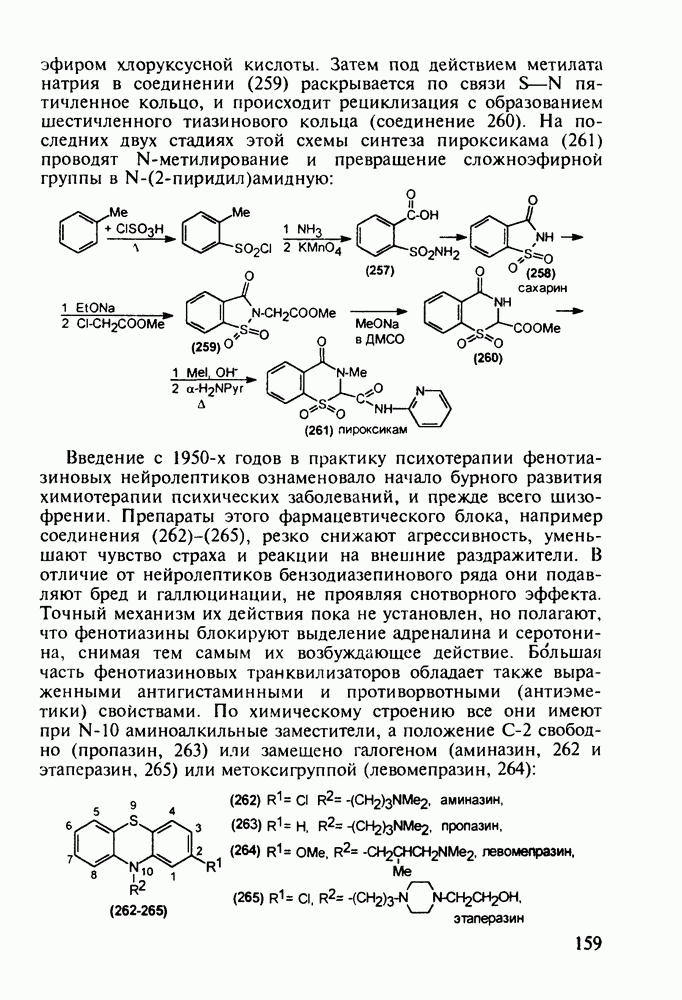
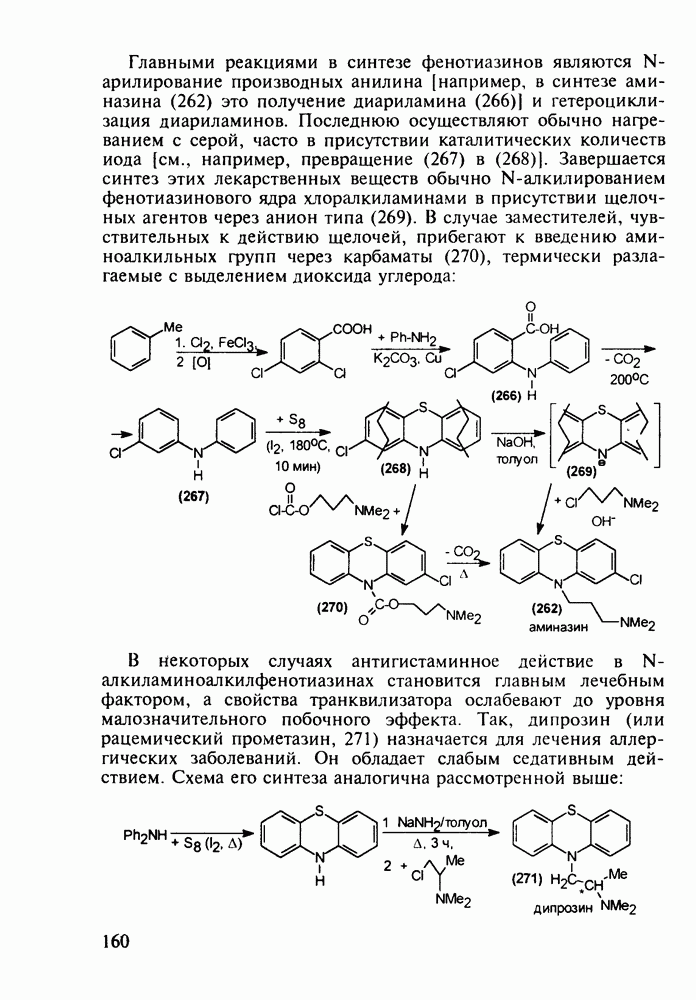
В классе 2,6-диоксопиперидинов также найдены различные лекарственные вещества. Такое производное циклического имида пентандиовой (глутаровой) кислоты, как бемегрид (143), является антагонистом снотворных и наркотиков. Его назначают в качестве аналептика при отравлениях ими или после наркоза для пробуждения и стимулирования центральной нервной системы, дыхания и кровообращения. В то же время его близкий аналог (глютетимид, 144), в котором два заместителя находятся не при С-4, а при С-3 пиперидинового цикла, обладает противоположным
биодействием - снотворным и седативным (успокаивающим ЦНС):

Глютетимид получают на основе последовательных конденсаций фенилацетонитрила сначала с этилхлоридом и далее - с метилакрилатом. Образующийся при этом эфир (146) гидролизуют до моноамида дикарбоновой кислоты (147), который затем циклизуют в пиперидиндион (144) кратковременным нагреванием в кислой среде:

| << Предыдущий параграф | Следующий параграф >> |
- Предисловие
- 1. ВВЕДЕНИЕ
- 1.1. Эволюция органической химии лекарственных веществ
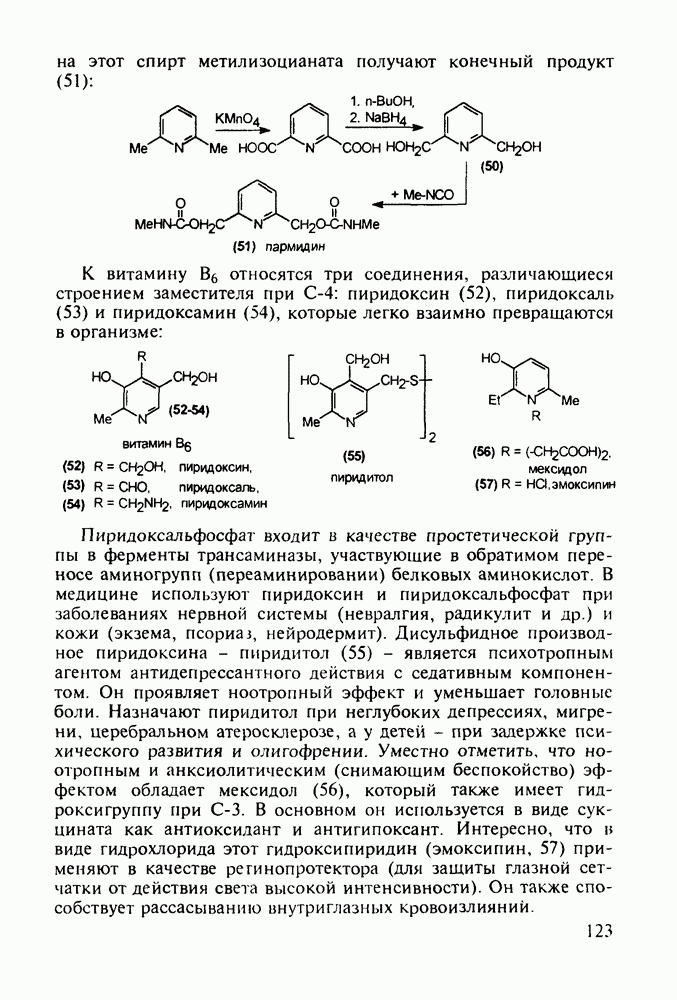
- 1.2. Современные требования к лекарственным веществам
- 1.3. Стадии биологического изучения лекарственного вещества
- 1.4. Основы стратегии создания новых синтетических лекарственных веществ
- 1.5. Связь структура-биологическая активность
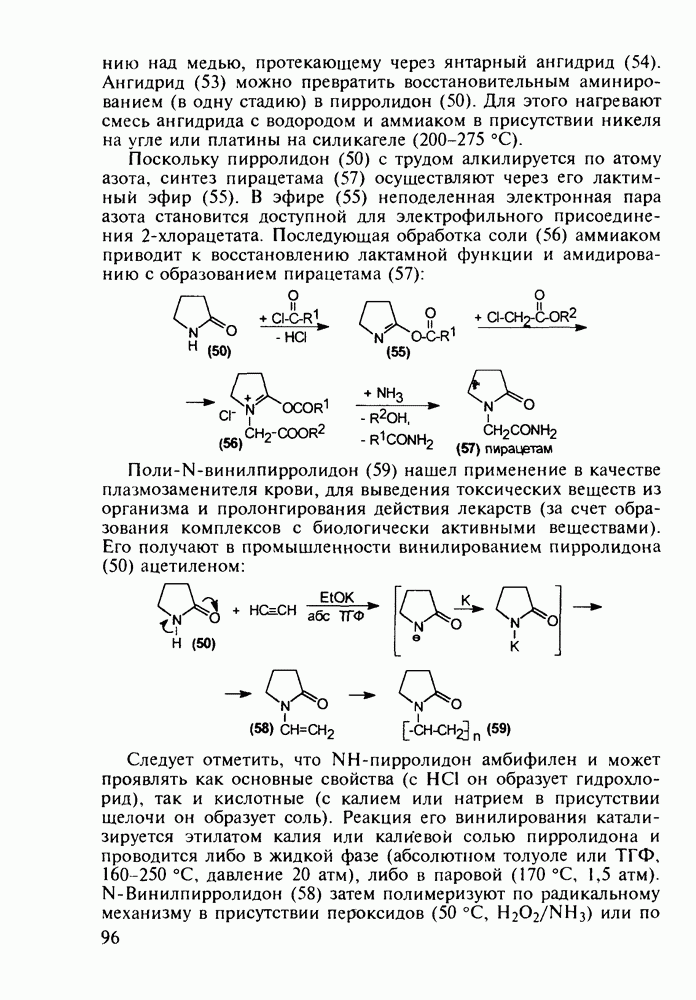
- 1.6. Принципиальная схема разработки нового лекарственного вещества
- 1.7. Классификация лекарственных веществ
- 1.8. Основные болезни человека и ведущие группы лекарственных веществ на современном фармацевтическом рынке
- 2. СИНТЕЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ АЛИФАТИЧЕСКОГО РЯДА
- 2.2. Группа противораковых веществ с дихлордиэтиламинным фармакофором
- 2.3. Алканолы, аминоалканолы и их эфиры. Нейромедиатор ацетилхолин и холиномиметики
- 2.4. Альдегиды и кислоты. Витамины F и B15
- 2.5. Аминокислоты
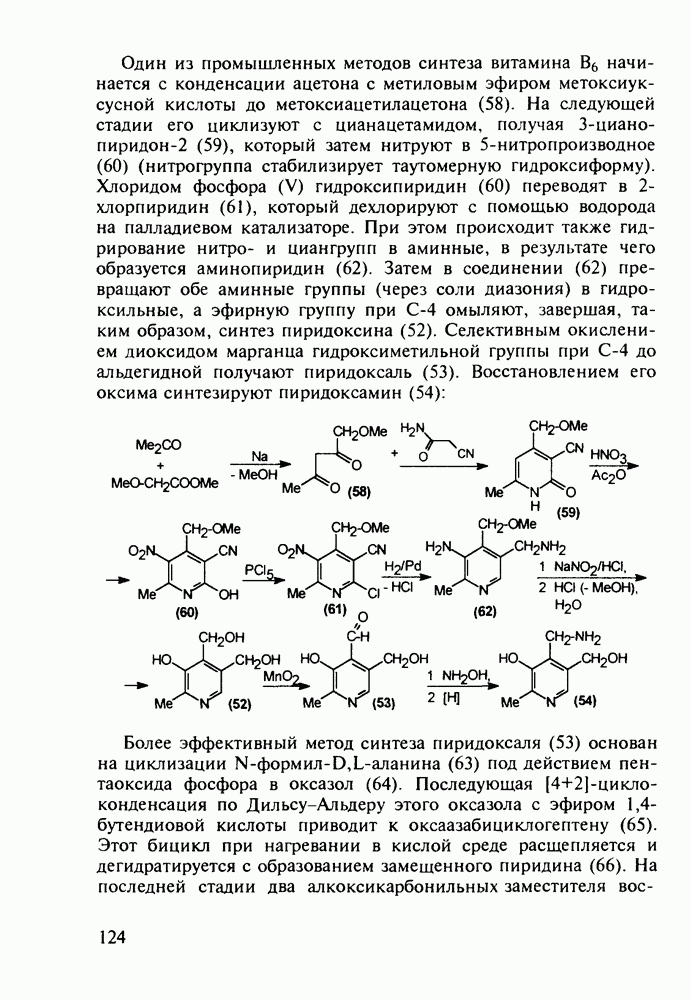
- 2.5.2. Производные b-аминокислот. Витамин B3
- 2.5.3. Производные у-аминомасляной кислоты. Нейротропные средства. Витамин BT
- 2.5.4. Другие аминокислоты
- 3. ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА АЛИЦИКЛИЧЕСКОГО РЯДА
- 3.2. Противозачаточные и противовоспалительные вещества на основе циклопентафенантрена. Синтез витамина D
- 3.3. Камфора. Производные адамантана в качестве антивирусных средств
- 4. СИНТЕЗ ПРОИЗВОДНЫХ АРОМАТИЧЕСКОГО РЯДА
- 4.2. Антигистаминные препараты группы диарилметана
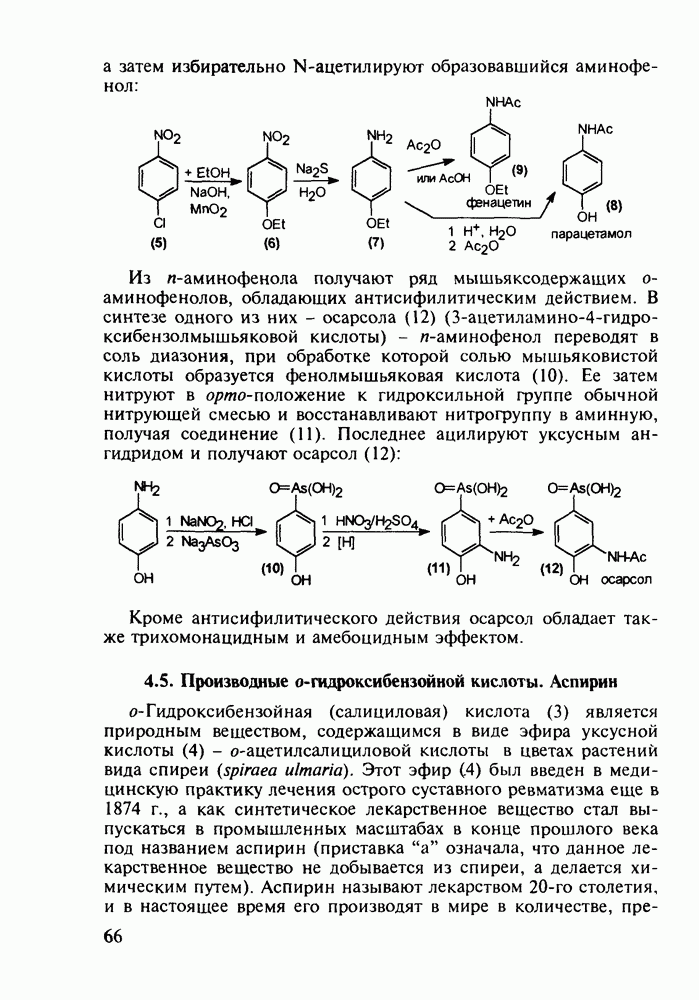
- 4.3. Антисептики и адреноблокаторы фенольного ряда
- 4.4. Аминофенолы в качестве обезболивающих и противотуберкулезных средств
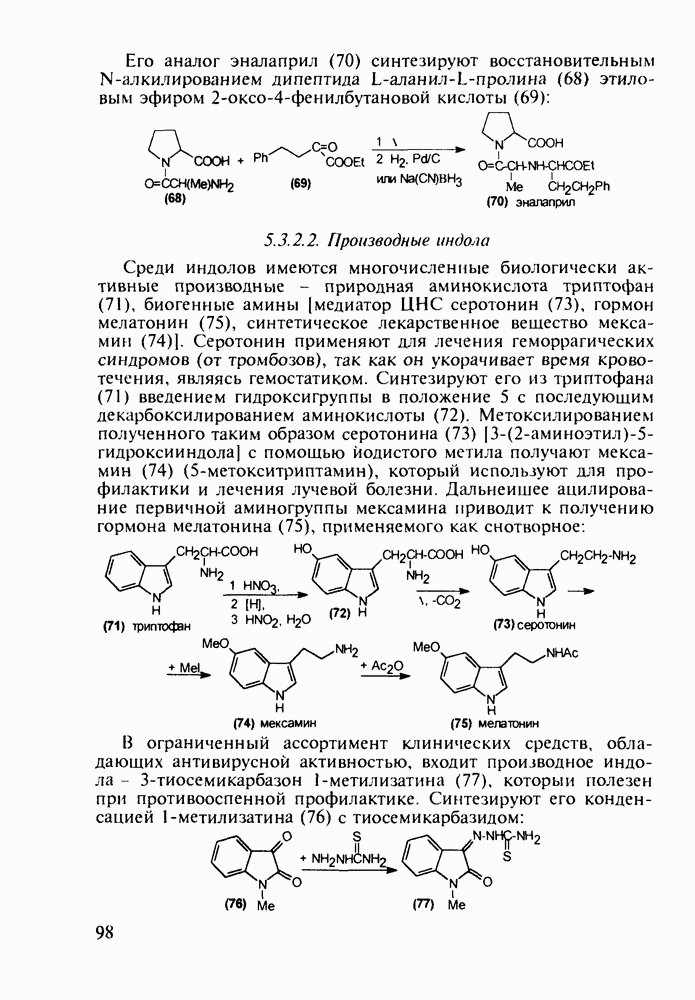
- 4.5. Производные о-гидроксибензойной кислоты. Аспирин
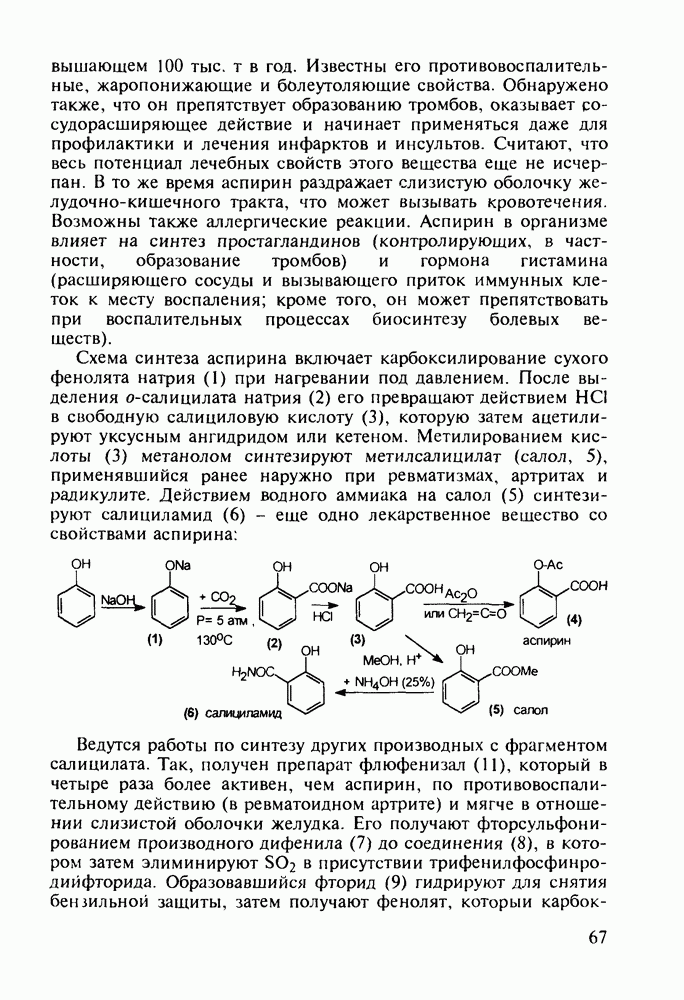
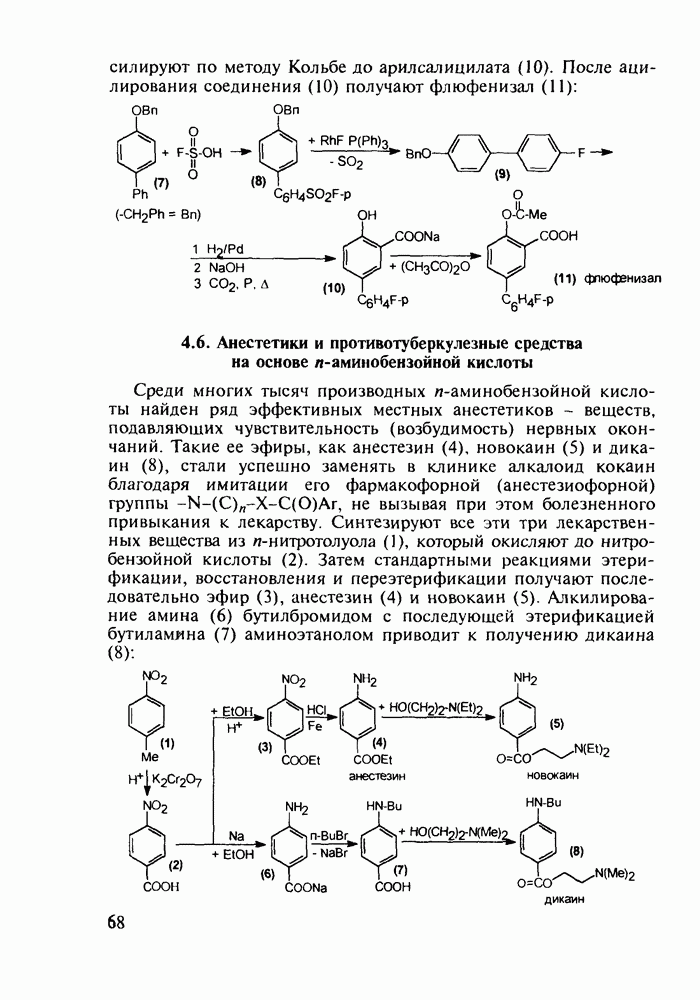
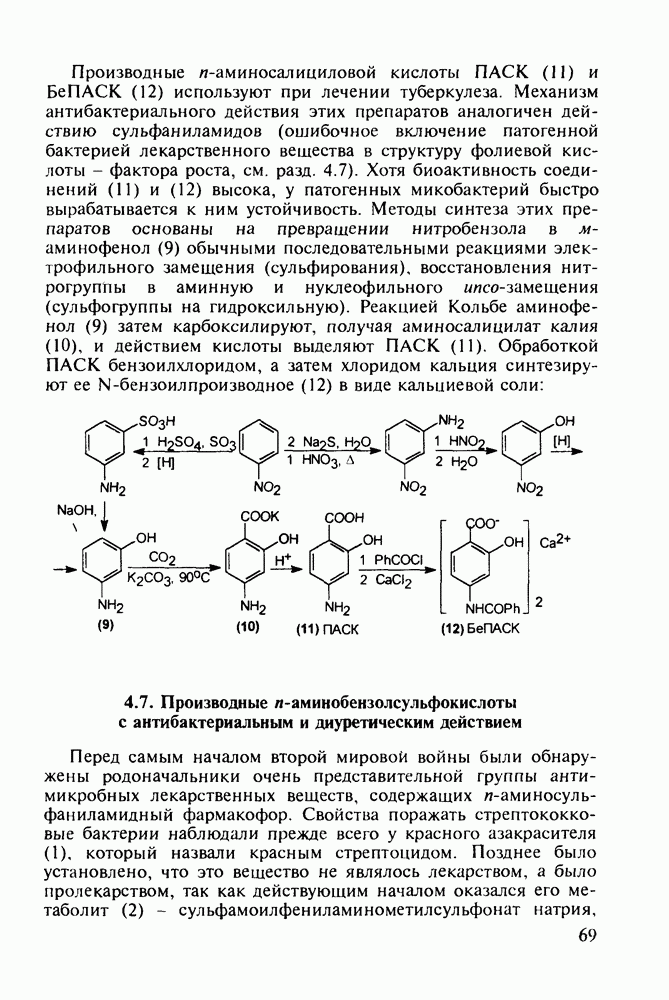
- 4.6. Анестетики и противотуберкулезные средства на основе n-аминобензойной кислоты
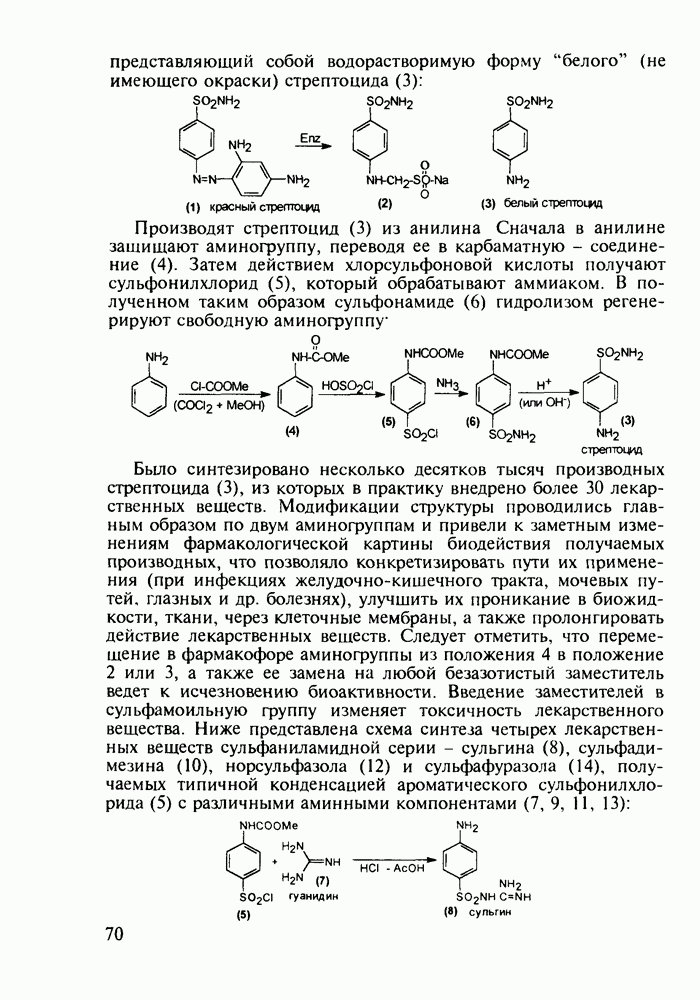
- 4.7. Производные n-аминобензолсульфокислоты с антибактериальным и диуретическим действием
- 4.8. Оксопроизводные нафталина. Витамин К1. Оксолин
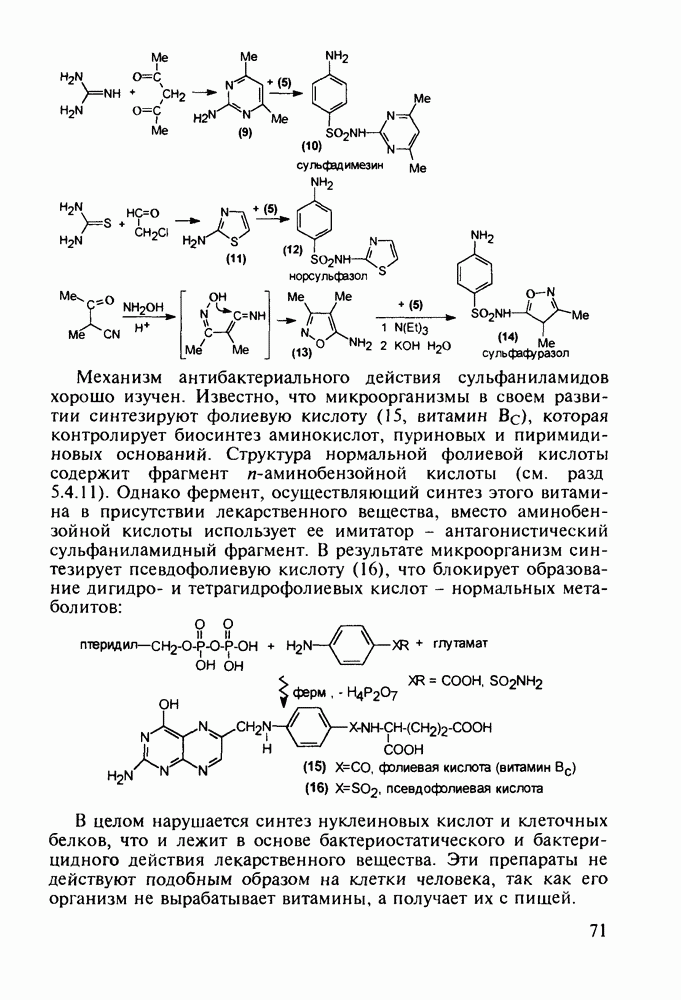
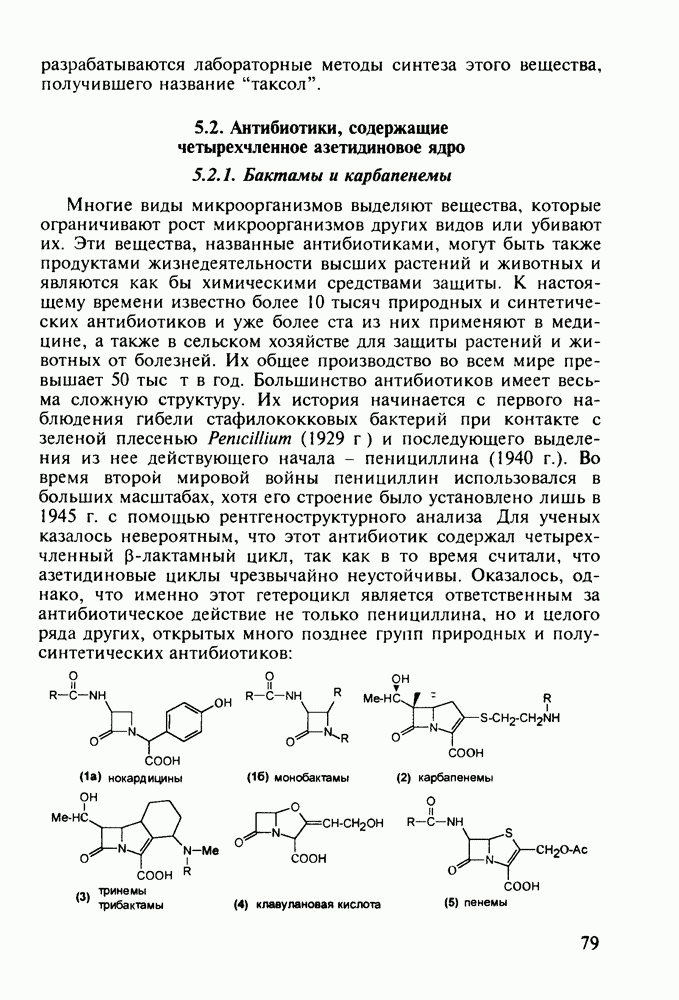
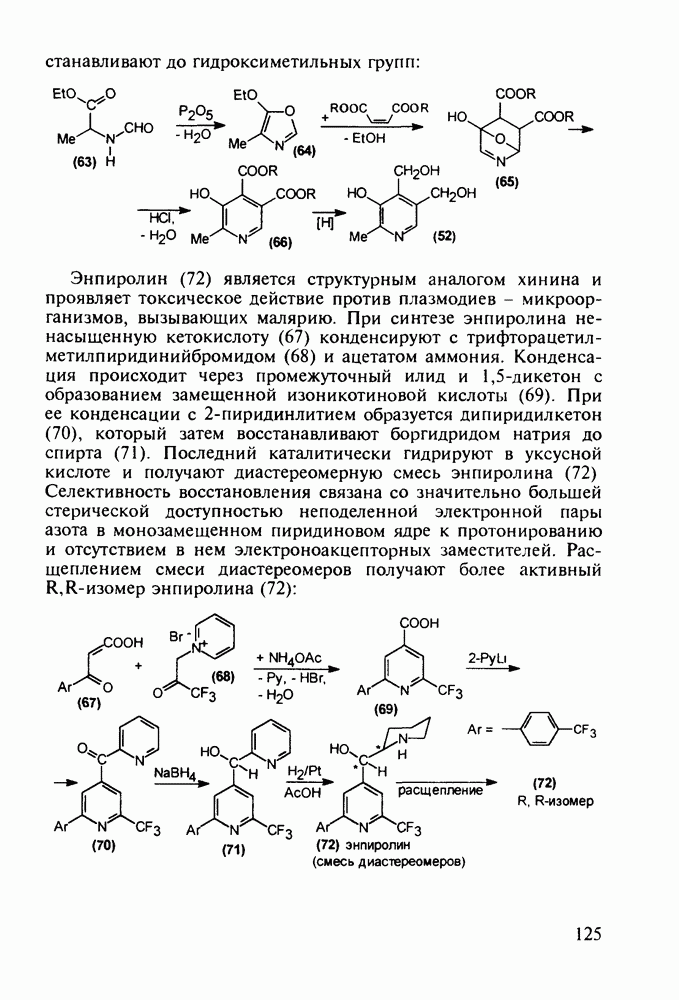
- 5. ХИМИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ С БАЗОВЫМ ГЕТЕРОЦИКЛИЧЕСКИМ ФРАГМЕНТОМ
- 5.2. Антибиотики, содержащие четырехчленное азетидиновое ядро
- 5.2.2. Пенициллины. Моксалактам
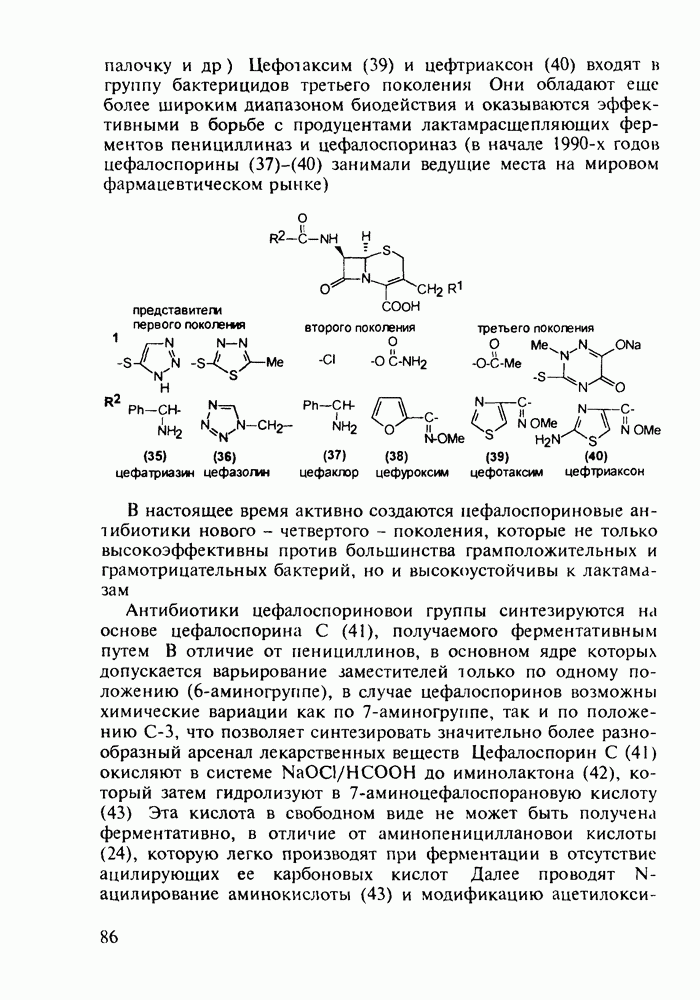
- 5.2.3. Цефалоспорины
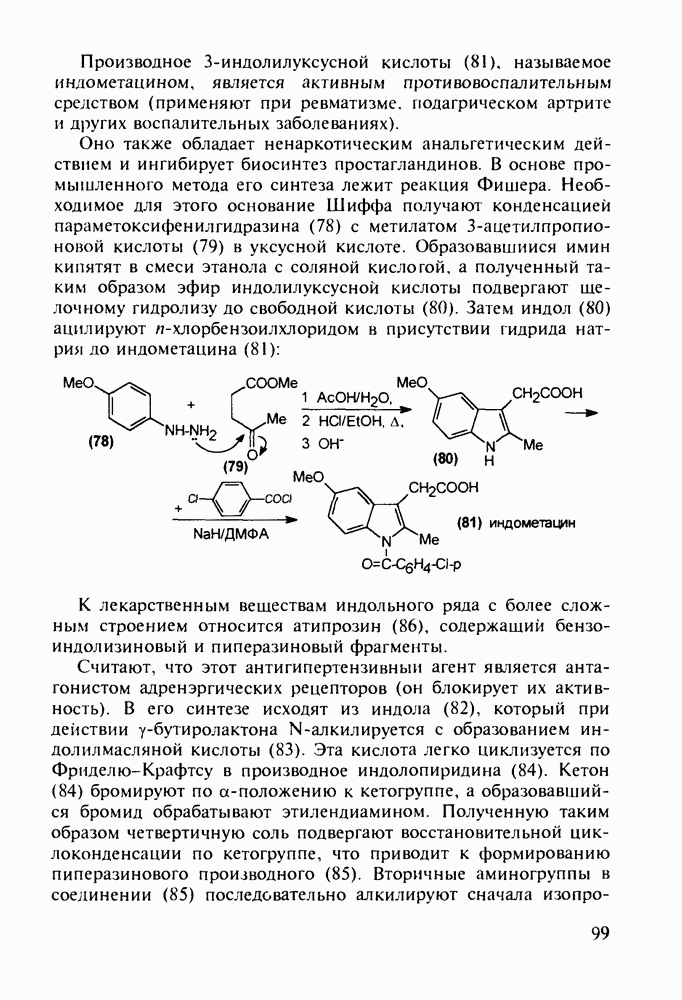
- 5.3. Лекарственные вещества на основе пятичленных гетероциклов
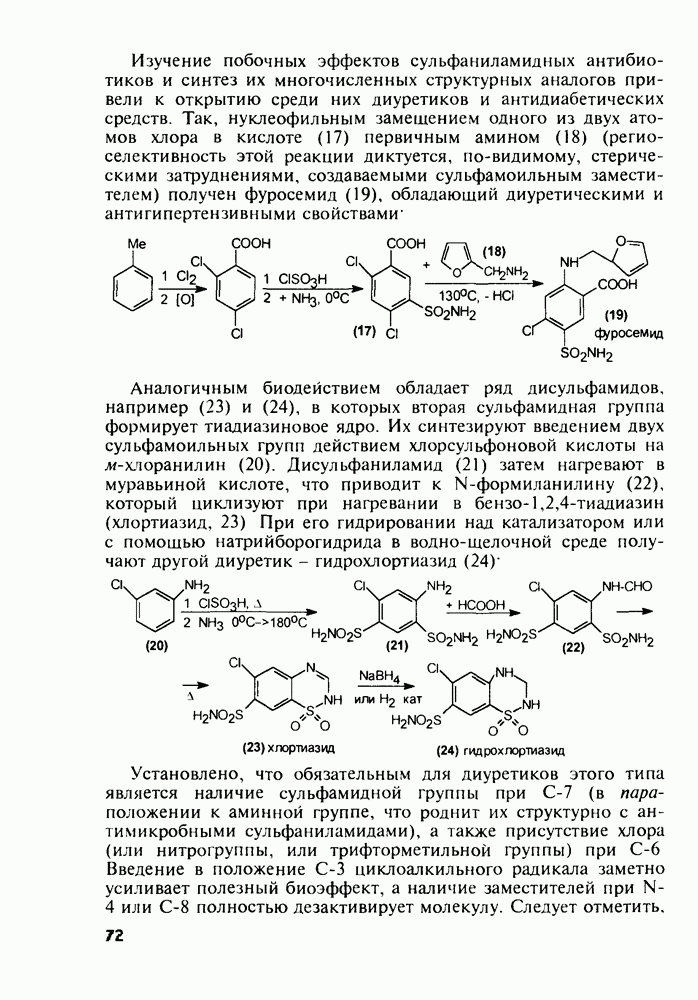
- 5.3.2. Синтез производных пиррола
- 5.3.3. Оксазолидины. Антибиотик циклосерин
- 5.3.4. Антипиретики и анальгетики пиразолинового ряда
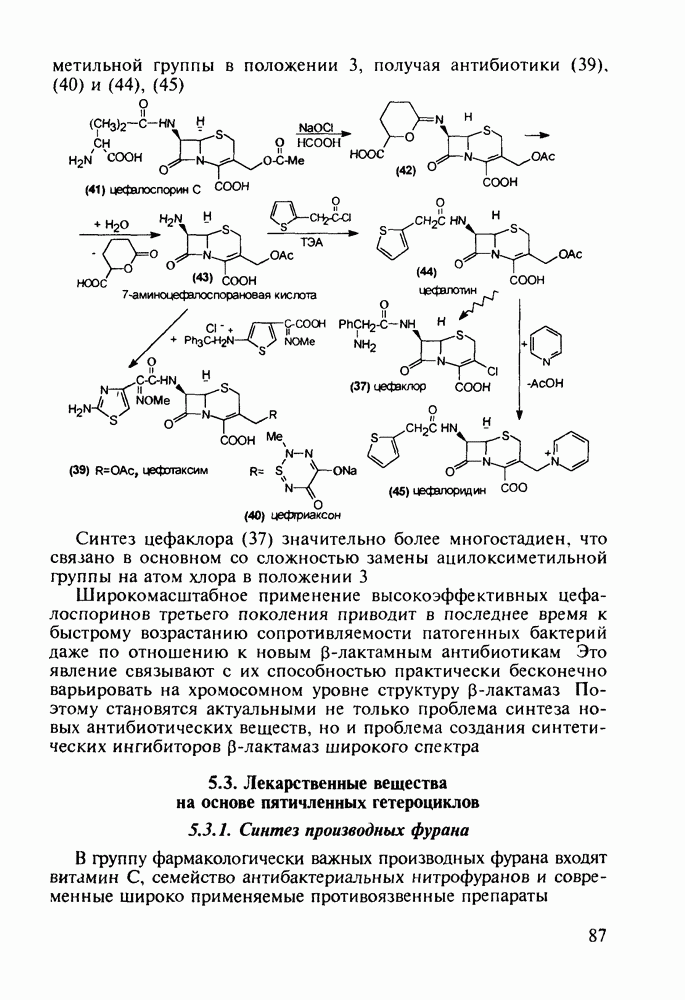
- 5.3.5. Имидазолы с противопаразитарной, антигипертензивной и другой биоактивностью
- 5.3.6. Производные тиазола. Витамин В1
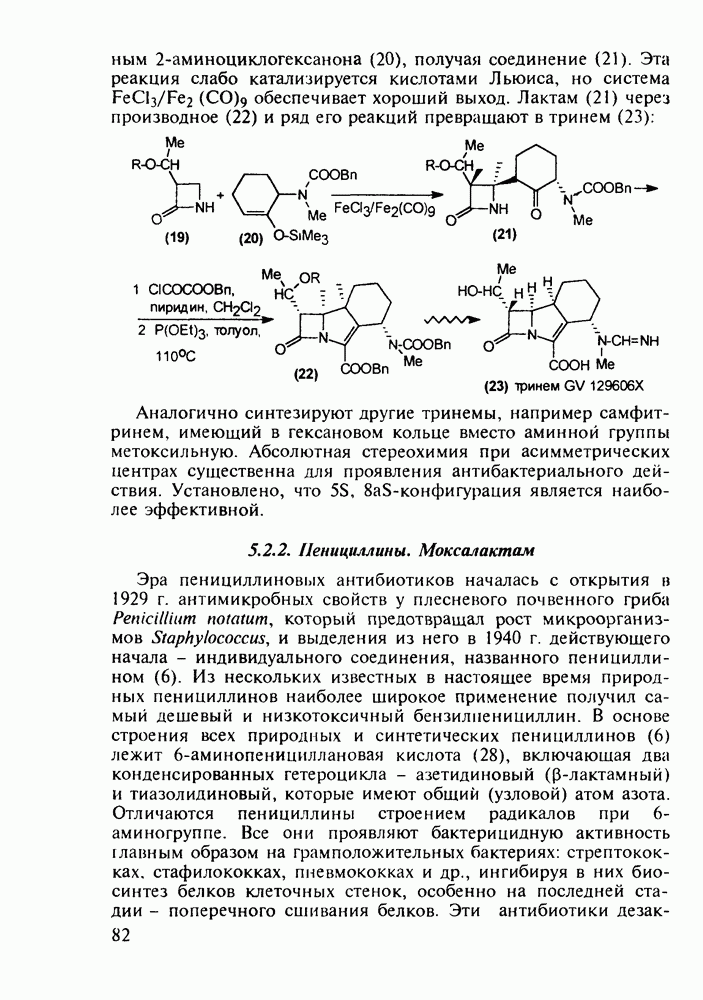
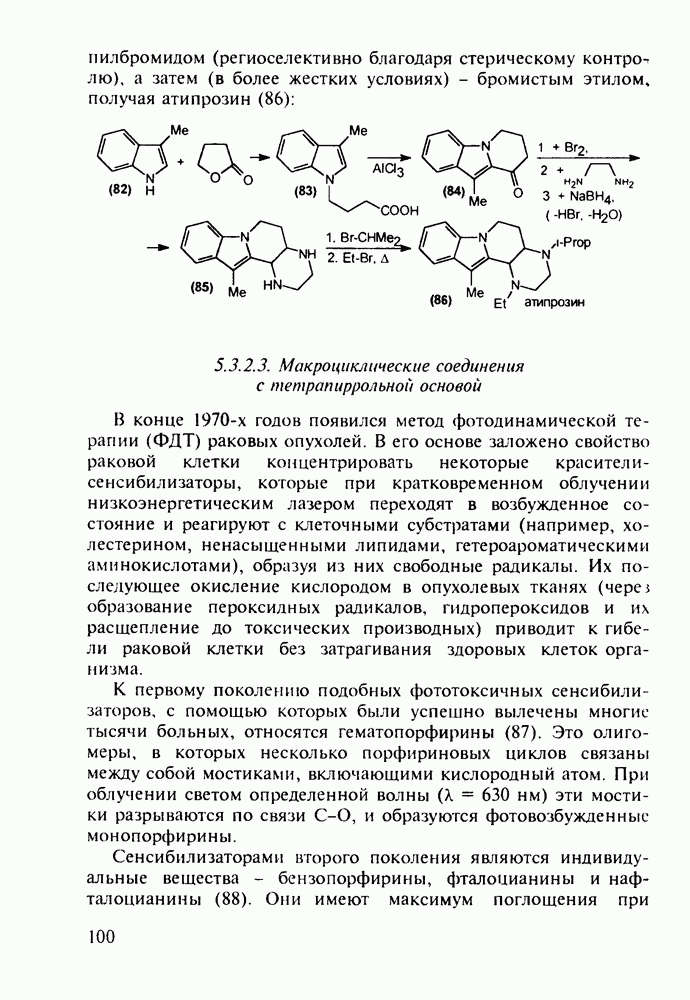
- 5.3.7. Психостимуляторы с оксадиазольным и тетразольным гетероциклами
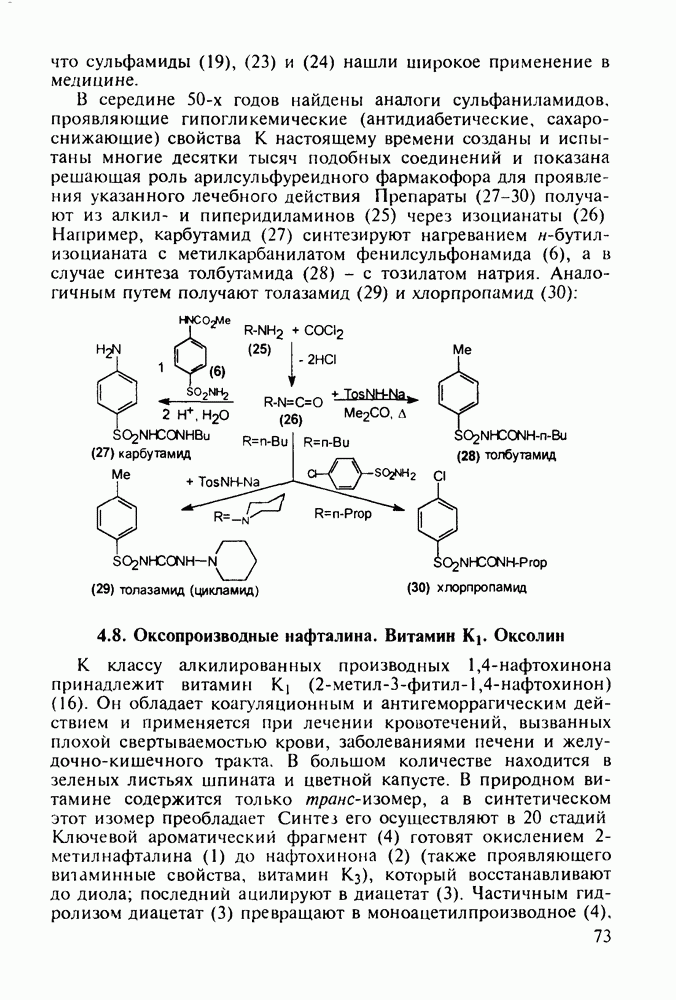
- 5.4. Синтез лекарственных веществ, содержащих шестичленные гетероциклы
- 5.4.2. Синтез лекарственных веществ пиридинового ряда
- 5.4.3. Анальгетики и транквилизаторы пиперидинового ряда
- 5.4.4. Производные хинолина с антималярийным и антибактериальным действием
- 5.4.5. Изохинолины в качестве спазмолитиков и трипаноцидов
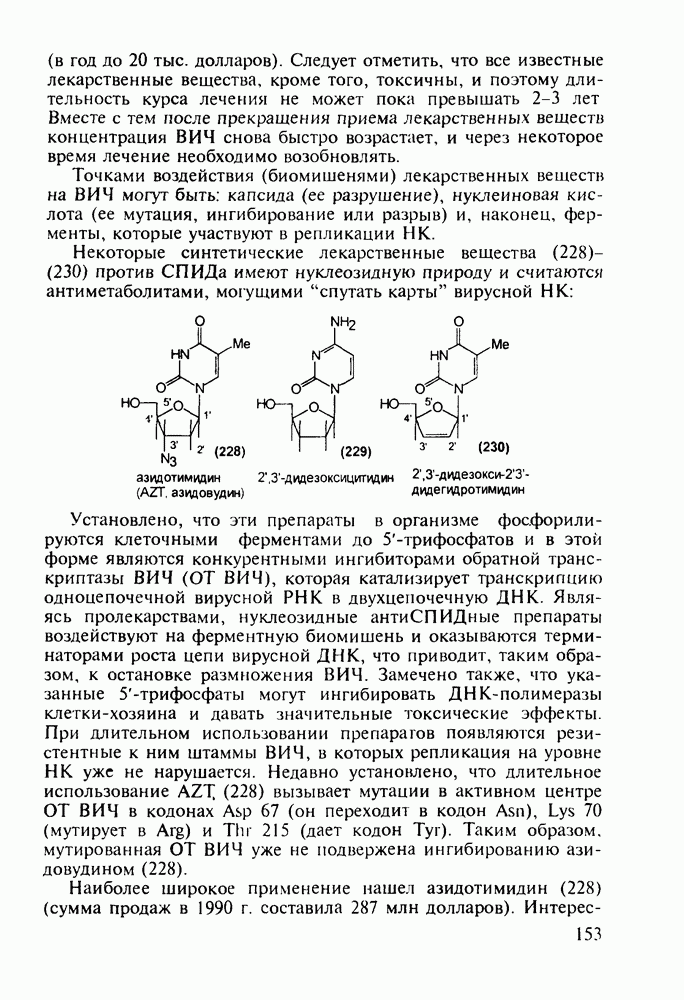
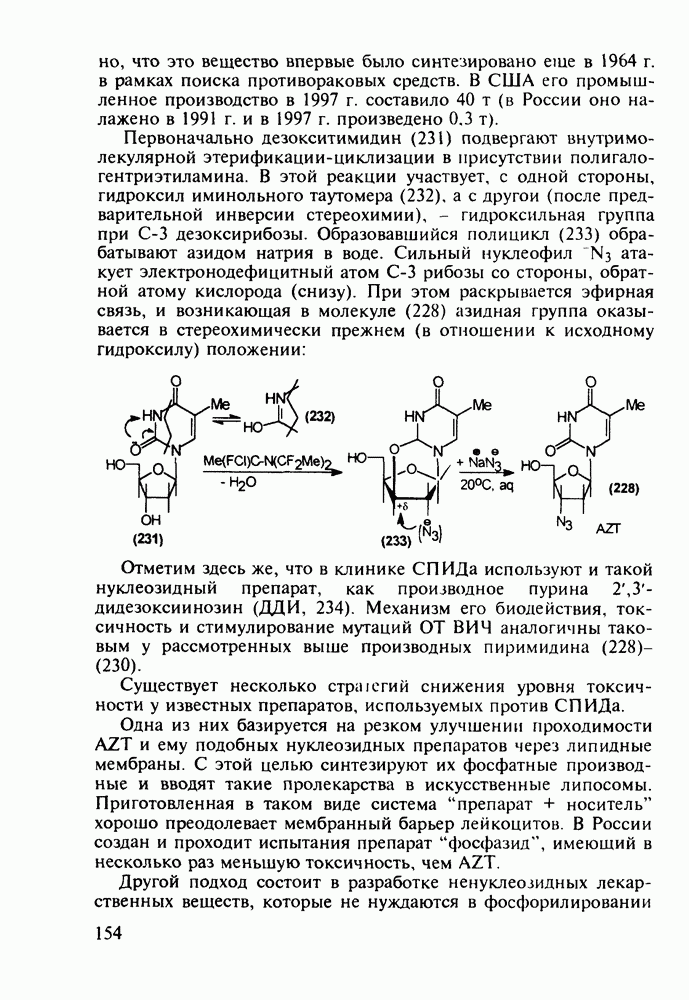
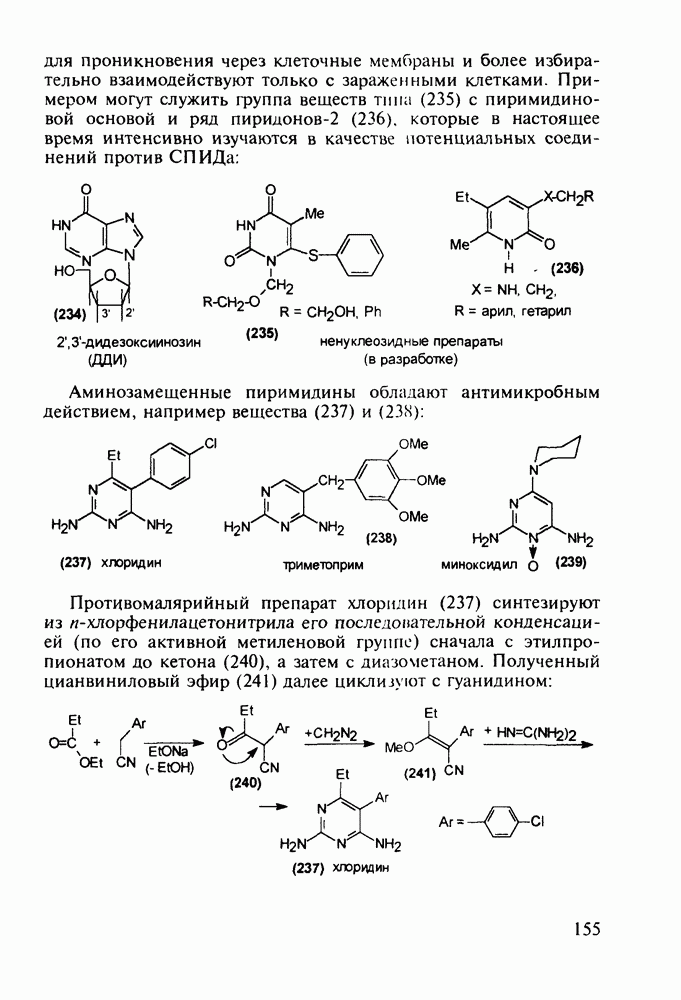
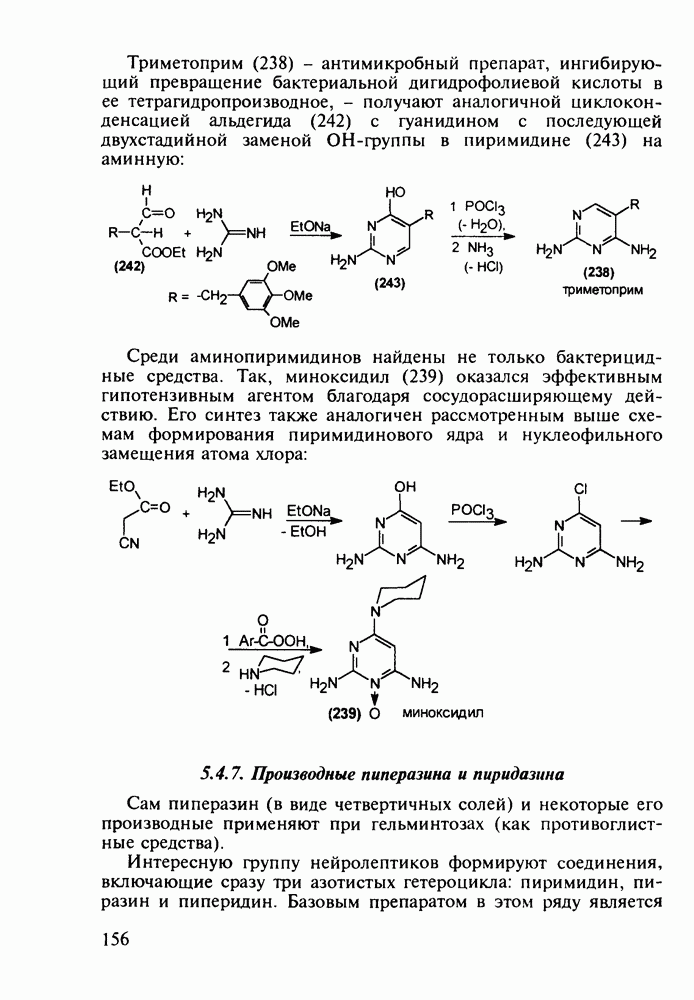
- 5.4.6. Производные пиримидинов
- 5.4.7. Производные пиперазина и пиридазина
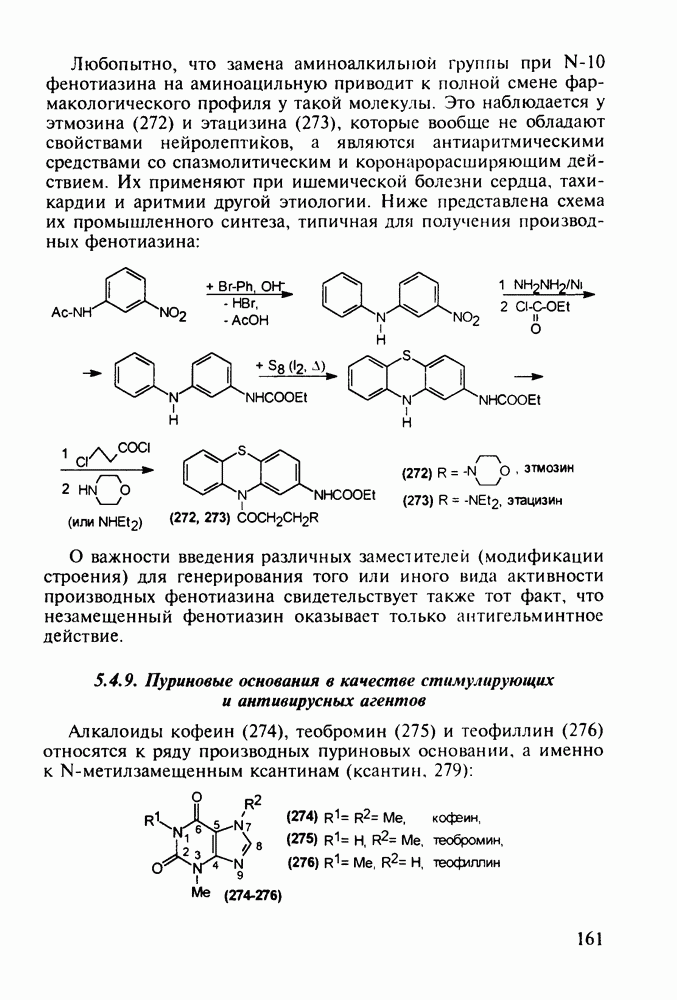
- 5.4.8. Бензотиазины. Нейролептики фенотиазинового ряда
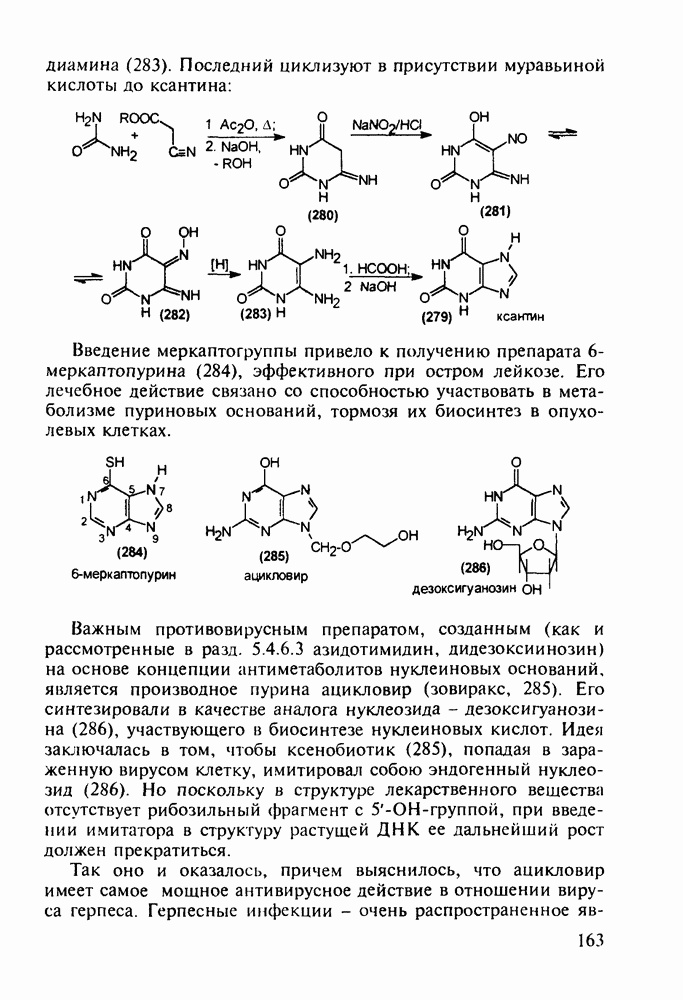
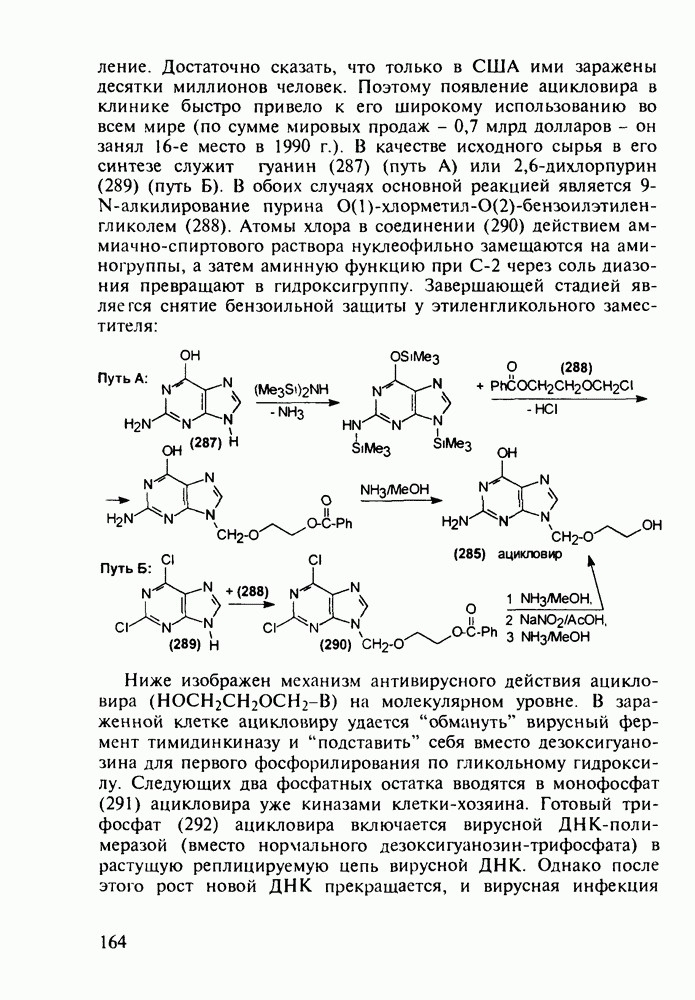
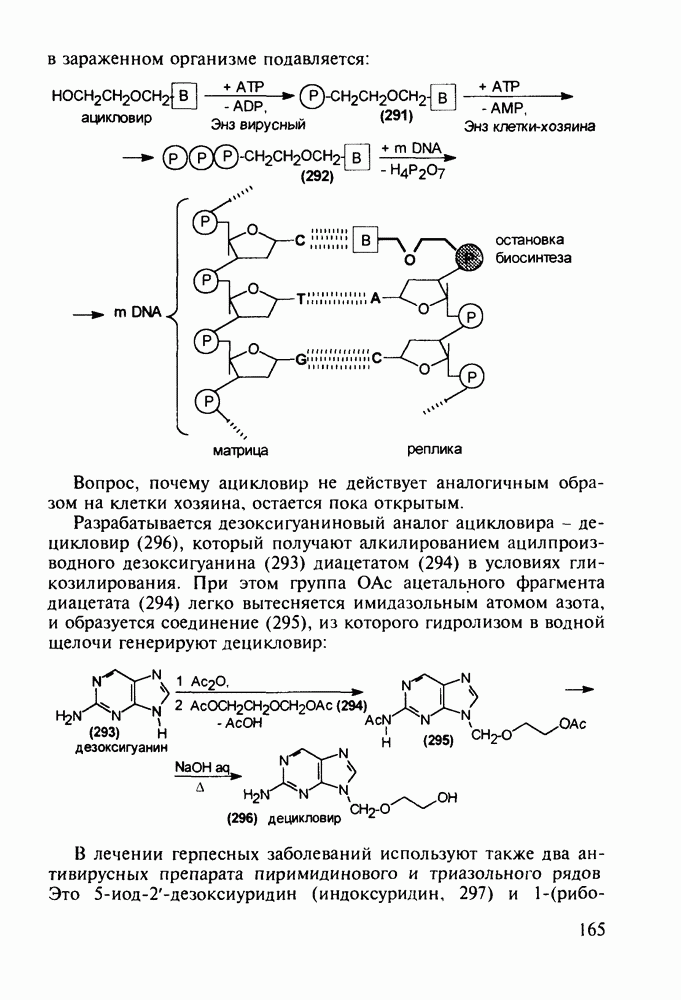
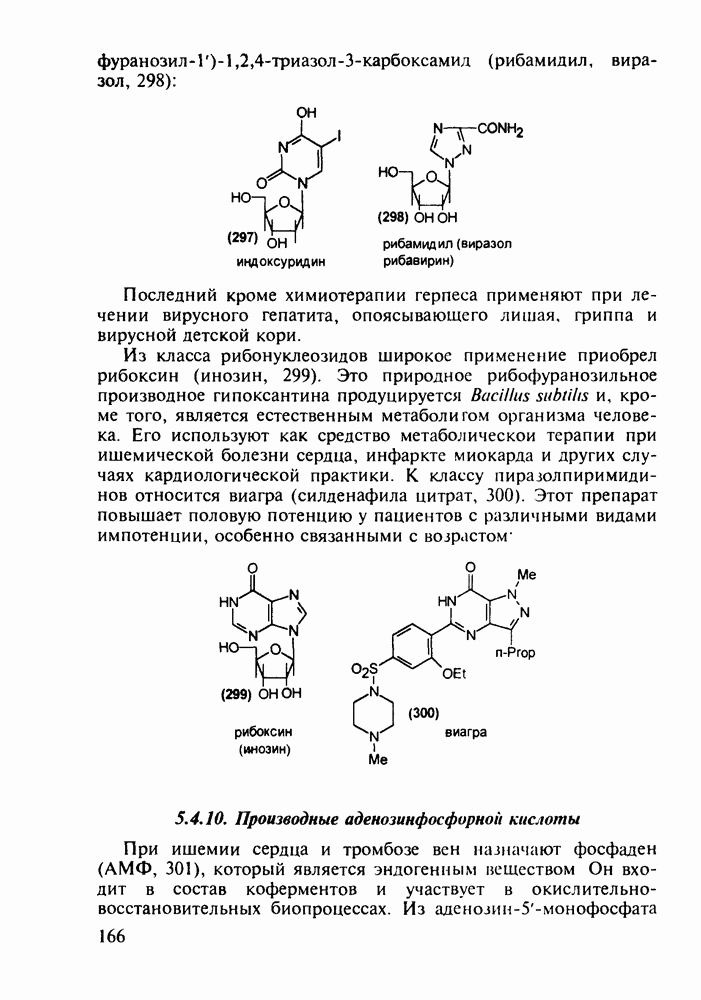
- 5.4.9. Пуриновые основания в качестве стимулирующих и антивирусных агентов
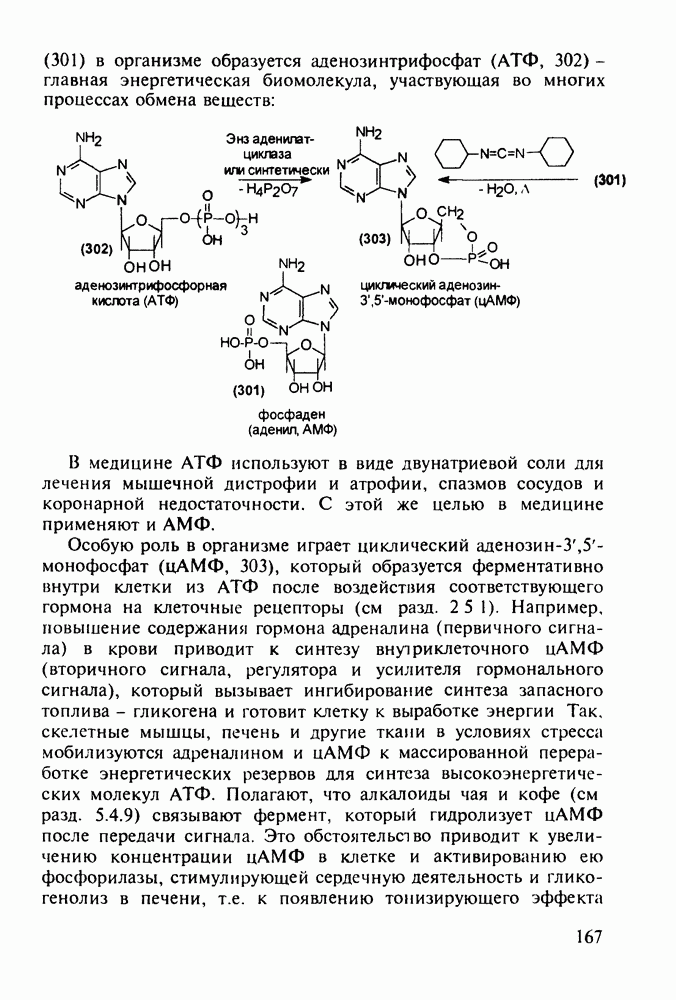
- 5.4.10. Производные аденозинфосфорной кислоты
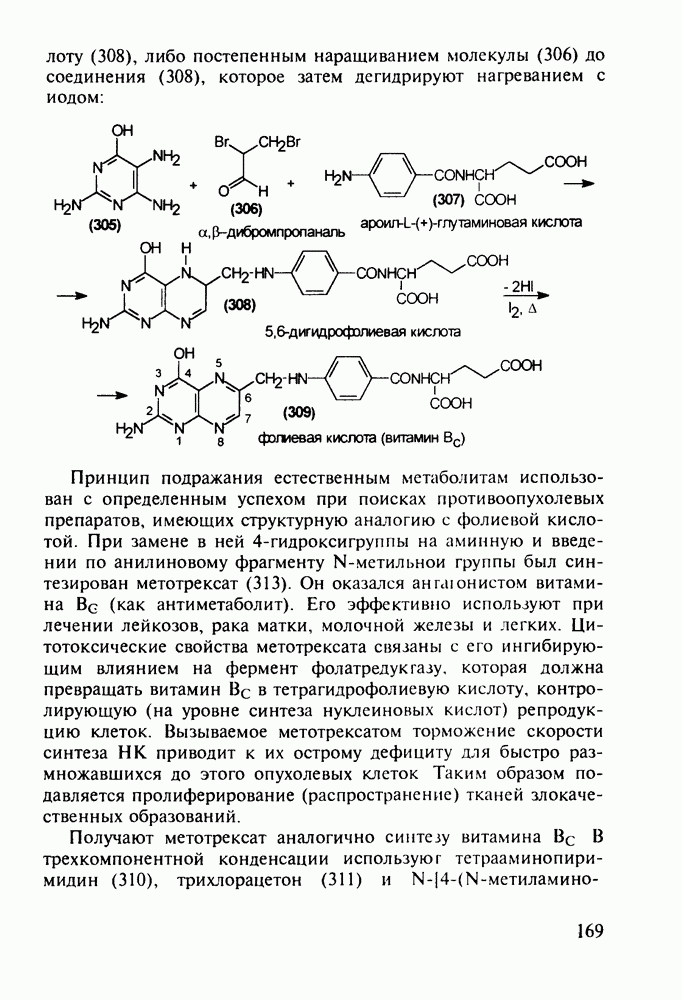
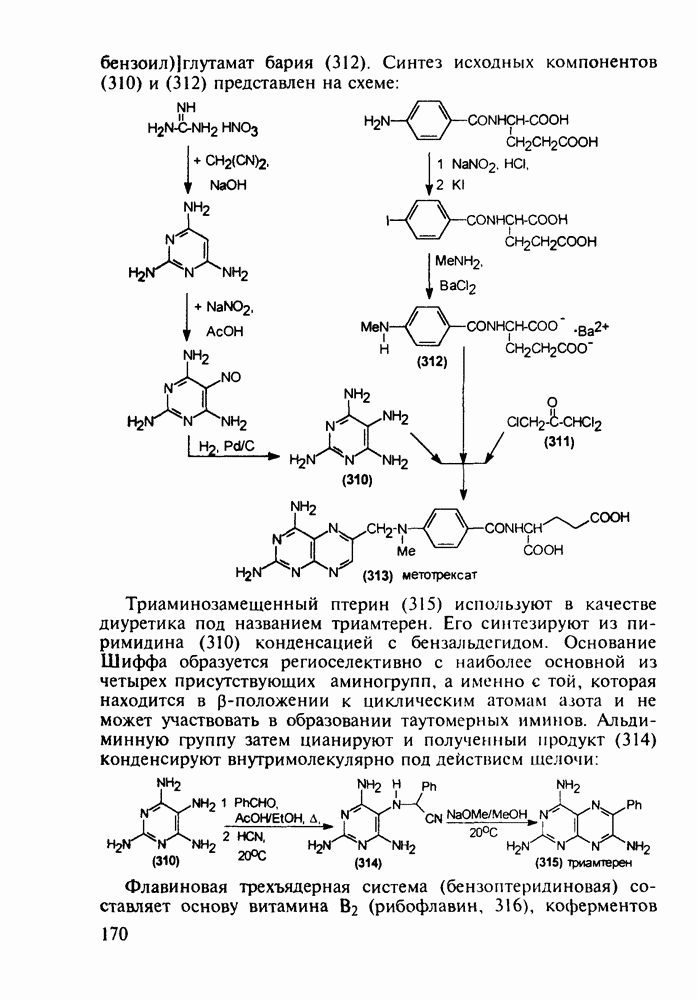
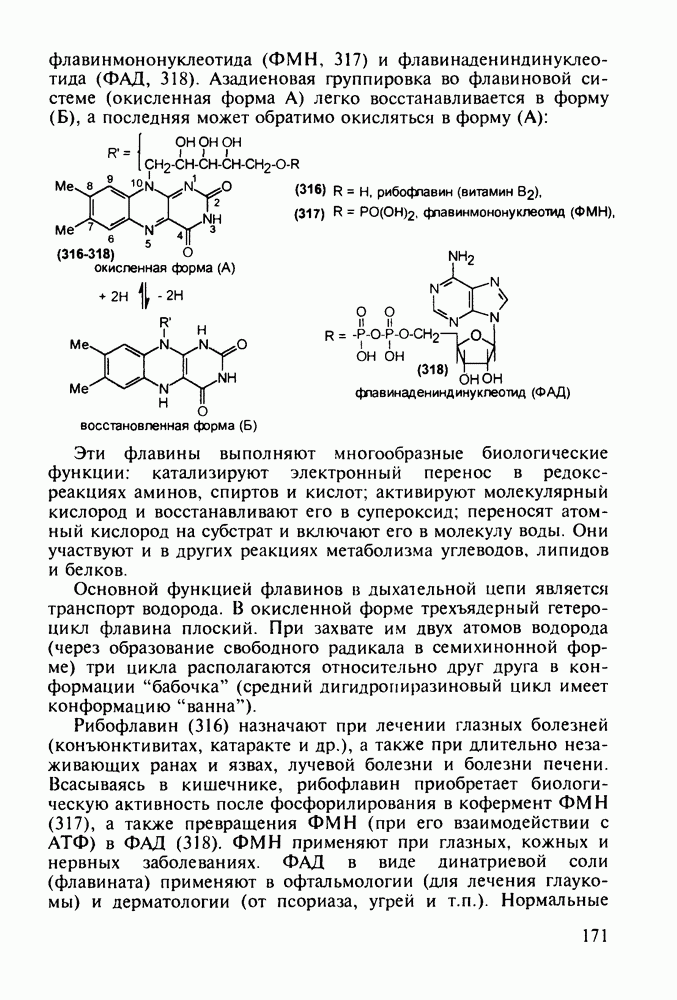
- 5.4.11. Производные птеридина с витаминной (витамины Вс и В2) и противораковой активностью
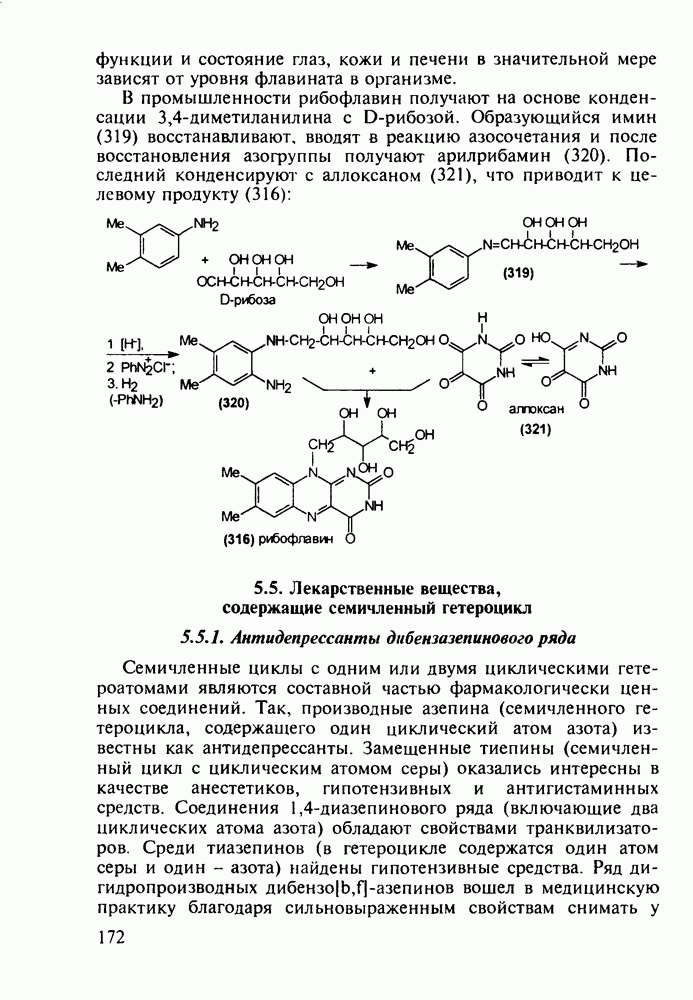
- 5.5. Лекарственные вещества, содержащие семичленный гетероцикл
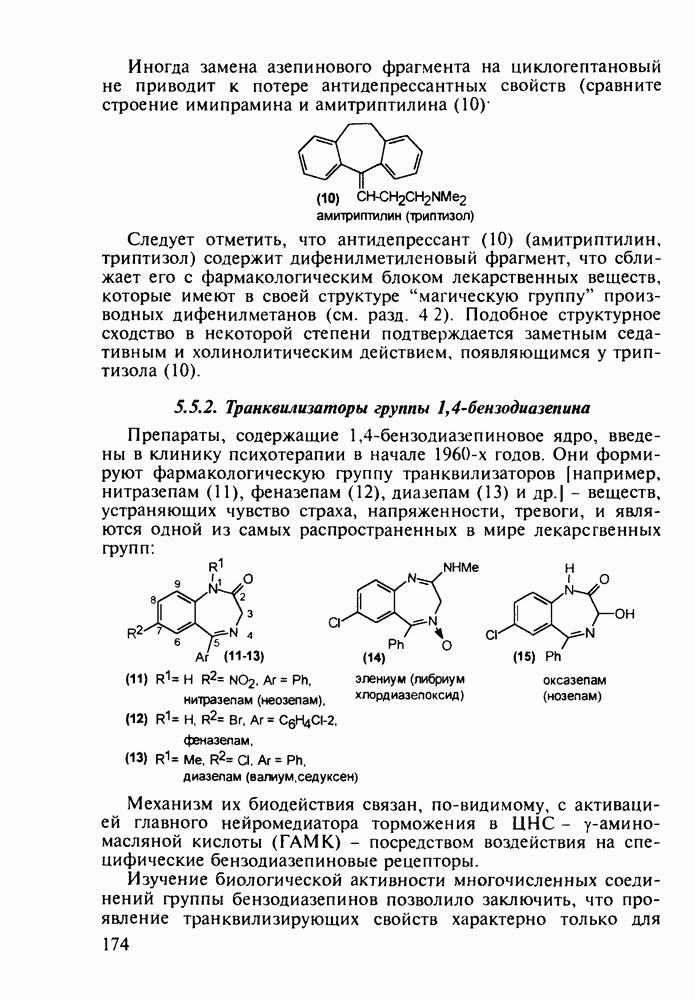
- 5.5.2. Транквилизаторы группы 1,4-бензодиазепина
- 5.6. Производные азабициклооктанов в качестве спазмолитиков и анестетиков. Лекарственные препараты на основе хинуклидина
- 5.7. Производные азабициклононанов в качестве анальгетиков
- 5.7.1. Группа пентазоцина
- 5.7.2. Морфин, его агонисты и антагонисты
- РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА