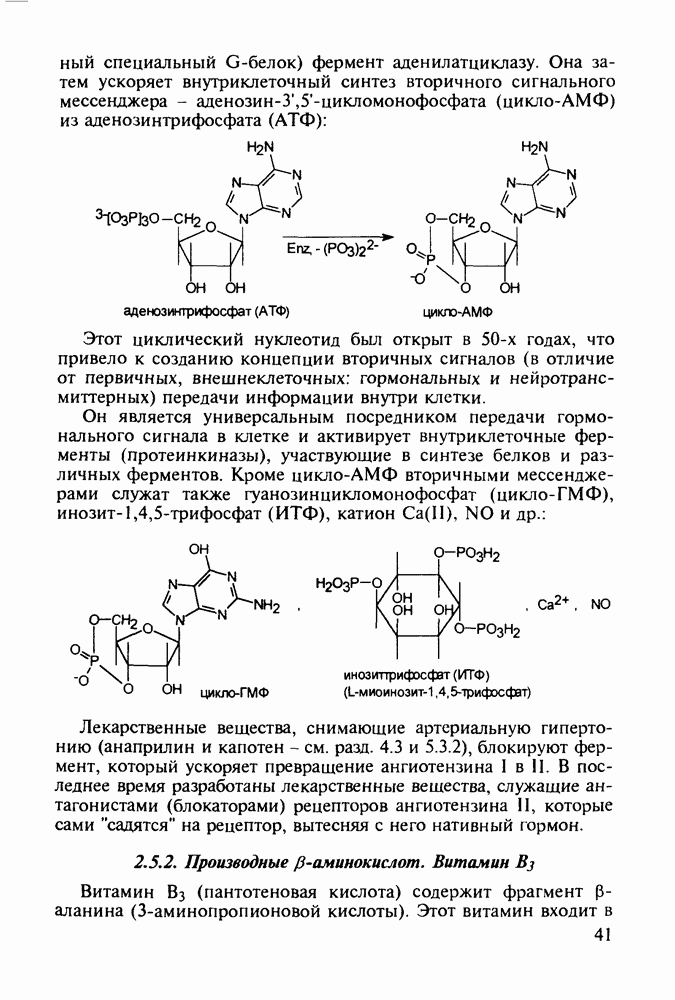
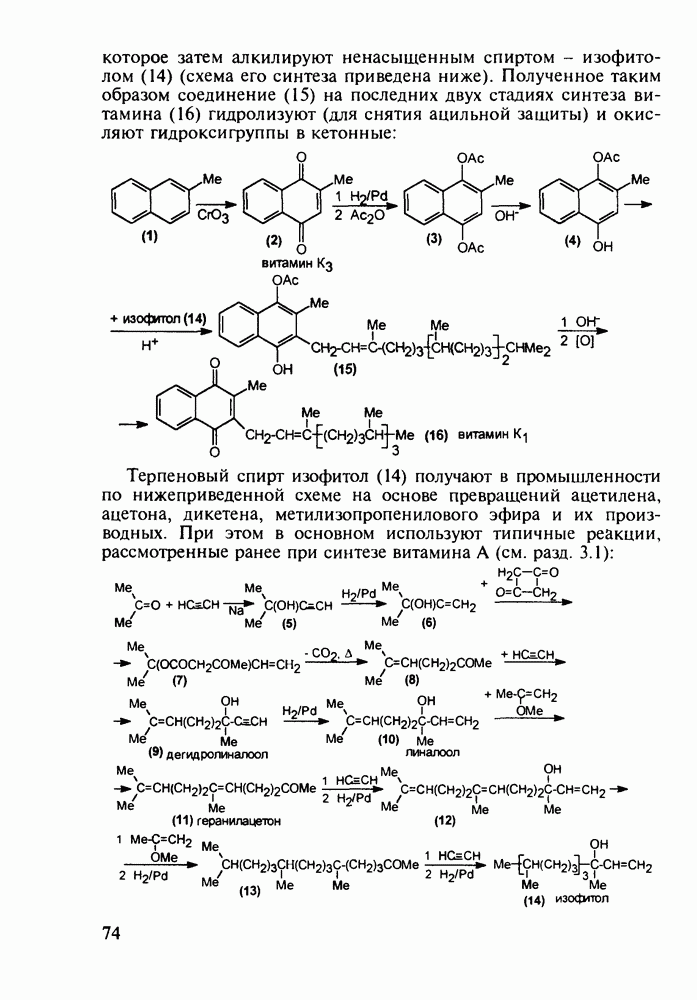
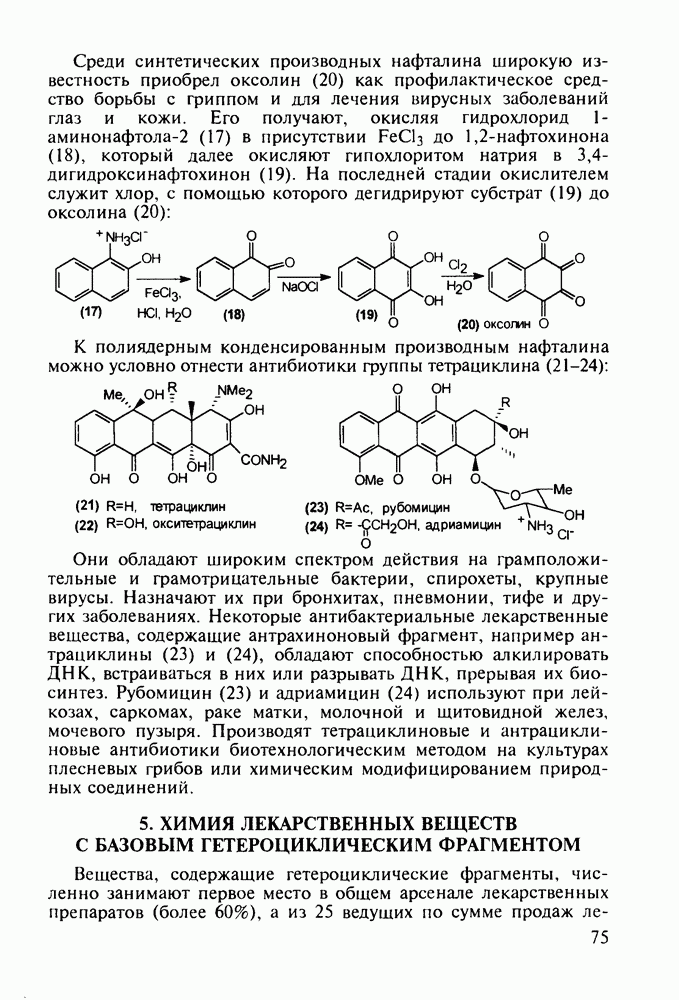
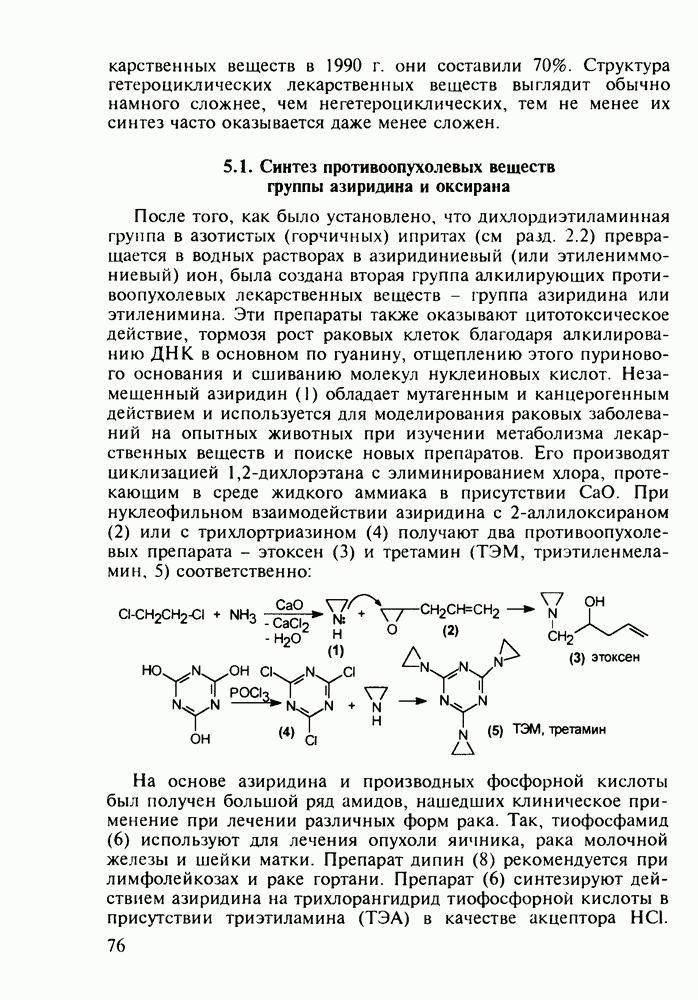
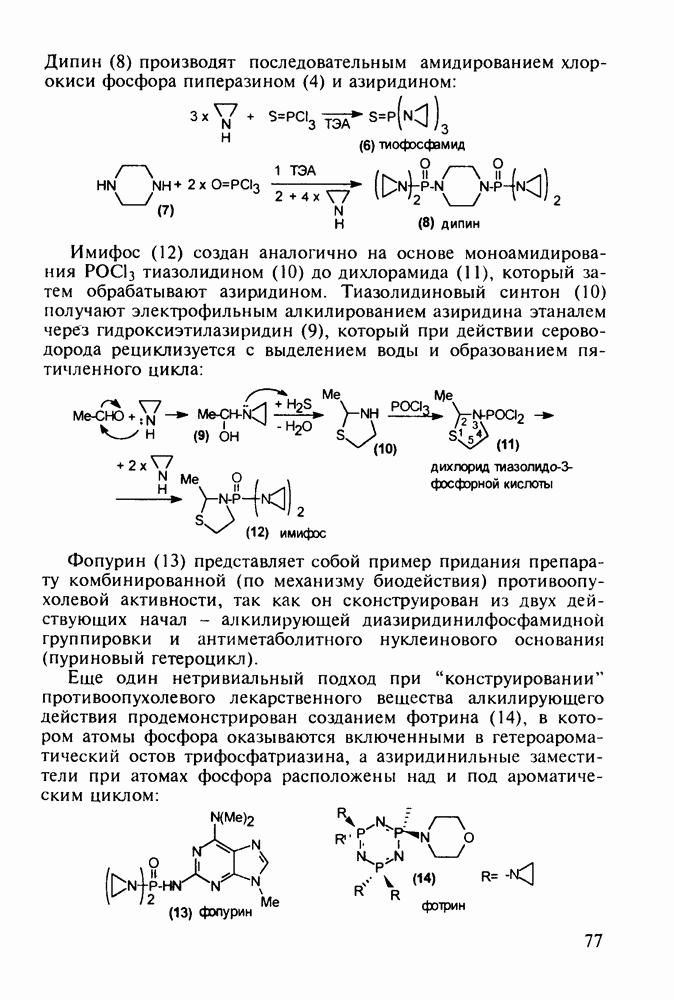
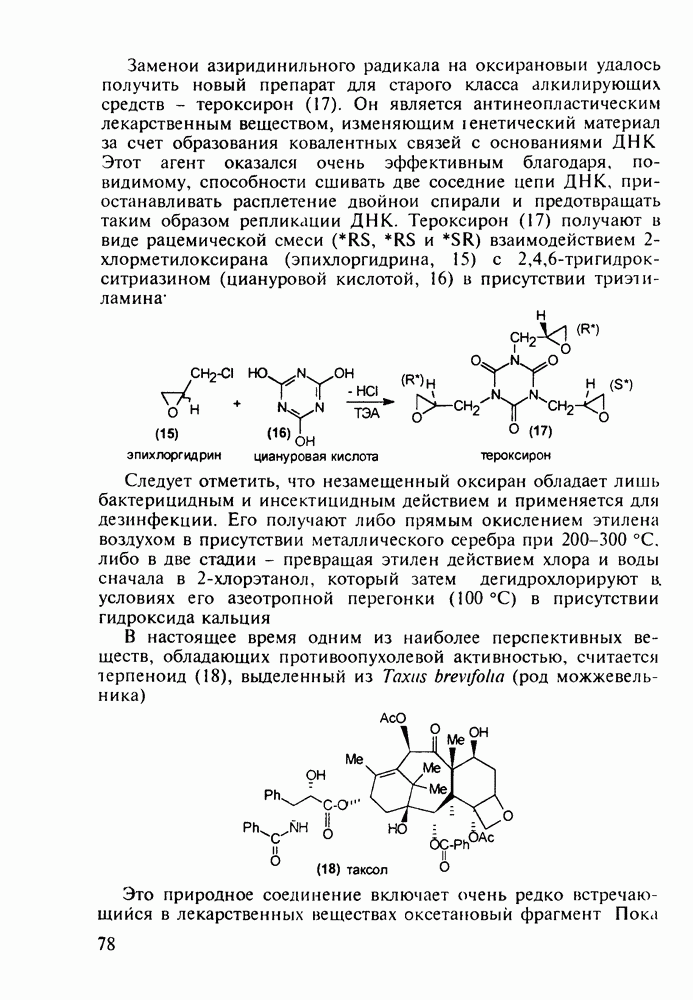
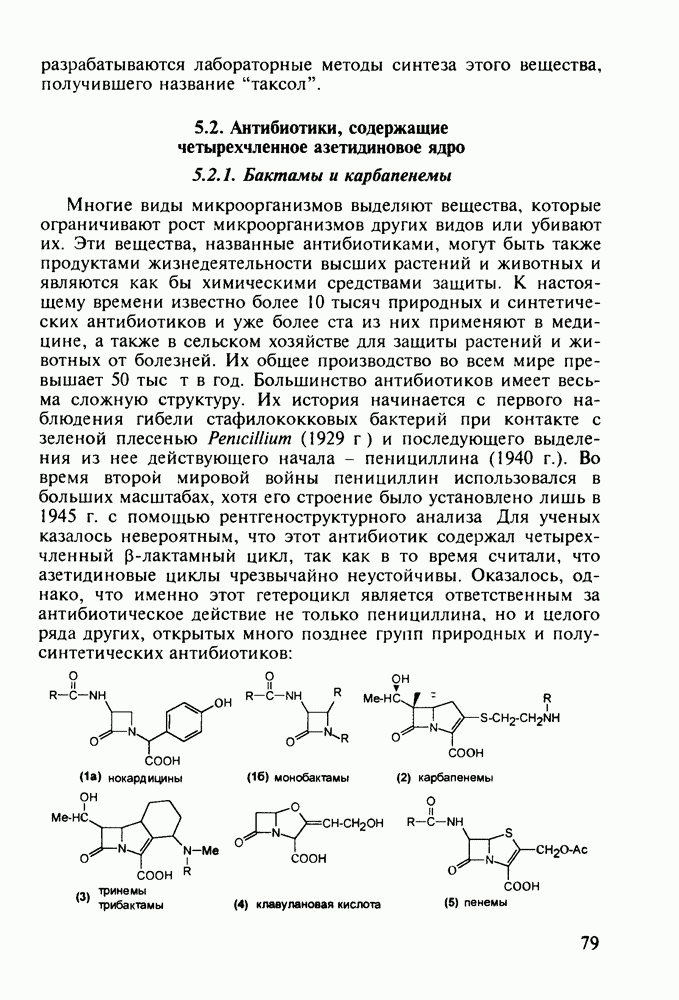
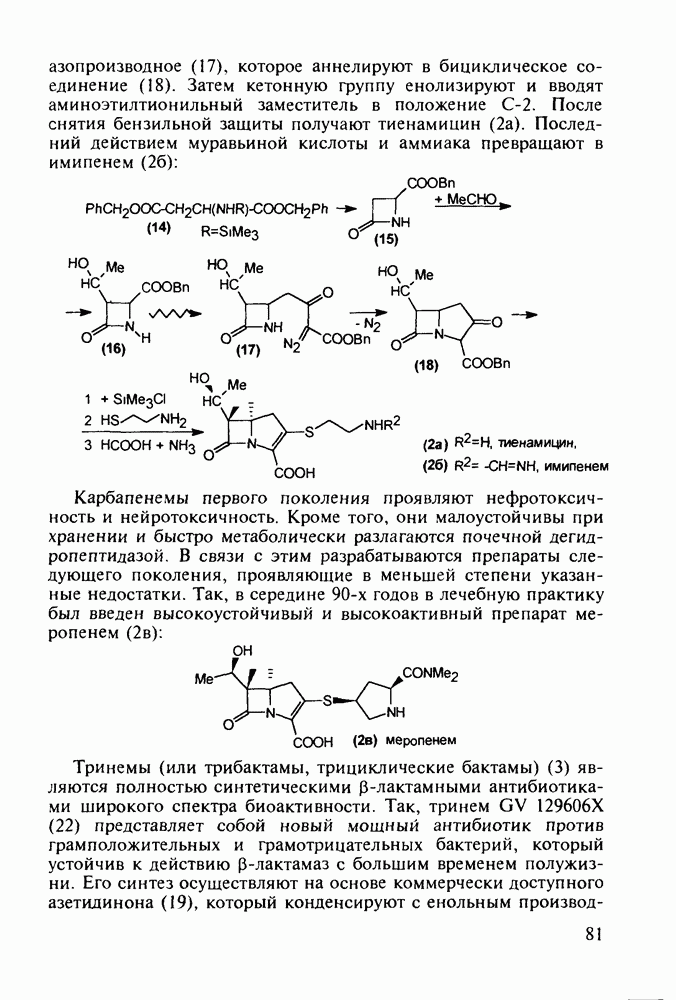
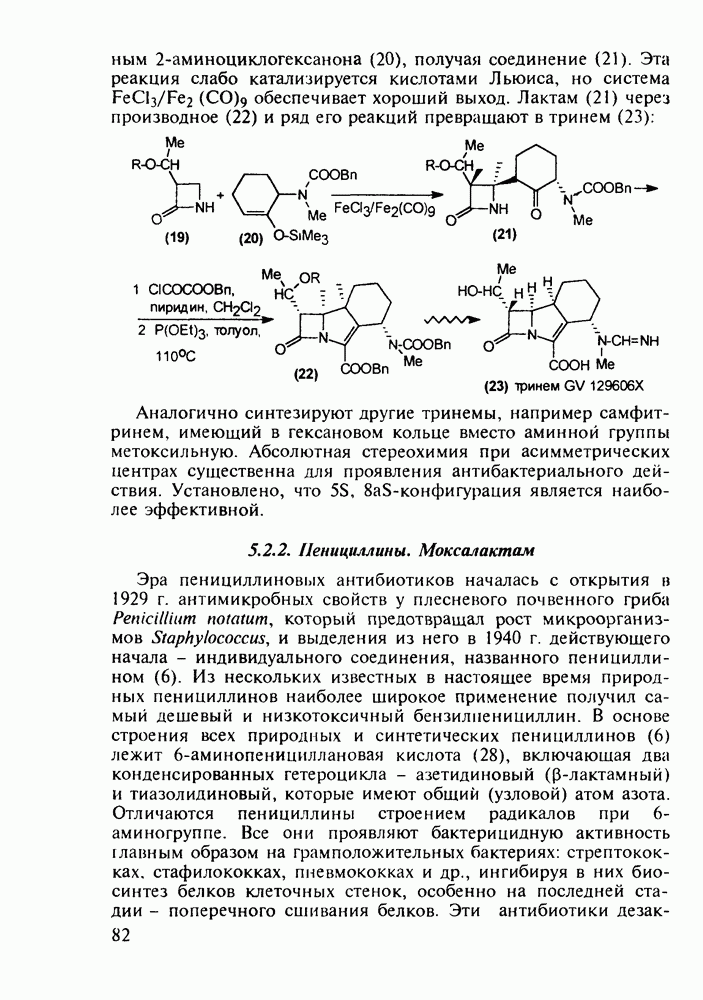
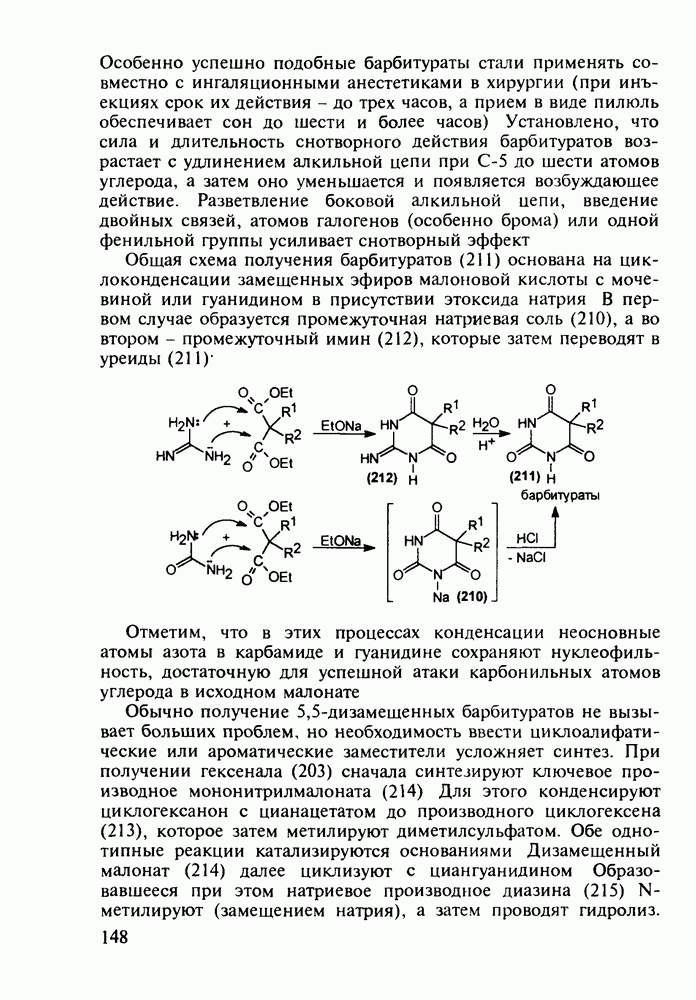
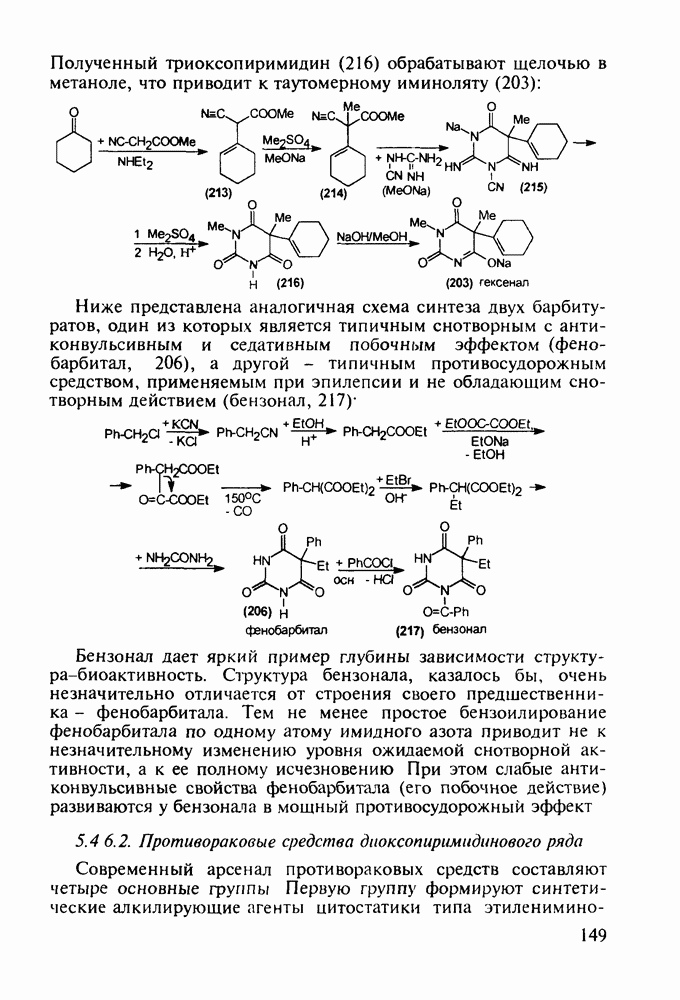
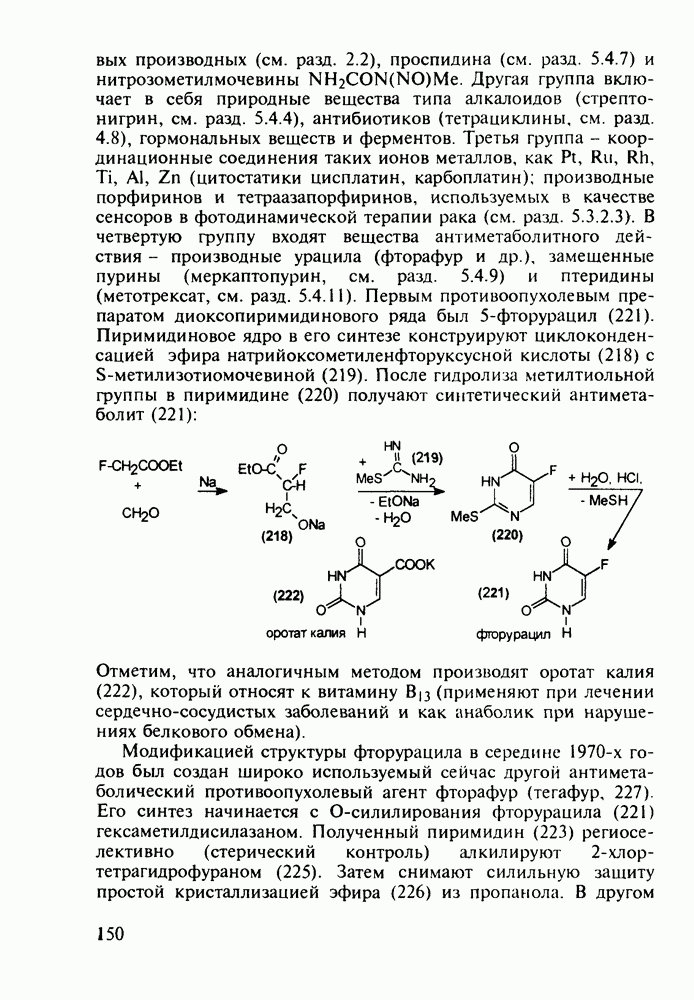
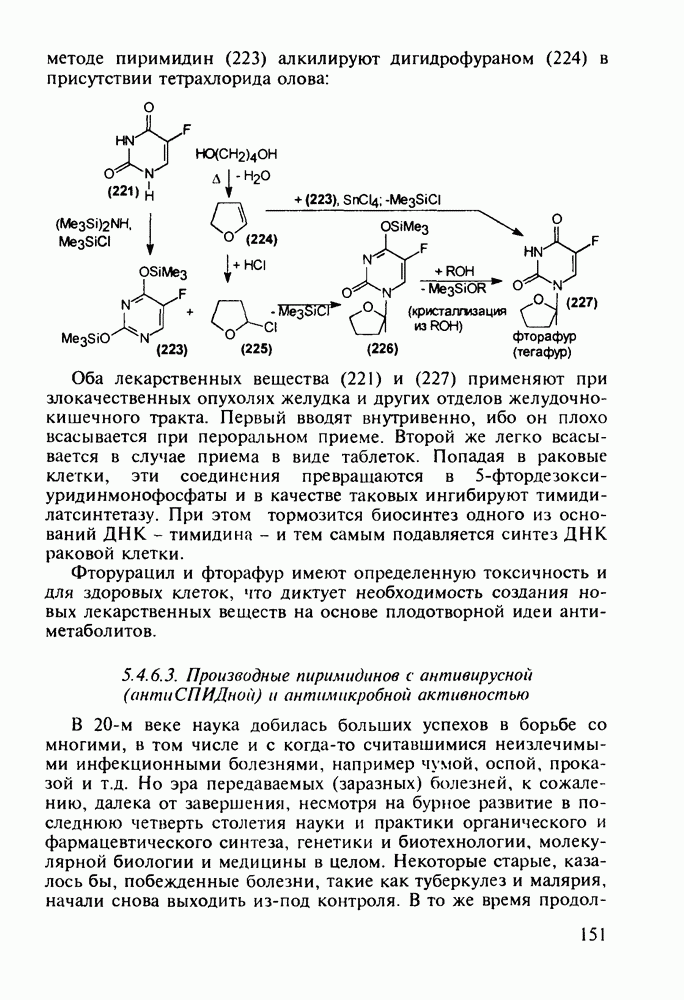
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
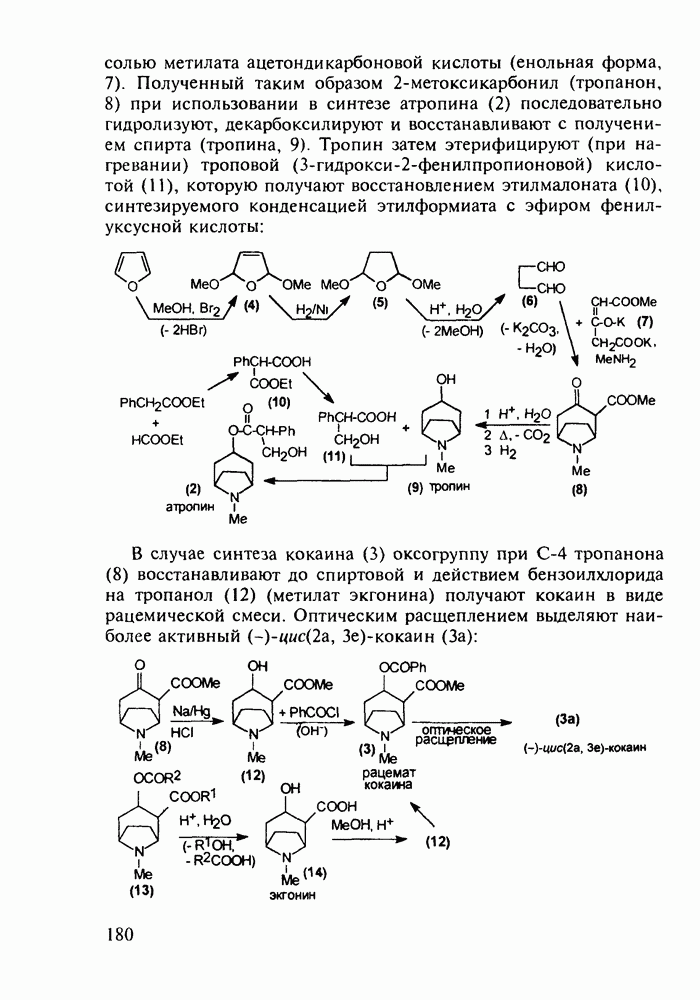
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
5.4.4. Производные хинолина с антималярийным и антибактериальным действием
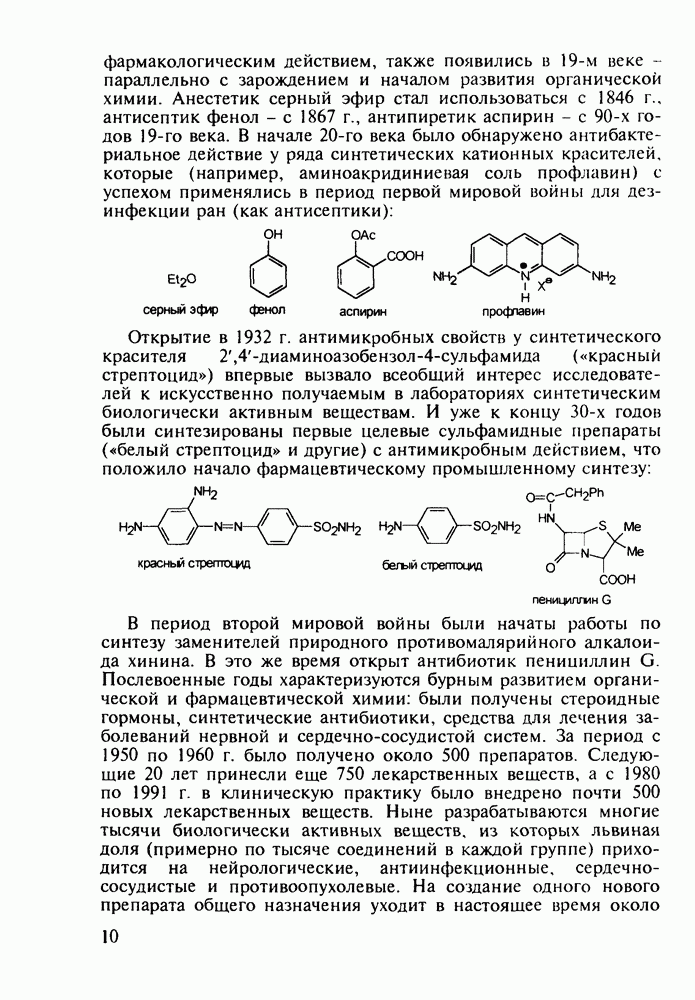
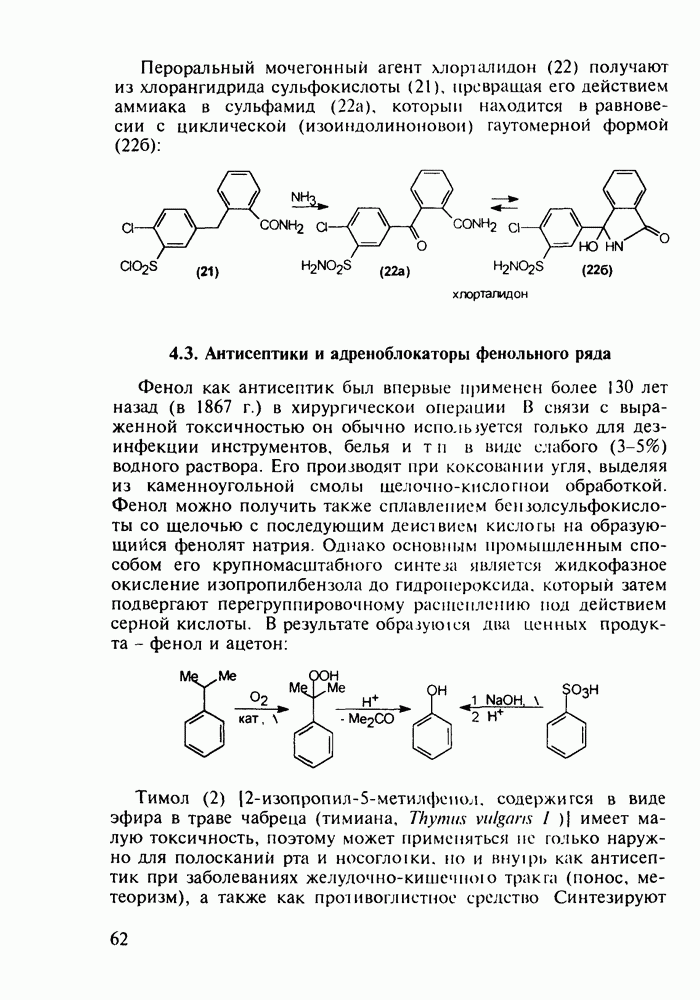
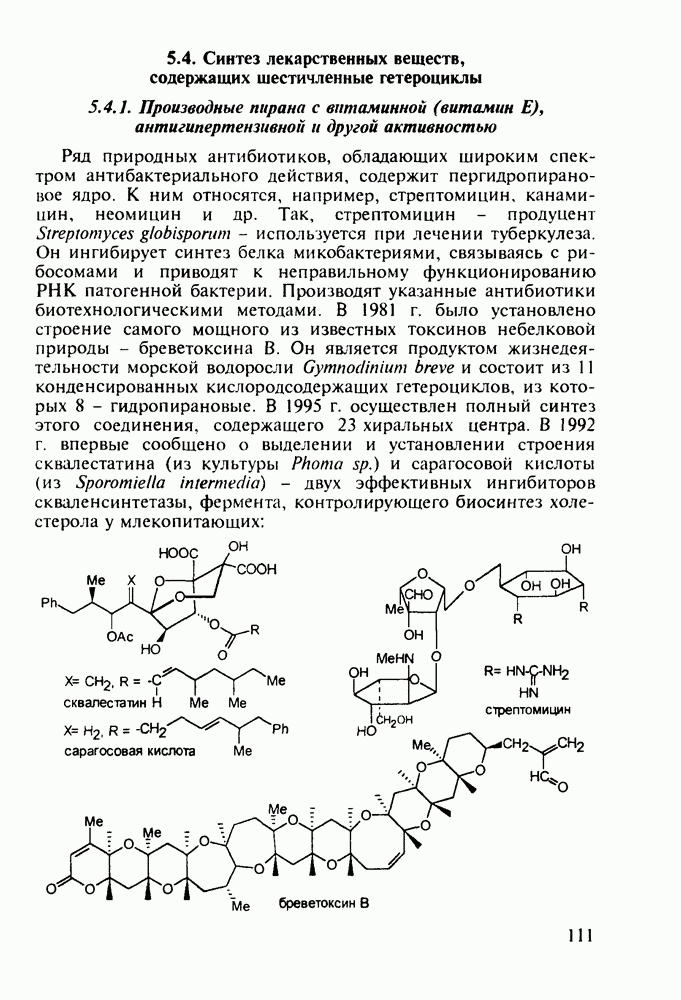
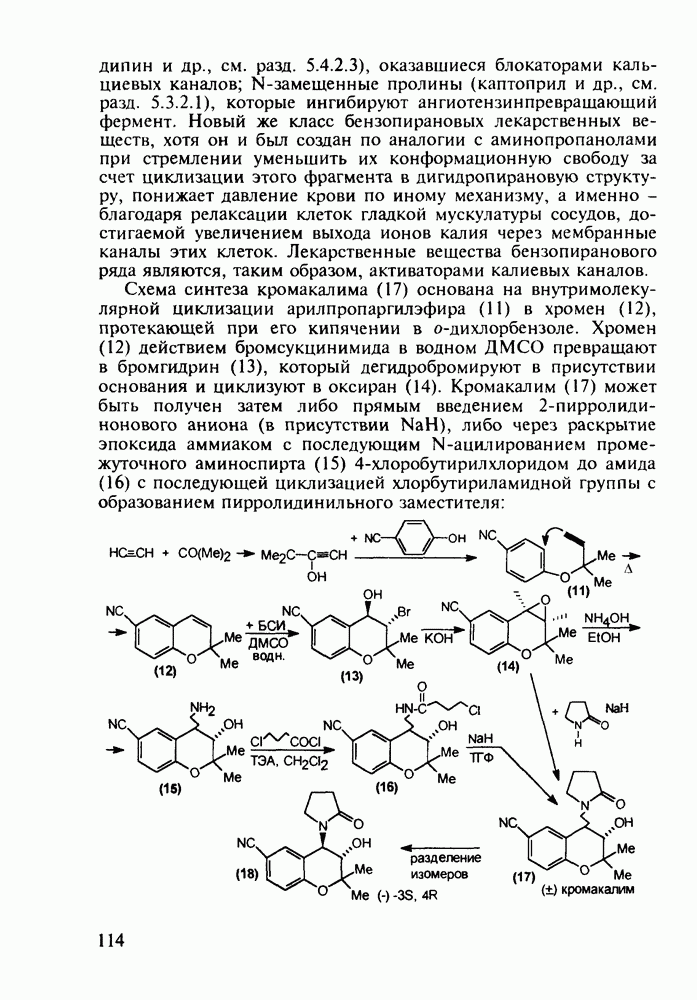
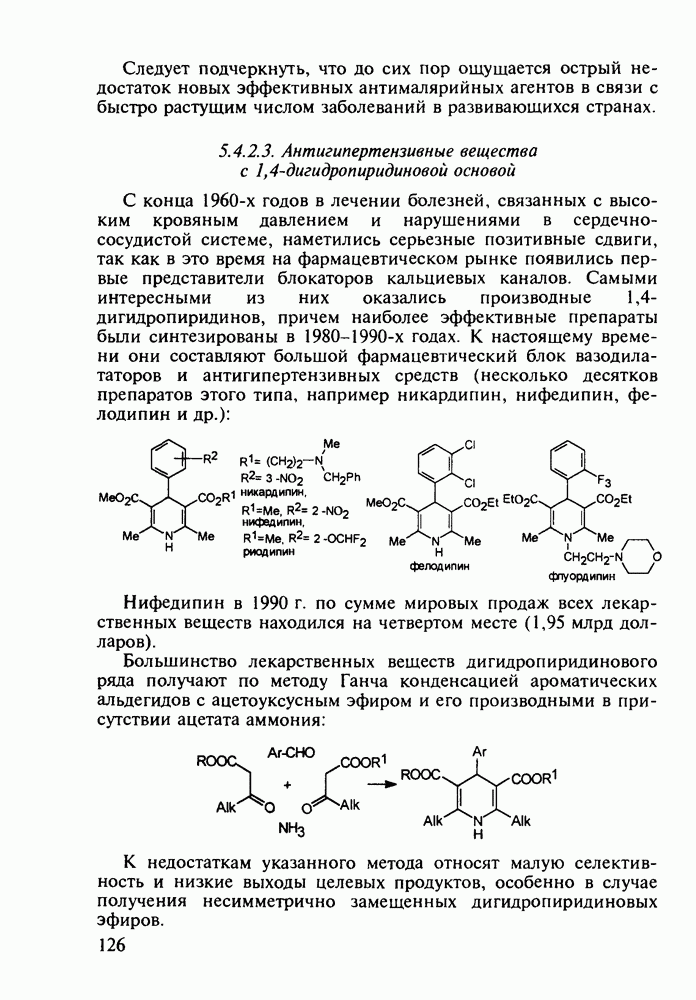
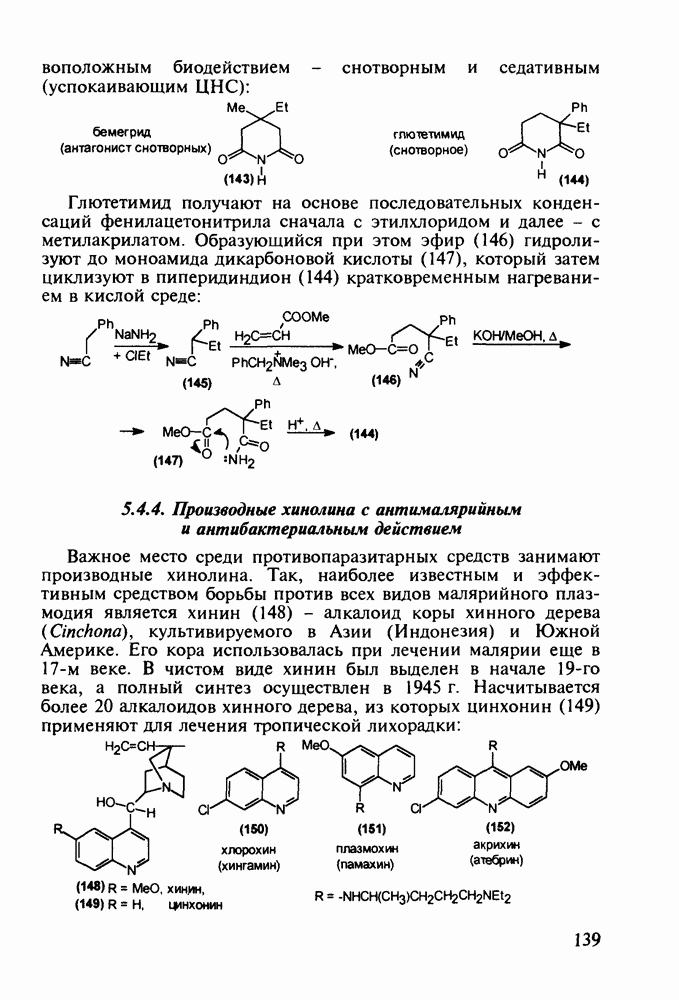
Важное место среди противопаразитарных средств занимают производные хинолина. Так, наиболее известным и эффективным средством борьбы против всех видов малярийного плазмодия является хинин (148) - алкалоид коры хинного дерева (Cinchona), культивируемого в Азии (Индонезия) и Южной Америке. Его кора использовалась при лечении малярии еще в 17-м веке. В чистом виде хинин был выделен в начале 19-го века, а полный синтез осуществлен в 1945 г. Насчитывается более 20 алкалоидов хинного дерева, из которых цинхонин (149) применяют для лечения тропической лихорадки:

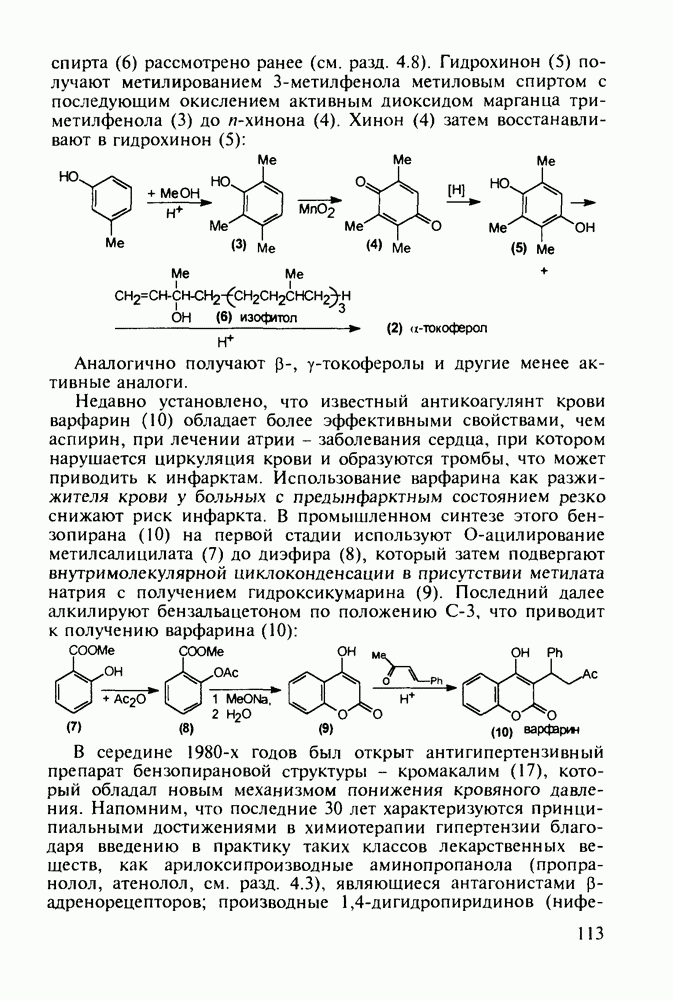
После запрета массового использования инсектицида ДДТ (в связи с его способностью аккумулироваться в тканях животных и приводить к отравлениям) резко возросло число случаев заболеваний малярией (несколько сотен миллионов в год).
Широкое применение синтетических лекарственных веществ, например (3)-(6), в борьбе с малярией привело к возникновению резистентных штаммов плазмодия [к природному хинину (148) возбудители малярии не имеют резистентности!]. В настоящее время стало известно, что в единственном экземпляре малярийного комара может содержаться до 70 генетических штаммов паразита. Этот факт делает понятным быстроту их эволюции в сторону штаммов, более устойчивых к действию применяемых лекарств. Поэтому значение поисков новых, более эффективных и менее токсичных препаратов (особенно близких по структуре к природному хинину) трудно переоценить.
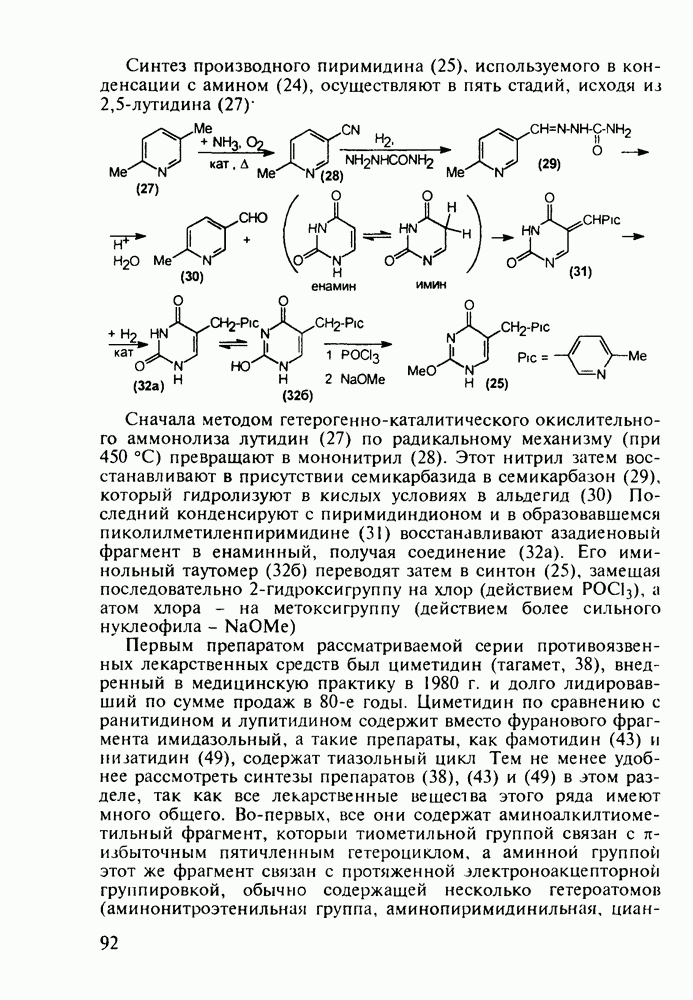
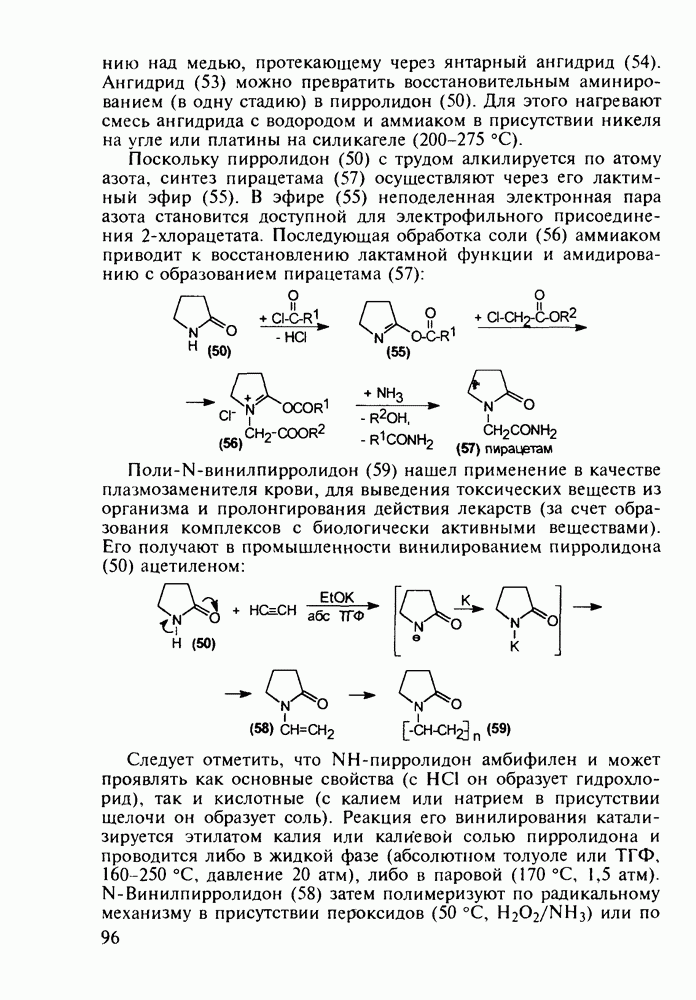
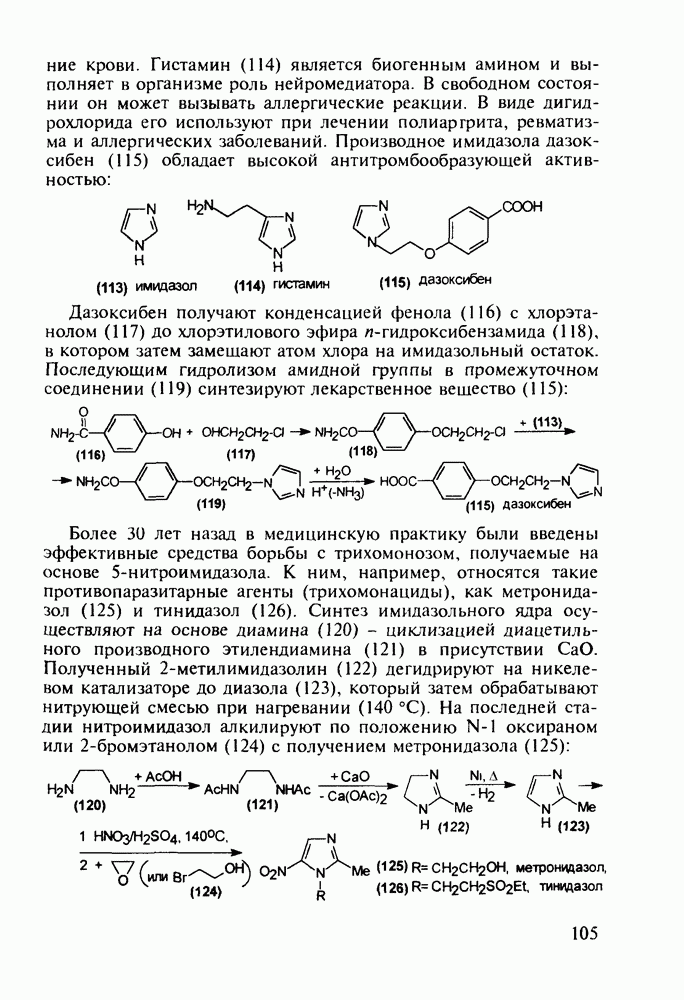
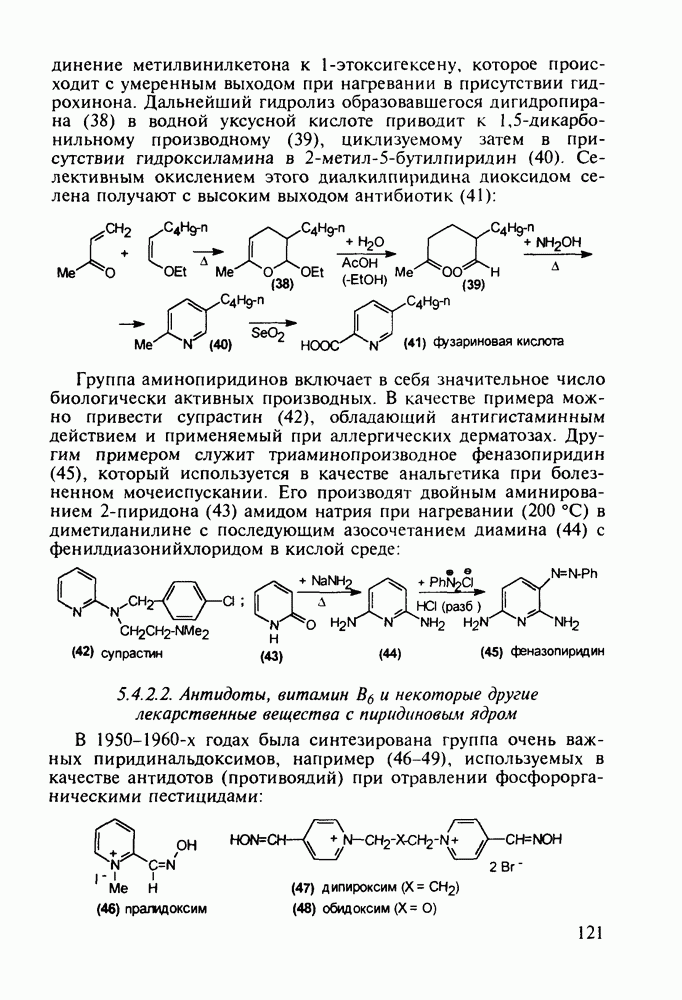
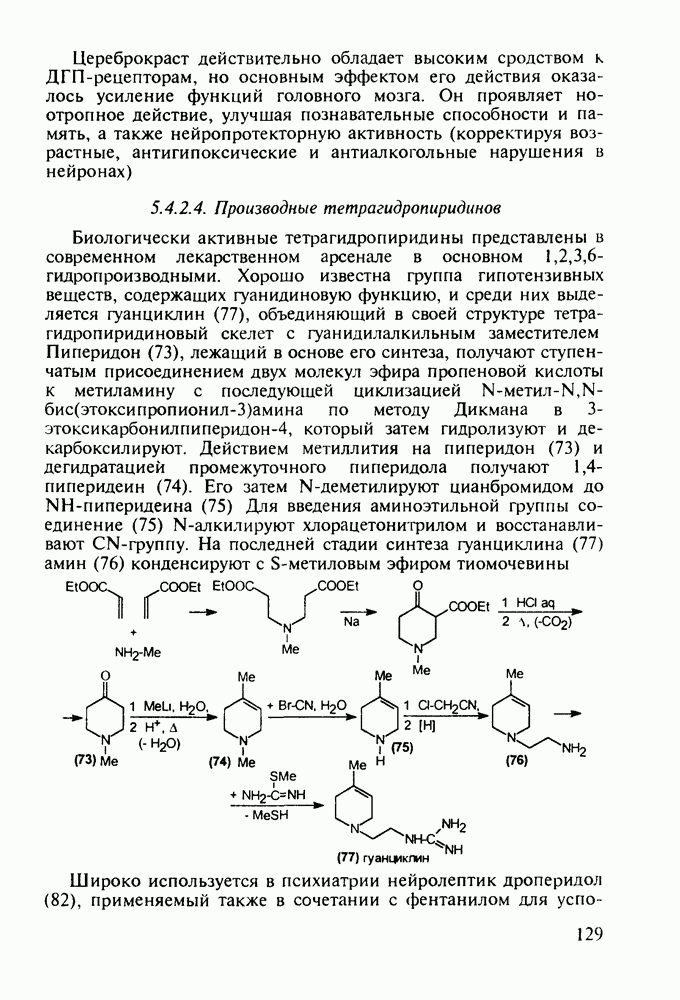
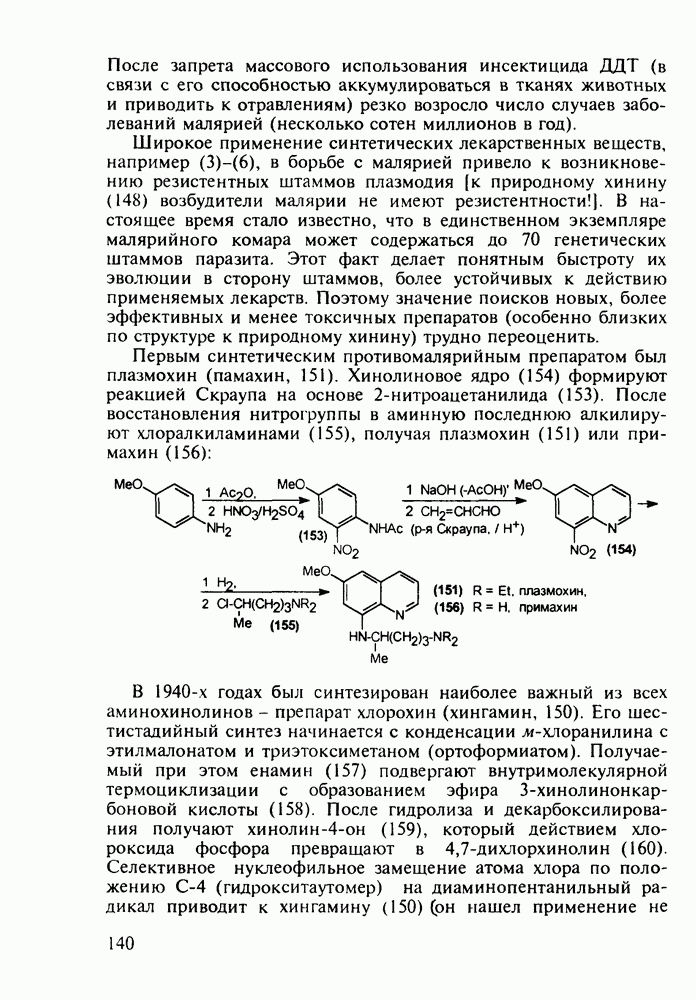
Первым синтетическим противомалярийным препаратом был плазмохин (памахин, 151). Хинолиновое ядро (154) формируют реакцией Скраупа на основе 2-нитроацетанилида (153). После восстановления нитрогруппы в аминную последнюю алкилируют хлоралкиламинами (155), получая плазмохин (151) или примахин (156):

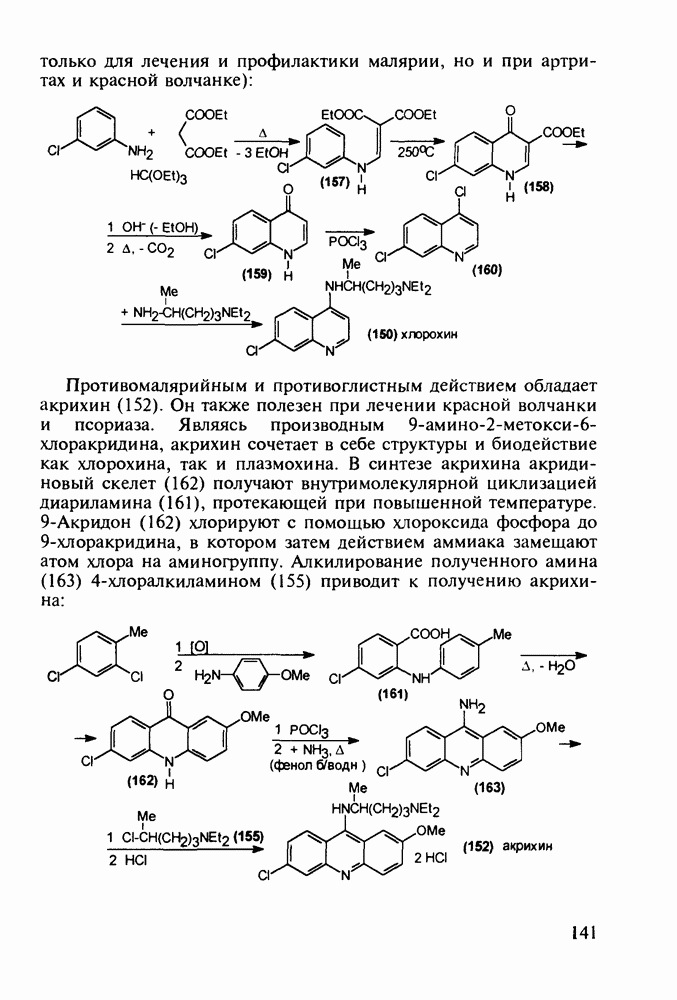
В 1940-х годах был синтезирован наиболее важный из всех аминохинолинов - препарат хлорохин (хингамин, 150). Его шестистадийный синтез начинается с конденсации  -хлоранилина с этилмалонатом и триэтоксиметаном (ортоформиатом). Получаемый при этом енамин (157) подвергают внутримолекулярной термоциклизации с образованием эфира
-хлоранилина с этилмалонатом и триэтоксиметаном (ортоформиатом). Получаемый при этом енамин (157) подвергают внутримолекулярной термоциклизации с образованием эфира  -хинолинонкар-боновой кислоты (158). После гидролиза и декарбоксилирования получают
-хинолинонкар-боновой кислоты (158). После гидролиза и декарбоксилирования получают  который действием хлороксида фосфора превращают в 4,7-дихлорхинолин (160). Селективное нуклеофильное замещение атома хлора по положению
который действием хлороксида фосфора превращают в 4,7-дихлорхинолин (160). Селективное нуклеофильное замещение атома хлора по положению  (гидрокситаутомер) на диаминопентанильный радикал приводит к хингамину (150) (он нашел применение не
(гидрокситаутомер) на диаминопентанильный радикал приводит к хингамину (150) (он нашел применение не
только для лечения и профилактики малярии, но и при артритах и красной волчанке):

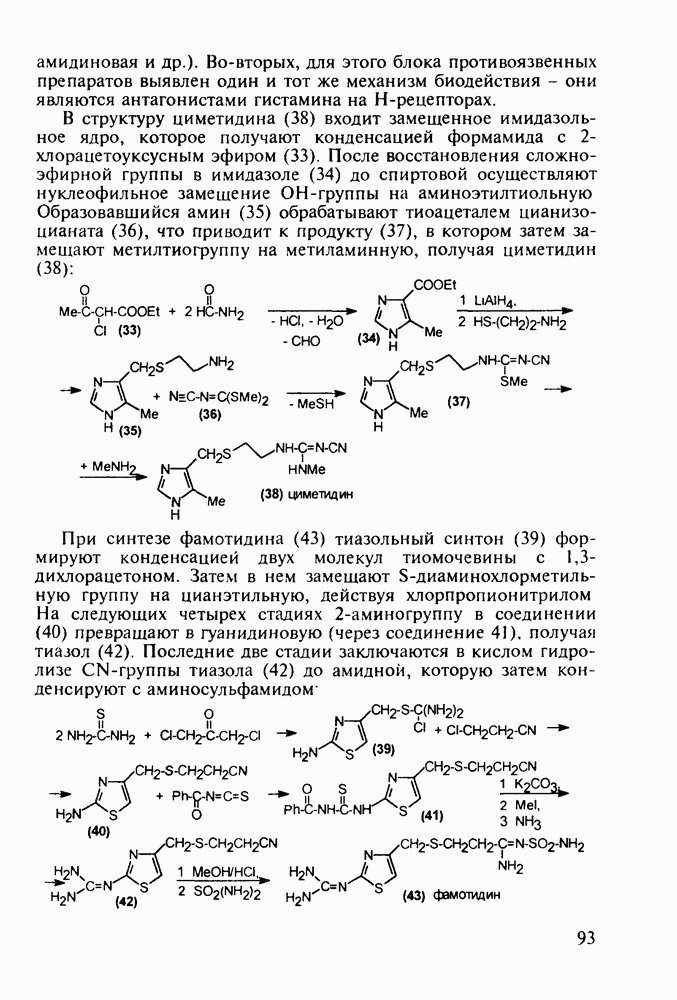
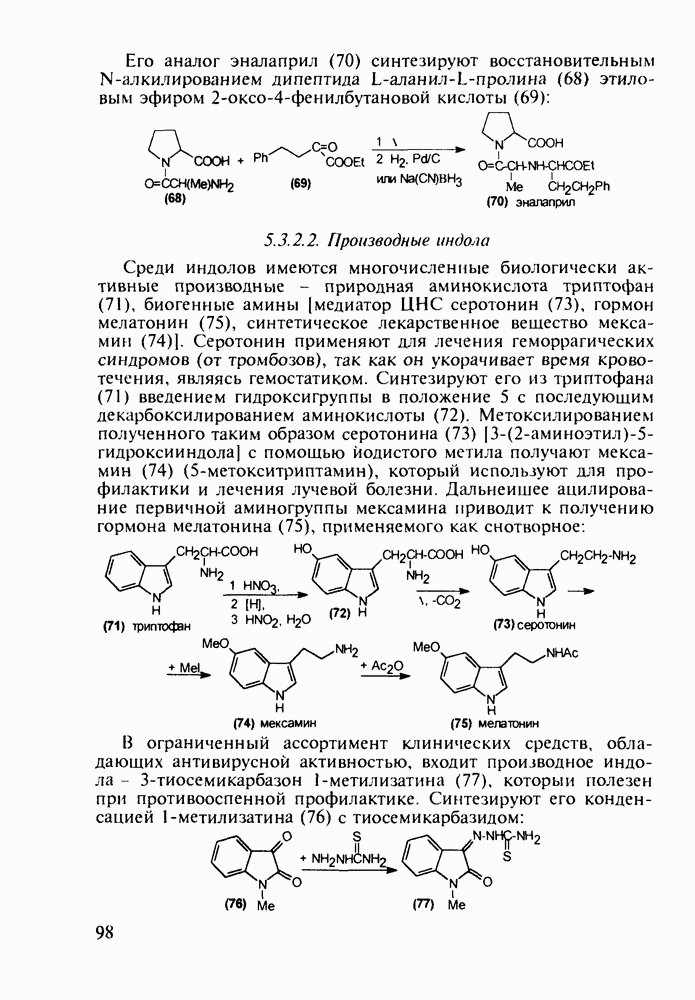
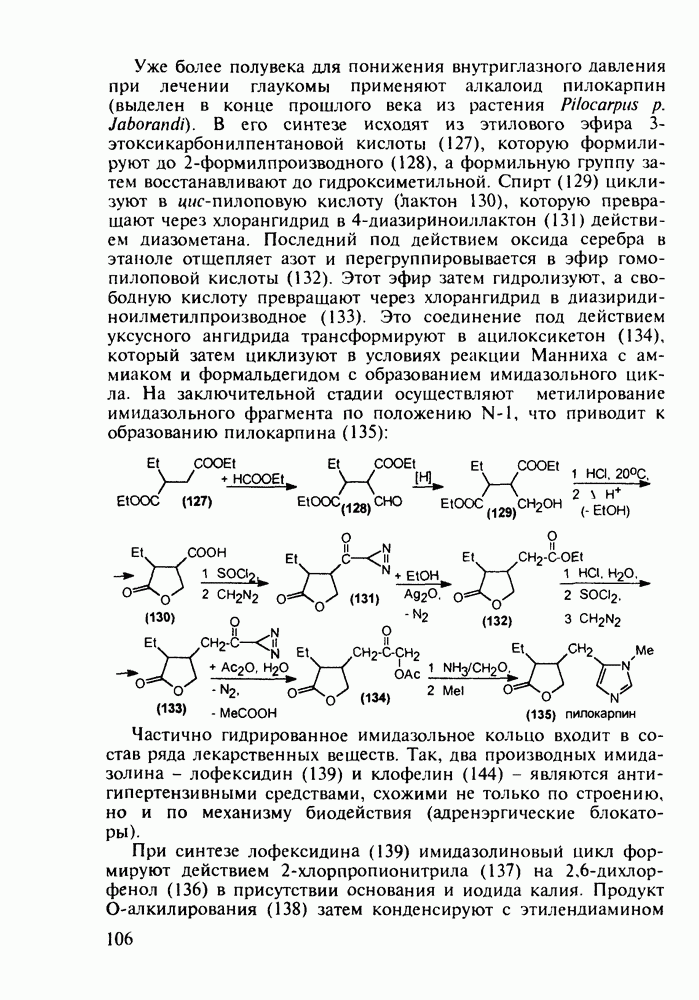
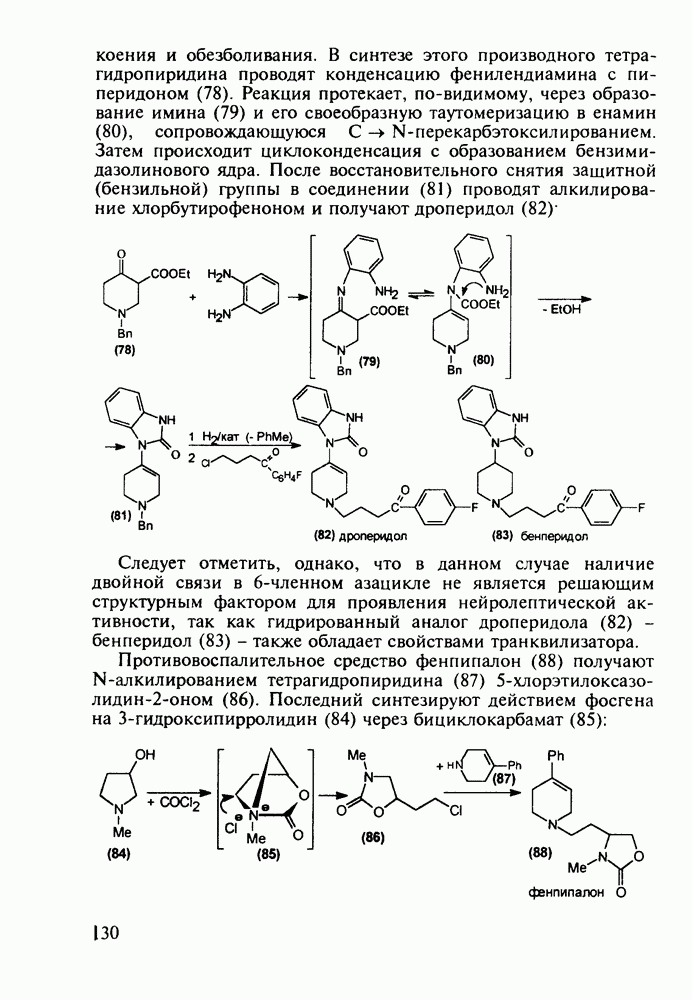
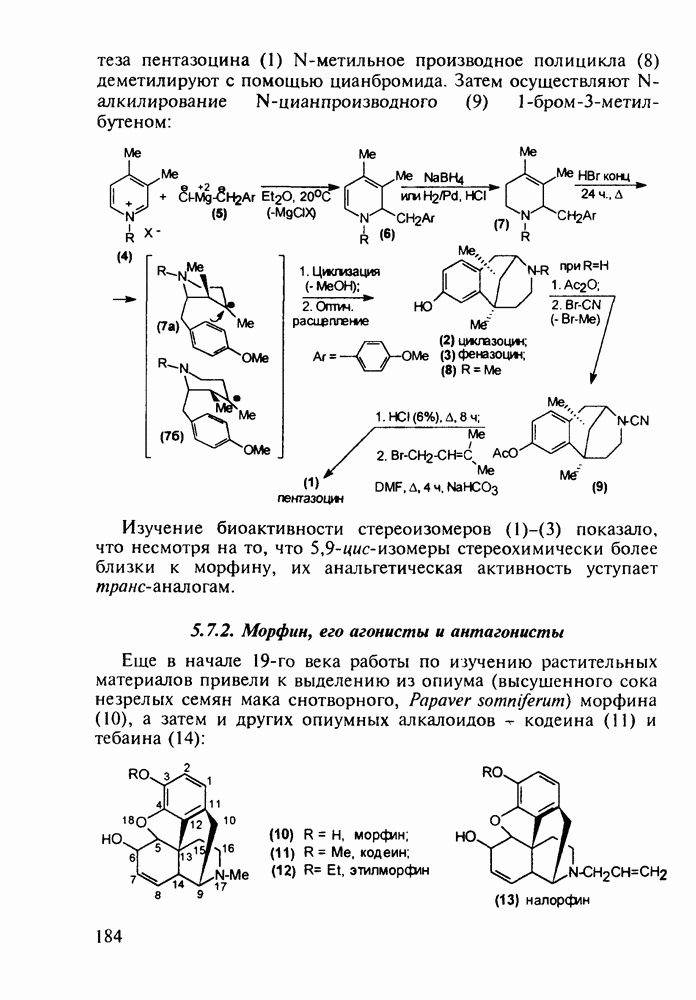
Противомалярийным и противоглистным действием обладает акрихин (152). Он также полезен при лечении красной волчанки и псориаза. Являясь производным  акрихин сочетает в себе структуры и биодействие как хлорохина, так и плазмохина. В синтезе акрихина акридиновый скелет (162) получают внутримолекулярной циклизацией диариламина (161), протекающей при повышенной температуре. 9-Акридон (162) хлорируют с помощью хлороксида фосфора до 9-хлоракридина, в котором затем действием аммиака замещают атом хлора на аминогруппу. Алкилирование полученного амина (163) 4-хлоралкиламином (155) приводит к получению акрихина:
акрихин сочетает в себе структуры и биодействие как хлорохина, так и плазмохина. В синтезе акрихина акридиновый скелет (162) получают внутримолекулярной циклизацией диариламина (161), протекающей при повышенной температуре. 9-Акридон (162) хлорируют с помощью хлороксида фосфора до 9-хлоракридина, в котором затем действием аммиака замещают атом хлора на аминогруппу. Алкилирование полученного амина (163) 4-хлоралкиламином (155) приводит к получению акрихина:

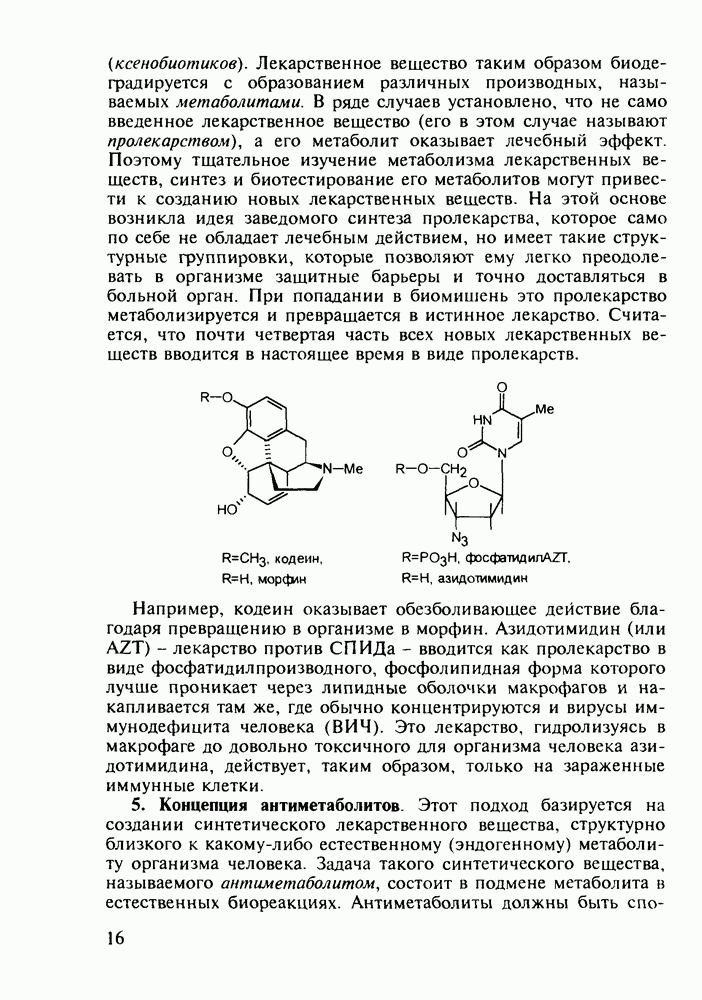
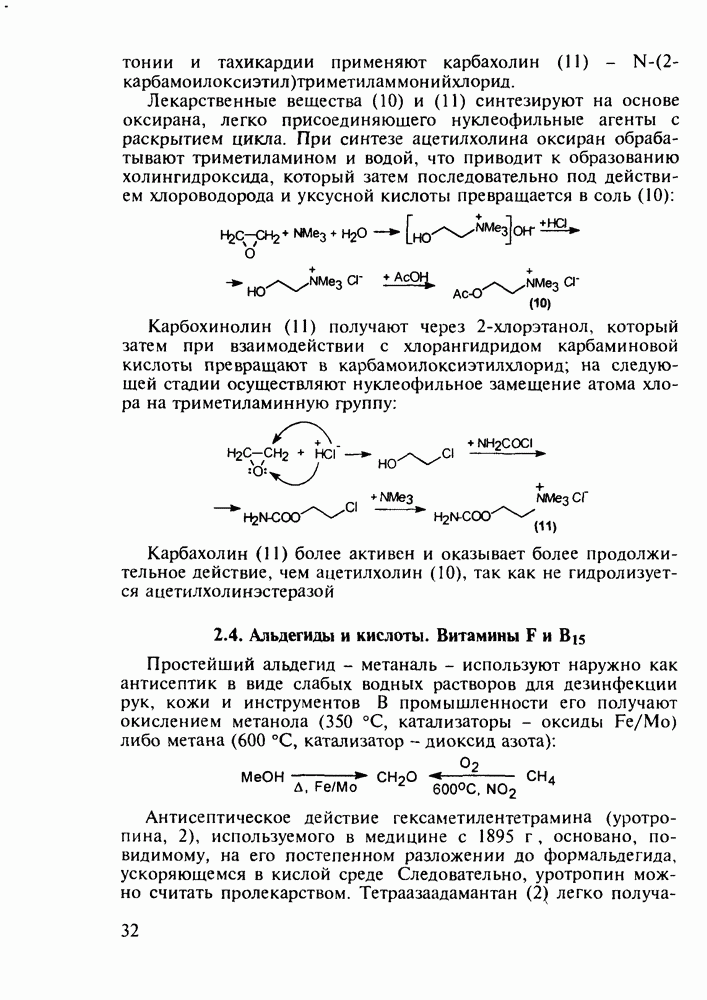
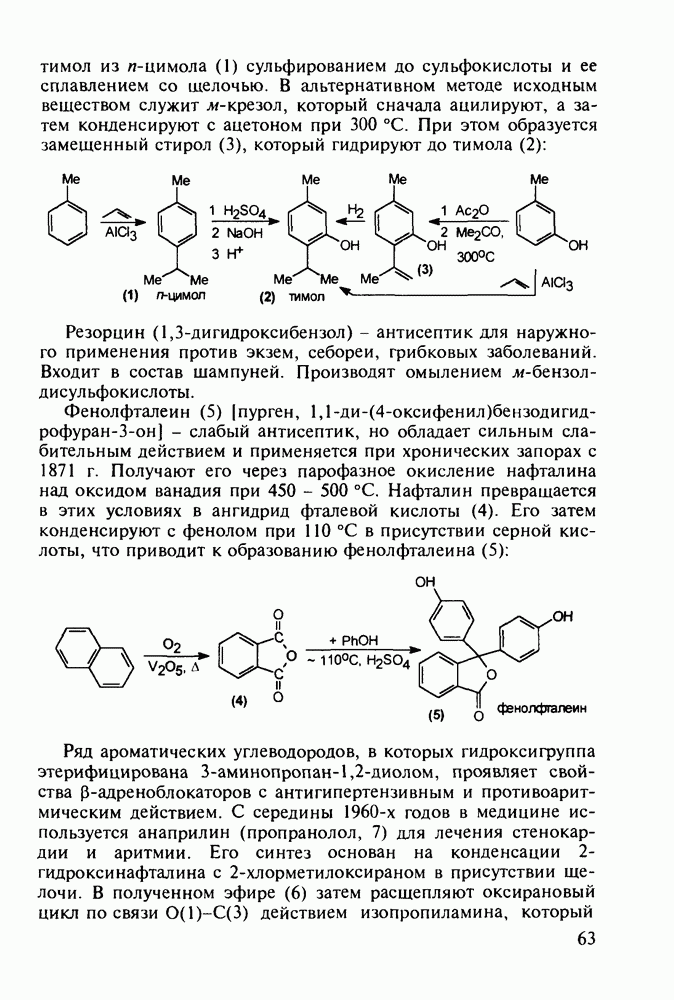
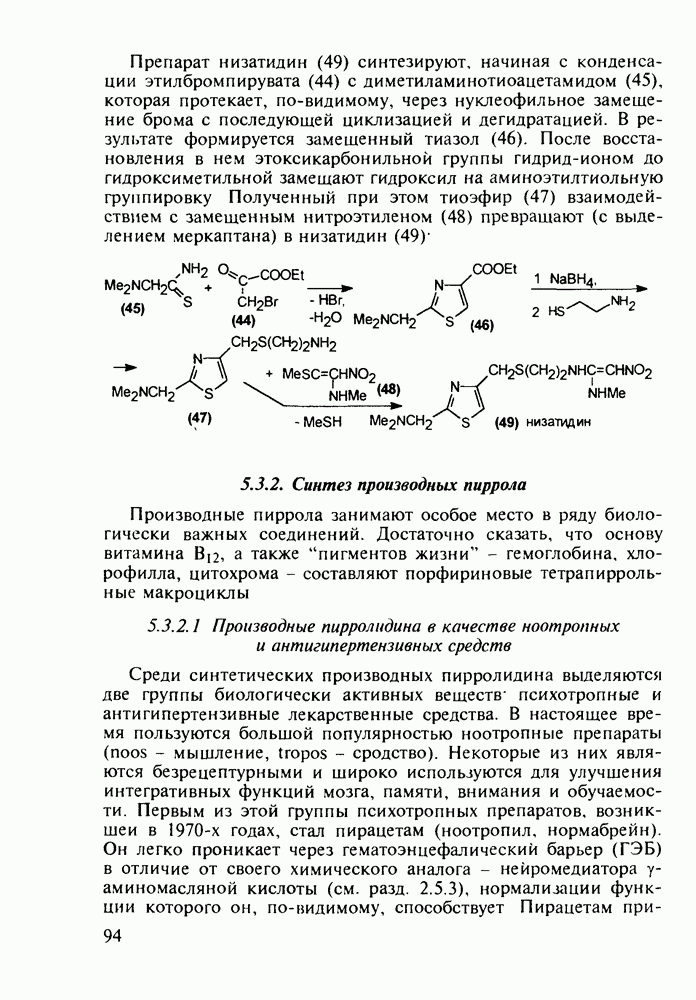
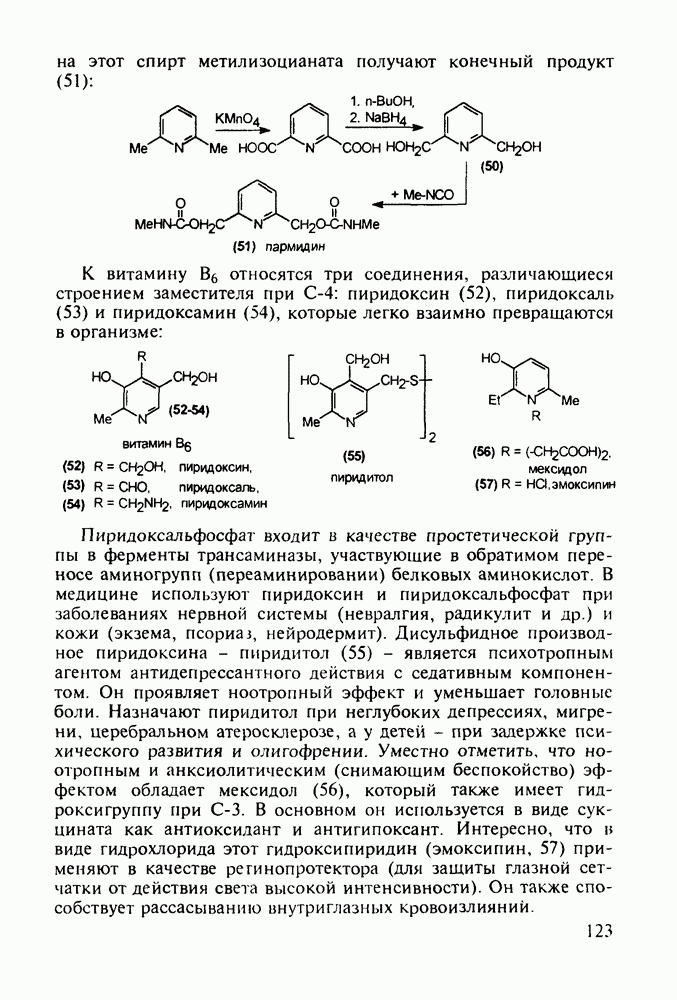
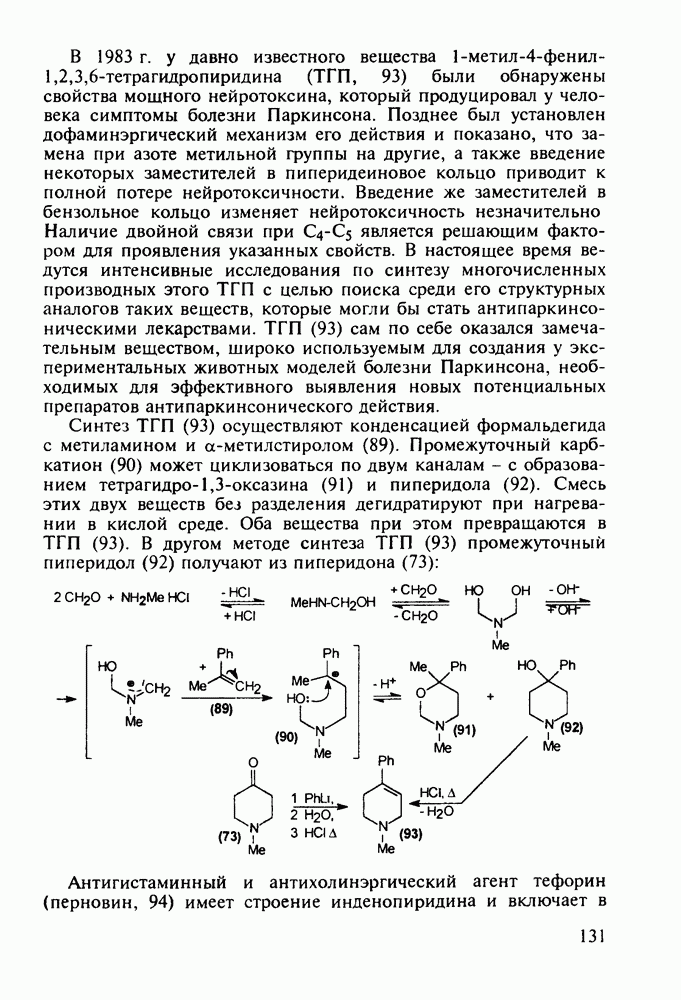
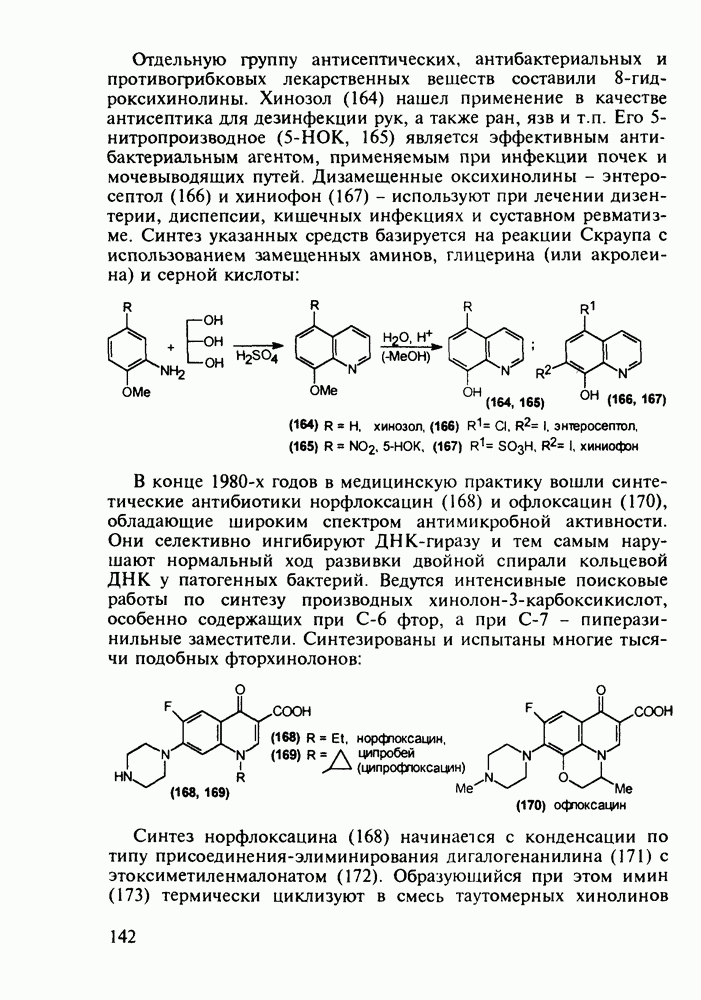
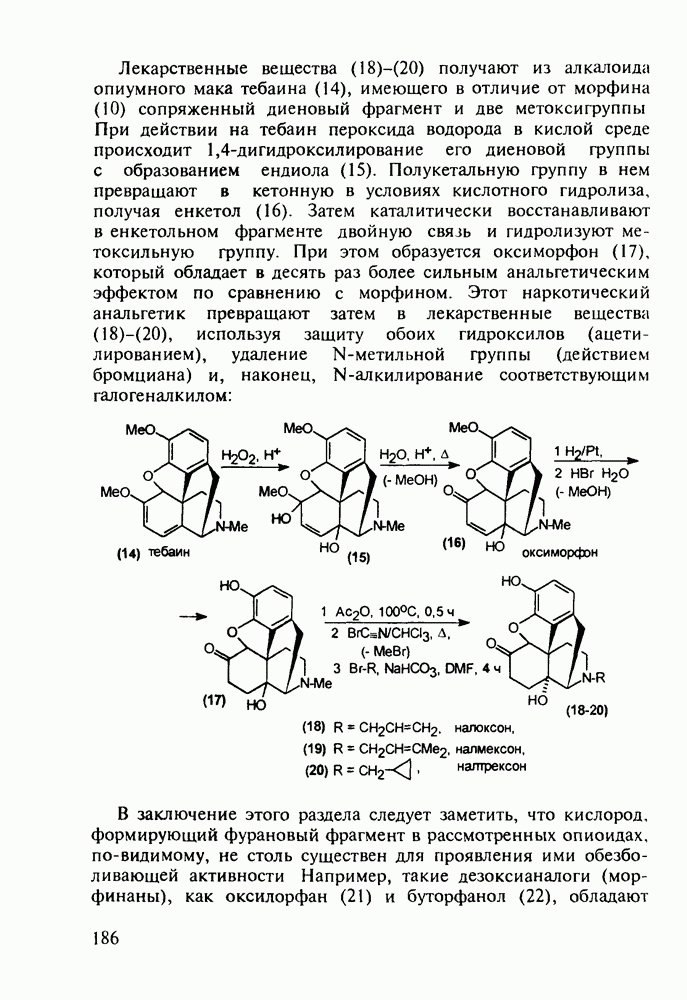
Отдельную группу антисептических, антибактериальных и противогрибковых лекарственных веществ составили  -гид-роксихинолины. Хинозол (164) нашел применение в качестве антисептика для дезинфекции рук, а также ран, язв и т.п. Его 5-нитропроизводное
-гид-роксихинолины. Хинозол (164) нашел применение в качестве антисептика для дезинфекции рук, а также ран, язв и т.п. Его 5-нитропроизводное  является эффективным антибактериальным агентом, применяемым при инфекции почек и мочевыводящих путей. Дизамещенные оксихинолины - энтеросептол (166) и хиниофон (167) - используют при лечении дизентерии, диспепсии, кишечных инфекциях и суставном ревматизме. Синтез указанных средств базируется на реакции Скраупа с использованием замещенных аминов, глицерина (или акролеина) и серной кислоты:
является эффективным антибактериальным агентом, применяемым при инфекции почек и мочевыводящих путей. Дизамещенные оксихинолины - энтеросептол (166) и хиниофон (167) - используют при лечении дизентерии, диспепсии, кишечных инфекциях и суставном ревматизме. Синтез указанных средств базируется на реакции Скраупа с использованием замещенных аминов, глицерина (или акролеина) и серной кислоты:

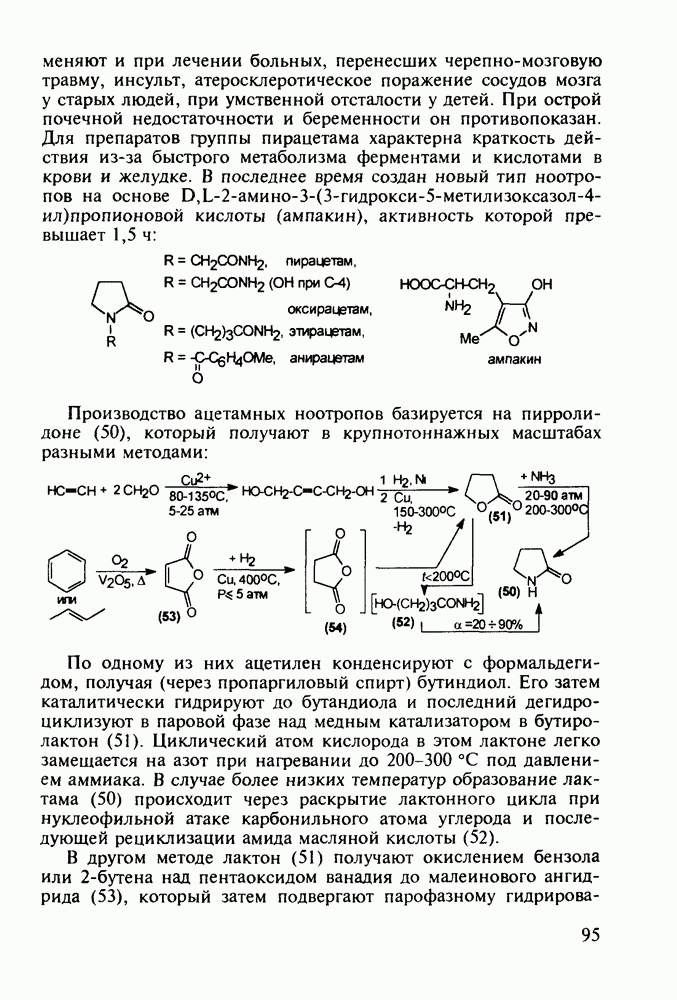
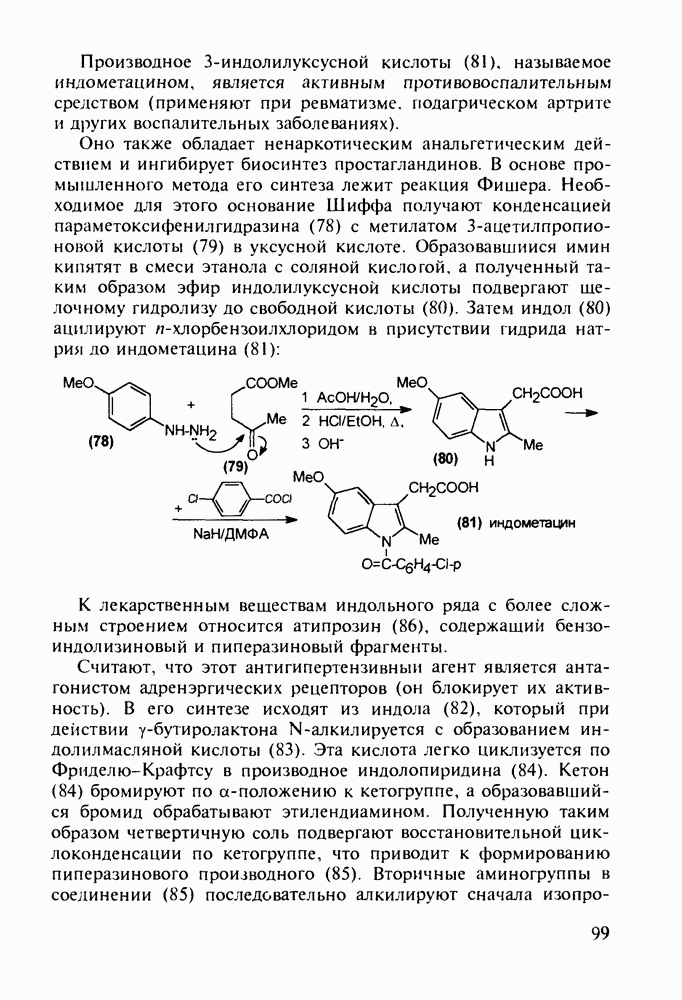
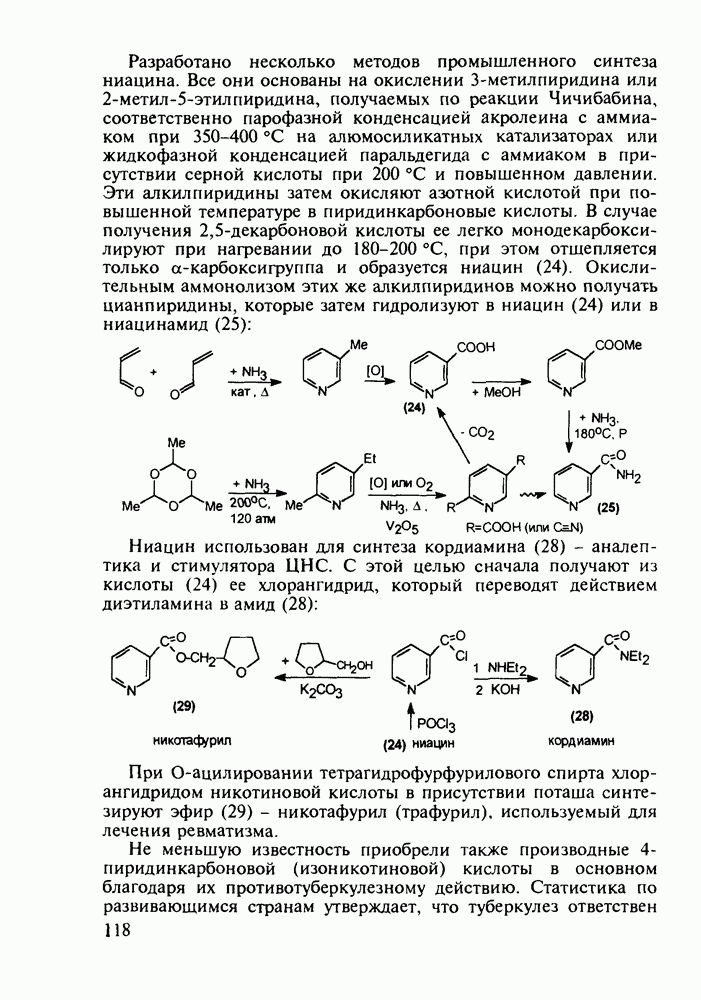
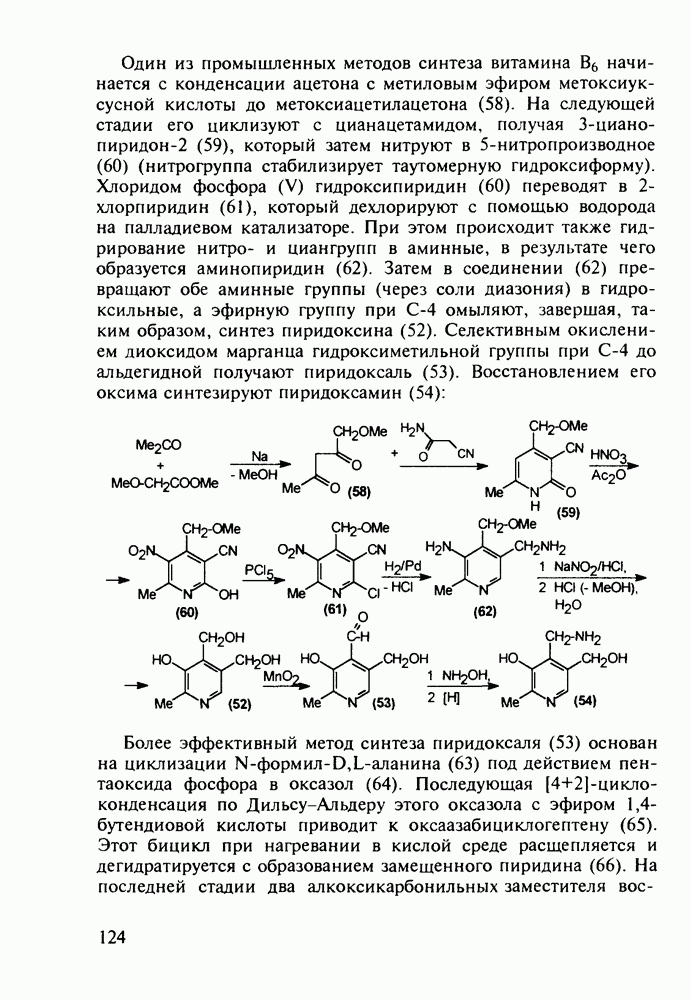
В конце 1980-х годов в медицинскую практику вошли синтетические антибиотики норфлоксацин (168) и офлоксацин (170), обладающие широким спектром антимикробной активности. Они селективно ингибируют ДНК-гиразу и тем самым нарушают нормальный ход развивки двойной спирали кольцевой ДНК у патогенных бактерий. Ведутся интенсивные поисковые работы по синтезу производных хинолон-3-карбоксикислот, особенно содержащих при С-6 фтор, а при С-7 - пиперазинильные заместители. Синтезированы и испытаны многие тысячи подобных фторхинолонов:

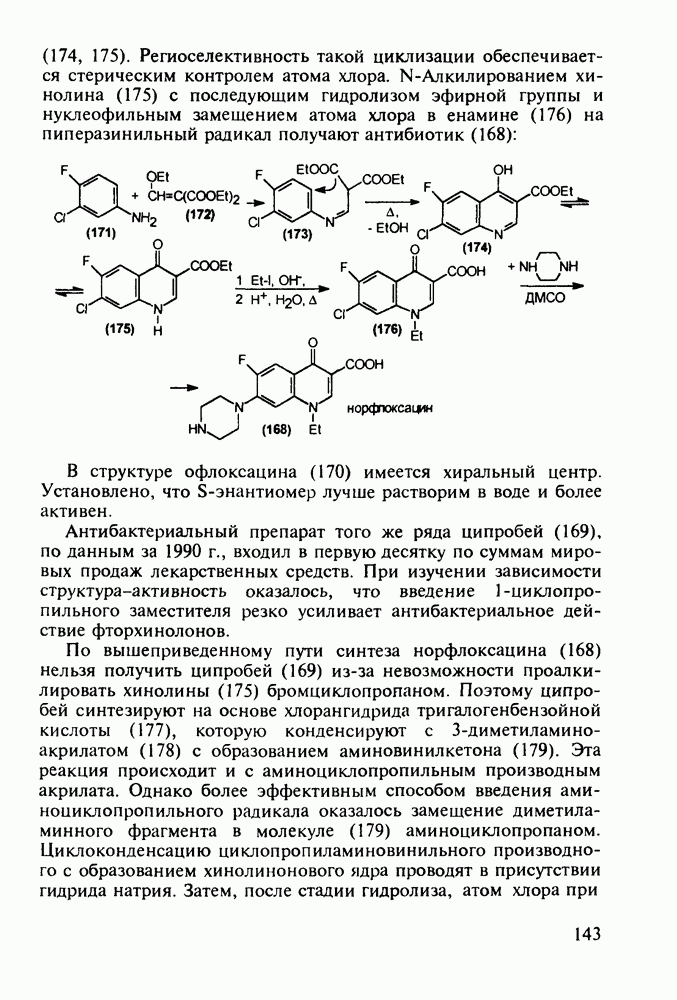
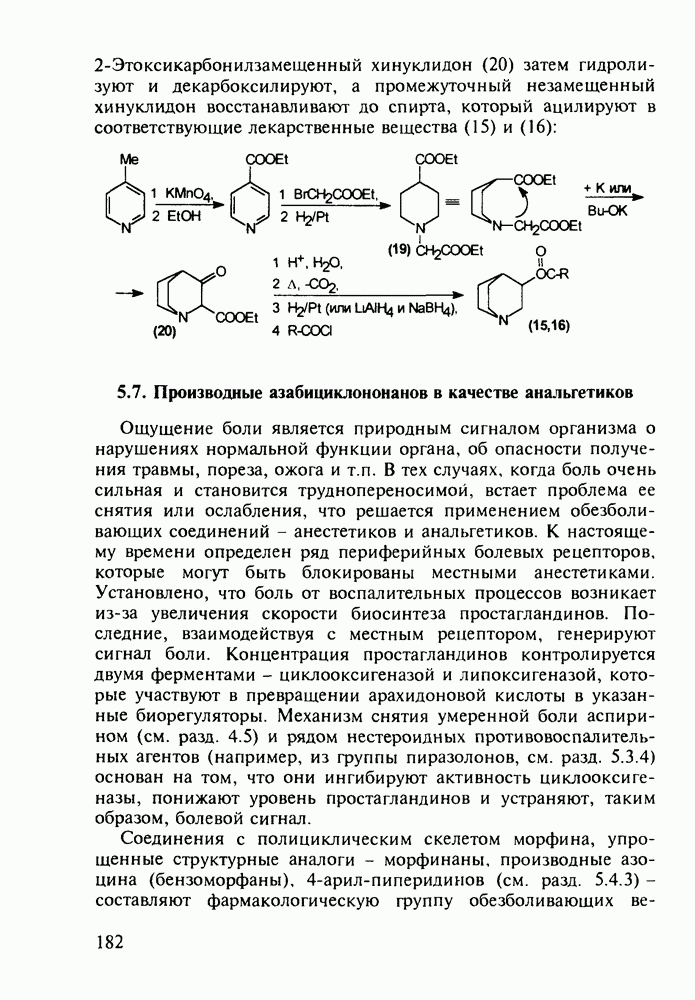
Синтез норфлоксацина (168) начинается с конденсации по типу присоединения-элиминирования дигалогенанилина (171) с этоксиметиленмалонатом (172). Образующийся при этом имин (173) термически циклизуют в смесь таутомерных хинолинов
(174, 175). Региоселективность такой циклизации обеспечивается стерическим контролем атома хлора. N-Алкилированием хинолина (175) с последующим гидролизом эфирной группы и нуклеофильным замещением атома хлора в енамине (176) на пиперазинильный радикал получают антибиотик (168):

В структуре офлоксацина (170) имеется хиральный центр. Установлено, что S-энантиомер лучше растворим в воде и более активен.
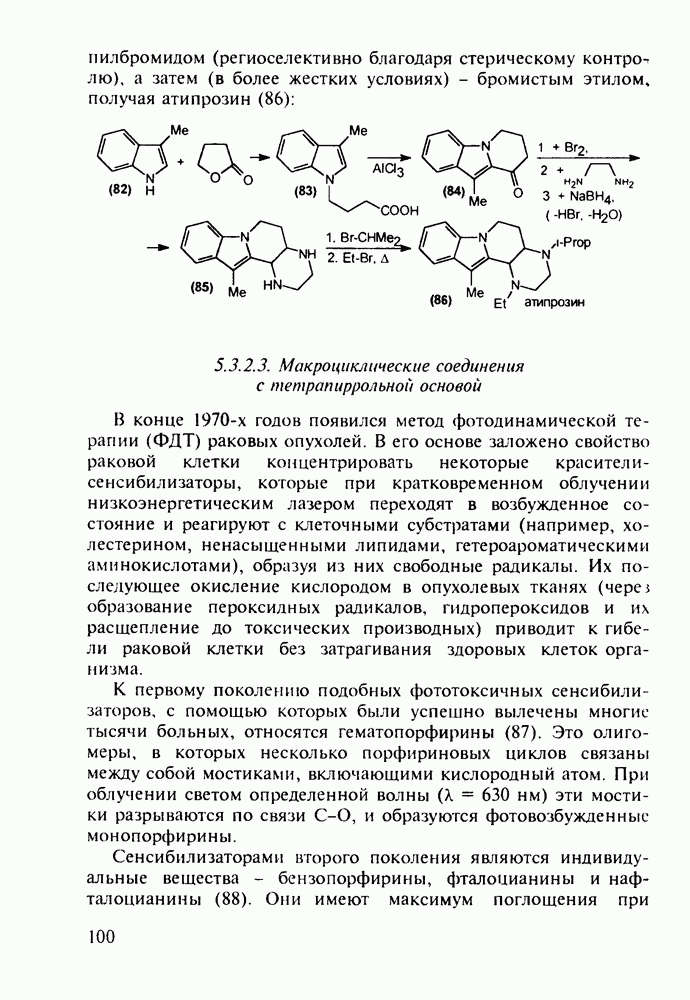
Антибактериальный препарат того же ряда ципробей (169), по данным за 1990 г., входил в первую десятку по суммам мировых продаж лекарственных средств. При изучении зависимости структура-активность оказалось, что введение 1-циклопро-пильного заместителя резко усиливает антибактериальное действие фторхинолонов.
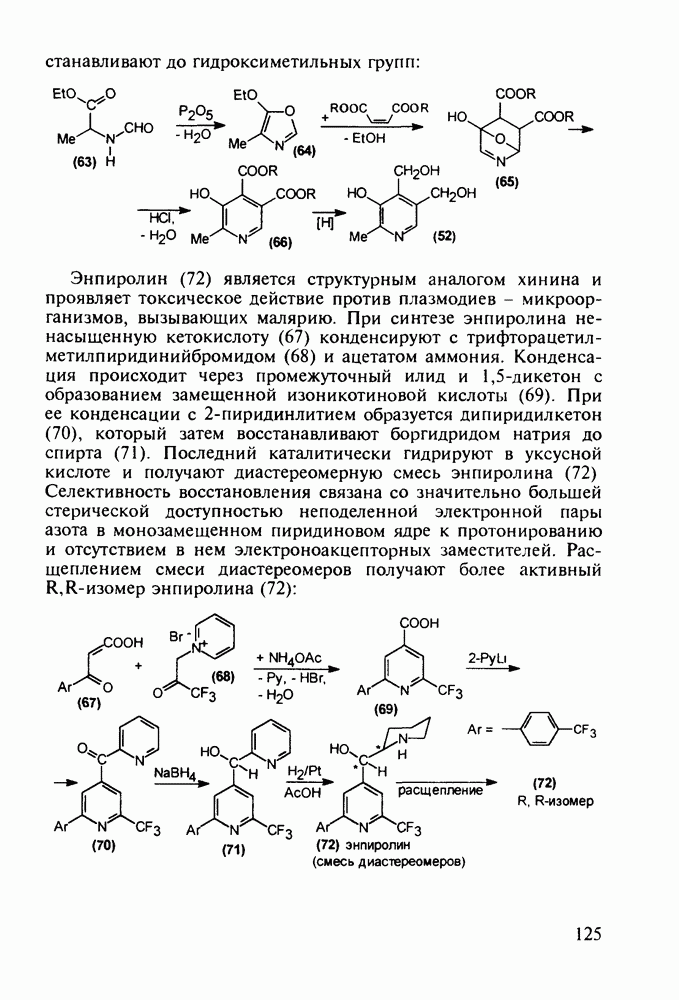
По вышеприведенному пути синтеза норфлоксацина (168) нельзя получить ципробей (169) из-за невозможности проалкилировать хинолины (175) бромциклопропаном. Поэтому ципробей синтезируют на основе хлорангидрида тригалогенбензойной кислоты (177), которую конденсируют с 3-диметиламино-акрилатом (178) с образованием аминовинилкетона (179). Эта реакция происходит и с аминоциклопропильным производным акрилата. Однако более эффективным способом введения аминоциклопропильного радикала оказалось замещение диметиламинного фрагмента в молекуле (179) аминоциклопропаном. Циклоконденсацию циклопропиламиновинильного производного с образованием хинолинонового ядра проводят в присутствии гидрида натрия. Затем, после стадии гидролиза, атом хлора при
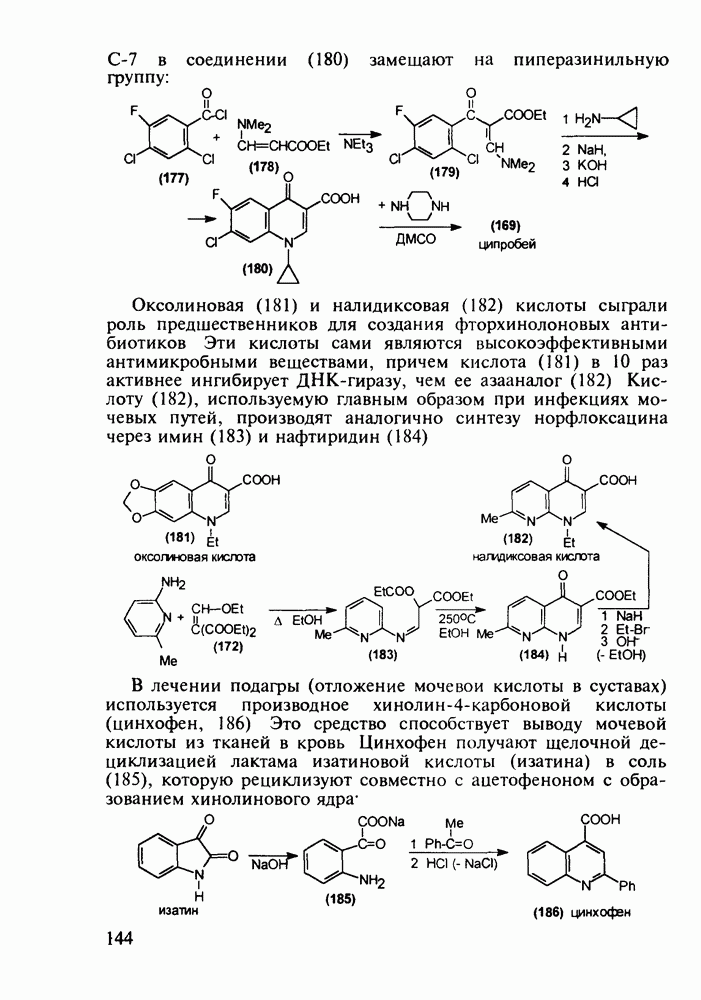
С-7 в соединении (180) замещают на пиперазинильную группу:

Оксолиновая (181) и налидиксовая (182) кислоты сыграли роль предшественников для создания фторхинолоновых антибиотиков Эти кислоты сами являются высокоэффективными антимикробными веществами, причем кислота (181) в 10 раз активнее ингибирует ДНК-гиразу, чем ее азааналог (182) Кислоту (182), используемую главным образом при инфекциях мочевых путей, производят аналогично синтезу норфлоксацина через имин (183) и нафтиридин (184)

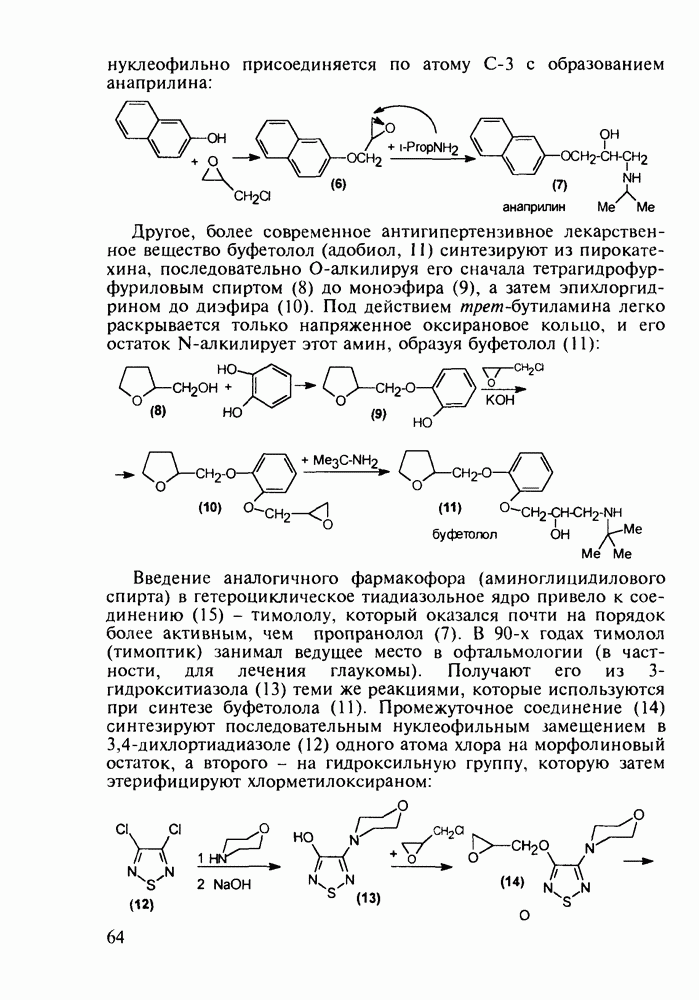
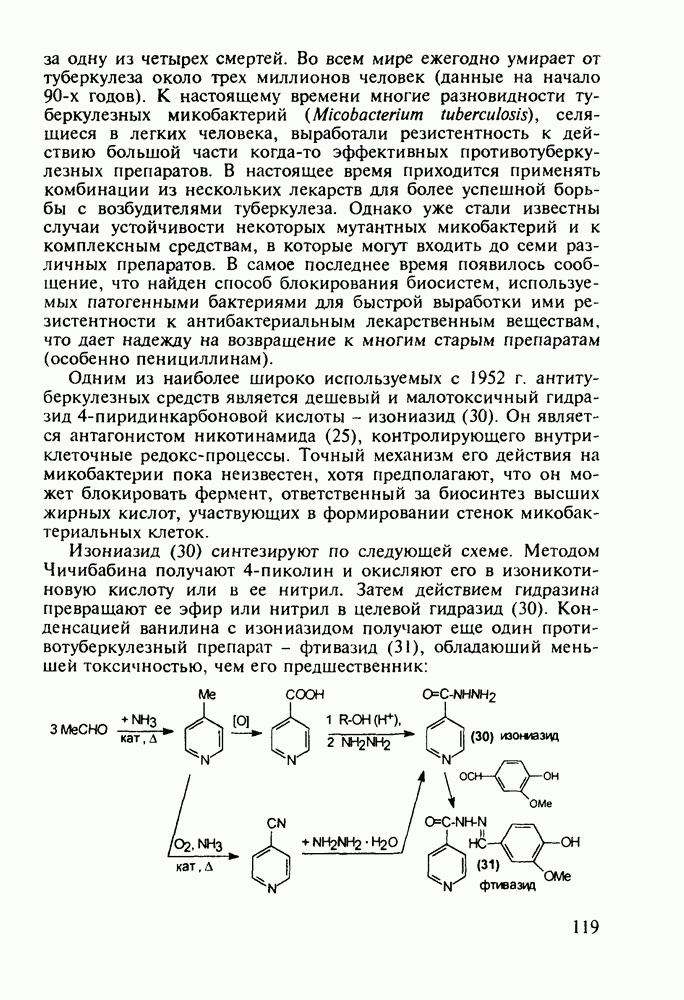
В лечении подагры (отложение мочевой кислоты в суставах) используется производное хинолин-4-карбоновой кислоты (цинхофен, 186) Это средство способствует выводу мочевой кислоты из тканей в кровь Цинхофен получают щелочной дециклизацией лактама изатиновой кислоты (изатина) в соль (185), которую рециклизуют совместно с ацетофеноном с образованием хинолинового ядра

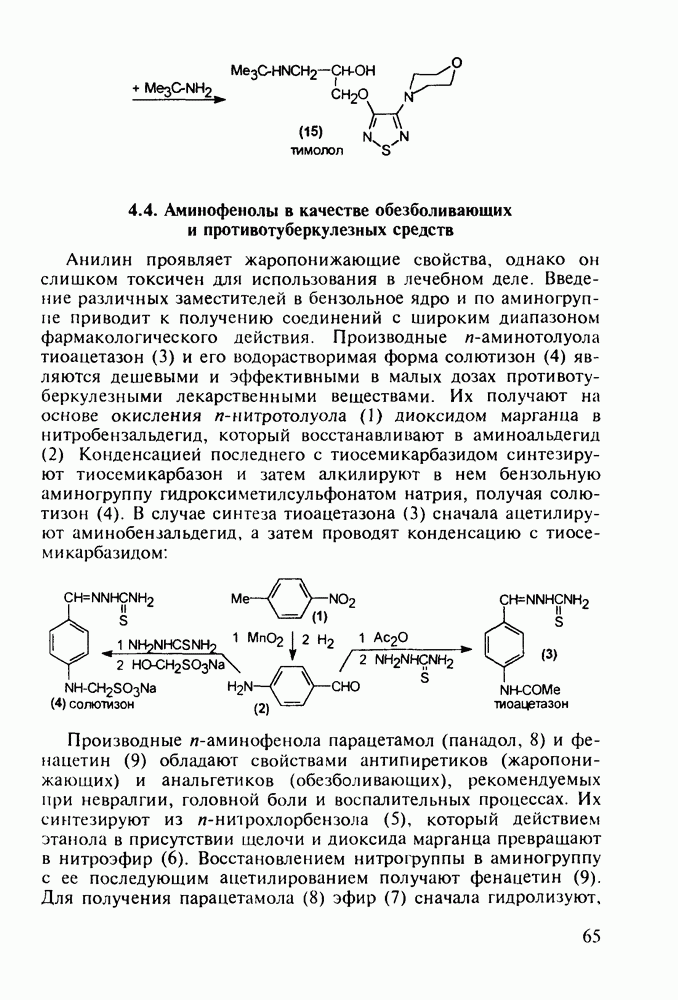
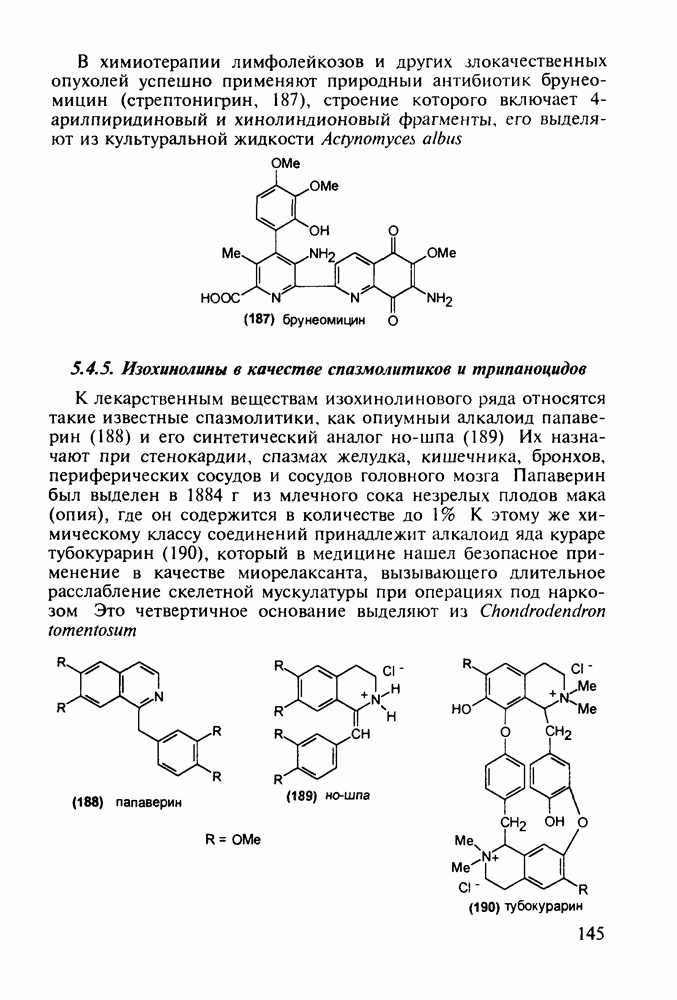
В химиотерапии лимфолейкозов и других злокачественных опухолей успешно применяют природный антибиотик брунео-мицин (стрептонигрин, 187), строение которого включает 4-арилпиридиновый и хинолиндионовый фрагменты, его выделяют из культуральной жидкости Actynomyces albus

| << Предыдущий параграф | Следующий параграф >> |
- Предисловие
- 1. ВВЕДЕНИЕ
- 1.1. Эволюция органической химии лекарственных веществ
- 1.2. Современные требования к лекарственным веществам
- 1.3. Стадии биологического изучения лекарственного вещества
- 1.4. Основы стратегии создания новых синтетических лекарственных веществ
- 1.5. Связь структура-биологическая активность
- 1.6. Принципиальная схема разработки нового лекарственного вещества
- 1.7. Классификация лекарственных веществ
- 1.8. Основные болезни человека и ведущие группы лекарственных веществ на современном фармацевтическом рынке
- 2. СИНТЕЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ АЛИФАТИЧЕСКОГО РЯДА
- 2.2. Группа противораковых веществ с дихлордиэтиламинным фармакофором
- 2.3. Алканолы, аминоалканолы и их эфиры. Нейромедиатор ацетилхолин и холиномиметики
- 2.4. Альдегиды и кислоты. Витамины F и B15
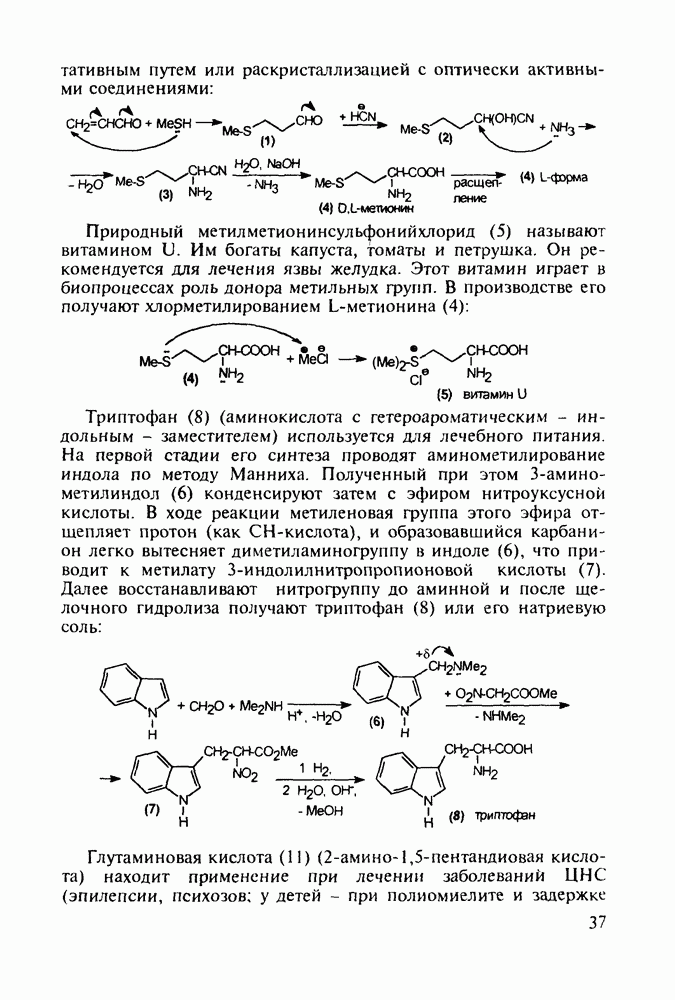
- 2.5. Аминокислоты
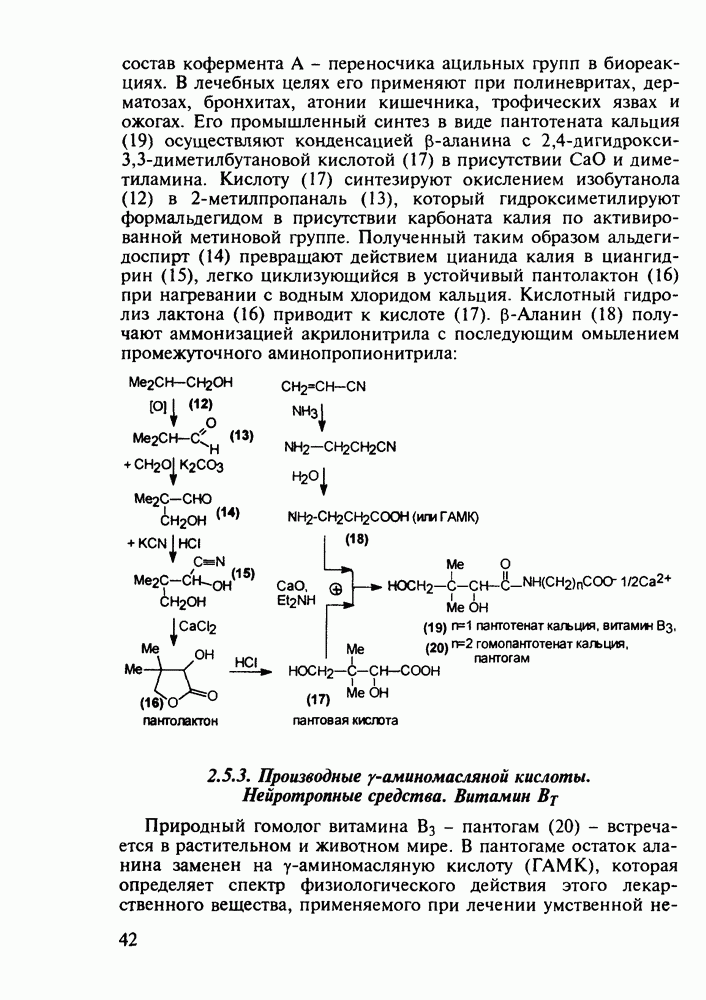
- 2.5.2. Производные b-аминокислот. Витамин B3
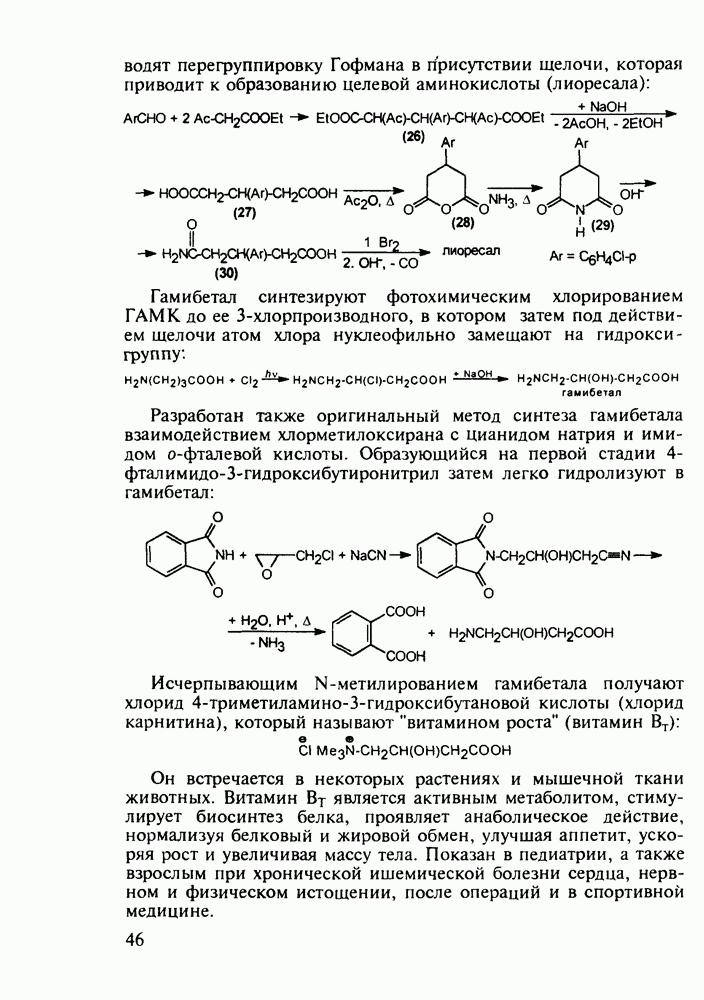
- 2.5.3. Производные у-аминомасляной кислоты. Нейротропные средства. Витамин BT
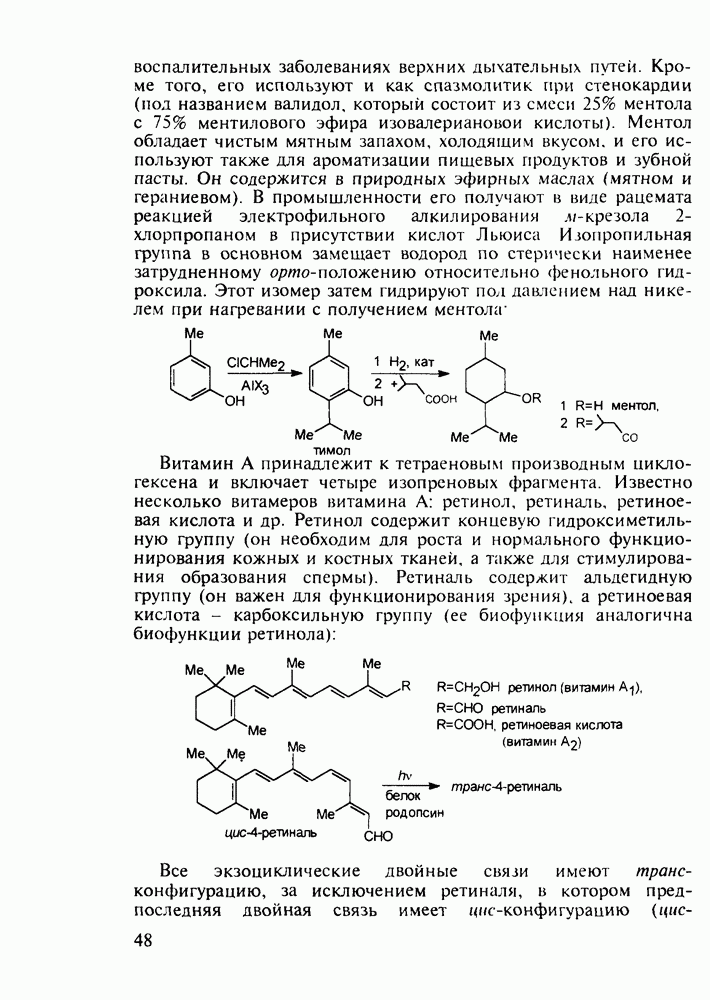
- 2.5.4. Другие аминокислоты
- 3. ЛЕКАРСТВЕННЫЕ ВЕЩЕСТВА АЛИЦИКЛИЧЕСКОГО РЯДА
- 3.2. Противозачаточные и противовоспалительные вещества на основе циклопентафенантрена. Синтез витамина D
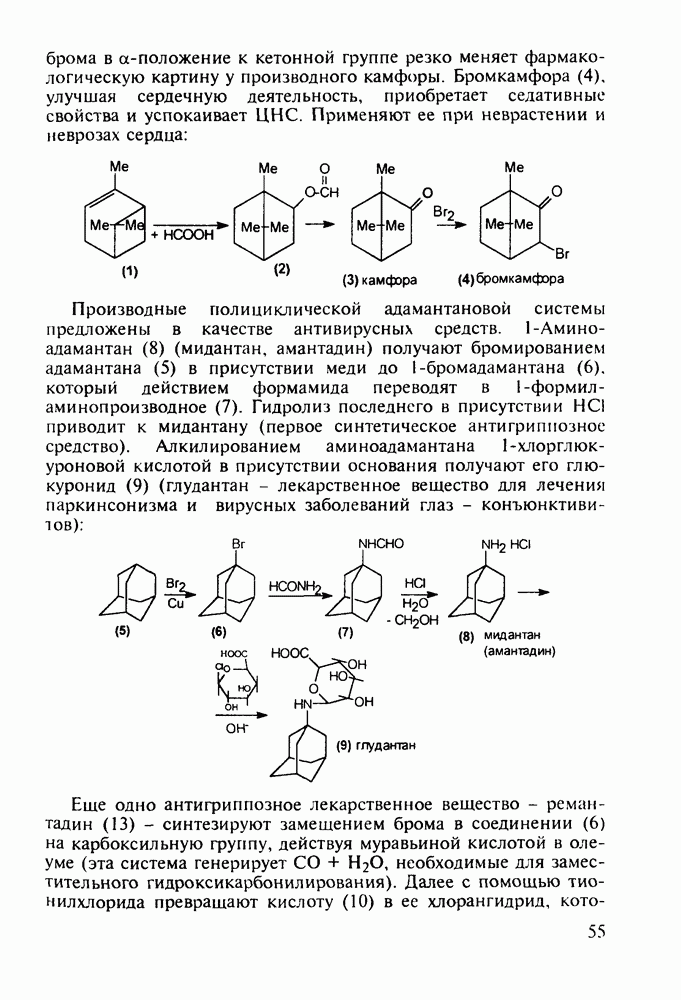
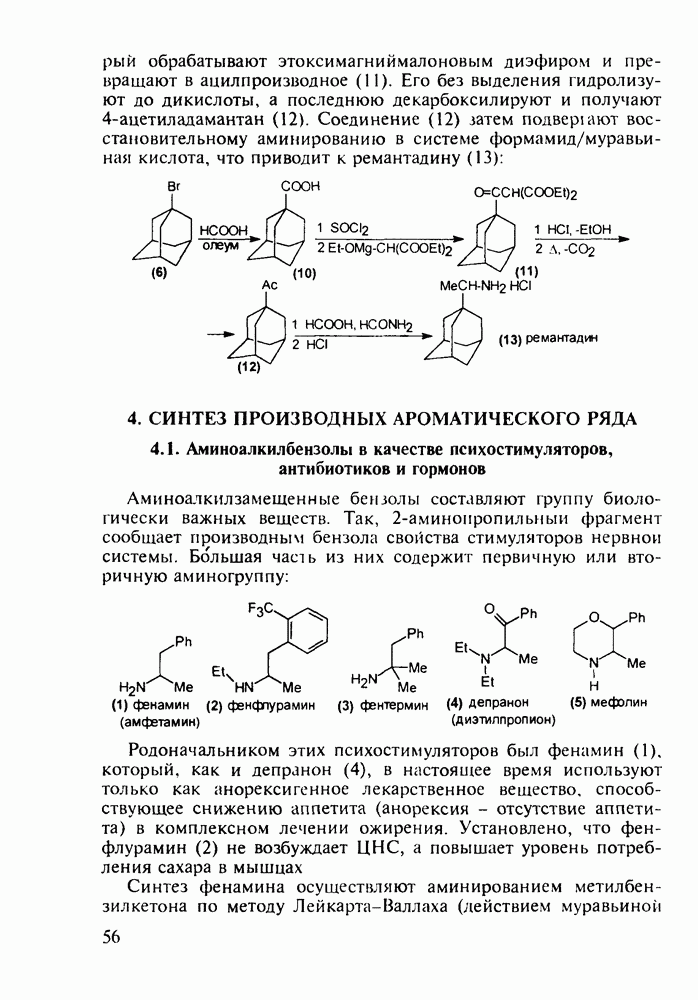
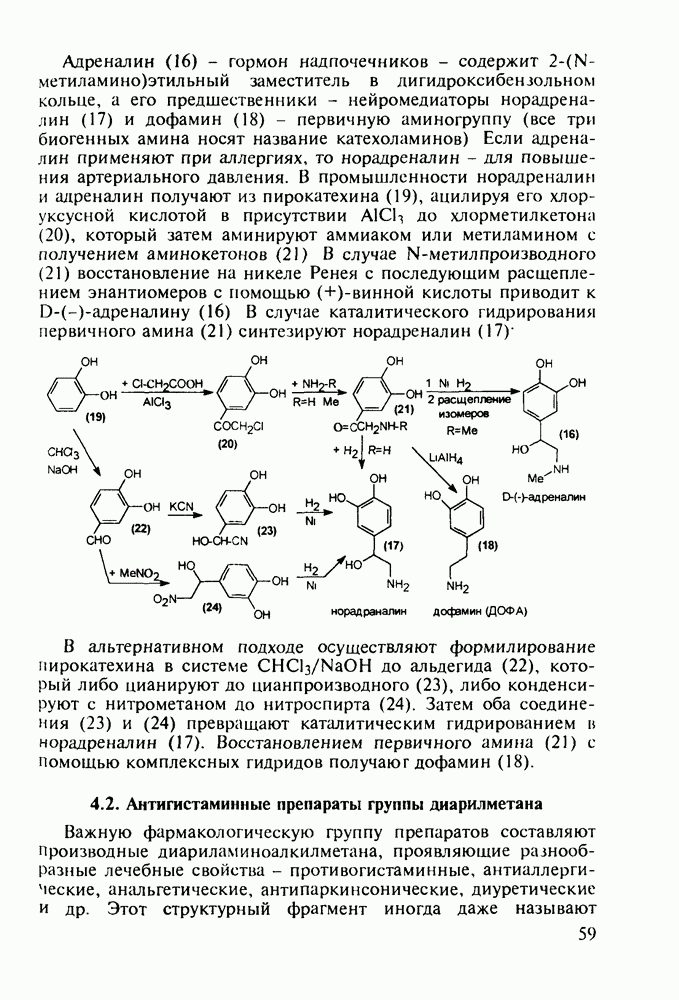
- 3.3. Камфора. Производные адамантана в качестве антивирусных средств
- 4. СИНТЕЗ ПРОИЗВОДНЫХ АРОМАТИЧЕСКОГО РЯДА
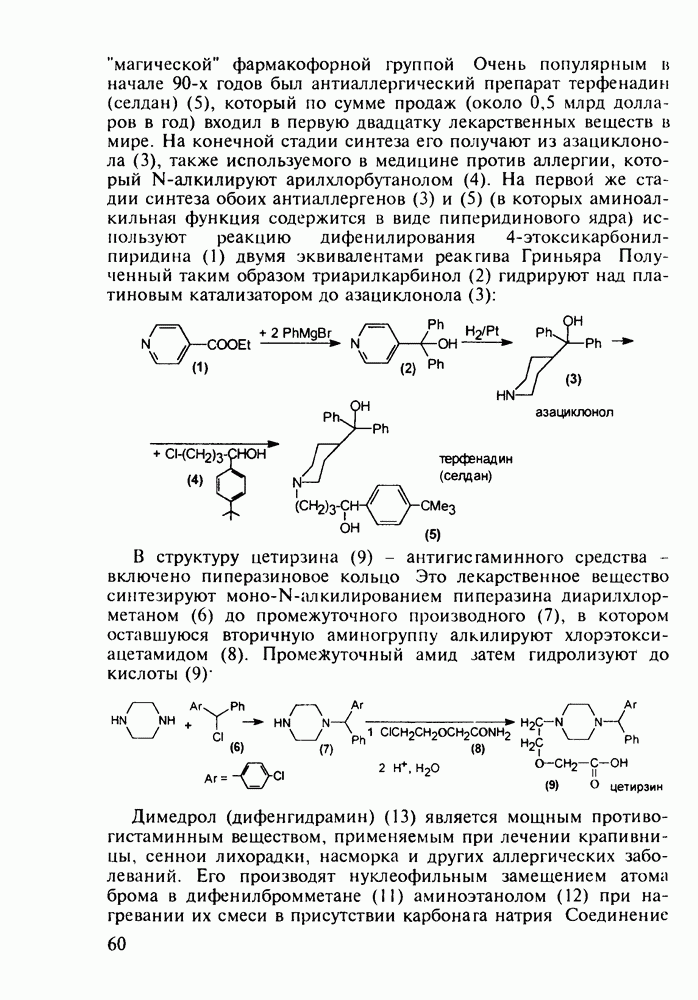
- 4.2. Антигистаминные препараты группы диарилметана
- 4.3. Антисептики и адреноблокаторы фенольного ряда
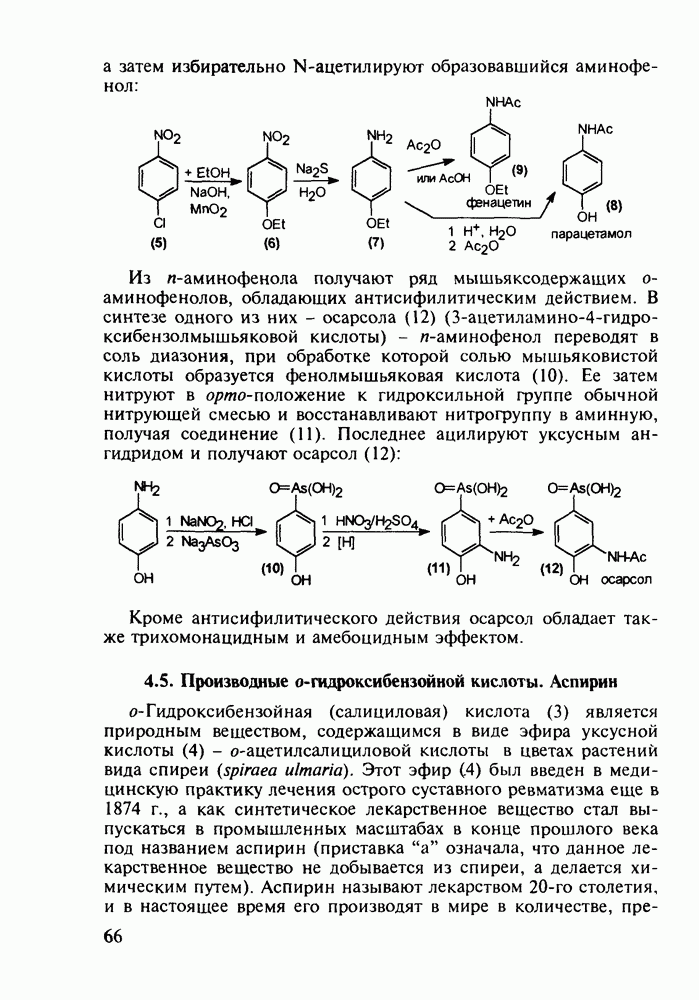
- 4.4. Аминофенолы в качестве обезболивающих и противотуберкулезных средств
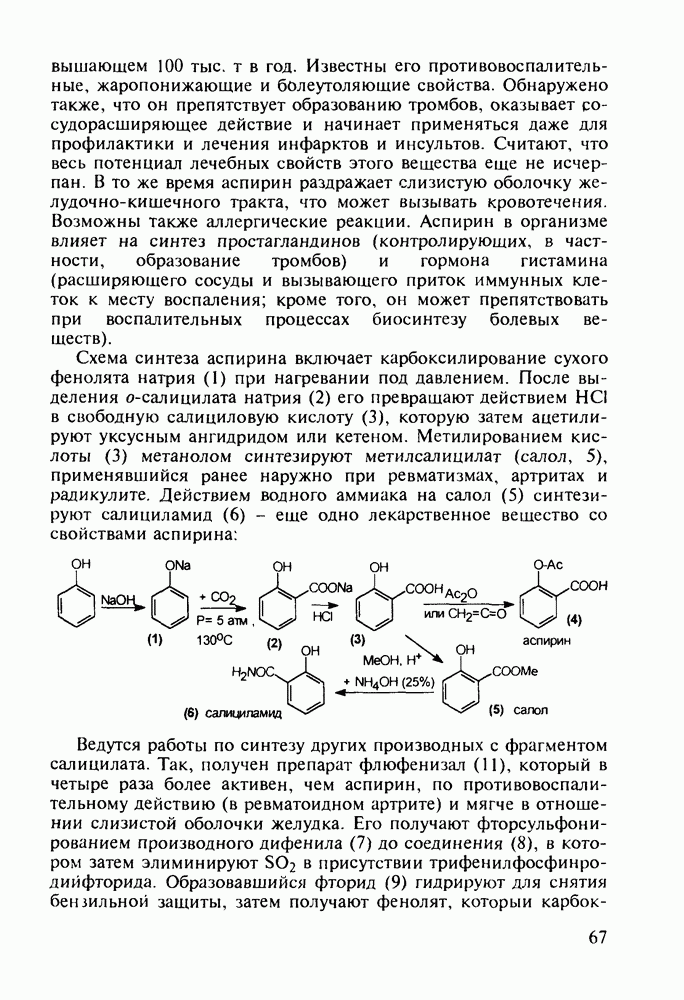
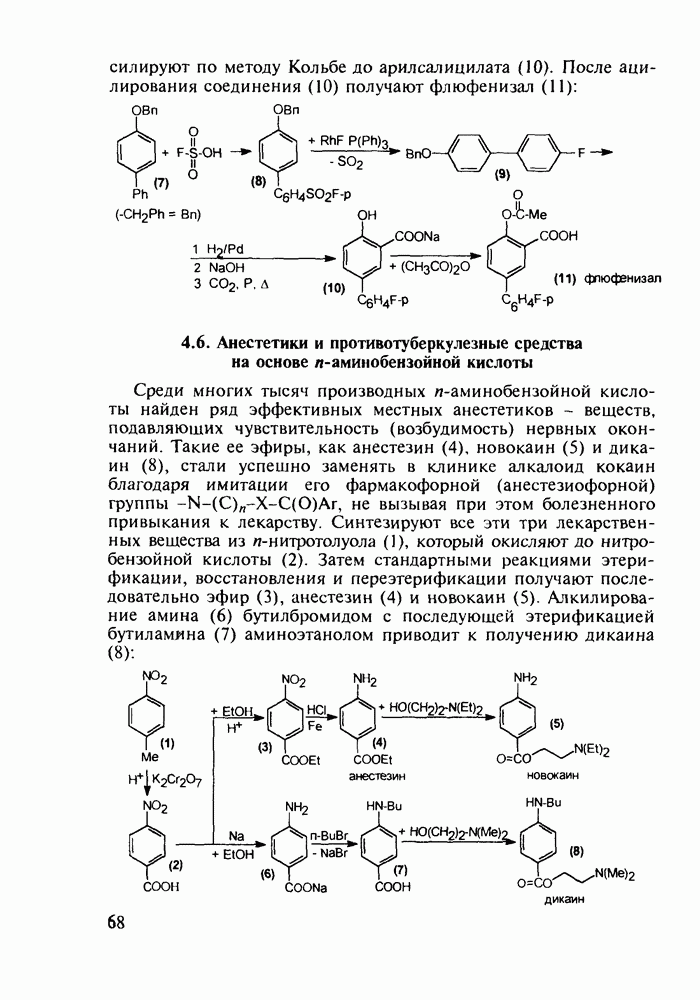
- 4.5. Производные о-гидроксибензойной кислоты. Аспирин
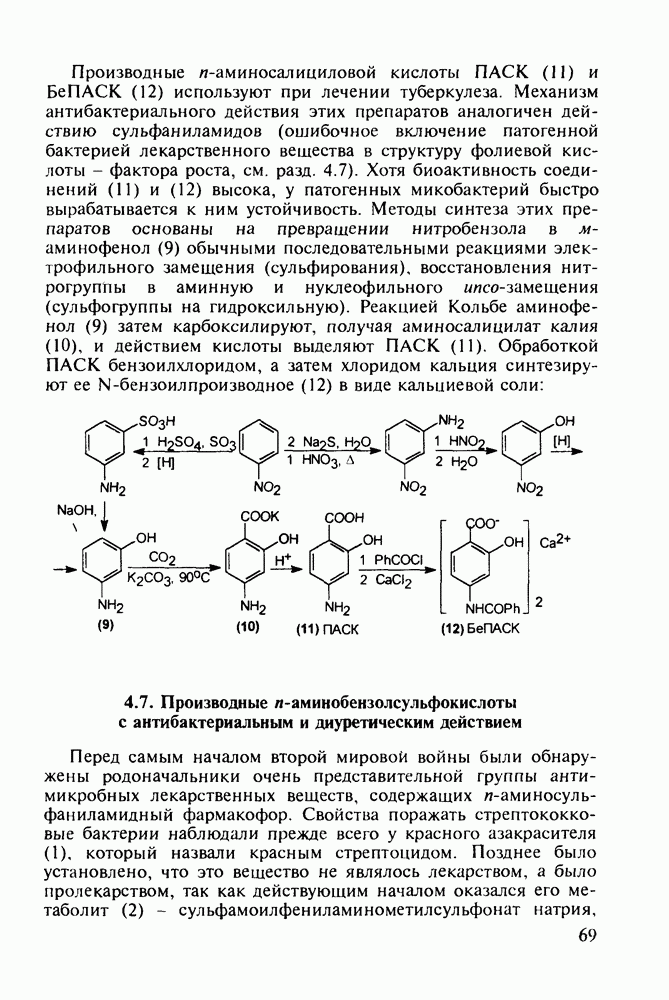
- 4.6. Анестетики и противотуберкулезные средства на основе n-аминобензойной кислоты
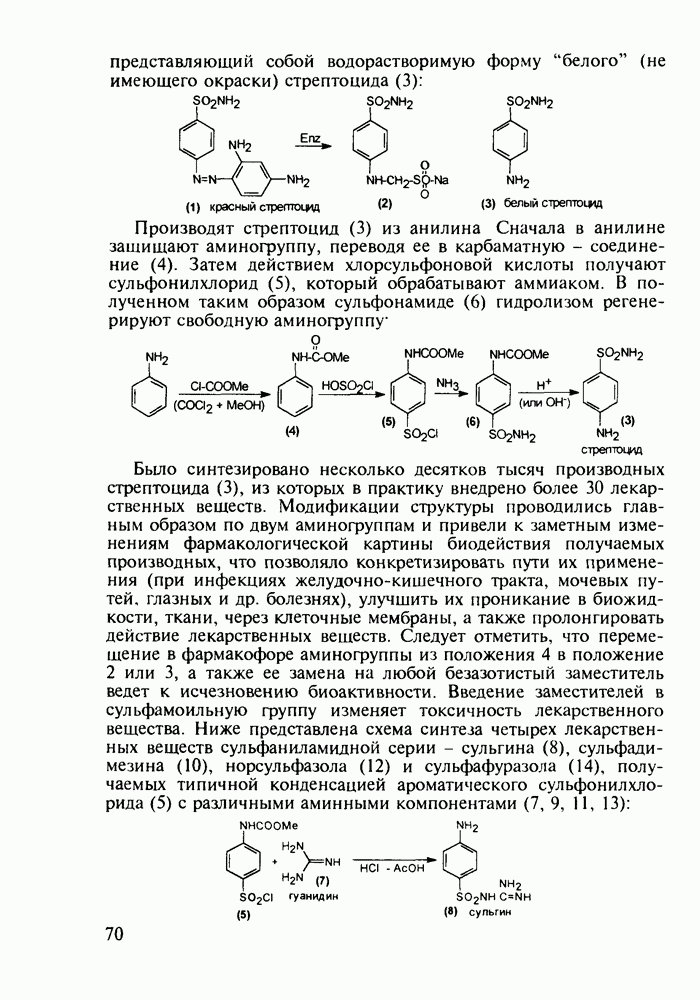
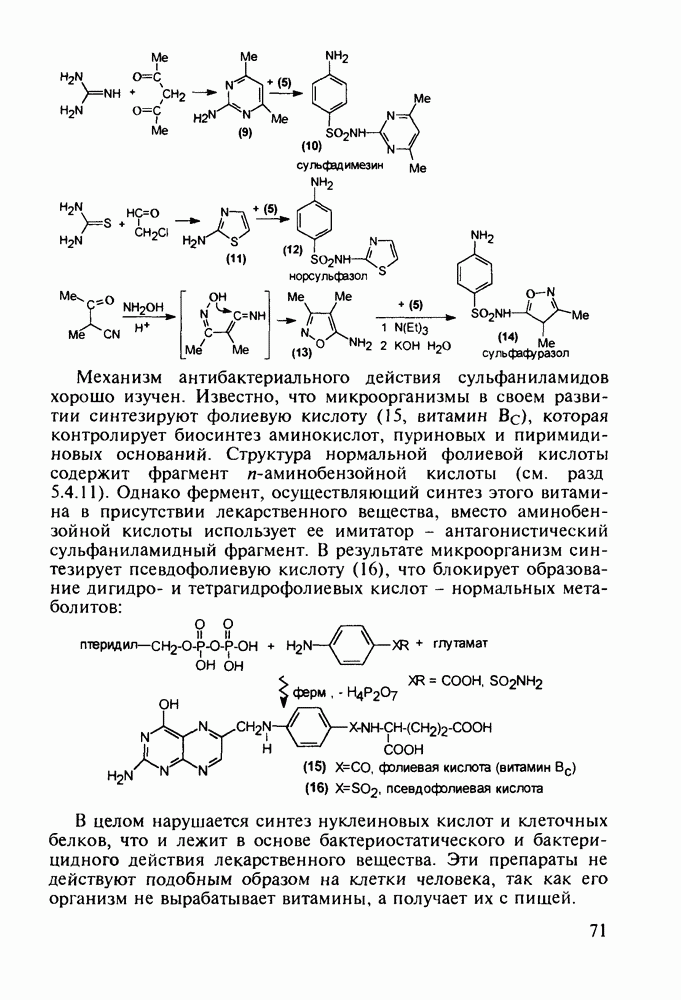
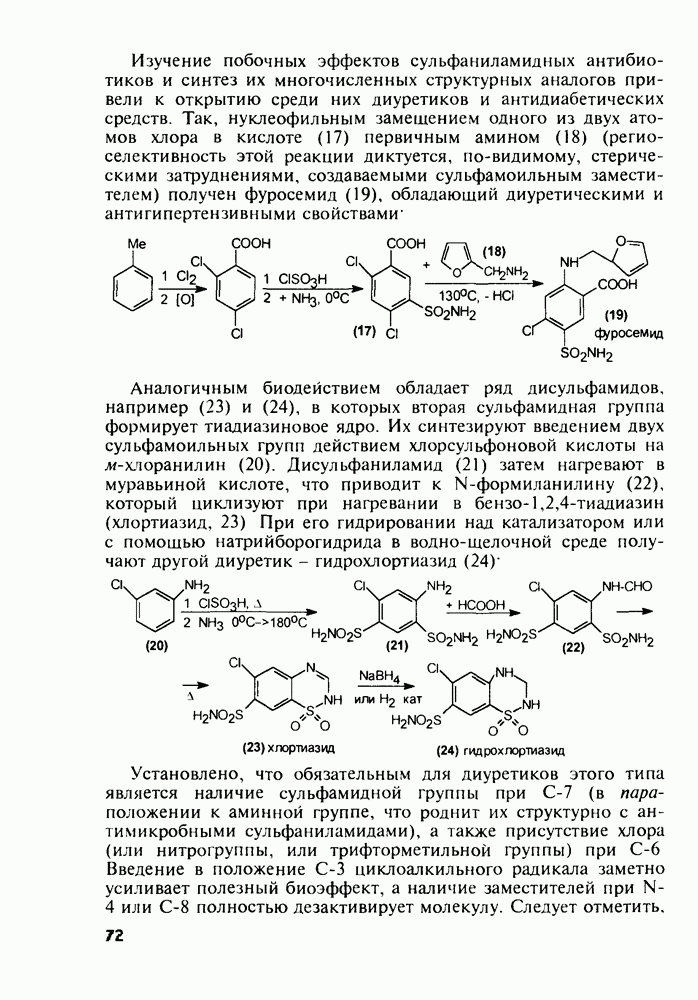
- 4.7. Производные n-аминобензолсульфокислоты с антибактериальным и диуретическим действием
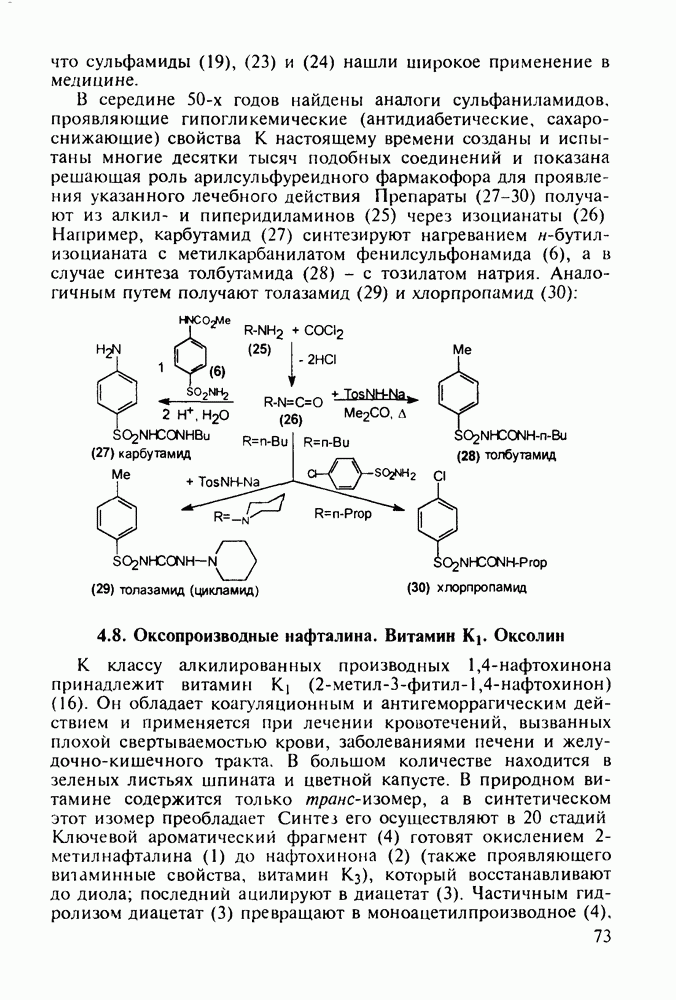
- 4.8. Оксопроизводные нафталина. Витамин К1. Оксолин
- 5. ХИМИЯ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ С БАЗОВЫМ ГЕТЕРОЦИКЛИЧЕСКИМ ФРАГМЕНТОМ
- 5.2. Антибиотики, содержащие четырехчленное азетидиновое ядро
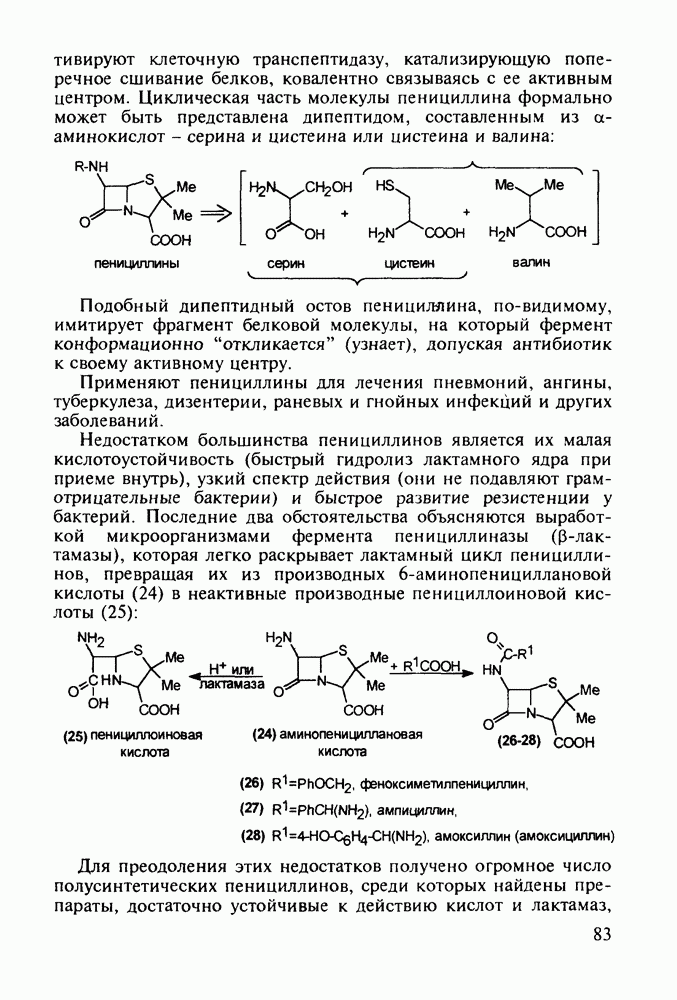
- 5.2.2. Пенициллины. Моксалактам
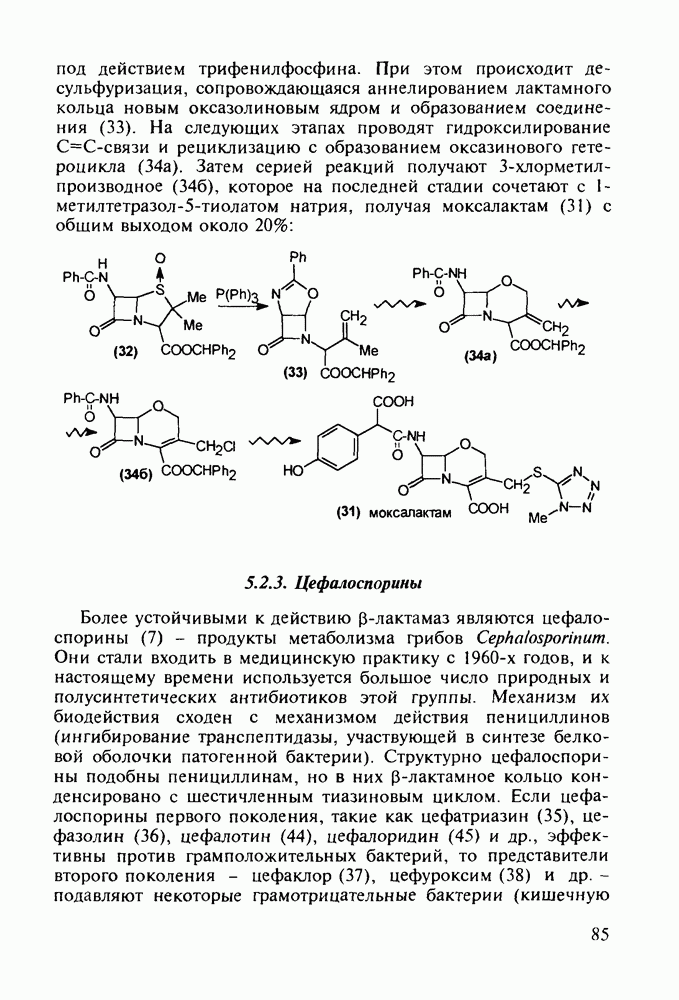
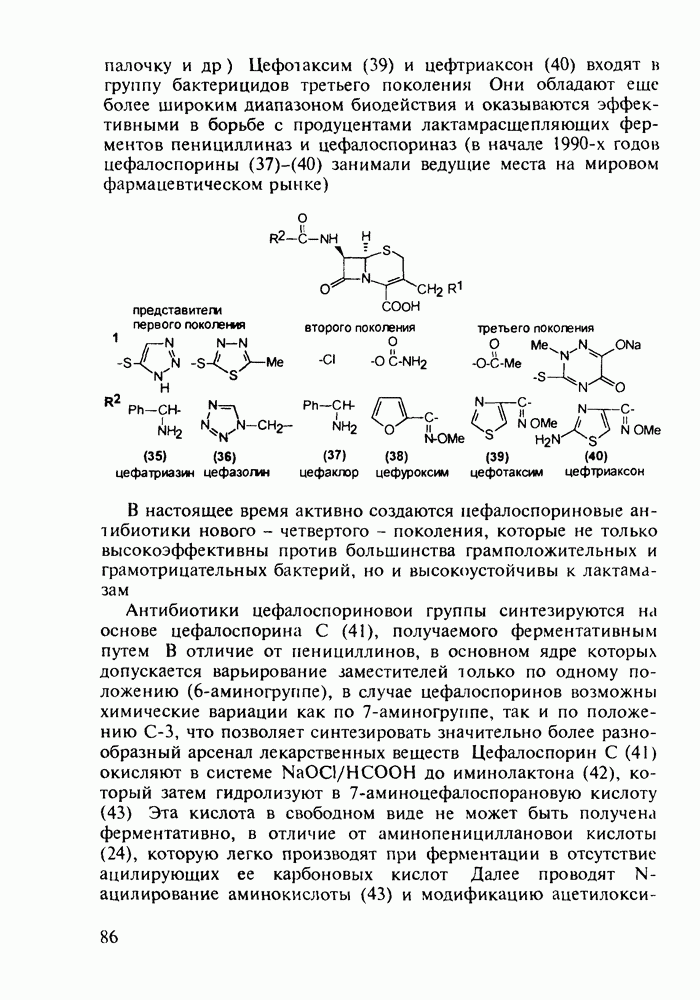
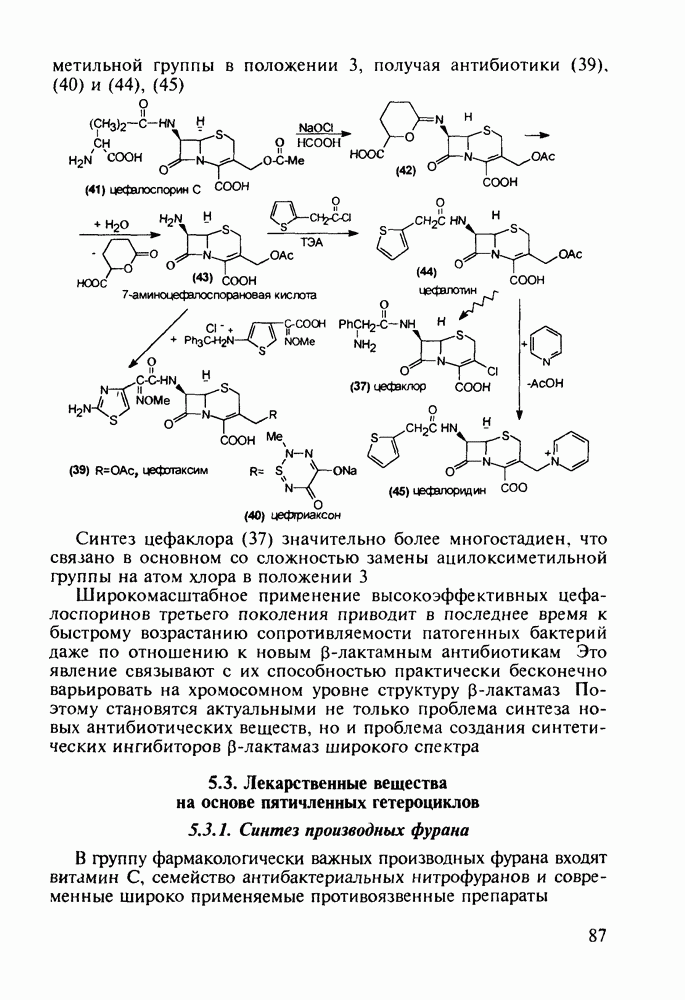
- 5.2.3. Цефалоспорины
- 5.3. Лекарственные вещества на основе пятичленных гетероциклов
- 5.3.2. Синтез производных пиррола
- 5.3.3. Оксазолидины. Антибиотик циклосерин
- 5.3.4. Антипиретики и анальгетики пиразолинового ряда
- 5.3.5. Имидазолы с противопаразитарной, антигипертензивной и другой биоактивностью
- 5.3.6. Производные тиазола. Витамин В1
- 5.3.7. Психостимуляторы с оксадиазольным и тетразольным гетероциклами
- 5.4. Синтез лекарственных веществ, содержащих шестичленные гетероциклы
- 5.4.2. Синтез лекарственных веществ пиридинового ряда
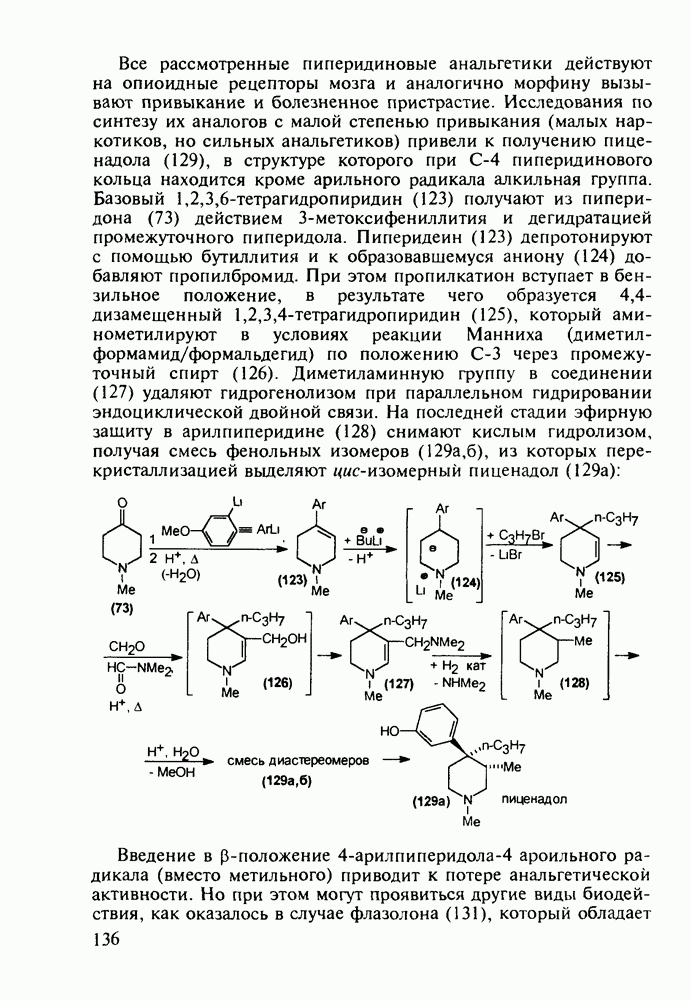
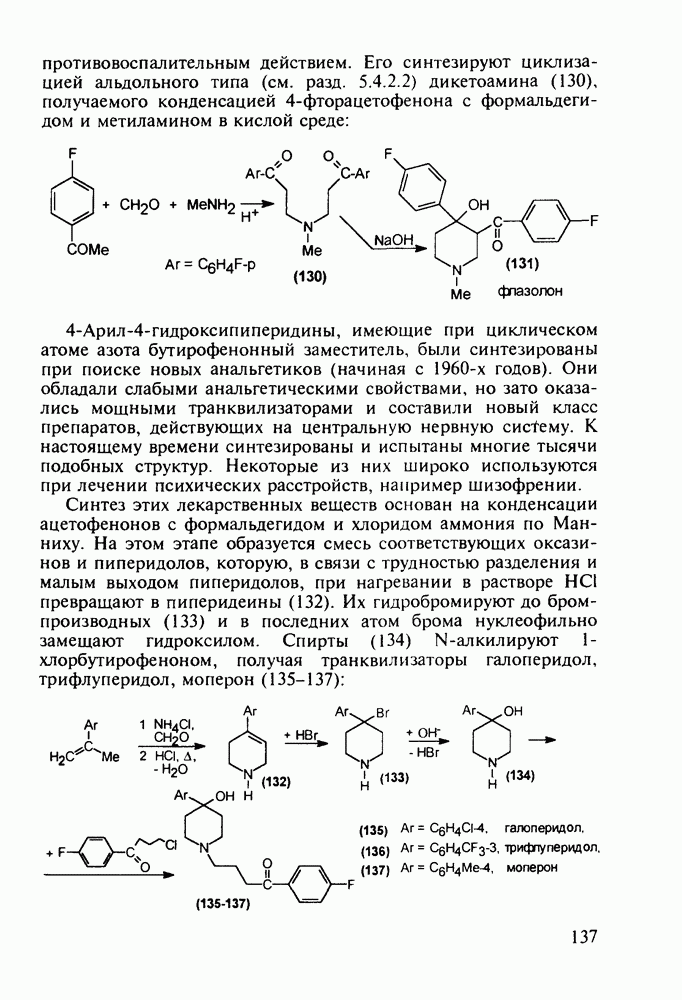
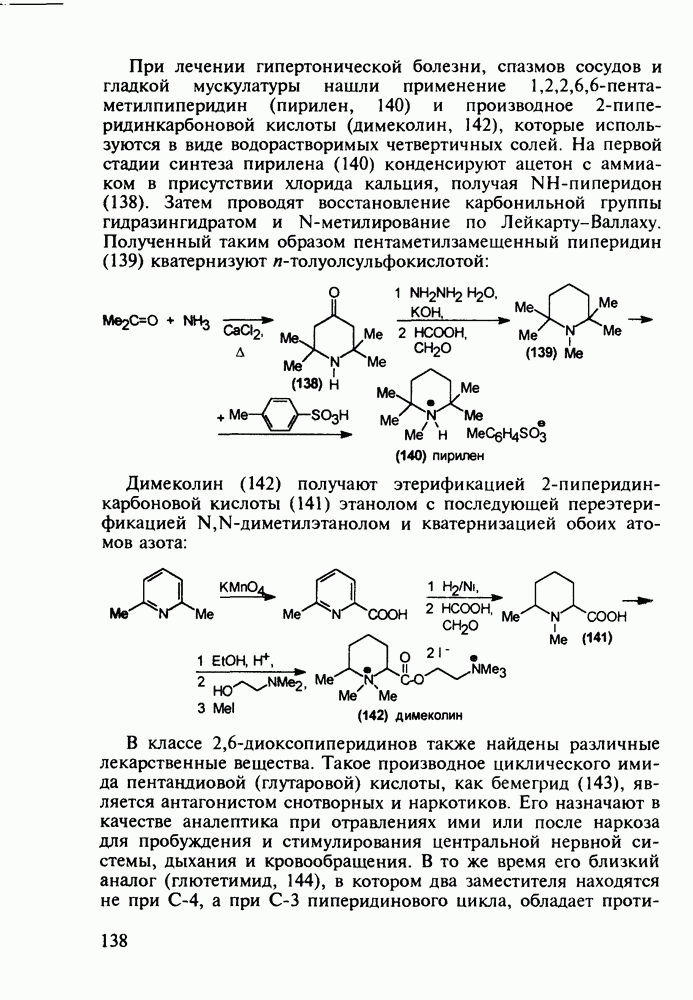
- 5.4.3. Анальгетики и транквилизаторы пиперидинового ряда
- 5.4.4. Производные хинолина с антималярийным и антибактериальным действием
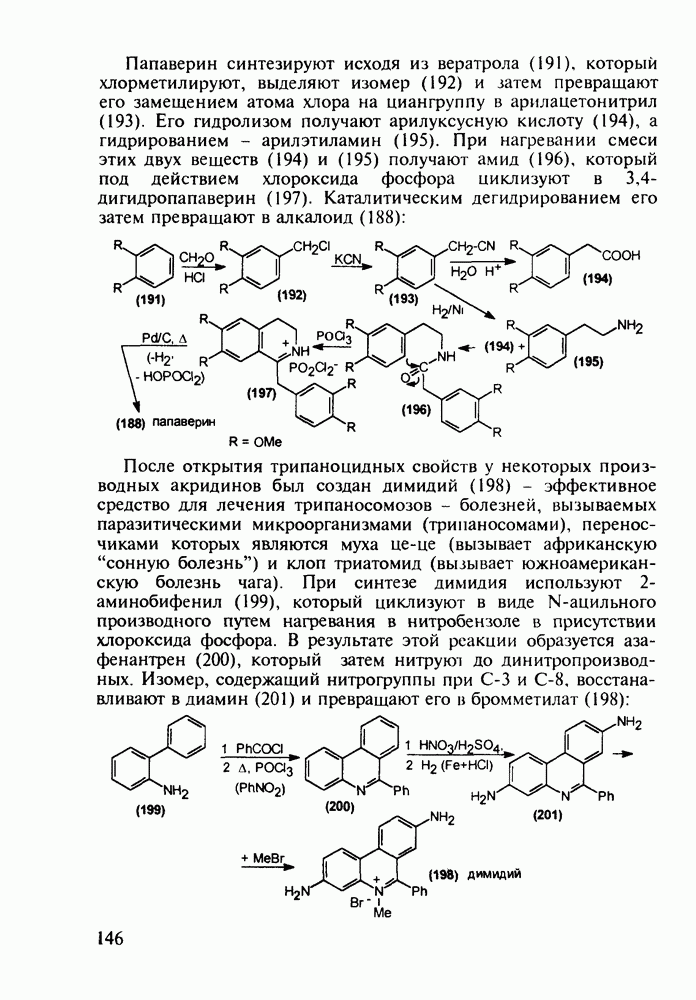
- 5.4.5. Изохинолины в качестве спазмолитиков и трипаноцидов
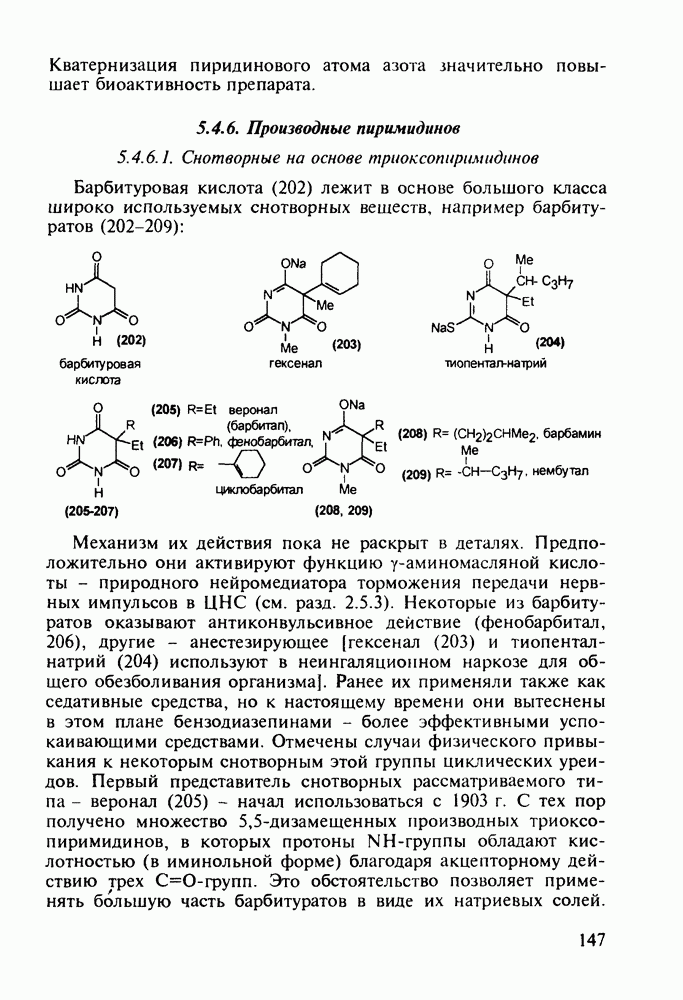
- 5.4.6. Производные пиримидинов
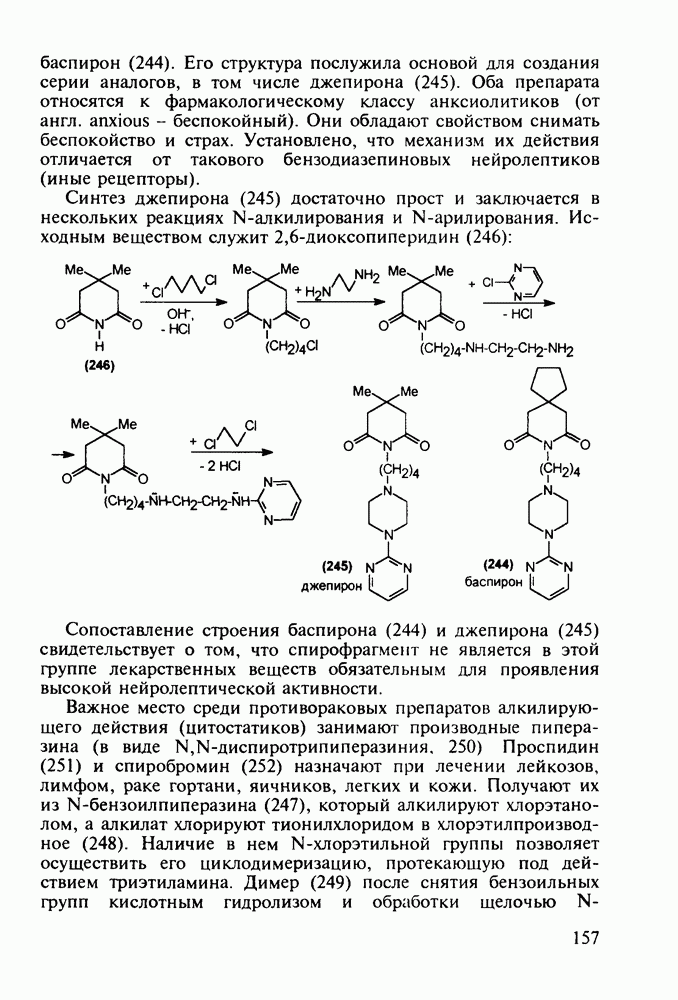
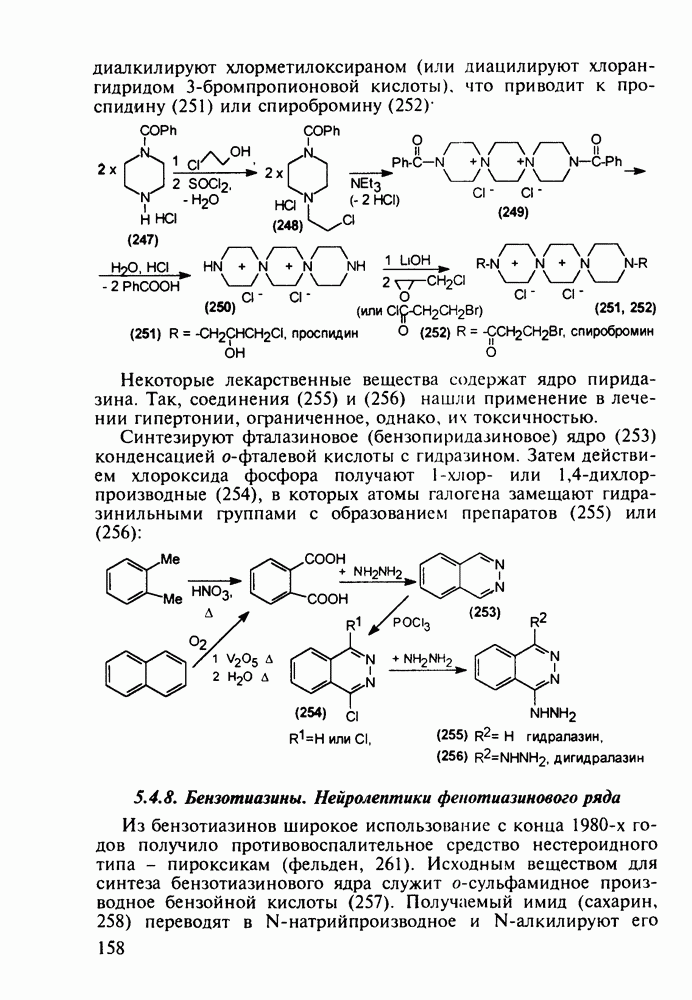
- 5.4.7. Производные пиперазина и пиридазина
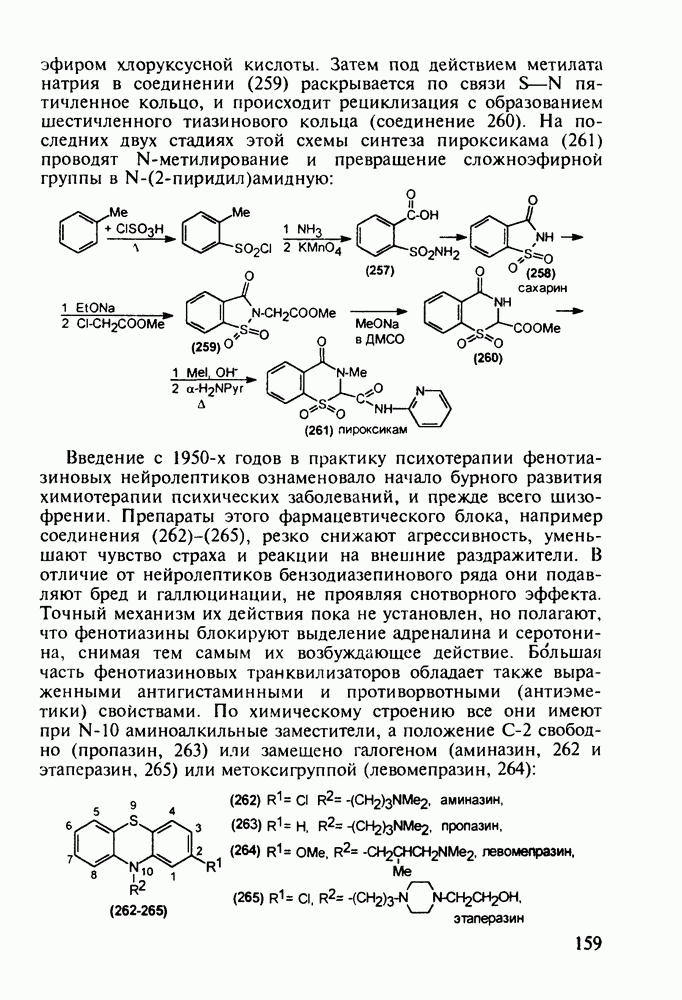
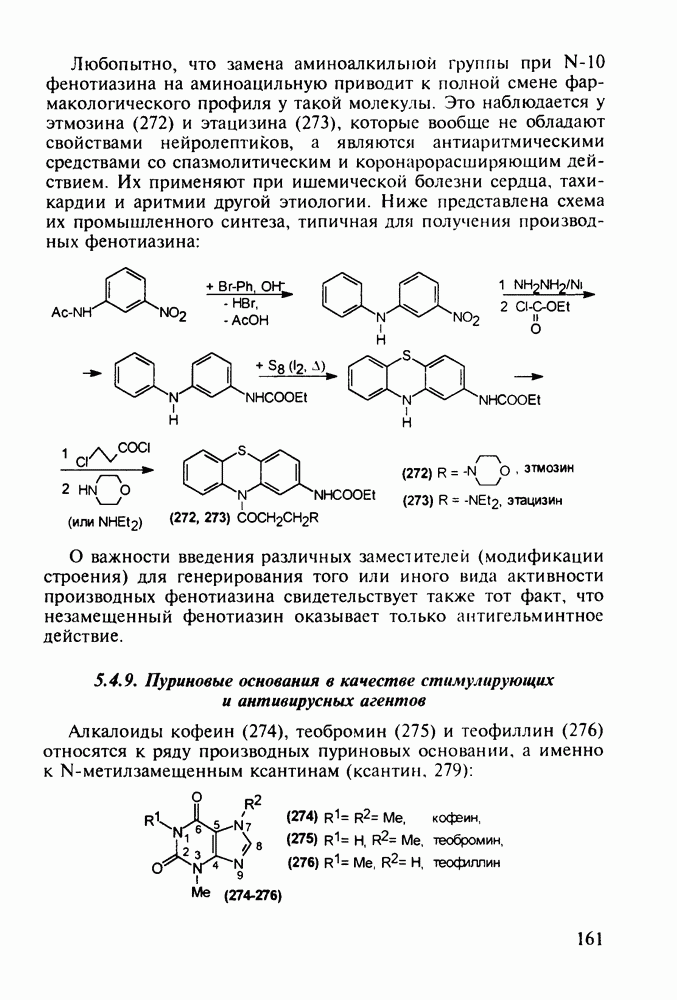
- 5.4.8. Бензотиазины. Нейролептики фенотиазинового ряда
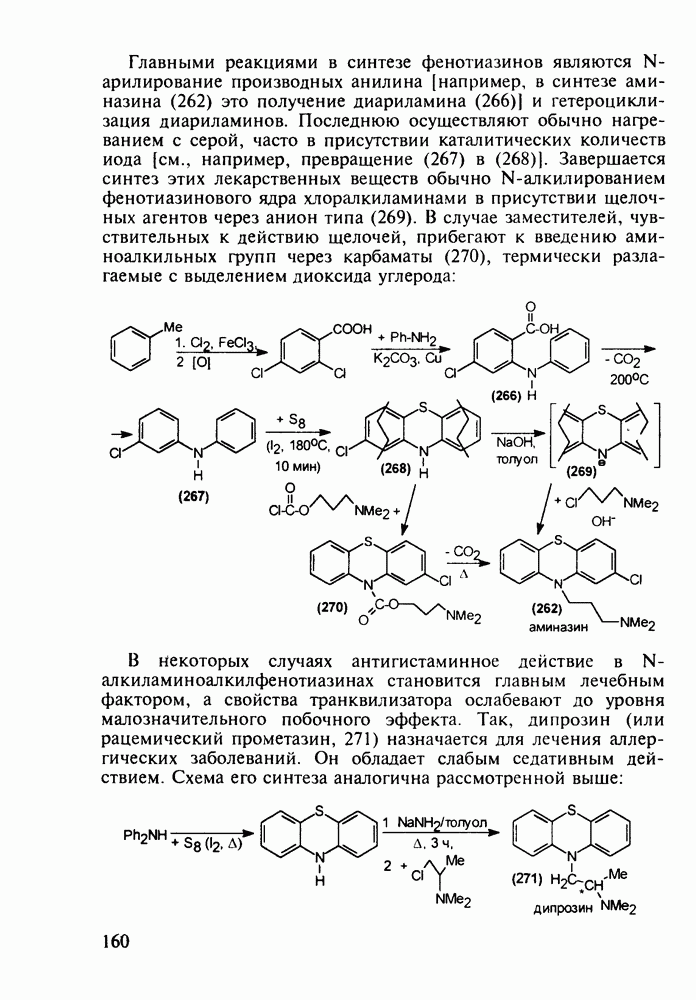
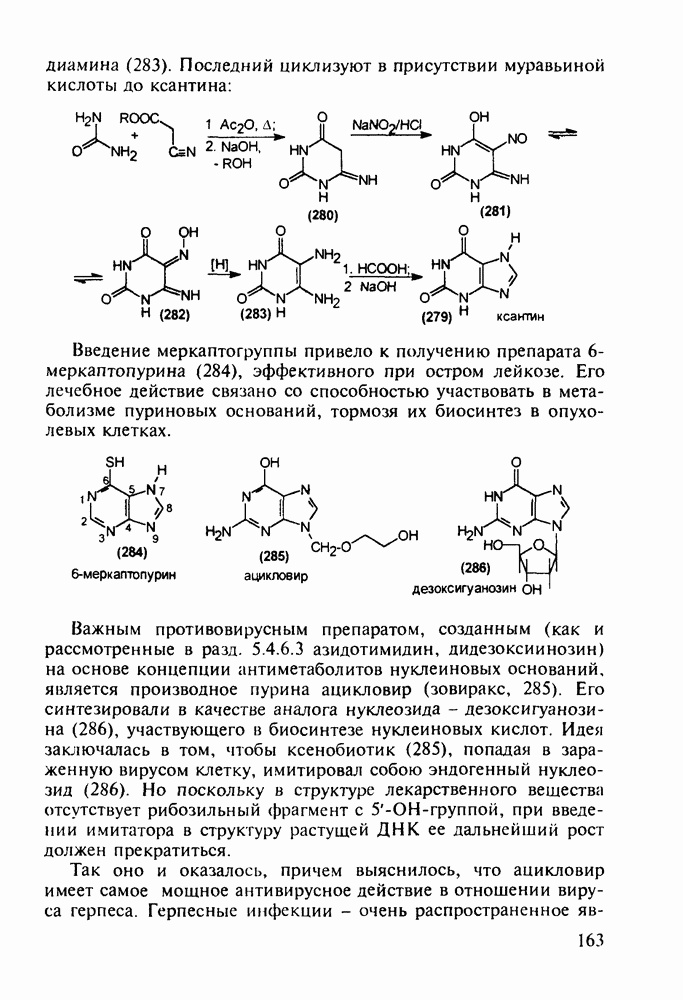
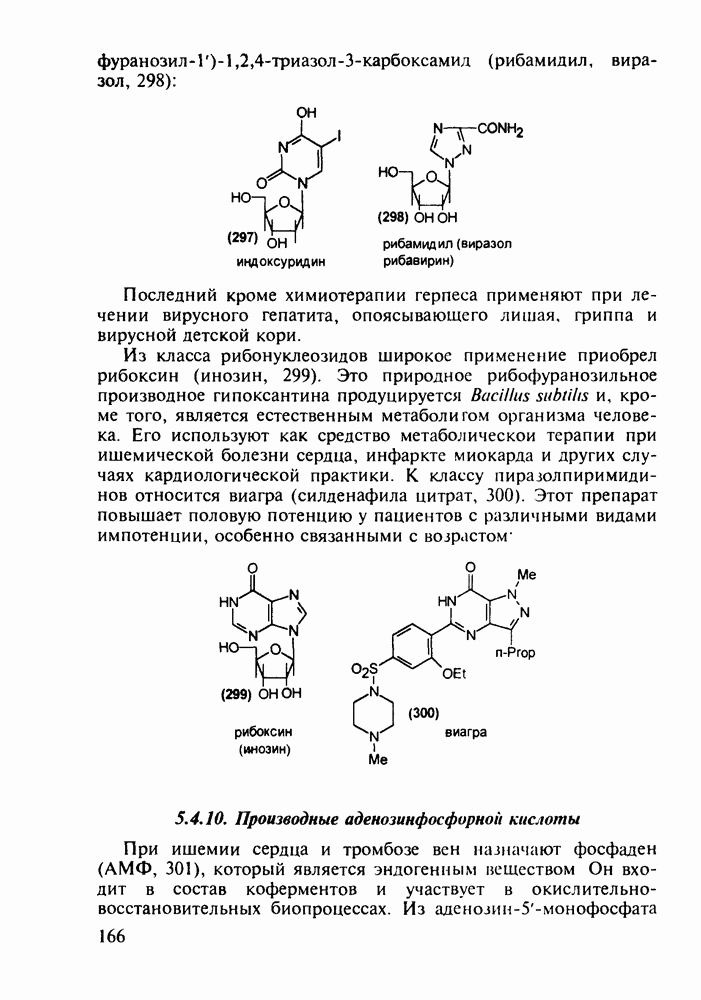
- 5.4.9. Пуриновые основания в качестве стимулирующих и антивирусных агентов
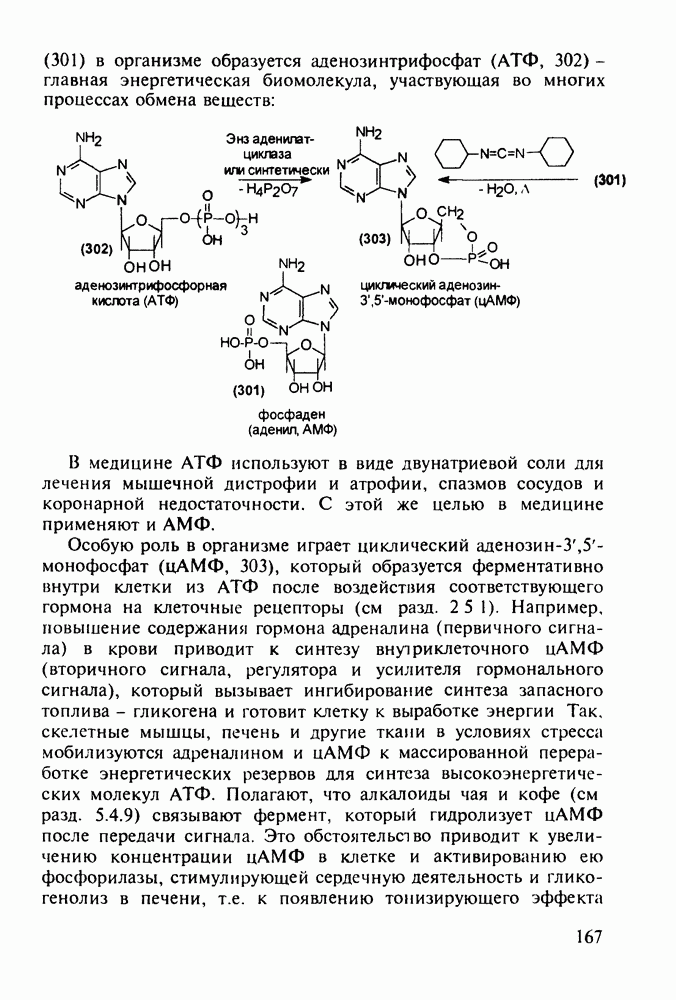
- 5.4.10. Производные аденозинфосфорной кислоты
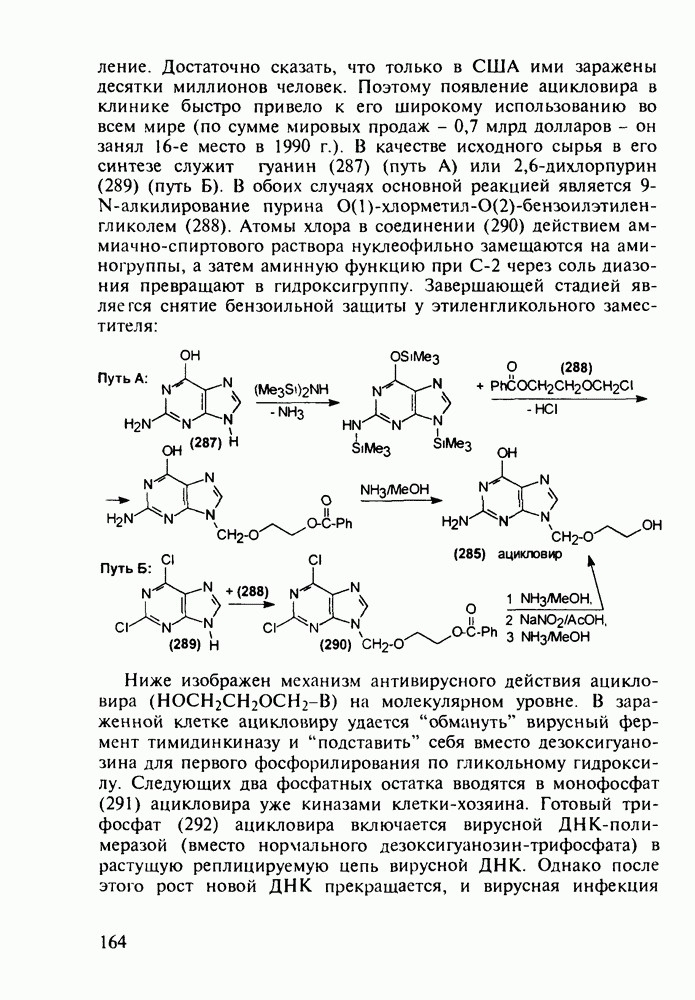
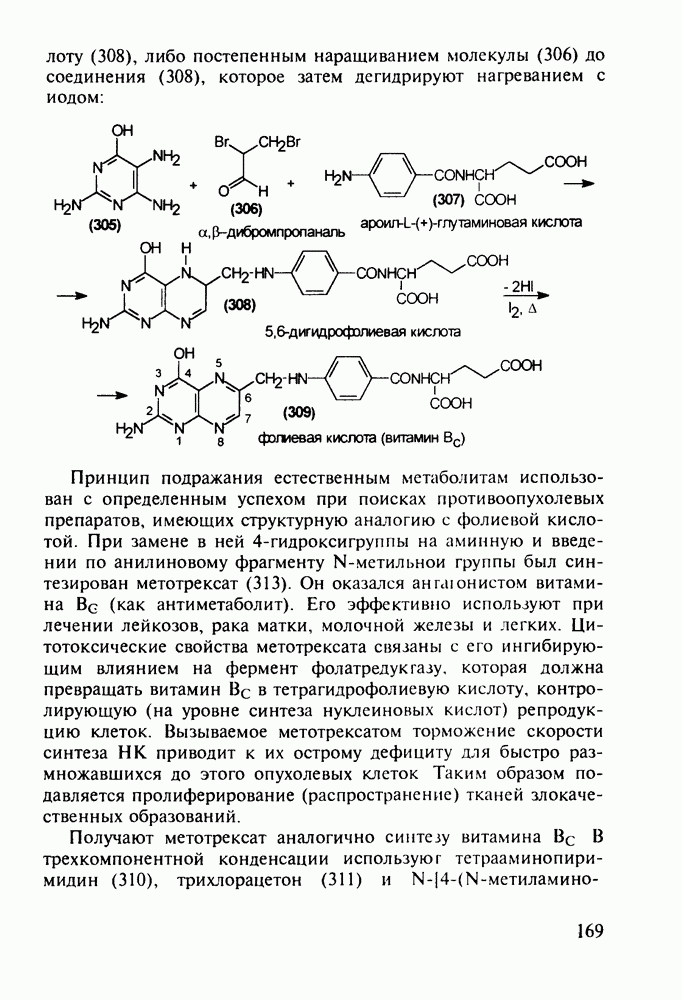
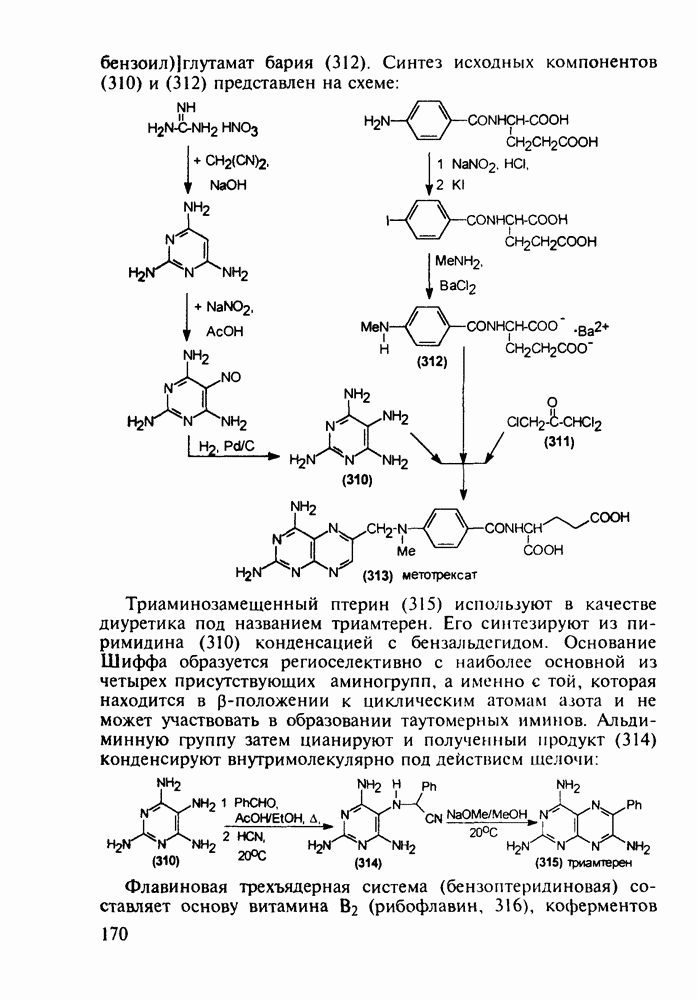
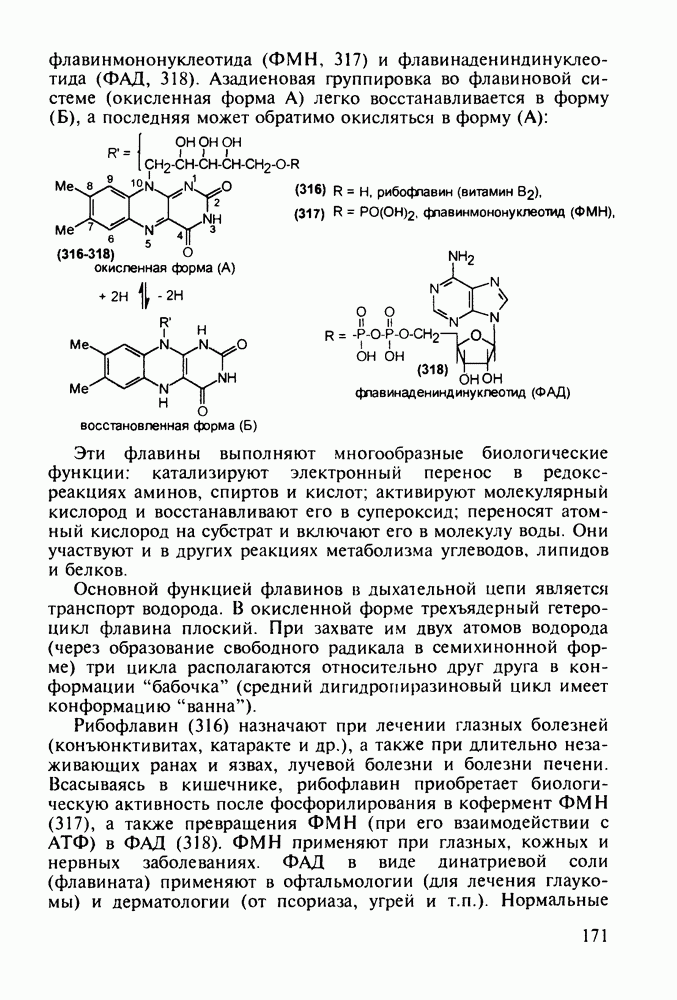
- 5.4.11. Производные птеридина с витаминной (витамины Вс и В2) и противораковой активностью
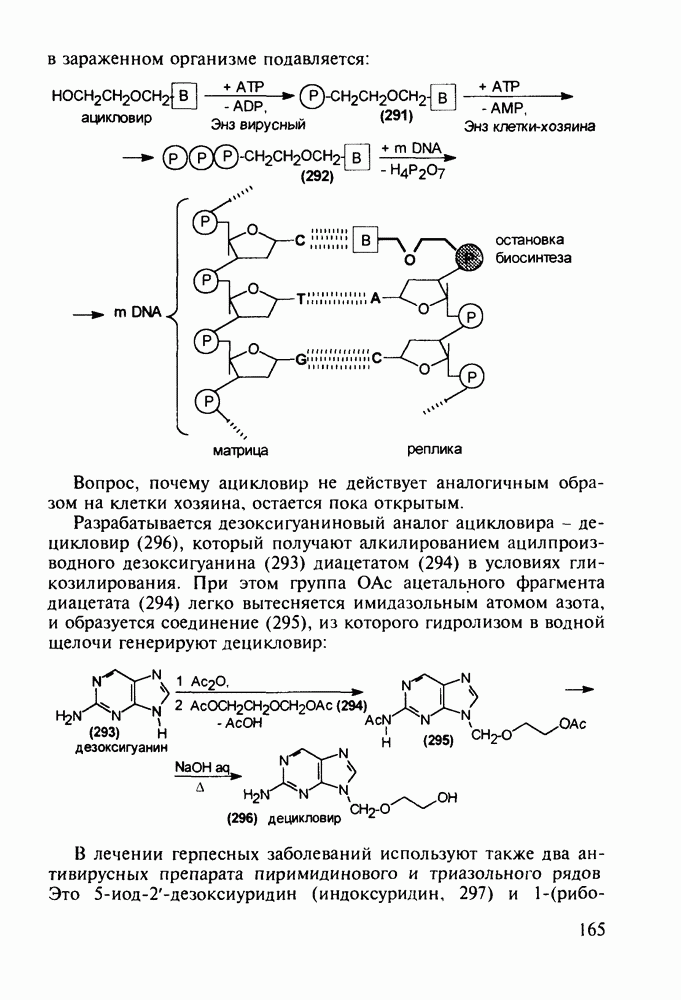
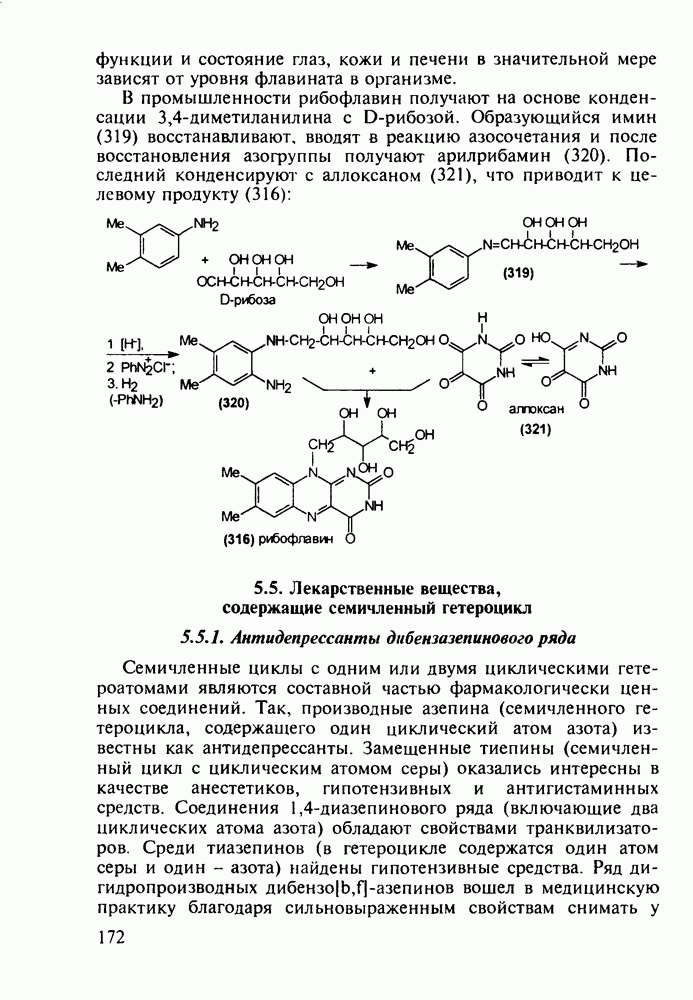
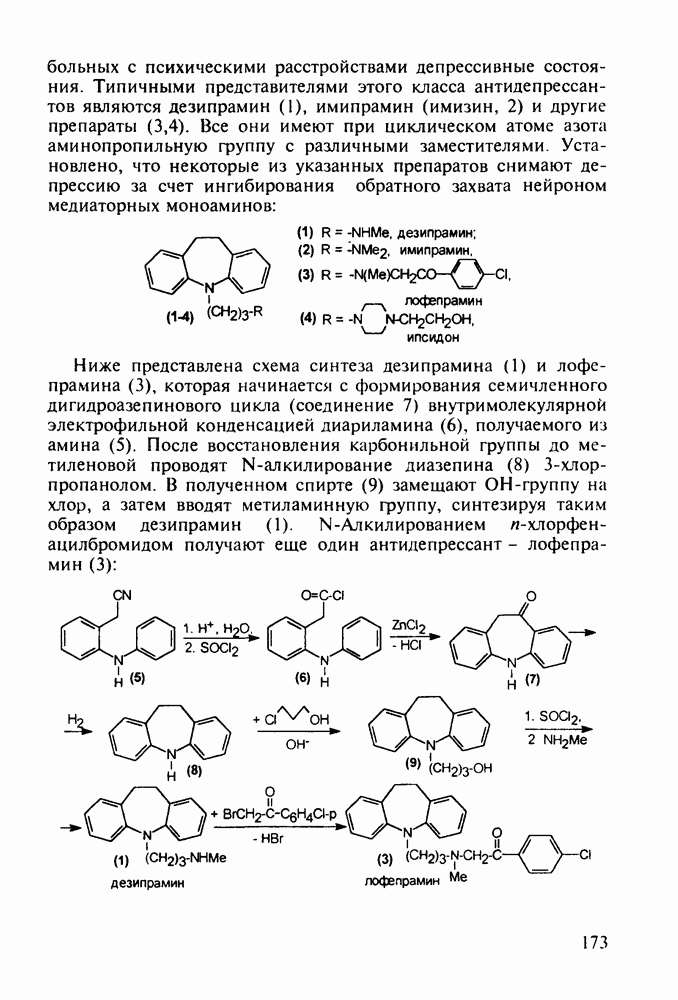
- 5.5. Лекарственные вещества, содержащие семичленный гетероцикл
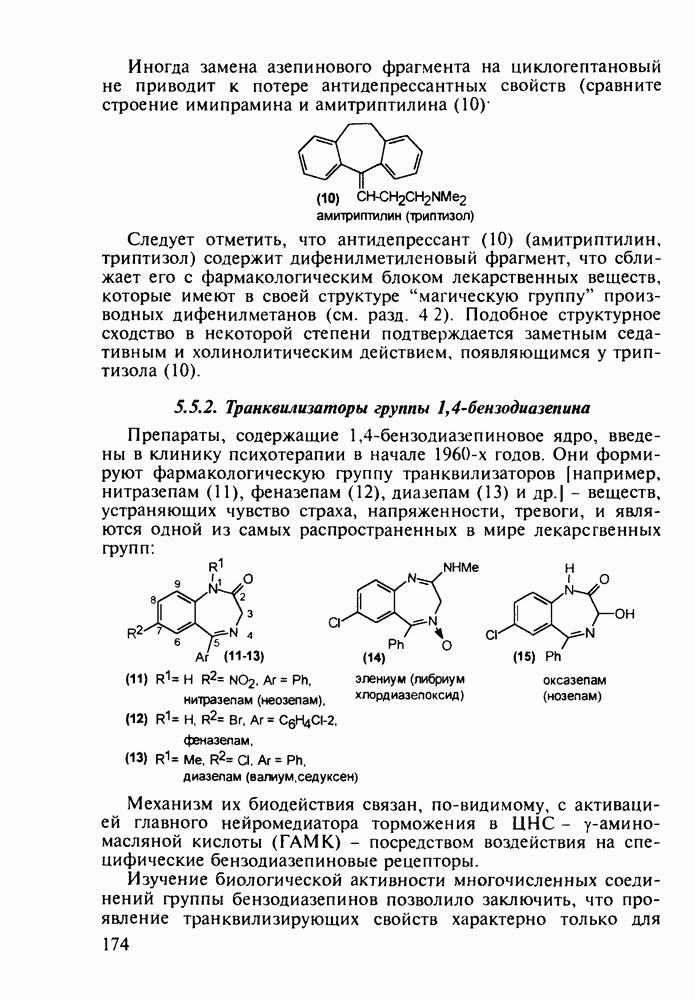
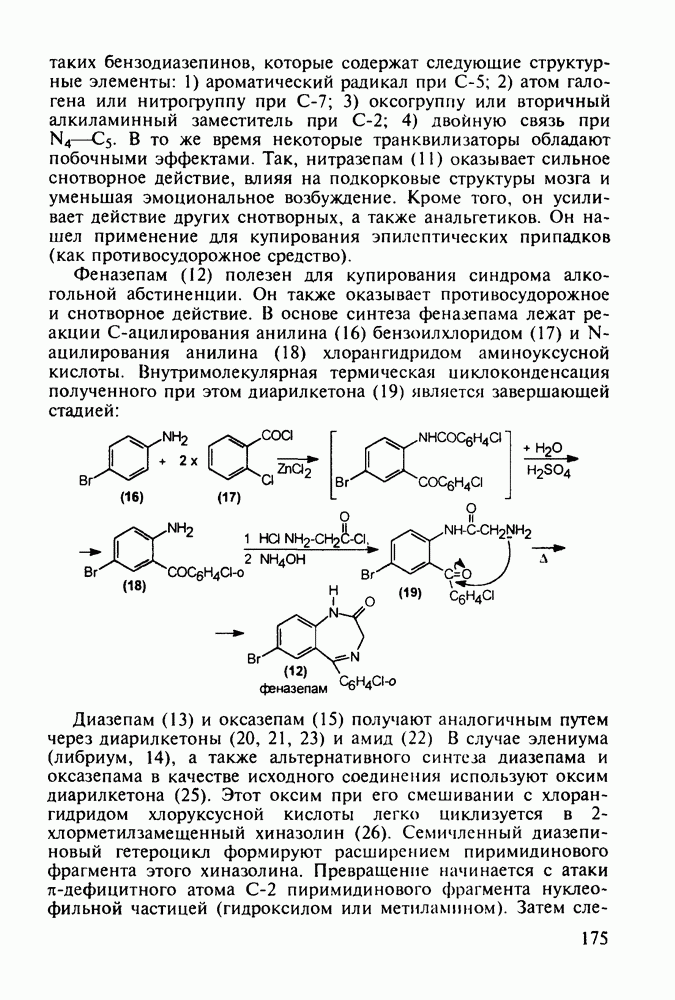
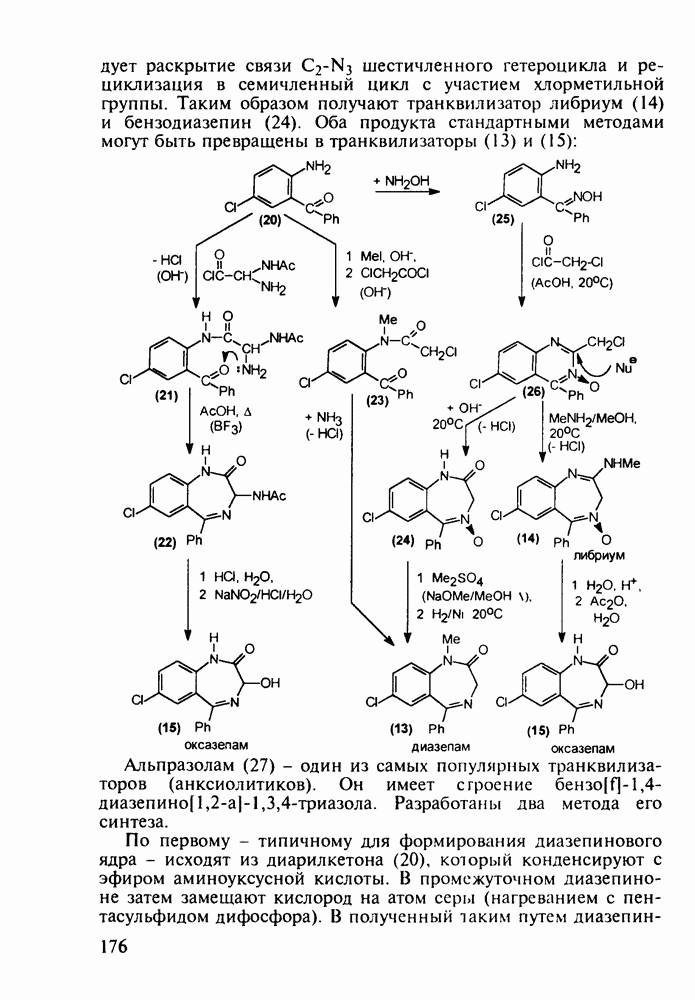
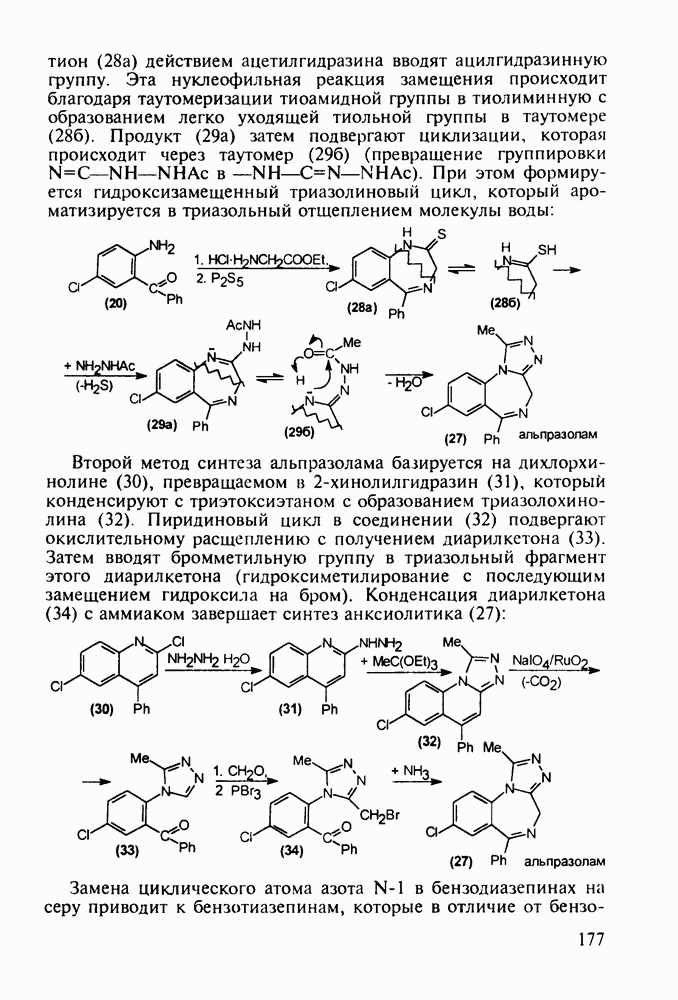
- 5.5.2. Транквилизаторы группы 1,4-бензодиазепина
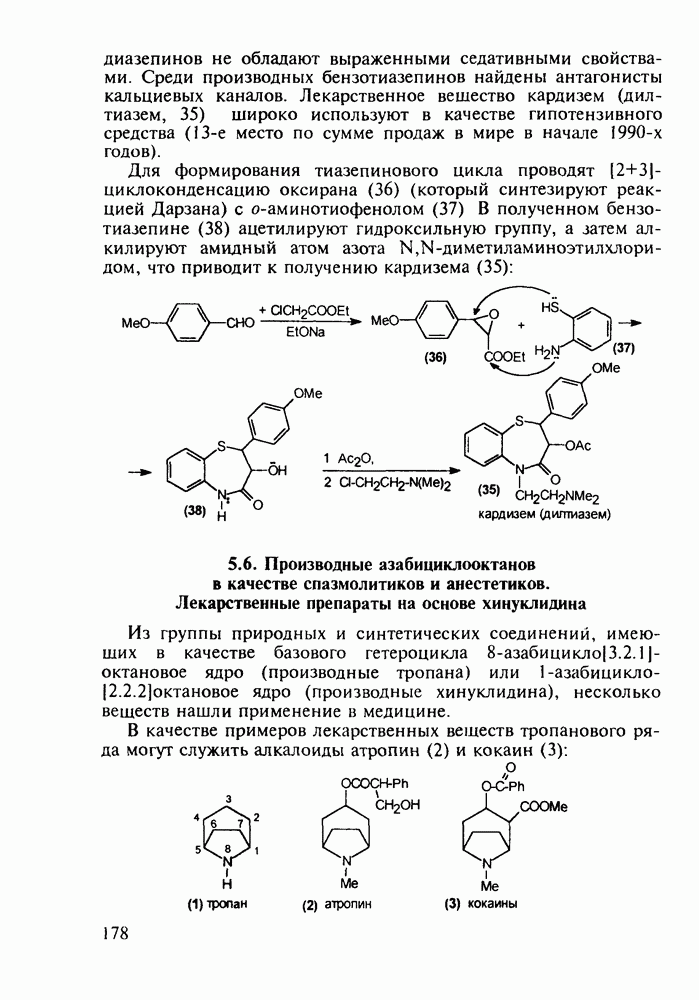
- 5.6. Производные азабициклооктанов в качестве спазмолитиков и анестетиков. Лекарственные препараты на основе хинуклидина
- 5.7. Производные азабициклононанов в качестве анальгетиков
- 5.7.1. Группа пентазоцина
- 5.7.2. Морфин, его агонисты и антагонисты
- РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА