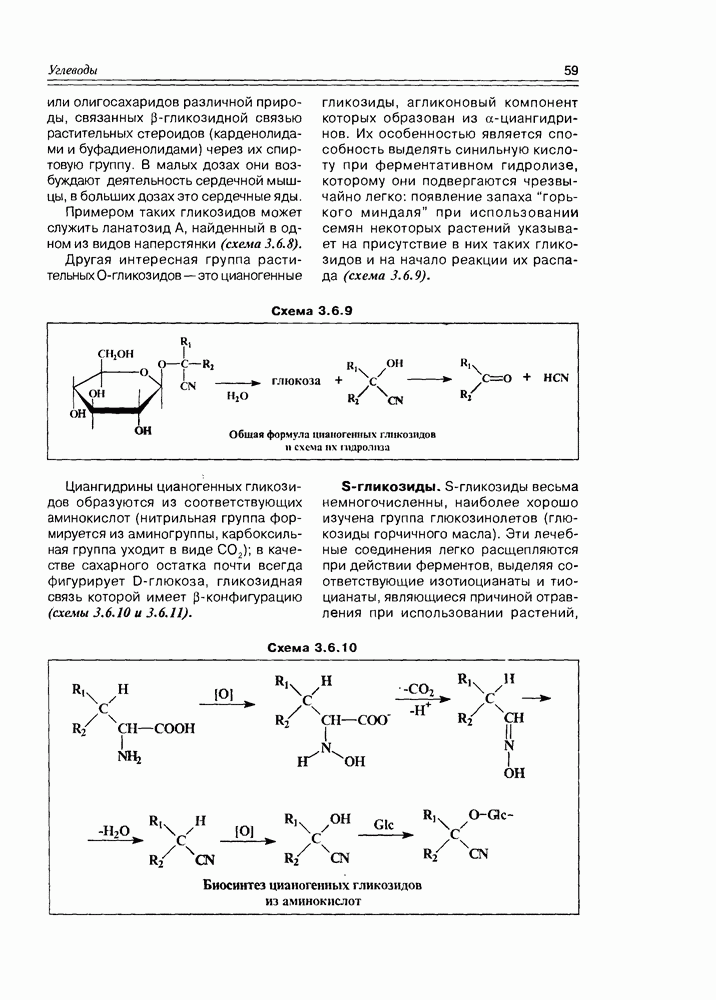
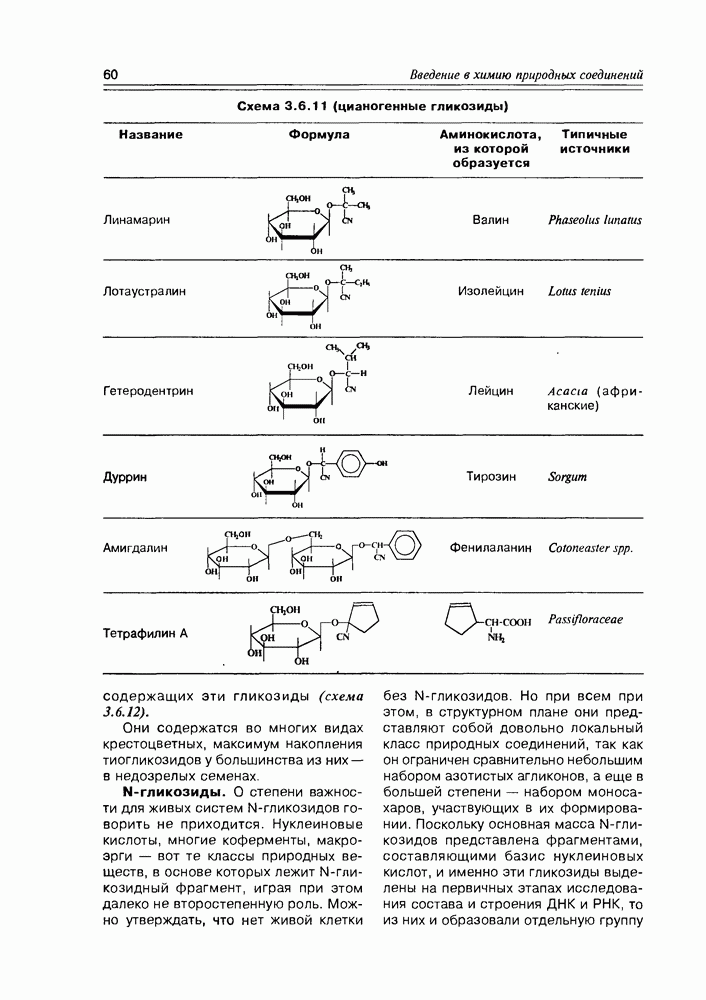
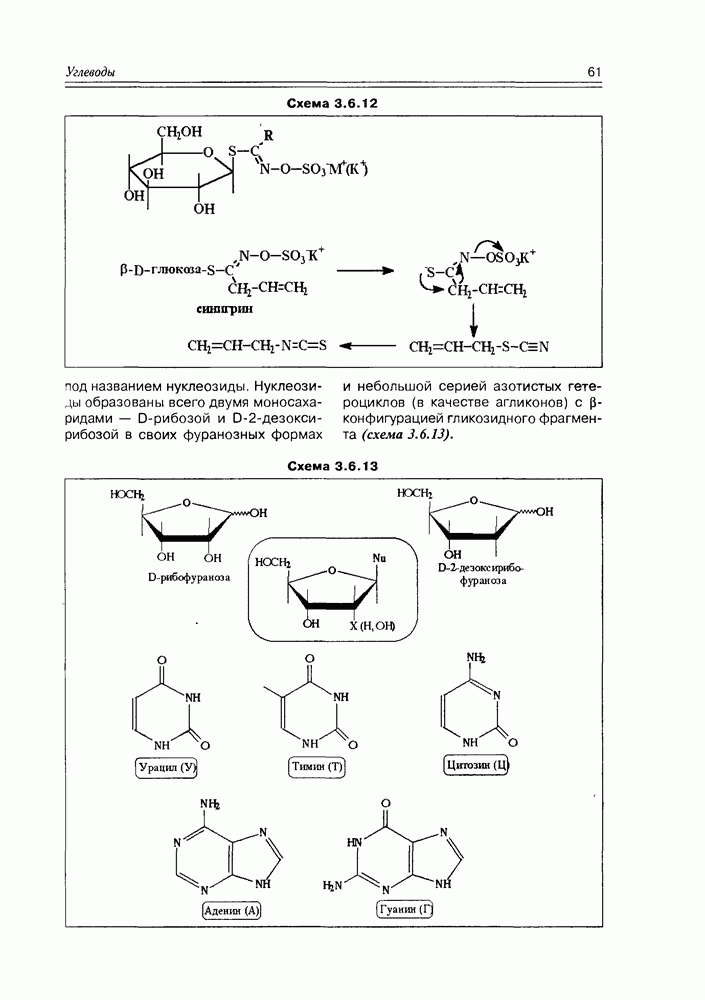
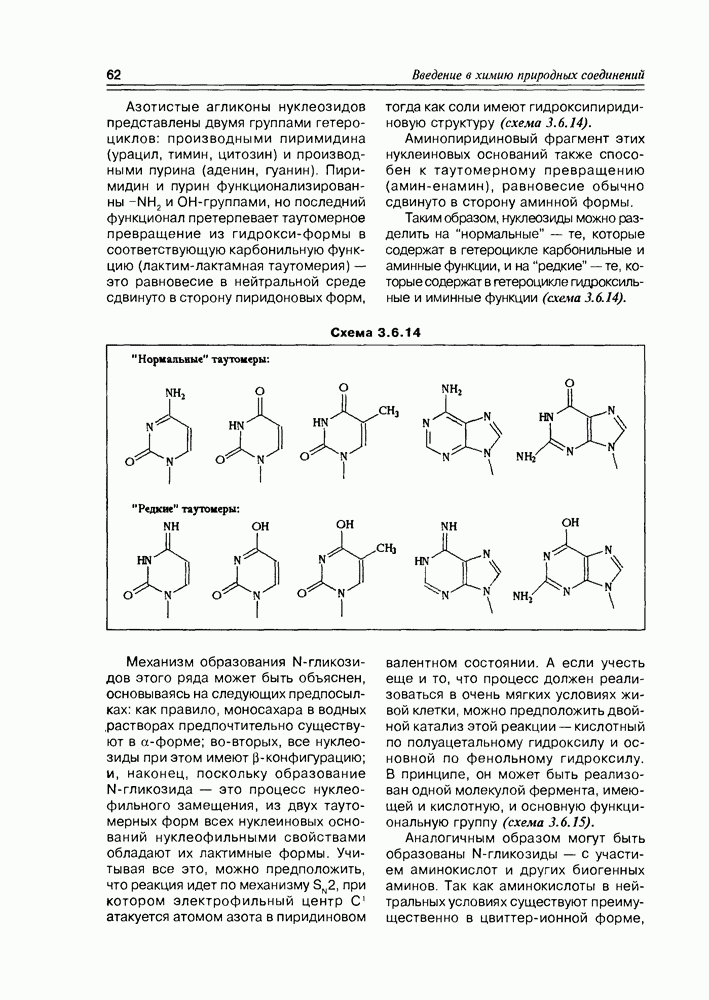
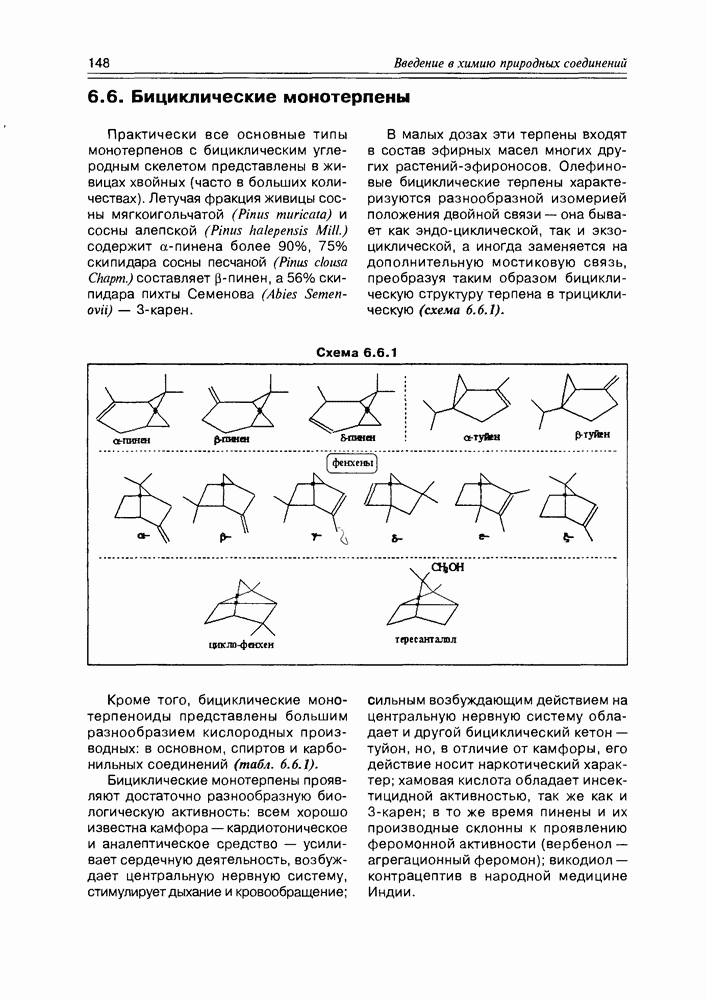
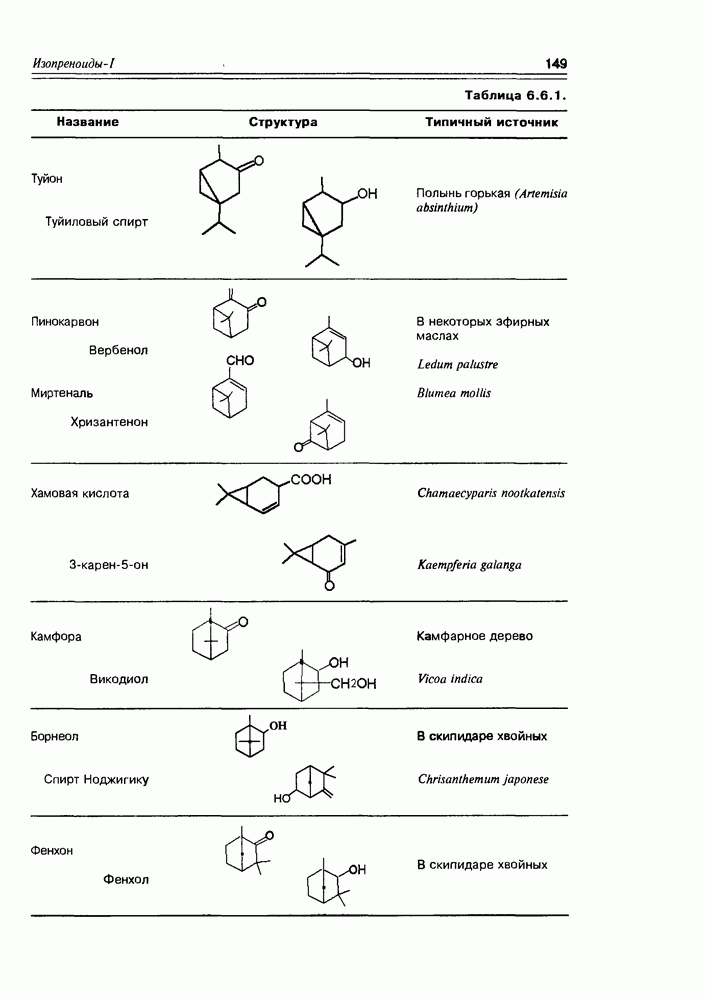
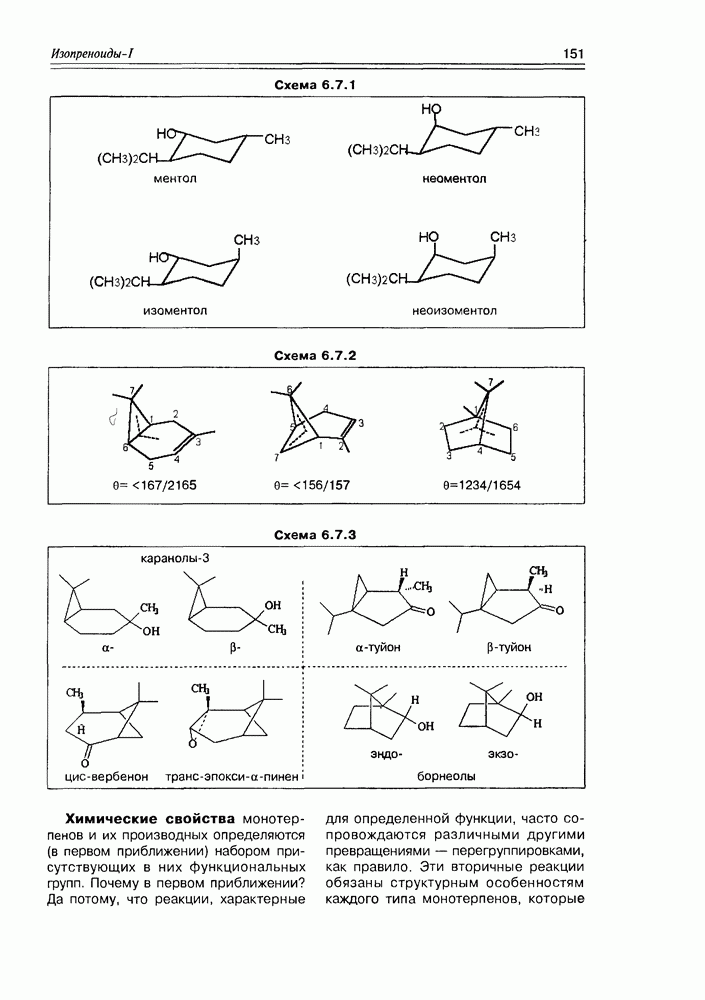
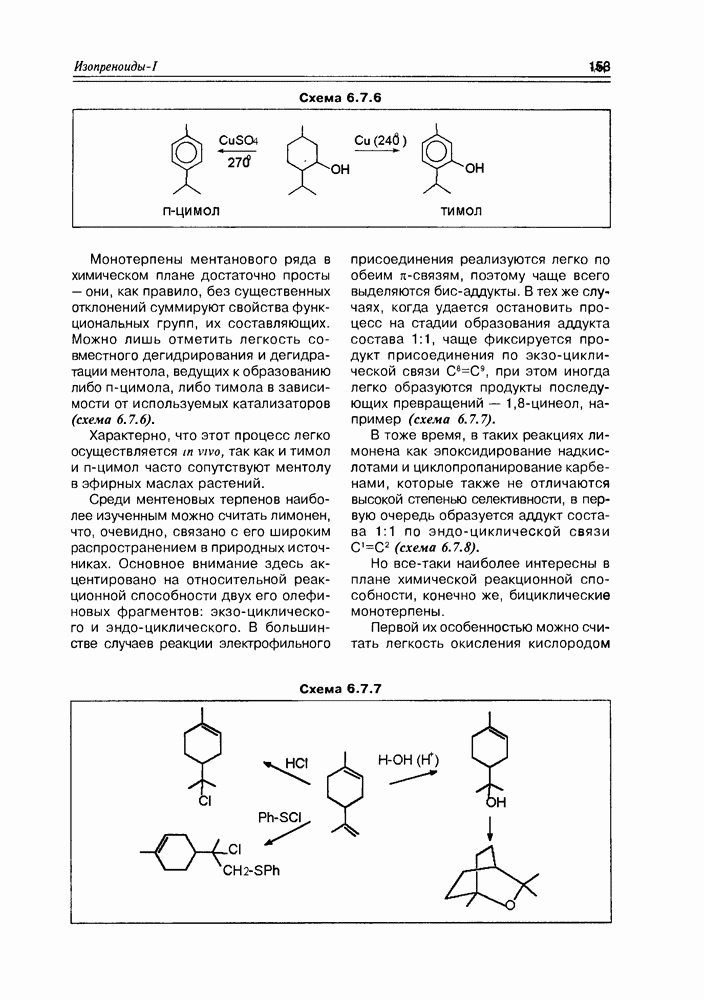
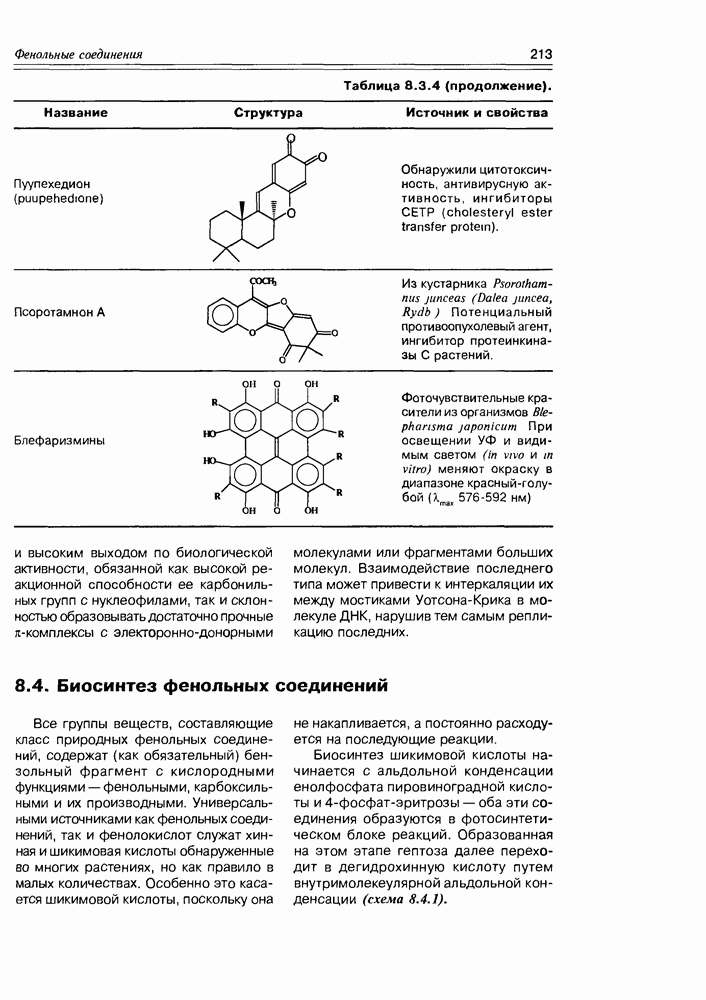
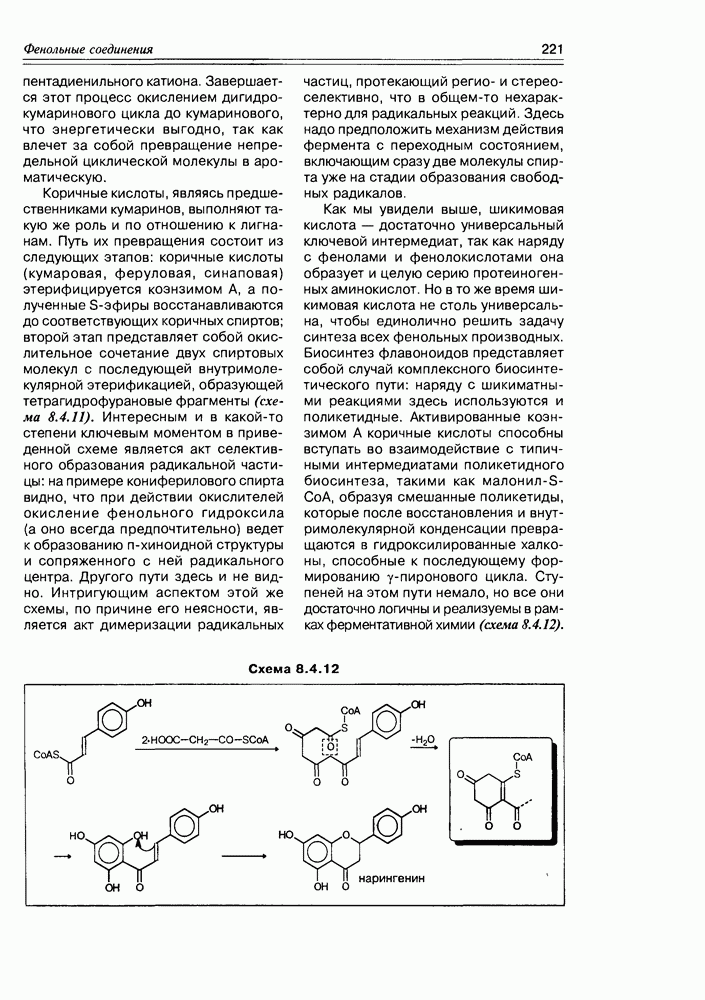
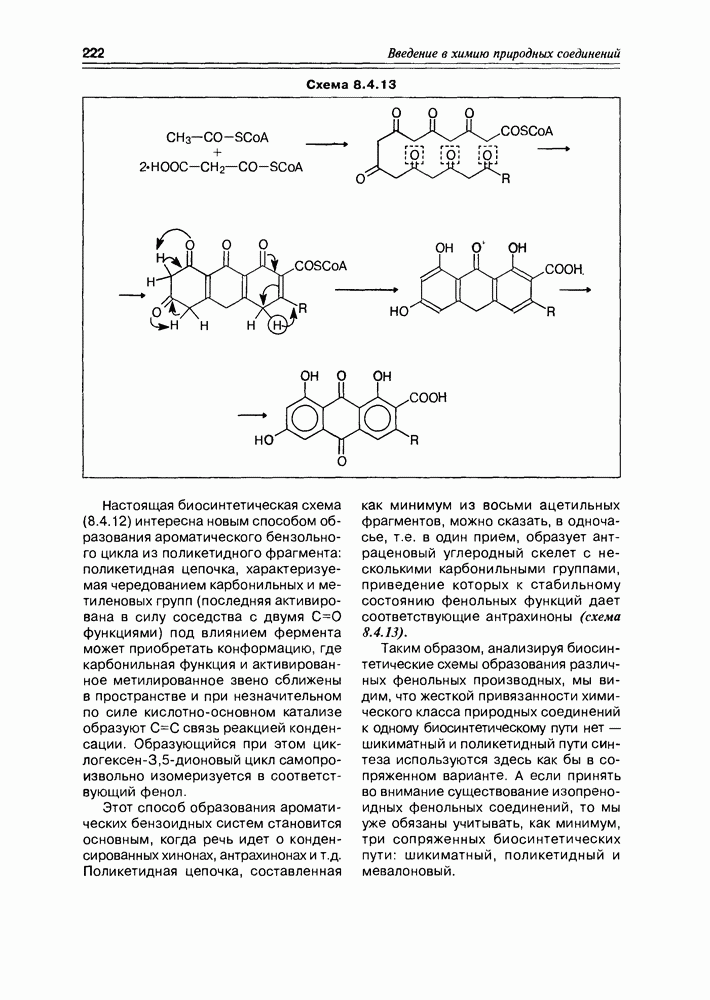
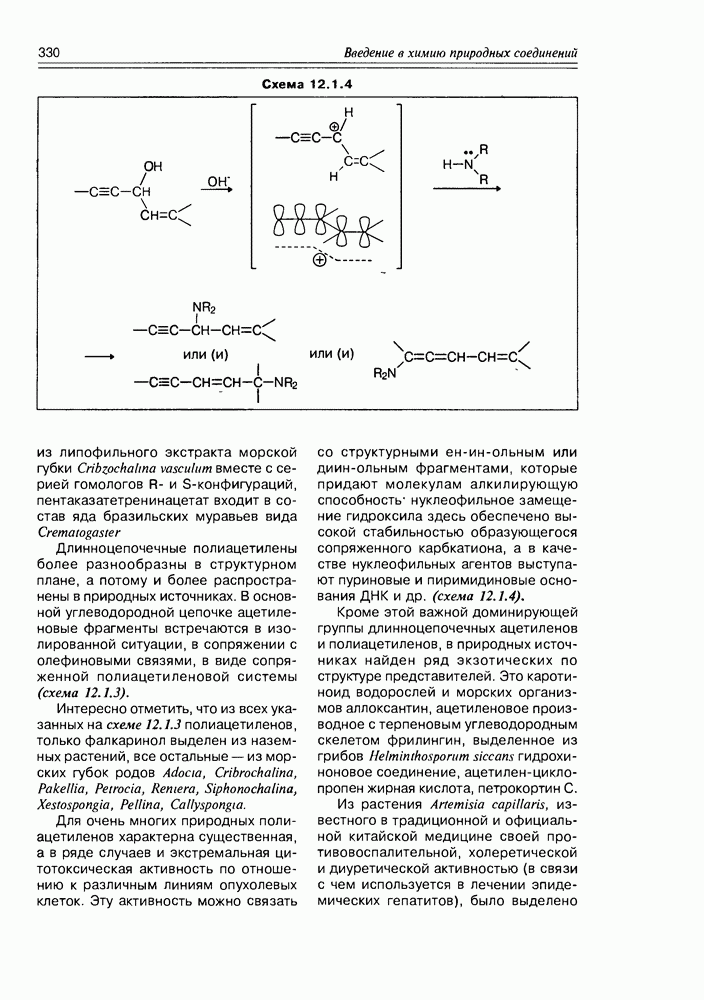
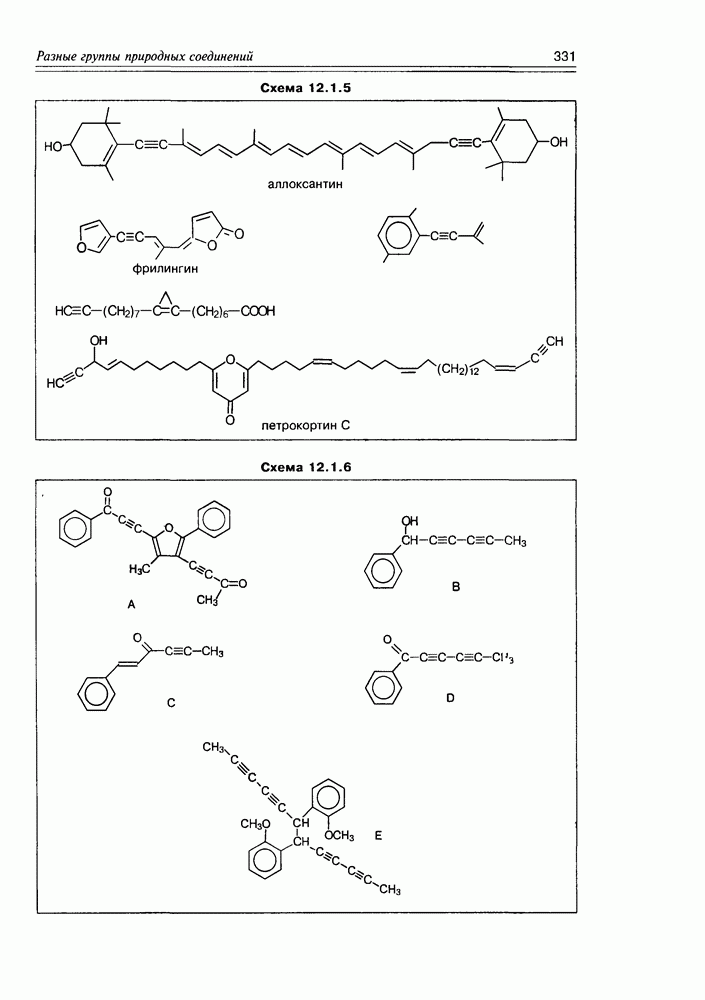
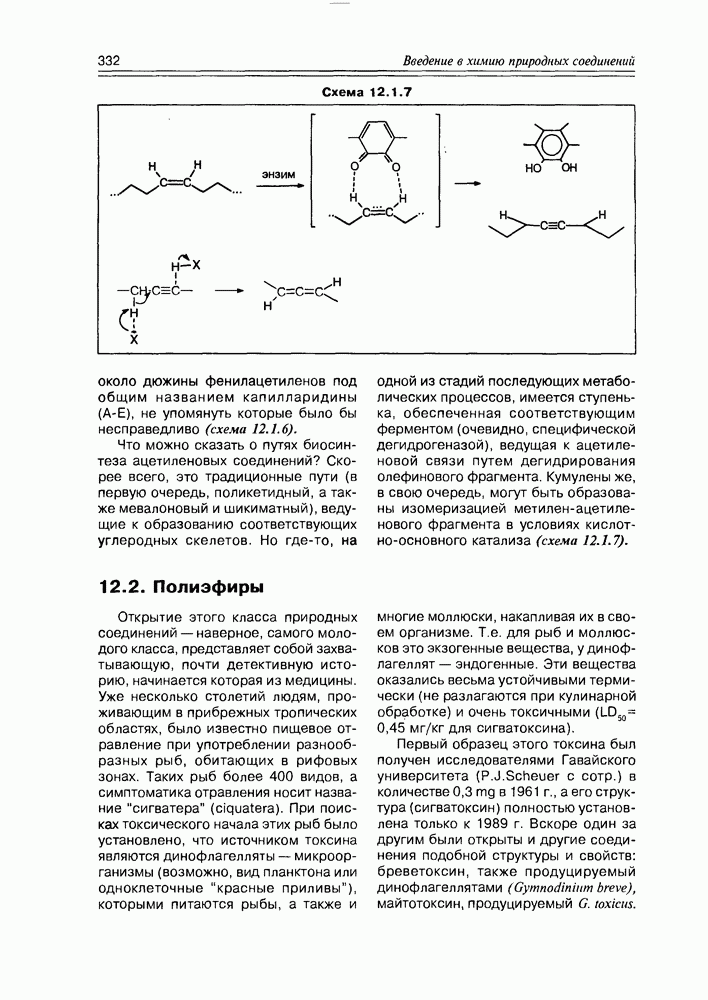
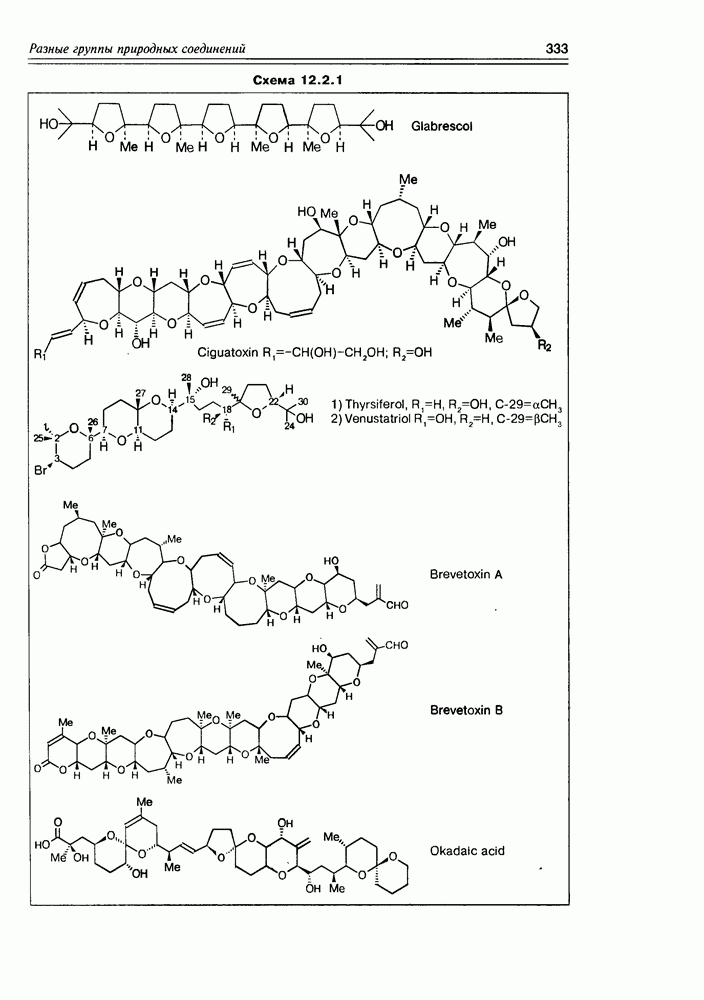
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
3.4. Биосинтетические реакции углеводов
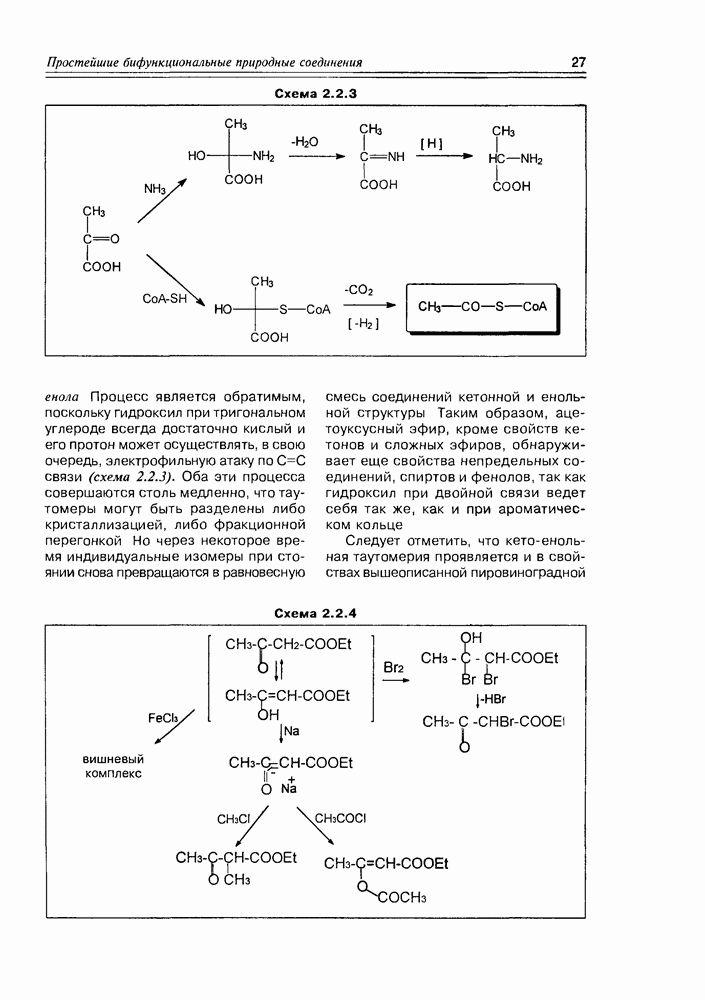
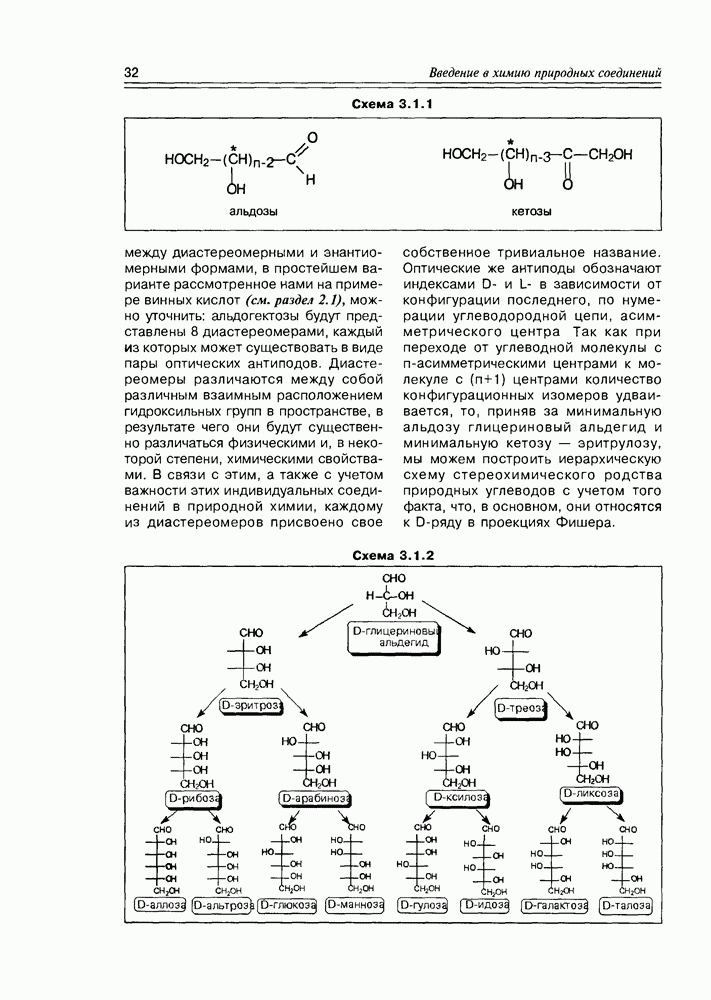
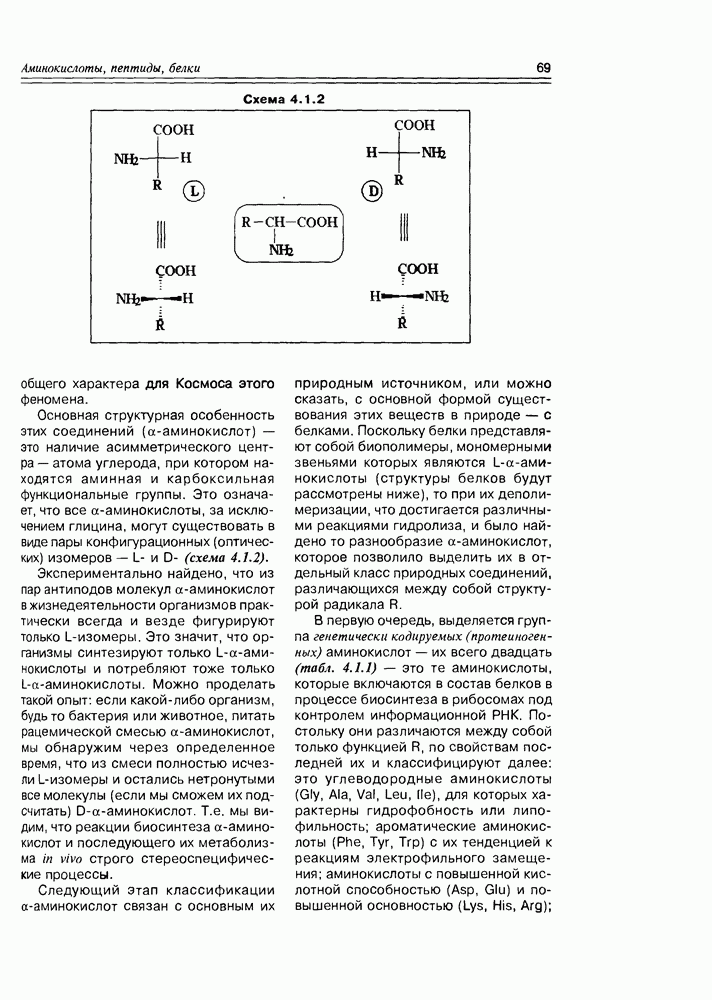
Одно из важных свойств моносахаров — это способность к енолизации, обеспечивающая как процессы взаимопревращения моносахаров (см. схему 3.3.9), так и различные реакции биосинтеза.
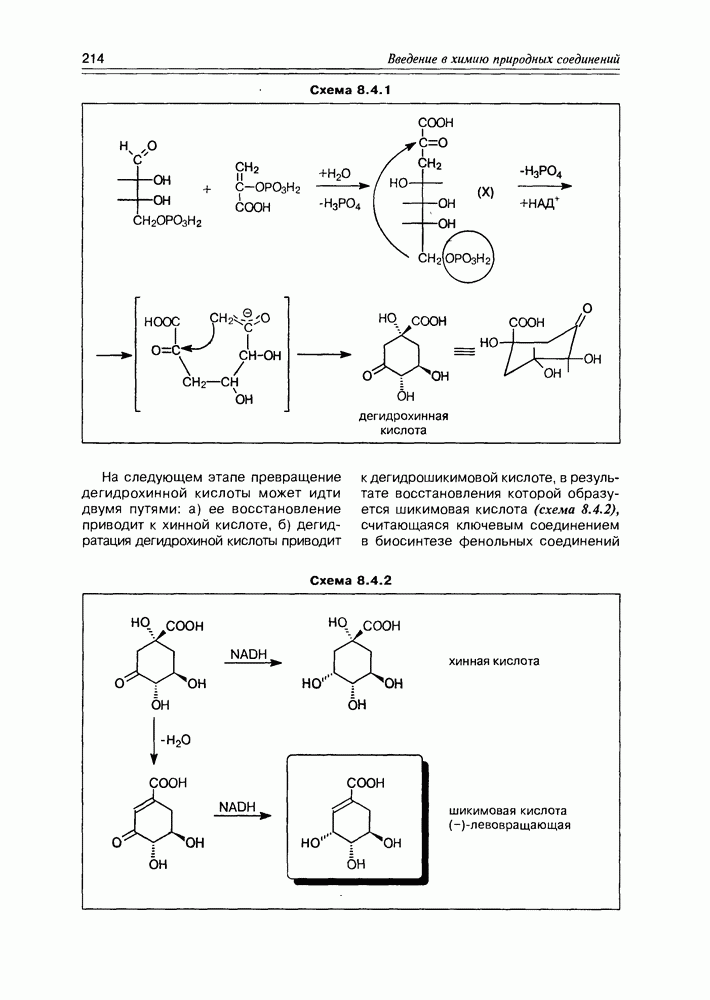
В ряду последних, в первую очередь, следует отметить реакцию фиксации диоксида углерода дифосфатом рибулозы как один из этапов цикла Кальвина. 1,5-дифосфат D-рибулозы (в таутомерной енольной форме) в присутствии оснований становится С-нуклеофилом, который легко присоединяет электрофильный диоксид углерода. Образующийся промежуточный разветвленный  -сахарид гидролитически расщепляется на два
-сахарид гидролитически расщепляется на два
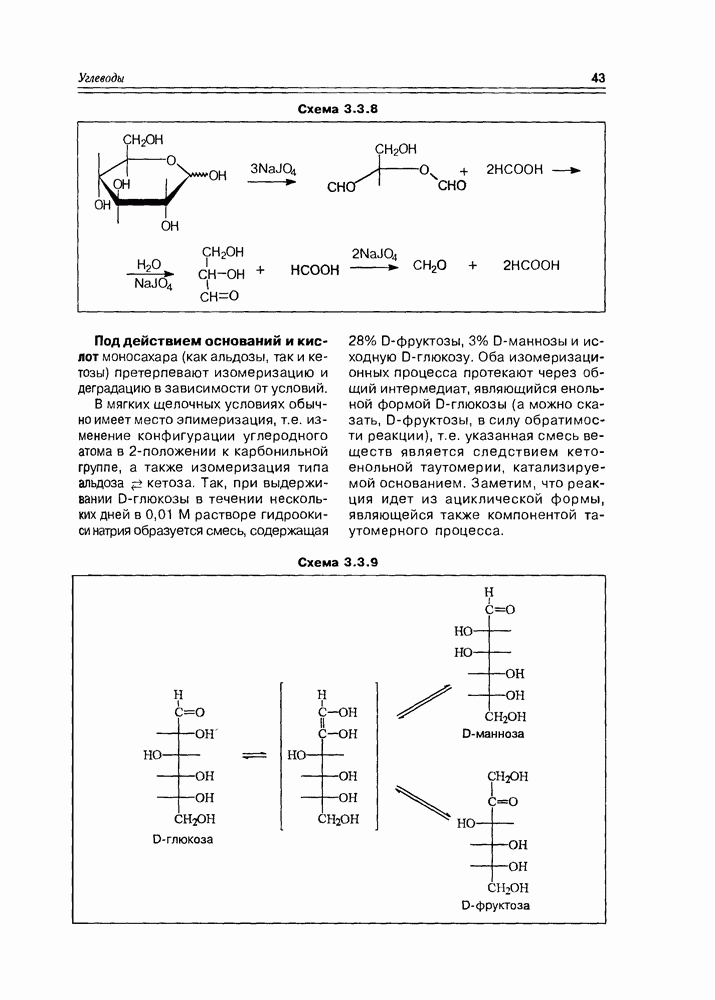
Схема 3.4.1.

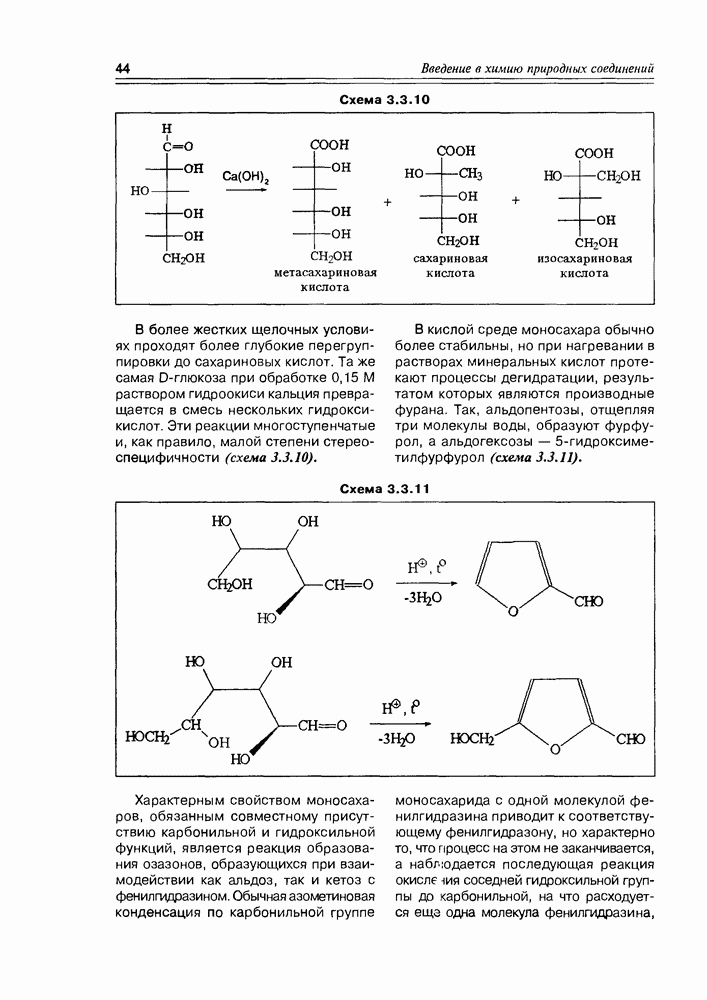
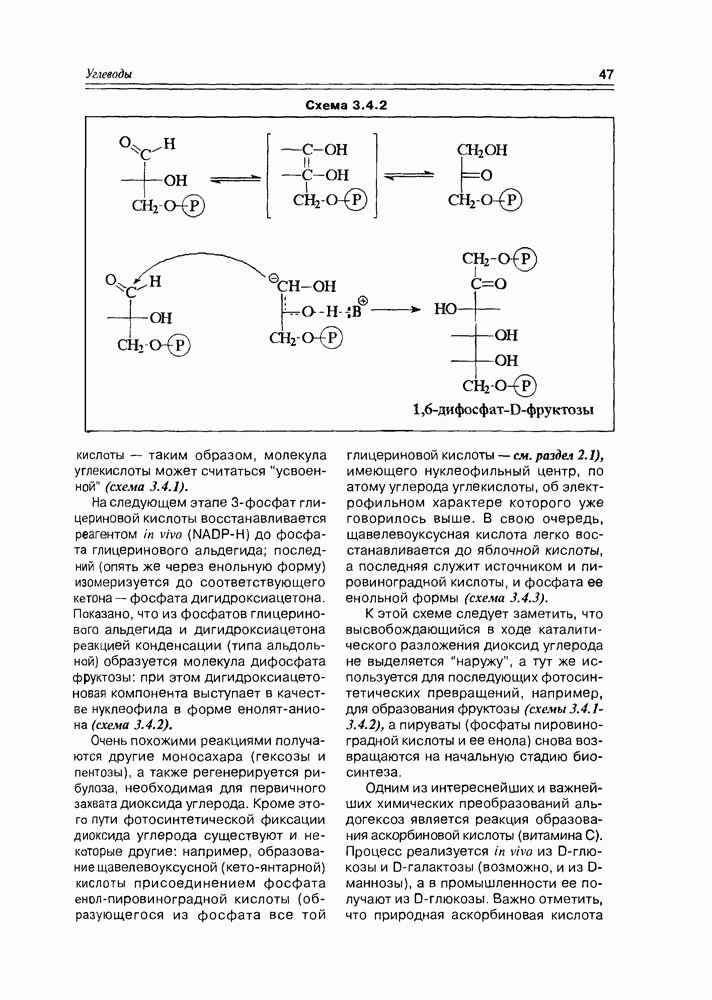
Схема 3.4.2

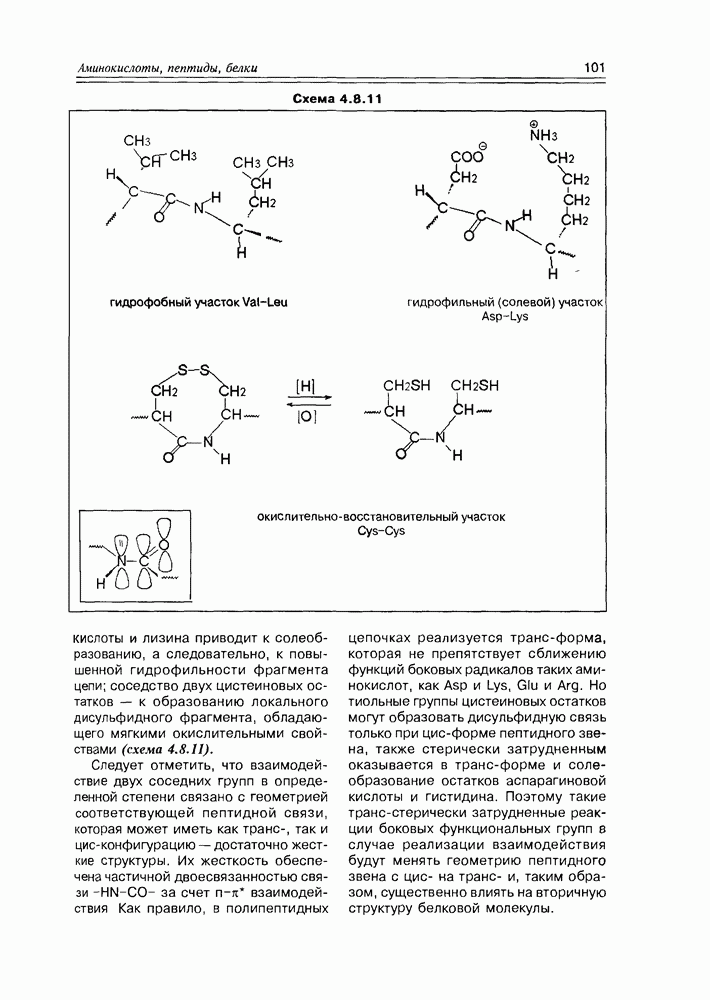
кислоты — таким образом, молекула углекислоты может считаться “усвоенной" (схема 3.4.1).
На следующем этапе 3-фосфат глицериновой кислоты восстанавливается реагентом in vivo (NADP-H) до фосфата глицеринового альдегида; последний (опять же через енольную форму) изомеризуется до соответствующего кетона — фосфата дигидроксиацетона. Показано, что из фосфатов глицеринового альдегида и дигидроксиацетона реакцией конденсации (типа альдольной) образуется молекула дифосфата фруктозы: при этом дигидроксиацетоновая компонента выступает в качестве нуклеофила в форме енолятаниона (схема 3.4.2).
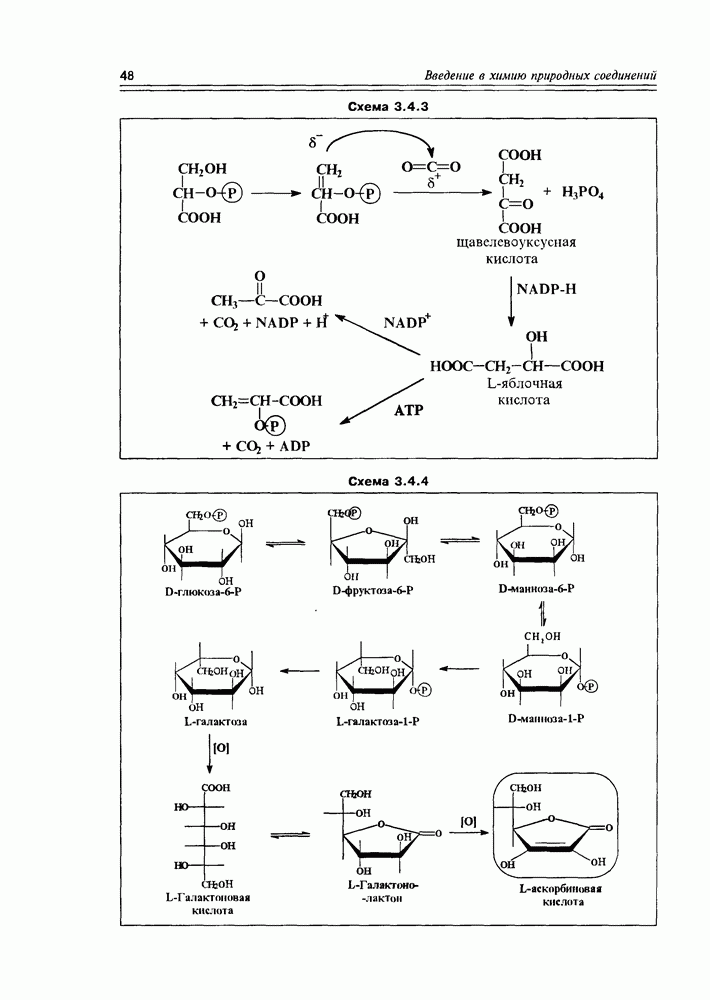
Очень похожими реакциями получаются другие моносахара (гексозы и пентозы), а также регенерируется рибулоза, необходимая для первичного захвата диоксида углерода. Кроме этого пути фотосинтетической фиксации диоксида углерода существуют и некоторые другие: например, образование щавелевоуксусной (кето-янтарной) кислоты присоединением фосфата енолпировиноградной кислоты (образующегося из фосфата все той глицериновой кислоты — см. раздел 2.1), имеющего нуклеофильный центр, по атому углерода углекислоты, об электрофильном характере которого уже говорилось выше. В свою очередь, щавелевоуксусная кислота легко восстанавливается до яблочной кислоты, а последняя служит источником и пировиноградной кислоты, и фосфата ее енольной формы (схема 3.4.3).
К этой схеме следует заметить, что высвобождающийся в ходе каталитического разложения диоксид углерода не выделяется “наружу”, а тут же используется для последующих фотосинтетических превращений, например, для образования фруктозы (схемы 3.4.1-3.4.2), а пируваты (фосфаты пировиноградной кислоты и ее енола) снова возвращаются на начальную стадию биосинтеза.
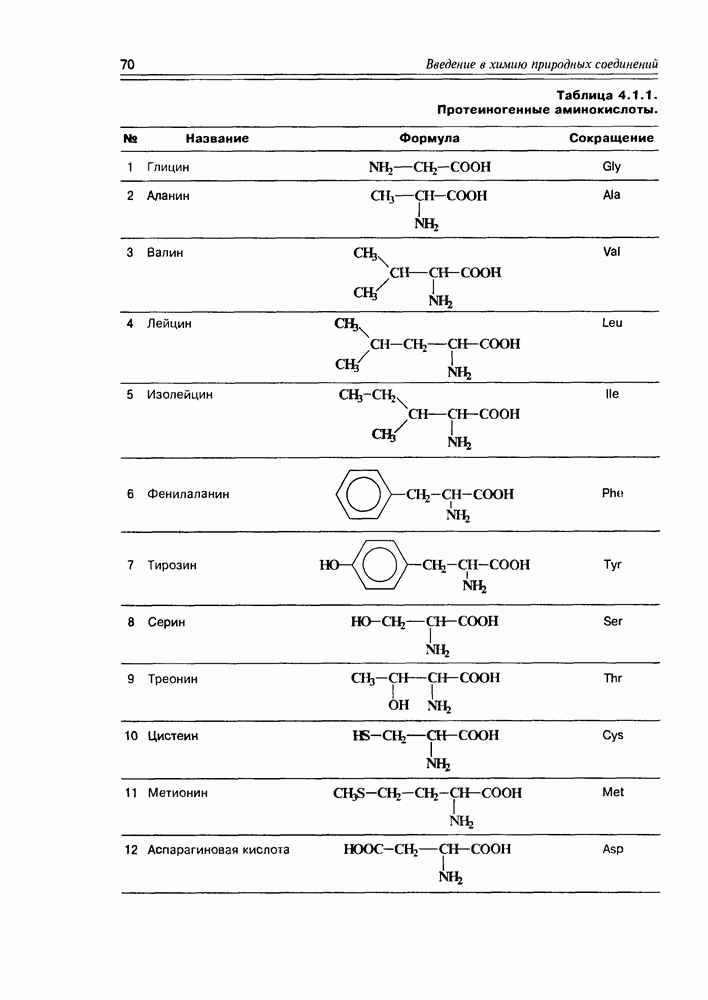
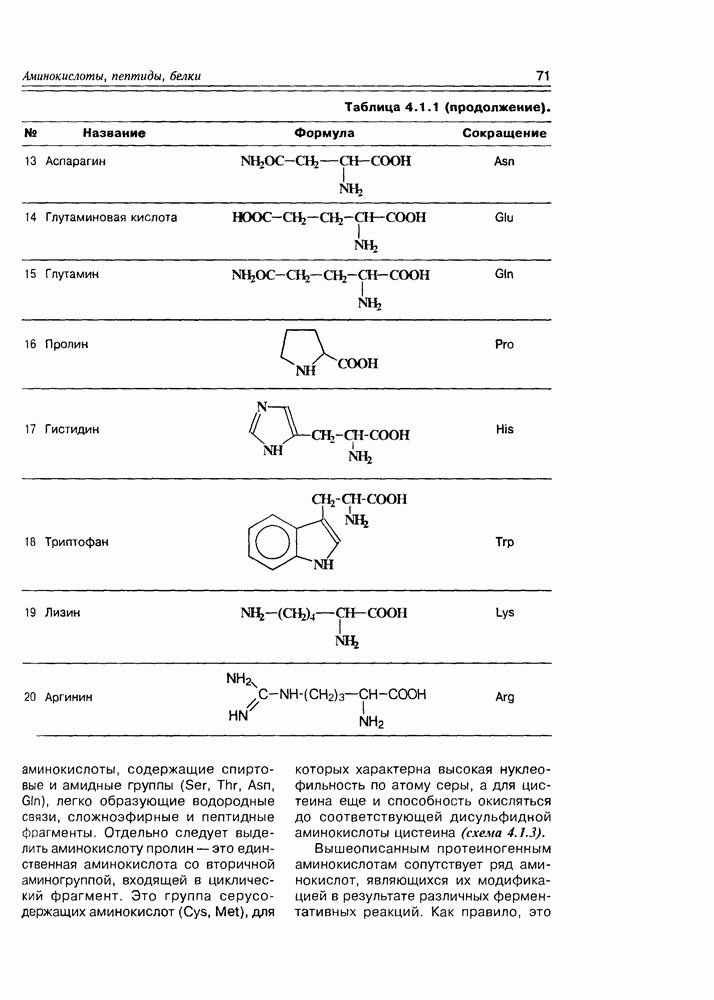
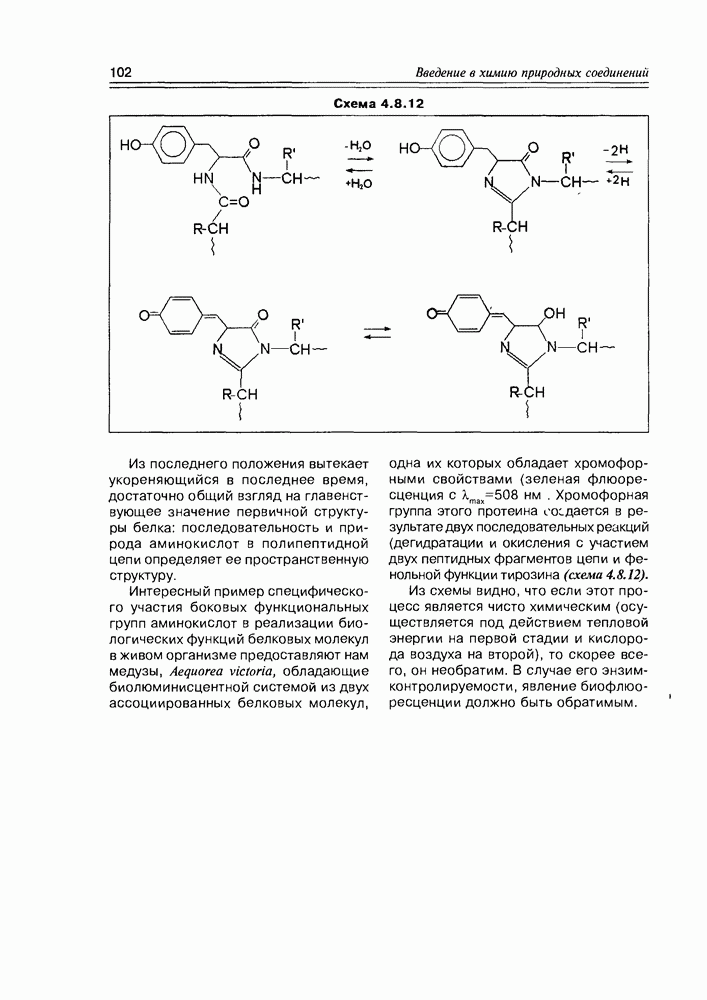
Одним из интереснейших и важнейших химических преобразований альдогексоз является реакция образования аскорбиновой кислоты (витамина С). Процесс реализуется in vivo из D-глюкозы и D-галактозы (возможно, и из D-маннозы), а в промышленности ее получают из D-глюкозы. Важно отметить, что природная аскорбиновая кислота
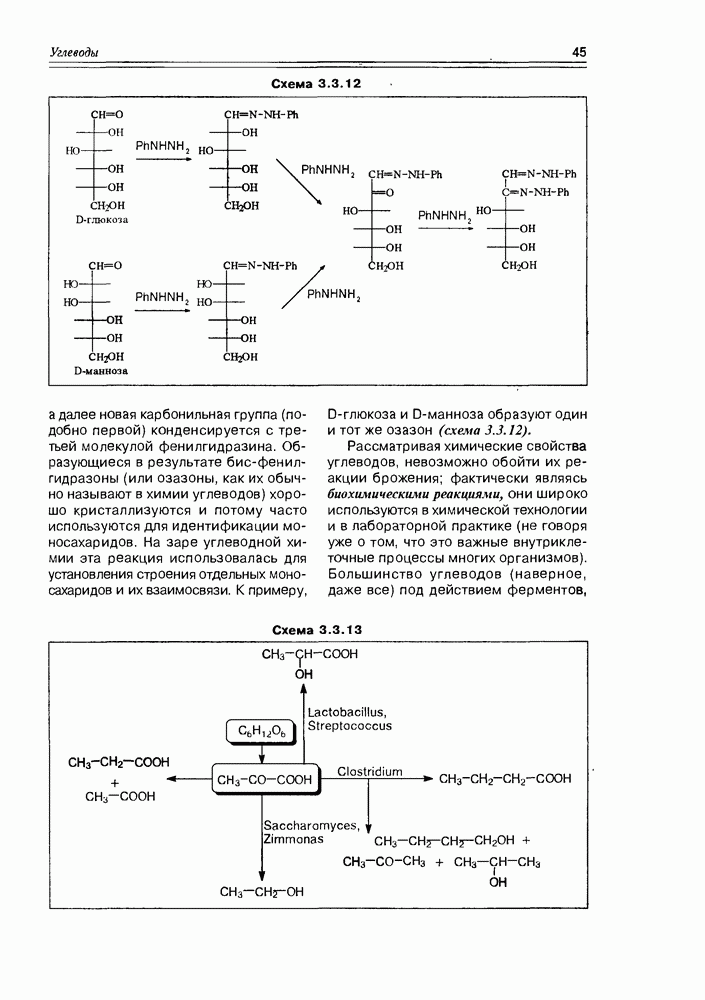
Схема 3.4.3
(см. скан)
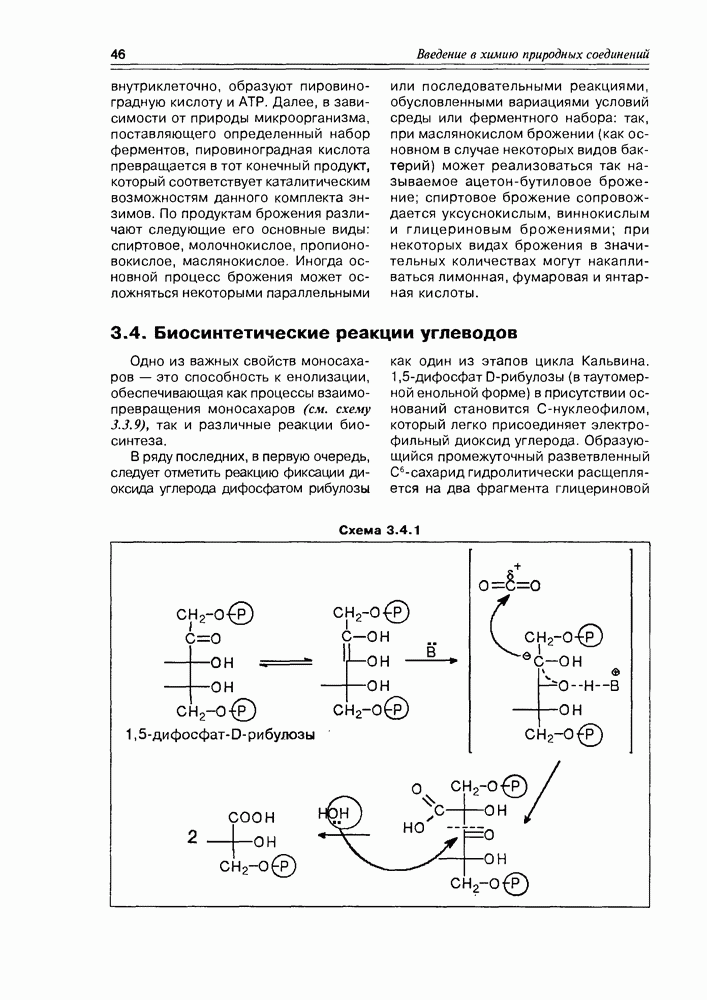
Схема 3.4.4
(см. скан)
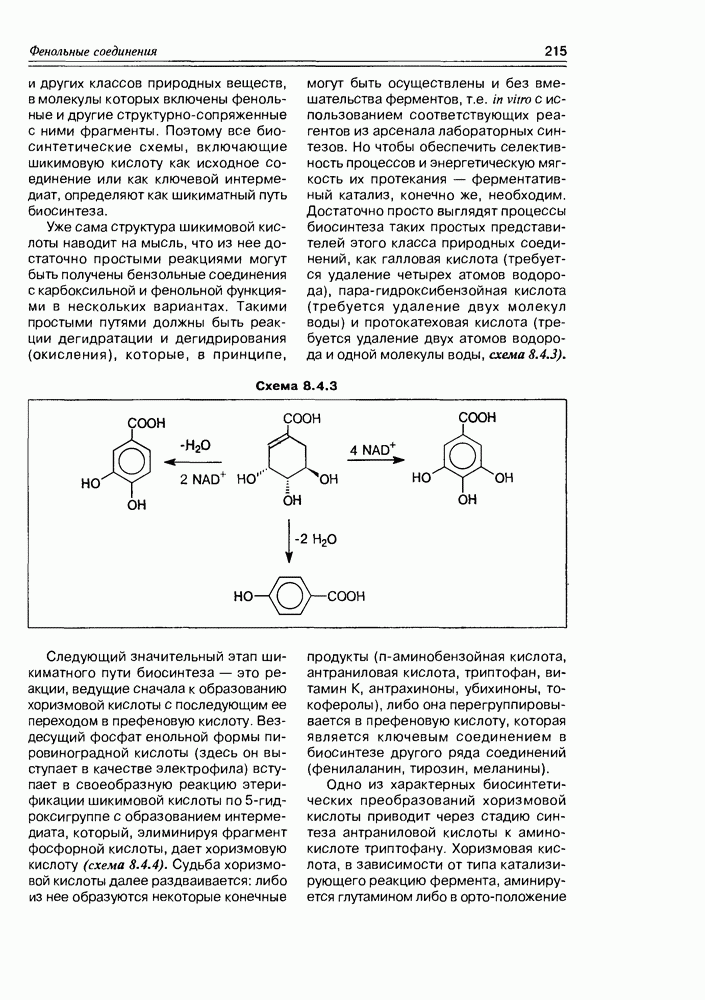
имеет L-конфигурацию. Установлено, что процесс ее образования имеет обязательные стадии: окисление при  или
или  эпимеризация или родственный процесс при
эпимеризация или родственный процесс при  лактонизация между
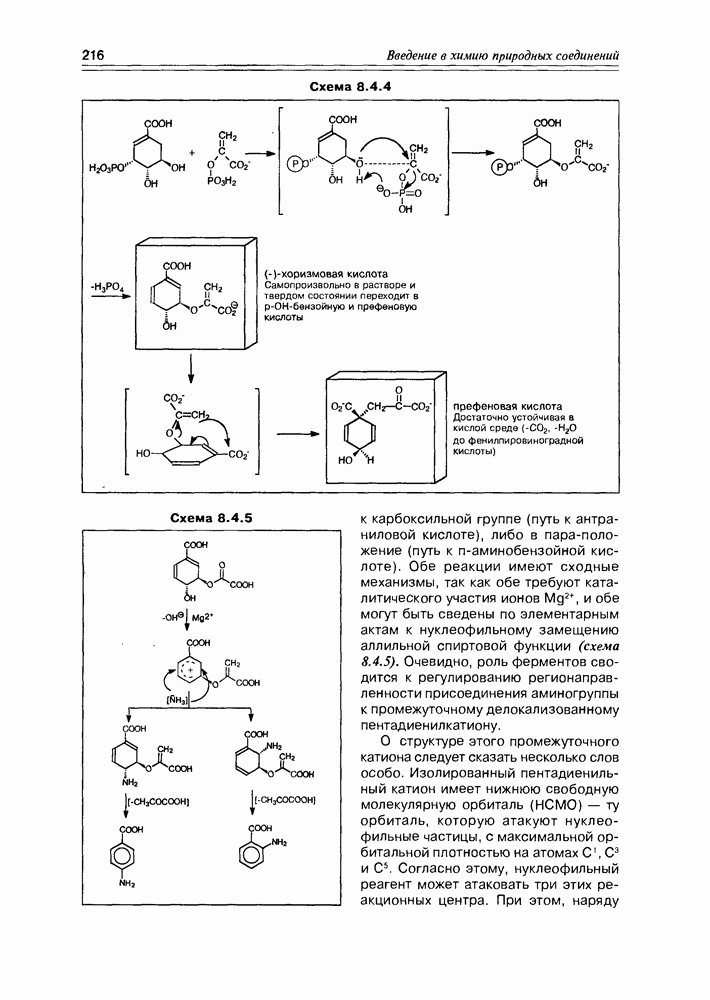
лактонизация между  . В каком порядке эти реакции осуществляются, не всегда можно сказать однозначно, хотя бы потому, что эти процессы несколько различаются у животных и у растений. Наиболее доказана к настоящему времени следующая (схема 3.4.4).
. В каком порядке эти реакции осуществляются, не всегда можно сказать однозначно, хотя бы потому, что эти процессы несколько различаются у животных и у растений. Наиболее доказана к настоящему времени следующая (схема 3.4.4).
3.5. Производные моносахаров
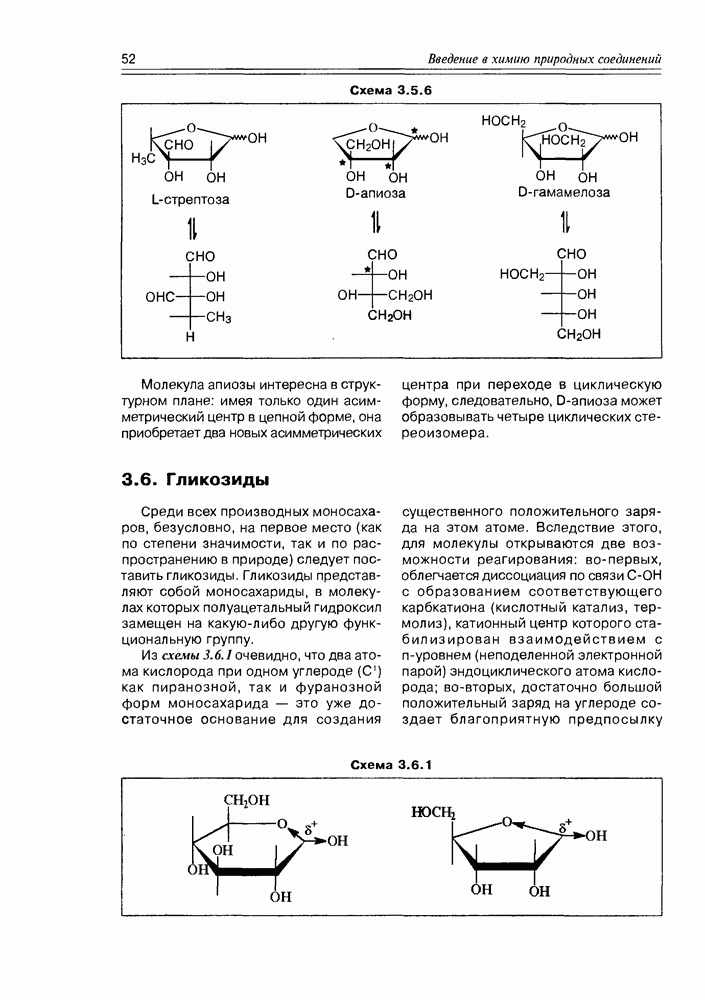
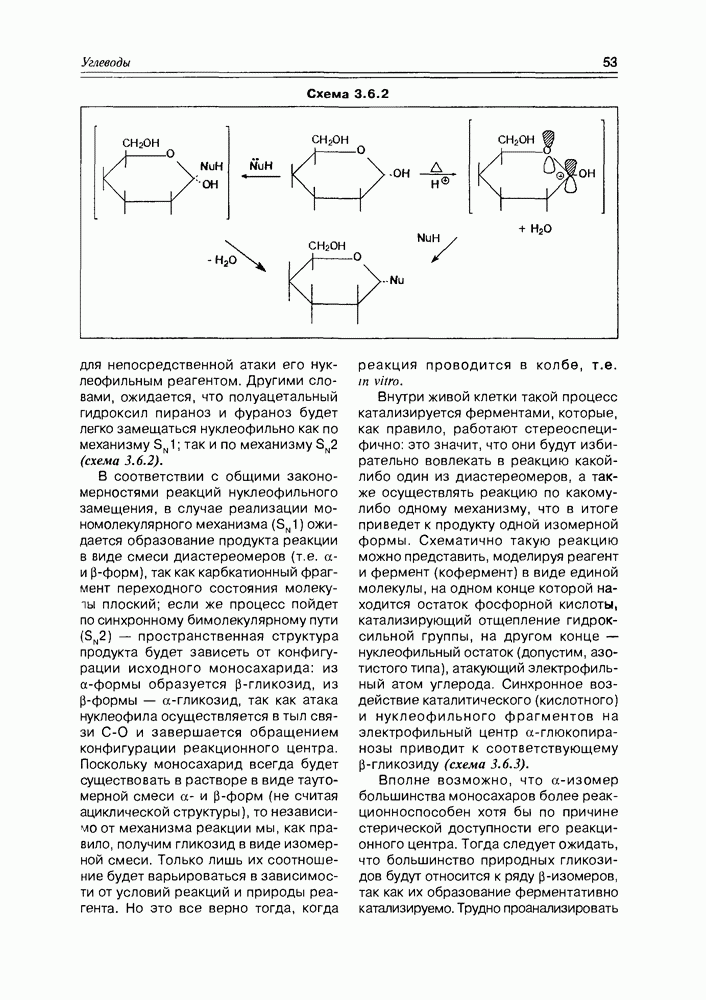
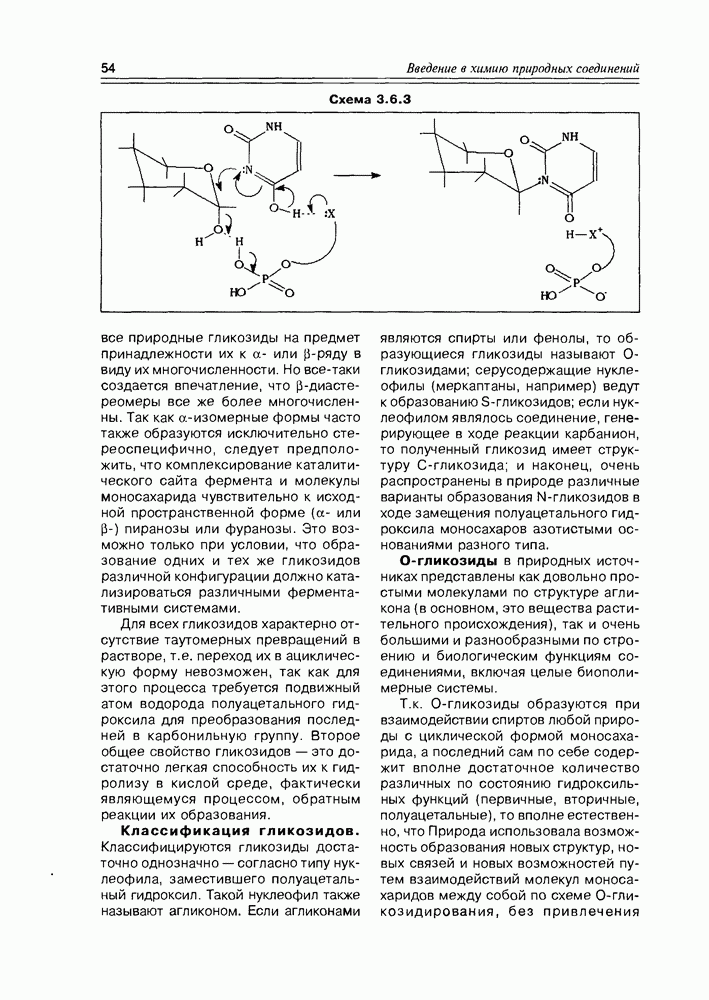
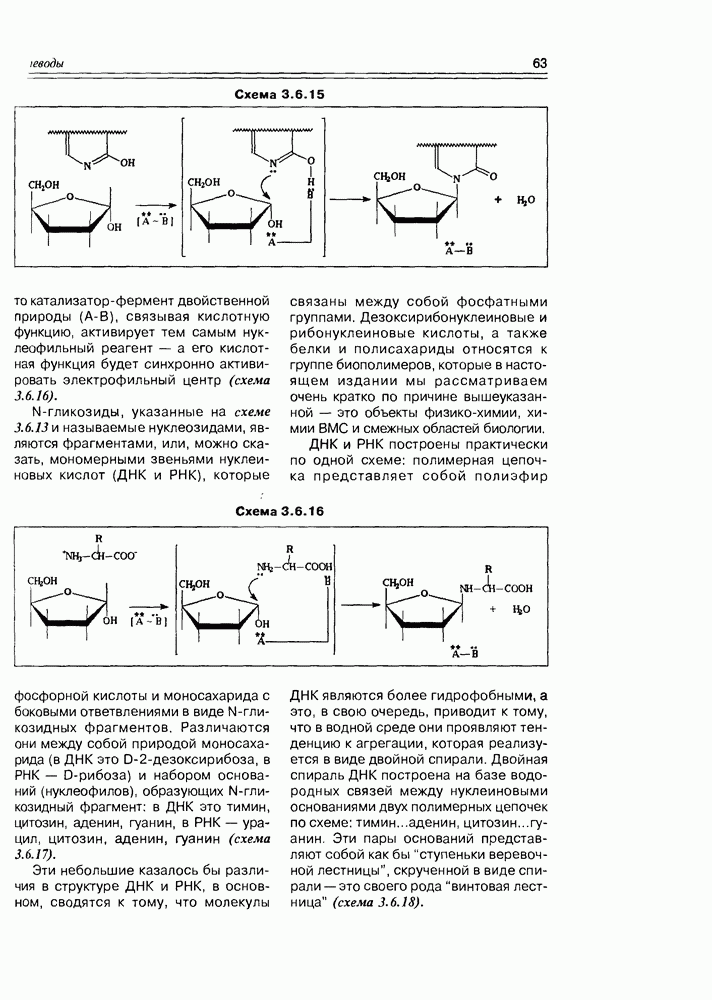
К производным моносахаридов относятся соединения, имеющие моносахаридную основу, но содержащие вместо одной или нескольких гидрокси-функций какие-либо другие функциональные группы (в том числе, и водород). Ввиду большого их разнообразия и широкого распространения в природе, имеет смысл разделить производные моносахаров на две подгруппы: производные по всем спиртовым группам и производные по полуацетальному гидроксилу. Последние в силу своей специфичности называют гликозидами и выделяют в особую группу, которую мы проанализируем позже.
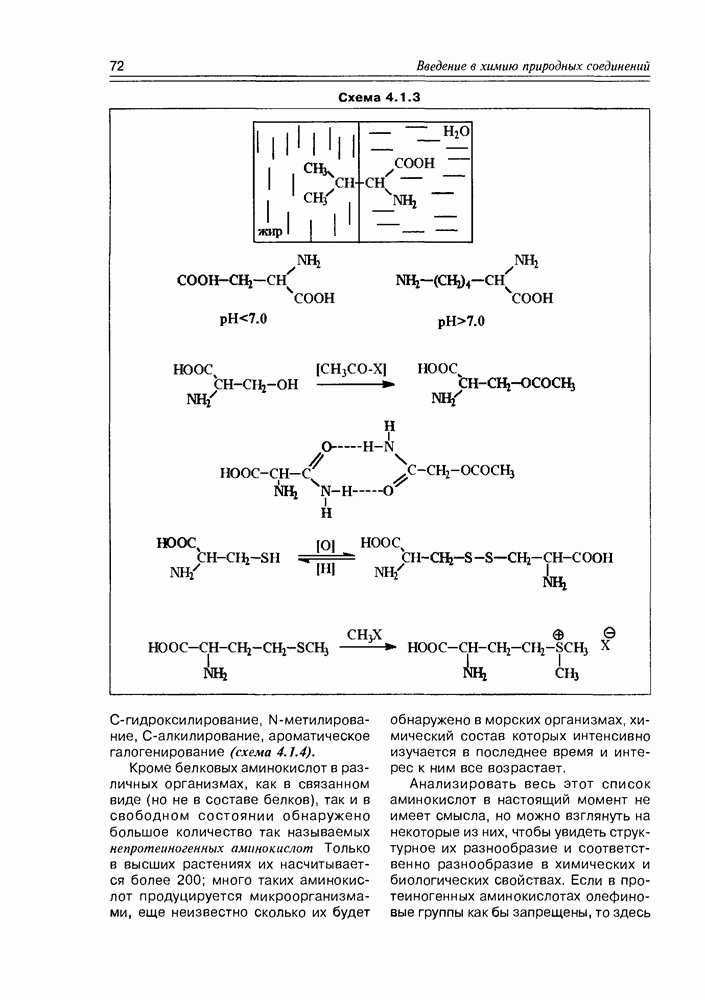
Все производные моносахаридов, в которых спиртовая группа замещена на любую другую, получают приставку дезокси-, далее называют замещающую функцию (атом водорода в этом случае не называется).
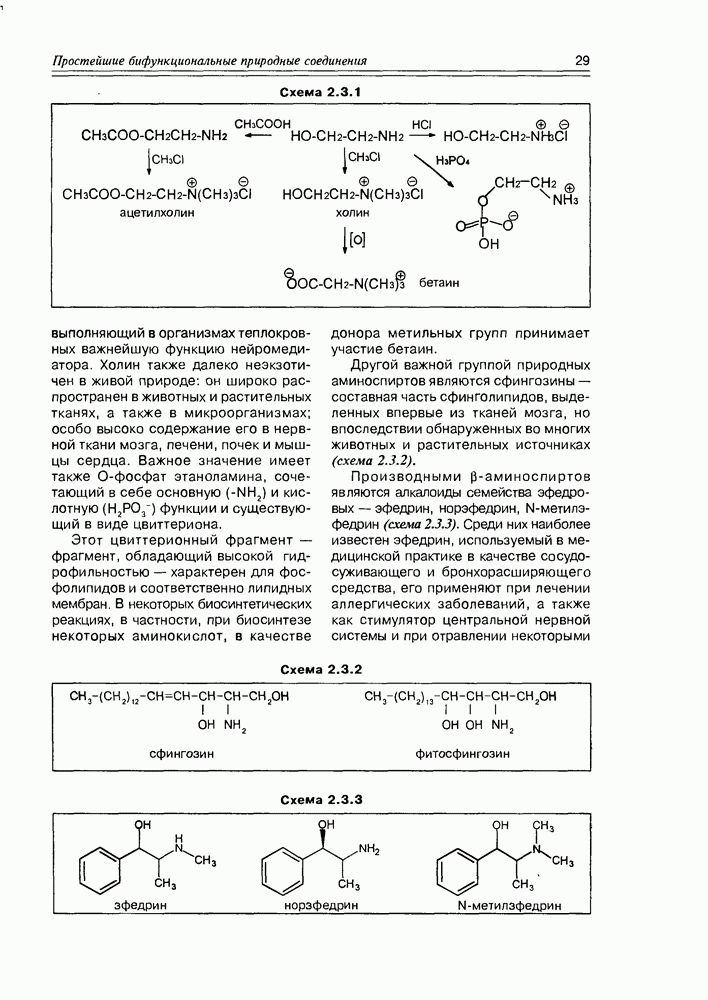
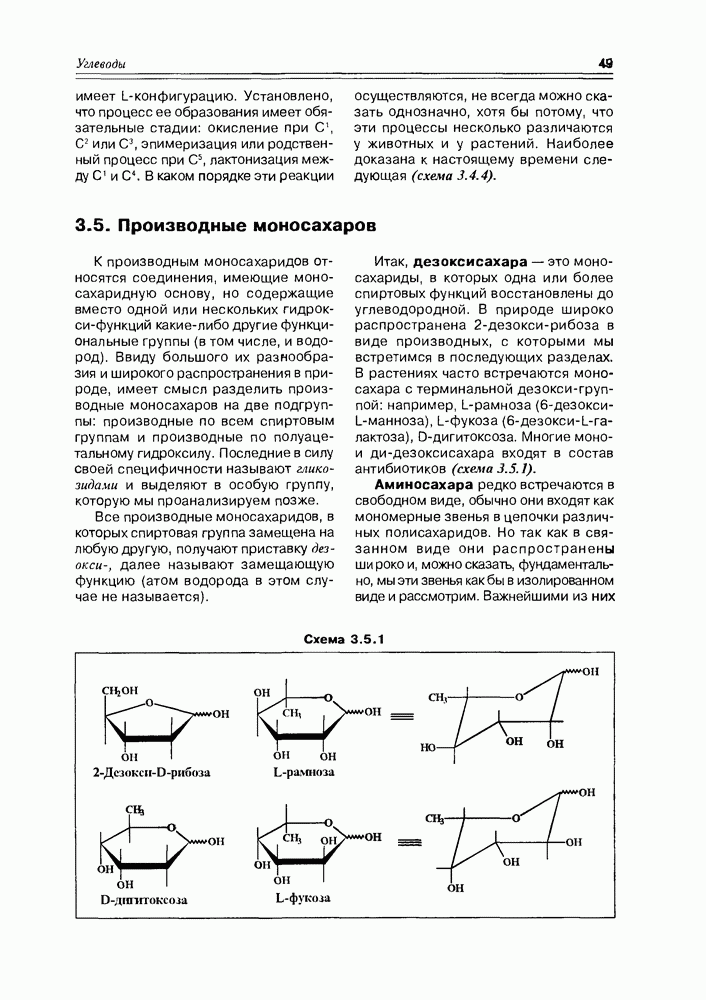
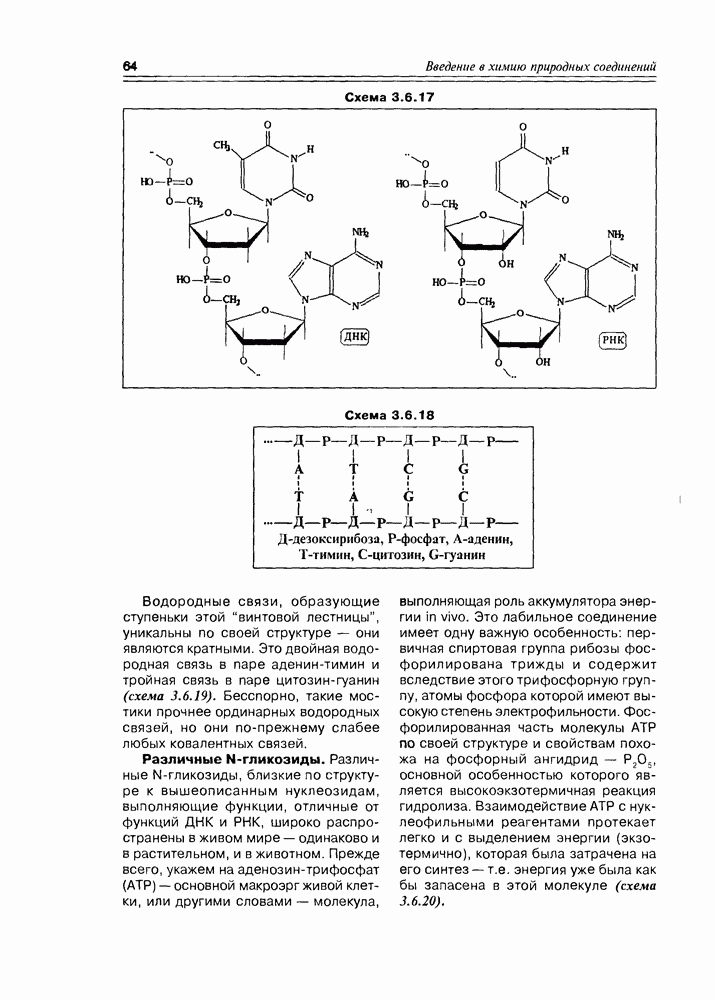
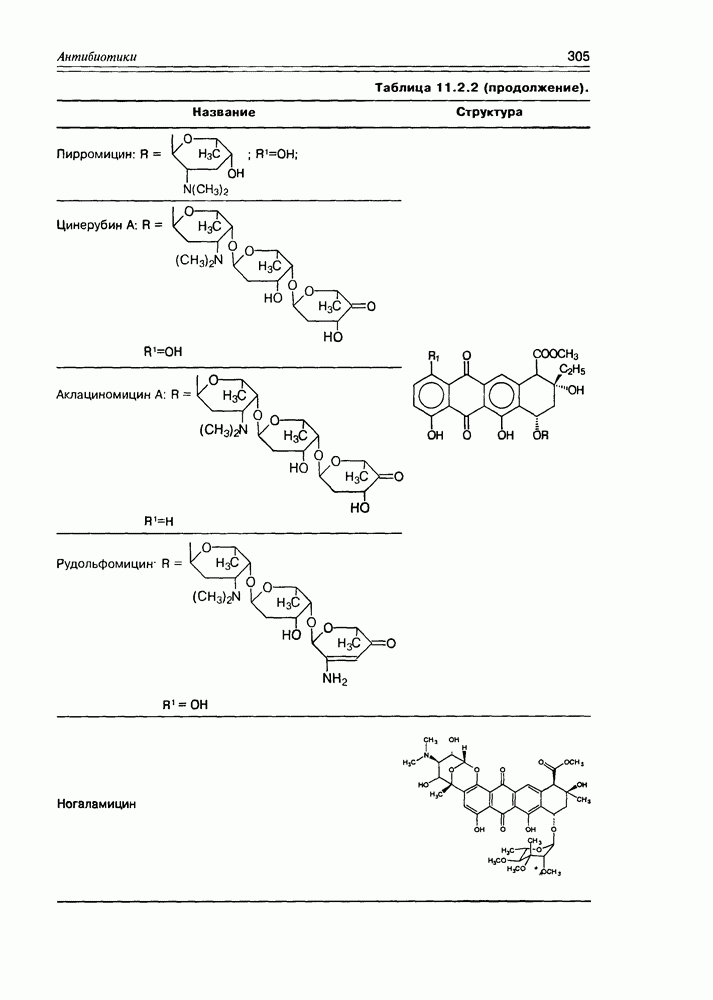
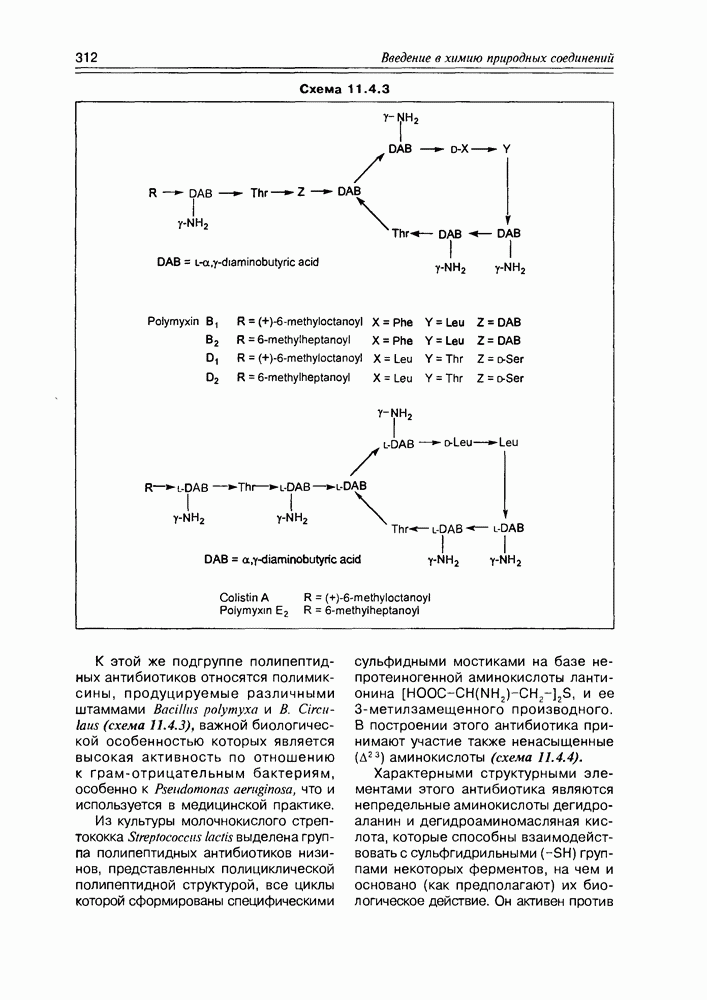
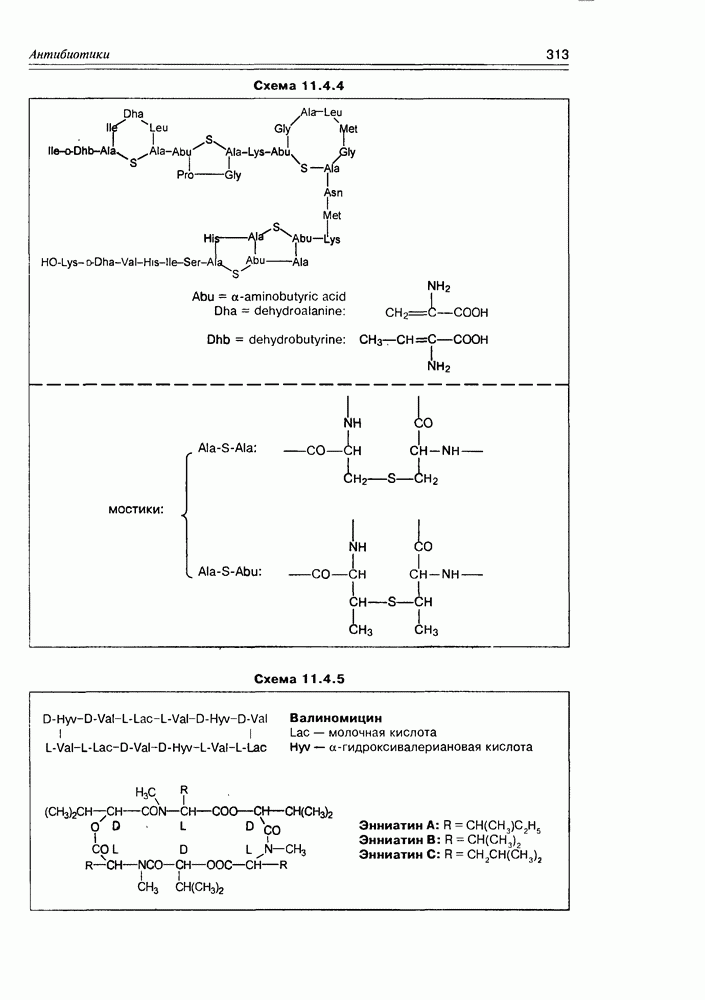
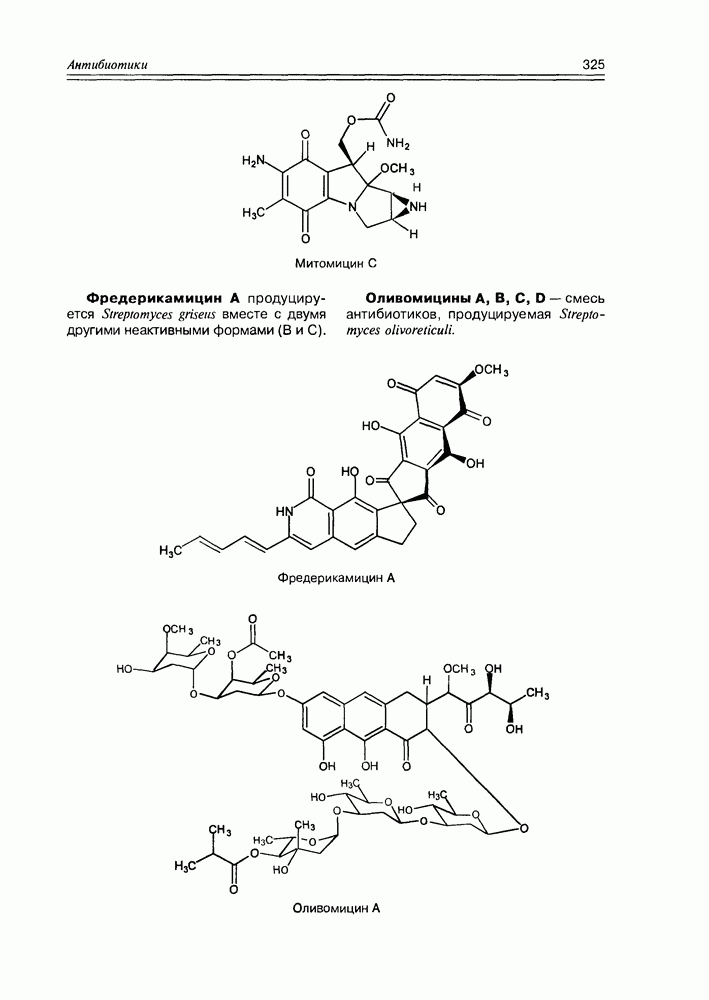
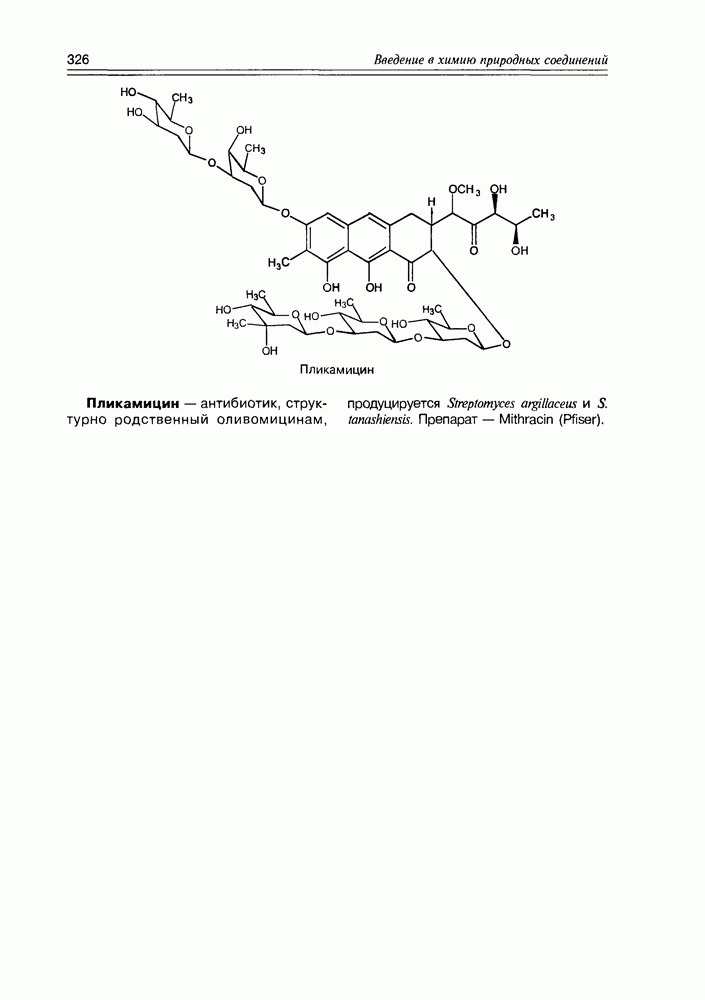
Итак, дезоксисахара — это моносахариды, в которых одна или более спиртовых функций восстановлены до углеводородной. В природе широко распространена  -дезоксирибоза в виде производных, с которыми мы встретимся в последующих разделах. В растениях часто встречаются моносахара с терминальной дезоксигруппой: например, L-рамноза (6-дезокси-L-манноза), L-фукоза (6-дезокси-L-галактоза), D-дигитоксоза. Многие моно- и дидезоксисахара входят в состав антибиотиков (схема 3.5.1).
-дезоксирибоза в виде производных, с которыми мы встретимся в последующих разделах. В растениях часто встречаются моносахара с терминальной дезоксигруппой: например, L-рамноза (6-дезокси-L-манноза), L-фукоза (6-дезокси-L-галактоза), D-дигитоксоза. Многие моно- и дидезоксисахара входят в состав антибиотиков (схема 3.5.1).
Аминосахара редко встречаются в свободном виде, обычно они входят как мономерные звенья в цепочки различных полисахаридов. Но так как в связанном виде они распространены широко и, можно сказать, фундаментально, мы эти звенья как бы в изолированном виде и рассмотрим. Важнейшими из них
Схема 3.5.1

Схема 3.5.2

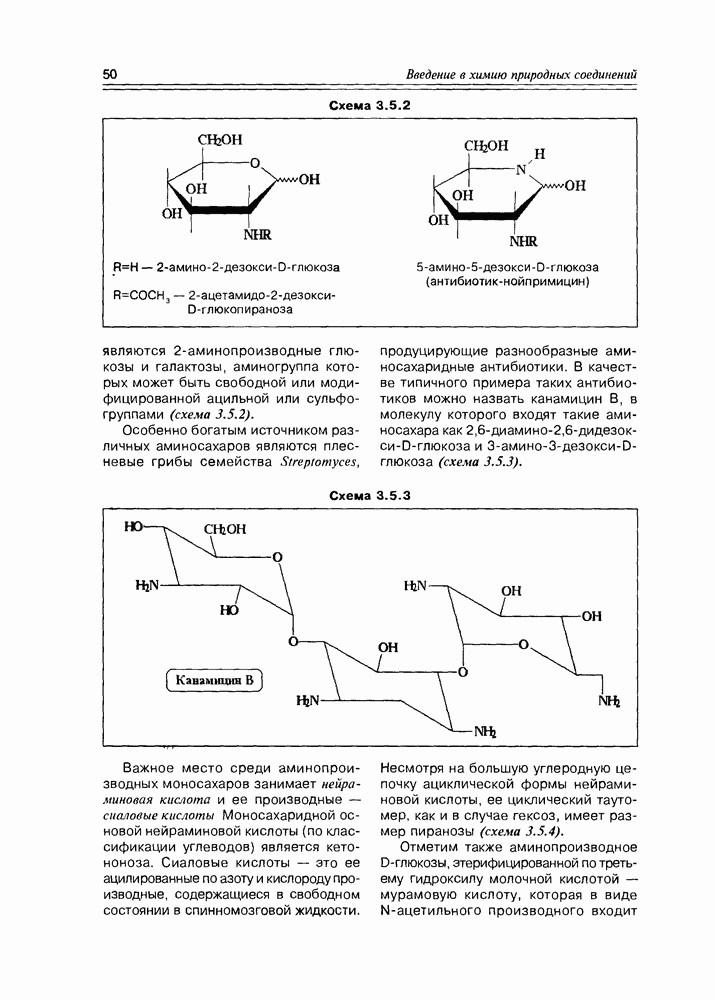
являются 2-аминопроизводные глюкозы и галактозы, аминогруппа которых может быть свободной или модифицированной ацильной или сульфогруппами (схема 3.5.2).
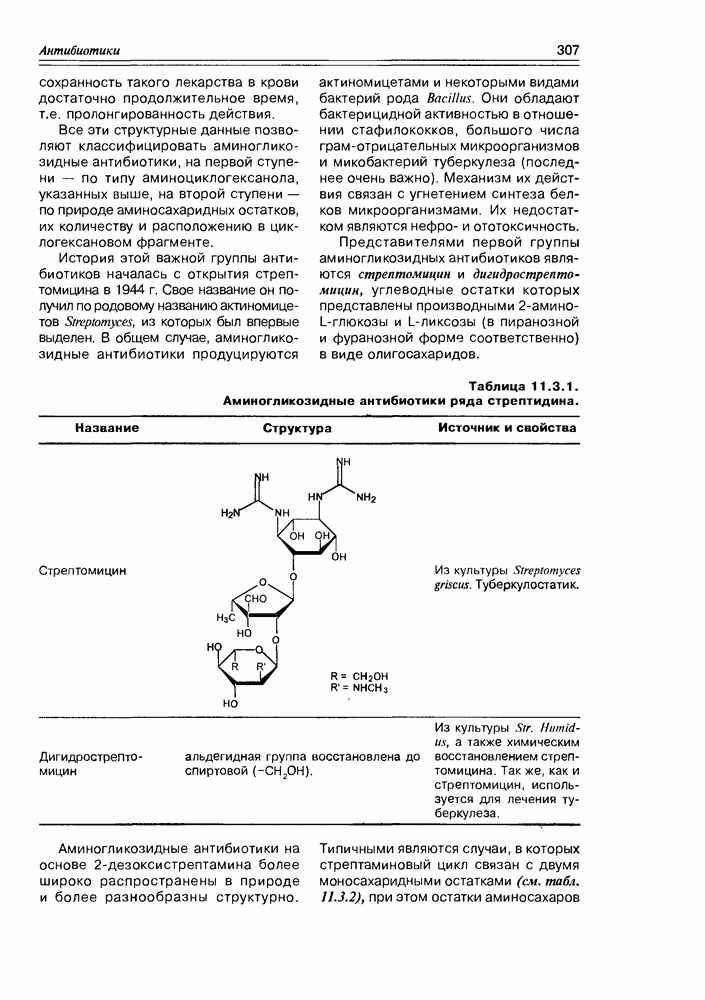
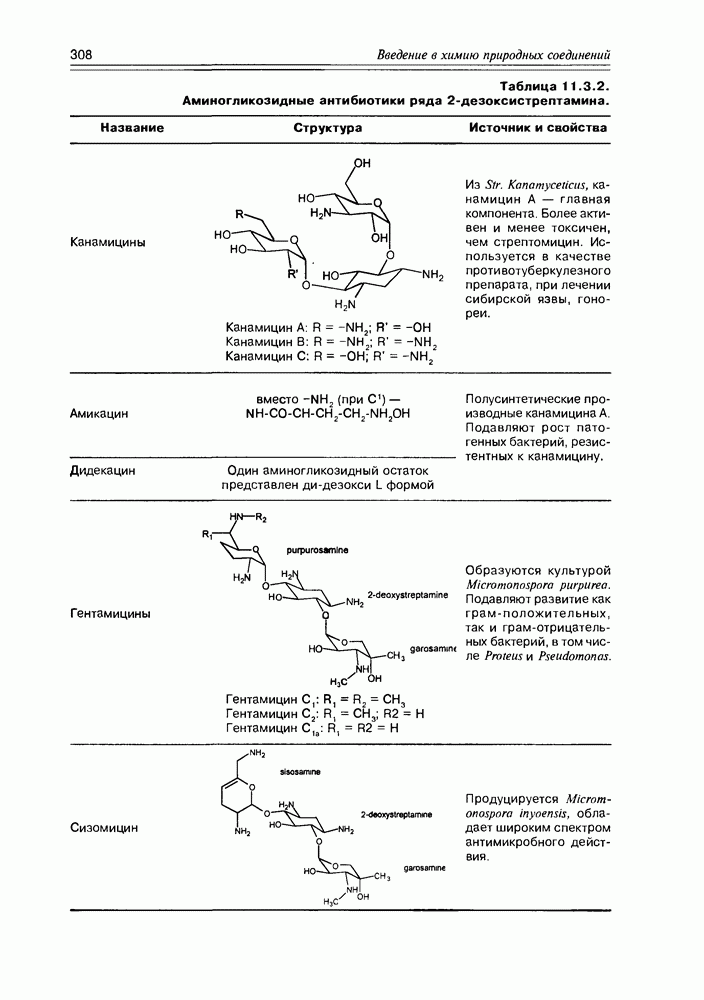
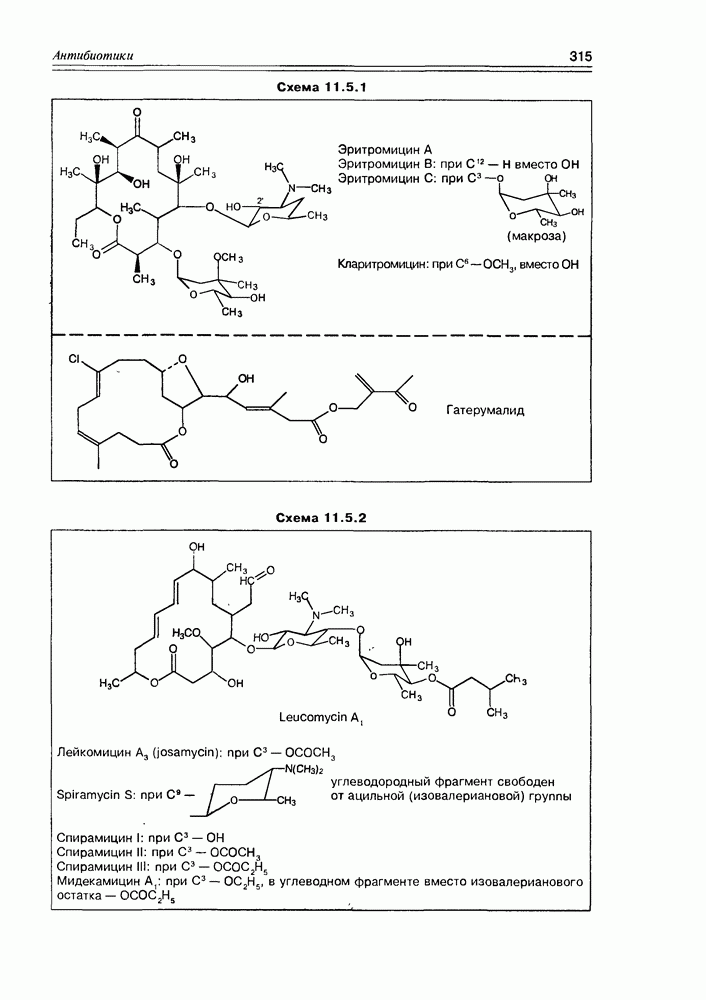
Особенно богатым источником различных аминосахаров являются плесневые грибы семейства Streptomyces, продуцирующие разнообразные аминосахаридные антибиотики. В качестве типичного примера таких антибиотиков можно назвать канамицин В, в молекулу которого входят такие аминосахара как 2,6-диамино-2,6-дидезокси-D-глюкоза и 3-амино-3-дезокси-D-глюкоза (схема 3.5.3).
Схема 3.5.3

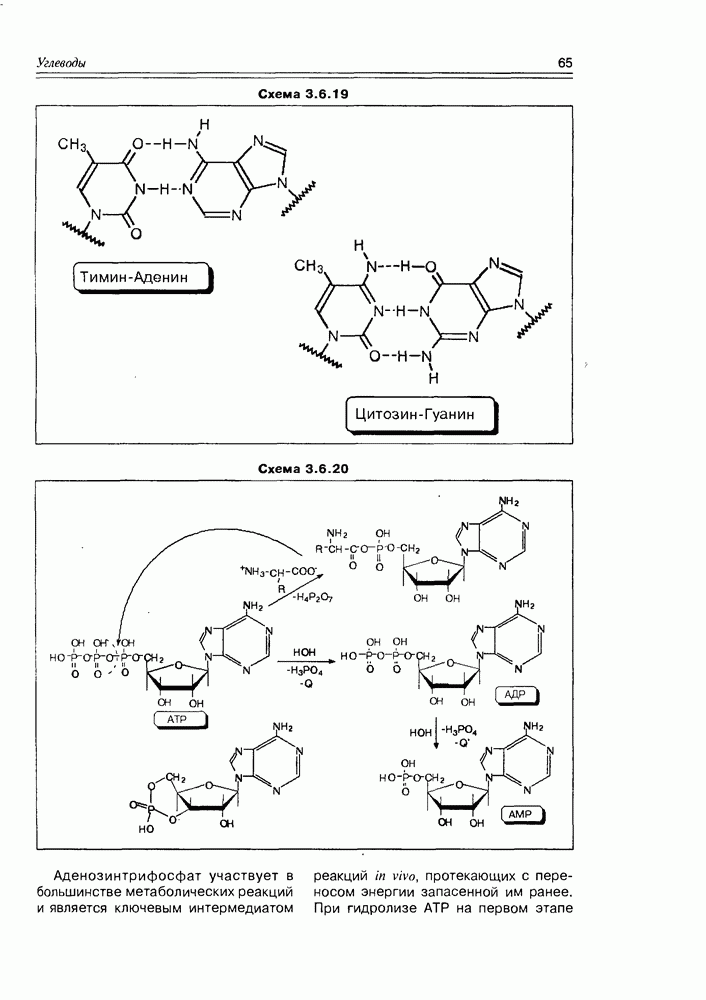
Важное место среди аминопроизводных моносахаров занимает нейраминовая кислота и ее производные — сиаповые кислоты Моносахаридной основой нейраминовой кислоты (по классификации углеводов) является кетононоза. Сиаловые кислоты — это ее ацилированные по азоту и кислороду производные, содержащиеся в свободном состоянии в спинномозговой жидкости.
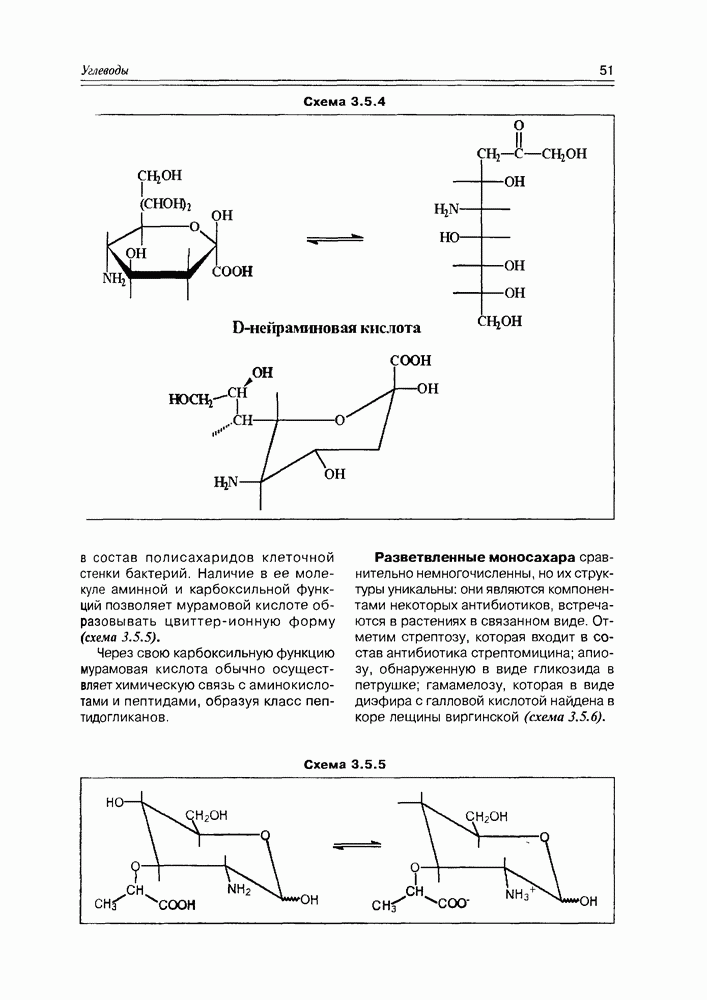
Несмотря на большую углеродную цепочку ациклической формы нейраминовой кислоты, ее циклический таутомер, как и в случае гексоз, имеет размер пиранозы (схема 3.5.4).
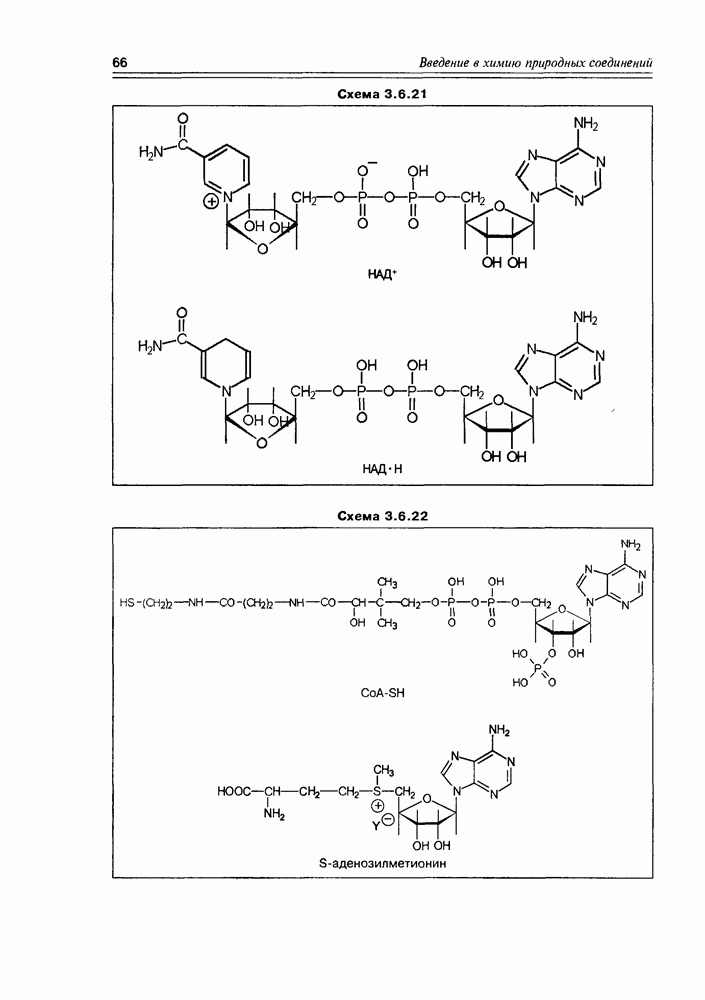
Отметим также аминопроизводное D-глюкозы, этерифицированной по третьему гидроксилу молочной кислотой — мурамовую кислоту, которая в виде N-ацетильного производного входит
Схема 3.5.4

в состав полисахаридов клеточной стенки бактерий. Наличие в ее молекуле аминной и карбоксильной функций позволяет мурамовой кислоте образовывать цвиттерионную форму (схема 3.5.5).
Через свою карбоксильную функцию мурамовая кислота обычно осуществляет химическую связь с аминокислотами и пептидами, образуя класс пептидогликанов.
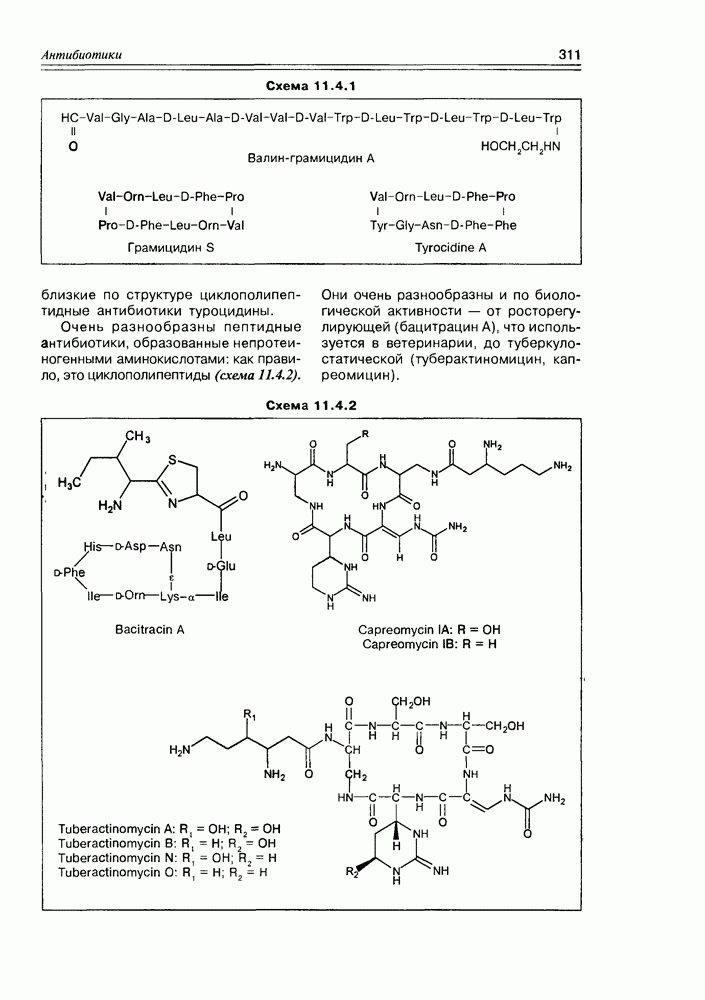
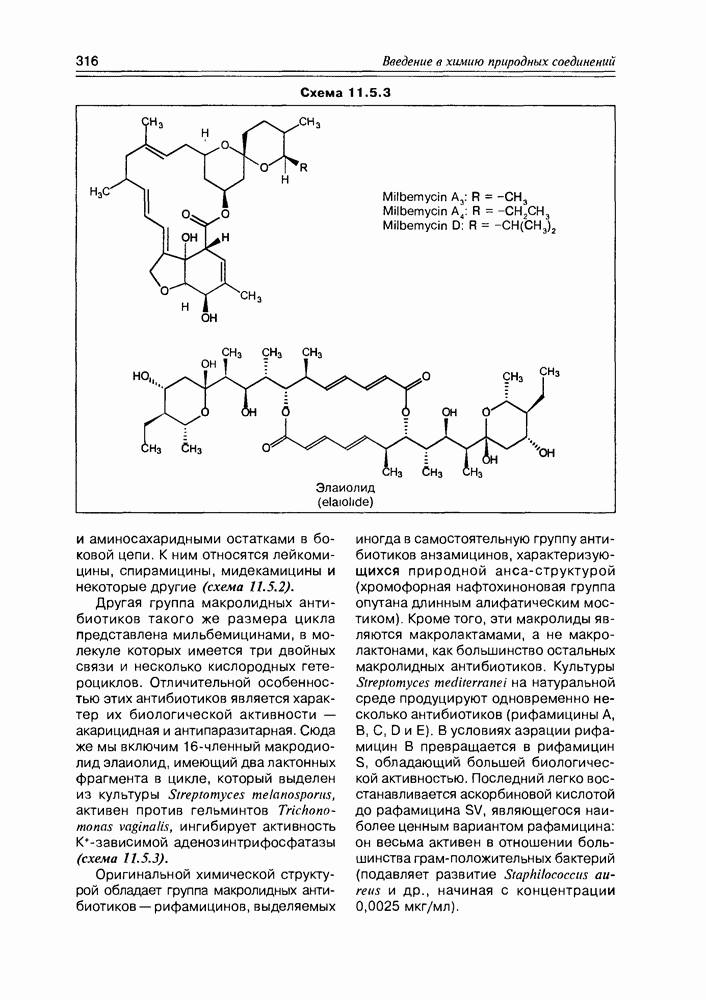
Разветвленные моносахара сравнительно немногочисленны, но их структуры уникальны: они являются компонентами некоторых антибиотиков, встречаются в растениях в связанном виде. Отметим стрептозу, которая входит в состав антибиотика стрептомицина; апиозу, обнаруженную в виде гликозида в петрушке; гамамелозу, которая в виде диэфира с галловой кислотой найдена в коре лещины виргинской (схема 3.5.6).
Схема 3.5.5

Схема 3.5.6

Молекула апиозы интересна в структурном плане: имея только один асимметрический центр в цепной форме, она приобретает два новых асимметрических центра при переходе в циклическую форму, следовательно, D-апиоза может образовывать четыре циклических стереоизомера.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ АВТОРА
- Глава 1. ВВЕДЕНИЕ
- 1.1. Предмет химии природных соединений
- 1.2. Классификация природных соединений
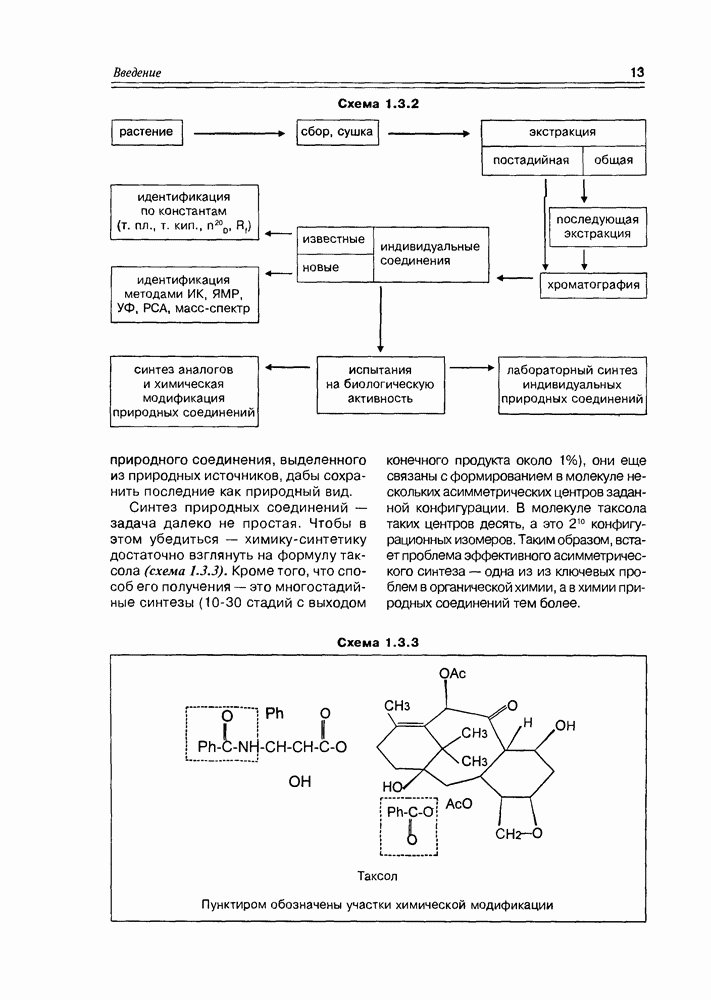
- 1.3. Методология химии природных соединений
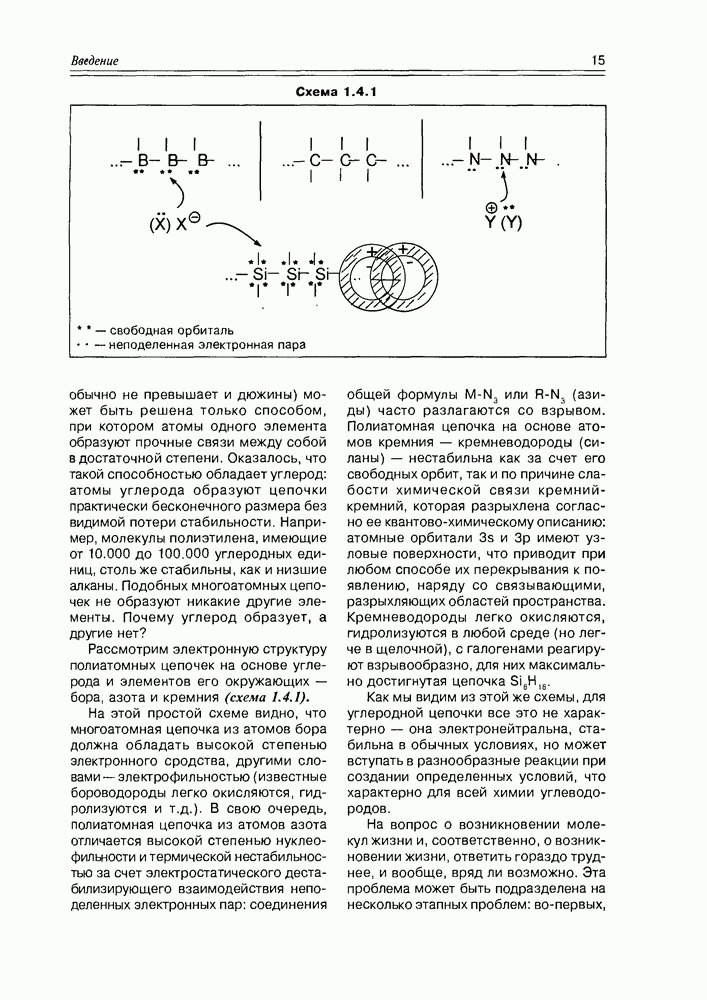
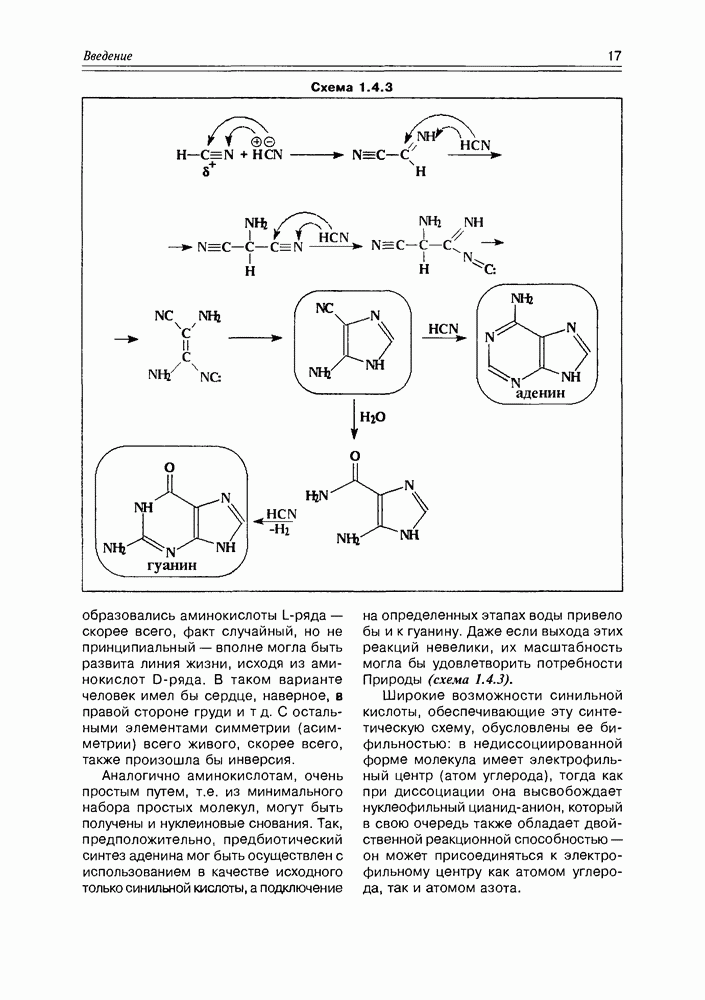
- 1.4. Углерод и жизнь
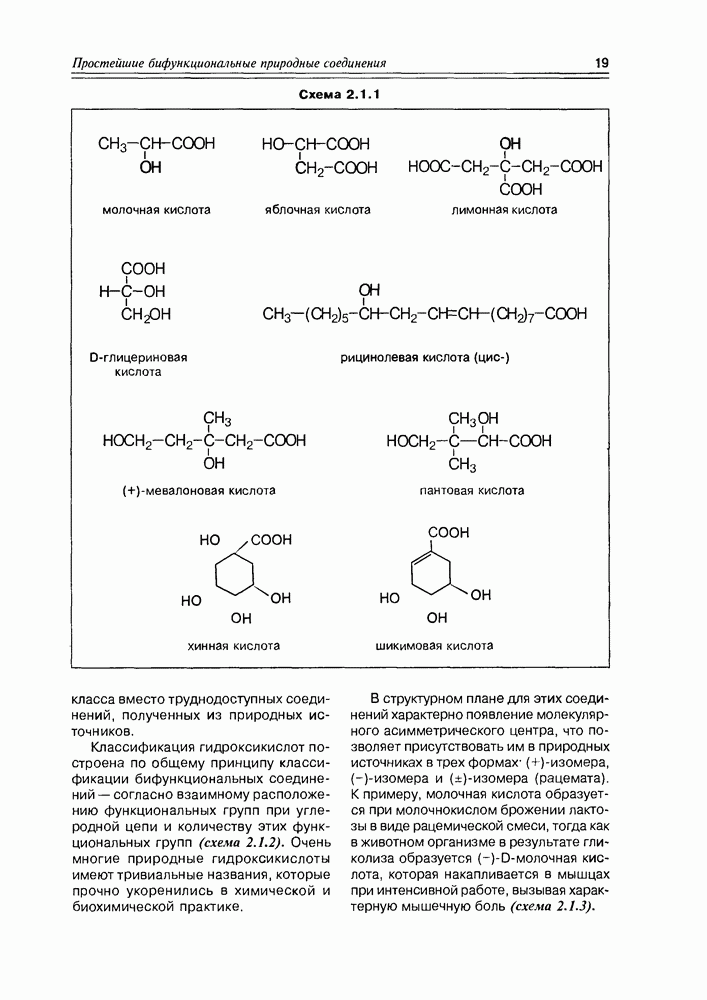
- Глава 2. ПРОСТЕЙШИЕ БИФУНКЦИОНАЛЬНЫЕ ПРИРОДНЫЕ СОЕДИНЕНИЯ — МОСТИК К МАССИВУ ПРИРОДНЫХ СОЕДИНЕНИЙ
- 2.2. Оксокислоты
- 2.3. Аминоспирты
- Глава 3. УГЛЕВОДЫ
- 3.2. Свойства и структура моносахаридов
- 3.3. Химические свойства моносахаридов
- 3.4. Биосинтетические реакции углеводов
- 3.6. Гликозиды
- Глава 4. АМИНОКИСЛОТЫ, ПЕПТИДЫ, БЕЛКИ
- 4.2. Химические свойства а-аминокислот
- 4.3. Биосинтез аминокислот
- 4.4. Полипептиды
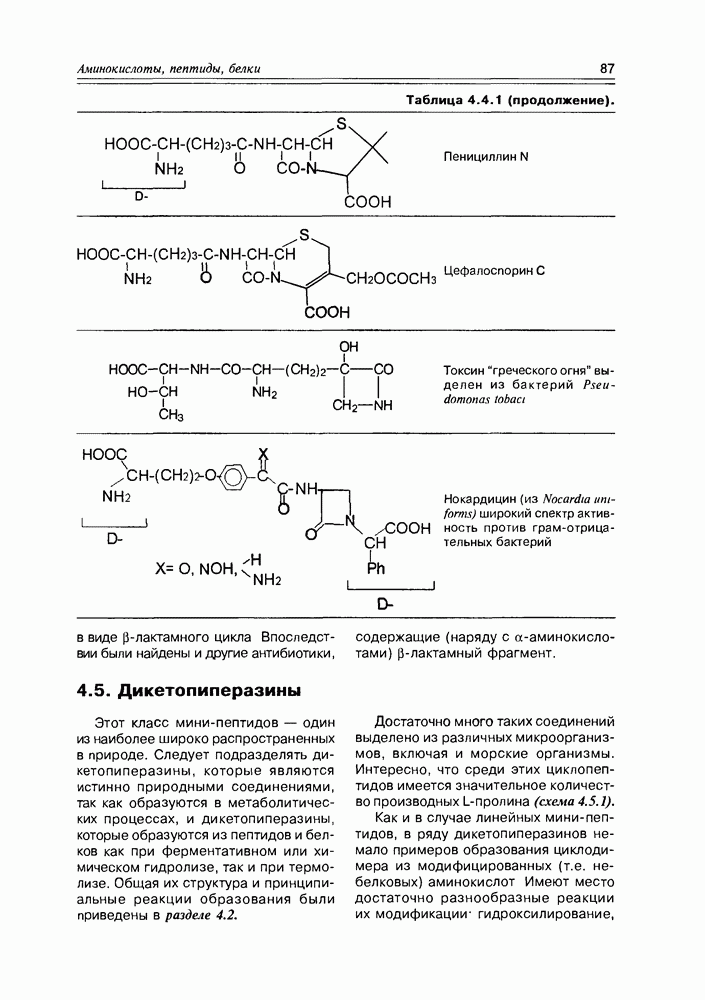
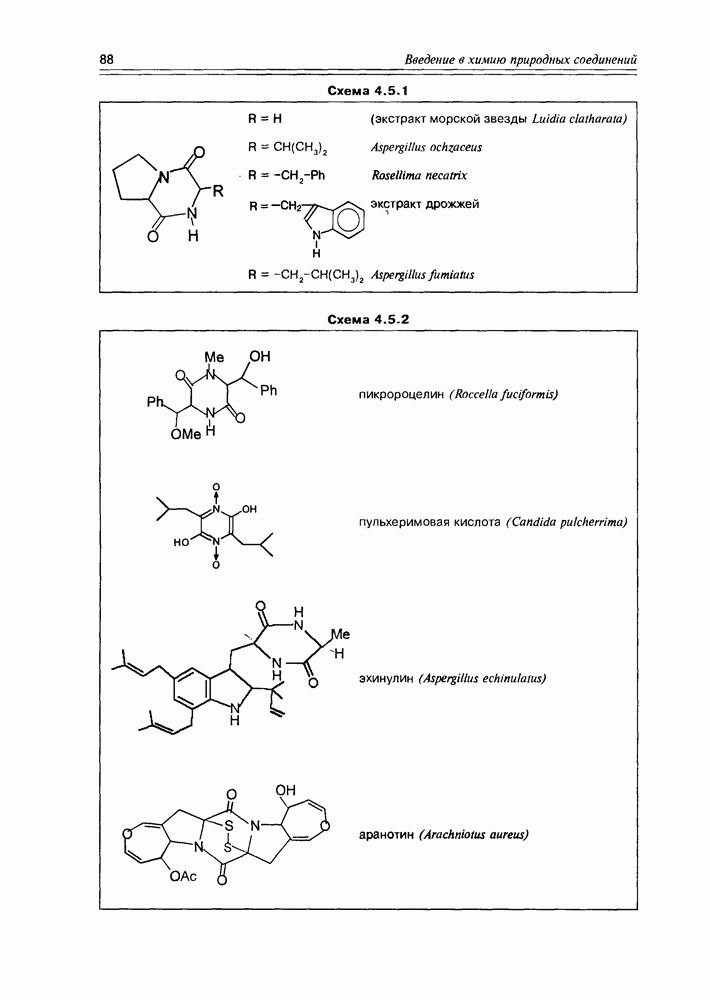
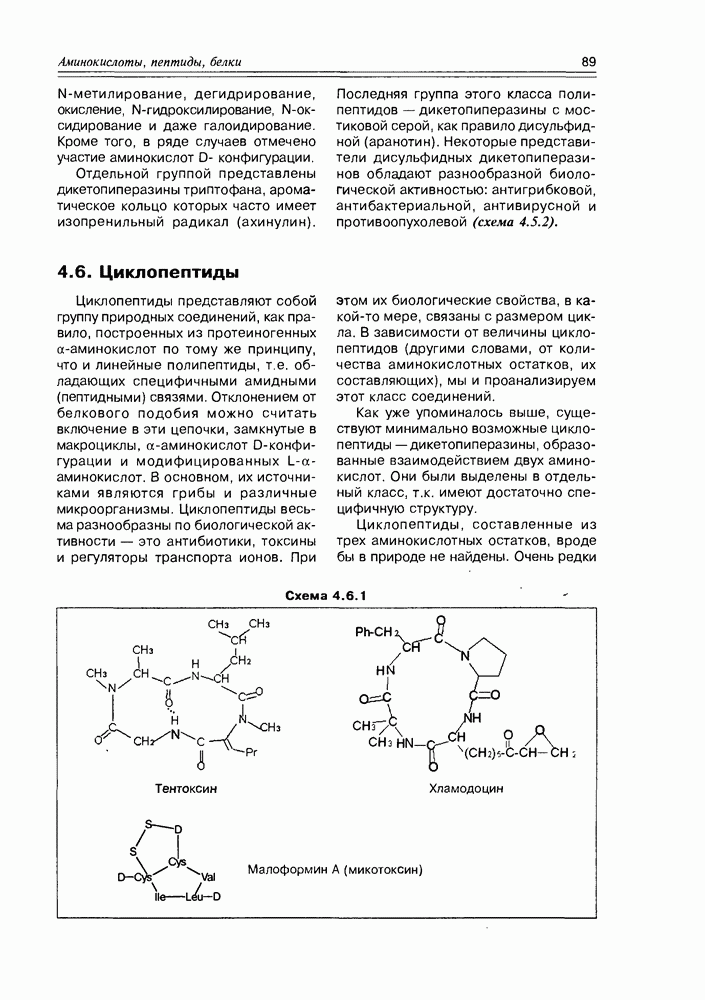
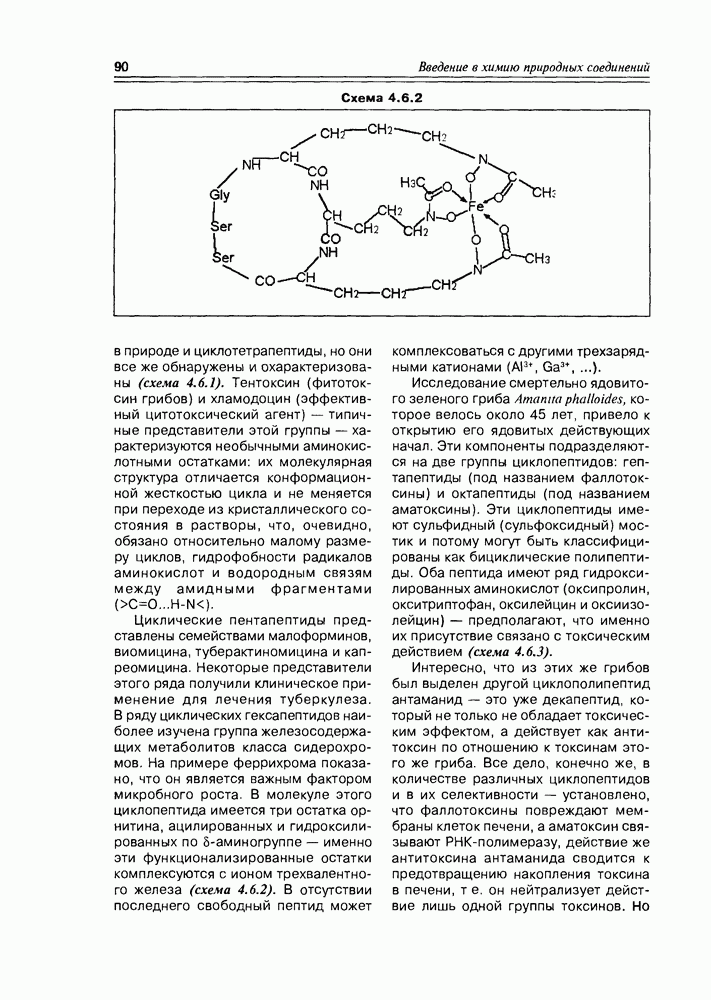
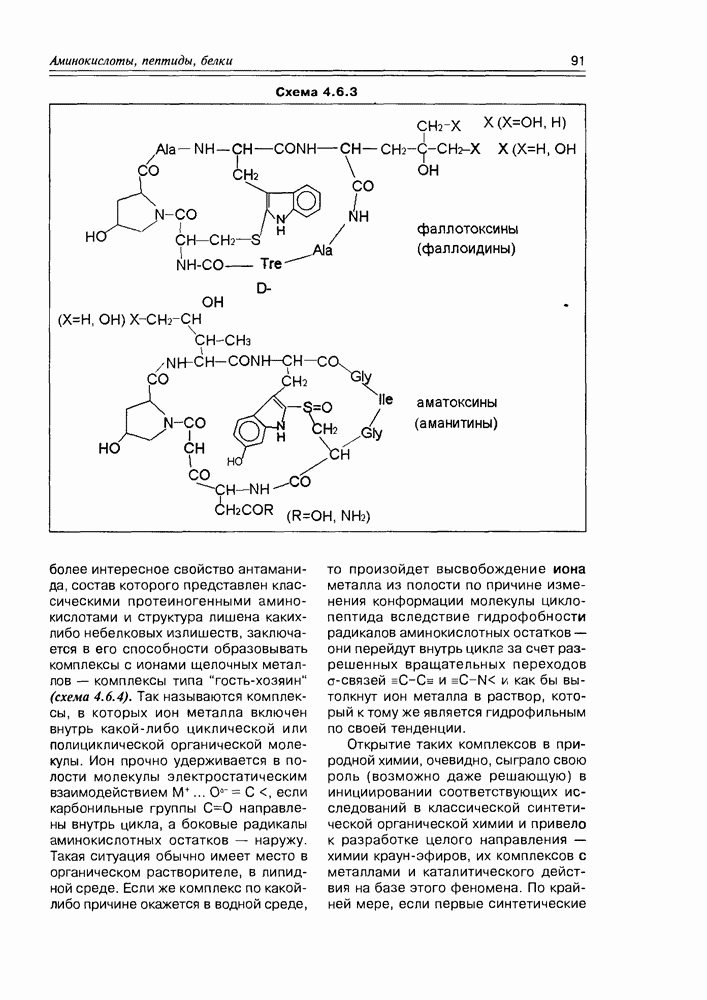
- 4.5. Дикетопиперазины
- 4.6. Циклопептиды
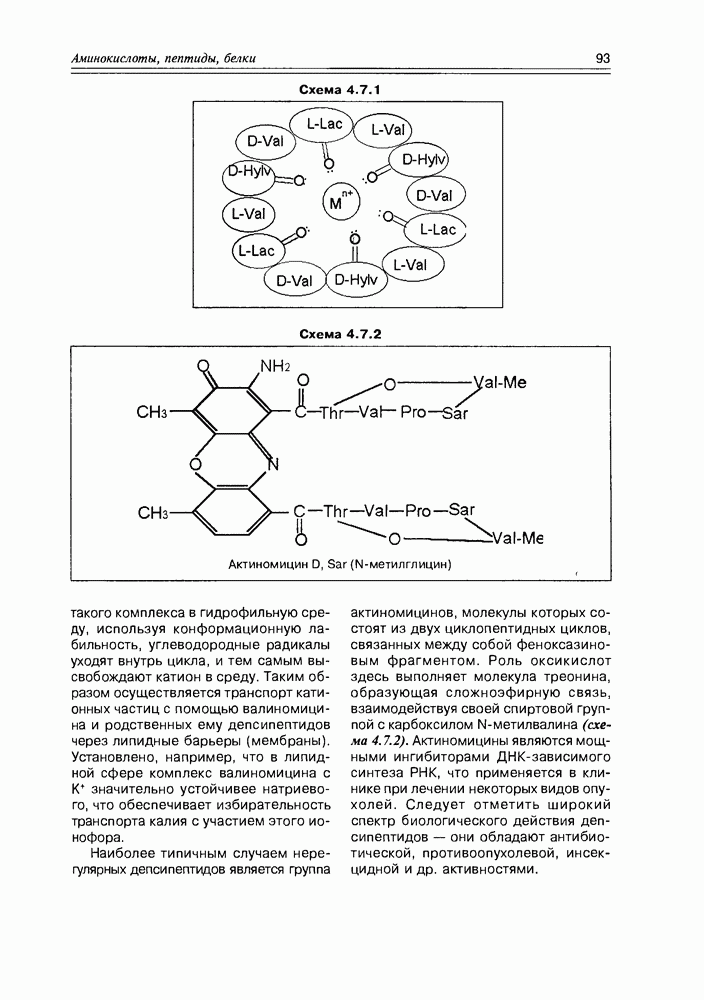
- 4.7. Депсипептиды
- 4.8. Белки
- Глава 5. ЛИПИДЫ: ЖИРНЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
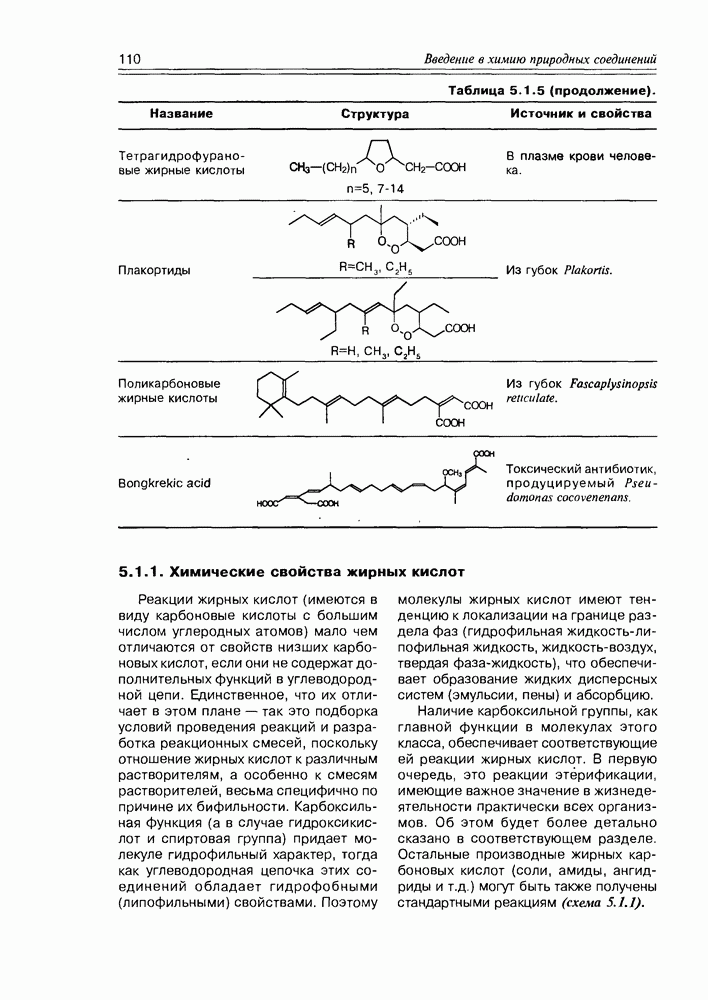
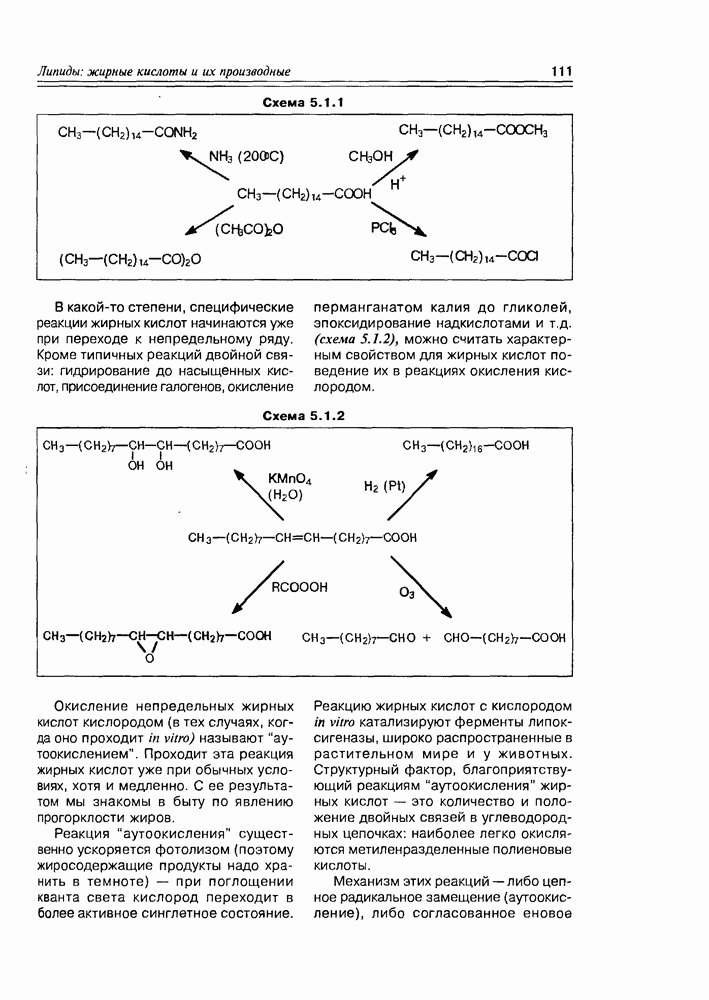
- 5.1.1. Химические свойства жирных кислот
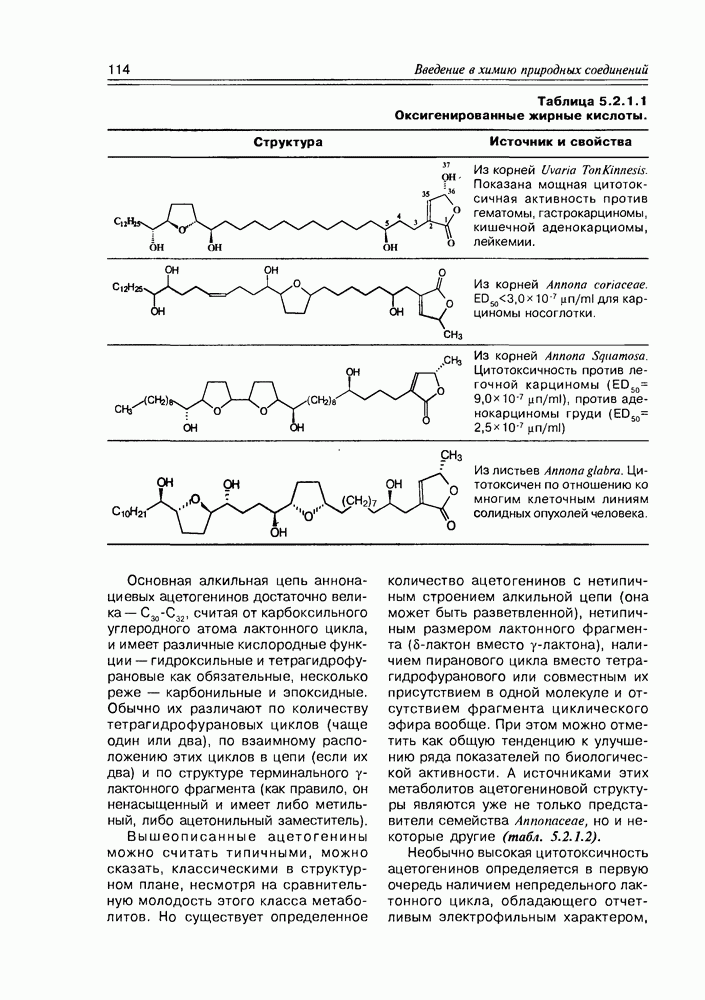
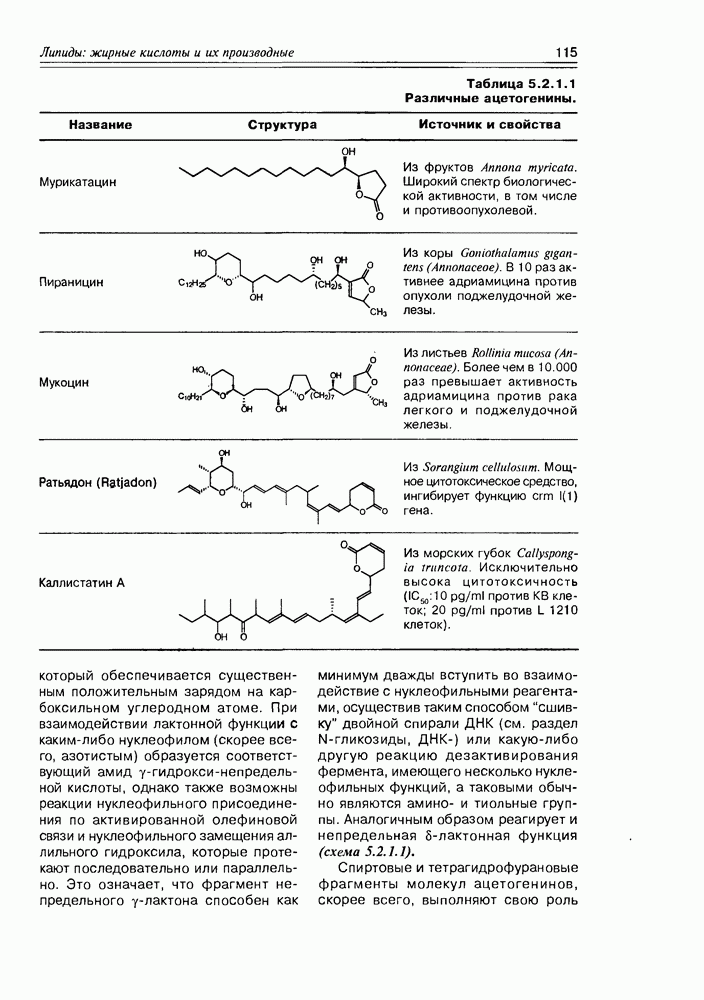
- 5.2. Метаболиты жирных кислот
- 5.2.2. Карбоциклические оксилипины
- 5.3. Жиры и жироподобные производные жирных кислот
- 5.4. Биосинтез жирных кислот и их производных
- Глава 6. ИЗОПРЕНОИДЫ-1
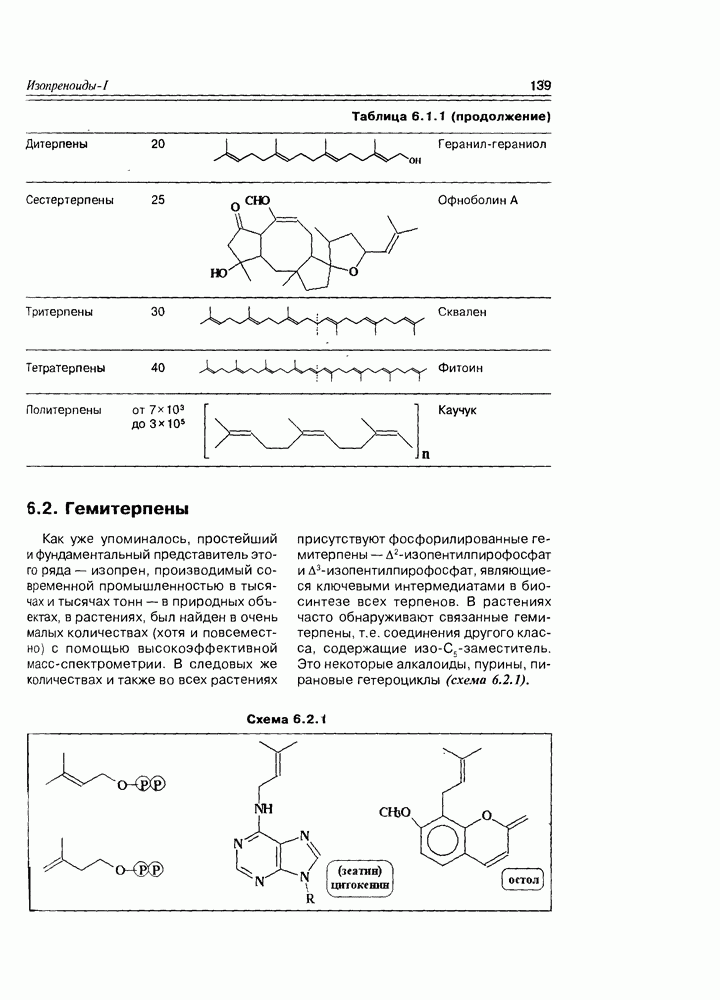
- 6.2. Гемитерпены
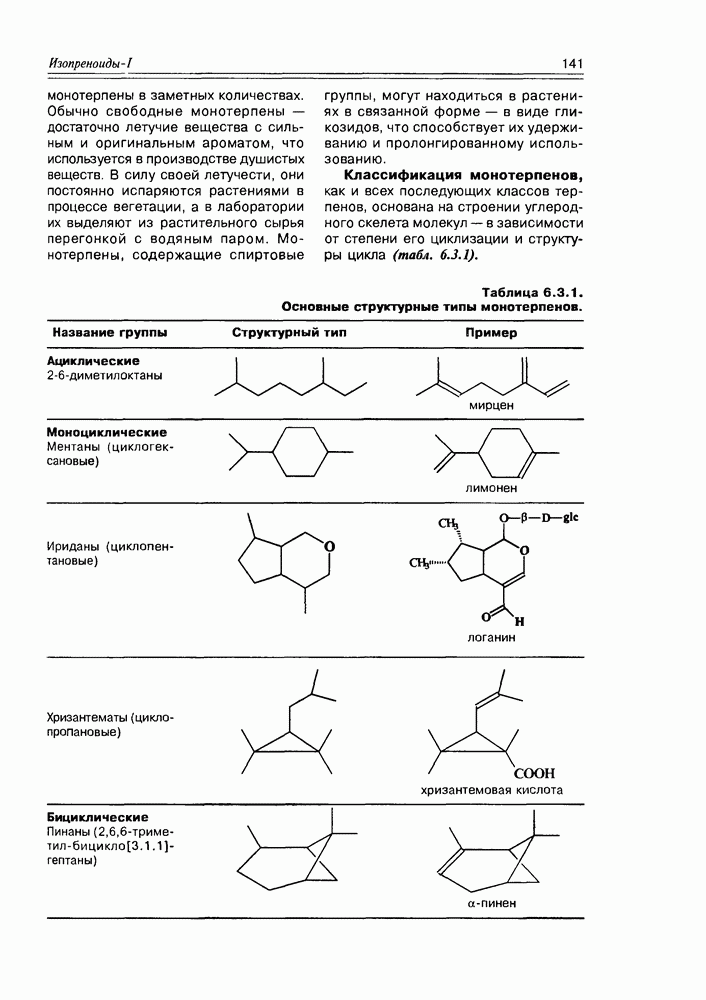
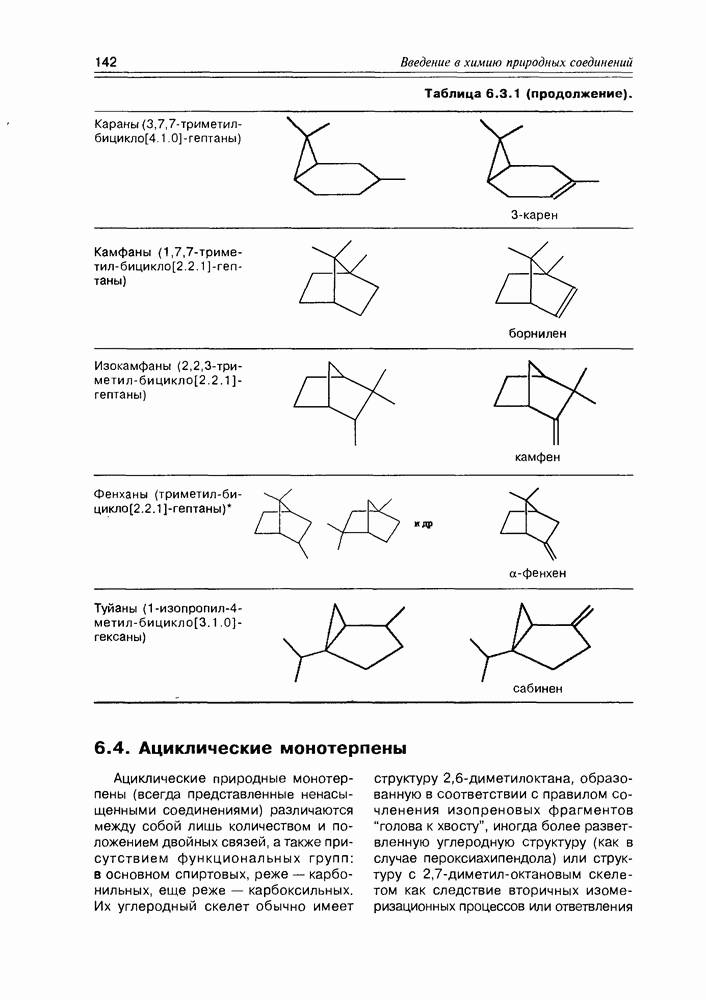
- 6.3. Монотерпены
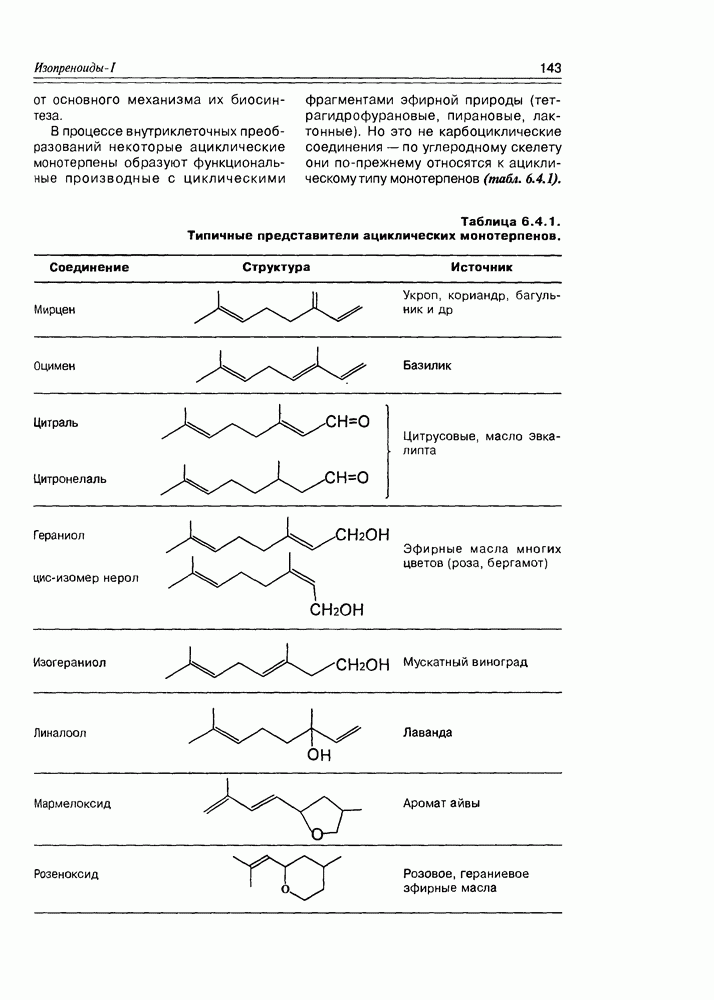
- 6.4. Ациклические монотерпены
- 6.5. Моноциклические терпены
- 6.6. Бициклические монотерпены
- 6.7. Строение и свойства монотерпенов
- 6.8. Биосинтез изопреноидов
- Глава 7. ИЗОПРЕНОИДЫ II. ОТ СЕСКВИТЕРПЕНОВ ДО ПОЛИТЕРПЕНОВ
- 7.2. Химические свойства сесквитерпенов
- 7.3. Дитерпены и сестертерпены
- 7.4. Тритерпеноиды и стероиды
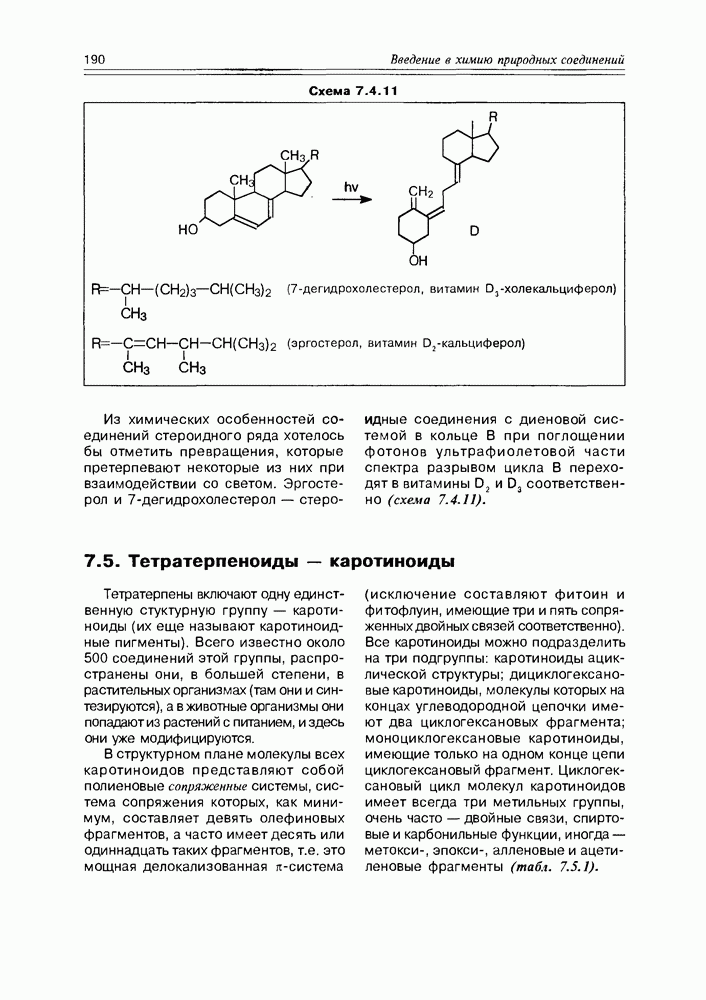
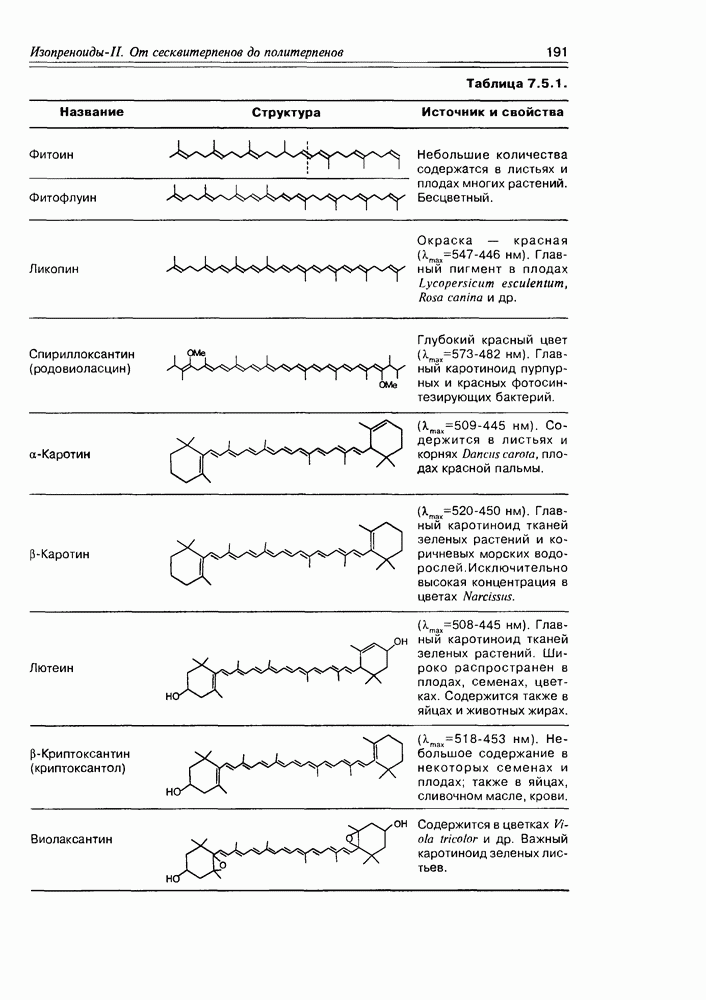
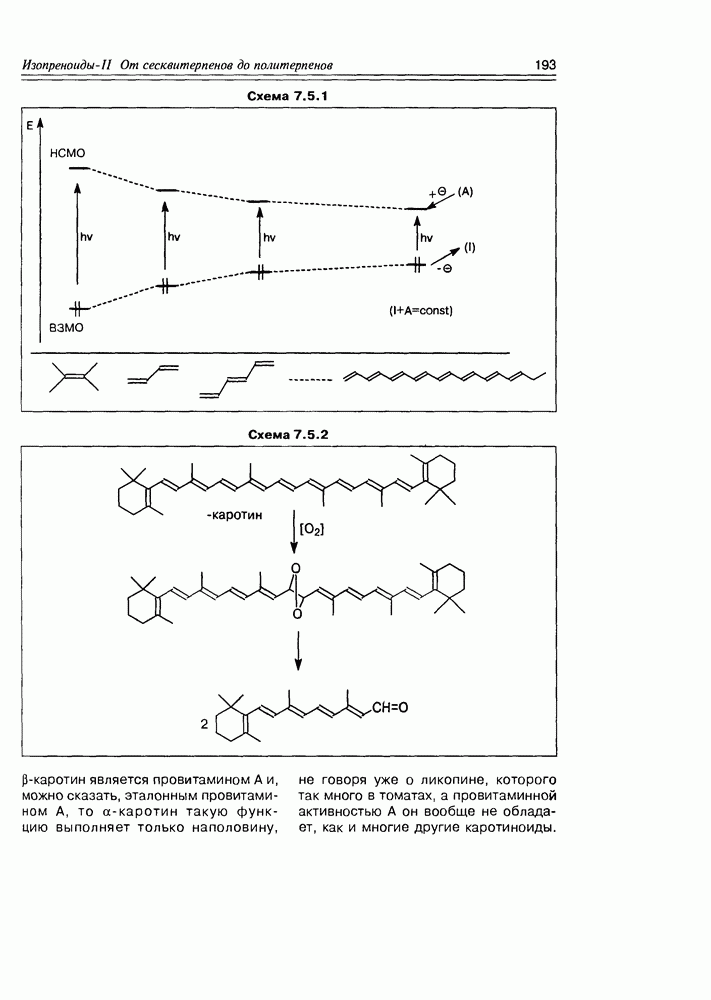
- 7.5. Тетратерпеноиды — каротиноиды
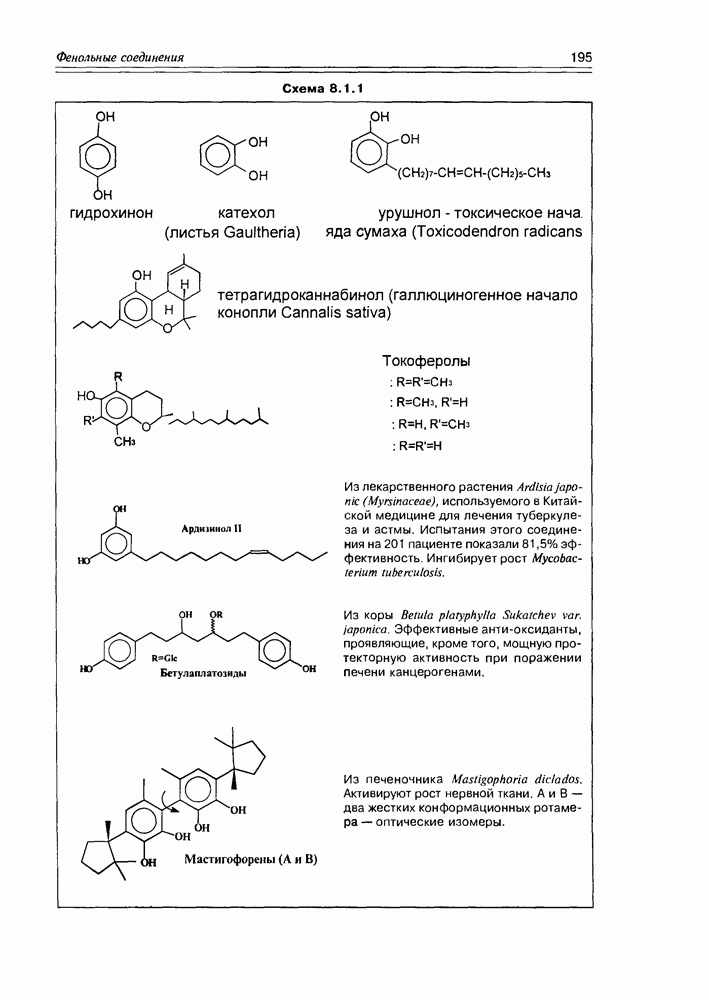
- Глава 8. ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ
- 8.2. Пираны
- 8.4. Биосинтез фенольных соединений
- Глава 9. АЛКАЛОИДЫ И ПОРФИРИНЫ
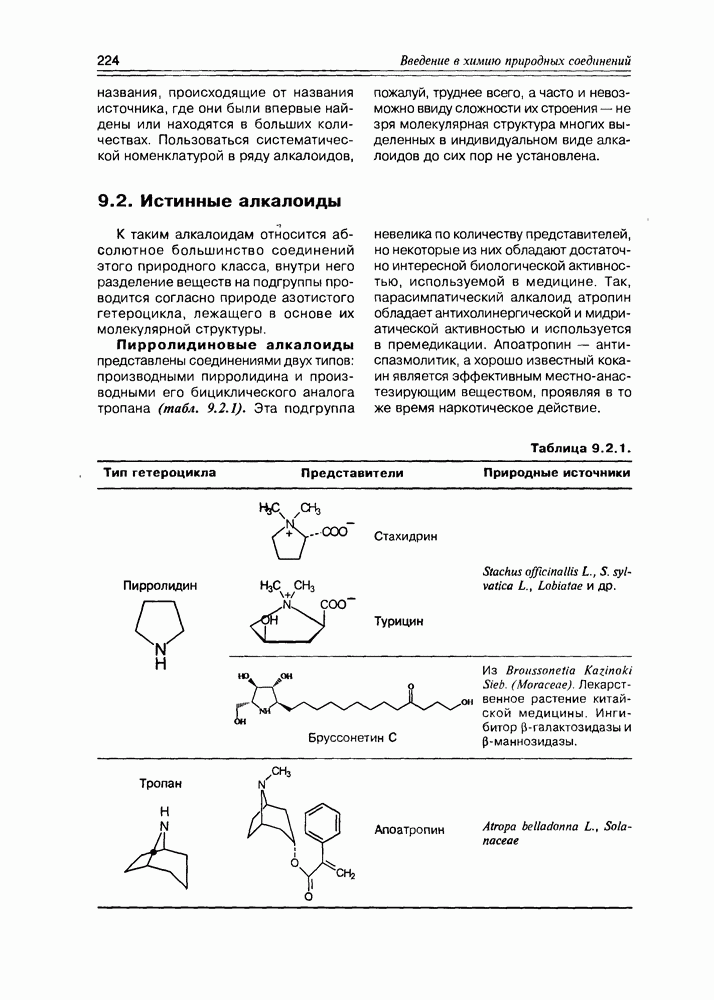
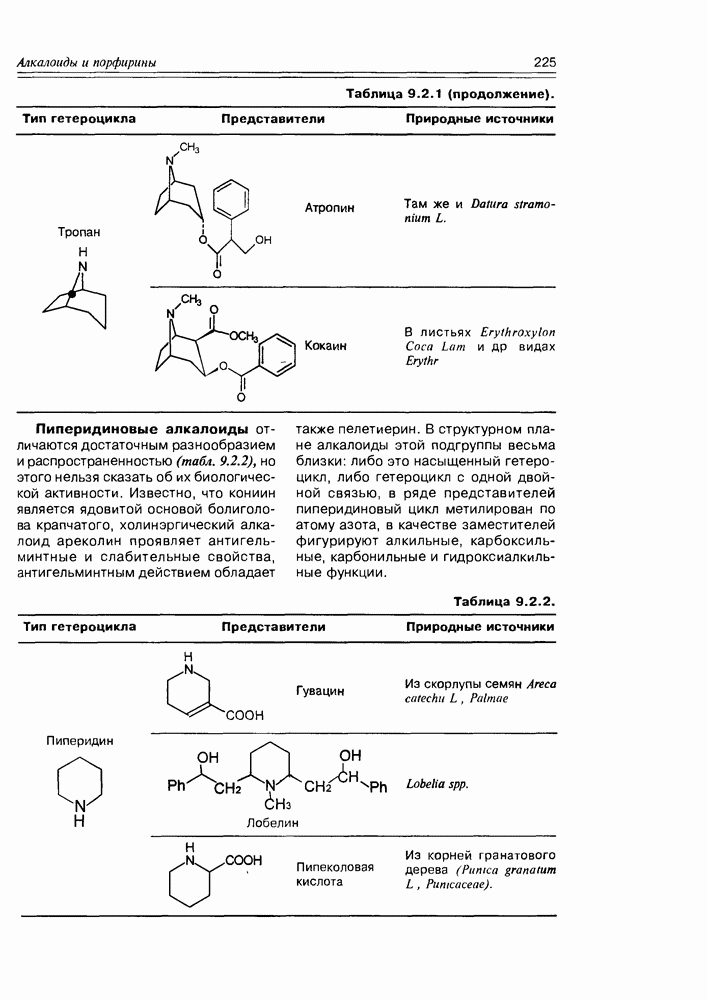
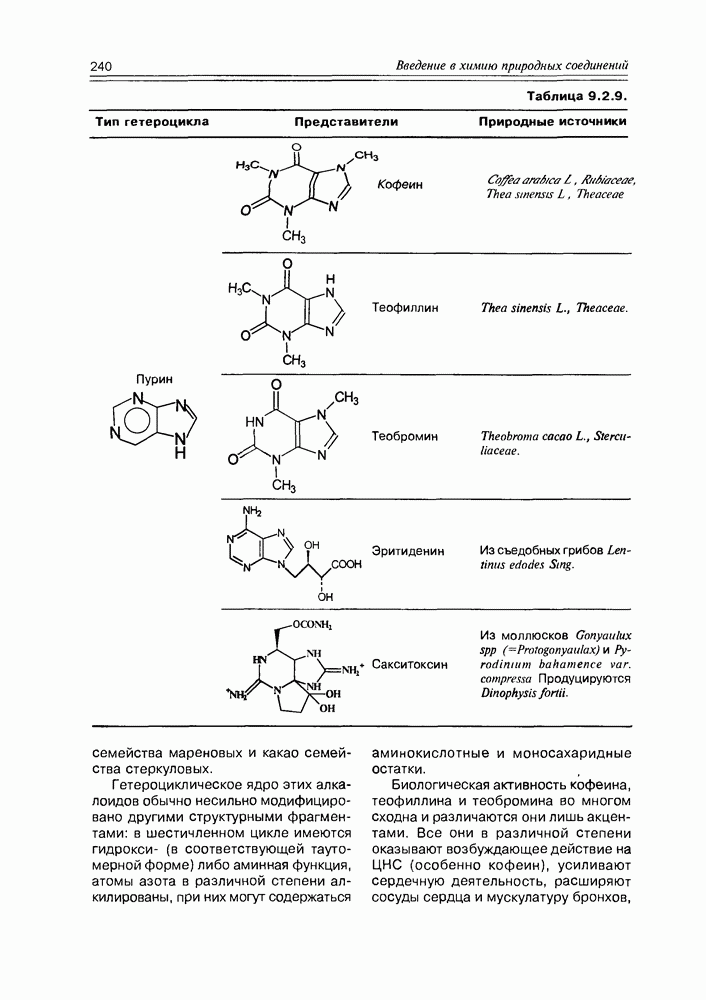
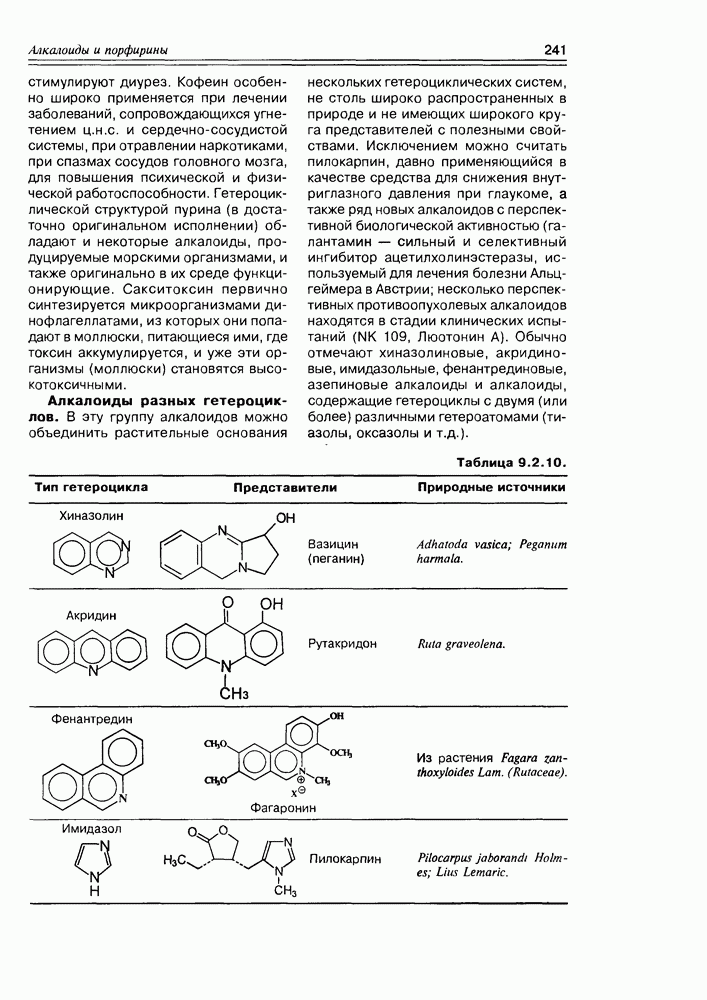
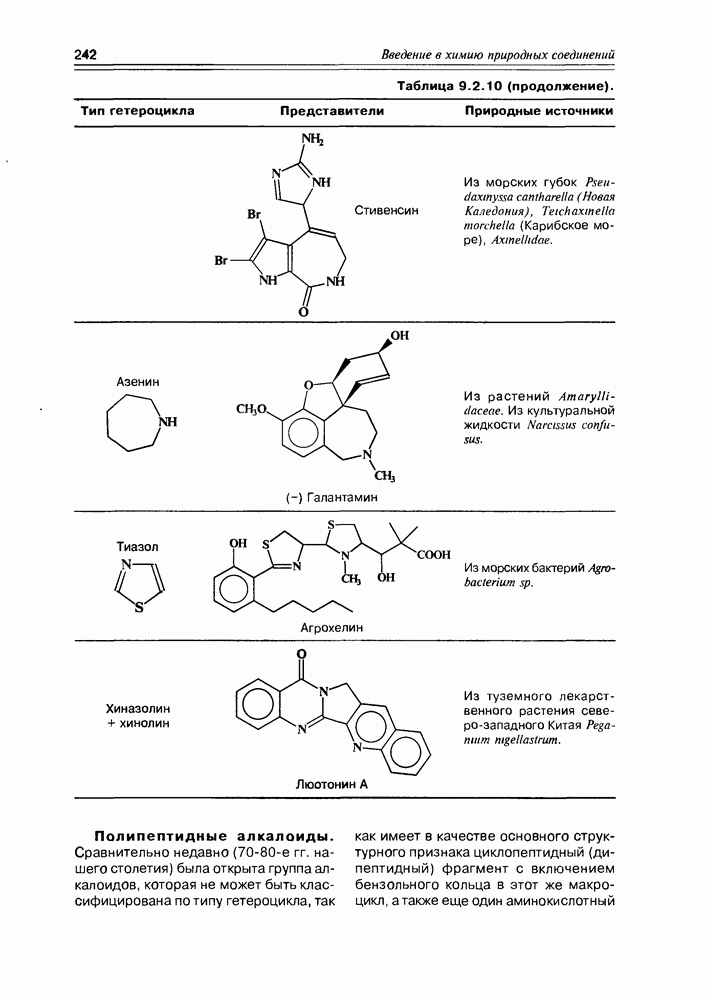
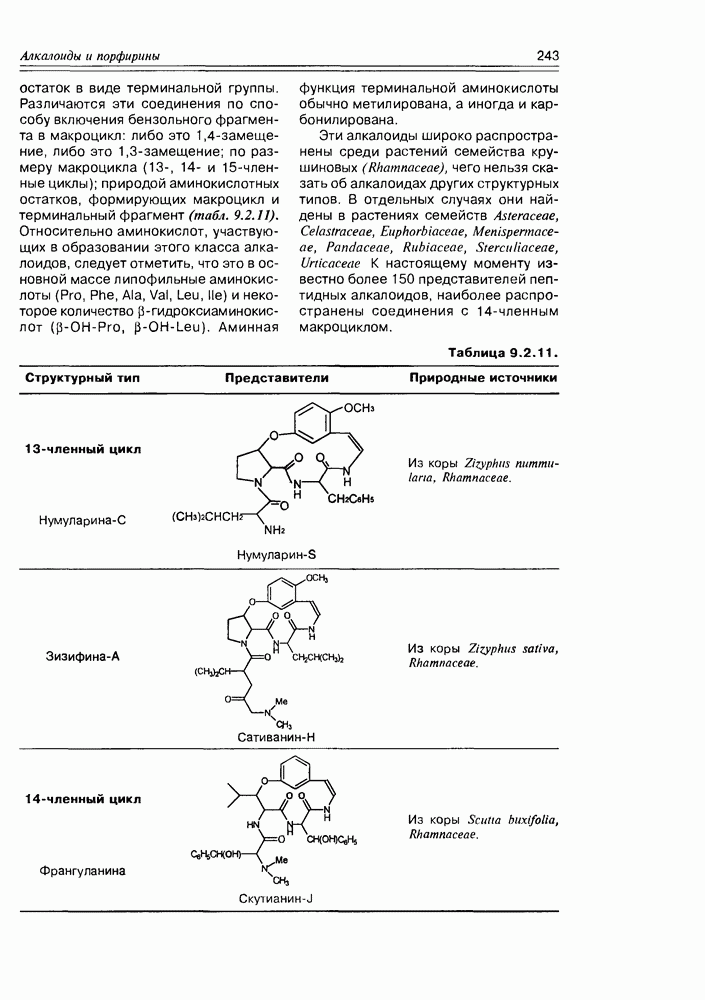
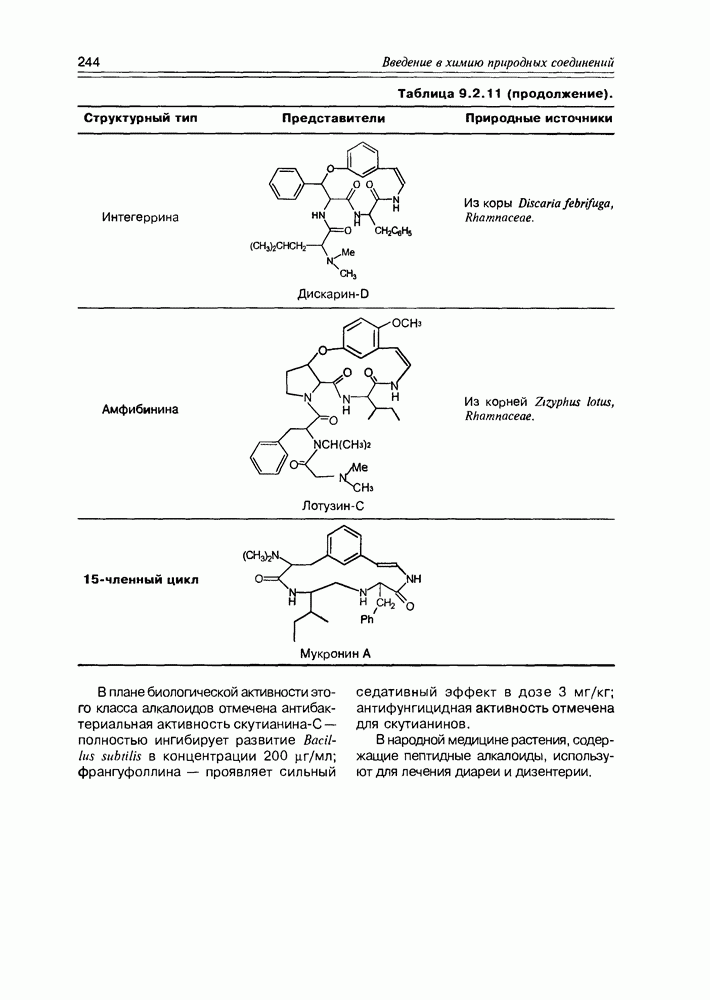
- 9.2. Истинные алкалоиды
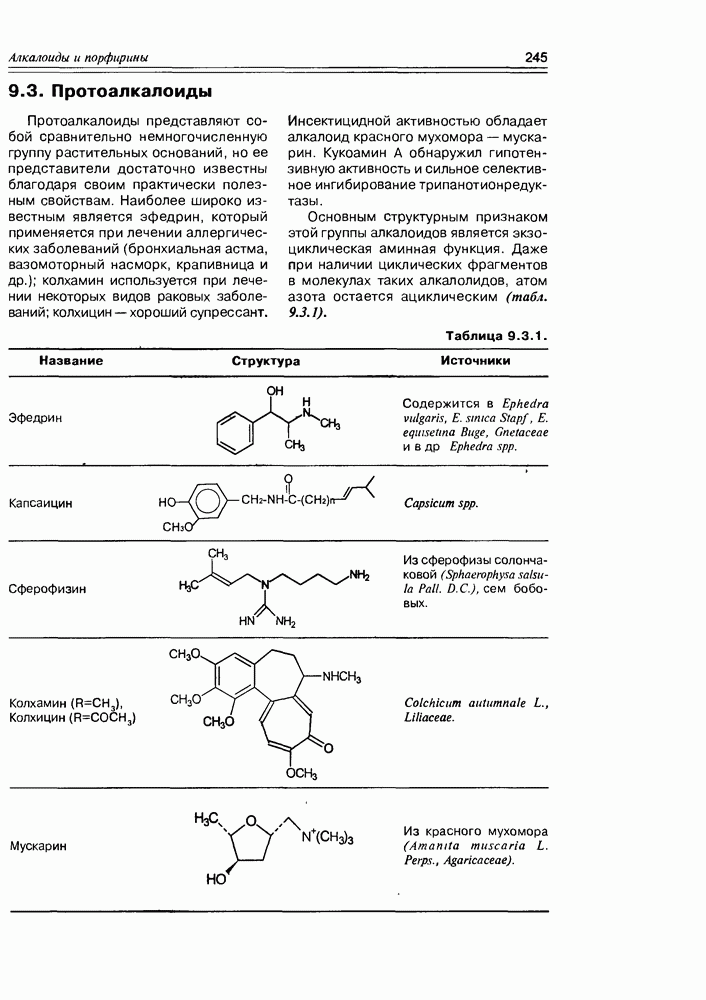
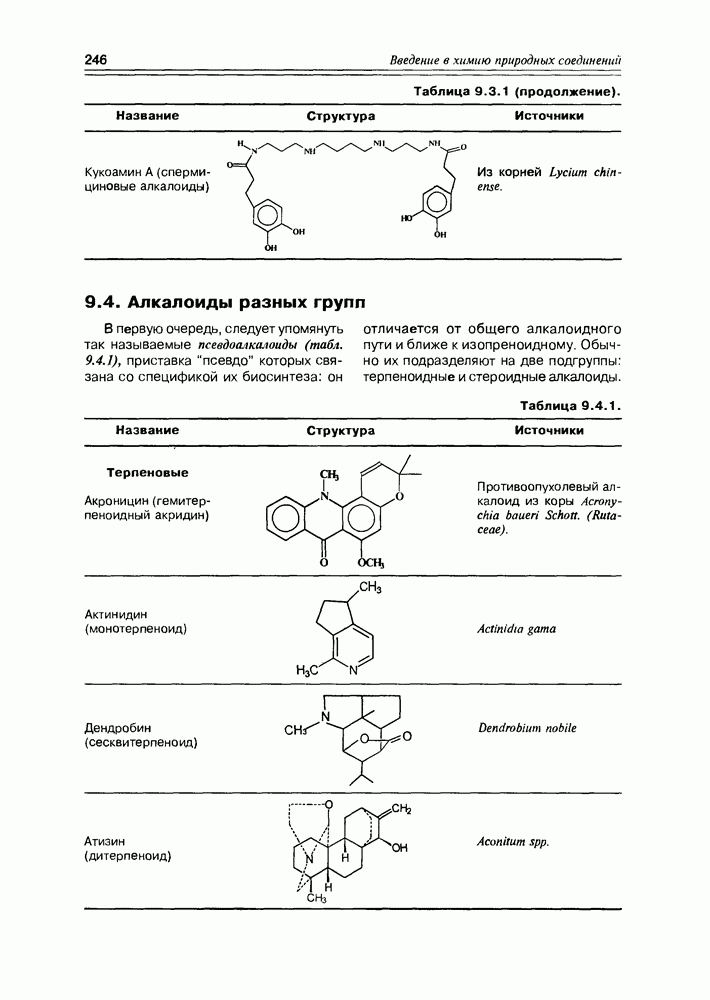
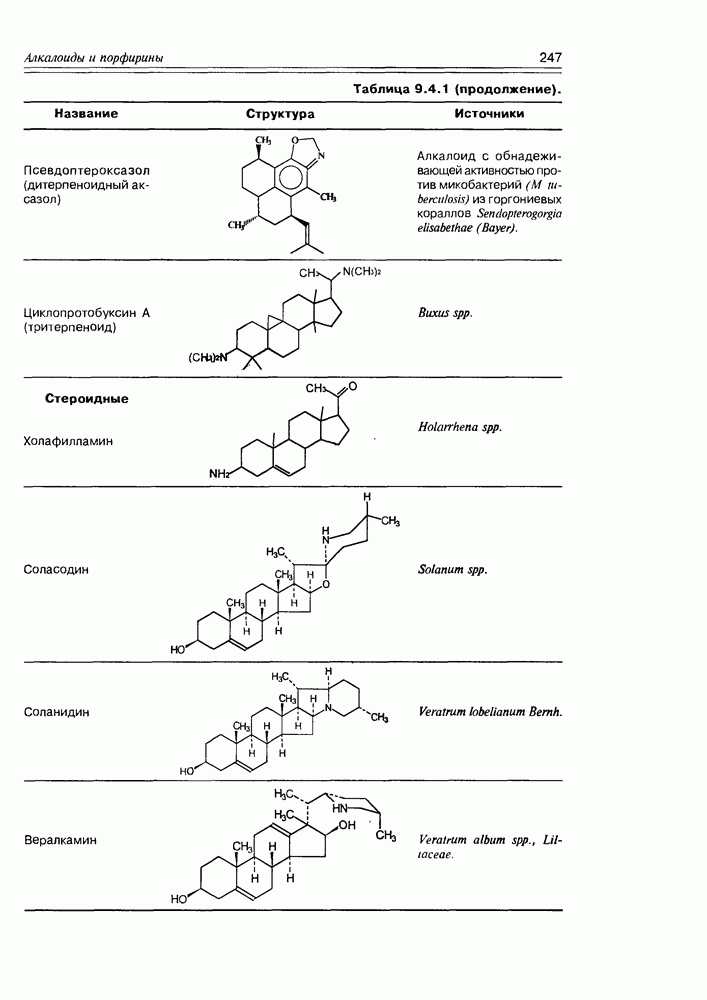
- 9.3. Протоалкалоиды
- 9.5. Химические свойства и химические модификации алкалоидов
- 9.6. Аминокислоты и биосинтез алкалоидов
- 9.7. Порфирины
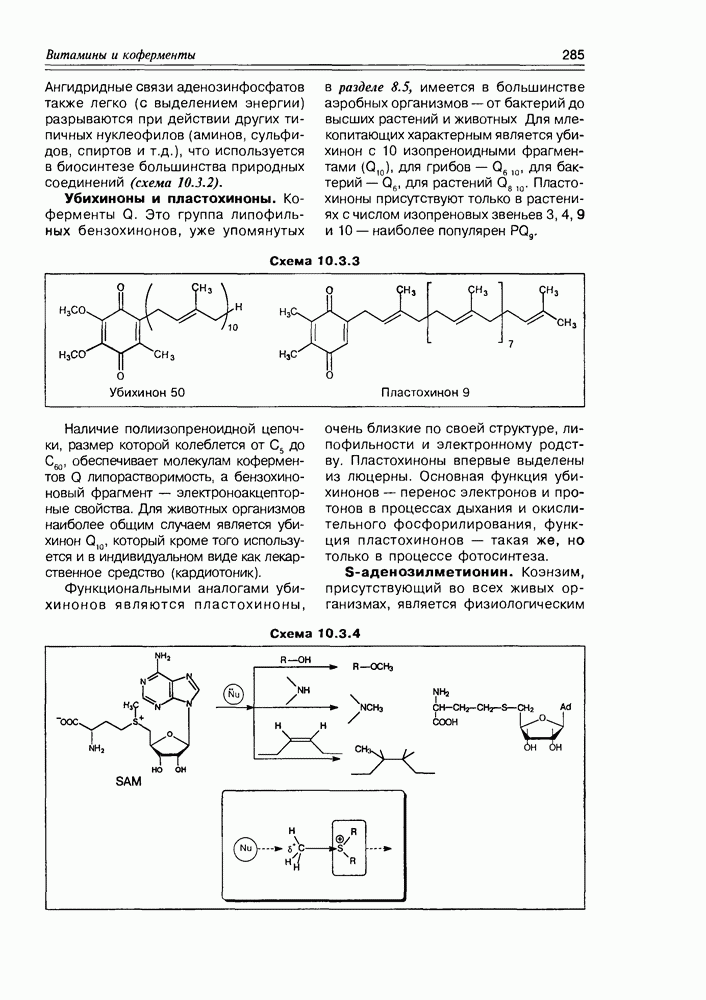
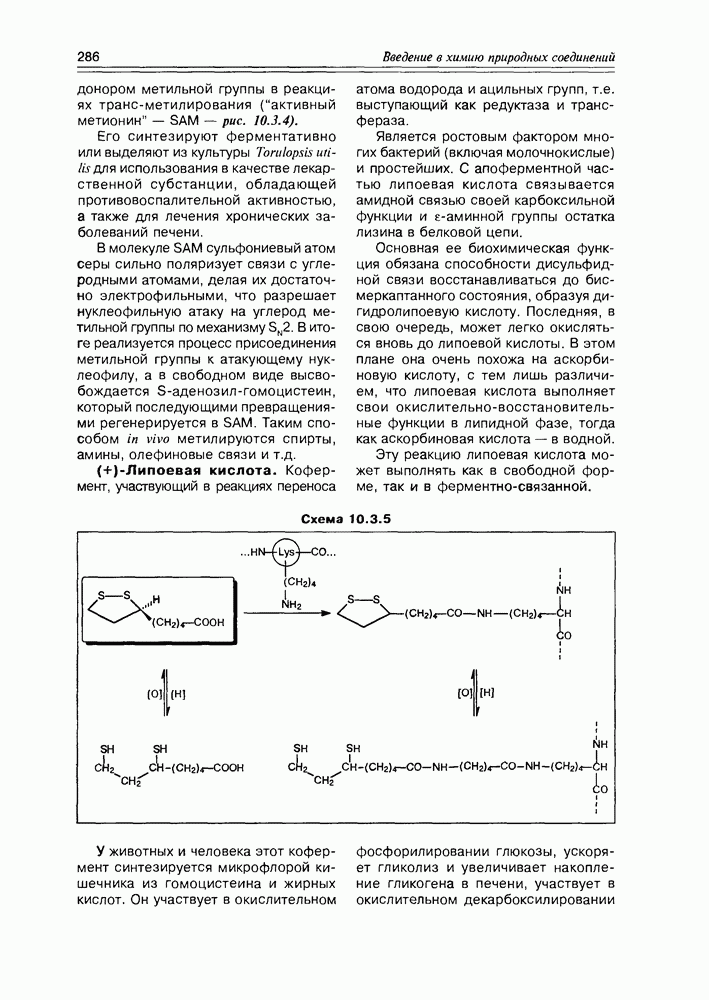
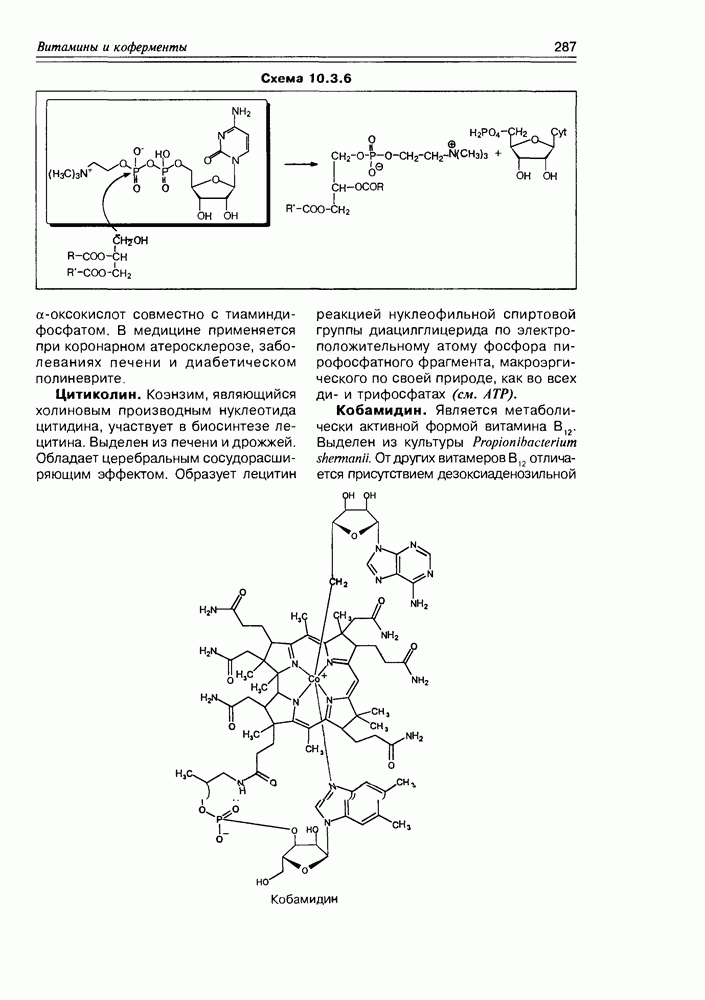
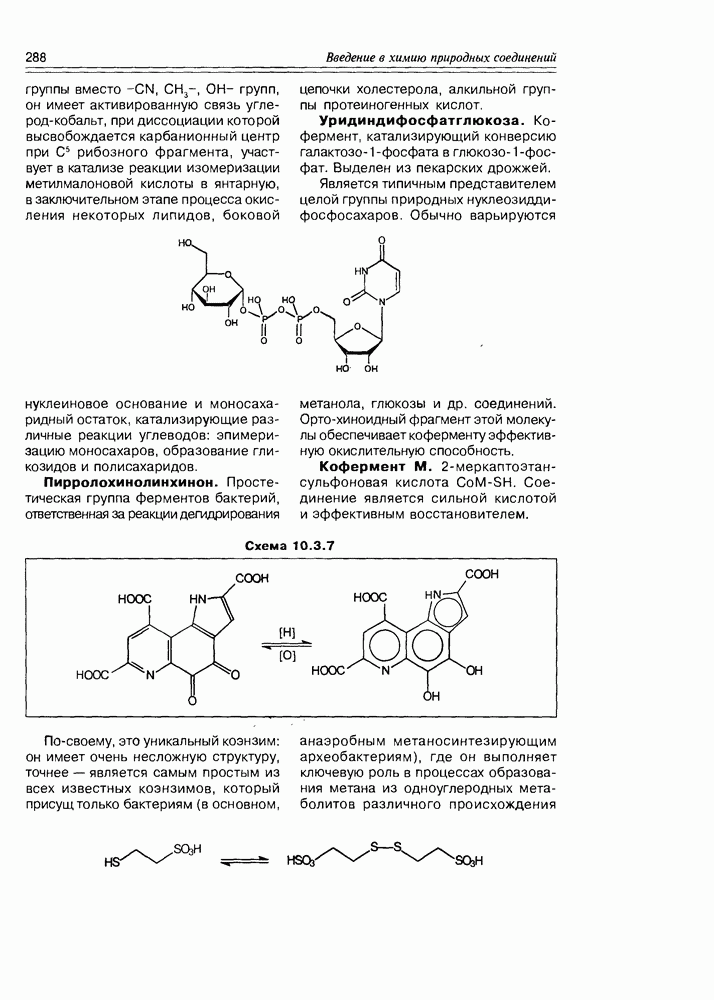
- Глава 10. ВИТАМИНЫ И КОФЕРМЕНТЫ
- 10.1. Витамины — собственно
- 10.2. Витамины-коферменты
- 10.3. Коферменты
- Глава 11. АНТИБИОТИКИ
- 11.1. b-Лактамные антибиотики
- 11.2. Тетраценовые антибиотики
- 11.3. Аминогликозидные антибиотики
- 11.4. Пептидные антибиотики
- 11.5. Макролидные антибиотики
- 11.6. Полиэфирные антибиотики
- 11.7. Антибиотики разные
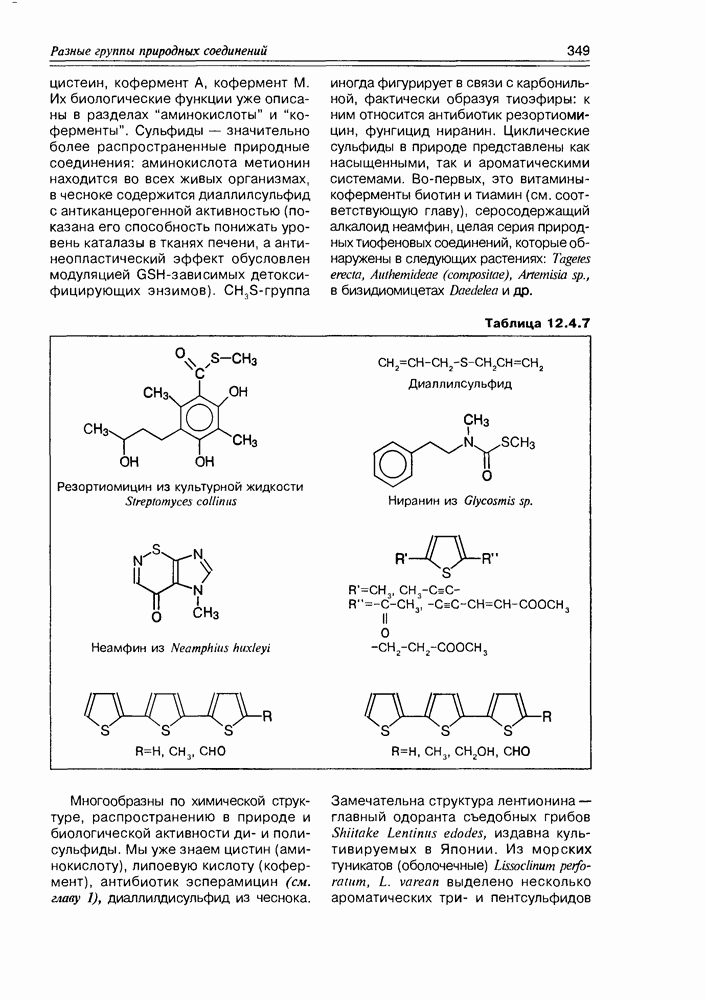
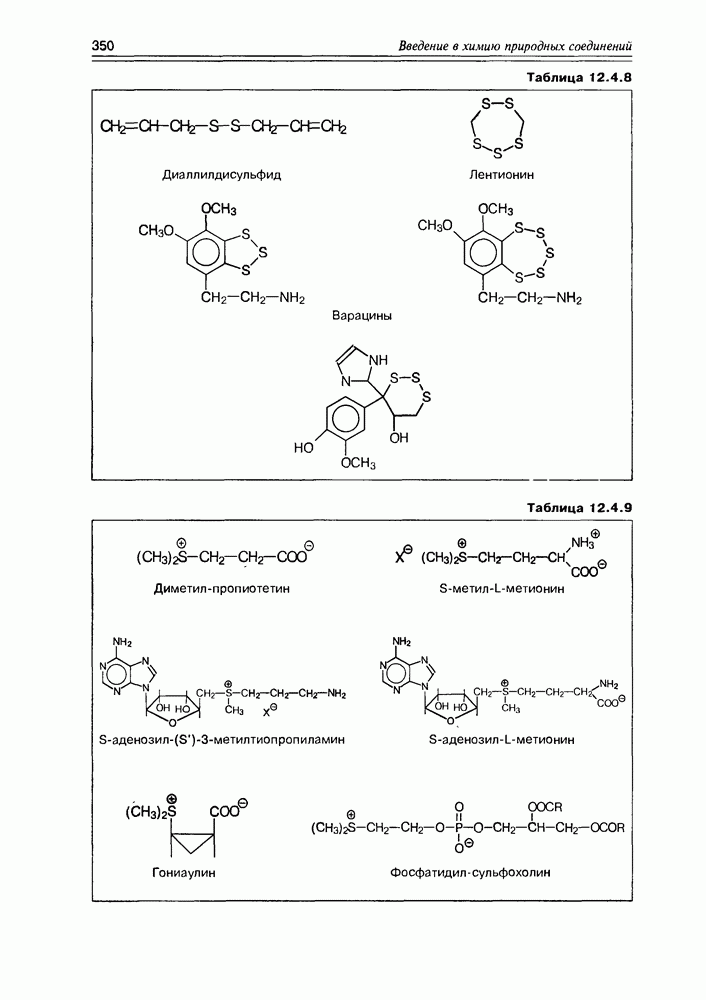
- Глава 12. РАЗНЫЕ ГРУППЫ ПРИРОДНЫХ СОЕДИНЕНИЙ
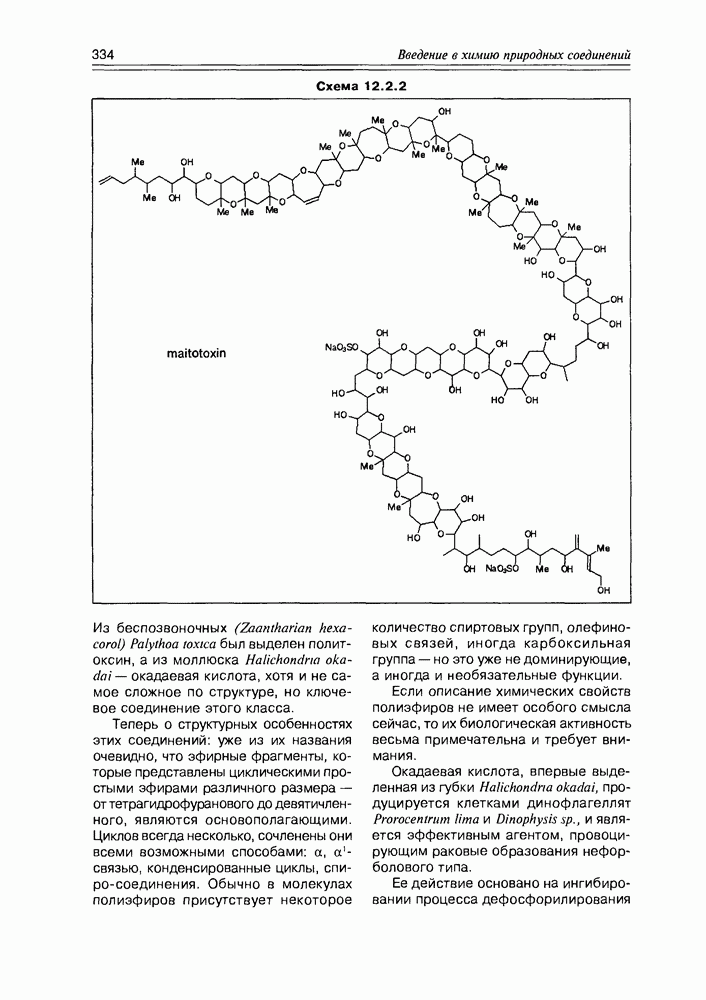
- 12.2. Полиэфиры
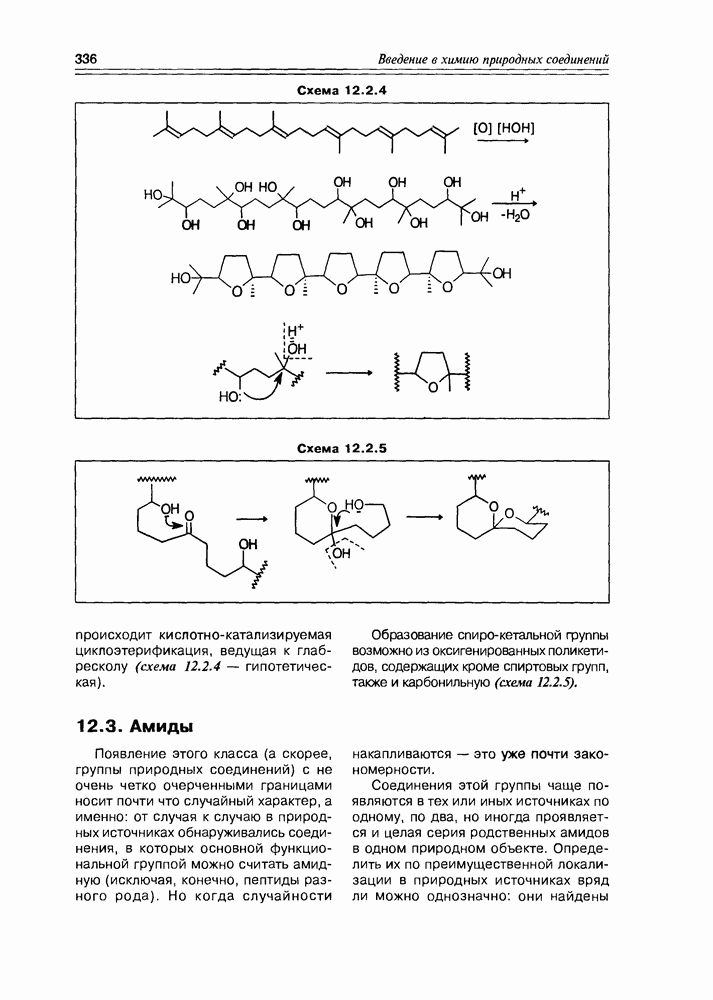
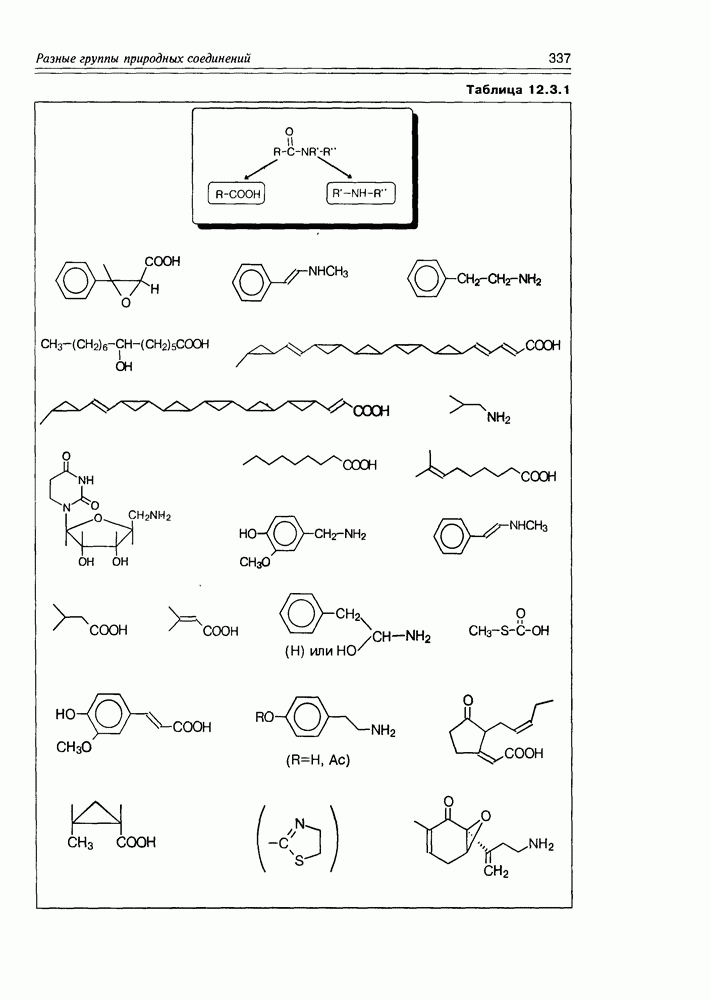
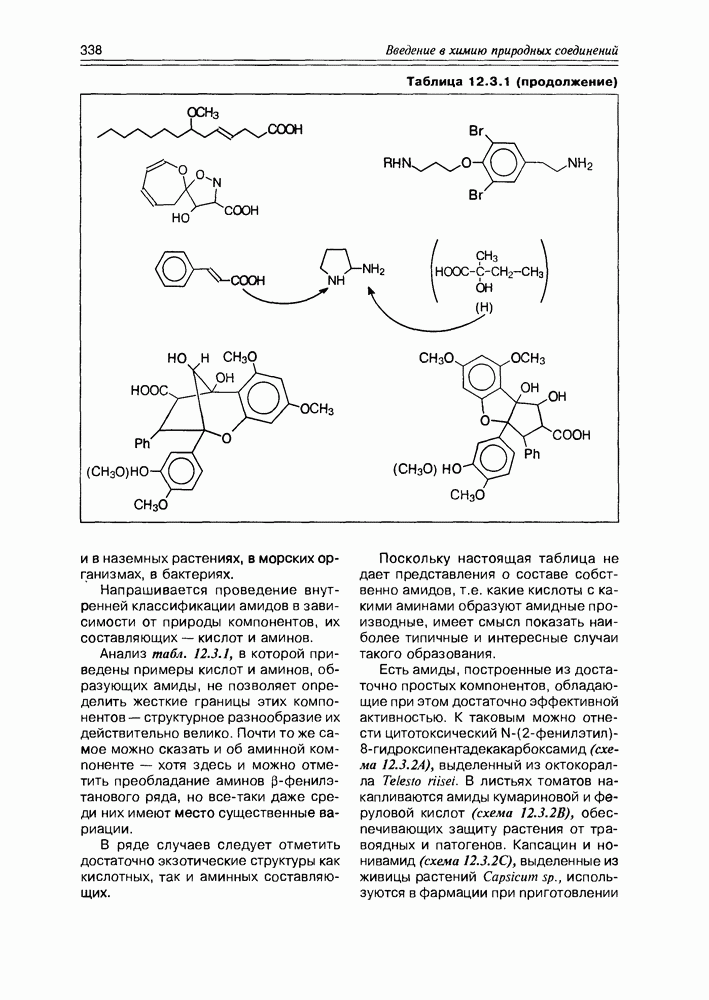
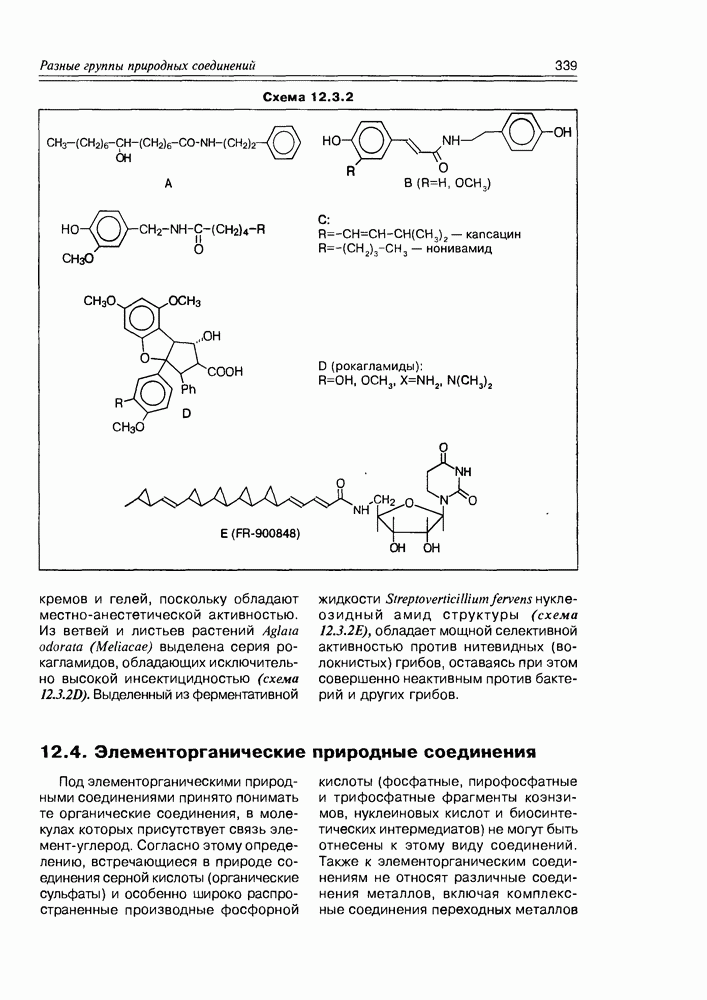
- 12.3. Амиды
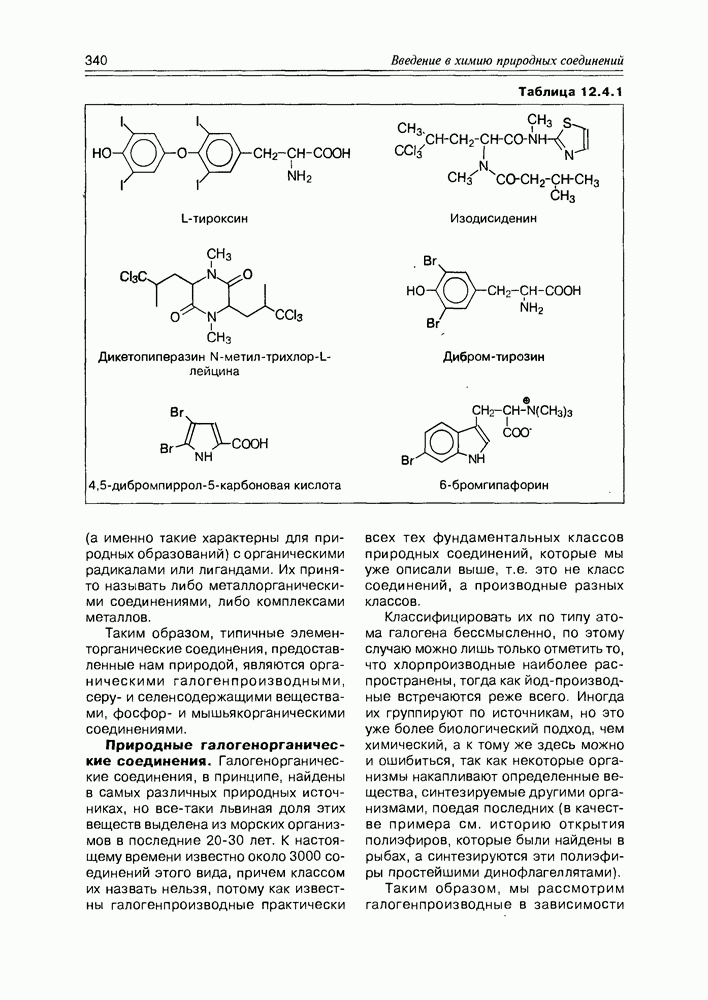
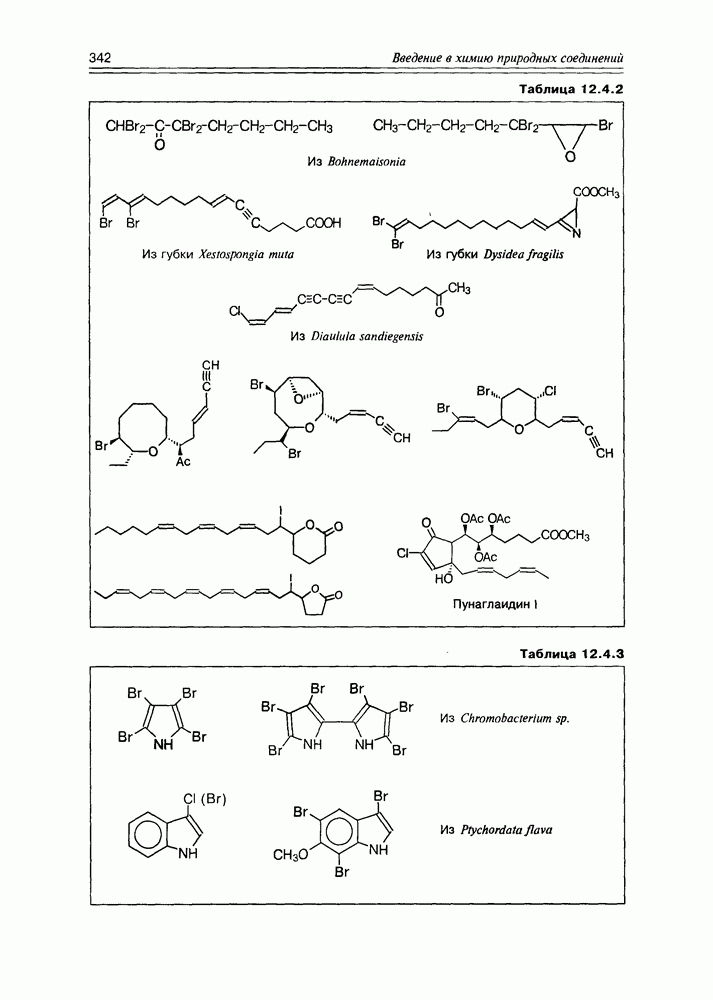
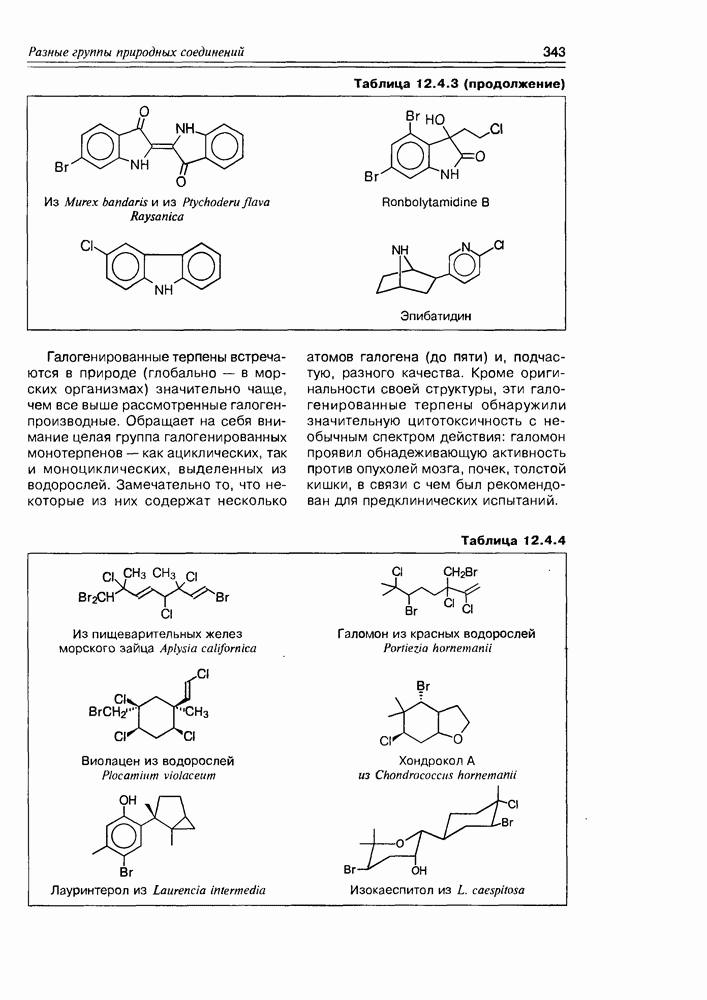
- 12.4. Элементорганические природные соединения
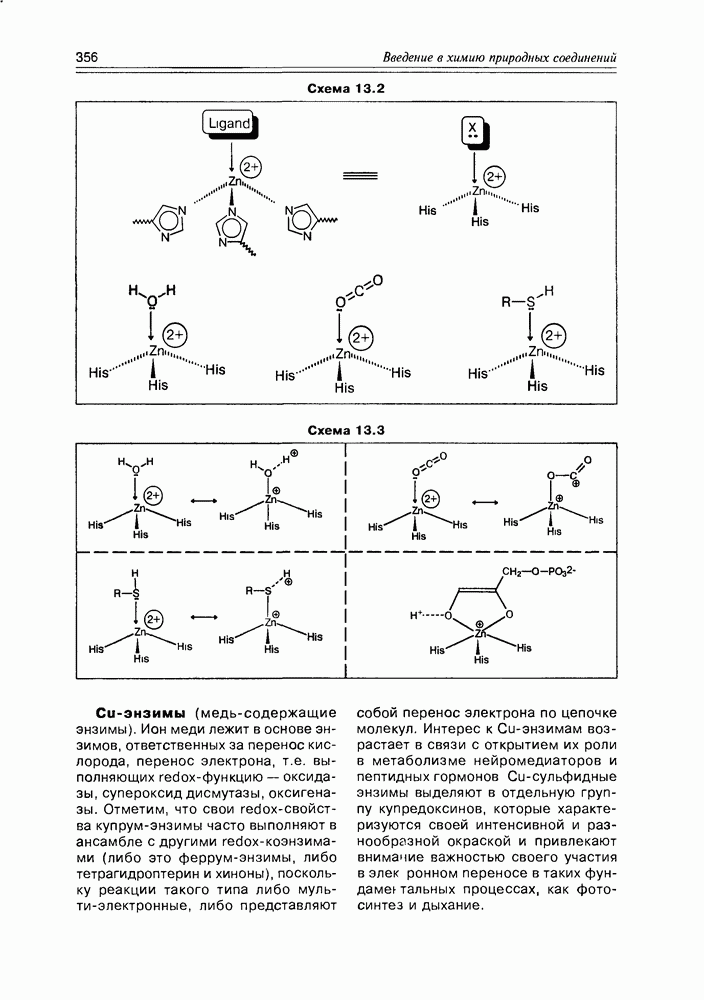
- Глава 13. МЕТАЛЛО-КОЭНЗИМЫ