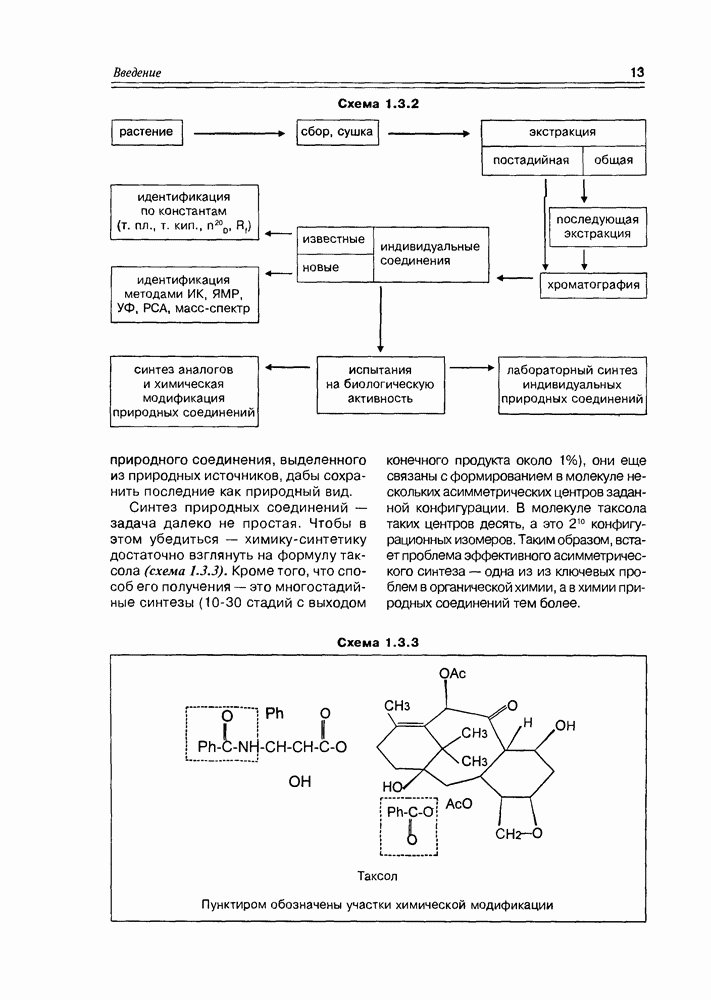
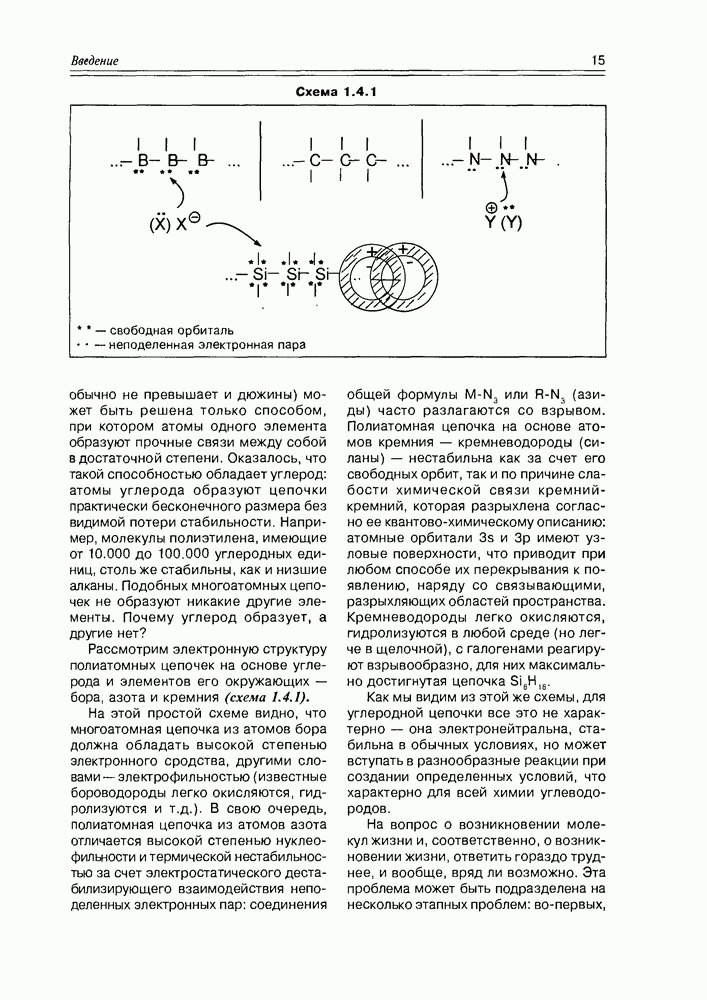
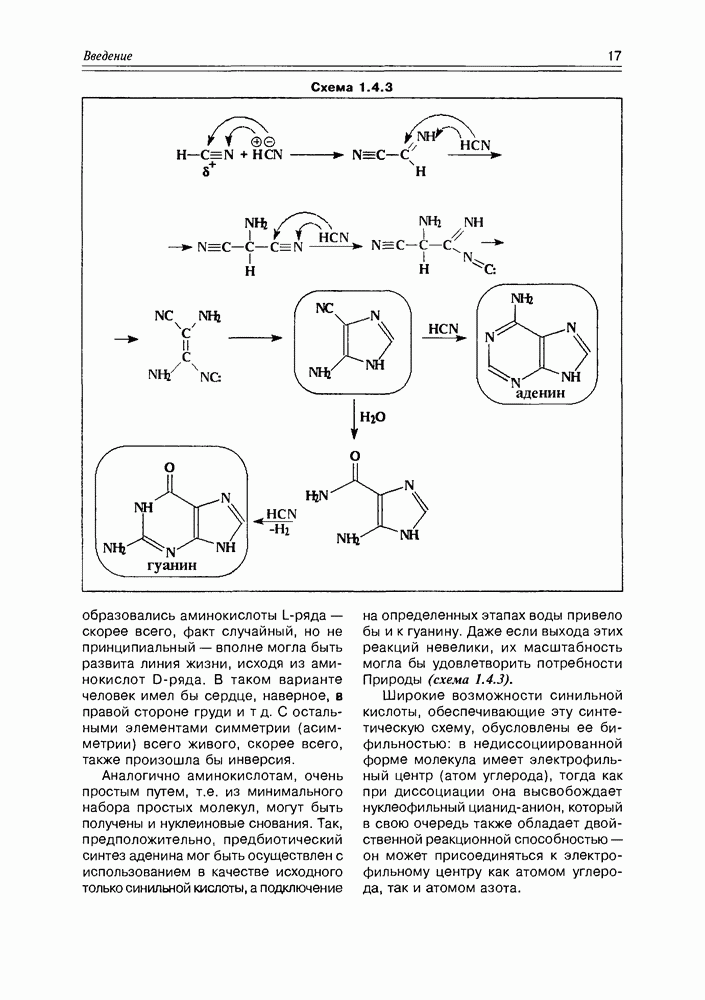
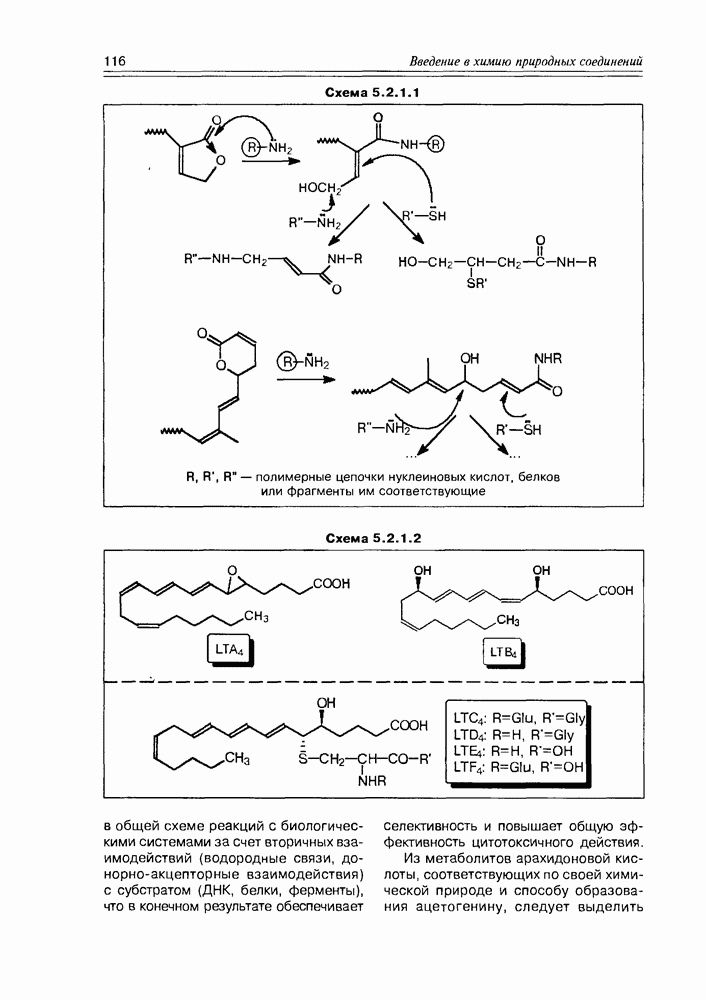
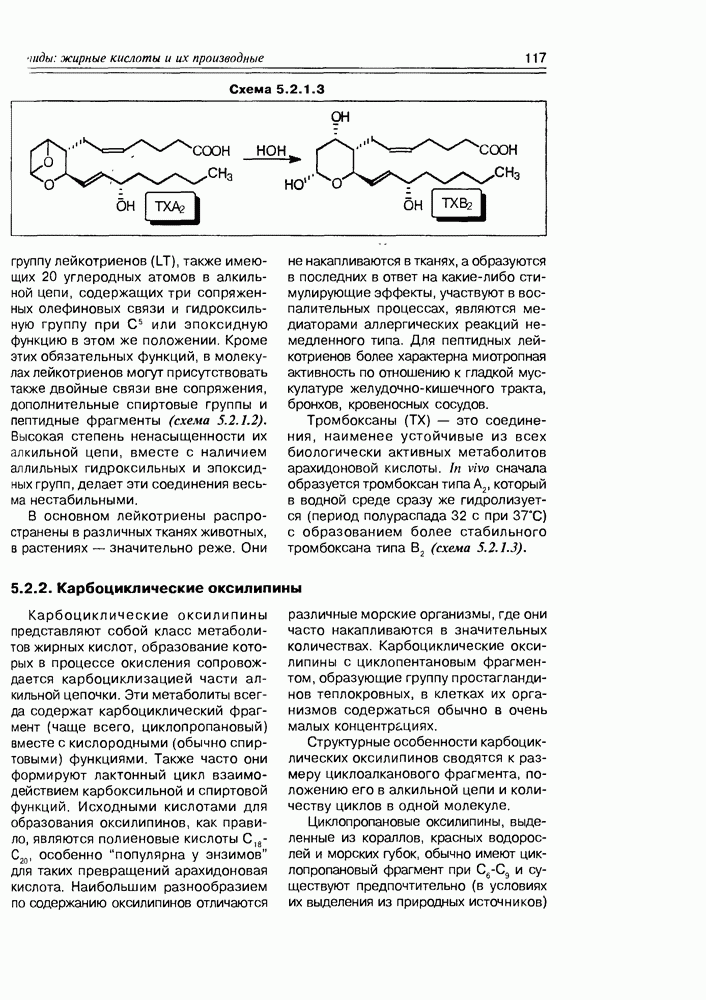
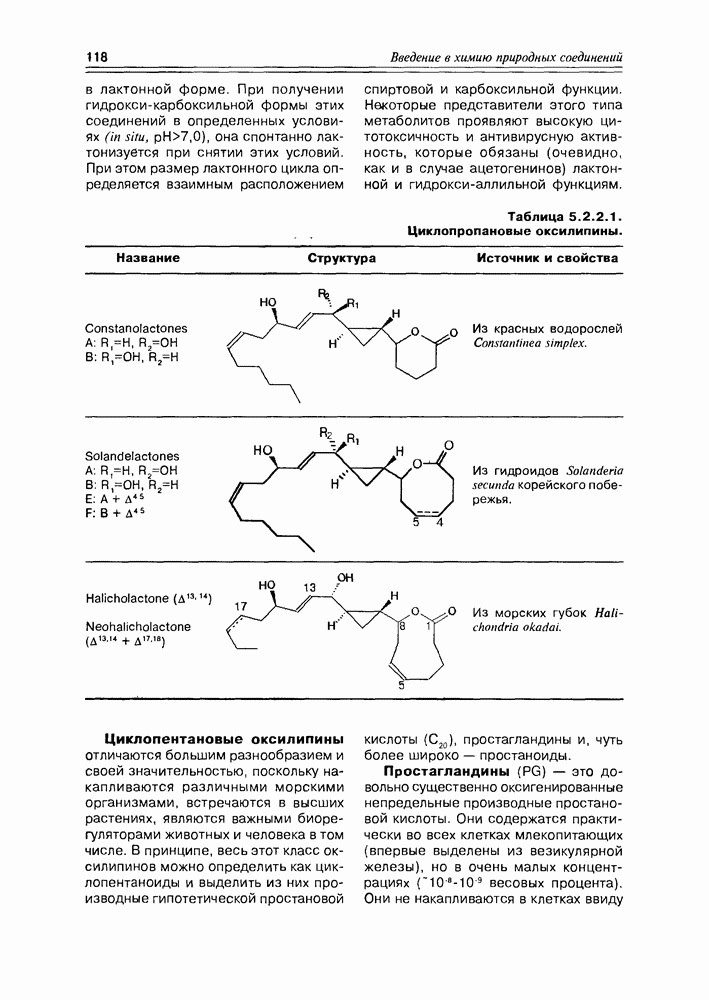
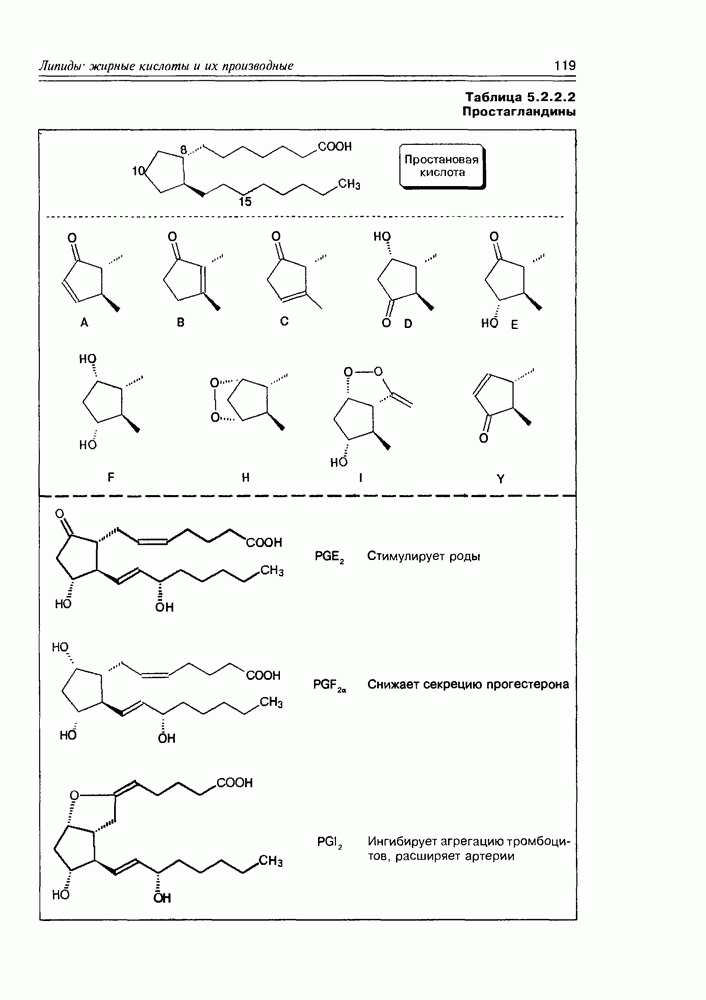
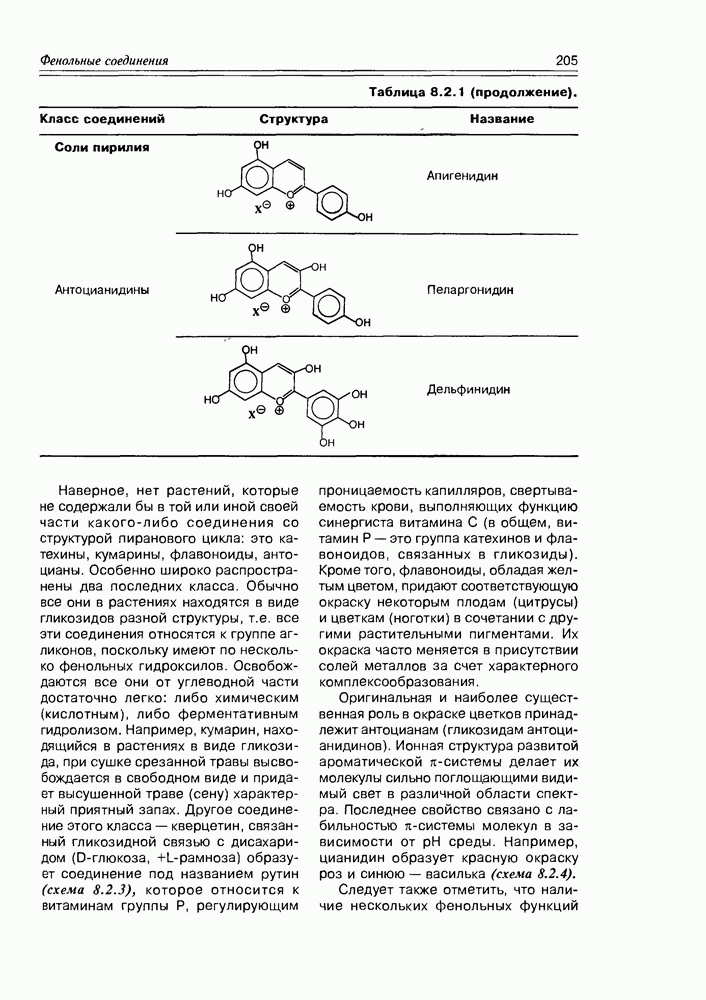
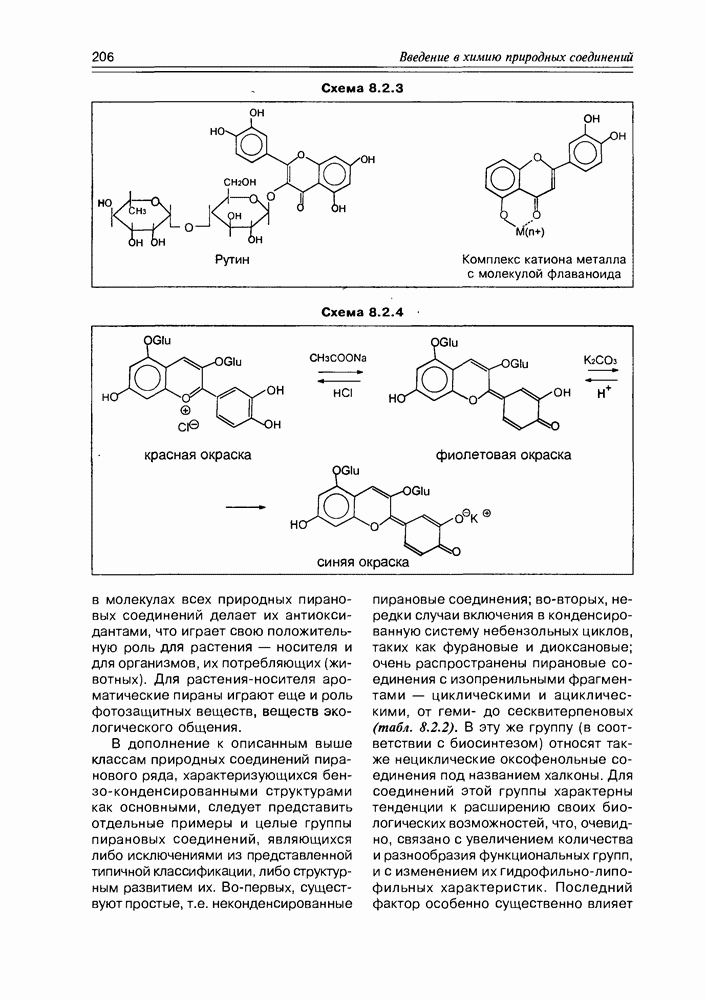
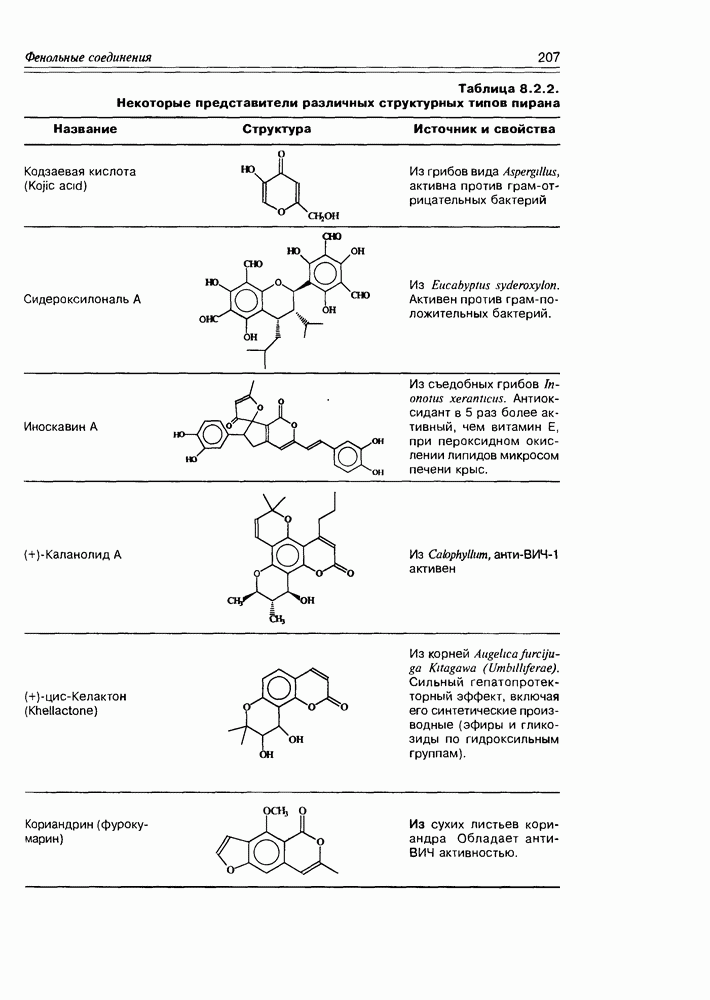
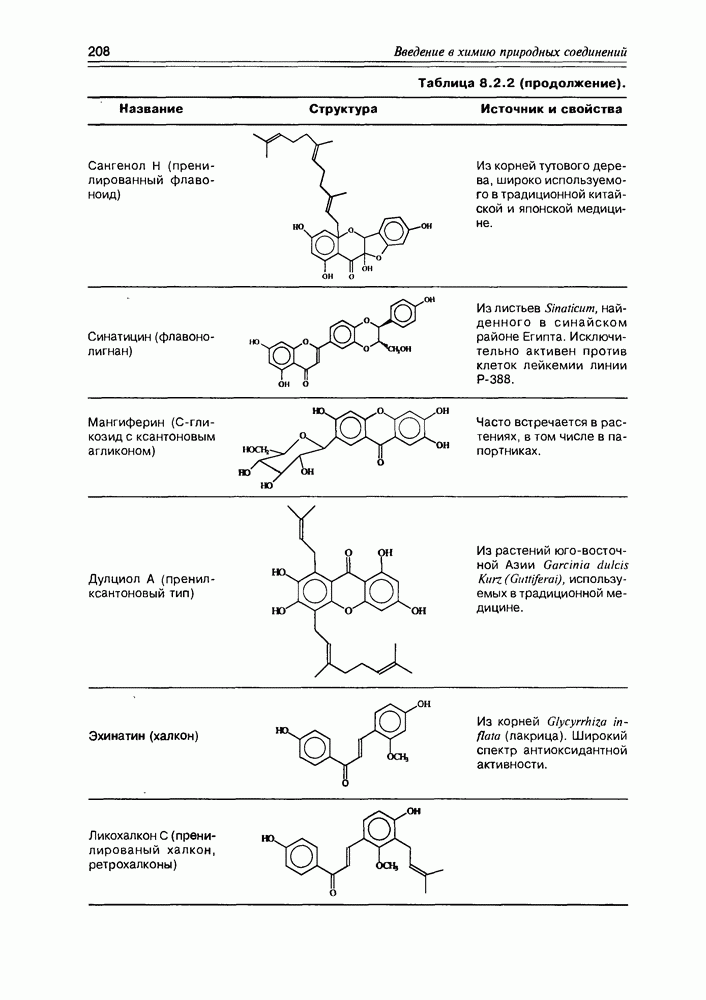
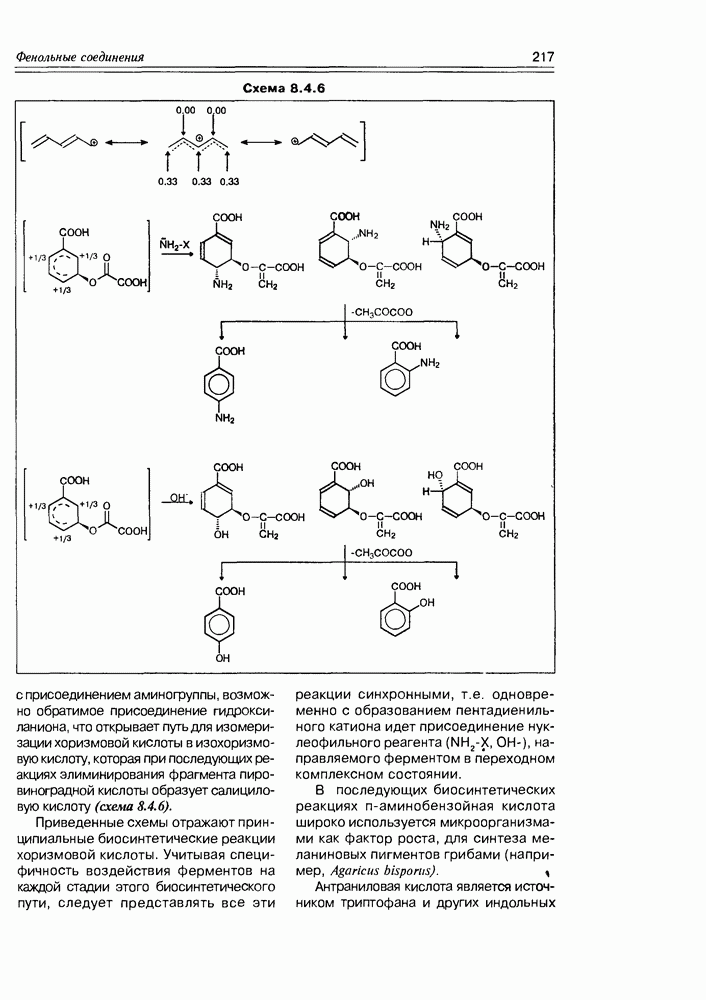
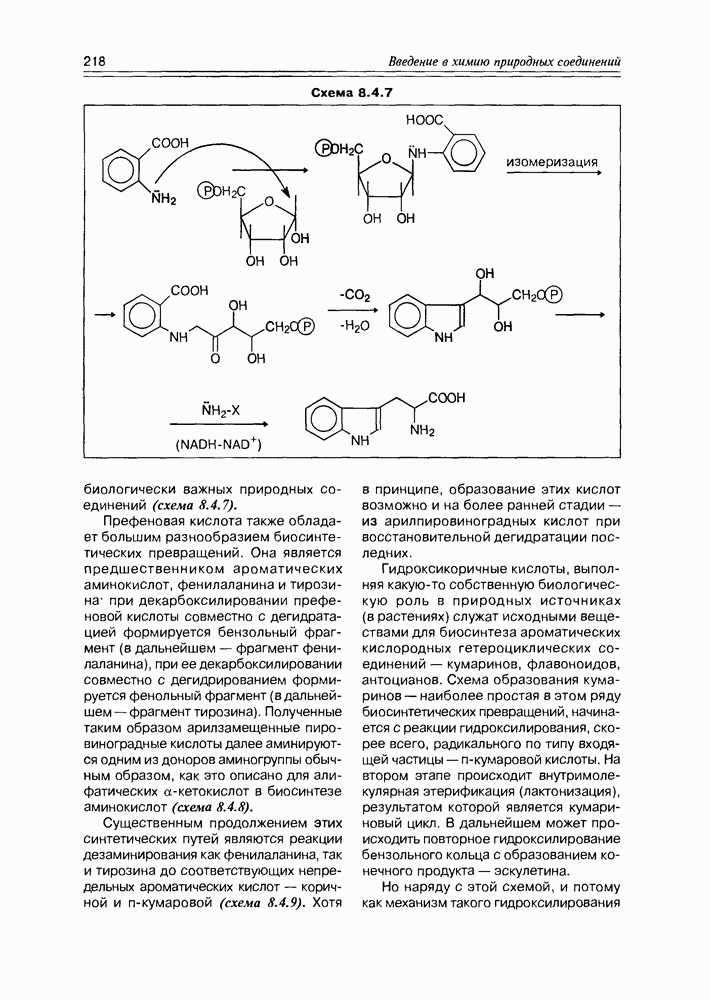
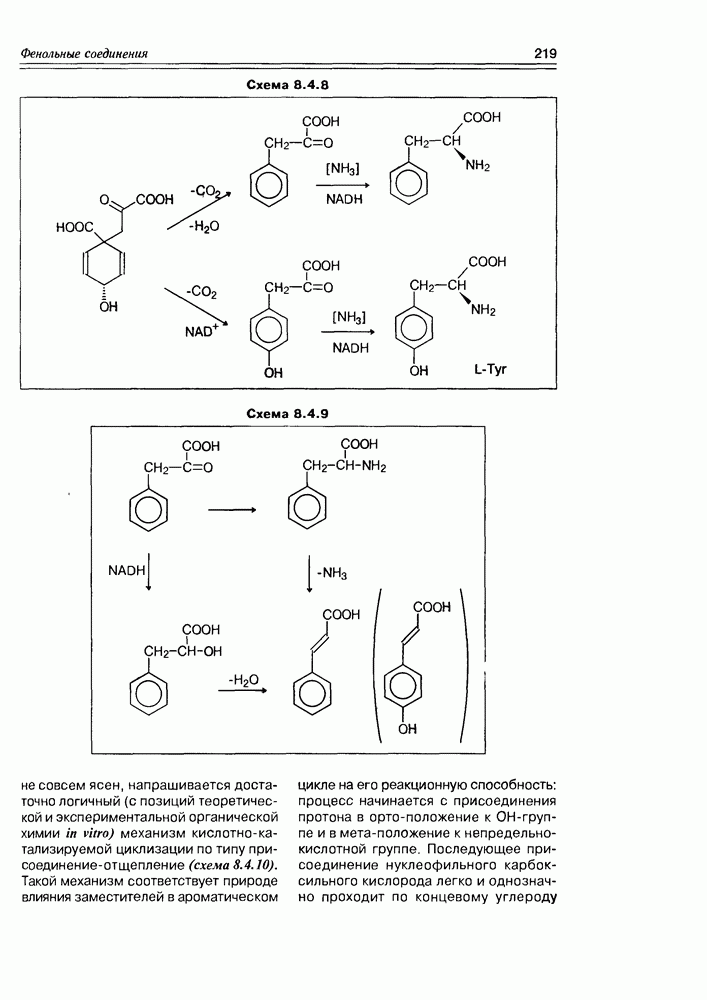
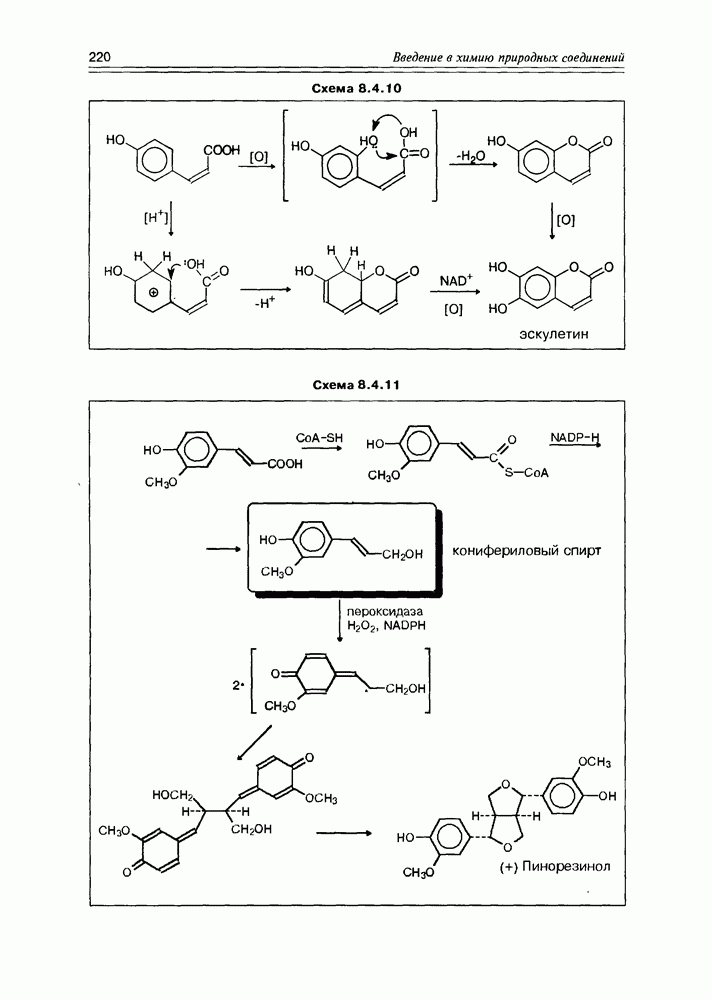
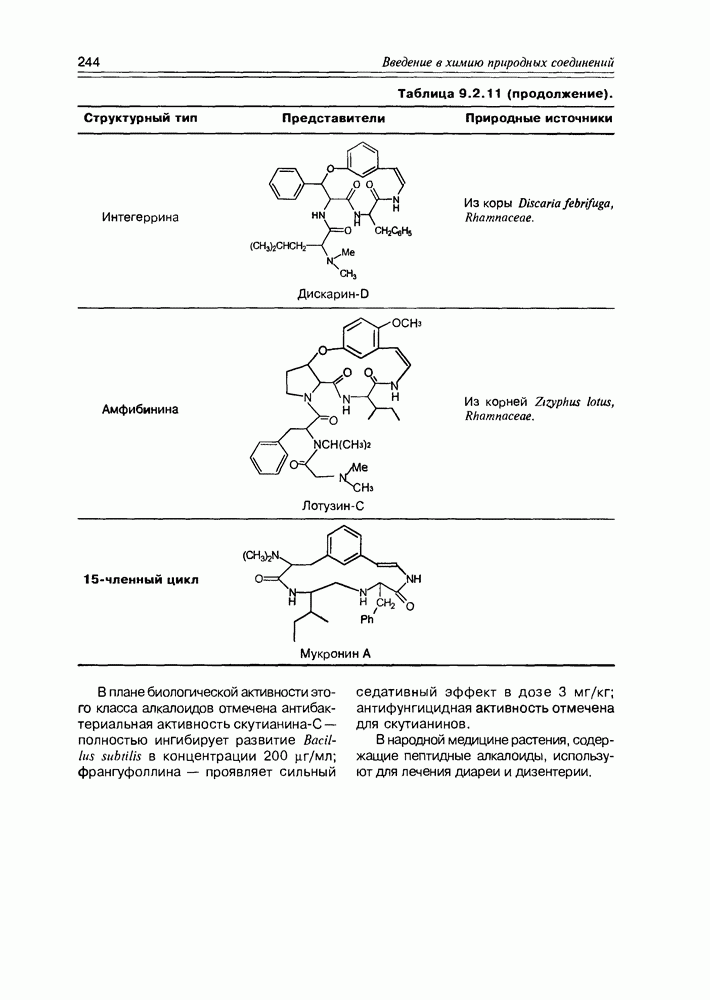
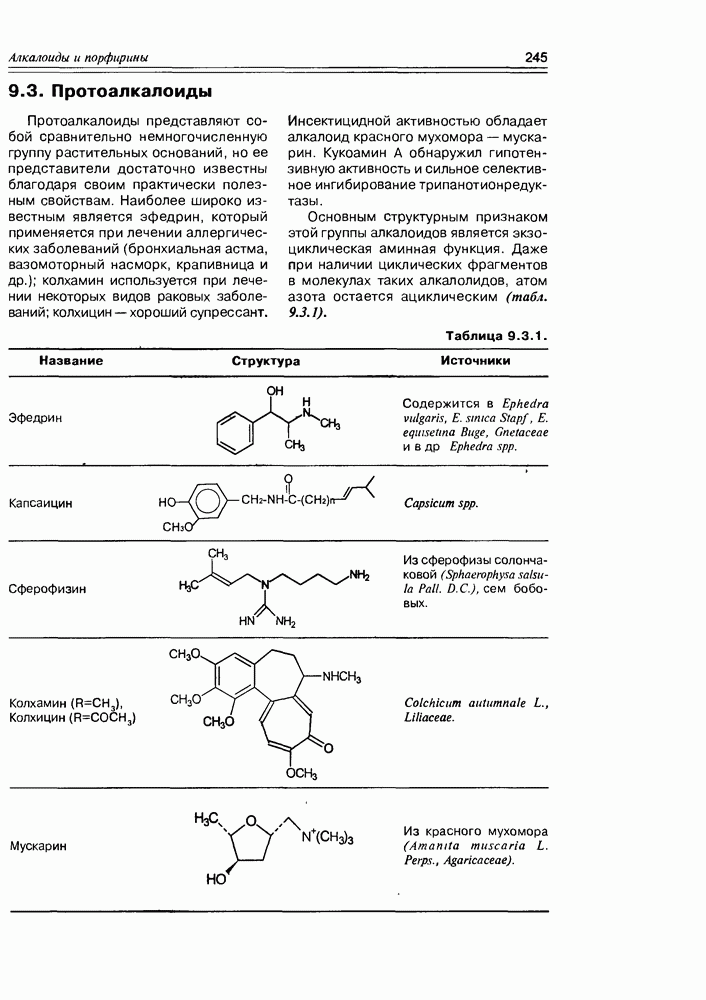
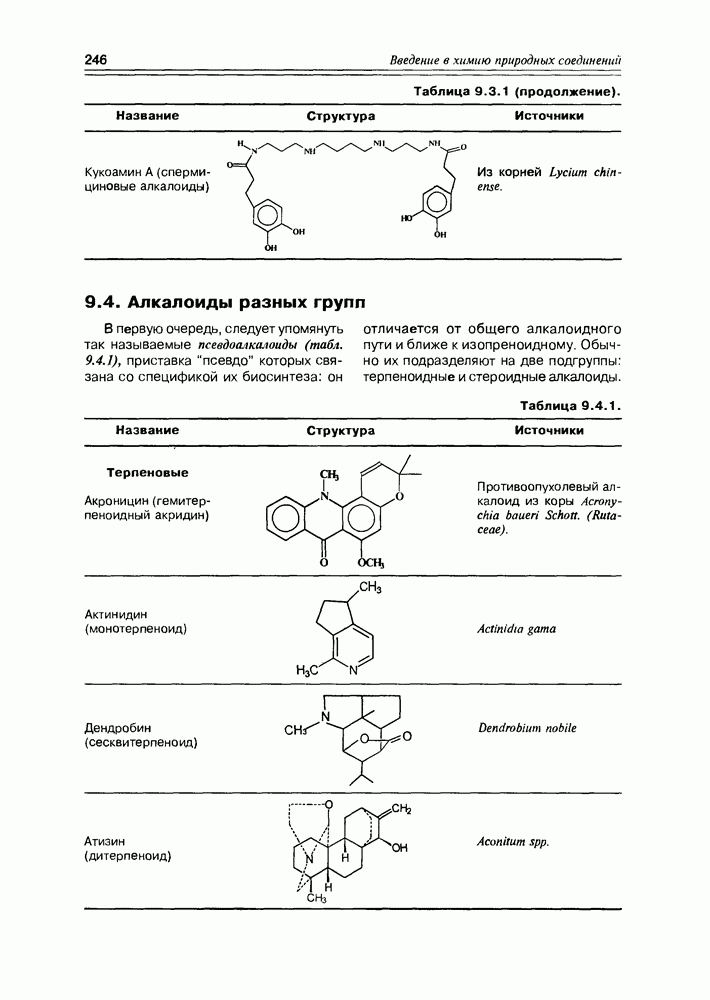
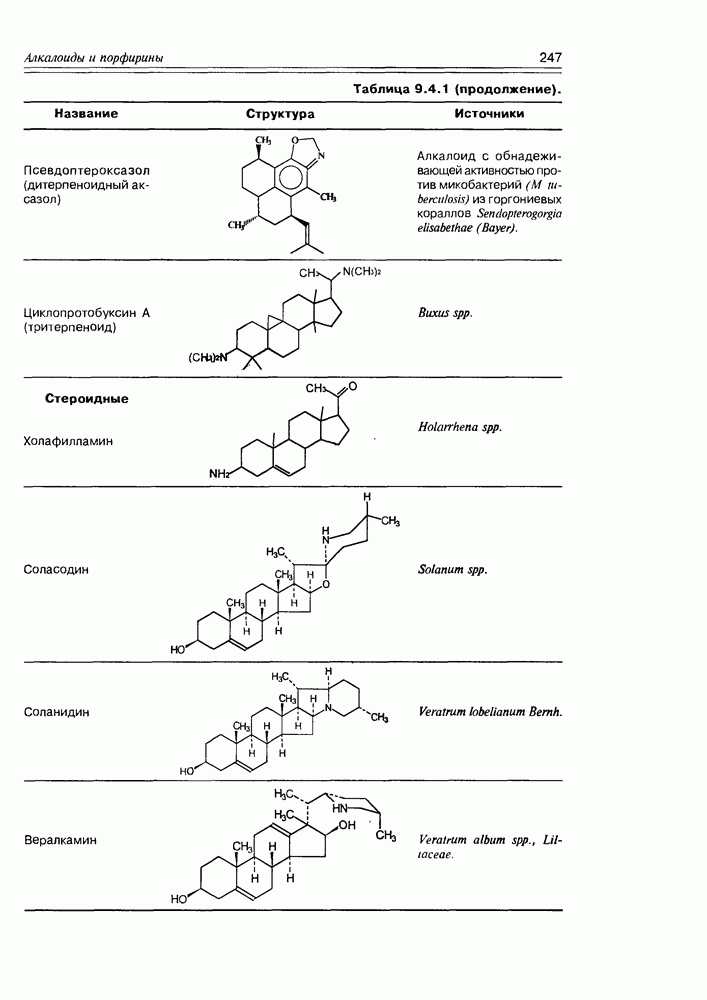
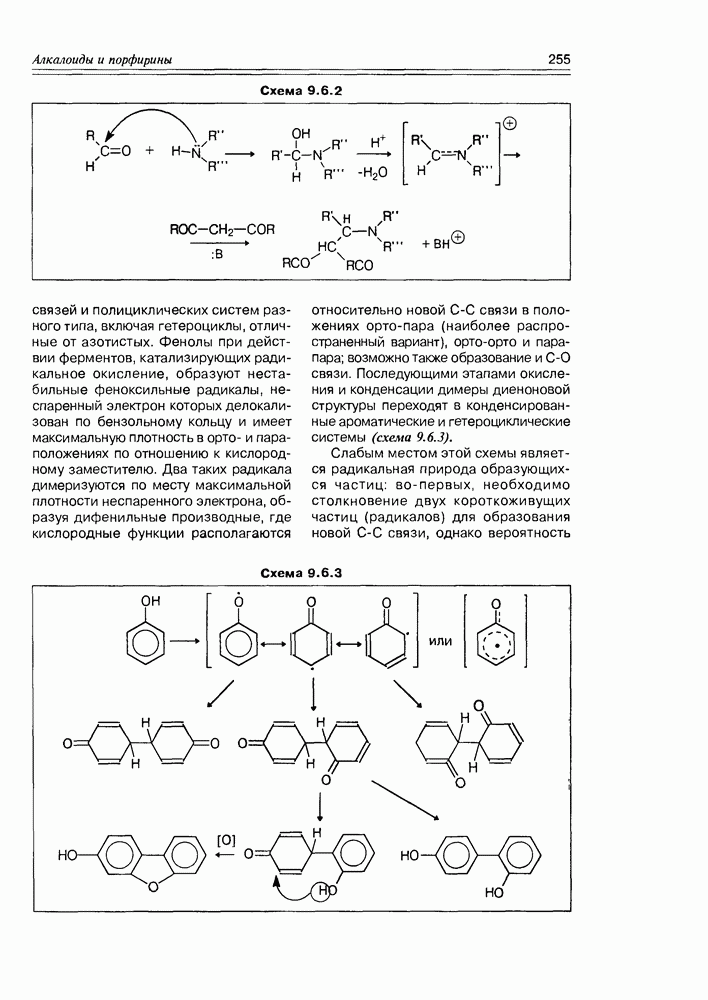
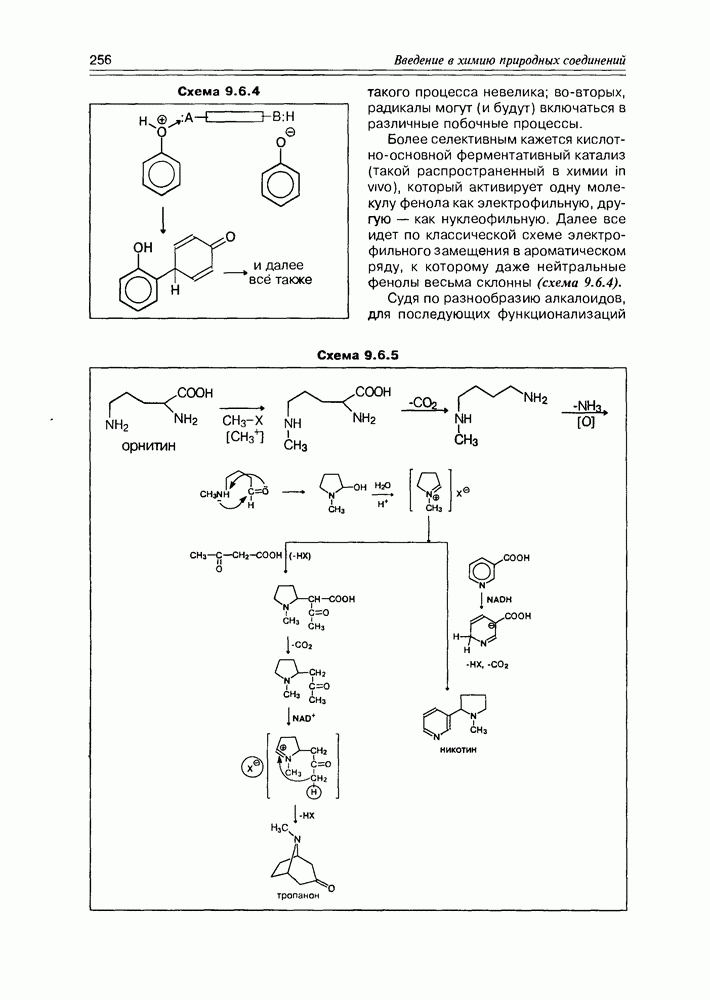
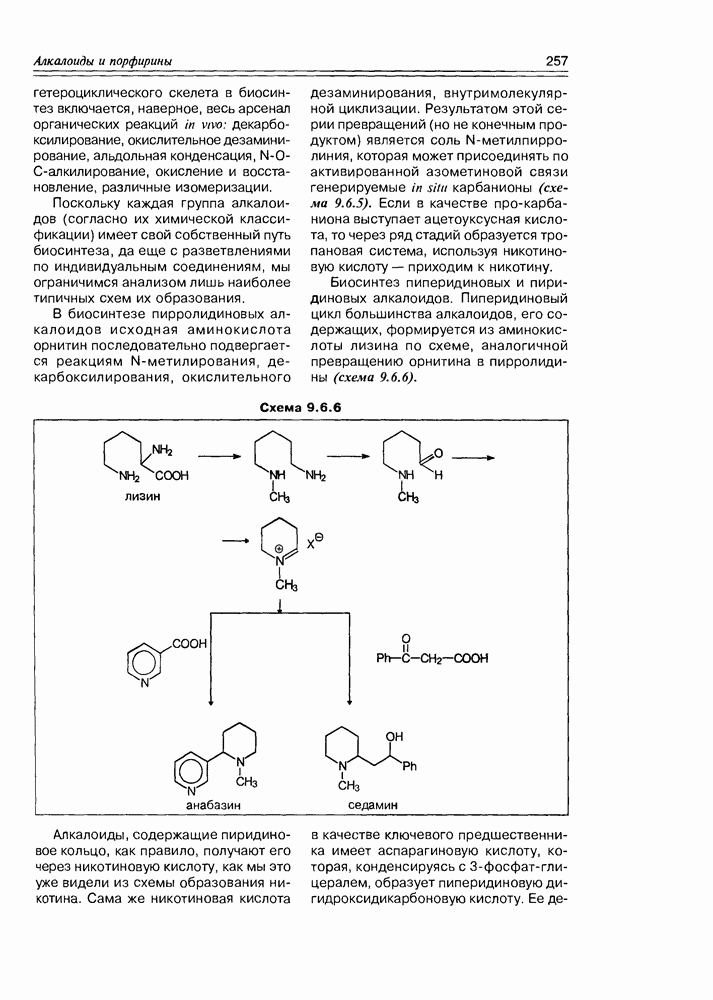
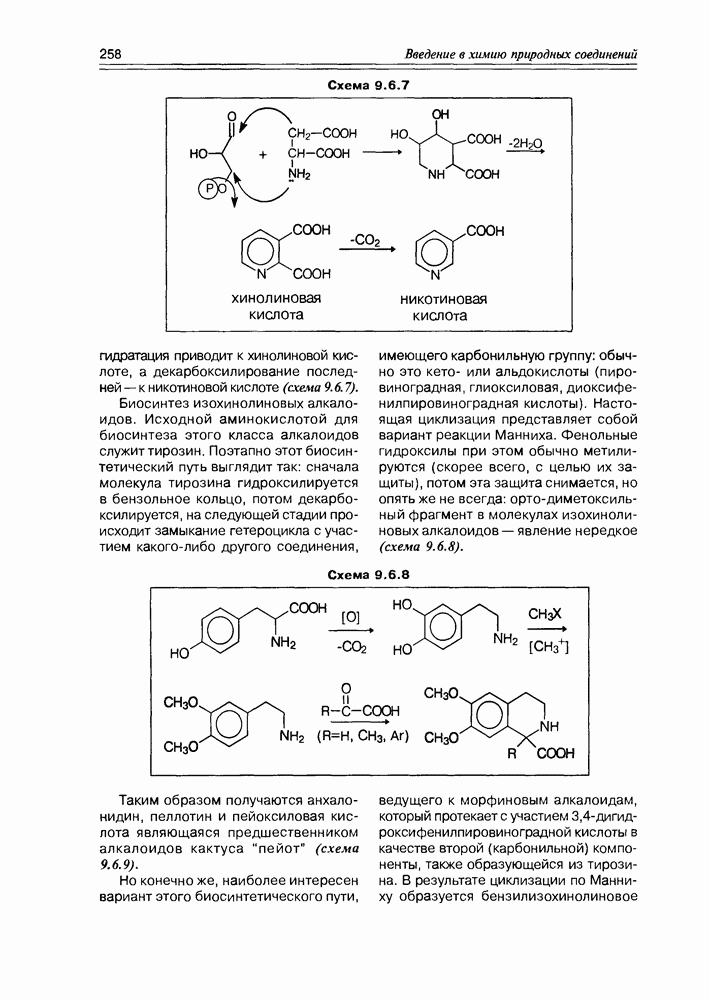
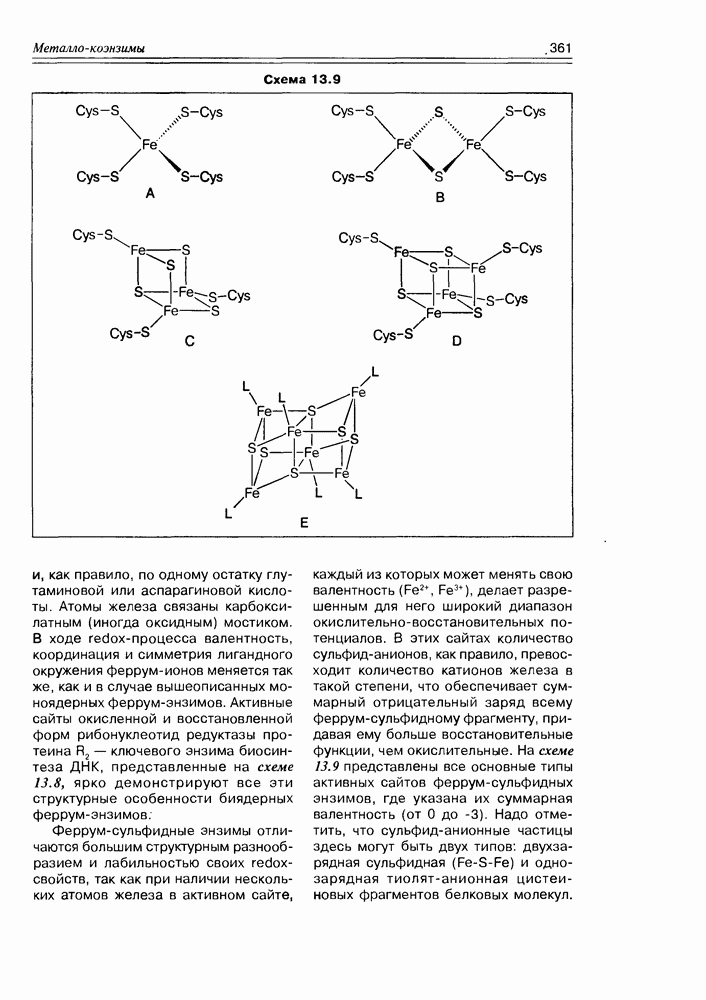
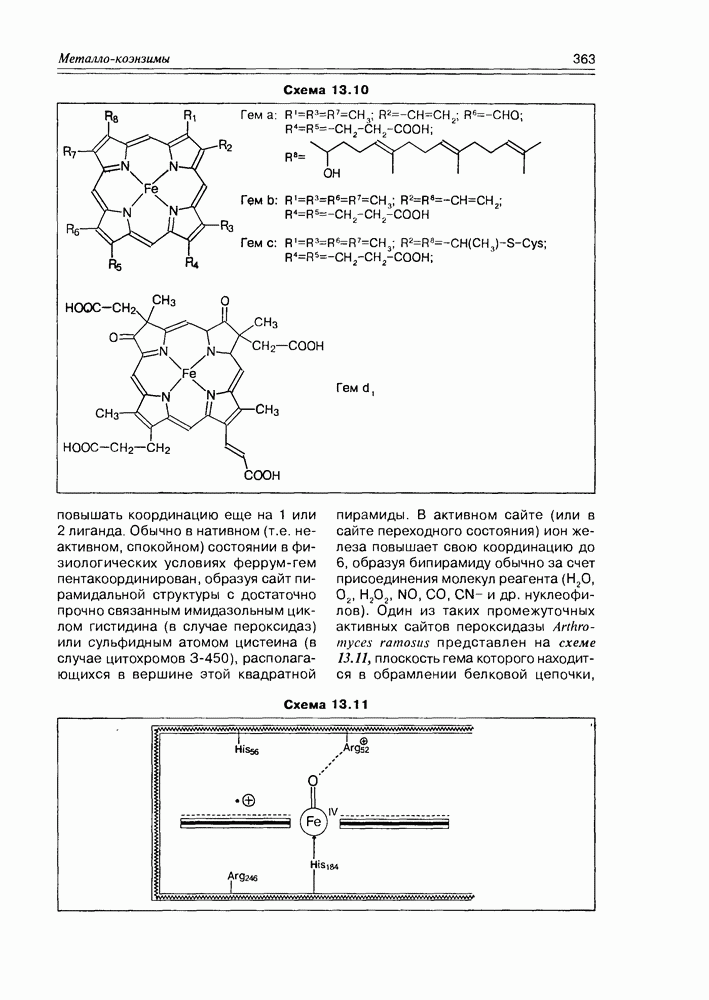
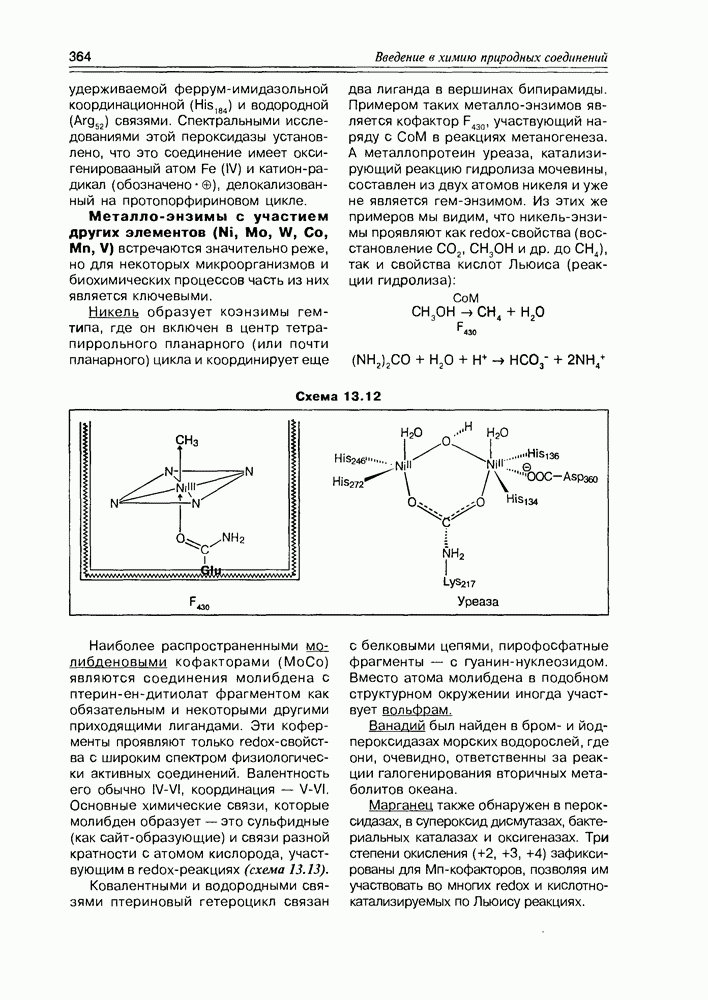
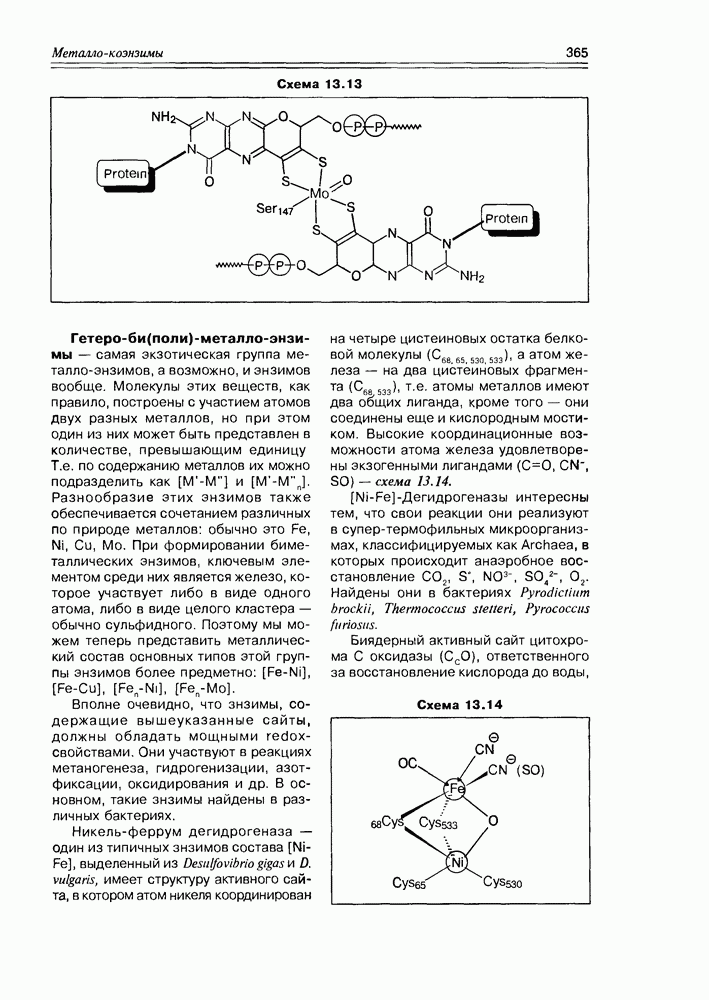
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Глава 2. ПРОСТЕЙШИЕ БИФУНКЦИОНАЛЬНЫЕ ПРИРОДНЫЕ СОЕДИНЕНИЯ - МОСТИК К МАССИВУ ПРИРОДНЫХ СОЕДИНЕНИЙ
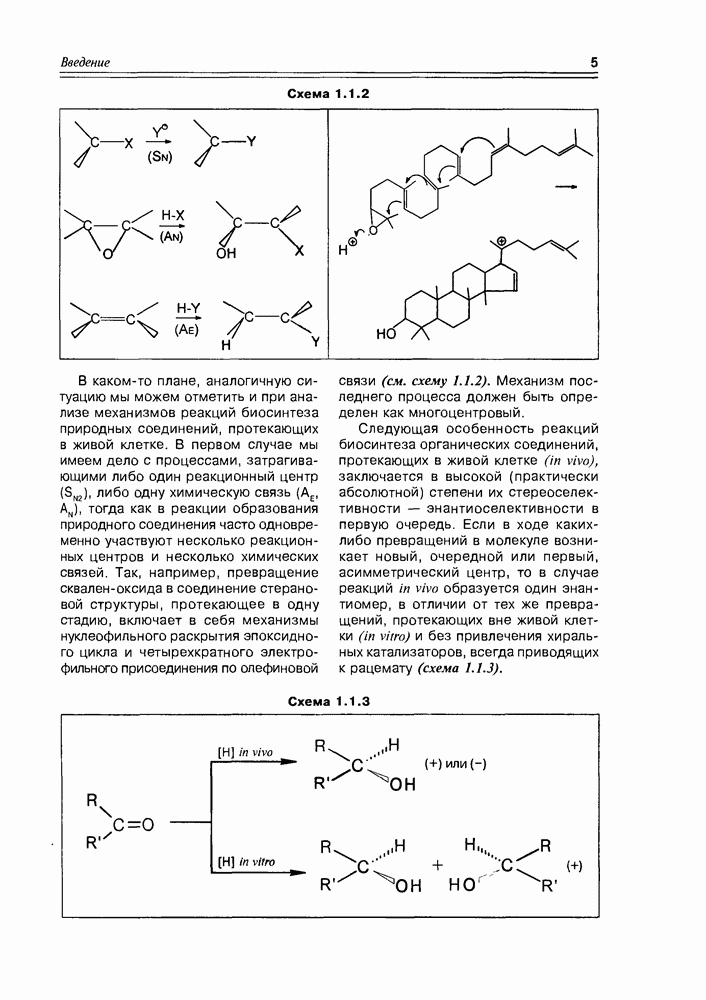
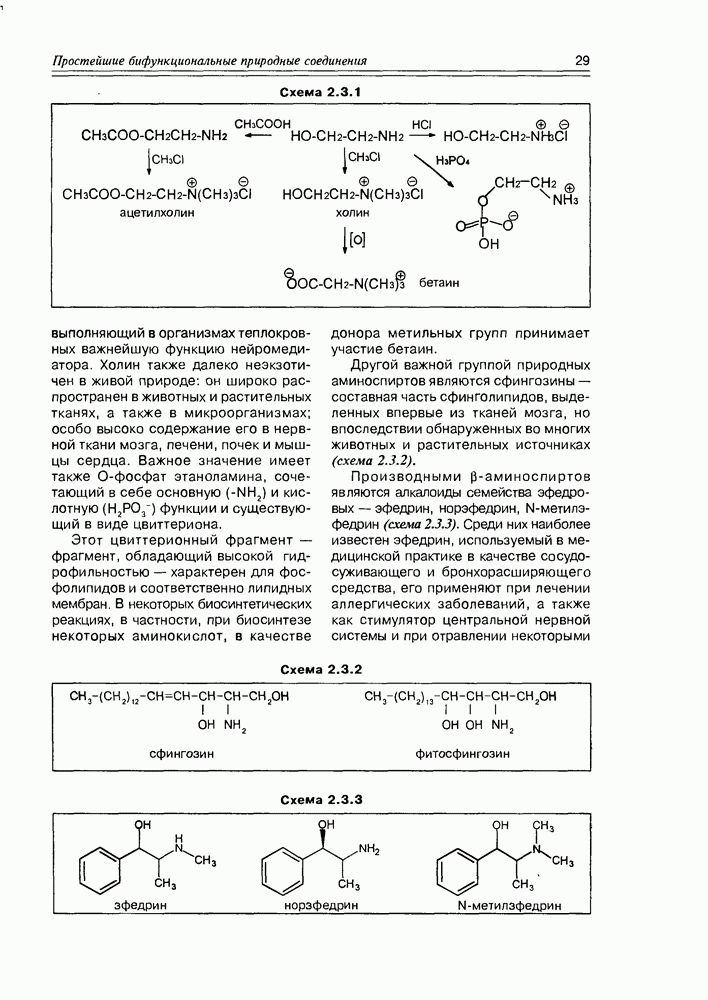
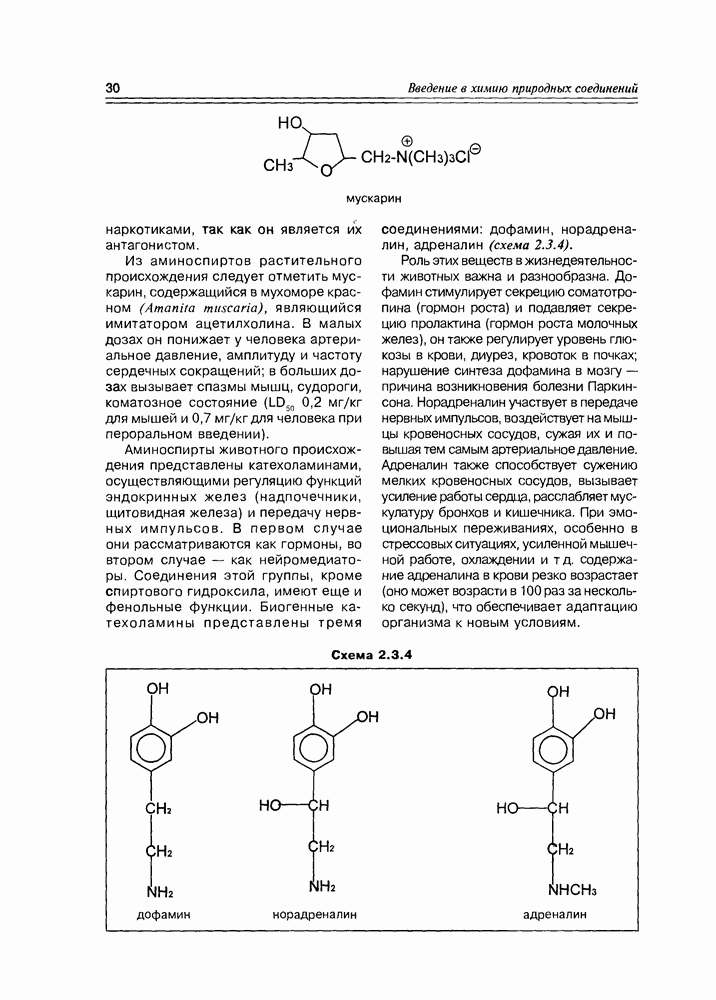
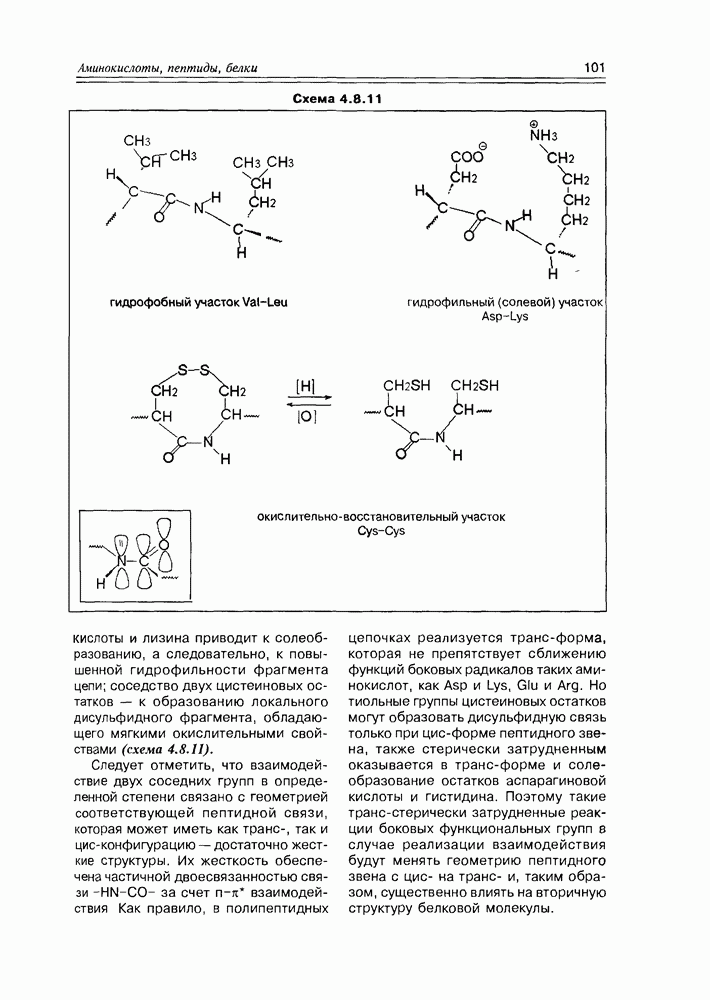
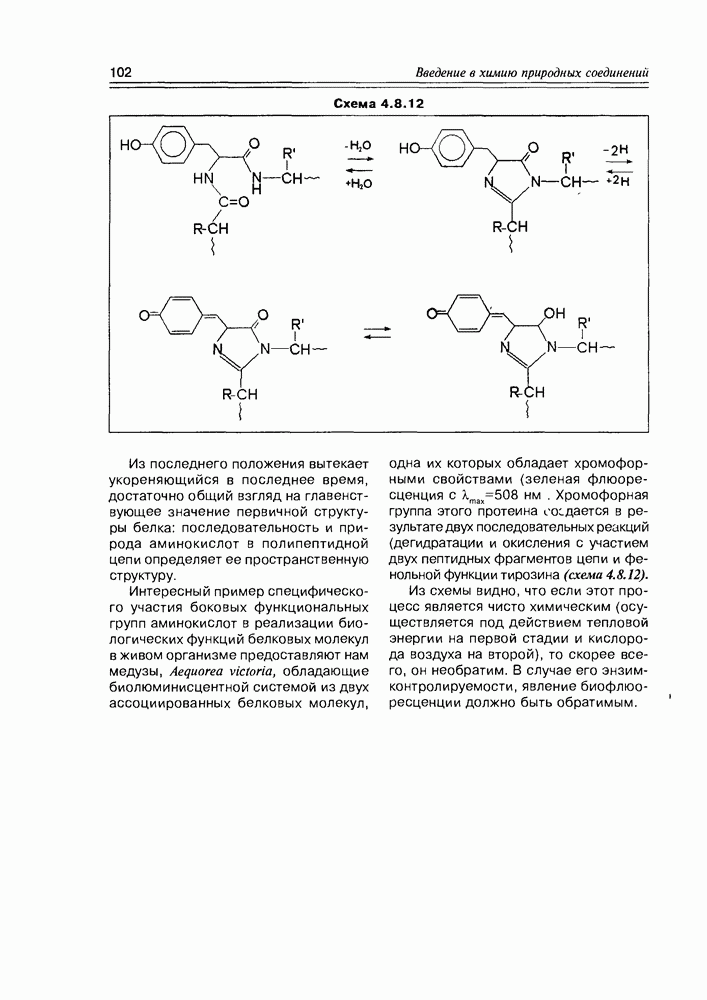
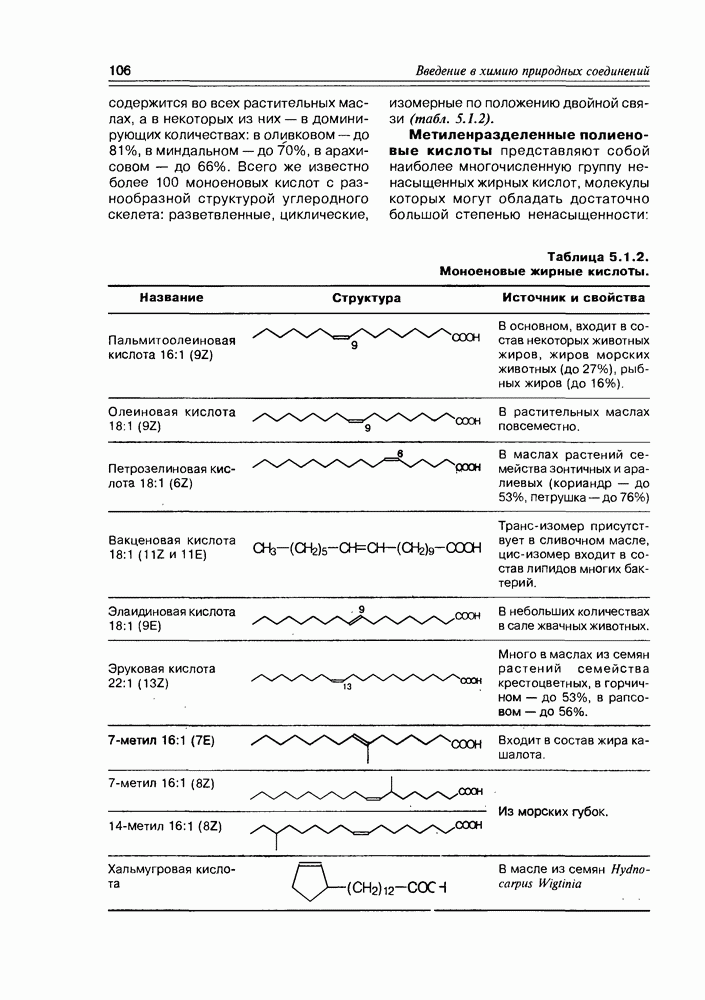
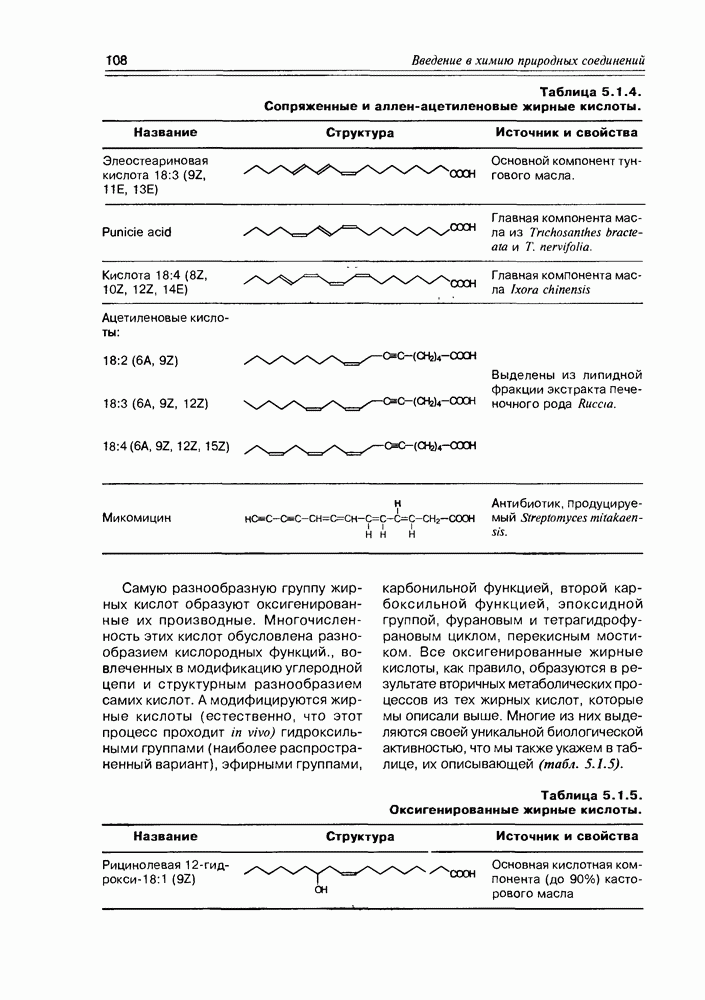
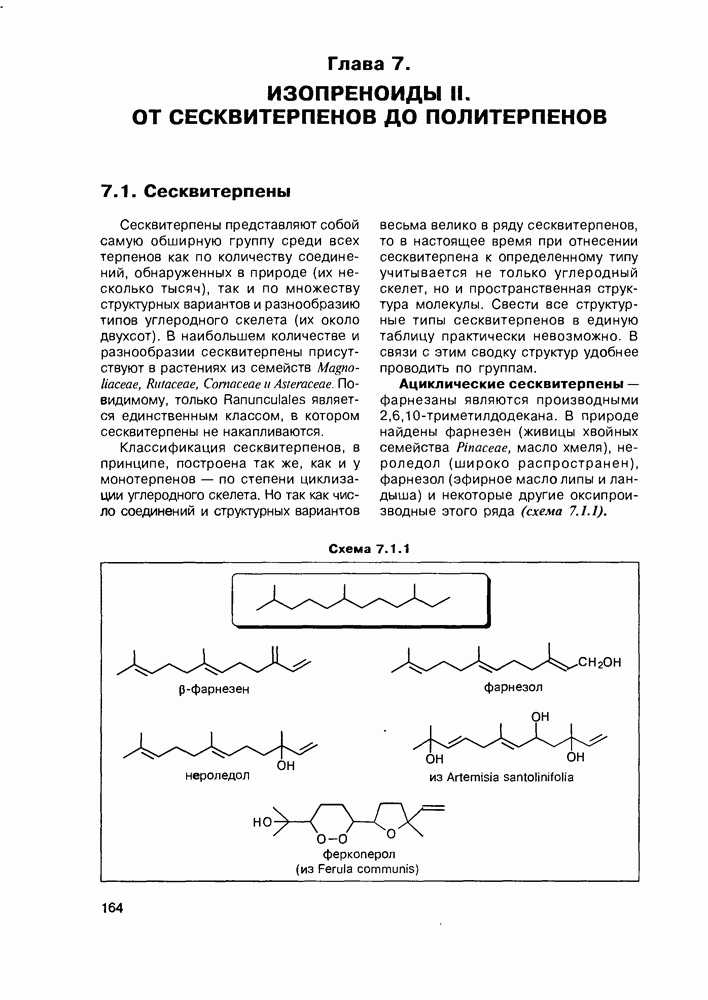
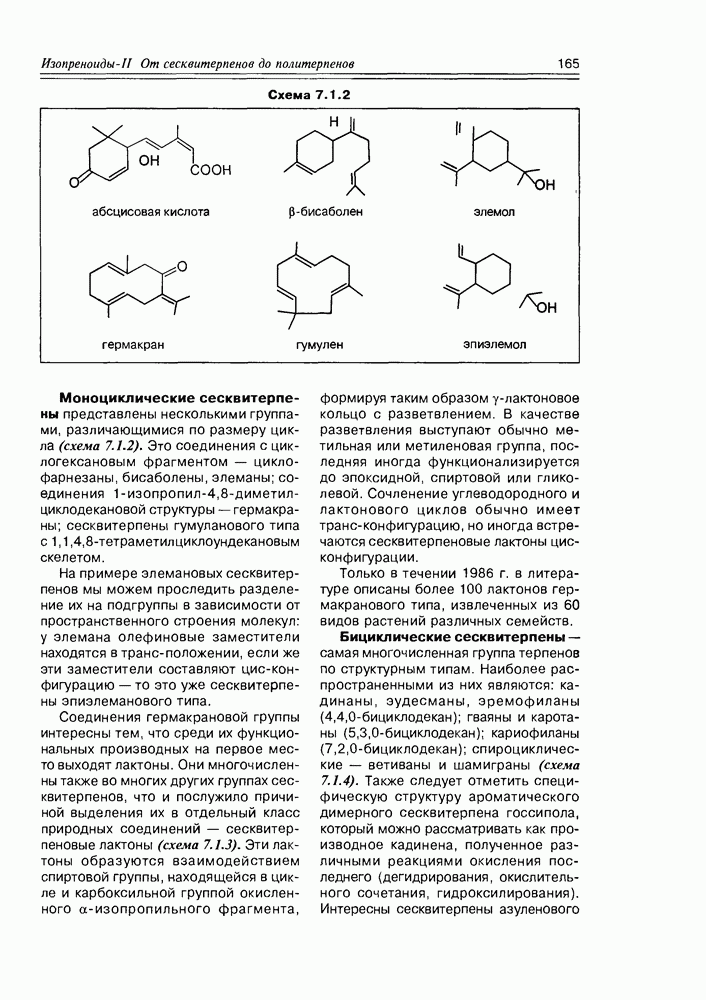
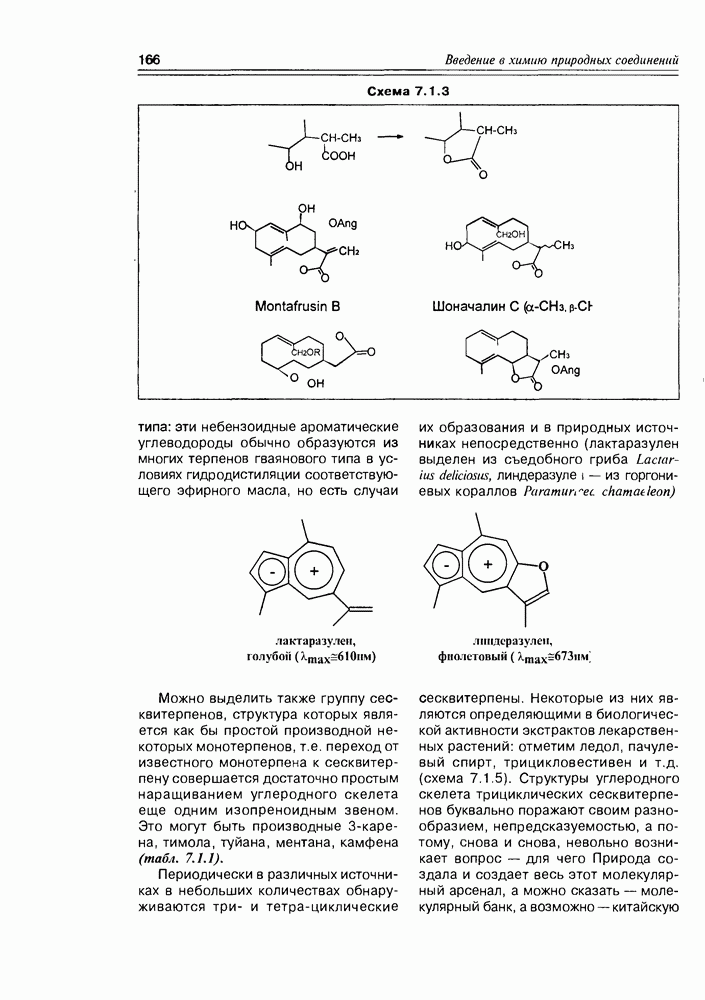
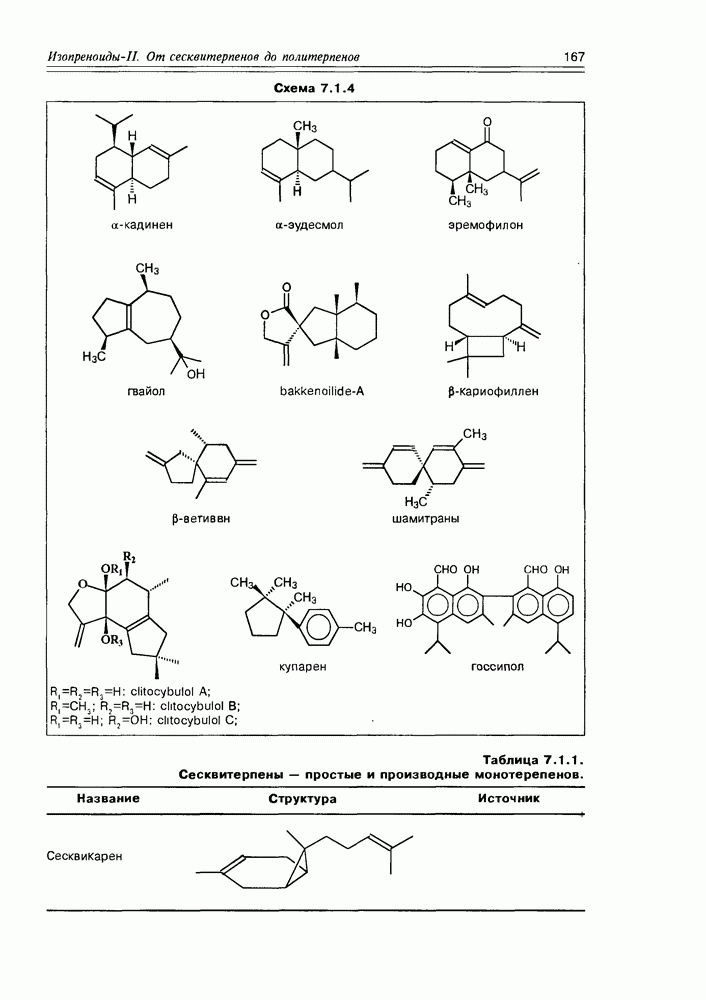
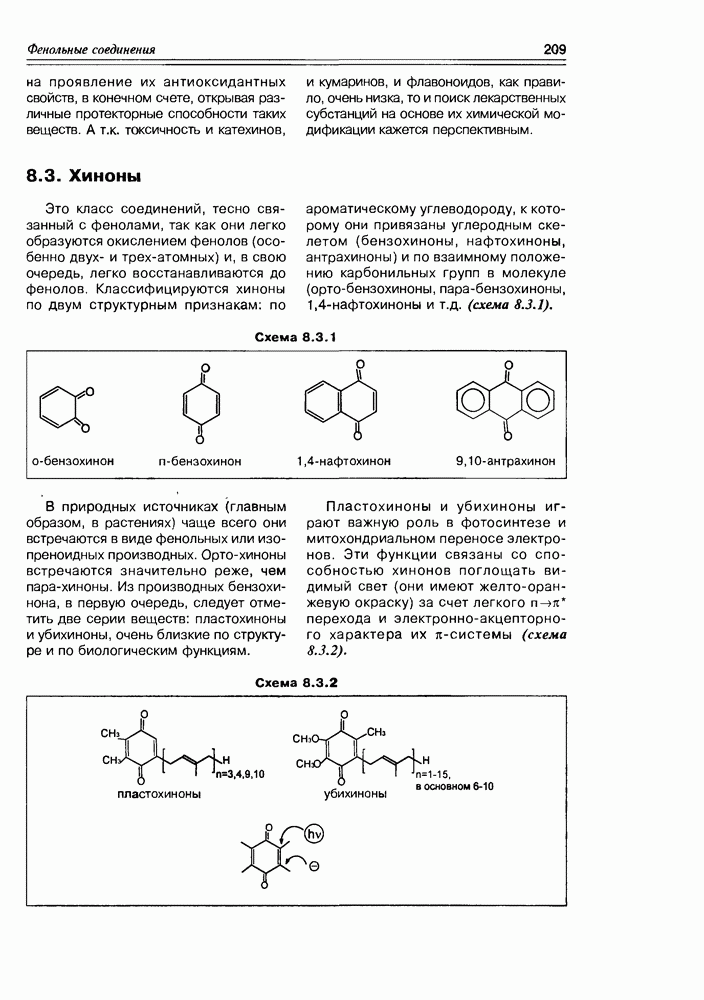
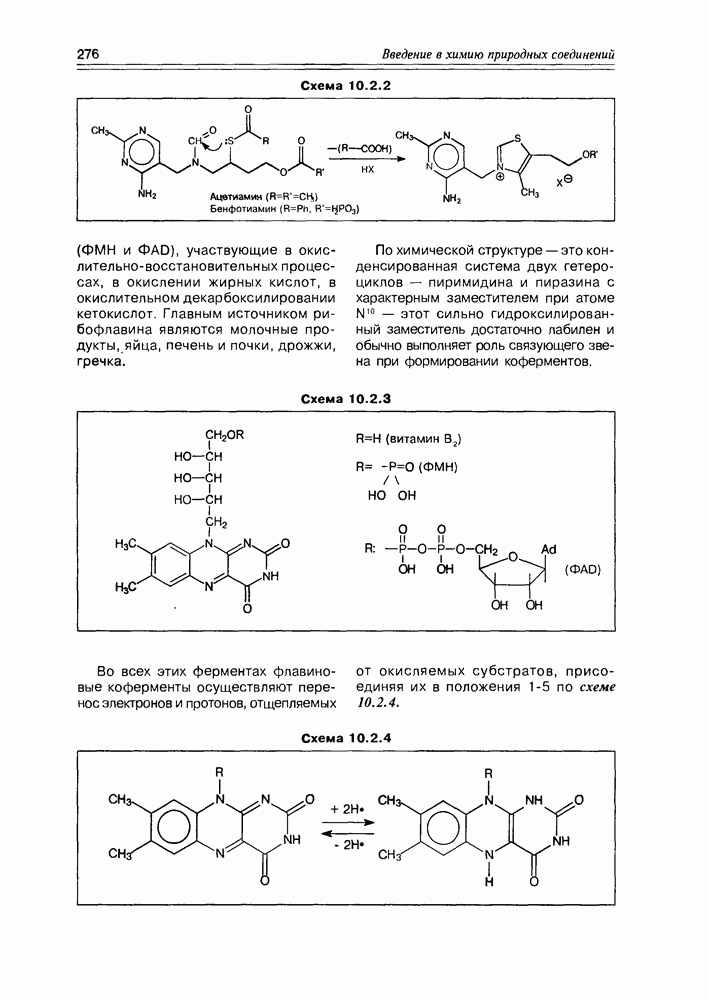
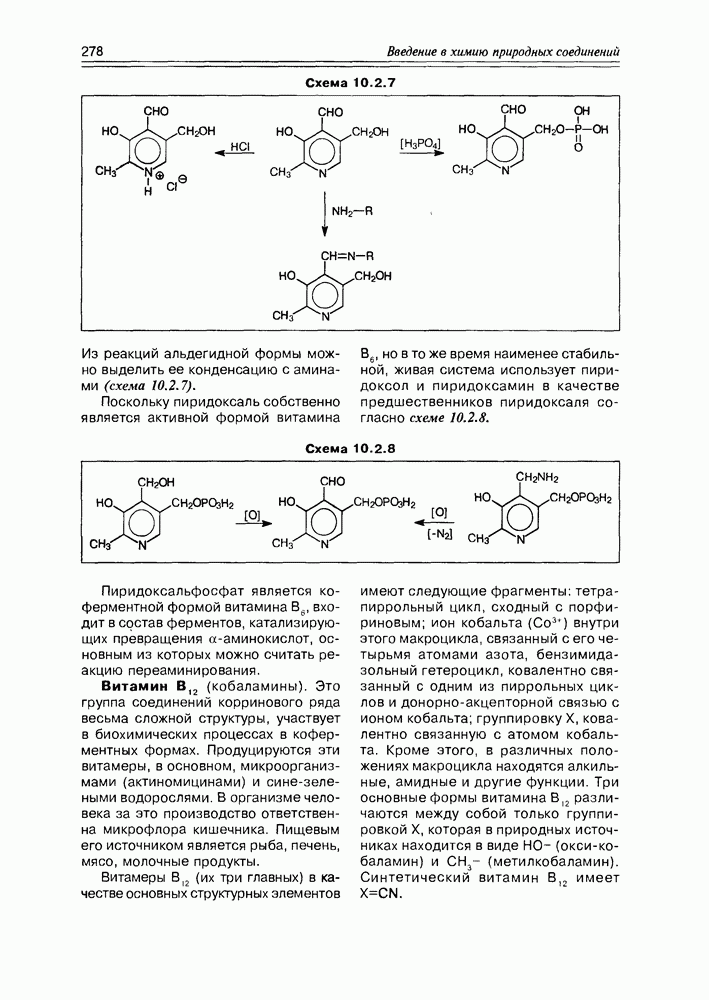
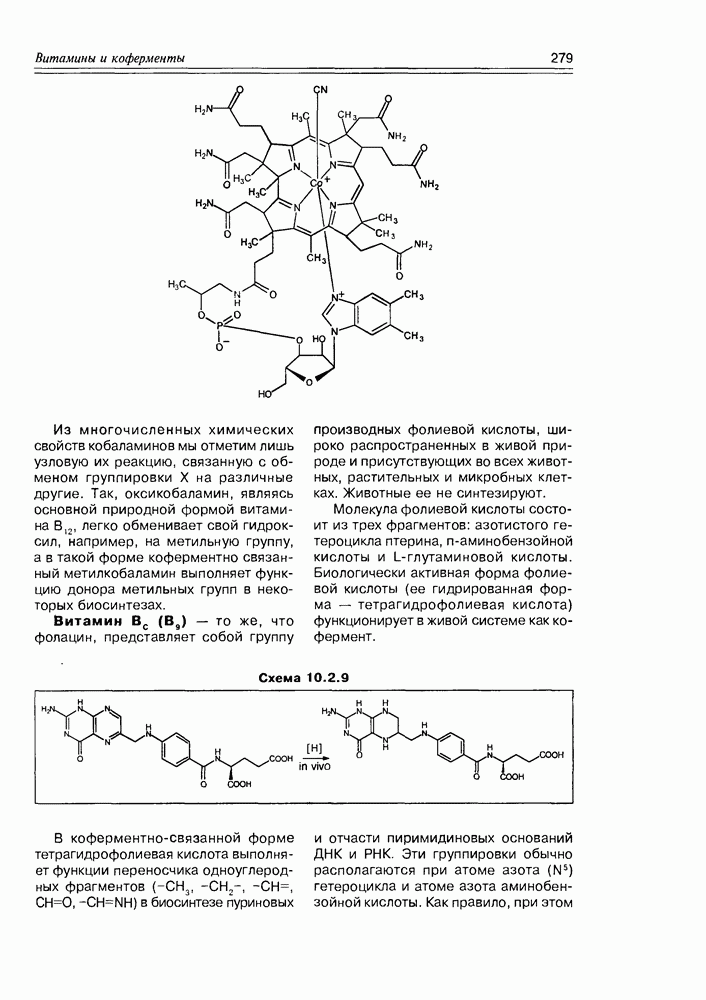
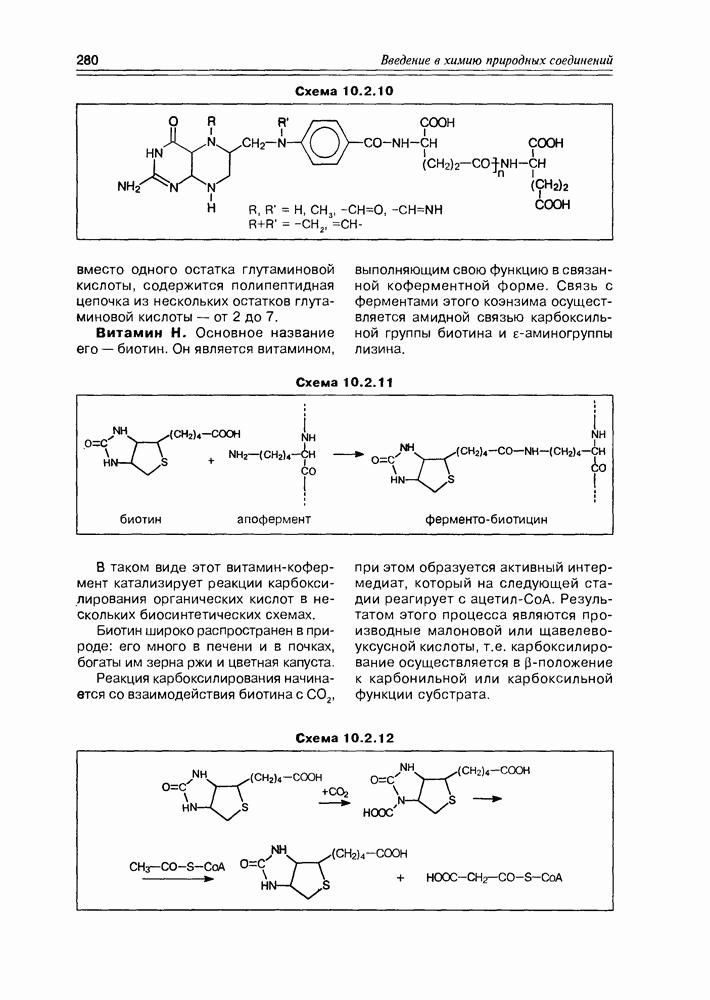
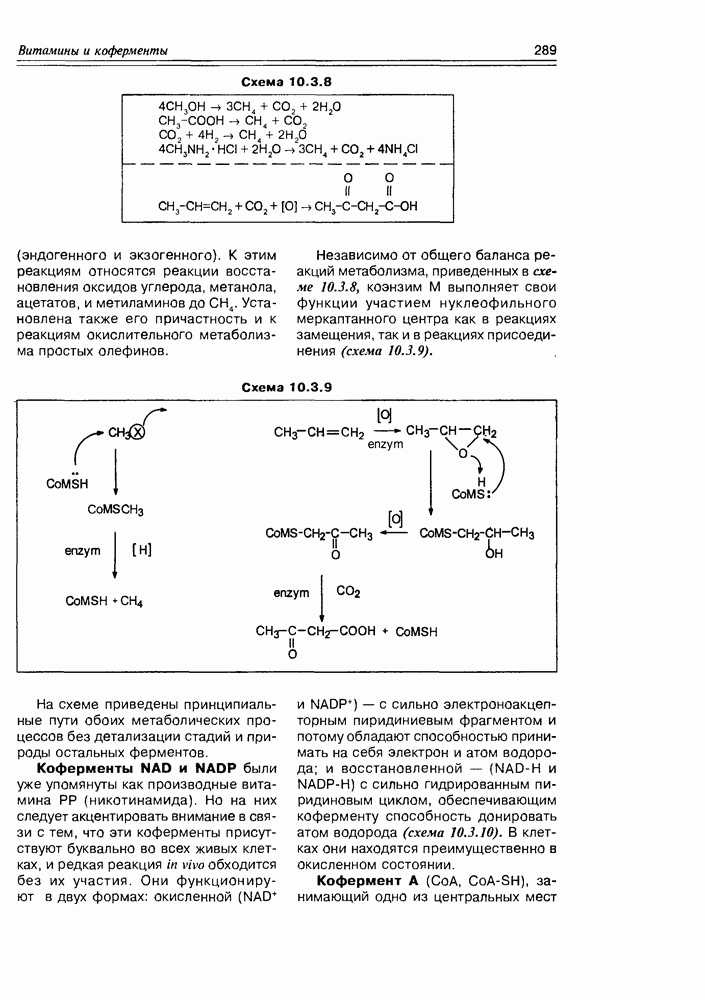
Изучение полифункционапьных природных соединений целесообразно начать с классов оксикислот, оксокис-лот и аминоспиртов, поскольку, во-первых, эти соединения достаточно широко представлены в живом мире на различных этапах его проявления — они встречаются в свободном виде (гидрок-сикислоты растений) и как фрагменты достаточно сложных молекул (фосфолипиды и сфингозины животных и бактерий), некоторые из них образуются в процессе метаболизма веществ первичного биосинтеза (окисление жирных кислот) или являются ключевыми соединениями главных путей биосинтеза (пировиноградная кислота, лимонная кислота, мевалоновая кислота, шикимовая кислота). Второй аргумент в пользу выделения такой группы природных соединений в начало нашего курса — это наглядность проявления внутримолекулярного взаимного влияния функциональных групп, ведущего к появлению новых физических и химических свойств относительно исходных простых функций как важного фактора формирования молекул жизни.
2.1. Гидроксикислоты
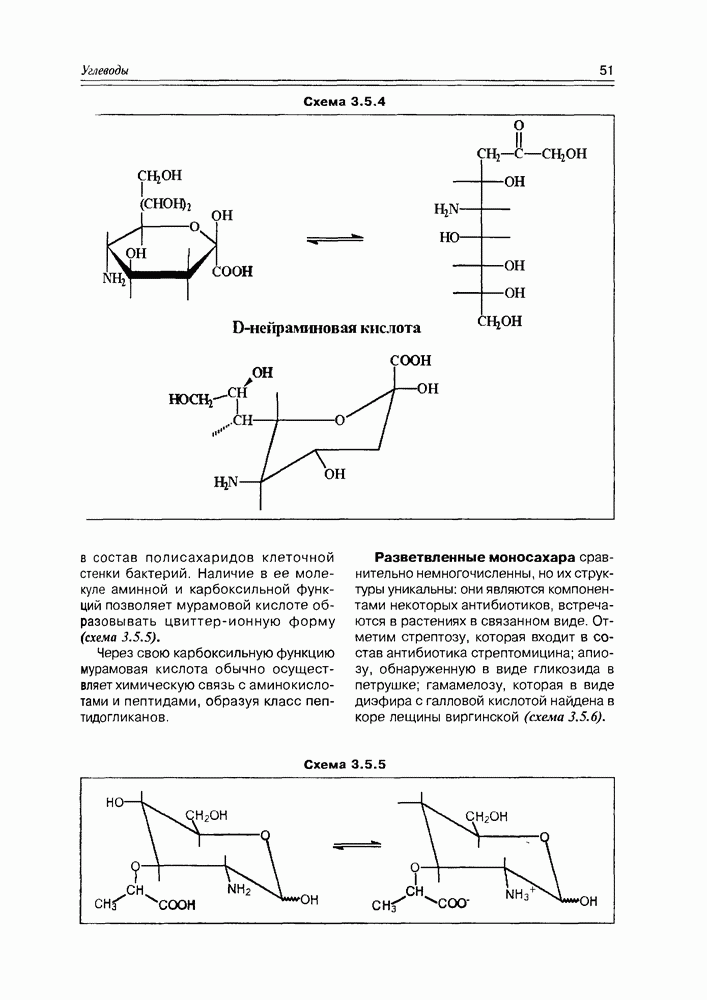
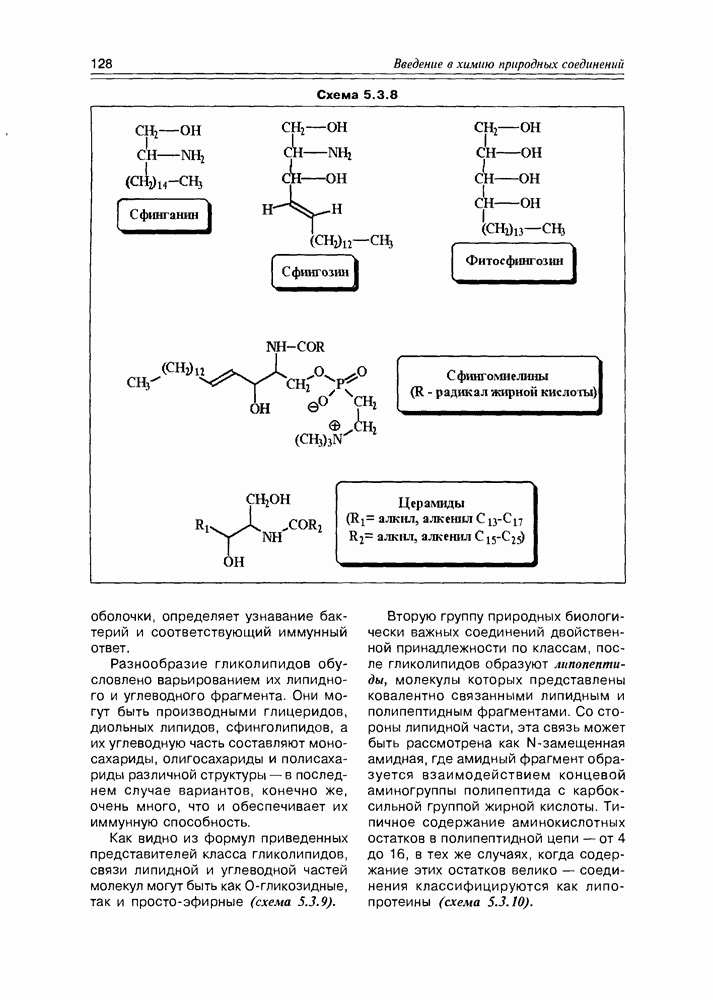
Соединения этого класса являются достаточно простыми представителями природных соединений, они весьма часто встречаются в самых различных природных источниках. Гидроксиалкановые кислоты были выделены из ланолина, пчелиного воска, коры, корней, воскообразного слоя листьев, семян, бактерий и грибов. Наиболее часто встречаются а-гидроксикислоты, a в комбинации со сфингозинами животных и фитосфингозинами растений и Микроорганизмов они, очевидно, входят в состав всего живого.
 -гидроксикислоты играют важную роль в биосинтезе и катаболизме жирных кислот. Жирные кислоты с длинной цепью с одной и более гидроксильными группами обнаружены в жирах растительного и животного происхождения. В таких молекулах гидроксильные функции находятся, главным образом, на некотором расстоянии от карбоксильной группы.
-гидроксикислоты играют важную роль в биосинтезе и катаболизме жирных кислот. Жирные кислоты с длинной цепью с одной и более гидроксильными группами обнаружены в жирах растительного и животного происхождения. В таких молекулах гидроксильные функции находятся, главным образом, на некотором расстоянии от карбоксильной группы.
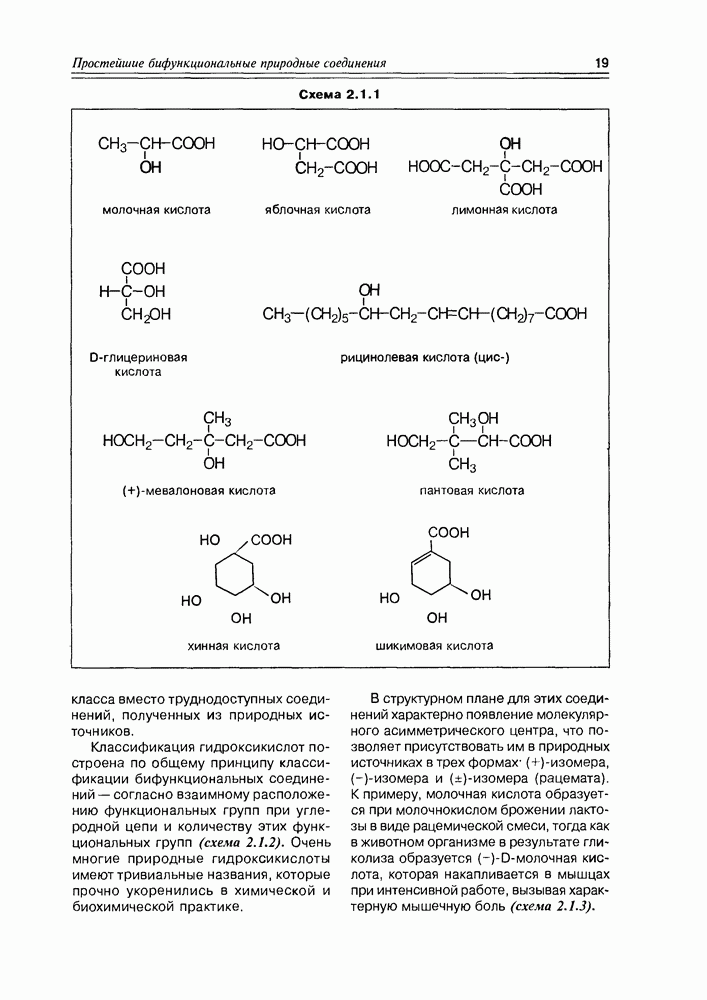
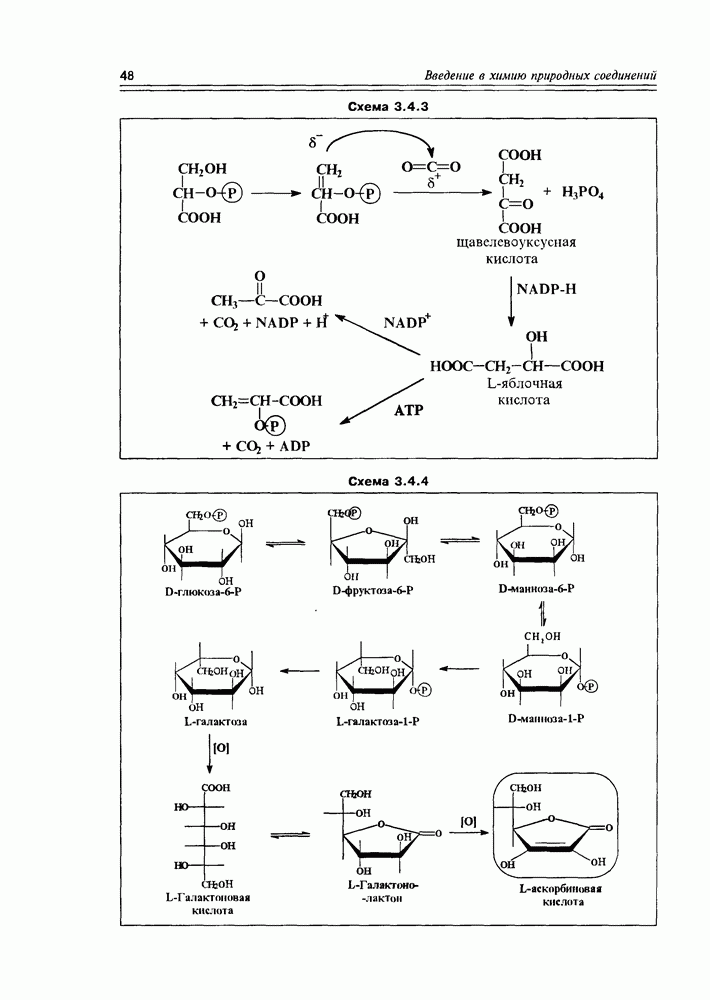
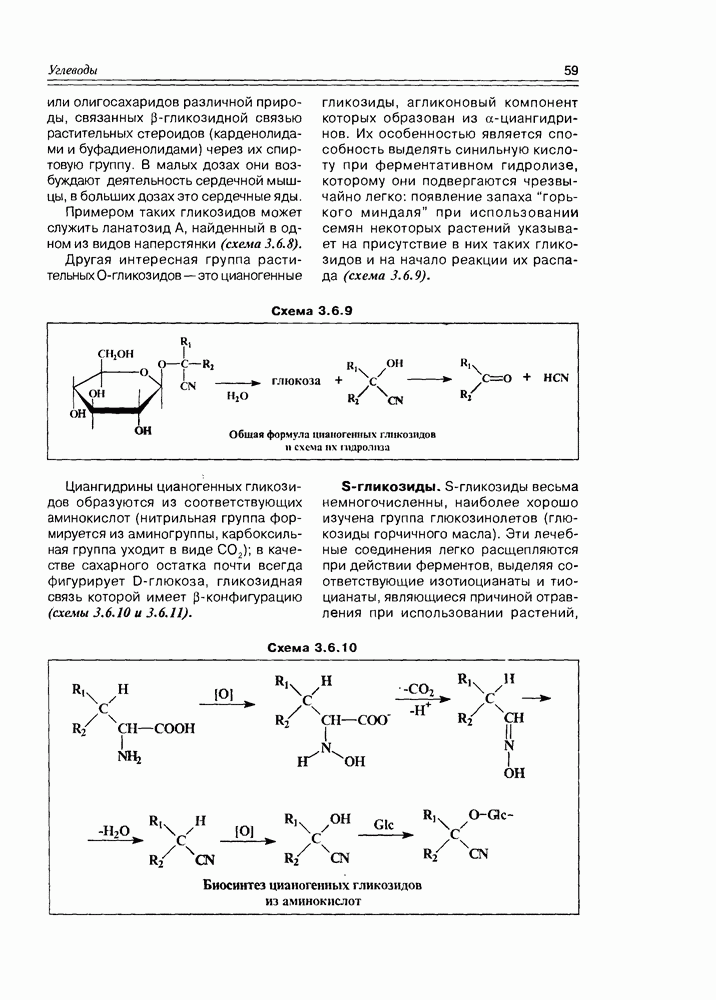
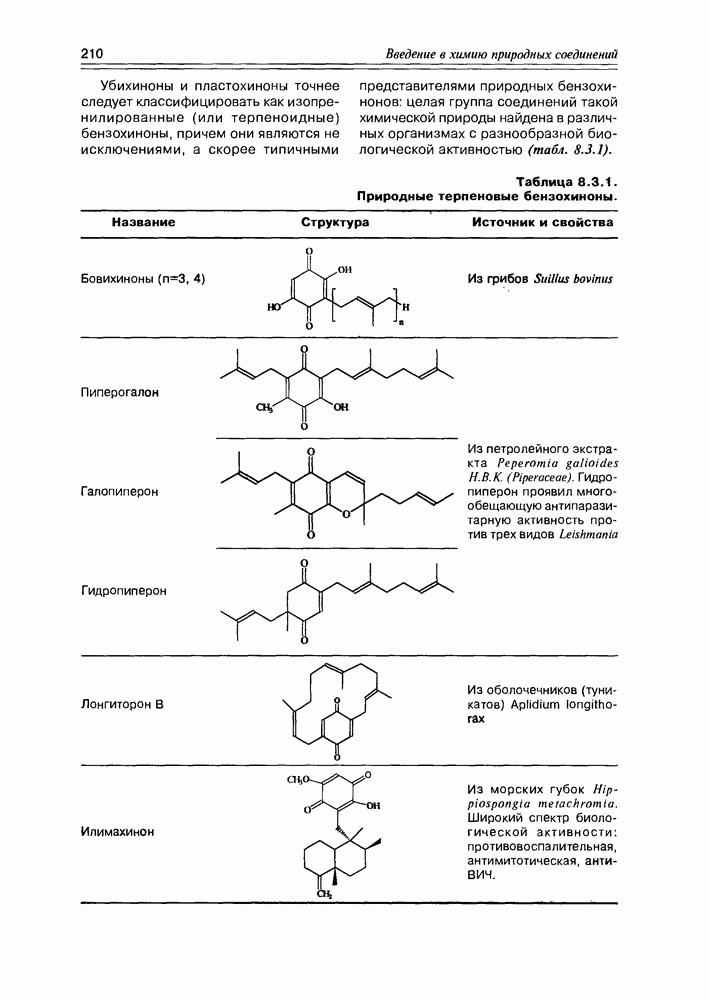
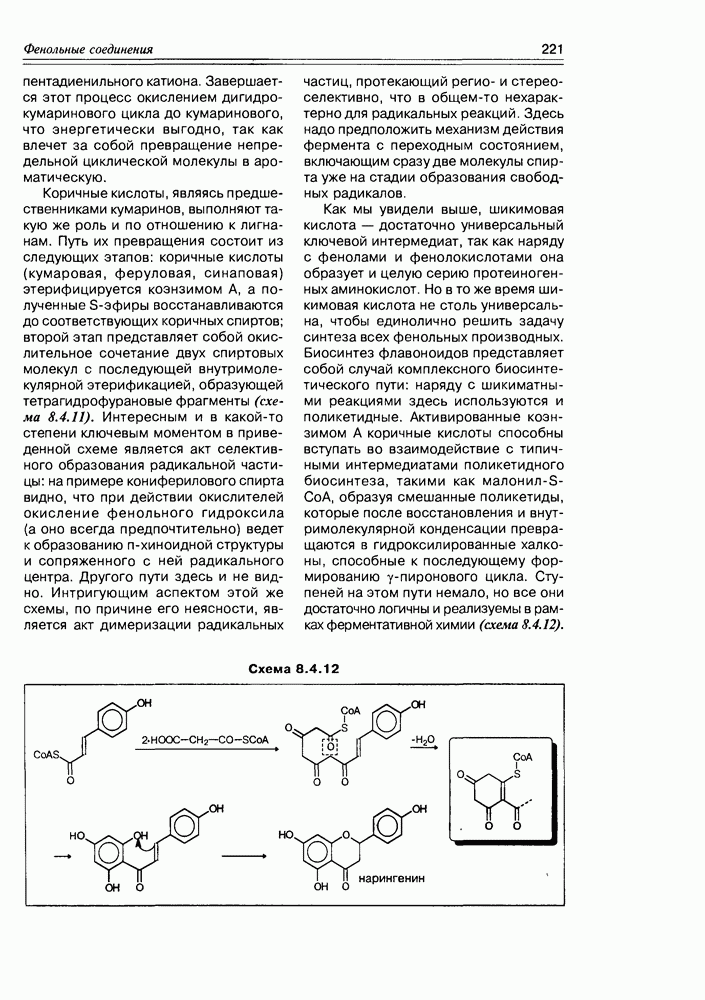
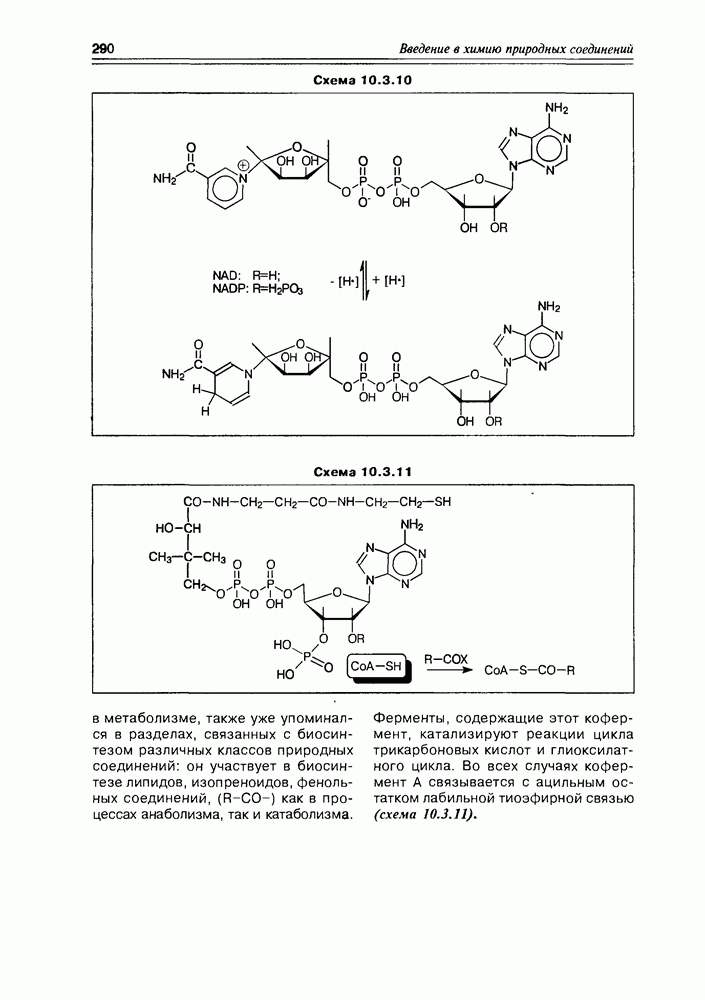
Некоторые оксикислоты являются ключевыми соединениями на главных путях биосинтеза (глицериновая, мевалоновая, шикимовая, лимонная и др.), пантовая кислота входит в состав кофермента А (схема 2.1.1). Простейшая оксикислота гликолевая,  содержится в незрелом винограде, свекле, сахарном тростнике. Природная яблочная кислота, имеющая
содержится в незрелом винограде, свекле, сахарном тростнике. Природная яблочная кислота, имеющая  содержится в кислых плодах, таких как незрелые яблоки, крыжовник, рябина, ревень. Лимонная кислота — важный продукт обмена веществ в живых организмах (цикл трикарбоновых кислот, глиоксалатный цикл), некоторыми растениями накапливается в значительных количествах — в плодах цитрусовых — 6-8%, в листьях махорки — 8-14%, культуральными жидкостями некоторых бактерий — до 10%.
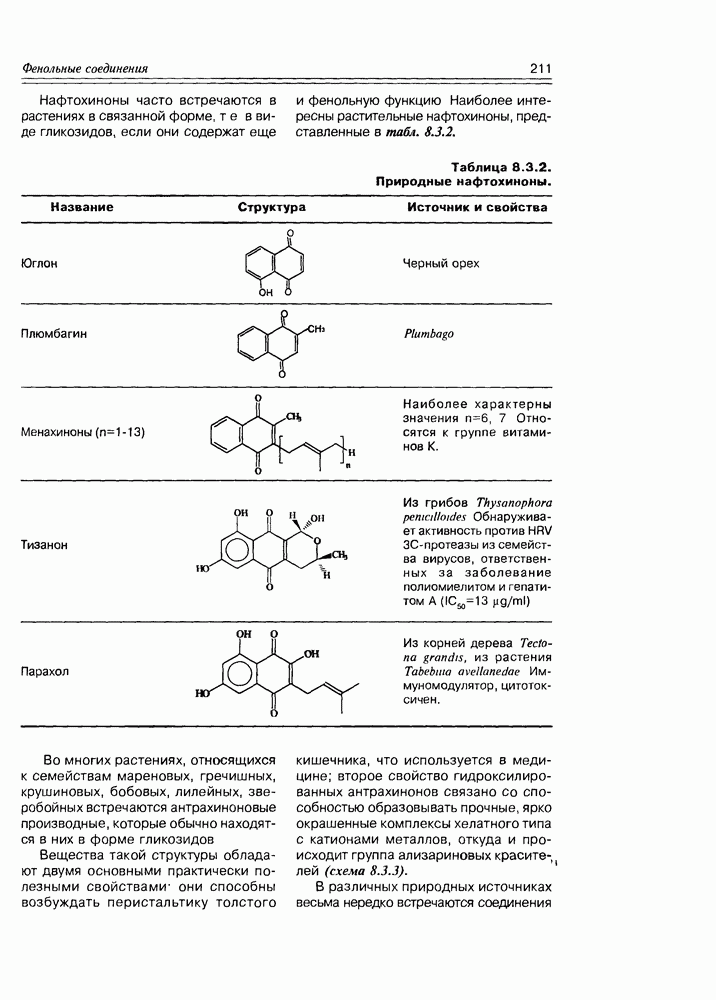
содержится в кислых плодах, таких как незрелые яблоки, крыжовник, рябина, ревень. Лимонная кислота — важный продукт обмена веществ в живых организмах (цикл трикарбоновых кислот, глиоксалатный цикл), некоторыми растениями накапливается в значительных количествах — в плодах цитрусовых — 6-8%, в листьях махорки — 8-14%, культуральными жидкостями некоторых бактерий — до 10%.
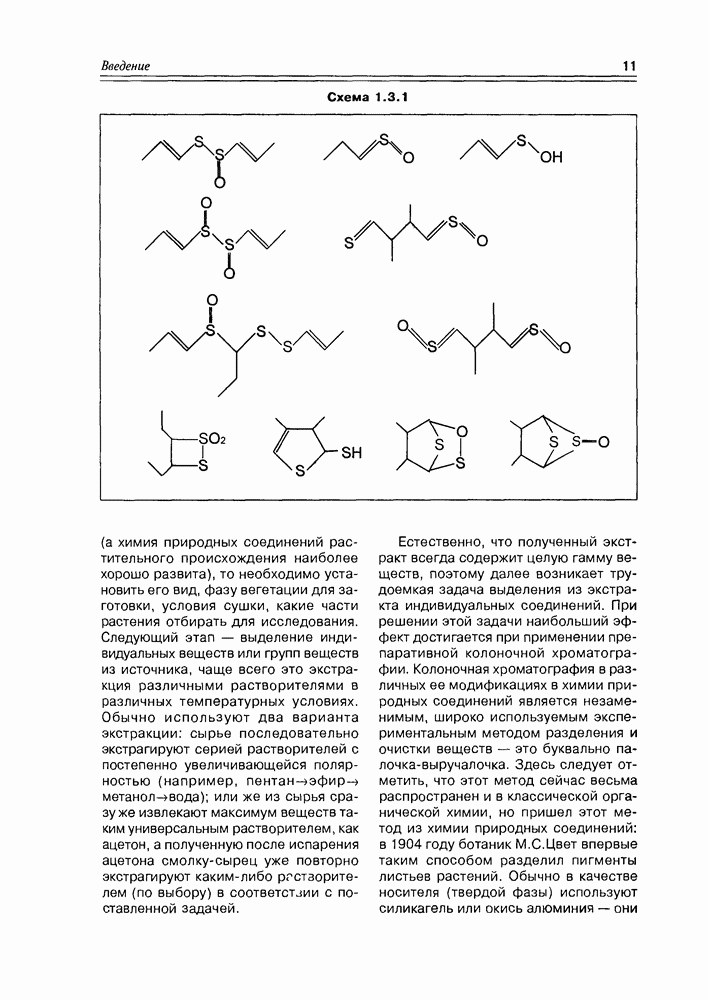
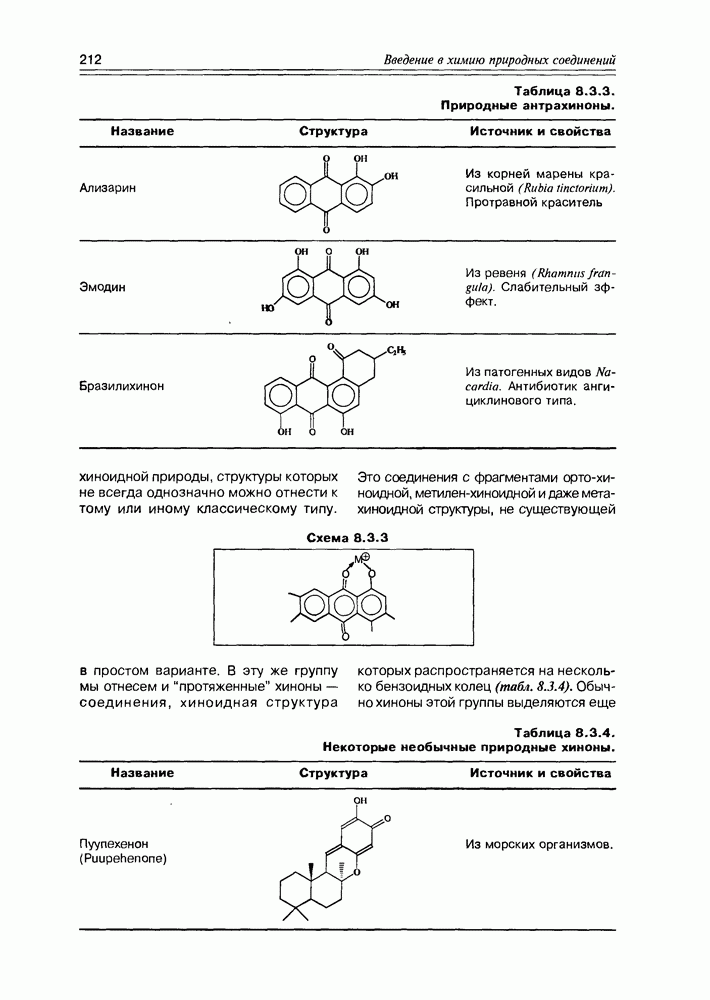
Следует отметить доступность многих гидроксикислот в лабораторных синтезах, а некоторых и в более крупных масштабах, что позволяет в ряде случаев использовать в практических целях синтетические вещества этого
Схема 2.1.1

класса вместо труднодоступных соединений, полученных из природных источников.
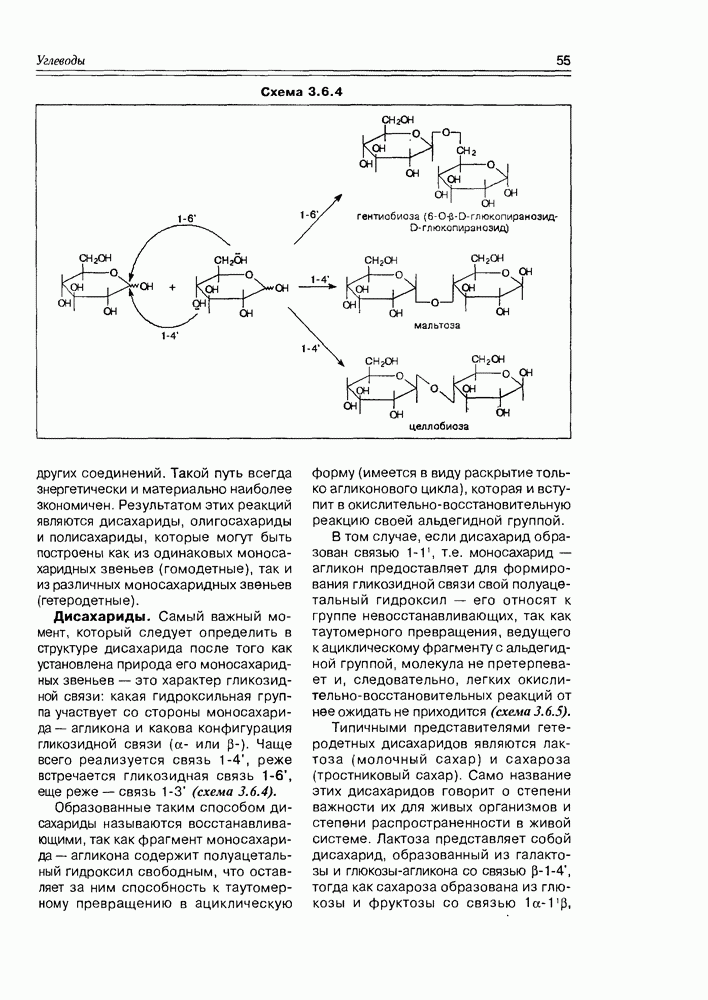
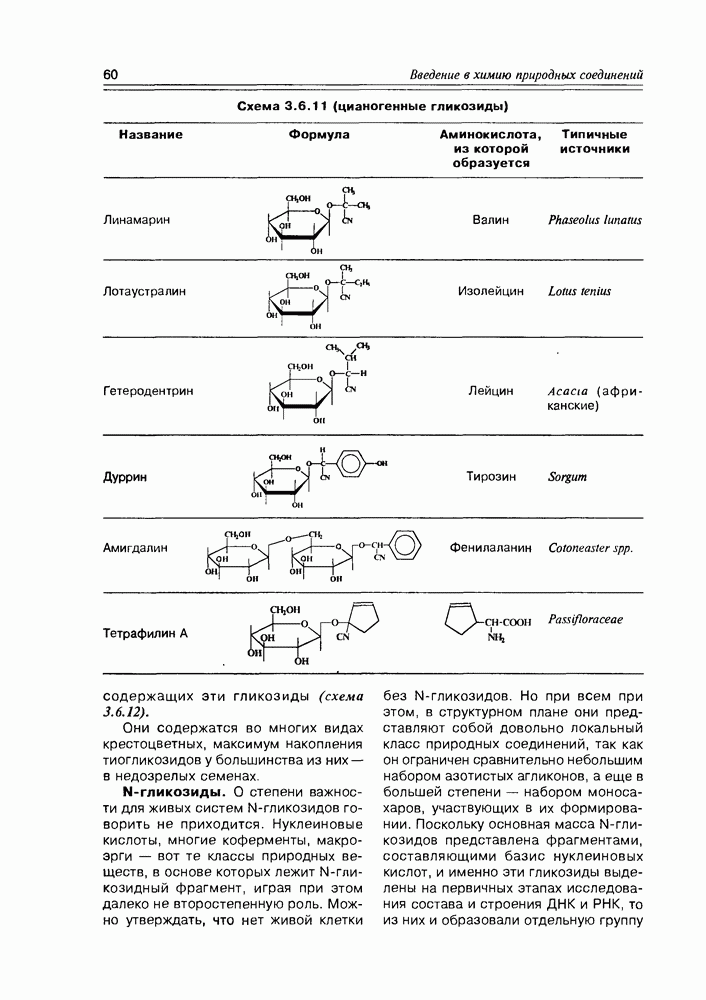
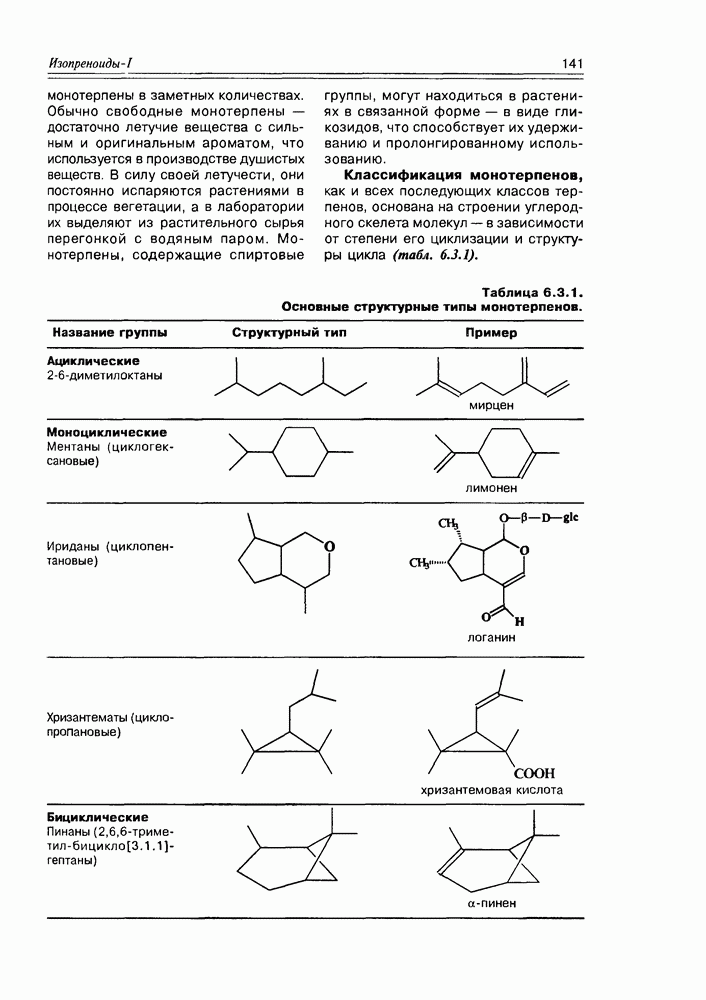
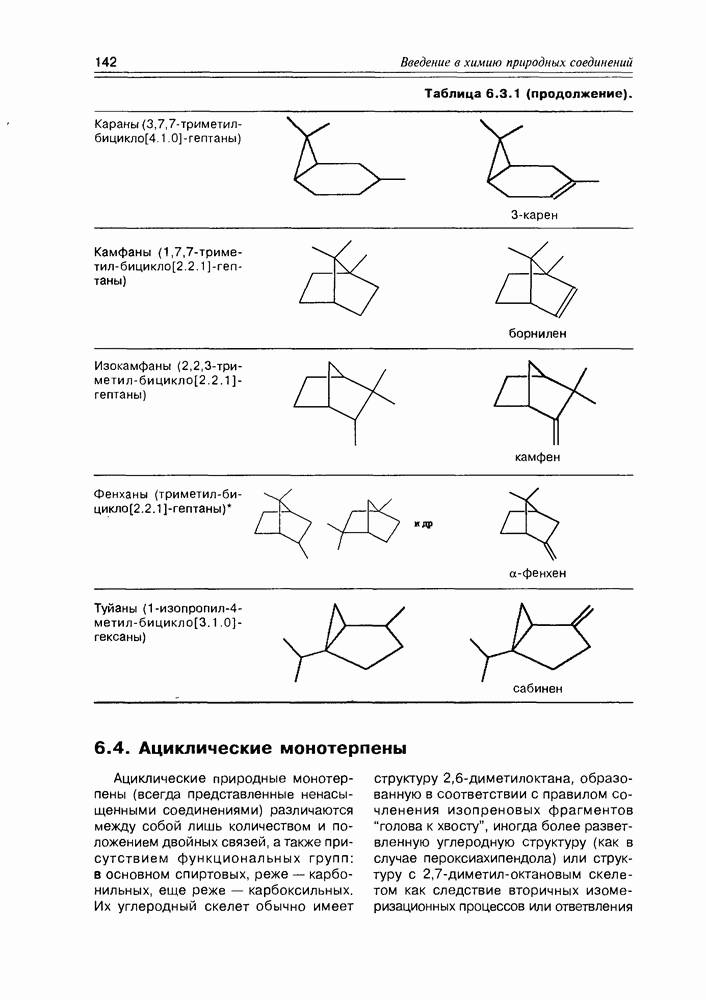
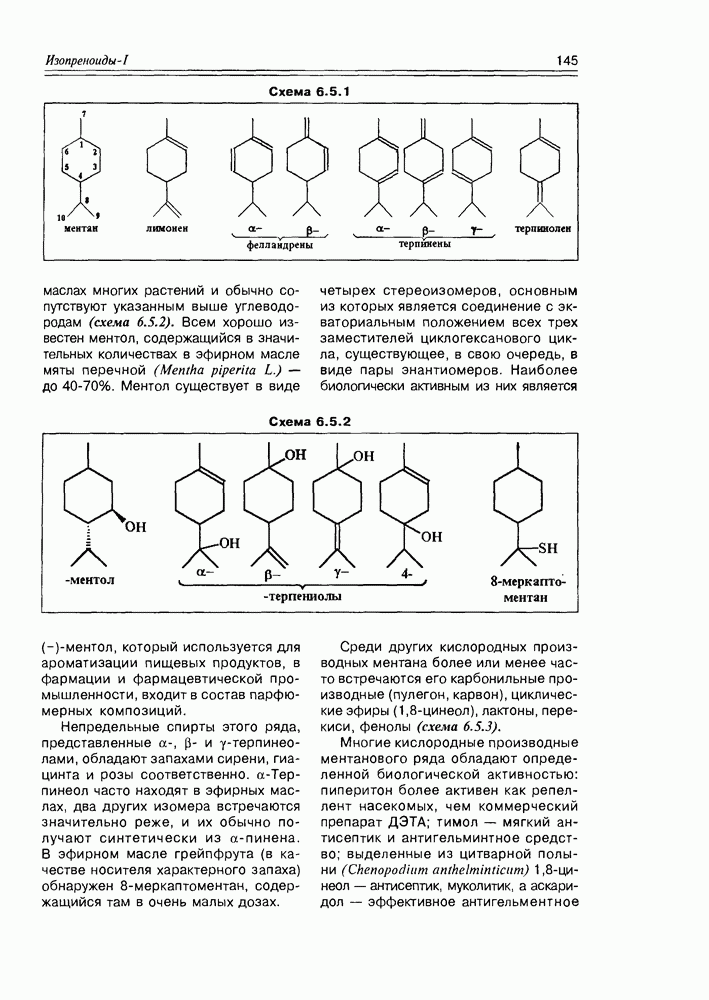
Классификация гидроксикислот построена по общему принципу классификации бифункциональных соединений — согласно взаимному расположению функциональных групп при углеродной цепи и количеству этих функциональных групп (схема 2.1.2). Очень многие природные гидроксикислоты имеют тривиальные названия, которые прочно укоренились в химической и биохимической практике.
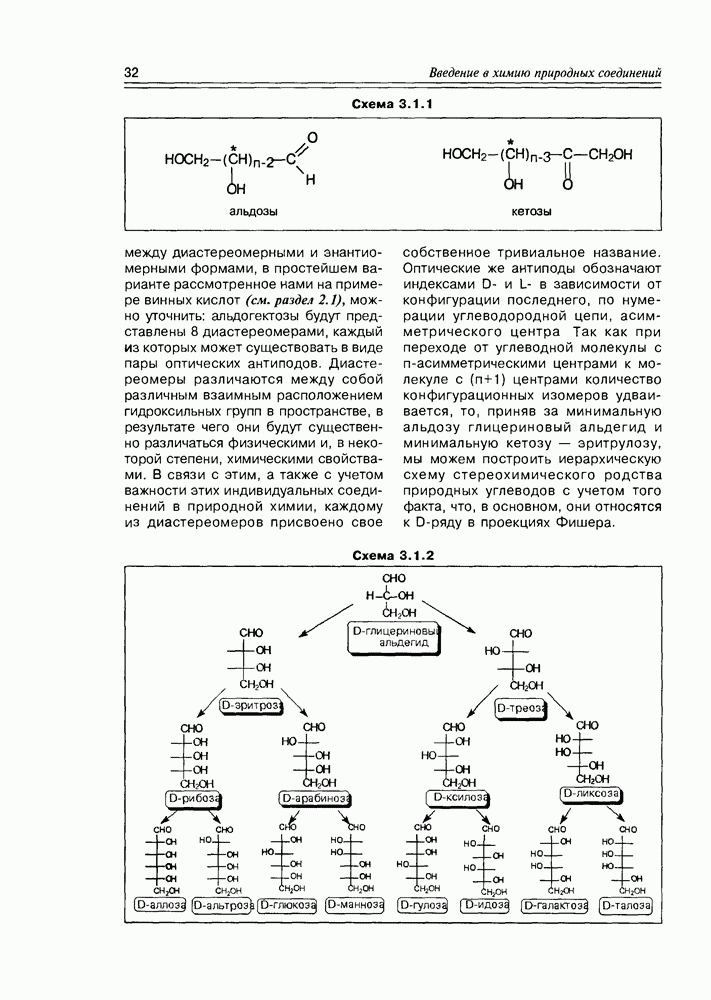
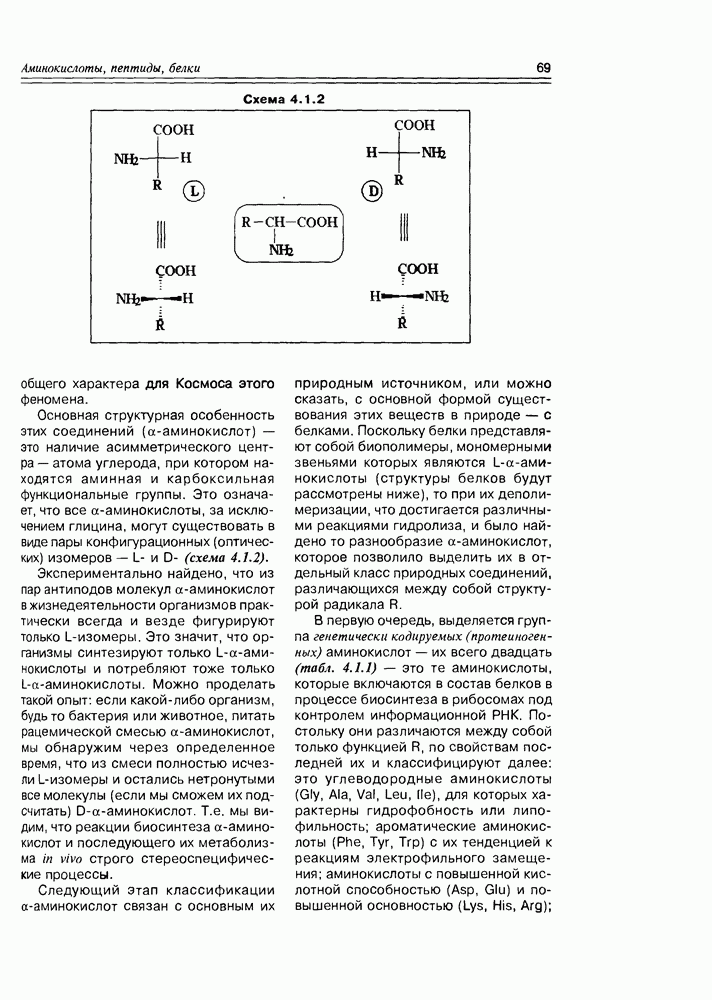
В структурном плане для этих соединений характерно появление молекулярного асимметрического центра, что позволяет присутствовать им в природных источниках в трех формах- (+)-изомера, (-)-изомера и ( -изомера (рацемата). К примеру, молочная кислота образуется при молочнокислом брожении лактозы в виде рацемической смеси, тогда как в животном организме в результате гликолиза образуется
-изомера (рацемата). К примеру, молочная кислота образуется при молочнокислом брожении лактозы в виде рацемической смеси, тогда как в животном организме в результате гликолиза образуется  кислота, которая накапливается в мышцах при интенсивной работе, вызывая характерную мышечную боль (схема 2.1.3).
кислота, которая накапливается в мышцах при интенсивной работе, вызывая характерную мышечную боль (схема 2.1.3).
Схема 2.1.2

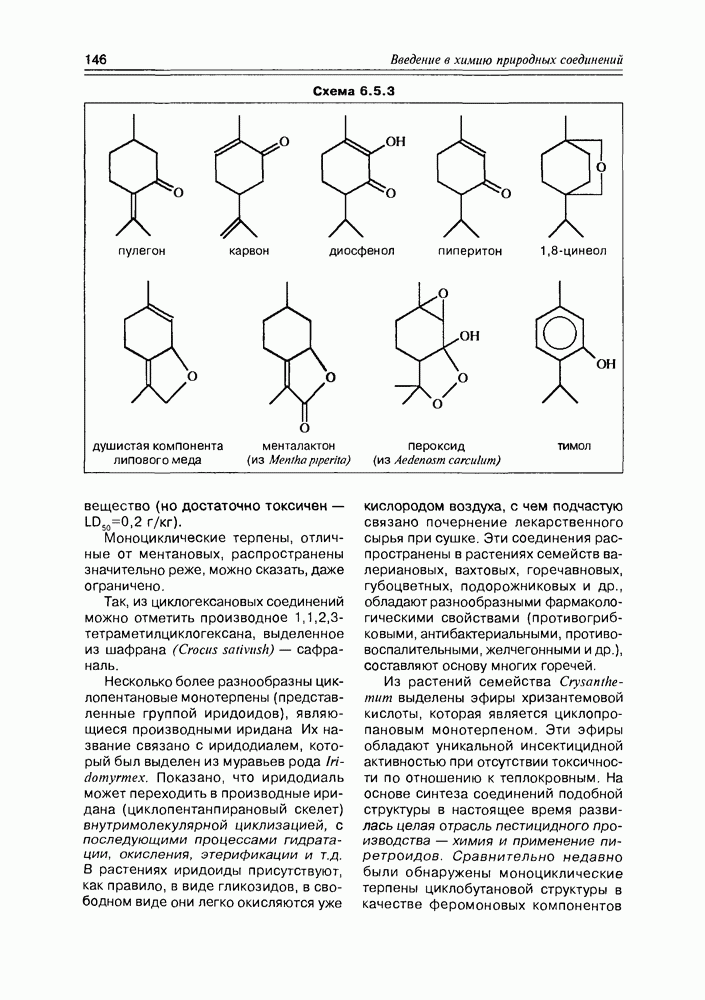
Молекула винной кислоты, образующаяся в процессе брожения виноградного сока, имеет два асимметрических центра, а так как каждый из них может иметь D- и  -конфигурации, то это соединение принципиально может образовать уже четыре конфигурационных изомера:
-конфигурации, то это соединение принципиально может образовать уже четыре конфигурационных изомера:  Так как в молекуле винной кислоты оба асимметрических центра имеют одинаковое окружение и собственно одинаковое вращение, т.е.
Так как в молекуле винной кислоты оба асимметрических центра имеют одинаковое окружение и собственно одинаковое вращение, т.е.  то изомеры
то изомеры  идентичны между собой и оптически неактивны. Фактически молекула этой конфигурации имеет плоскость симметрии и молекулярная асимметрия в ней исчезает. Такой изомер, представляющий собой как бы внутримолекулярный рацемат, называют мезоформой. Этерификация одной карбоксильной группы (или спиртовой группы) мезоформы винной кислоты приводит к нарушению симметрии молекулы (так как два асимметрических центра становятся неравноценными) и, соответственно, к возникновению оптической активности у изомеров
идентичны между собой и оптически неактивны. Фактически молекула этой конфигурации имеет плоскость симметрии и молекулярная асимметрия в ней исчезает. Такой изомер, представляющий собой как бы внутримолекулярный рацемат, называют мезоформой. Этерификация одной карбоксильной группы (или спиртовой группы) мезоформы винной кислоты приводит к нарушению симметрии молекулы (так как два асимметрических центра становятся неравноценными) и, соответственно, к возникновению оптической активности у изомеров 
Тавинная кислота, которая образуется при брожении виноградной кислоты, имеет  еще ее называют виннокаменной кислотой. Остальные изомеры получают рацемизацией природной
еще ее называют виннокаменной кислотой. Остальные изомеры получают рацемизацией природной  кислоты, которая при кипячении со щелочью образует смесь D,
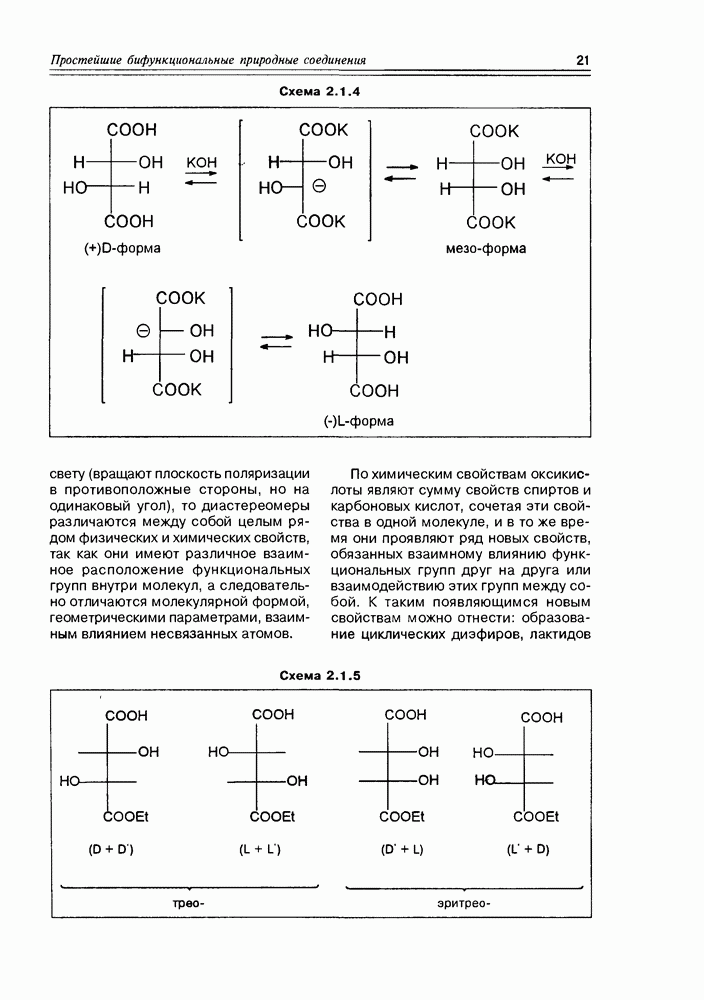
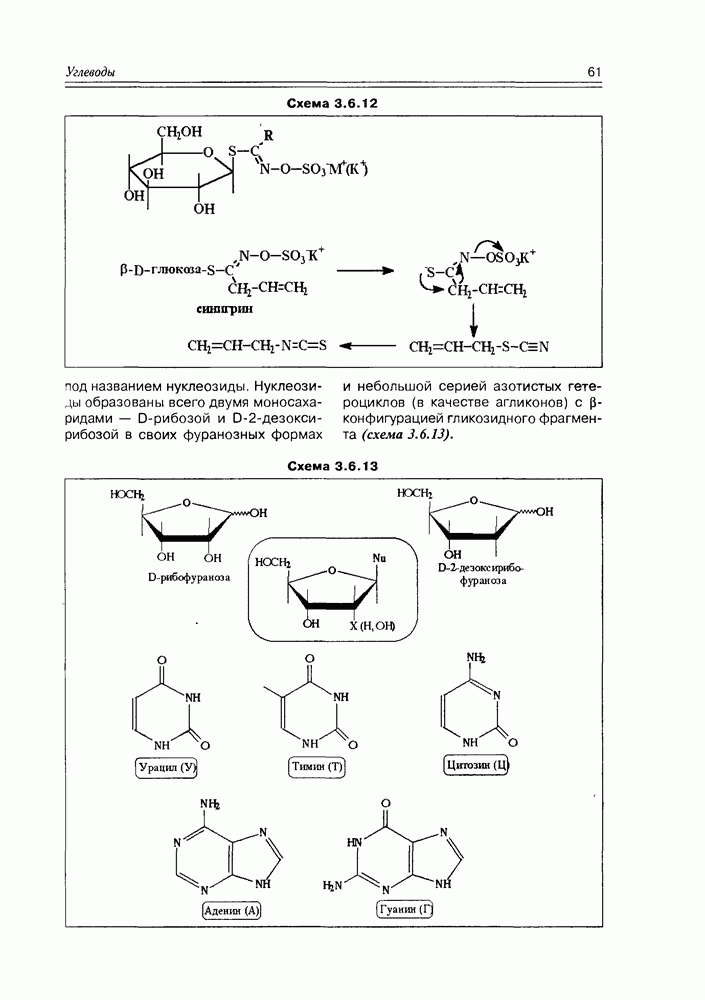
кислоты, которая при кипячении со щелочью образует смесь D,  -рацемата и мезоформы Процесс рацемизации винной кислоты обусловлен ее С-Н-кислыми свойствами (наряду с ОН-кислотностью, конечно) — в щелочной среде она образует карбанион, который легко инвертирует (схема 2.1.4).
-рацемата и мезоформы Процесс рацемизации винной кислоты обусловлен ее С-Н-кислыми свойствами (наряду с ОН-кислотностью, конечно) — в щелочной среде она образует карбанион, который легко инвертирует (схема 2.1.4).
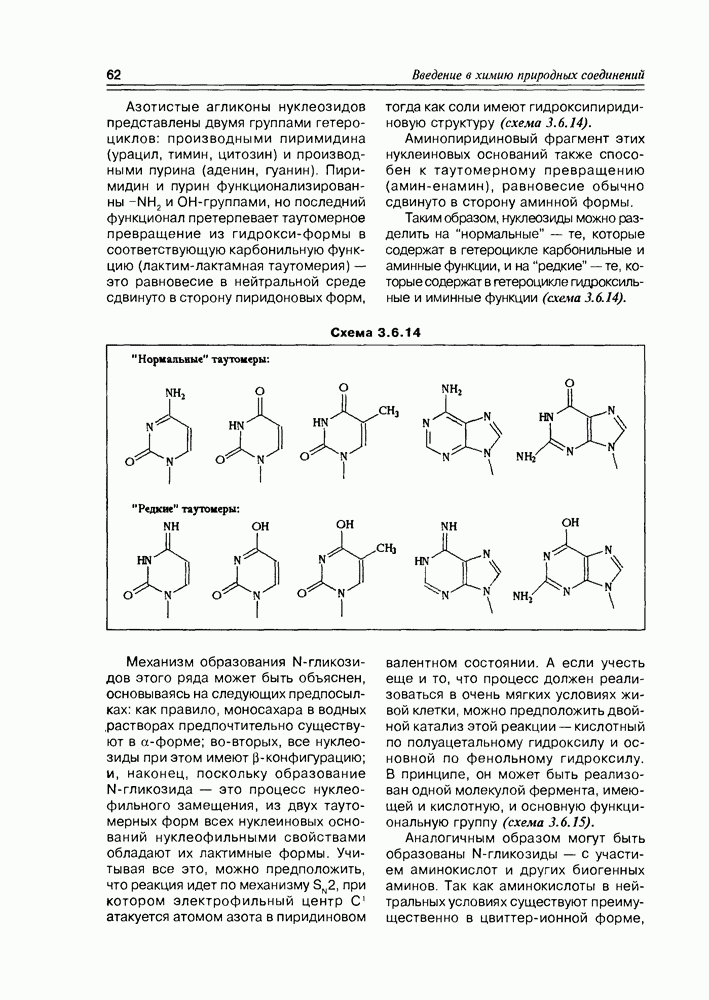
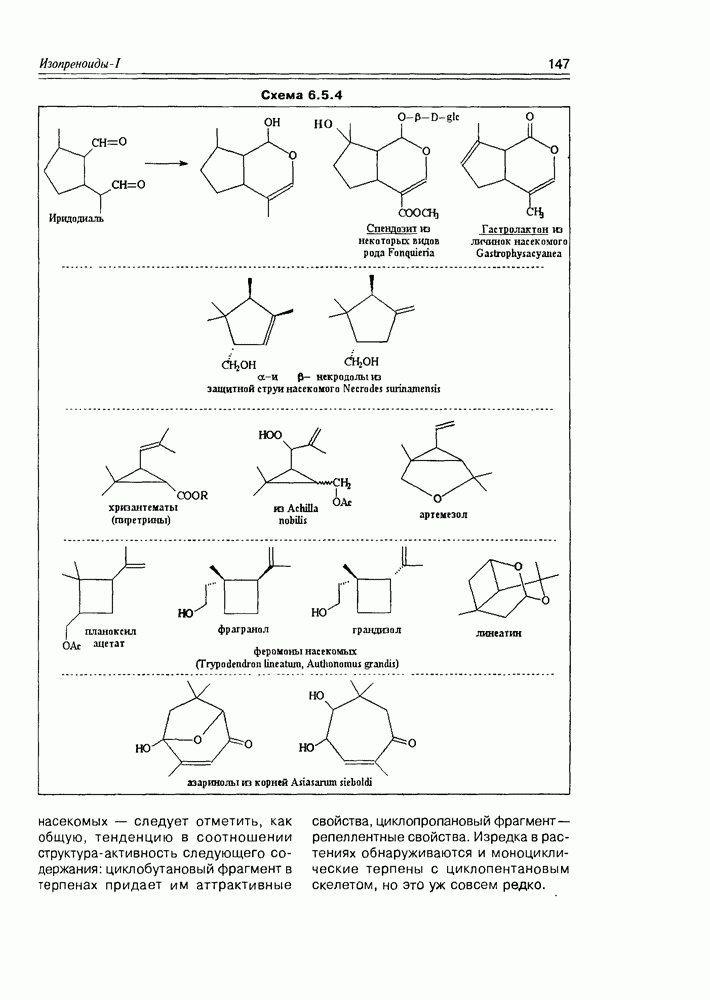
Таким образом, мы получаем общую картину конфигурационной изомерии молекул с двумя асимметрическими центрами, согласно которой такие соединения могут существовать в четырех стереоизомерных формах — пара-треоизомеров и пара-эритроизомеров. Мезоформа, являющаяся результатом идентичности двух асимметрических центров, представляет собой частный случай эритроформы (схема 2.1.5).
Трео-изомеры являют собой пару энантиомеров, также как и эритро-изомеры. Относительно друг друга трео-и эритро-изомеры определяются как диастереомеры. Если известно, что энантиомеры являются друг относительно друга оптическими антиподами, т.е. различаются только по своему отношению к плоскополяризованному
Схема 2.1.4

свету (вращают плоскость поляризации в противоположные стороны, но на одинаковый угол), то диастереомеры различаются между собой целым рядом физических и химических свойств, так как они имеют различное взаимное расположение функциональных групп внутри молекул, а следовательно отличаются молекулярной формой, геометрическими параметрами, взаимным влиянием несвязанных атомов.
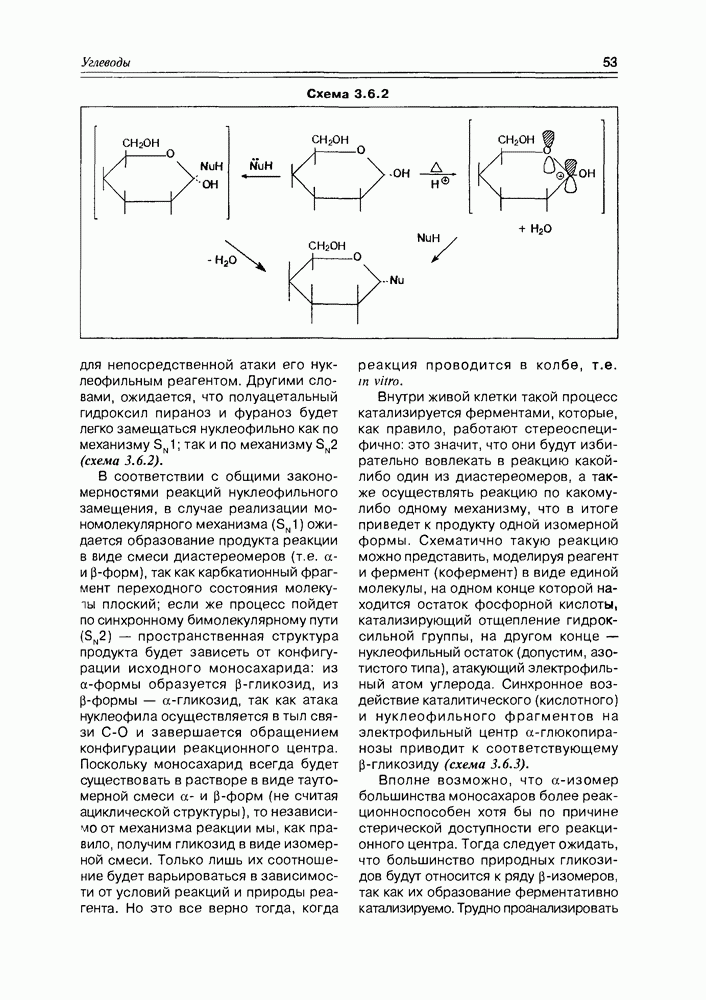
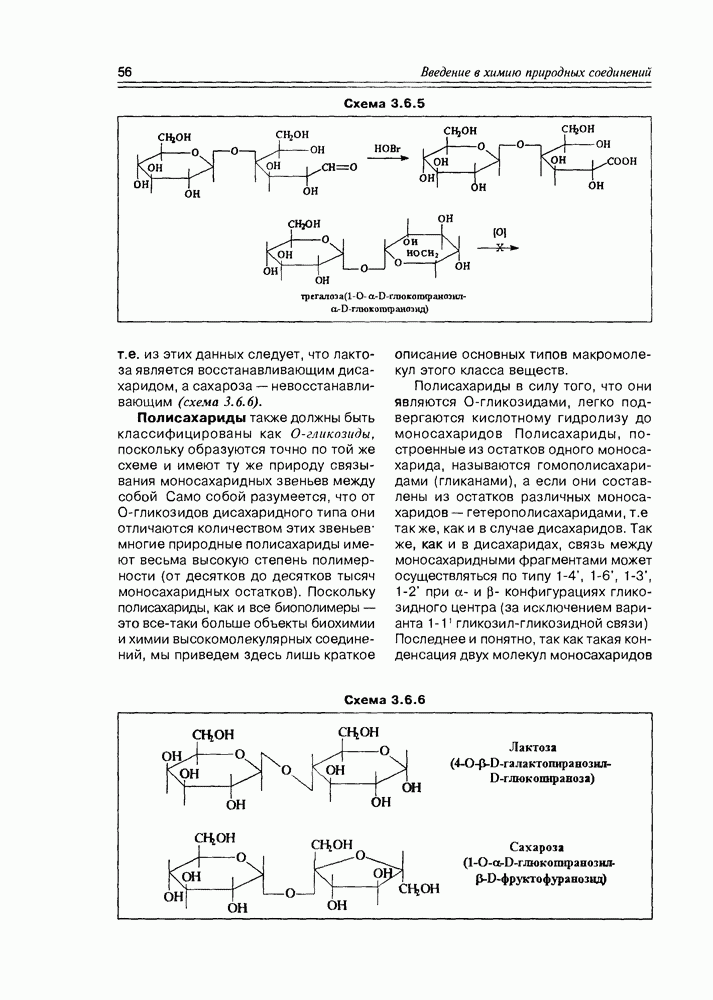
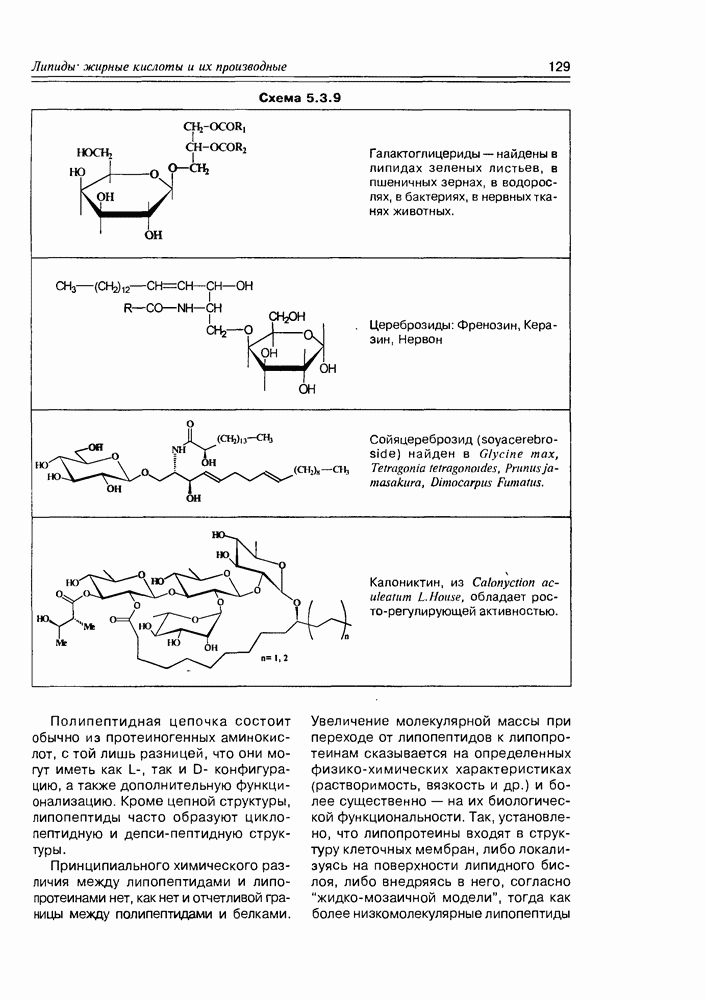
По химическим свойствам оксикислоты являют сумму свойств спиртов и карбоновых кислот, сочетая эти свойства в одной молекуле, и в то же время они проявляют ряд новых свойств, обязанных взаимному влиянию функциональных групп друг на друга или взаимодействию этих групп между собой. К таким появляющимся новым свойствам можно отнести: образование циклических диэфиров, лактидов
Схема 2.1.5

Схема 2.1.6

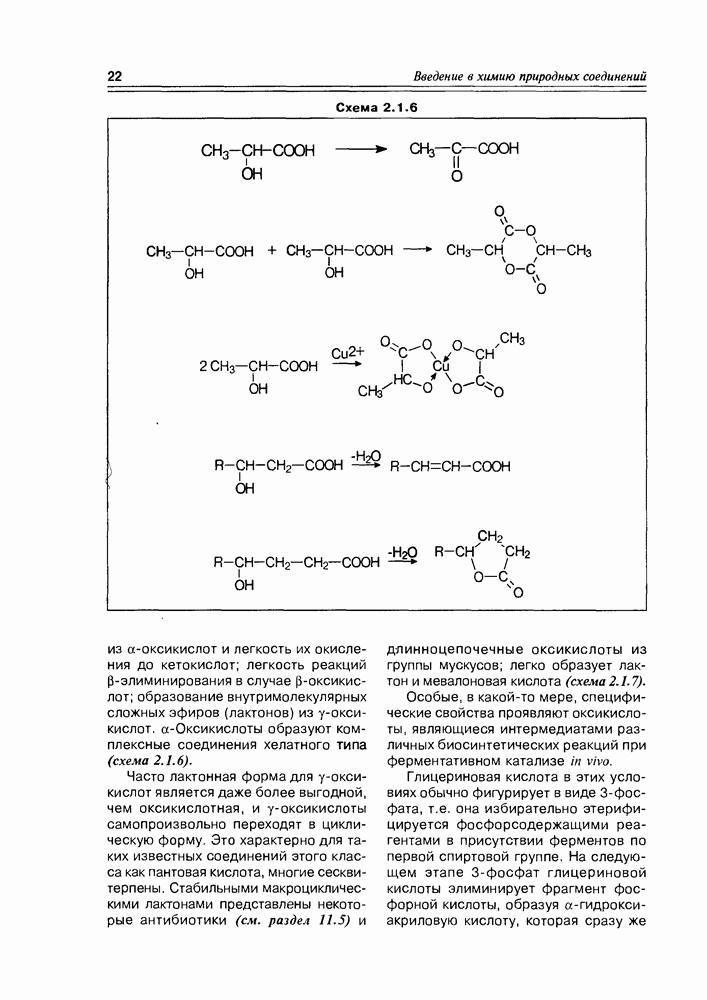
из а-оксикислот и легкость их окисления до кетокислот; легкость реакций  -элиминирования в случае
-элиминирования в случае  -оксикислот; образование внутримолекулярных сложных эфиров (лактонов) из у-оксикислот. а-Оксикислоты образуют комплексные соединения хелатного типа (схема 2.1.6).
-оксикислот; образование внутримолекулярных сложных эфиров (лактонов) из у-оксикислот. а-Оксикислоты образуют комплексные соединения хелатного типа (схема 2.1.6).
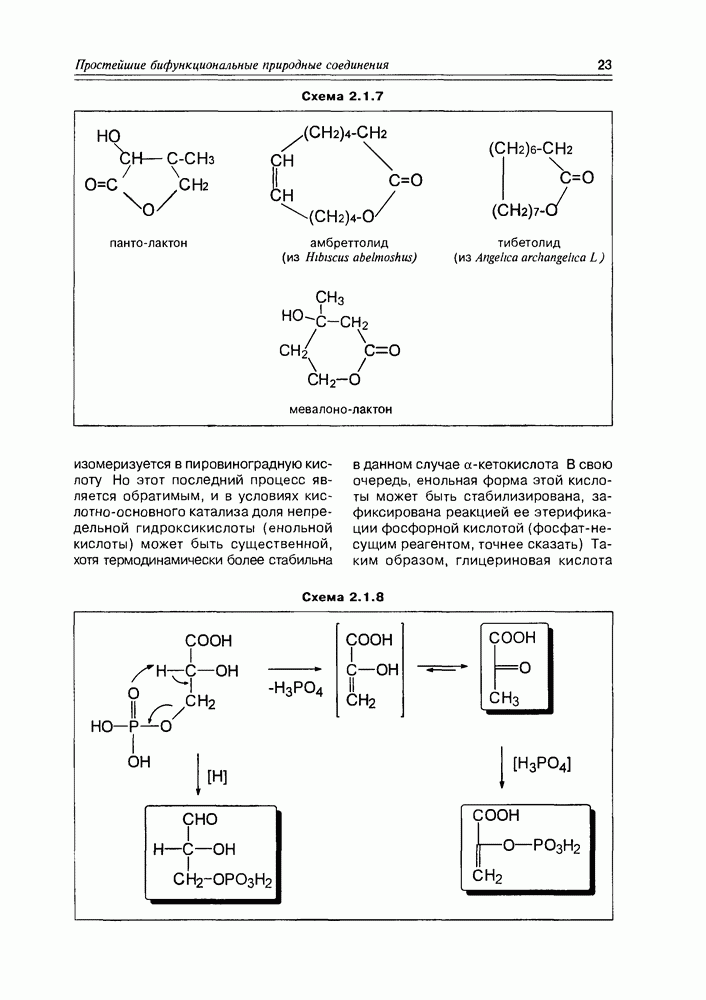
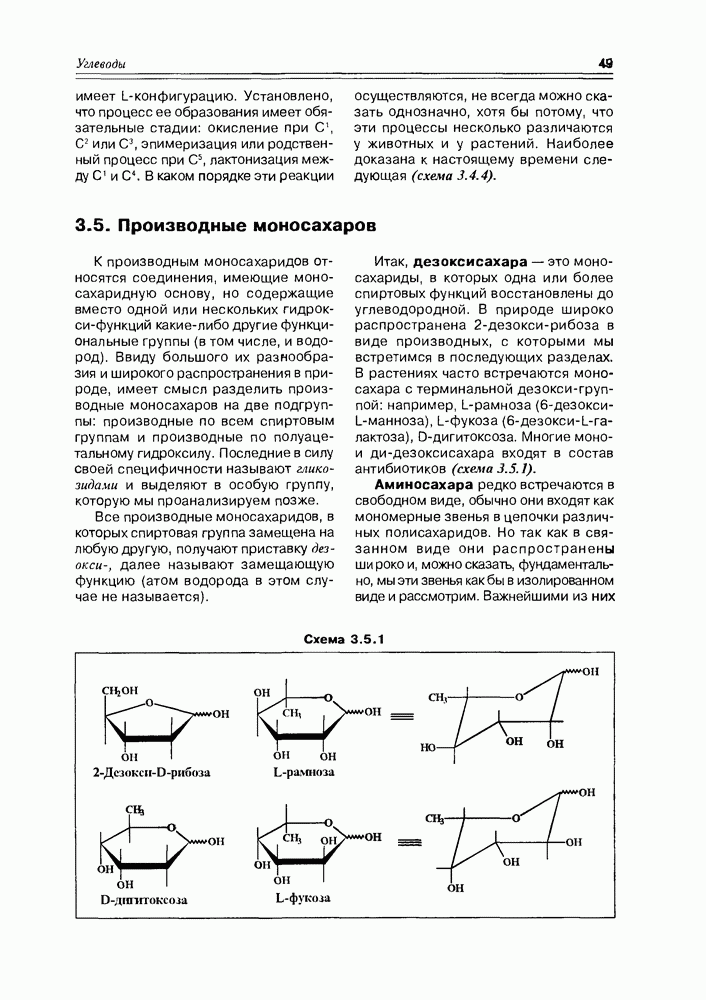
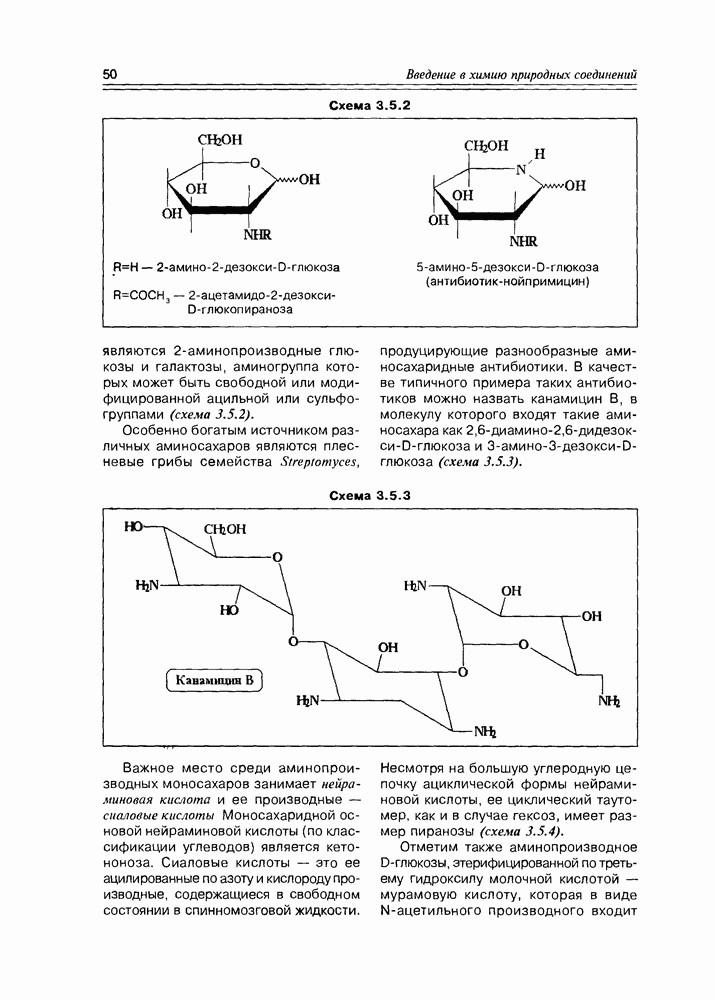
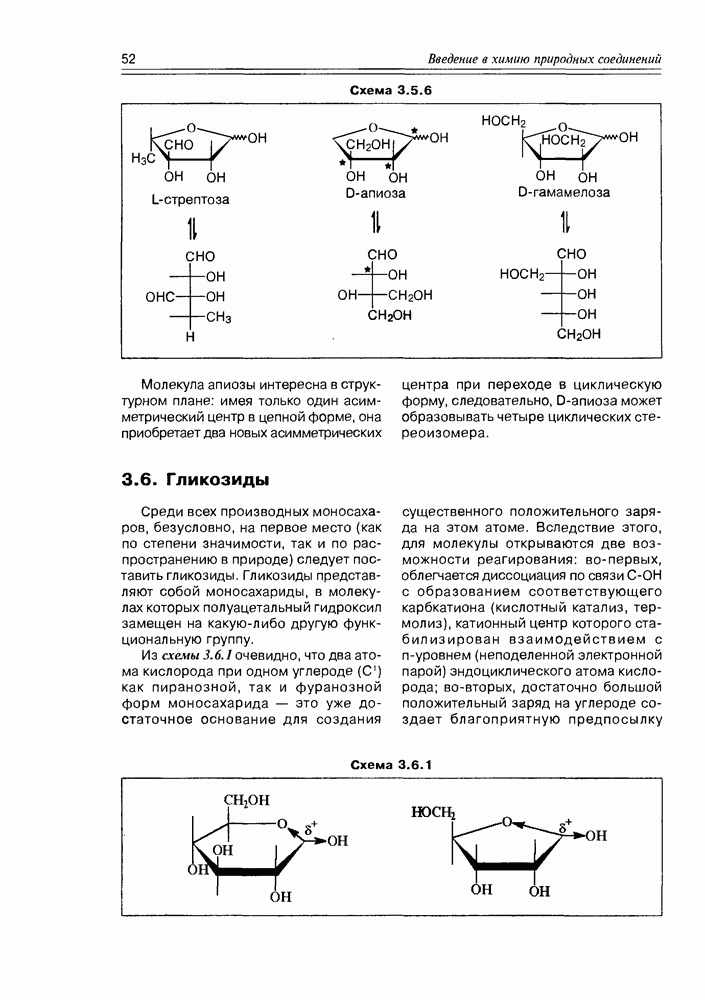
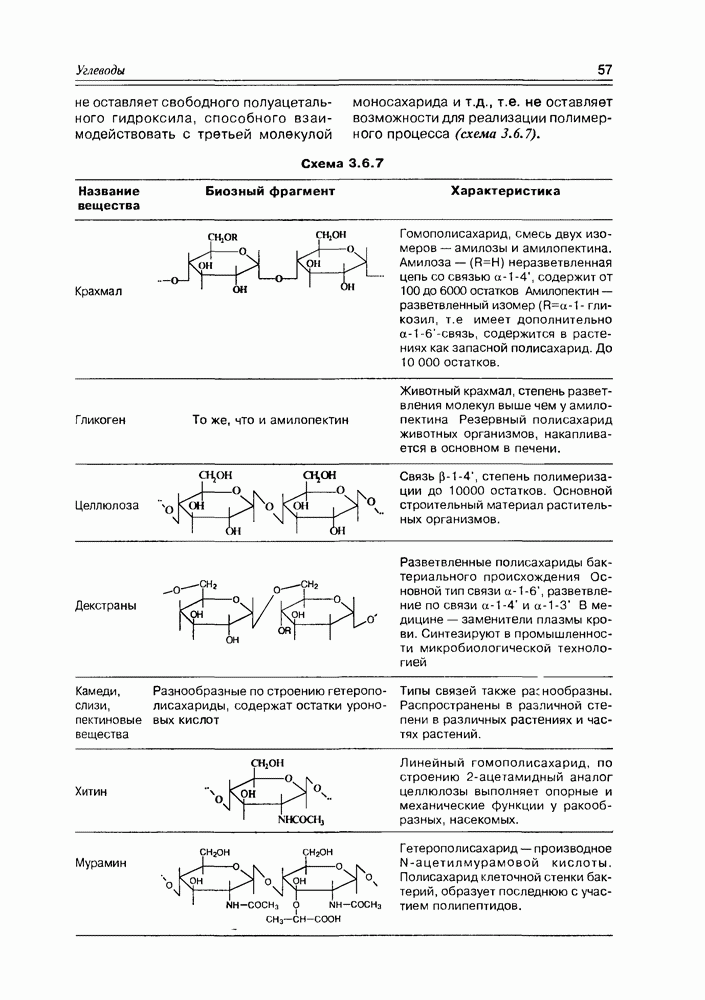
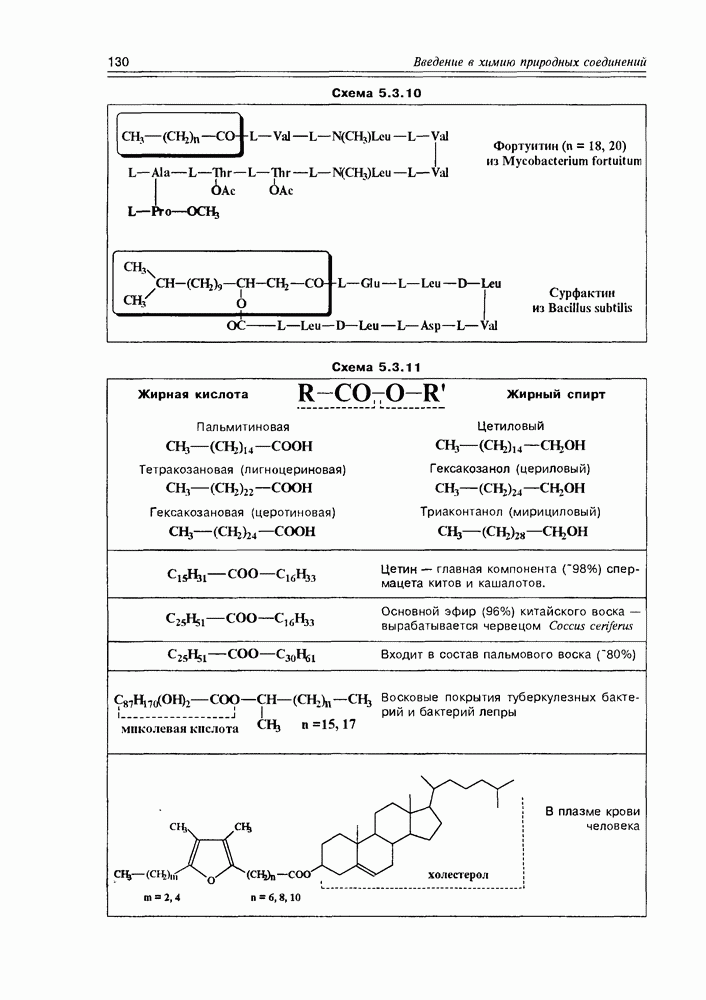
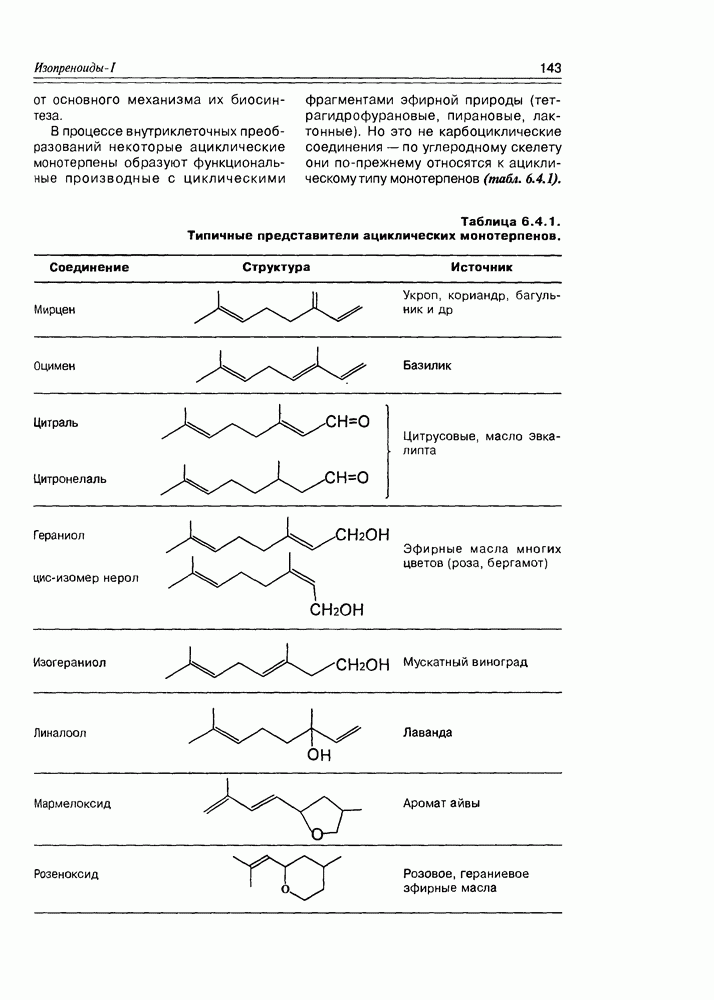
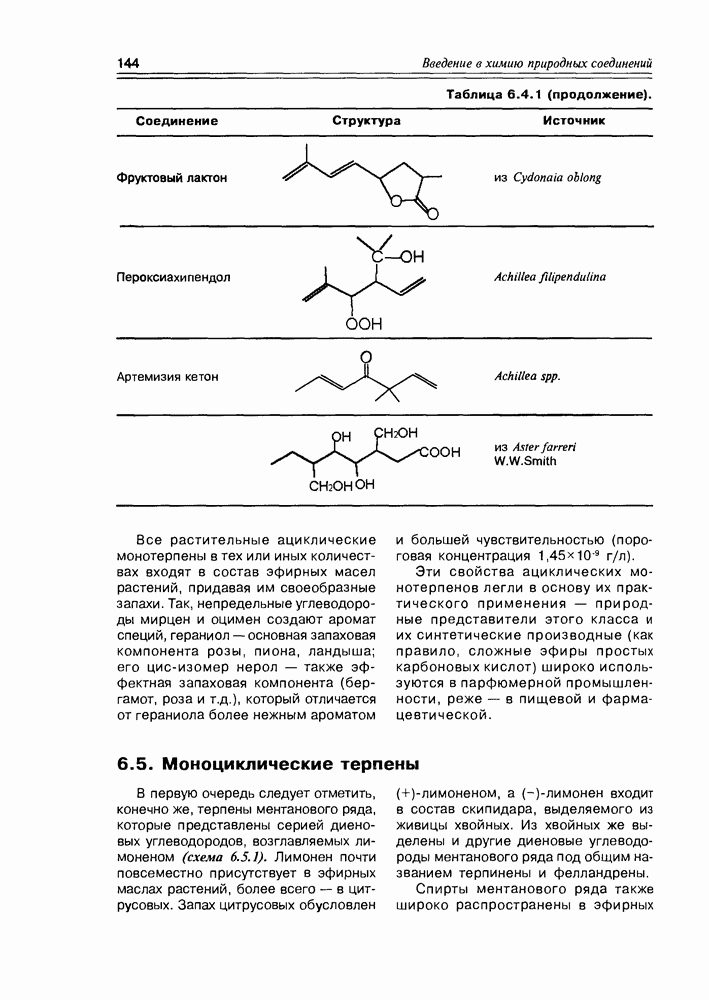
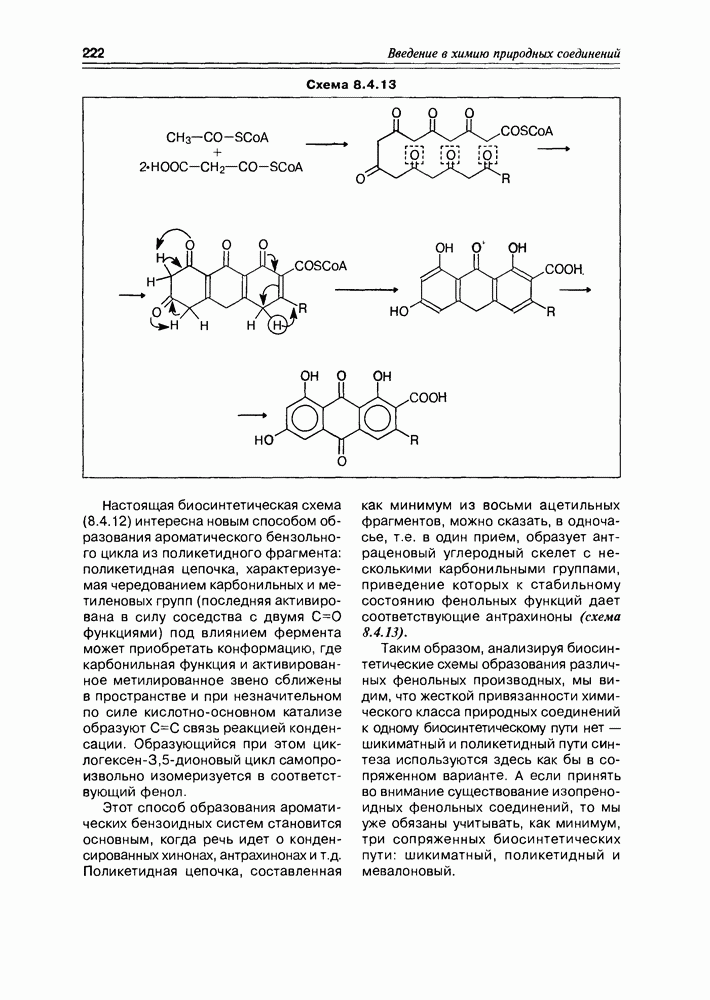
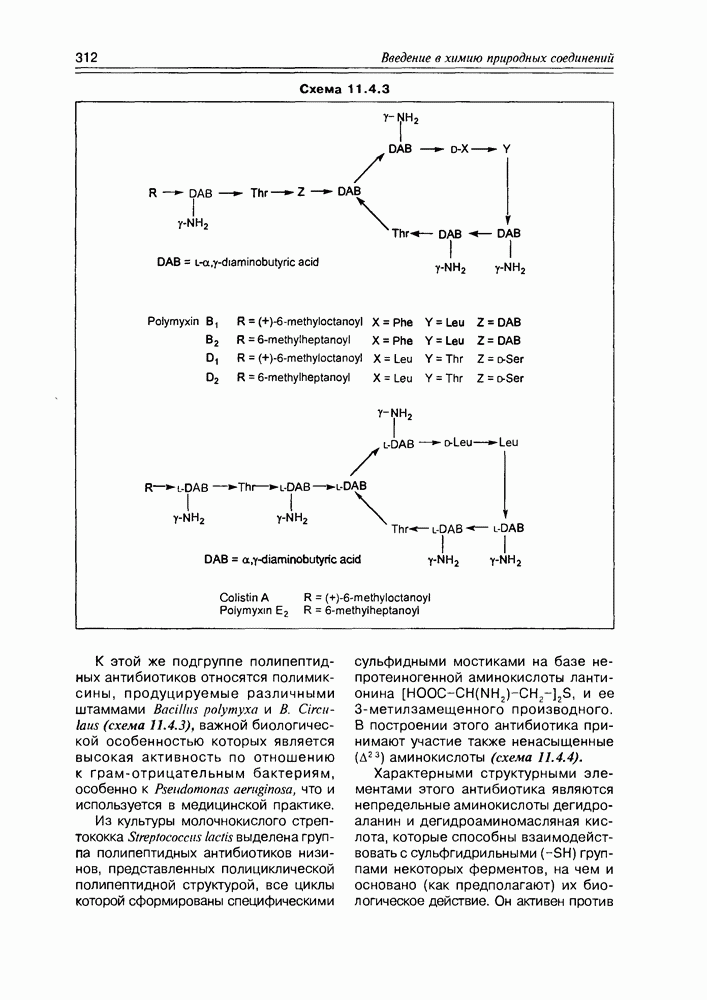
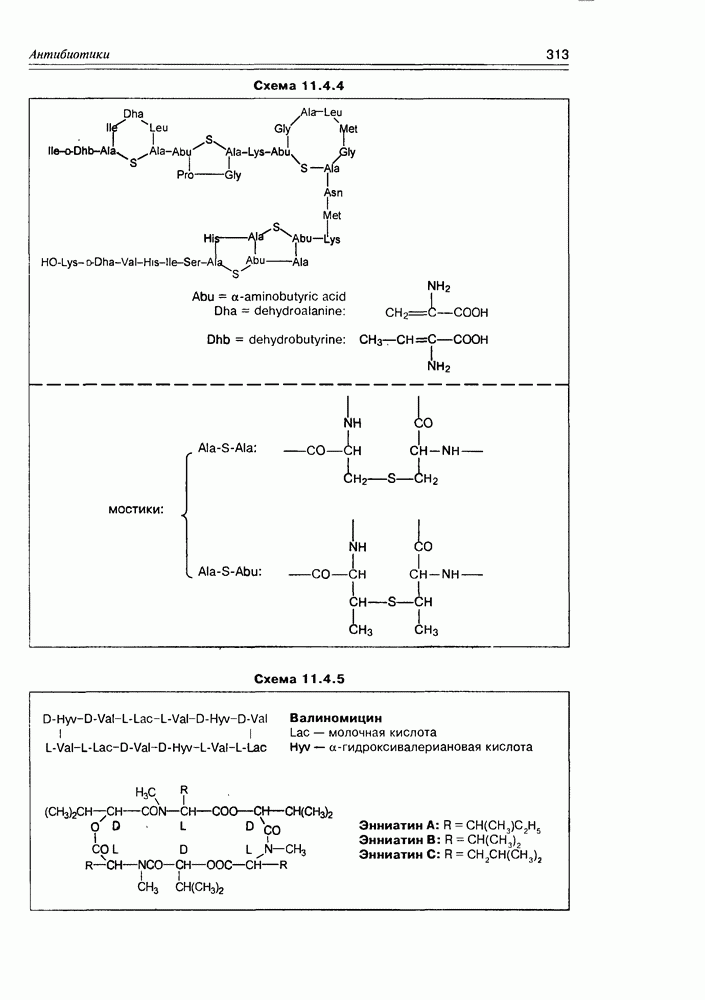
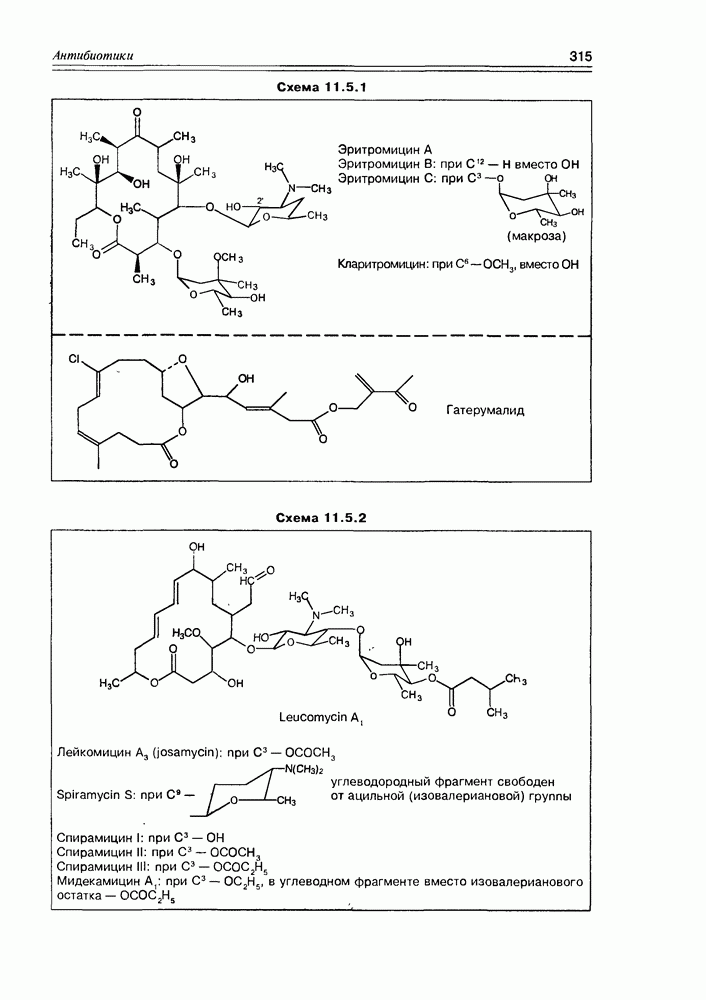
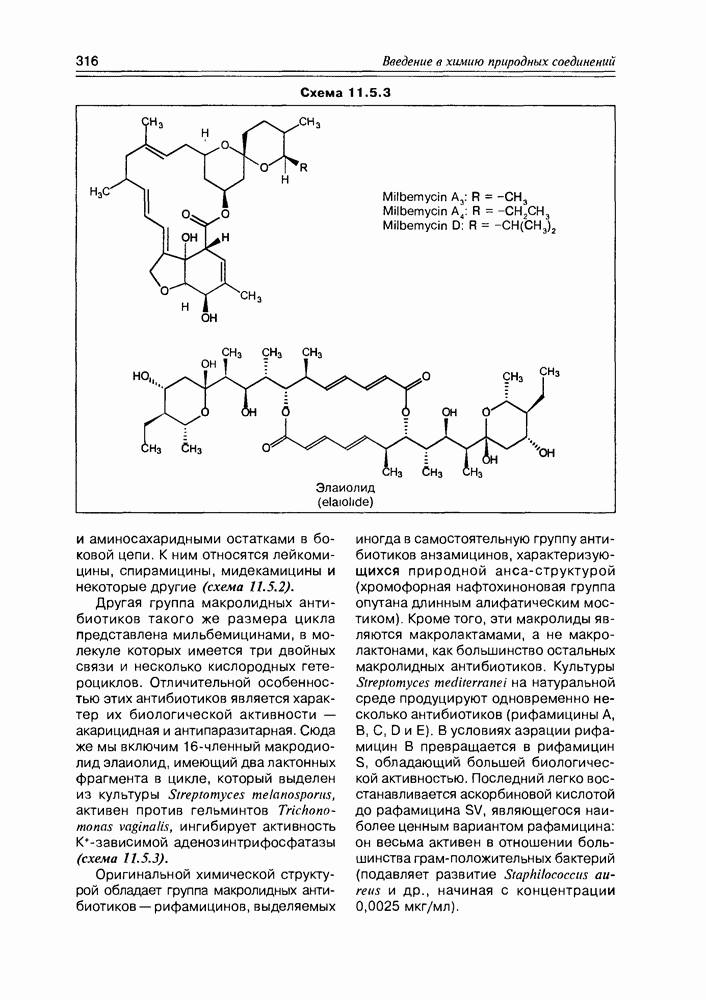
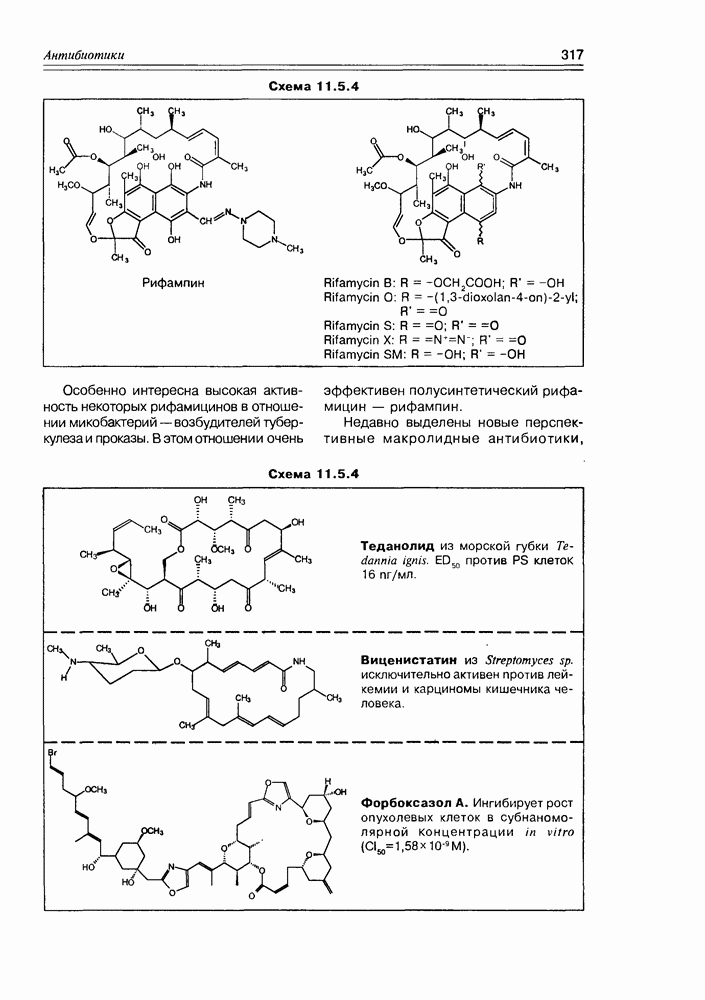
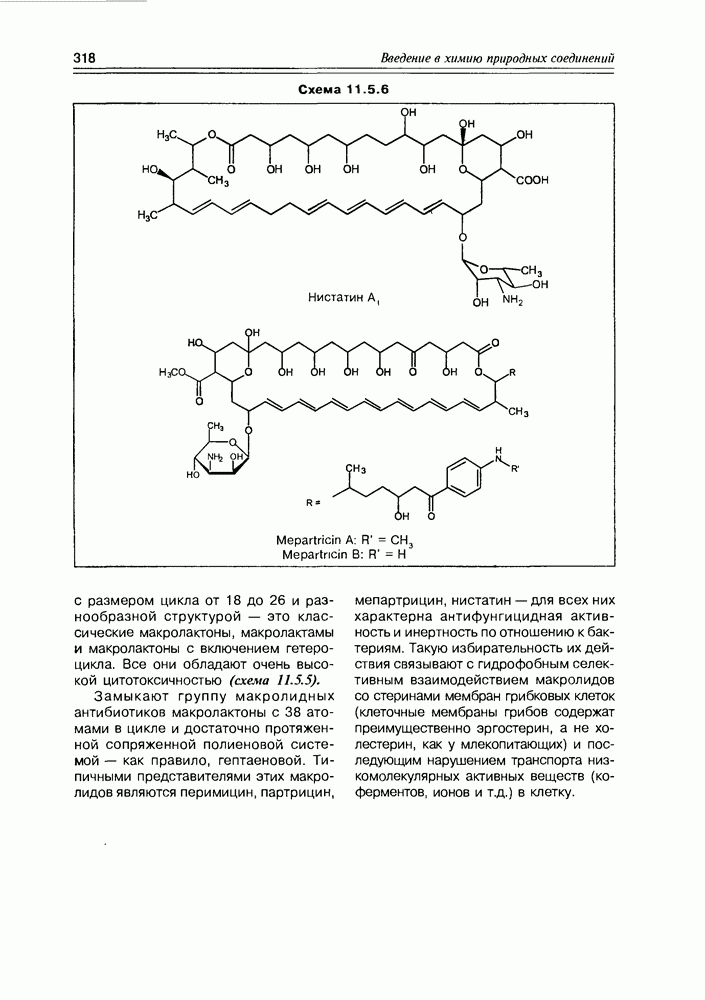
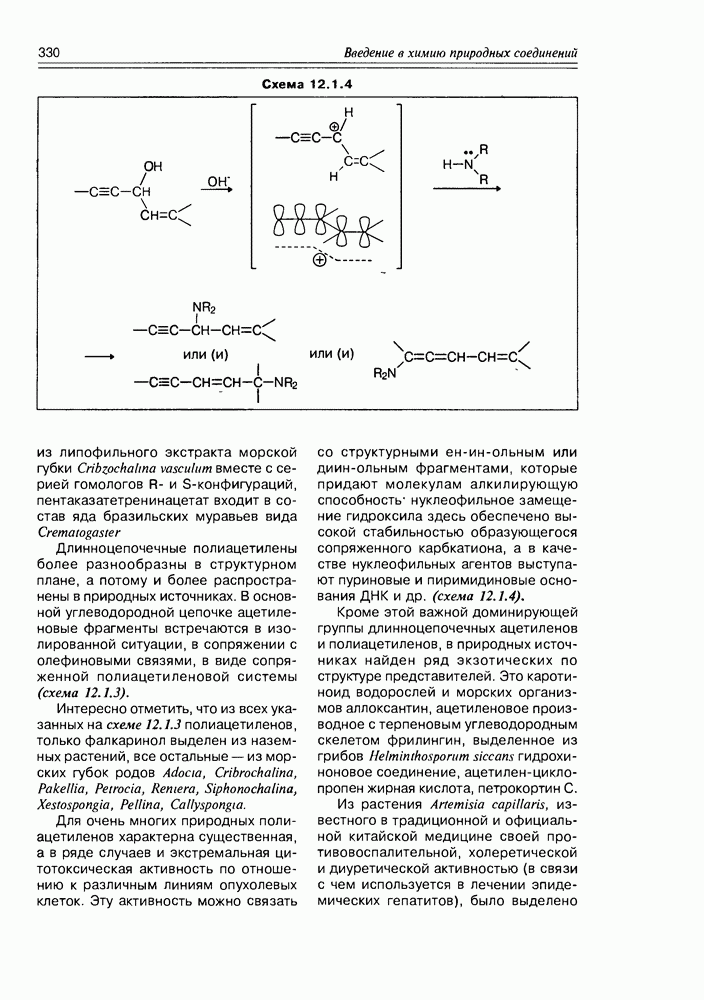
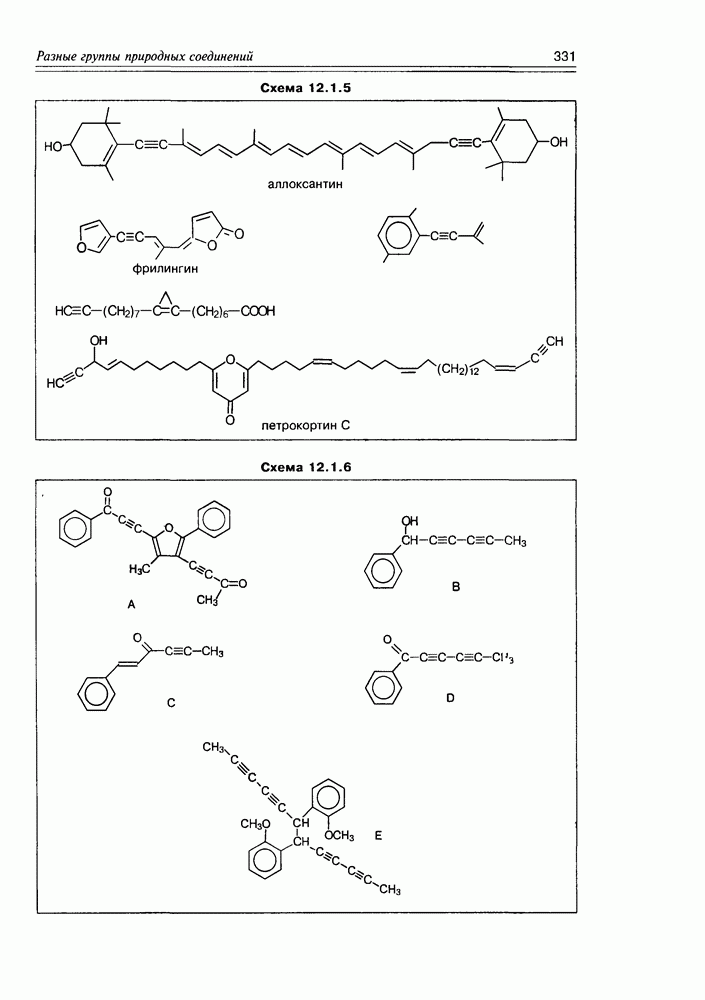
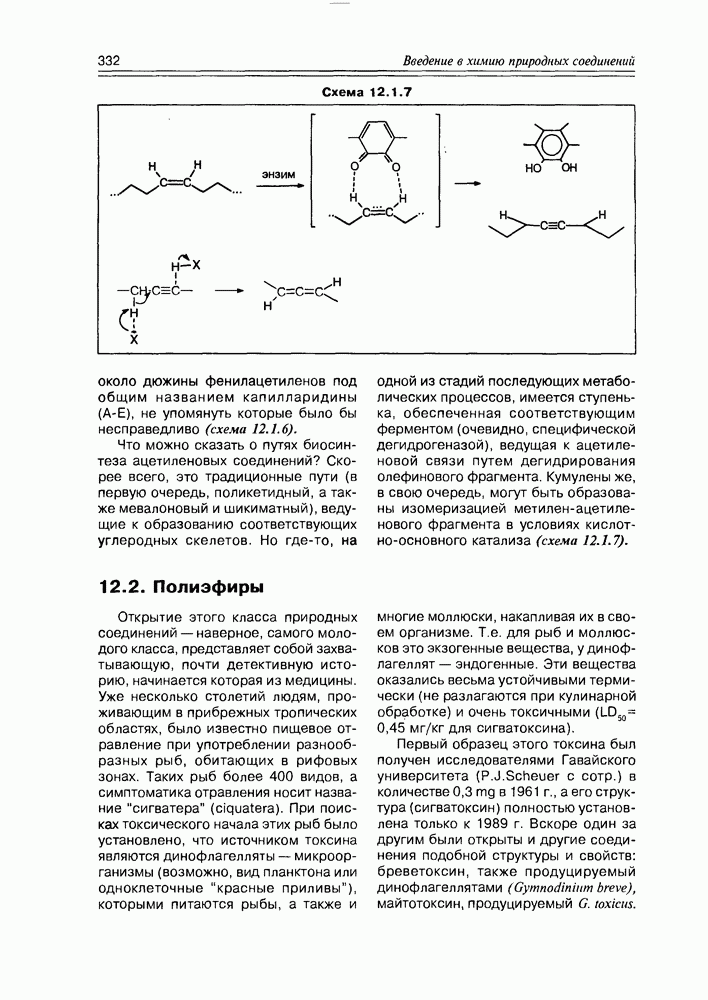
Часто лактонная форма для у-оксикислот является даже более выгодной, чем оксикислотная, и у-оксикислоты самопроизвольно переходят в циклическую форму. Это характерно для таких известных соединений этого класса как пантовая кислота, многие сесквитерпены. Стабильными макроциклическими лактонами представлены некоторые антибиотики (см. раздел 11.5) и длинноцепочечные оксикислоты из группы мускусов; легко образует лактон и мевалоновая кислота (схема 2.1.7).
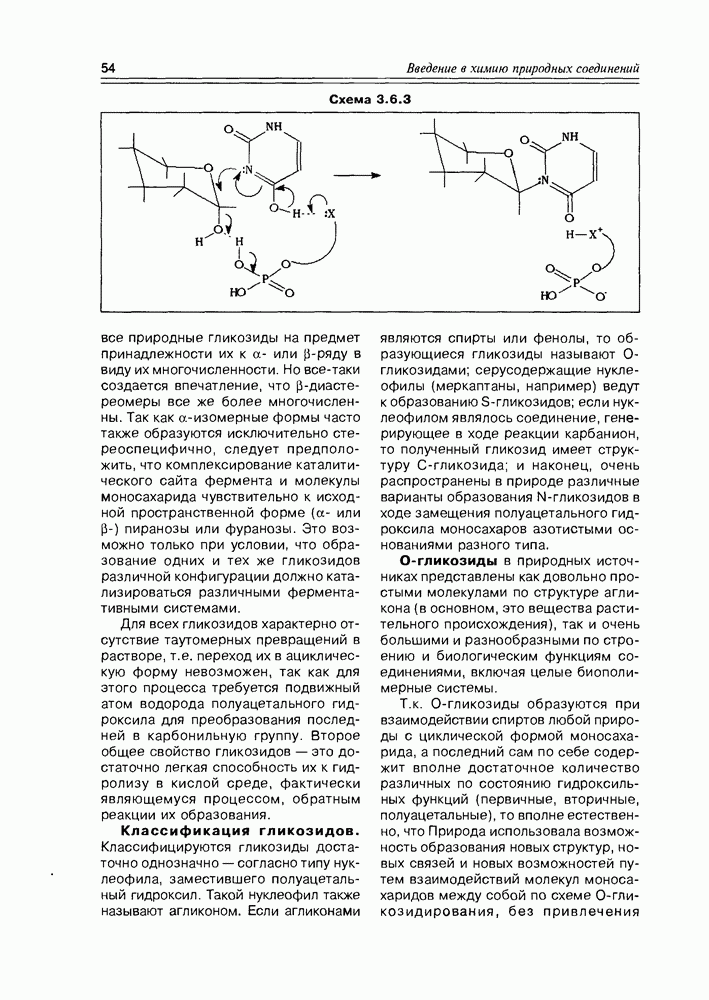
Особые, в какой-то мере, специфические свойства проявляют оксикислоты, являющиеся интермедиатами различных биосинтетических реакций при ферментативном катализе in vivo.
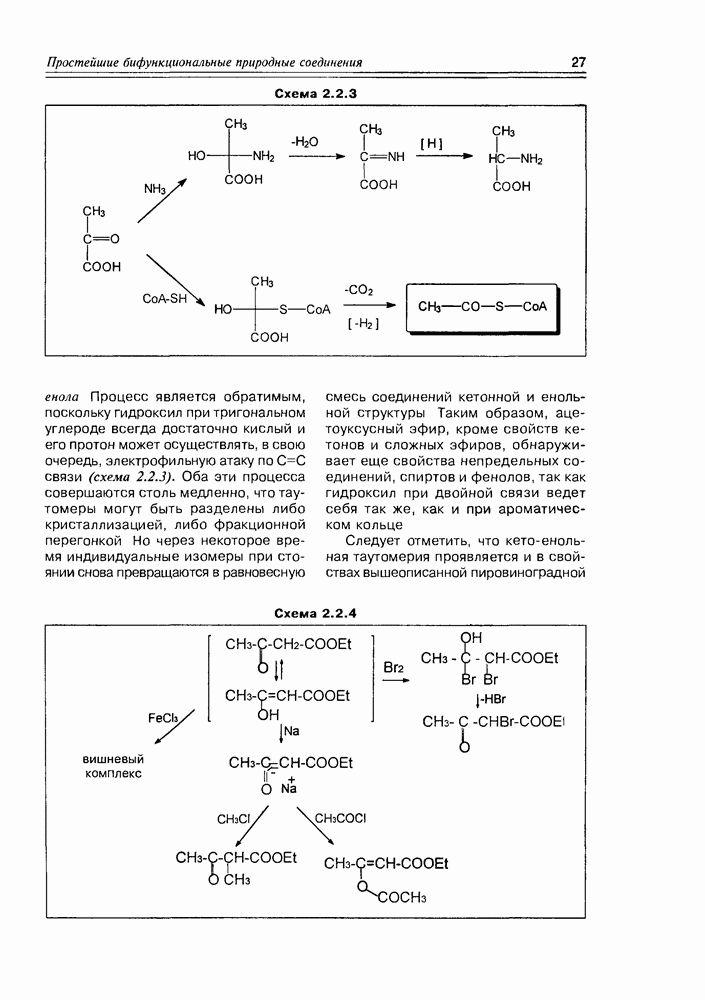
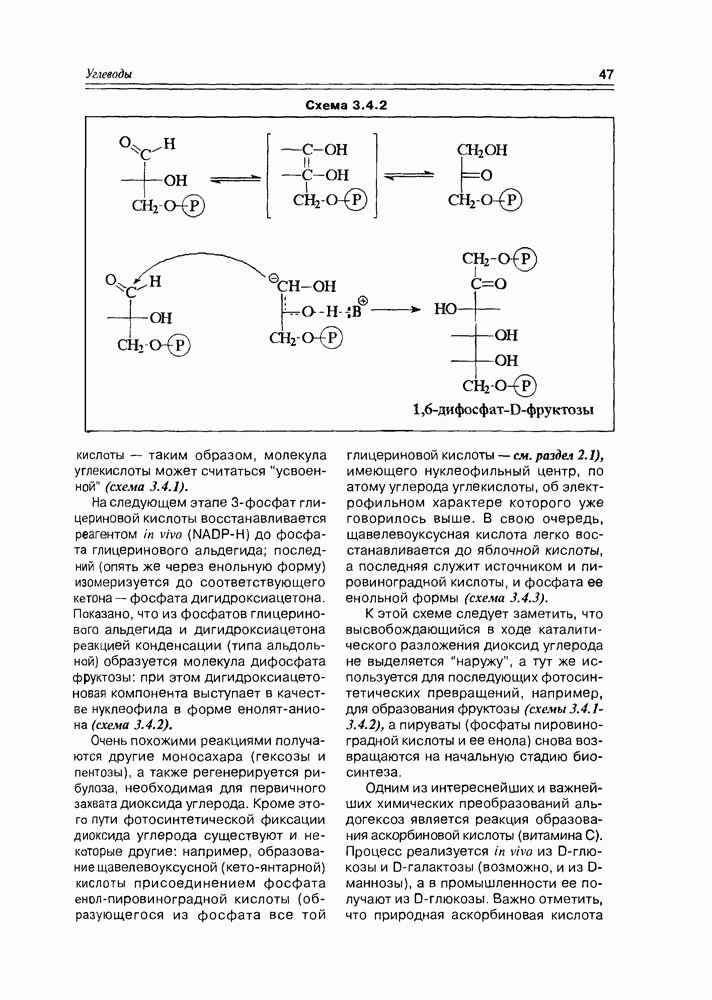
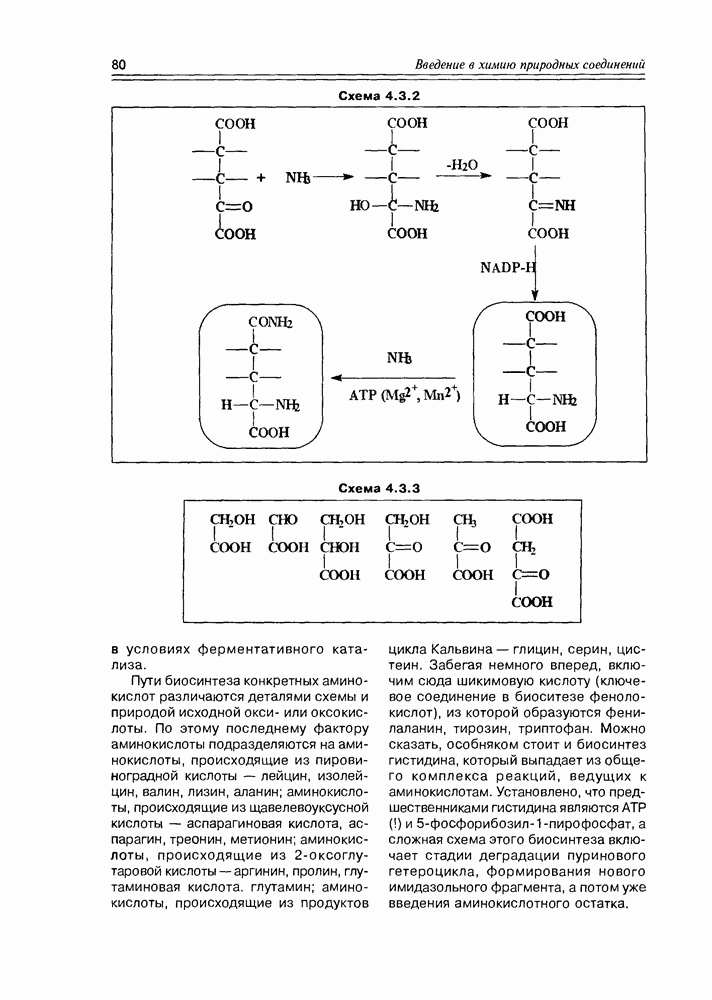
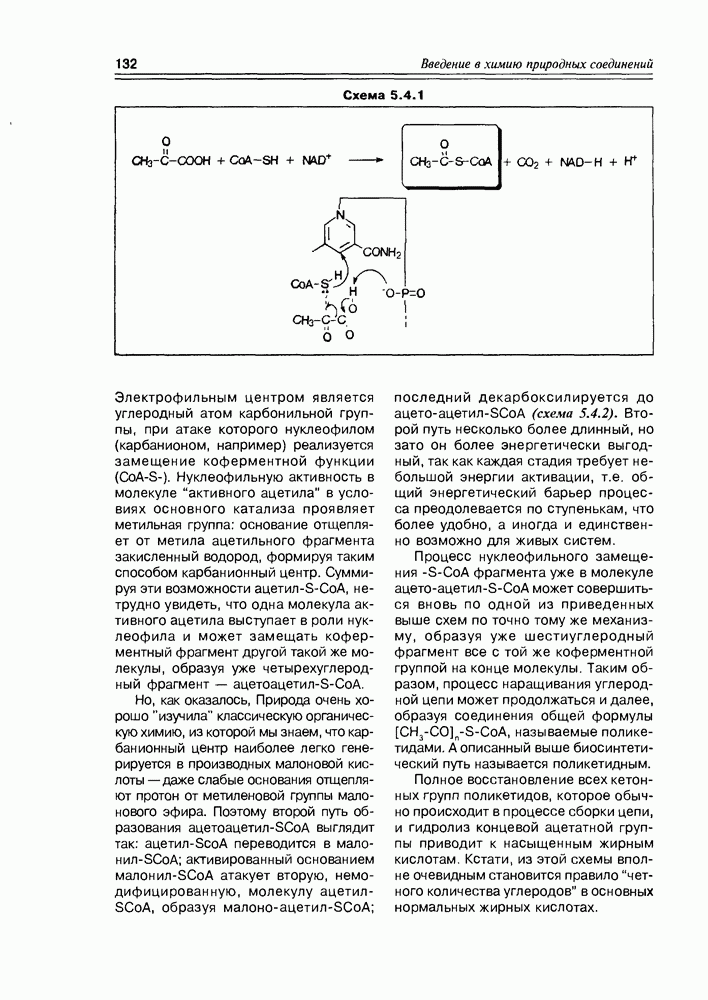
Глицериновая кислота в этих условиях обычно фигурирует в виде 3-фосфата, т.е. она избирательно этерифицируется фосфорсодержащими реагентами в присутствии ферментов по первой спиртовой группе. На следующем этапе 3-фосфат глицериновой кислоты элиминирует фрагмент фосфорной кислоты, образуя а-гидроксиакриловую кислоту, которая сразу же
Схема 2.1.7

изомеризуется в пировиноградную кислоту Но этот последний процесс является обратимым, и в условиях кислотно-основного катализа доля непредельной гидроксикислоты (енольной кислоты) может быть существенной, хотя термодинамически более стабильна в данном случае а-кетокислота В свою очередь, енольная форма этой кислоты может быть стабилизирована, зафиксирована реакцией ее этерификации фосфорной кислотой (фосфат-несущим реагентом, точнее сказать) Таким образом, глицериновая кислота
Схема 2.1.8

Схема 2.1.9
(см. скан)
Схема 2.1.10
(см. скан)
является источником двух новых соединений кислотного типа, а если учесть еще реакцию восстановления карбоксильной группы до альдегидной, то уже трех веществ, которые известны как важные промежуточные продукты основных химических процессов in vivo (схема 2.1.8). Следует заметить, что в заметных количествах они в организмах не накапливаются.
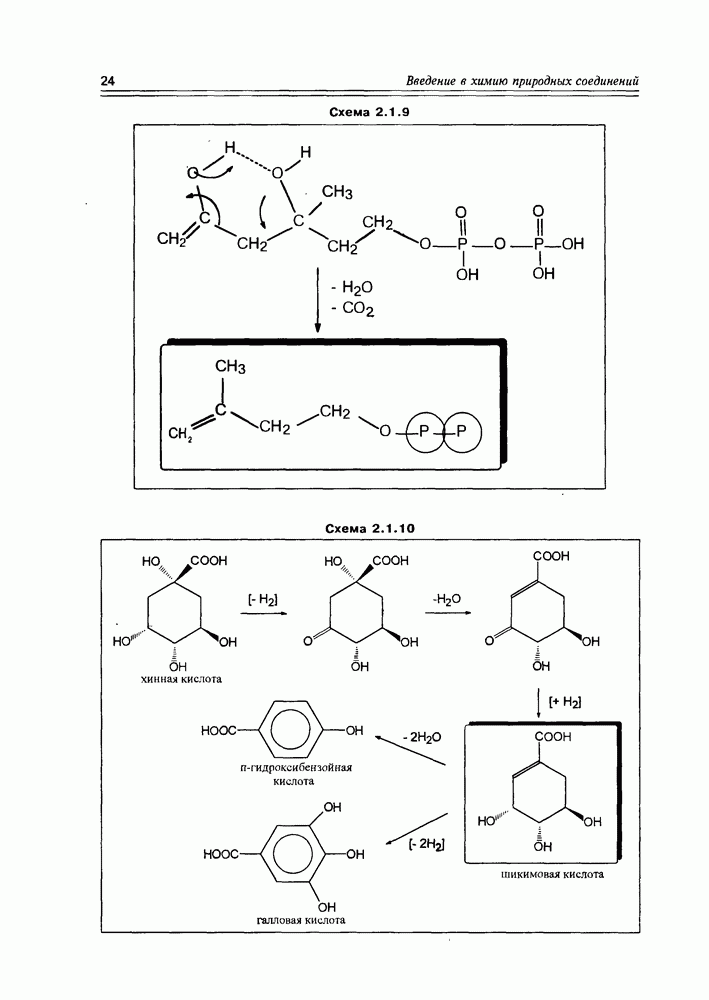
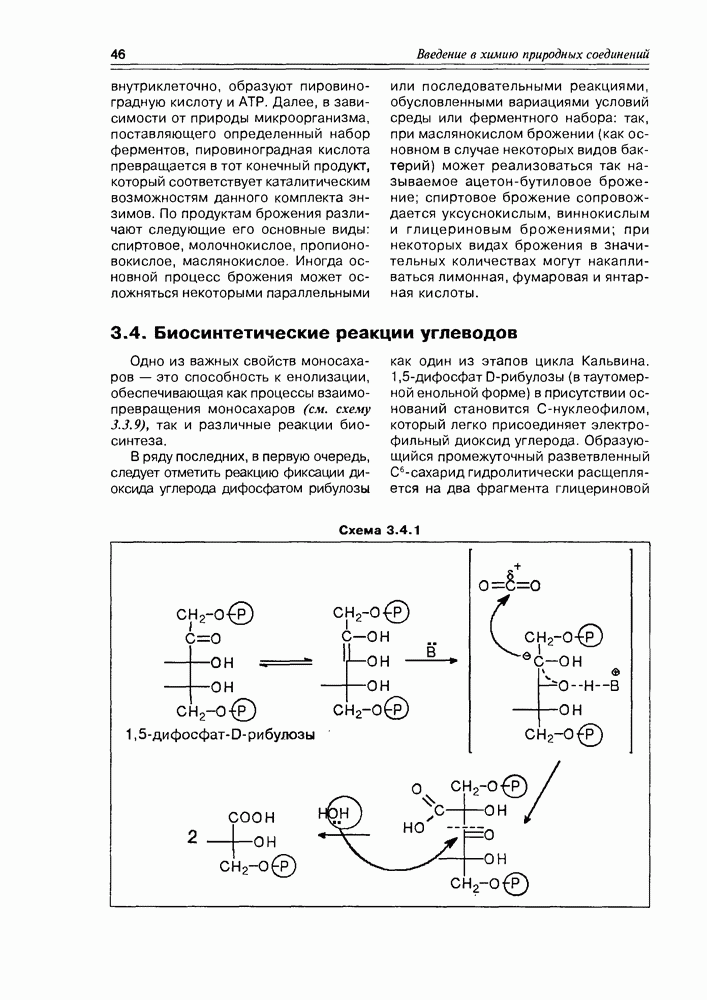
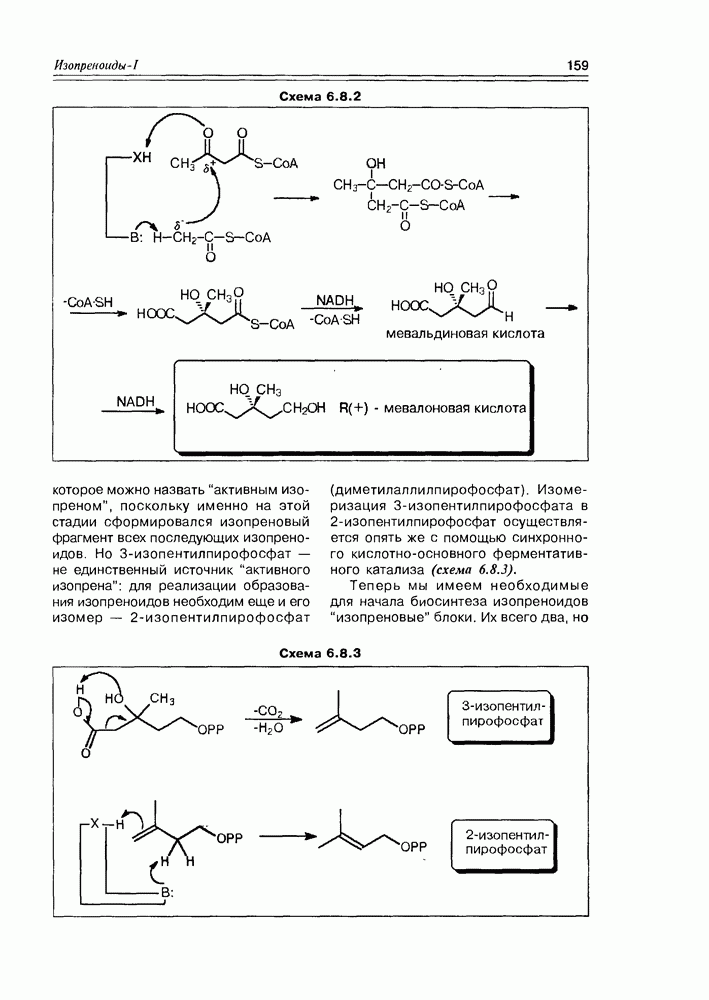
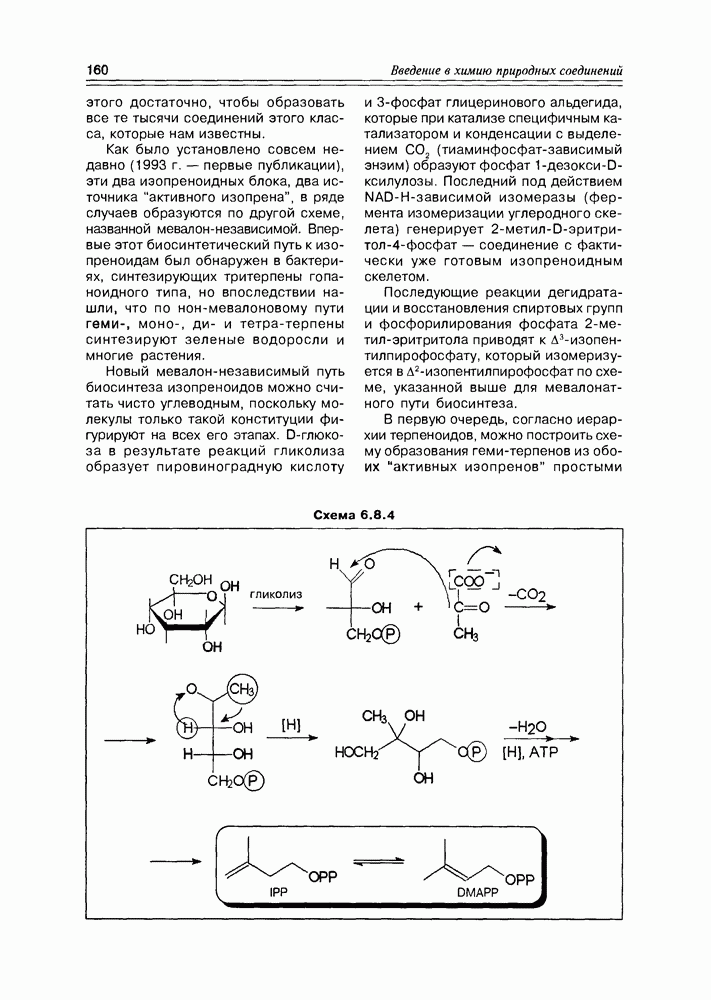
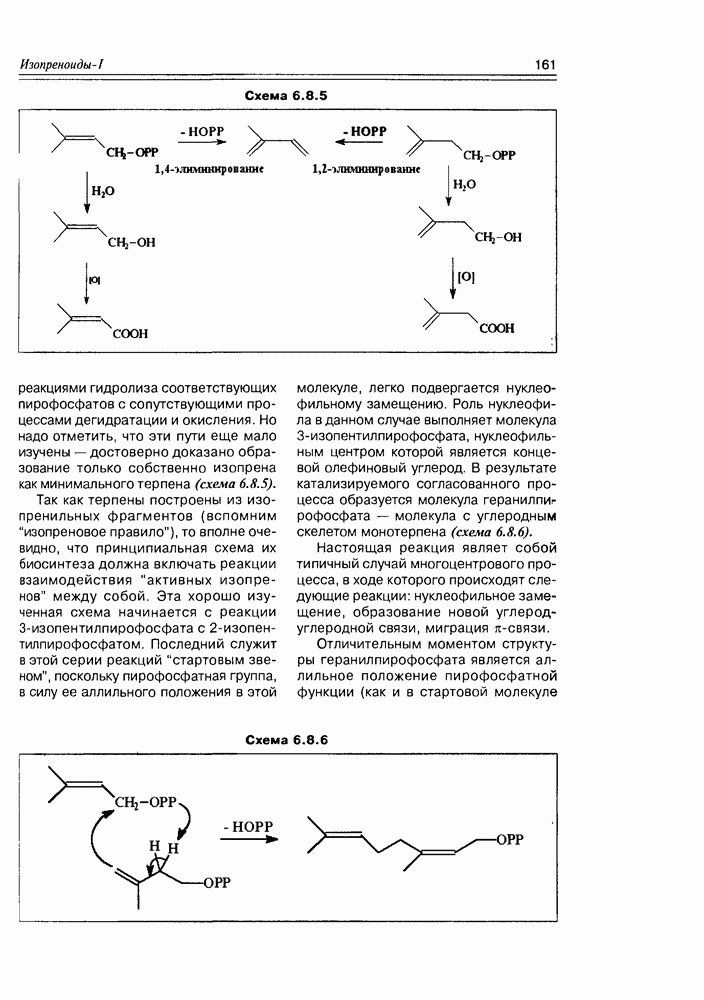
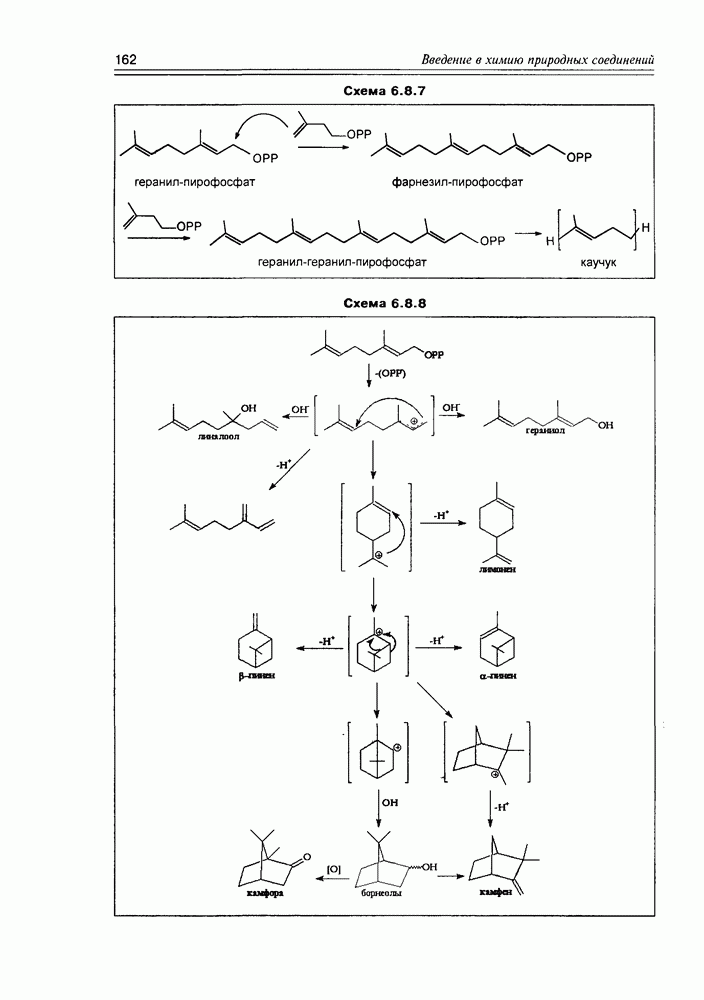
Из природных оксикислот можно выделить мевалоновую, являющуюся ключевым соединением биосинтеза изопре-ноидов, легко претерпевающую in vivo синхронное элиминирование фрагментов  образуя при этом пирофосфатное производное (поскольку и исходная мевалоновая кислота функционирует в виде пирофосфатного эфира)
образуя при этом пирофосфатное производное (поскольку и исходная мевалоновая кислота функционирует в виде пирофосфатного эфира)  с которого и начинаются процессы формирования изопреноидных углеродных систем (схема 2.1.9).
с которого и начинаются процессы формирования изопреноидных углеродных систем (схема 2.1.9).
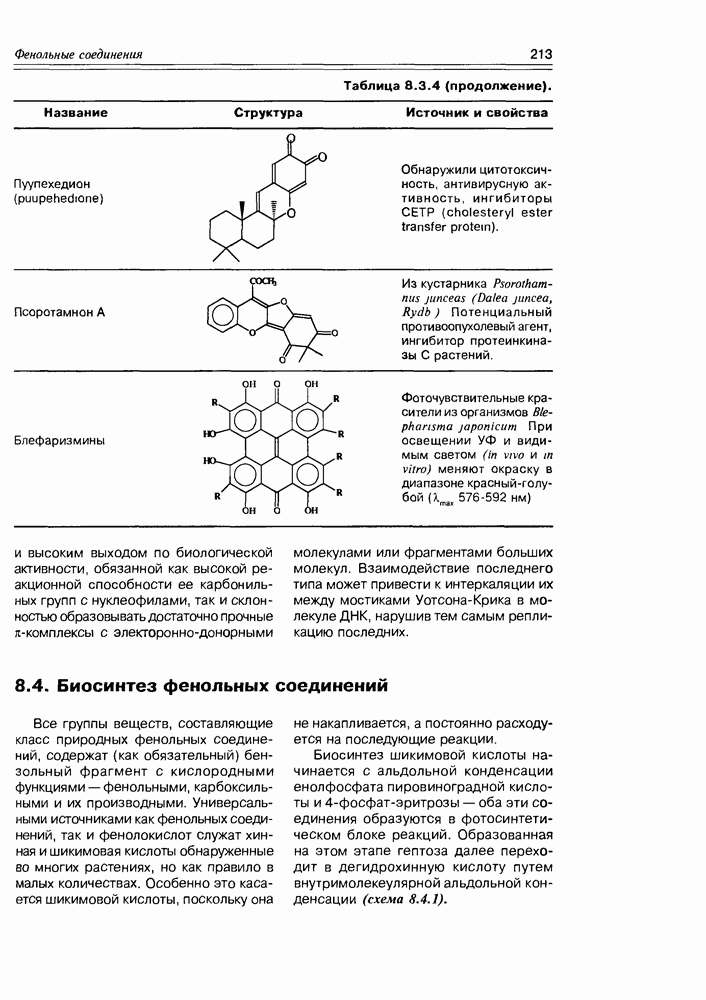
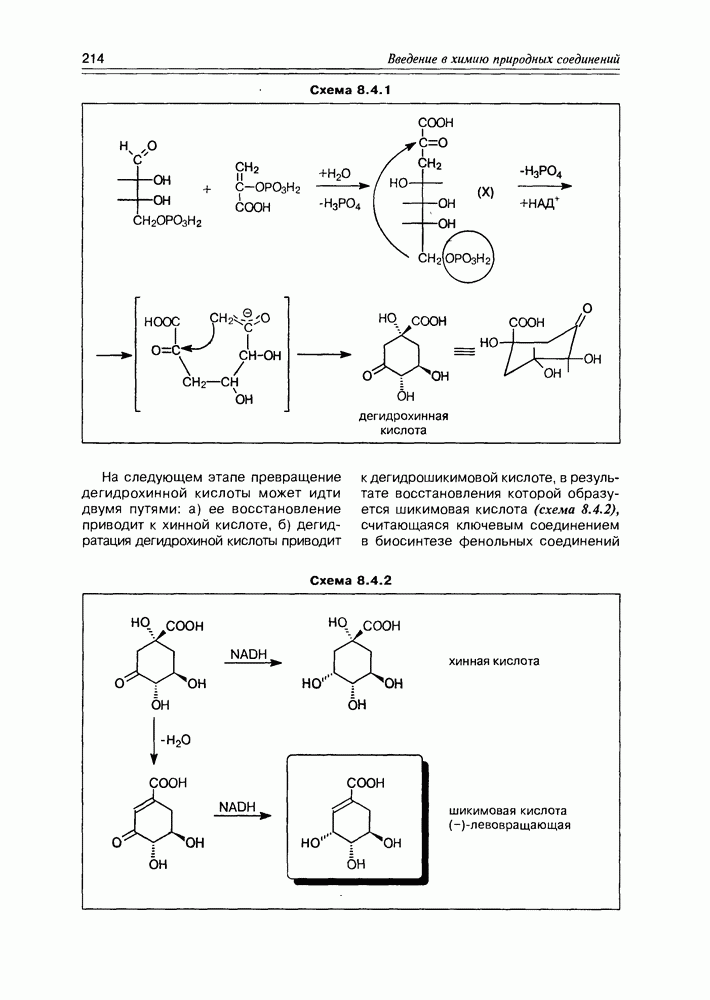
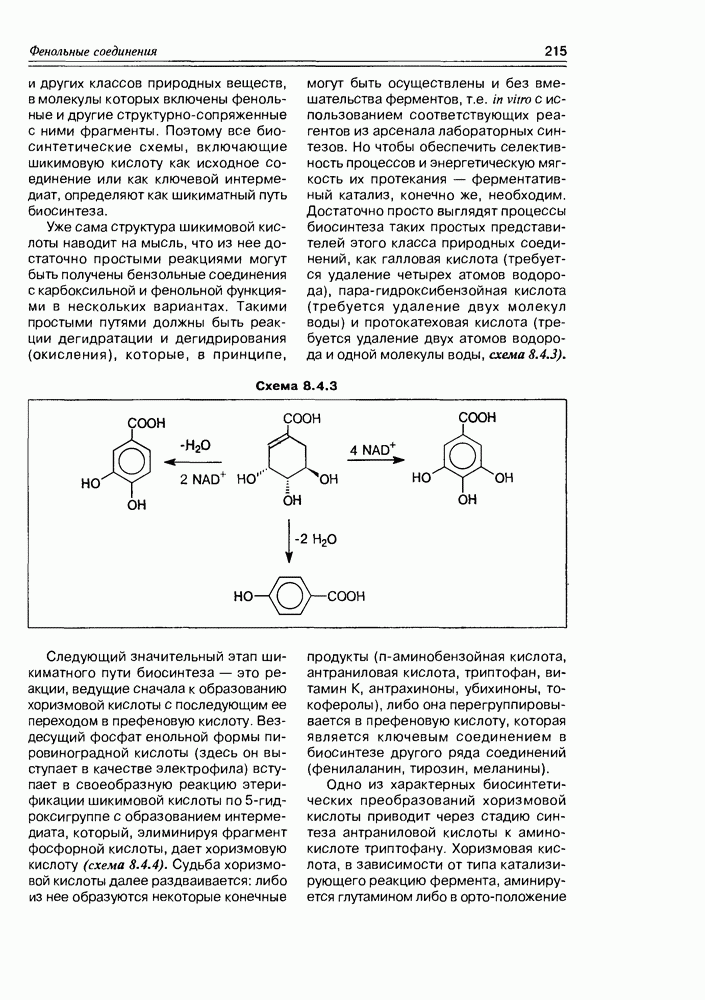
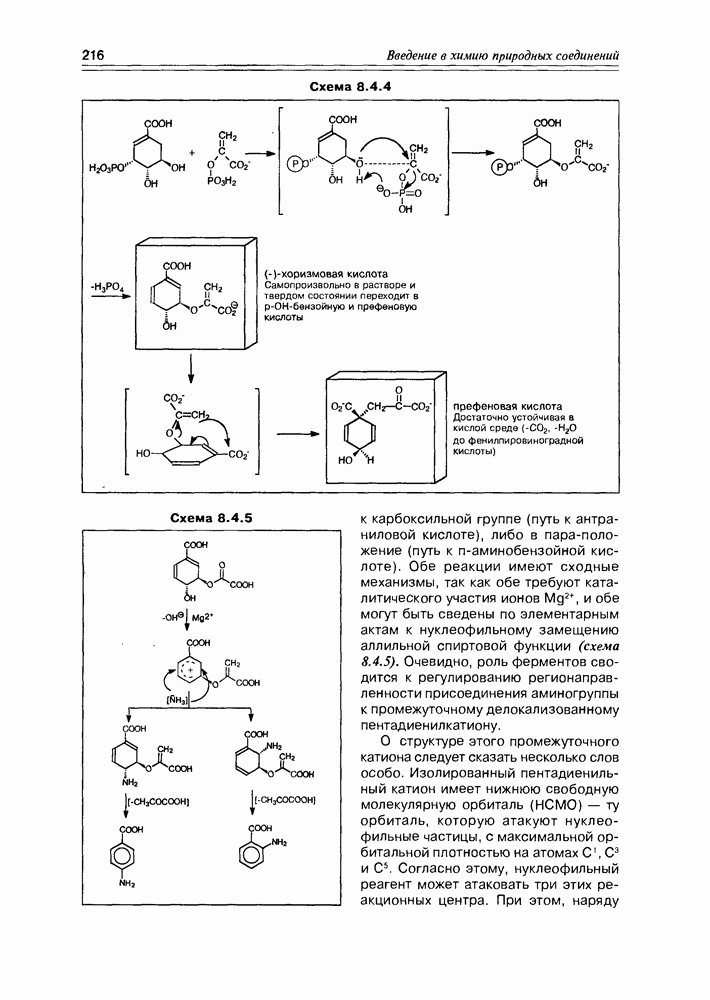
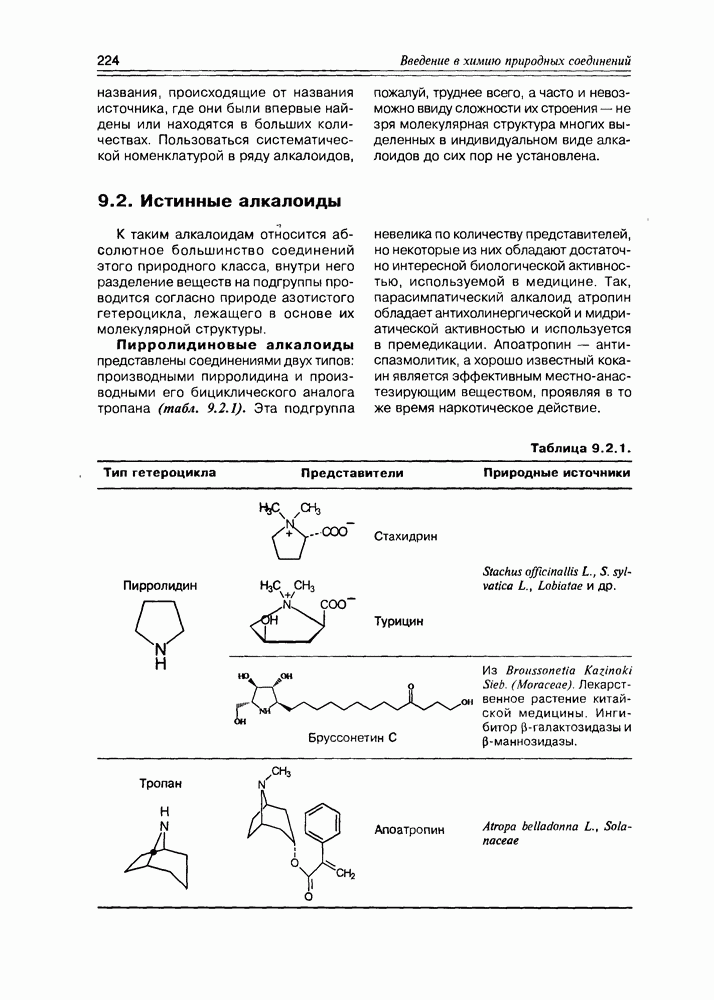
Хинная кислота, являясь исходным соединением биосинтеза ароматических кислородсодержащих соединений (а- и  -пиронов, фенолокислот и др.), может накапливаться в некоторых растениях в заметных количествах (в коре хинного дерева, например). Но основное предназначение этой кислоты — образование шикимовой кислоты, ключевого интермедиата вышеуказанных синтезов, с последующим переходом к бензольным производным, используя реакции дегидратации и дегидрогенизации(окисления).
-пиронов, фенолокислот и др.), может накапливаться в некоторых растениях в заметных количествах (в коре хинного дерева, например). Но основное предназначение этой кислоты — образование шикимовой кислоты, ключевого интермедиата вышеуказанных синтезов, с последующим переходом к бензольным производным, используя реакции дегидратации и дегидрогенизации(окисления).
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ АВТОРА
- Глава 1. ВВЕДЕНИЕ
- 1.1. Предмет химии природных соединений
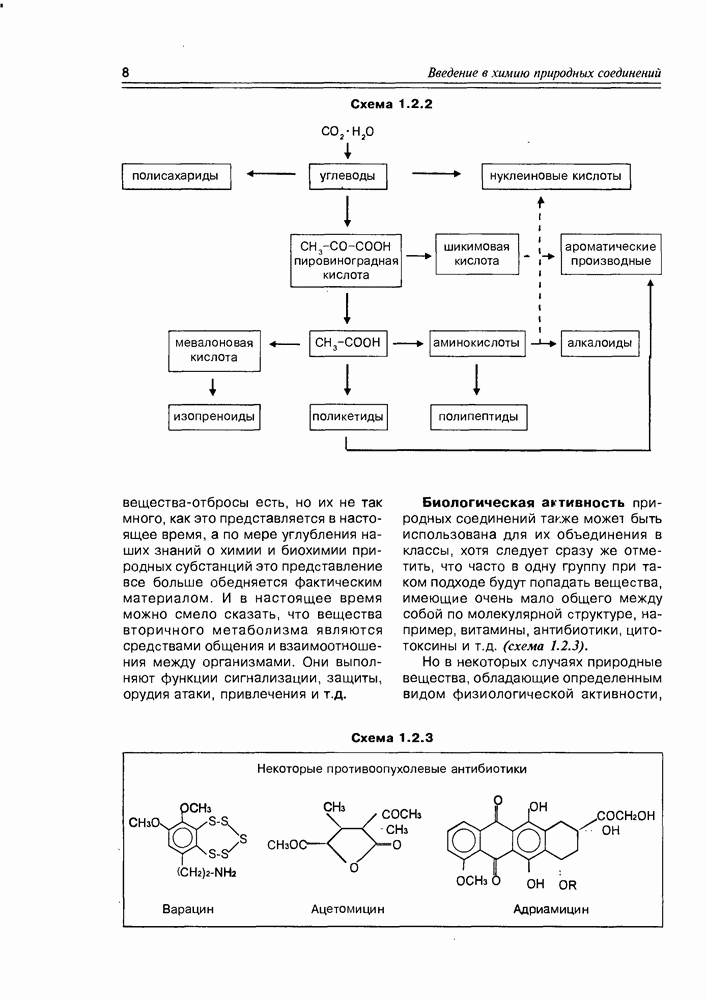
- 1.2. Классификация природных соединений
- 1.3. Методология химии природных соединений
- 1.4. Углерод и жизнь
- Глава 2. ПРОСТЕЙШИЕ БИФУНКЦИОНАЛЬНЫЕ ПРИРОДНЫЕ СОЕДИНЕНИЯ — МОСТИК К МАССИВУ ПРИРОДНЫХ СОЕДИНЕНИЙ
- 2.2. Оксокислоты
- 2.3. Аминоспирты
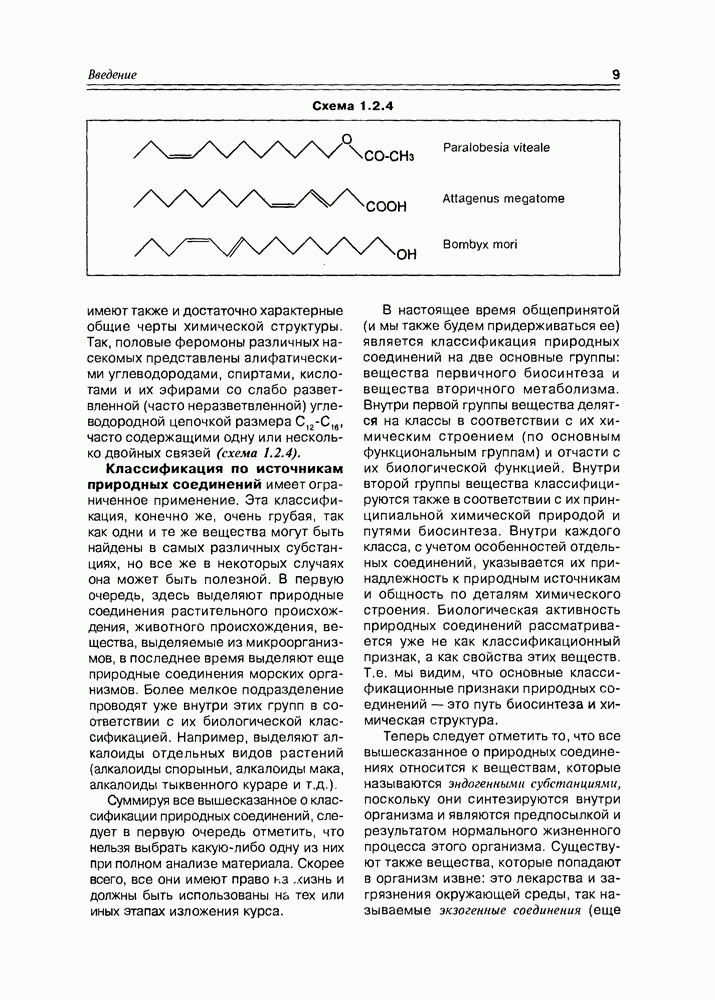
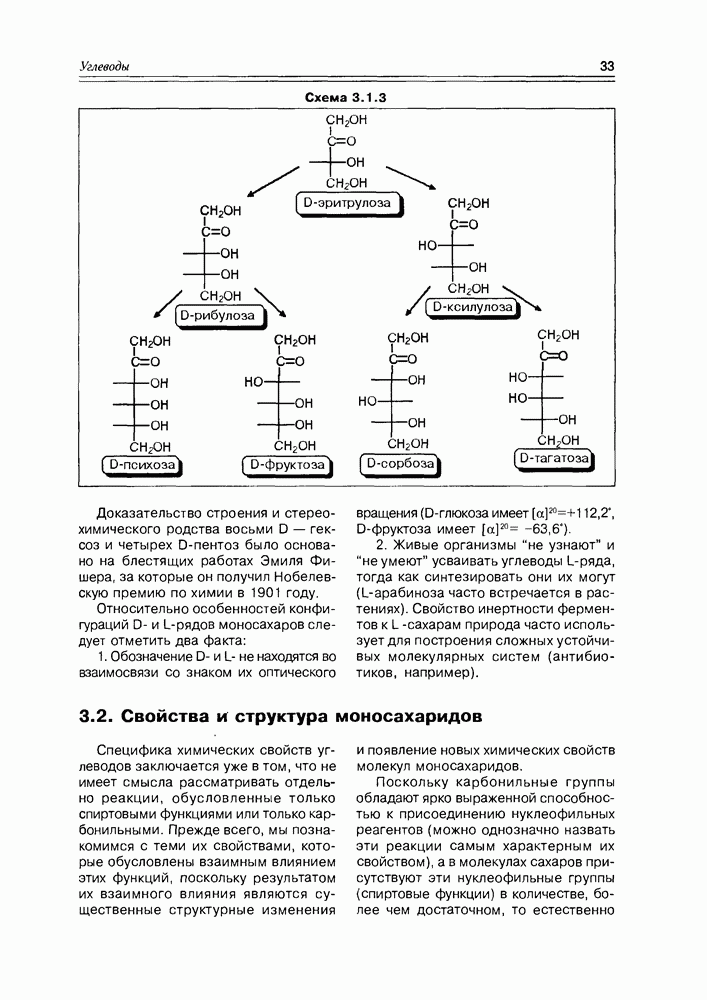
- Глава 3. УГЛЕВОДЫ
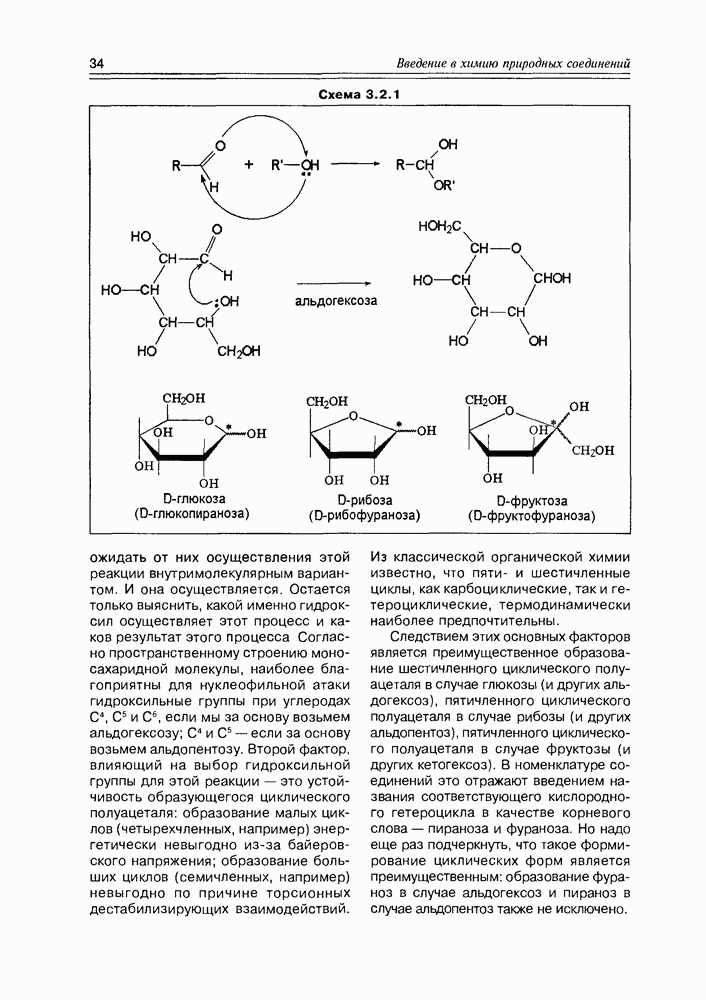
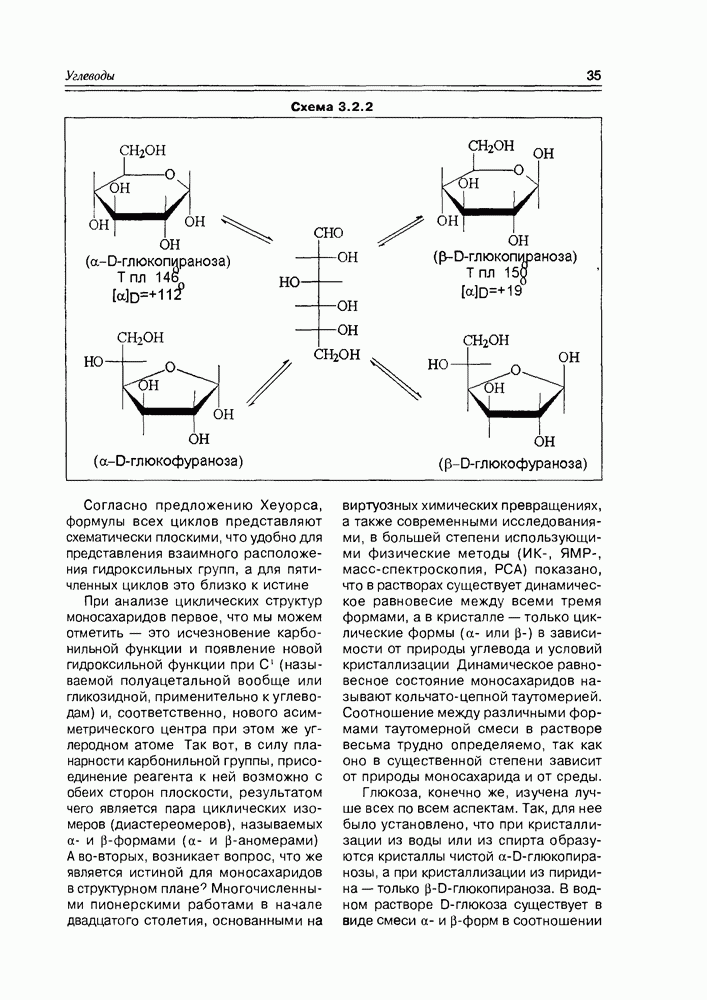
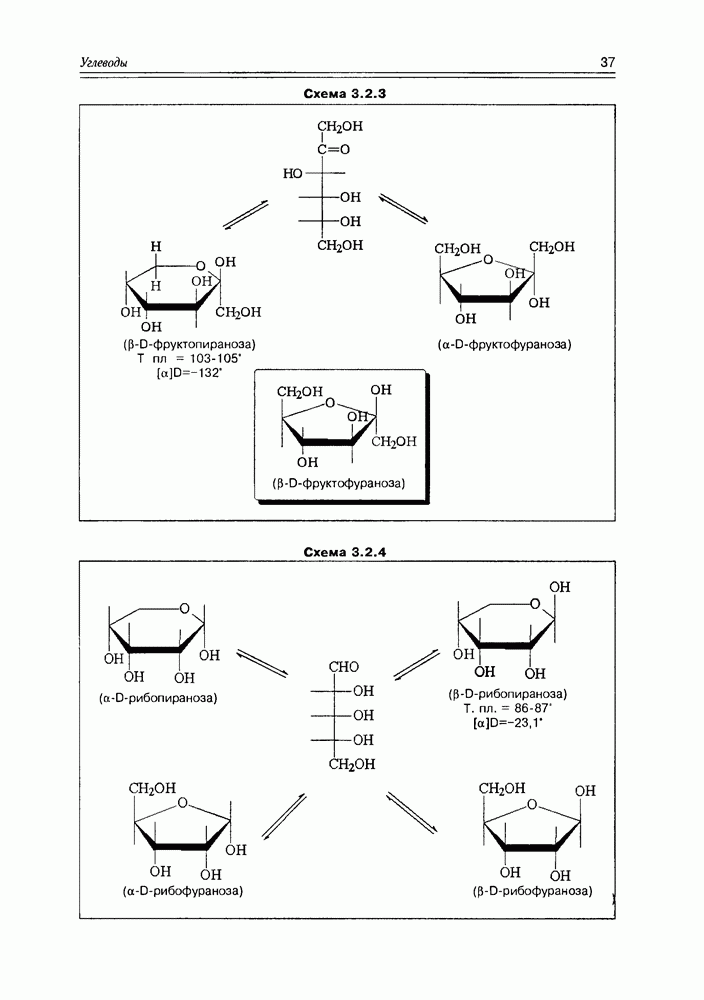
- 3.2. Свойства и структура моносахаридов
- 3.3. Химические свойства моносахаридов
- 3.4. Биосинтетические реакции углеводов
- 3.6. Гликозиды
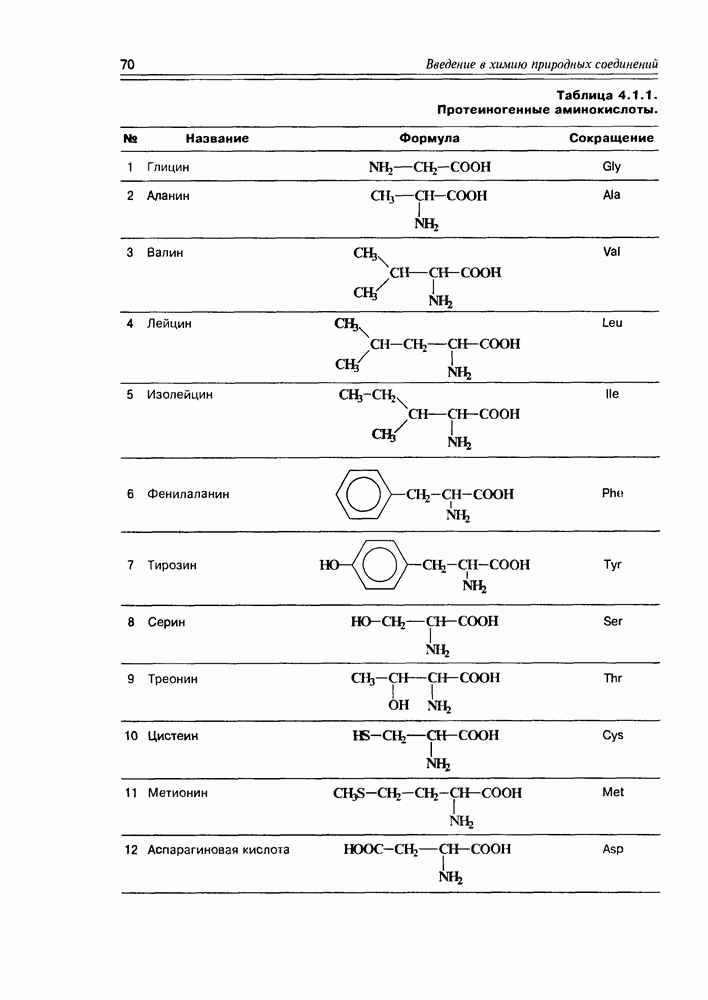
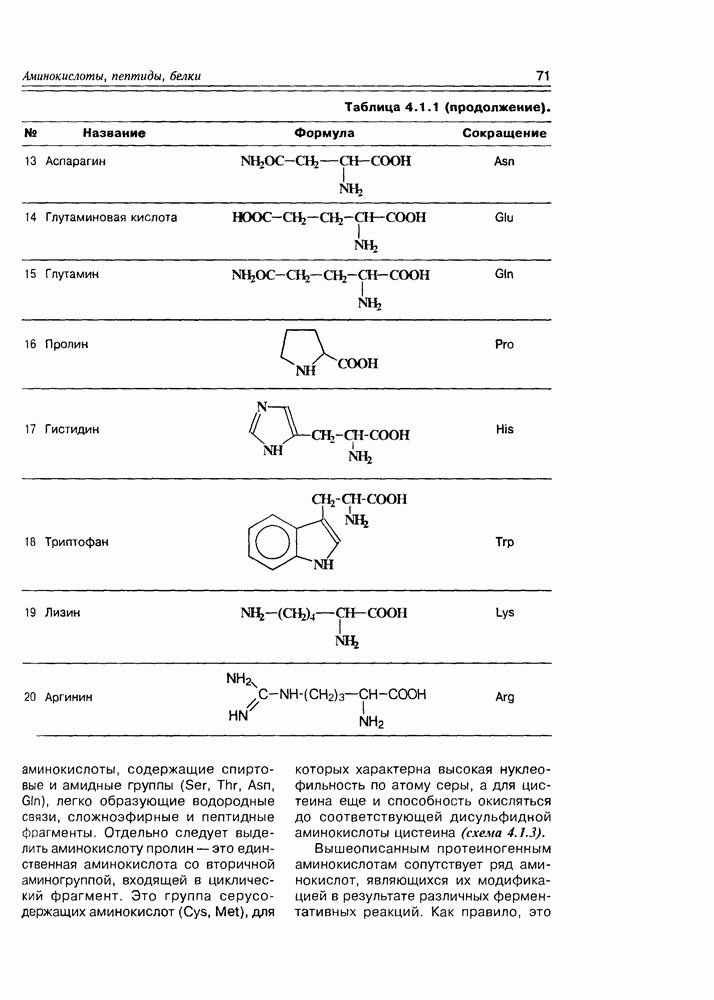
- Глава 4. АМИНОКИСЛОТЫ, ПЕПТИДЫ, БЕЛКИ
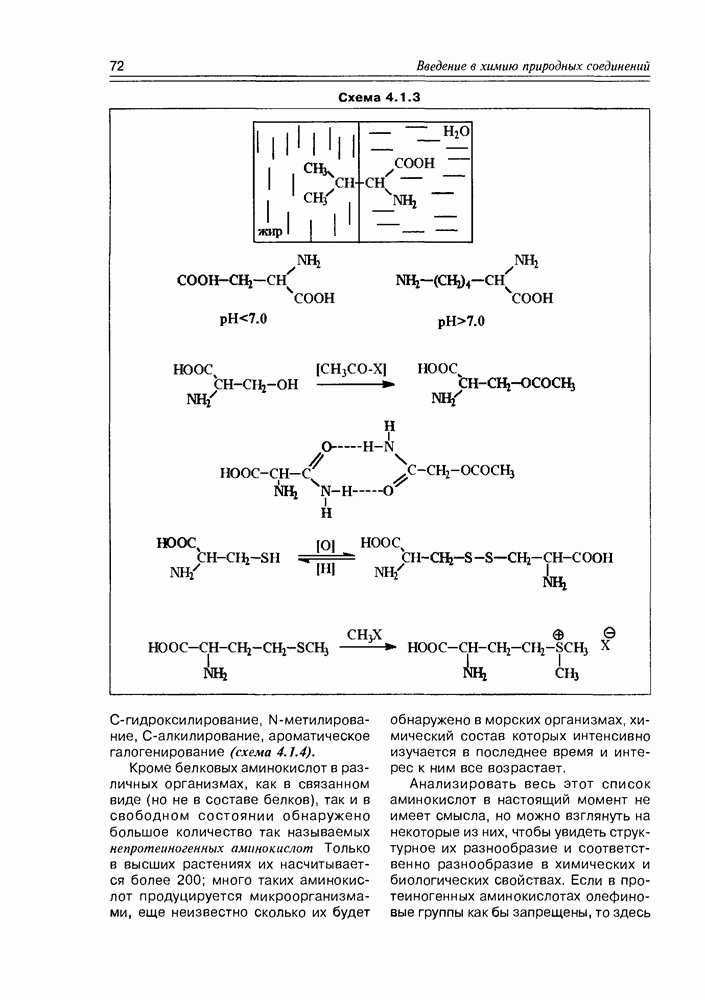
- 4.2. Химические свойства а-аминокислот
- 4.3. Биосинтез аминокислот
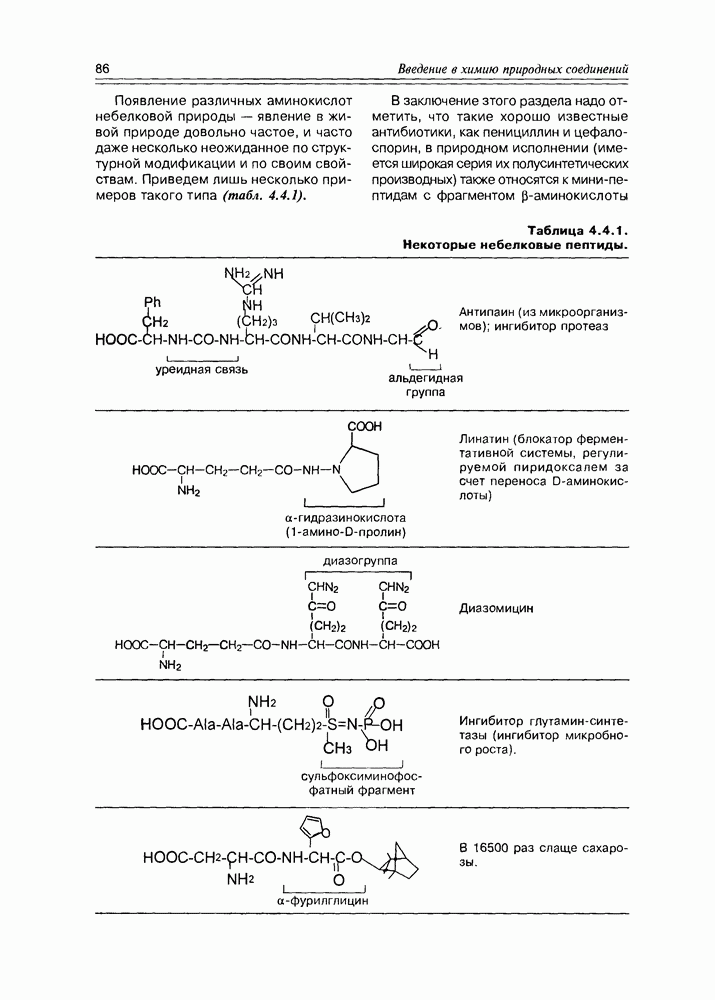
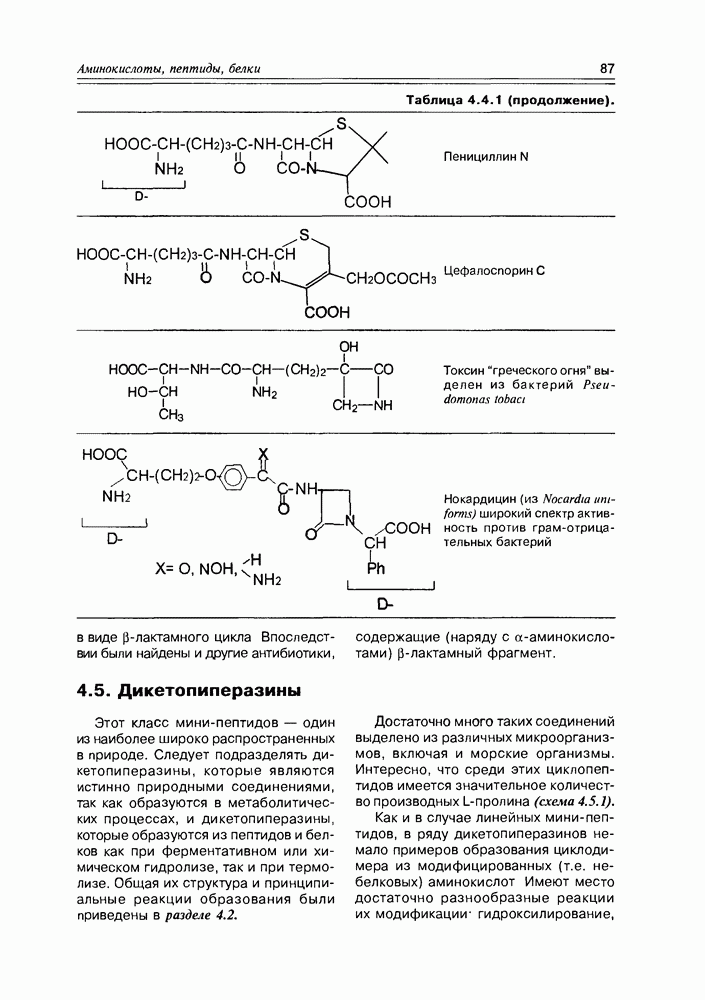
- 4.4. Полипептиды
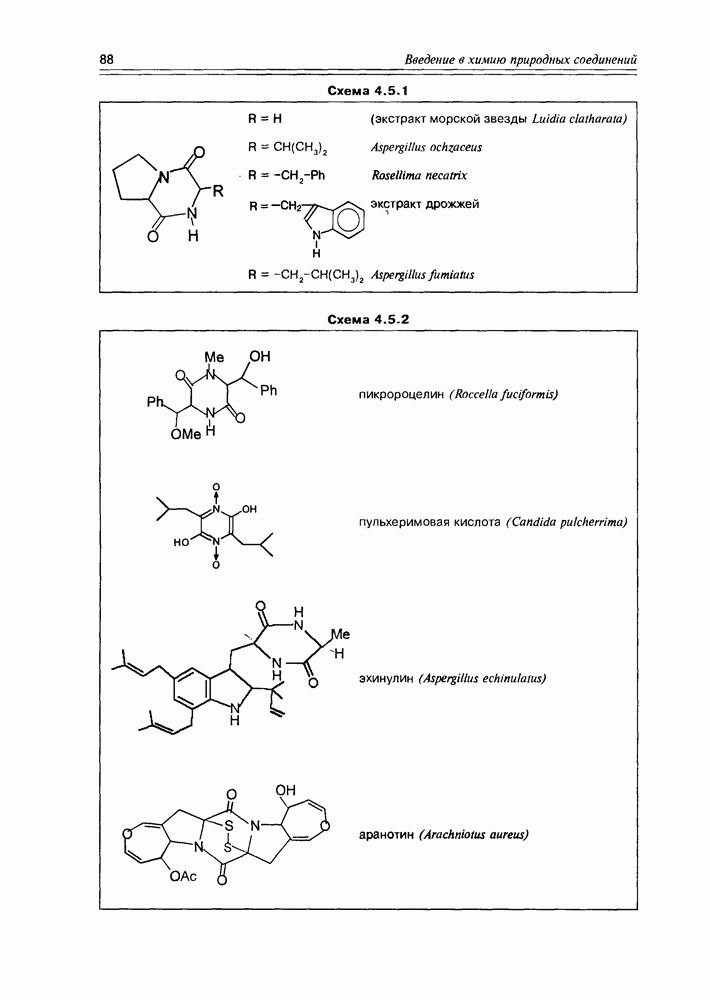
- 4.5. Дикетопиперазины
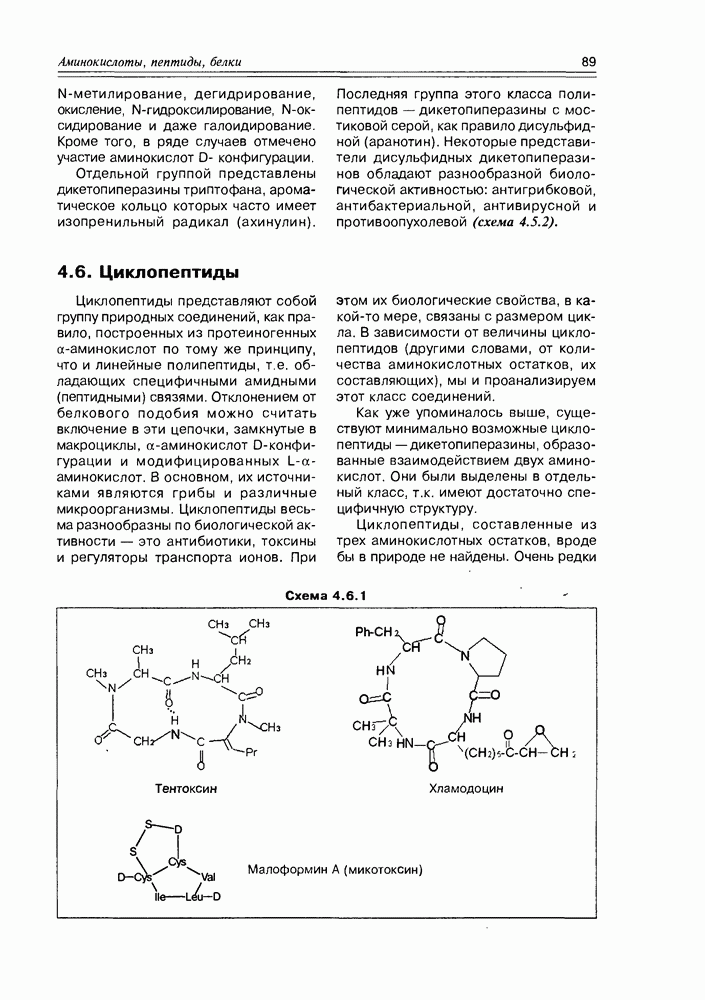
- 4.6. Циклопептиды
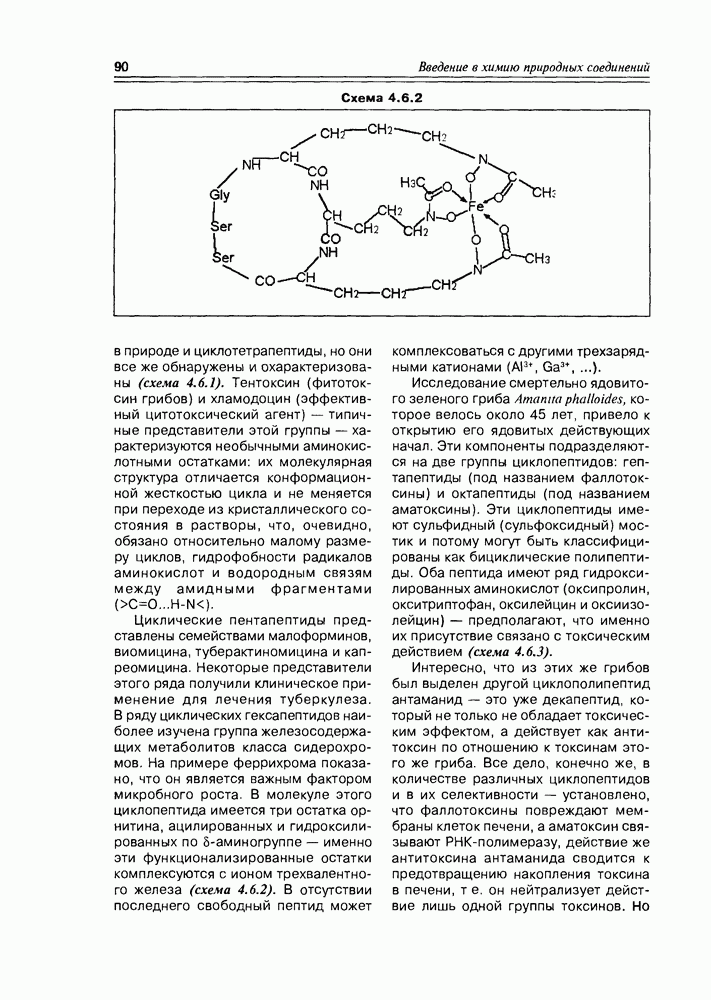
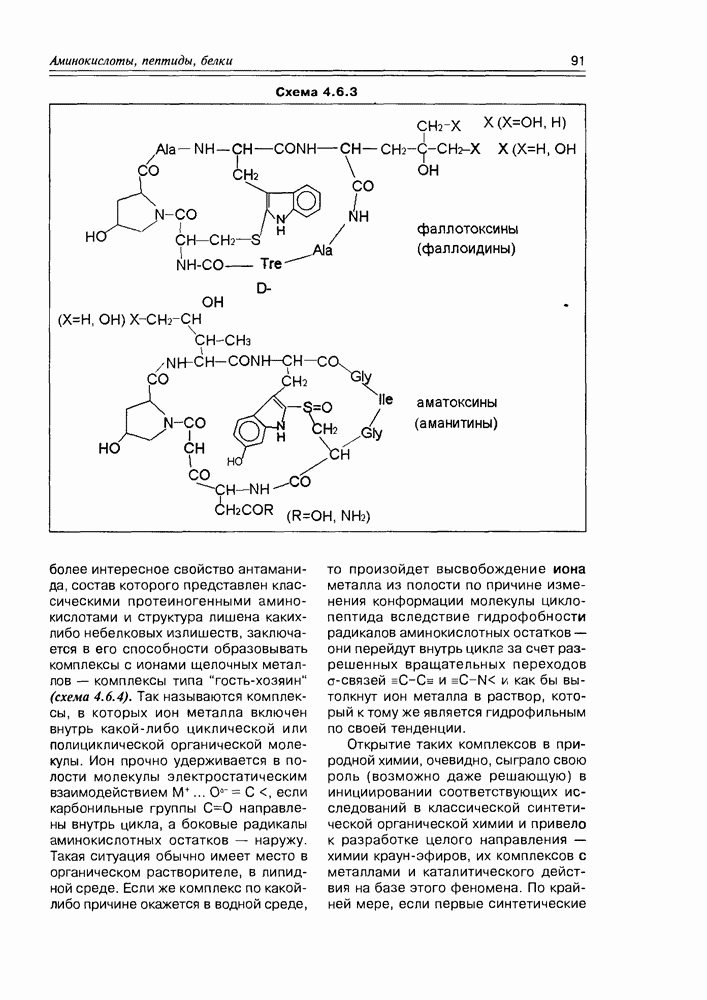
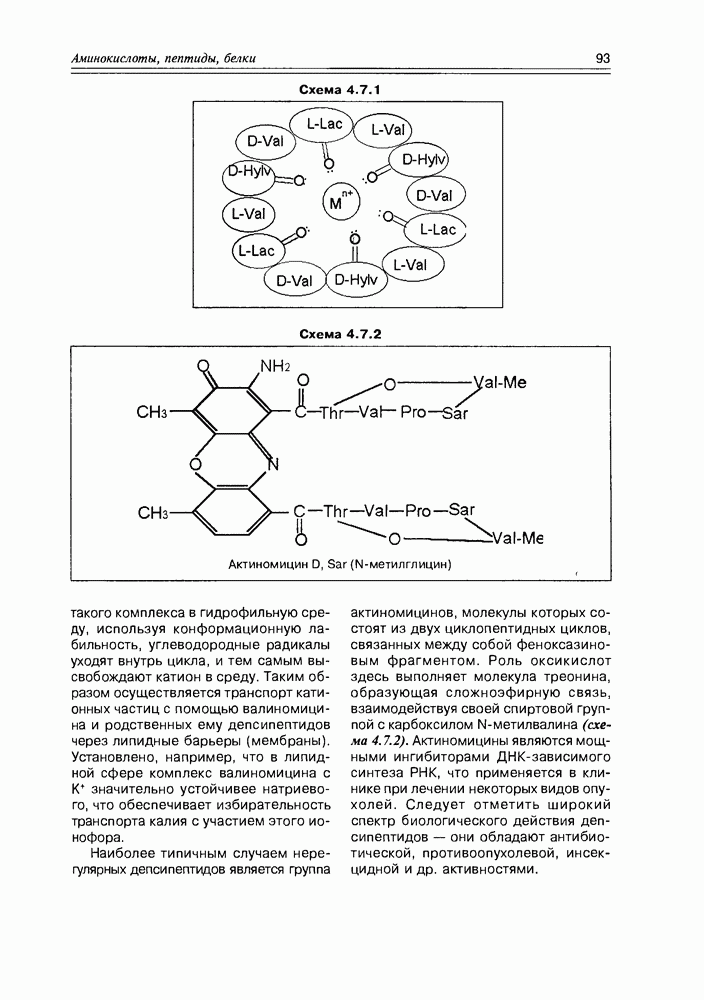
- 4.7. Депсипептиды
- 4.8. Белки
- Глава 5. ЛИПИДЫ: ЖИРНЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
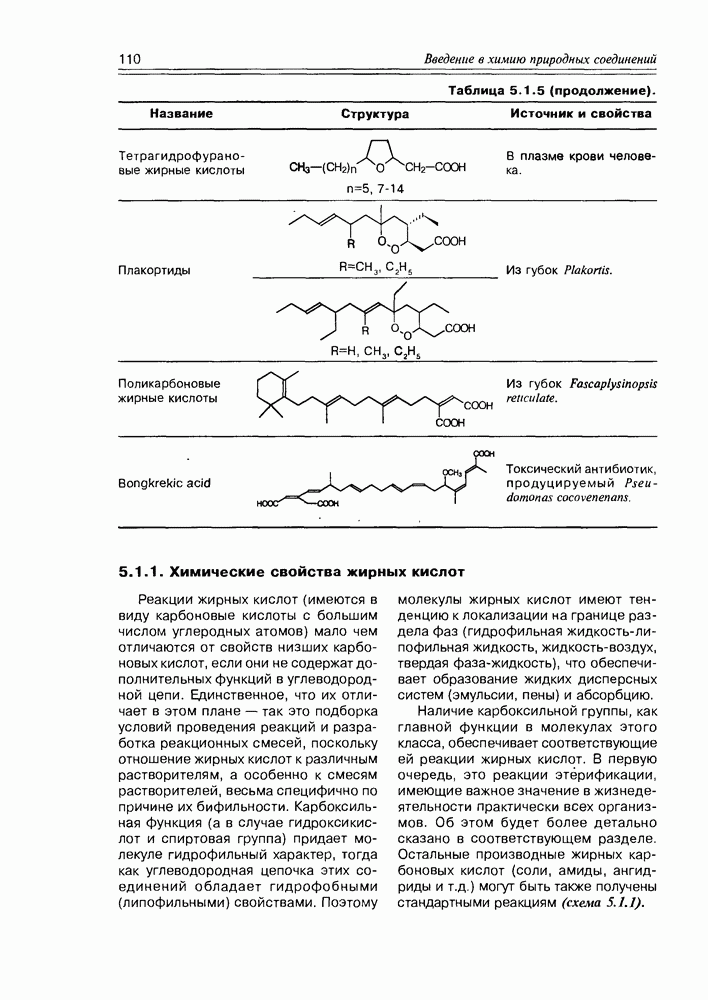
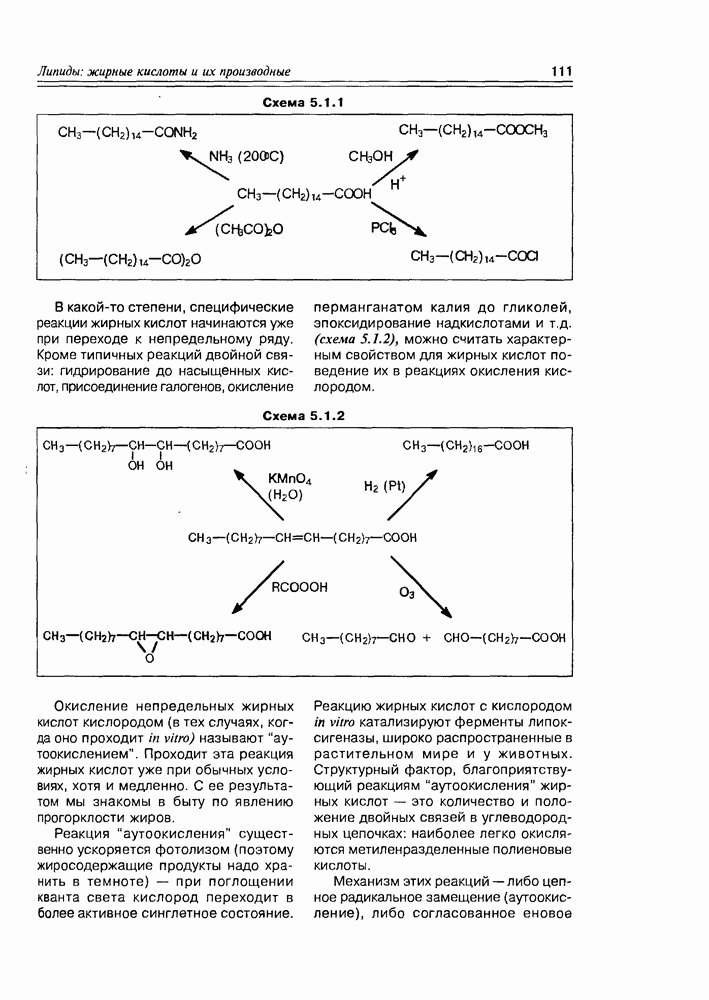
- 5.1.1. Химические свойства жирных кислот
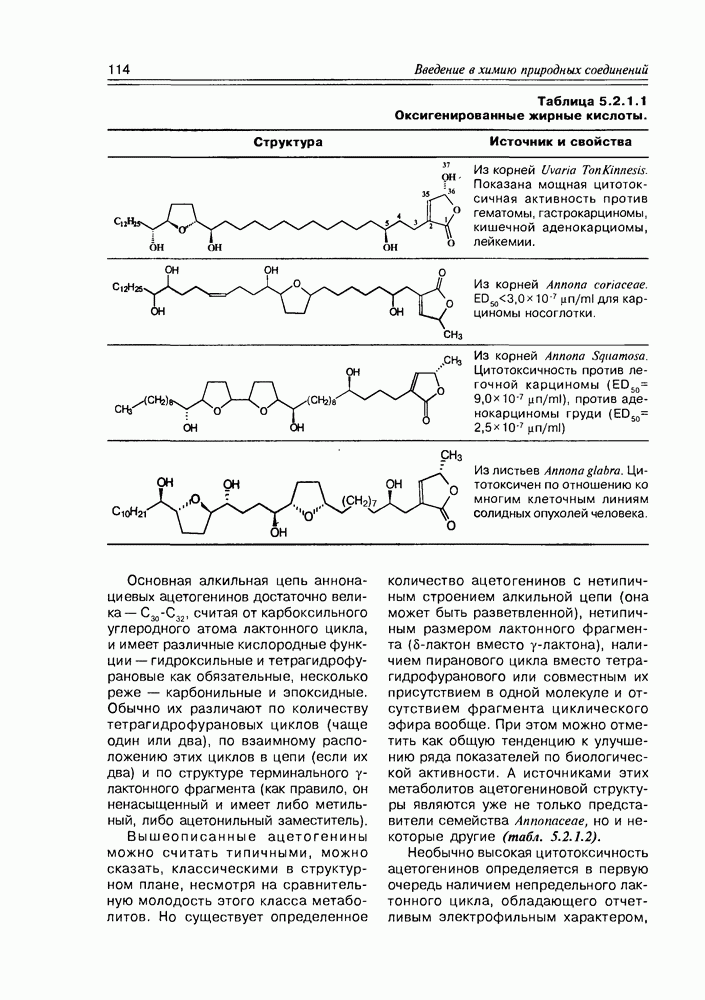
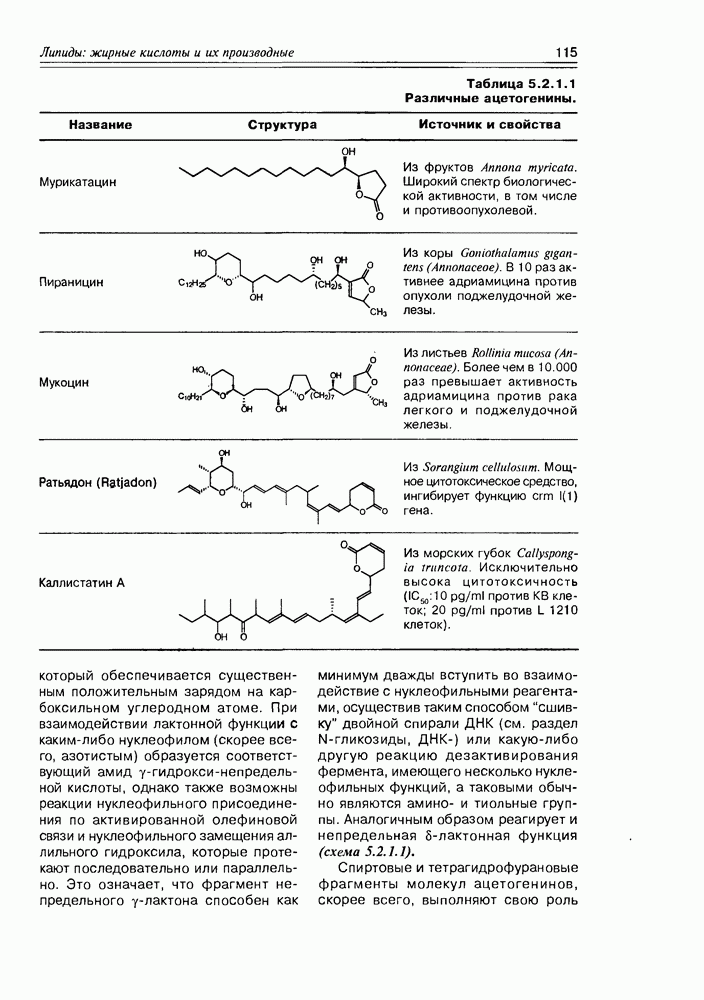
- 5.2. Метаболиты жирных кислот
- 5.2.2. Карбоциклические оксилипины
- 5.3. Жиры и жироподобные производные жирных кислот
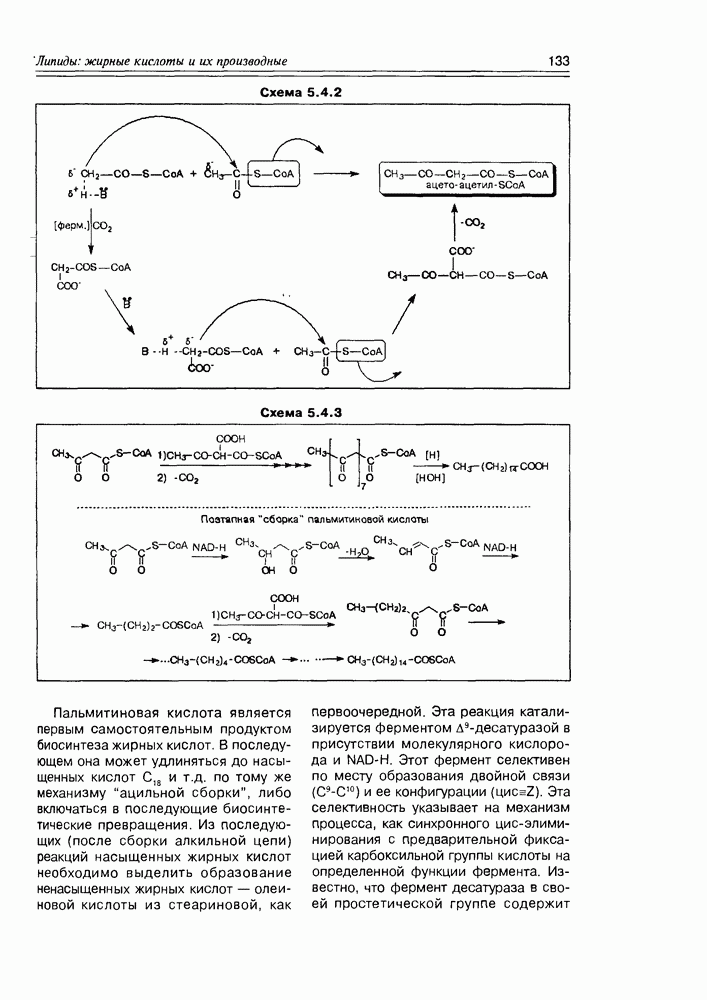
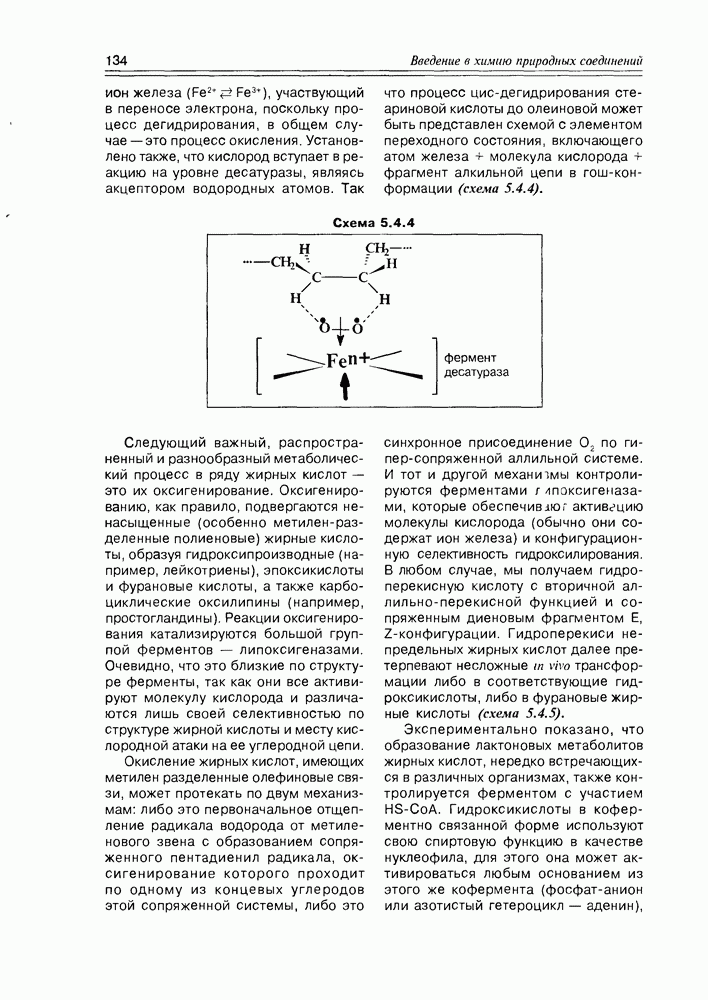
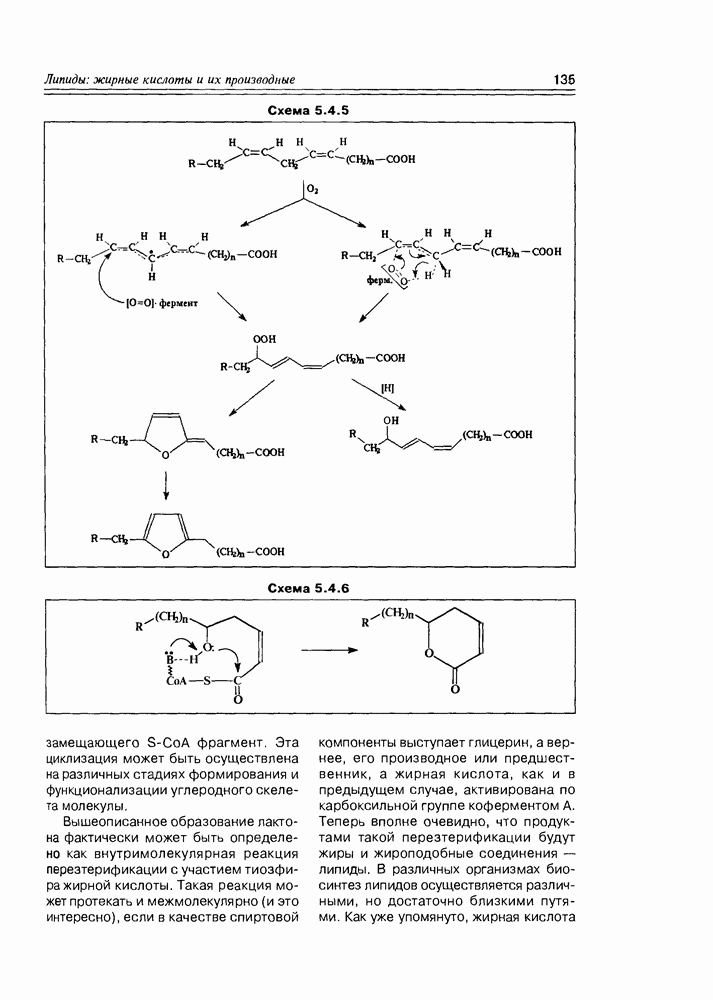
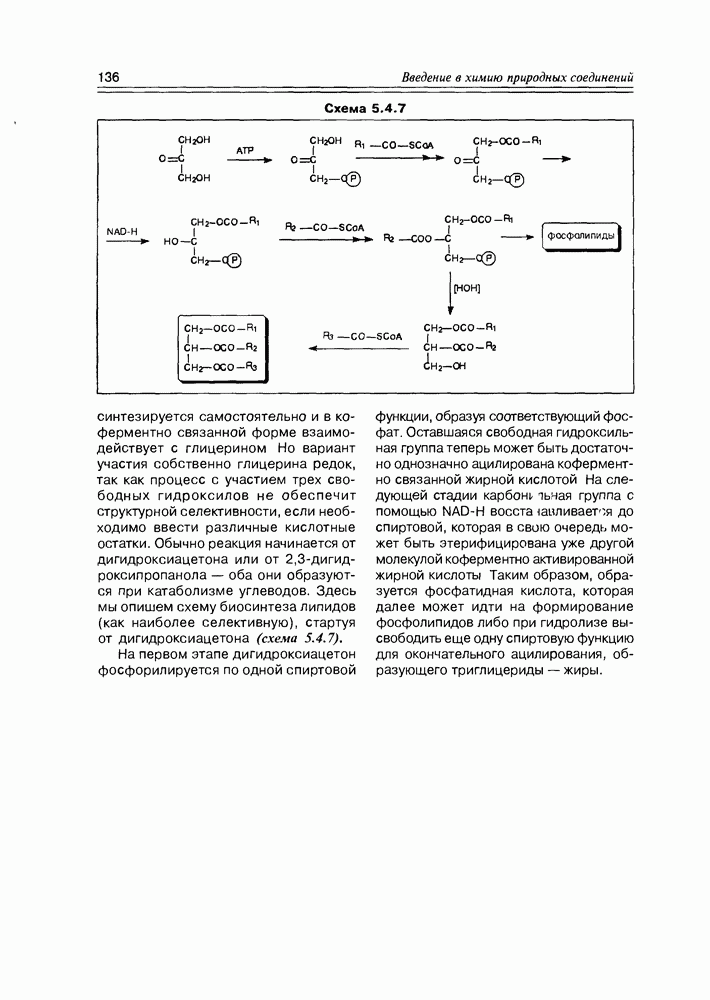
- 5.4. Биосинтез жирных кислот и их производных
- Глава 6. ИЗОПРЕНОИДЫ-1
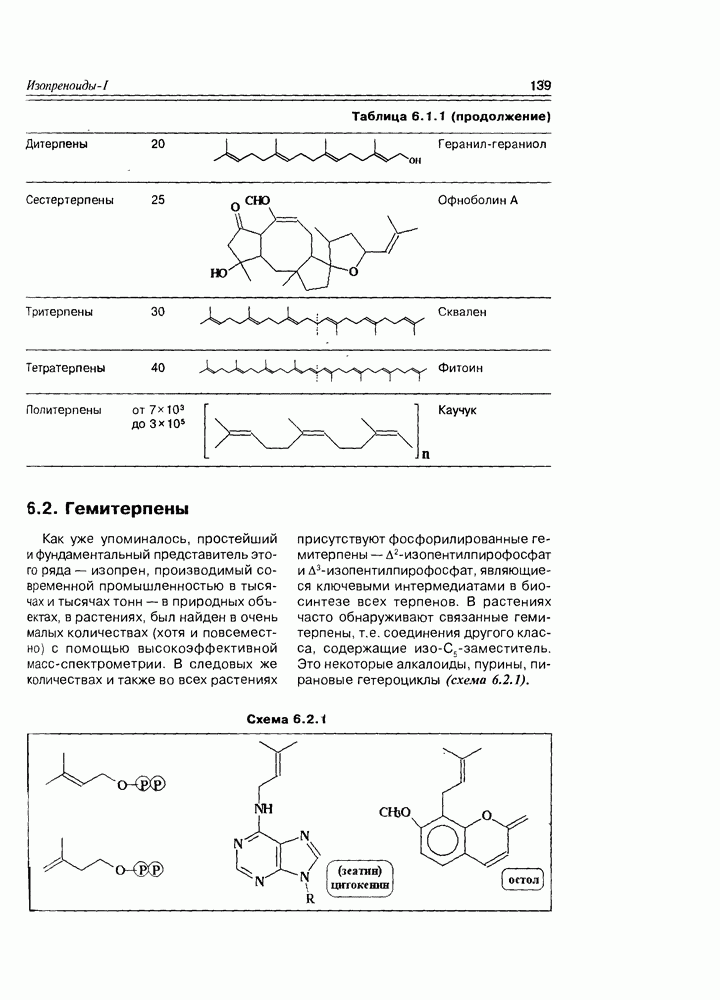
- 6.2. Гемитерпены
- 6.3. Монотерпены
- 6.4. Ациклические монотерпены
- 6.5. Моноциклические терпены
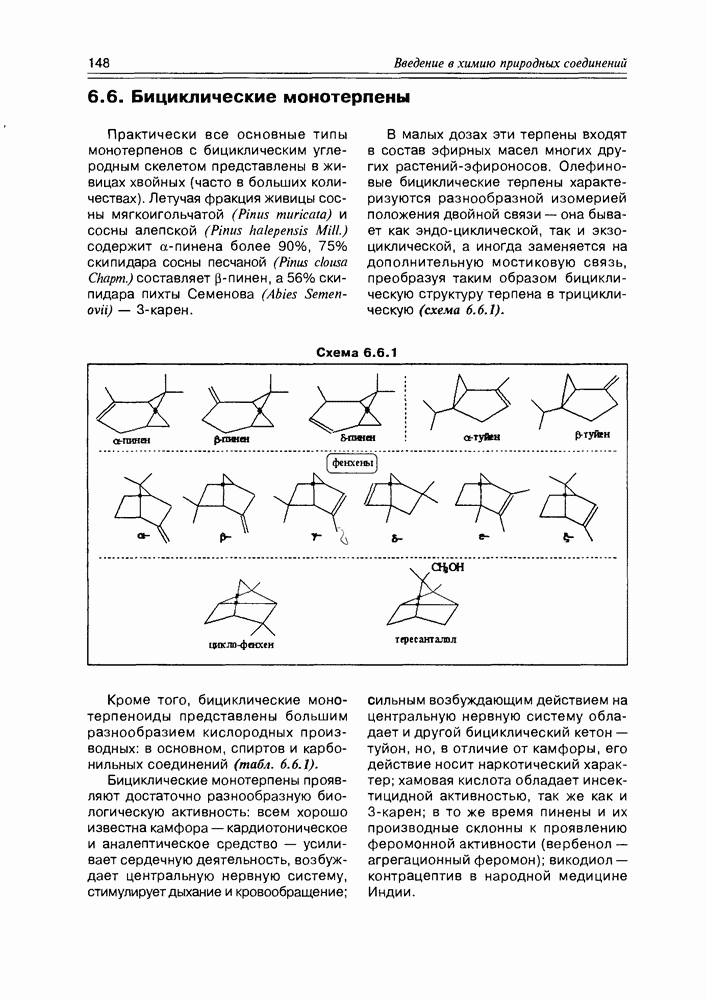
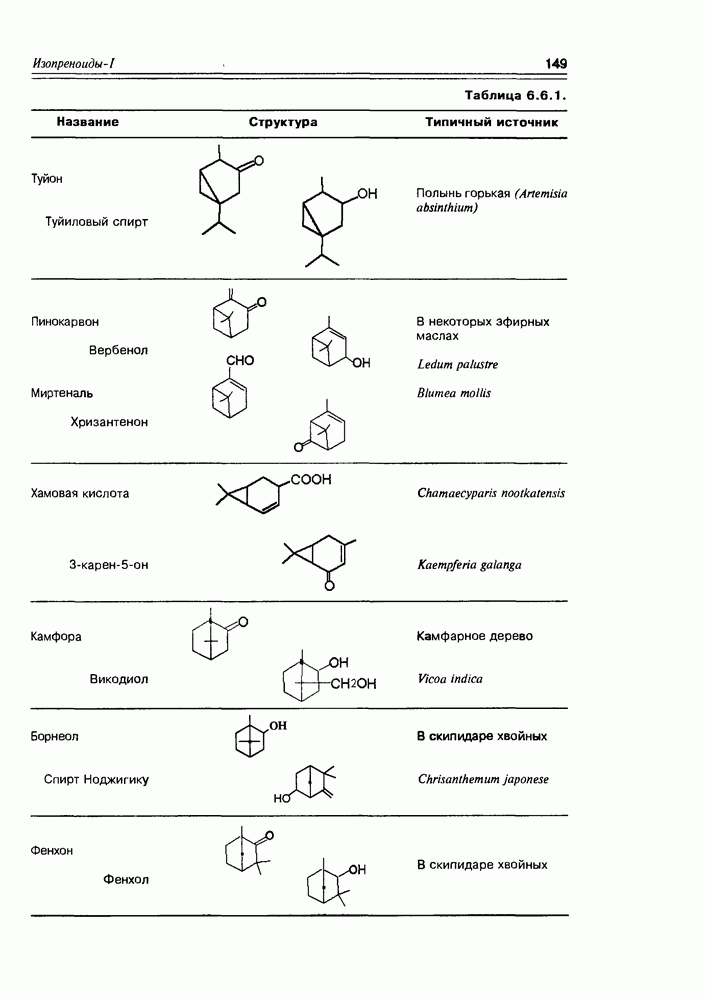
- 6.6. Бициклические монотерпены
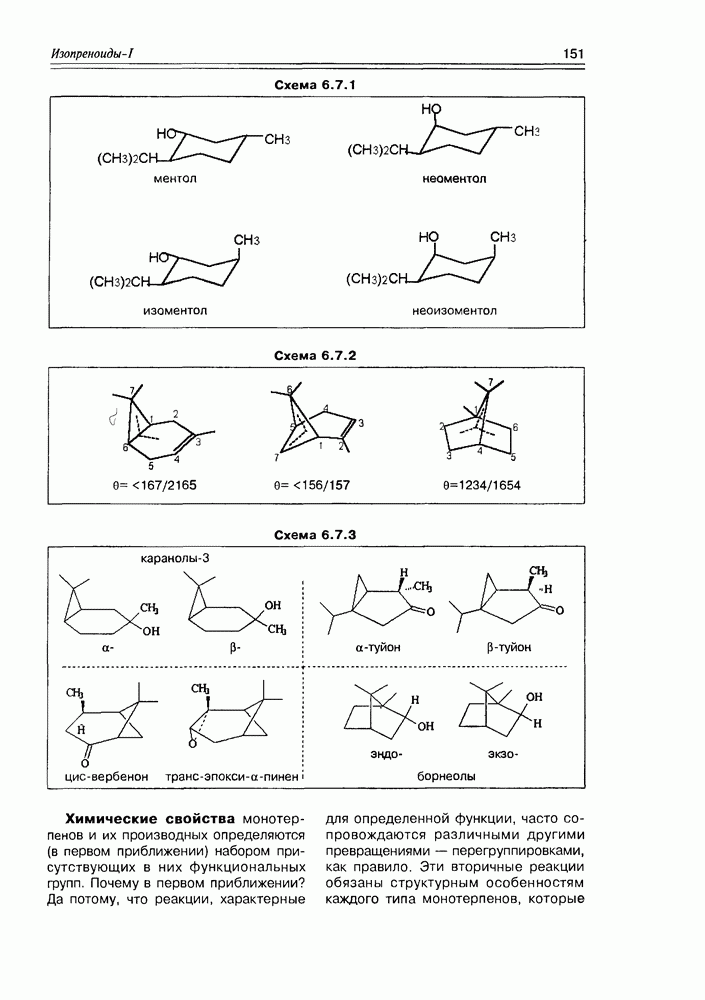
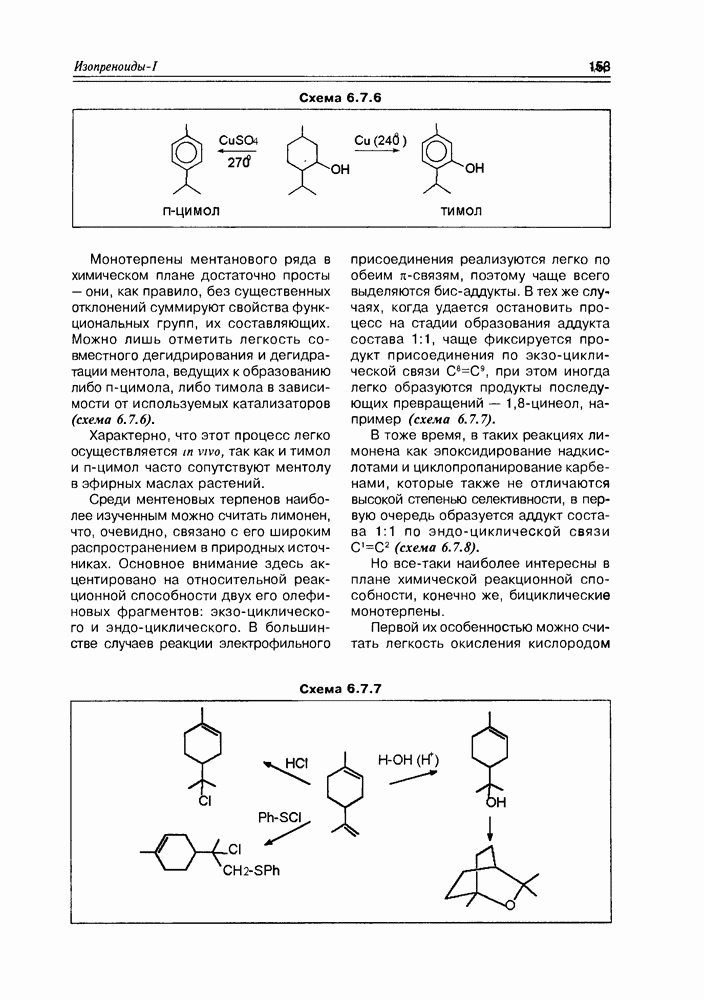
- 6.7. Строение и свойства монотерпенов
- 6.8. Биосинтез изопреноидов
- Глава 7. ИЗОПРЕНОИДЫ II. ОТ СЕСКВИТЕРПЕНОВ ДО ПОЛИТЕРПЕНОВ
- 7.2. Химические свойства сесквитерпенов
- 7.3. Дитерпены и сестертерпены
- 7.4. Тритерпеноиды и стероиды
- 7.5. Тетратерпеноиды — каротиноиды
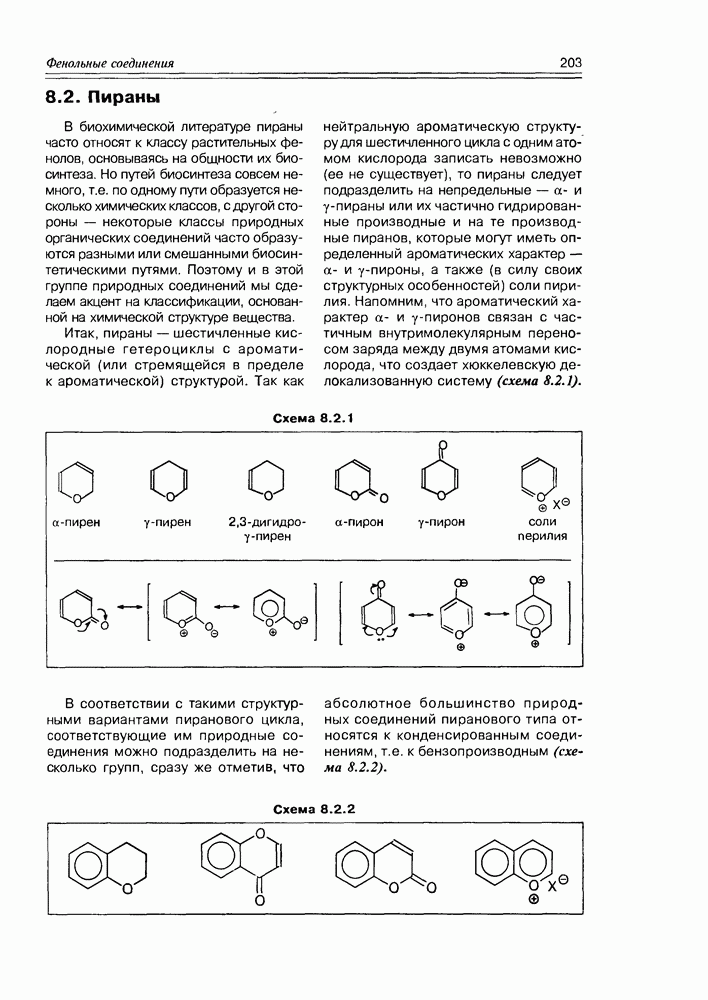
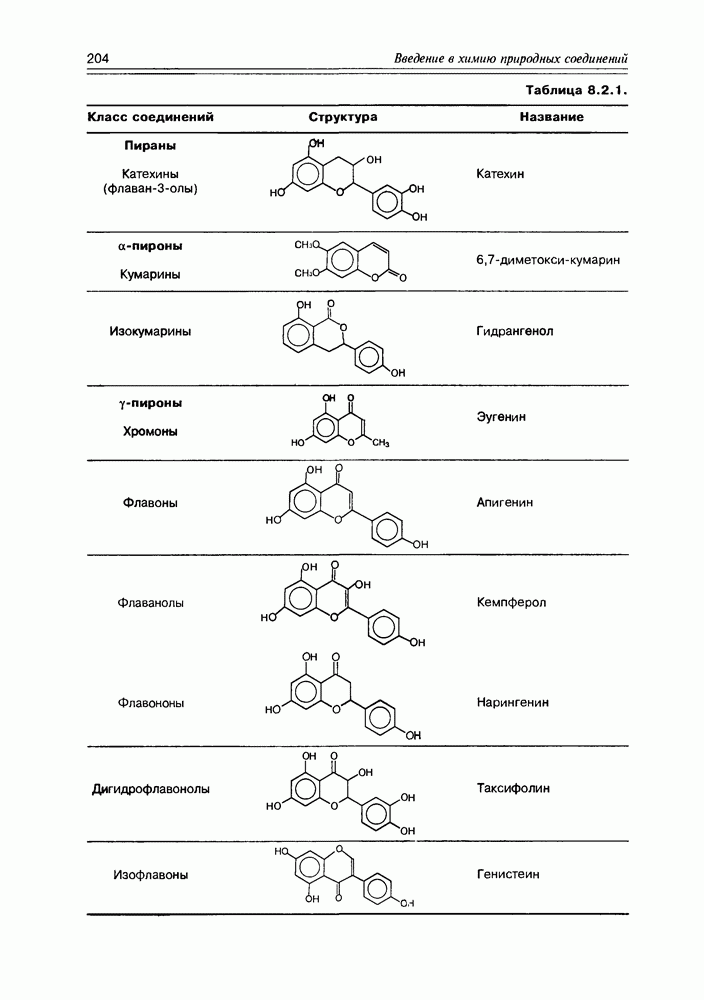
- Глава 8. ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ
- 8.2. Пираны
- 8.4. Биосинтез фенольных соединений
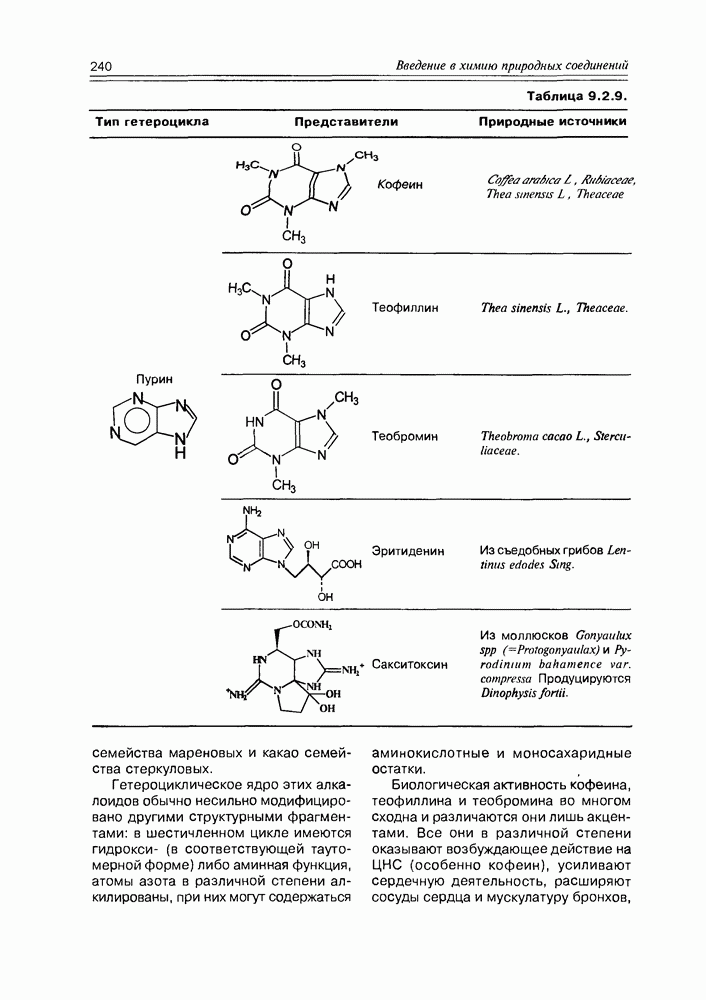
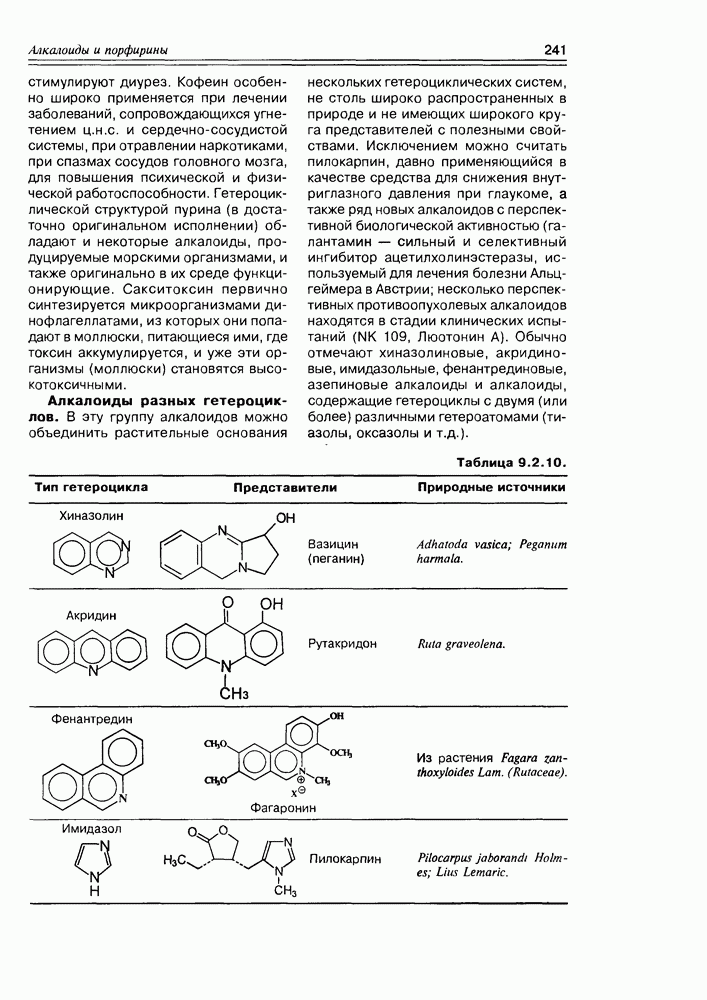
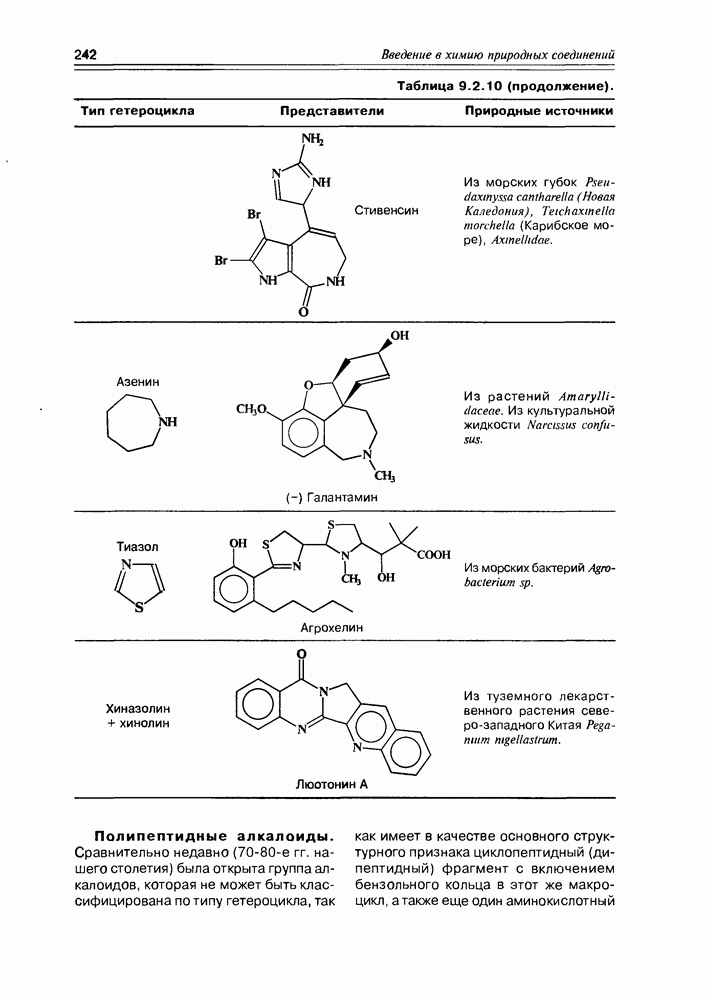
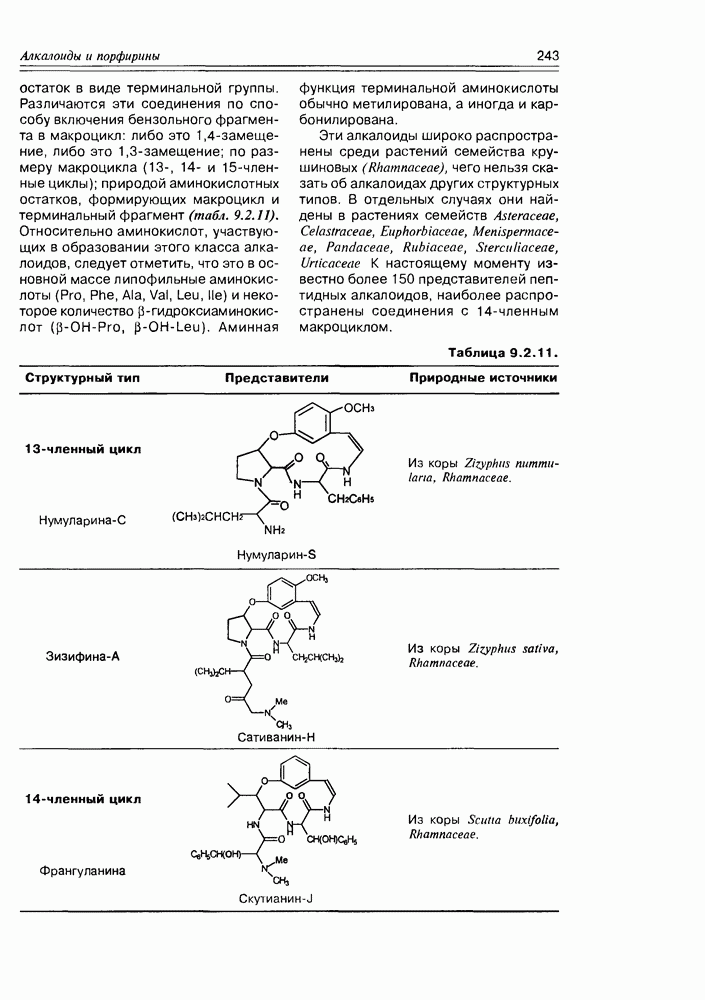
- Глава 9. АЛКАЛОИДЫ И ПОРФИРИНЫ
- 9.2. Истинные алкалоиды
- 9.3. Протоалкалоиды
- 9.5. Химические свойства и химические модификации алкалоидов
- 9.6. Аминокислоты и биосинтез алкалоидов
- 9.7. Порфирины
- Глава 10. ВИТАМИНЫ И КОФЕРМЕНТЫ
- 10.1. Витамины — собственно
- 10.2. Витамины-коферменты
- 10.3. Коферменты
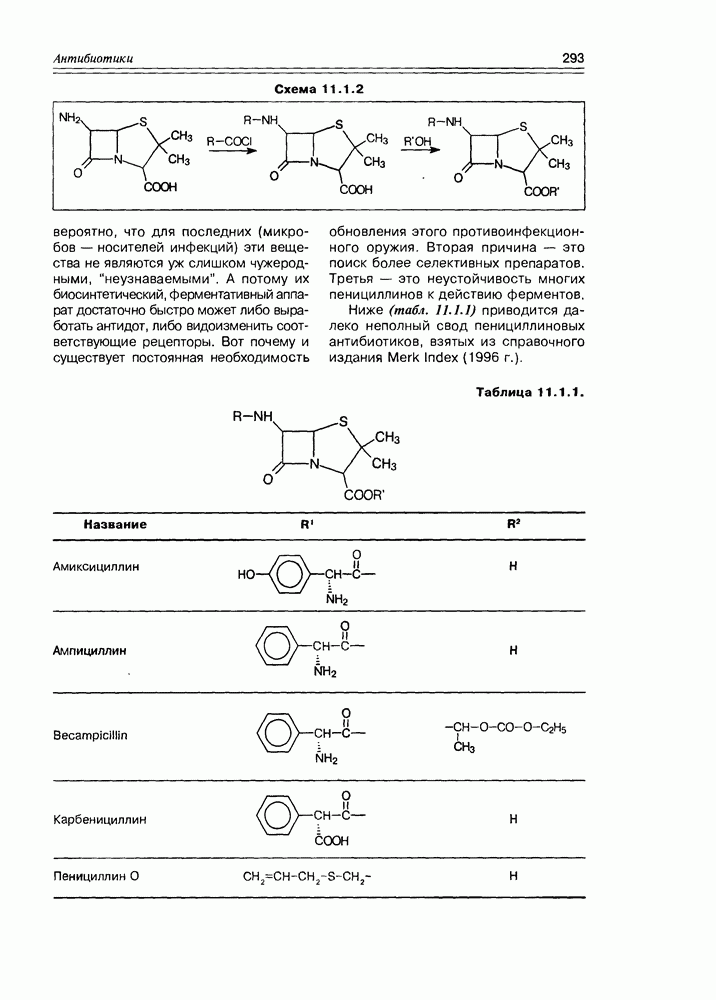
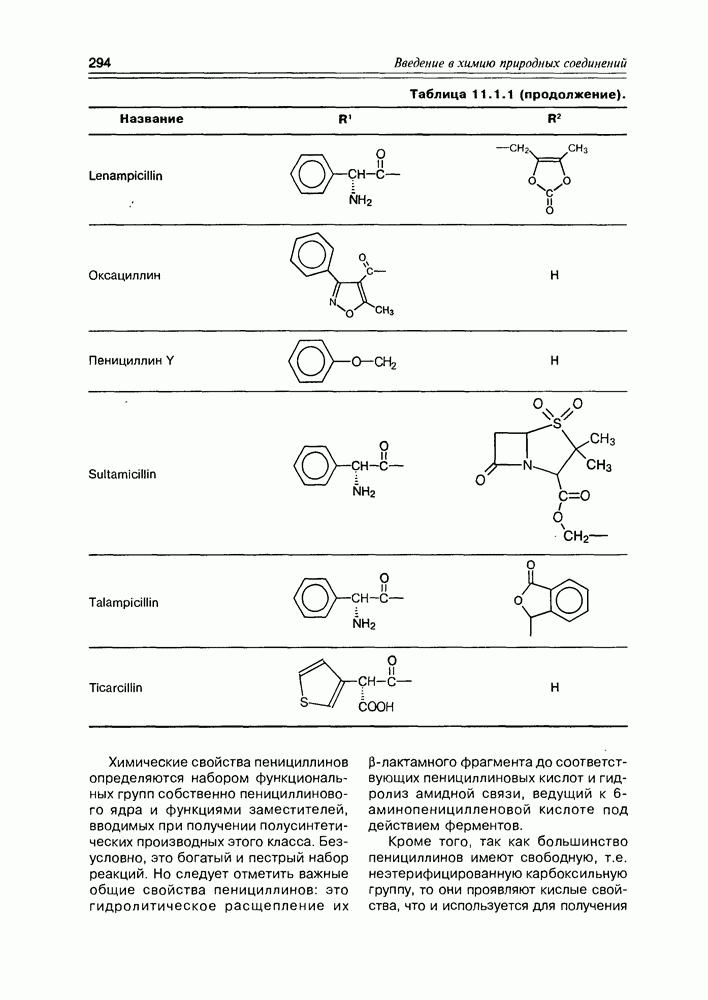
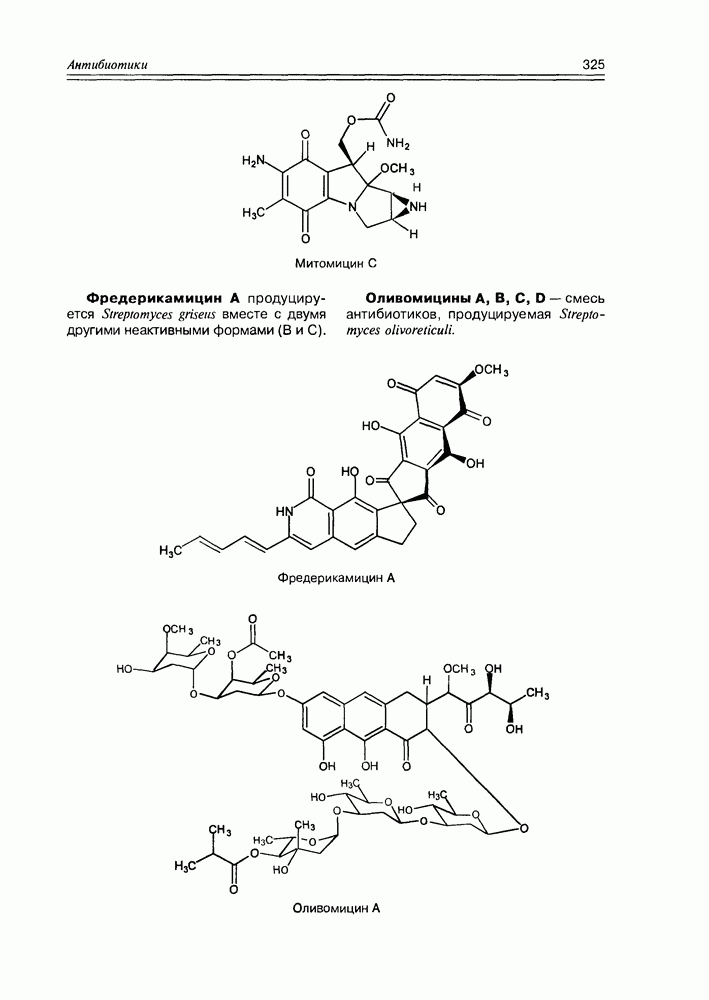
- Глава 11. АНТИБИОТИКИ
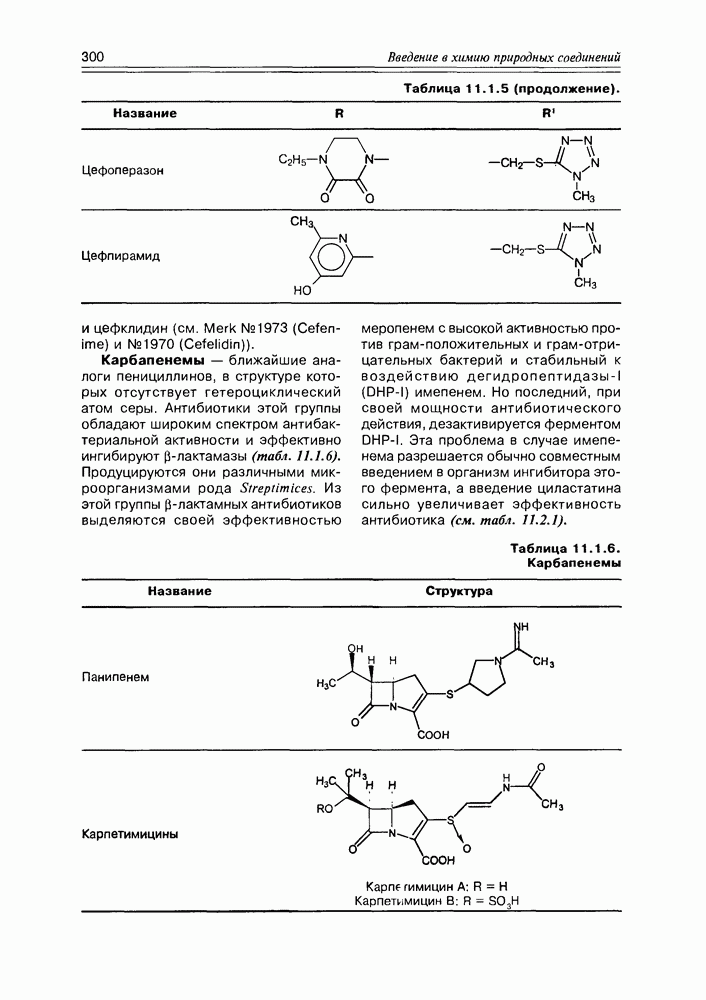
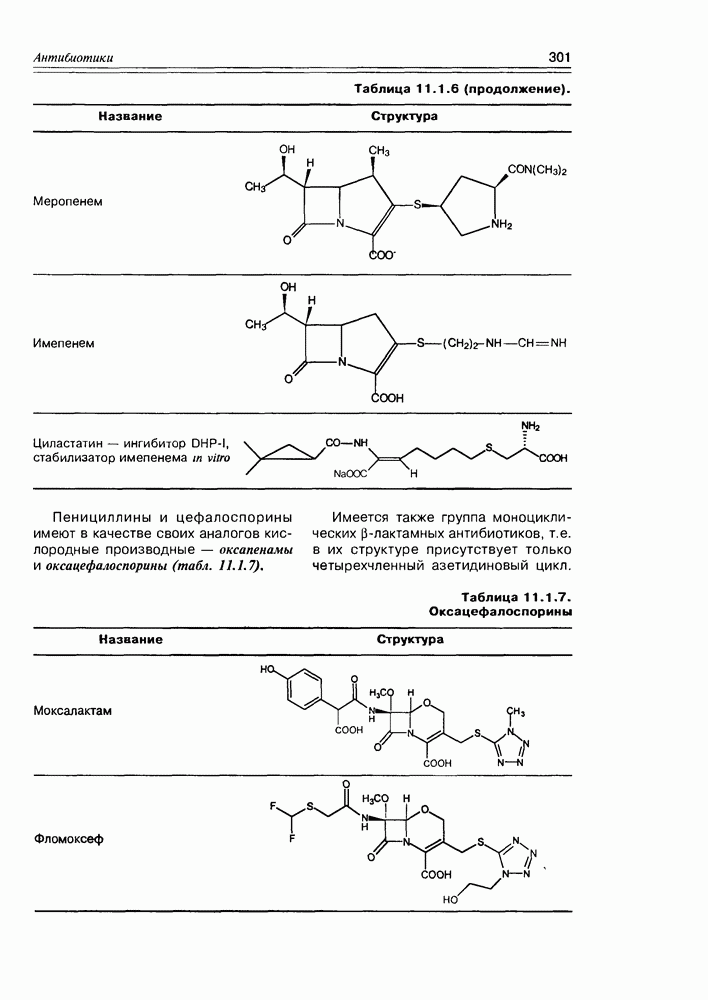
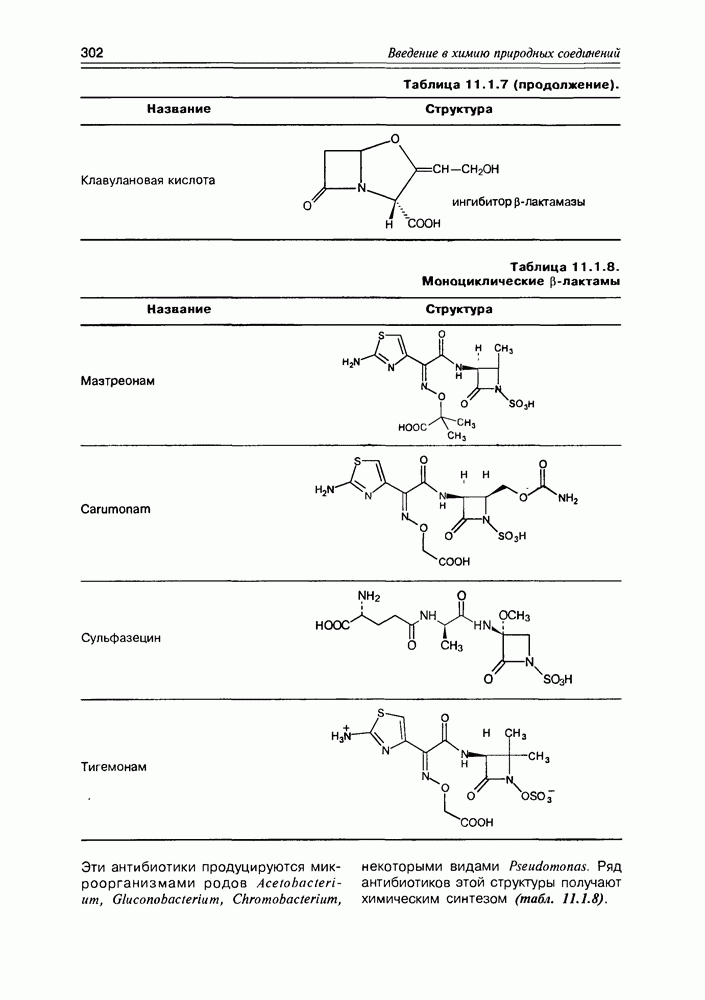
- 11.1. b-Лактамные антибиотики
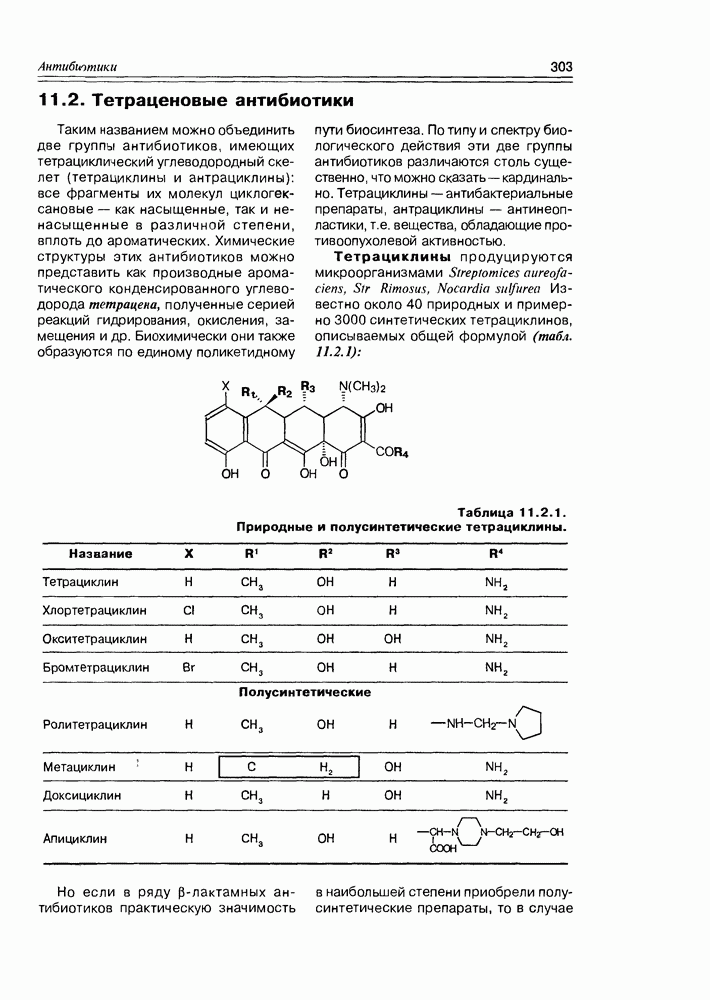
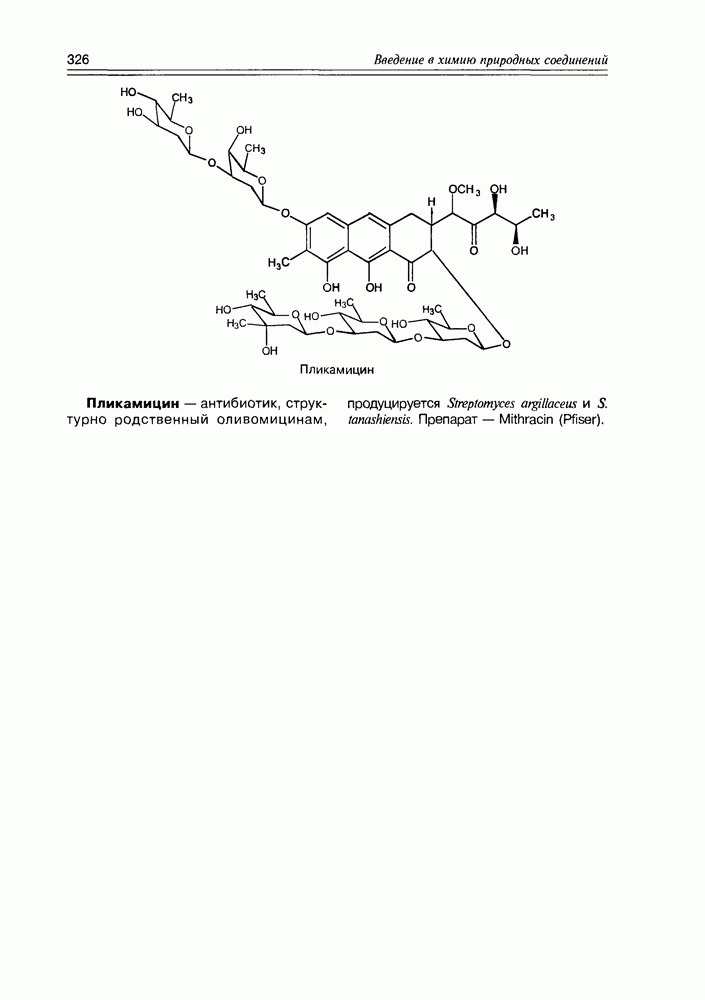
- 11.2. Тетраценовые антибиотики
- 11.3. Аминогликозидные антибиотики
- 11.4. Пептидные антибиотики
- 11.5. Макролидные антибиотики
- 11.6. Полиэфирные антибиотики
- 11.7. Антибиотики разные
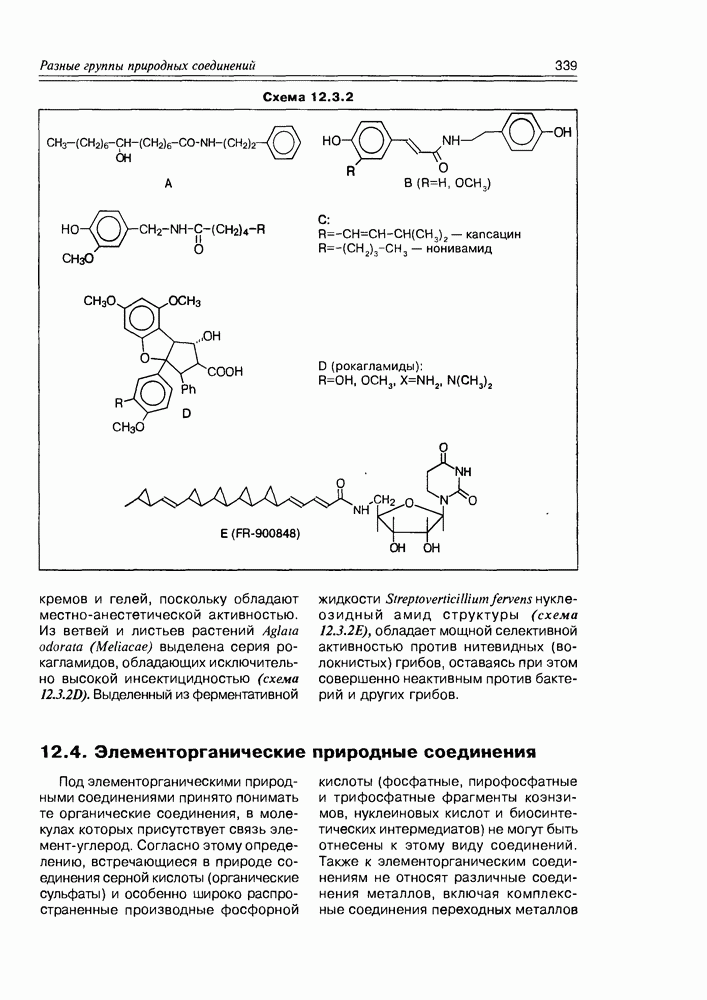
- Глава 12. РАЗНЫЕ ГРУППЫ ПРИРОДНЫХ СОЕДИНЕНИЙ
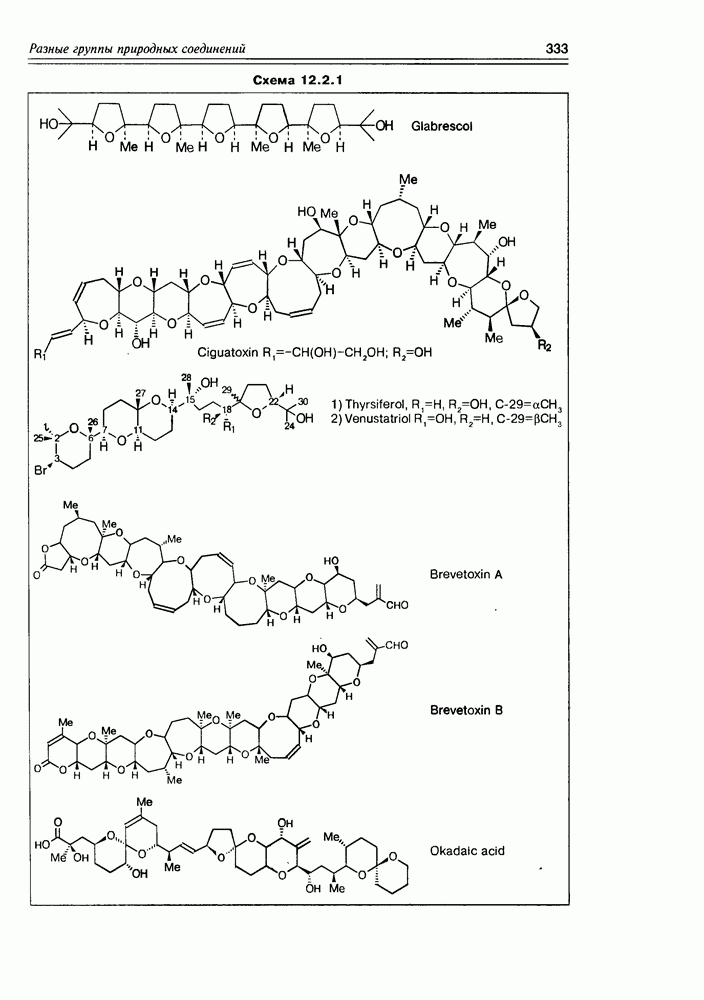
- 12.2. Полиэфиры
- 12.3. Амиды
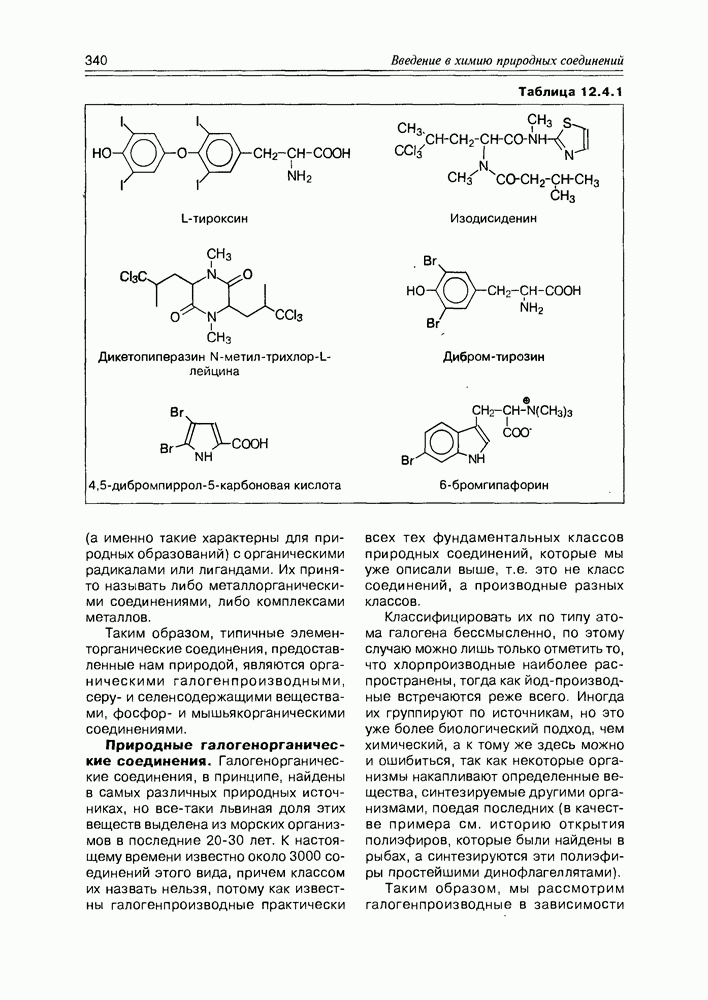
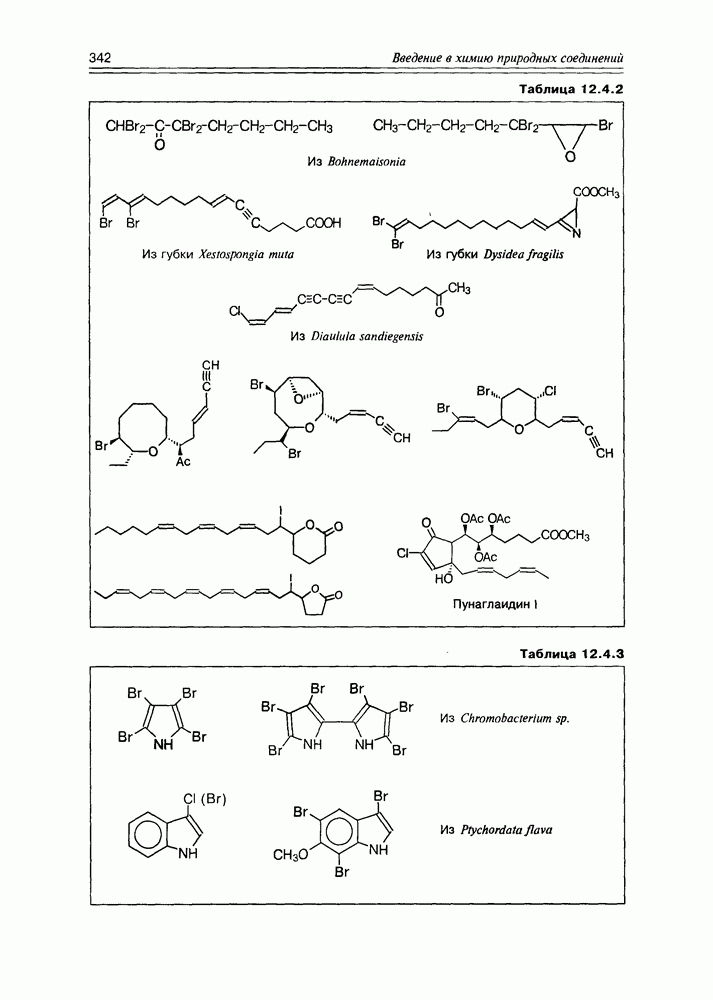
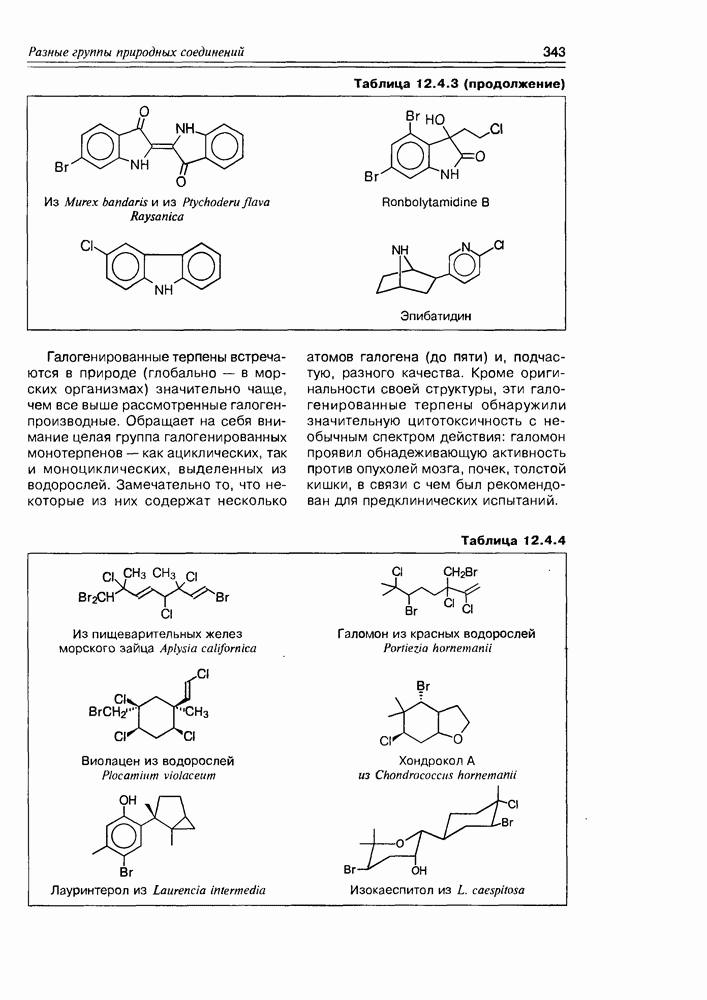
- 12.4. Элементорганические природные соединения
- Глава 13. МЕТАЛЛО-КОЭНЗИМЫ