| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 104. Статистический смысл энтропии
В противоположность первому началу второе начало термодинамики имеет статистическую основу. События микромира (соударения молекул, тепловое излучение атомов) подчинены закону распределения случайных событий, так называемому закону больших чисел; это сказывается в неполноценности тепла в сравнении с работой, или, что то же, в невозможности некомпенсированного превращения теплоты в работу.
Второе начало неприложимо к отдельной молекуле или к малому числу молекул. Иногда говорят, что оно в этом случае является неверным. Это не вполне так. Второе начало оказалось бы неверным, если бы оно содержало в себе какие-либо утверждения, касающиеся отдельной молекулы. Но легко видеть, что второе начало ничего не говорит по поводу того, каково должно быть поведение отдельной молекулы или малой группы молекул: оно в этом случае ничего не утверждает по той простой причине, что к отдельной молекуле неприменимо понятие тепла. Понятия — тепло, температура, энтропия — имеют смысл только по отношению к достаточно крупному агрегату молекул.
Статистический смысл второго начала был вскрыт с полной ясностью в особенности работами Больцмана и Гиббса. Больцман установил, что с молекулярно-кинетической точки зрения смысл второго начала заключается в следующем:
Природа стремится от состояний менее вероятных к состояниям более вероятным.
Наиболее вероятным является равномерное распределение молекул по всему объему, занятому телом. Наиболее вероятным является некоторое вполне определенное распределение скоростей молекул — максвеллово распределение скоростей. Если в системе существует неравномерное распределение молекул по объему или отклоняющееся от закона Максвелла распределение скоростей, то, когда внешние
воздействия на систему будут устранены, в ней сами собой возникнут процессы, которые в конце концов приведут систему в наиболее вероятное состояние. С макрофизической точки зрения эти процессы будут заключаться в выравнивании плотности, в выравнивании температуры, в выравнивании давлений, в выравнивании так называемых химических потенциалов и т. д.
В зависимости от условий, в которые поставлено тело, то или иное состояние тела является наиболее вероятным. Так, в поле тяжести наиболее вероятным является некоторое вполне определенное распределение молекул; для газа это будет то распределение, которое отвечает барометрическому закону изменения плотности (§ 98).
Если мы представим себе, что внутри тела какая-либо молекула переставлена (перемещена) в другое место пространства или имеет другую скорость (причем энергия какой-нибудь другой молекулы тоже изменена так, чтобы в целом энергия тела оставалась неизменной), то от этого, понятно, термодинамическое состояние тела не изменится. Допустим, что мы подсчитали число всех молекулярных перестановок — таких, чтобы термодинамическое состояние тела при этом не изменилось. Для различных термодинамических состояний одного и того же тела это число будет, вообще говоря, неодинаково. Именно это число и называют термодинамической вероятностью состояния тела.
Чем больше объем тела (чем меньше его плотность) и чем больше молекулярно-кинетическая энергия тела (т. е. чем выше температура), тем соответственно больше и число молекулярных пространственно-энергетических перемещений, которые могут быть осуществлены без изменения термодинамического состояния тела, т. е. тем больше термодинамическая вероятность данного состояния тела.
Из сказанного выше ясно, что между энтропией тела и вероятностью состояния существует связь: обе эти величины возрастают, когда изолированная система испытывает необратимый процесс (§ 103). Соотношение, существующее между этими двумя величинами (для случая газа), можно установить, основываясь на простейших свойствах энтропии и вероятности состояния. Для этой цели надо только сопоставить, как изменяются эти две величины в зависимости от количества вещества при неизменности его термодинамического состояния. Вспомним, что энтропия газа пропорциональна его количеству. Возьмем какой-либо объем газа и осторожно, не изменяя состояния газа, разделим перегородкой этот объем газа на две части. Очевидно, что энтропия всего количества взятого газа будет равна сумме энтропий двух его частей:

Теперь спросим себя: чему равна термодинамическая вероятность  всего взятого количества газа, если термодинамические
всего взятого количества газа, если термодинамические
вероятности двух его частей равны  Чтобы правильно ответить на этот вопрос, надо иметь в виду, что вероятность какого-либо совокупного события равна произведению вероятностей отдельных событий. Например, пусть вероятность выигрыша по лотерейному билету есть
Чтобы правильно ответить на этот вопрос, надо иметь в виду, что вероятность какого-либо совокупного события равна произведению вероятностей отдельных событий. Например, пусть вероятность выигрыша по лотерейному билету есть  Допустим, что мы имеем еще другой лотерейный билет, для которого вероятность выигрыша есть
Допустим, что мы имеем еще другой лотерейный билет, для которого вероятность выигрыша есть  тогда вероятность, что мы выиграем по одному из них, будет
тогда вероятность, что мы выиграем по одному из них, будет  но вероятность, что выиграют одновременно оба билета, будет равна произведению
но вероятность, что выиграют одновременно оба билета, будет равна произведению  Аналогично вероятность состояния
Аналогично вероятность состояния  всего взятого количества газа равна произведению вероятностей двух его частей:
всего взятого количества газа равна произведению вероятностей двух его частей:

Итак, суммированию энтропий соответствует умножение термодинамических вероятностей. Такого рода связь между величинами имеет место тогда, когда первая из этих величин  пропорциональна логарифму второй величины
пропорциональна логарифму второй величины  Следовательно, энтропия газа пропорциональна логарифму его термодинамической вероятности:
Следовательно, энтропия газа пропорциональна логарифму его термодинамической вероятности:

Больцман показал, что коэффициент пропорциональности  для 1 моля равен универсальной газовой постоянной
для 1 моля равен универсальной газовой постоянной  разделенной на число молекул в 1 моле:
разделенной на число молекул в 1 моле:

Термодинамическая вероятность является мерой хаотичности молекулярных движений и «рассеяния» молекул (т. е. беспорядочности их размещения и широты их разброса в пространстве). Но термодинамическая вероятность имеет чрезмерно огромное численное значение, поэтому энтропия, пропорциональная логарифму термодинамической вероятности (причем коэффициент пропорциональности весьма мал), представляет собой более удобную меру хаотичности, порождаемой тепловым движением частиц.  Только для кристаллов при температурах, близких к абсолютному нулю, термодинамическая вероятность выражается малым числом, так как в этом случае размещение в пространстве частиц тела вполне упорядочено силами их взаимодействия, а энергия колебательного движения частиц ничтожна. В пределе, для абсолютного
Только для кристаллов при температурах, близких к абсолютному нулю, термодинамическая вероятность выражается малым числом, так как в этом случае размещение в пространстве частиц тела вполне упорядочено силами их взаимодействия, а энергия колебательного движения частиц ничтожна. В пределе, для абсолютного
нуля температуры (когда термодинамическая вероятность размещения частиц может считаться равной единице), энтропия по соотношению (21) становится равной нулю. В связи с этим, как было показано экспериментально и теоретически Нернстом (1907-1911 гг.), теплоемкость кристаллических тел вблизи абсолютного нуля становится исчезающе малой. Нернст показал также, что равновесное сжатие и растяжение кристаллического тела при температуре абсолютного нуля не должно вызывать изменения энтропии, остающейся равной нулю (строго упорядоченное размещение частиц тела в пространстве в этом случае однозначно определяется совокупным действием сил взаимодействия и внешних сжимающих или растягивающих сил). Иначе говоря, изотерма абсолютного нуля для кристаллических тел является вместе с тем адиабатой (в этом заключается сущность теплового закона Нернста).
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- ЧАСТЬ ПЕРВАЯ. ФИЗИЧЕСКИЕ ОСНОВЫ МЕХАНИКИ И АКУСТИКА
- § 1. О взаимосвязи явлений и допустимых границах их схематизации в физике
- § 2. Система ориентировки. Материальная точка и ее перемещение
- § 3. Элементарное перемещение. Векторы скорости и ускорения
- § 4. Тангенциальное и центростремительное ускорения
- § 5. Угловая скорость и угловое ускорение
- § 6. Абсолютное, переносное и относительное движения
- § 7. Закон сложения ускорений
- ГЛАВА II. ЗАКОНЫ НЬЮТОНА
- § 9. Первый ньютонов закон механики (закон инерции)
- § 10. О понятиях «покоя» и «равномерности»
- § 11. Инерциальная система. Принцип относительности
- § 12. Второй ньютонов закон механики
- § 13. Различные понимания второго закона механики
- § 14. Движение под действием постоянной силы
- § 15. Третий ньютонов закон механики
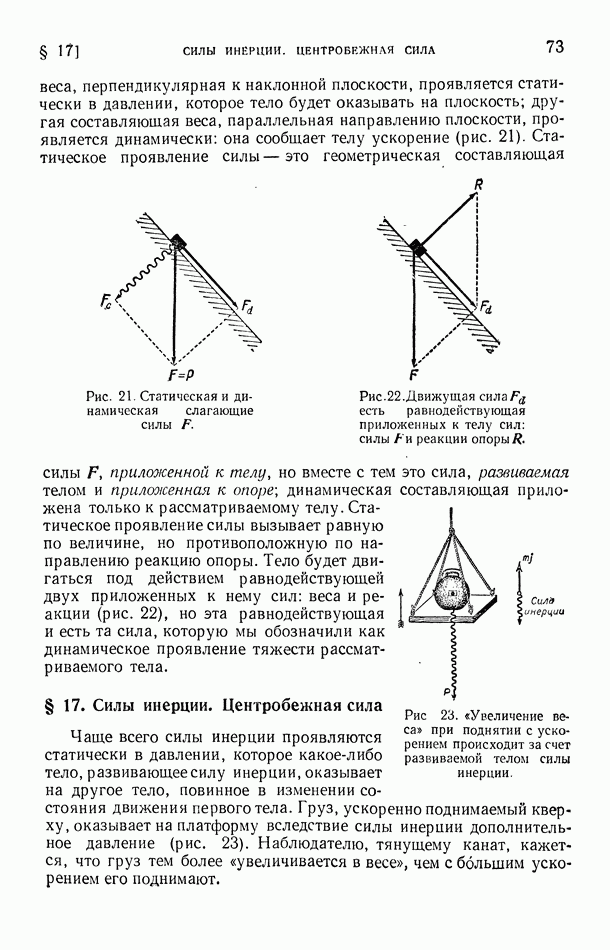
- § 16. Статическое и динамическое проявления сил
- § 17. Силы инерции. Центробежная сила
- ГЛАВА III. РАБОТА И ЭНЕРГИЯ
- § 18. Работа, энергия, мощность. Элемент и интеграл работы
- § 19. Кинетическая энергия и потенциальная энергия
- § 20. Системы мер и размерность механических величин
- ГЛАВА IV. ДИНАМИКА СИСТЕМЫ
- § 21. Механическая система. Внутренние и внешние силы. Центр масс
- § 22. Закон сохранения количества движения и теорема о движении центра масс
- § 23. Закон сохранения энергии в консервативных системах. Минимум потенциальной энергии при равновесии
- § 24. Число степеней свободы и работа сил связи. Принцип возможных перемещений
- § 25. Принцип Даламбера и релятивистское понимание инерции
- ГЛАВА V. МЕХАНИЧЕСКАЯ ПЕРЕДАЧА СИЛ И ЭНЕРГИИ (ТРЕНИЕ, УДАР, ТЯГА)
- § 26. Трение. Тяга
- § 27. Удар
- ГЛАВА VI. ЗАКОН ВСЕМИРНОГО ТЯГОТЕНИЯ И ЭЛЕМЕНТЫ НЕБЕСНОЙ МЕХАНИКИ
- § 28. Законы Кеплера
- § 29. Ньютонов закон тяготения
- § 30. Зависимость веса и ускорения силы тяжести от высоты и географической широты местности
- § 31. Вычисление массы Солнца, Земли и планет
- § 32. Потенциальная энергия и потенциал тяготения
- § 33. Некоторые теоремы о потенциале тяготения
- § 34. Потенциальная энергия системы частиц
- ГЛАВА VII. ДИНАМИКА ВРАЩАТЕЛЬНОГО ДВИЖЕНИЯ ТВЕРДЫХ ТЕЛ
- § 35. Момент силы
- § 36. Кинетическая энергия вращательного движения. Момент инерции
- § 37. Основное уравнение динамики вращательного движения
- § 38. Закон сохранения момента количества движения
- § 39. Проявление поворотных (кориолисовых) сил инерции
- ГЛАВА VIII. ЭЛЕМЕНТЫ ТЕОРИИ УПРУГОСТИ И МЕХАНИЧЕСКИЕ СВОЙСТВА ТЕЛ
- § 40. Упругие свойства тел
- § 41. Закон Гуна. Энергия деформированного тела
- § 42. Модуль объемной упругости. Сжимаемость
- § 43. Модуль Юнга, коэффициент Пуассона, модуль сдвига и соотношение между ними
- § 44. Характеристика механических свойств твердого тела по диаграмме растяжения. Явление наклепа
- § 45. Пластичность
- § 46. Прочность и твердость
- § 47. Механические свойства важнейших материалов
- ГЛАВА IX. ОСНОВЫ ГИДРОДИНАМИКИ И АЭРОДИНАМИКИ
- § 48. Основные понятия и направления гидродинамики
- § 49. Уравнение Бернулли
- § 50. Гидравлическая энергия
- § 51. Вязкость и течение жидкости при трении
- § 52. Пограничный слой и вихреобразование. Строение турбулентного потока
- § 53. Сопротивление движению тел в жидкостях и газах
- § 54. Числа Рейнольдса. Кинематическая вязкость
- § 55. Аэродинамические силы. Подъемная сила крыла и тяга самолета
- ГЛАВА X. КОЛЕБАТЕЛЬНОЕ ДВИЖЕНИЕ
- § 56. Гармоническое колебание
- § 57. Энергия и собственная частота гармонических колебаний
- § 58. Сложение колебаний одинаковой частоты и одинакового направления (интерференция колебаний)
- § 59. Другие случаи сложения колебаний
- § 60. Затухающие колебания
- § 61. Вынужденные колебания. Резонанс
- § 62. Связанные колебания
- ГЛАВА XI. УЧЕНИЕ О ВОЛНАХ
- § 63. Волновой процесс. Уравнение волн. Виды волн
- § 64. Интерференция волн. Стоячие волны
- § 65. Фазовая и групповая скорости волн
- ГЛАВА XII. АКУСТИКА
- § 66. Звук как физическое явление. Распространение звуковых волн
- § 67. Интенсивность звука
- § 68. Частота и состав звуков
- § 69. Явление Допплера
- § 70. Звук как психофизиологическое явление. Механизм звукового восприятия
- § 71. Высота и тембр звука
- § 72. Ультразвуки
- ЧАСТЬ ВТОРАЯ. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
- § 73. Исторические сведения. Картина молекулярного движения
- § 74. Статистический метод в физике
- § 75. Термодинамический метод
- § 76. Термодинамическая характеристика состояния тел и термодинамические процессы
- § 77. Уравнение Клапейрона
- § 78. Внутренняя энергия. Теплота и работа. Уравнение первого начала
- § 79. Изобарная и изотермическая работа газа
- § 80. Термохимические уравнения
- ГЛАВА XIV. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
- § 81. Схематизация явлений («модели» в молекулярной физике)
- § 82. Максвеллов закон распределения молекулярных скоростей в газе
- § 83. Основное уравнение кинетической теории газов
- § 84. Молекулярно-кинетическое понимание абсолютной температуры
- § 85. Об уточненном (термодинамическом) понимании абсолютной температуры
- § 86. Тепловое равновесие и распределение энергии по степеням свободы
- § 87. Максвеллова теория газовых теплоемкостей
- § 88. Молекулярно-кинетическое пояснение работы расширения газа
- § 89. Средний свободный пробег газовых молекул
- ГЛАВА XV. ТЕПЛОПЕРЕДАЧА, ДИФФУЗИЯ И ВЯЗКОСТЬ. ВАКУУМ
- § 90. Тепловое излучение (законы Стефана и Ньютона)
- § 91. Теплопроводность (закон Фурье)
- § 92. Диффузия (закон Фика)
- § 93. Молекулярная теория теплопроводности газов
- § 94. Молекулярная теория вязкости газов
- § 95. Сопоставление явлений диффузии, теплопроводности и вязкости газов
- § 96. Вакуум. Манометры
- § 97. Вакуумные насосы
- ГЛАВА XVI. ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ И ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- § 98. Термодинамическое равновесие и e-положение Больцмана
- § 99. Ограничения, налагаемые вторым началом термодинамики на циклические превращения тепла в работу
- § 100. Уравнение Пуассона. Адиабатная работа газа
- § 101. Цикл Карно и теорема о сумме приведенных теплот
- § 102. Энтропия. Основное уравнение термодинамики
- § 103. Процессы обратимые и необратимые. Теорема о возрастании энтропии
- § 104. Статистический смысл энтропии
- § 105. Теоремы о термодинамическом равновесии. Свободная энергия и термодинамический потенциал
- § 106. О так называемой «тепловой смерти» мира
- § 107. Уравнения Гиббса — Гельмгольца и Клапейрона—Клаузиуса
- ГЛАВА XVII. ФИЗИКА РЕАЛЬНЫХ ГАЗОВ И ПАРОВ. УРАВНЕНИЕ ВАН-ДЕР-ВАЛЬСА
- § 108. Пары насыщенные и перегретые. Диаграмма Эндрюса
- § 109. Конденсация газов
- § 110. Уравнение Ван-дер-Вальса
- § 111. Учение о соответственных состояниях
- § 112. О качественных превращениях при тепловых процессах
- ГЛАВА XVIII. ФИЗИКА ЖИДКОСТЕЙ
- § 113. Механические и термодинамические свойства жидкостей
- § 114. Поверхностное натяжение
- § 115. Формула Лапласа. Явления капиллярности и смачивания
- § 116. Поверхностноактивные вещества
- § 117. Строение жидкостей
- § 118. Кинетика испарения. Зависимость давления насыщенного пара от кривизны поверхности жидкости. Формула Томсона — Шиллера
- § 119. Понижение давления пара над раствором и повышение температуры кипения растворов. Законы Рауля
- § 120. Осмотическое давление. Закон Вант-Гоффа
- § 121. Электролитическая диссоциация. Закон Оствальда
- § 122. Абсорбция. Закон Генри
- § 123. О столкновении противоположных процессов в молекулярно-тепловых явлениях
- ГЛАВА XIX. ФИЗИКА ТВЕРДЫХ ТЕЛ
- § 124. Строение кристаллов
- § 125. Понятие о кристаллохимии
- § 126. Форма и рост кристаллов
- § 127. Теплоемкость твердых тел
- § 128. Сублимация твердых тел. Тройная точка
- § 129. Кристаллизация растворов. Диаграмма плавкости
- § 130. Силы связи в кристаллах
- § 131. Адсорбция
- ГЛАВА XX. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ В ДВИГАТЕЛЯХ И СВЕРХЗВУКОВОЕ ДВИЖЕНИЕ
- § 132. Основное уравнение газодинамики. Адиабатный теплоперепад
- § 133. Адиабатное течение газа
- § 134. Ударные волны и скачки уплотнения. Адиабата Гюгонио
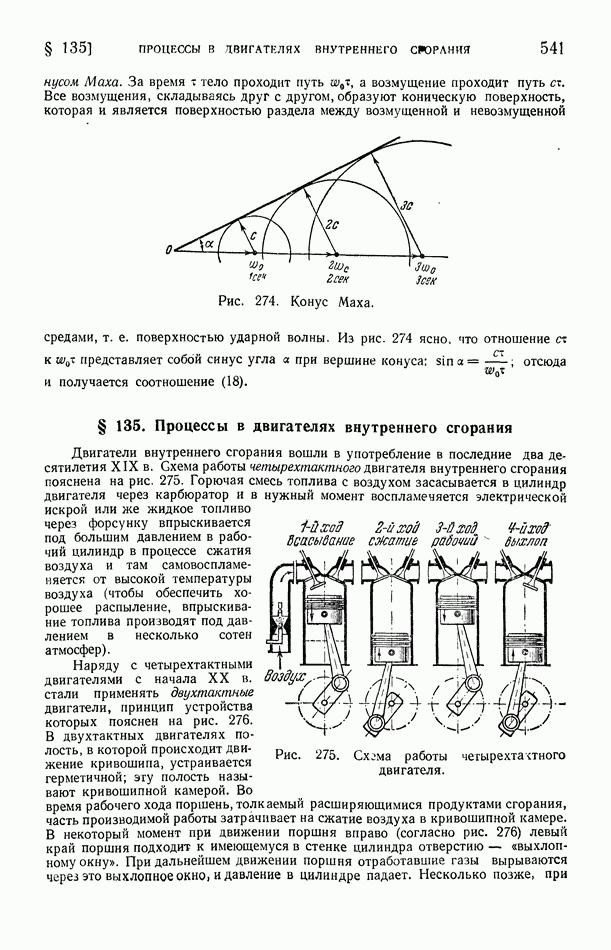
- § 135. Процессы в двигателях внутреннего сгорания
- § 136. Процессы в паровых машинах и паровых турбинах
- § 137. Реактивные двигатели