| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 105. Теоремы о термодинамическом равновесии. Свободная энергия и термодинамический потенциал
Некоторые весьма общие теоремы о термодинамическом равновесии были установлены во второй половине прошлого столетия Клаузиусом и Гельмгольцем и вслед за ними, в наиболее строгой форме, Гиббсом. Эти теоремы основаны на учении об энтропии, которое Гельмгольц и Гиббс развили в учение о термодинамических потенциалах. Мы ограничимся здесь кратким пояснением некоторых наиболее важных понятий и выводов.
Процесс, испытываемый изолированной системой, может быть или обратимым, или же необратимым. В первом случае энтропия изолированной системы остается неизменной, во втором — энтропия возрастает. Отсюда ясно, что когда энтропия системы достигнет максимума, изолированная система будет пребывать в состоянии устойчивого равновесия. Она может быть выведена из этого состояния только посредством внешних воздействий.
Возьмем, например, стакан воды и, изолировав его в тепловом отношении от окружающей среды, бросим в него достаточно большой кусок медного купороса. Часть медного купороса растворится и при этом температура воды несколько понизится (растворение многих других тел сопровождается, напротив, повышением температуры). Растворение приостановится тогда, когда энтропия системы — в данном случае сумма энтропий медного купороса и его водного раствора — достигнет максимума.
На практике часто приходится иметь дело с системами, которые в тепловом отношении не только не изолированы от окружающей их среды, но, напротив, поставлены в такие условия, что, несмотря на протекающие в них процессы, температура их все время поддерживается примерно постоянной.
Если мы обратимся к примеру, приведенному выше, то сможем утверждать, что в этом случае (когда температуру воды поддерживают постоянной) растворится большее количество медного купороса. Состояние равновесия будет иное; оно не будет уже соответствовать максимуму энтропии купороса и его водного раствора. Конечно, и в этом случае можно применить ту же теорему о максимуме энтропии, если опять изучать изолированную систему, включающую в себя в данном случае не только стакан с раствором медного купороса, но также и среду, в которой этот стакан находится. Но это усложняет дело, и в этом нет надобности, так как для важного случая изотермических процессов термодинамика устанавливает особый критерий равновесия.
Вспомним то, что было сказано в § 103 (стр. 419) о величине  Эта величина (по терминологии Гельмгольца — связанная энергия) представляет собой ту часть внутренней энергии тела, которая может быть получена нами только в форме тепла, если отнятие тепла производить при температурах не ниже
Эта величина (по терминологии Гельмгольца — связанная энергия) представляет собой ту часть внутренней энергии тела, которая может быть получена нами только в форме тепла, если отнятие тепла производить при температурах не ниже  Остальная, полноценная часть внутренней энергии
Остальная, полноценная часть внутренней энергии  при тех же условиях может быть получена в форме работы. Эту полноценную часть внутренней энергии называют свободной энергией и обычно обозначают буквой
при тех же условиях может быть получена в форме работы. Эту полноценную часть внутренней энергии называют свободной энергией и обычно обозначают буквой 
Пусть система изотермически переходит из состояния  Приращение энтропии системы равно приведенной теплоте этого процесса:
Приращение энтропии системы равно приведенной теплоте этого процесса:  Здесь
Здесь  есть теплота, сообщенная системе; желая отметить, что температура остается неизменной, величину
есть теплота, сообщенная системе; желая отметить, что температура остается неизменной, величину  обычно называют скрытой теплотой: скрытая теплота плавления, испарения и т. д. Скрытую теплоту часто обозначают буквой
обычно называют скрытой теплотой: скрытая теплота плавления, испарения и т. д. Скрытую теплоту часто обозначают буквой  Мы видим, что скрытая теплота изотермического процесса идет на увеличение обесцененной части внутренней энергии:
Мы видим, что скрытая теплота изотермического процесса идет на увеличение обесцененной части внутренней энергии:

Работу, произведенную системой при изотермическом процессе, обозначим через  Система производит работу за счет убыли внутренней энергии
Система производит работу за счет убыли внутренней энергии  и за счет сообщенного системе тепла
и за счет сообщенного системе тепла  Следовательно,
Следовательно,  Соединяя в правой части этого выражения средние и крайние члены и имея в виду, что
Соединяя в правой части этого выражения средние и крайние члены и имея в виду, что  есть свободная энергия
есть свободная энергия  которая присуща системе в состоянии
которая присуща системе в состоянии  есть свободная энергия
есть свободная энергия  в состоянии
в состоянии  мы видим, что при изотермическом процессе система производит работу за счет убыли свободной энергии:
мы видим, что при изотермическом процессе система производит работу за счет убыли свободной энергии:

Например, гальванический элемент производит работу (работу электрического тока), равную убыли свободной энергии веществ, химически реагирующих в элементе.
Одна из самых важных теорем термодинамики гласит: если температуру и объем системы сохранять неизменными, то внутри системы будут протекать только такие процессы, которые сопровождаются убылью свободной энергии или же (при равновесном течении) не изменяют ее величины. Когда обстановкой опыта гарантирована неизменность температуры и объема, состоянию устойчивого равновесия соответствует минимум свободной энергии.
Свободная энергия единицы массы вещества  в сумме с энергией, которую можно было бы назвать объемной, равной произведению давления на удельный (или мольный) объем, составляет так называемый полный термодинамический потенциал (для химически однородных веществ его называют также химическим потенциалом):
в сумме с энергией, которую можно было бы назвать объемной, равной произведению давления на удельный (или мольный) объем, составляет так называемый полный термодинамический потенциал (для химически однородных веществ его называют также химическим потенциалом):

Как мы убедимся в дальнейшем (§ 108), при термодинамическом равновесии жидкости и ее насыщенного пара (а также и при термодинамическом равновесии жидкой и твердой фаз) полные термодинамические потенциалы в равновесных фазах одинаковы.
Подобно разности температур, которая является мерой отклонения от теплового равновесия тел, разность полных термодинамических потенциалов (а в случае смеси веществ разность химических потенциалов) служит мерой отклонения от состояния термодинамического равновесия.
Заметим, что термодинамические величины  принято относить к состоянию вещества в кристаллическом виде при абсолютном нуле; тогда значения указанных величин называют абсолютными. Очевидно, что для вычисления абсолютных значений свободной энергии и полного термодинамического потенциала необходимо предварительно вычислить абсолютное значение энтропии.
принято относить к состоянию вещества в кристаллическом виде при абсолютном нуле; тогда значения указанных величин называют абсолютными. Очевидно, что для вычисления абсолютных значений свободной энергии и полного термодинамического потенциала необходимо предварительно вычислить абсолютное значение энтропии.

Рис. 212. К вычислению энтропии по закону Нернста.
Как проще всего можно вычислить энтропию? Легче всего может быть измерена теплоемкость тела при постоянном давлении,  Основываясь на законе Нернста, мы покажем сейчас, что для вычисления абсолютных значений энтропии надо измерить, как изменяется величина
Основываясь на законе Нернста, мы покажем сейчас, что для вычисления абсолютных значений энтропии надо измерить, как изменяется величина  в зависимости от температуры вплоть до предельно низкой температуры. Пусть заданное состояние тела С (рис. 212), энтропию которого требуется вычислить, характеризуется абсолютной температурой
в зависимости от температуры вплоть до предельно низкой температуры. Пусть заданное состояние тела С (рис. 212), энтропию которого требуется вычислить, характеризуется абсолютной температурой  и давлением
и давлением  Представим себе, что мы взяли то же самое тело при
Представим себе, что мы взяли то же самое тело при  В этом (начальном) состоянии
В этом (начальном) состоянии  его энтропия
его энтропия  Подвергнем тело
Подвергнем тело
равновесному адиабатному сжатию до тех пор, пока его давление не достигнет заданного значения  Согласно закону Нернста нулевая адиабата совпадает с изотермой абсолютного нуля (рис. 212), и, следовательно, энтропия и температура тела останутся равными нулю. Теперь начнем нагревать тело, сохраняя давление на него неизменным, и будем так нагревать его до тех пор, пока температура его не достигнет заданного значения
Согласно закону Нернста нулевая адиабата совпадает с изотермой абсолютного нуля (рис. 212), и, следовательно, энтропия и температура тела останутся равными нулю. Теперь начнем нагревать тело, сохраняя давление на него неизменным, и будем так нагревать его до тех пор, пока температура его не достигнет заданного значения  Когда нагревают тело при постоянном давлении, то, чтобы повысить температуру тела на
Когда нагревают тело при постоянном давлении, то, чтобы повысить температуру тела на  надо каждый раз сообщать телу теплоту
надо каждый раз сообщать телу теплоту  при этом энтропия его возрастет на
при этом энтропия его возрастет на  Сумма (интеграл) этих величин, взятая для всего интервала температур от
Сумма (интеграл) этих величин, взятая для всего интервала температур от  до
до  будет представлять собой абсолютное значение энтропии:
будет представлять собой абсолютное значение энтропии:

(интегрирование производится при постоянном давлении).
Здесь самое важное — то, что для вычисления абсолютного значения энтропии достаточно знать, как теплоемкость тела  изменяется в зависимости от температуры, и нет надобности знать, как она зависит от давления (или же от плотности) тела.
изменяется в зависимости от температуры, и нет надобности знать, как она зависит от давления (или же от плотности) тела.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- ЧАСТЬ ПЕРВАЯ. ФИЗИЧЕСКИЕ ОСНОВЫ МЕХАНИКИ И АКУСТИКА
- § 1. О взаимосвязи явлений и допустимых границах их схематизации в физике
- § 2. Система ориентировки. Материальная точка и ее перемещение
- § 3. Элементарное перемещение. Векторы скорости и ускорения
- § 4. Тангенциальное и центростремительное ускорения
- § 5. Угловая скорость и угловое ускорение
- § 6. Абсолютное, переносное и относительное движения
- § 7. Закон сложения ускорений
- ГЛАВА II. ЗАКОНЫ НЬЮТОНА
- § 9. Первый ньютонов закон механики (закон инерции)
- § 10. О понятиях «покоя» и «равномерности»
- § 11. Инерциальная система. Принцип относительности
- § 12. Второй ньютонов закон механики
- § 13. Различные понимания второго закона механики
- § 14. Движение под действием постоянной силы
- § 15. Третий ньютонов закон механики
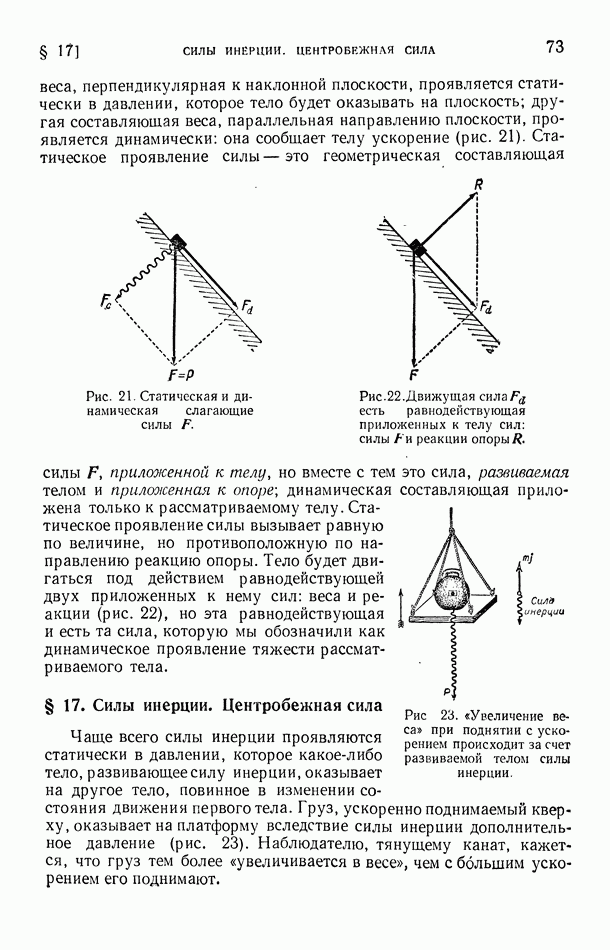
- § 16. Статическое и динамическое проявления сил
- § 17. Силы инерции. Центробежная сила
- ГЛАВА III. РАБОТА И ЭНЕРГИЯ
- § 18. Работа, энергия, мощность. Элемент и интеграл работы
- § 19. Кинетическая энергия и потенциальная энергия
- § 20. Системы мер и размерность механических величин
- ГЛАВА IV. ДИНАМИКА СИСТЕМЫ
- § 21. Механическая система. Внутренние и внешние силы. Центр масс
- § 22. Закон сохранения количества движения и теорема о движении центра масс
- § 23. Закон сохранения энергии в консервативных системах. Минимум потенциальной энергии при равновесии
- § 24. Число степеней свободы и работа сил связи. Принцип возможных перемещений
- § 25. Принцип Даламбера и релятивистское понимание инерции
- ГЛАВА V. МЕХАНИЧЕСКАЯ ПЕРЕДАЧА СИЛ И ЭНЕРГИИ (ТРЕНИЕ, УДАР, ТЯГА)
- § 26. Трение. Тяга
- § 27. Удар
- ГЛАВА VI. ЗАКОН ВСЕМИРНОГО ТЯГОТЕНИЯ И ЭЛЕМЕНТЫ НЕБЕСНОЙ МЕХАНИКИ
- § 28. Законы Кеплера
- § 29. Ньютонов закон тяготения
- § 30. Зависимость веса и ускорения силы тяжести от высоты и географической широты местности
- § 31. Вычисление массы Солнца, Земли и планет
- § 32. Потенциальная энергия и потенциал тяготения
- § 33. Некоторые теоремы о потенциале тяготения
- § 34. Потенциальная энергия системы частиц
- ГЛАВА VII. ДИНАМИКА ВРАЩАТЕЛЬНОГО ДВИЖЕНИЯ ТВЕРДЫХ ТЕЛ
- § 35. Момент силы
- § 36. Кинетическая энергия вращательного движения. Момент инерции
- § 37. Основное уравнение динамики вращательного движения
- § 38. Закон сохранения момента количества движения
- § 39. Проявление поворотных (кориолисовых) сил инерции
- ГЛАВА VIII. ЭЛЕМЕНТЫ ТЕОРИИ УПРУГОСТИ И МЕХАНИЧЕСКИЕ СВОЙСТВА ТЕЛ
- § 40. Упругие свойства тел
- § 41. Закон Гуна. Энергия деформированного тела
- § 42. Модуль объемной упругости. Сжимаемость
- § 43. Модуль Юнга, коэффициент Пуассона, модуль сдвига и соотношение между ними
- § 44. Характеристика механических свойств твердого тела по диаграмме растяжения. Явление наклепа
- § 45. Пластичность
- § 46. Прочность и твердость
- § 47. Механические свойства важнейших материалов
- ГЛАВА IX. ОСНОВЫ ГИДРОДИНАМИКИ И АЭРОДИНАМИКИ
- § 48. Основные понятия и направления гидродинамики
- § 49. Уравнение Бернулли
- § 50. Гидравлическая энергия
- § 51. Вязкость и течение жидкости при трении
- § 52. Пограничный слой и вихреобразование. Строение турбулентного потока
- § 53. Сопротивление движению тел в жидкостях и газах
- § 54. Числа Рейнольдса. Кинематическая вязкость
- § 55. Аэродинамические силы. Подъемная сила крыла и тяга самолета
- ГЛАВА X. КОЛЕБАТЕЛЬНОЕ ДВИЖЕНИЕ
- § 56. Гармоническое колебание
- § 57. Энергия и собственная частота гармонических колебаний
- § 58. Сложение колебаний одинаковой частоты и одинакового направления (интерференция колебаний)
- § 59. Другие случаи сложения колебаний
- § 60. Затухающие колебания
- § 61. Вынужденные колебания. Резонанс
- § 62. Связанные колебания
- ГЛАВА XI. УЧЕНИЕ О ВОЛНАХ
- § 63. Волновой процесс. Уравнение волн. Виды волн
- § 64. Интерференция волн. Стоячие волны
- § 65. Фазовая и групповая скорости волн
- ГЛАВА XII. АКУСТИКА
- § 66. Звук как физическое явление. Распространение звуковых волн
- § 67. Интенсивность звука
- § 68. Частота и состав звуков
- § 69. Явление Допплера
- § 70. Звук как психофизиологическое явление. Механизм звукового восприятия
- § 71. Высота и тембр звука
- § 72. Ультразвуки
- ЧАСТЬ ВТОРАЯ. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
- § 73. Исторические сведения. Картина молекулярного движения
- § 74. Статистический метод в физике
- § 75. Термодинамический метод
- § 76. Термодинамическая характеристика состояния тел и термодинамические процессы
- § 77. Уравнение Клапейрона
- § 78. Внутренняя энергия. Теплота и работа. Уравнение первого начала
- § 79. Изобарная и изотермическая работа газа
- § 80. Термохимические уравнения
- ГЛАВА XIV. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
- § 81. Схематизация явлений («модели» в молекулярной физике)
- § 82. Максвеллов закон распределения молекулярных скоростей в газе
- § 83. Основное уравнение кинетической теории газов
- § 84. Молекулярно-кинетическое понимание абсолютной температуры
- § 85. Об уточненном (термодинамическом) понимании абсолютной температуры
- § 86. Тепловое равновесие и распределение энергии по степеням свободы
- § 87. Максвеллова теория газовых теплоемкостей
- § 88. Молекулярно-кинетическое пояснение работы расширения газа
- § 89. Средний свободный пробег газовых молекул
- ГЛАВА XV. ТЕПЛОПЕРЕДАЧА, ДИФФУЗИЯ И ВЯЗКОСТЬ. ВАКУУМ
- § 90. Тепловое излучение (законы Стефана и Ньютона)
- § 91. Теплопроводность (закон Фурье)
- § 92. Диффузия (закон Фика)
- § 93. Молекулярная теория теплопроводности газов
- § 94. Молекулярная теория вязкости газов
- § 95. Сопоставление явлений диффузии, теплопроводности и вязкости газов
- § 96. Вакуум. Манометры
- § 97. Вакуумные насосы
- ГЛАВА XVI. ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ И ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- § 98. Термодинамическое равновесие и e-положение Больцмана
- § 99. Ограничения, налагаемые вторым началом термодинамики на циклические превращения тепла в работу
- § 100. Уравнение Пуассона. Адиабатная работа газа
- § 101. Цикл Карно и теорема о сумме приведенных теплот
- § 102. Энтропия. Основное уравнение термодинамики
- § 103. Процессы обратимые и необратимые. Теорема о возрастании энтропии
- § 104. Статистический смысл энтропии
- § 105. Теоремы о термодинамическом равновесии. Свободная энергия и термодинамический потенциал
- § 106. О так называемой «тепловой смерти» мира
- § 107. Уравнения Гиббса — Гельмгольца и Клапейрона—Клаузиуса
- ГЛАВА XVII. ФИЗИКА РЕАЛЬНЫХ ГАЗОВ И ПАРОВ. УРАВНЕНИЕ ВАН-ДЕР-ВАЛЬСА
- § 108. Пары насыщенные и перегретые. Диаграмма Эндрюса
- § 109. Конденсация газов
- § 110. Уравнение Ван-дер-Вальса
- § 111. Учение о соответственных состояниях
- § 112. О качественных превращениях при тепловых процессах
- ГЛАВА XVIII. ФИЗИКА ЖИДКОСТЕЙ
- § 113. Механические и термодинамические свойства жидкостей
- § 114. Поверхностное натяжение
- § 115. Формула Лапласа. Явления капиллярности и смачивания
- § 116. Поверхностноактивные вещества
- § 117. Строение жидкостей
- § 118. Кинетика испарения. Зависимость давления насыщенного пара от кривизны поверхности жидкости. Формула Томсона — Шиллера
- § 119. Понижение давления пара над раствором и повышение температуры кипения растворов. Законы Рауля
- § 120. Осмотическое давление. Закон Вант-Гоффа
- § 121. Электролитическая диссоциация. Закон Оствальда
- § 122. Абсорбция. Закон Генри
- § 123. О столкновении противоположных процессов в молекулярно-тепловых явлениях
- ГЛАВА XIX. ФИЗИКА ТВЕРДЫХ ТЕЛ
- § 124. Строение кристаллов
- § 125. Понятие о кристаллохимии
- § 126. Форма и рост кристаллов
- § 127. Теплоемкость твердых тел
- § 128. Сублимация твердых тел. Тройная точка
- § 129. Кристаллизация растворов. Диаграмма плавкости
- § 130. Силы связи в кристаллах
- § 131. Адсорбция
- ГЛАВА XX. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ В ДВИГАТЕЛЯХ И СВЕРХЗВУКОВОЕ ДВИЖЕНИЕ
- § 132. Основное уравнение газодинамики. Адиабатный теплоперепад
- § 133. Адиабатное течение газа
- § 134. Ударные волны и скачки уплотнения. Адиабата Гюгонио
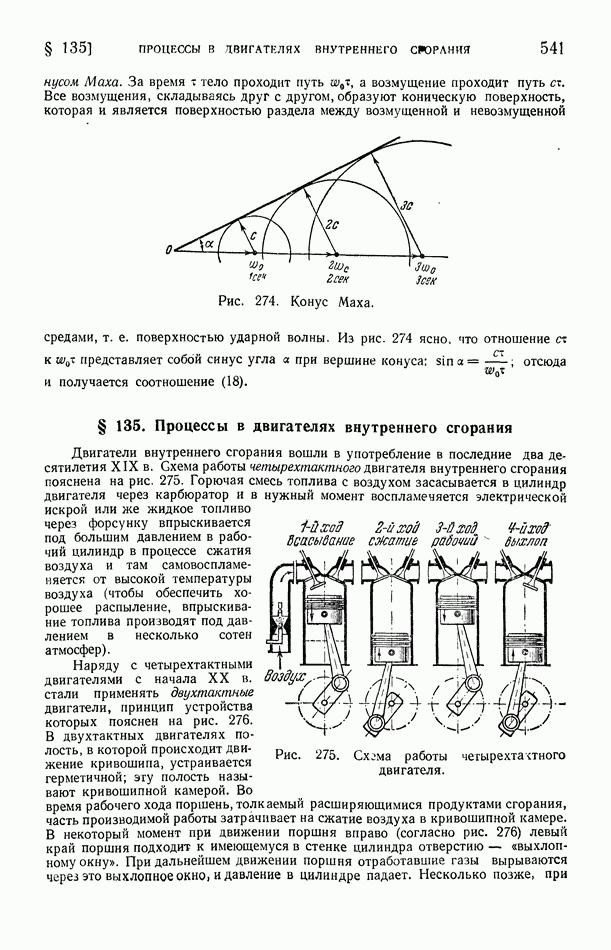
- § 135. Процессы в двигателях внутреннего сгорания
- § 136. Процессы в паровых машинах и паровых турбинах
- § 137. Реактивные двигатели