| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 121. Электролитическая диссоциация. Закон Оствальда
Совершенно чистая вода не проводит электрического тока. Хлористоводородный газ  (как вообще газы) также является непроводником электрического тока. Но если растворить в воде некоторое количество хлористоводородного газа, то полученный раствор будет хорошо проводить электричество. Можно было бы заменить в предыдущем примере хлористоводородный газ каким-нибудь другим веществом (твердым, жидким или газообразным), принадлежащим к обширному классу так называемых электролитов.
(как вообще газы) также является непроводником электрического тока. Но если растворить в воде некоторое количество хлористоводородного газа, то полученный раствор будет хорошо проводить электричество. Можно было бы заменить в предыдущем примере хлористоводородный газ каким-нибудь другим веществом (твердым, жидким или газообразным), принадлежащим к обширному классу так называемых электролитов.
Сильными электролитами называют вещества, которые при растворении в воде почти полностью диссоцируют на ионы; вещества, у которых при растворении в воде только часть молекул распадается на ионы, называют слабыми электролитами.
Не следует думать, что ионы возникают лишь тогда, когда, например, кристаллик соли попадает в воду. У многих твердых тел в узлах кристаллической решетки находятся не молекулы, а ионы. В химических реакциях образование ионов сопровождается обменом электронов между атомами При электронном обмене одни атомы отдают электроны, превращаясь в положительные ионы, а другие принимают электроны, становясь отрицательными ионами, после чего те и другие вследствие взаимного электрического притяжения образуют электрополярную, или, как говорят иначе, гетерополярную молекулу. Число электронов, которое при этом отдается или принимается атомом того или иного элемента, определяется его валентностью.
Действие растворителя заключается лишь в том, что он расщепляет молекулу сложного вещества на те ионы, которые в ней уже заранее содержатся. Распад молекул на ионы совершается по следующим схемам:
Кислоты диссоциируются на ионы водорода (протоны) и ионы кислотного остатка. Например,

Ионы  при этом гид ротируются, т. е. соединяются с молекулами воды, образуя сложные («комплексные») ионы
при этом гид ротируются, т. е. соединяются с молекулами воды, образуя сложные («комплексные») ионы  так называемые ионы гидроксония. Именно ионы гидроксония являются носителями «кислотных» свойств растворов кислот (а не свободные протоны).
так называемые ионы гидроксония. Именно ионы гидроксония являются носителями «кислотных» свойств растворов кислот (а не свободные протоны).
Щелочи диссоциируют на ионы металла и ионы гидроксила (водного остатка). Например,

Соли диссоциируют на ионы металла и ионы кислотного остатка. Например,

Вода также в незначительной степени диссоциирует по уравнению

Основной причиной разрушительного действия воды на молекулы (электролита) является ее способность уменьшать напряженность электростатического поля в определенное число раз, равное ее диэлектрической постоянной (для воды  В отношении диэлектрической постоянной, а отсюда и по диссоциирующей способности вода превосходит почти все известные жидкости. Из последних сравнительно большую диэлектрическую постоянную имеют глицерин, метиловый спирт, этилен-гликоль и винный (этиловый) спирт; большинство же жидкостей имеет диэлектрические постоянные, мало превосходящие единицу, т. е. эти жидкости почти совершенно не «экранируют» электрических сил, например диэлектрическая постоянная бензола 2,3, бензина — еще меньше. Поэтому в этих жидкостях соли, кислоты и щелочи почти не растворяются и не диссоциируют на ионы.
В отношении диэлектрической постоянной, а отсюда и по диссоциирующей способности вода превосходит почти все известные жидкости. Из последних сравнительно большую диэлектрическую постоянную имеют глицерин, метиловый спирт, этилен-гликоль и винный (этиловый) спирт; большинство же жидкостей имеет диэлектрические постоянные, мало превосходящие единицу, т. е. эти жидкости почти совершенно не «экранируют» электрических сил, например диэлектрическая постоянная бензола 2,3, бензина — еще меньше. Поэтому в этих жидкостях соли, кислоты и щелочи почти не растворяются и не диссоциируют на ионы.
При равновесии в растворе число молекул, возникающих в единицу времени благодаря случайным столкновениям противоположно заряженных ионов, равно числу молекул, распадающихся в тот же промежуток времени на ионы. Обозначим общее число молекул растворенного вещества в единице объема буквой  Степень диссоциации, т. е. отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества, обозначим а. Число молекул, не подвергнувшихся распаду, равно, очевидно,
Степень диссоциации, т. е. отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества, обозначим а. Число молекул, не подвергнувшихся распаду, равно, очевидно,  число положительных ионов равно а
число положительных ионов равно а  и таково же число отрицательных ионов (в том случае, конечно, если молекула при диссоциации распадается только на два иона).
и таково же число отрицательных ионов (в том случае, конечно, если молекула при диссоциации распадается только на два иона).
Вероятность соударения какого-либо отрицательного иона с одним из положительных ионов пропорциональна числу положительных ионов  Общее число соударений ионов, а значит, и число молекул, возникающих в единицу времени, пропорционально, во-первых, вероятности, что данный отрицательный ион встретится с каким-либо положительным ионом, и, во-вторых, числу
Общее число соударений ионов, а значит, и число молекул, возникающих в единицу времени, пропорционально, во-первых, вероятности, что данный отрицательный ион встретится с каким-либо положительным ионом, и, во-вторых, числу
отридательных ионов; следовательно, оно пропорционально произведению а  Если коэффициент пропорциональности обозначить буквой
Если коэффициент пропорциональности обозначить буквой  то мы можем написать, что число молекул возникающих в единицу времени, равно
то мы можем написать, что число молекул возникающих в единицу времени, равно 
С другой стороны, очевидно, что число молекул, распадающихся в единицу времени на ионы в связи с ионизирующим действием растворителя, будет тем больше, чем больше при прочих равных условиях общее число нераспавшихся молекул. Если в данном случае коэффициент пропорциональности мы обозначим буквой  то мы можем написать, что число молекул, распадающихся в единицу времени на ионы, равно:
то мы можем написать, что число молекул, распадающихся в единицу времени на ионы, равно:

Так как при равновесии процесс диссоциации должен уравновешиваться процессом воссоединения ионов, то

откуда

Это уравнение известно под названием закона Оствальда.
Влияние температуры на интенсивность процессов воссоединения ионов и диссоциации в предыдущих рассуждениях не было учтено, поэтому правую часть написанного уравнения, которую мы назвали константой, в действительности следует рассматривать как величину, неизменную только в том случае, если температура раствора постоянна. Закон Оствальда связывает, таким образом, степень диссоциации а с числом молекул  растворенного вещества в единице объема, т. е. с концентрацией раствора но он не устанавливает зависимости степени диссоциации от температуры.
растворенного вещества в единице объема, т. е. с концентрацией раствора но он не устанавливает зависимости степени диссоциации от температуры.
Нетрудно видеть» что если  в законе Оствальда убывает, то
в законе Оствальда убывает, то  должно возрастать, следовательно а должна приближаться к единице. Это означает, что при разведении раствора степень диссоциации растет. В пределе в бесконечно разбавленном растворе степень диссоциации должна быть равна единице, т. е. все молекулы растворенного вещества должны быть диссоциированы на ионы. В разбавленном растворе ионы более удалены друг от друга, и возможность образования недиссоциированных молекул понижена.
должно возрастать, следовательно а должна приближаться к единице. Это означает, что при разведении раствора степень диссоциации растет. В пределе в бесконечно разбавленном растворе степень диссоциации должна быть равна единице, т. е. все молекулы растворенного вещества должны быть диссоциированы на ионы. В разбавленном растворе ионы более удалены друг от друга, и возможность образования недиссоциированных молекул понижена.
Закон Оствальда может быть выведен также термодинамическим путем в предположении, что молекулы растворенного вещества и ионы в растворах не взаимодействуют друг с другом. Однако взаимодействием ионов можно пренебречь лишь в случае весьма разбавленного раствора, когда ионы достаточно удалены друг от друга. Поэтому закон Оствальда является предельным законом. Закон Оствальда относится к слабым электролитам; для сильных же электролитов диссоциацию считают почти полной.
Теория сильных электролитов была построена в 1923 г. и в последующие годы Дебаем и Хюккелем. В основе теории Дебая и Хюккеля лежит представление, что каждый ион растворенного вещества окружен в растворе некоторым числом ионов противоположного знака, которые удерживаются силами электролитического притяжения и составляют как бы ионную атмосферу. Эту ионную атмосферу, однако, не следует представлять себе как вполне устойчивое образование; она легко разрушается, но вместе с тем и легко восстанавливается.
Теория Дебая — Хюккеля получила детальное математическое развитие и объяснила ряд отступлений сильных электролитов от простых законов слабых электролитов. Однако некоторые факты не охватываются теорией Дебая — Хюккеля, что, возможно, является следствием недооценки роли взаимодействия растворенного вещества с молекулами растворителя.
От проницательного взгляда Дмитрия Ивановича Менделеева не ускользнул факт, что взаимодействие растворителя с растворяемыми веществами имеет характер химического взаимодействия; молекулы растворенного вещества и раство
рителя (например, серной кислоты и воды) могут образовать в растворе нестойкие химические соединения (гидраты). Указанный Д. И. Менделеевым химический подход к растворам приобретает все большее значение.
Считают, что ион растворенного вещества, притягивая к себе молекулы растворителя, оказывается окруженным этими молекулами, как некоторой оболочкой; ее называют сольватной оболочкой, а для водных растворов — гидратной оболочкой.
В весьма концентрированных растворах явления еще более осложняются. Частые встречи и столкновения ионов приводят здесь, даже в случае сильных электролитов, к наличию значительного числа недиссоциированных молекул и даже к возникновению двойных — ассоциированных молекул растворенного вещества. Кроме того, могут возникать сложные комплексные ионы, образующиеся в результате присоединения ионов к недиссоциированным молекулам.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- ЧАСТЬ ПЕРВАЯ. ФИЗИЧЕСКИЕ ОСНОВЫ МЕХАНИКИ И АКУСТИКА
- § 1. О взаимосвязи явлений и допустимых границах их схематизации в физике
- § 2. Система ориентировки. Материальная точка и ее перемещение
- § 3. Элементарное перемещение. Векторы скорости и ускорения
- § 4. Тангенциальное и центростремительное ускорения
- § 5. Угловая скорость и угловое ускорение
- § 6. Абсолютное, переносное и относительное движения
- § 7. Закон сложения ускорений
- ГЛАВА II. ЗАКОНЫ НЬЮТОНА
- § 9. Первый ньютонов закон механики (закон инерции)
- § 10. О понятиях «покоя» и «равномерности»
- § 11. Инерциальная система. Принцип относительности
- § 12. Второй ньютонов закон механики
- § 13. Различные понимания второго закона механики
- § 14. Движение под действием постоянной силы
- § 15. Третий ньютонов закон механики
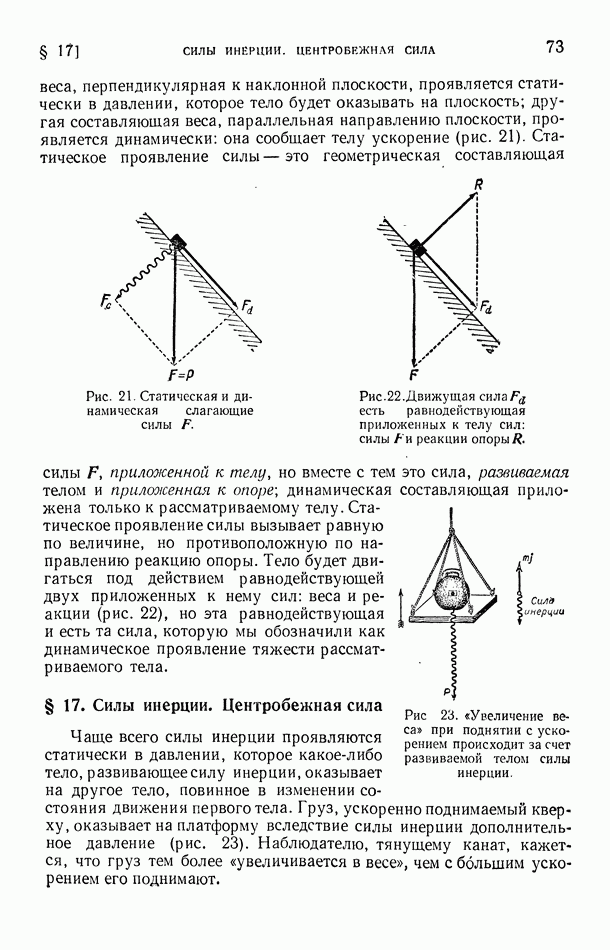
- § 16. Статическое и динамическое проявления сил
- § 17. Силы инерции. Центробежная сила
- ГЛАВА III. РАБОТА И ЭНЕРГИЯ
- § 18. Работа, энергия, мощность. Элемент и интеграл работы
- § 19. Кинетическая энергия и потенциальная энергия
- § 20. Системы мер и размерность механических величин
- ГЛАВА IV. ДИНАМИКА СИСТЕМЫ
- § 21. Механическая система. Внутренние и внешние силы. Центр масс
- § 22. Закон сохранения количества движения и теорема о движении центра масс
- § 23. Закон сохранения энергии в консервативных системах. Минимум потенциальной энергии при равновесии
- § 24. Число степеней свободы и работа сил связи. Принцип возможных перемещений
- § 25. Принцип Даламбера и релятивистское понимание инерции
- ГЛАВА V. МЕХАНИЧЕСКАЯ ПЕРЕДАЧА СИЛ И ЭНЕРГИИ (ТРЕНИЕ, УДАР, ТЯГА)
- § 26. Трение. Тяга
- § 27. Удар
- ГЛАВА VI. ЗАКОН ВСЕМИРНОГО ТЯГОТЕНИЯ И ЭЛЕМЕНТЫ НЕБЕСНОЙ МЕХАНИКИ
- § 28. Законы Кеплера
- § 29. Ньютонов закон тяготения
- § 30. Зависимость веса и ускорения силы тяжести от высоты и географической широты местности
- § 31. Вычисление массы Солнца, Земли и планет
- § 32. Потенциальная энергия и потенциал тяготения
- § 33. Некоторые теоремы о потенциале тяготения
- § 34. Потенциальная энергия системы частиц
- ГЛАВА VII. ДИНАМИКА ВРАЩАТЕЛЬНОГО ДВИЖЕНИЯ ТВЕРДЫХ ТЕЛ
- § 35. Момент силы
- § 36. Кинетическая энергия вращательного движения. Момент инерции
- § 37. Основное уравнение динамики вращательного движения
- § 38. Закон сохранения момента количества движения
- § 39. Проявление поворотных (кориолисовых) сил инерции
- ГЛАВА VIII. ЭЛЕМЕНТЫ ТЕОРИИ УПРУГОСТИ И МЕХАНИЧЕСКИЕ СВОЙСТВА ТЕЛ
- § 40. Упругие свойства тел
- § 41. Закон Гуна. Энергия деформированного тела
- § 42. Модуль объемной упругости. Сжимаемость
- § 43. Модуль Юнга, коэффициент Пуассона, модуль сдвига и соотношение между ними
- § 44. Характеристика механических свойств твердого тела по диаграмме растяжения. Явление наклепа
- § 45. Пластичность
- § 46. Прочность и твердость
- § 47. Механические свойства важнейших материалов
- ГЛАВА IX. ОСНОВЫ ГИДРОДИНАМИКИ И АЭРОДИНАМИКИ
- § 48. Основные понятия и направления гидродинамики
- § 49. Уравнение Бернулли
- § 50. Гидравлическая энергия
- § 51. Вязкость и течение жидкости при трении
- § 52. Пограничный слой и вихреобразование. Строение турбулентного потока
- § 53. Сопротивление движению тел в жидкостях и газах
- § 54. Числа Рейнольдса. Кинематическая вязкость
- § 55. Аэродинамические силы. Подъемная сила крыла и тяга самолета
- ГЛАВА X. КОЛЕБАТЕЛЬНОЕ ДВИЖЕНИЕ
- § 56. Гармоническое колебание
- § 57. Энергия и собственная частота гармонических колебаний
- § 58. Сложение колебаний одинаковой частоты и одинакового направления (интерференция колебаний)
- § 59. Другие случаи сложения колебаний
- § 60. Затухающие колебания
- § 61. Вынужденные колебания. Резонанс
- § 62. Связанные колебания
- ГЛАВА XI. УЧЕНИЕ О ВОЛНАХ
- § 63. Волновой процесс. Уравнение волн. Виды волн
- § 64. Интерференция волн. Стоячие волны
- § 65. Фазовая и групповая скорости волн
- ГЛАВА XII. АКУСТИКА
- § 66. Звук как физическое явление. Распространение звуковых волн
- § 67. Интенсивность звука
- § 68. Частота и состав звуков
- § 69. Явление Допплера
- § 70. Звук как психофизиологическое явление. Механизм звукового восприятия
- § 71. Высота и тембр звука
- § 72. Ультразвуки
- ЧАСТЬ ВТОРАЯ. МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА
- § 73. Исторические сведения. Картина молекулярного движения
- § 74. Статистический метод в физике
- § 75. Термодинамический метод
- § 76. Термодинамическая характеристика состояния тел и термодинамические процессы
- § 77. Уравнение Клапейрона
- § 78. Внутренняя энергия. Теплота и работа. Уравнение первого начала
- § 79. Изобарная и изотермическая работа газа
- § 80. Термохимические уравнения
- ГЛАВА XIV. ОСНОВЫ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ ТЕОРИИ
- § 81. Схематизация явлений («модели» в молекулярной физике)
- § 82. Максвеллов закон распределения молекулярных скоростей в газе
- § 83. Основное уравнение кинетической теории газов
- § 84. Молекулярно-кинетическое понимание абсолютной температуры
- § 85. Об уточненном (термодинамическом) понимании абсолютной температуры
- § 86. Тепловое равновесие и распределение энергии по степеням свободы
- § 87. Максвеллова теория газовых теплоемкостей
- § 88. Молекулярно-кинетическое пояснение работы расширения газа
- § 89. Средний свободный пробег газовых молекул
- ГЛАВА XV. ТЕПЛОПЕРЕДАЧА, ДИФФУЗИЯ И ВЯЗКОСТЬ. ВАКУУМ
- § 90. Тепловое излучение (законы Стефана и Ньютона)
- § 91. Теплопроводность (закон Фурье)
- § 92. Диффузия (закон Фика)
- § 93. Молекулярная теория теплопроводности газов
- § 94. Молекулярная теория вязкости газов
- § 95. Сопоставление явлений диффузии, теплопроводности и вязкости газов
- § 96. Вакуум. Манометры
- § 97. Вакуумные насосы
- ГЛАВА XVI. ТЕРМОДИНАМИЧЕСКОЕ РАВНОВЕСИЕ И ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- § 98. Термодинамическое равновесие и e-положение Больцмана
- § 99. Ограничения, налагаемые вторым началом термодинамики на циклические превращения тепла в работу
- § 100. Уравнение Пуассона. Адиабатная работа газа
- § 101. Цикл Карно и теорема о сумме приведенных теплот
- § 102. Энтропия. Основное уравнение термодинамики
- § 103. Процессы обратимые и необратимые. Теорема о возрастании энтропии
- § 104. Статистический смысл энтропии
- § 105. Теоремы о термодинамическом равновесии. Свободная энергия и термодинамический потенциал
- § 106. О так называемой «тепловой смерти» мира
- § 107. Уравнения Гиббса — Гельмгольца и Клапейрона—Клаузиуса
- ГЛАВА XVII. ФИЗИКА РЕАЛЬНЫХ ГАЗОВ И ПАРОВ. УРАВНЕНИЕ ВАН-ДЕР-ВАЛЬСА
- § 108. Пары насыщенные и перегретые. Диаграмма Эндрюса
- § 109. Конденсация газов
- § 110. Уравнение Ван-дер-Вальса
- § 111. Учение о соответственных состояниях
- § 112. О качественных превращениях при тепловых процессах
- ГЛАВА XVIII. ФИЗИКА ЖИДКОСТЕЙ
- § 113. Механические и термодинамические свойства жидкостей
- § 114. Поверхностное натяжение
- § 115. Формула Лапласа. Явления капиллярности и смачивания
- § 116. Поверхностноактивные вещества
- § 117. Строение жидкостей
- § 118. Кинетика испарения. Зависимость давления насыщенного пара от кривизны поверхности жидкости. Формула Томсона — Шиллера
- § 119. Понижение давления пара над раствором и повышение температуры кипения растворов. Законы Рауля
- § 120. Осмотическое давление. Закон Вант-Гоффа
- § 121. Электролитическая диссоциация. Закон Оствальда
- § 122. Абсорбция. Закон Генри
- § 123. О столкновении противоположных процессов в молекулярно-тепловых явлениях
- ГЛАВА XIX. ФИЗИКА ТВЕРДЫХ ТЕЛ
- § 124. Строение кристаллов
- § 125. Понятие о кристаллохимии
- § 126. Форма и рост кристаллов
- § 127. Теплоемкость твердых тел
- § 128. Сублимация твердых тел. Тройная точка
- § 129. Кристаллизация растворов. Диаграмма плавкости
- § 130. Силы связи в кристаллах
- § 131. Адсорбция
- ГЛАВА XX. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ В ДВИГАТЕЛЯХ И СВЕРХЗВУКОВОЕ ДВИЖЕНИЕ
- § 132. Основное уравнение газодинамики. Адиабатный теплоперепад
- § 133. Адиабатное течение газа
- § 134. Ударные волны и скачки уплотнения. Адиабата Гюгонио
- § 135. Процессы в двигателях внутреннего сгорания
- § 136. Процессы в паровых машинах и паровых турбинах
- § 137. Реактивные двигатели