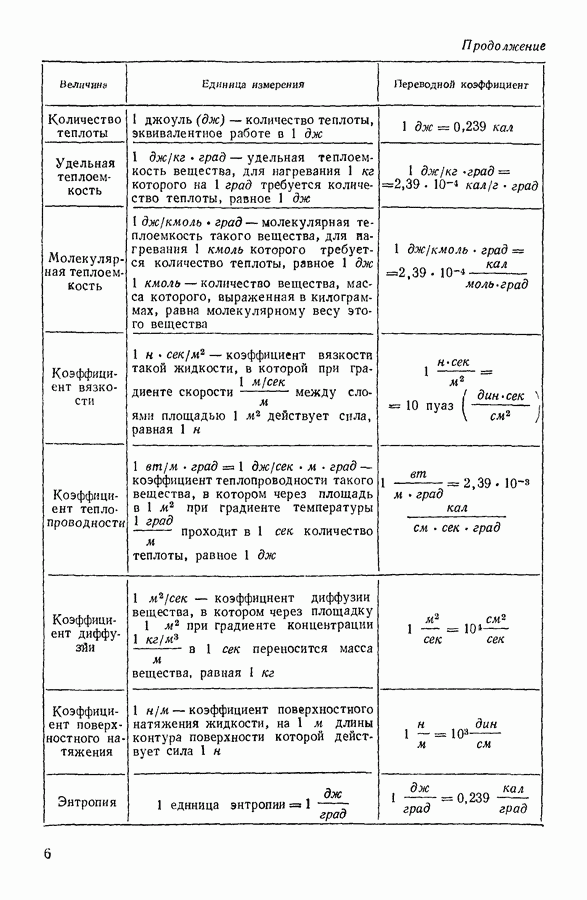
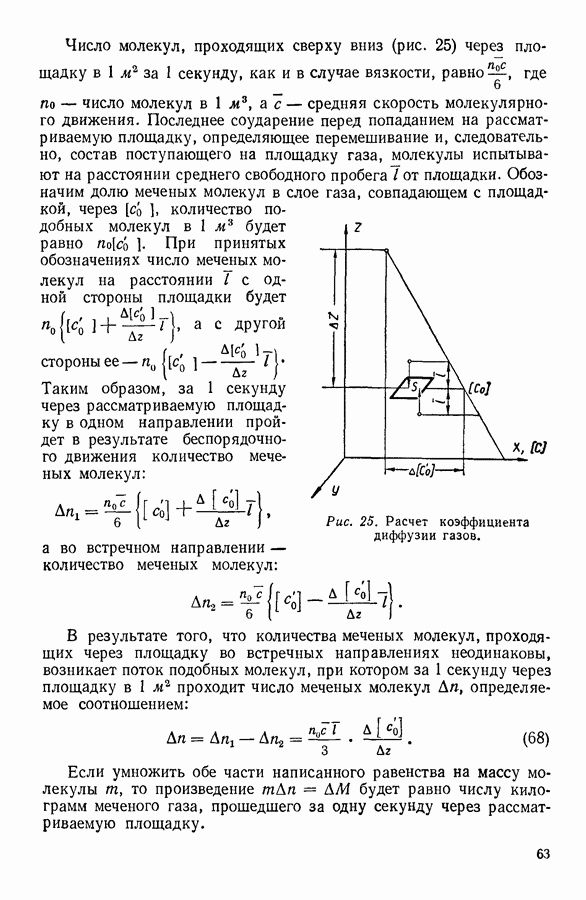
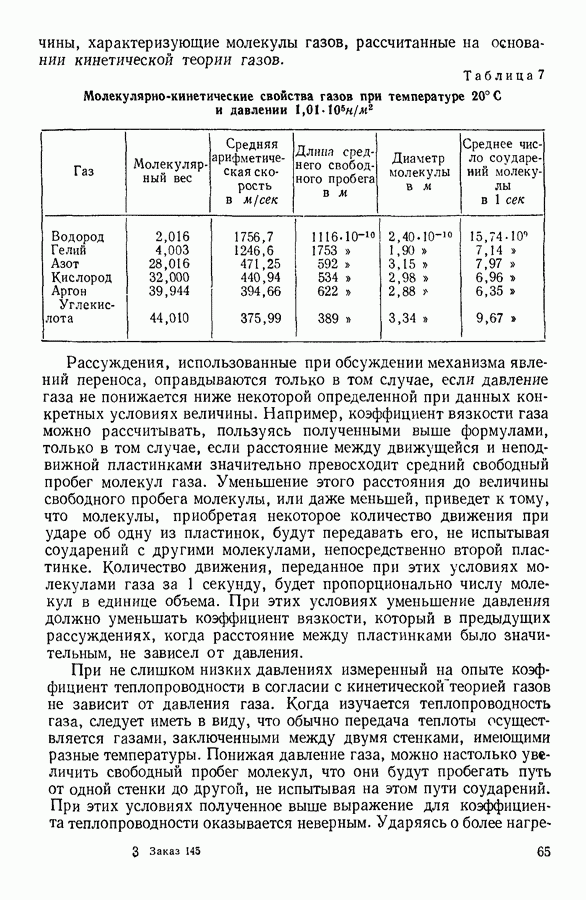
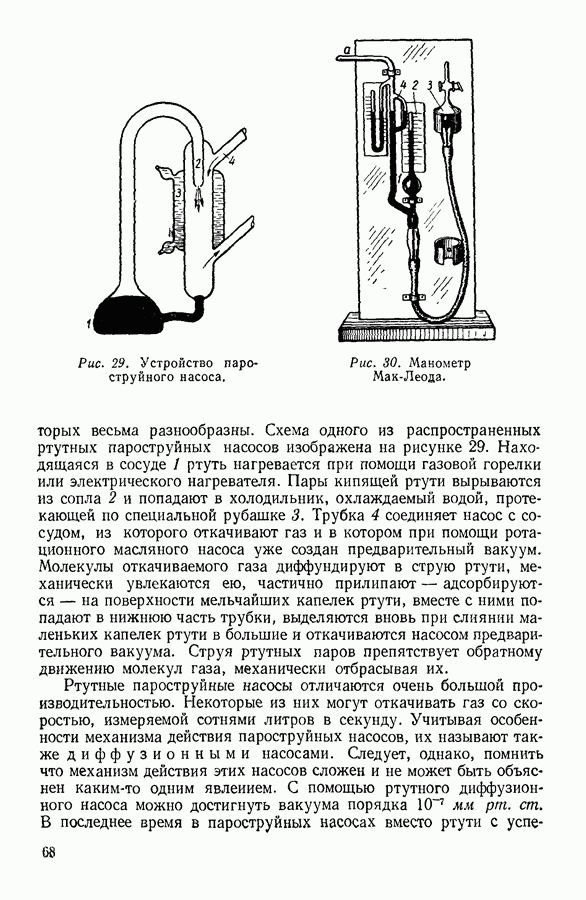
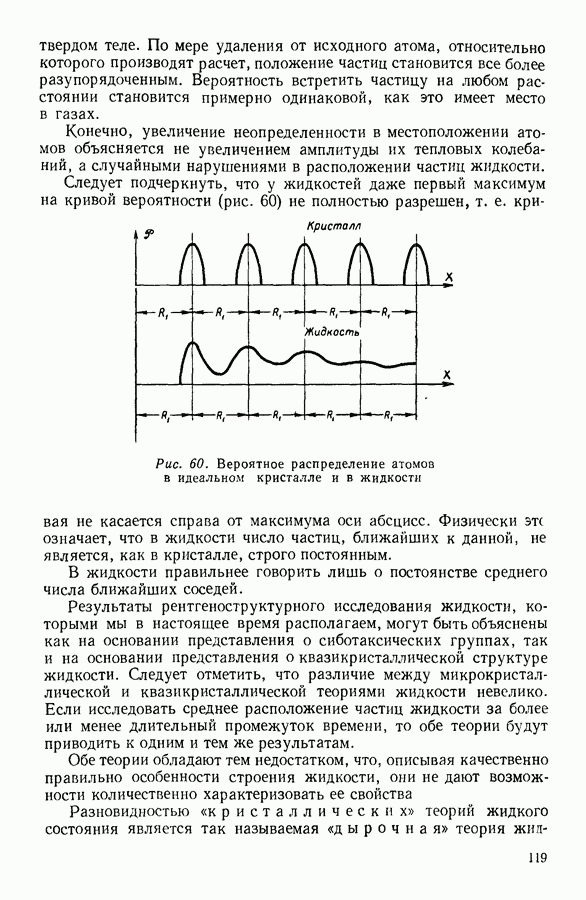
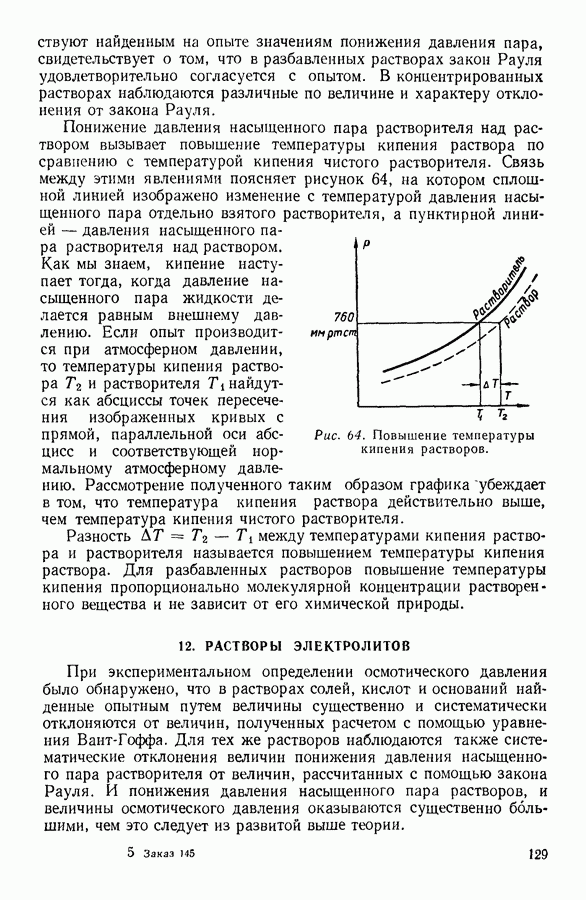
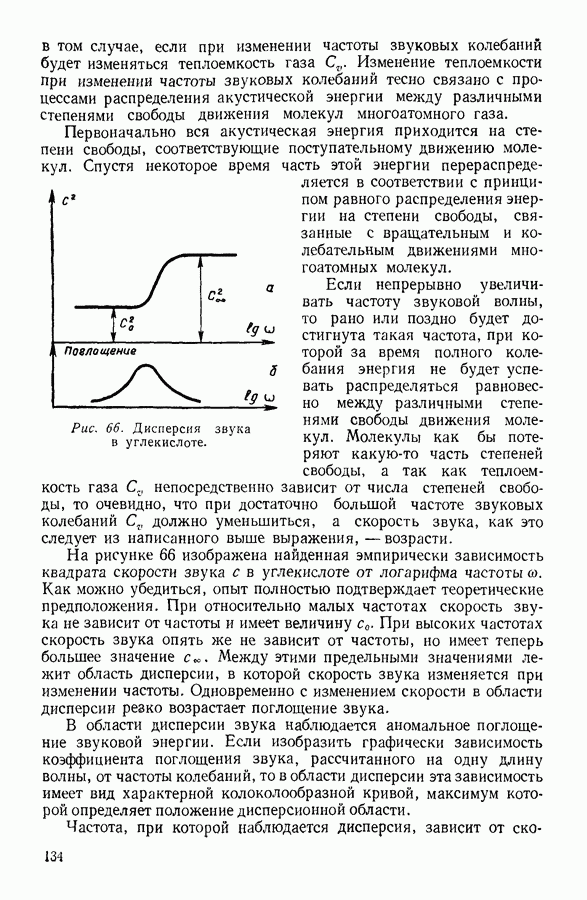
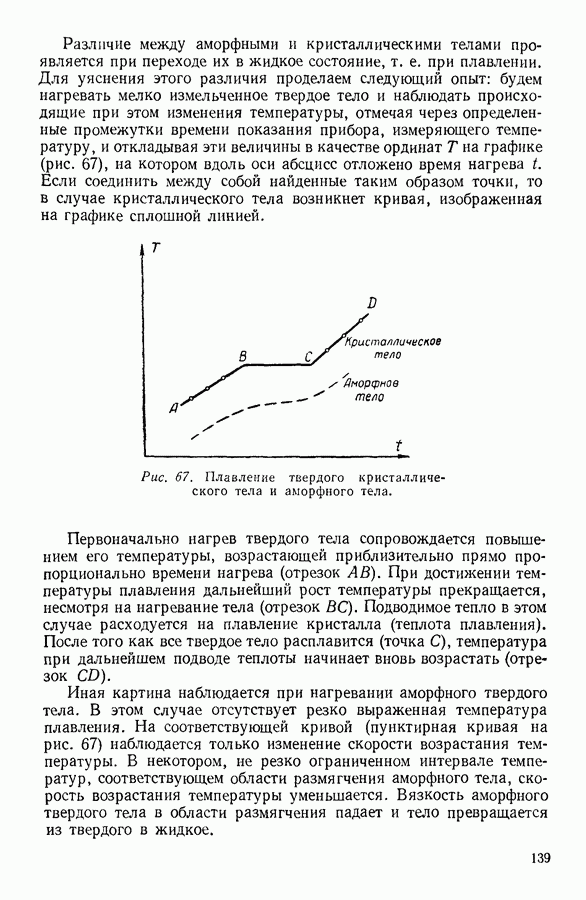
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
7. ИСПАРЕНИЕ ЖИДКОСТЕЙ. НАСЫЩЕННЫЙ ПАР И ЕГО СВОЙСТВА
Расположенные в поверхностном слое жидкости молекулы не остаются в нем неограниченно долго. Тепловое движение вызывает непрерывную замену их молекулами, расположенными в более глубоких слоях жидкости, с которыми они как бы меняются местами. При подобном перемещении может оказаться, что молекула, движущаяся из глубины жидкости к поверхности, будет обладать большой скоростью. В этом случае можно было бы ожидать, что молекула обязательно покинет жидкость и перейдет в паровую фазу.
Такое предположение, однако, неверно, поскольку при этом не учитывается, что удаление молекул из поверхностного слоя связано с работой испарения —  которую необходимо совершить для преодоления сил молекулярного притяжения. Работа по преодолению молекулярного сцепления совершается за счет кинетической энергии движущейся молекулы, определяемой однозначно ее скоростью. Решающее значение при переходе молекулы в паровую фазу имеет не вообще величина скорости, а только ее составляющая
которую необходимо совершить для преодоления сил молекулярного притяжения. Работа по преодолению молекулярного сцепления совершается за счет кинетической энергии движущейся молекулы, определяемой однозначно ее скоростью. Решающее значение при переходе молекулы в паровую фазу имеет не вообще величина скорости, а только ее составляющая  в направлении, перпендикулярном к поверхности. Молекула покинет жидкость в том случае, если выполняется неравенство:
в направлении, перпендикулярном к поверхности. Молекула покинет жидкость в том случае, если выполняется неравенство:

где  масса молекулы.
масса молекулы.
Поскольку при испарении жидкости работа против сил молекулярного сцепления совершается за счет энергии теплового движения ее молекул, то температура жидкости понижается. Для поддержания температуры испаряющейся жидкости постоянной к ней необходимо подводить теплоту. Эта теплота не вызывает повышения температуры и потому ее называют внутренней скрытой теплотой испарения, или просто внутренней теплотой испарения (обозначается —  Помимо работы, обусловленной преодолением сил молекулярного сцепления, при испарении жидкости необходимо также совершить работу, связанную с увеличением объема, занимаемого веществом. Количественно эта работа равна произведению давления пара жидкости на разность объемов вещества в парообразном и жидком состояниях:
Помимо работы, обусловленной преодолением сил молекулярного сцепления, при испарении жидкости необходимо также совершить работу, связанную с увеличением объема, занимаемого веществом. Количественно эта работа равна произведению давления пара жидкости на разность объемов вещества в парообразном и жидком состояниях:

Эквивалентное количество теплоты называют внешней теплотой испарения.
Сумму внутренней и внешней теплот испарения

называют общей теплотой испарения, а часто просто теплотой испарения жидкости.
Количество теплоты, необходимое для изотермического испарения  жидкости, называют удельной теплотой испарения, а количество теплоты, необходимое для изотермического испарения 1 киломоля жидкости, — молекулярной теплотой испарения.
жидкости, называют удельной теплотой испарения, а количество теплоты, необходимое для изотермического испарения 1 киломоля жидкости, — молекулярной теплотой испарения.
Очевидно, что неравенство (13), определяющее возможность перехода молекулы из жидкости в область пара, будет выполняться не для каждой молекулы. Если теплота испарения велика, то только немногие молекулы окажутся обладающими составляющей скорости  достаточной для того, чтобы молекула покинула жидкость и перешла бы в паровую фазу. Поэтому из общего числа молекул, которые за 1 секунду подходят к квадратному метру поверхности раздела жидкости и пара со стороны жидкости, только небольшая часть будет переходить в паровую фазу. Количество молекул, переходящих за 1 секунду из жидкости в пар на
достаточной для того, чтобы молекула покинула жидкость и перешла бы в паровую фазу. Поэтому из общего числа молекул, которые за 1 секунду подходят к квадратному метру поверхности раздела жидкости и пара со стороны жидкости, только небольшая часть будет переходить в паровую фазу. Количество молекул, переходящих за 1 секунду из жидкости в пар на  поверхности их раздела, определяет интенсивность испарения жидкости.
поверхности их раздела, определяет интенсивность испарения жидкости.
Для молекул, подходящих к поверхности раздела со стороны паровой фазы, указанного ограничения не существует. При приближении молекул пара к границе, разделяющей пар и жидкость, они попадают в ненасыщенное силовое поле, существующее вблизи поверхности жидкости, и их движение в некоторой степени должно напоминать движение тяжелого тела вблизи земной поверхности. Поэтому, если только поверхность жидкости не загрязнена, случаи отражения молекул пара от поверхности жидкости будут крайне редкими. Можно принять, и это, вероятно, близко к истине, что все молекулы пара, которые ударяются о незагрязненную поверхность жидкости, переходят в жидкую фазу.
Таким образом, интенсивность конденсации пара, измеряемая числом молекул, переходящих на  поверхности раздела за 1 секунду из паровой фазы в жидкую, по существу определяется числом соударений молекул пара с указанной поверхностью за 1 секунду.
поверхности раздела за 1 секунду из паровой фазы в жидкую, по существу определяется числом соударений молекул пара с указанной поверхностью за 1 секунду.
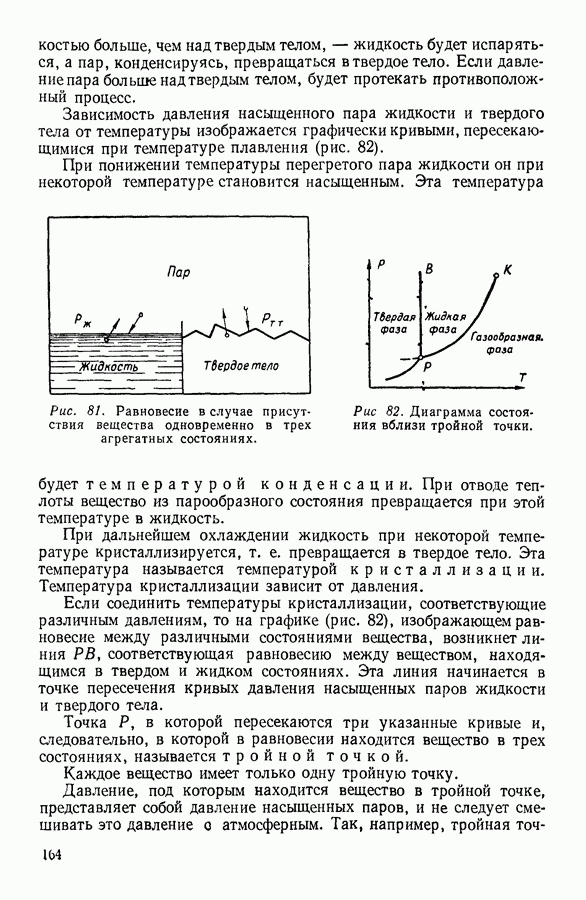
Известно, что в закрытом сосуде жидкость при достаточном ее количестве испаряется не целиком. В определенный для данной температуры момент процесс испарения жидкости компенсируется процессом конденсации пара. Возникает состояние динамического равновесия, при котором макроскопические количества жидкости и пара остаются неизменными.
Условием динамического равновесия является равенство скоростей взаимно компенсирующихся процессов. В рассматриваемом
случае число молекул жидкости, отрывающихся за 1 секунду от 1 квадратного метра поверхности жидкости и переходящих в пар, должно быть равно числу молекул пара, переходящих за то же время на той же поверхности в жидкость. Из сказанного выше совершенно ясно, что подобное равенство может выполняться только в том случае, если за единицу времени к данному участку поверхности раздела фаз со стороны жидкости будет подходить гораздо больше молекул, чем со стороны пара. Это обусловлено тем, что молекулы пара все без остатка будут переходить в жидкость, а из жидкости переходить в пар будет только небольшая часть из числа молекул, оказавшихся на поверхности.
При одинаковой средней скорости молекулярного движения указанное условие может выполняться только в том случае, если плотность жидкости будет гораздо больше плотности пара. Такое соотношение в плотностях и наблюдается в действительности при температурах, далеких от критической. Пар, находящийся в равновесии с жидкостью, называется насыщенным.
Для каждой жидкости, находящейся при некоторой температуре в равновесии с собственным паром, число ежесекундно испаряющихся молекул является постоянной величиной, а следовательно, постоянным является и число молекул, переходящих из пара в жидкость. В свою очередь количество конденсирующихся молекул зависит от плотности, а следовательно, и давления пара, и поэтому можно утверждать, что при постоянной температуре давление насыщенного пара для данной жидкости — величина постоянная, независящая от объема, им занимаемого. Изменение объема, занимаемого паровой фазой, вызывает или дальнейшее испарение жидкости, если объем увеличивается, или же частичную конденсацию пара, если объем уменьшается.
Следует также отметить, что давление насыщенного пара не зависит от величины поверхности, с которой происходит испарение. Величина поверхности может влиять только на время, необходимое для достижения равновесного состояния.
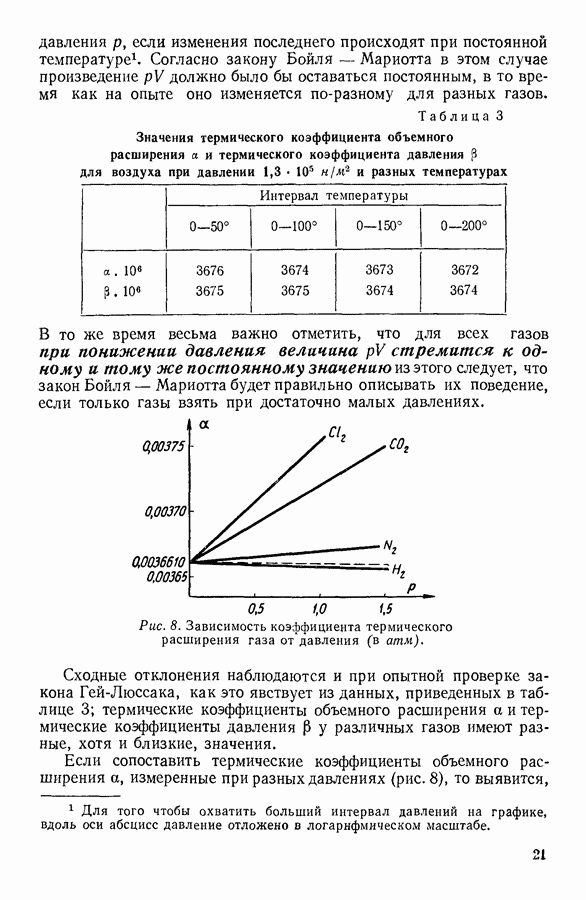
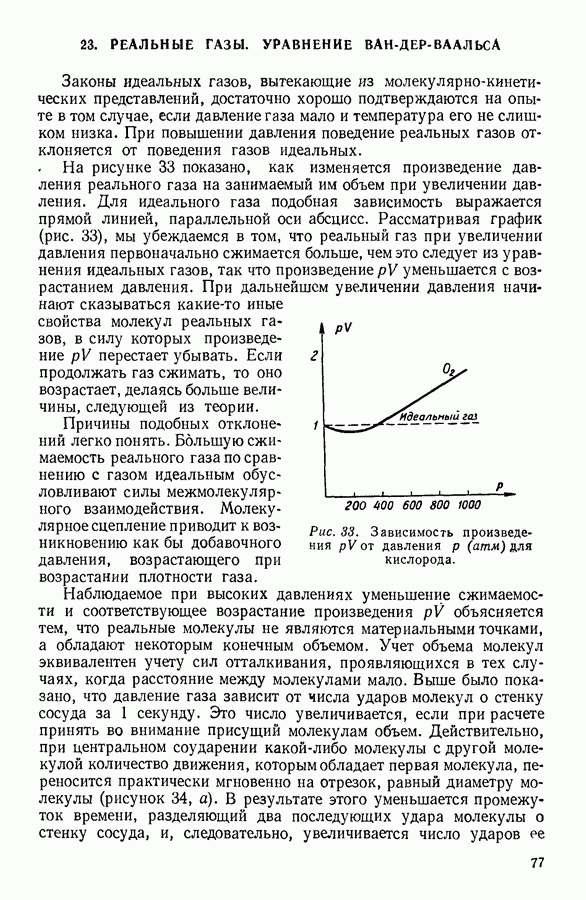
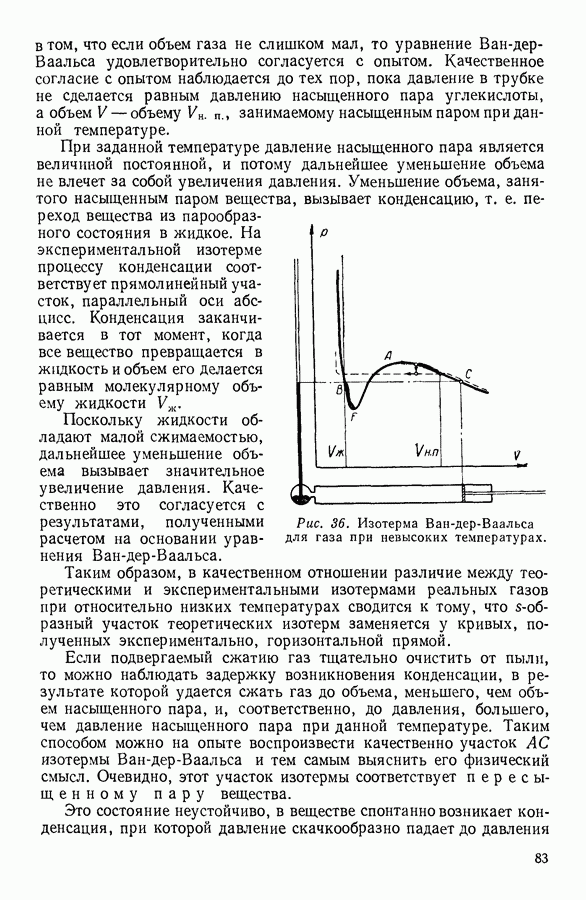
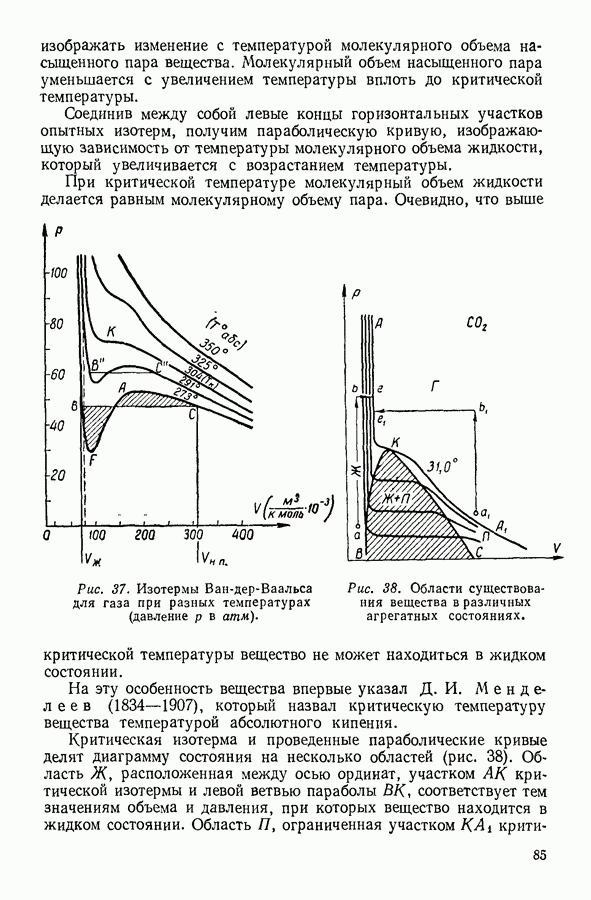
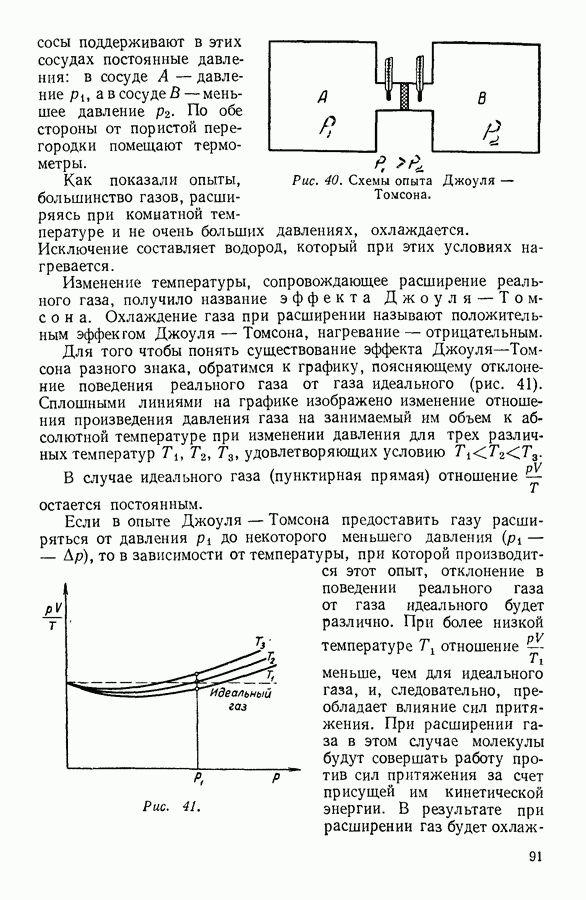
Наоборот, температура сильно влияет на давление насыщенного пара. Объясняется это тем, что скорость теплового движения молекул жидкости зависит от температуры и число молекул, скорости которых превышают необходимую для испарения предельную величину, быстро возрастает с ростом температуры. Кроме того, с ростом температуры возрастает число молекул, подходящих к поверхности за 1 секунду. Оба эти обстоятельства увеличивают количество ежесекундно испаряющихся молекул, а следовательно, и равновесное значение числа молекул пара, конденсирующихся за то же время. Графически зависимость давления насыщенного пара от температуры для различных жидкостей выражается кривыми параболического вида (рис. 57), обрывающимися в критическси точке.
Таким образом, критическое давление — это максимальное давление насыщенного пара данной жидкости.
В заключение следует подчеркнуть, что испарение жидкости происходит при всех температурах. При низких температурах испарение происходит только со свободной поверхности жидкости. Когда при постепенном повышении температуры давление насыщенного пара жидкости сделается равным атмосферному давлению, пузырьки пара начнут образовываться в толще жидкости. Процесс испарения, сопровождающийся образованием пузырей пара внутри жидкости, низывается кипением. Температура кипения жидкости зависит от внешнего давления: с понижением внешнего давления температура кипения понижается.

Рис. 57. Зависимость давления насыщенного пара жидкости от температуры.
Образование пузырьков пара внутри жидкости часто бывает затруднено. Одна из причин этого — большое лапласовское давление в возникающих в толще жидкости микроскопических пузырьках. Процесс возникновения пузырьков пара облегчается присутствием в жидкости растворенных газов. С повышением температуры растворимость газов в жидкости уменьшается и они выделяются в виде мельчайших пузырьков газа, которые играют роль центров возникновения пузырьков пара. При отсутствии растворенных газов жидкости легко перегреваются выше температуры кипения и процесс кипения приобретает бурный характер.
Иногда для предотвращения перегрева всей жидкости в ней искусственно создают небольшие области перегрева, в которых возникают микроскопические пузырьки пара, вызывающие кипение.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ОСНОВНЫЕ ЕДИНИЦЫ СИ
- I. ГАЗООБРАЗНОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- 1. РАЗВИТИЕ АТОМНЫХ ПРЕДСТАВЛЕНИЙ В НАУКЕ
- 2. ПОНЯТИЕ О СОСТОЯНИИ ВЕЩЕСТВА
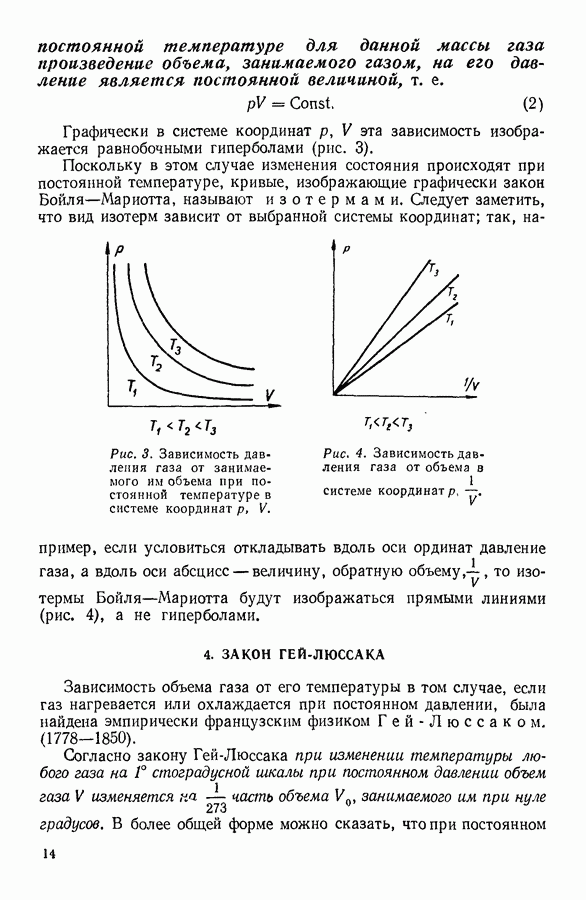
- 3. ЗАКОН БОЙЛЯ — МАРИОТТА
- 4. ЗАКОН ГЕЙ-ЛЮССАКА
- 5. ОБЪЕДИНЕННЫЙ ГАЗОВЫЙ ЗАКОН
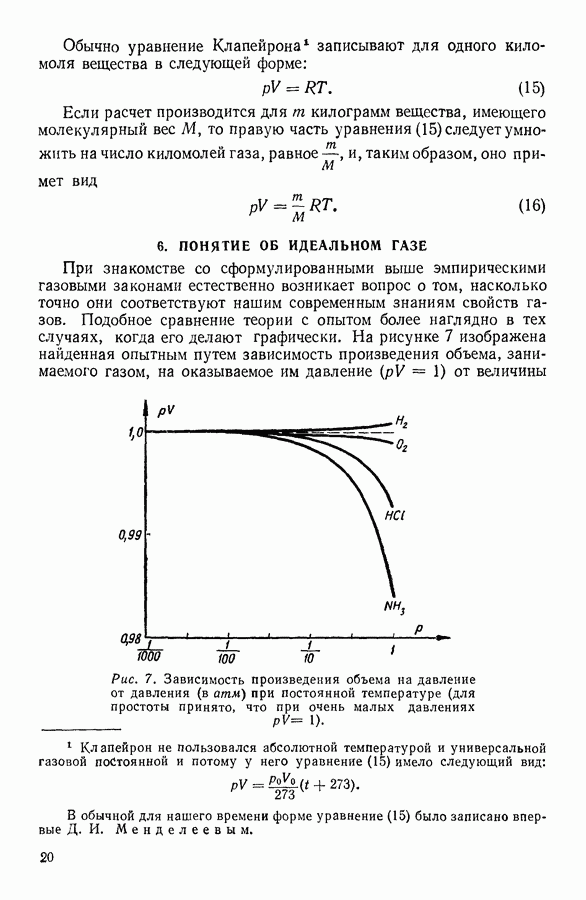
- 6. ПОНЯТИЕ ОБ ИДЕАЛЬНОМ ГАЗЕ
- 7. ОСНОВНЫЕ ПОЛОЖЕНИЯ КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ
- 8. ОСНОВНОЕ УРАВНЕНИЕ КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ
- 9. НЕКОТОРЫЕ СЛЕДСТВИЯ ИЗ ОСНОВНОГО УРАВНЕНИЯ КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ
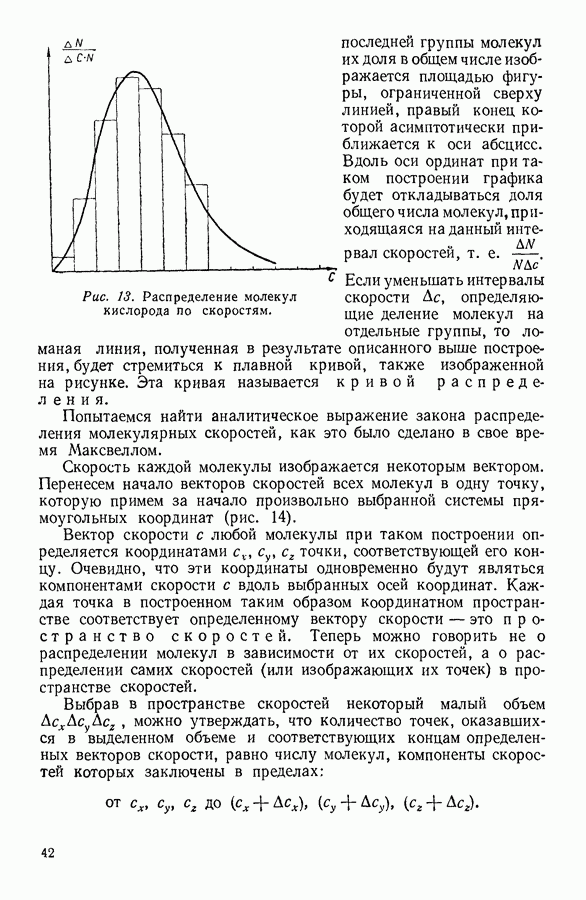
- 10. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ГАЗА В ПОЛЕ ЗЕМНОГО ТЯГОТЕНИЯ
- 11. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ЧИСЛА АВОГАДРО
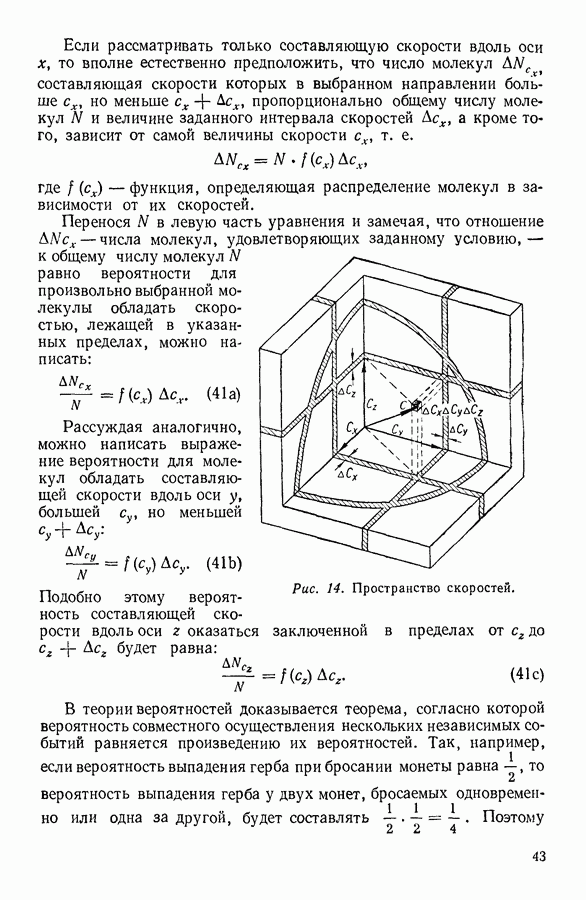
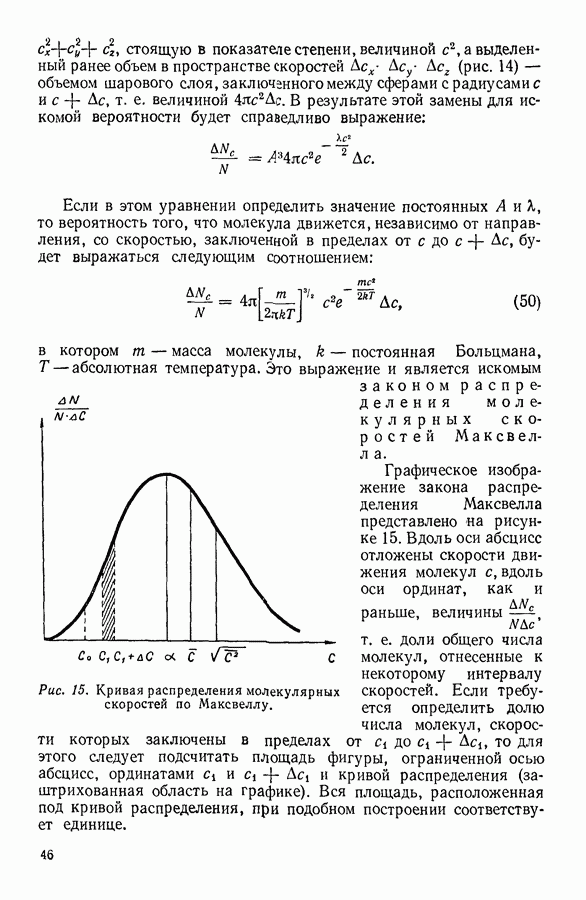
- 12. ЗАКОН РАСПРЕДЕЛЕНИЯ СКОРОСТЕЙ
- 13. ЭКСПЕРИМЕНТАЛЬНАЯ ПРОВЕРКА ЗАКОНА РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА
- 14. ЧИСЛО СОУДАРЕНИЙ И ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛЫ
- 15. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ДЛИНЫ СРЕДНЕГО СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ
- 16. ЯВЛЕНИЯ ПЕРЕНОСА. ВЯЗКОСТЬ ГАЗОВ
- 17. ТЕПЛОПРОВОДНОСТЬ ГАЗОВ
- 18. ДИФФУЗИЯ ГАЗОВ
- 19. ВАКУУМ. ПОЛУЧЕНИЕ И ИЗМЕРЕНИЕ ВАКУУМА
- 20. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА
- 21. ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА
- 22. СООТНОШЕНИЕ МЕЖДУ ТЕПЛОЕМКОСТЬЮ ГАЗА ПРИ ПОСТОЯННОМ ОБЪЕМЕ И ТЕПЛОЕМКОСТЬЮ ГАЗА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
- 23. РЕАЛЬНЫЕ ГАЗЫ. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- 24. ИССЛЕДОВАНИЕ УРАВНЕНИЯ ВАН-ДЕР-ВААЛЬСА
- 25. ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ПАРАМЕТРОВ ВЕЩЕСТВА
- 26. ПРИРОДА СИЛ МОЛЕКУЛЯРНОГО ПРИТЯЖЕНИЯ
- 27. ВНУТРЕННЯЯ ЭНЕРГИЯ РЕАЛЬНОГО ГАЗА
- 28. СЖИЖЕНИЕ ГАЗОВ
- II. ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- 1. СРАВНЕНИЕ СВОЙСТВ ЖИДКОСТЕЙ СО СВОЙСТВАМИ ГАЗОВ И ТВЕРДЫХ ТЕЛ
- 2. МОЛЕКУЛЯРНОЕ ДАВЛЕНИЕ
- 3. ПОВЕРХНОСТНЫЕ СВОЙСТВА ЖИДКОСТЕЙ
- 4. ЯВЛЕНИЯ НА ГРАНИЦЕ ЖИДКОСТИ С ТВЕРДЫМ ТЕЛОМ
- 5. ДАВЛЕНИЕ ПОД ИЗОГНУТОЙ ПОВЕРХНОСТЬЮ ЖИДКОСТИ
- 6. ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА
- 7. ИСПАРЕНИЕ ЖИДКОСТЕЙ. НАСЫЩЕННЫЙ ПАР И ЕГО СВОЙСТВА
- 8. МОЛЕКУЛЯРНОЕ СТРОЕНИЕ ЖИДКОСТЕЙ
- 9. ВЯЗКОСТЬ ЖИДКОСТЕЙ
- 10. РАСТВОРЫ. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
- 11. ПОНИЖЕНИЕ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА РАСТВОРИТЕЛЯ НАД РАСТВОРОМ
- 12. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- 13. ПРИМЕНЕНИЕ УЛЬТРААКУСТИЧЕСКИХ МЕТОДОВ К ИССЛЕДОВАНИЮ ГАЗОВ И ЖИДКОСТЕЙ
- III. ТВЕРДОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- 1. КРИСТАЛЛИЧЕСКИЕ И АМОРФНЫЕ ТВЕРДЫЕ ТЕЛА
- 2. МОЛЕКУЛЯРНОЕ СТРОЕНИЕ КРИСТАЛЛОВ
- 3. ПОЛИМЕРЫ
- 4. СИЛЫ, ДЕЙСТВУЮЩИЕ МЕЖДУ ЧАСТИЦАМИ В ТВЕРДЫХ ТЕЛАХ
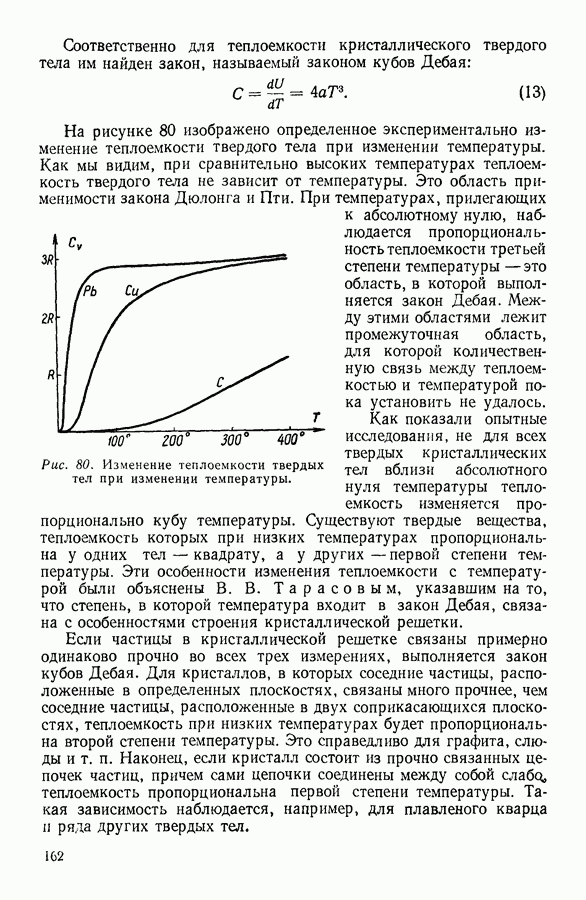
- 5. ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ
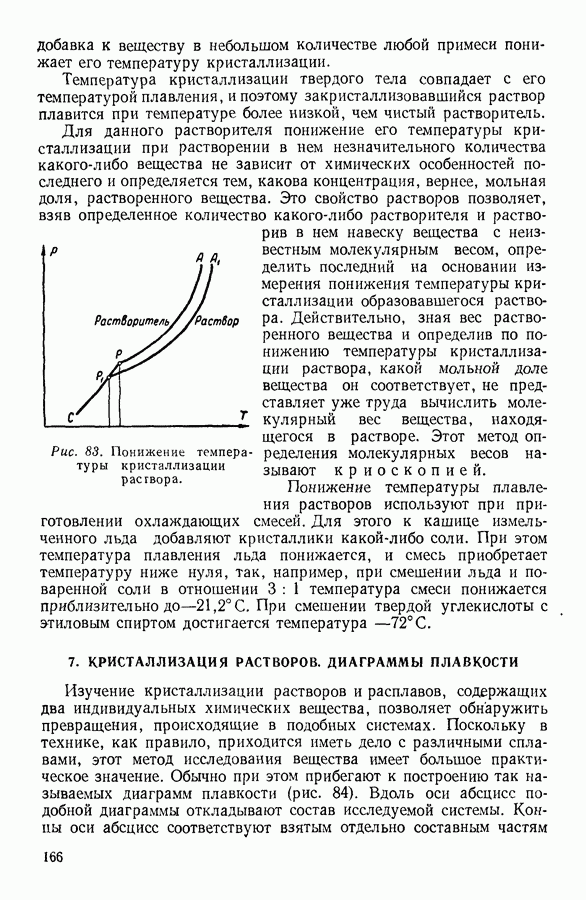
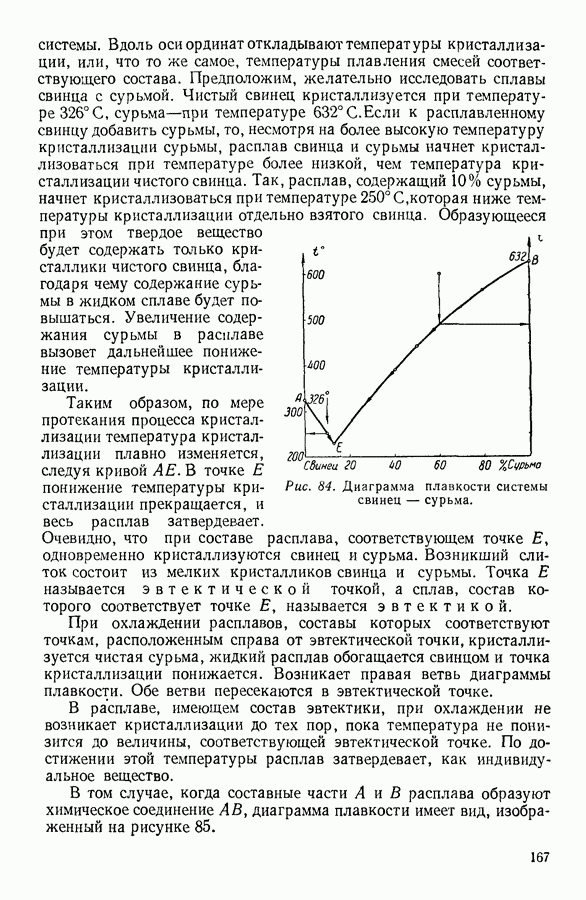
- 6. СУБЛИМАЦИЯ, ПЛАВЛЕНИЕ И КРИСТАЛЛИЗАЦИЯ ТВЕРДЫХ ТЕЛ
- 7. КРИСТАЛЛИЗАЦИЯ РАСТВОРОВ. ДИАГРАММЫ ПЛАВКОСТИ
- 8. АДСОРБЦИЯ
- IV. ФИЗИЧЕСКИЕ ОСНОВЫ ТЕРМОДИНАМИКИ
- 1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ МЕТОД, МЕТОД СТАТИСТИЧЕСКОЙ МЕХАНИКИ И ТЕРМОДИНАМИЧЕСКИЙ МЕТОД
- 2. ПРЕДМЕТ ТЕРМОДИНАМИКИ. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПОНЯТИЯ.
- 3. ФИЗИЧЕСКИЙ СМЫСЛ ПОНЯТИЯ «ТЕПЛОТА»
- 4. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- 5. МЕТОДЫ НАХОЖДЕНИЯ ТЕРМОДИНАМИЧЕСКИХ СООТНОШЕНИЙ
- 6. АДИАБАТНЫЕ ПРОЦЕССЫ. УРАВНЕНИЕ ПУАССОНА
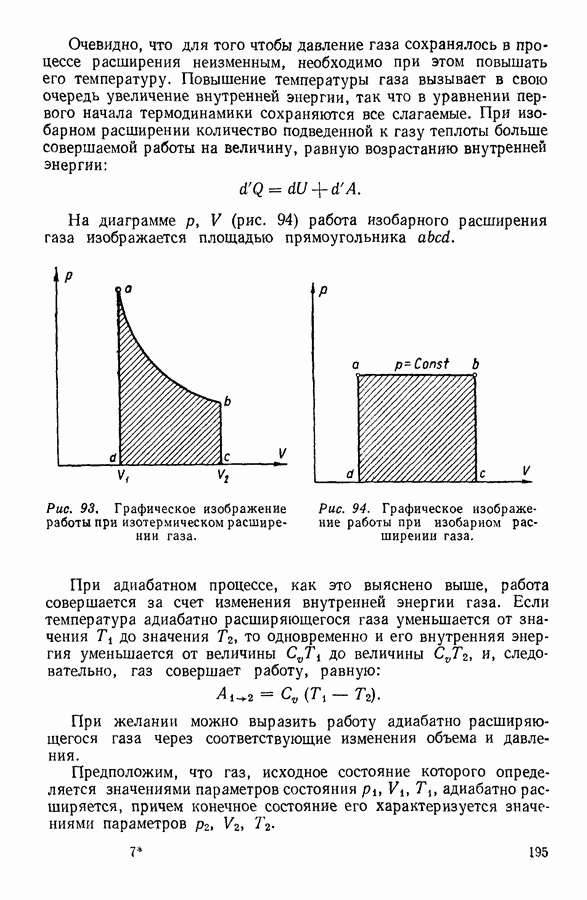
- 7. ПРИМЕНЕНИЕ ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ К НЕКОТОРЫМ ПРОЦЕССАМ В ГАЗАХ
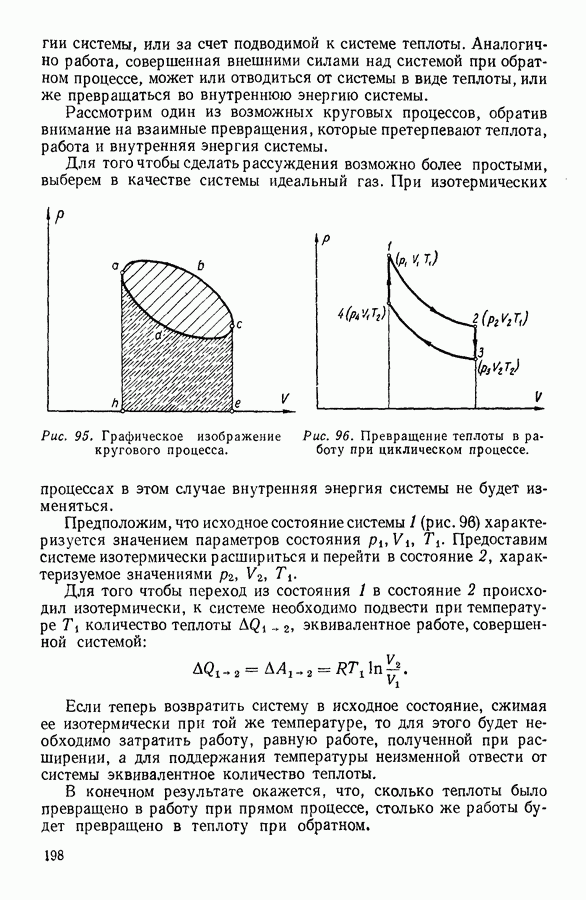
- 8. КРУГОВЫЕ ПРОЦЕССЫ
- 9. ЦИКЛ КАРНО
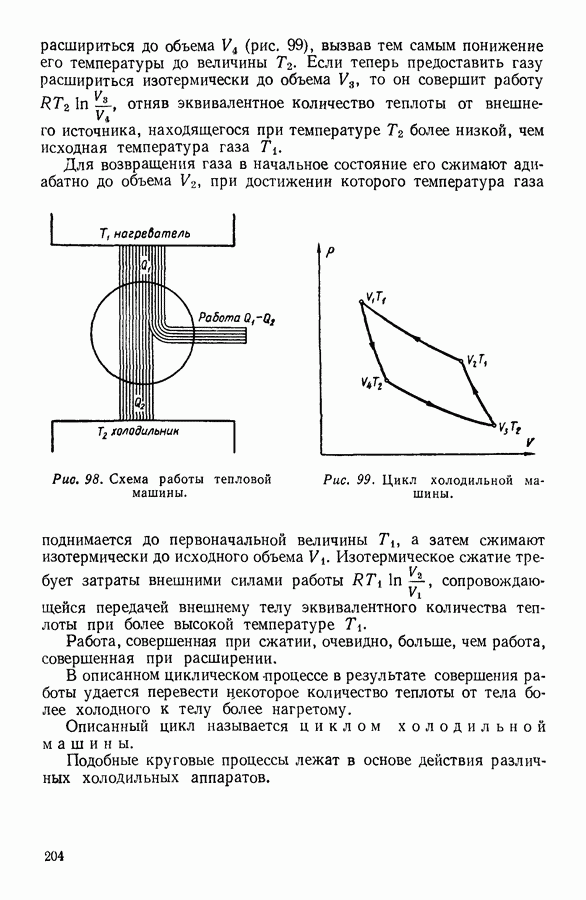
- 10. ИСПОЛЬЗОВАНИЕ ЦИКЛИЧЕСКИХ ПРОЦЕССОВ В ТЕРМОДИНАМИЧЕСКИХ РАССУЖДЕНИЯХ
- 11. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
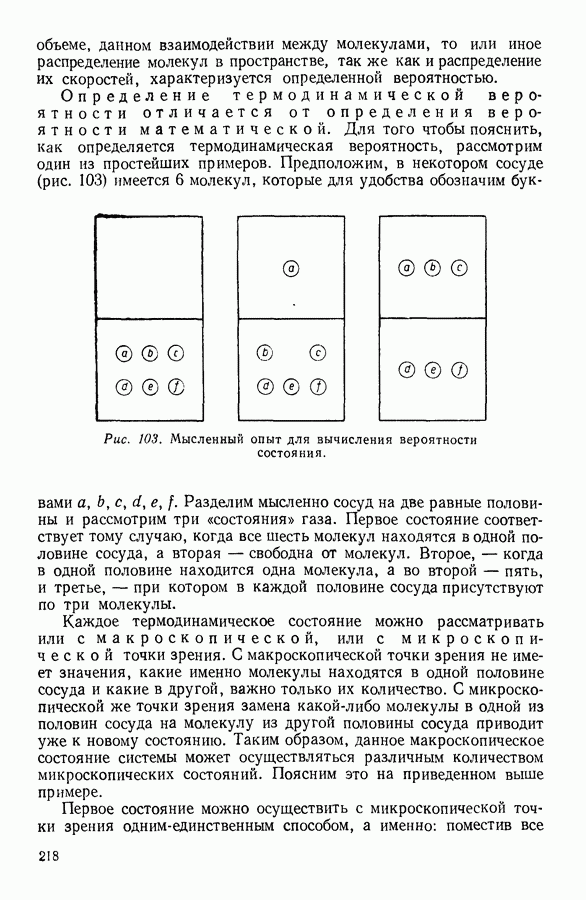
- 12. СТАТИСТИЧЕСКИЙ СМЫСЛ ВТОРОГО НАЧАЛА ТЕРМОДИНАМИКИ
- 13. КРИТИКА ТАК НАЗЫВАЕМОЙ «ТЕОРИИ ТЕПЛОВОЙ СМЕРТИ ВСЕЛЕННОЙ»