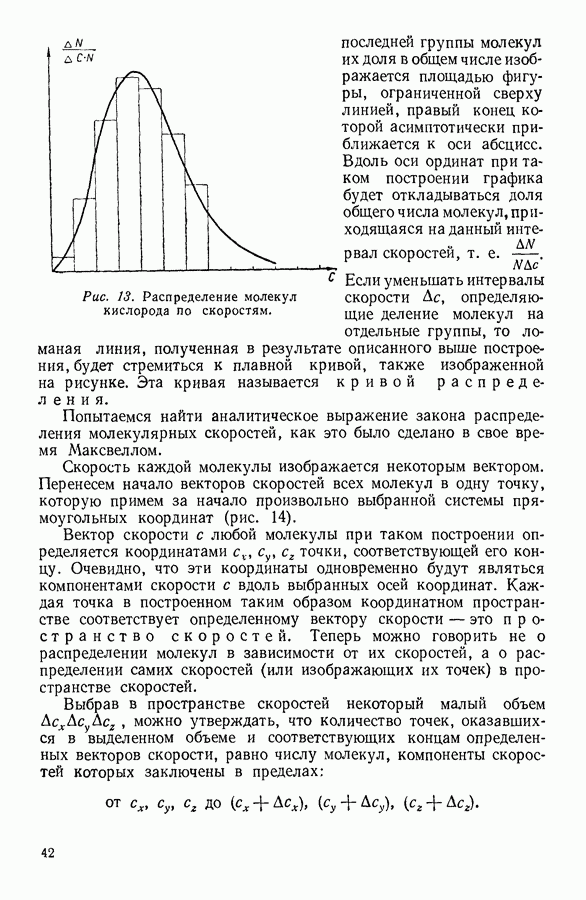
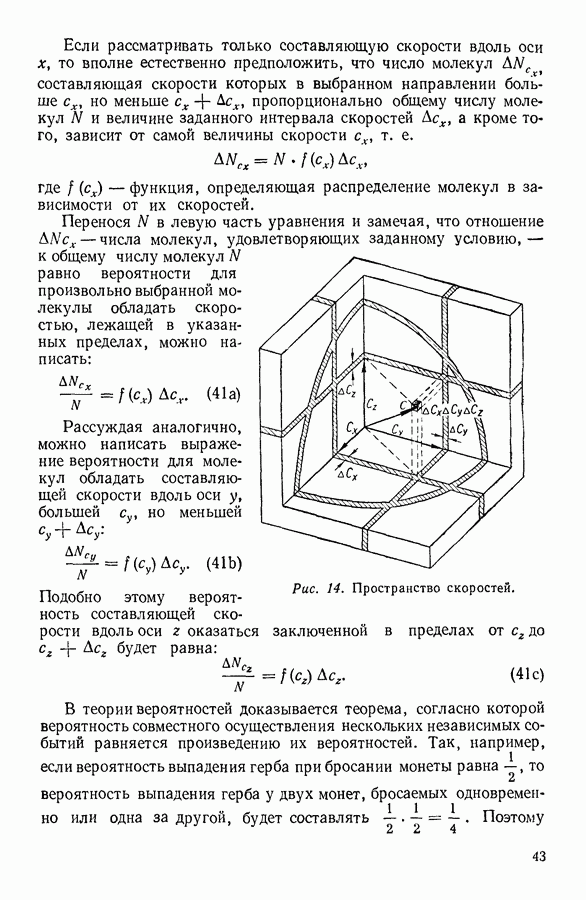
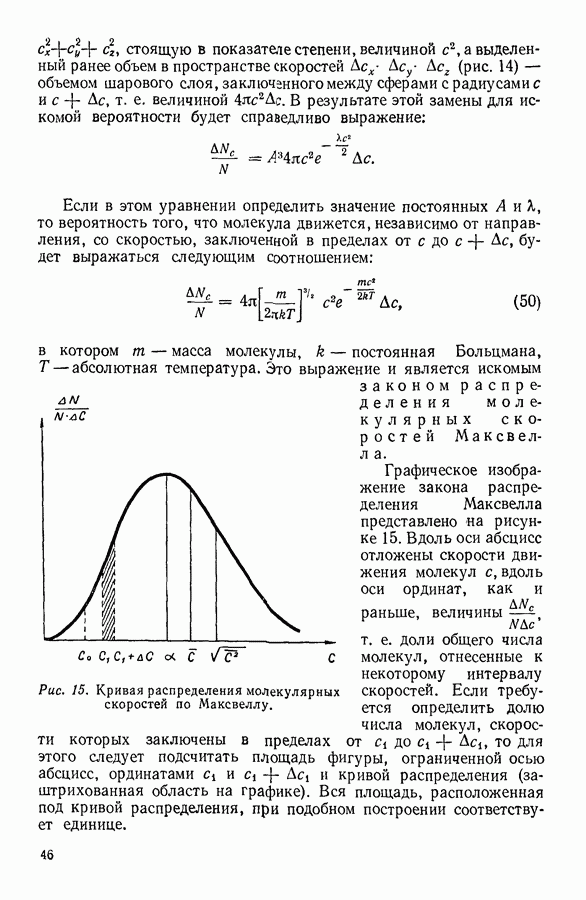
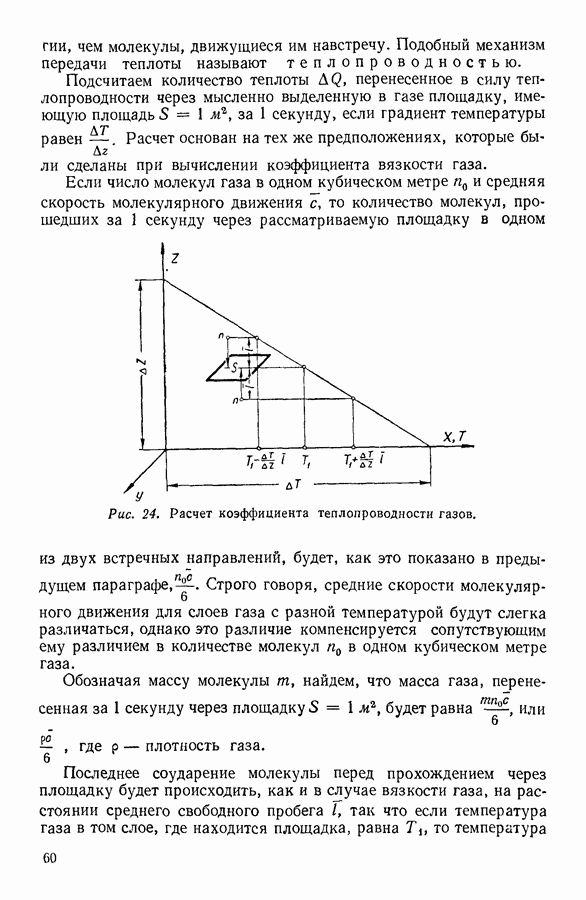
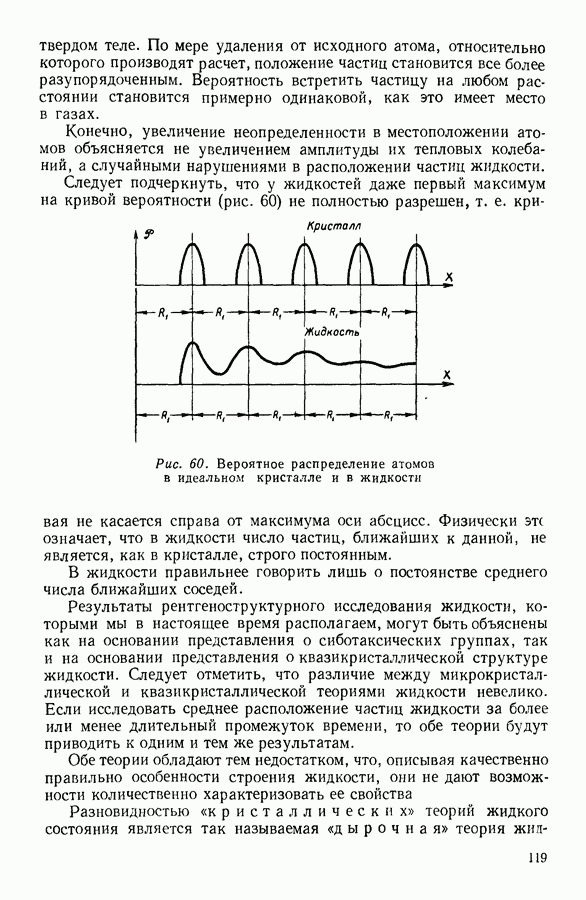
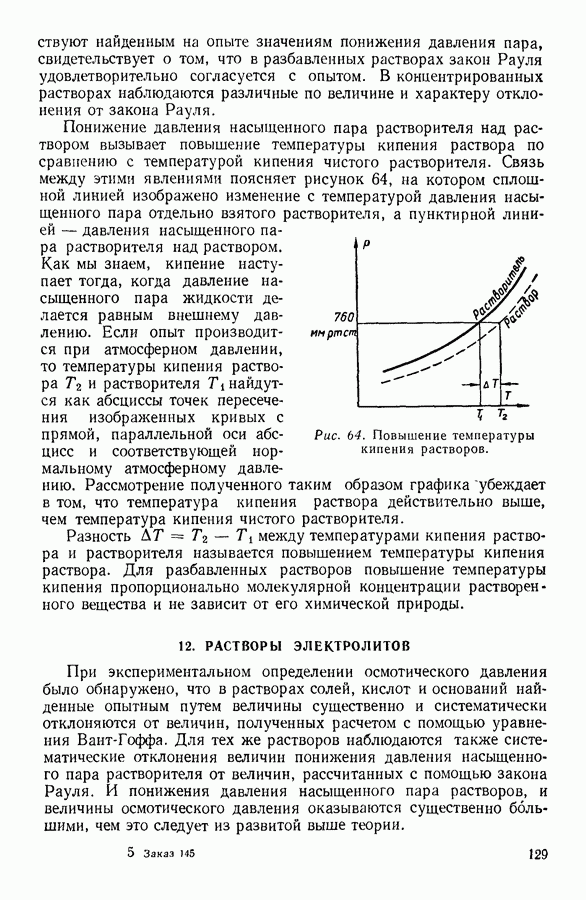
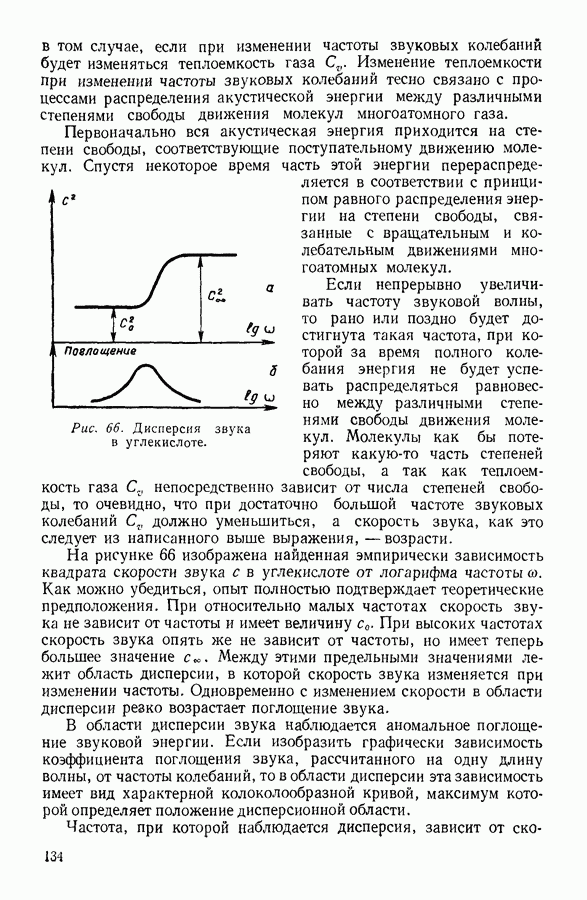
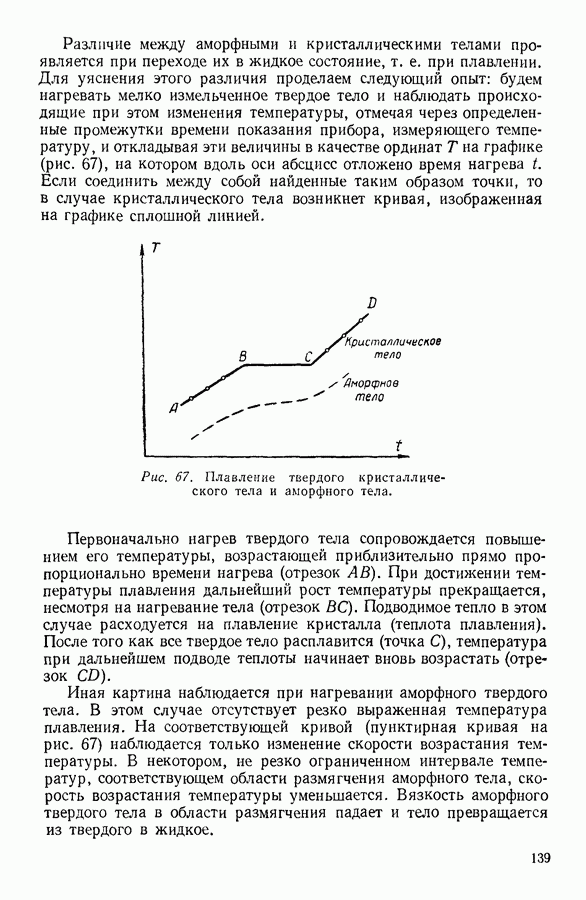
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
10. РАСТВОРЫ. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
Многие твердые тела способны растворяться в жидкостях. При растворении вещества его молекулы равномерно распределяются среди молекул растворителя.
Как правило, процесс растворения не представляет собой простого молекулярного раздробления растворяемого вещества. Обычно растворение сопровождается энергичным физическим и химическим взаимодействием молекул растворителя с молекулами растворенного вещества. Весьма часто молекулы растворенного вещества оказываются окруженными молекулами растворителя, образующими вокруг них более или менее устойчивую оболочку. В йодных растворах эти оболочки называют гидратными оболочками, в неводных — сольватными.
Д. И. Менделеев впервые указал на необходимость учитывать при растворении вещества химические взаимодействия. Хотя дальнейшее развитие учения о растворах и подтвердило правильность мысли Менделеева о наличии химических взаимодействий между молекулами веществ при растворении, однако не у всех растворов это взаимодействие существенно влияет на свойства растворов. Во многих растворах взаимодействие между молекулами растворенного вещества и растворителя мало отличается от взаимодействия молекул этих веществ, взятых порознь. Подобные растворы должны напоминать по своим свойствам смеси газов.
Если раствор разбавленный, т. е. если в единице объема растворителя содержится небольшое количество растворенного вещества, то молекулы последнего оказываются отстоящими далеко друг от друга и особенности их взаимодействия никак не проявляются. Влияние молекул растворителя на движение молекул растворенного вещества взаимно компенсируется, так что его оказывается возможным не учитывать. Растворенное вещество в разбавленном растворе ведет себя подобно идеальному газу.
Мысль о сходстве свойств растворенного вещества со свойствами идеального газа была высказана голландским физиком Вант-Гоффом (1852—1911). Развивая мысль об аналогии между смесью газов и жидким раствором, Вант-Гофф пришел к выводу о том, что растворенное вещество должно оказывать давление, подобное парциальному давлению газа, добавленного в небольшом количестве к какому-либо другому газу. Это давление  было названо осмотическим.
было названо осмотическим.
Если раствор, содержащий  килограмм растворенного вещества, молекулярный вес которого
килограмм растворенного вещества, молекулярный вес которого  занимает объем V, то, согласно закону Вант-Гоффа, осмотическое давление можно подсчитать по аналогии с давлением идеального газа при помощи уравнения:
занимает объем V, то, согласно закону Вант-Гоффа, осмотическое давление можно подсчитать по аналогии с давлением идеального газа при помощи уравнения:

в котором  универсальная газовая постоянная,
универсальная газовая постоянная,  -абсолютная температура. Величина
-абсолютная температура. Величина  численно равная числу киломолей растворенного вещества в
численно равная числу киломолей растворенного вещества в  раствора, называется молярной концентрацией с, поэтому закон Вант-Гоффа часто записывают в следующей форме:
раствора, называется молярной концентрацией с, поэтому закон Вант-Гоффа часто записывают в следующей форме:

Таким образом, осмотическое давление пропорционально молярной концентрации растворенного вещества и абсолютной температуре раствора.
Естественно возникает вопрос, как обнаружить проявления осмотического давления.
Жидкость находится, с одной стороны, под действием внешнего давления р, а с другой стороны — под действием внутреннего давления  обусловленного силами молекулярного притяжения. Осмотическое давление, оказываемое частицами растворенного вещества, должно несколько увеличить объем жидкости, поскольку оно направлено противоположно внешнему и внутреннему давлениям, сжимающим жидкость. Обнаружить, однако, это в разбавленных растворах, для которых справедливы сформулированные выше простые закономерности, практически невозможно, поскольку внутреннее давление по абсолютной величине несоизмеримо больше осмотическою давления и полностью маскирует его действие.
обусловленного силами молекулярного притяжения. Осмотическое давление, оказываемое частицами растворенного вещества, должно несколько увеличить объем жидкости, поскольку оно направлено противоположно внешнему и внутреннему давлениям, сжимающим жидкость. Обнаружить, однако, это в разбавленных растворах, для которых справедливы сформулированные выше простые закономерности, практически невозможно, поскольку внутреннее давление по абсолютной величине несоизмеримо больше осмотическою давления и полностью маскирует его действие.

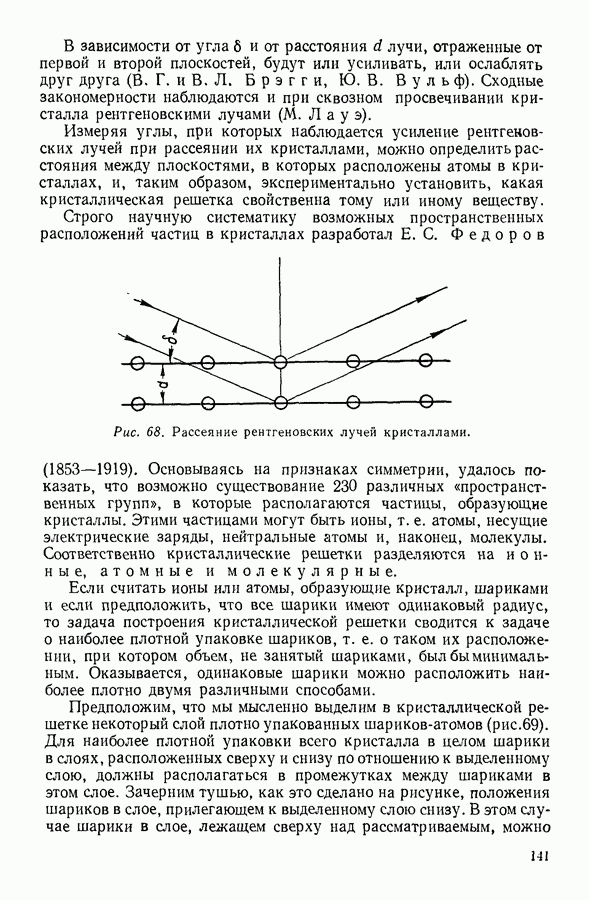
Рис. 62. Обнаружение осмотического давления.
Для обнаружения осмотического давления прибегают к использованию свойств полупроницаемых перегородок, способных свободно пропускать растворитель, но задерживающих частицы растворенного вещества. Для точных измерений полупроницаемые перегородки обычно приготавливаются следующим образом: пористый сосуд из неглазурованного фарфора погружают в сосуд больших размеров, наполненный раствором медного купороса. Внутрь пористого сосуда наливают раствор железистосинеродистого калия. Растворенные соли диффундируют в поры фарфорового сосуда и, встречаясь, реагируют, образуя пленку железистосинеродистой меди, пропускающей воду, но не пропускающей молекулы многих растворенных веществ, например сахара.
Осмотическое давление в растворе, помещенном во внутренний сосуд прибора, изображенного на рисунке 62, уравновешивается внешним и внутренним давлениями, действующими на жидкость. Если заменить дно сосуда, содержащего раствор, полупроницаемой перегородкой, то растворитель из внешнего сосуда сможет свободно поступать во внутренний. Осмотическое давление на поверхность раствора окажется неуравновешенным, и поверхность начнет перемещаться вверх, как бы втягивая при этом растворитель во внутренний сосуд.
Движение жидкости будет продолжаться до тех пор, пока возникшая разница уровней жидкости во внешнем и внутреннем сосудах не уравновесит осмотическое давление. Результаты экспериментального определения осмотического давления (таблица № 13) подтверждают справедливость представлений Вант-Гоффа. Осмотические явления играют большую роль в жизнедеятельности растительных и животных организмов. Оболочки клеток, из
Таблица 13 (см. скан) Осмотическое давление сахарозы при 0° С
которых состоят живые организмы, являются полупроницаемыми перегородками, и многие виды важного для организма обмена веществ совершаются в результате осмотического проникновения жидкости через полупроницаемую перегородку.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
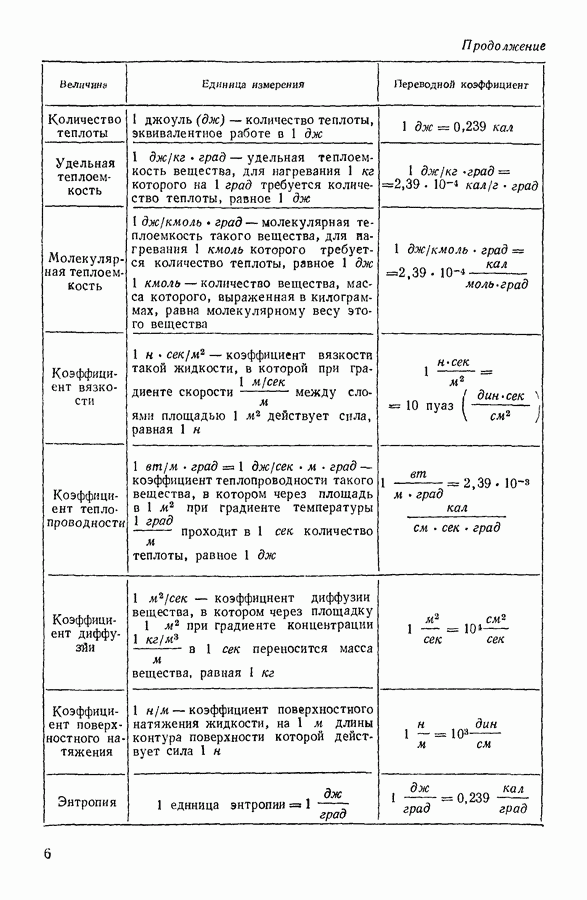
- ОСНОВНЫЕ ЕДИНИЦЫ СИ
- I. ГАЗООБРАЗНОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- 1. РАЗВИТИЕ АТОМНЫХ ПРЕДСТАВЛЕНИЙ В НАУКЕ
- 2. ПОНЯТИЕ О СОСТОЯНИИ ВЕЩЕСТВА
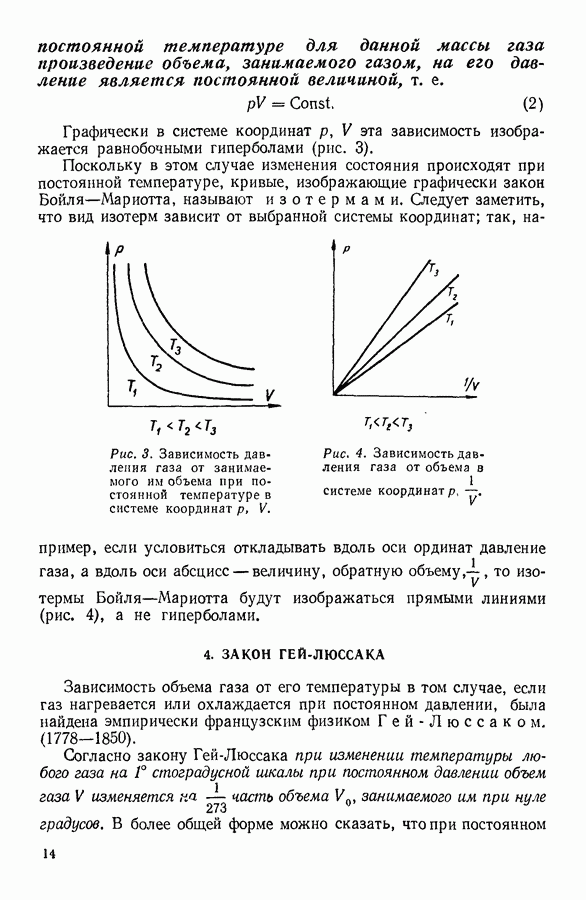
- 3. ЗАКОН БОЙЛЯ — МАРИОТТА
- 4. ЗАКОН ГЕЙ-ЛЮССАКА
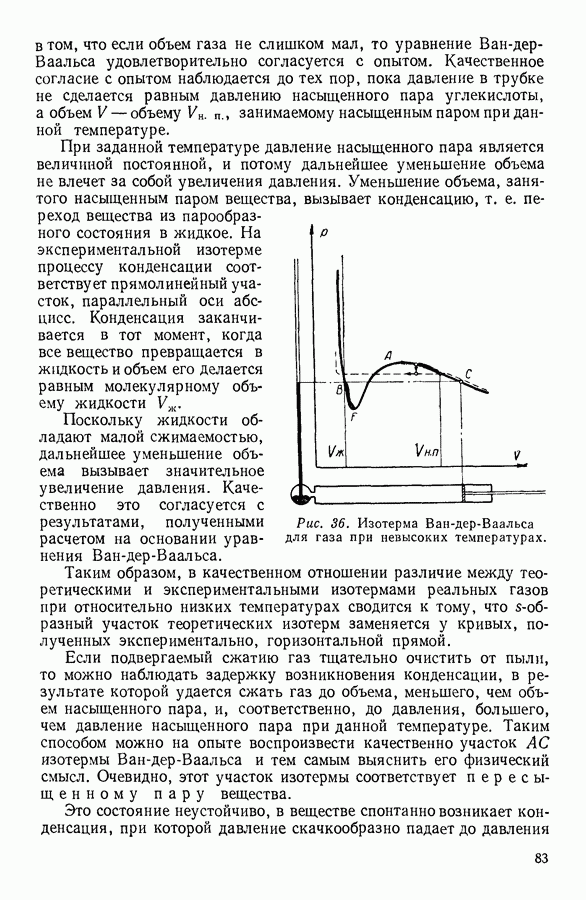
- 5. ОБЪЕДИНЕННЫЙ ГАЗОВЫЙ ЗАКОН
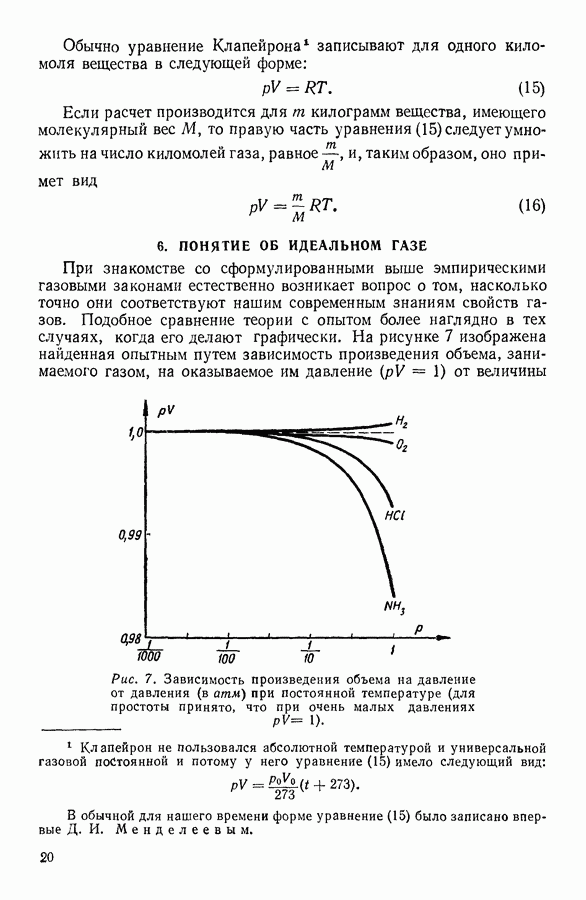
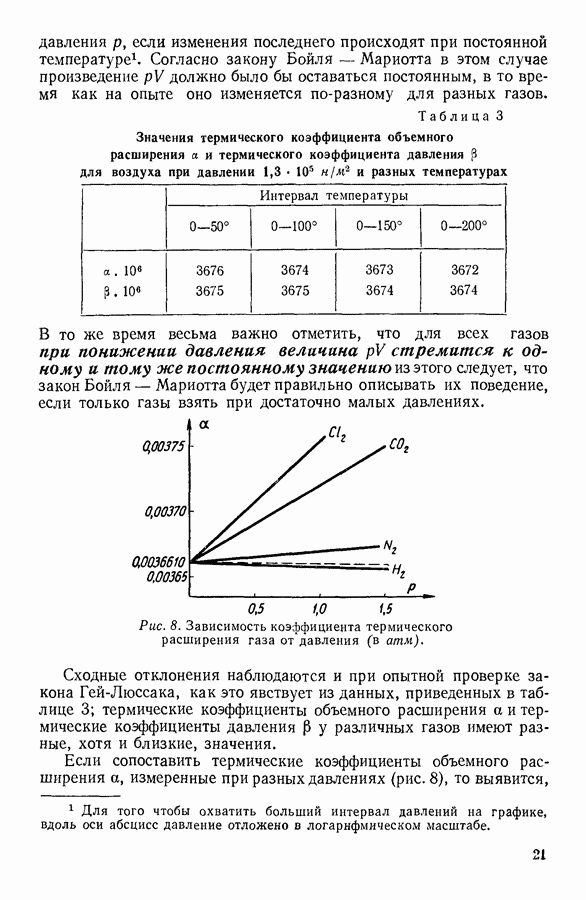
- 6. ПОНЯТИЕ ОБ ИДЕАЛЬНОМ ГАЗЕ
- 7. ОСНОВНЫЕ ПОЛОЖЕНИЯ КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ
- 8. ОСНОВНОЕ УРАВНЕНИЕ КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ
- 9. НЕКОТОРЫЕ СЛЕДСТВИЯ ИЗ ОСНОВНОГО УРАВНЕНИЯ КИНЕТИЧЕСКОЙ ТЕОРИИ ГАЗОВ
- 10. РАСПРЕДЕЛЕНИЕ МОЛЕКУЛ ГАЗА В ПОЛЕ ЗЕМНОГО ТЯГОТЕНИЯ
- 11. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ЧИСЛА АВОГАДРО
- 12. ЗАКОН РАСПРЕДЕЛЕНИЯ СКОРОСТЕЙ
- 13. ЭКСПЕРИМЕНТАЛЬНАЯ ПРОВЕРКА ЗАКОНА РАСПРЕДЕЛЕНИЯ МАКСВЕЛЛА
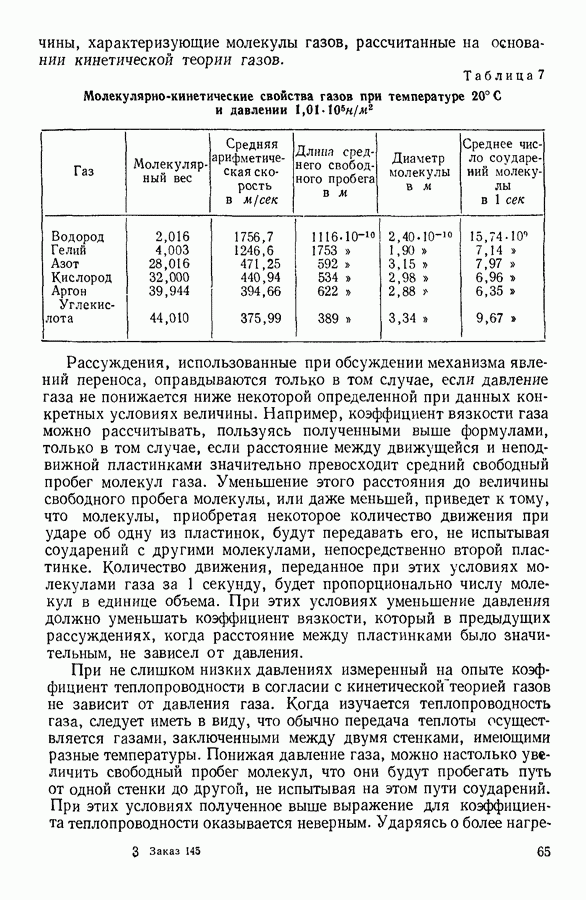
- 14. ЧИСЛО СОУДАРЕНИЙ И ДЛИНА СВОБОДНОГО ПРОБЕГА МОЛЕКУЛЫ
- 15. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ДЛИНЫ СРЕДНЕГО СВОБОДНОГО ПРОБЕГА МОЛЕКУЛ
- 16. ЯВЛЕНИЯ ПЕРЕНОСА. ВЯЗКОСТЬ ГАЗОВ
- 17. ТЕПЛОПРОВОДНОСТЬ ГАЗОВ
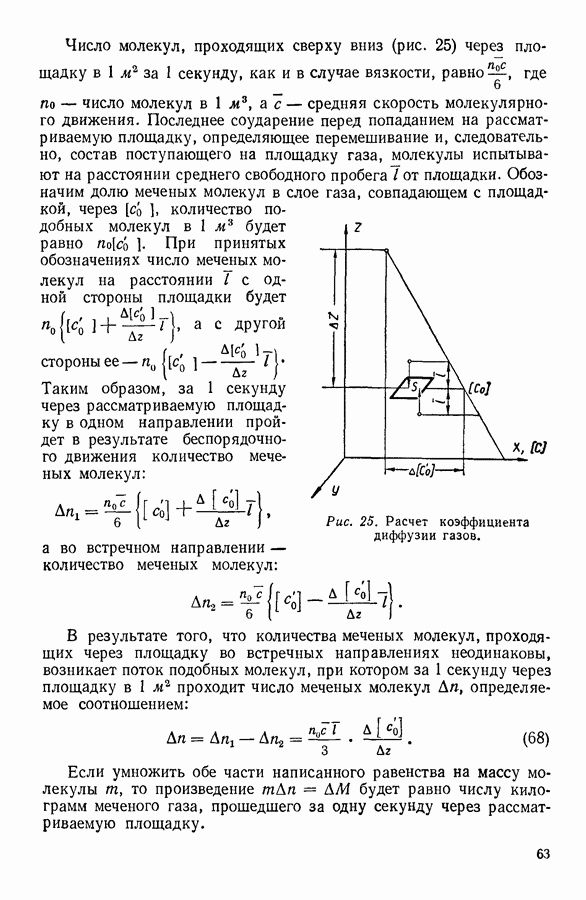
- 18. ДИФФУЗИЯ ГАЗОВ
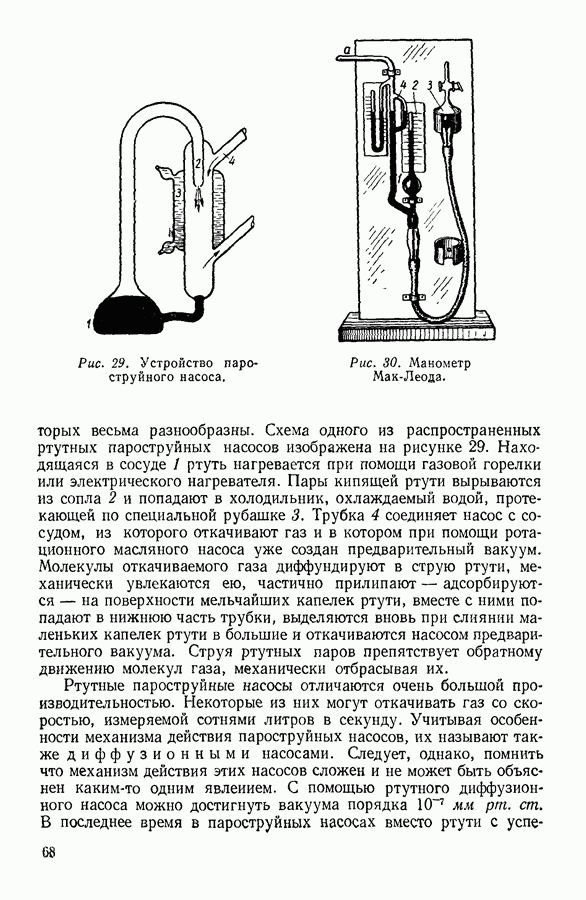
- 19. ВАКУУМ. ПОЛУЧЕНИЕ И ИЗМЕРЕНИЕ ВАКУУМА
- 20. ВНУТРЕННЯЯ ЭНЕРГИЯ ИДЕАЛЬНОГО ГАЗА
- 21. ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА
- 22. СООТНОШЕНИЕ МЕЖДУ ТЕПЛОЕМКОСТЬЮ ГАЗА ПРИ ПОСТОЯННОМ ОБЪЕМЕ И ТЕПЛОЕМКОСТЬЮ ГАЗА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
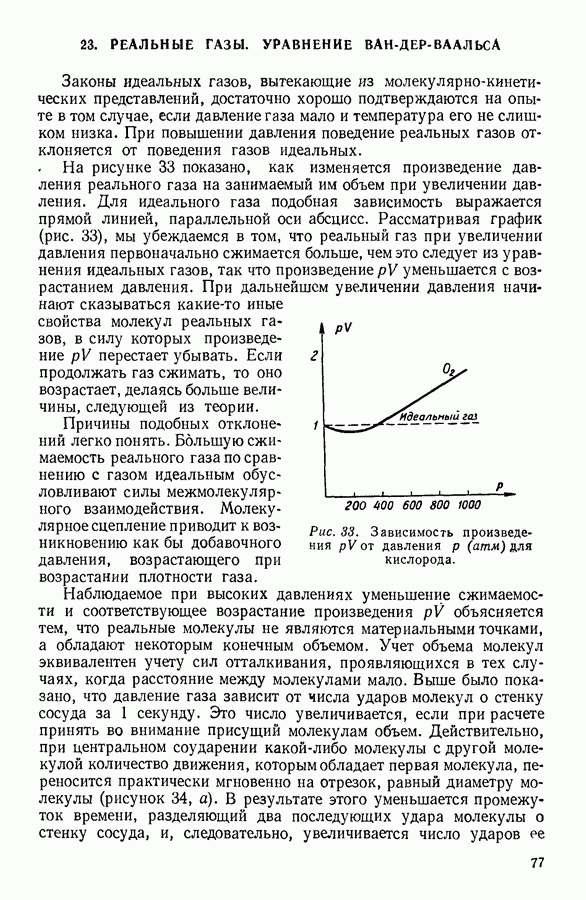
- 23. РЕАЛЬНЫЕ ГАЗЫ. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
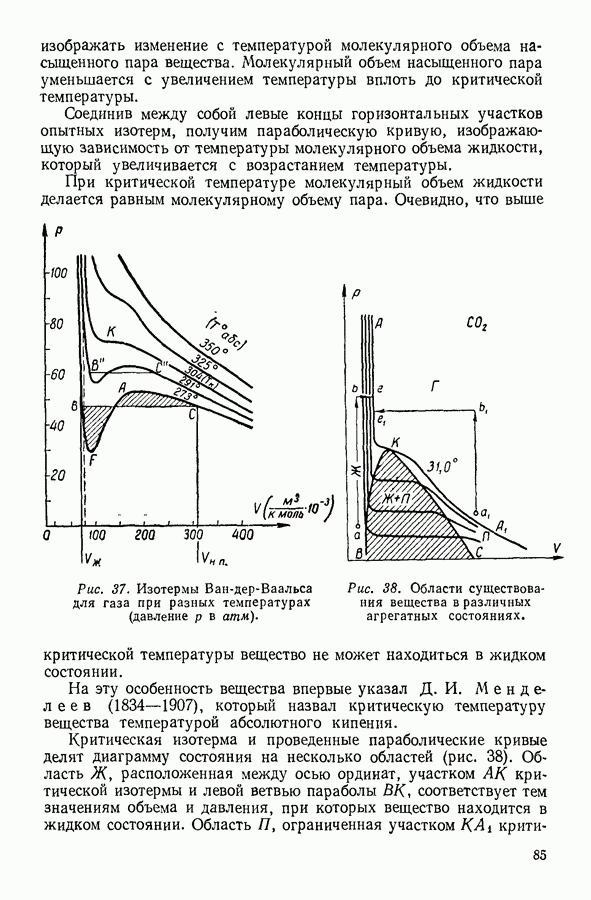
- 24. ИССЛЕДОВАНИЕ УРАВНЕНИЯ ВАН-ДЕР-ВААЛЬСА
- 25. ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ ПАРАМЕТРОВ ВЕЩЕСТВА
- 26. ПРИРОДА СИЛ МОЛЕКУЛЯРНОГО ПРИТЯЖЕНИЯ
- 27. ВНУТРЕННЯЯ ЭНЕРГИЯ РЕАЛЬНОГО ГАЗА
- 28. СЖИЖЕНИЕ ГАЗОВ
- II. ЖИДКОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- 1. СРАВНЕНИЕ СВОЙСТВ ЖИДКОСТЕЙ СО СВОЙСТВАМИ ГАЗОВ И ТВЕРДЫХ ТЕЛ
- 2. МОЛЕКУЛЯРНОЕ ДАВЛЕНИЕ
- 3. ПОВЕРХНОСТНЫЕ СВОЙСТВА ЖИДКОСТЕЙ
- 4. ЯВЛЕНИЯ НА ГРАНИЦЕ ЖИДКОСТИ С ТВЕРДЫМ ТЕЛОМ
- 5. ДАВЛЕНИЕ ПОД ИЗОГНУТОЙ ПОВЕРХНОСТЬЮ ЖИДКОСТИ
- 6. ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА
- 7. ИСПАРЕНИЕ ЖИДКОСТЕЙ. НАСЫЩЕННЫЙ ПАР И ЕГО СВОЙСТВА
- 8. МОЛЕКУЛЯРНОЕ СТРОЕНИЕ ЖИДКОСТЕЙ
- 9. ВЯЗКОСТЬ ЖИДКОСТЕЙ
- 10. РАСТВОРЫ. ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
- 11. ПОНИЖЕНИЕ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА РАСТВОРИТЕЛЯ НАД РАСТВОРОМ
- 12. РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- 13. ПРИМЕНЕНИЕ УЛЬТРААКУСТИЧЕСКИХ МЕТОДОВ К ИССЛЕДОВАНИЮ ГАЗОВ И ЖИДКОСТЕЙ
- III. ТВЕРДОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- 1. КРИСТАЛЛИЧЕСКИЕ И АМОРФНЫЕ ТВЕРДЫЕ ТЕЛА
- 2. МОЛЕКУЛЯРНОЕ СТРОЕНИЕ КРИСТАЛЛОВ
- 3. ПОЛИМЕРЫ
- 4. СИЛЫ, ДЕЙСТВУЮЩИЕ МЕЖДУ ЧАСТИЦАМИ В ТВЕРДЫХ ТЕЛАХ
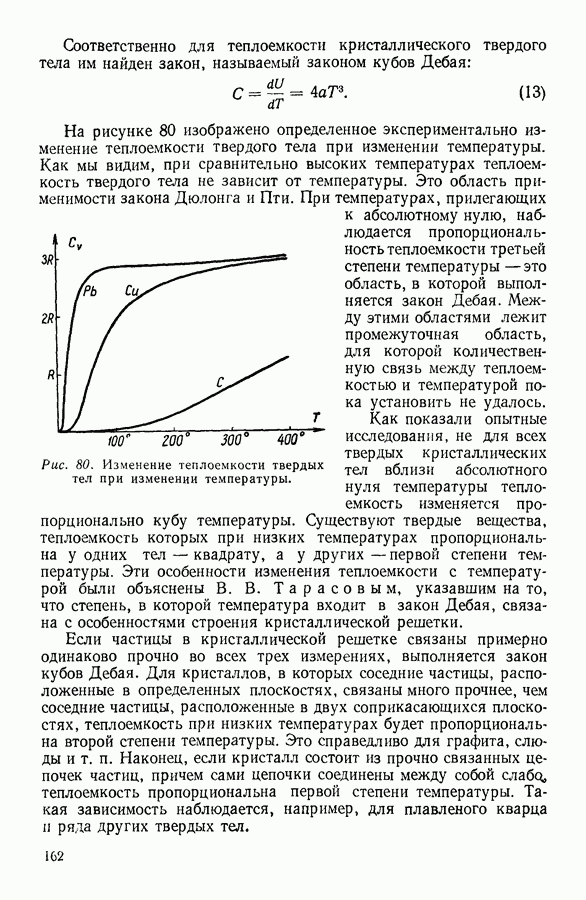
- 5. ТЕПЛОЕМКОСТЬ ТВЕРДЫХ ТЕЛ
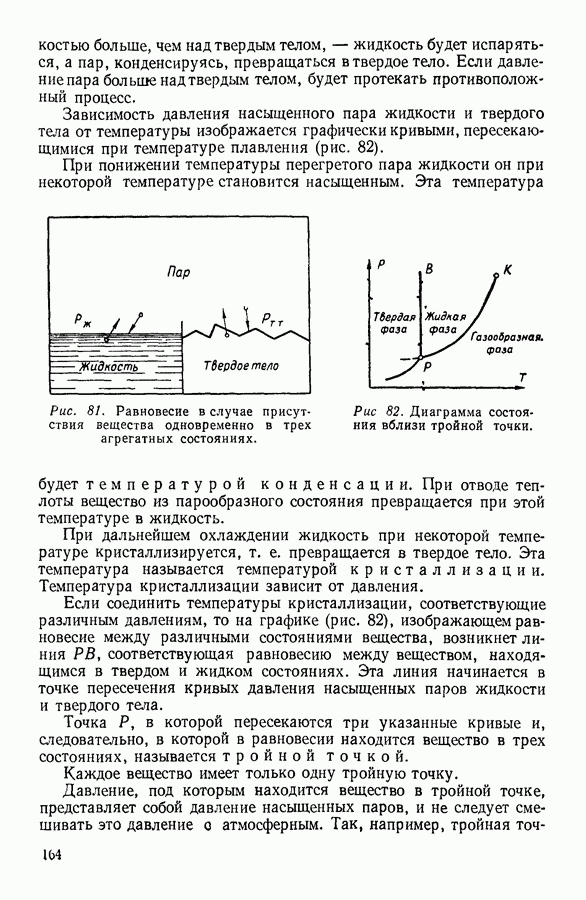
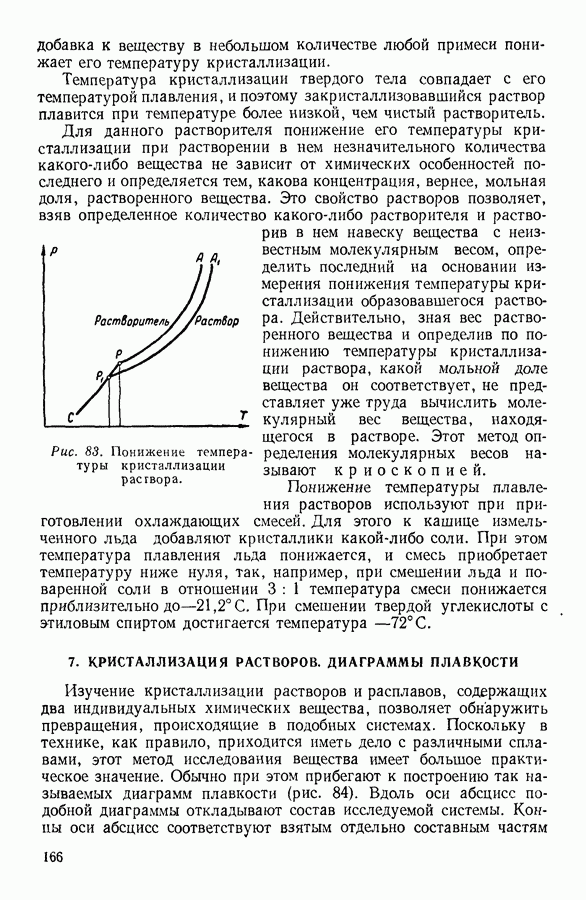
- 6. СУБЛИМАЦИЯ, ПЛАВЛЕНИЕ И КРИСТАЛЛИЗАЦИЯ ТВЕРДЫХ ТЕЛ
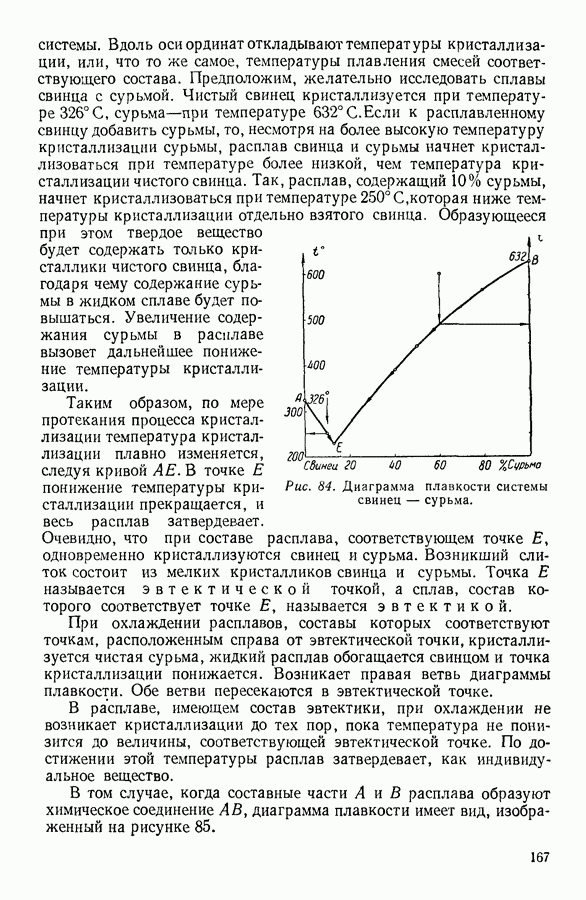
- 7. КРИСТАЛЛИЗАЦИЯ РАСТВОРОВ. ДИАГРАММЫ ПЛАВКОСТИ
- 8. АДСОРБЦИЯ
- IV. ФИЗИЧЕСКИЕ ОСНОВЫ ТЕРМОДИНАМИКИ
- 1. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКИЙ МЕТОД, МЕТОД СТАТИСТИЧЕСКОЙ МЕХАНИКИ И ТЕРМОДИНАМИЧЕСКИЙ МЕТОД
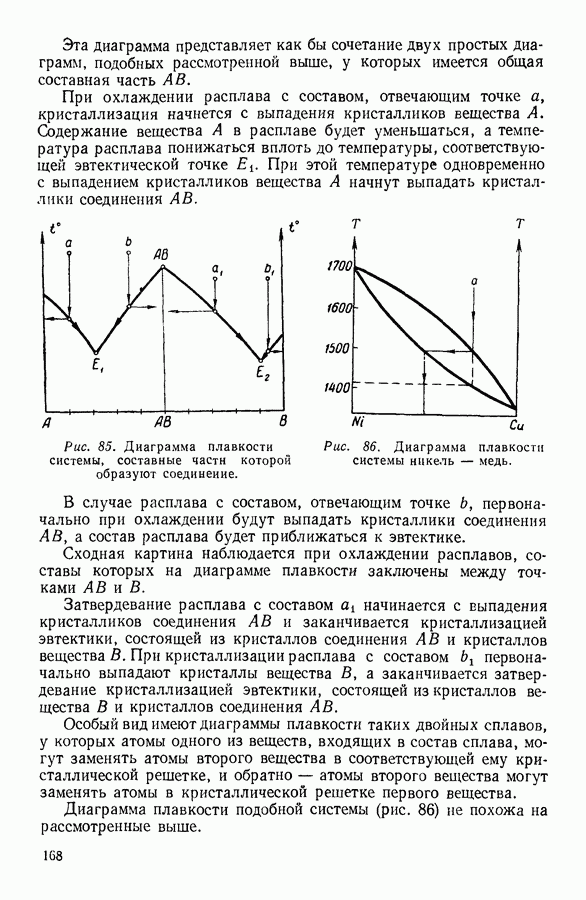
- 2. ПРЕДМЕТ ТЕРМОДИНАМИКИ. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПОНЯТИЯ.
- 3. ФИЗИЧЕСКИЙ СМЫСЛ ПОНЯТИЯ «ТЕПЛОТА»
- 4. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- 5. МЕТОДЫ НАХОЖДЕНИЯ ТЕРМОДИНАМИЧЕСКИХ СООТНОШЕНИЙ
- 6. АДИАБАТНЫЕ ПРОЦЕССЫ. УРАВНЕНИЕ ПУАССОНА
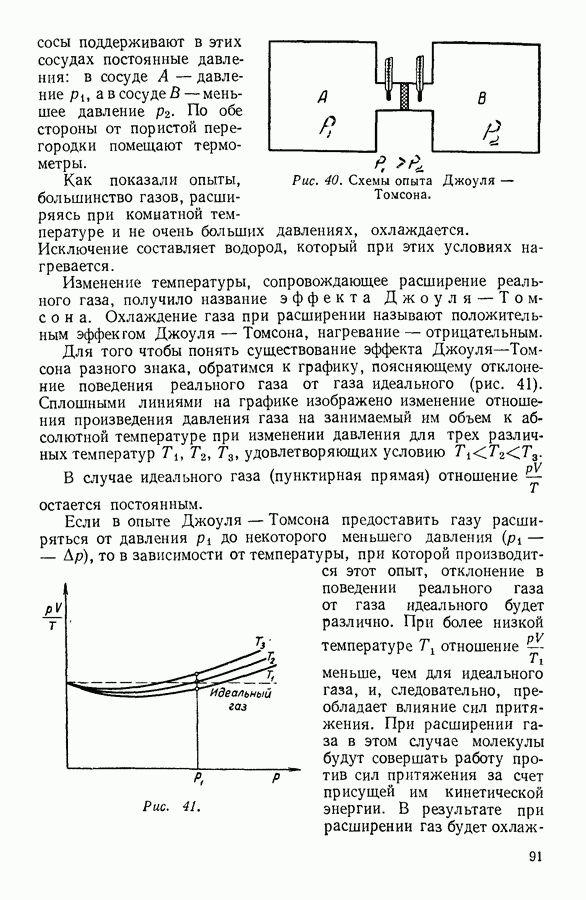
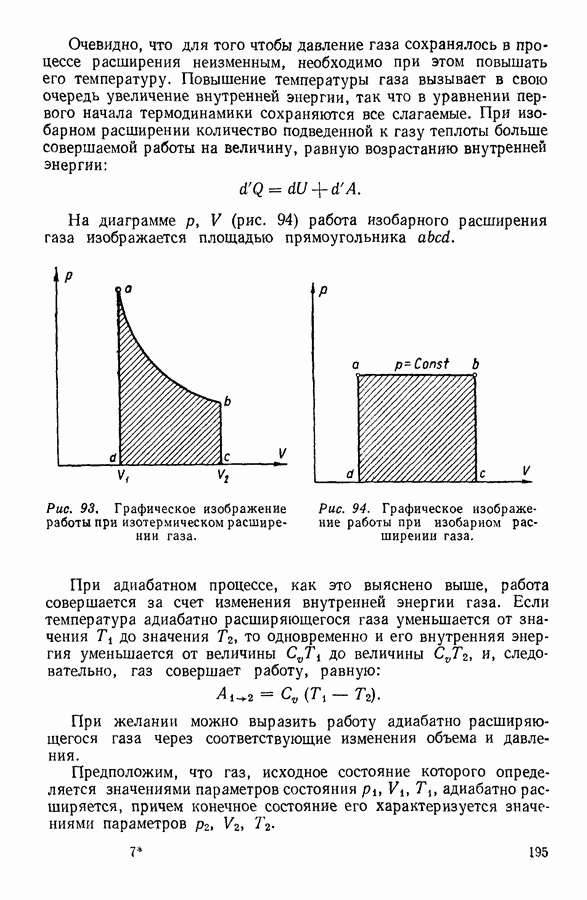
- 7. ПРИМЕНЕНИЕ ПЕРВОГО НАЧАЛА ТЕРМОДИНАМИКИ К НЕКОТОРЫМ ПРОЦЕССАМ В ГАЗАХ
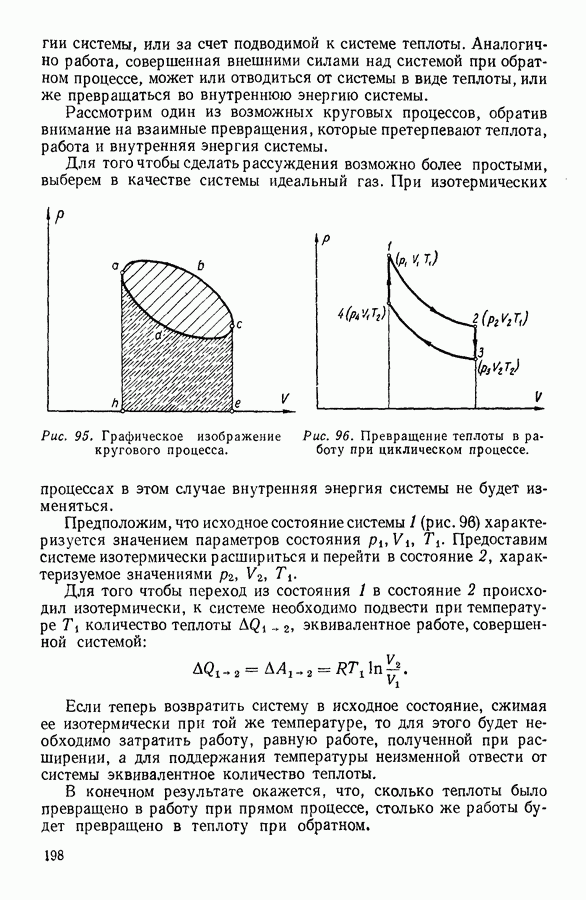
- 8. КРУГОВЫЕ ПРОЦЕССЫ
- 9. ЦИКЛ КАРНО
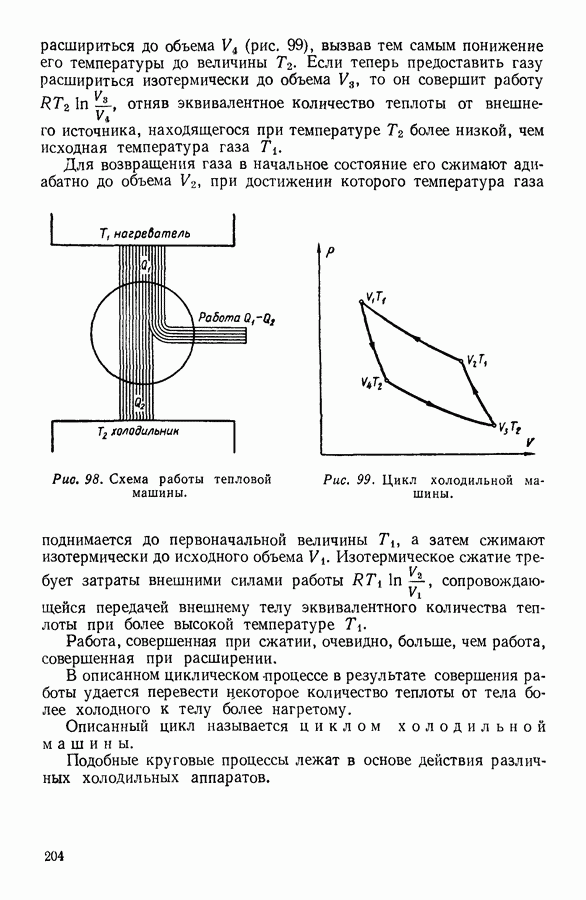
- 10. ИСПОЛЬЗОВАНИЕ ЦИКЛИЧЕСКИХ ПРОЦЕССОВ В ТЕРМОДИНАМИЧЕСКИХ РАССУЖДЕНИЯХ
- 11. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
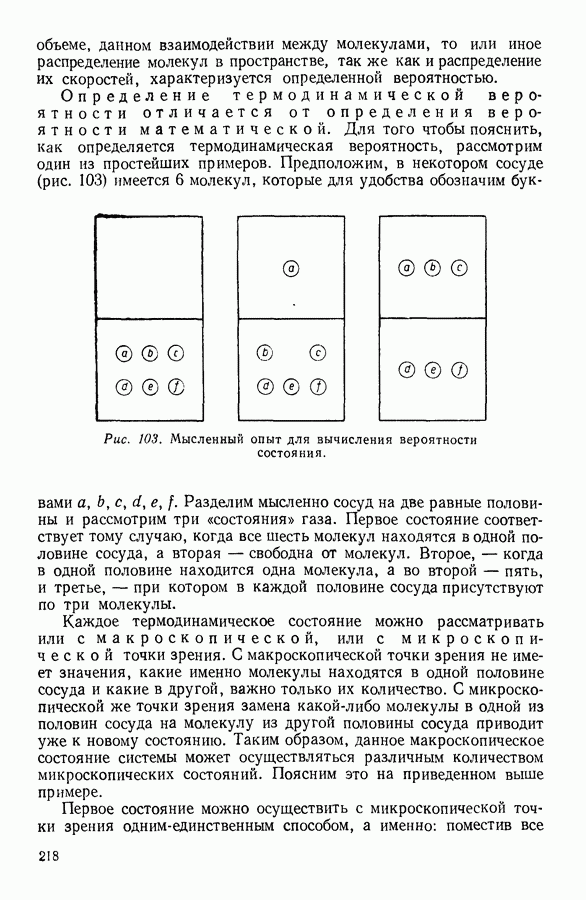
- 12. СТАТИСТИЧЕСКИЙ СМЫСЛ ВТОРОГО НАЧАЛА ТЕРМОДИНАМИКИ
- 13. КРИТИКА ТАК НАЗЫВАЕМОЙ «ТЕОРИИ ТЕПЛОВОЙ СМЕРТИ ВСЕЛЕННОЙ»