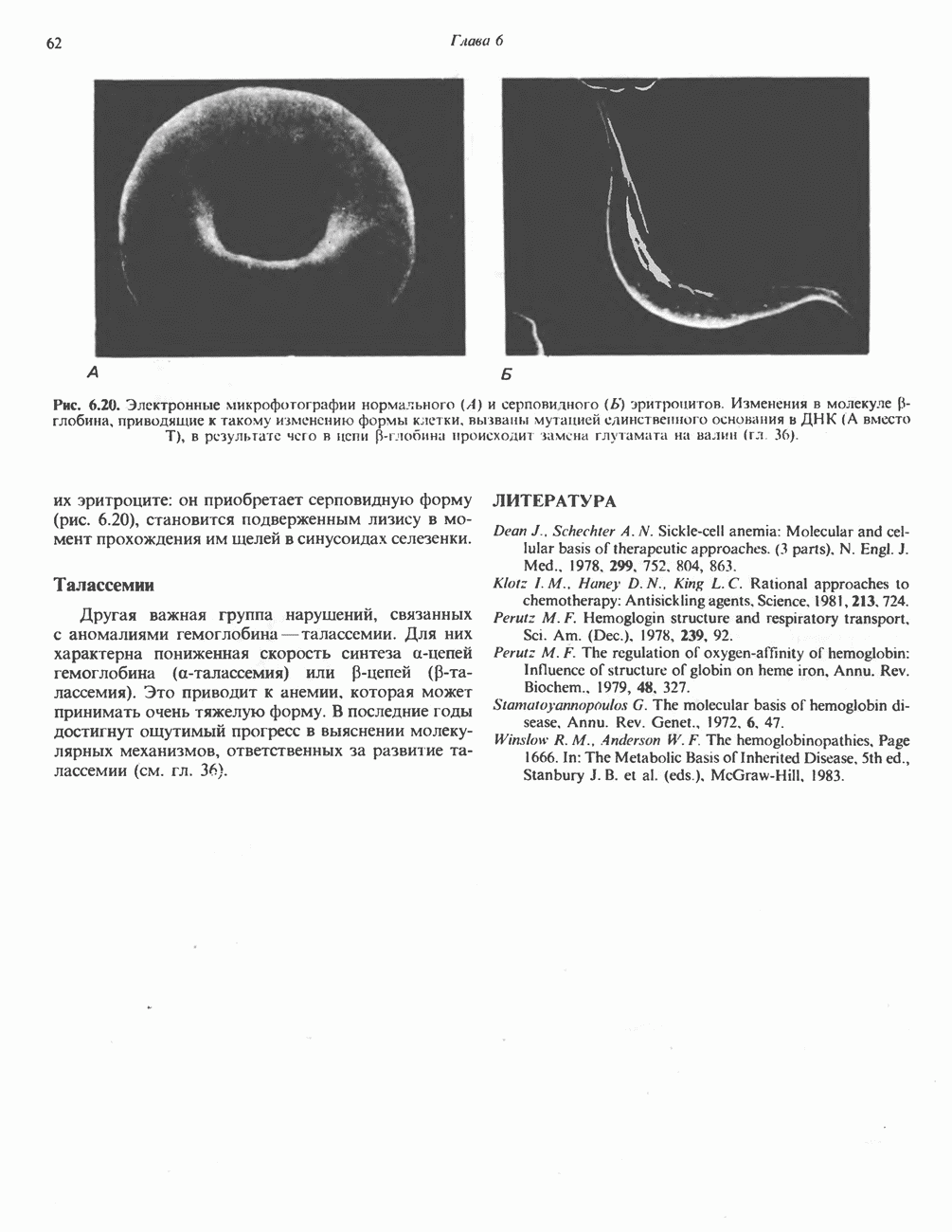
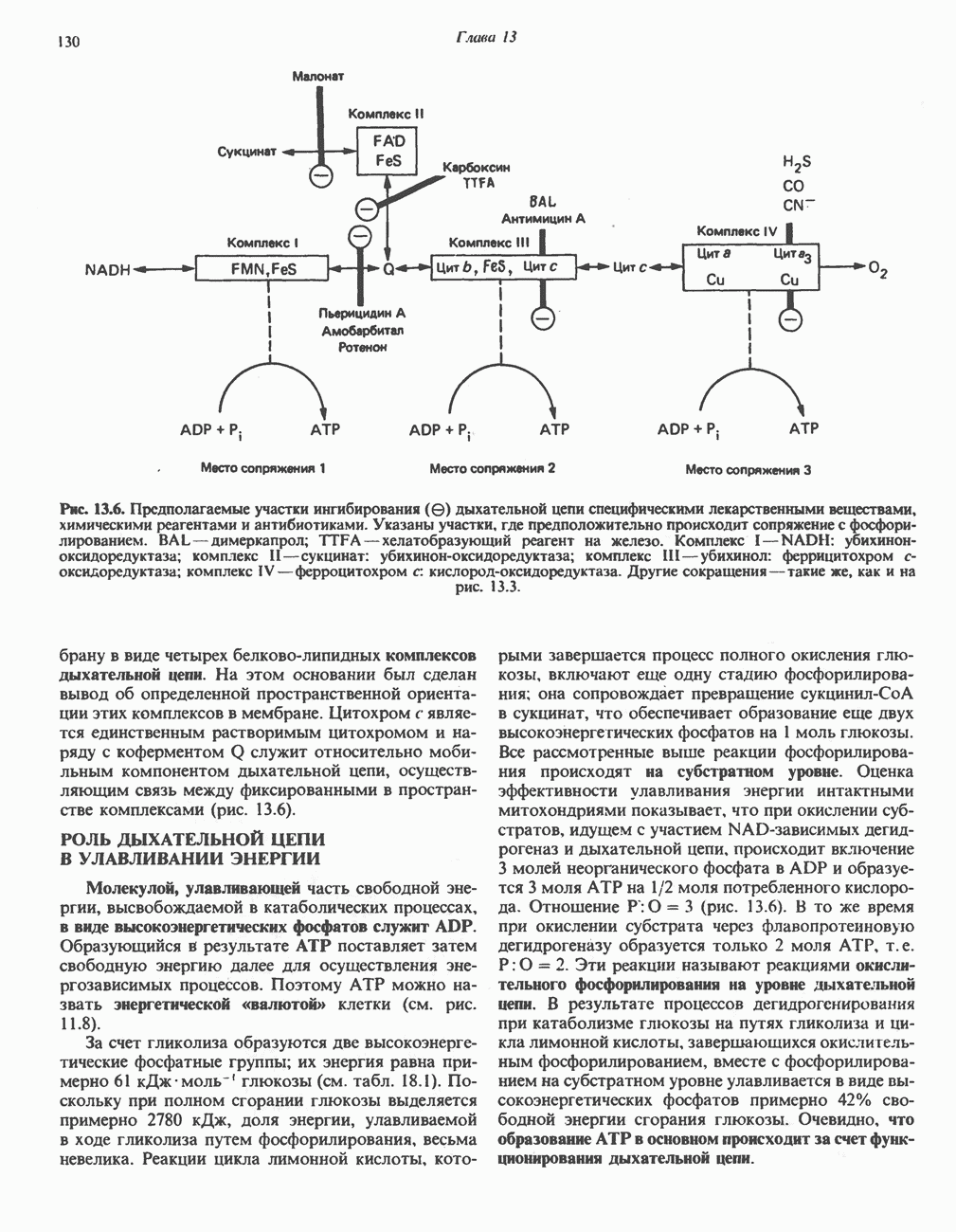
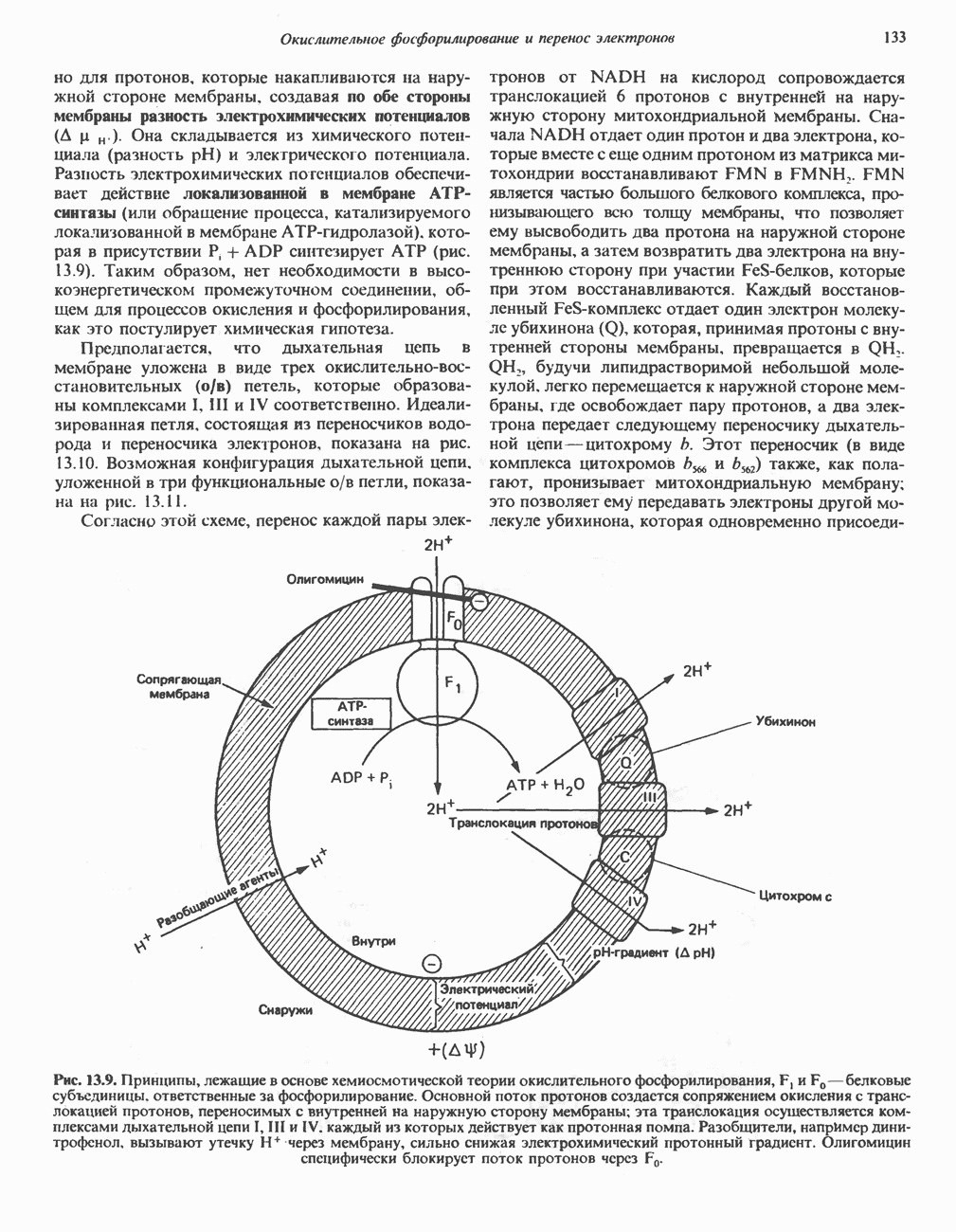
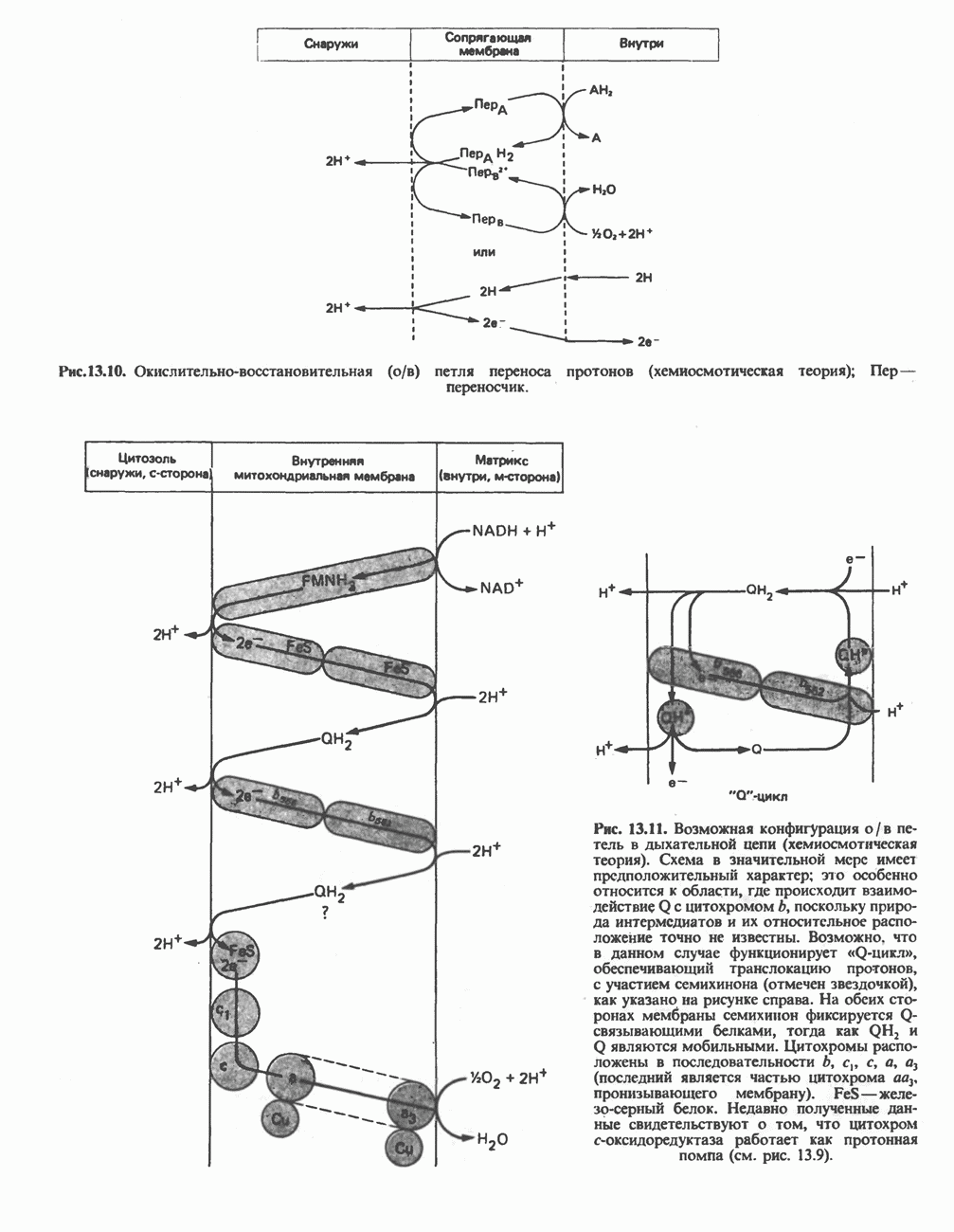
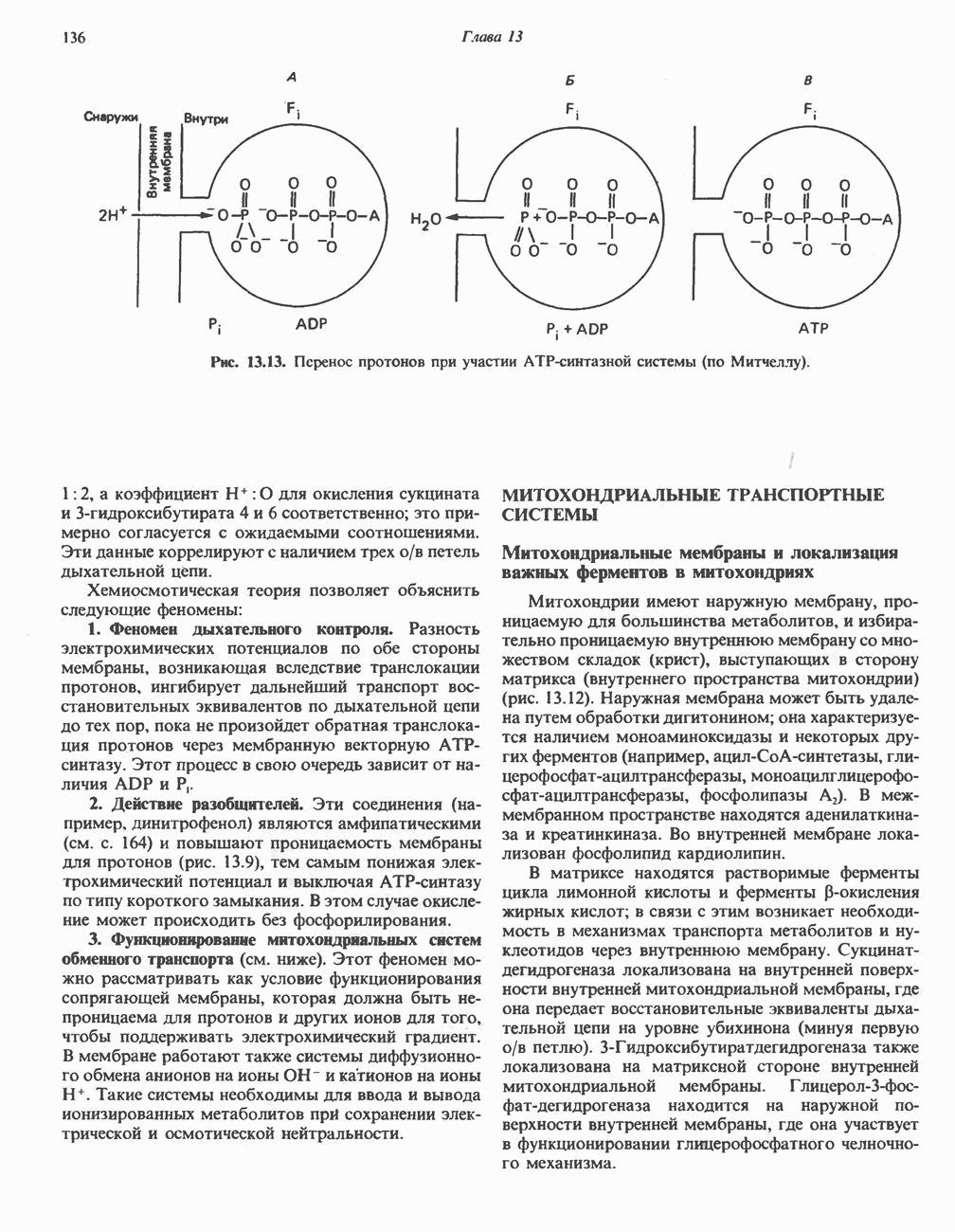
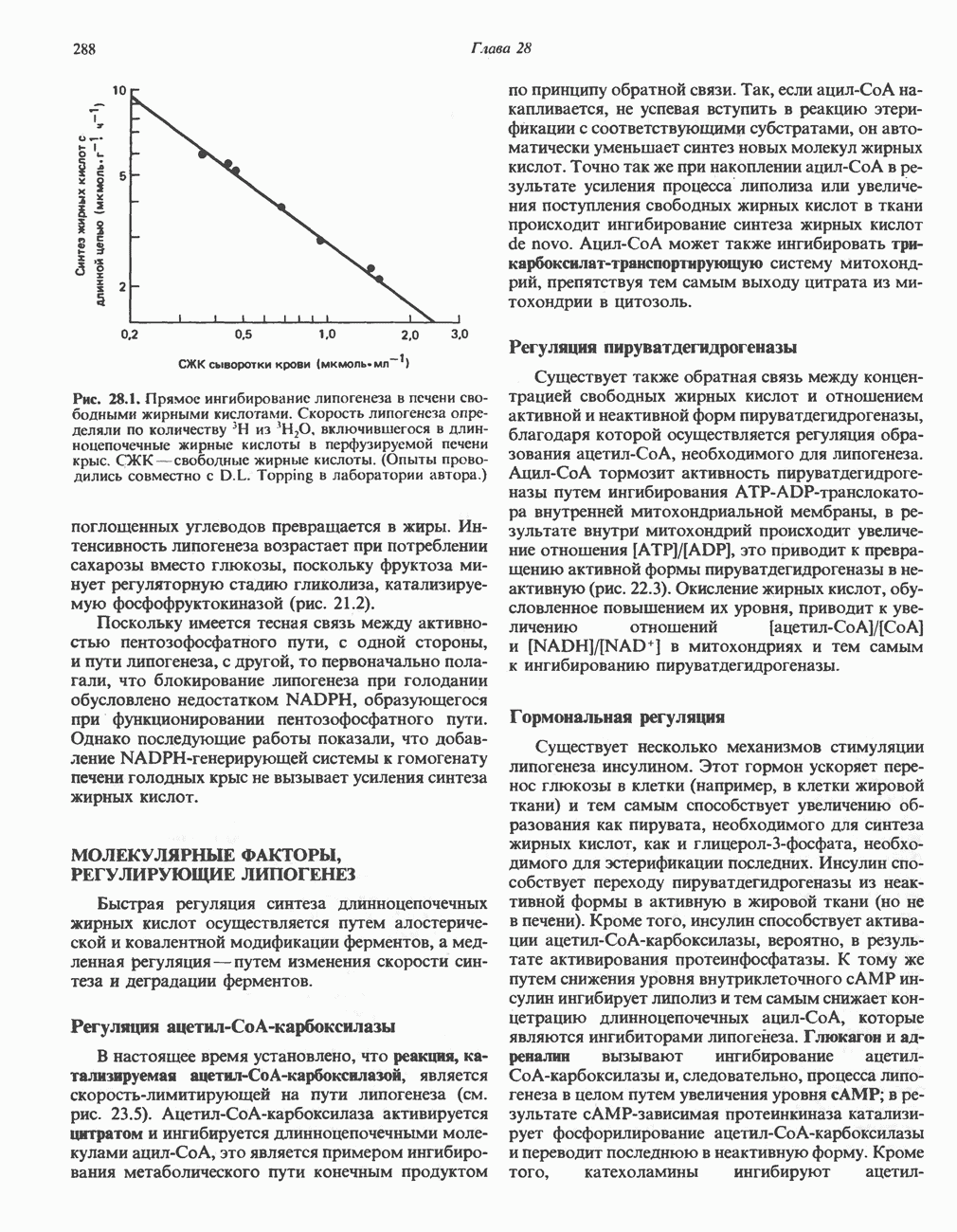
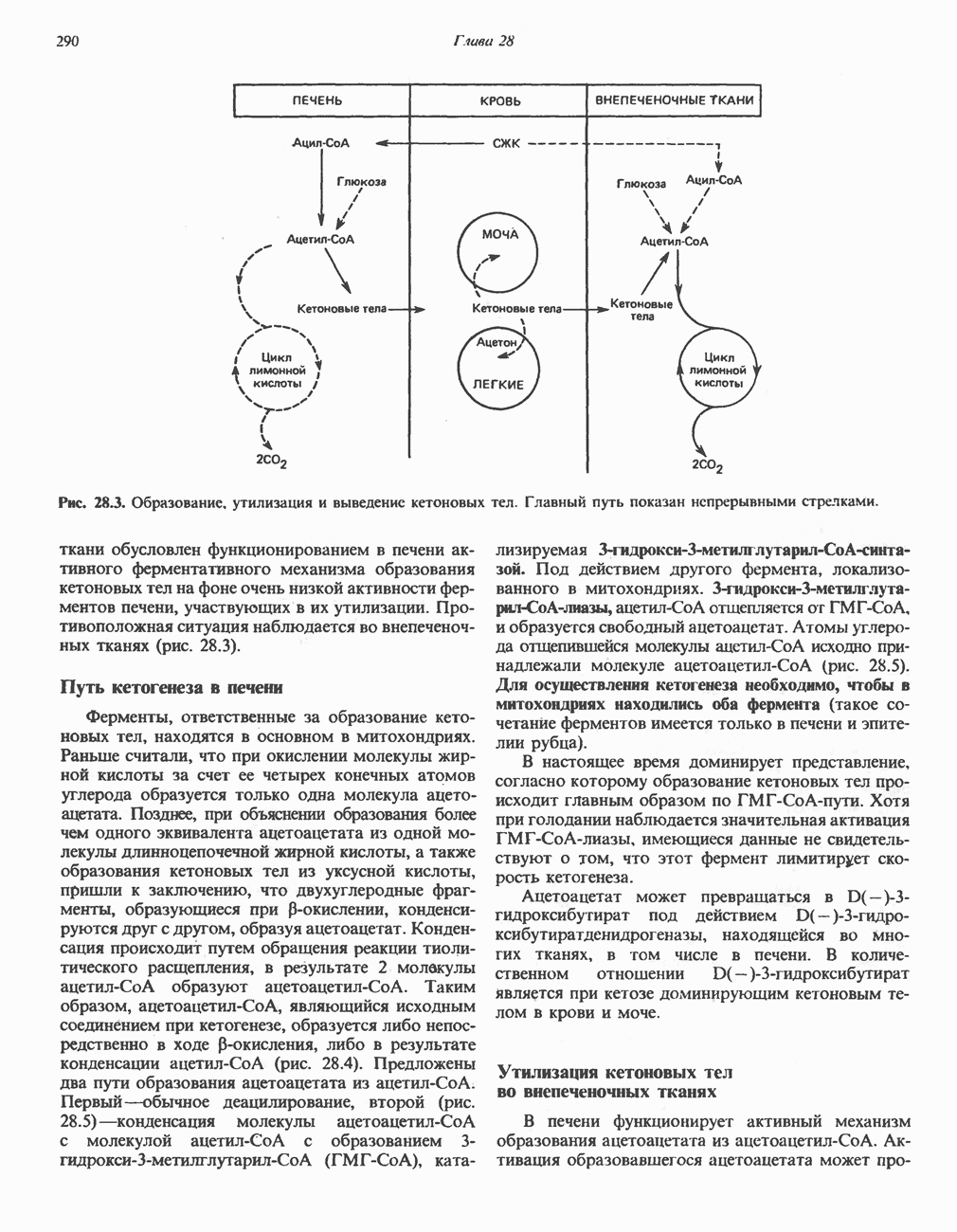
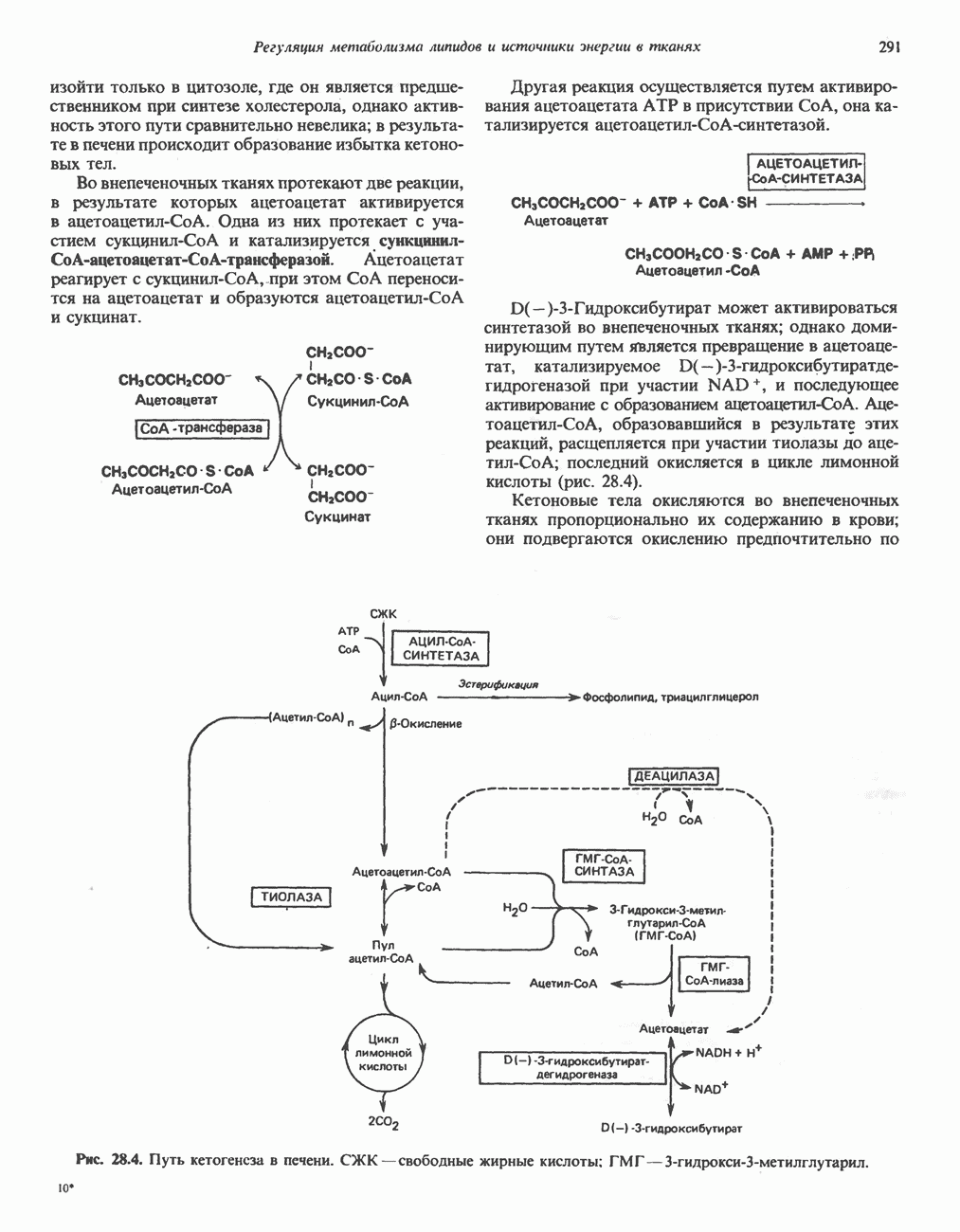
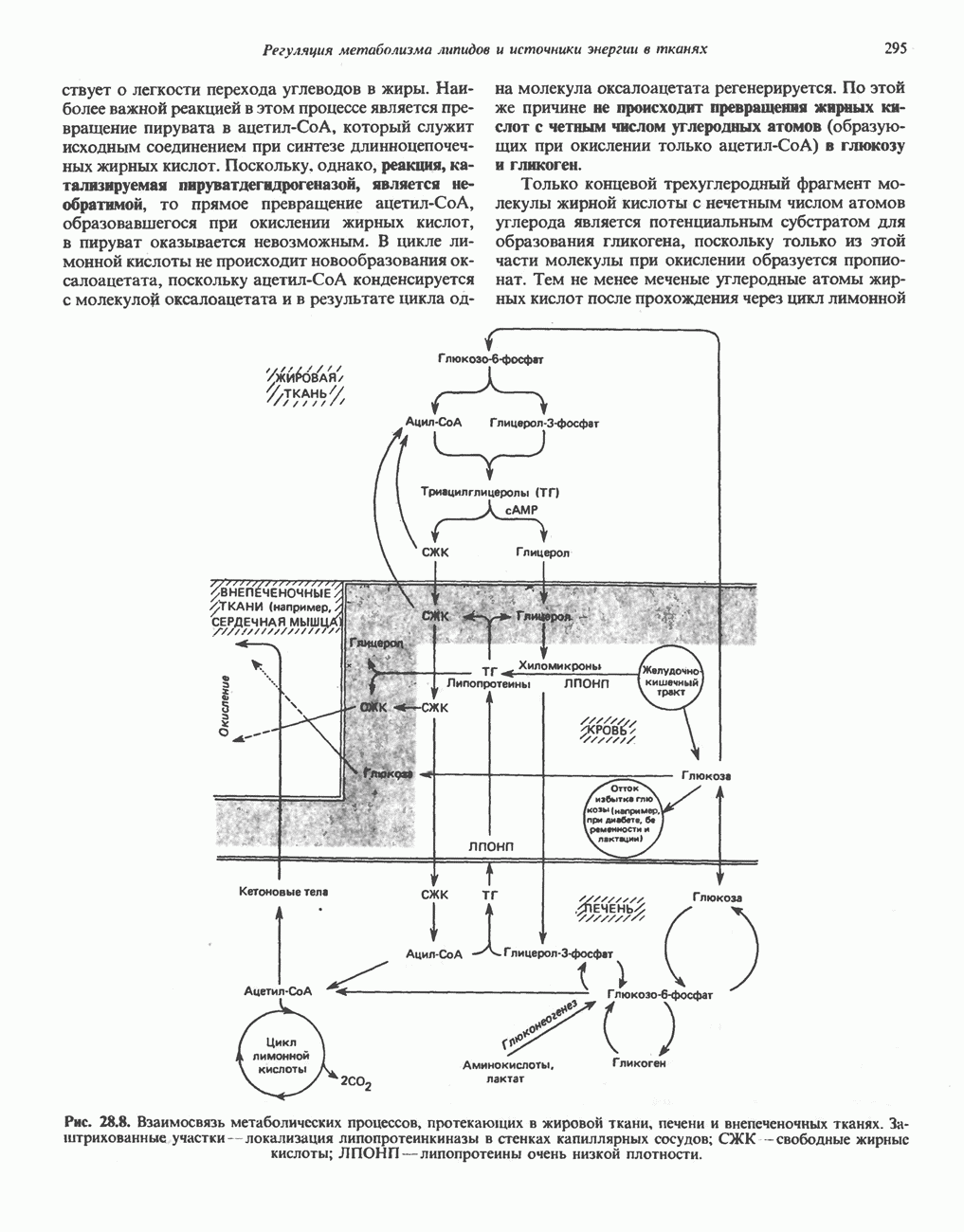
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ
Из 12 заменимых аминокислот (табл. 29.1) 9 образуются из амфиболических метаболитов, а три  незаменимых аминокислот.
незаменимых аминокислот.
Центральное место в биосинтезе аминокислот занимают глутаматдегидрогеназа, глутаминсинтаза и трансаминазы. Благодаря совместному действию этих ферментов катализируется включение неорганического иона аммония в а-аминогруппу аминокислот.
Глутамат
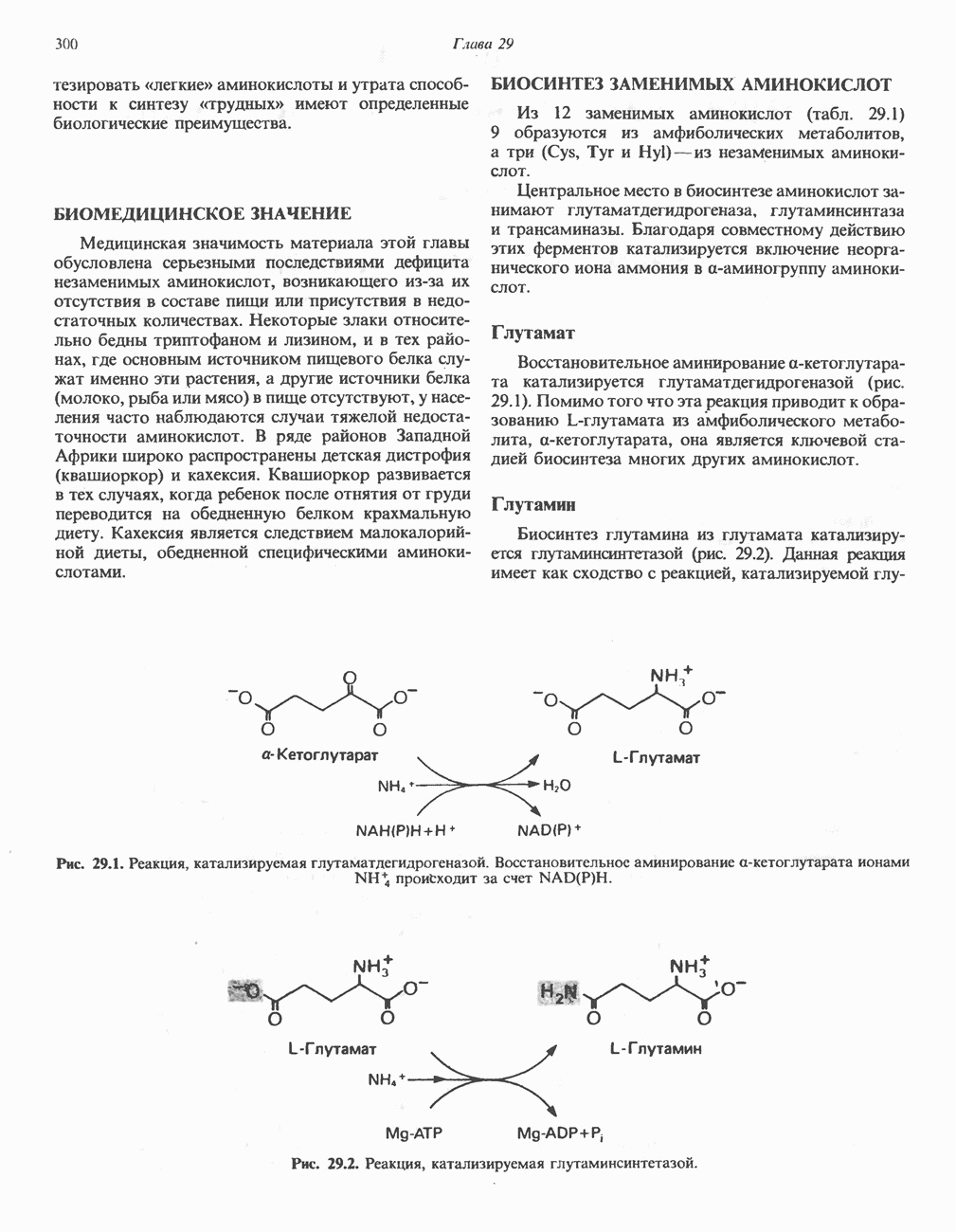
Восстановительное аминирование а-кетоглутарата катализируется глутаматдегидрогеназой (рис. 29.1). Помимо того что эта реакция приводит к образованию L-глутамата из амфиболического метаболита, а-кетоглутарата, она является ключевой стадией биосинтеза многих других аминокислот.
Глутамин
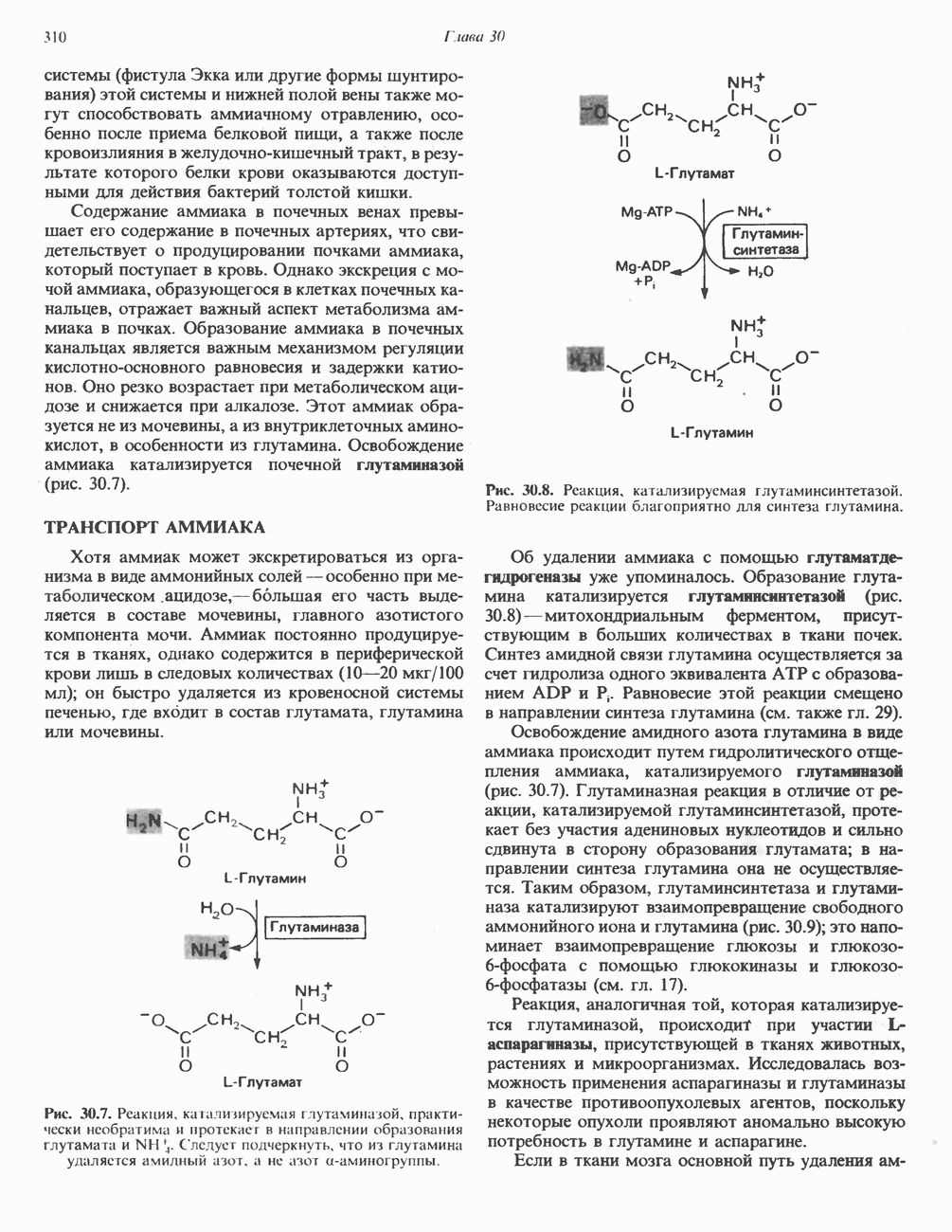
Биосинтез глутамина из глутамата катализируется глутаминсинтетазой (рис. 29.2). Данная реакция имеет как сходство с реакцией, катализируемой

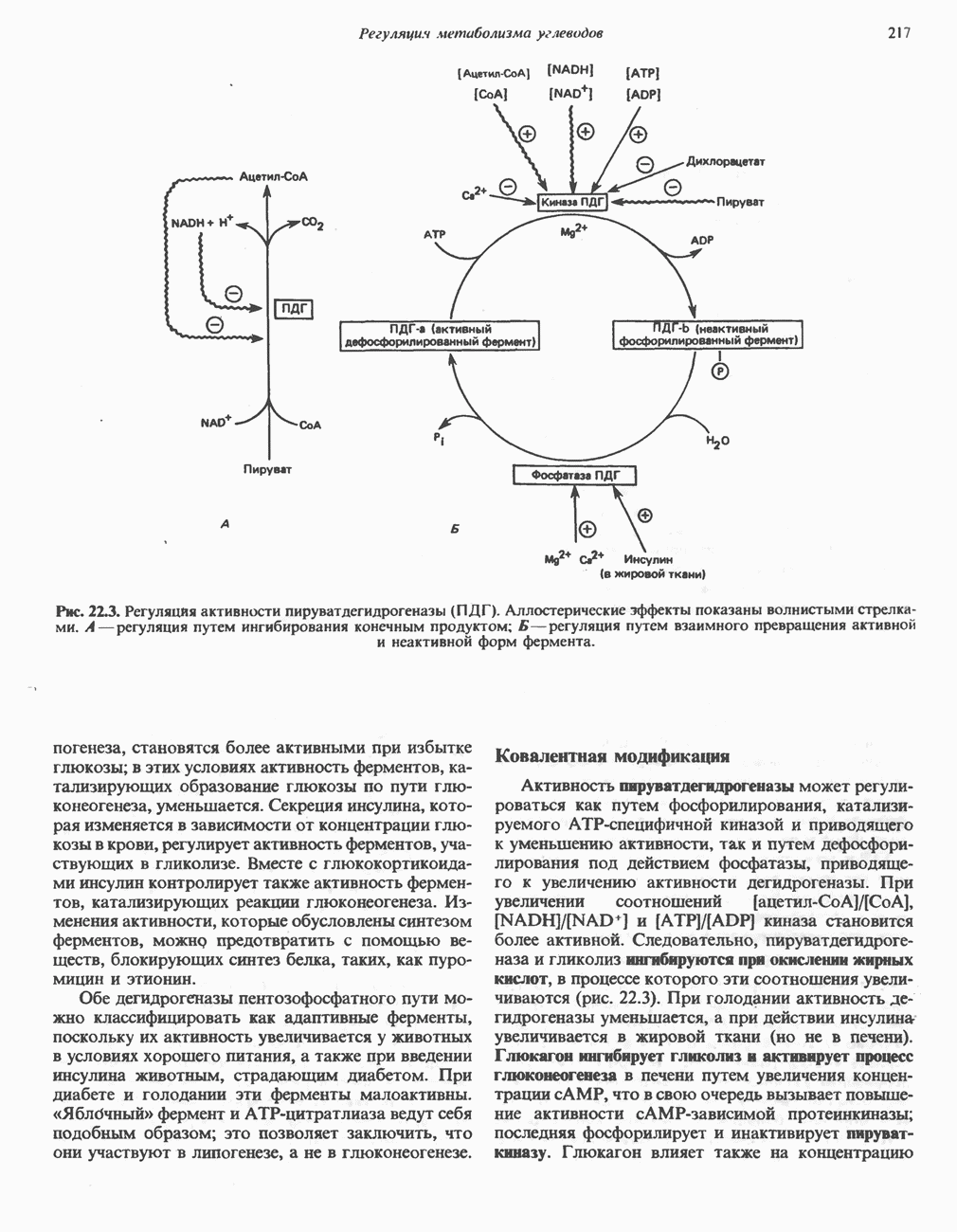
Рис. 29.1. Реакция, катализируемая глутаматдегидрогеназой. Восстановительное аминирование а-кетоглутарата ионами NH происходит за счет 

Рис. 29.2. Реакция, катализируемая глутаминсинтетазой.

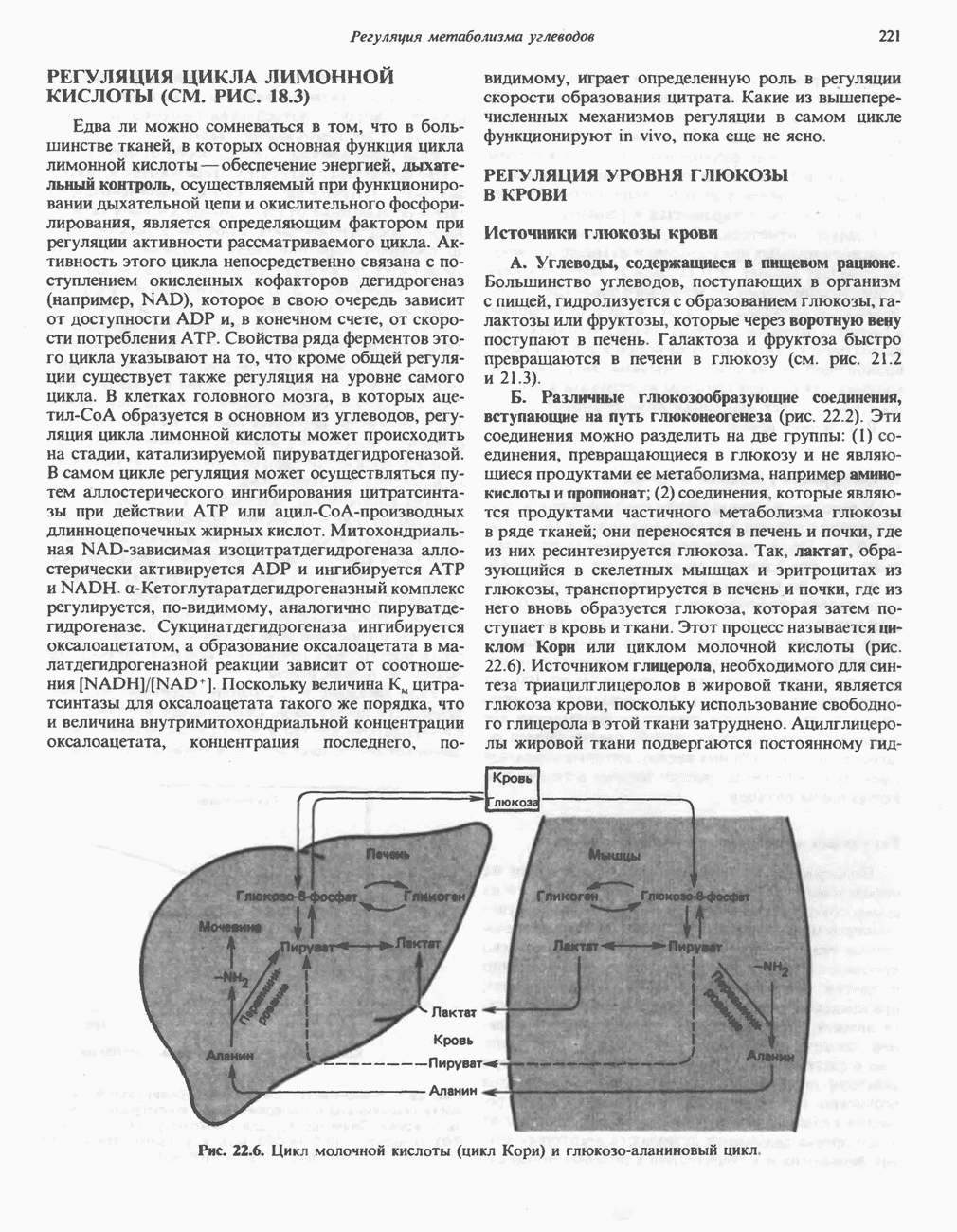
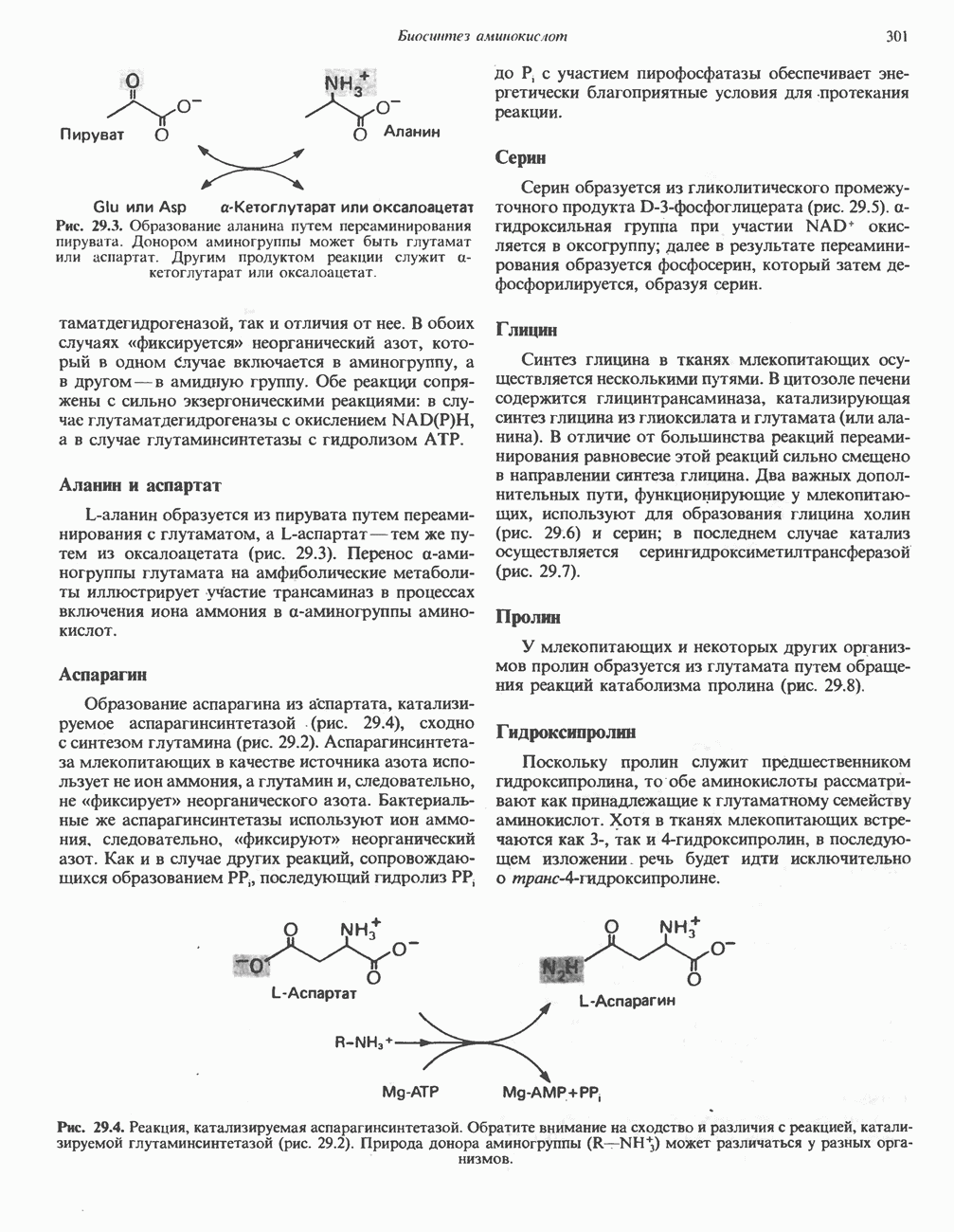
Рис. 29.3. Образование аланина путем переаминировання пирувата. Донором аминогруппы может быть глутамат или аспартат. Другим продуктом реакции служит а-кетоглутарат или оксалоацетат.
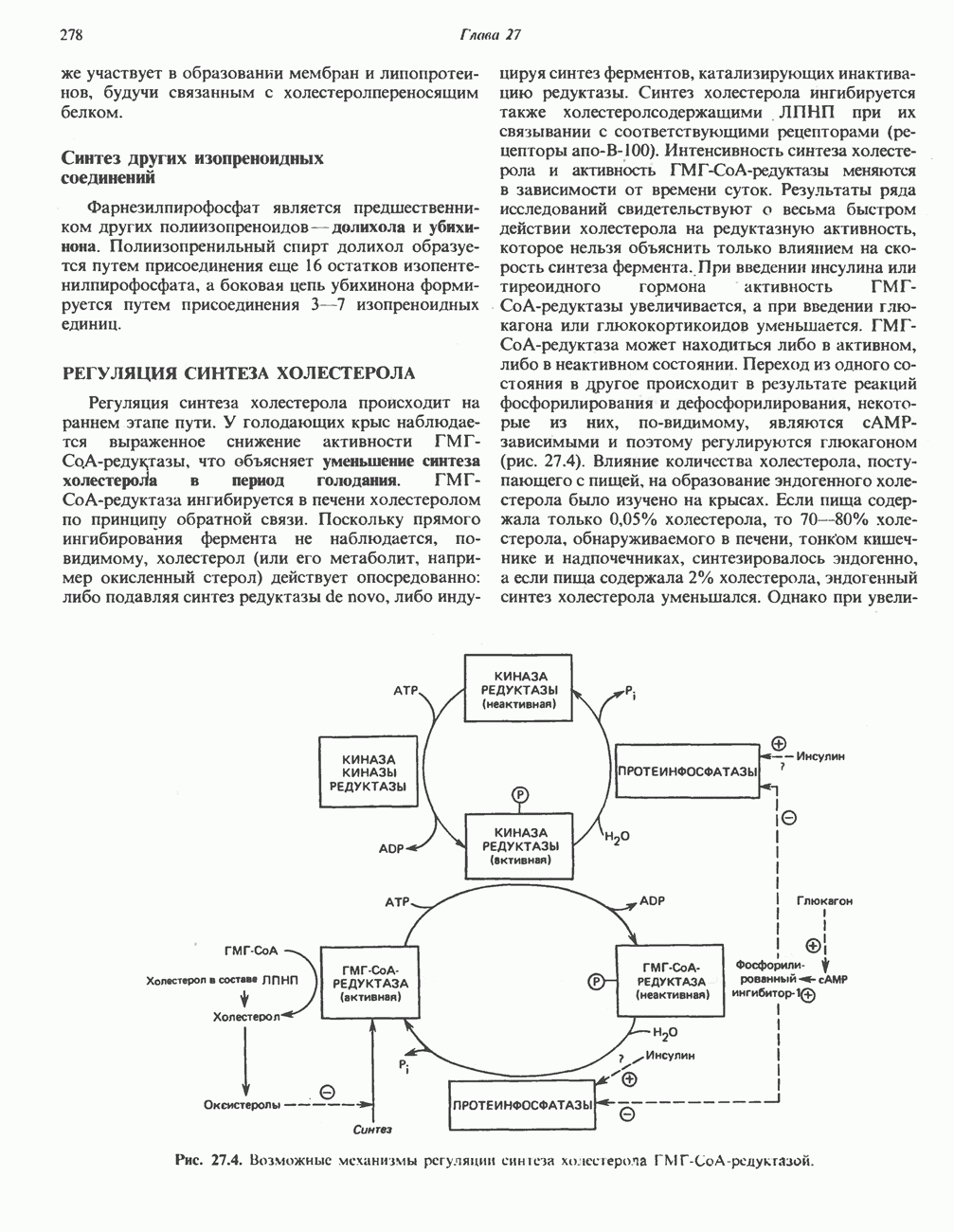
глутаматдегидрогеназой, так и отличия от нее. В обоих случаях «фиксируется» неорганический азот, который в одном Случае включается в аминогруппу, а в другом — в амидную группу. Обе реакции сопряжены с сильно экзергоническими реакциями: в случае глутаматдегидрогеназы с окислением  а в случае глутаминсинтетазы с гидролизом АТР.
а в случае глутаминсинтетазы с гидролизом АТР.
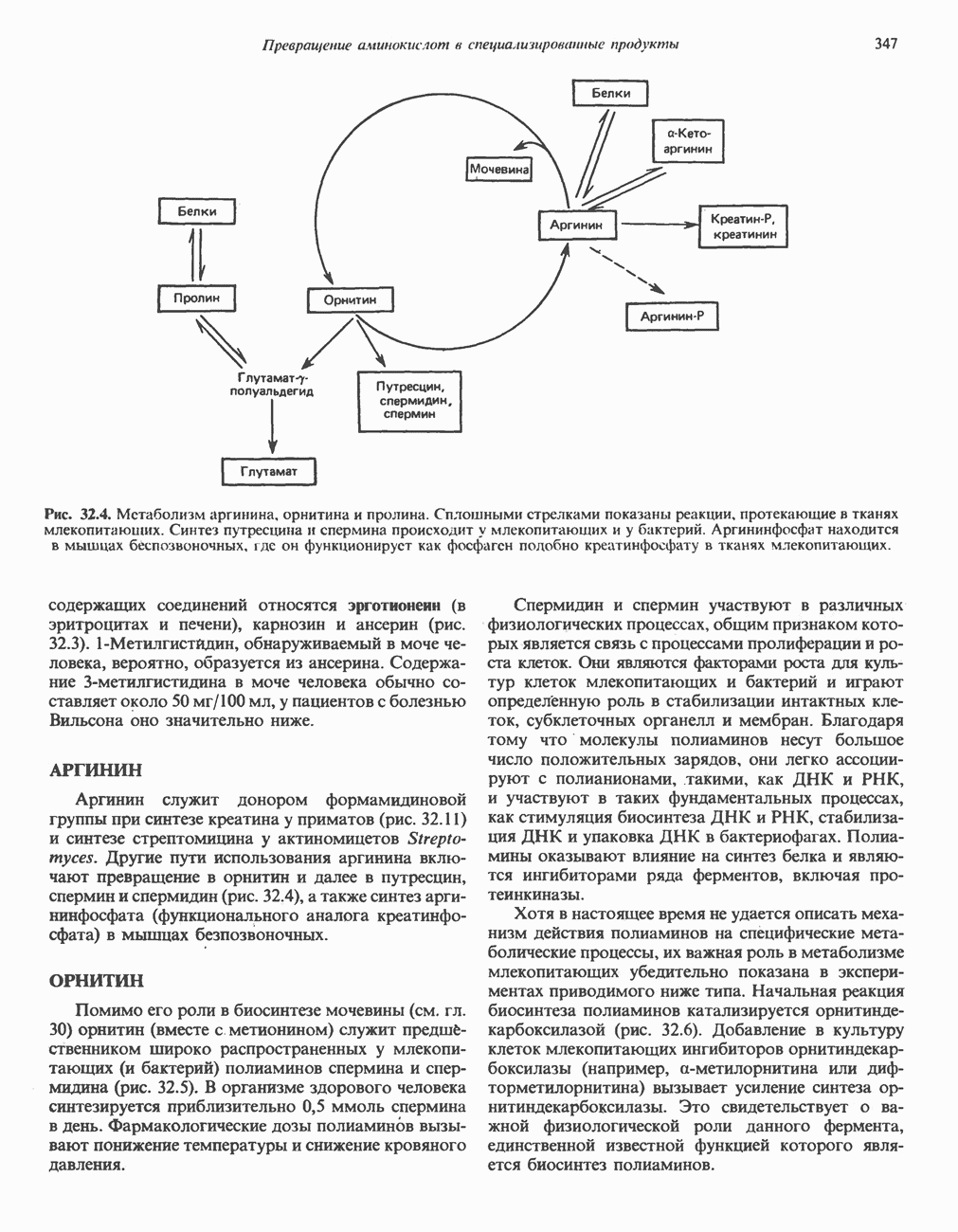
Аланин и аспартат
L-аланин образуется из пирувата путем переами-нирования с глутаматом, а  -аспартаттем же путем из оксалоацетата (рис. 29.3). Перенос а-аминогруппы глутамата на амфиболические метаболиты иллюстрирует участие трансаминаз в процессах включения иона аммония в а-аминогруппы аминокислот.
-аспартаттем же путем из оксалоацетата (рис. 29.3). Перенос а-аминогруппы глутамата на амфиболические метаболиты иллюстрирует участие трансаминаз в процессах включения иона аммония в а-аминогруппы аминокислот.
Аспарагин
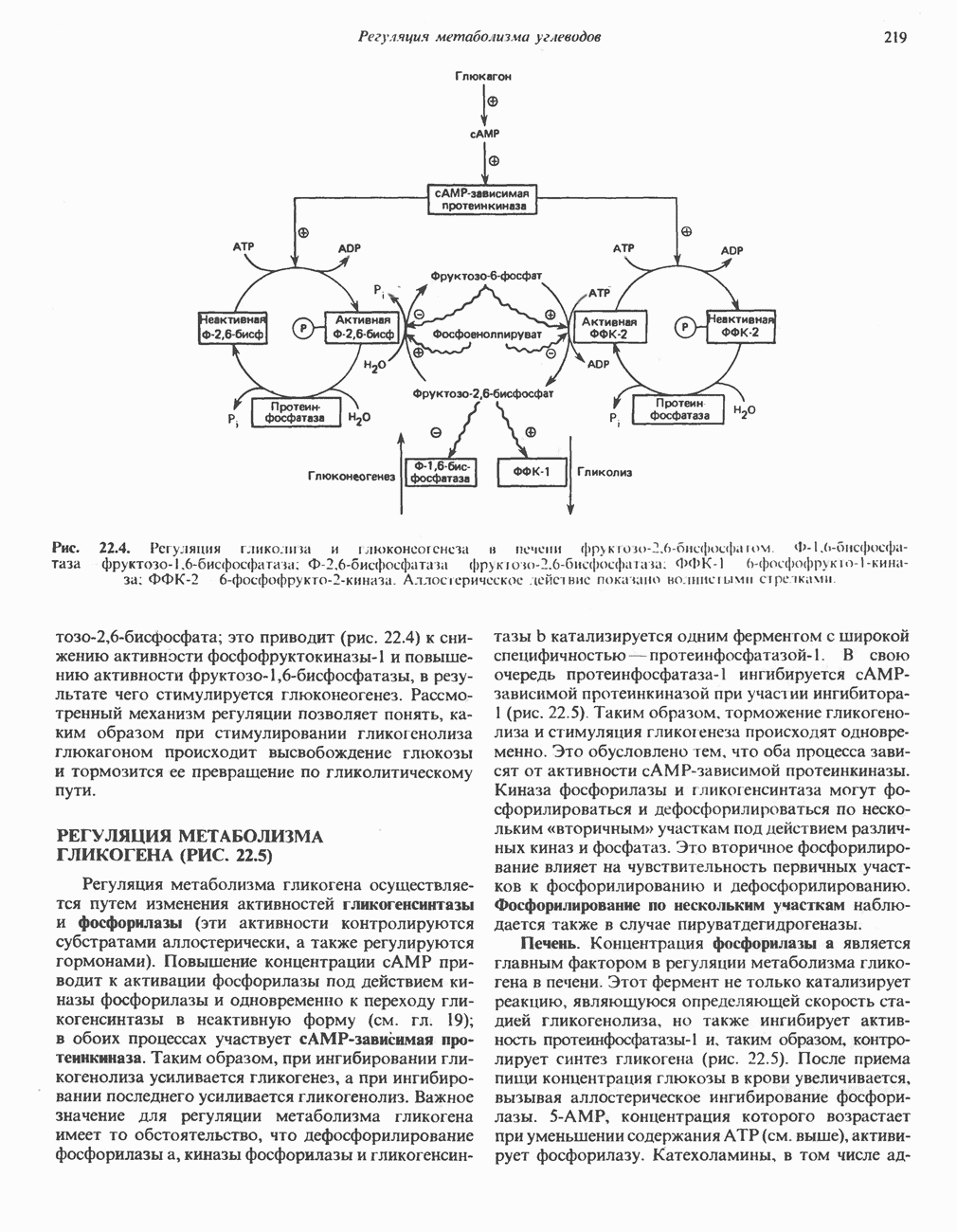
Образование аспарагина из аспартата, катализируемое аспарагинсинтетазой (рис. 29.4), сходно с синтезом глутамина (рис. 29.2). Аспарагинсинтетаза млекопитающих в качестве источника азота использует не ион аммония, а глутамин и, следовательно, не «фиксирует» неорганического азота. Бактериальные же аспарагинсинтетазы используют ион аммония, следовательно, «фиксируют» неорганический азот. Как и в случае других реакций, сопровождающихся образованием  последующий гидролиз РР, до Р, с участием пирофосфатазы обеспечивает энергетически благоприятные условия для протекания реакции.
последующий гидролиз РР, до Р, с участием пирофосфатазы обеспечивает энергетически благоприятные условия для протекания реакции.
Серин
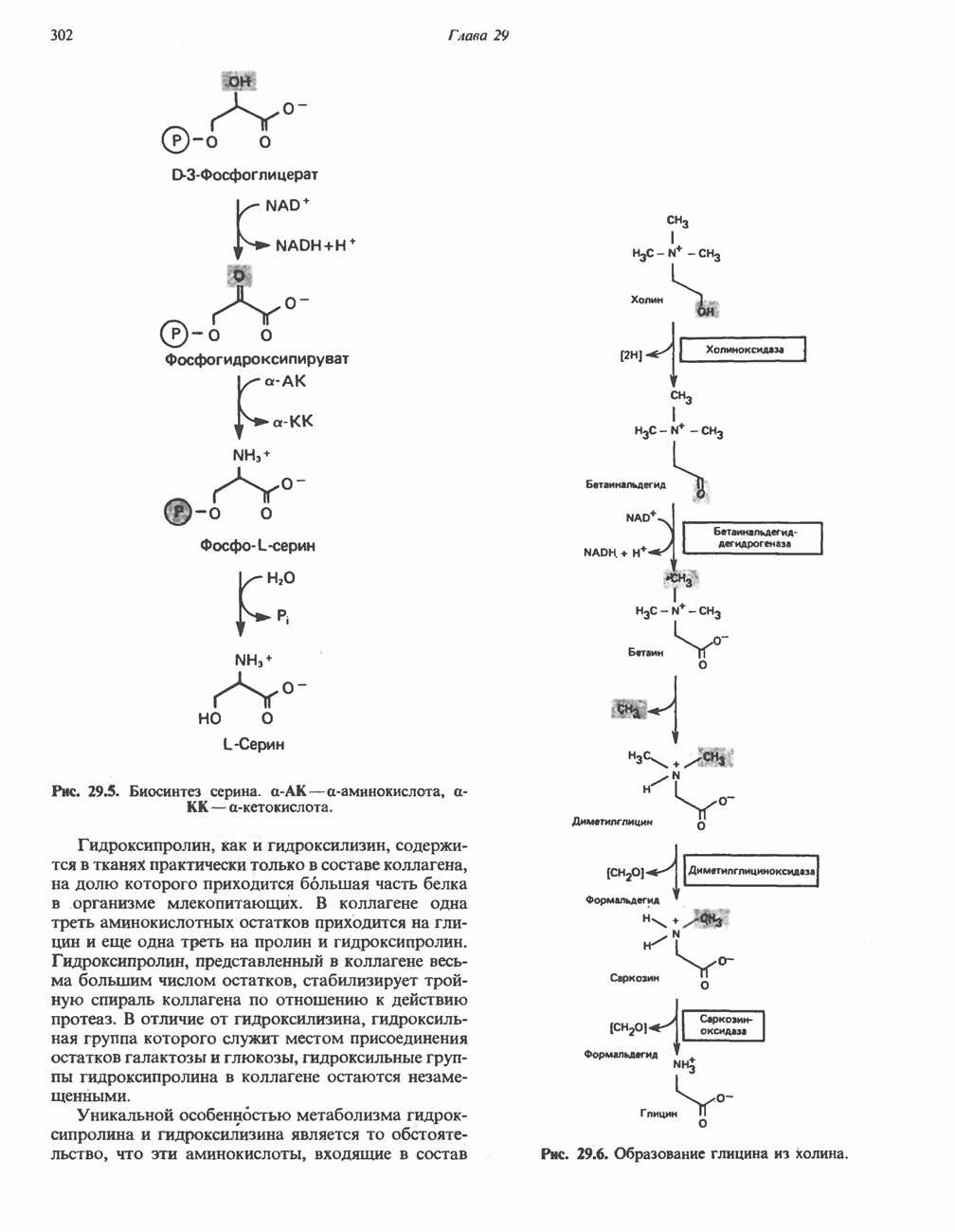
Серин образуется из гликолитического промежуточного продукта D-3-фосфоглицерата (рис. 29.5). а-гидроксильная группа при участии NAD+ окисляется в оксогруппу; далее в результате переаминирования образуется фосфосерин, который затем дефосфорилируется, образуя серин.
Глицин
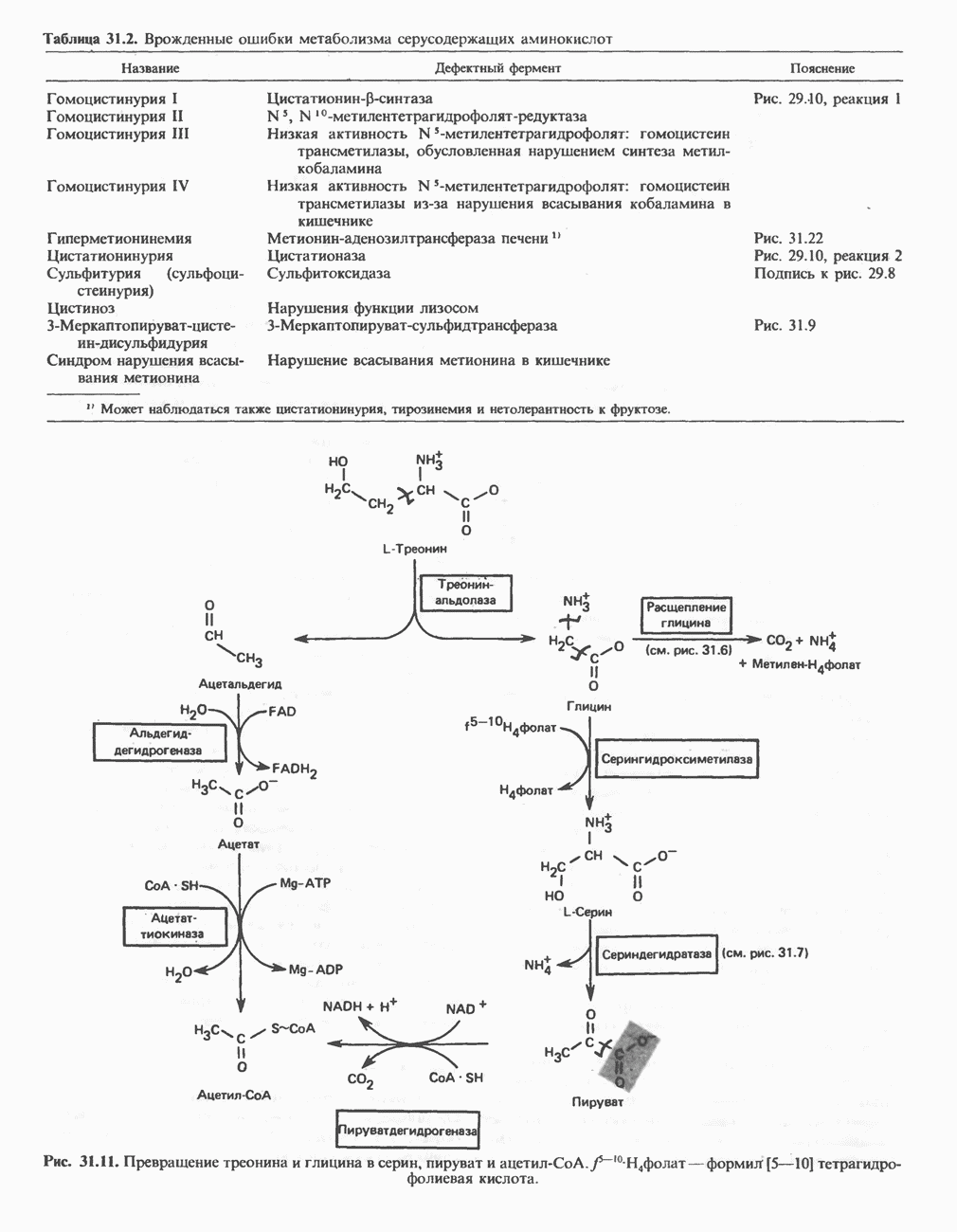
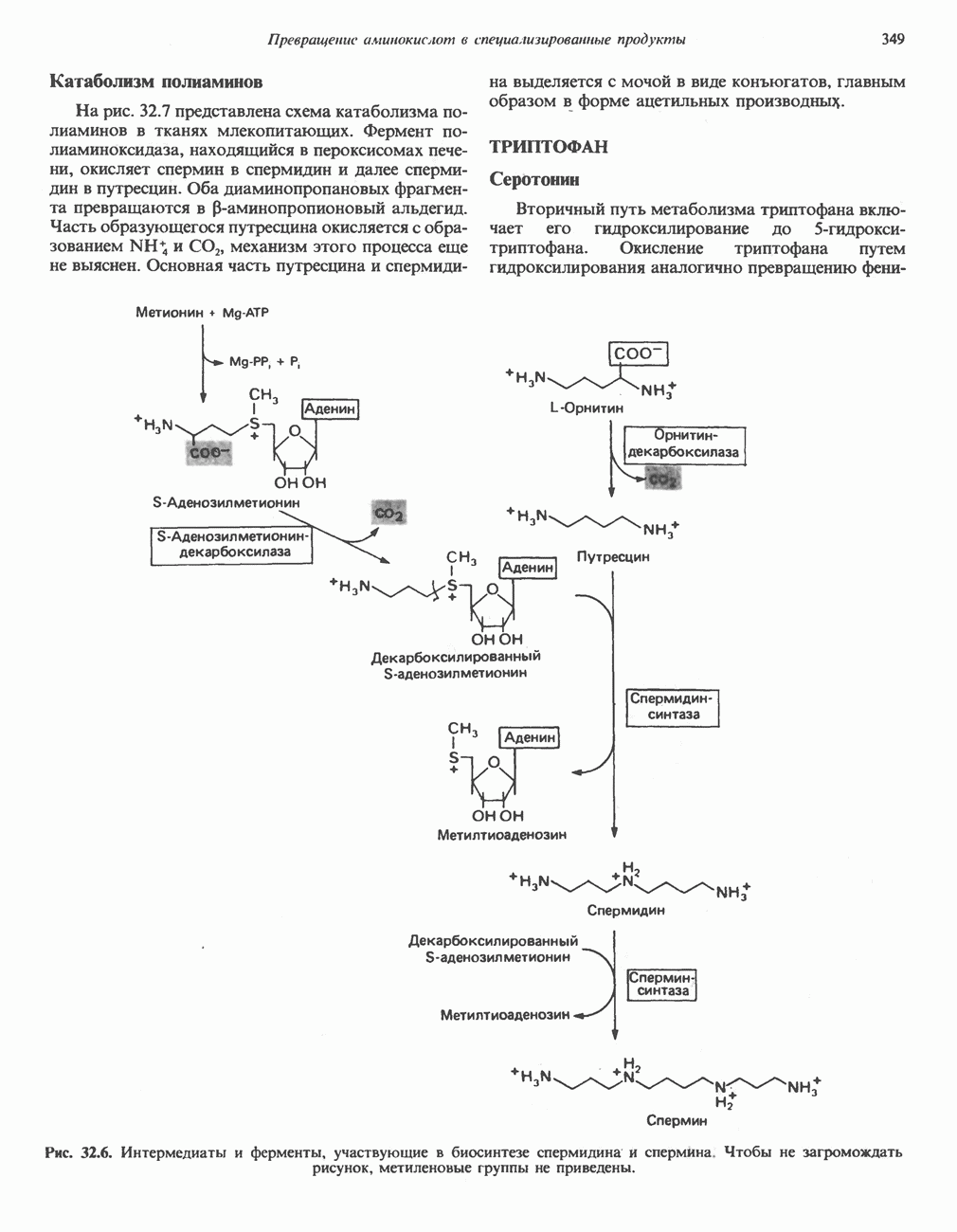
Синтез глицина в тканях млекопитающих осуществляется несколькими путями. В цитозоле печени содержится глицинтрансаминаза, катализирующая синтез глицина из глиоксилата и глутамата (или аланина). В отличие от большинства реакций переаминирования равновесие этой реакций сильно смещено в направлении синтеза глицина. Два важных дополнительных пути, функционирующие у млекопитающих, используют для образования глицина холин (рис. 29.6) и серин; в последнем случае катализ осуществляется серингидроксиметилтрансферазой (рис. 29.7).
Пролин
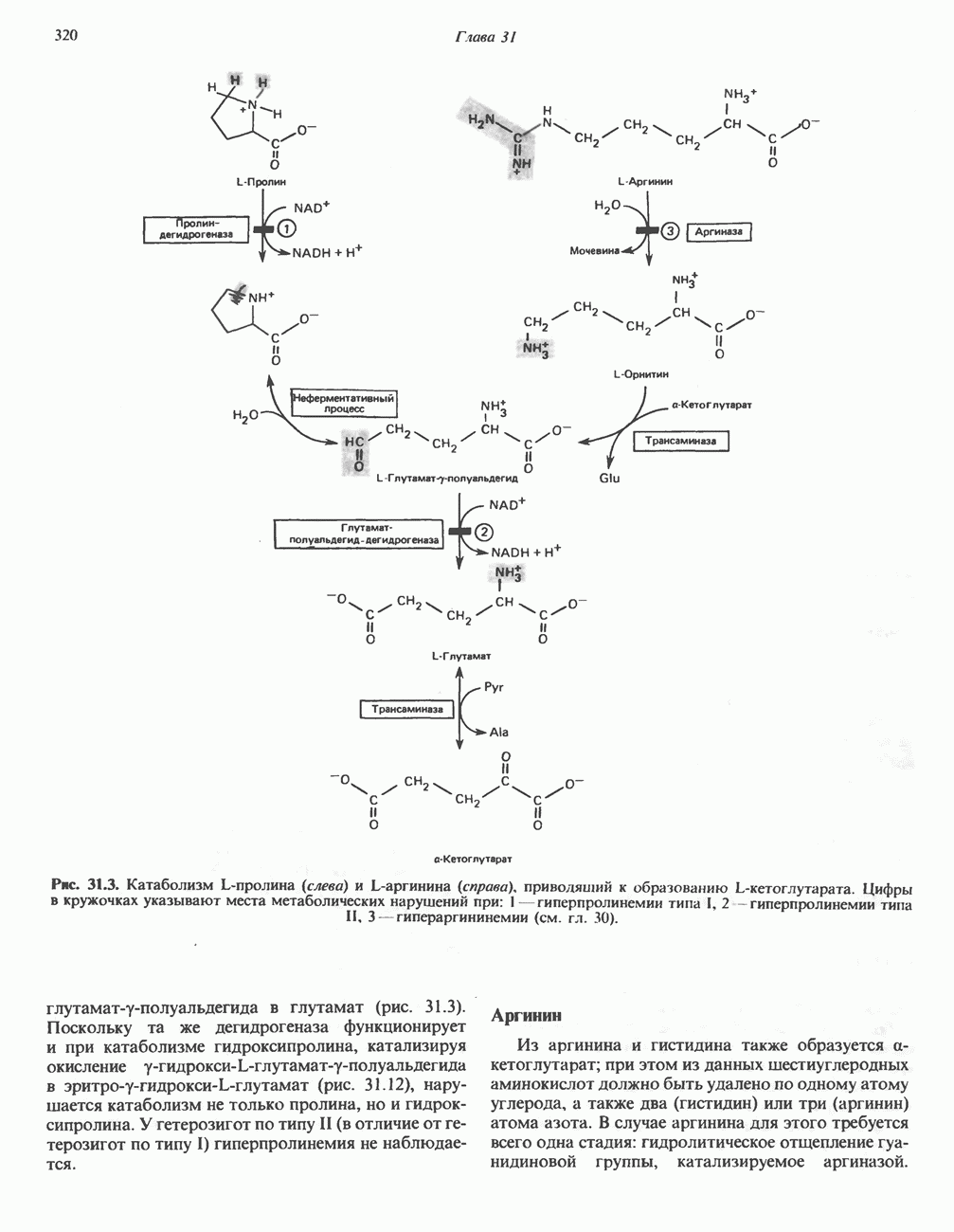
У млекопитающих и некоторых других организмов пролин образуется из глутамата путем обращения реакций катаболизма пролина (рис. 29.8).
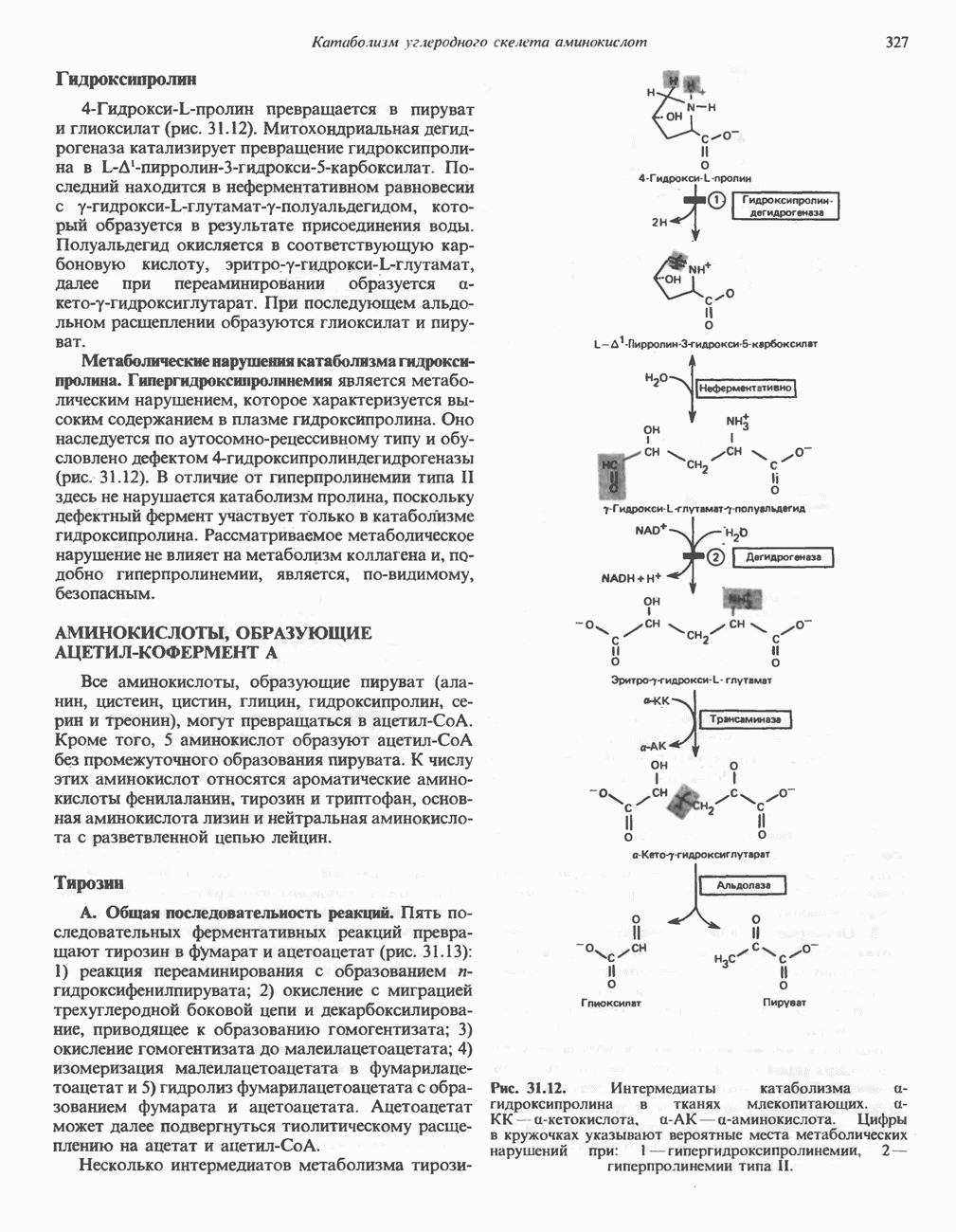
Гидроксипролин
Поскольку пролин служит предшественником гидроксипролина, то обе аминокислоты рассматривают как принадлежащие к глутаматному семейству аминокислот. Хотя в тканях млекопитающих встречаются как 3-, так и 4-гидроксипролин, в последующем изложении - речь будет идти исключительно о 

Рис. 29.4. Реакция, катализируемая аспарагинсинтетазой. Обратите внимание на сходство и различия с реакцией, катализируемой глутаминсинтетазой (рис. 29.2). Природа донора аминогруппы  может различаться у разных организмов.
может различаться у разных организмов.

Рис. 29.5. Биосинтез серина. а-АК—а-аминокислота, а-КК—а-кетокислота.
Гидроксипролин, как и гидроксилизин, содержится в тканях практически только в составе коллагена, на долю которого приходится большая часть белка в организме млекопитающих. В коллагене одна треть аминокислотных остатков приходится на глицин и еще одна треть на пролин и гидроксипролин. Гидроксипролин, представленный в коллагене весьма большим числом остатков, стабилизирует тройную спираль коллагена по отношению к действию протеаз. В отличие от гидроксилизина, гидроксильная группа которого служит местом присоединения остатков галактозы и глюкозы, гидроксильные группы гидроксипролина в коллагене остаются незамещенными.
Уникальной особенностью метаболизма гидроксипролина и гидроксилизина является то обстоятельство, что эти аминокислоты, входящие в состав

Рис. 29.6. Образование глицина из холина.

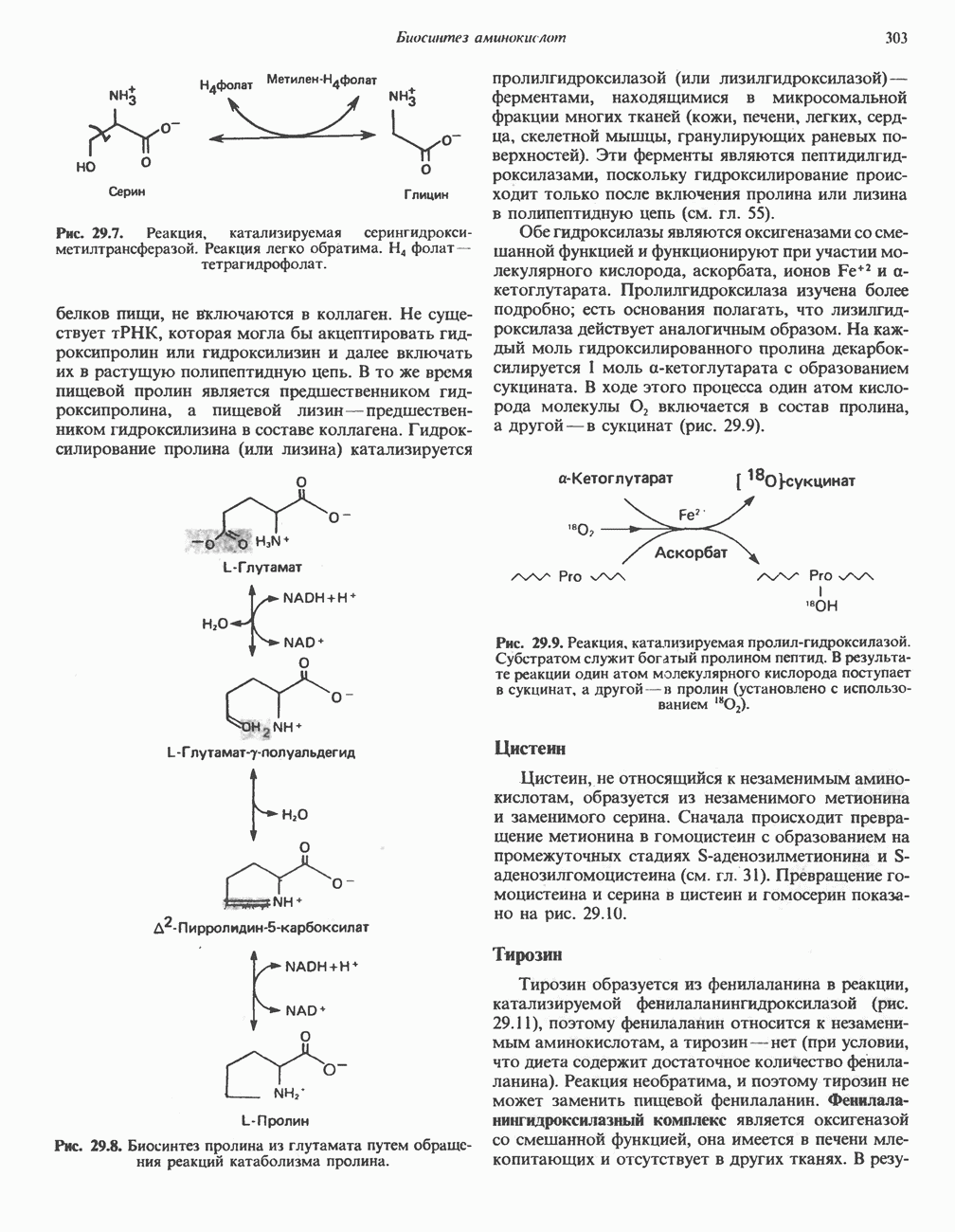
Рис. 29.7. Реакция, катализируемая серингидрокси-метилтрансферазой. Реакция легко обратима.  фолат— тетрагидрофолат.
фолат— тетрагидрофолат.
белков пищи, не включаются в коллаген. Не существует  которая могла бы акцептировать гидроксипролин или гидроксилизин и далее включать их в растущую полипептидную цепь. В то же время пищевой пролин является предшественником гидроксипролина, а пищевой лизин—предшественником гидроксилизина в составе коллагена.
которая могла бы акцептировать гидроксипролин или гидроксилизин и далее включать их в растущую полипептидную цепь. В то же время пищевой пролин является предшественником гидроксипролина, а пищевой лизин—предшественником гидроксилизина в составе коллагена.

Рис. 29.8. Биосинтез пролина из глутамата путем обращения реакций катаболизма пролина.
Гидроксилирование пролина (или лизина) катализируется пролилгидроксилазой (или лизилгидроксилазой) - ферментами, находящимися в микросомальной фракции многих тканей (кожи, печени, легких, сердца, скелетной мышцы, гранулирующих раневых поверхностей). Эти ферменты являются пептидилгид-роксилазами, поскольку гидроксилирование происходит только после включения пролина или лизина в полипептидную цепь (см. гл. 55).
Обе гидроксилазы являются оксигеназами со смешанной функцией и функционируют при участии молекулярного кислорода, аскорбата, ионов  и а-кетоглутарата. Пролилгидроксилаза изучена более подробно; есть основания полагать, что лизилгидроксилаза действует аналогичным образом. На каждый моль гидроксилированного пролина декарбоксилируется I моль а-кетоглутарата с образованием сукцината. В ходе этого процесса один атом кислорода молекулы
и а-кетоглутарата. Пролилгидроксилаза изучена более подробно; есть основания полагать, что лизилгидроксилаза действует аналогичным образом. На каждый моль гидроксилированного пролина декарбоксилируется I моль а-кетоглутарата с образованием сукцината. В ходе этого процесса один атом кислорода молекулы  включается в состав пролина, а другой — в сукцинат (рис. 29.9).
включается в состав пролина, а другой — в сукцинат (рис. 29.9).

Рис. 29.9. Реакция, катализируемая пролилгидроксилазой. Субстратом служит богатый пролином пептид. В результате реакции один атом молекулярного кислорода поступает в сукцинат, а другой — в пролин (установлено с использованием  ).
).
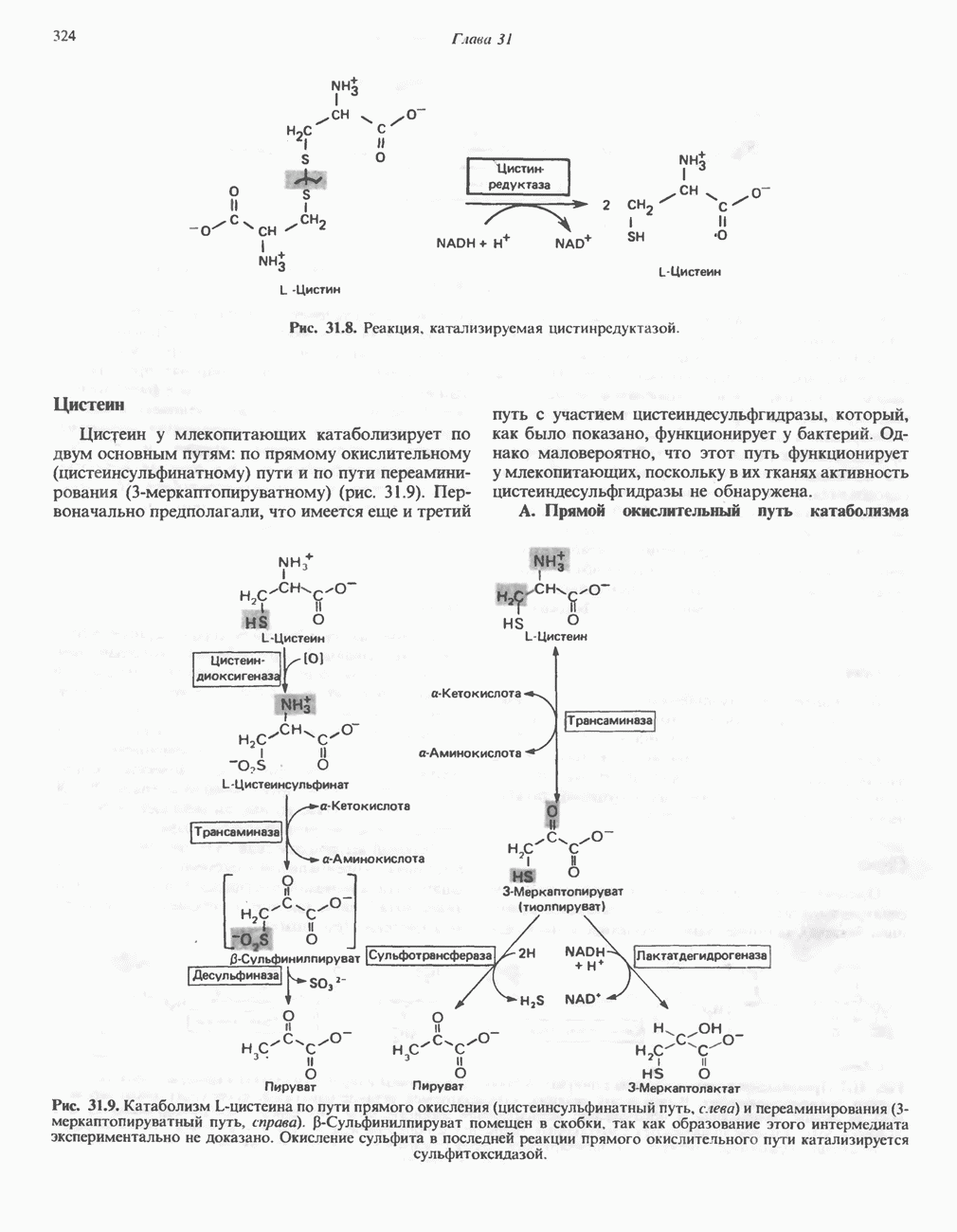
Цистеин
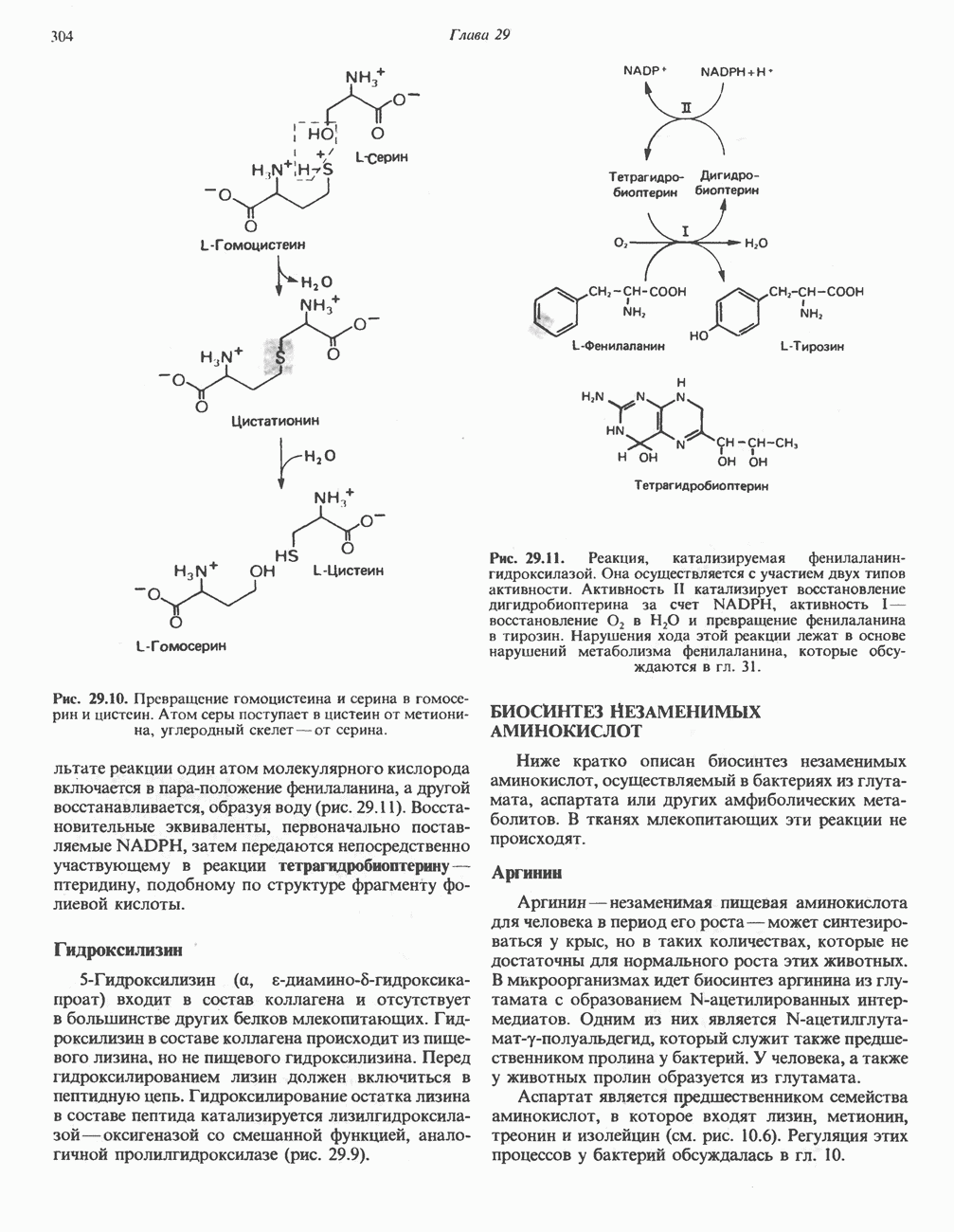
Цистеин, не относящийся к незаменимым аминокислотам, образуется из незаменимого метионина и заменимого серина. Сначала происходит превращение метионина в гомоцистеин с образованием на промежуточных стадиях  -аденозилметионина и
-аденозилметионина и  -аденозилгомоцистеина (см. гл. 31). Превращение гомоцистеина и серина в цистеин и гомосерин показано на рис. 29.10.
-аденозилгомоцистеина (см. гл. 31). Превращение гомоцистеина и серина в цистеин и гомосерин показано на рис. 29.10.
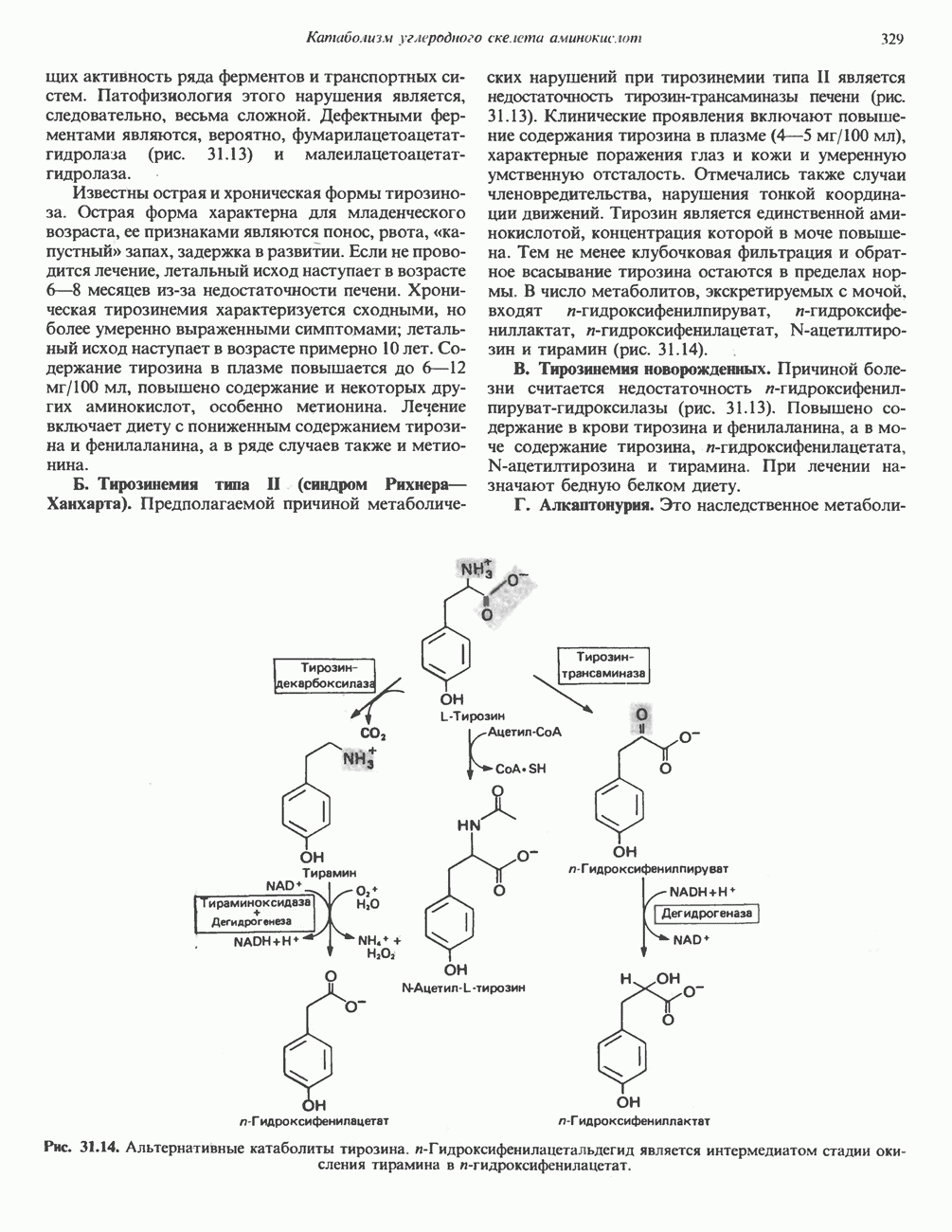
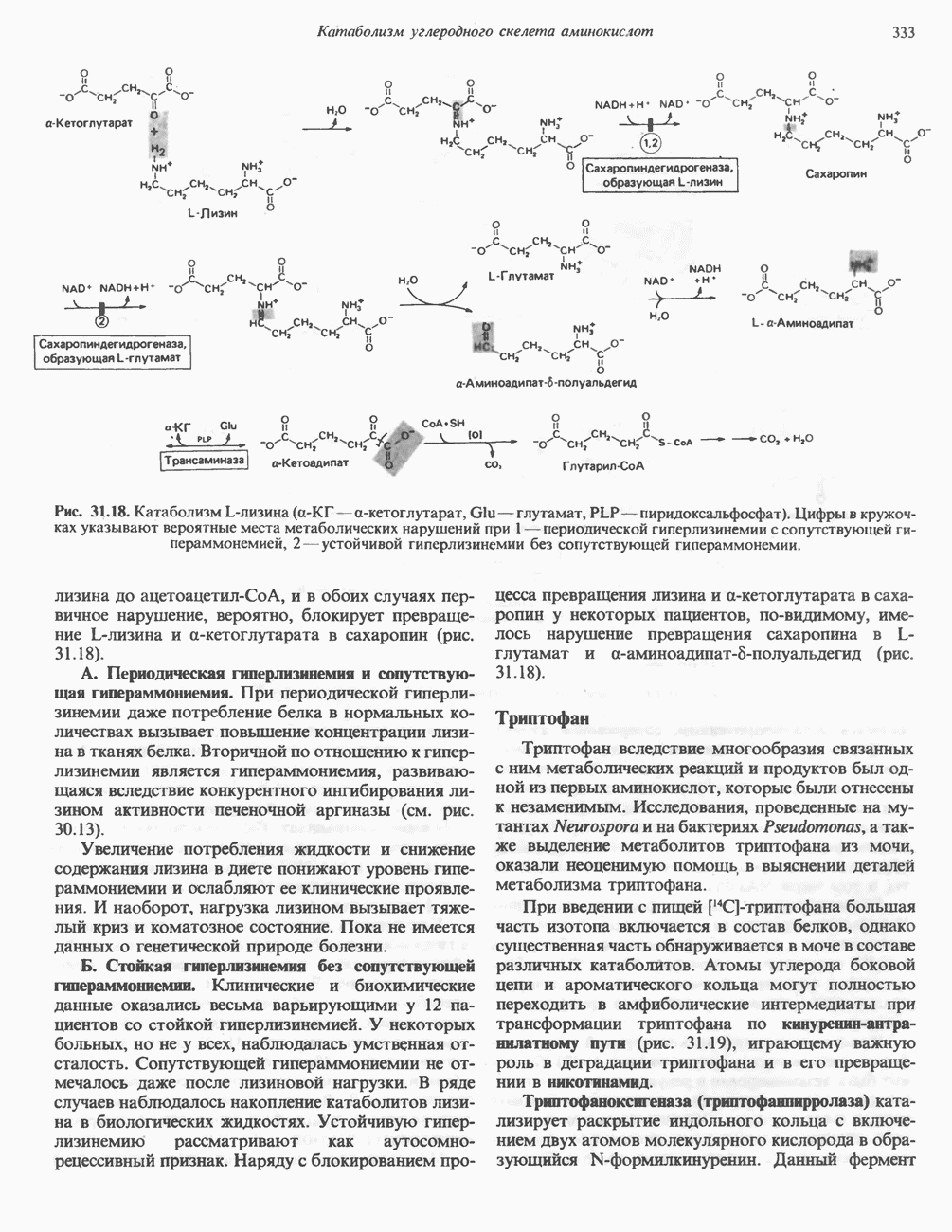
Тирозин
Тирозин образуется из фенилаланина в реакции, катализируемой фенилаланингидроксилазой (рис. 29.11), поэтому фенилаланин относится к незаменимым аминокислотам, а тирозиннет (при условии, что диета содержит достаточное количество фенилаланина). Реакция необратима, и поэтому тирозин не может заменить пищевой фенилаланин. Фенилала-нингидрокснлазный комплекс является оксигеназой со смешанной функцией, она имеется в печени млекопитающих и отсутствует в других тканях. В результате

Рис. 29.10. Превращение гомоцистеина и серина в гомосе-рин и цистеин. Атом серы поступает в цистеин от метионина, углеродный скелет — от серина.
реакции один атом молекулярного кислорода включается в пара-положение фенилаланина, а другой восстанавливается, образуя воду (рис. 29.11). Восстановительные эквиваленты, первоначально поставляемые NADPH, затем передаются непосредственно участвующему в реакции тетрагидробиоптерину—птеридину, подобному по структуре фрагменту фолиевой кислоты.
Гидроксилизин
5-Гидроксилизин (а, е-диамино-8-гидроксикапроат) входит в состав коллагена и отсутствует в большинстве других белков млекопитающих. Г идроксилизин в составе коллагена происходит из пищевого лизина, но не пищевого гидроксилизина. Перед гидроксилированием лизин должен включиться в пептидную цепь. Гидроксилирование остатка лизина в составе пептида катализируется лизилгидроксила-зой—оксигеназой со смешанной функцией, аналогичной пролилгидроксилазе (рис. 29.9).

Рис. 29.11. Реакция, катализируемая фенилаланин-гидроксил азой. Она осуществляется с участием двух типов активности. Активность II катализирует восстановление дигидробиоптерина за счет NADPH, активность I— восстановление  в
в  и превращение фенилаланина в тирозин. Нарушения хода этой реакции лежат в основе нарушений метаболизма фенилаланина, которые обсуждаются в гл. 31.
и превращение фенилаланина в тирозин. Нарушения хода этой реакции лежат в основе нарушений метаболизма фенилаланина, которые обсуждаются в гл. 31.
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие к русскому изданию
- Предисловие
- Глава 1. Биохимия и медицина
- Глава 2. Биомолекулы и биохимические методы
- КЛЕТКА
- ОБЩИЙ ЭКСПЕРИМЕНТАЛЬНЫЙ ПОДХОД, ИСПОЛЬЗУЕМЫЙ В БИОХИМИИ
- ОСНОВНЫЕ ДОСТИЖЕНИЯ БИОХИМИИ
- Раздел I. Структура и функции белков и ферментов
- Глава 3. Аминокислоты
- АМИНОКИСЛОТЫ
- ИОННЫЕ ФОРМЫ АМИНОКИСЛОТ
- СТРУКТУРА АМИНОКИСЛОТ
- РАСТВОРИМОСТЬ АМИНОКИСЛОТ
- ОБЩИЕ ХИМИЧЕСКИЕ РЕАКЦИИ
- СВОЙСТВА ИНДИВИДУАЛЬНЫХ АМИНОКИСЛОТ
- МЕТОДЫ РАЗДЕЛЕНИЯ АМИНОКИСЛОТ
- Глава 4. Пептиды
- СТРУКТУРА ПЕПТИДОВ
- ИОННЫЕ ФОРМЫ ПЕПТИДОВ
- КОНФОРМАЦИЯ ПЕПТИДОВ В РАСТВОРЕ
- МЕТОДЫ РАЗДЕЛЕНИЯ ПЕПТИДОВ
- ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОГО СОСТАВА ПЕПТИДОВ
- ОПРЕДЕЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ ПОЛИПЕПТИДОВ
- АВТОМАТИЧЕСКОЕ ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ПОЛИПЕПТИДОВ МЕТОДОМ ЭДМАНА
- АВТОМАТИЧЕСКИЙ СИНТЕЗ ПЕПТИДОВ
- ЛИТЕРАТУРА
- Глава 5. Белки: структура и свойства
- КЛАССИФИКАЦИЯ БЕЛКОВ
- СВЯЗИ, ОТВЕТСТВЕННЫЕ ЗА ФОРМИРОВАНИЕ СТРУКТУРЫ БЕЛКА
- УПОРЯДОЧЕННЫЕ КОНФОРМАЦИИ ПОЛИПЕПТИДОВ
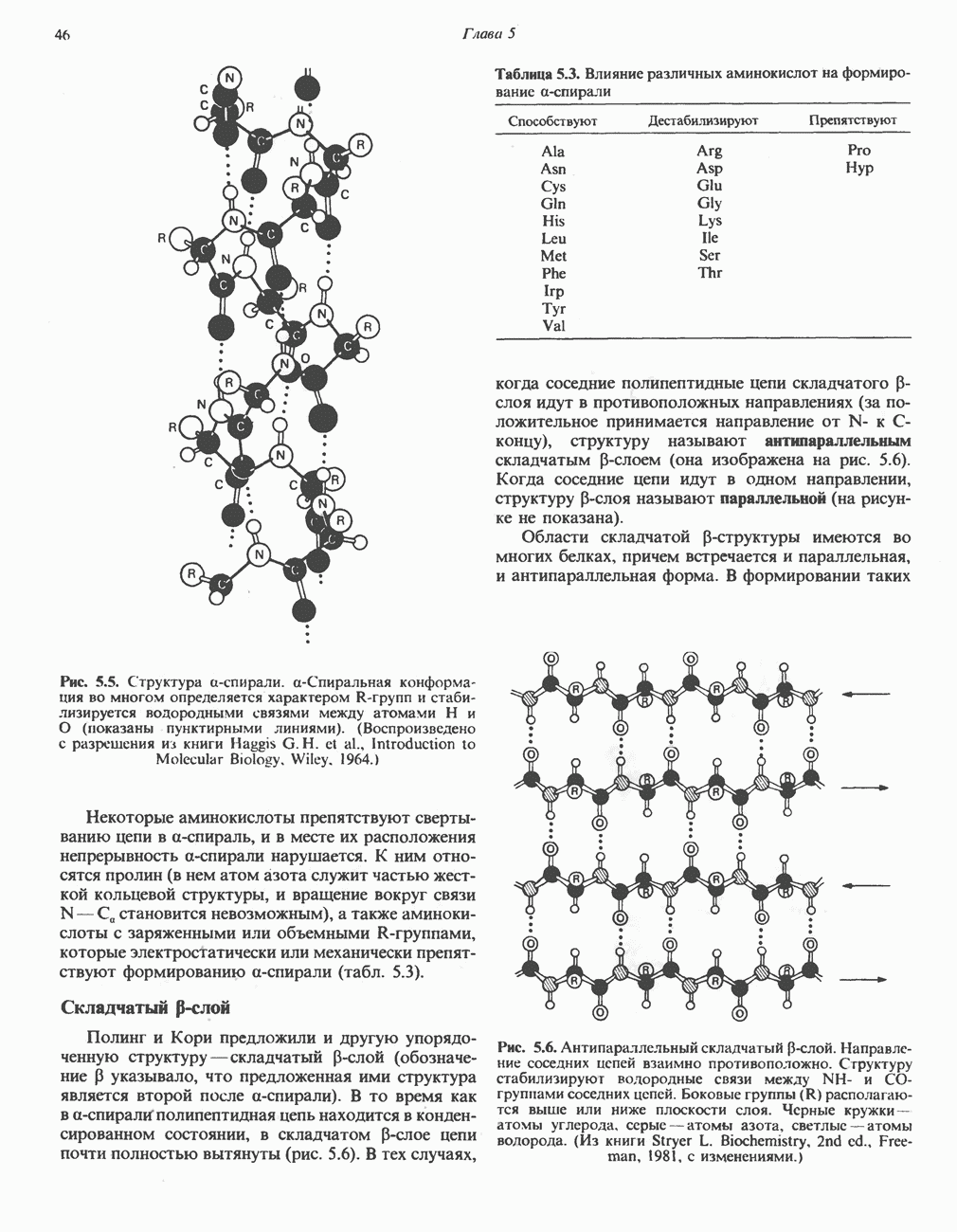
- УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКА
- ДЕНАТУРАЦИЯ
- МЕТОДЫ ОПРЕДЕЛЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ
- ОПРЕДЕЛЕНИЕ ВТОРИЧНОЙ И ТРЕТИЧНОЙ СТРУКТУРЫ МЕТОДОМ РЕНТГЕНОВСКОЙ КРИСТАЛЛОГРАФИИ
- ОПРЕДЕЛЕНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ
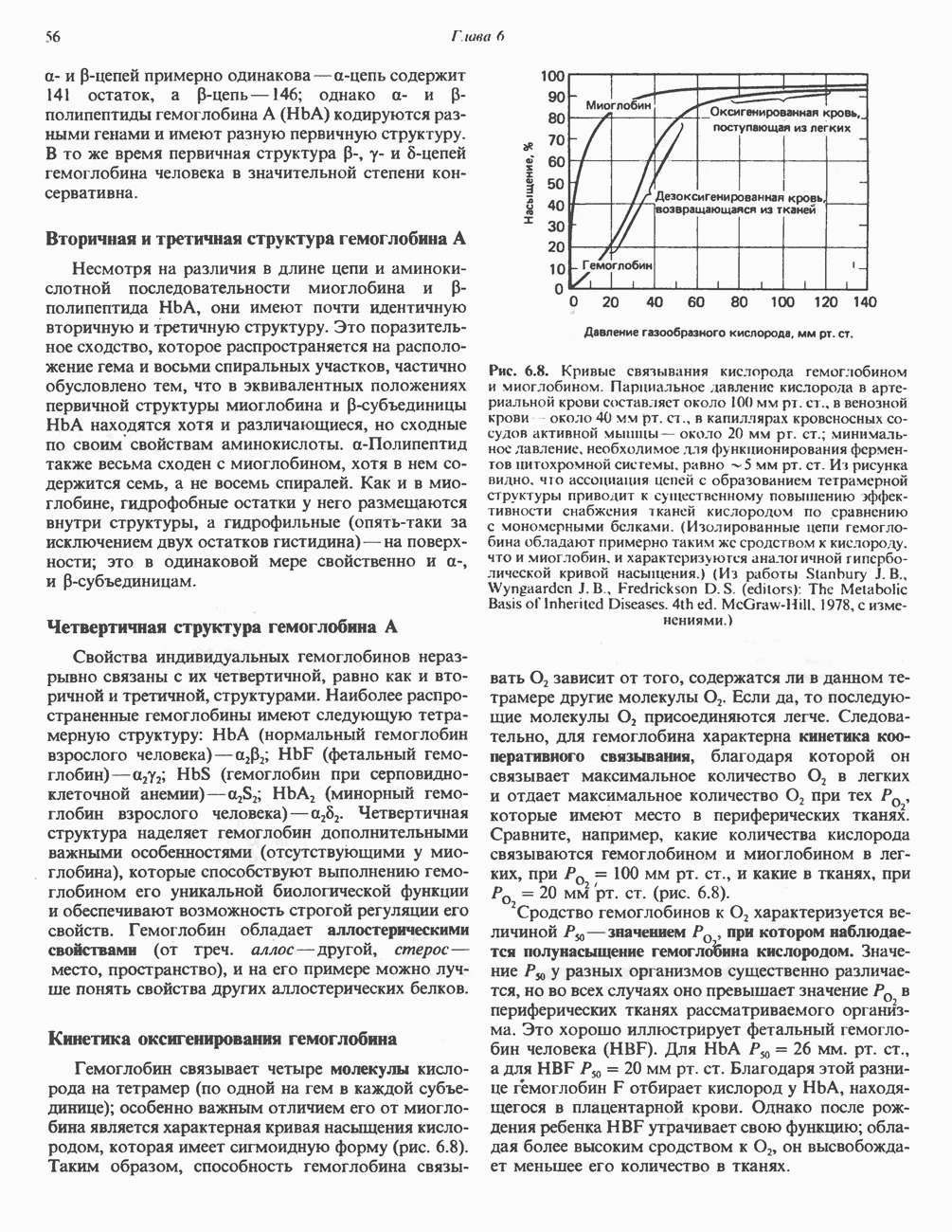
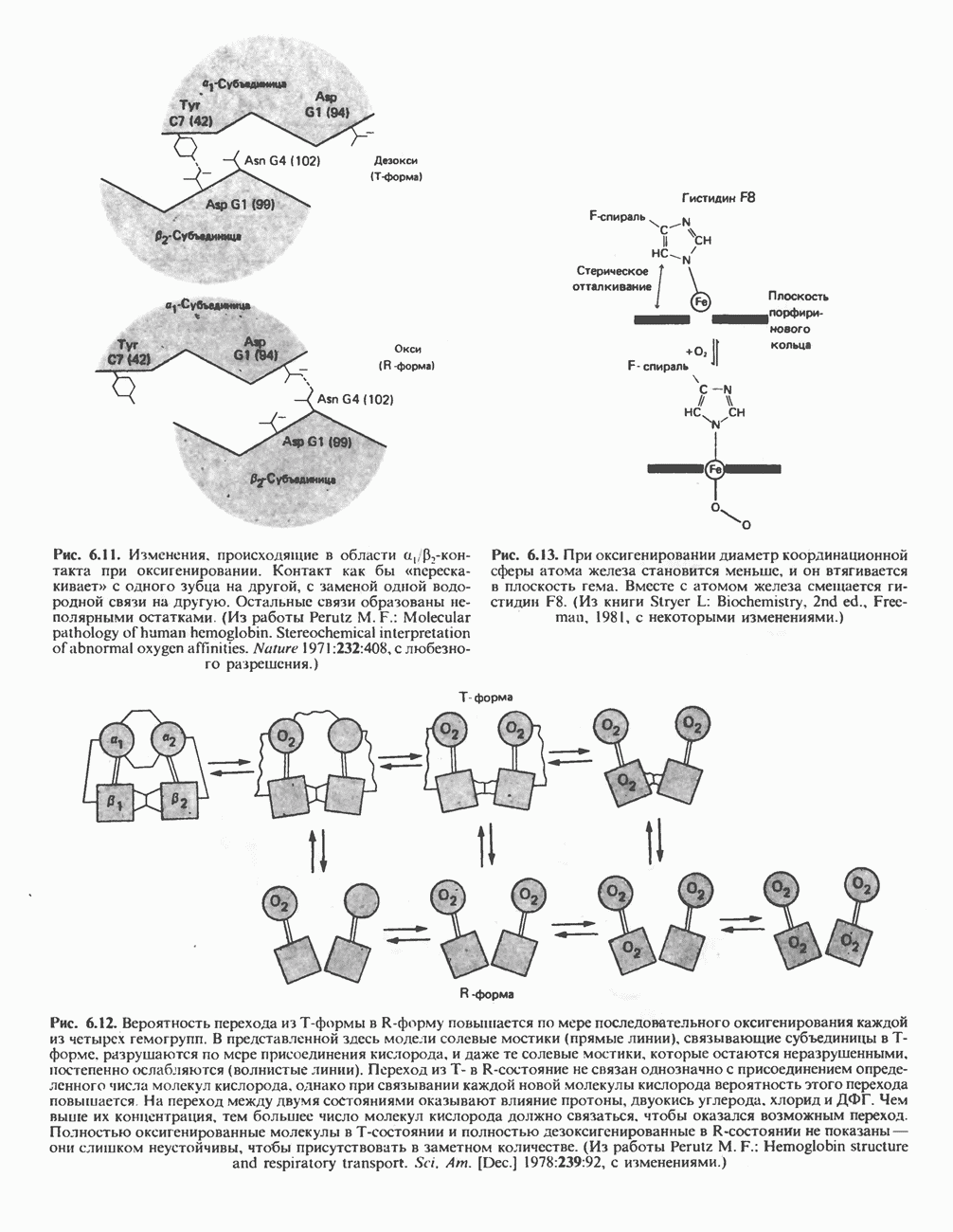
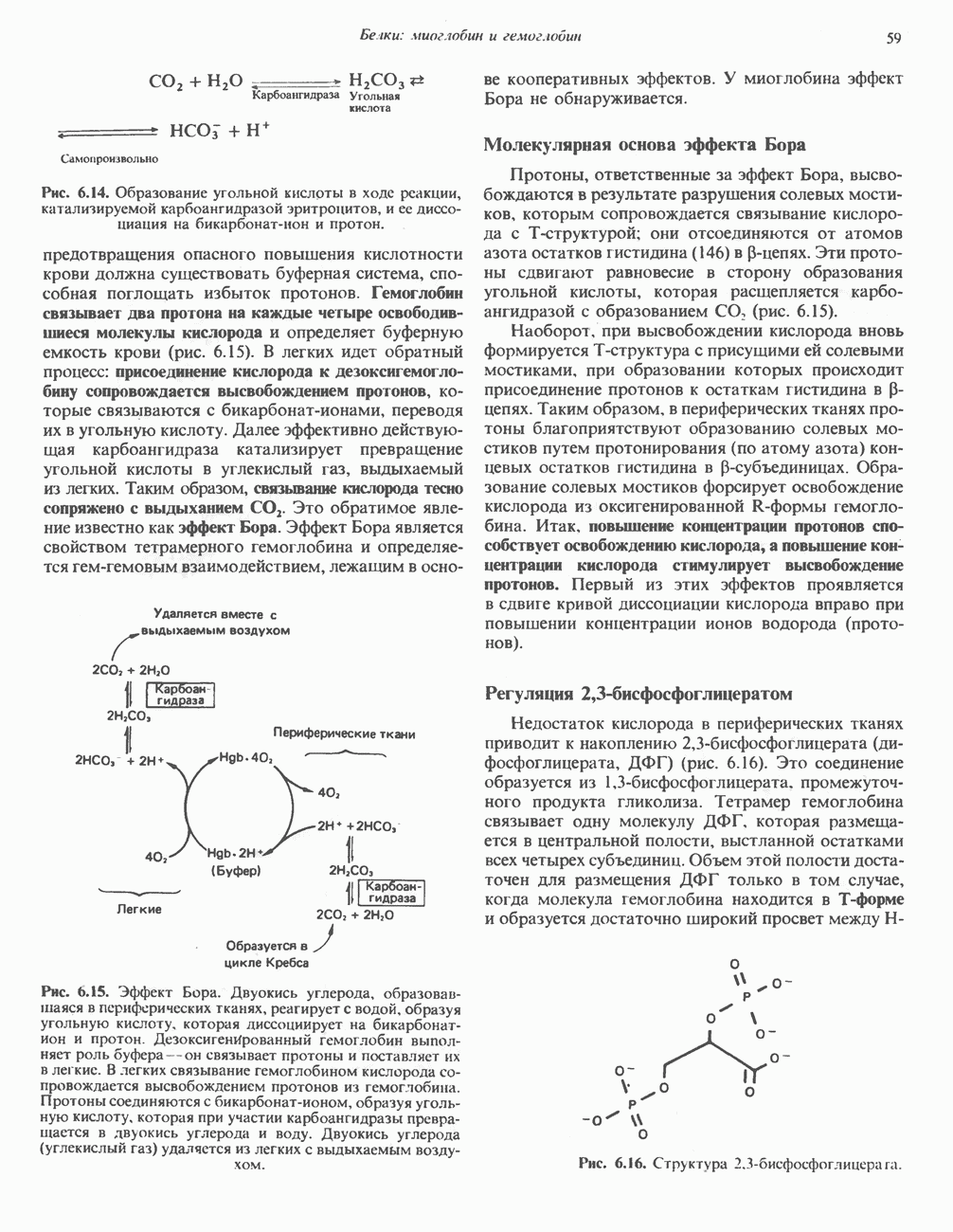
- ГЛАВА 6. Белки: миоглобин и гемоглобин
- ГЕМОПРОТЕИНЫ — МИОГЛОБИН И ГЕМОГЛОБИН
- МИОГЛОБИН
- ГЕМОГЛОБИНЫ
- Глава 7. Ферменты: общие свойства
- КОФЕРМЕНТЫ
- «ТРЕХТОЧЕЧНАЯ ФИКСАЦИЯ» СУБСТРАТОВ НА ФЕРМЕНТАХ
- СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
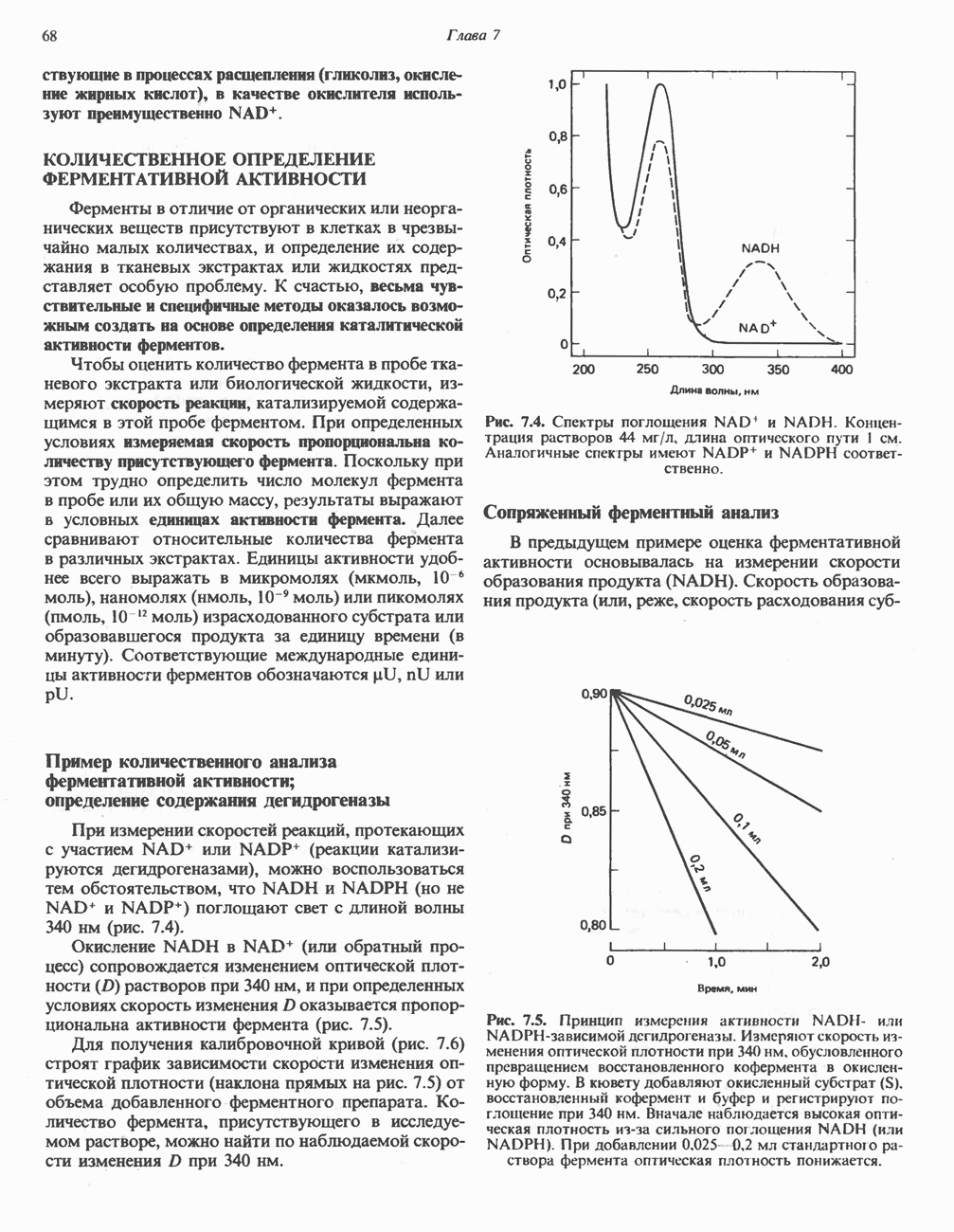
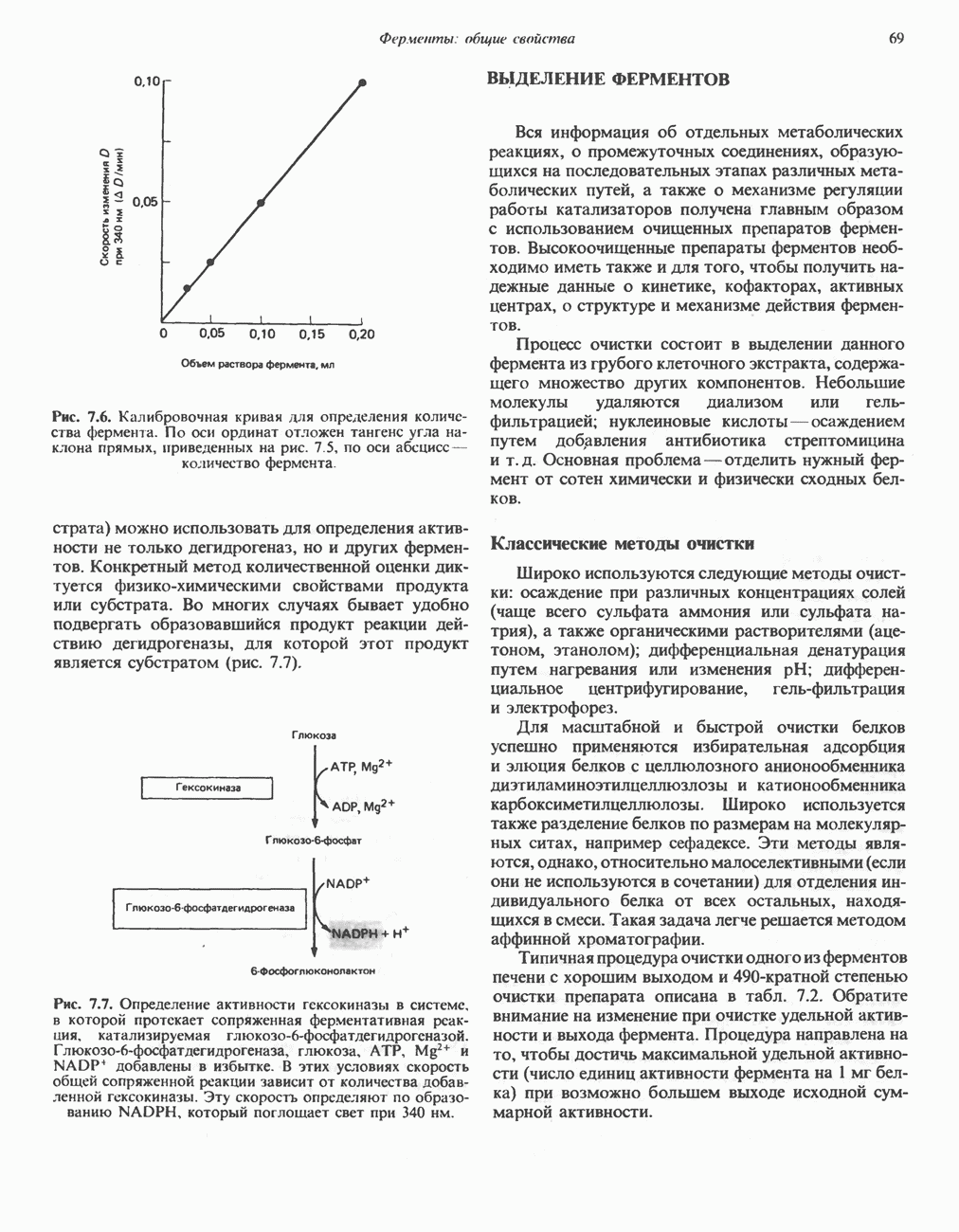
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
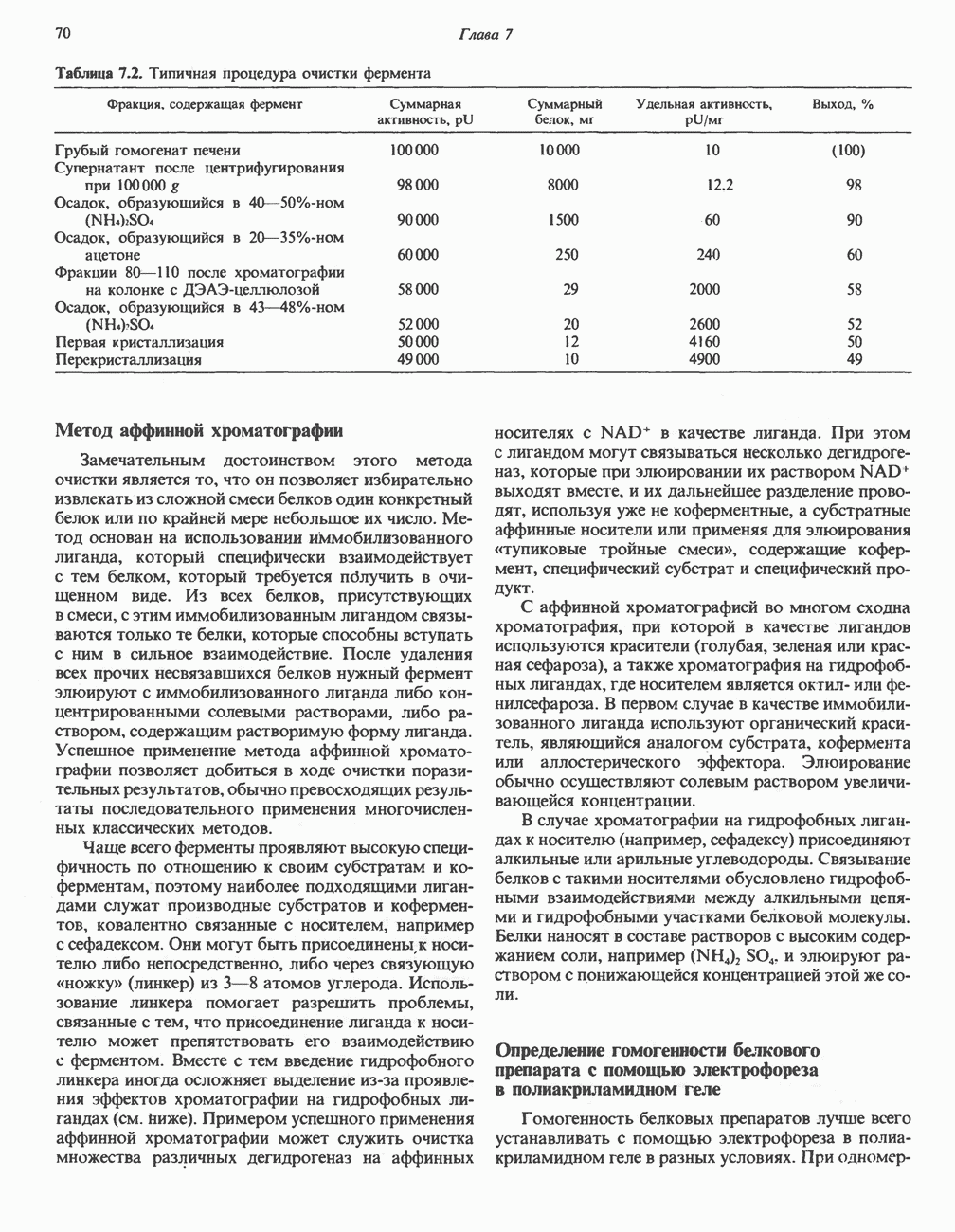
- ВЫДЕЛЕНИЕ ФЕРМЕНТОВ
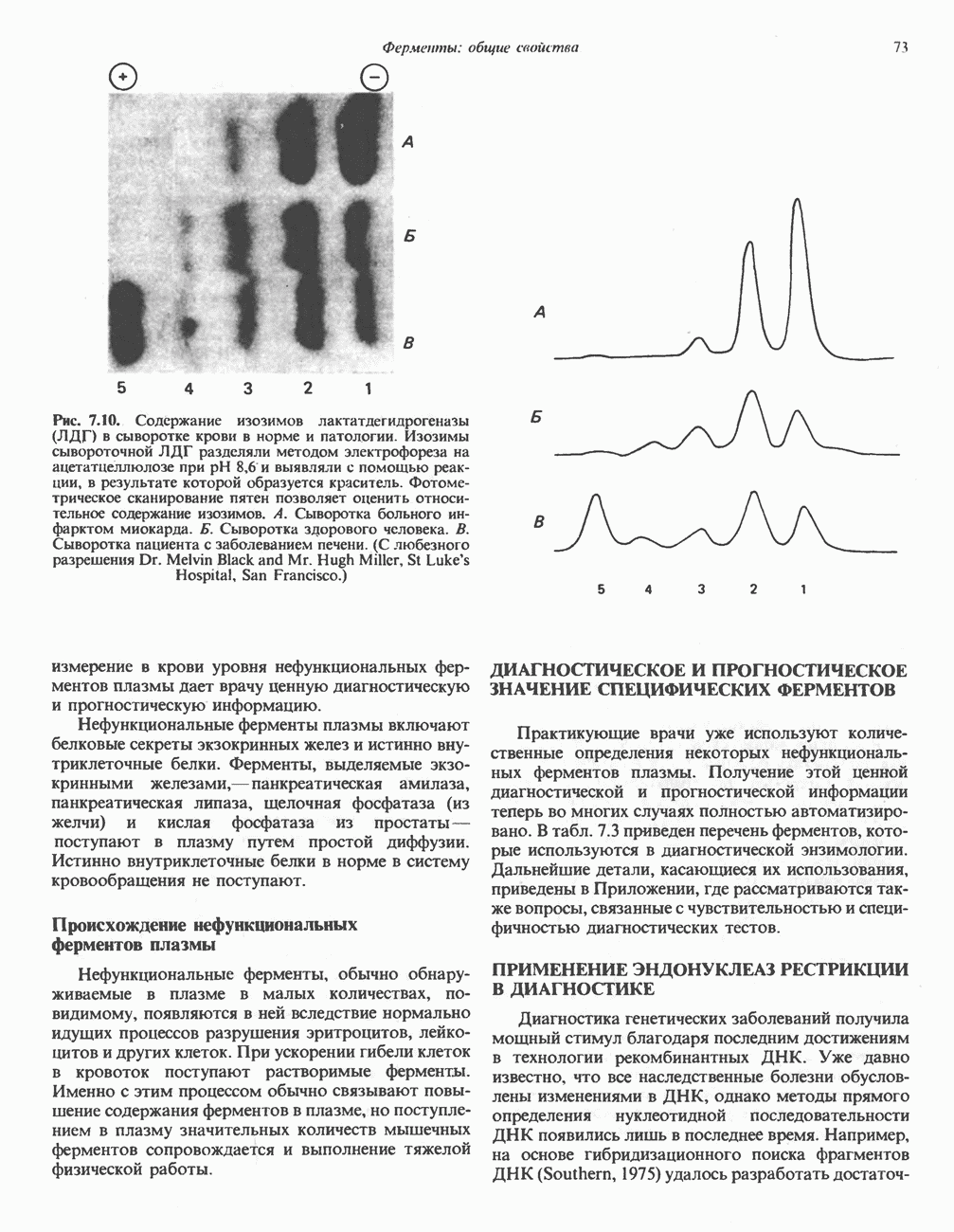
- ИЗОФЕРМЕНТЫ (ИЗОЗИМЫ)
- ФЕРМЕНТЫ В КЛИНИЧЕСКОЙ ДИАГНОСТИКЕ
- ДИАГНОСТИЧЕСКОЕ И ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ СПЕЦИФИЧЕСКИХ ФЕРМЕНТОВ
- ПРИМЕНЕНИЕ ЭНДОНУКЛЕАЗ РЕСТРИКЦИИ В ДИАГНОСТИКЕ
- ЛИТЕРАТУРА
- Глава 8. ФЕРМЕНТЫ: КИНЕТИКА
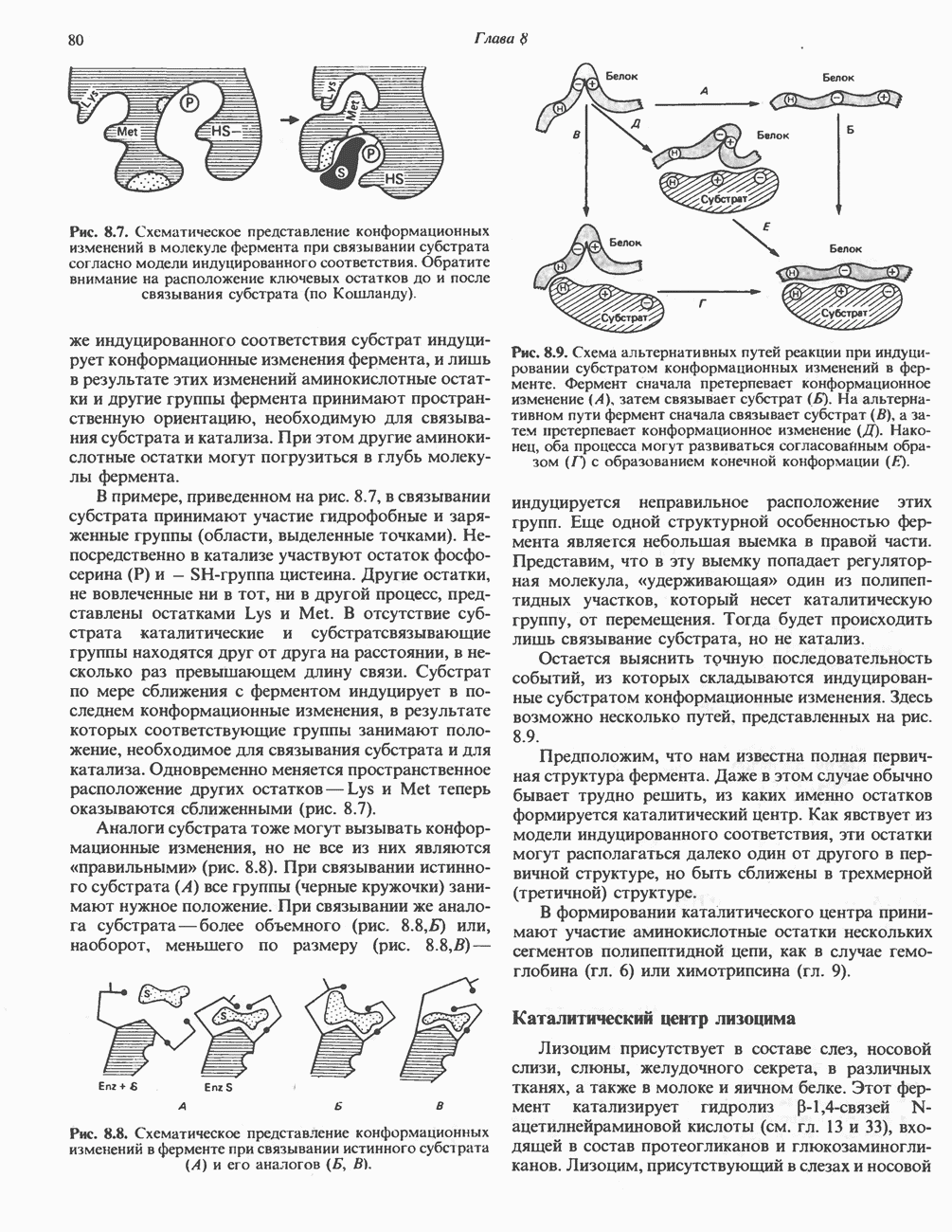
- ОБРАЗОВАНИЕ И РАСПАД ПЕРЕХОДНЫХ СОСТОЯНИЙ
- ИЗМЕНЕНИЯ СВОБОДНОЙ ЭНЕРГИИ, СВЯЗАННЫЕ С ОБРАЗОВАНИЕМ И РАСПАДОМ ПЕРЕХОДНЫХ СОСТОЯНИЙ
- РОЛЬ КАТАЛИЗАТОРОВ В ОБРАЗОВАНИИ ПРОДУКТИВНЫХ ПЕРЕХОДНЫХ СОСТОЯНИЙ
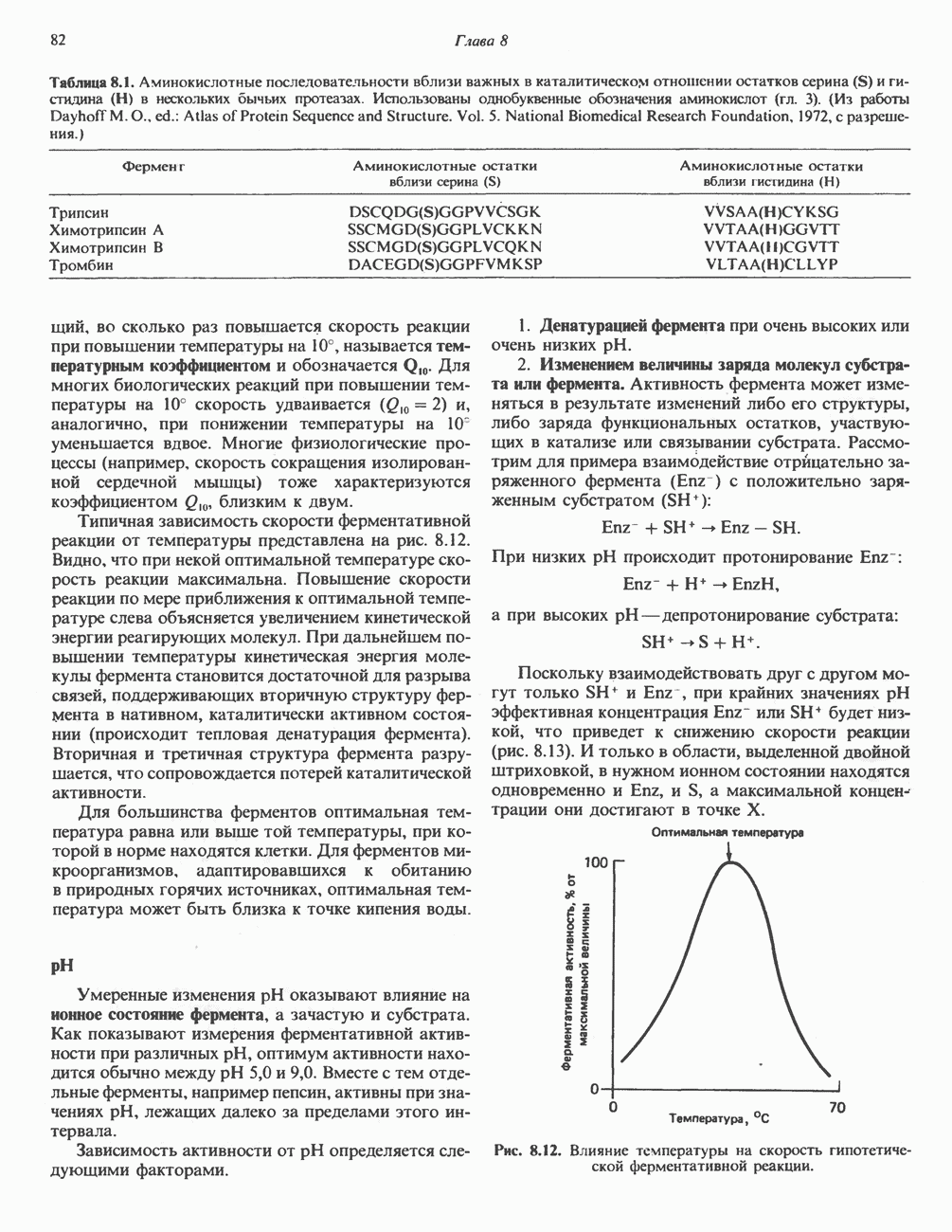
- ТЕОРИЯ СТОЛКНОВЕНИЙ
- РОЛЬ ФЕРМЕНТОВ В РАЗРЫВЕ И ОБРАЗОВАНИИ КОВАЛЕНТНЫХ СВЯЗЕЙ
- КАТАЛИТИЧЕСКИЙ ЦЕНТР
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА АКТИВНОСТЬ ФЕРМЕНТОВ
- КОНСТАНТА РАВНОВЕСИЯ
- КОНЦЕНТРАЦИЯ ФЕРМЕНТА
- КОНЦЕНТРАЦИЯ СУБСТРАТА
- УРАВНЕНИЕ МИХАЭЛИСА—МЕНТЕН
- ОГРАНИЧЕНИЯ, ПРИСУЩИЕ УРАВНЕНИЮ МИХАЭЛИСА — МЕНТЕН
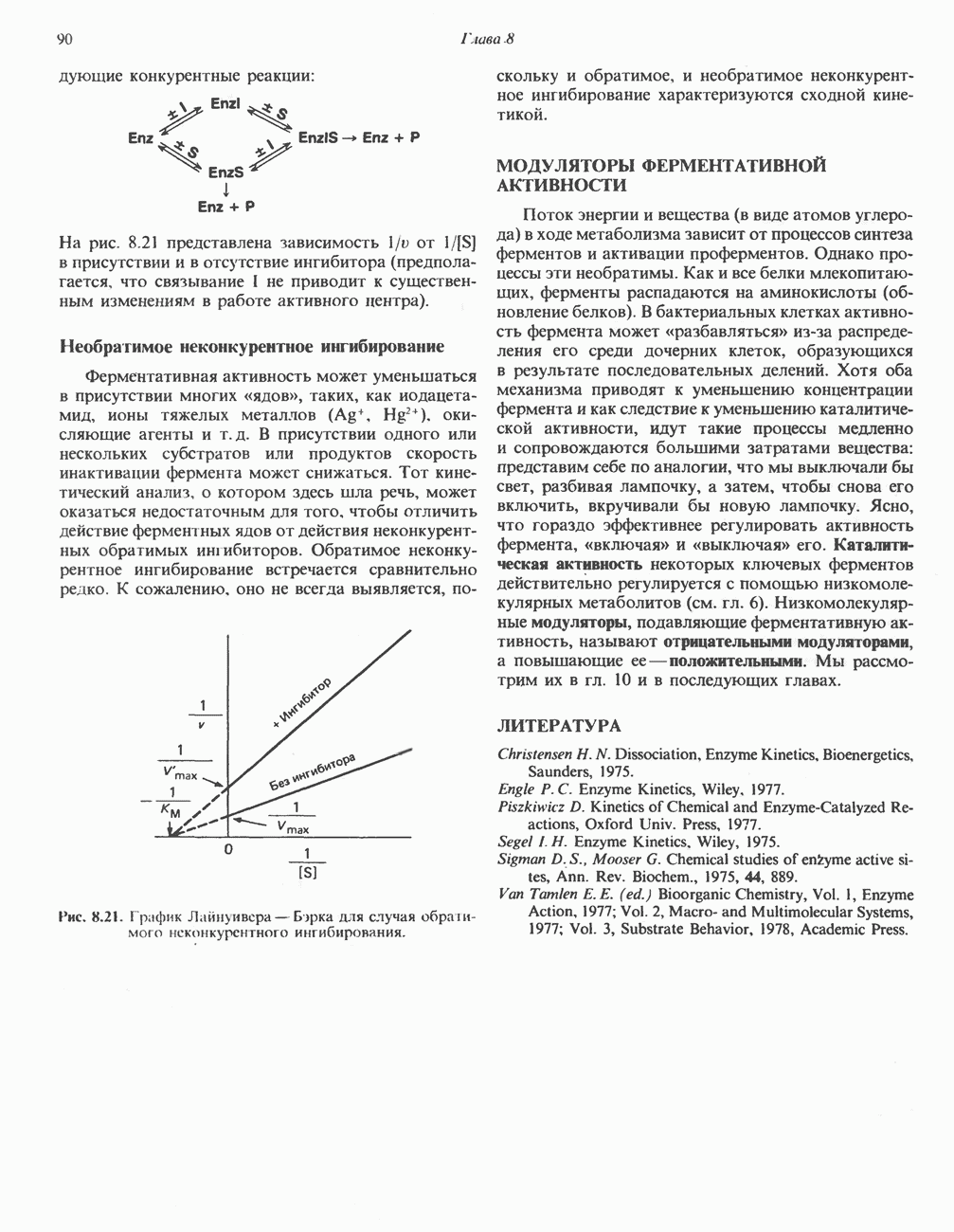
- ИНГИБИРОВАНИЕ АКТИВНОСТИ ФЕРМЕНТОВ
- МОДУЛЯТОРЫ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
- Глава 9. Ферменты: механизм действия
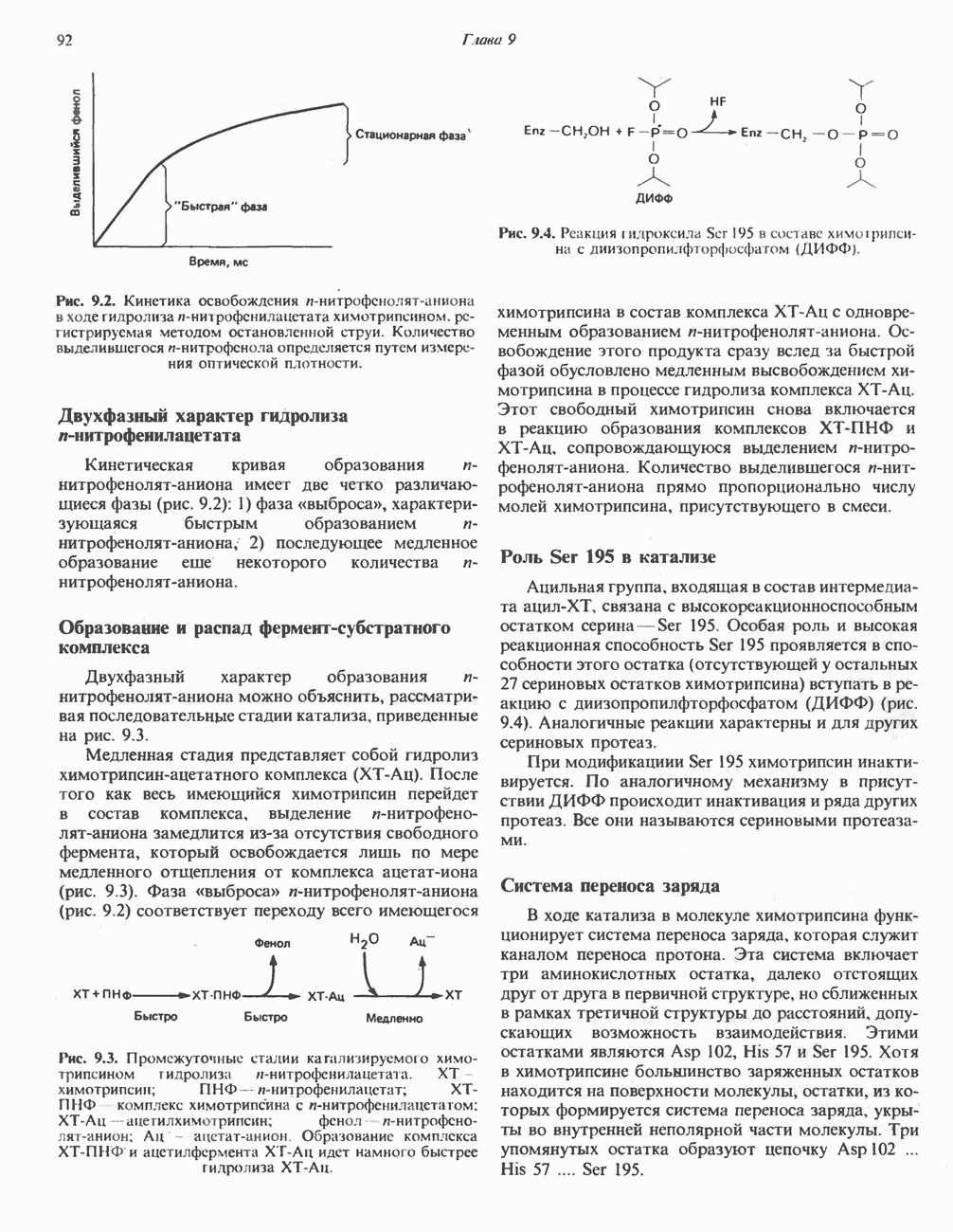
- МЕХАНИЗМ КАТАЛИТИЧЕСКОГО ДЕЙСТВИЯ ХИМОТРИПСИНА
- РОЛЬ ИЗБИРАТЕЛЬНОГО ПРОТЕОЛИЗА В ФОРМИРОВАНИИ АКТИВНЫХ ЦЕНТРОВ ФЕРМЕНТОВ
- УПОРЯДОЧЕННОЕ И НЕУПОРЯДОЧЕННОЕ СВЯЗЫВАНИЕ СУБСТРАТОВ
- ФЕРМЕНТЫ КАК КАТАЛИЗАТОРЫ ОБЩЕГО КИСЛОТНОГО И ОБЩЕГО ОСНОВНОГО ТИПА
- ИОНЫ МЕТАЛЛОВ
- Глава 10. Ферменты: регуляция активности
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА
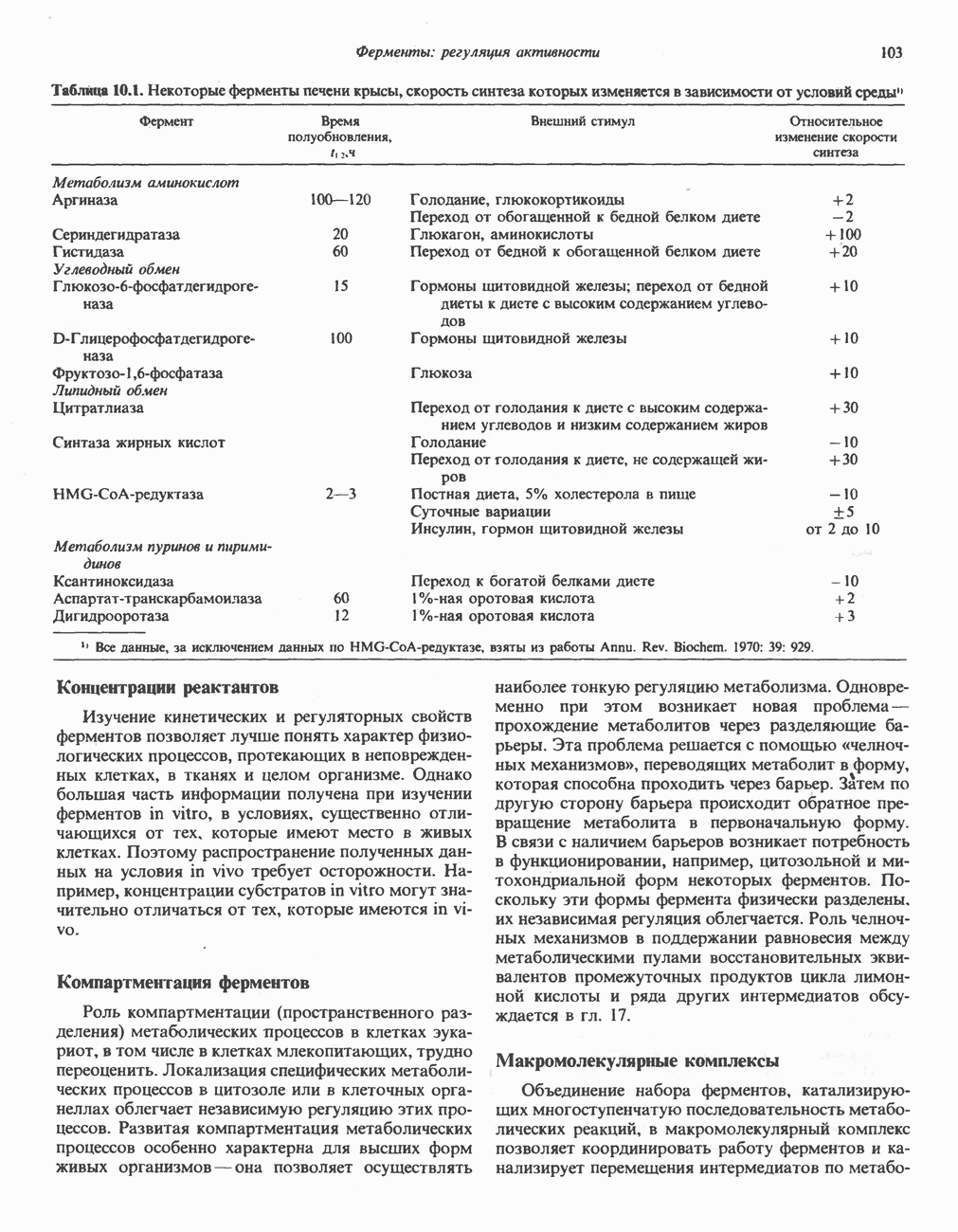
- РЕГУЛЯЦИЯ КОЛИЧЕСТВА ФЕРМЕНТА ПУТЕМ РЕГУЛЯЦИИ СКОРОСТИ ЕГО СИНТЕЗА И РАСПАДА
- РЕГУЛЯЦИЯ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ФЕРМЕНТОВ
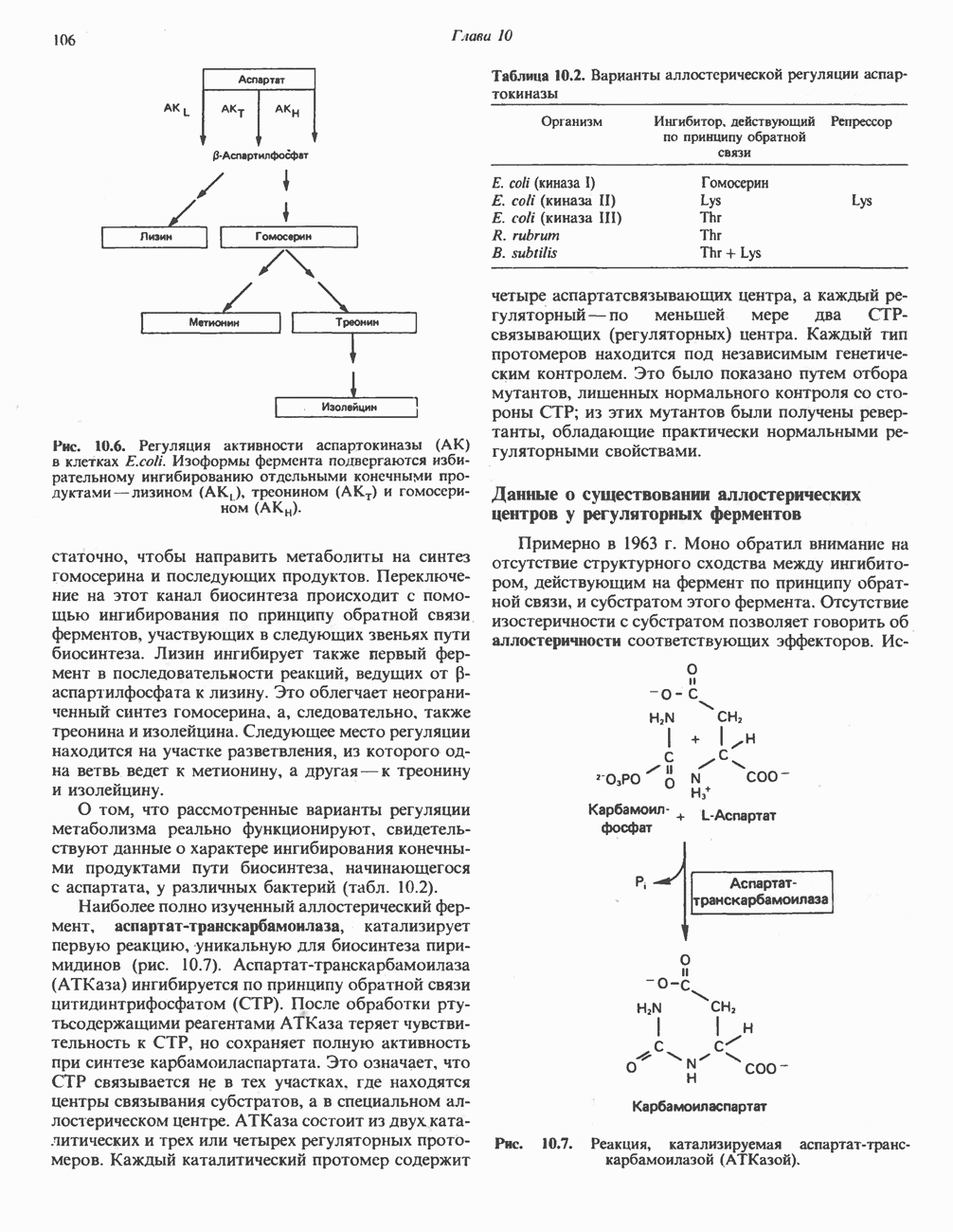
- АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ
- КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ФЕРМЕНТОВ
- Раздел II. Биоэнергетика и метаболизм углеводов и липидов
- Глава 11. Биоэнергетика
- СВОБОДНАЯ ЭНЕРГИЯ И ЗАКОНЫ ТЕРМОДИНАМИКИ
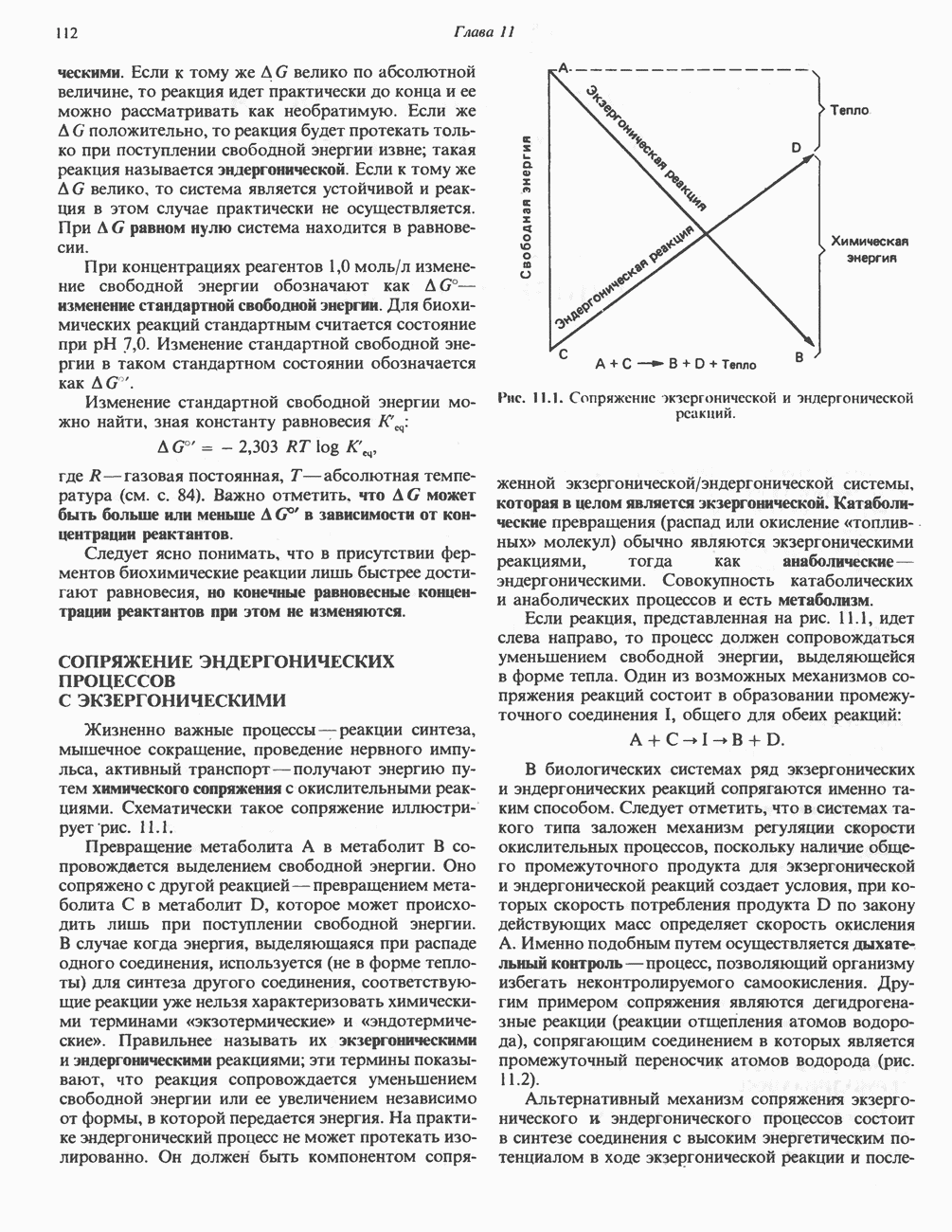
- СОПРЯЖЕНИЕ ЭНДЕРГОНИЧЕСКИХ ПРОЦЕССОВ С ЭКЗЕРГОНИЧЕСКИМИ
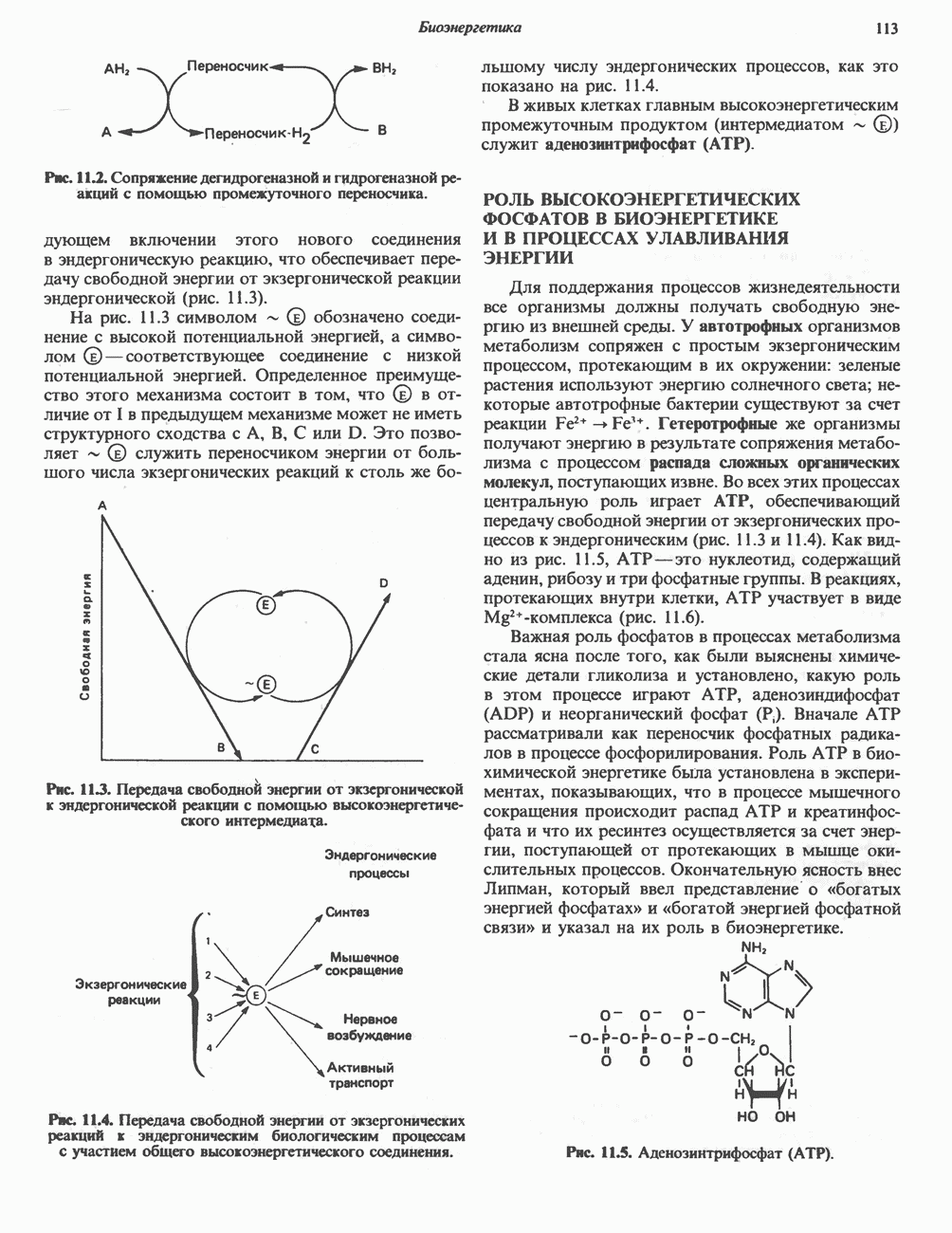
- РОЛЬ ВЫСОКОЭНЕРГЕТИЧЕСКИХ ФОСФАТОВ В БИОЭНЕРГЕТИКЕ И В ПРОЦЕССАХ УЛАВЛИВАНИЯ ЭНЕРГИИ
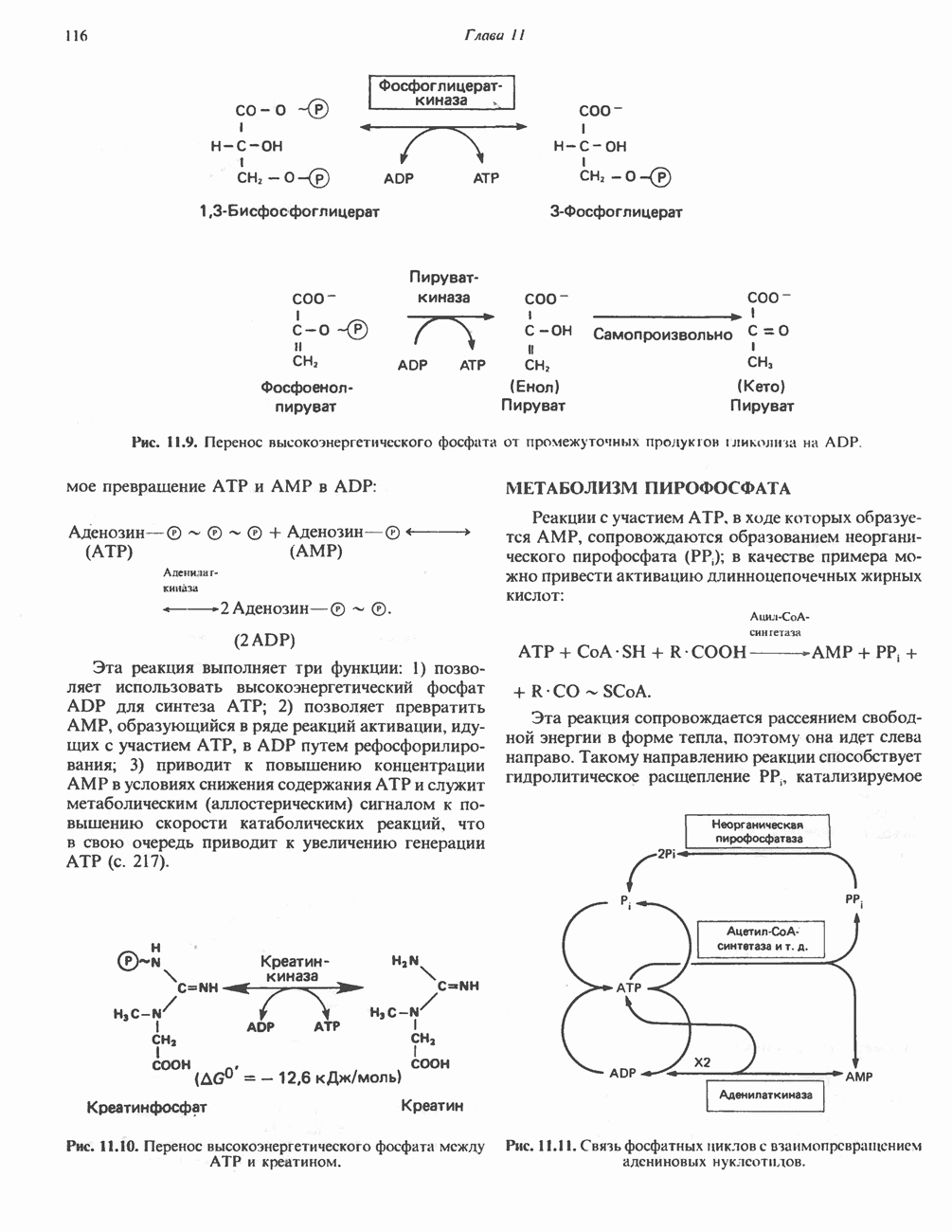
- МЕТАБОЛИЗМ ПИРОФОСФАТА
- Глава 12. Биологическое окисление
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ РАВНОВЕСИЕ, ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ
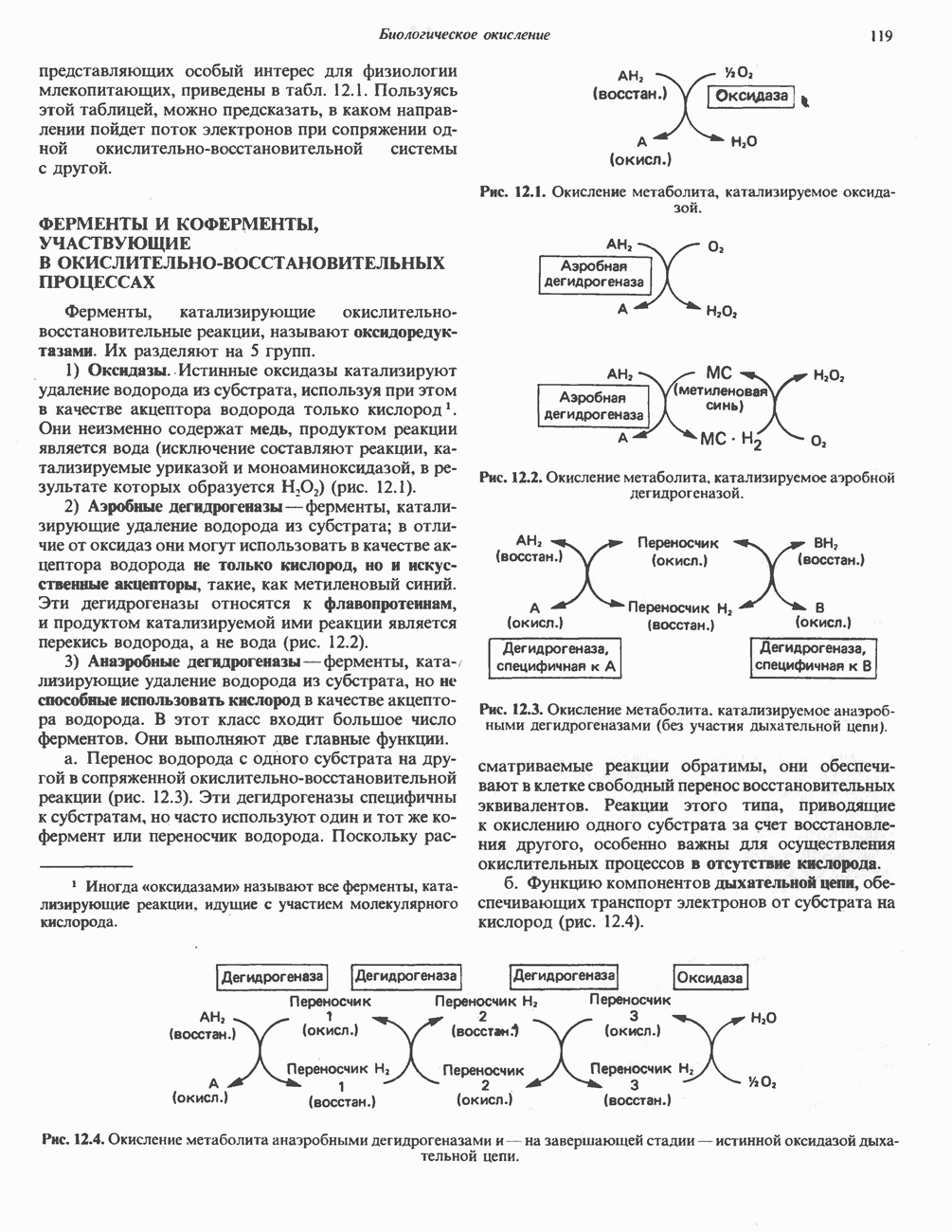
- ФЕРМЕНТЫ И КОФЕРМЕНТЫ, УЧАСТВУЮЩИЕ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССАХ
- Глава 13. Окислительное фосфорилирование и транспортные системы митохондрий
- ДЫХАТЕЛЬНАЯ ЦЕПЬ
- ОРГАНИЗАЦИЯ ДЫХАТЕЛЬНОЙ ЦЕПИ В МИТОХОНДРИЯХ
- РОЛЬ ДЫХАТЕЛЬНОЙ ЦЕПИ В УЛАВЛИВАНИИ ЭНЕРГИИ
- ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
- ИНГИБИТОРЫ ДЫХАТЕЛЬНОЙ ЦЕПИ И ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
- МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
- МИТОХОНДРИАЛЬНЫЕ ТРАНСПОРТНЫЕ СИСТЕМЫ
- Глава 14. Физиологически важные углеводы
- КЛАССИФИКАЦИЯ УГЛЕВОДОВ
- МОНОСАХАРИДЫ
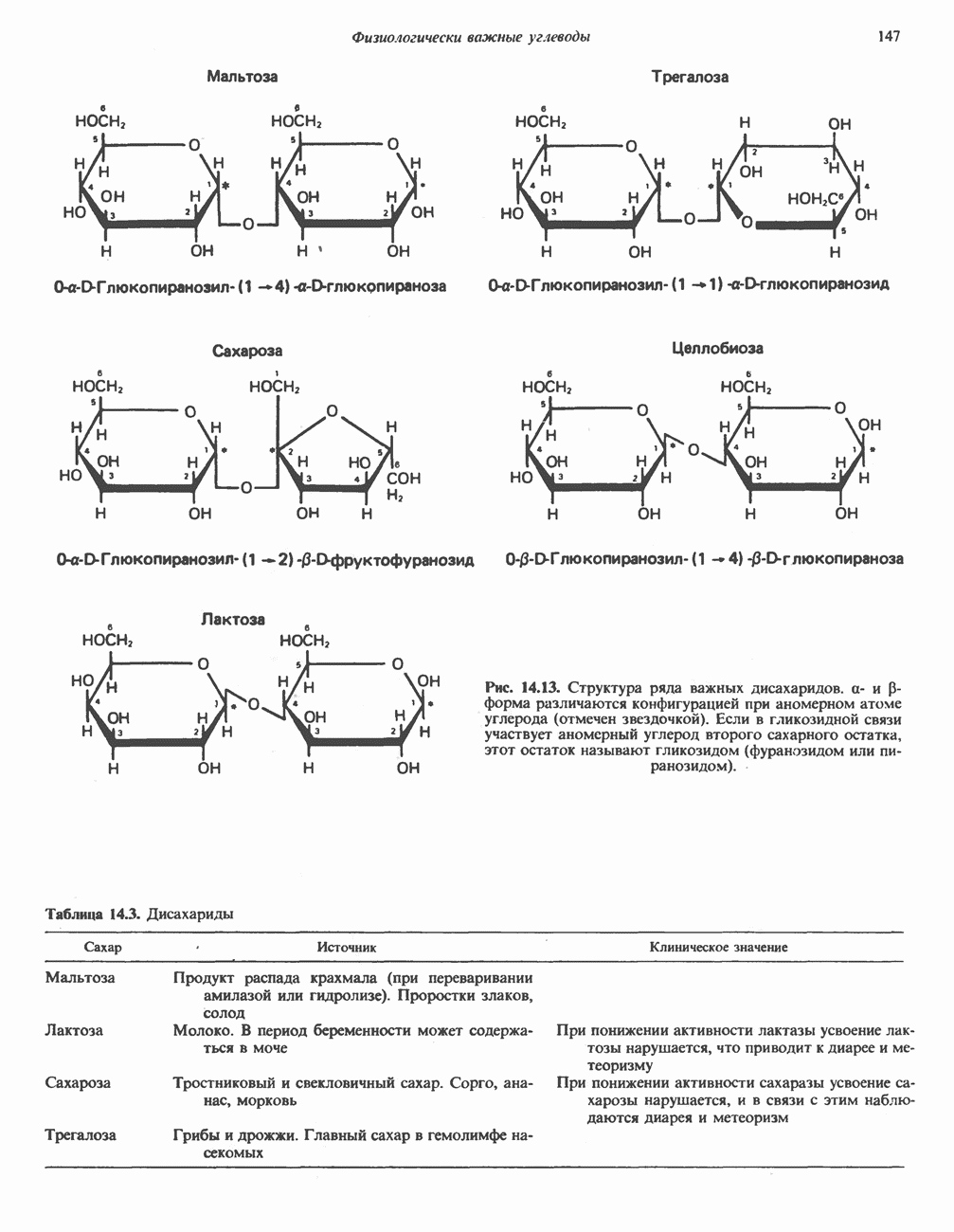
- ДИСАХАРИДЫ
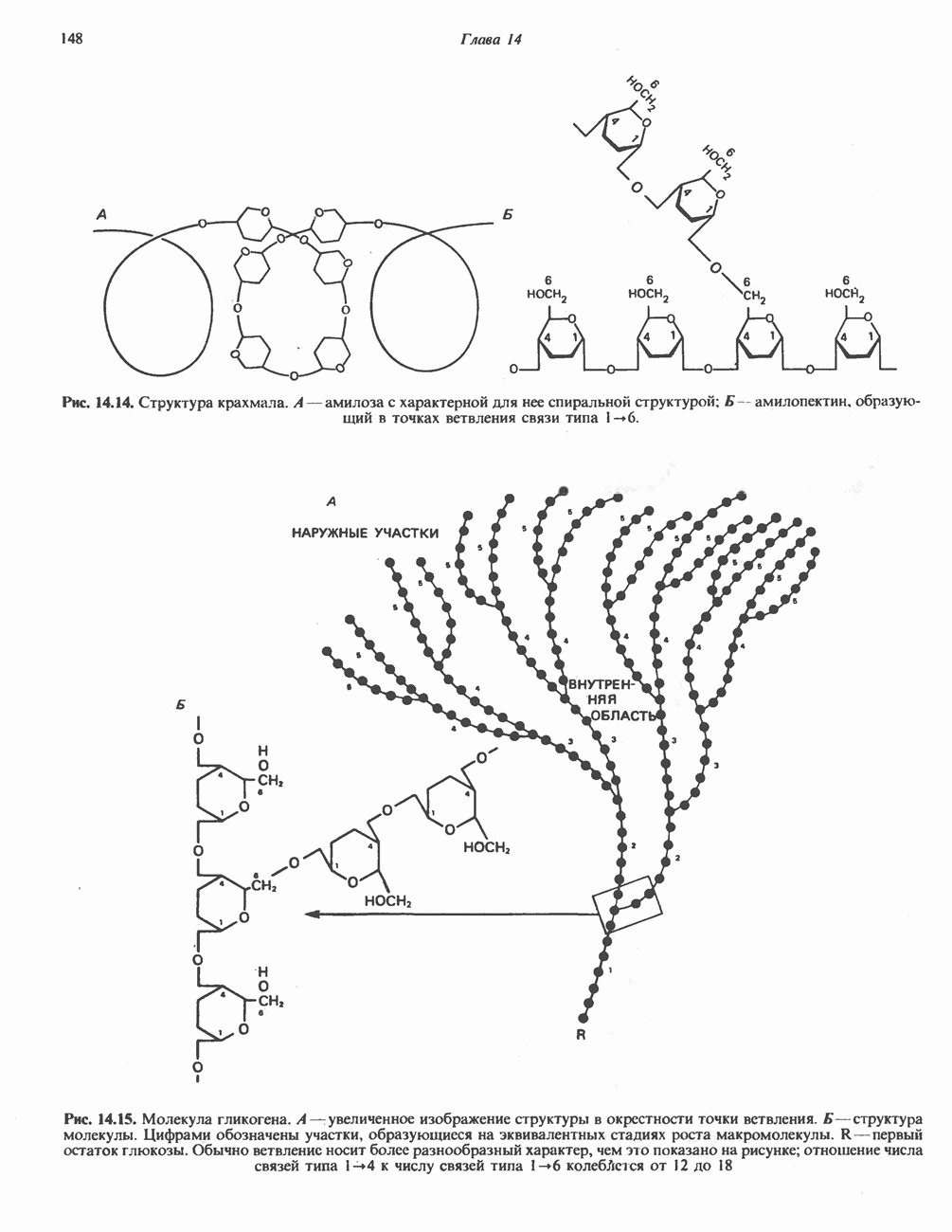
- ПОЛИСАХАРИДЫ
- УГЛЕВОДЫ КЛЕТОЧНЫХ МЕМБРАН
- Глава 15. Физиологически важные липиды
- КЛАССИФИКАЦИЯ ЛИПИДОВ
- ЖИРНЫЕ КИСЛОТЫ
- ТРИАЦИЛГЛИЦЕРОЛЫ (триглицериды)
- ФОСФОЛИПИДЫ
- ГЛИКОЛИПИДЫ (ГЛИКОСФИНГОЛИПИДЫ)
- СТЕРОИДЫ
- ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ
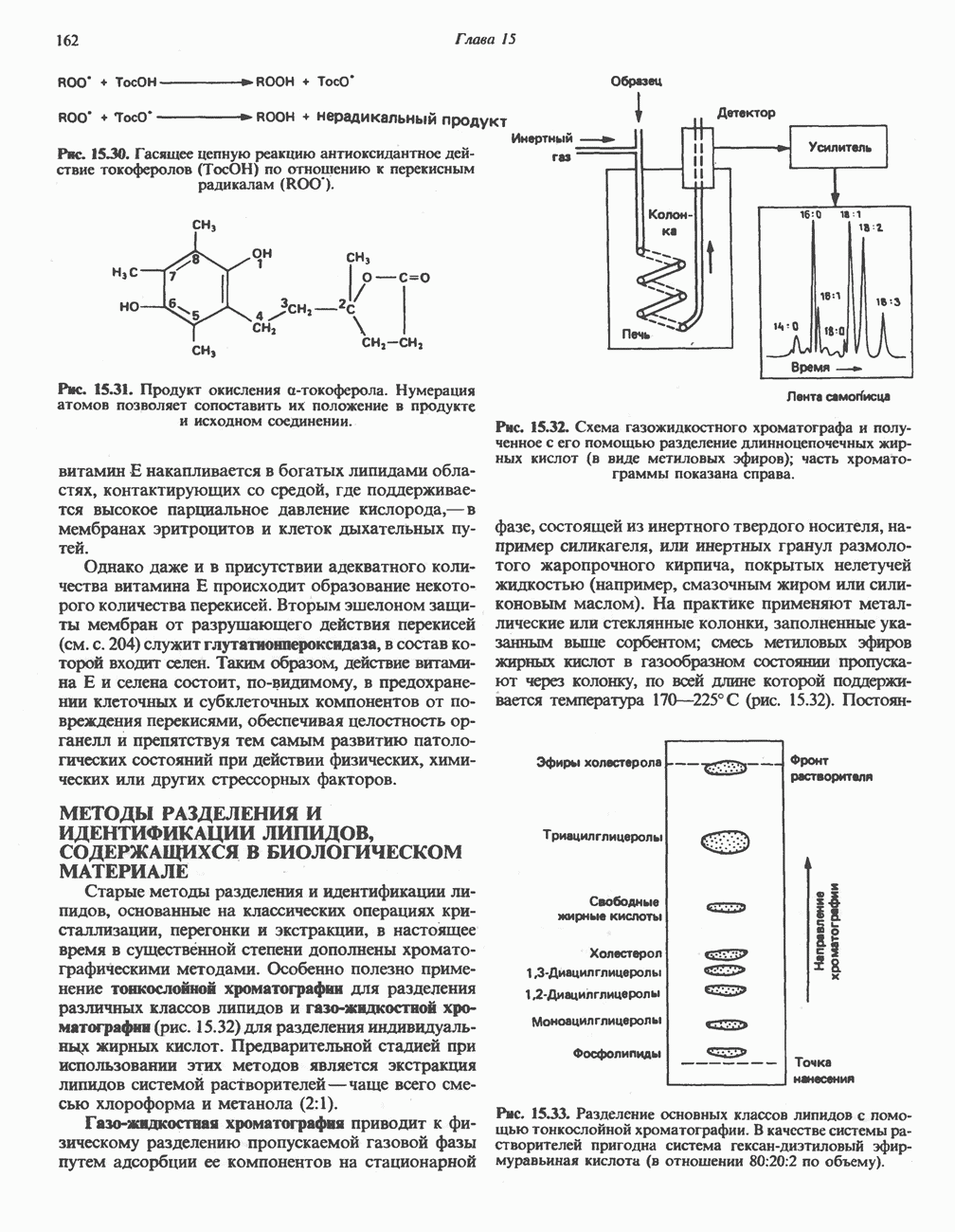
- МЕТОДЫ РАЗДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ ЛИПИДОВ, СОДЕРЖАЩИХСЯ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ
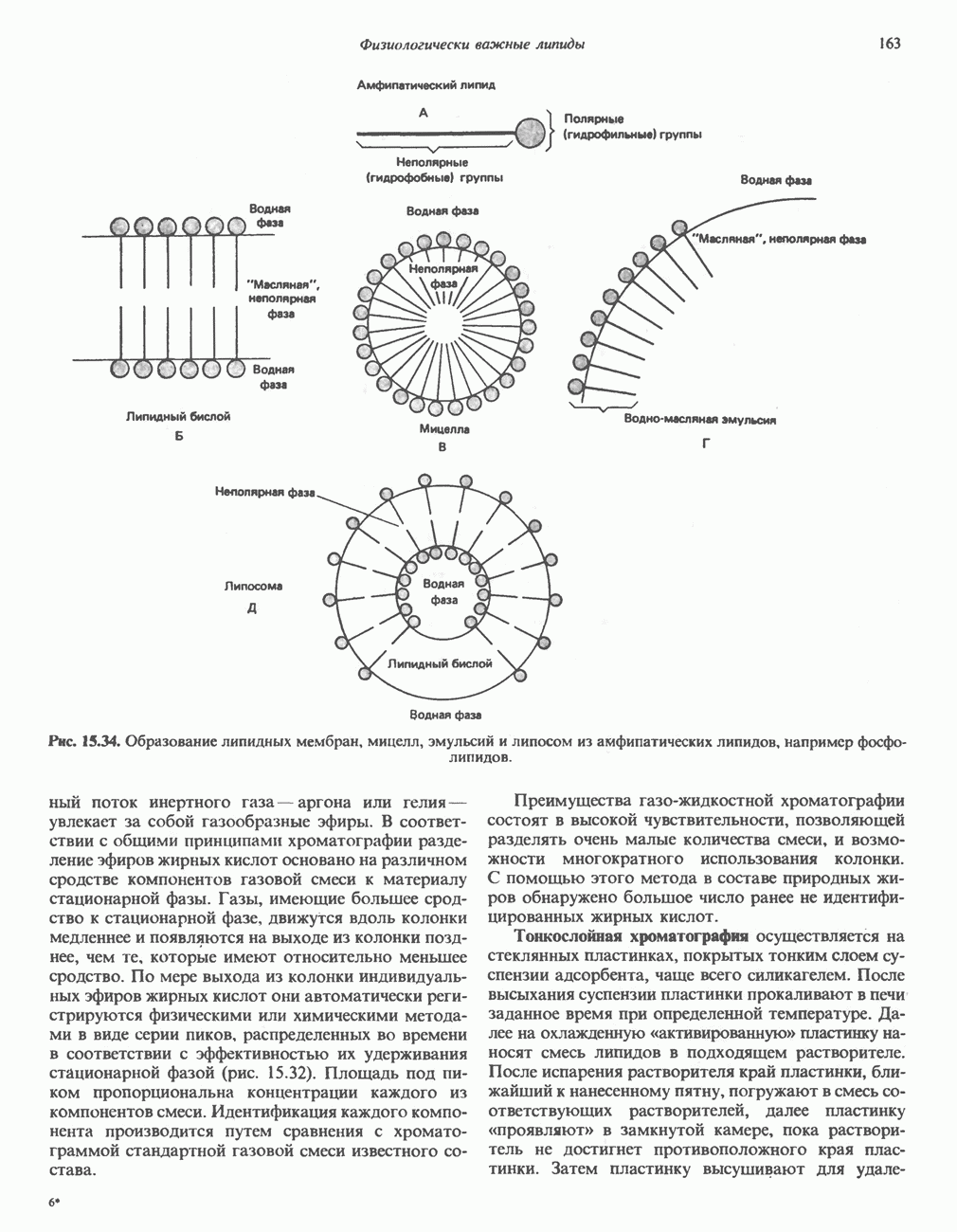
- АМФИПАТИЧЕСКИЕ ЛИПИДЫ
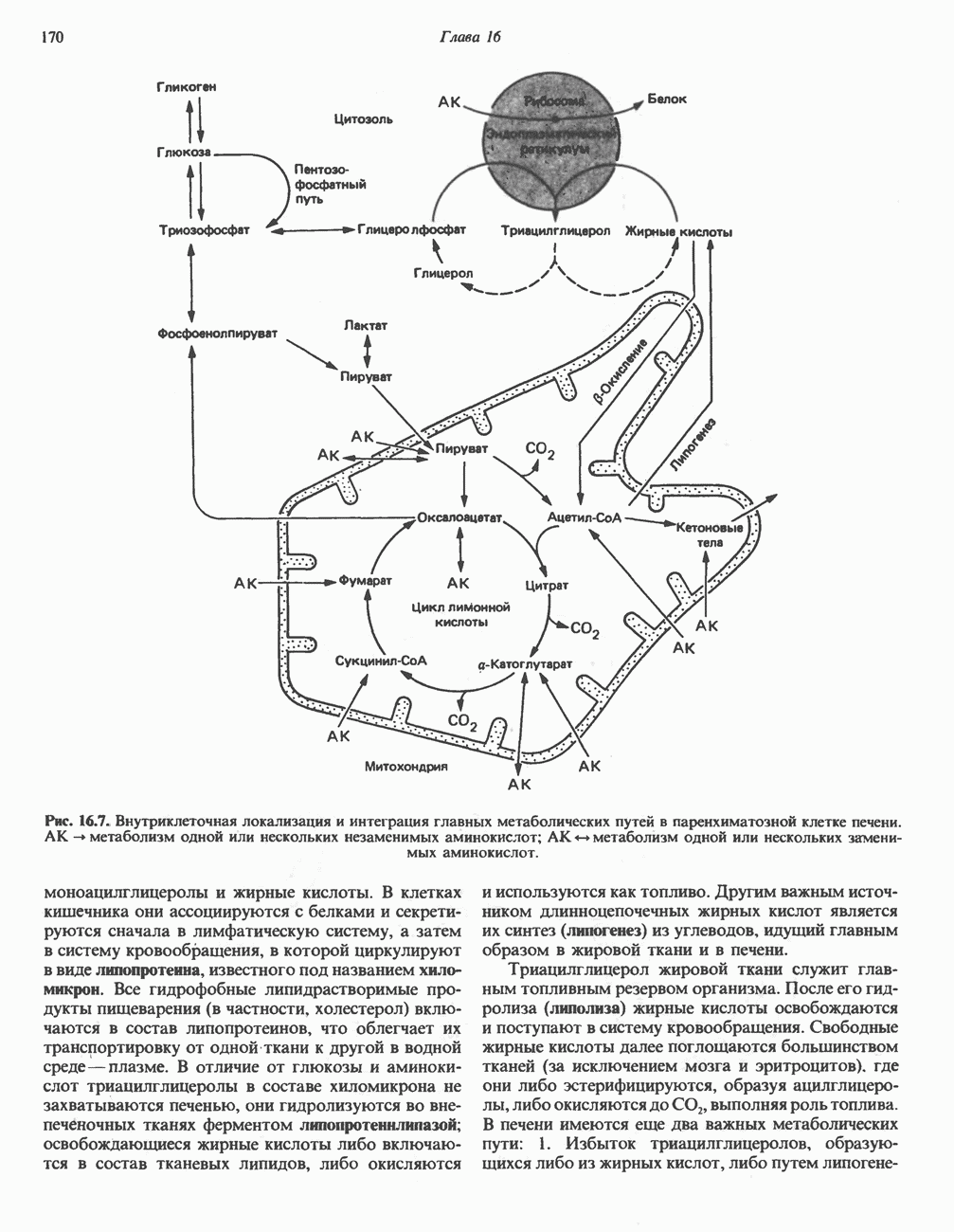
- Глава 16. Промежуточный обмен
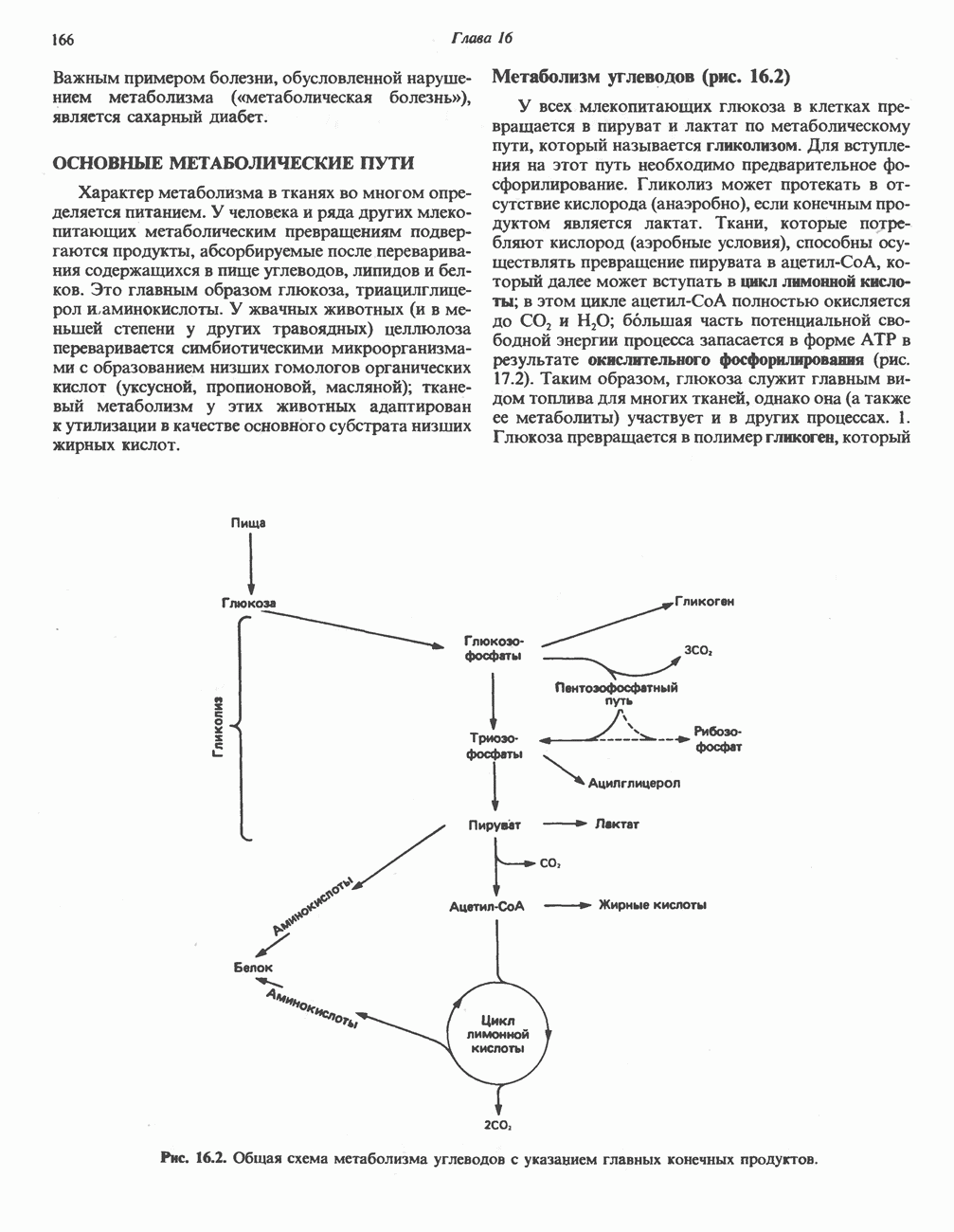
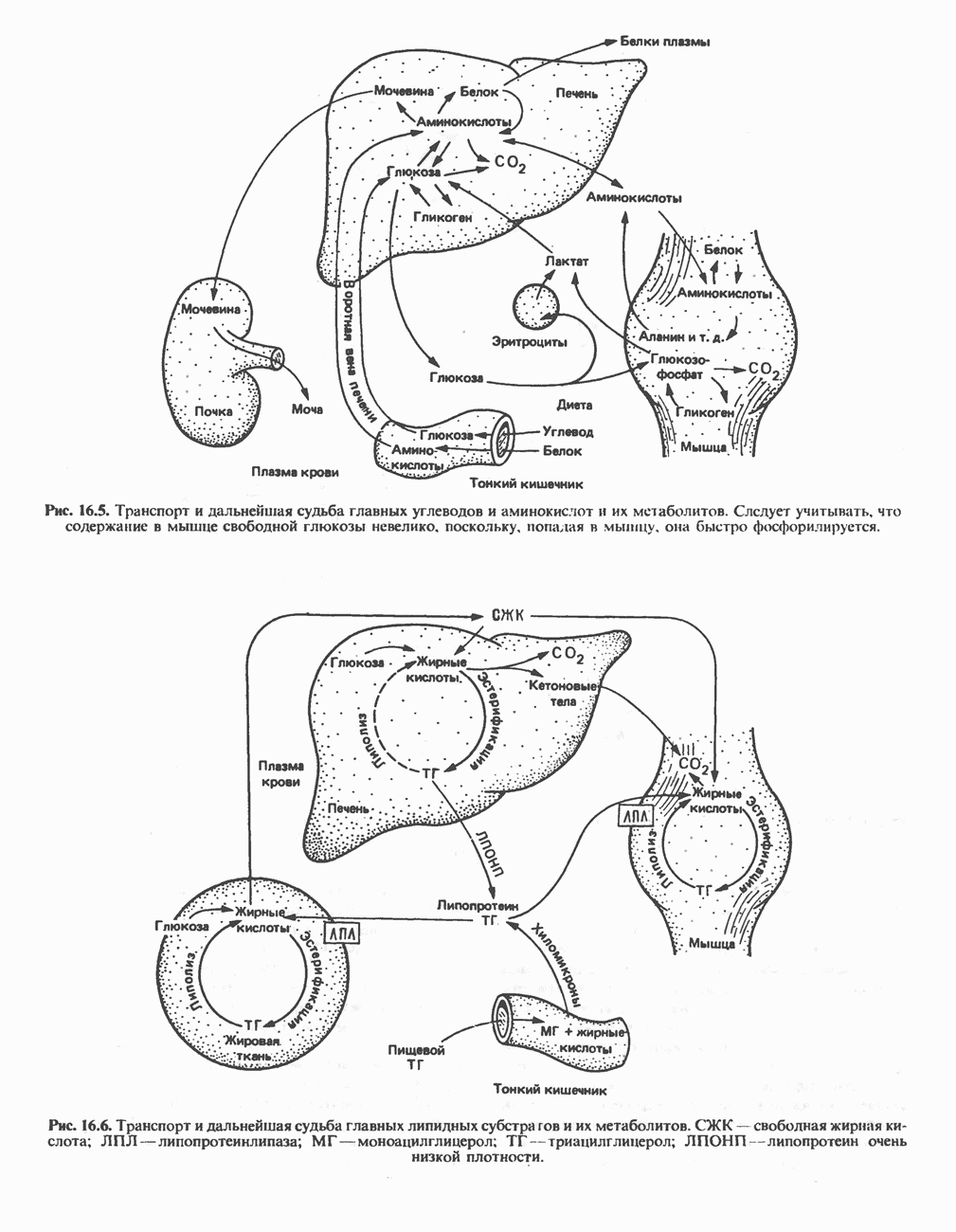
- ОСНОВНЫЕ МЕТАБОЛИЧЕСКИЕ ПУТИ
- ЛОКАЛИЗАЦИЯ МЕТАБОЛИЧЕСКИХ ПУТЕЙ
- Глава 17. Цикл лимонной кислоты: катаболизм ацетил-СоА
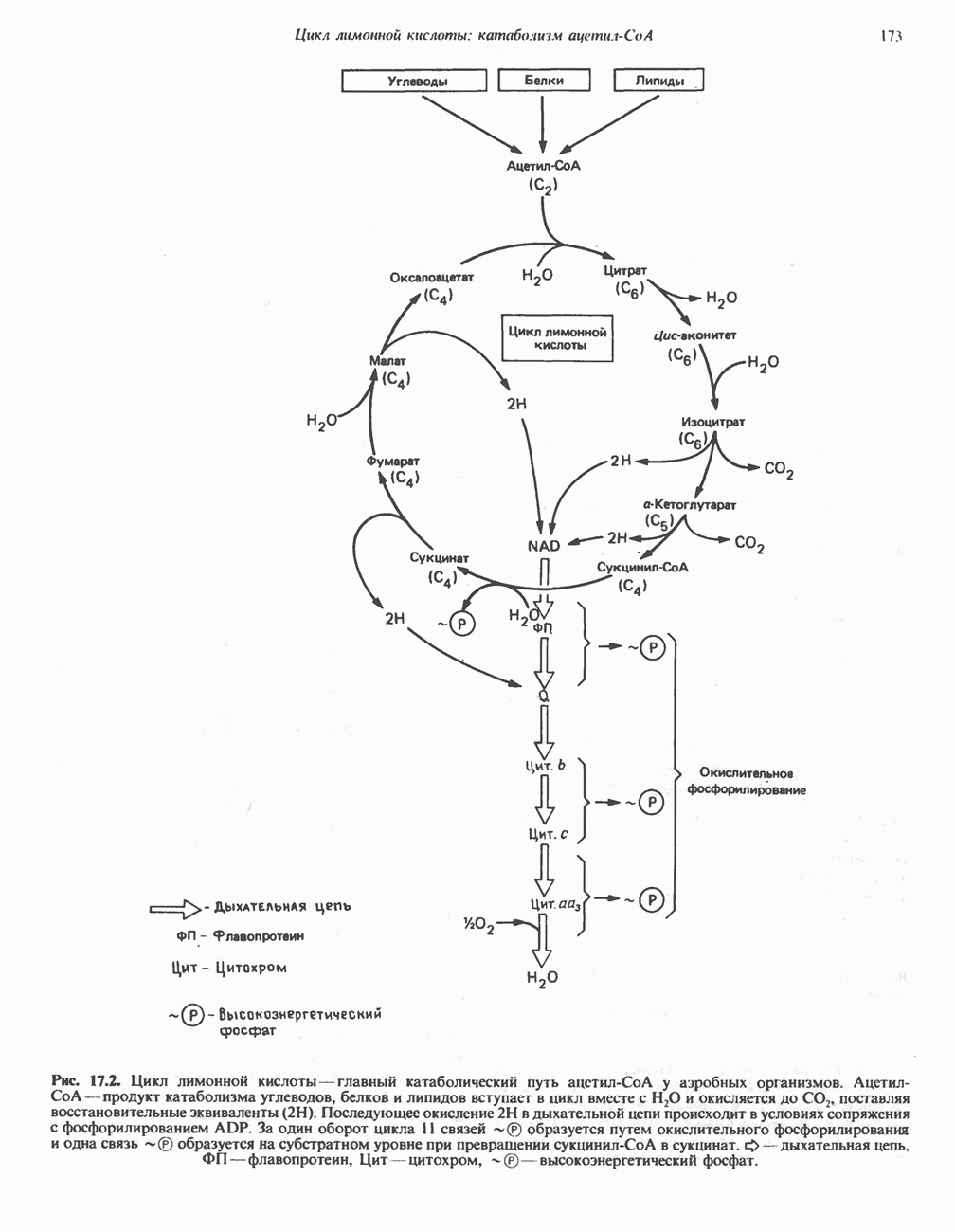
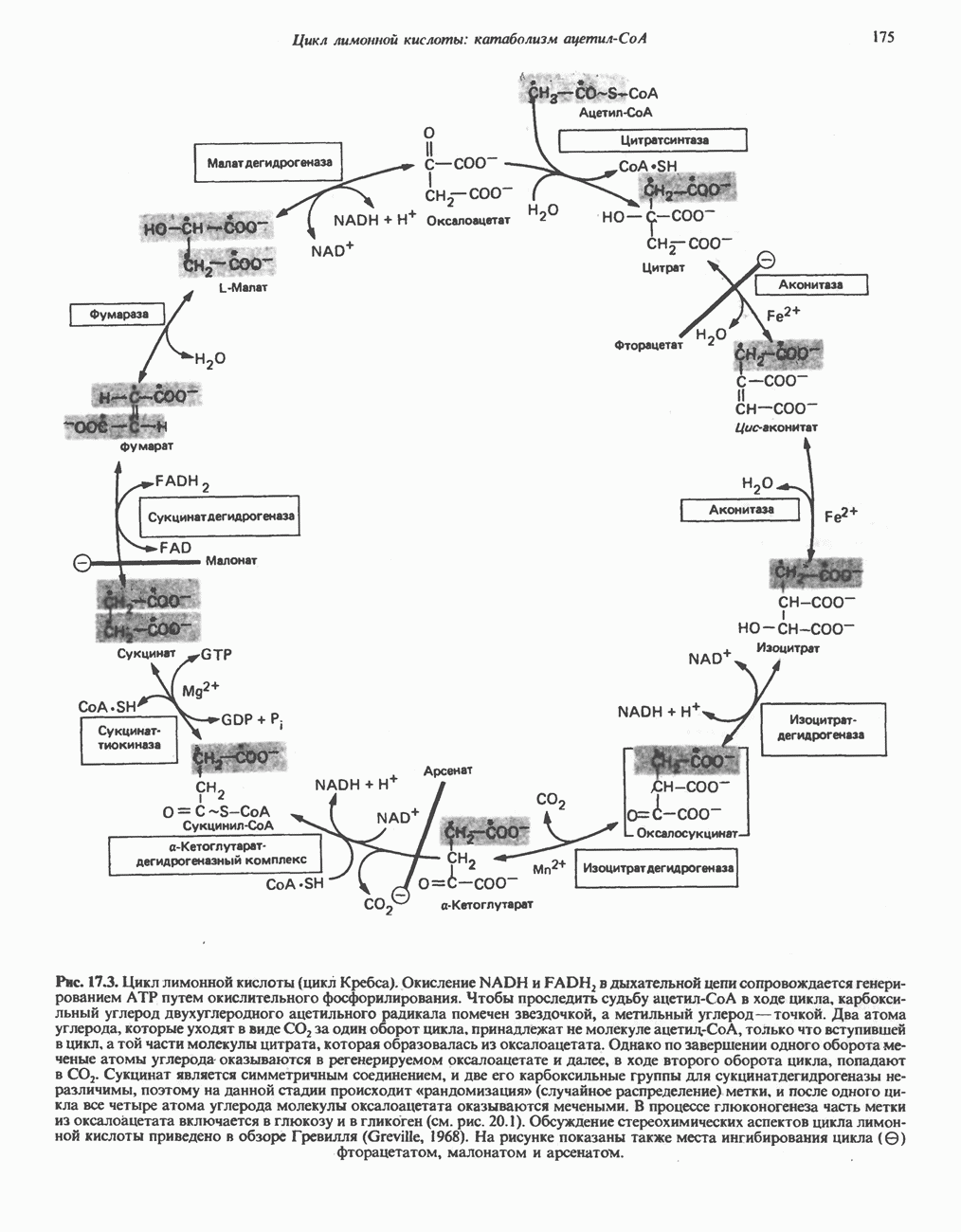
- КАТАБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
- РЕАКЦИИ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (рис. 17.3)
- ЭНЕРГЕТИКА ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
- РОЛЬ ВИТАМИНОВ В ЦИКЛЕ ЛИМОННОЙ КИСЛОТЫ
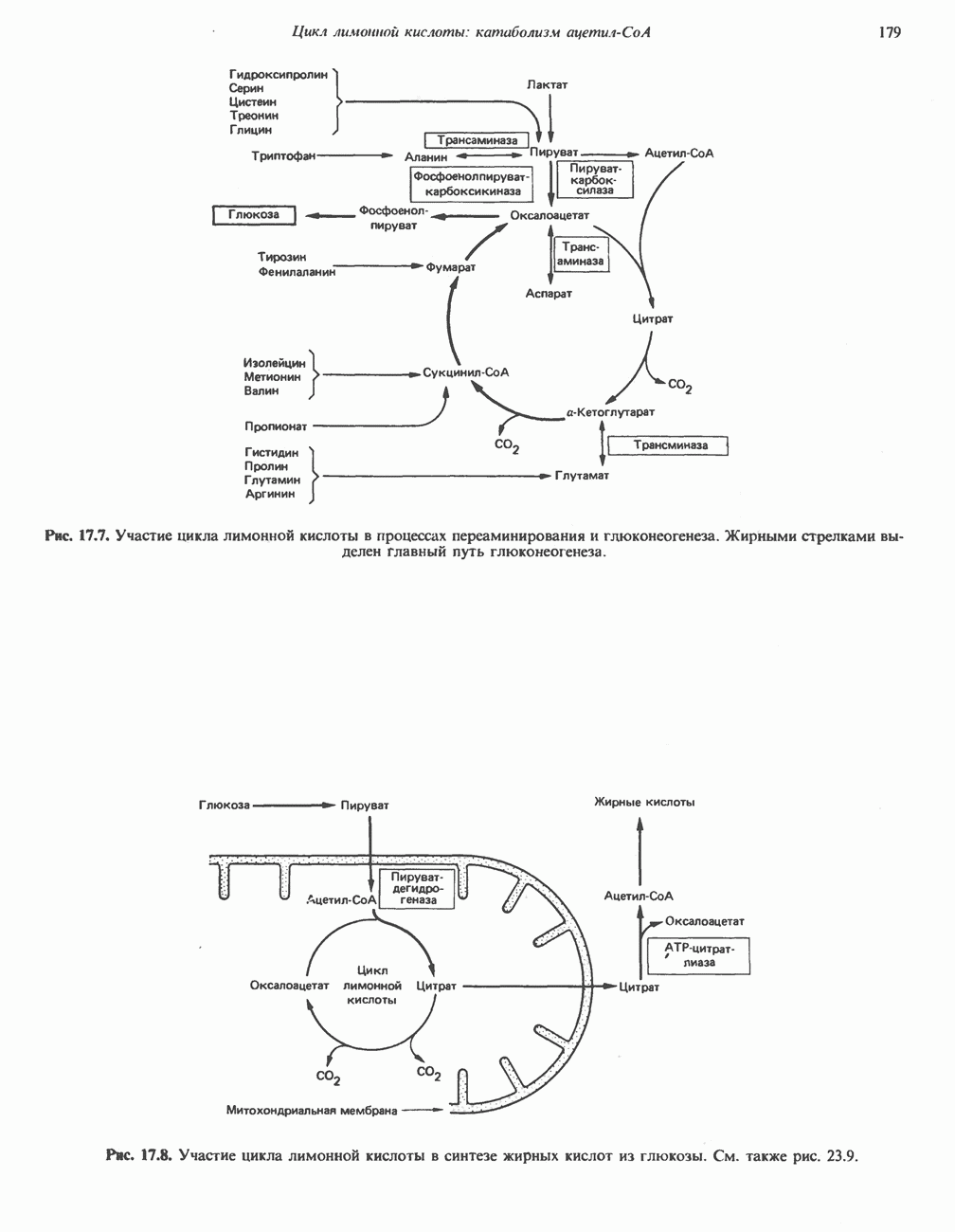
- АМФИБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
- Глава 18. Гликолиз и окисление пирувата
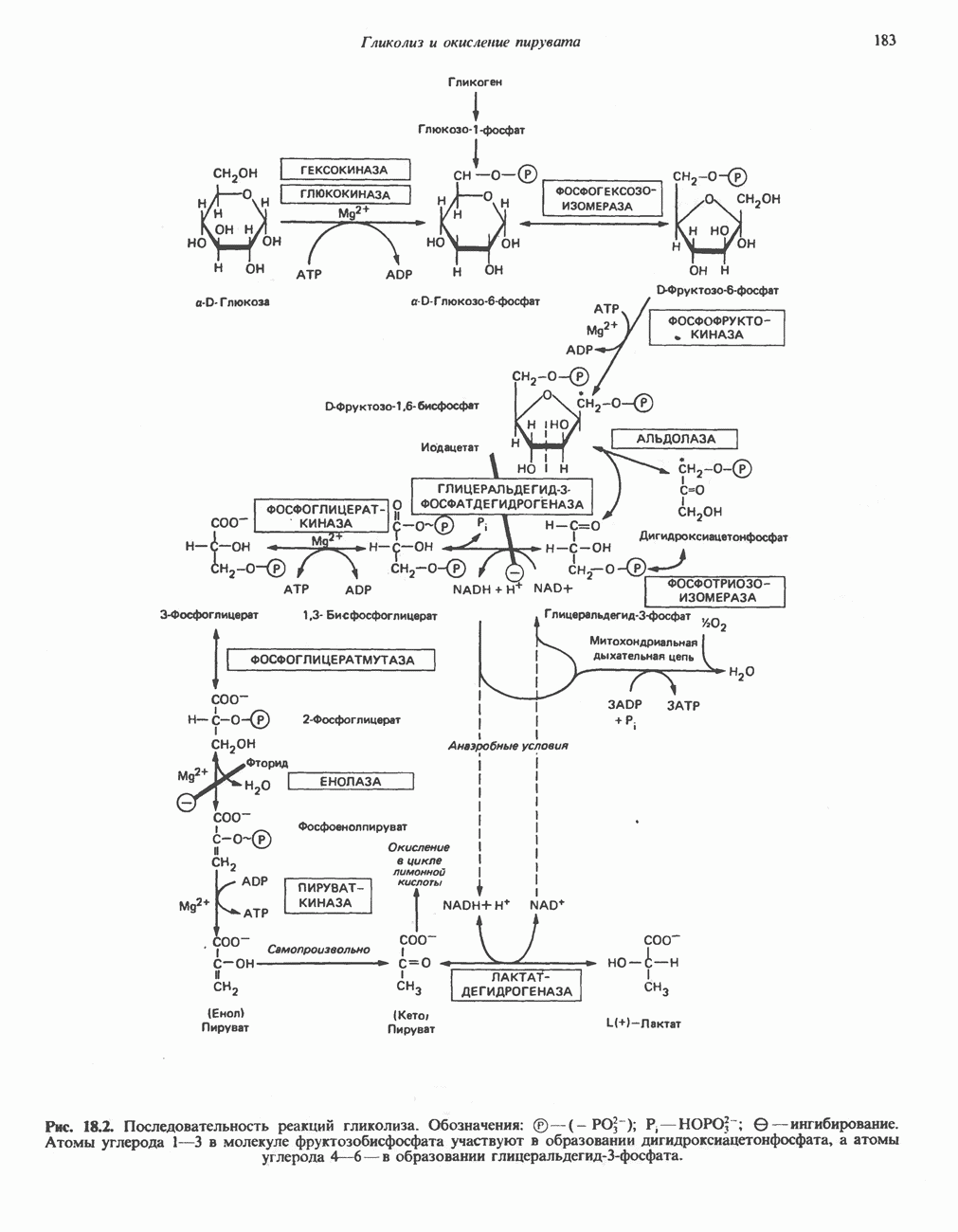
- ГЛИКОЛИТИЧЕСКИЙ ПУТЬ
- ПОСЛЕДОВАТЕЛЬНЫЕ СТАДИИ ГЛИКОЛИЗА
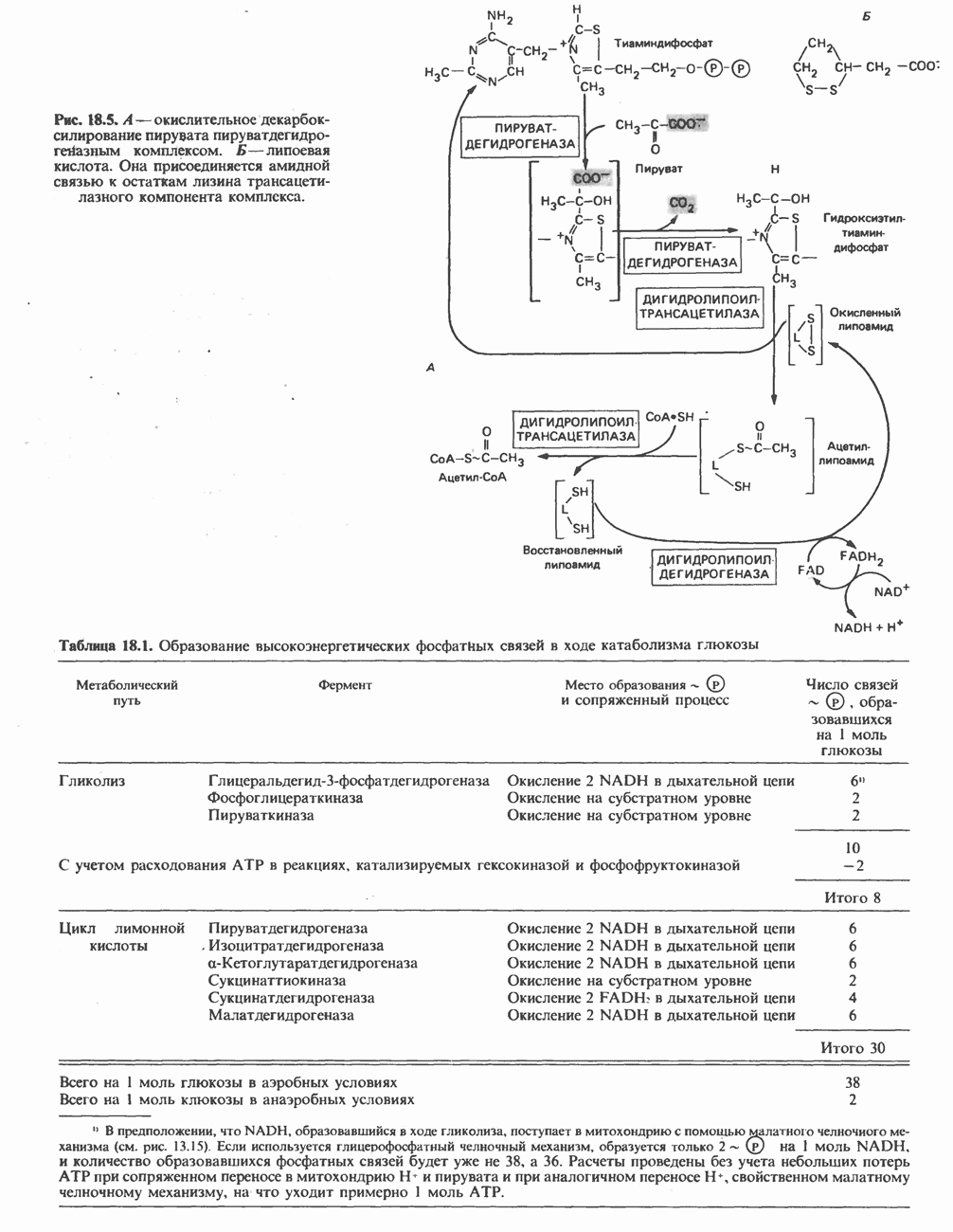
- ОКИСЛЕНИЕ ПИРУВАТА В АЦЕТИЛ-СоА
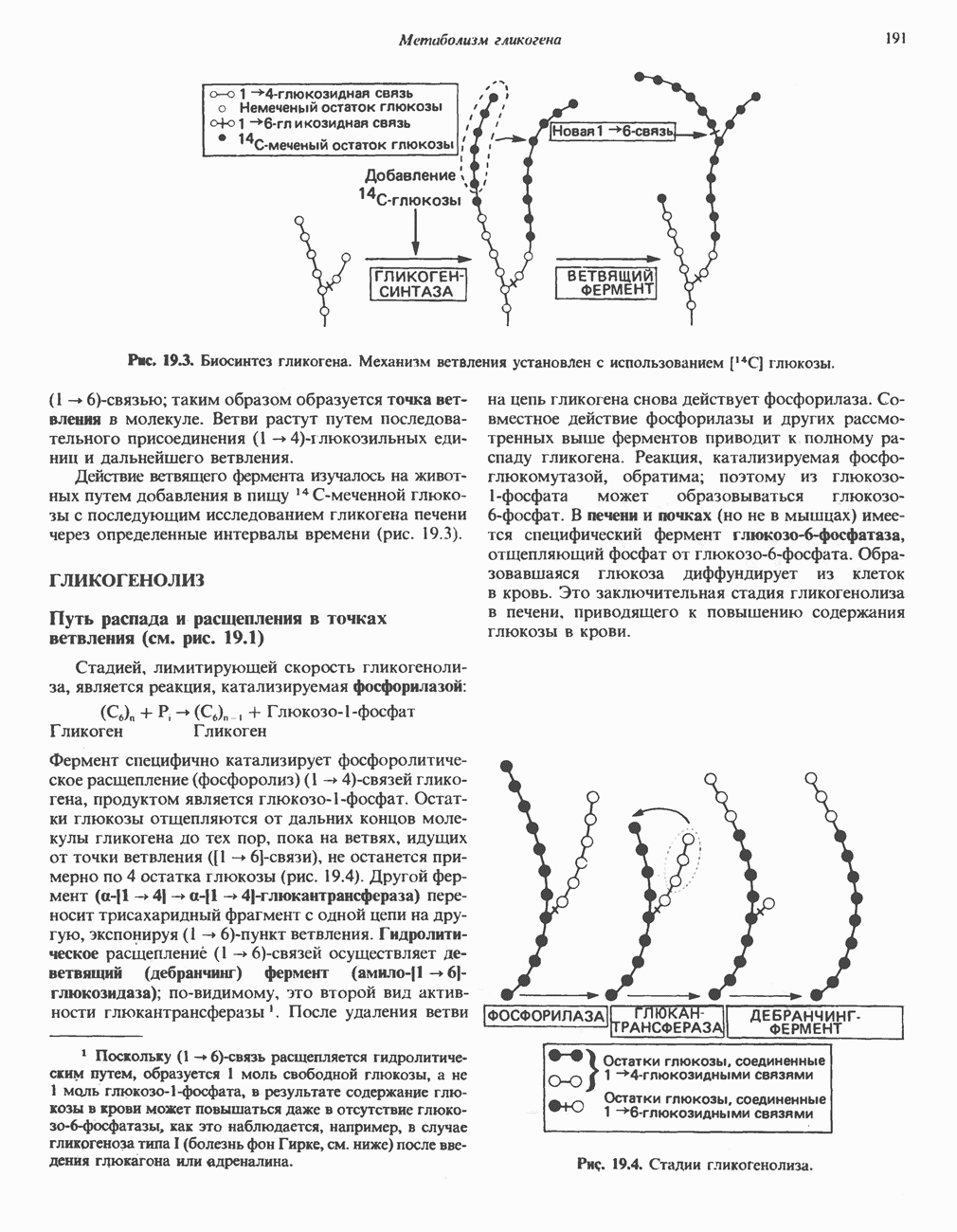
- Глава 19. Метаболизм гликогена
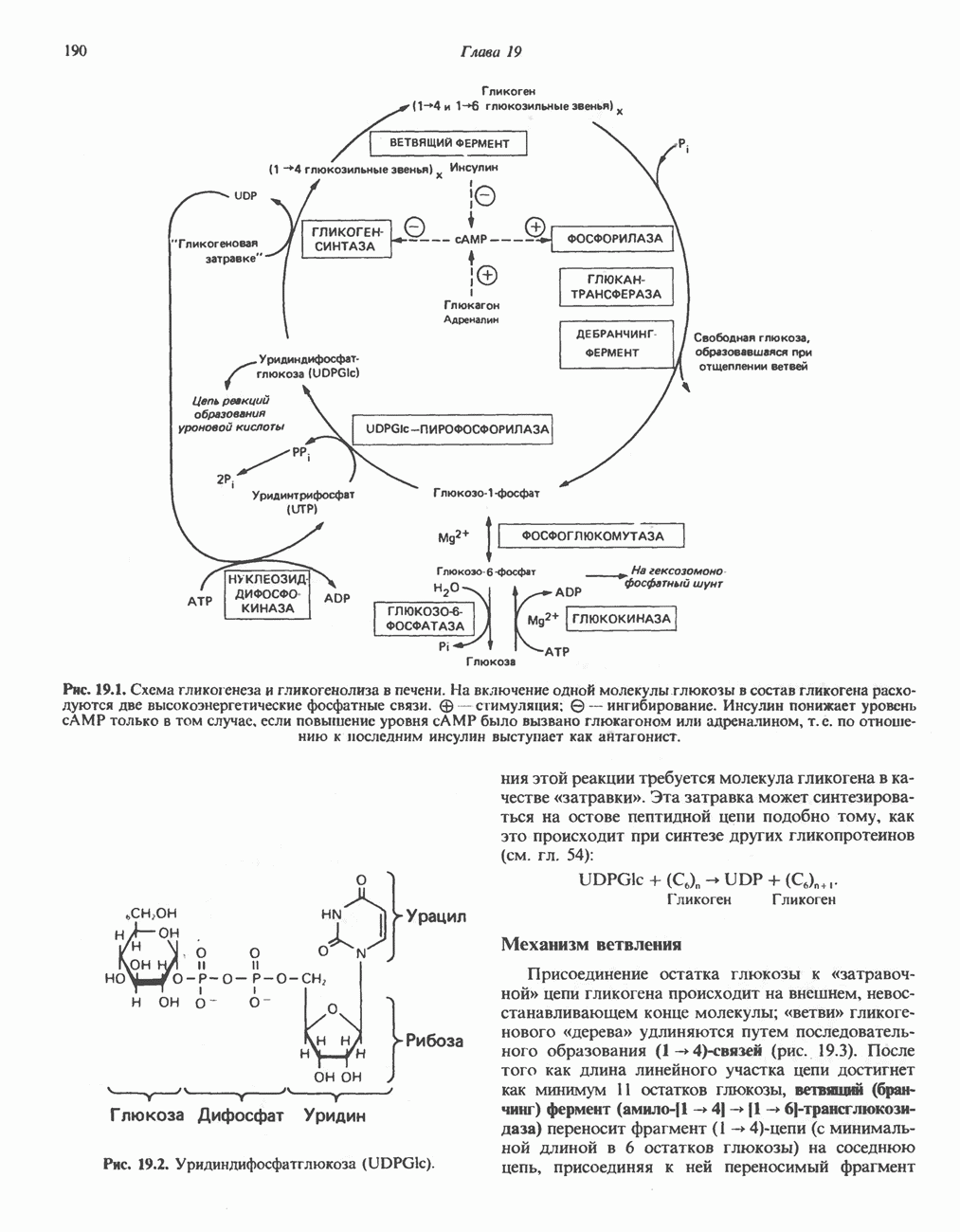
- ГЛИКОГЕНЕЗ
- ГЛИКОГЕНОЛИЗ
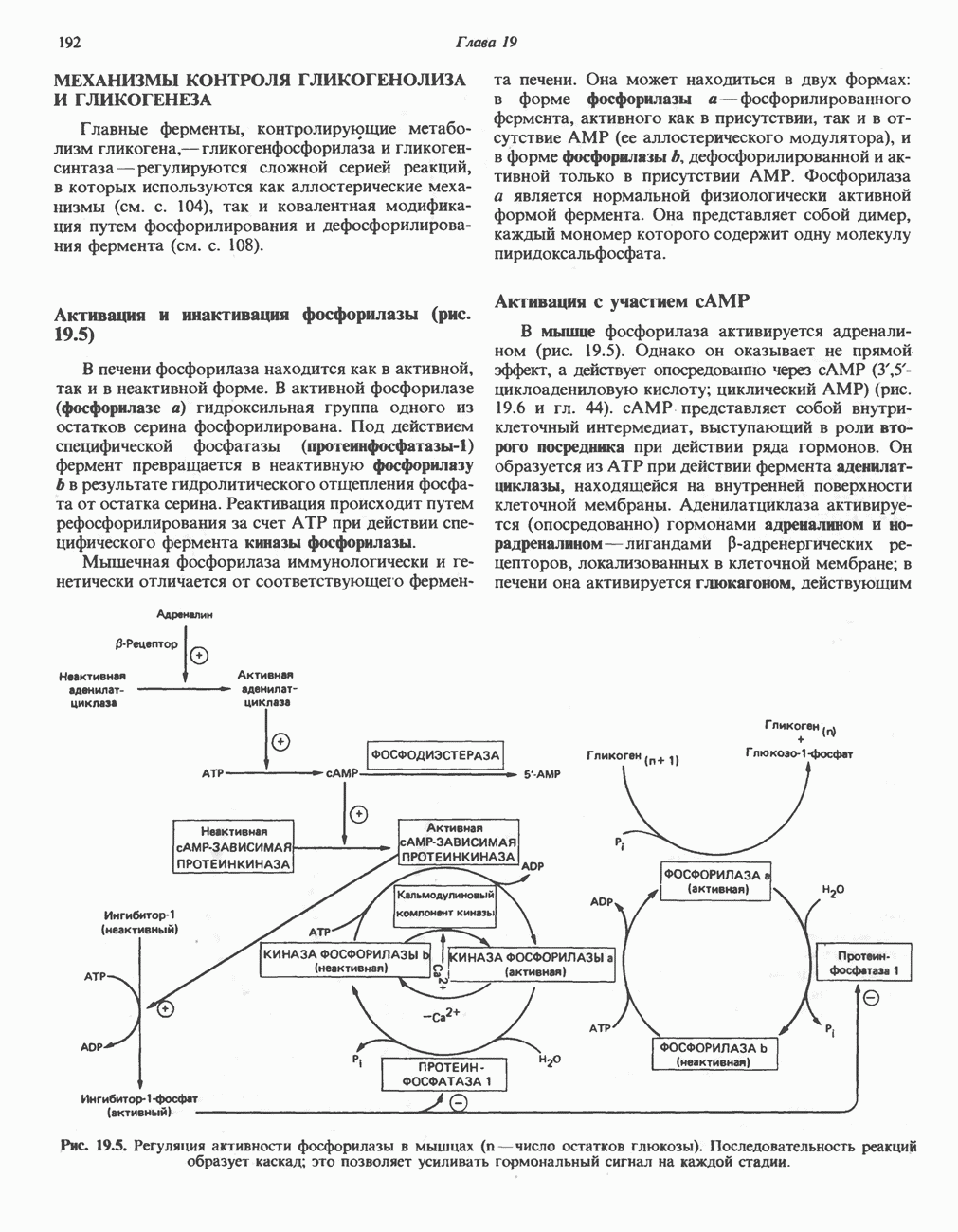
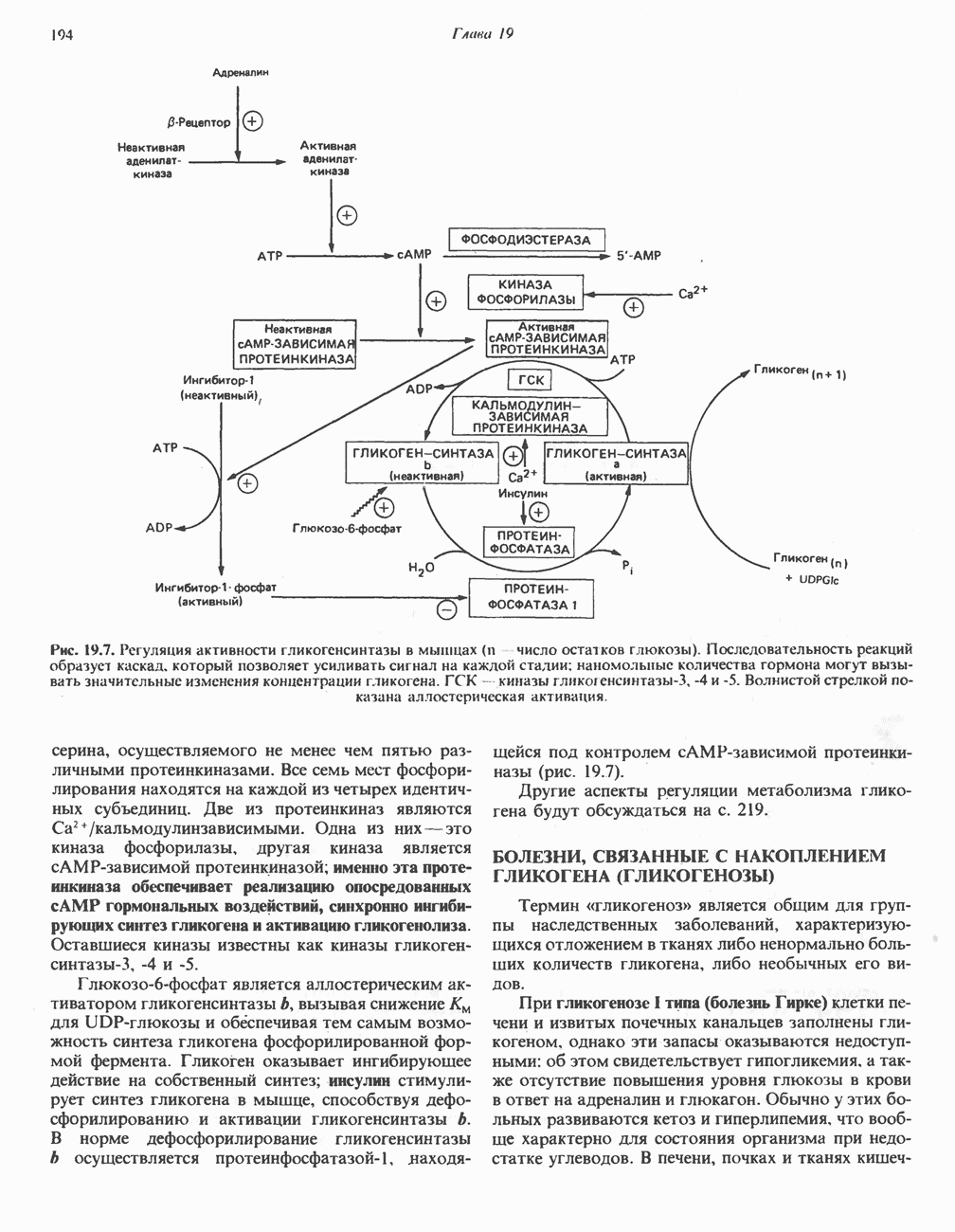
- МЕХАНИЗМЫ КОНТРОЛЯ ГЛИКОГЕНОЛИЗА И ГЛИКОГЕНЕЗА
- БОЛЕЗНИ, СВЯЗАННЫЕ С НАКОПЛЕНИЕМ ГЛИКОГЕНА (ГЛИКОГЕНОЗЫ)
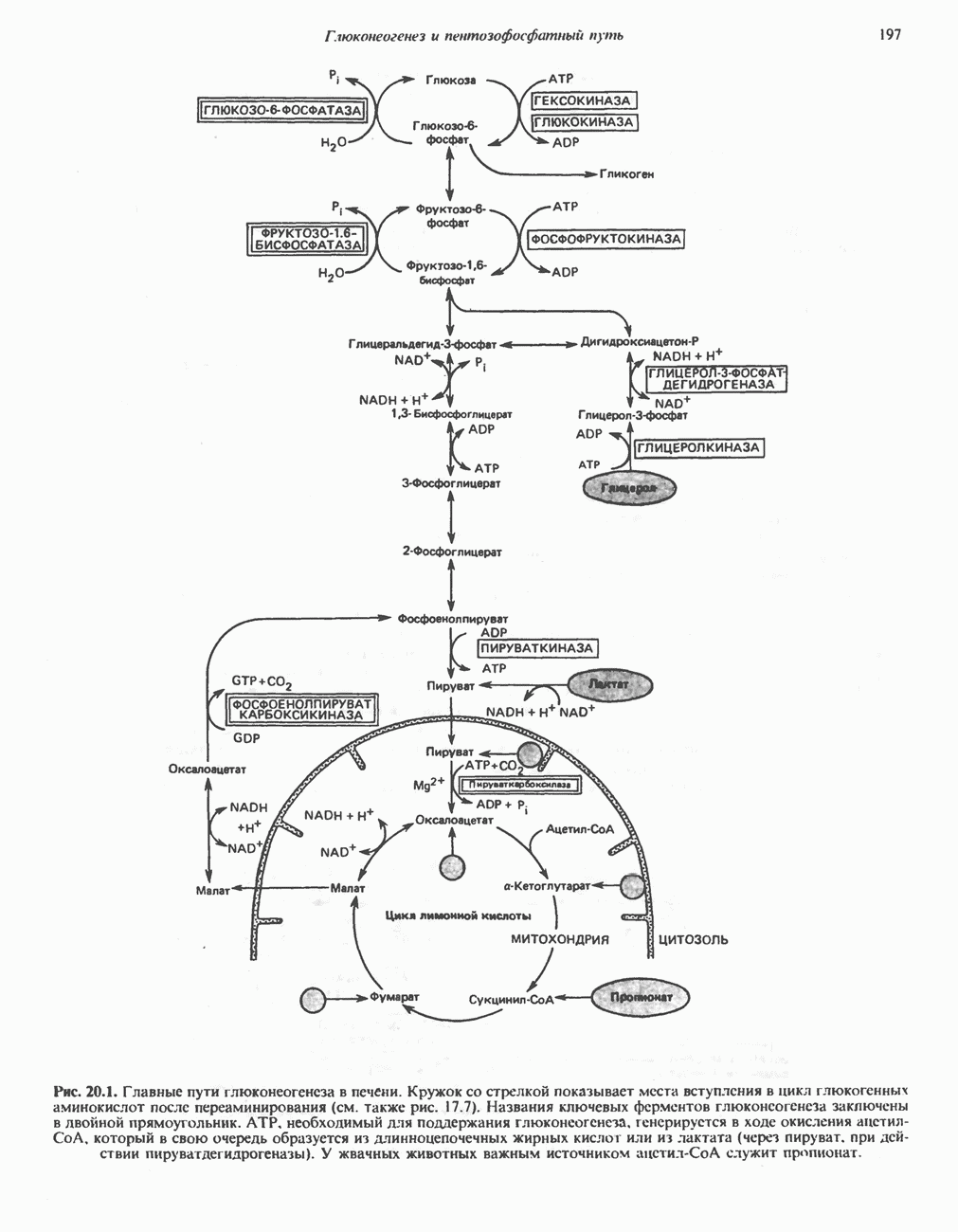
- Глава 20. Глюконеогенез и пентозофосфатный путь
- МЕТАБОЛИЧЕСКИЕ ПУТИ, УЧАСТВУЮЩИЕ В ГЛЮКОНЕОГЕНЕЗЕ (рис. 20.1)
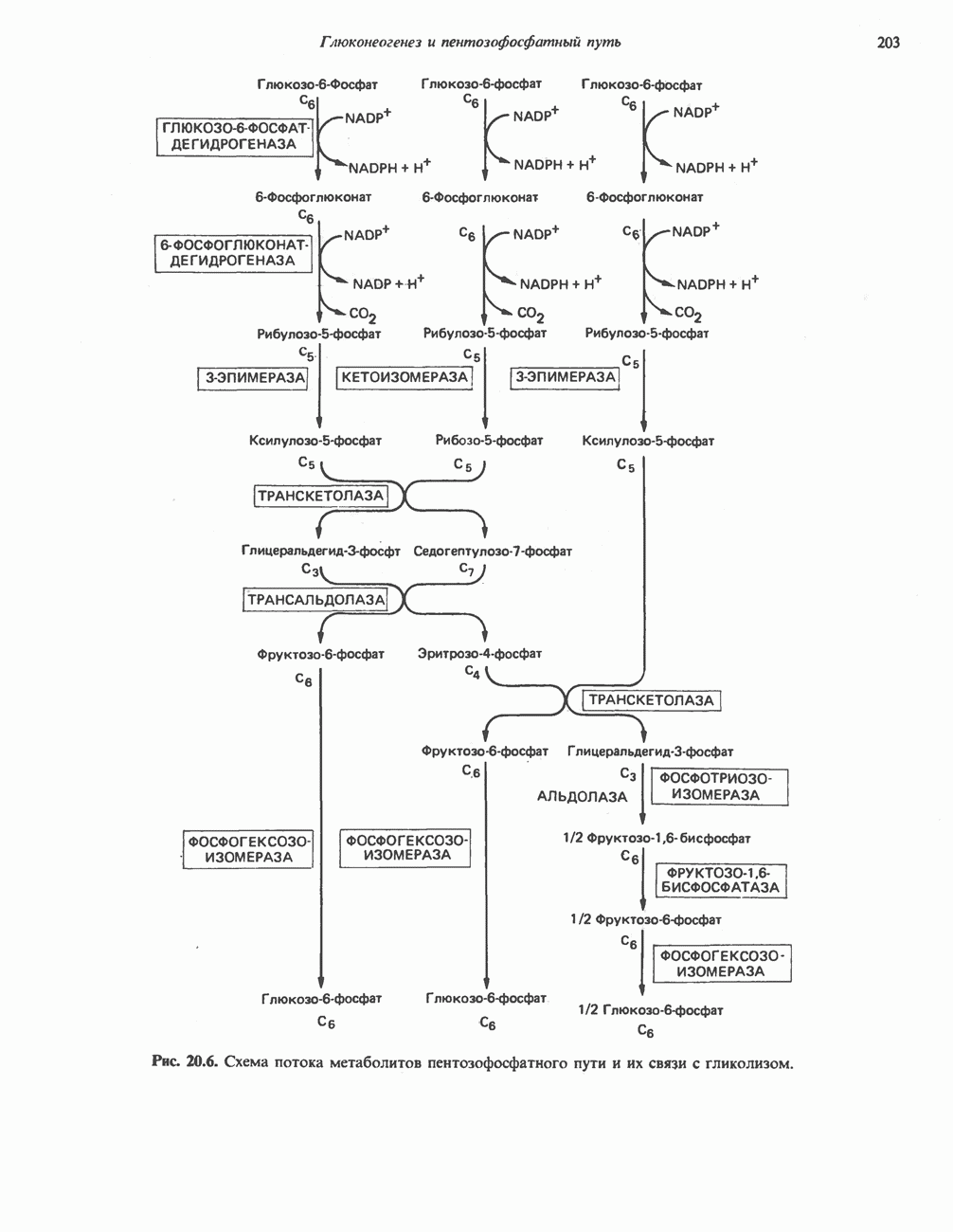
- ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ИЛИ ГЕКСОЗОМОНОФОСФАТНЫЙ ШУНТ
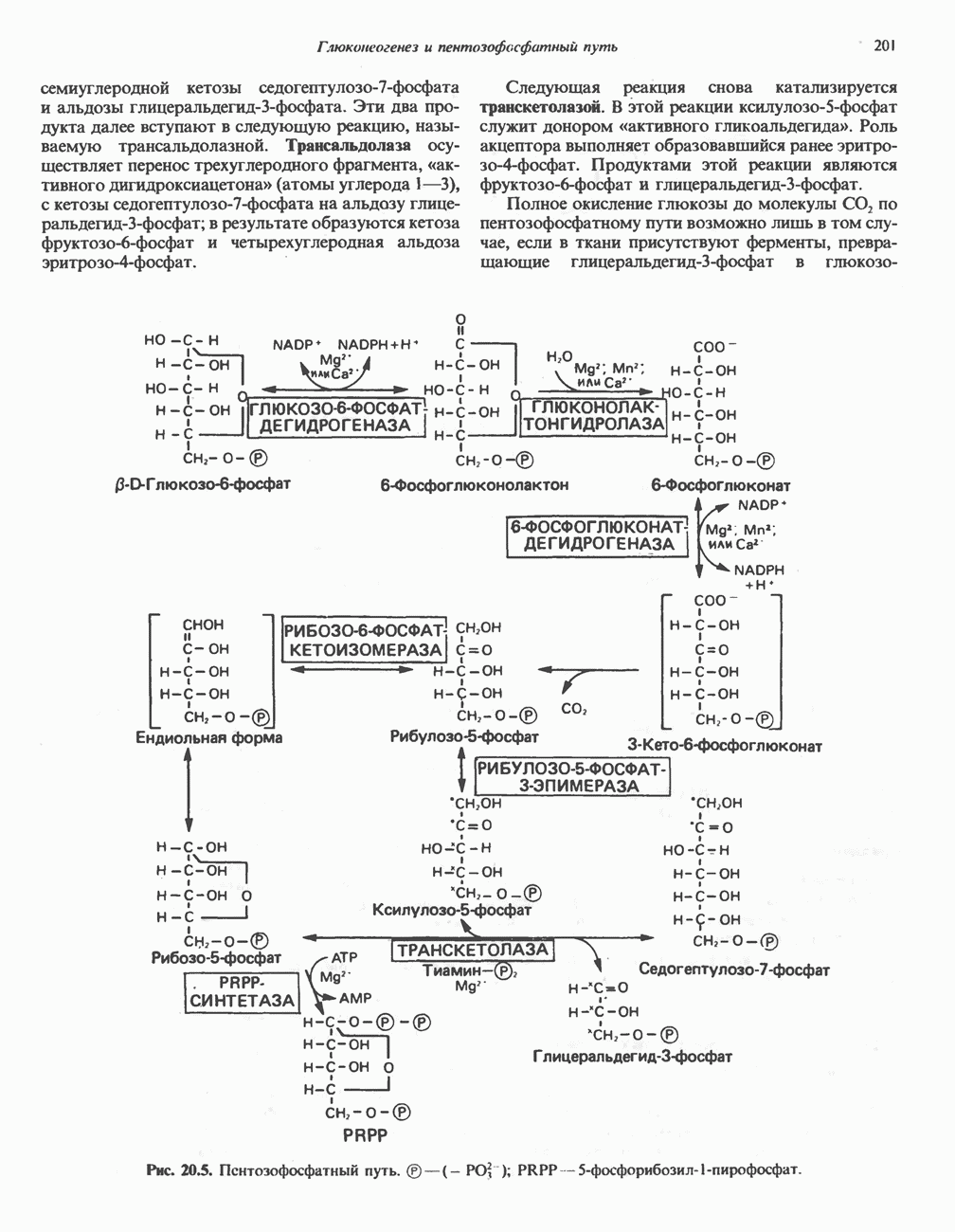
- ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ
- МЕТАБОЛИЧЕСКОЕ ЗНАЧЕНИЕ ПЕНТОЗОФОСФАТНОГО ПУТИ
- КЛИНИЧЕСКИЕ АСПЕКТЫ
- Глава 21. Метаболизм наиболее важных гексоз
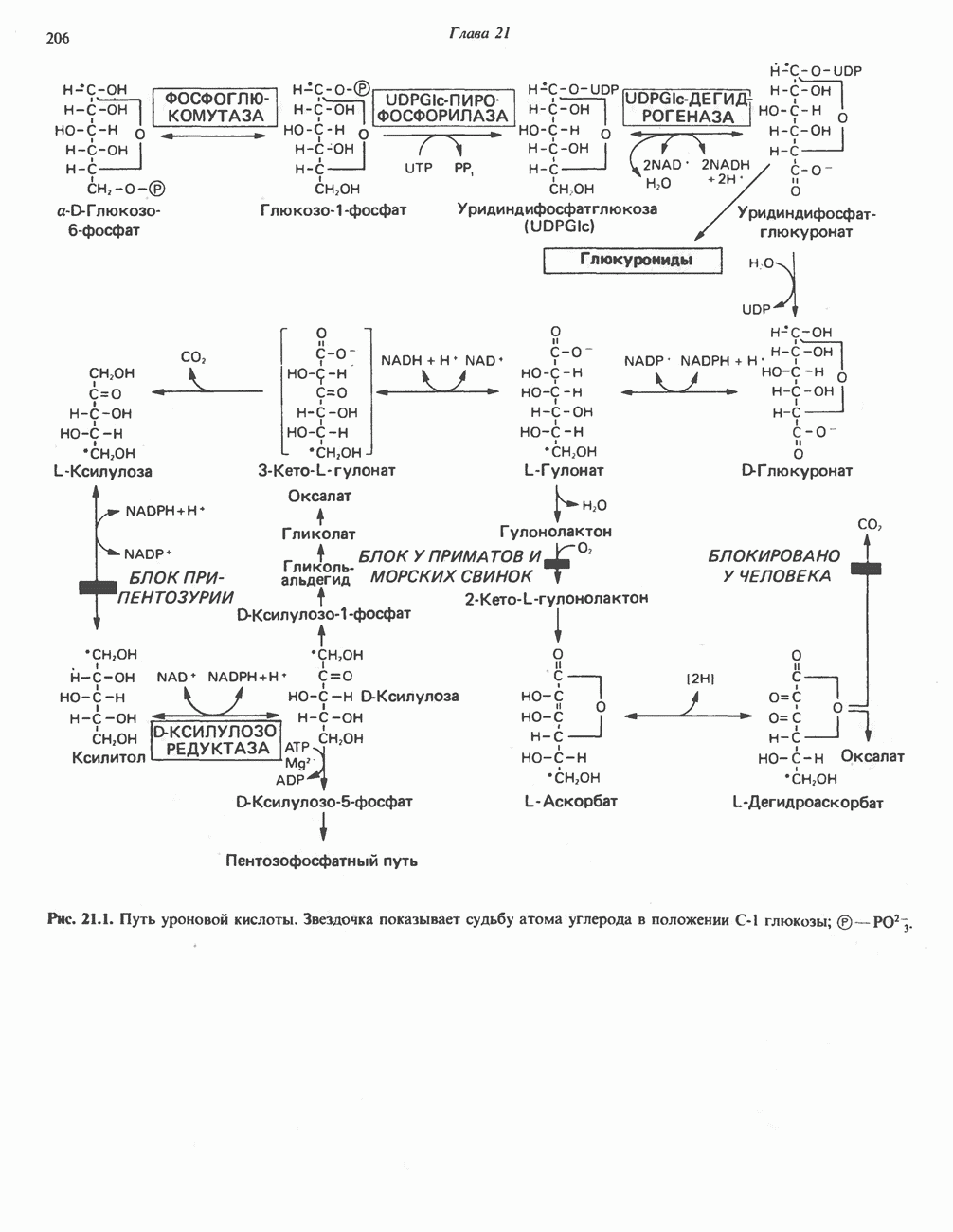
- ПУТЬ УРОНОВЫХ КИСЛОТ
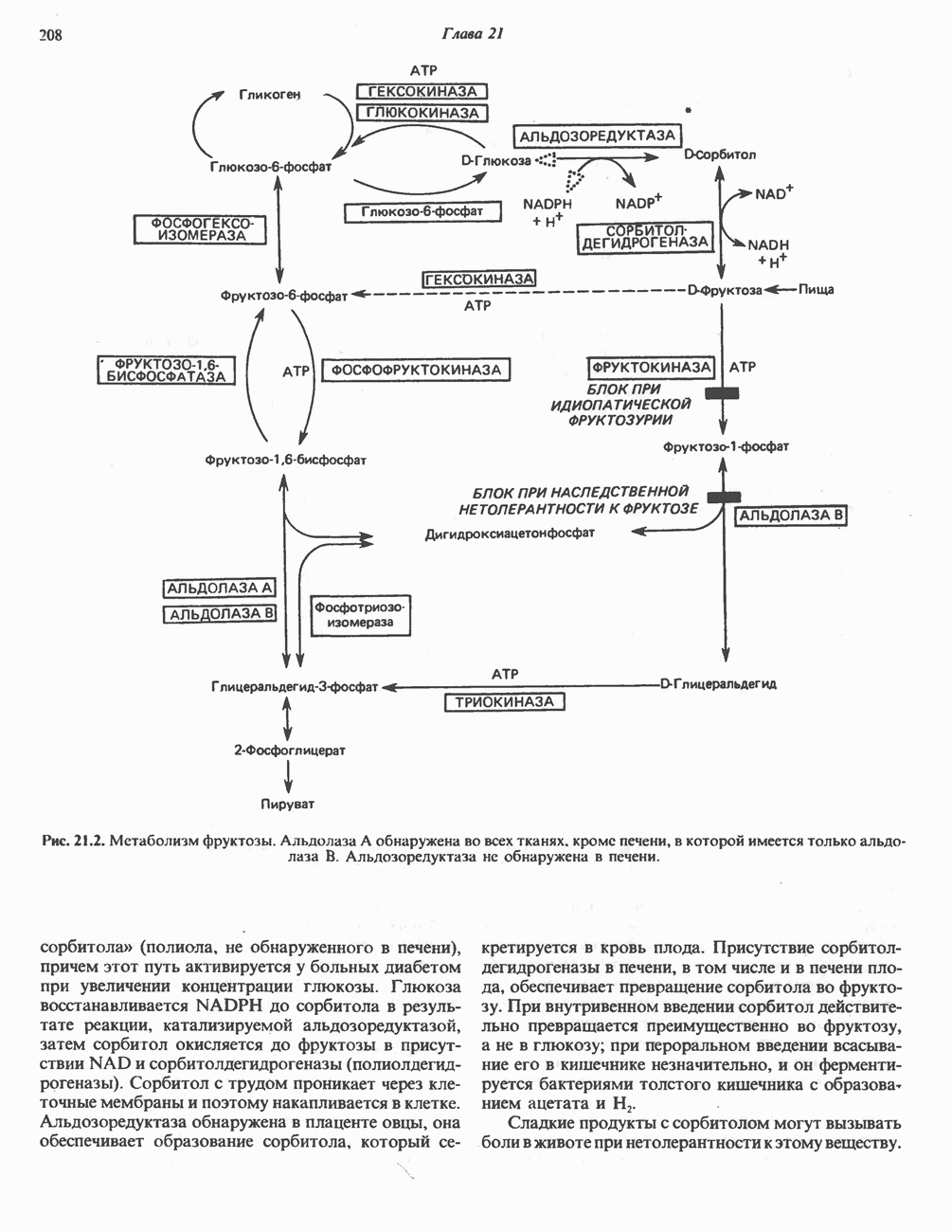
- МЕТАБОЛИЗМ ФРУКТОЗЫ
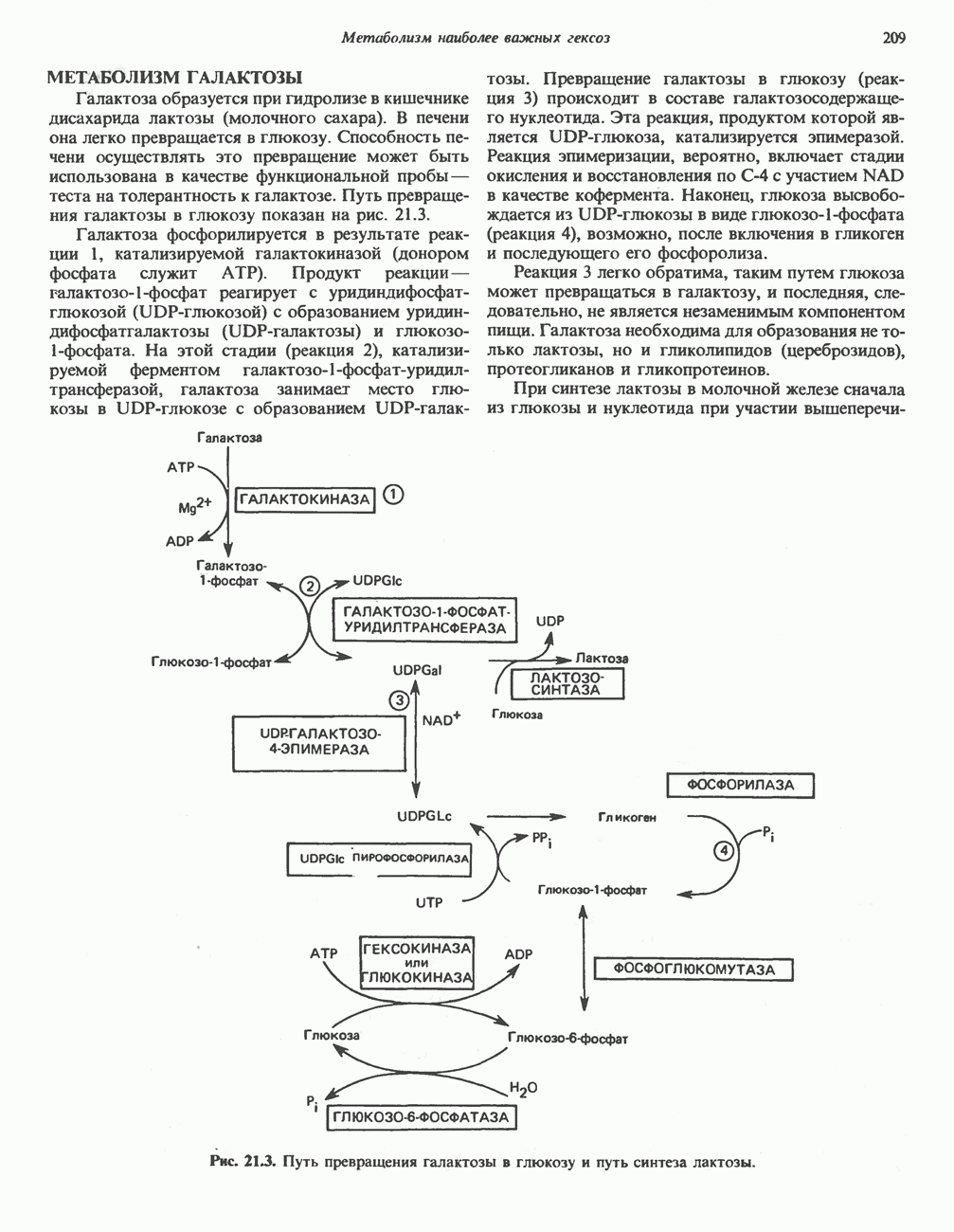
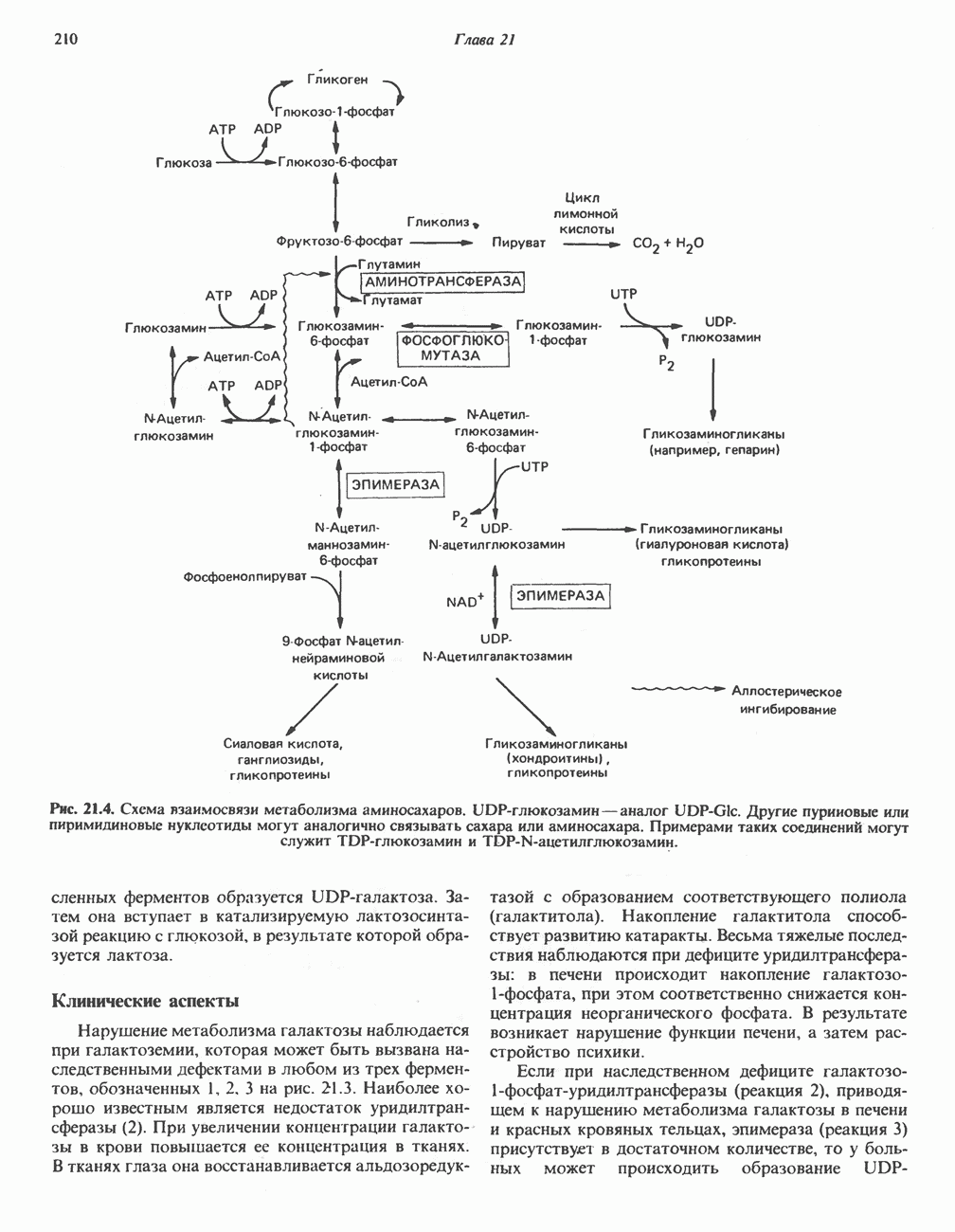
- МЕТАБОЛИЗМ ГАЛАКТОЗЫ
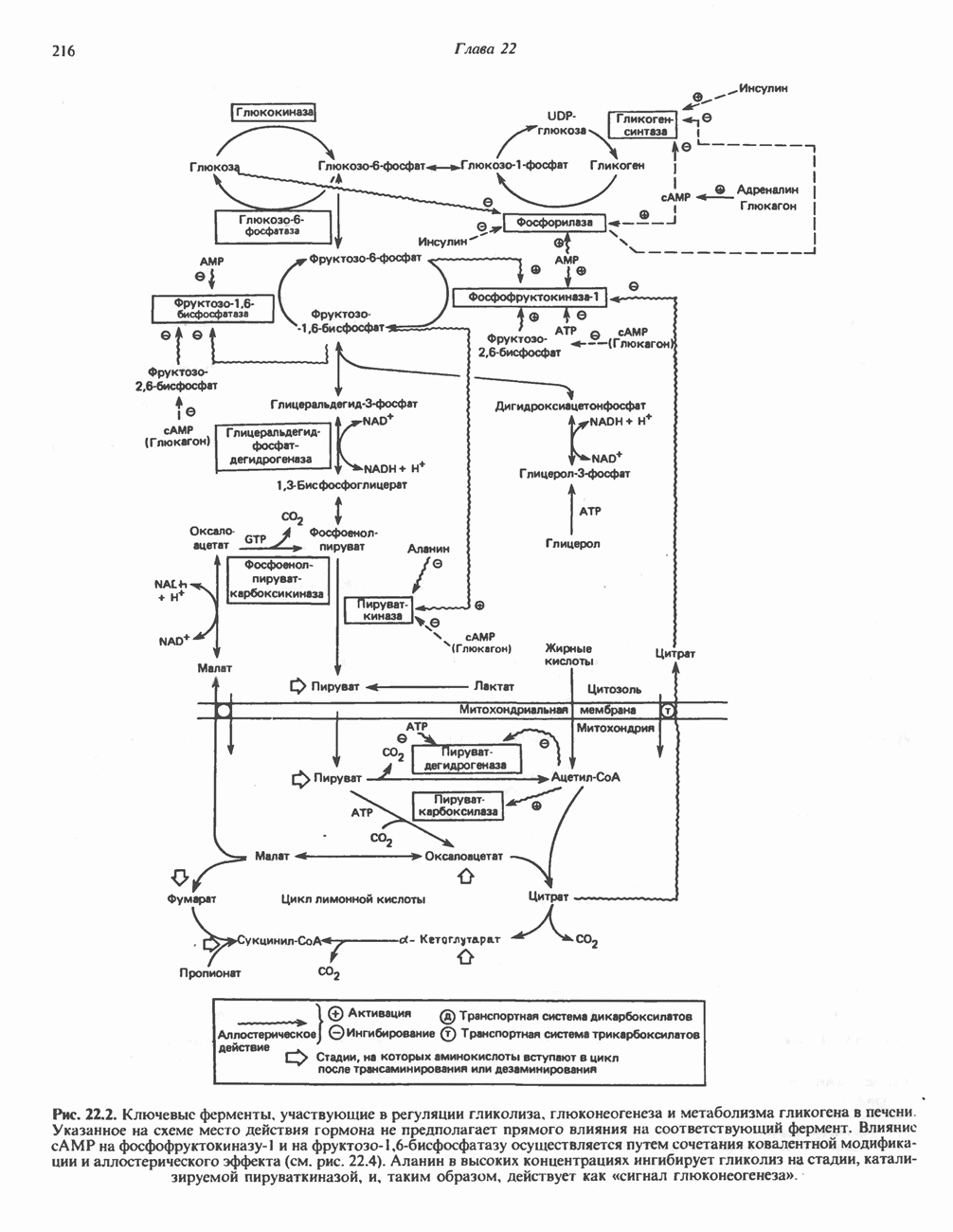
- Глава 22. Регуляция метаболизма углеводов
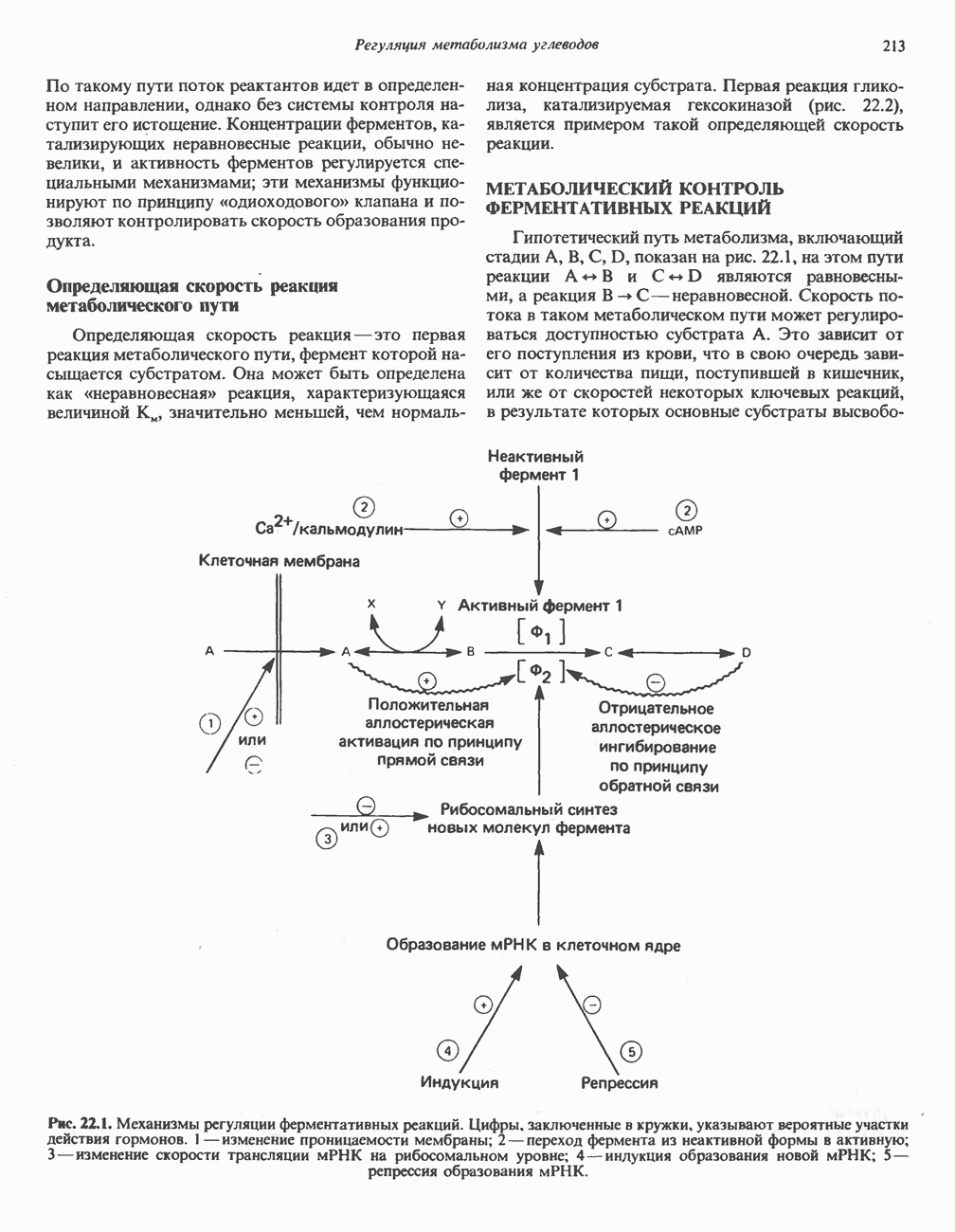
- ОБЩИЕ ПРИНЦИПЫ РЕГУЛЯЦИИ ПУТЕЙ МЕТАБОЛИЗМА
- МЕТАБОЛИЧЕСКИЙ КОНТРОЛЬ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА УГЛЕВОДОВ НА КЛЕТОЧНОМ И ФЕРМЕНТНОМ УРОВНЕ
- РЕГУЛЯЦИЯ ГЛИКОЛИЗА, ГЛЮКОНЕОГЕНЕЗА И ПЕНТОЗОФОСФАТНОГО ПУТИ
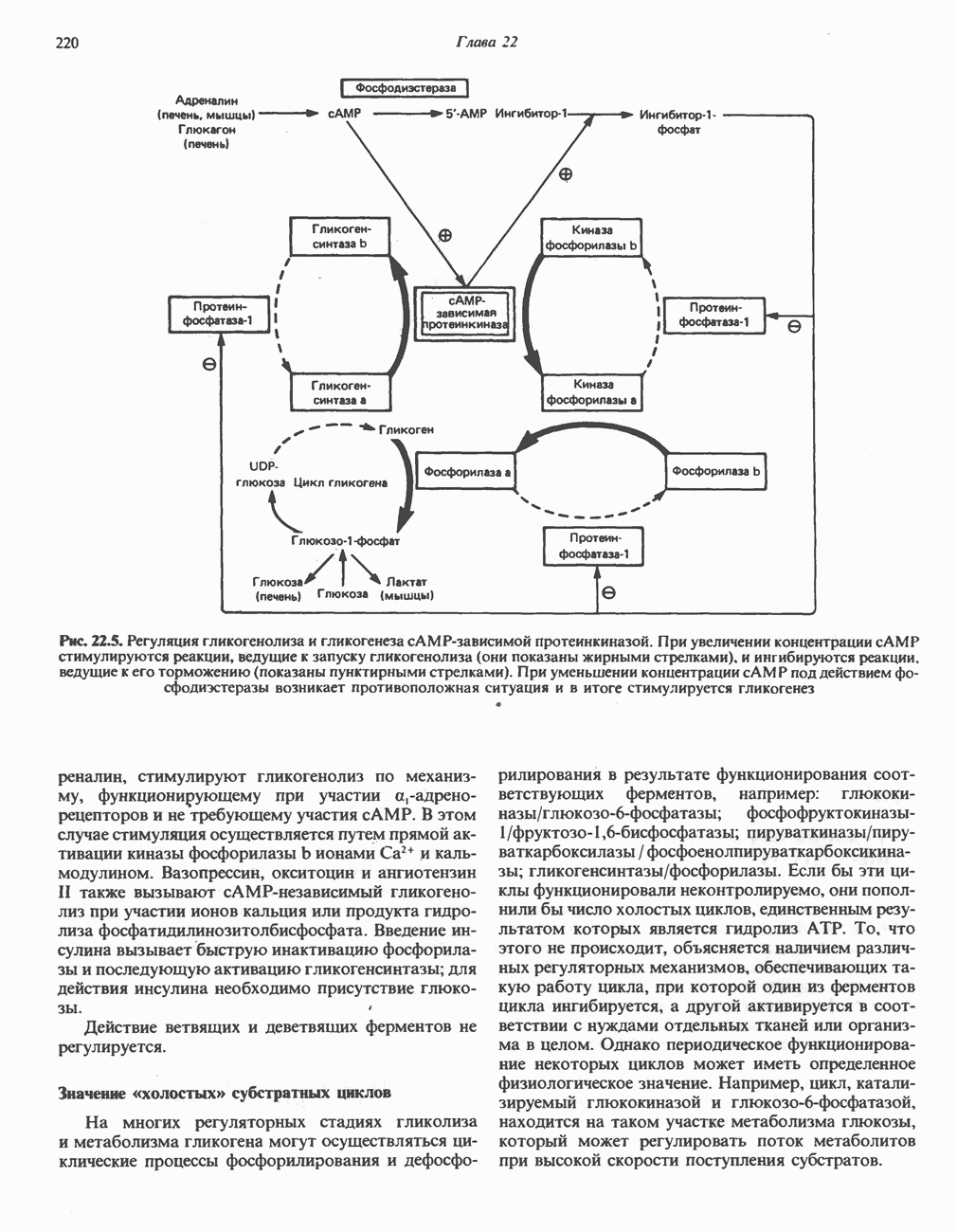
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ГЛИКОГЕНА (РИС. 22.5)
- РЕГУЛЯЦИЯ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (СМ. РИС. 18.3)
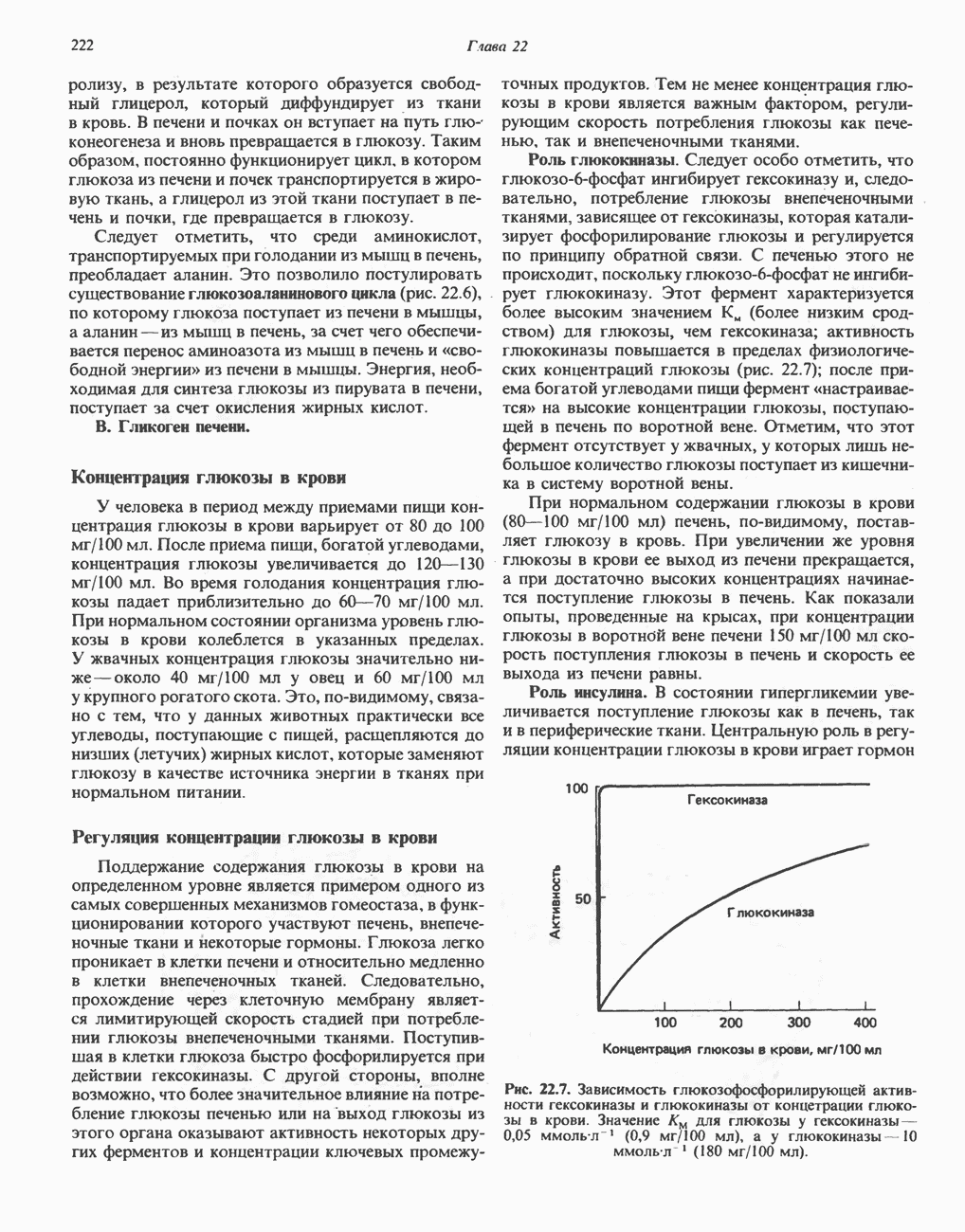
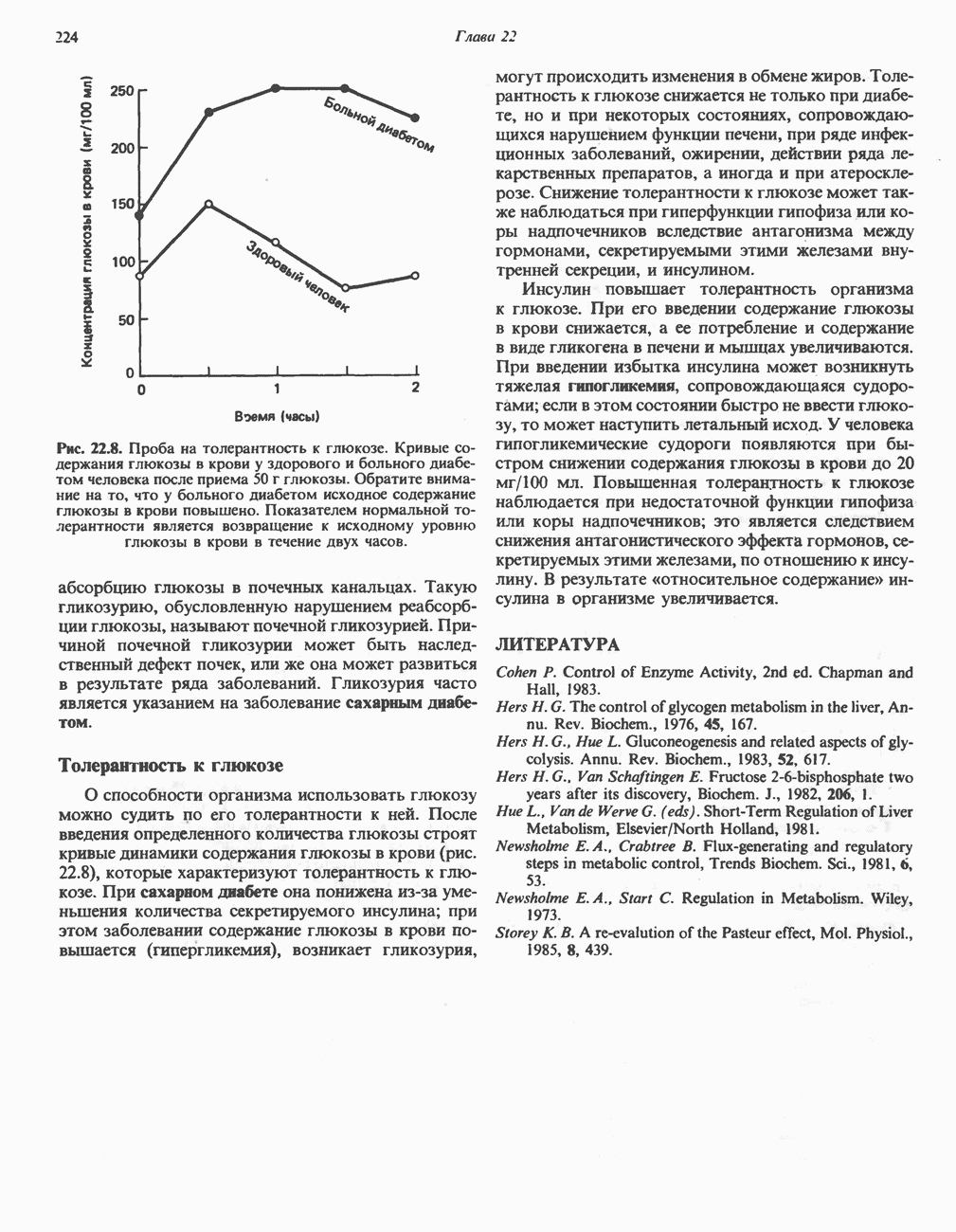
- РЕГУЛЯЦИЯ УРОВНЯ ГЛЮКОЗЫ В КРОВИ
- Глава 23. Окисление и биосинтез жирных кислот
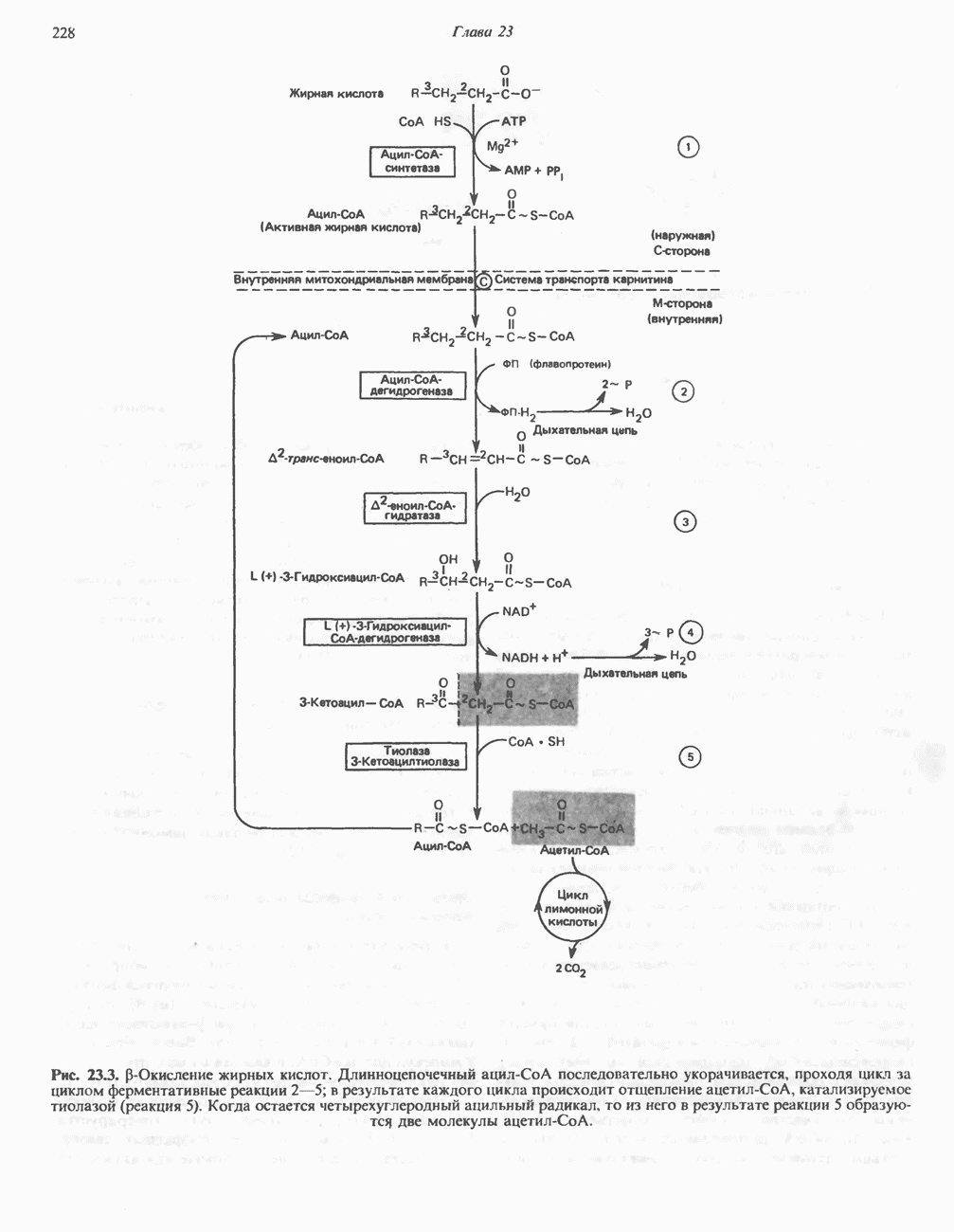
- ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ
- БИОСИНТЕЗ НАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
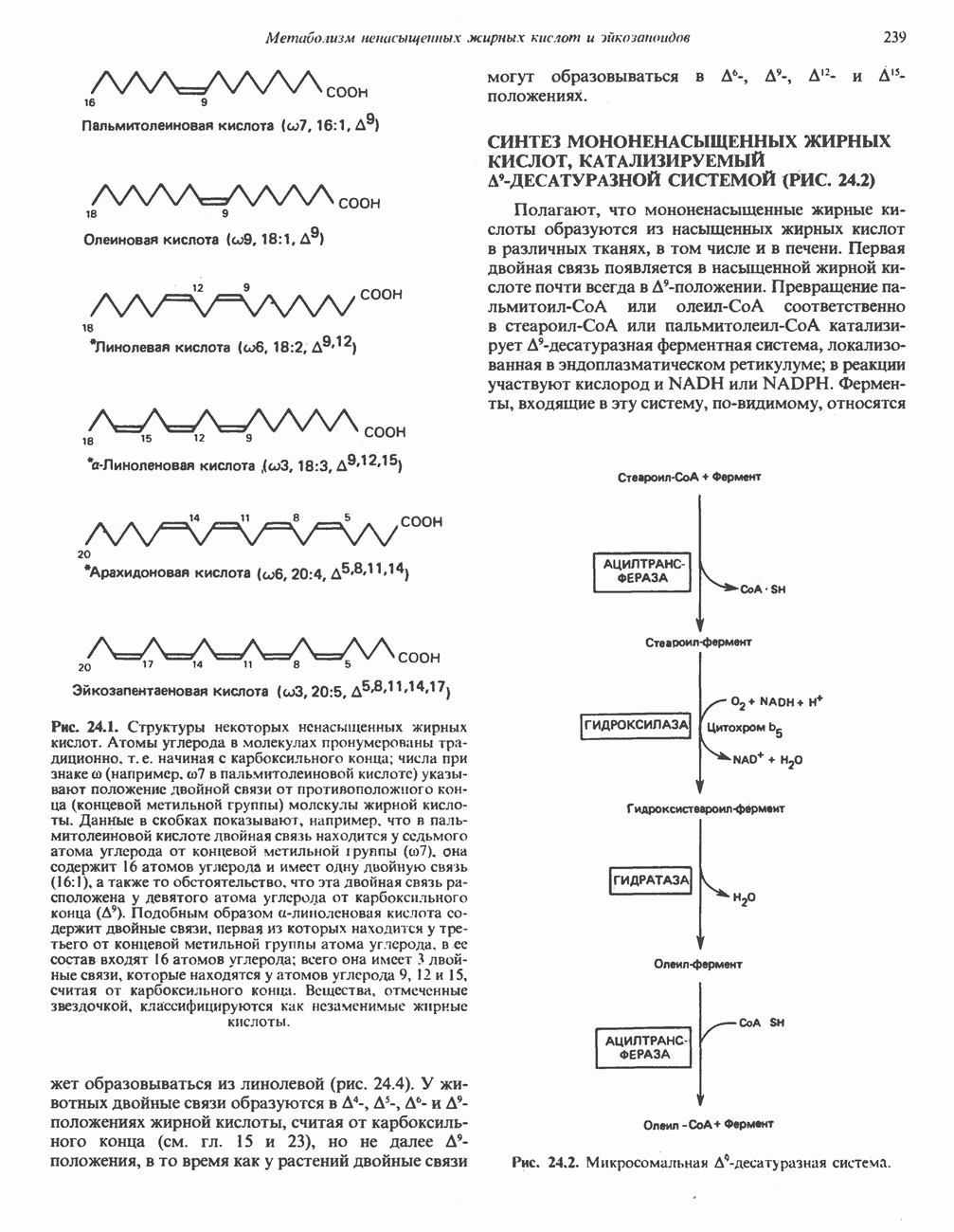
- Глава 24. Метаболизм ненасыщенных жирных кислот и эйкозаноидов
- МЕТАБОЛИЗМ НЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
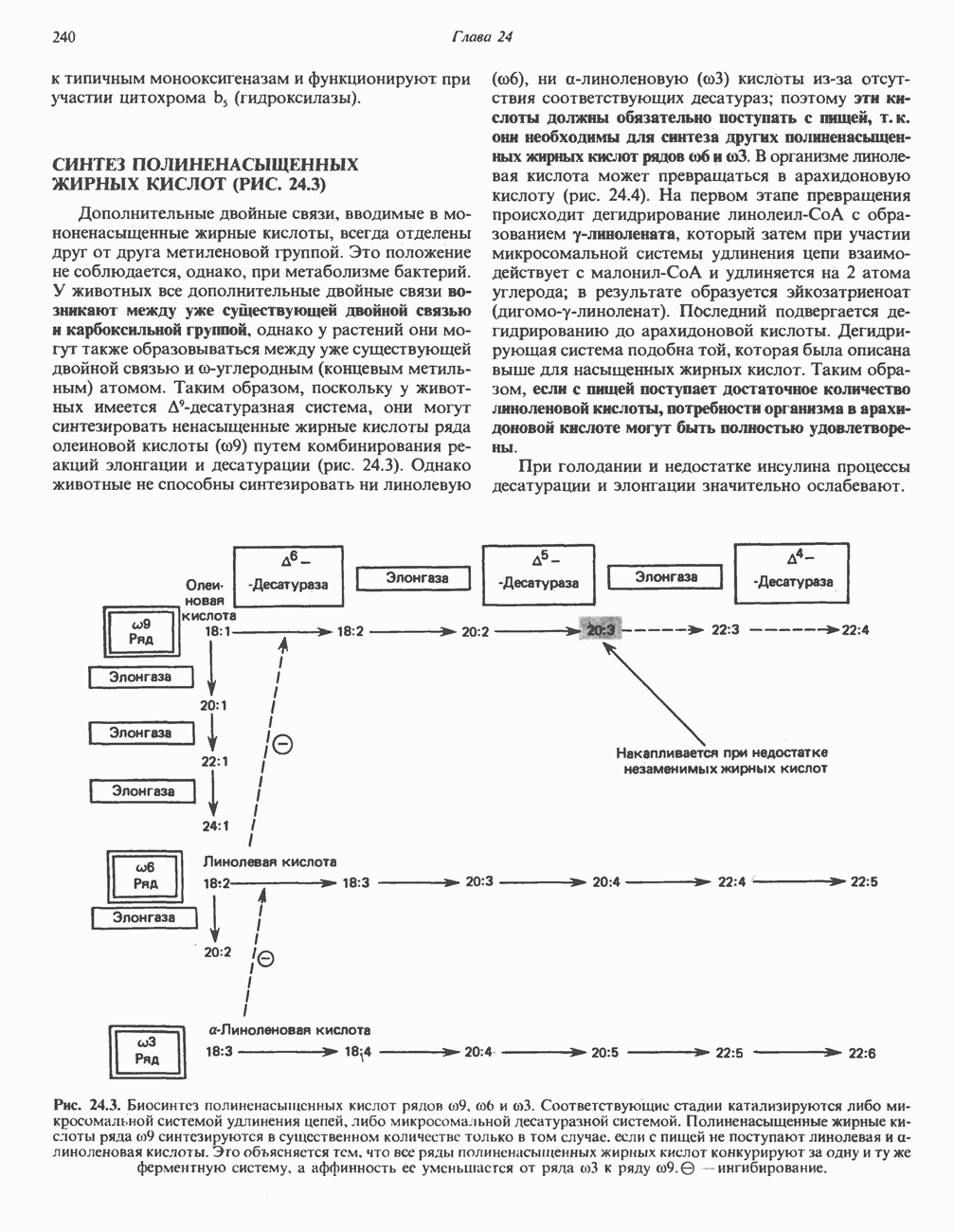
- СИНТЕЗ МОНОНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ, КАТАЛИЗИРУЕМЫЙ Д9-ДЕСАТУРАЗНОЙ СИСТЕМОЙ (РИС. 24.2)
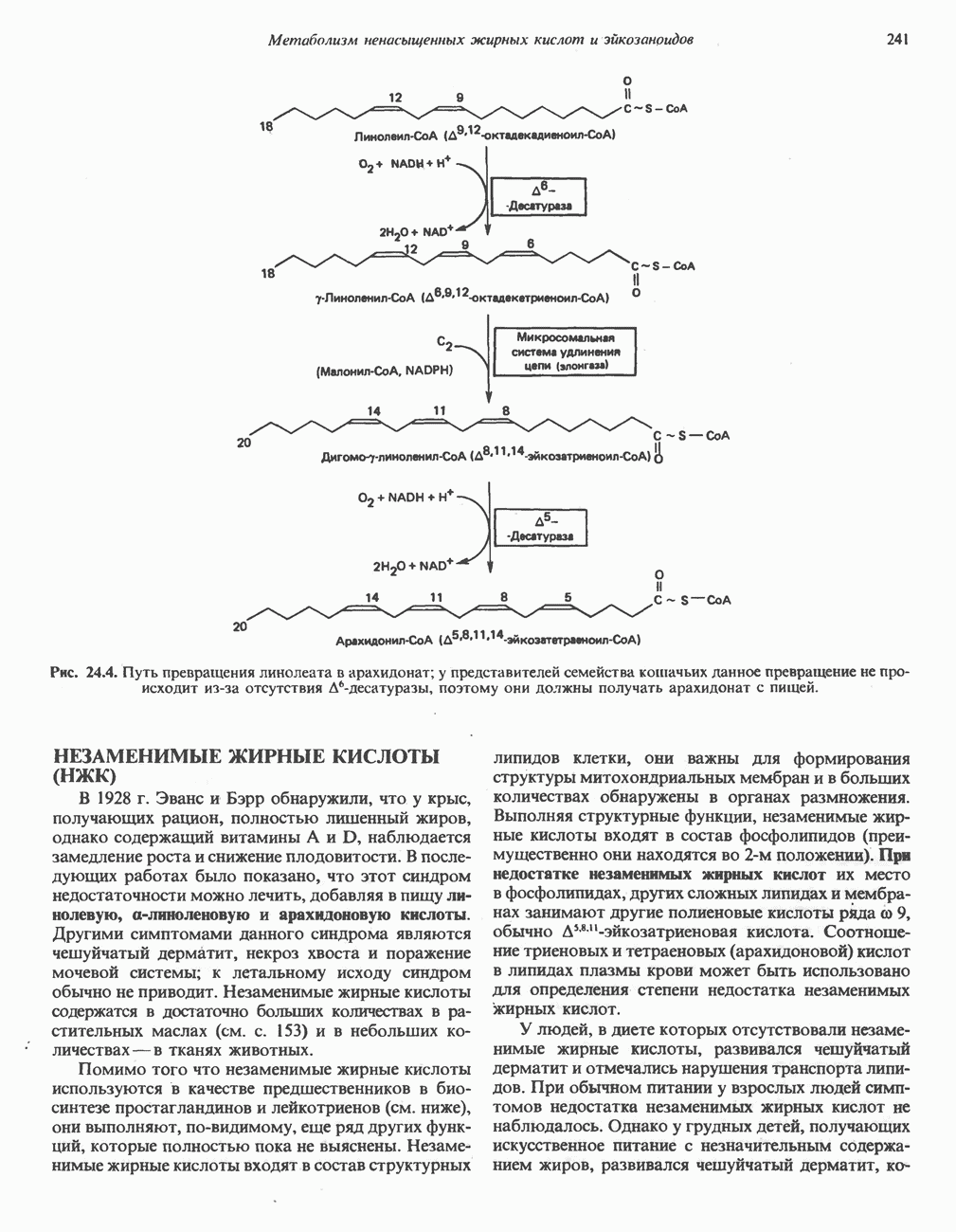
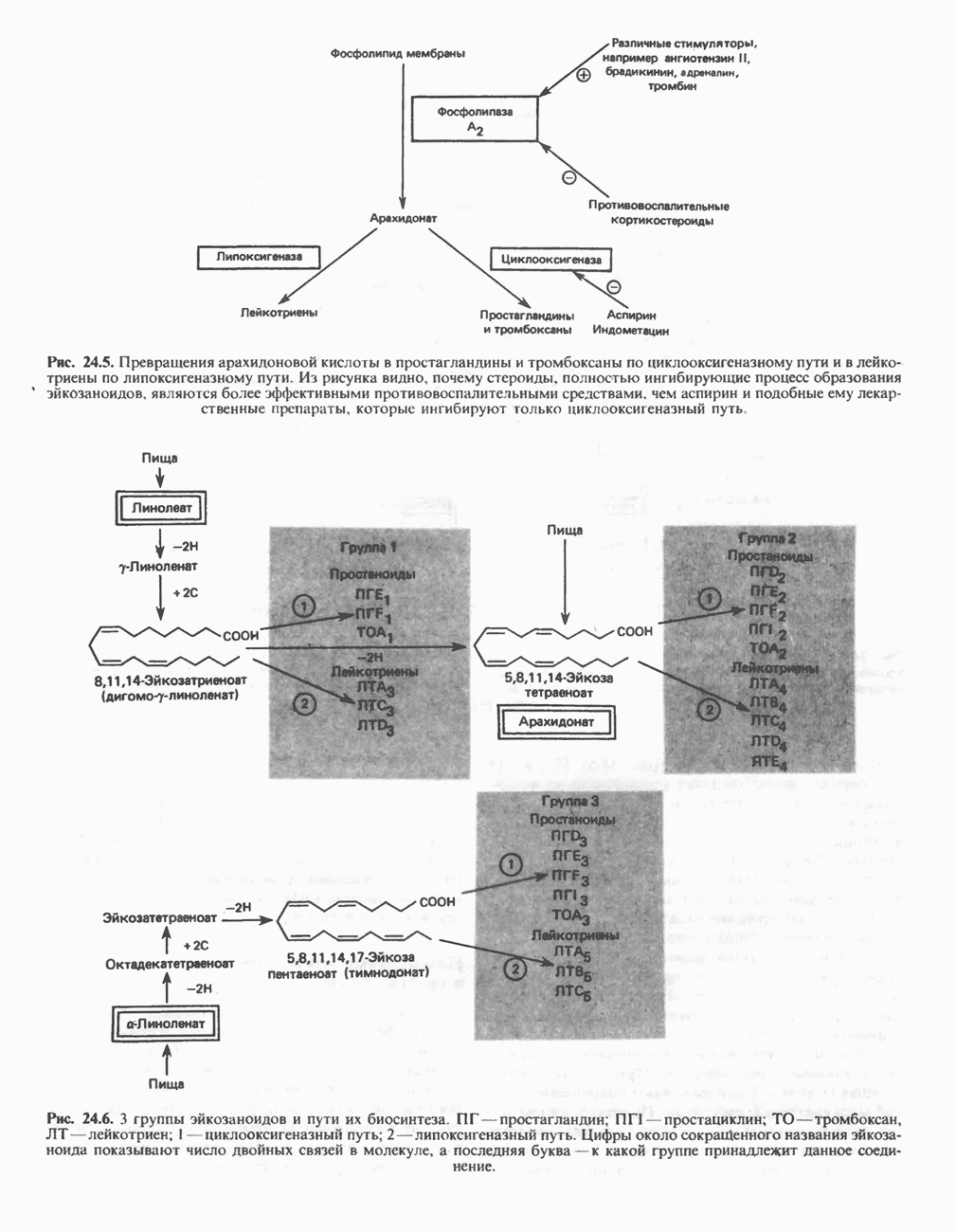
- СИНТЕЗ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ (РИС. 24.3)
- НЕЗАМЕНИМЫЕ ЖИРНЫЕ КИСЛОТЫ (НЖК)
- ЭЙКОЗАНОИДЫ
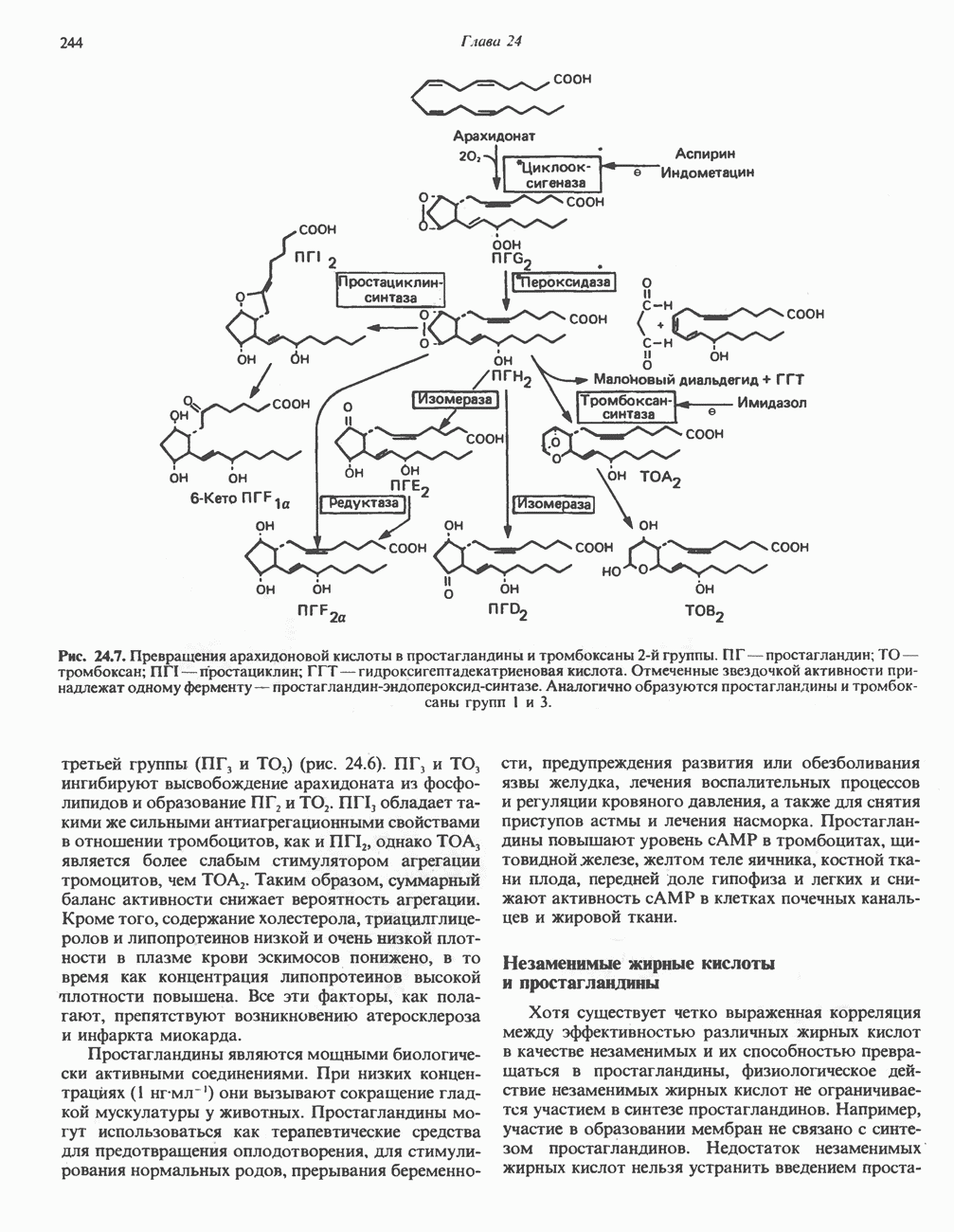
- ПРОСТАНОИДЫ
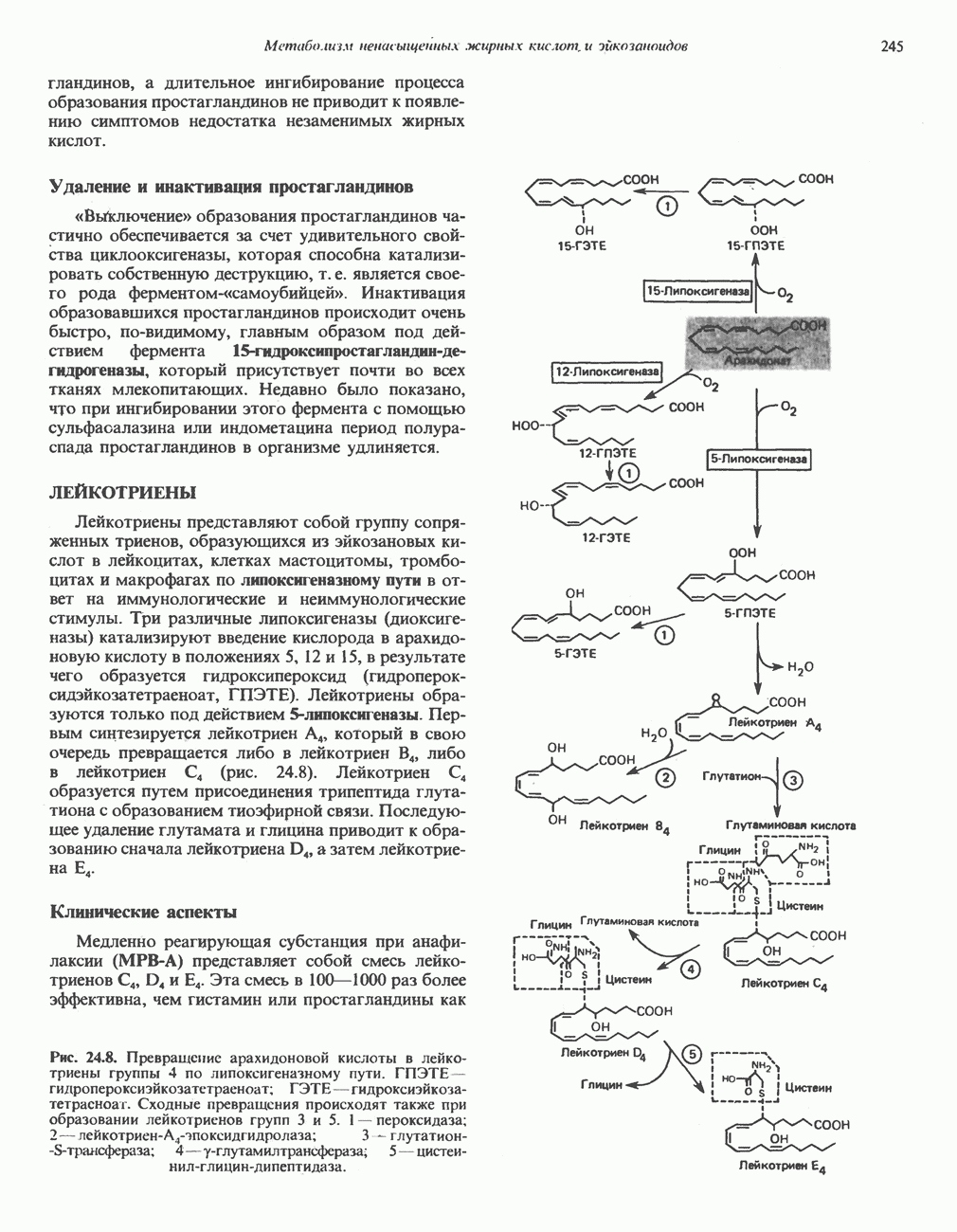
- ЛЕЙКОТРИЕНЫ
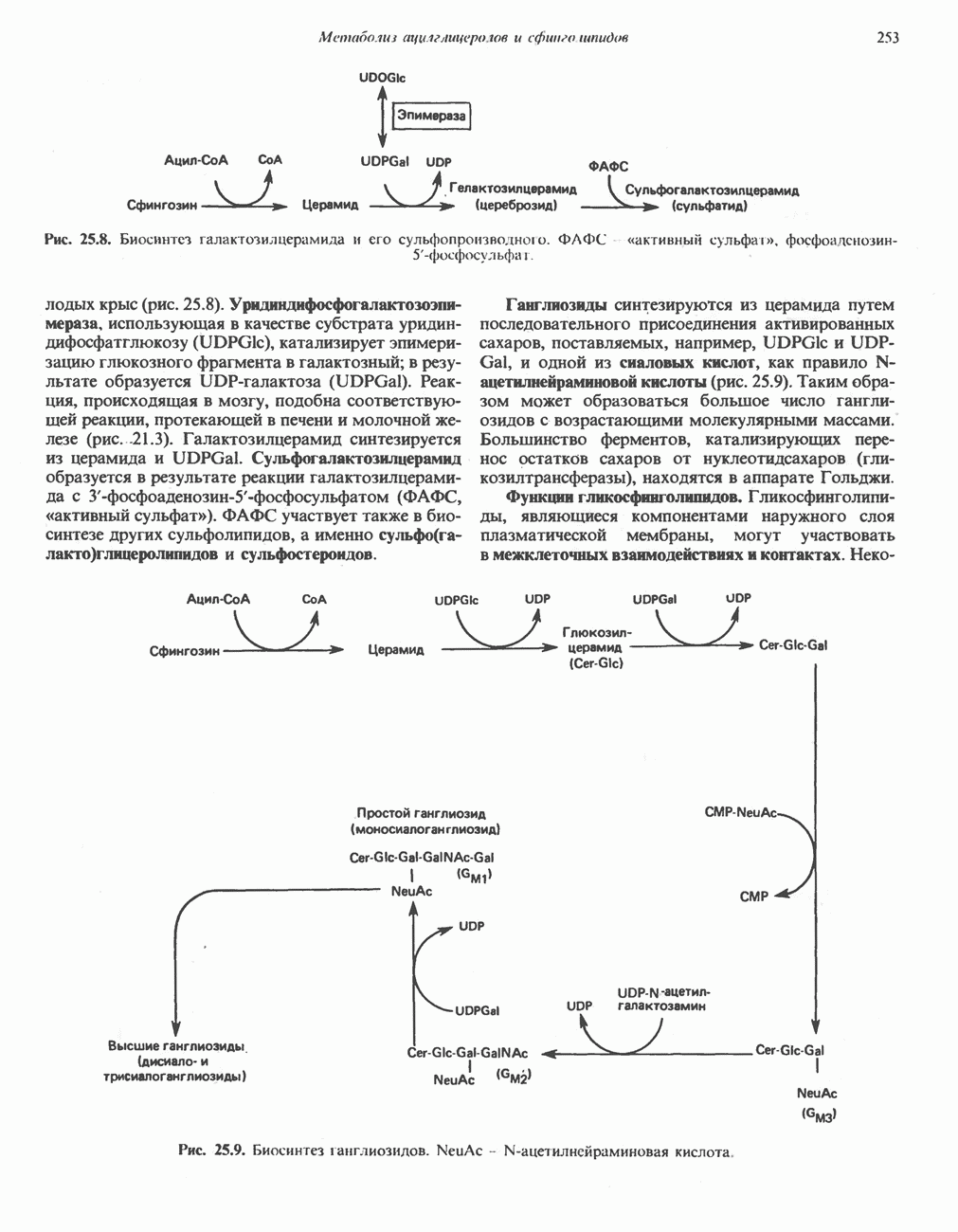
- Глава 25. Метаболизм ацилглицеролов и сфинголипидов
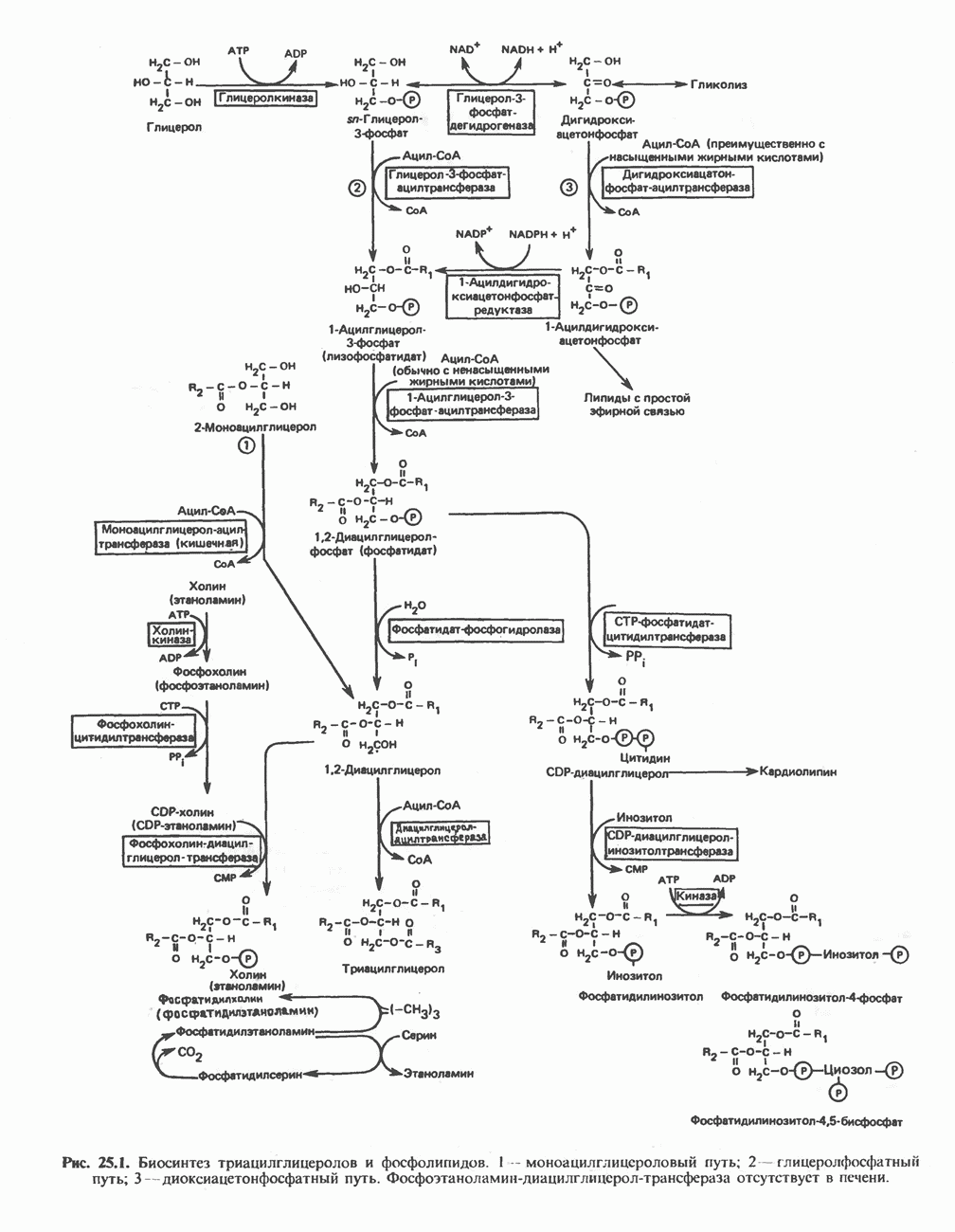
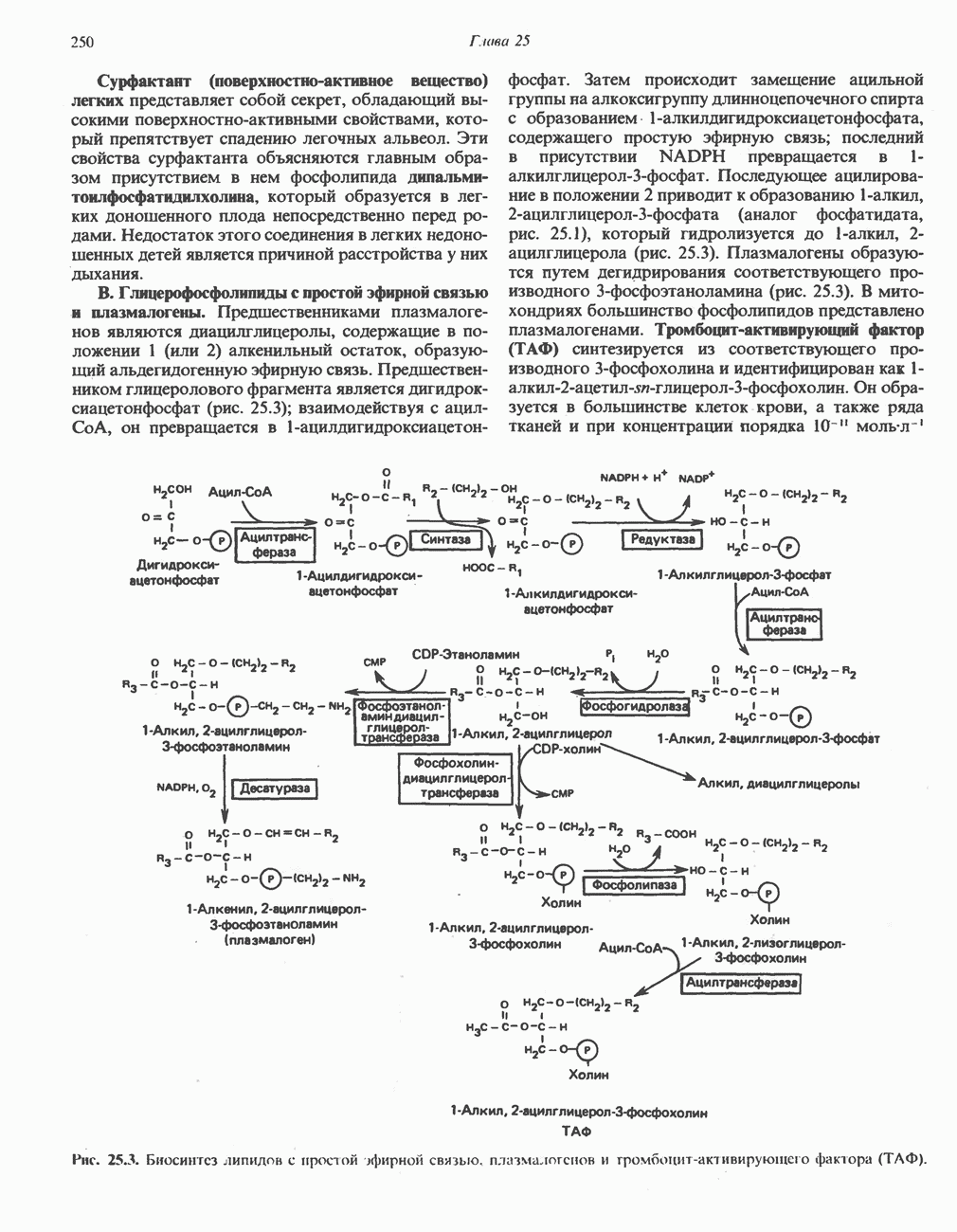
- МЕТАБОЛИЗМ АЦИЛГЛИЦЕРОЛОВ
- МЕТАБОЛИЗМ СФИНГОЛИПИДОВ
- ГЛИКОЛИПИДЫ
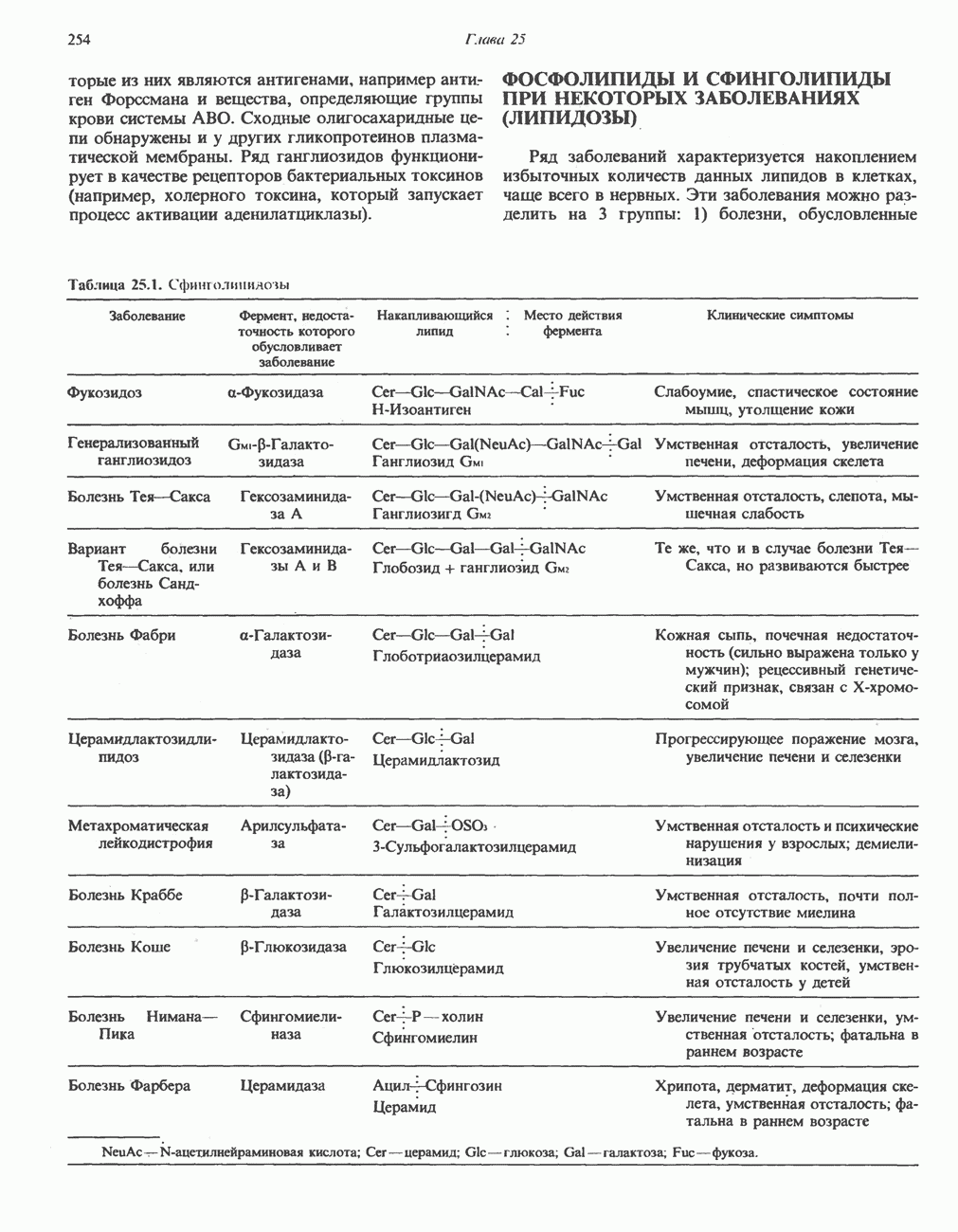
- ФОСФОЛИПИДЫ И СФИНГОЛИПИДЫ ПРИ НЕКОТОРЫХ ЗАБОЛЕВАНИЯХ (ЛИПИДОЗЫ)
- Глава 26. Транспорт и запасание липидов
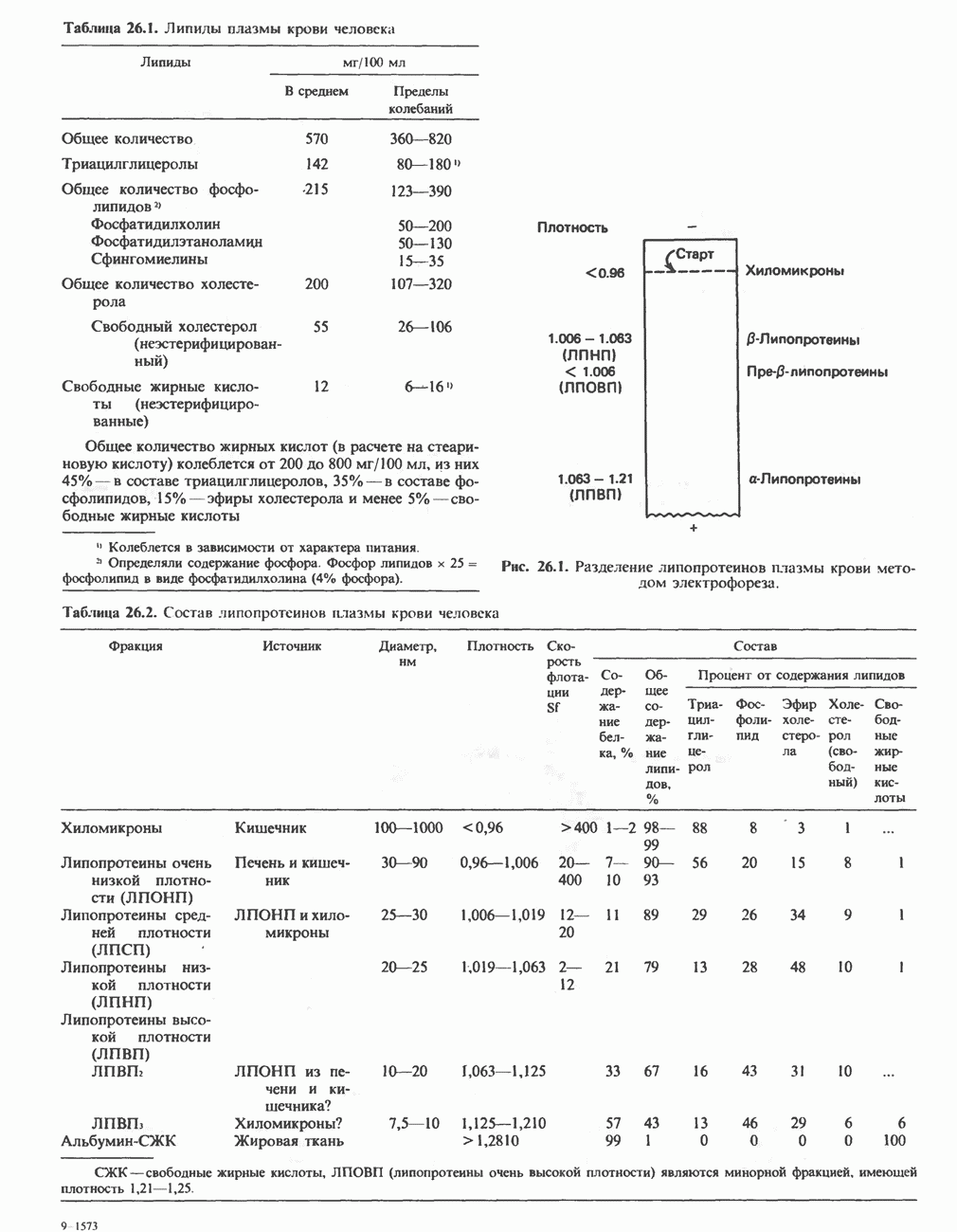
- ЛИПИДЫ ПЛАЗМЫ КРОВИ И ЛИПОПРОТЕИНЫ
- МЕТАБОЛИЗМ ЛИПОПРОТЕИНОВ ПЛАЗМЫ КРОВИ
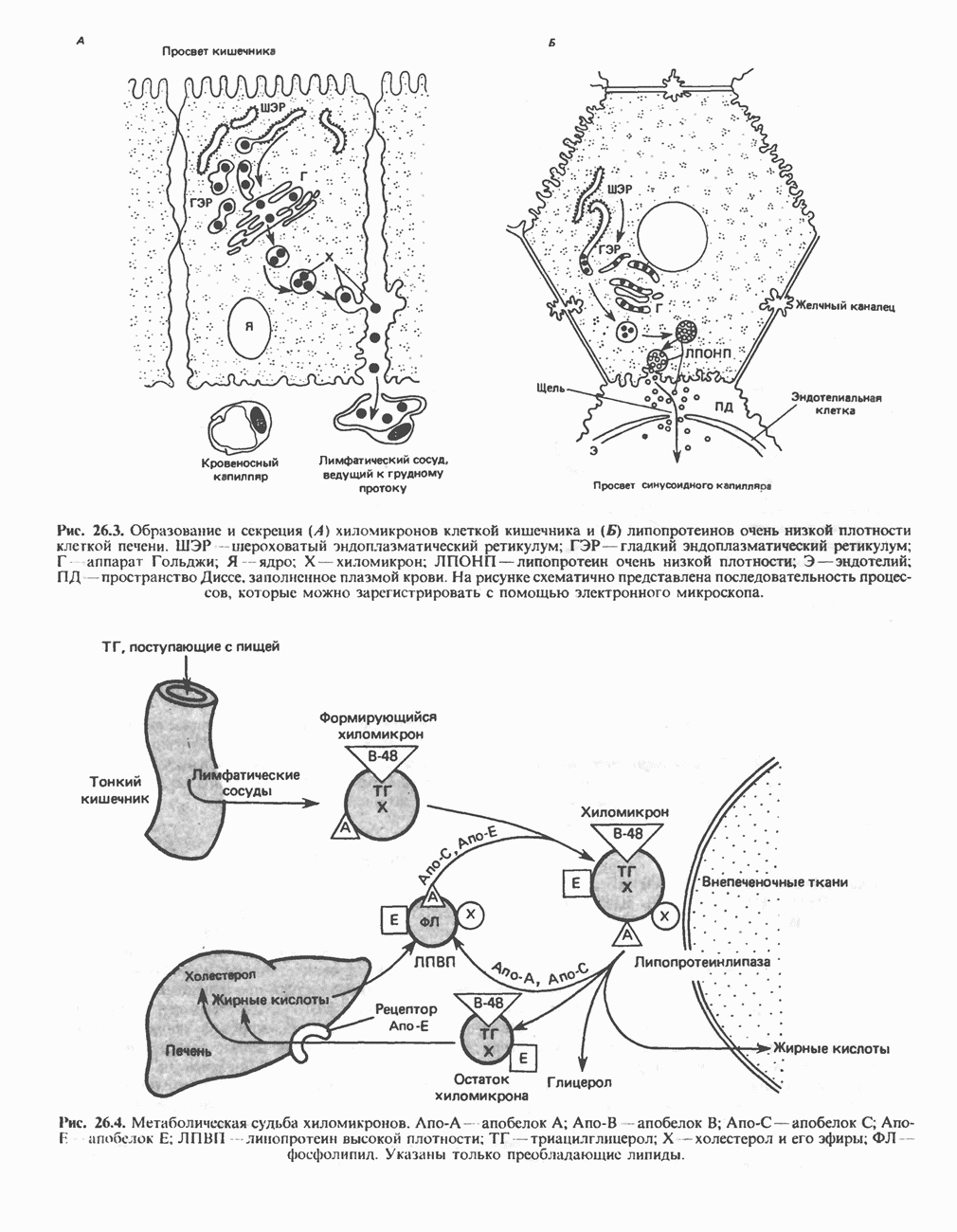
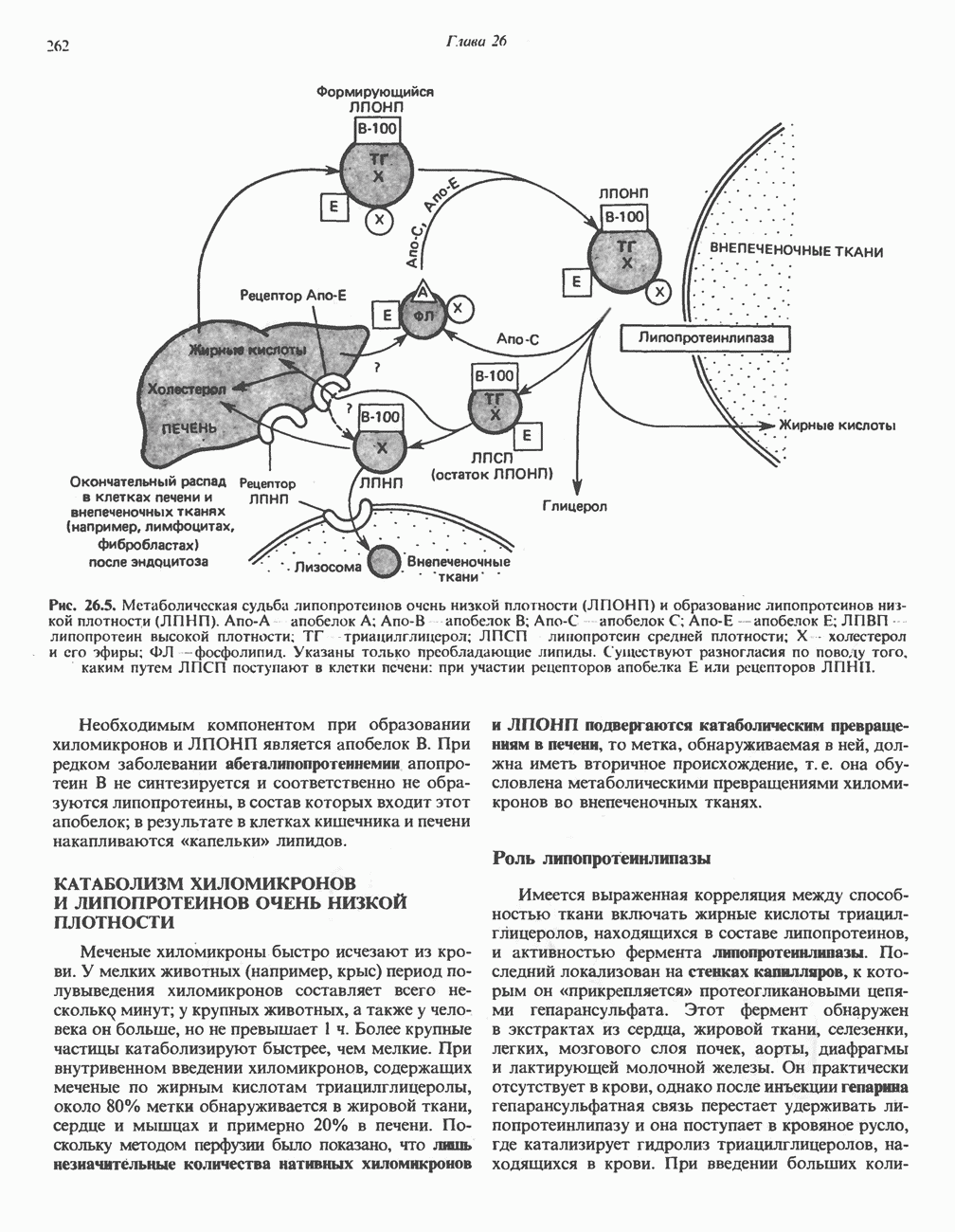
- ОБРАЗОВАНИЕ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ (ЛПОНП)
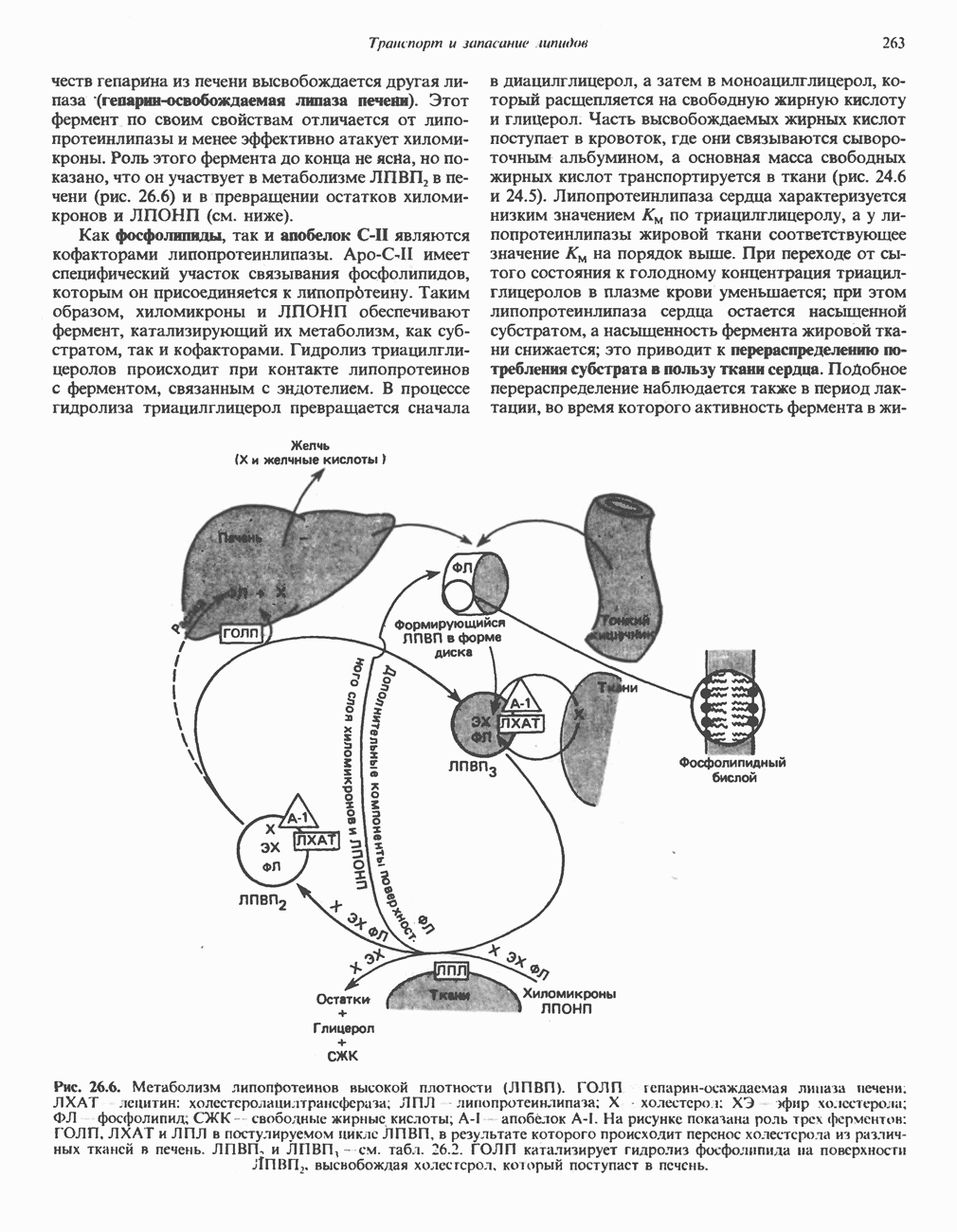
- КАТАБОЛИЗМ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ
- МЕТАБОЛИЗМ ЛПНП
- МЕТАБОЛИЗМ ЛПВП (рис. 26.6)
- РОЛЬ ПЕЧЕНИ В ТРАНСПОРТЕ И МЕТАБОЛИЗМЕ ЛИПИДОВ
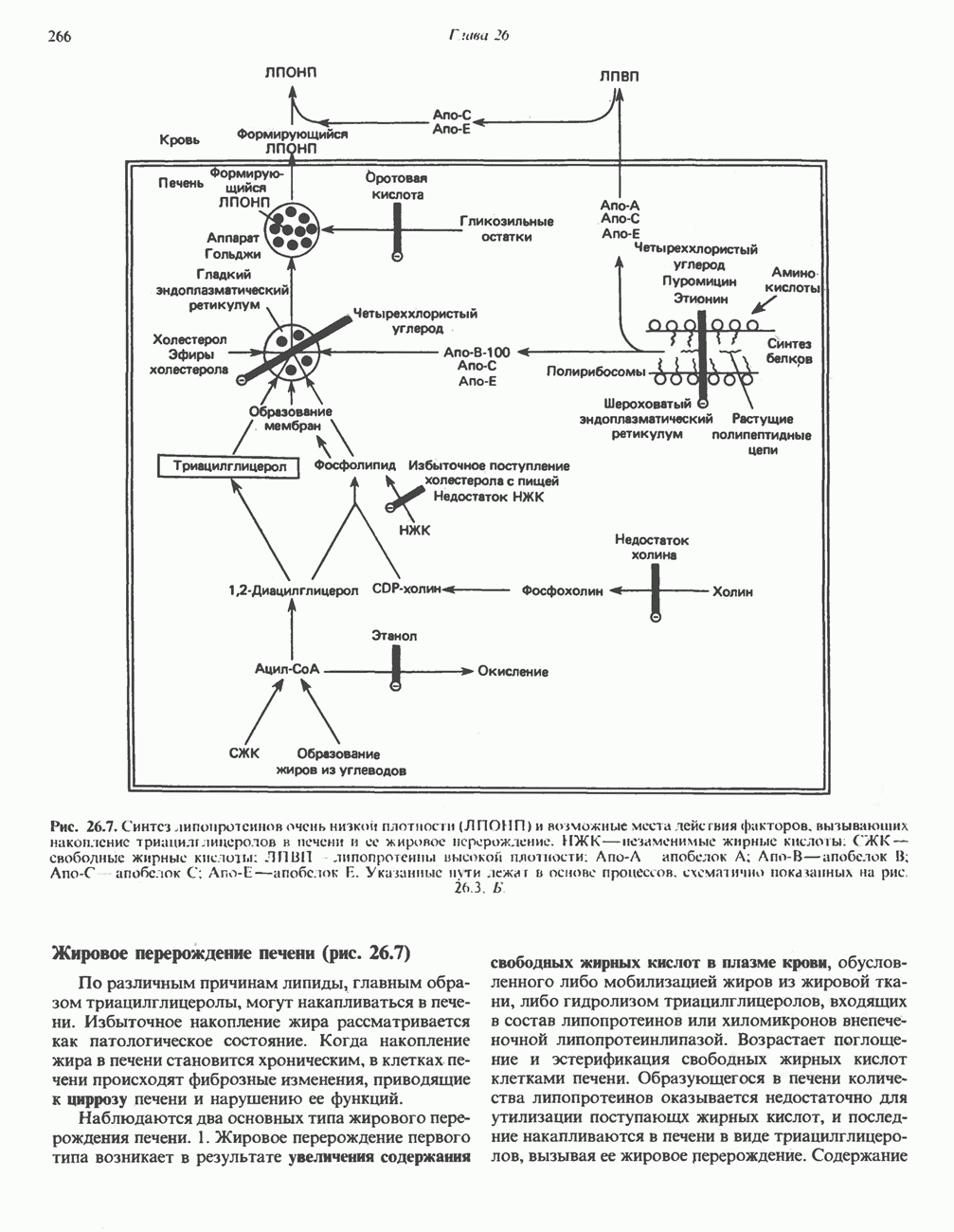
- СИНТЕЗ ТРИАЦИЛГЛИЦЕРОЛОВ И ОБРАЗОВАНИЕ ЛПОНП (рис. 26.7)
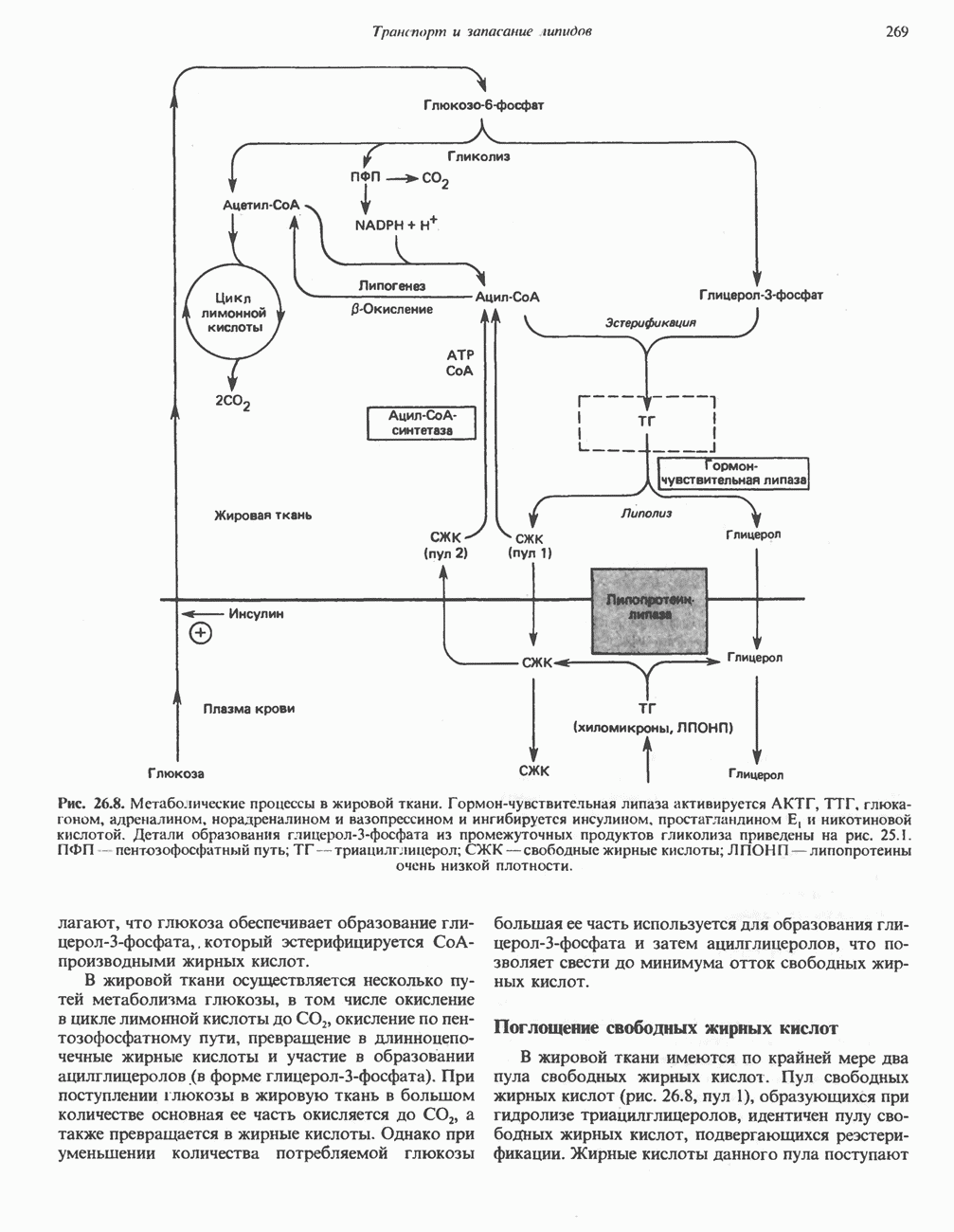
- МЕТАБОЛИЧЕСКИЕ ПРЕВРАЩЕНИЯ В ЖИРОВОЙ ТКАНИ И МОБИЛИЗАЦИЯ ЖИРОВ
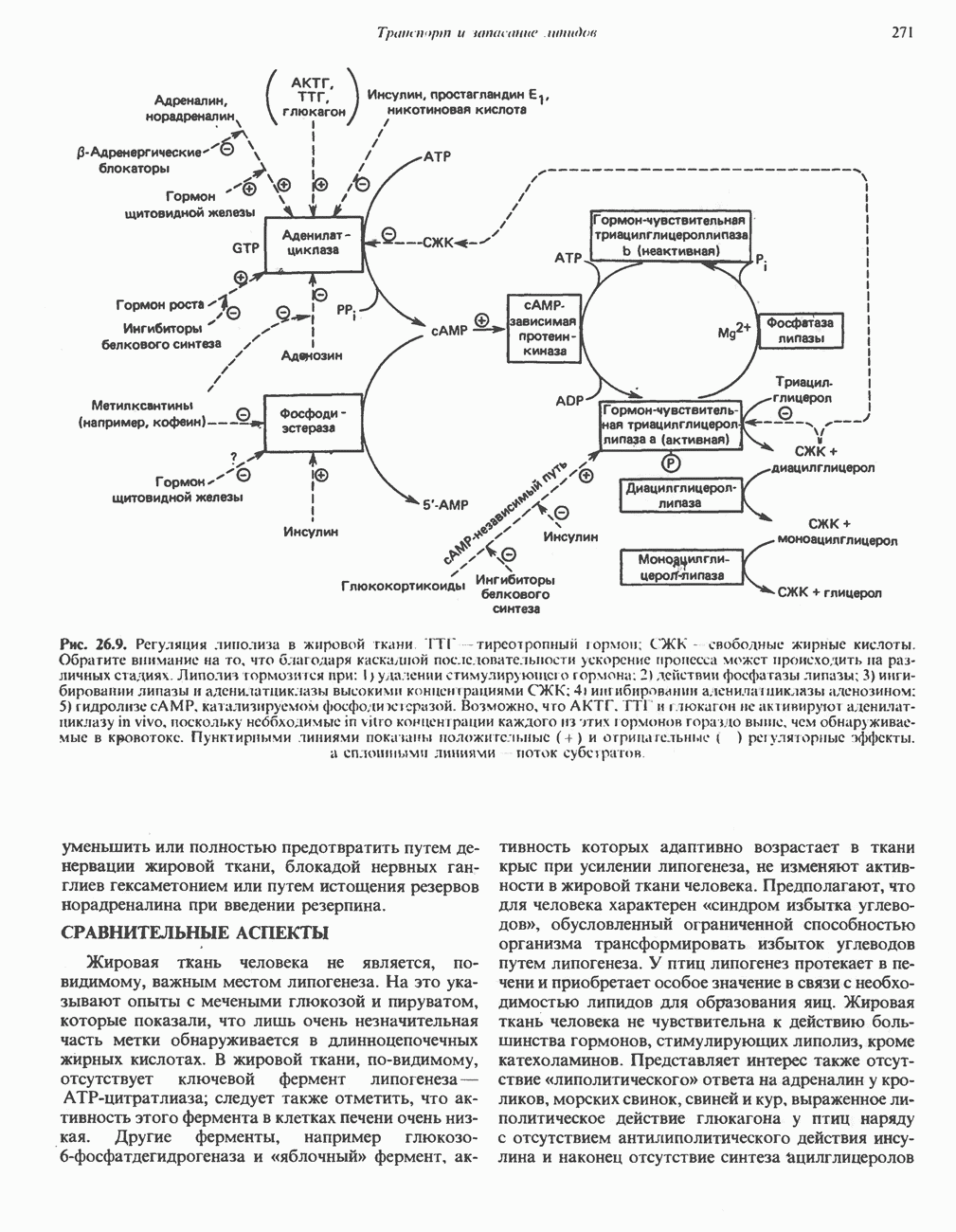
- РОЛЬ ГОРМОНОВ В МОБИЛИЗАЦИИ ЖИРОВ
- СРАВНИТЕЛЬНЫЕ АСПЕКТЫ
- РОЛЬ БУРОЙ ЖИРОВОЙ ТКАНИ В ТЕРМОГЕНЕЗЕ
- Глава 27. Синтез, транспорт и экскреция холестерола
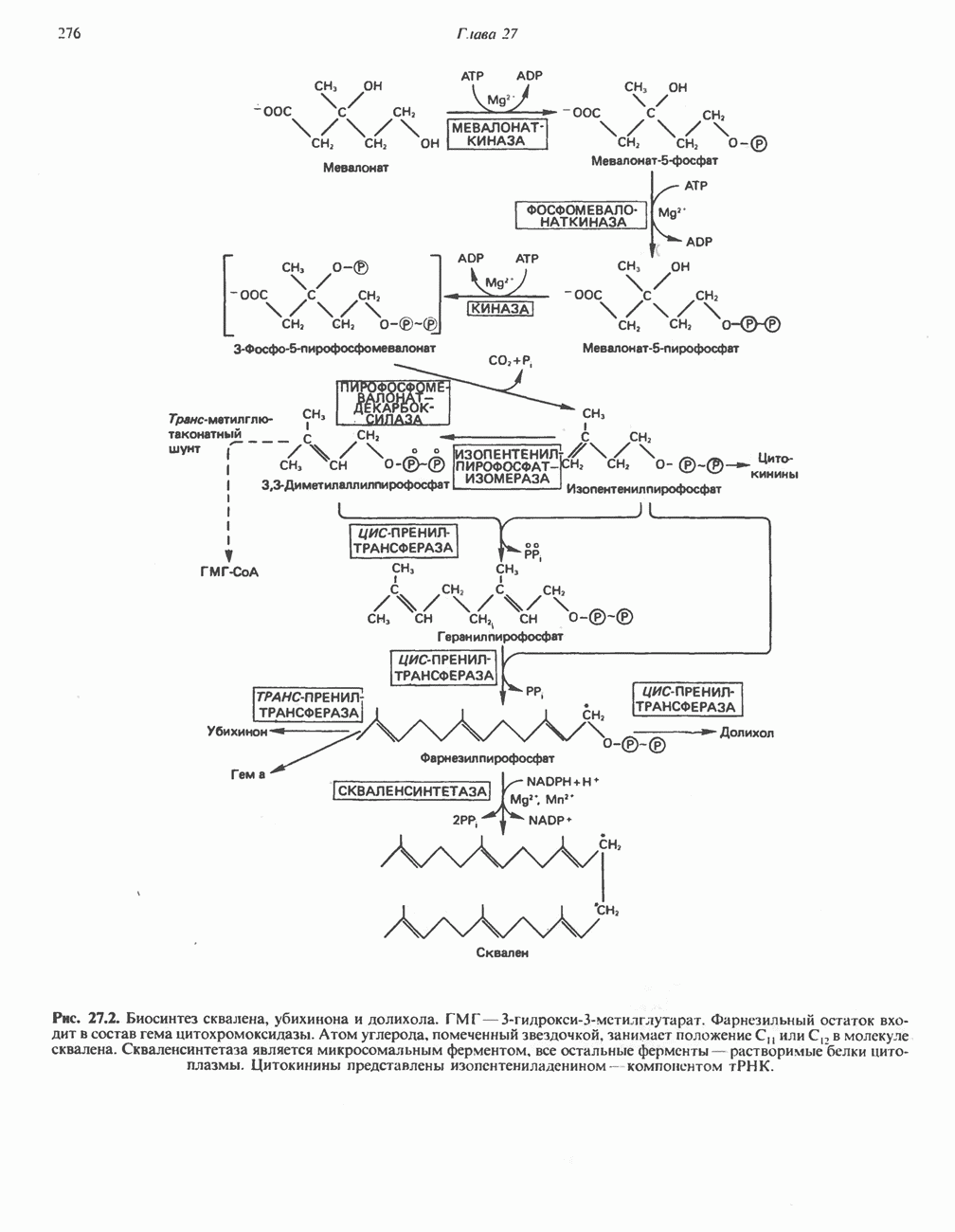
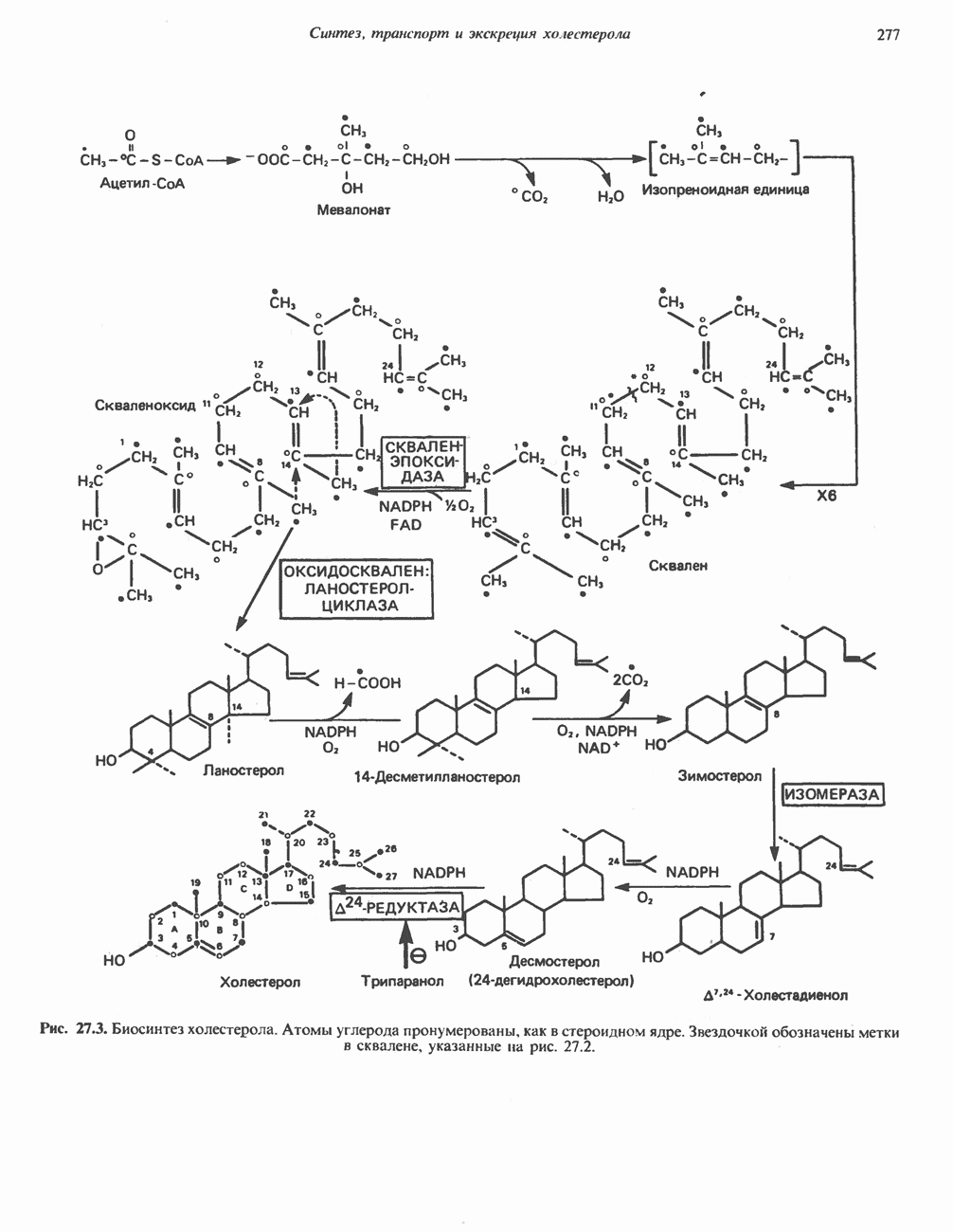
- БИОСИНТЕЗ ХОЛЕСТЕРОЛА
- РЕГУЛЯЦИЯ СИНТЕЗА ХОЛЕСТЕРОЛА
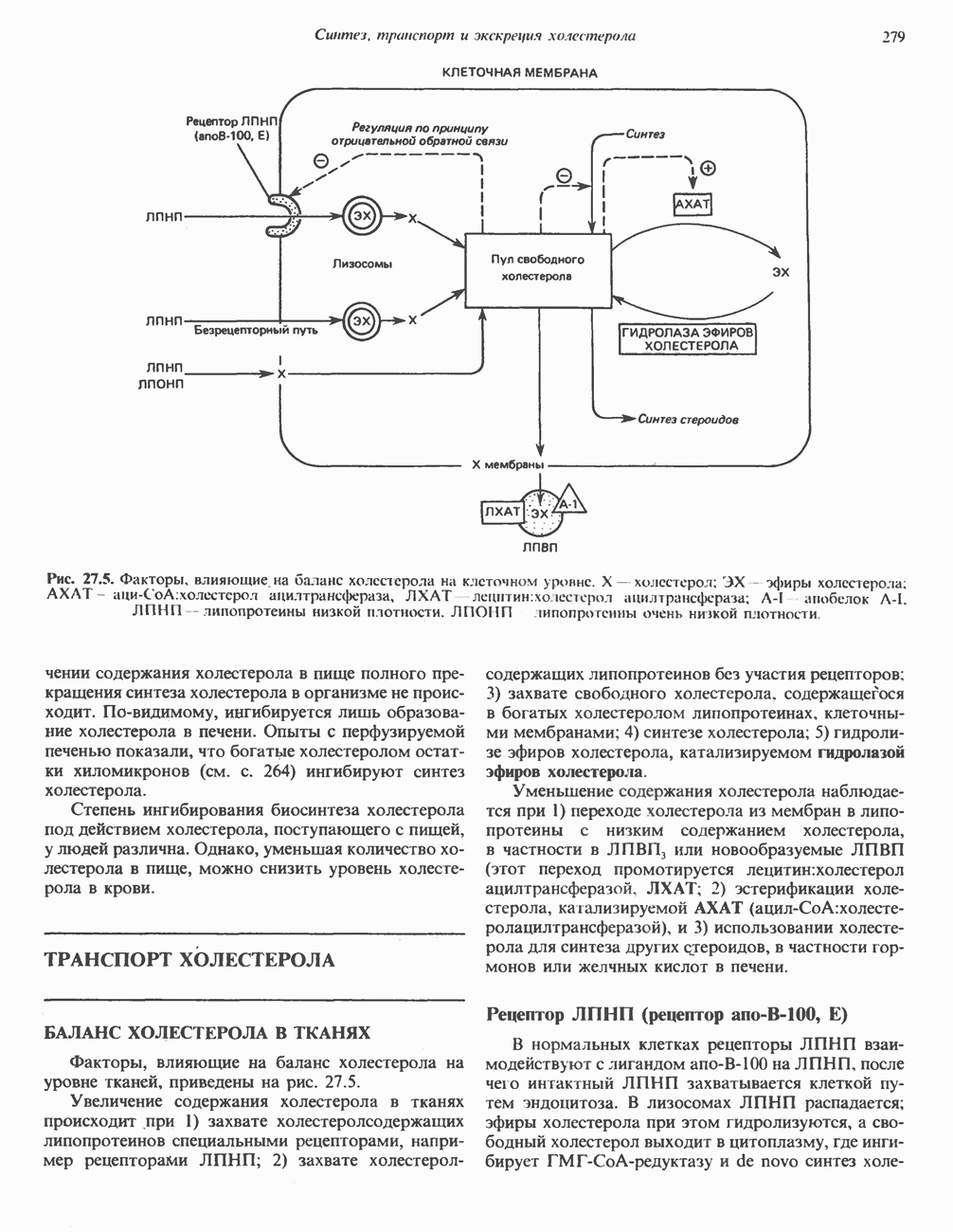
- ТРАНСПОРТ ХОЛЕСТЕРОЛА
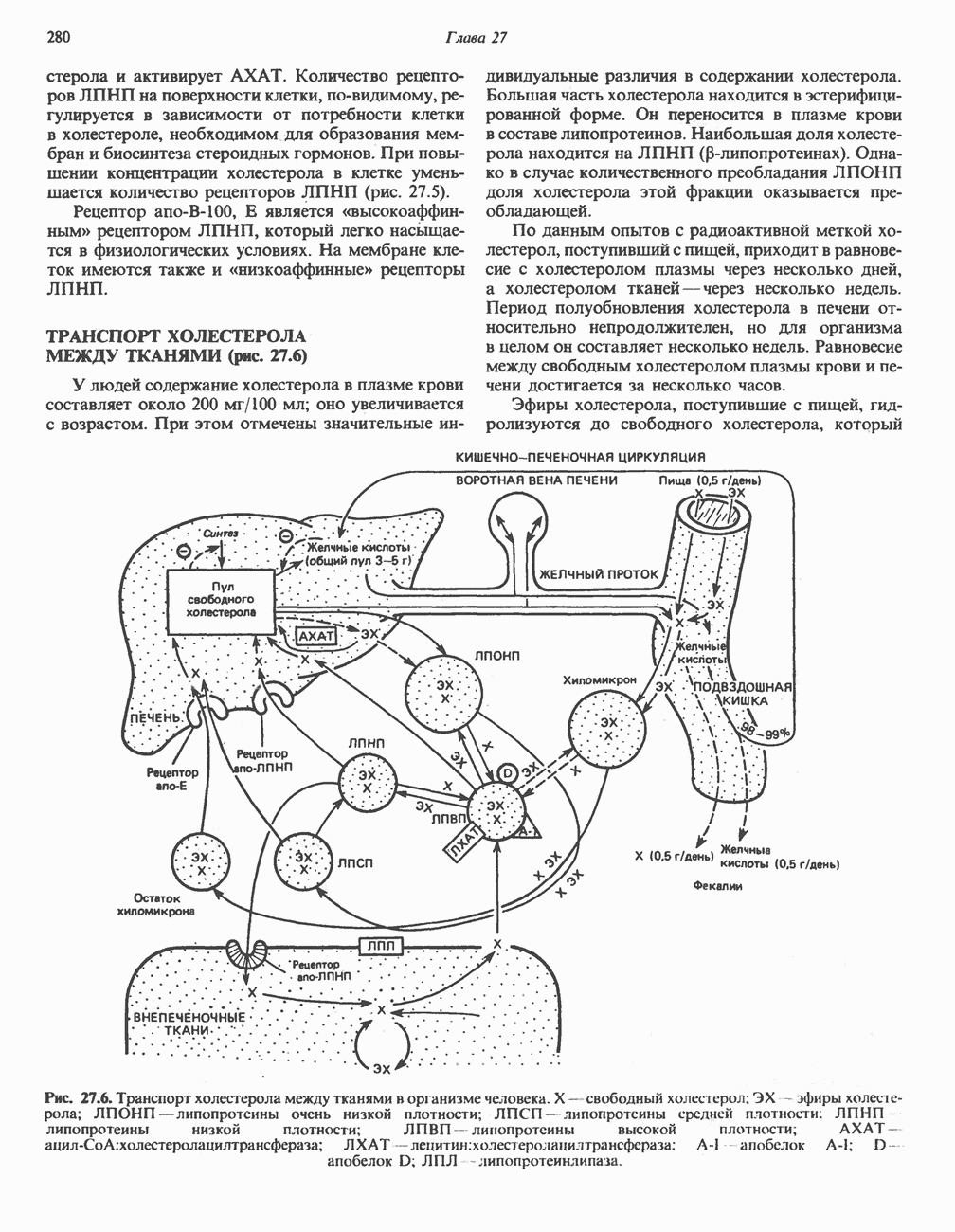
- ТРАНСПОРТ ХОЛЕСТЕРОЛА МЕЖДУ ТКАНЯМИ (рис. 27.6)
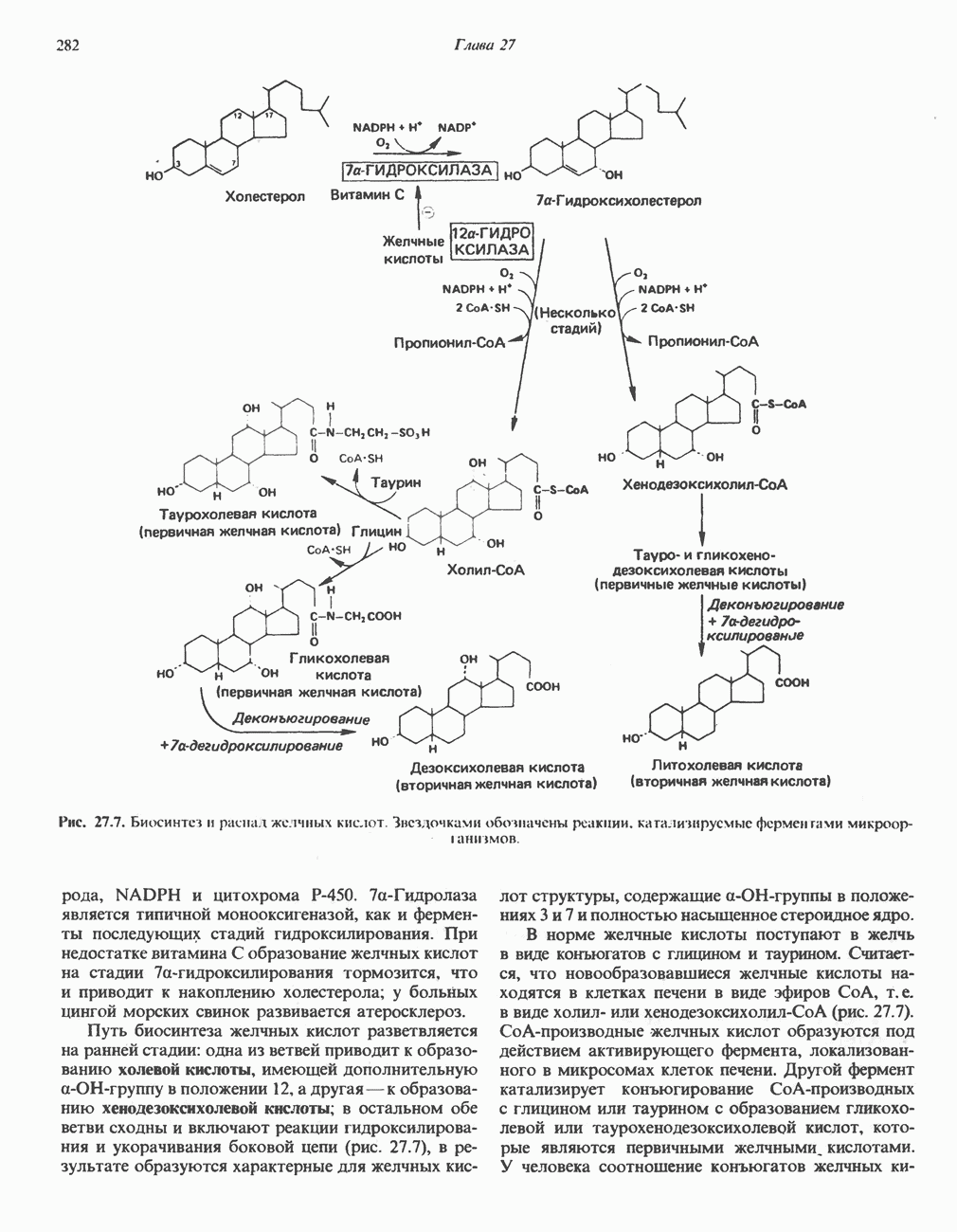
- ВЫВЕДЕНИЕ ХОЛЕСТЕРОЛА И ОБРАЗОВАНИЕ СОЛЕЙ ЖЕЛЧНЫХ КИСЛОТ
- КИШЕЧНО-ПЕЧЕНОЧНАЯ ЦИРКУЛЯЦИЯ ЖЕЛЧНЫХ КИСЛОТ
- КЛИНИЧЕСКИЕ АСПЕКТЫ
- Глава 28. Регуляция метаболизма липидов и источники энергии в тканях
- РЕГУЛЯЦИЯ БИОСИНТЕЗА ЖИРНЫХ КИСЛОТ (ЛИПОГЕНЕЗА)
- МОЛЕКУЛЯРНЫЕ ФАКТОРЫ, РЕГУЛИРУЮЩИЕ ЛИПОГЕНЕЗ
- РЕГУЛЯЦИЯ ОКИСЛЕНИЯ ЖИРНЫХ КИСЛОТ
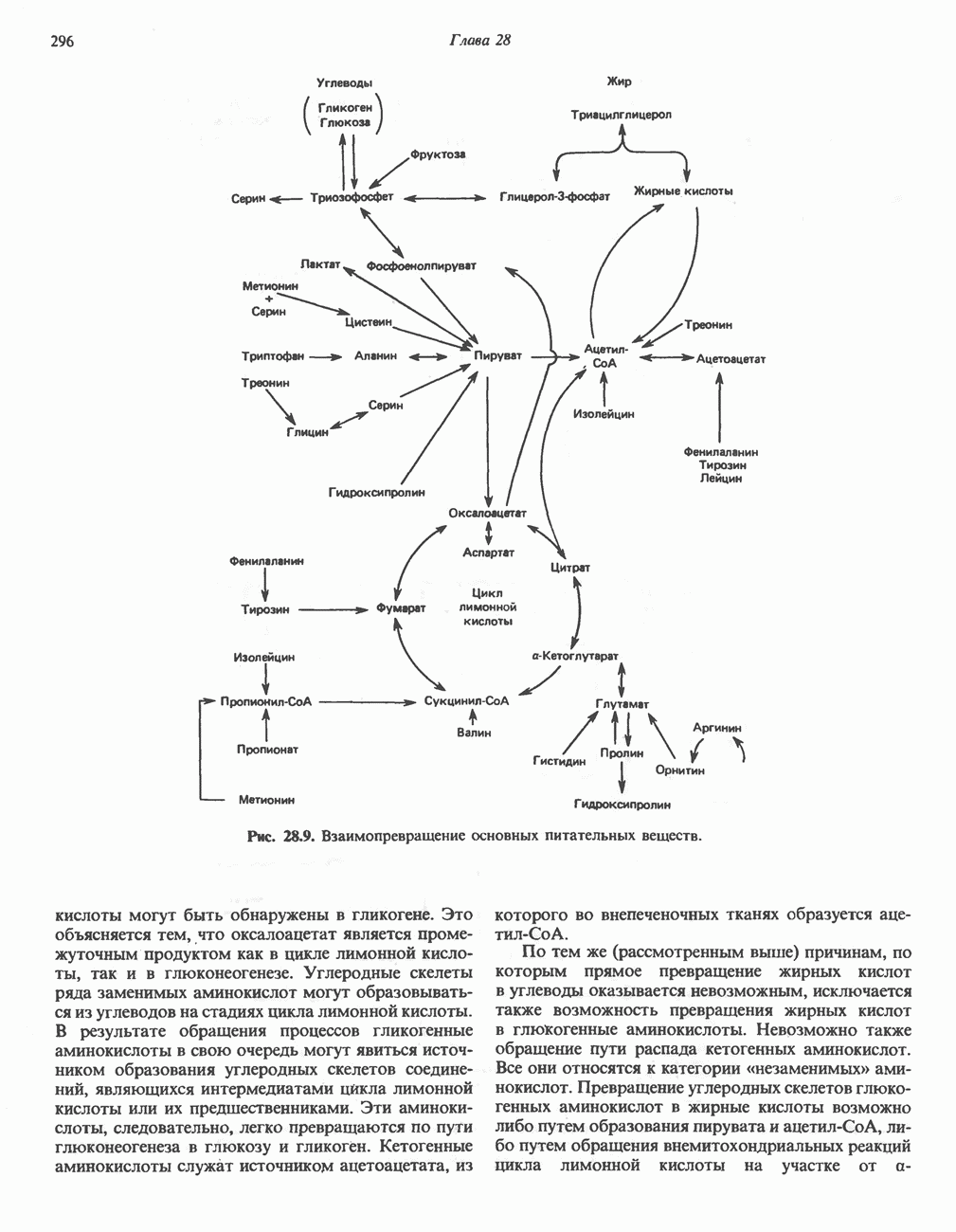
- ВЗАИМНОЕ ПРЕВРАЩЕНИЕ ОСНОВНЫХ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ (рис. 28.9)
- ЭКОНОМИКА УГЛЕВОДНОГО И ЛИПИДНОГО ОБМЕНА В ОРГАНИЗМЕ
- ГОЛОДАНИЕ
- Раздел III. Метаболизм белков и аминокислот
- Глава 29. Биосинтез аминокислот
- БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ
- БИОСИНТЕЗ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ
- Глава 30. Катаболизм азота аминокислот
- ПЕРЕАМИНИРОВАНИЕ
- ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ
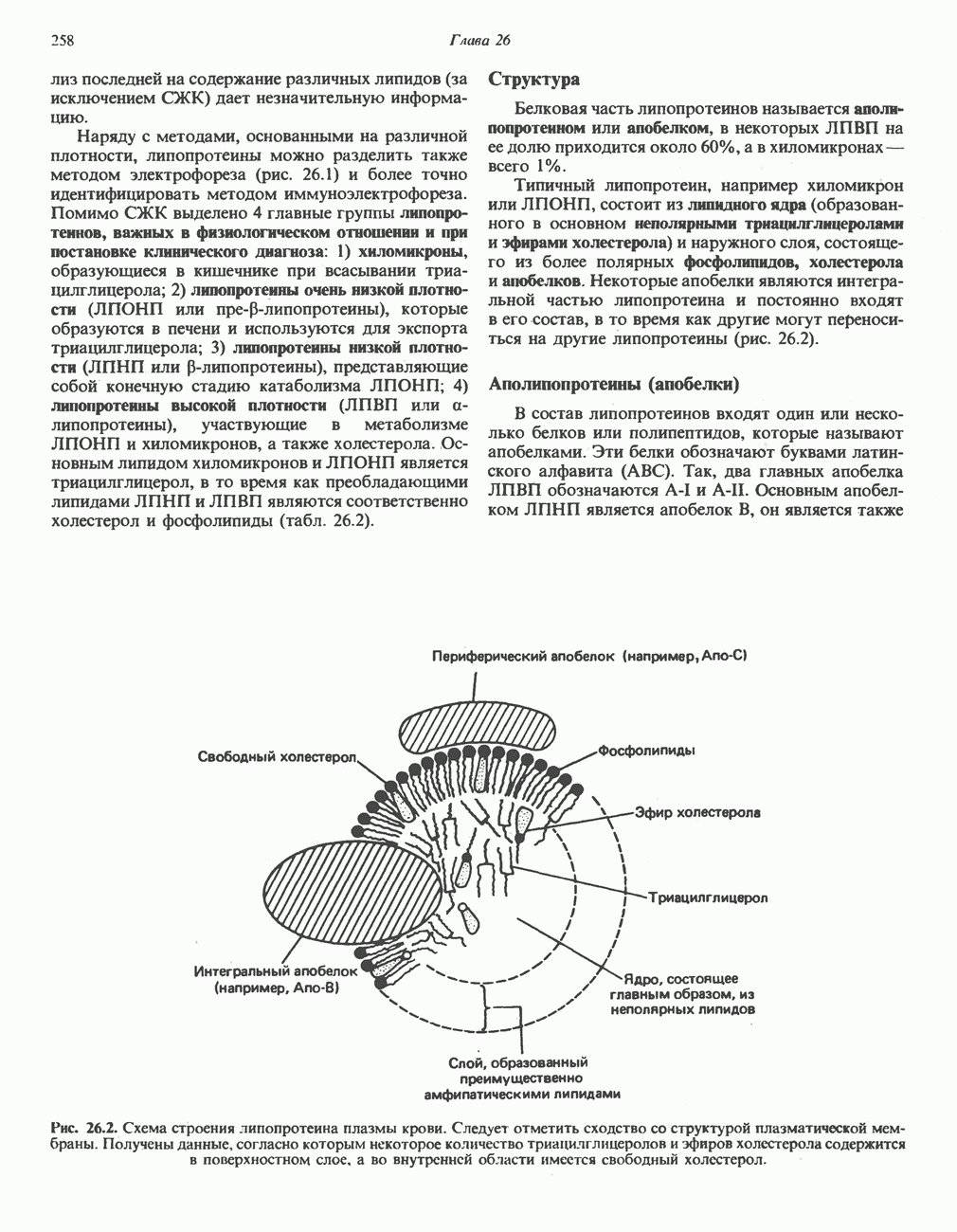
- ОБРАЗОВАНИЕ АММИАКА
- ТРАНСПОРТ АММИАКА
- ОБМЕН АМИНОКИСЛОТАМИ МЕЖДУ ОРГАНАМИ В ПОСТАБСОРБТИВНОМ СОСТОЯНИИ
- ОБМЕН АМИНОКИСЛОТ МЕЖДУ ОРГАНАМИ ПОСЛЕ ПРИЕМА ПИЩИ
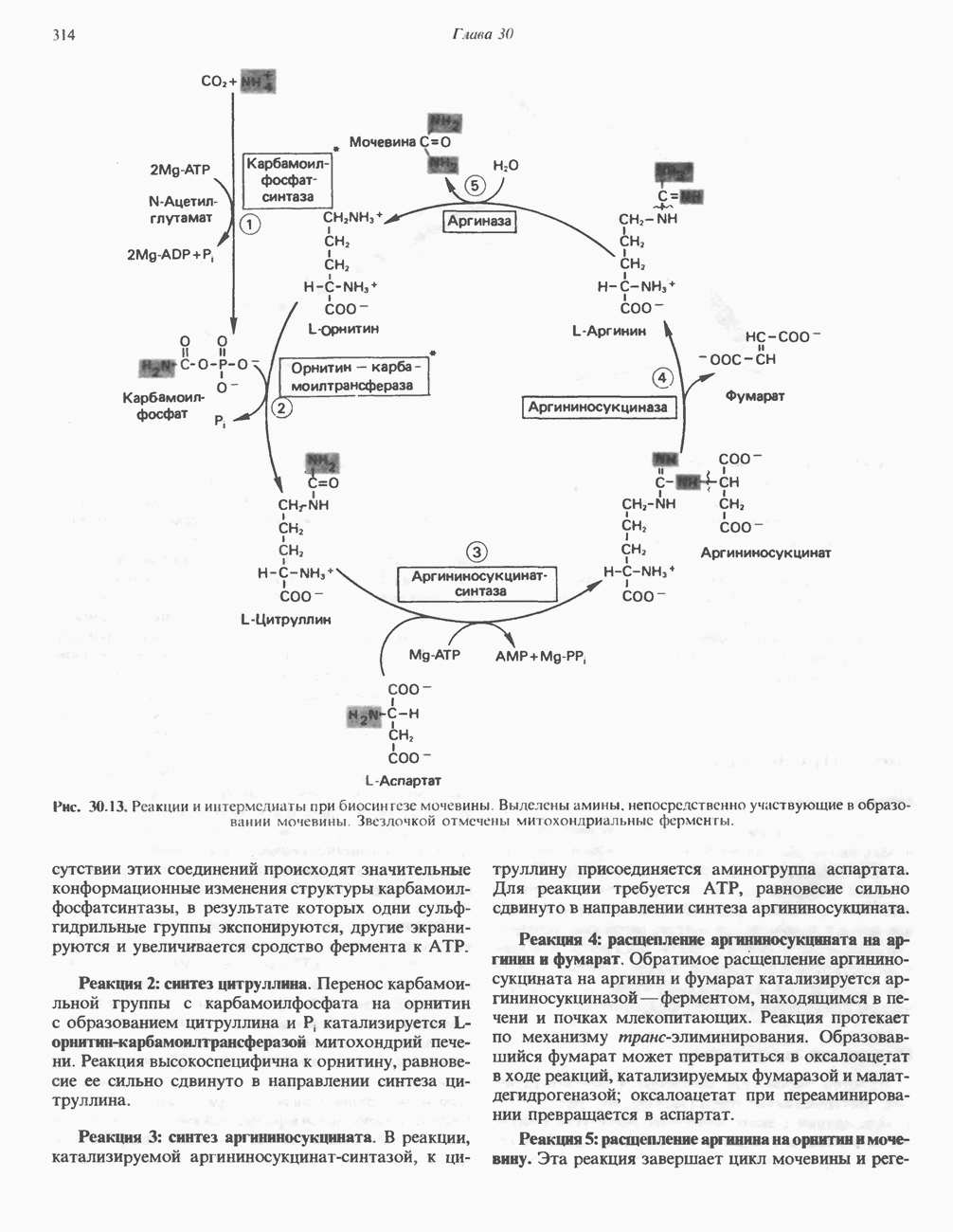
- БИОСИНТЕЗ МОЧЕВИНЫ
- РЕГУЛЯЦИЯ СИНТЕЗА МОЧЕВИНЫ
- МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ ЦИКЛА МОЧЕВИНЫ
- Глава 31. Катаболизм углеродного скелета аминокислот
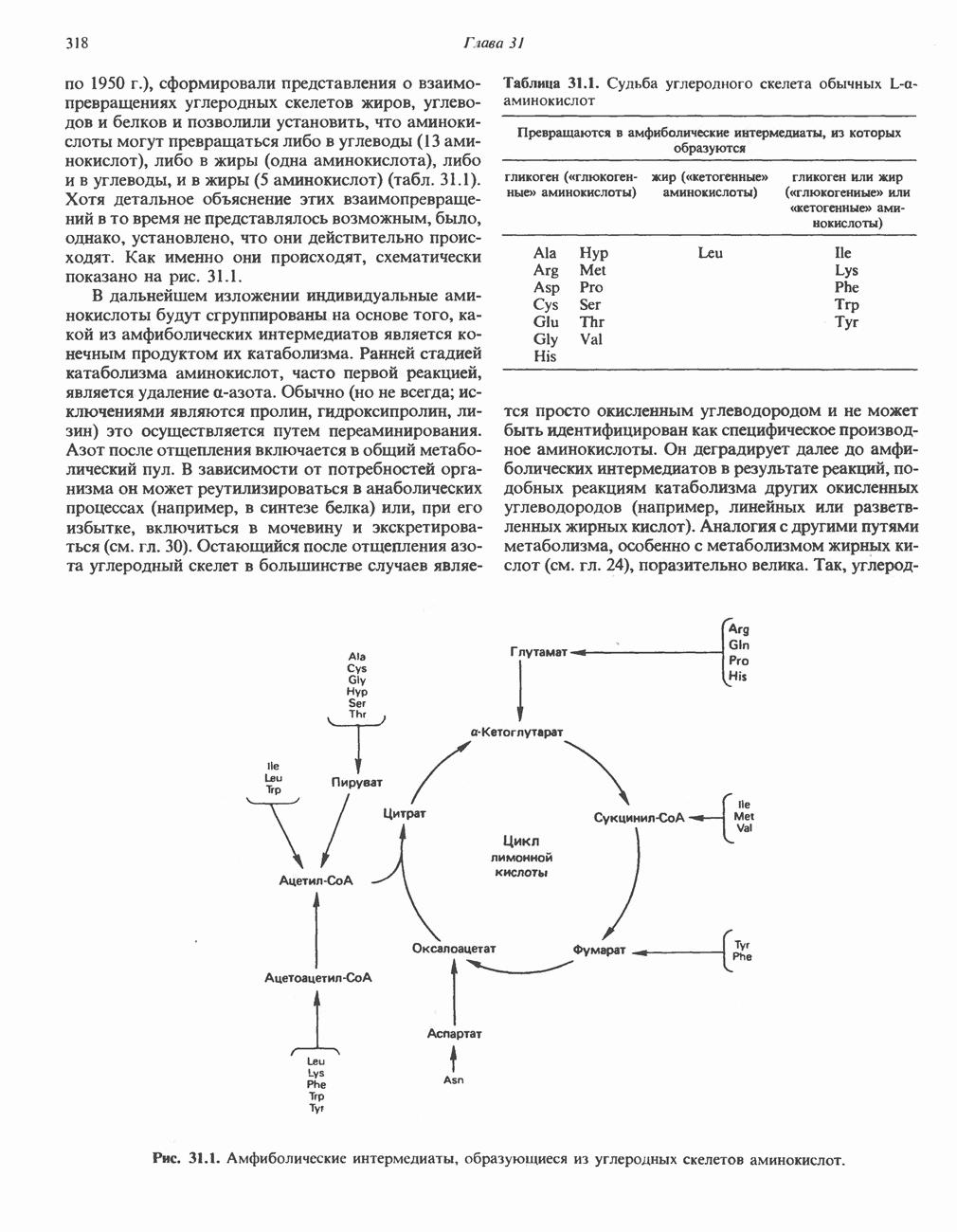
- ПРЕВРАЩЕНИЕ УГЛЕРОДНОГО СКЕЛЕТА ОБЫЧНЫХ L-a-АМИНОКИСЛОТ В АМФИБОЛИЧЕСКИЕ ИНТЕРМЕДИАТЫ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ОКСАЛОАЦЕТАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ а-КЕТОГЛУТАРАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ПИРУВАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ АЦЕТИЛ-КОФЕРМЕНТ А
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ СУКЦИНИЛ-КОФЕРМЕНТ А
- Глава 32. Превращение аминокислот в специализированные продукты
- ГЛИЦИН
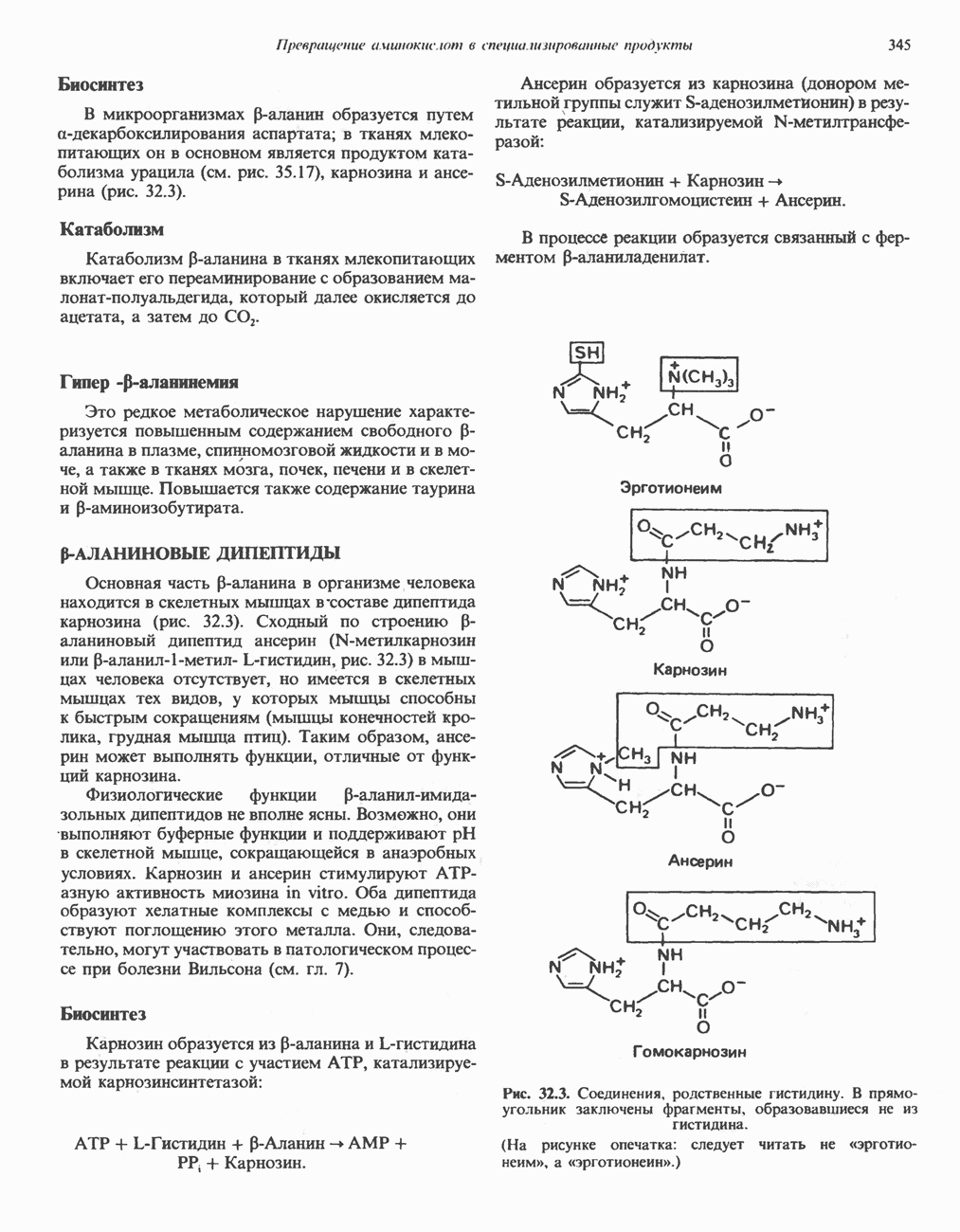
- р-АЛАНИНОВЫЕ ДИПЕПТИДЫ
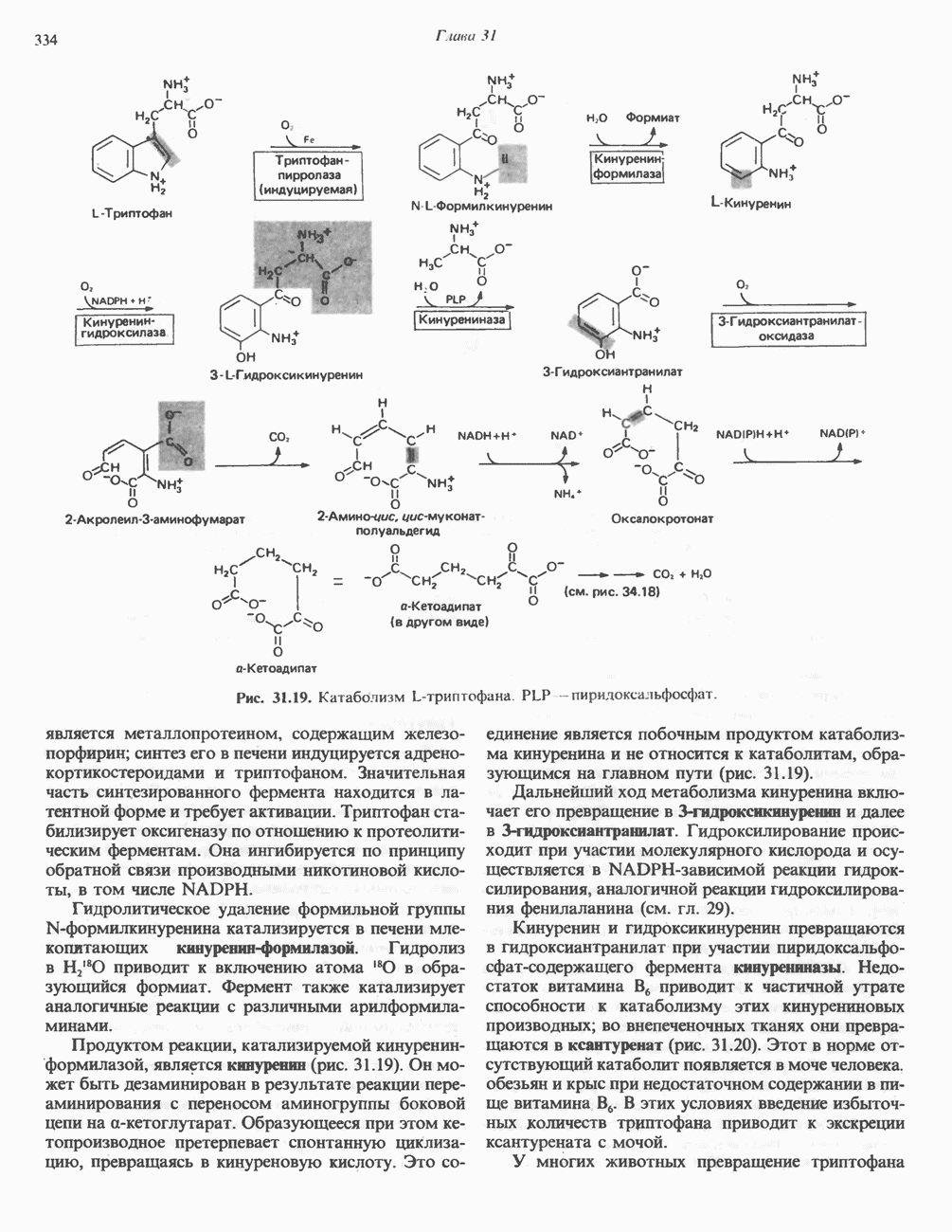
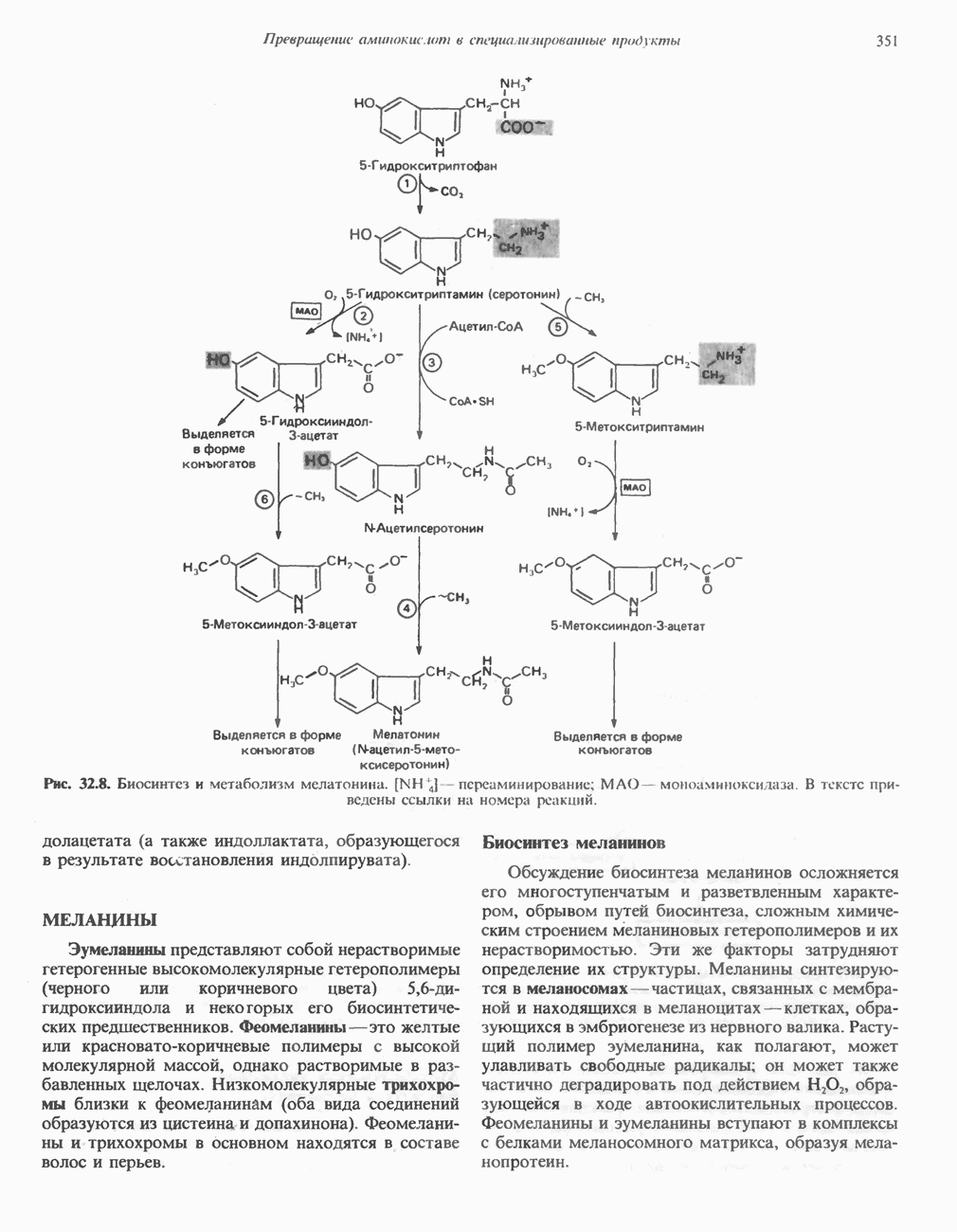
- ТРИПТОФАН
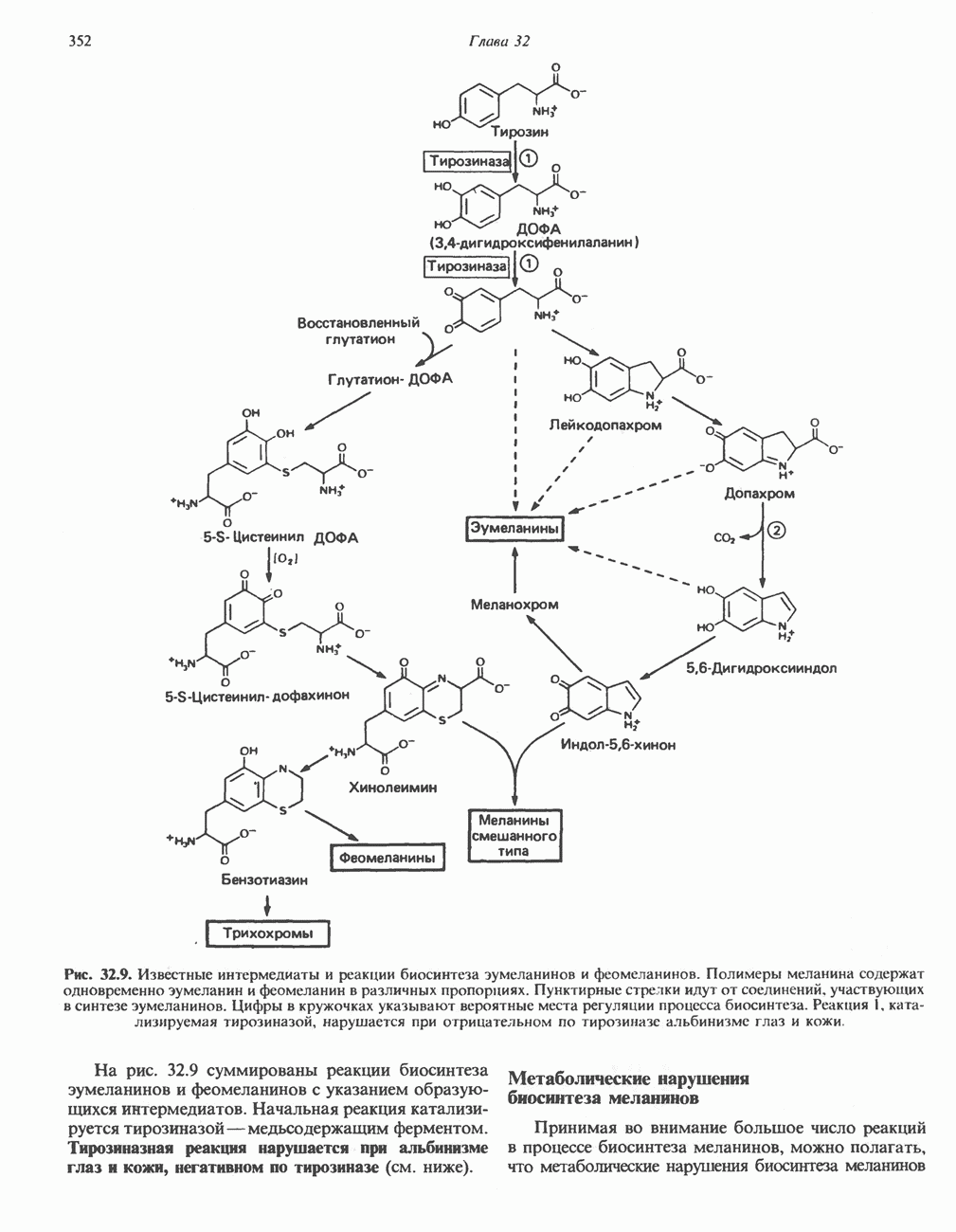
- МЕЛАНИНЫ
- ТИРОЗИН
- КРЕАТИН И КРЕАТИНИН
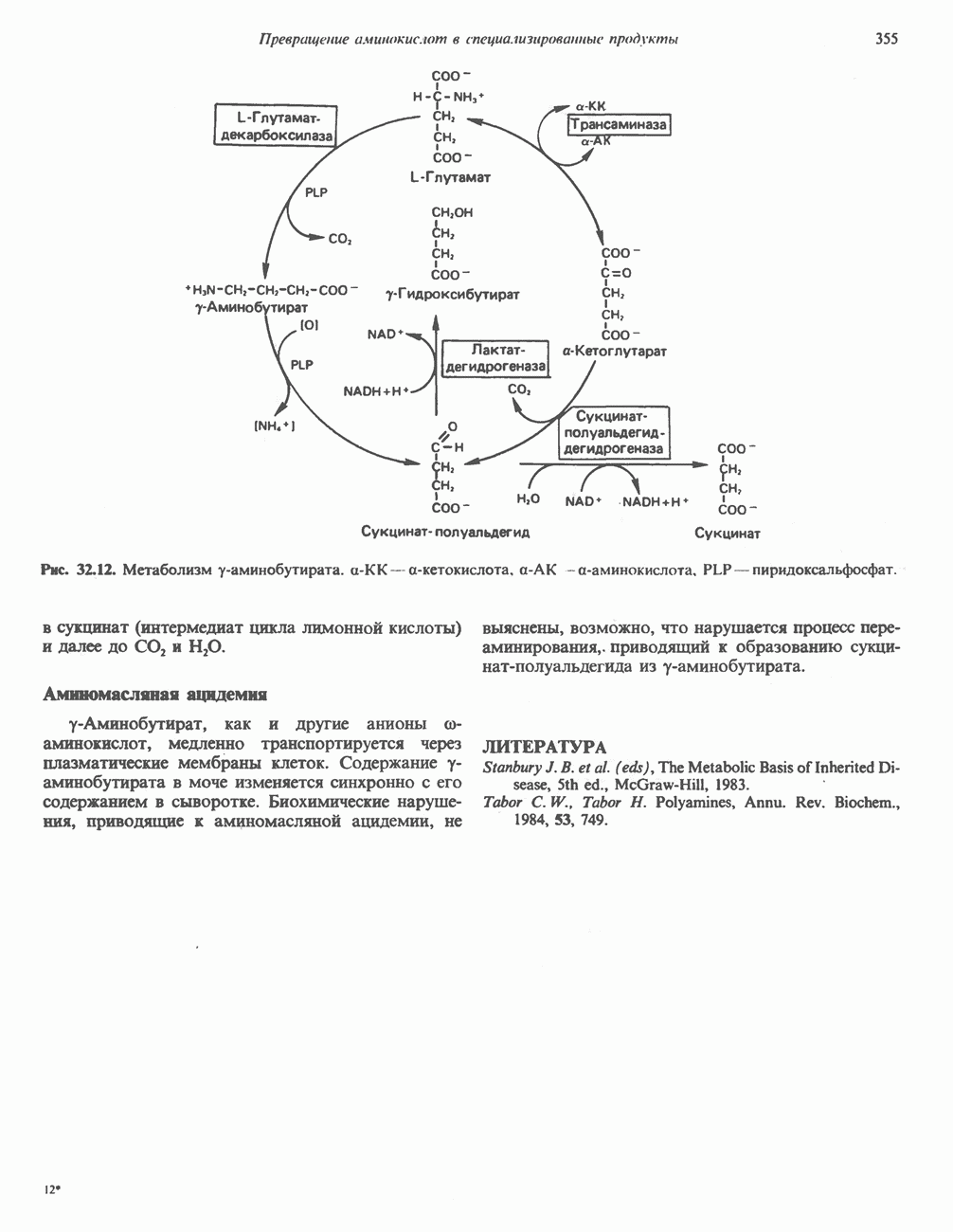
- у-АМИНОБУТИРАТ
- Глава 33. Порфирины и желчные пигменты
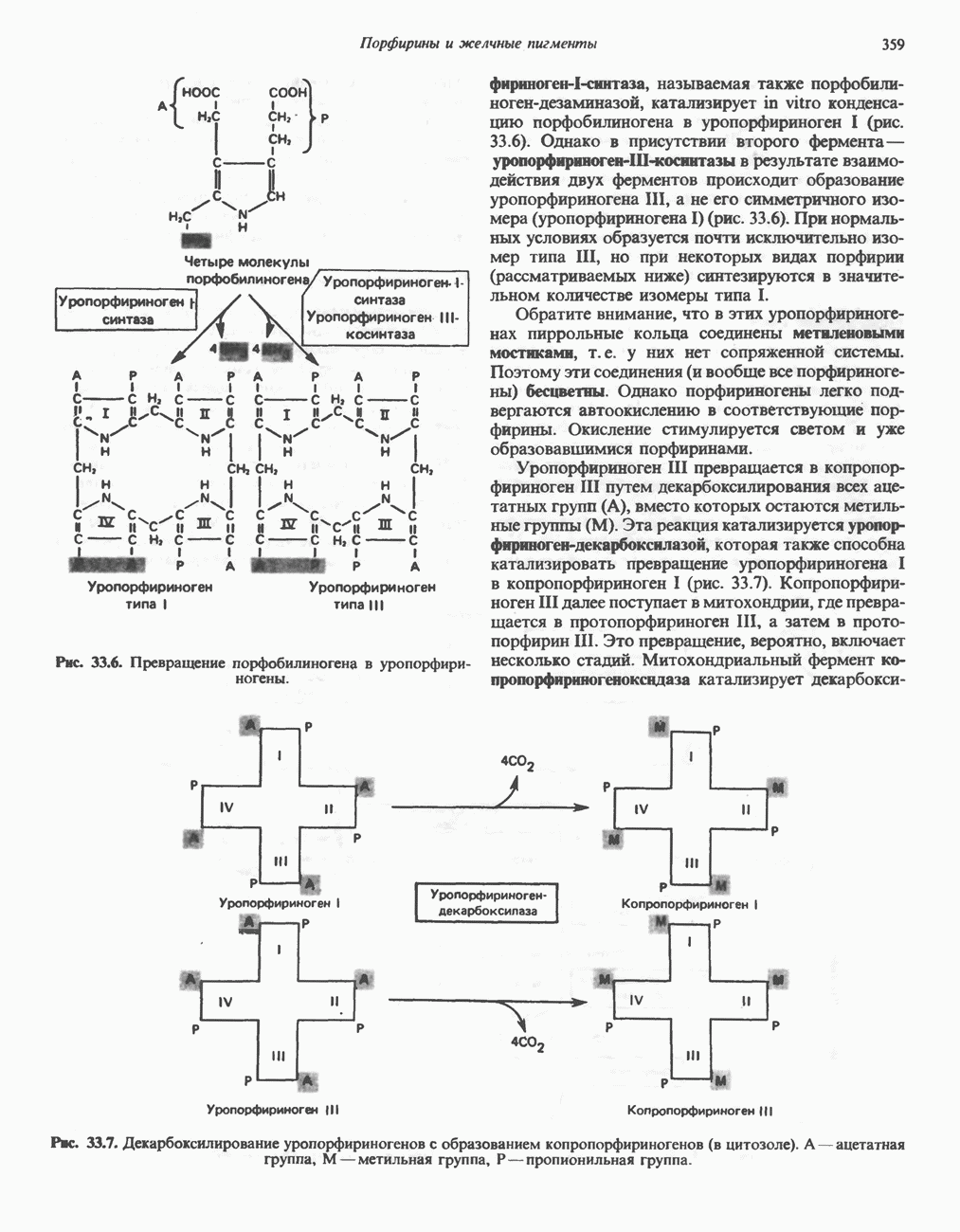
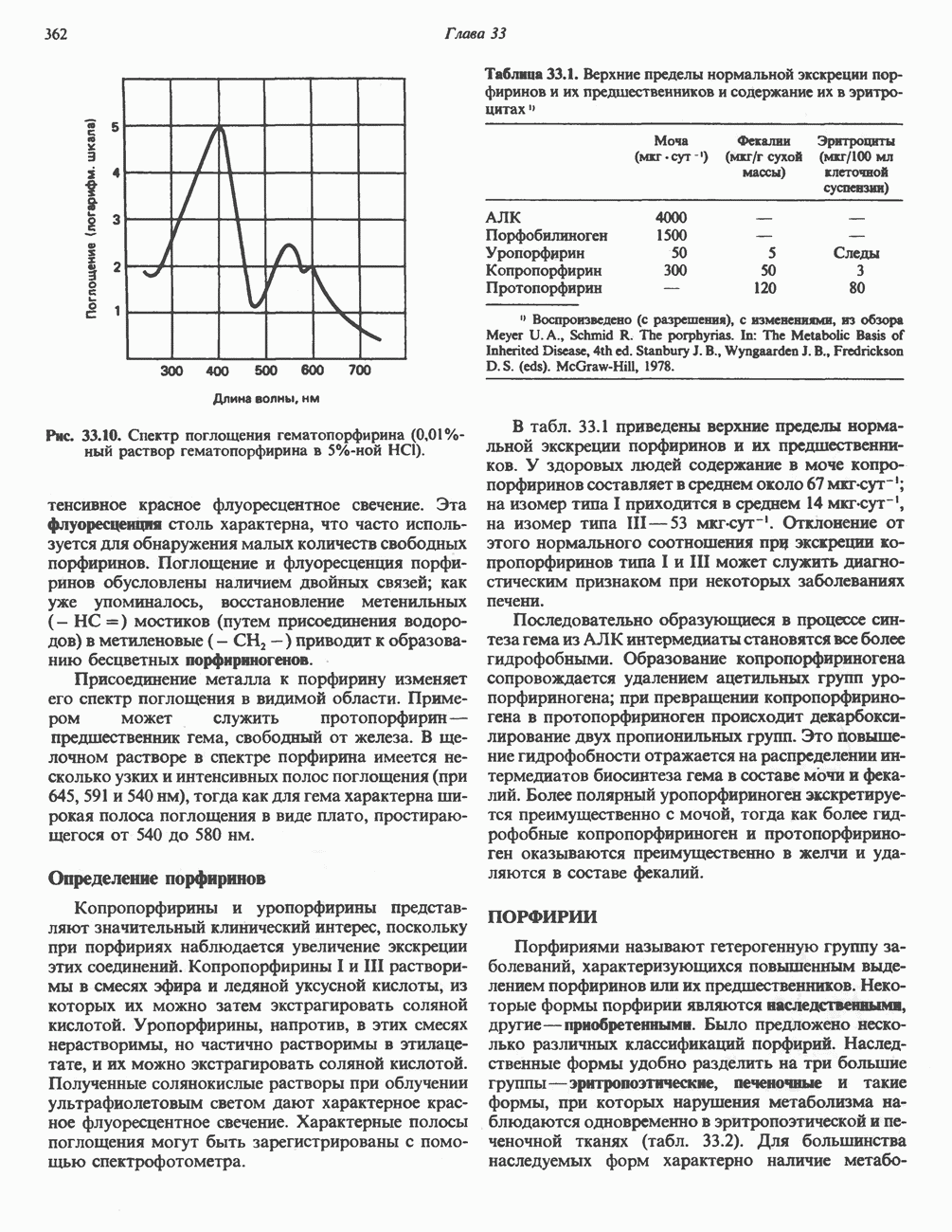
- ПОРФИРИНЫ
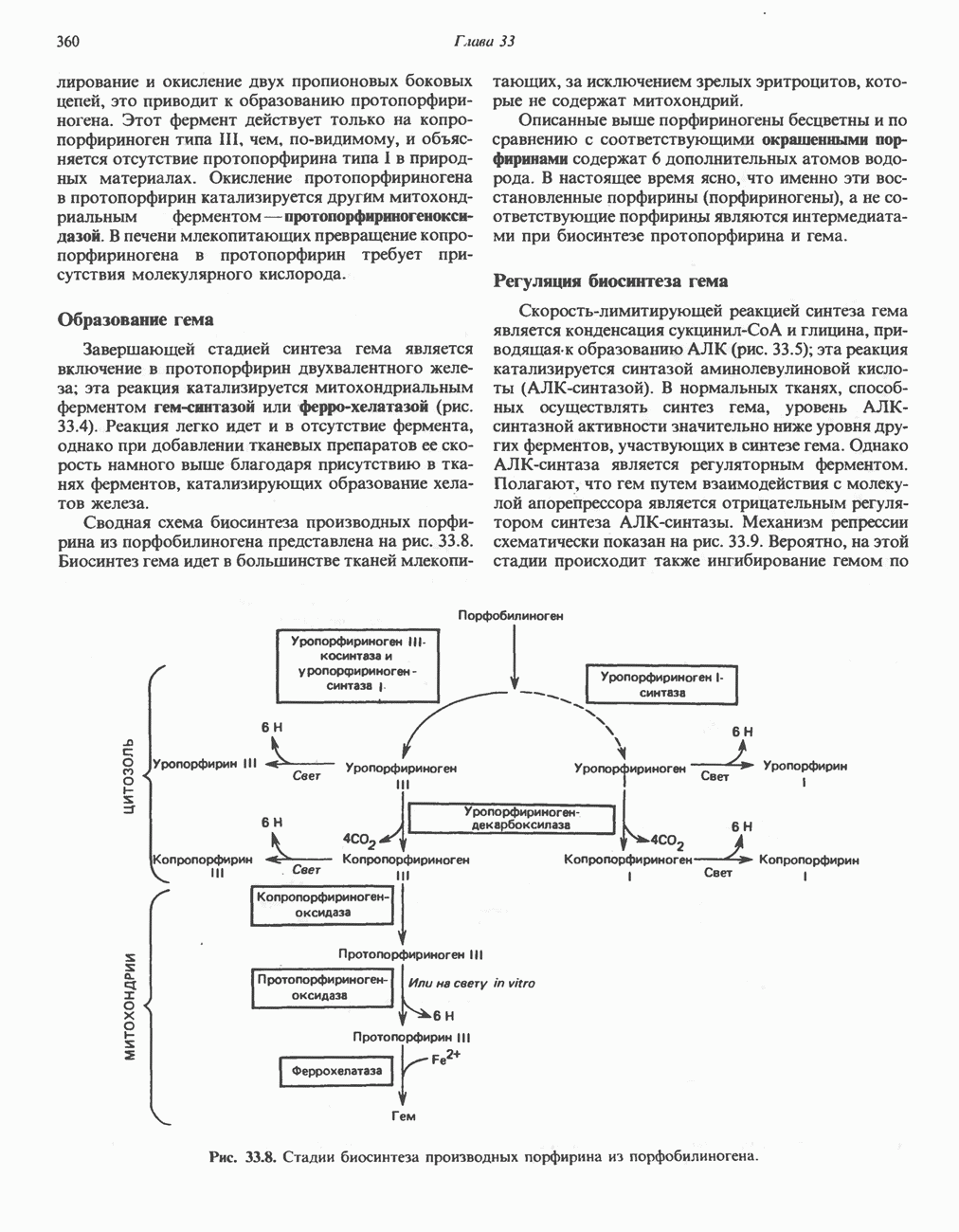
- ПОРФИРИН
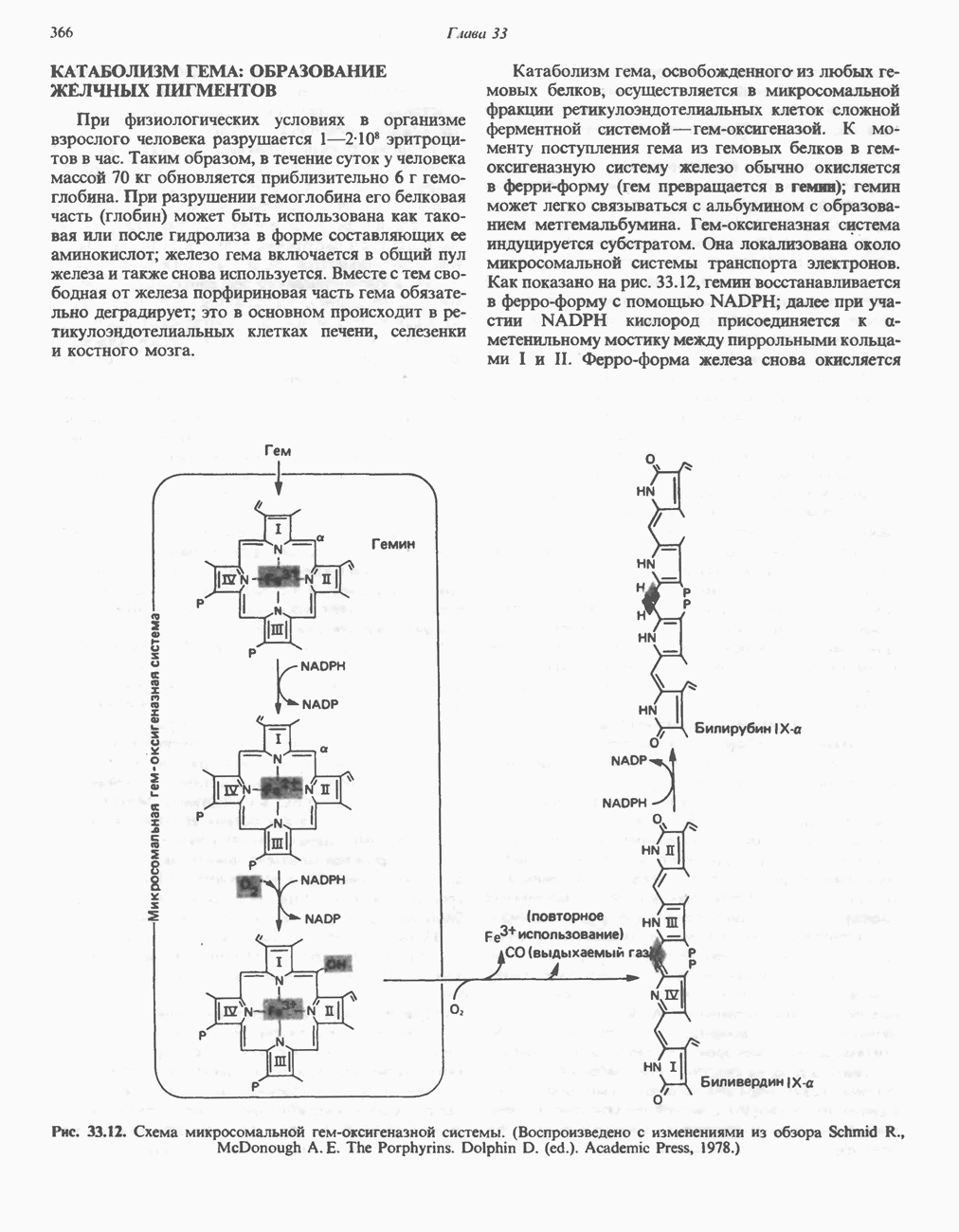
- КАТАБОЛИЗМ ГЕМА: ОБРАЗОВАНИЕ ЖЕЛЧНЫХ ПИГМЕНТОВ
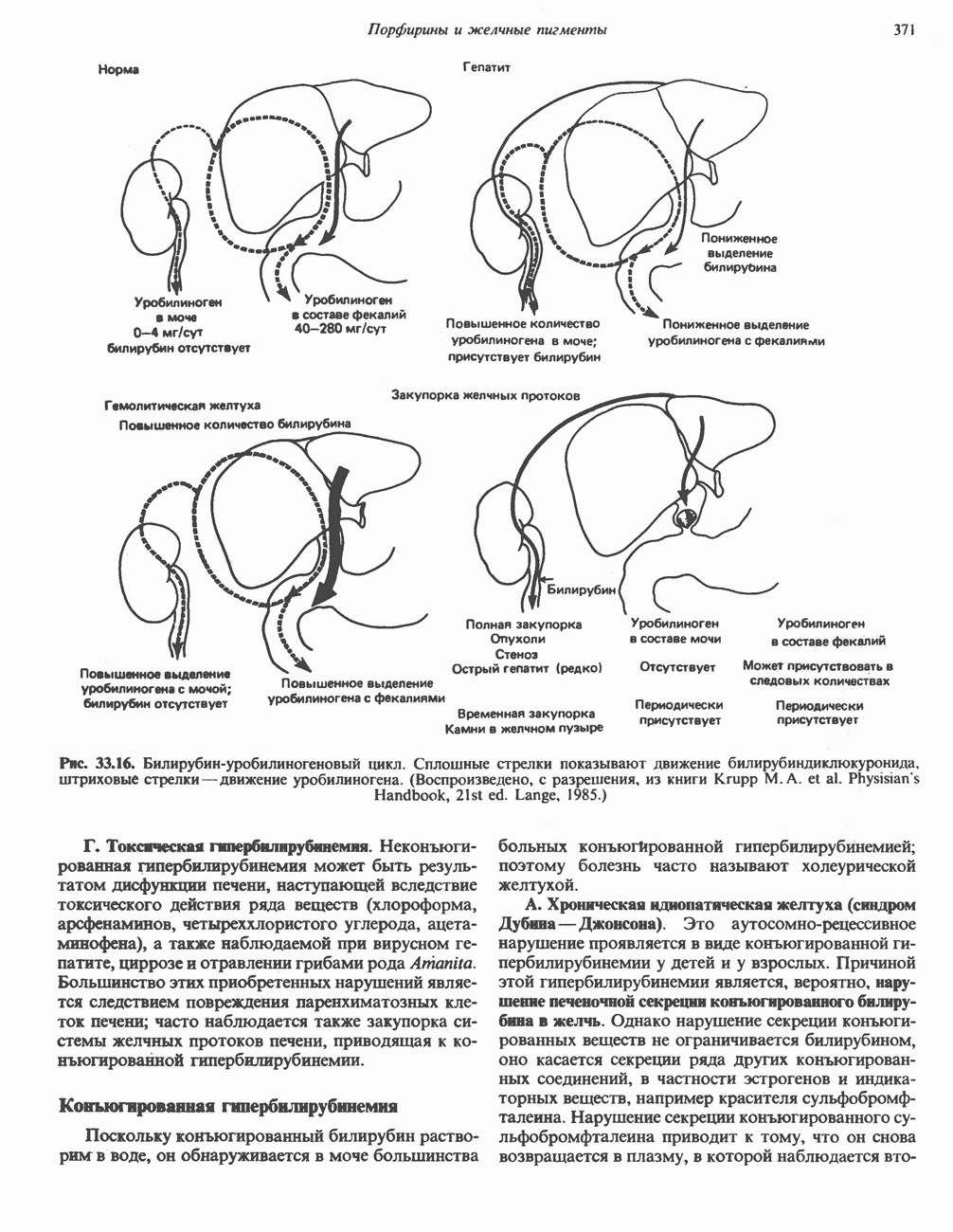
- МЕТАБОЛИЗМ БИЛИРУБИНА В КИШЕЧНИКЕ
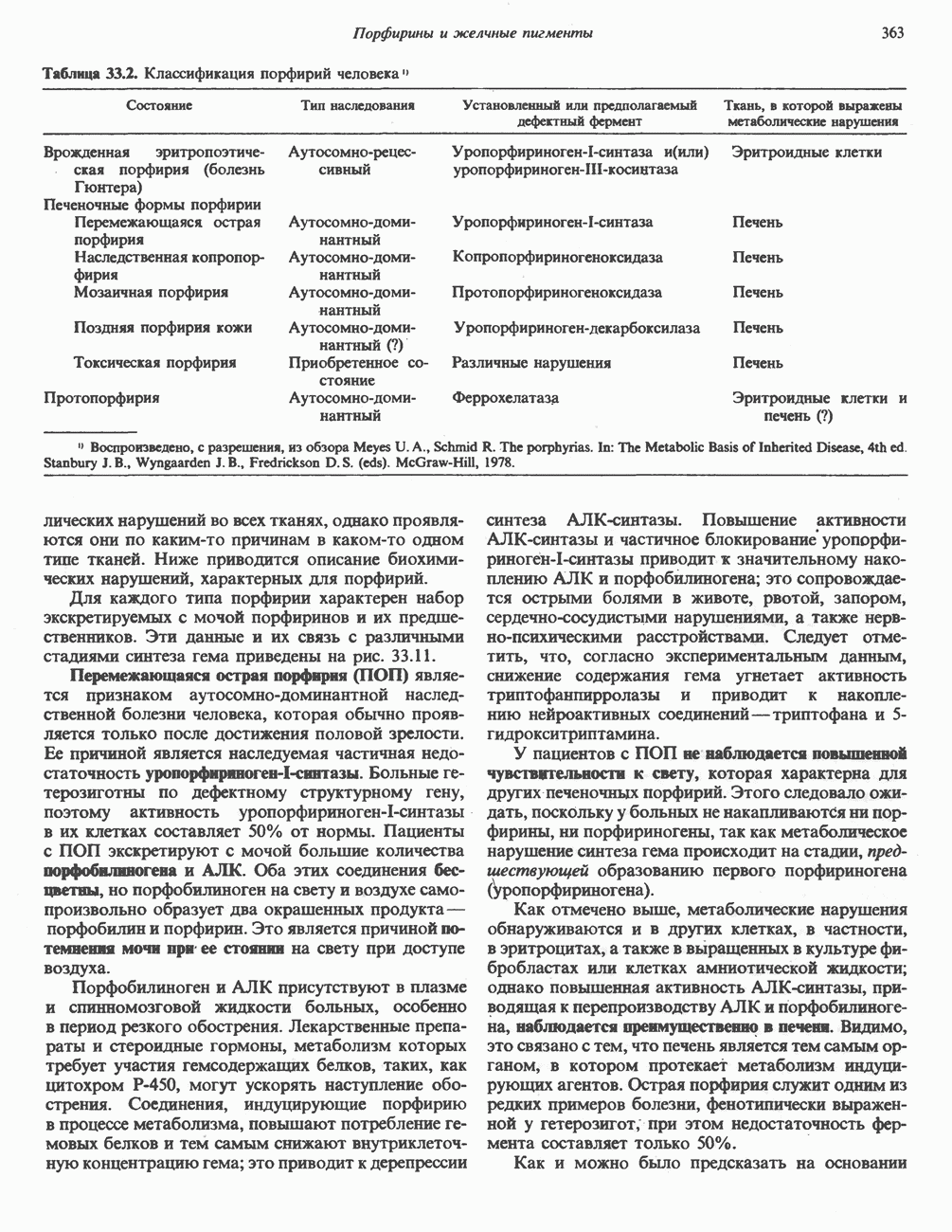
- ГИПЕРБИЛИРУБИНЕМИЯ
- Список сокращений