| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
КАТАЛИТИЧЕСКИЙ ЦЕНТР
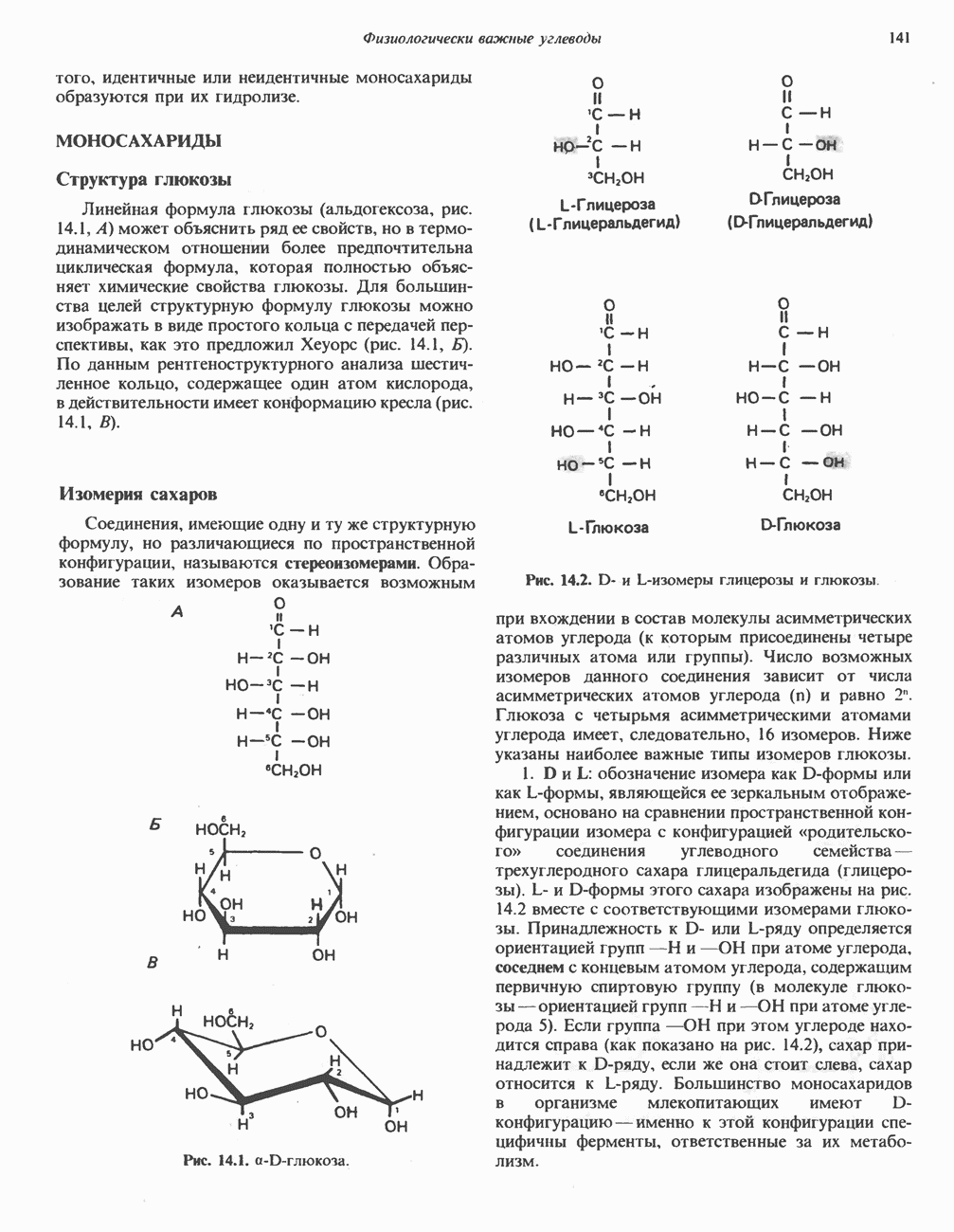
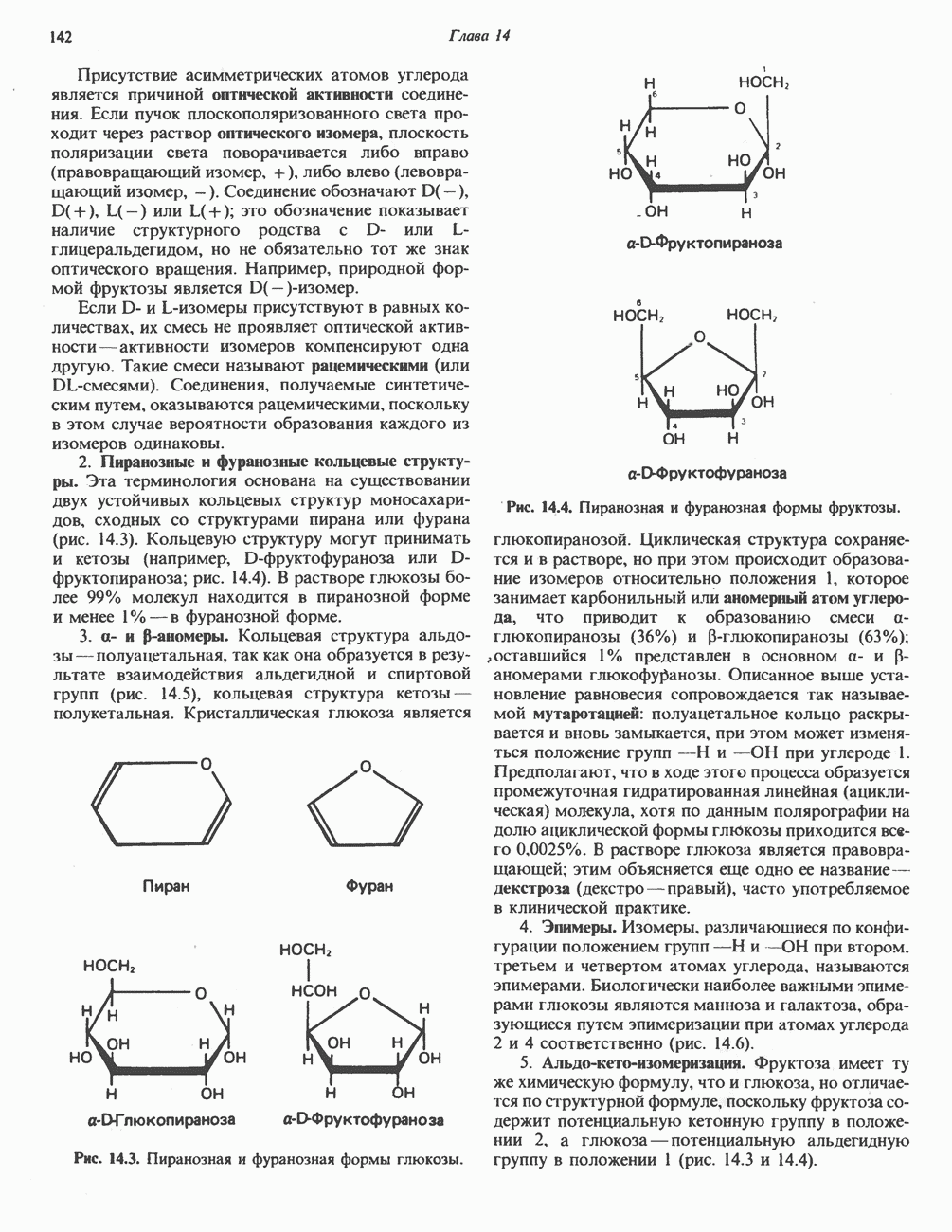
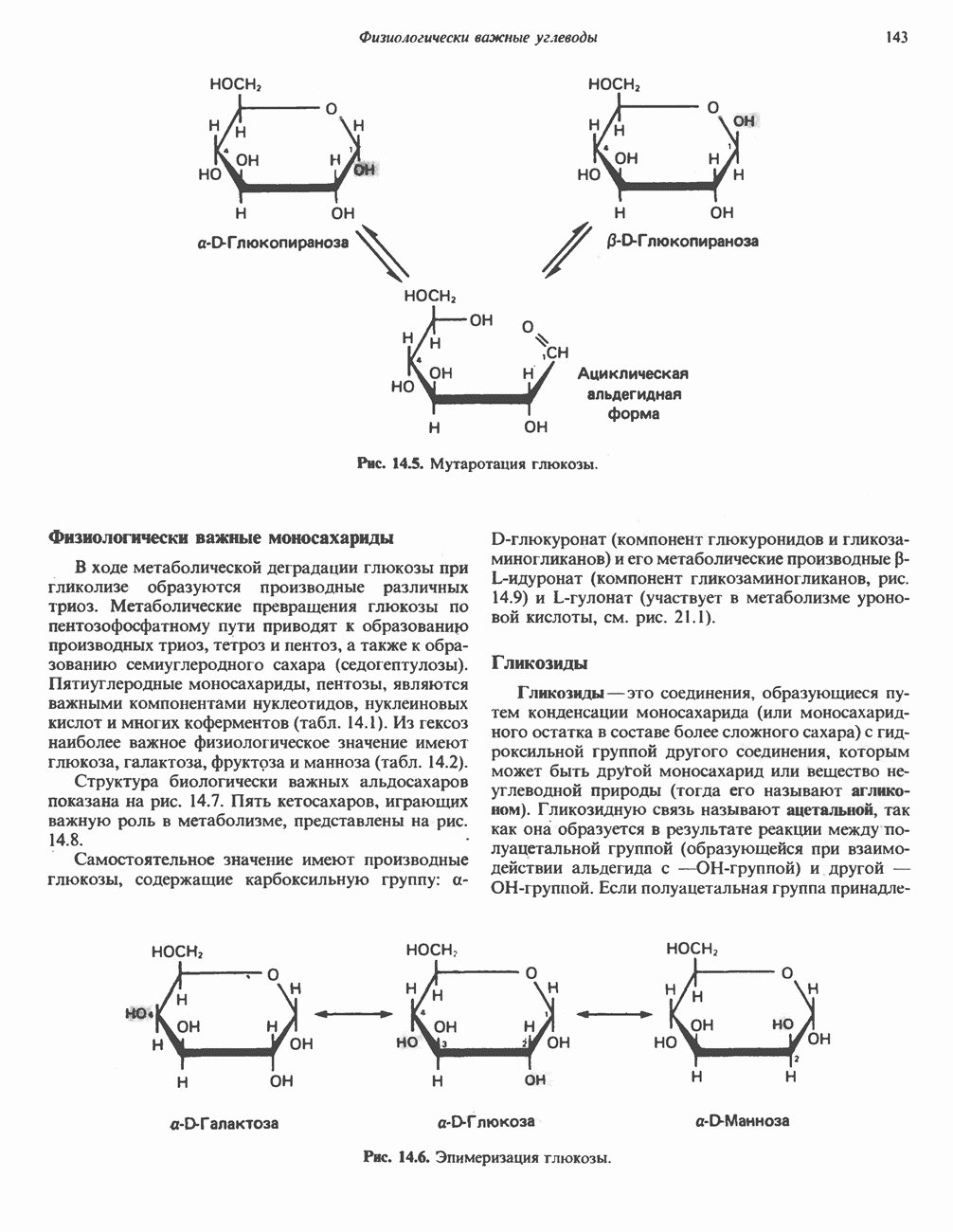
Размеры белков намного превышают размеры низкомолекулярных субстратов, в связи с чем возникло представление о том, что в катализе участвует лишь ограниченная область молекулы фермента. Эту область мы и называем каталитическим центром.

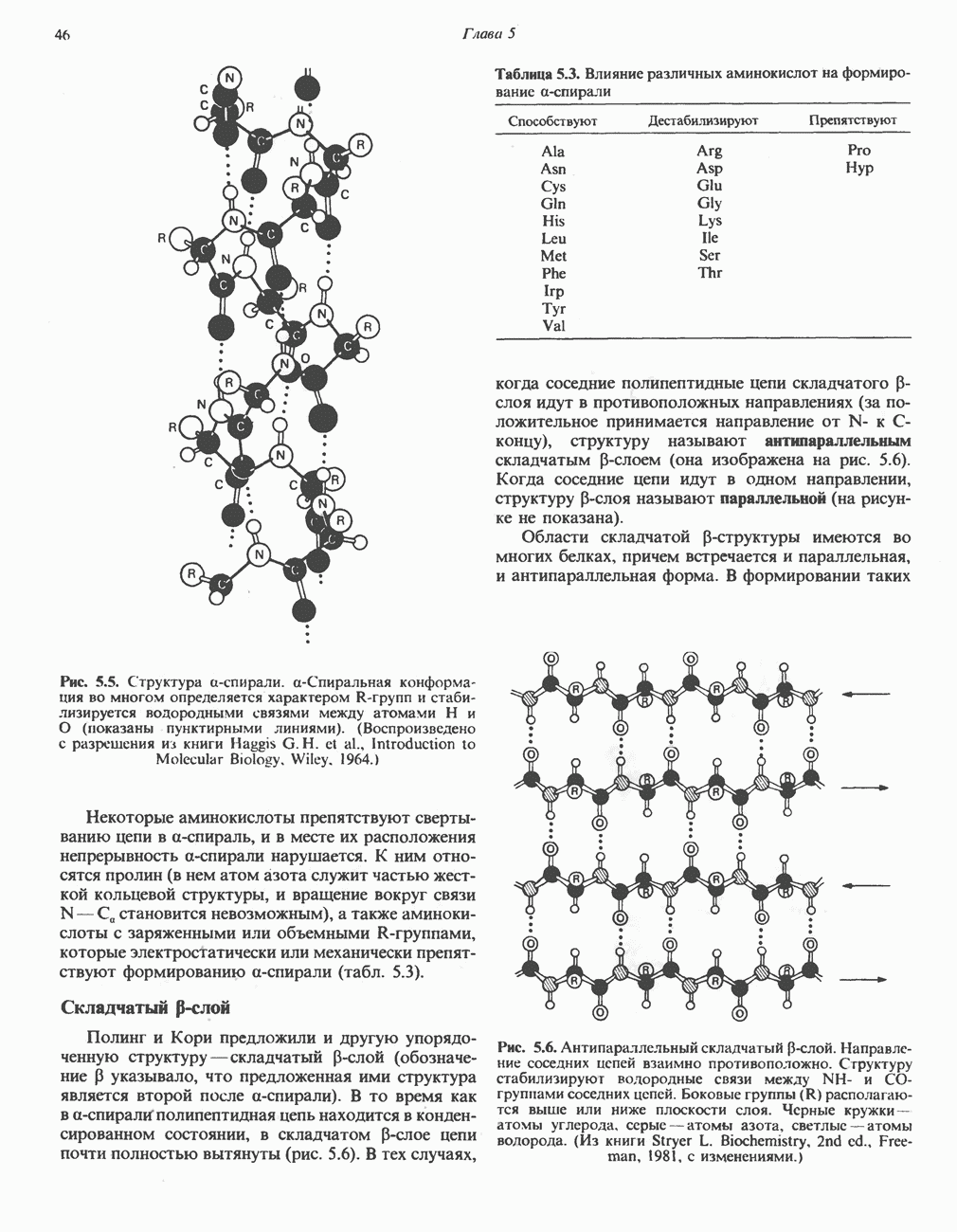
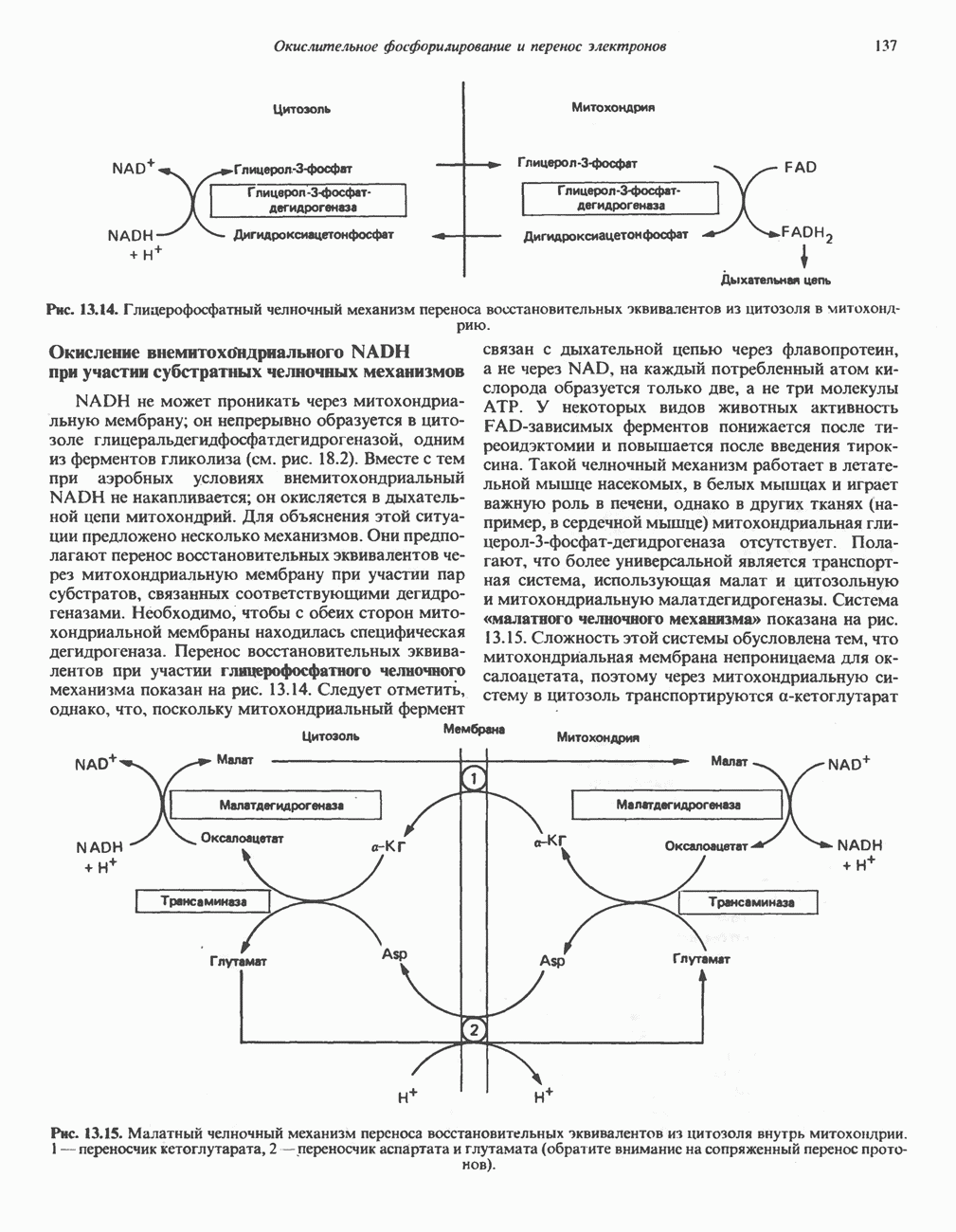
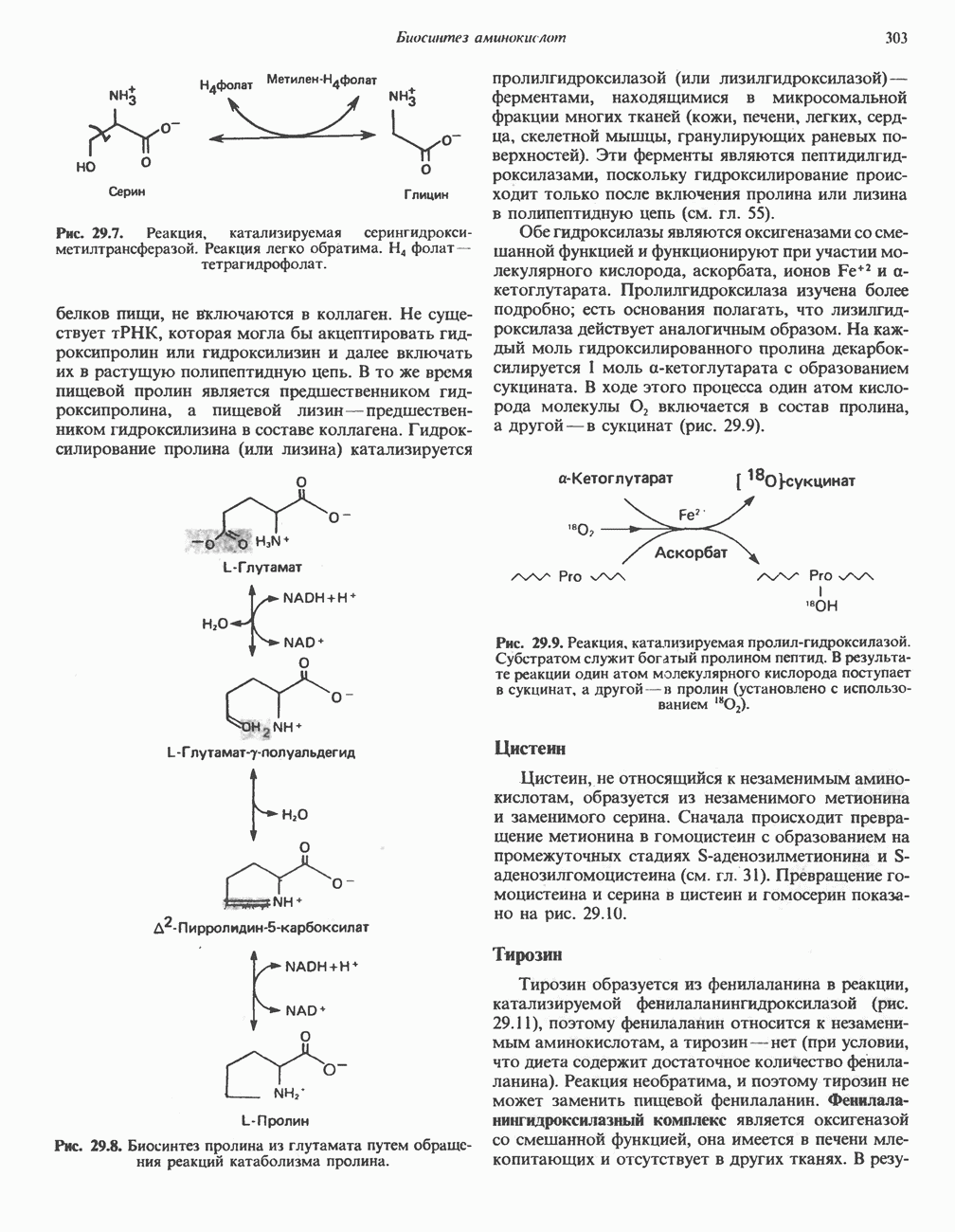
Рис. 8.5. Образование комплекса  согласно модели «жесткой матрицы» Фишера.
согласно модели «жесткой матрицы» Фишера.
Вначале было непонятно, почему молекулы ферментов столь велики, если только часть их структуры участвует в связывании субстрата и непосредственно в катализе. Однако, как показал анализ трехмерной структуры ферментов, с субстратом взаимодействует намного большая часть белковой молекулы, чем предполагалось ранее. Если еще учесть включение в работу ферментов аллостерических центров такого же размера (см. гл. 10), не приходится удивляться объемности ферментов.
Модель «ключ—замок»
Первоначальная модель каталитического центра, предложенная Эмилем Фишером, трактовала взаимодействие субстрата и фермента по аналогии с системой «ключ — замок». Эта модель, которую иногда называют моделью «жесткой матрицы» (рис. 8.5), не утратила своего значения для понимания некоторых свойств ферментов, например их способности к строго определенному связыванию двух или большего числа субстратов (рис. 8.6), или для объяснения кинетики насыщения субстратом.
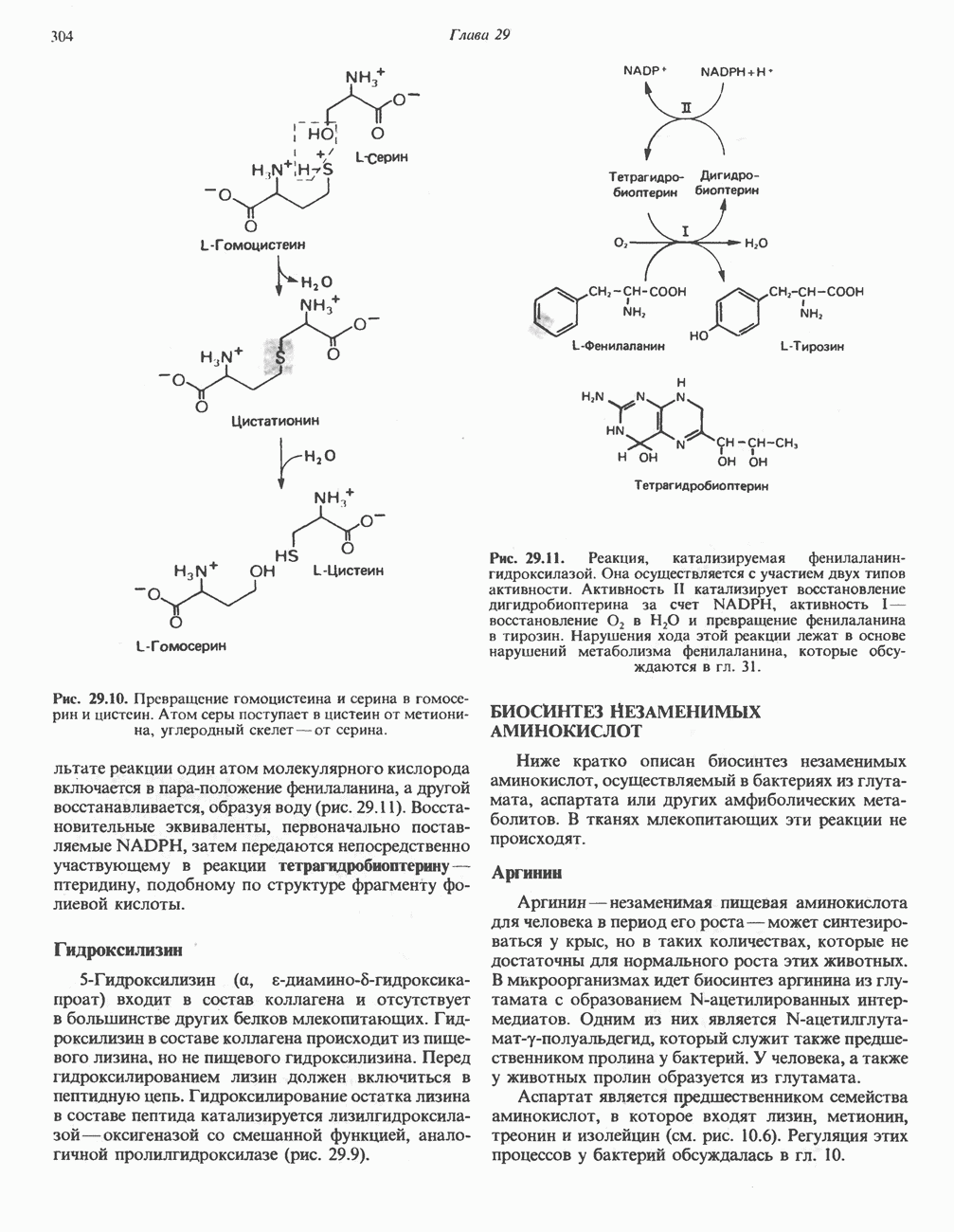
Модель индуцированного соответствия
Недостатком модели Фишера является подразумеваемая в ней жесткость каталитического центра. Более общий характер имеет модель индуцированного соответствия, предложенная Кошландом. Эта модель основывается на весьма убедительных экспериментальных данных. Ее существенной чертой является гибкость каталитического центра. В модели Фишера каталитический центр считается заранее подогнанным под форму молекулы субстрата. В модели

Рис. 8.6. Последовательное связывание ферментом кофермента  и двух субстратов
и двух субстратов  в рамках гипотезы «жесткой матрицы». Предполагается, что кофермент содержит участок, способный связывать первый субстрат
в рамках гипотезы «жесткой матрицы». Предполагается, что кофермент содержит участок, способный связывать первый субстрат  после связывания первого субстрата облегчается связывание второго субстрата
после связывания первого субстрата облегчается связывание второго субстрата 

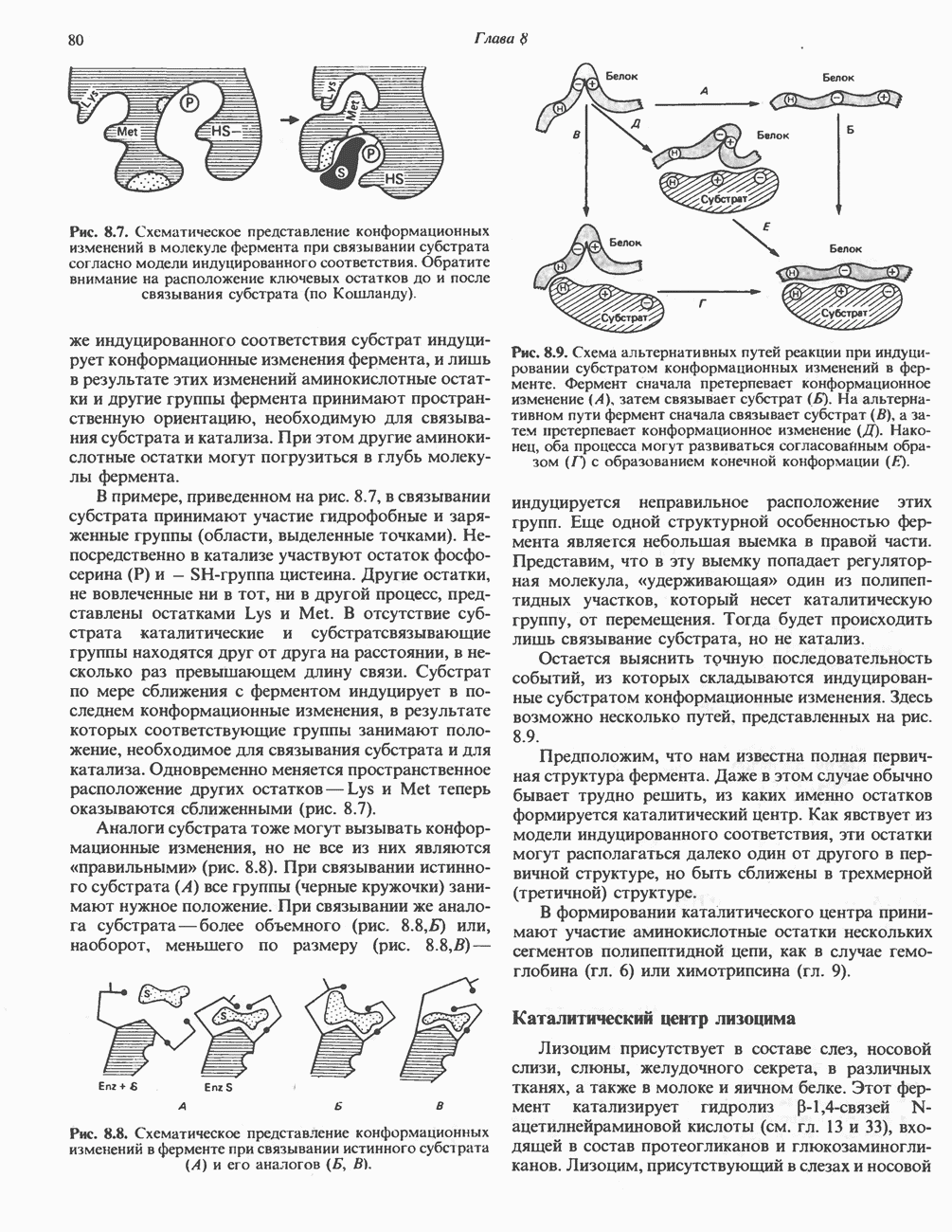
Рис. 8.7. Схематическое представление конформационных изменений в молекуле фермента при связывании субстрата согласно модели индуцированного соответствия. Обратите внимание на расположение ключевых остатков до и после связывания субстрата (по Кошланду).
же индуцированного соответствия субстрат индуцирует конформационные изменения фермента, и лишь в результате этих изменений аминокислотные остатки и другие группы фермента принимают пространственную ориентацию, необходимую для связывания субстрата и катализа. При этом другие аминокислотные остатки могут погрузиться в глубь молекулы фермента.
В примере, приведенном на рис. 8.7, в связывании субстрата принимают участие гидрофобные и заряженные группы (области, выделенные точками). Непосредственно в катализе участвуют остаток фосфосерина (Р) и — SH-группа цистеина. Другие остатки, не вовлеченные ни в тот, ни в другой процесс, представлены остатками Lys и Met. В отсутствие субстрата каталитические и субстратсвязывающие группы находятся друг от друга на расстоянии, в несколько раз превышающем длину связи. Субстрат по мере сближения с ферментом индуцирует в последнем конформационные изменения, в результате которых соответствующие группы занимают положение, необходимое для связывания субстрата и для катализа. Одновременно меняется пространственное расположение других остатков - Lys и Met теперь оказываются сближенными (рис. 8.7).
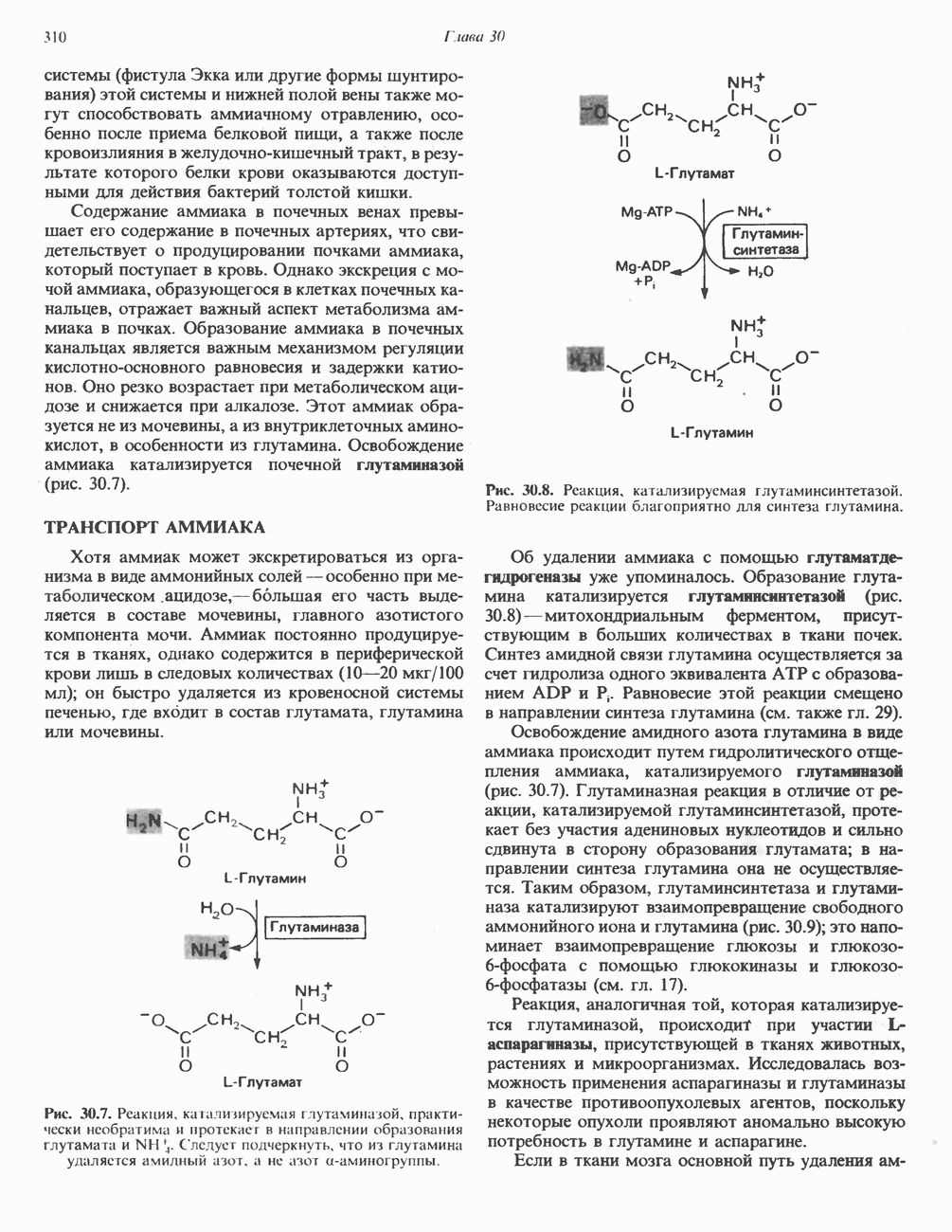
Аналоги субстрата тоже могут вызывать конформационные изменения, но не все из них являются «правильными» (рис. 8.8). При связывании истинного субстрата (А) все группы (черные кружочки) занимают нужное положение. При связывании же аналога субстрата — более объемного (рис.  ) или, наоборот, меньшего по размеру (рис.
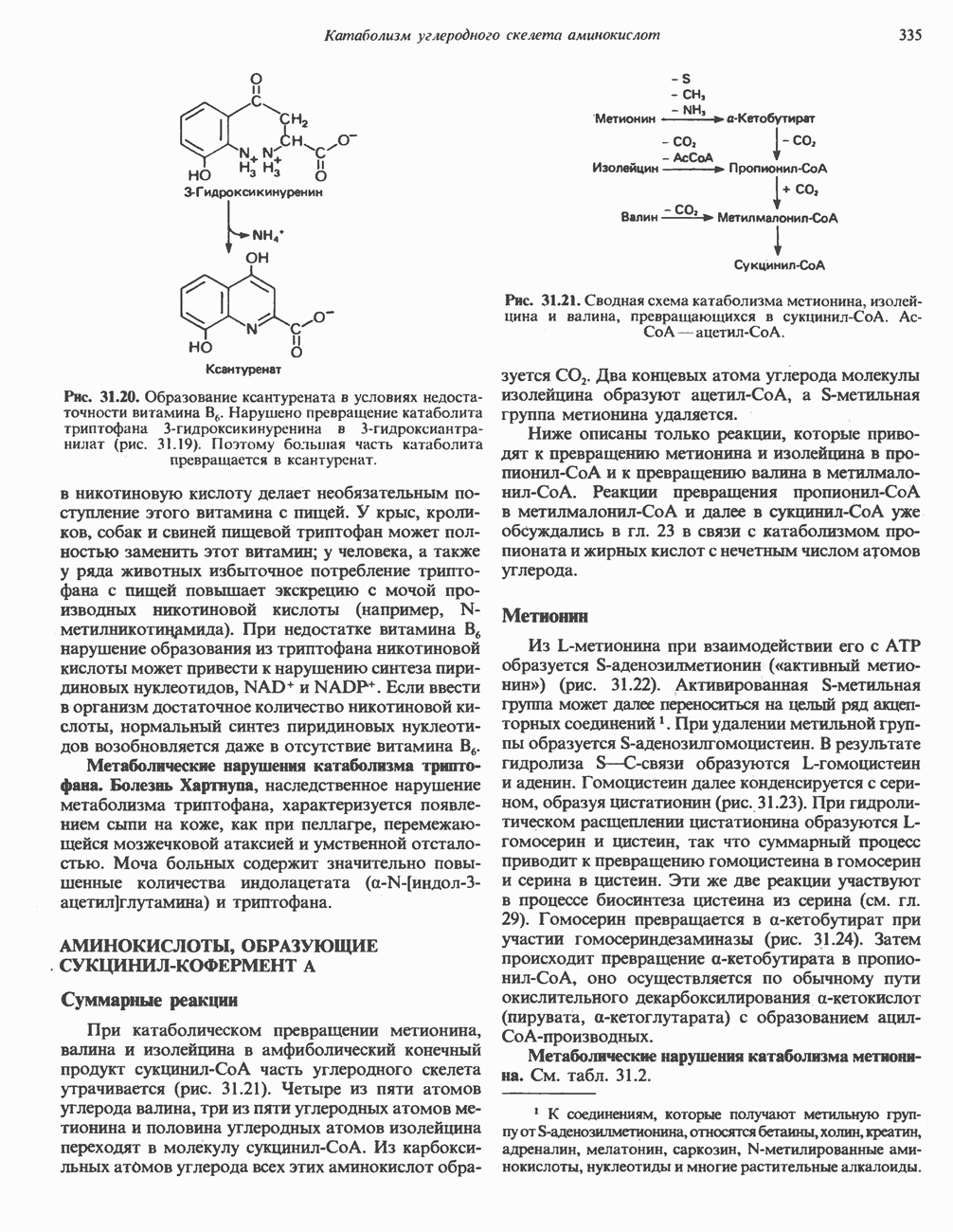
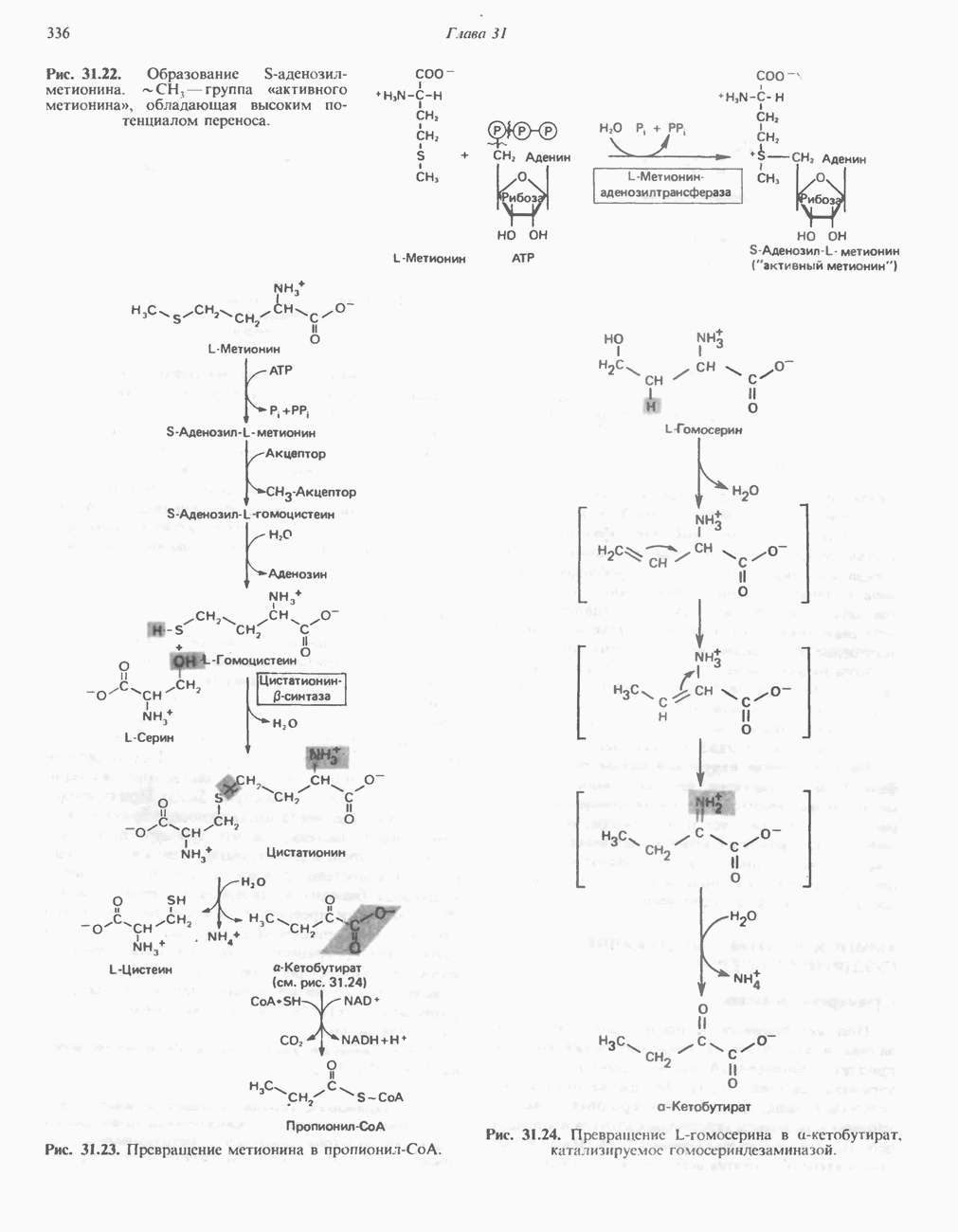
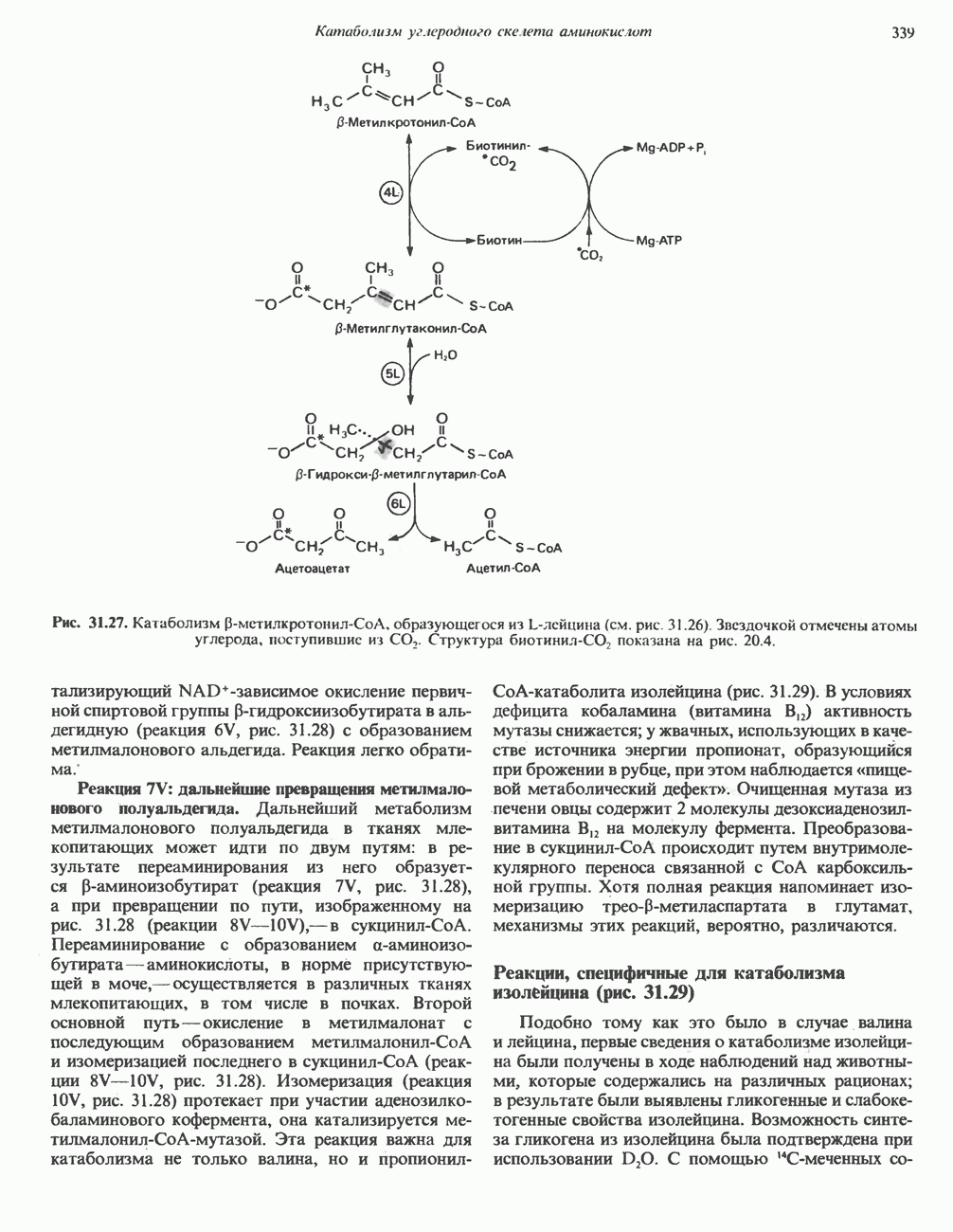
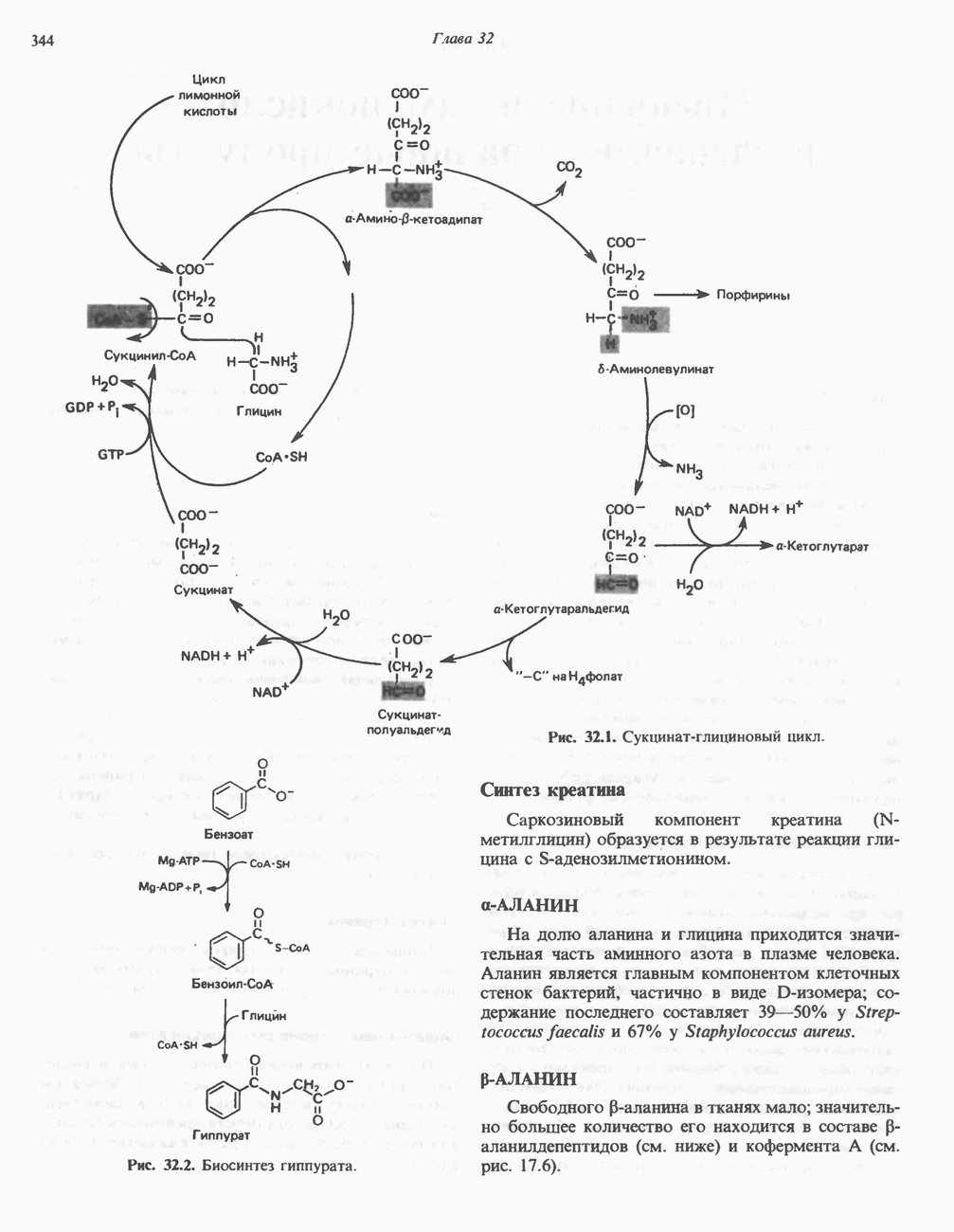
) или, наоборот, меньшего по размеру (рис.  ) — индуцируется неправильное расположение этих групп.
) — индуцируется неправильное расположение этих групп.

Рис. 8.8. Схематическое представление конформационных изменений в ферменте при связывании истинного субст рата (А) и его аналогов  В).
В).

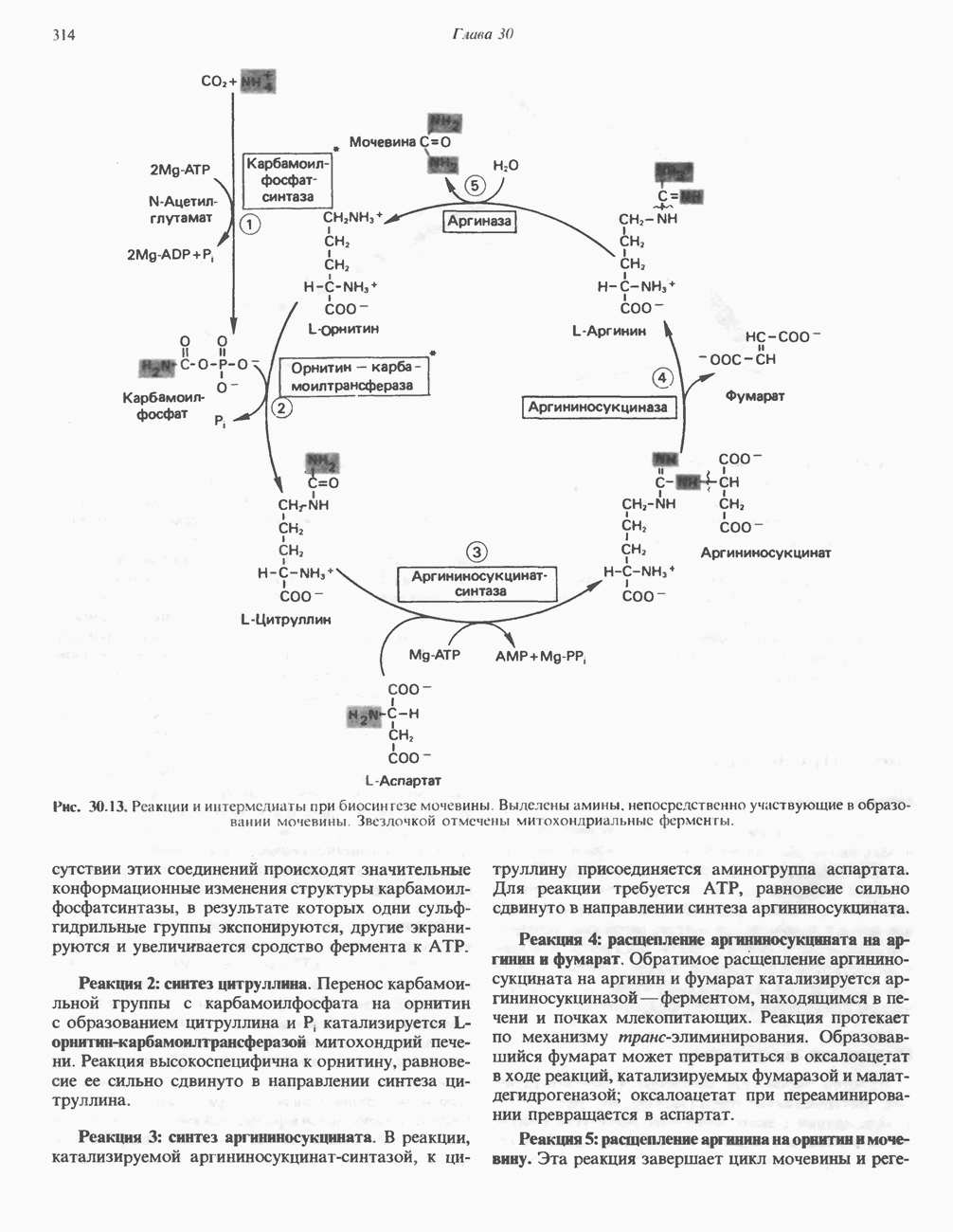
Рис. 8.9. Схема альтернативных путей реакции при индуцировании субстратом конформационных изменений в ферменте. Фермент сначала претерпевает конформационное изменение (А), затем связывает субстрат (Б). На альтернативном пути фермент сначала связывает субстрат (В), а затем претерпевает конформационное изменение (Д). Наконец, оба процесса могут развиваться согласованным образом (Г) с образованием конечной конформации 
Еще одной структурной особенностью фермента является небольшая выемка в правой части. Представим, что в эту выемку попадает регуляторная молекула, «удерживающая» один из полипептидных участков, который несет каталитическую группу, от перемещения. Тогда будет происходить лишь связывание субстрата, но не катализ.
Остается выяснить точную последовательность событий, из которых складываются индуцированные субстратом конформационные изменения. Здесь возможно несколько путей, представленных на рис. 8.9.
Предположим, что нам известна полная первичная структура фермента. Даже в этом случае обычно бывает трудно решить, из каких именно остатков формируется каталитический центр. Как явствует из модели индуцированного соответствия, эти остатки могут располагаться далеко один от другого в первичной структуре, но быть сближены в трехмерной (третичной) структуре.
В формировании каталитического центра принимают участие аминокислотные остатки нескольких сегментов полипептидной цепи, как в случае гемоглобина (гл. 6) или химотрипсина (гл. 9).
Каталитический центр лизоцима
Лизоцим присутствует в составе слез, носовой слизи, слюны, желудочного секрета, в различных тканях, а также в молоке и яичном белке. Этот фермент катализирует гидролиз Р-1,4-связей N-ацетилнейраминовой кислоты (см. гл. 13 и 33), входящей в состав протеогликанов и глюкозаминогликанов. Лизоцим, присутствующий в слезах и носовой

Рис. 8.10. Схематическое представление каталитического центра, расположенного в щели, которая проходит посредине молекулы лизоцима. Глнкозильные звенья гексасахарида обозначены буквами от А до F. Указаны некоторые остатки, выстилающие щель активного центра, и их номера в аминокислотной последовательности лизоцима.
слизи, разрушает клеточные стенки многих попадающих из воздуха грамположительных бактерий. Лизоцим (мол. масса около 15 000) образован одной полипептидной цепью, содержащей 129 остатков. Поскольку в составе молекулы нет ни кофермента, ни ионов металлов, катализ, специфичность и трехмерная структура лизоцима целиком определяются аминокислотной последовательностью. В молекуле имеются небольшие области складчатого слоя, несколько коротких а-спиралей и достаточно большие участки с нерегулярной структурой. Цветной снимок трехмерной модели лизоцима в комплексе с субстратом можно найти в работе J. Biol. Chem. 1968: 243, 1663. Посредине молекулы лизоцима проходит глубокая щель, в которой находятся остатки, формирующие каталитический центр и субстратсвязывающую область; последняя содержит шесть участков, взаимодействующих с разными субстратами или ингибиторами (рис. 8.10). Остатки, ответственные за расщепление связи, располагаются между участками D и Е; наиболее важную роль играют карбоксильные группы остатков  Последний, по всей вероятности, протонирует гликозидную связь субстрата, а отрицательно заряженный остаток
Последний, по всей вероятности, протонирует гликозидную связь субстрата, а отрицательно заряженный остаток  располагающийся на противоположной стороне, стабилйзирует образующийся в результате карбониевый ион.
располагающийся на противоположной стороне, стабилйзирует образующийся в результате карбониевый ион.
Каталитический центр рибонуклеазы
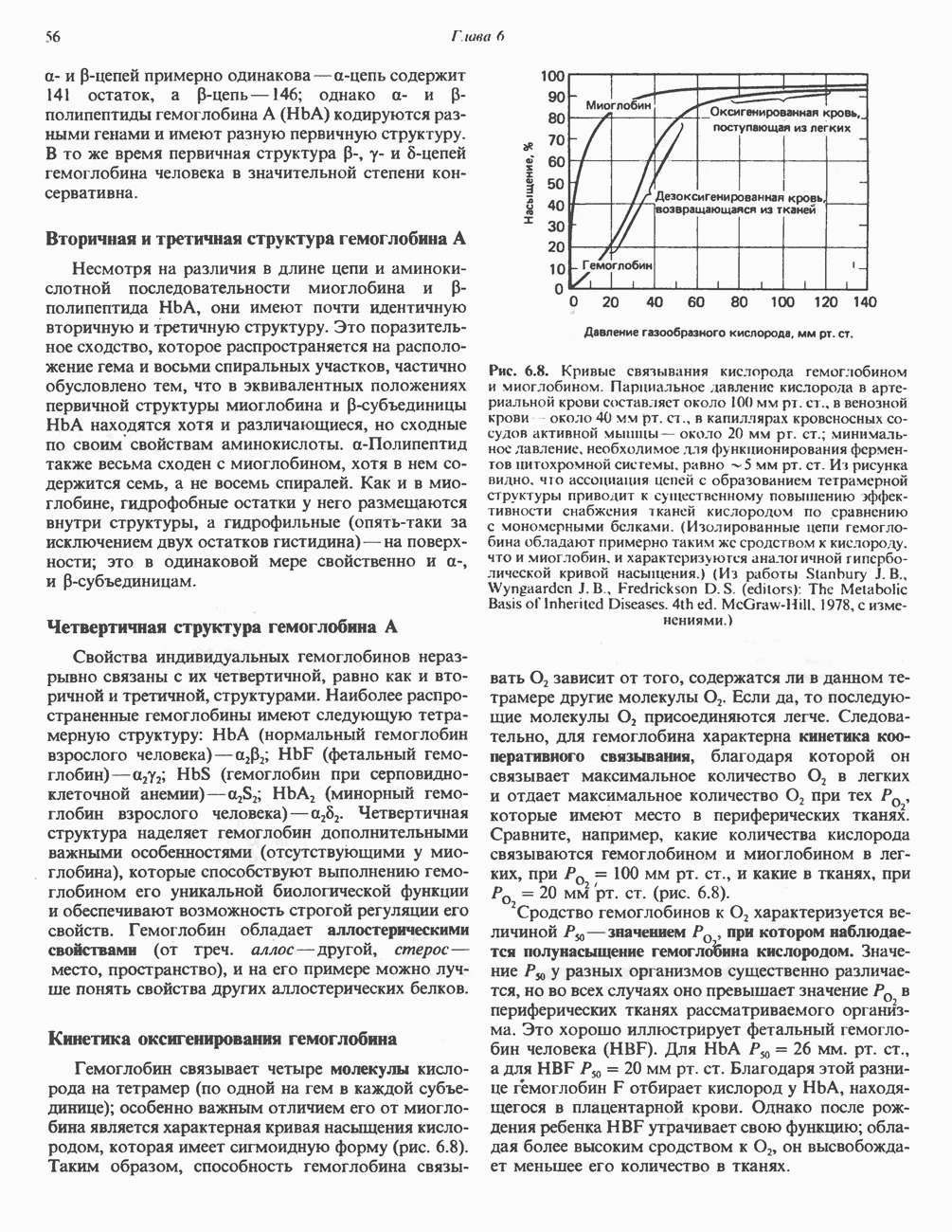
В отличие от ситуации с лизоцимом информация о каталитическом центре рибонуклеазы была в значительной мере получена еще до определения ее трехмерной структуры. Выводы, основанные на химических исследованиях, подтверждены кристаллографическими данными.

Рис. 8.11. Структура рибонуклеазы по данным рентгено-структурного анализа. Указаны номера специфических остатков. (См. также рис. 5.7.)
В молекуле рибонуклеазы тоже имеется щель, сходная со щелью в лизоциме, в которую выступают два остатка,  Из полученных ранее химических данных следовало, что эти остатки входят в состав каталитического центра. Оба они располагаются вблизи места связывания уридиловой кислоты (рис. 8.11).
Из полученных ранее химических данных следовало, что эти остатки входят в состав каталитического центра. Оба они располагаются вблизи места связывания уридиловой кислоты (рис. 8.11).
Аминокислотные последовательности в области каталитического центра
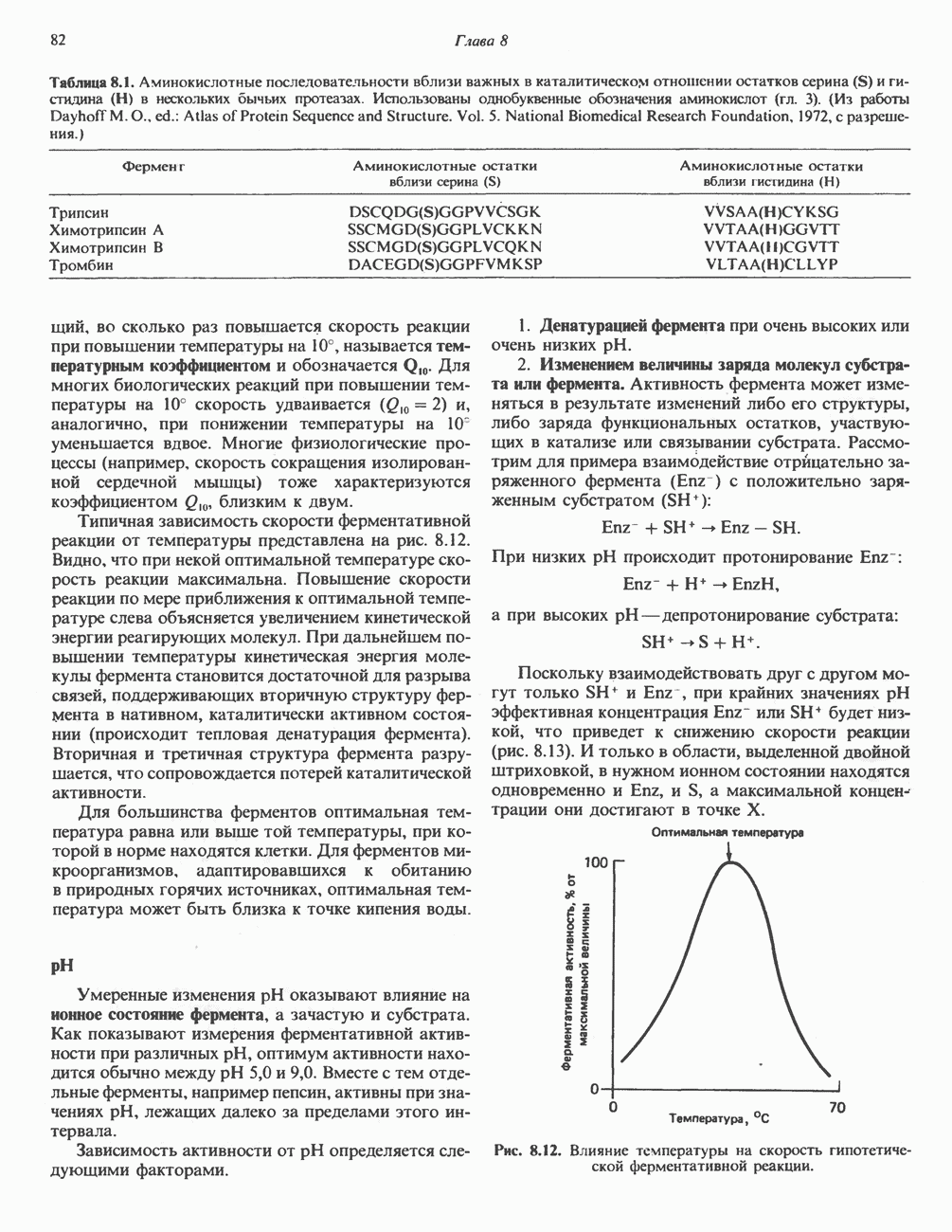
Первичная структура в окрестности каталитического центра у различных семейств гидролитических ферментов оказывается довольно близкой (табл. 8.1). Это позволяет предполагать, что механизмы гидролиза связей в биологических системах относительно немногочисленны. Поэтому неудивительно, что аминокислотные последовательности в области каталитического центра у одного и того же фермента, выделенного из разных видов, еще более сходны.
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие к русскому изданию
- Предисловие
- Глава 1. Биохимия и медицина
- Глава 2. Биомолекулы и биохимические методы
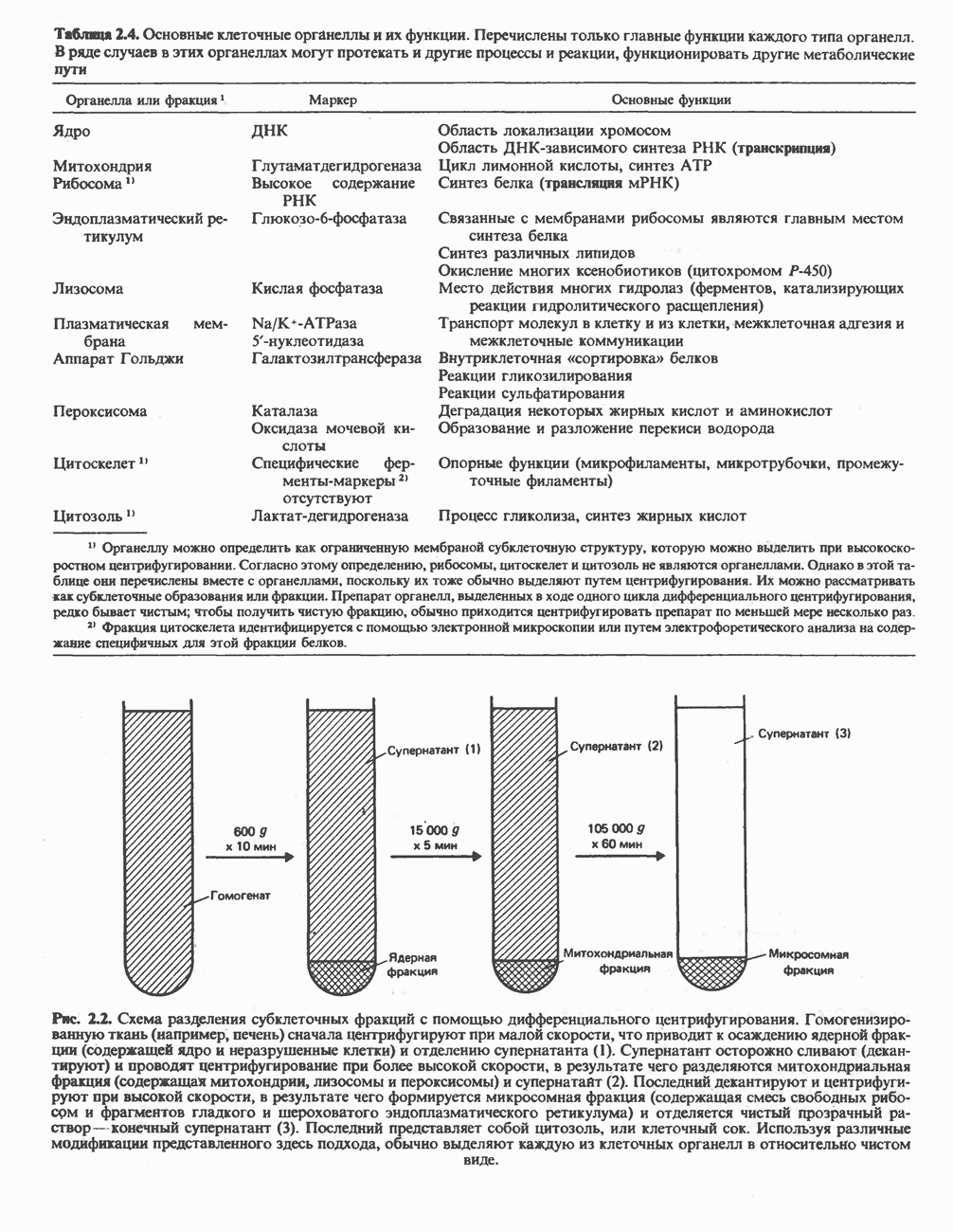
- КЛЕТКА
- ОБЩИЙ ЭКСПЕРИМЕНТАЛЬНЫЙ ПОДХОД, ИСПОЛЬЗУЕМЫЙ В БИОХИМИИ
- ОСНОВНЫЕ ДОСТИЖЕНИЯ БИОХИМИИ
- Раздел I. Структура и функции белков и ферментов
- Глава 3. Аминокислоты
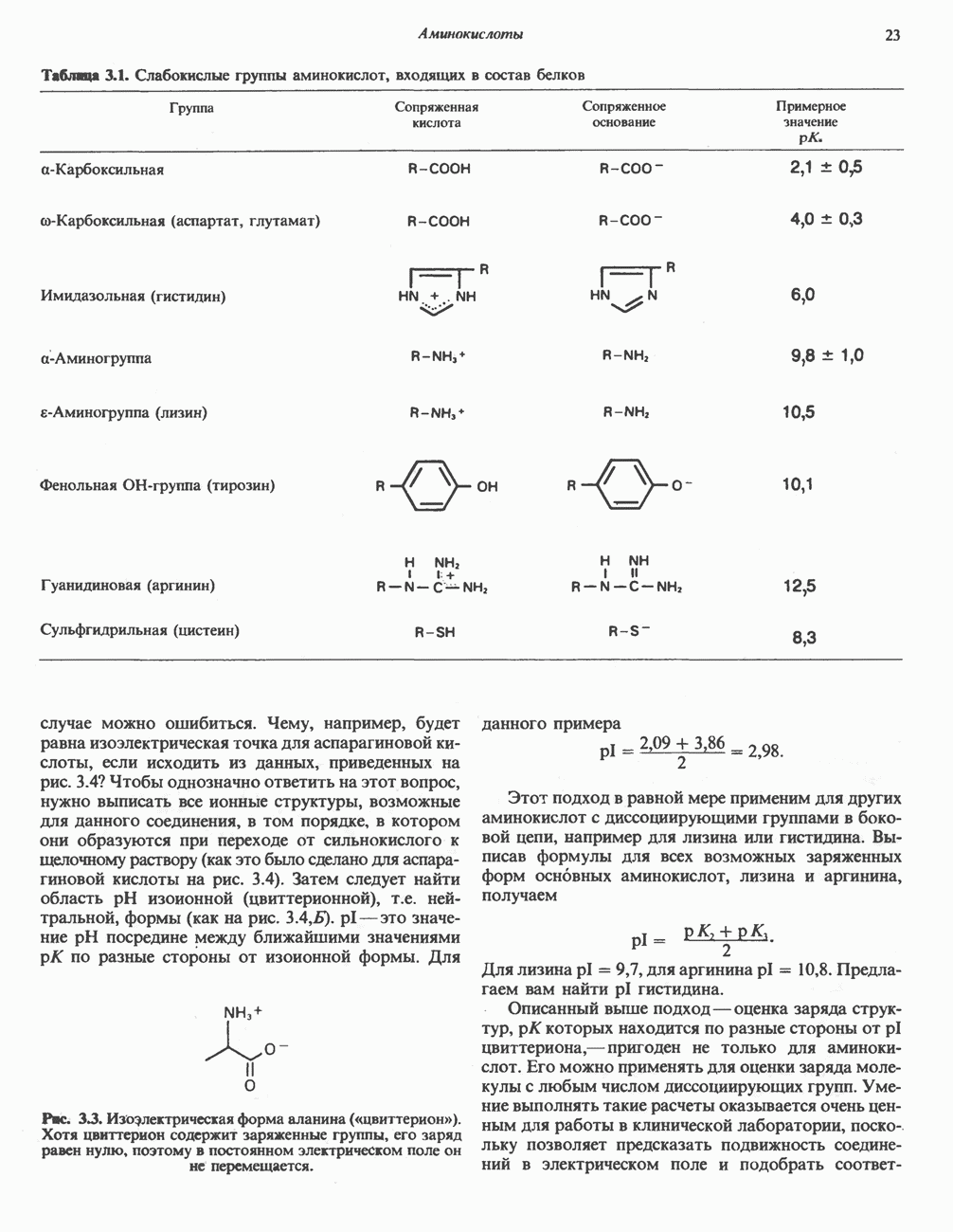
- АМИНОКИСЛОТЫ
- ИОННЫЕ ФОРМЫ АМИНОКИСЛОТ
- СТРУКТУРА АМИНОКИСЛОТ
- РАСТВОРИМОСТЬ АМИНОКИСЛОТ
- ОБЩИЕ ХИМИЧЕСКИЕ РЕАКЦИИ
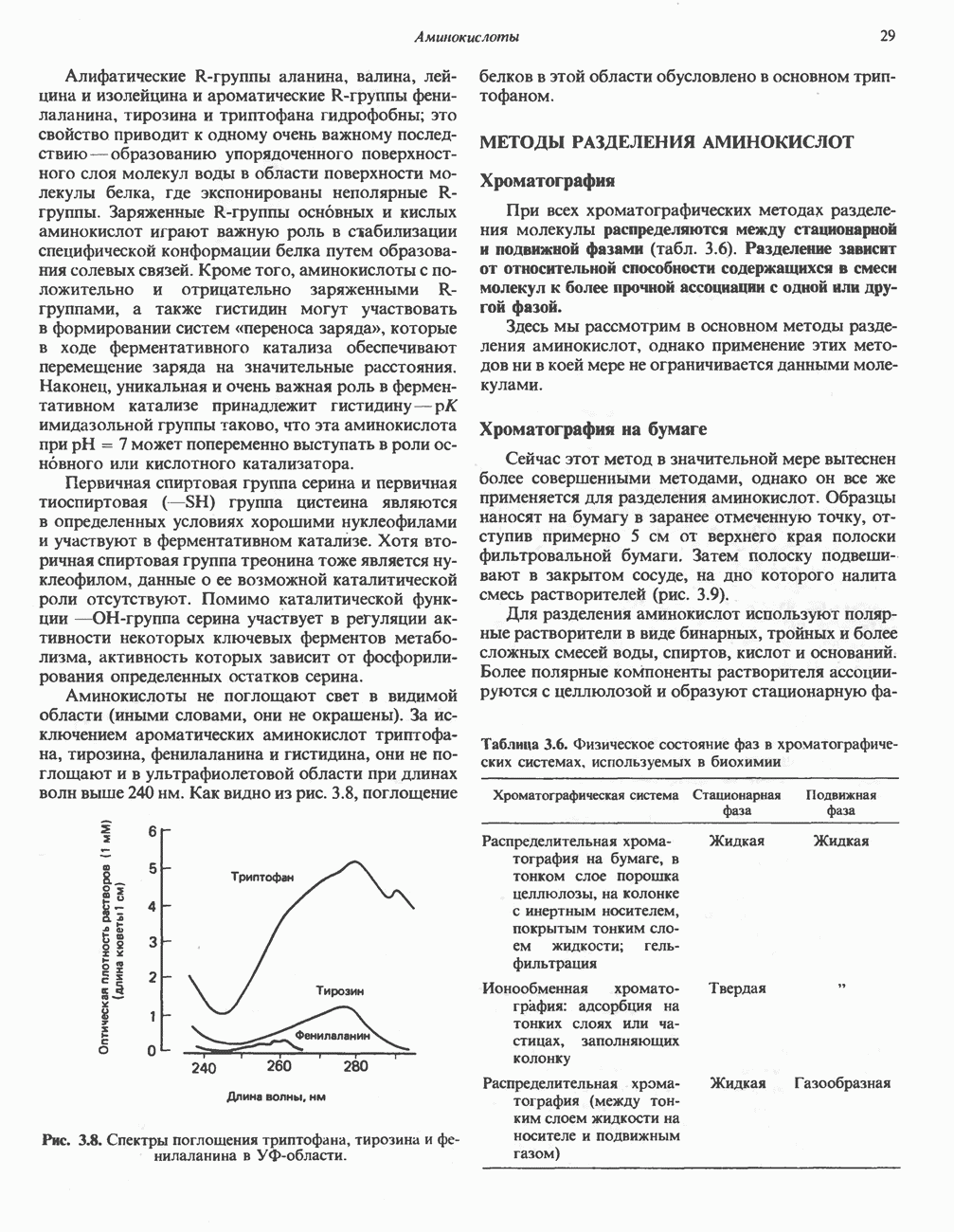
- СВОЙСТВА ИНДИВИДУАЛЬНЫХ АМИНОКИСЛОТ
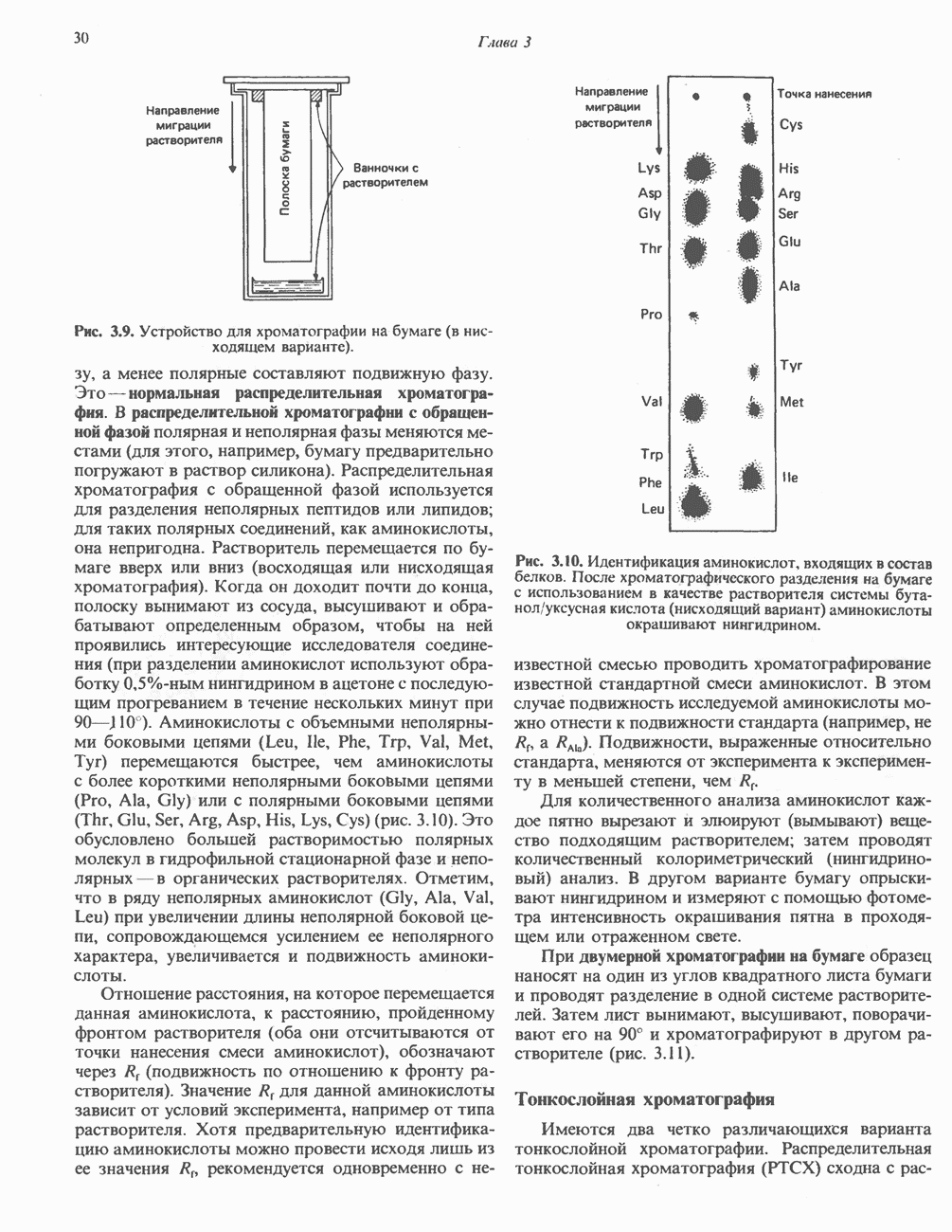
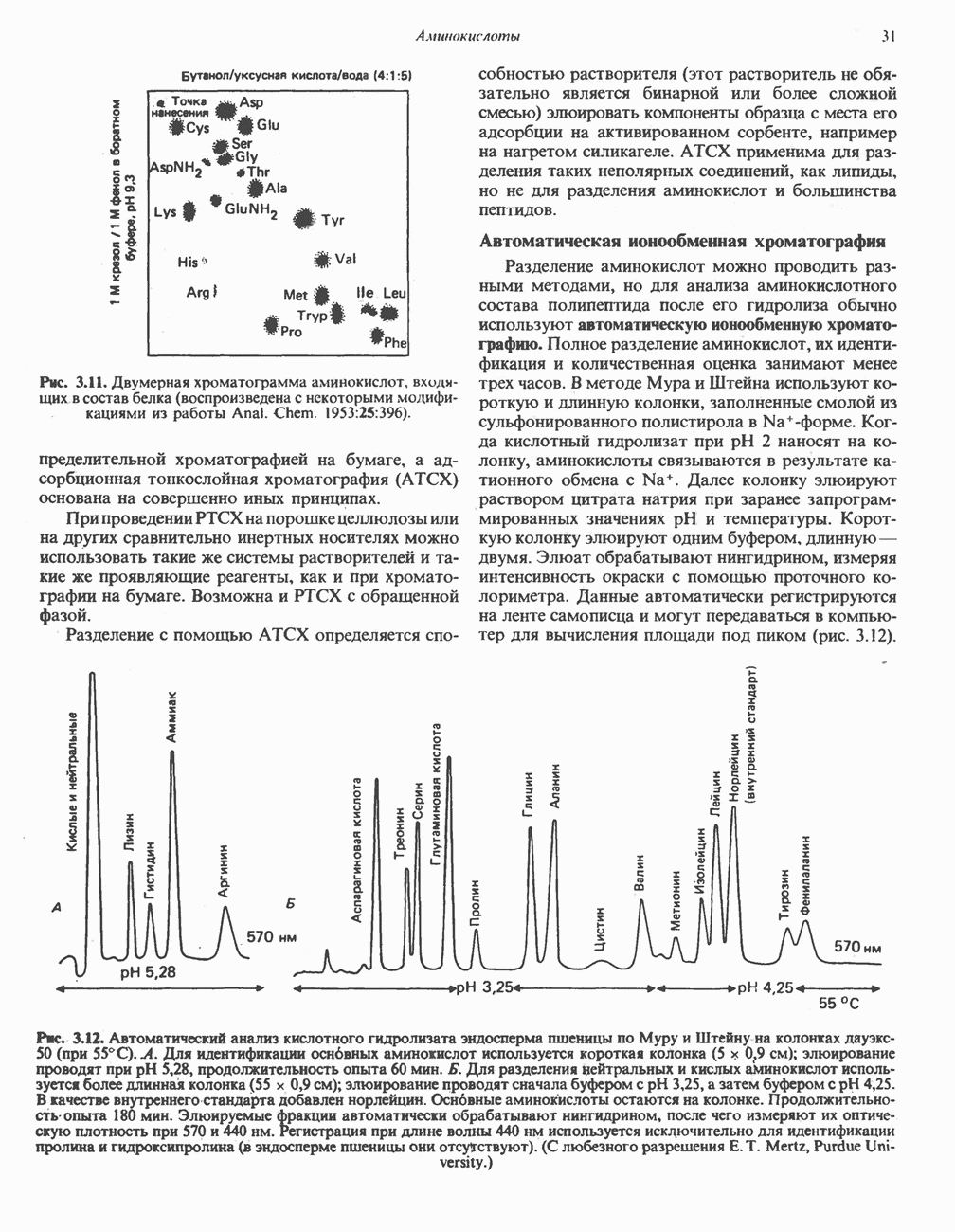
- МЕТОДЫ РАЗДЕЛЕНИЯ АМИНОКИСЛОТ
- Глава 4. Пептиды
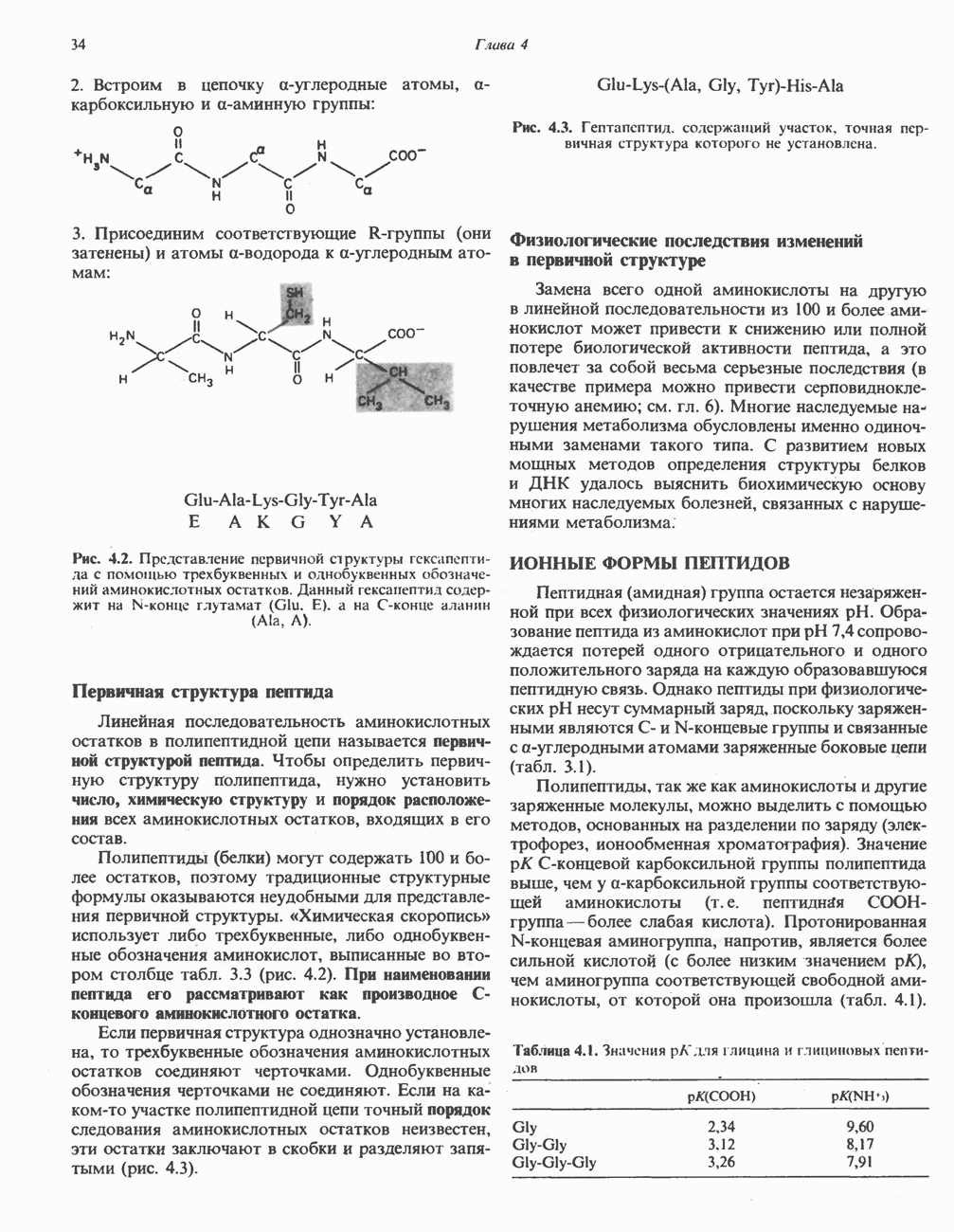
- СТРУКТУРА ПЕПТИДОВ
- ИОННЫЕ ФОРМЫ ПЕПТИДОВ
- КОНФОРМАЦИЯ ПЕПТИДОВ В РАСТВОРЕ
- МЕТОДЫ РАЗДЕЛЕНИЯ ПЕПТИДОВ
- ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОГО СОСТАВА ПЕПТИДОВ
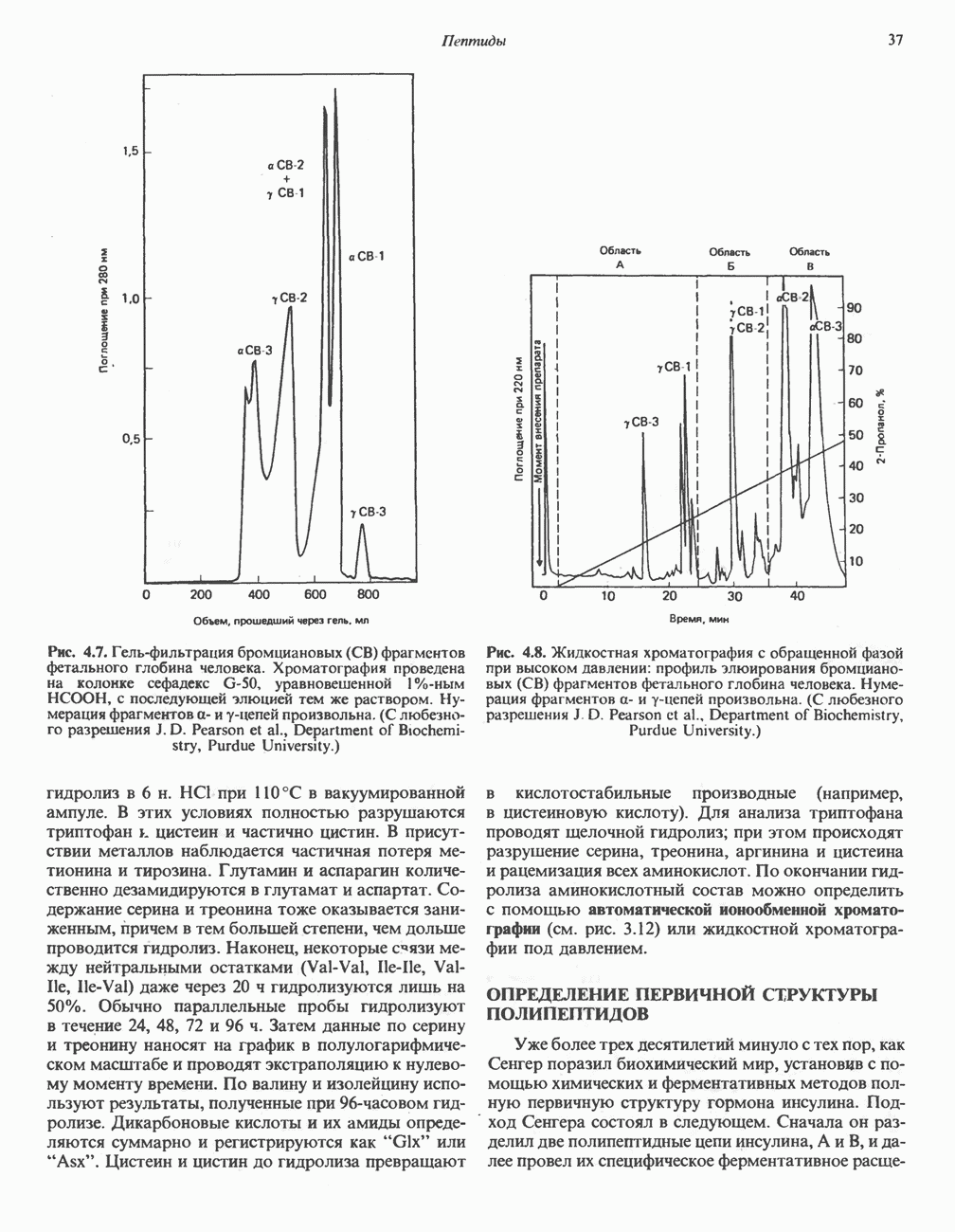
- ОПРЕДЕЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ ПОЛИПЕПТИДОВ
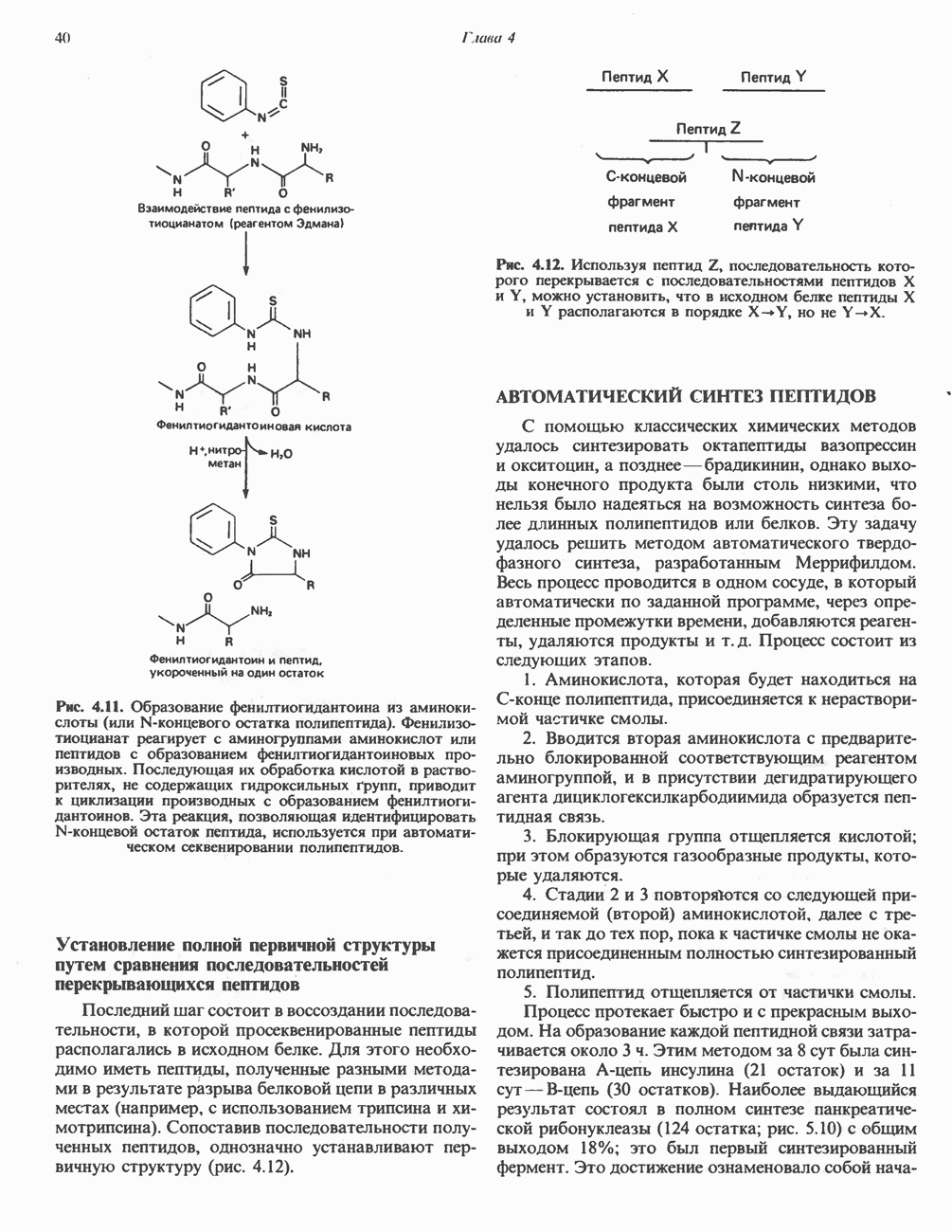
- АВТОМАТИЧЕСКОЕ ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ПОЛИПЕПТИДОВ МЕТОДОМ ЭДМАНА
- АВТОМАТИЧЕСКИЙ СИНТЕЗ ПЕПТИДОВ
- ЛИТЕРАТУРА
- Глава 5. Белки: структура и свойства
- КЛАССИФИКАЦИЯ БЕЛКОВ
- СВЯЗИ, ОТВЕТСТВЕННЫЕ ЗА ФОРМИРОВАНИЕ СТРУКТУРЫ БЕЛКА
- УПОРЯДОЧЕННЫЕ КОНФОРМАЦИИ ПОЛИПЕПТИДОВ
- УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКА
- ДЕНАТУРАЦИЯ
- МЕТОДЫ ОПРЕДЕЛЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ
- ОПРЕДЕЛЕНИЕ ВТОРИЧНОЙ И ТРЕТИЧНОЙ СТРУКТУРЫ МЕТОДОМ РЕНТГЕНОВСКОЙ КРИСТАЛЛОГРАФИИ
- ОПРЕДЕЛЕНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ
- ГЛАВА 6. Белки: миоглобин и гемоглобин
- ГЕМОПРОТЕИНЫ — МИОГЛОБИН И ГЕМОГЛОБИН
- МИОГЛОБИН
- ГЕМОГЛОБИНЫ
- Глава 7. Ферменты: общие свойства
- КОФЕРМЕНТЫ
- «ТРЕХТОЧЕЧНАЯ ФИКСАЦИЯ» СУБСТРАТОВ НА ФЕРМЕНТАХ
- СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
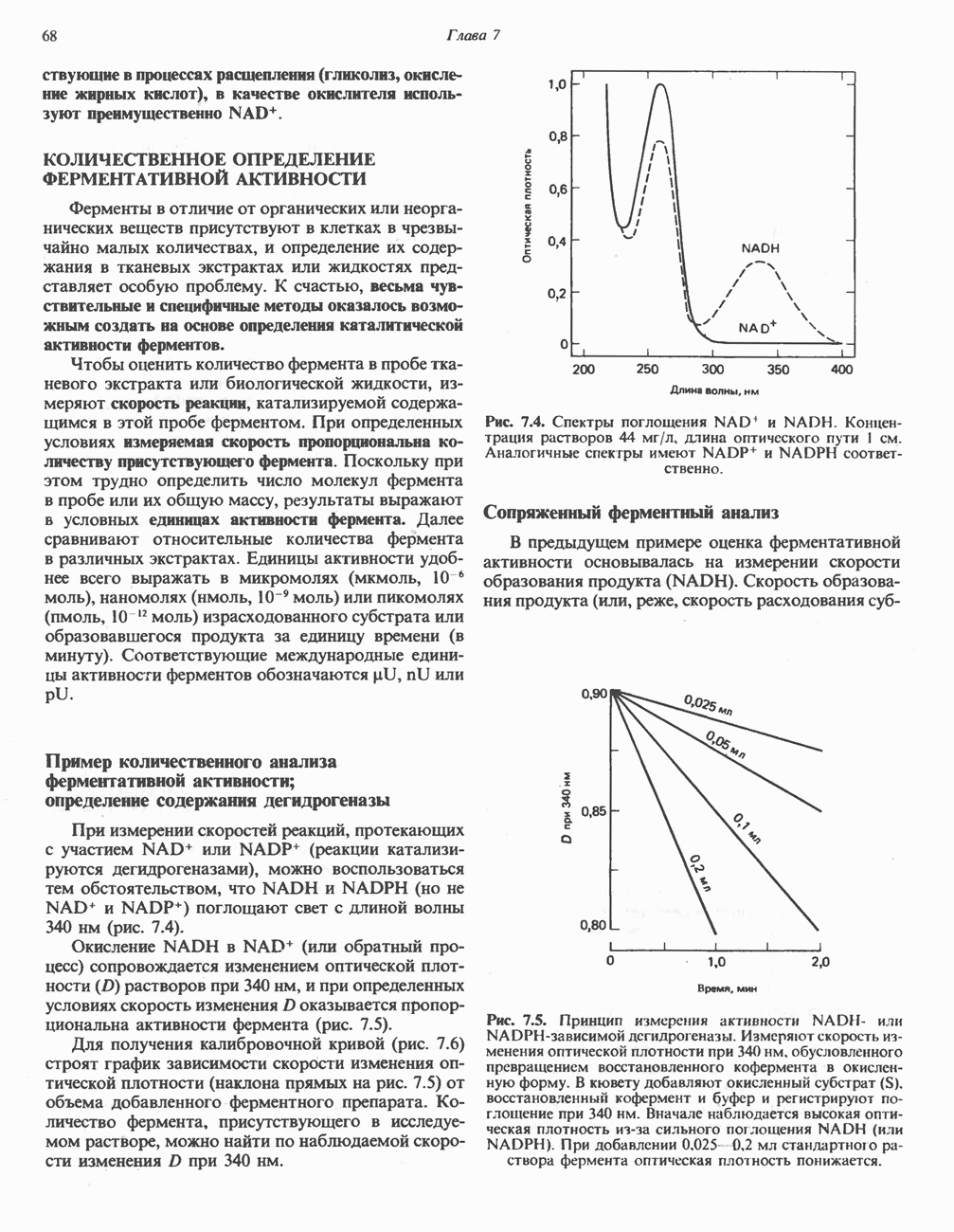
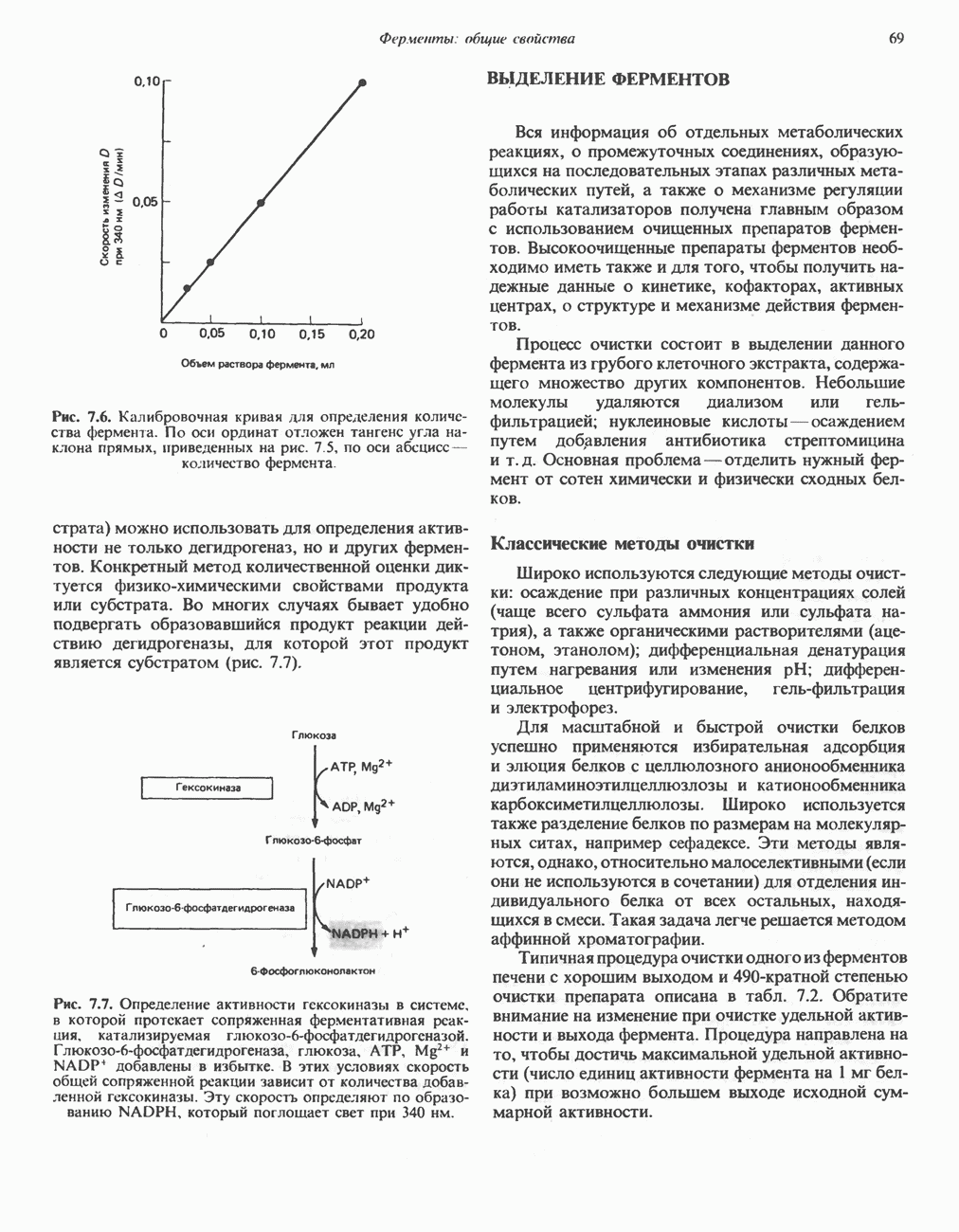
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
- ВЫДЕЛЕНИЕ ФЕРМЕНТОВ
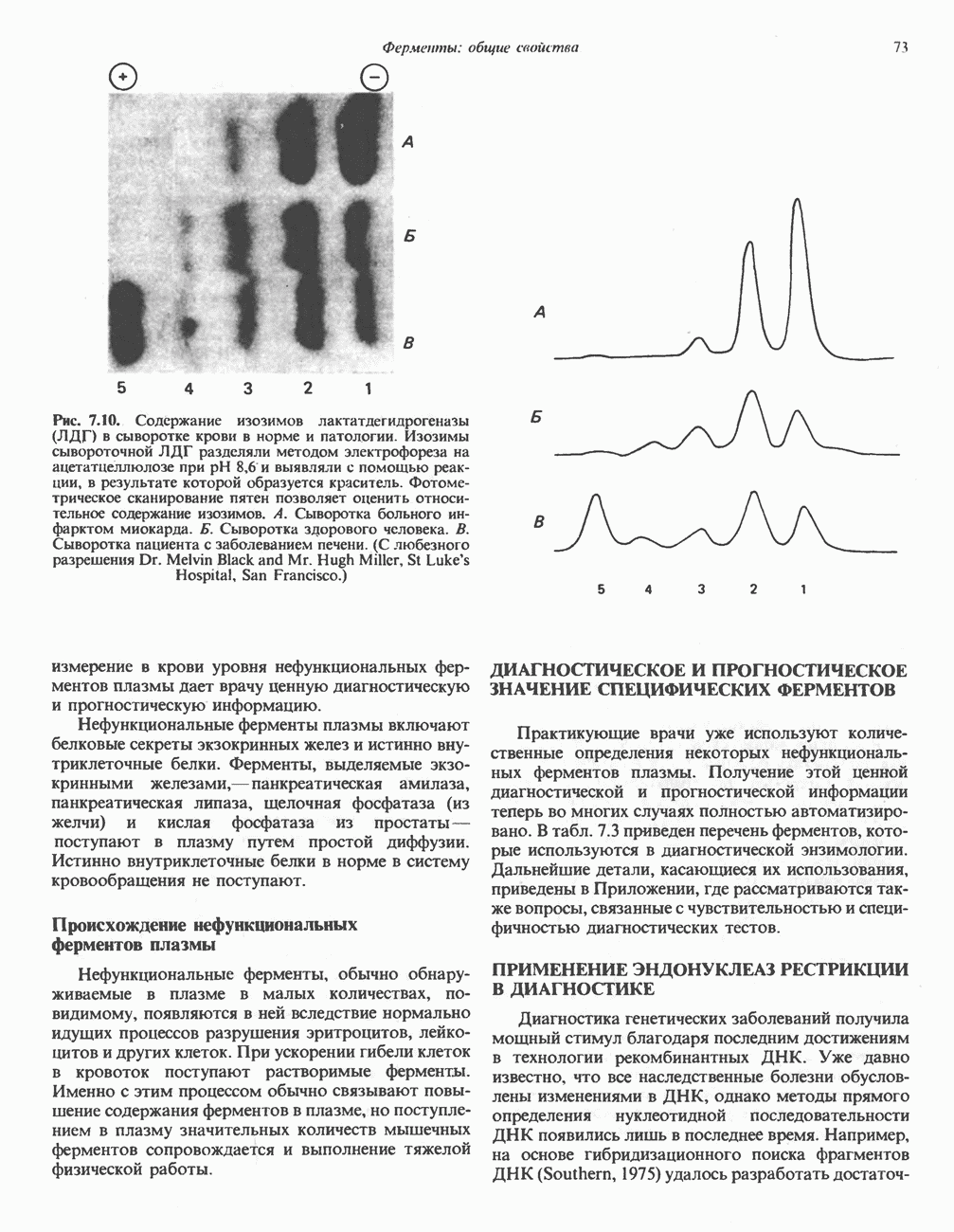
- ИЗОФЕРМЕНТЫ (ИЗОЗИМЫ)
- ФЕРМЕНТЫ В КЛИНИЧЕСКОЙ ДИАГНОСТИКЕ
- ДИАГНОСТИЧЕСКОЕ И ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ СПЕЦИФИЧЕСКИХ ФЕРМЕНТОВ
- ПРИМЕНЕНИЕ ЭНДОНУКЛЕАЗ РЕСТРИКЦИИ В ДИАГНОСТИКЕ
- ЛИТЕРАТУРА
- Глава 8. ФЕРМЕНТЫ: КИНЕТИКА
- ОБРАЗОВАНИЕ И РАСПАД ПЕРЕХОДНЫХ СОСТОЯНИЙ
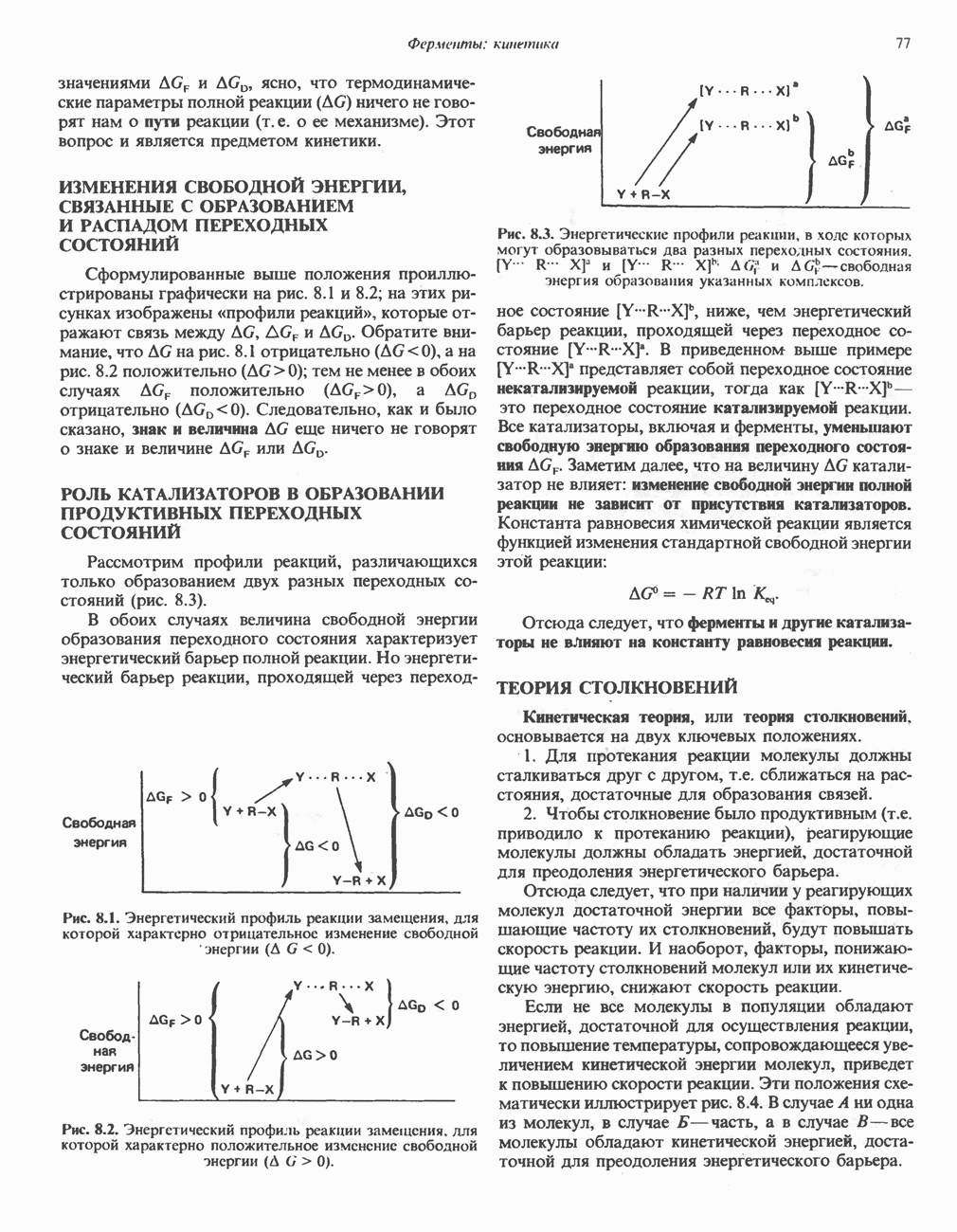
- ИЗМЕНЕНИЯ СВОБОДНОЙ ЭНЕРГИИ, СВЯЗАННЫЕ С ОБРАЗОВАНИЕМ И РАСПАДОМ ПЕРЕХОДНЫХ СОСТОЯНИЙ
- РОЛЬ КАТАЛИЗАТОРОВ В ОБРАЗОВАНИИ ПРОДУКТИВНЫХ ПЕРЕХОДНЫХ СОСТОЯНИЙ
- ТЕОРИЯ СТОЛКНОВЕНИЙ
- РОЛЬ ФЕРМЕНТОВ В РАЗРЫВЕ И ОБРАЗОВАНИИ КОВАЛЕНТНЫХ СВЯЗЕЙ
- КАТАЛИТИЧЕСКИЙ ЦЕНТР
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА АКТИВНОСТЬ ФЕРМЕНТОВ
- КОНСТАНТА РАВНОВЕСИЯ
- КОНЦЕНТРАЦИЯ ФЕРМЕНТА
- КОНЦЕНТРАЦИЯ СУБСТРАТА
- УРАВНЕНИЕ МИХАЭЛИСА—МЕНТЕН
- ОГРАНИЧЕНИЯ, ПРИСУЩИЕ УРАВНЕНИЮ МИХАЭЛИСА — МЕНТЕН
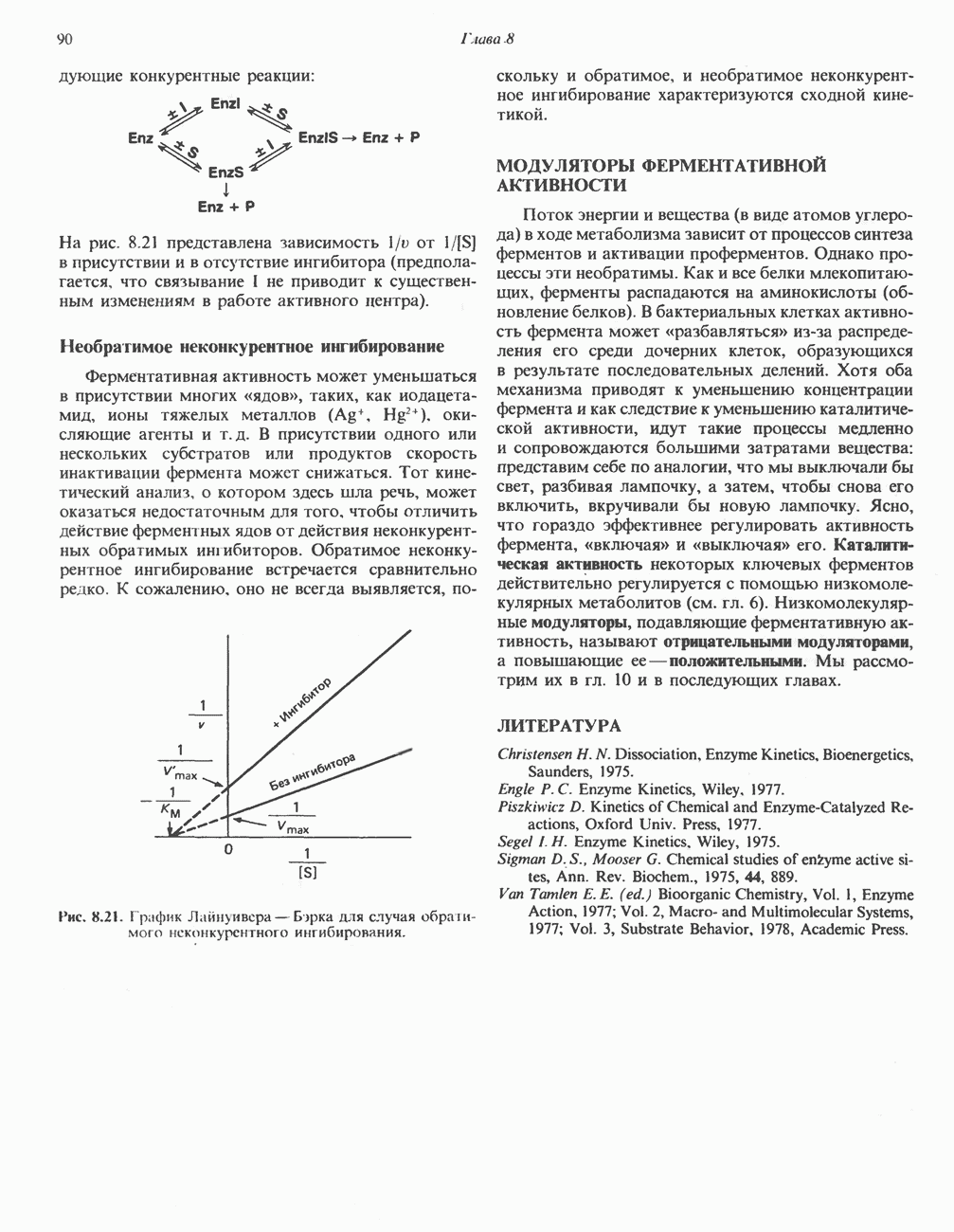
- ИНГИБИРОВАНИЕ АКТИВНОСТИ ФЕРМЕНТОВ
- МОДУЛЯТОРЫ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
- Глава 9. Ферменты: механизм действия
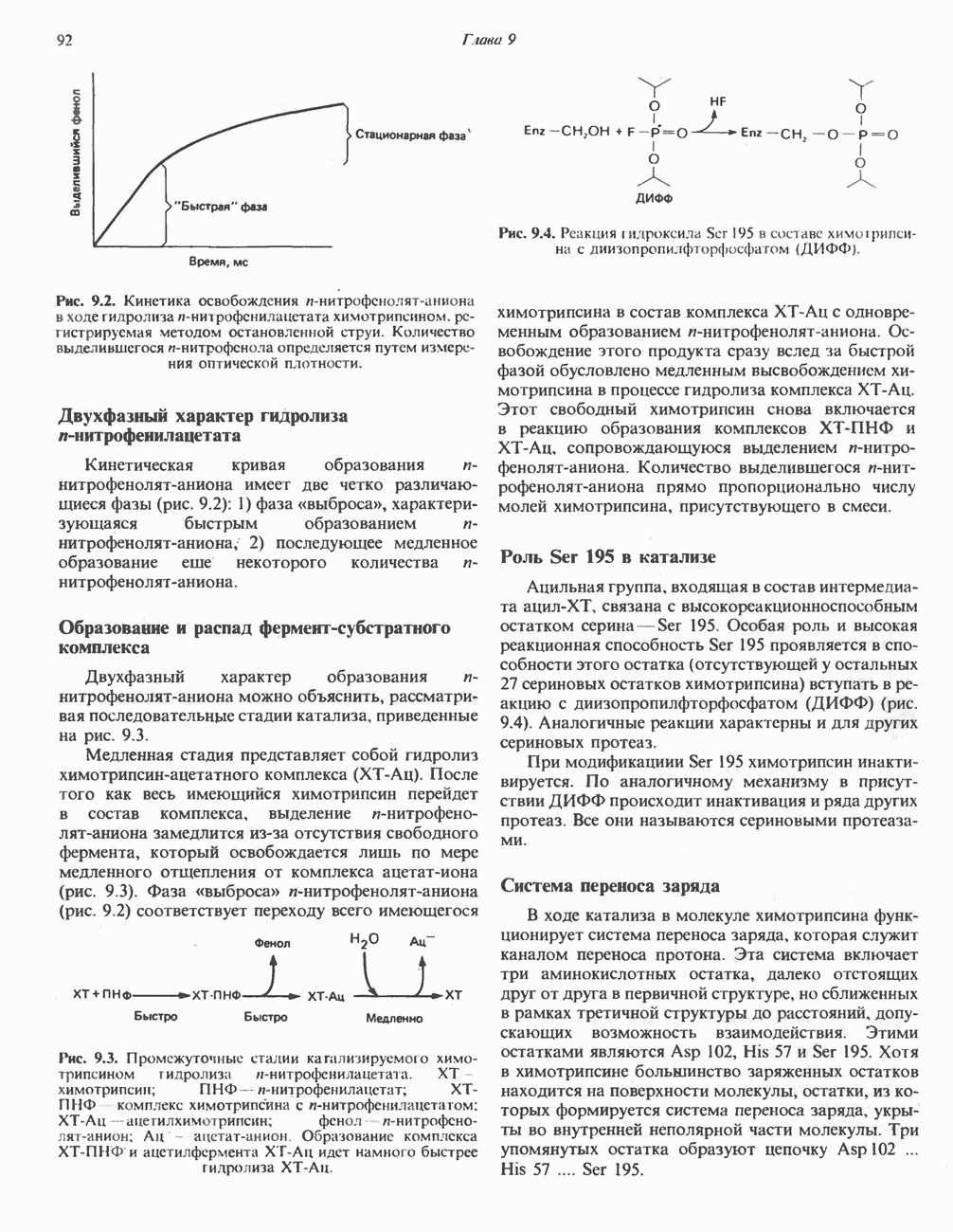
- МЕХАНИЗМ КАТАЛИТИЧЕСКОГО ДЕЙСТВИЯ ХИМОТРИПСИНА
- РОЛЬ ИЗБИРАТЕЛЬНОГО ПРОТЕОЛИЗА В ФОРМИРОВАНИИ АКТИВНЫХ ЦЕНТРОВ ФЕРМЕНТОВ
- УПОРЯДОЧЕННОЕ И НЕУПОРЯДОЧЕННОЕ СВЯЗЫВАНИЕ СУБСТРАТОВ
- ФЕРМЕНТЫ КАК КАТАЛИЗАТОРЫ ОБЩЕГО КИСЛОТНОГО И ОБЩЕГО ОСНОВНОГО ТИПА
- ИОНЫ МЕТАЛЛОВ
- Глава 10. Ферменты: регуляция активности
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА
- РЕГУЛЯЦИЯ КОЛИЧЕСТВА ФЕРМЕНТА ПУТЕМ РЕГУЛЯЦИИ СКОРОСТИ ЕГО СИНТЕЗА И РАСПАДА
- РЕГУЛЯЦИЯ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ФЕРМЕНТОВ
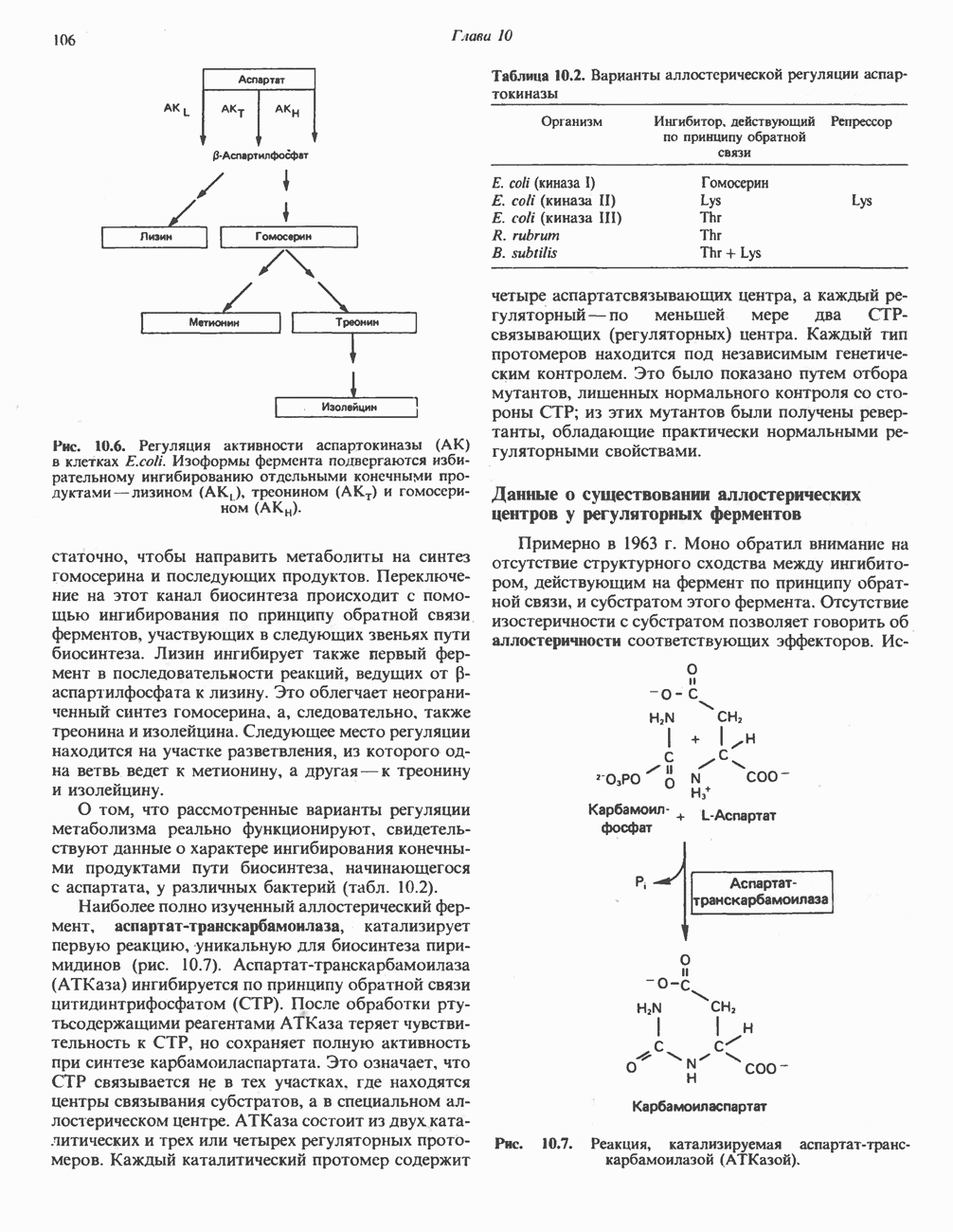
- АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ
- КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ФЕРМЕНТОВ
- Раздел II. Биоэнергетика и метаболизм углеводов и липидов
- Глава 11. Биоэнергетика
- СВОБОДНАЯ ЭНЕРГИЯ И ЗАКОНЫ ТЕРМОДИНАМИКИ
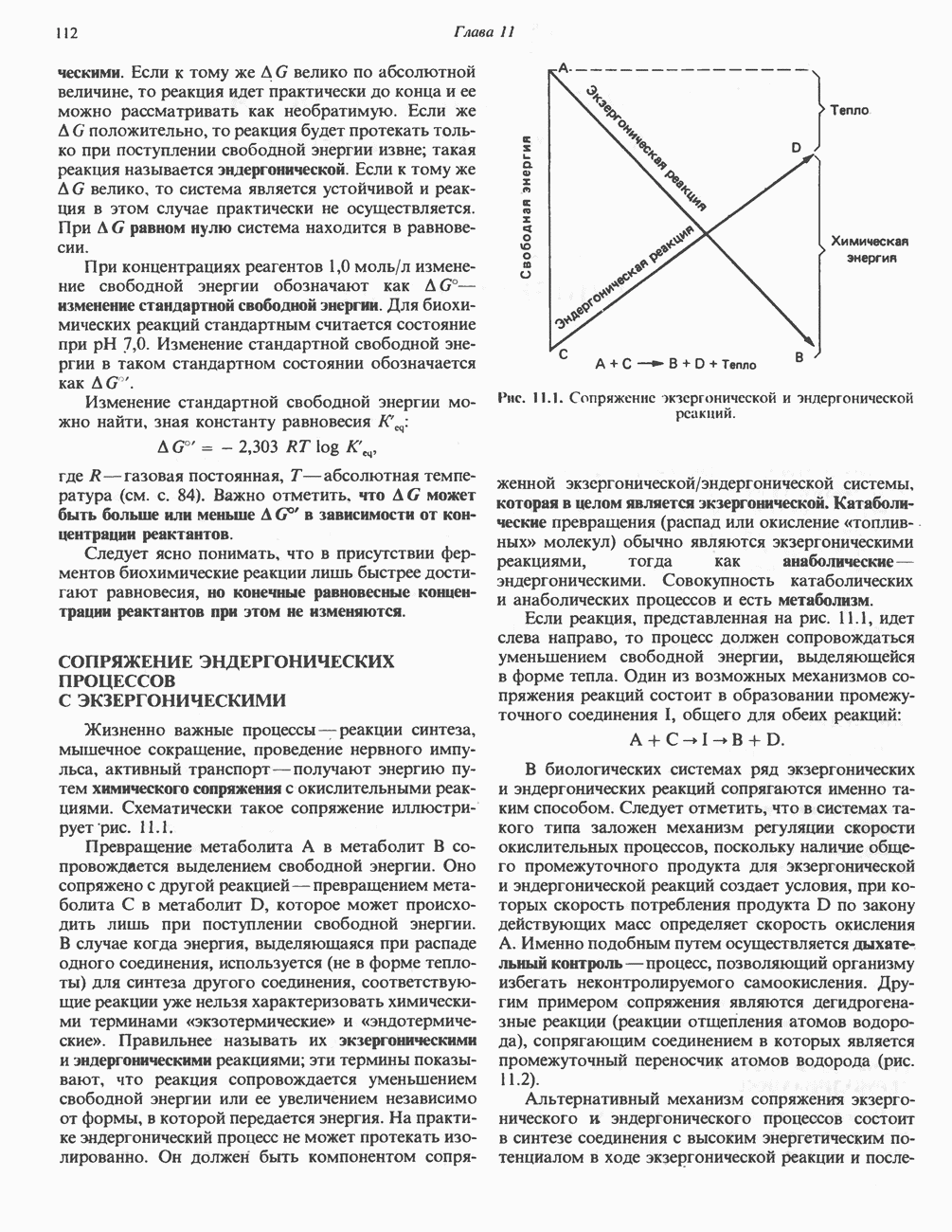
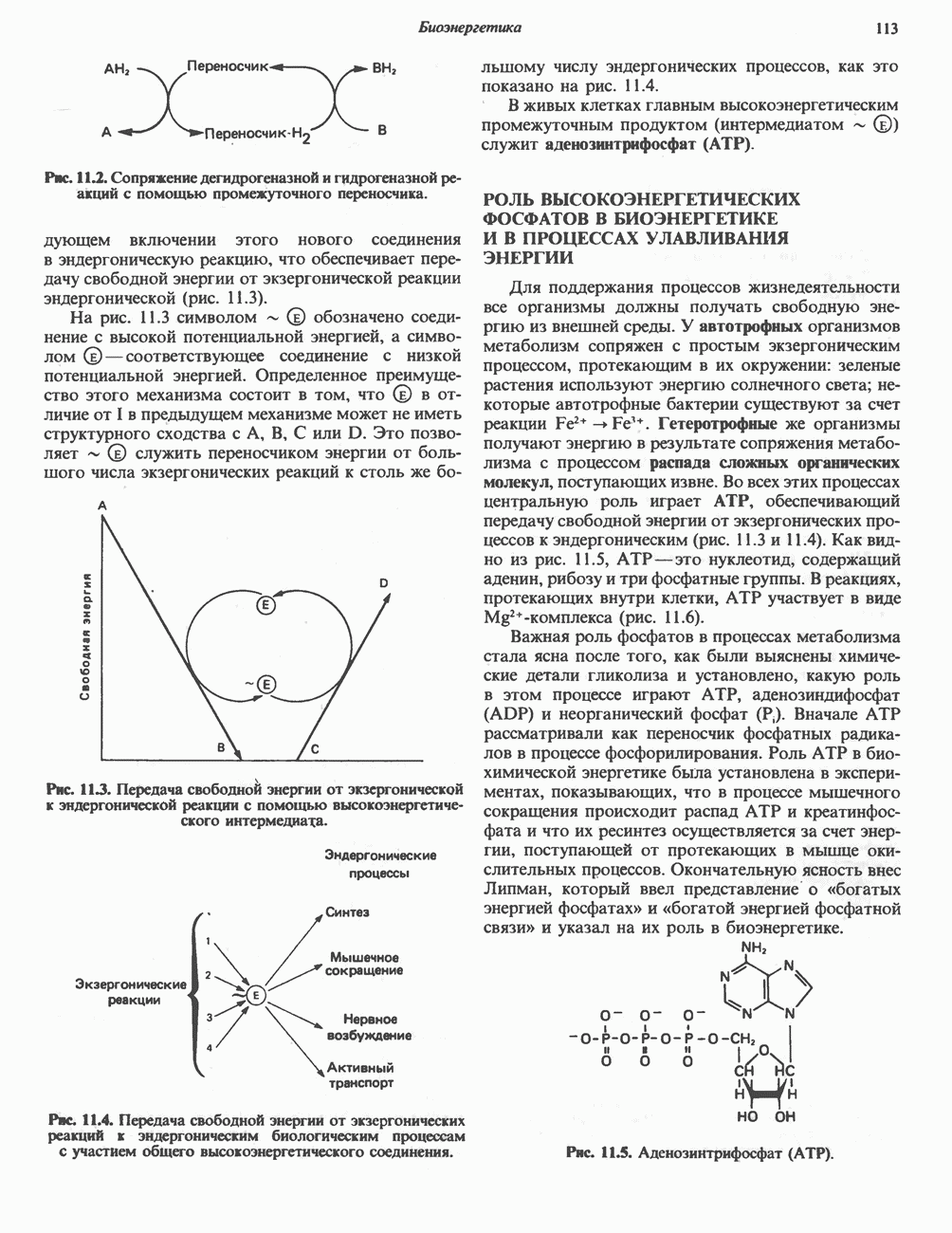
- СОПРЯЖЕНИЕ ЭНДЕРГОНИЧЕСКИХ ПРОЦЕССОВ С ЭКЗЕРГОНИЧЕСКИМИ
- РОЛЬ ВЫСОКОЭНЕРГЕТИЧЕСКИХ ФОСФАТОВ В БИОЭНЕРГЕТИКЕ И В ПРОЦЕССАХ УЛАВЛИВАНИЯ ЭНЕРГИИ
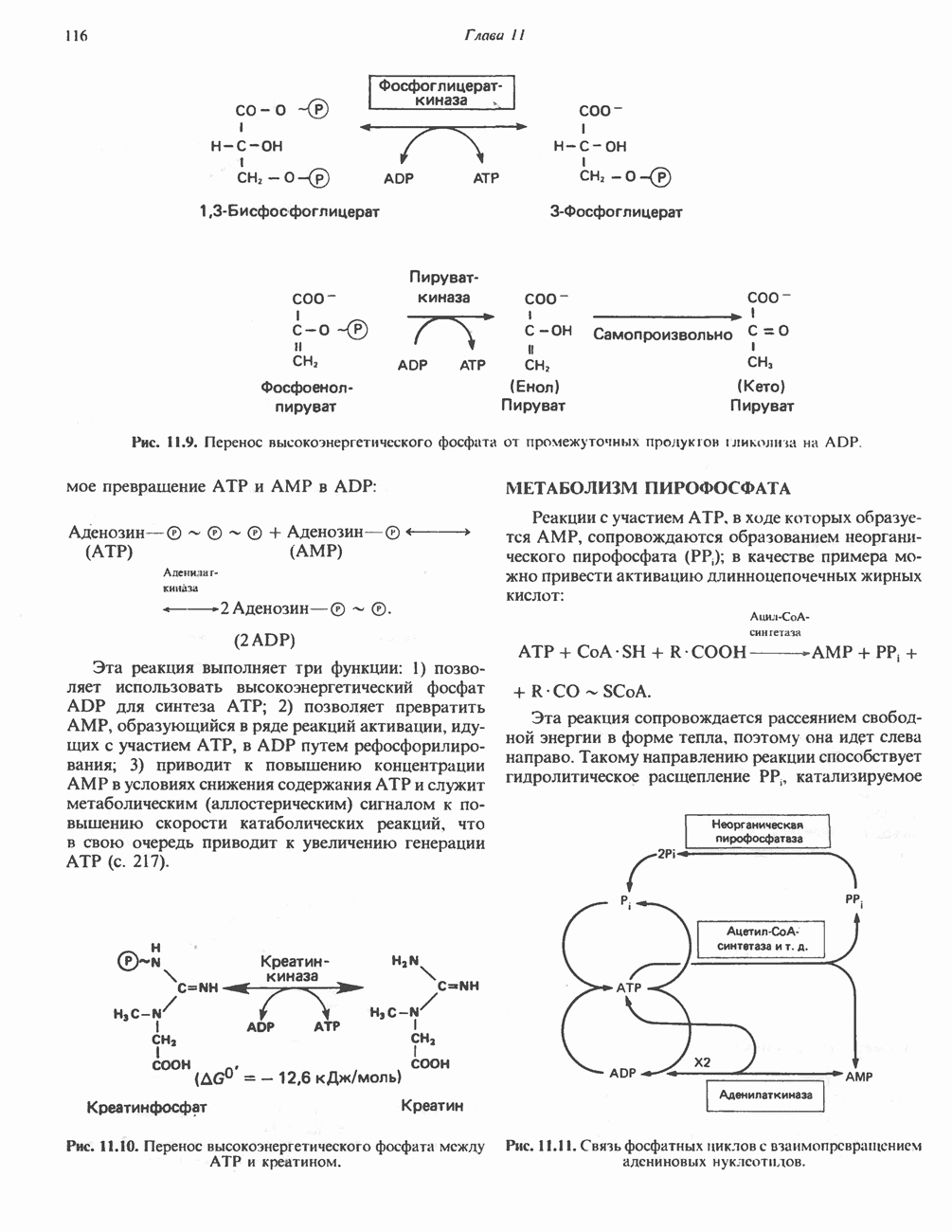
- МЕТАБОЛИЗМ ПИРОФОСФАТА
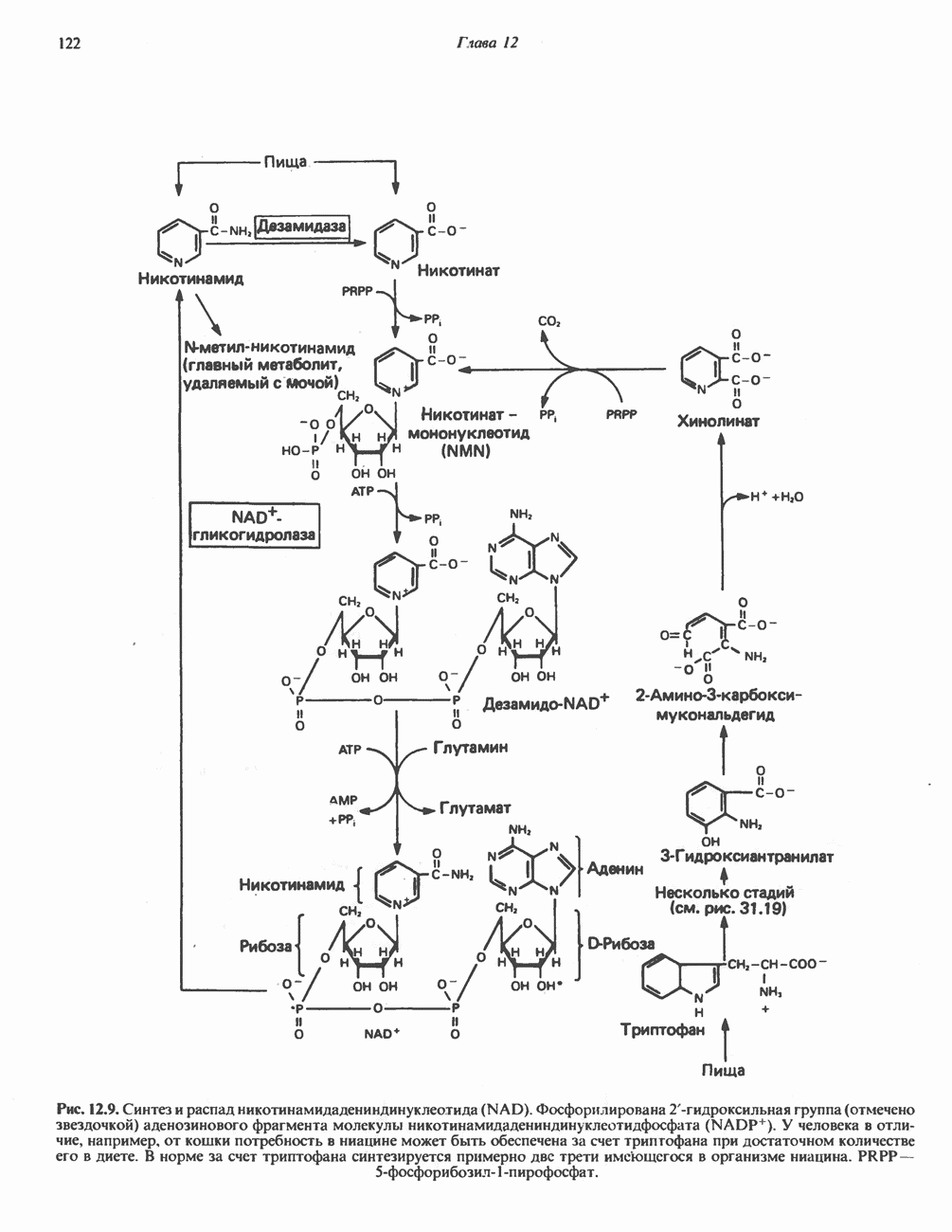
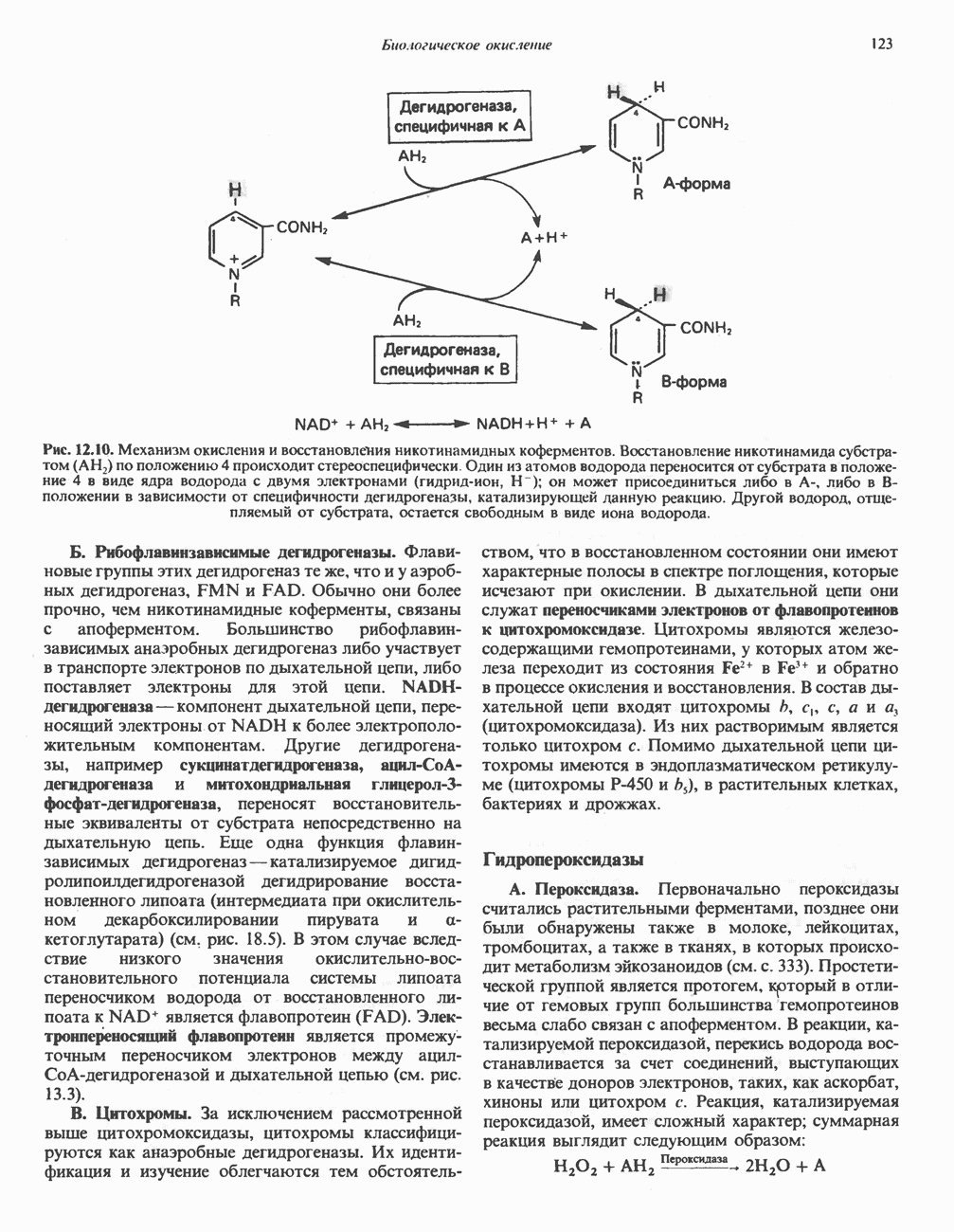
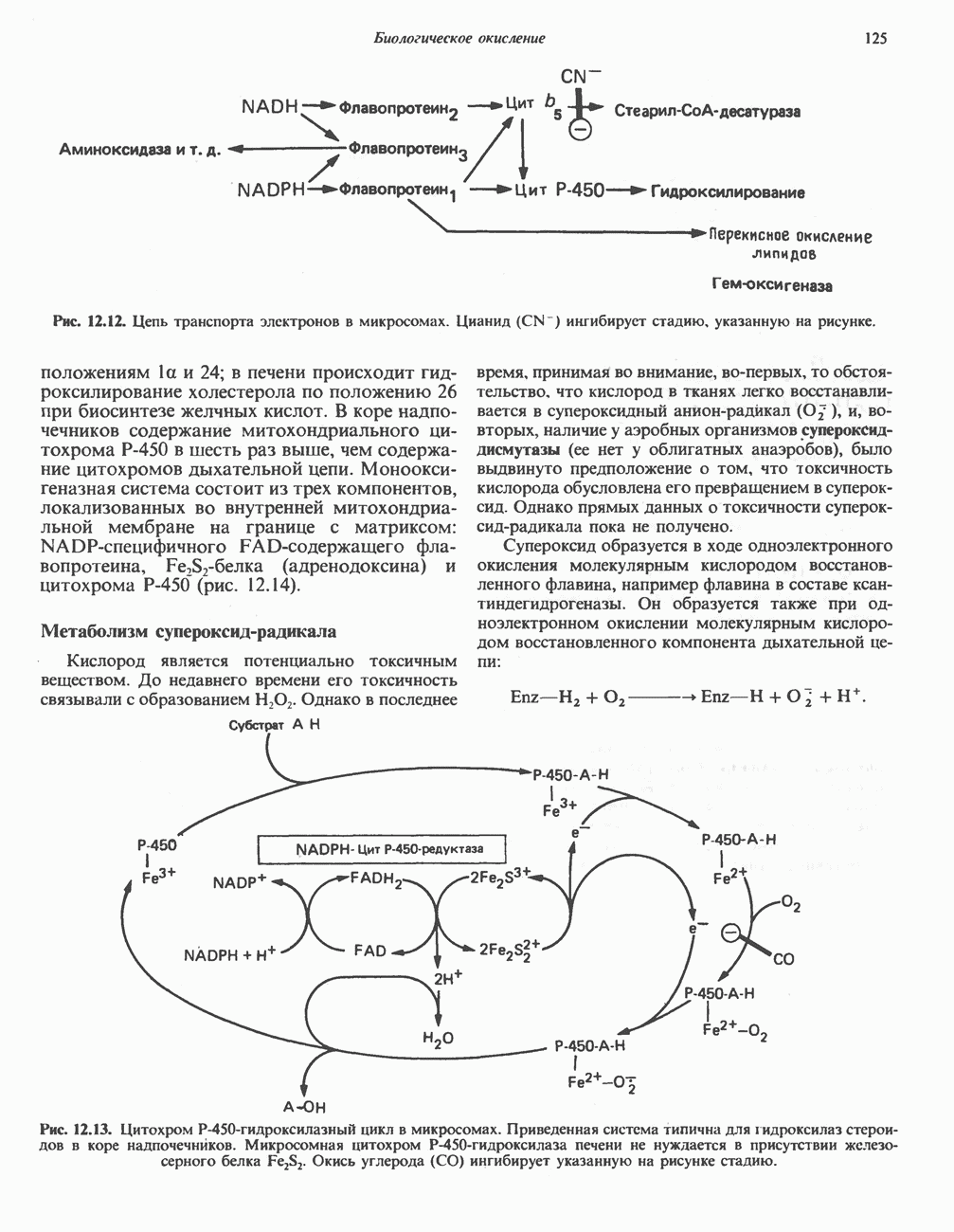
- Глава 12. Биологическое окисление
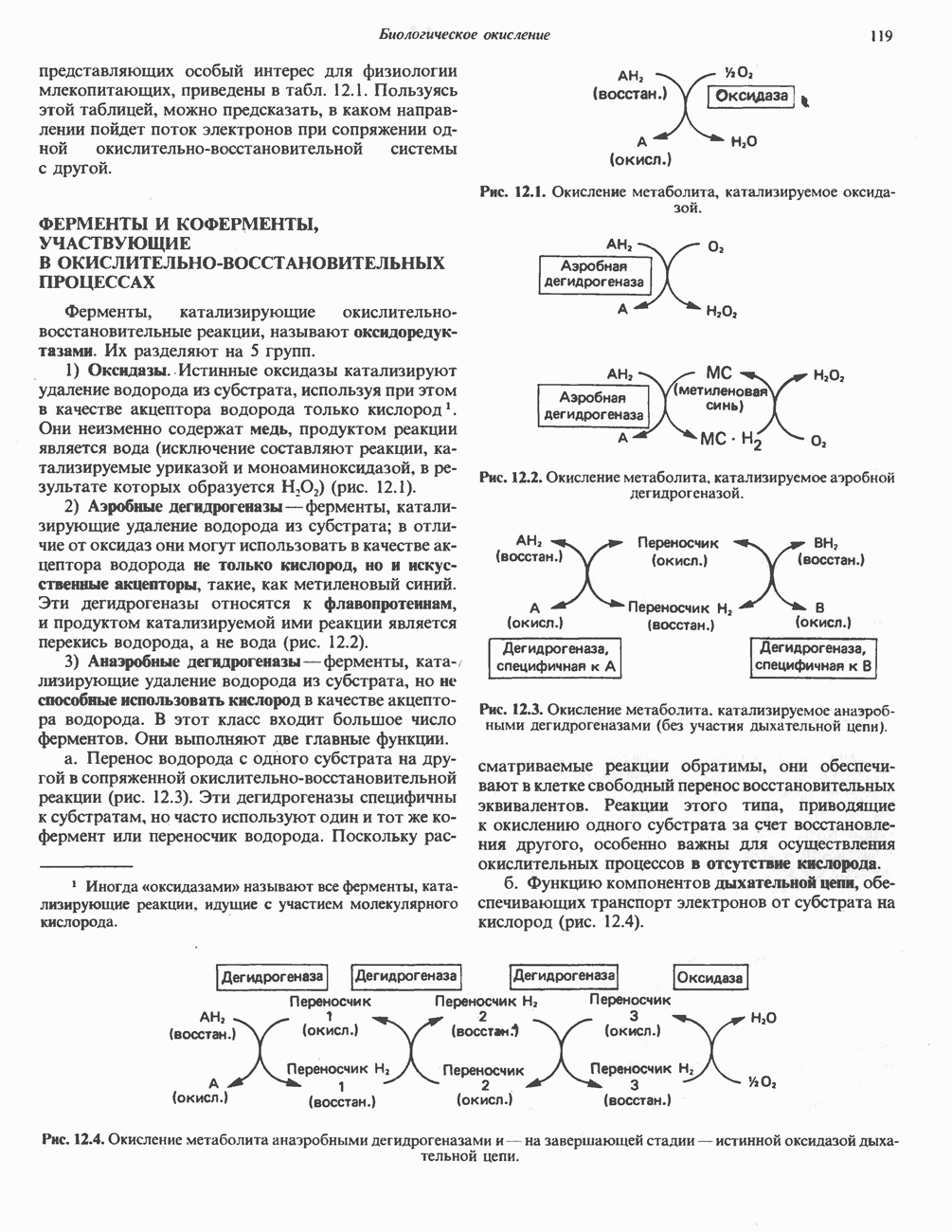
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ РАВНОВЕСИЕ, ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ
- ФЕРМЕНТЫ И КОФЕРМЕНТЫ, УЧАСТВУЮЩИЕ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССАХ
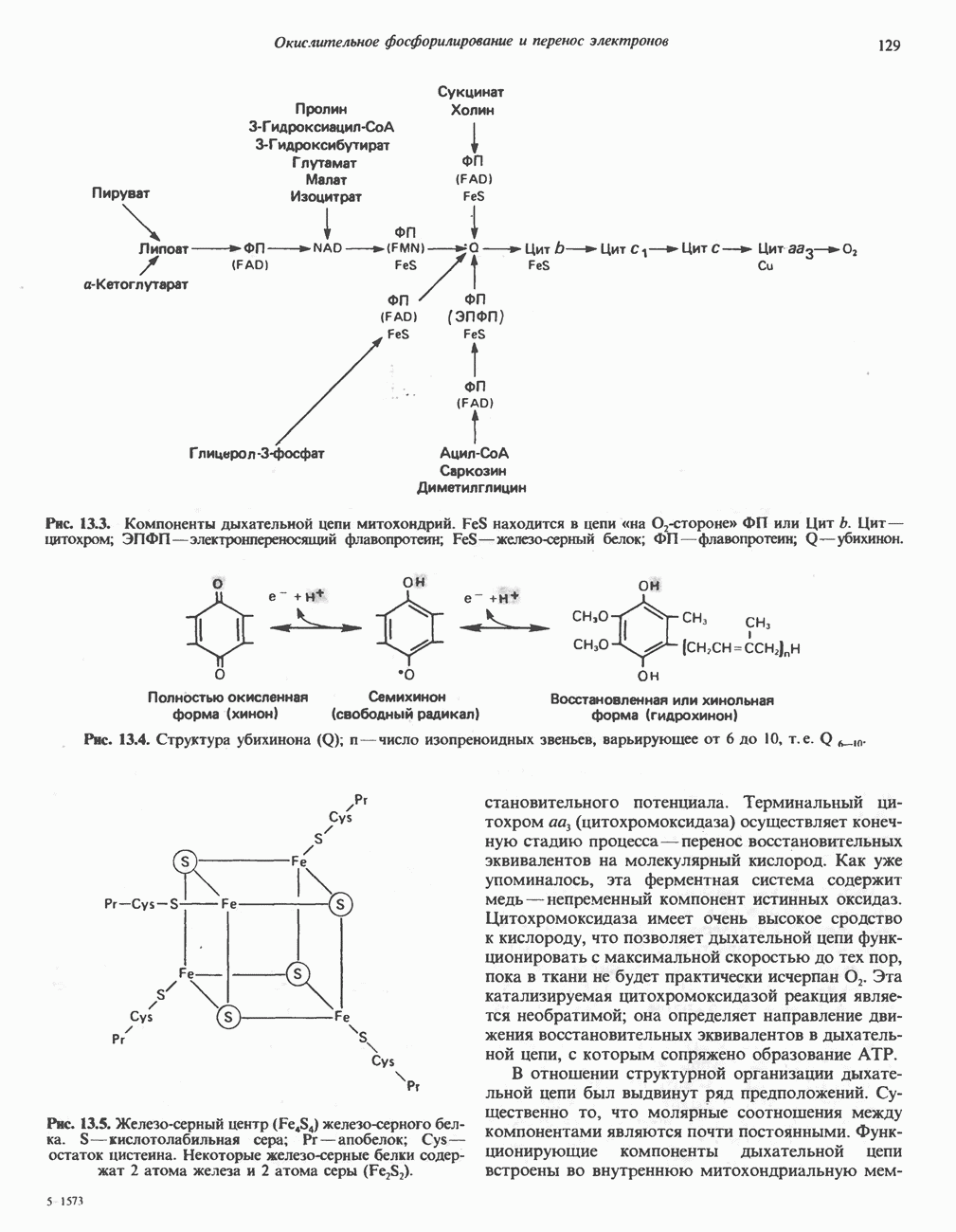
- Глава 13. Окислительное фосфорилирование и транспортные системы митохондрий
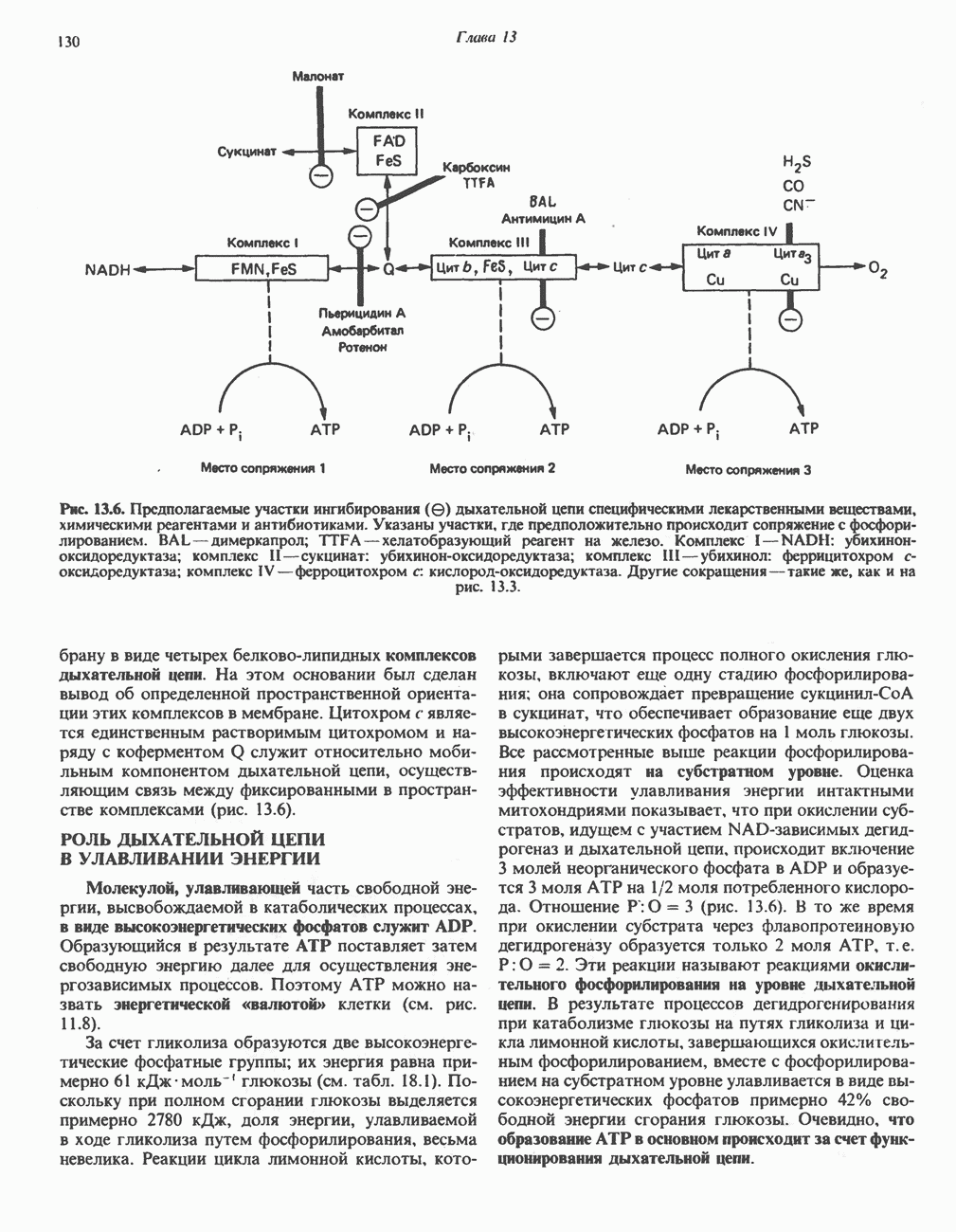
- ДЫХАТЕЛЬНАЯ ЦЕПЬ
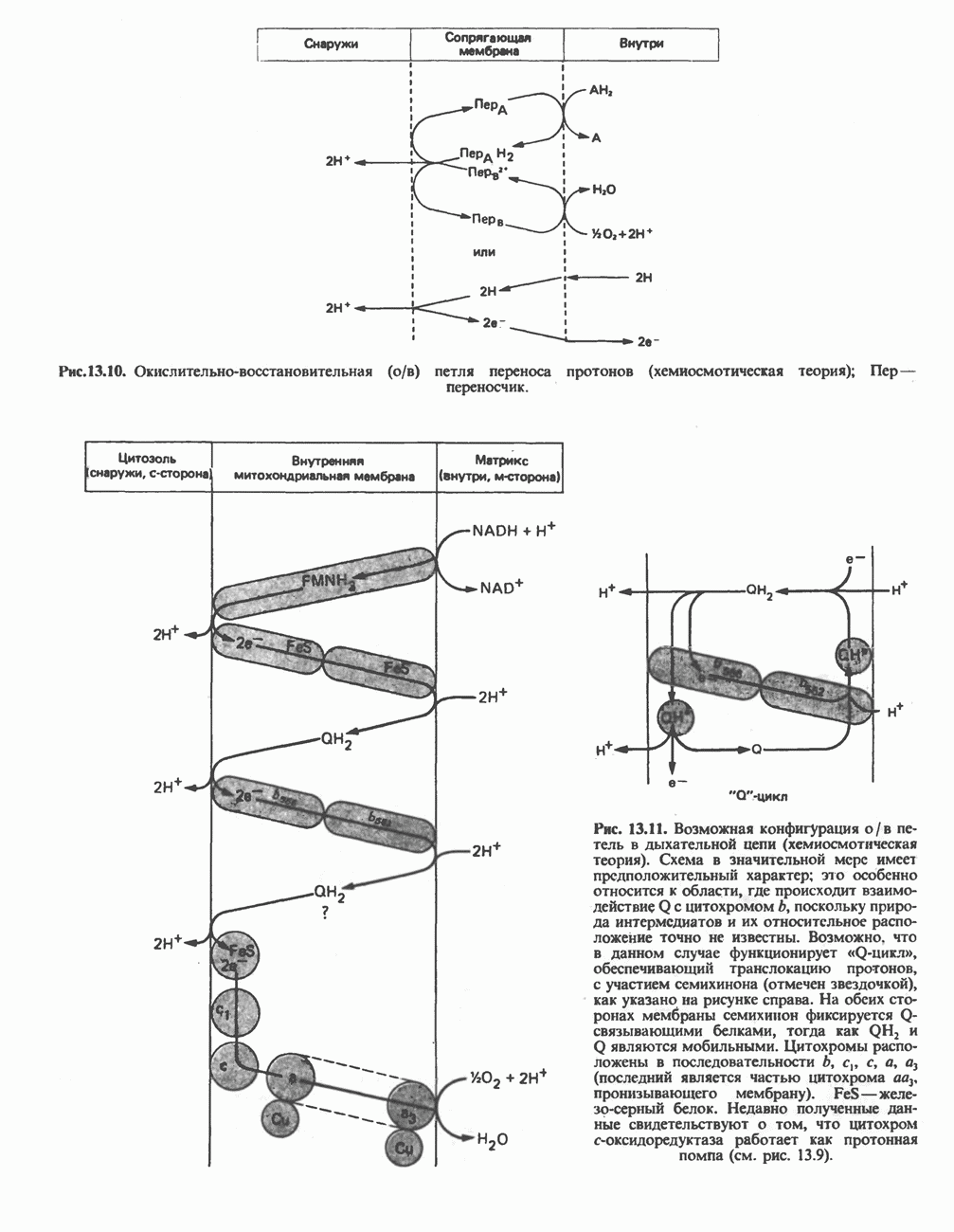
- ОРГАНИЗАЦИЯ ДЫХАТЕЛЬНОЙ ЦЕПИ В МИТОХОНДРИЯХ
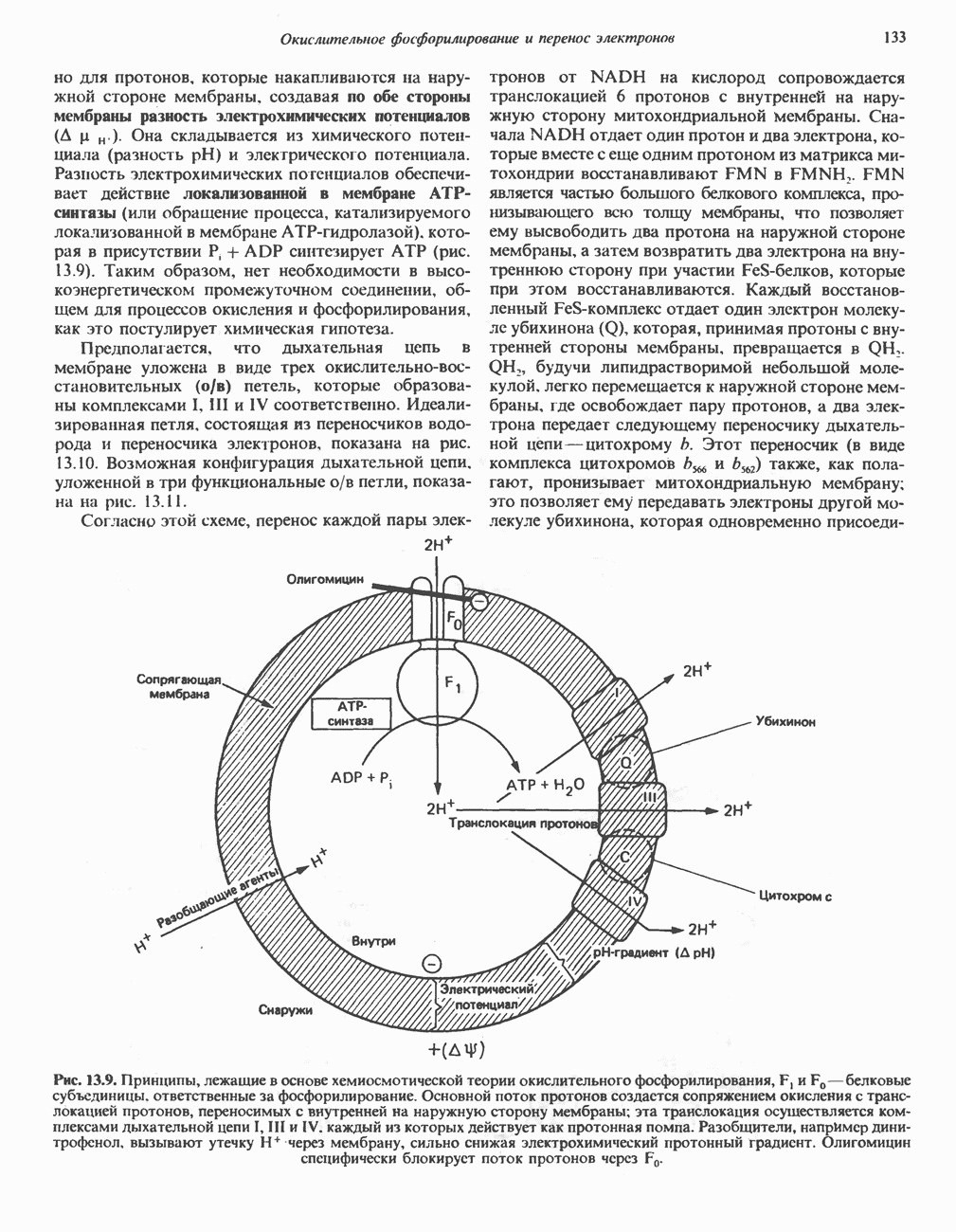
- РОЛЬ ДЫХАТЕЛЬНОЙ ЦЕПИ В УЛАВЛИВАНИИ ЭНЕРГИИ
- ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
- ИНГИБИТОРЫ ДЫХАТЕЛЬНОЙ ЦЕПИ И ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
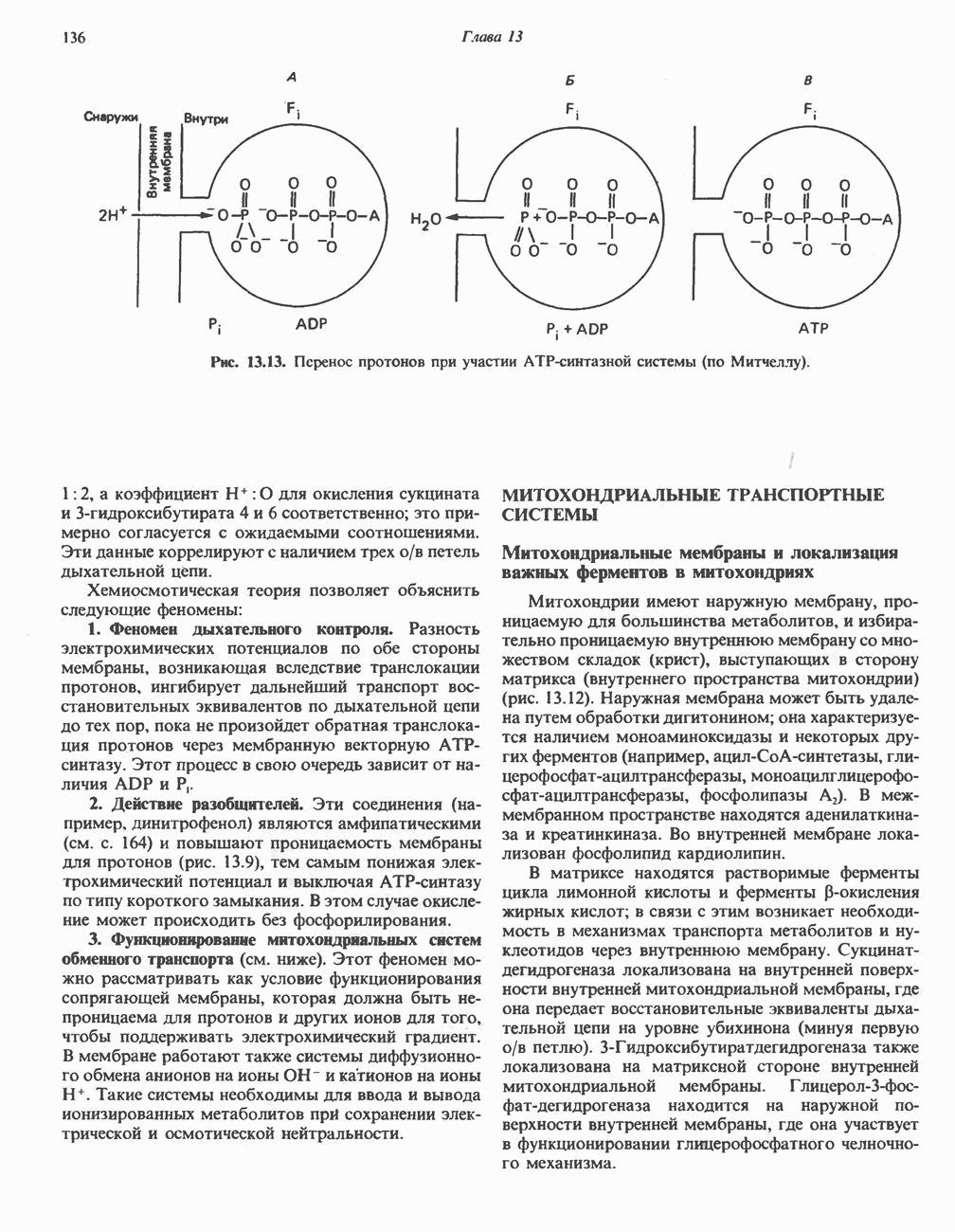
- МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
- МИТОХОНДРИАЛЬНЫЕ ТРАНСПОРТНЫЕ СИСТЕМЫ
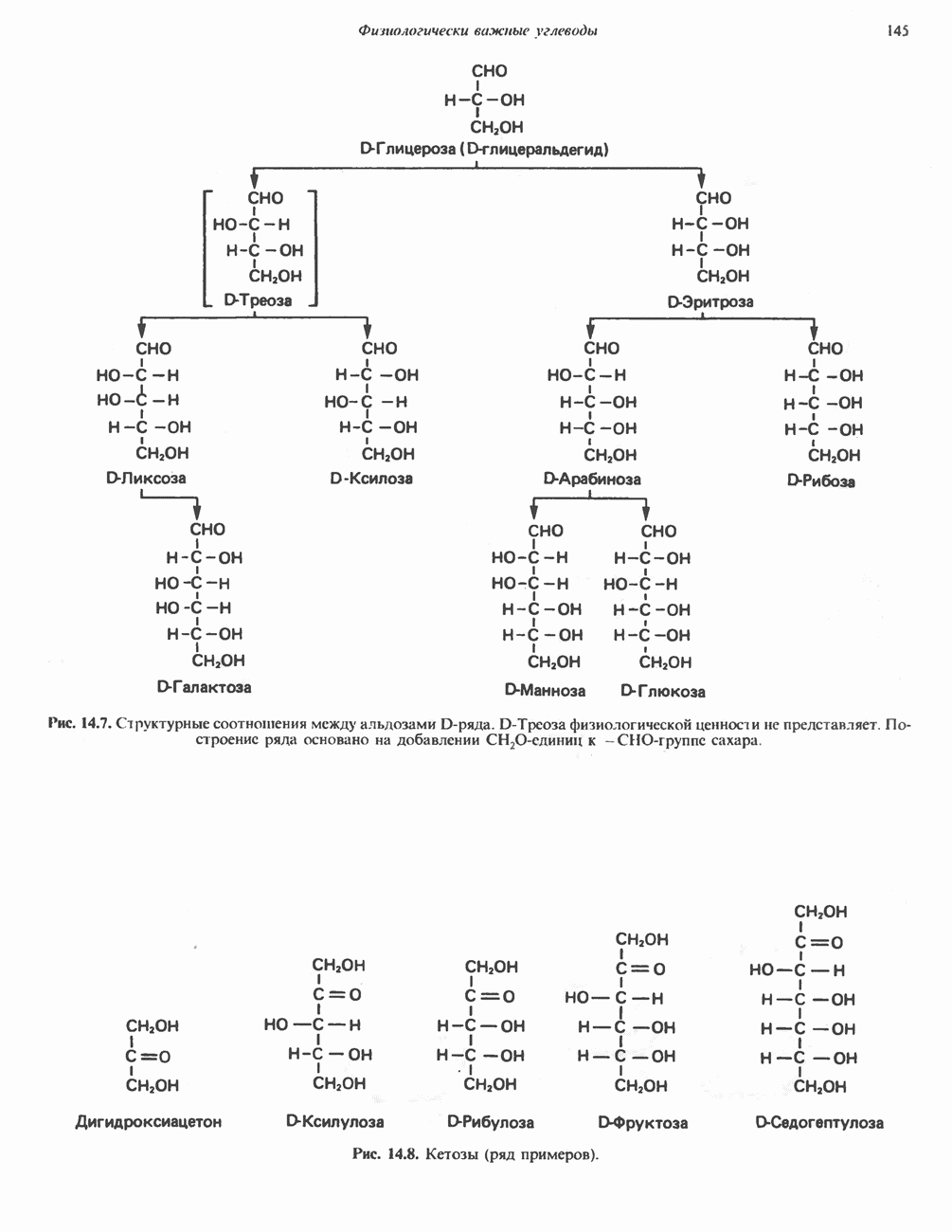
- Глава 14. Физиологически важные углеводы
- КЛАССИФИКАЦИЯ УГЛЕВОДОВ
- МОНОСАХАРИДЫ
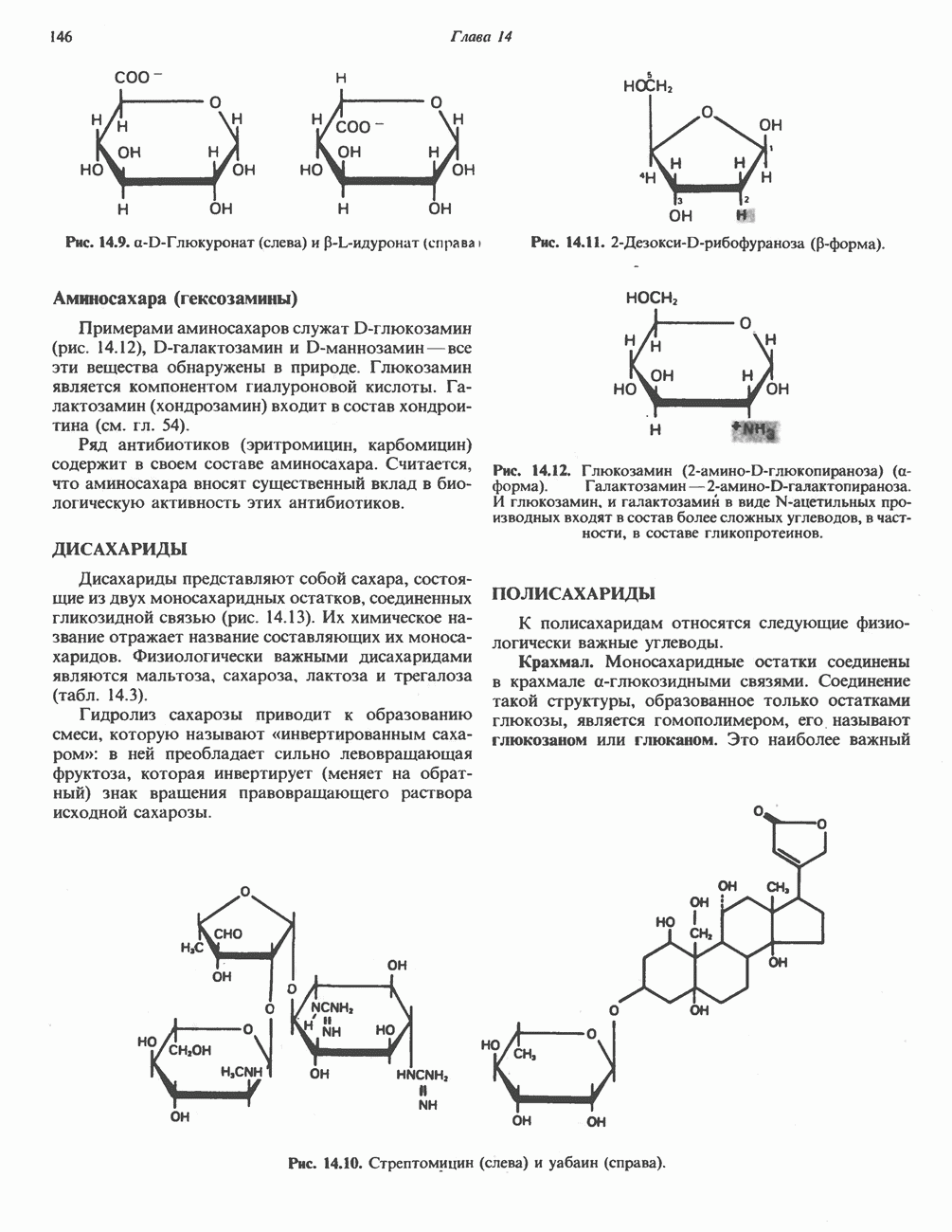
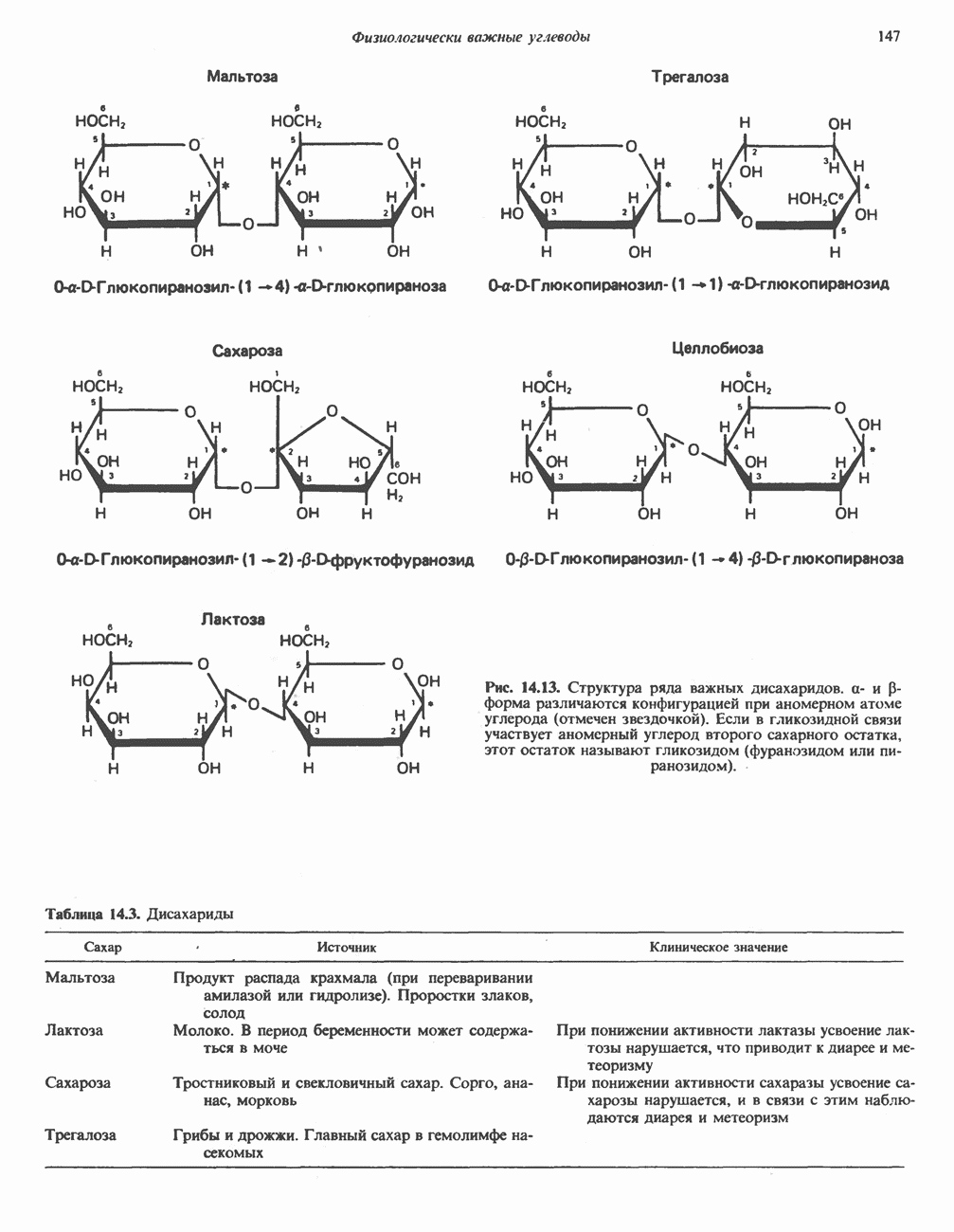
- ДИСАХАРИДЫ
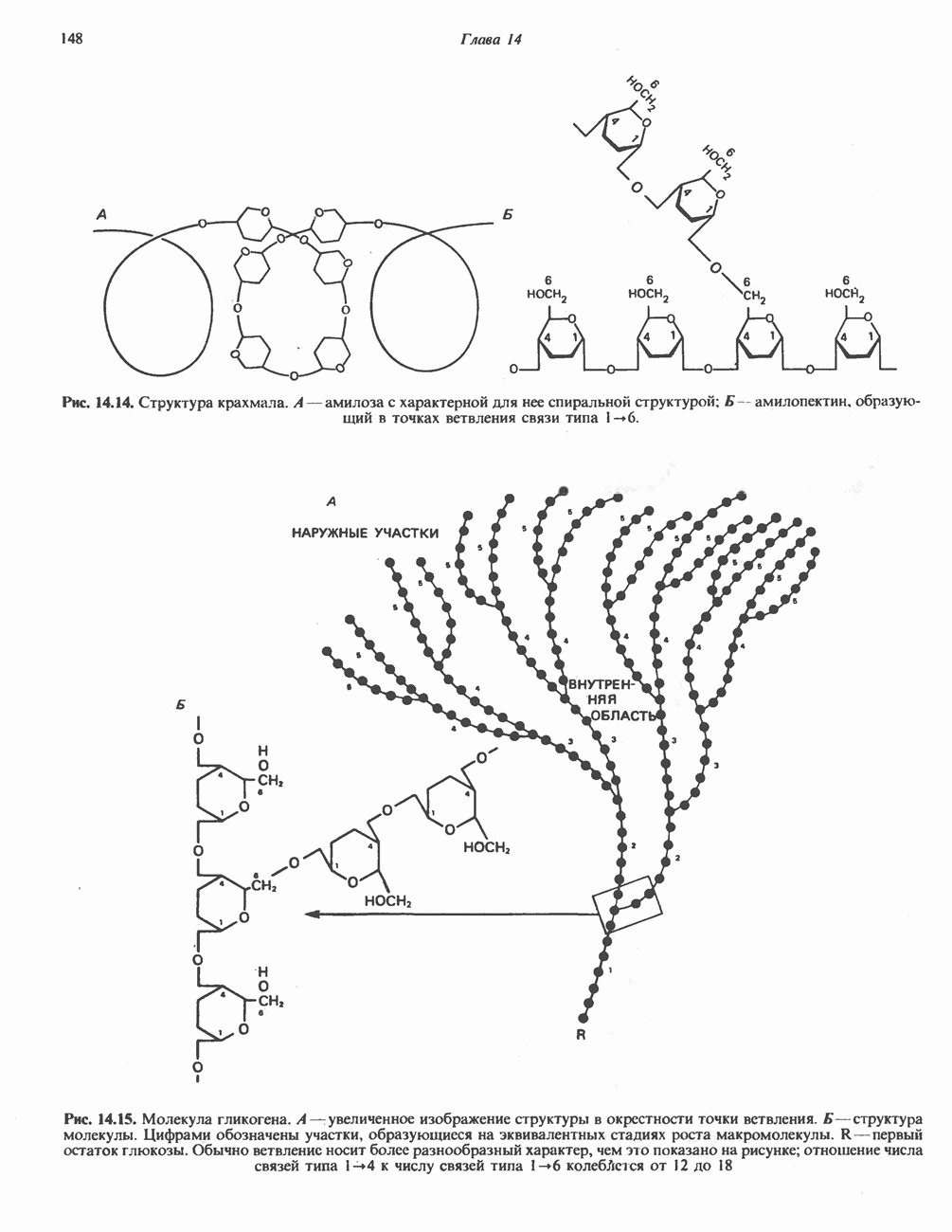
- ПОЛИСАХАРИДЫ
- УГЛЕВОДЫ КЛЕТОЧНЫХ МЕМБРАН
- Глава 15. Физиологически важные липиды
- КЛАССИФИКАЦИЯ ЛИПИДОВ
- ЖИРНЫЕ КИСЛОТЫ
- ТРИАЦИЛГЛИЦЕРОЛЫ (триглицериды)
- ФОСФОЛИПИДЫ
- ГЛИКОЛИПИДЫ (ГЛИКОСФИНГОЛИПИДЫ)
- СТЕРОИДЫ
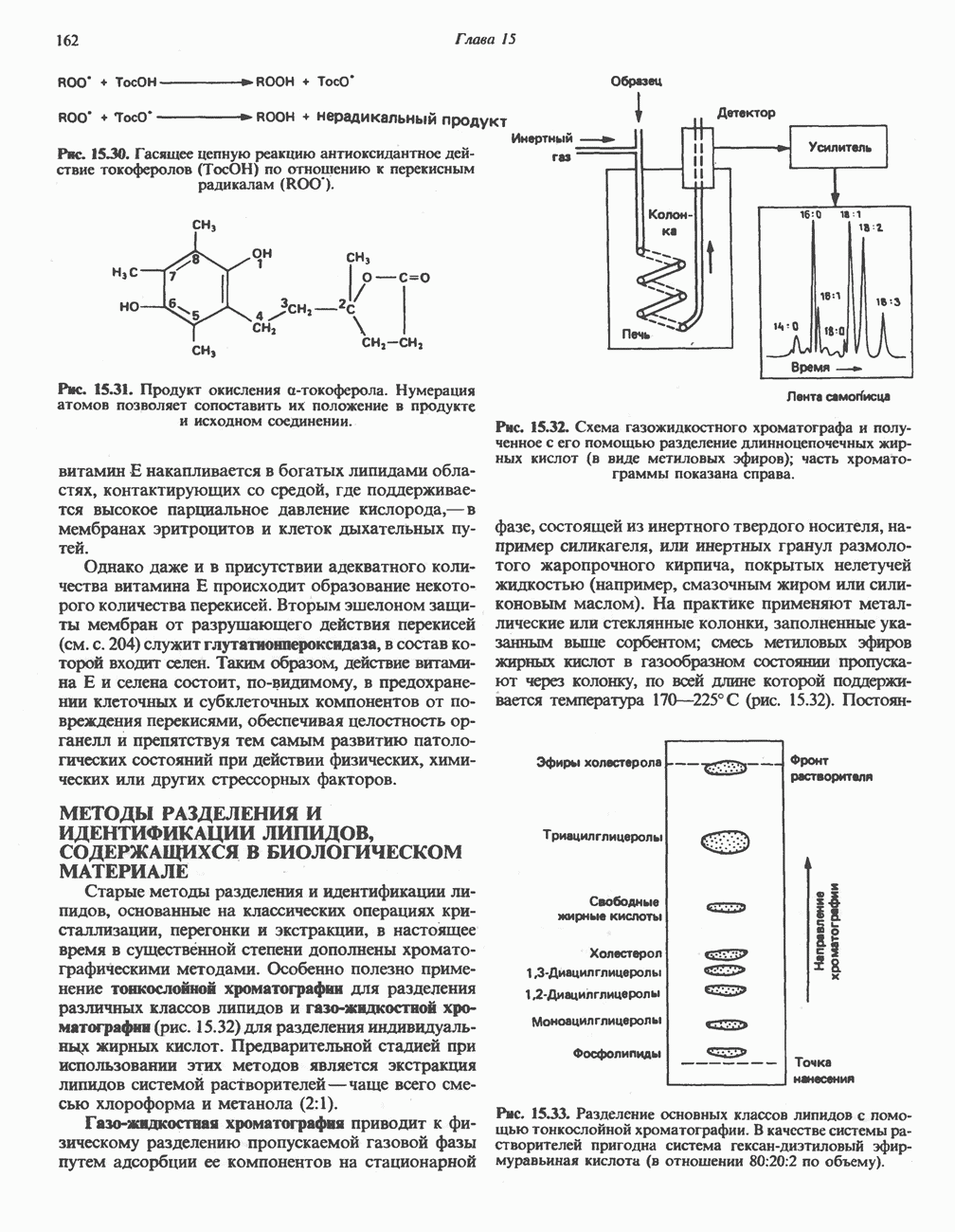
- ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ
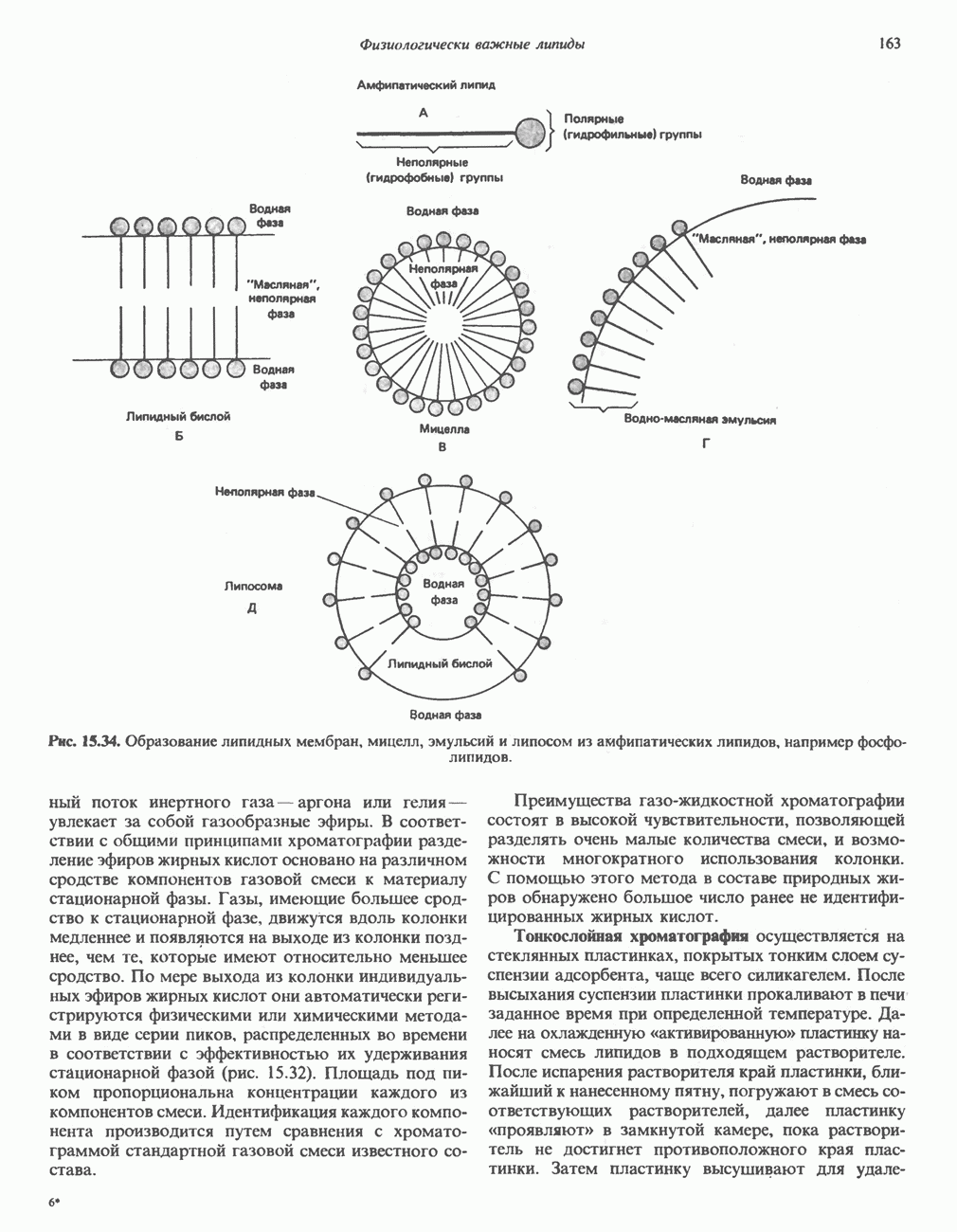
- МЕТОДЫ РАЗДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ ЛИПИДОВ, СОДЕРЖАЩИХСЯ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ
- АМФИПАТИЧЕСКИЕ ЛИПИДЫ
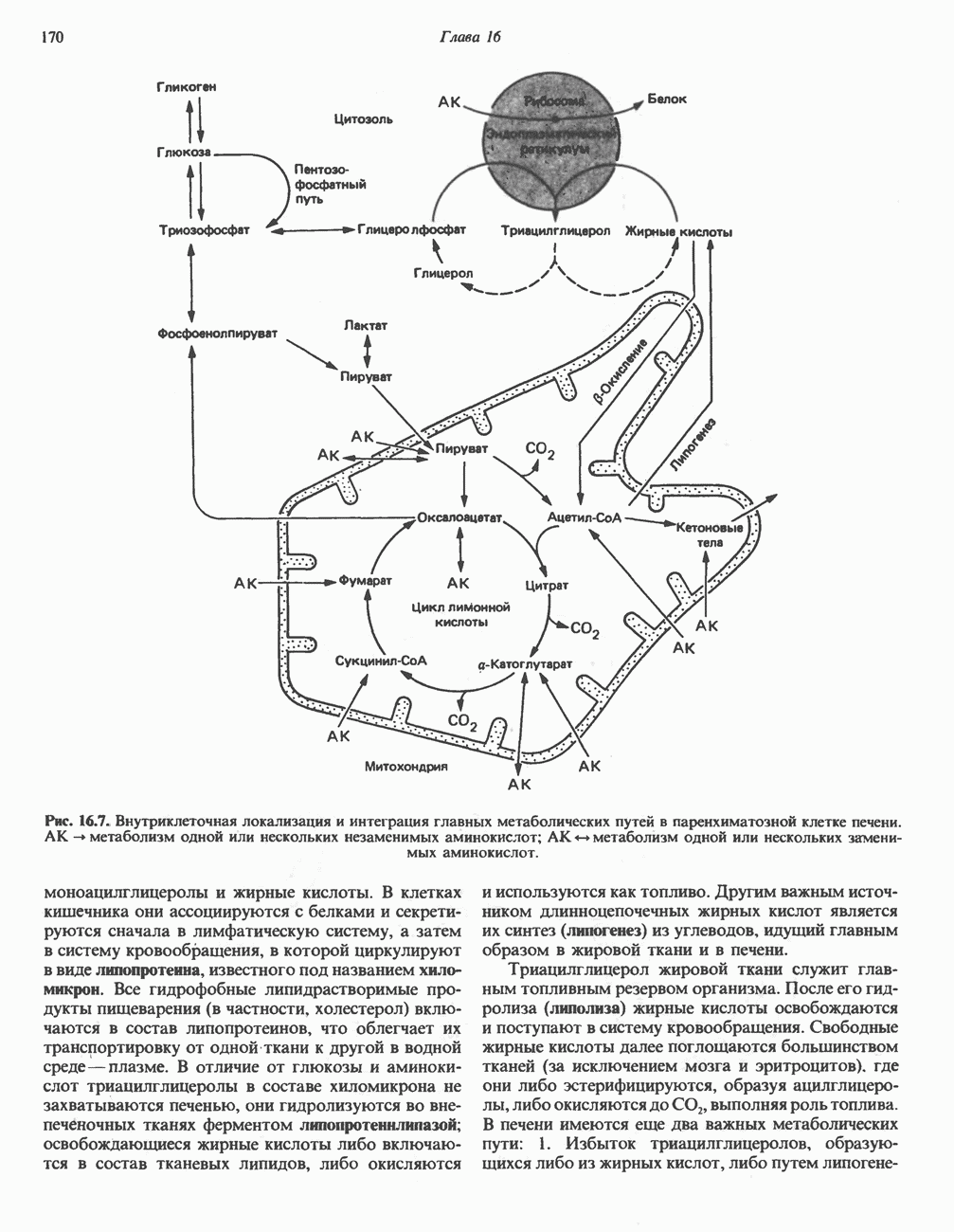
- Глава 16. Промежуточный обмен
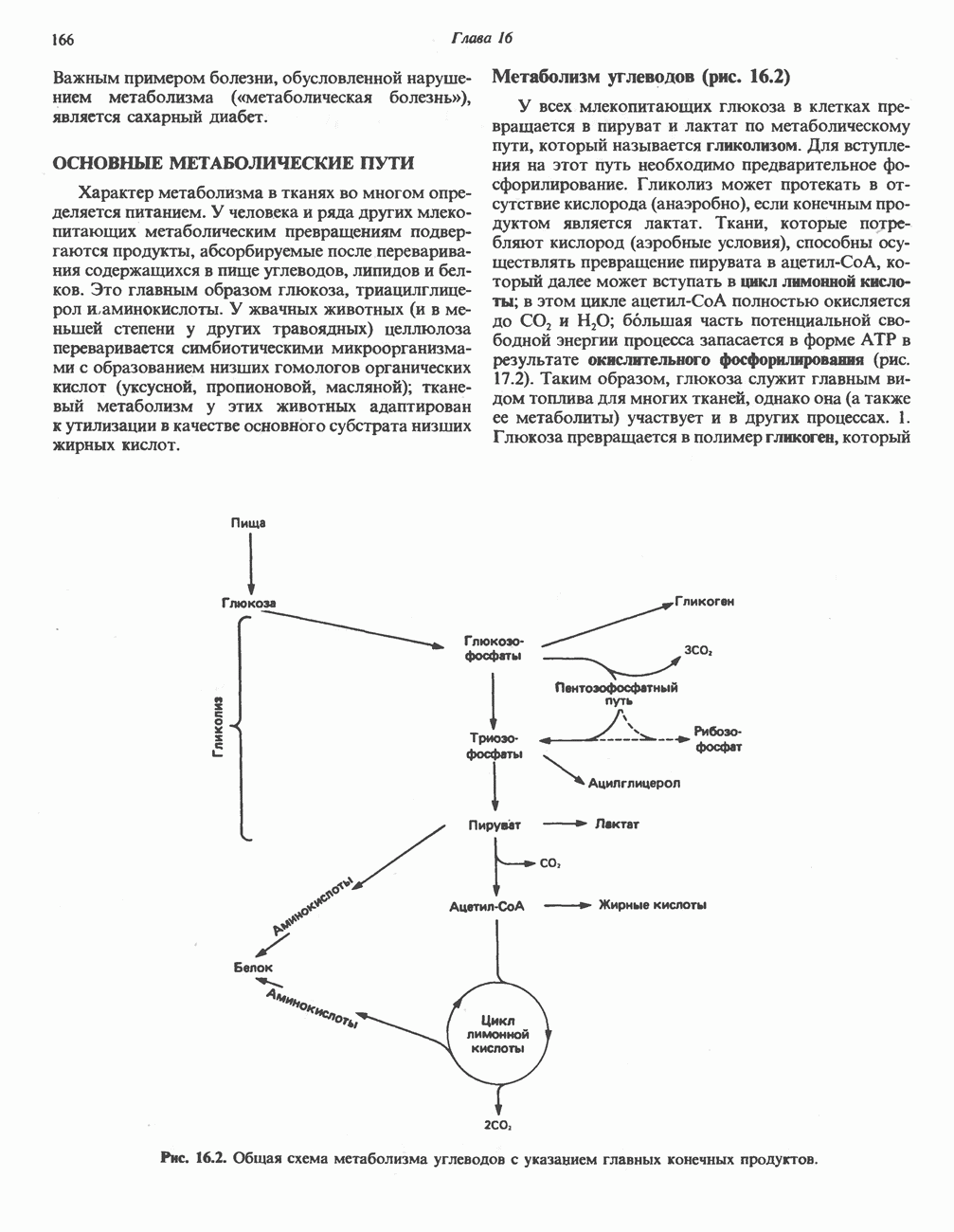
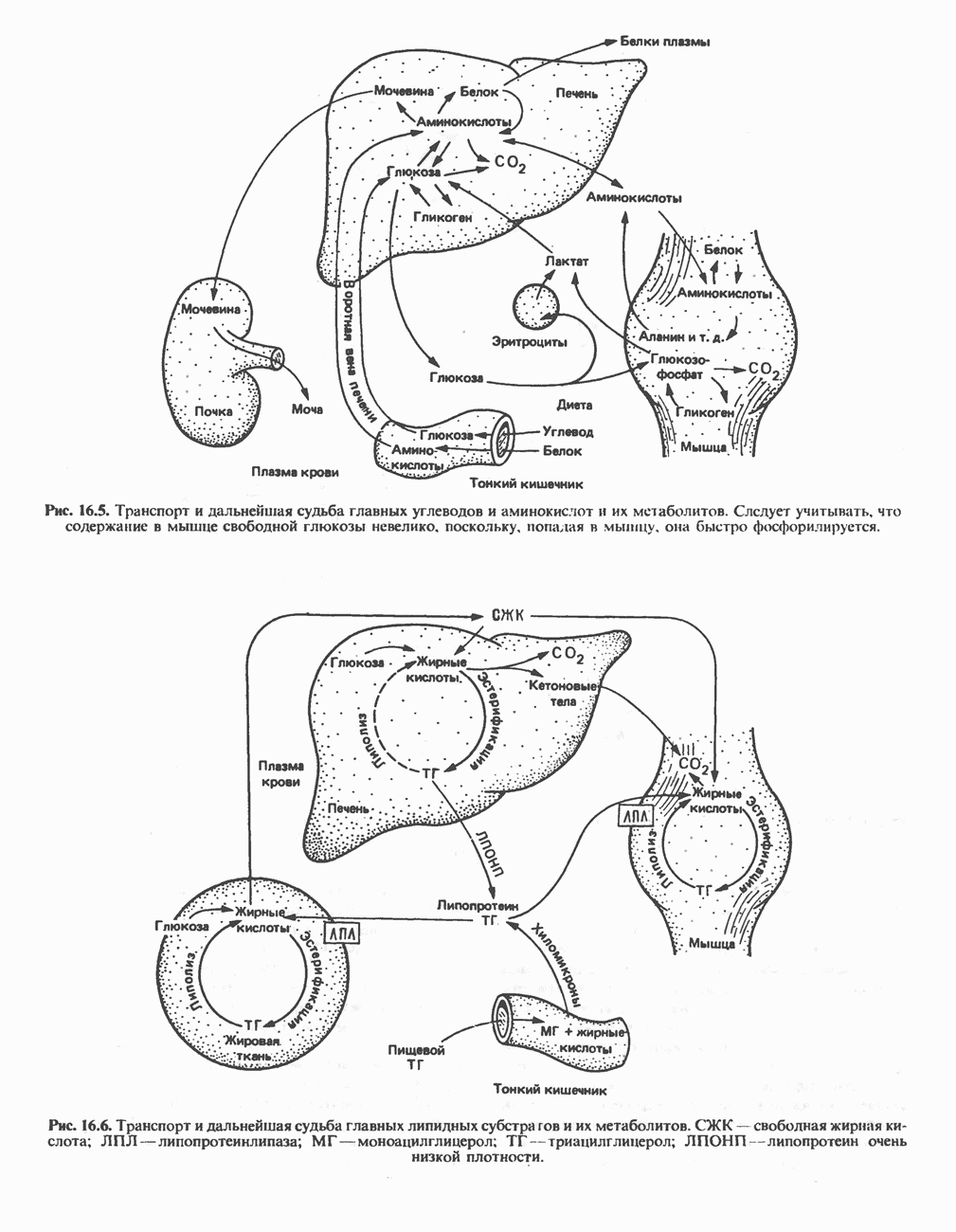
- ОСНОВНЫЕ МЕТАБОЛИЧЕСКИЕ ПУТИ
- ЛОКАЛИЗАЦИЯ МЕТАБОЛИЧЕСКИХ ПУТЕЙ
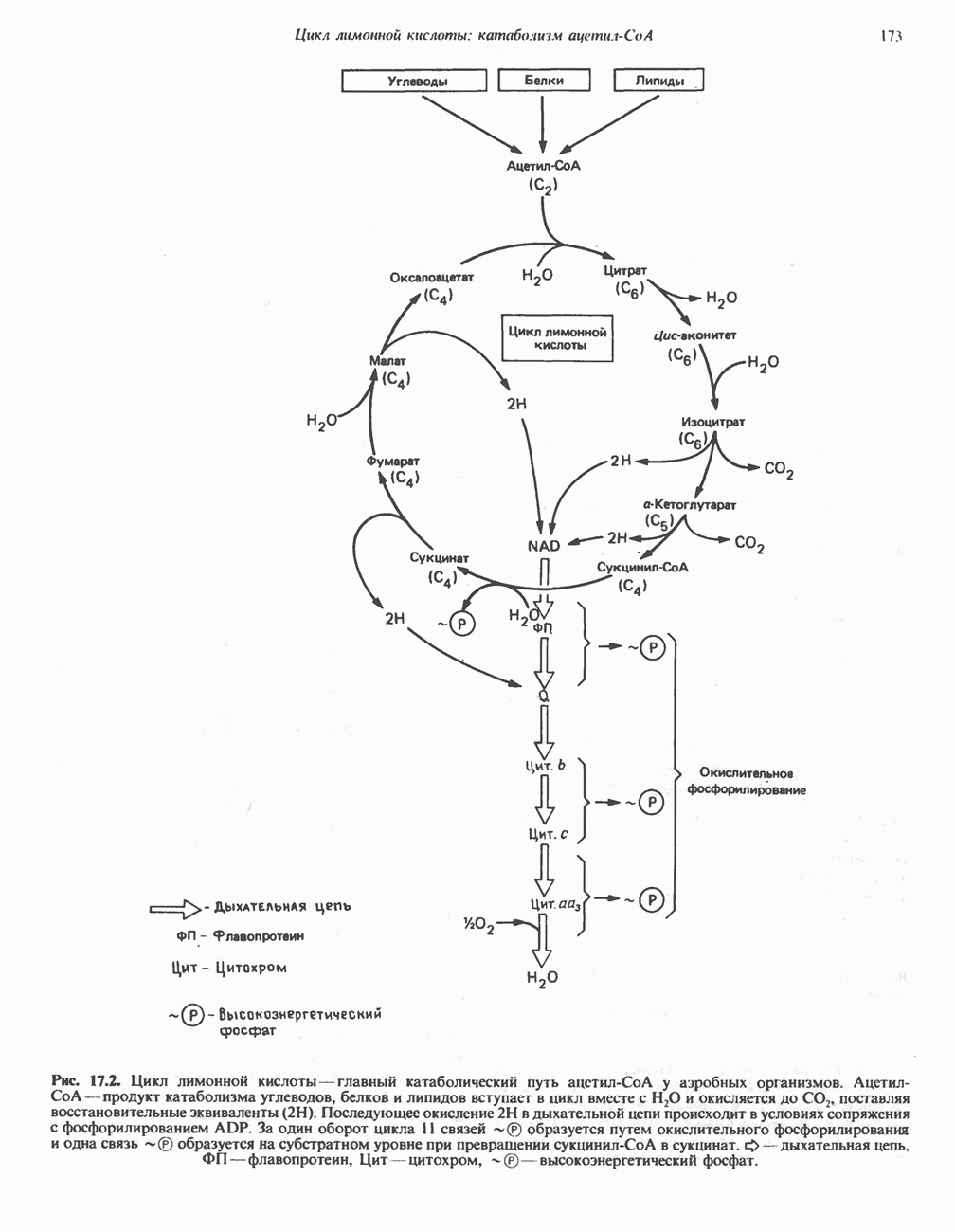
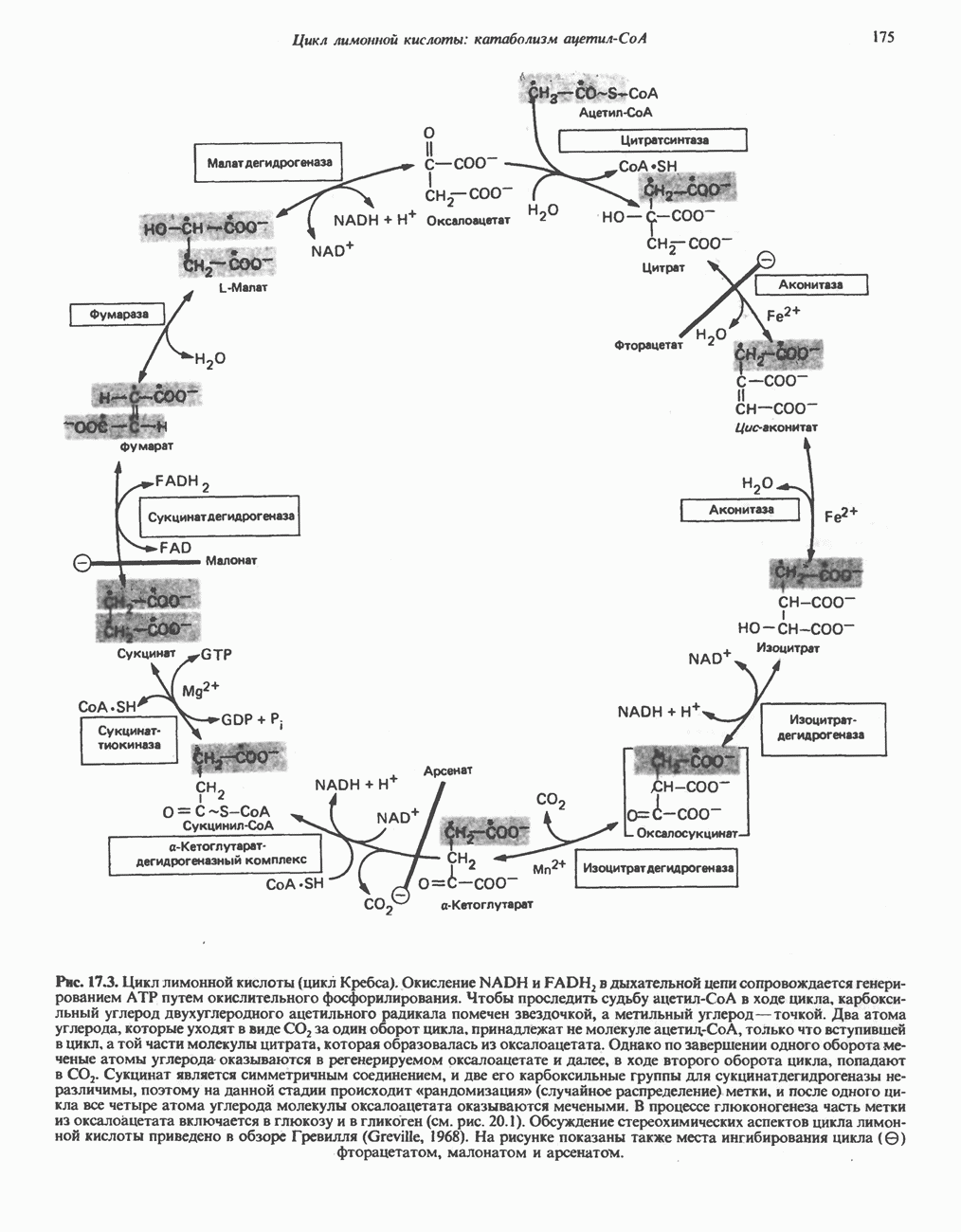
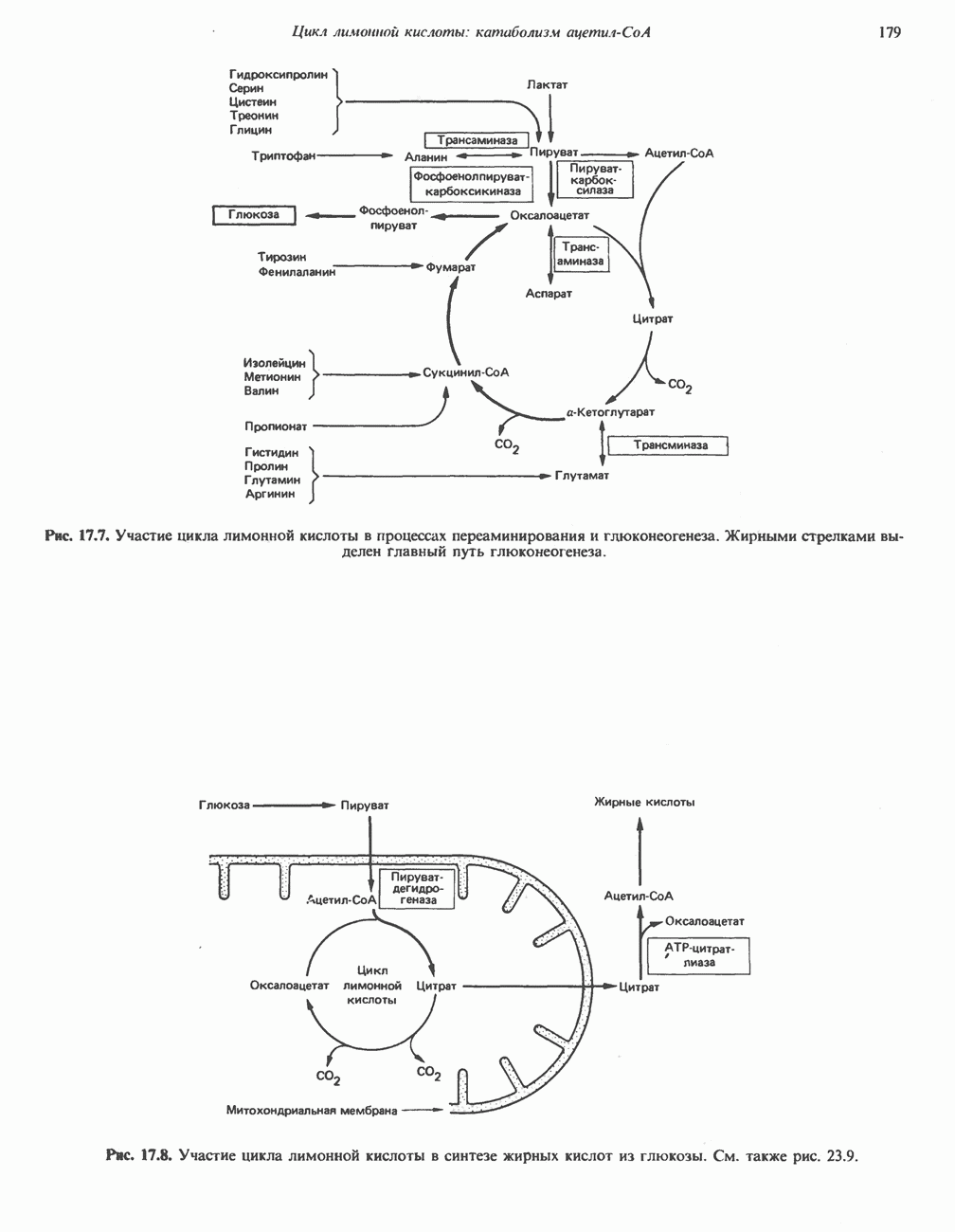
- Глава 17. Цикл лимонной кислоты: катаболизм ацетил-СоА
- КАТАБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
- РЕАКЦИИ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (рис. 17.3)
- ЭНЕРГЕТИКА ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
- РОЛЬ ВИТАМИНОВ В ЦИКЛЕ ЛИМОННОЙ КИСЛОТЫ
- АМФИБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
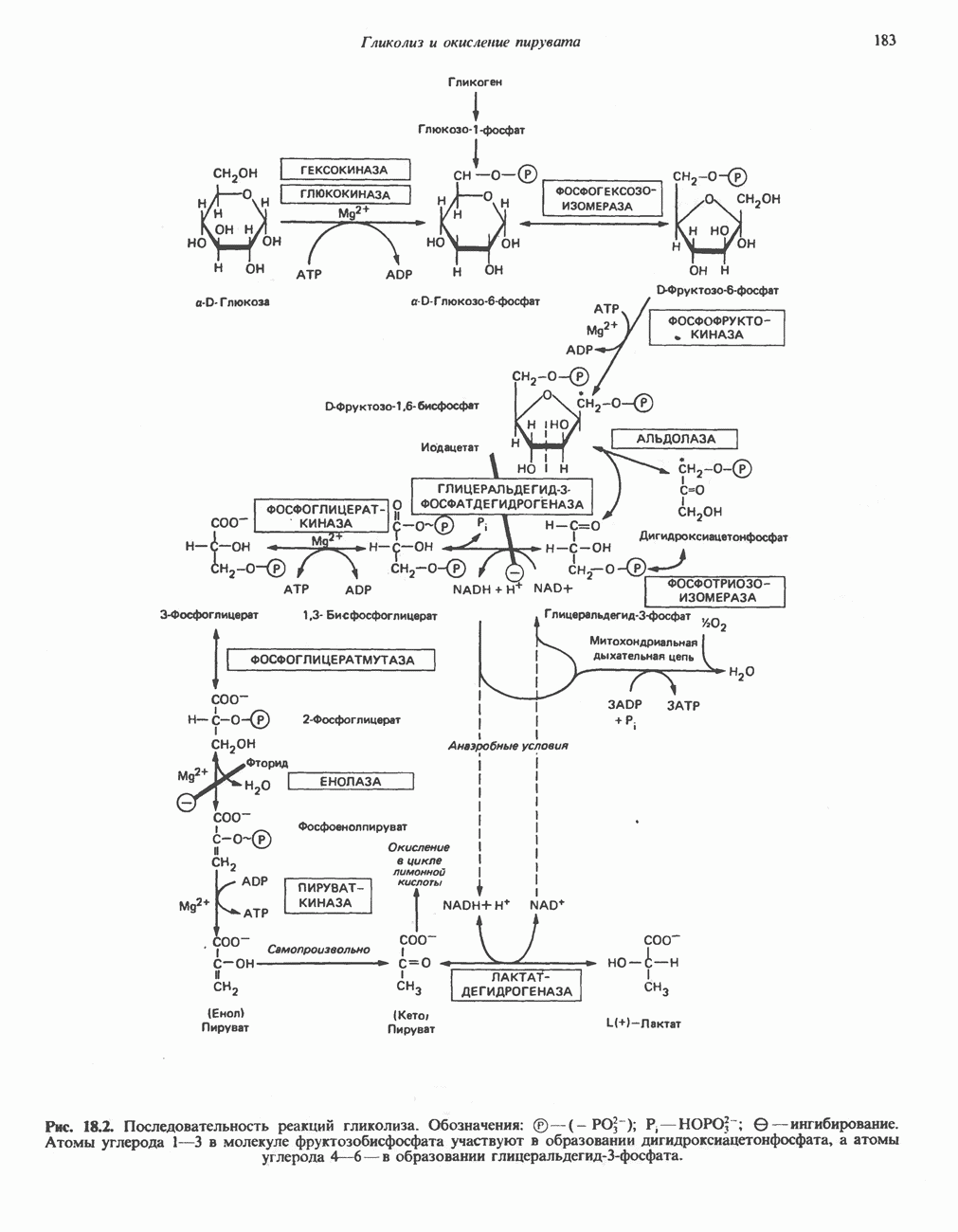
- Глава 18. Гликолиз и окисление пирувата
- ГЛИКОЛИТИЧЕСКИЙ ПУТЬ
- ПОСЛЕДОВАТЕЛЬНЫЕ СТАДИИ ГЛИКОЛИЗА
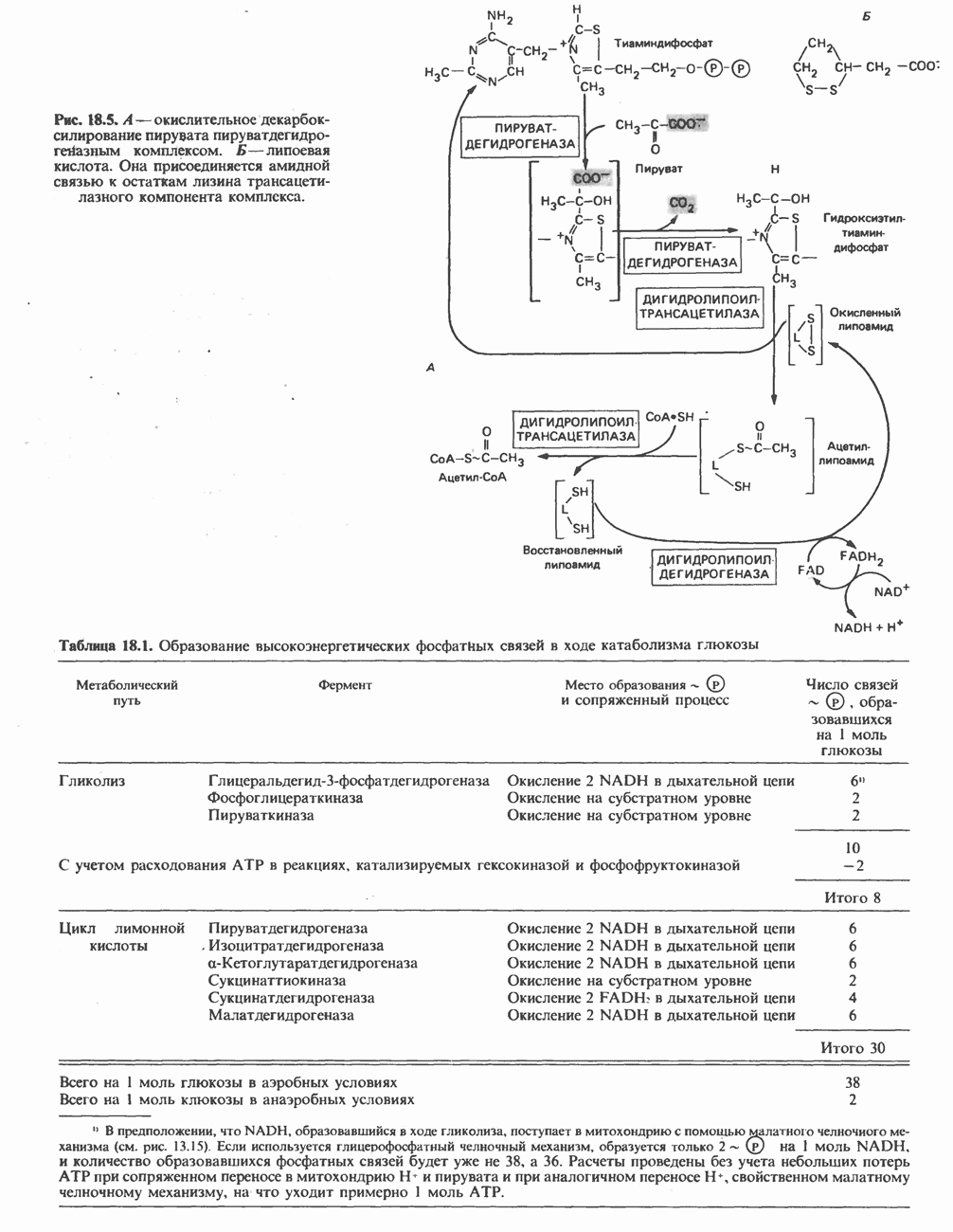
- ОКИСЛЕНИЕ ПИРУВАТА В АЦЕТИЛ-СоА
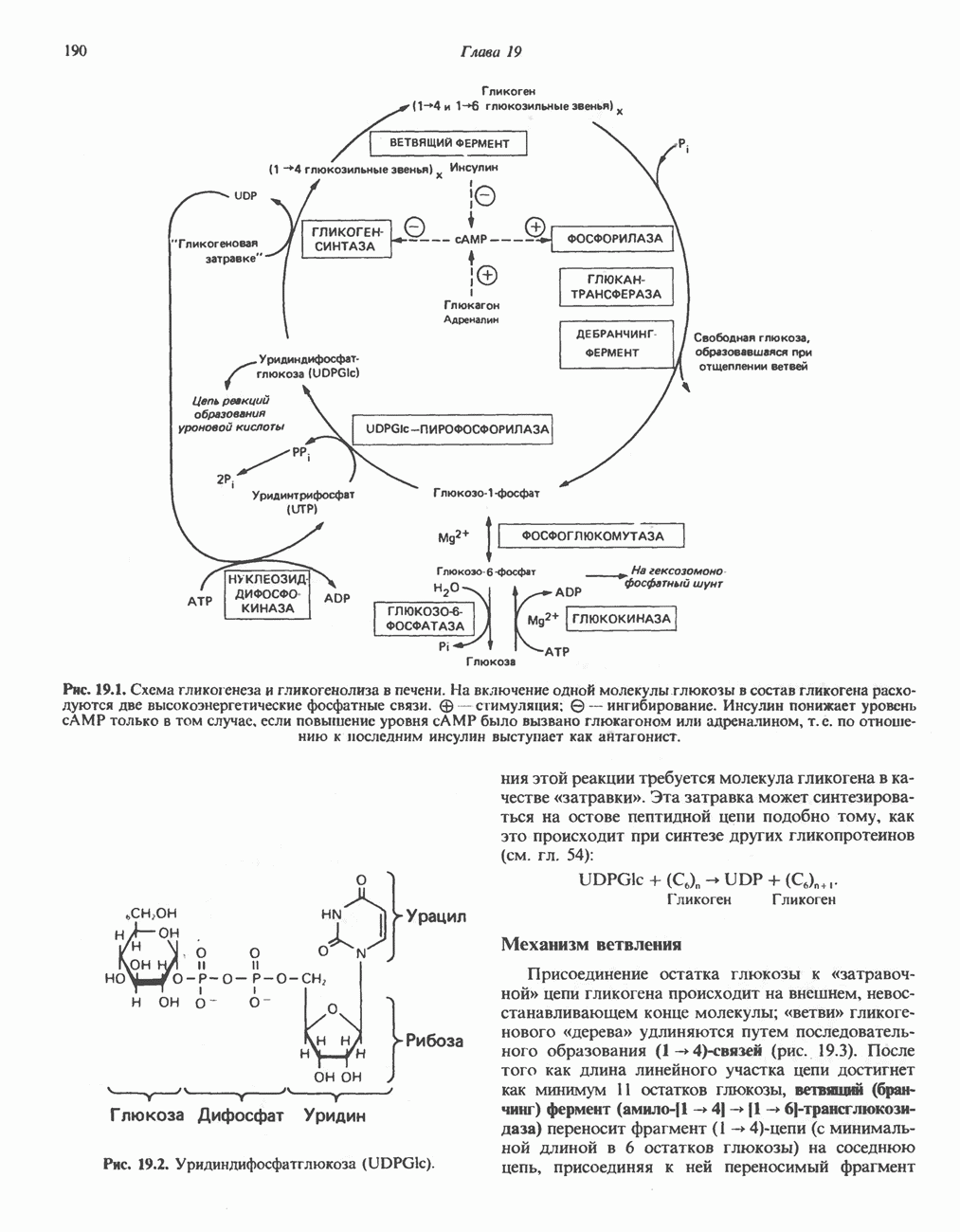
- Глава 19. Метаболизм гликогена
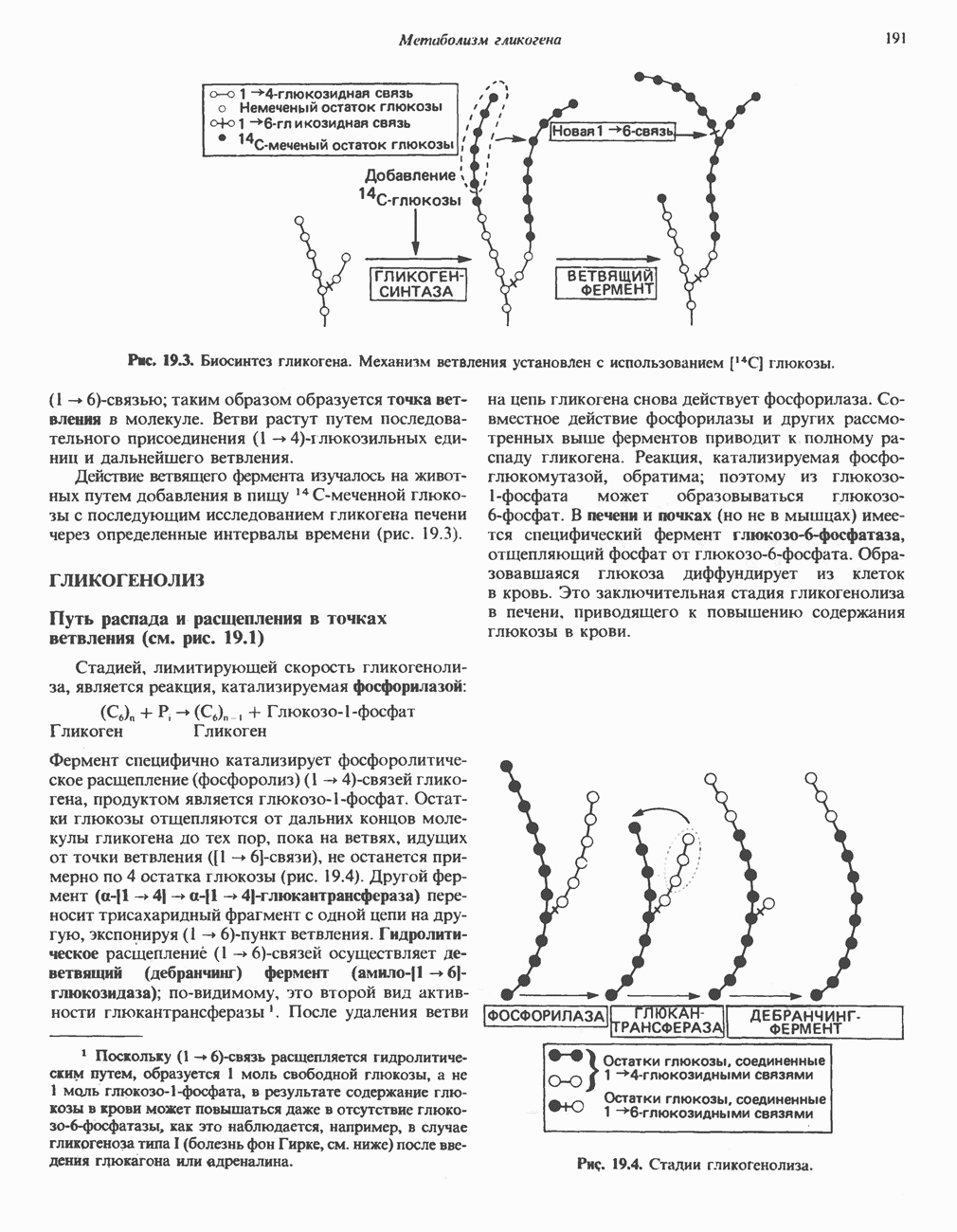
- ГЛИКОГЕНЕЗ
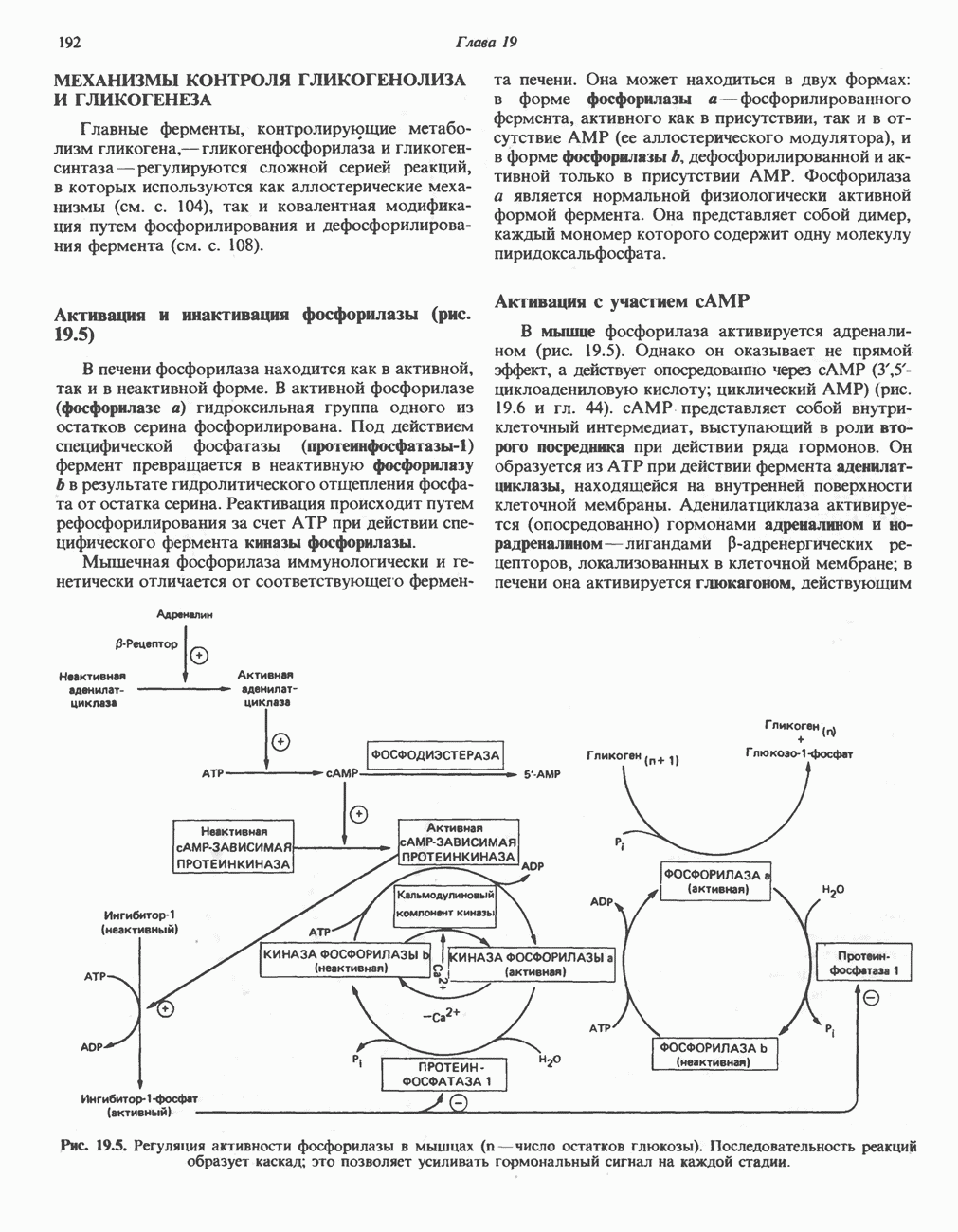
- ГЛИКОГЕНОЛИЗ
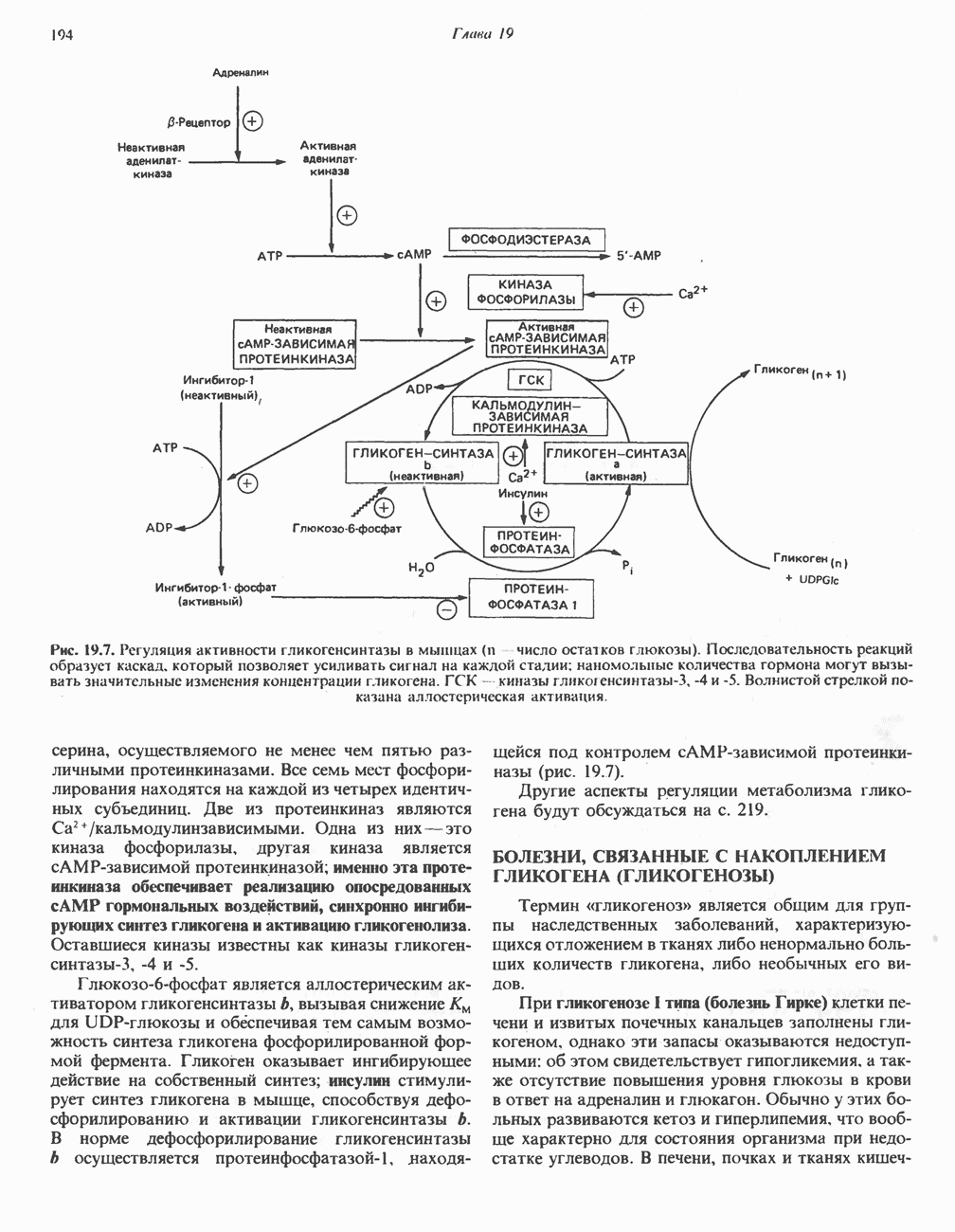
- МЕХАНИЗМЫ КОНТРОЛЯ ГЛИКОГЕНОЛИЗА И ГЛИКОГЕНЕЗА
- БОЛЕЗНИ, СВЯЗАННЫЕ С НАКОПЛЕНИЕМ ГЛИКОГЕНА (ГЛИКОГЕНОЗЫ)
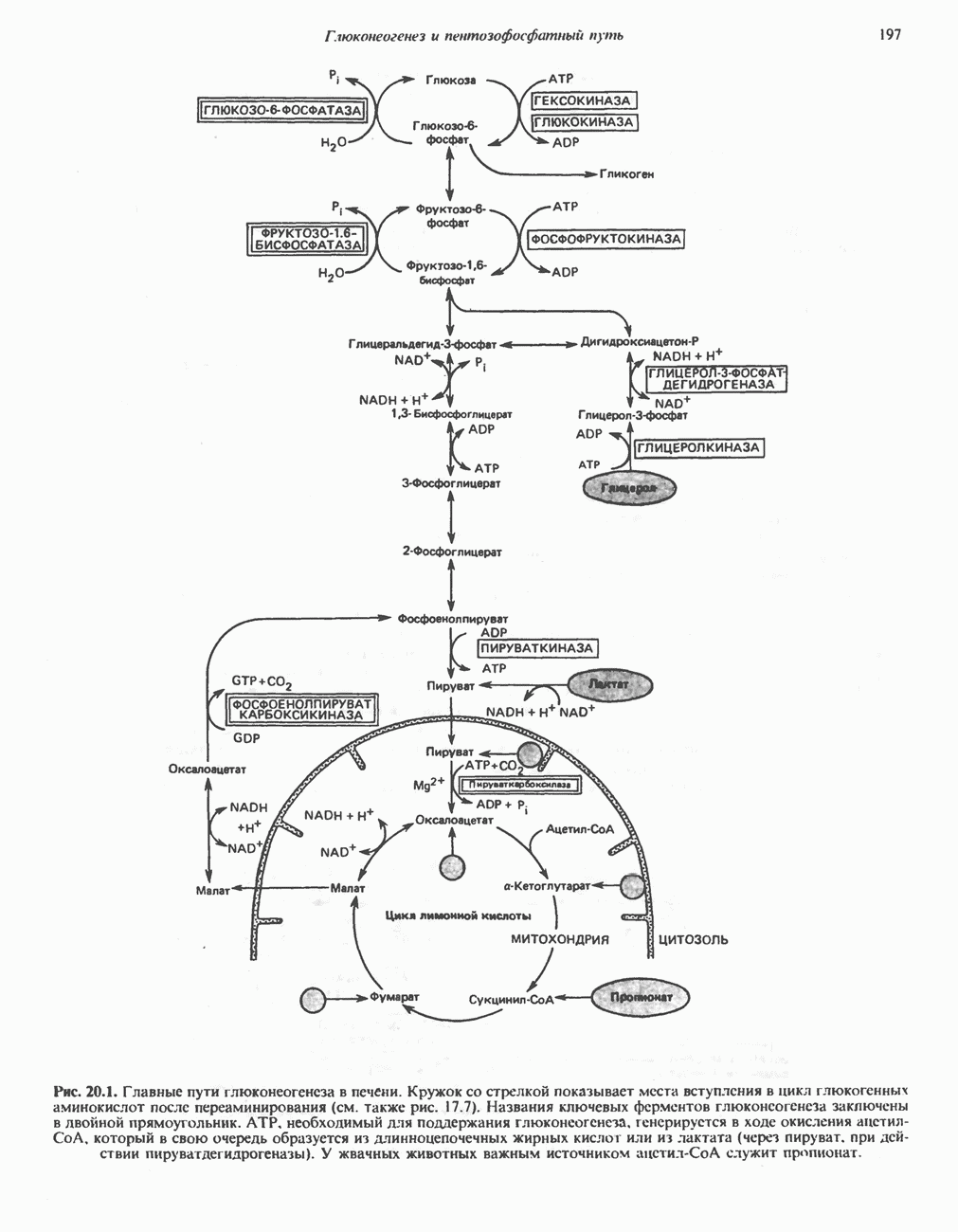
- Глава 20. Глюконеогенез и пентозофосфатный путь
- МЕТАБОЛИЧЕСКИЕ ПУТИ, УЧАСТВУЮЩИЕ В ГЛЮКОНЕОГЕНЕЗЕ (рис. 20.1)
- ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ИЛИ ГЕКСОЗОМОНОФОСФАТНЫЙ ШУНТ
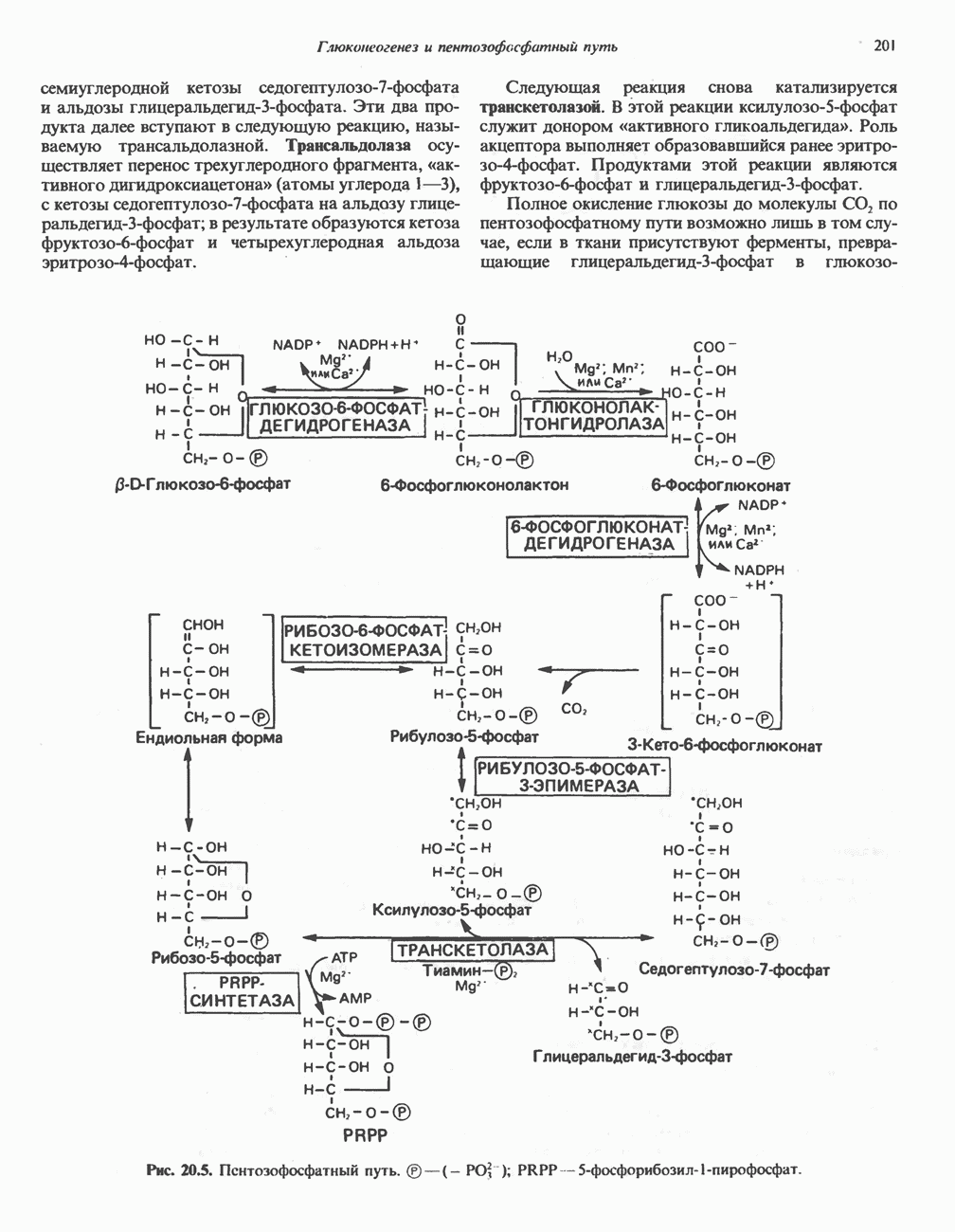
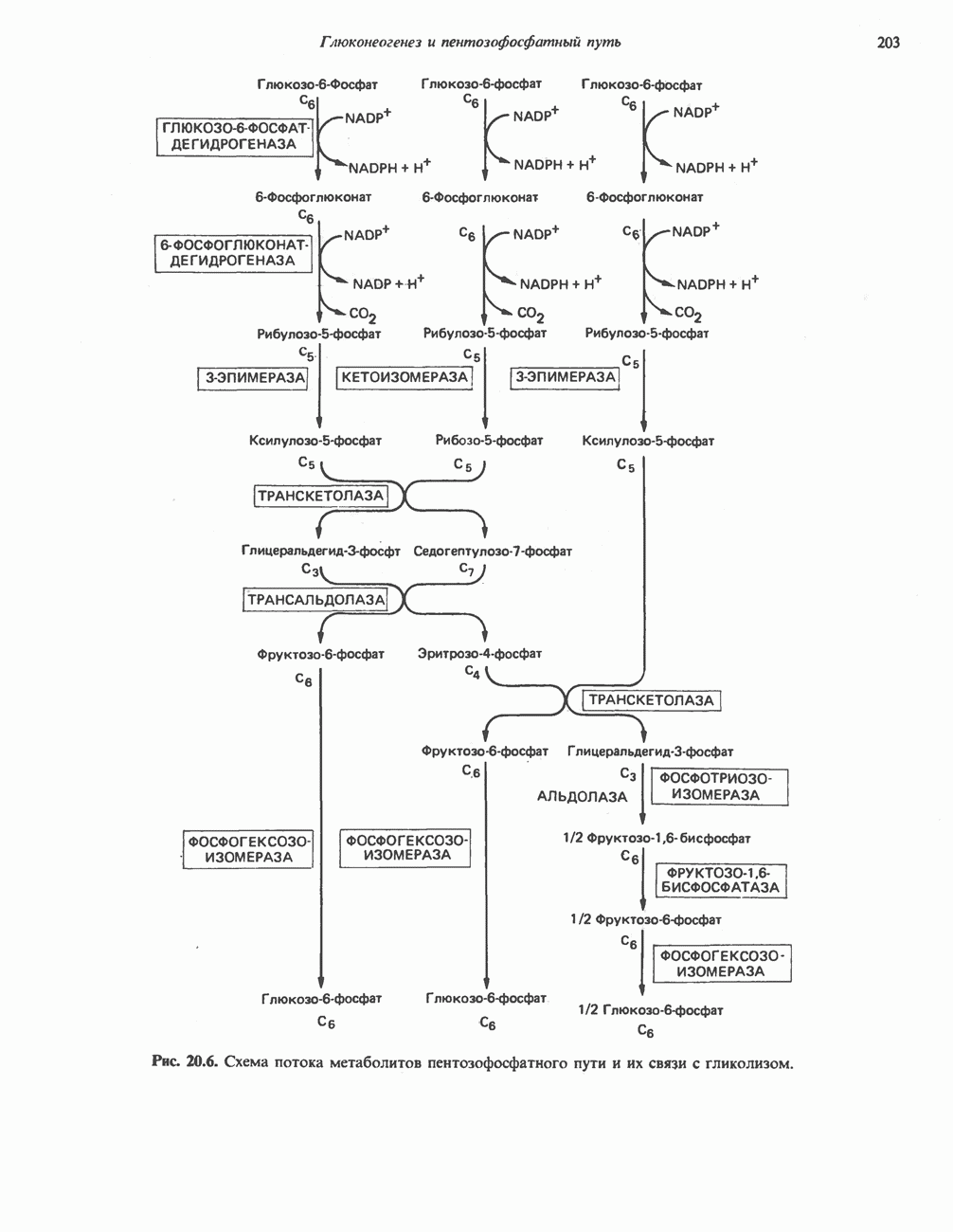
- ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ
- МЕТАБОЛИЧЕСКОЕ ЗНАЧЕНИЕ ПЕНТОЗОФОСФАТНОГО ПУТИ
- КЛИНИЧЕСКИЕ АСПЕКТЫ
- Глава 21. Метаболизм наиболее важных гексоз
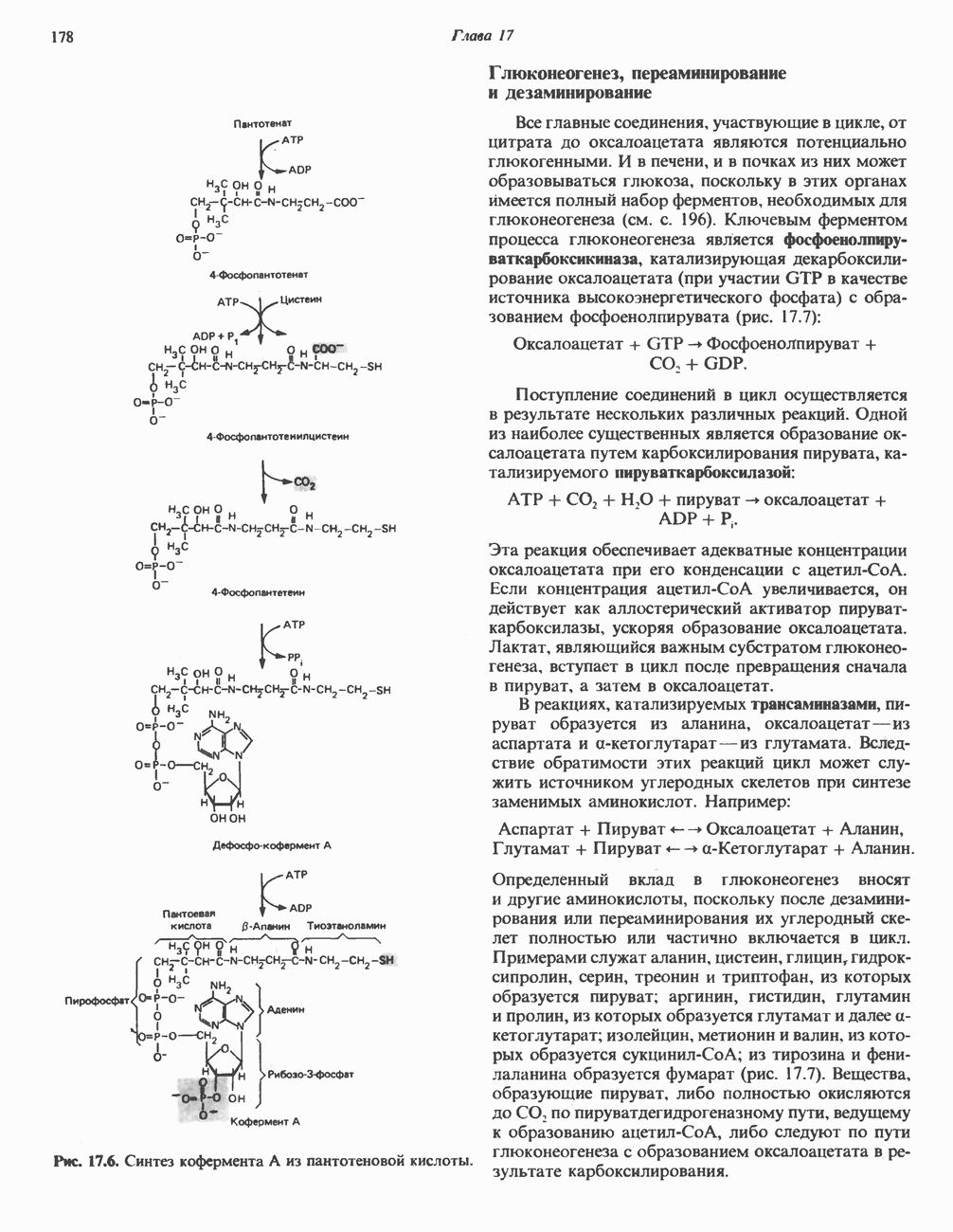
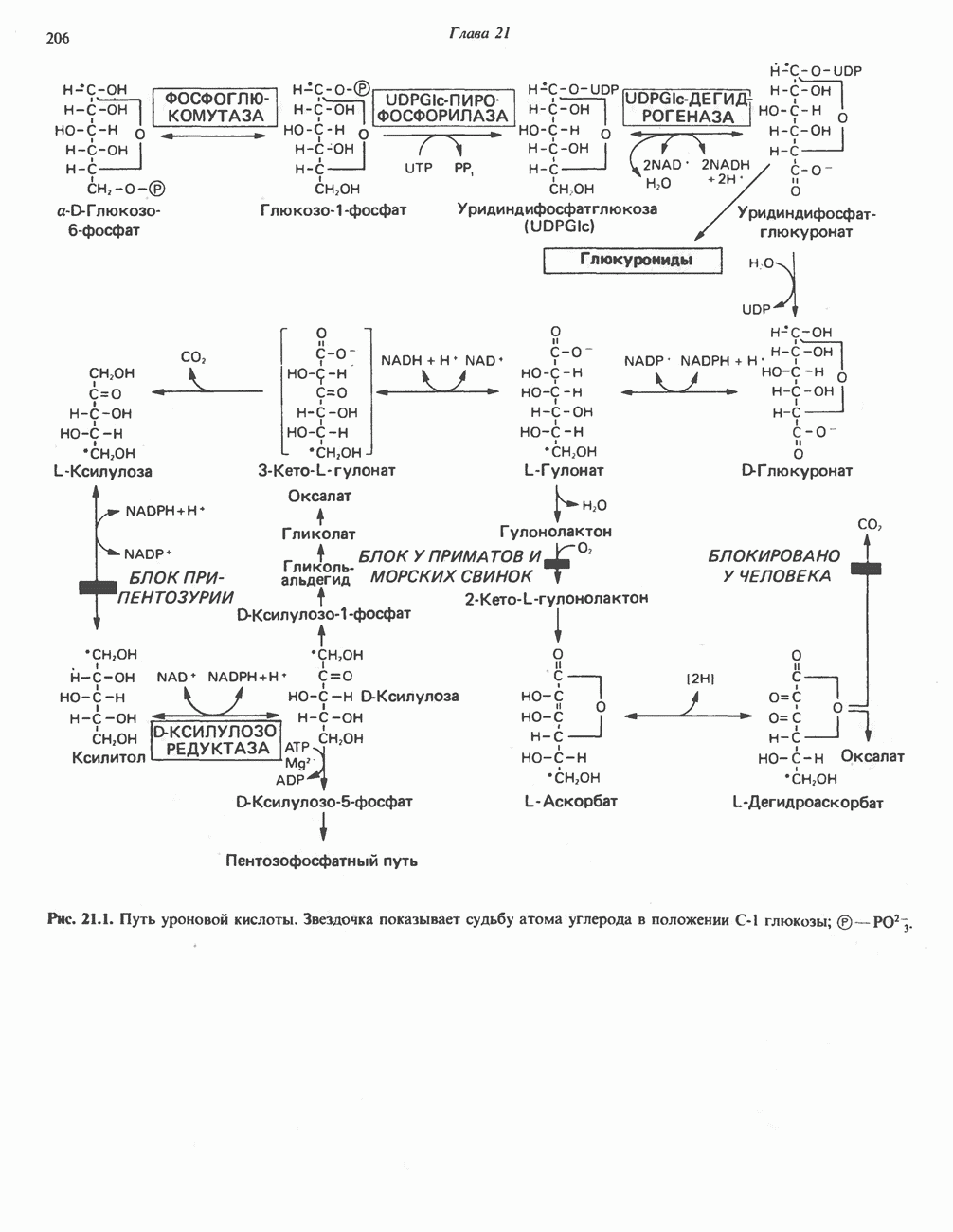
- ПУТЬ УРОНОВЫХ КИСЛОТ
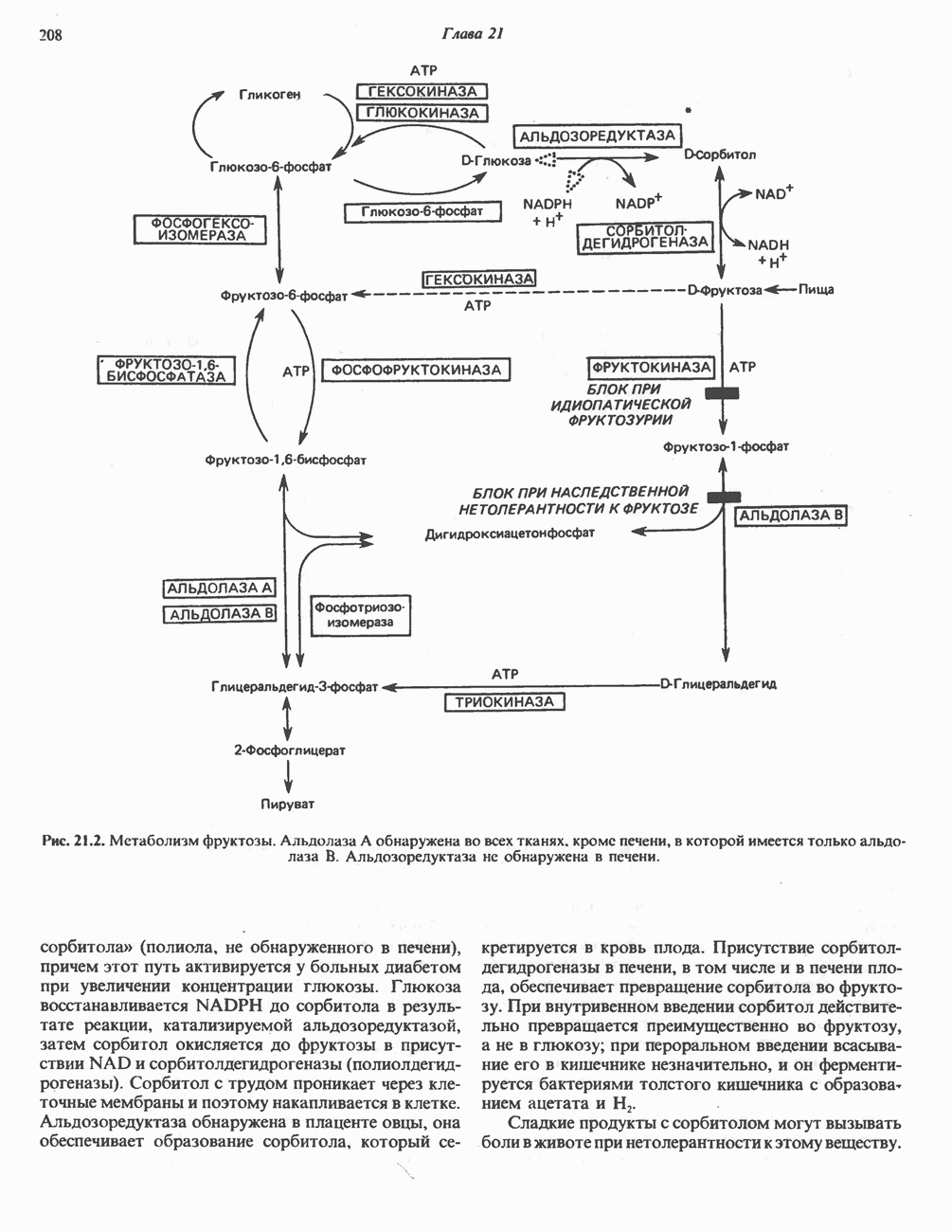
- МЕТАБОЛИЗМ ФРУКТОЗЫ
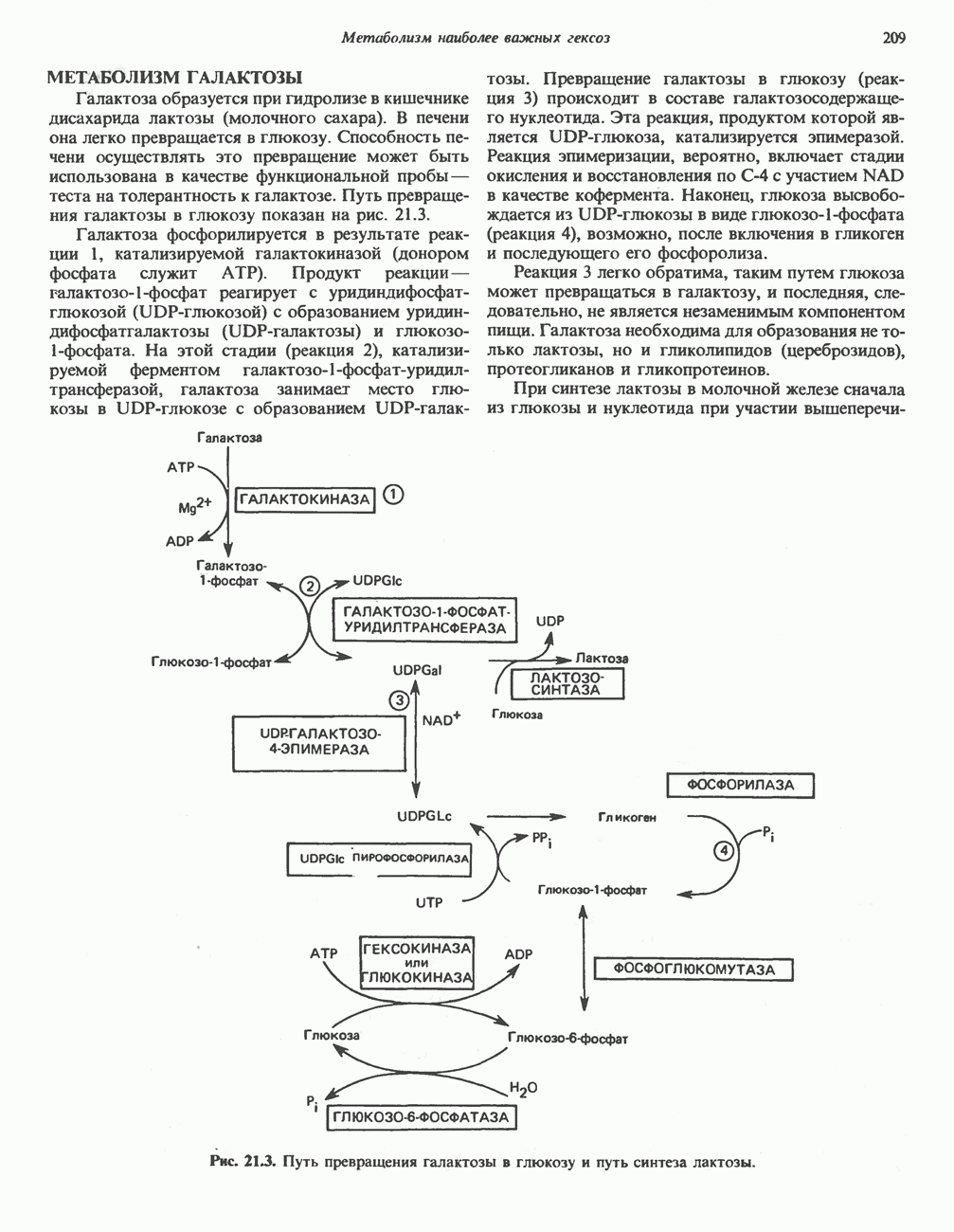
- МЕТАБОЛИЗМ ГАЛАКТОЗЫ
- Глава 22. Регуляция метаболизма углеводов
- ОБЩИЕ ПРИНЦИПЫ РЕГУЛЯЦИИ ПУТЕЙ МЕТАБОЛИЗМА
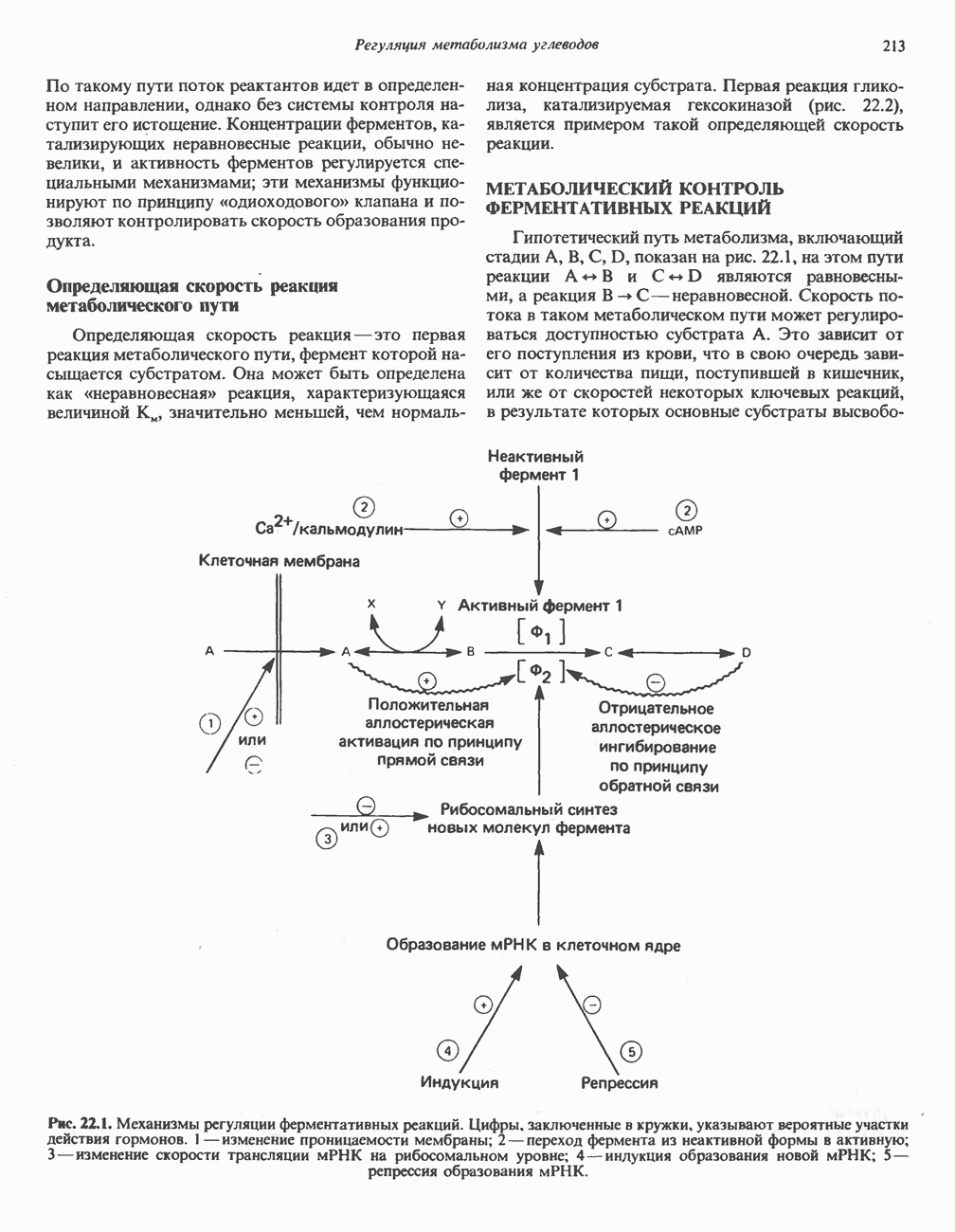
- МЕТАБОЛИЧЕСКИЙ КОНТРОЛЬ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
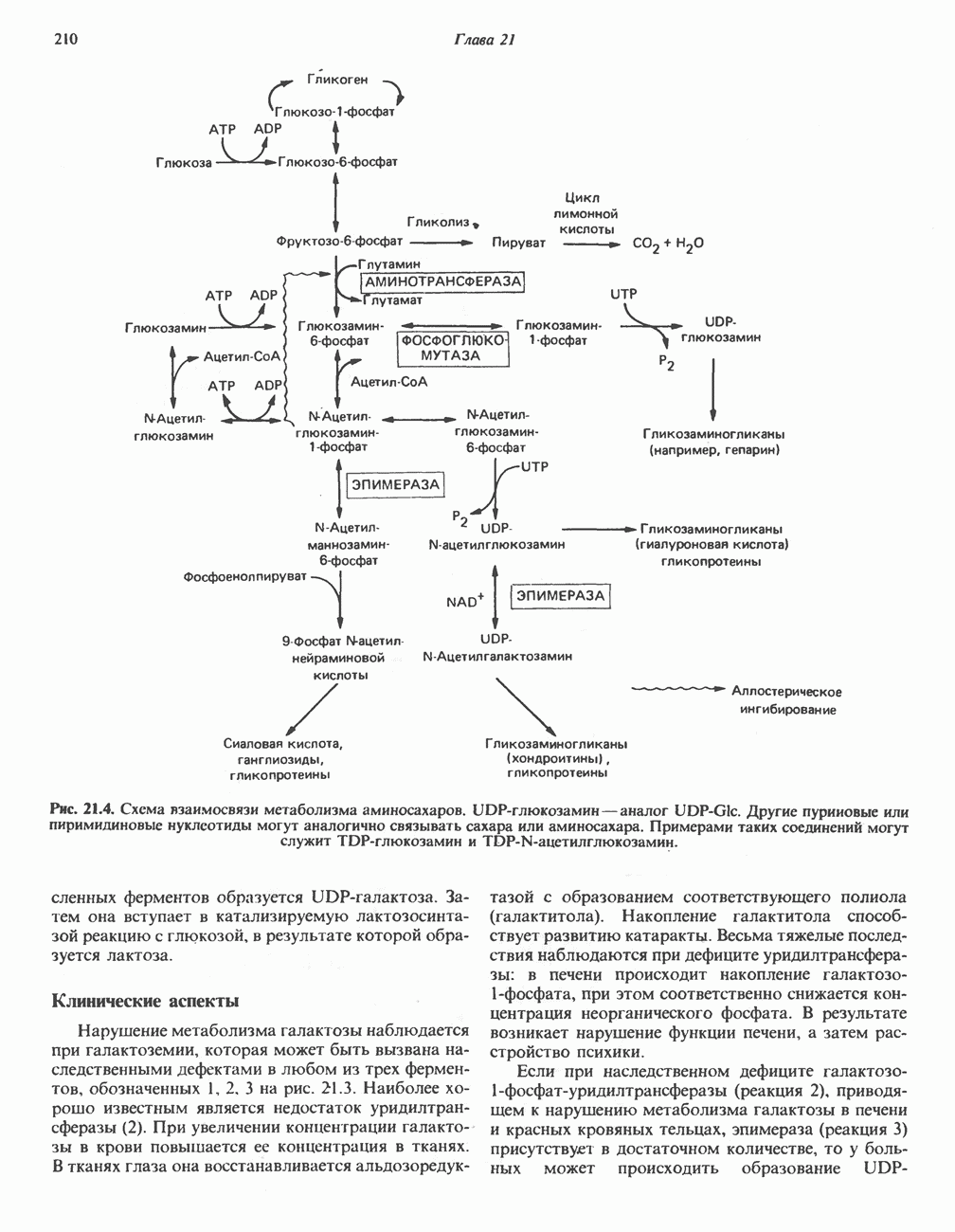
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА УГЛЕВОДОВ НА КЛЕТОЧНОМ И ФЕРМЕНТНОМ УРОВНЕ
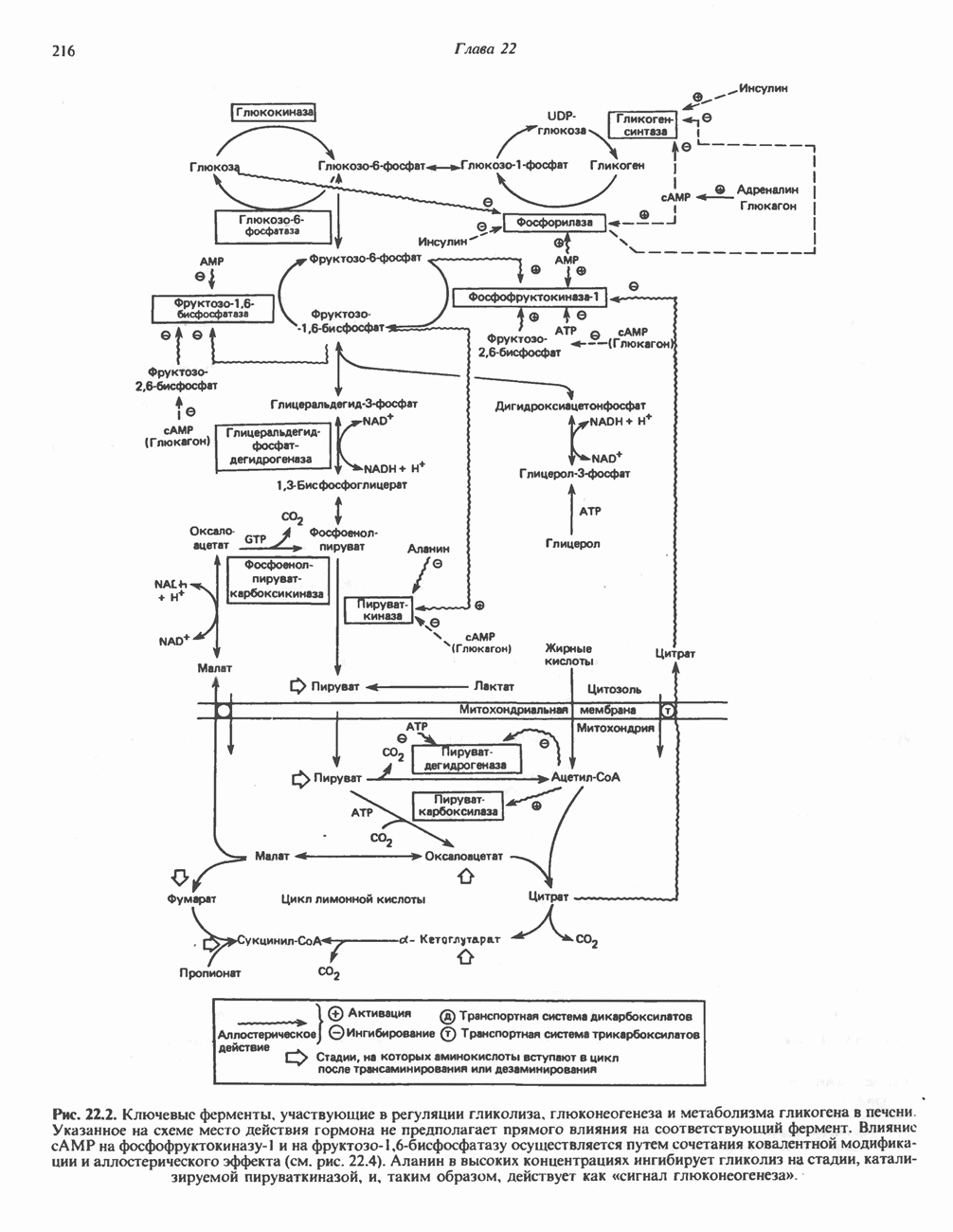
- РЕГУЛЯЦИЯ ГЛИКОЛИЗА, ГЛЮКОНЕОГЕНЕЗА И ПЕНТОЗОФОСФАТНОГО ПУТИ
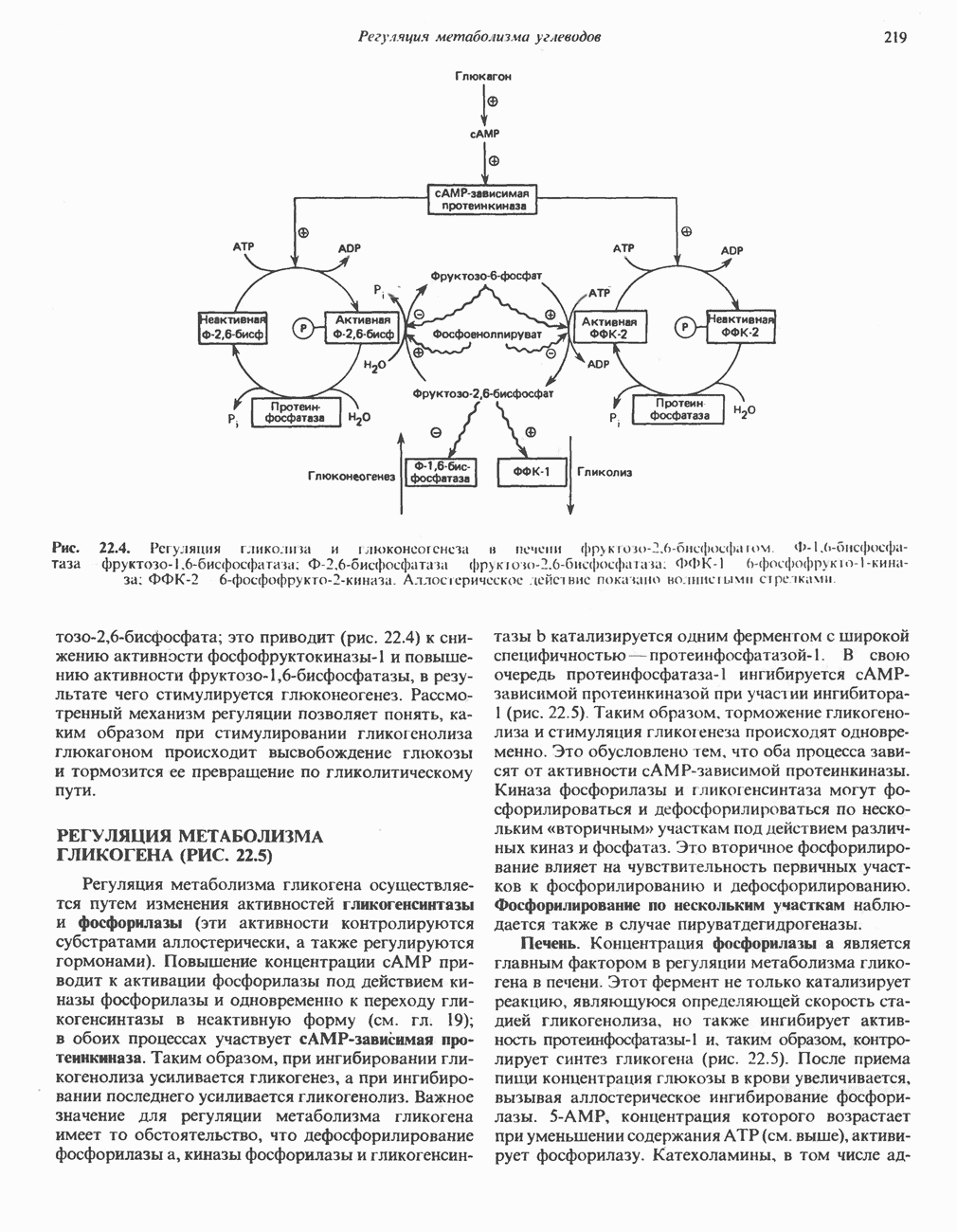
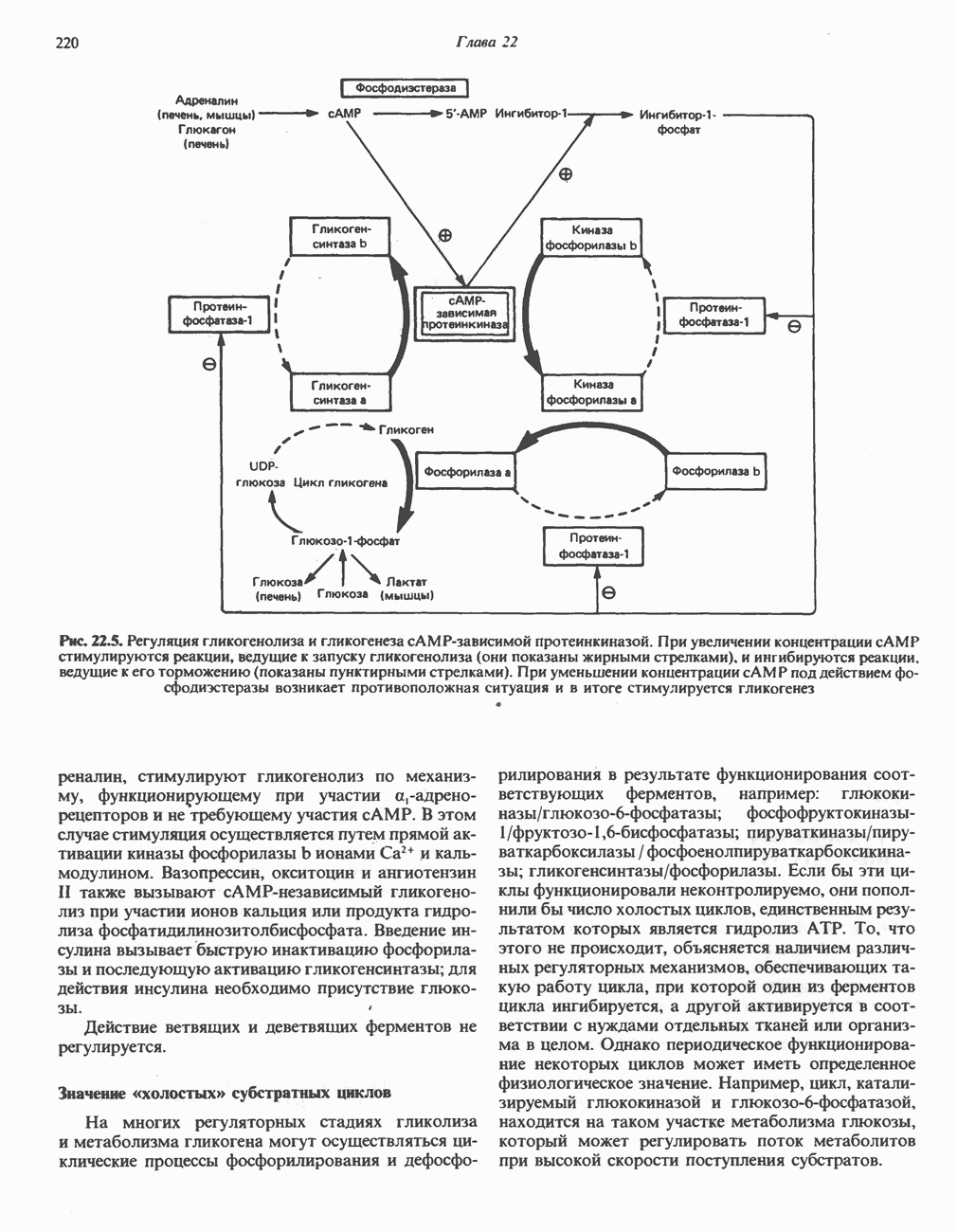
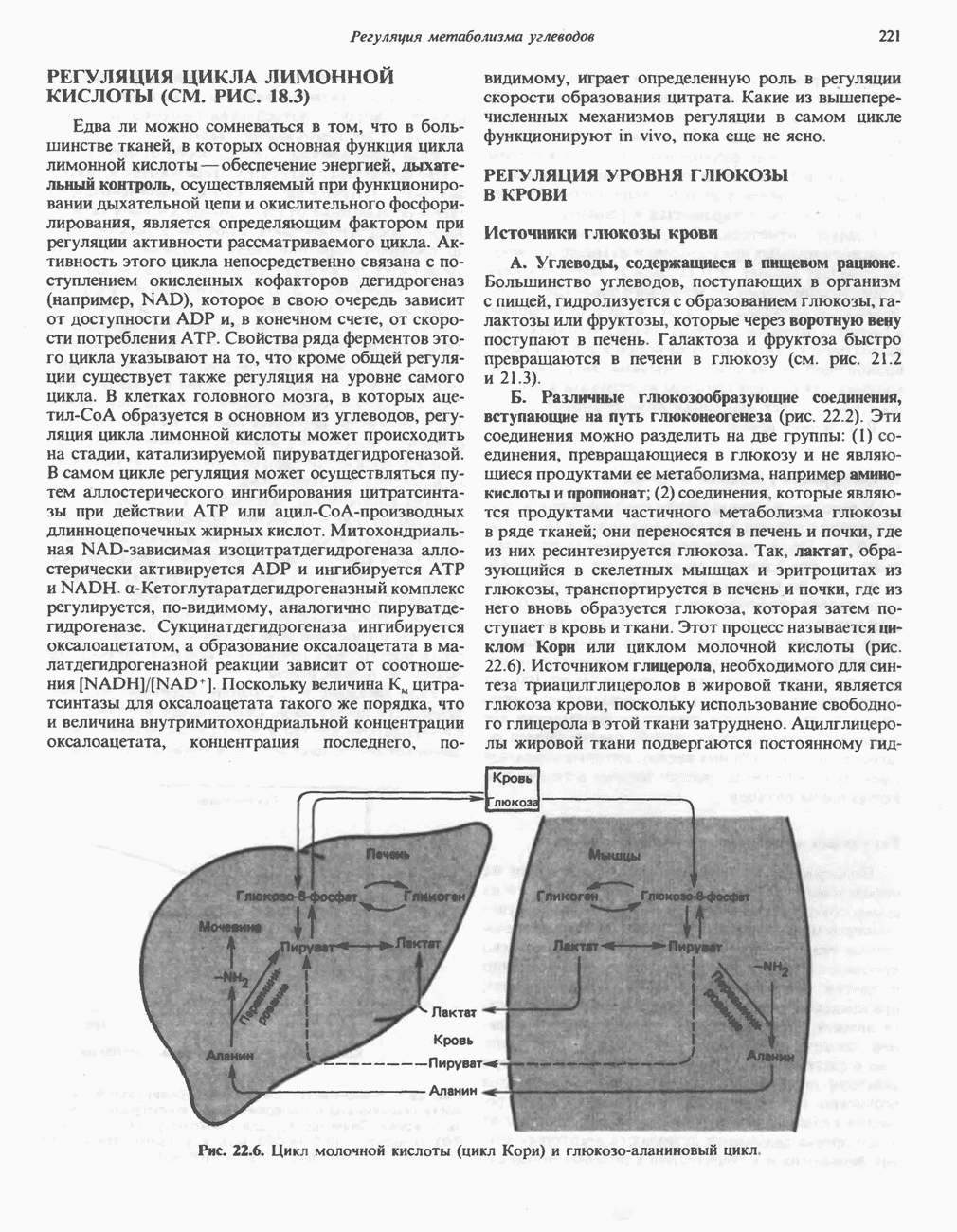
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ГЛИКОГЕНА (РИС. 22.5)
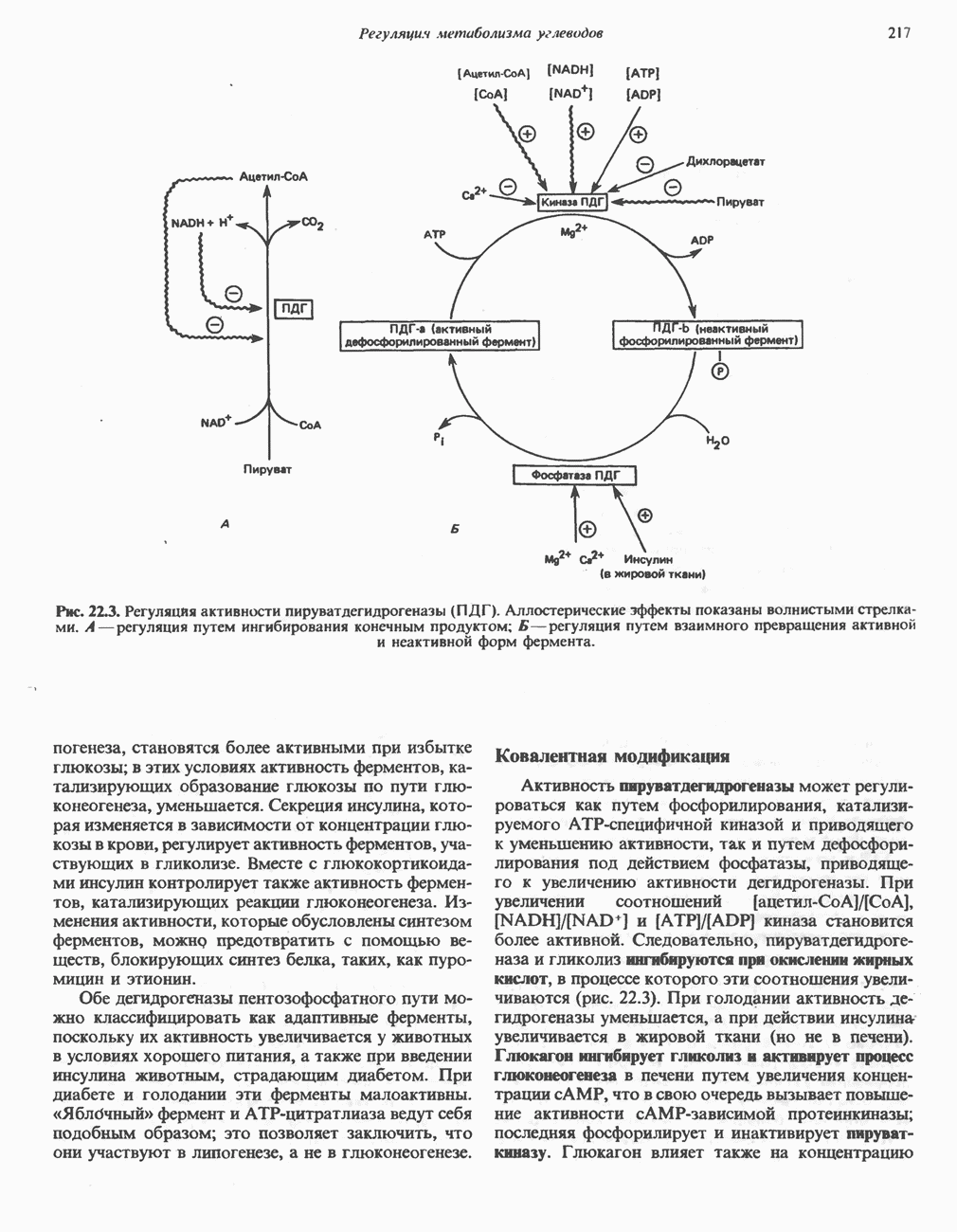
- РЕГУЛЯЦИЯ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (СМ. РИС. 18.3)
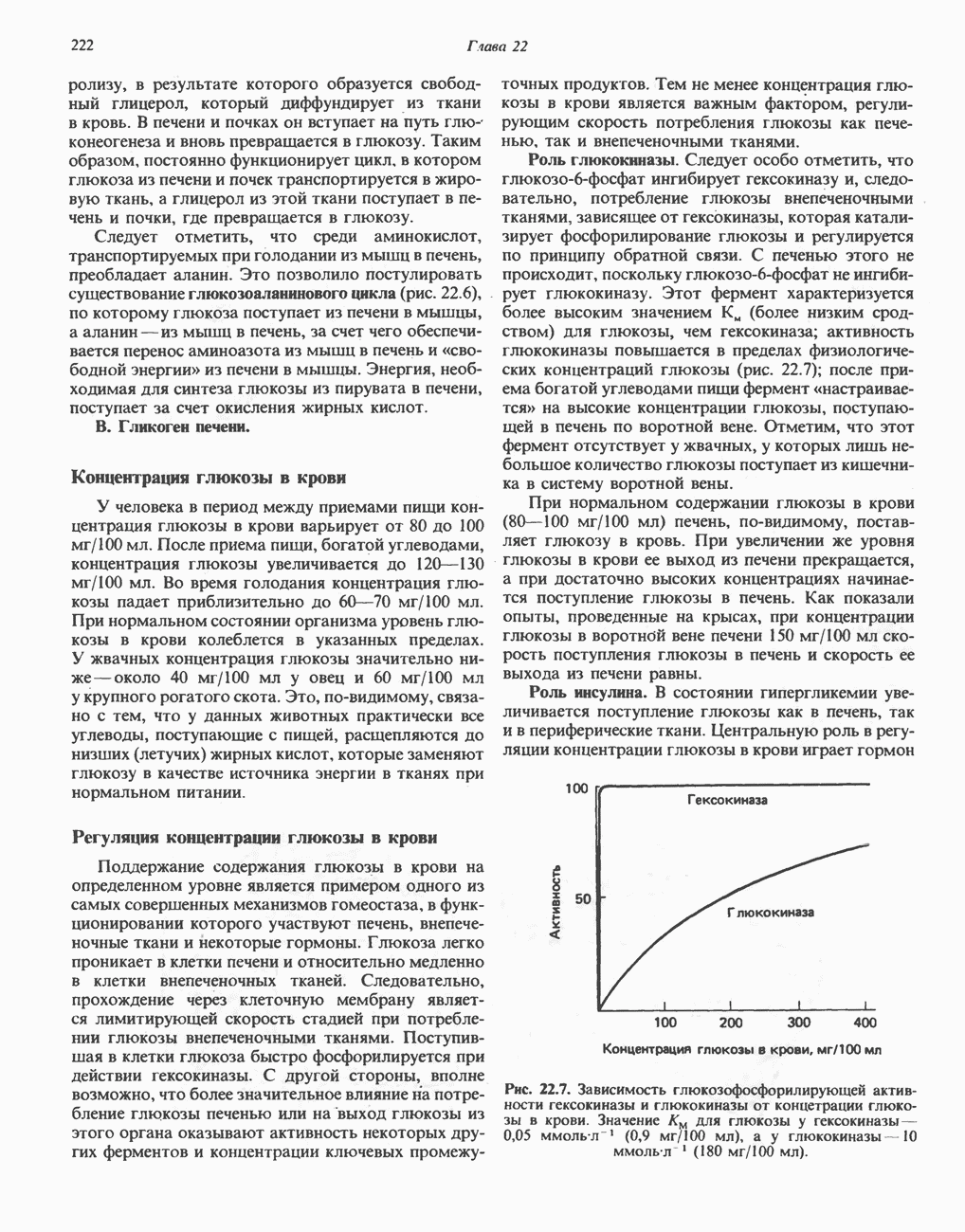
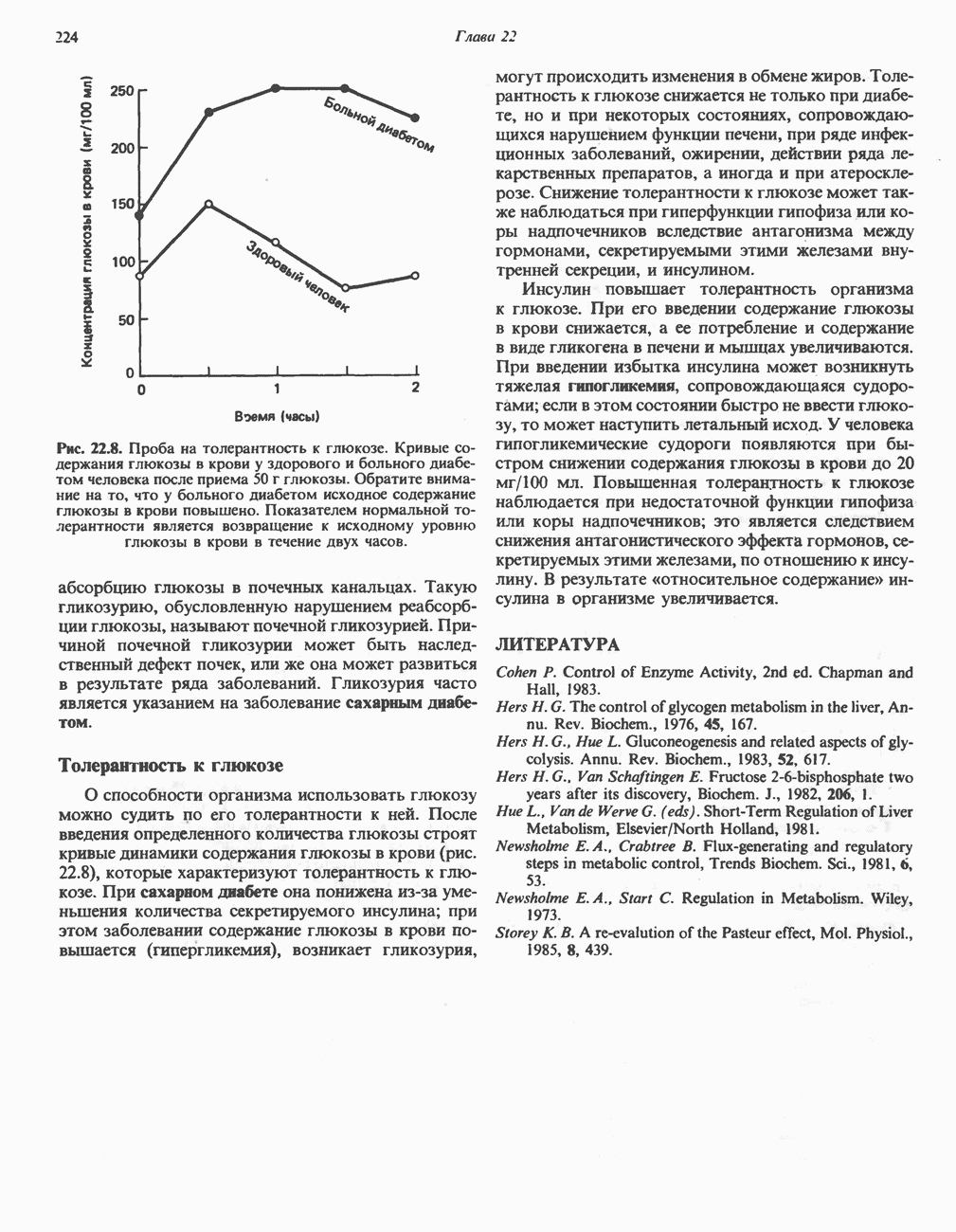
- РЕГУЛЯЦИЯ УРОВНЯ ГЛЮКОЗЫ В КРОВИ
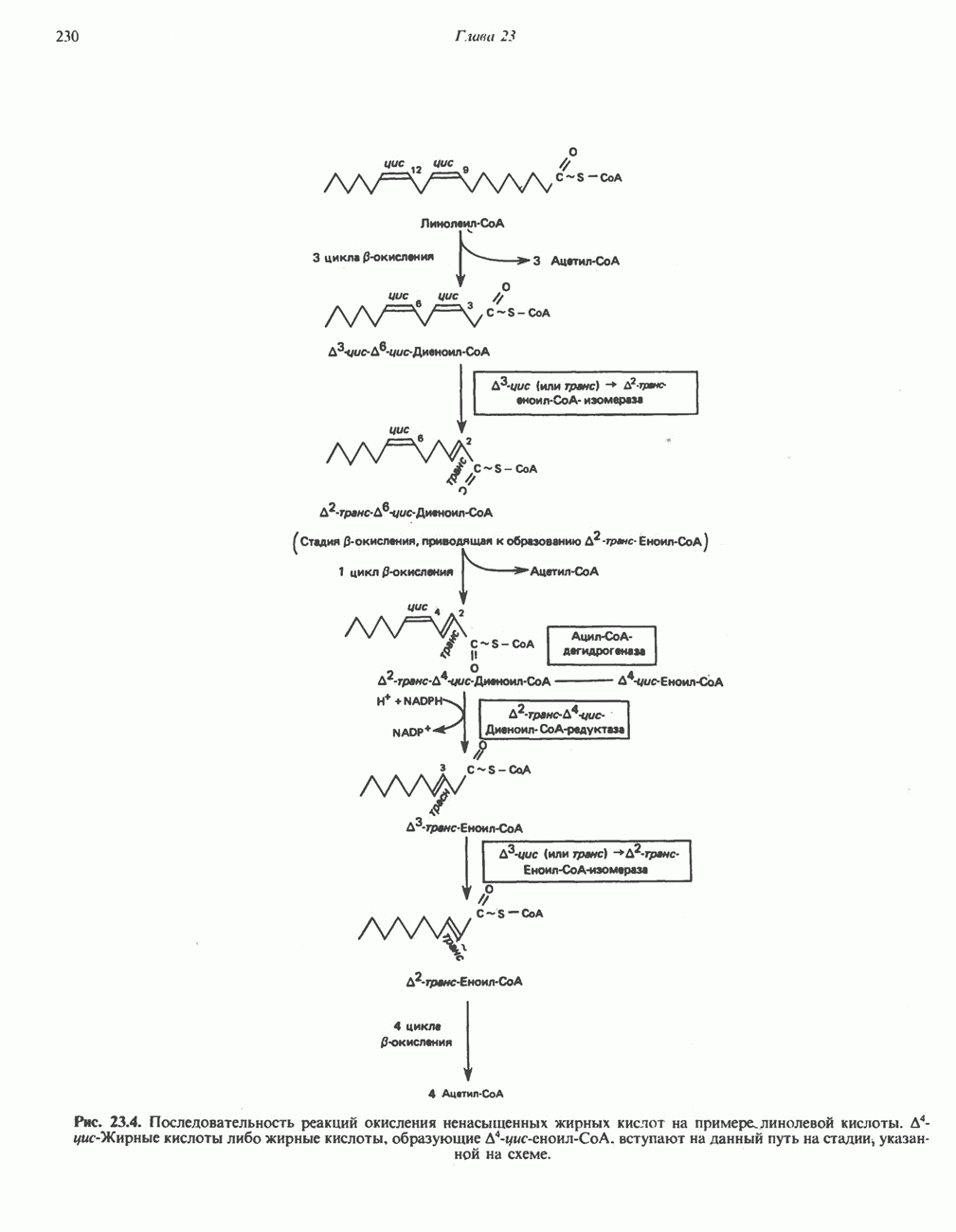
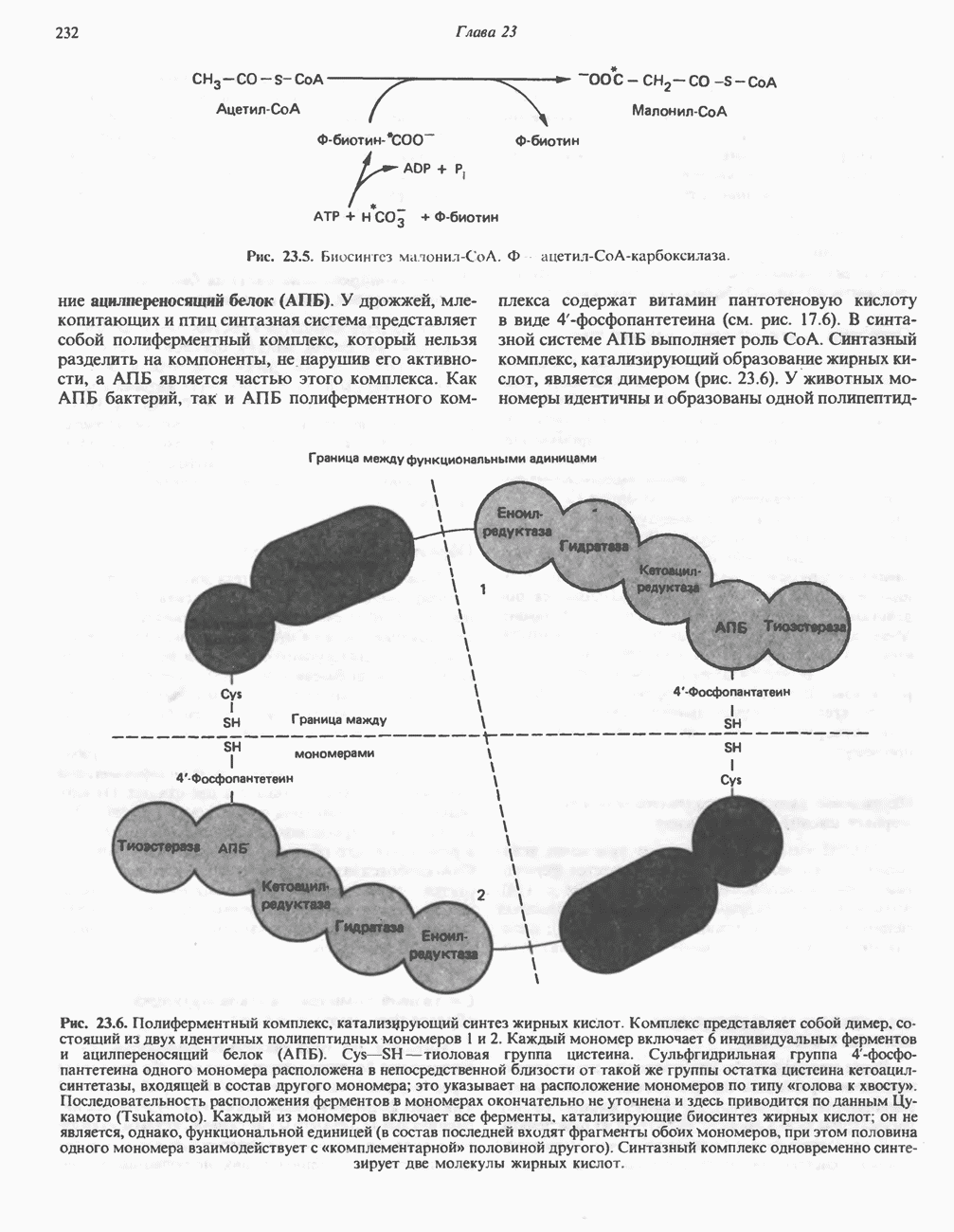
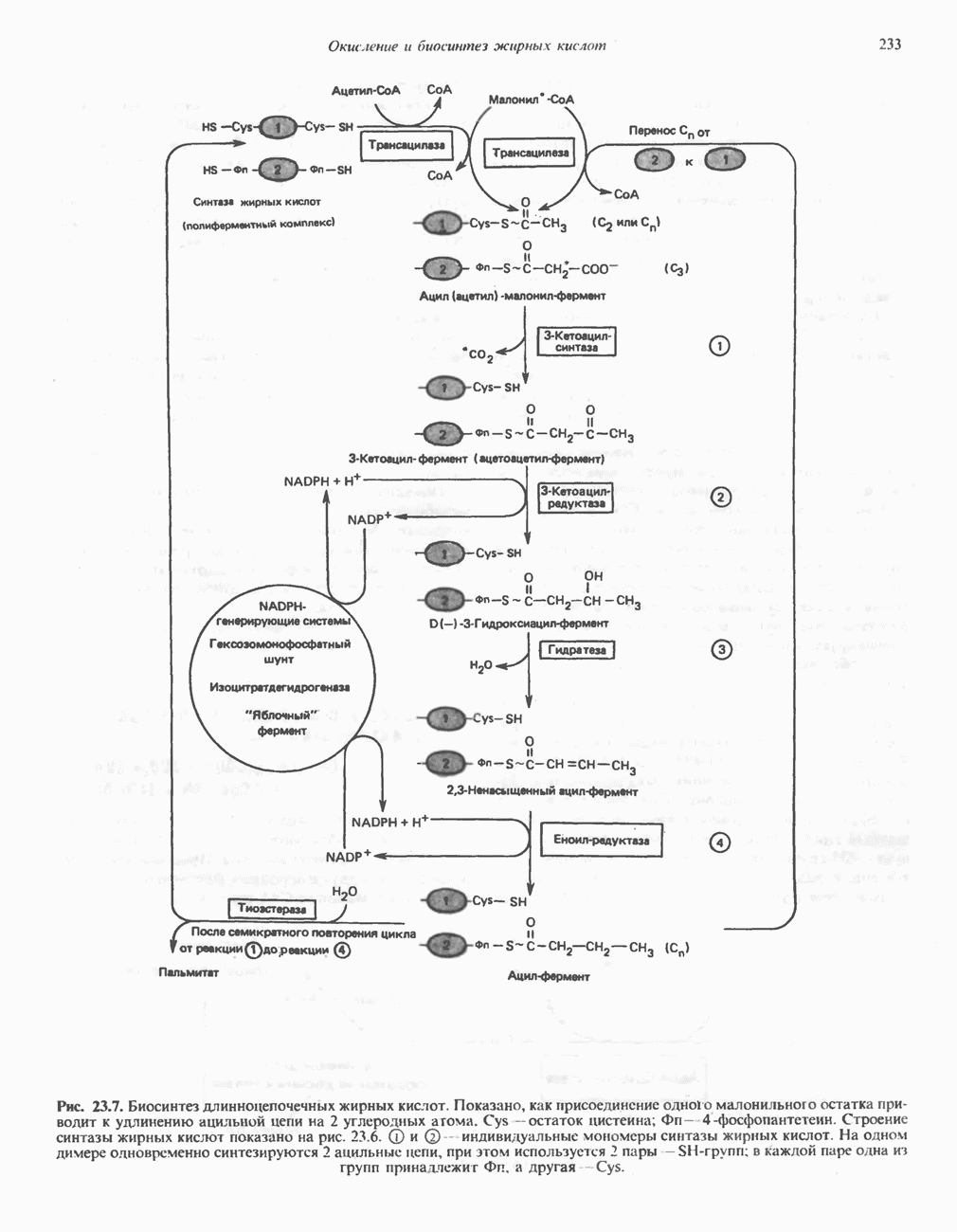
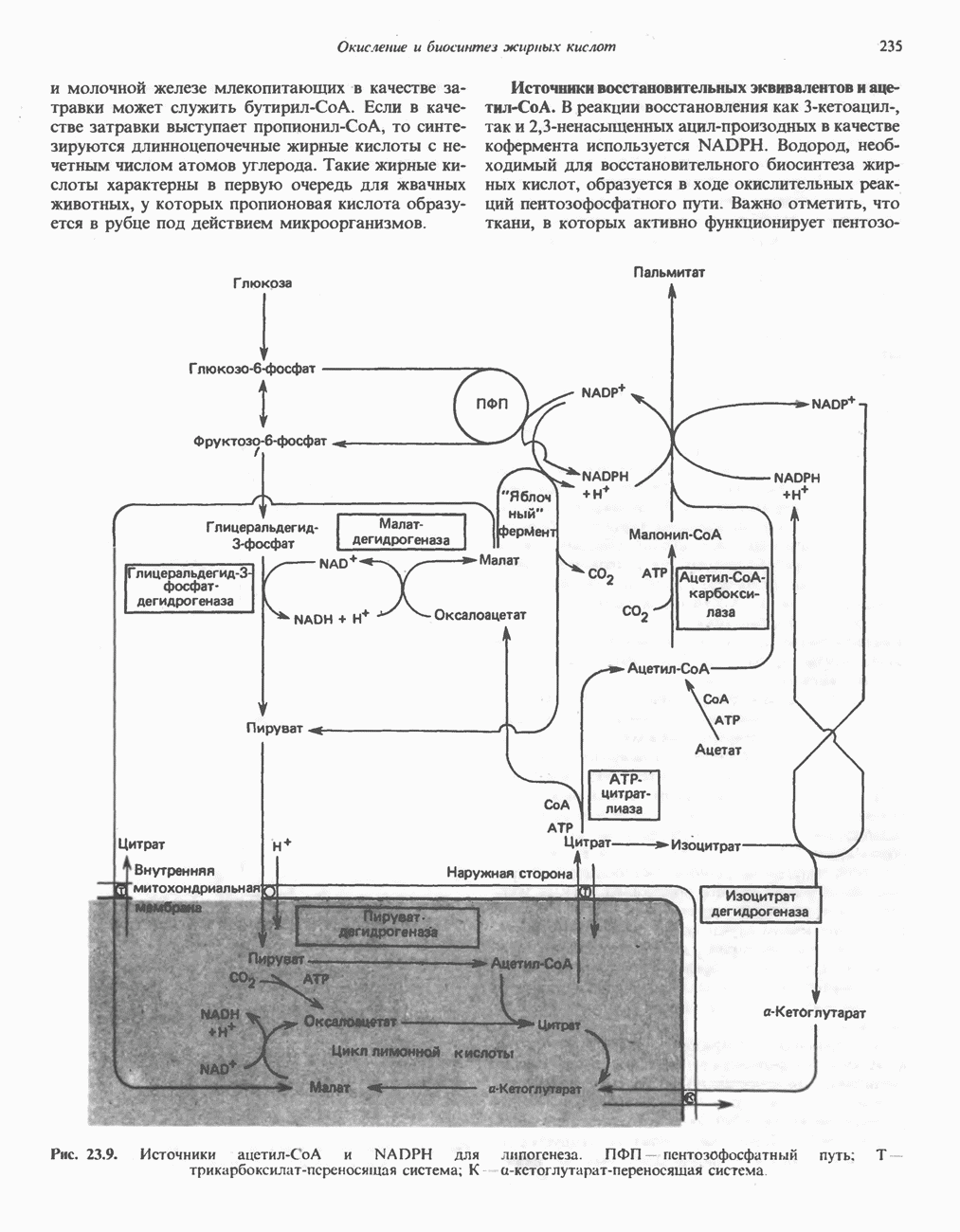
- Глава 23. Окисление и биосинтез жирных кислот
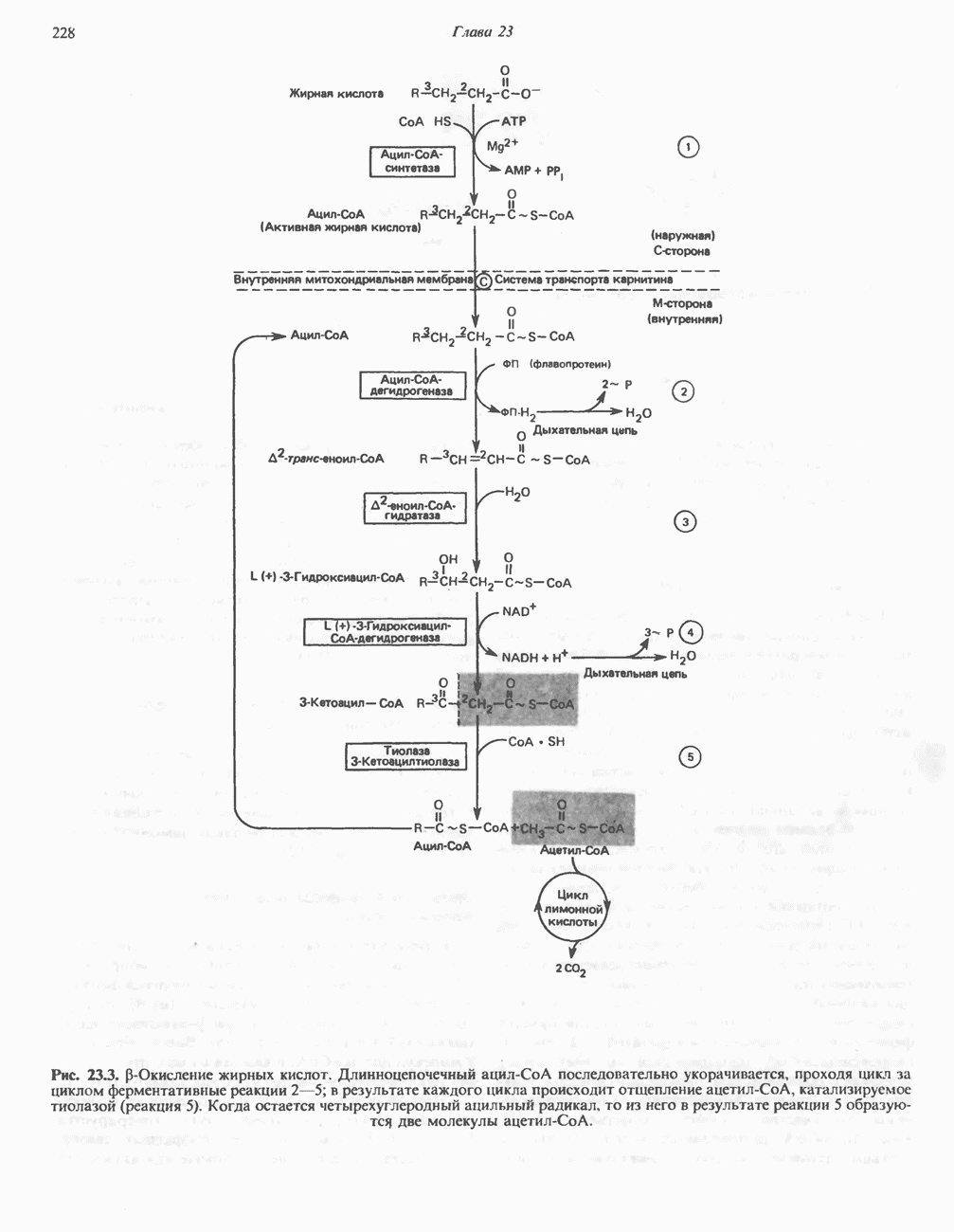
- ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ
- БИОСИНТЕЗ НАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
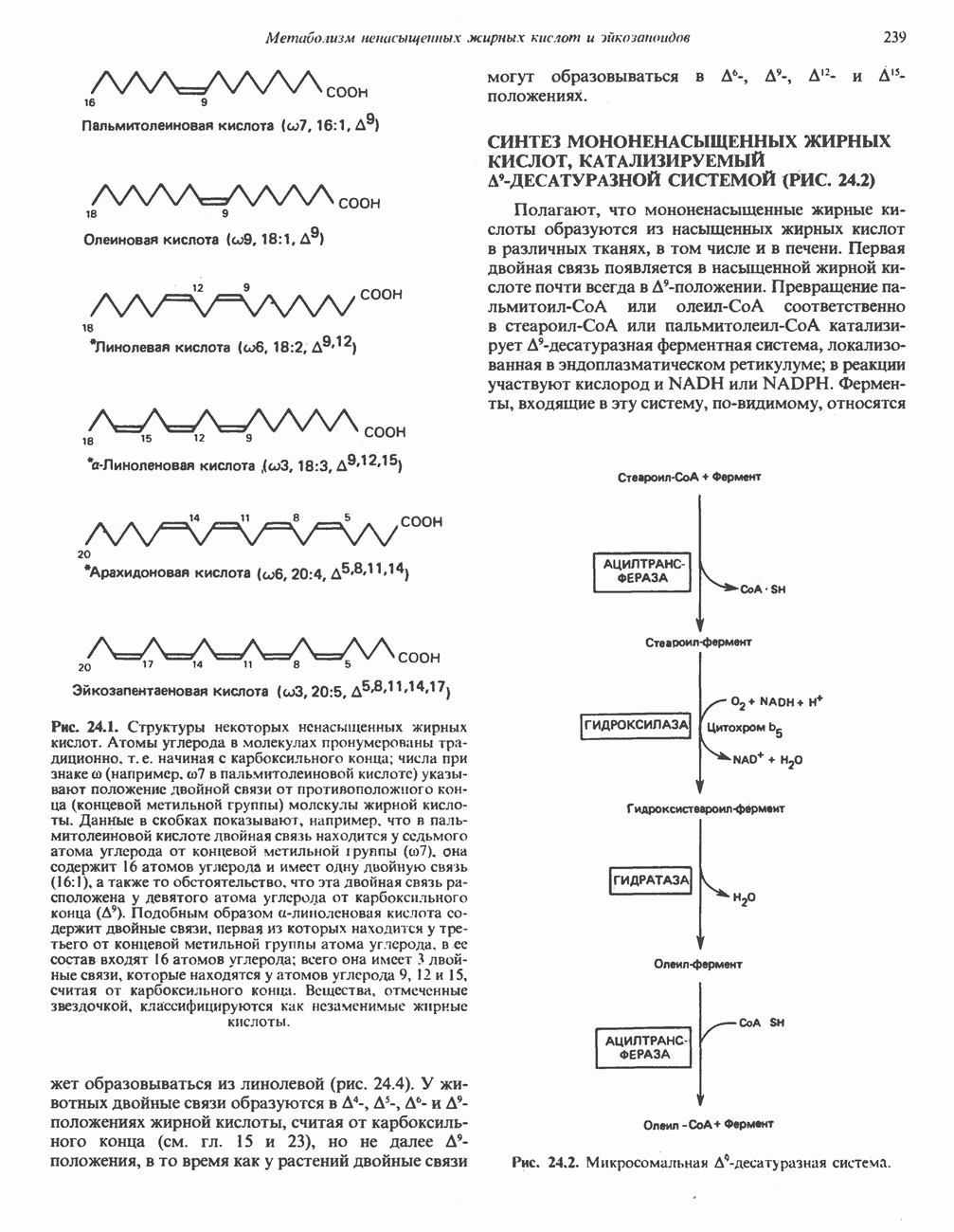
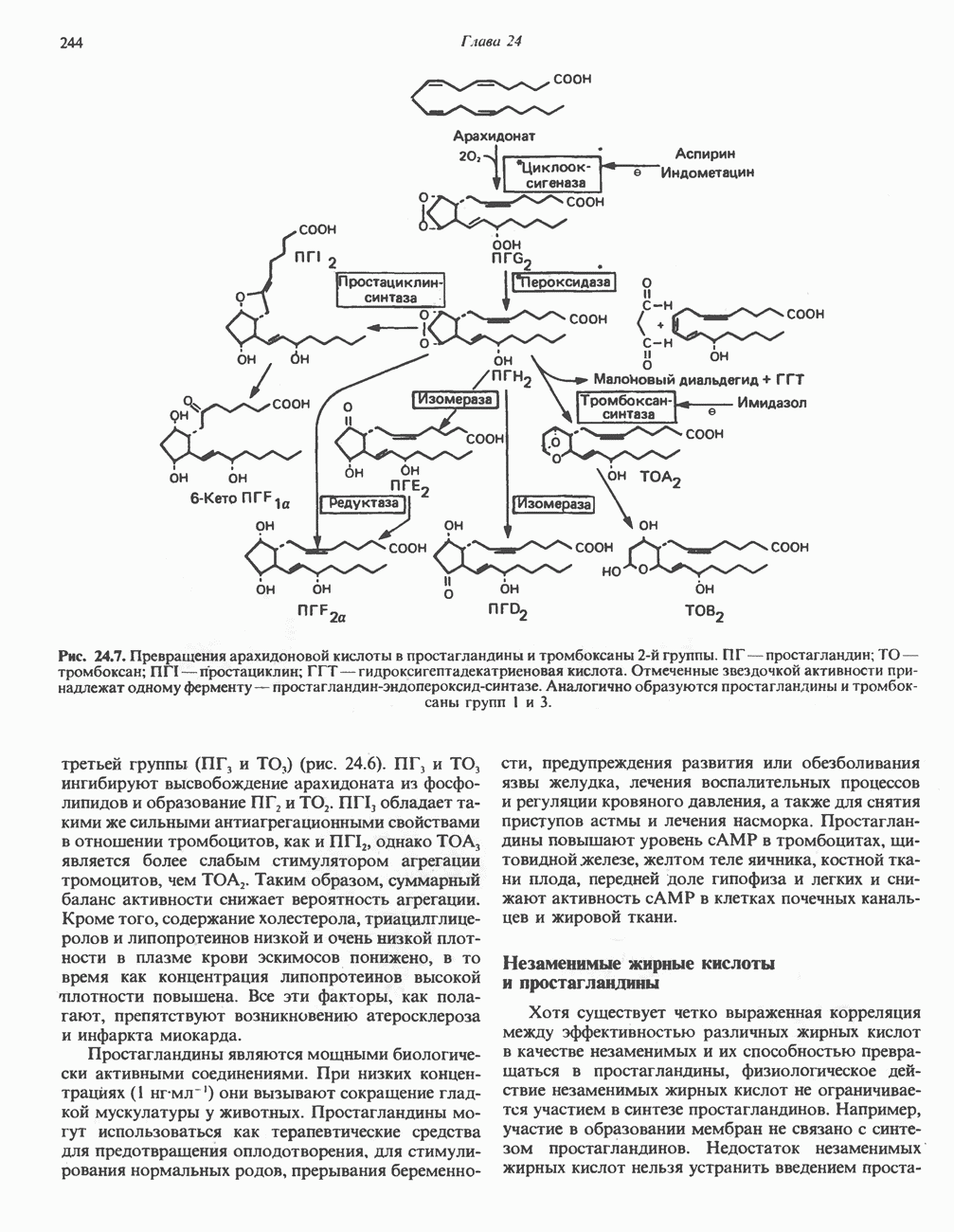
- Глава 24. Метаболизм ненасыщенных жирных кислот и эйкозаноидов
- МЕТАБОЛИЗМ НЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
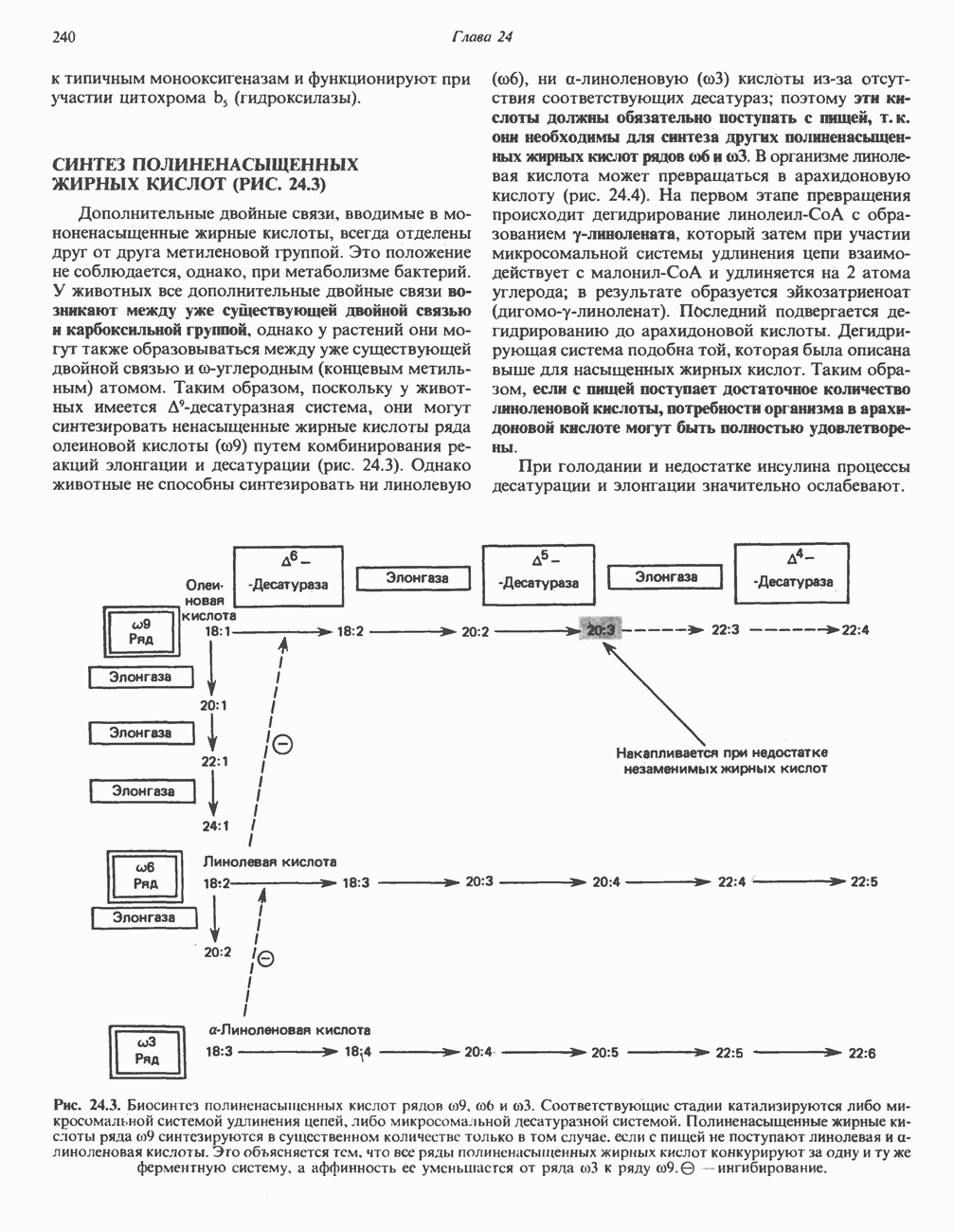
- СИНТЕЗ МОНОНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ, КАТАЛИЗИРУЕМЫЙ Д9-ДЕСАТУРАЗНОЙ СИСТЕМОЙ (РИС. 24.2)
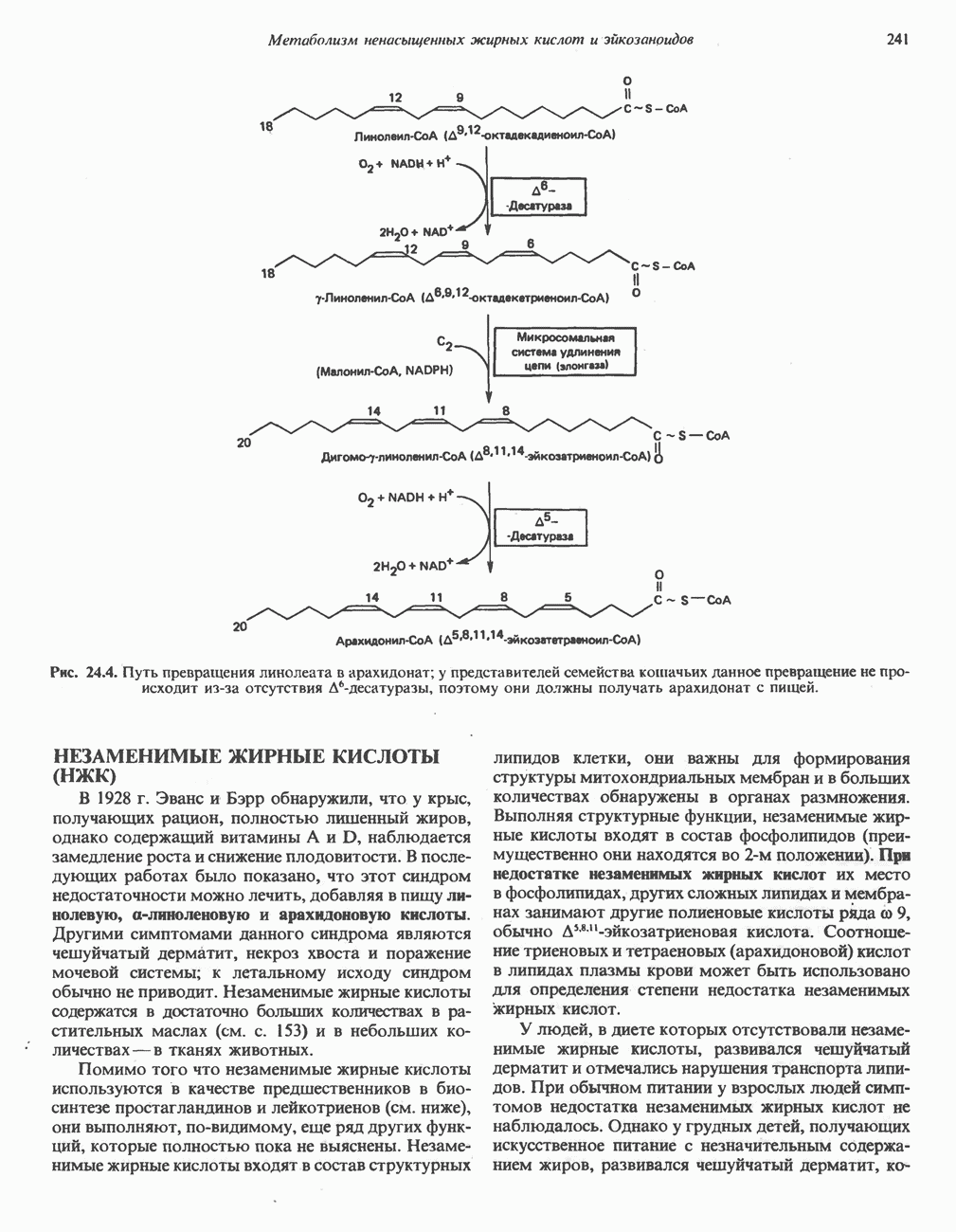
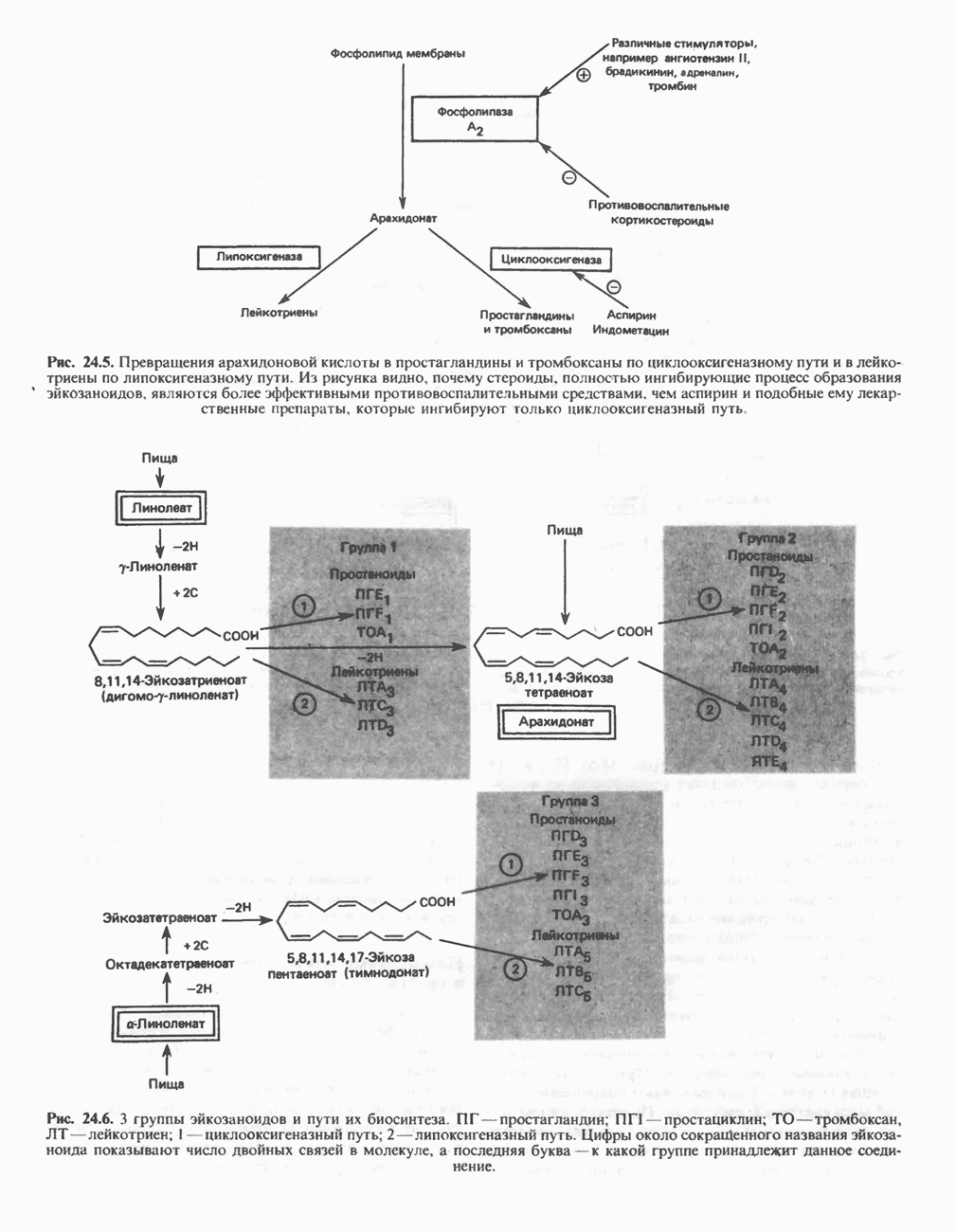
- СИНТЕЗ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ (РИС. 24.3)
- НЕЗАМЕНИМЫЕ ЖИРНЫЕ КИСЛОТЫ (НЖК)
- ЭЙКОЗАНОИДЫ
- ПРОСТАНОИДЫ
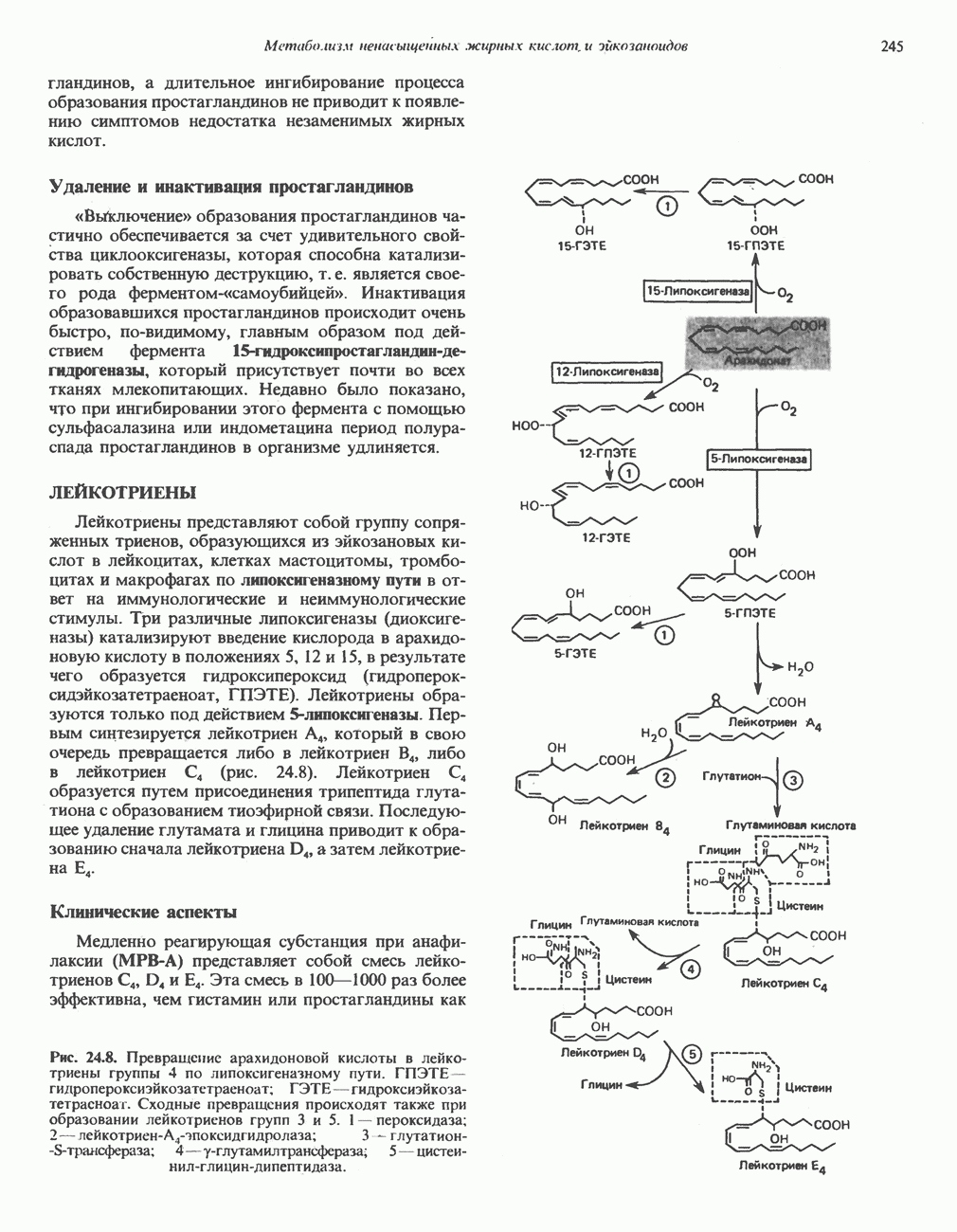
- ЛЕЙКОТРИЕНЫ
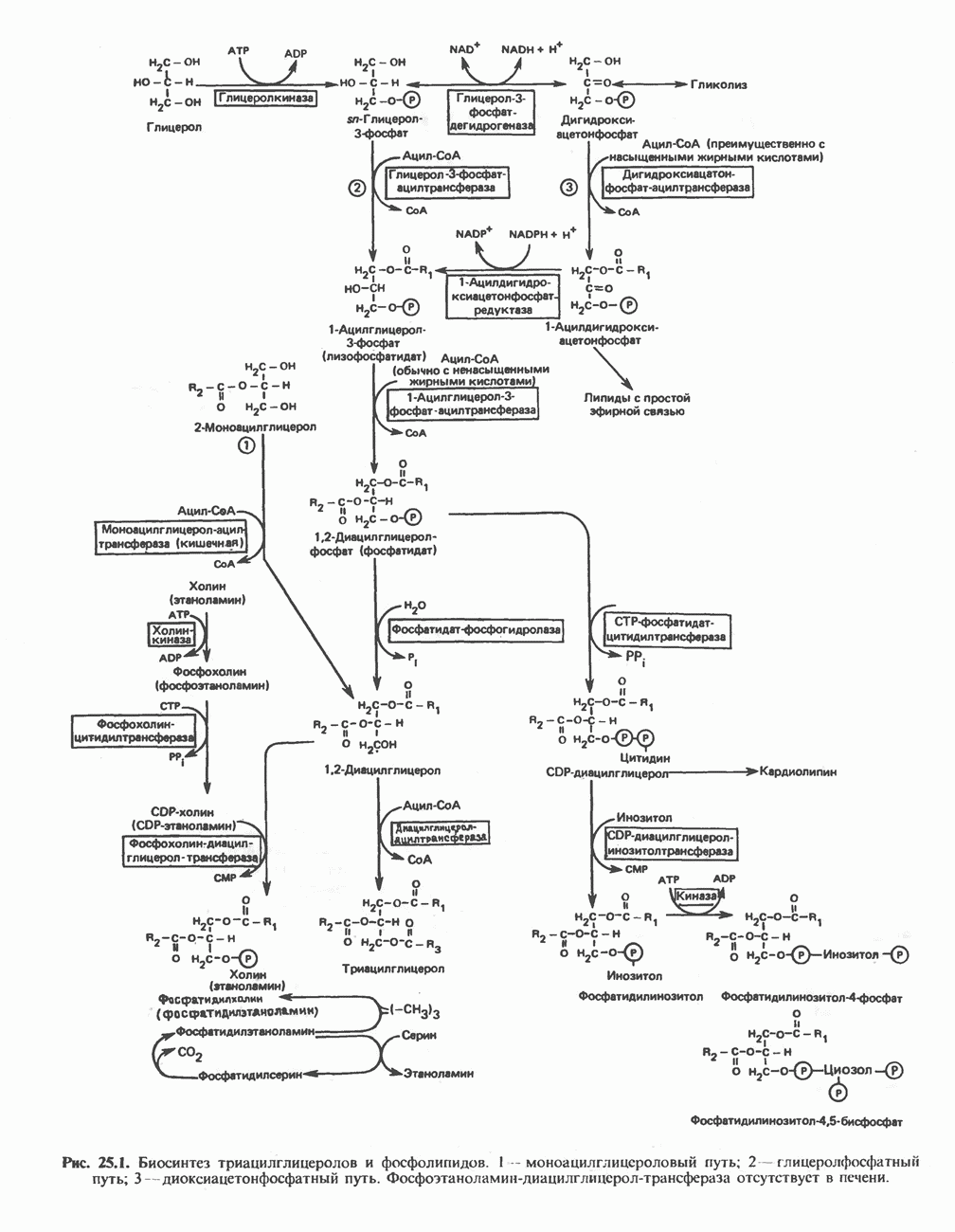
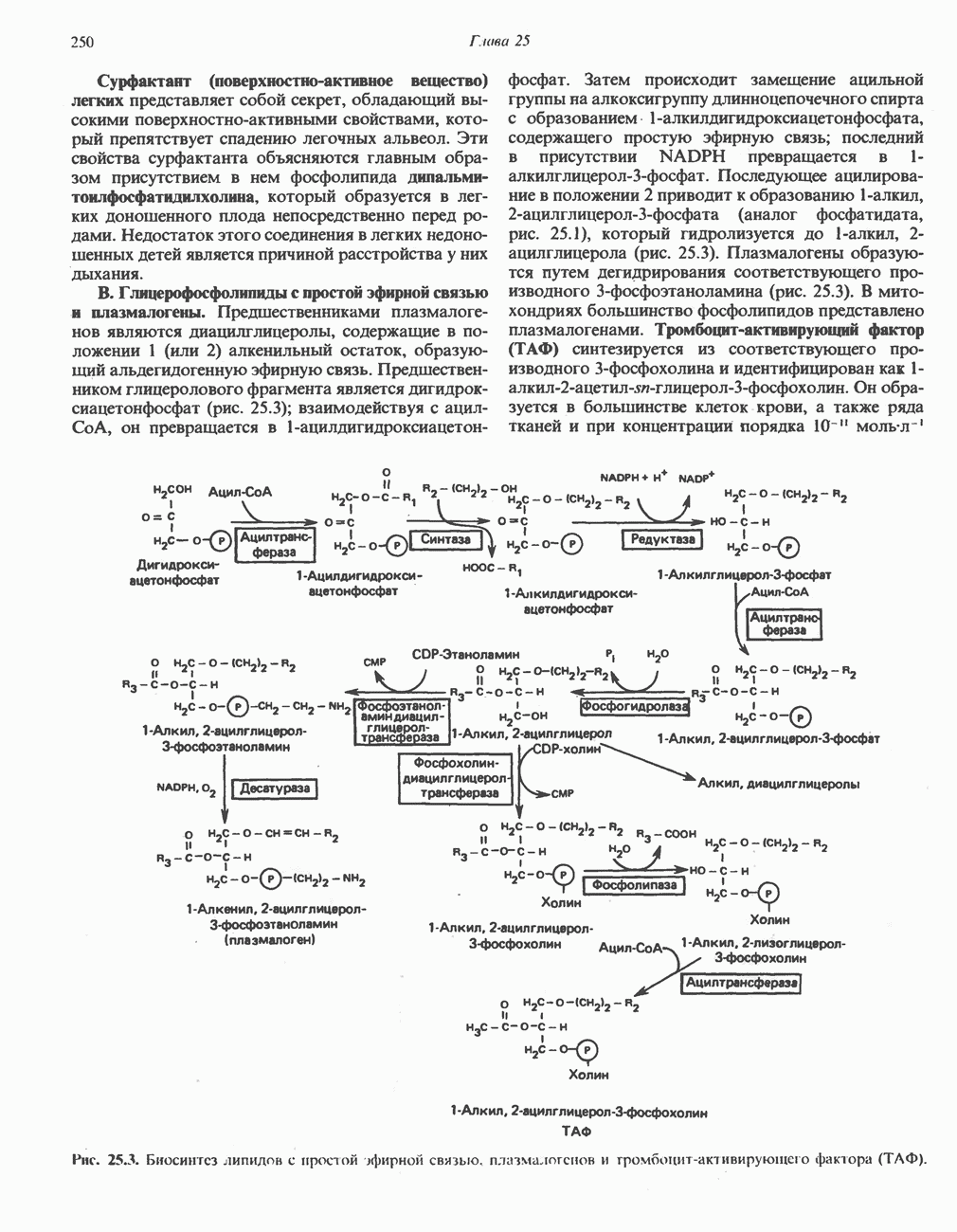
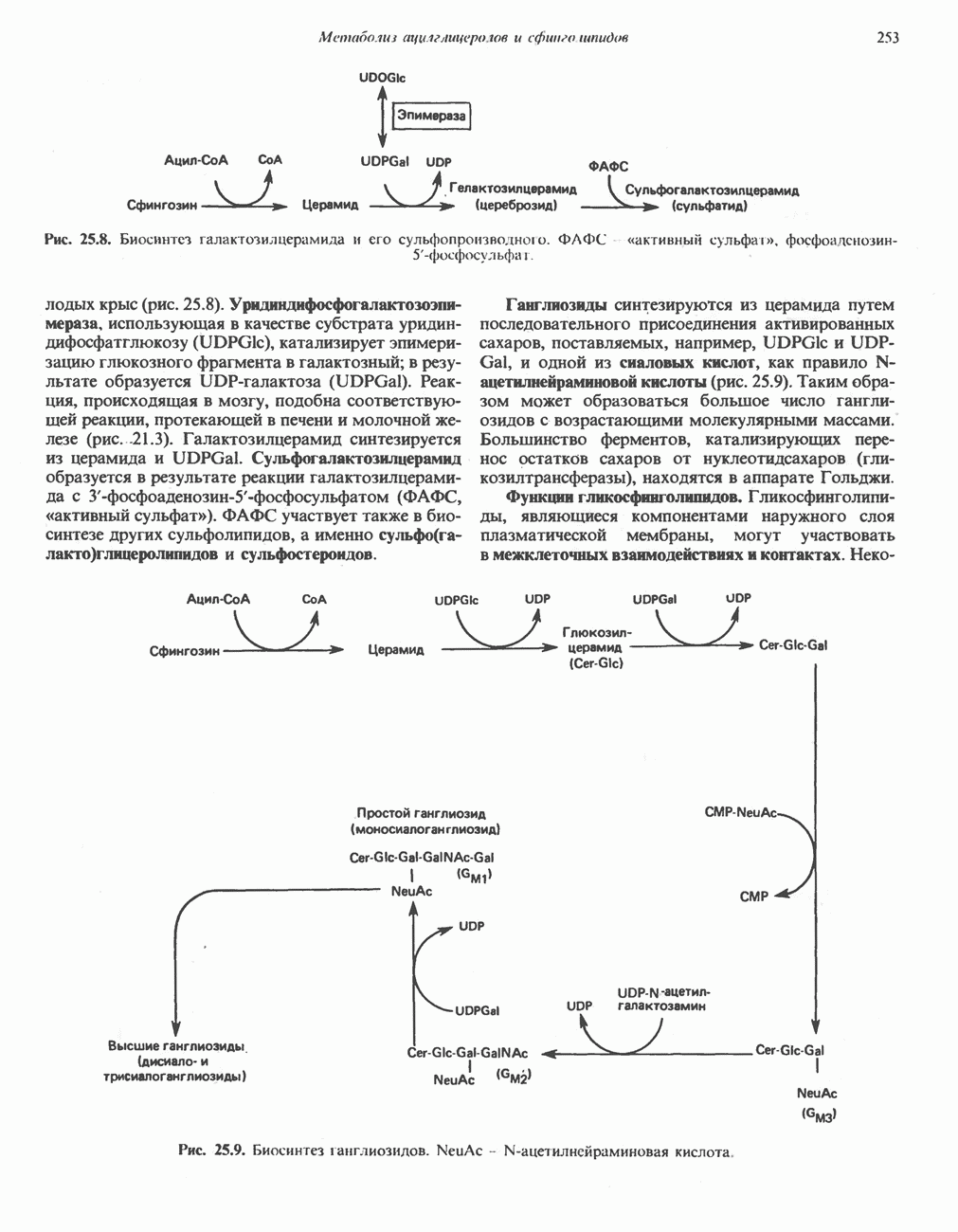
- Глава 25. Метаболизм ацилглицеролов и сфинголипидов
- МЕТАБОЛИЗМ АЦИЛГЛИЦЕРОЛОВ
- МЕТАБОЛИЗМ СФИНГОЛИПИДОВ
- ГЛИКОЛИПИДЫ
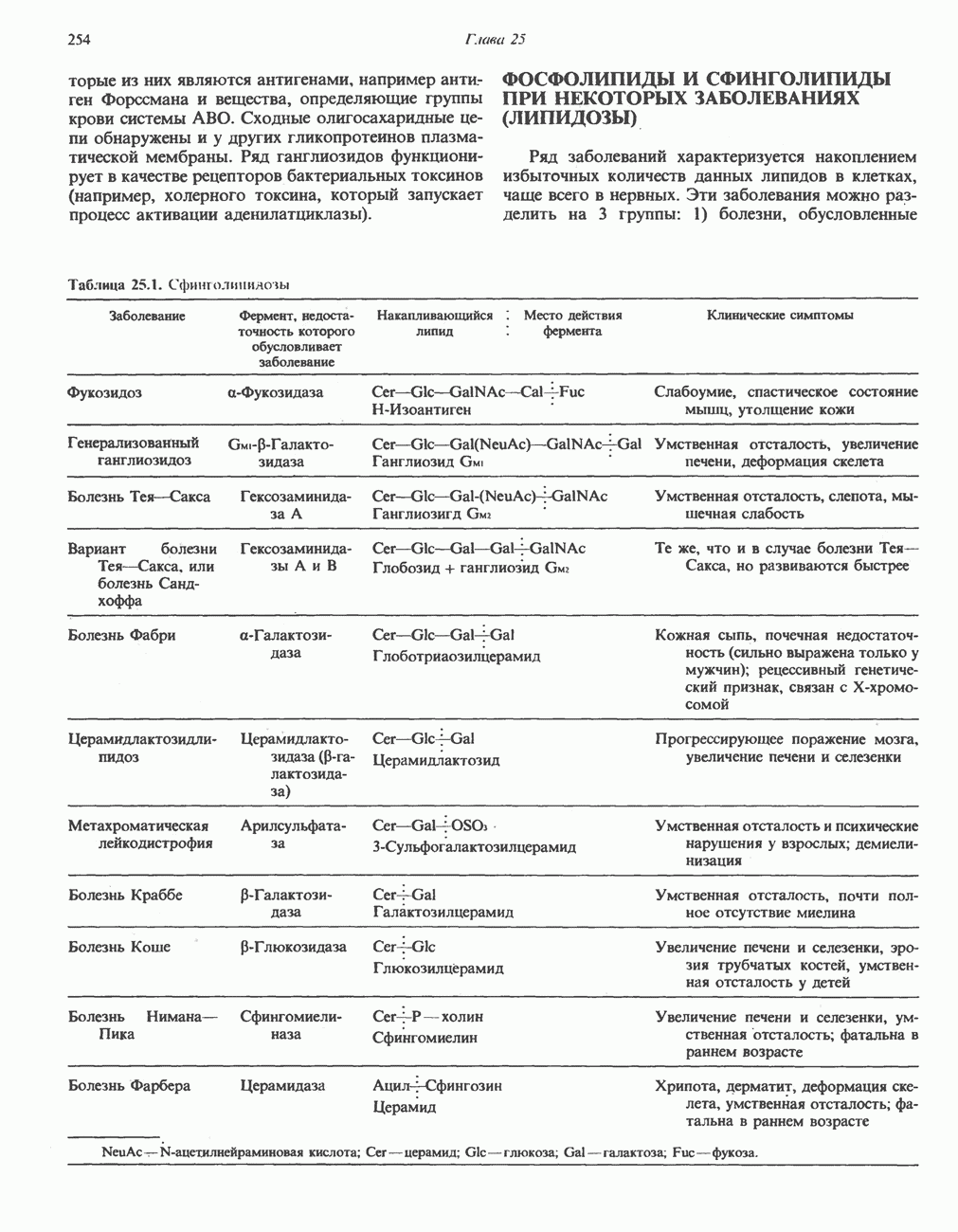
- ФОСФОЛИПИДЫ И СФИНГОЛИПИДЫ ПРИ НЕКОТОРЫХ ЗАБОЛЕВАНИЯХ (ЛИПИДОЗЫ)
- Глава 26. Транспорт и запасание липидов
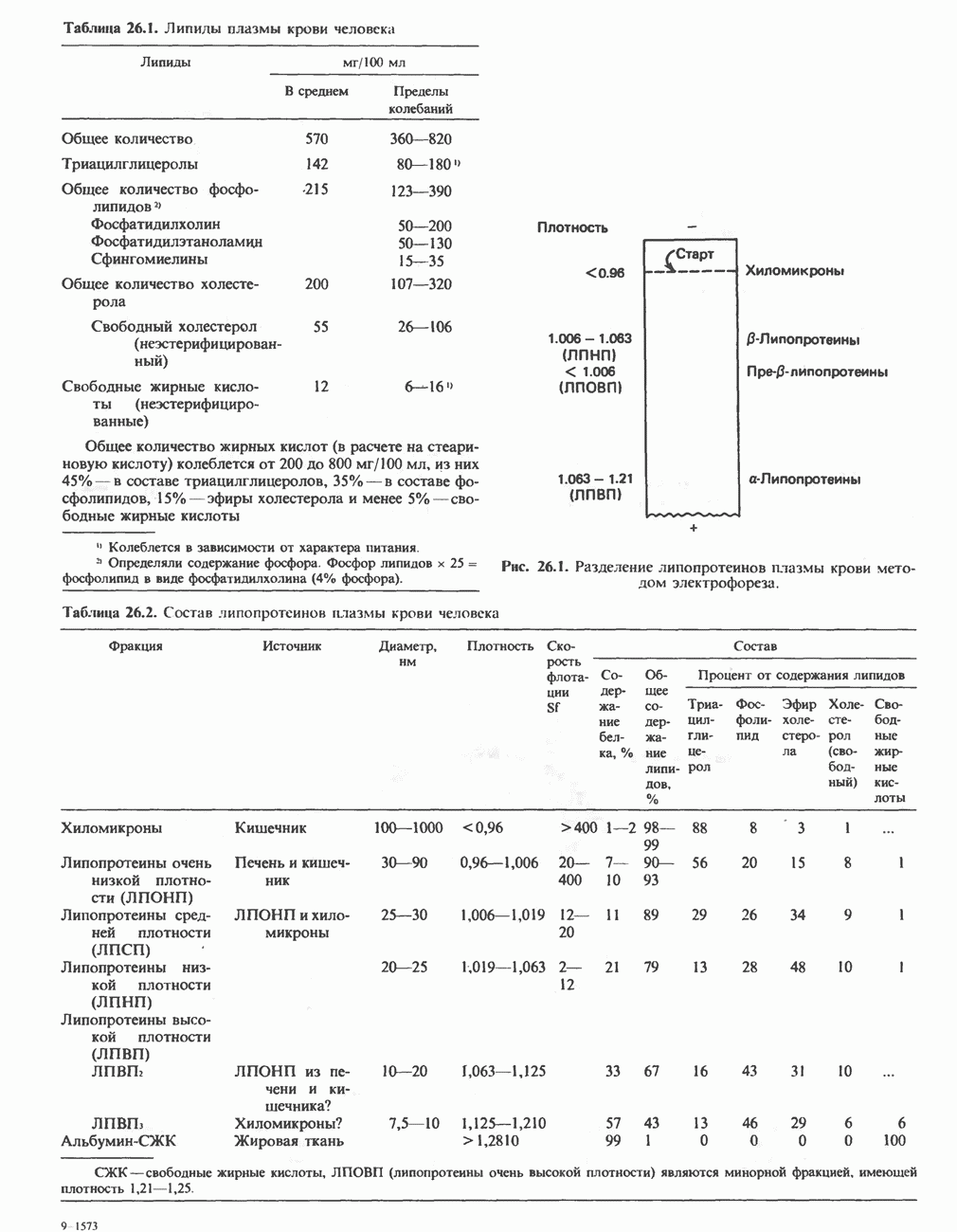
- ЛИПИДЫ ПЛАЗМЫ КРОВИ И ЛИПОПРОТЕИНЫ
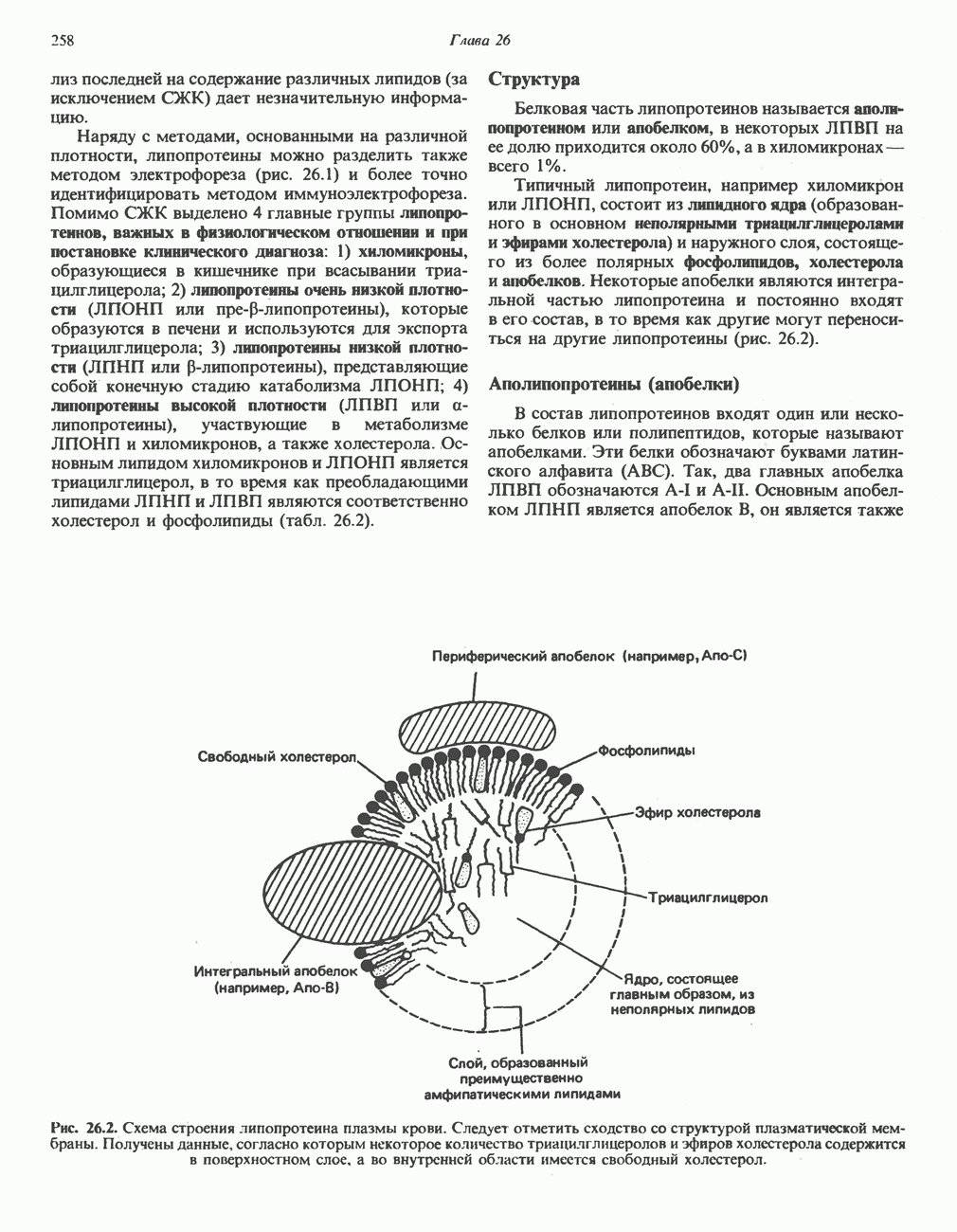
- МЕТАБОЛИЗМ ЛИПОПРОТЕИНОВ ПЛАЗМЫ КРОВИ
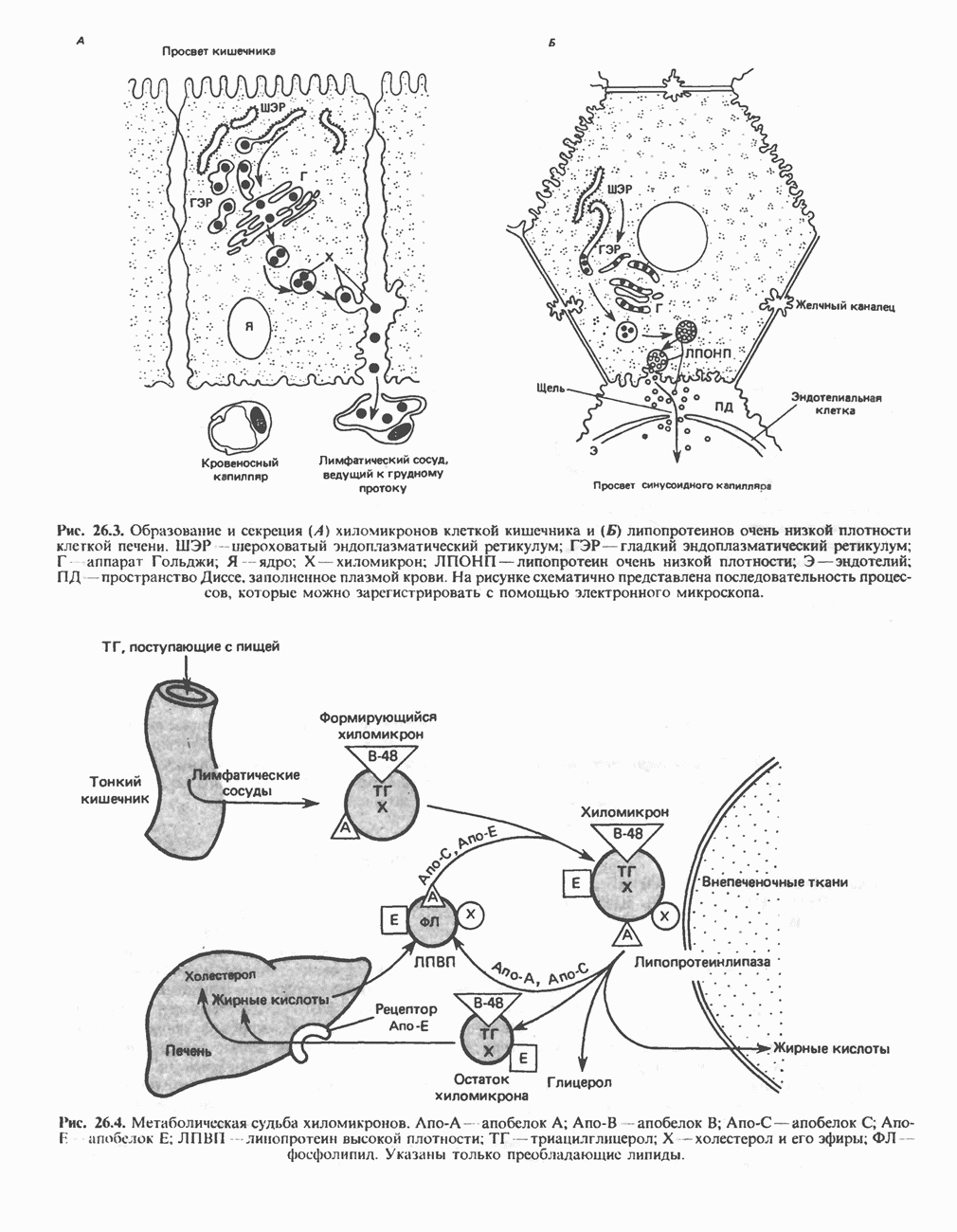
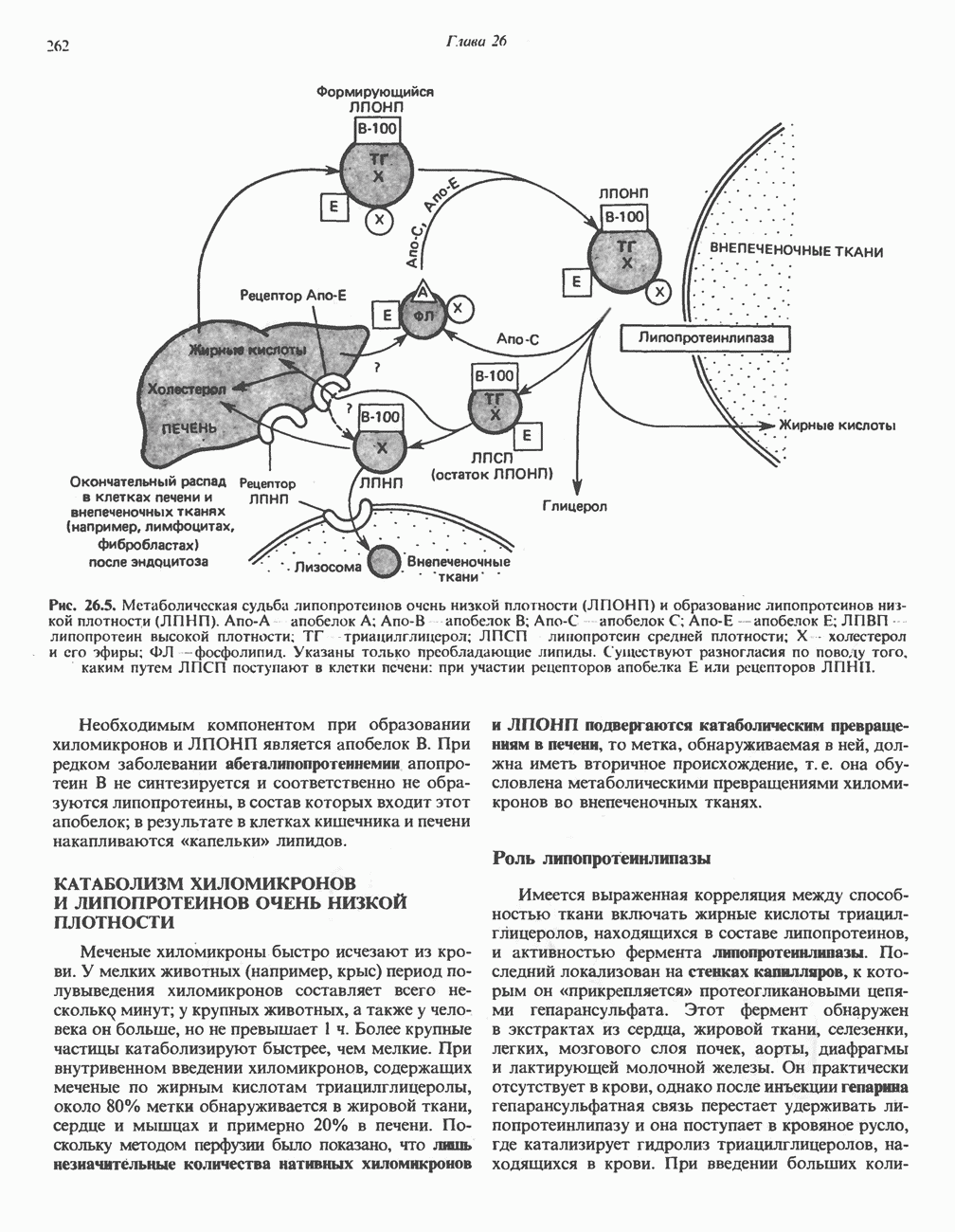
- ОБРАЗОВАНИЕ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ (ЛПОНП)
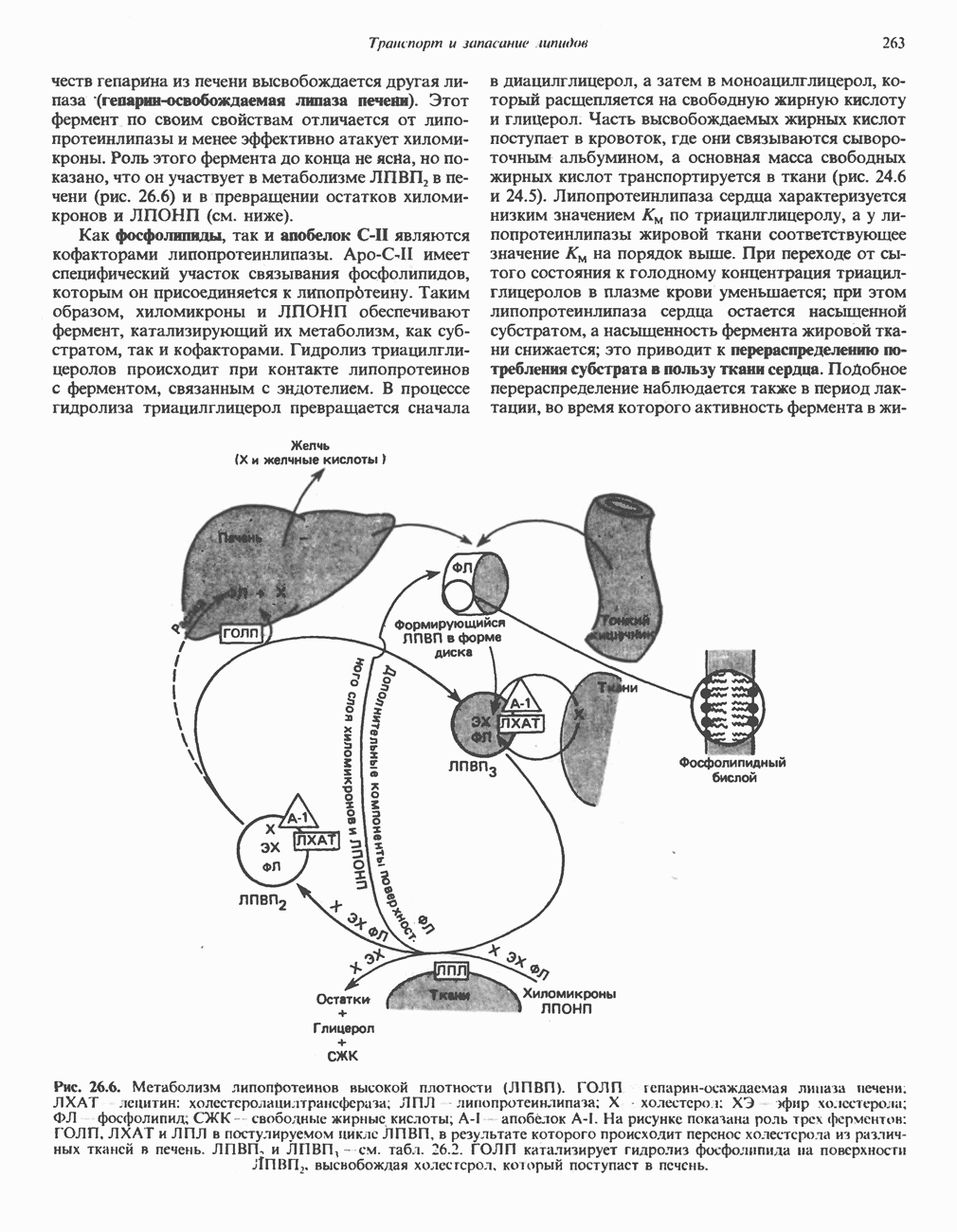
- КАТАБОЛИЗМ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ
- МЕТАБОЛИЗМ ЛПНП
- МЕТАБОЛИЗМ ЛПВП (рис. 26.6)
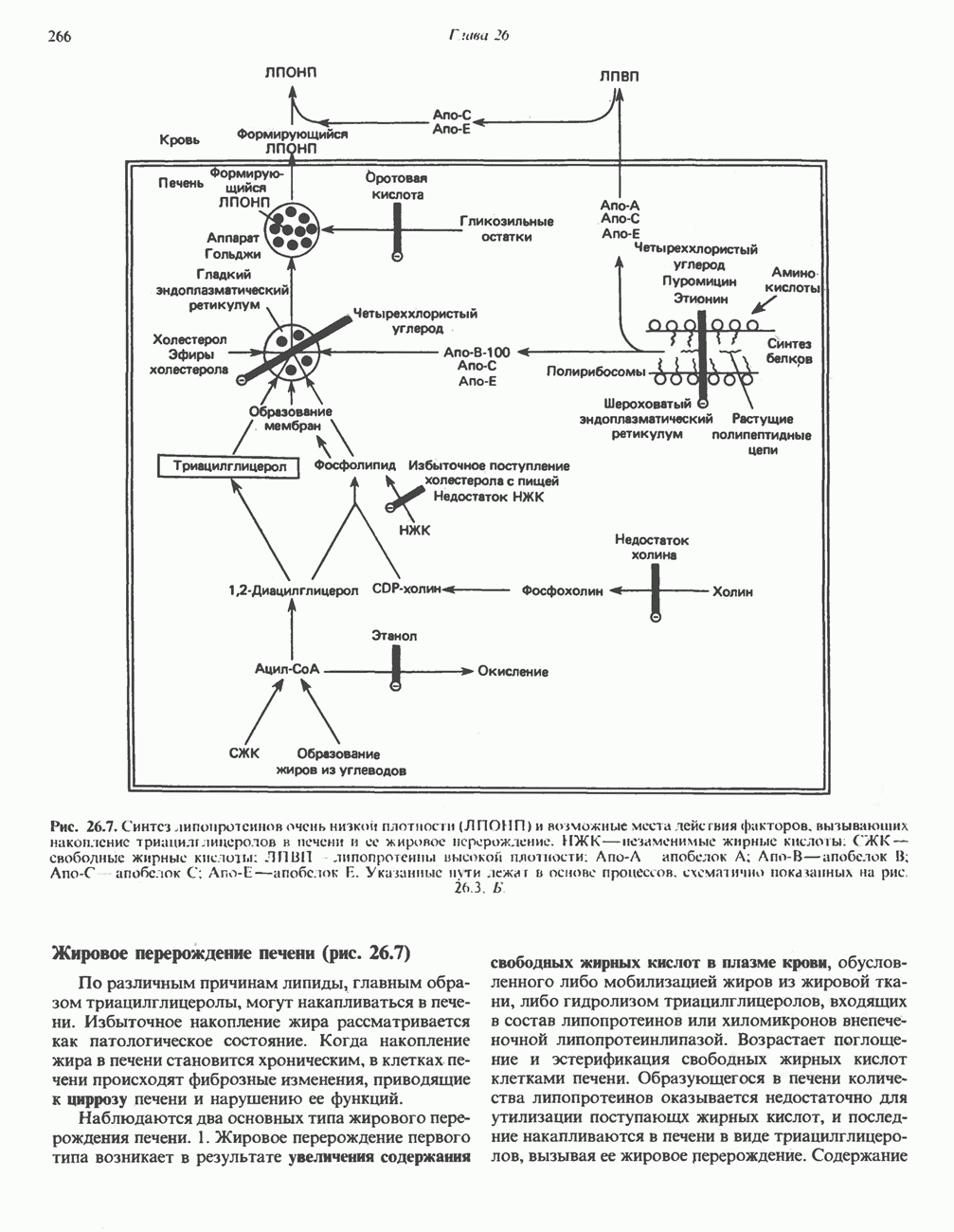
- РОЛЬ ПЕЧЕНИ В ТРАНСПОРТЕ И МЕТАБОЛИЗМЕ ЛИПИДОВ
- СИНТЕЗ ТРИАЦИЛГЛИЦЕРОЛОВ И ОБРАЗОВАНИЕ ЛПОНП (рис. 26.7)
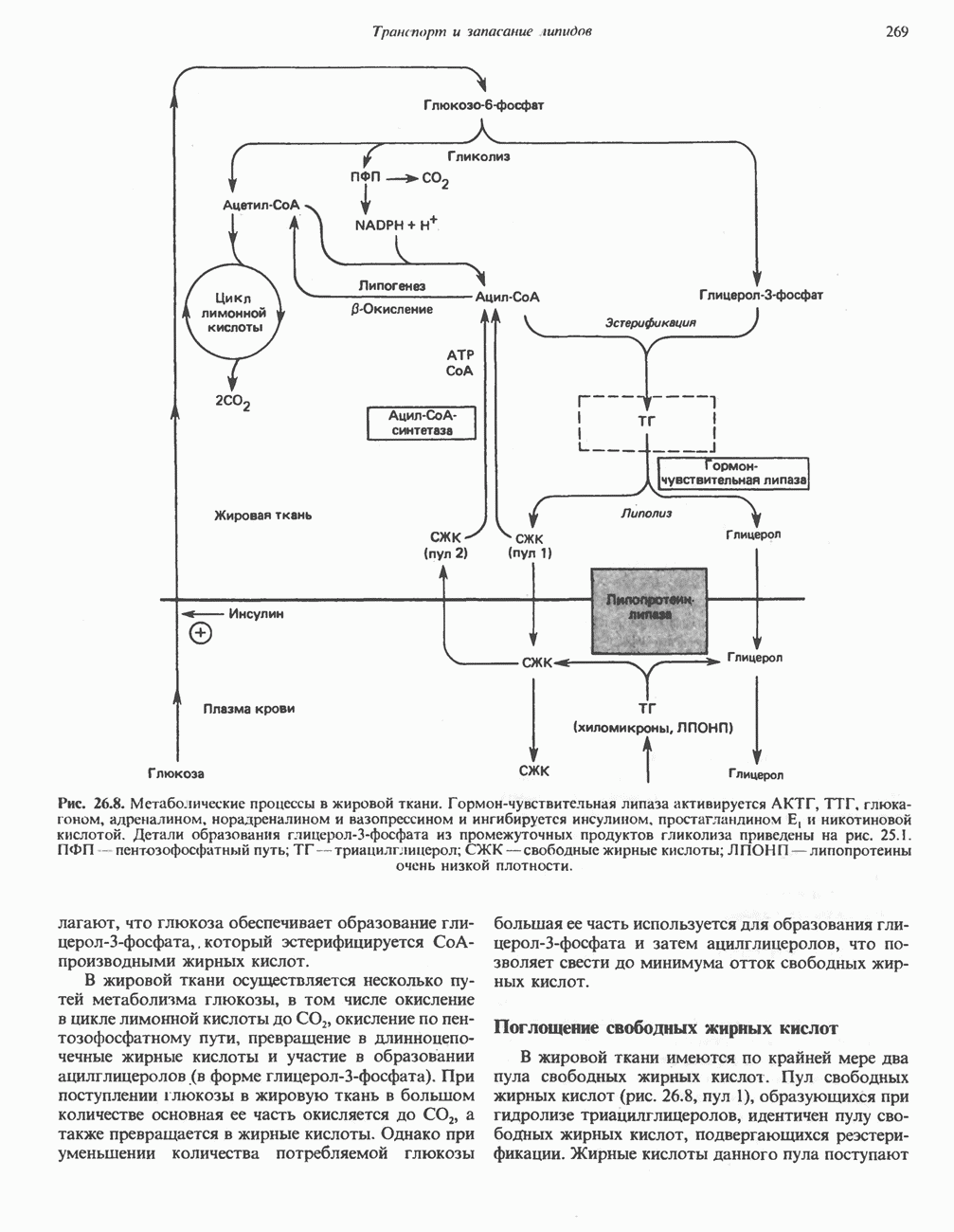
- МЕТАБОЛИЧЕСКИЕ ПРЕВРАЩЕНИЯ В ЖИРОВОЙ ТКАНИ И МОБИЛИЗАЦИЯ ЖИРОВ
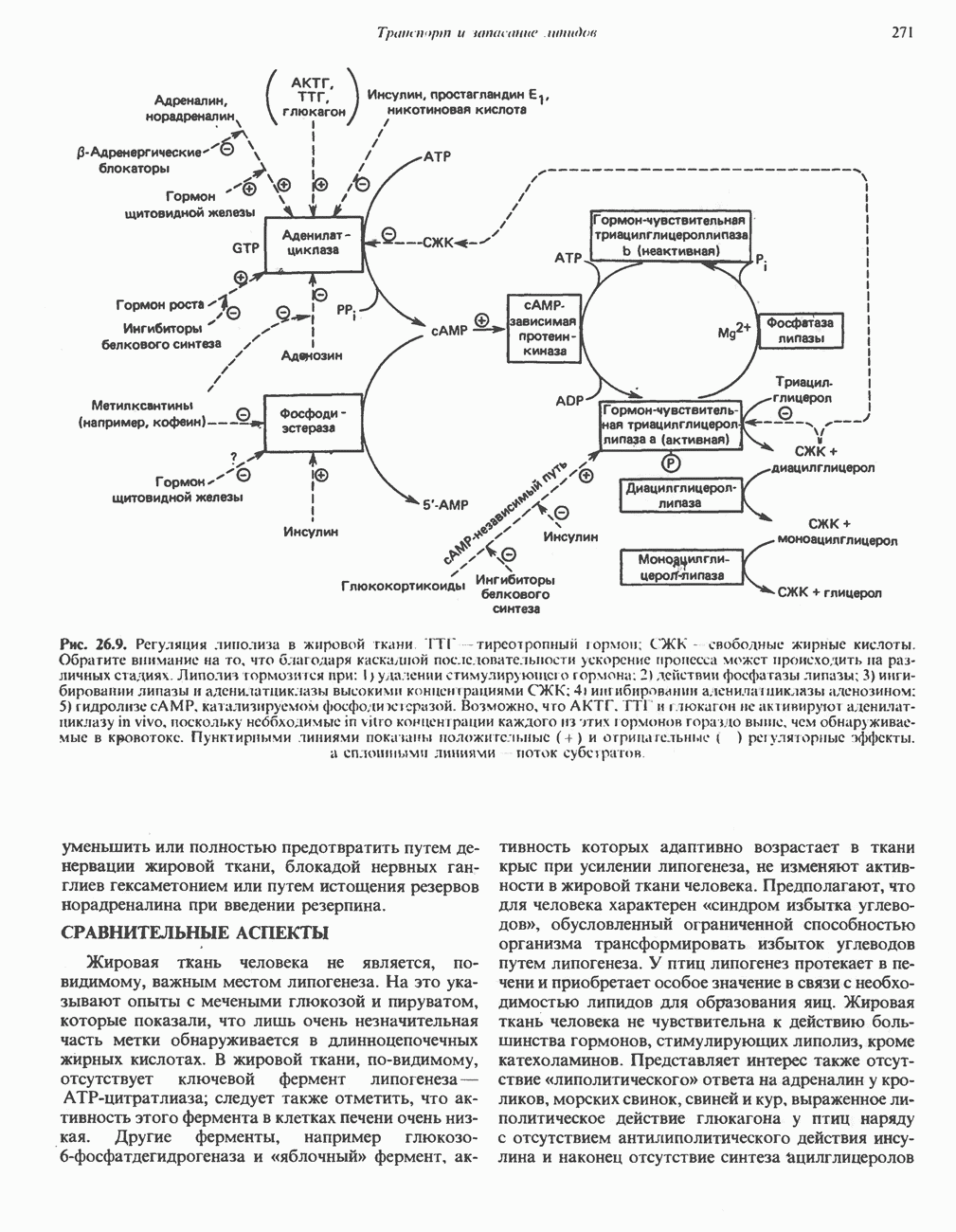
- РОЛЬ ГОРМОНОВ В МОБИЛИЗАЦИИ ЖИРОВ
- СРАВНИТЕЛЬНЫЕ АСПЕКТЫ
- РОЛЬ БУРОЙ ЖИРОВОЙ ТКАНИ В ТЕРМОГЕНЕЗЕ
- Глава 27. Синтез, транспорт и экскреция холестерола
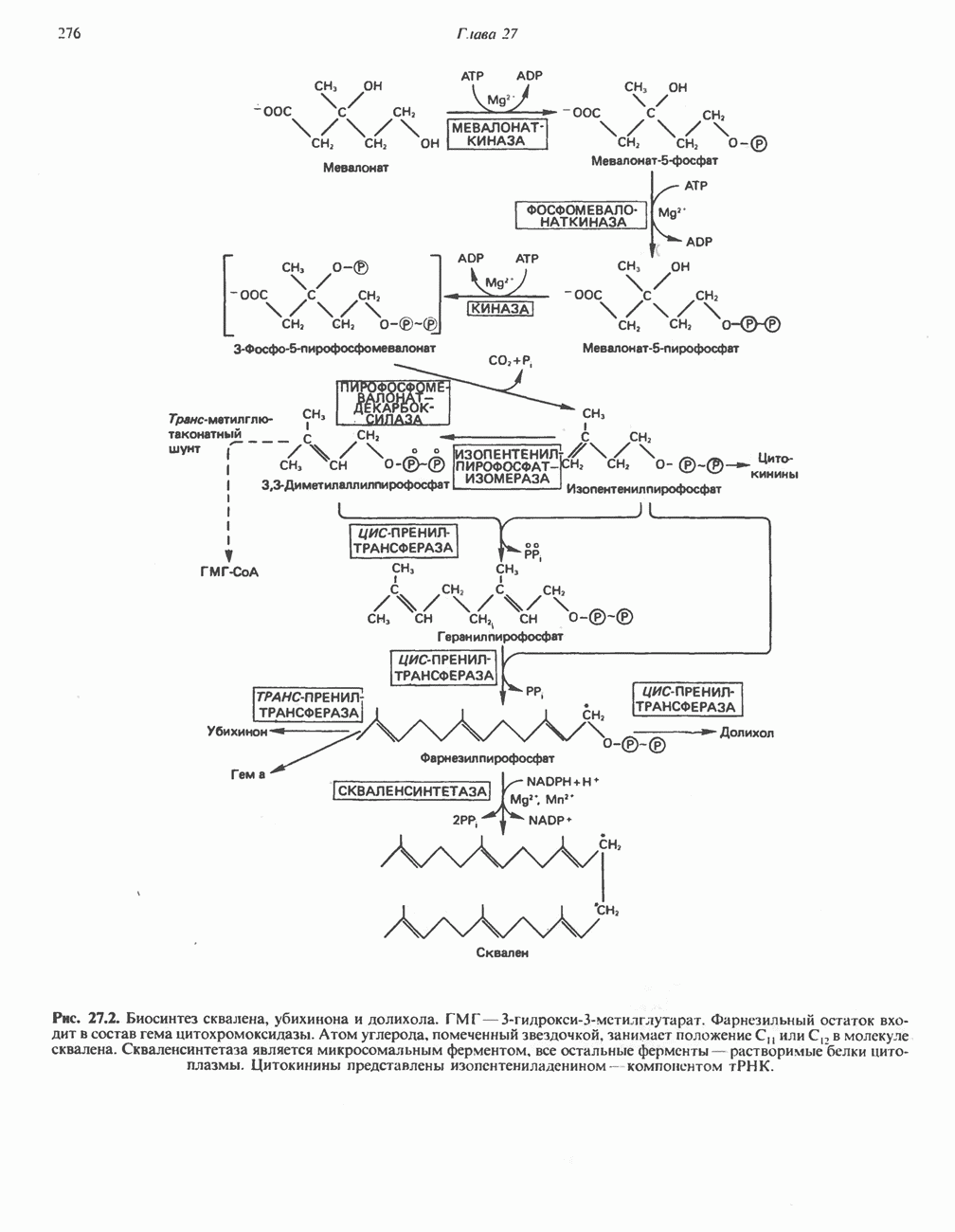
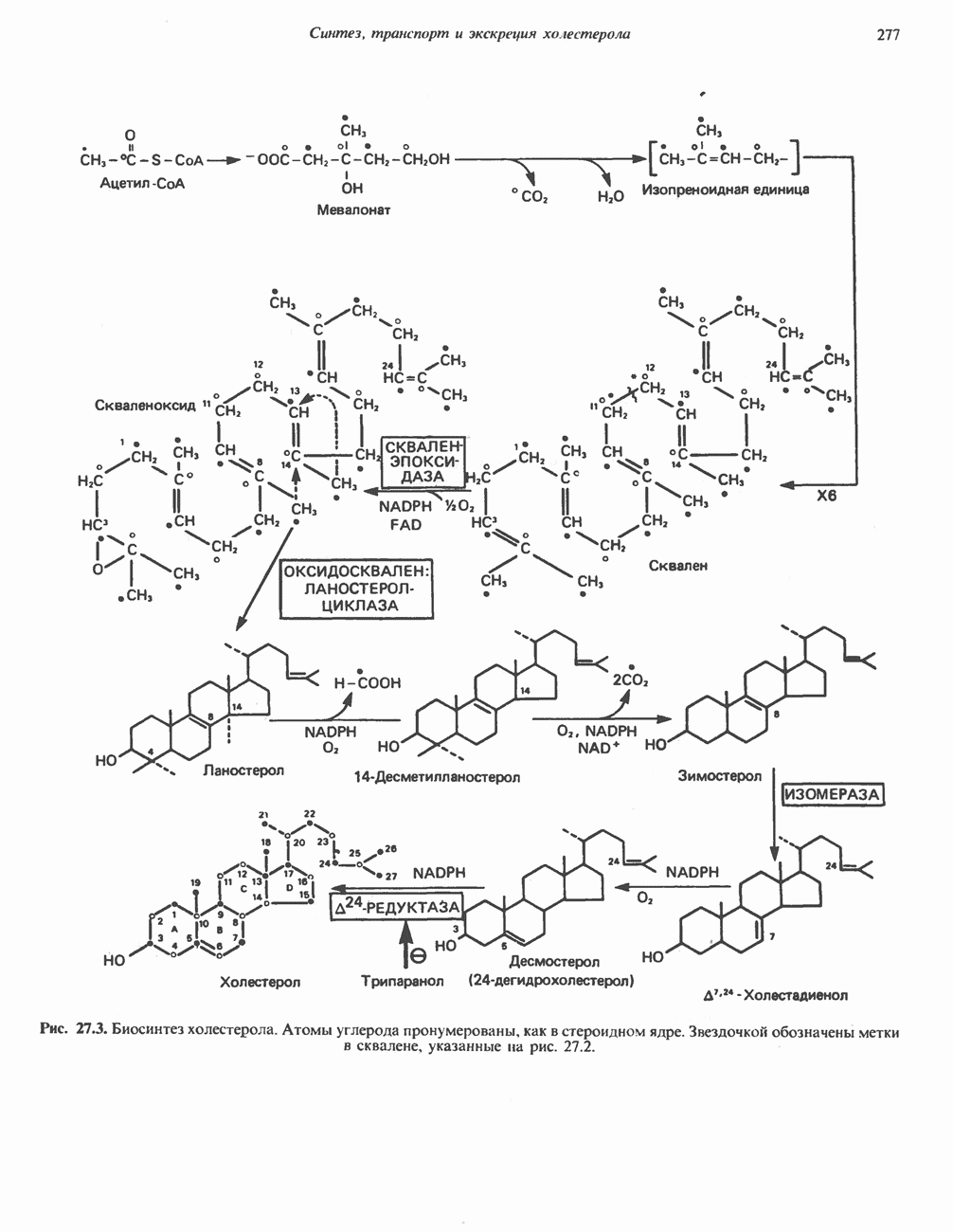
- БИОСИНТЕЗ ХОЛЕСТЕРОЛА
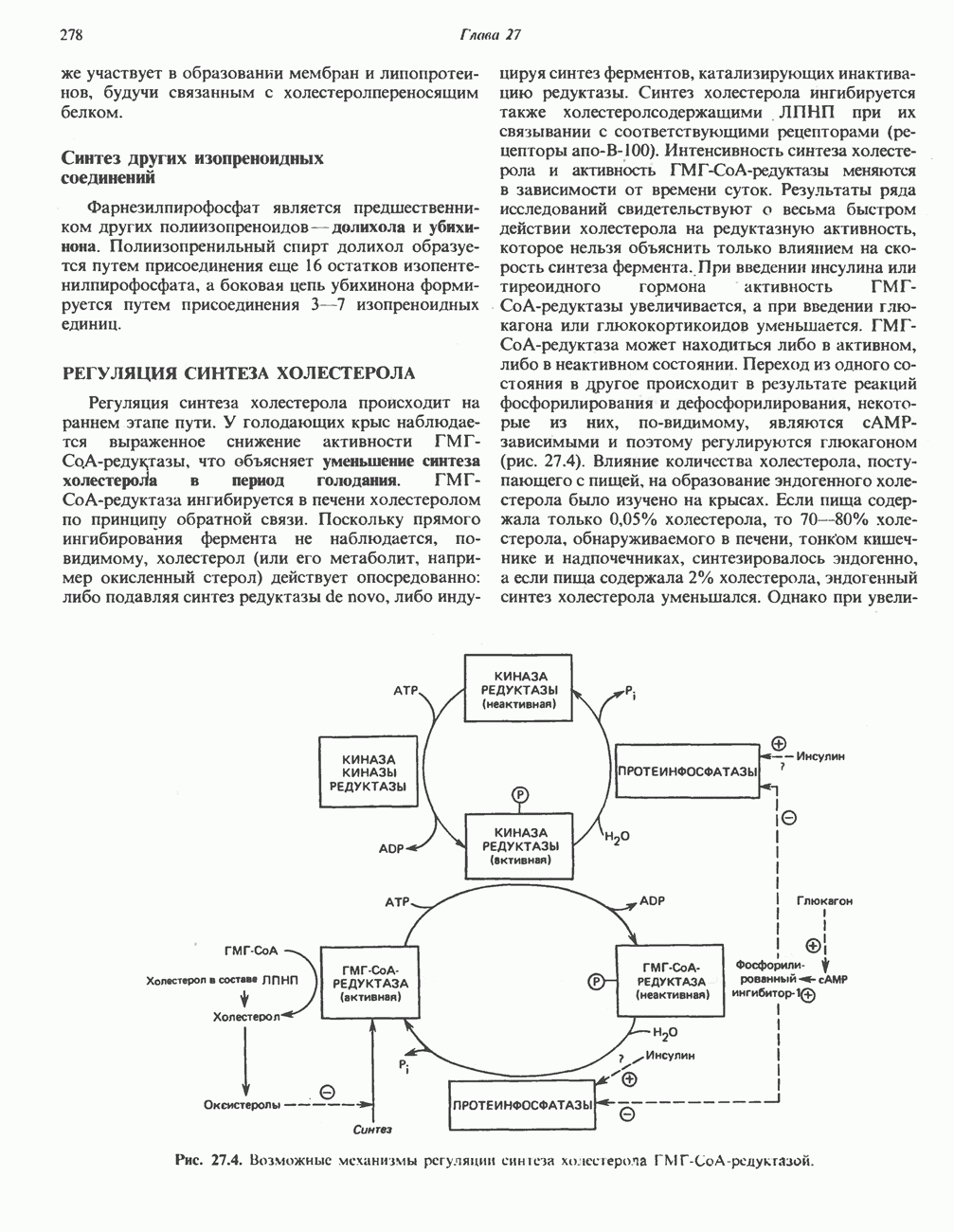
- РЕГУЛЯЦИЯ СИНТЕЗА ХОЛЕСТЕРОЛА
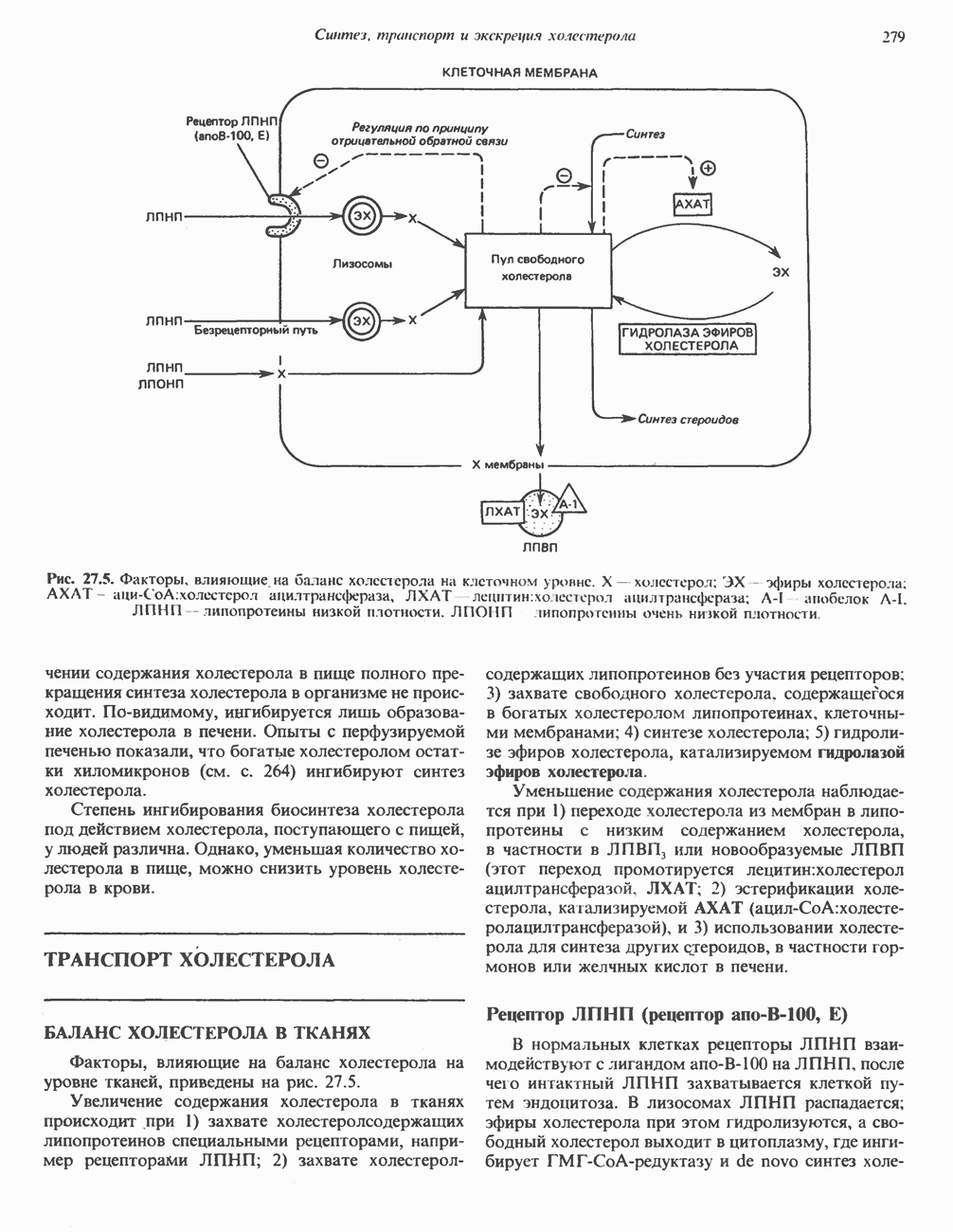
- ТРАНСПОРТ ХОЛЕСТЕРОЛА
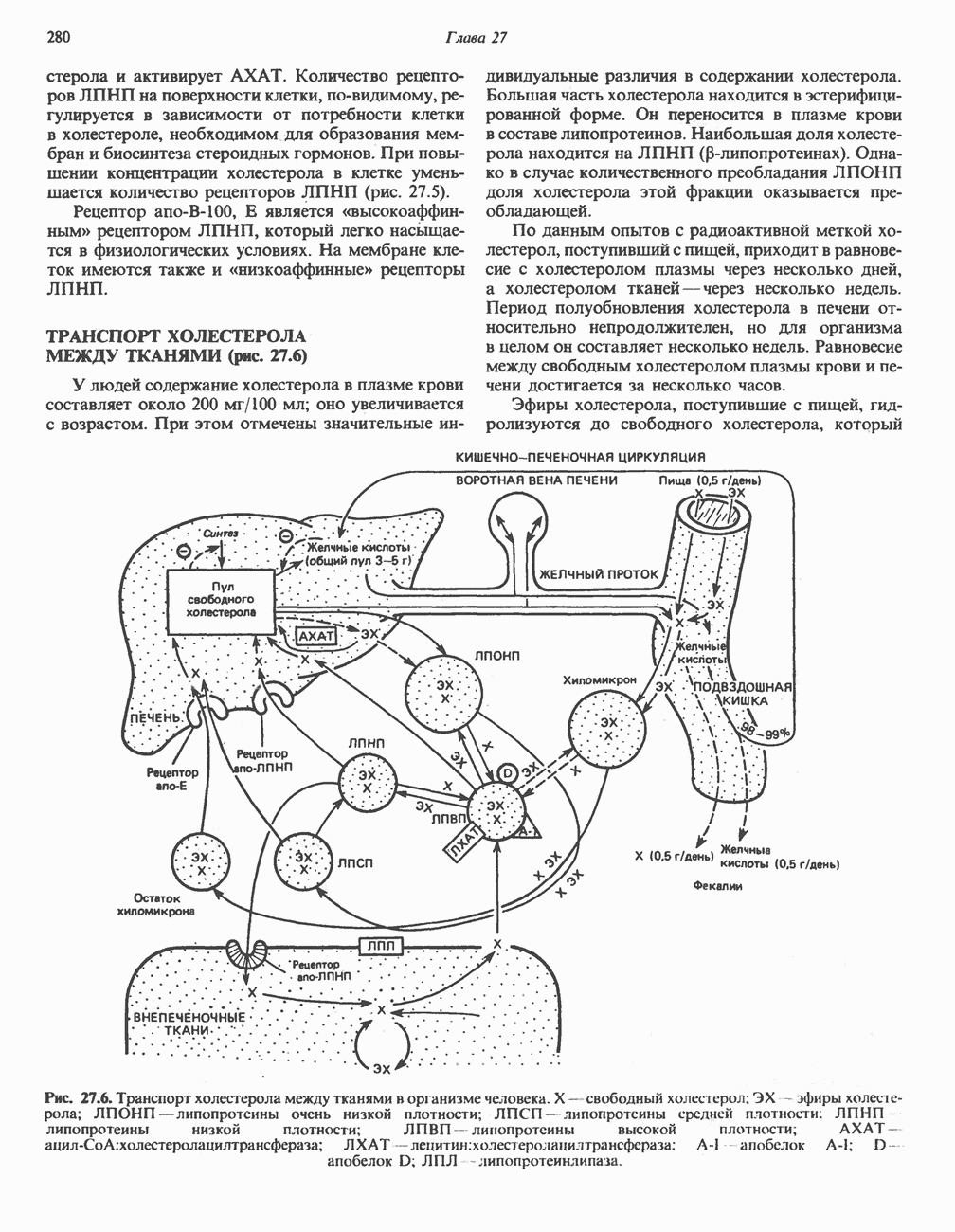
- ТРАНСПОРТ ХОЛЕСТЕРОЛА МЕЖДУ ТКАНЯМИ (рис. 27.6)
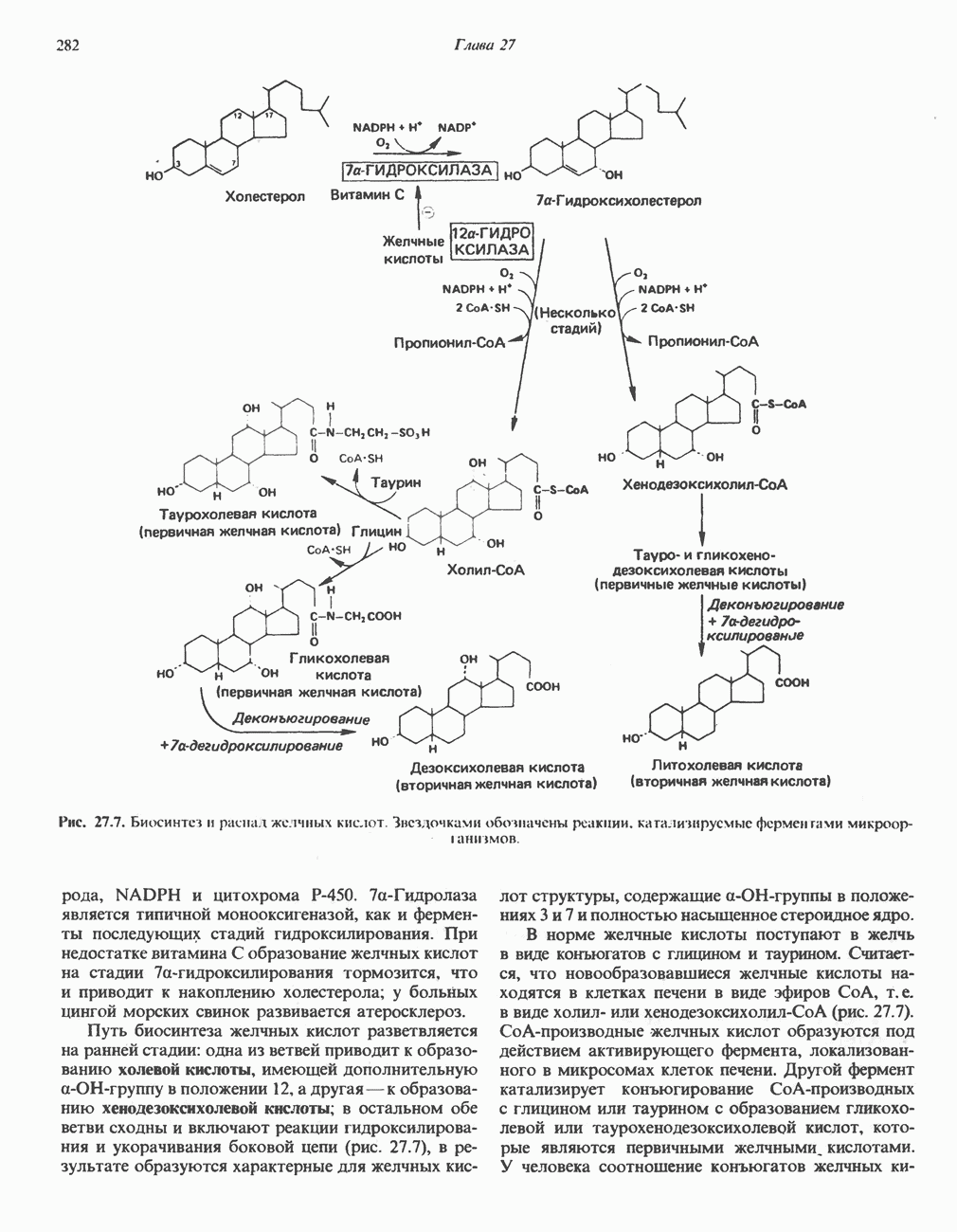
- ВЫВЕДЕНИЕ ХОЛЕСТЕРОЛА И ОБРАЗОВАНИЕ СОЛЕЙ ЖЕЛЧНЫХ КИСЛОТ
- КИШЕЧНО-ПЕЧЕНОЧНАЯ ЦИРКУЛЯЦИЯ ЖЕЛЧНЫХ КИСЛОТ
- КЛИНИЧЕСКИЕ АСПЕКТЫ
- Глава 28. Регуляция метаболизма липидов и источники энергии в тканях
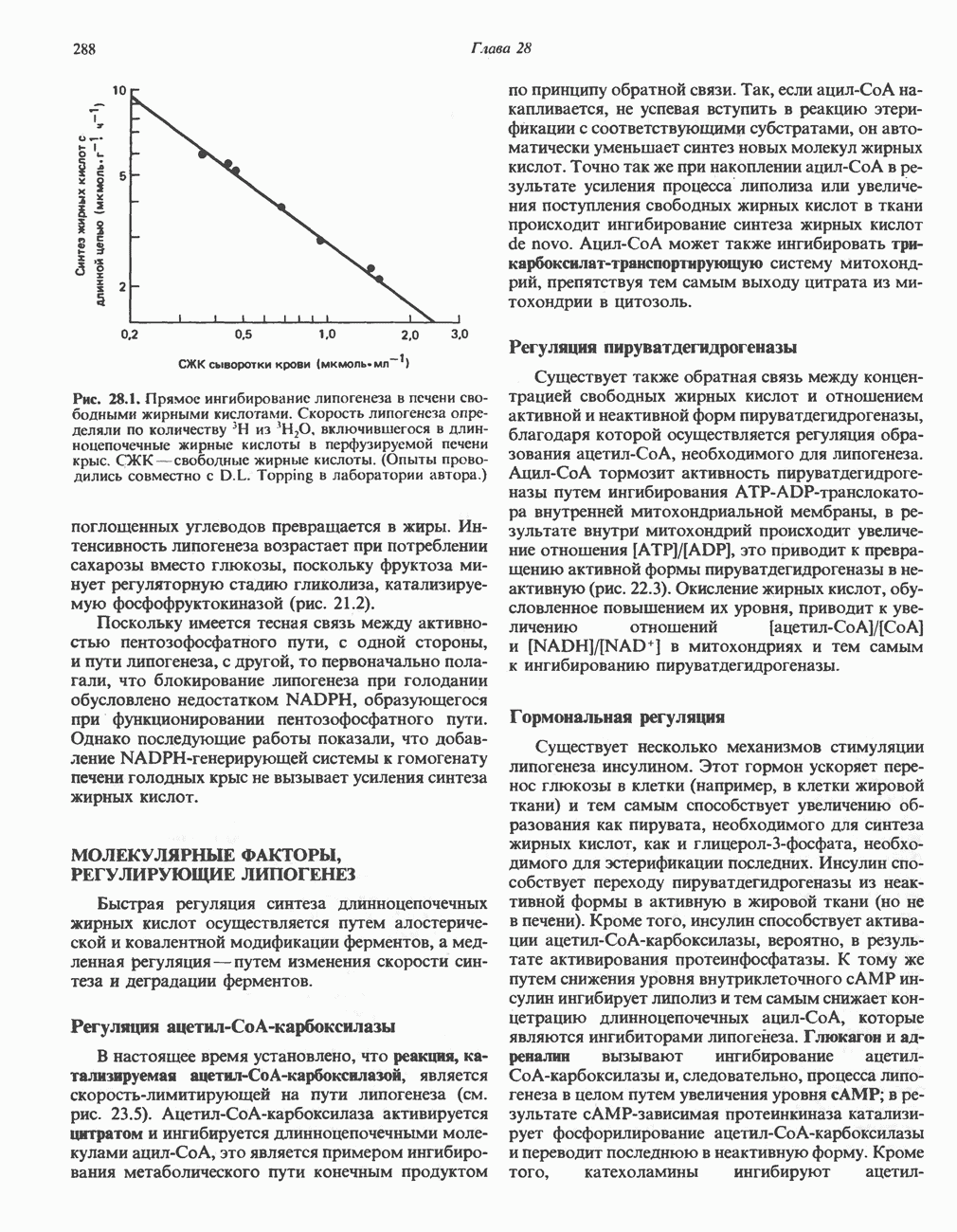
- РЕГУЛЯЦИЯ БИОСИНТЕЗА ЖИРНЫХ КИСЛОТ (ЛИПОГЕНЕЗА)
- МОЛЕКУЛЯРНЫЕ ФАКТОРЫ, РЕГУЛИРУЮЩИЕ ЛИПОГЕНЕЗ
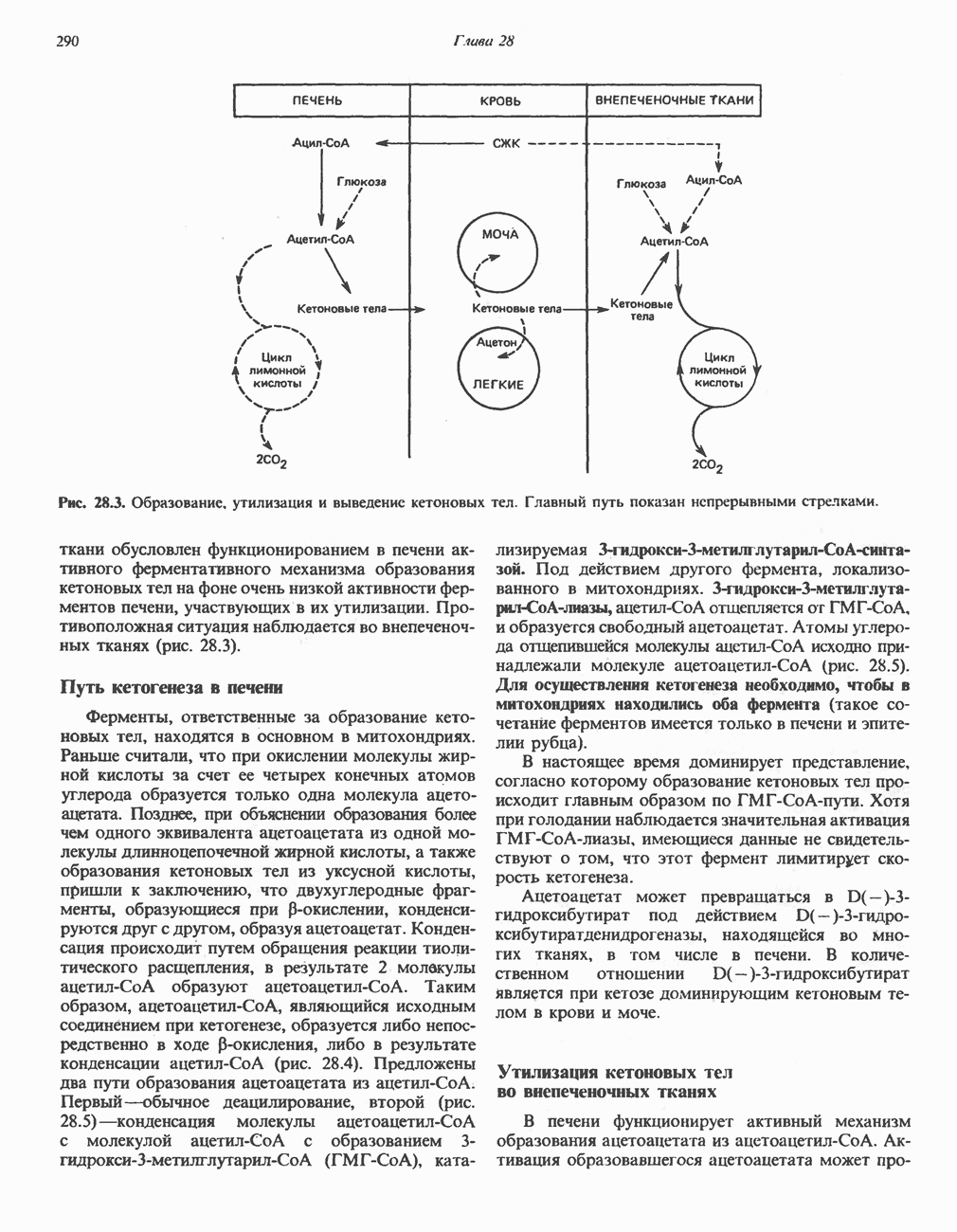
- РЕГУЛЯЦИЯ ОКИСЛЕНИЯ ЖИРНЫХ КИСЛОТ
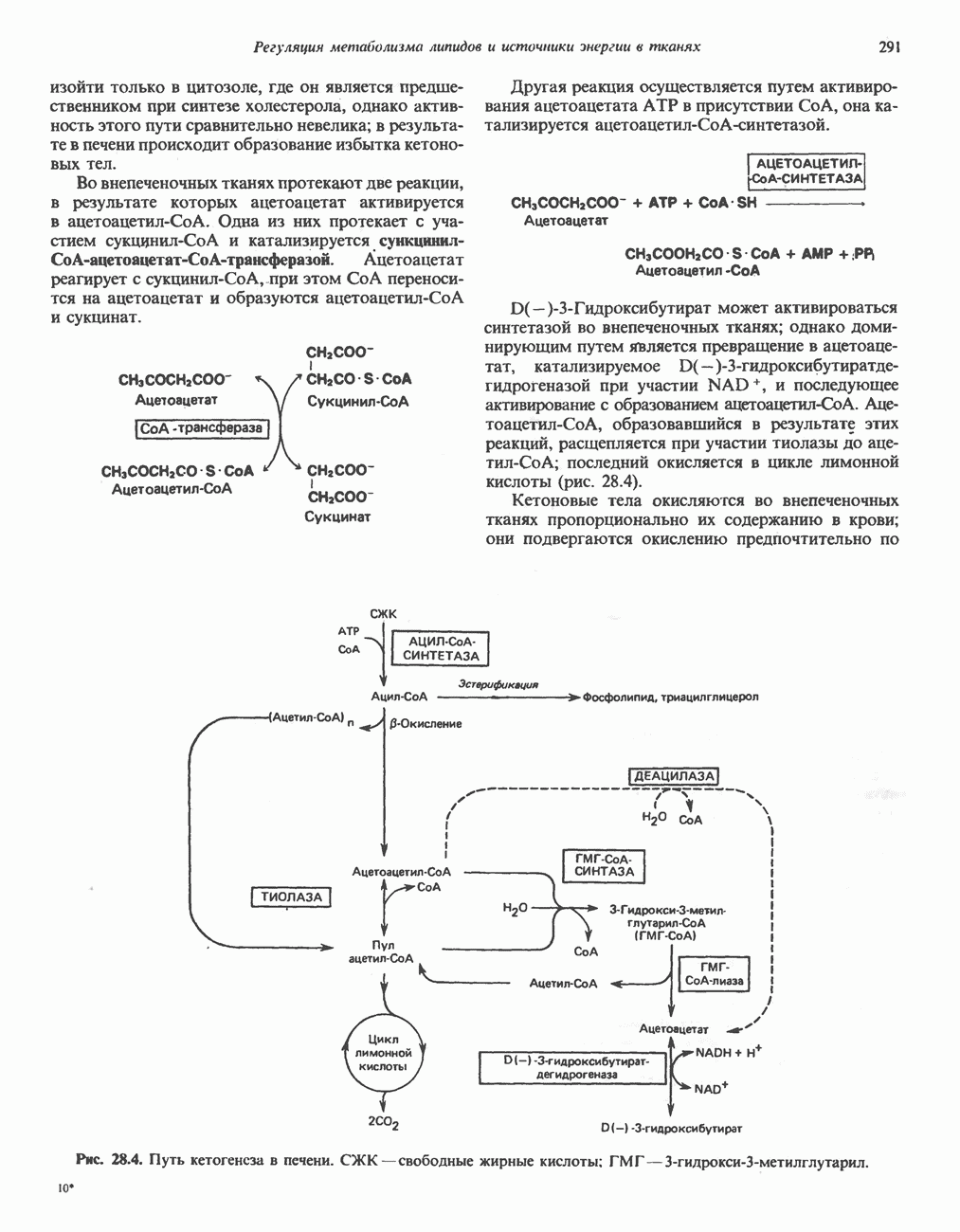
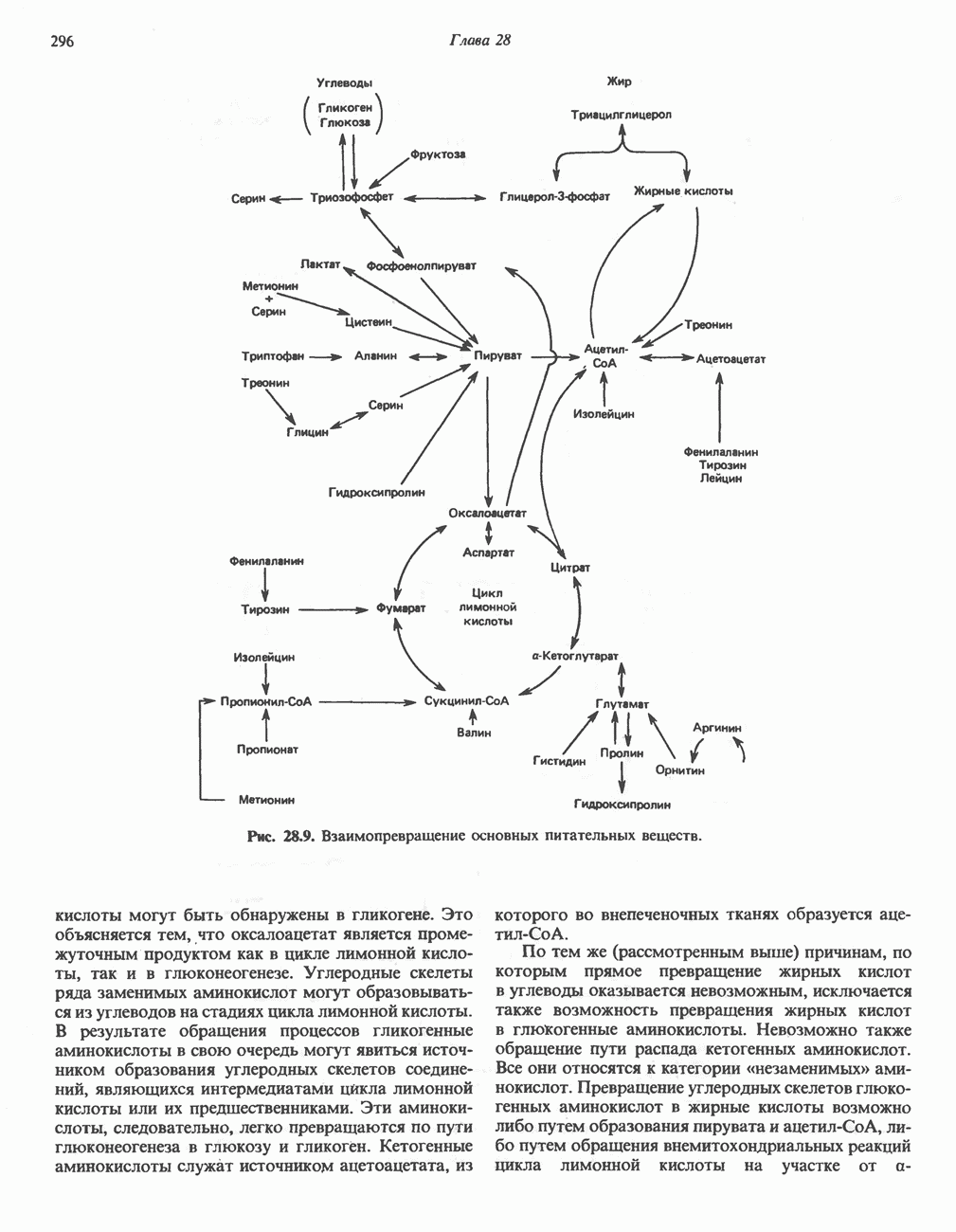
- ВЗАИМНОЕ ПРЕВРАЩЕНИЕ ОСНОВНЫХ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ (рис. 28.9)
- ЭКОНОМИКА УГЛЕВОДНОГО И ЛИПИДНОГО ОБМЕНА В ОРГАНИЗМЕ
- ГОЛОДАНИЕ
- Раздел III. Метаболизм белков и аминокислот
- Глава 29. Биосинтез аминокислот
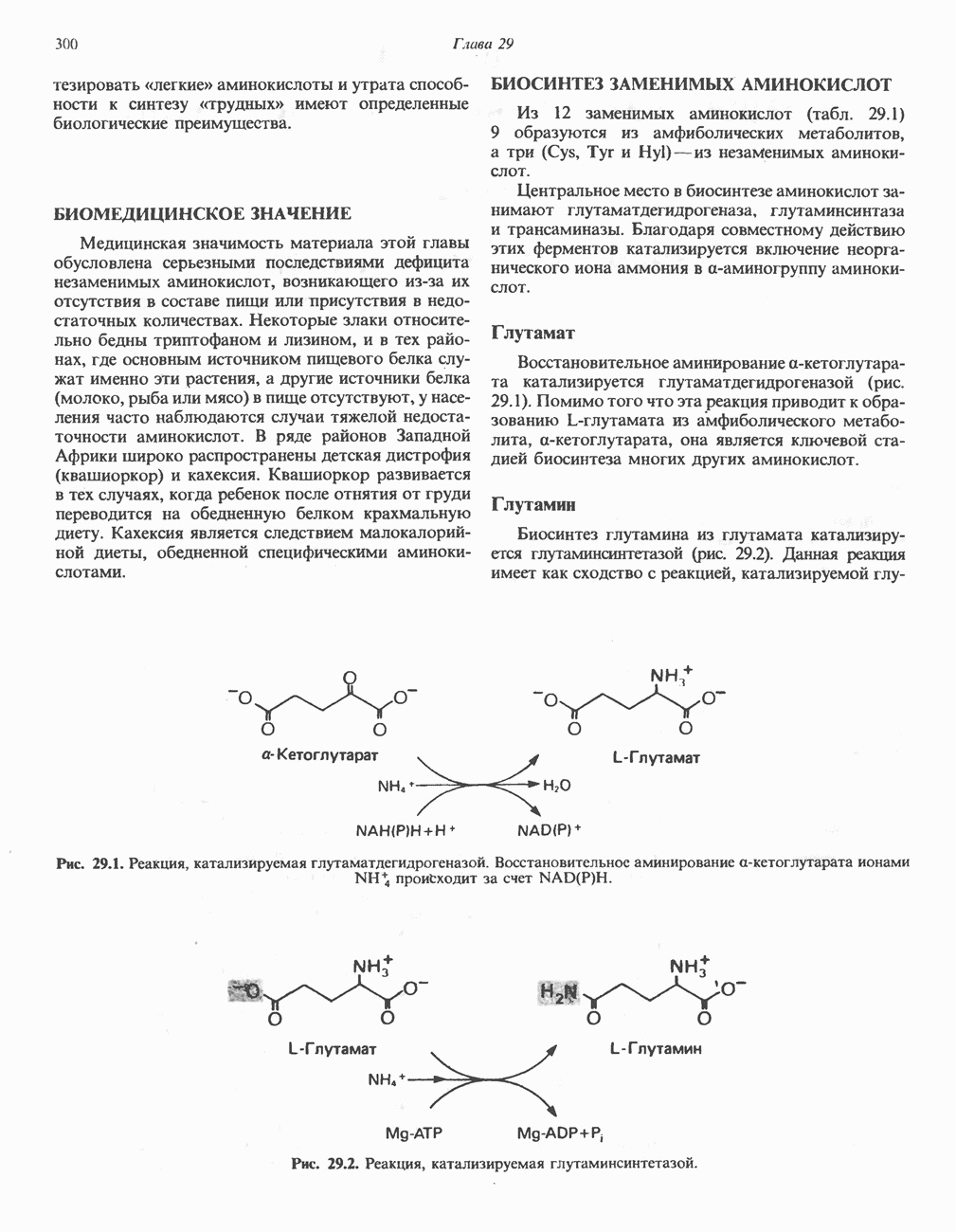
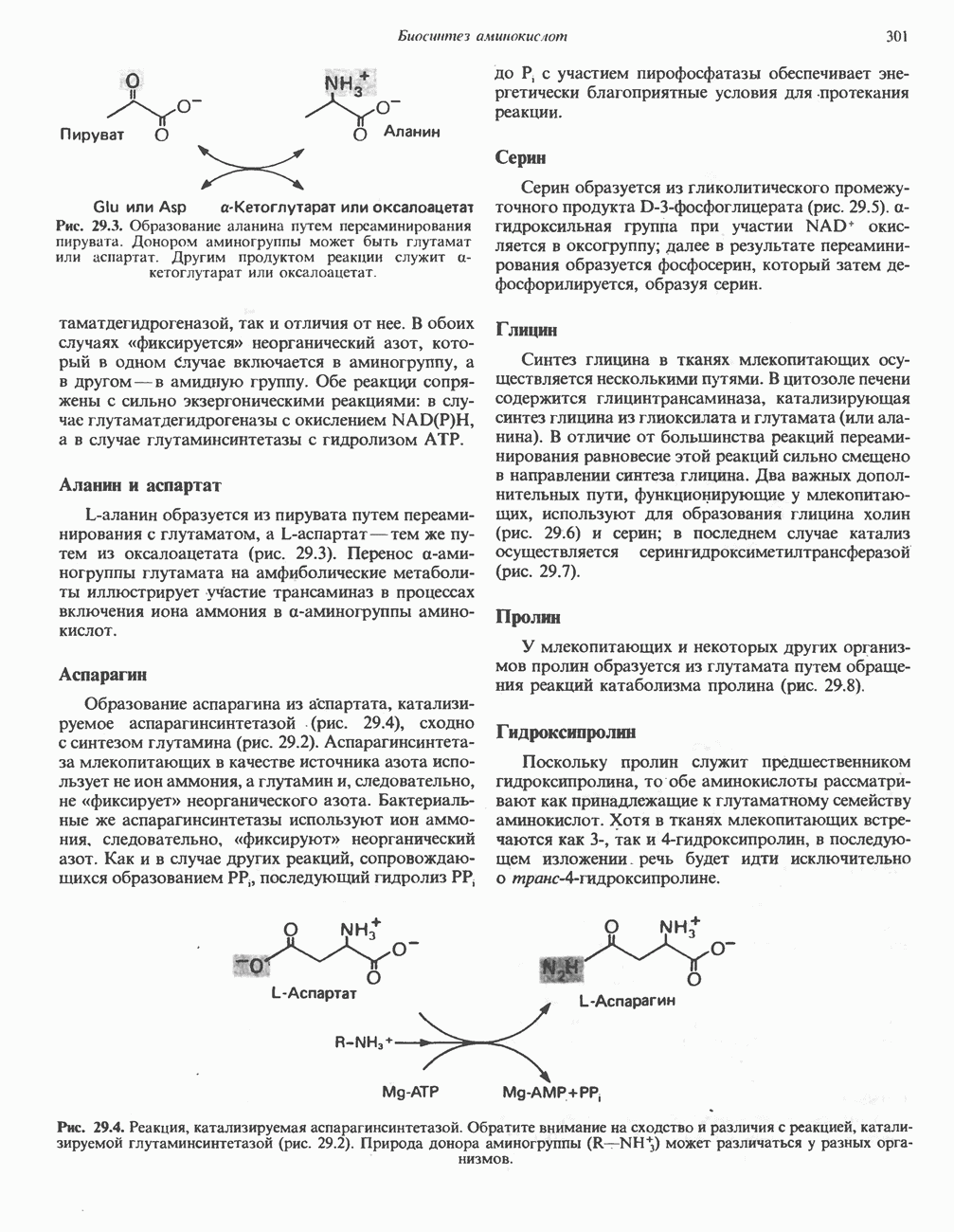
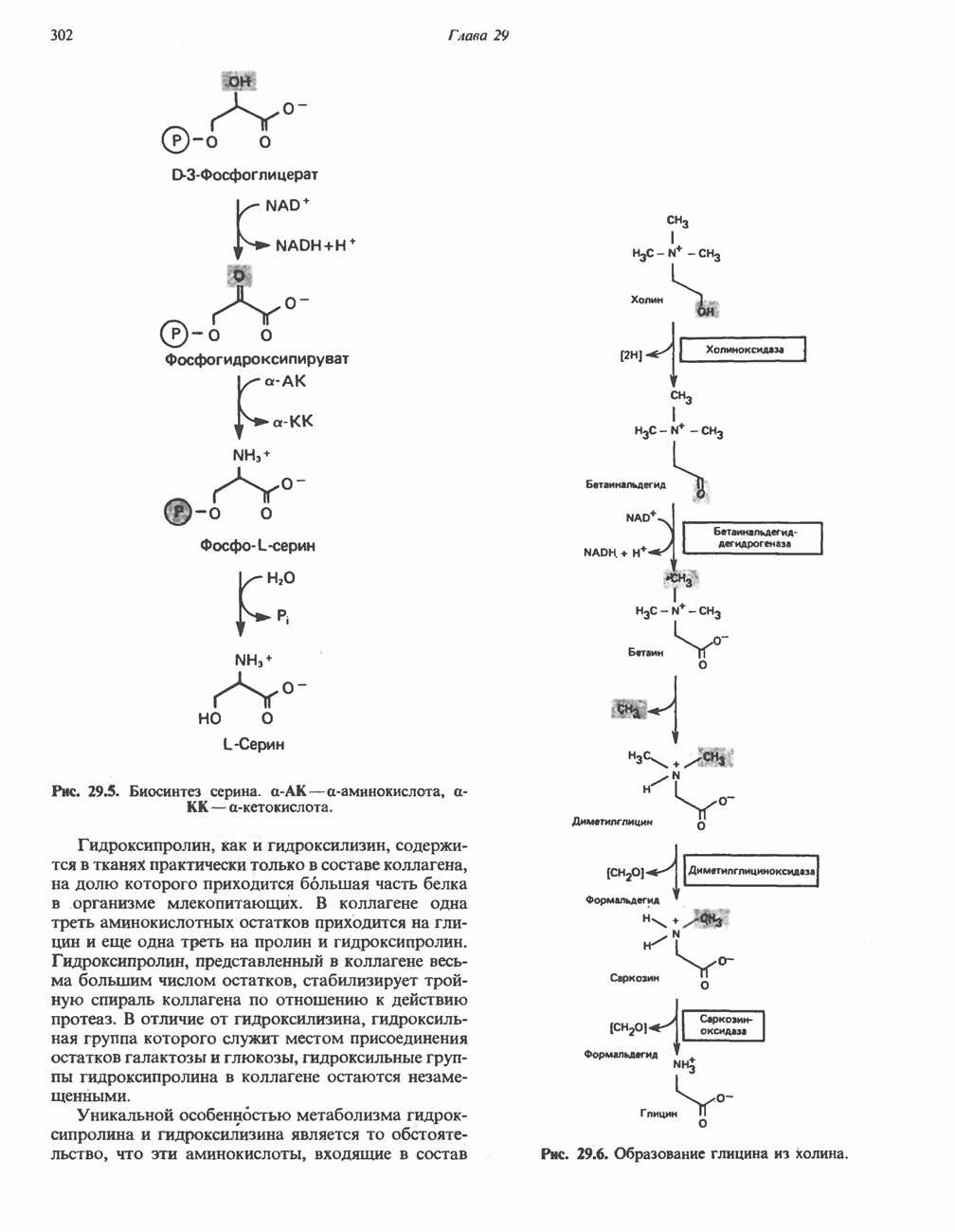
- БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ
- БИОСИНТЕЗ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ
- Глава 30. Катаболизм азота аминокислот
- ПЕРЕАМИНИРОВАНИЕ
- ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ
- ОБРАЗОВАНИЕ АММИАКА
- ТРАНСПОРТ АММИАКА
- ОБМЕН АМИНОКИСЛОТАМИ МЕЖДУ ОРГАНАМИ В ПОСТАБСОРБТИВНОМ СОСТОЯНИИ
- ОБМЕН АМИНОКИСЛОТ МЕЖДУ ОРГАНАМИ ПОСЛЕ ПРИЕМА ПИЩИ
- БИОСИНТЕЗ МОЧЕВИНЫ
- РЕГУЛЯЦИЯ СИНТЕЗА МОЧЕВИНЫ
- МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ ЦИКЛА МОЧЕВИНЫ
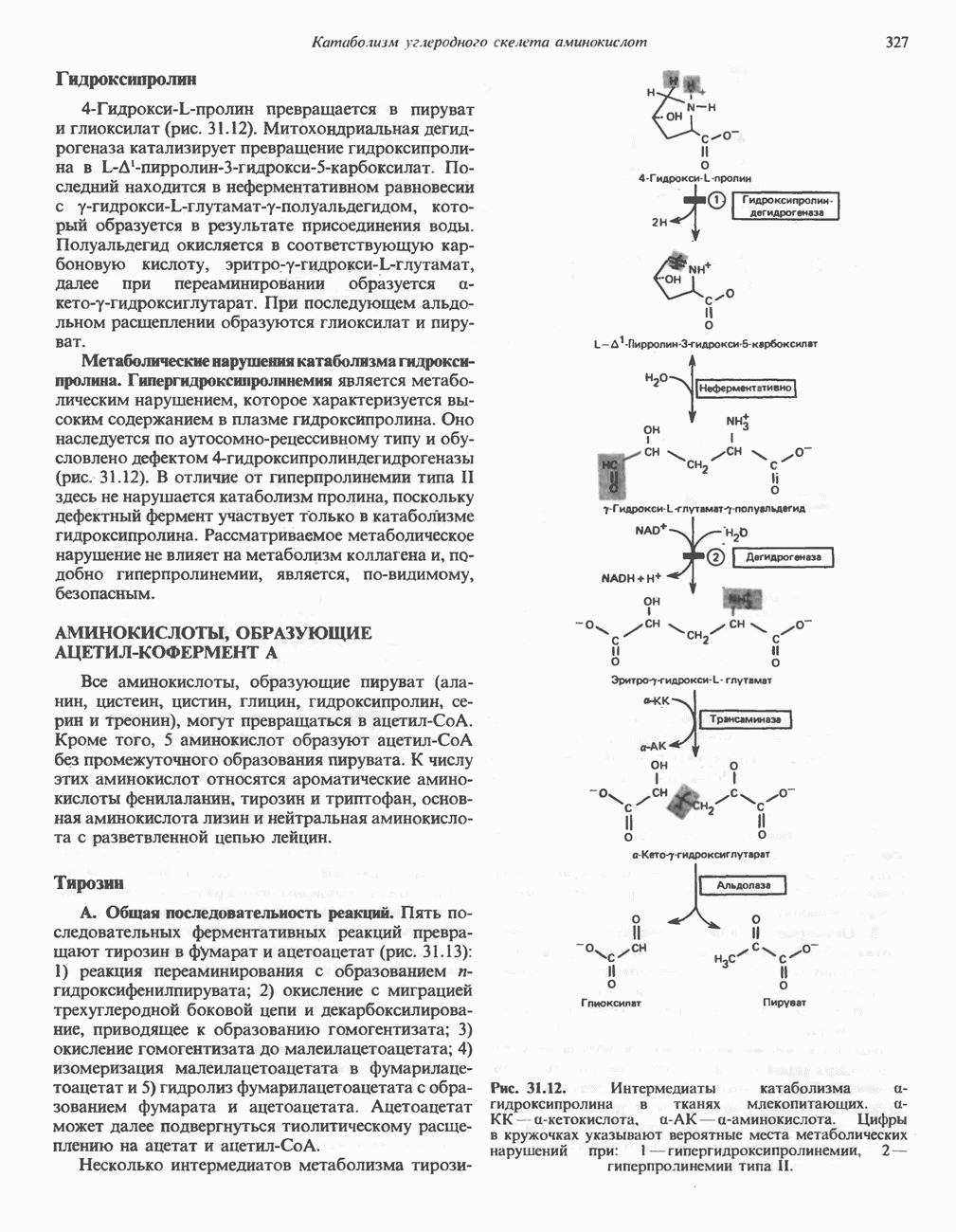
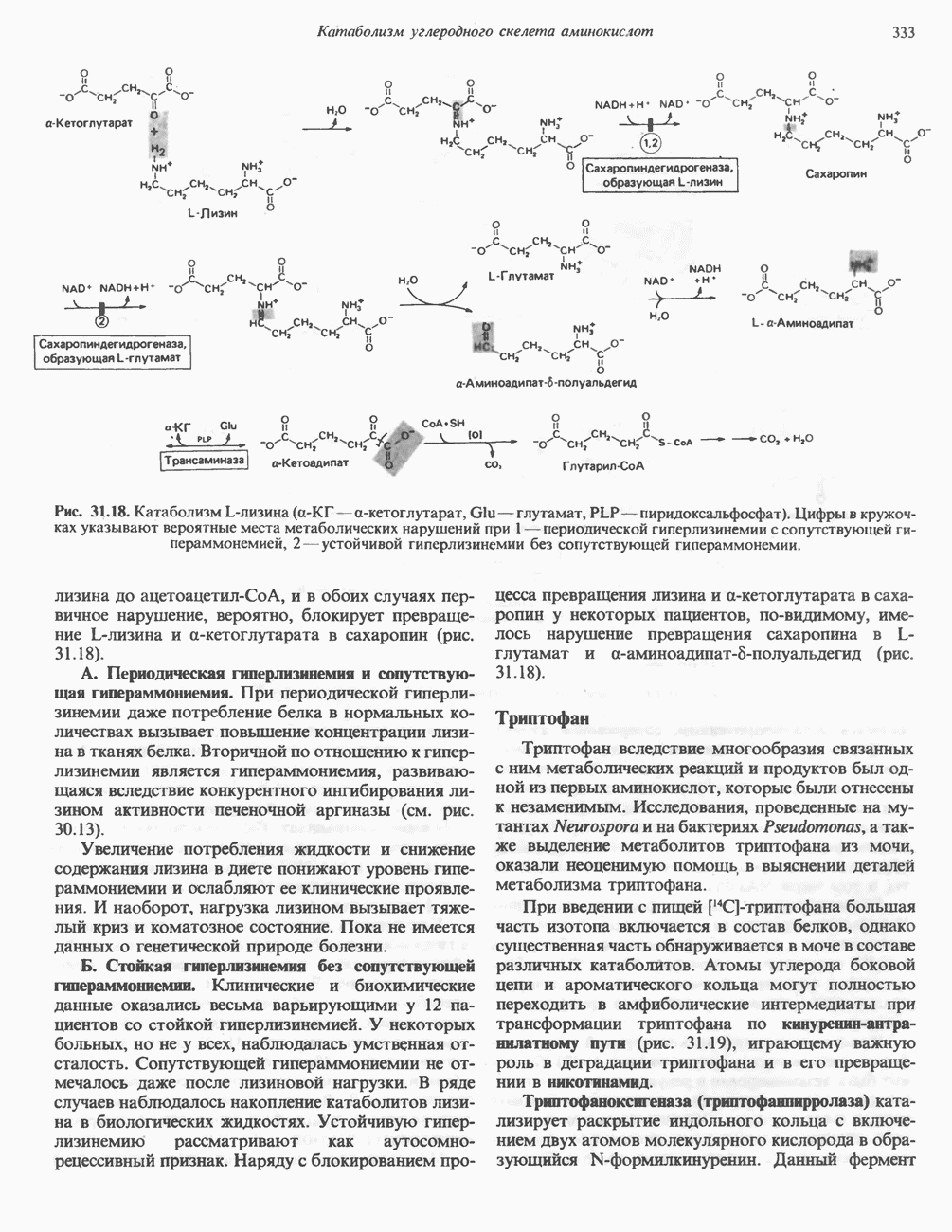
- Глава 31. Катаболизм углеродного скелета аминокислот
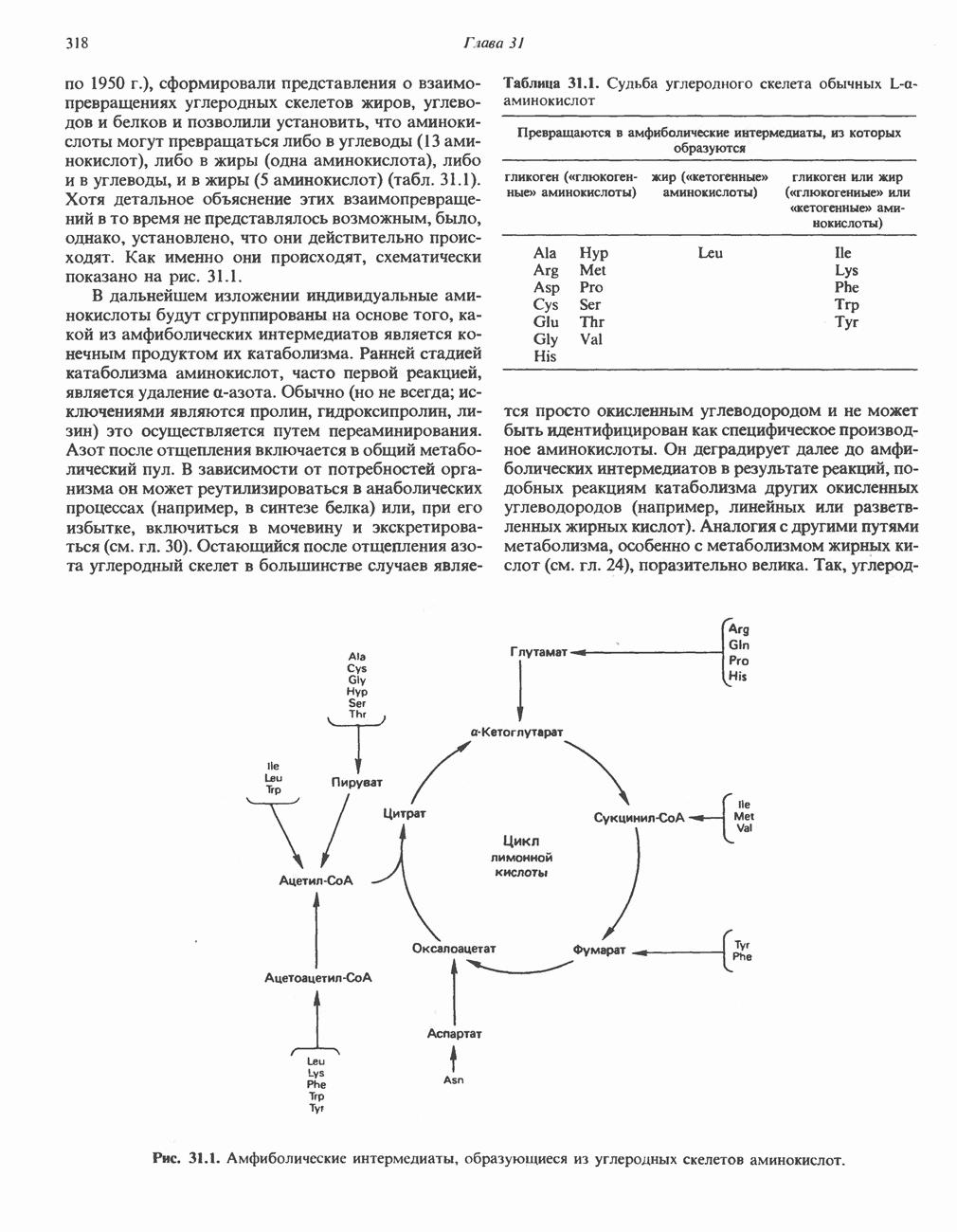
- ПРЕВРАЩЕНИЕ УГЛЕРОДНОГО СКЕЛЕТА ОБЫЧНЫХ L-a-АМИНОКИСЛОТ В АМФИБОЛИЧЕСКИЕ ИНТЕРМЕДИАТЫ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ОКСАЛОАЦЕТАТ
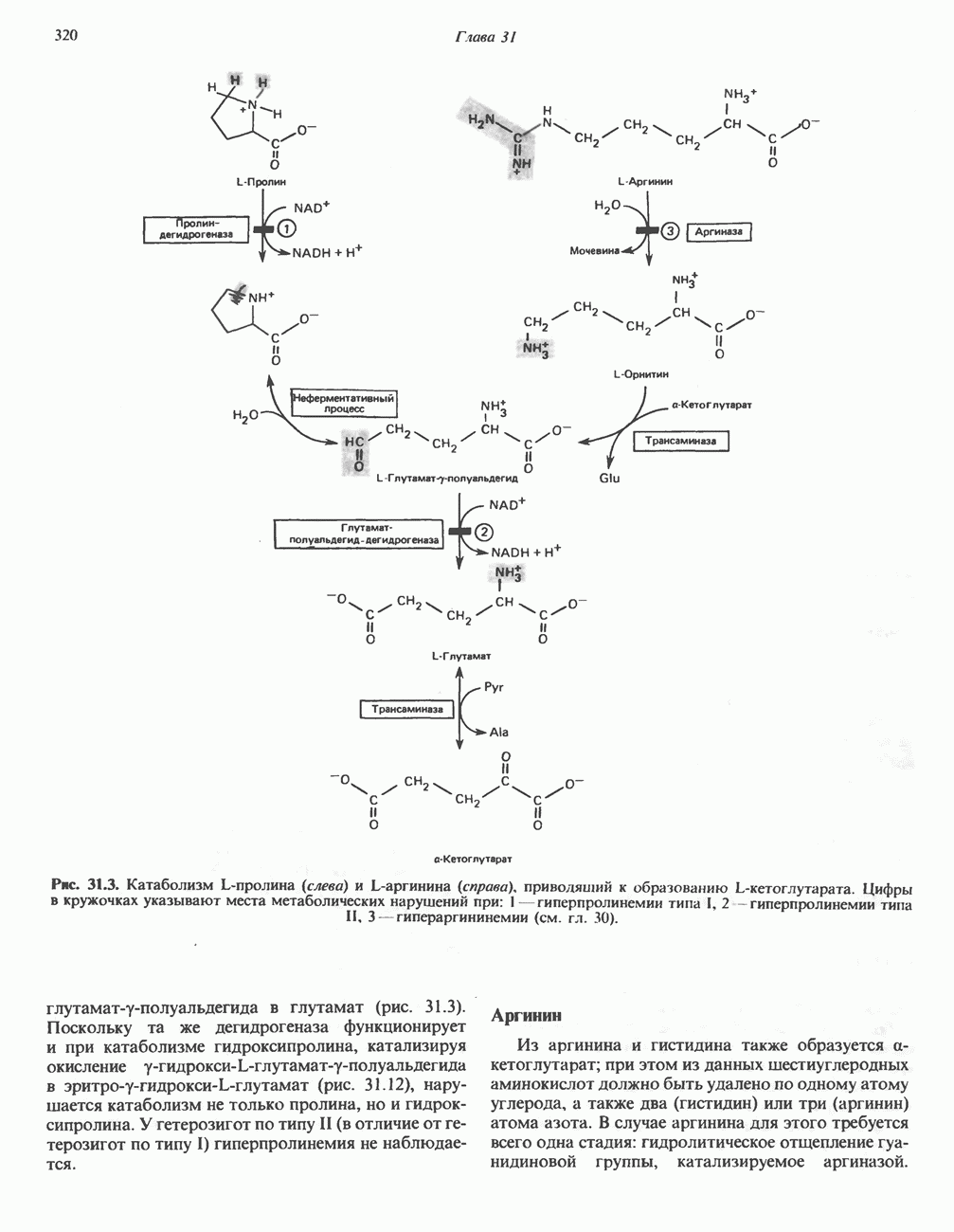
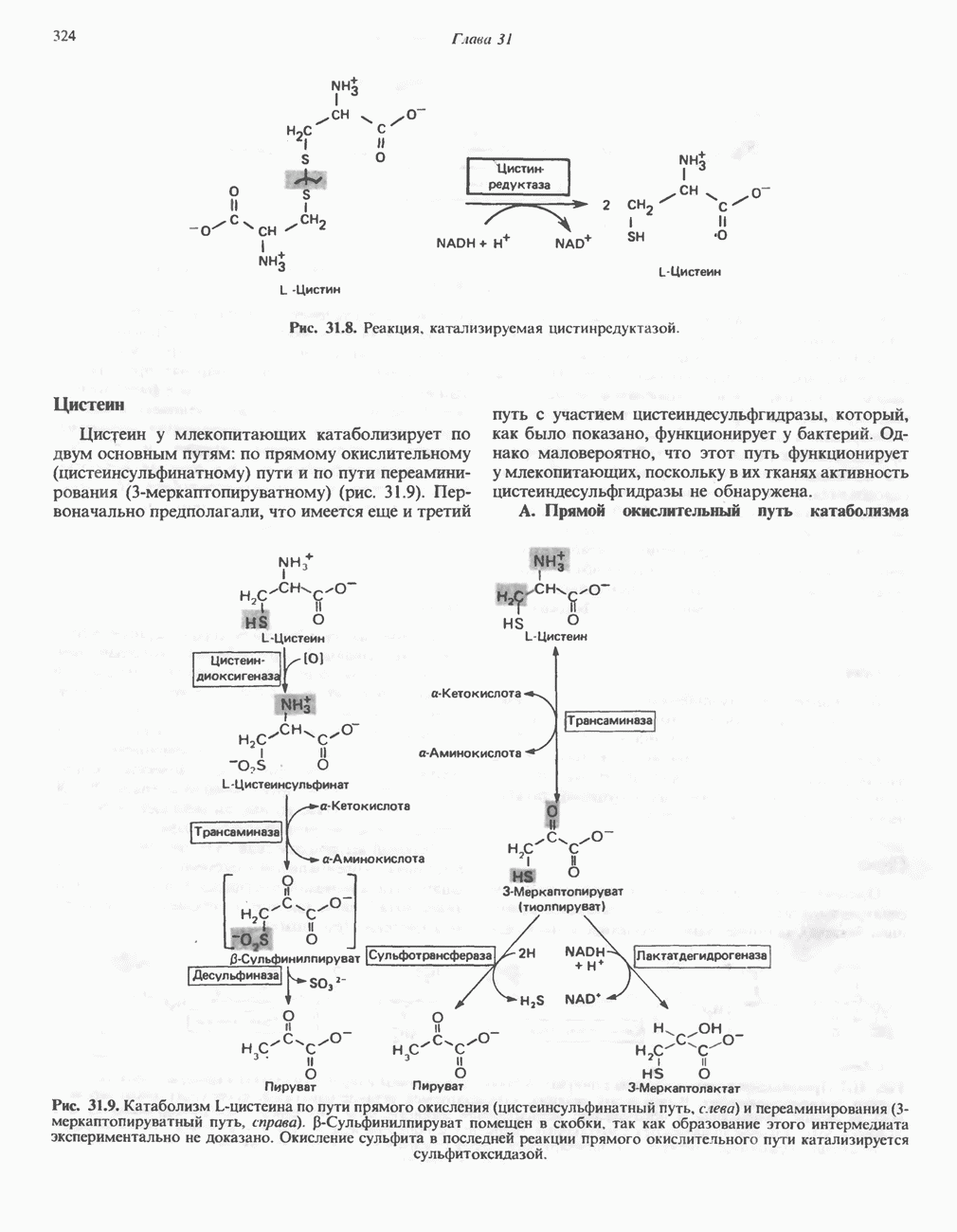
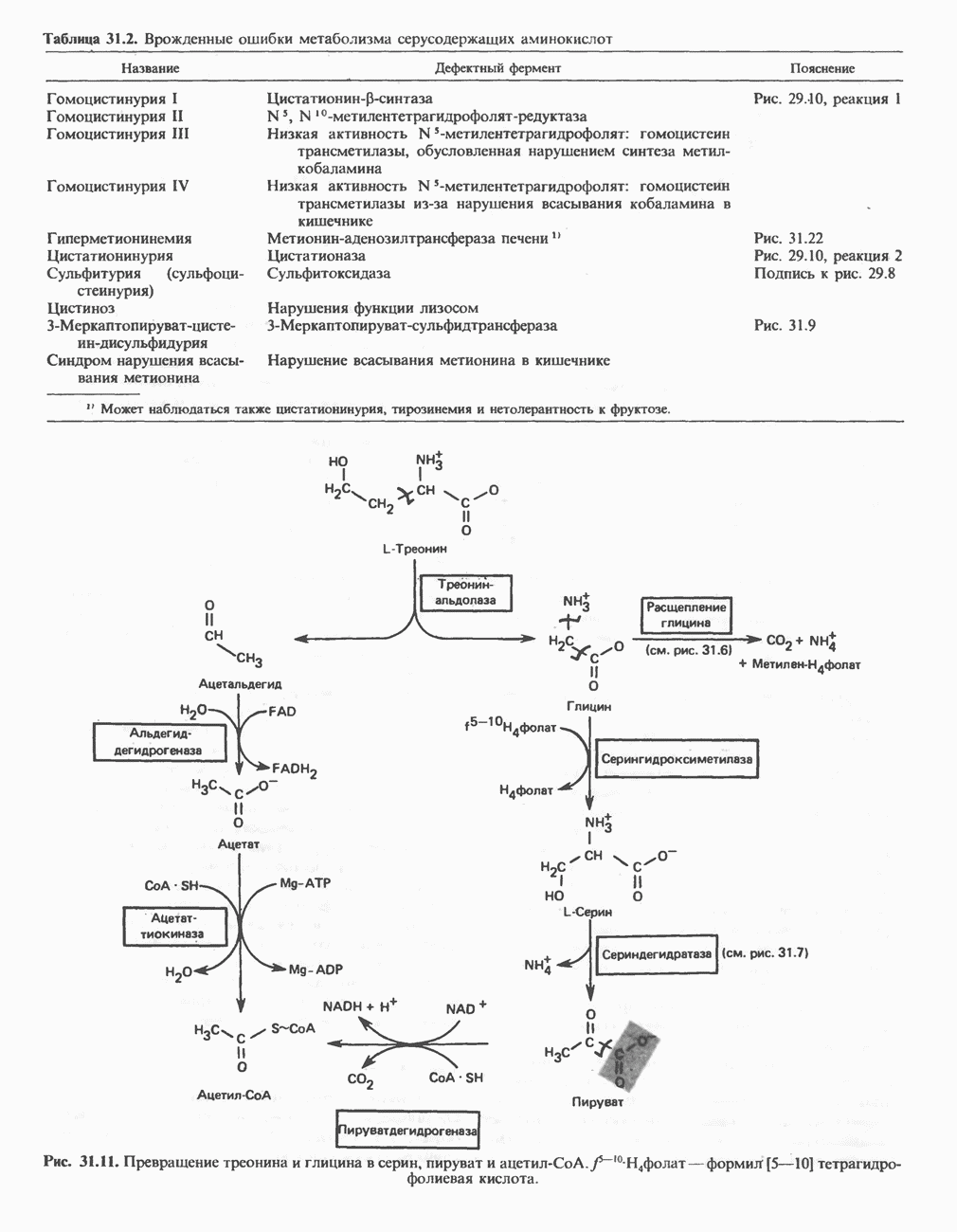
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ а-КЕТОГЛУТАРАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ПИРУВАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ АЦЕТИЛ-КОФЕРМЕНТ А
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ СУКЦИНИЛ-КОФЕРМЕНТ А
- Глава 32. Превращение аминокислот в специализированные продукты
- ГЛИЦИН
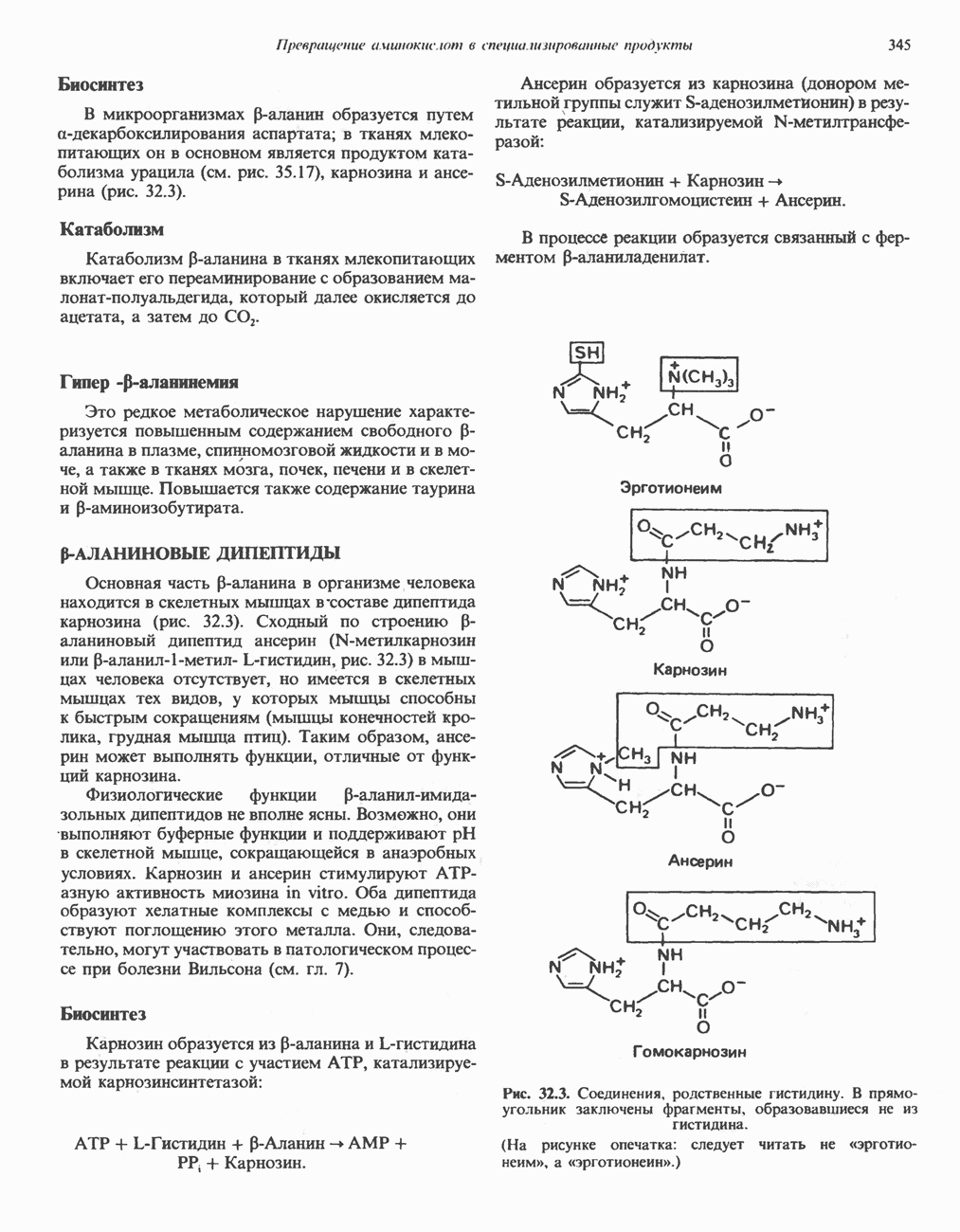
- р-АЛАНИНОВЫЕ ДИПЕПТИДЫ
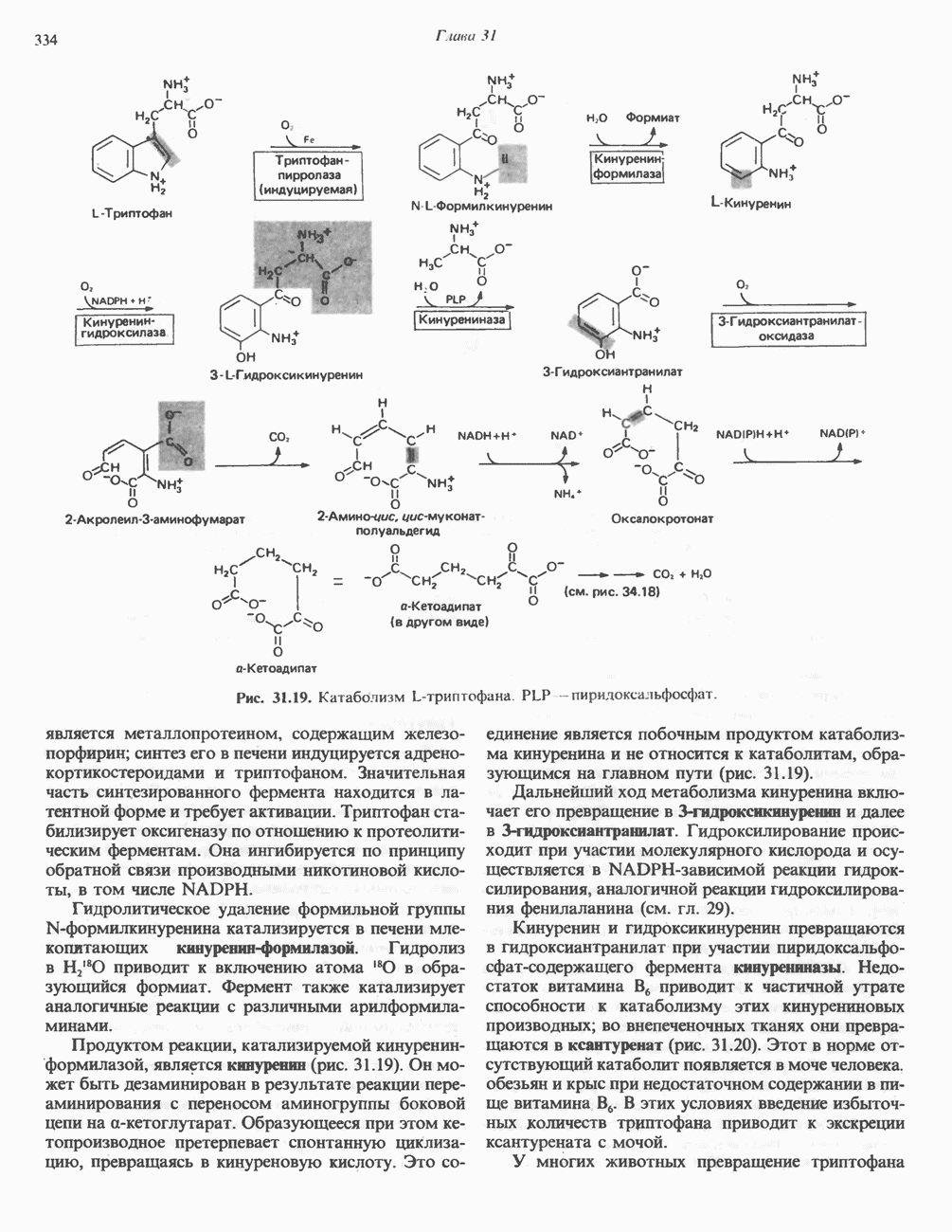
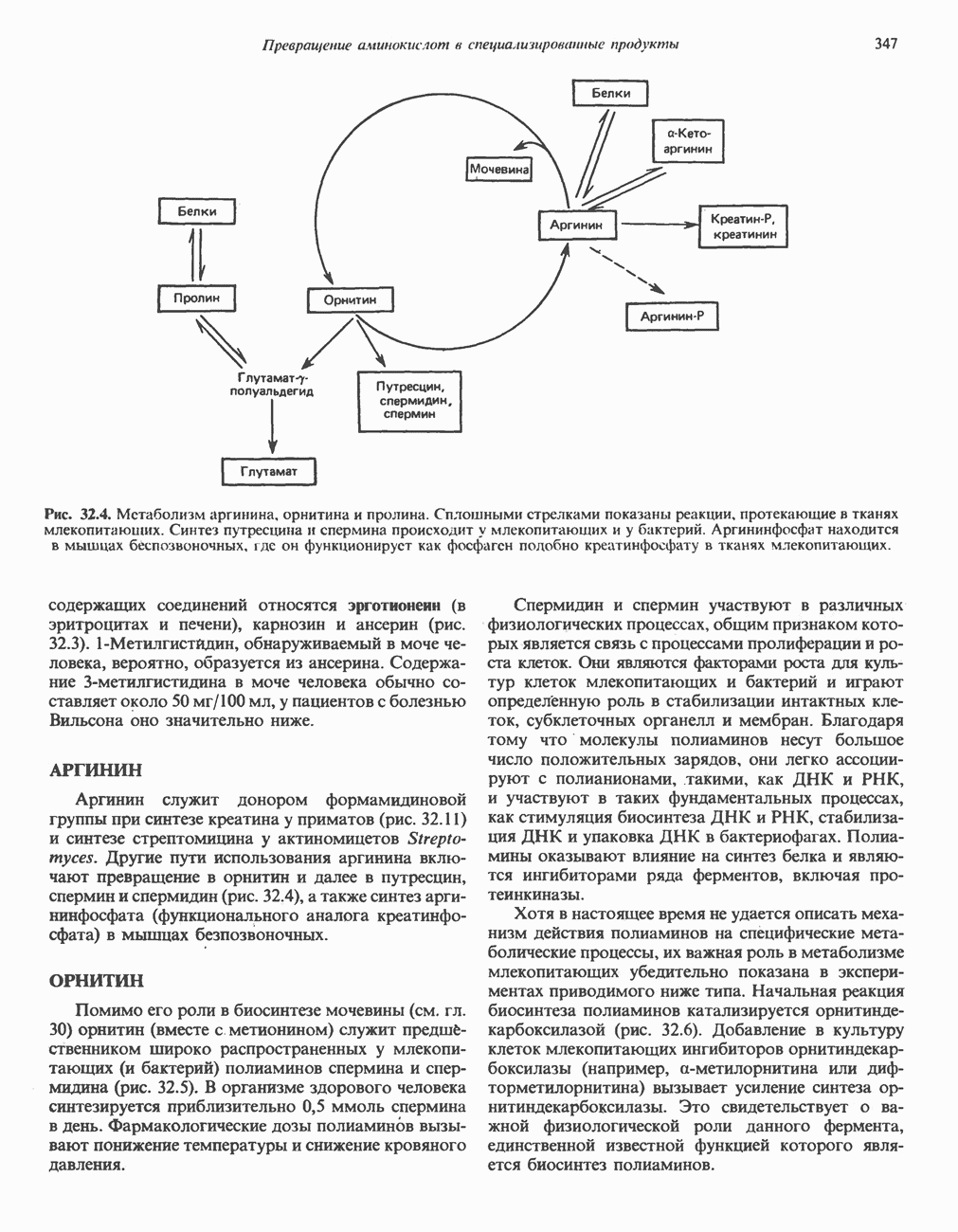
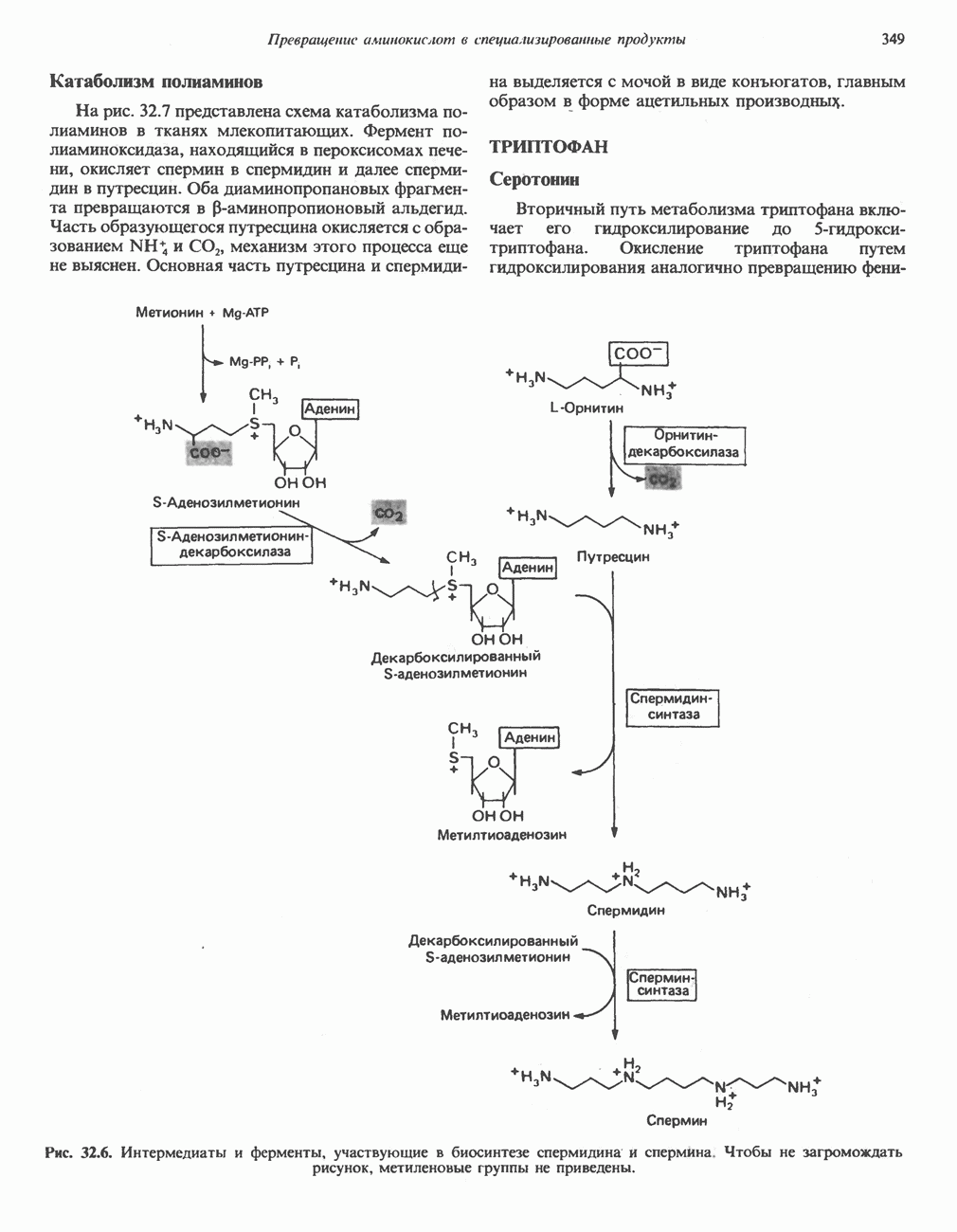
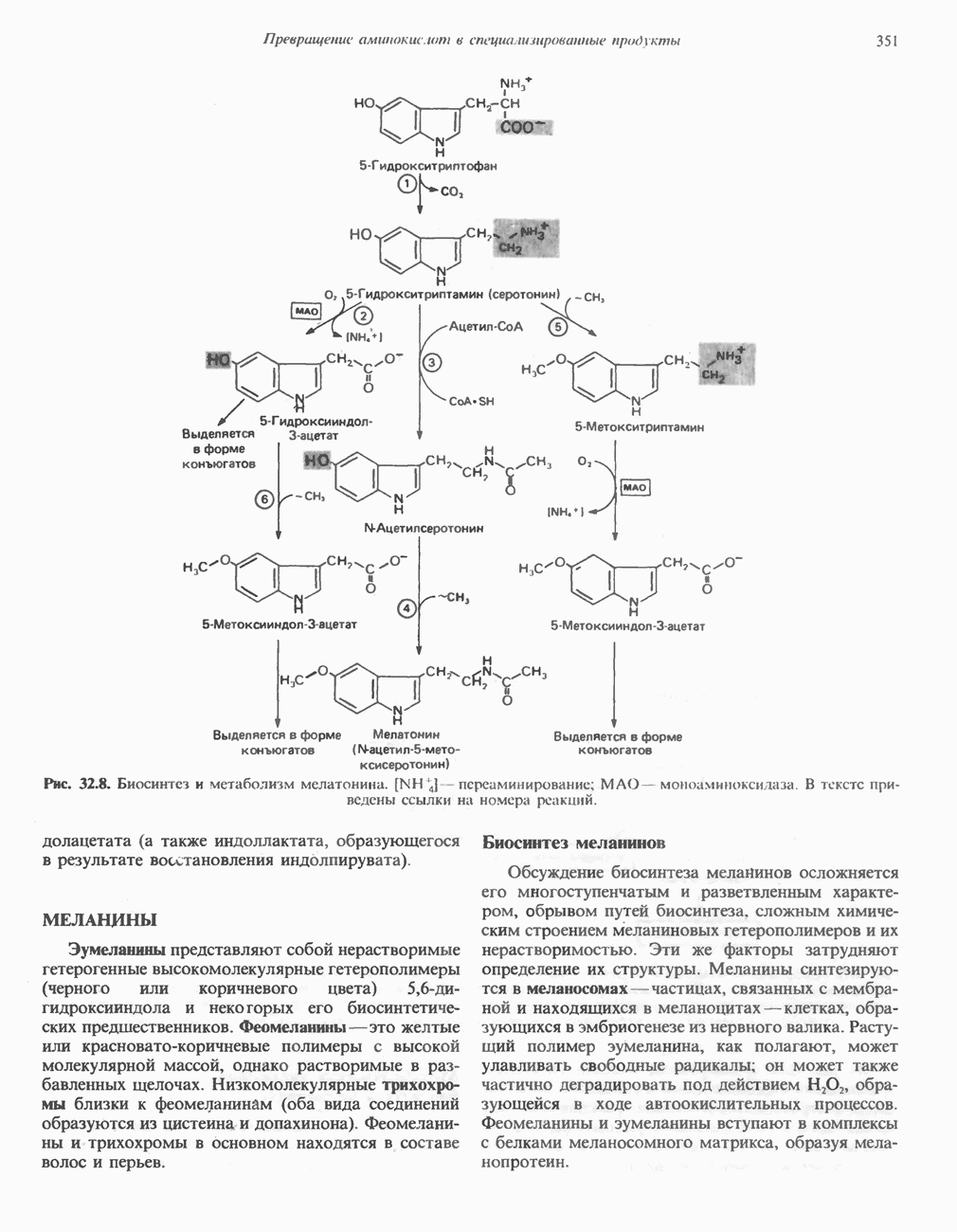
- ТРИПТОФАН
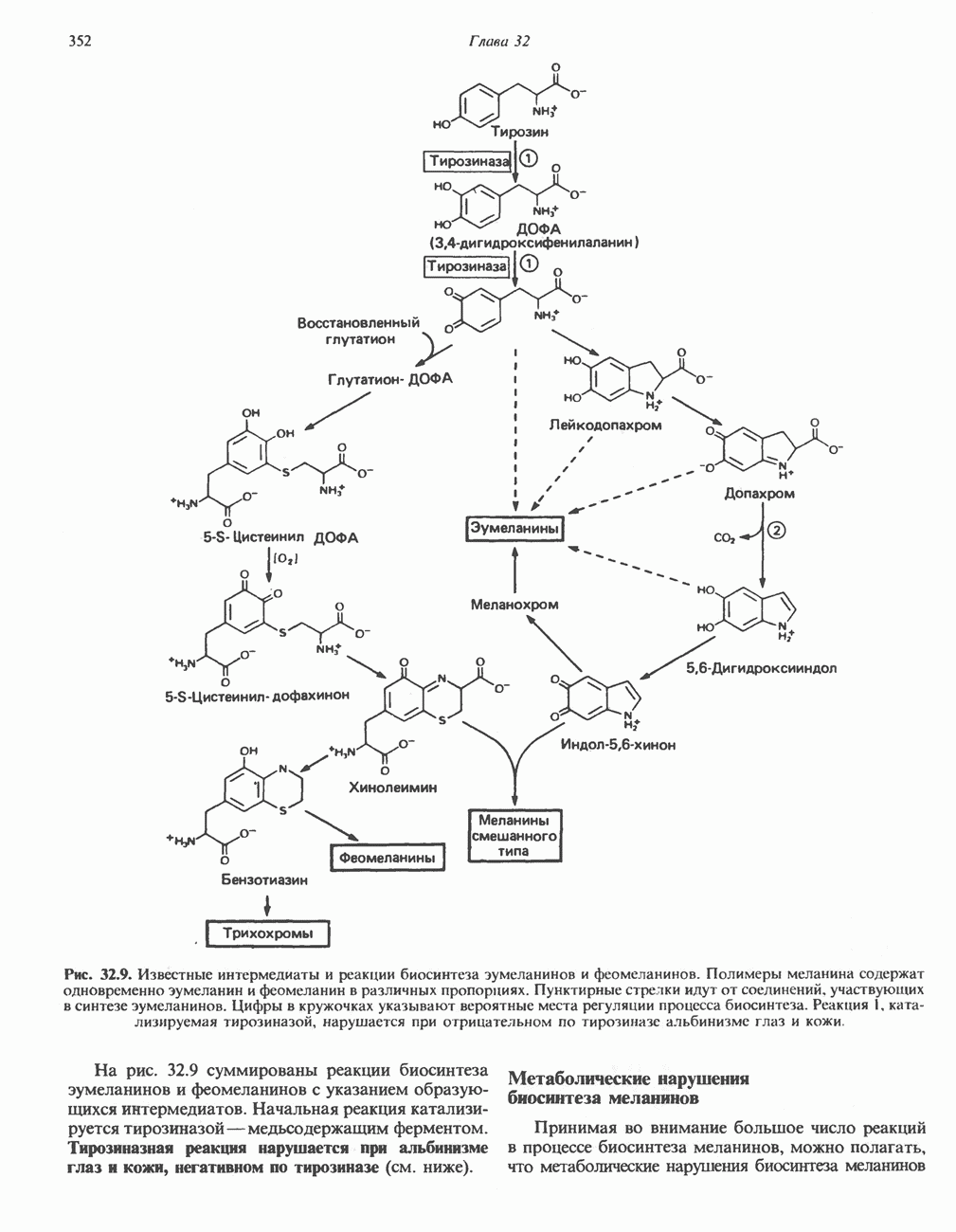
- МЕЛАНИНЫ
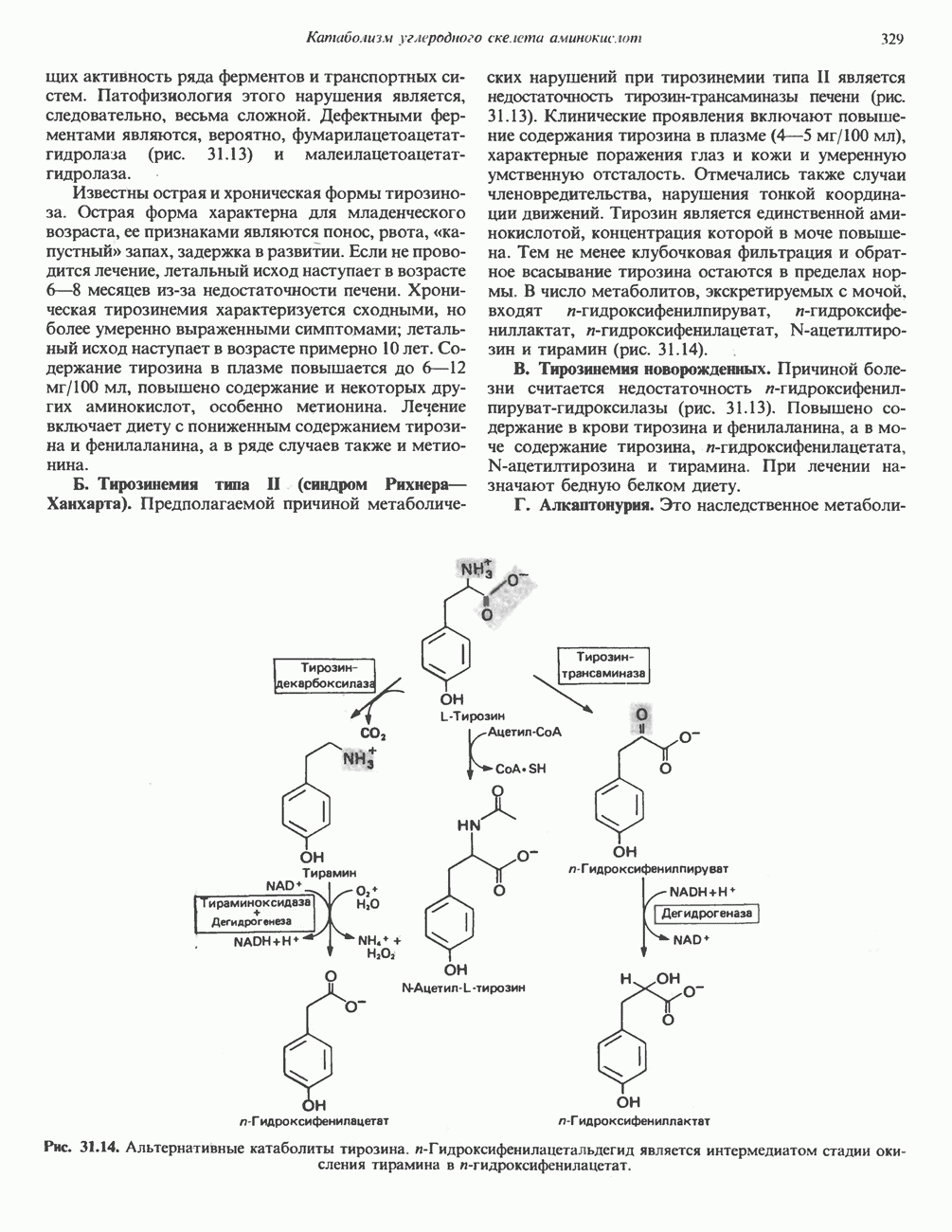
- ТИРОЗИН
- КРЕАТИН И КРЕАТИНИН
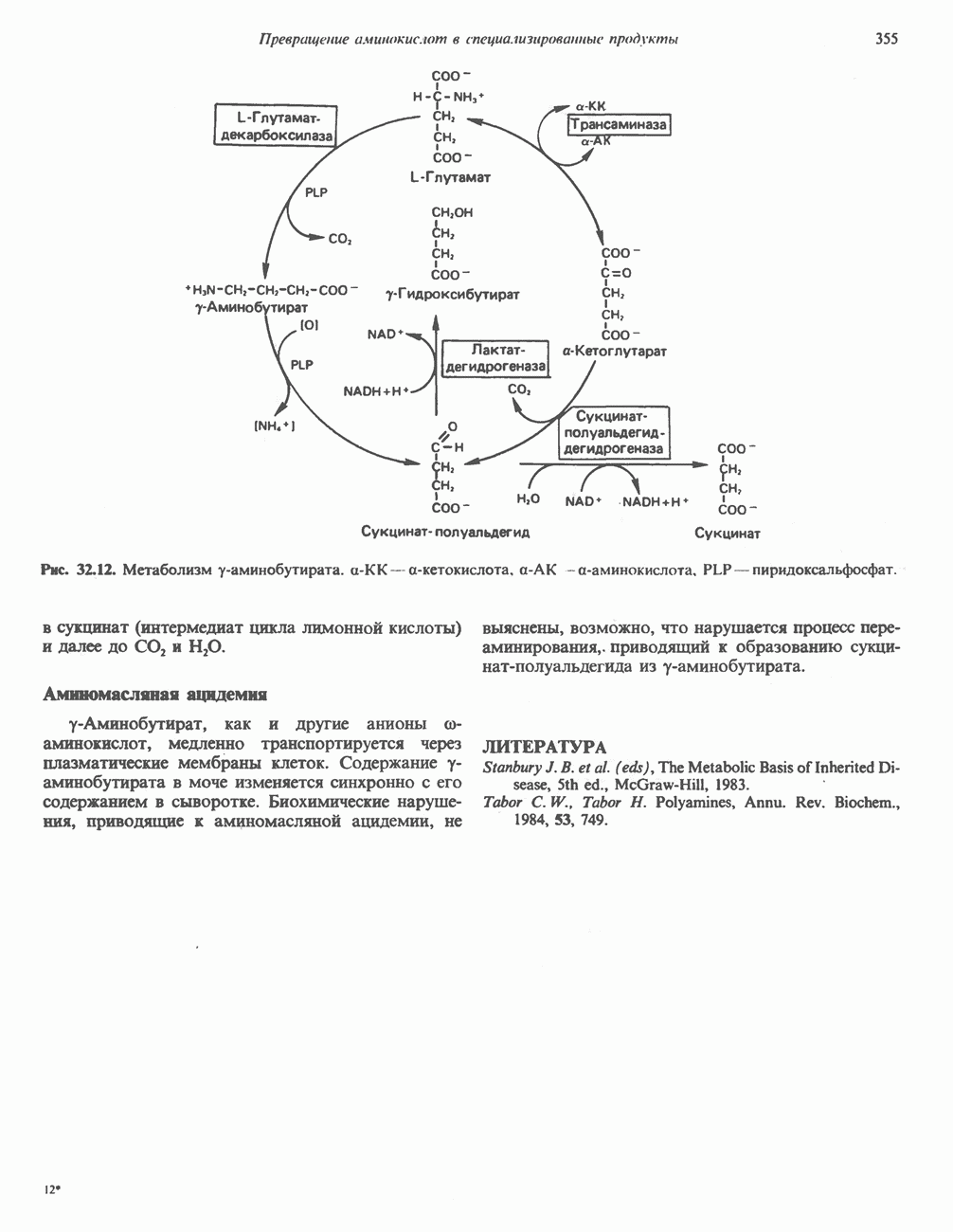
- у-АМИНОБУТИРАТ
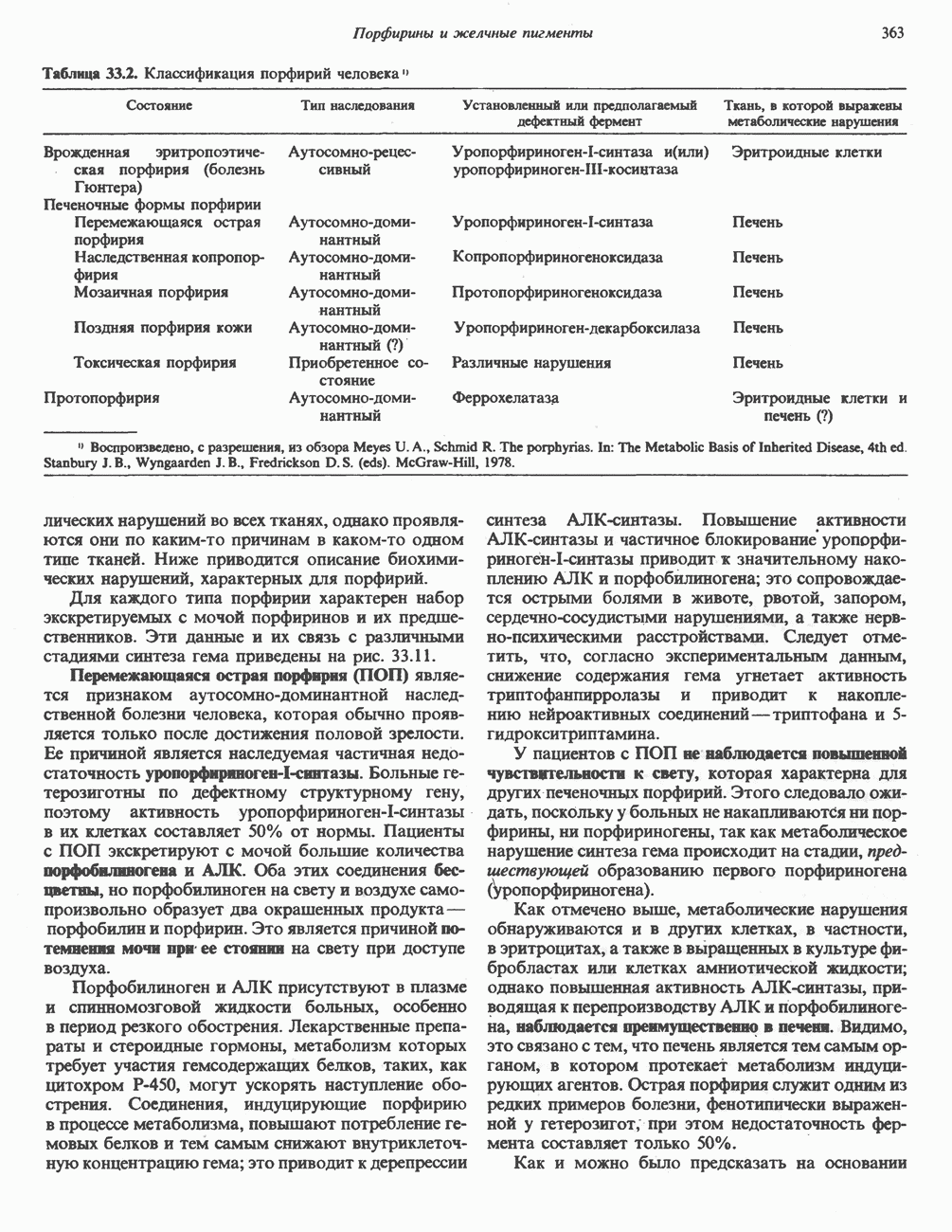
- Глава 33. Порфирины и желчные пигменты
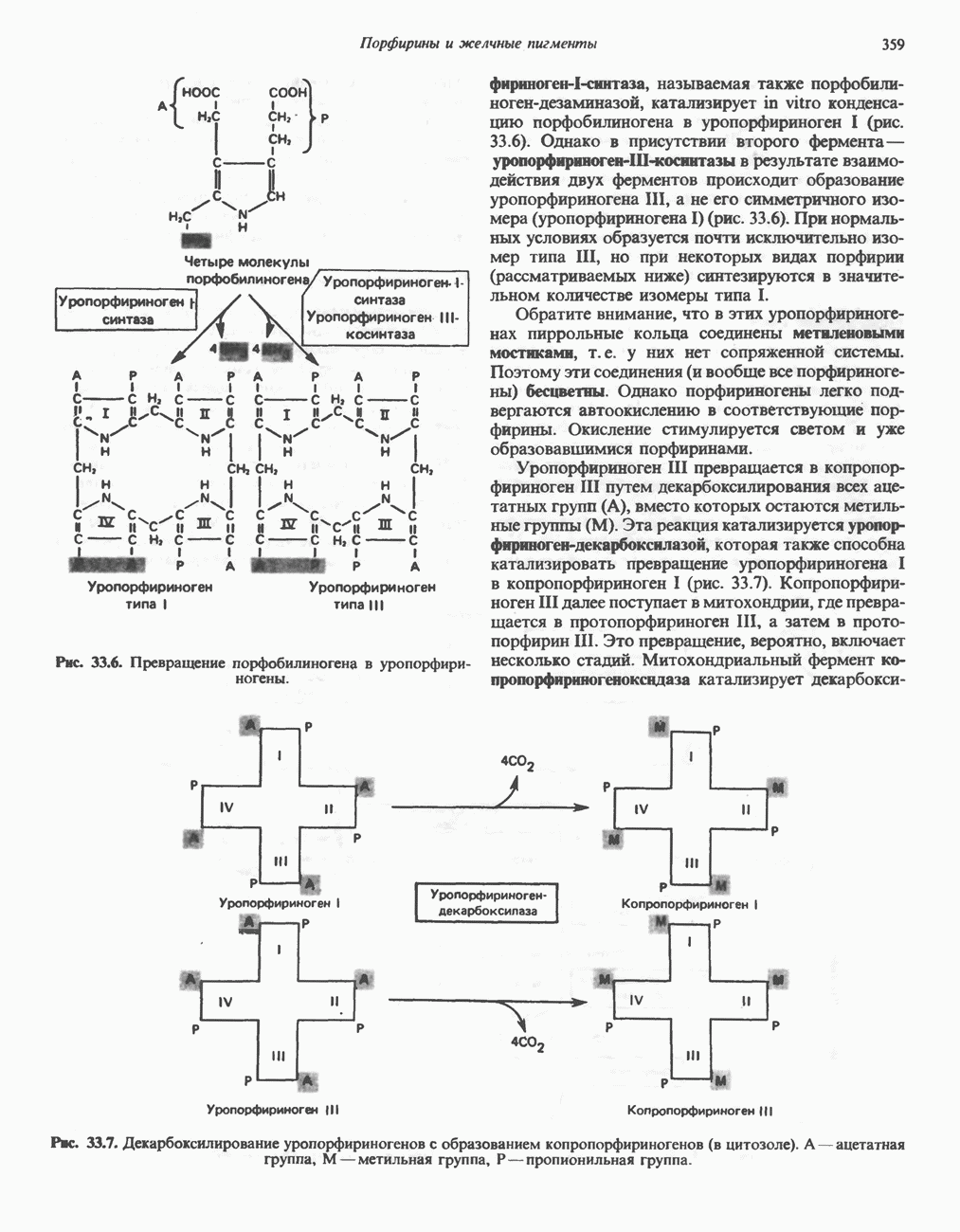
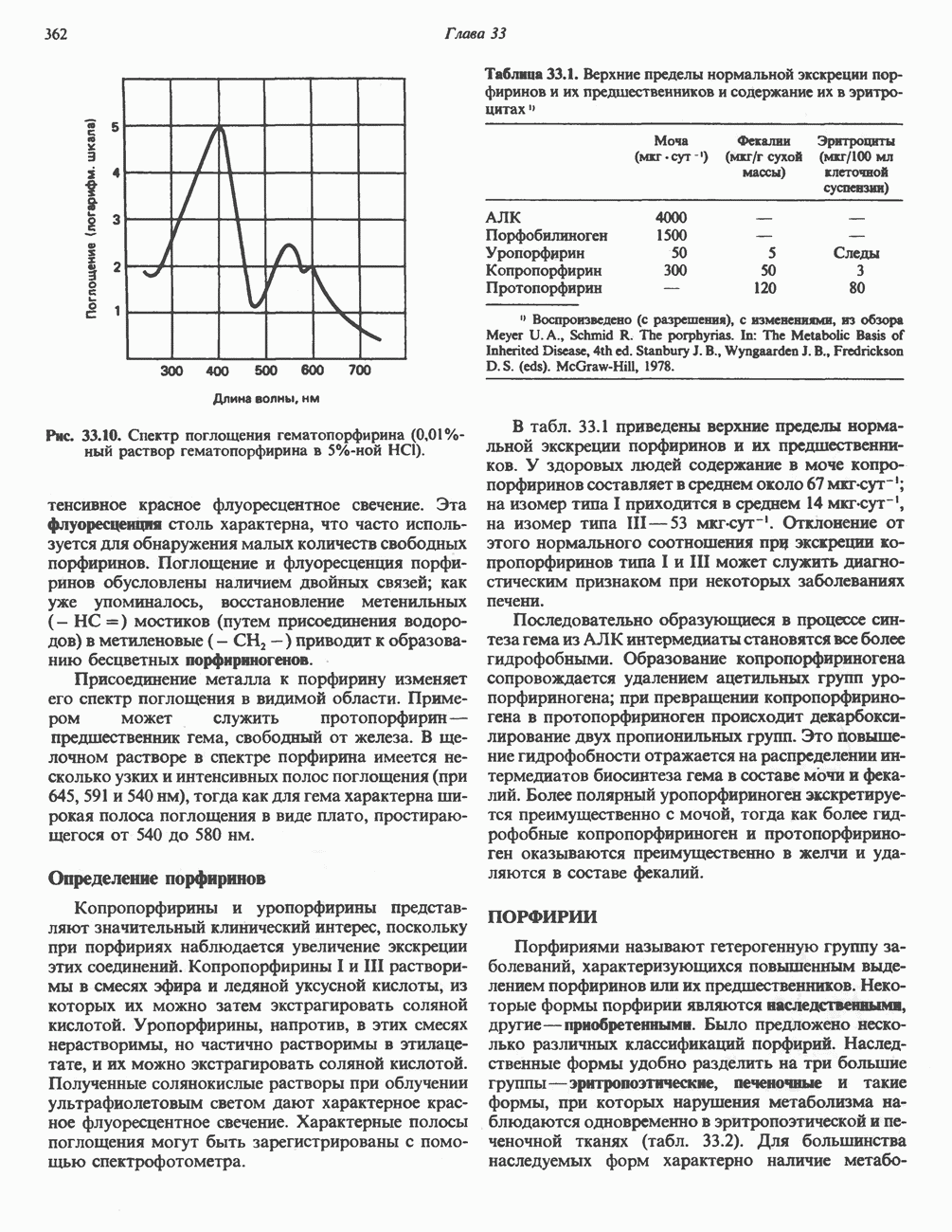
- ПОРФИРИНЫ
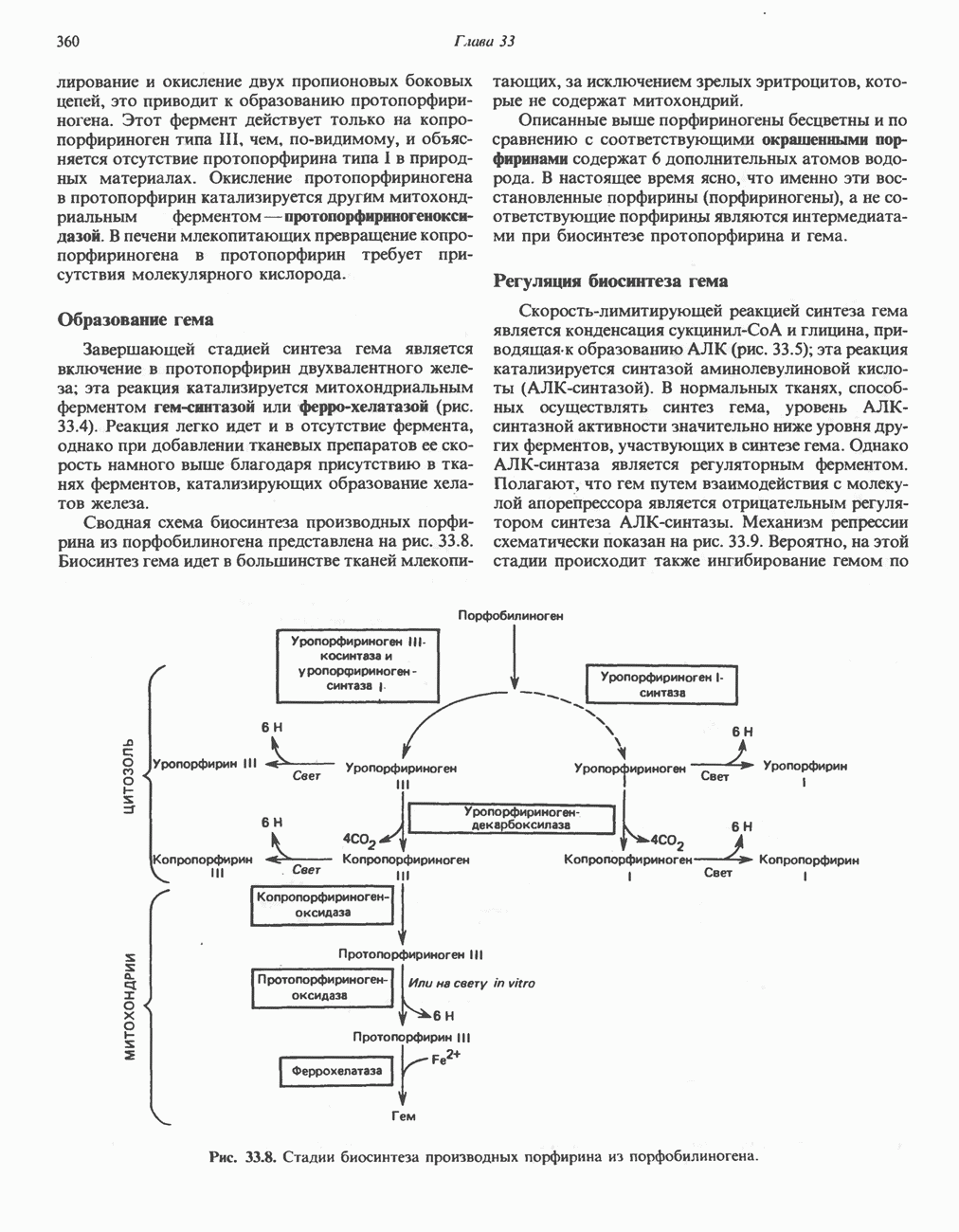
- ПОРФИРИН
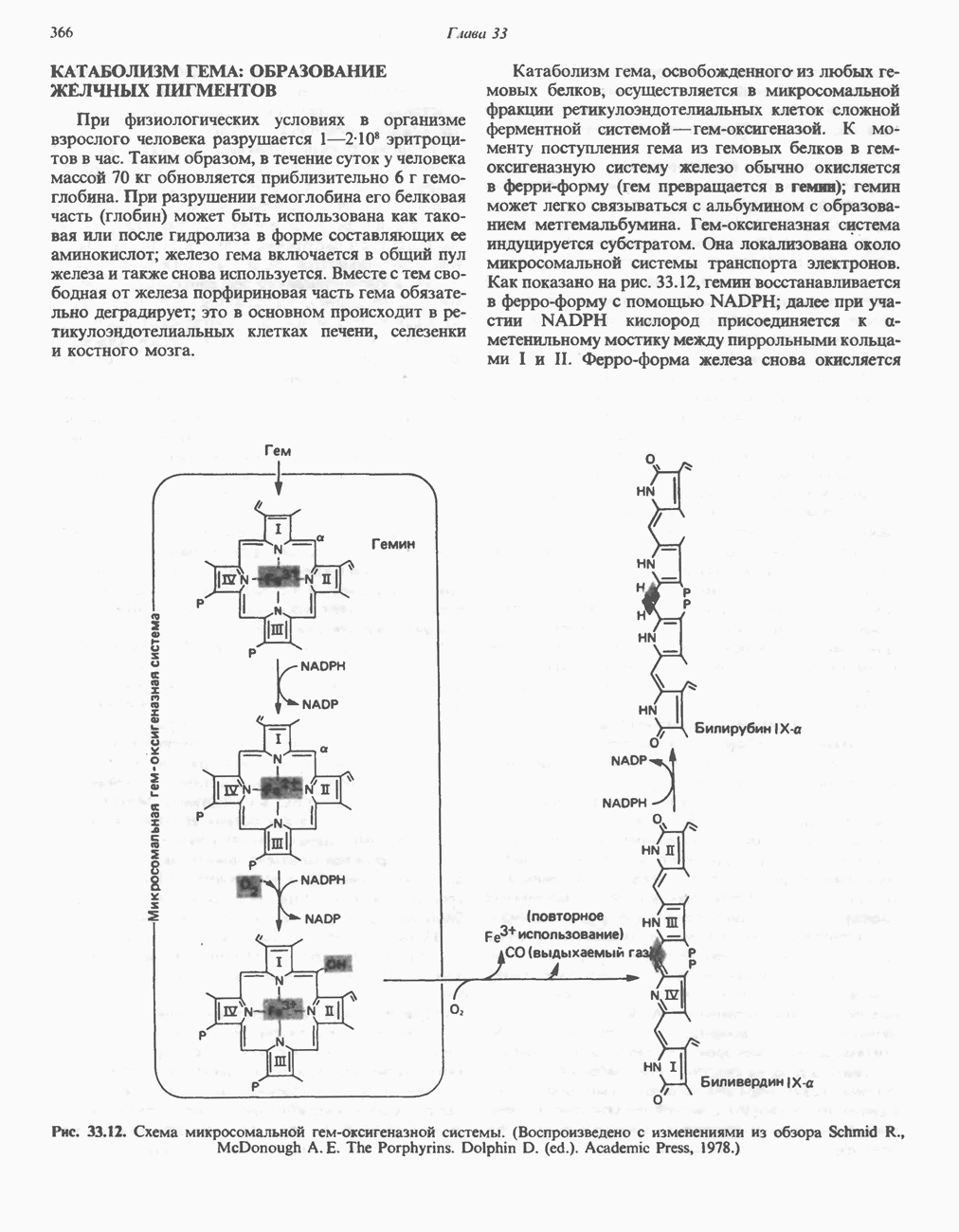
- КАТАБОЛИЗМ ГЕМА: ОБРАЗОВАНИЕ ЖЕЛЧНЫХ ПИГМЕНТОВ
- МЕТАБОЛИЗМ БИЛИРУБИНА В КИШЕЧНИКЕ
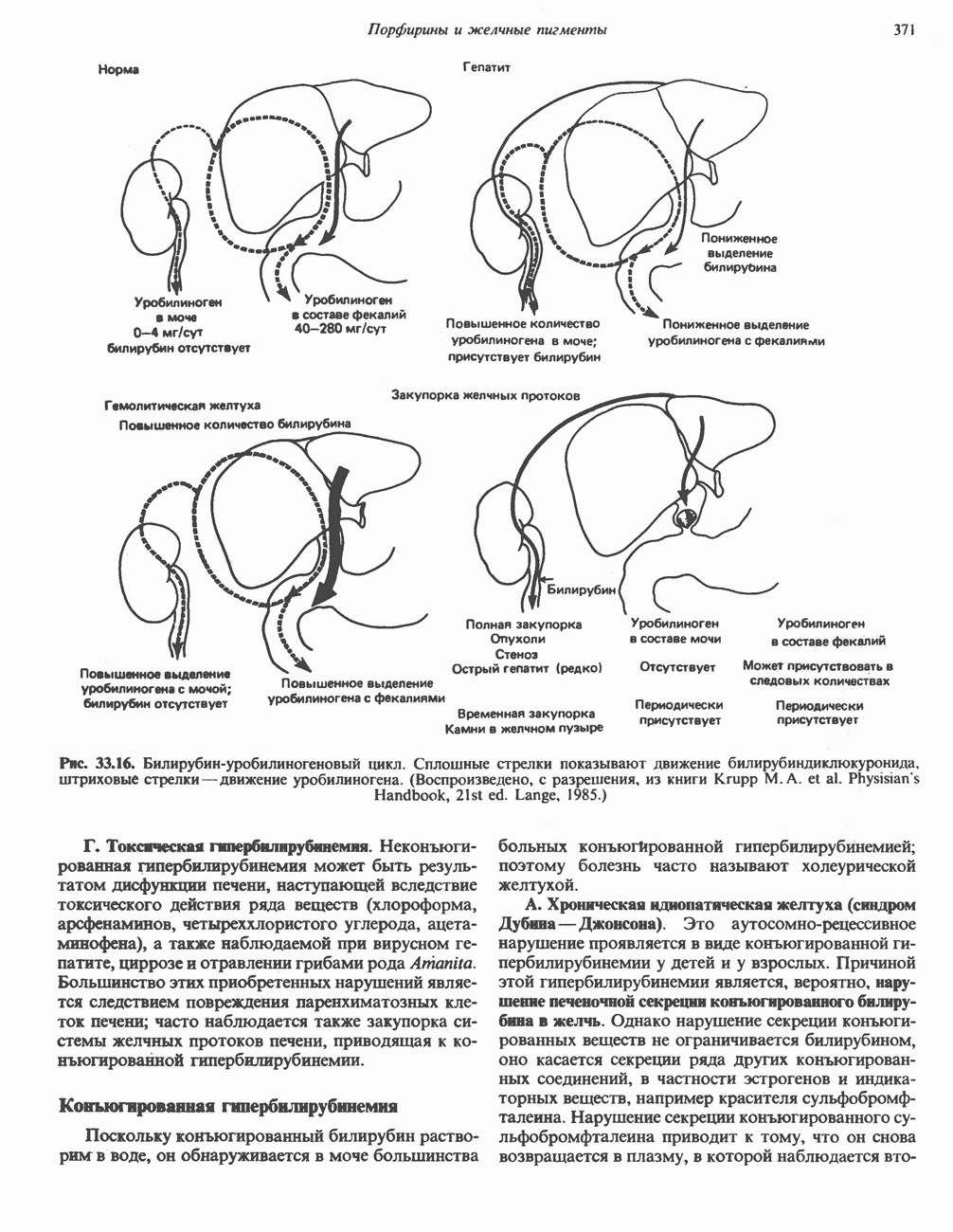
- ГИПЕРБИЛИРУБИНЕМИЯ
- Список сокращений