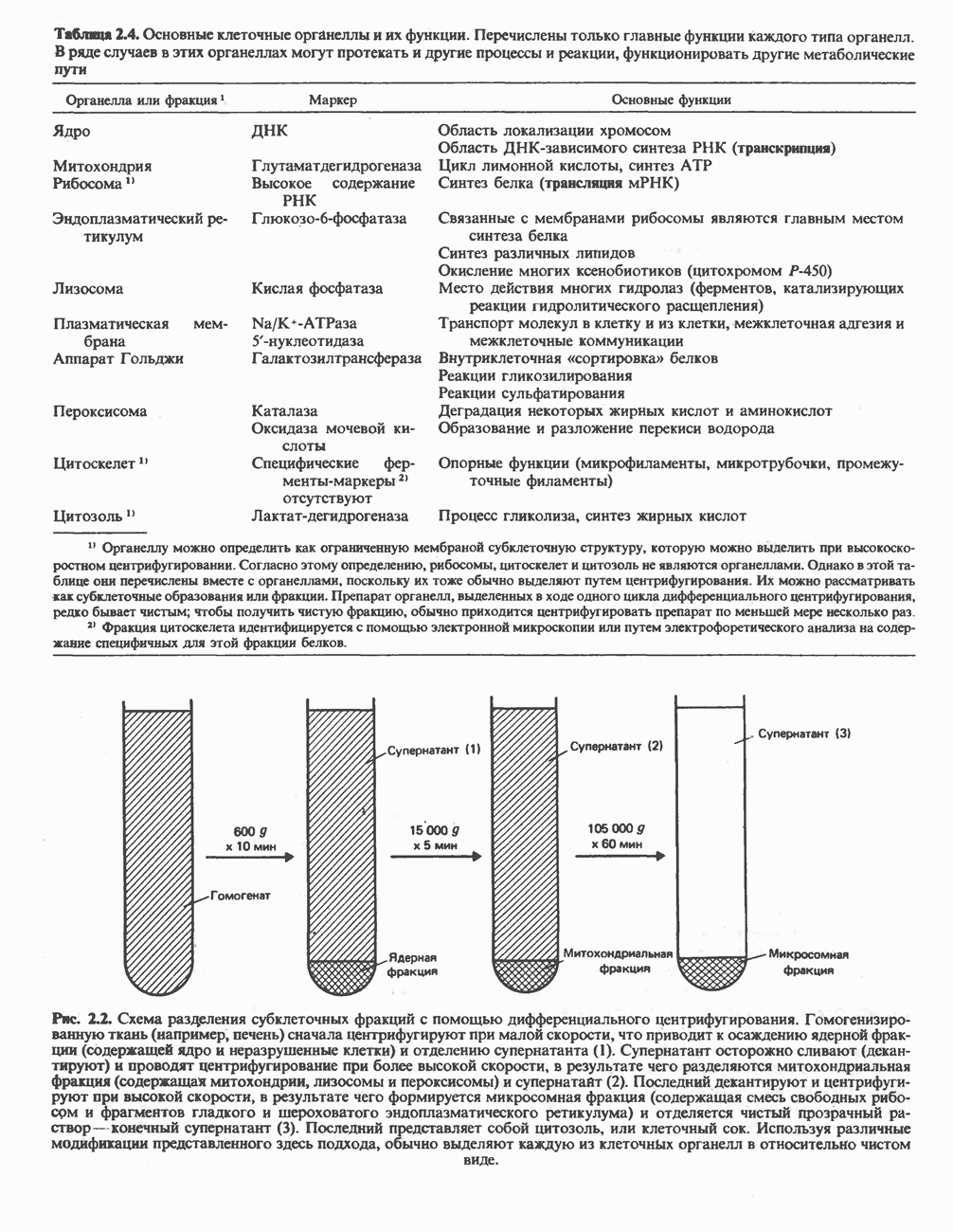
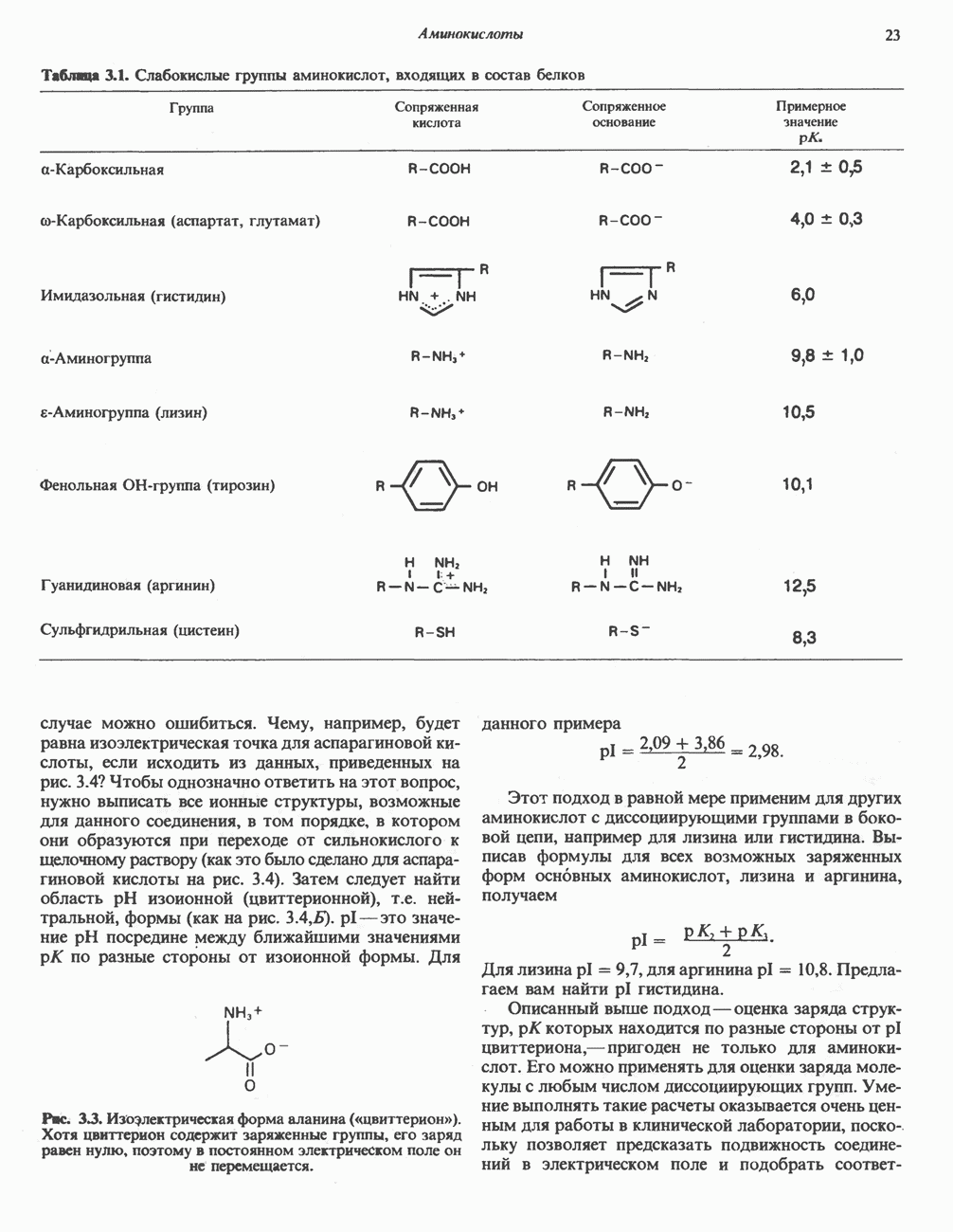
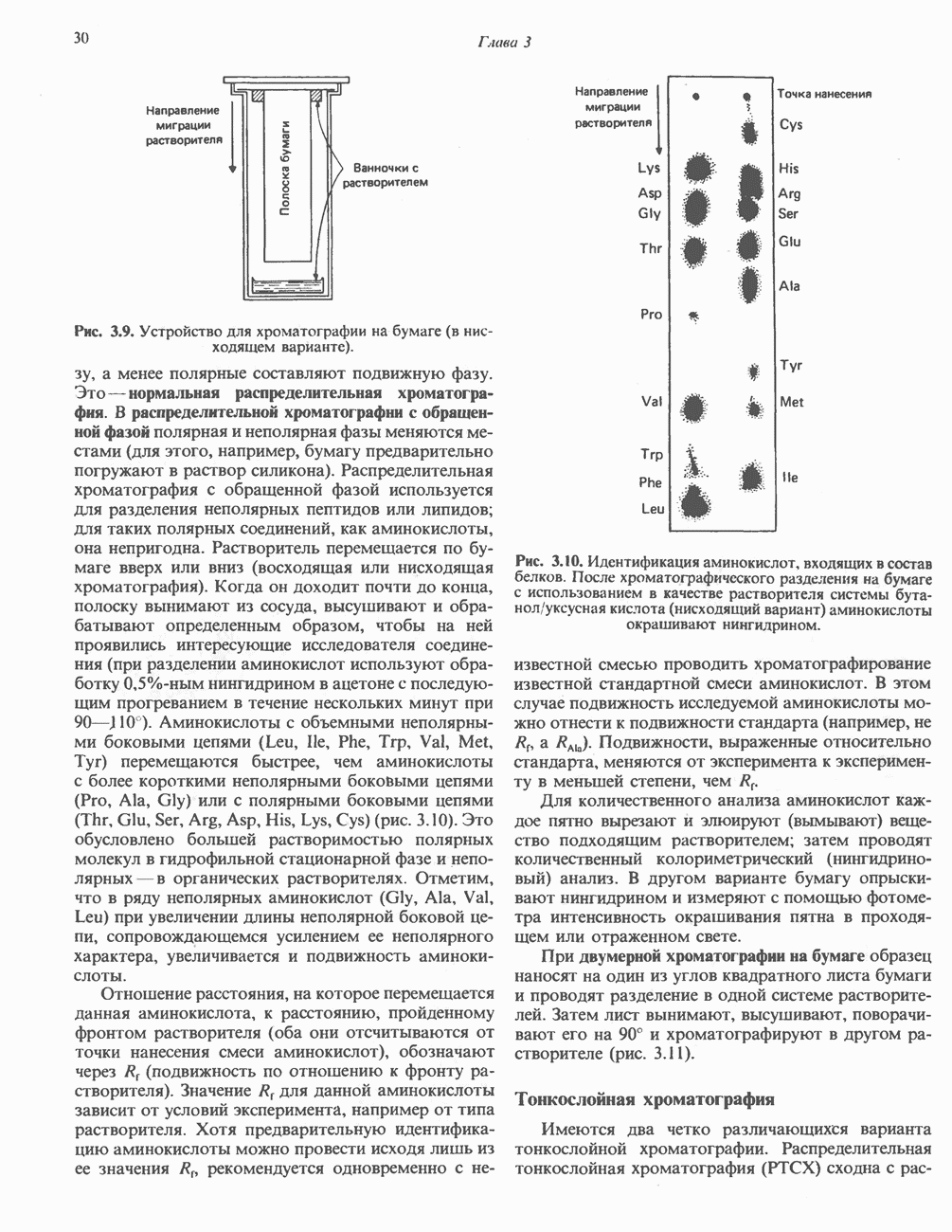
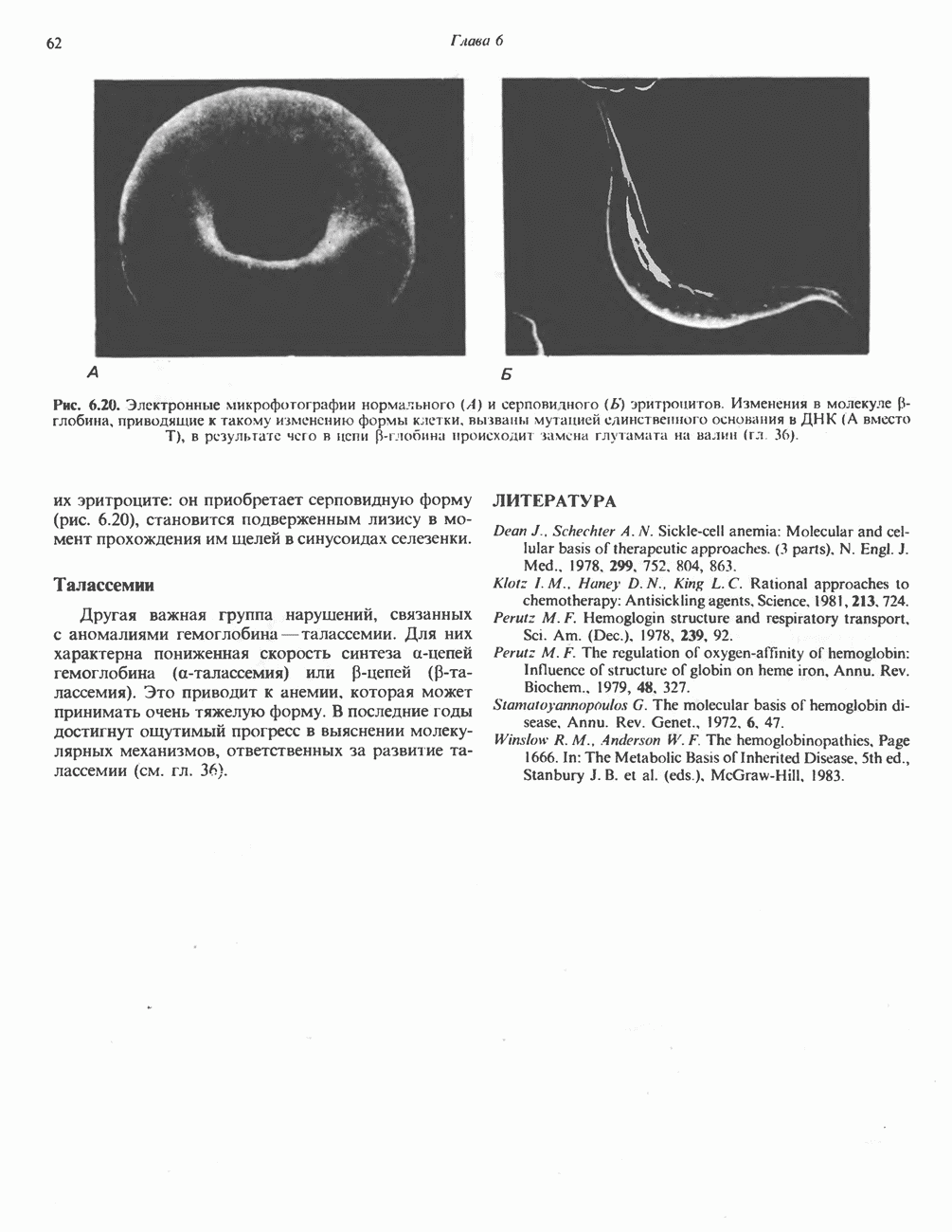
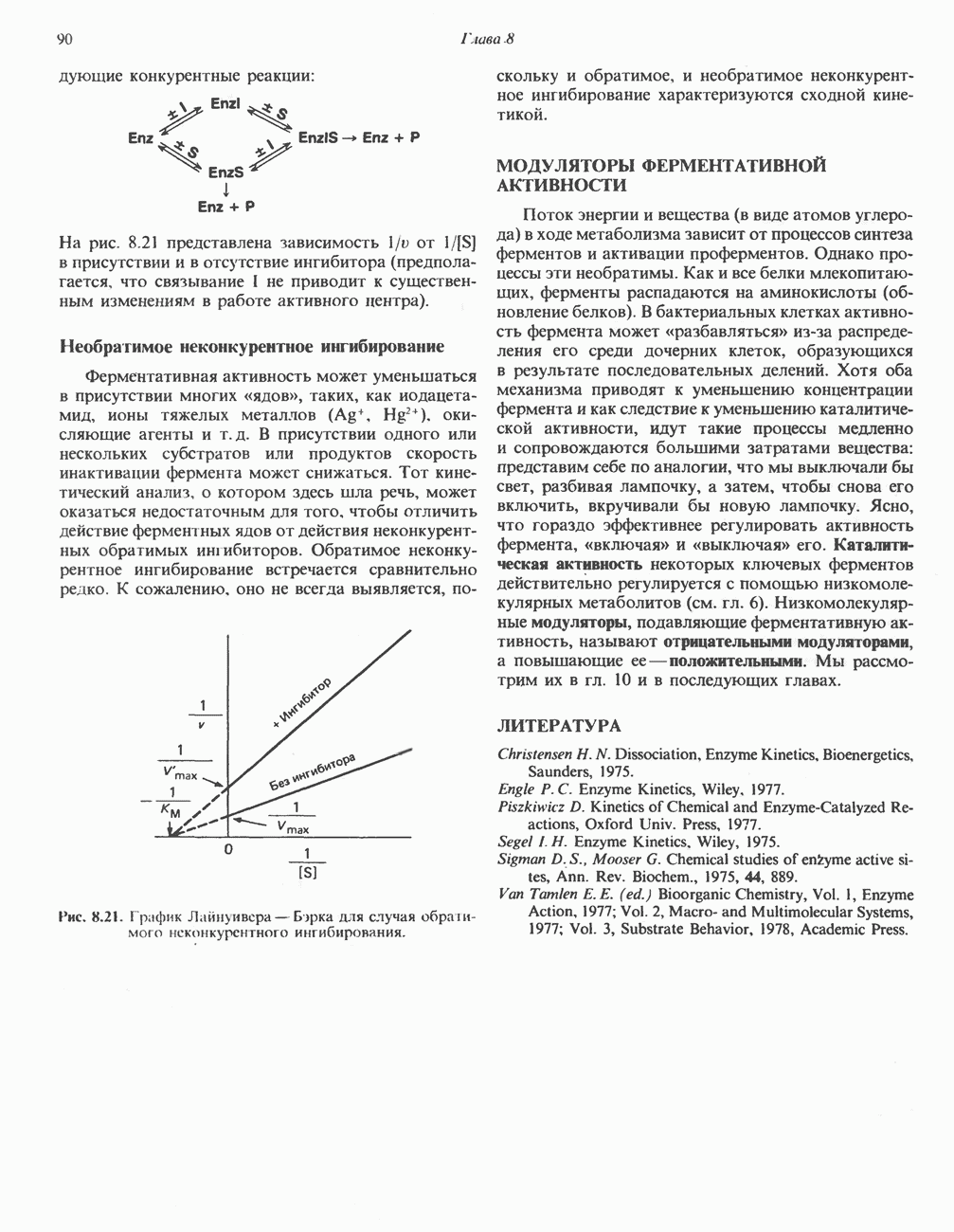
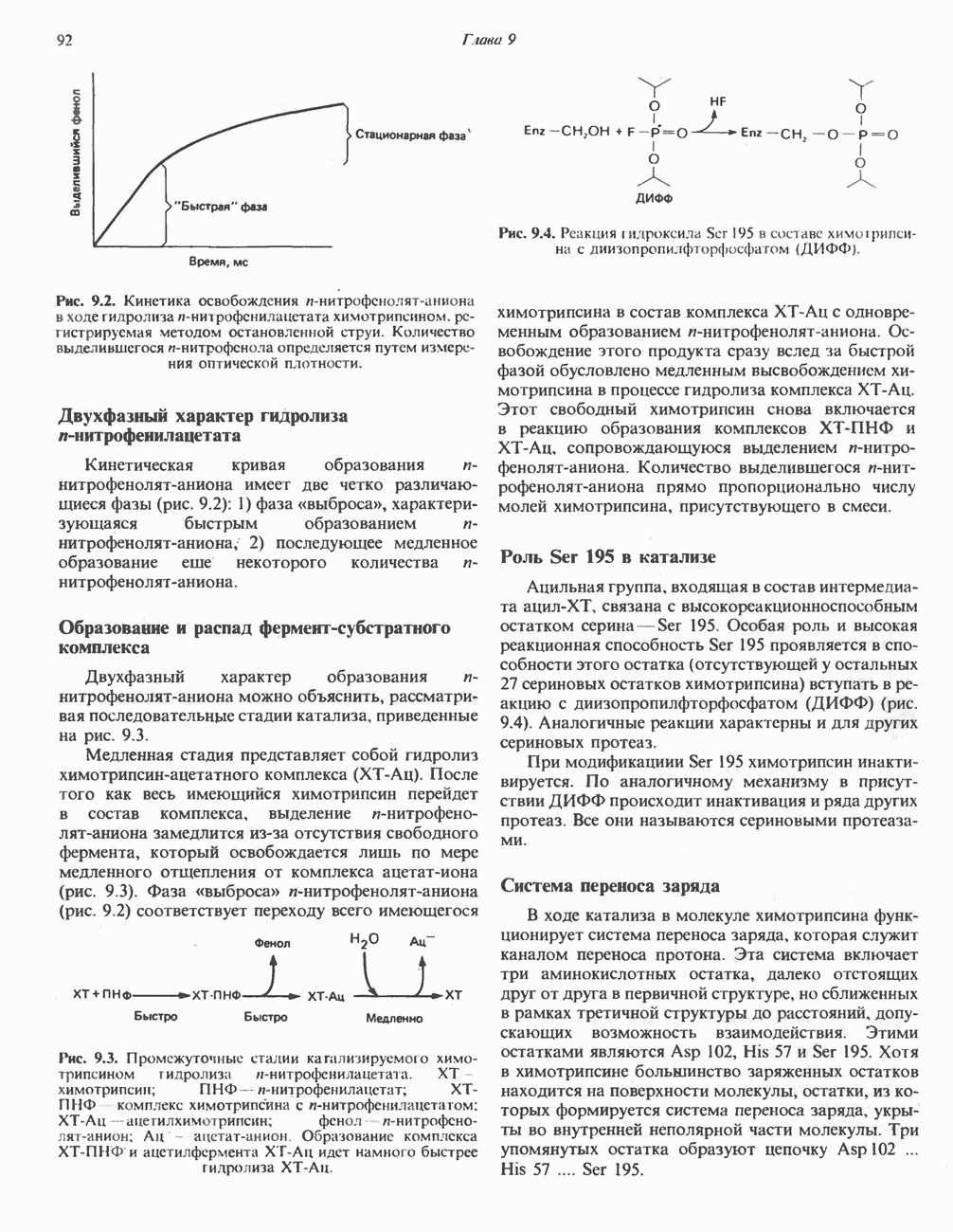
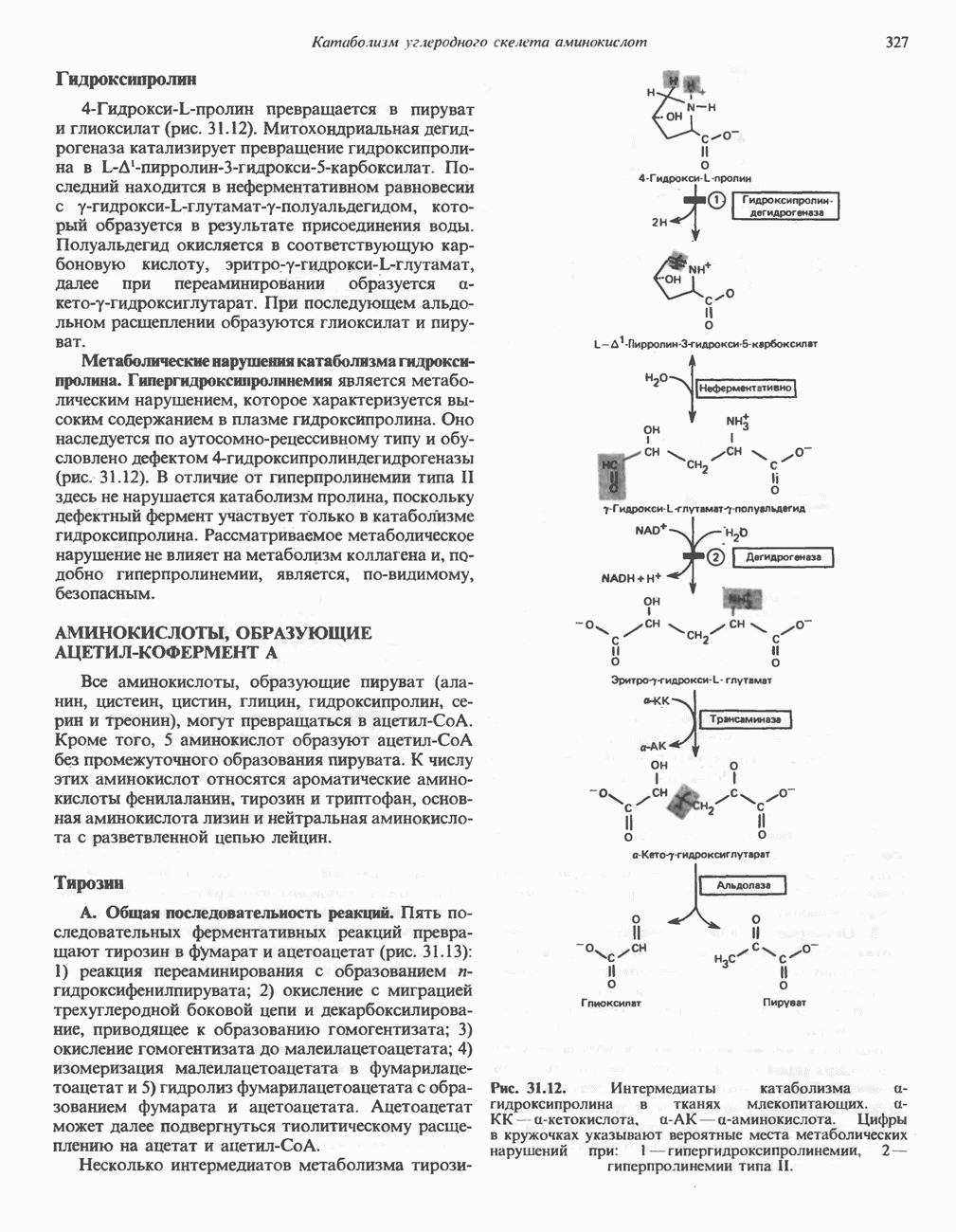
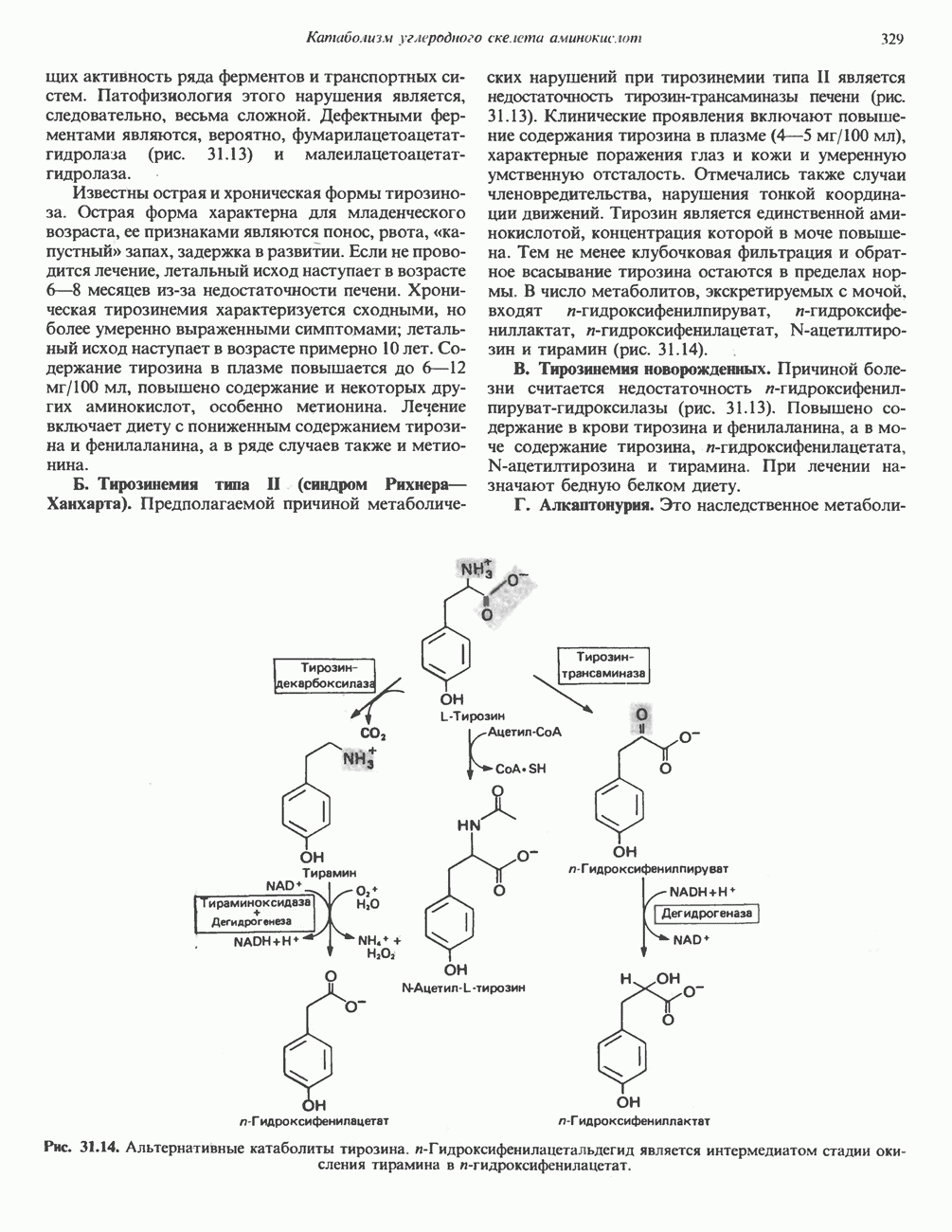
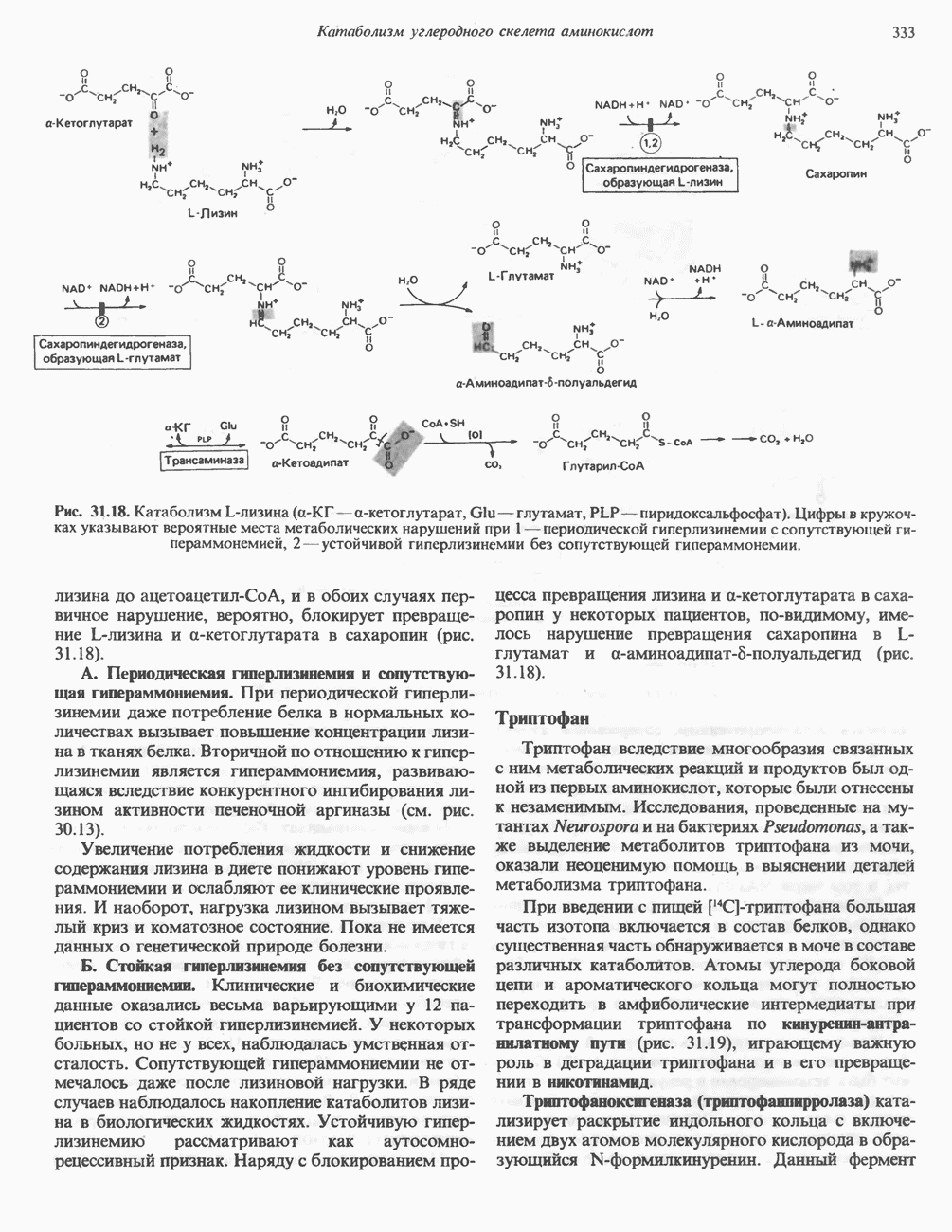
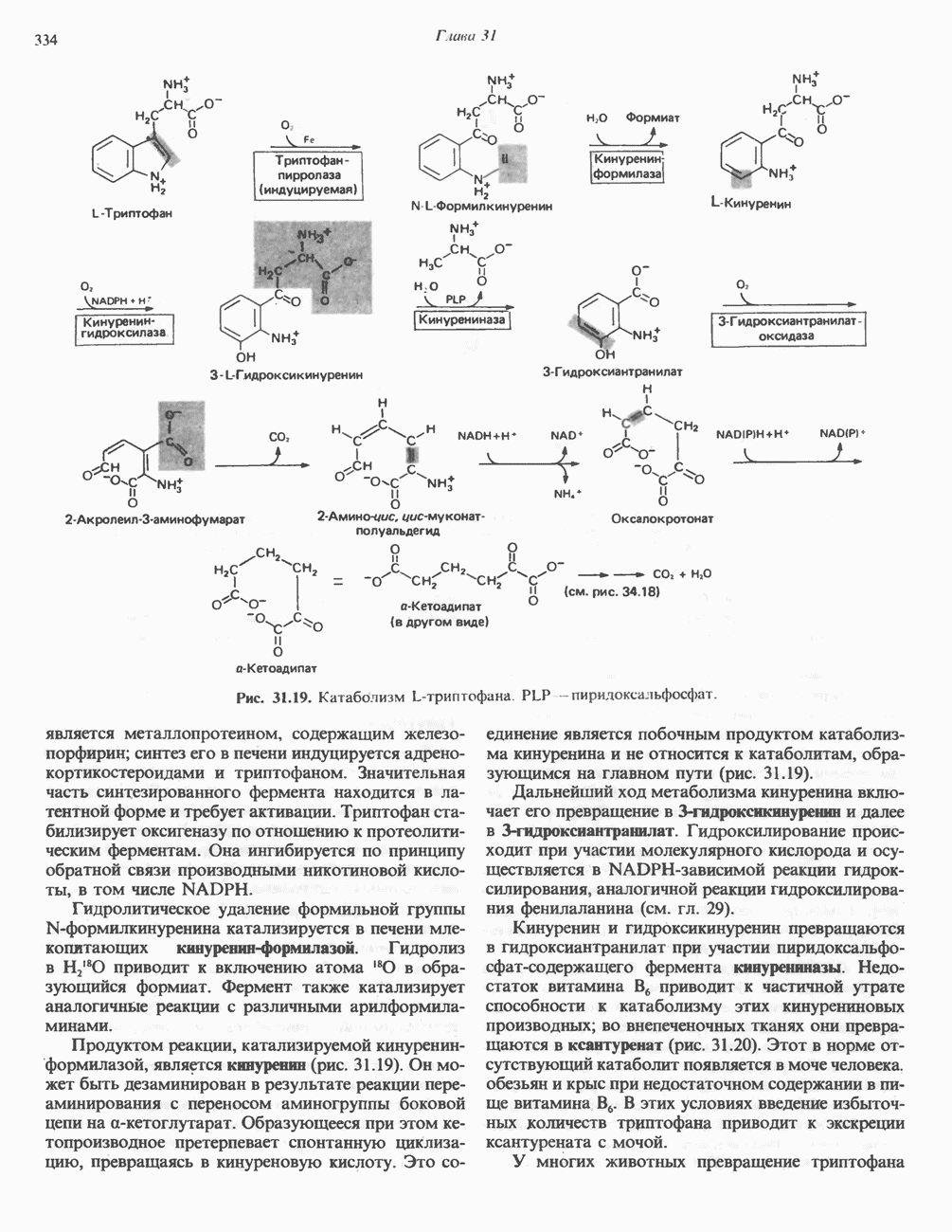
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
МИОГЛОБИН
Биологическая функция миоглобина
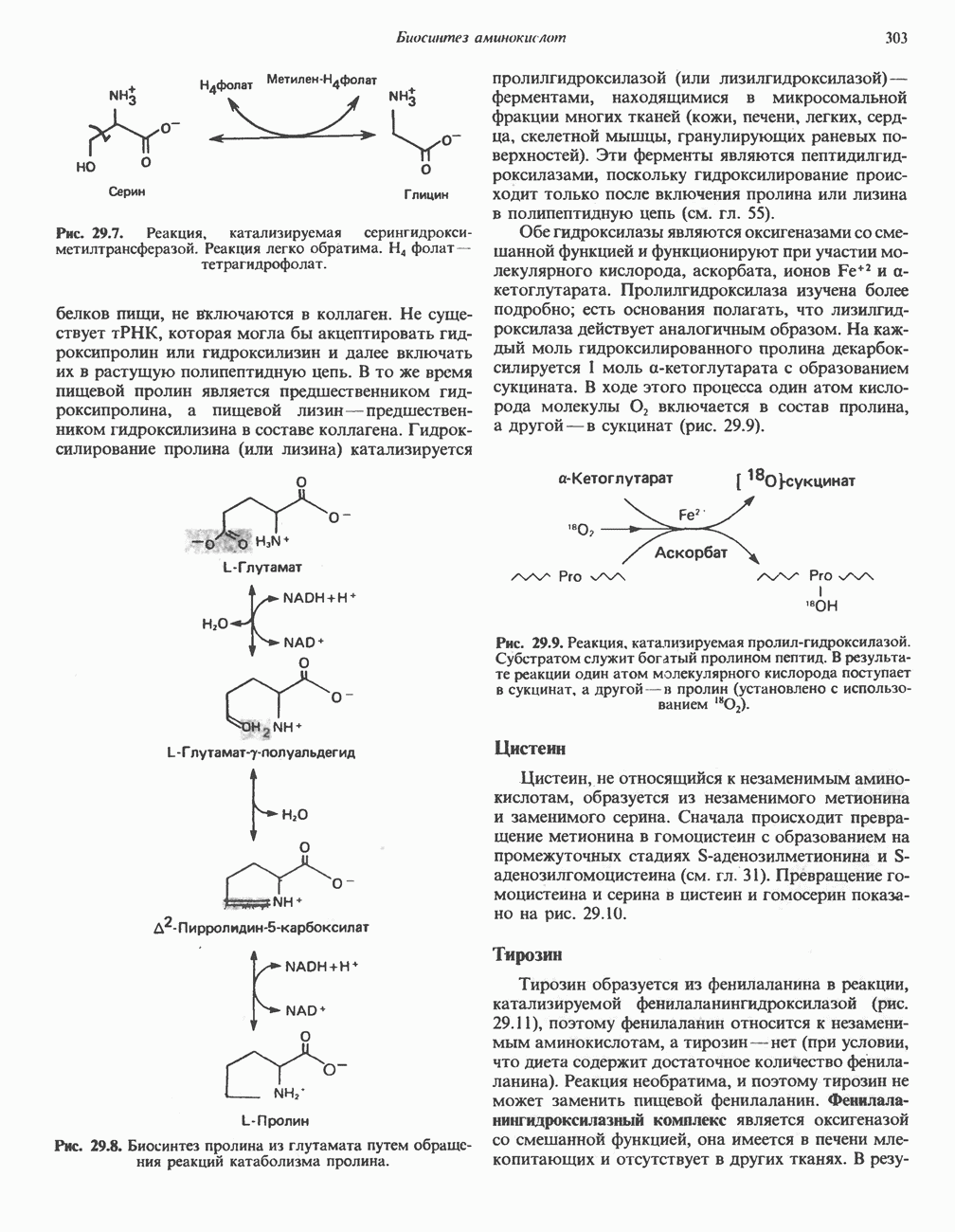
Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях кислородного голодания (например, при сильной физической нагрузке) кислород высвобождается из комплекса с миоглобином и поступает в митохондрии мышечных клеток, где осуществляется синтез АТР (окислительное фосфорилирование; см. гл. 13).
Первичная структура и распределение аминокислот
Миоглобин состоит из единичной полипептидной цепи с мол. массой 17000; никаких особенностей в характере составляющих его 153 аминокислотных остатков не обнаруживается. При анализе же их пространственного распределения четко выявляется одна особенность: на поверхности молекулы находятся полярные остатки, а внутри структуры — неполярные; это свойство характерно для глобулярных белков. Остатки, содержащие одновременно и полярные, и неполярные группы (например, Thr, Тrр, расположены так, что неполярные группы ориентируются внутрь глобулы. Если не считать двух остатков гистидина, принимающих участие в связывании кислорода, то внутренние области миоглобина содержат только неполярные остатки (например, Leu, Val, Phe, Met).
Вторичная и третичная структура миоглобина
Как показывает рентгеноструктурный анализ, миоглобин представляет собой компактную, примерно сферическую молекулу размером 4,5 х 3,5 х 2,5 нм (рис. 6.3). Примерно 75% остатков образуют восемь правых а-спиралей, содержащих от 7 до 20 остатков. Начиная с N-конца, спирали обозначают буквами от А до Н. Участки, соединяющие спирали, обозначают двумя буквами, указывающими соответствующие спирали. Индивидуальным остаткам присваивают букву, указывающую спираль, в которой они находятся, и порядковый номер, отсчитываемый от  -конца спирали. Например,
-конца спирали. Например,  восьмой остаток в спирали F, им является гистидин. Остатки, далеко отстоящие друг от друга вдоль цепи (например, принадлежащие разным спиралям), могут быть пространственно сближены; например, довольно близко находятся остатки гистидина
восьмой остаток в спирали F, им является гистидин. Остатки, далеко отстоящие друг от друга вдоль цепи (например, принадлежащие разным спиралям), могут быть пространственно сближены; например, довольно близко находятся остатки гистидина  (проксимальный) и
(проксимальный) и  (дистальный) (рис. 6.3).
(дистальный) (рис. 6.3).
Ряд данных свидетельствует о том, что в растворе вторичная и третичная структуры миоглобина

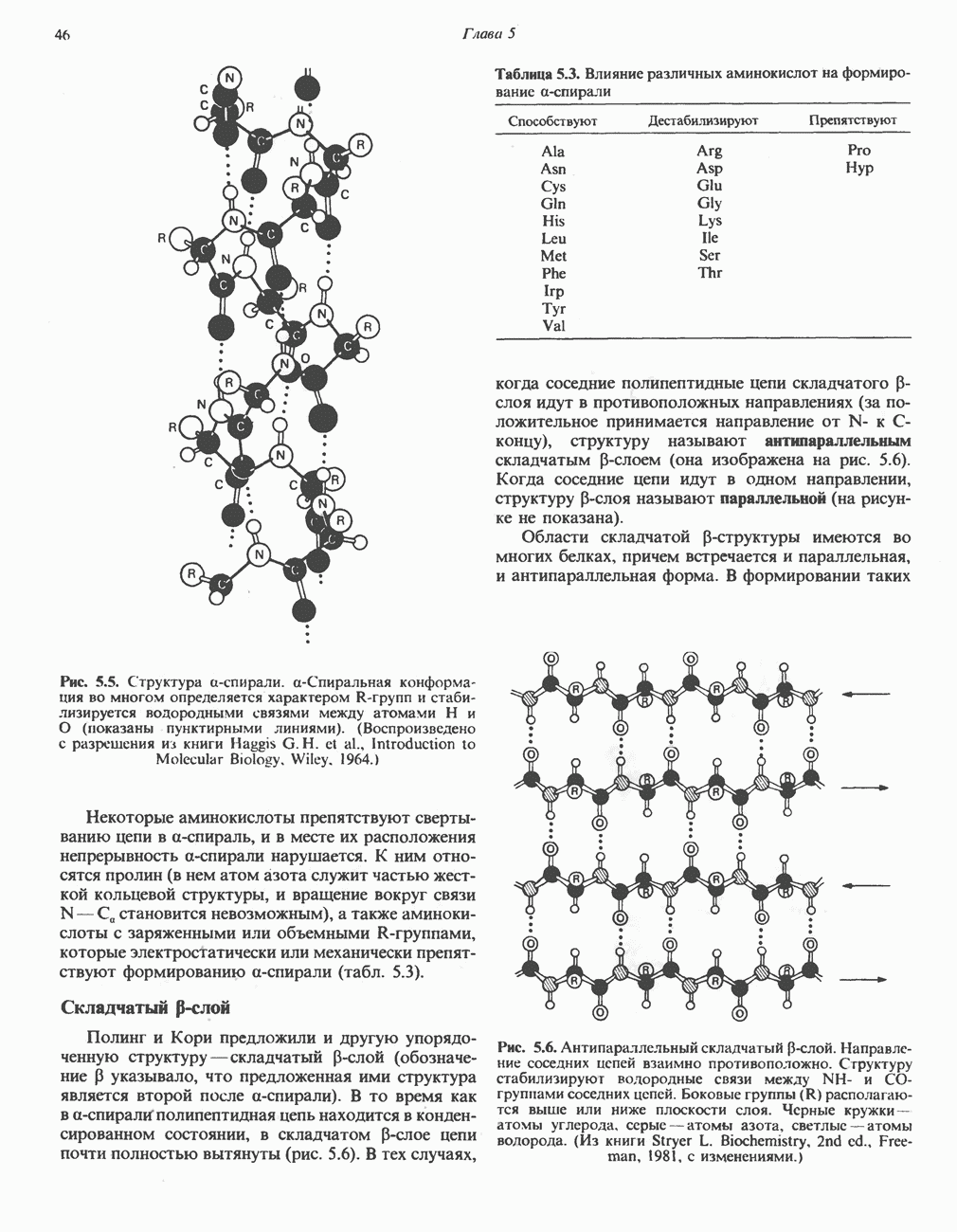
Рис. 6.3. Модель молекулы миоглобина. Контуры — это очертания, наблюдаемые при низком разрешении. Изображены в основном только атомы а-углерода и гем. (Из статьи Dickerson R. Е. In: The Proteins, 2nd ed., Vol. 2. Neurath H. (editor). Academic Press, 1964, с любезного разрешения.)
близки к структуре кристаллического миоглобина. В обоих случаях наблюдаются практически идентичные спектры поглощения; кристаллический миоглобин связывает кислород; содержание а-спиралей в растворе, оцениваемое по дисперсии оптического вращения и круговому дихроизму, сходно с данными, полученными методом рентгеноструктурного анализа.
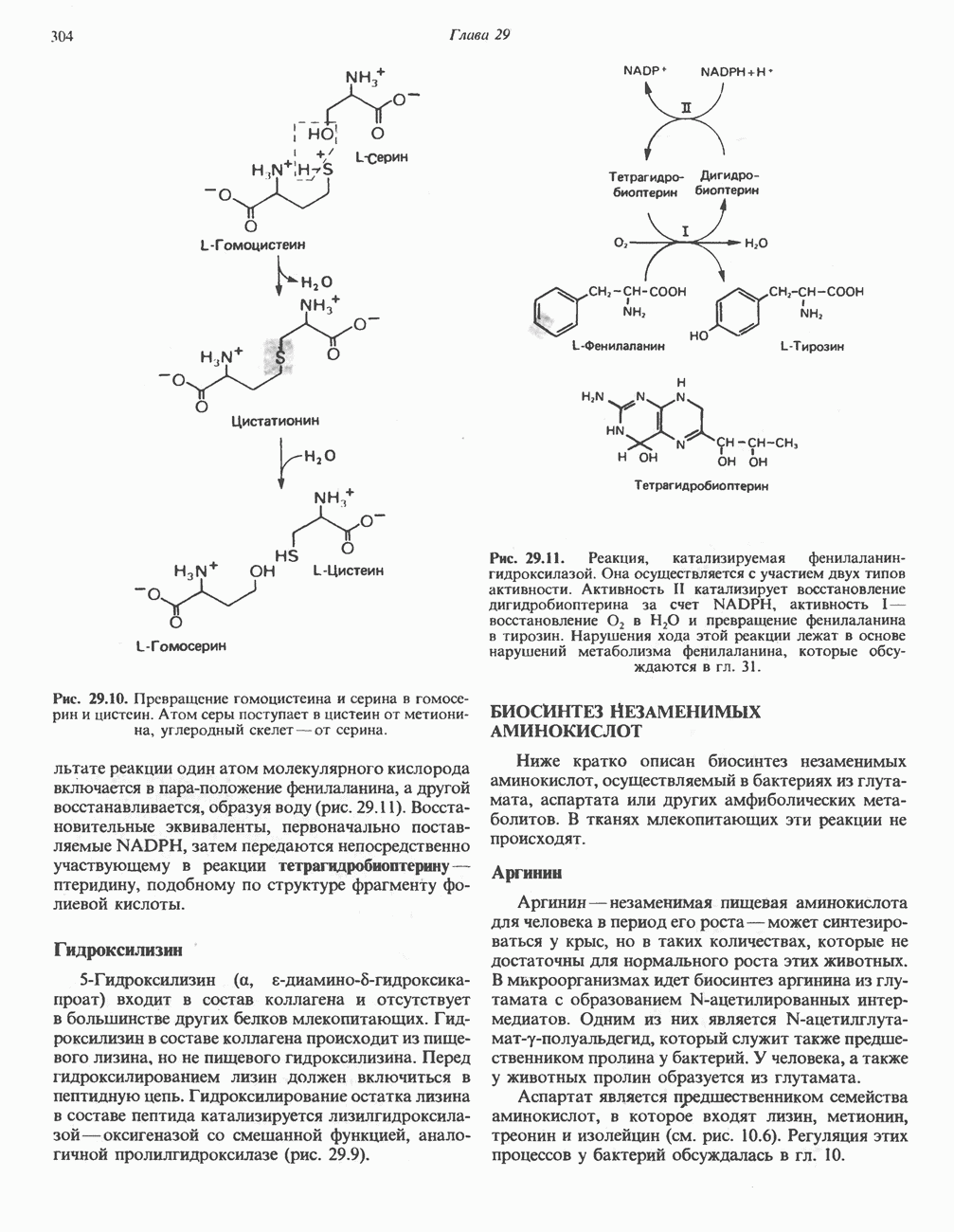
Влияние гема на конформацию миоглобина
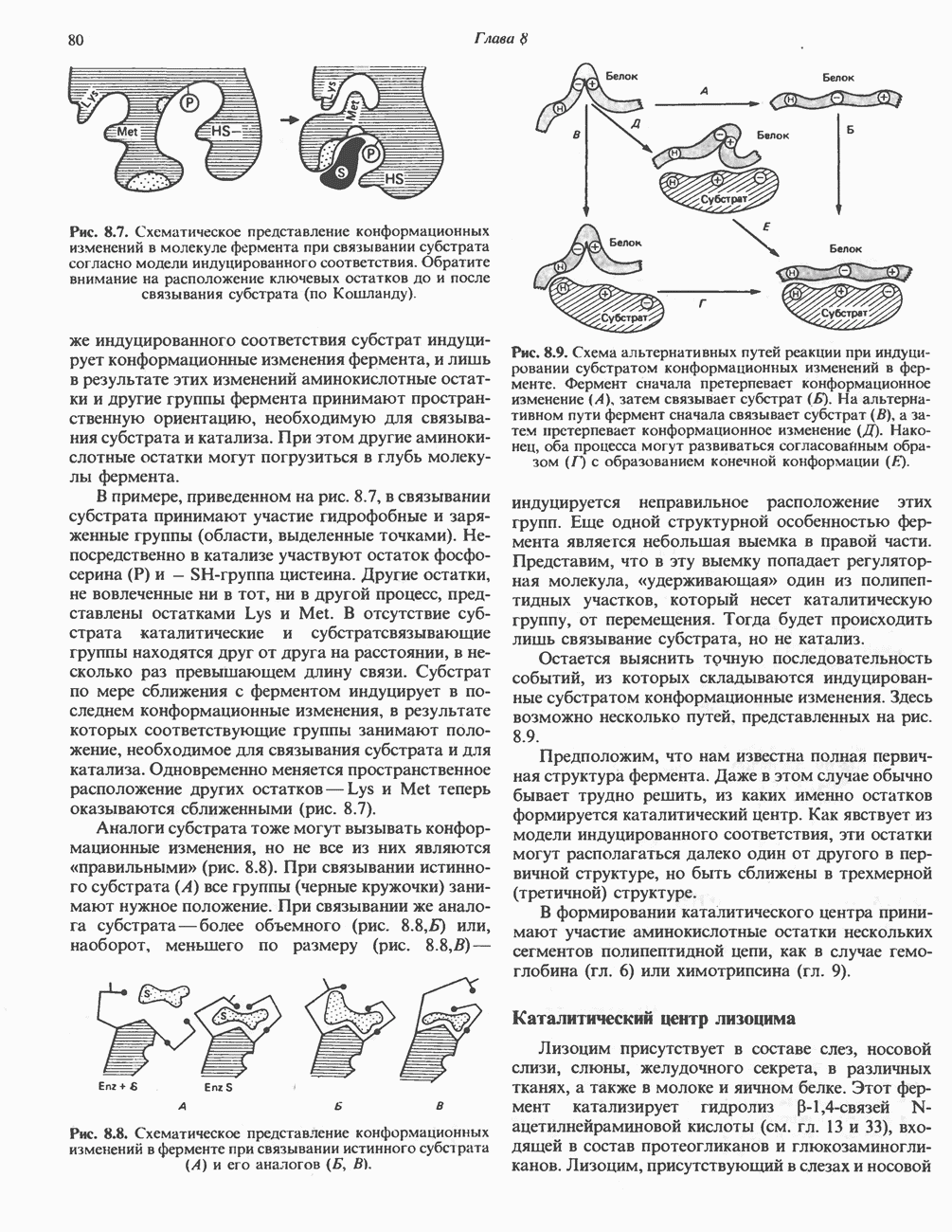
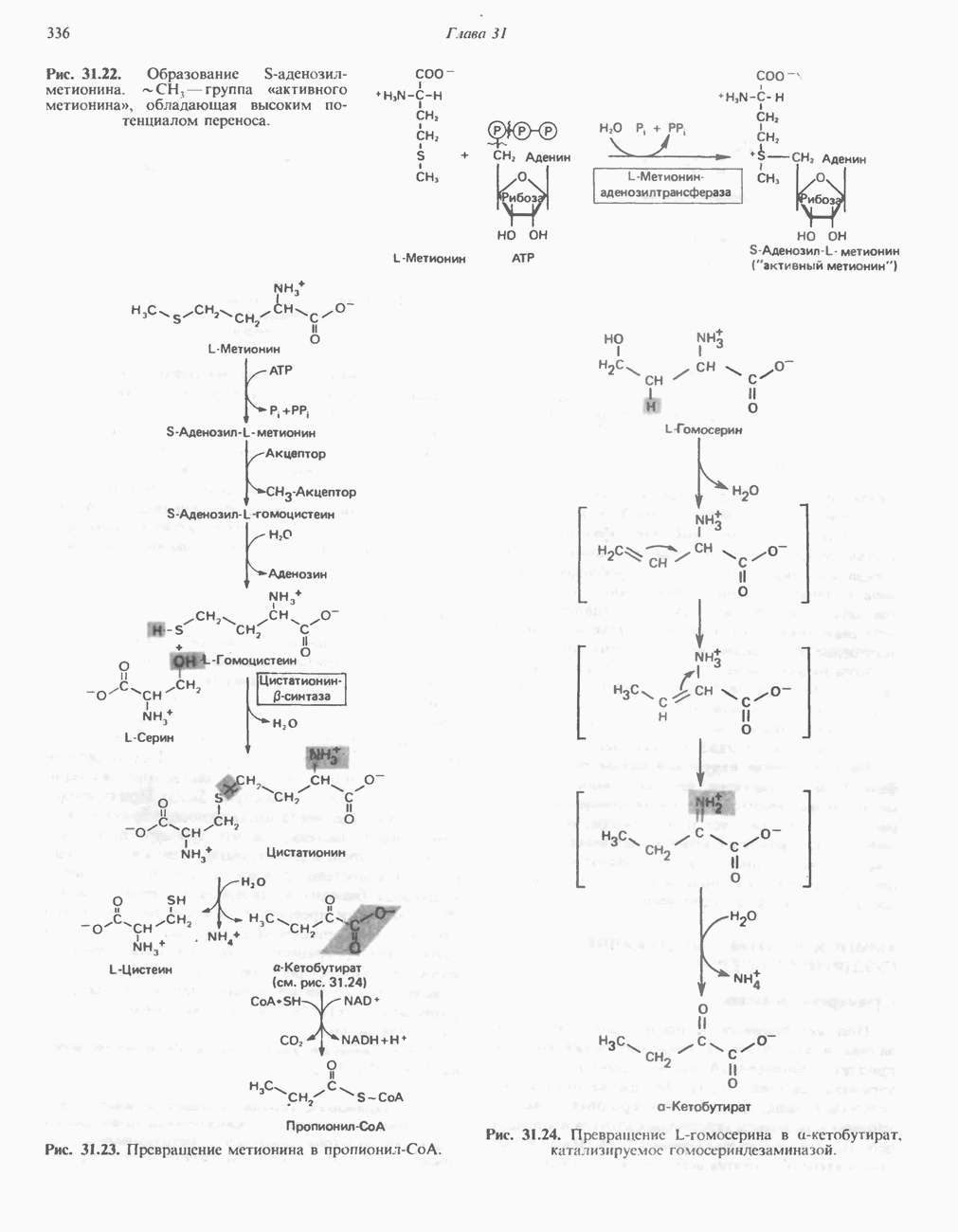
При понижении pH до 3,5 образуется апомиоглобин (миоглобин, не содержащий гема), и содержание а-спиралей резко падает, а последующее добавление мочевины к апомиоглобину при нейтральном pH приводит к почти полному их исчезновению. Последующее удаление мочевины диализом и добавление гема полностью восстанавливает число а-спиралей, а добавление  приводит к полному восстановлению биологической (кислородсвязываю-щей) активности. Таким образом, информация, содержащаяся в первичной структуре апомиоглобина, в присутствии гема однозначно детерминирует свертывание молекулы белка с образованием нативной, биологически активной конформации. Это важное положение распространяется и на другие белки: первичная структура белка определяет его вторичную и третичную структуру.
приводит к полному восстановлению биологической (кислородсвязываю-щей) активности. Таким образом, информация, содержащаяся в первичной структуре апомиоглобина, в присутствии гема однозначно детерминирует свертывание молекулы белка с образованием нативной, биологически активной конформации. Это важное положение распространяется и на другие белки: первичная структура белка определяет его вторичную и третичную структуру.
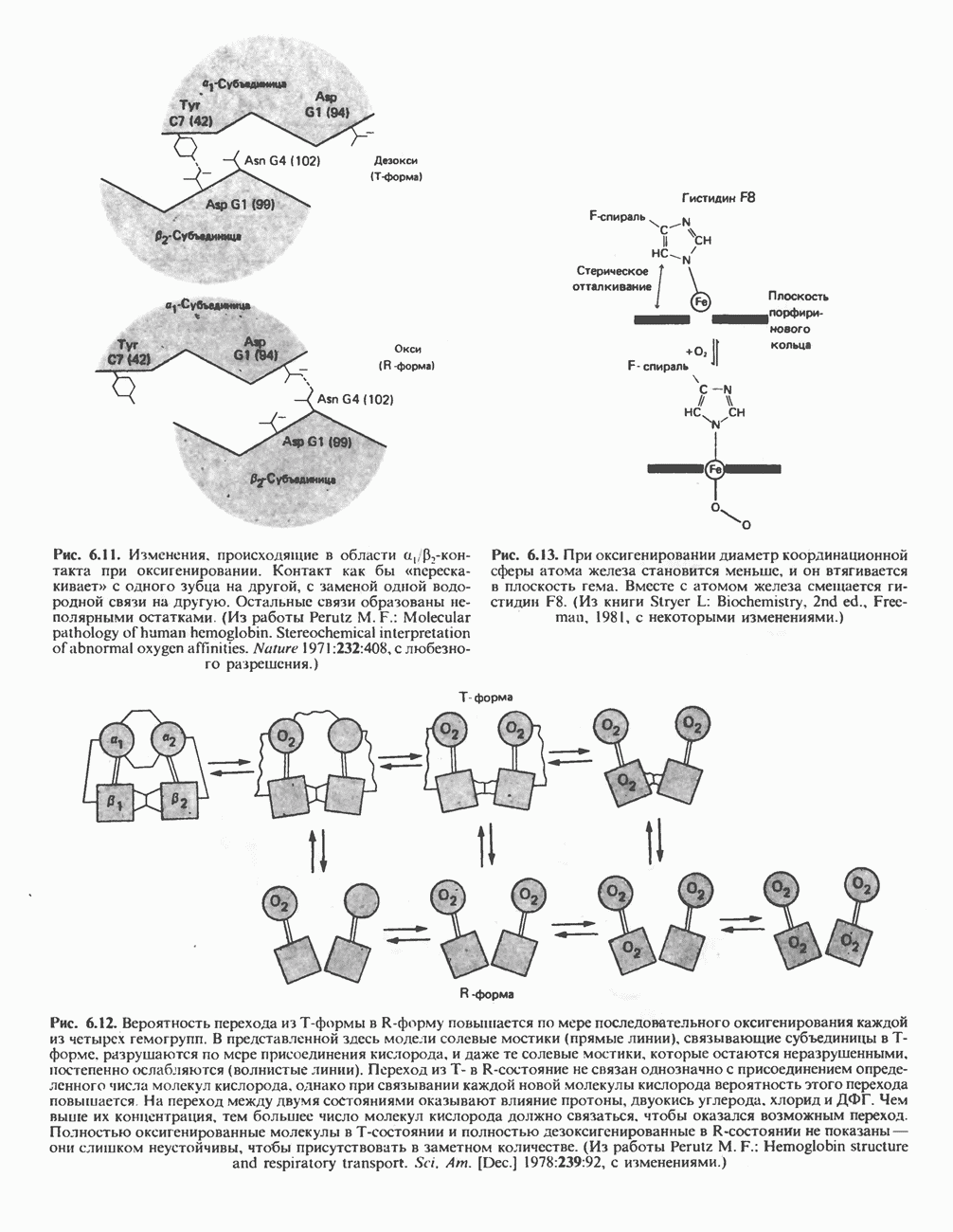
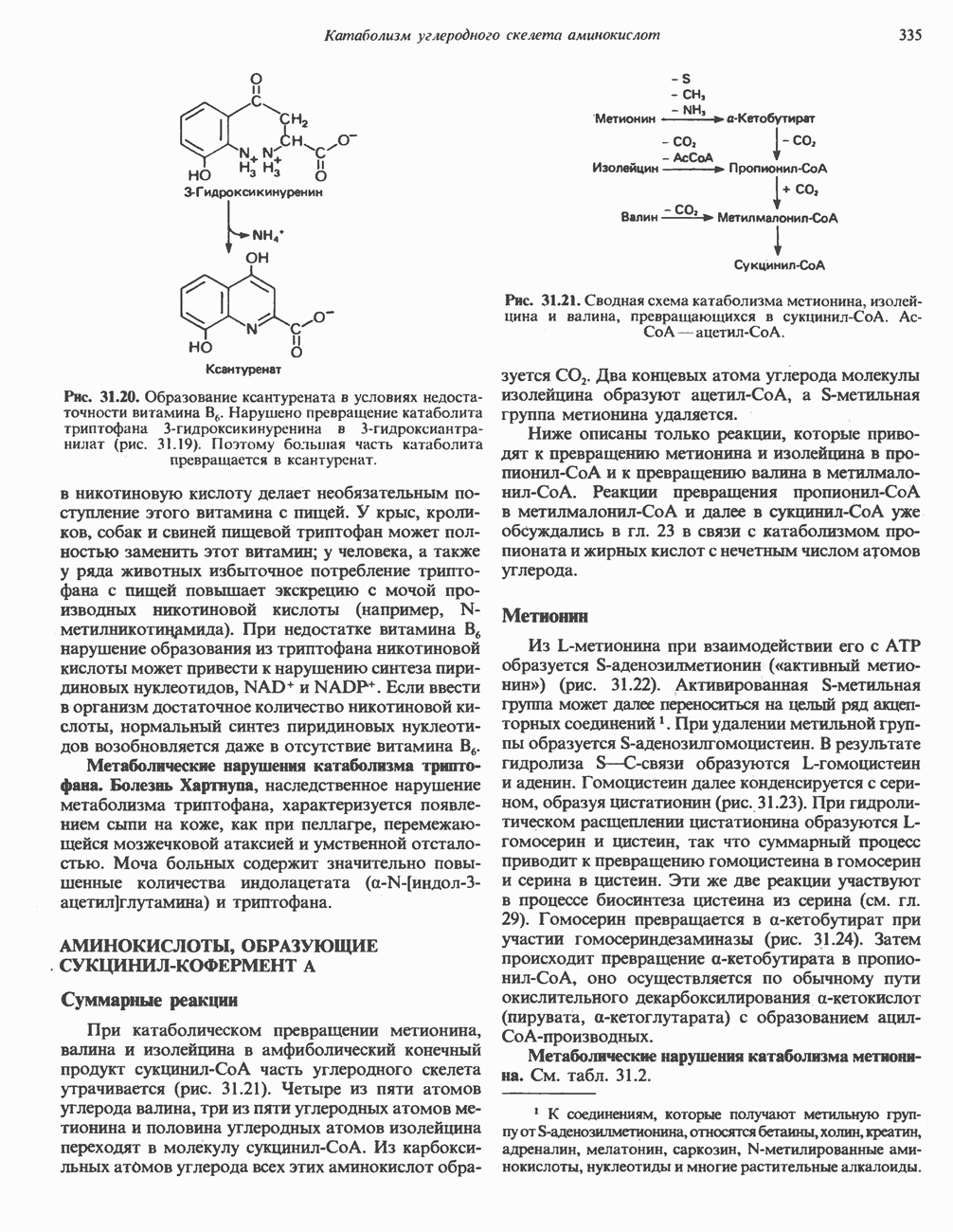
Пространственная ориентация атома железа, проксимального и дистального остатков гистидина в молекуле миоглобина
Гем в молекуле миоглобина расположен в щели между спиралями Е и F; его полярные пропионатные группы ориентированы к поверхности глобулы, а остальная часть находится внутри структуры и окружена неполярными остатками, за исключением  Пятое координационное положение атома железа занято атомом азота гетероциклического кольца проксимального гистидина
Пятое координационное положение атома железа занято атомом азота гетероциклического кольца проксимального гистидина  Дистальный гистидин
Дистальный гистидин  расположен по другую сторону гемового кольца, почти напротив
расположен по другую сторону гемового кольца, почти напротив  но шестое координационное положение атома железа
но шестое координационное положение атома железа  остается свободным (рис. 6.4).
остается свободным (рис. 6.4).
Расположение атома железа
В неоксигенированном миоглобине атом железа на 0,03 нм выступает из плоскости кольца в направлении  . В оксигенированном миоглобине атом кислорода занимает шестое координационное положение атома железа, а сам атом железа выступает из плоскости гема только на 0,01 нм. Таким образом, оксигенирование миоглобина сопровождается смещением атома железа и, следовательно,
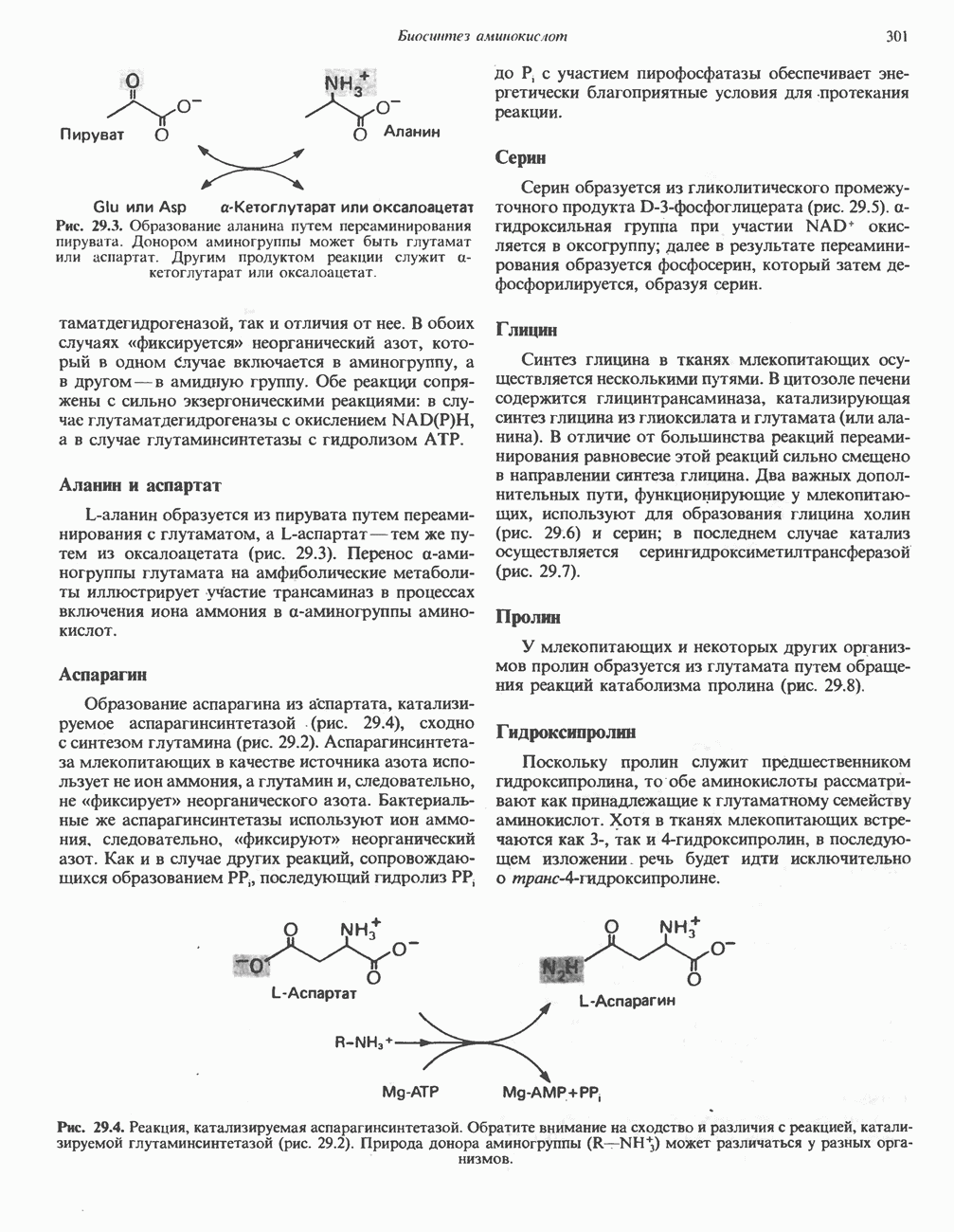
. В оксигенированном миоглобине атом кислорода занимает шестое координационное положение атома железа, а сам атом железа выступает из плоскости гема только на 0,01 нм. Таким образом, оксигенирование миоглобина сопровождается смещением атома железа и, следовательно,  и ковалентно связанных с ним остатков в направлении плоскости кольца; в результате эта область белковой глобулы принимает новую конформацию.
и ковалентно связанных с ним остатков в направлении плоскости кольца; в результате эта область белковой глобулы принимает новую конформацию.

Рис. 6.4. Положение молекулы кислорода в теме после ок-сигснирования. Изображены также имидазольные кольца двух важных остатков гистидина в глобиновой цепи, которые располагаются рядом с атомом железа. (Из работы Harper Н. A. et al., Physioldgische Chemie. Springer-Vcrlag, 1975, с любезного разрешения.)
Лиганды
Связь, образующаяся между атомом кислорода и атомом  при оксигенировании миоглобина направлена перпендикулярно плоскости кольца гема. Второй атом кислорода удален от дистального гистидина, и связь между атомами кислорода образует относительно плоскости гема угол 121° (рис. 6.5).
при оксигенировании миоглобина направлена перпендикулярно плоскости кольца гема. Второй атом кислорода удален от дистального гистидина, и связь между атомами кислорода образует относительно плоскости гема угол 121° (рис. 6.5).

Рис. 6.5. Предпочтительные ориентации молекул кислорода и окиси углерода, связанных с атомом железа изолированного гема (темные полоски).
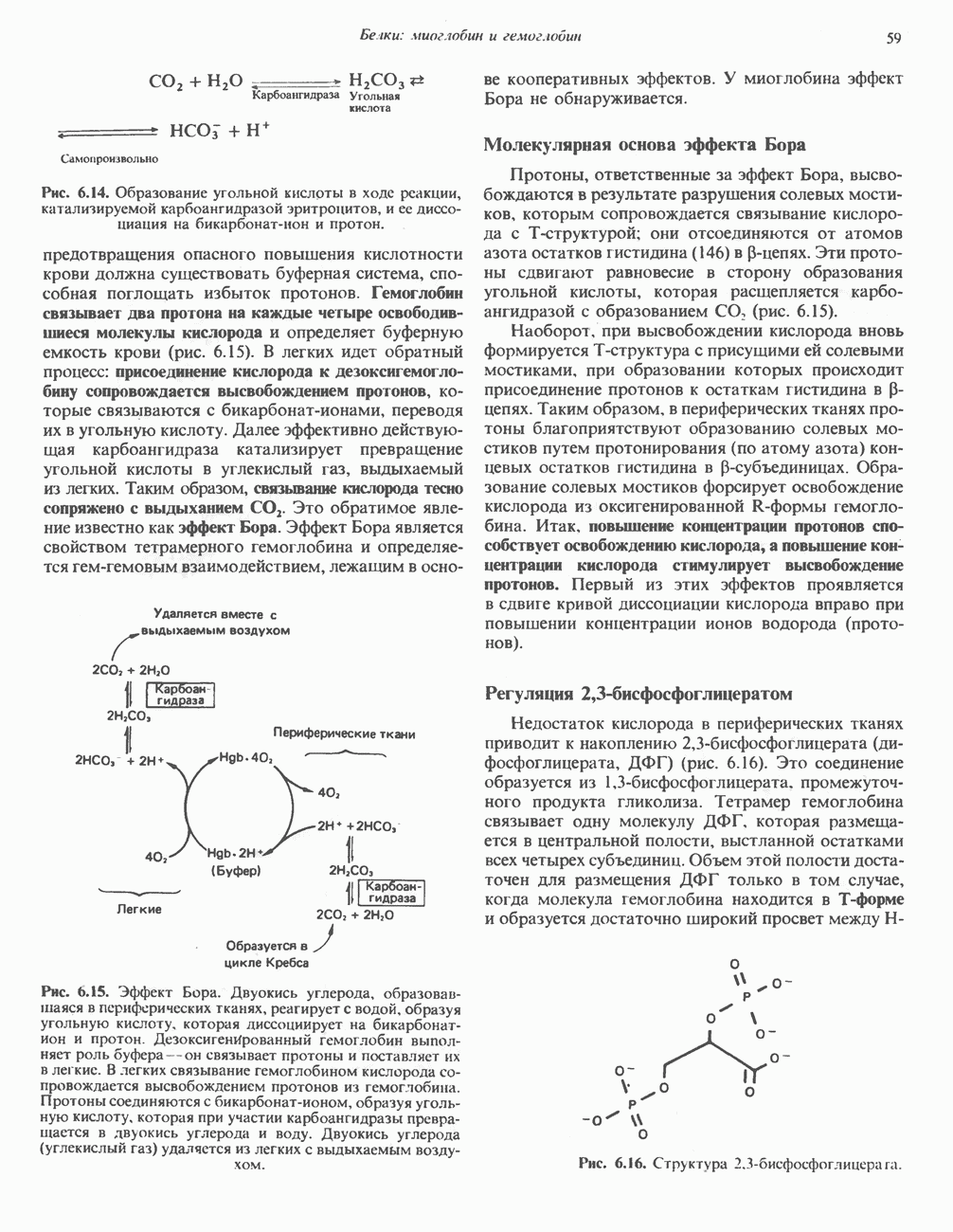
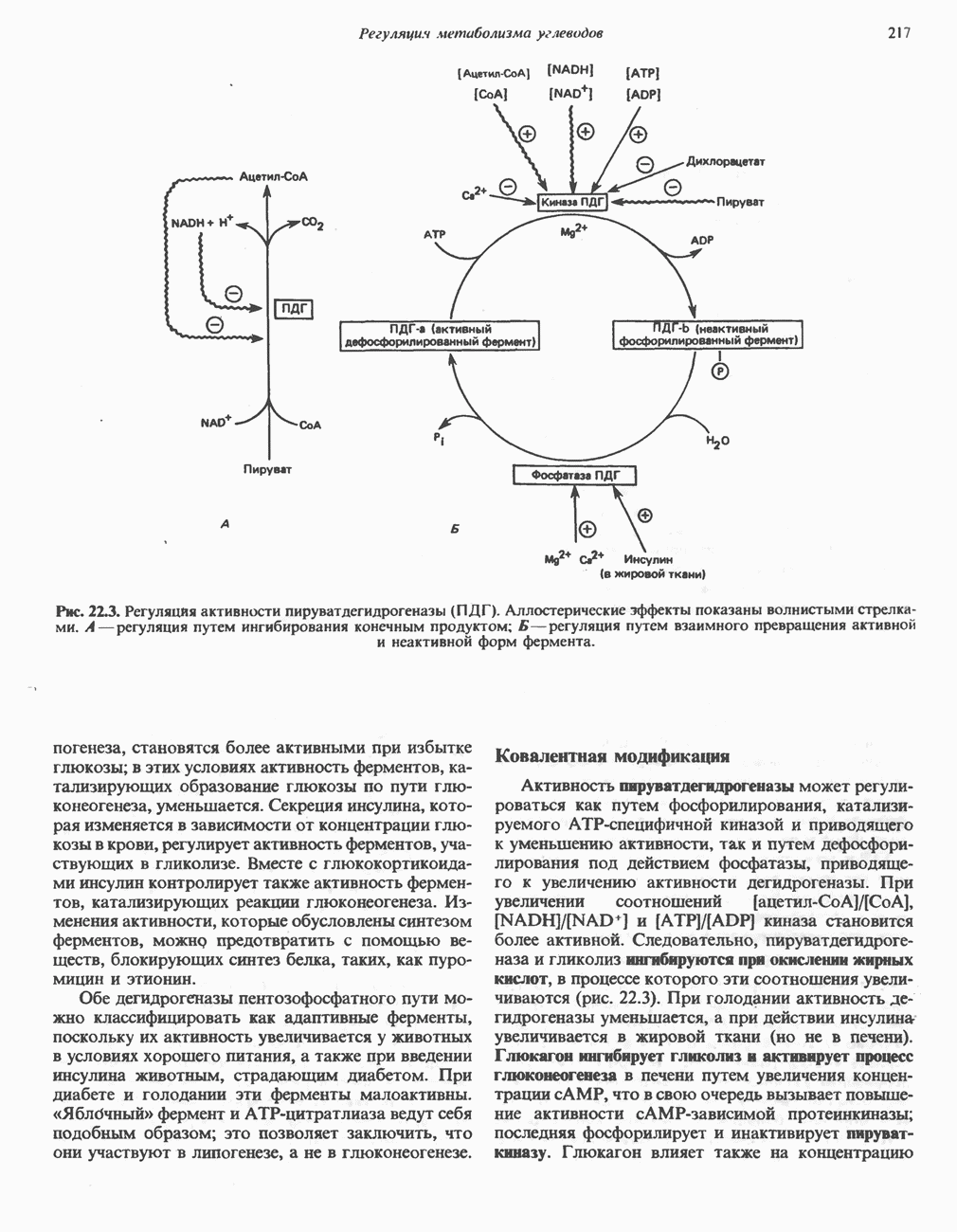
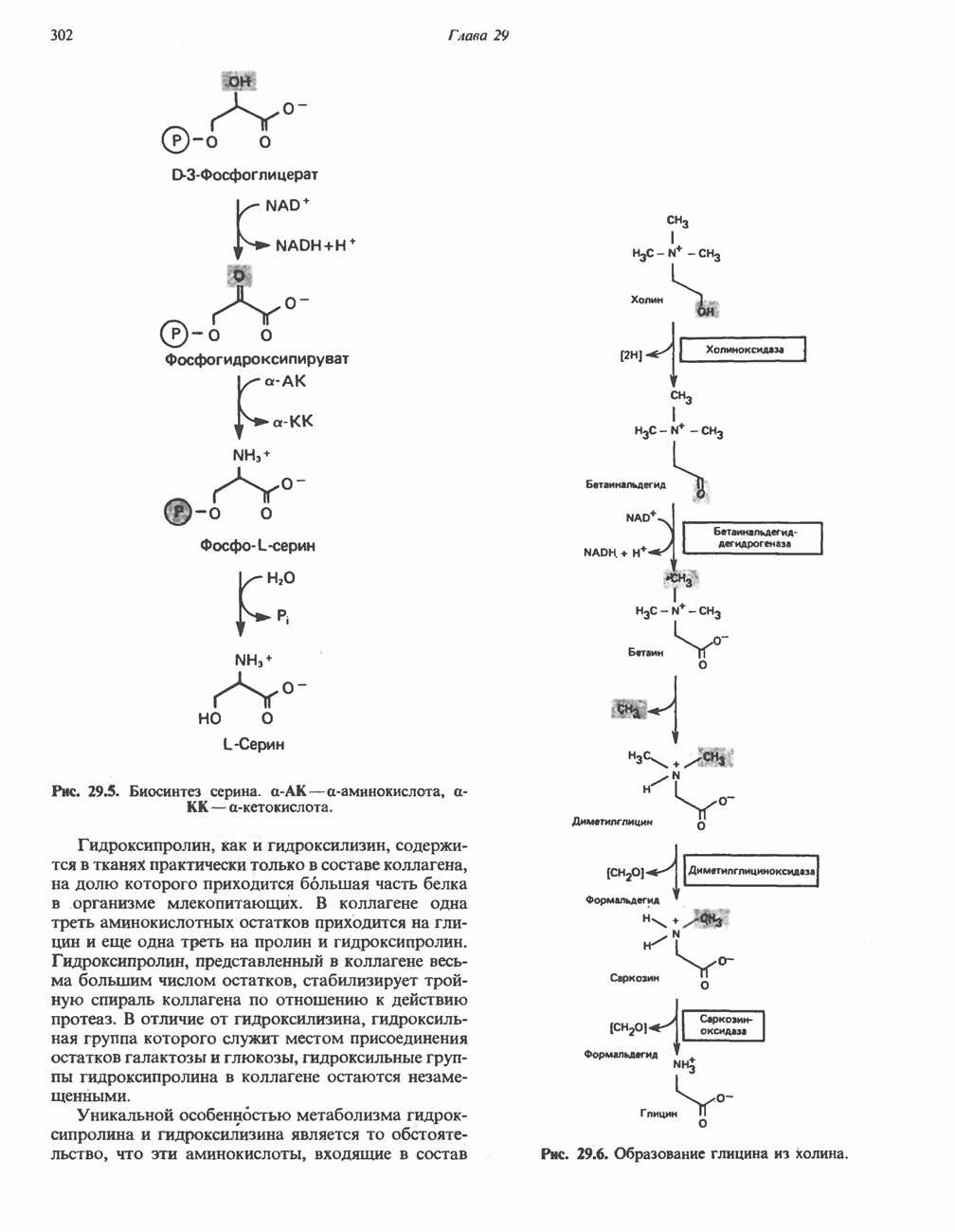
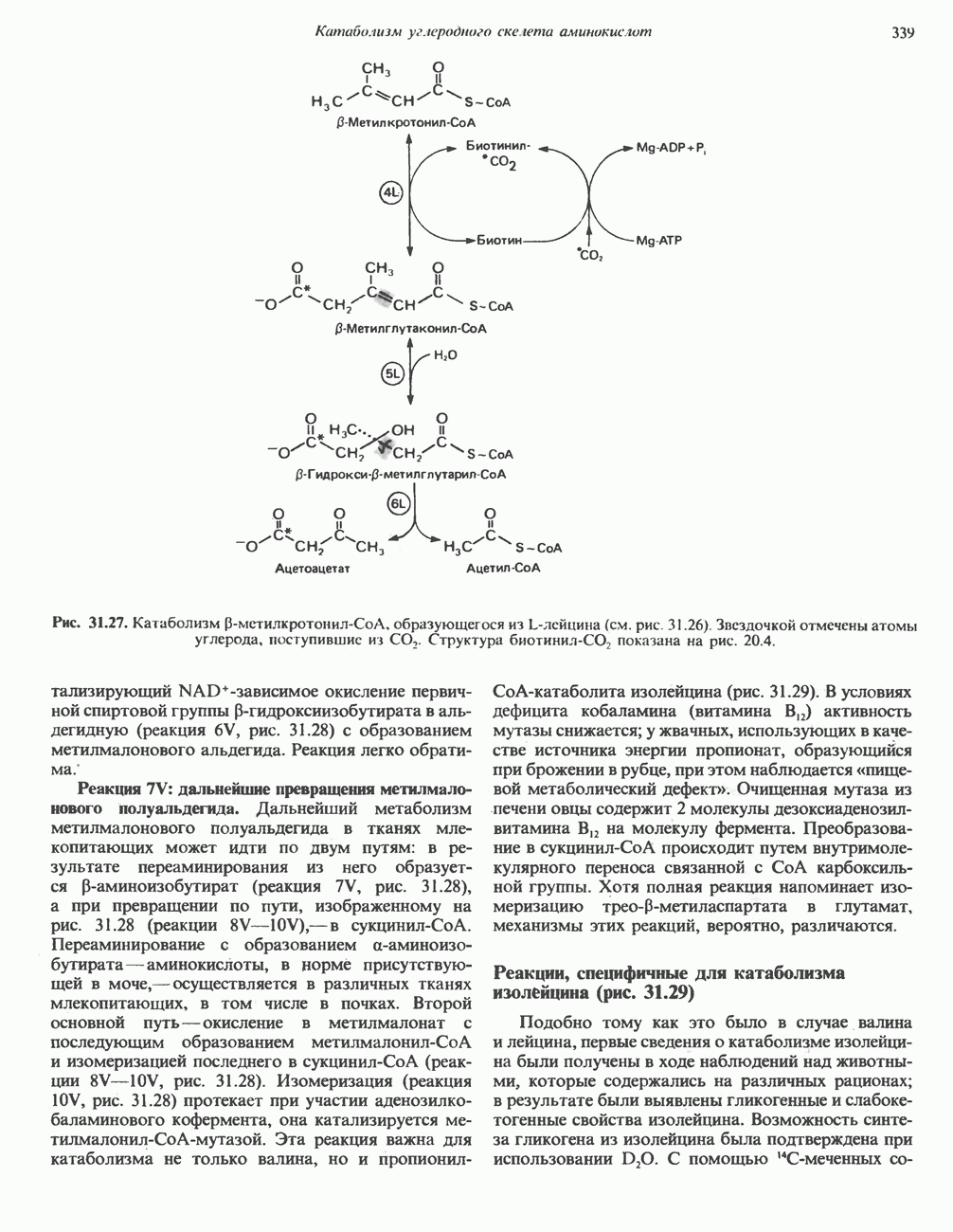
Окись углерода (СО) связывается с изолированным гемом примерно в 25 000 раз более прочно, чем кислород. Поскольку атмосферный воздух содержит следы СО и еще небольшое количество СО образуется в ходе нормального. катаболизма гема, возникает вопрос: почему же шестое координационное положение железа в миоглобине занято не СО, а молекулой 02? Связано это со стерическими ограничениями, возникающими в миоглобине. Молекула СО, связываясь с гемом, стремится принять такую ориентацию, при которой все три атома (Fe, находятся вдоль линии, перпендикулярной плоскости кольца гема (рис. 6.6). Для изолированного гема такая ориентация вполне возможна, но в миоглобине связыванию СО в такой ориентации стерически препятствует дистальный гистидин (рис. 6.6). Поэтому СО связывается в менее благоприятной конфигурации, что понижает прочность связи СО с гемом более чем на два порядка, так что она становится всего лишь в 200 раз прочнее, чем связь гем-02. Тем не менее небольшая часть молекул миоглобина (около 1%) в нормальных условиях связывает СО.
Кинетика оксигеиирования миоглобина
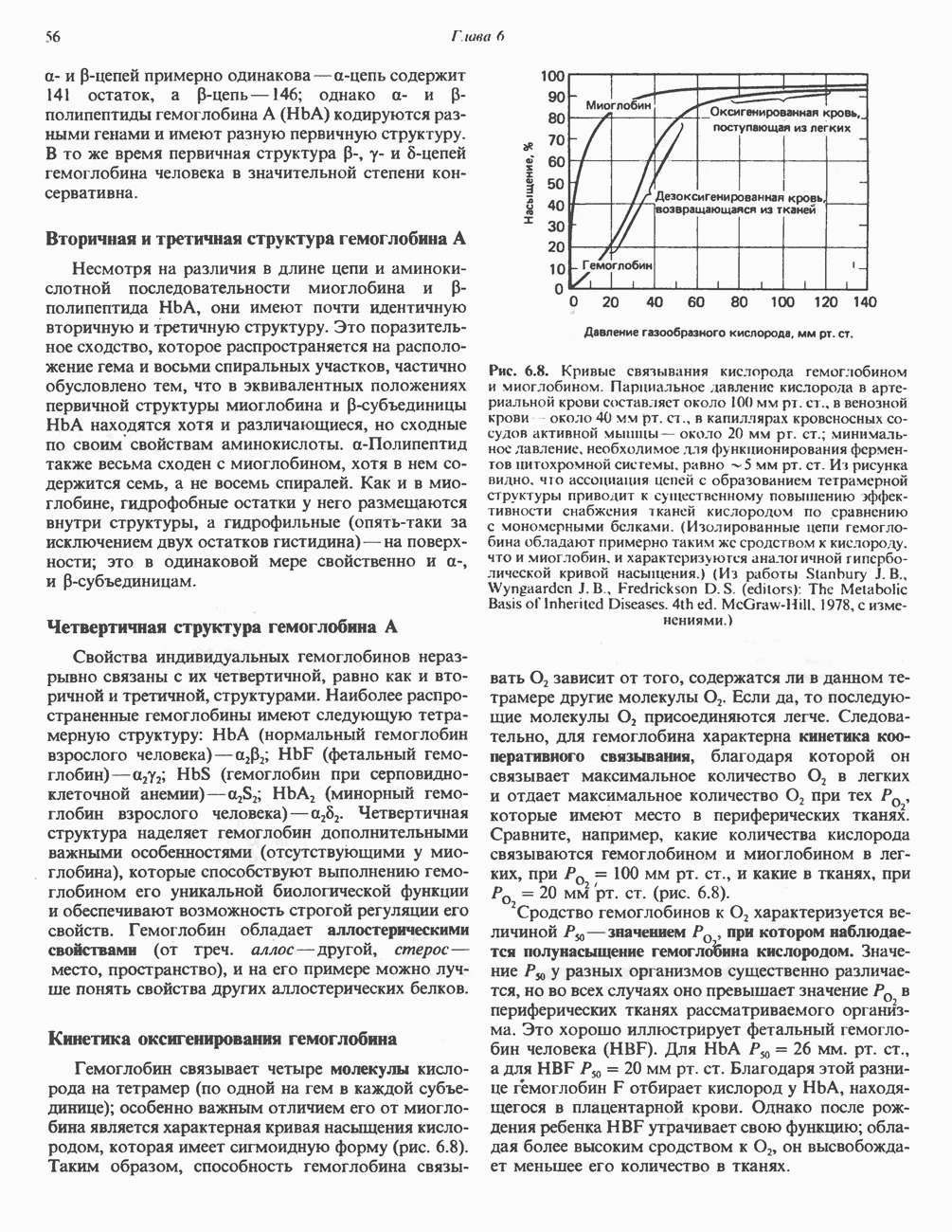
Почему миоглобин неспособен транспортировать кислород, но зато эффективно его запасает? Количество кислорода, связывающегося с миоглобином («процент насыщения»), зависит от концентрации кислорода в среде, непосредственно окружающей молекулу белка (эту концентрацию выражают как PQ — парциальное давление кислорода). Зависимость  между количеством связанного кислорода и PQ можно представить графически в виде кривой насыщения миоглобина кислородом (кривой диссоциации кислорода). Для миоглобина изотерма адсорбции кислорода имеет форму гиперболы (рис. 6.7)
между количеством связанного кислорода и PQ можно представить графически в виде кривой насыщения миоглобина кислородом (кривой диссоциации кислорода). Для миоглобина изотерма адсорбции кислорода имеет форму гиперболы (рис. 6.7)  в ткани, окружающей легочные капилляры, составляет 100 мм
в ткани, окружающей легочные капилляры, составляет 100 мм  поэтому миоглобин в легких мог бы весьма эффективно насыщаться кислородом.
поэтому миоглобин в легких мог бы весьма эффективно насыщаться кислородом.

Рис. 6.6. Ориентация молекул кислорода и окиси углерода, связанных с атомом железа гема в составе миоглобина. Дистальный гистидин  препятствует связыванию СО в предпочтительной для этой молекулы ориентации — под углом 90° к плоскости гемового кольца.
препятствует связыванию СО в предпочтительной для этой молекулы ориентации — под углом 90° к плоскости гемового кольца.

Рис. 6.7. Кривая насыщения миоглобина кислородом.
В венозной крови PQ равно 40 мм рт. ст., а в активно работающей мышце—около 20 мм рт. ст. Но даже при парциальном давлении 20 мм рт. ст. степень насыщения миоглобина кислородом будет весьма значительной, и поэтому миоглобин не может служить средством его доставки от легких к периферическим тканям. Однако при кислородном голодании, которым сопровождается тяжелая физическая работа, PQ в мышечной ткани может понизиться и до 5 мм рт. ст.; при столь низком давлении миоглобин легко отдает связанный кислород, обеспечивая тем самым окислительный синтез АТР в митохондриях мышечных клеток.
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие к русскому изданию
- Предисловие
- Глава 1. Биохимия и медицина
- Глава 2. Биомолекулы и биохимические методы
- КЛЕТКА
- ОБЩИЙ ЭКСПЕРИМЕНТАЛЬНЫЙ ПОДХОД, ИСПОЛЬЗУЕМЫЙ В БИОХИМИИ
- ОСНОВНЫЕ ДОСТИЖЕНИЯ БИОХИМИИ
- Раздел I. Структура и функции белков и ферментов
- Глава 3. Аминокислоты
- АМИНОКИСЛОТЫ
- ИОННЫЕ ФОРМЫ АМИНОКИСЛОТ
- СТРУКТУРА АМИНОКИСЛОТ
- РАСТВОРИМОСТЬ АМИНОКИСЛОТ
- ОБЩИЕ ХИМИЧЕСКИЕ РЕАКЦИИ
- СВОЙСТВА ИНДИВИДУАЛЬНЫХ АМИНОКИСЛОТ
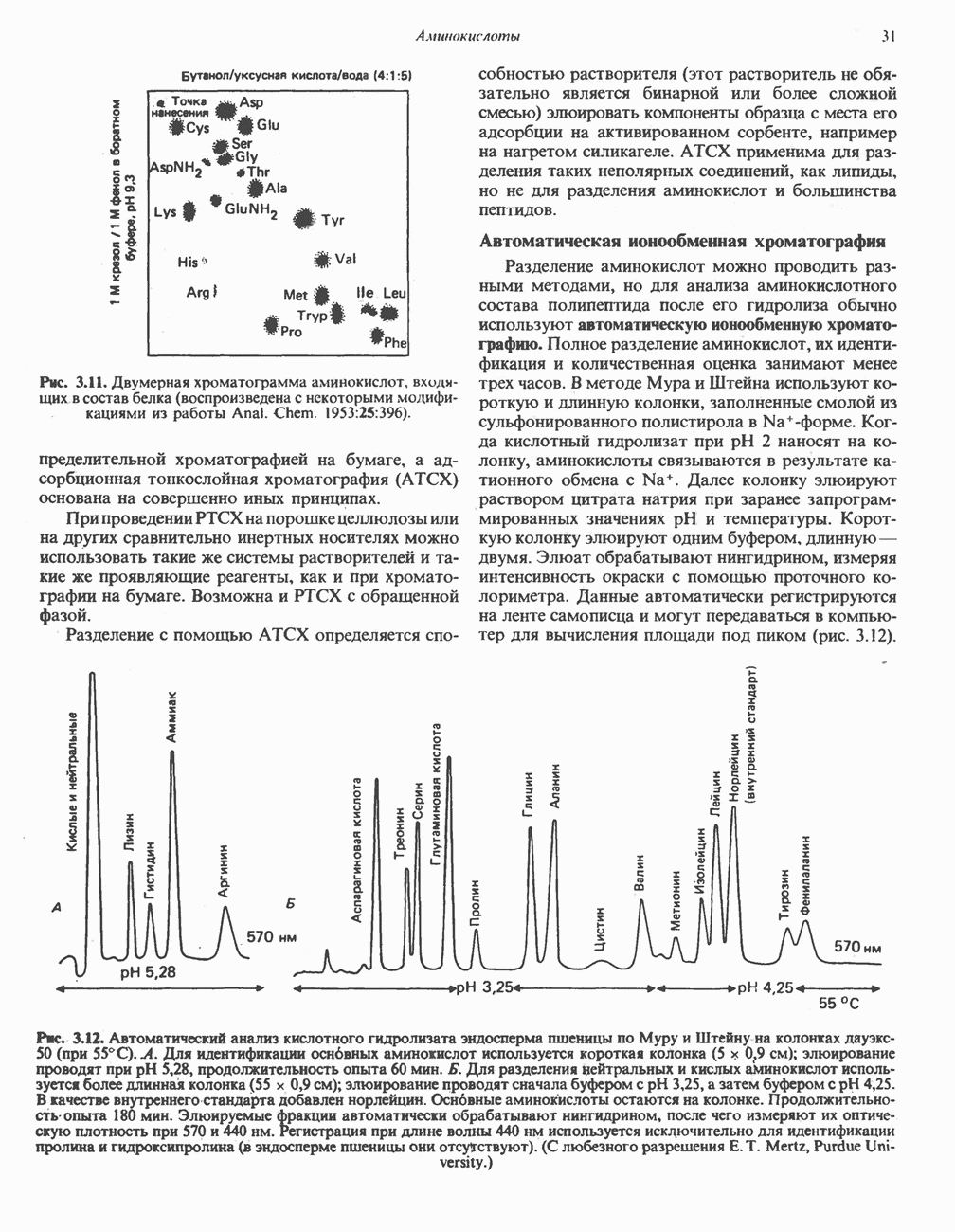
- МЕТОДЫ РАЗДЕЛЕНИЯ АМИНОКИСЛОТ
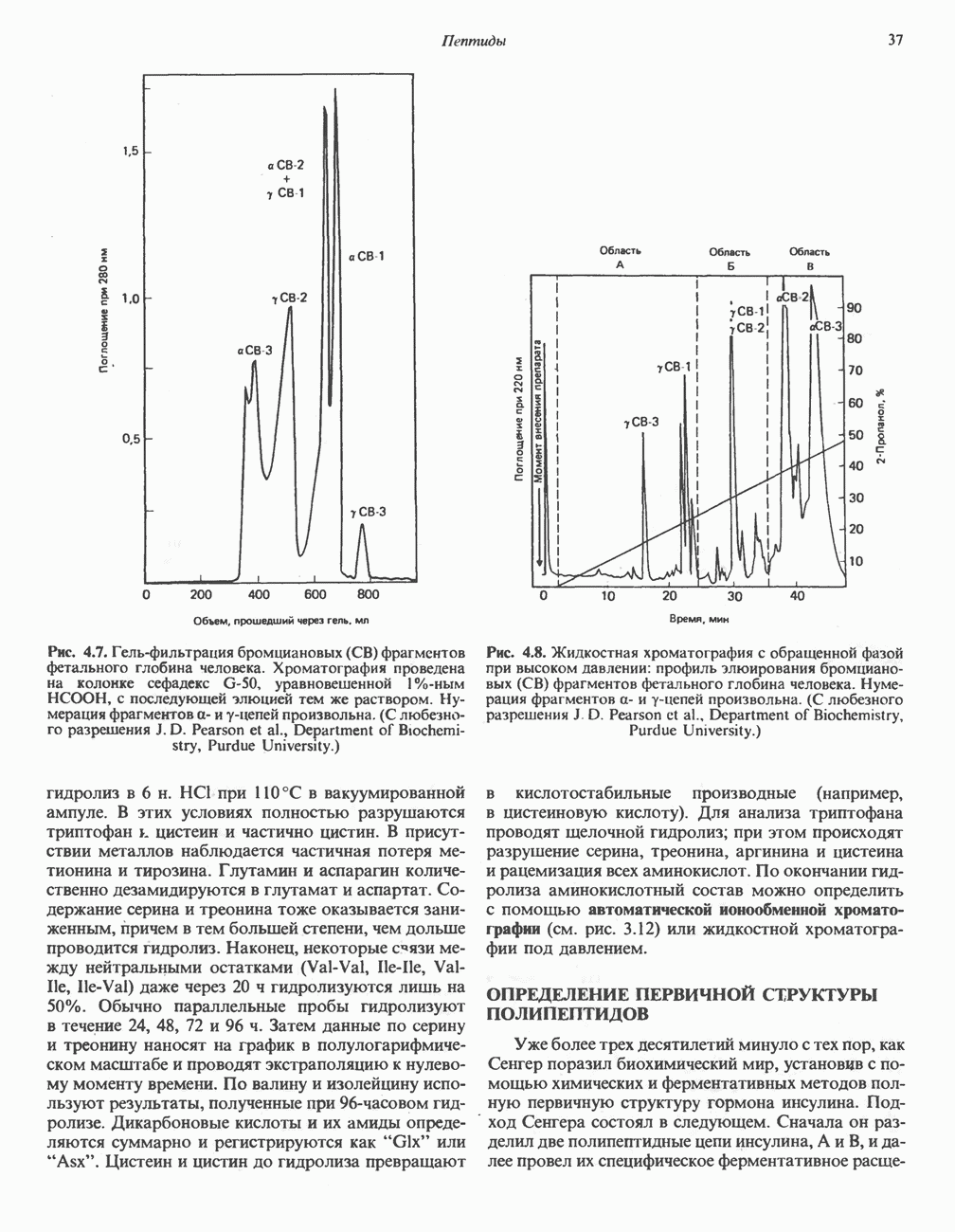
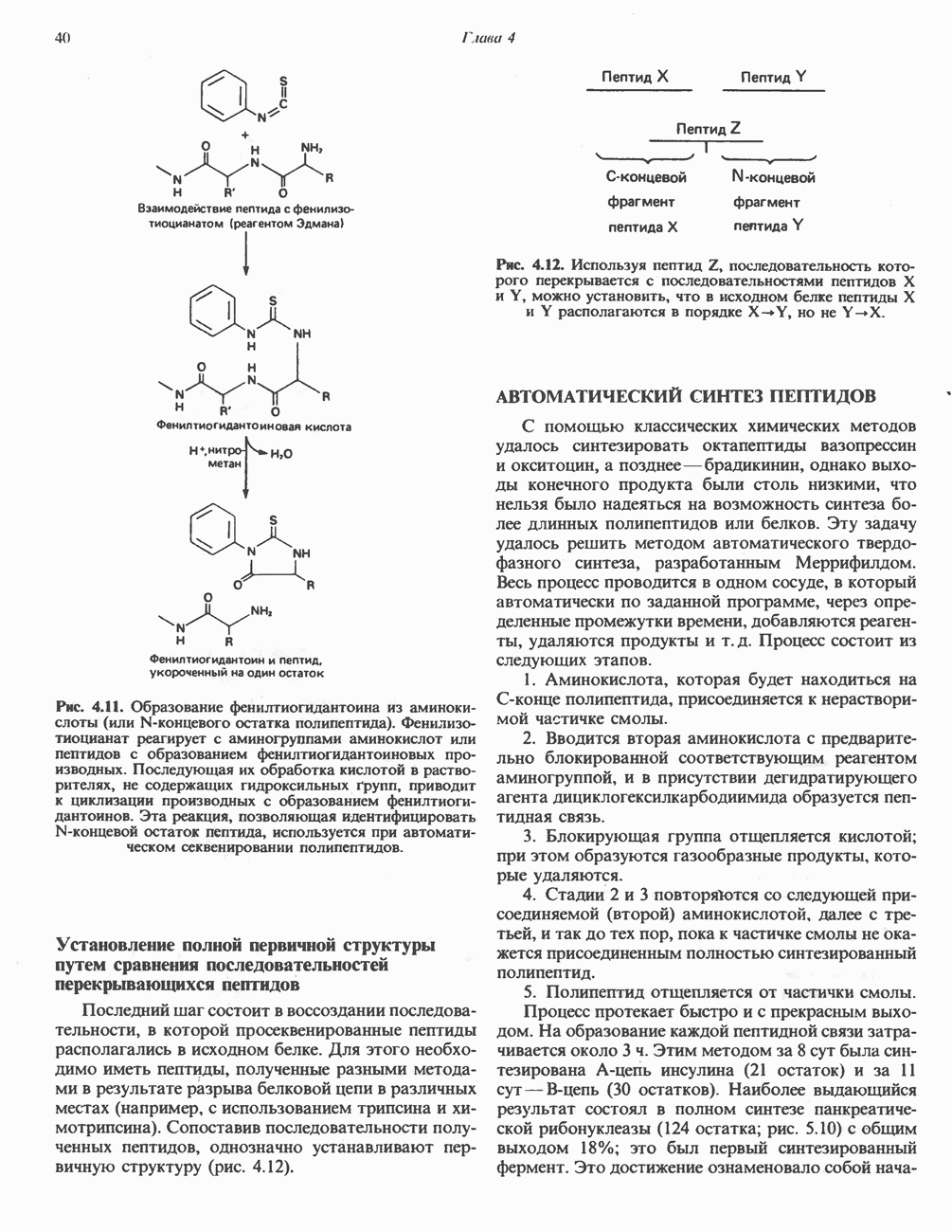
- Глава 4. Пептиды
- СТРУКТУРА ПЕПТИДОВ
- ИОННЫЕ ФОРМЫ ПЕПТИДОВ
- КОНФОРМАЦИЯ ПЕПТИДОВ В РАСТВОРЕ
- МЕТОДЫ РАЗДЕЛЕНИЯ ПЕПТИДОВ
- ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОГО СОСТАВА ПЕПТИДОВ
- ОПРЕДЕЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ ПОЛИПЕПТИДОВ
- АВТОМАТИЧЕСКОЕ ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ПОЛИПЕПТИДОВ МЕТОДОМ ЭДМАНА
- АВТОМАТИЧЕСКИЙ СИНТЕЗ ПЕПТИДОВ
- ЛИТЕРАТУРА
- Глава 5. Белки: структура и свойства
- КЛАССИФИКАЦИЯ БЕЛКОВ
- СВЯЗИ, ОТВЕТСТВЕННЫЕ ЗА ФОРМИРОВАНИЕ СТРУКТУРЫ БЕЛКА
- УПОРЯДОЧЕННЫЕ КОНФОРМАЦИИ ПОЛИПЕПТИДОВ
- УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКА
- ДЕНАТУРАЦИЯ
- МЕТОДЫ ОПРЕДЕЛЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ
- ОПРЕДЕЛЕНИЕ ВТОРИЧНОЙ И ТРЕТИЧНОЙ СТРУКТУРЫ МЕТОДОМ РЕНТГЕНОВСКОЙ КРИСТАЛЛОГРАФИИ
- ОПРЕДЕЛЕНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ
- ГЛАВА 6. Белки: миоглобин и гемоглобин
- ГЕМОПРОТЕИНЫ — МИОГЛОБИН И ГЕМОГЛОБИН
- МИОГЛОБИН
- ГЕМОГЛОБИНЫ
- Глава 7. Ферменты: общие свойства
- КОФЕРМЕНТЫ
- «ТРЕХТОЧЕЧНАЯ ФИКСАЦИЯ» СУБСТРАТОВ НА ФЕРМЕНТАХ
- СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
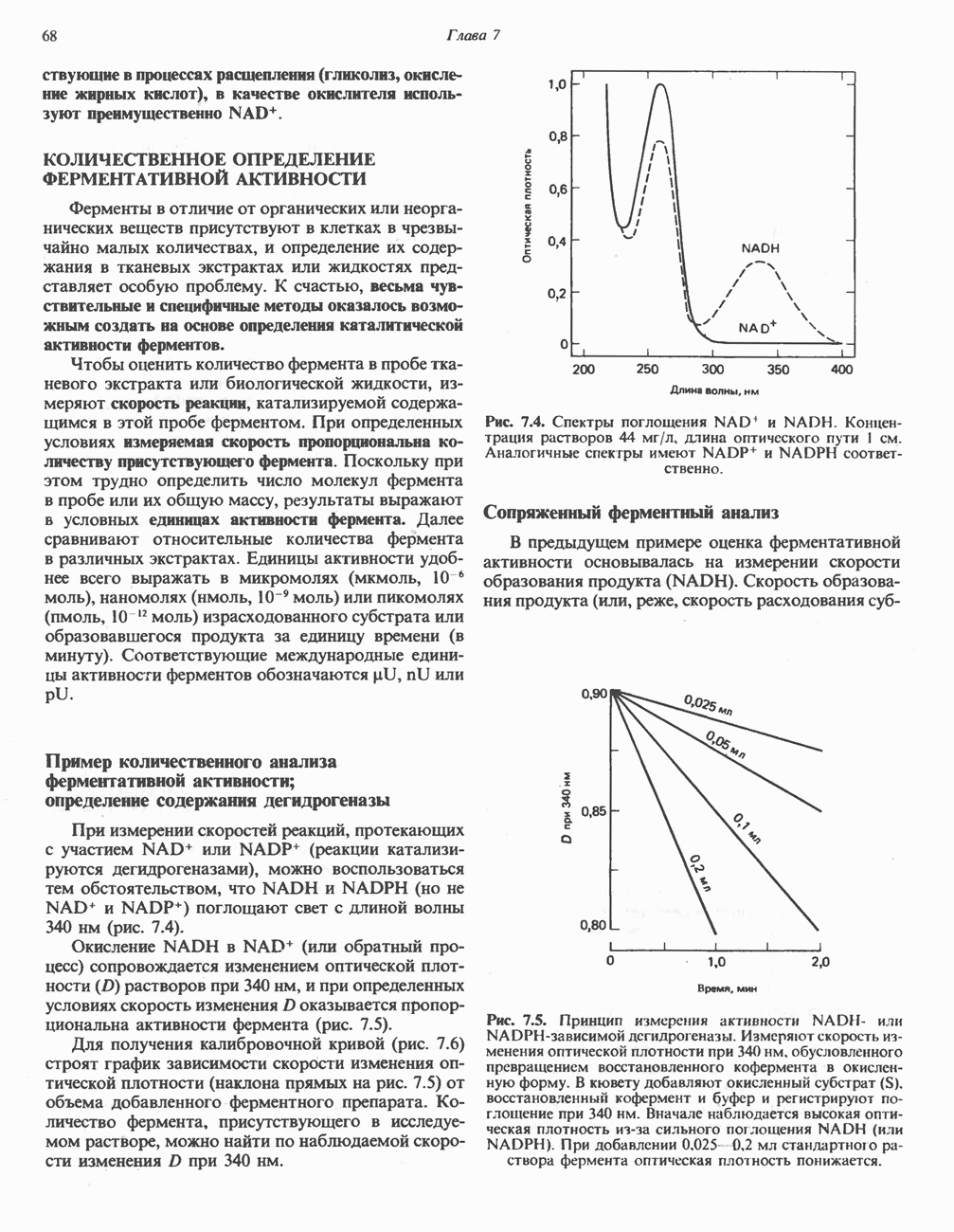
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
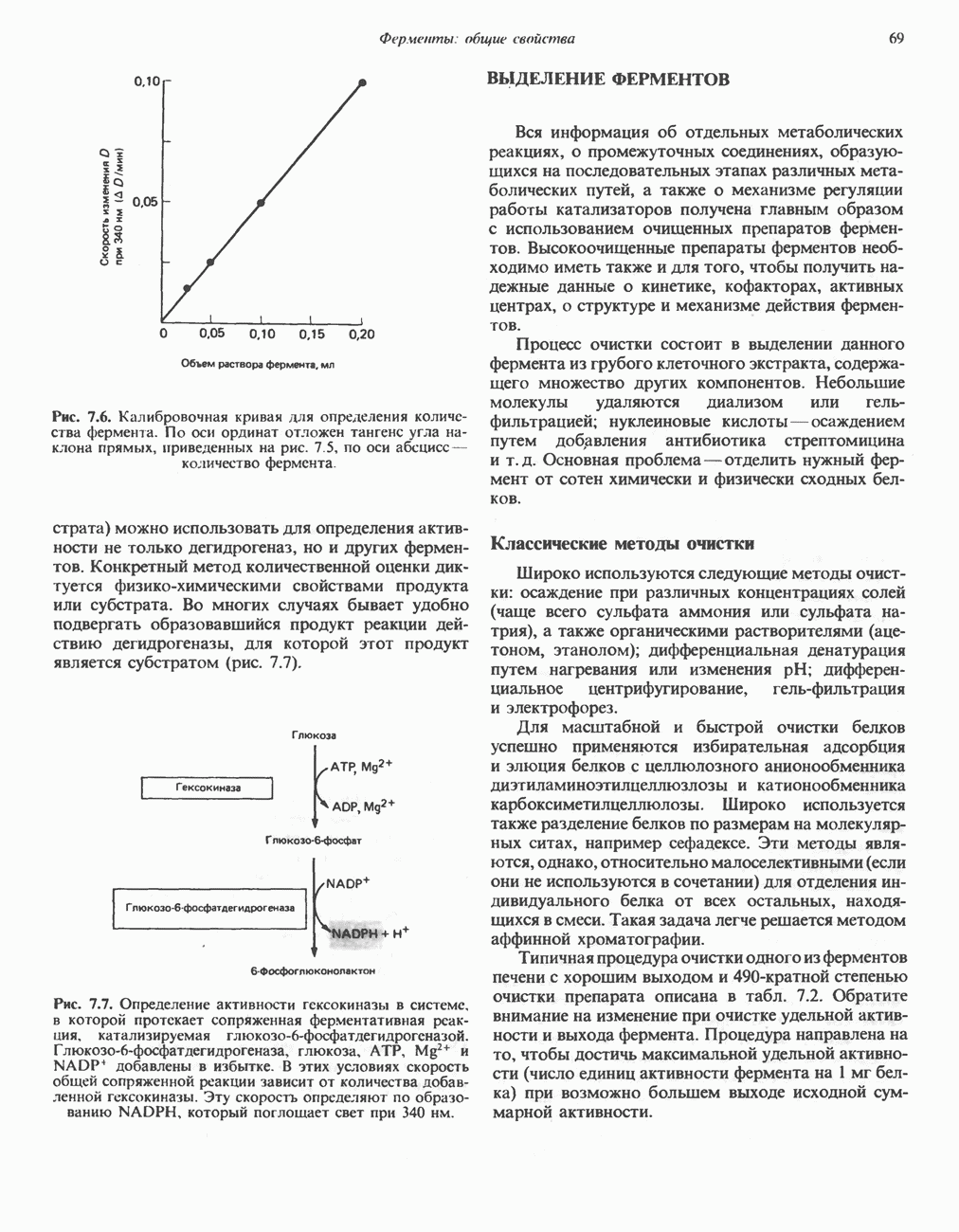
- ВЫДЕЛЕНИЕ ФЕРМЕНТОВ
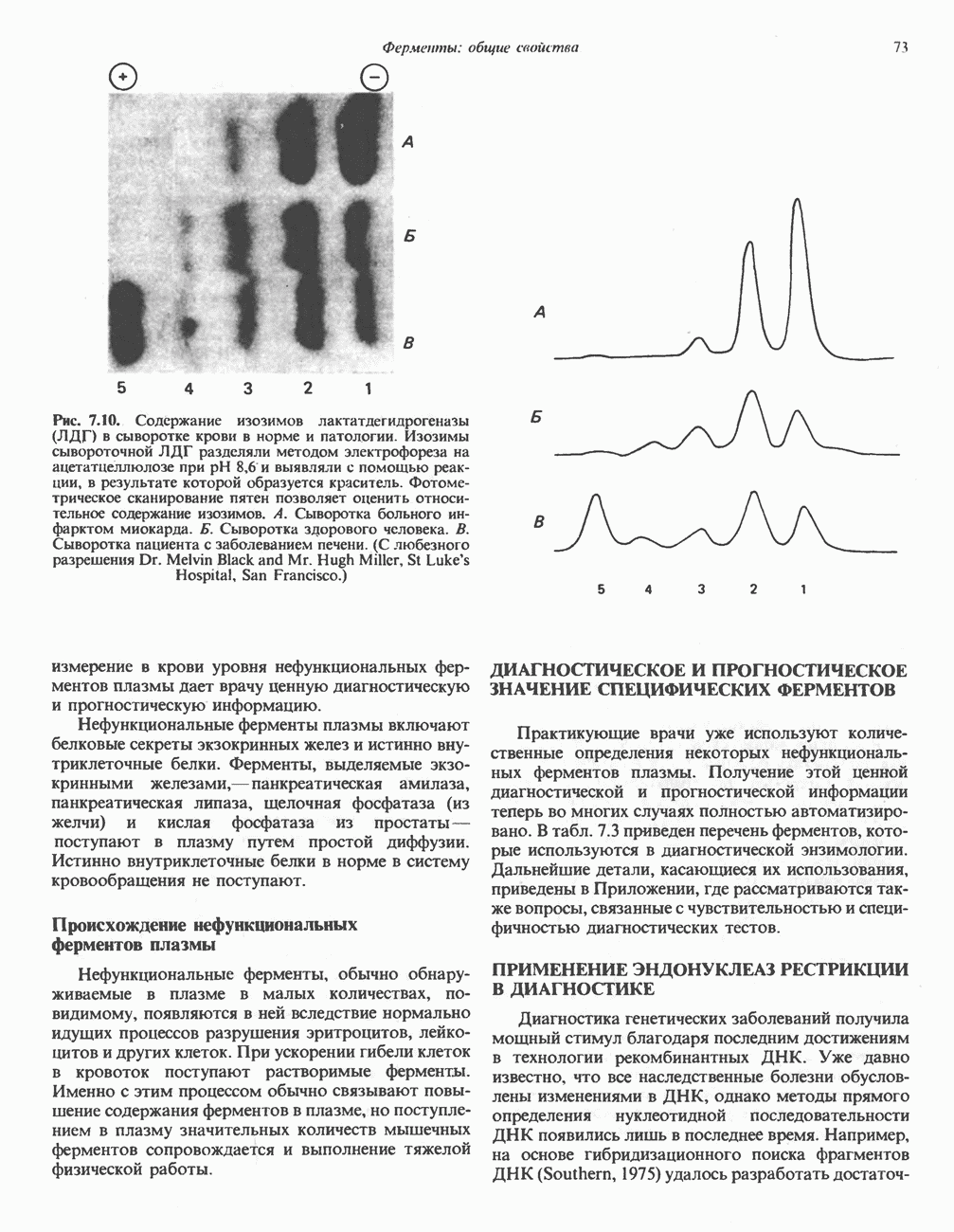
- ИЗОФЕРМЕНТЫ (ИЗОЗИМЫ)
- ФЕРМЕНТЫ В КЛИНИЧЕСКОЙ ДИАГНОСТИКЕ
- ДИАГНОСТИЧЕСКОЕ И ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ СПЕЦИФИЧЕСКИХ ФЕРМЕНТОВ
- ПРИМЕНЕНИЕ ЭНДОНУКЛЕАЗ РЕСТРИКЦИИ В ДИАГНОСТИКЕ
- ЛИТЕРАТУРА
- Глава 8. ФЕРМЕНТЫ: КИНЕТИКА
- ОБРАЗОВАНИЕ И РАСПАД ПЕРЕХОДНЫХ СОСТОЯНИЙ
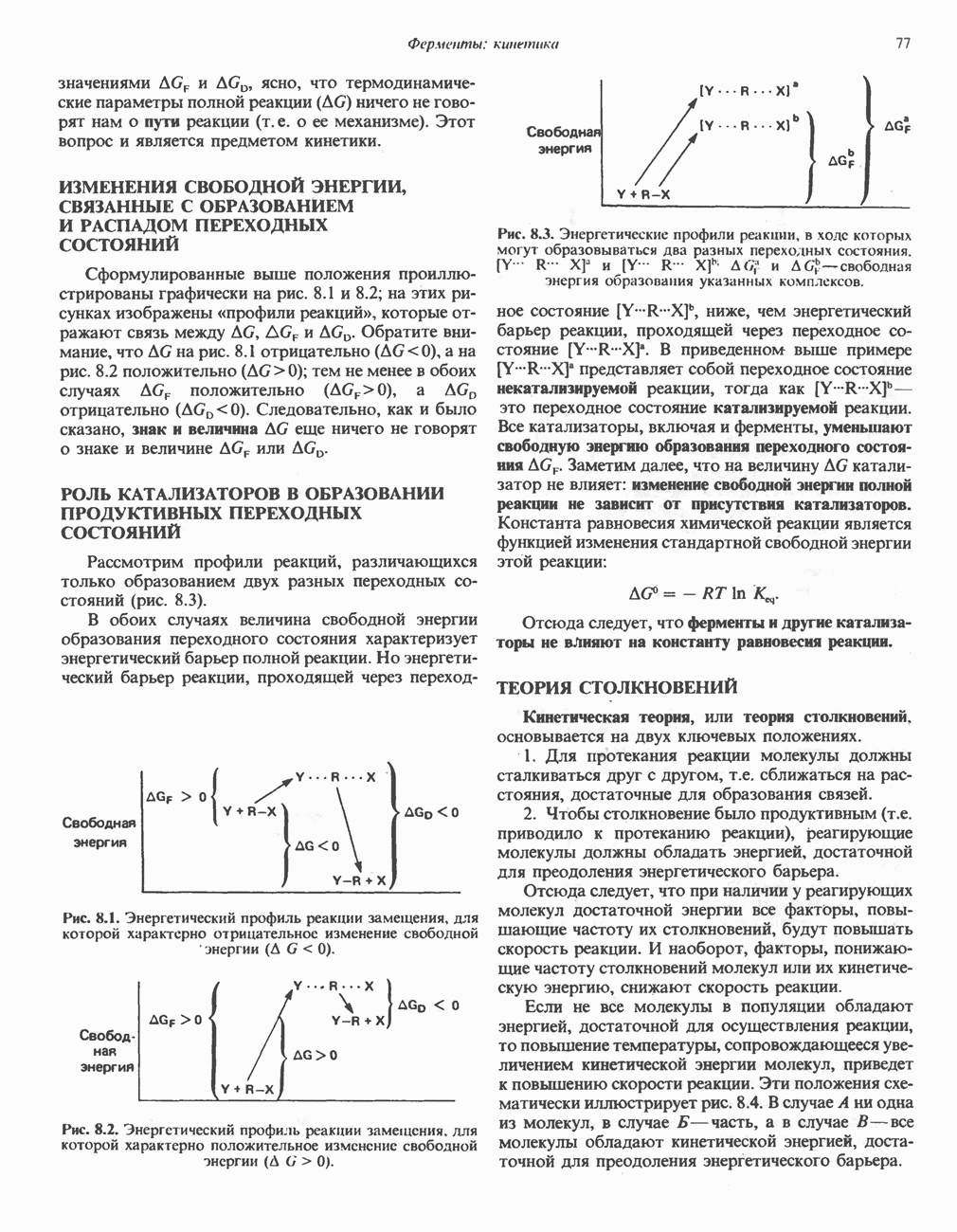
- ИЗМЕНЕНИЯ СВОБОДНОЙ ЭНЕРГИИ, СВЯЗАННЫЕ С ОБРАЗОВАНИЕМ И РАСПАДОМ ПЕРЕХОДНЫХ СОСТОЯНИЙ
- РОЛЬ КАТАЛИЗАТОРОВ В ОБРАЗОВАНИИ ПРОДУКТИВНЫХ ПЕРЕХОДНЫХ СОСТОЯНИЙ
- ТЕОРИЯ СТОЛКНОВЕНИЙ
- РОЛЬ ФЕРМЕНТОВ В РАЗРЫВЕ И ОБРАЗОВАНИИ КОВАЛЕНТНЫХ СВЯЗЕЙ
- КАТАЛИТИЧЕСКИЙ ЦЕНТР
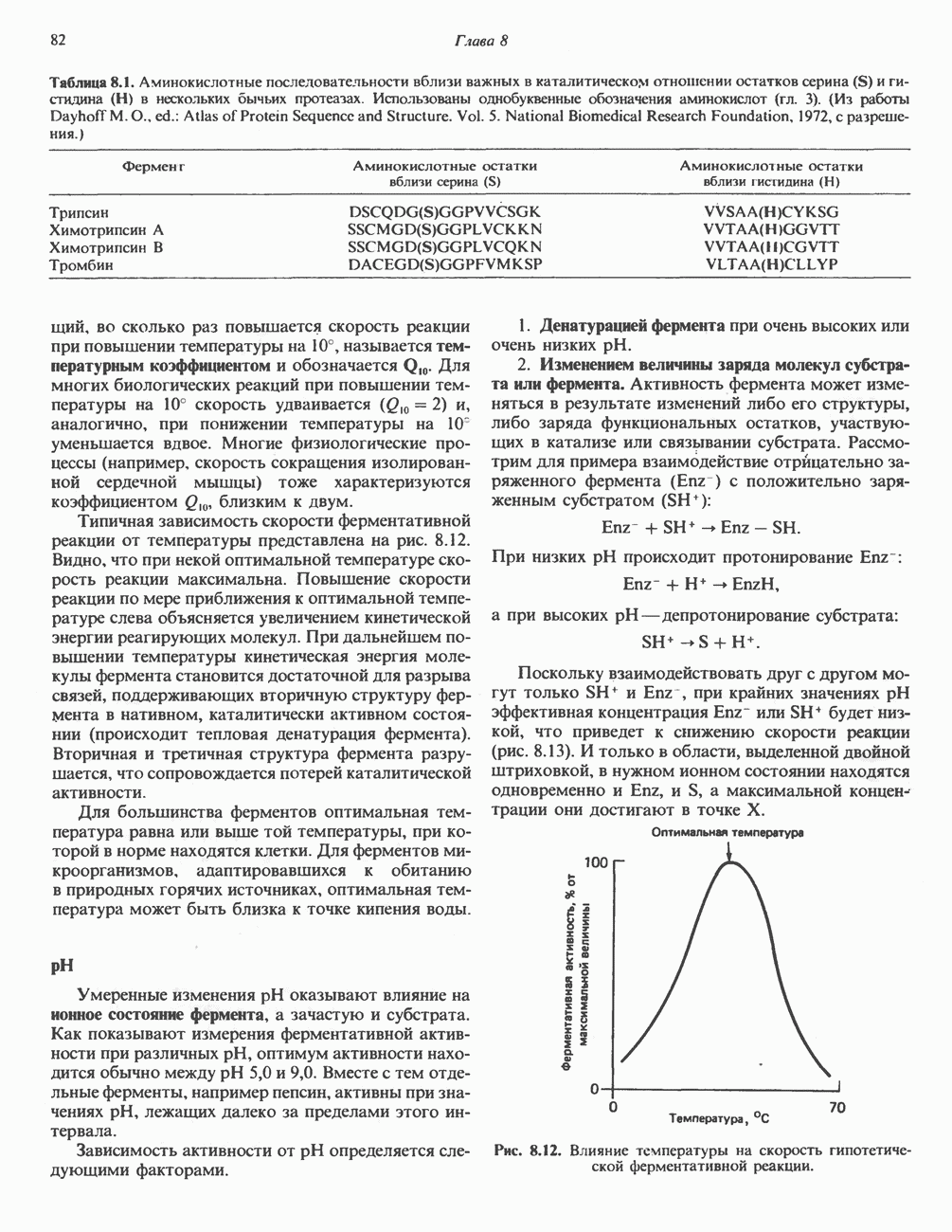
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА АКТИВНОСТЬ ФЕРМЕНТОВ
- КОНСТАНТА РАВНОВЕСИЯ
- КОНЦЕНТРАЦИЯ ФЕРМЕНТА
- КОНЦЕНТРАЦИЯ СУБСТРАТА
- УРАВНЕНИЕ МИХАЭЛИСА—МЕНТЕН
- ОГРАНИЧЕНИЯ, ПРИСУЩИЕ УРАВНЕНИЮ МИХАЭЛИСА — МЕНТЕН
- ИНГИБИРОВАНИЕ АКТИВНОСТИ ФЕРМЕНТОВ
- МОДУЛЯТОРЫ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
- Глава 9. Ферменты: механизм действия
- МЕХАНИЗМ КАТАЛИТИЧЕСКОГО ДЕЙСТВИЯ ХИМОТРИПСИНА
- РОЛЬ ИЗБИРАТЕЛЬНОГО ПРОТЕОЛИЗА В ФОРМИРОВАНИИ АКТИВНЫХ ЦЕНТРОВ ФЕРМЕНТОВ
- УПОРЯДОЧЕННОЕ И НЕУПОРЯДОЧЕННОЕ СВЯЗЫВАНИЕ СУБСТРАТОВ
- ФЕРМЕНТЫ КАК КАТАЛИЗАТОРЫ ОБЩЕГО КИСЛОТНОГО И ОБЩЕГО ОСНОВНОГО ТИПА
- ИОНЫ МЕТАЛЛОВ
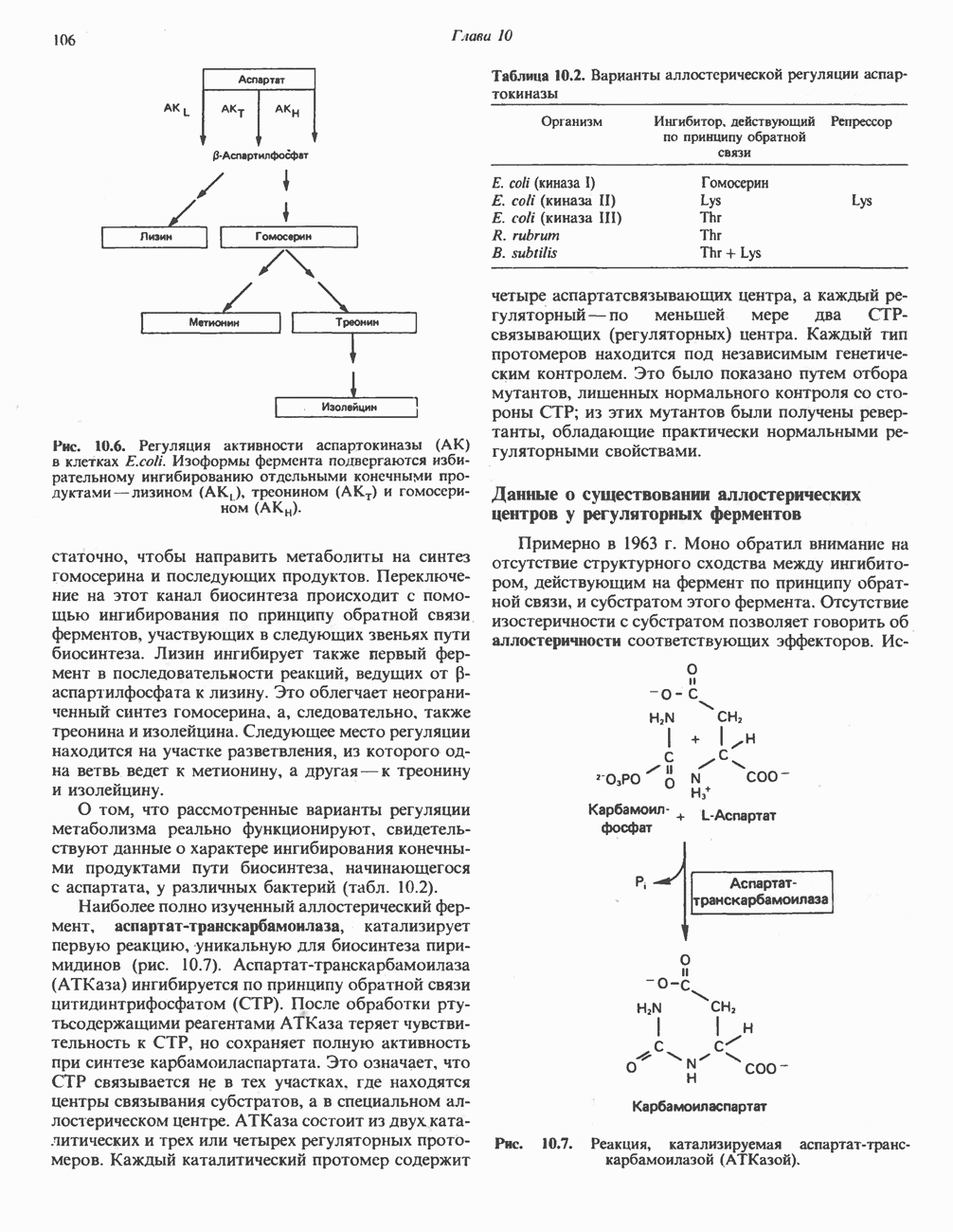
- Глава 10. Ферменты: регуляция активности
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА
- РЕГУЛЯЦИЯ КОЛИЧЕСТВА ФЕРМЕНТА ПУТЕМ РЕГУЛЯЦИИ СКОРОСТИ ЕГО СИНТЕЗА И РАСПАДА
- РЕГУЛЯЦИЯ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ФЕРМЕНТОВ
- АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ
- КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ФЕРМЕНТОВ
- Раздел II. Биоэнергетика и метаболизм углеводов и липидов
- Глава 11. Биоэнергетика
- СВОБОДНАЯ ЭНЕРГИЯ И ЗАКОНЫ ТЕРМОДИНАМИКИ
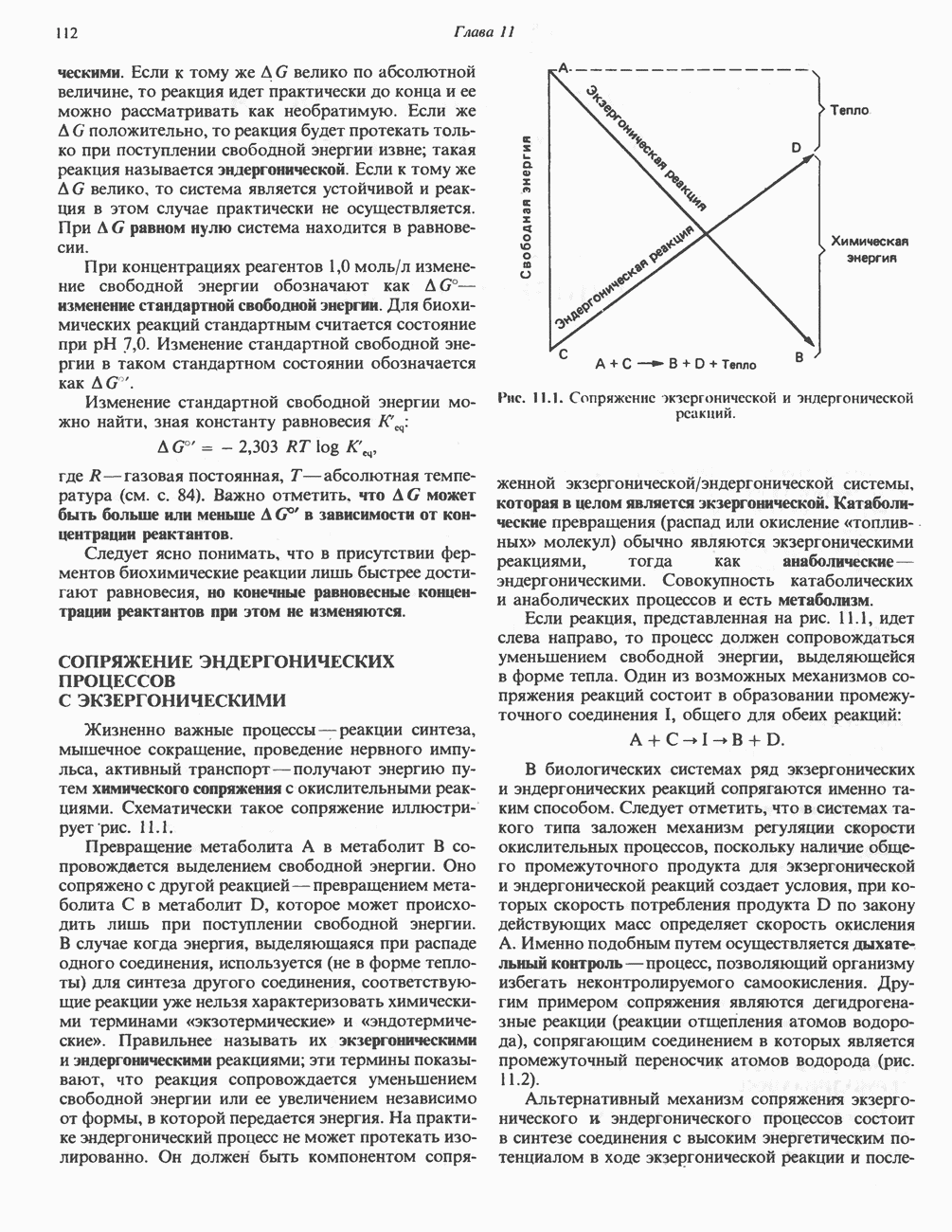
- СОПРЯЖЕНИЕ ЭНДЕРГОНИЧЕСКИХ ПРОЦЕССОВ С ЭКЗЕРГОНИЧЕСКИМИ
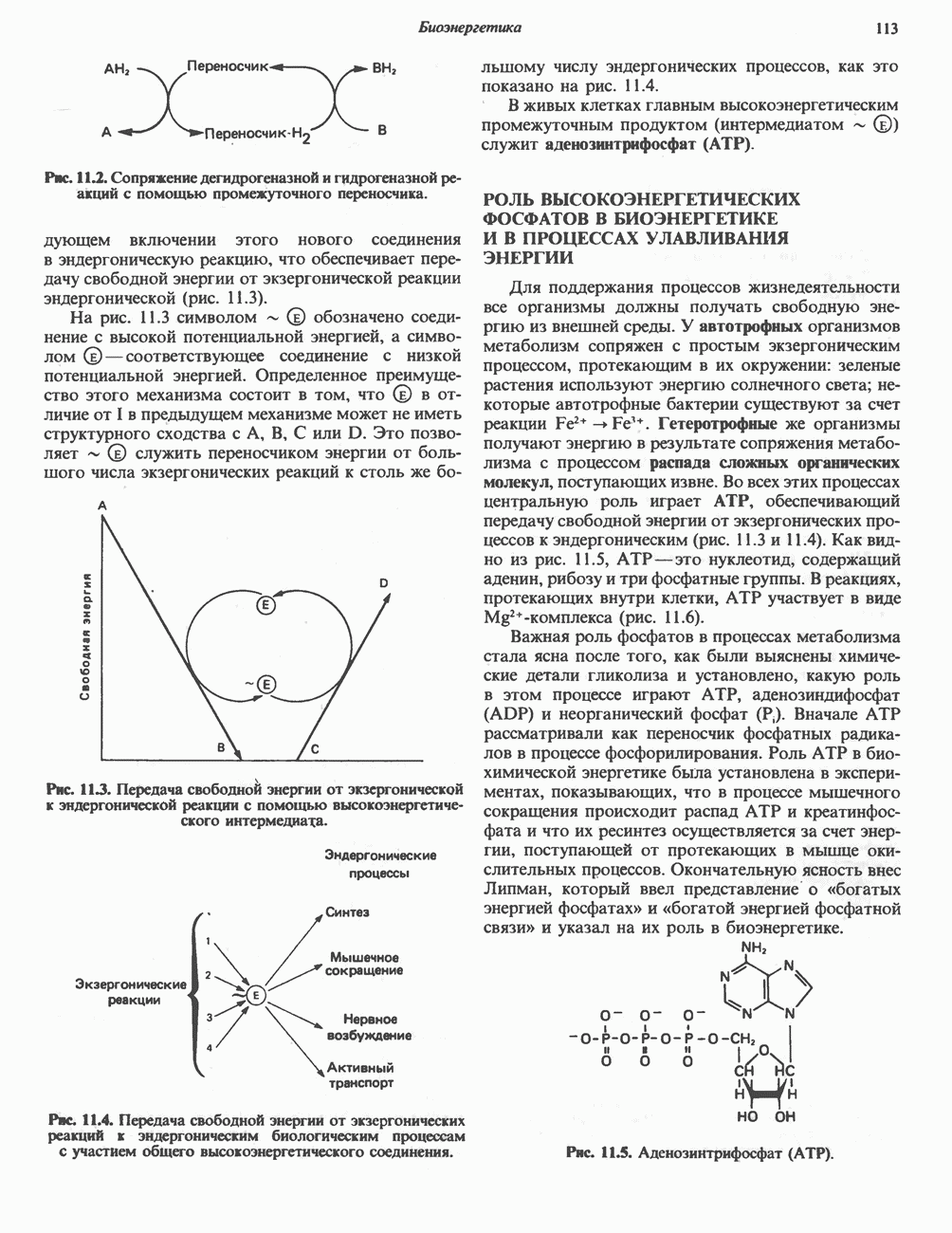
- РОЛЬ ВЫСОКОЭНЕРГЕТИЧЕСКИХ ФОСФАТОВ В БИОЭНЕРГЕТИКЕ И В ПРОЦЕССАХ УЛАВЛИВАНИЯ ЭНЕРГИИ
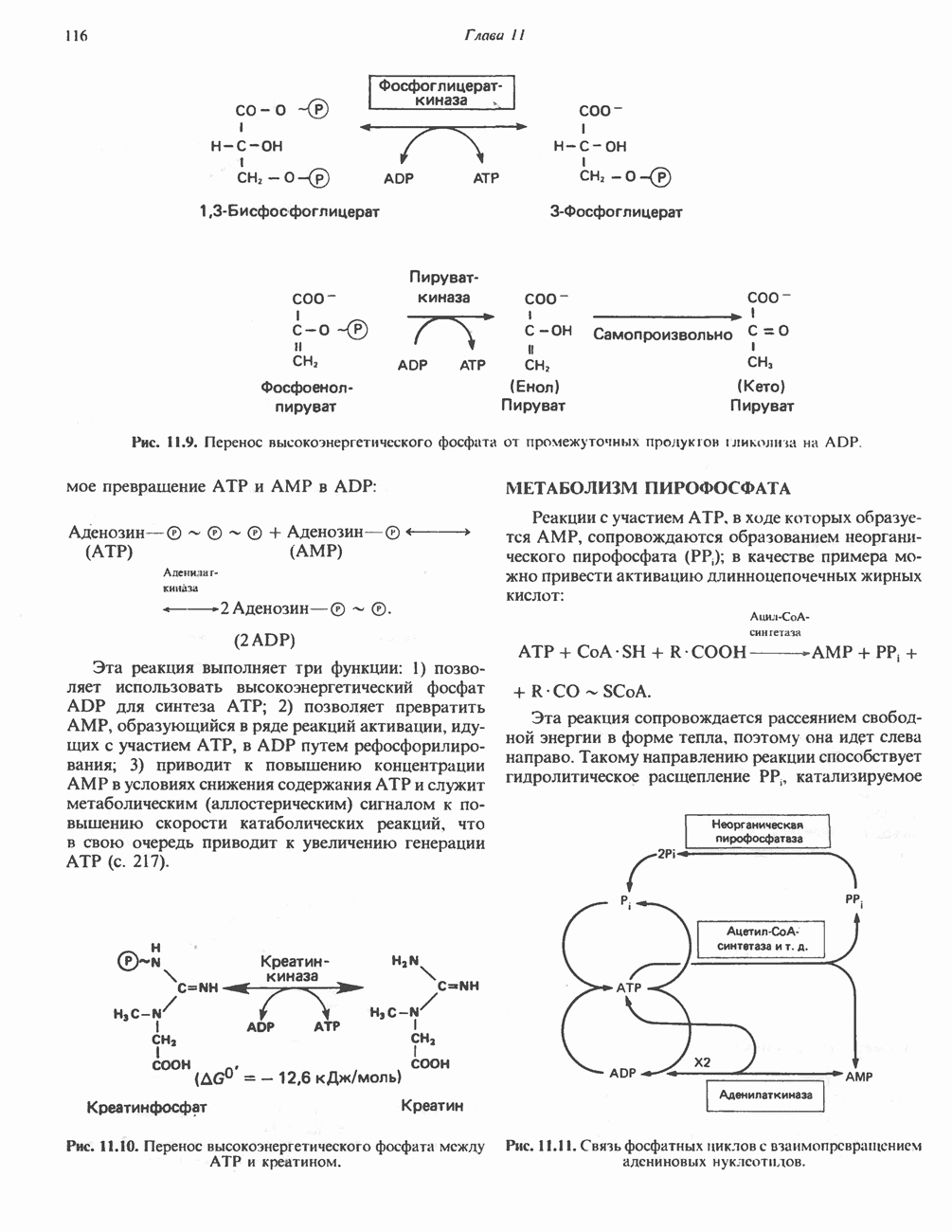
- МЕТАБОЛИЗМ ПИРОФОСФАТА
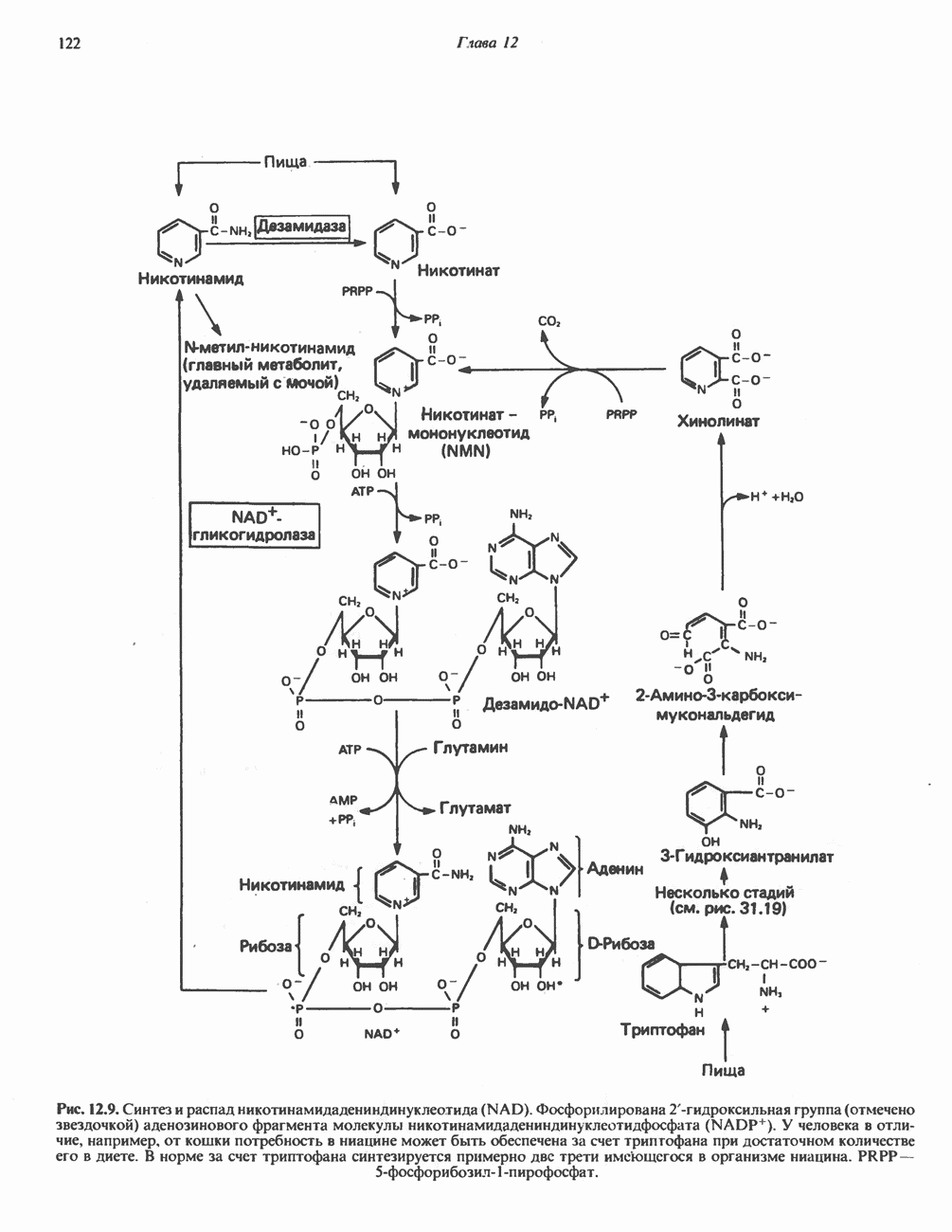
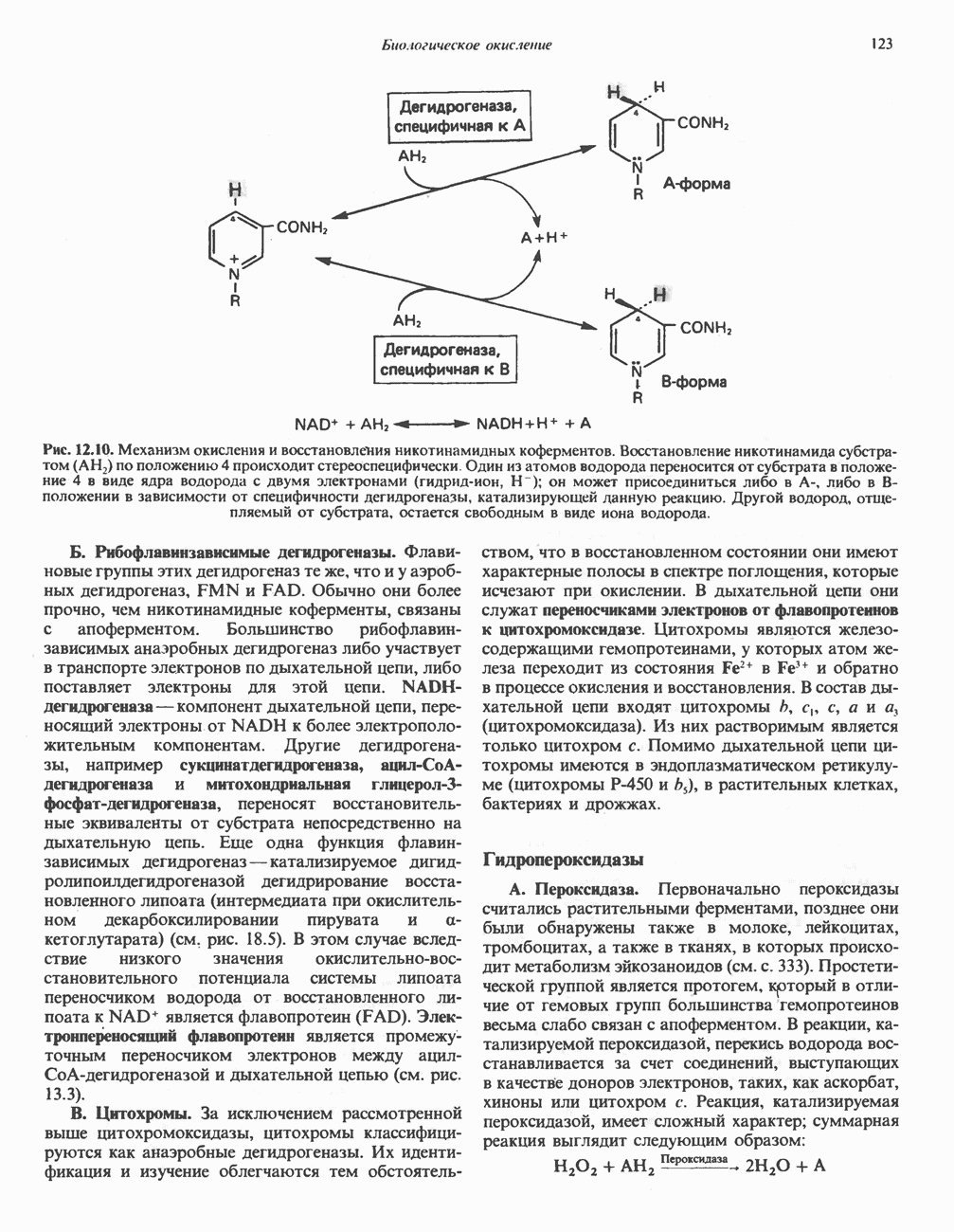
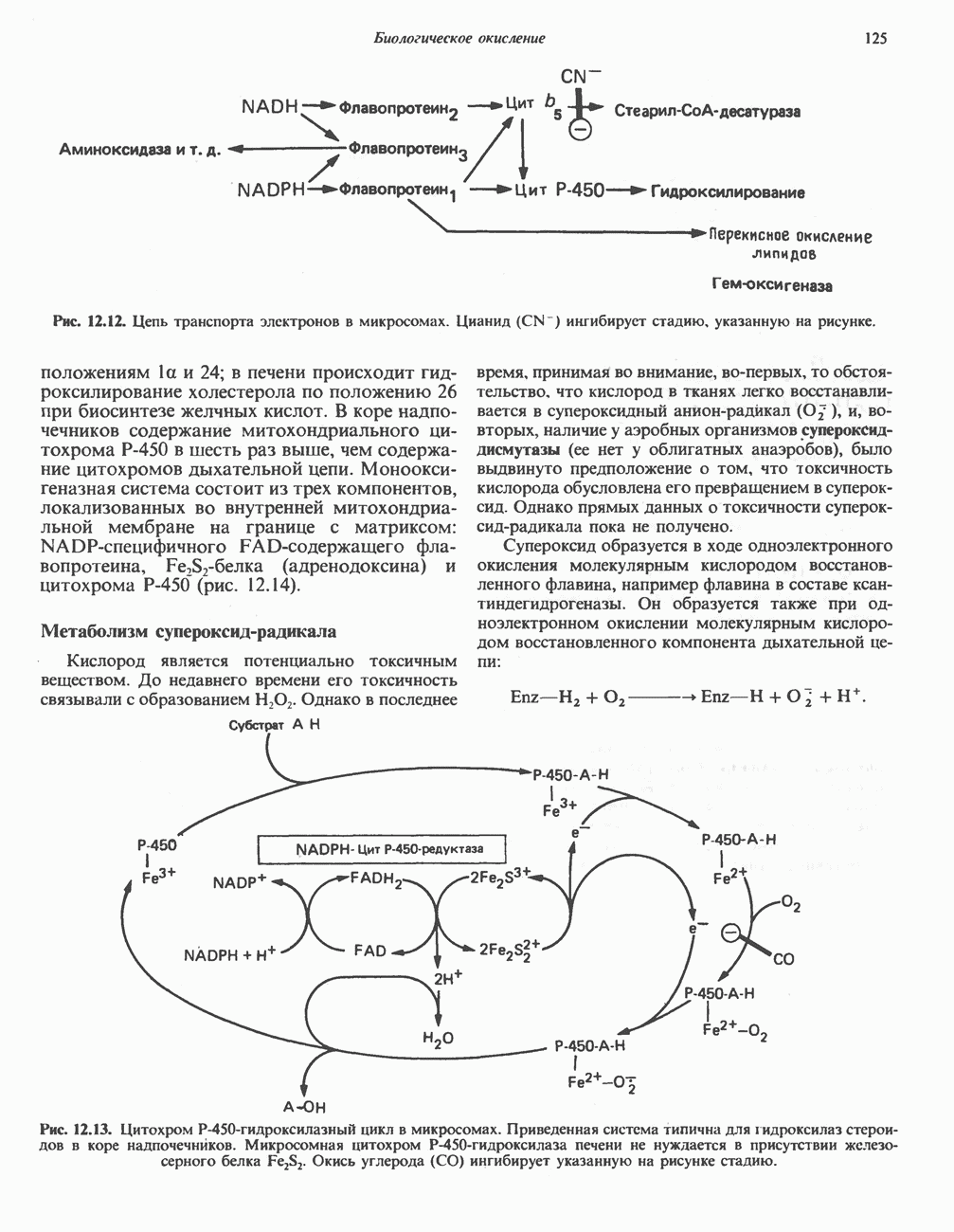
- Глава 12. Биологическое окисление
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ РАВНОВЕСИЕ, ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ
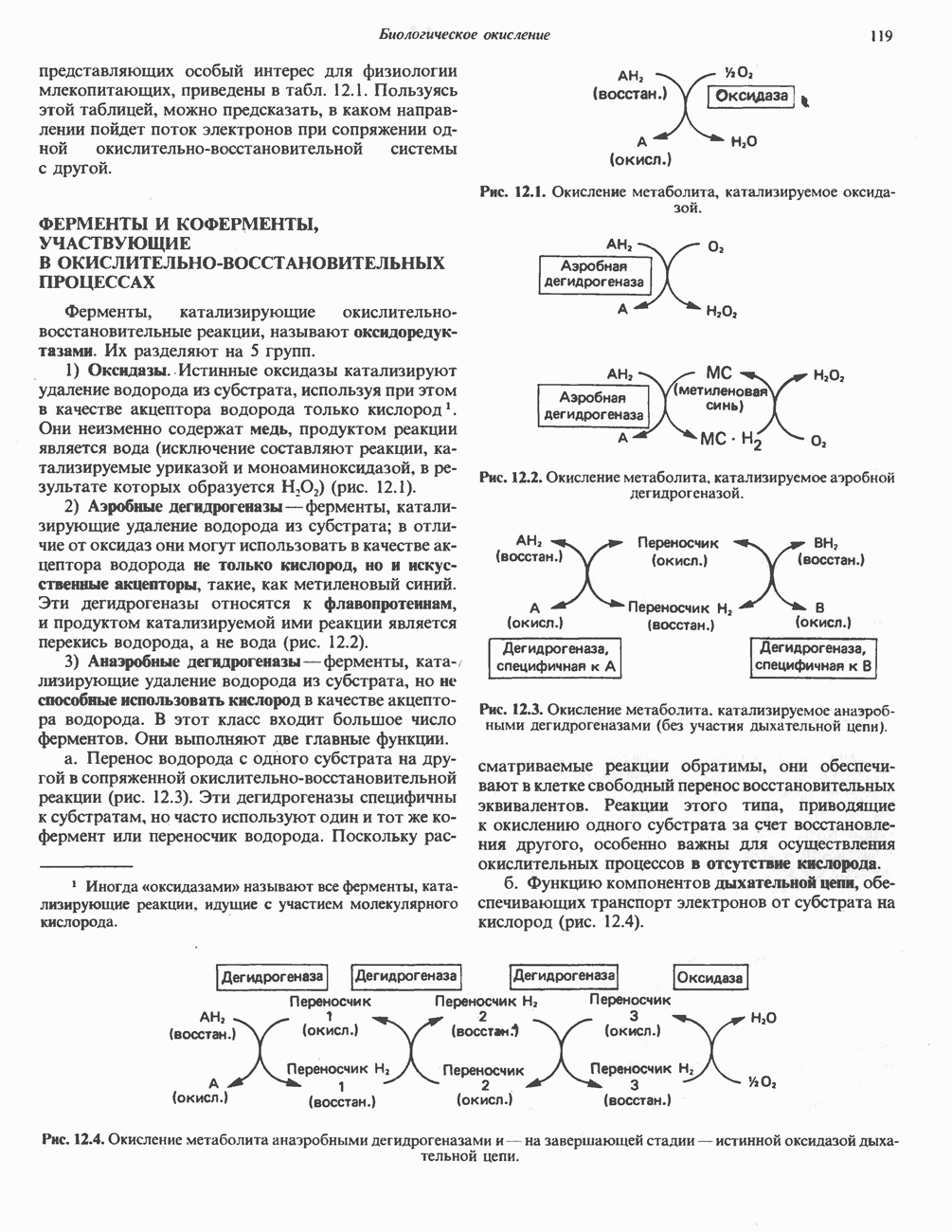
- ФЕРМЕНТЫ И КОФЕРМЕНТЫ, УЧАСТВУЮЩИЕ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССАХ
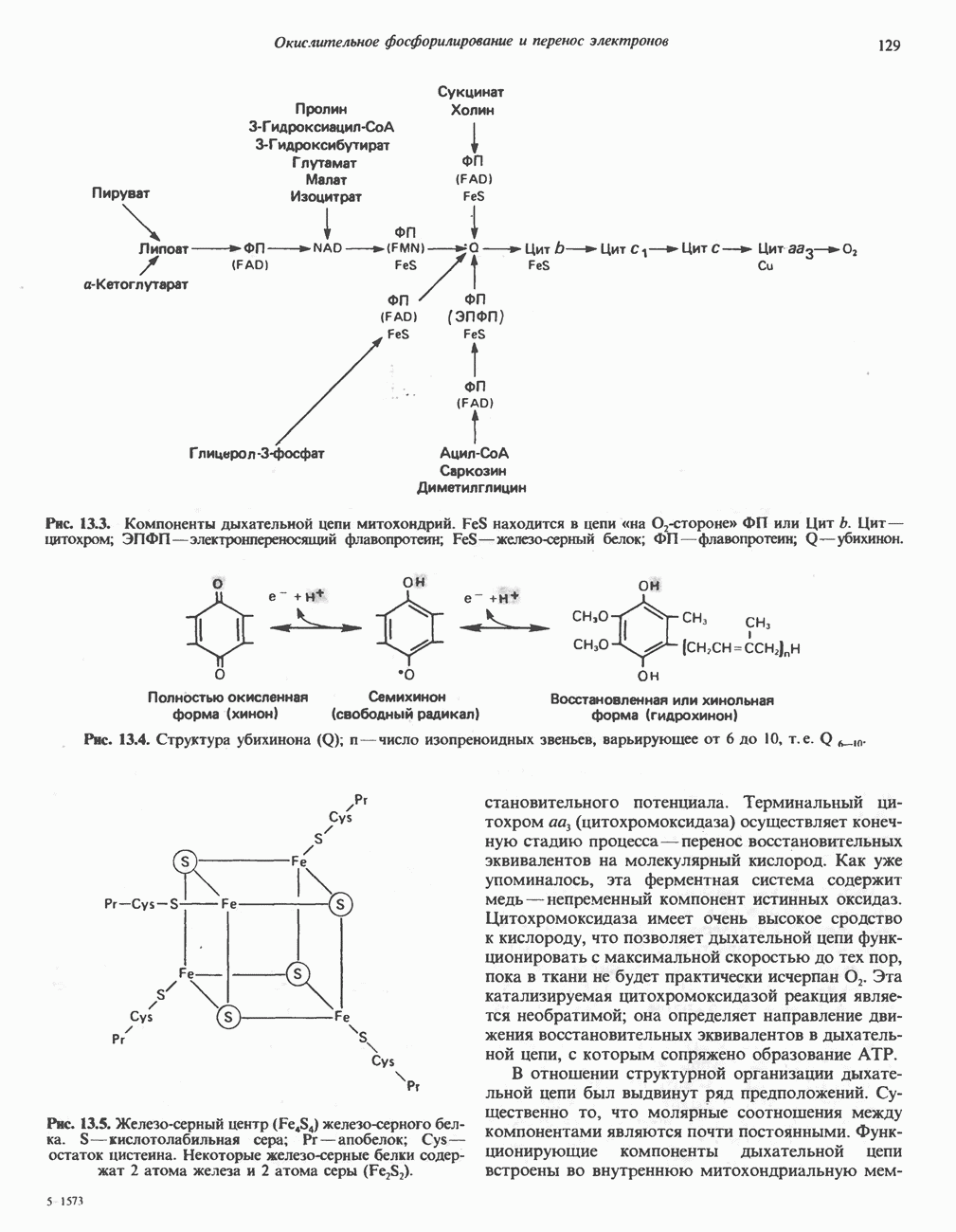
- Глава 13. Окислительное фосфорилирование и транспортные системы митохондрий
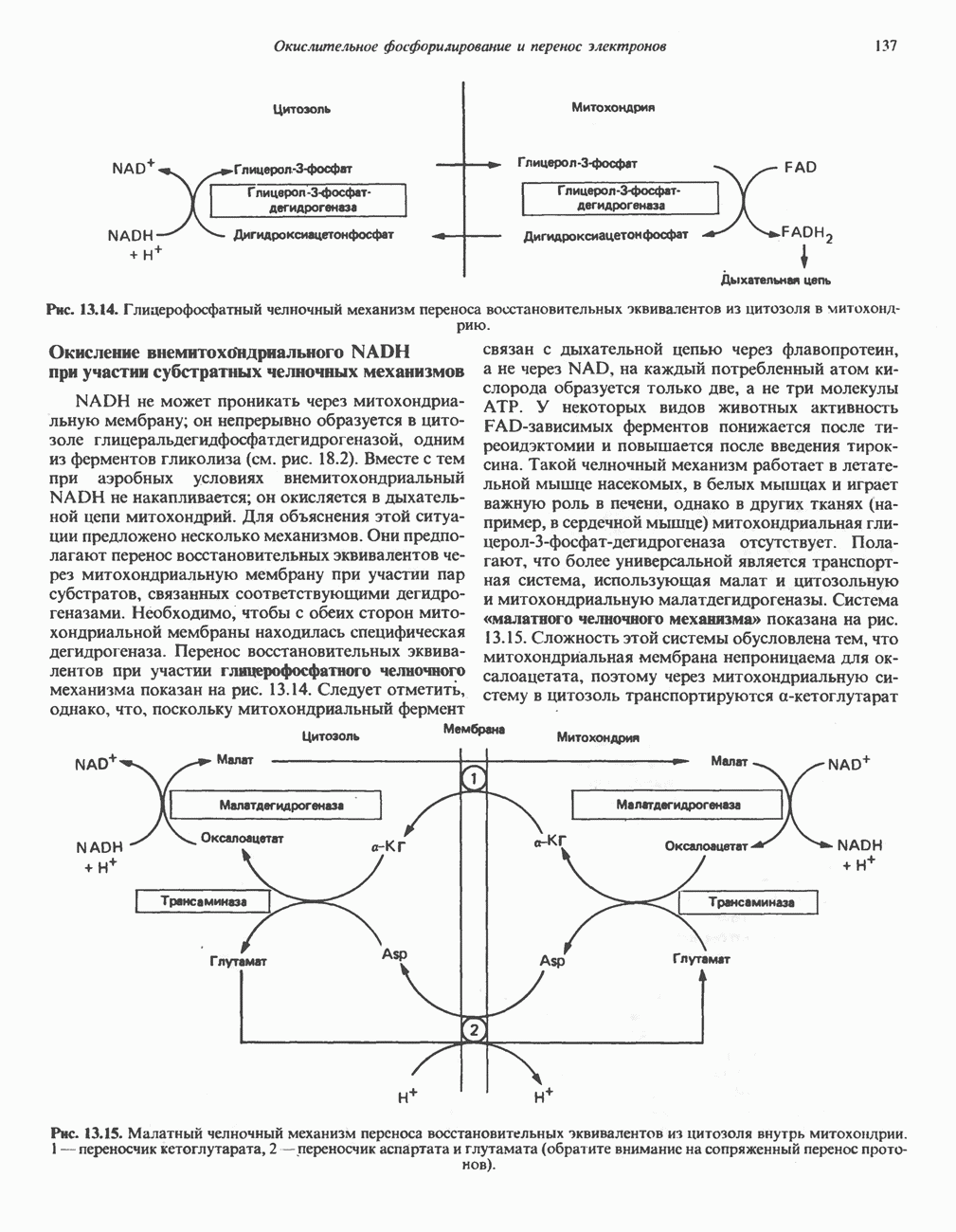
- ДЫХАТЕЛЬНАЯ ЦЕПЬ
- ОРГАНИЗАЦИЯ ДЫХАТЕЛЬНОЙ ЦЕПИ В МИТОХОНДРИЯХ
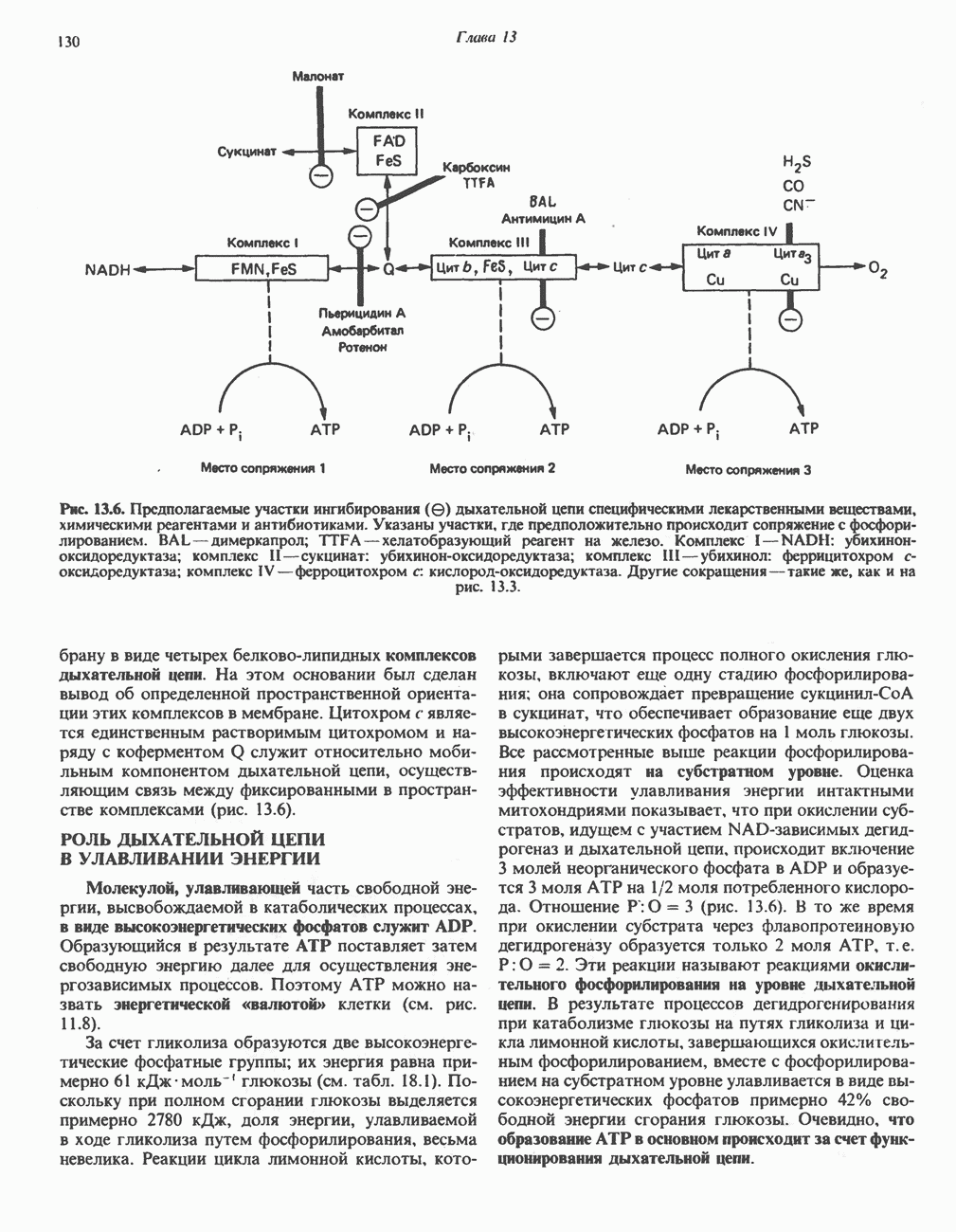
- РОЛЬ ДЫХАТЕЛЬНОЙ ЦЕПИ В УЛАВЛИВАНИИ ЭНЕРГИИ
- ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
- ИНГИБИТОРЫ ДЫХАТЕЛЬНОЙ ЦЕПИ И ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
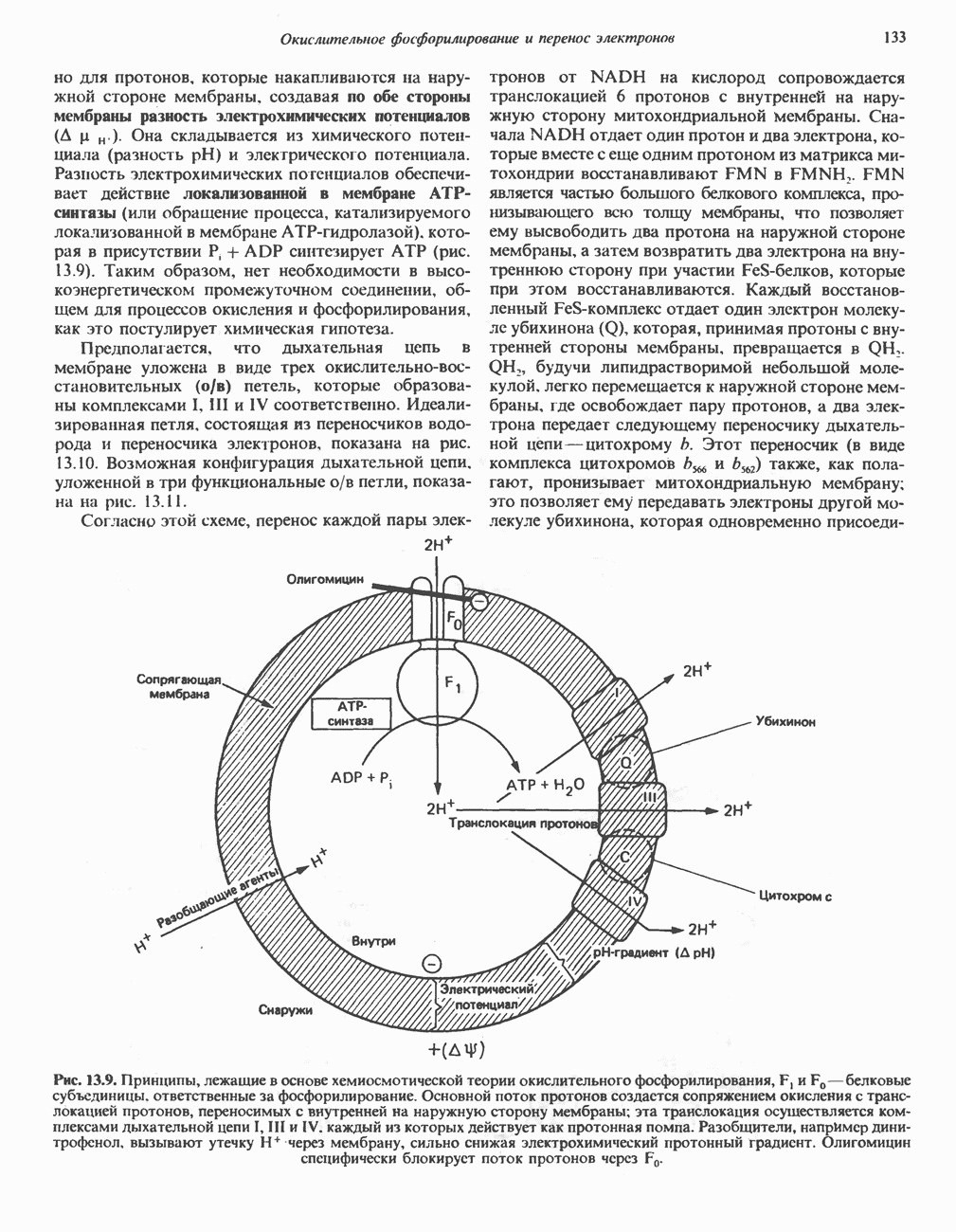
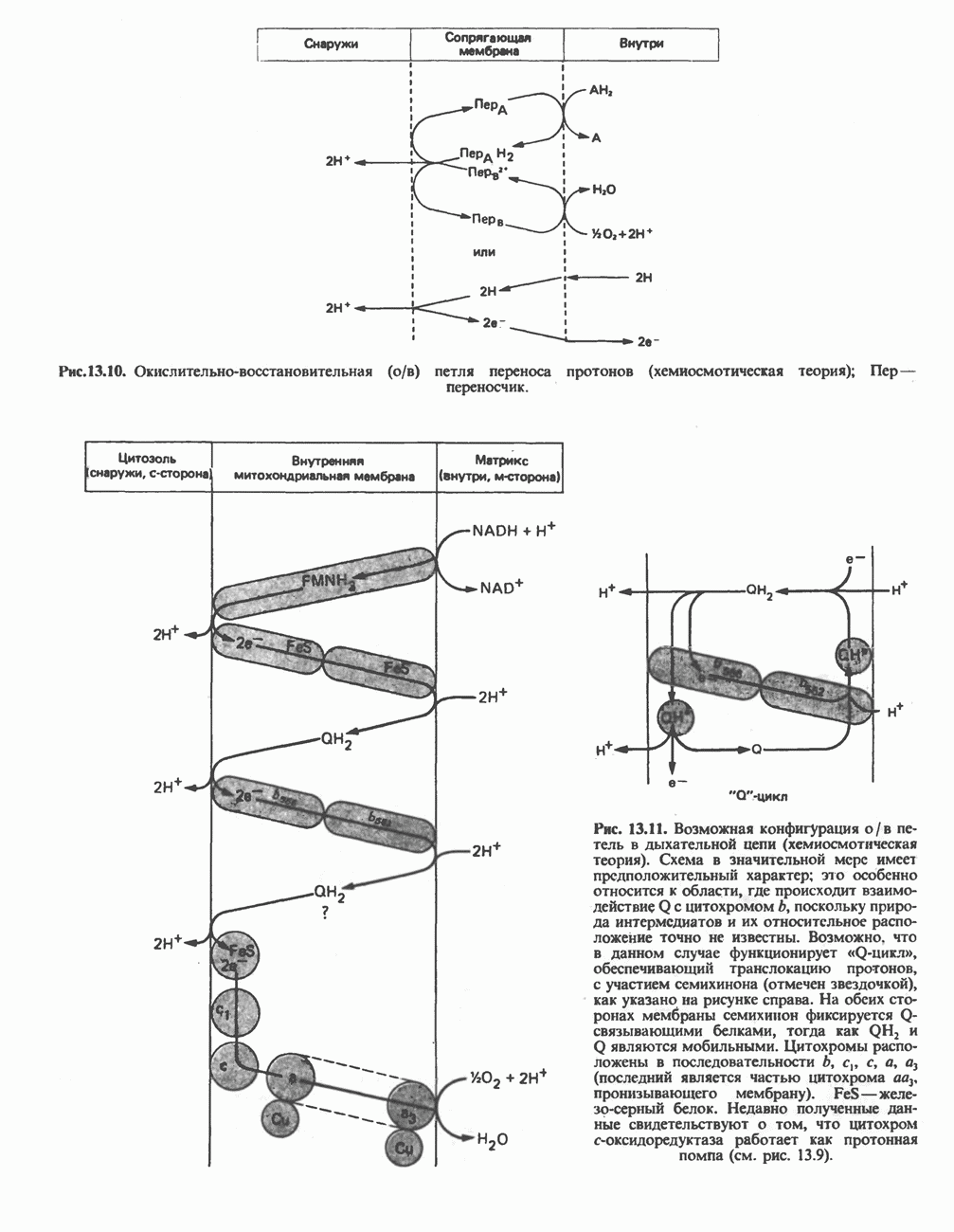
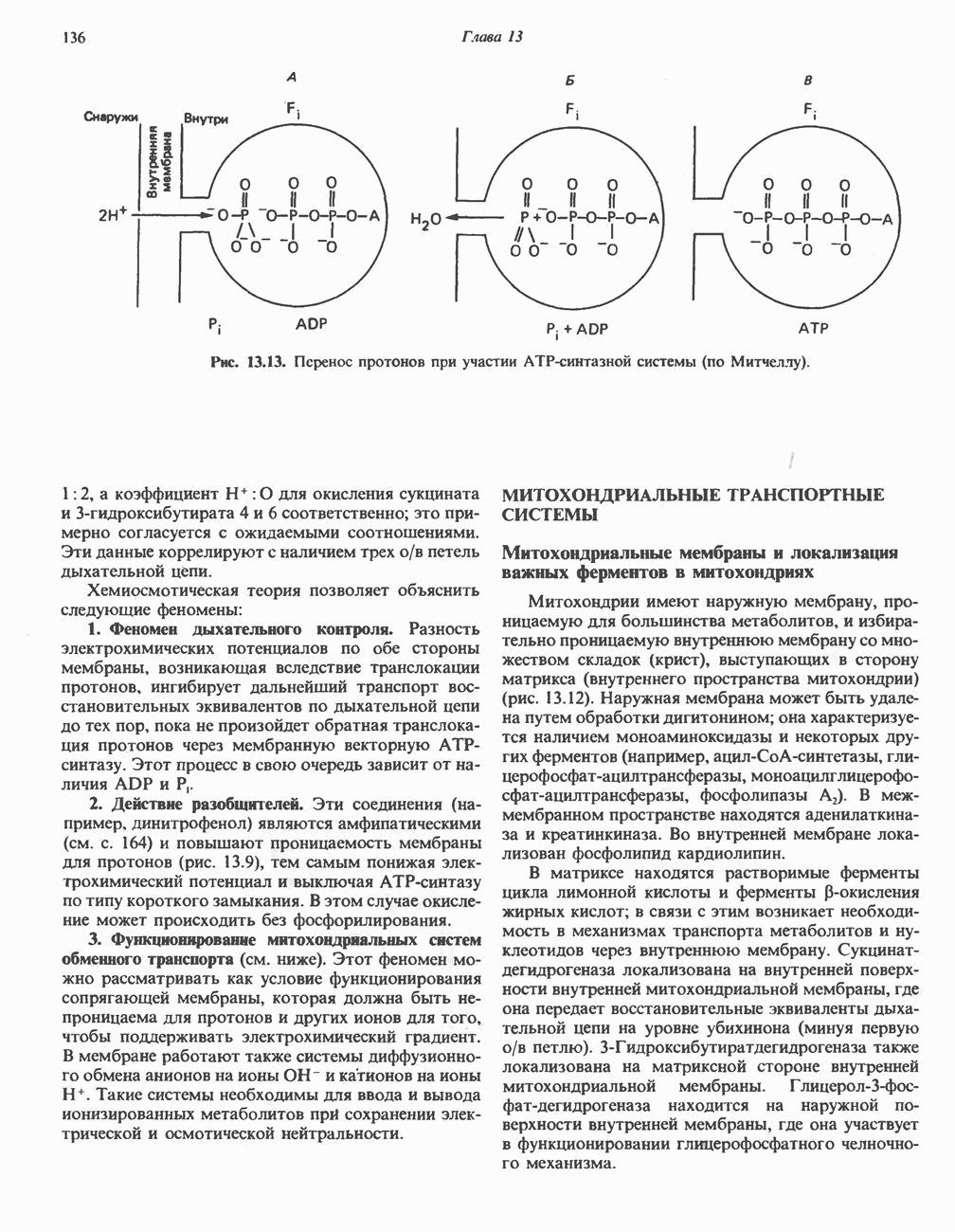
- МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
- МИТОХОНДРИАЛЬНЫЕ ТРАНСПОРТНЫЕ СИСТЕМЫ
- Глава 14. Физиологически важные углеводы
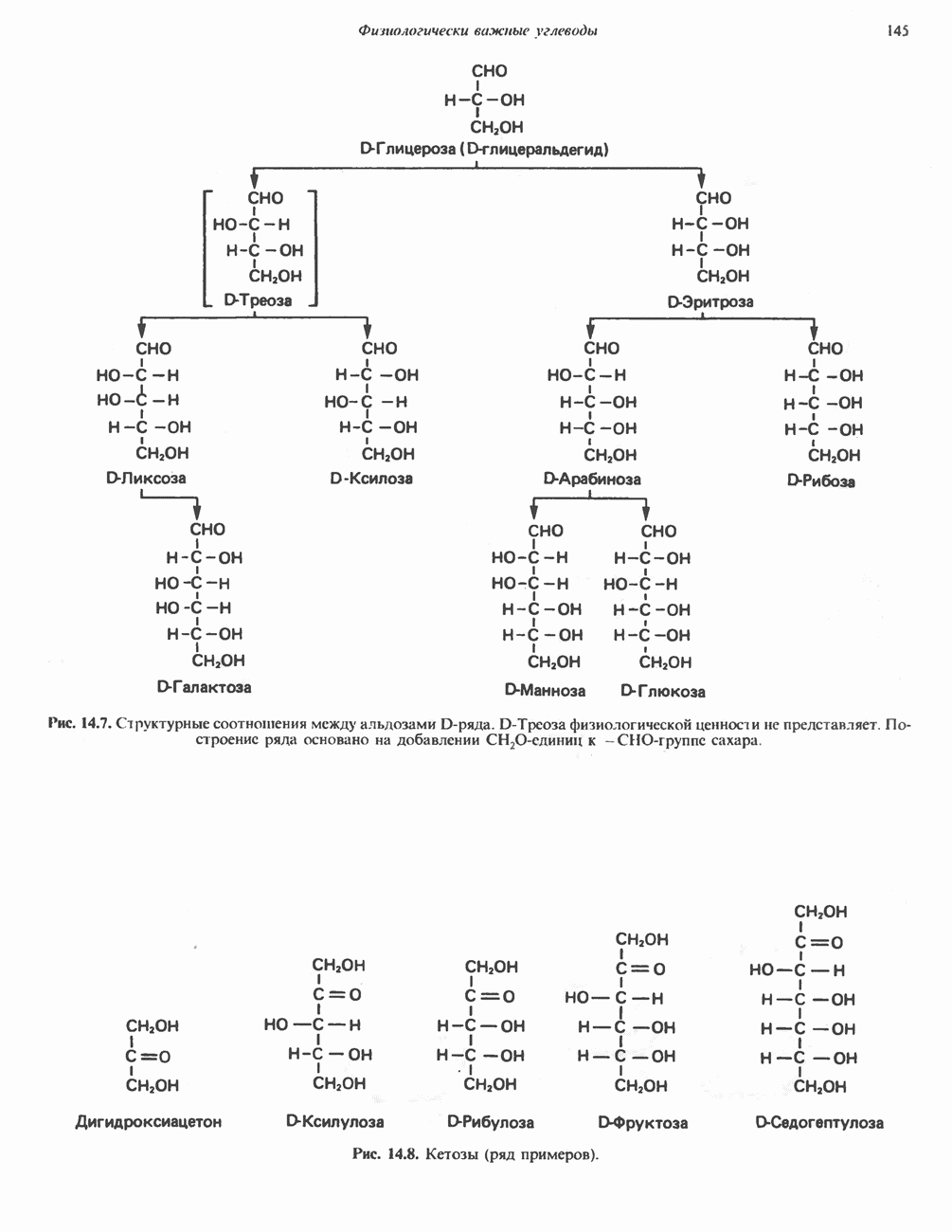
- КЛАССИФИКАЦИЯ УГЛЕВОДОВ
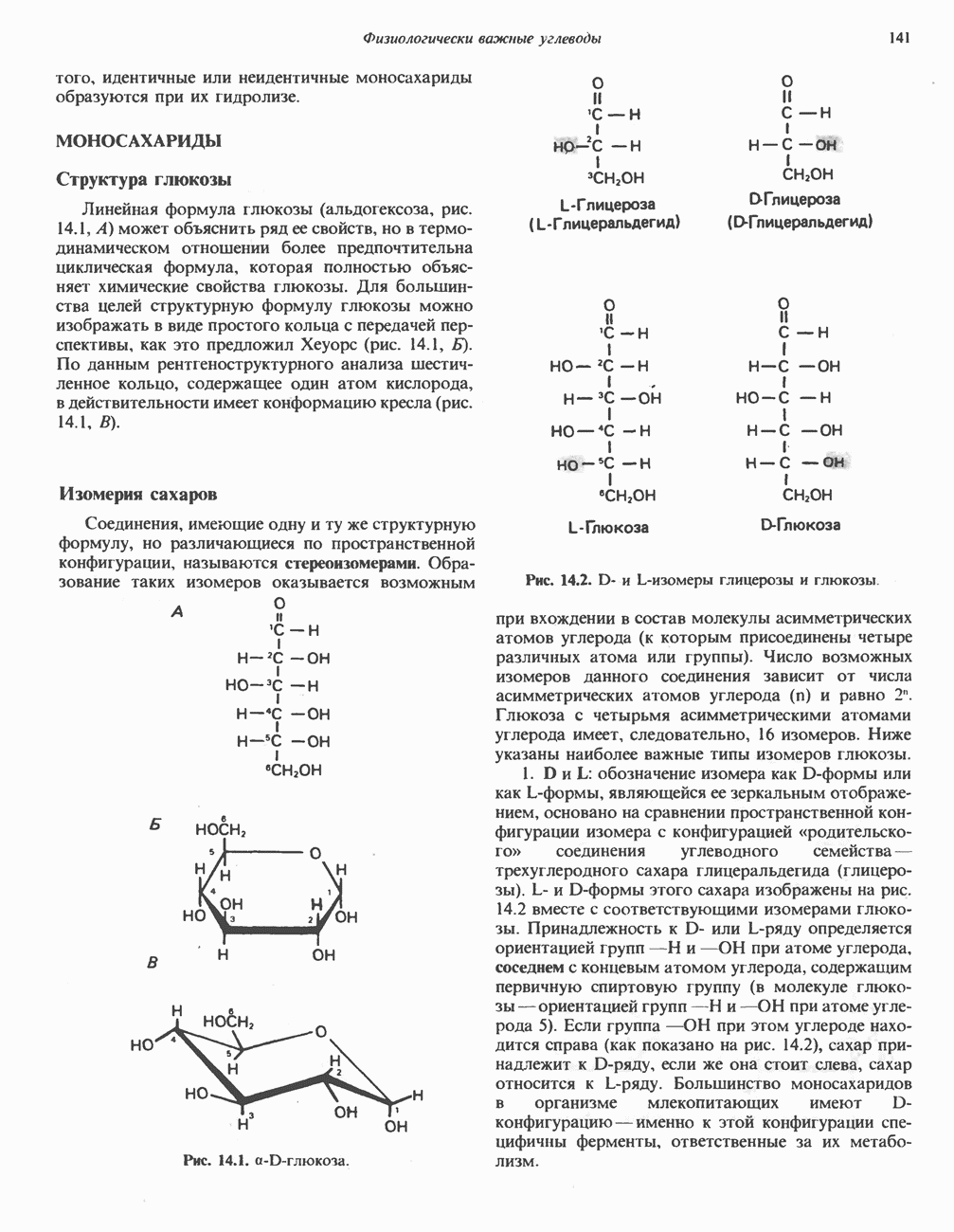
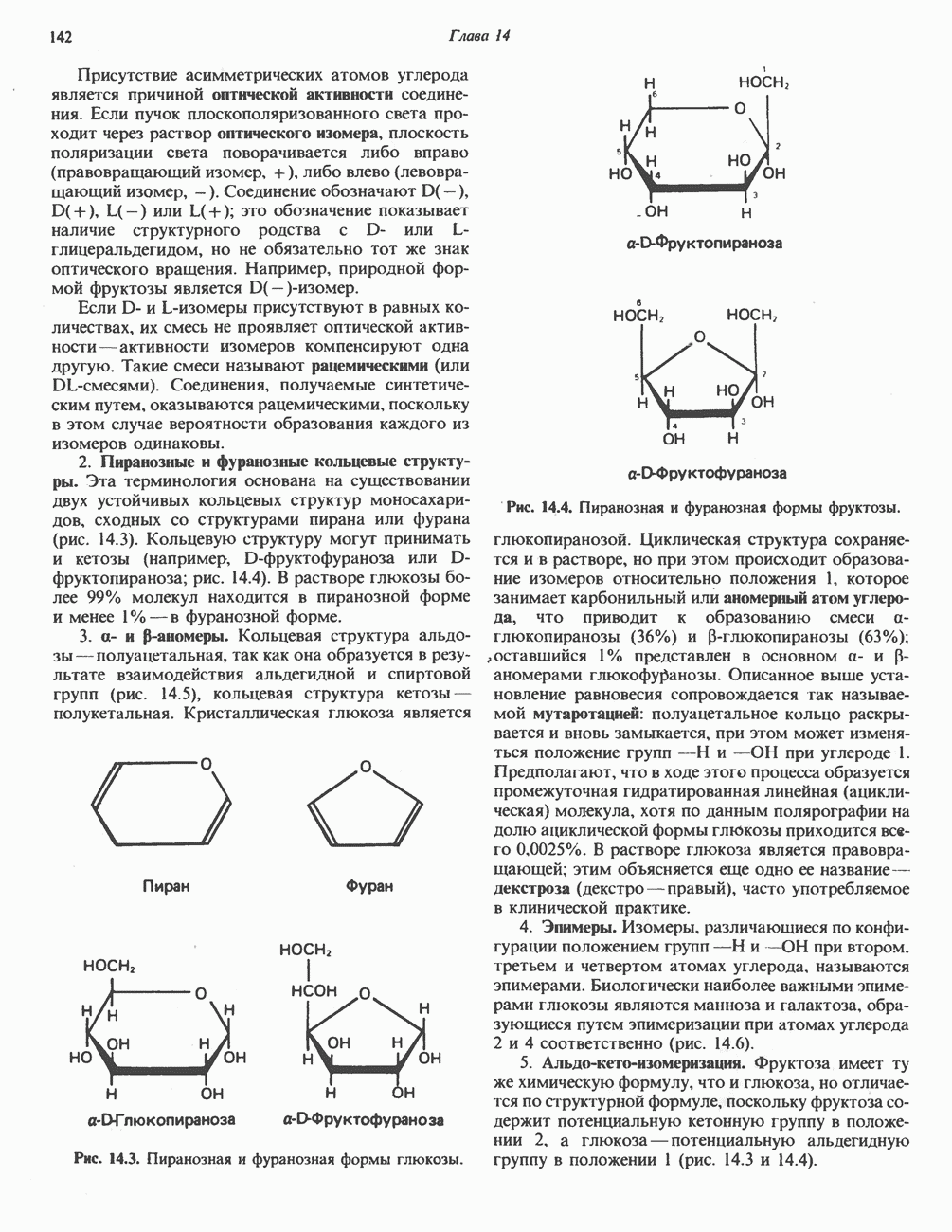
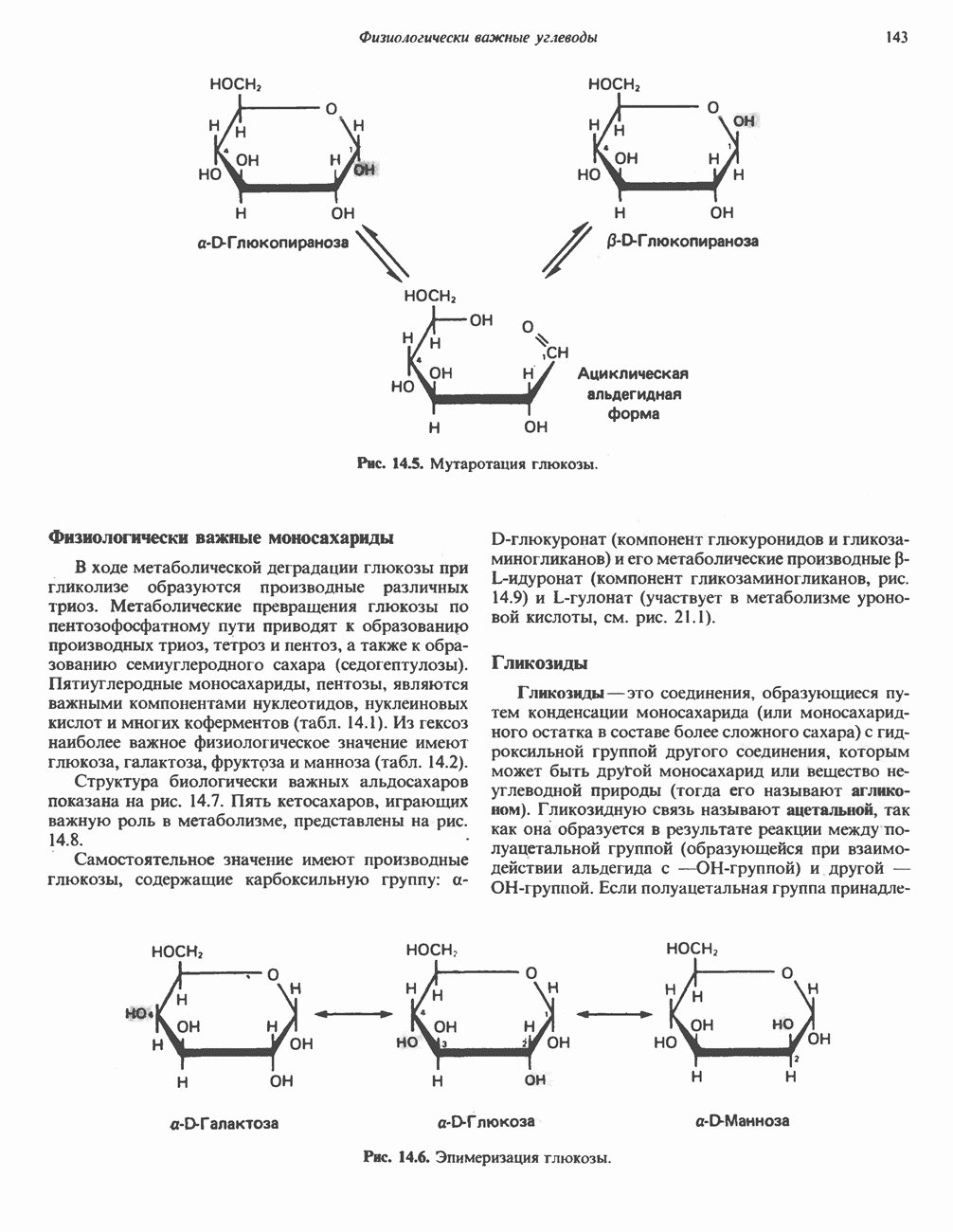
- МОНОСАХАРИДЫ
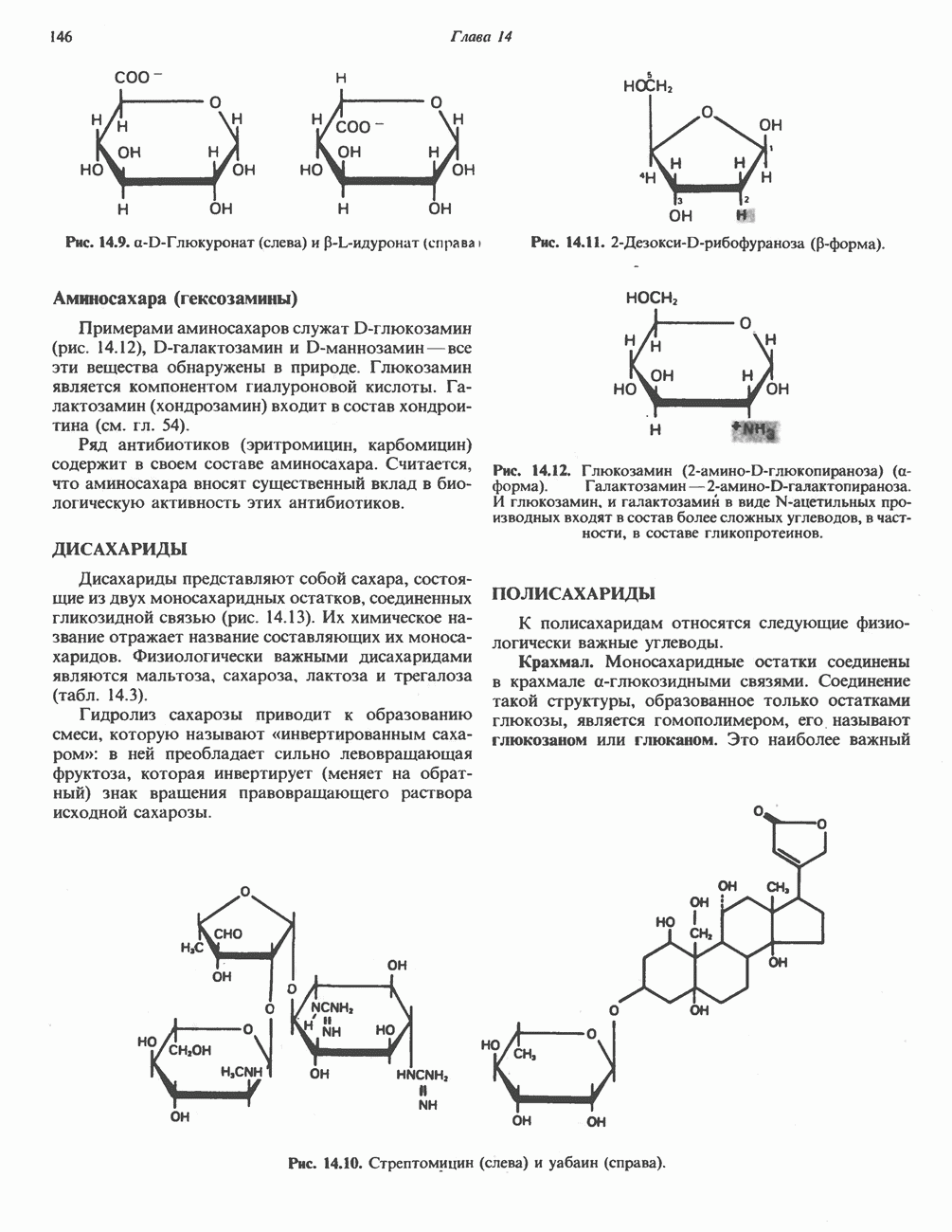
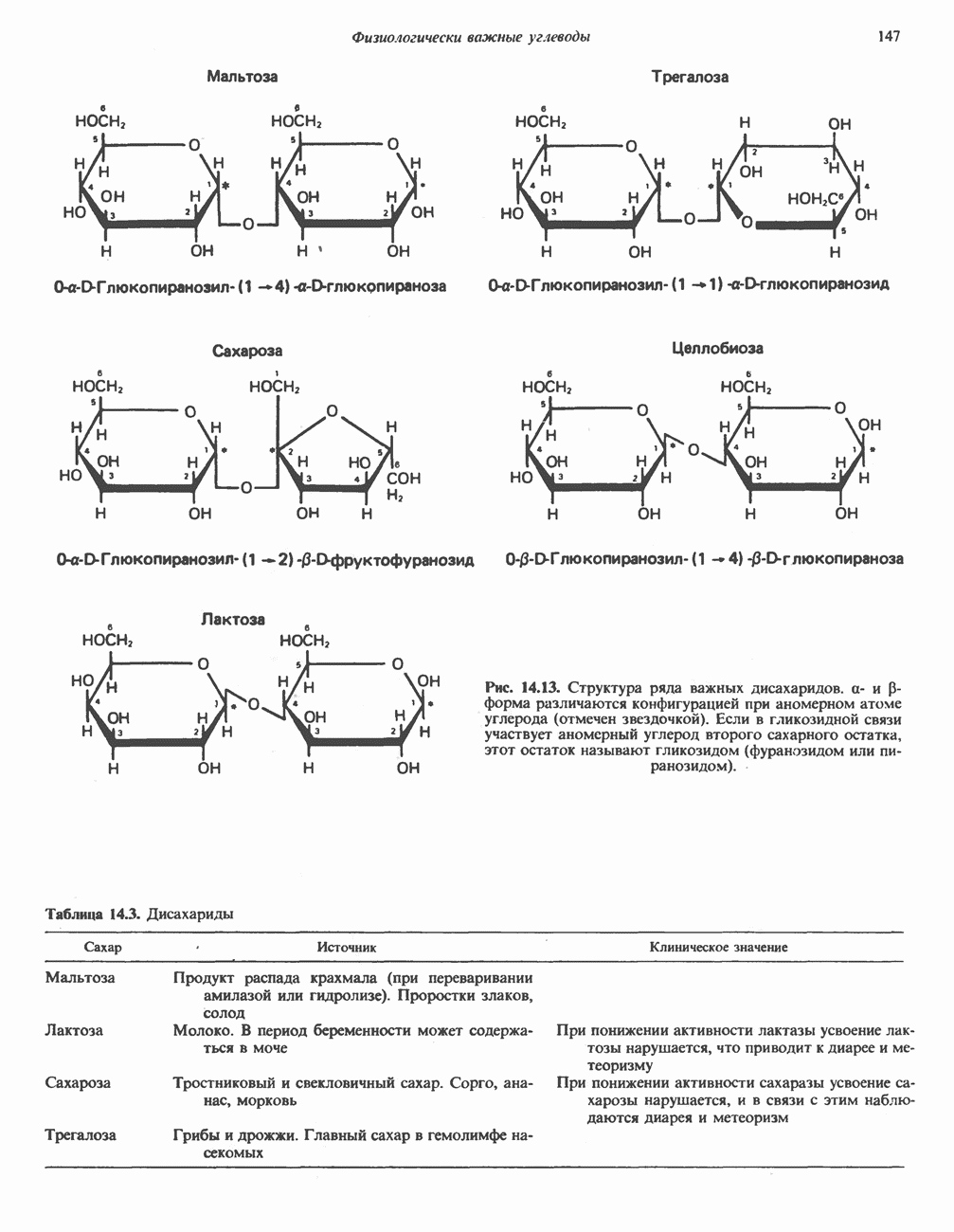
- ДИСАХАРИДЫ
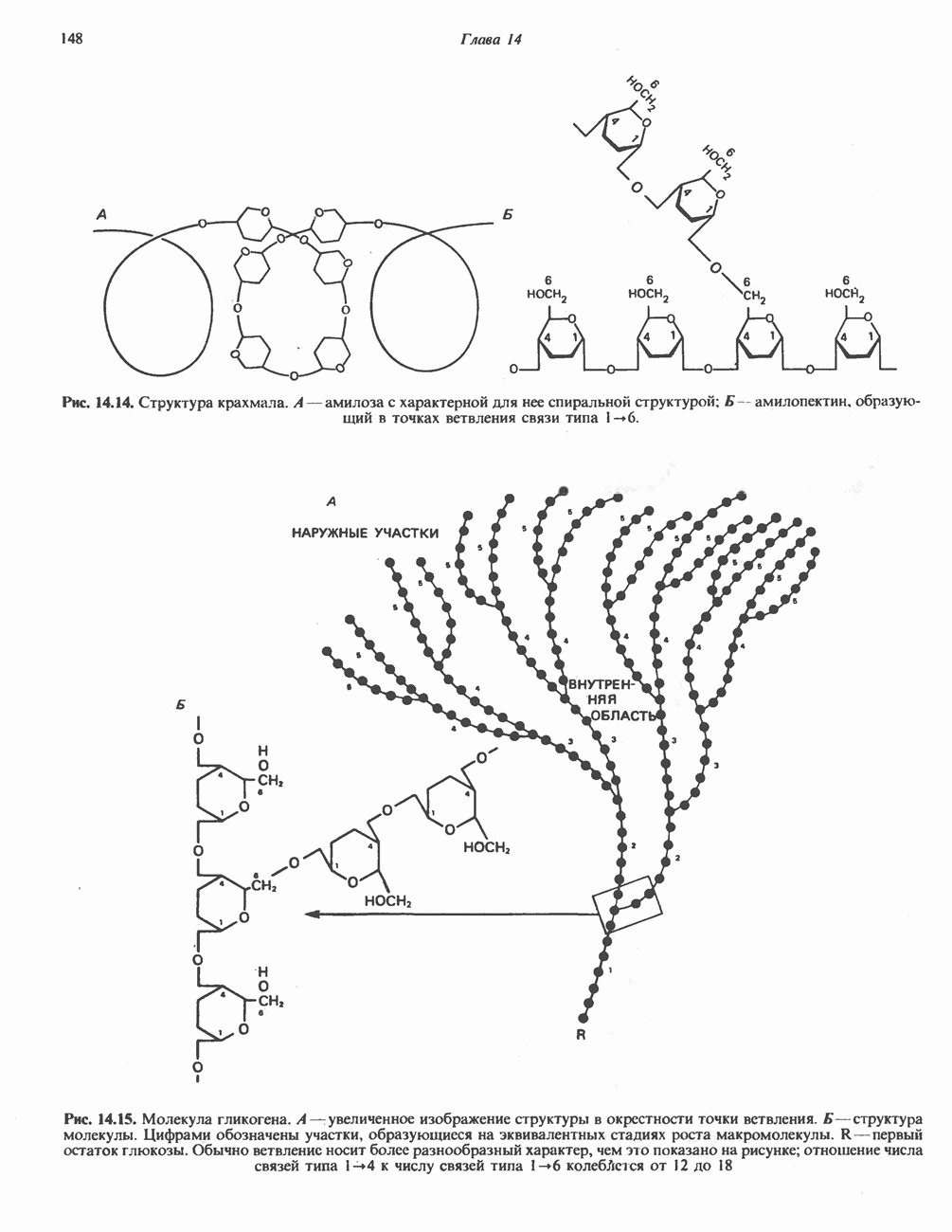
- ПОЛИСАХАРИДЫ
- УГЛЕВОДЫ КЛЕТОЧНЫХ МЕМБРАН
- Глава 15. Физиологически важные липиды
- КЛАССИФИКАЦИЯ ЛИПИДОВ
- ЖИРНЫЕ КИСЛОТЫ
- ТРИАЦИЛГЛИЦЕРОЛЫ (триглицериды)
- ФОСФОЛИПИДЫ
- ГЛИКОЛИПИДЫ (ГЛИКОСФИНГОЛИПИДЫ)
- СТЕРОИДЫ
- ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ
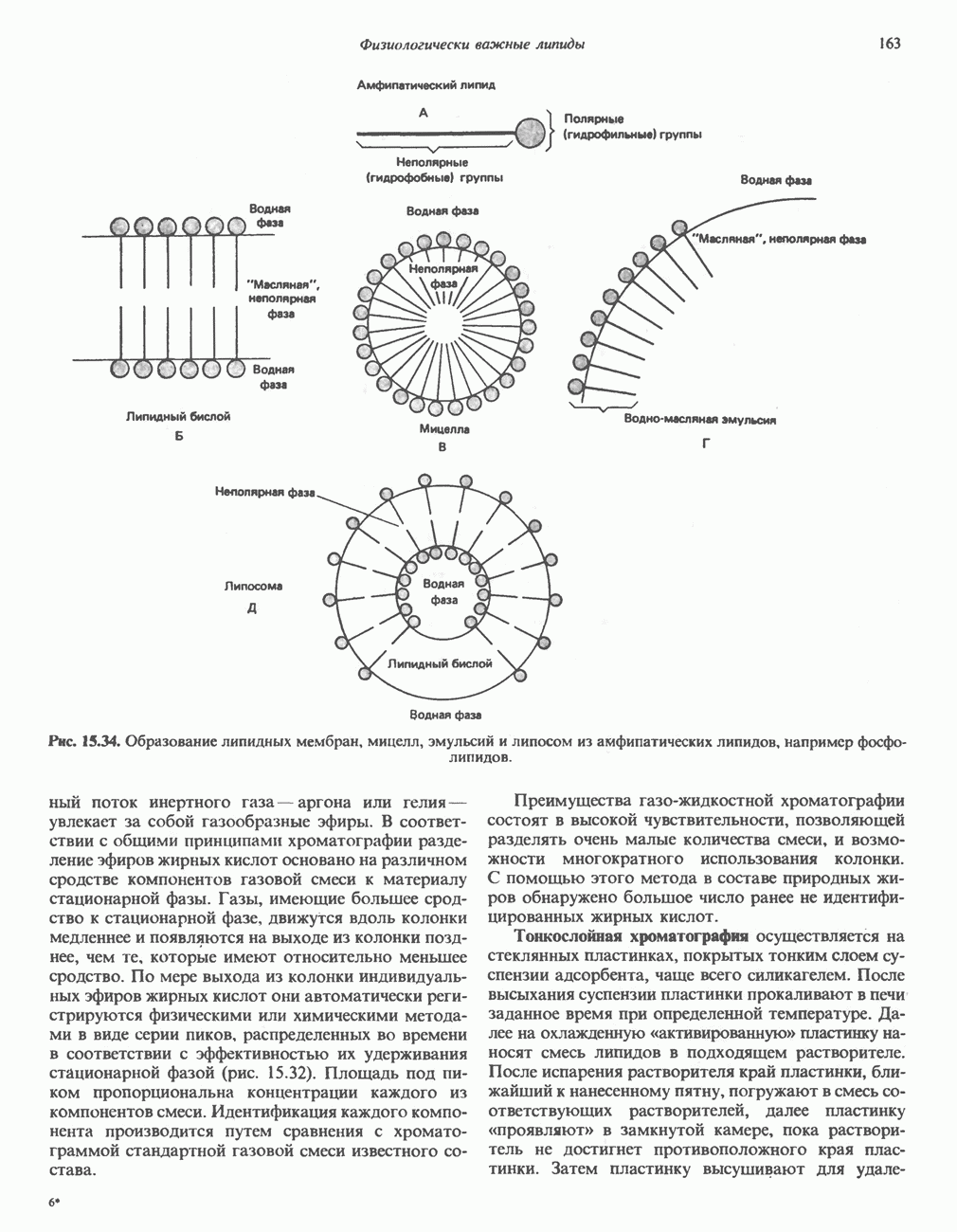
- МЕТОДЫ РАЗДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ ЛИПИДОВ, СОДЕРЖАЩИХСЯ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ
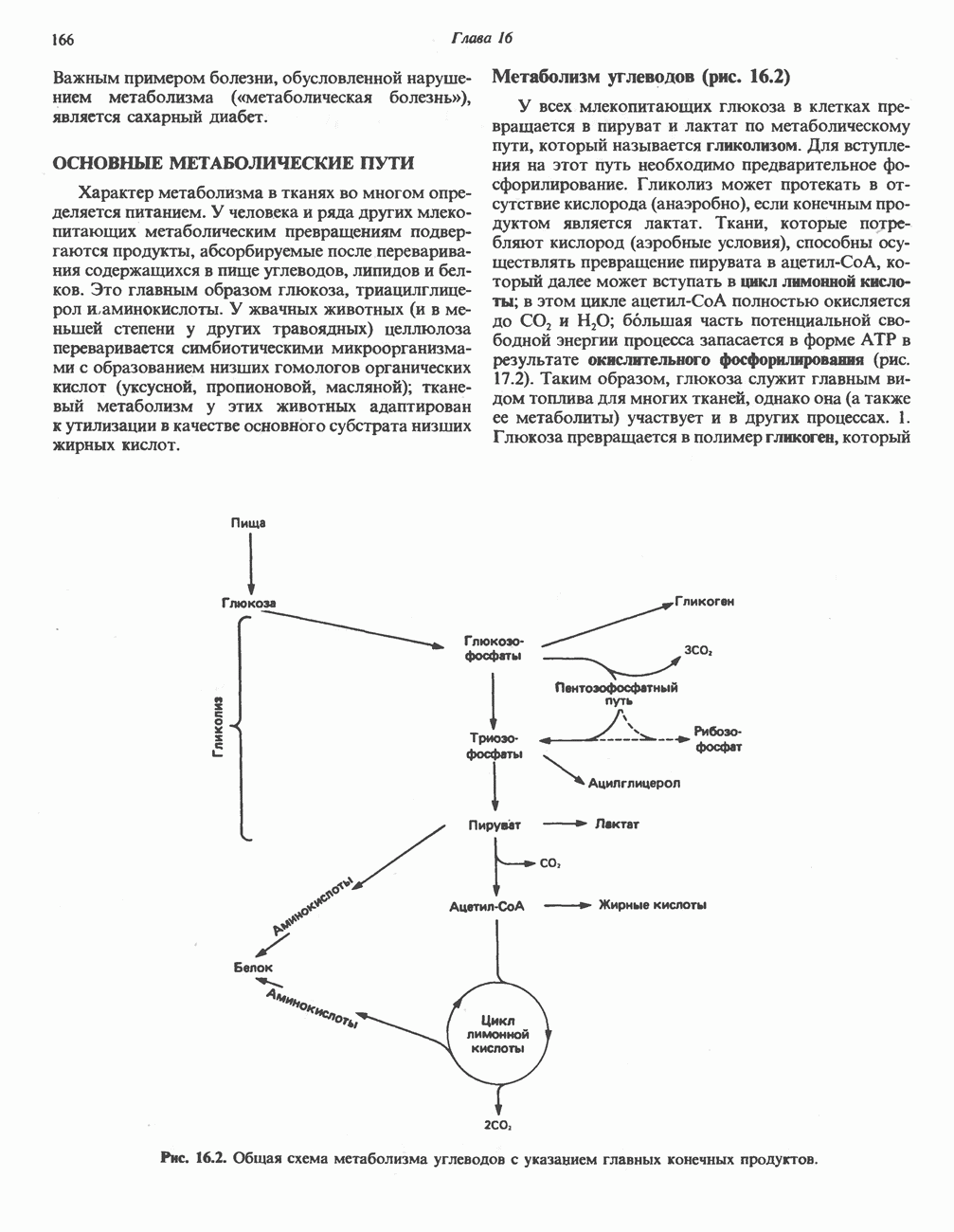
- АМФИПАТИЧЕСКИЕ ЛИПИДЫ
- Глава 16. Промежуточный обмен
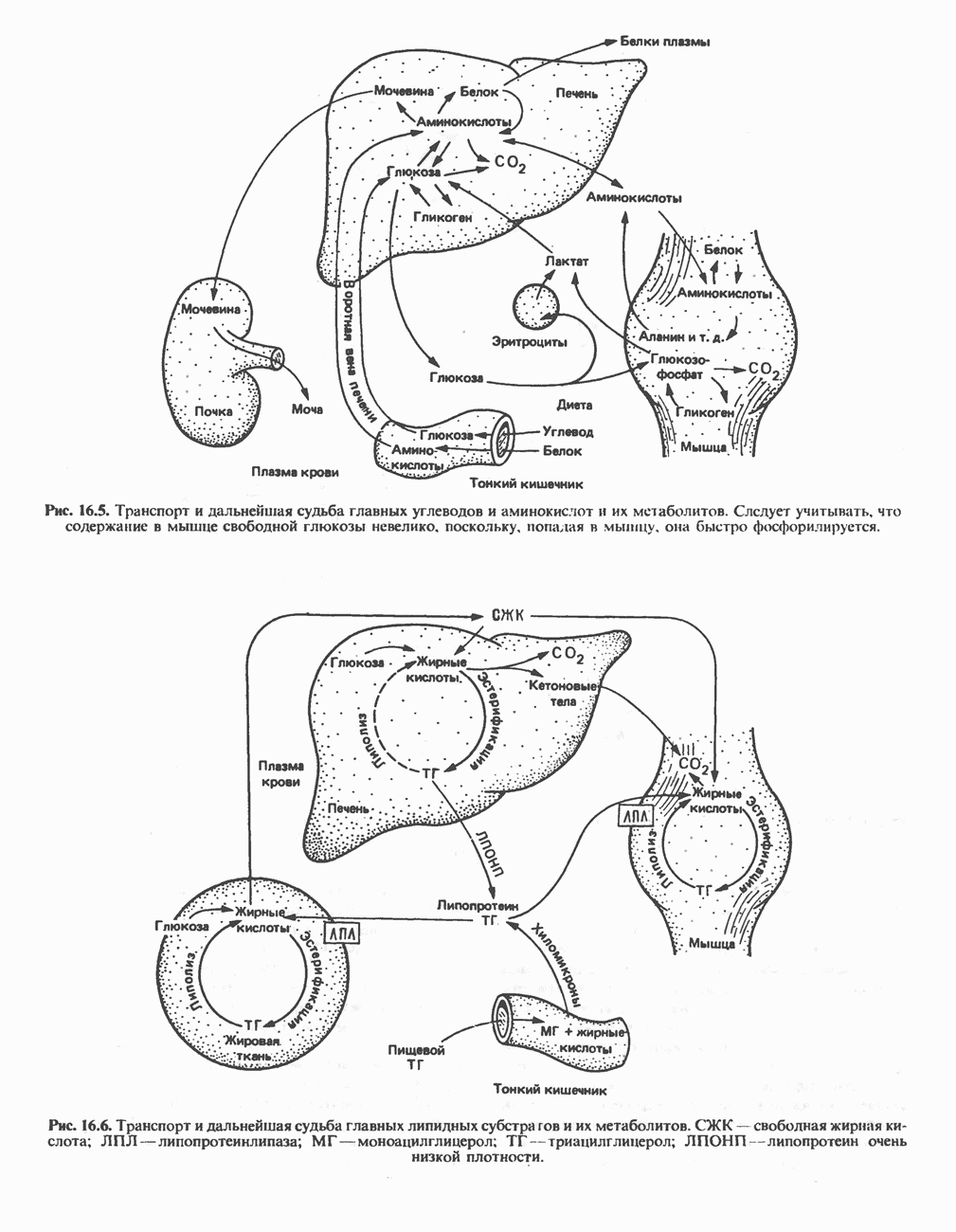
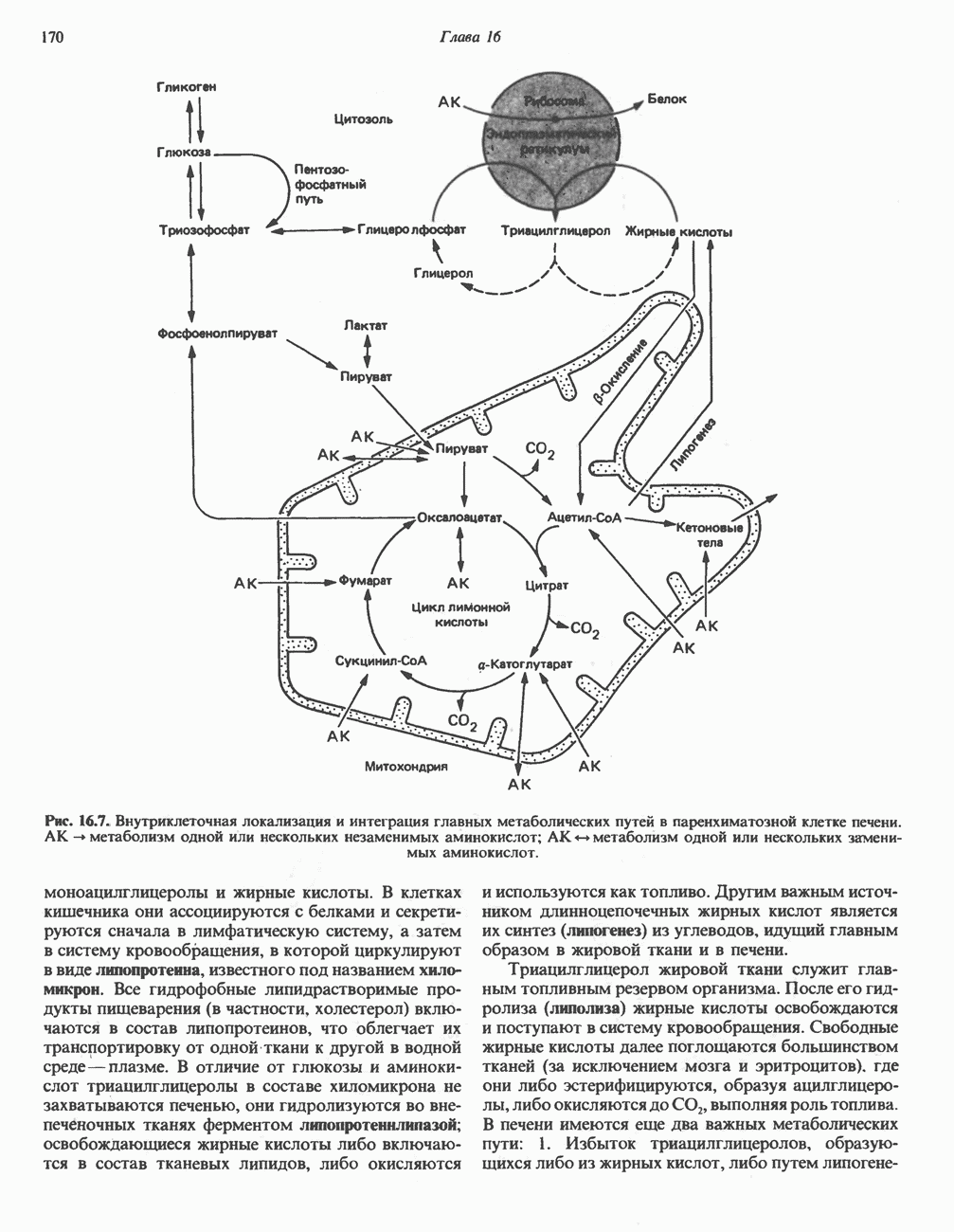
- ОСНОВНЫЕ МЕТАБОЛИЧЕСКИЕ ПУТИ
- ЛОКАЛИЗАЦИЯ МЕТАБОЛИЧЕСКИХ ПУТЕЙ
- Глава 17. Цикл лимонной кислоты: катаболизм ацетил-СоА
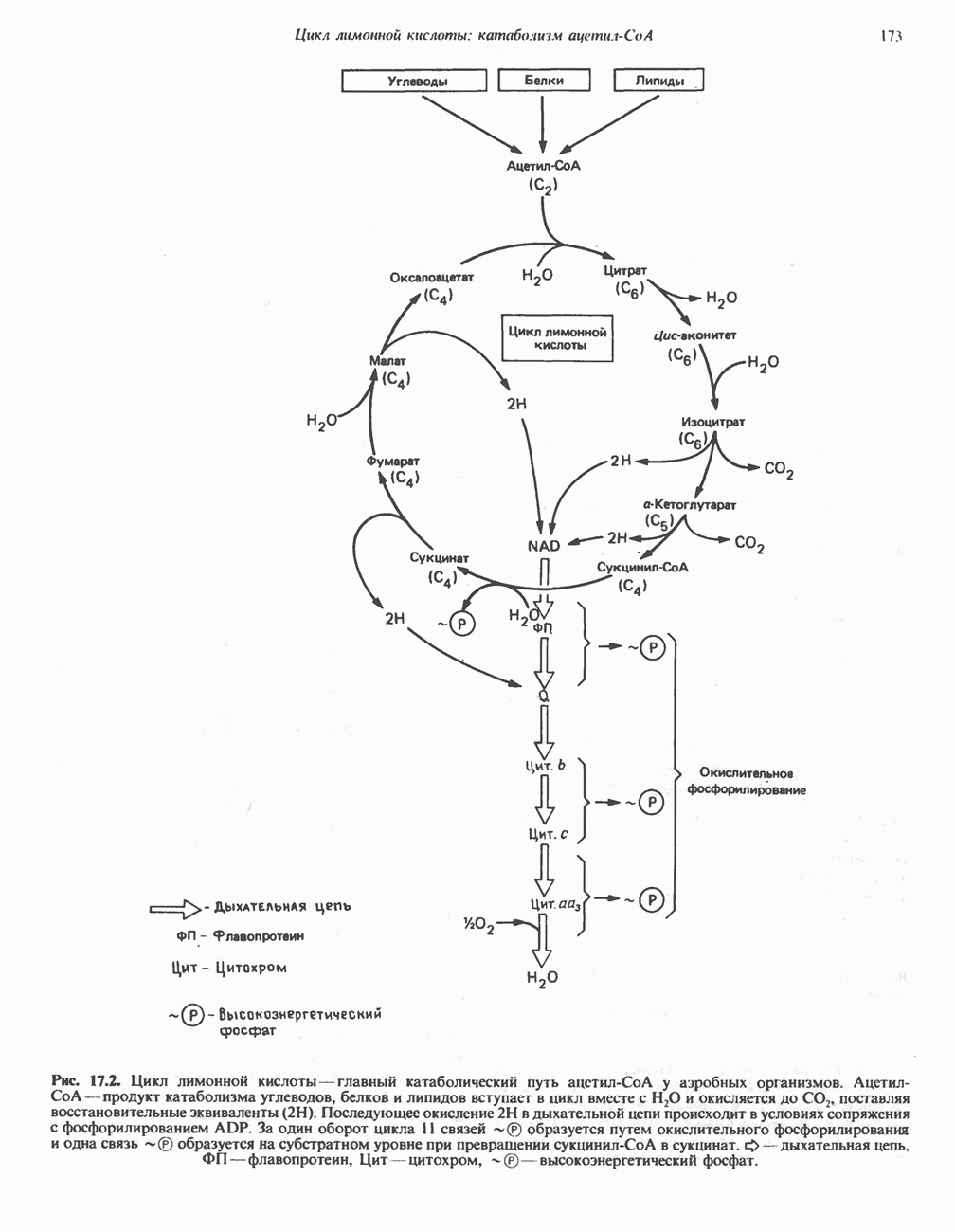
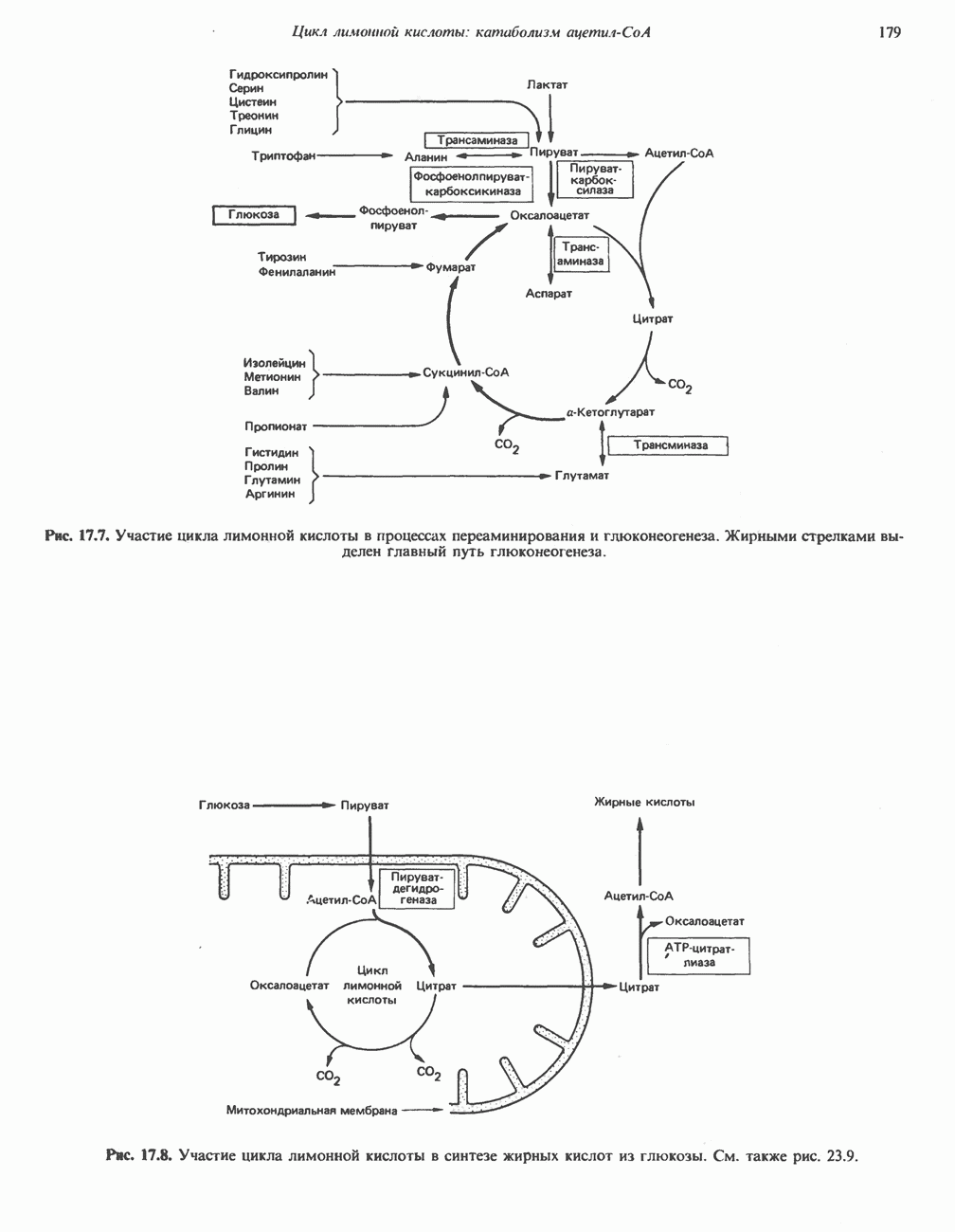
- КАТАБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
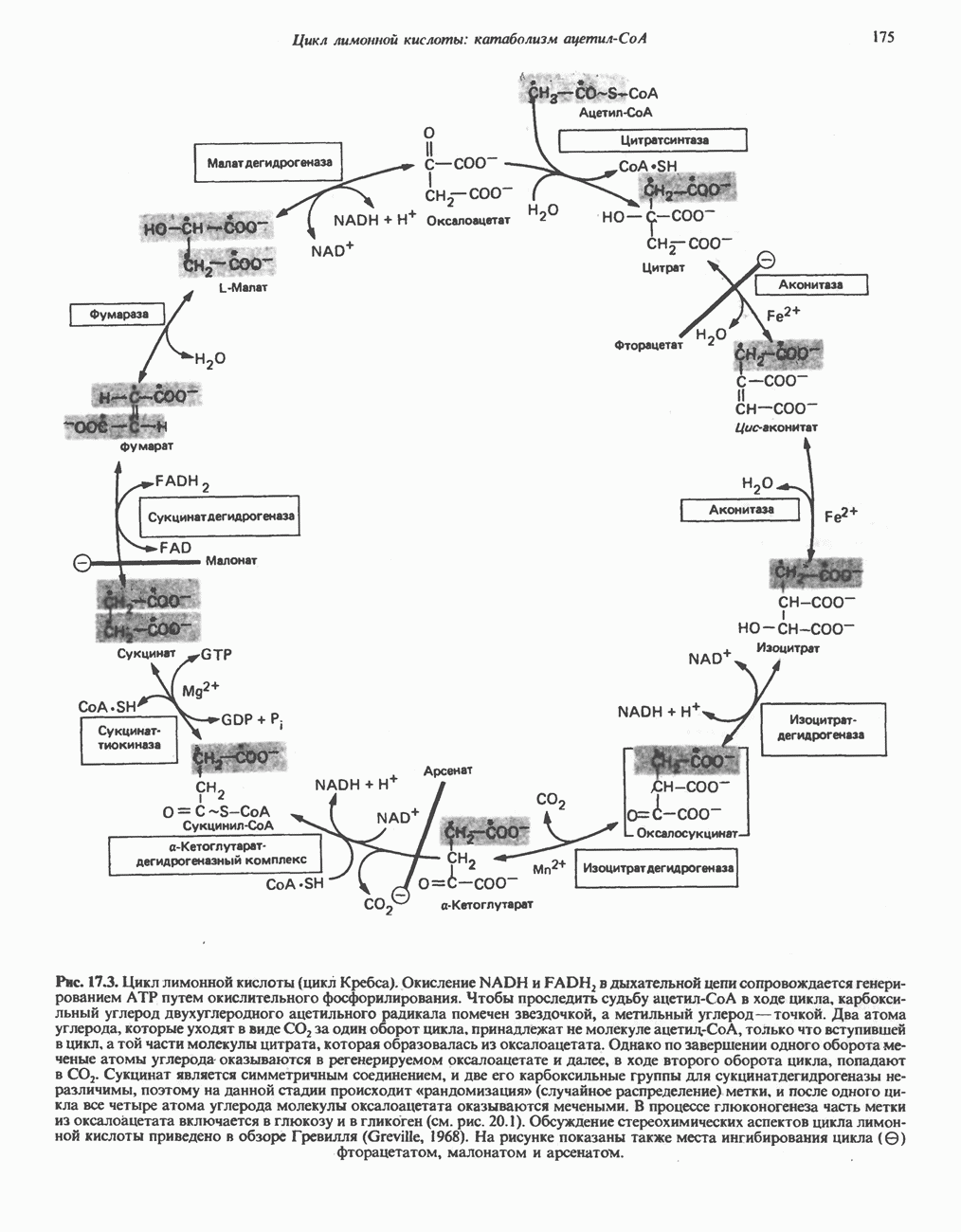
- РЕАКЦИИ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (рис. 17.3)
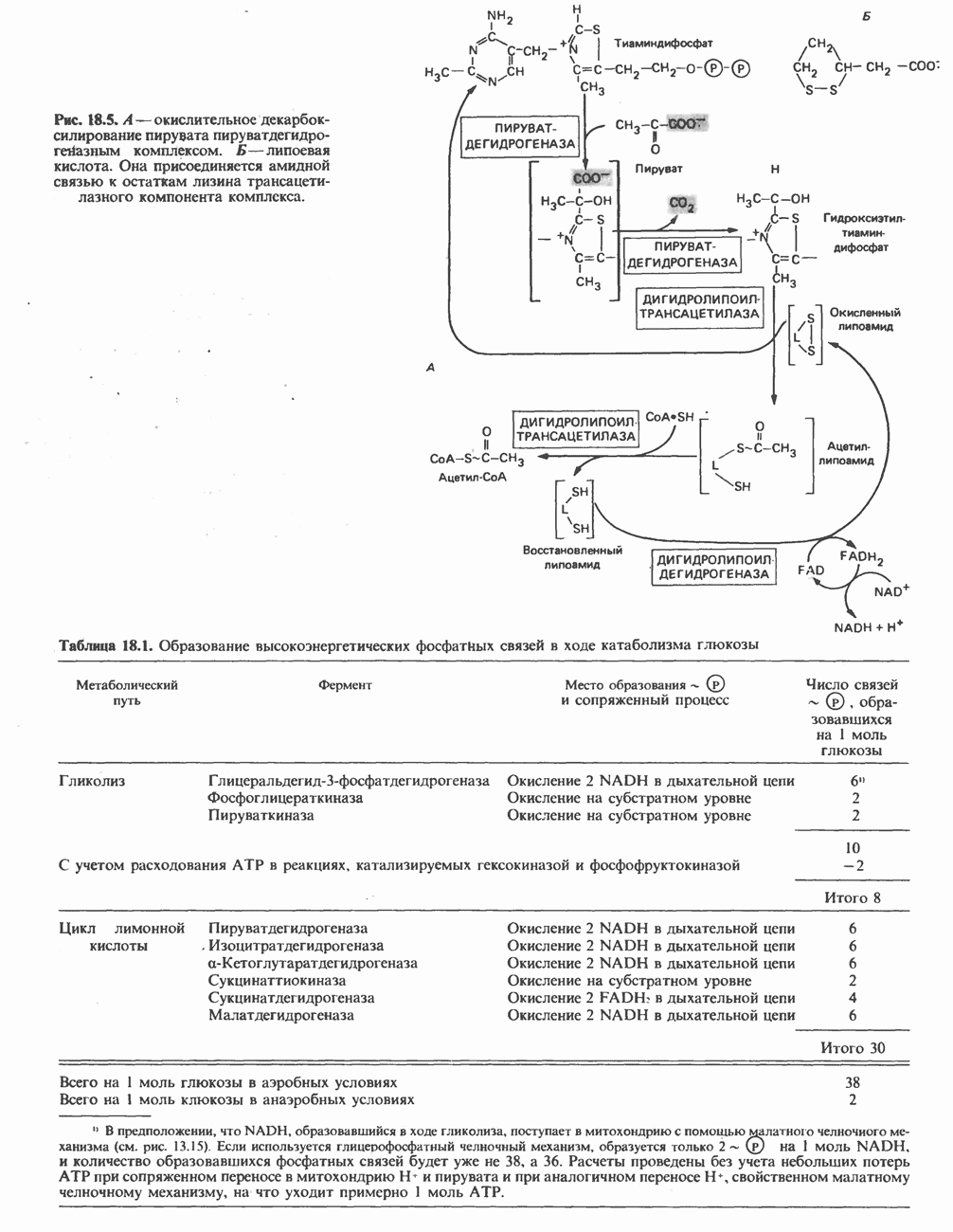
- ЭНЕРГЕТИКА ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
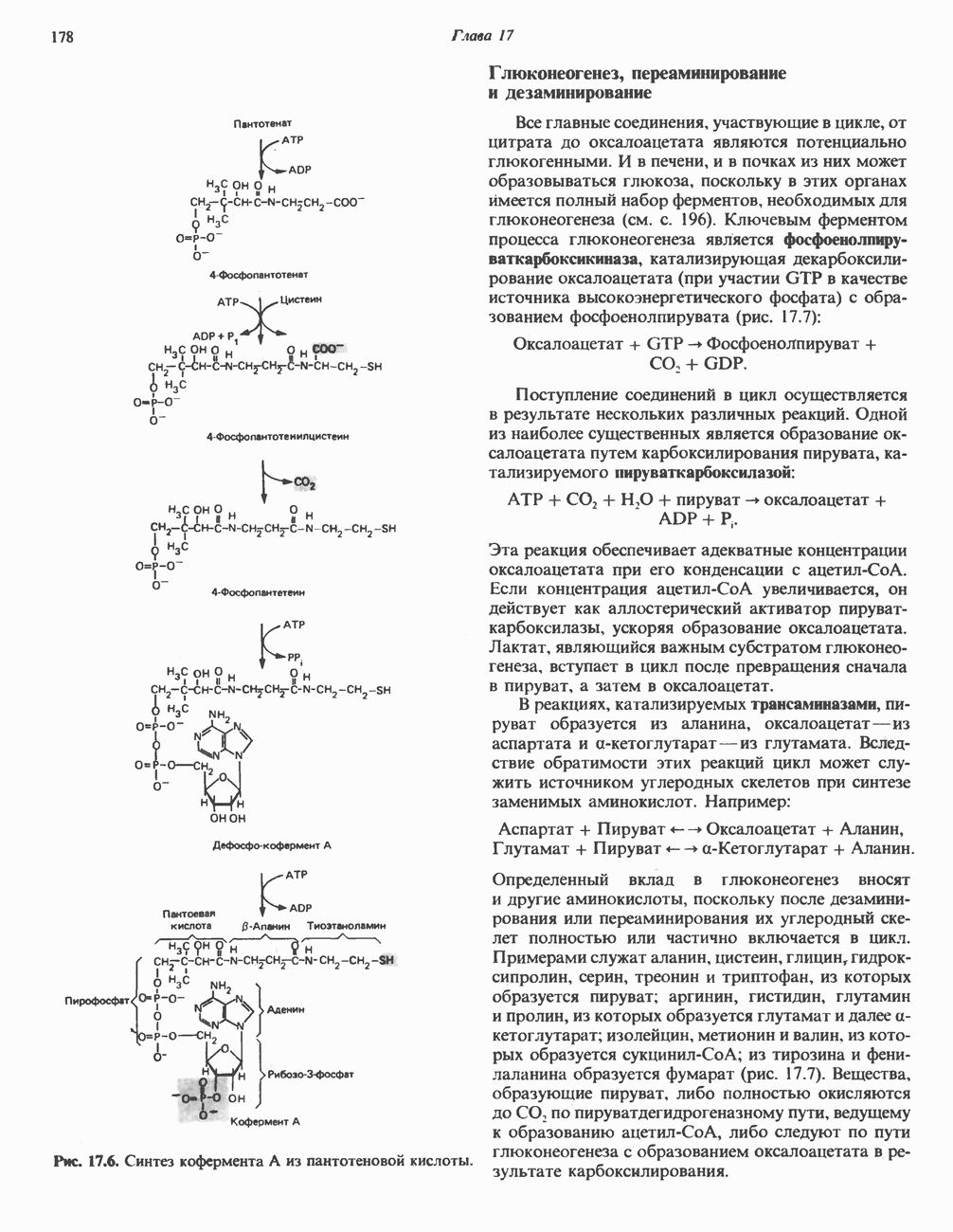
- РОЛЬ ВИТАМИНОВ В ЦИКЛЕ ЛИМОННОЙ КИСЛОТЫ
- АМФИБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
- Глава 18. Гликолиз и окисление пирувата
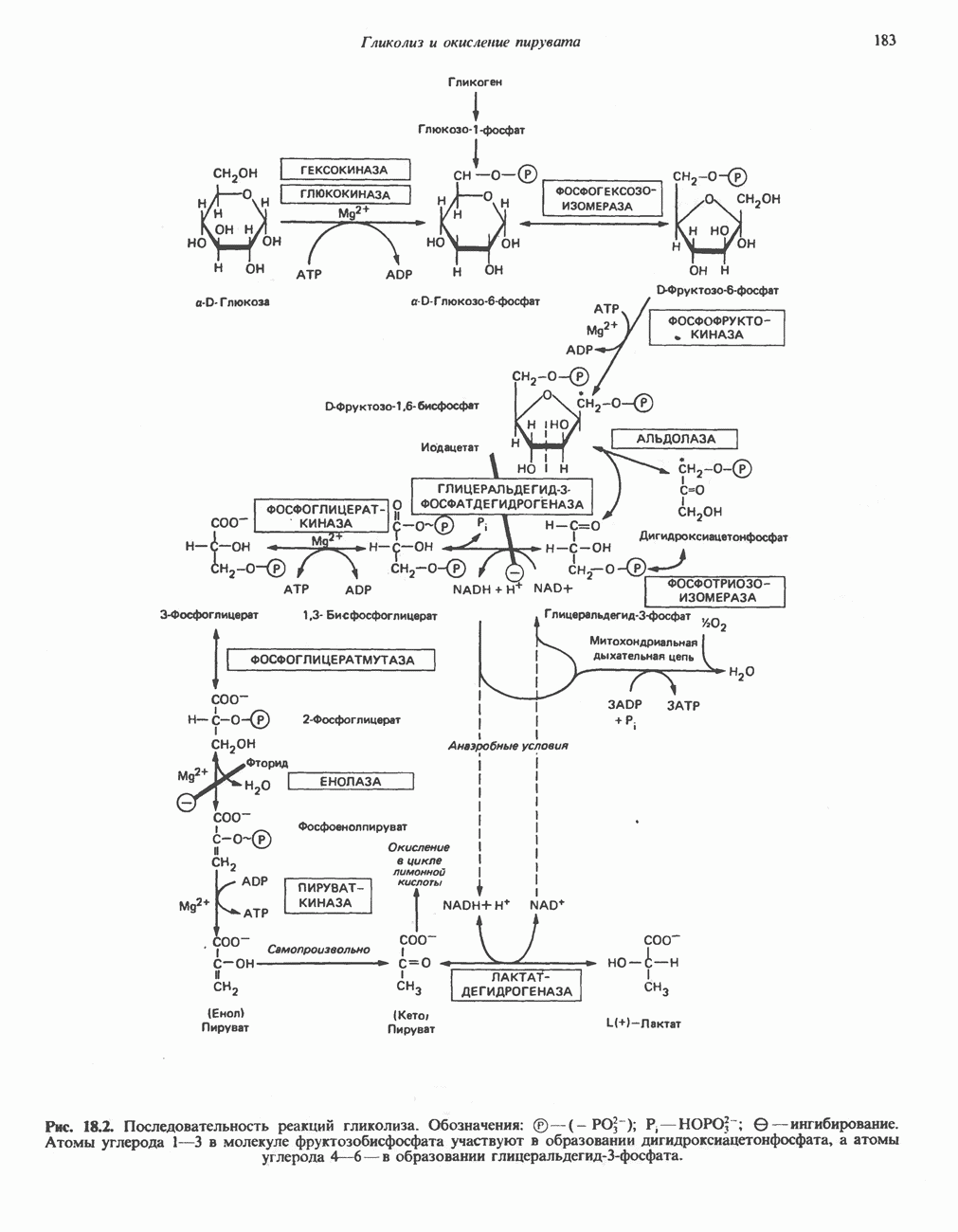
- ГЛИКОЛИТИЧЕСКИЙ ПУТЬ
- ПОСЛЕДОВАТЕЛЬНЫЕ СТАДИИ ГЛИКОЛИЗА
- ОКИСЛЕНИЕ ПИРУВАТА В АЦЕТИЛ-СоА
- Глава 19. Метаболизм гликогена
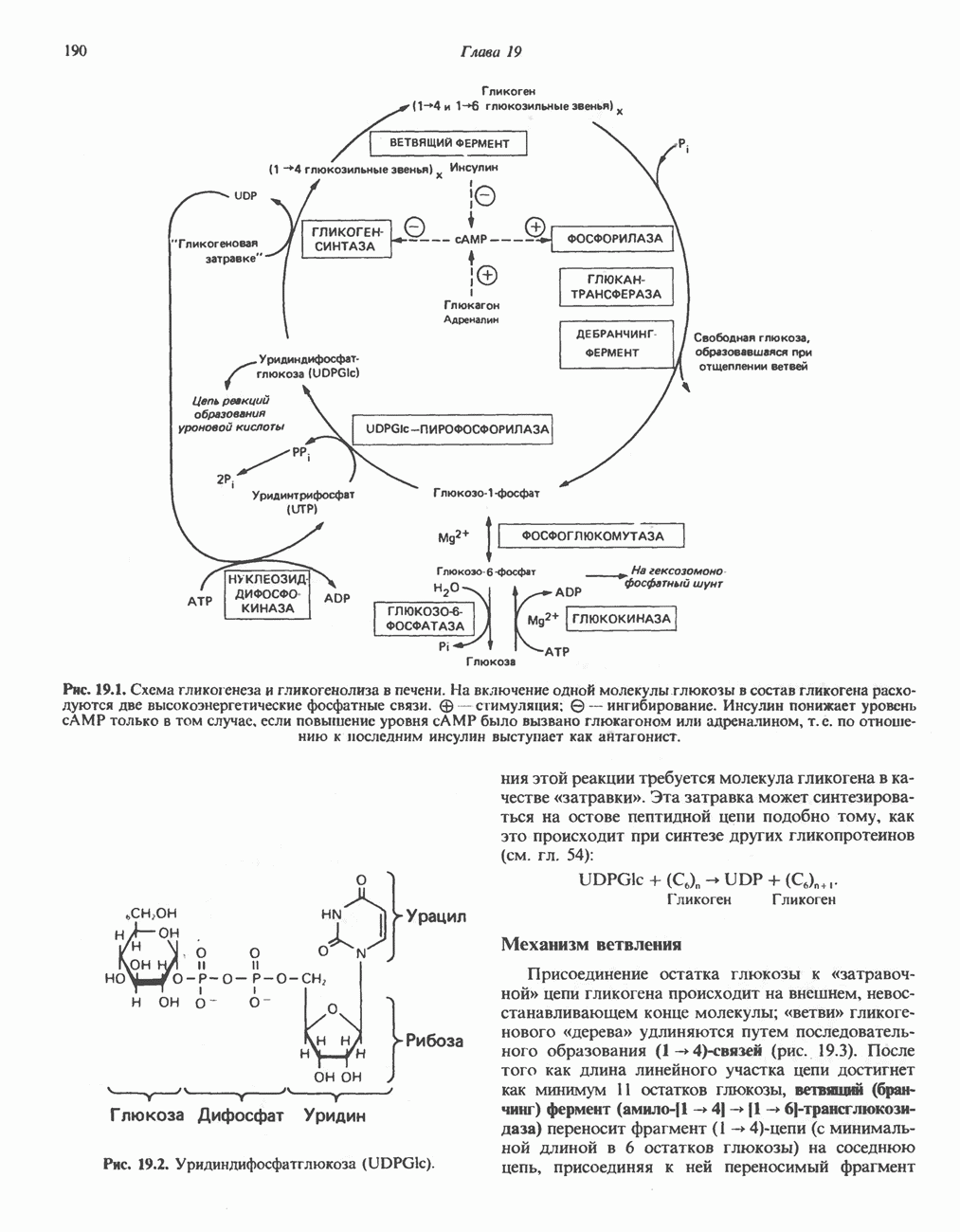
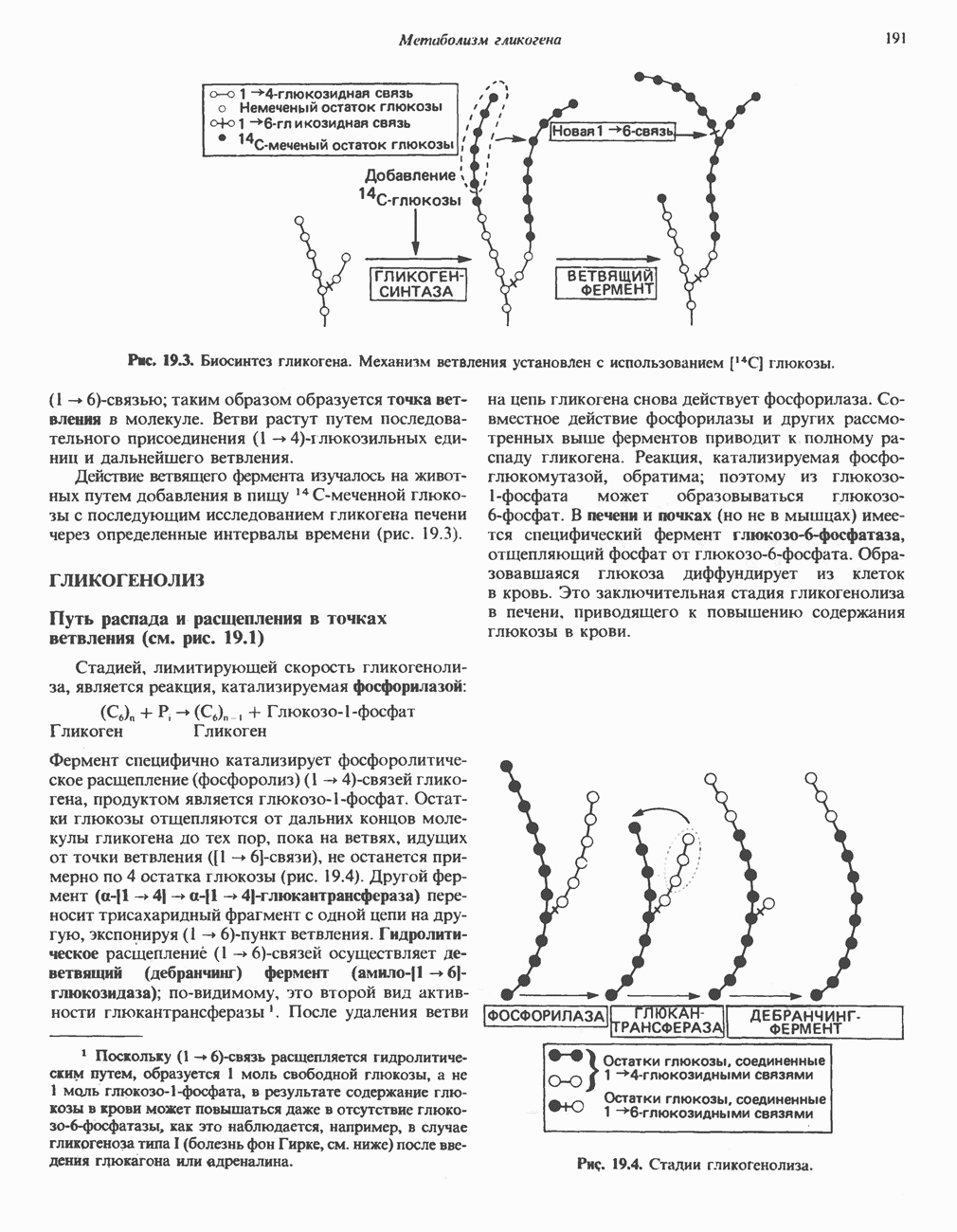
- ГЛИКОГЕНЕЗ
- ГЛИКОГЕНОЛИЗ
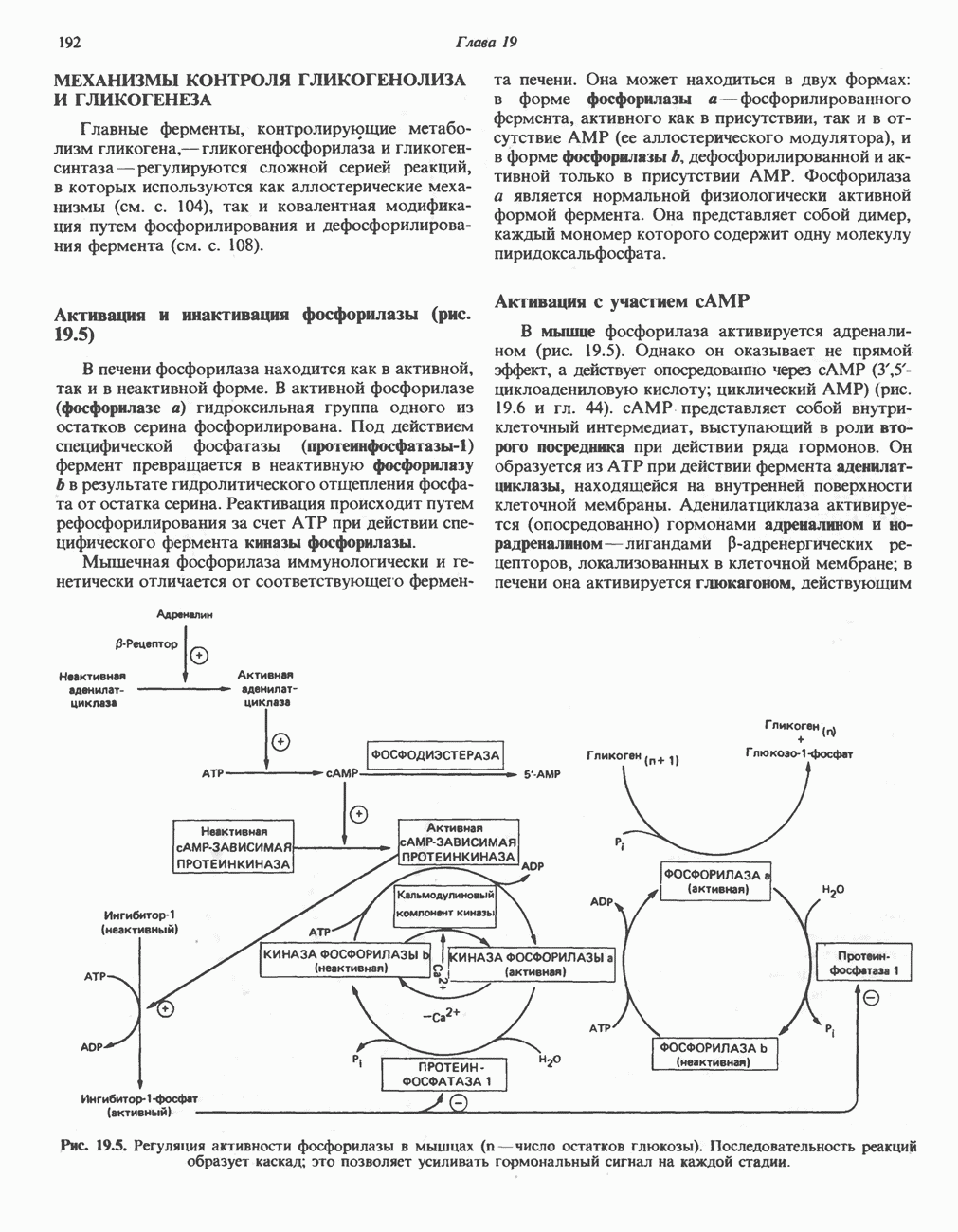
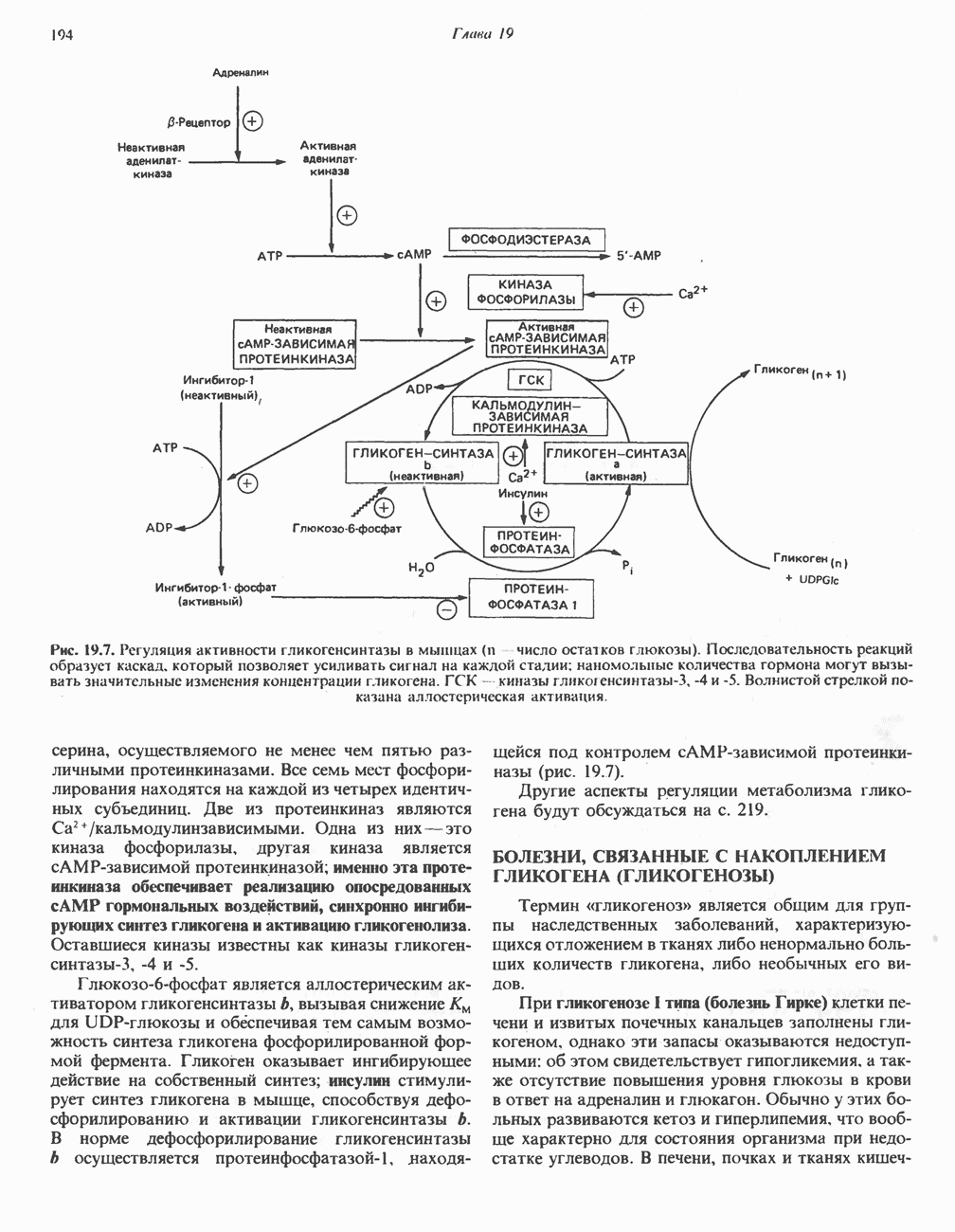
- МЕХАНИЗМЫ КОНТРОЛЯ ГЛИКОГЕНОЛИЗА И ГЛИКОГЕНЕЗА
- БОЛЕЗНИ, СВЯЗАННЫЕ С НАКОПЛЕНИЕМ ГЛИКОГЕНА (ГЛИКОГЕНОЗЫ)
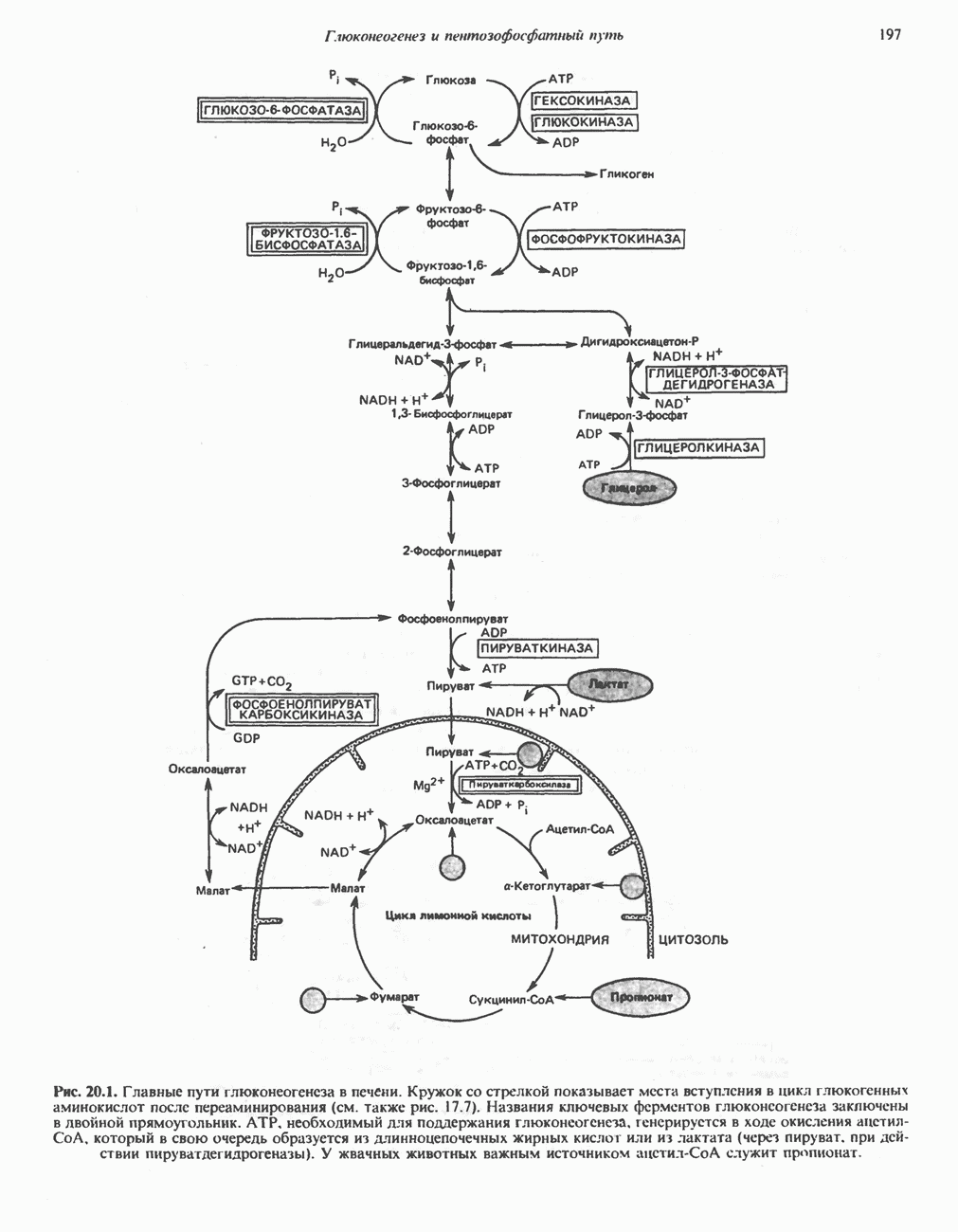
- Глава 20. Глюконеогенез и пентозофосфатный путь
- МЕТАБОЛИЧЕСКИЕ ПУТИ, УЧАСТВУЮЩИЕ В ГЛЮКОНЕОГЕНЕЗЕ (рис. 20.1)
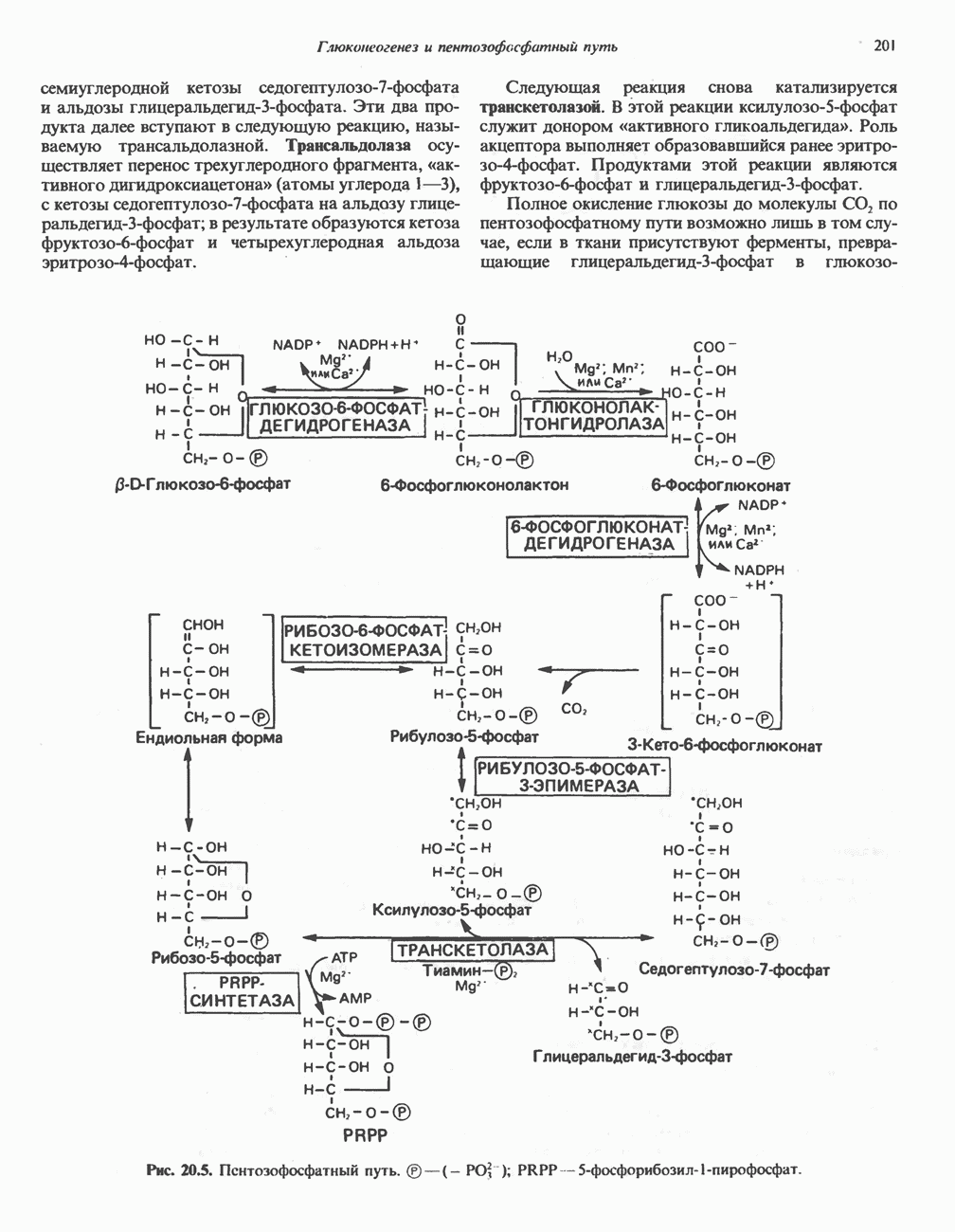
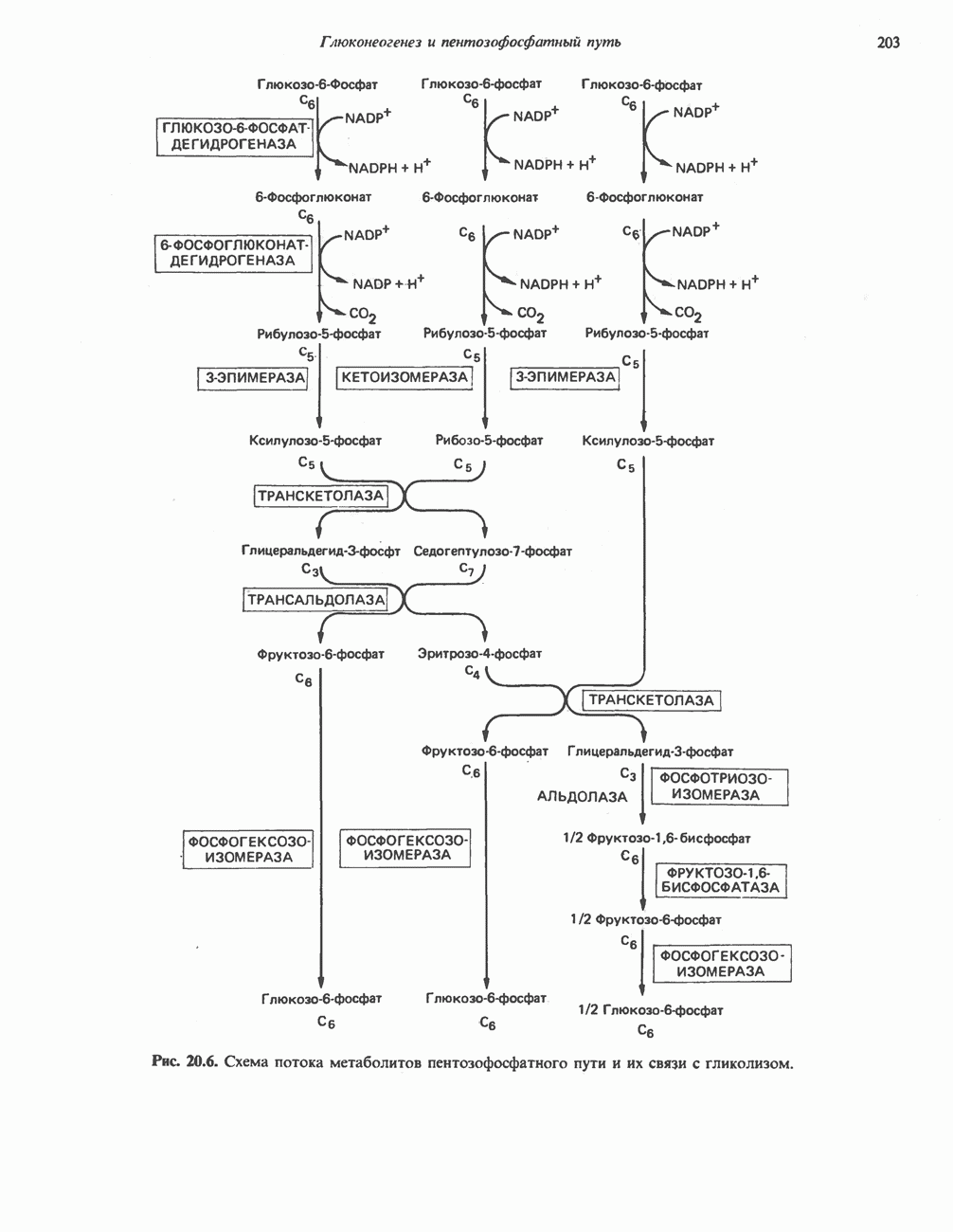
- ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ИЛИ ГЕКСОЗОМОНОФОСФАТНЫЙ ШУНТ
- ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ
- МЕТАБОЛИЧЕСКОЕ ЗНАЧЕНИЕ ПЕНТОЗОФОСФАТНОГО ПУТИ
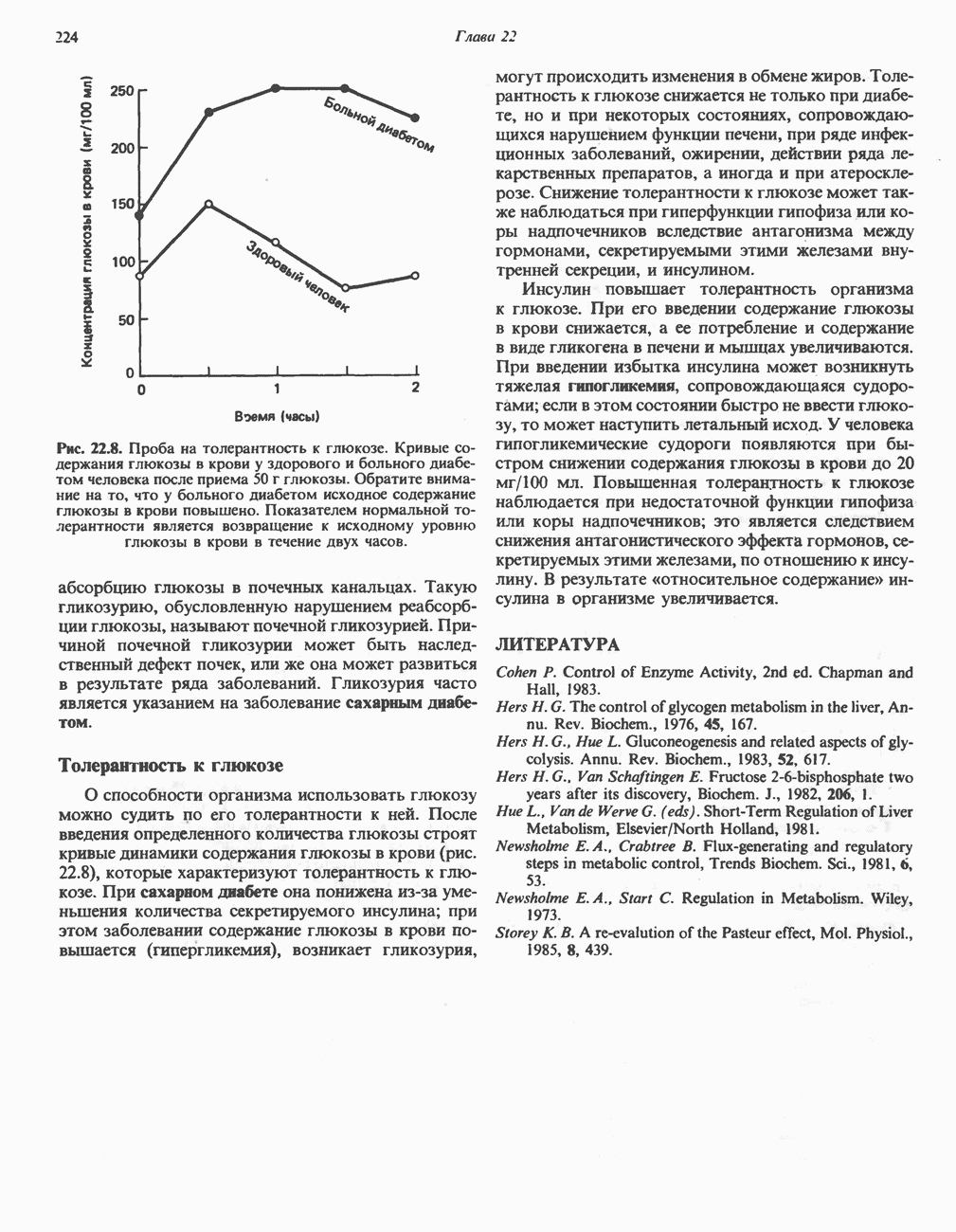
- КЛИНИЧЕСКИЕ АСПЕКТЫ
- Глава 21. Метаболизм наиболее важных гексоз
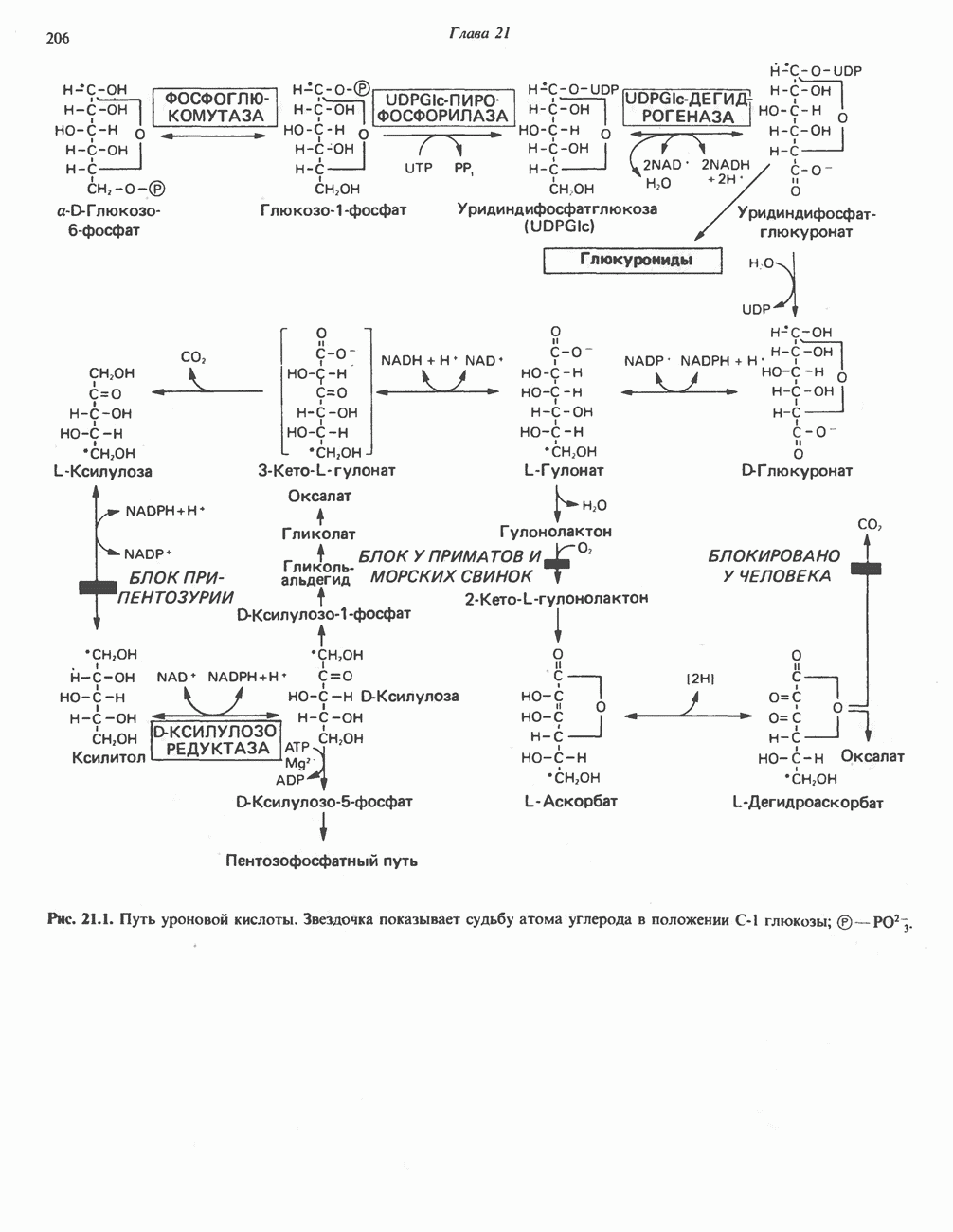
- ПУТЬ УРОНОВЫХ КИСЛОТ
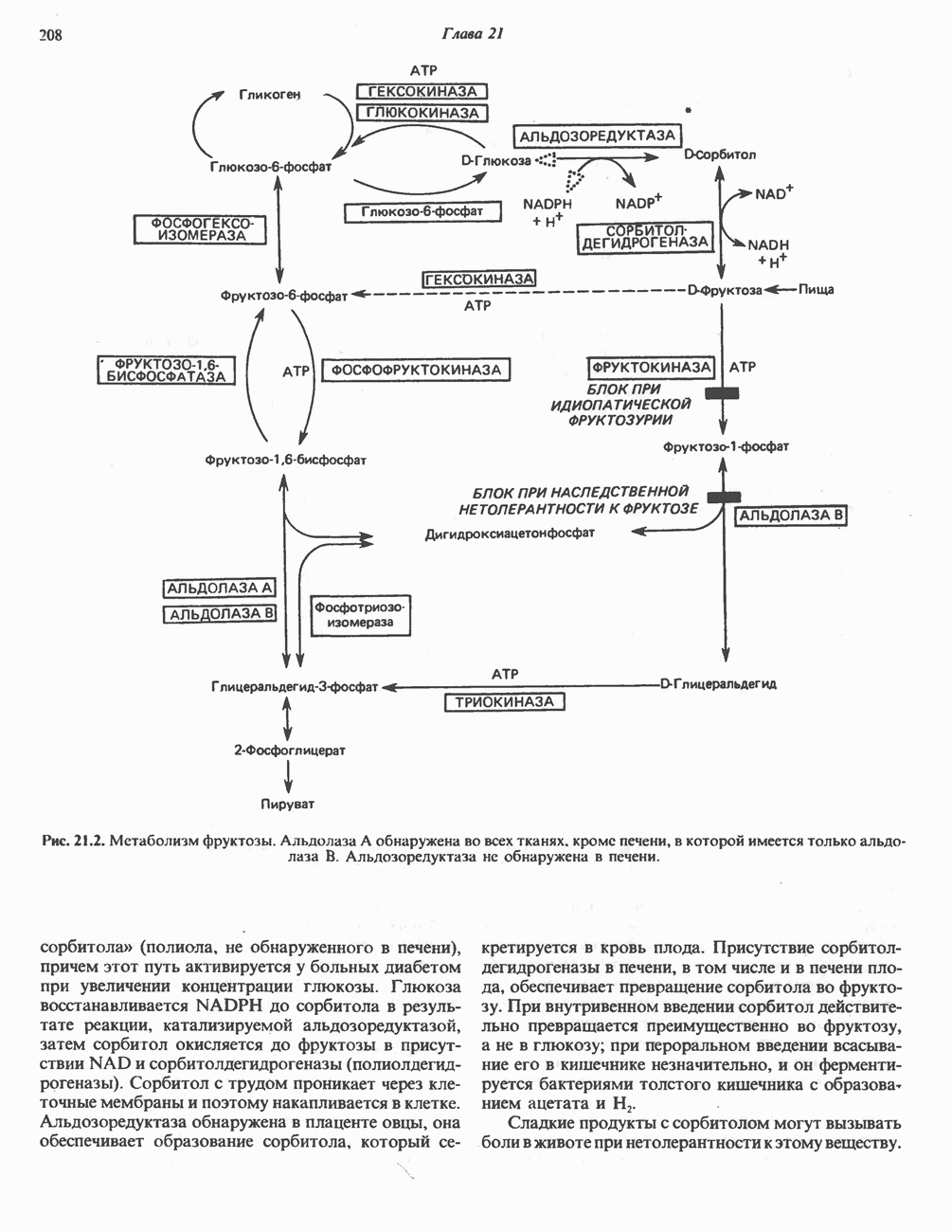
- МЕТАБОЛИЗМ ФРУКТОЗЫ
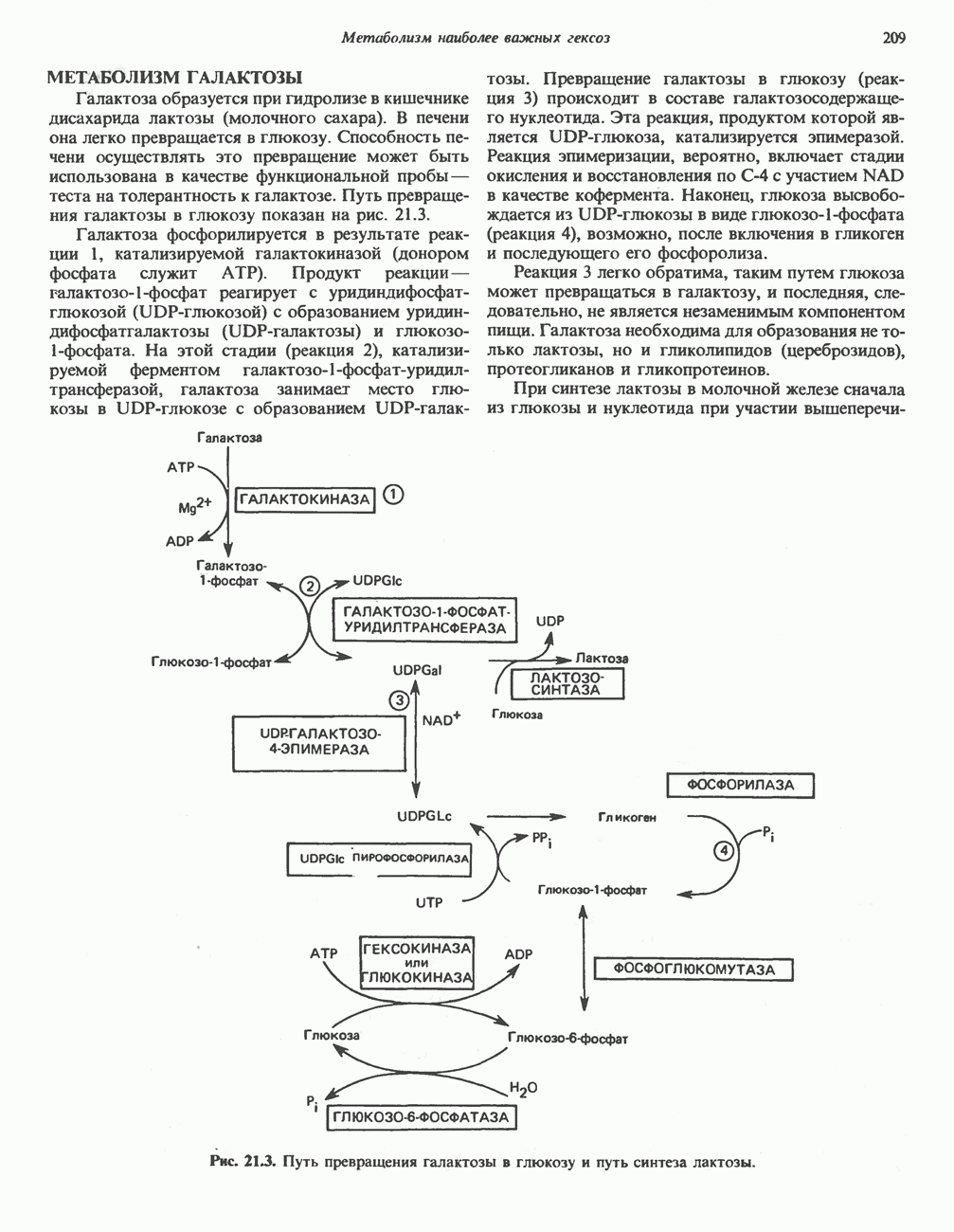
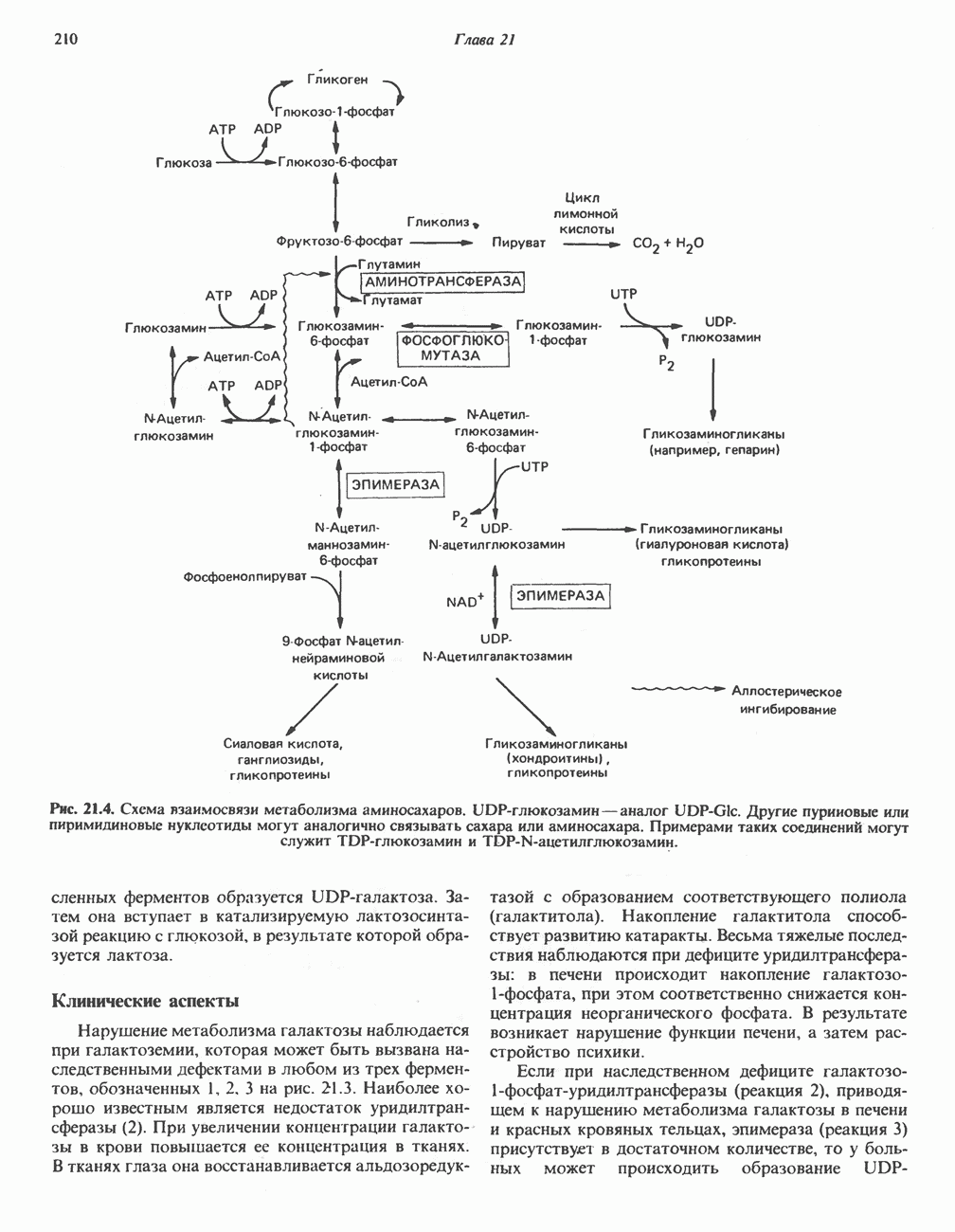
- МЕТАБОЛИЗМ ГАЛАКТОЗЫ
- Глава 22. Регуляция метаболизма углеводов
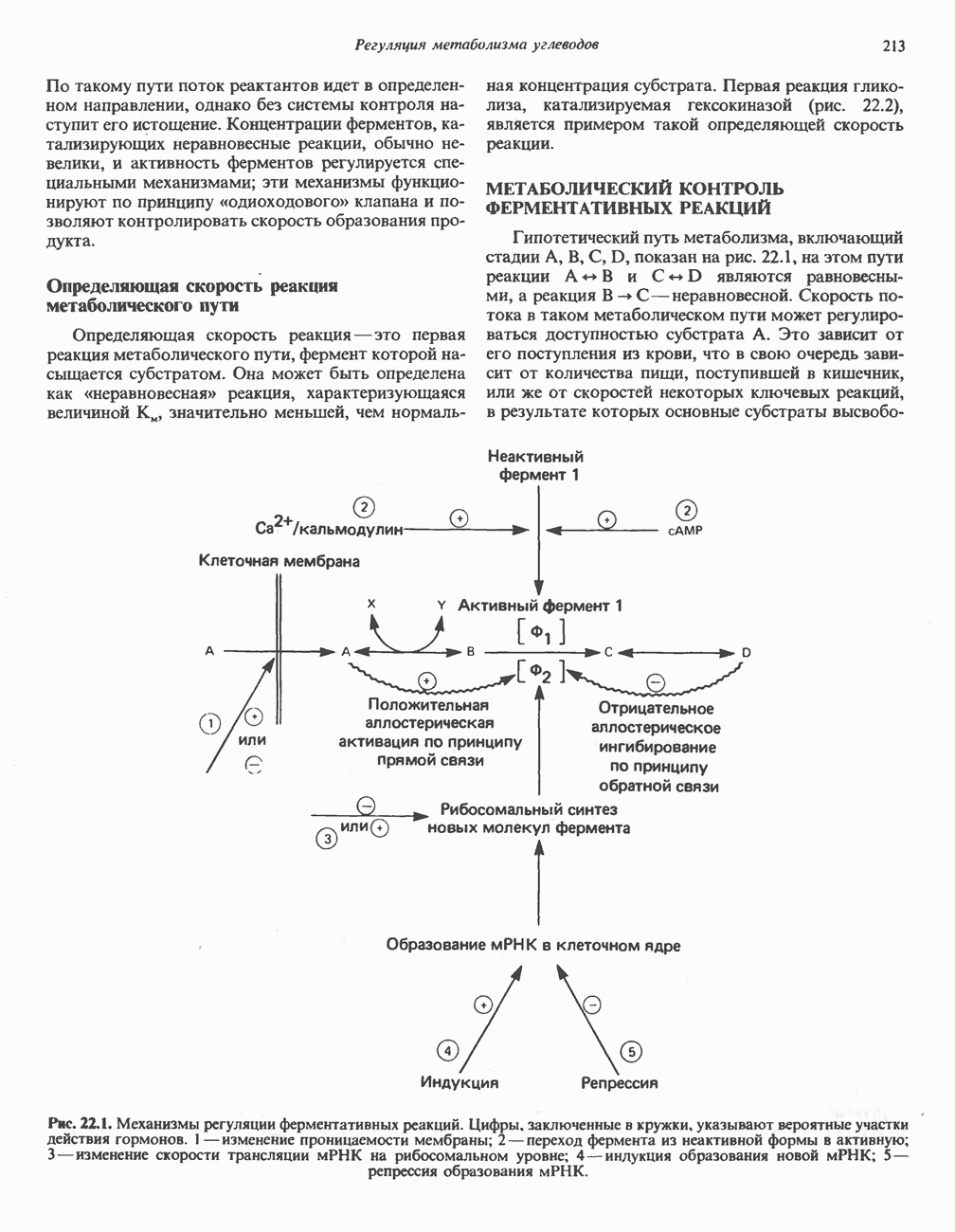
- ОБЩИЕ ПРИНЦИПЫ РЕГУЛЯЦИИ ПУТЕЙ МЕТАБОЛИЗМА
- МЕТАБОЛИЧЕСКИЙ КОНТРОЛЬ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
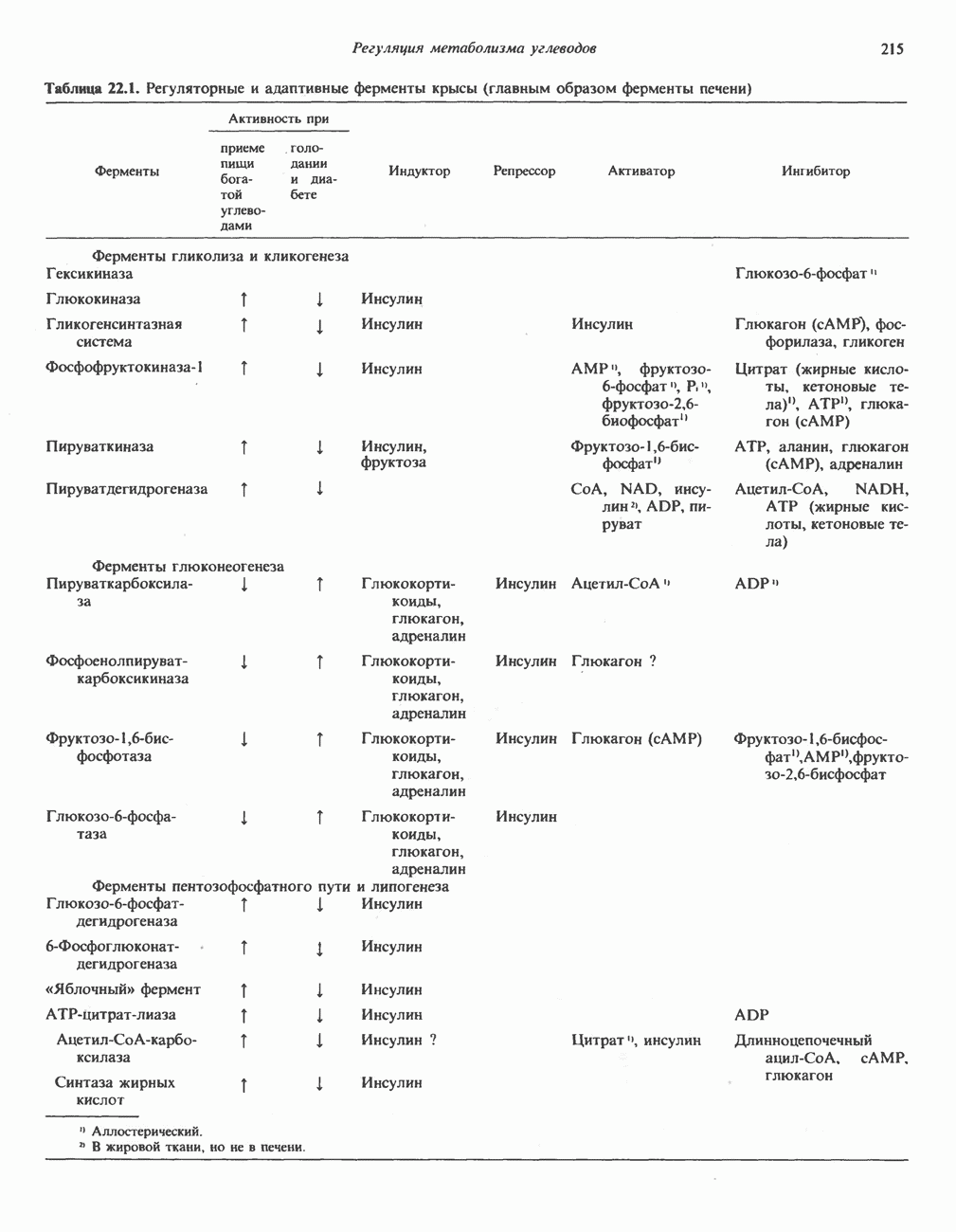
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА УГЛЕВОДОВ НА КЛЕТОЧНОМ И ФЕРМЕНТНОМ УРОВНЕ
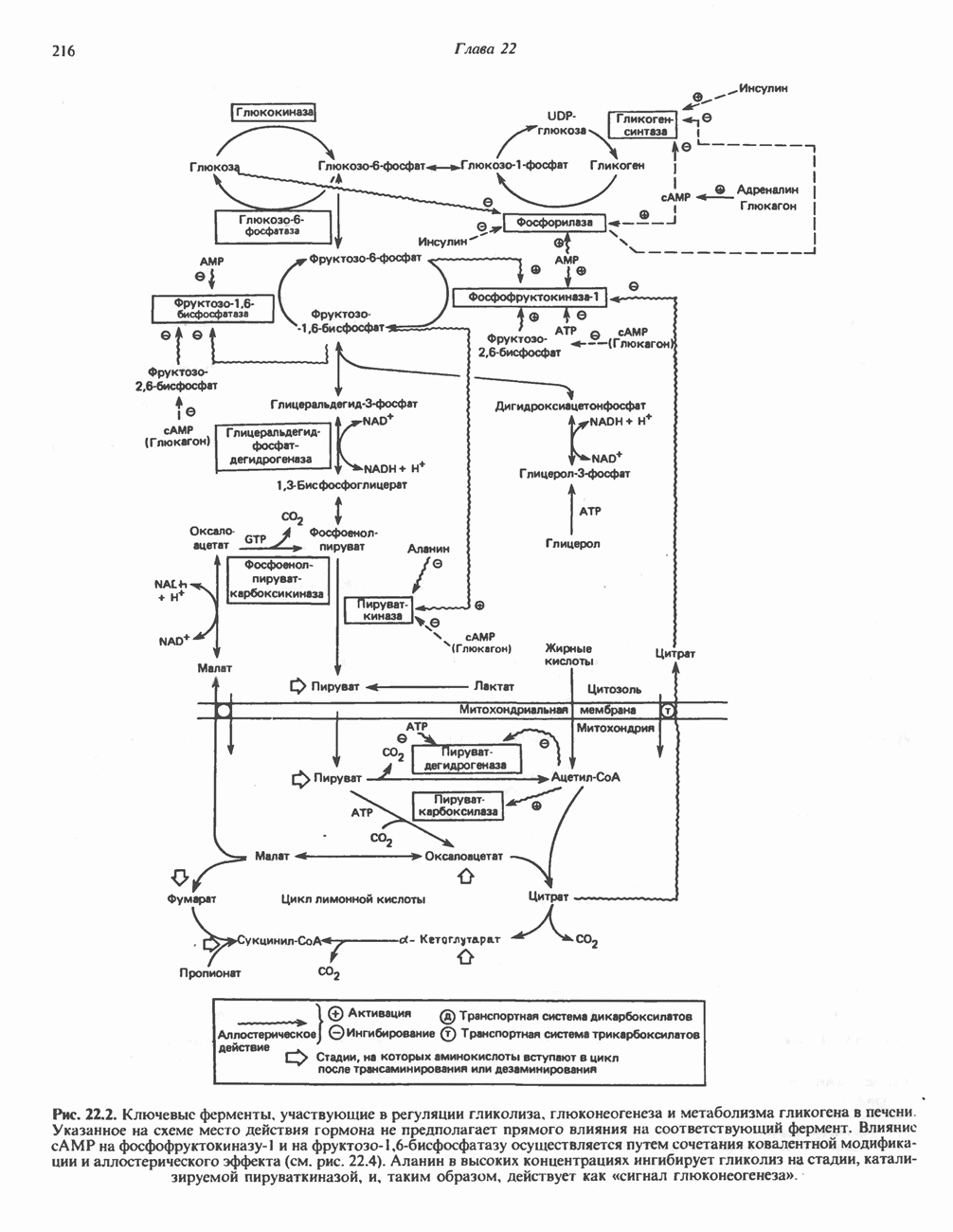
- РЕГУЛЯЦИЯ ГЛИКОЛИЗА, ГЛЮКОНЕОГЕНЕЗА И ПЕНТОЗОФОСФАТНОГО ПУТИ
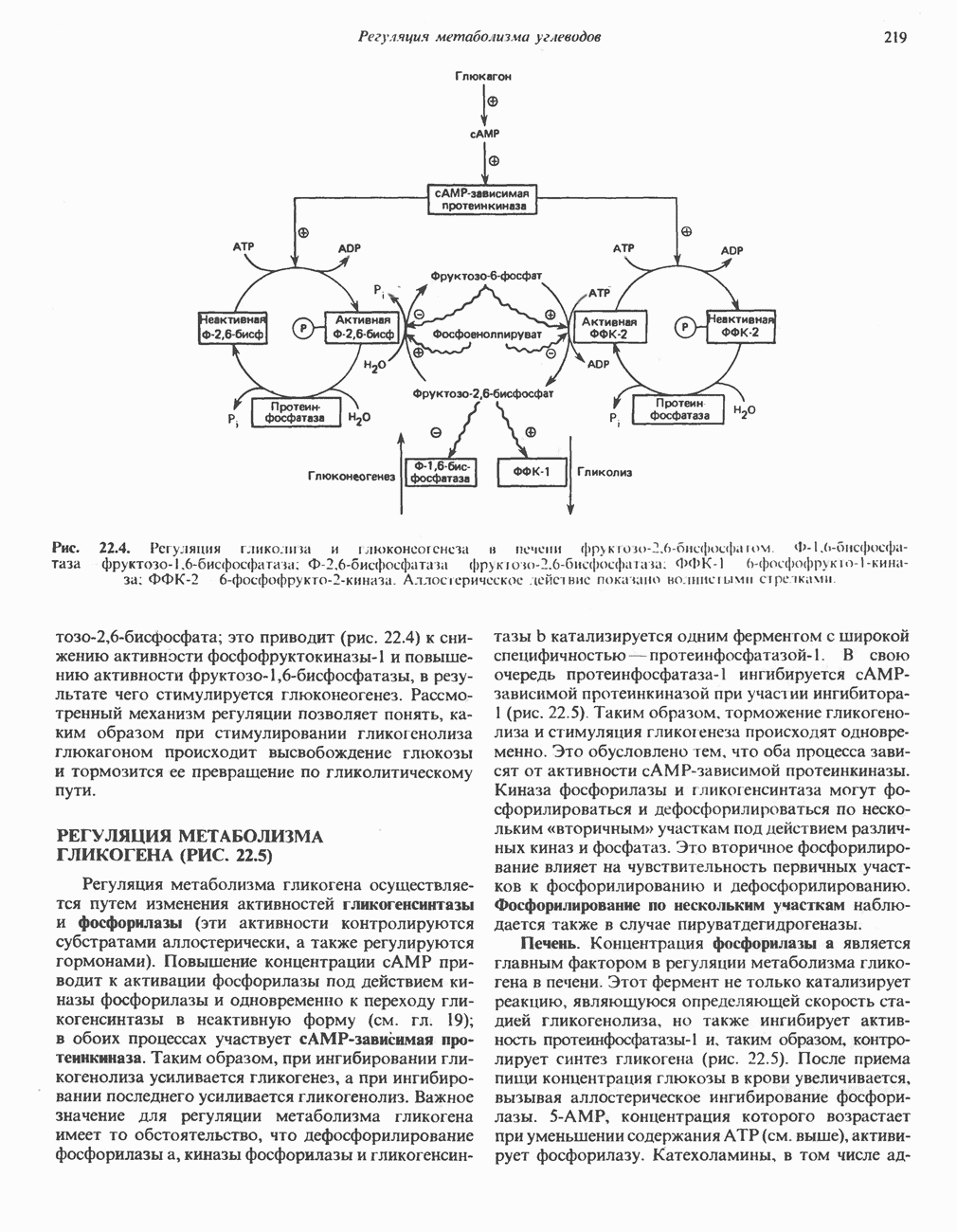
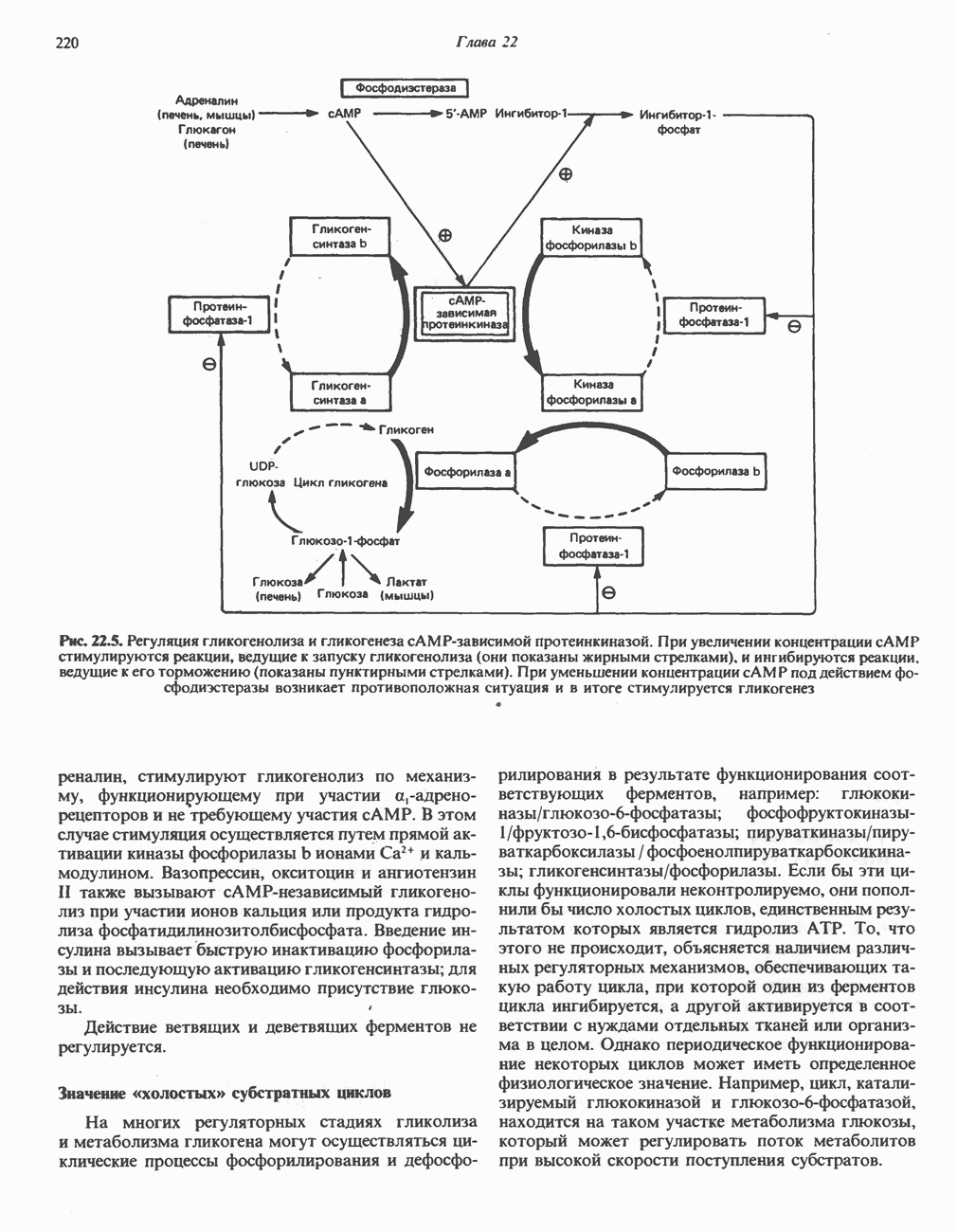
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ГЛИКОГЕНА (РИС. 22.5)
- РЕГУЛЯЦИЯ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (СМ. РИС. 18.3)
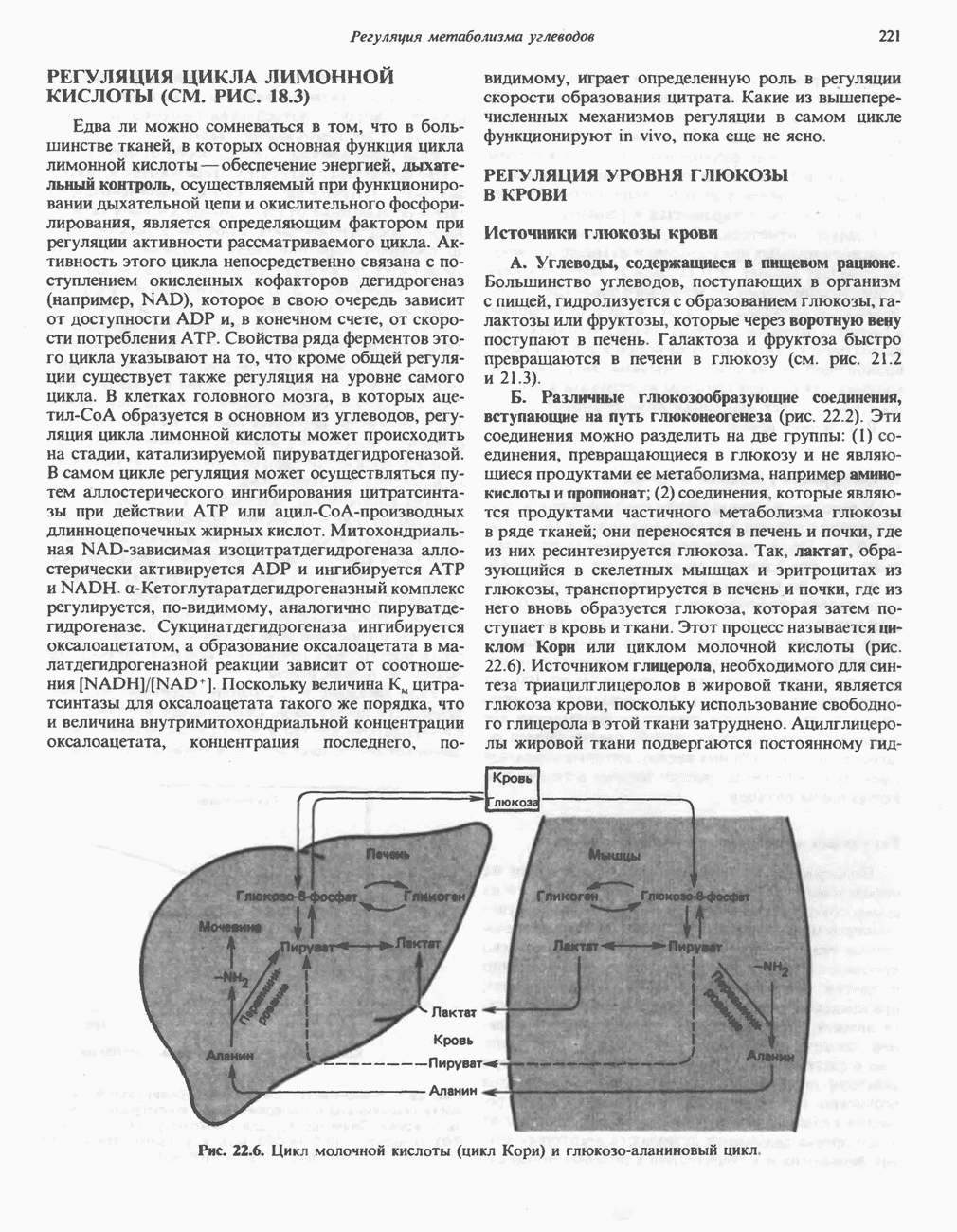
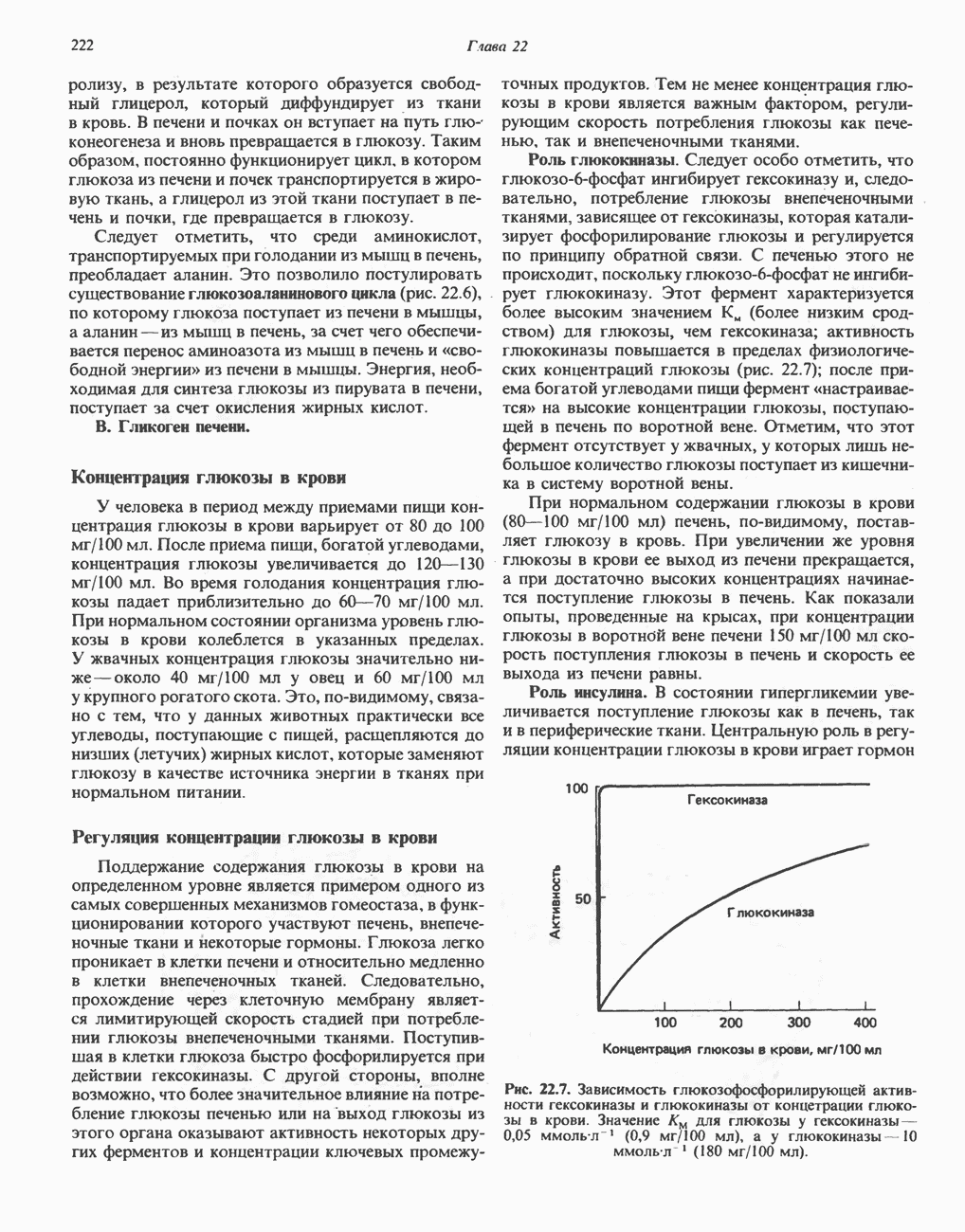
- РЕГУЛЯЦИЯ УРОВНЯ ГЛЮКОЗЫ В КРОВИ
- Глава 23. Окисление и биосинтез жирных кислот
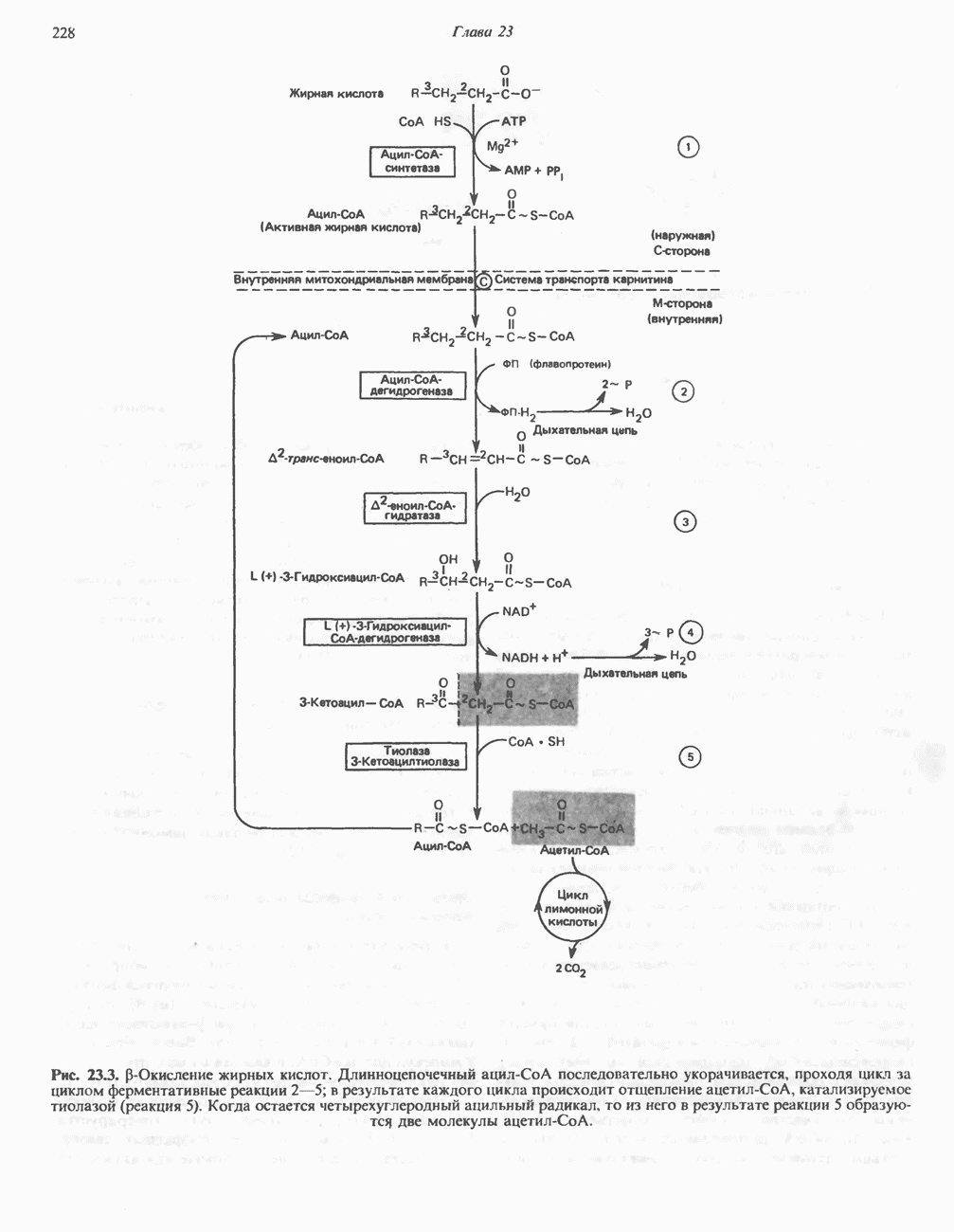
- ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ
- БИОСИНТЕЗ НАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
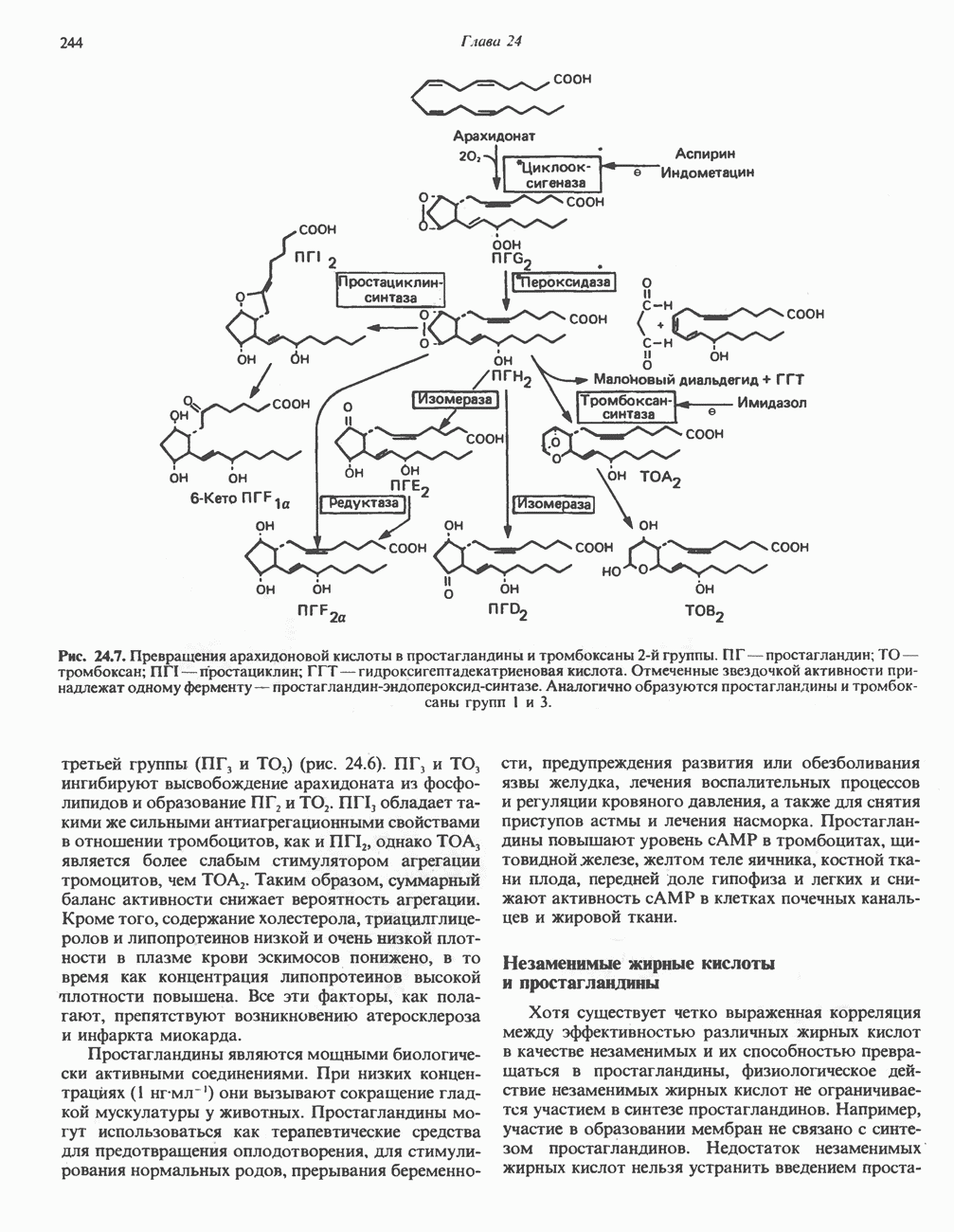
- Глава 24. Метаболизм ненасыщенных жирных кислот и эйкозаноидов
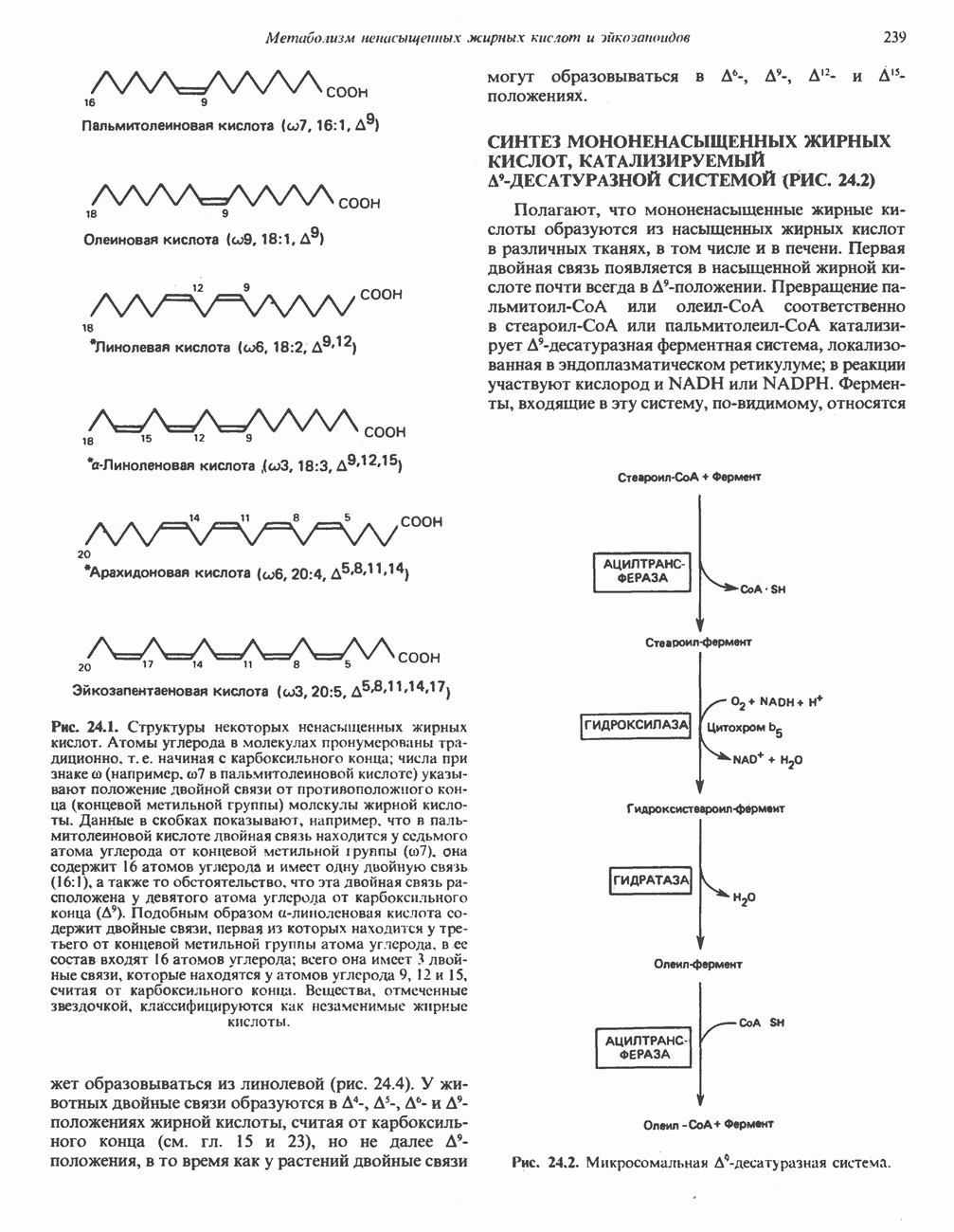
- МЕТАБОЛИЗМ НЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
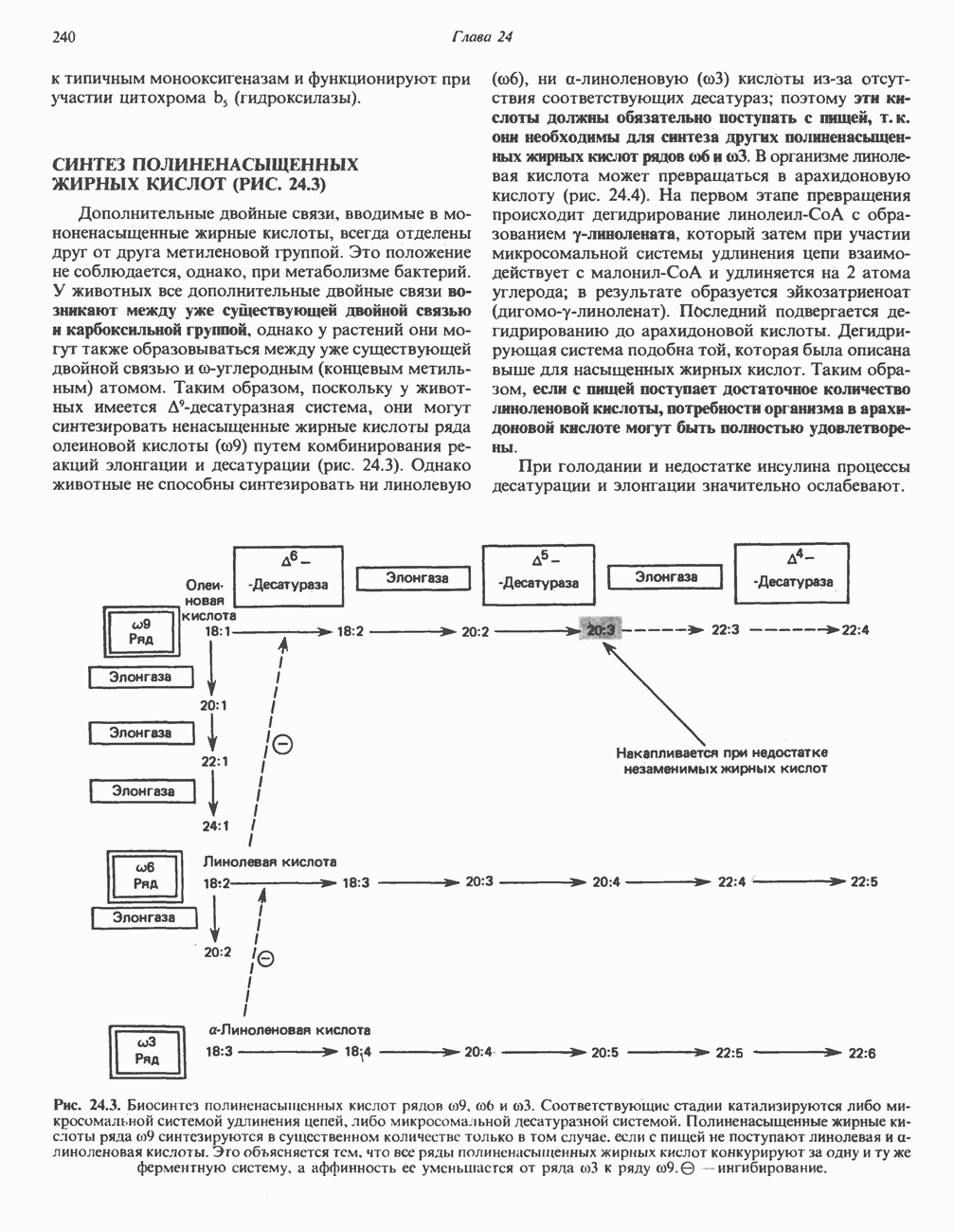
- СИНТЕЗ МОНОНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ, КАТАЛИЗИРУЕМЫЙ Д9-ДЕСАТУРАЗНОЙ СИСТЕМОЙ (РИС. 24.2)
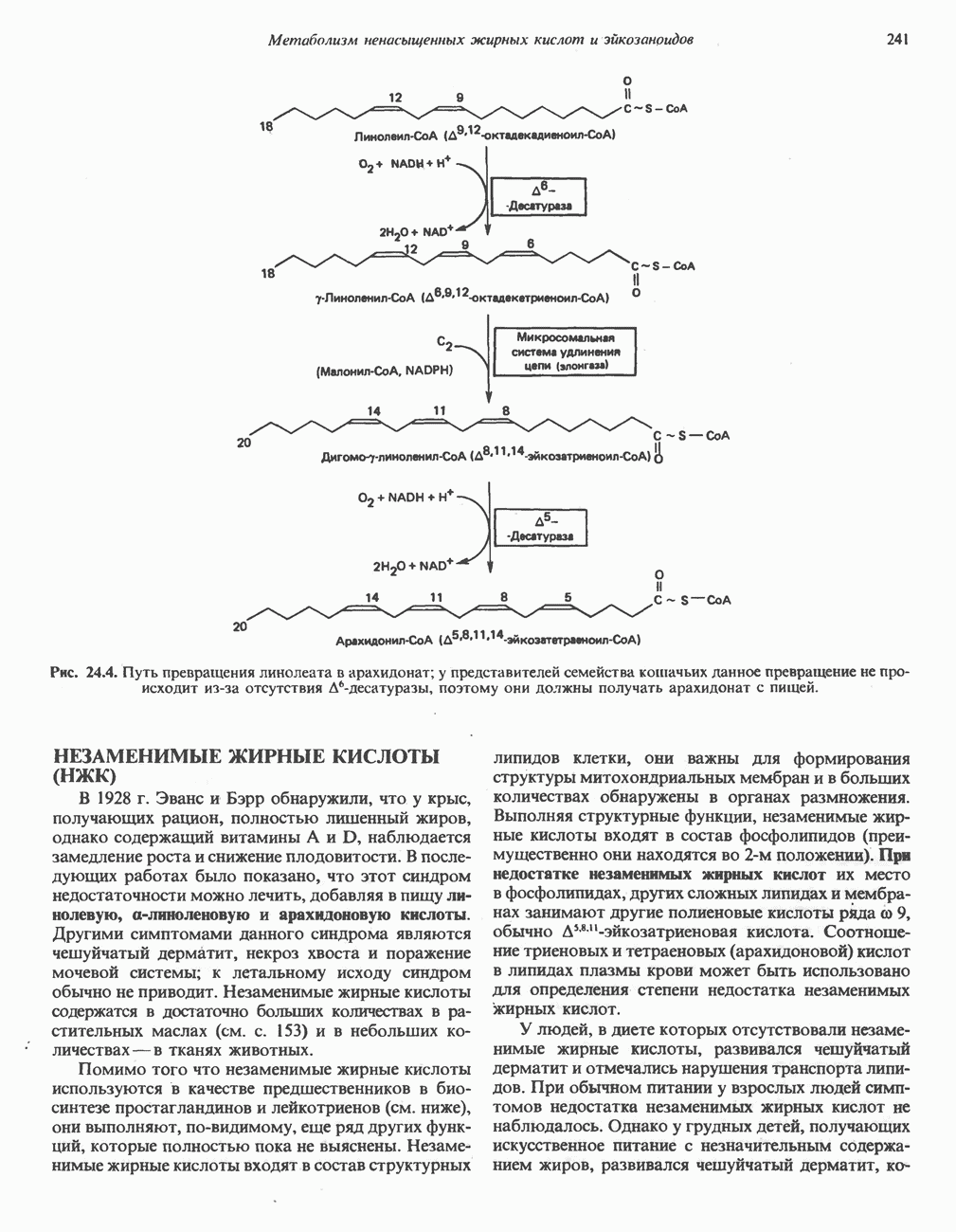
- СИНТЕЗ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ (РИС. 24.3)
- НЕЗАМЕНИМЫЕ ЖИРНЫЕ КИСЛОТЫ (НЖК)
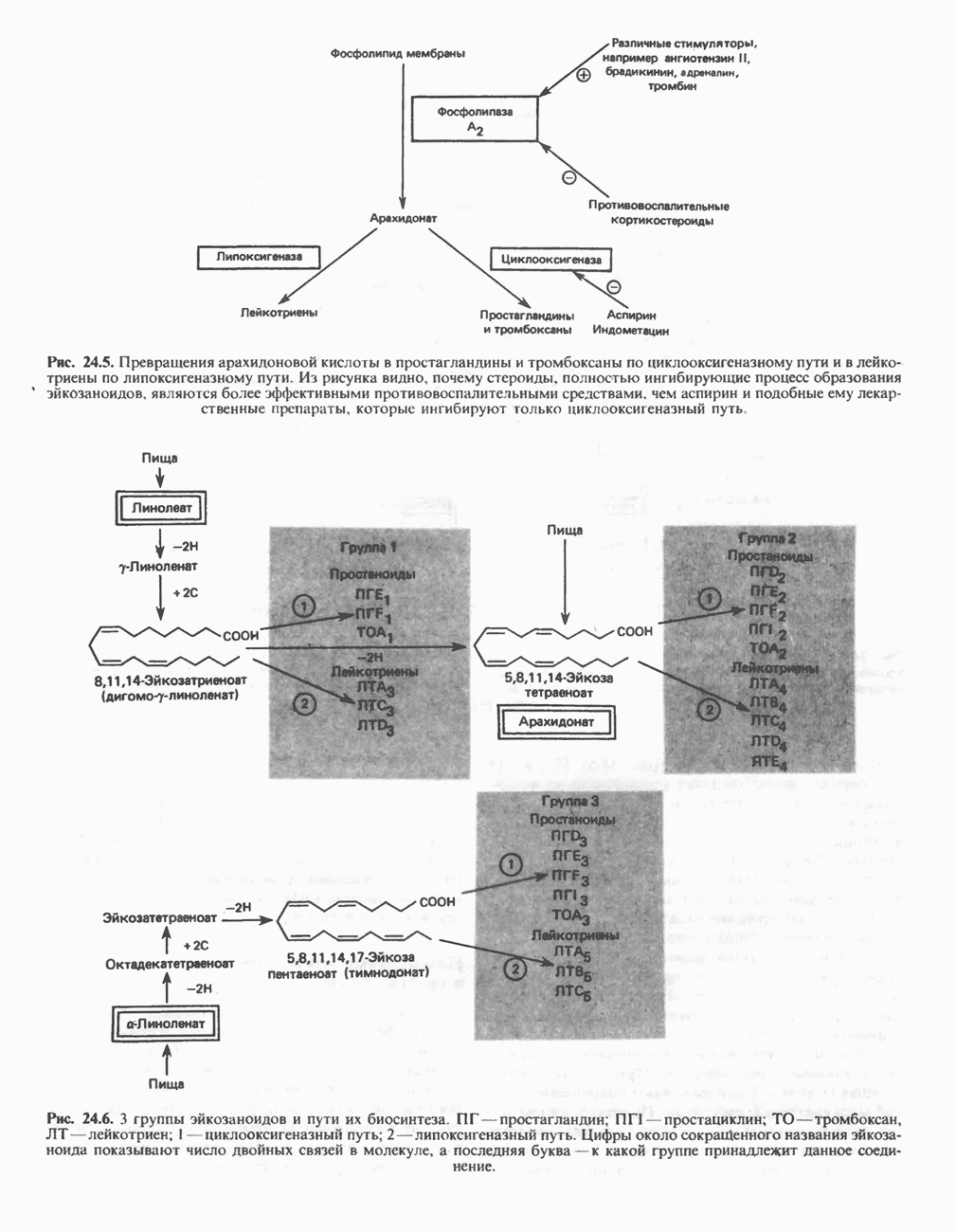
- ЭЙКОЗАНОИДЫ
- ПРОСТАНОИДЫ
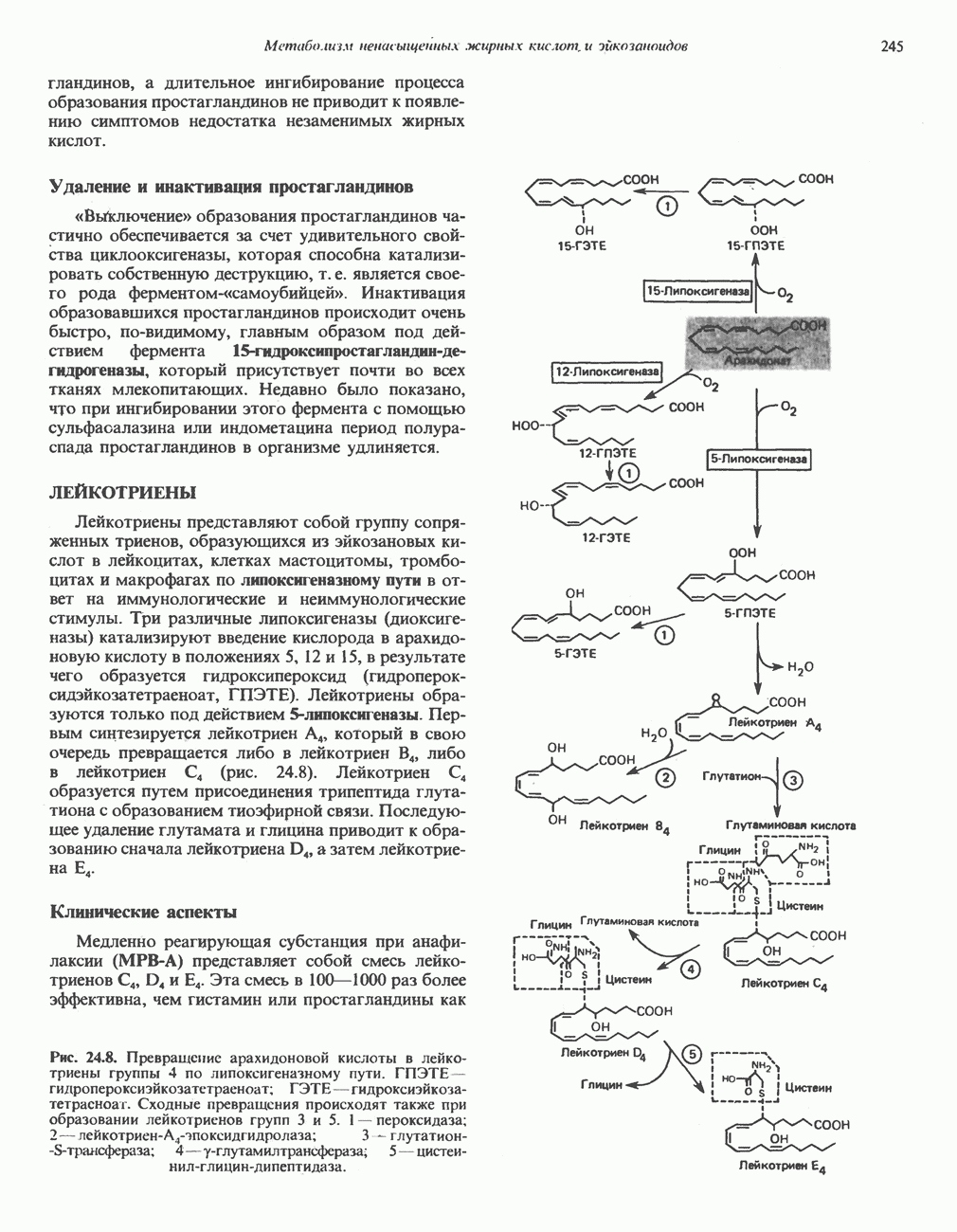
- ЛЕЙКОТРИЕНЫ
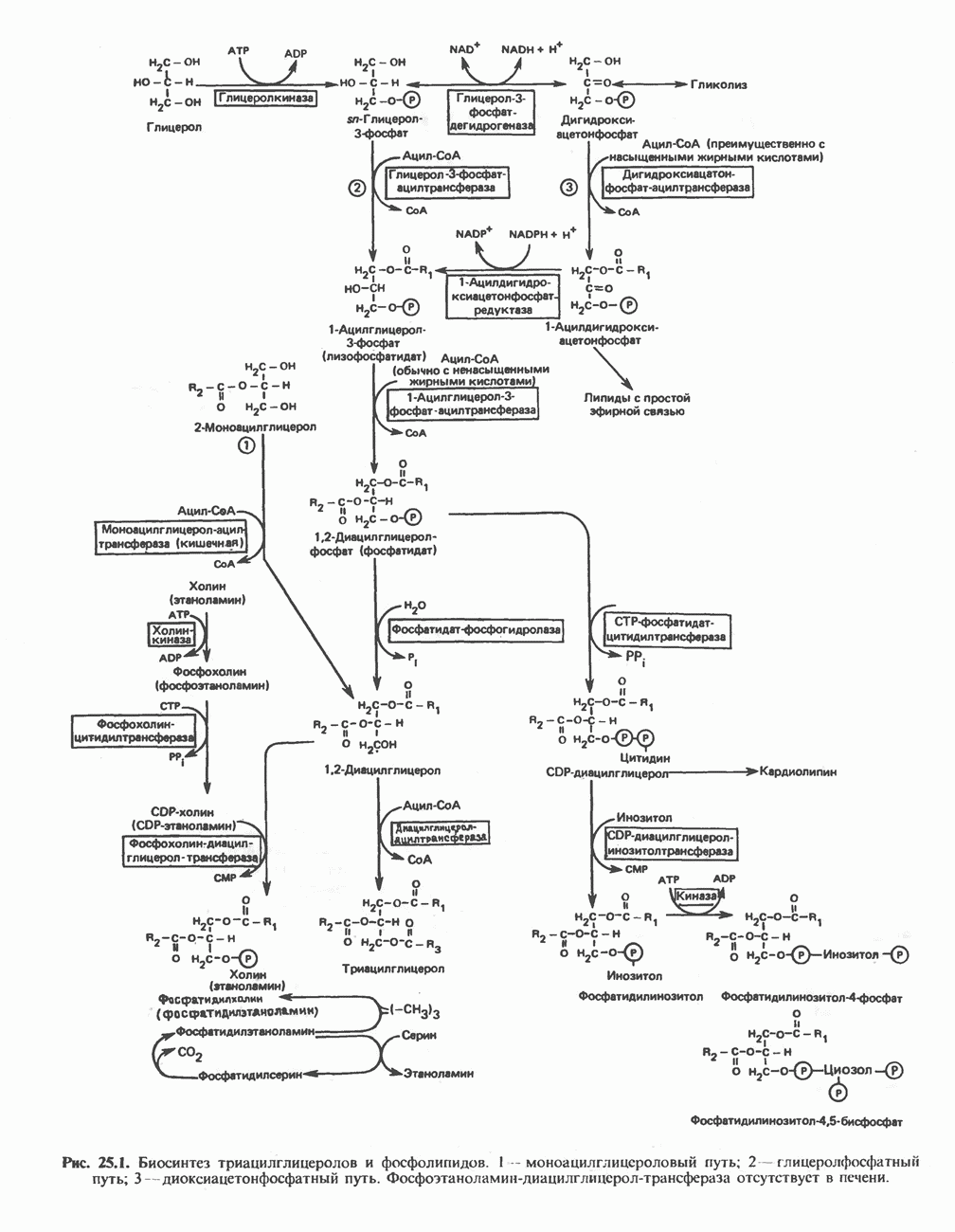
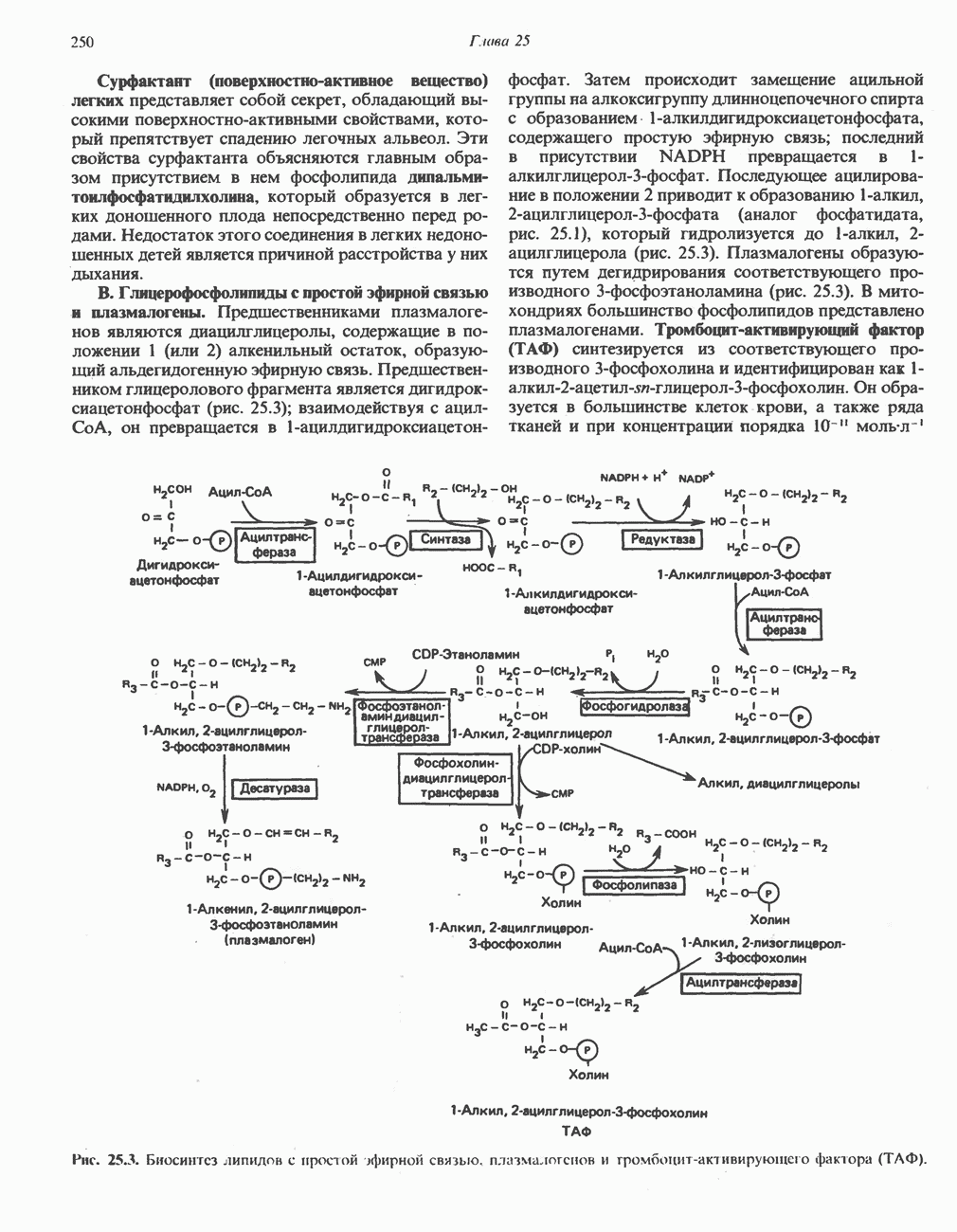
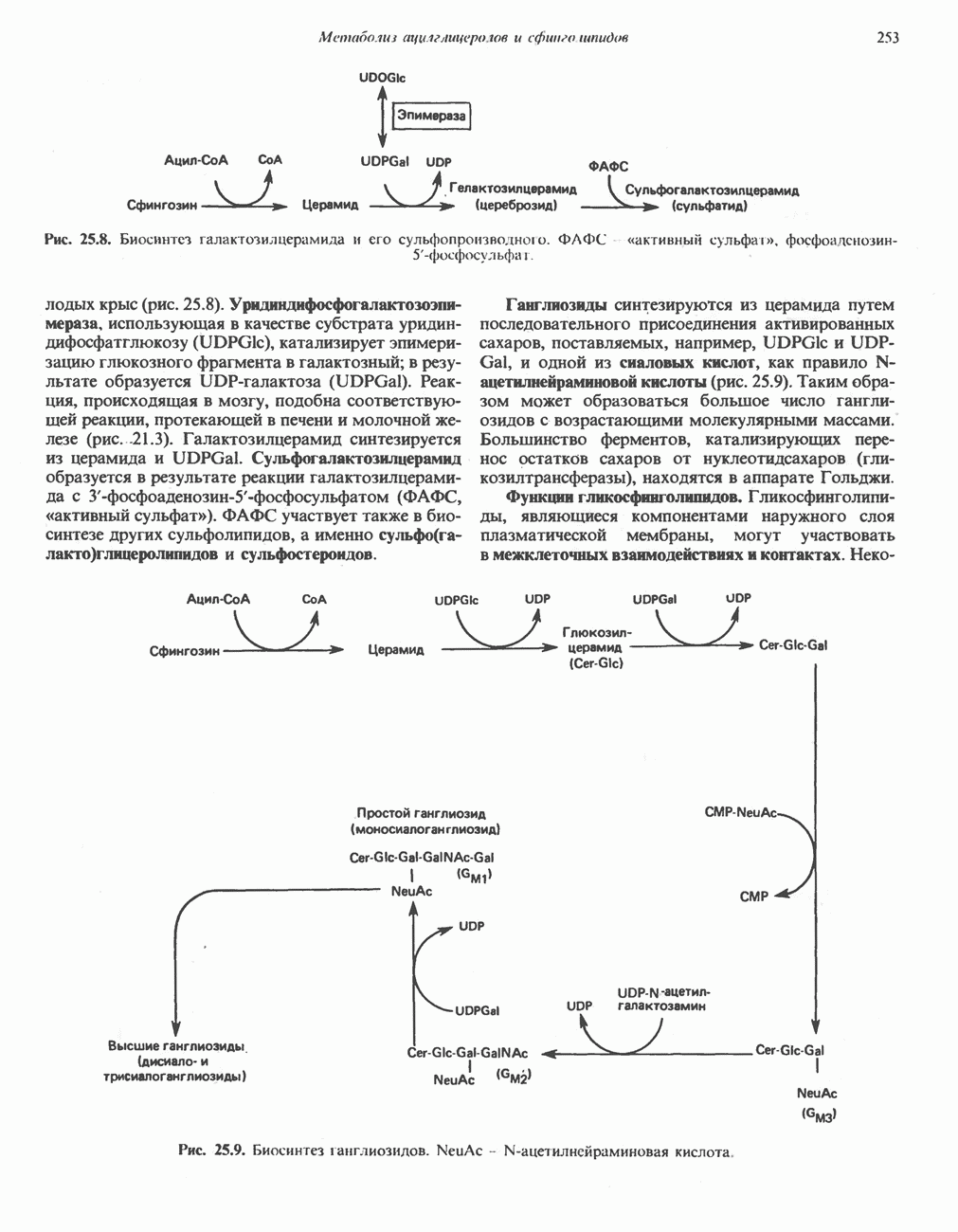
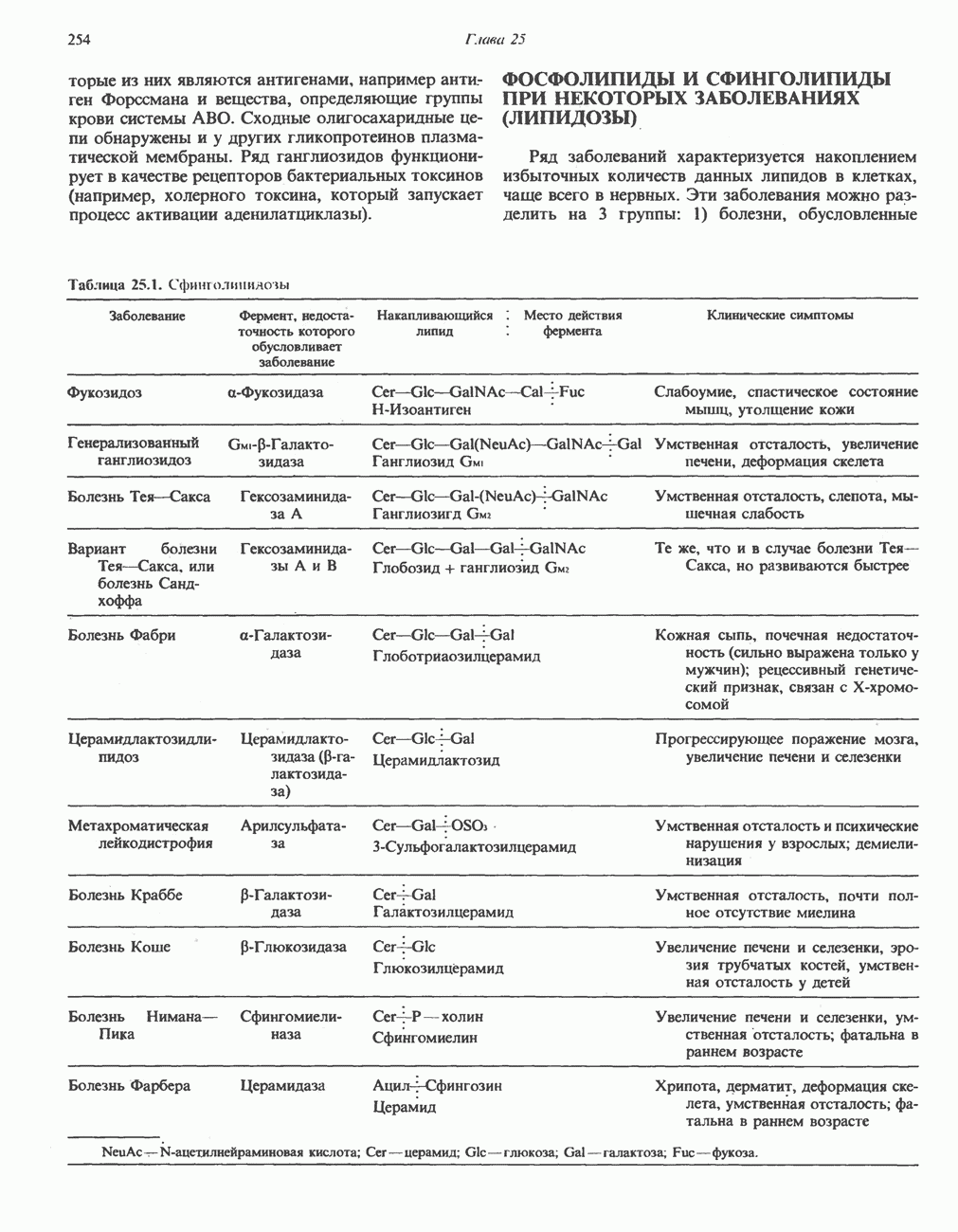
- Глава 25. Метаболизм ацилглицеролов и сфинголипидов
- МЕТАБОЛИЗМ АЦИЛГЛИЦЕРОЛОВ
- МЕТАБОЛИЗМ СФИНГОЛИПИДОВ
- ГЛИКОЛИПИДЫ
- ФОСФОЛИПИДЫ И СФИНГОЛИПИДЫ ПРИ НЕКОТОРЫХ ЗАБОЛЕВАНИЯХ (ЛИПИДОЗЫ)
- Глава 26. Транспорт и запасание липидов
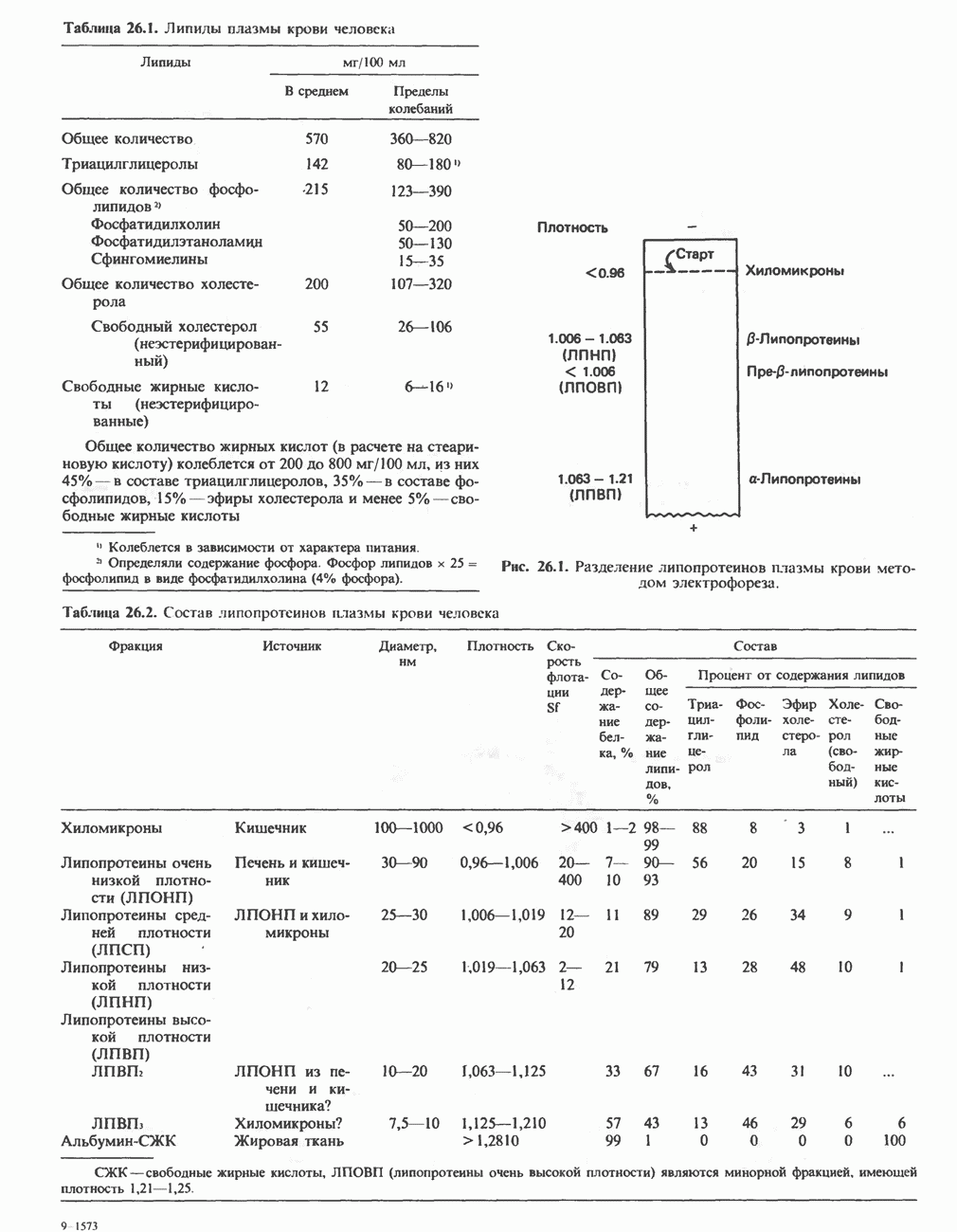
- ЛИПИДЫ ПЛАЗМЫ КРОВИ И ЛИПОПРОТЕИНЫ
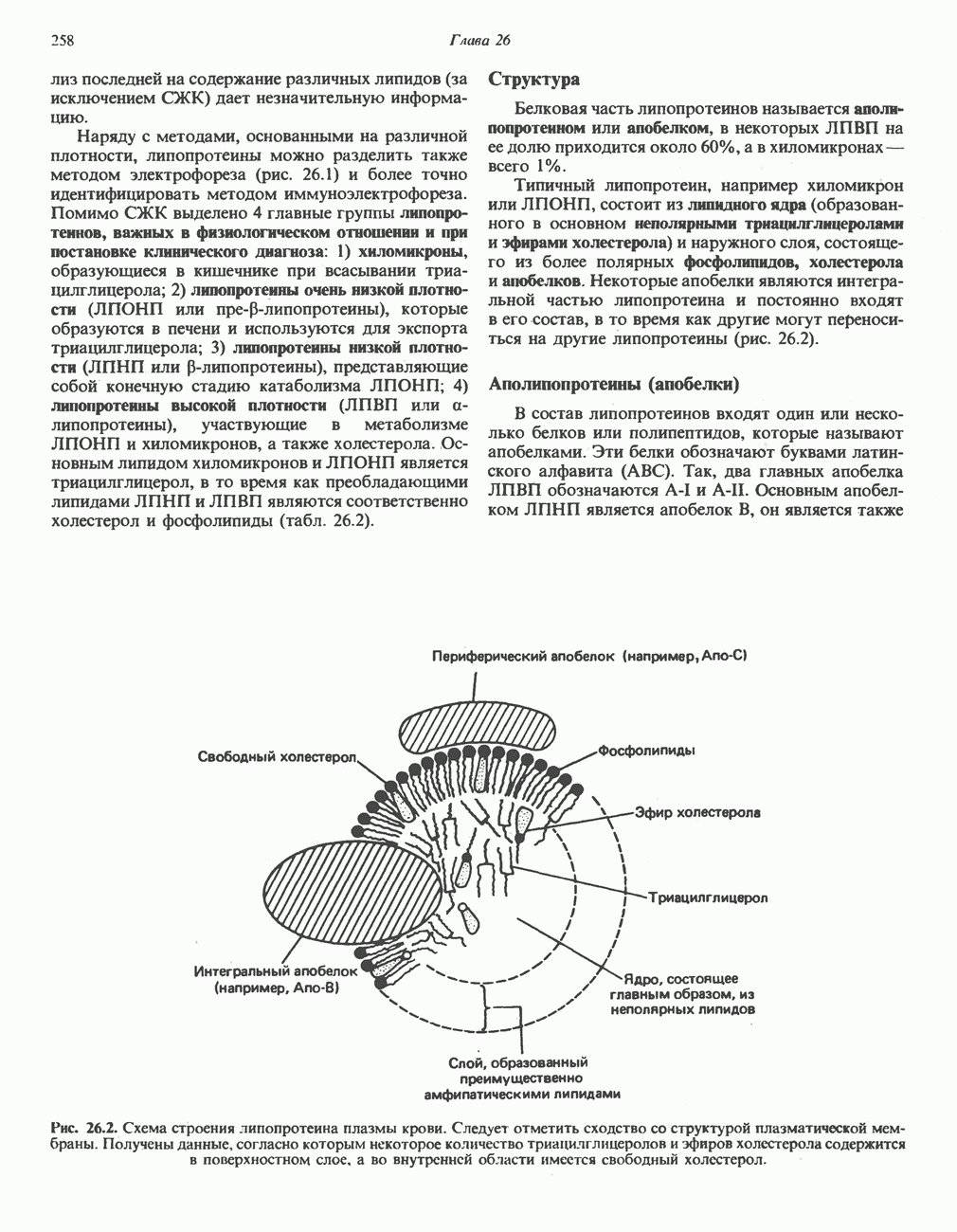
- МЕТАБОЛИЗМ ЛИПОПРОТЕИНОВ ПЛАЗМЫ КРОВИ
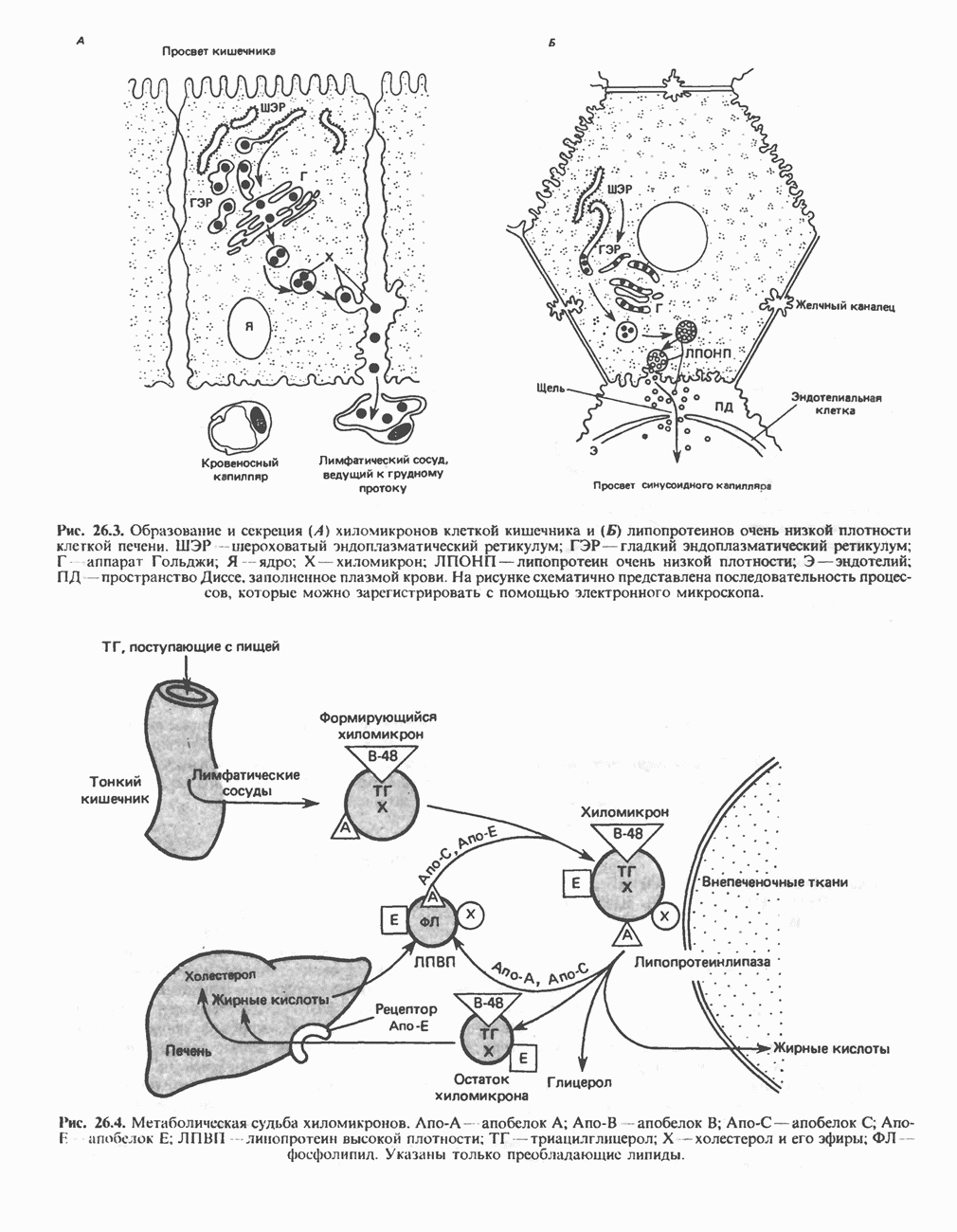
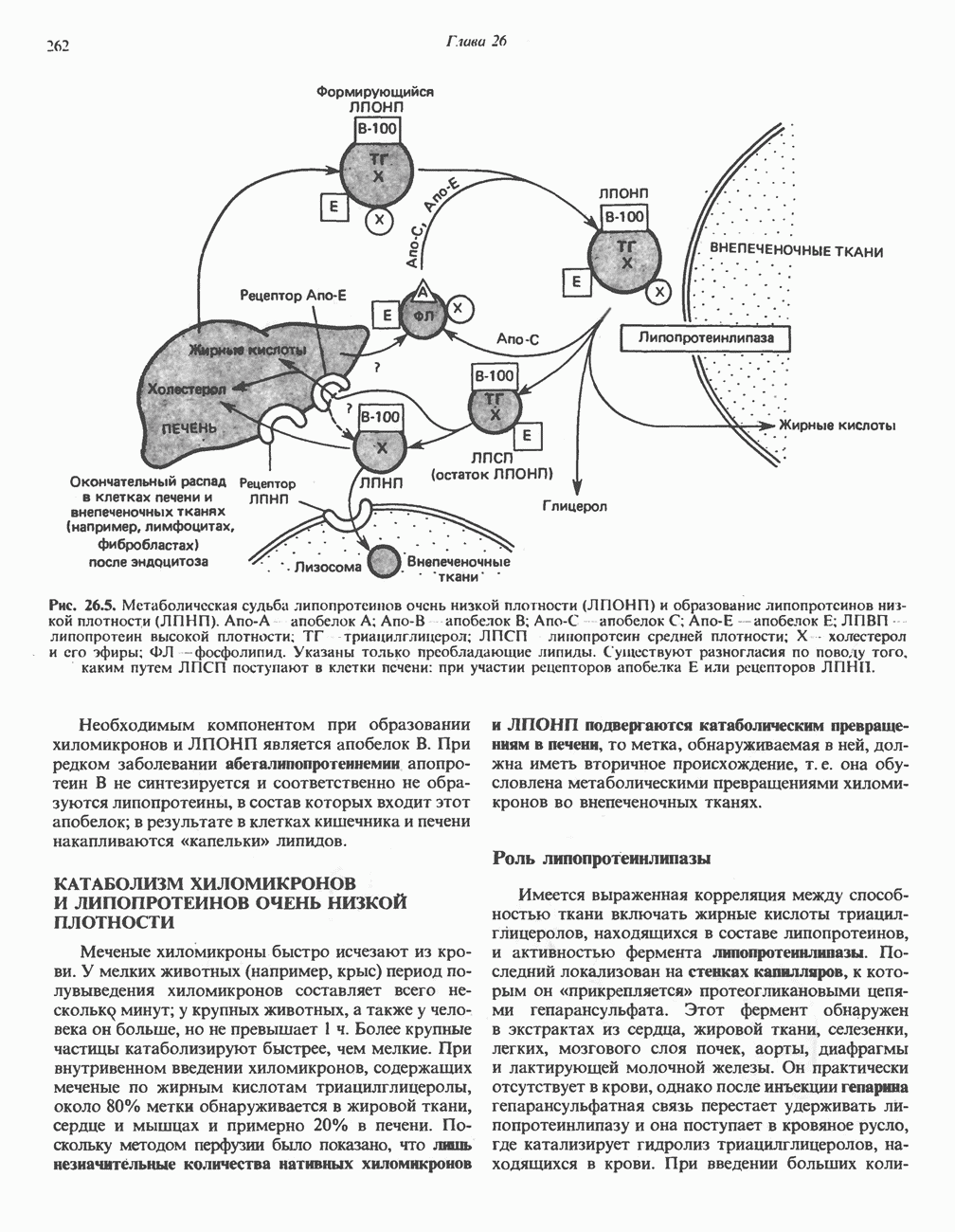
- ОБРАЗОВАНИЕ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ (ЛПОНП)
- КАТАБОЛИЗМ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ
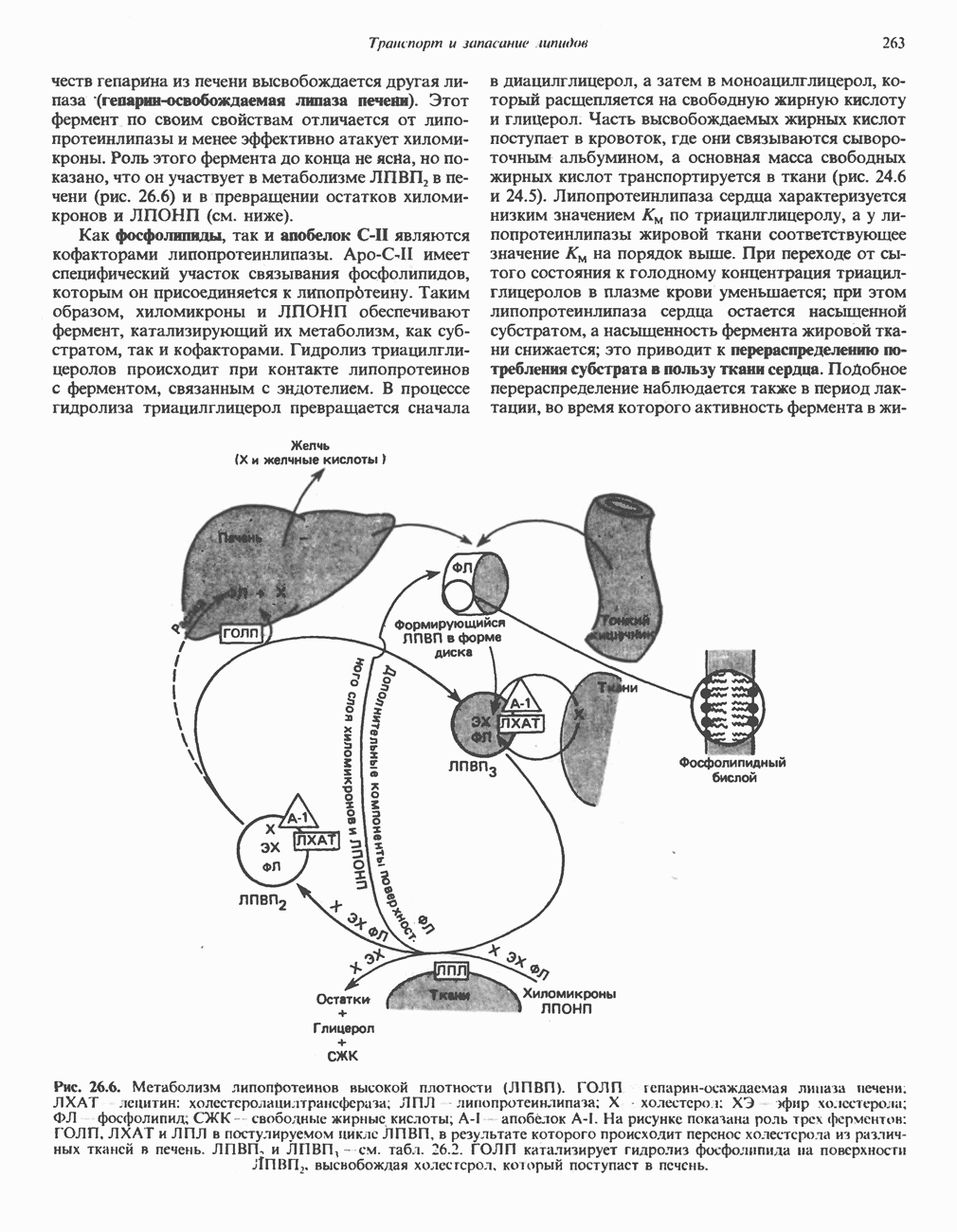
- МЕТАБОЛИЗМ ЛПНП
- МЕТАБОЛИЗМ ЛПВП (рис. 26.6)
- РОЛЬ ПЕЧЕНИ В ТРАНСПОРТЕ И МЕТАБОЛИЗМЕ ЛИПИДОВ
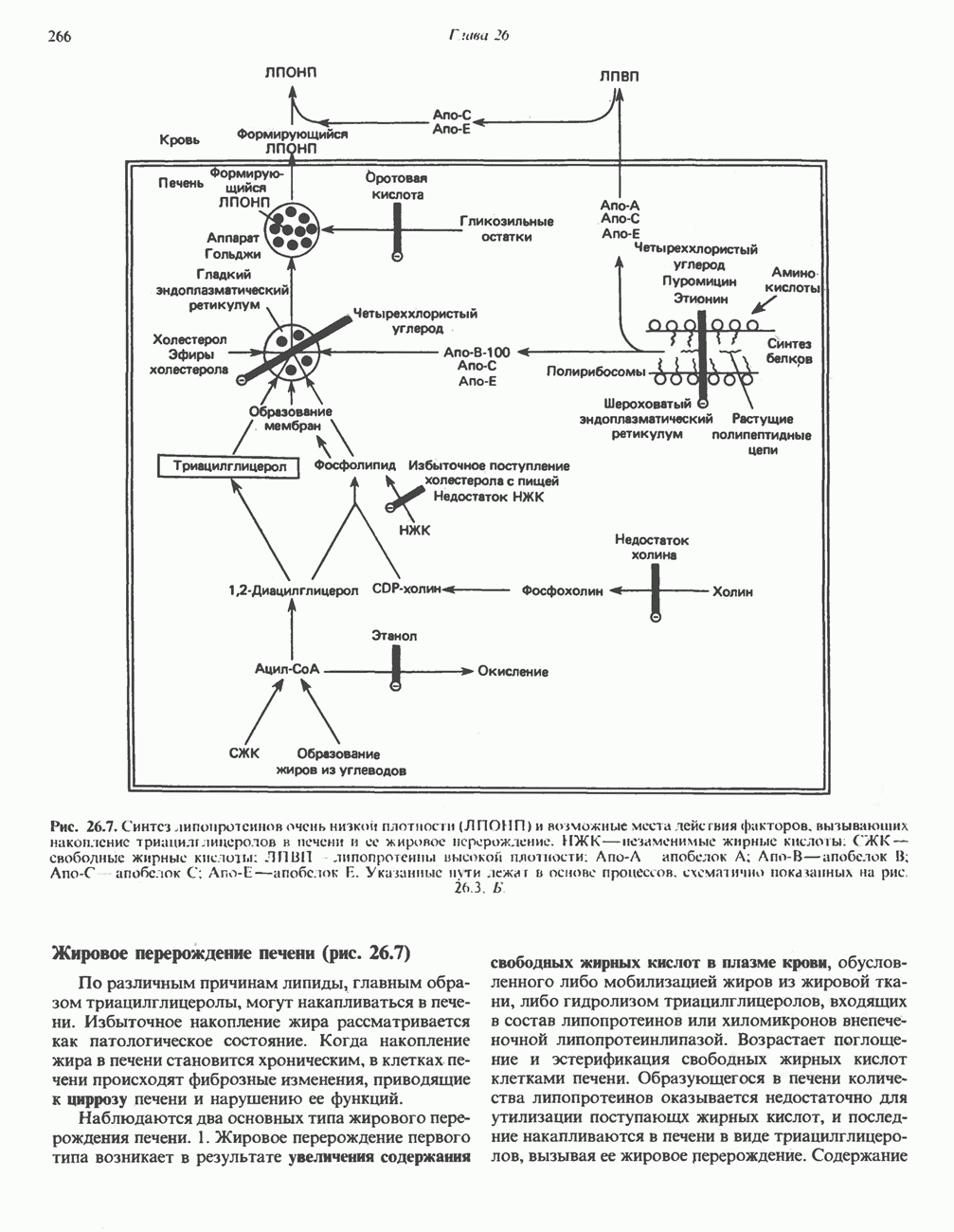
- СИНТЕЗ ТРИАЦИЛГЛИЦЕРОЛОВ И ОБРАЗОВАНИЕ ЛПОНП (рис. 26.7)
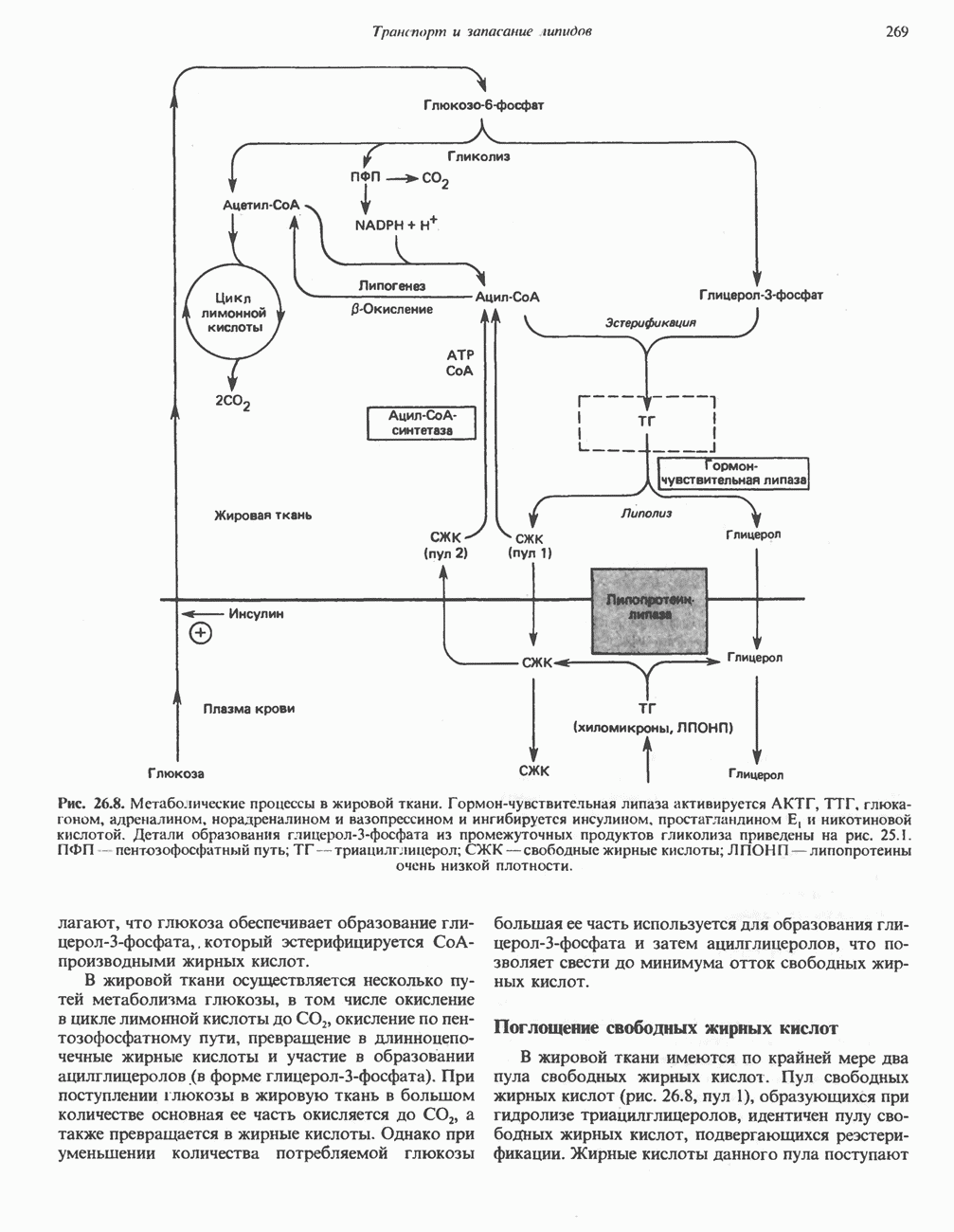
- МЕТАБОЛИЧЕСКИЕ ПРЕВРАЩЕНИЯ В ЖИРОВОЙ ТКАНИ И МОБИЛИЗАЦИЯ ЖИРОВ
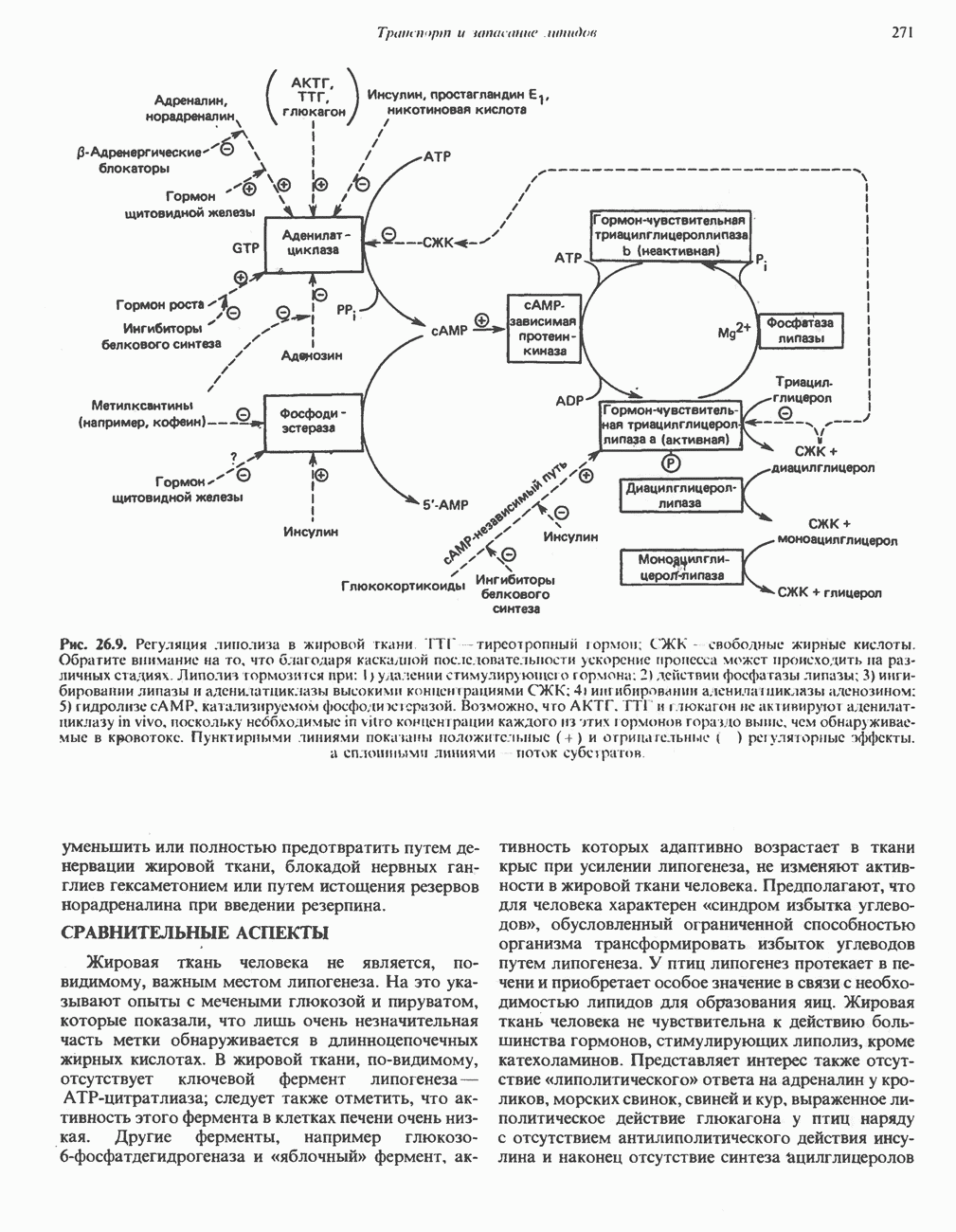
- РОЛЬ ГОРМОНОВ В МОБИЛИЗАЦИИ ЖИРОВ
- СРАВНИТЕЛЬНЫЕ АСПЕКТЫ
- РОЛЬ БУРОЙ ЖИРОВОЙ ТКАНИ В ТЕРМОГЕНЕЗЕ
- Глава 27. Синтез, транспорт и экскреция холестерола
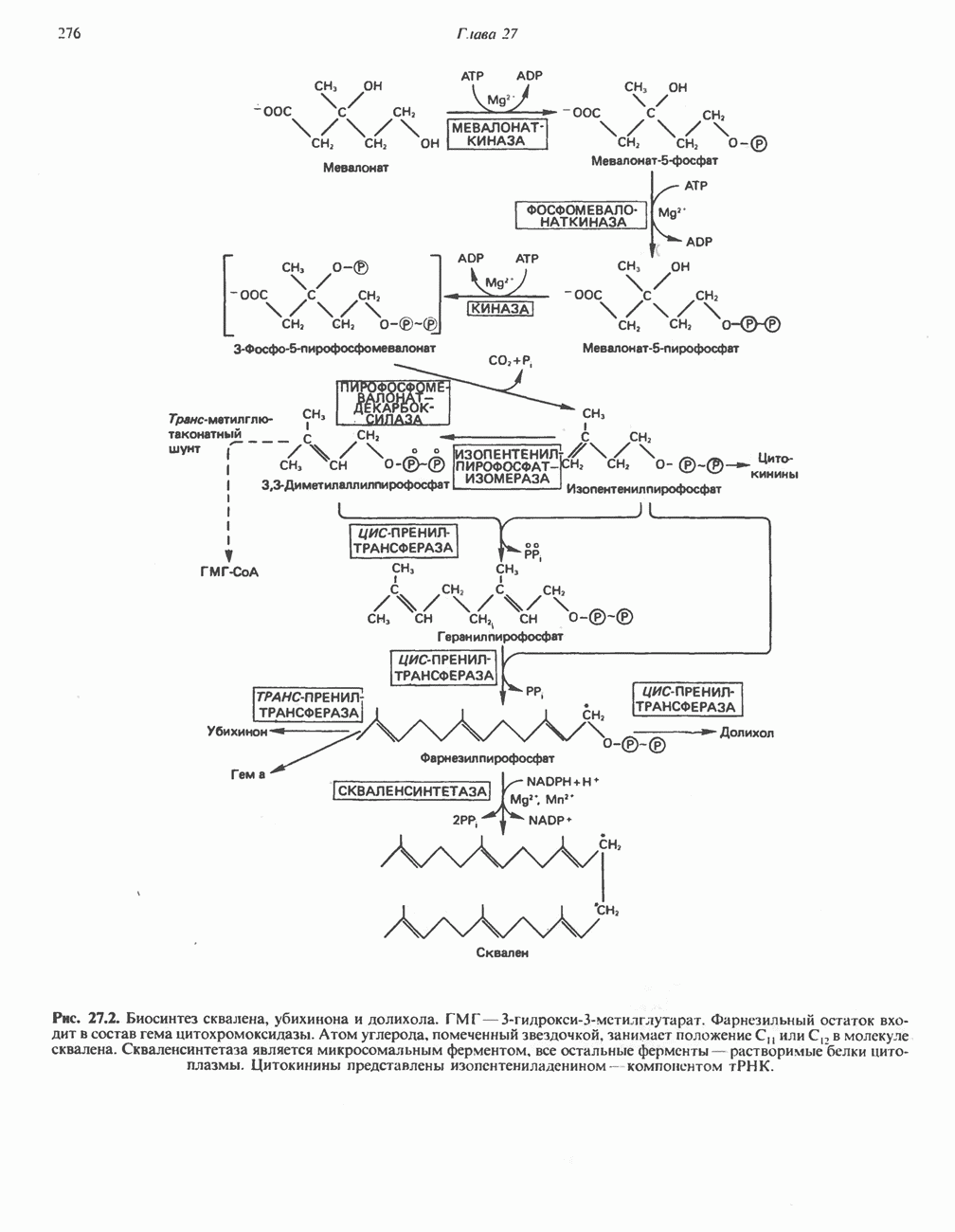
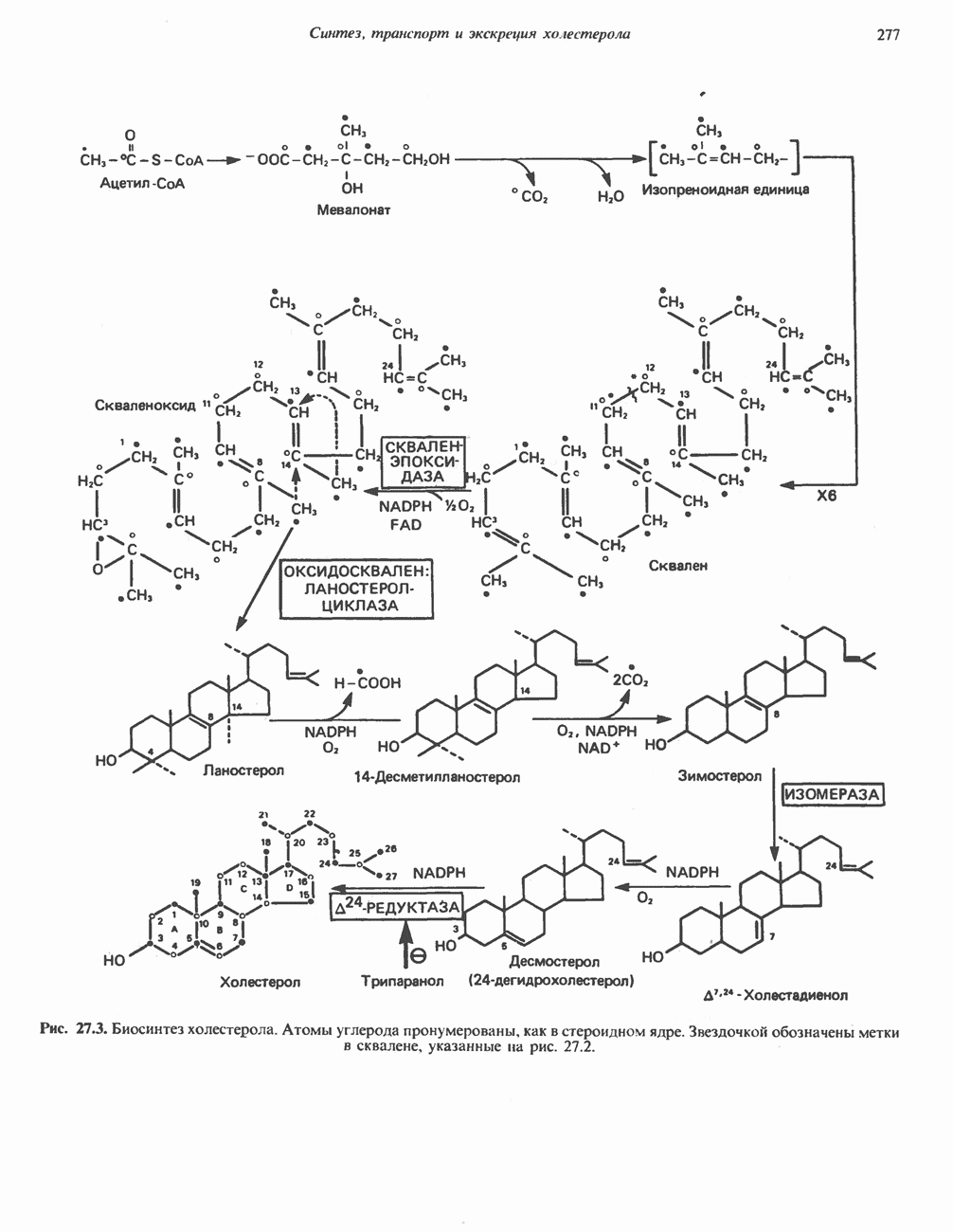
- БИОСИНТЕЗ ХОЛЕСТЕРОЛА
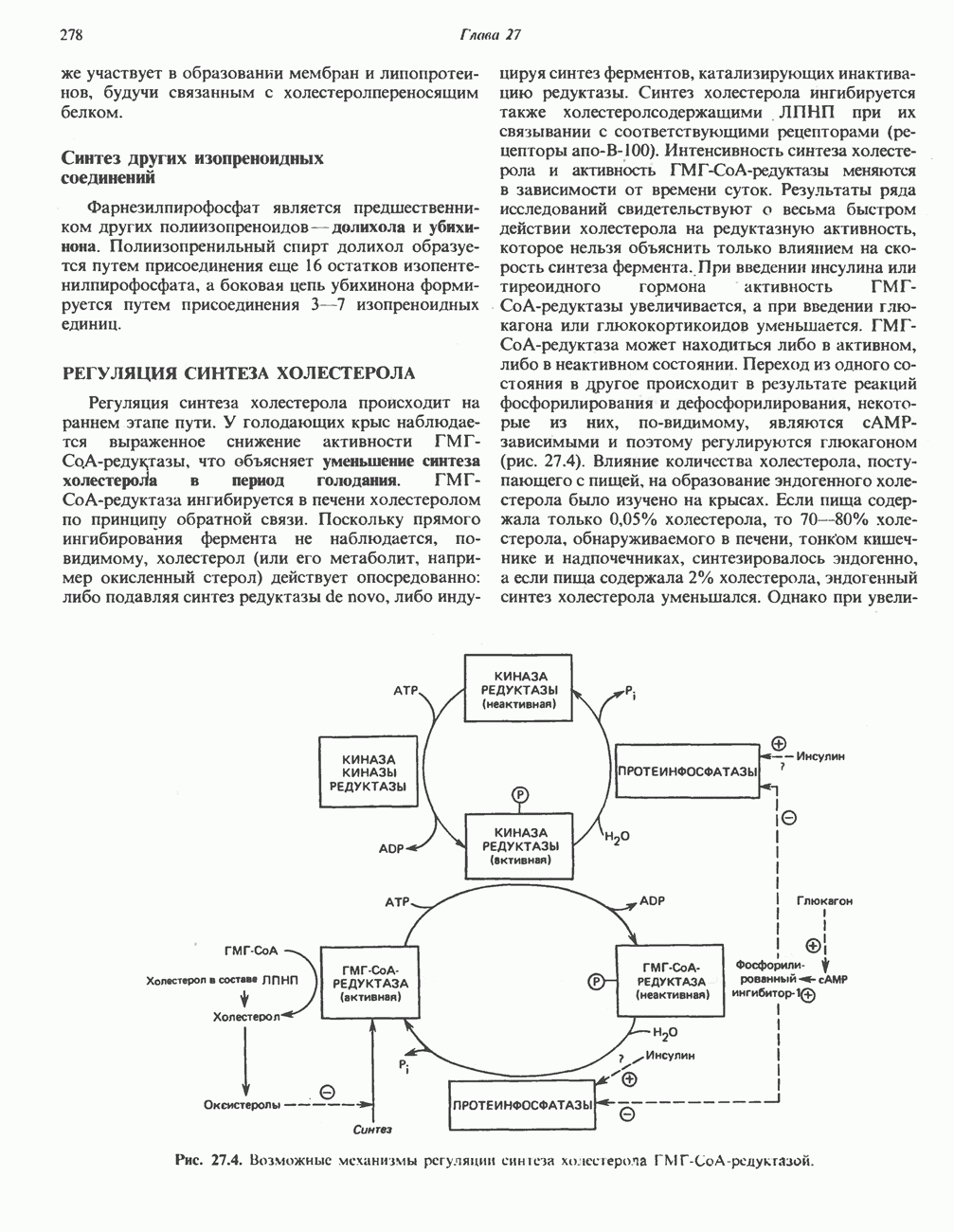
- РЕГУЛЯЦИЯ СИНТЕЗА ХОЛЕСТЕРОЛА
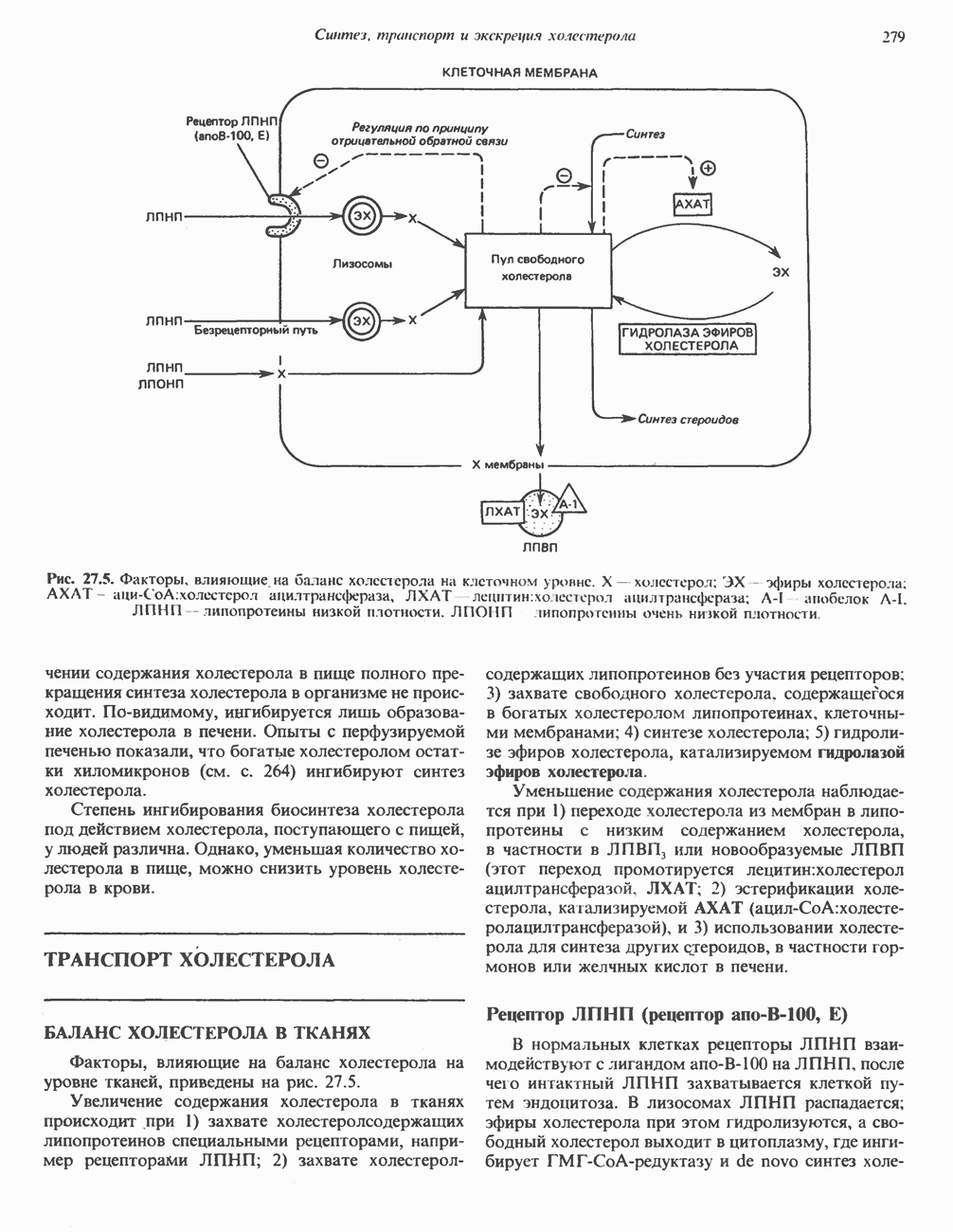
- ТРАНСПОРТ ХОЛЕСТЕРОЛА
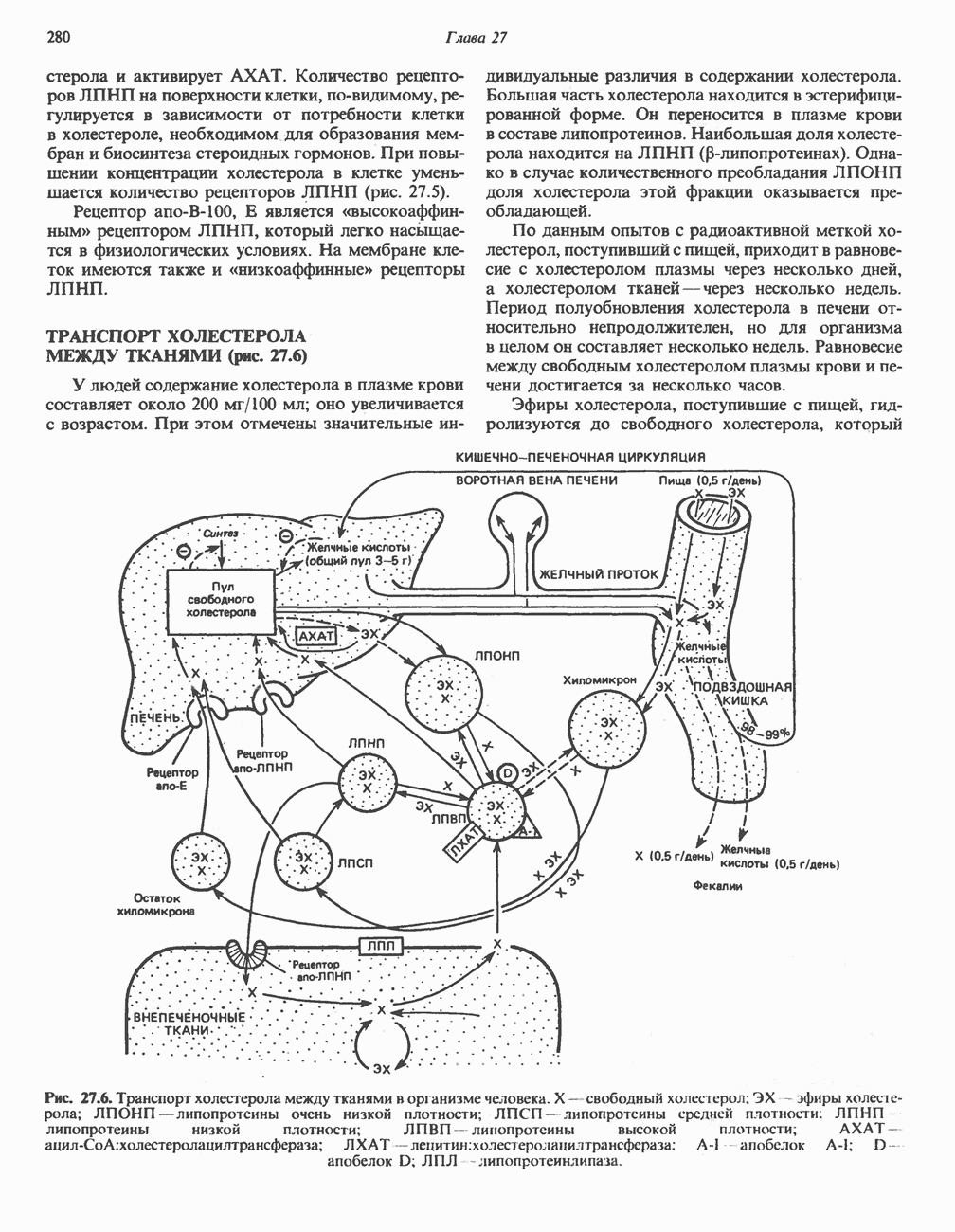
- ТРАНСПОРТ ХОЛЕСТЕРОЛА МЕЖДУ ТКАНЯМИ (рис. 27.6)
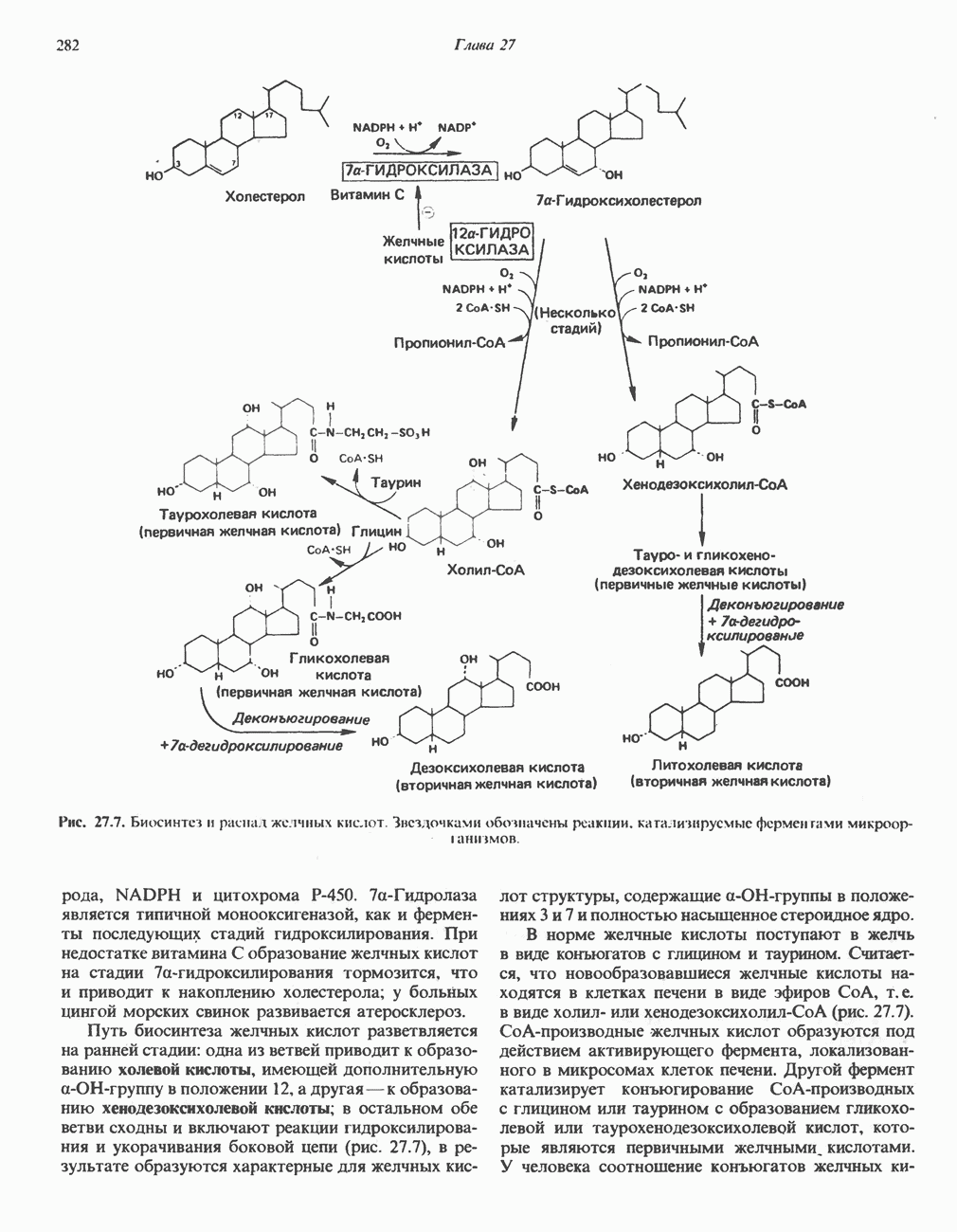
- ВЫВЕДЕНИЕ ХОЛЕСТЕРОЛА И ОБРАЗОВАНИЕ СОЛЕЙ ЖЕЛЧНЫХ КИСЛОТ
- КИШЕЧНО-ПЕЧЕНОЧНАЯ ЦИРКУЛЯЦИЯ ЖЕЛЧНЫХ КИСЛОТ
- КЛИНИЧЕСКИЕ АСПЕКТЫ
- Глава 28. Регуляция метаболизма липидов и источники энергии в тканях
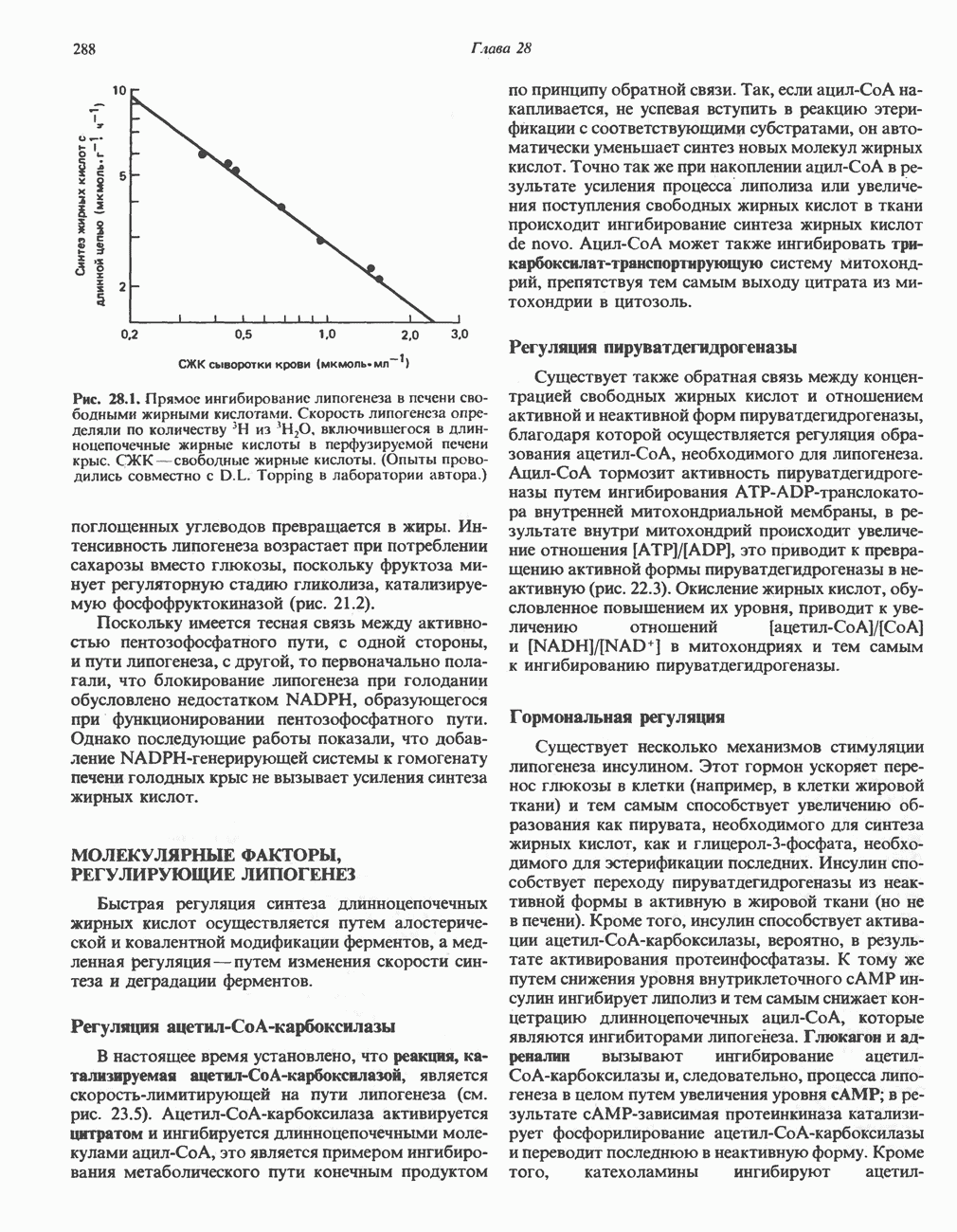
- РЕГУЛЯЦИЯ БИОСИНТЕЗА ЖИРНЫХ КИСЛОТ (ЛИПОГЕНЕЗА)
- МОЛЕКУЛЯРНЫЕ ФАКТОРЫ, РЕГУЛИРУЮЩИЕ ЛИПОГЕНЕЗ
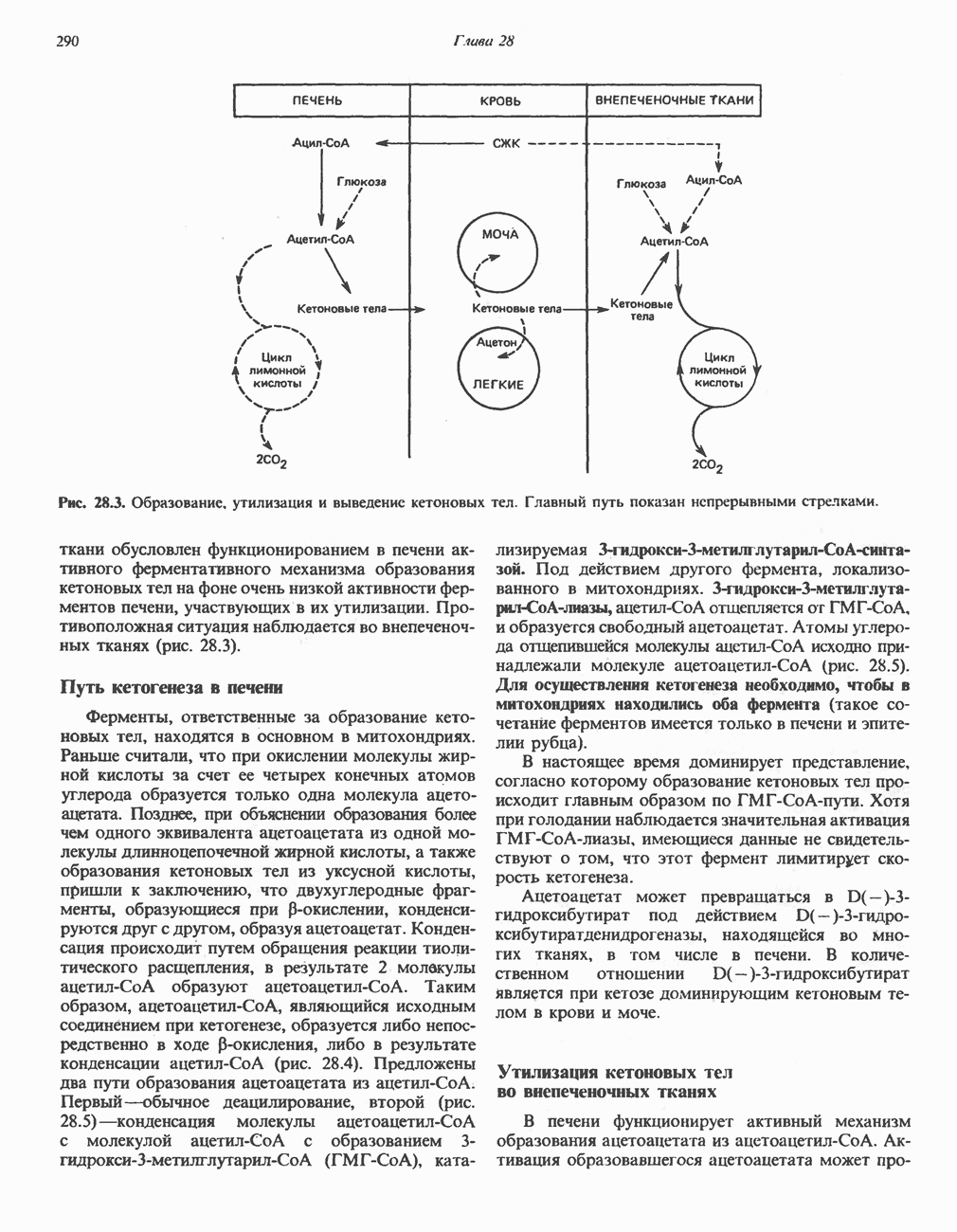
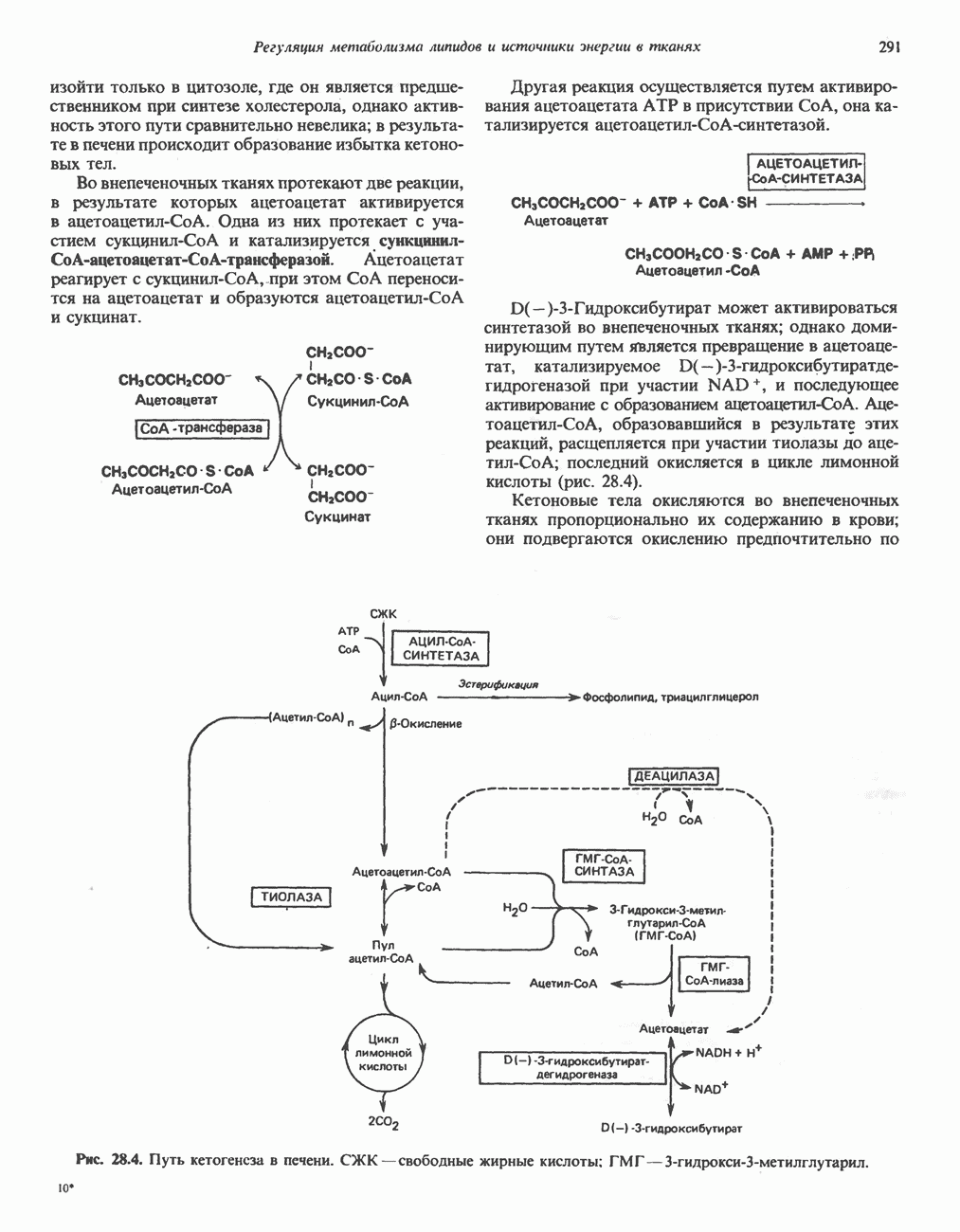
- РЕГУЛЯЦИЯ ОКИСЛЕНИЯ ЖИРНЫХ КИСЛОТ
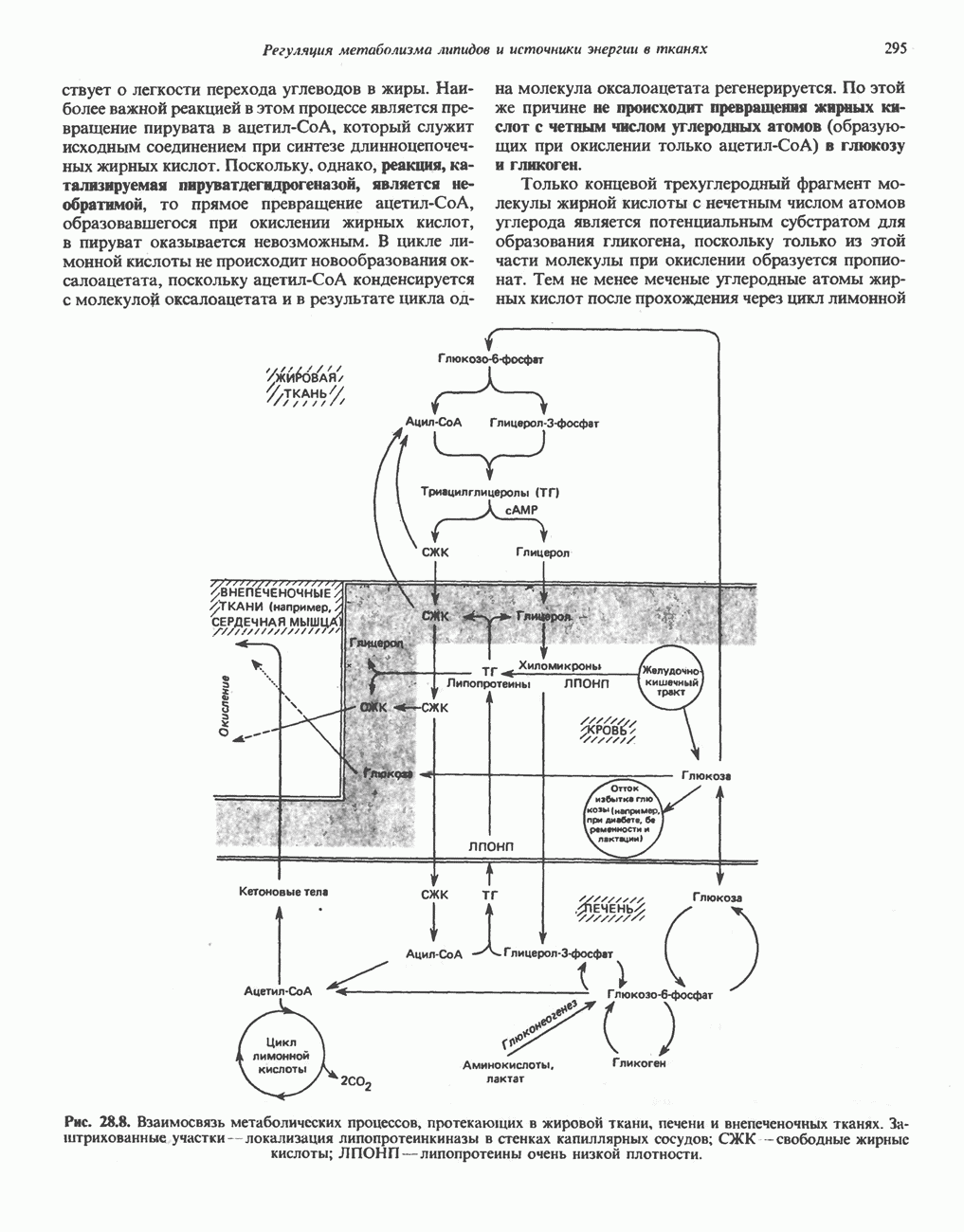
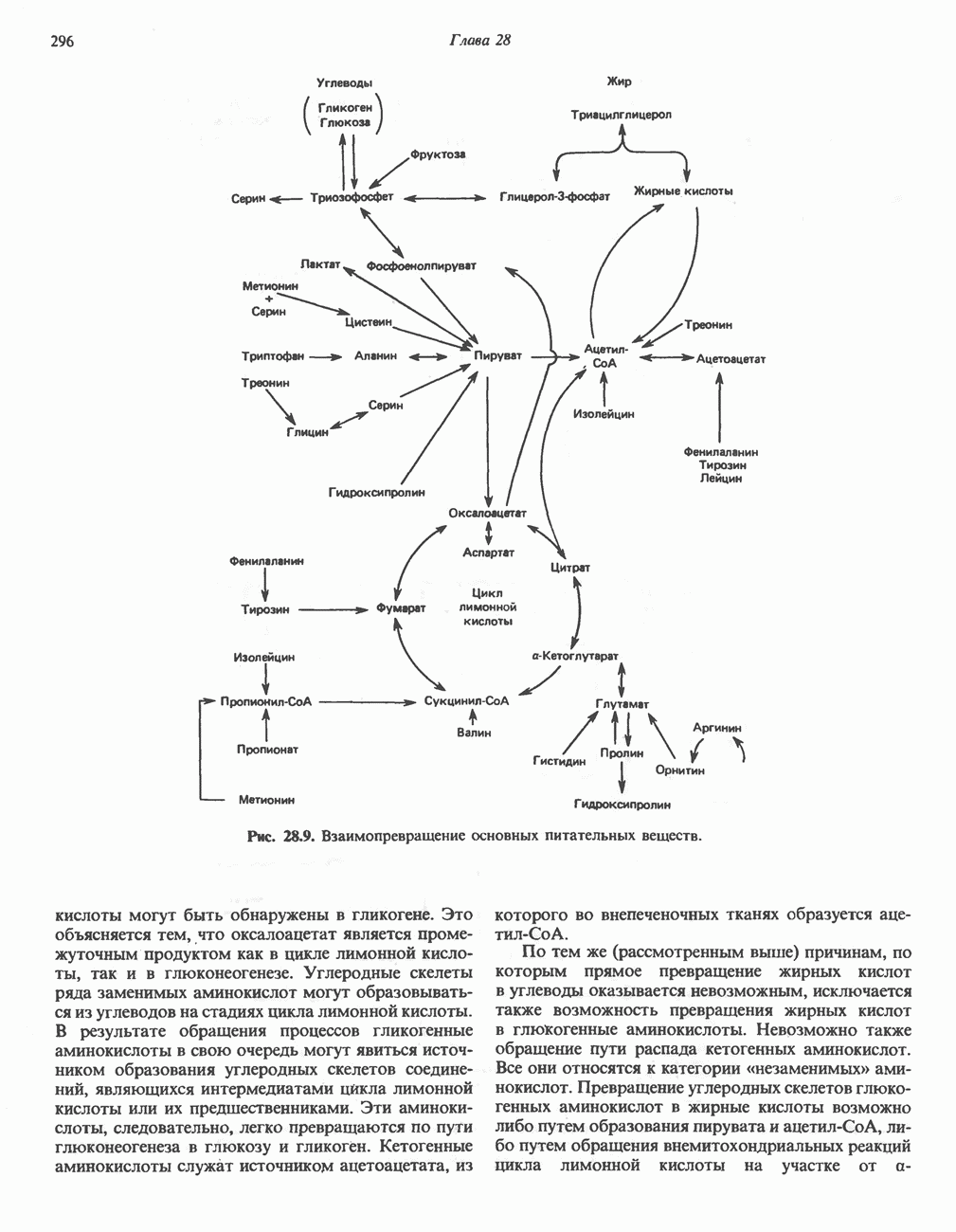
- ВЗАИМНОЕ ПРЕВРАЩЕНИЕ ОСНОВНЫХ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ (рис. 28.9)
- ЭКОНОМИКА УГЛЕВОДНОГО И ЛИПИДНОГО ОБМЕНА В ОРГАНИЗМЕ
- ГОЛОДАНИЕ
- Раздел III. Метаболизм белков и аминокислот
- Глава 29. Биосинтез аминокислот
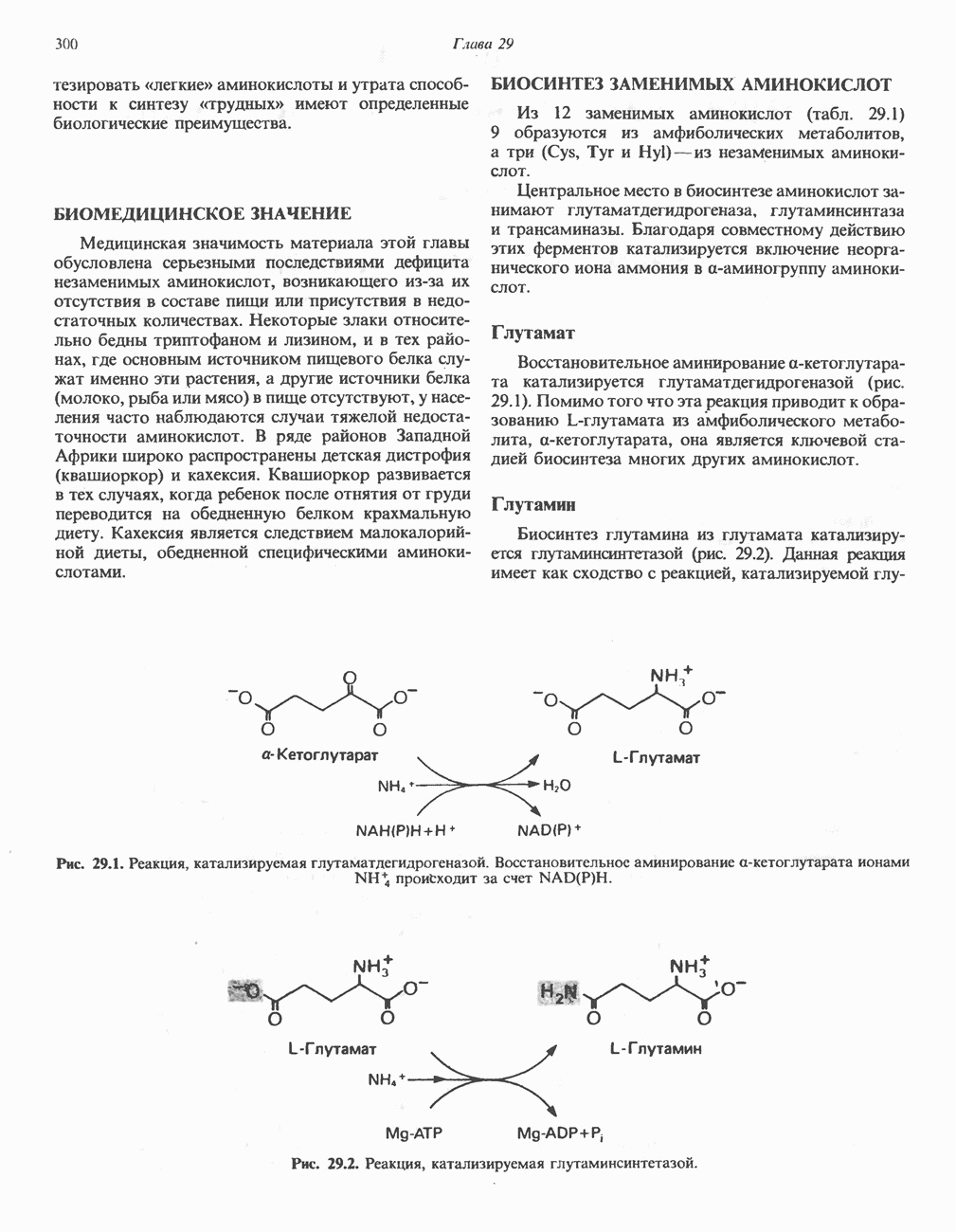
- БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ
- БИОСИНТЕЗ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ
- Глава 30. Катаболизм азота аминокислот
- ПЕРЕАМИНИРОВАНИЕ
- ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ
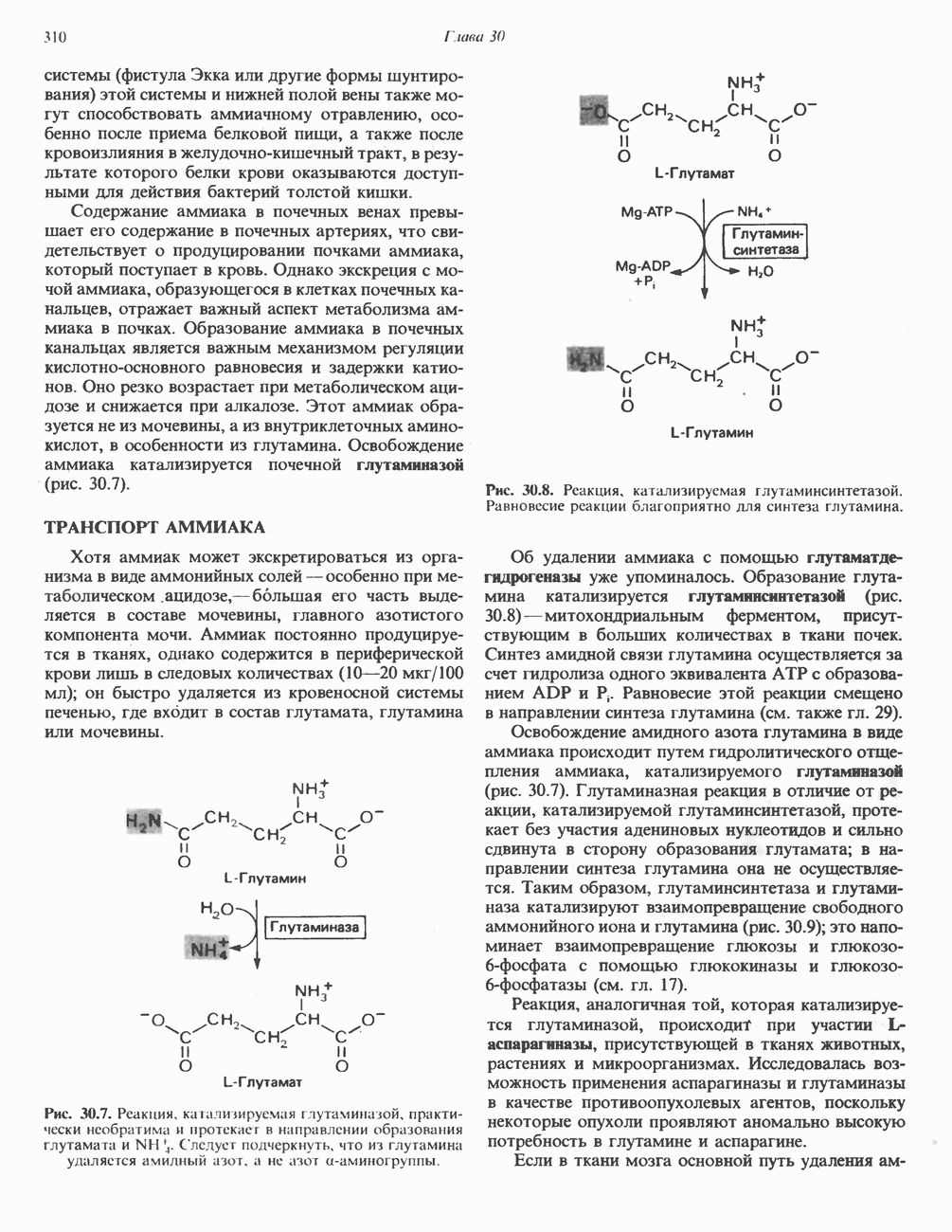
- ОБРАЗОВАНИЕ АММИАКА
- ТРАНСПОРТ АММИАКА
- ОБМЕН АМИНОКИСЛОТАМИ МЕЖДУ ОРГАНАМИ В ПОСТАБСОРБТИВНОМ СОСТОЯНИИ
- ОБМЕН АМИНОКИСЛОТ МЕЖДУ ОРГАНАМИ ПОСЛЕ ПРИЕМА ПИЩИ
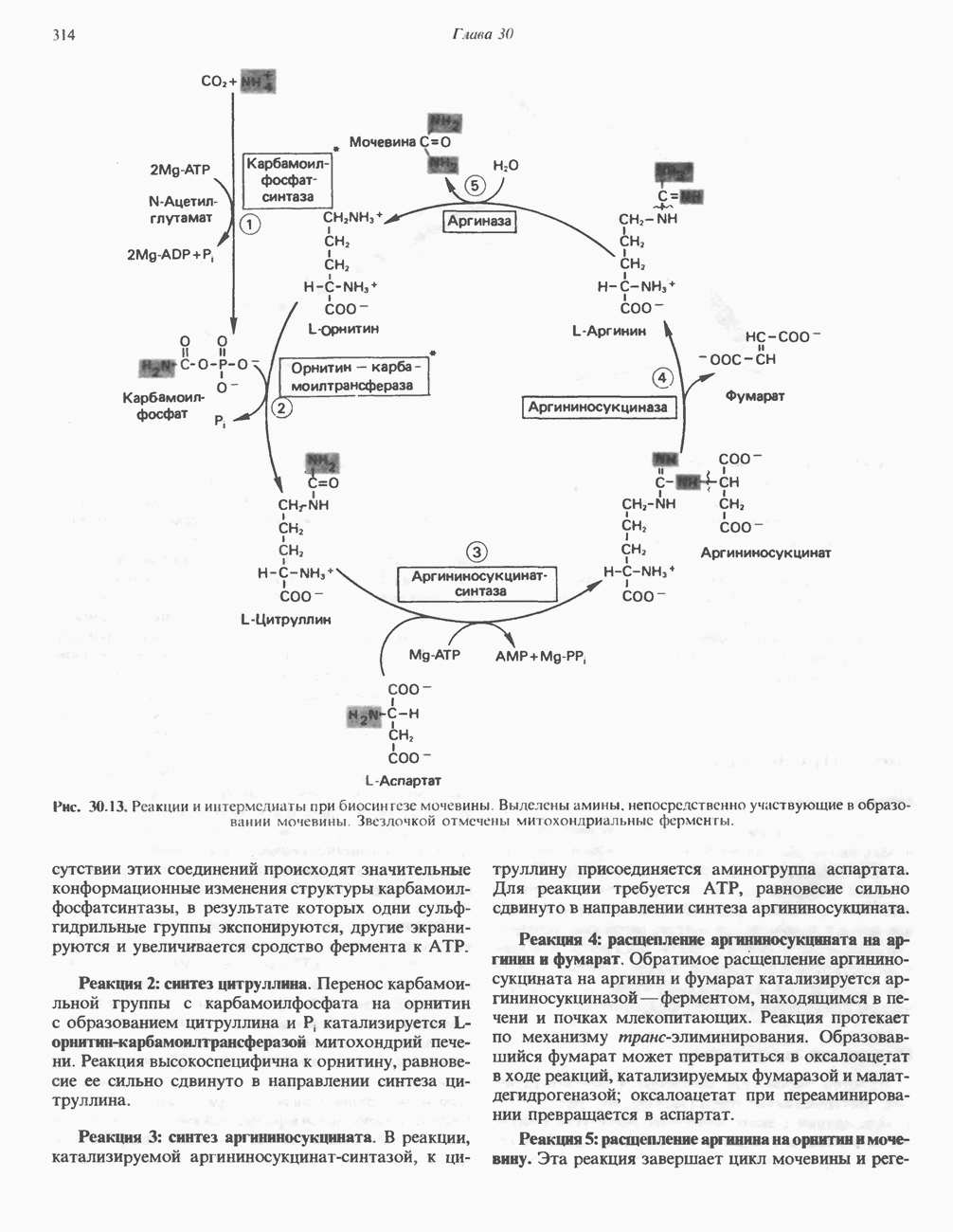
- БИОСИНТЕЗ МОЧЕВИНЫ
- РЕГУЛЯЦИЯ СИНТЕЗА МОЧЕВИНЫ
- МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ ЦИКЛА МОЧЕВИНЫ
- Глава 31. Катаболизм углеродного скелета аминокислот
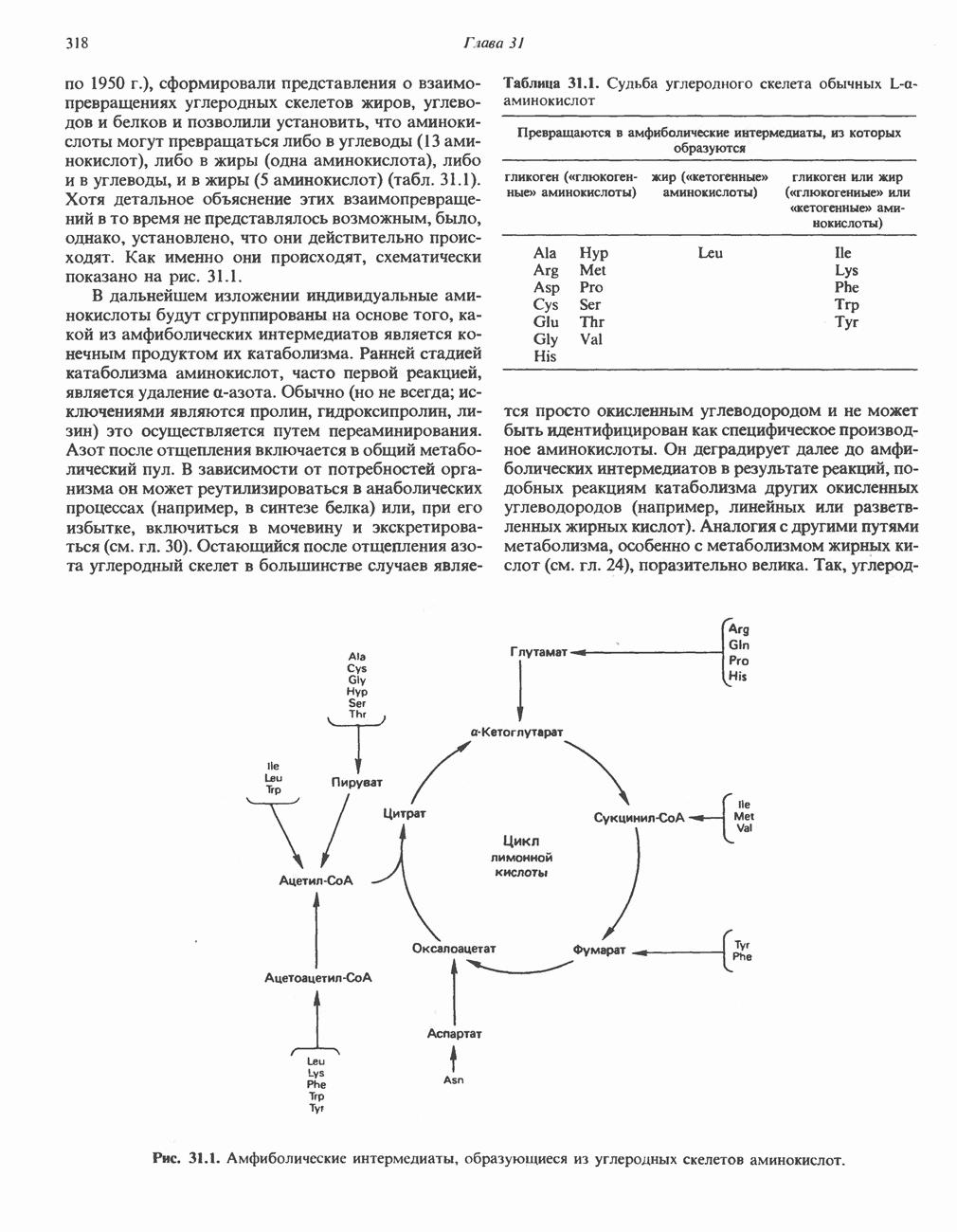
- ПРЕВРАЩЕНИЕ УГЛЕРОДНОГО СКЕЛЕТА ОБЫЧНЫХ L-a-АМИНОКИСЛОТ В АМФИБОЛИЧЕСКИЕ ИНТЕРМЕДИАТЫ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ОКСАЛОАЦЕТАТ
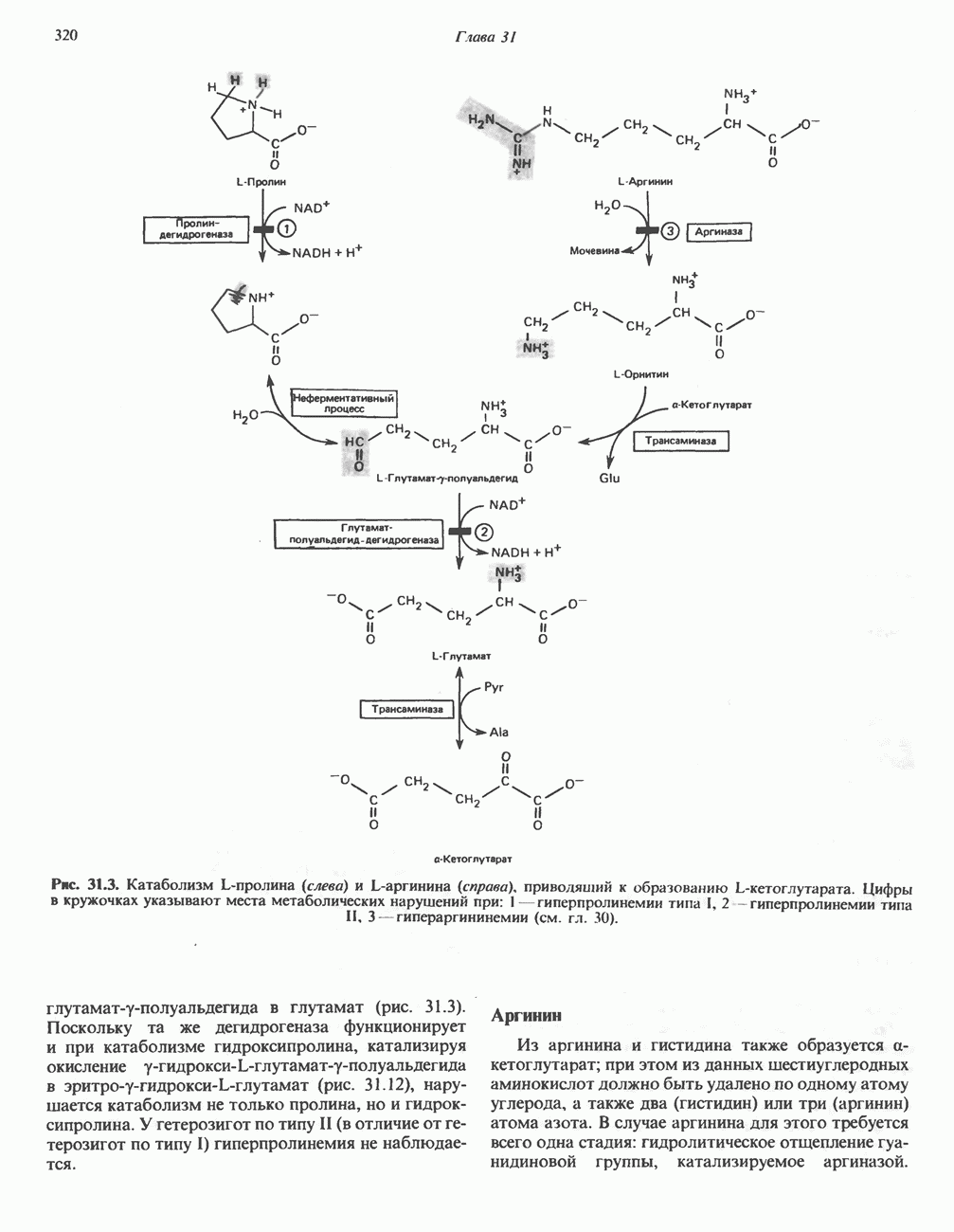
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ а-КЕТОГЛУТАРАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ПИРУВАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ АЦЕТИЛ-КОФЕРМЕНТ А
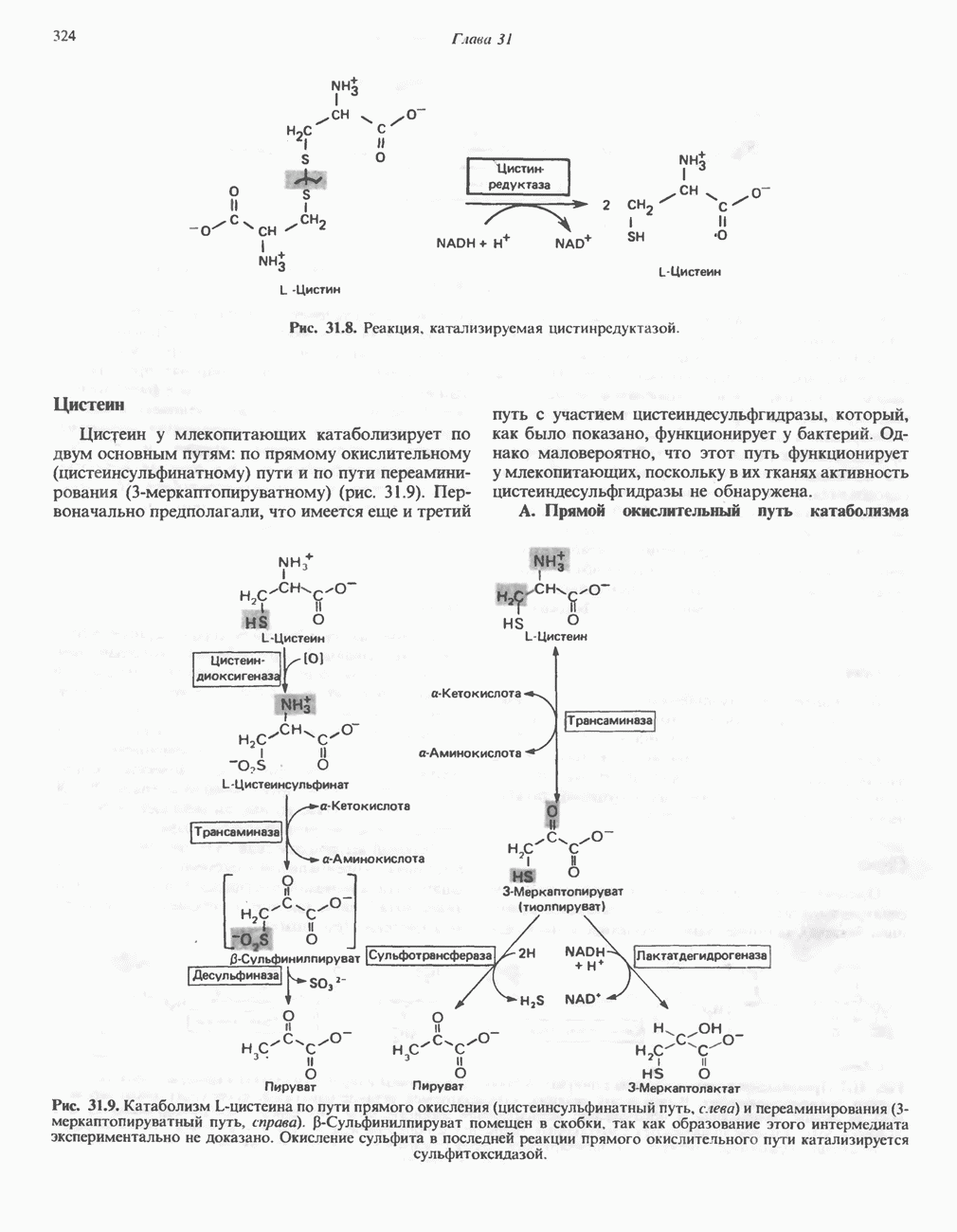
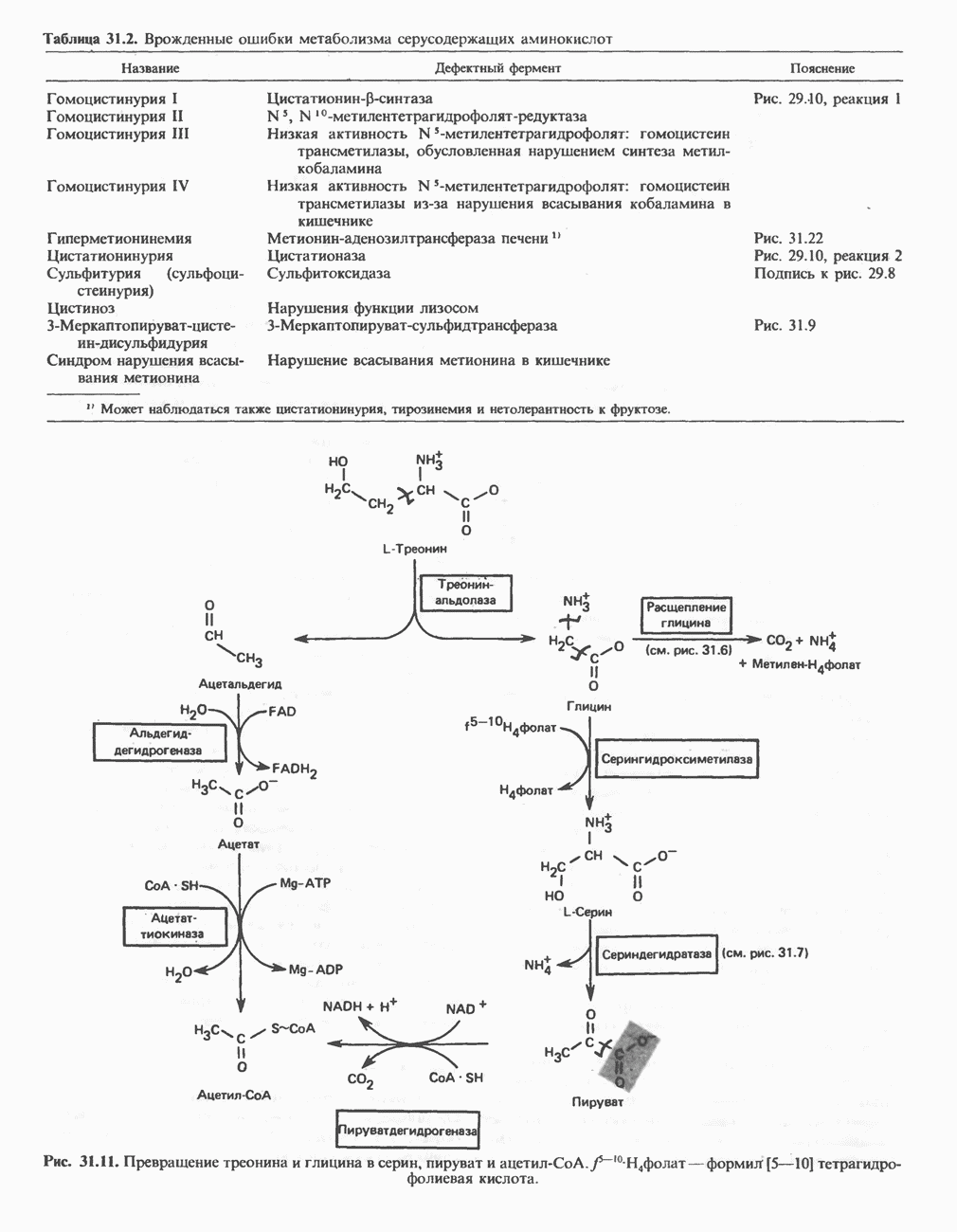
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ СУКЦИНИЛ-КОФЕРМЕНТ А
- Глава 32. Превращение аминокислот в специализированные продукты
- ГЛИЦИН
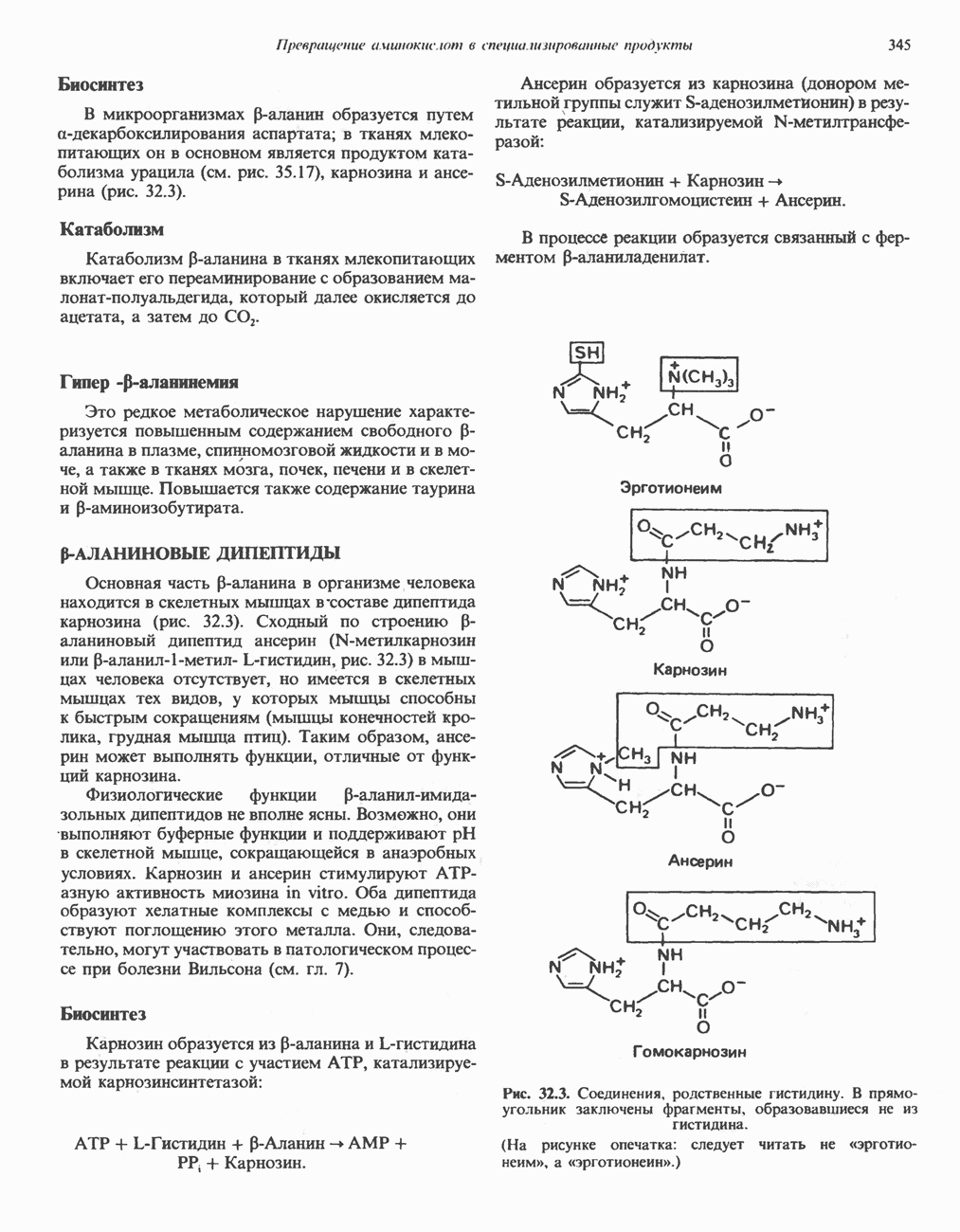
- р-АЛАНИНОВЫЕ ДИПЕПТИДЫ
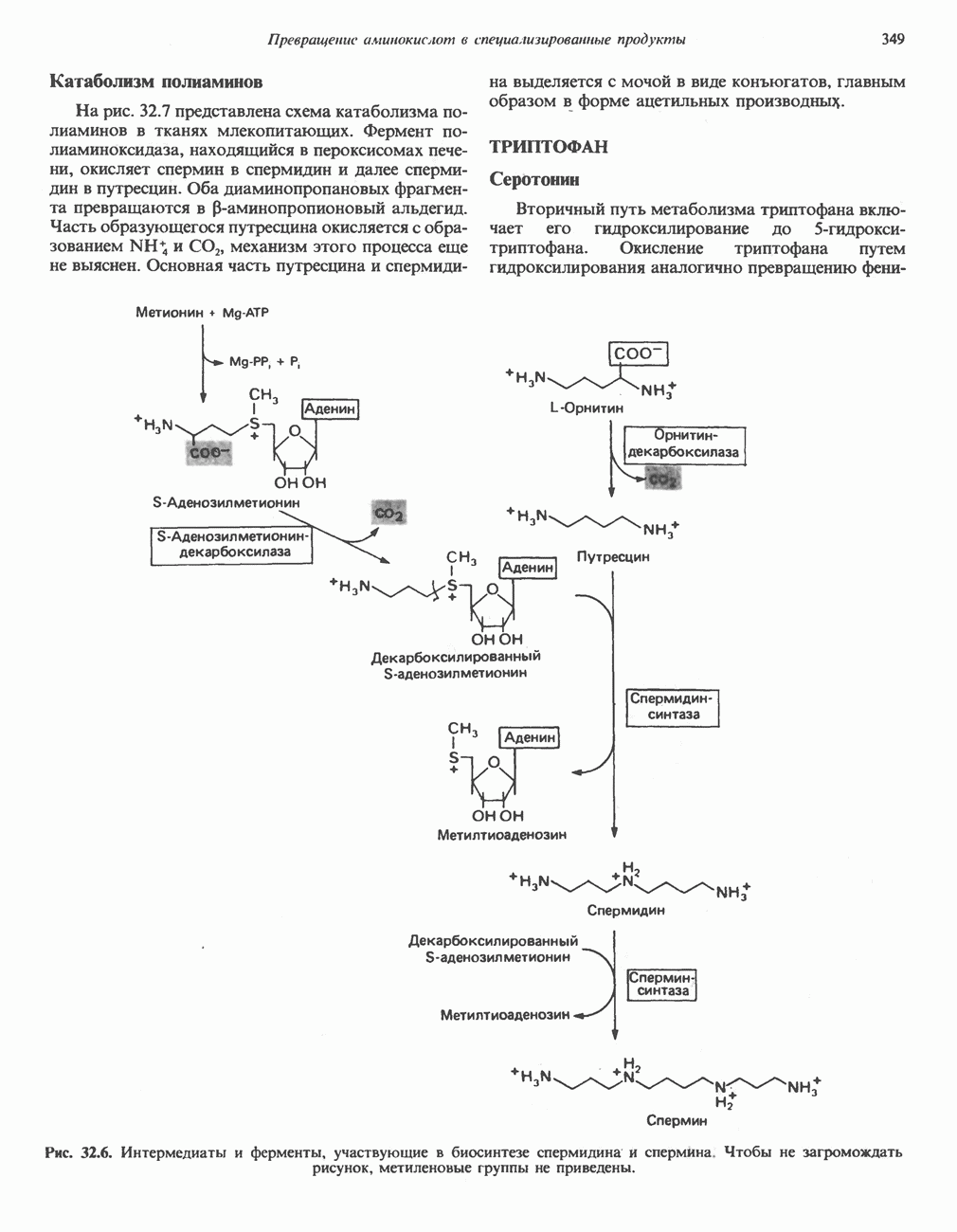
- ТРИПТОФАН
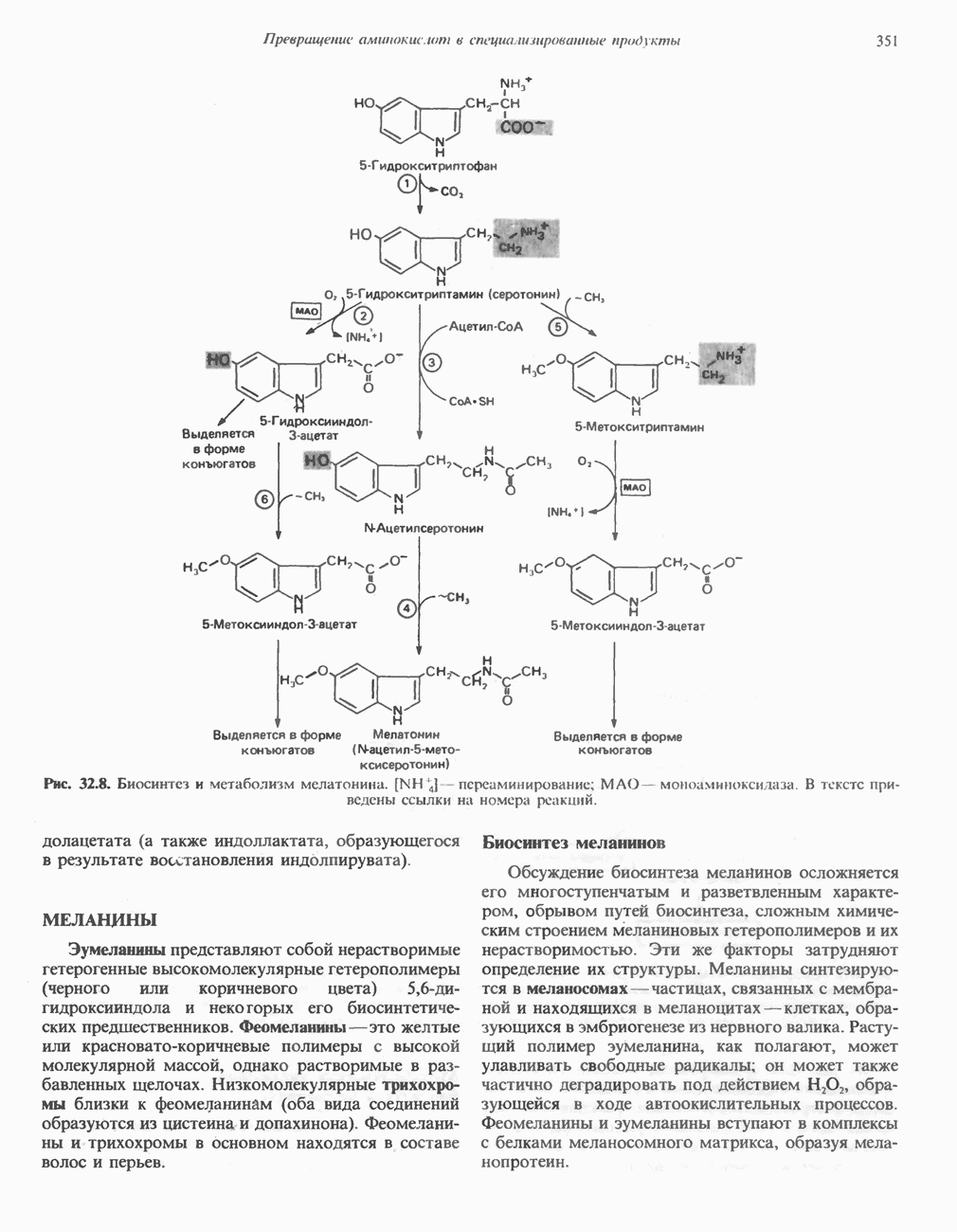
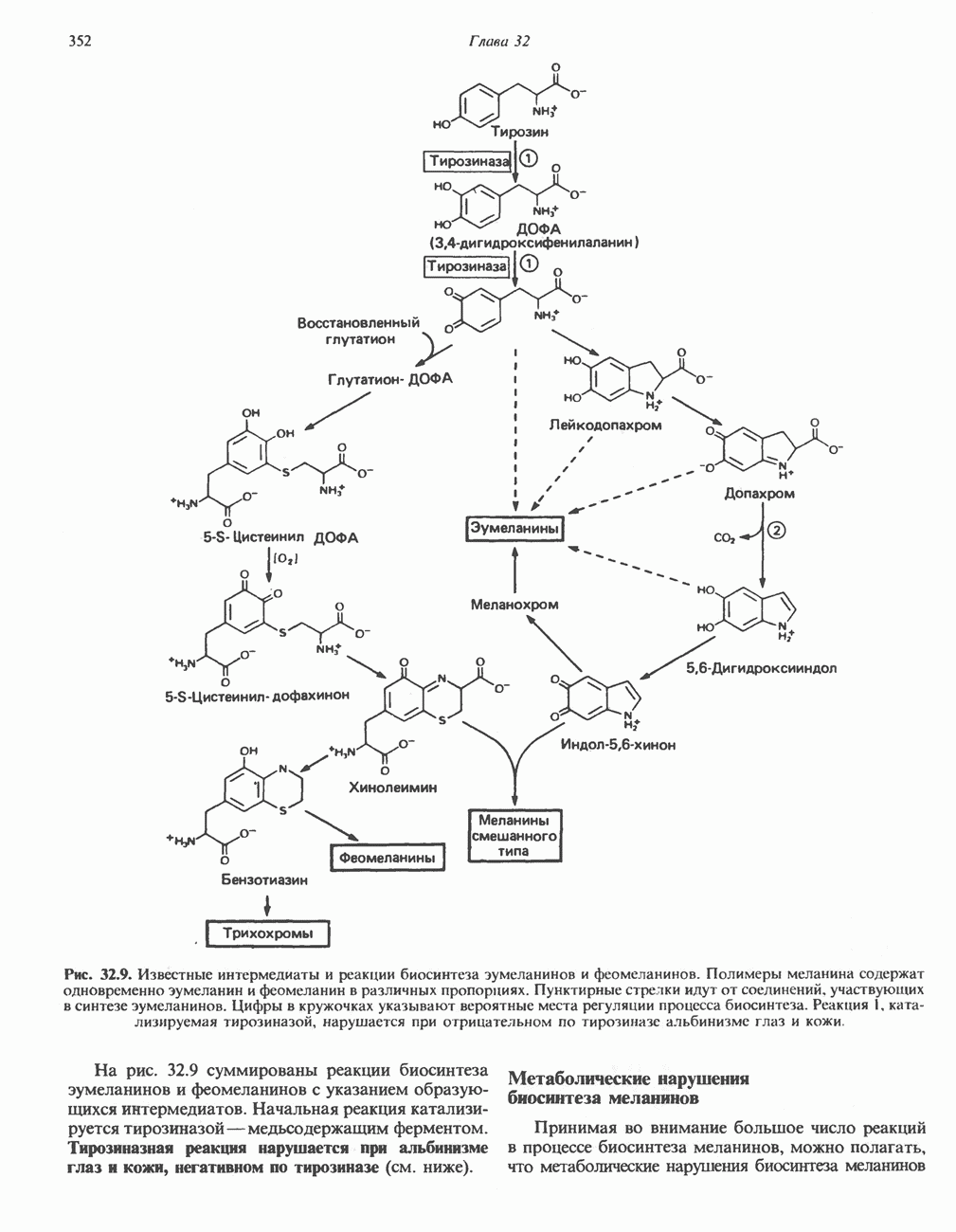
- МЕЛАНИНЫ
- ТИРОЗИН
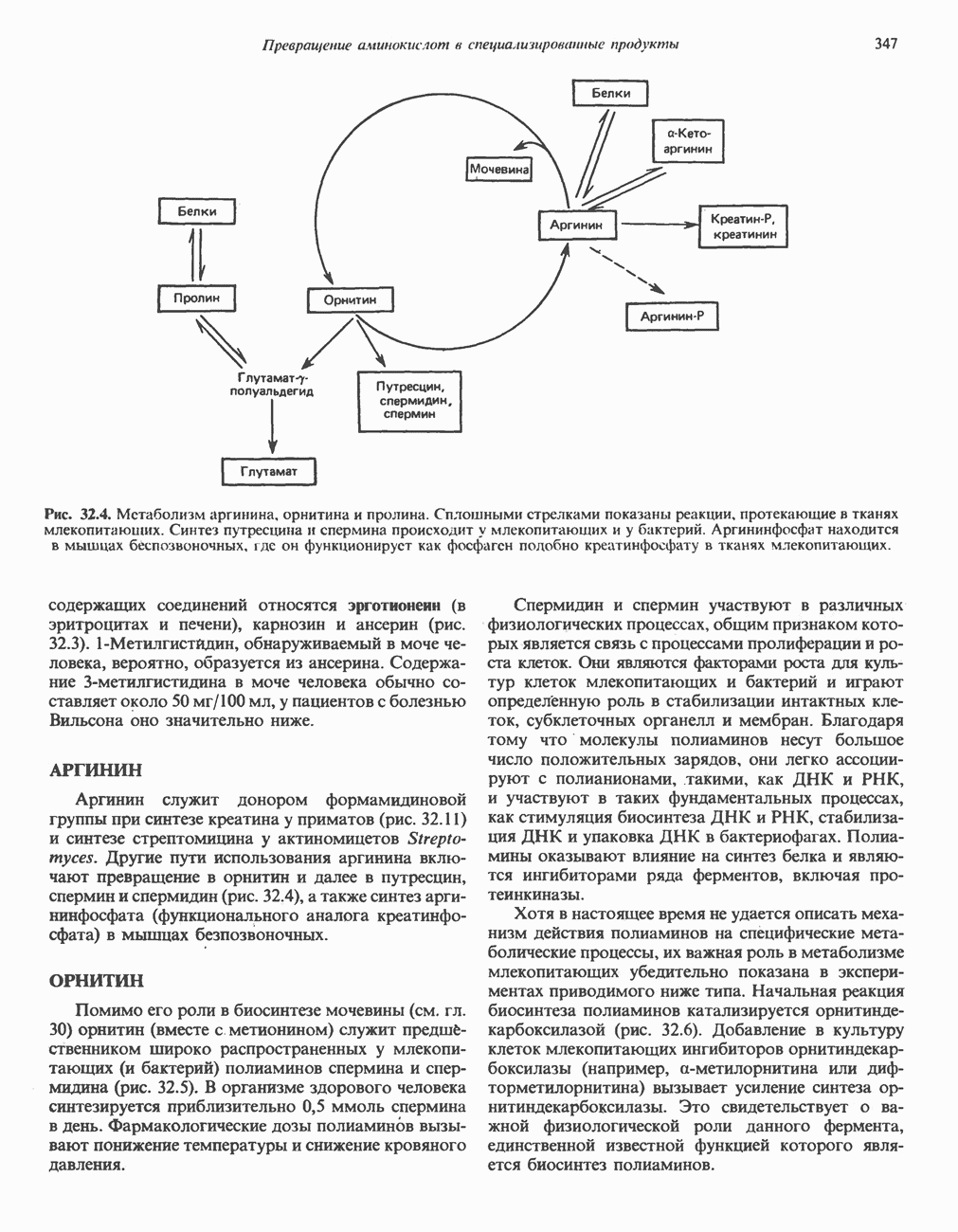
- КРЕАТИН И КРЕАТИНИН
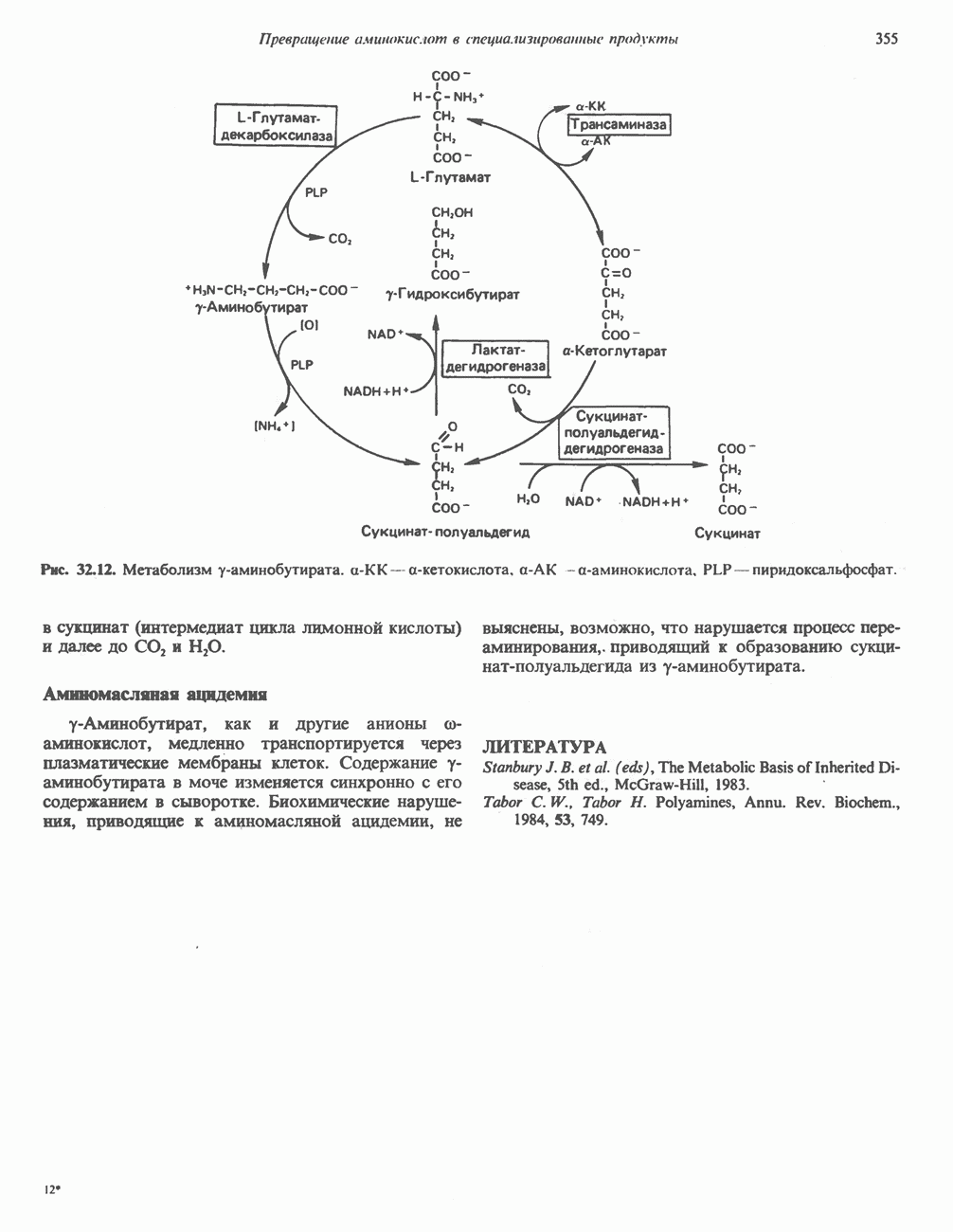
- у-АМИНОБУТИРАТ
- Глава 33. Порфирины и желчные пигменты
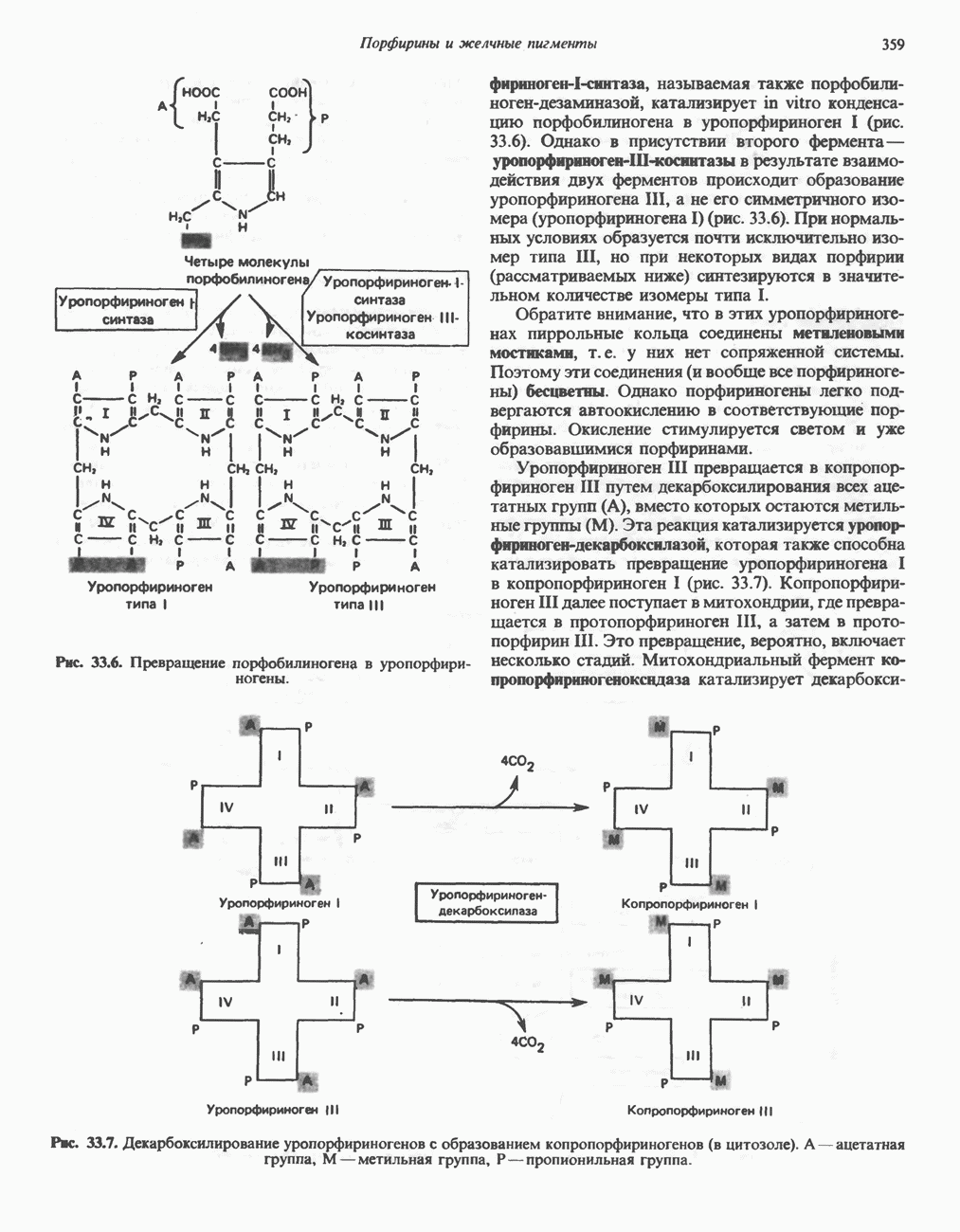
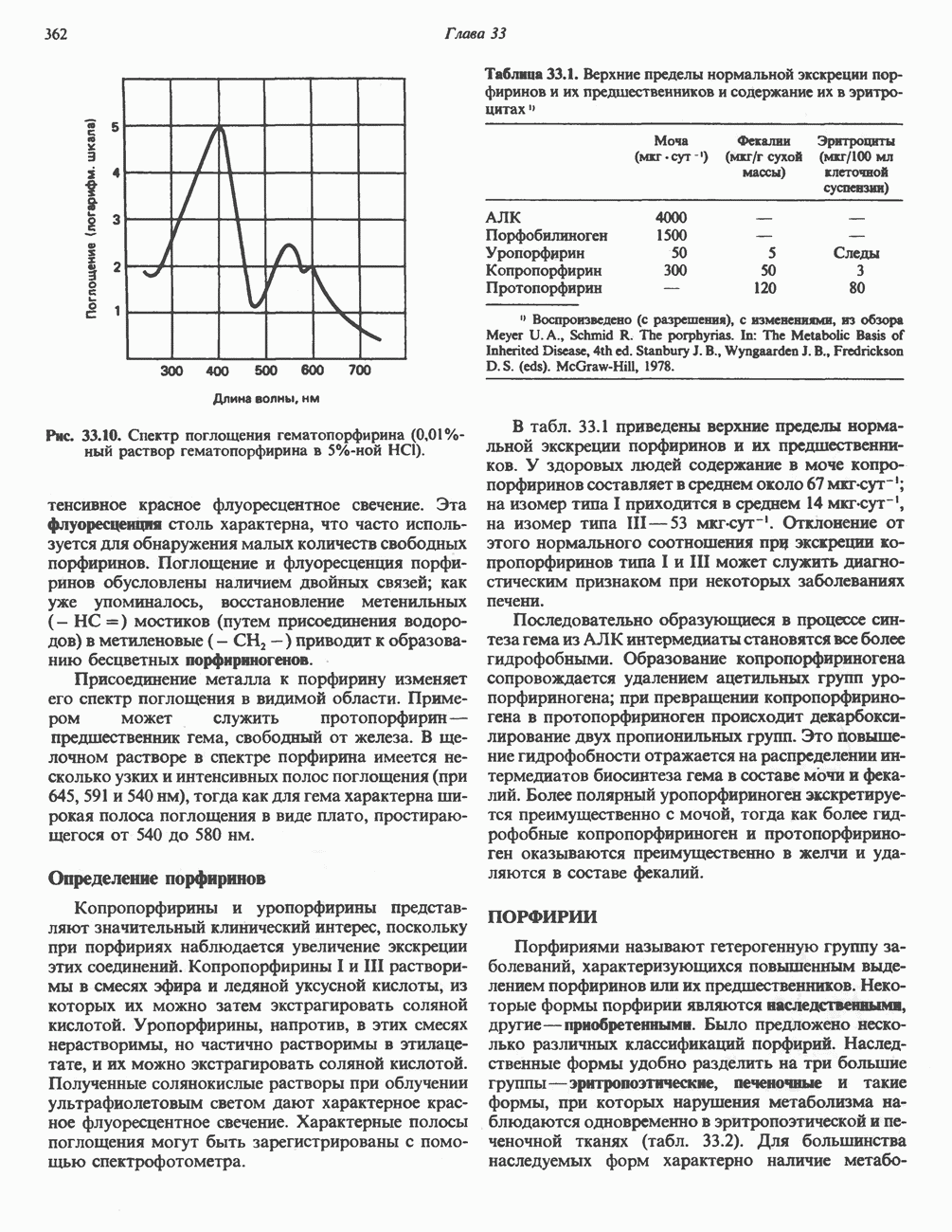
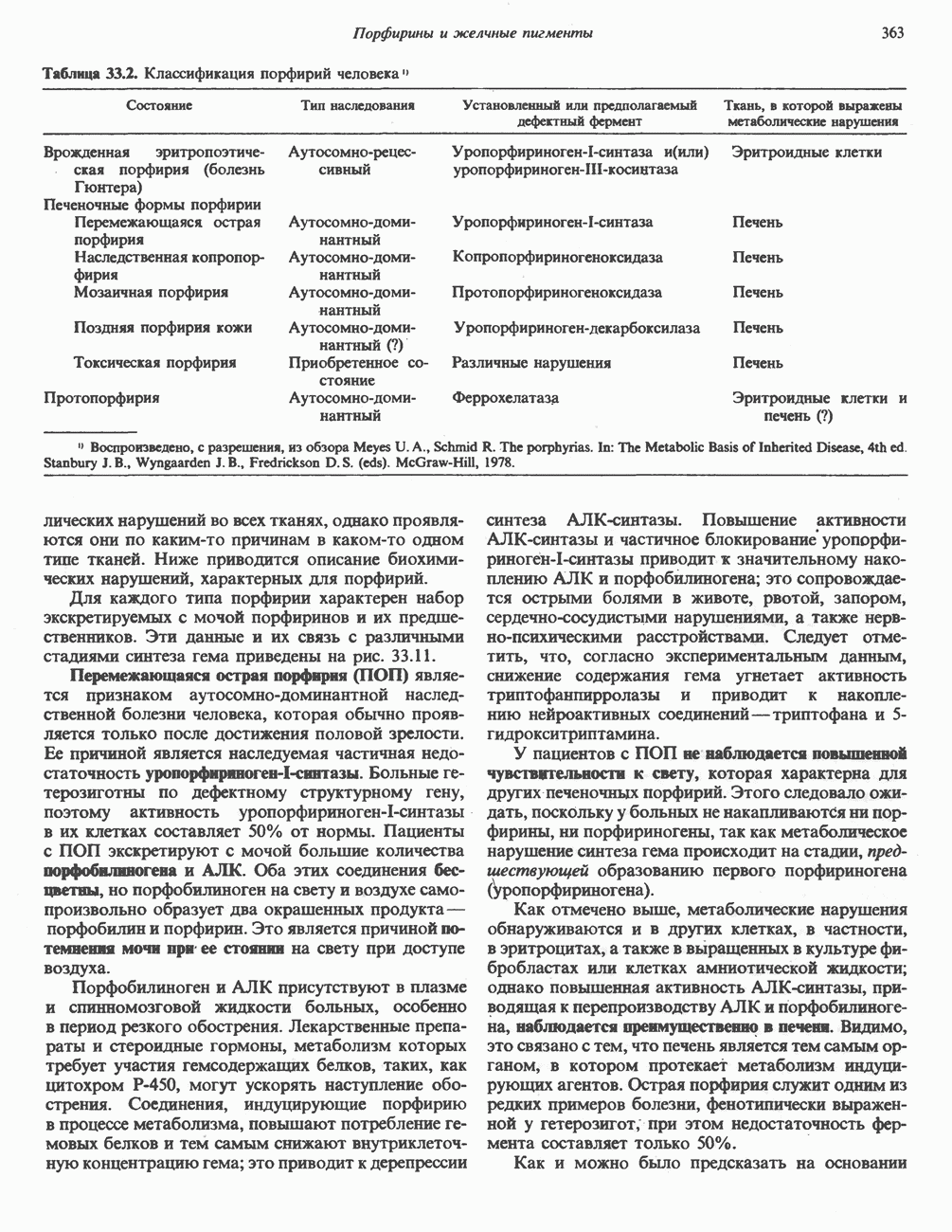
- ПОРФИРИНЫ
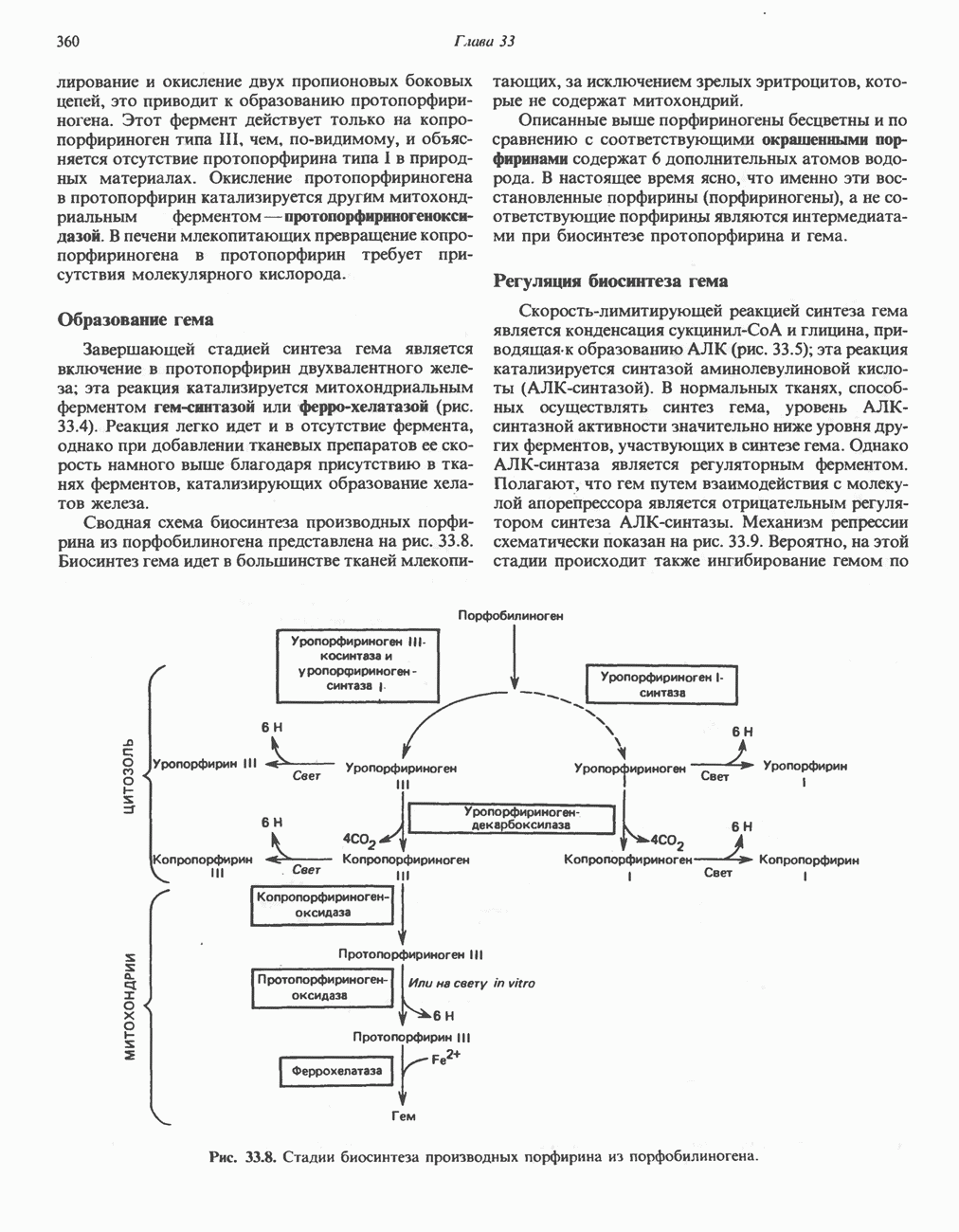
- ПОРФИРИН
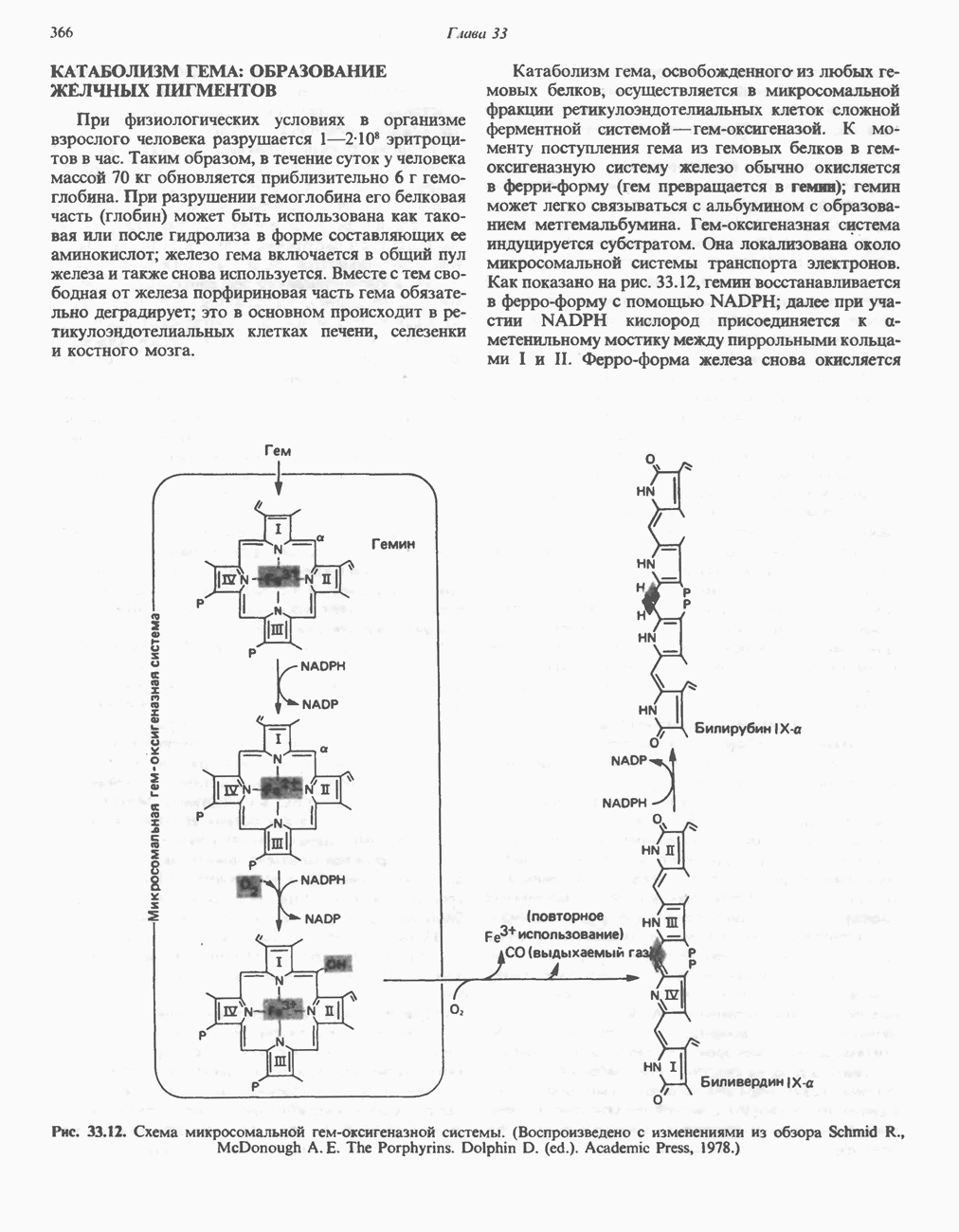
- КАТАБОЛИЗМ ГЕМА: ОБРАЗОВАНИЕ ЖЕЛЧНЫХ ПИГМЕНТОВ
- МЕТАБОЛИЗМ БИЛИРУБИНА В КИШЕЧНИКЕ
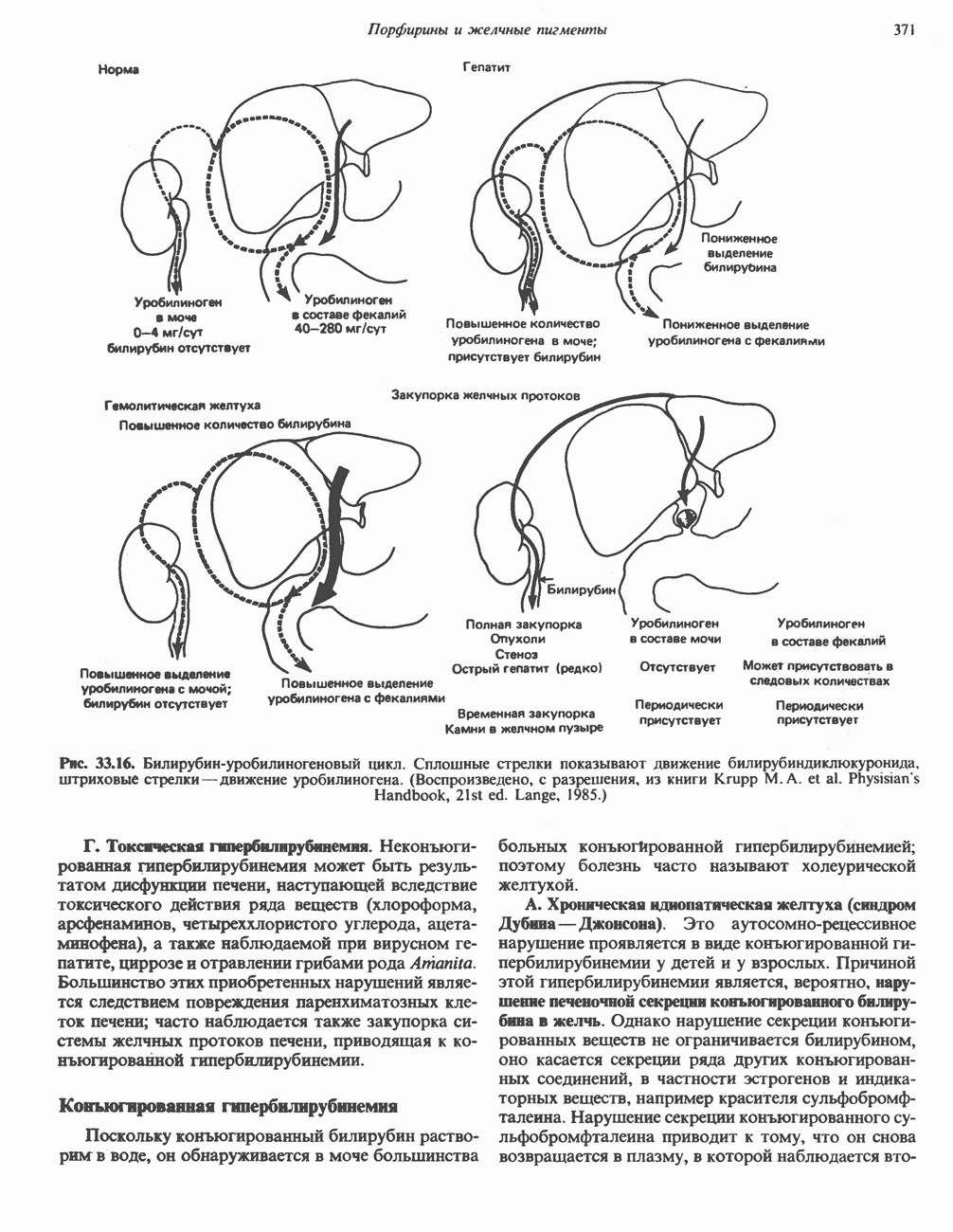
- ГИПЕРБИЛИРУБИНЕМИЯ
- Список сокращений