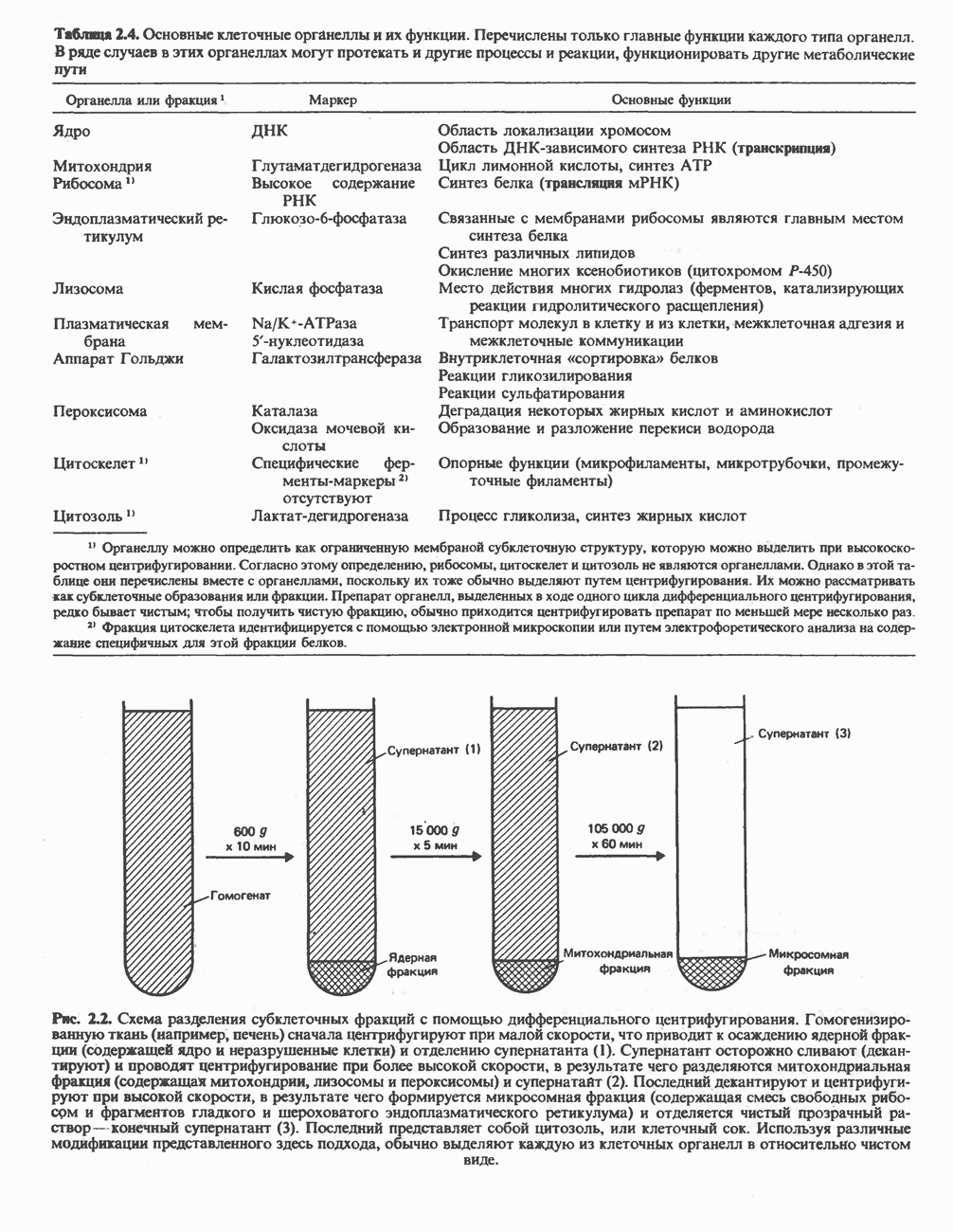
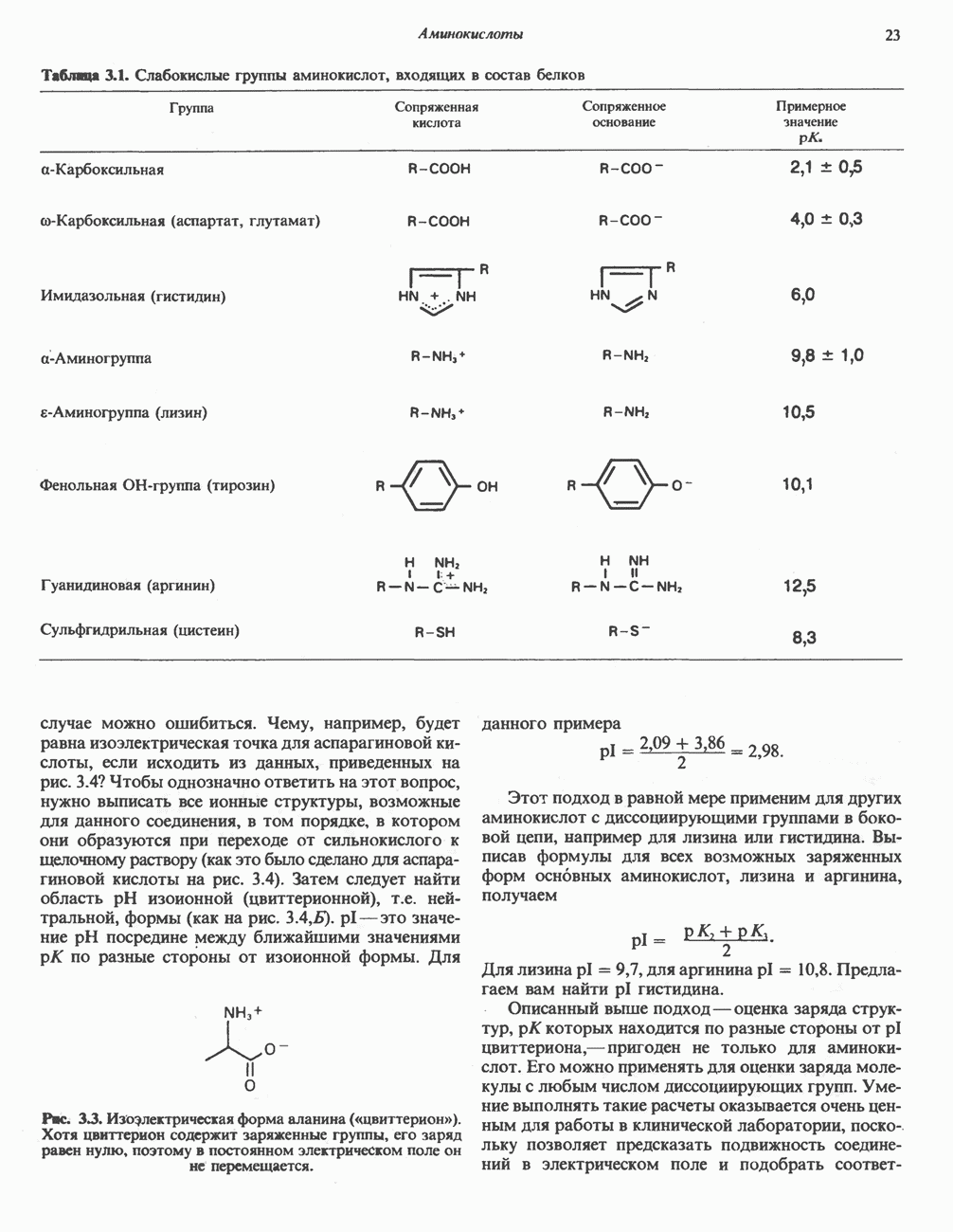
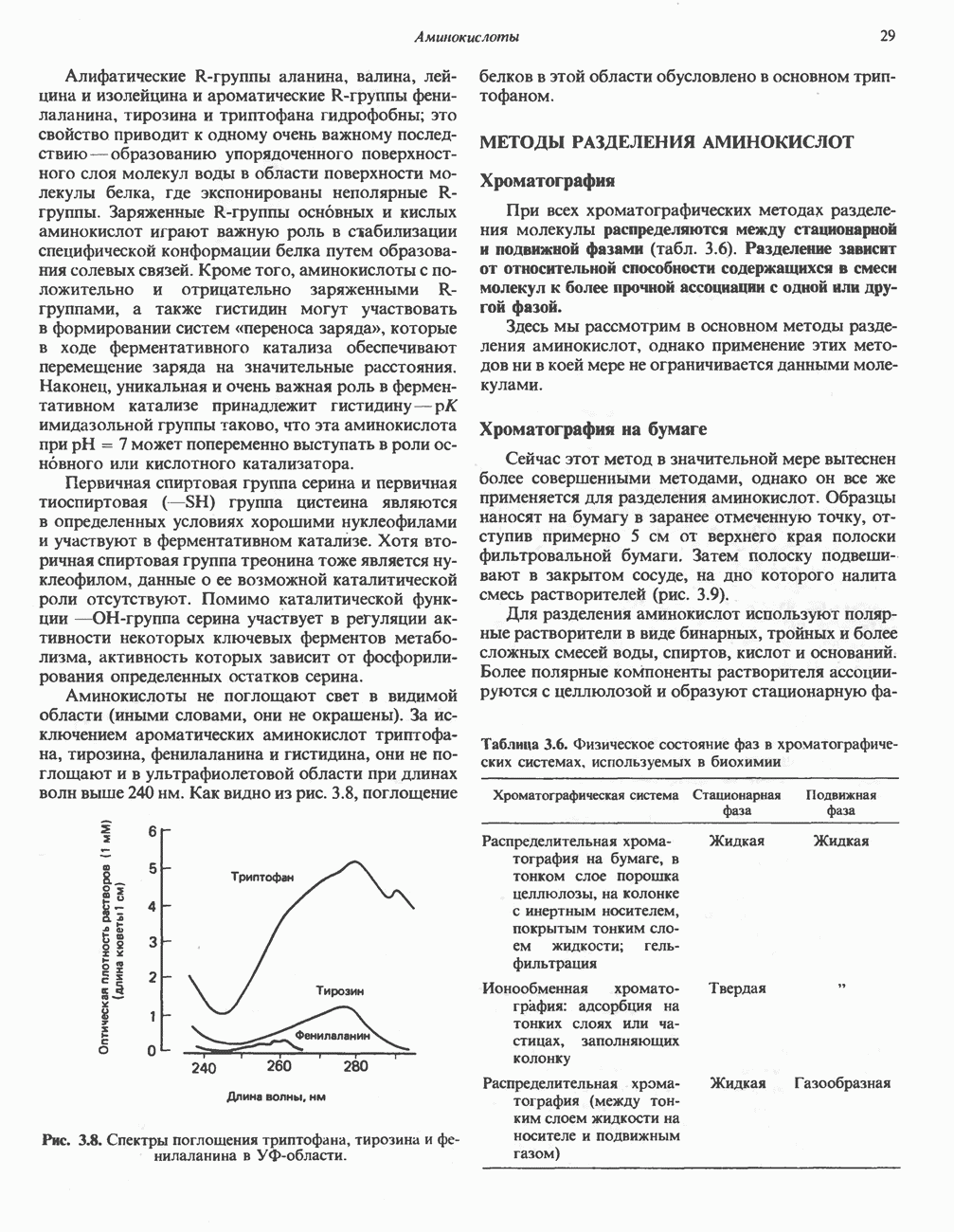
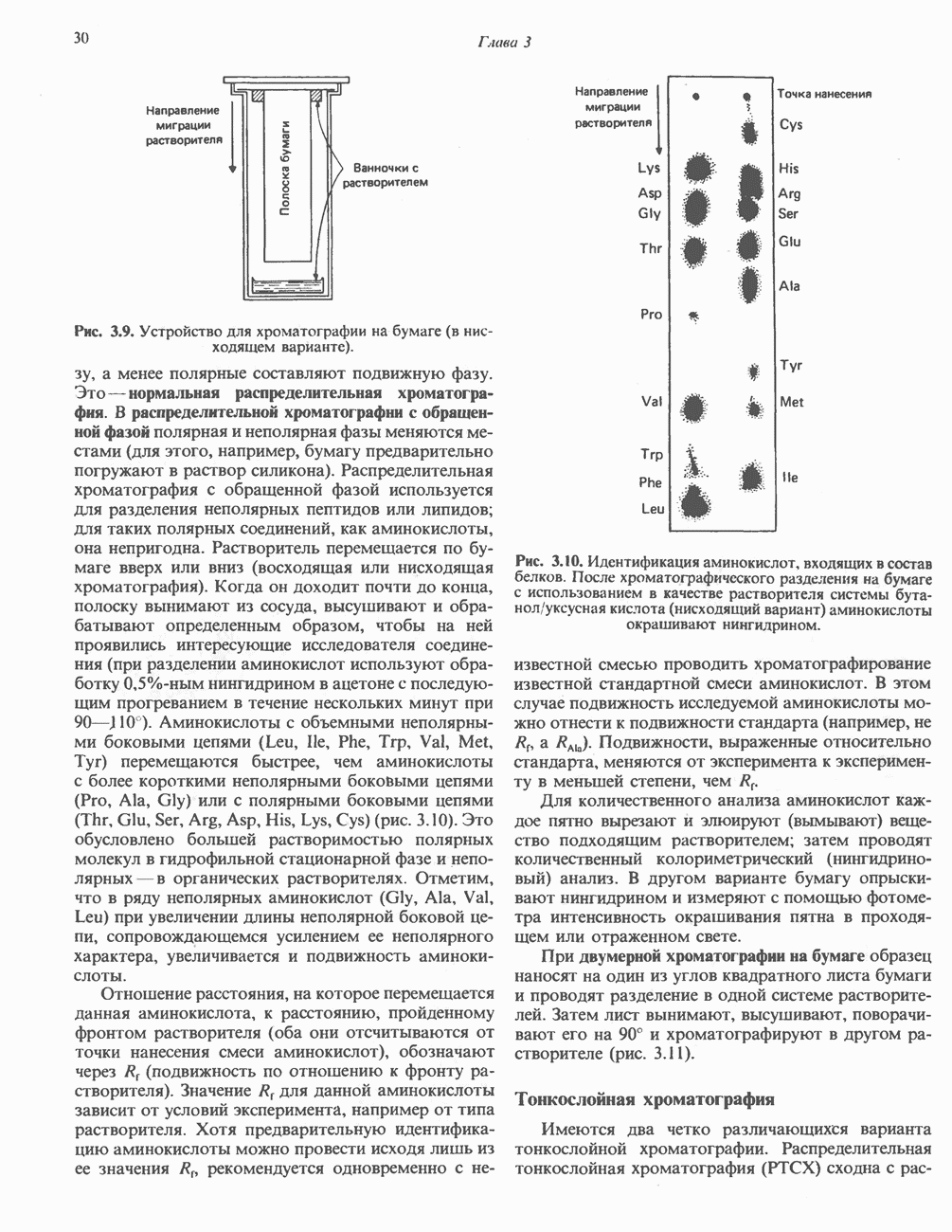
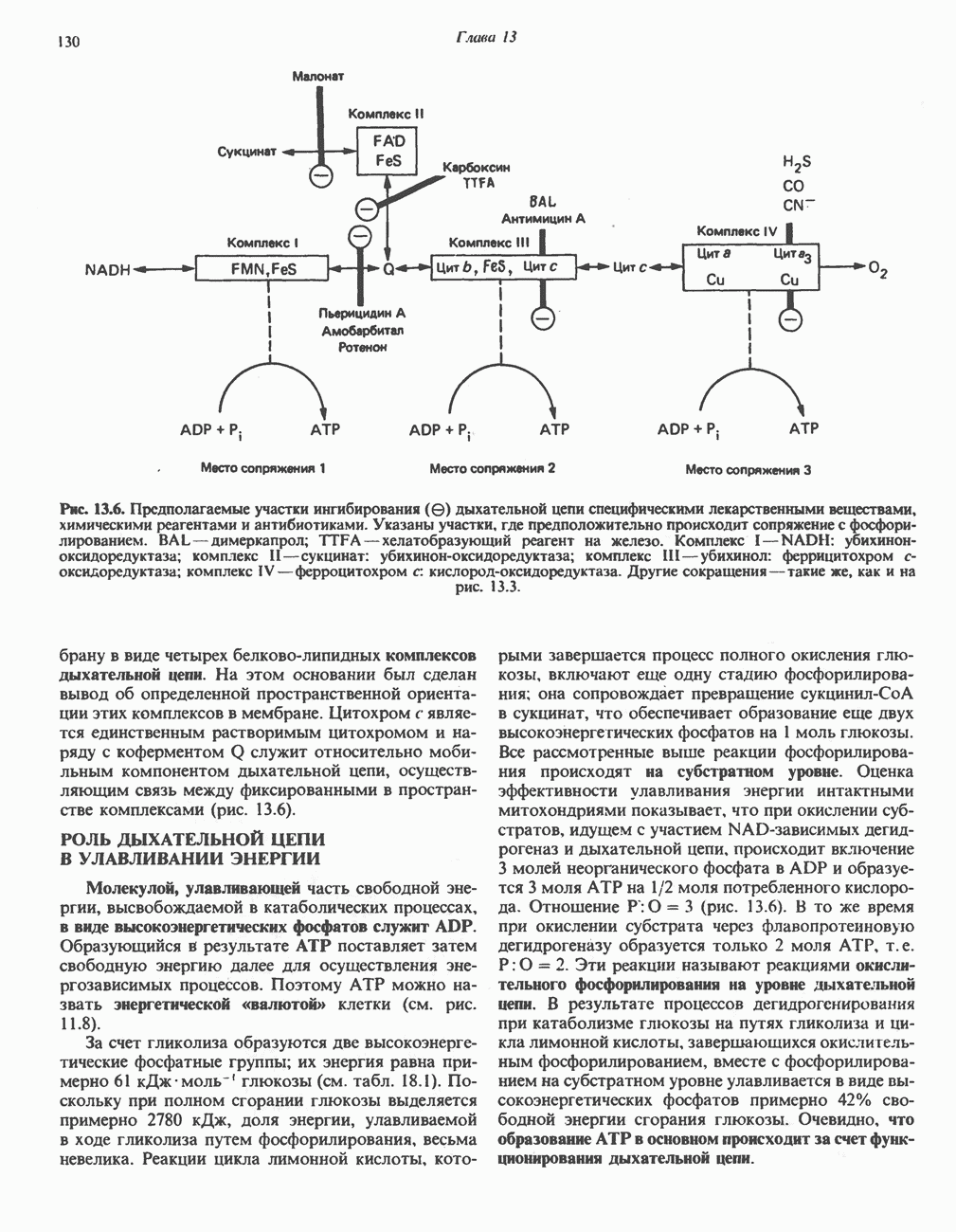
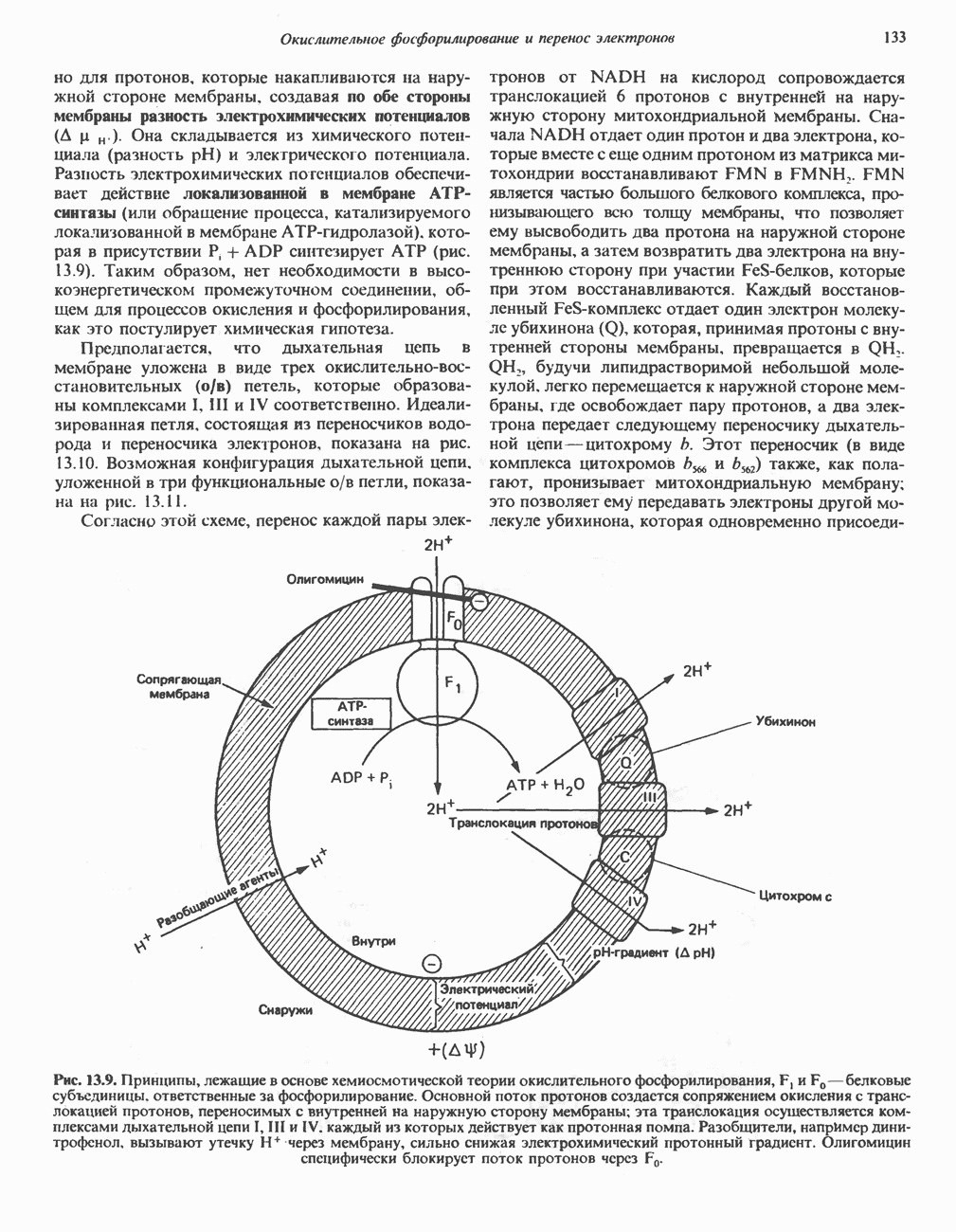
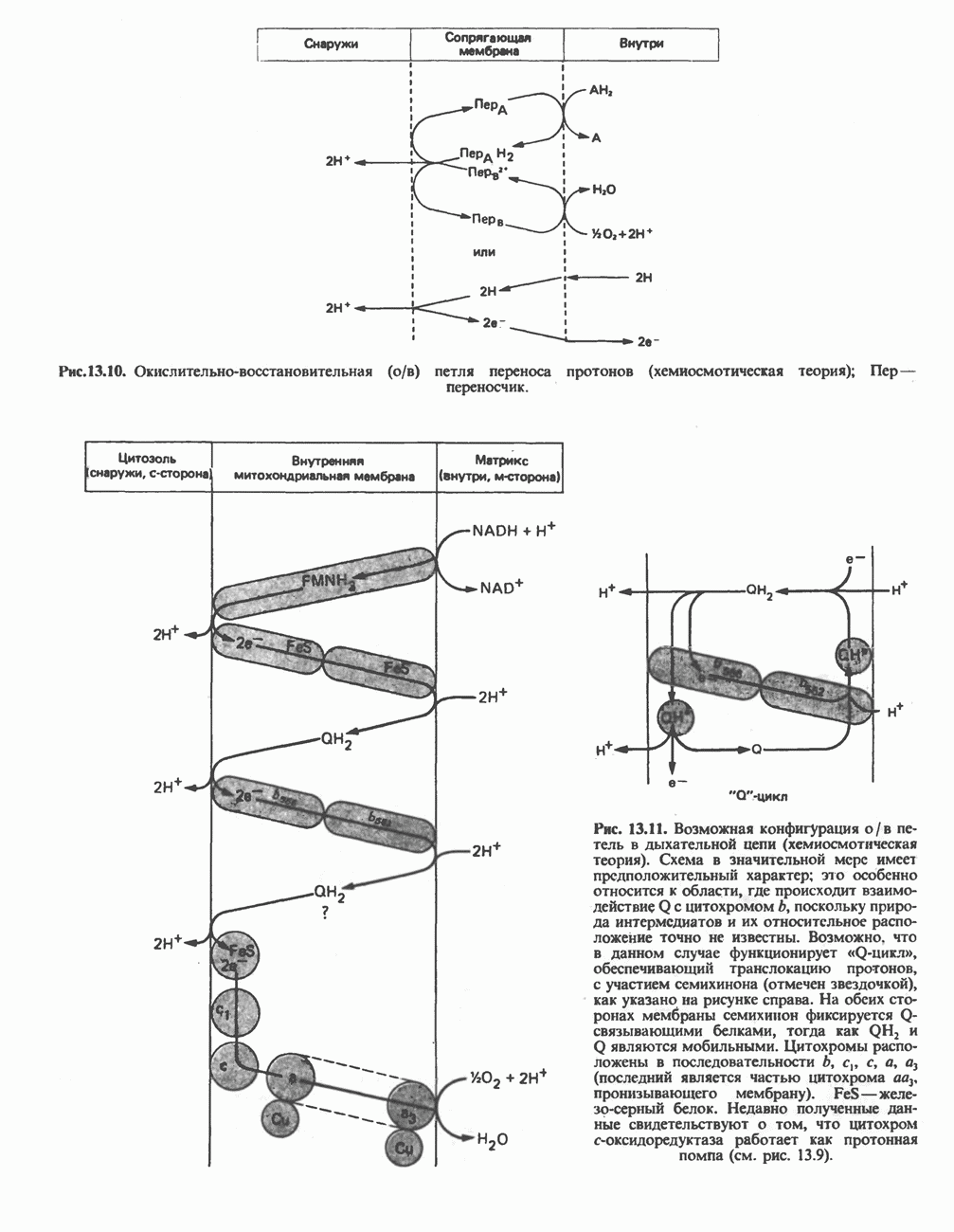
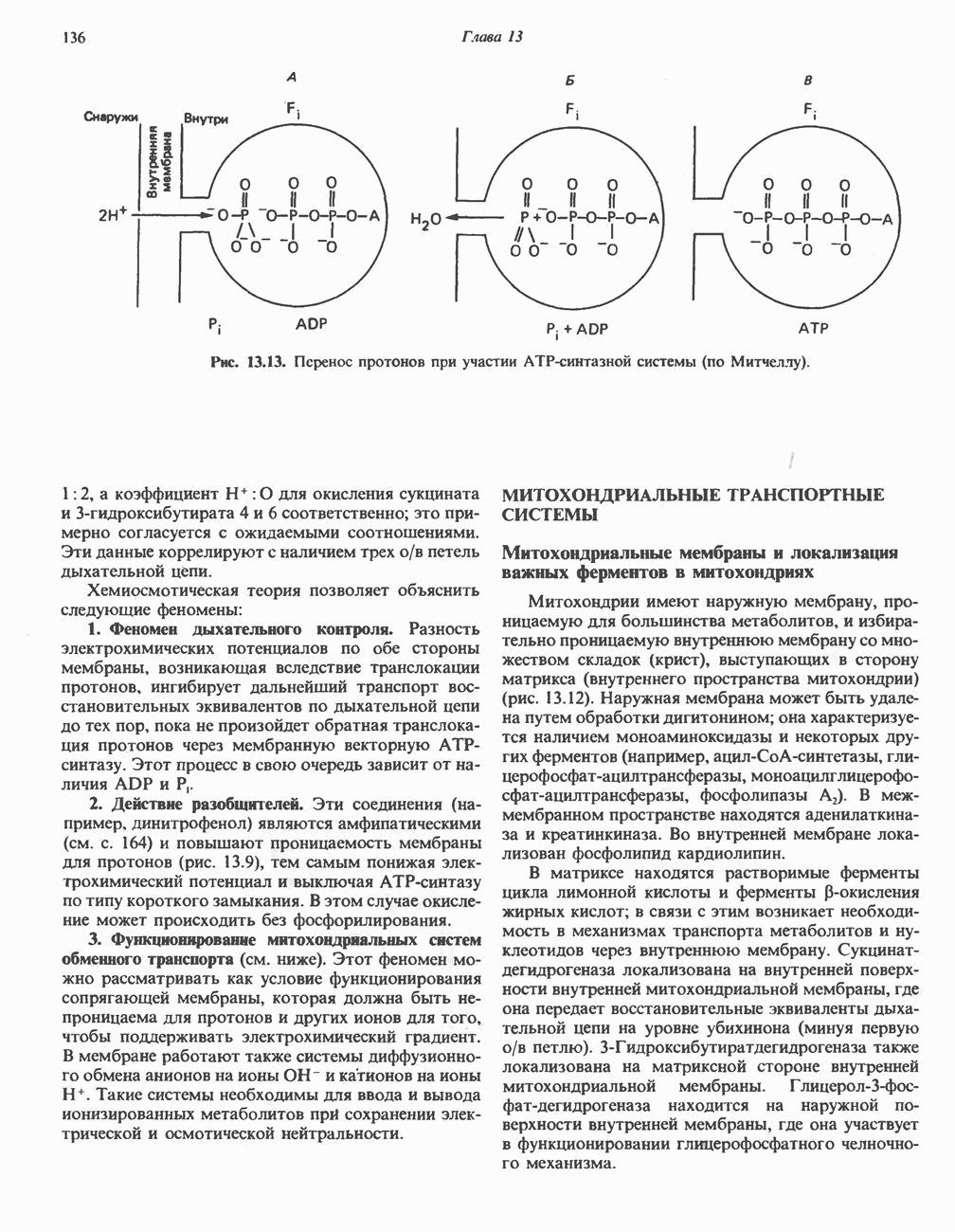
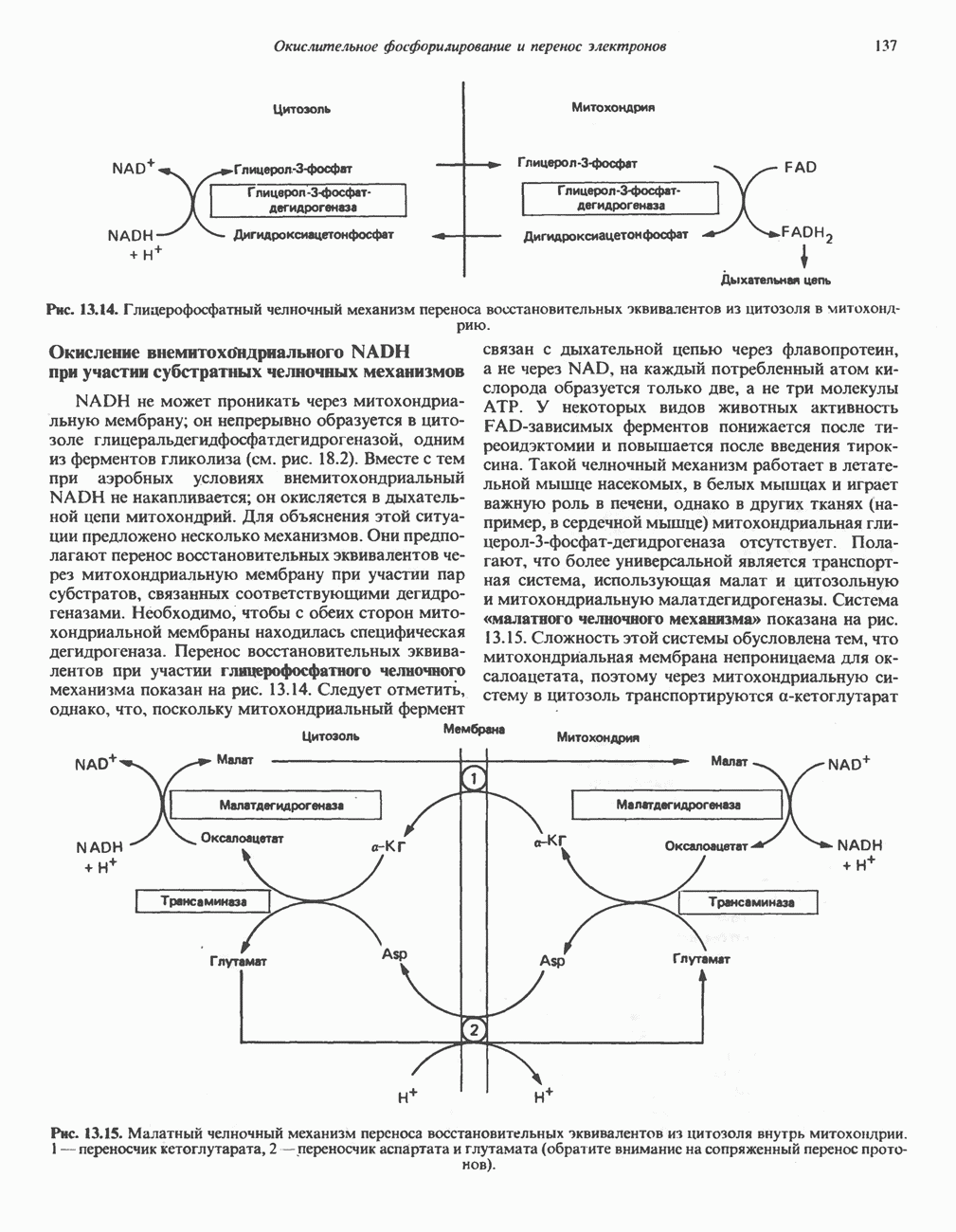
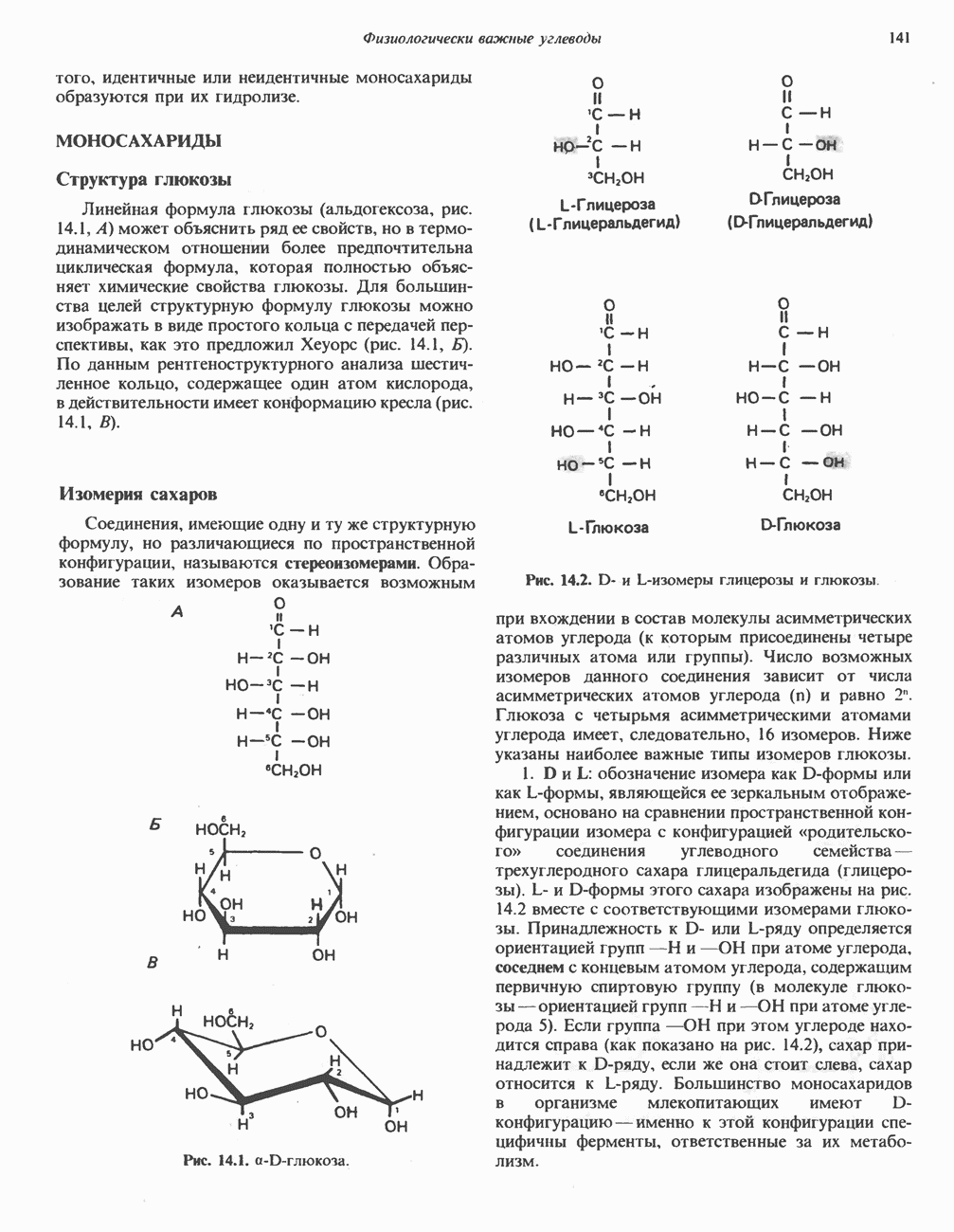
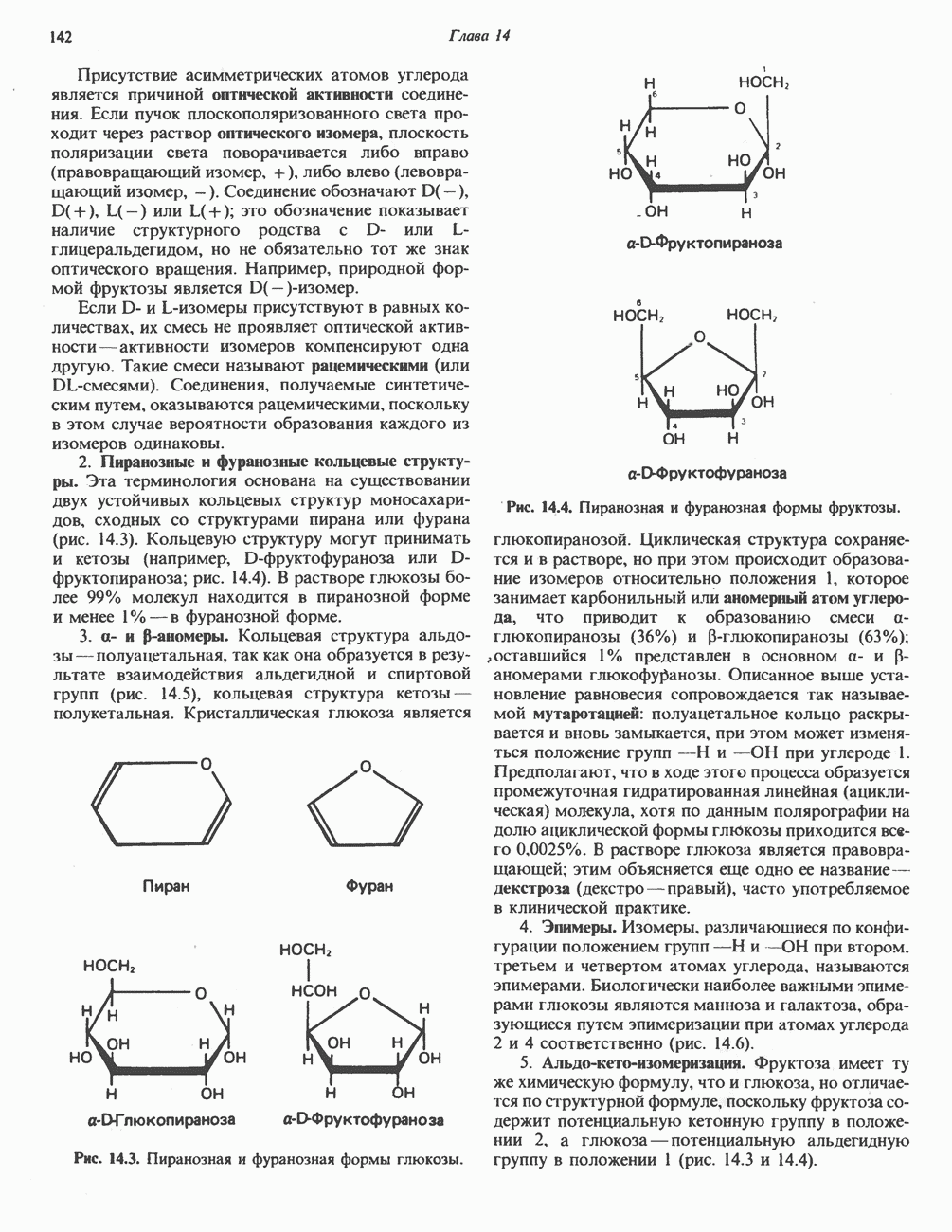
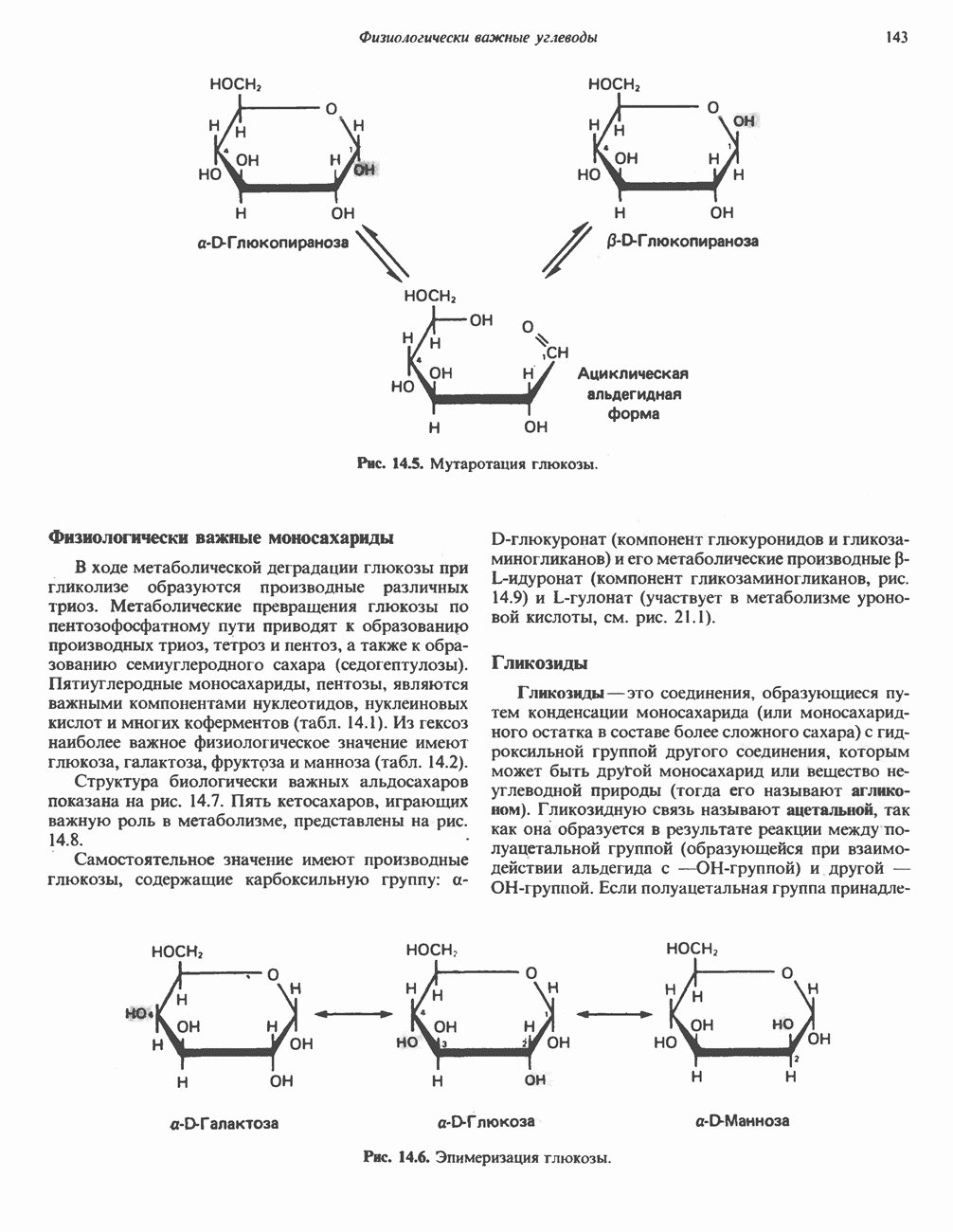
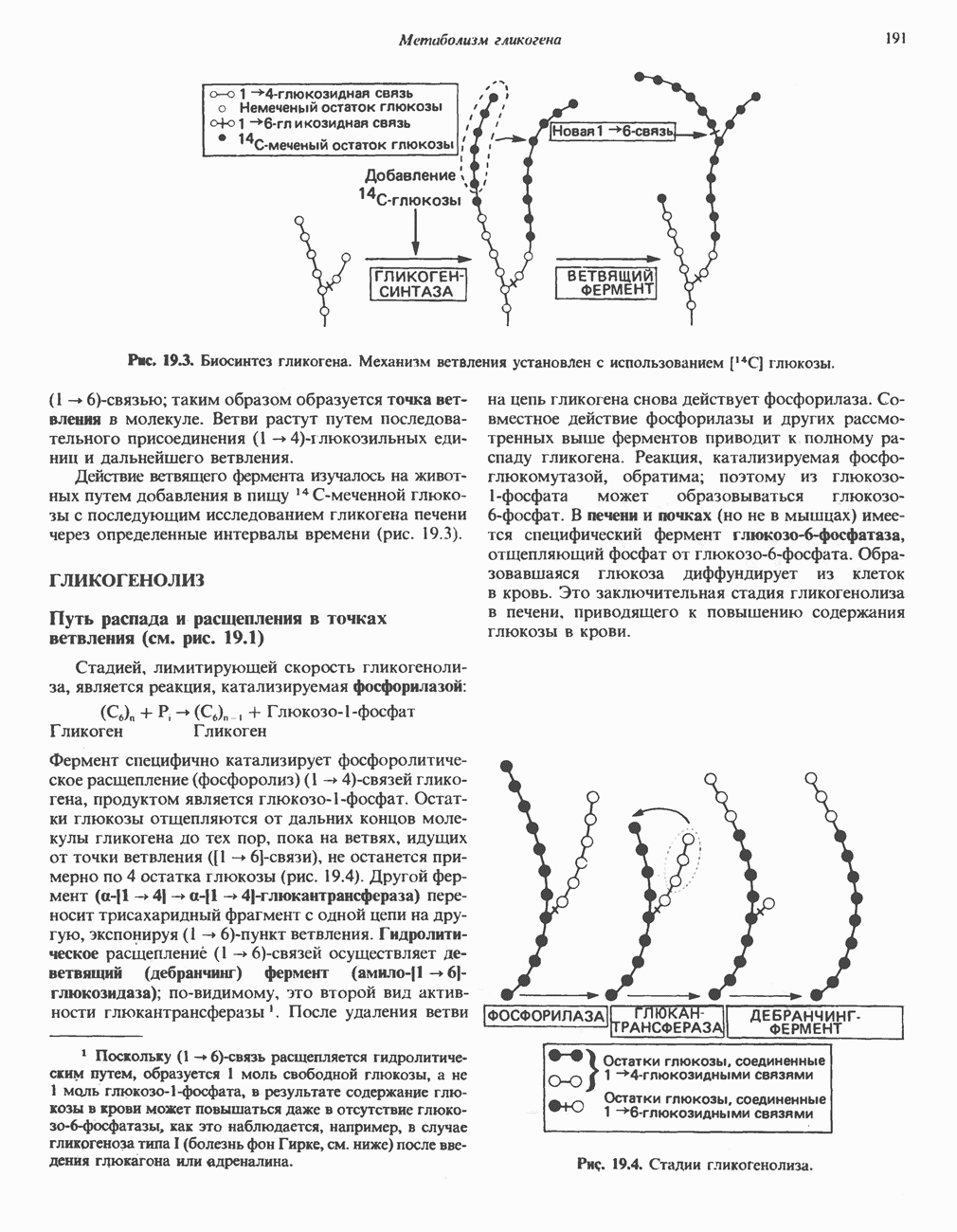
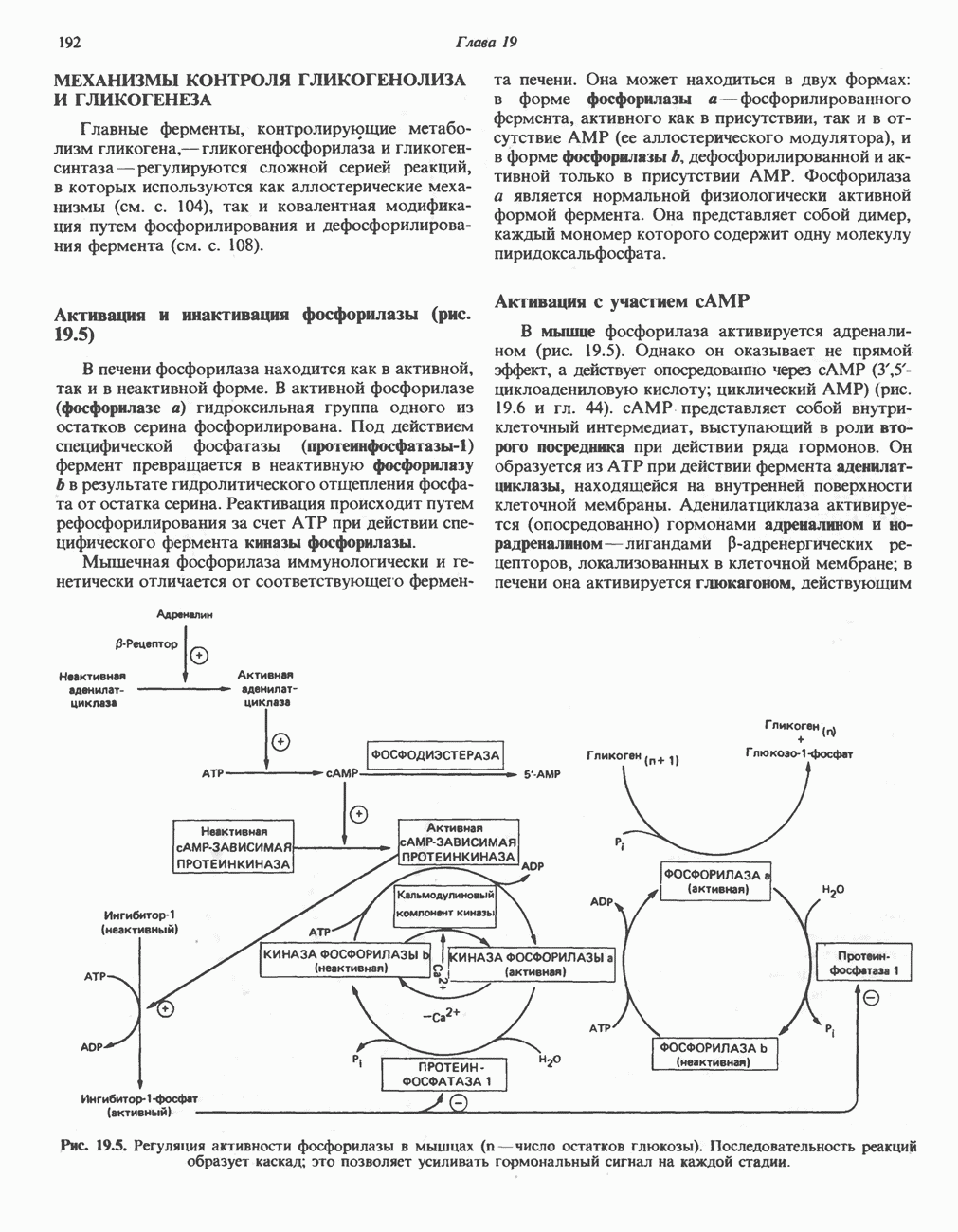
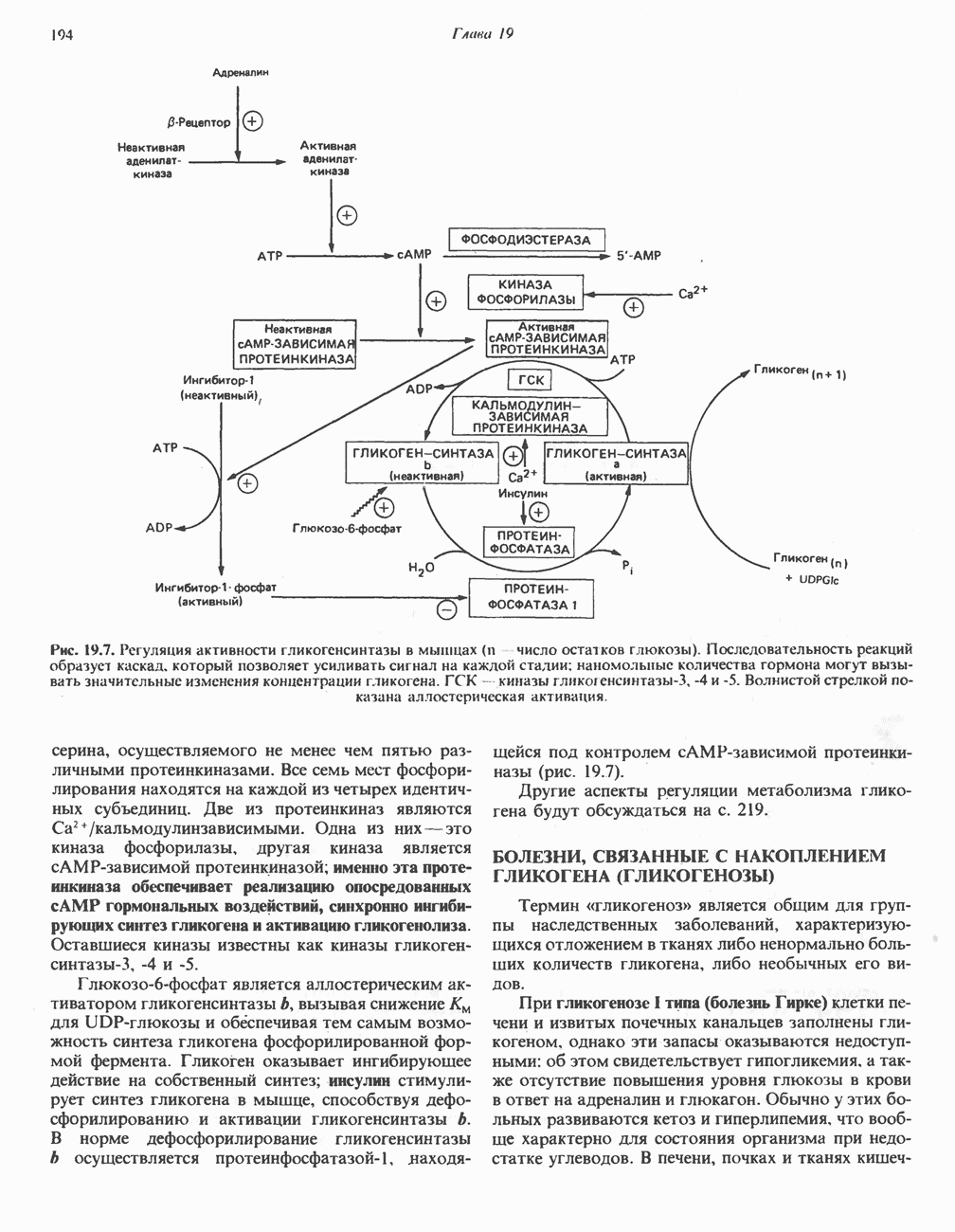
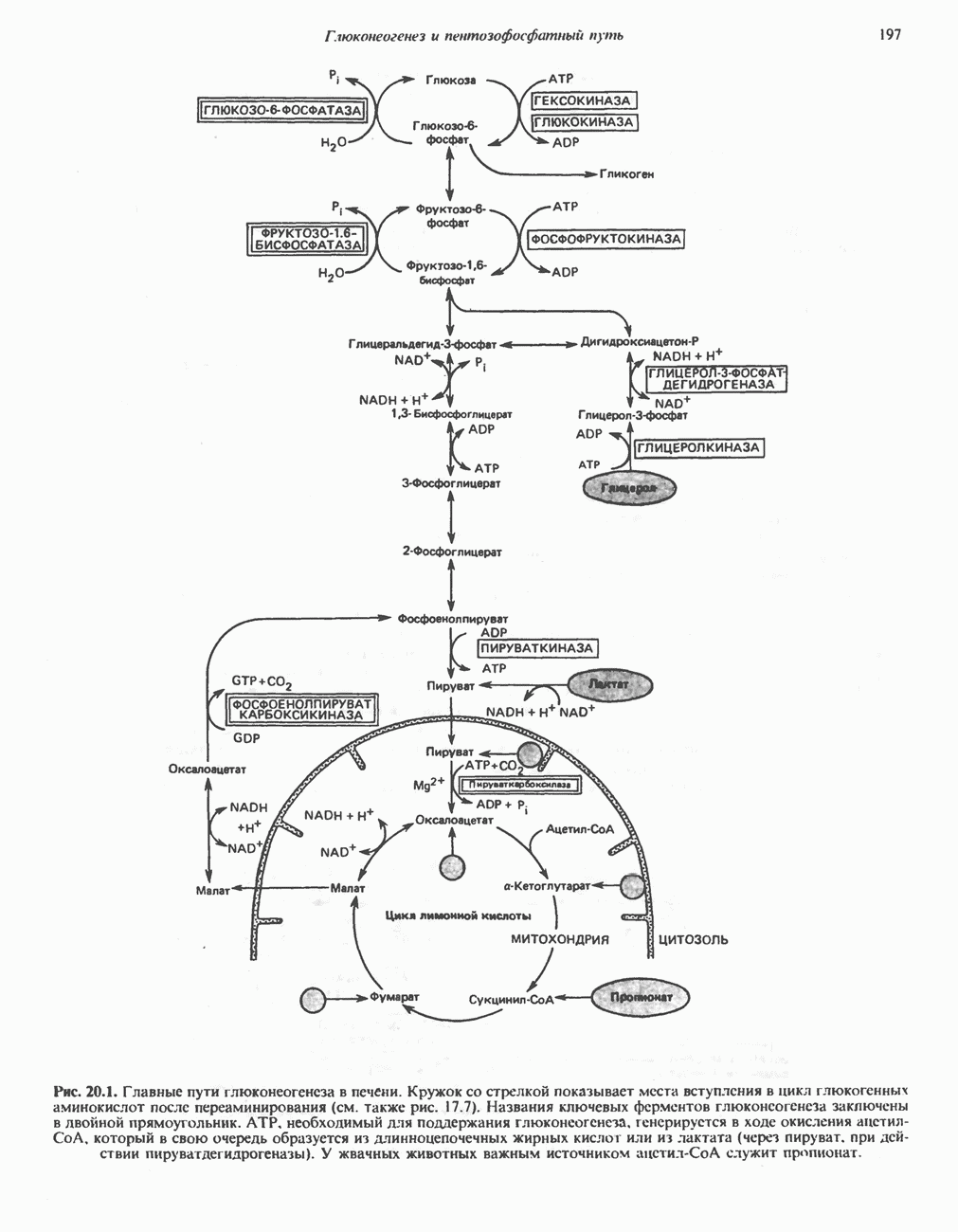
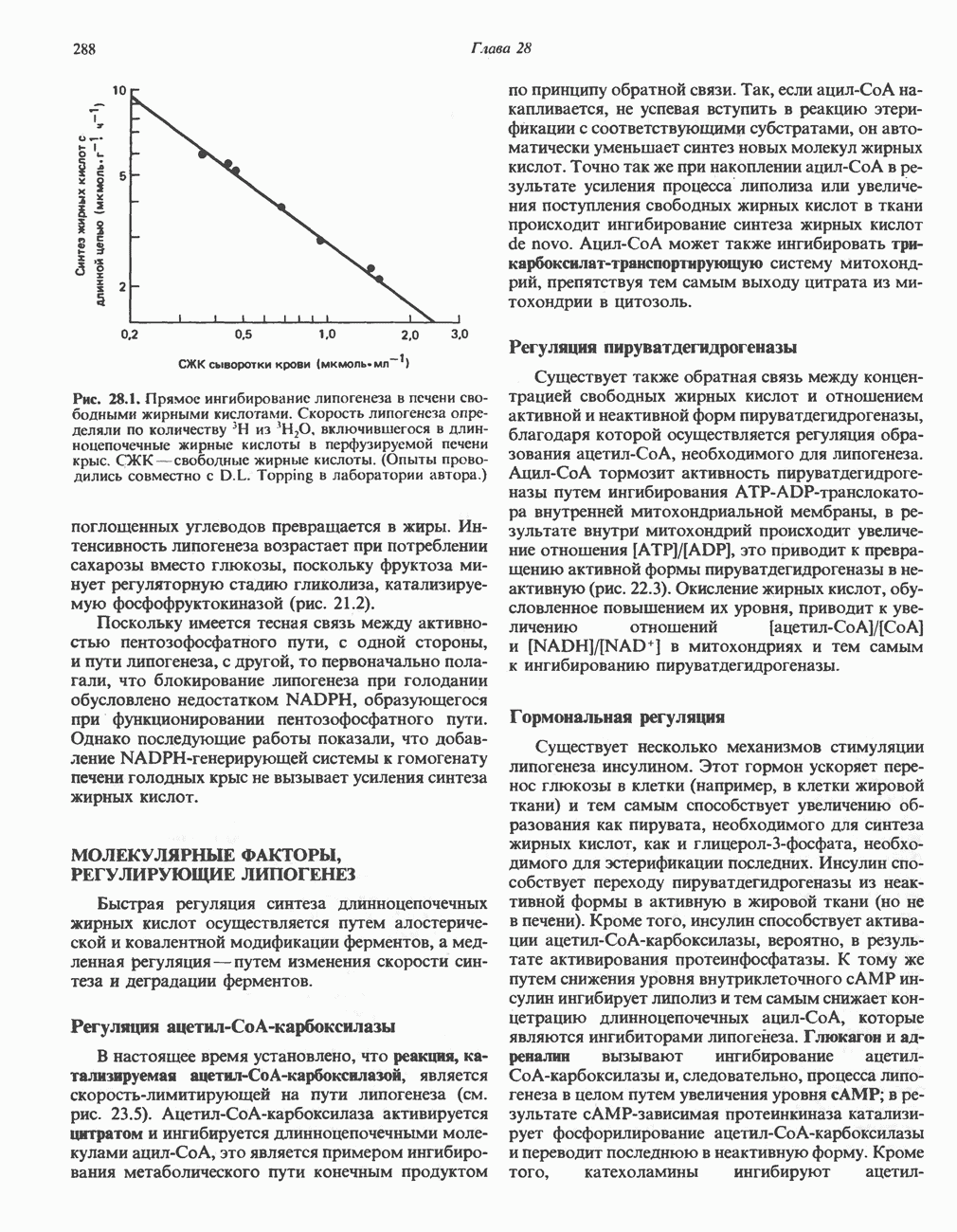
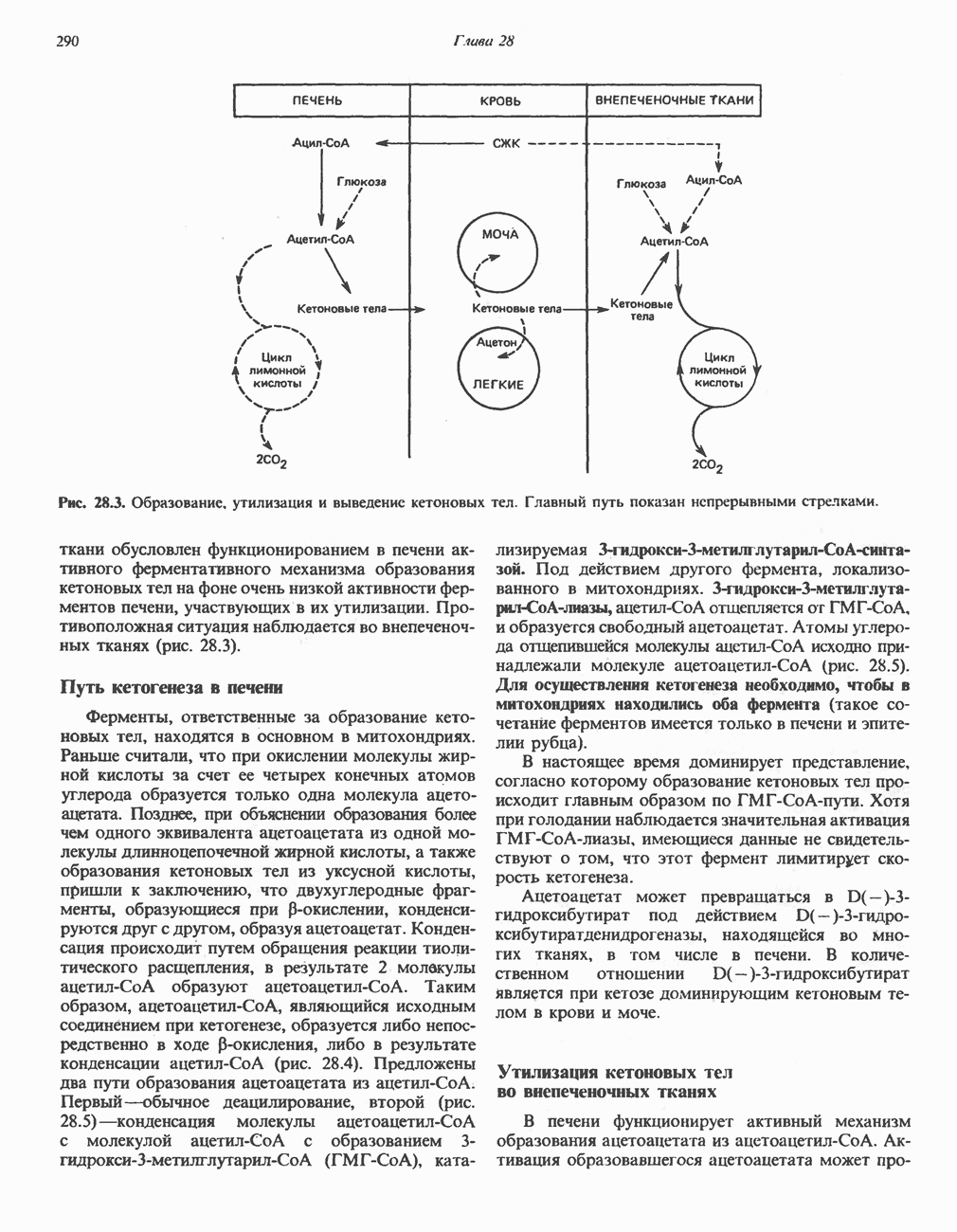
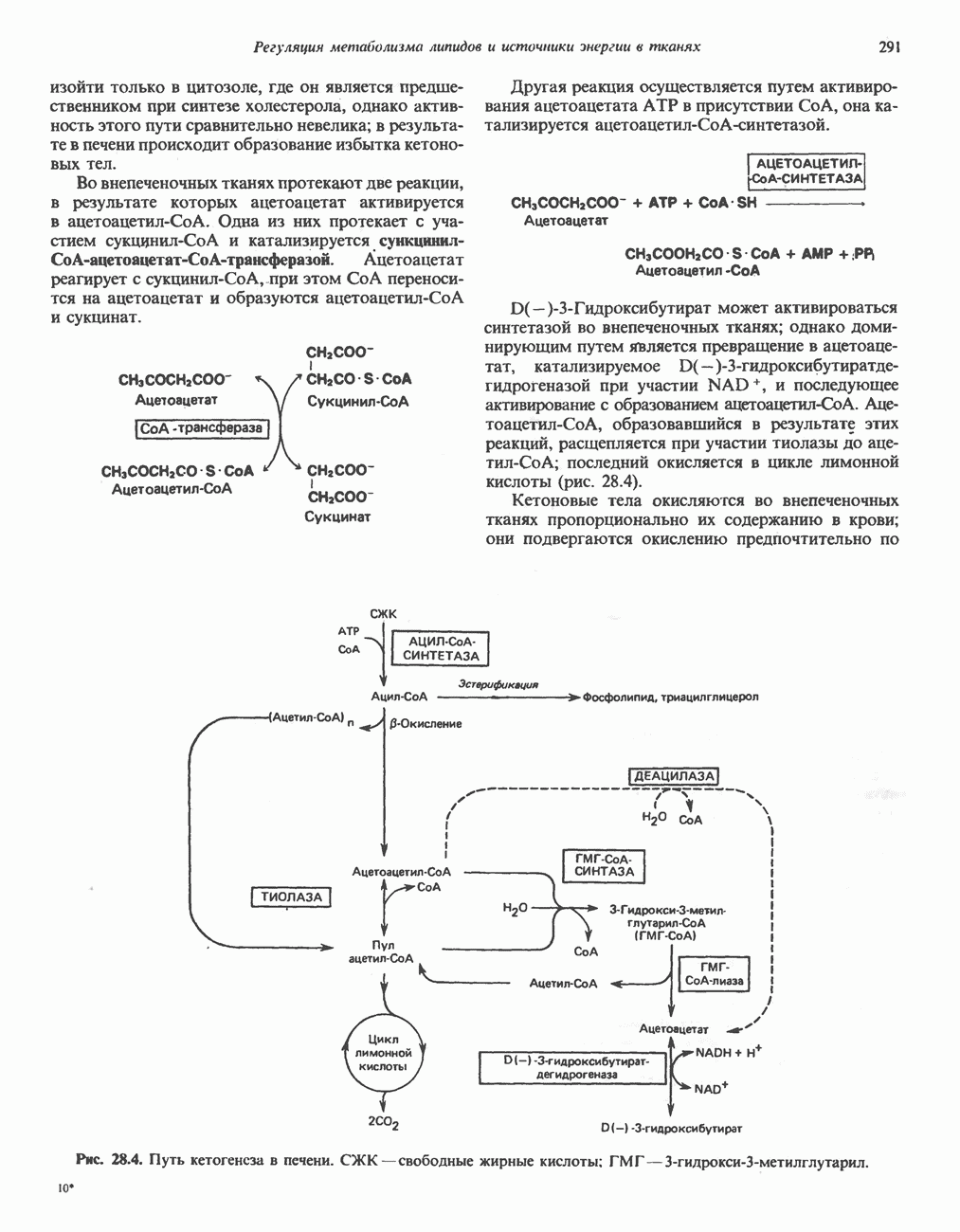
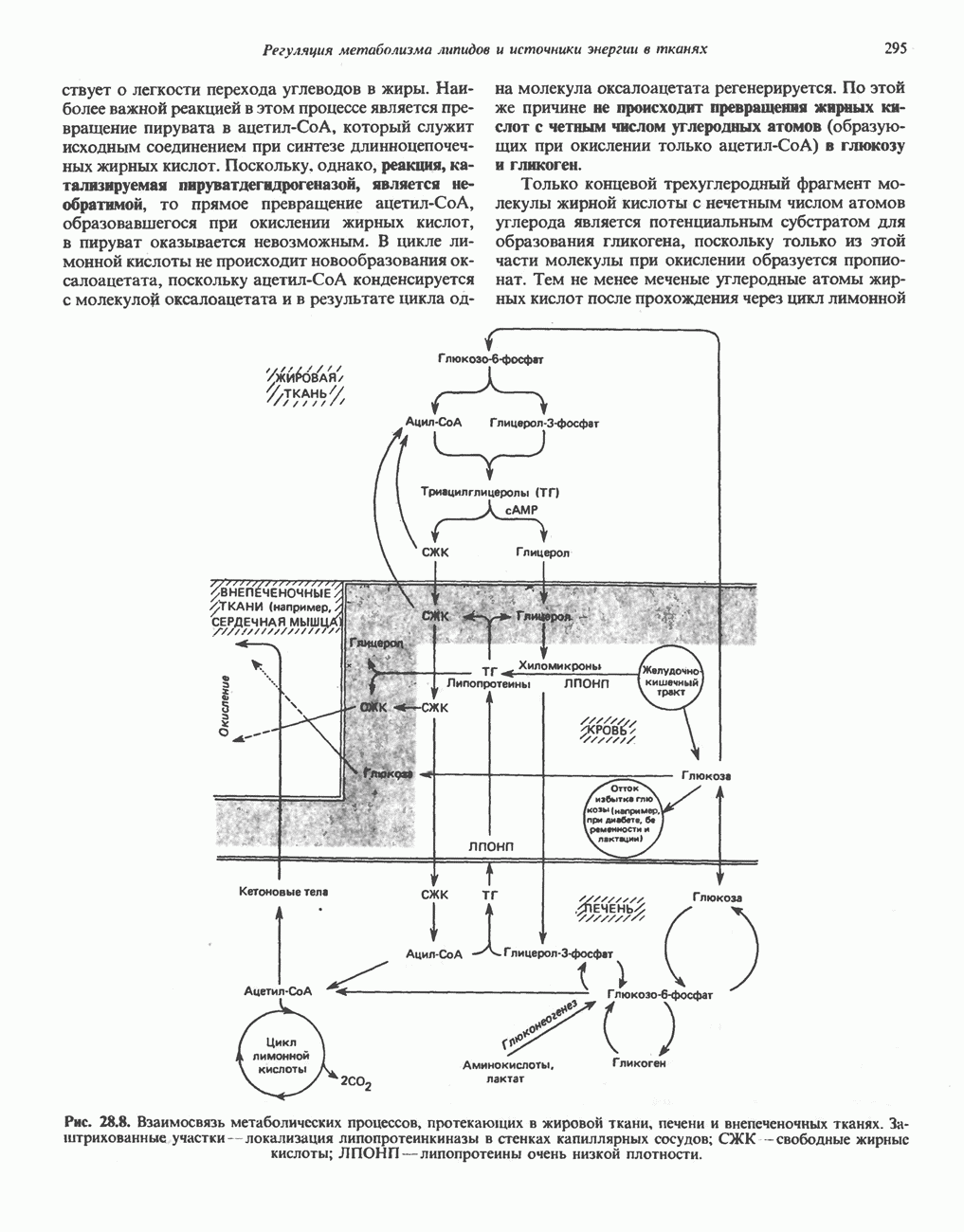
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
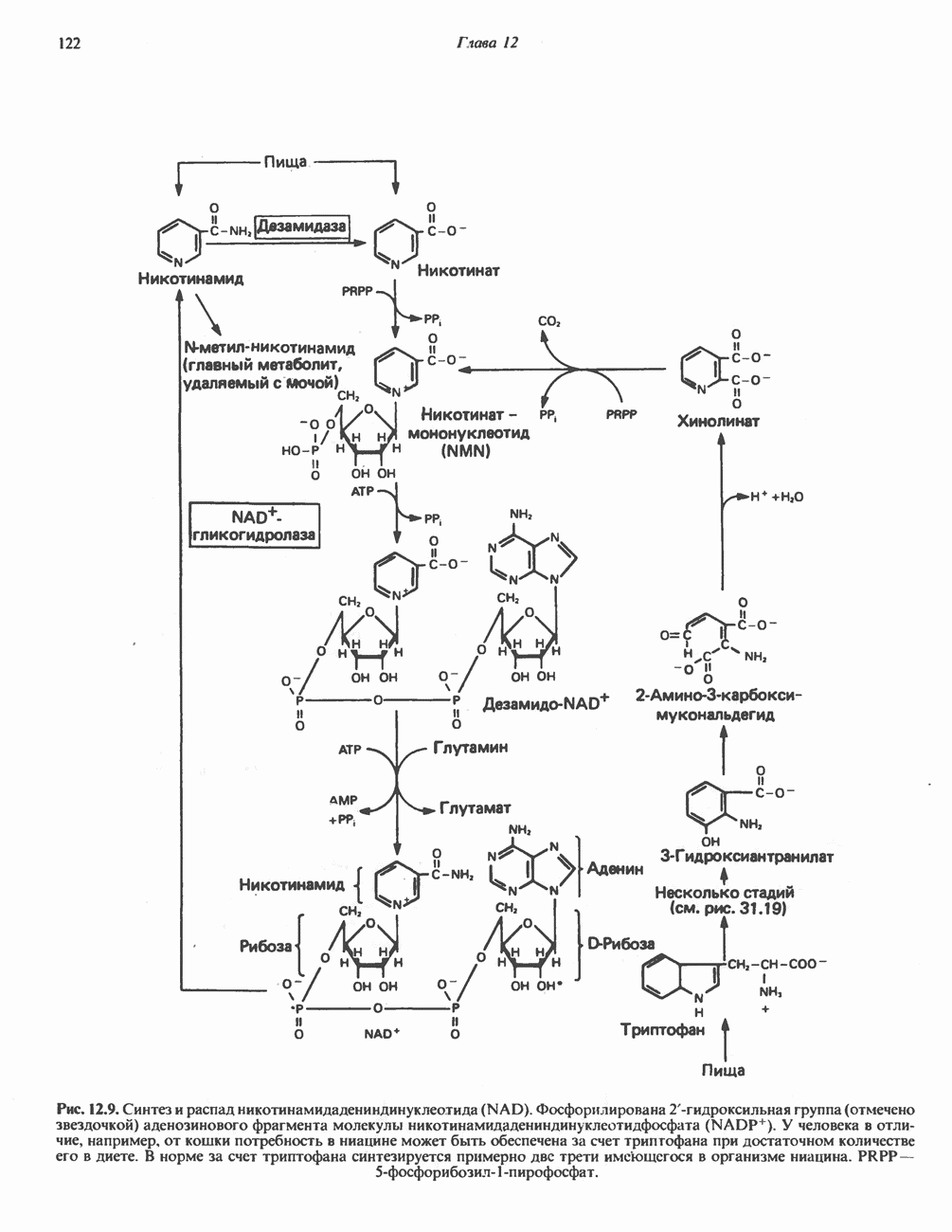
ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ
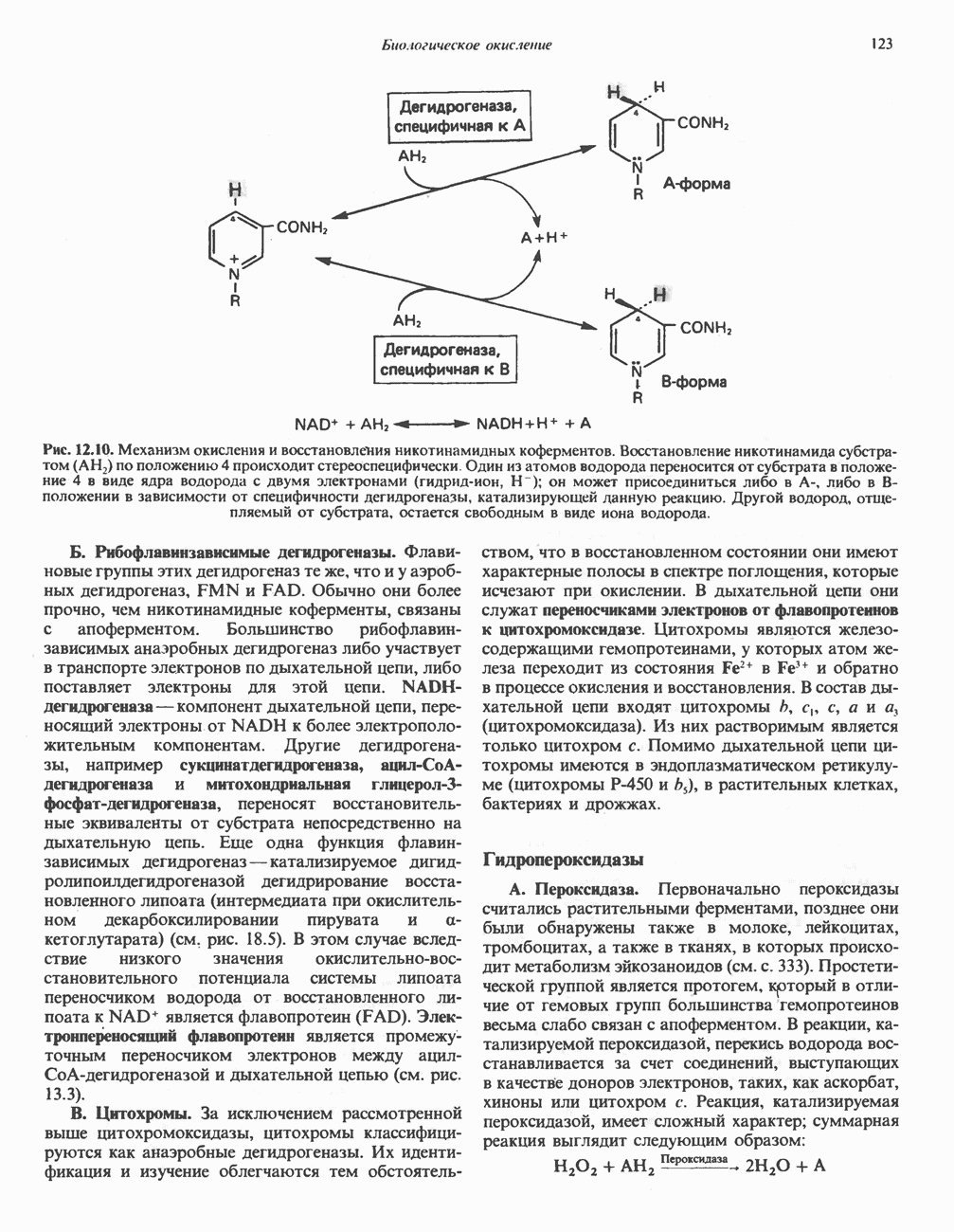
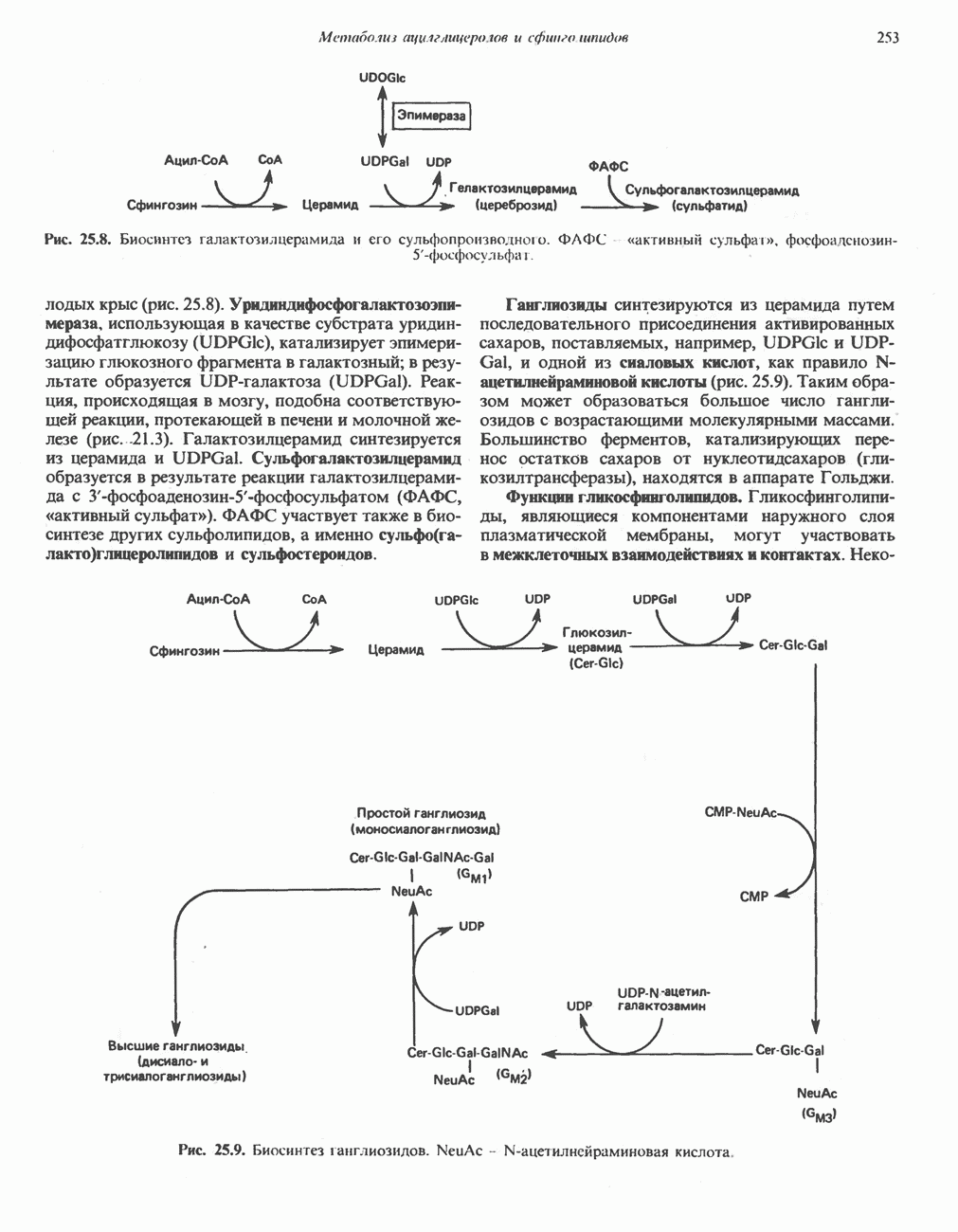
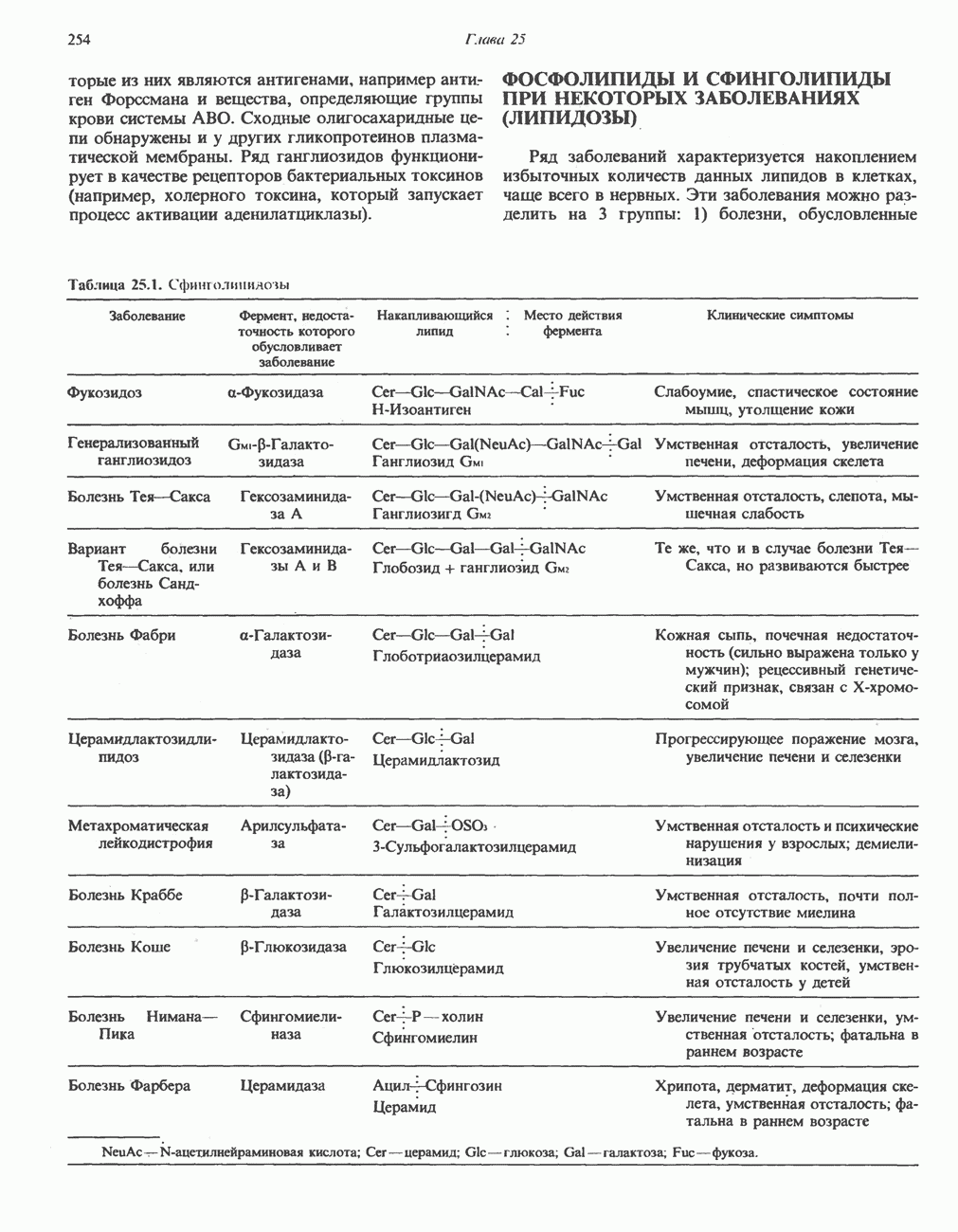
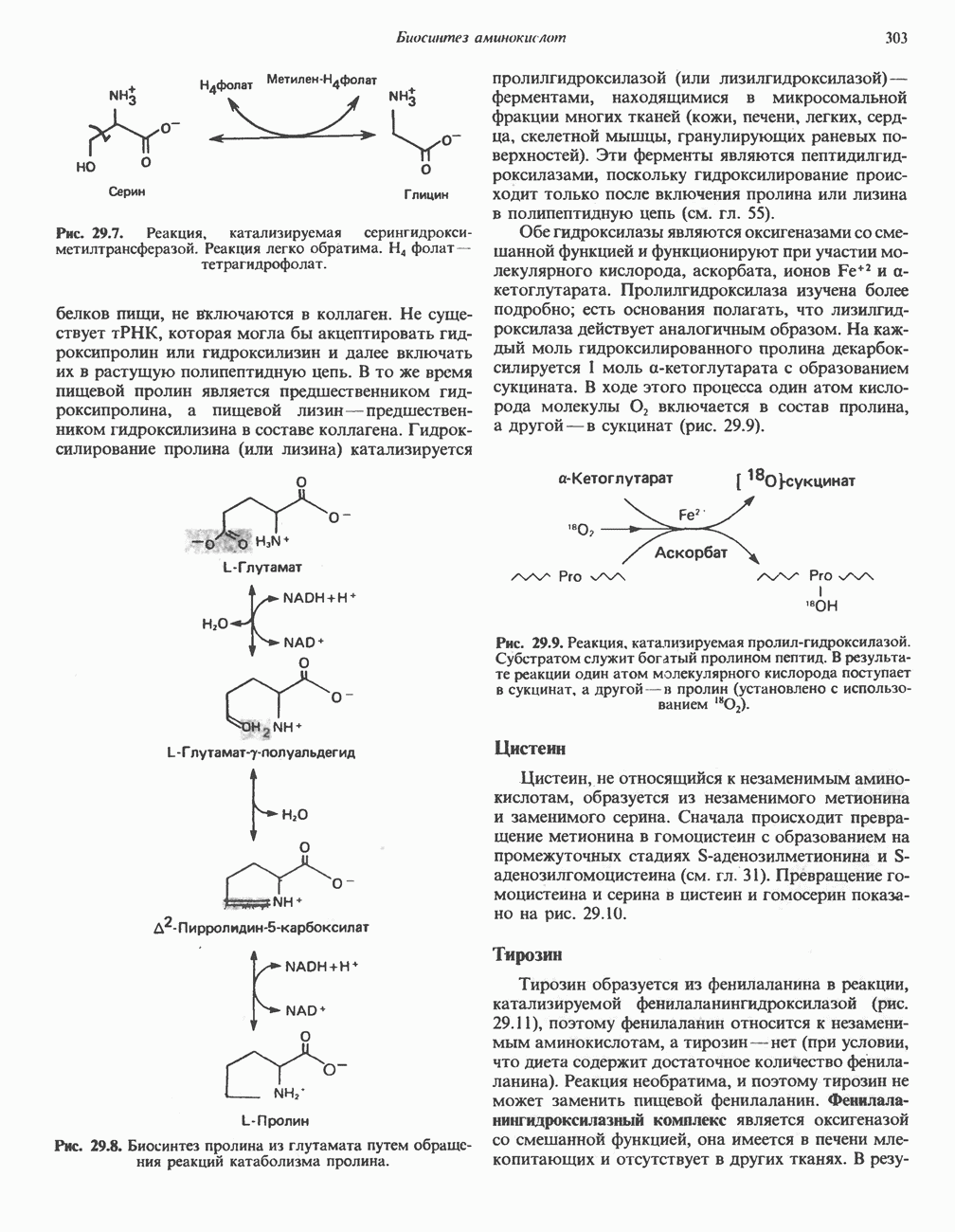
В печени и почках млекопитающих происходит окислительное превращение многих аминокислот в соответствующие кетокислоты. Большая часть активности в отношении  обусловлена сопряженным действием трансаминаз и L-глутаматдегидрогеназы, однако в печени и почках млекопитающих имеются также оксидазы L- и D-аминокислот; эти оксидазы имеются и у многих других животных и микроорганизмов. Однако не вполне ясно, какую физиологическую функцию выполняют оксидазы L- и D-аминокислот в тканях млекопитающих.
обусловлена сопряженным действием трансаминаз и L-глутаматдегидрогеназы, однако в печени и почках млекопитающих имеются также оксидазы L- и D-аминокислот; эти оксидазы имеются и у многих других животных и микроорганизмов. Однако не вполне ясно, какую физиологическую функцию выполняют оксидазы L- и D-аминокислот в тканях млекопитающих.
Оксидазы аминокислот являются автоокисляемыми флавопротеинами, т.е. восстановленные FMN или FAD окисляются непосредственно молекулярным кислородом (без участия цитохромов и других переносчиков электронов) с образованием перекиси водорода  Токсичный продукт
Токсичный продукт  далее расщепляется на
далее расщепляется на  и
и  каталазой, широко распространенной в тканях (особенно много ее в печени). В отсутствие каталазы образующаяся а-кетокислота может декарбоксилироваться неферментативным путем перекисью водорода
каталазой, широко распространенной в тканях (особенно много ее в печени). В отсутствие каталазы образующаяся а-кетокислота может декарбоксилироваться неферментативным путем перекисью водорода  с образованием карбоновой кислоты, имеющей на один атом углерода меньше. Впрочем, представляется маловероятным, чтобы такое декарбоксилирование играло какую-то роль в интактных тканях человека.
с образованием карбоновой кислоты, имеющей на один атом углерода меньше. Впрочем, представляется маловероятным, чтобы такое декарбоксилирование играло какую-то роль в интактных тканях человека.
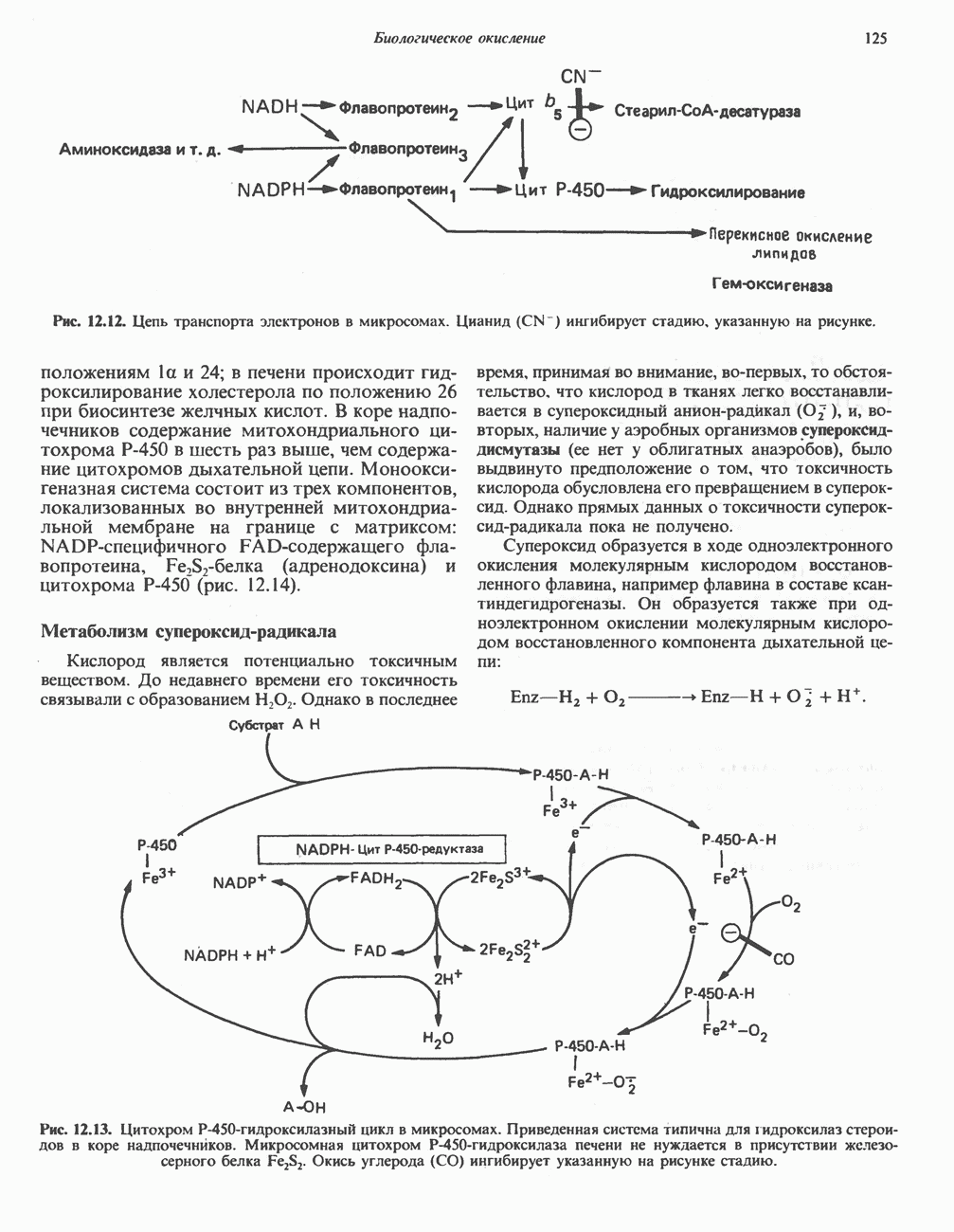
В реакциях, катализируемых оксидазами аминокислот (рис. 30.5), сначала происходит дегидрогенирование при участии флавопротеиновой оксидазы, приводящее к образованию  -иминокислоты. Последняя неферментативно присоединяет молекулу воды и превращается в соответствующую а-кетокислоту с потерей а-аминного азота в виде иона аммония.
-иминокислоты. Последняя неферментативно присоединяет молекулу воды и превращается в соответствующую а-кетокислоту с потерей а-аминного азота в виде иона аммония.
Оксидаза  -аминокислот, являющаяся
-аминокислот, являющаяся  -содержащим флавопротеином, у большинства млекопитающих находится только в почках и печени. Ее
-содержащим флавопротеином, у большинства млекопитающих находится только в почках и печени. Ее

Рис. 30.5. Окислительное дезаминирование, катализируемое оксидазой L-аминокислот (L-a-аминокислота: кислородоксидоредуктаза). Заключенная в скобки а-иминокислота является нестабильным интермедиатом
активность весьма низка, а на глицин, L-изомеры дикарбоновых аминокислот и  -гидрокси-а-аминокислот она вообще не действует. Едва ли этот фермент играет существенную роль в катаболизме аминокислот у млекопитающих.
-гидрокси-а-аминокислот она вообще не действует. Едва ли этот фермент играет существенную роль в катаболизме аминокислот у млекопитающих.
Оксидаза D-аминокислот у млекопитающих представляет собой  флавопротеин, обладающий широкой субстратной специфичностью, фермент обнаружен в печени и почках большинства млекопитающих. D-аспарагин и D-глутамин не окисляются этим ферментом, а глицин и D-изомеры кислых и основных аминокислот являются плохими субстратами. Физиологическое значение этого фермента у млекопитающих неизвестно.
флавопротеин, обладающий широкой субстратной специфичностью, фермент обнаружен в печени и почках большинства млекопитающих. D-аспарагин и D-глутамин не окисляются этим ферментом, а глицин и D-изомеры кислых и основных аминокислот являются плохими субстратами. Физиологическое значение этого фермента у млекопитающих неизвестно.
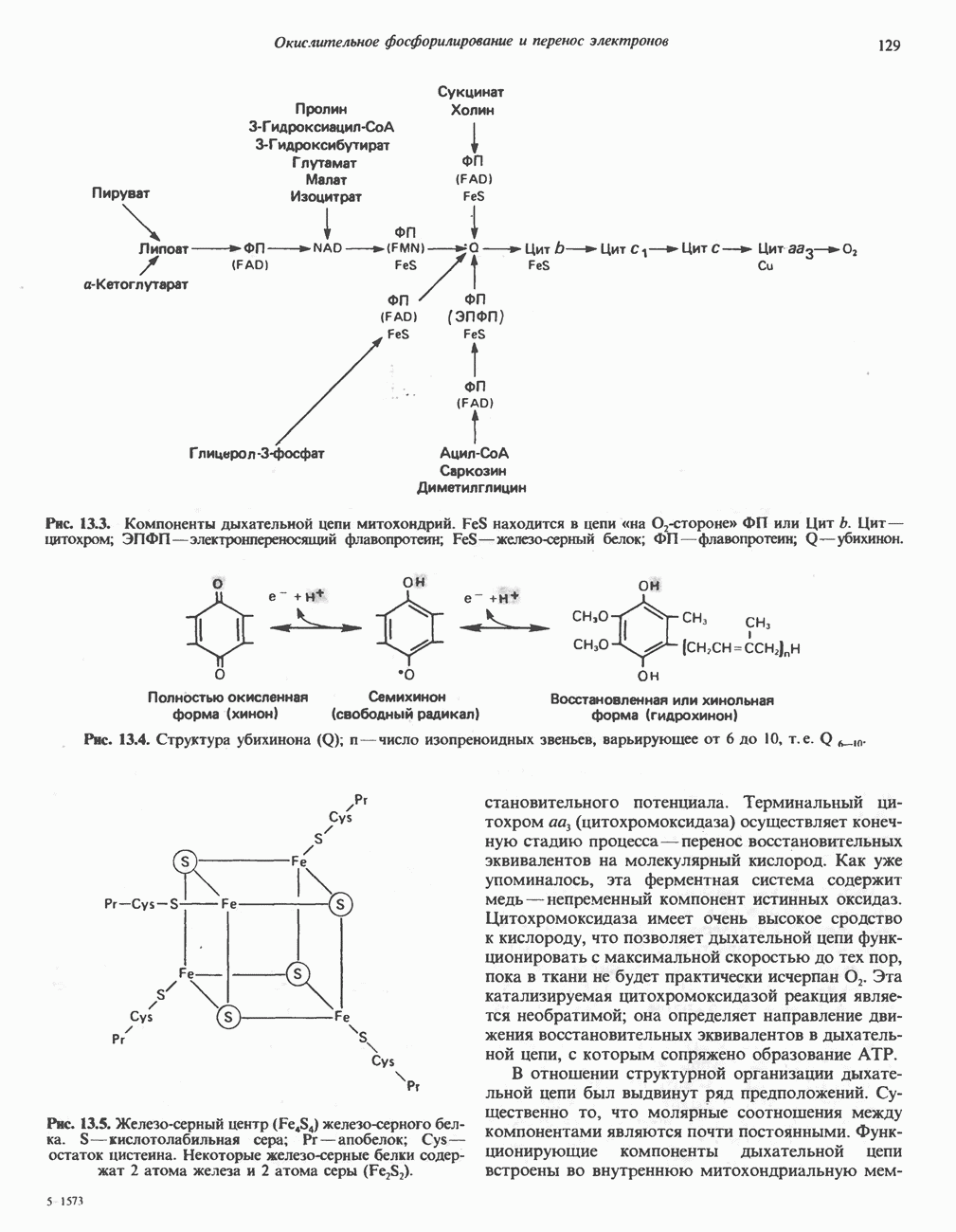
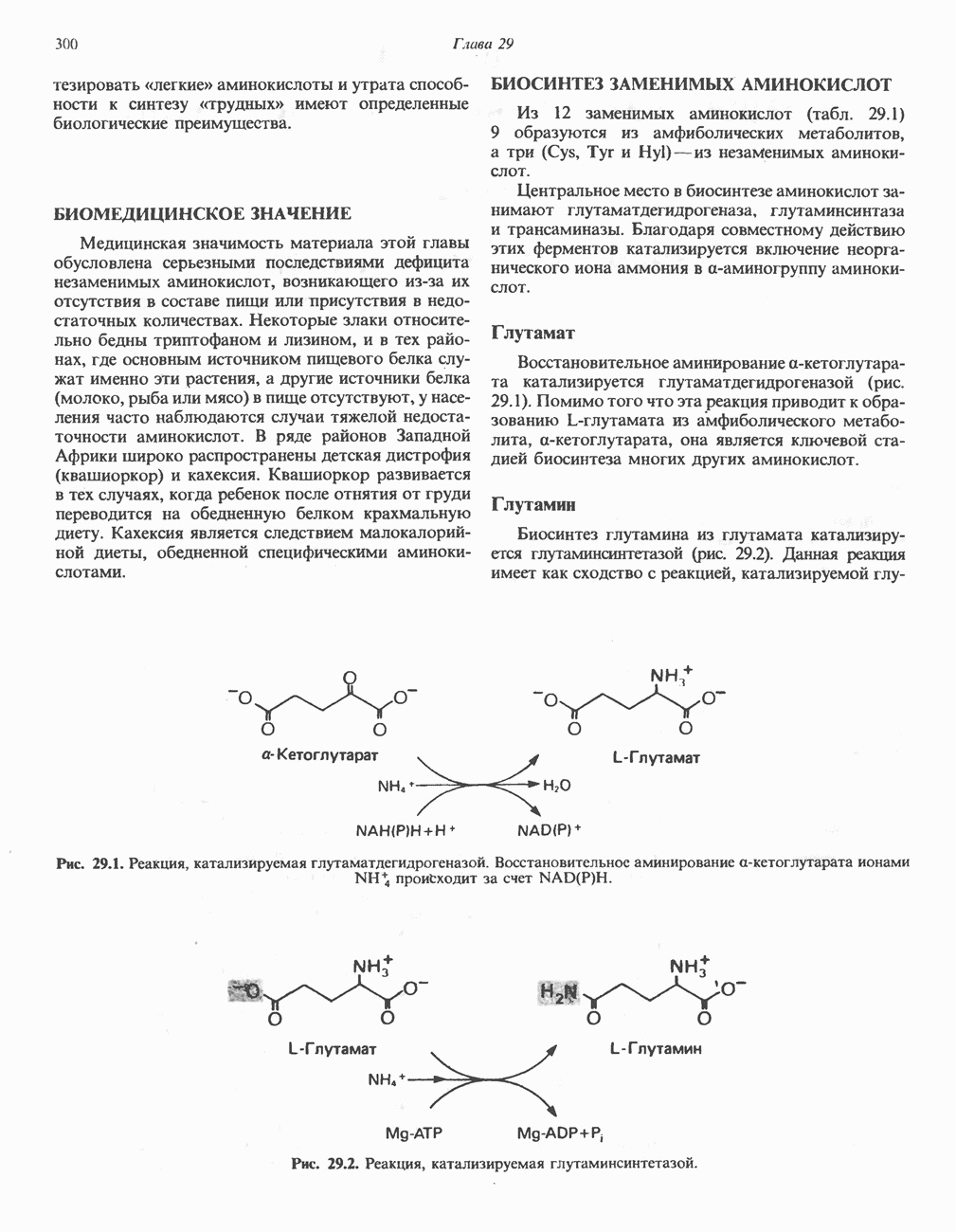
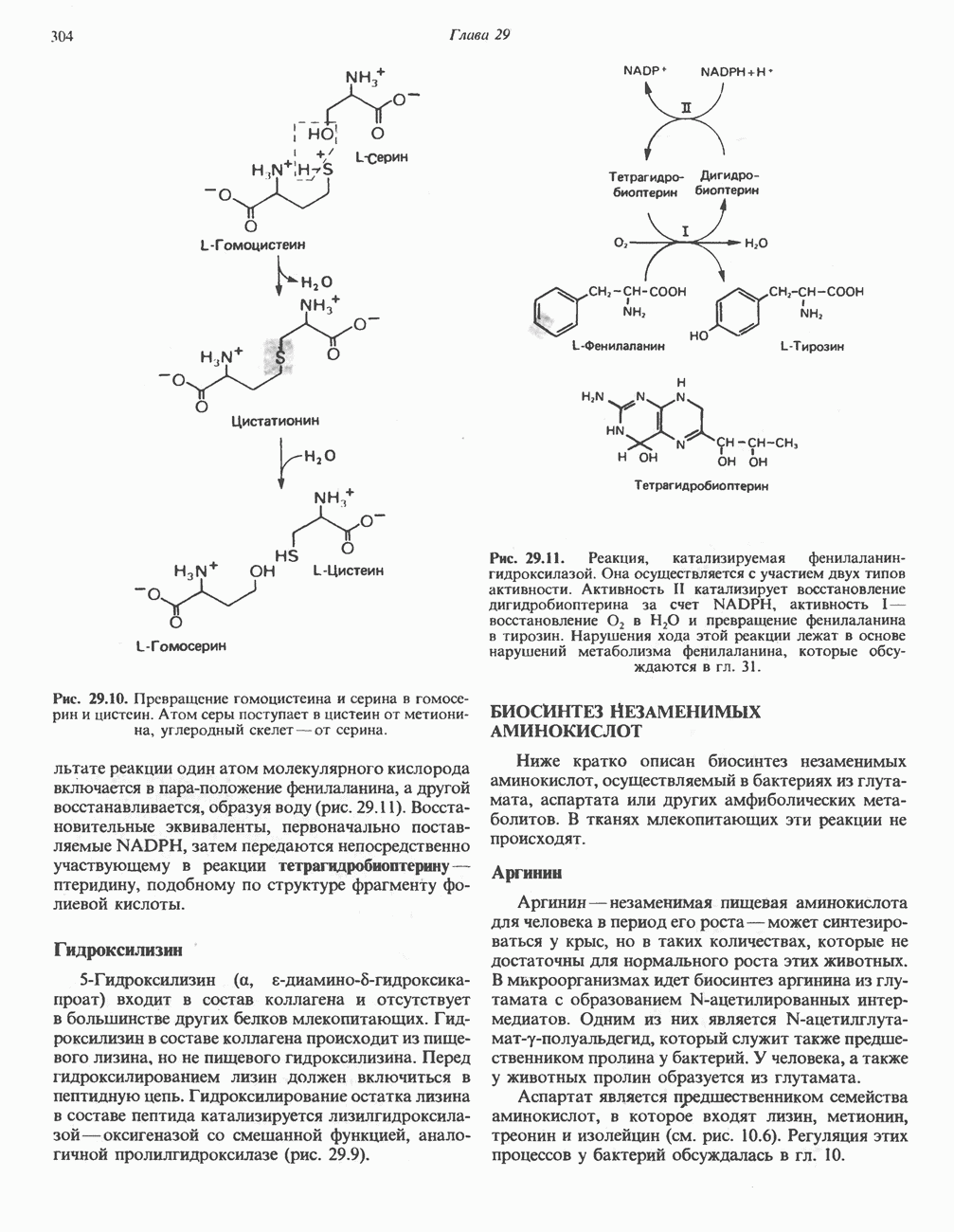
L-Глутаматдегидрогеназа
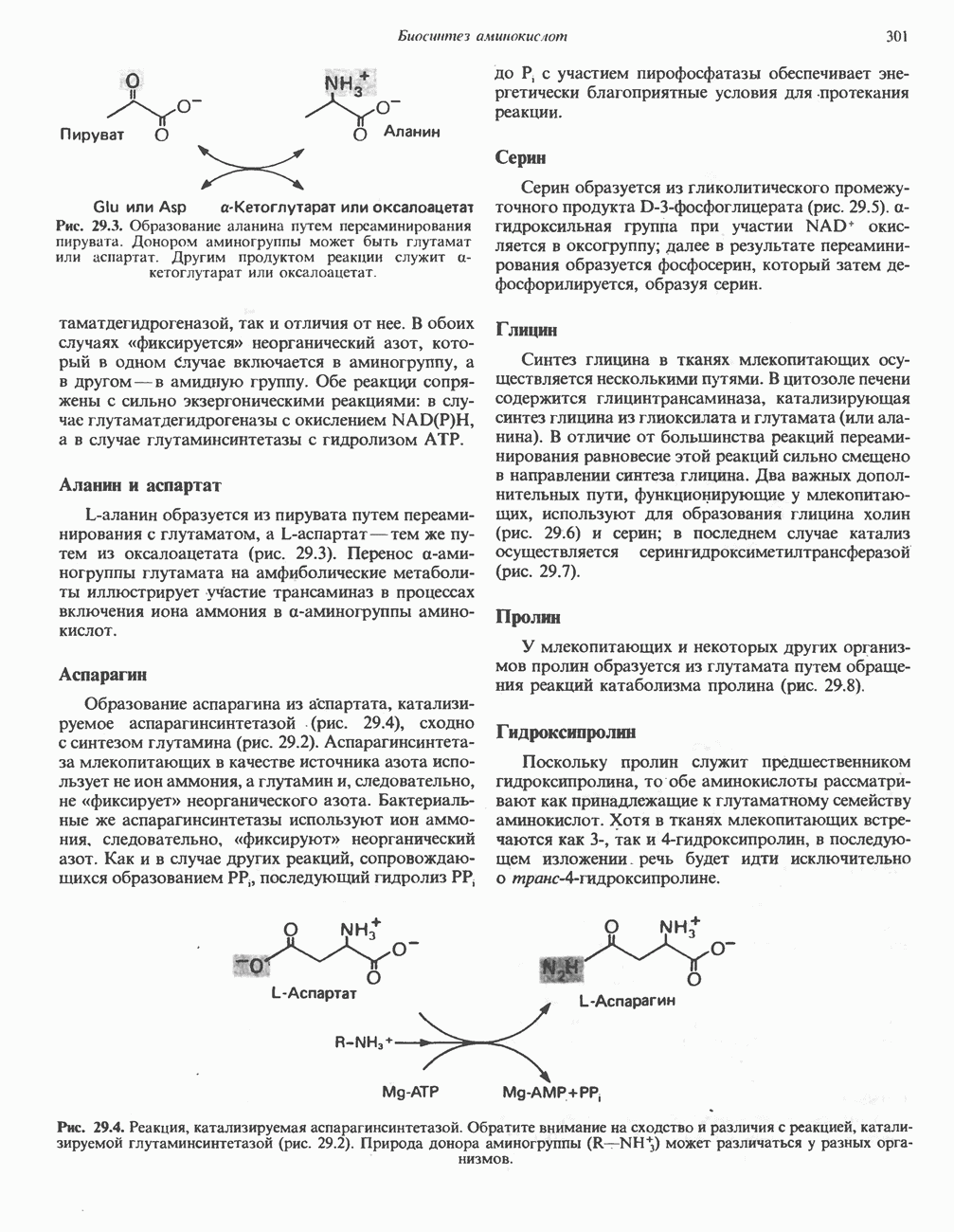
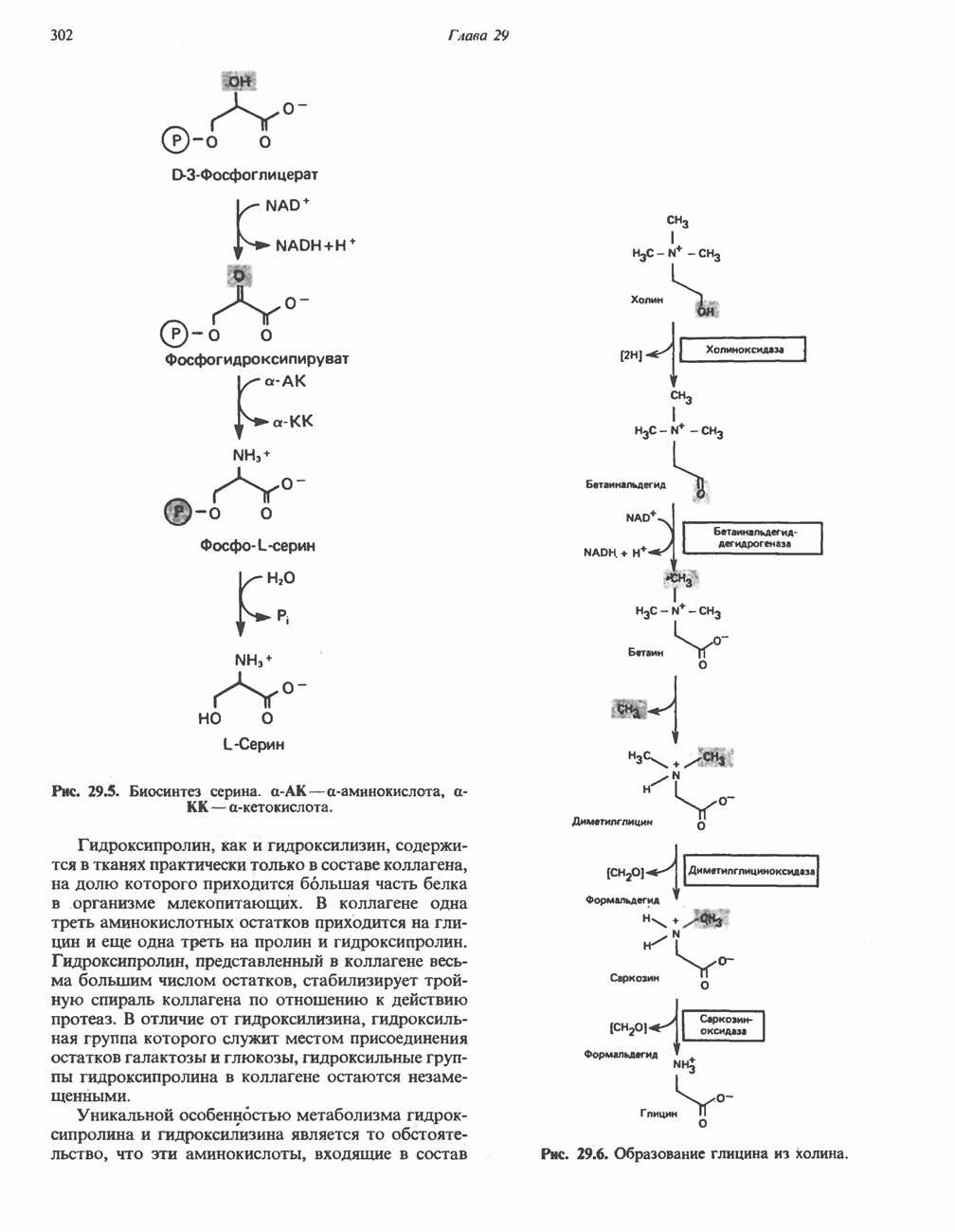
Аминогруппы большинства аминокислот в конечном итоге путем переаминировання переносятся на  -кетоглутарат с образованием глутамата (рис. 30.2). Освобождение азота аминогруппы глутамата в виде аммиака катализируется
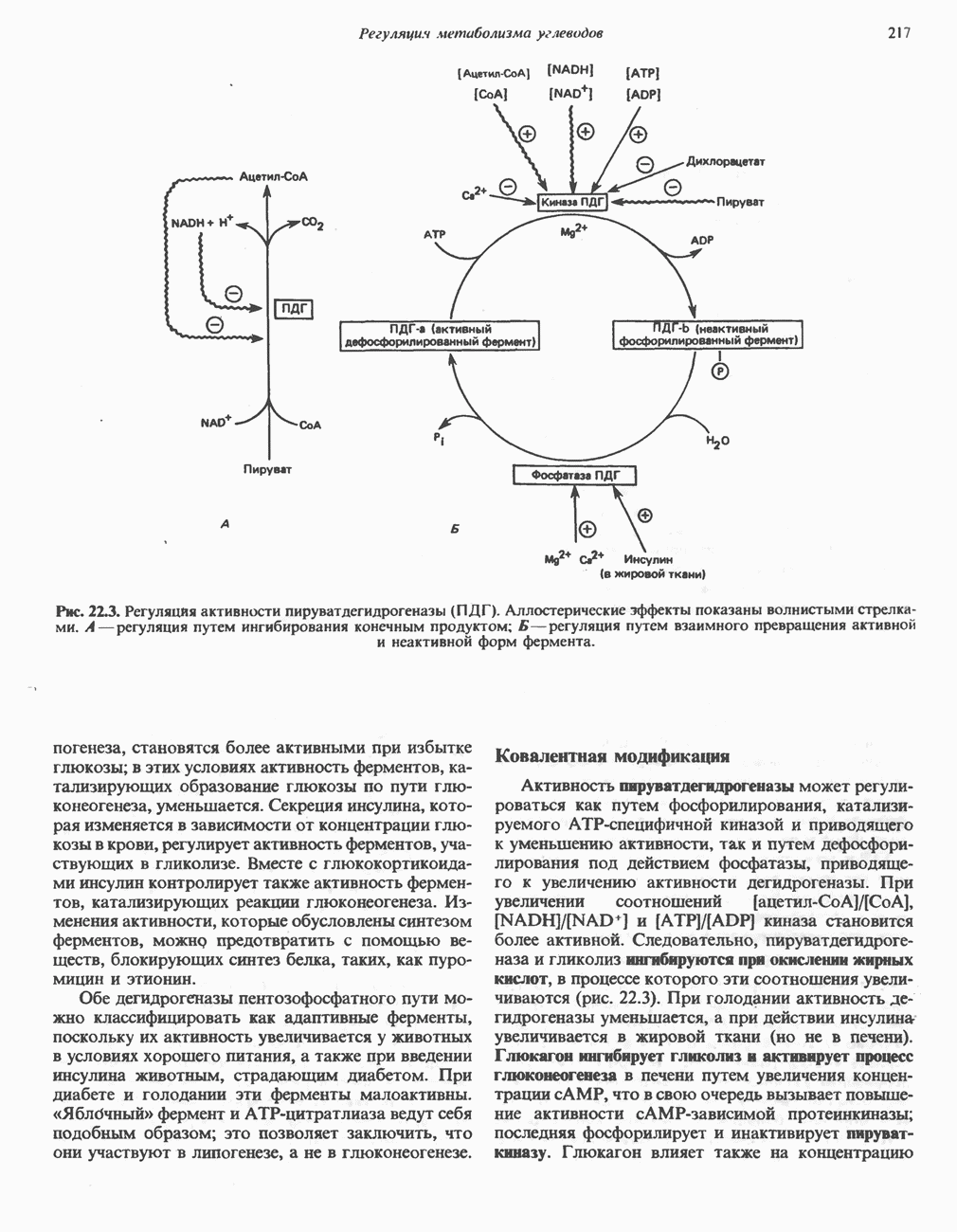
-кетоглутарат с образованием глутамата (рис. 30.2). Освобождение азота аминогруппы глутамата в виде аммиака катализируется  -глута-мат дегидрогеназой—ферментом с высокой активностью, широко распространенным в тканях млекопитающих (рис. 30.6). Глутаматдегидрогеназа печени является регуляторным ферментом; ее активность ингибируется аллостерическими эффектами, такими, как АТР, GTP и NADH, и стимулируется ADP. На активность глутаматдегидрогеназы влияют некоторые гормоны.
-глута-мат дегидрогеназой—ферментом с высокой активностью, широко распространенным в тканях млекопитающих (рис. 30.6). Глутаматдегидрогеназа печени является регуляторным ферментом; ее активность ингибируется аллостерическими эффектами, такими, как АТР, GTP и NADH, и стимулируется ADP. На активность глутаматдегидрогеназы влияют некоторые гормоны.
Глутаматдегидрогеназа может использовать в качестве косубстрата как  так и
так и  Реакция обратима и функционирует в процессах как катаболизма, так и биосинтеза аминокислот.
Реакция обратима и функционирует в процессах как катаболизма, так и биосинтеза аминокислот.

Рис. 30.6. Реакция, катализируемая  означает либо
означает либо  либо
либо  т. е. что оба кофермента могут быть использованы в качестве косубстратов. Реакция обратима, но константа равновесия ее благоприятна для образования глутамата.
т. е. что оба кофермента могут быть использованы в качестве косубстратов. Реакция обратима, но константа равновесия ее благоприятна для образования глутамата.
Поэтому ее функция заключается не только в том, чтобы направлять азот из глутамата для синтеза мочевины (катаболизм), но также и в том, чтобы катализировать аминирование  -кетоглутарата свободным аммиаком (см. гл. 29).
-кетоглутарата свободным аммиаком (см. гл. 29).
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- Предисловие к русскому изданию
- Предисловие
- Глава 1. Биохимия и медицина
- Глава 2. Биомолекулы и биохимические методы
- КЛЕТКА
- ОБЩИЙ ЭКСПЕРИМЕНТАЛЬНЫЙ ПОДХОД, ИСПОЛЬЗУЕМЫЙ В БИОХИМИИ
- ОСНОВНЫЕ ДОСТИЖЕНИЯ БИОХИМИИ
- Раздел I. Структура и функции белков и ферментов
- Глава 3. Аминокислоты
- АМИНОКИСЛОТЫ
- ИОННЫЕ ФОРМЫ АМИНОКИСЛОТ
- СТРУКТУРА АМИНОКИСЛОТ
- РАСТВОРИМОСТЬ АМИНОКИСЛОТ
- ОБЩИЕ ХИМИЧЕСКИЕ РЕАКЦИИ
- СВОЙСТВА ИНДИВИДУАЛЬНЫХ АМИНОКИСЛОТ
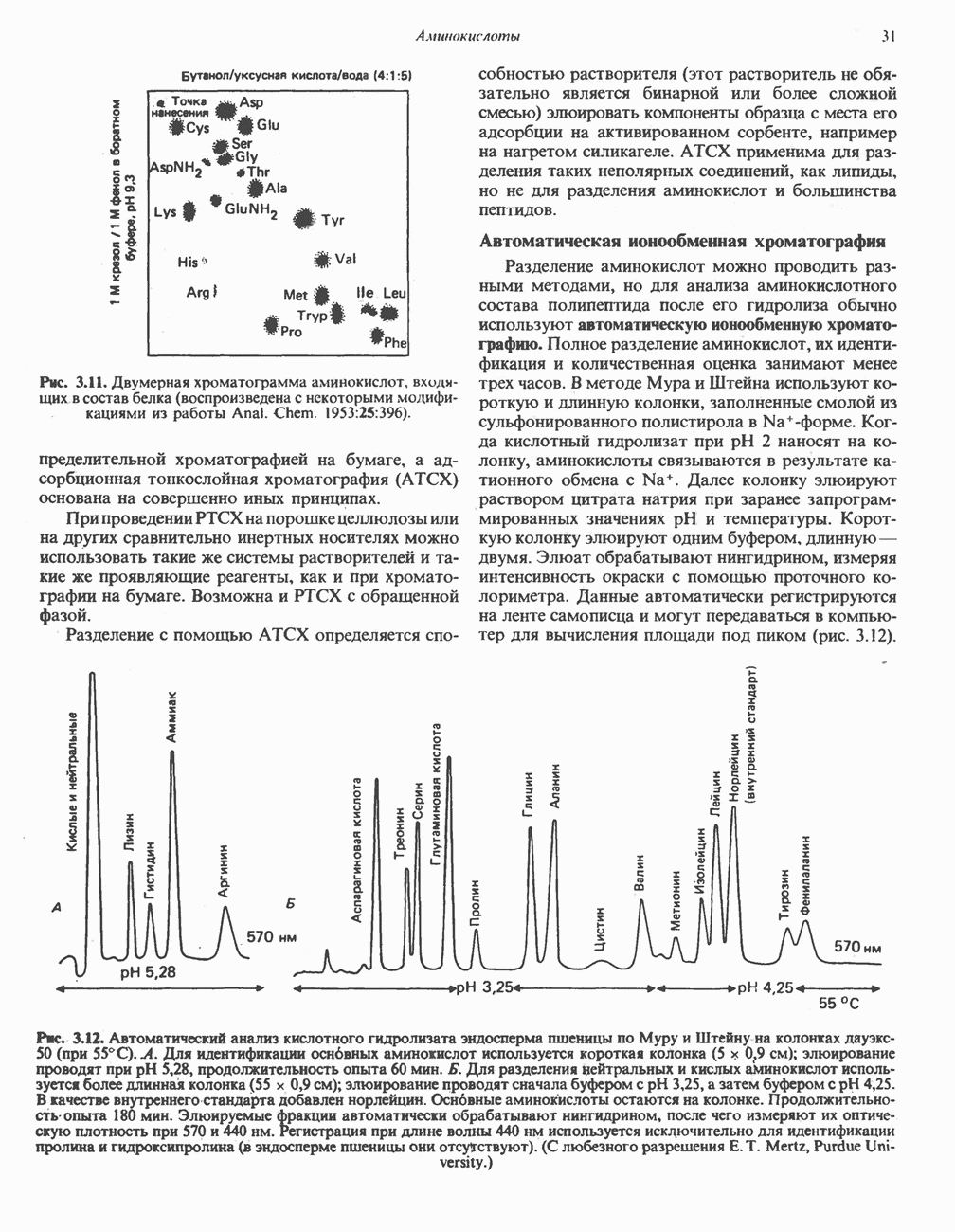
- МЕТОДЫ РАЗДЕЛЕНИЯ АМИНОКИСЛОТ
- Глава 4. Пептиды
- СТРУКТУРА ПЕПТИДОВ
- ИОННЫЕ ФОРМЫ ПЕПТИДОВ
- КОНФОРМАЦИЯ ПЕПТИДОВ В РАСТВОРЕ
- МЕТОДЫ РАЗДЕЛЕНИЯ ПЕПТИДОВ
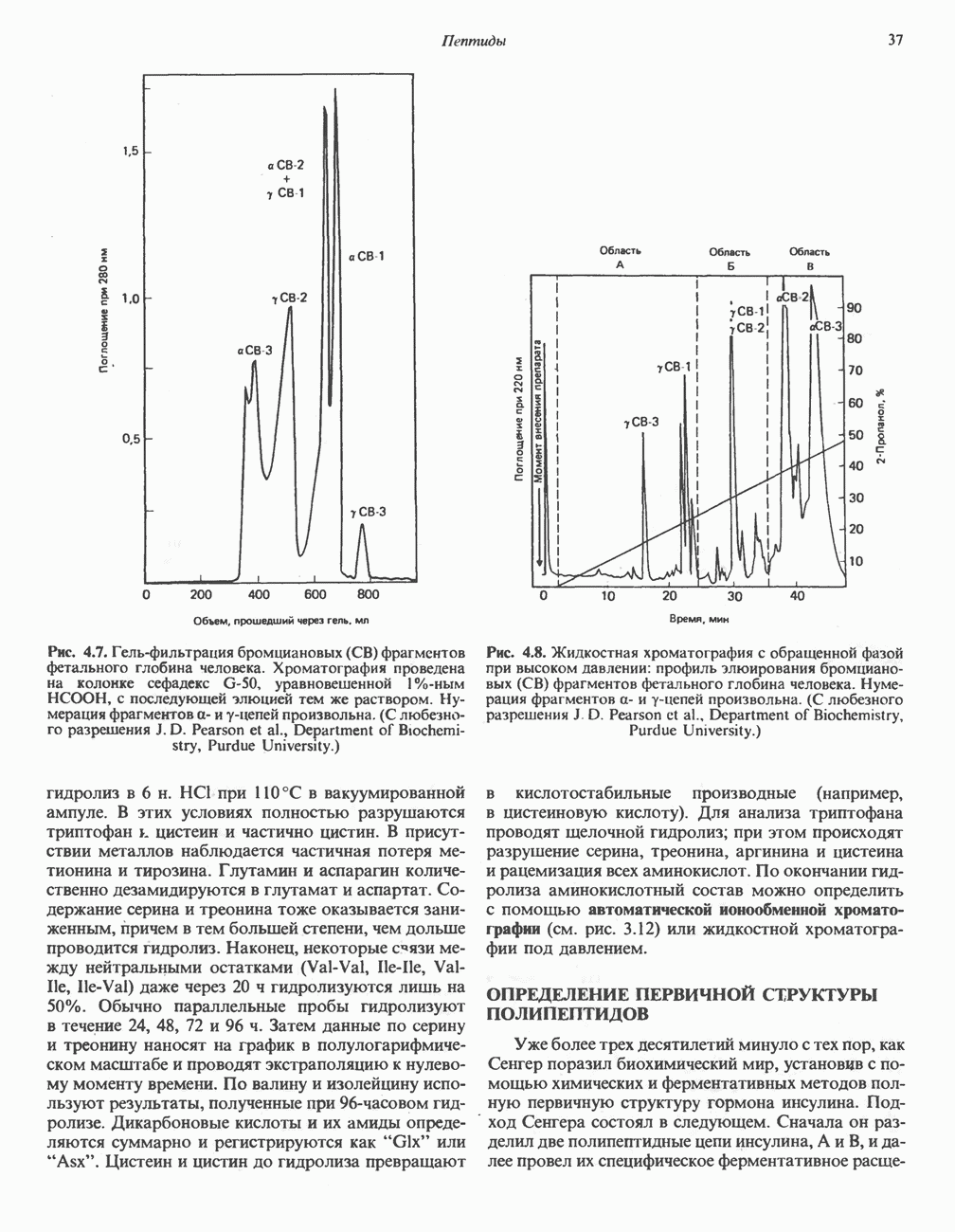
- ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОГО СОСТАВА ПЕПТИДОВ
- ОПРЕДЕЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ ПОЛИПЕПТИДОВ
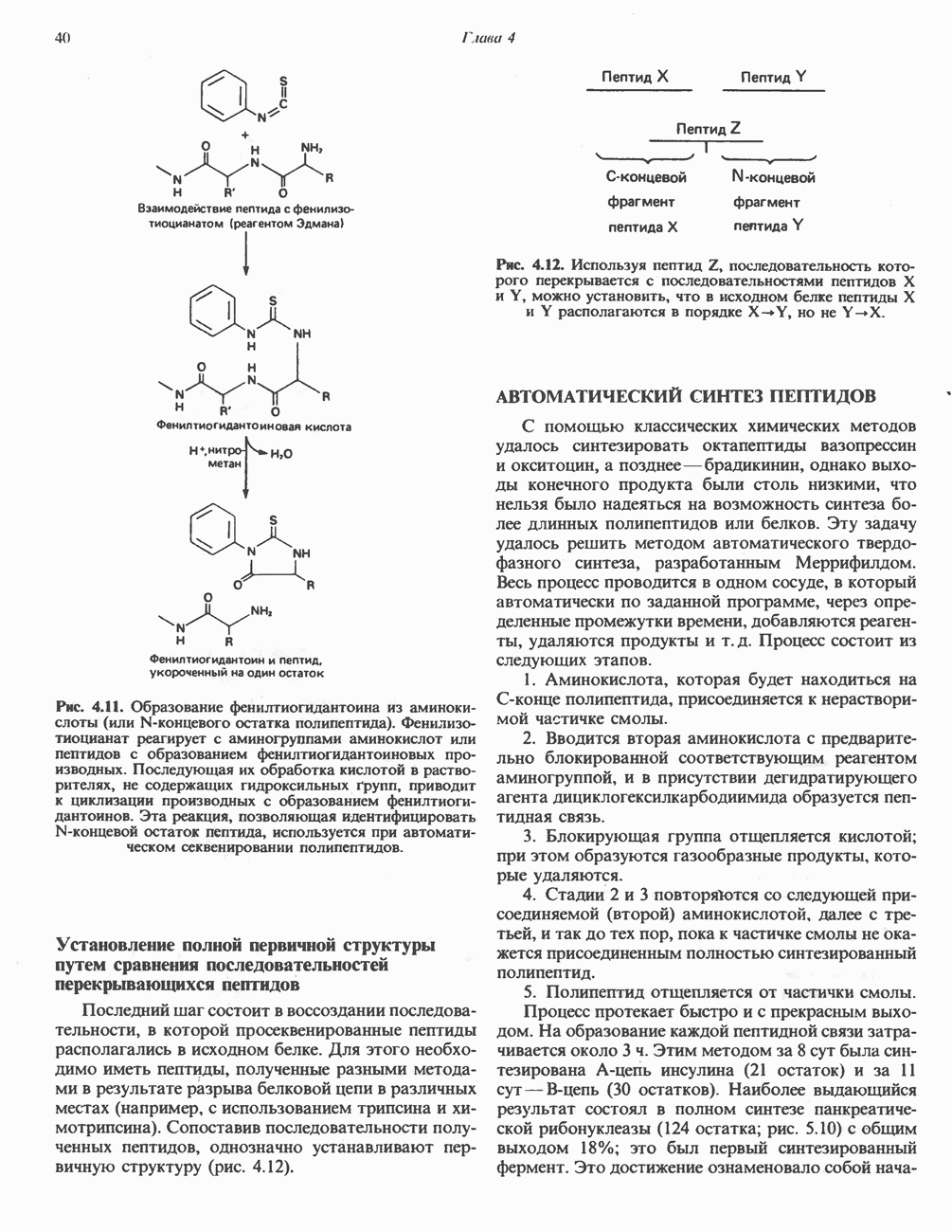
- АВТОМАТИЧЕСКОЕ ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ПОЛИПЕПТИДОВ МЕТОДОМ ЭДМАНА
- АВТОМАТИЧЕСКИЙ СИНТЕЗ ПЕПТИДОВ
- ЛИТЕРАТУРА
- Глава 5. Белки: структура и свойства
- КЛАССИФИКАЦИЯ БЕЛКОВ
- СВЯЗИ, ОТВЕТСТВЕННЫЕ ЗА ФОРМИРОВАНИЕ СТРУКТУРЫ БЕЛКА
- УПОРЯДОЧЕННЫЕ КОНФОРМАЦИИ ПОЛИПЕПТИДОВ
- УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКА
- ДЕНАТУРАЦИЯ
- МЕТОДЫ ОПРЕДЕЛЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ
- ОПРЕДЕЛЕНИЕ ВТОРИЧНОЙ И ТРЕТИЧНОЙ СТРУКТУРЫ МЕТОДОМ РЕНТГЕНОВСКОЙ КРИСТАЛЛОГРАФИИ
- ОПРЕДЕЛЕНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ
- ГЛАВА 6. Белки: миоглобин и гемоглобин
- ГЕМОПРОТЕИНЫ — МИОГЛОБИН И ГЕМОГЛОБИН
- МИОГЛОБИН
- ГЕМОГЛОБИНЫ
- Глава 7. Ферменты: общие свойства
- КОФЕРМЕНТЫ
- «ТРЕХТОЧЕЧНАЯ ФИКСАЦИЯ» СУБСТРАТОВ НА ФЕРМЕНТАХ
- СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
- ВЫДЕЛЕНИЕ ФЕРМЕНТОВ
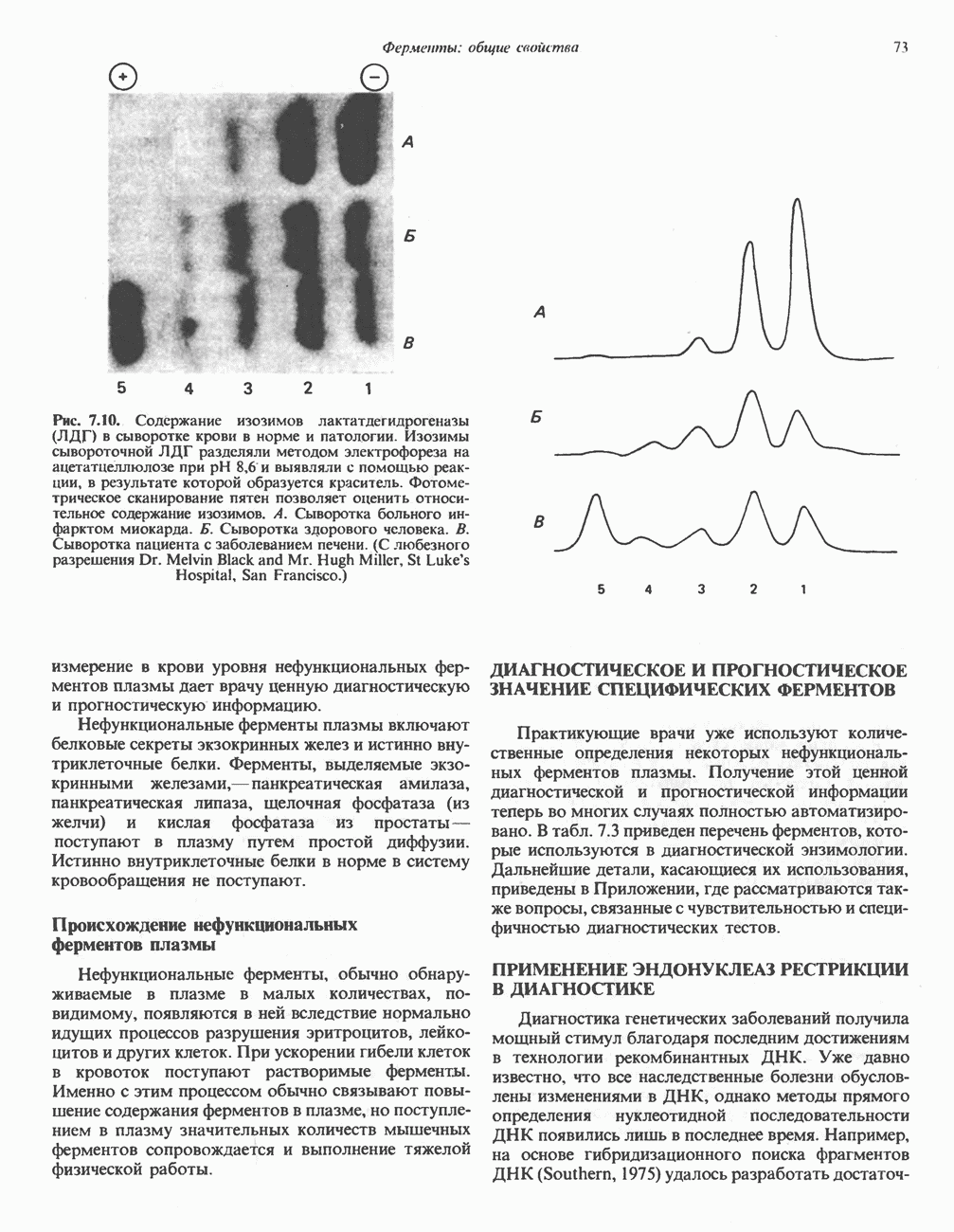
- ИЗОФЕРМЕНТЫ (ИЗОЗИМЫ)
- ФЕРМЕНТЫ В КЛИНИЧЕСКОЙ ДИАГНОСТИКЕ
- ДИАГНОСТИЧЕСКОЕ И ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ СПЕЦИФИЧЕСКИХ ФЕРМЕНТОВ
- ПРИМЕНЕНИЕ ЭНДОНУКЛЕАЗ РЕСТРИКЦИИ В ДИАГНОСТИКЕ
- ЛИТЕРАТУРА
- Глава 8. ФЕРМЕНТЫ: КИНЕТИКА
- ОБРАЗОВАНИЕ И РАСПАД ПЕРЕХОДНЫХ СОСТОЯНИЙ
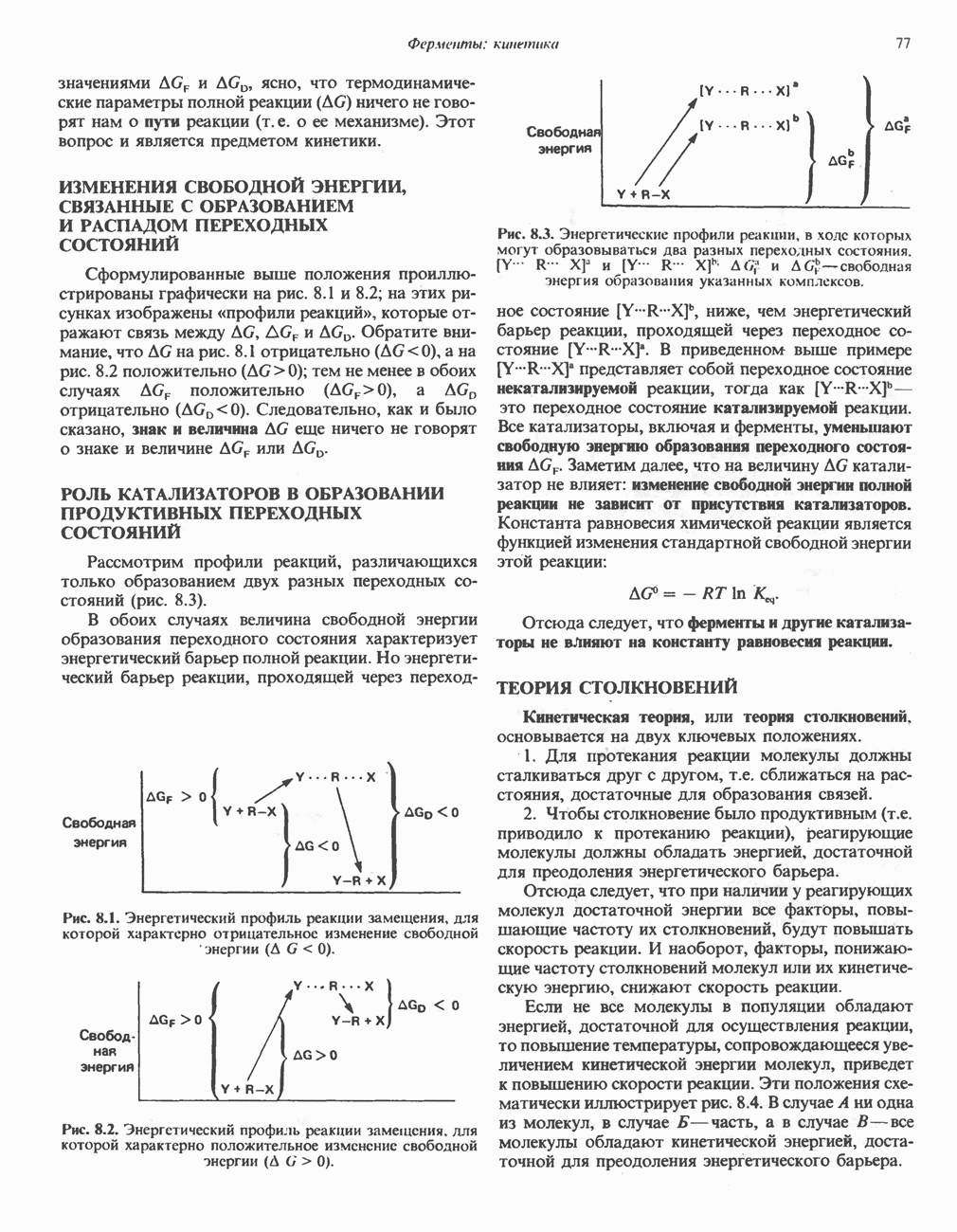
- ИЗМЕНЕНИЯ СВОБОДНОЙ ЭНЕРГИИ, СВЯЗАННЫЕ С ОБРАЗОВАНИЕМ И РАСПАДОМ ПЕРЕХОДНЫХ СОСТОЯНИЙ
- РОЛЬ КАТАЛИЗАТОРОВ В ОБРАЗОВАНИИ ПРОДУКТИВНЫХ ПЕРЕХОДНЫХ СОСТОЯНИЙ
- ТЕОРИЯ СТОЛКНОВЕНИЙ
- РОЛЬ ФЕРМЕНТОВ В РАЗРЫВЕ И ОБРАЗОВАНИИ КОВАЛЕНТНЫХ СВЯЗЕЙ
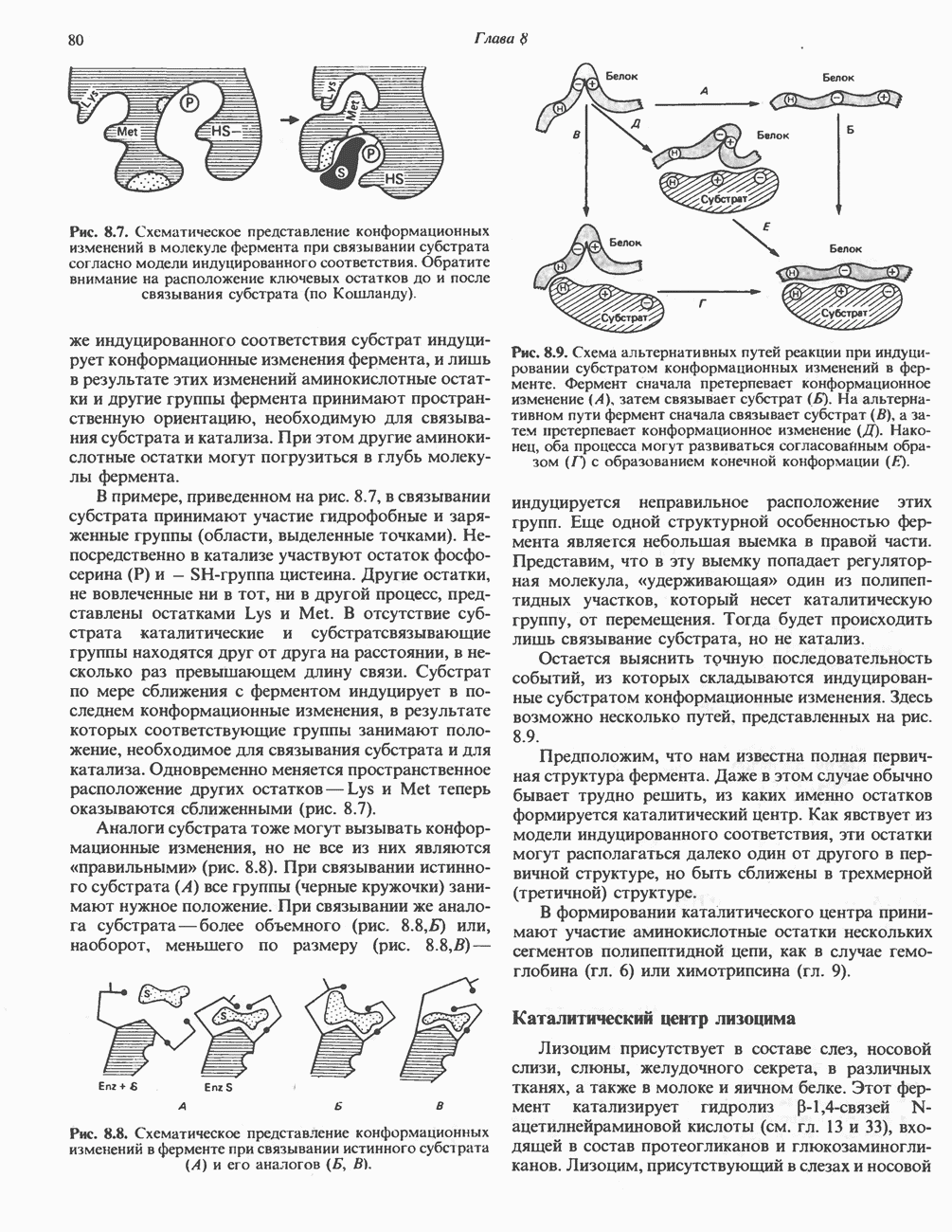
- КАТАЛИТИЧЕСКИЙ ЦЕНТР
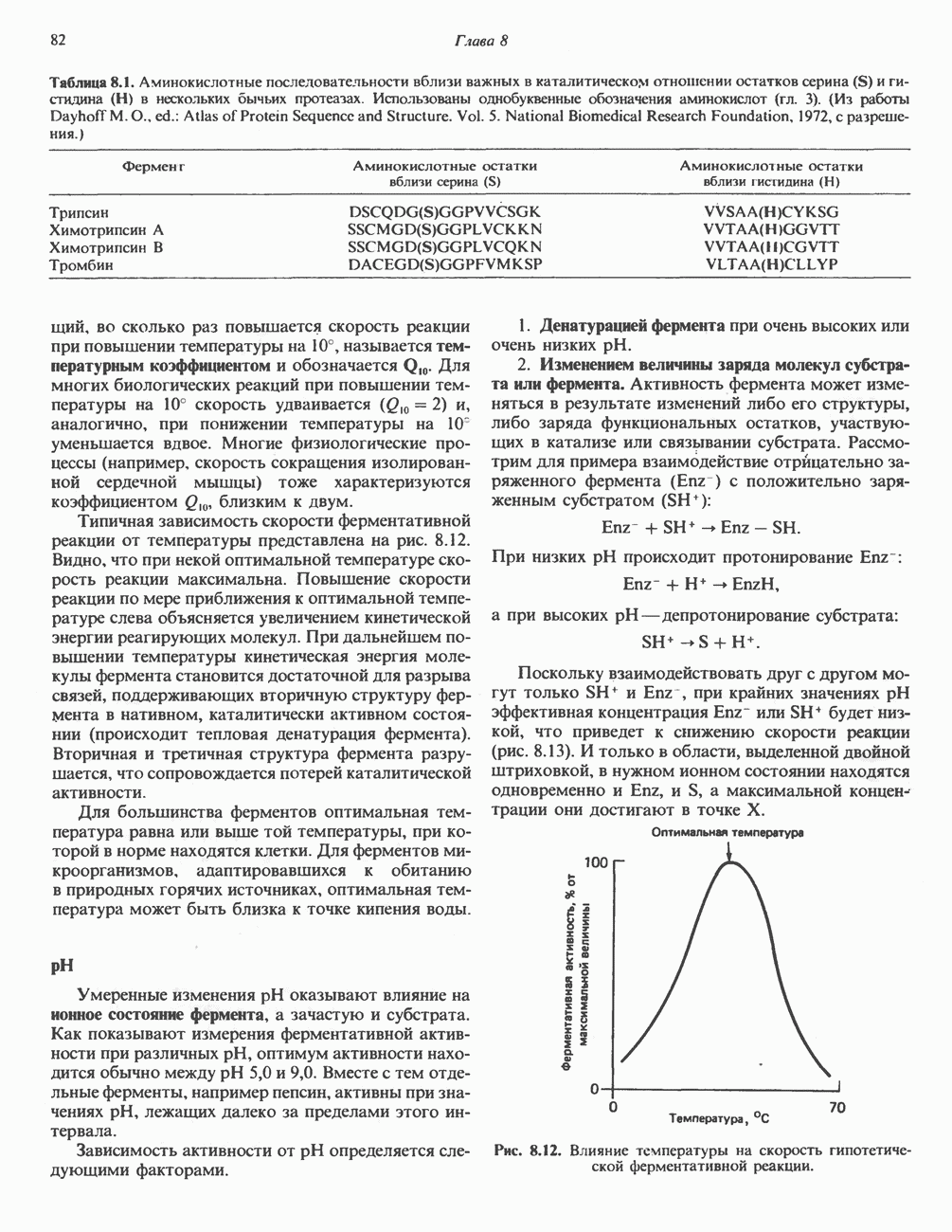
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА АКТИВНОСТЬ ФЕРМЕНТОВ
- КОНСТАНТА РАВНОВЕСИЯ
- КОНЦЕНТРАЦИЯ ФЕРМЕНТА
- КОНЦЕНТРАЦИЯ СУБСТРАТА
- УРАВНЕНИЕ МИХАЭЛИСА—МЕНТЕН
- ОГРАНИЧЕНИЯ, ПРИСУЩИЕ УРАВНЕНИЮ МИХАЭЛИСА — МЕНТЕН
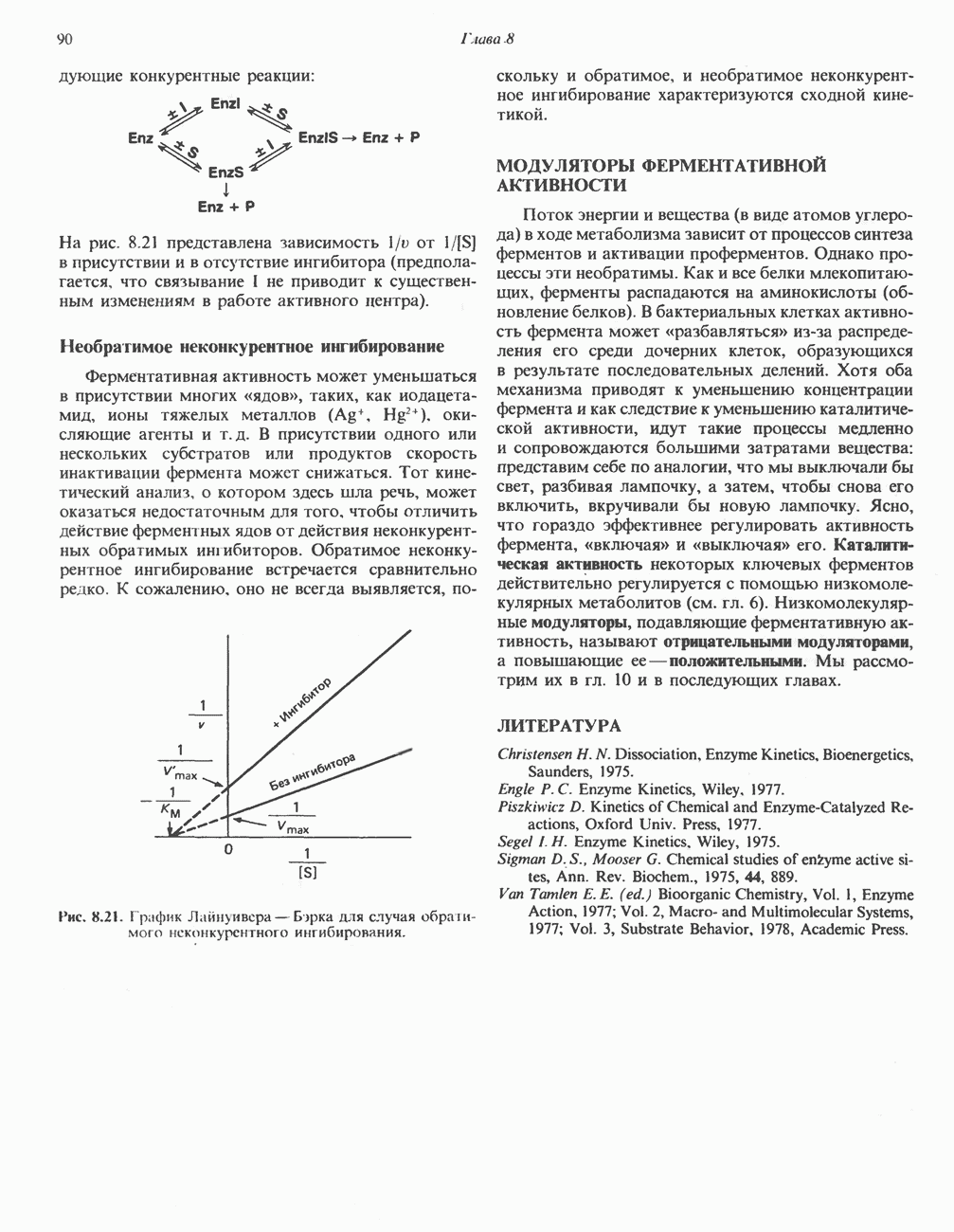
- ИНГИБИРОВАНИЕ АКТИВНОСТИ ФЕРМЕНТОВ
- МОДУЛЯТОРЫ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
- Глава 9. Ферменты: механизм действия
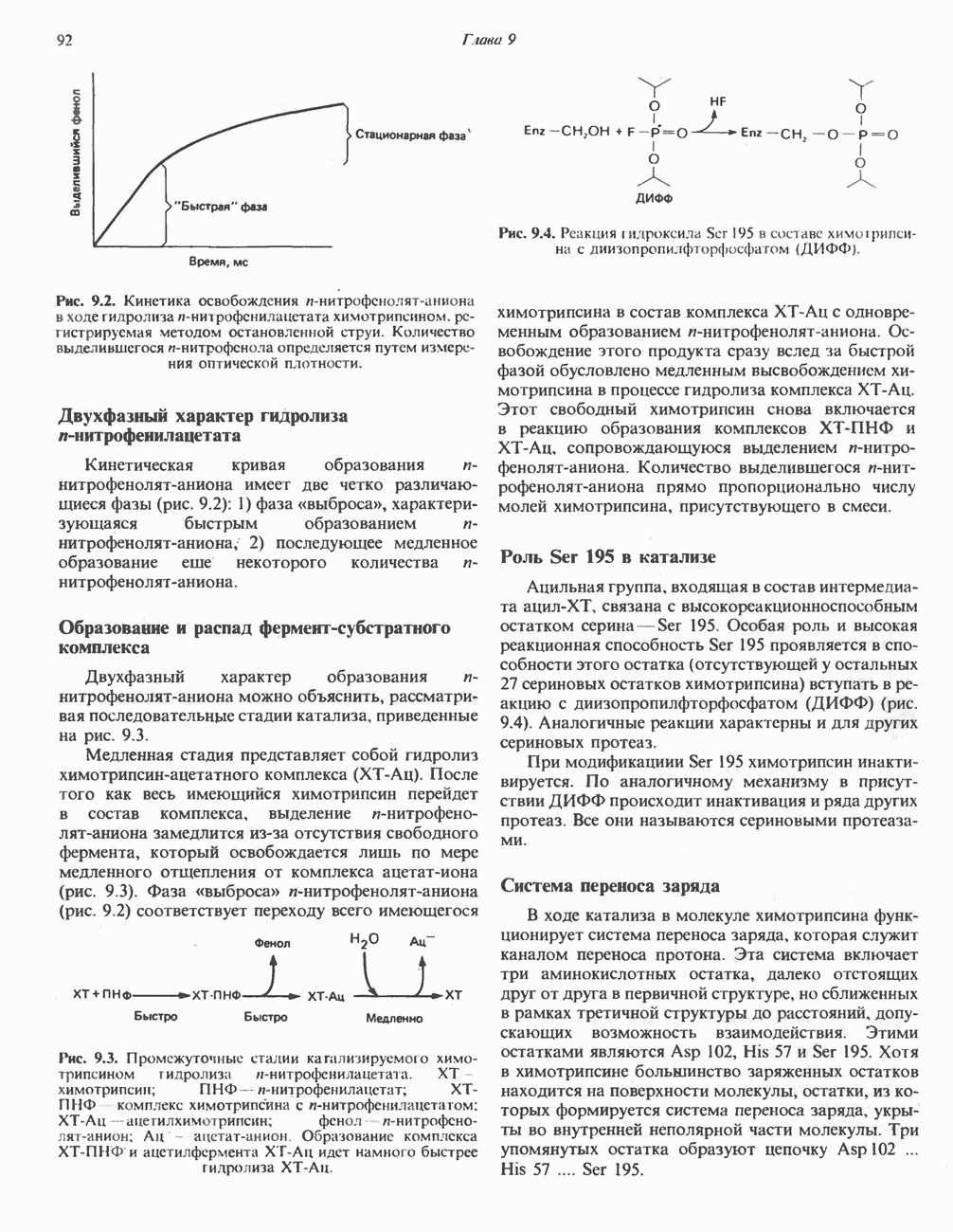
- МЕХАНИЗМ КАТАЛИТИЧЕСКОГО ДЕЙСТВИЯ ХИМОТРИПСИНА
- РОЛЬ ИЗБИРАТЕЛЬНОГО ПРОТЕОЛИЗА В ФОРМИРОВАНИИ АКТИВНЫХ ЦЕНТРОВ ФЕРМЕНТОВ
- УПОРЯДОЧЕННОЕ И НЕУПОРЯДОЧЕННОЕ СВЯЗЫВАНИЕ СУБСТРАТОВ
- ФЕРМЕНТЫ КАК КАТАЛИЗАТОРЫ ОБЩЕГО КИСЛОТНОГО И ОБЩЕГО ОСНОВНОГО ТИПА
- ИОНЫ МЕТАЛЛОВ
- Глава 10. Ферменты: регуляция активности
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА
- РЕГУЛЯЦИЯ КОЛИЧЕСТВА ФЕРМЕНТА ПУТЕМ РЕГУЛЯЦИИ СКОРОСТИ ЕГО СИНТЕЗА И РАСПАДА
- РЕГУЛЯЦИЯ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ФЕРМЕНТОВ
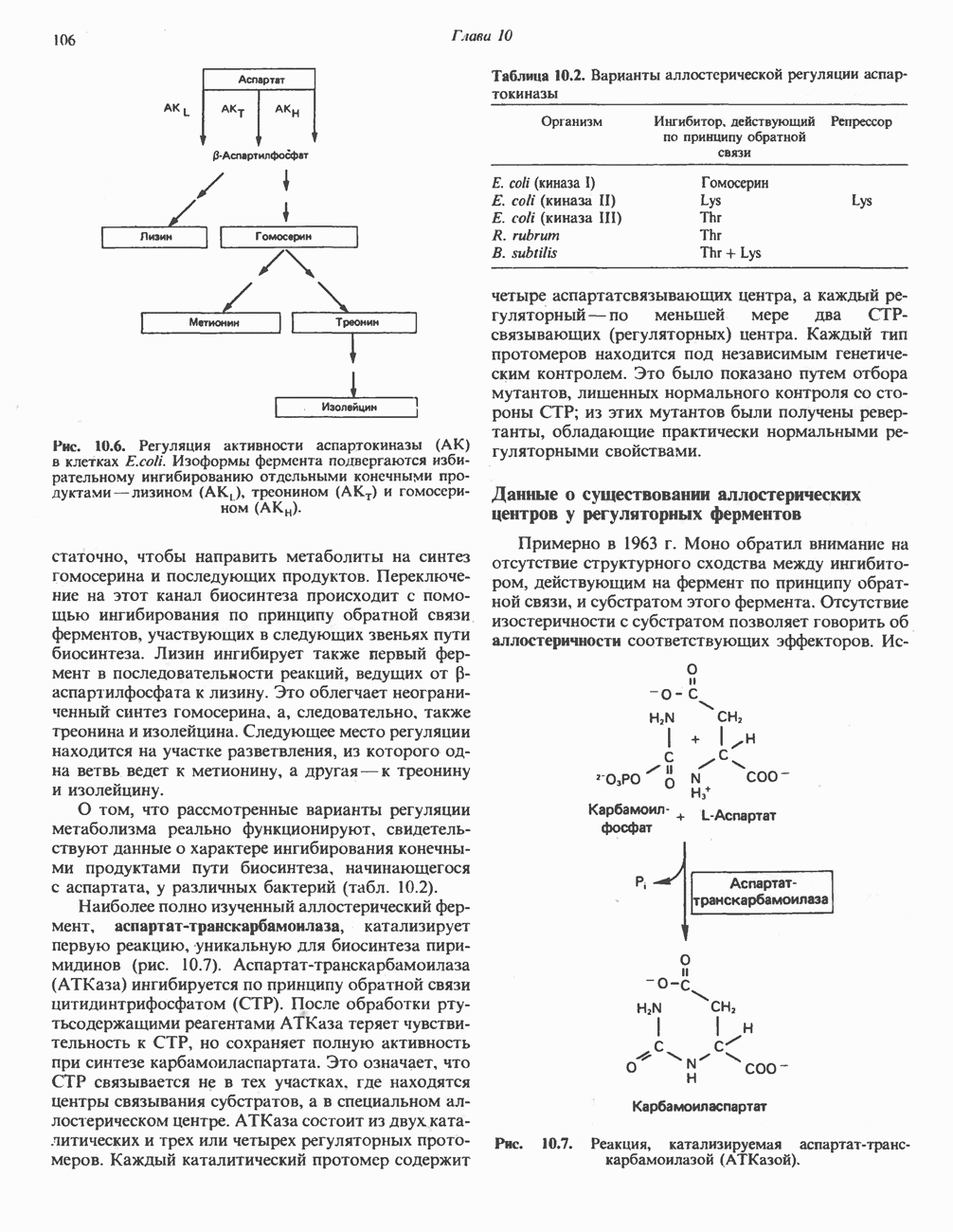
- АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ
- КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ФЕРМЕНТОВ
- Раздел II. Биоэнергетика и метаболизм углеводов и липидов
- Глава 11. Биоэнергетика
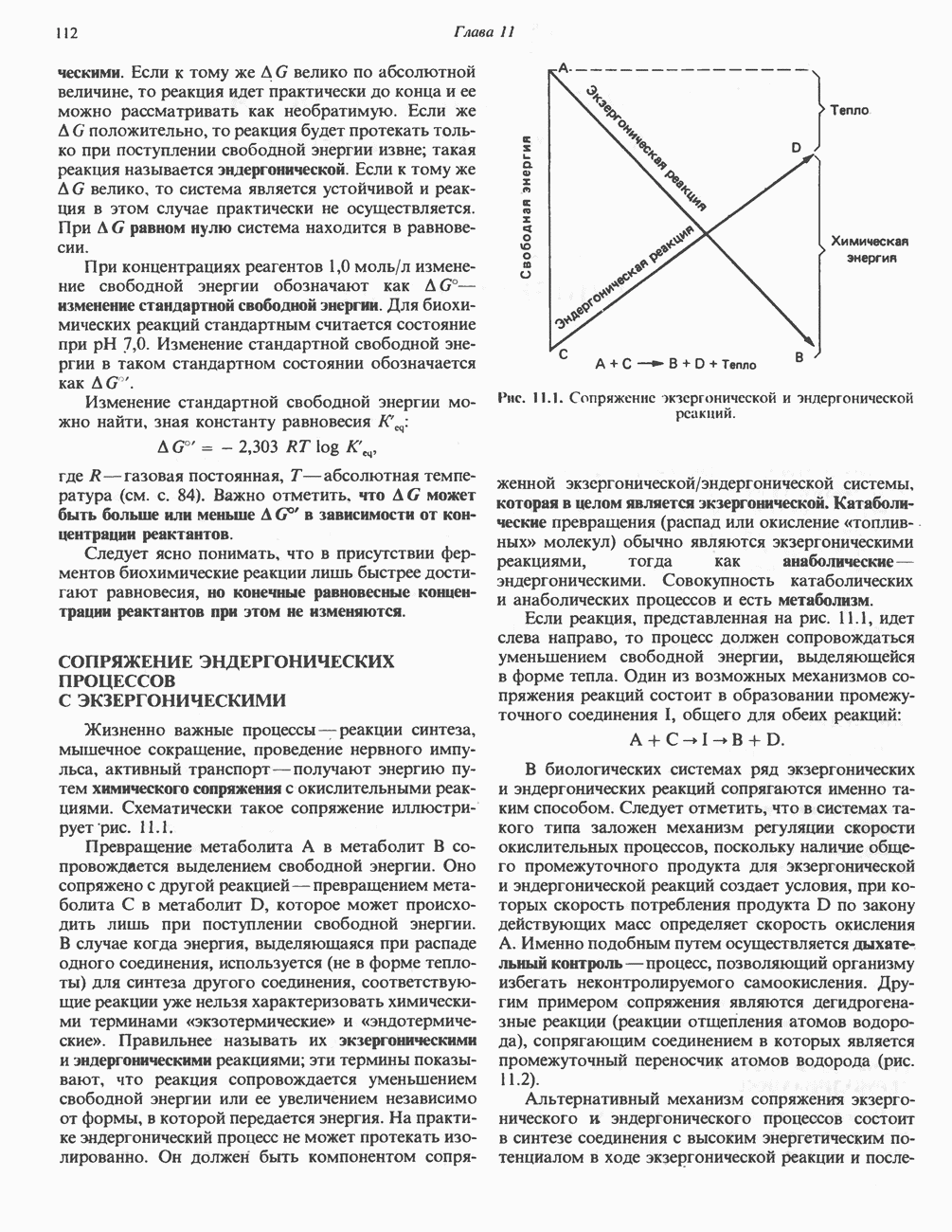
- СВОБОДНАЯ ЭНЕРГИЯ И ЗАКОНЫ ТЕРМОДИНАМИКИ
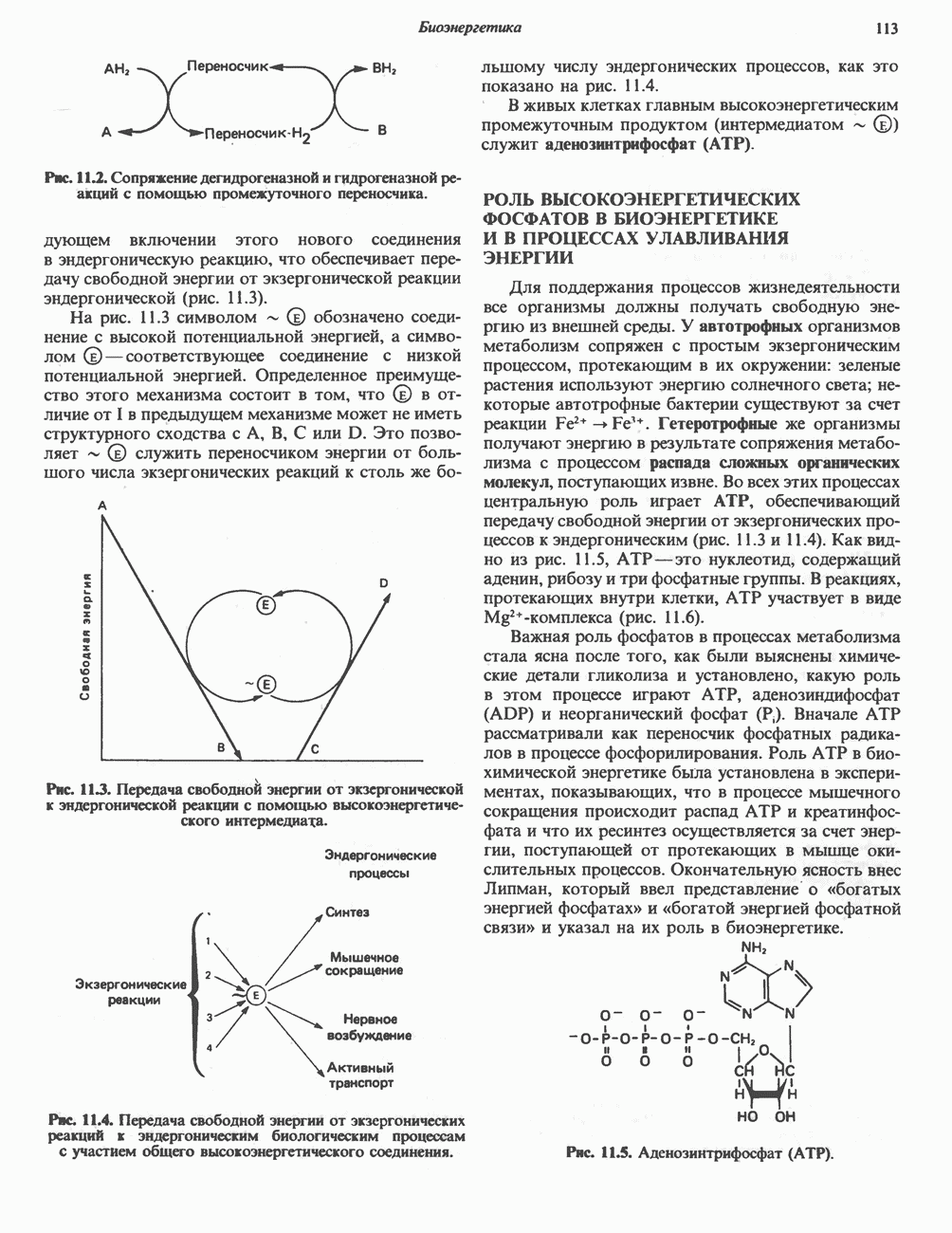
- СОПРЯЖЕНИЕ ЭНДЕРГОНИЧЕСКИХ ПРОЦЕССОВ С ЭКЗЕРГОНИЧЕСКИМИ
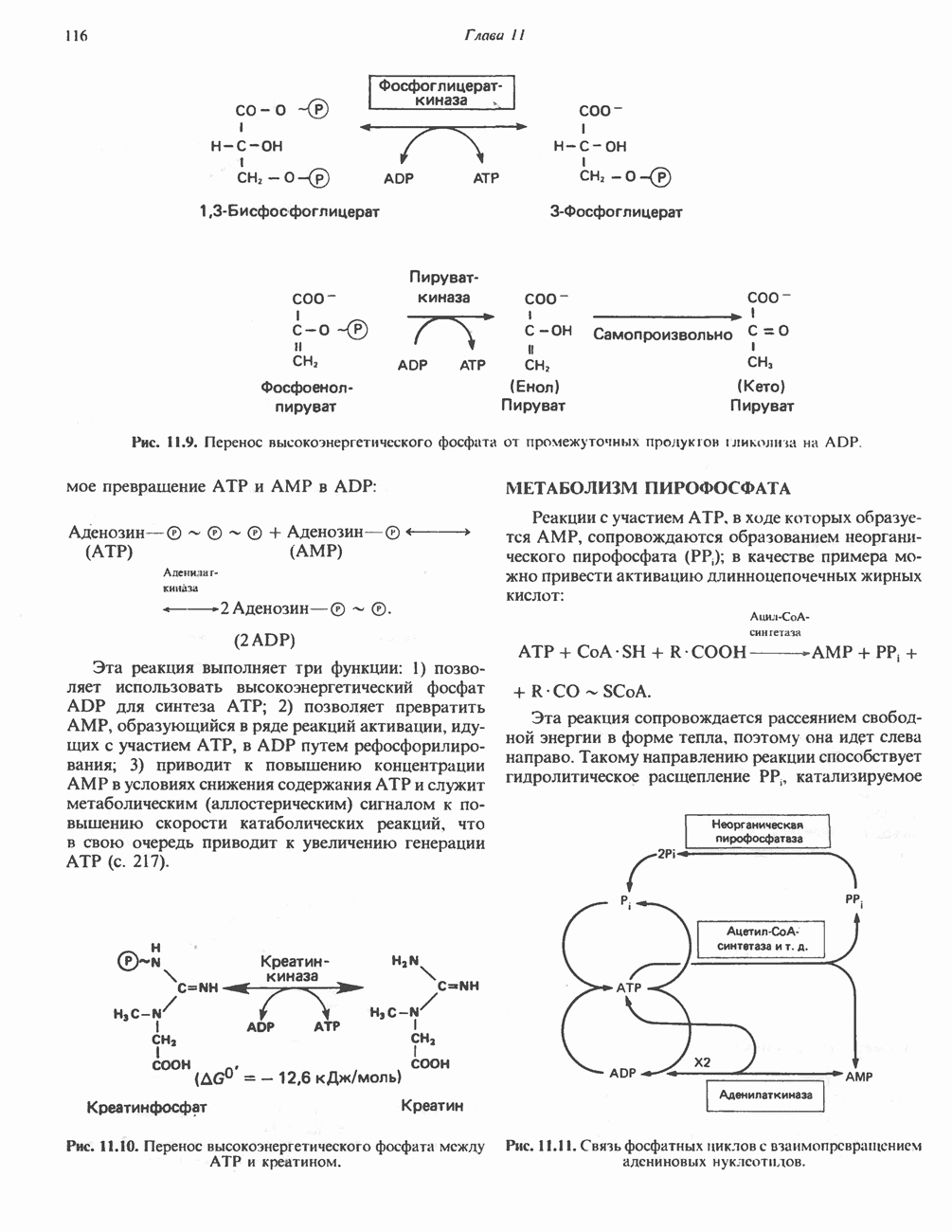
- РОЛЬ ВЫСОКОЭНЕРГЕТИЧЕСКИХ ФОСФАТОВ В БИОЭНЕРГЕТИКЕ И В ПРОЦЕССАХ УЛАВЛИВАНИЯ ЭНЕРГИИ
- МЕТАБОЛИЗМ ПИРОФОСФАТА
- Глава 12. Биологическое окисление
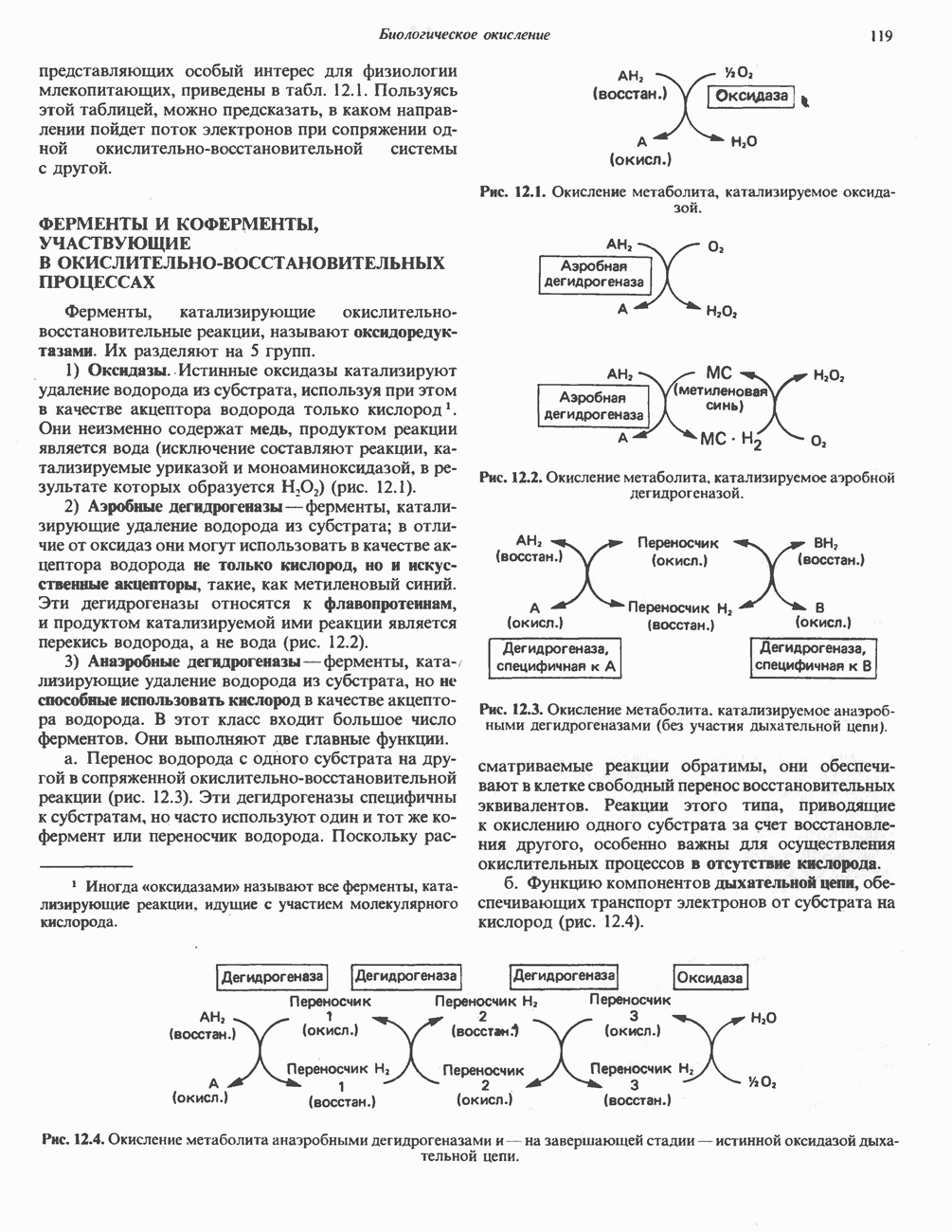
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ РАВНОВЕСИЕ, ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ
- ФЕРМЕНТЫ И КОФЕРМЕНТЫ, УЧАСТВУЮЩИЕ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССАХ
- Глава 13. Окислительное фосфорилирование и транспортные системы митохондрий
- ДЫХАТЕЛЬНАЯ ЦЕПЬ
- ОРГАНИЗАЦИЯ ДЫХАТЕЛЬНОЙ ЦЕПИ В МИТОХОНДРИЯХ
- РОЛЬ ДЫХАТЕЛЬНОЙ ЦЕПИ В УЛАВЛИВАНИИ ЭНЕРГИИ
- ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
- ИНГИБИТОРЫ ДЫХАТЕЛЬНОЙ ЦЕПИ И ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
- МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
- МИТОХОНДРИАЛЬНЫЕ ТРАНСПОРТНЫЕ СИСТЕМЫ
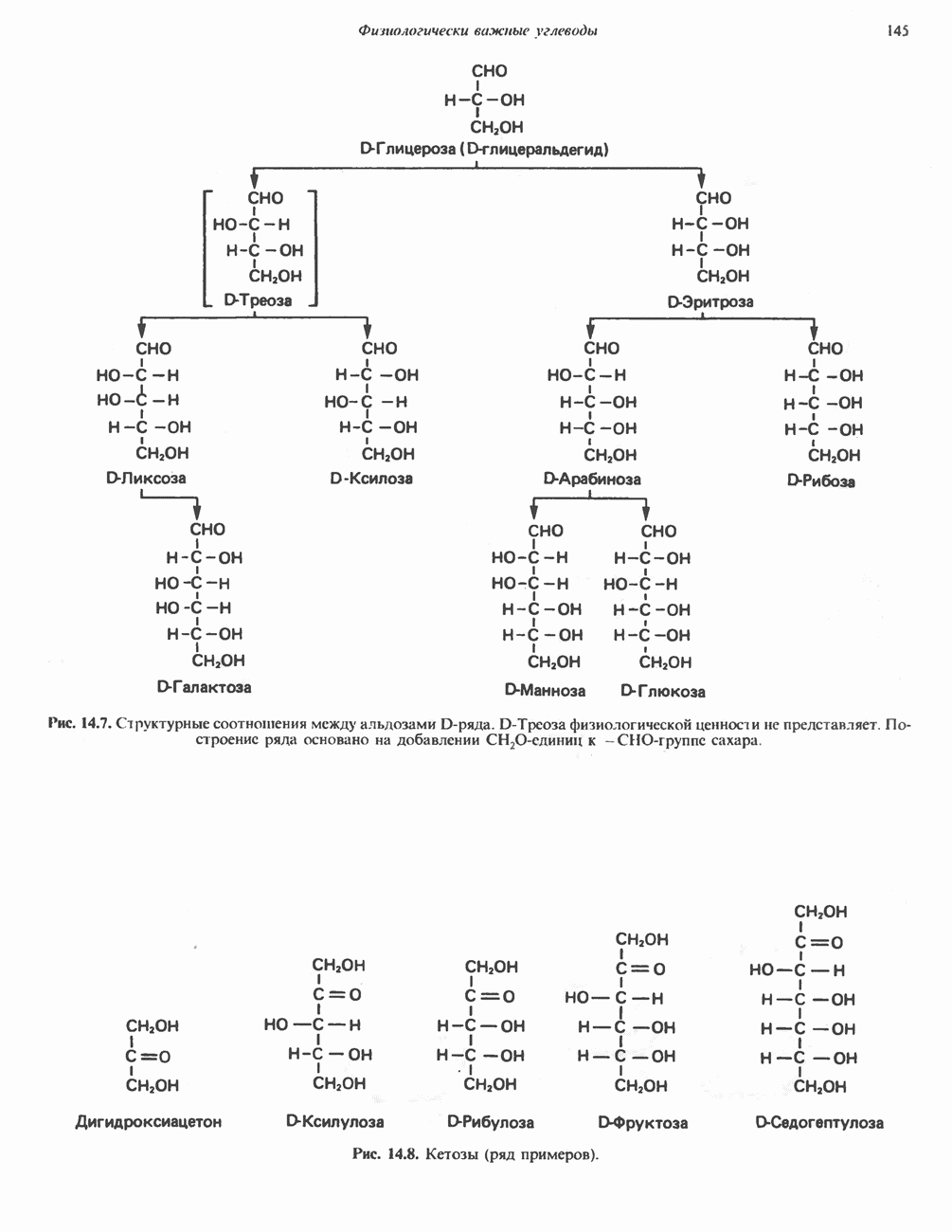
- Глава 14. Физиологически важные углеводы
- КЛАССИФИКАЦИЯ УГЛЕВОДОВ
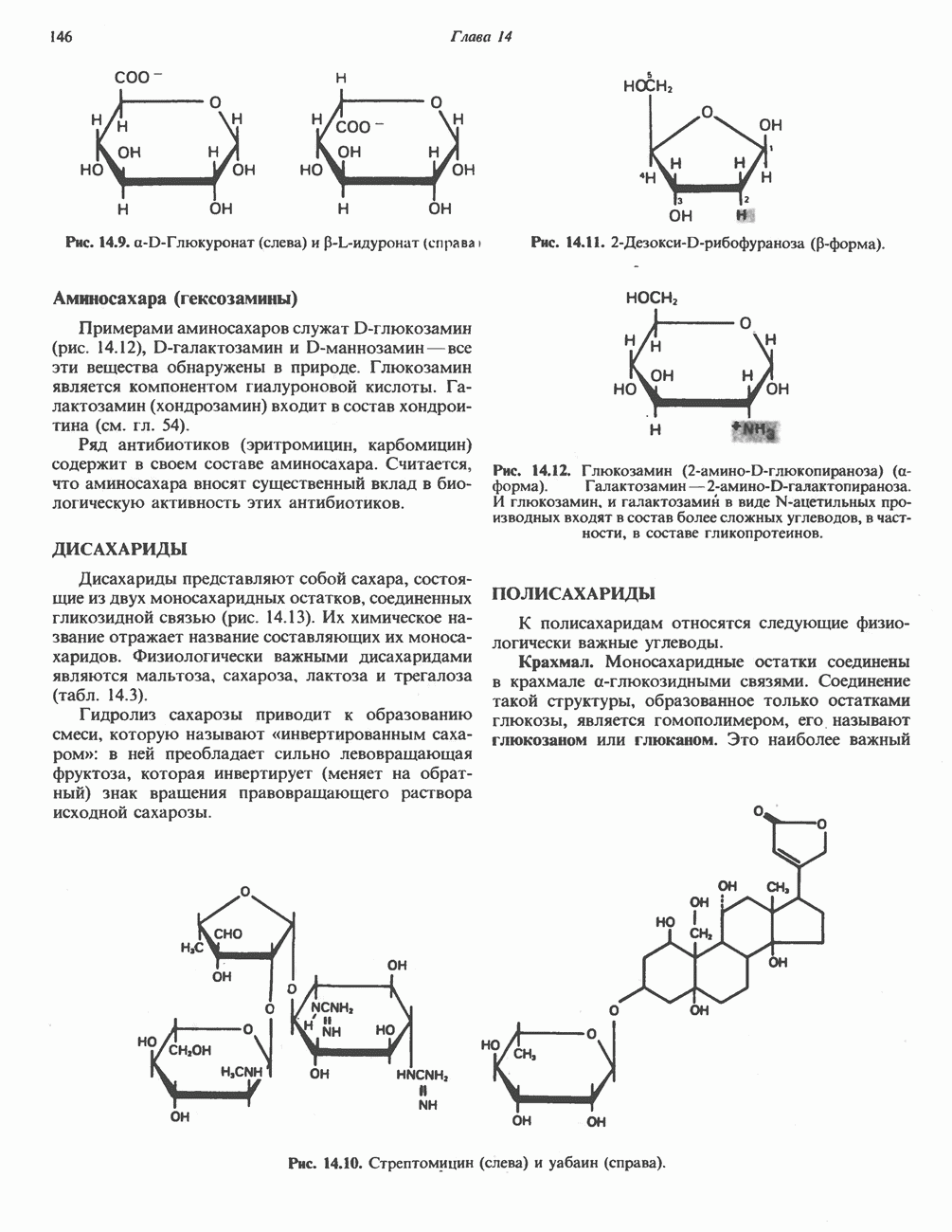
- МОНОСАХАРИДЫ
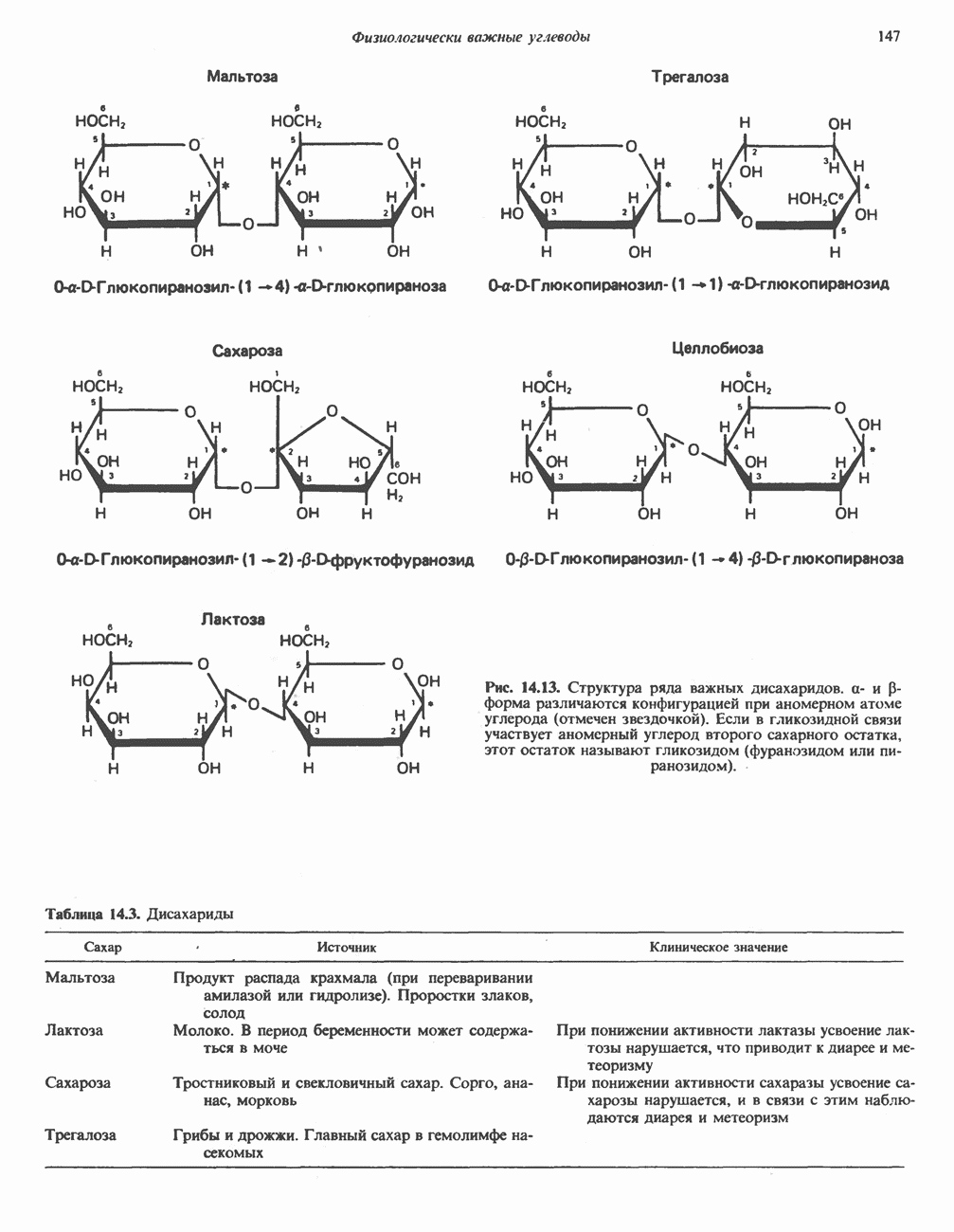
- ДИСАХАРИДЫ
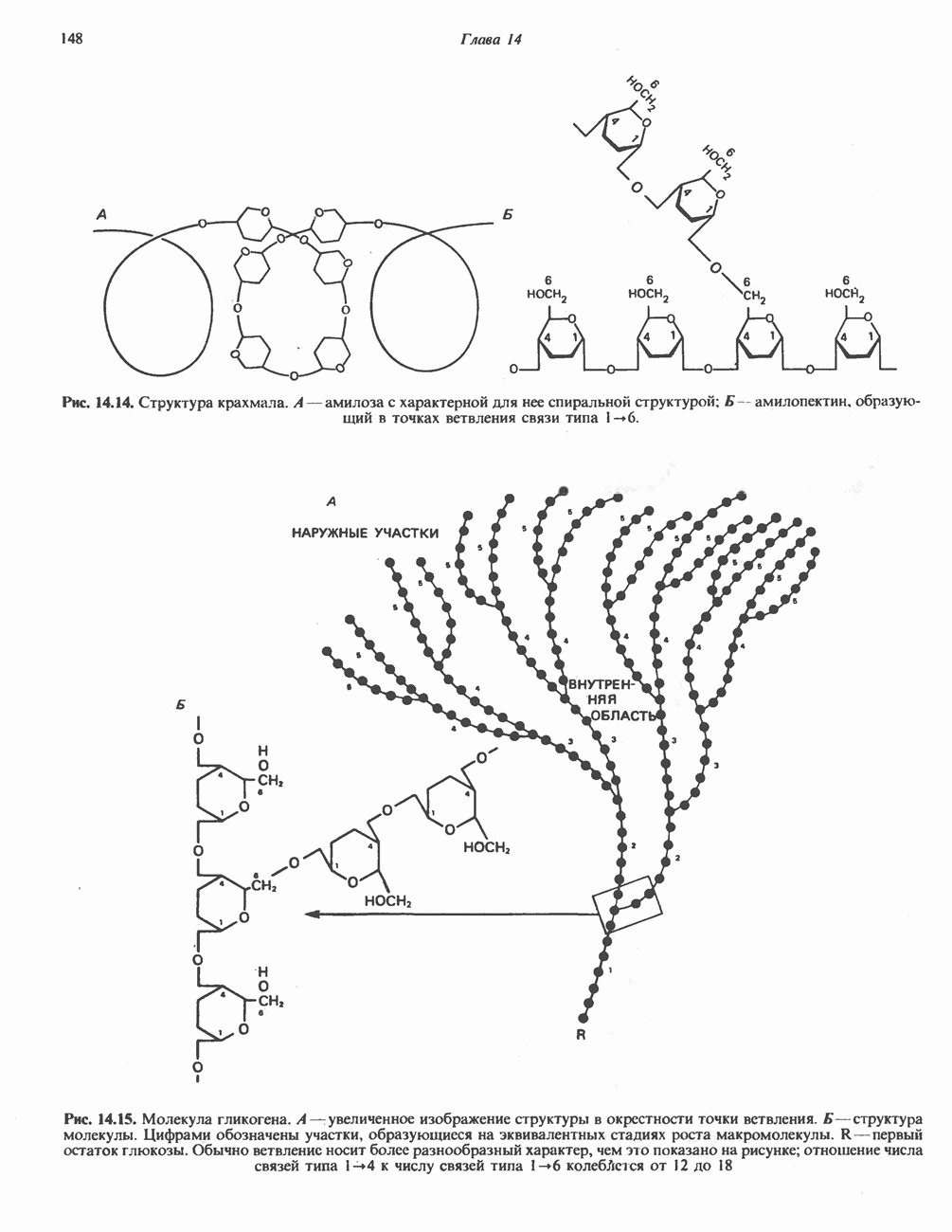
- ПОЛИСАХАРИДЫ
- УГЛЕВОДЫ КЛЕТОЧНЫХ МЕМБРАН
- Глава 15. Физиологически важные липиды
- КЛАССИФИКАЦИЯ ЛИПИДОВ
- ЖИРНЫЕ КИСЛОТЫ
- ТРИАЦИЛГЛИЦЕРОЛЫ (триглицериды)
- ФОСФОЛИПИДЫ
- ГЛИКОЛИПИДЫ (ГЛИКОСФИНГОЛИПИДЫ)
- СТЕРОИДЫ
- ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ
- МЕТОДЫ РАЗДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ ЛИПИДОВ, СОДЕРЖАЩИХСЯ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ
- АМФИПАТИЧЕСКИЕ ЛИПИДЫ
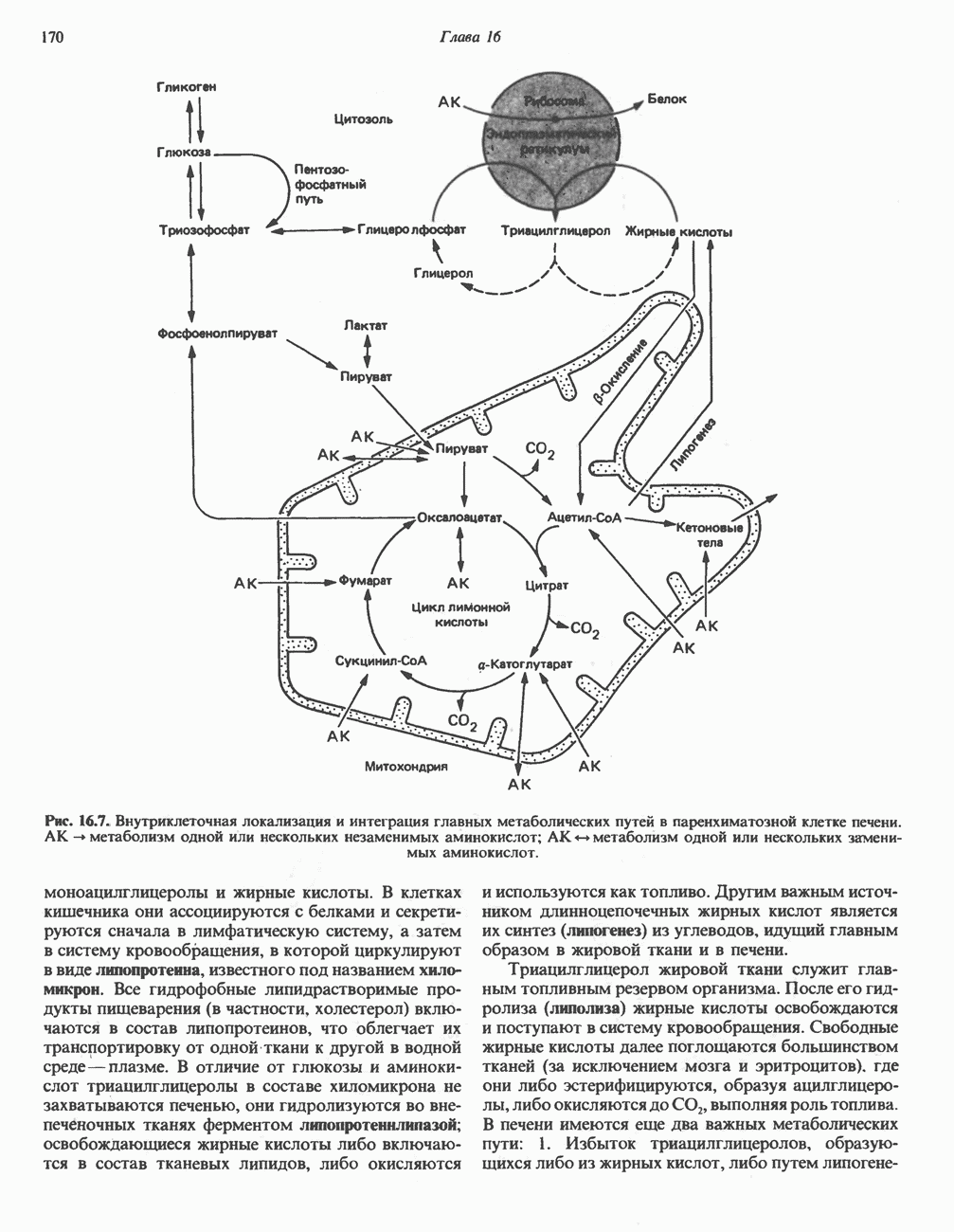
- Глава 16. Промежуточный обмен
- ОСНОВНЫЕ МЕТАБОЛИЧЕСКИЕ ПУТИ
- ЛОКАЛИЗАЦИЯ МЕТАБОЛИЧЕСКИХ ПУТЕЙ
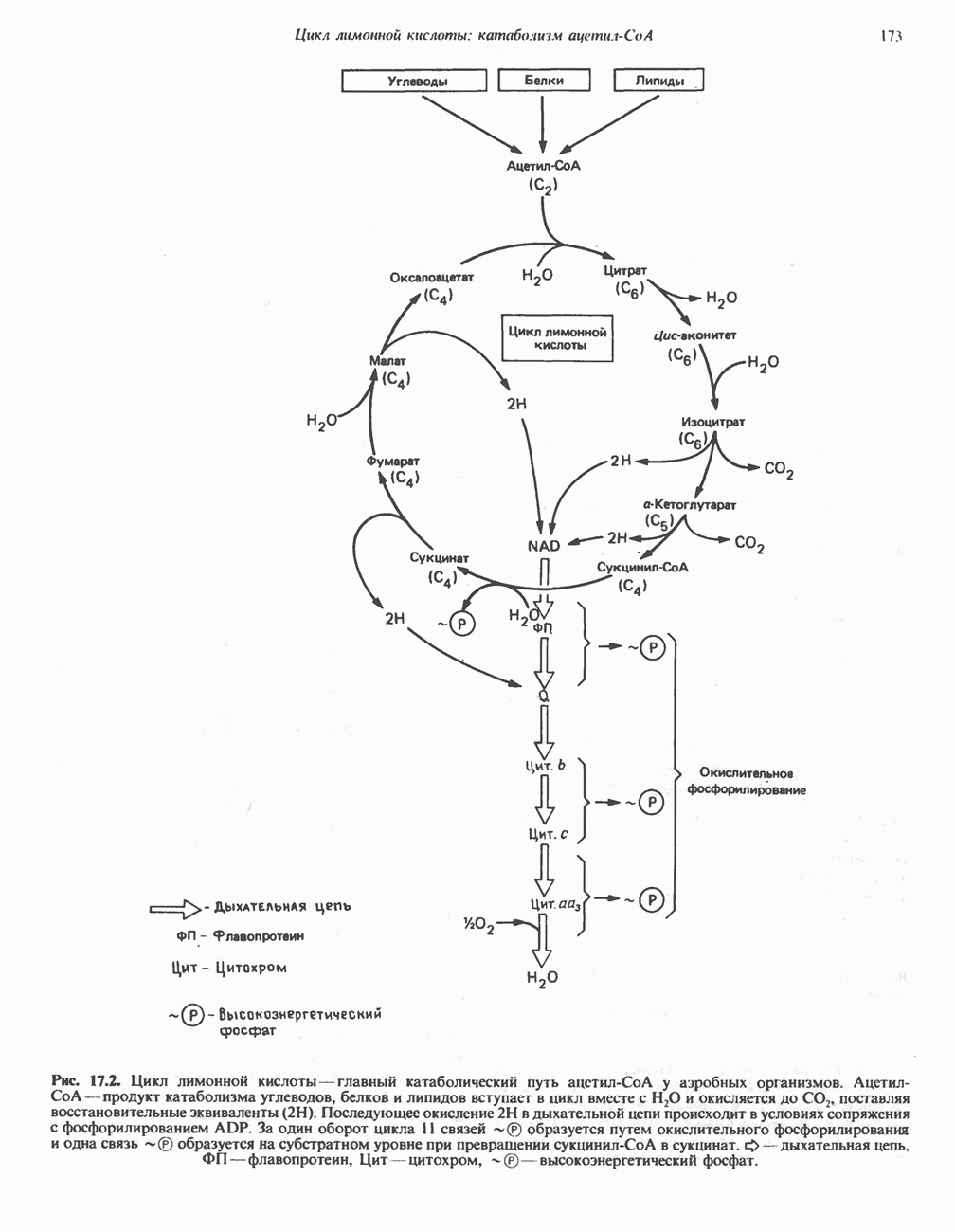
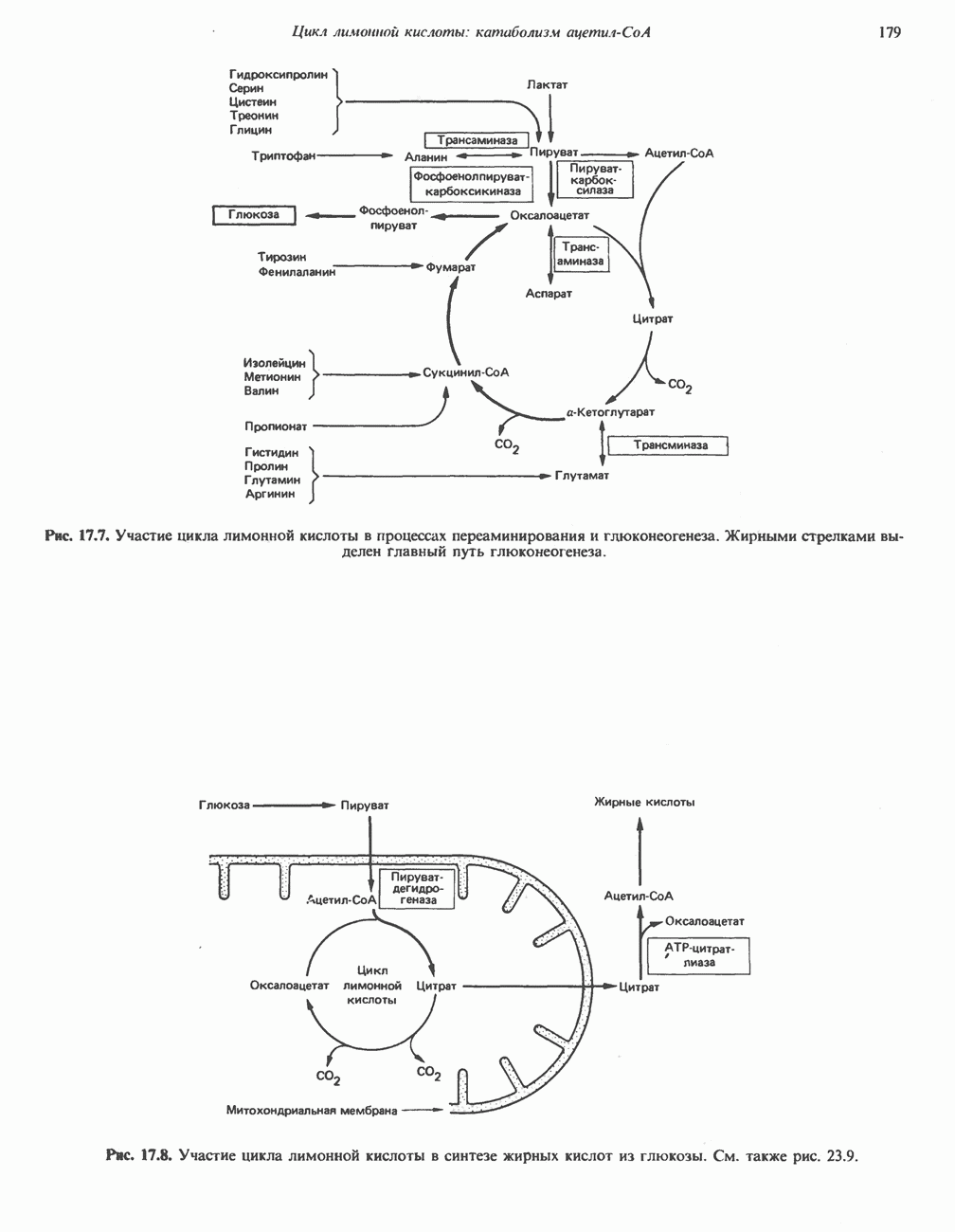
- Глава 17. Цикл лимонной кислоты: катаболизм ацетил-СоА
- КАТАБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
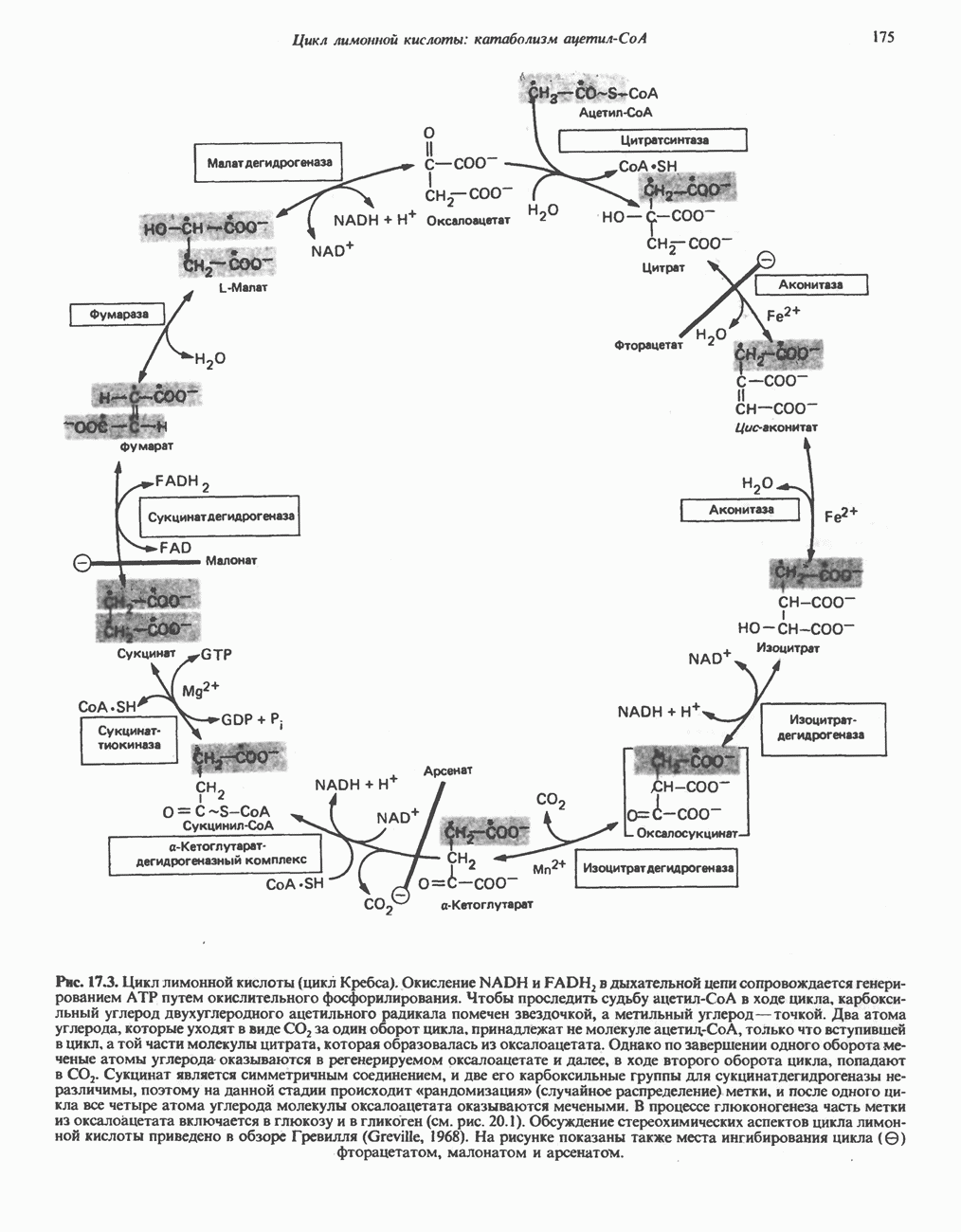
- РЕАКЦИИ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (рис. 17.3)
- ЭНЕРГЕТИКА ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
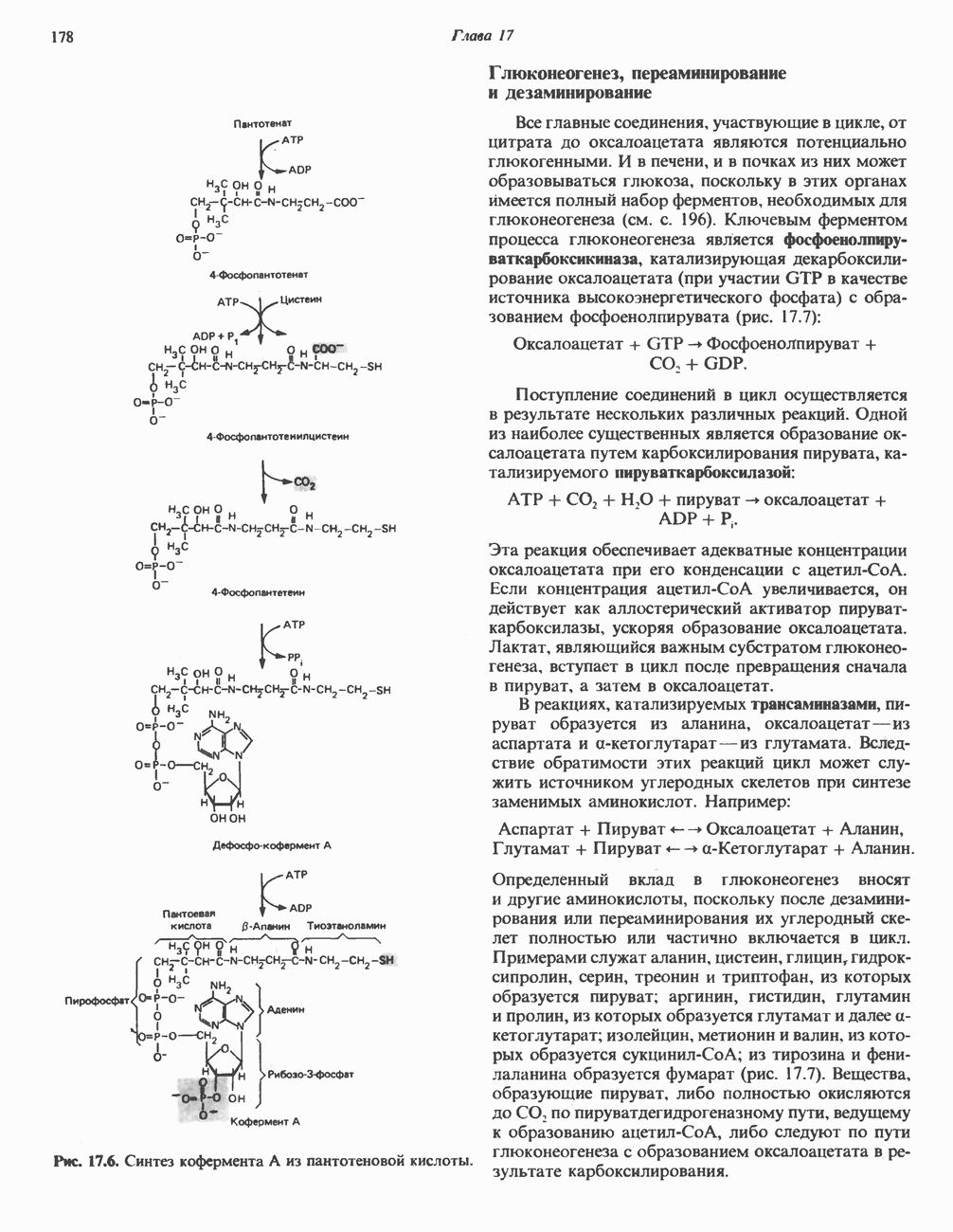
- РОЛЬ ВИТАМИНОВ В ЦИКЛЕ ЛИМОННОЙ КИСЛОТЫ
- АМФИБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
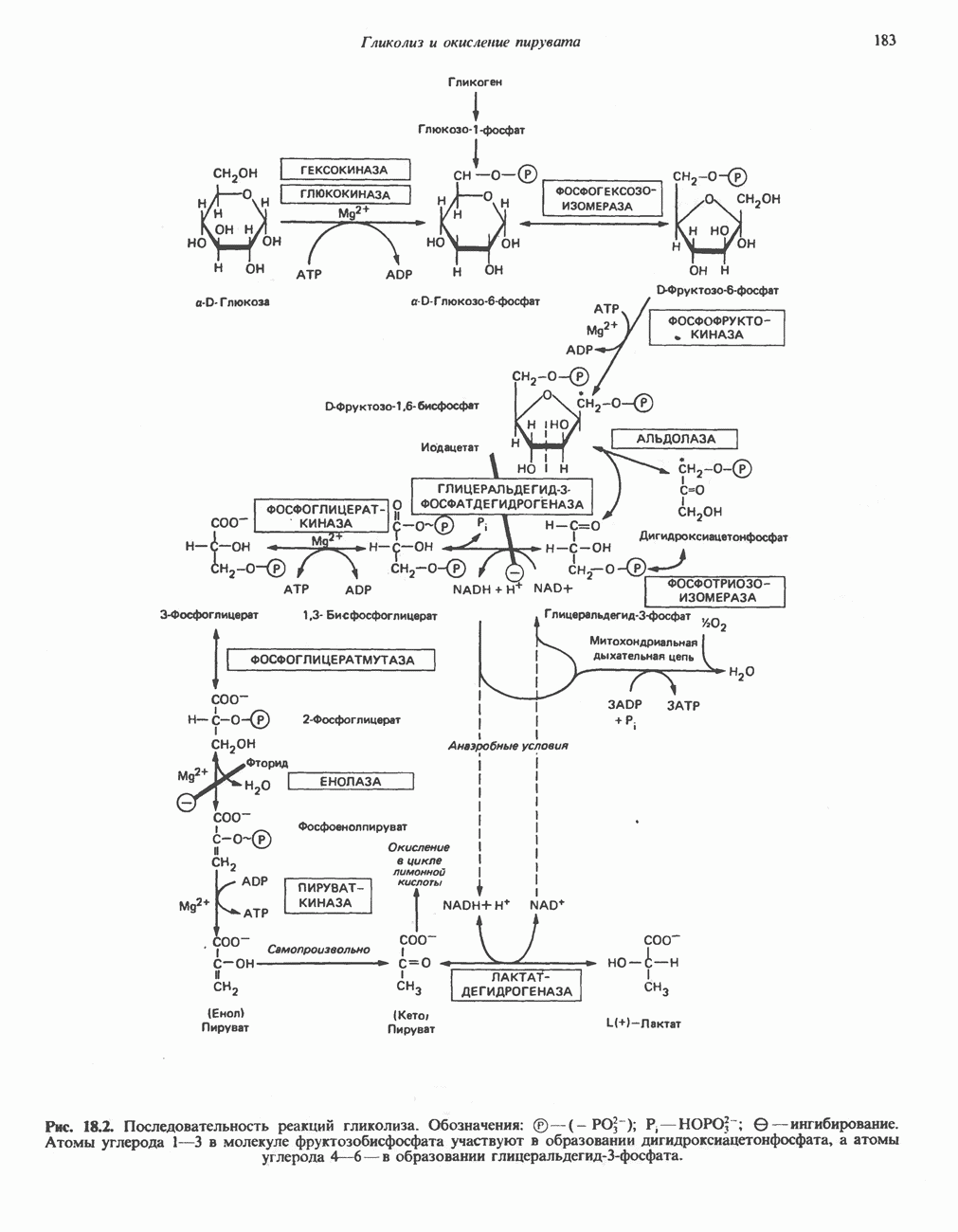
- Глава 18. Гликолиз и окисление пирувата
- ГЛИКОЛИТИЧЕСКИЙ ПУТЬ
- ПОСЛЕДОВАТЕЛЬНЫЕ СТАДИИ ГЛИКОЛИЗА
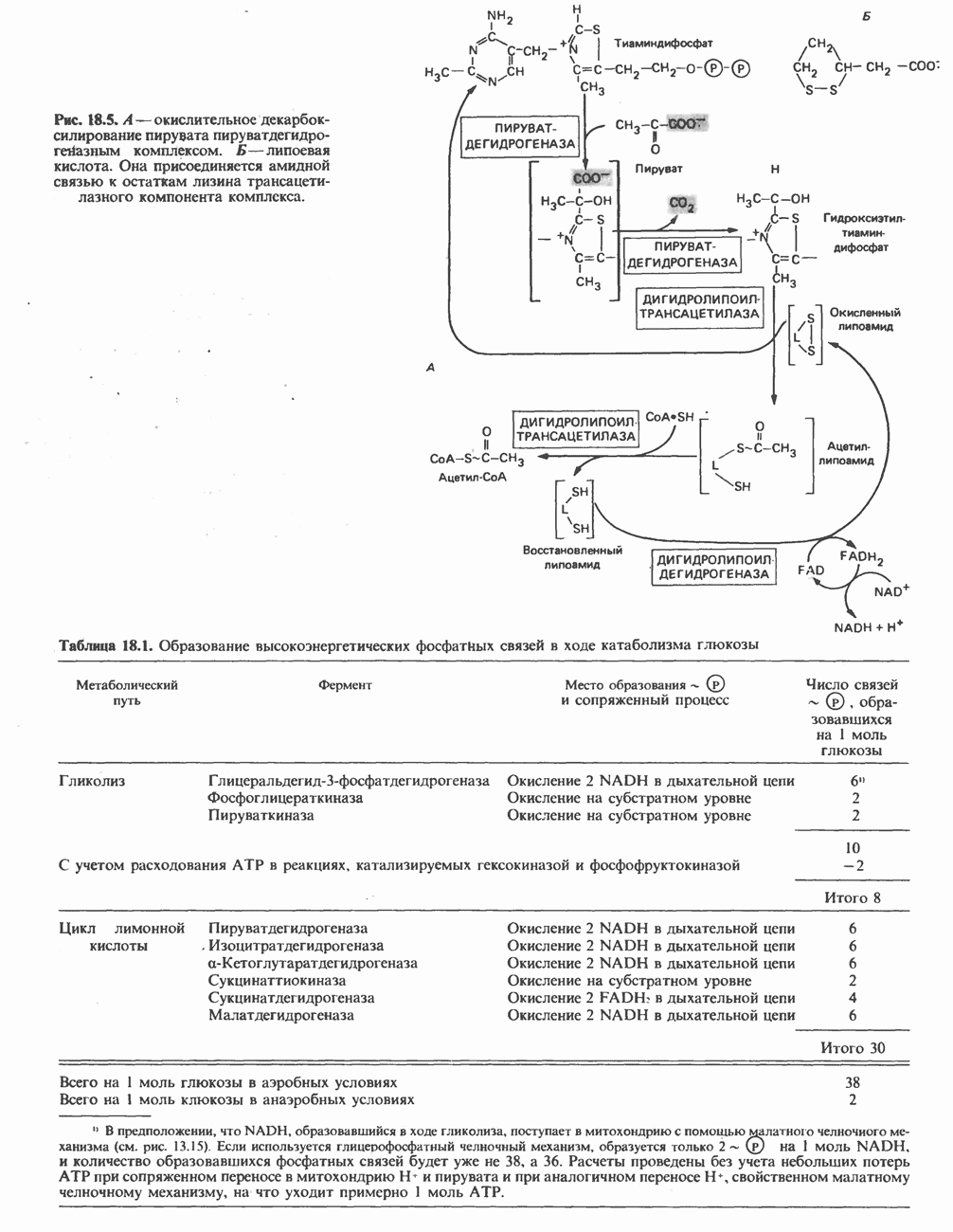
- ОКИСЛЕНИЕ ПИРУВАТА В АЦЕТИЛ-СоА
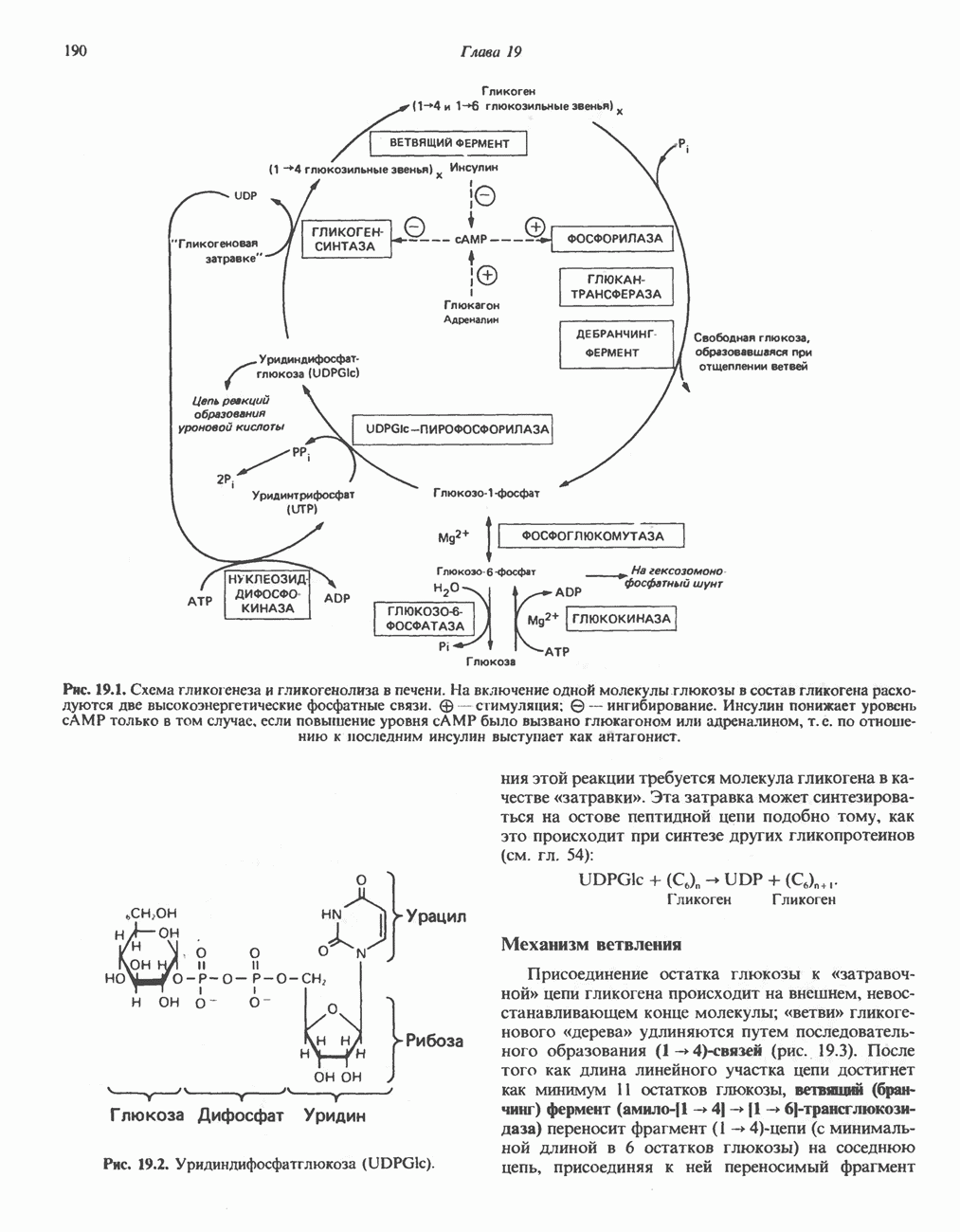
- Глава 19. Метаболизм гликогена
- ГЛИКОГЕНЕЗ
- ГЛИКОГЕНОЛИЗ
- МЕХАНИЗМЫ КОНТРОЛЯ ГЛИКОГЕНОЛИЗА И ГЛИКОГЕНЕЗА
- БОЛЕЗНИ, СВЯЗАННЫЕ С НАКОПЛЕНИЕМ ГЛИКОГЕНА (ГЛИКОГЕНОЗЫ)
- Глава 20. Глюконеогенез и пентозофосфатный путь
- МЕТАБОЛИЧЕСКИЕ ПУТИ, УЧАСТВУЮЩИЕ В ГЛЮКОНЕОГЕНЕЗЕ (рис. 20.1)
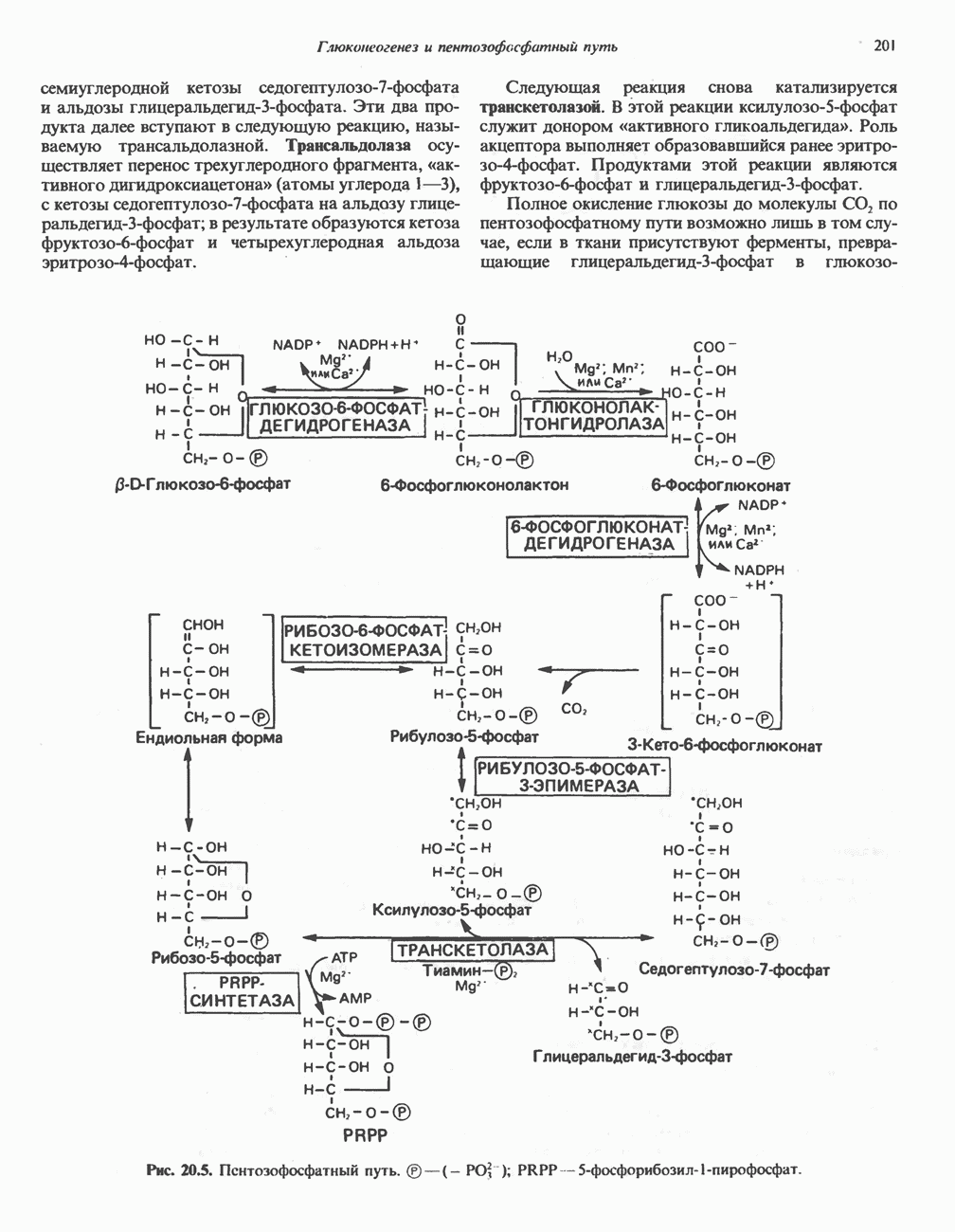
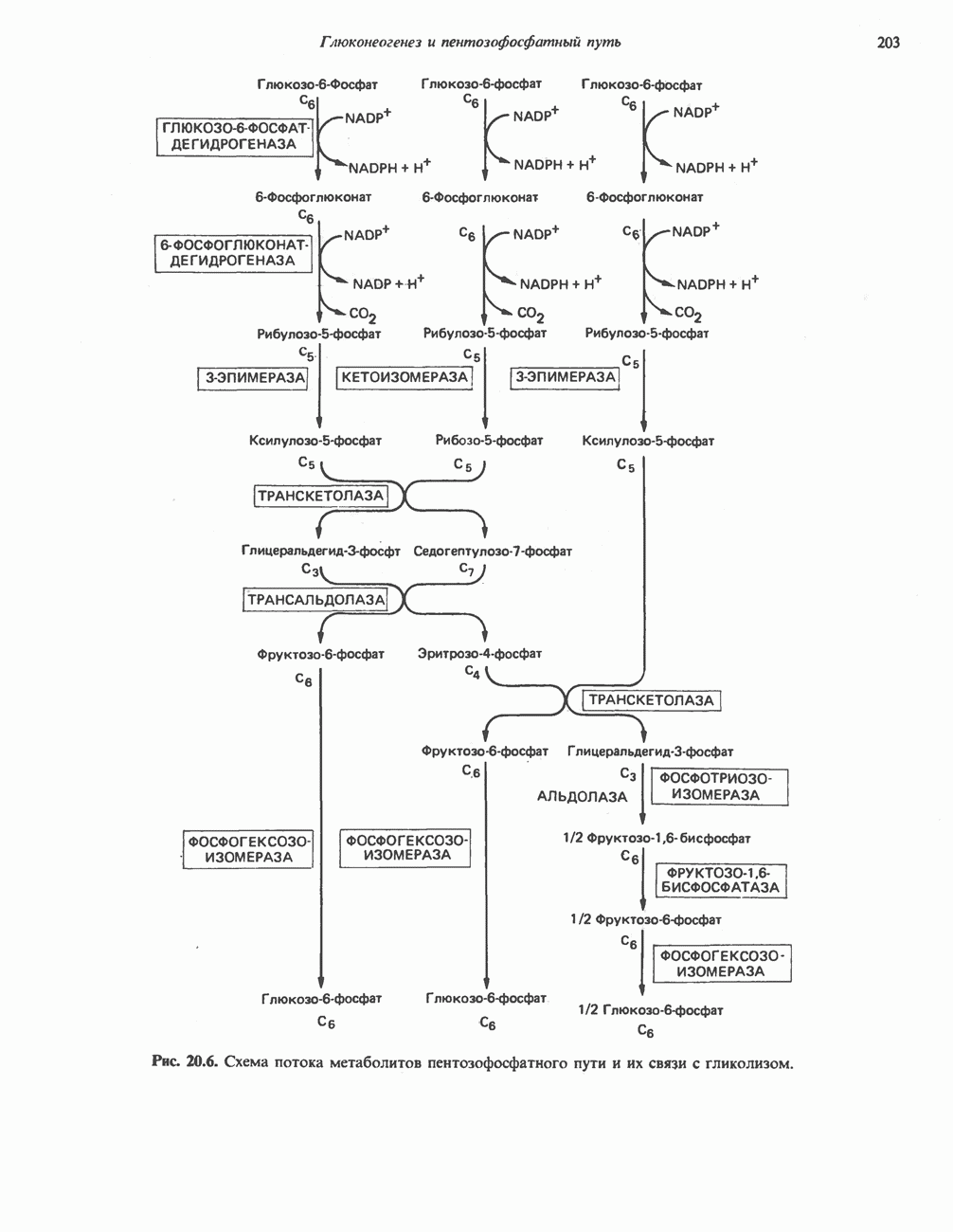
- ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ИЛИ ГЕКСОЗОМОНОФОСФАТНЫЙ ШУНТ
- ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ
- МЕТАБОЛИЧЕСКОЕ ЗНАЧЕНИЕ ПЕНТОЗОФОСФАТНОГО ПУТИ
- КЛИНИЧЕСКИЕ АСПЕКТЫ
- Глава 21. Метаболизм наиболее важных гексоз
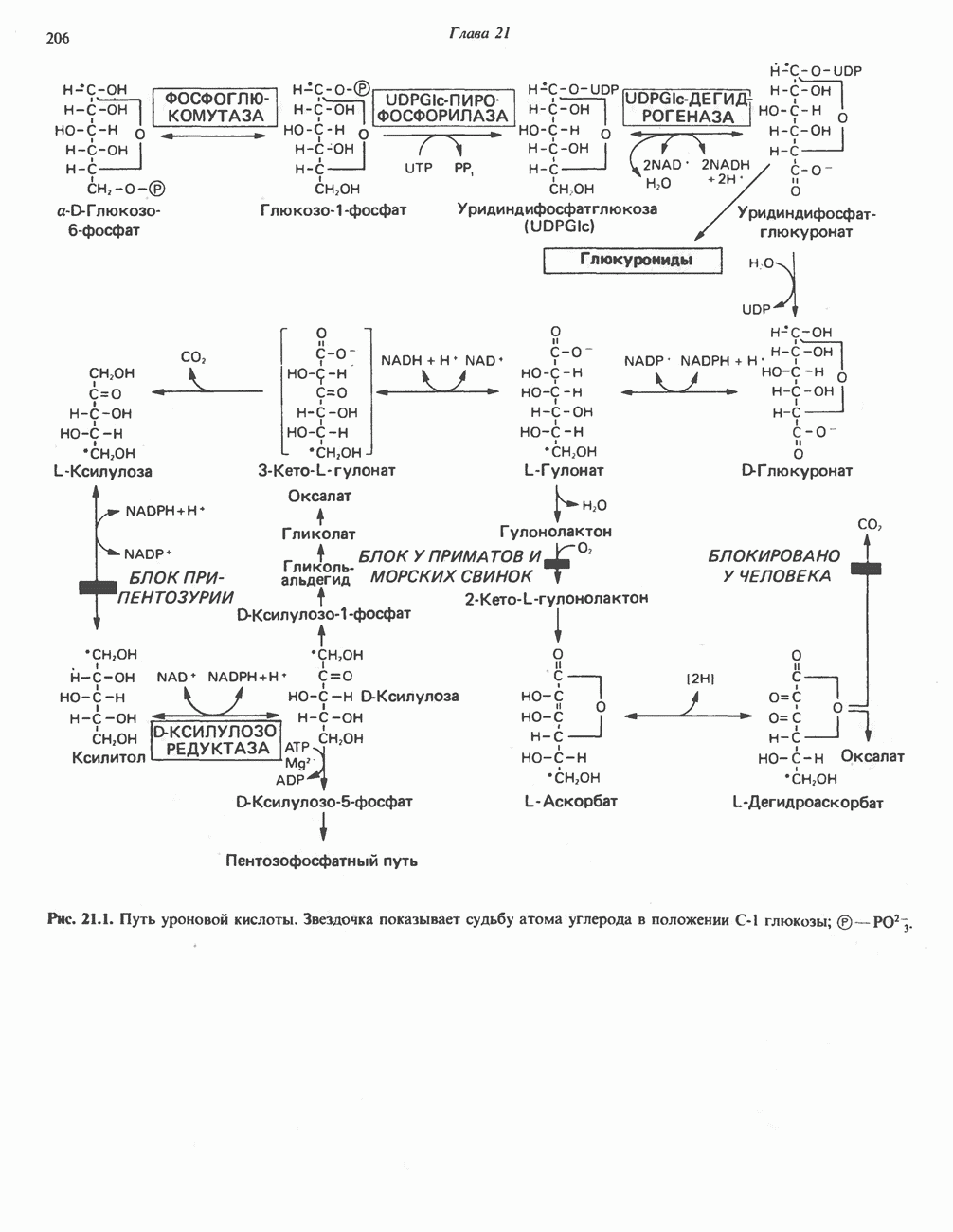
- ПУТЬ УРОНОВЫХ КИСЛОТ
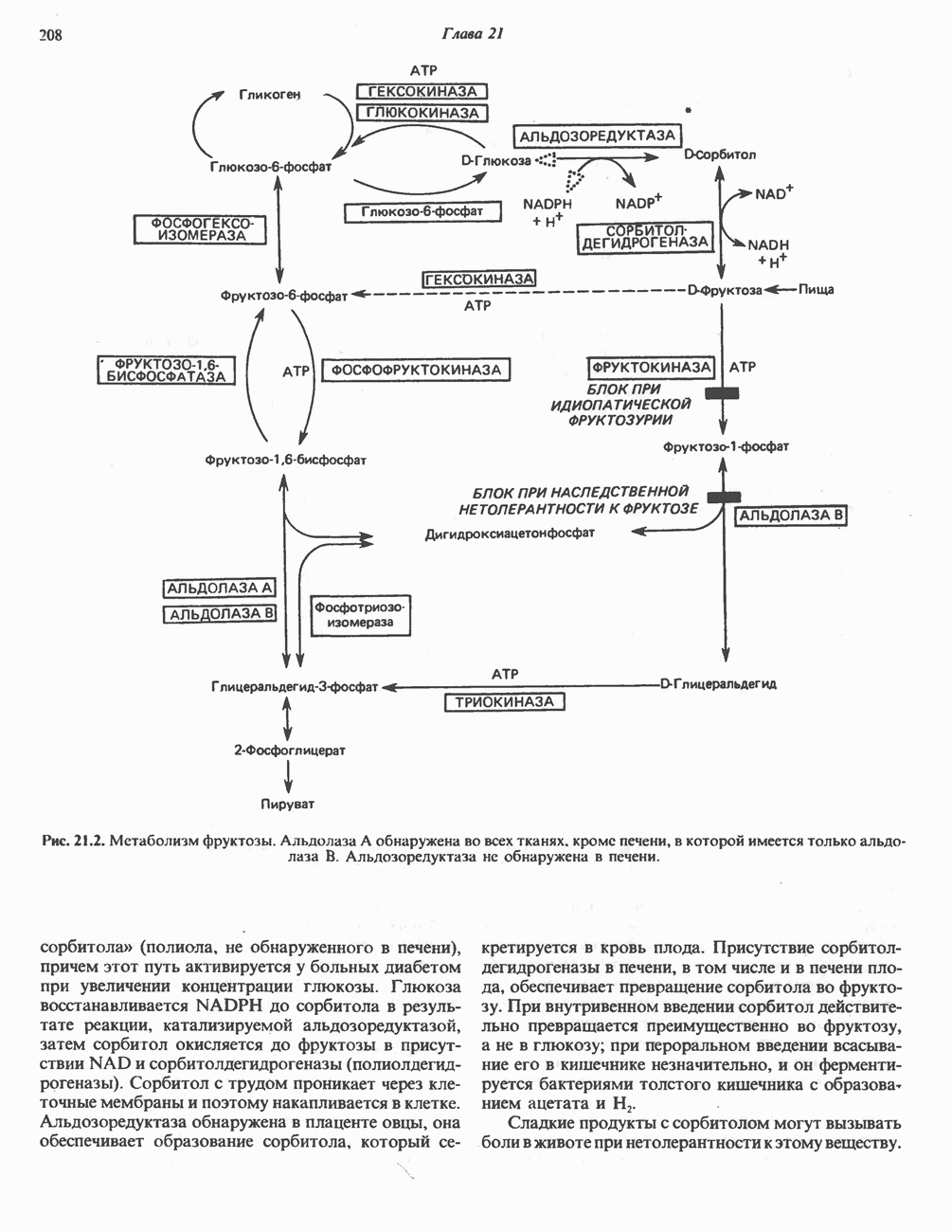
- МЕТАБОЛИЗМ ФРУКТОЗЫ
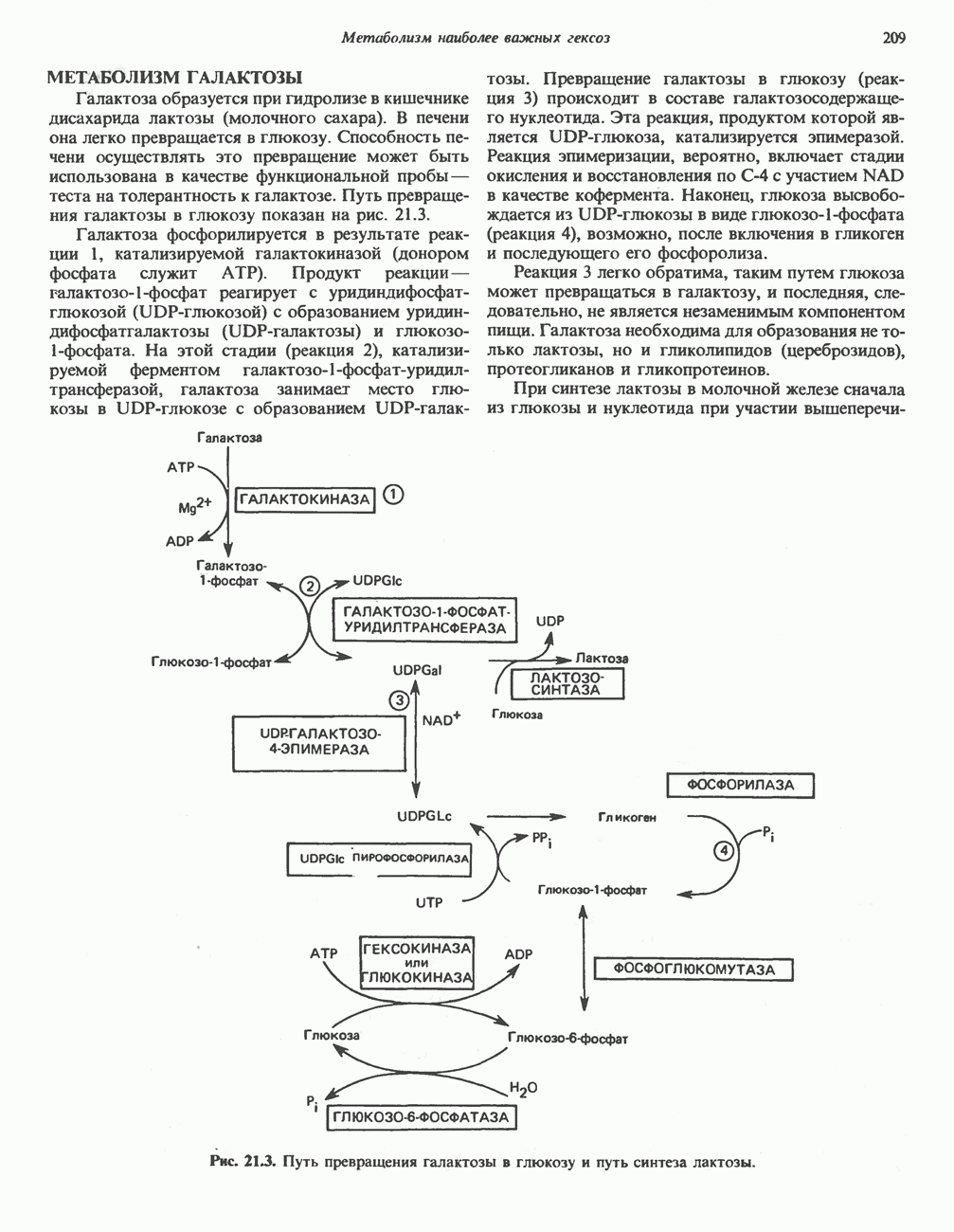
- МЕТАБОЛИЗМ ГАЛАКТОЗЫ
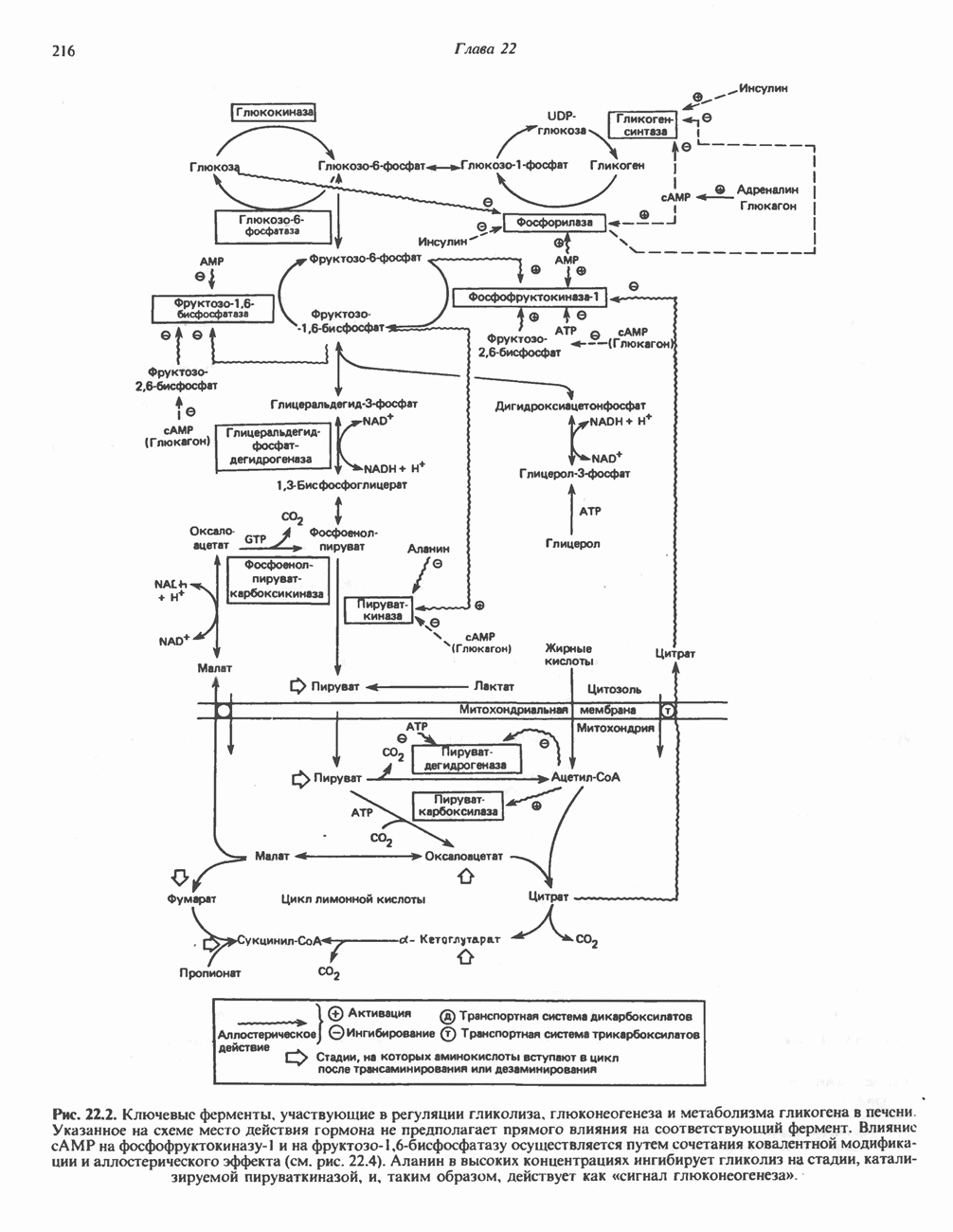
- Глава 22. Регуляция метаболизма углеводов
- ОБЩИЕ ПРИНЦИПЫ РЕГУЛЯЦИИ ПУТЕЙ МЕТАБОЛИЗМА
- МЕТАБОЛИЧЕСКИЙ КОНТРОЛЬ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА УГЛЕВОДОВ НА КЛЕТОЧНОМ И ФЕРМЕНТНОМ УРОВНЕ
- РЕГУЛЯЦИЯ ГЛИКОЛИЗА, ГЛЮКОНЕОГЕНЕЗА И ПЕНТОЗОФОСФАТНОГО ПУТИ
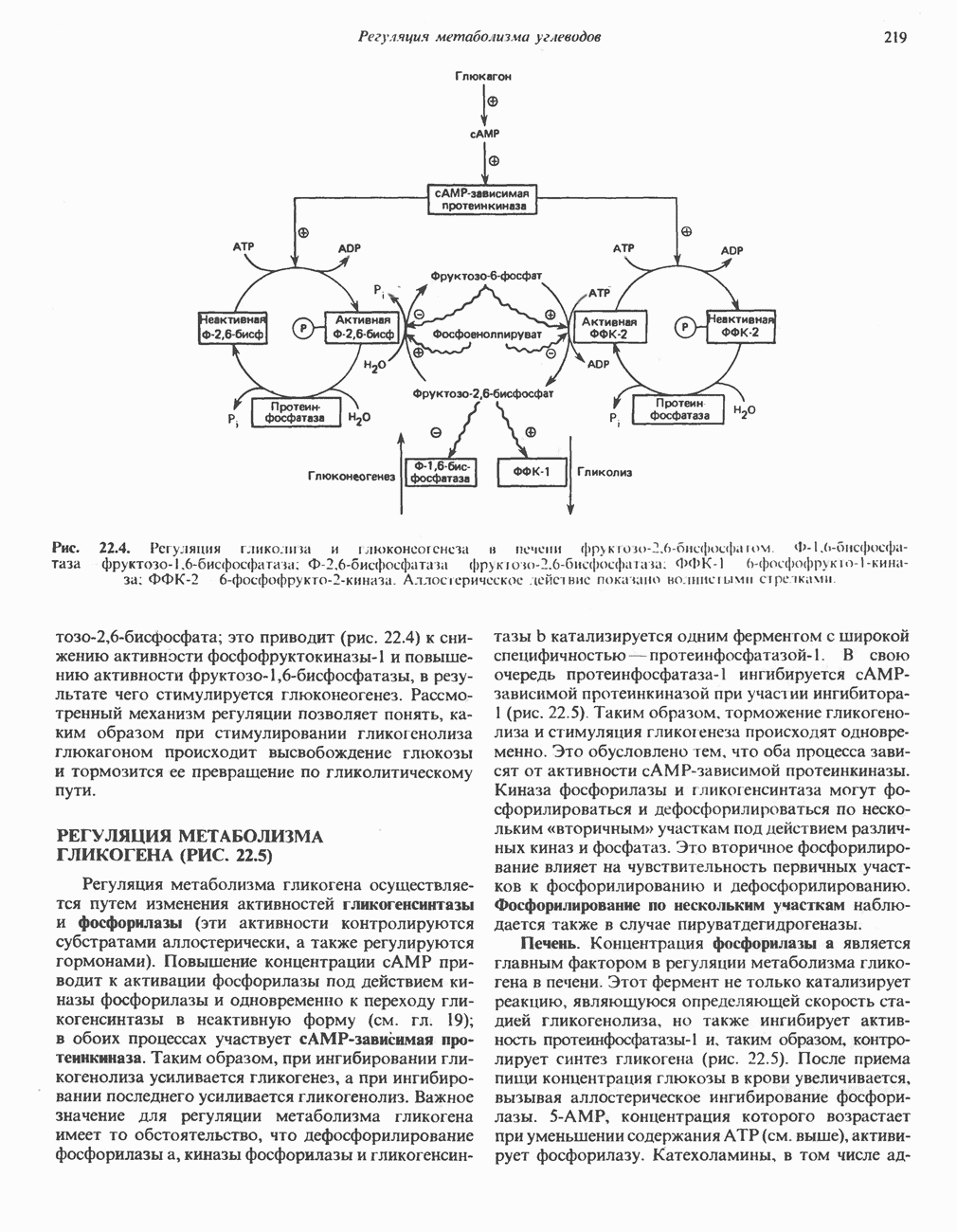
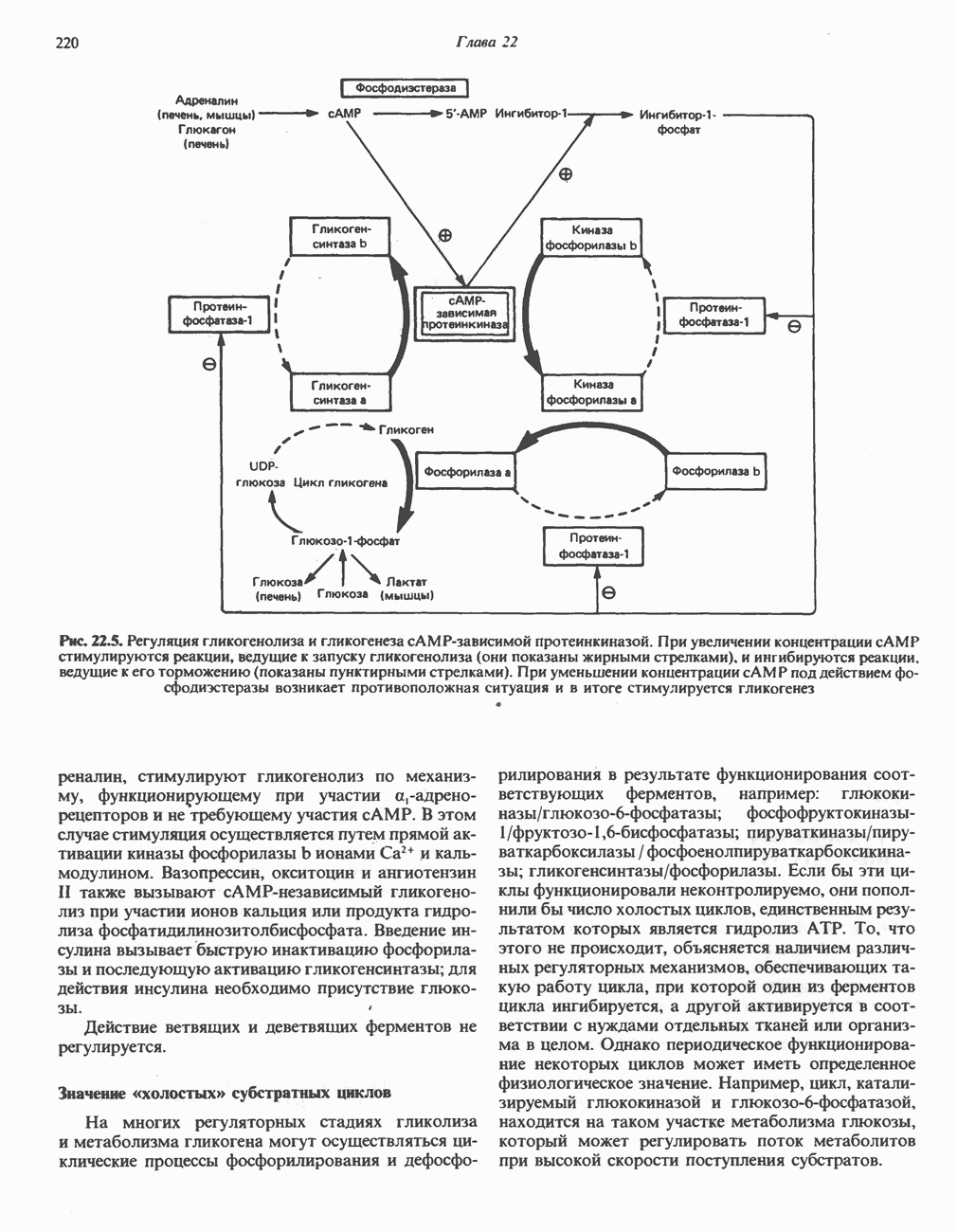
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ГЛИКОГЕНА (РИС. 22.5)
- РЕГУЛЯЦИЯ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (СМ. РИС. 18.3)
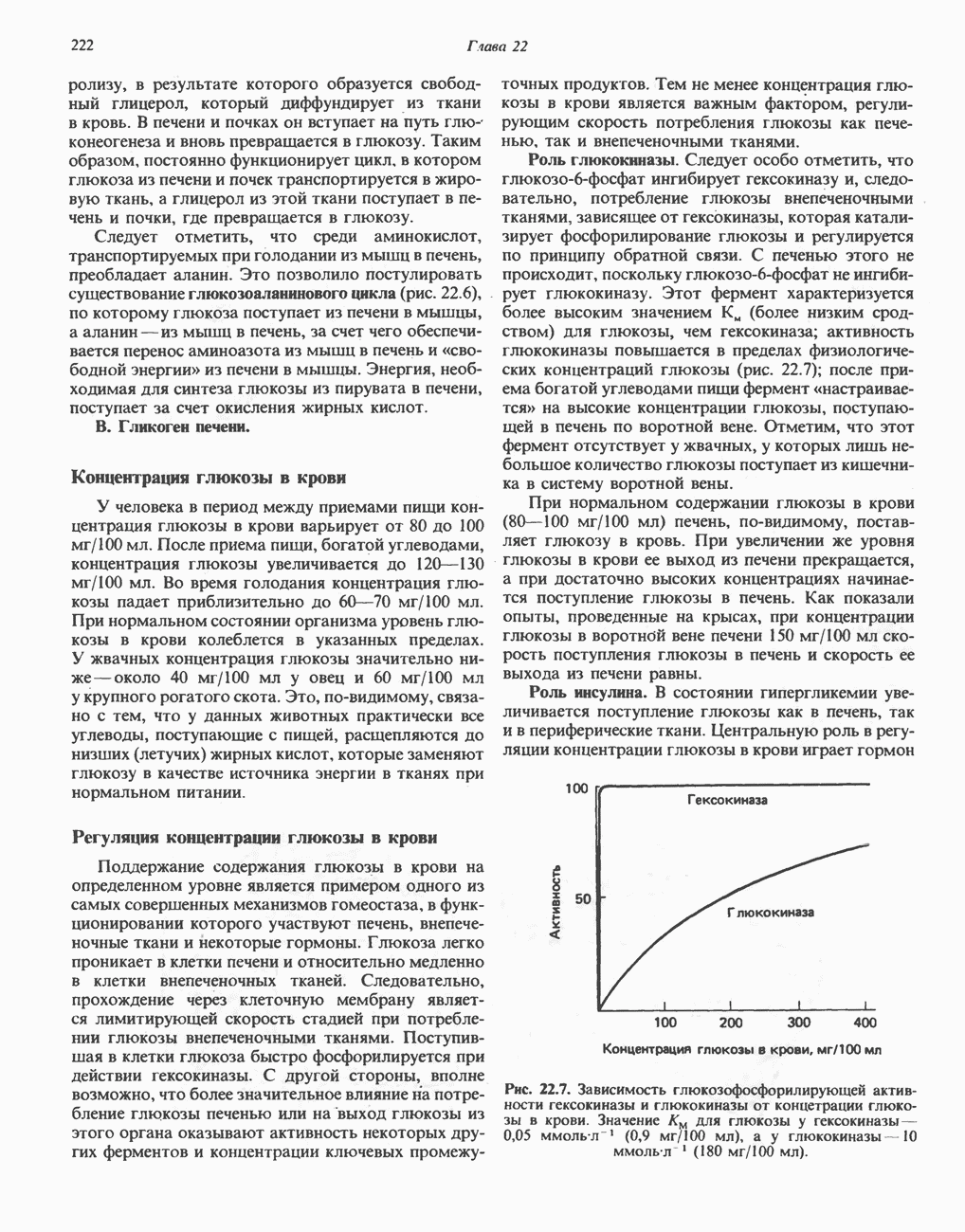
- РЕГУЛЯЦИЯ УРОВНЯ ГЛЮКОЗЫ В КРОВИ
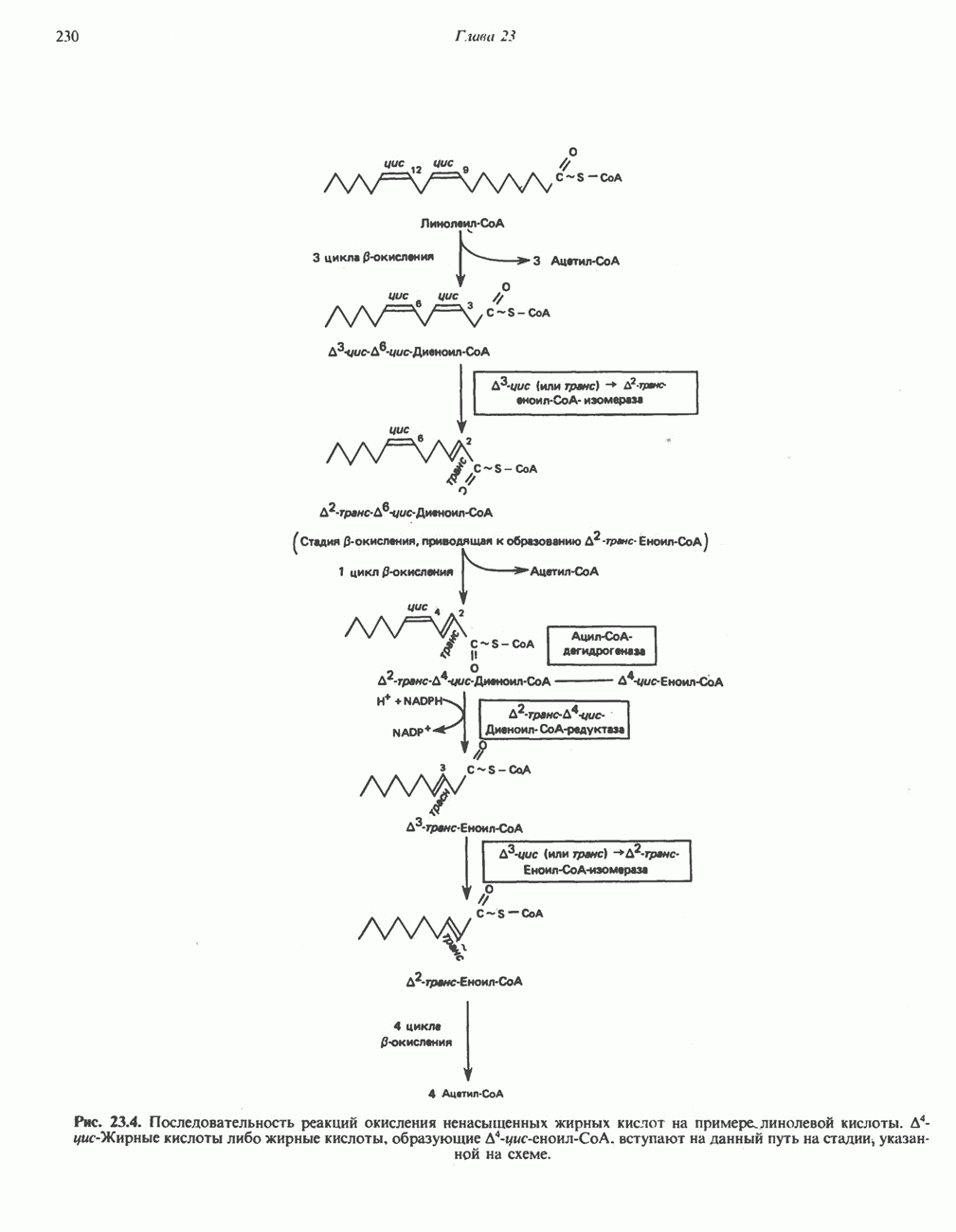
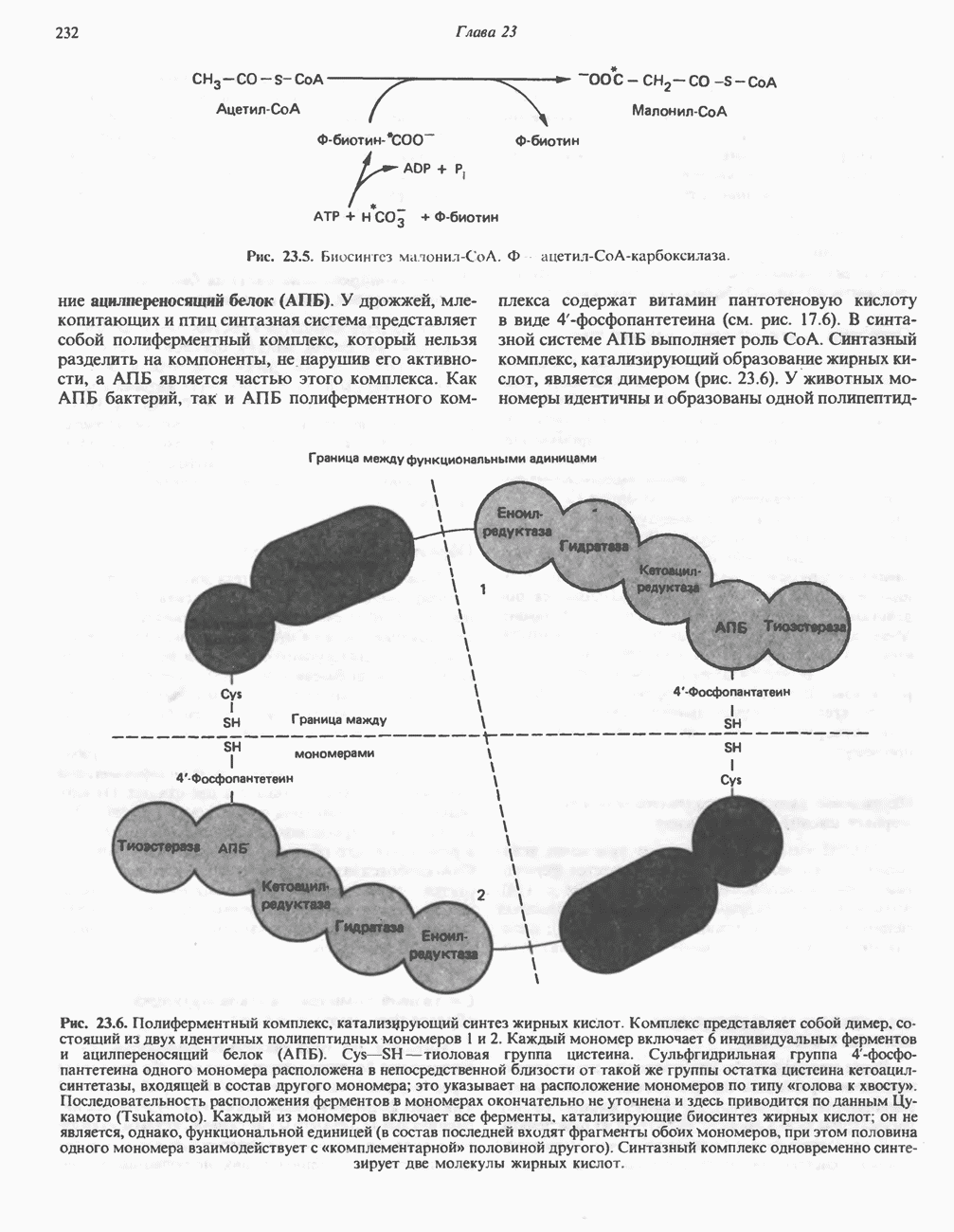
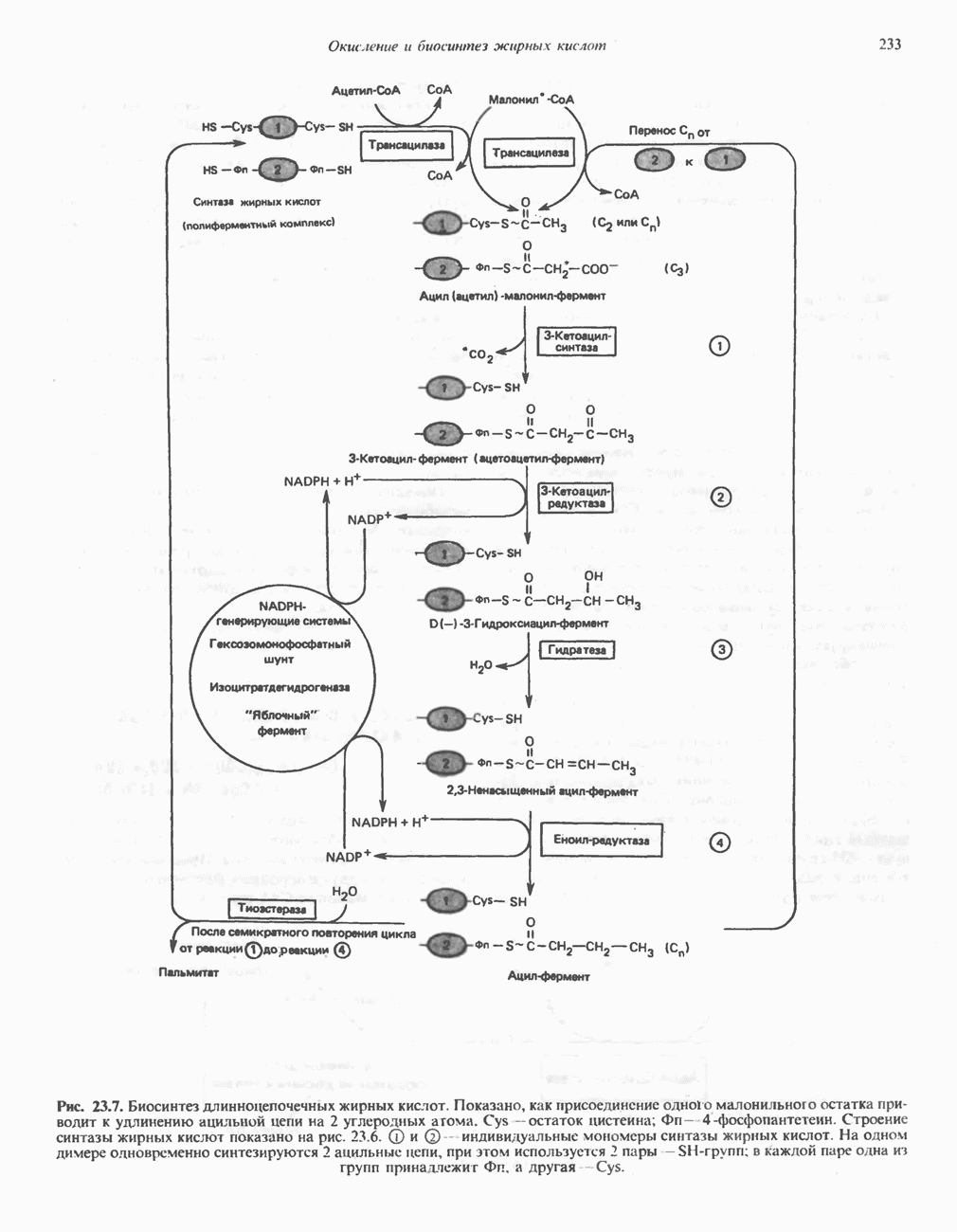
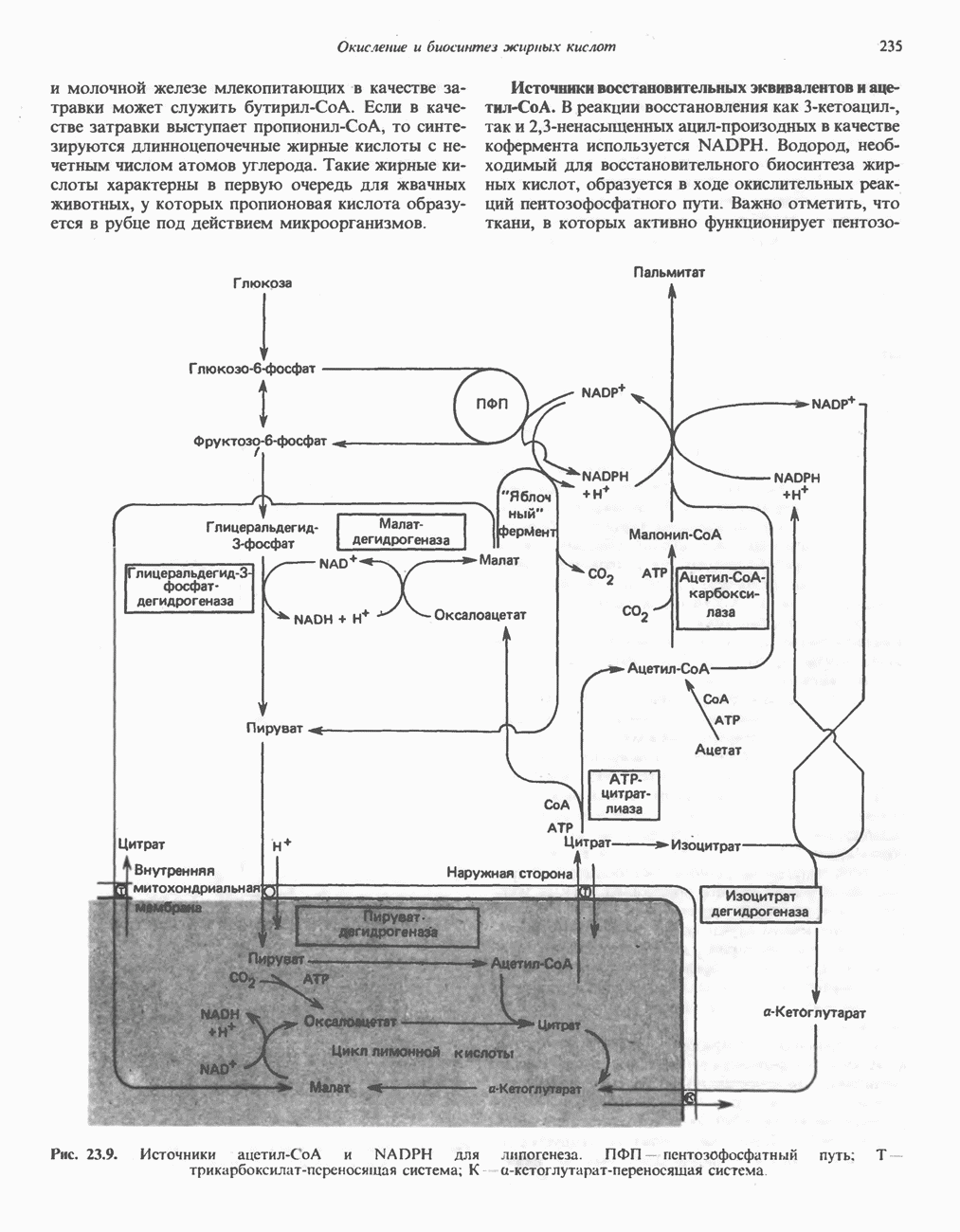
- Глава 23. Окисление и биосинтез жирных кислот
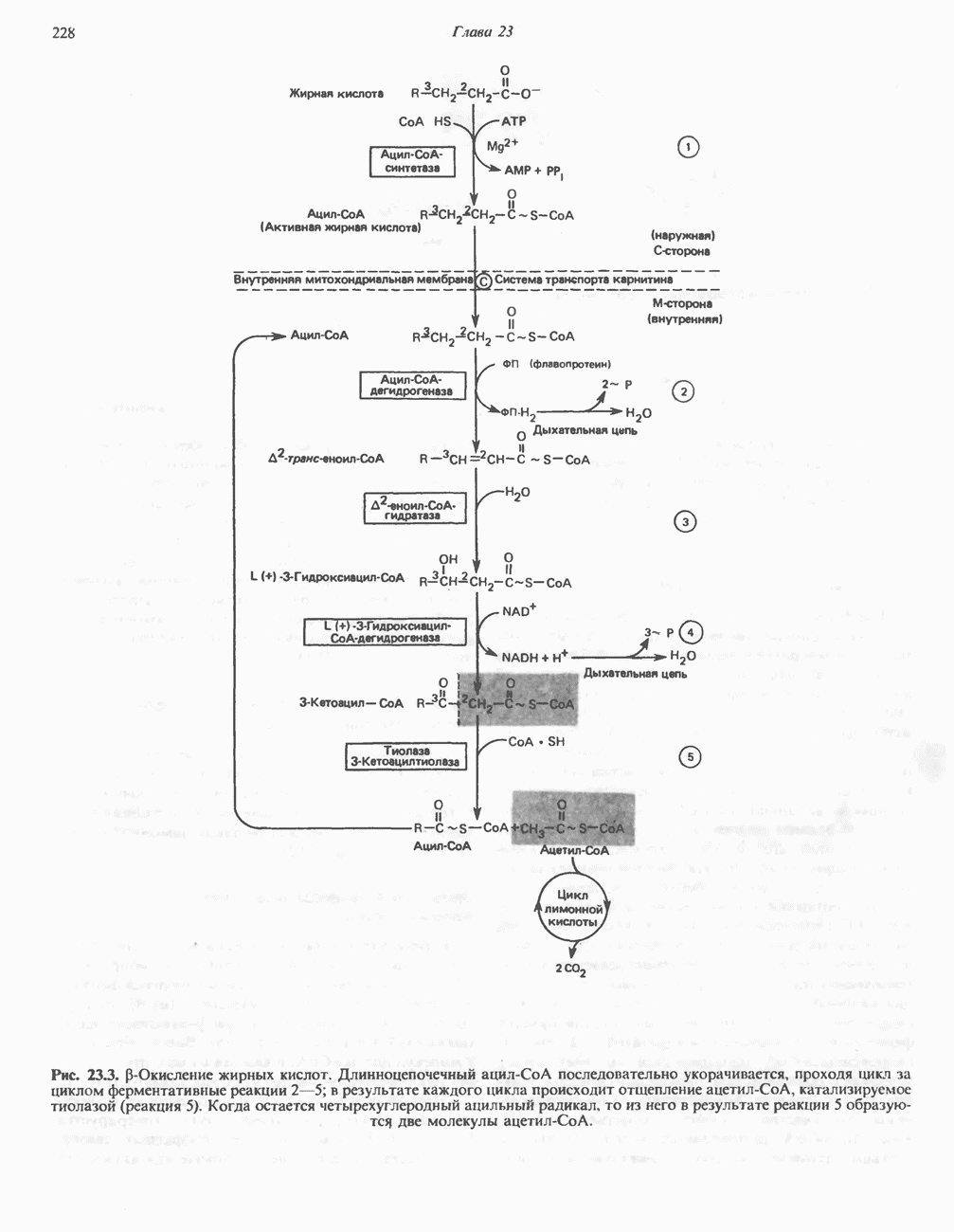
- ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ
- БИОСИНТЕЗ НАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
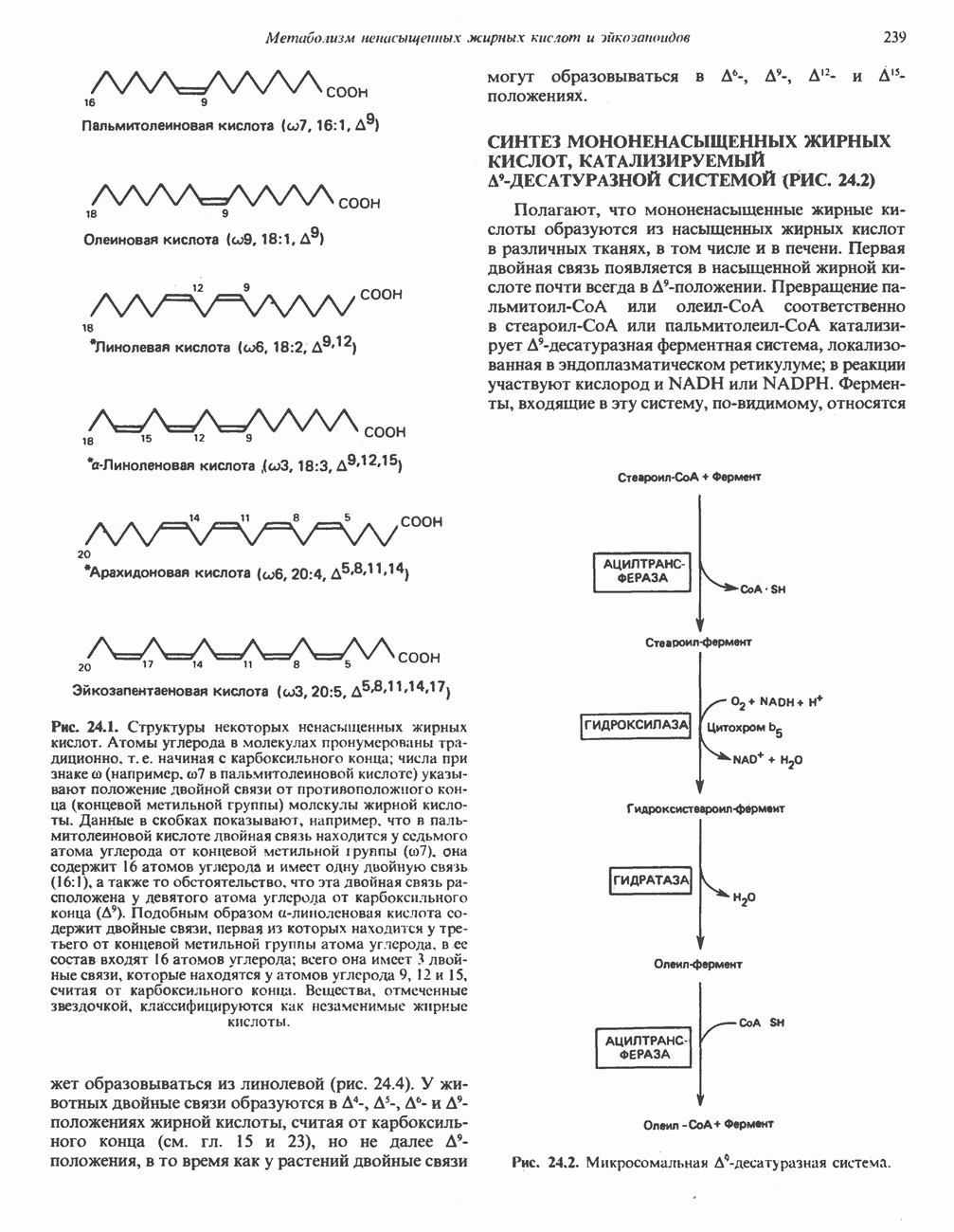
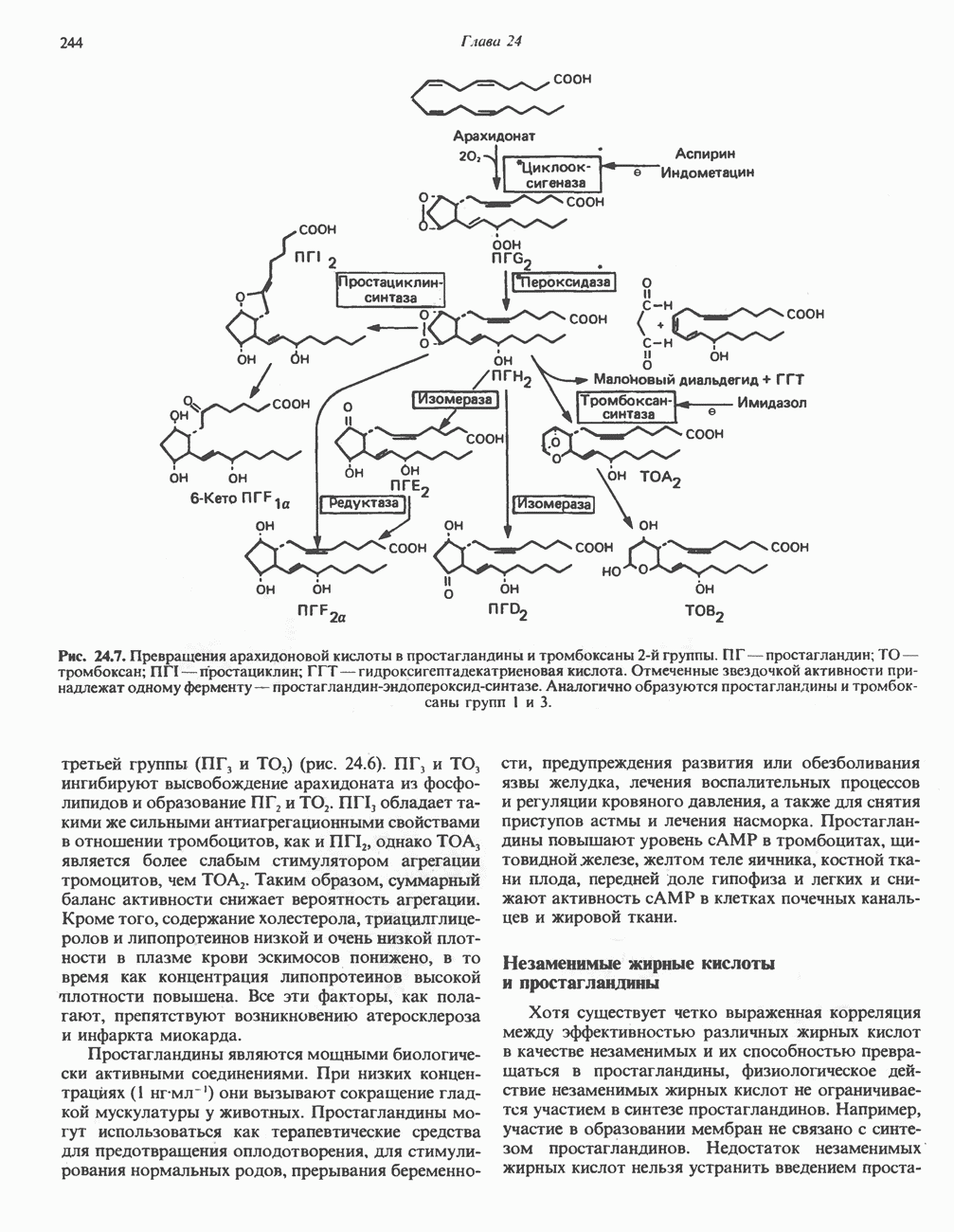
- Глава 24. Метаболизм ненасыщенных жирных кислот и эйкозаноидов
- МЕТАБОЛИЗМ НЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
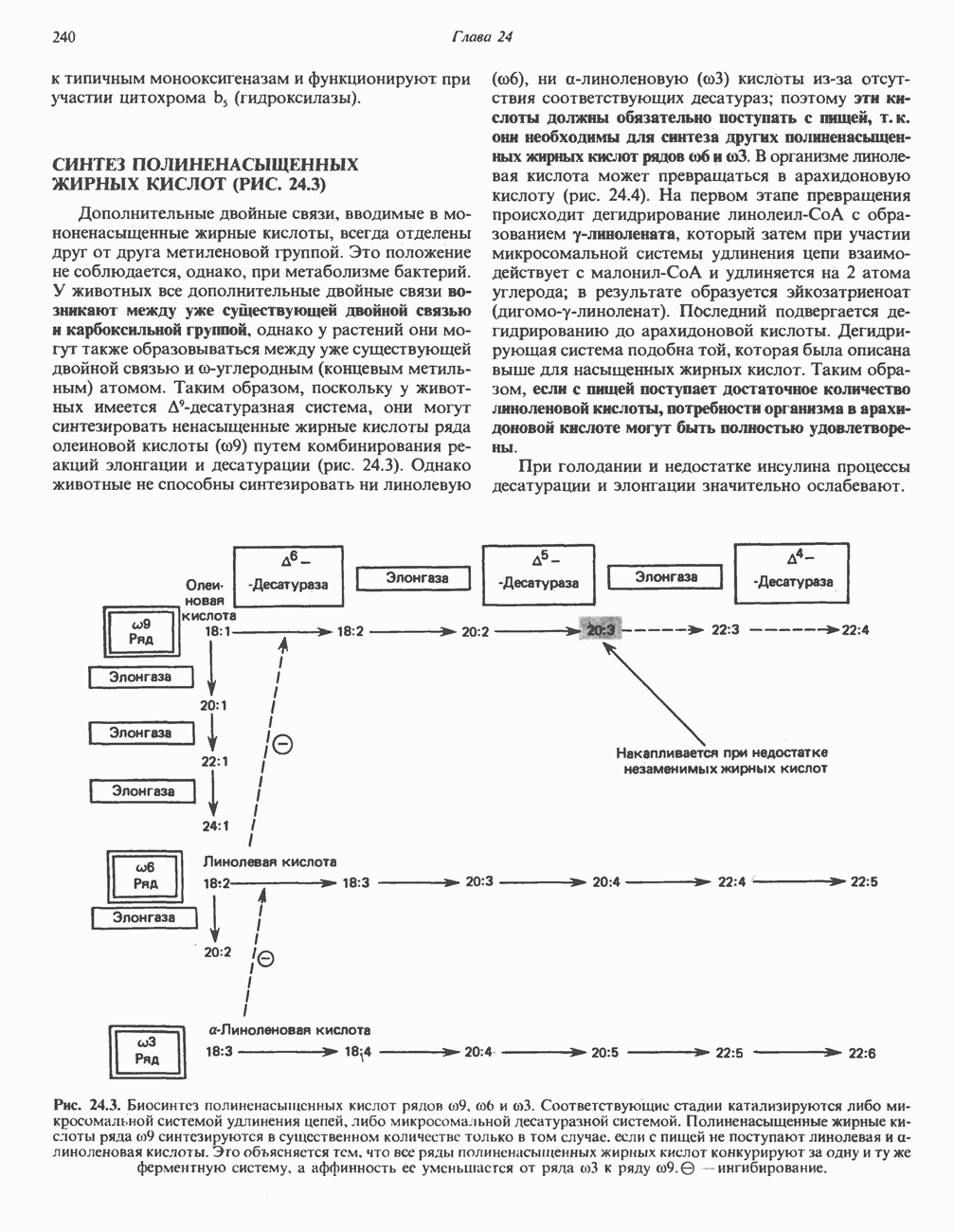
- СИНТЕЗ МОНОНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ, КАТАЛИЗИРУЕМЫЙ Д9-ДЕСАТУРАЗНОЙ СИСТЕМОЙ (РИС. 24.2)
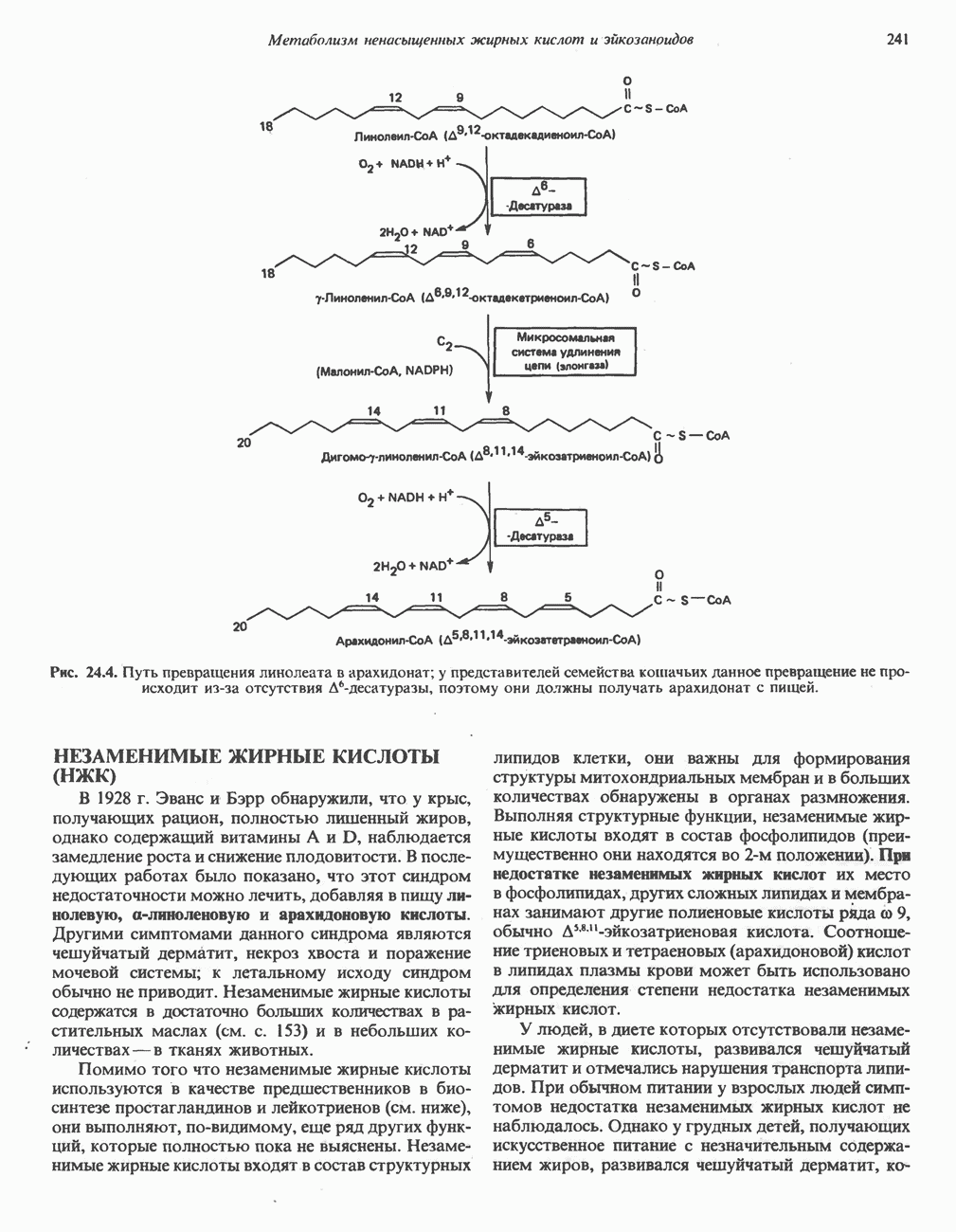
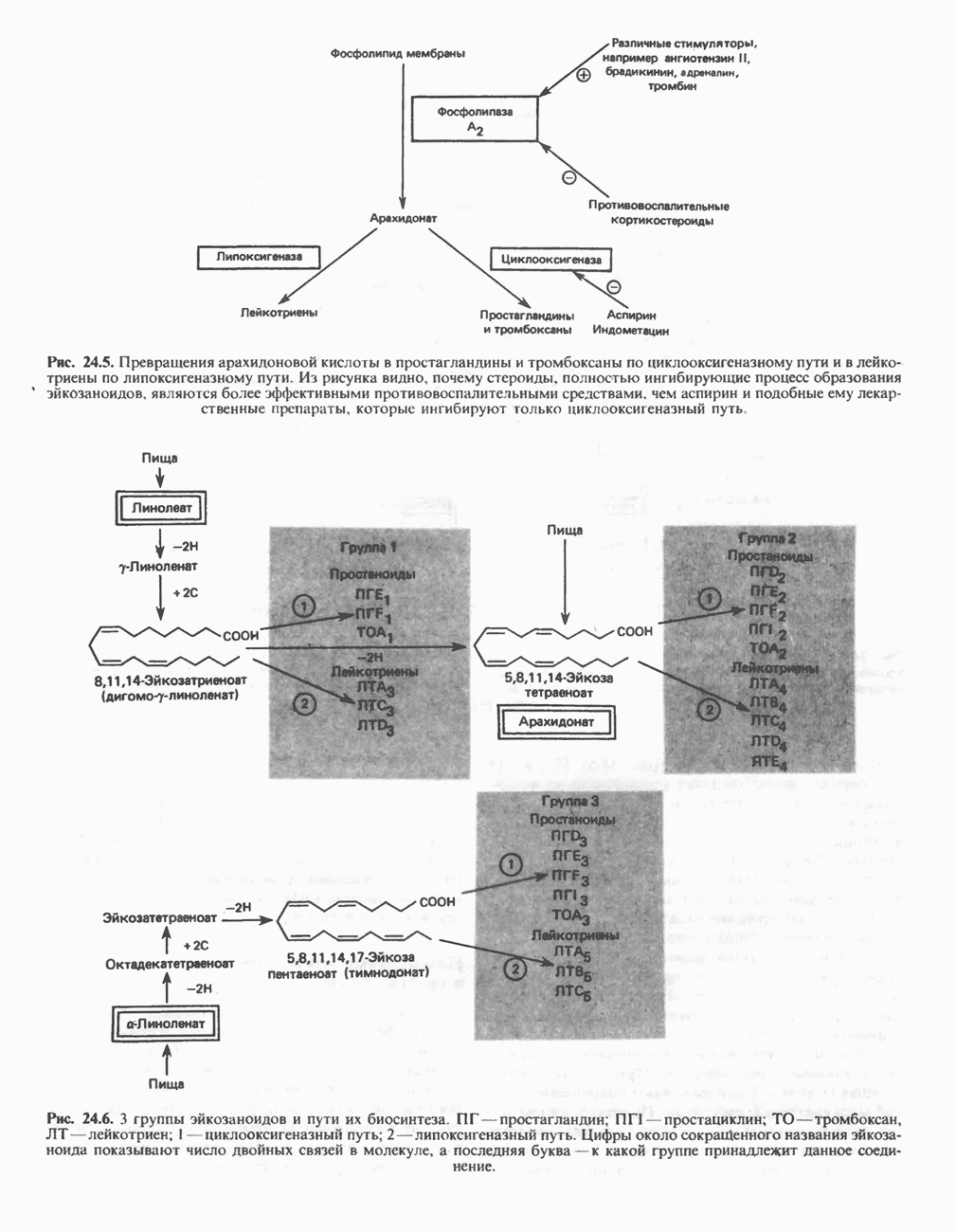
- СИНТЕЗ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ (РИС. 24.3)
- НЕЗАМЕНИМЫЕ ЖИРНЫЕ КИСЛОТЫ (НЖК)
- ЭЙКОЗАНОИДЫ
- ПРОСТАНОИДЫ
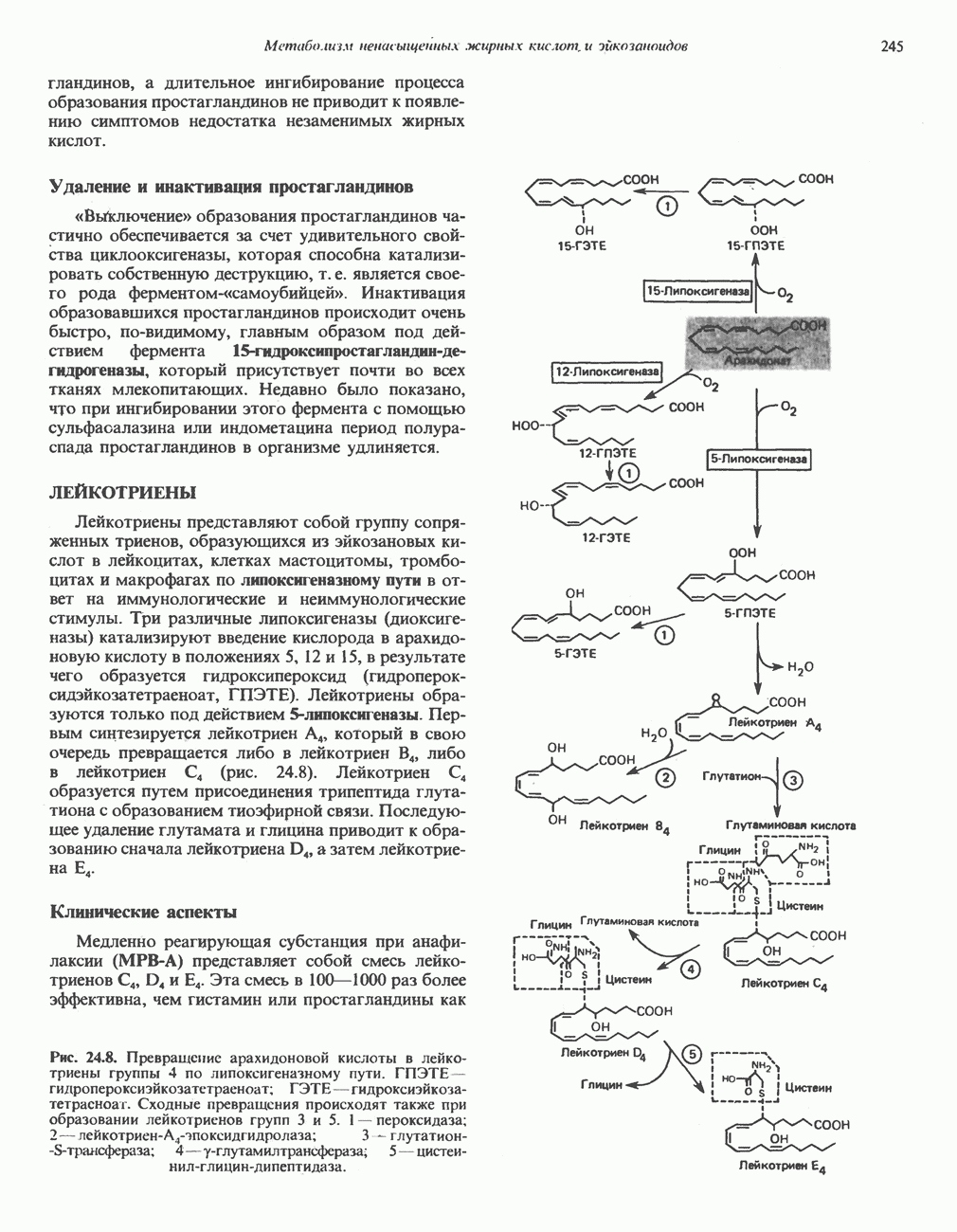
- ЛЕЙКОТРИЕНЫ
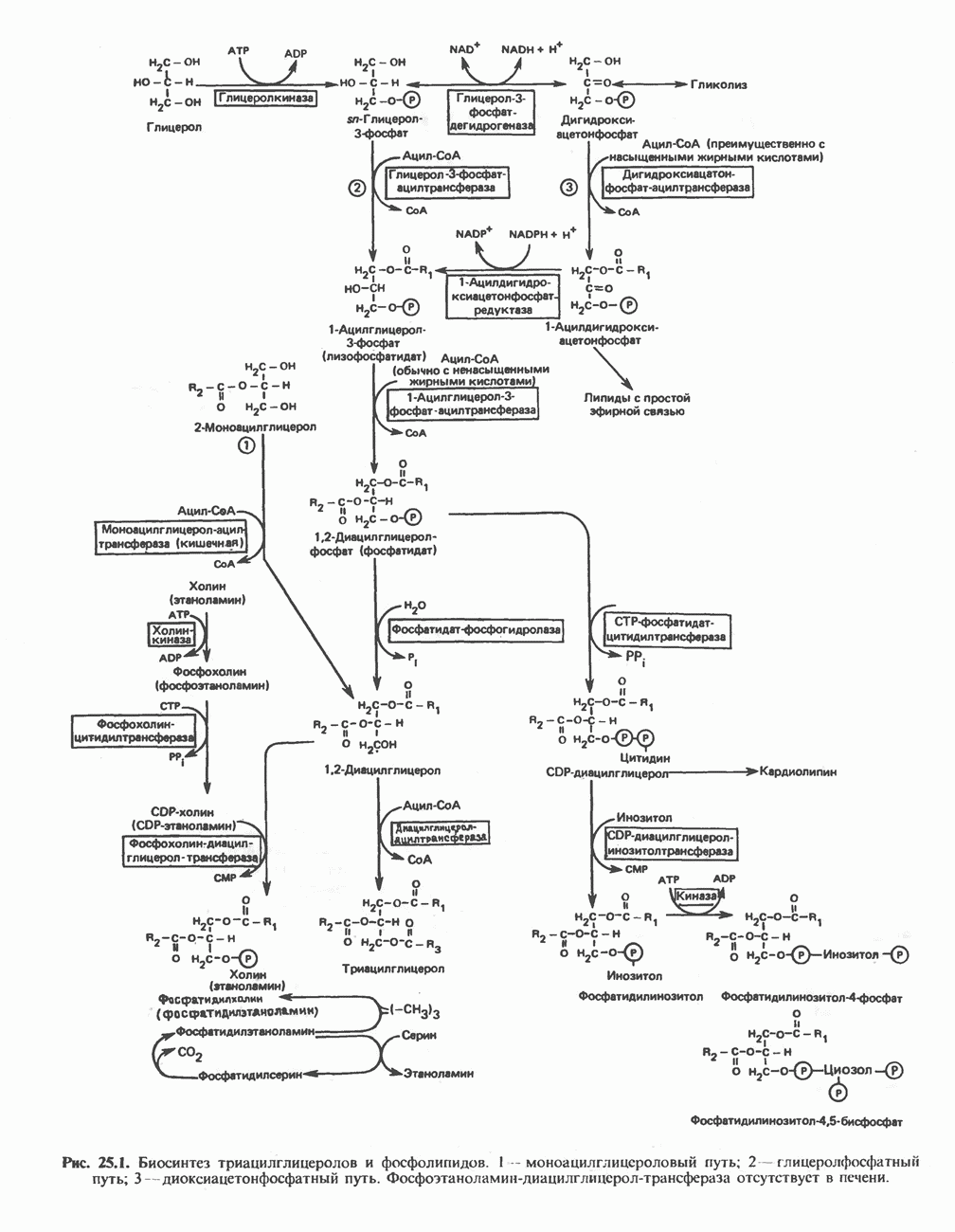
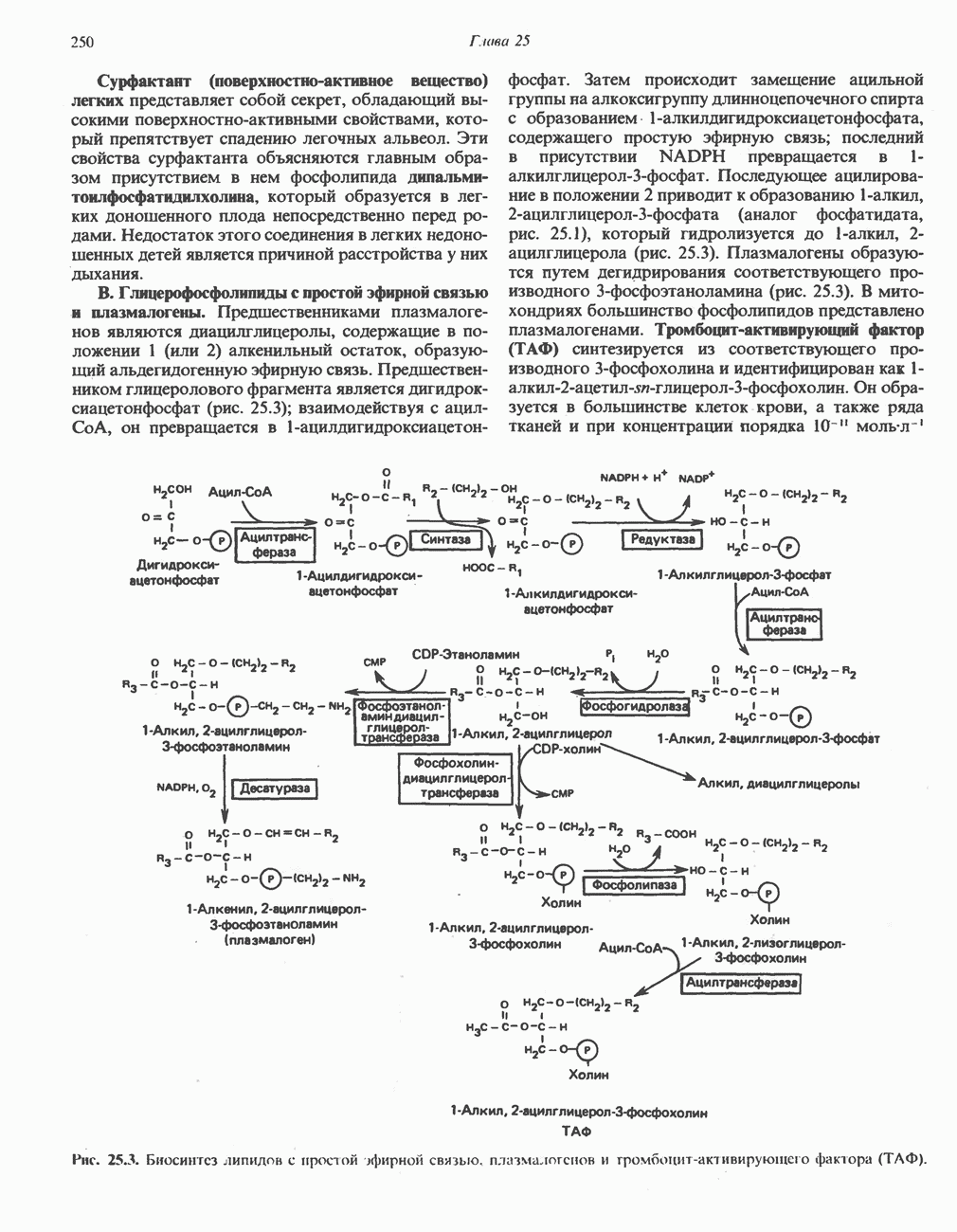
- Глава 25. Метаболизм ацилглицеролов и сфинголипидов
- МЕТАБОЛИЗМ АЦИЛГЛИЦЕРОЛОВ
- МЕТАБОЛИЗМ СФИНГОЛИПИДОВ
- ГЛИКОЛИПИДЫ
- ФОСФОЛИПИДЫ И СФИНГОЛИПИДЫ ПРИ НЕКОТОРЫХ ЗАБОЛЕВАНИЯХ (ЛИПИДОЗЫ)
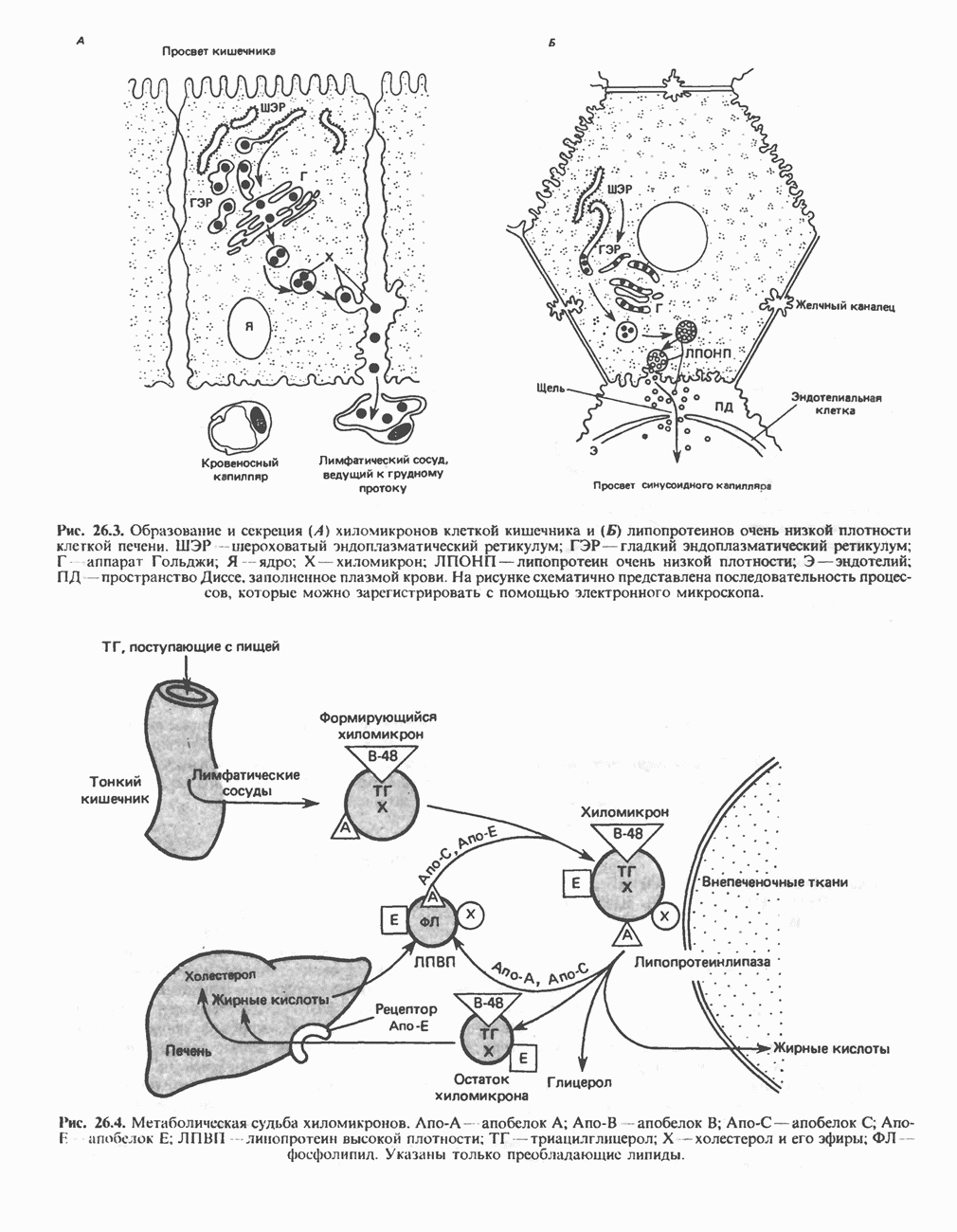
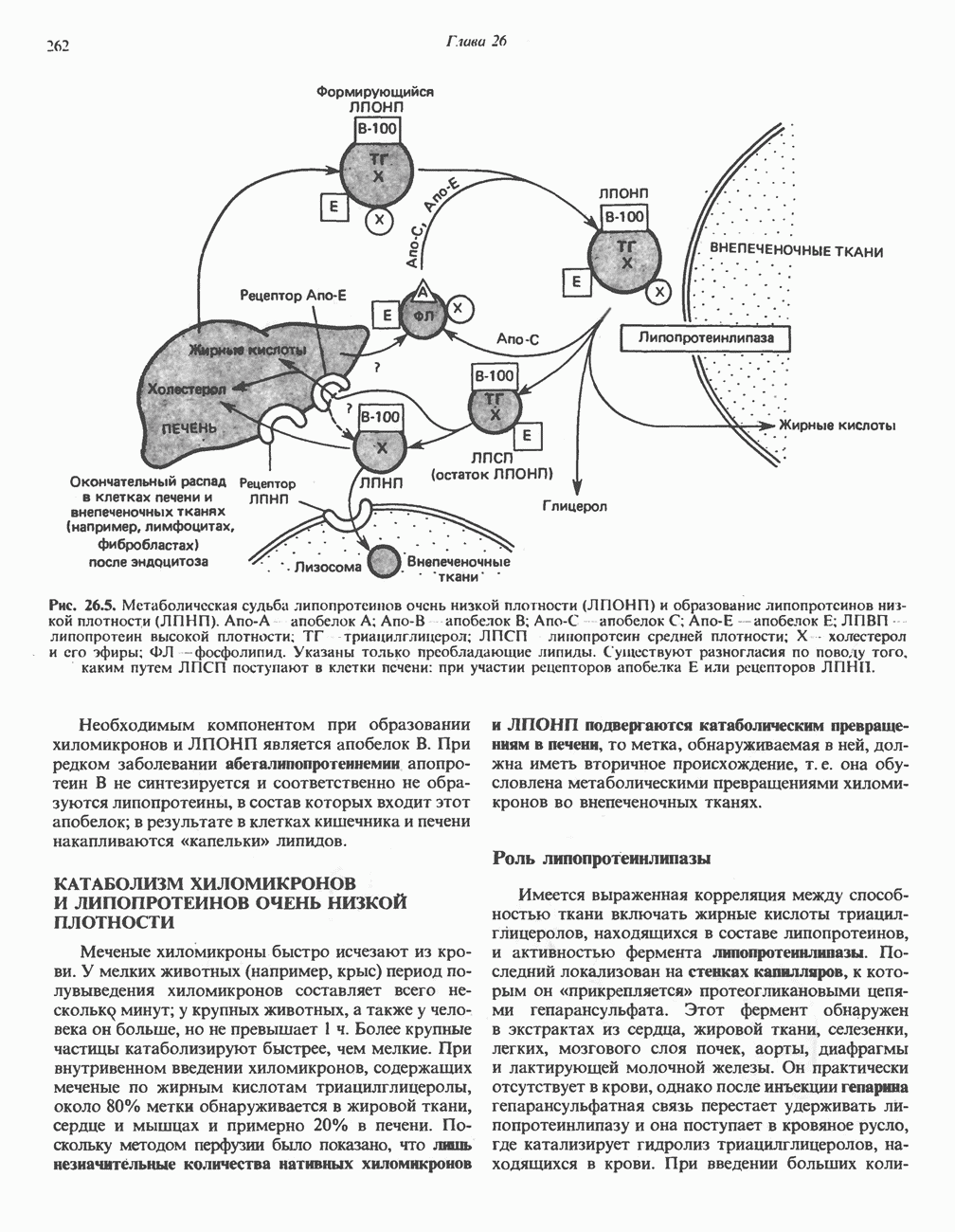
- Глава 26. Транспорт и запасание липидов
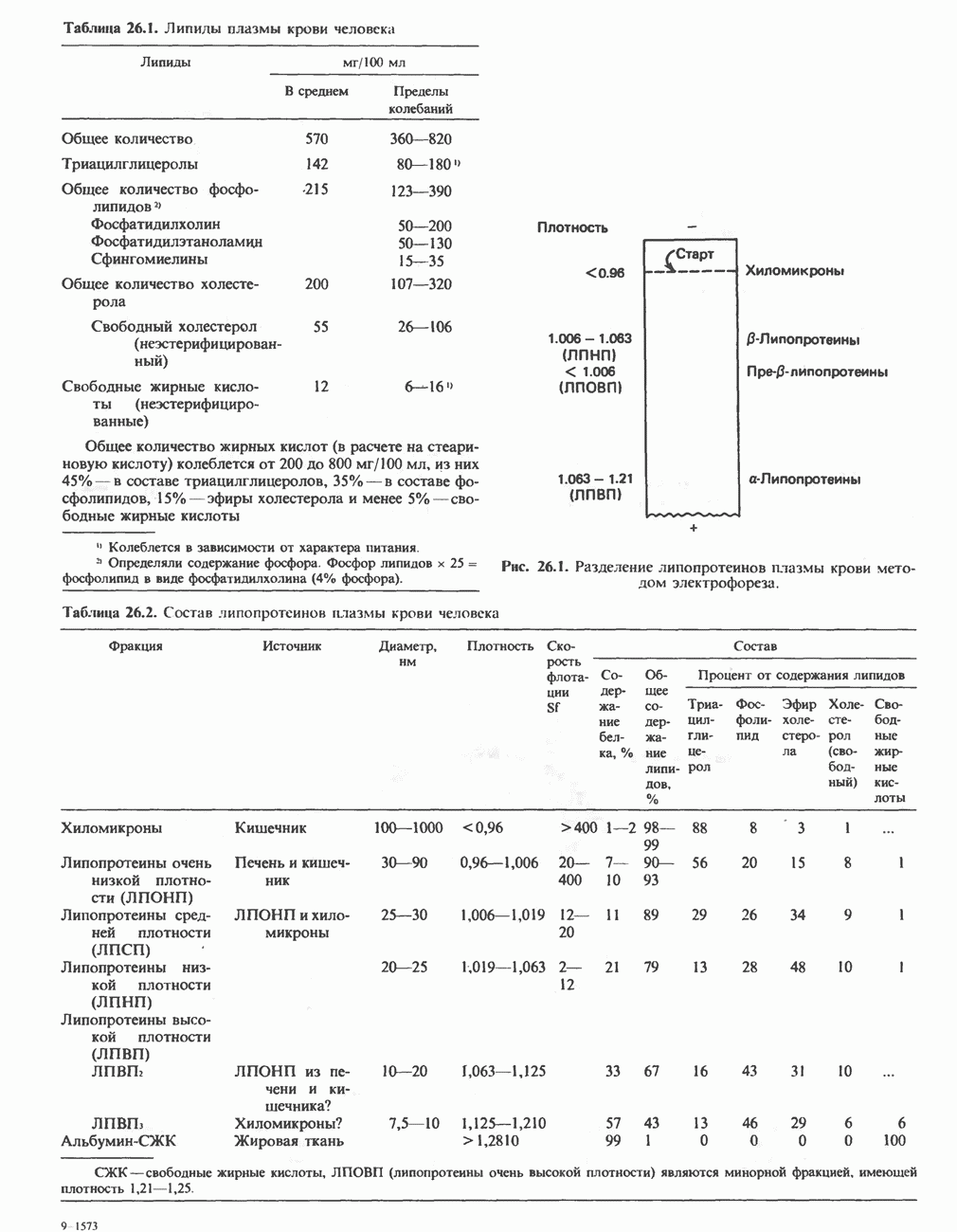
- ЛИПИДЫ ПЛАЗМЫ КРОВИ И ЛИПОПРОТЕИНЫ
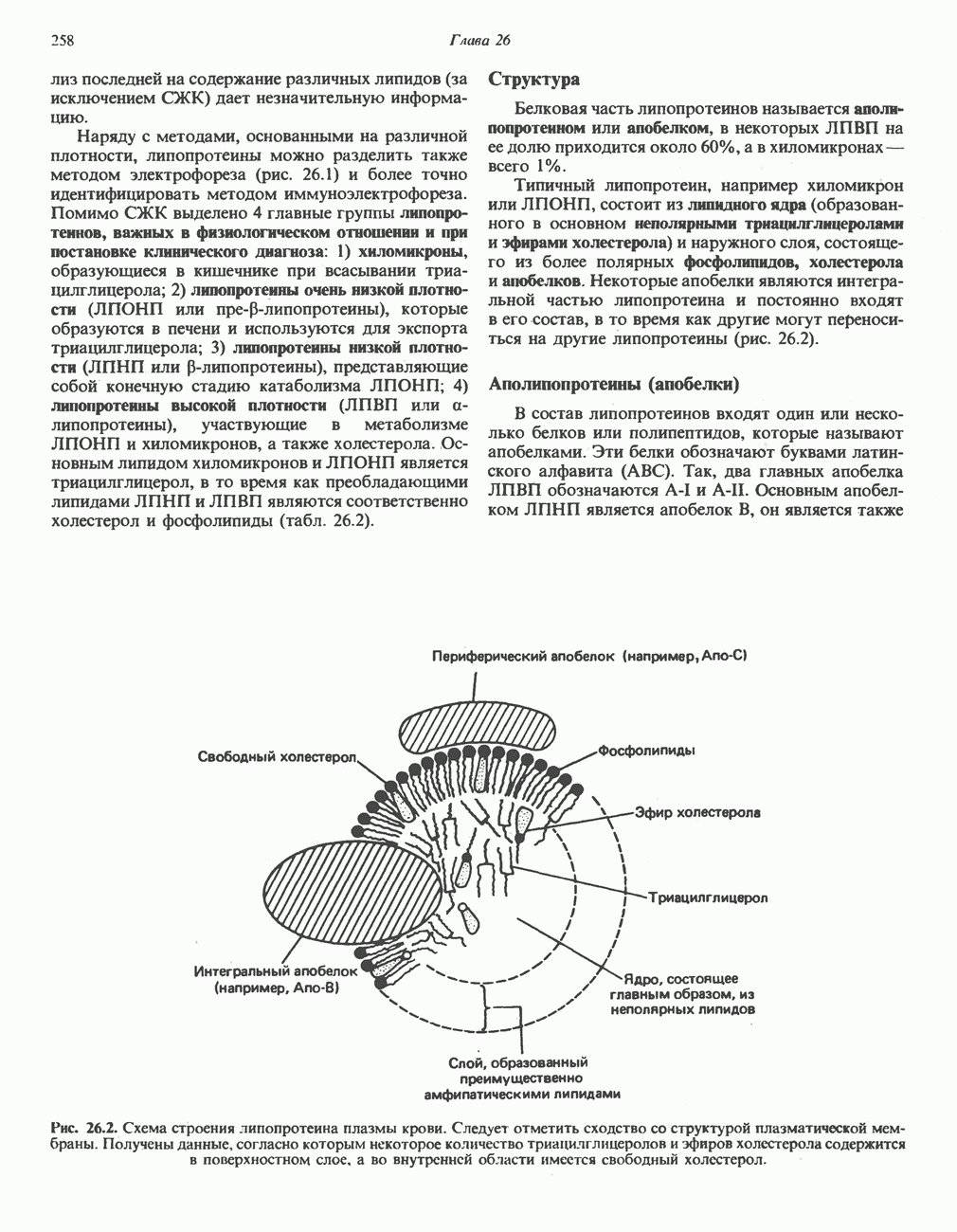
- МЕТАБОЛИЗМ ЛИПОПРОТЕИНОВ ПЛАЗМЫ КРОВИ
- ОБРАЗОВАНИЕ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ (ЛПОНП)
- КАТАБОЛИЗМ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ
- МЕТАБОЛИЗМ ЛПНП
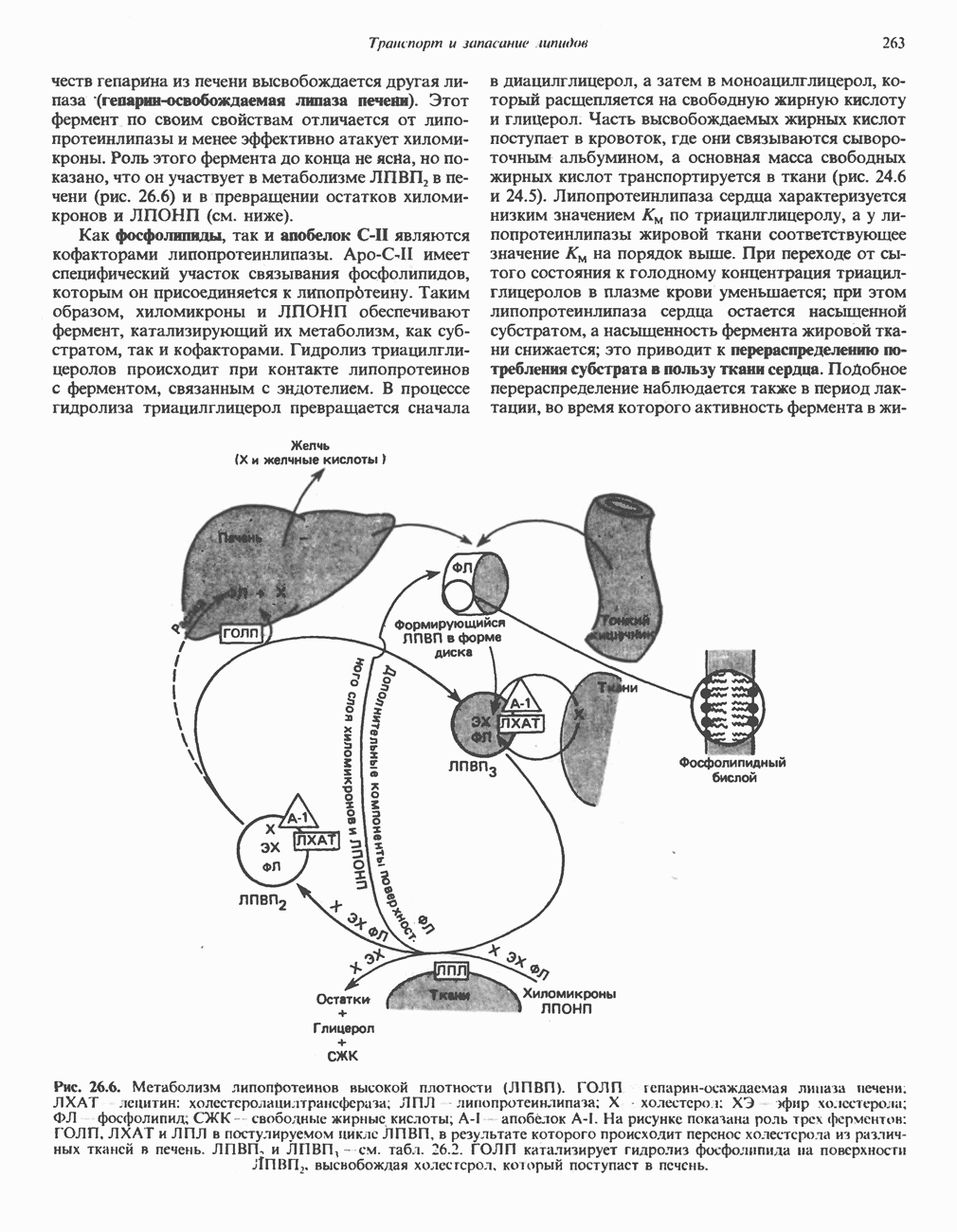
- МЕТАБОЛИЗМ ЛПВП (рис. 26.6)
- РОЛЬ ПЕЧЕНИ В ТРАНСПОРТЕ И МЕТАБОЛИЗМЕ ЛИПИДОВ
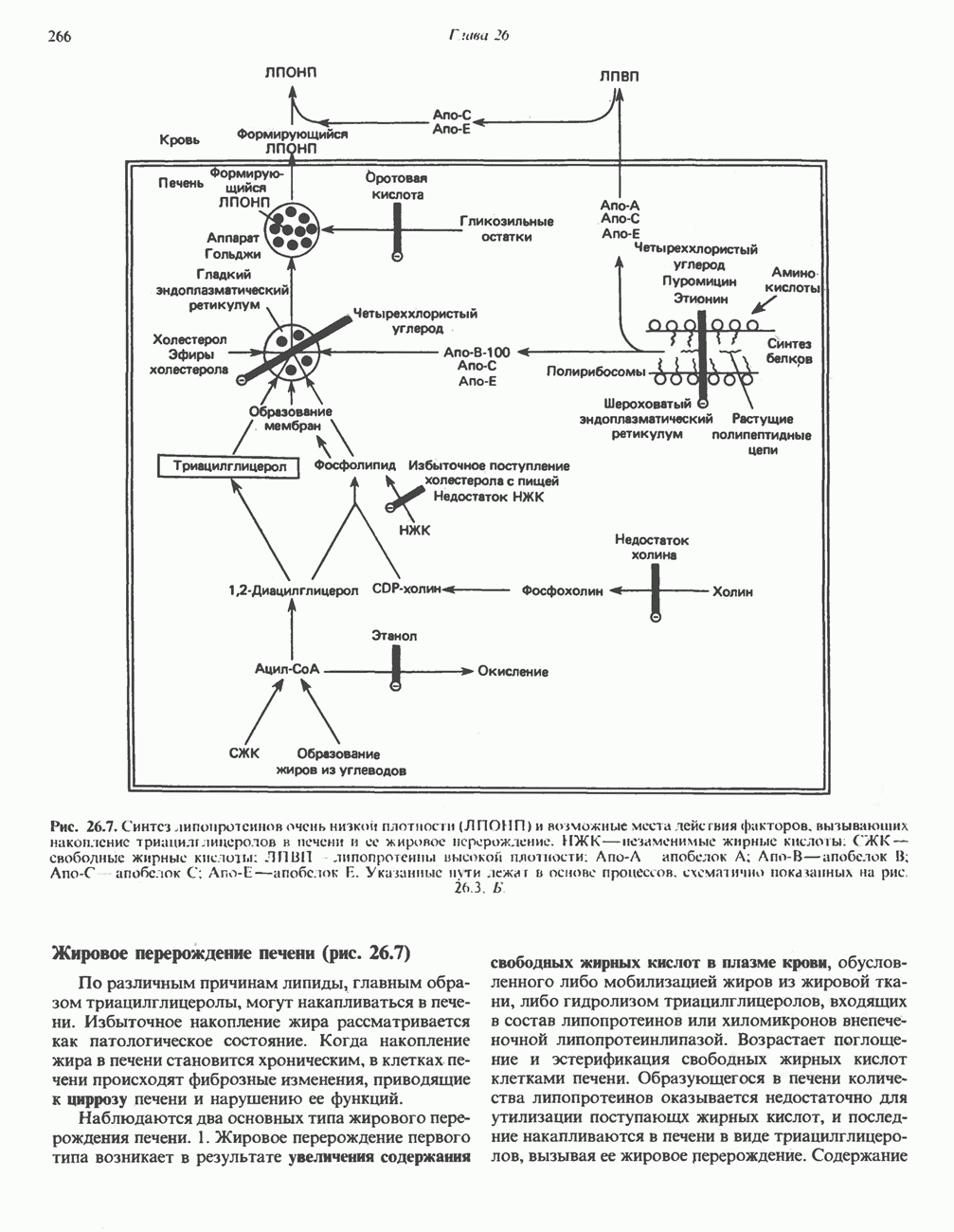
- СИНТЕЗ ТРИАЦИЛГЛИЦЕРОЛОВ И ОБРАЗОВАНИЕ ЛПОНП (рис. 26.7)
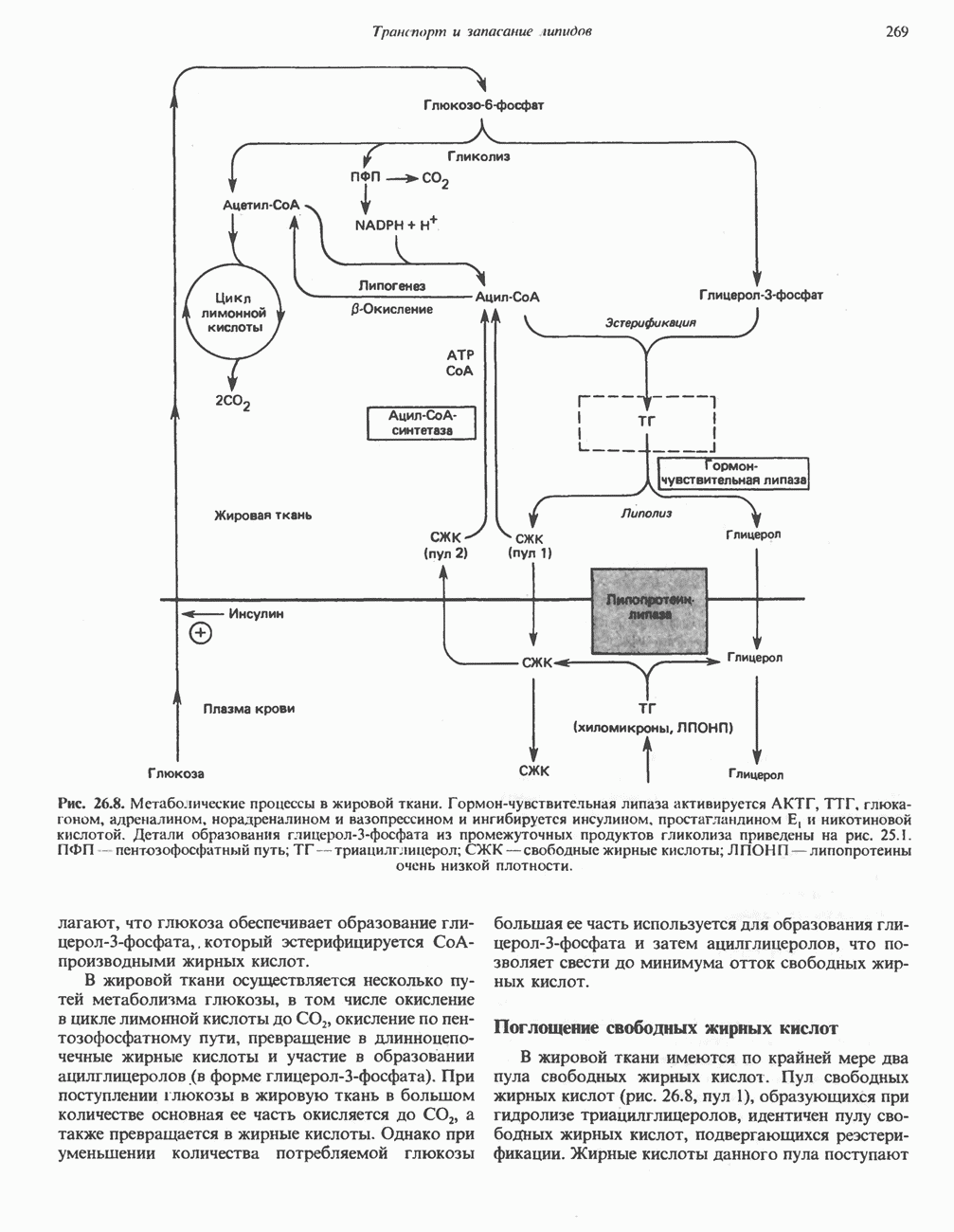
- МЕТАБОЛИЧЕСКИЕ ПРЕВРАЩЕНИЯ В ЖИРОВОЙ ТКАНИ И МОБИЛИЗАЦИЯ ЖИРОВ
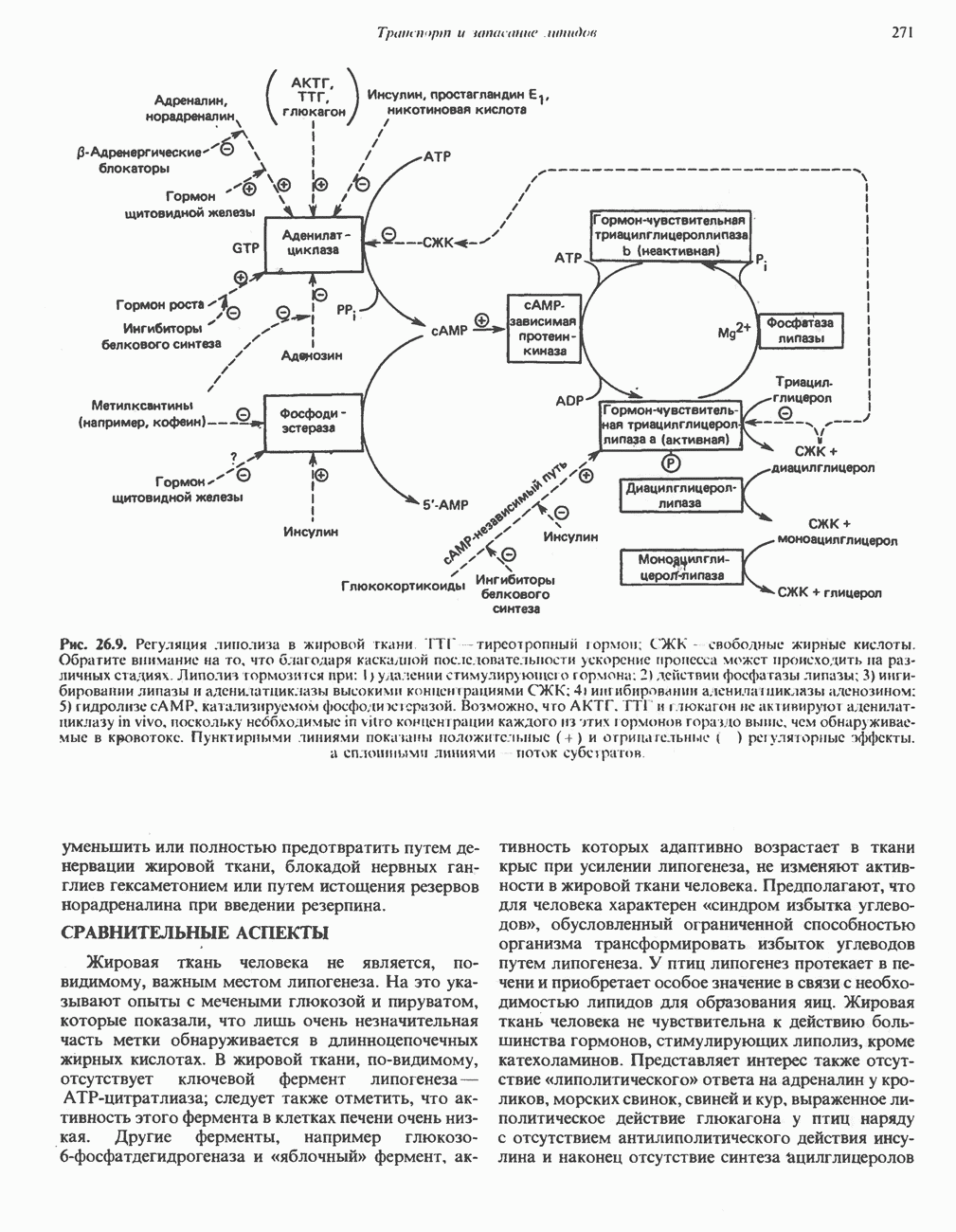
- РОЛЬ ГОРМОНОВ В МОБИЛИЗАЦИИ ЖИРОВ
- СРАВНИТЕЛЬНЫЕ АСПЕКТЫ
- РОЛЬ БУРОЙ ЖИРОВОЙ ТКАНИ В ТЕРМОГЕНЕЗЕ
- Глава 27. Синтез, транспорт и экскреция холестерола
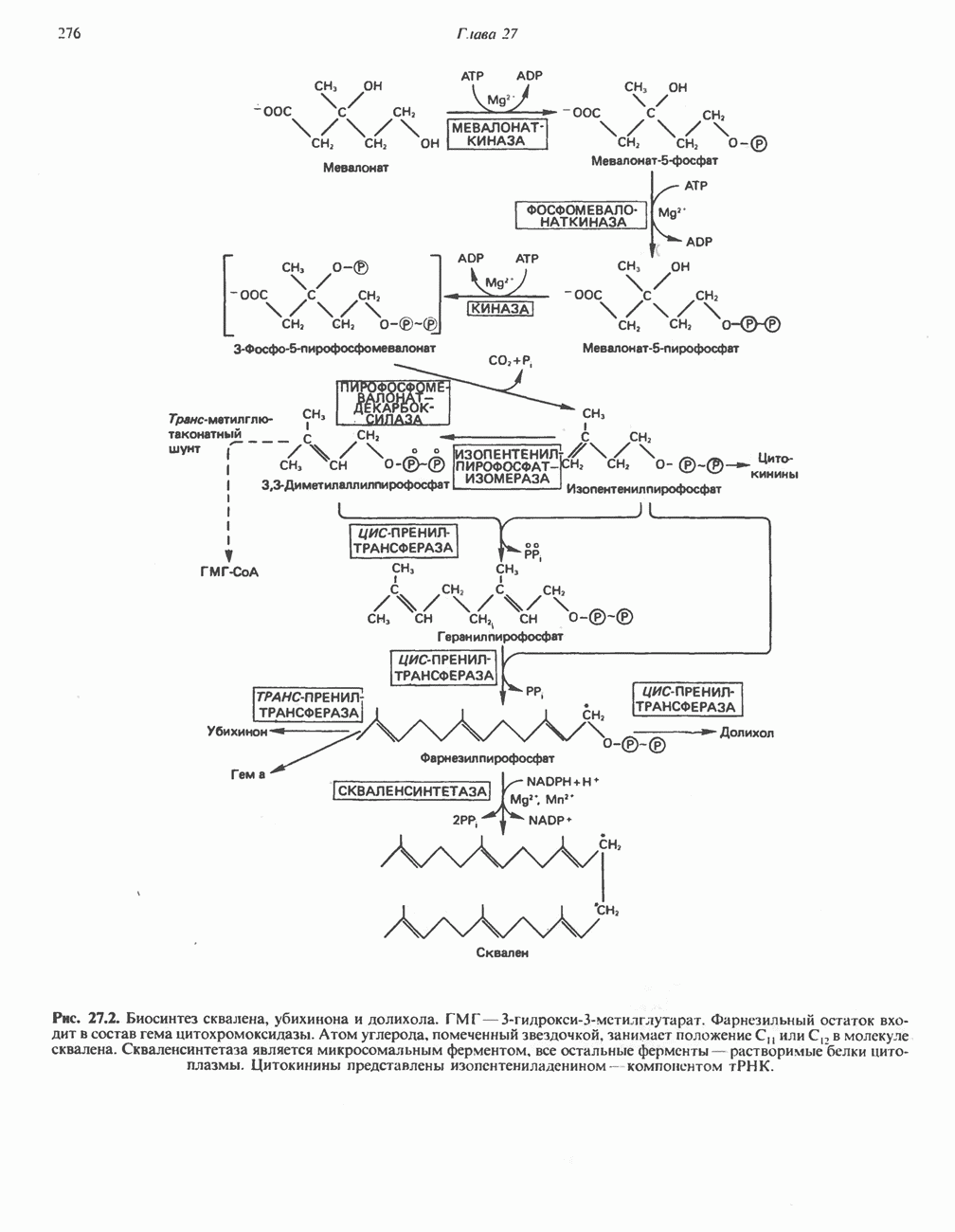
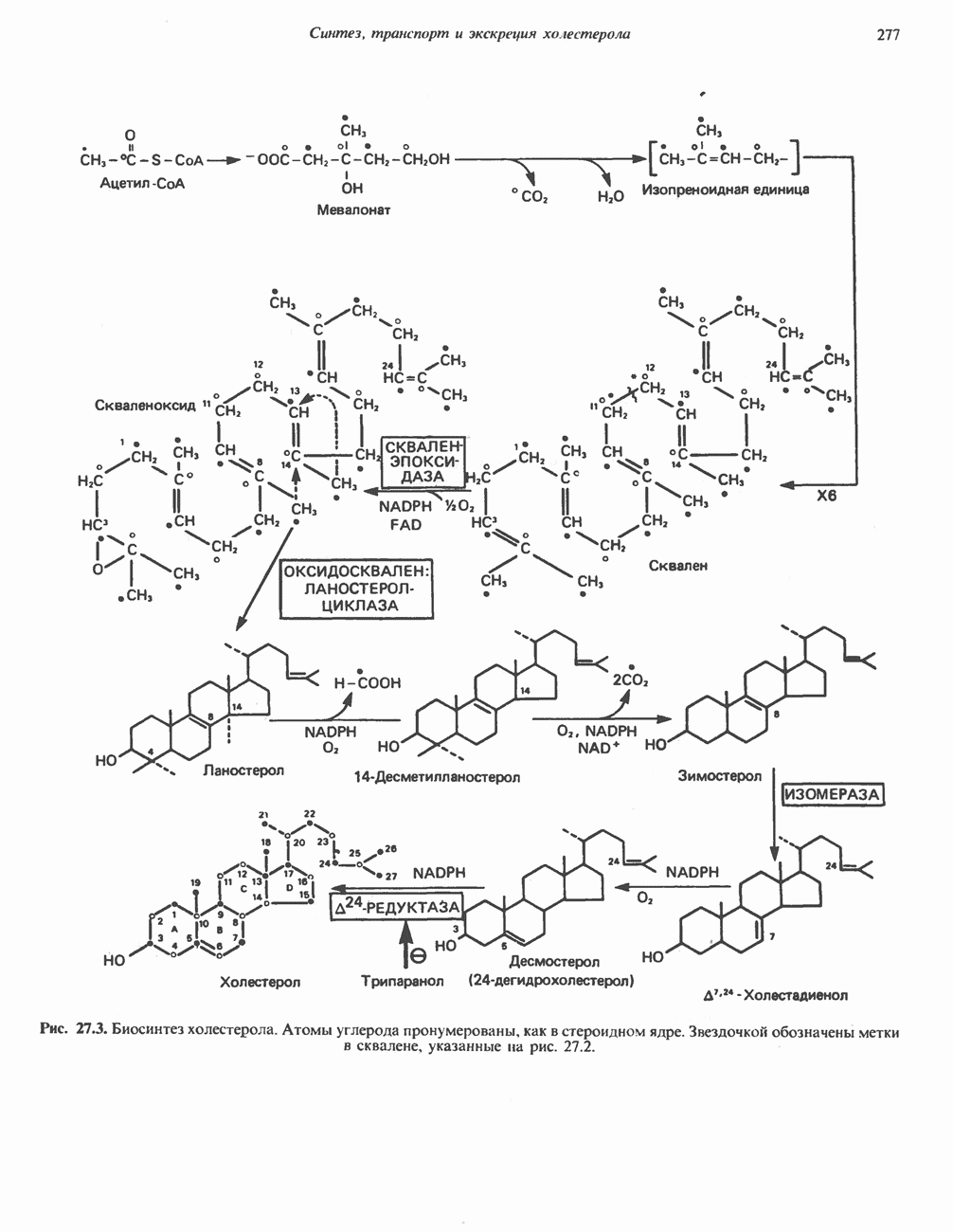
- БИОСИНТЕЗ ХОЛЕСТЕРОЛА
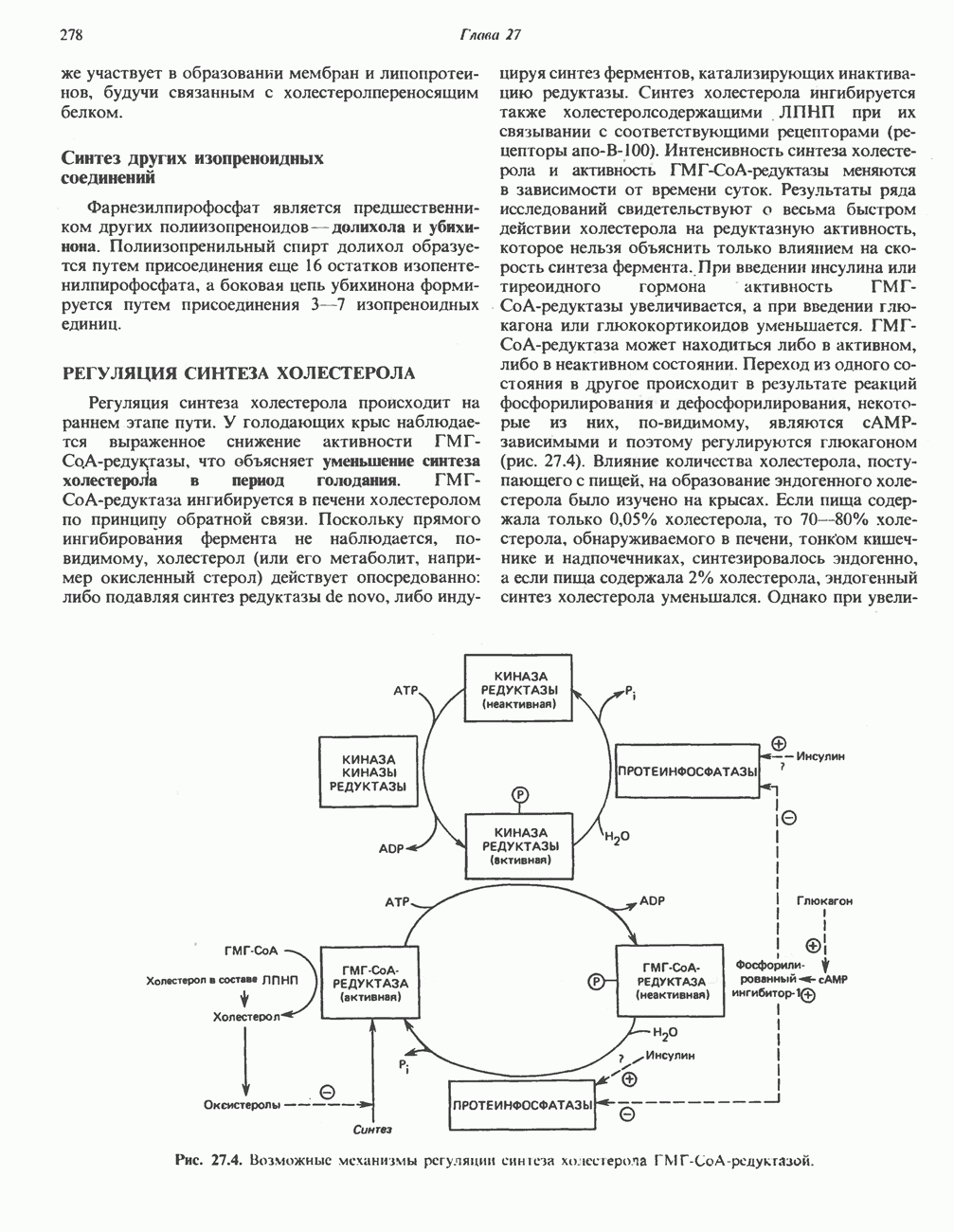
- РЕГУЛЯЦИЯ СИНТЕЗА ХОЛЕСТЕРОЛА
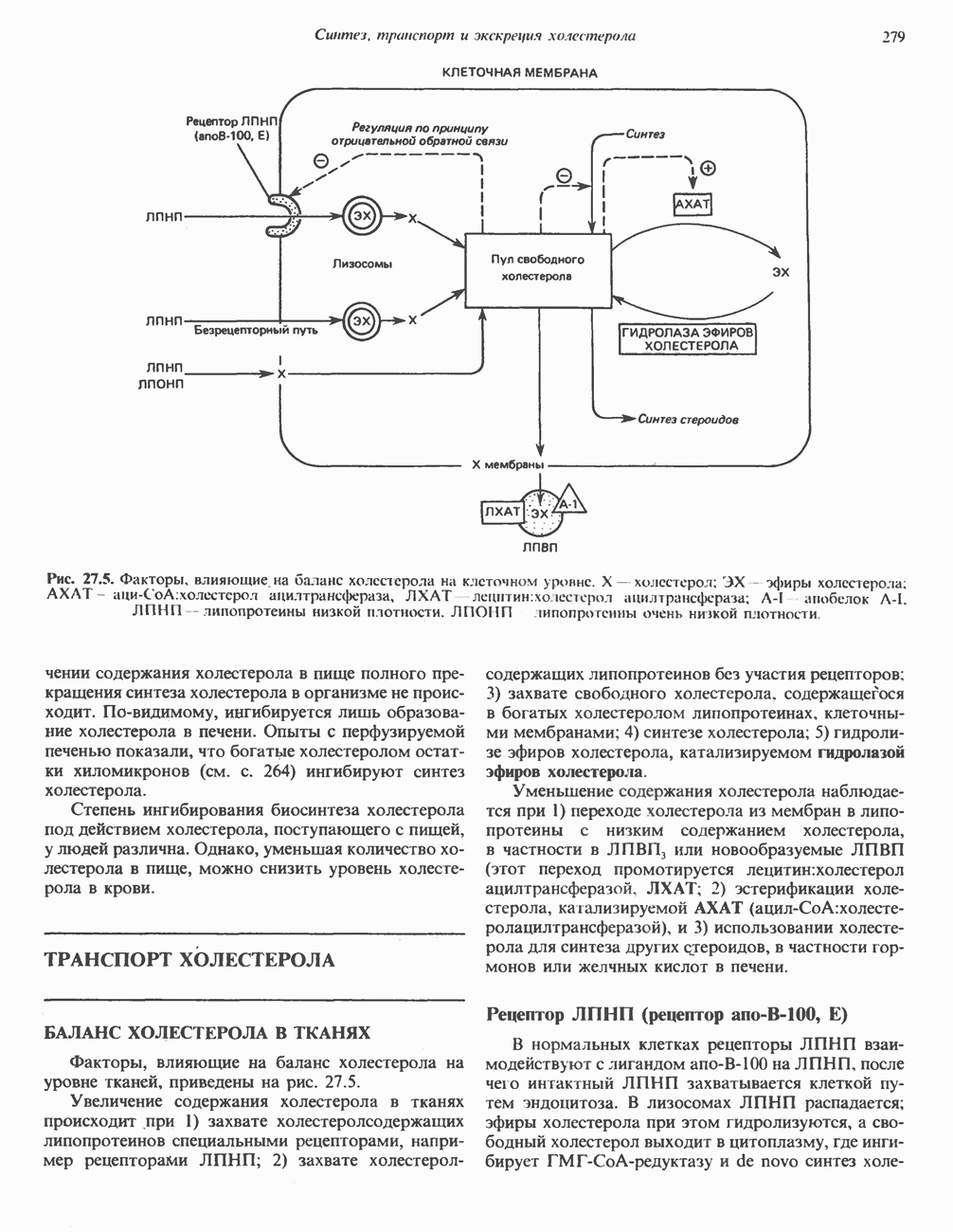
- ТРАНСПОРТ ХОЛЕСТЕРОЛА
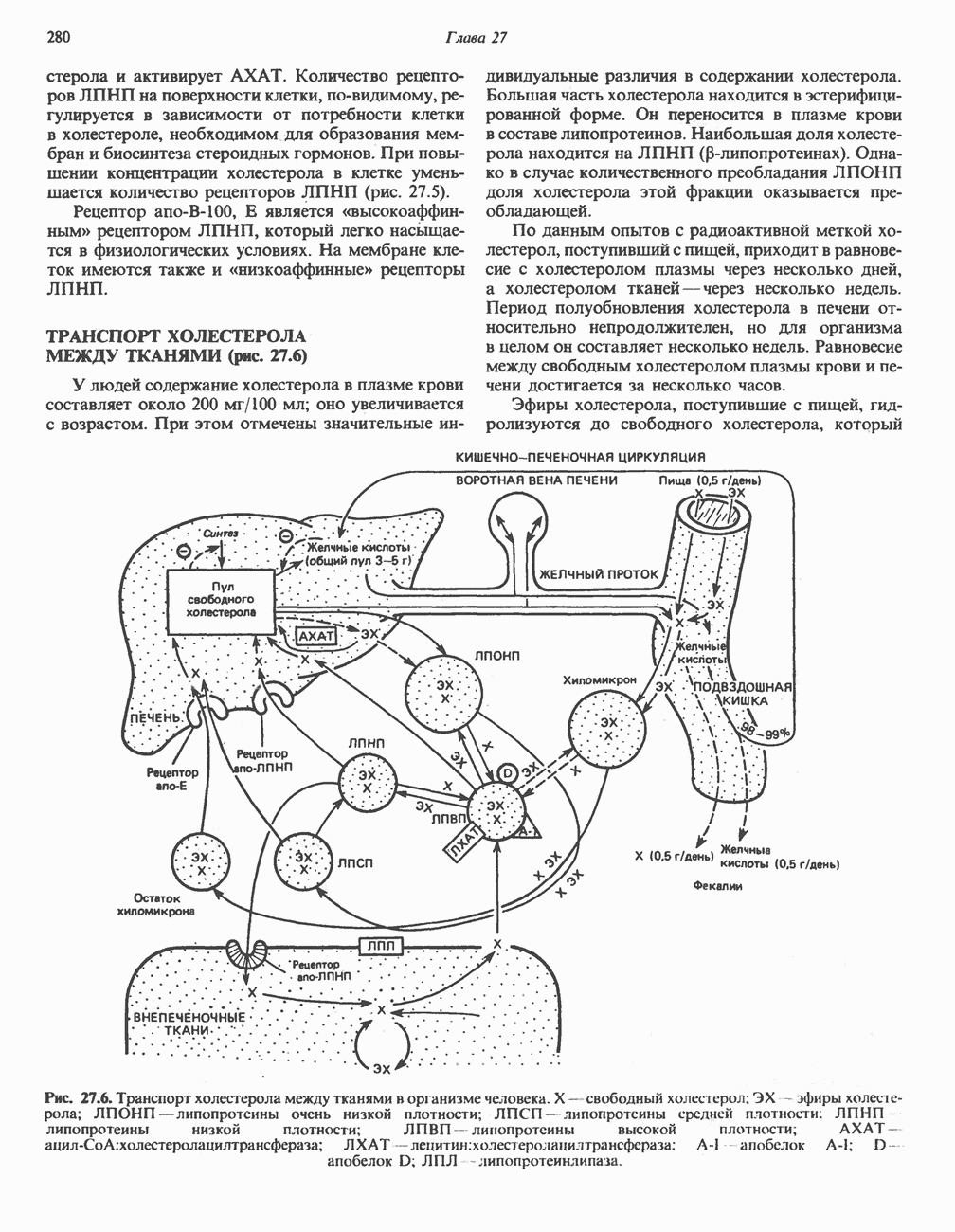
- ТРАНСПОРТ ХОЛЕСТЕРОЛА МЕЖДУ ТКАНЯМИ (рис. 27.6)
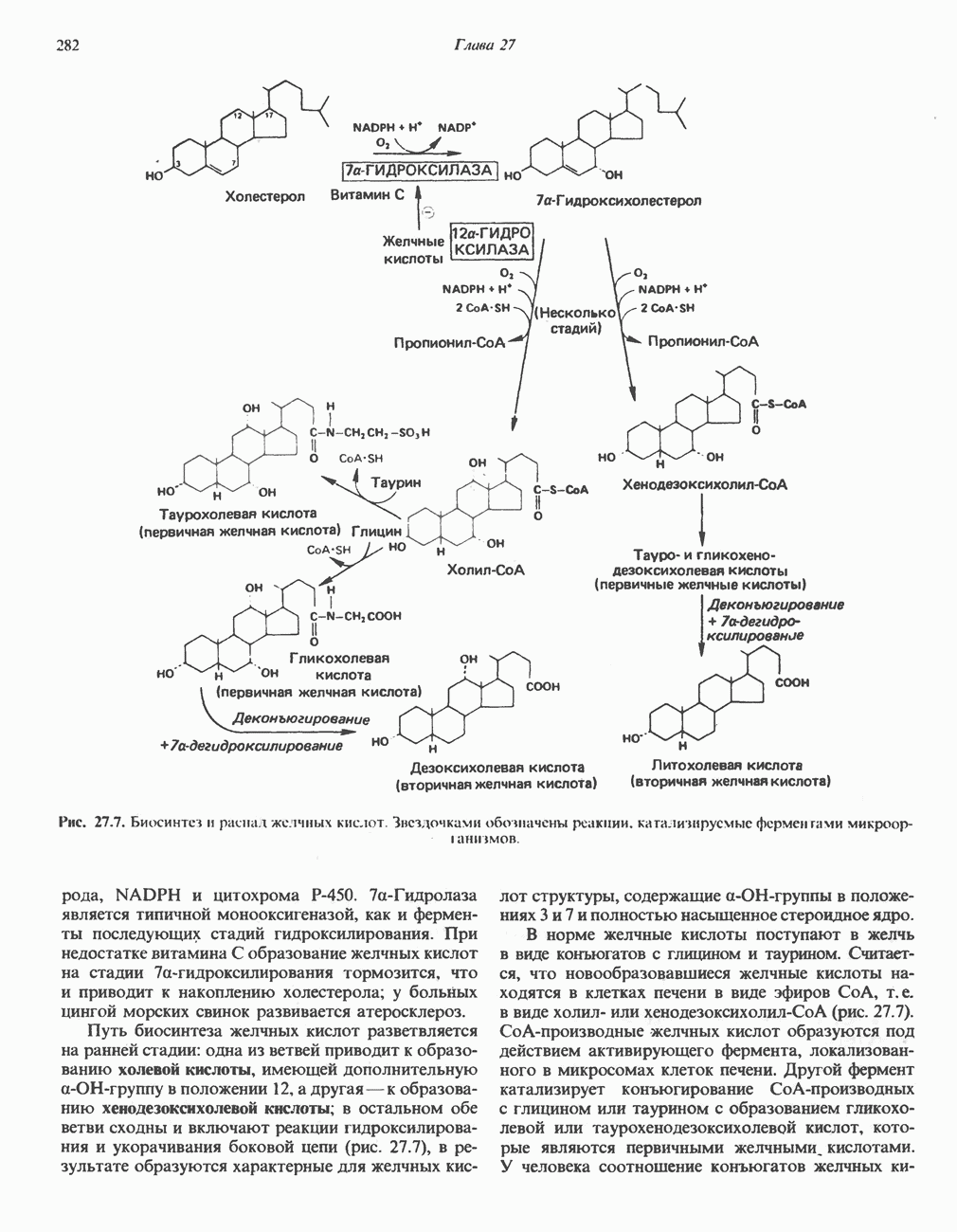
- ВЫВЕДЕНИЕ ХОЛЕСТЕРОЛА И ОБРАЗОВАНИЕ СОЛЕЙ ЖЕЛЧНЫХ КИСЛОТ
- КИШЕЧНО-ПЕЧЕНОЧНАЯ ЦИРКУЛЯЦИЯ ЖЕЛЧНЫХ КИСЛОТ
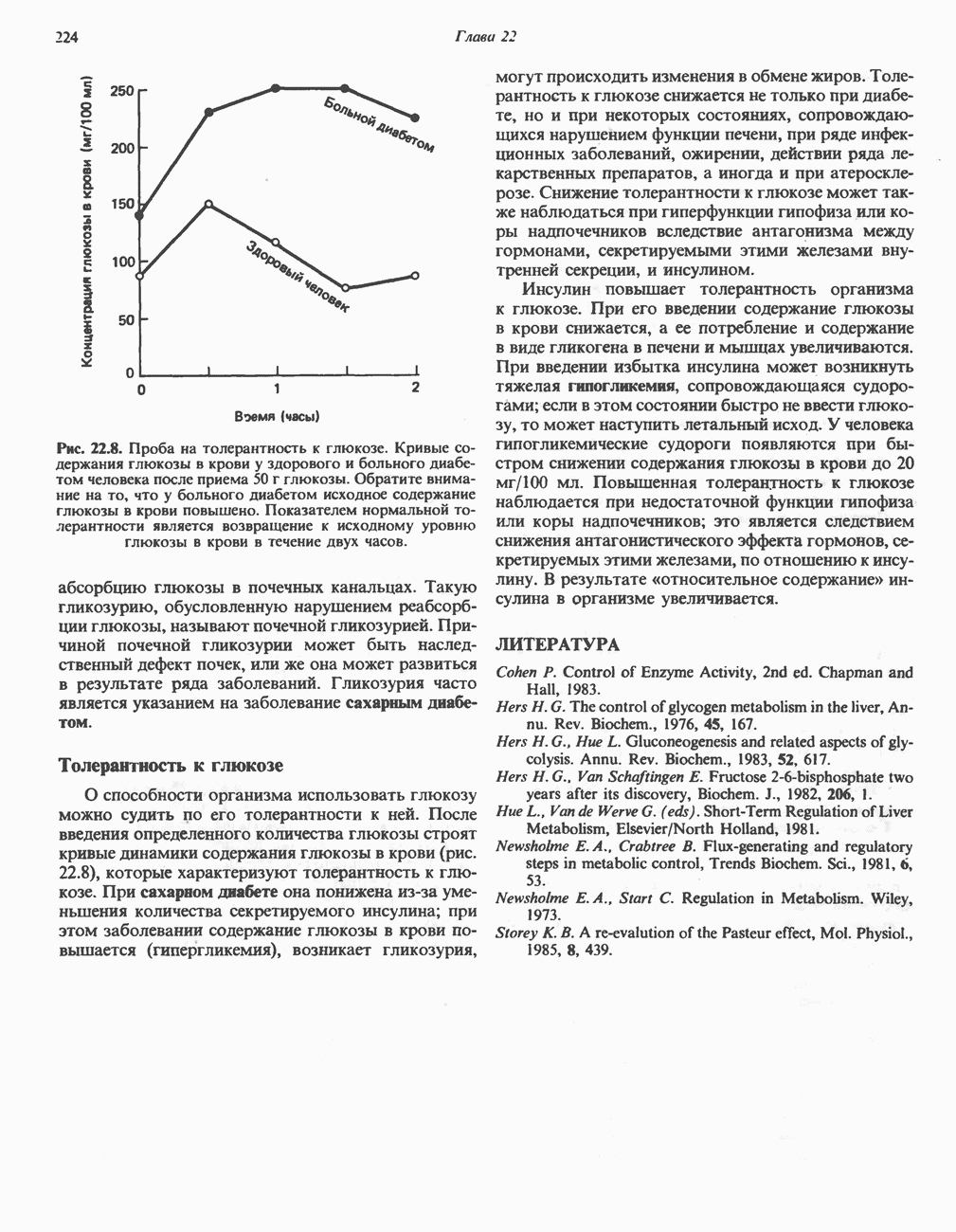
- КЛИНИЧЕСКИЕ АСПЕКТЫ
- Глава 28. Регуляция метаболизма липидов и источники энергии в тканях
- РЕГУЛЯЦИЯ БИОСИНТЕЗА ЖИРНЫХ КИСЛОТ (ЛИПОГЕНЕЗА)
- МОЛЕКУЛЯРНЫЕ ФАКТОРЫ, РЕГУЛИРУЮЩИЕ ЛИПОГЕНЕЗ
- РЕГУЛЯЦИЯ ОКИСЛЕНИЯ ЖИРНЫХ КИСЛОТ
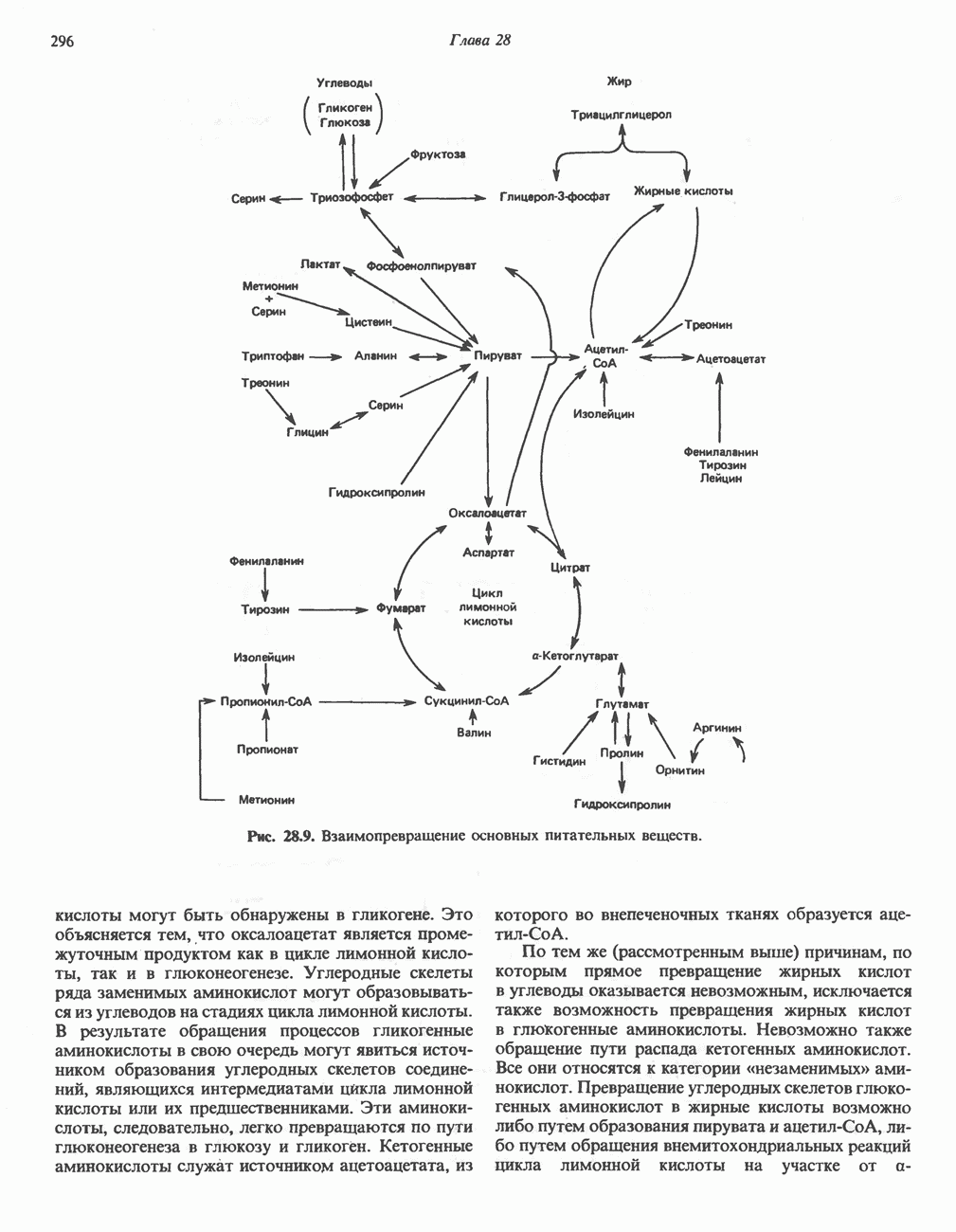
- ВЗАИМНОЕ ПРЕВРАЩЕНИЕ ОСНОВНЫХ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ (рис. 28.9)
- ЭКОНОМИКА УГЛЕВОДНОГО И ЛИПИДНОГО ОБМЕНА В ОРГАНИЗМЕ
- ГОЛОДАНИЕ
- Раздел III. Метаболизм белков и аминокислот
- Глава 29. Биосинтез аминокислот
- БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ
- БИОСИНТЕЗ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ
- Глава 30. Катаболизм азота аминокислот
- ПЕРЕАМИНИРОВАНИЕ
- ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ
- ОБРАЗОВАНИЕ АММИАКА
- ТРАНСПОРТ АММИАКА
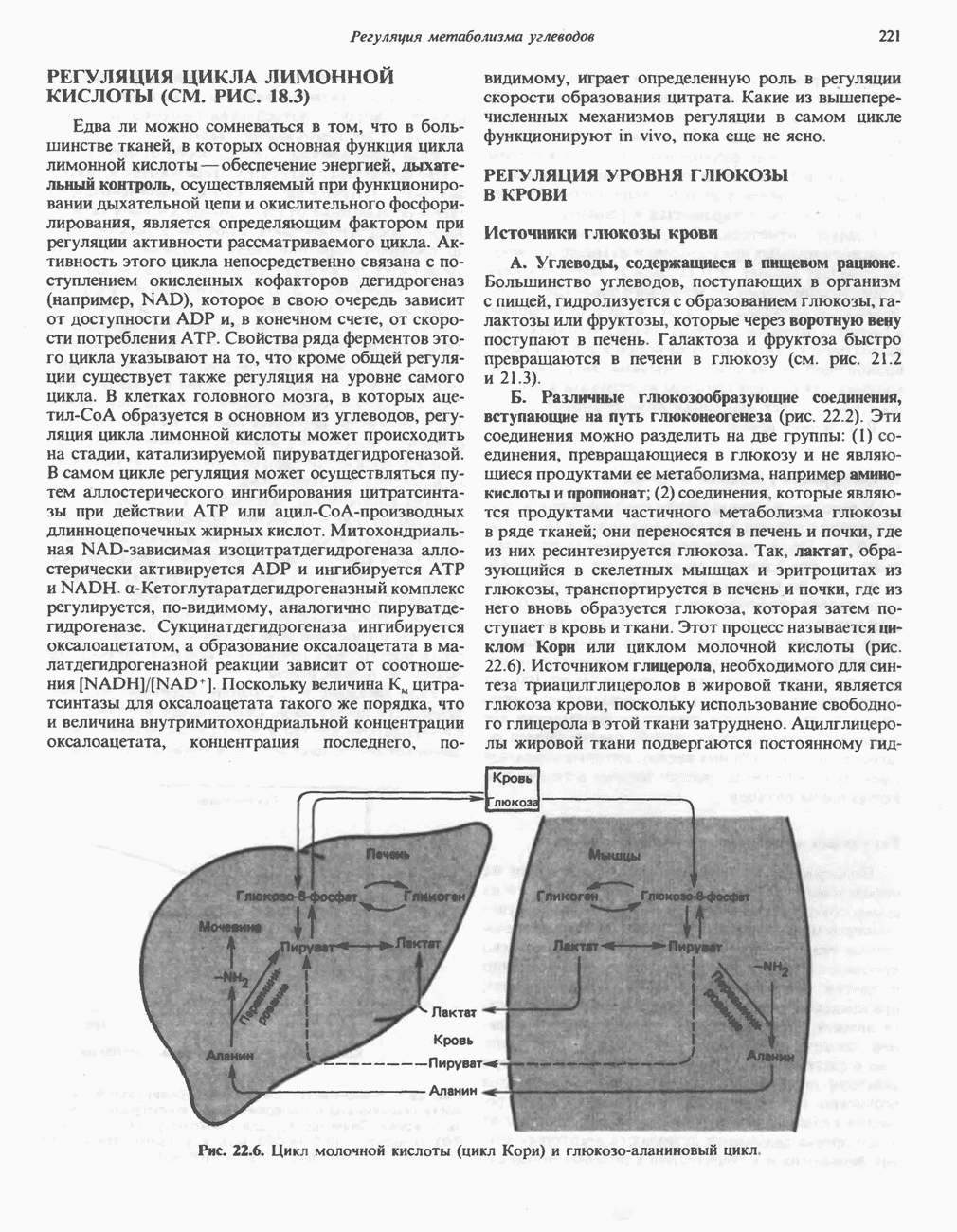
- ОБМЕН АМИНОКИСЛОТАМИ МЕЖДУ ОРГАНАМИ В ПОСТАБСОРБТИВНОМ СОСТОЯНИИ
- ОБМЕН АМИНОКИСЛОТ МЕЖДУ ОРГАНАМИ ПОСЛЕ ПРИЕМА ПИЩИ
- БИОСИНТЕЗ МОЧЕВИНЫ
- РЕГУЛЯЦИЯ СИНТЕЗА МОЧЕВИНЫ
- МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ ЦИКЛА МОЧЕВИНЫ
- Глава 31. Катаболизм углеродного скелета аминокислот
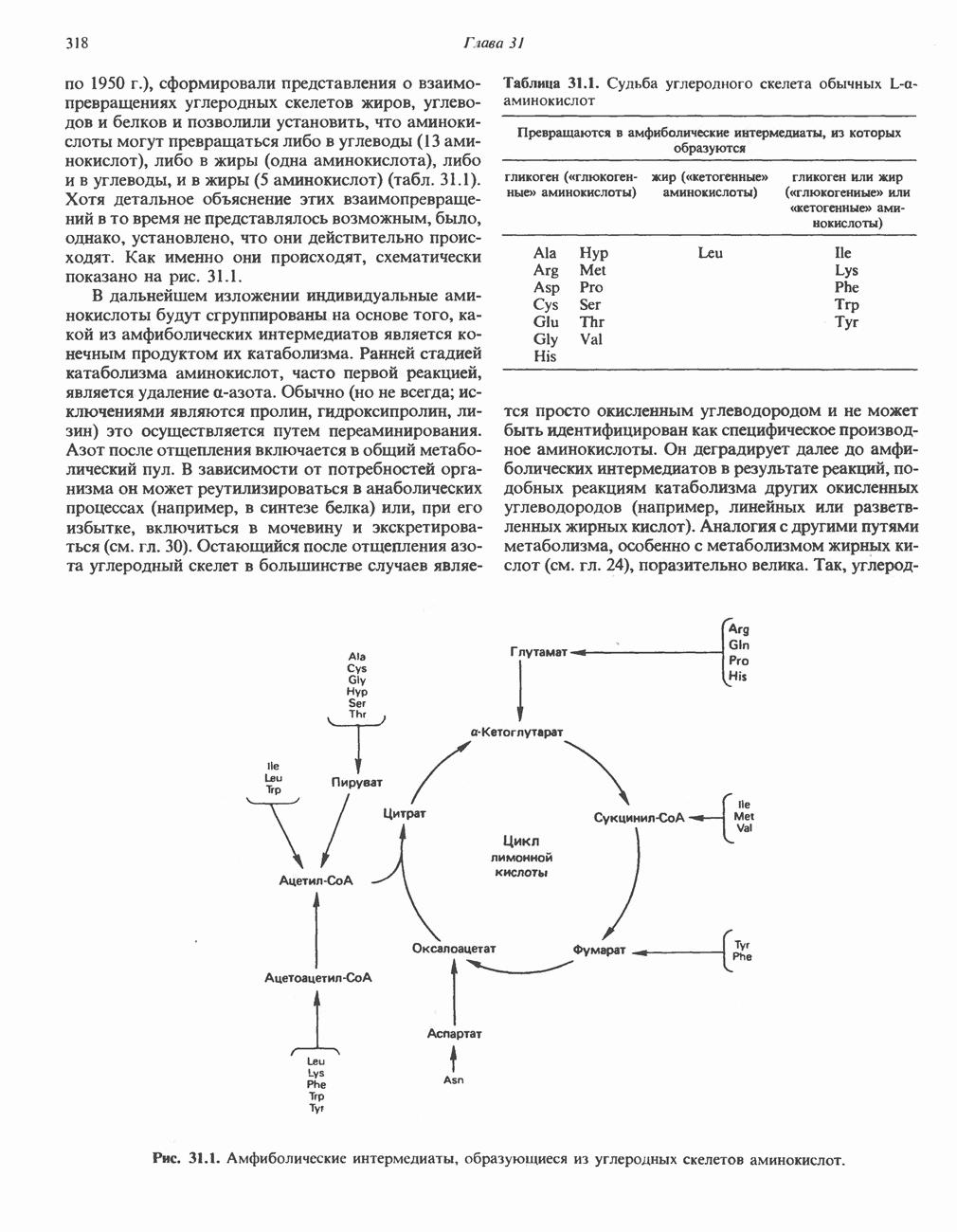
- ПРЕВРАЩЕНИЕ УГЛЕРОДНОГО СКЕЛЕТА ОБЫЧНЫХ L-a-АМИНОКИСЛОТ В АМФИБОЛИЧЕСКИЕ ИНТЕРМЕДИАТЫ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ОКСАЛОАЦЕТАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ а-КЕТОГЛУТАРАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ПИРУВАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ АЦЕТИЛ-КОФЕРМЕНТ А
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ СУКЦИНИЛ-КОФЕРМЕНТ А
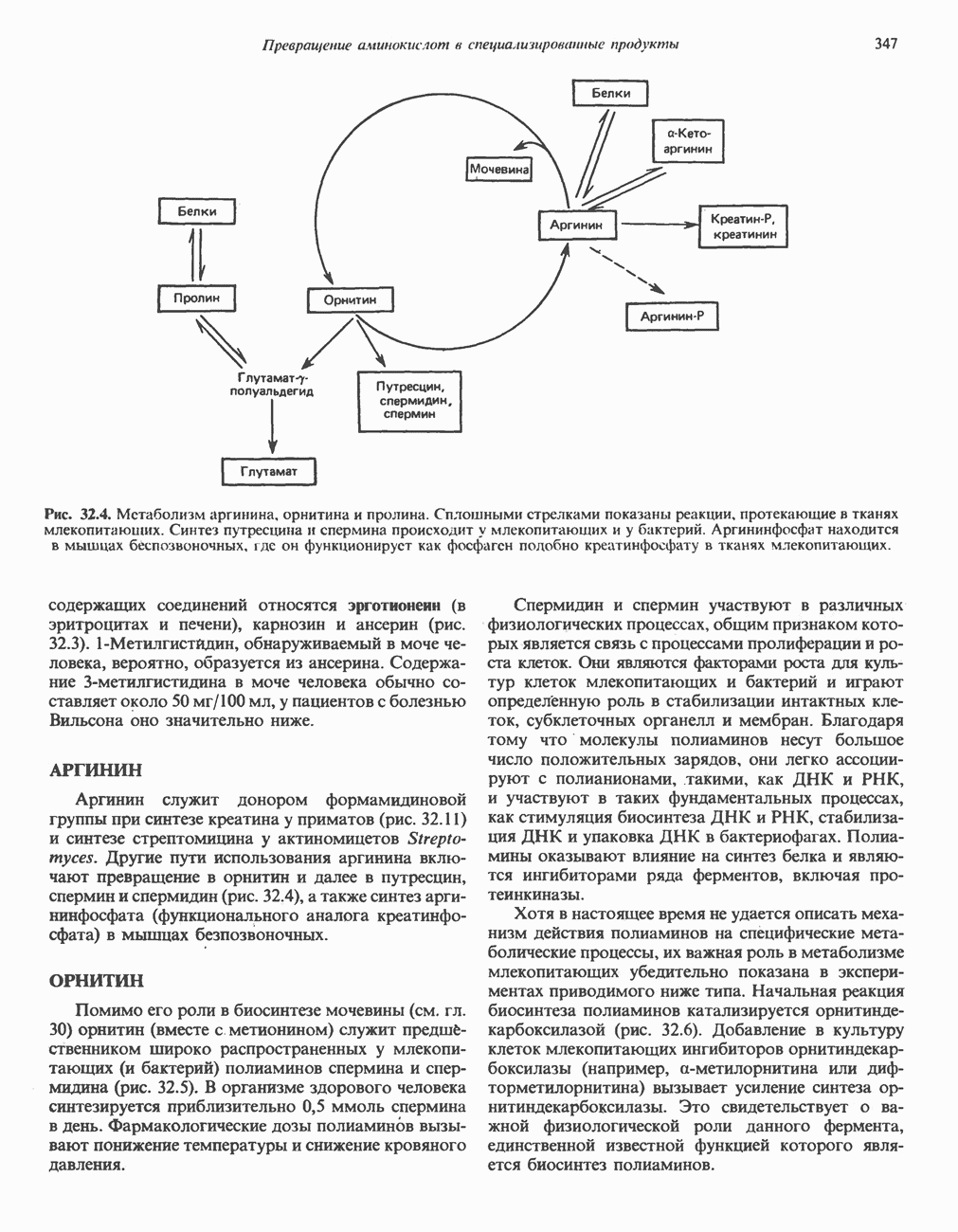
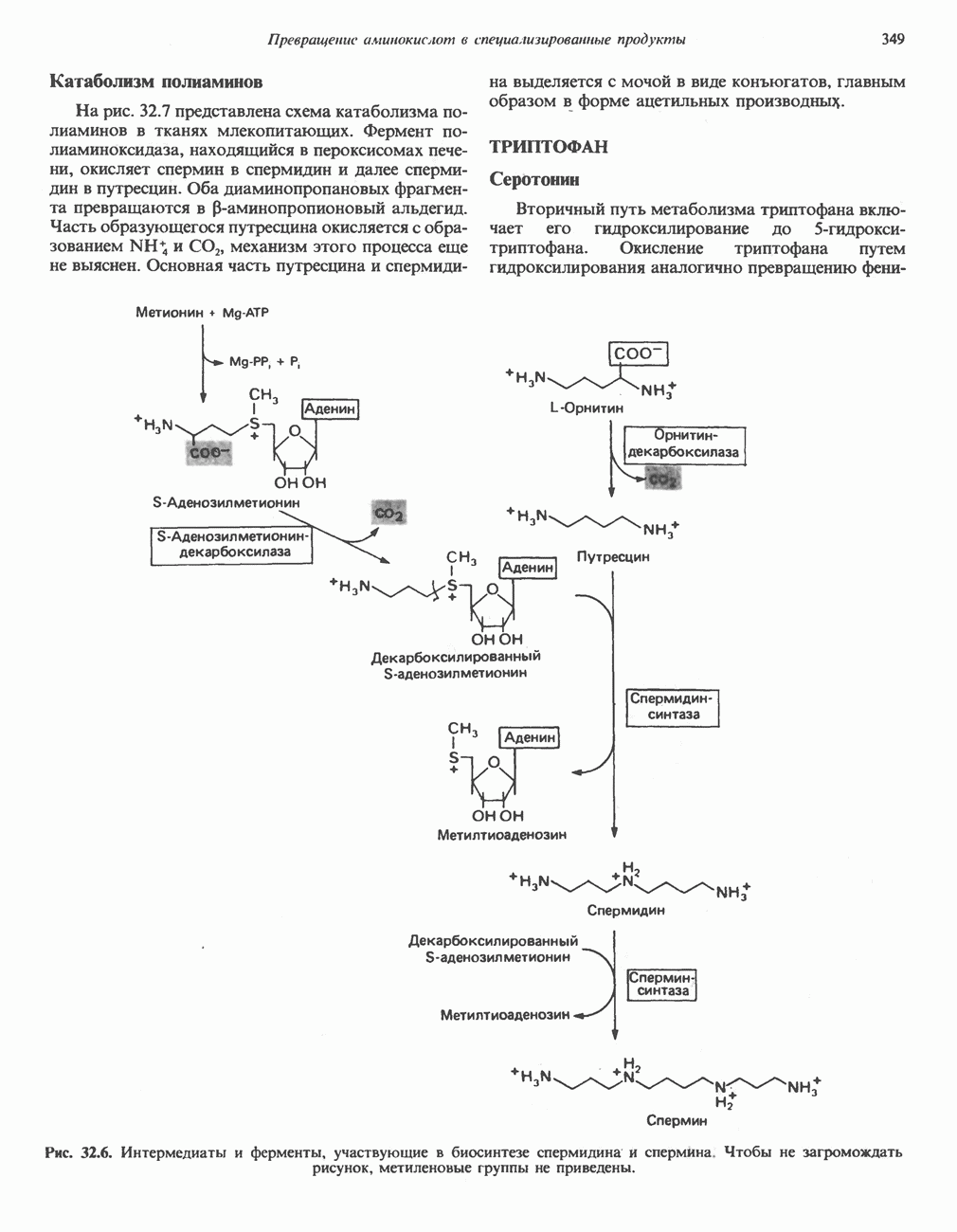
- Глава 32. Превращение аминокислот в специализированные продукты
- ГЛИЦИН
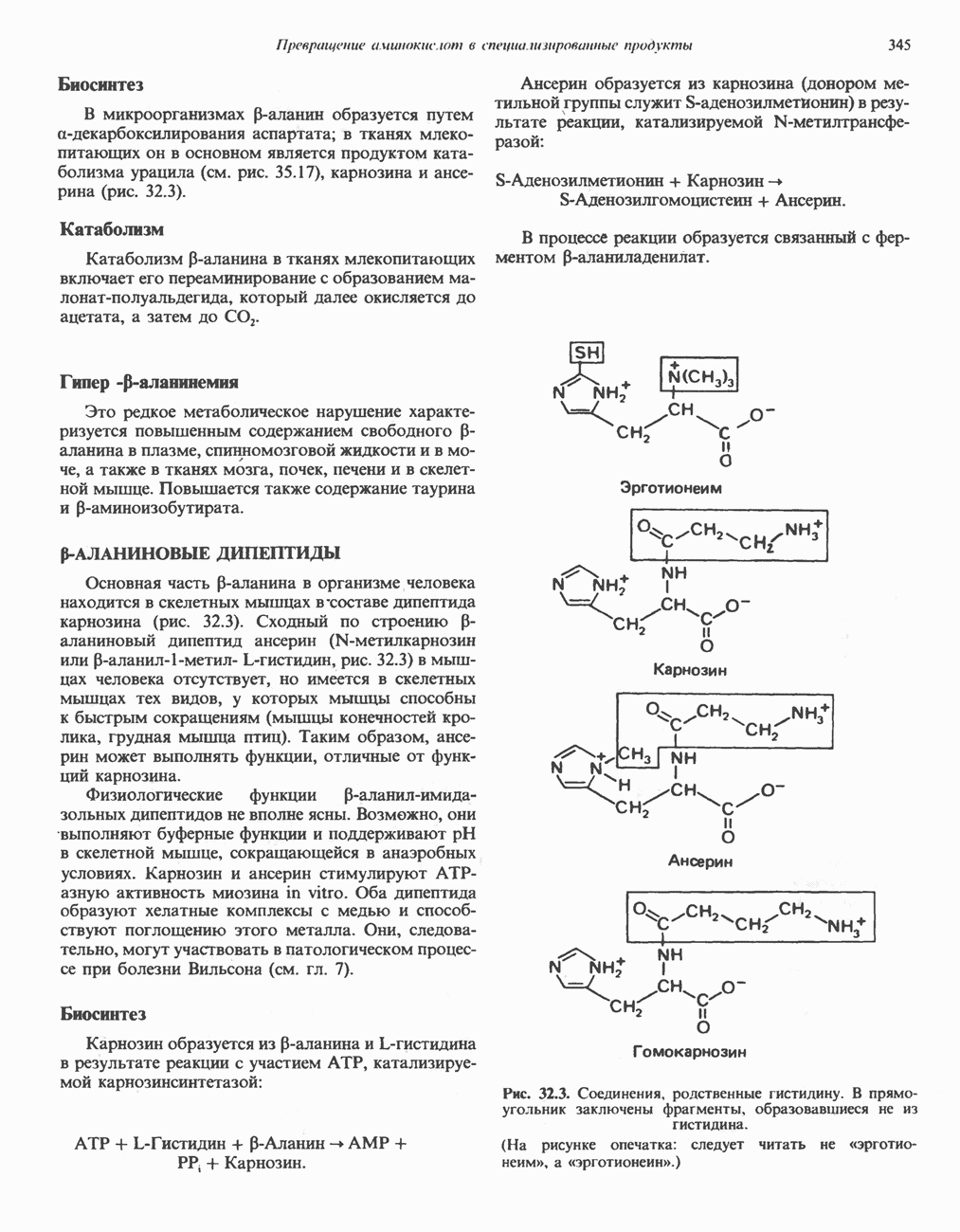
- р-АЛАНИНОВЫЕ ДИПЕПТИДЫ
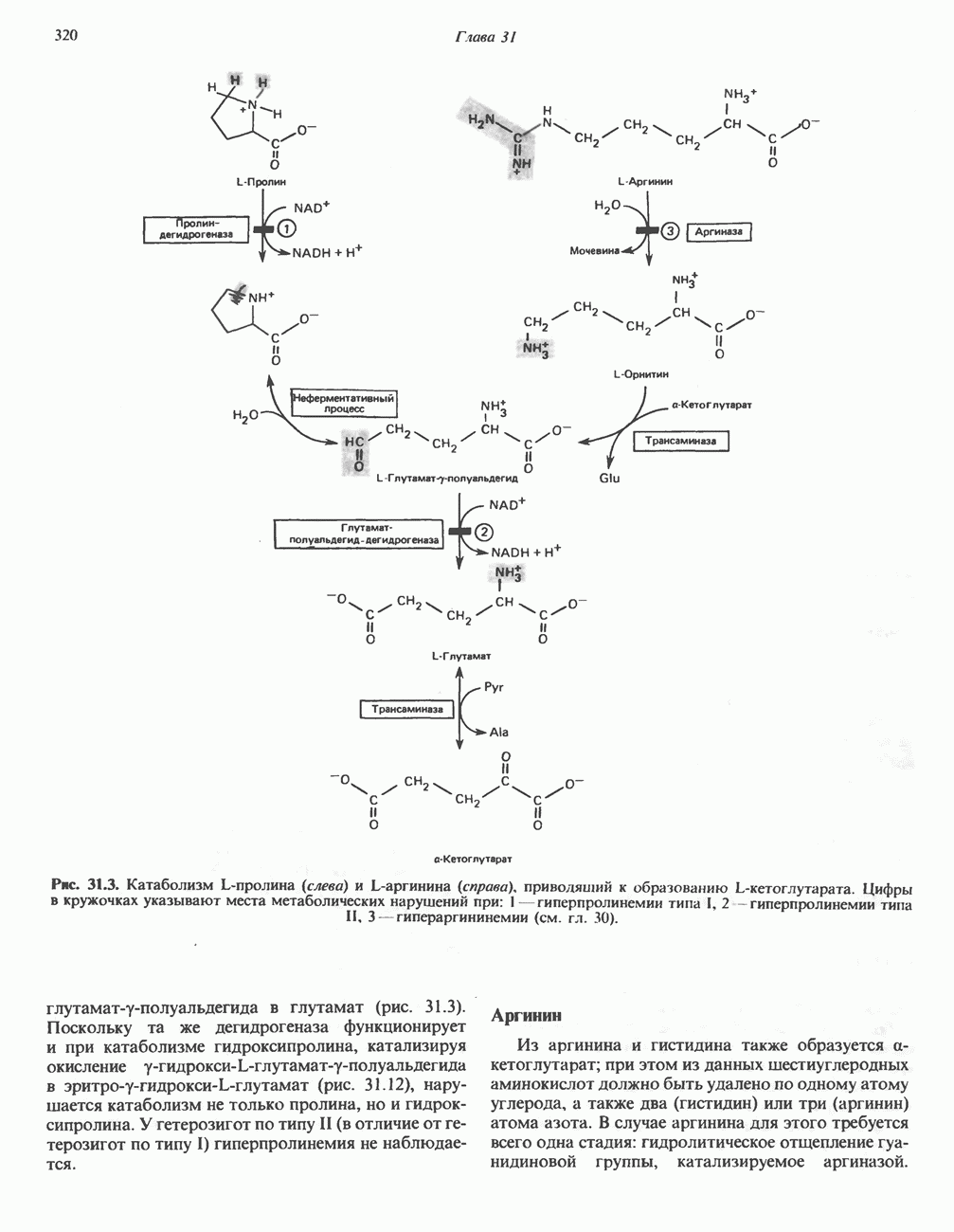
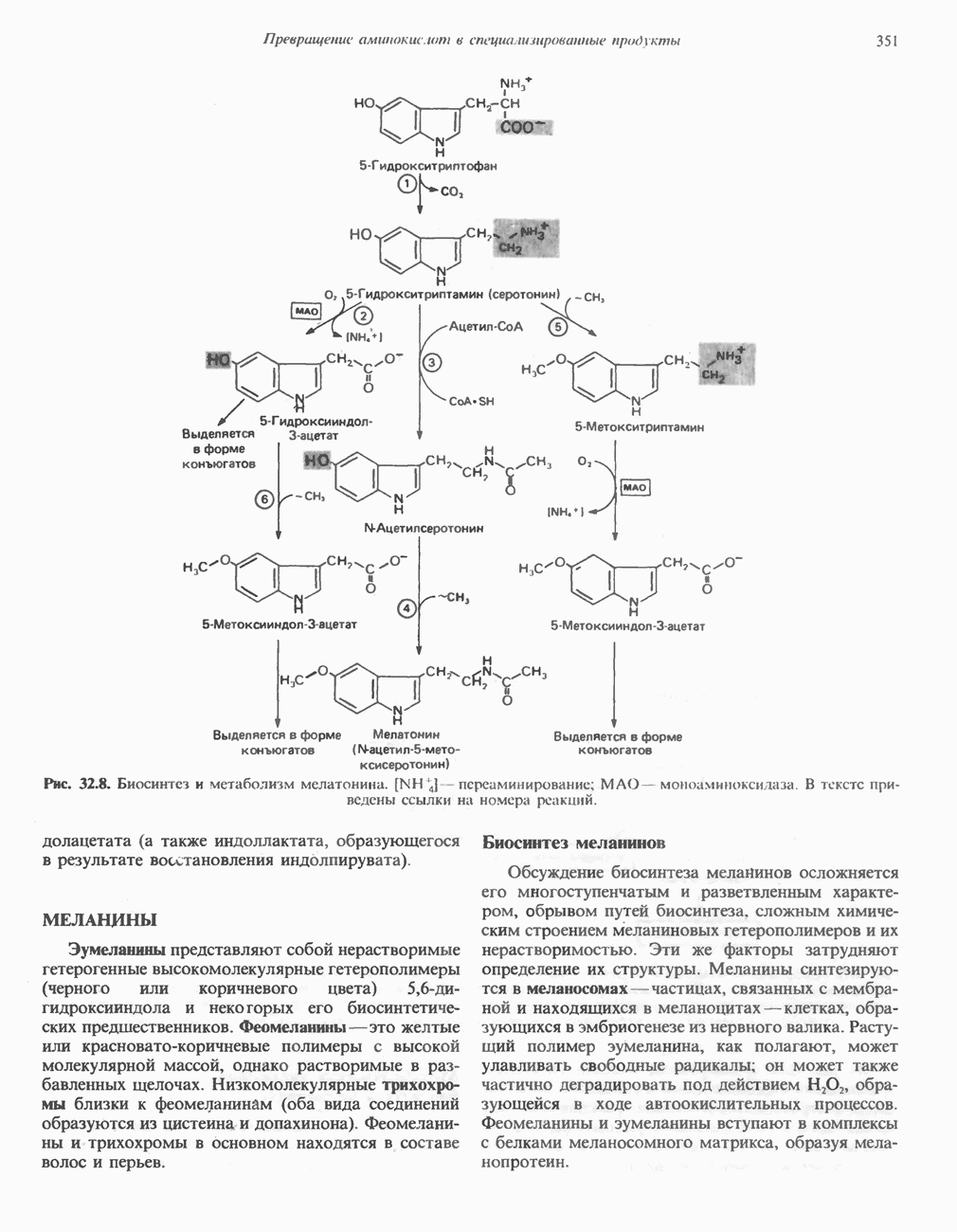
- ТРИПТОФАН
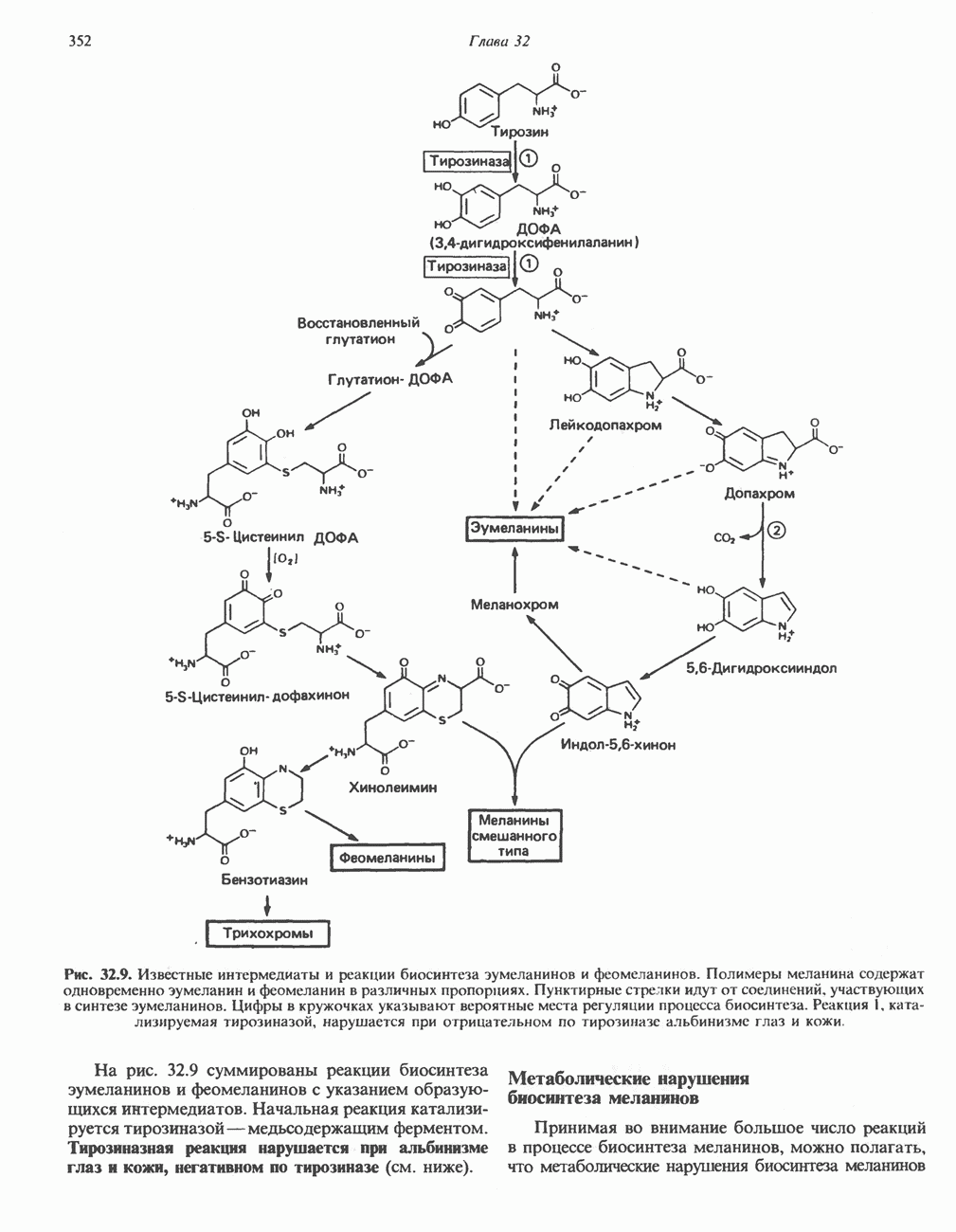
- МЕЛАНИНЫ
- ТИРОЗИН
- КРЕАТИН И КРЕАТИНИН
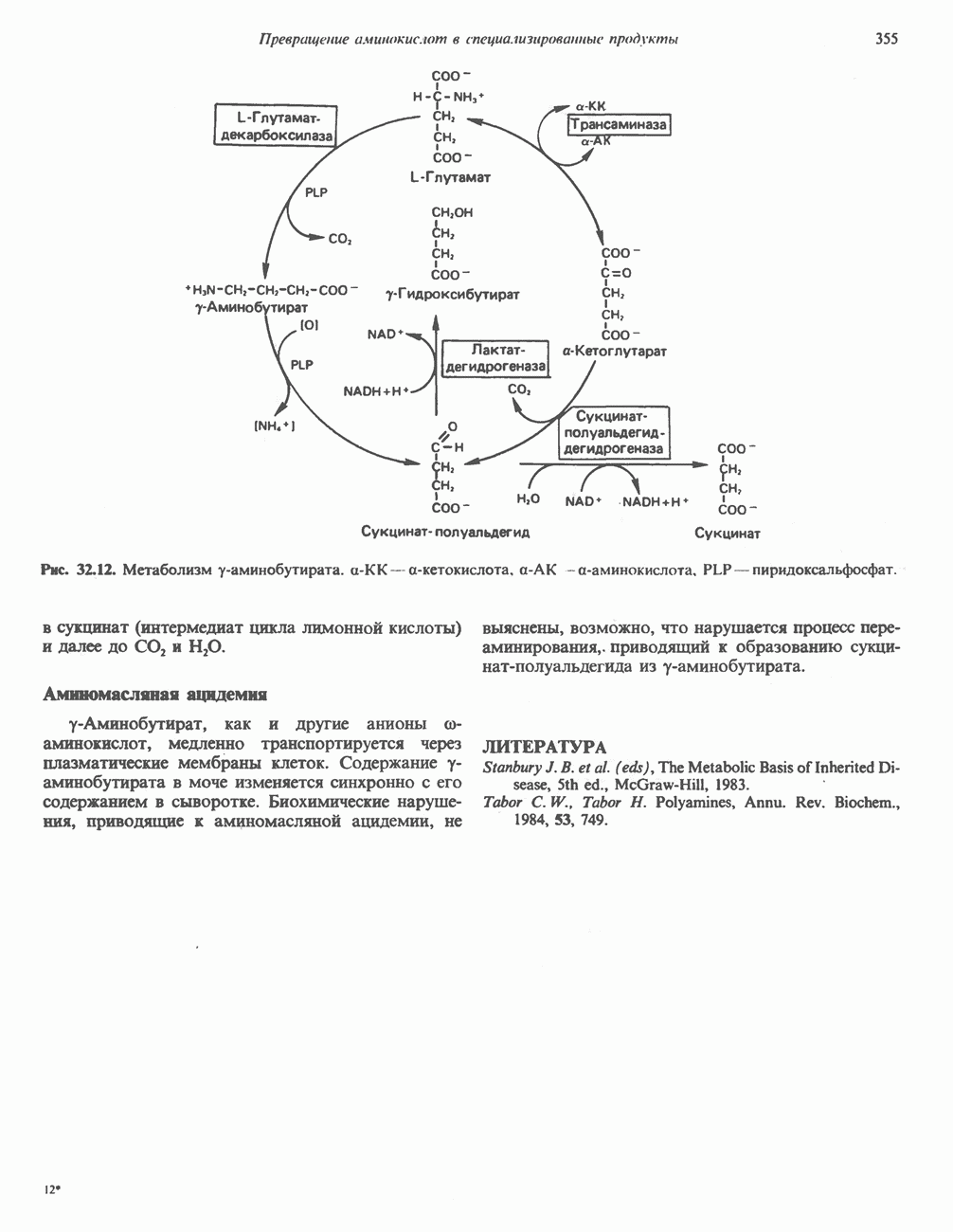
- у-АМИНОБУТИРАТ
- Глава 33. Порфирины и желчные пигменты
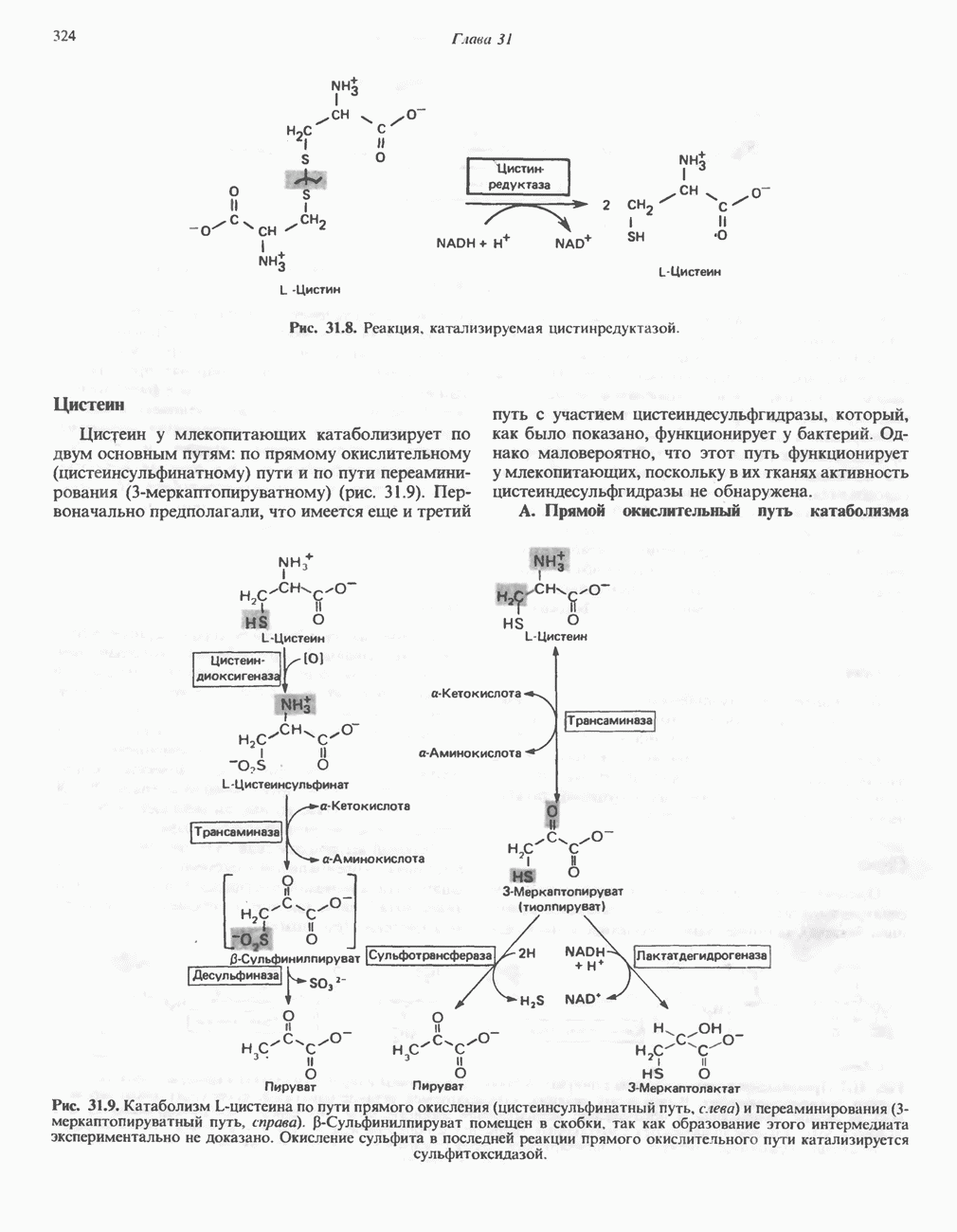
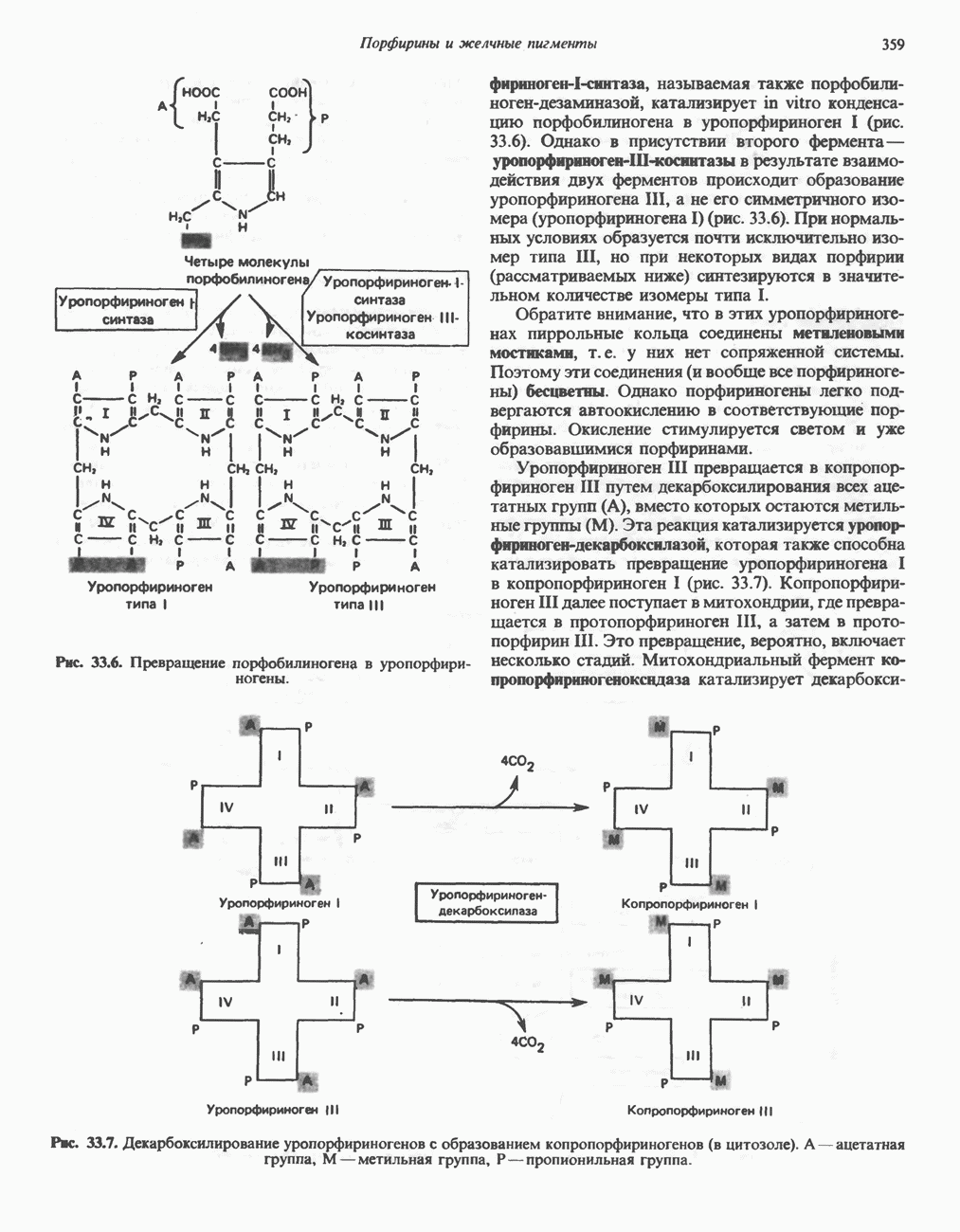
- ПОРФИРИНЫ
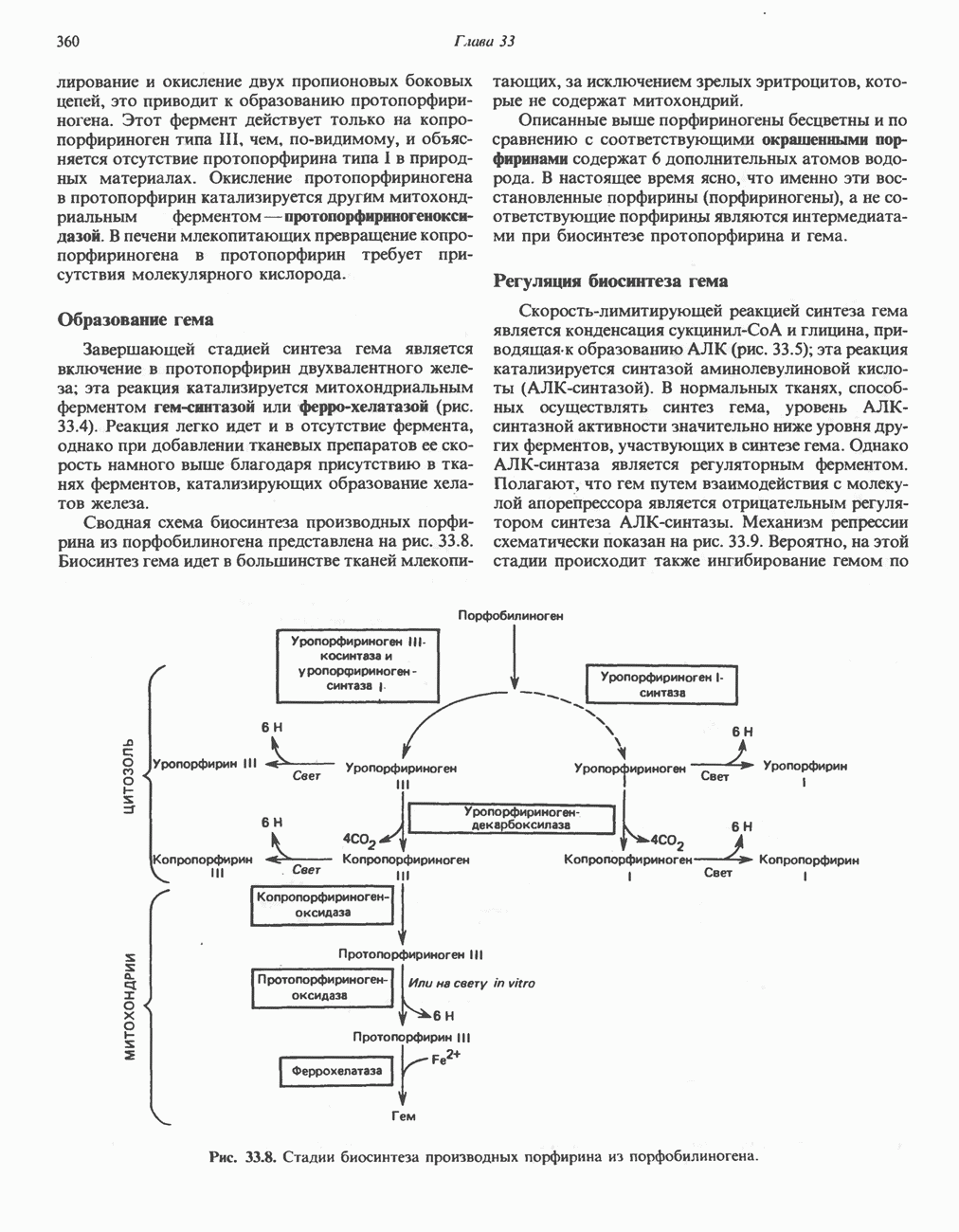
- ПОРФИРИН
- КАТАБОЛИЗМ ГЕМА: ОБРАЗОВАНИЕ ЖЕЛЧНЫХ ПИГМЕНТОВ
- МЕТАБОЛИЗМ БИЛИРУБИНА В КИШЕЧНИКЕ
- ГИПЕРБИЛИРУБИНЕМИЯ
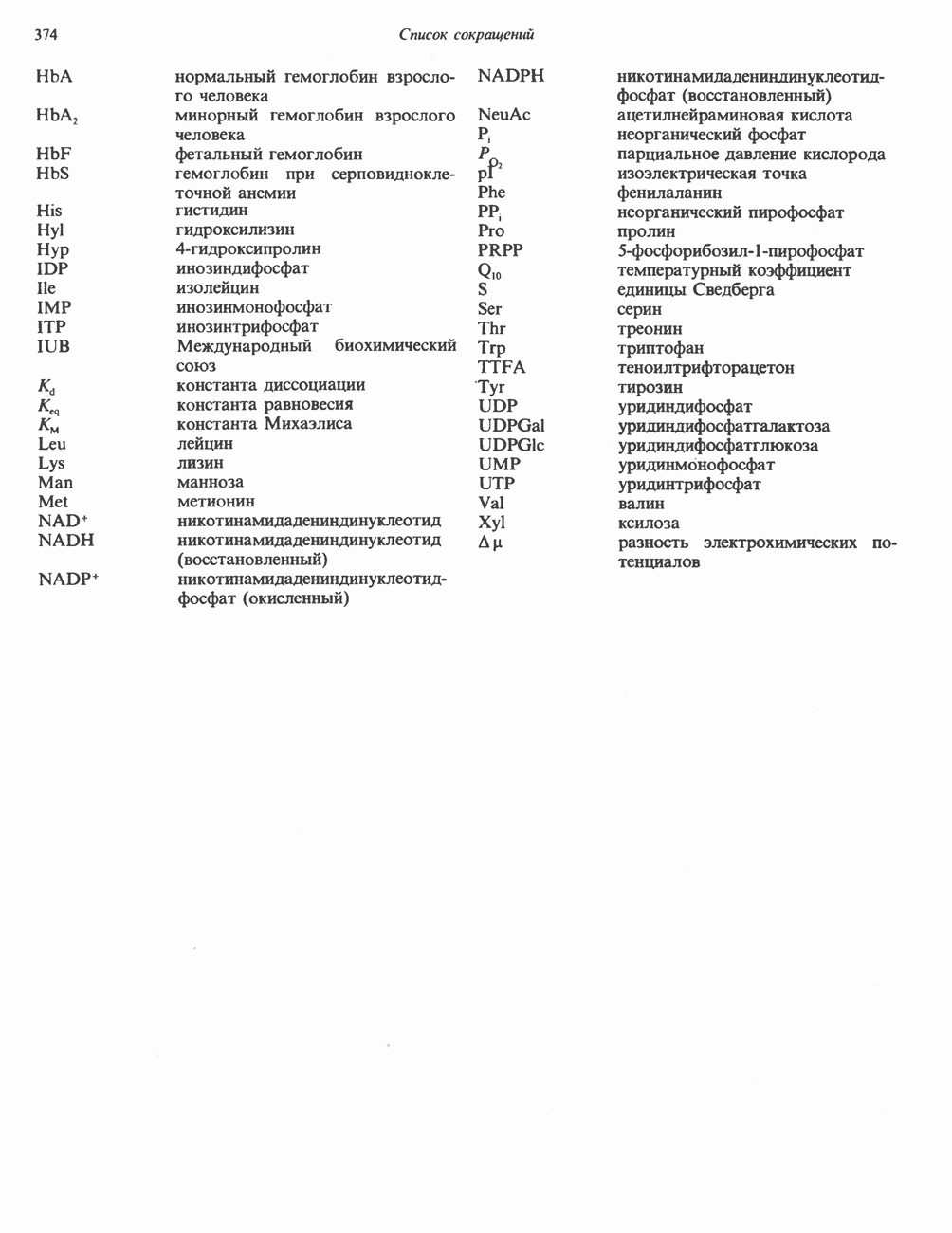
- Список сокращений