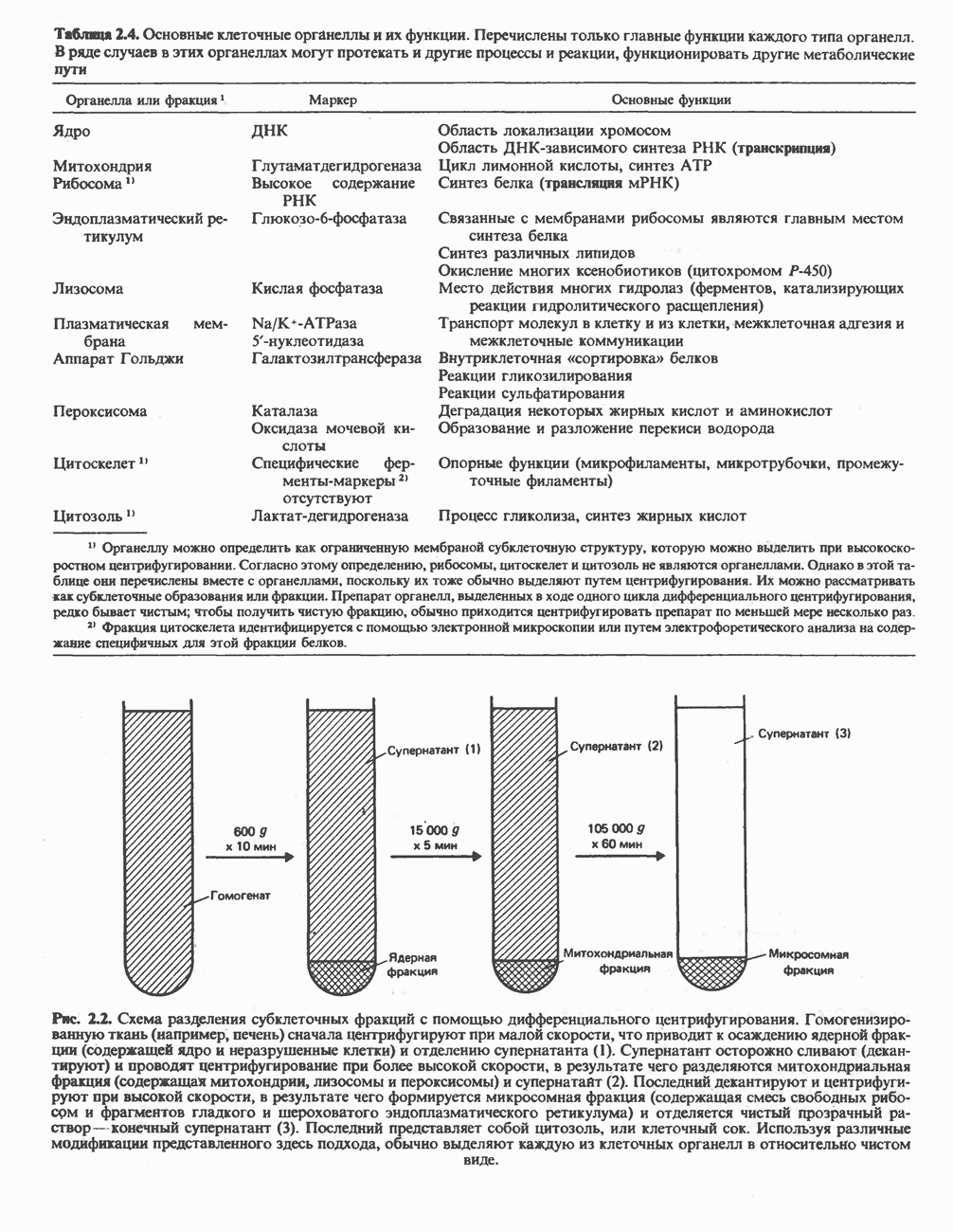
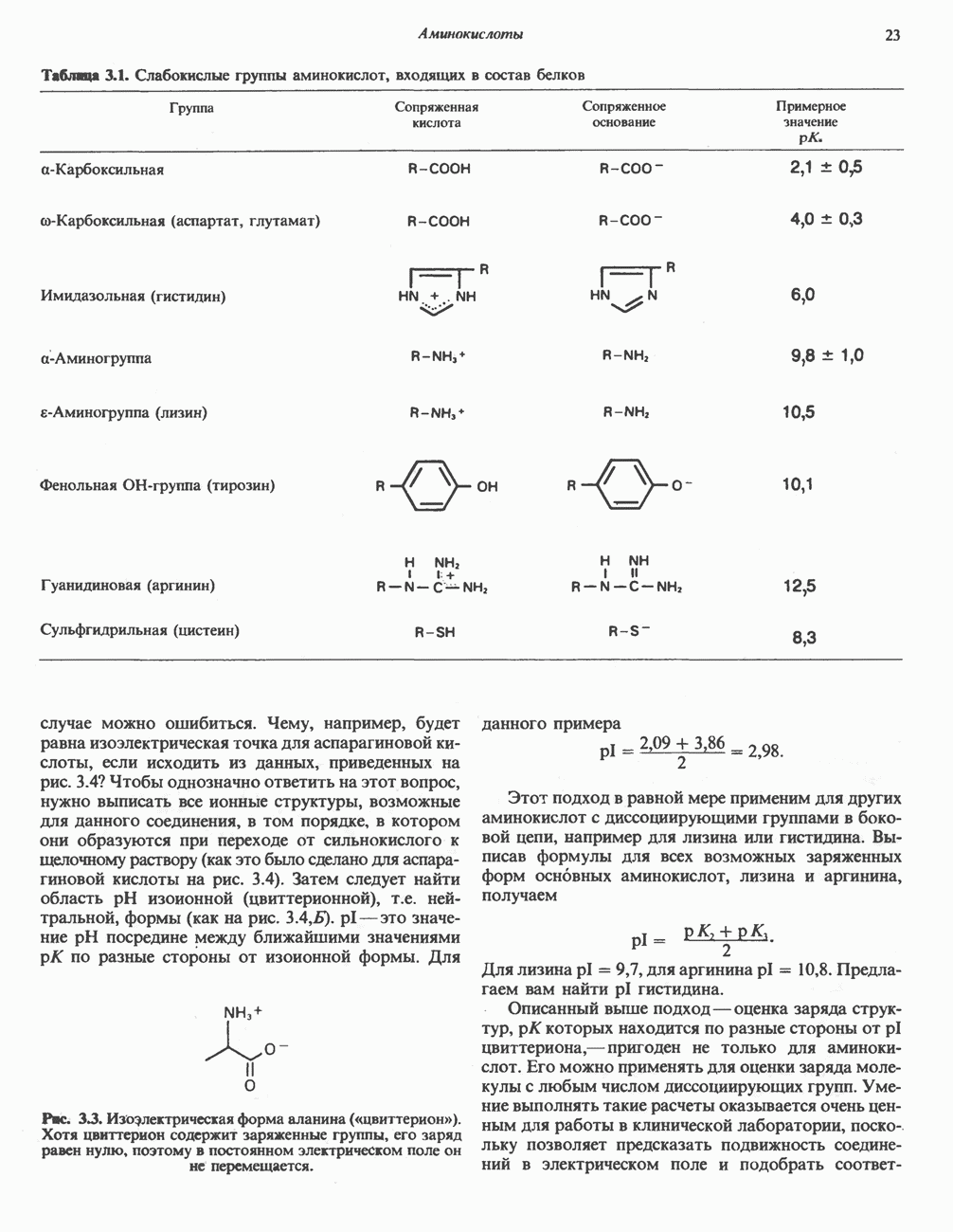
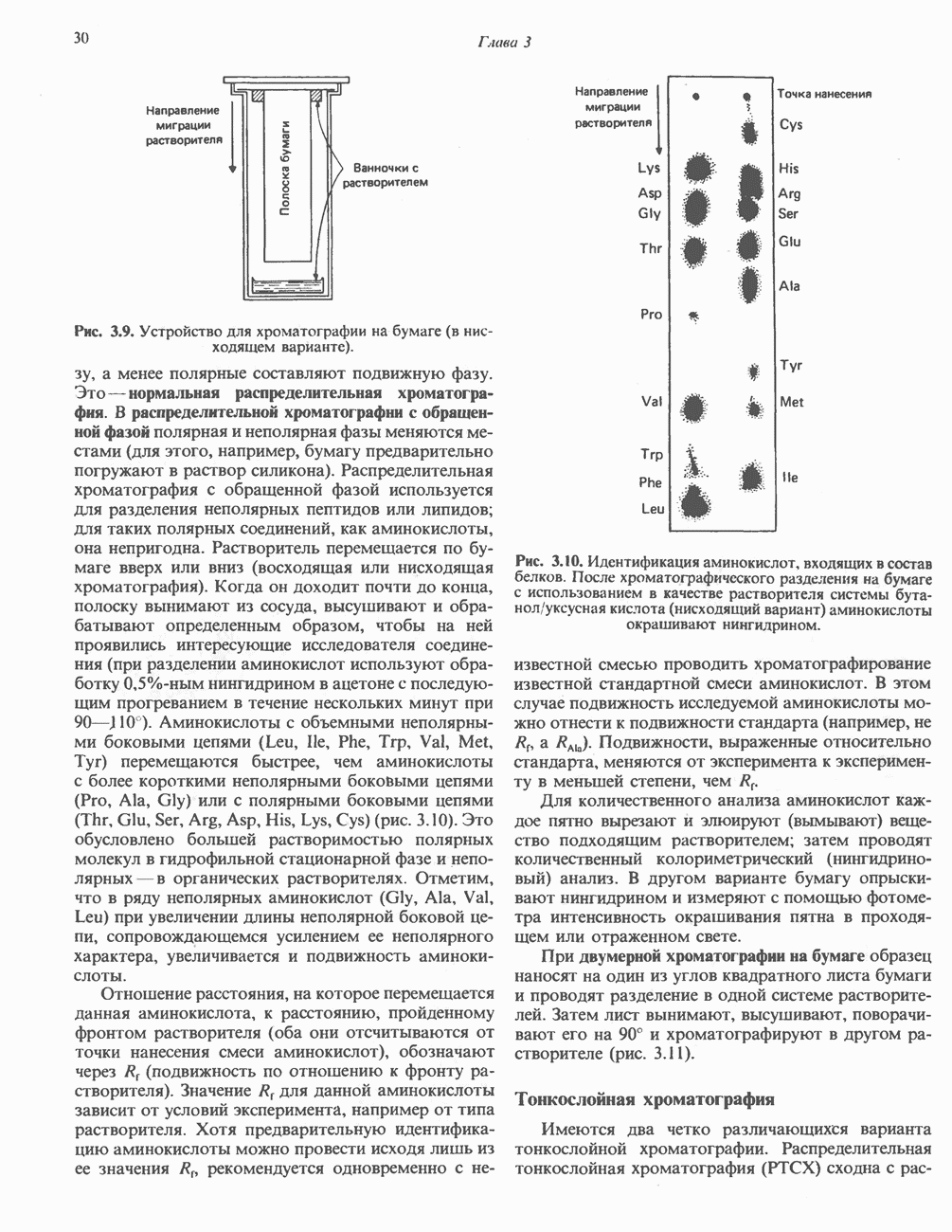
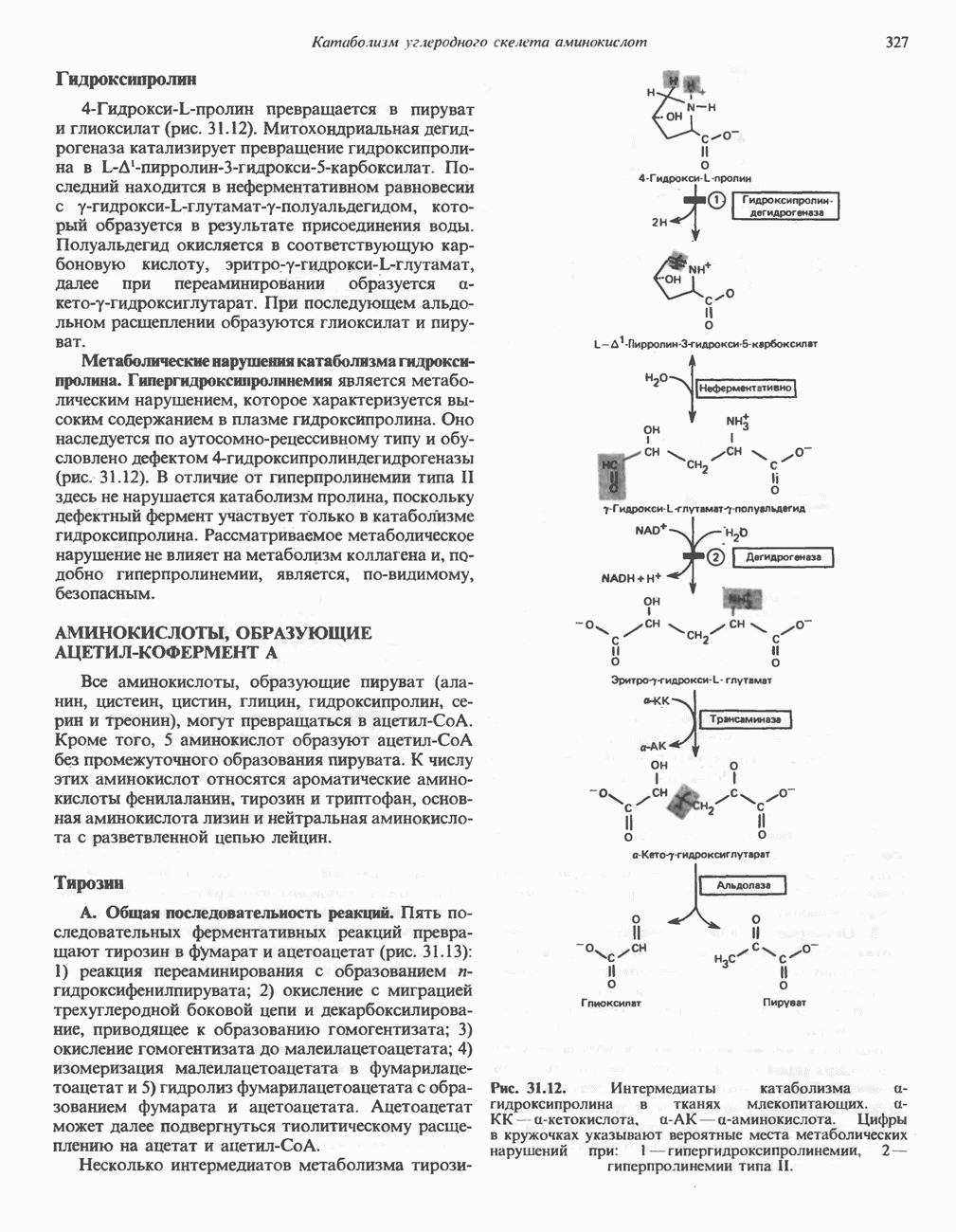
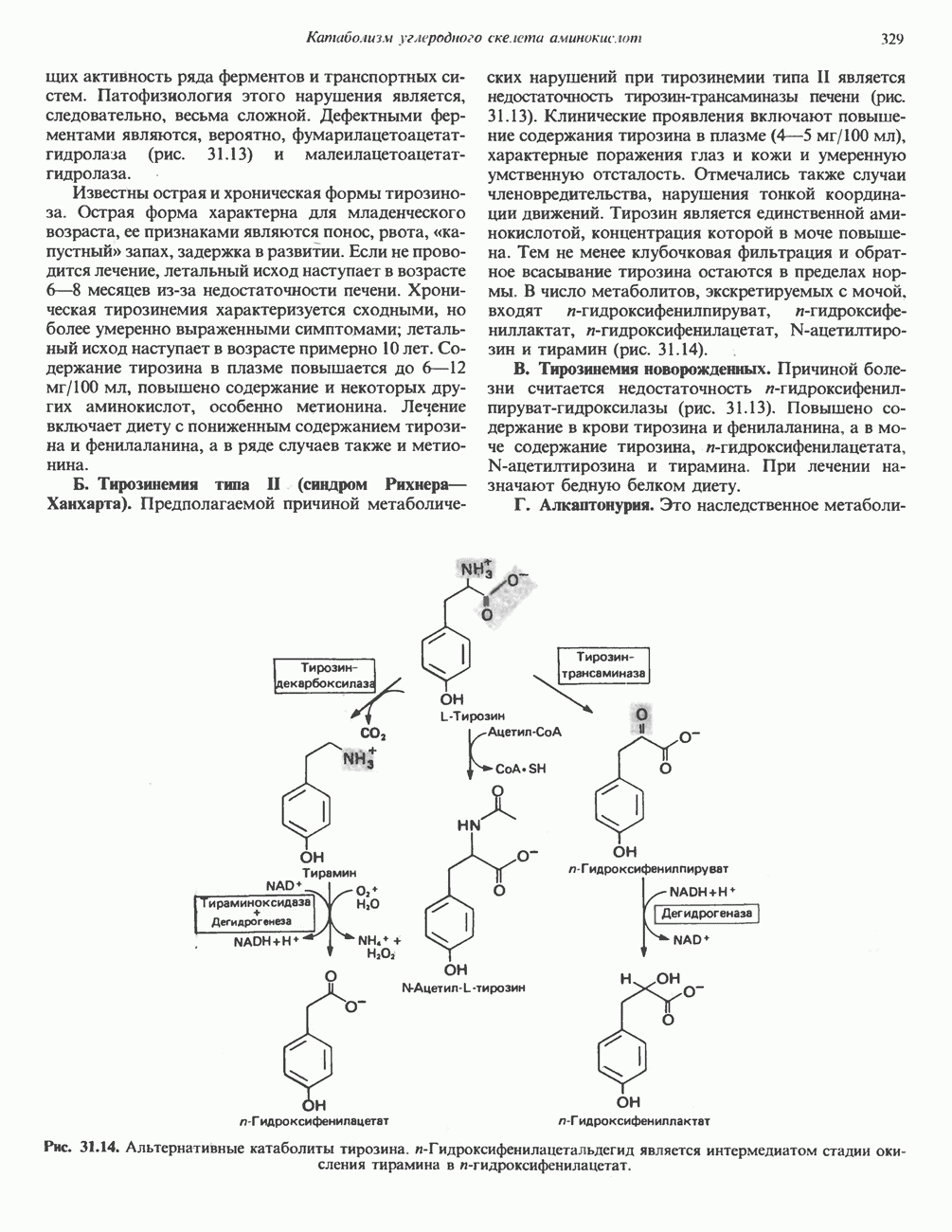
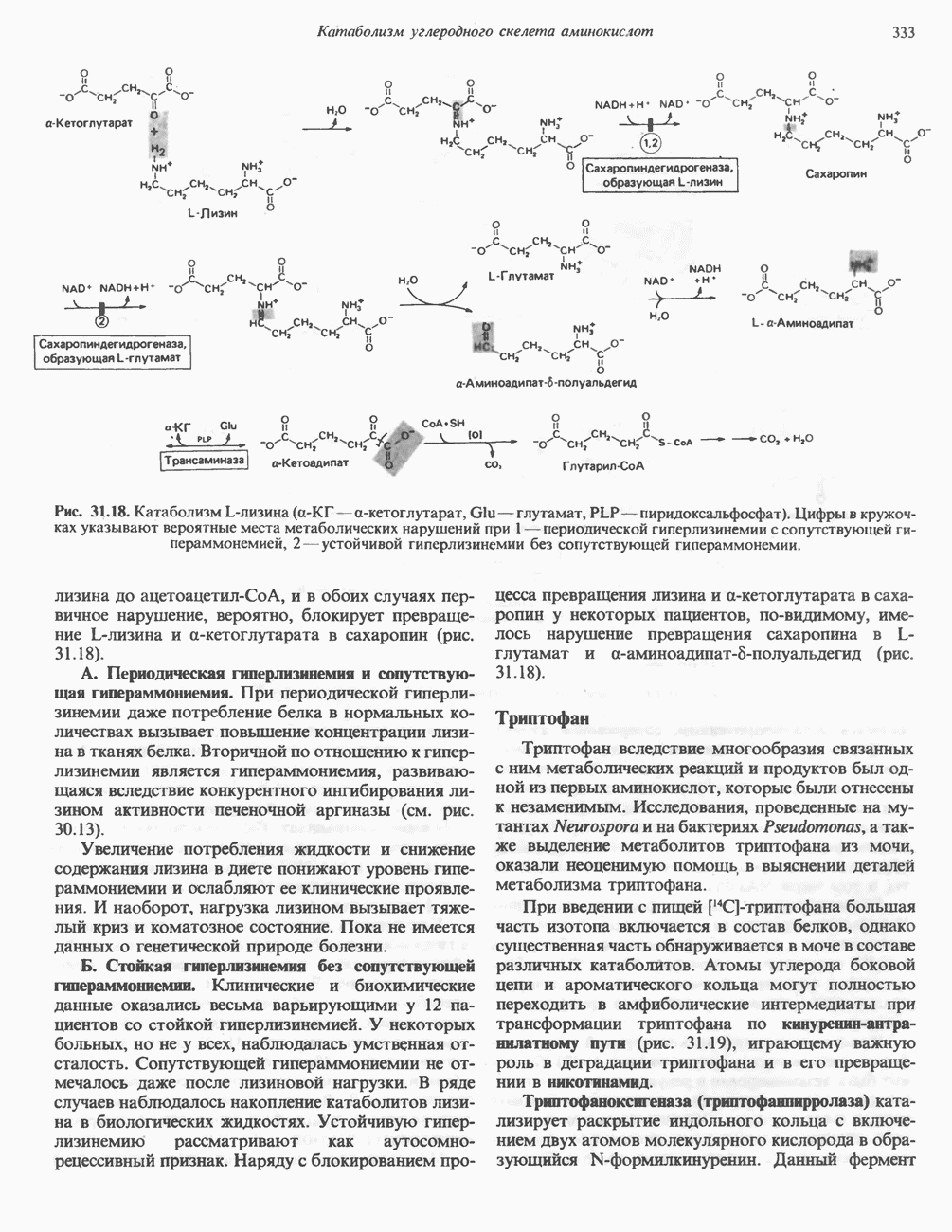
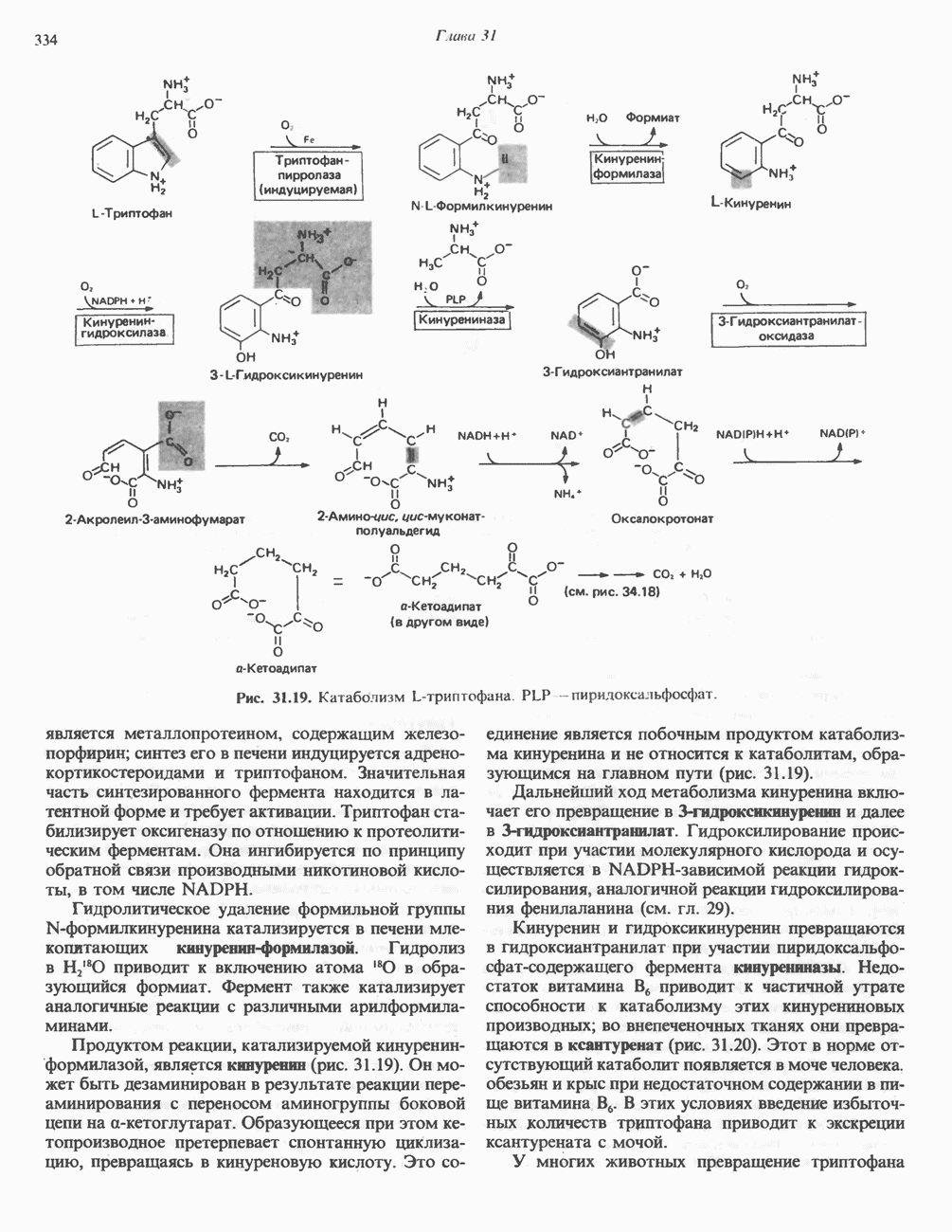
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
ФЕРМЕНТЫ КАК КАТАЛИЗАТОРЫ ОБЩЕГО КИСЛОТНОГО И ОБЩЕГО ОСНОВНОГО ТИПА
После связывания субстрата в области каталитического центра заряженные (или способные нести заряд) функциональные группы боковых цепей могут

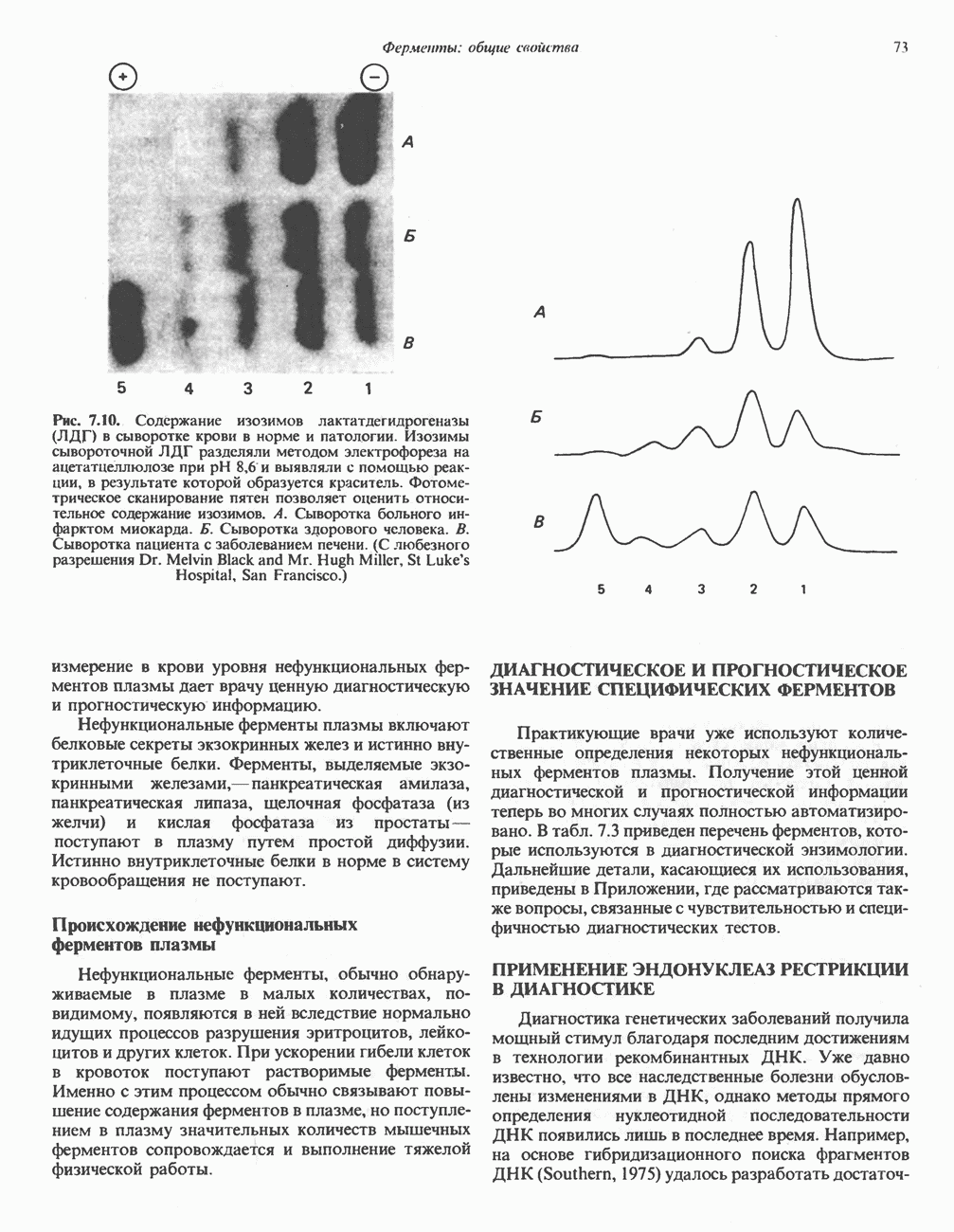
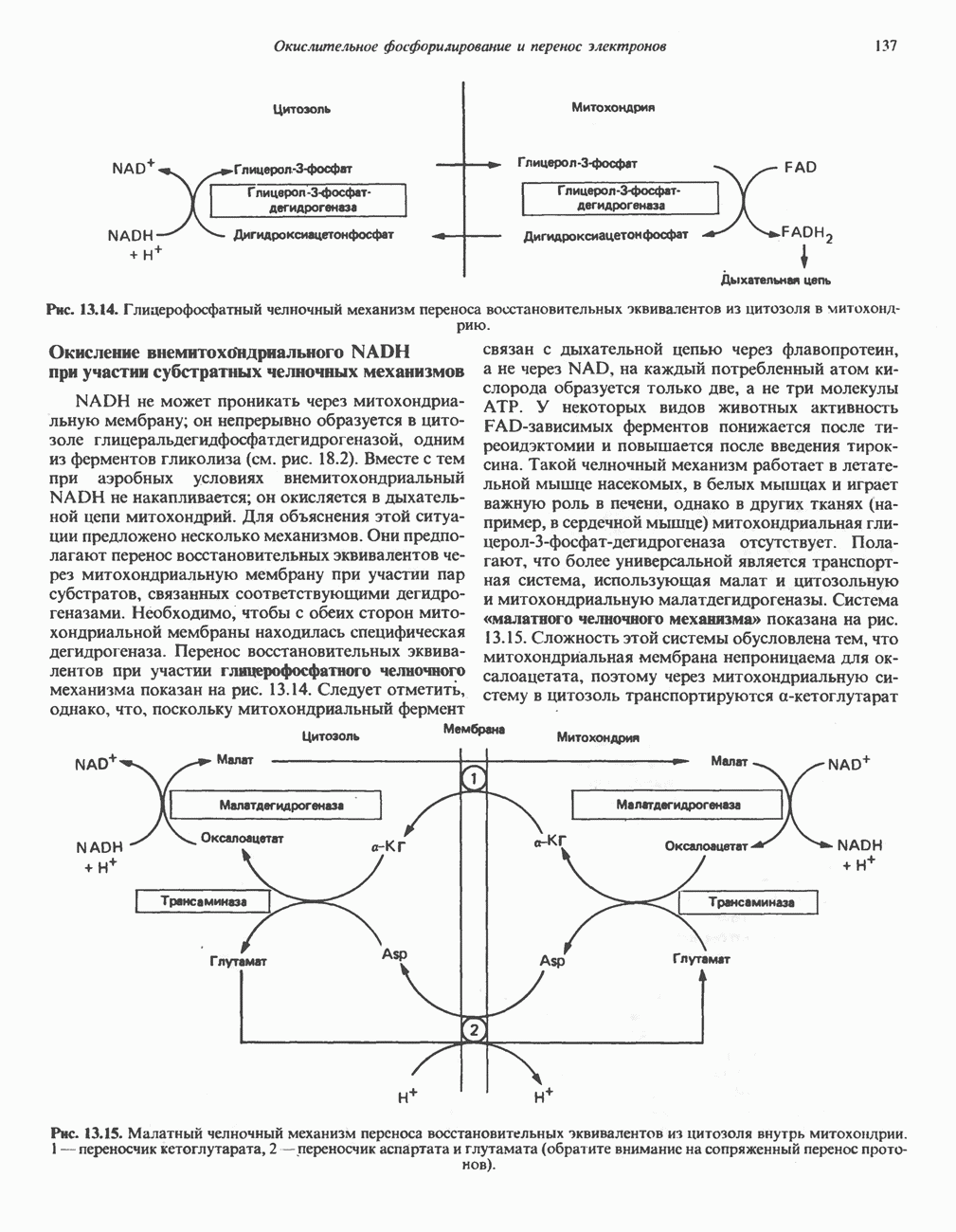
Рис. 9.8. Неупорядоченное и упорядоченное присоединение субстратов А и В к фермецту и высвобождение продуктов Р и О из комплекса с ферментом Е.

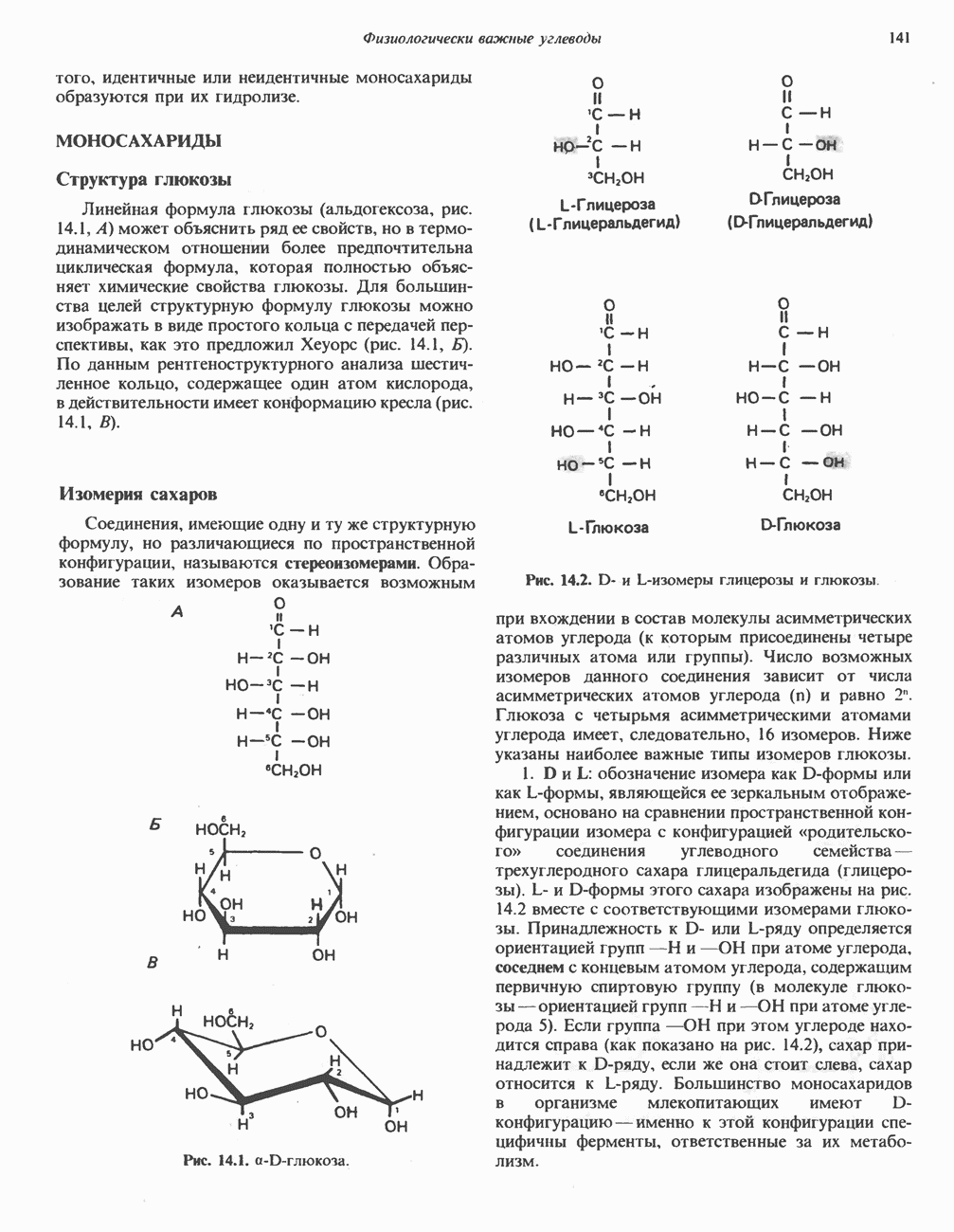
Рис. 9.9. Схема механизма «пинг-понг» ферментативного катализа.

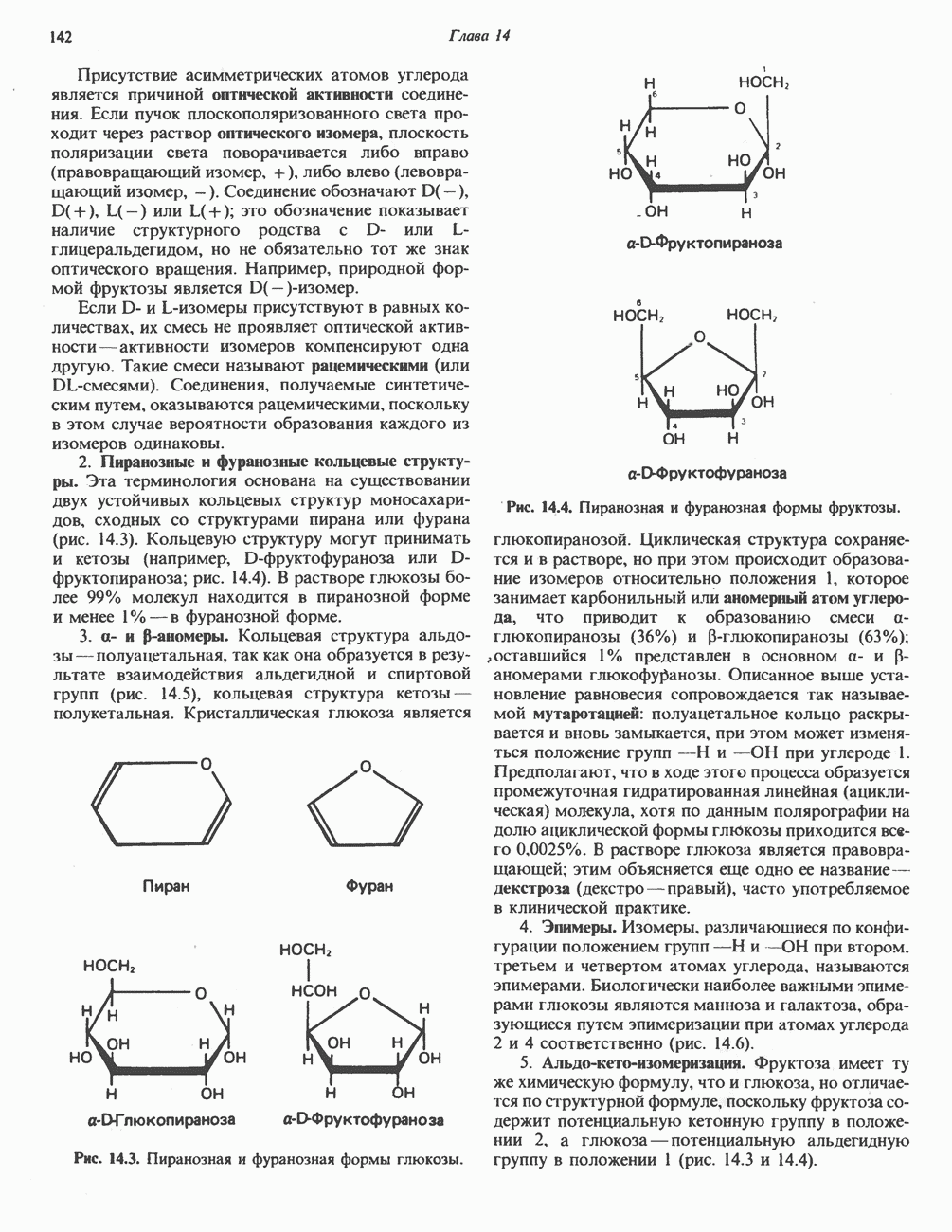
Рис. 9.10. Механизм «пинг-понг» при переаминировании. Е—СНО и  комплексы фермента с пиридоксаль-фосфатом и пиридоксаминфосфатом соответственно.
комплексы фермента с пиридоксаль-фосфатом и пиридоксаминфосфатом соответственно.  аланин,
аланин,  пируват,
пируват,  глутамат.)
глутамат.)
участвовать в катализе в качестве кислотных или основных катализаторов.
Мы различаем две широкие категории ферментативного кислотно-основного катализа: общий кислотный (или основный) и специфический кислотный (или основный).
Реакции, скорость которых изменяется при изменении концентрации ионов  или
или  но не зависит от концентрации других кислот или оснований, присутствующих в растворе, рассматриваются как реакции, осуществляемые в результате специфического кислотного или специфического основного катализа. Реакции, скорость которых зависит от присутствия в растворе любых кислот (доноров протонов) и любых оснований (акцепторов протонов), рассматриваются как реакции, осуществляемые в результате общего кислотного или общего основного катализа.
но не зависит от концентрации других кислот или оснований, присутствующих в растворе, рассматриваются как реакции, осуществляемые в результате специфического кислотного или специфического основного катализа. Реакции, скорость которых зависит от присутствия в растворе любых кислот (доноров протонов) и любых оснований (акцепторов протонов), рассматриваются как реакции, осуществляемые в результате общего кислотного или общего основного катализа.
Для того чтобы решить, какой именно катализ имеет место в данной ферментативной реакции — общий или специфический кислотный или основный, - нужно измерить скорость реакции в следующих условиях: 1) при различных  но при постоянной концентрации буфера; 2) при фиксированном
но при постоянной концентрации буфера; 2) при фиксированном  но при различных концентрациях буфера.
но при различных концентрациях буфера.
Если скорость реакции при постоянной концентрации буфера изменяется с изменением  то имеет место специфический основный катализ (при pH > 7) или специфический кислотный катализ (при pH < 7). Если же скорость реакции при фиксированном
то имеет место специфический основный катализ (при pH > 7) или специфический кислотный катализ (при pH < 7). Если же скорость реакции при фиксированном  возрастает с повышением концентрации буфера, то осуществляется общий основный катализ (при pH > 7) или общий кислотный катализ (при pH < 7).
возрастает с повышением концентрации буфера, то осуществляется общий основный катализ (при pH > 7) или общий кислотный катализ (при pH < 7).
В качестве примера специфического кислотного катализа рассмотрим превращение субстрата S в продукт Р. Реакция протекает в две стадии: за быстрой стадией, включающей обратимый перенос протона:

следует более медленная, лимитирующая скорость всего процесса стадия превращения протонированного субстрата в продукт:

Повышая концентрацию ионов гидрония  мы повышаем концентрацию
мы повышаем концентрацию  сопряженной кислотной формы субстрата; поскольку
сопряженной кислотной формы субстрата; поскольку  является субстратом лимитирующей стадии, возрастет и скорость полной реакции. Математически это можно записать следующим образом:
является субстратом лимитирующей стадии, возрастет и скорость полной реакции. Математически это можно записать следующим образом:

где P — продукт,  время, к — удельная константа скорости,
время, к — удельная константа скорости,  концентрация сопряженной кислотной формы субстрата.
концентрация сопряженной кислотной формы субстрата.
Поскольку концентрация  зависит одновременно от концентраций S и
зависит одновременно от концентраций S и  общее выражение для скорости реакции, катализируемой по типу специфического кислотного катализа, примет вид
общее выражение для скорости реакции, катализируемой по типу специфического кислотного катализа, примет вид

Обратите внимание на свойственную специфическому кислотному катализу особенность: в выражение для скорости реакции входят только члены 
Рассмотрим теперь в дополнение к описанному выше специфическому кислотному катализу также и катализ, осуществляемый ионом имидазолия имидазольного буфера. Поскольку имидазол — это слабая кислота  он является плохим донором протонов; поэтому реакция
он является плохим донором протонов; поэтому реакция

протекает медленно и лимитирует скорость полной реакции. Отметим, что быстрая и медленная стадии в случаях специфического и общего кислотного катализа меняются местами. Выражение для скорости реакции в случае общего кислотного катализа часто имеет довольно сложный вид и поэтому здесь не рассматривается.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- Предисловие к русскому изданию
- Предисловие
- Глава 1. Биохимия и медицина
- Глава 2. Биомолекулы и биохимические методы
- КЛЕТКА
- ОБЩИЙ ЭКСПЕРИМЕНТАЛЬНЫЙ ПОДХОД, ИСПОЛЬЗУЕМЫЙ В БИОХИМИИ
- ОСНОВНЫЕ ДОСТИЖЕНИЯ БИОХИМИИ
- Раздел I. Структура и функции белков и ферментов
- Глава 3. Аминокислоты
- АМИНОКИСЛОТЫ
- ИОННЫЕ ФОРМЫ АМИНОКИСЛОТ
- СТРУКТУРА АМИНОКИСЛОТ
- РАСТВОРИМОСТЬ АМИНОКИСЛОТ
- ОБЩИЕ ХИМИЧЕСКИЕ РЕАКЦИИ
- СВОЙСТВА ИНДИВИДУАЛЬНЫХ АМИНОКИСЛОТ
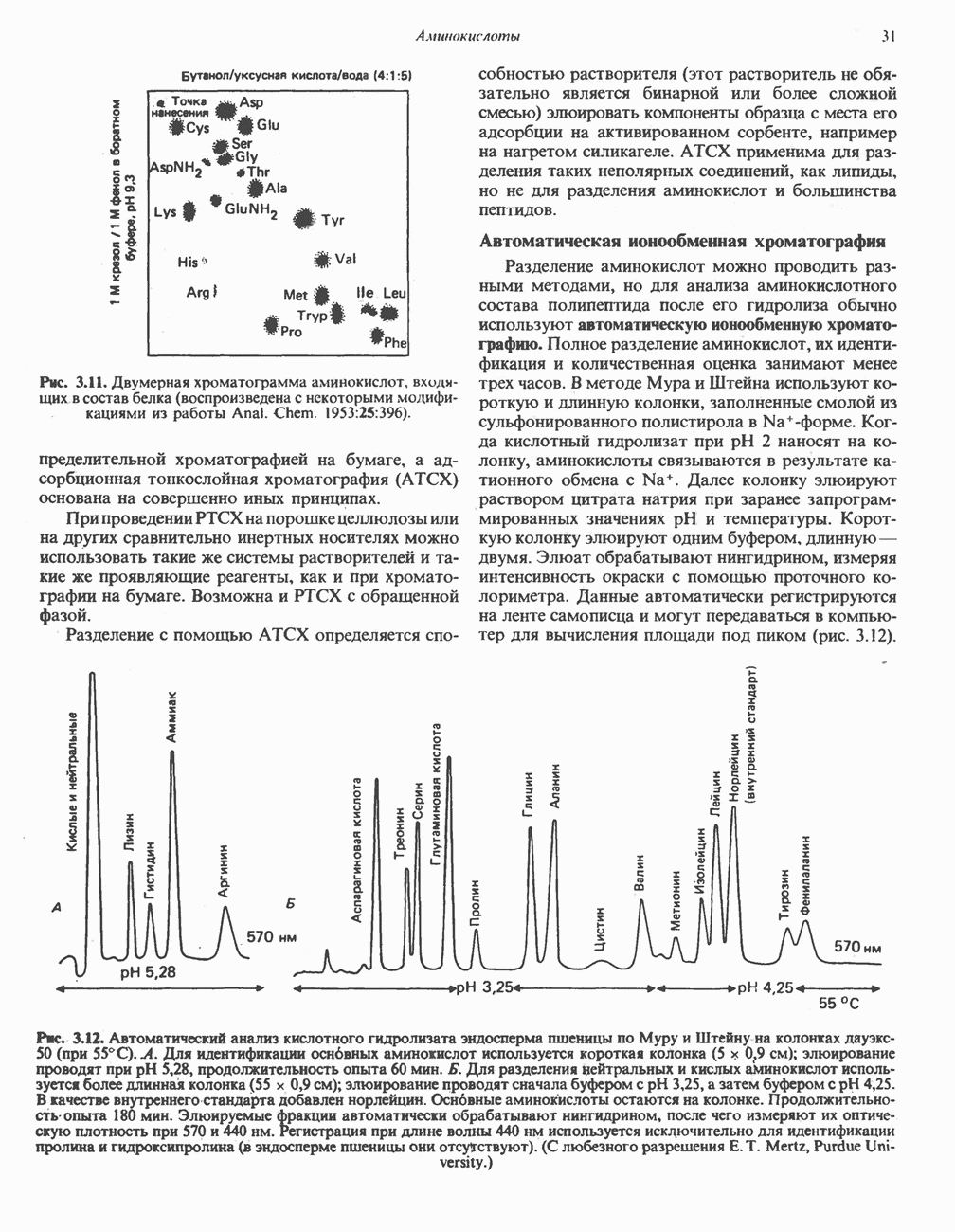
- МЕТОДЫ РАЗДЕЛЕНИЯ АМИНОКИСЛОТ
- Глава 4. Пептиды
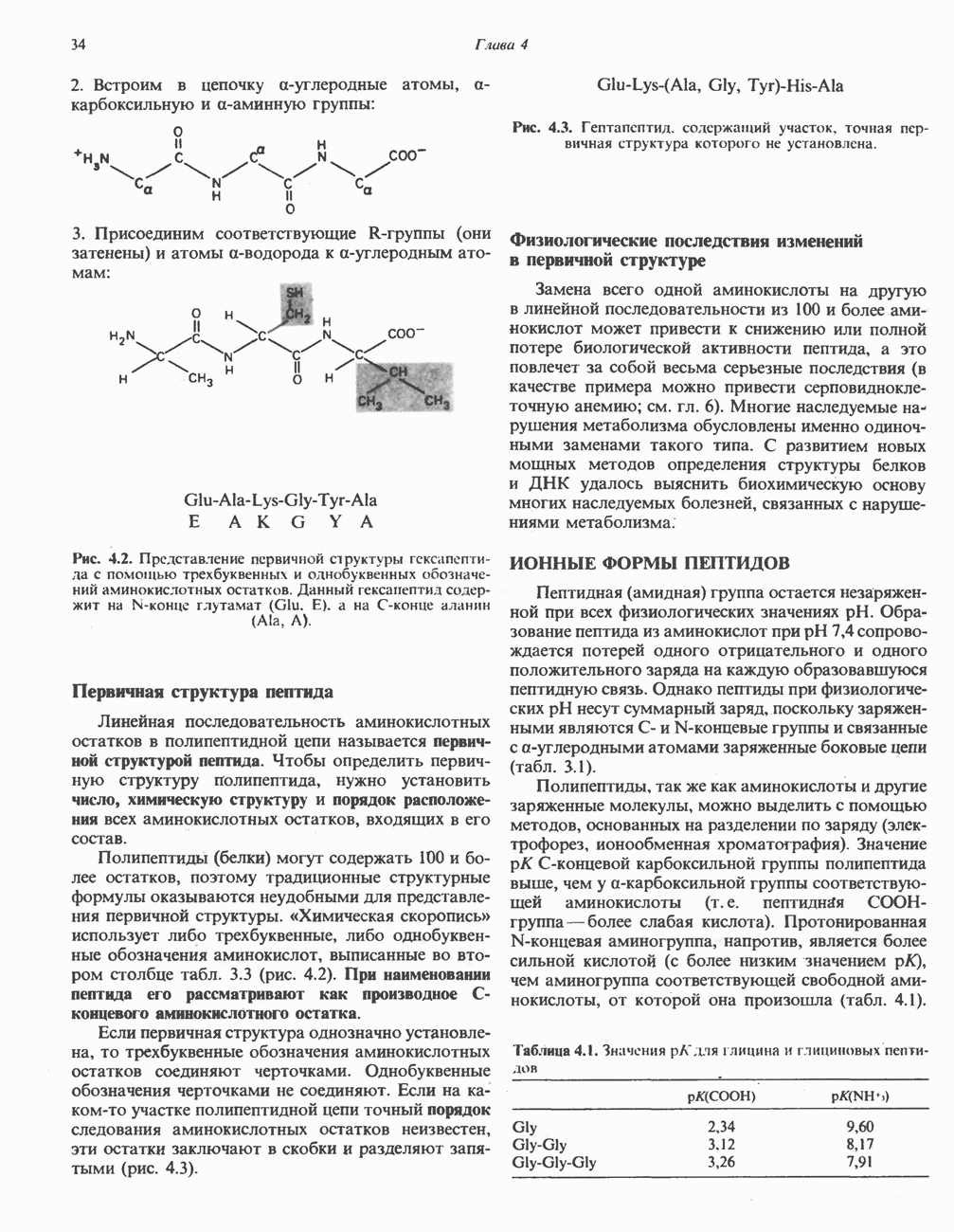
- СТРУКТУРА ПЕПТИДОВ
- ИОННЫЕ ФОРМЫ ПЕПТИДОВ
- КОНФОРМАЦИЯ ПЕПТИДОВ В РАСТВОРЕ
- МЕТОДЫ РАЗДЕЛЕНИЯ ПЕПТИДОВ
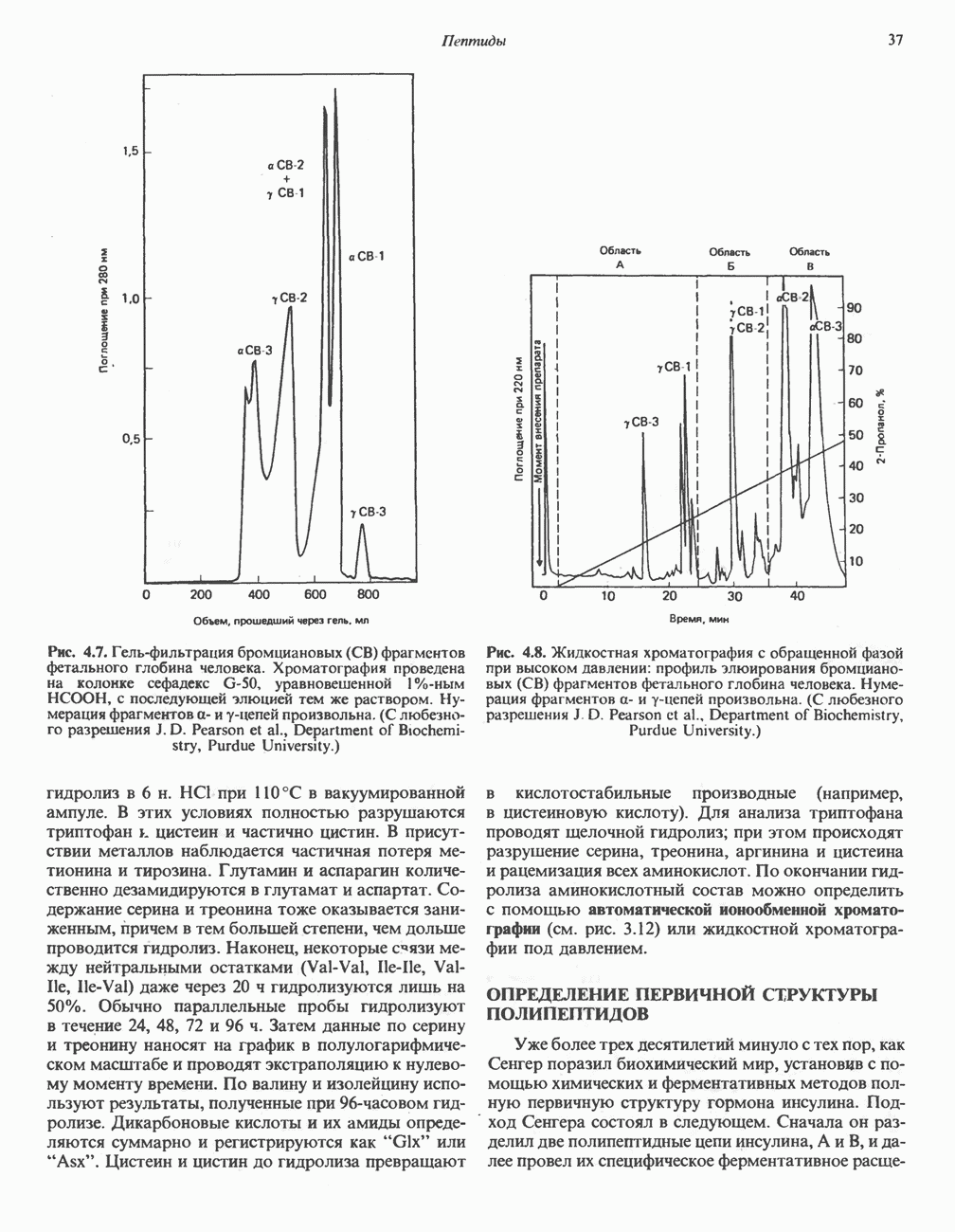
- ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОГО СОСТАВА ПЕПТИДОВ
- ОПРЕДЕЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ ПОЛИПЕПТИДОВ
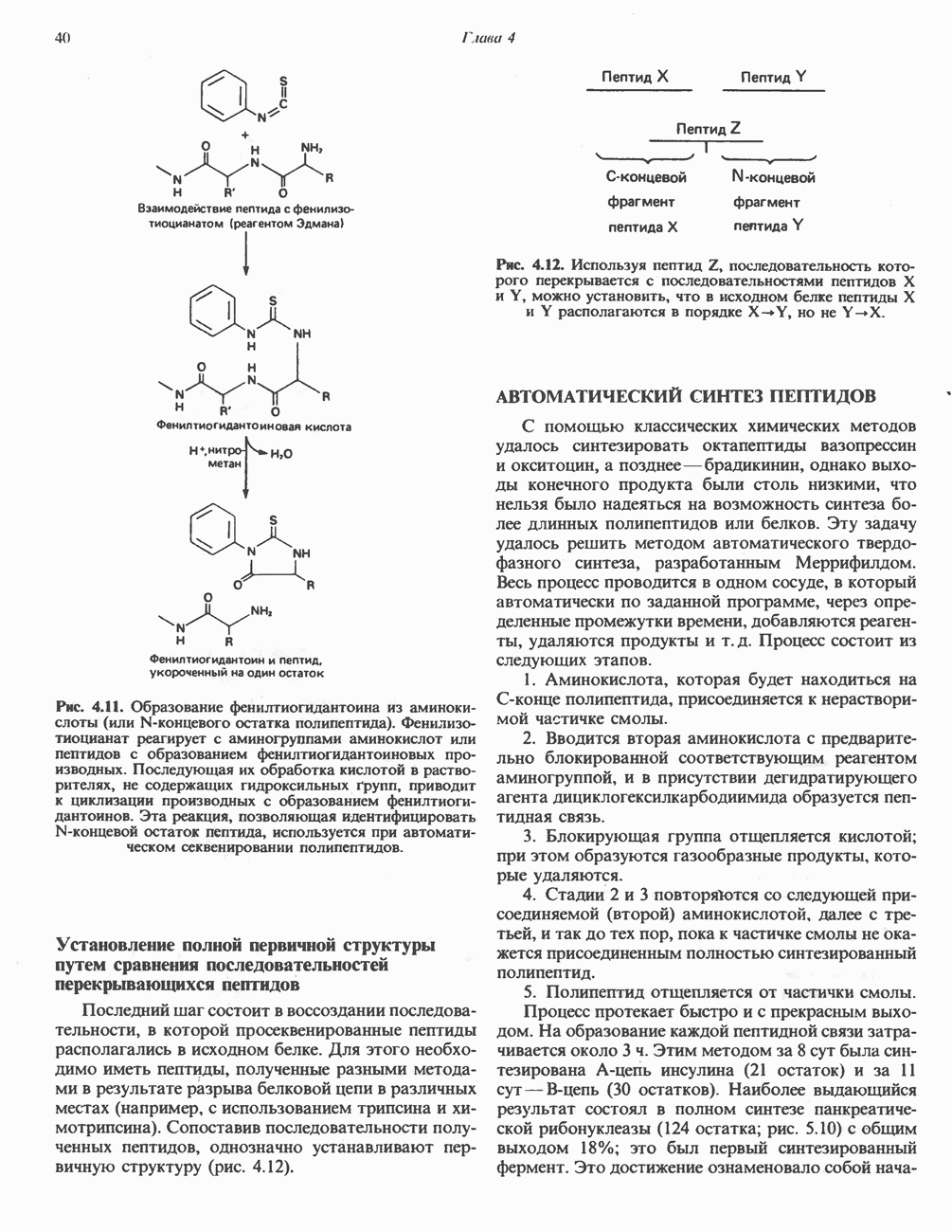
- АВТОМАТИЧЕСКОЕ ОПРЕДЕЛЕНИЕ АМИНОКИСЛОТНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ ПОЛИПЕПТИДОВ МЕТОДОМ ЭДМАНА
- АВТОМАТИЧЕСКИЙ СИНТЕЗ ПЕПТИДОВ
- ЛИТЕРАТУРА
- Глава 5. Белки: структура и свойства
- КЛАССИФИКАЦИЯ БЕЛКОВ
- СВЯЗИ, ОТВЕТСТВЕННЫЕ ЗА ФОРМИРОВАНИЕ СТРУКТУРЫ БЕЛКА
- УПОРЯДОЧЕННЫЕ КОНФОРМАЦИИ ПОЛИПЕПТИДОВ
- УРОВНИ СТРУКТУРНОЙ ОРГАНИЗАЦИИ БЕЛКА
- ДЕНАТУРАЦИЯ
- МЕТОДЫ ОПРЕДЕЛЕНИЯ ПЕРВИЧНОЙ СТРУКТУРЫ
- ОПРЕДЕЛЕНИЕ ВТОРИЧНОЙ И ТРЕТИЧНОЙ СТРУКТУРЫ МЕТОДОМ РЕНТГЕНОВСКОЙ КРИСТАЛЛОГРАФИИ
- ОПРЕДЕЛЕНИЕ ЧЕТВЕРТИЧНОЙ СТРУКТУРЫ
- ГЛАВА 6. Белки: миоглобин и гемоглобин
- ГЕМОПРОТЕИНЫ — МИОГЛОБИН И ГЕМОГЛОБИН
- МИОГЛОБИН
- ГЕМОГЛОБИНЫ
- Глава 7. Ферменты: общие свойства
- КОФЕРМЕНТЫ
- «ТРЕХТОЧЕЧНАЯ ФИКСАЦИЯ» СУБСТРАТОВ НА ФЕРМЕНТАХ
- СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
- КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
- ВЫДЕЛЕНИЕ ФЕРМЕНТОВ
- ИЗОФЕРМЕНТЫ (ИЗОЗИМЫ)
- ФЕРМЕНТЫ В КЛИНИЧЕСКОЙ ДИАГНОСТИКЕ
- ДИАГНОСТИЧЕСКОЕ И ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ СПЕЦИФИЧЕСКИХ ФЕРМЕНТОВ
- ПРИМЕНЕНИЕ ЭНДОНУКЛЕАЗ РЕСТРИКЦИИ В ДИАГНОСТИКЕ
- ЛИТЕРАТУРА
- Глава 8. ФЕРМЕНТЫ: КИНЕТИКА
- ОБРАЗОВАНИЕ И РАСПАД ПЕРЕХОДНЫХ СОСТОЯНИЙ
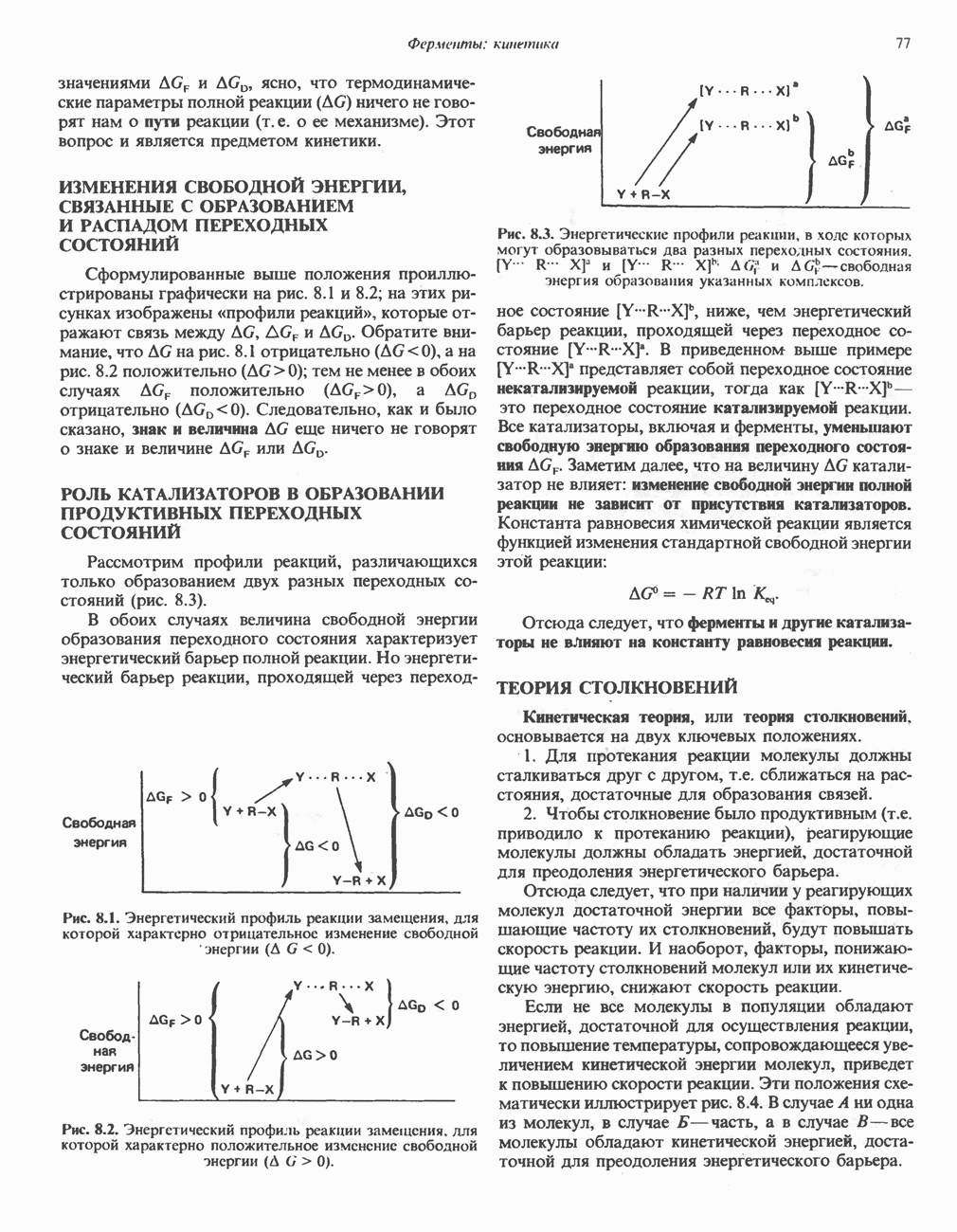
- ИЗМЕНЕНИЯ СВОБОДНОЙ ЭНЕРГИИ, СВЯЗАННЫЕ С ОБРАЗОВАНИЕМ И РАСПАДОМ ПЕРЕХОДНЫХ СОСТОЯНИЙ
- РОЛЬ КАТАЛИЗАТОРОВ В ОБРАЗОВАНИИ ПРОДУКТИВНЫХ ПЕРЕХОДНЫХ СОСТОЯНИЙ
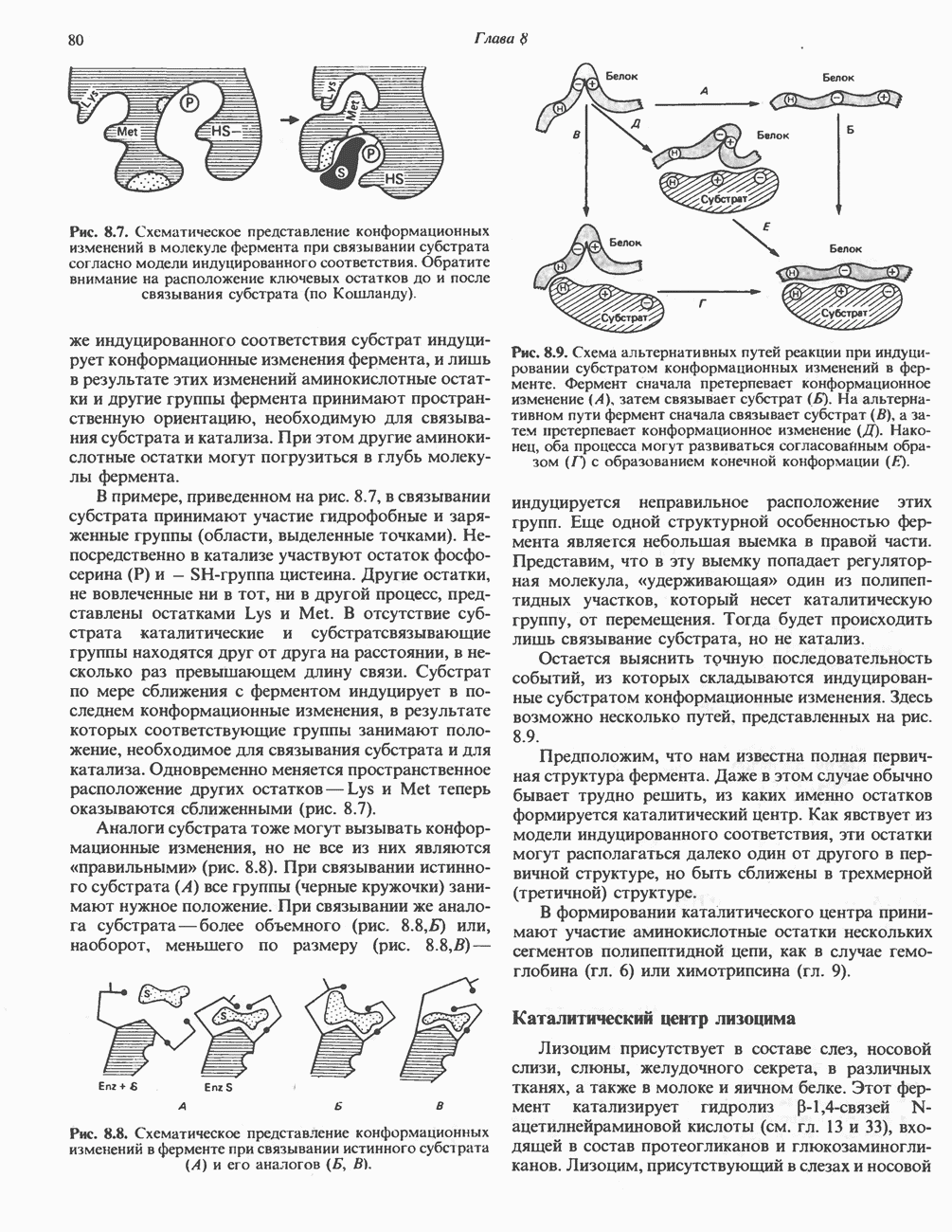
- ТЕОРИЯ СТОЛКНОВЕНИЙ
- РОЛЬ ФЕРМЕНТОВ В РАЗРЫВЕ И ОБРАЗОВАНИИ КОВАЛЕНТНЫХ СВЯЗЕЙ
- КАТАЛИТИЧЕСКИЙ ЦЕНТР
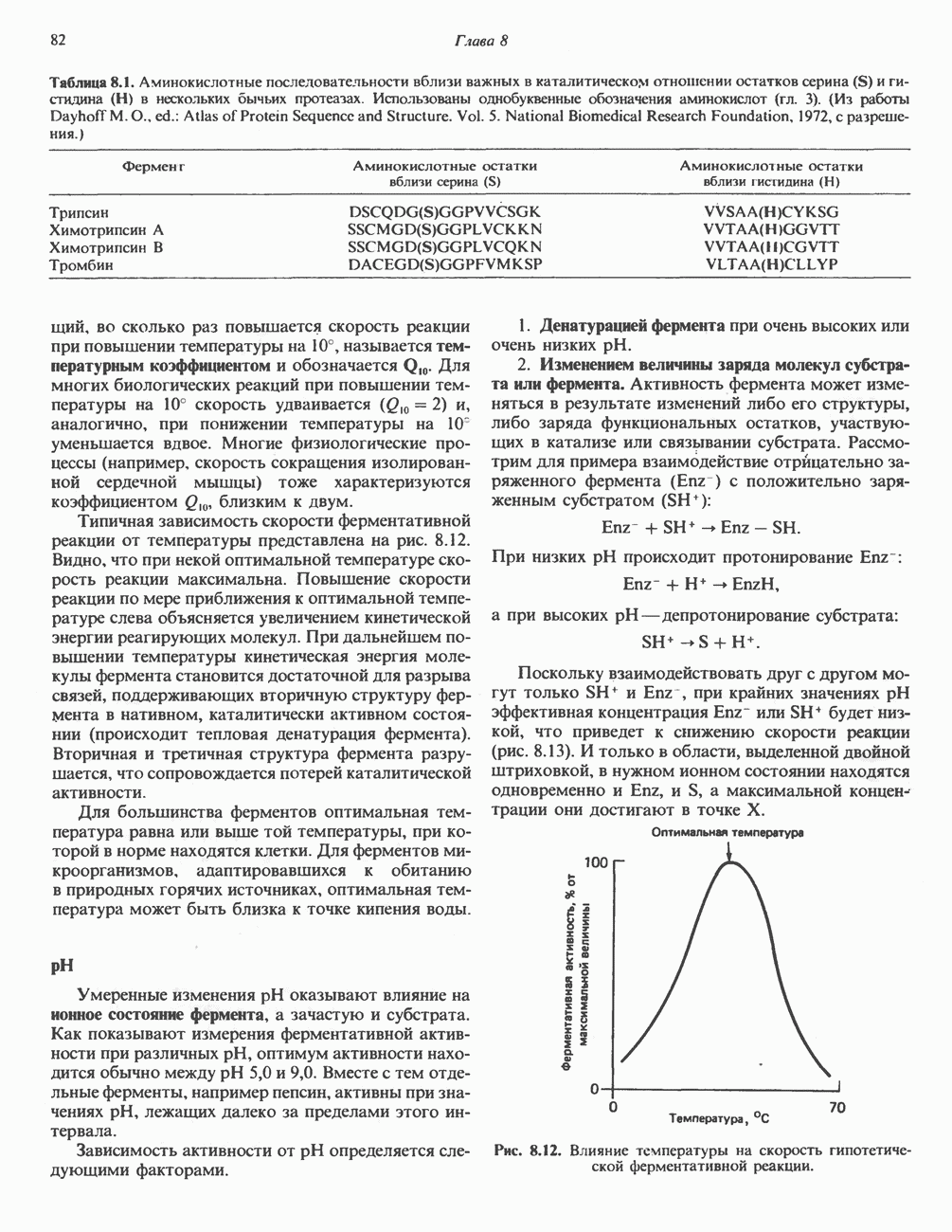
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА АКТИВНОСТЬ ФЕРМЕНТОВ
- КОНСТАНТА РАВНОВЕСИЯ
- КОНЦЕНТРАЦИЯ ФЕРМЕНТА
- КОНЦЕНТРАЦИЯ СУБСТРАТА
- УРАВНЕНИЕ МИХАЭЛИСА—МЕНТЕН
- ОГРАНИЧЕНИЯ, ПРИСУЩИЕ УРАВНЕНИЮ МИХАЭЛИСА — МЕНТЕН
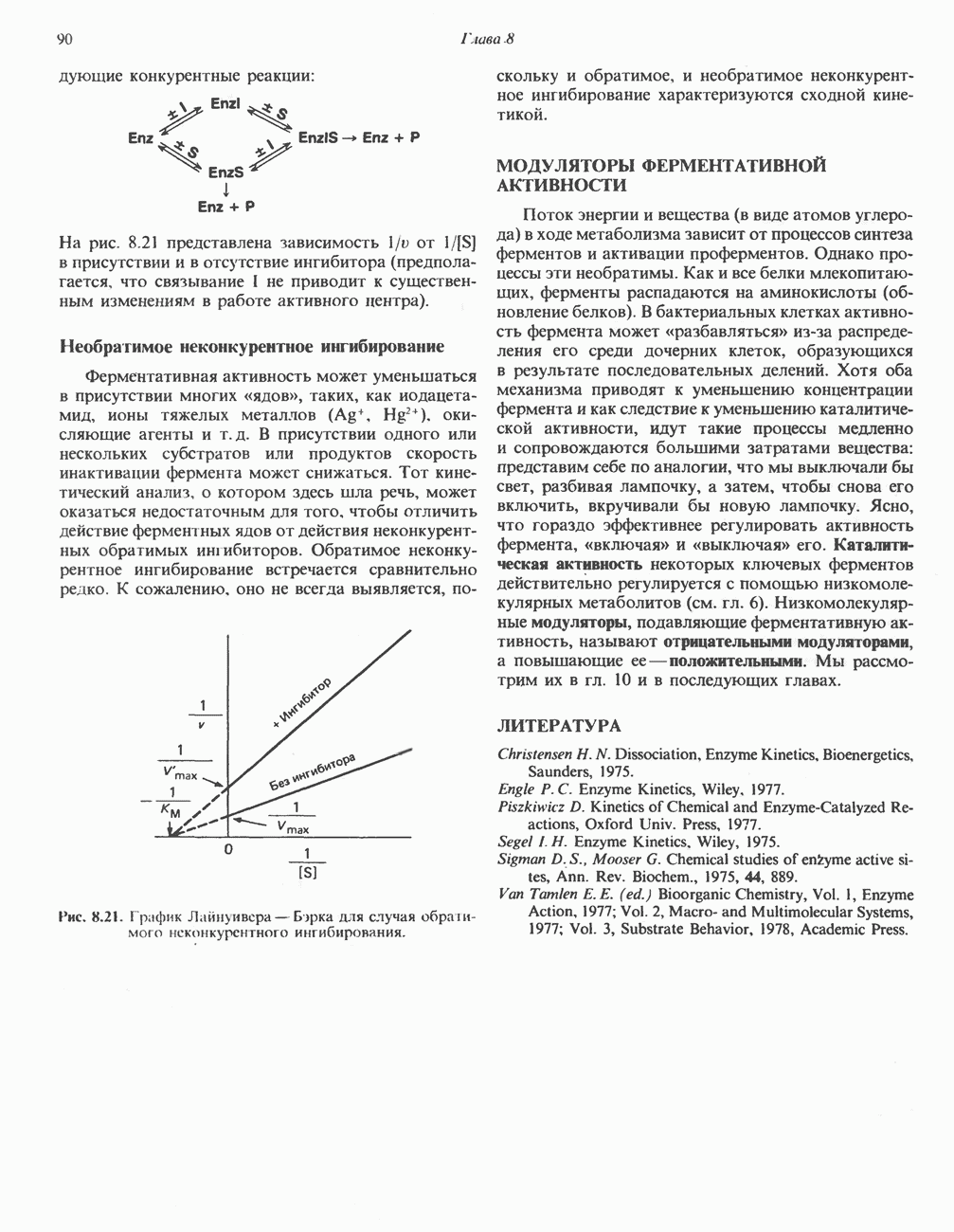
- ИНГИБИРОВАНИЕ АКТИВНОСТИ ФЕРМЕНТОВ
- МОДУЛЯТОРЫ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
- Глава 9. Ферменты: механизм действия
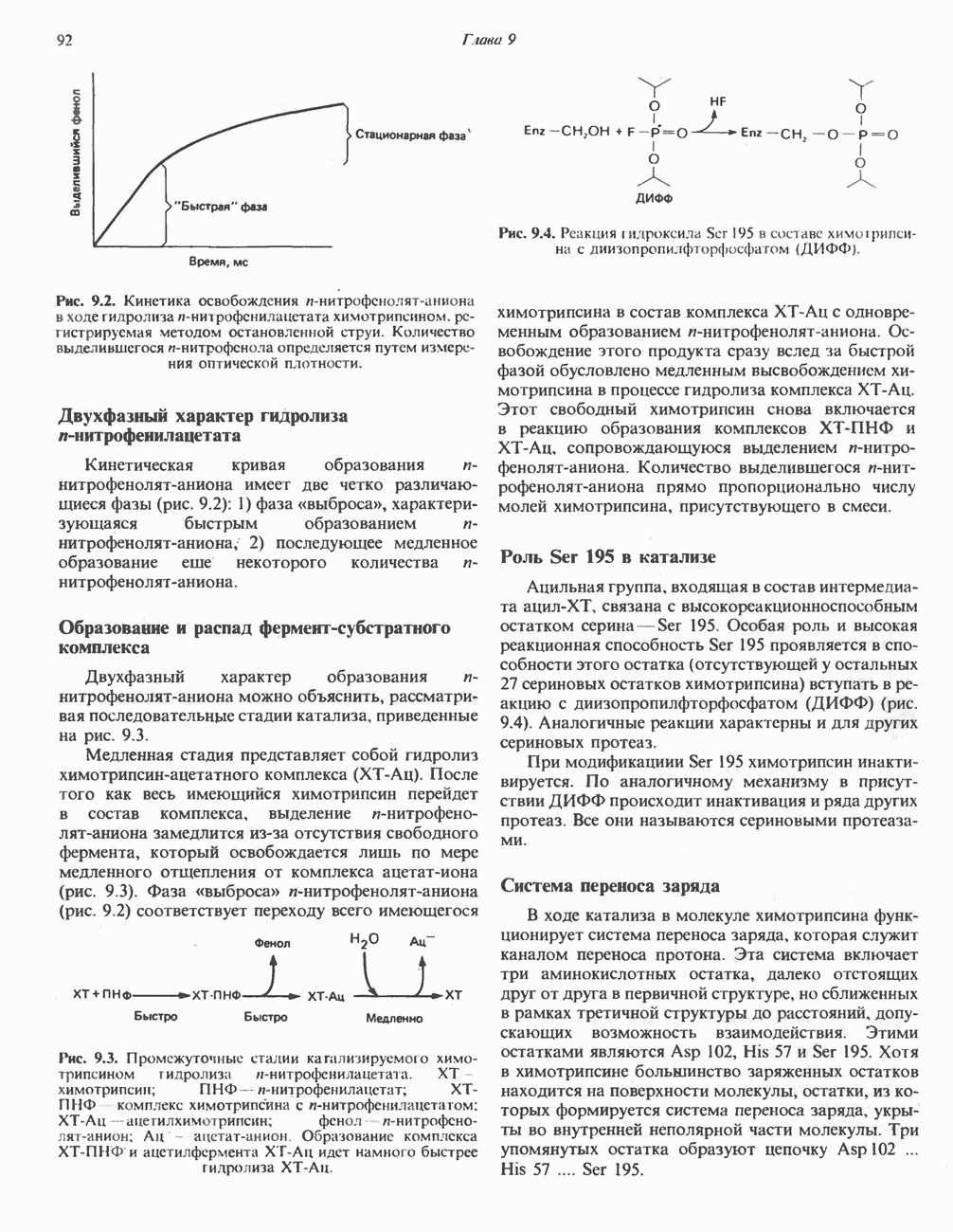
- МЕХАНИЗМ КАТАЛИТИЧЕСКОГО ДЕЙСТВИЯ ХИМОТРИПСИНА
- РОЛЬ ИЗБИРАТЕЛЬНОГО ПРОТЕОЛИЗА В ФОРМИРОВАНИИ АКТИВНЫХ ЦЕНТРОВ ФЕРМЕНТОВ
- УПОРЯДОЧЕННОЕ И НЕУПОРЯДОЧЕННОЕ СВЯЗЫВАНИЕ СУБСТРАТОВ
- ФЕРМЕНТЫ КАК КАТАЛИЗАТОРЫ ОБЩЕГО КИСЛОТНОГО И ОБЩЕГО ОСНОВНОГО ТИПА
- ИОНЫ МЕТАЛЛОВ
- Глава 10. Ферменты: регуляция активности
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА
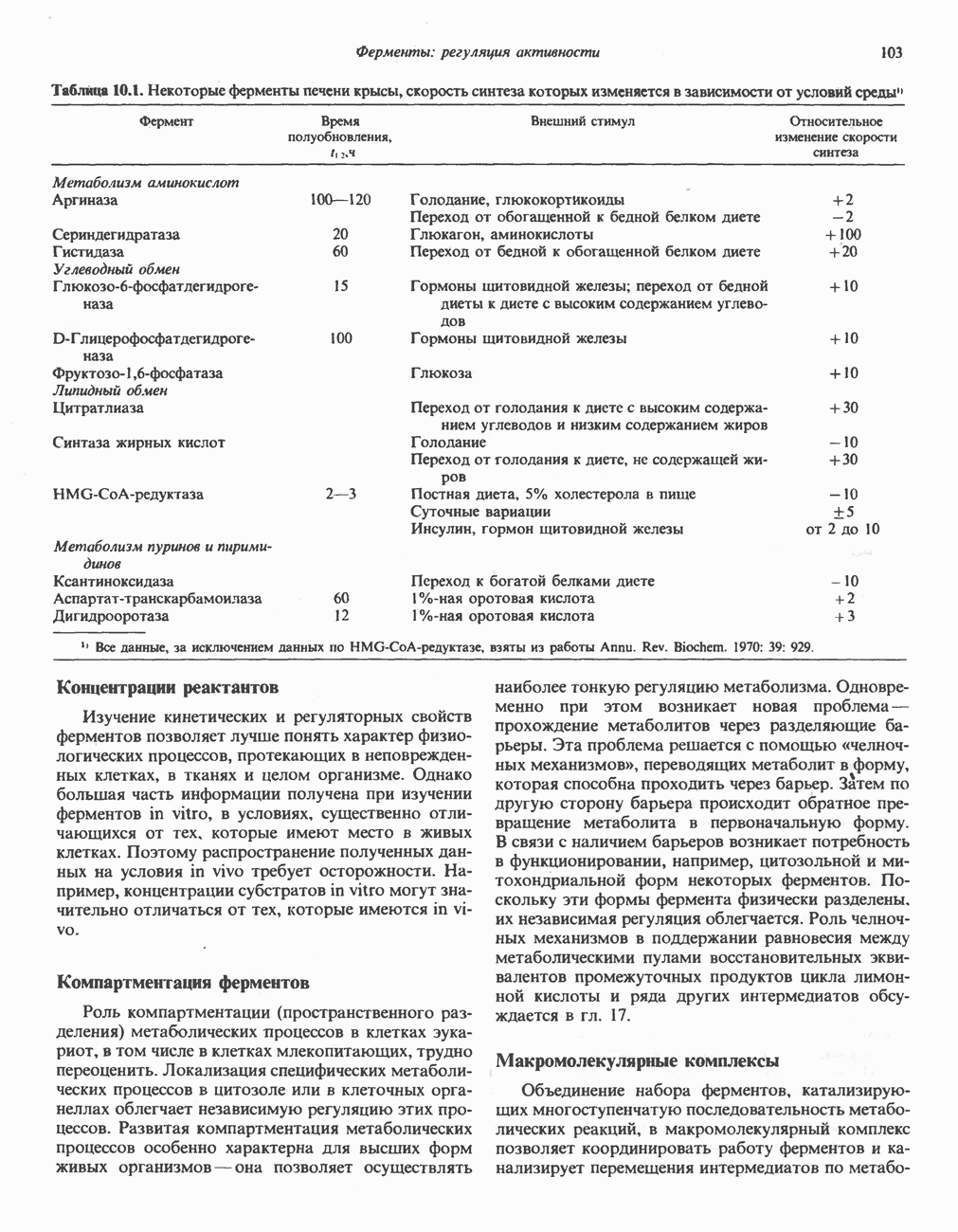
- РЕГУЛЯЦИЯ КОЛИЧЕСТВА ФЕРМЕНТА ПУТЕМ РЕГУЛЯЦИИ СКОРОСТИ ЕГО СИНТЕЗА И РАСПАДА
- РЕГУЛЯЦИЯ КАТАЛИТИЧЕСКОЙ АКТИВНОСТИ ФЕРМЕНТОВ
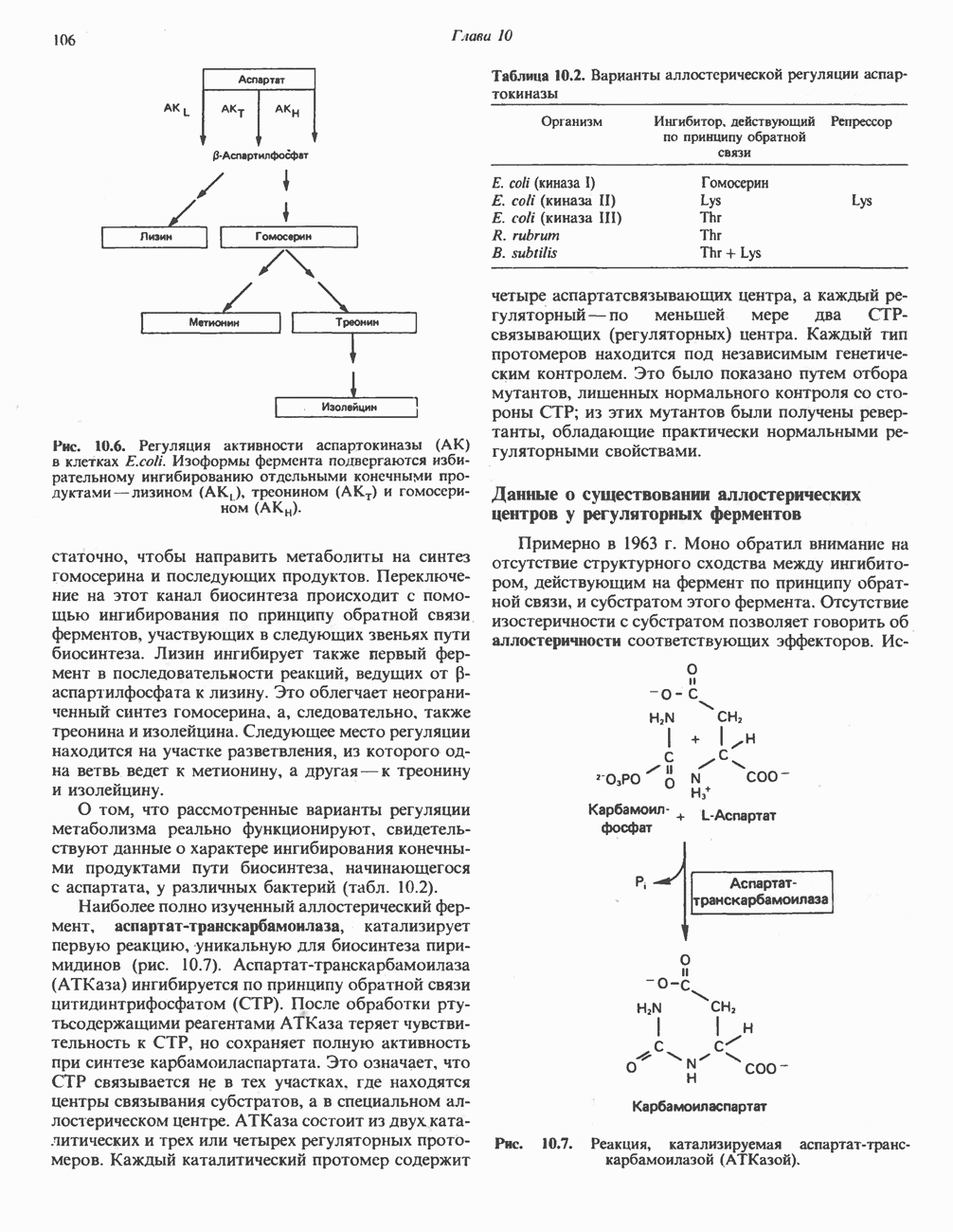
- АЛЛОСТЕРИЧЕСКАЯ РЕГУЛЯЦИЯ
- КОВАЛЕНТНАЯ МОДИФИКАЦИЯ ФЕРМЕНТОВ
- Раздел II. Биоэнергетика и метаболизм углеводов и липидов
- Глава 11. Биоэнергетика
- СВОБОДНАЯ ЭНЕРГИЯ И ЗАКОНЫ ТЕРМОДИНАМИКИ
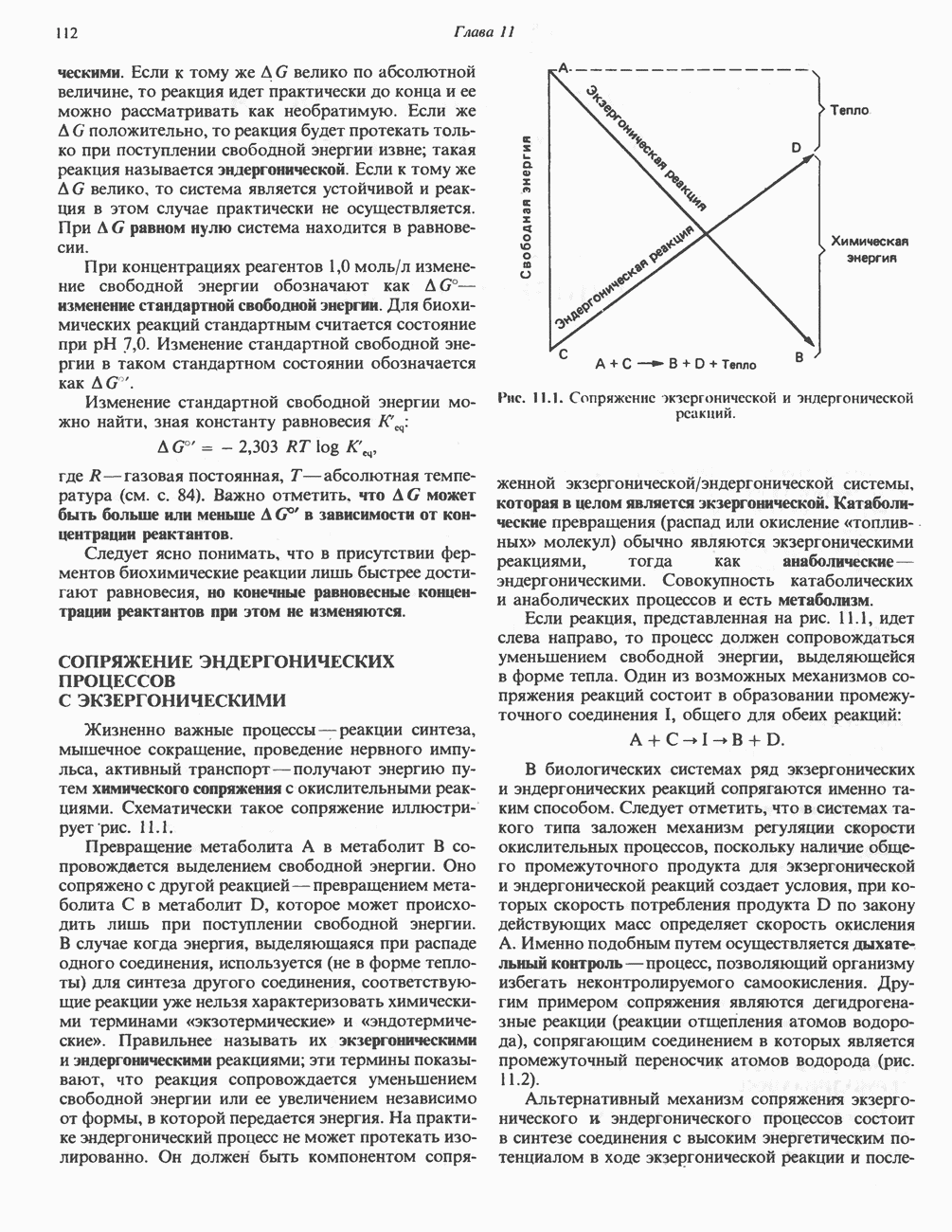
- СОПРЯЖЕНИЕ ЭНДЕРГОНИЧЕСКИХ ПРОЦЕССОВ С ЭКЗЕРГОНИЧЕСКИМИ
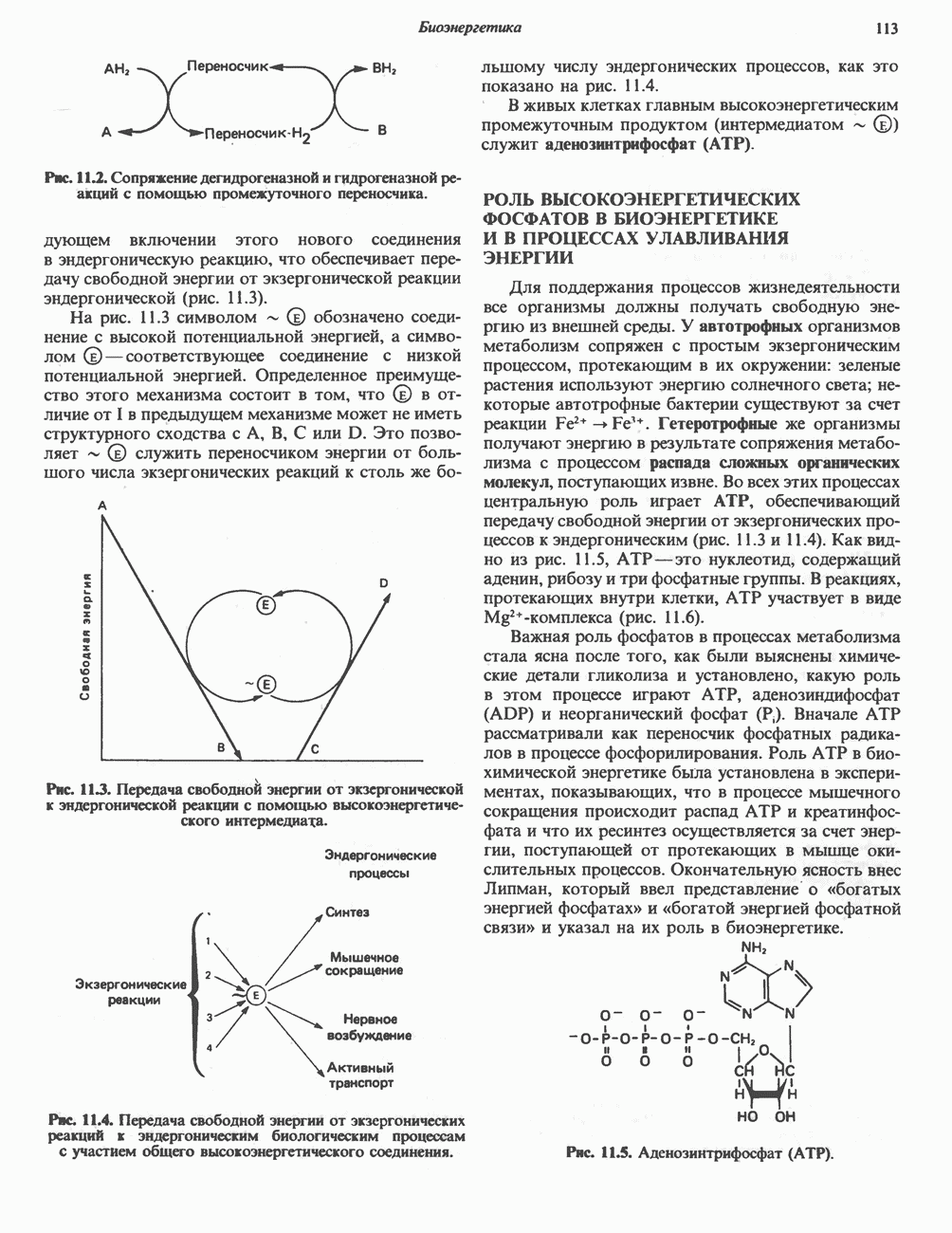
- РОЛЬ ВЫСОКОЭНЕРГЕТИЧЕСКИХ ФОСФАТОВ В БИОЭНЕРГЕТИКЕ И В ПРОЦЕССАХ УЛАВЛИВАНИЯ ЭНЕРГИИ
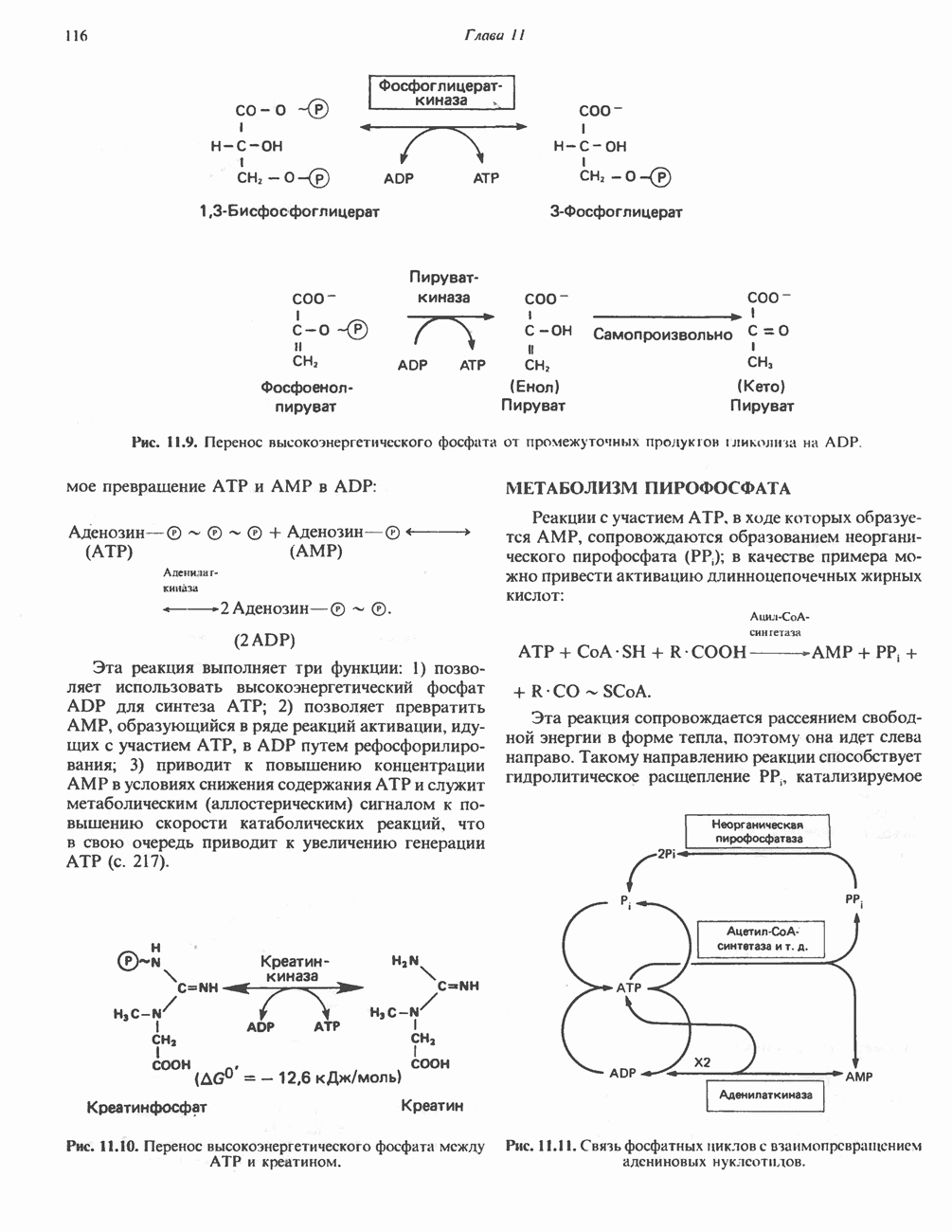
- МЕТАБОЛИЗМ ПИРОФОСФАТА
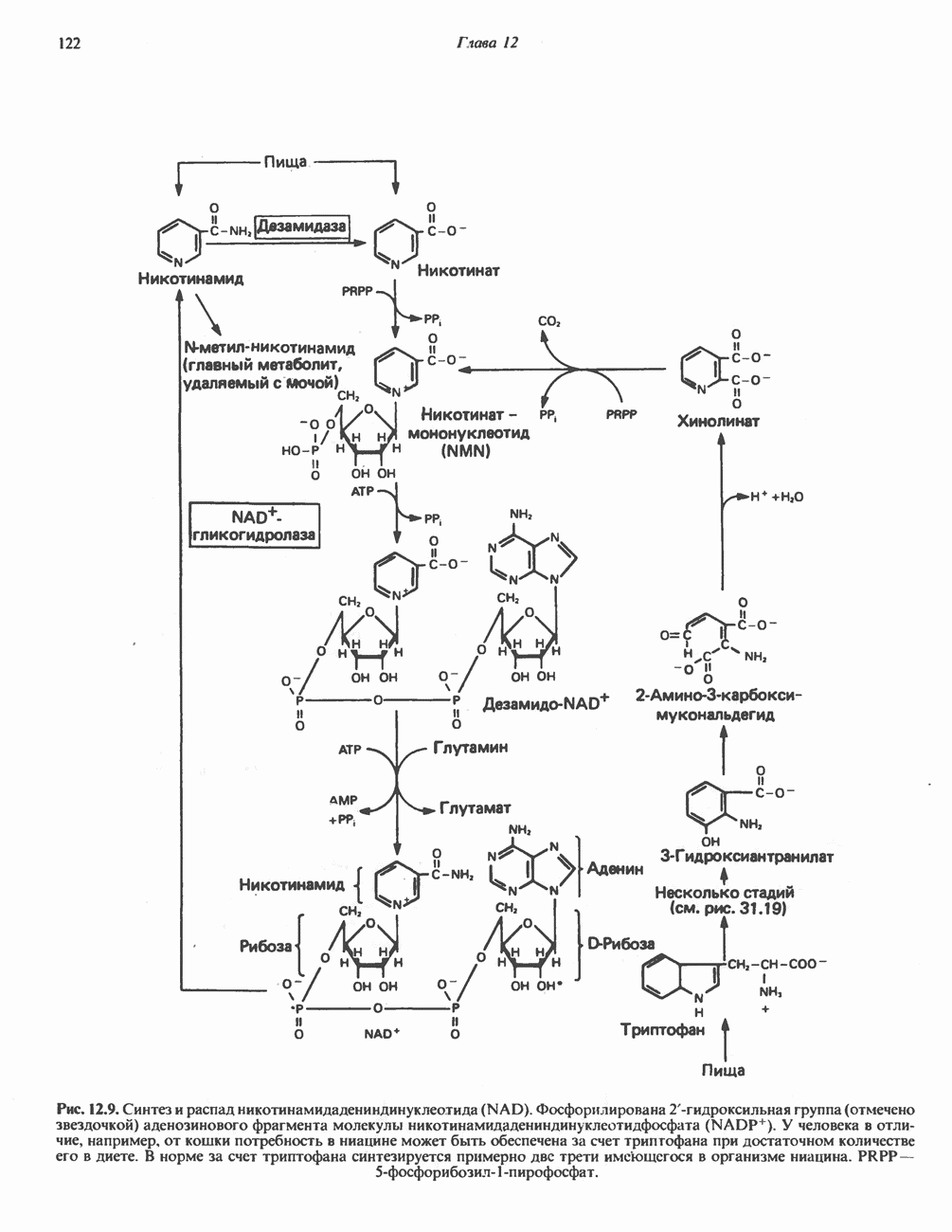
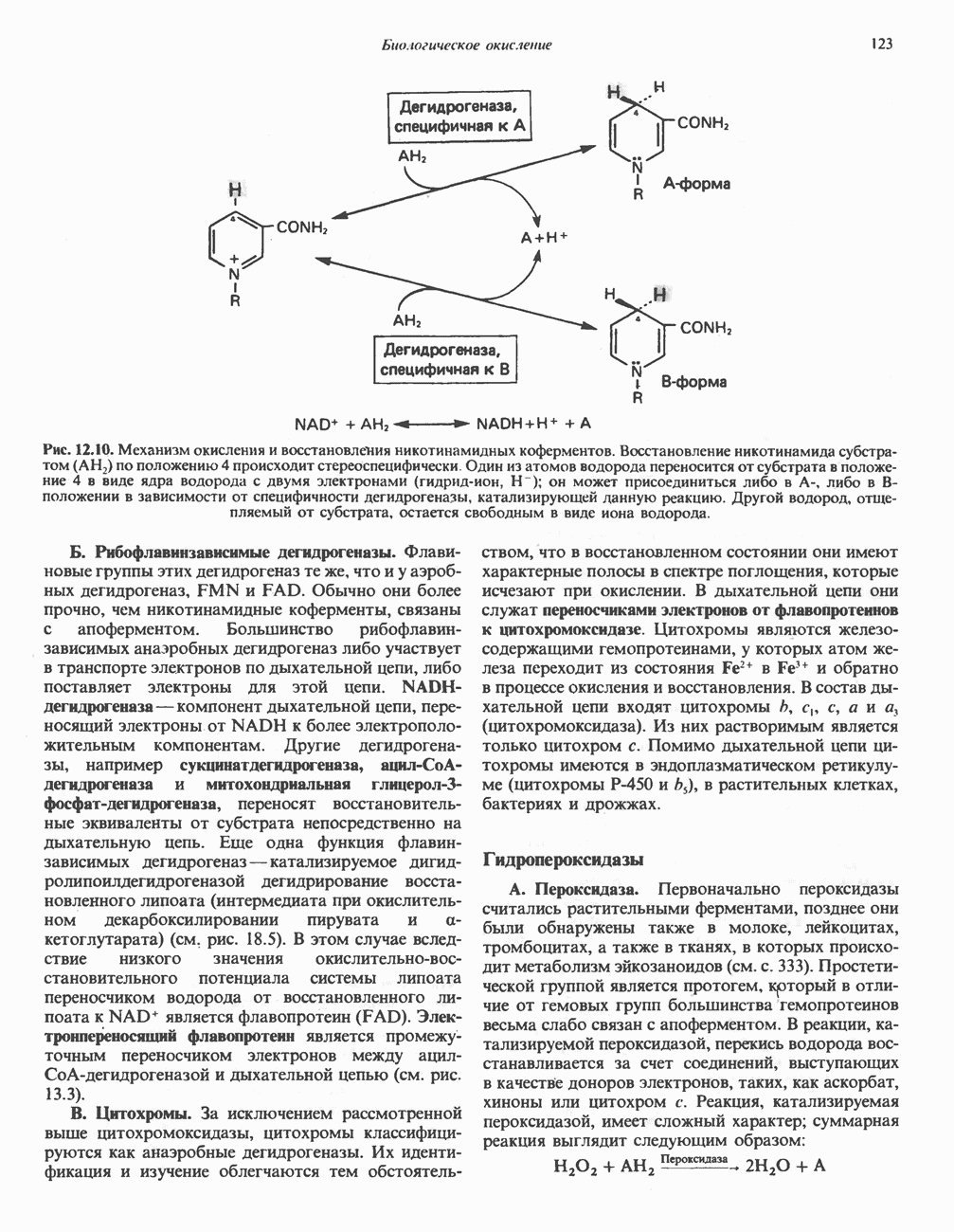
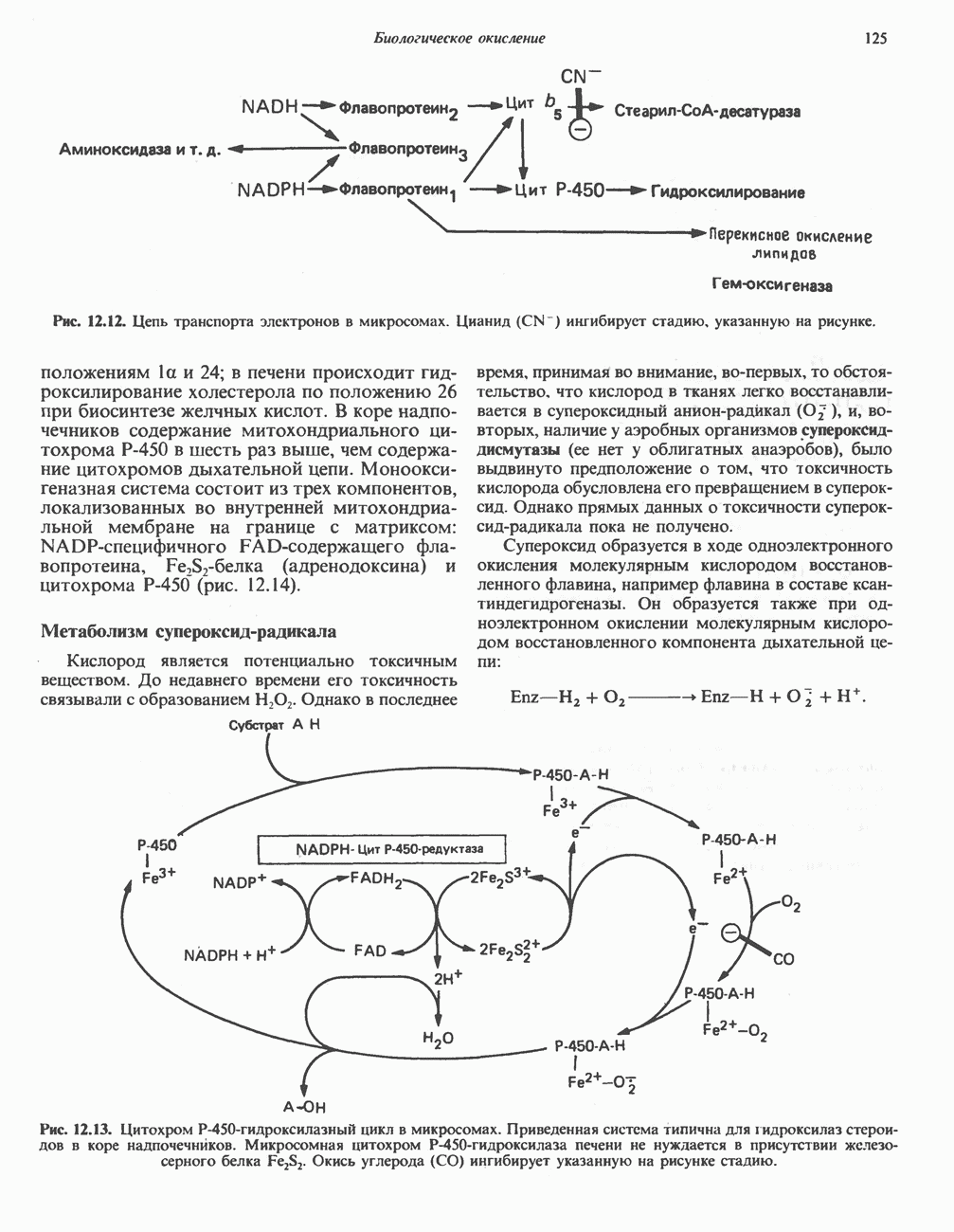
- Глава 12. Биологическое окисление
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ РАВНОВЕСИЕ, ОКИСЛИТЕЛЬНОВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ
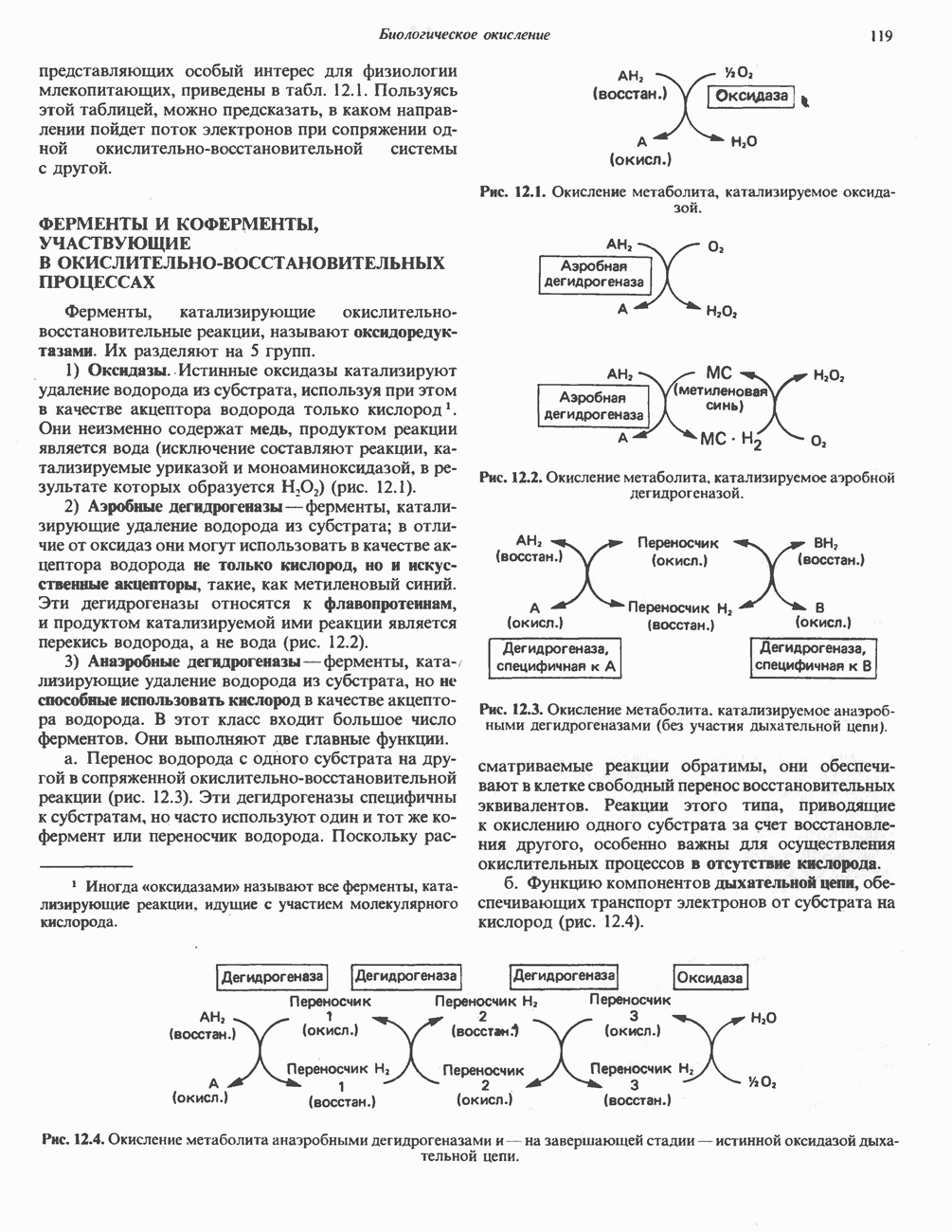
- ФЕРМЕНТЫ И КОФЕРМЕНТЫ, УЧАСТВУЮЩИЕ В ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССАХ
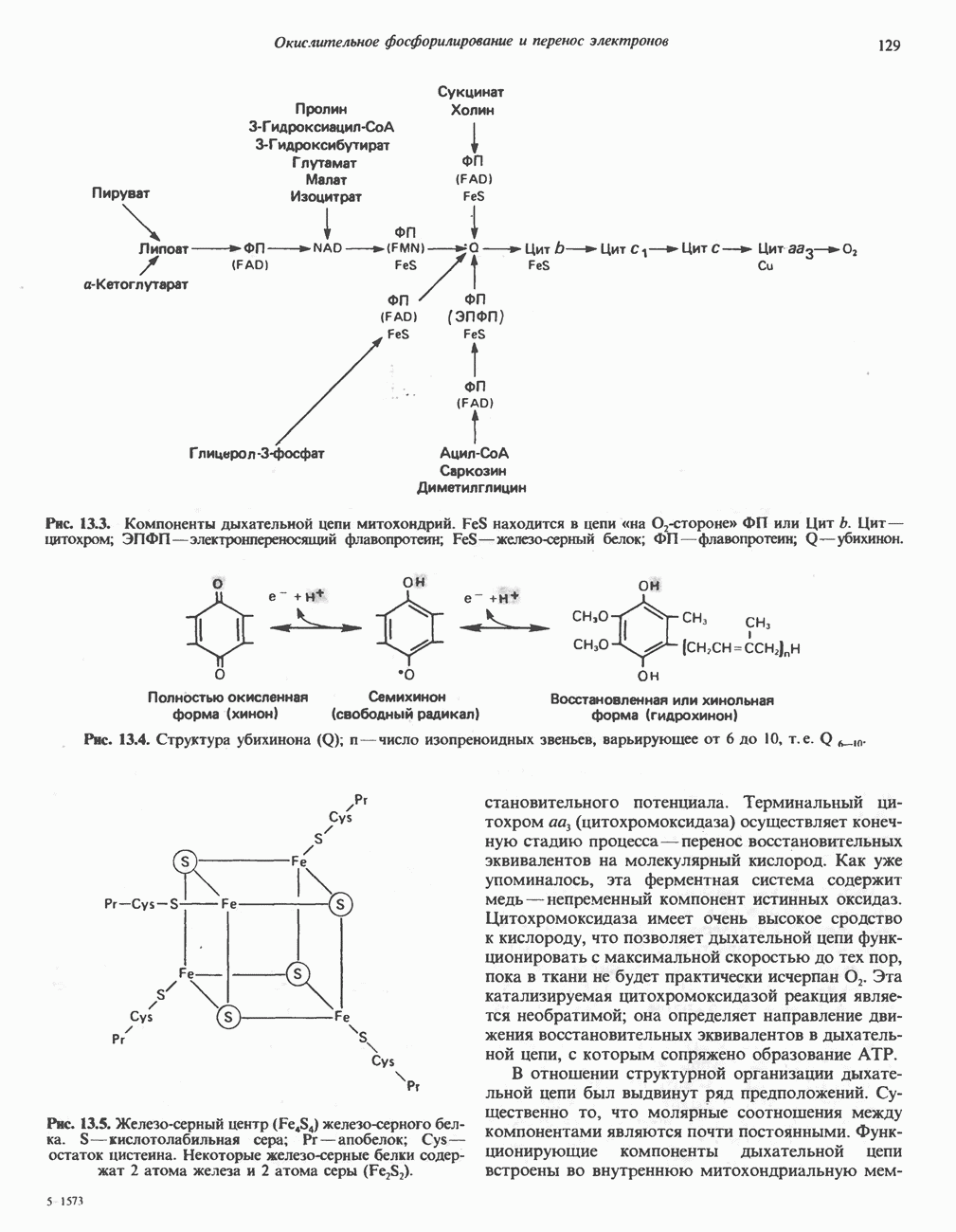
- Глава 13. Окислительное фосфорилирование и транспортные системы митохондрий
- ДЫХАТЕЛЬНАЯ ЦЕПЬ
- ОРГАНИЗАЦИЯ ДЫХАТЕЛЬНОЙ ЦЕПИ В МИТОХОНДРИЯХ
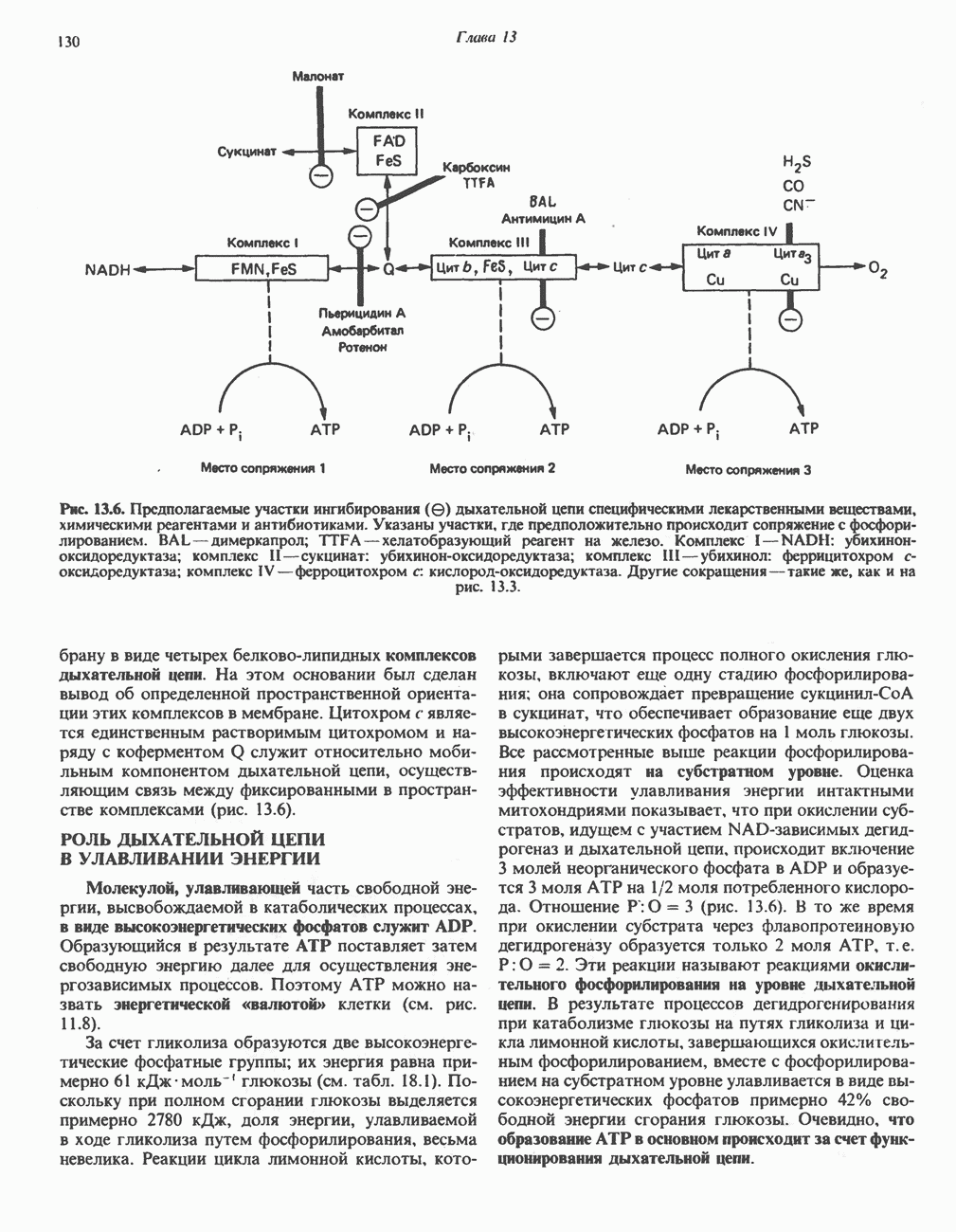
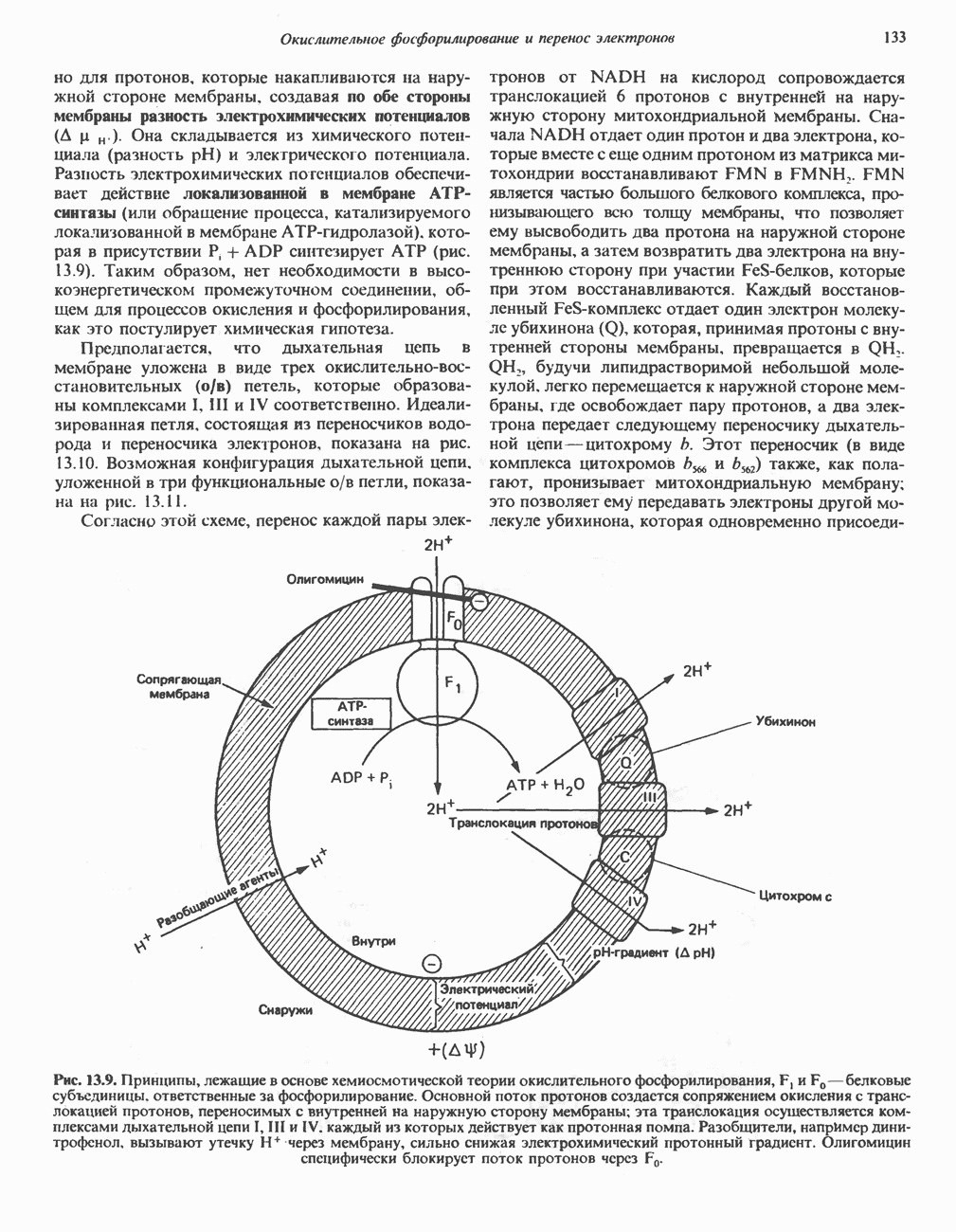
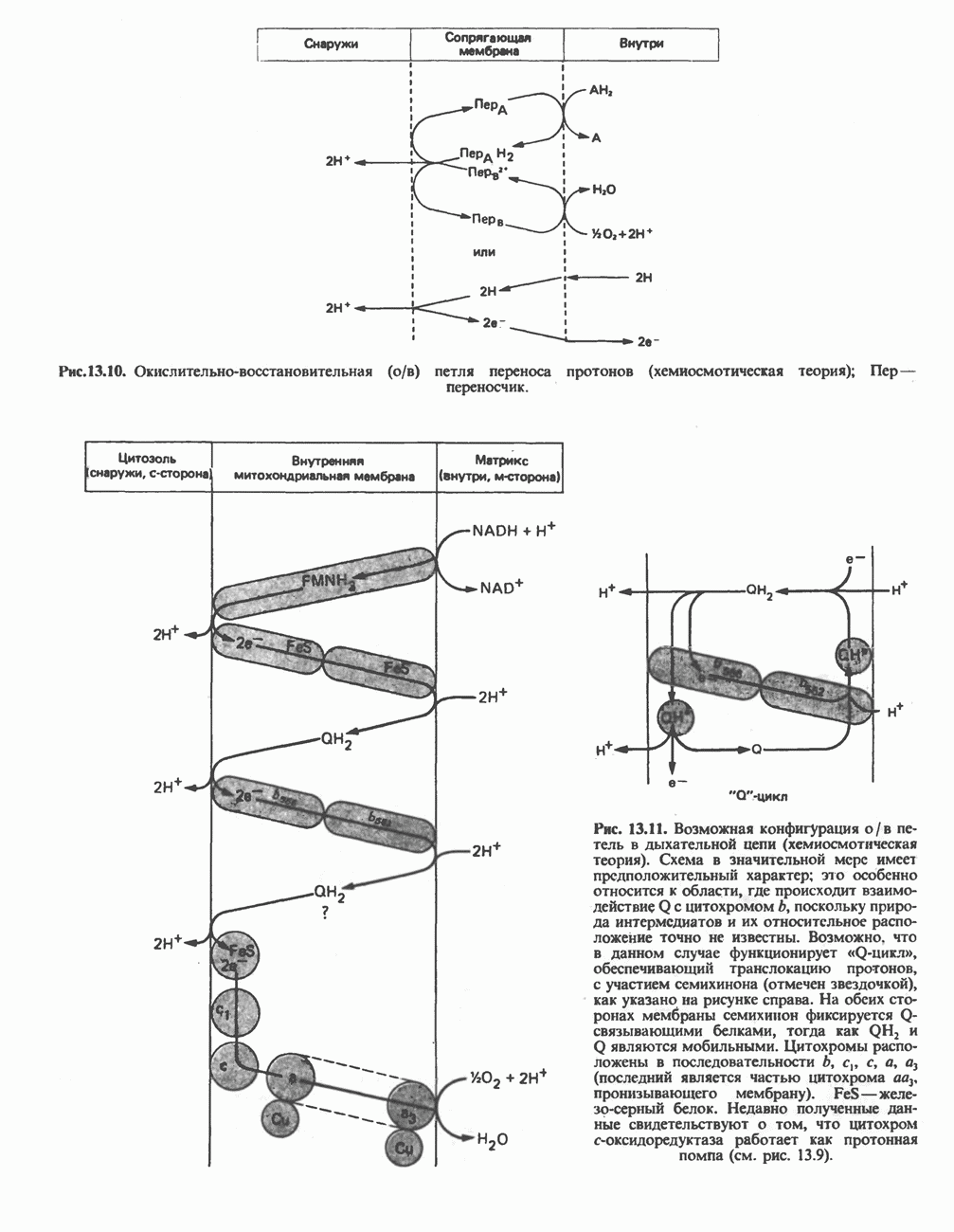
- РОЛЬ ДЫХАТЕЛЬНОЙ ЦЕПИ В УЛАВЛИВАНИИ ЭНЕРГИИ
- ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
- ИНГИБИТОРЫ ДЫХАТЕЛЬНОЙ ЦЕПИ И ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
- МЕХАНИЗМ ОКИСЛИТЕЛЬНОГО ФОСФОРИЛИРОВАНИЯ
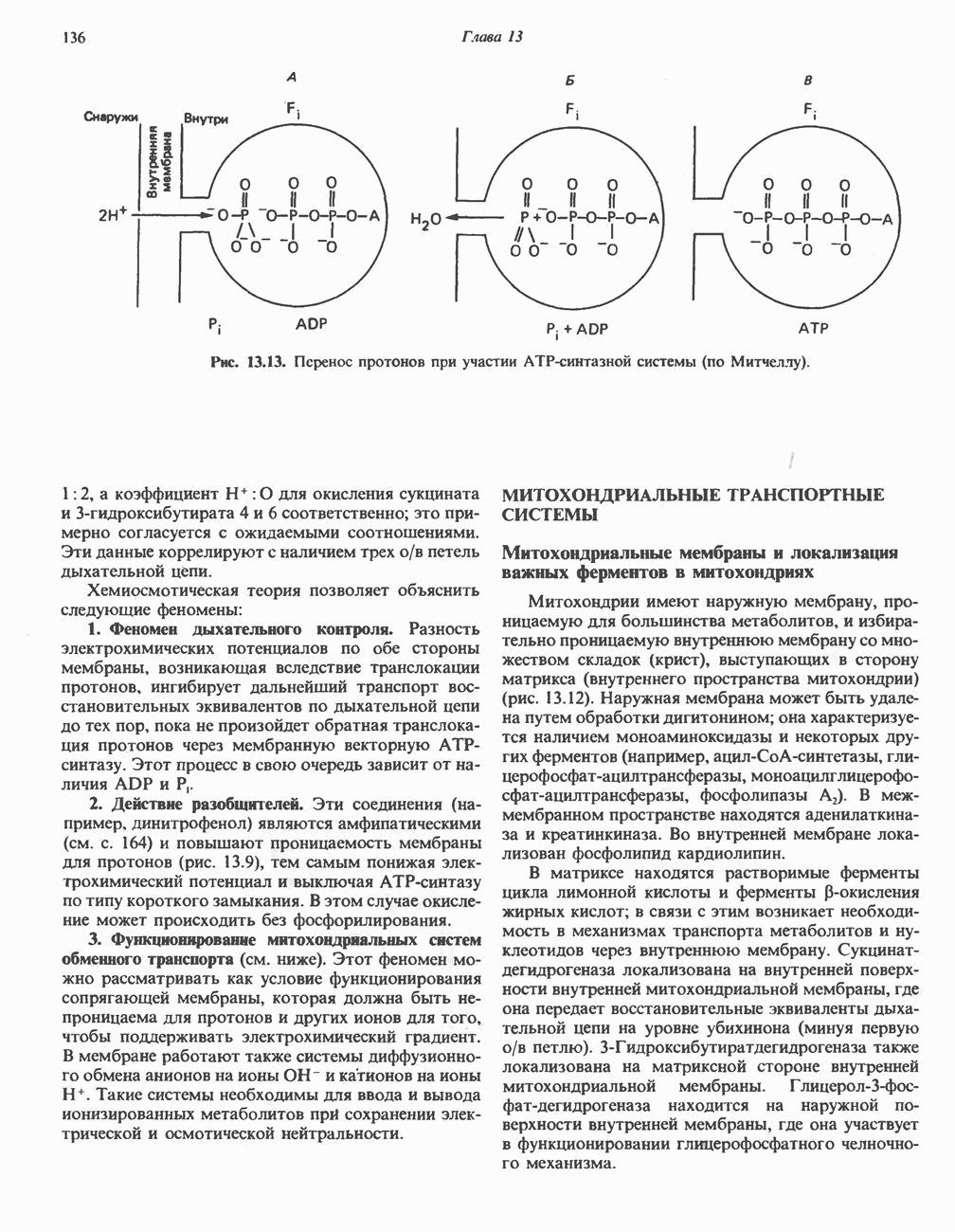
- МИТОХОНДРИАЛЬНЫЕ ТРАНСПОРТНЫЕ СИСТЕМЫ
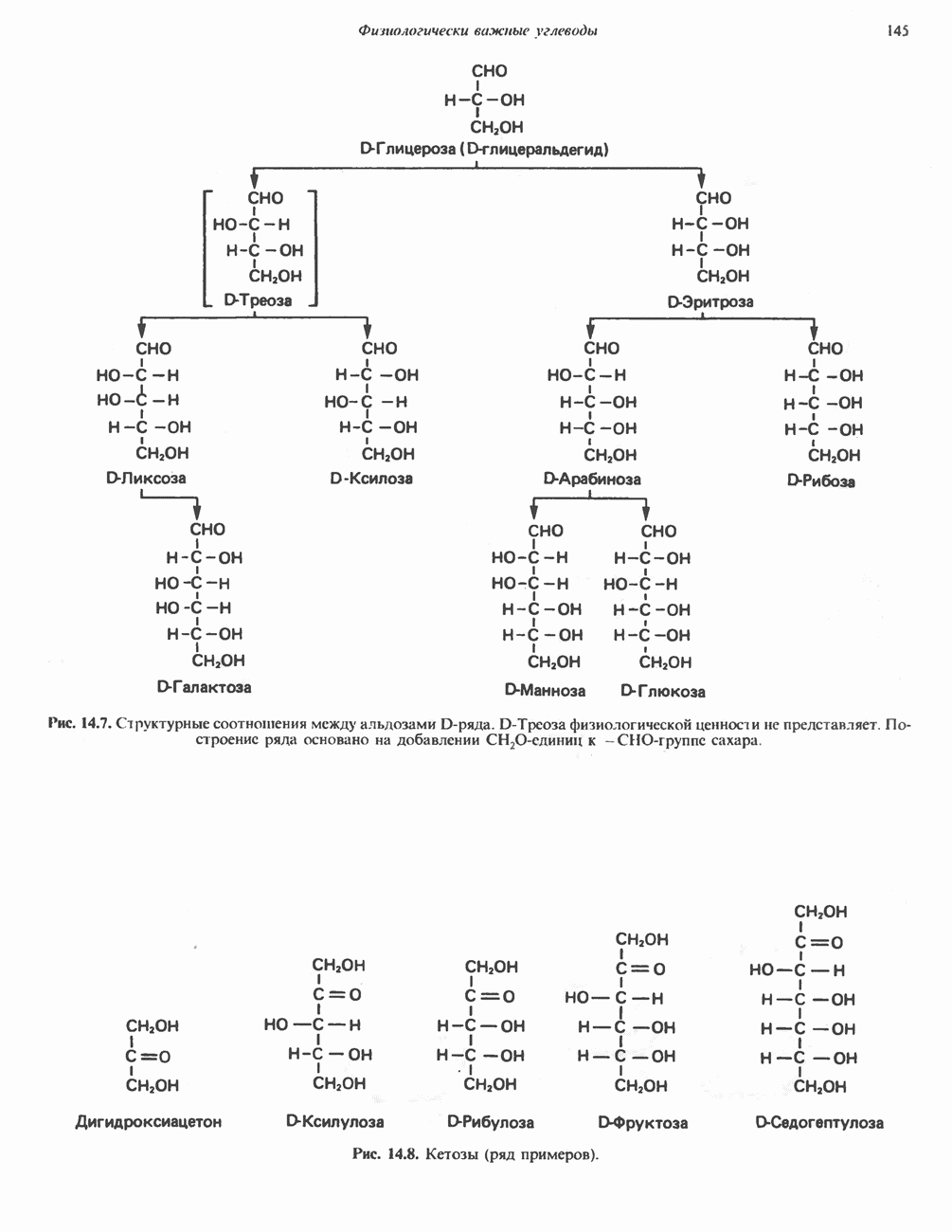
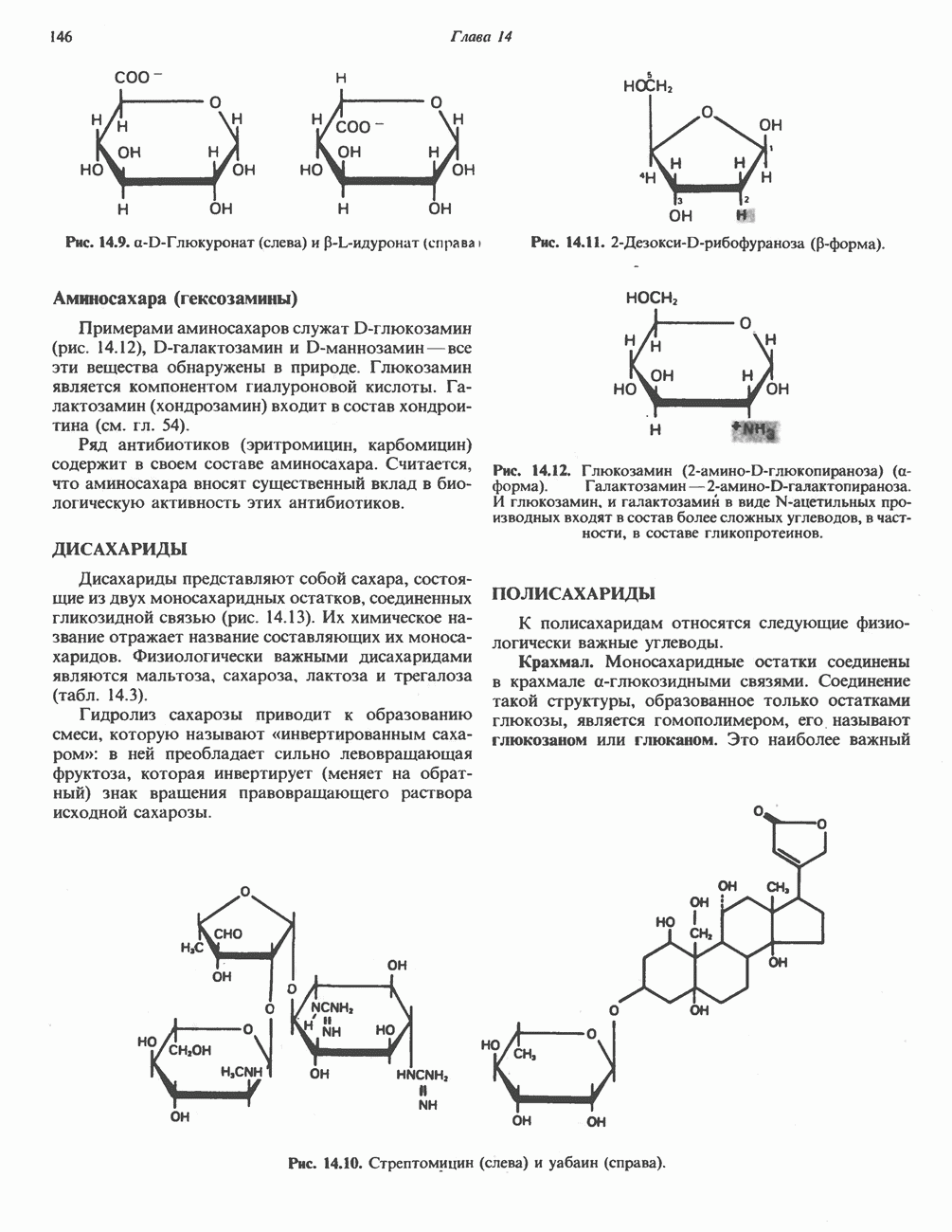
- Глава 14. Физиологически важные углеводы
- КЛАССИФИКАЦИЯ УГЛЕВОДОВ
- МОНОСАХАРИДЫ
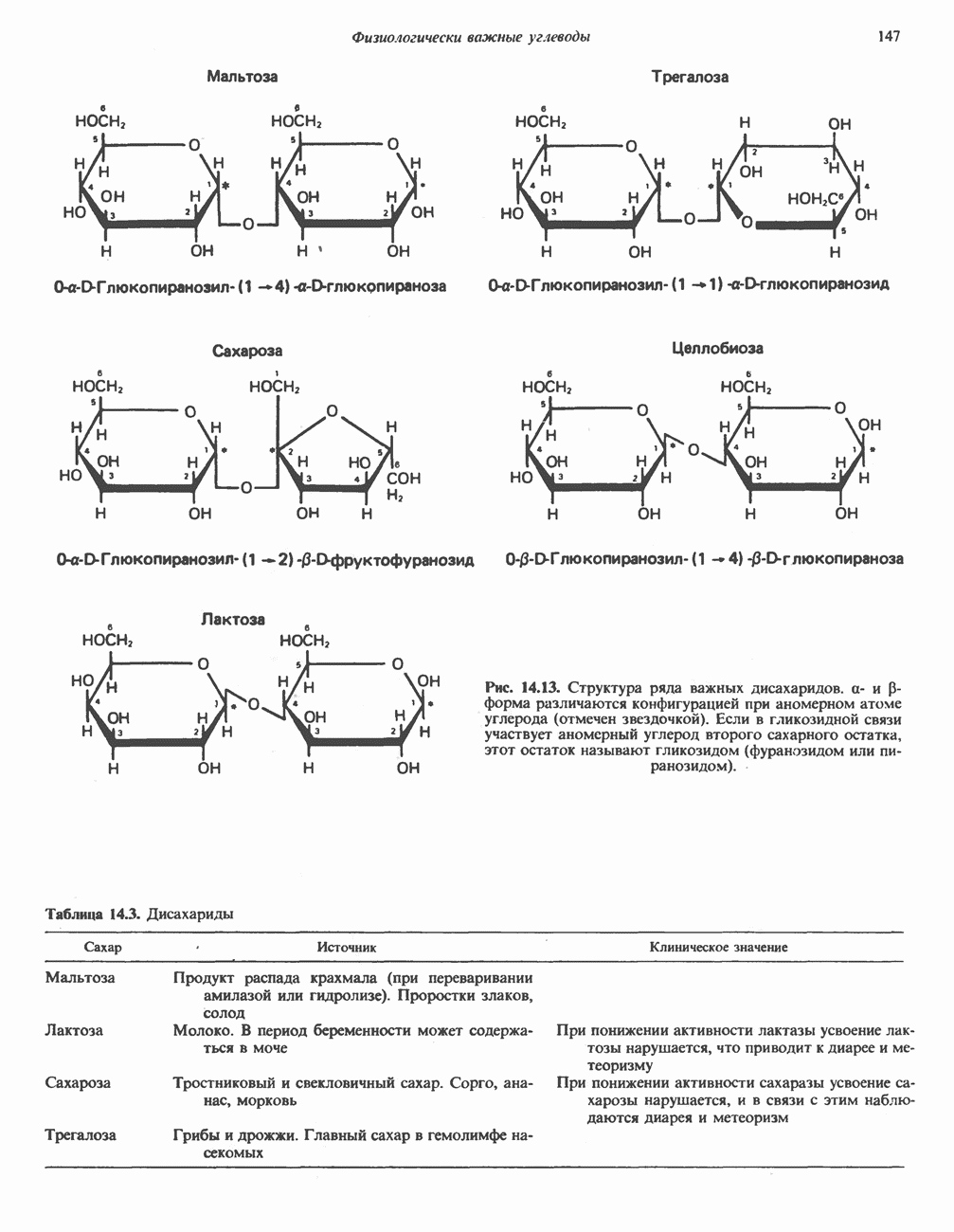
- ДИСАХАРИДЫ
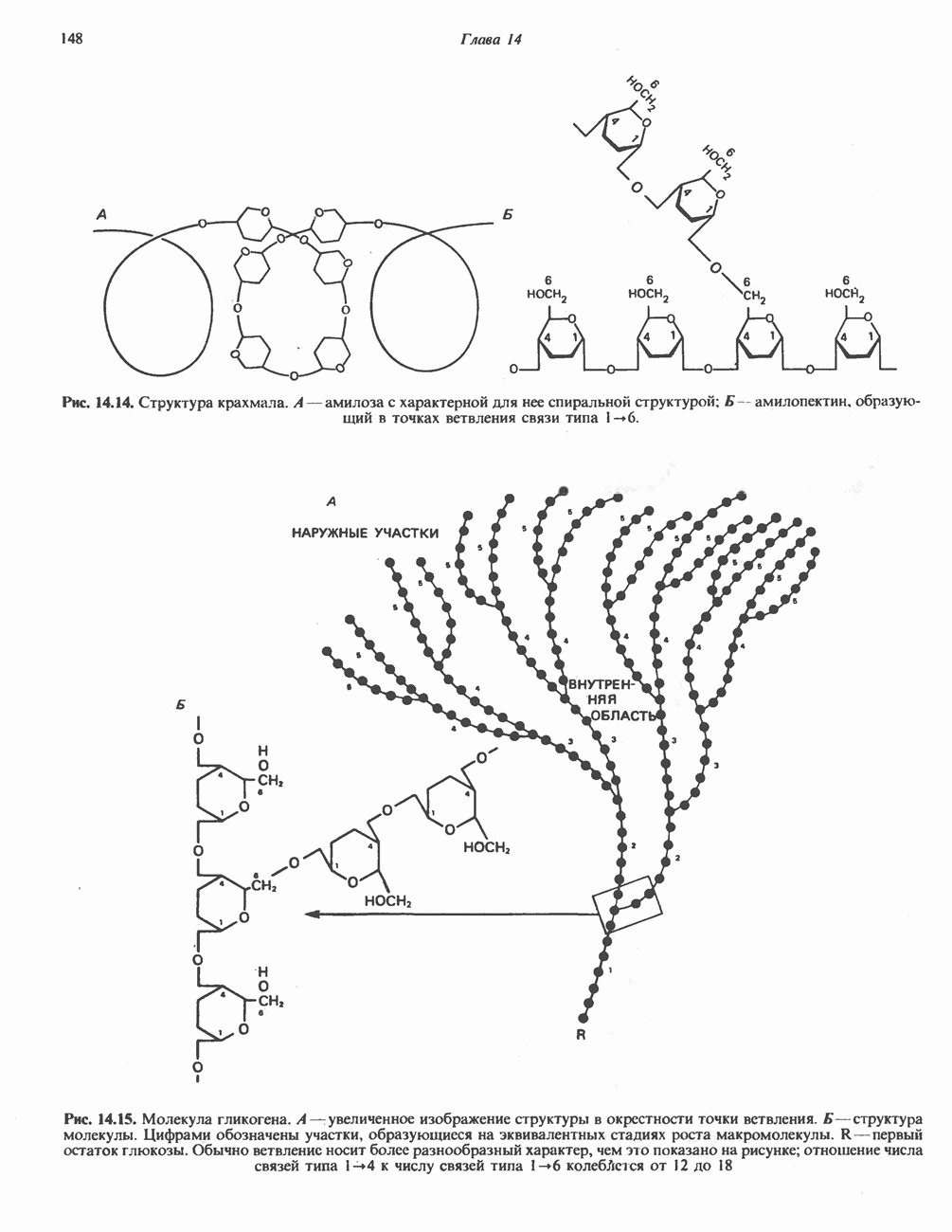
- ПОЛИСАХАРИДЫ
- УГЛЕВОДЫ КЛЕТОЧНЫХ МЕМБРАН
- Глава 15. Физиологически важные липиды
- КЛАССИФИКАЦИЯ ЛИПИДОВ
- ЖИРНЫЕ КИСЛОТЫ
- ТРИАЦИЛГЛИЦЕРОЛЫ (триглицериды)
- ФОСФОЛИПИДЫ
- ГЛИКОЛИПИДЫ (ГЛИКОСФИНГОЛИПИДЫ)
- СТЕРОИДЫ
- ПЕРЕКИСНОЕ ОКИСЛЕНИЕ ЛИПИДОВ
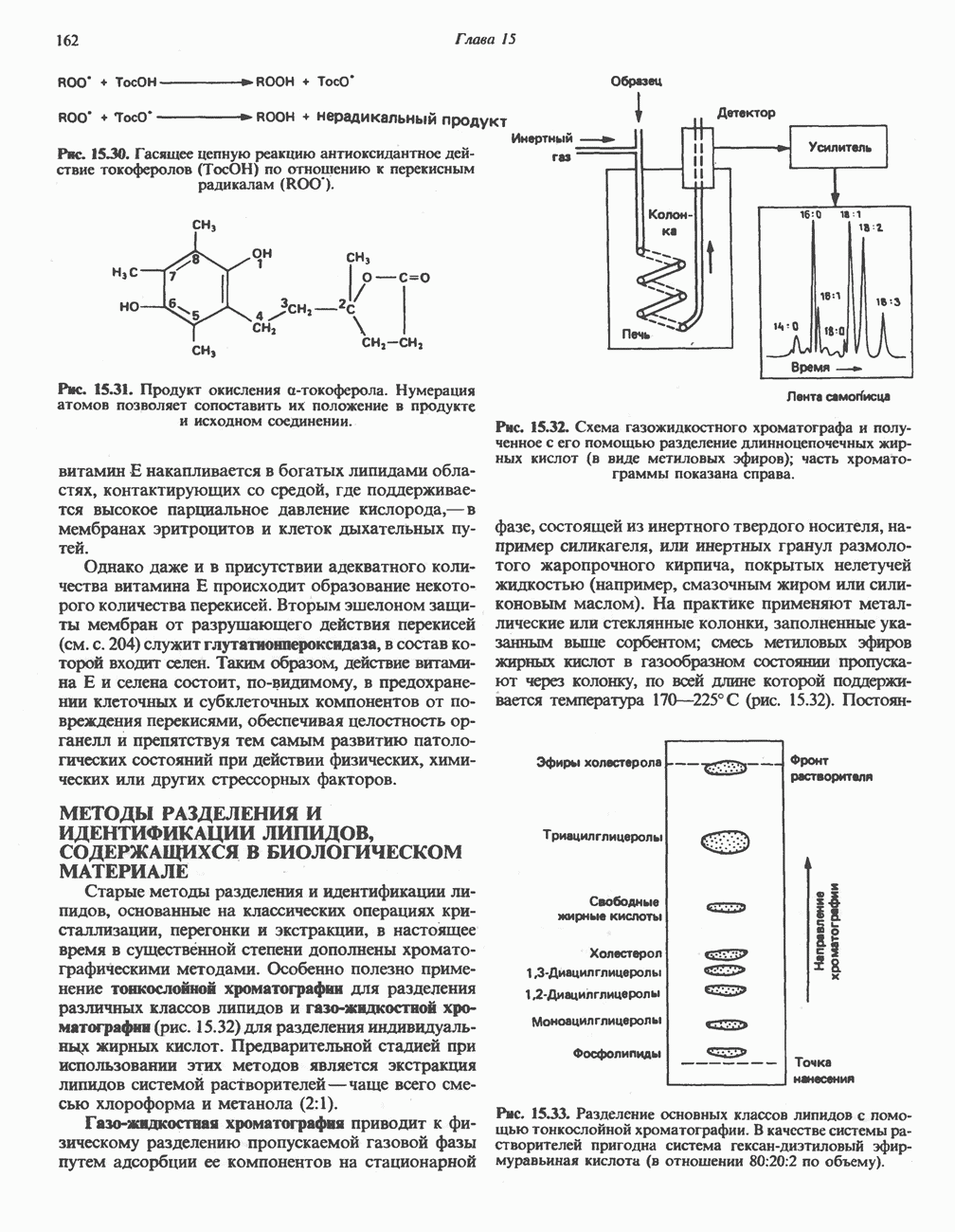
- МЕТОДЫ РАЗДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ ЛИПИДОВ, СОДЕРЖАЩИХСЯ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ
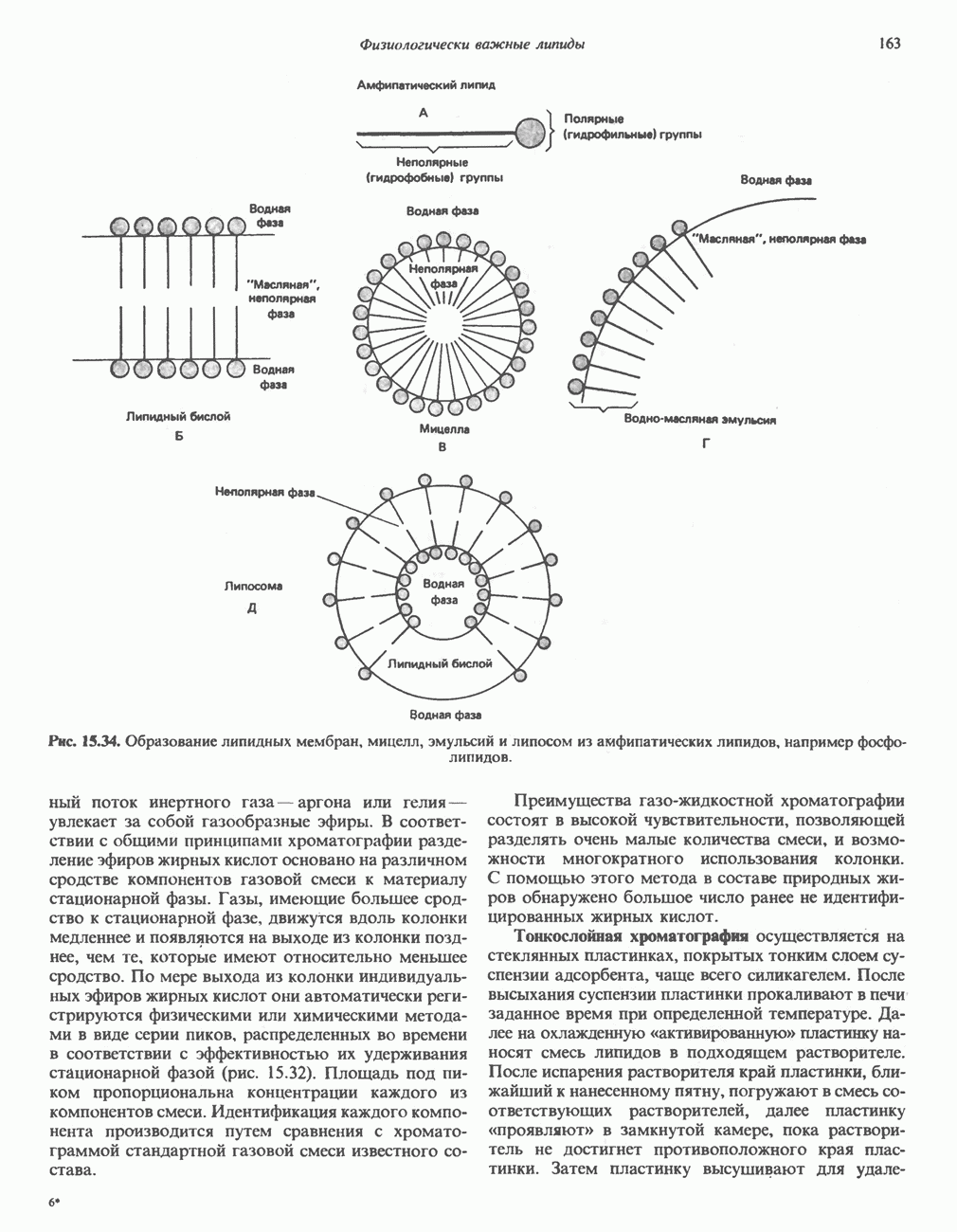
- АМФИПАТИЧЕСКИЕ ЛИПИДЫ
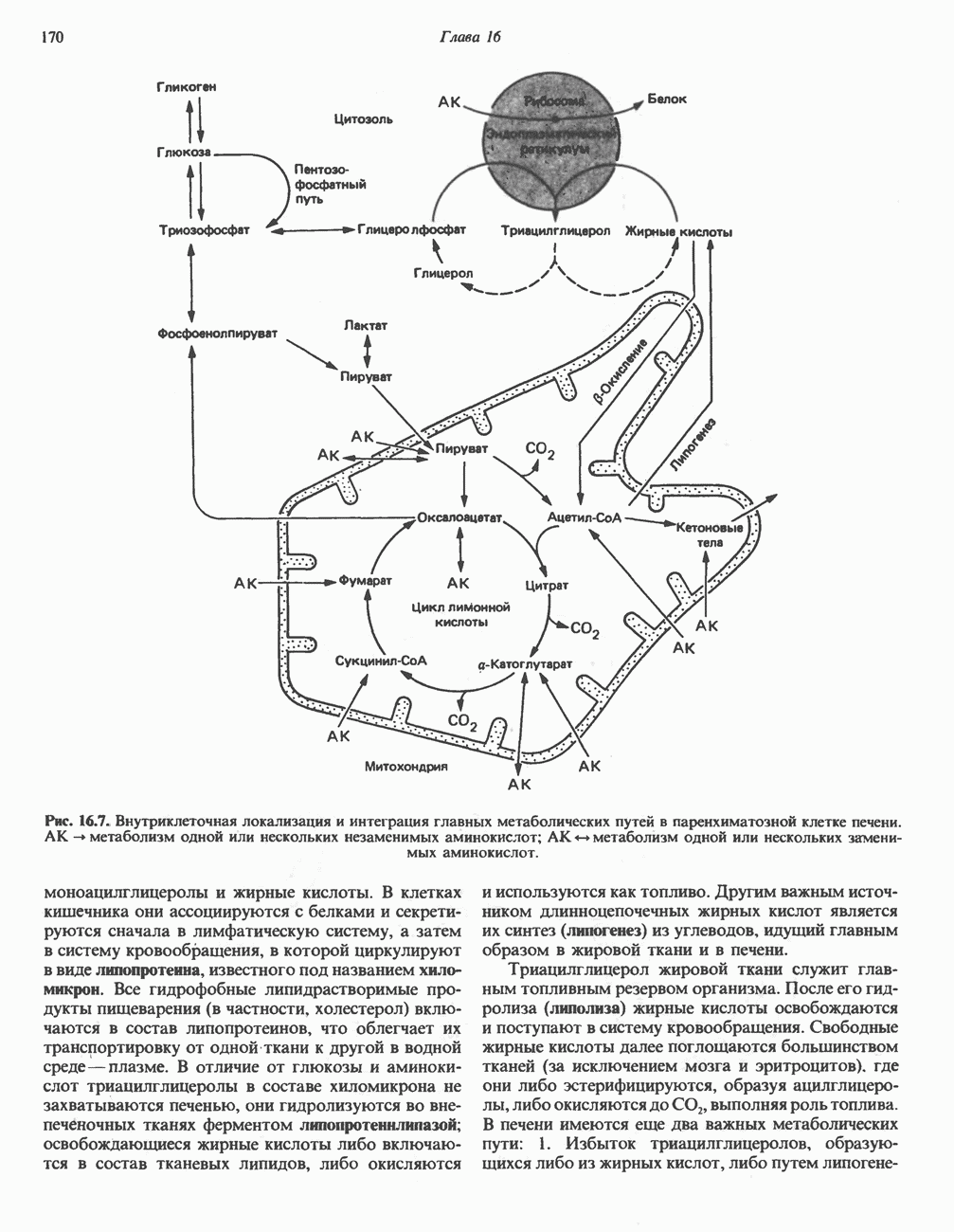
- Глава 16. Промежуточный обмен
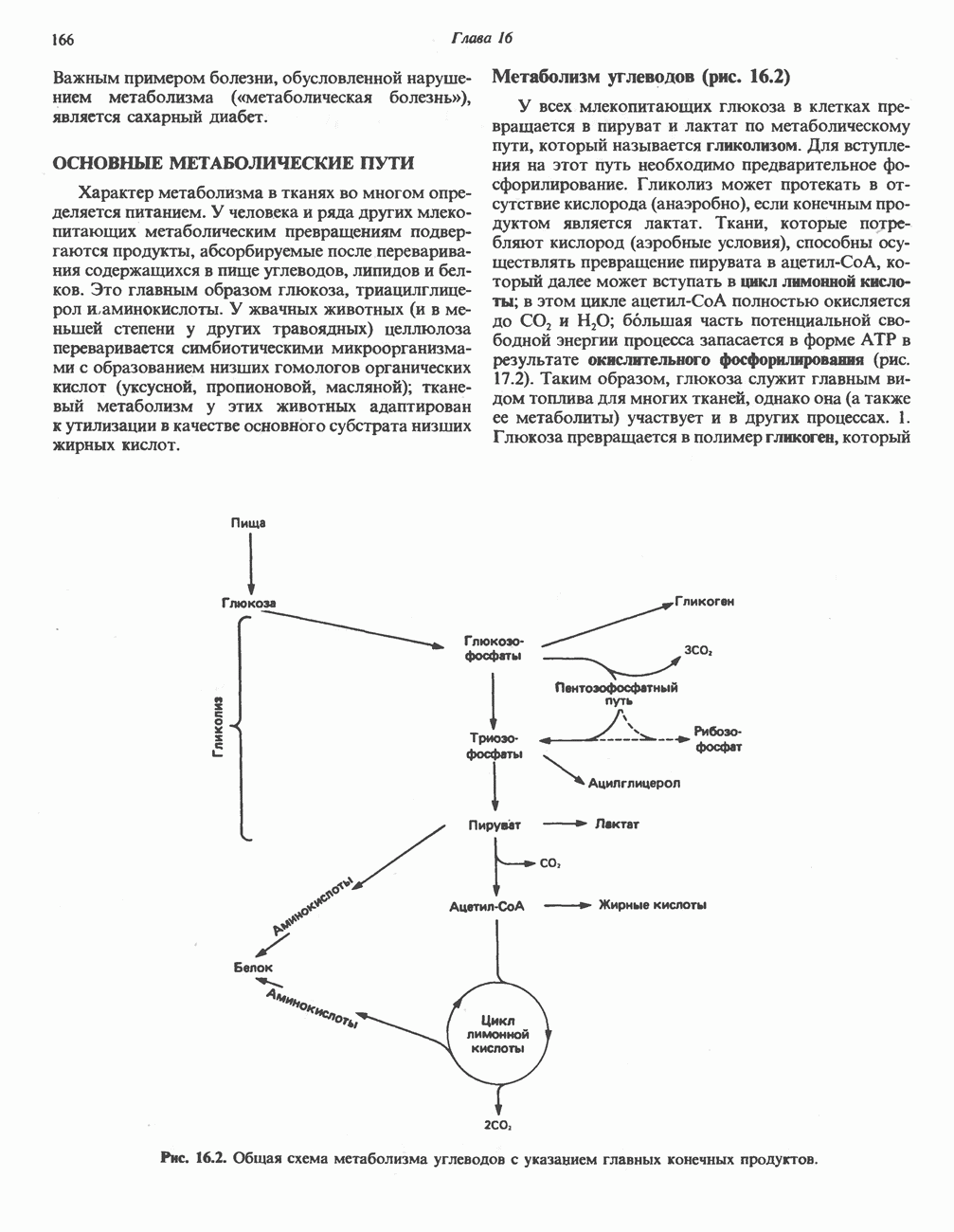
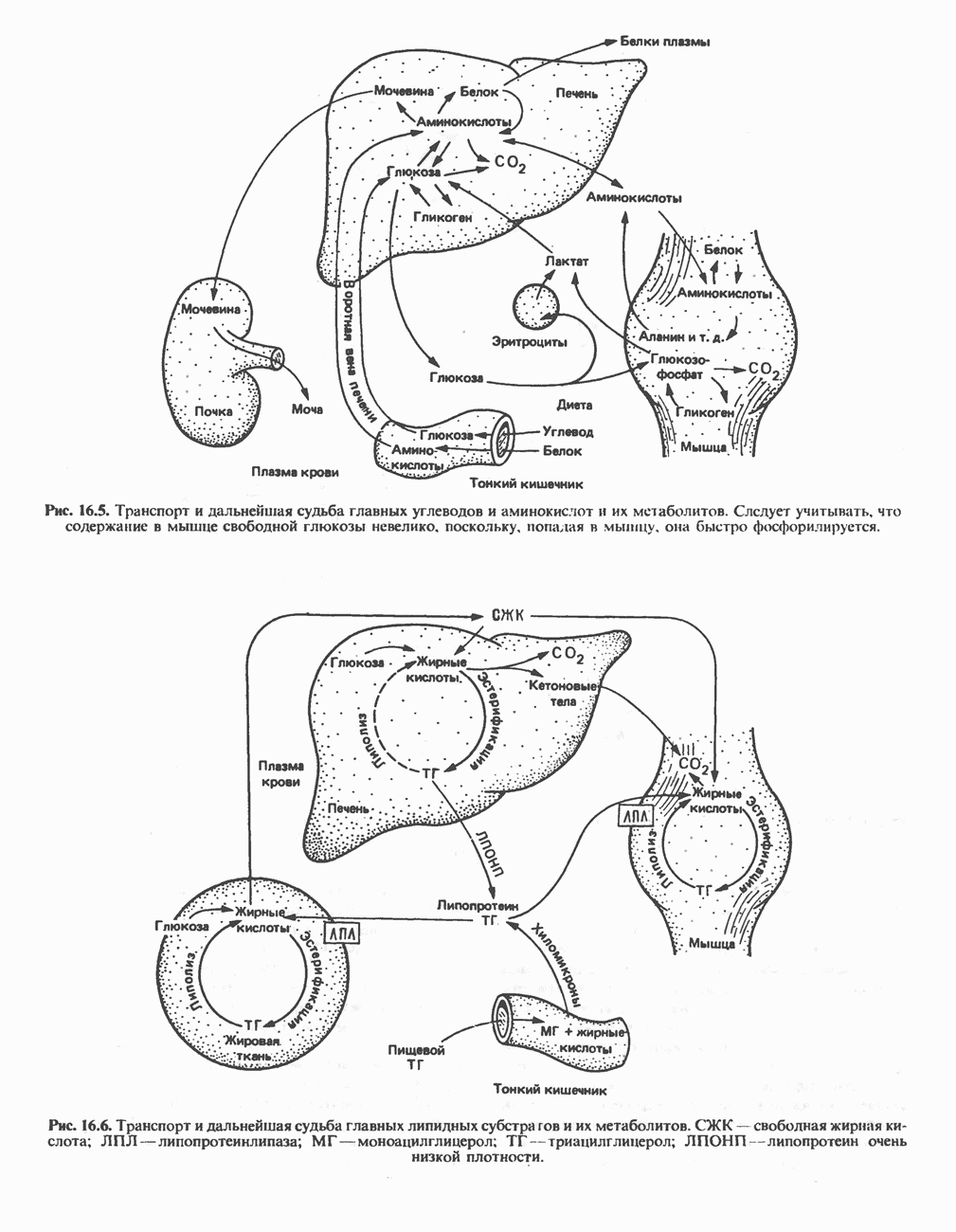
- ОСНОВНЫЕ МЕТАБОЛИЧЕСКИЕ ПУТИ
- ЛОКАЛИЗАЦИЯ МЕТАБОЛИЧЕСКИХ ПУТЕЙ
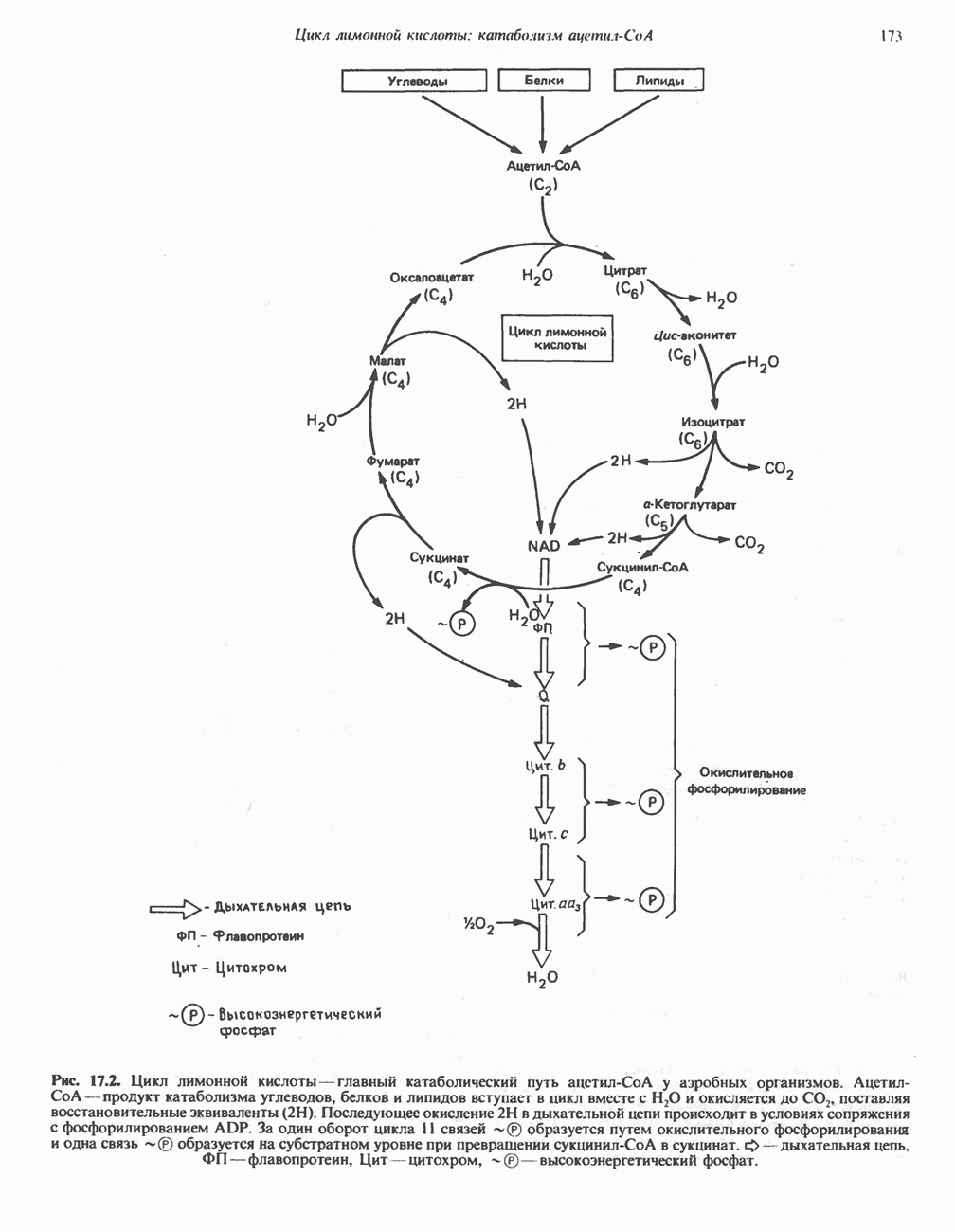
- Глава 17. Цикл лимонной кислоты: катаболизм ацетил-СоА
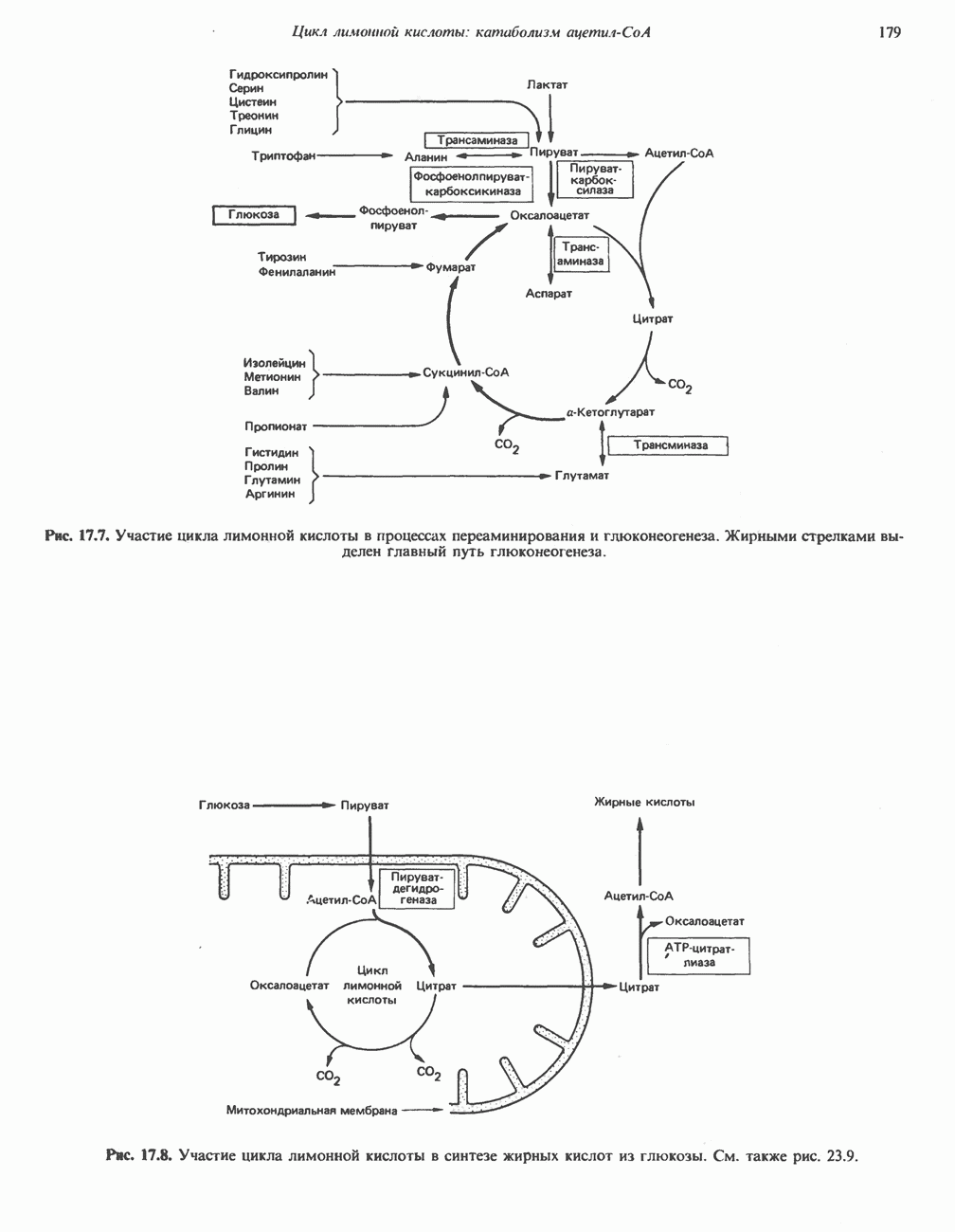
- КАТАБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
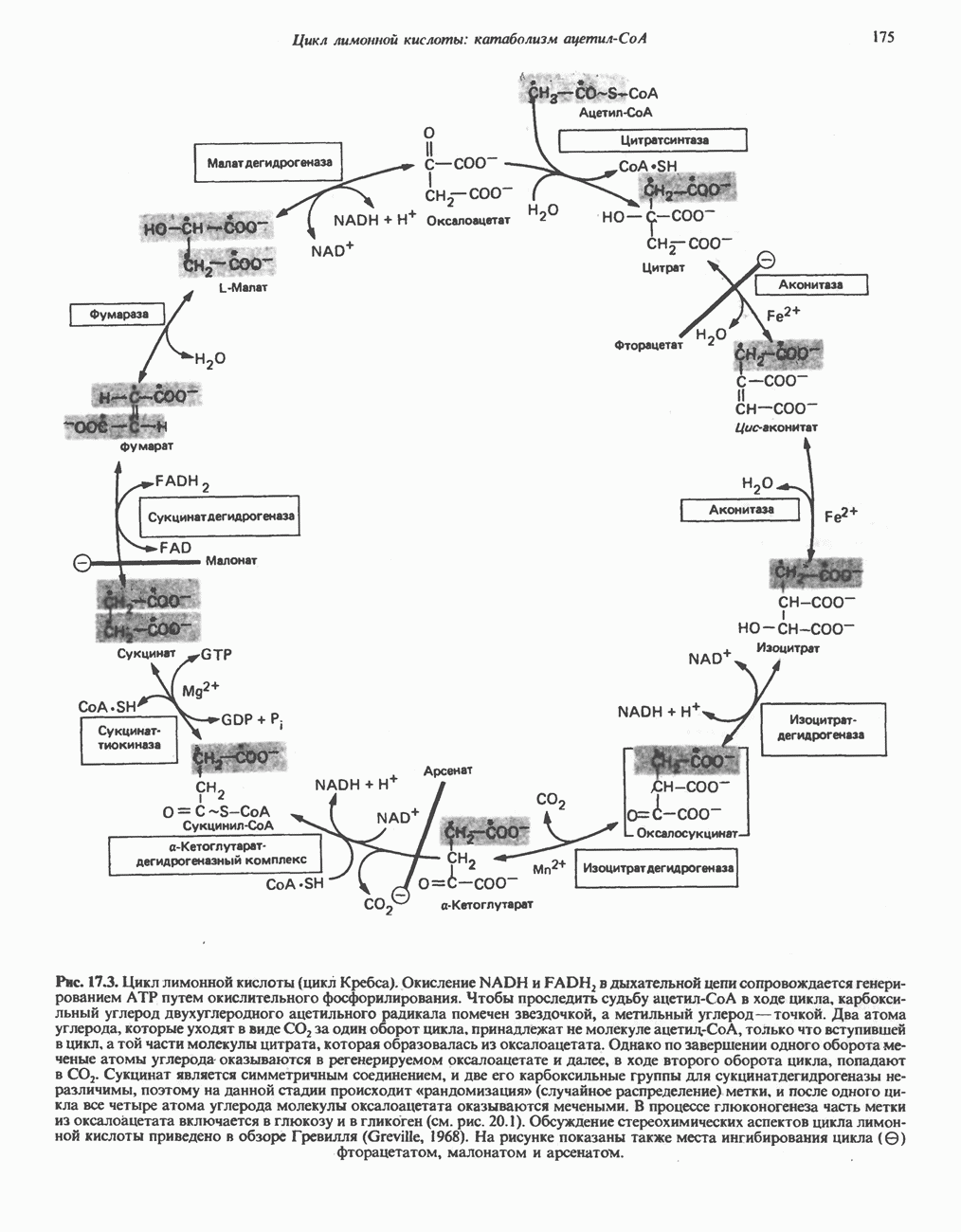
- РЕАКЦИИ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (рис. 17.3)
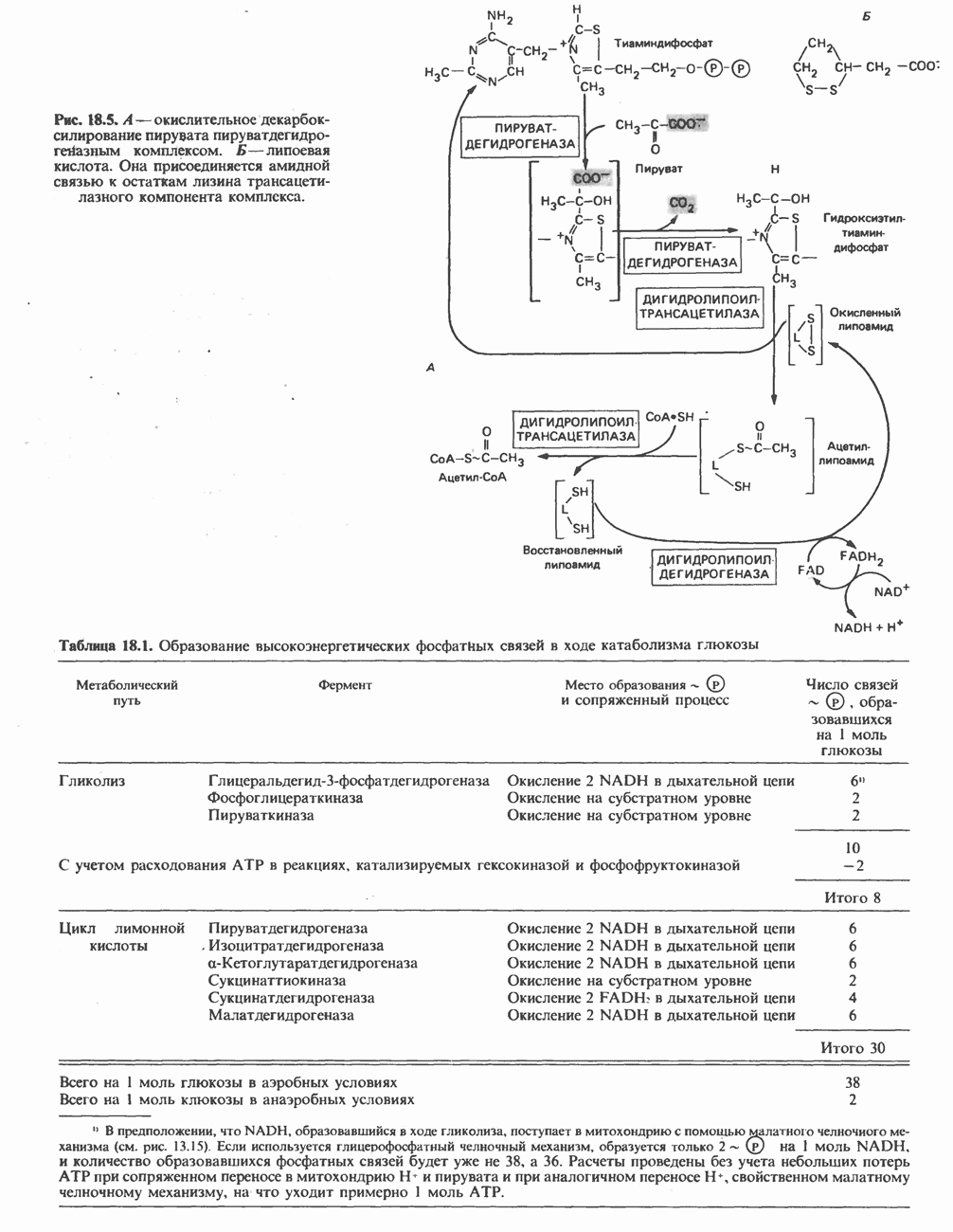
- ЭНЕРГЕТИКА ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
- РОЛЬ ВИТАМИНОВ В ЦИКЛЕ ЛИМОННОЙ КИСЛОТЫ
- АМФИБОЛИЧЕСКАЯ РОЛЬ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ
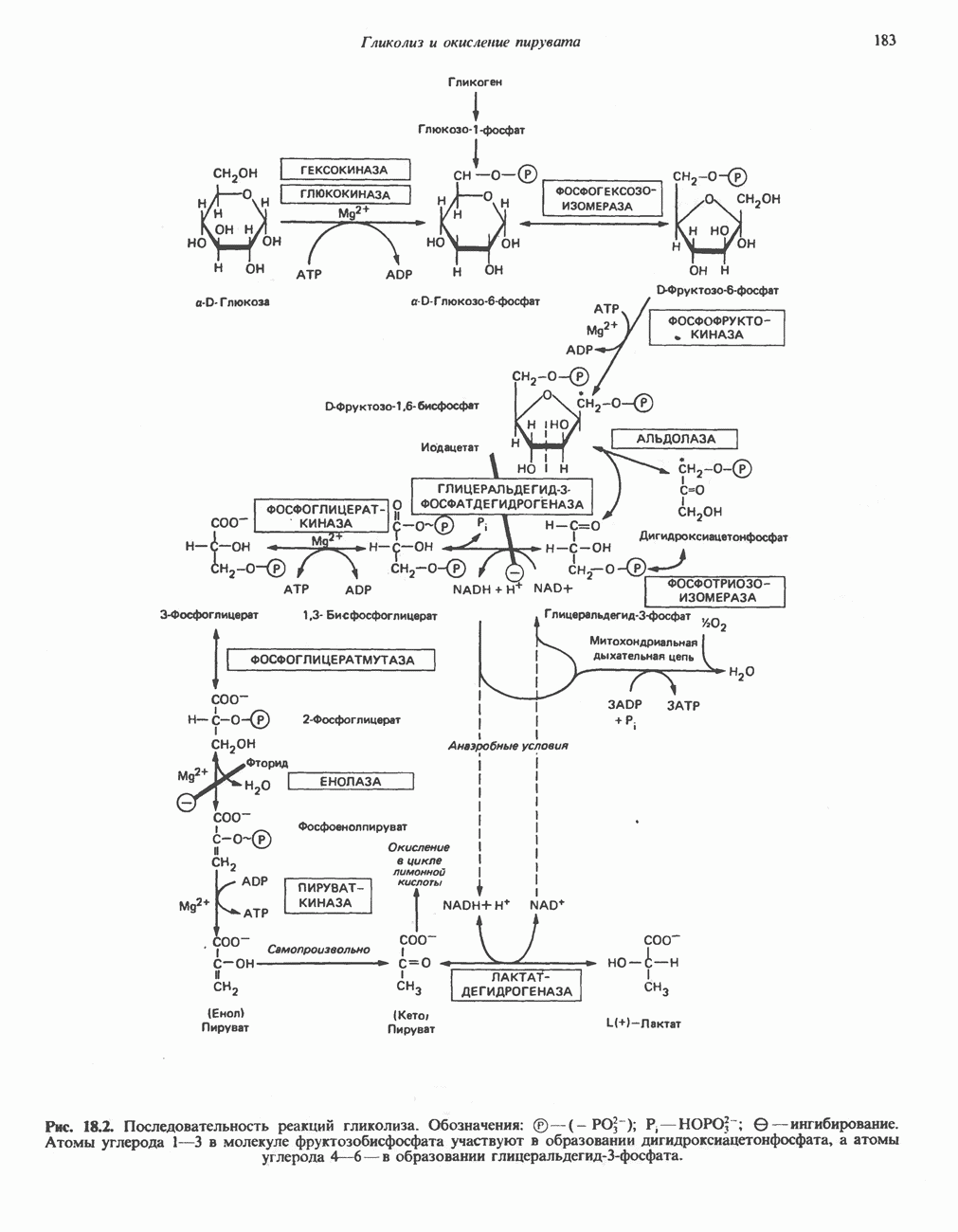
- Глава 18. Гликолиз и окисление пирувата
- ГЛИКОЛИТИЧЕСКИЙ ПУТЬ
- ПОСЛЕДОВАТЕЛЬНЫЕ СТАДИИ ГЛИКОЛИЗА
- ОКИСЛЕНИЕ ПИРУВАТА В АЦЕТИЛ-СоА
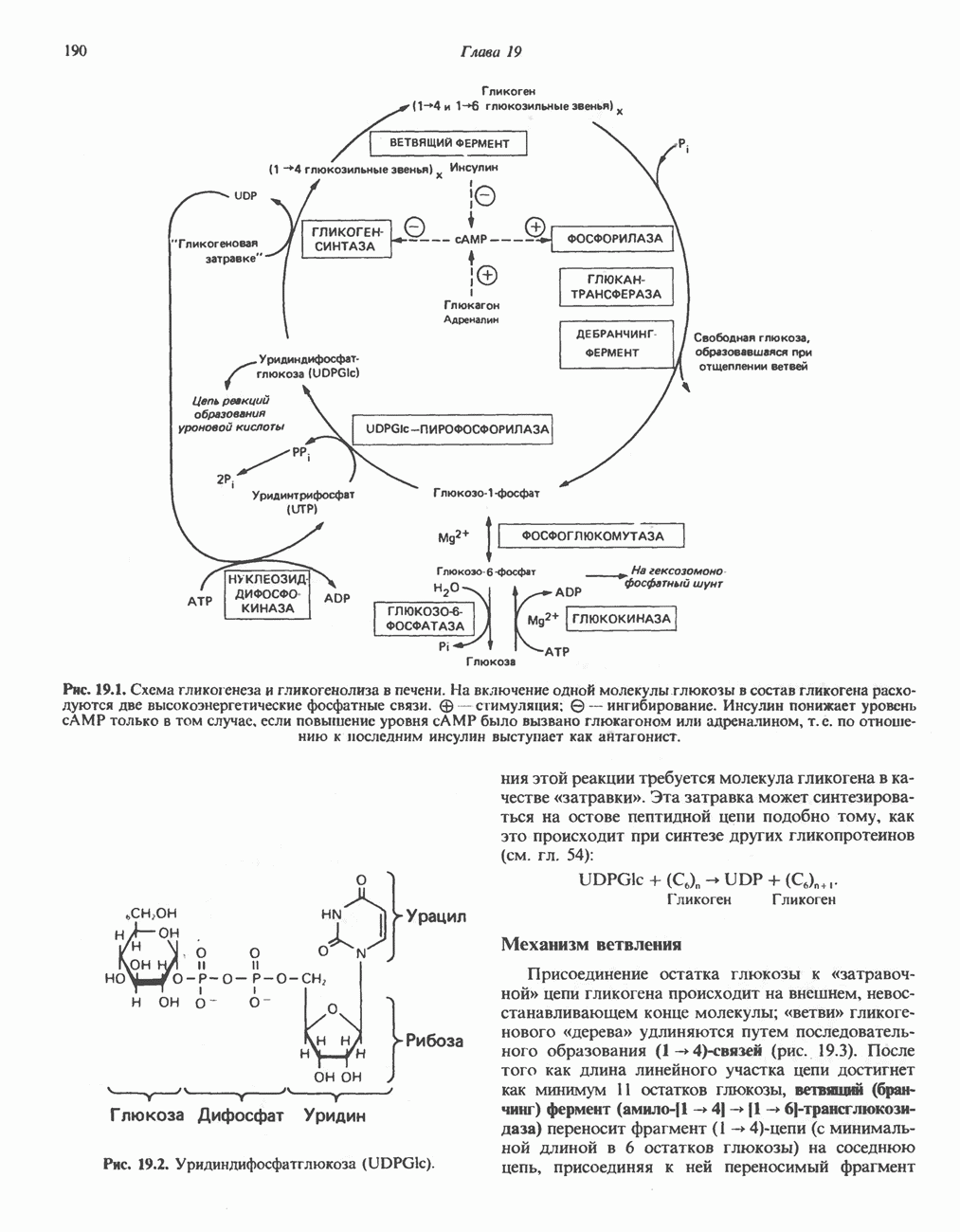
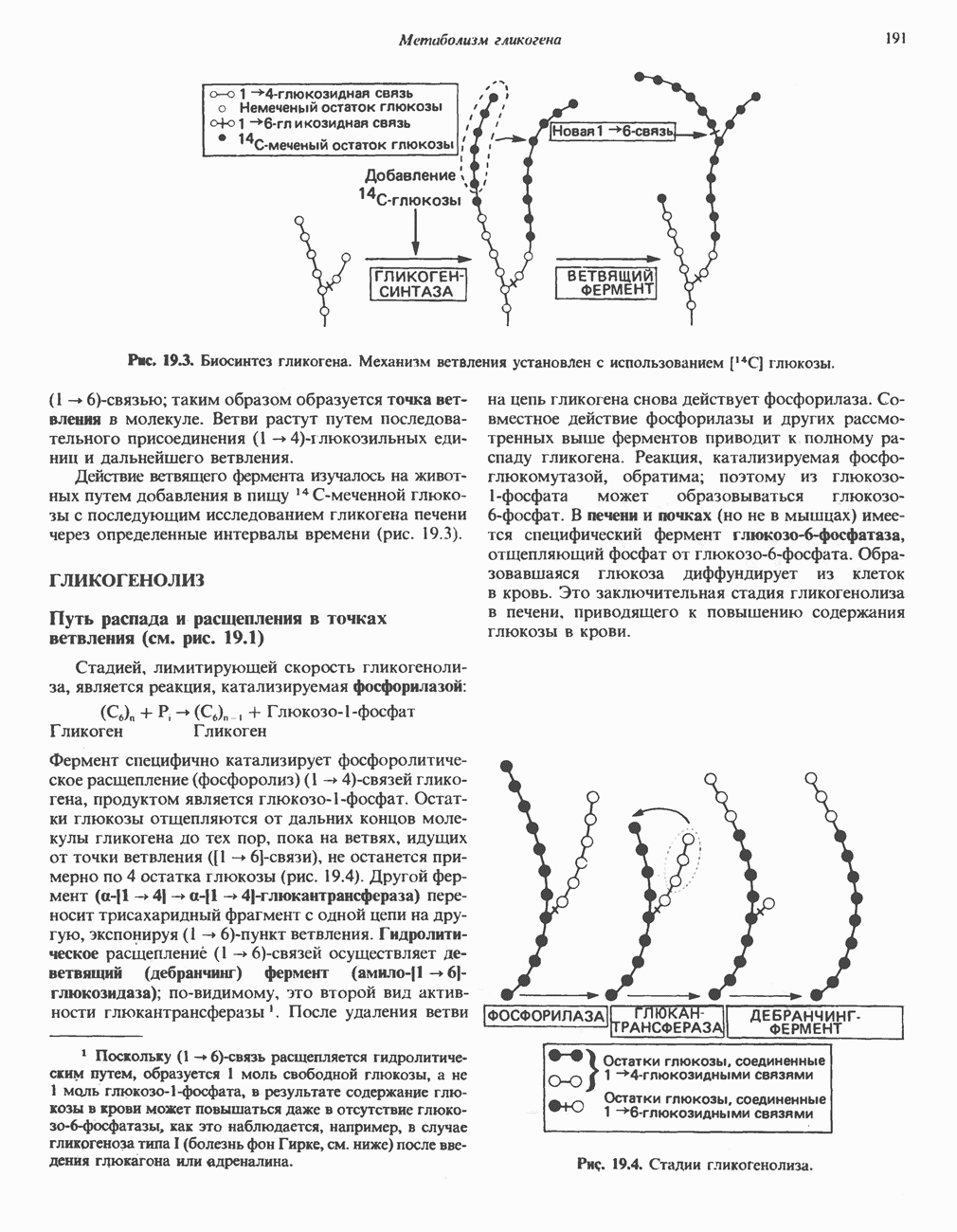
- Глава 19. Метаболизм гликогена
- ГЛИКОГЕНЕЗ
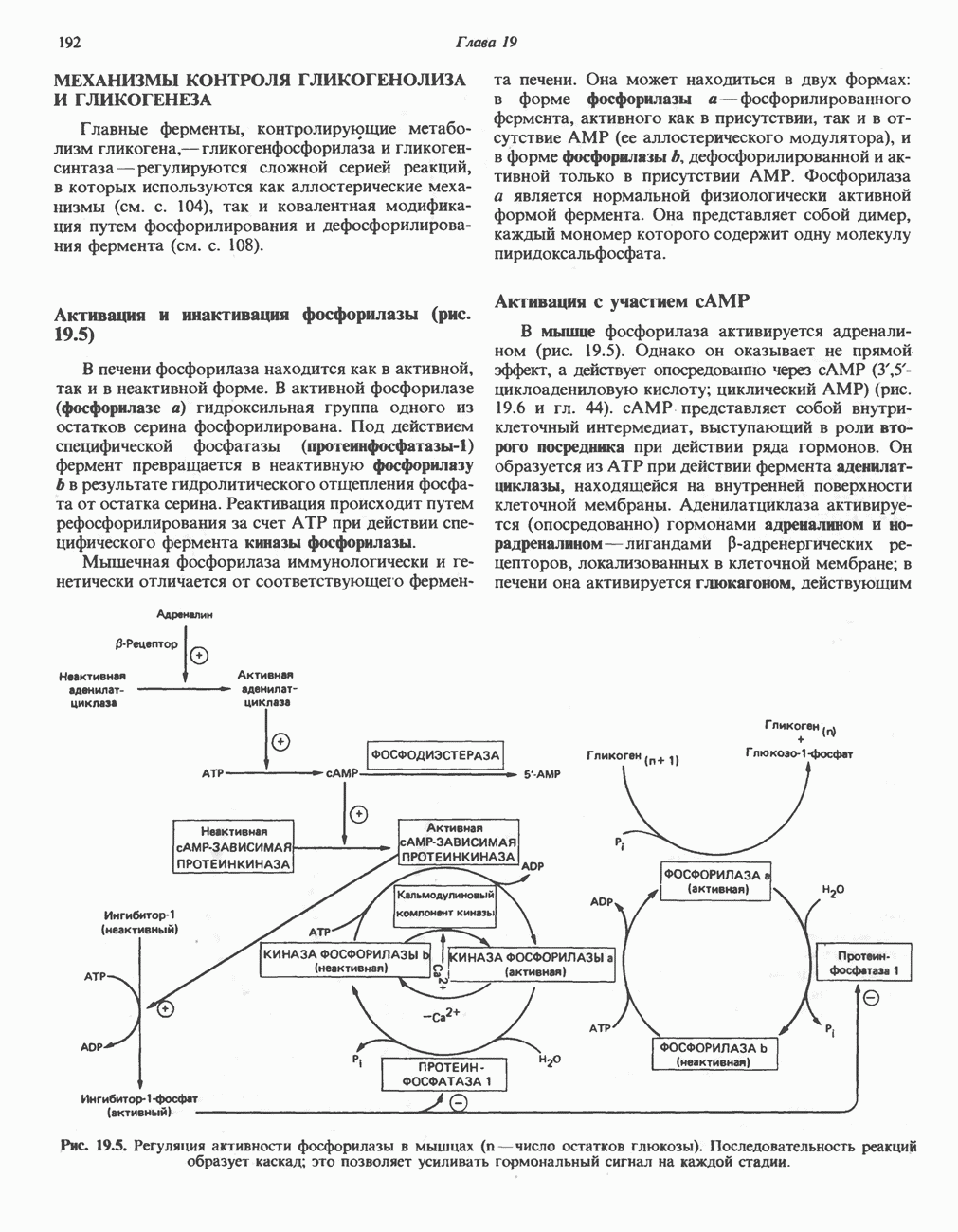
- ГЛИКОГЕНОЛИЗ
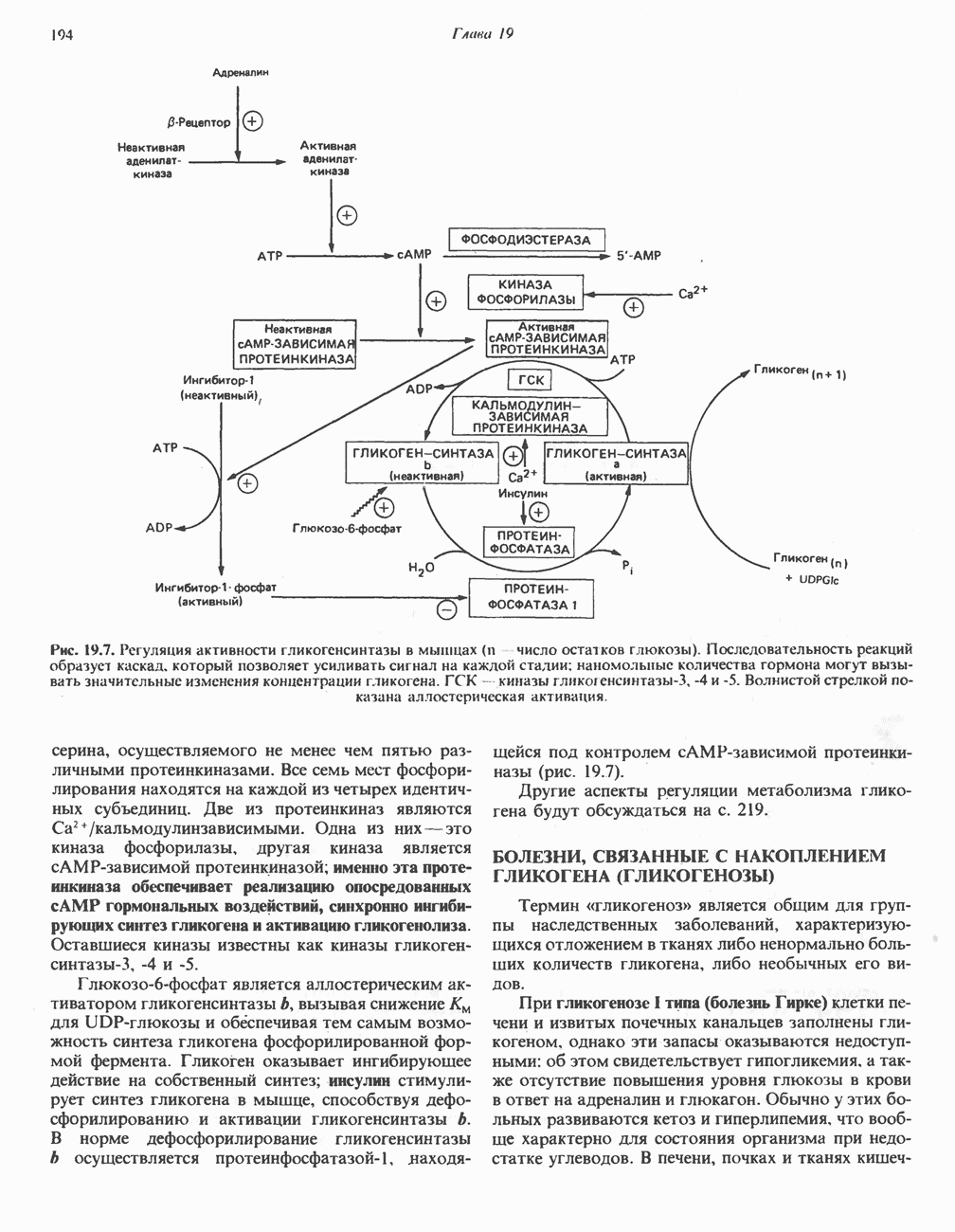
- МЕХАНИЗМЫ КОНТРОЛЯ ГЛИКОГЕНОЛИЗА И ГЛИКОГЕНЕЗА
- БОЛЕЗНИ, СВЯЗАННЫЕ С НАКОПЛЕНИЕМ ГЛИКОГЕНА (ГЛИКОГЕНОЗЫ)
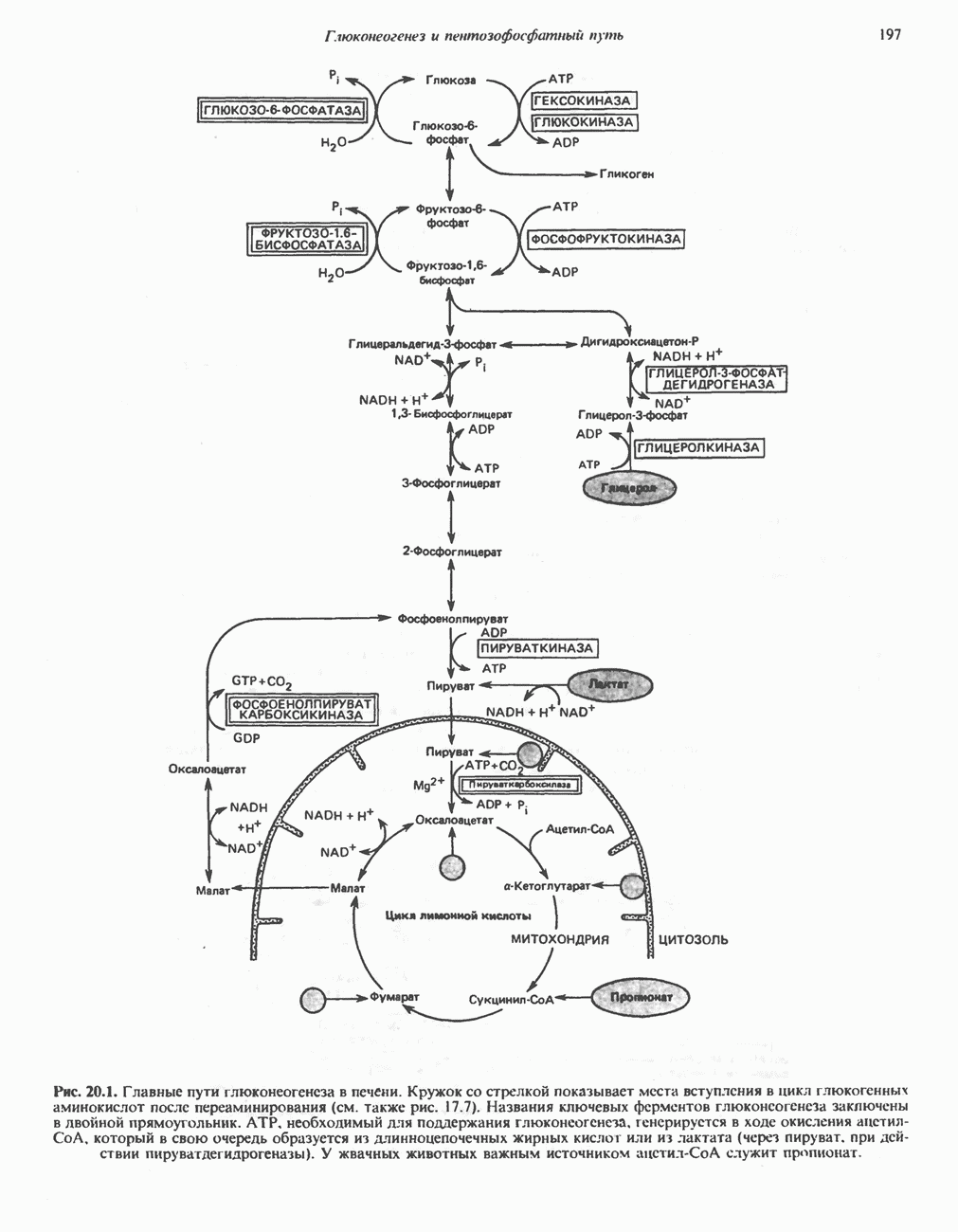
- Глава 20. Глюконеогенез и пентозофосфатный путь
- МЕТАБОЛИЧЕСКИЕ ПУТИ, УЧАСТВУЮЩИЕ В ГЛЮКОНЕОГЕНЕЗЕ (рис. 20.1)
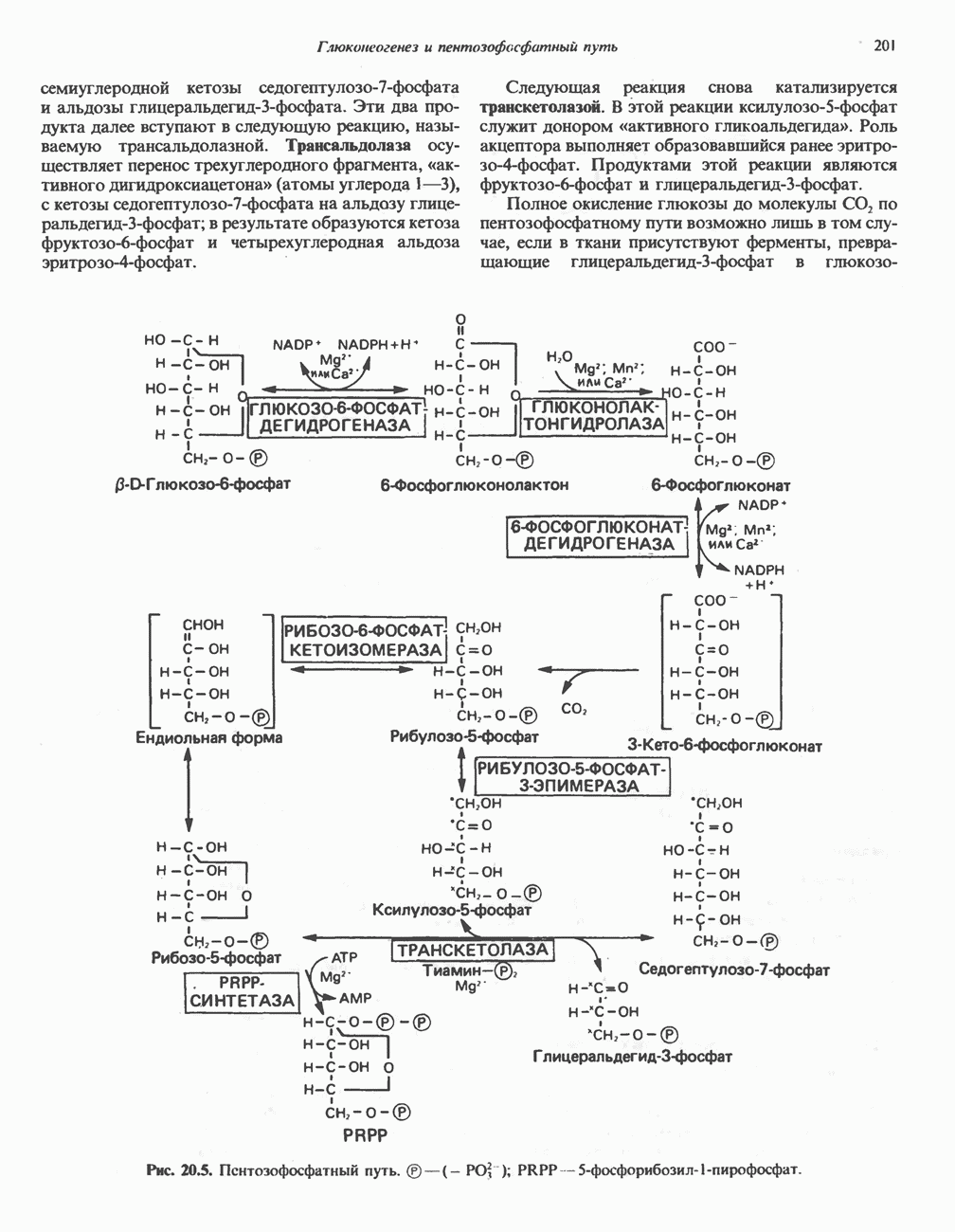
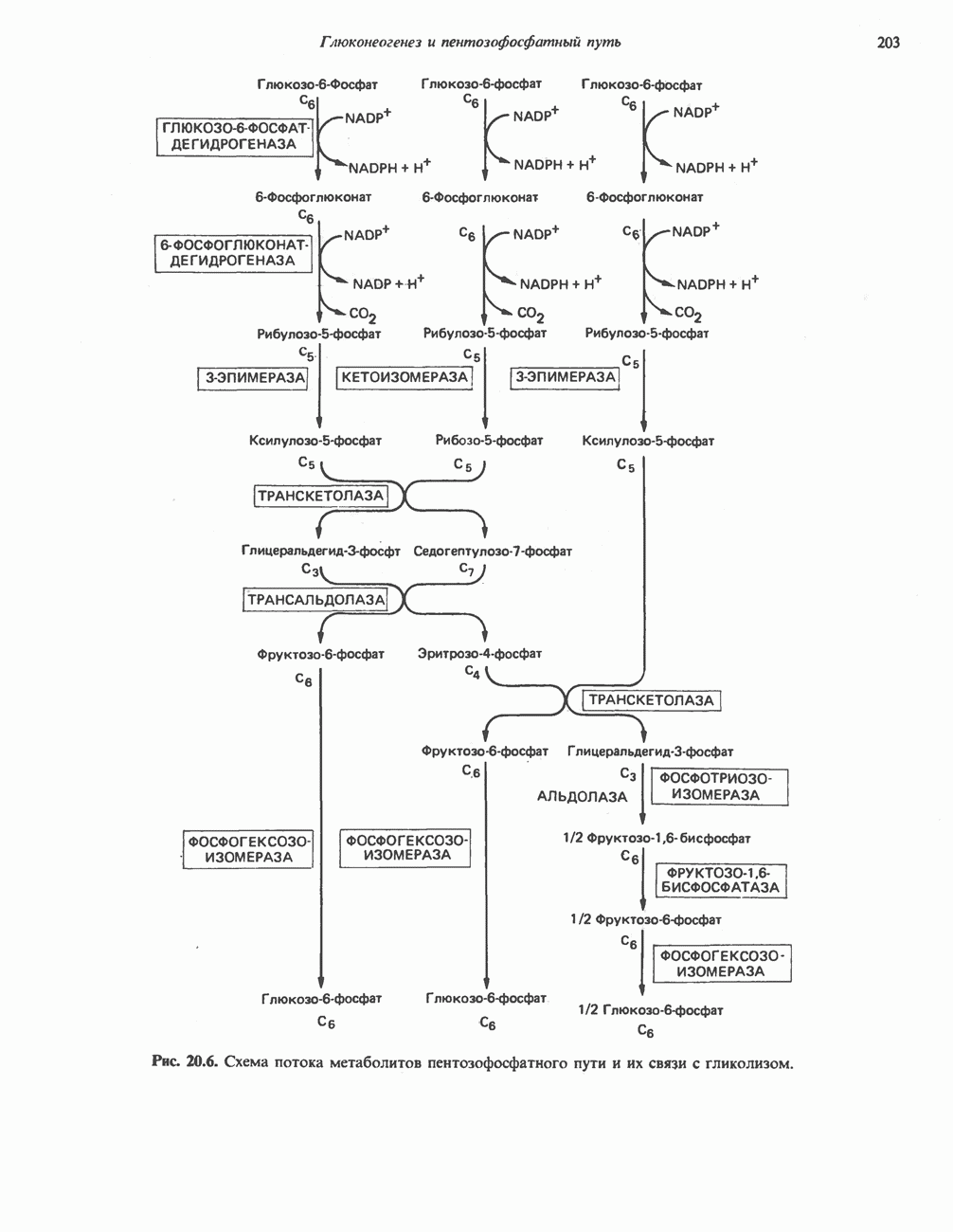
- ПЕНТОЗОФОСФАТНЫЙ ПУТЬ ИЛИ ГЕКСОЗОМОНОФОСФАТНЫЙ ШУНТ
- ПОСЛЕДОВАТЕЛЬНОСТЬ РЕАКЦИЙ
- МЕТАБОЛИЧЕСКОЕ ЗНАЧЕНИЕ ПЕНТОЗОФОСФАТНОГО ПУТИ
- КЛИНИЧЕСКИЕ АСПЕКТЫ
- Глава 21. Метаболизм наиболее важных гексоз
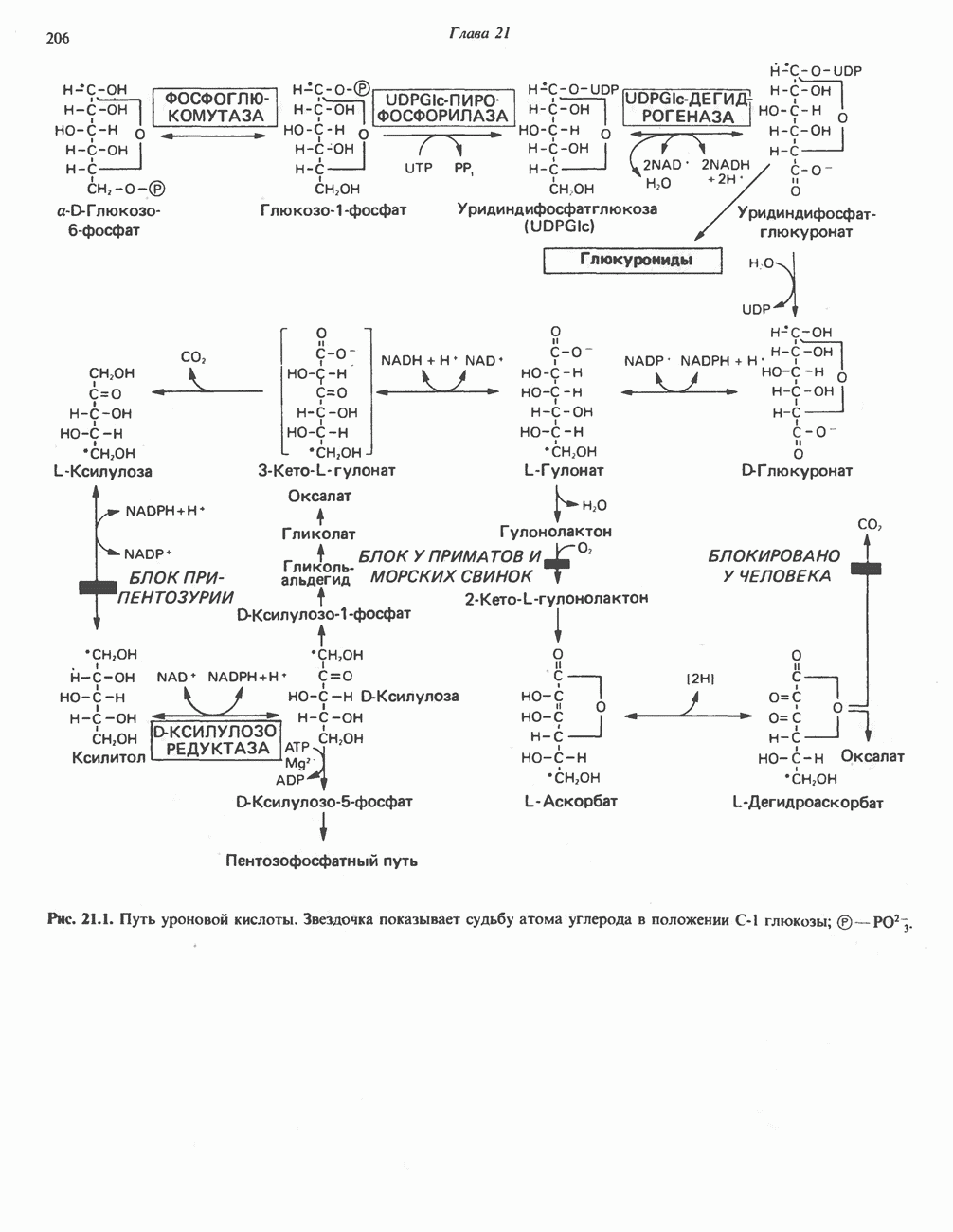
- ПУТЬ УРОНОВЫХ КИСЛОТ
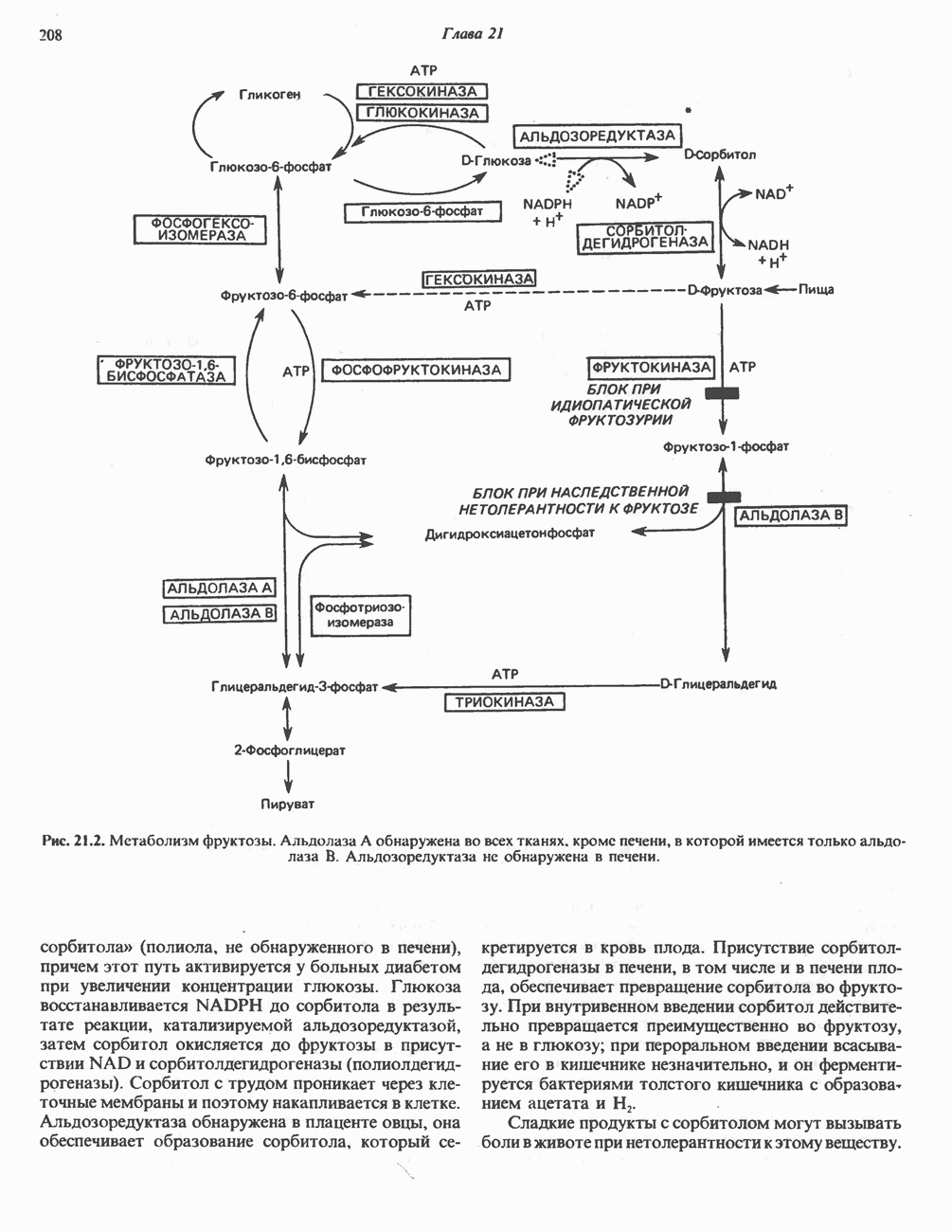
- МЕТАБОЛИЗМ ФРУКТОЗЫ
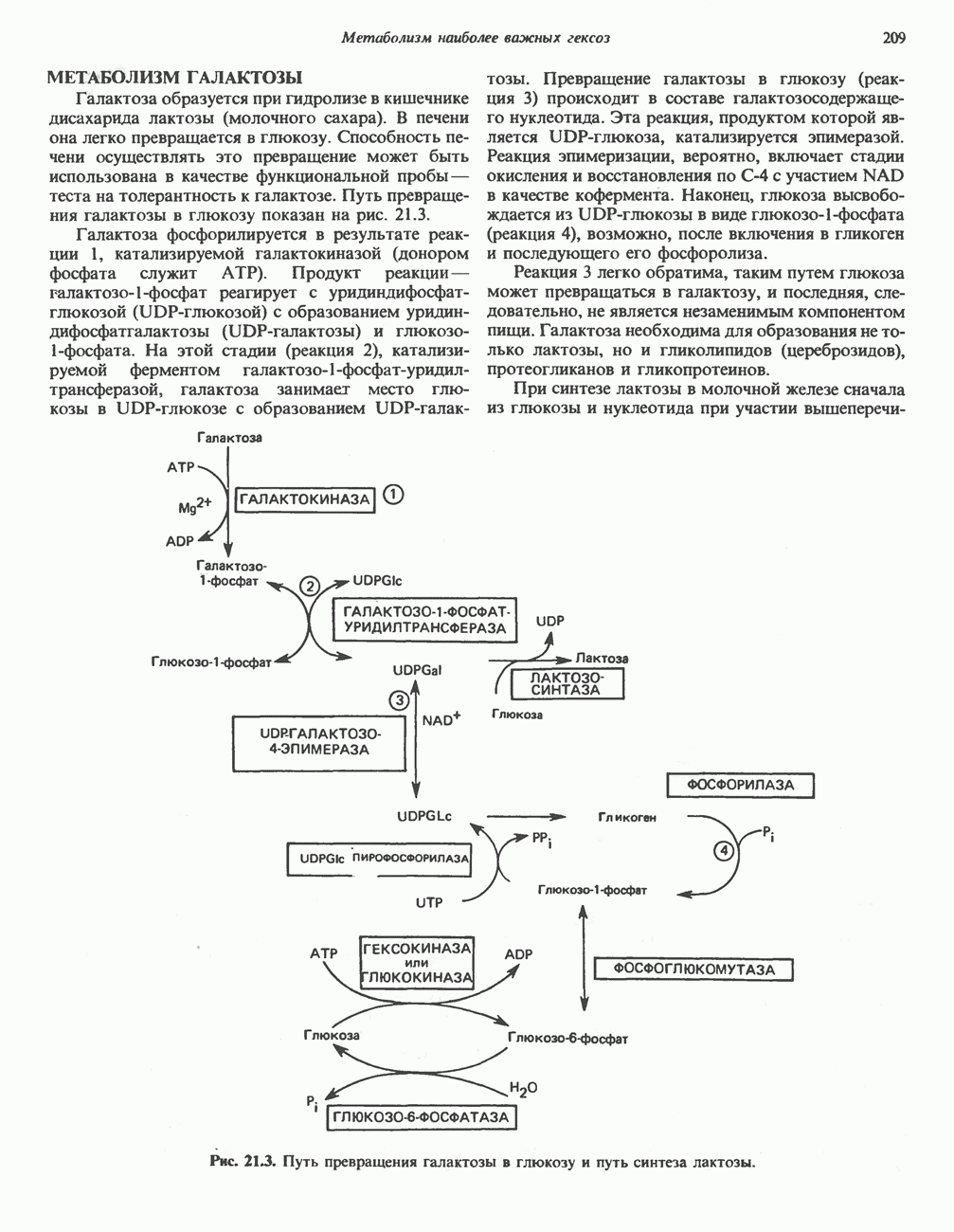
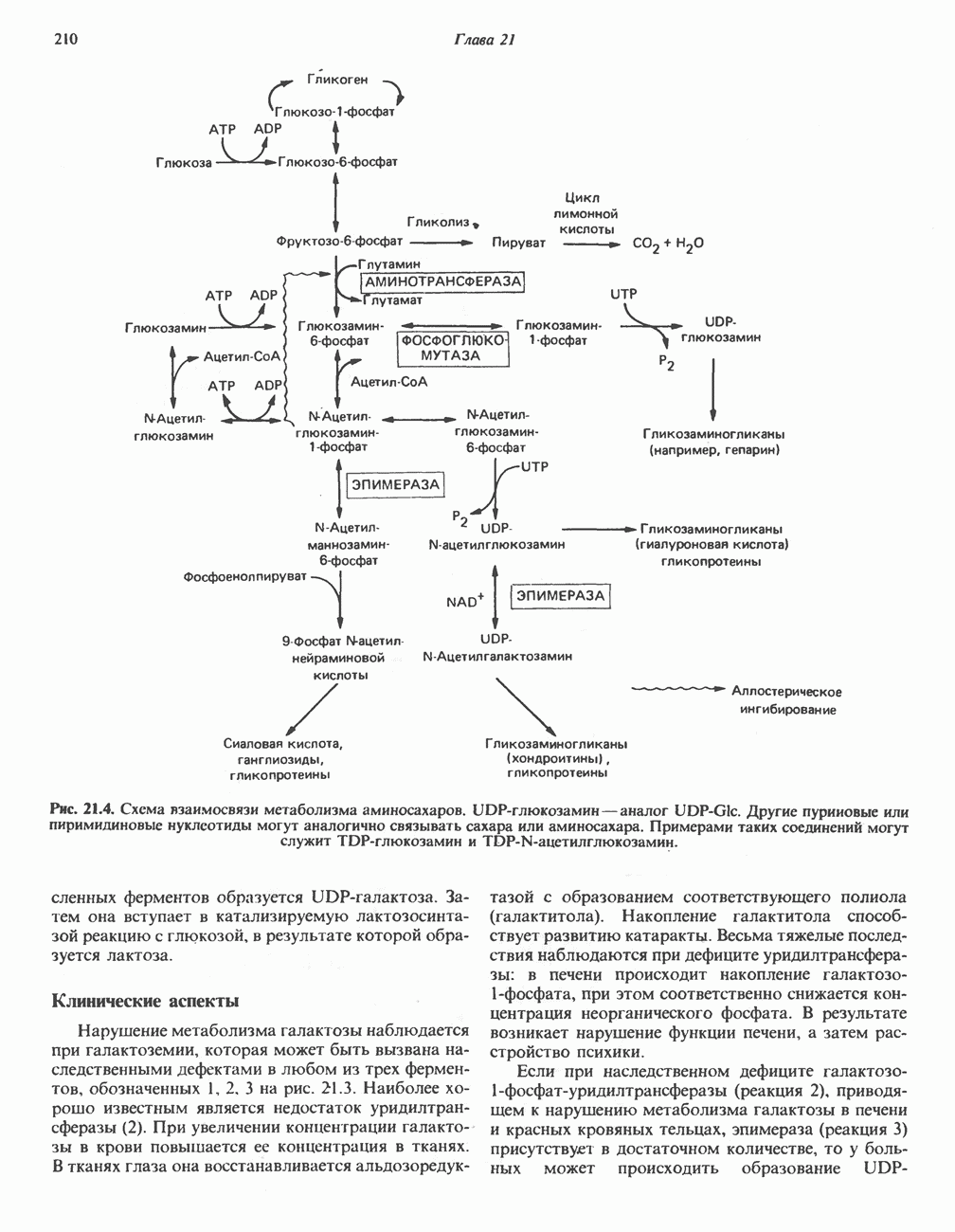
- МЕТАБОЛИЗМ ГАЛАКТОЗЫ
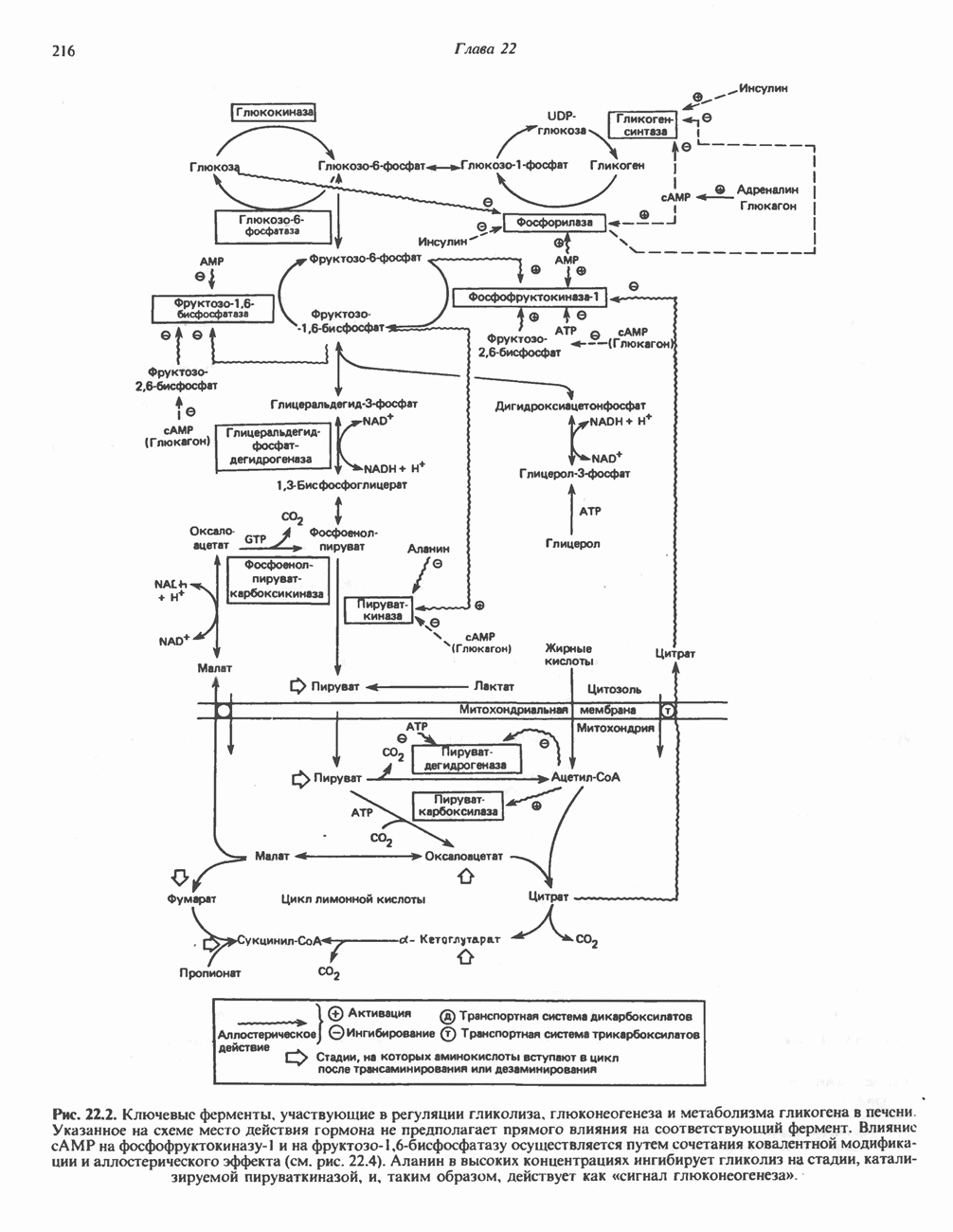
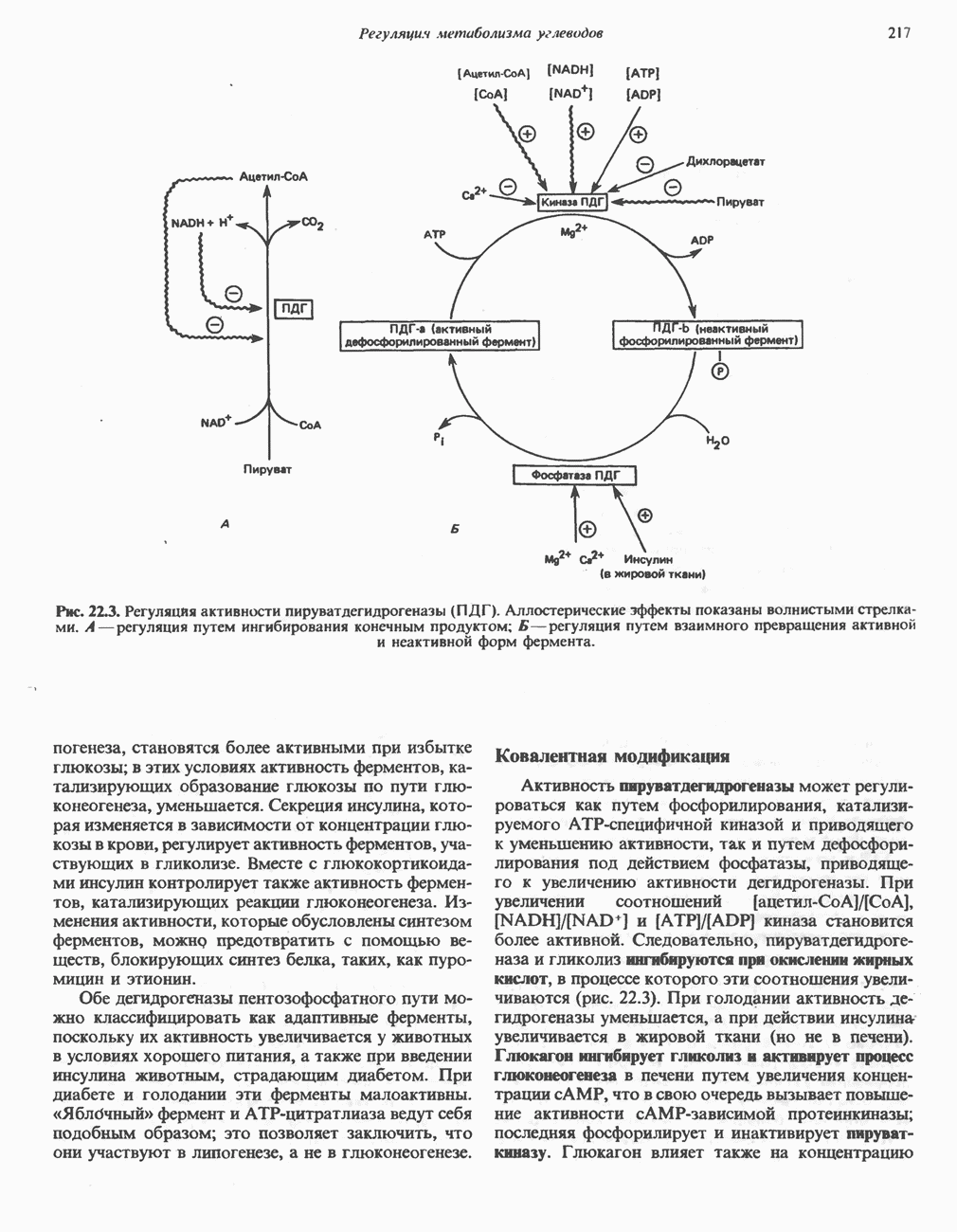
- Глава 22. Регуляция метаболизма углеводов
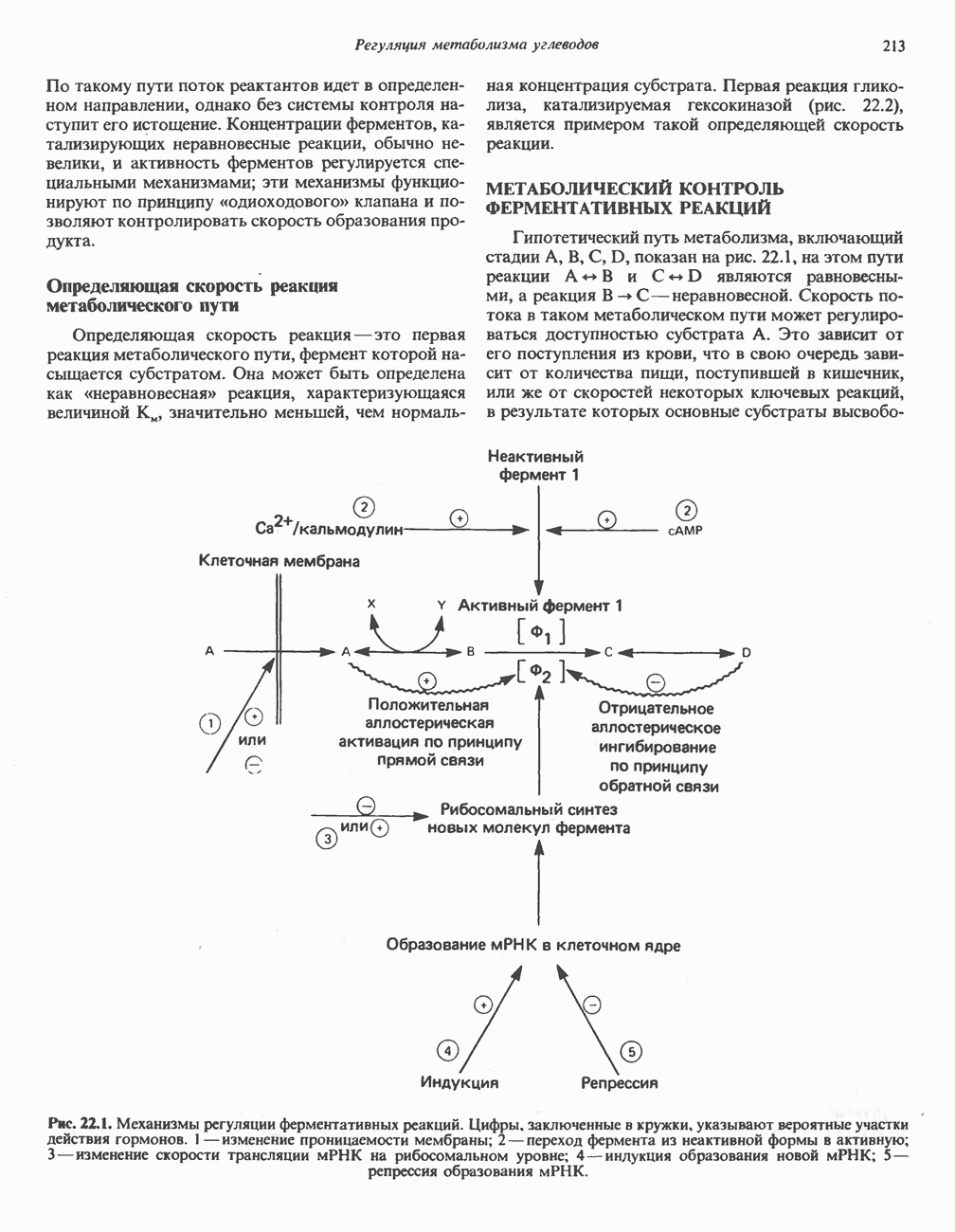
- ОБЩИЕ ПРИНЦИПЫ РЕГУЛЯЦИИ ПУТЕЙ МЕТАБОЛИЗМА
- МЕТАБОЛИЧЕСКИЙ КОНТРОЛЬ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
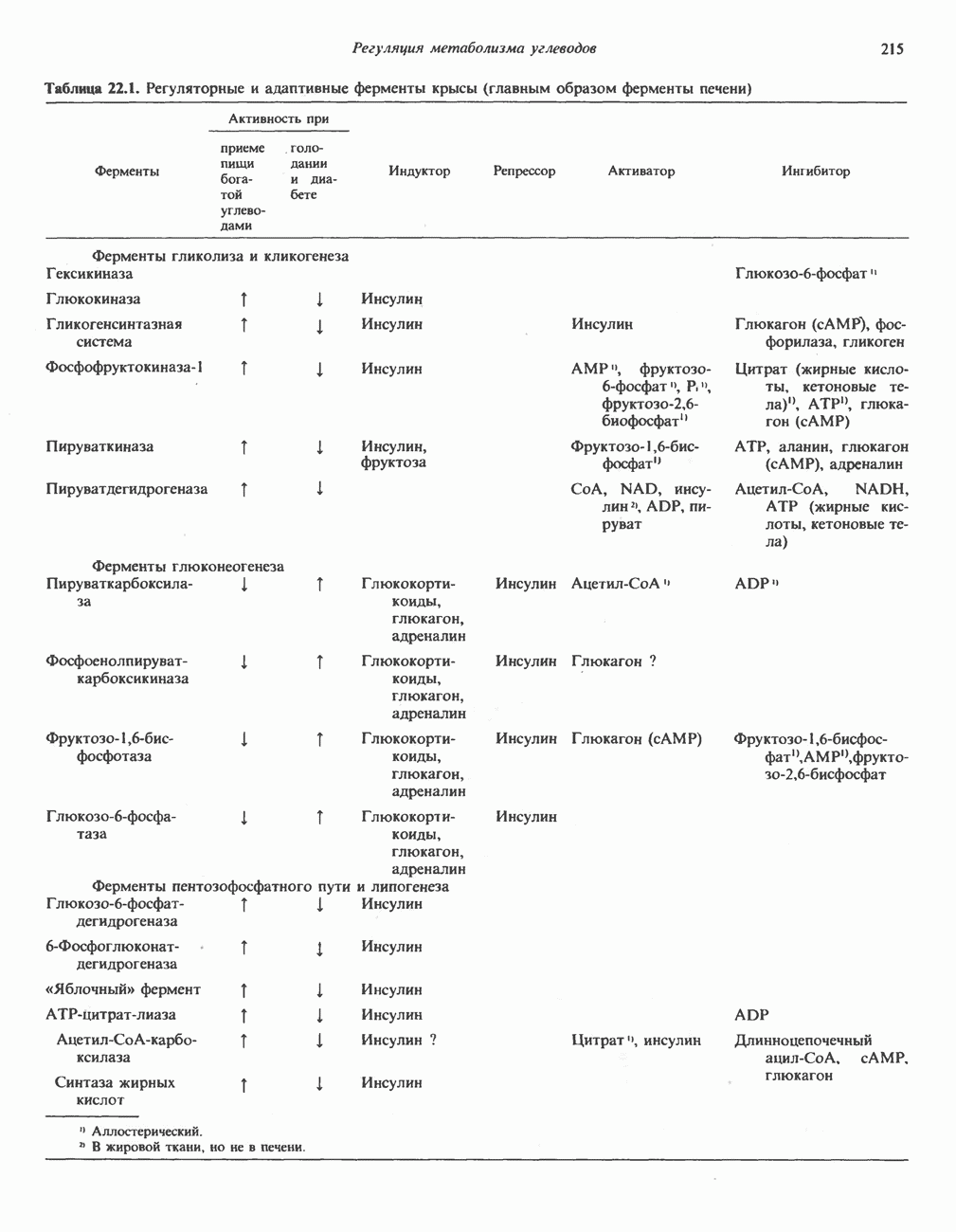
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА УГЛЕВОДОВ НА КЛЕТОЧНОМ И ФЕРМЕНТНОМ УРОВНЕ
- РЕГУЛЯЦИЯ ГЛИКОЛИЗА, ГЛЮКОНЕОГЕНЕЗА И ПЕНТОЗОФОСФАТНОГО ПУТИ
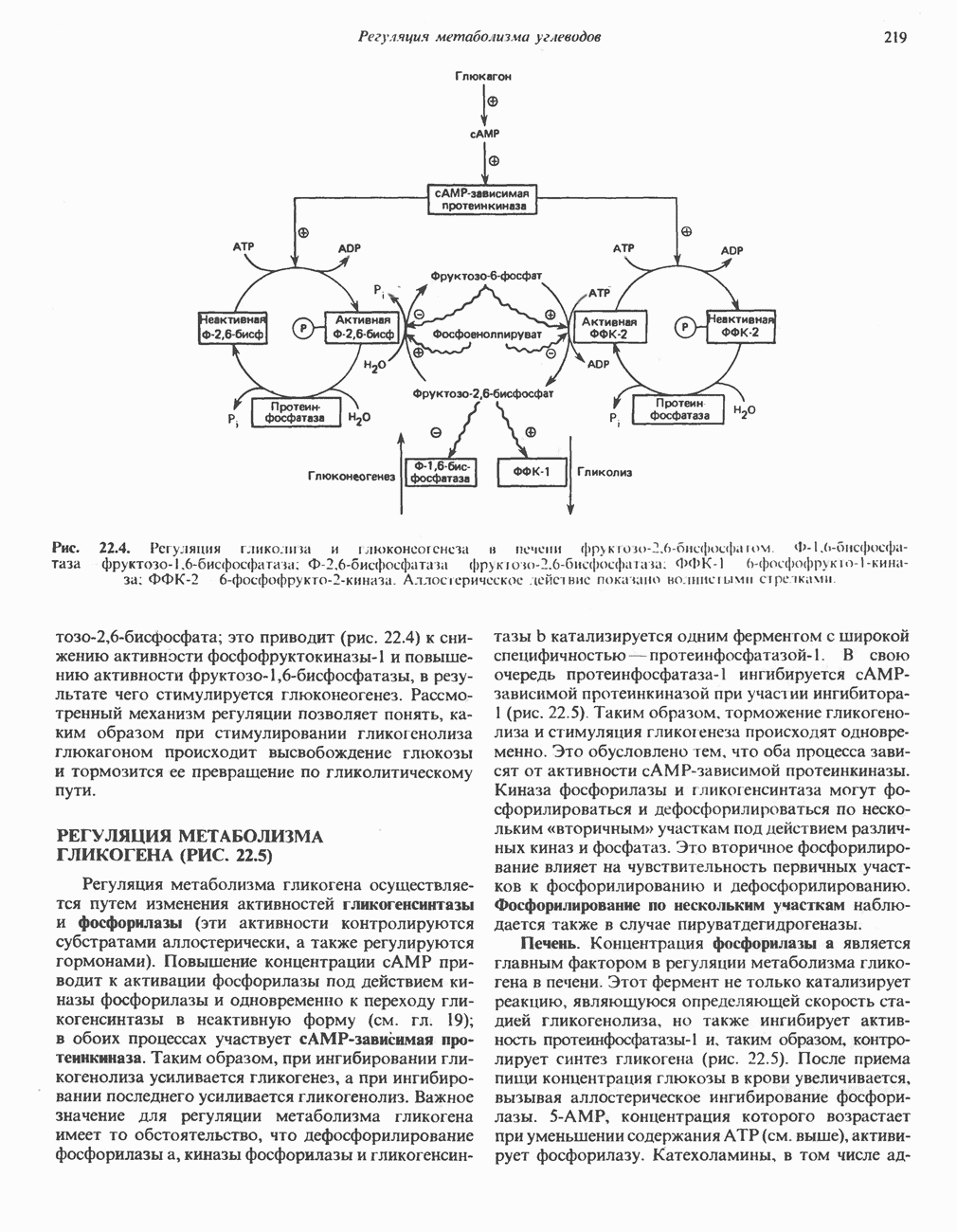
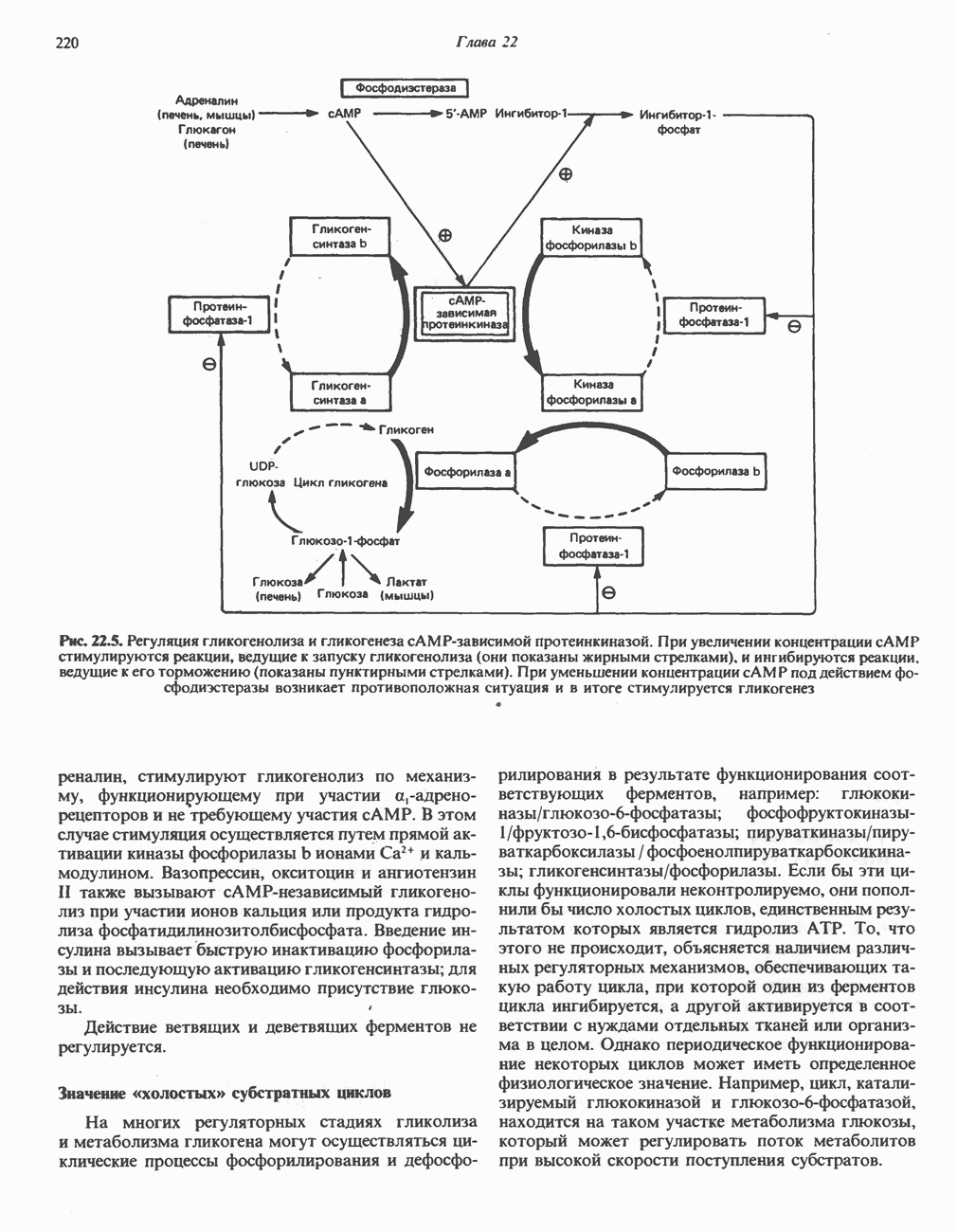
- РЕГУЛЯЦИЯ МЕТАБОЛИЗМА ГЛИКОГЕНА (РИС. 22.5)
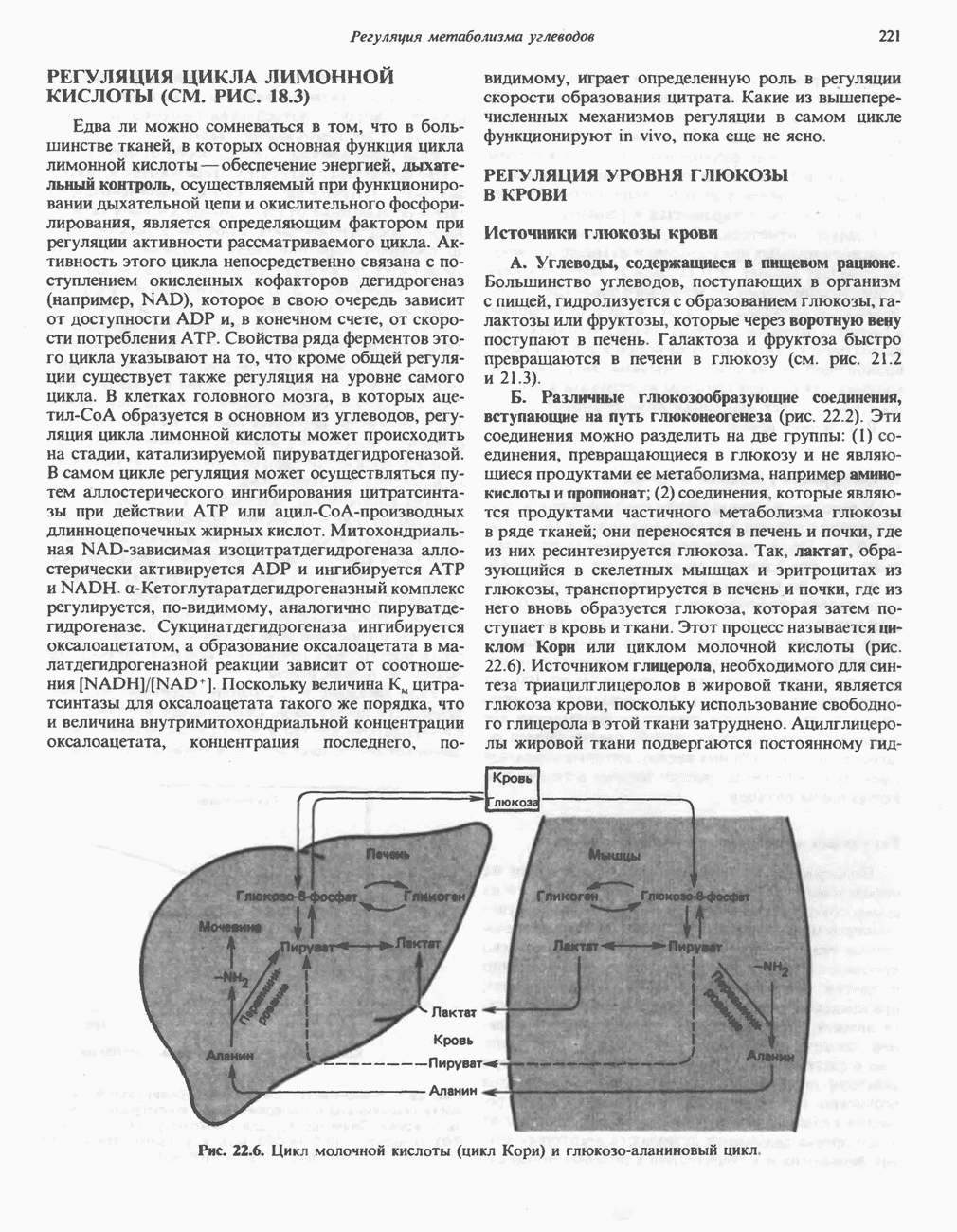
- РЕГУЛЯЦИЯ ЦИКЛА ЛИМОННОЙ КИСЛОТЫ (СМ. РИС. 18.3)
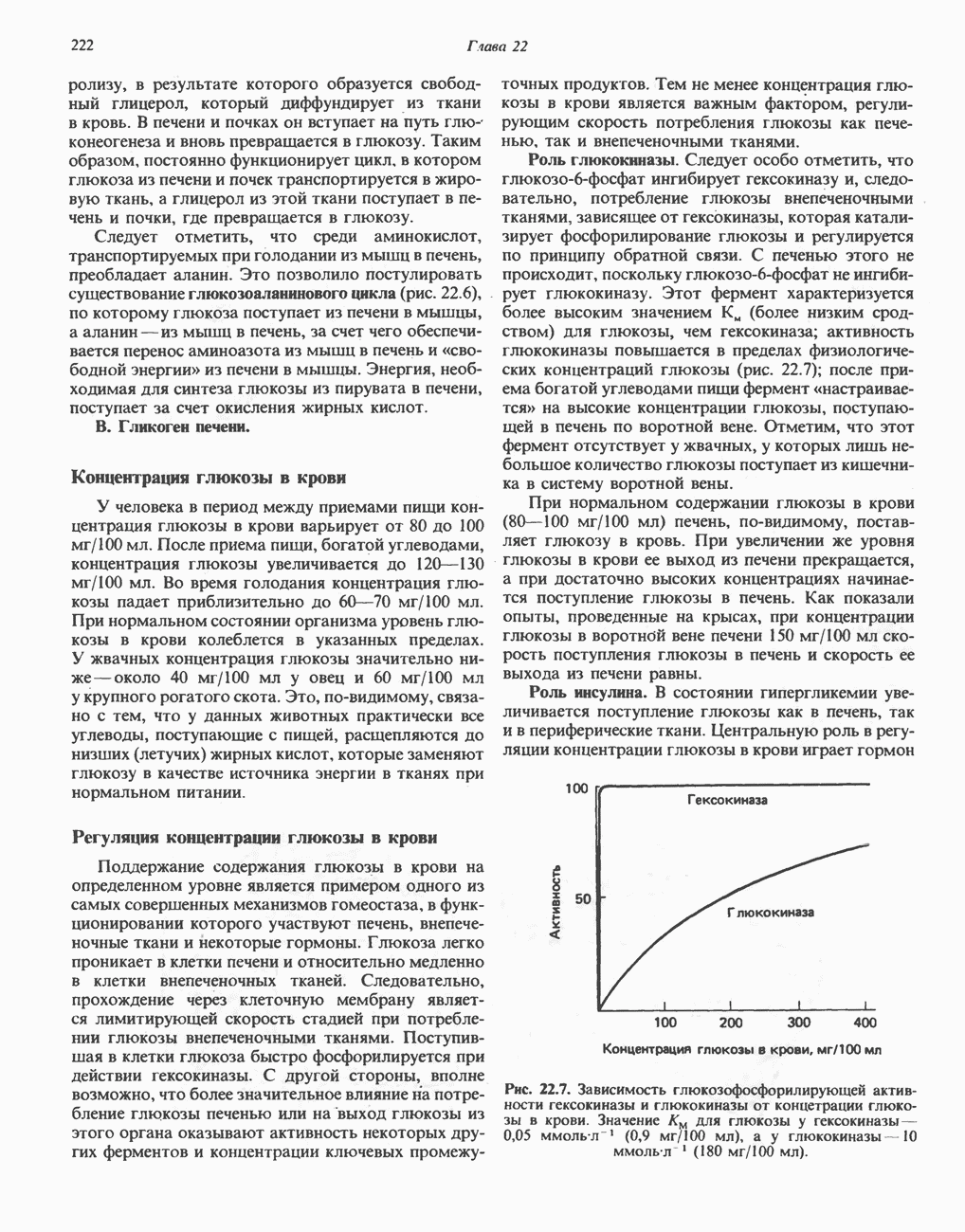
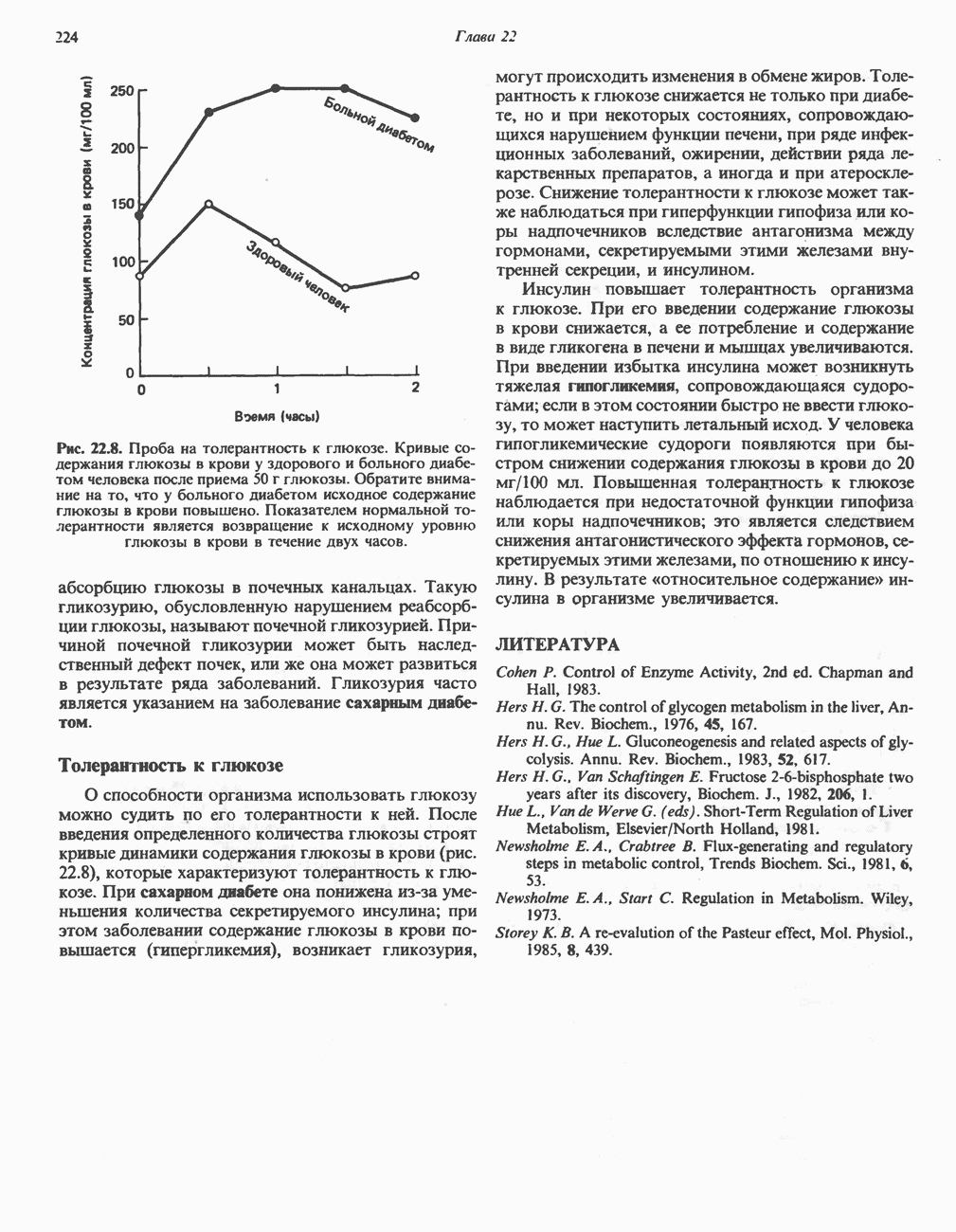
- РЕГУЛЯЦИЯ УРОВНЯ ГЛЮКОЗЫ В КРОВИ
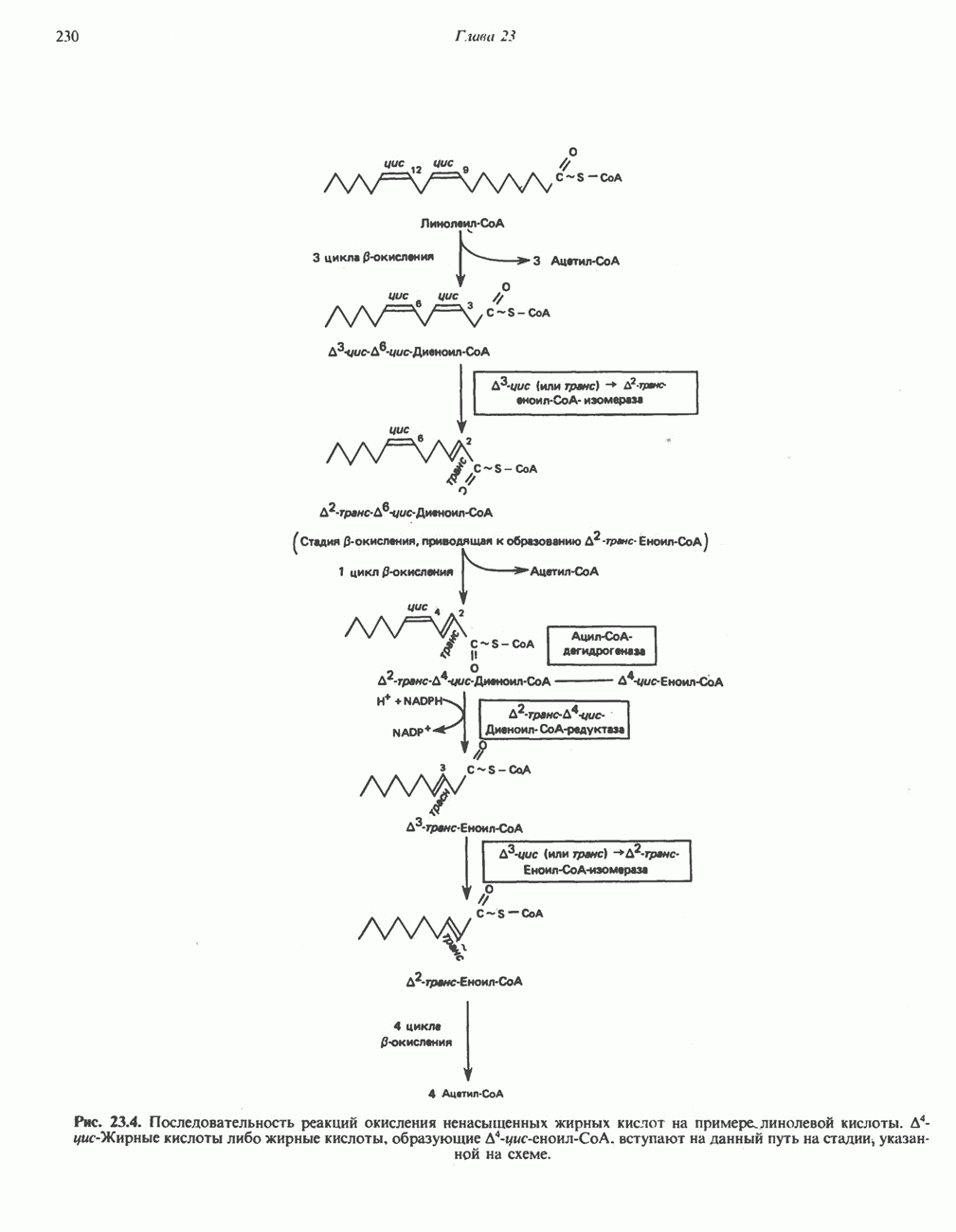
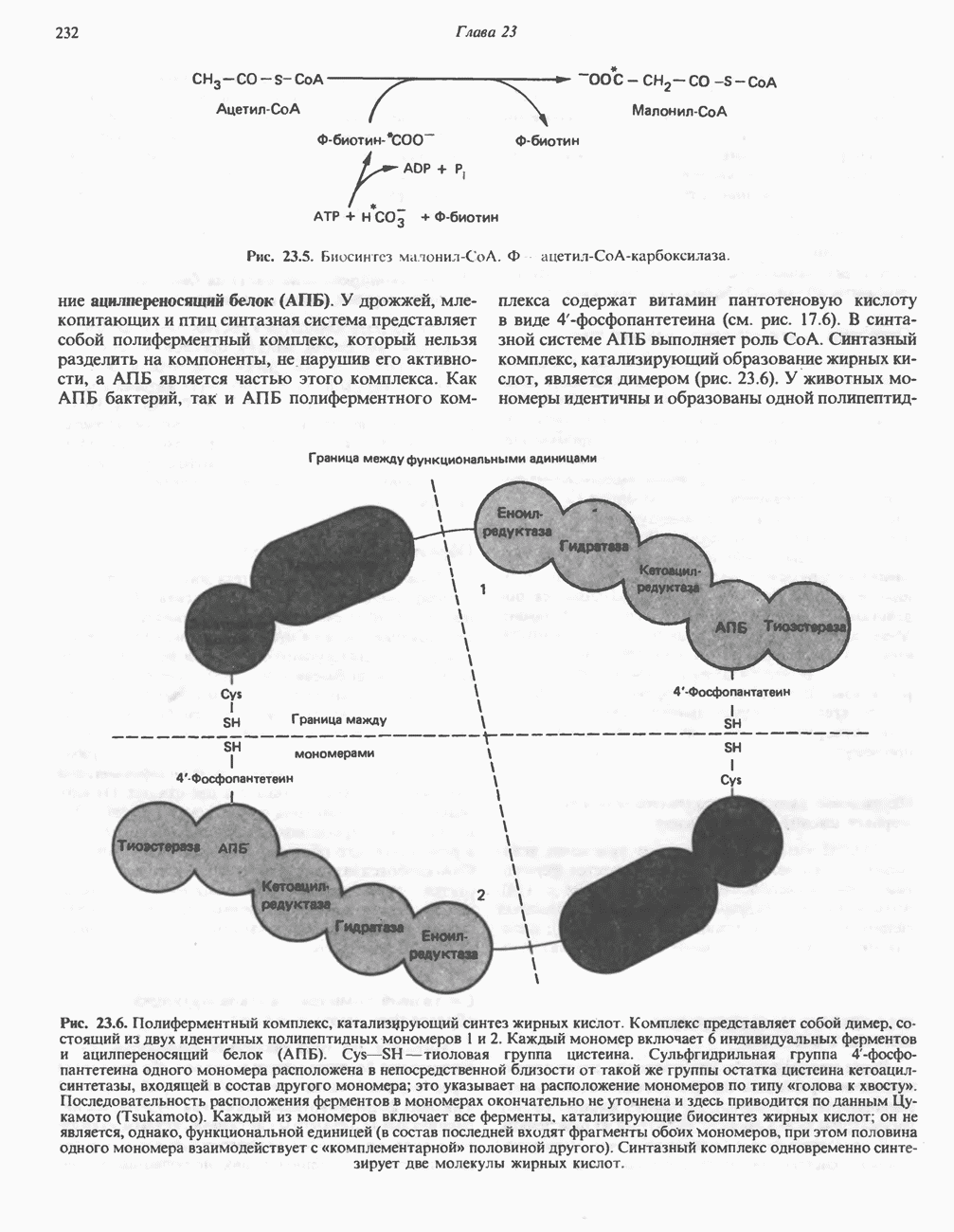
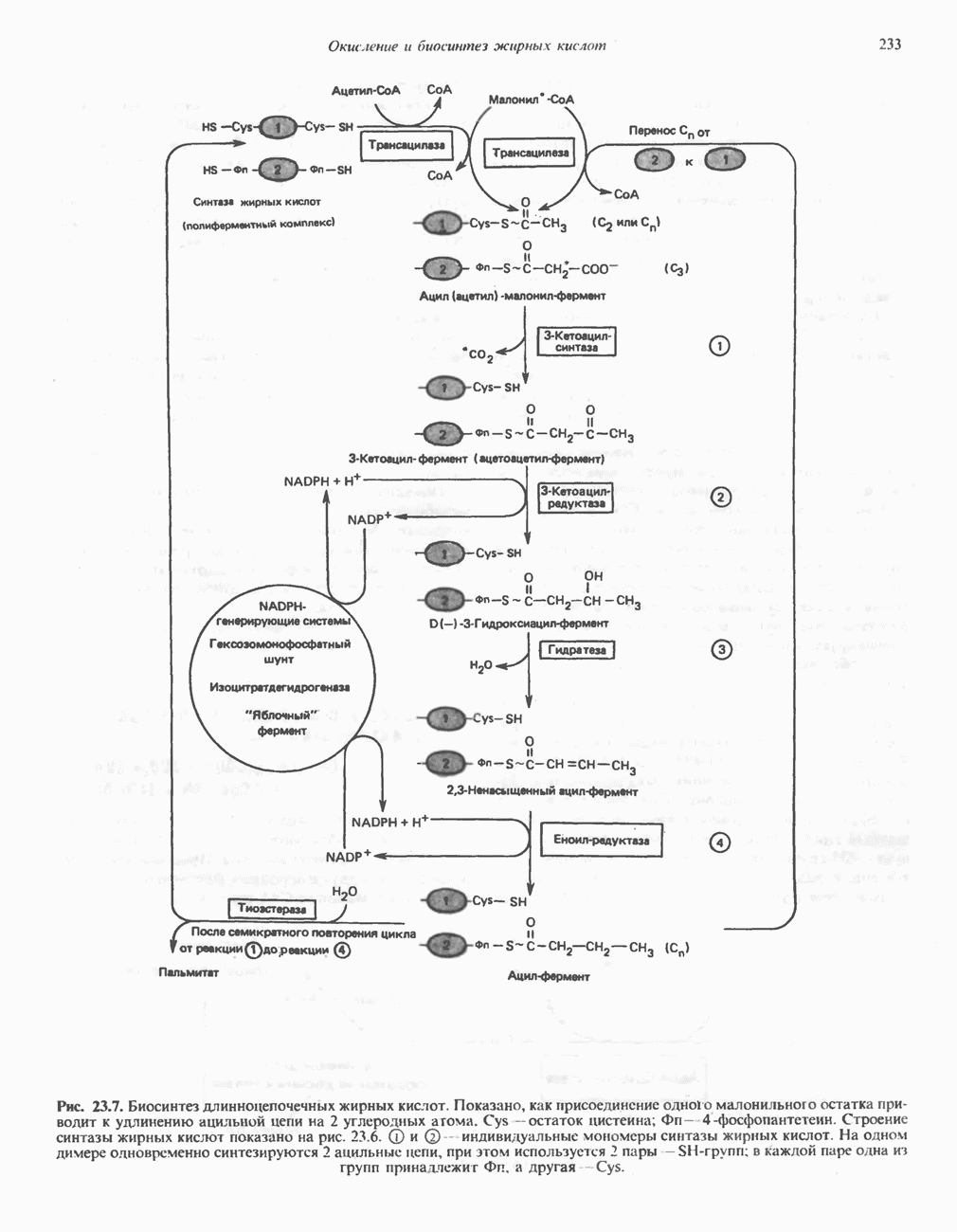
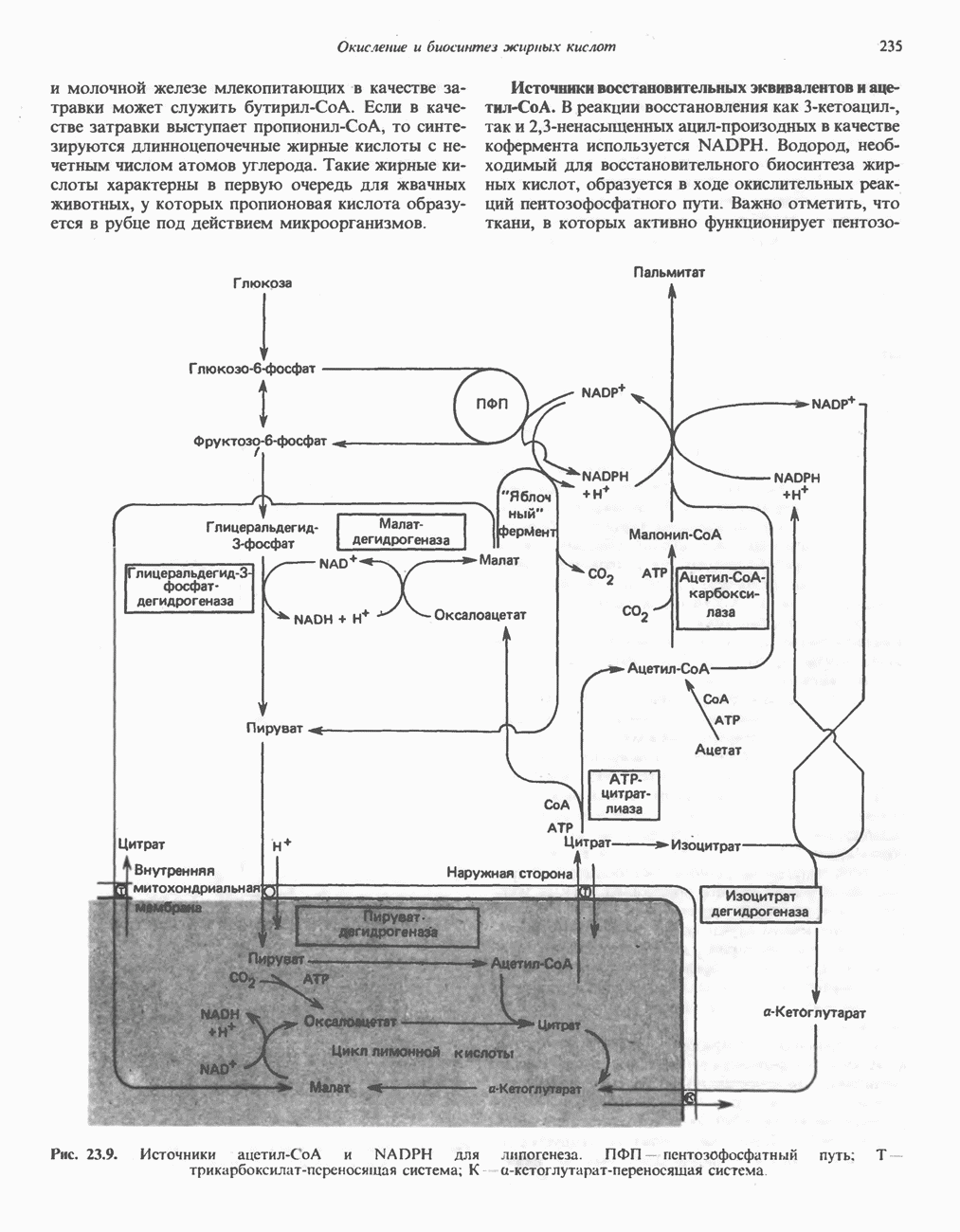
- Глава 23. Окисление и биосинтез жирных кислот
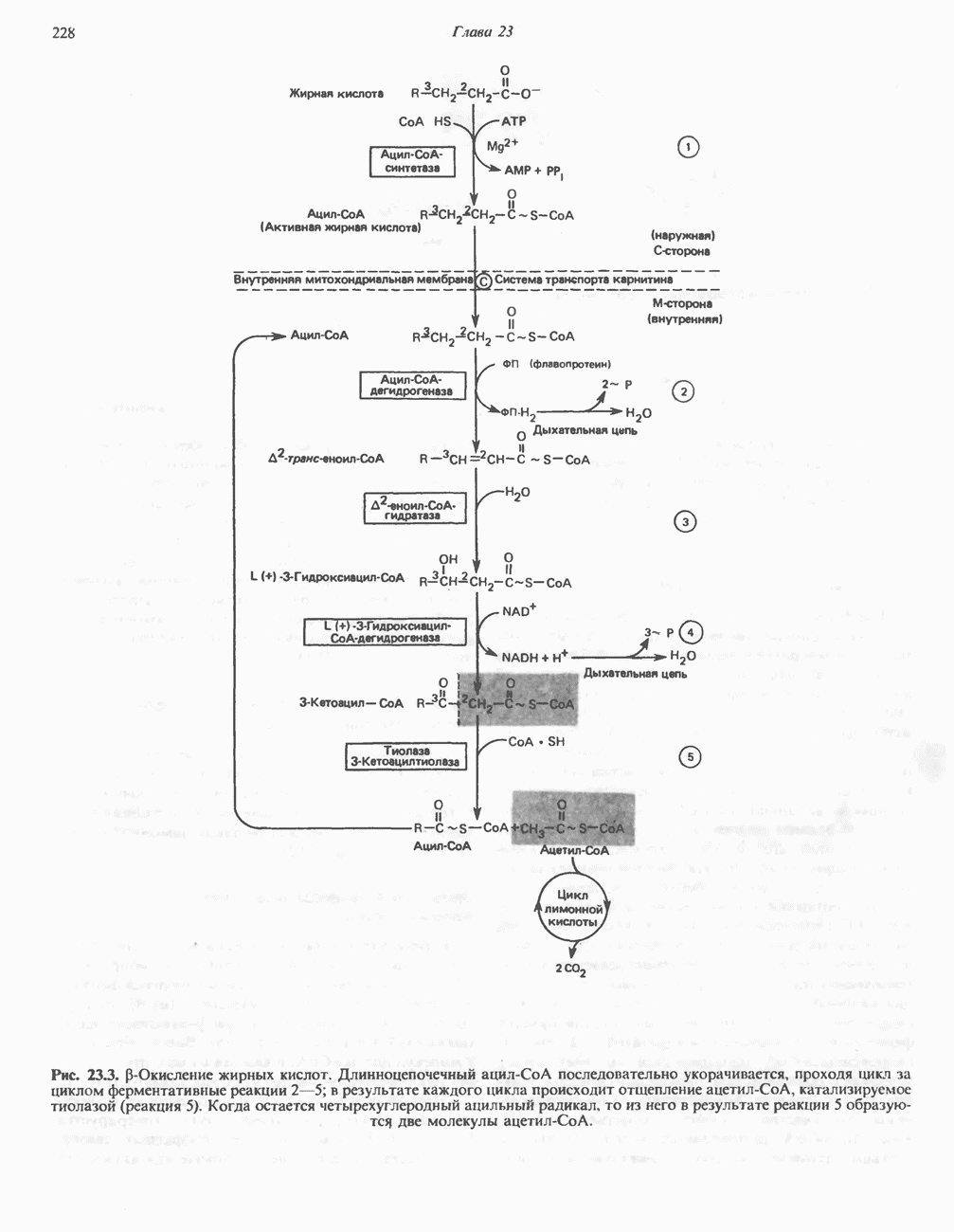
- ОКИСЛЕНИЕ ЖИРНЫХ КИСЛОТ
- БИОСИНТЕЗ НАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
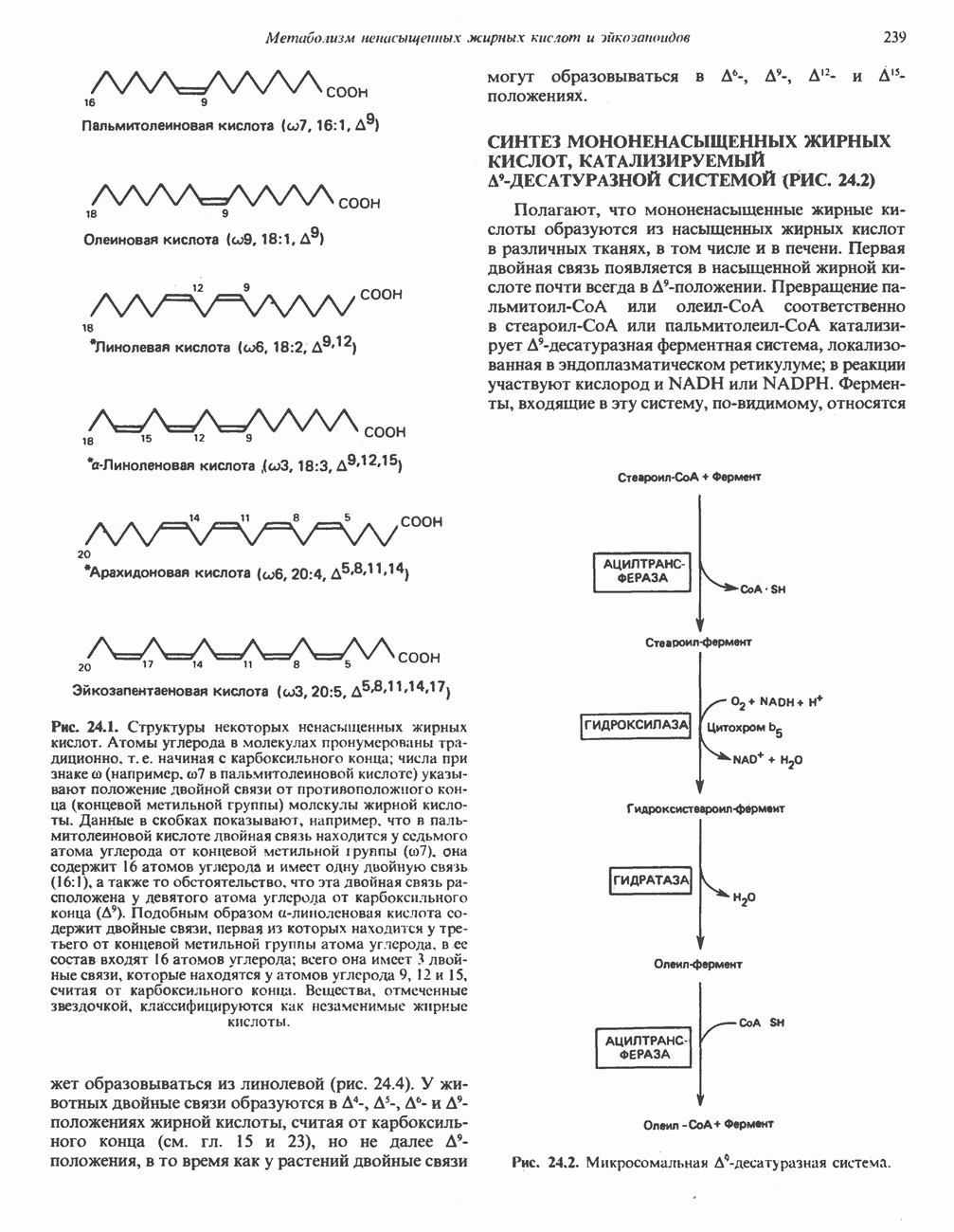
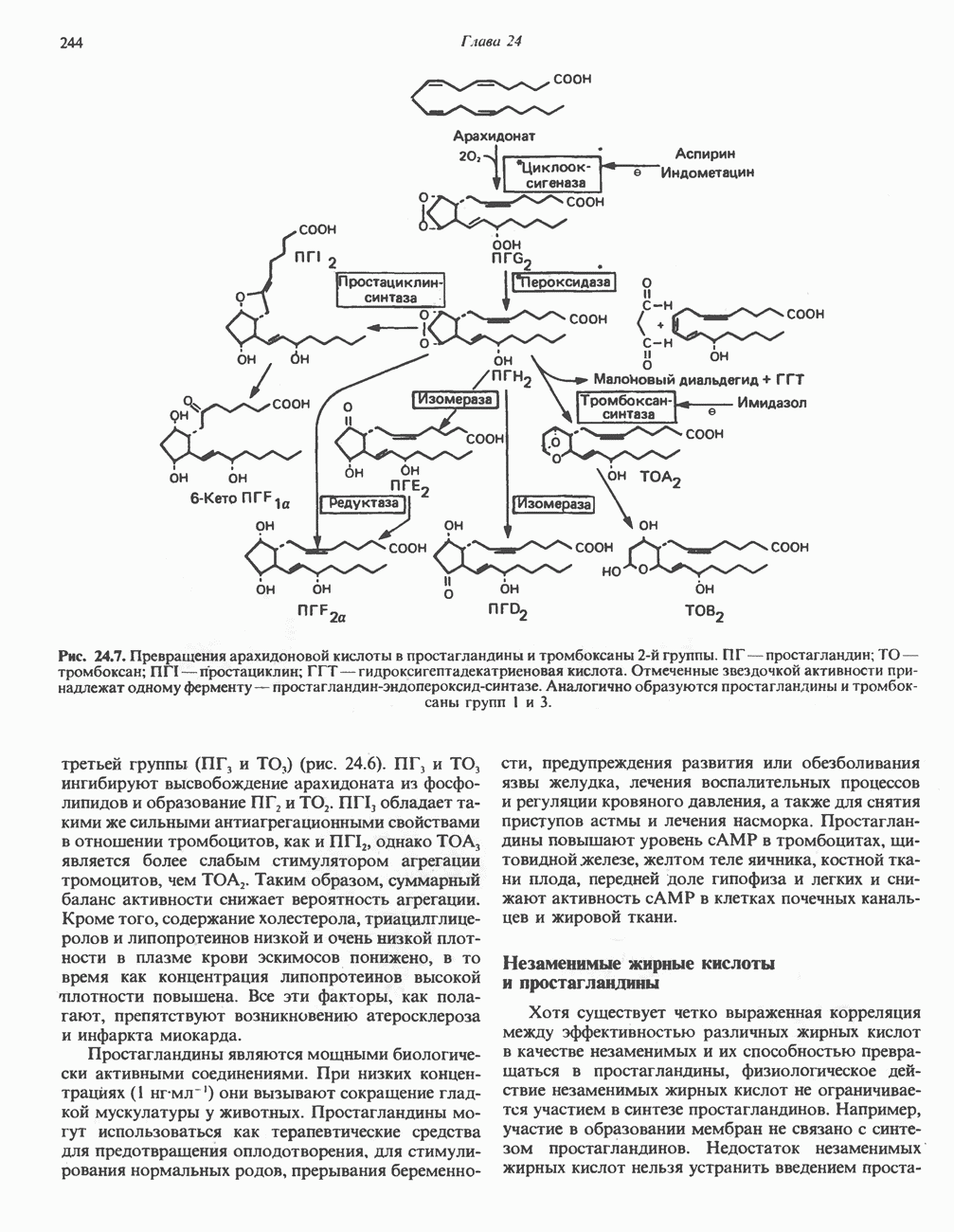
- Глава 24. Метаболизм ненасыщенных жирных кислот и эйкозаноидов
- МЕТАБОЛИЗМ НЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ
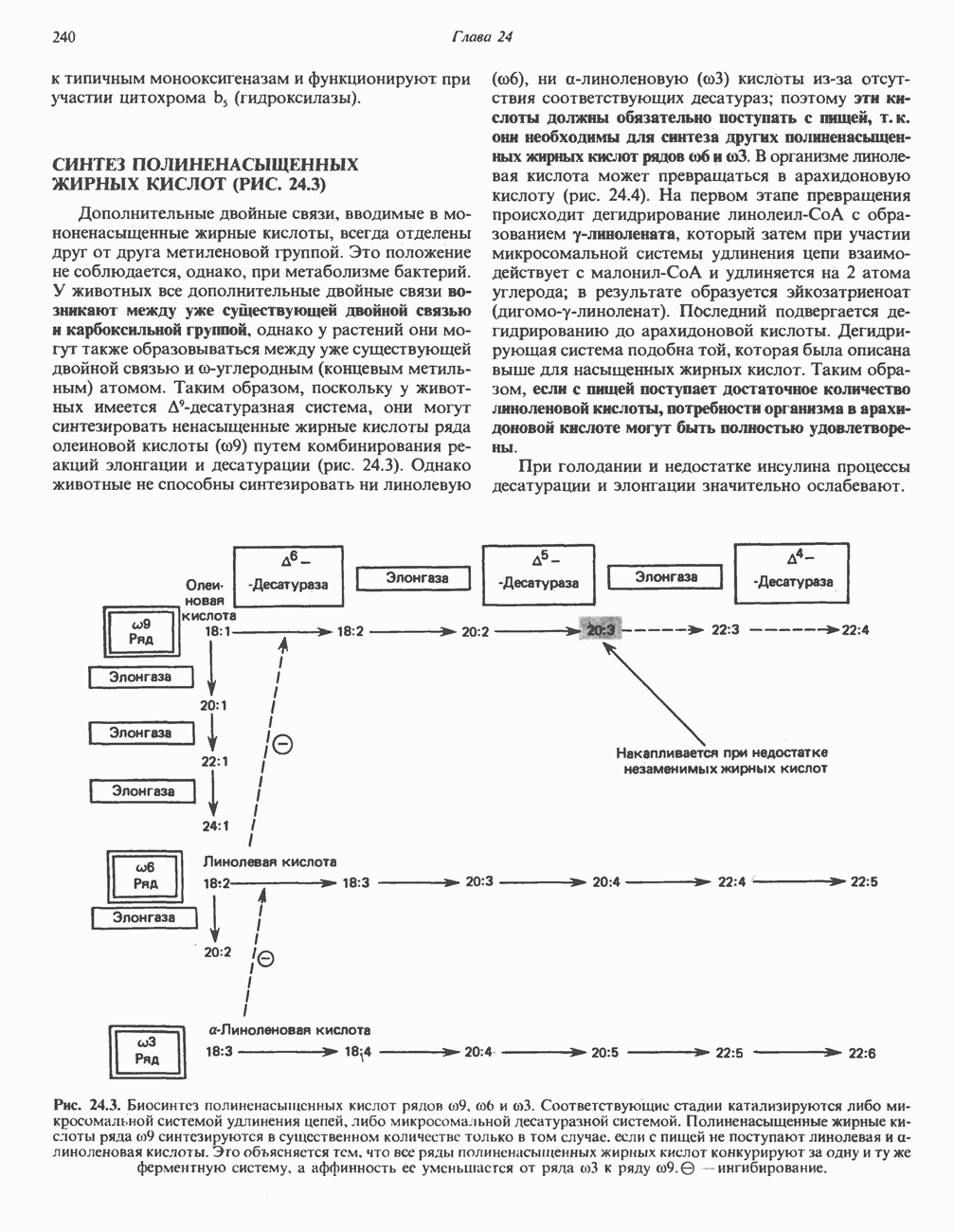
- СИНТЕЗ МОНОНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ, КАТАЛИЗИРУЕМЫЙ Д9-ДЕСАТУРАЗНОЙ СИСТЕМОЙ (РИС. 24.2)
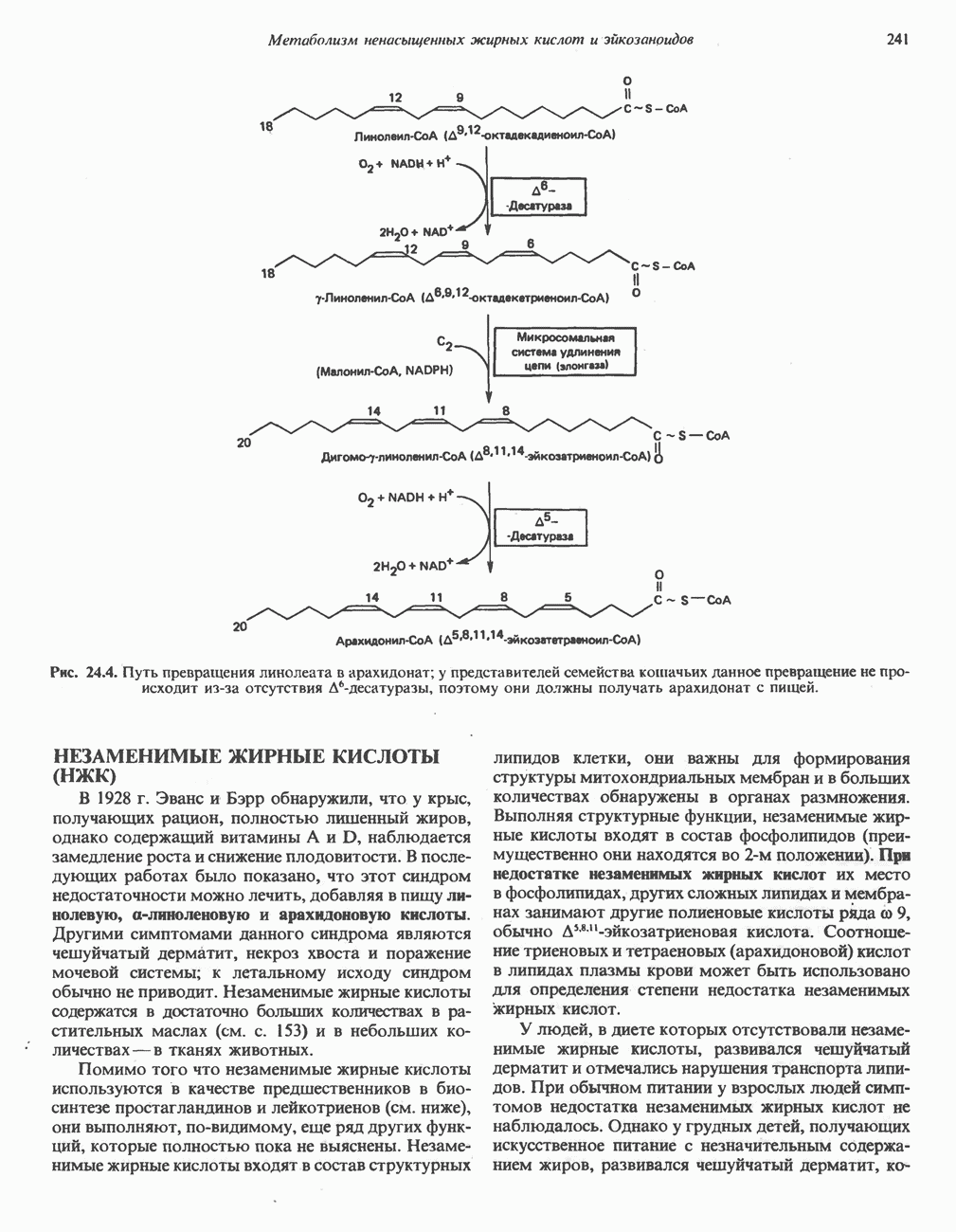
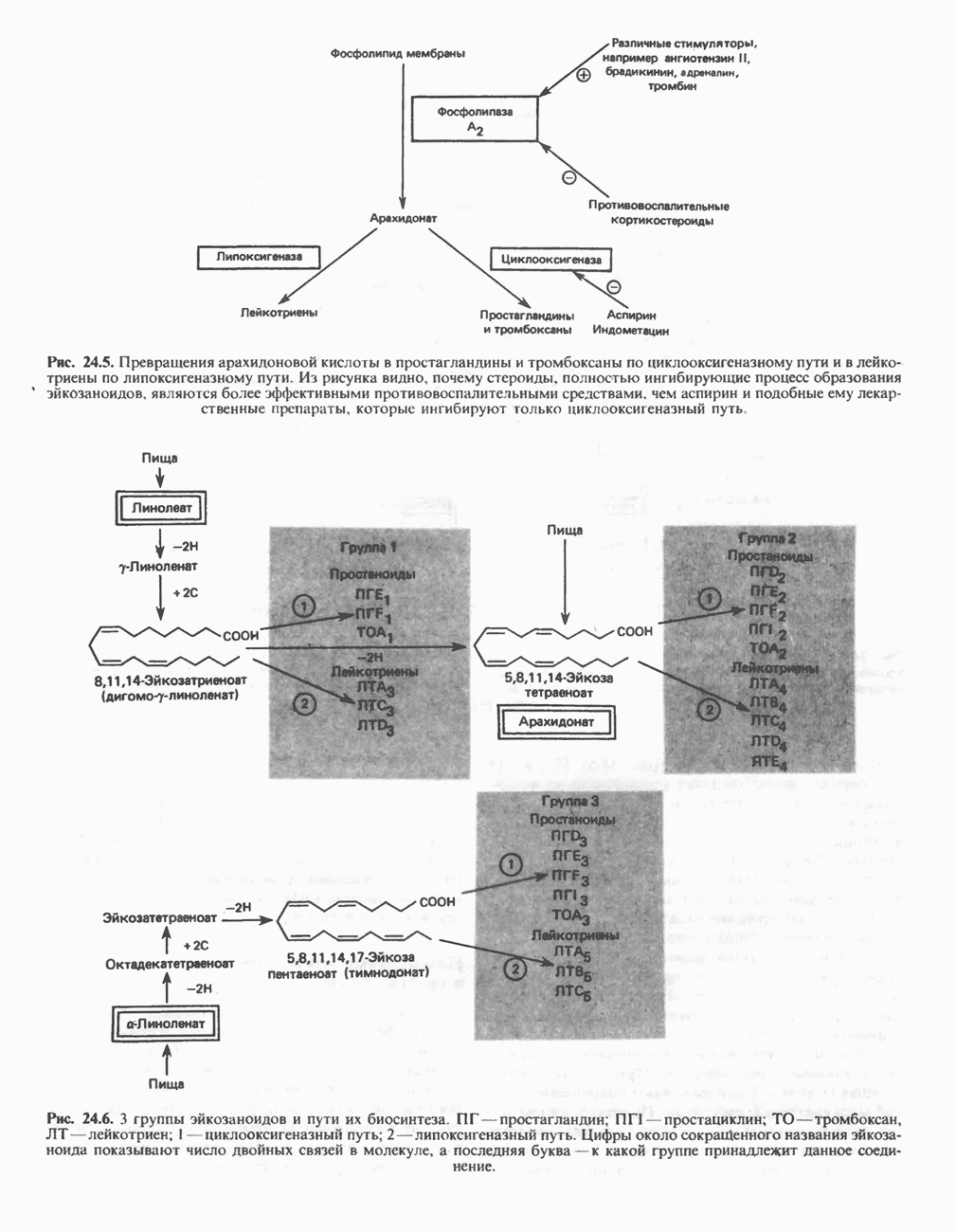
- СИНТЕЗ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ (РИС. 24.3)
- НЕЗАМЕНИМЫЕ ЖИРНЫЕ КИСЛОТЫ (НЖК)
- ЭЙКОЗАНОИДЫ
- ПРОСТАНОИДЫ
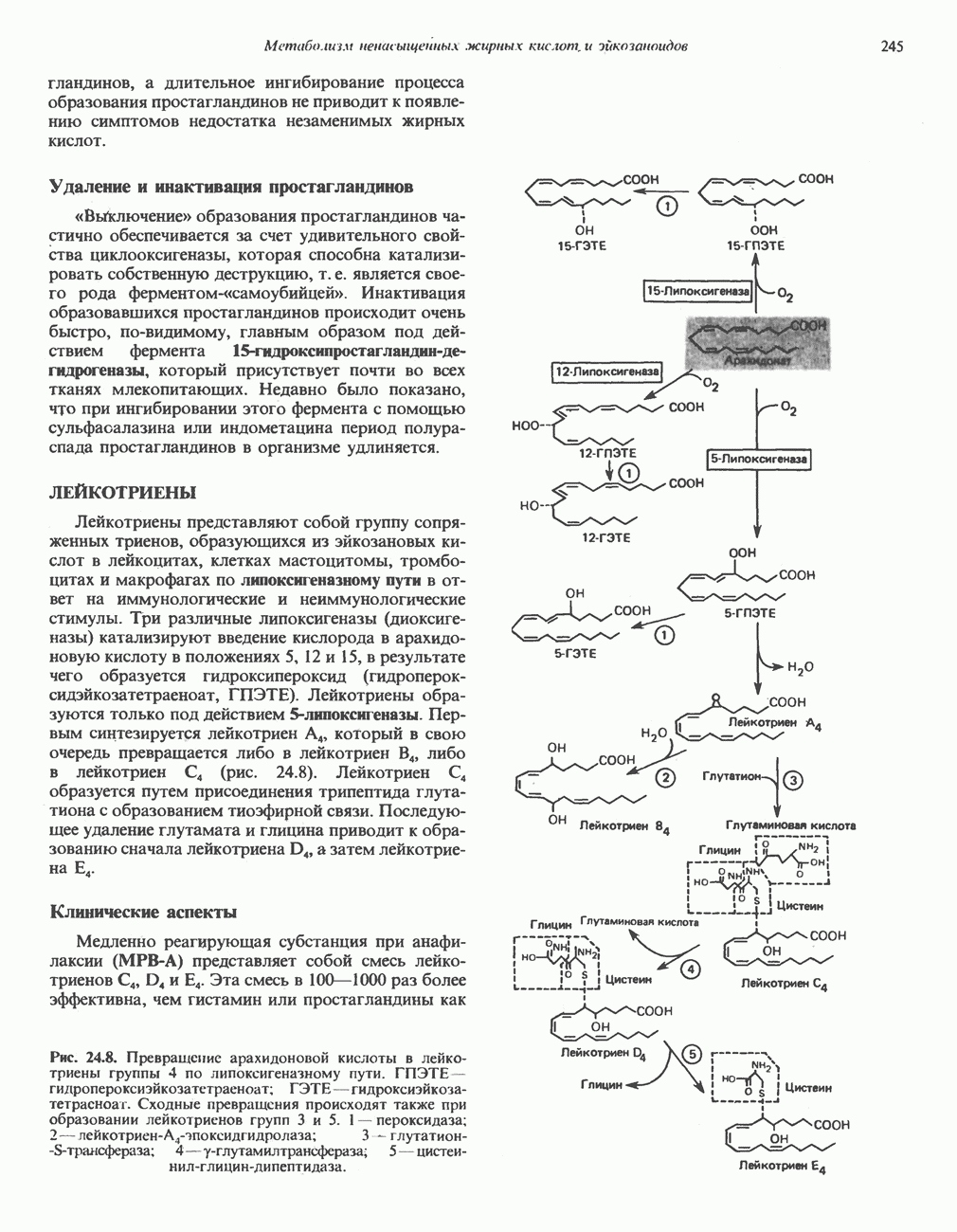
- ЛЕЙКОТРИЕНЫ
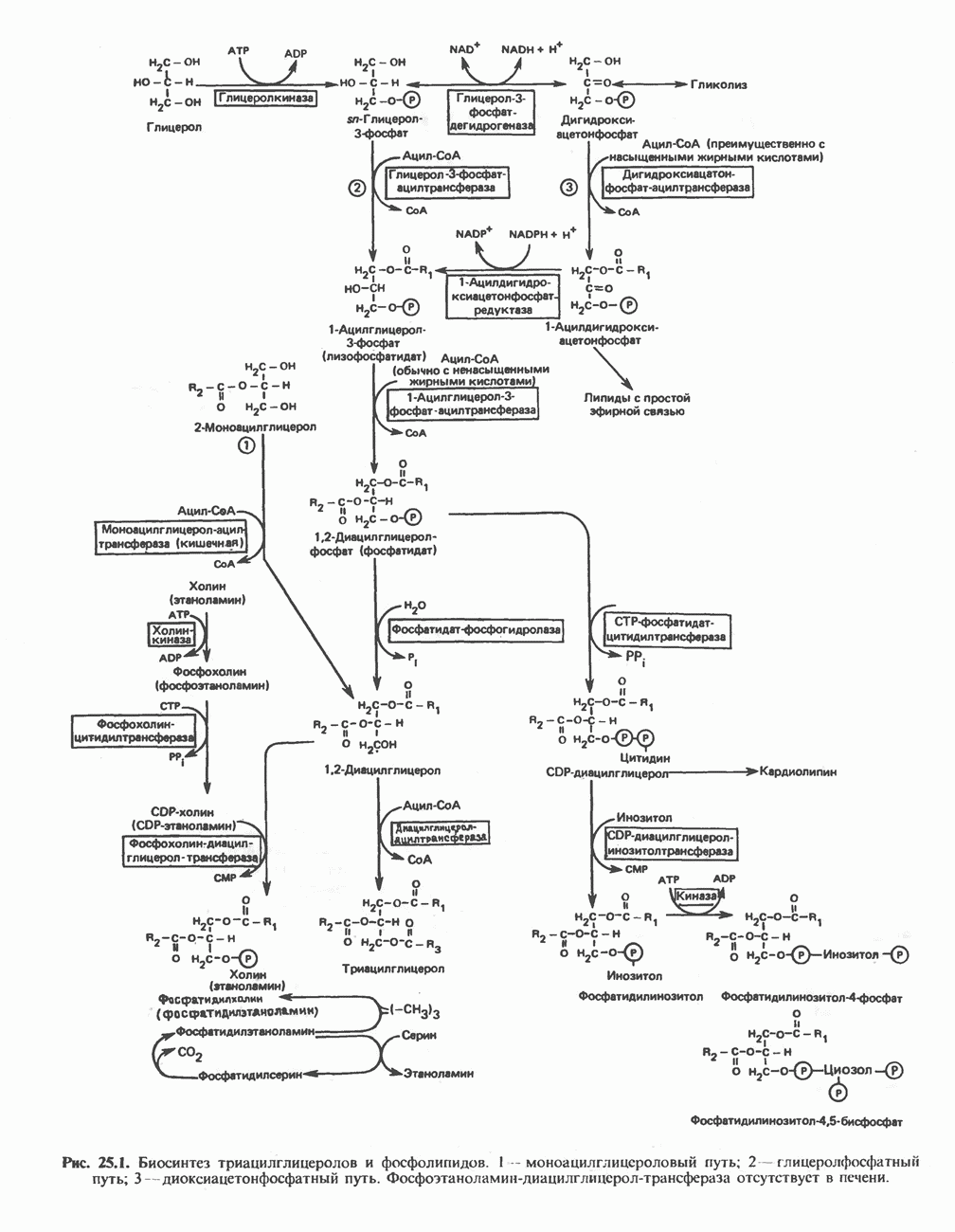
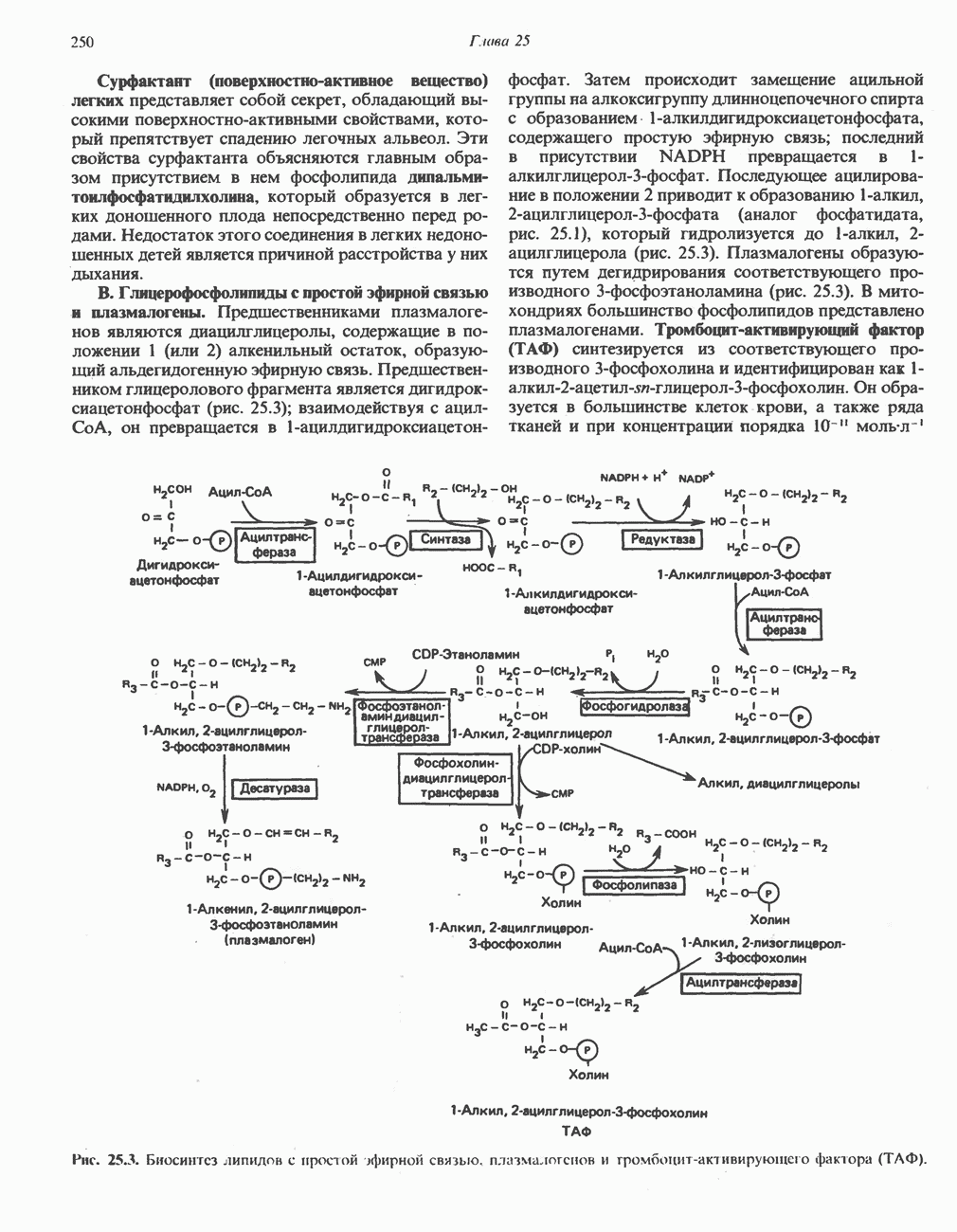
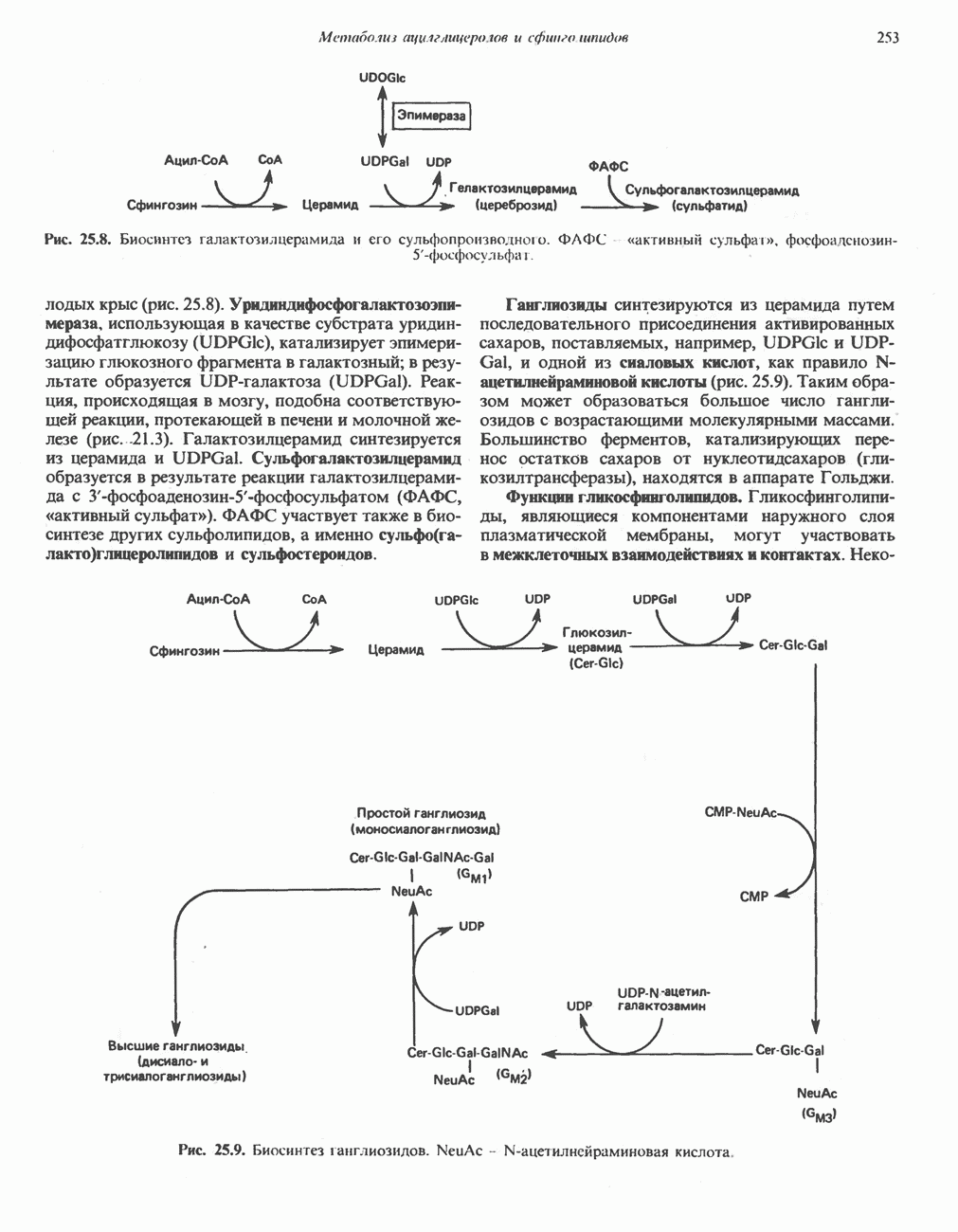
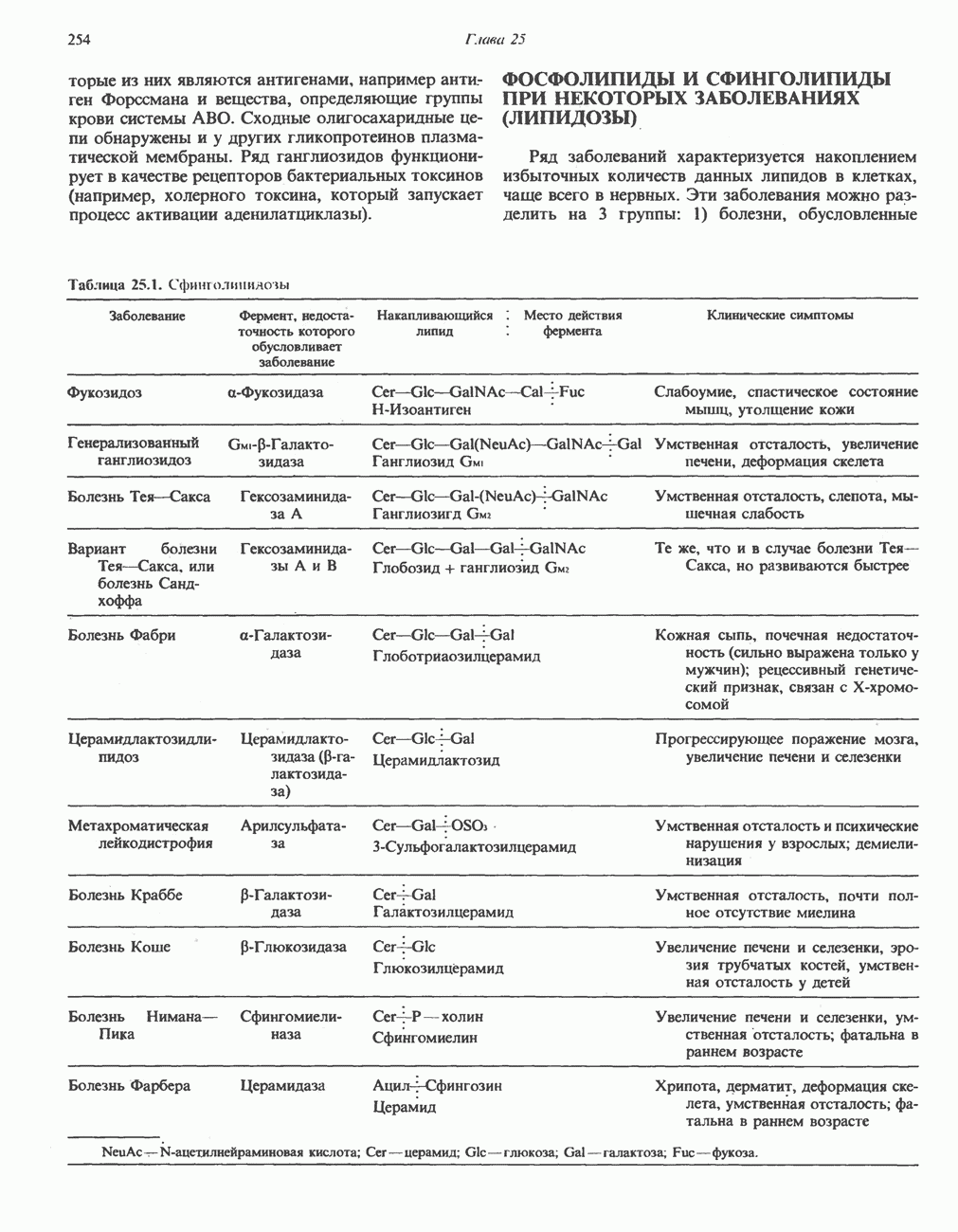
- Глава 25. Метаболизм ацилглицеролов и сфинголипидов
- МЕТАБОЛИЗМ АЦИЛГЛИЦЕРОЛОВ
- МЕТАБОЛИЗМ СФИНГОЛИПИДОВ
- ГЛИКОЛИПИДЫ
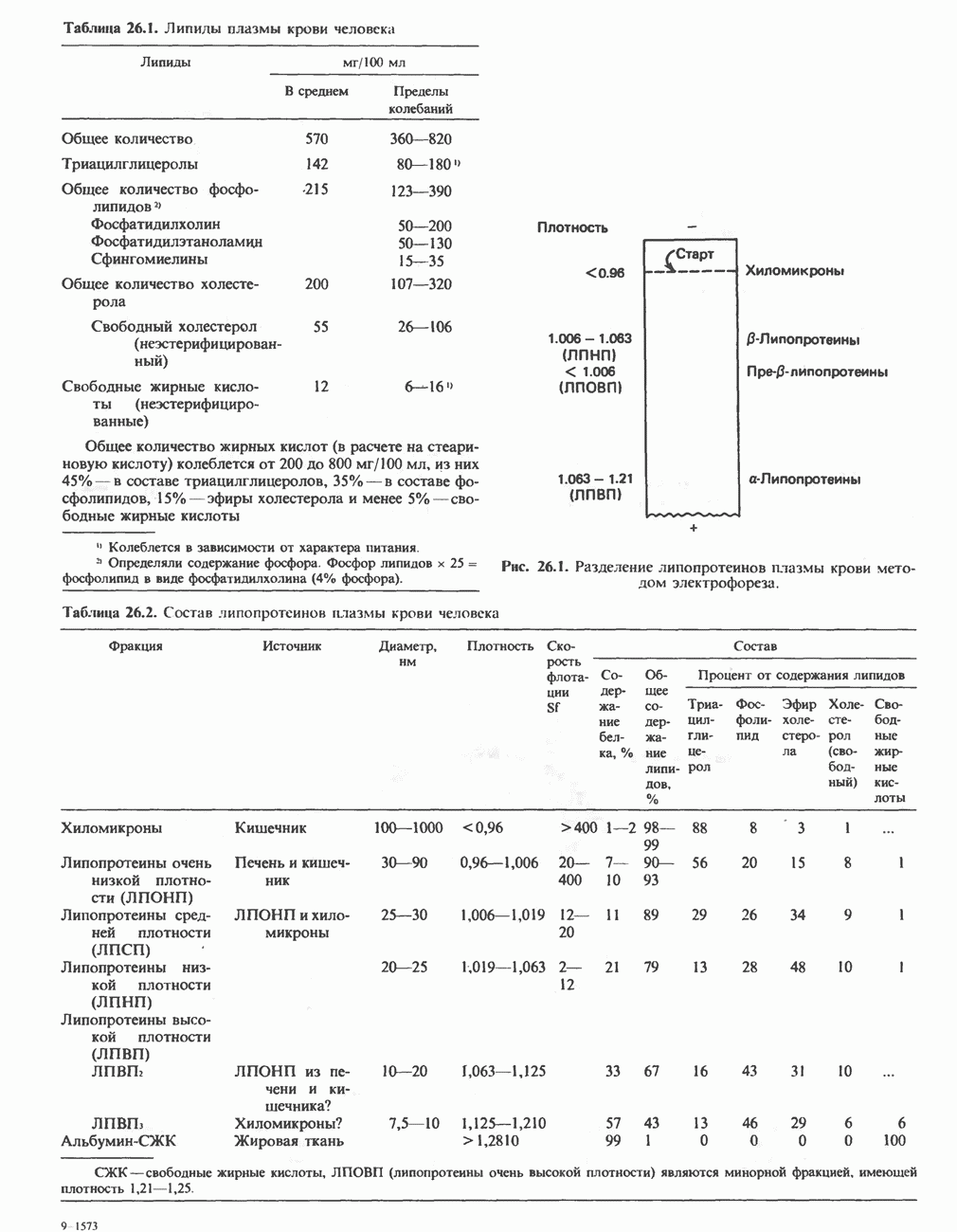
- ФОСФОЛИПИДЫ И СФИНГОЛИПИДЫ ПРИ НЕКОТОРЫХ ЗАБОЛЕВАНИЯХ (ЛИПИДОЗЫ)
- Глава 26. Транспорт и запасание липидов
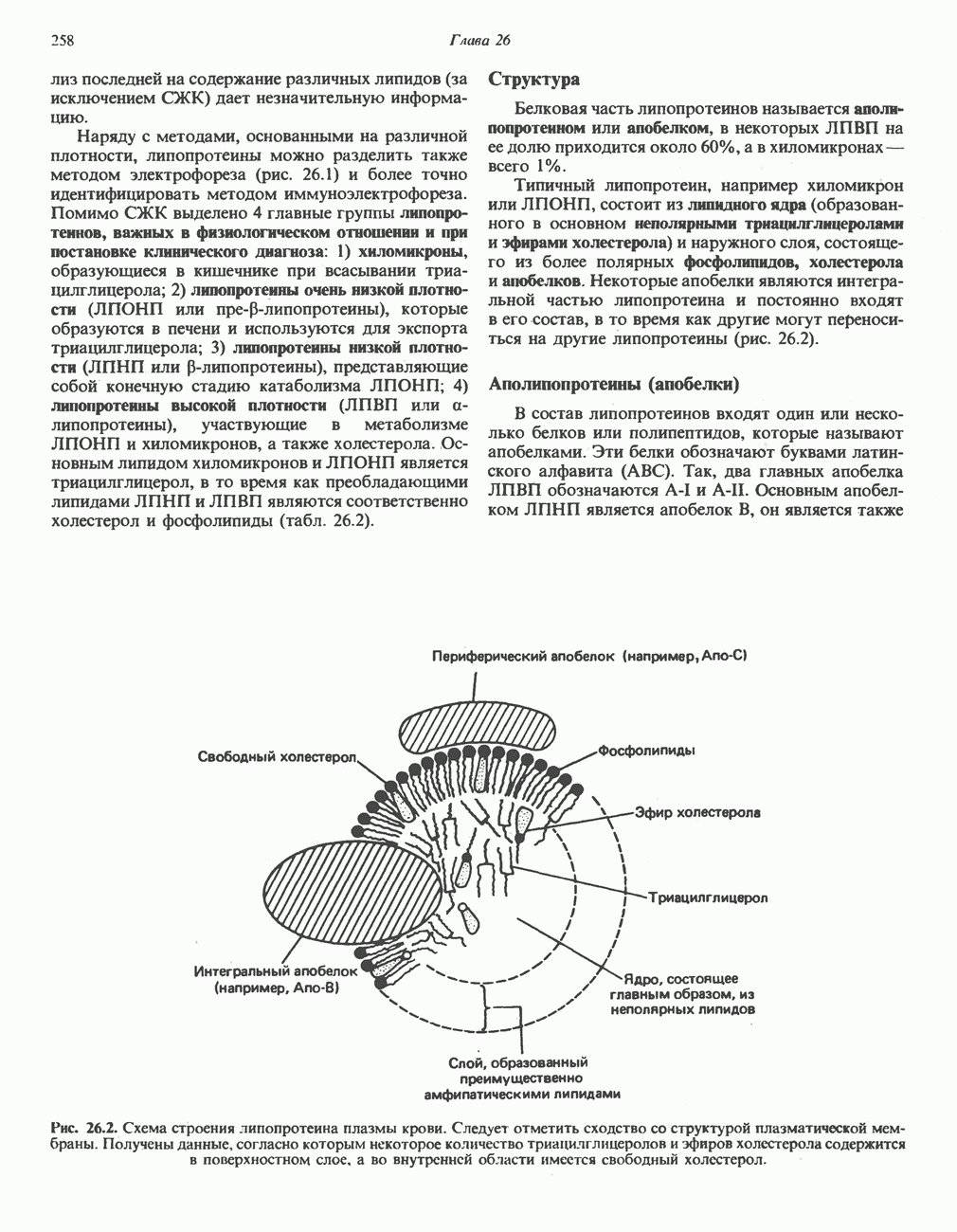
- ЛИПИДЫ ПЛАЗМЫ КРОВИ И ЛИПОПРОТЕИНЫ
- МЕТАБОЛИЗМ ЛИПОПРОТЕИНОВ ПЛАЗМЫ КРОВИ
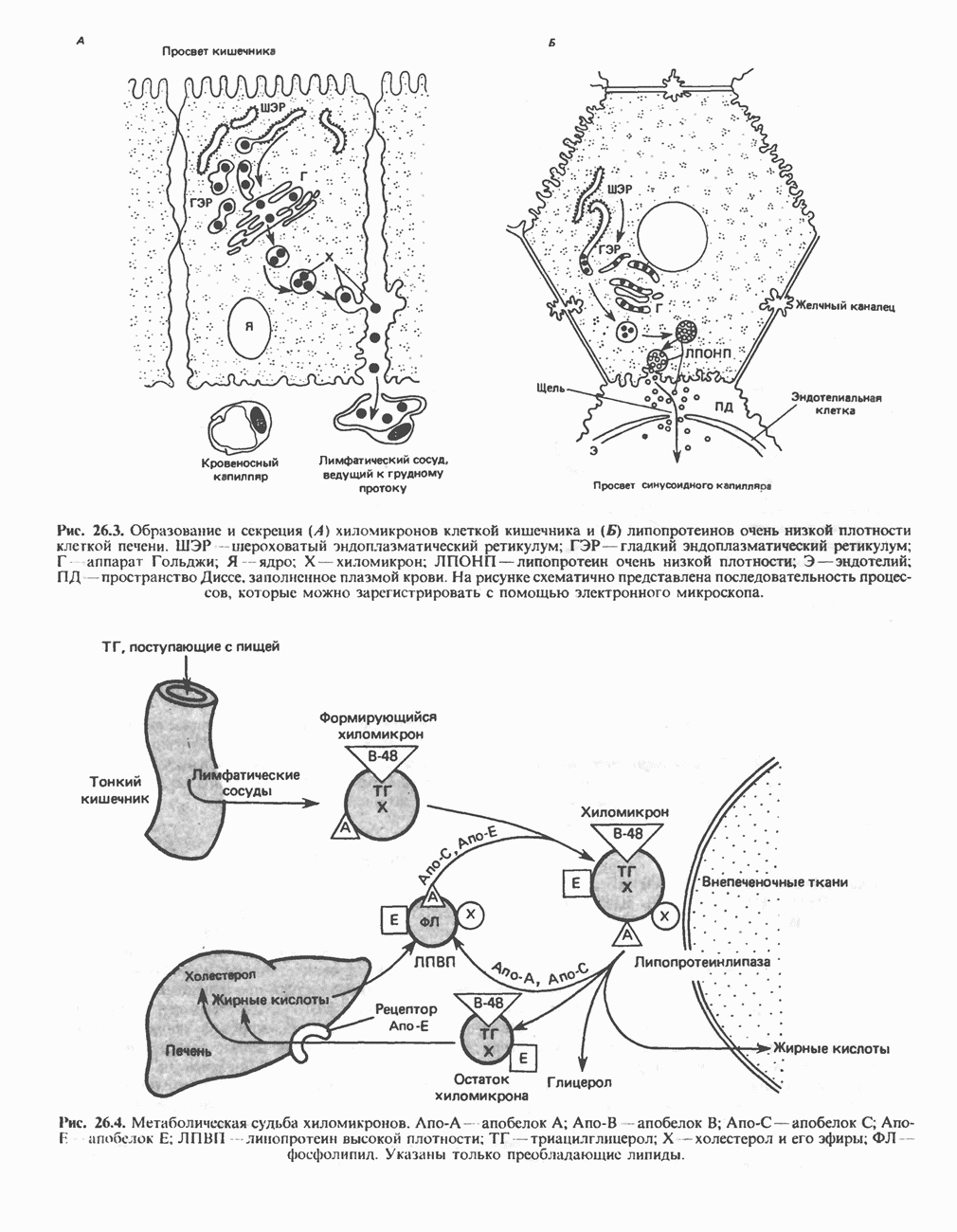
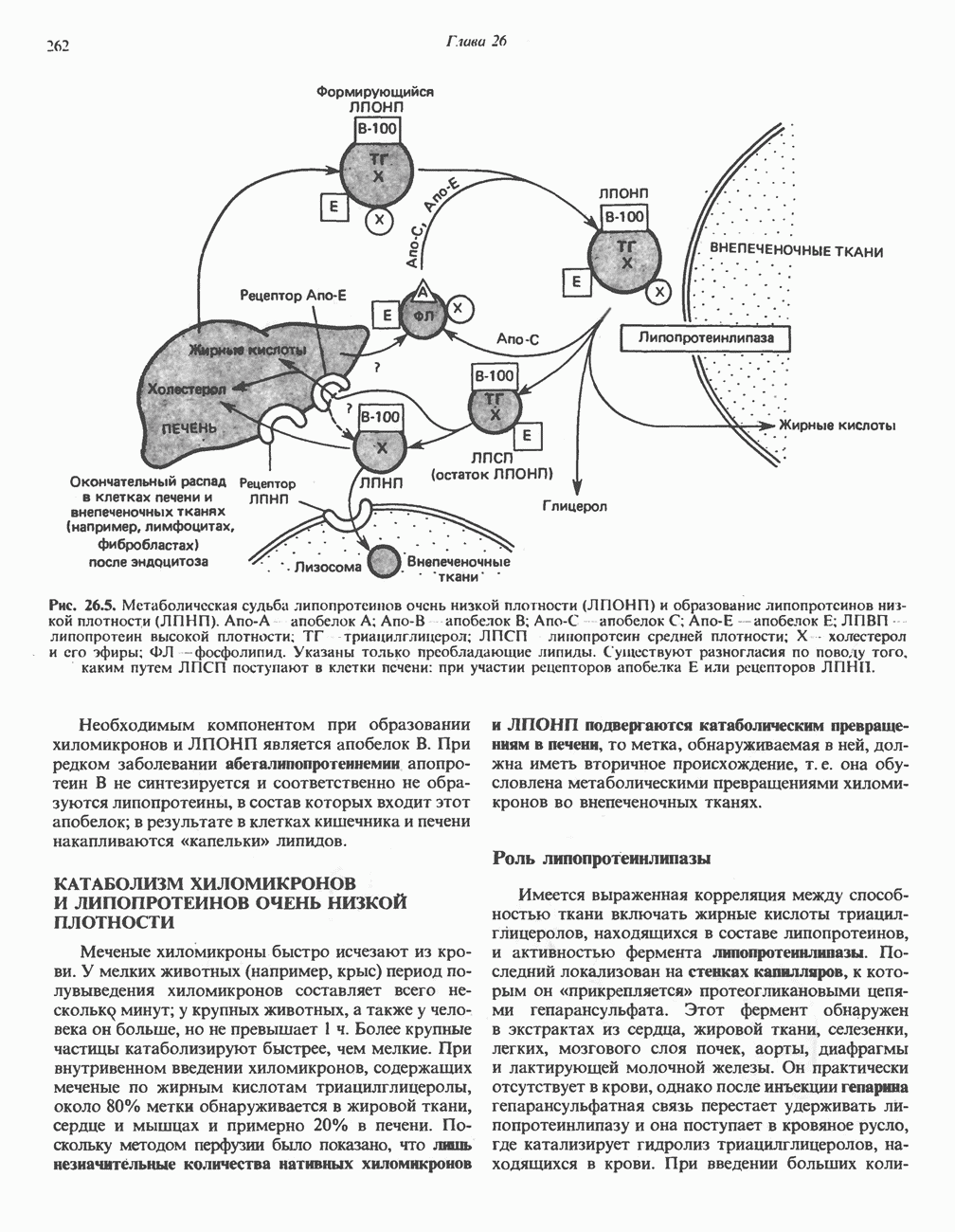
- ОБРАЗОВАНИЕ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ (ЛПОНП)
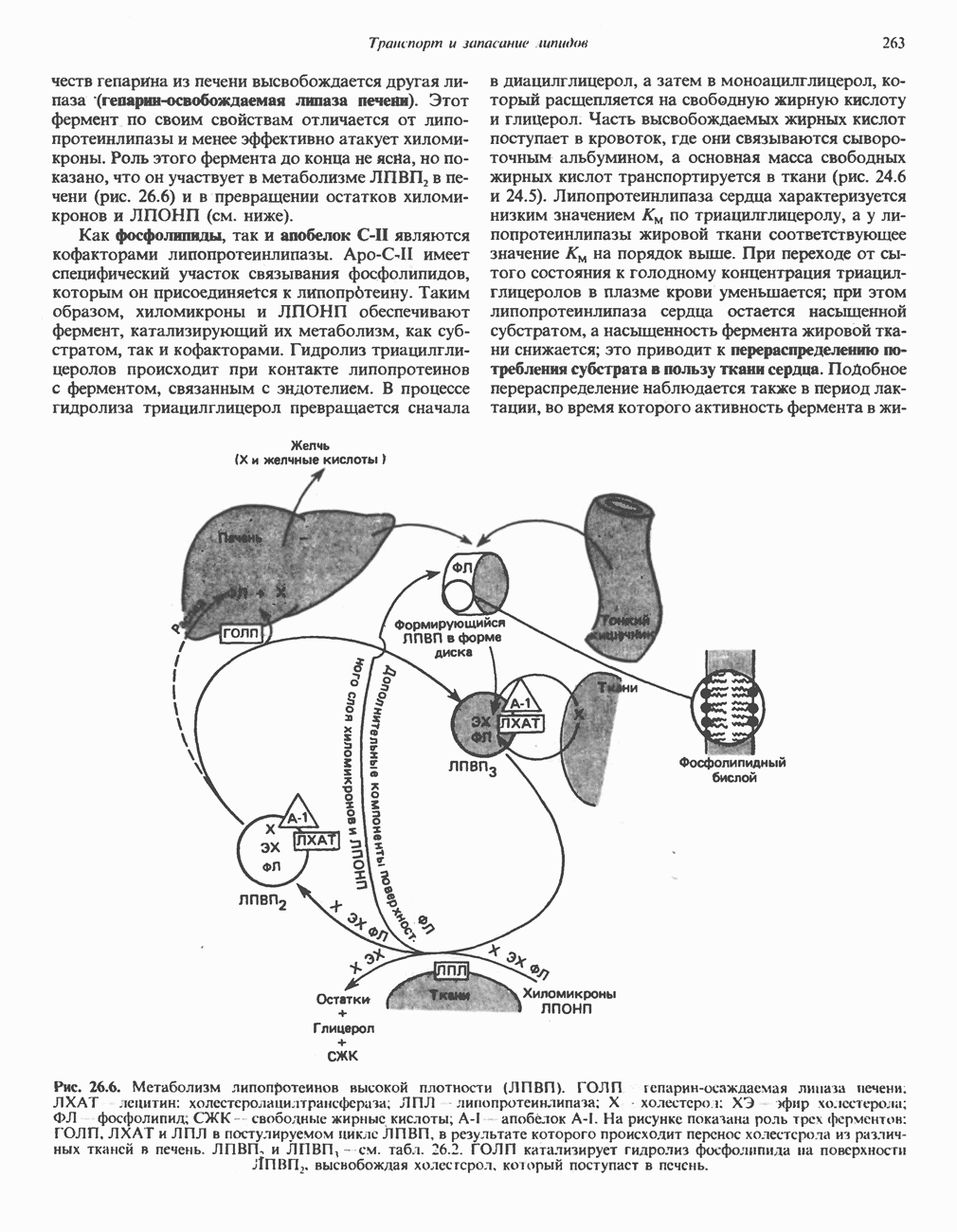
- КАТАБОЛИЗМ ХИЛОМИКРОНОВ И ЛИПОПРОТЕИНОВ ОЧЕНЬ НИЗКОЙ ПЛОТНОСТИ
- МЕТАБОЛИЗМ ЛПНП
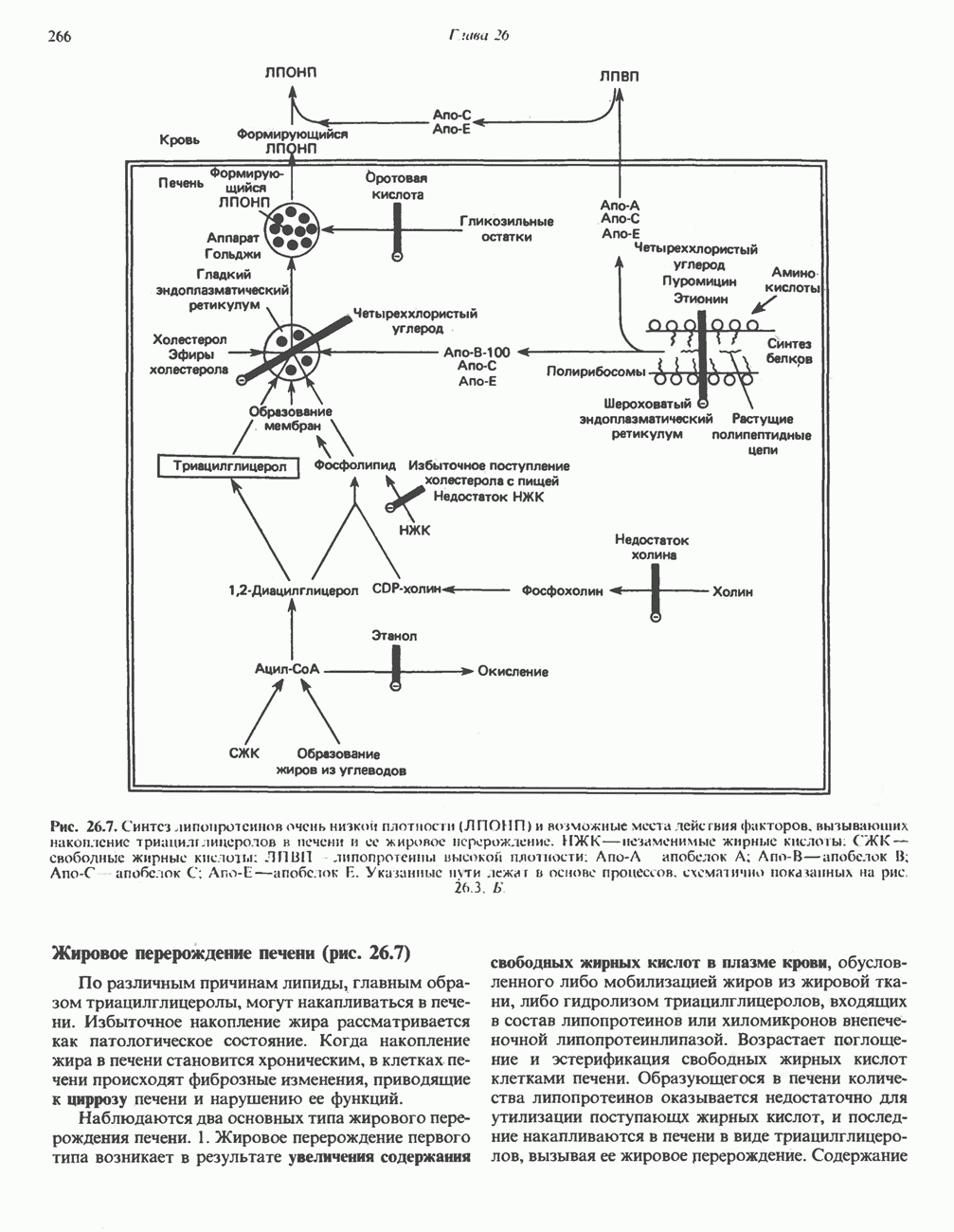
- МЕТАБОЛИЗМ ЛПВП (рис. 26.6)
- РОЛЬ ПЕЧЕНИ В ТРАНСПОРТЕ И МЕТАБОЛИЗМЕ ЛИПИДОВ
- СИНТЕЗ ТРИАЦИЛГЛИЦЕРОЛОВ И ОБРАЗОВАНИЕ ЛПОНП (рис. 26.7)
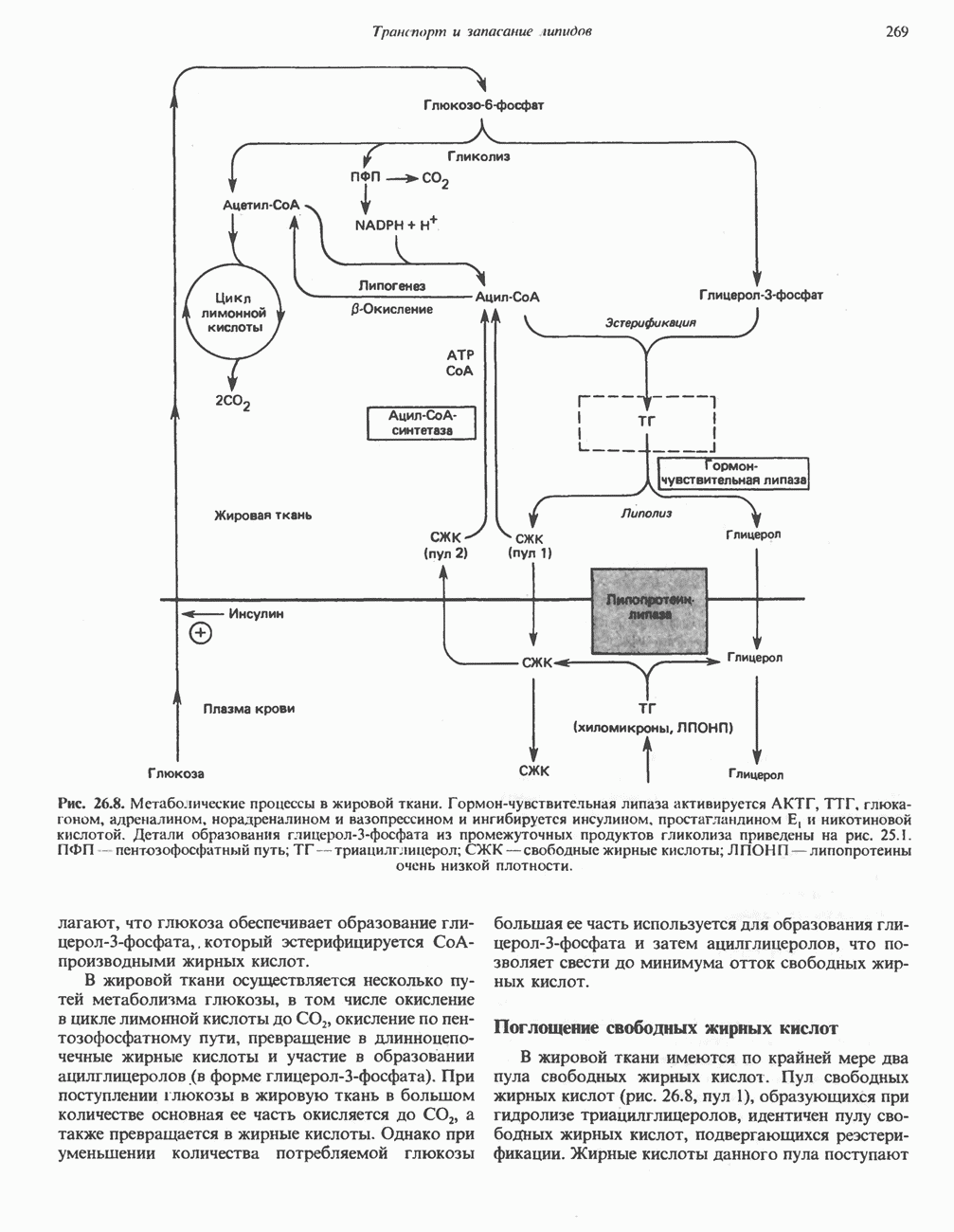
- МЕТАБОЛИЧЕСКИЕ ПРЕВРАЩЕНИЯ В ЖИРОВОЙ ТКАНИ И МОБИЛИЗАЦИЯ ЖИРОВ
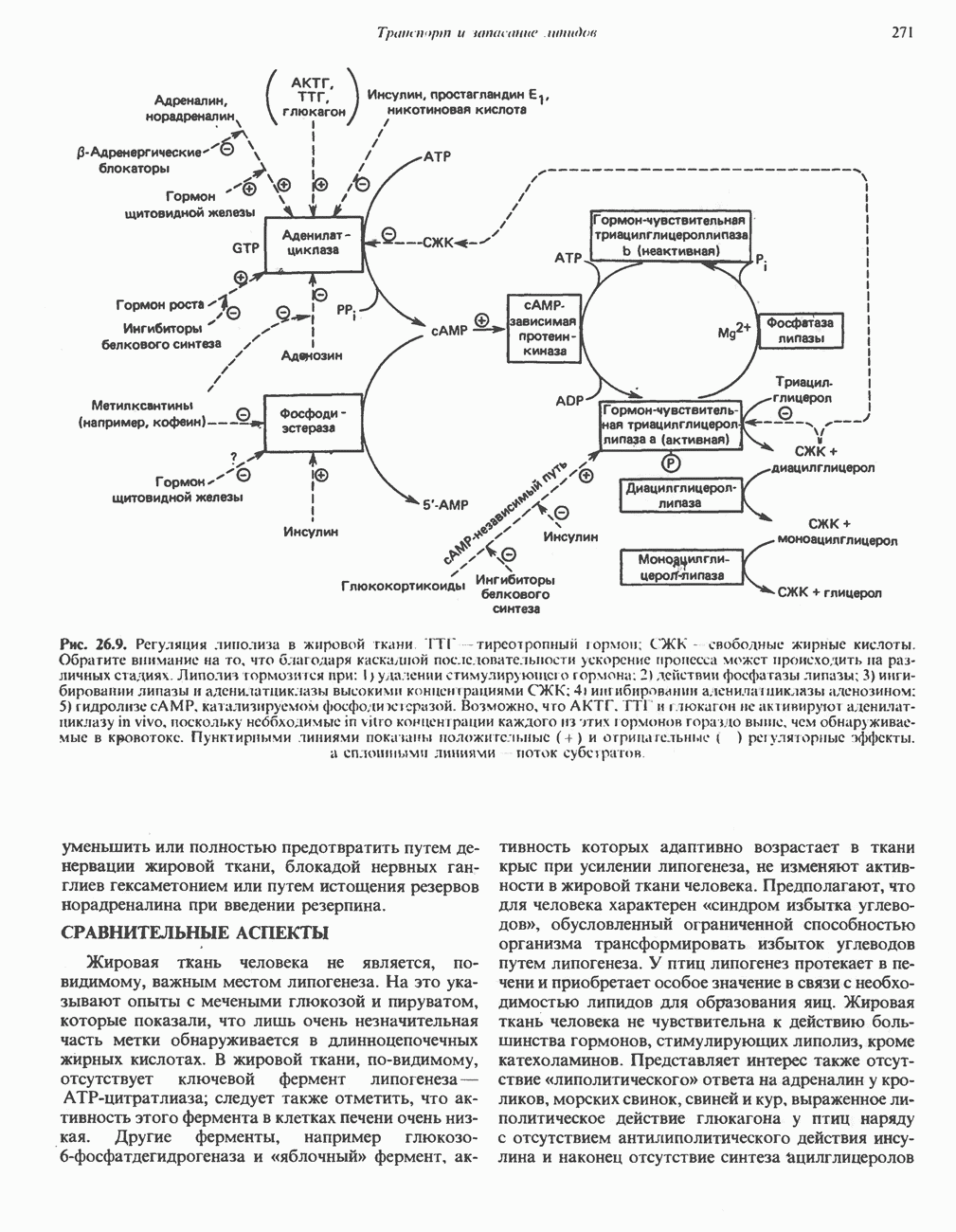
- РОЛЬ ГОРМОНОВ В МОБИЛИЗАЦИИ ЖИРОВ
- СРАВНИТЕЛЬНЫЕ АСПЕКТЫ
- РОЛЬ БУРОЙ ЖИРОВОЙ ТКАНИ В ТЕРМОГЕНЕЗЕ
- Глава 27. Синтез, транспорт и экскреция холестерола
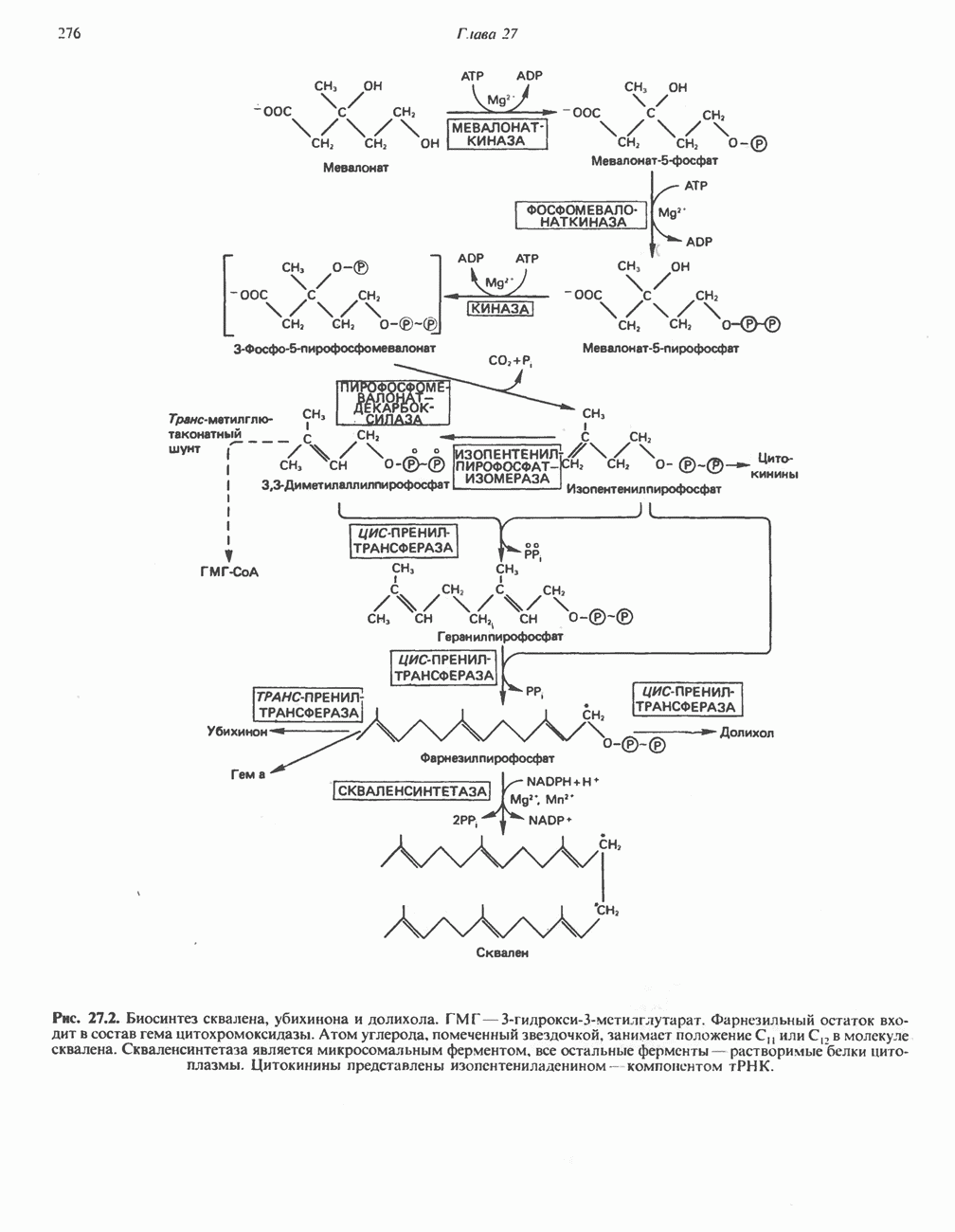
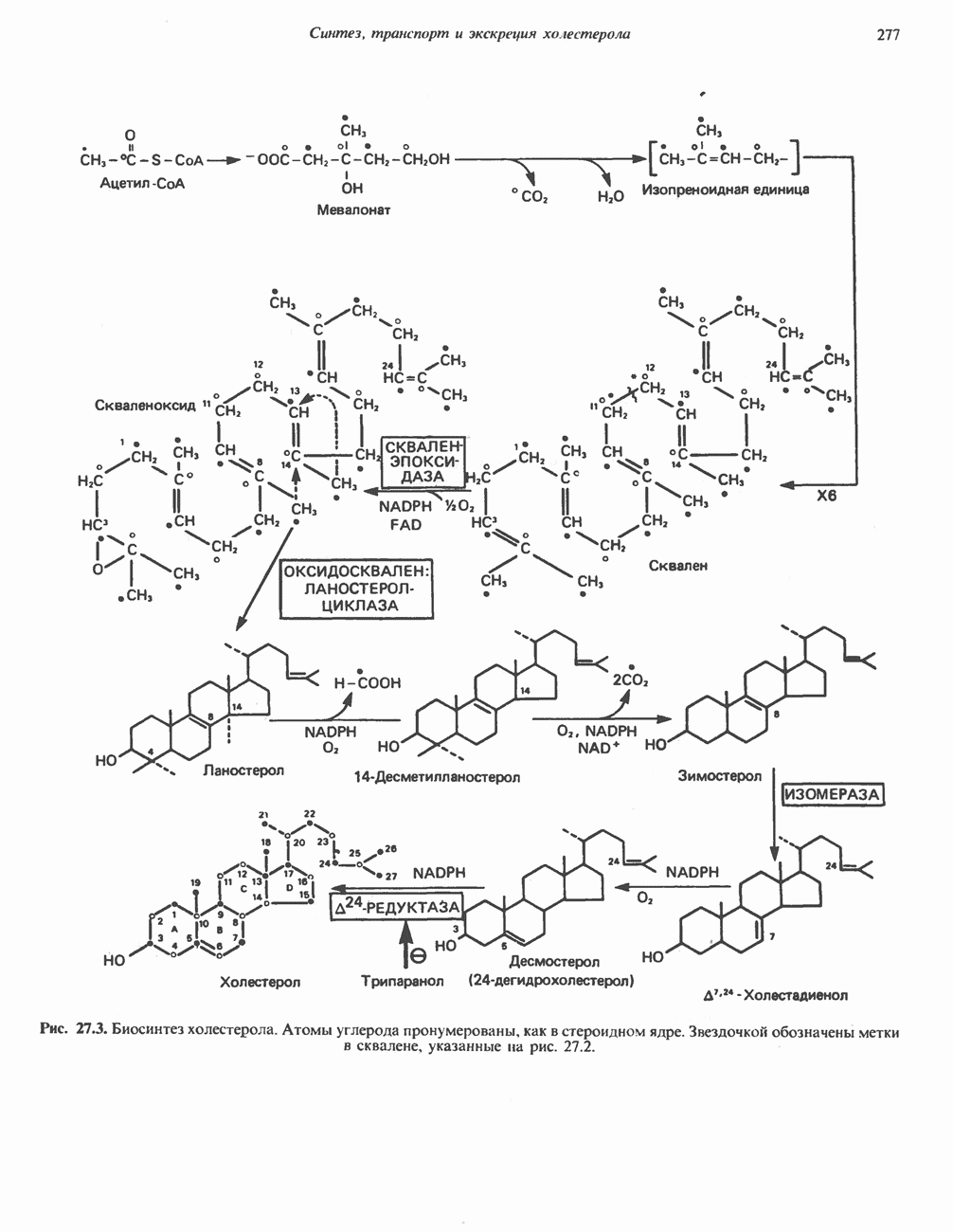
- БИОСИНТЕЗ ХОЛЕСТЕРОЛА
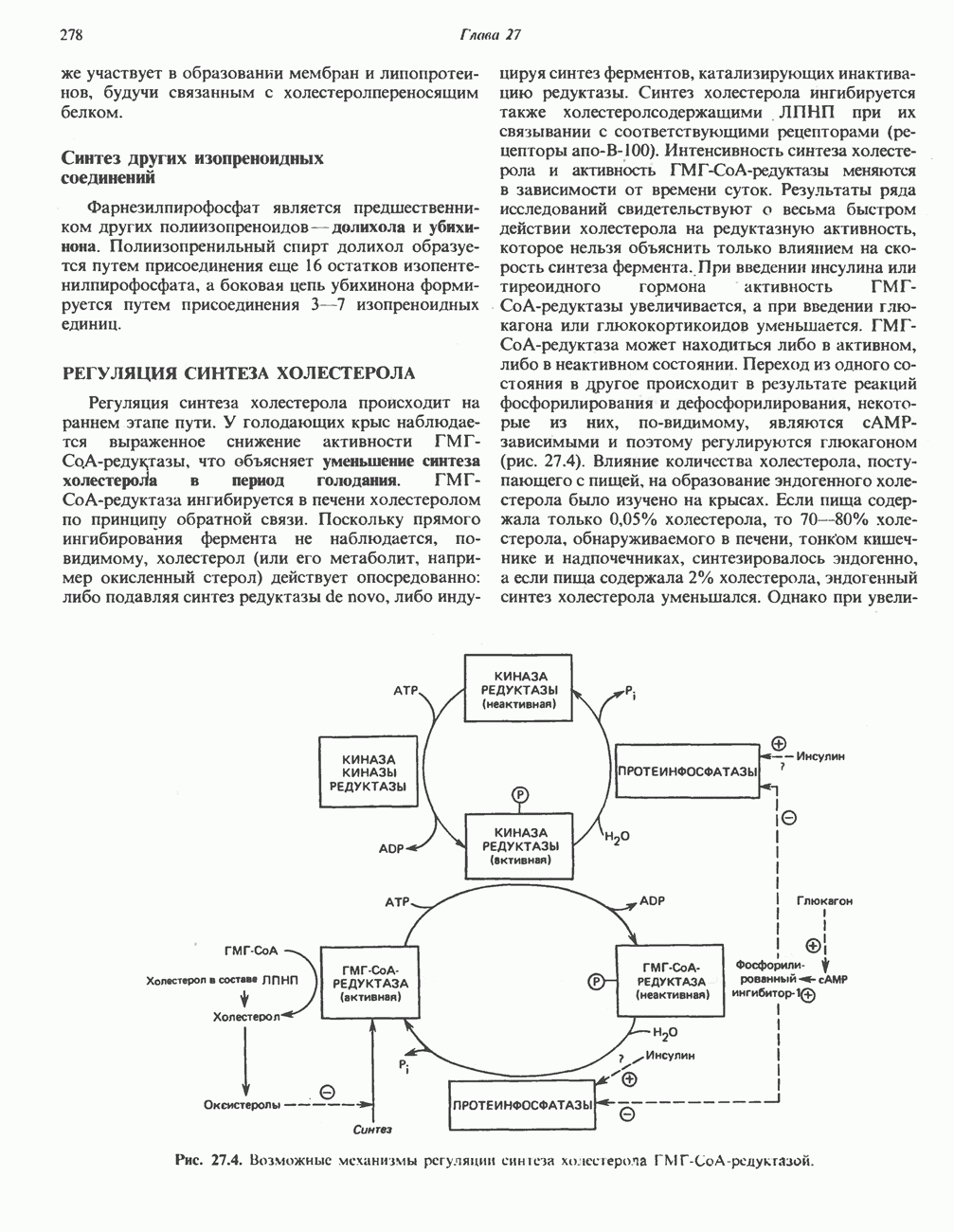
- РЕГУЛЯЦИЯ СИНТЕЗА ХОЛЕСТЕРОЛА
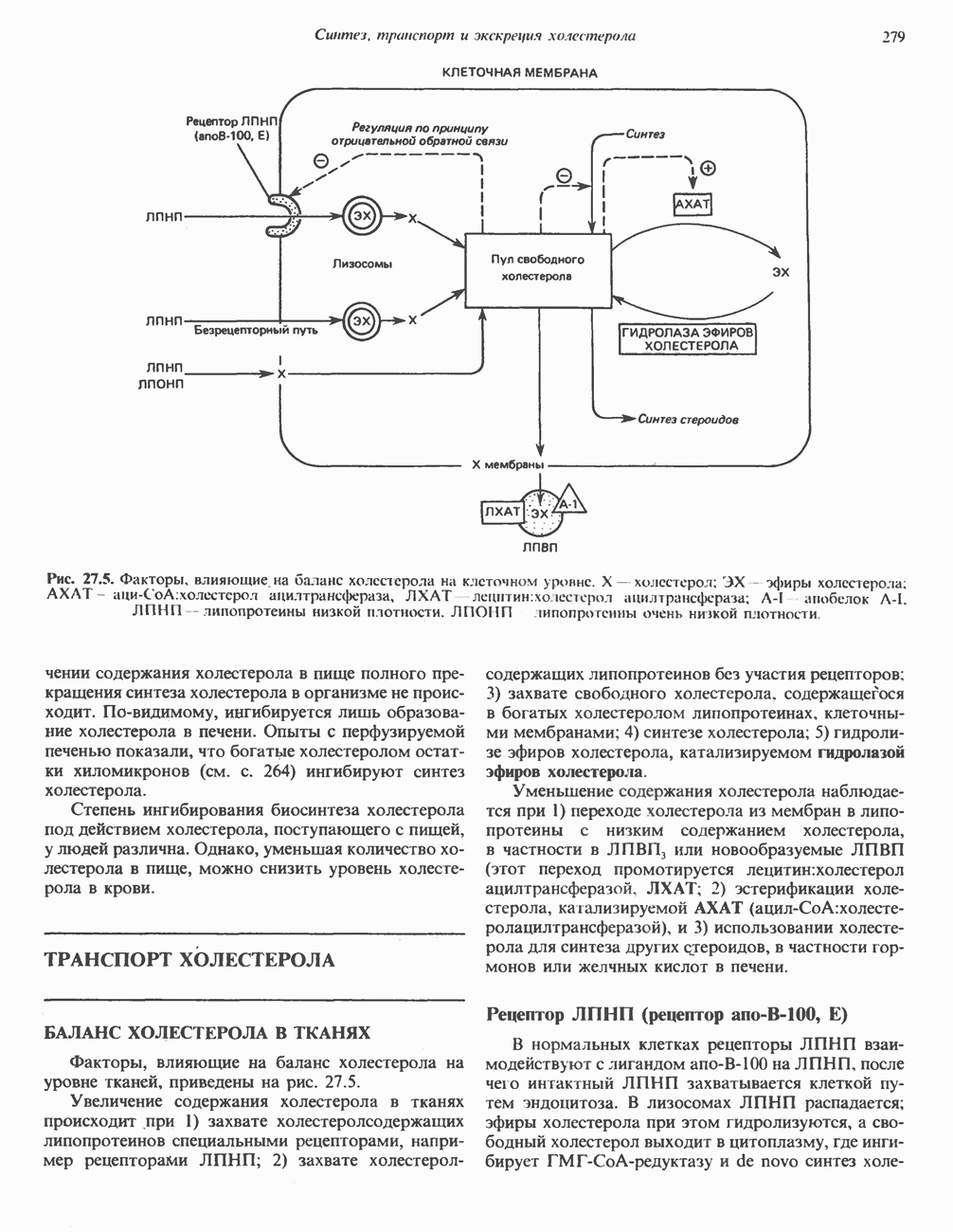
- ТРАНСПОРТ ХОЛЕСТЕРОЛА
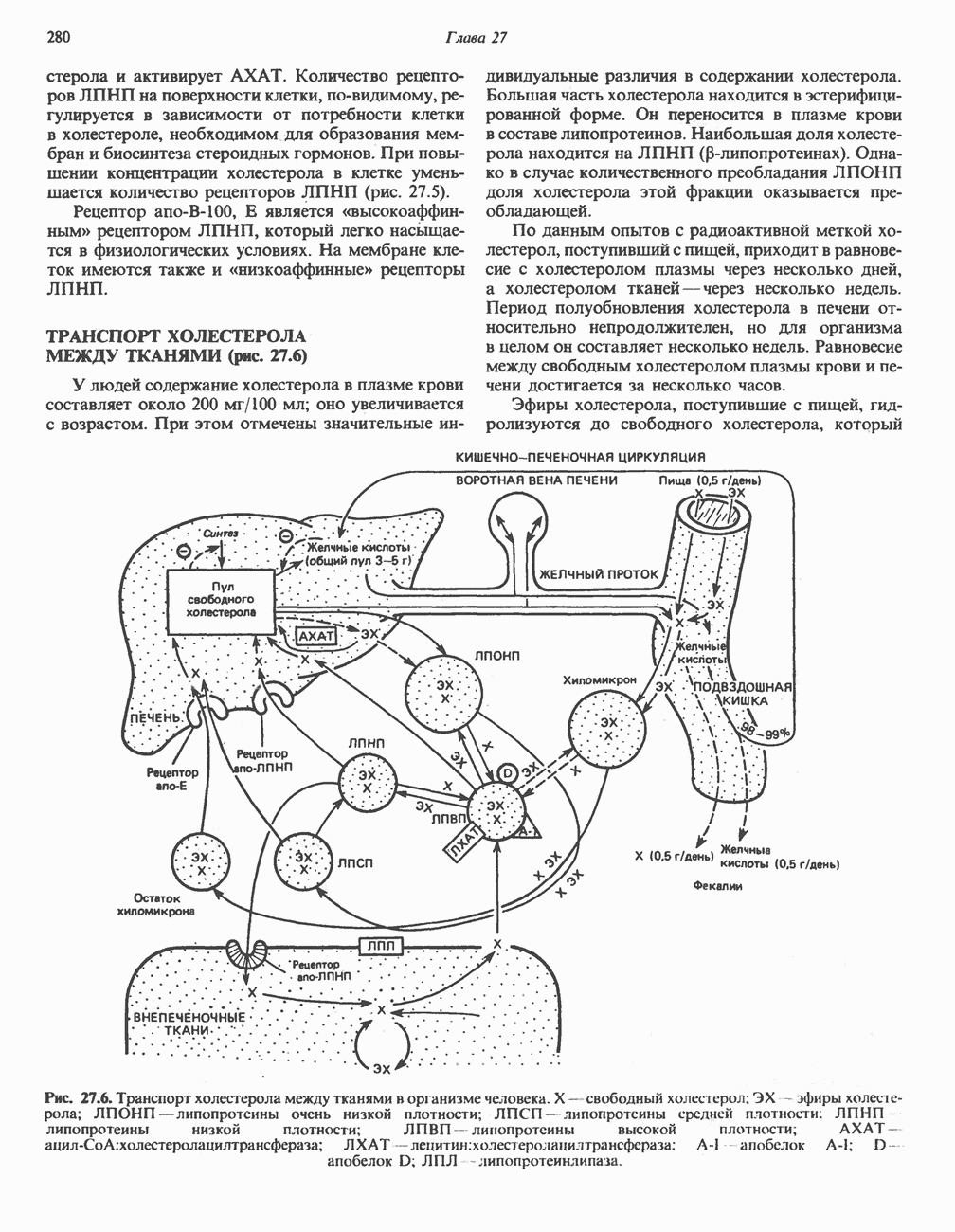
- ТРАНСПОРТ ХОЛЕСТЕРОЛА МЕЖДУ ТКАНЯМИ (рис. 27.6)
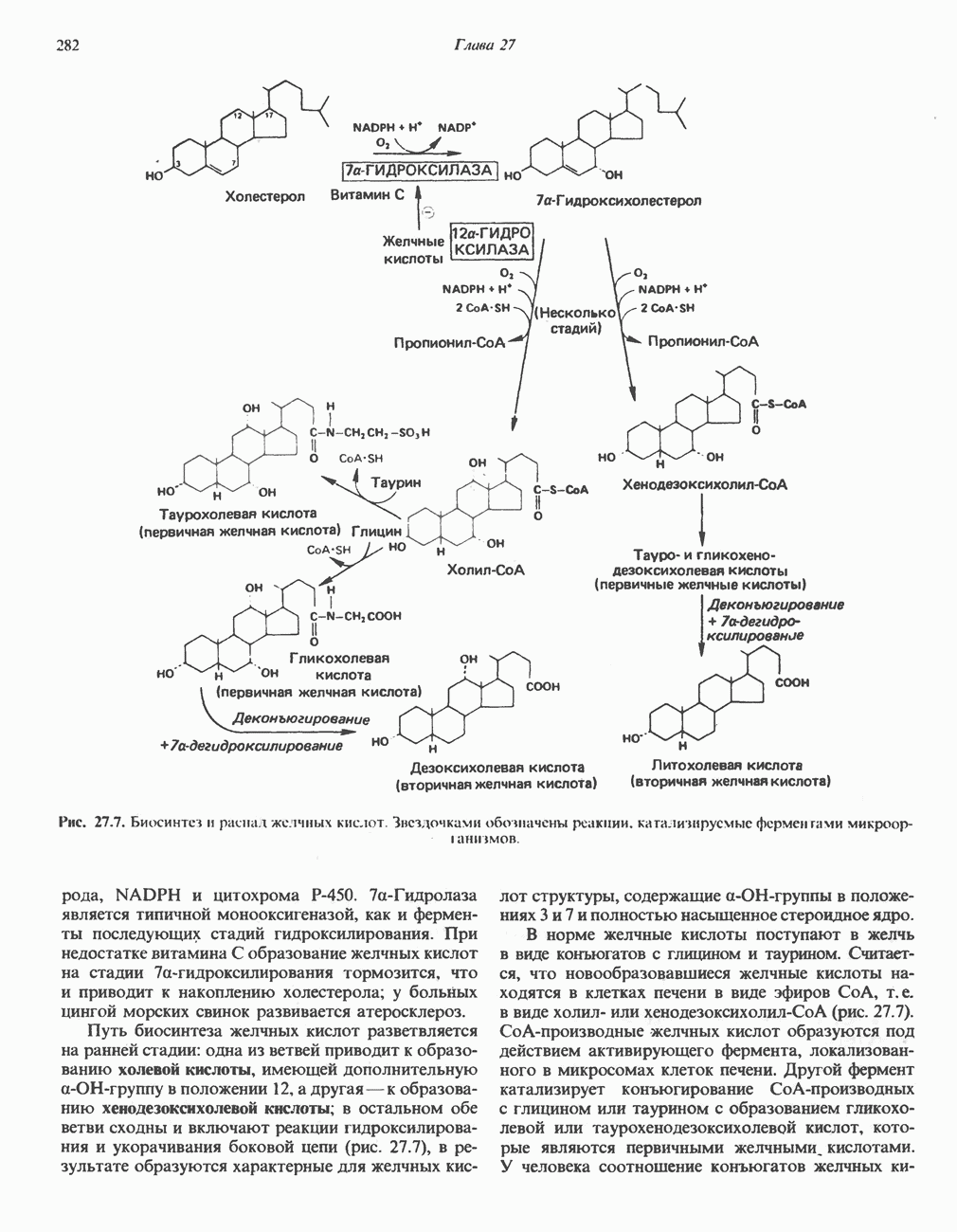
- ВЫВЕДЕНИЕ ХОЛЕСТЕРОЛА И ОБРАЗОВАНИЕ СОЛЕЙ ЖЕЛЧНЫХ КИСЛОТ
- КИШЕЧНО-ПЕЧЕНОЧНАЯ ЦИРКУЛЯЦИЯ ЖЕЛЧНЫХ КИСЛОТ
- КЛИНИЧЕСКИЕ АСПЕКТЫ
- Глава 28. Регуляция метаболизма липидов и источники энергии в тканях
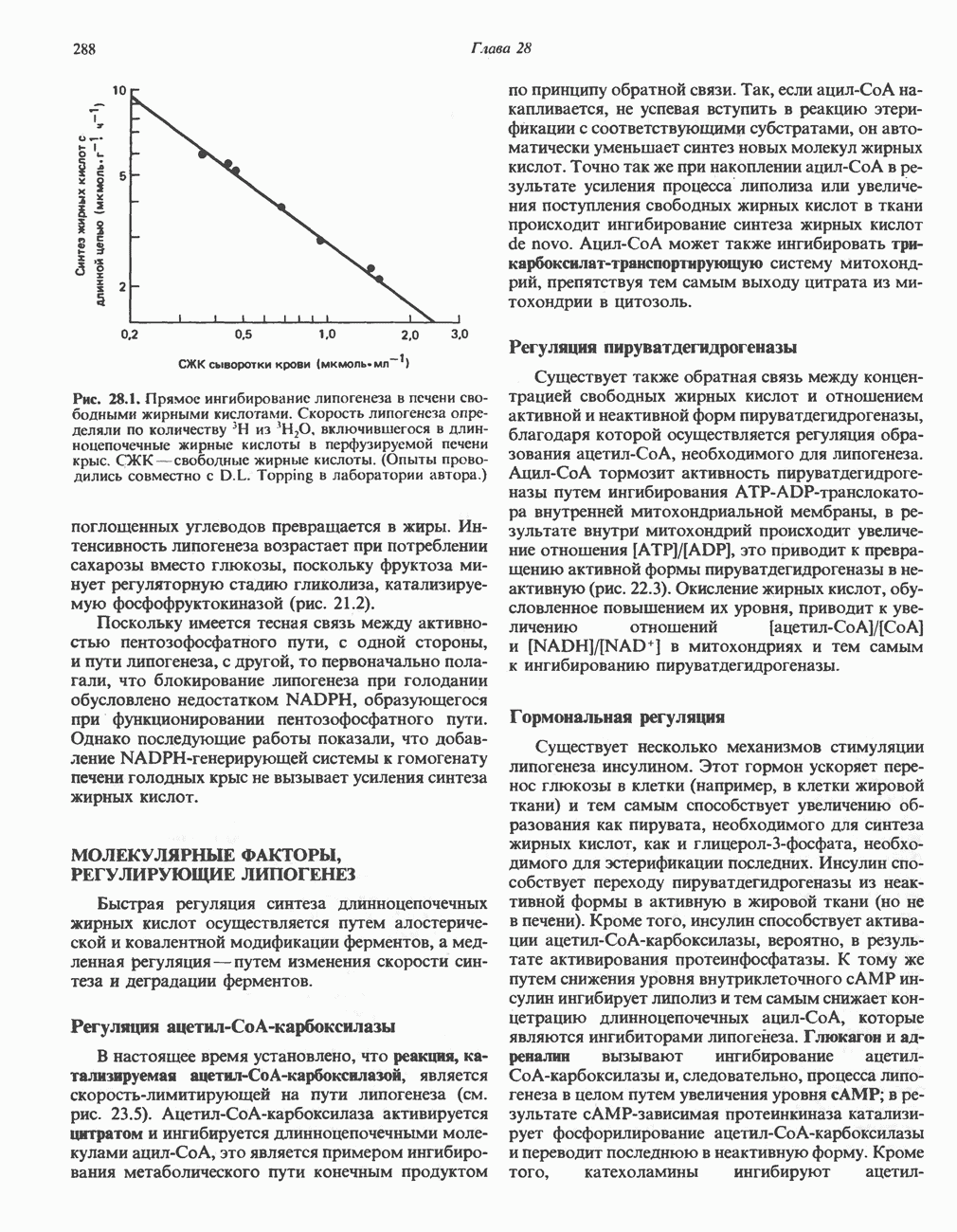
- РЕГУЛЯЦИЯ БИОСИНТЕЗА ЖИРНЫХ КИСЛОТ (ЛИПОГЕНЕЗА)
- МОЛЕКУЛЯРНЫЕ ФАКТОРЫ, РЕГУЛИРУЮЩИЕ ЛИПОГЕНЕЗ
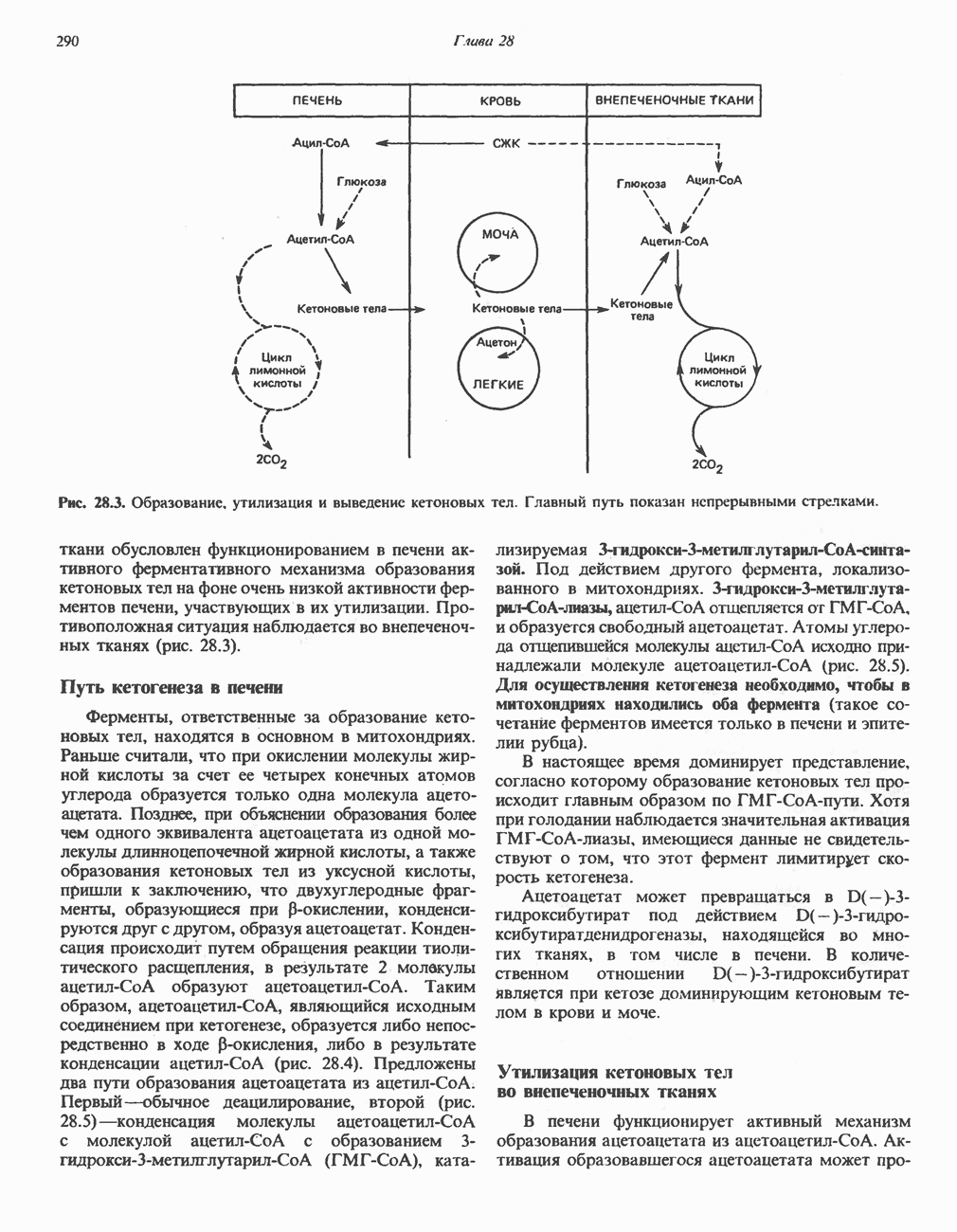
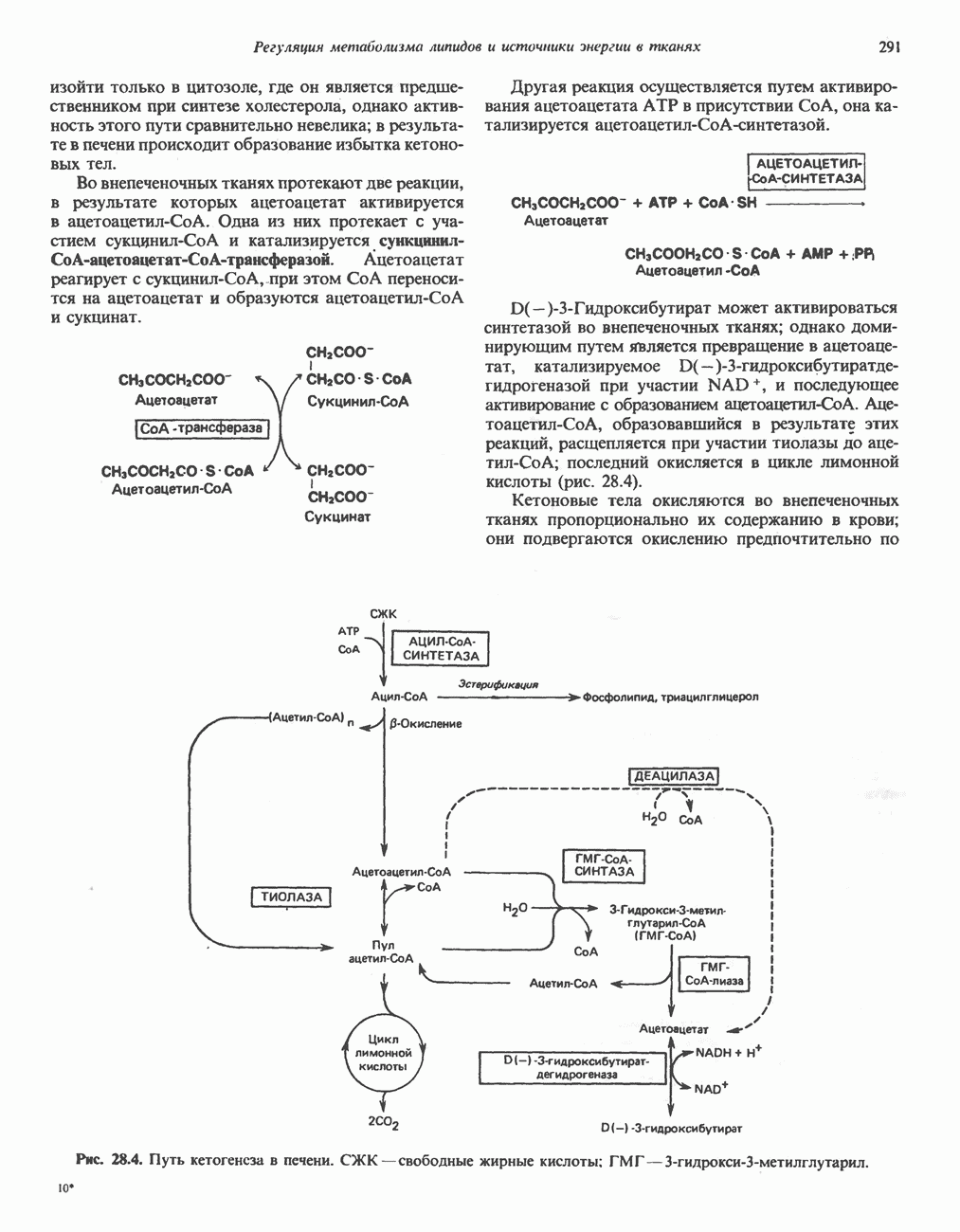
- РЕГУЛЯЦИЯ ОКИСЛЕНИЯ ЖИРНЫХ КИСЛОТ
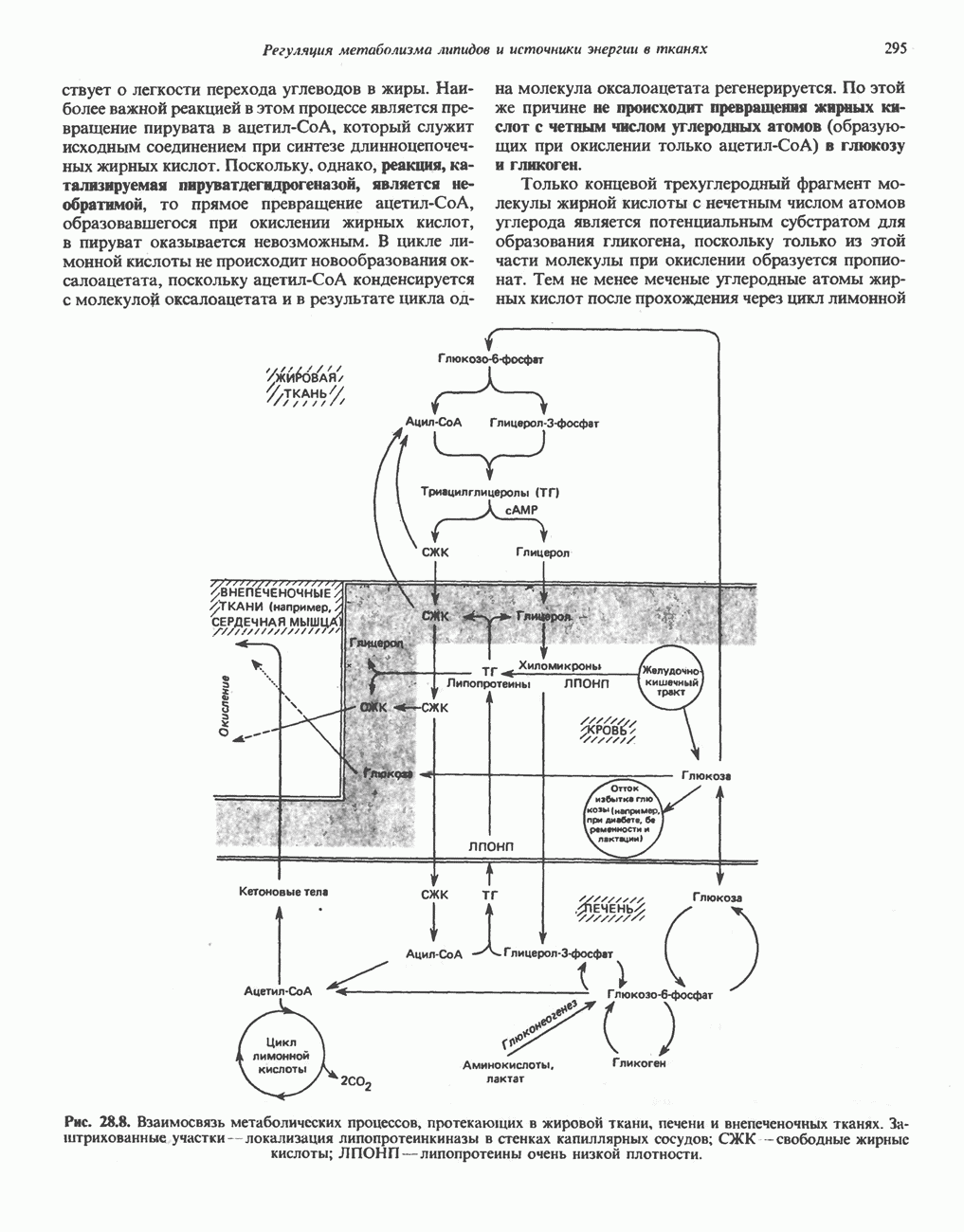
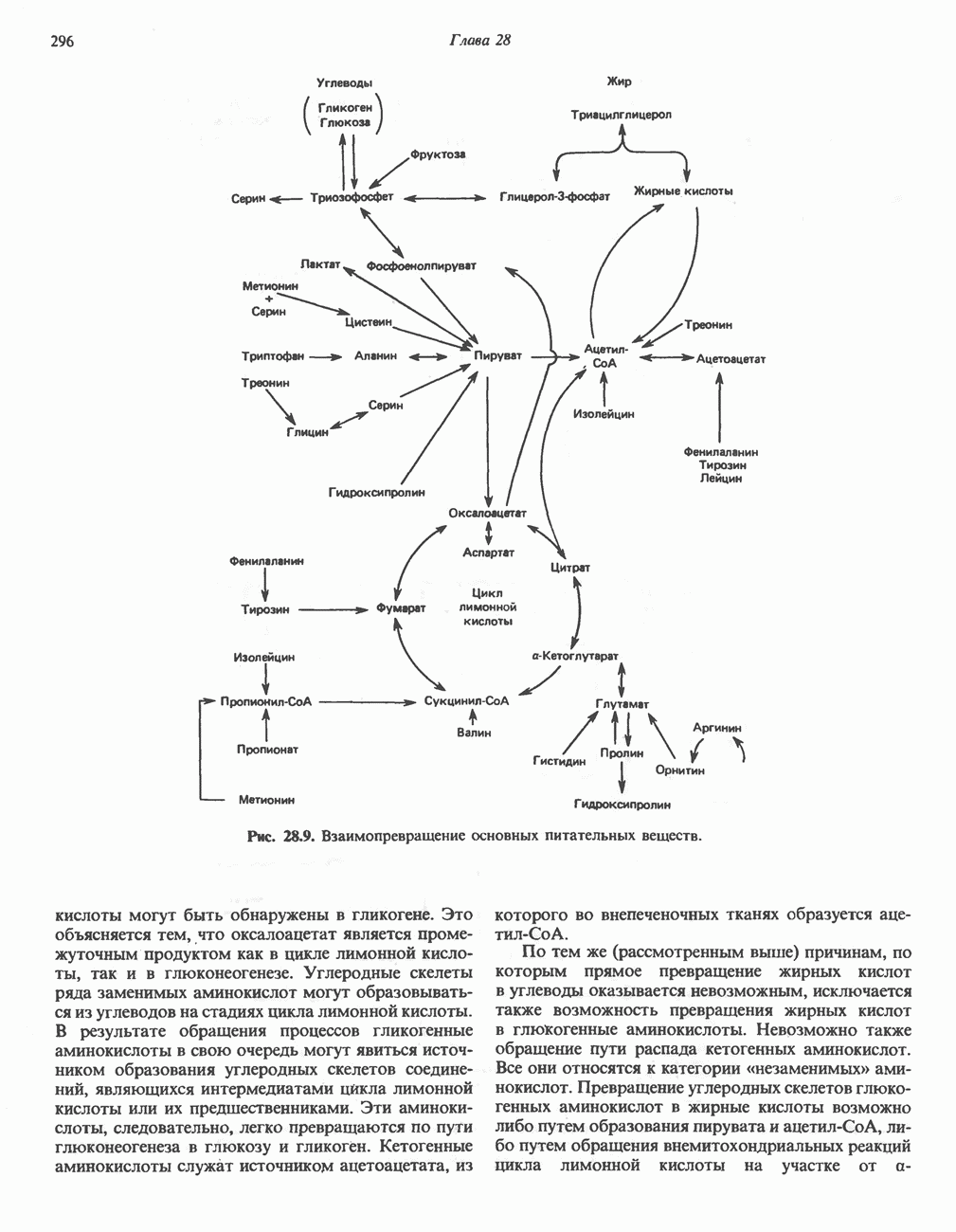
- ВЗАИМНОЕ ПРЕВРАЩЕНИЕ ОСНОВНЫХ ПИТАТЕЛЬНЫХ ВЕЩЕСТВ (рис. 28.9)
- ЭКОНОМИКА УГЛЕВОДНОГО И ЛИПИДНОГО ОБМЕНА В ОРГАНИЗМЕ
- ГОЛОДАНИЕ
- Раздел III. Метаболизм белков и аминокислот
- Глава 29. Биосинтез аминокислот
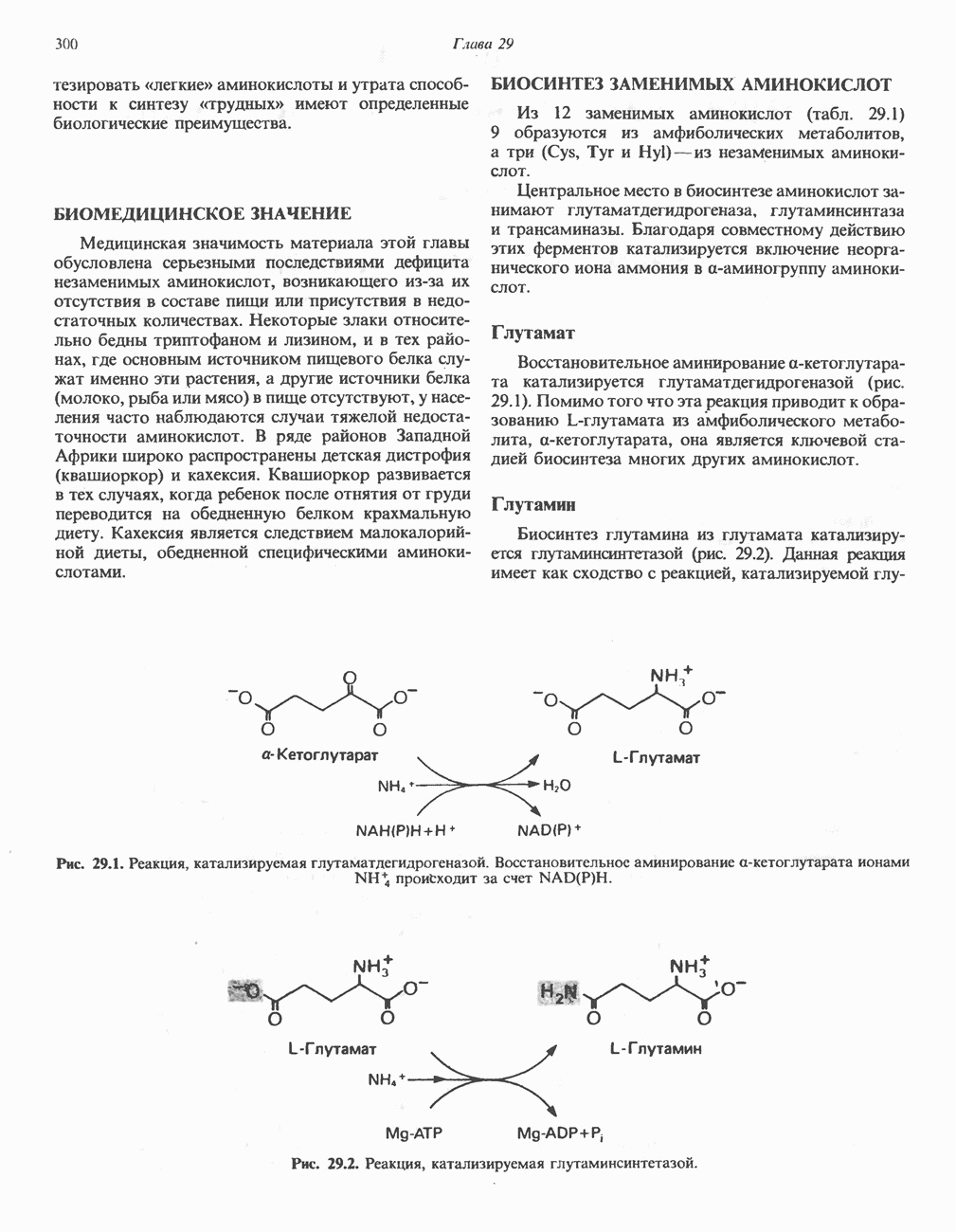
- БИОСИНТЕЗ ЗАМЕНИМЫХ АМИНОКИСЛОТ
- БИОСИНТЕЗ НЕЗАМЕНИМЫХ АМИНОКИСЛОТ
- Глава 30. Катаболизм азота аминокислот
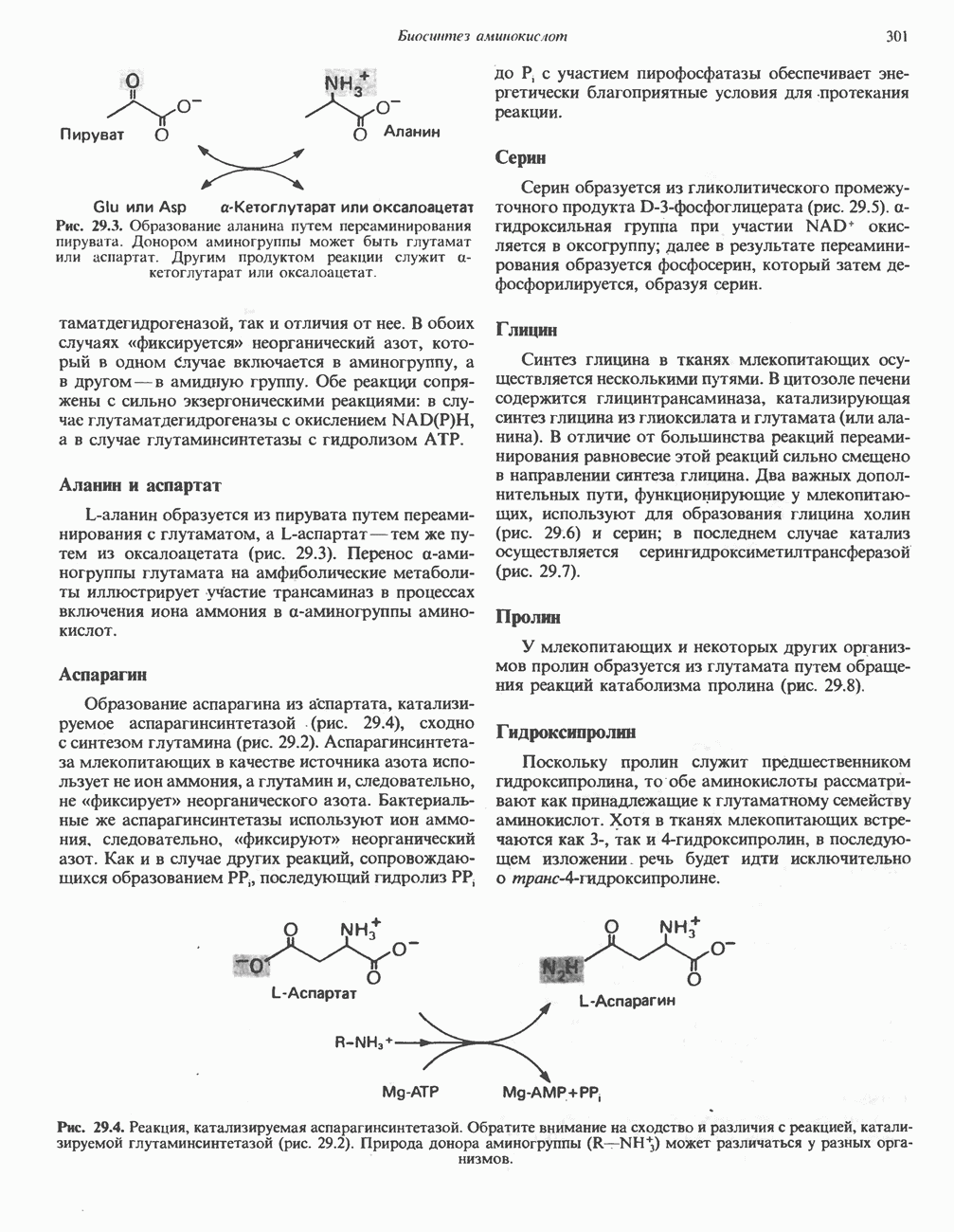
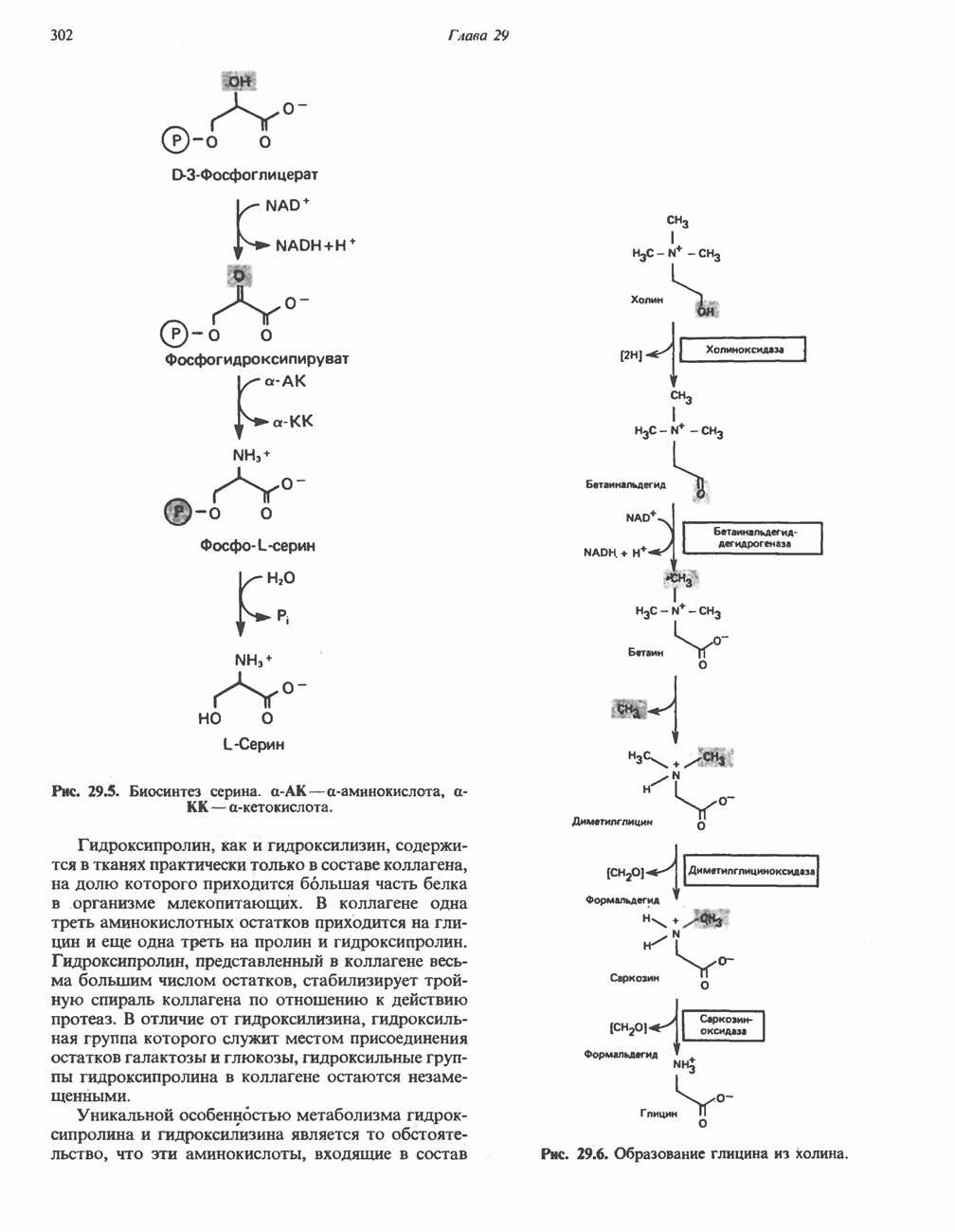
- ПЕРЕАМИНИРОВАНИЕ
- ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ
- ОБРАЗОВАНИЕ АММИАКА
- ТРАНСПОРТ АММИАКА
- ОБМЕН АМИНОКИСЛОТАМИ МЕЖДУ ОРГАНАМИ В ПОСТАБСОРБТИВНОМ СОСТОЯНИИ
- ОБМЕН АМИНОКИСЛОТ МЕЖДУ ОРГАНАМИ ПОСЛЕ ПРИЕМА ПИЩИ
- БИОСИНТЕЗ МОЧЕВИНЫ
- РЕГУЛЯЦИЯ СИНТЕЗА МОЧЕВИНЫ
- МЕТАБОЛИЧЕСКИЕ НАРУШЕНИЯ ЦИКЛА МОЧЕВИНЫ
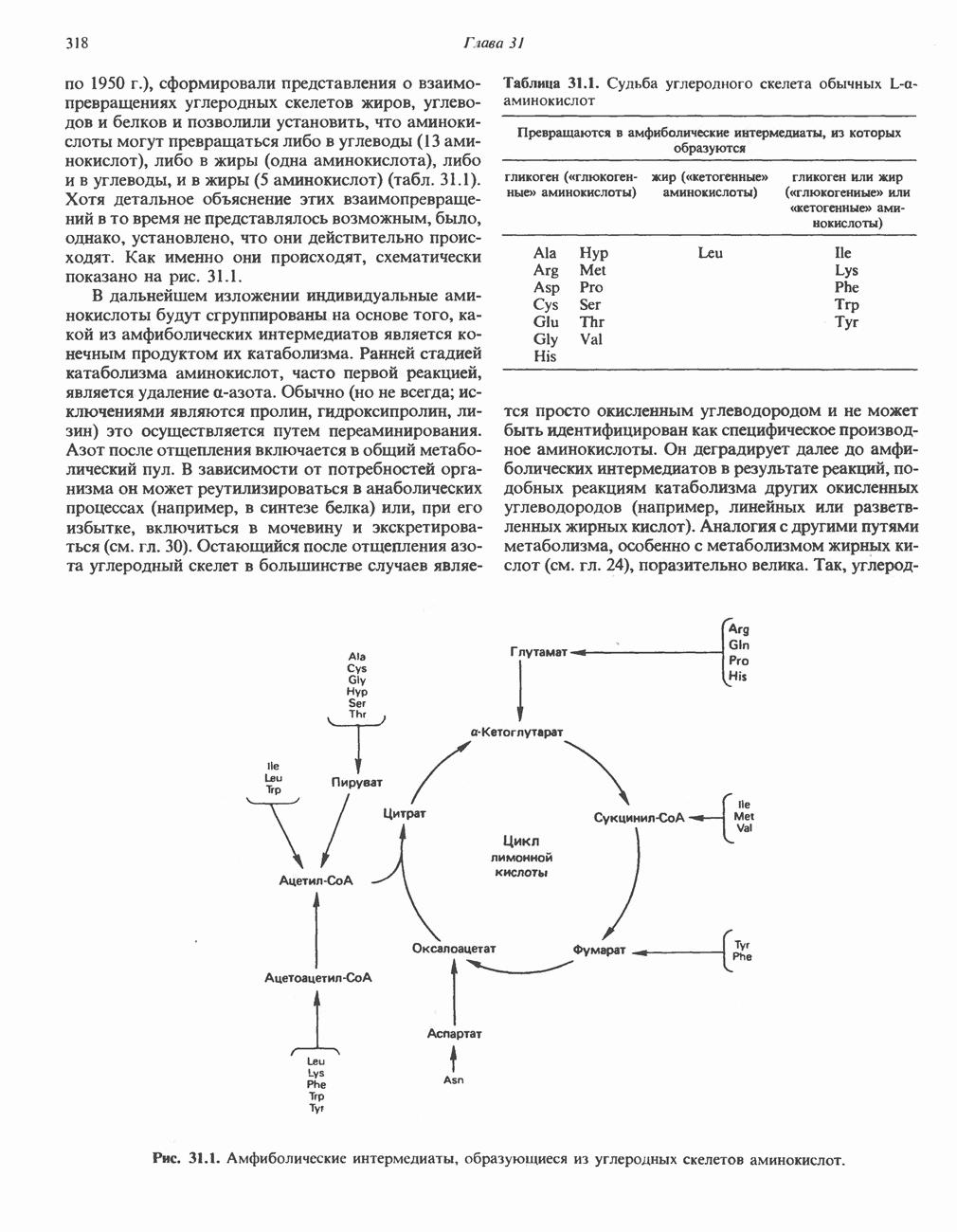
- Глава 31. Катаболизм углеродного скелета аминокислот
- ПРЕВРАЩЕНИЕ УГЛЕРОДНОГО СКЕЛЕТА ОБЫЧНЫХ L-a-АМИНОКИСЛОТ В АМФИБОЛИЧЕСКИЕ ИНТЕРМЕДИАТЫ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ОКСАЛОАЦЕТАТ
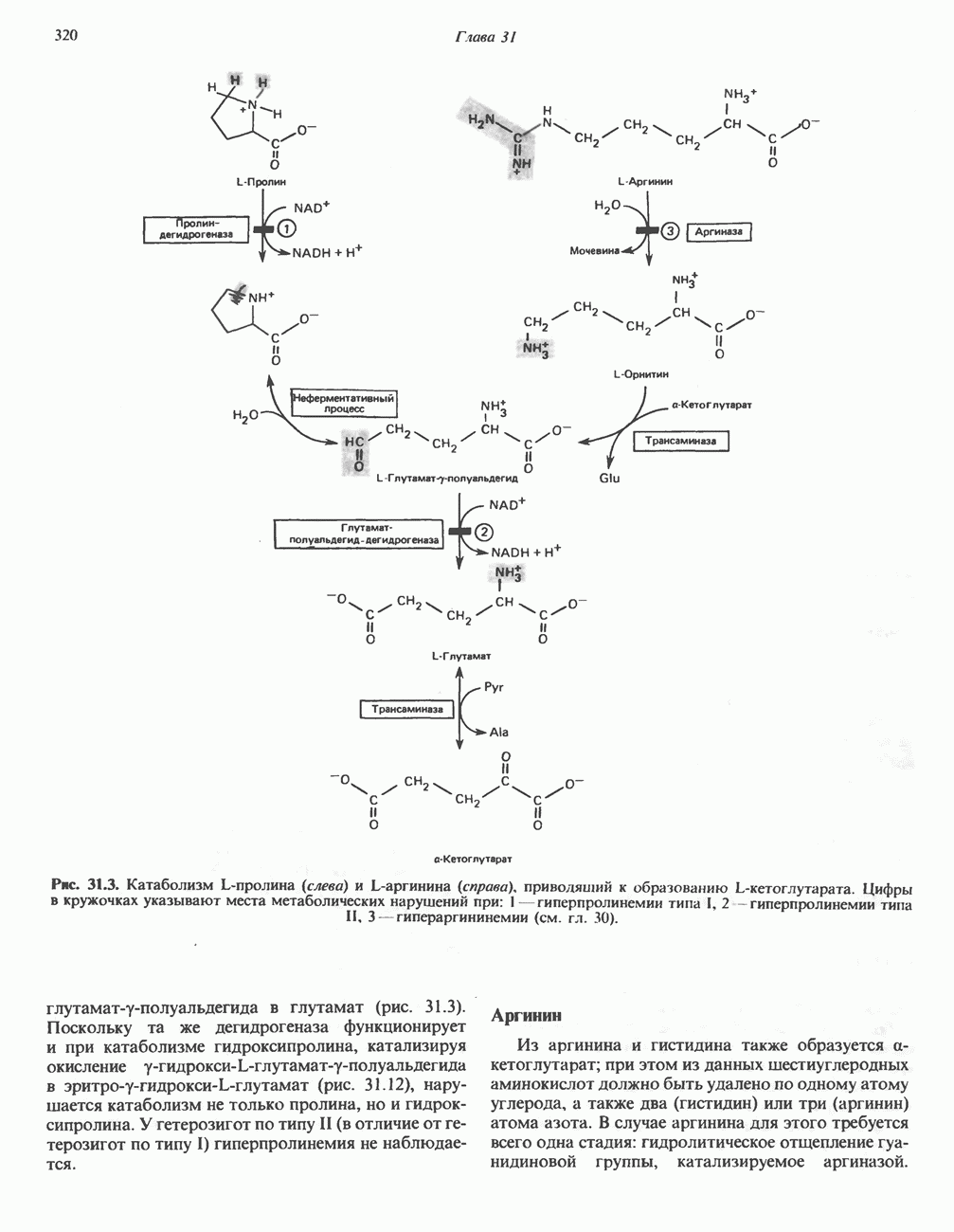
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ а-КЕТОГЛУТАРАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ ПИРУВАТ
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ АЦЕТИЛ-КОФЕРМЕНТ А
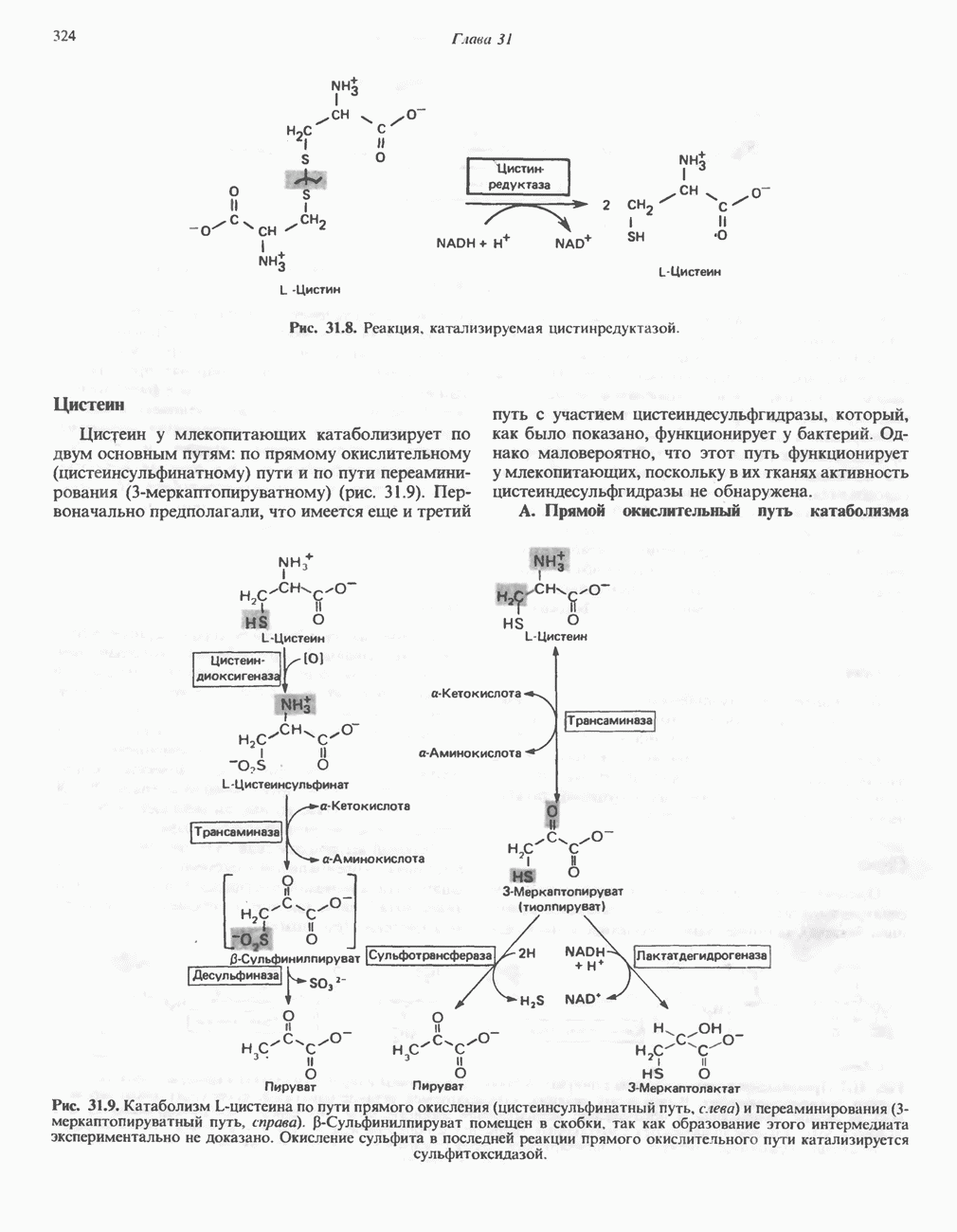
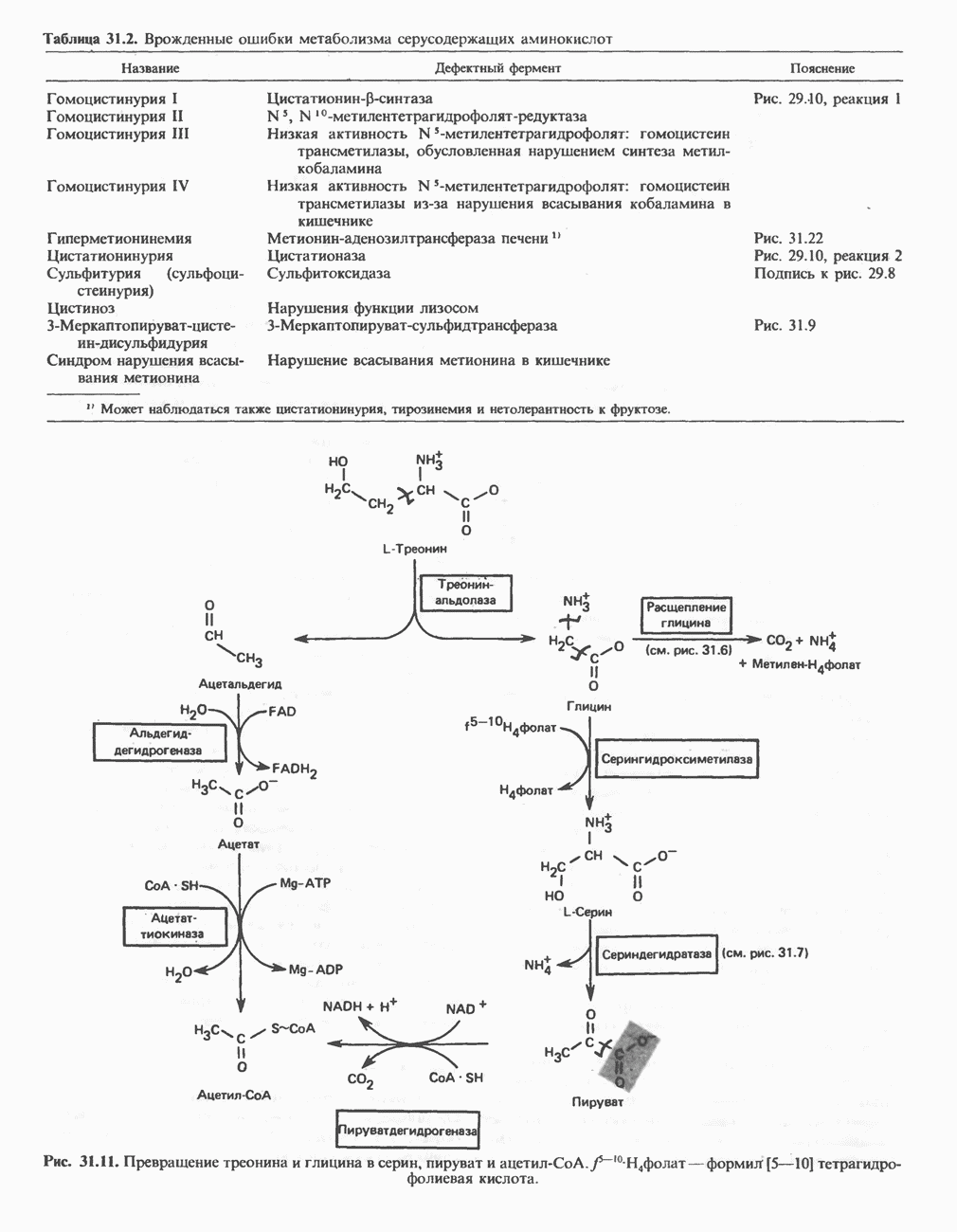
- АМИНОКИСЛОТЫ, ОБРАЗУЮЩИЕ СУКЦИНИЛ-КОФЕРМЕНТ А
- Глава 32. Превращение аминокислот в специализированные продукты
- ГЛИЦИН
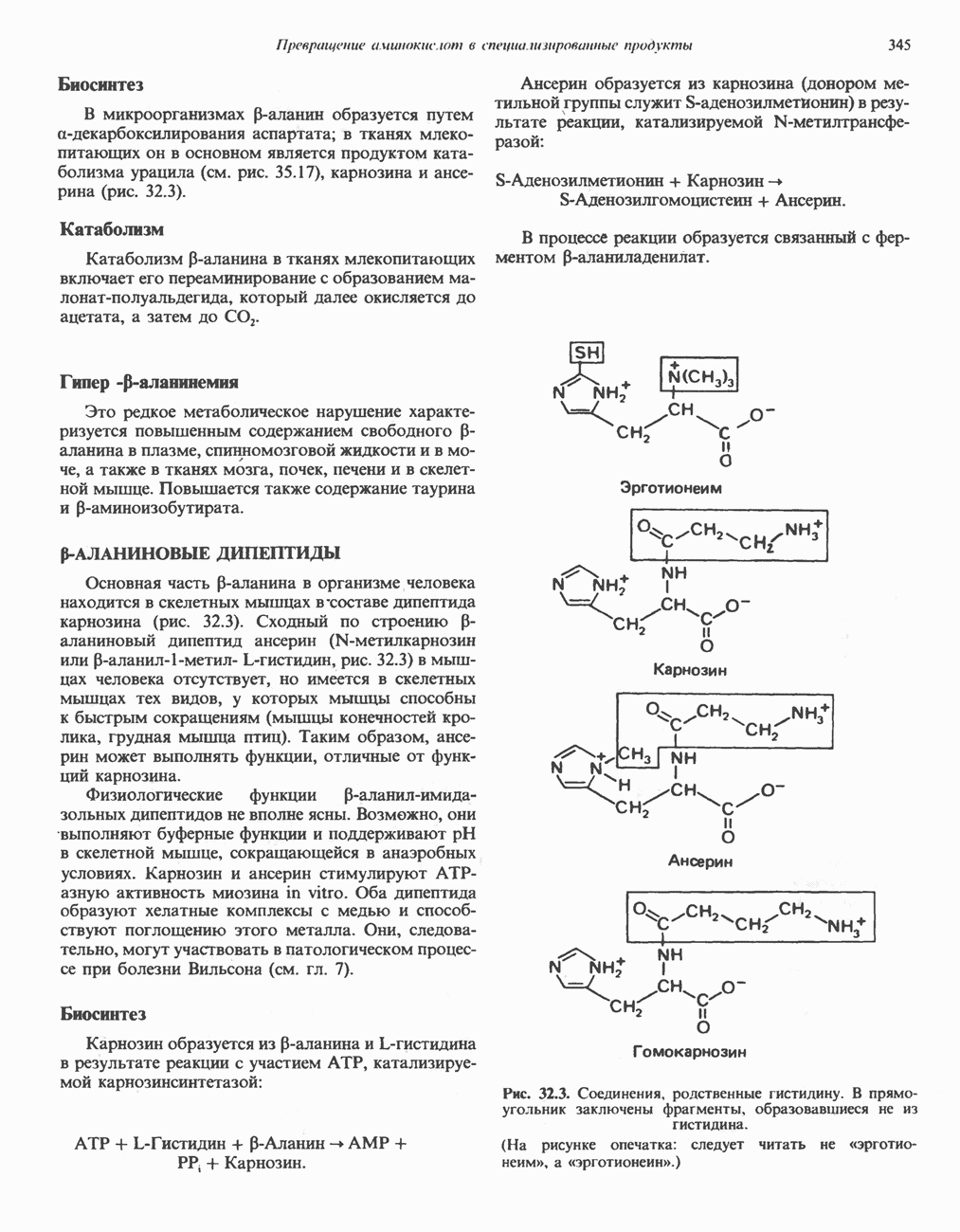
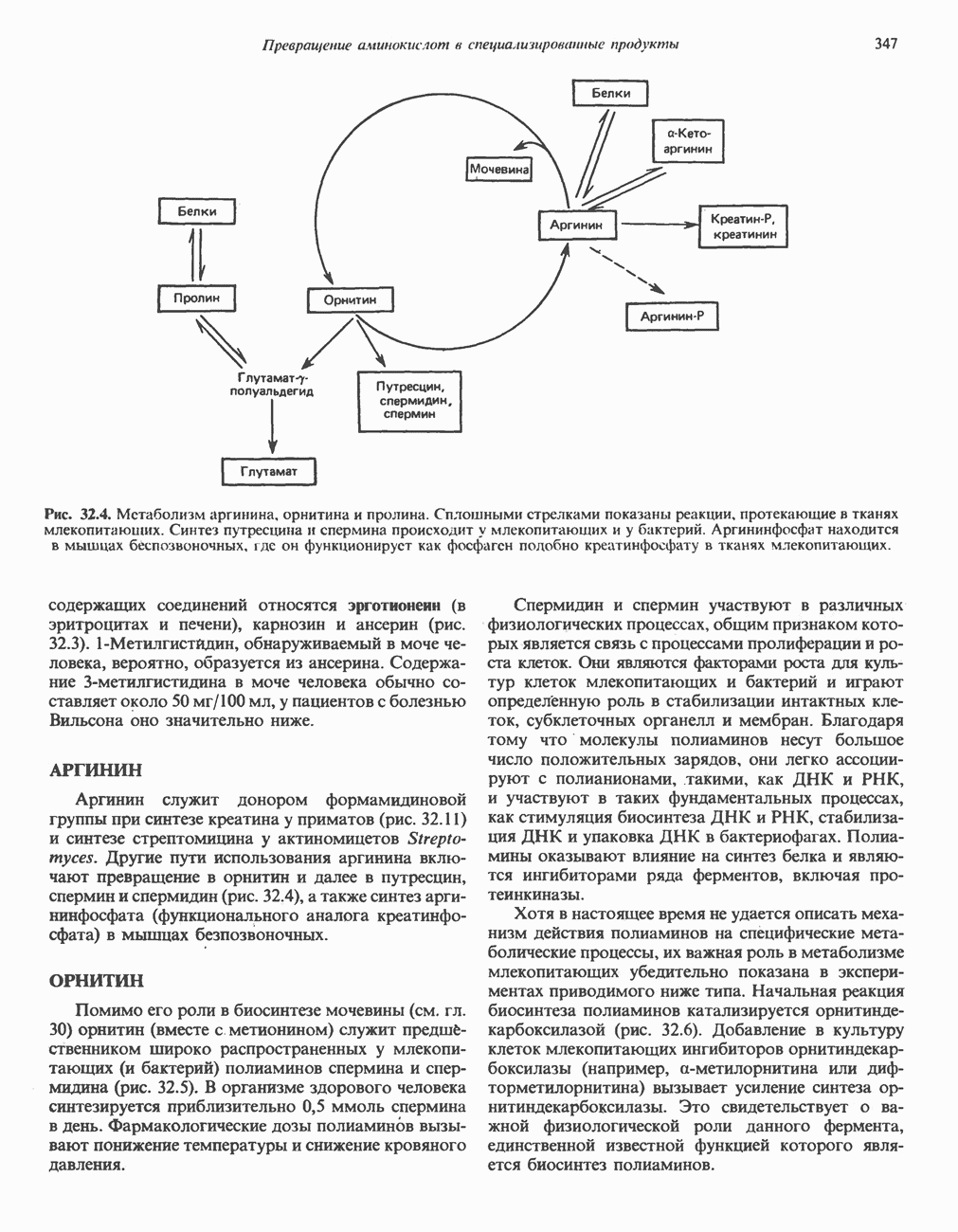
- р-АЛАНИНОВЫЕ ДИПЕПТИДЫ
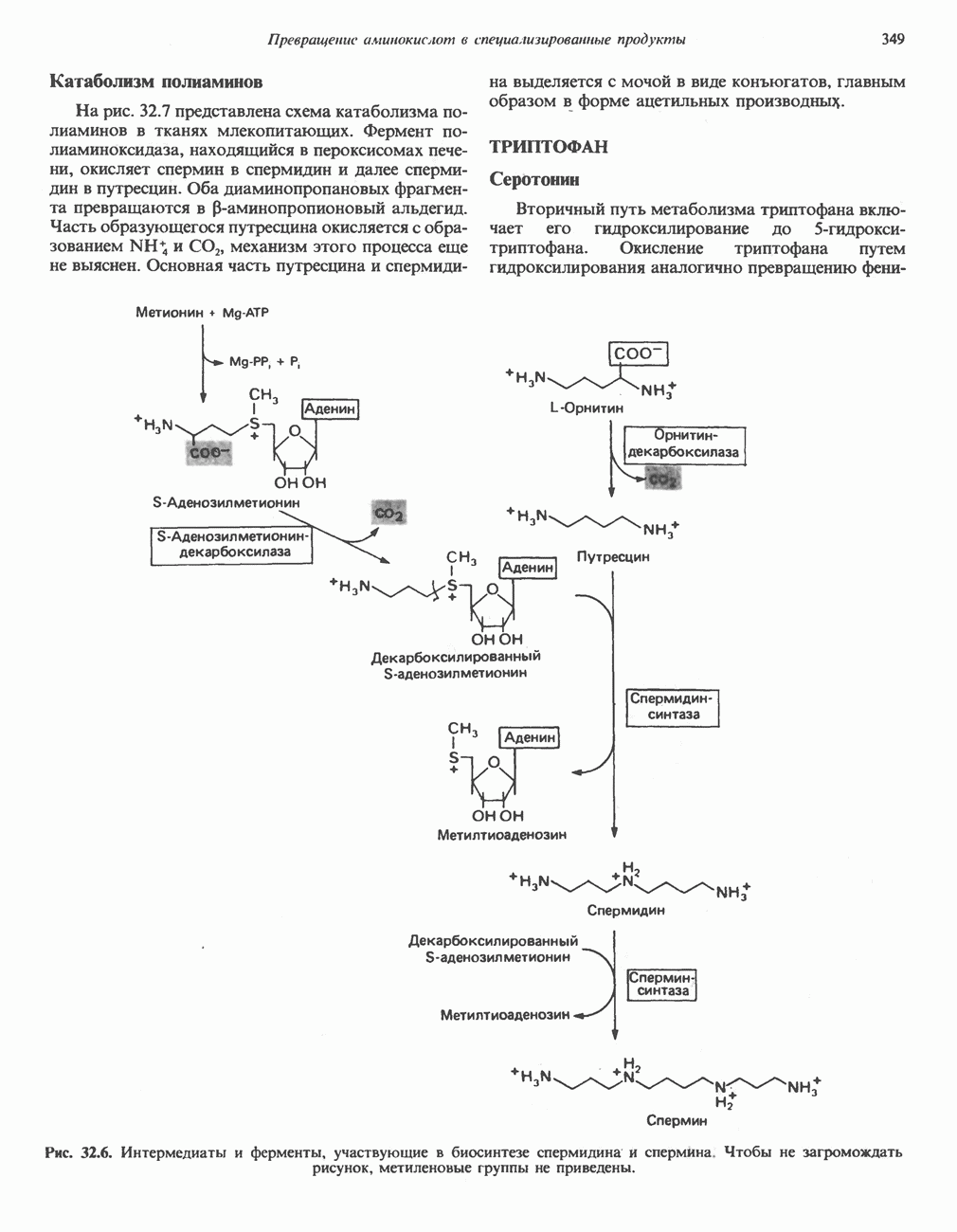
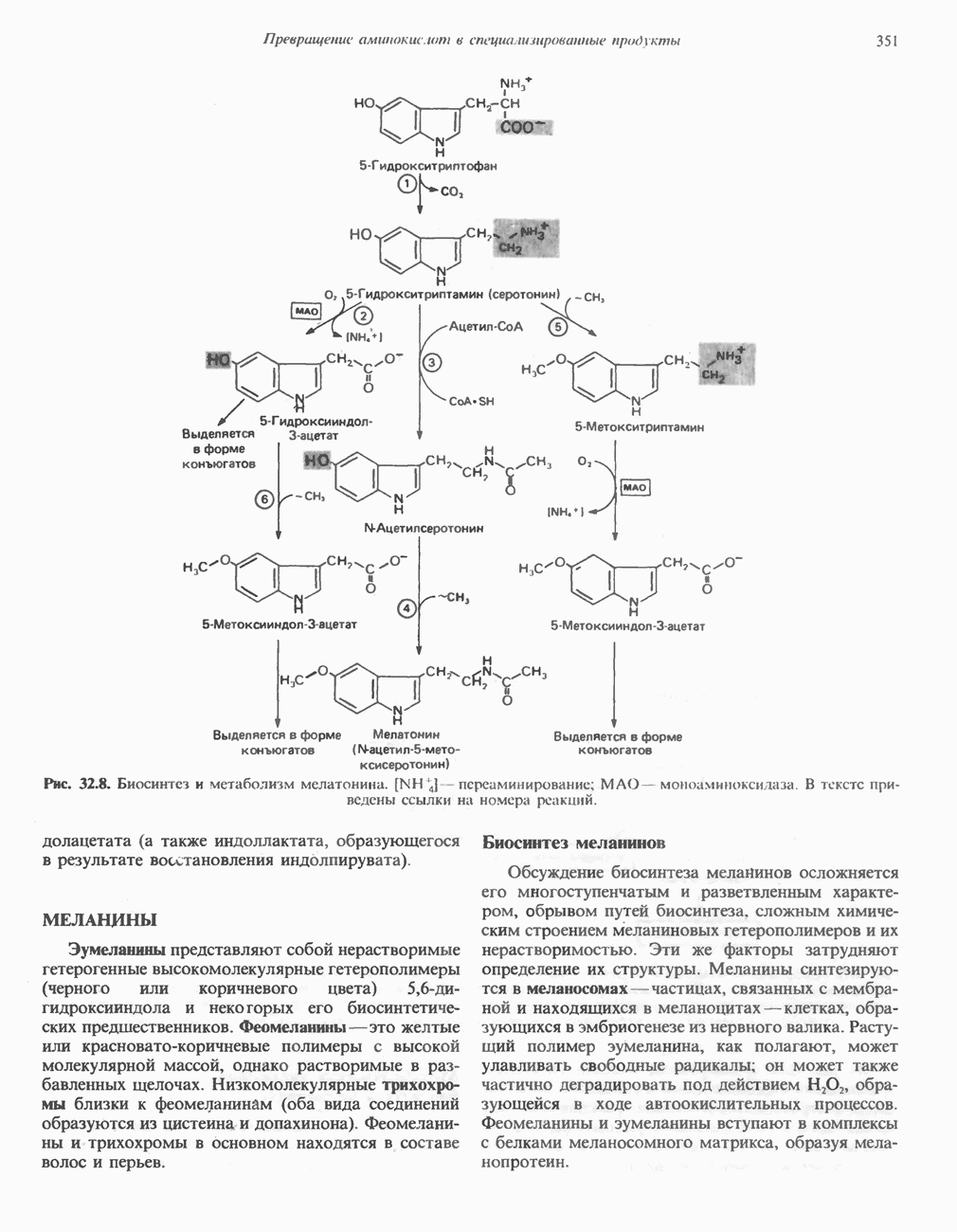
- ТРИПТОФАН
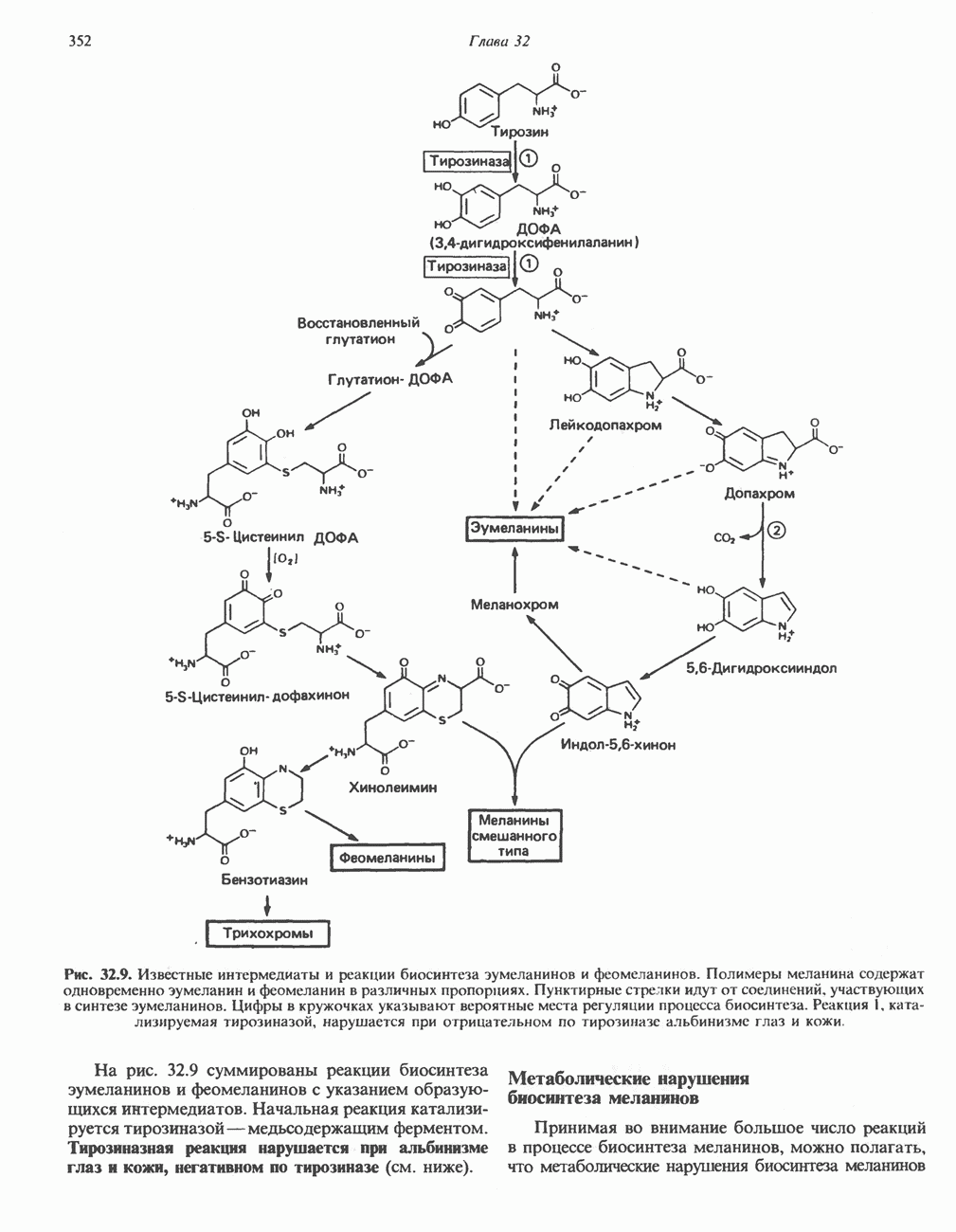
- МЕЛАНИНЫ
- ТИРОЗИН
- КРЕАТИН И КРЕАТИНИН
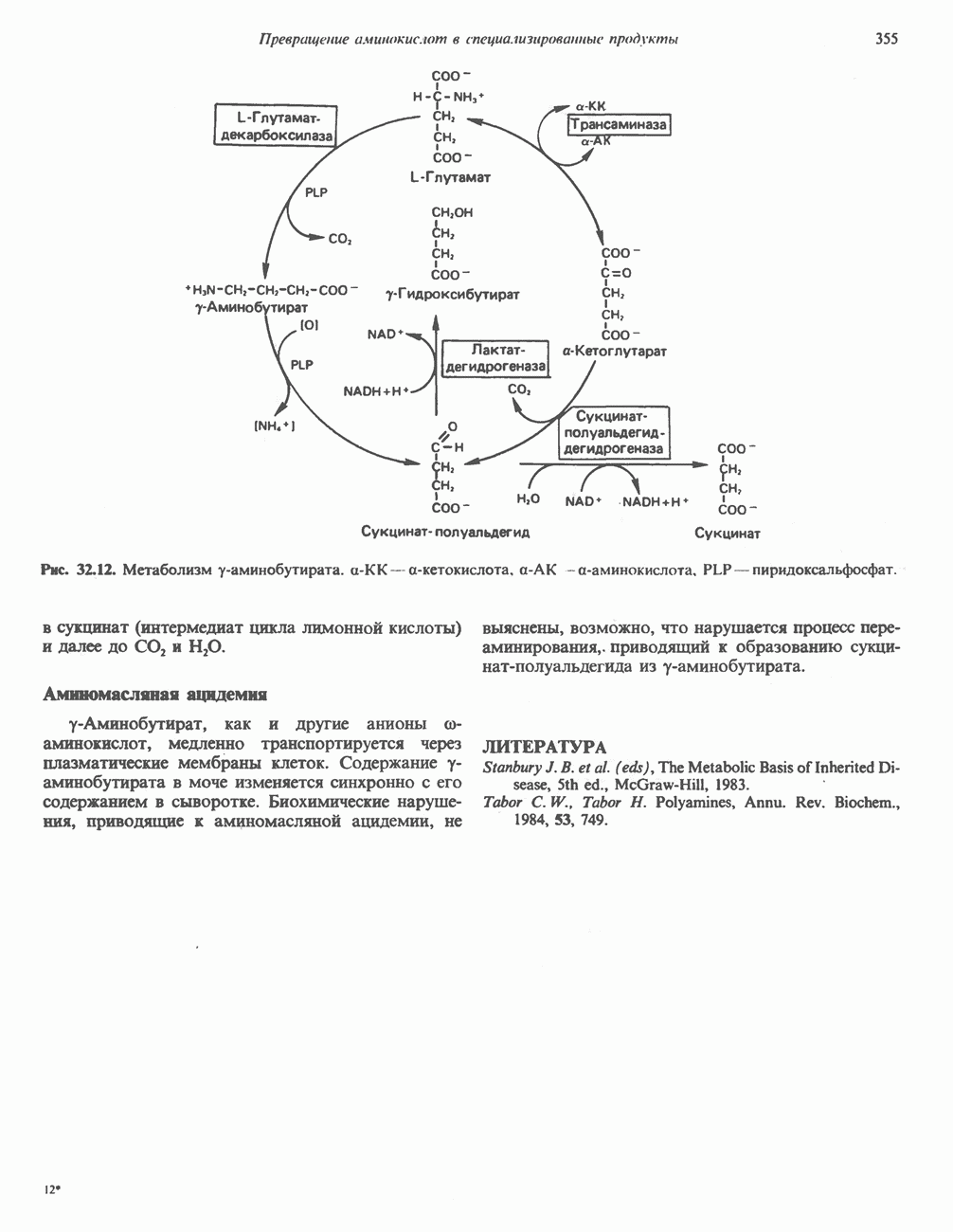
- у-АМИНОБУТИРАТ
- Глава 33. Порфирины и желчные пигменты
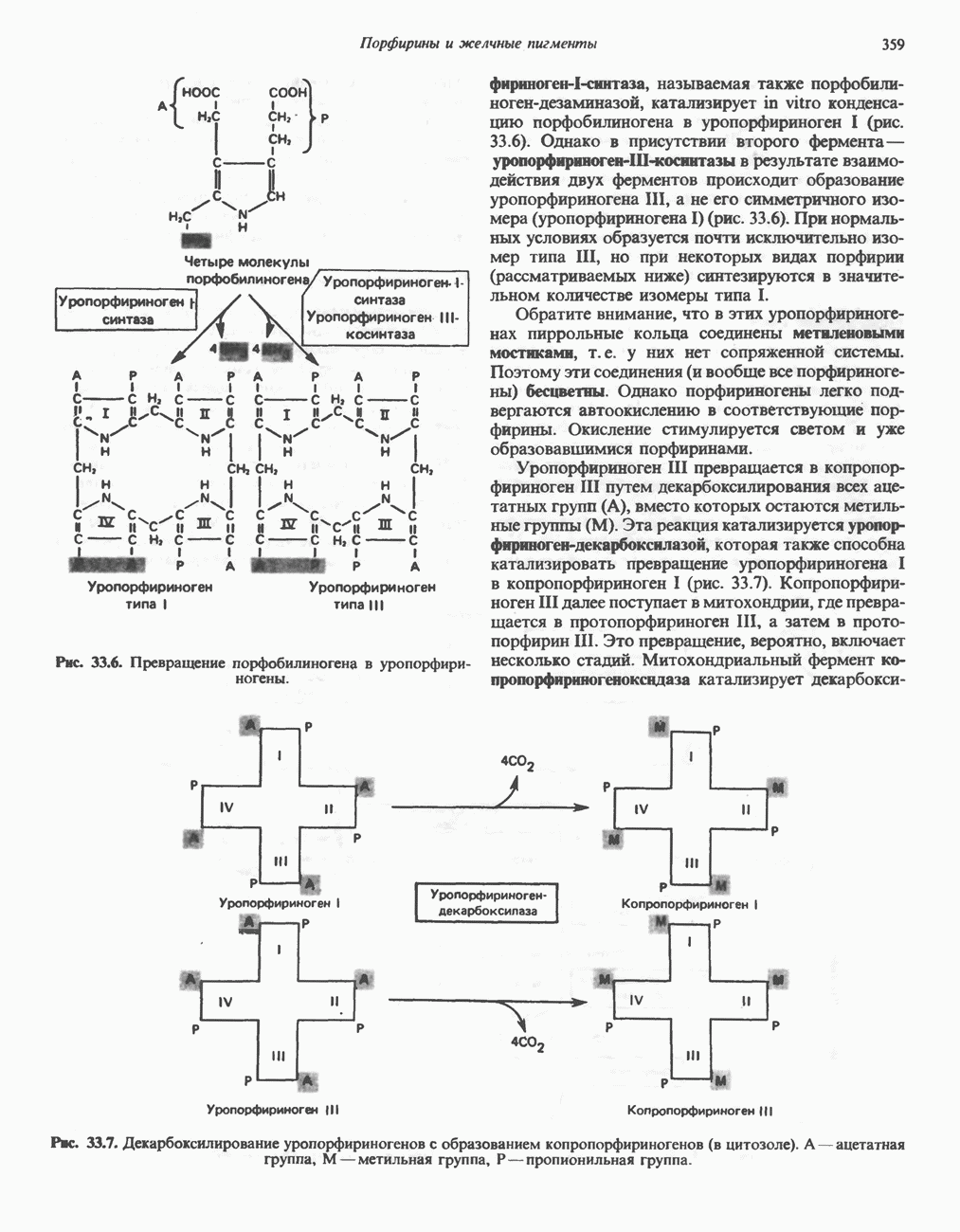
- ПОРФИРИНЫ
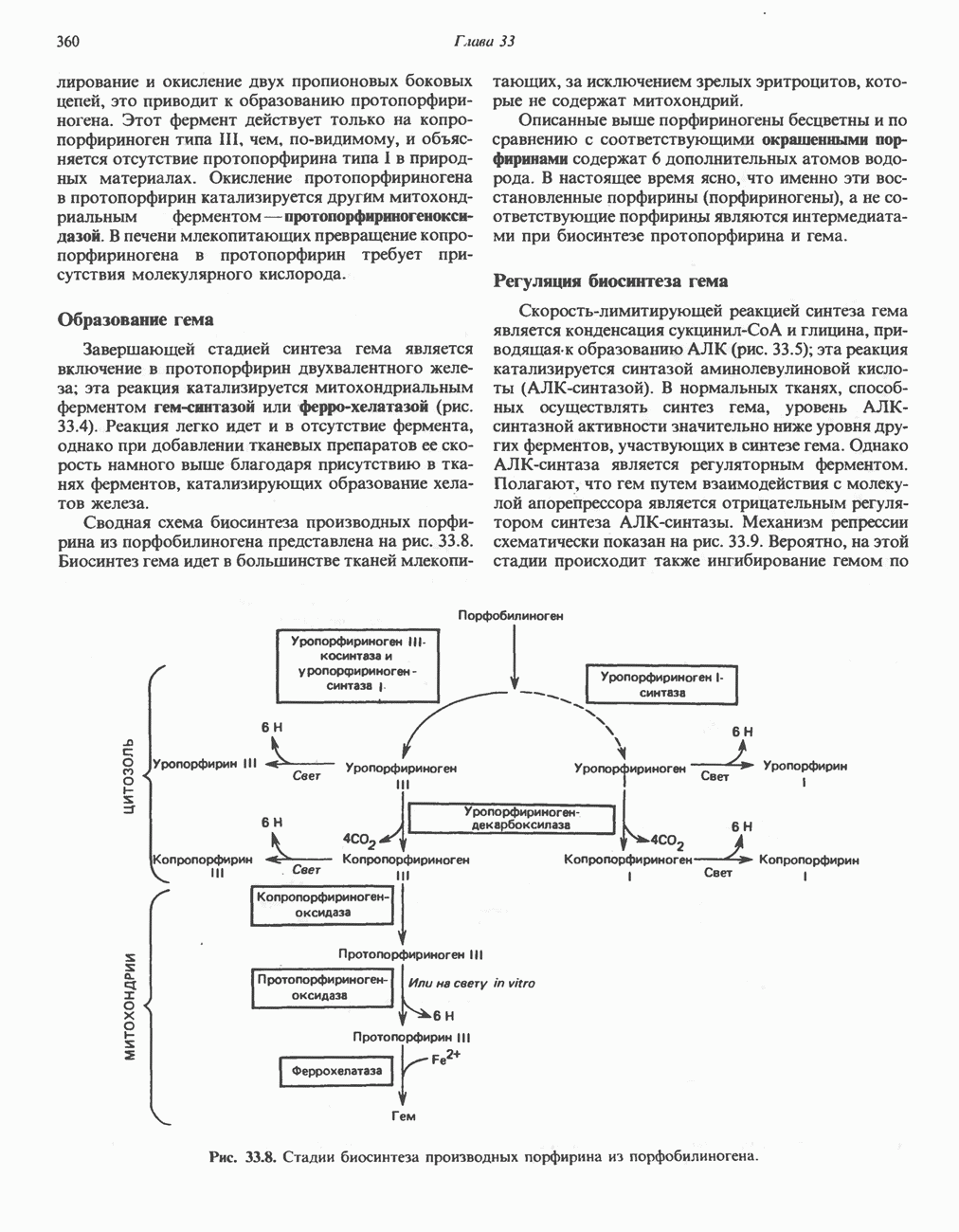
- ПОРФИРИН
- КАТАБОЛИЗМ ГЕМА: ОБРАЗОВАНИЕ ЖЕЛЧНЫХ ПИГМЕНТОВ
- МЕТАБОЛИЗМ БИЛИРУБИНА В КИШЕЧНИКЕ
- ГИПЕРБИЛИРУБИНЕМИЯ
- Список сокращений