| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
Сорбционные процессы.
Процесс поглощения одного вещества поверхностью или объемом другого называется сорбцией (от лат.  — поглощаю). Вещество, частицы которого поглощаются (газ, жидкость или растворенный компонент), называют сорбатом, а поглотитель (чаще всего твердое тело) — сорбентом. Так, при 288 К и нормальном давлении 1 кг древесного угля сорбирует
— поглощаю). Вещество, частицы которого поглощаются (газ, жидкость или растворенный компонент), называют сорбатом, а поглотитель (чаще всего твердое тело) — сорбентом. Так, при 288 К и нормальном давлении 1 кг древесного угля сорбирует  диоксида серы
диоксида серы  аммиака
аммиака 
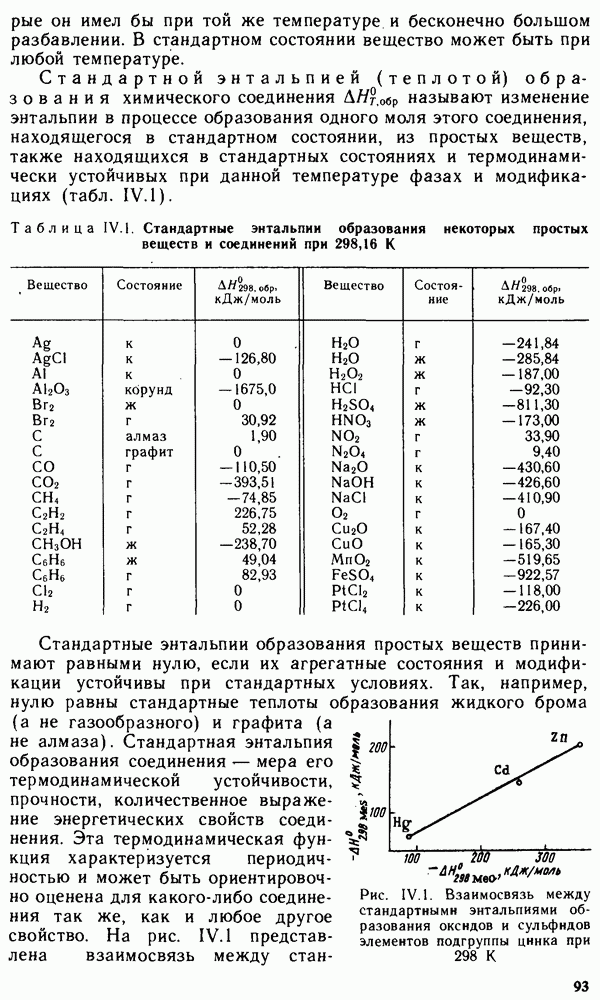
Сорбционные процессы играют большую роль в технике. Например, для поддержания высокого вакуума в действующем электронно-вакуумном приборе применяют геттеры — специально изготовленные материалы, которые активно поглощают (сорбируют) остаточные газы. В качестве геттеров используют чаще всего компактные (Zr, Та, Nb и др.) или распыленные (Ва, Са, Sr) металлы. Сорбционные процессы широко используют в металлургии при обогащении руд (флотация), в энергетике при водоподготовке (ионный обмен) и во многих других отраслях промышленности.
При контакте сорбент поглощает сорбат или поверхностью, или всем объемом. Сорбция только поверхностью называется адсорбцией, а только объемом — абсорбцией. Часто адсорбция и

Рис. V.11. Поверхностный слой адсорбента
абсорбция протекают совместно. Как правило, адсорбция предшествует абсорбции.
Адсорбция на поверхности твердых тел.
Явление адсорбции было открыто во второй половине XVIII в. Шееле в 1773 г. (Швеция) и Фонтана в 1777 г.
(Франция) наблюдали поглощение газов углем, а Т. Е. Ловитц в 1785 г.
(Россия) — поглощение углем органических веществ из водных растворов.
В 1915 г. Н. Д. Зелинский на основе адсорбции газов активированным углем создал противогаз, который применялся во время первой мировой войны для защиты от отравляющих веществ. Активированный уголь и в настоящее время используют как адсорбент в различных технологических процессах.
Адсорбция играет важную роль во многих физико-химических и физических процессах. Советскими учеными П. А. Ребиндером, Ю. В. Горюновым и Е. Д. Щукиным было, например, установлено, что адсорбция поверхностно-активных веществ уменьшает энергию химических связей в поверхностном слое твердого тела и соответственно уменьшает прочность последнего (эффект Ребиндера). Исследование этого явления лежит в основе нового направления науки — физико-химической механики. Использование эффекта Ребиндера дает огромный экономический эффект. Благодаря ему ускоряют процессы механической обработки металлов, бурения горных пород и др.
Адсорбция связана с особым энергетическим состоянием частиц на поверхности адсорбента в отличие от энергетического состояния частиц, находящихся в его объеме (рис. V.11). Частицы (молекулы, атомы или ионы) во внутренних слоях вещества испытывают в среднем одинаковое по всем направлениям притяжение со стороны окружающих частиц. Частицы же поверхностного слоя подвергаются неодинаковому притяжению со стороны частиц внутренних слоев вещества и со стороны частиц граничащей с веществом посторонней фазы. Поэтому частицы поверхностного слоя адсорбента обладают свободной поверхностной энергией, которая может быть снижена за счет возникновения адсорбционных взаимодействий с молекулами, атомами и ионами адсорбата.
Адсорбционная способность любого адсорбента определяется в первую очередь его удельной площадью поверхности 

где  — площадь поверхности адсорбента;
— площадь поверхности адсорбента;  — масса адсорбента. Поскольку
— масса адсорбента. Поскольку  где
где  — плотность; V — объем, уравнение (V.37) можно записать и так:
— плотность; V — объем, уравнение (V.37) можно записать и так:

где  степень дисперсности (раздробленности) адсорбента.
степень дисперсности (раздробленности) адсорбента.
Таким образом, удельная площадь поверхности адсорбента, а следовательно, и адсорбционная способность будут тем больше, чем больше его степень дисперсности  или чем меньше линейные размеры частиц, на которые раздроблен адсорбент. Активные, т. е. хорошо поглощающие, адсорбенты обладают весьма большой удельной площадью поверхности. Примерами таких высокодисперсных адсорбентов с удельной площадью поверхности до нескольких сотен и даже тысяч квадратных метров на
или чем меньше линейные размеры частиц, на которые раздроблен адсорбент. Активные, т. е. хорошо поглощающие, адсорбенты обладают весьма большой удельной площадью поверхности. Примерами таких высокодисперсных адсорбентов с удельной площадью поверхности до нескольких сотен и даже тысяч квадратных метров на  являются активированный уголь, силикагель, пористые кристаллы цеолитов.
являются активированный уголь, силикагель, пористые кристаллы цеолитов.
Взаимодействия между частицами адсорбата и адсорбента могут иметь различный характер. В зависимости от природы возникающих взаимодействий различают физическую адсорбцию и химическую (хемосорбцию).
При физической адсорбции частицы адсорбата и адсорбента связываются относительно непрочными межмолекулярными силами сцепления (силами Ван-дер-Ваальса). В связи с этим физическая адсорбция сопровождается небольшим отрицательным тепловым эффектом  и протекает обратимо.
и протекает обратимо.
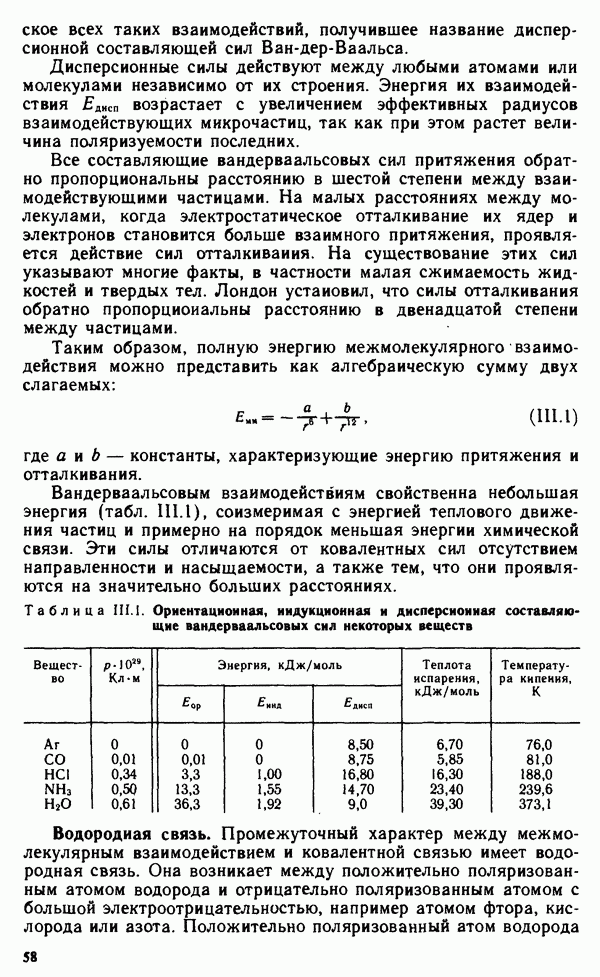
При хемосорбции частицы адсорбата и адсорбента связываются более прочными силами сцепления за счет возникающего химического взаимодействия, которое приводит к образованию нового химического соединения на поверхности адсорбента. Хемосорбция, как правило, сопровождается отрицательным тепловым эффектом, величина которого имеет порядок теплового эффекта экзотермической химической реакции. Примером хемосорбции может служить адсорбция кислорода металлами. Хемосорбция может распространяться с поверхности адсорбента на его объем, переходя в обычную гетерогенную реакцию.
Изотерма адсорбции.
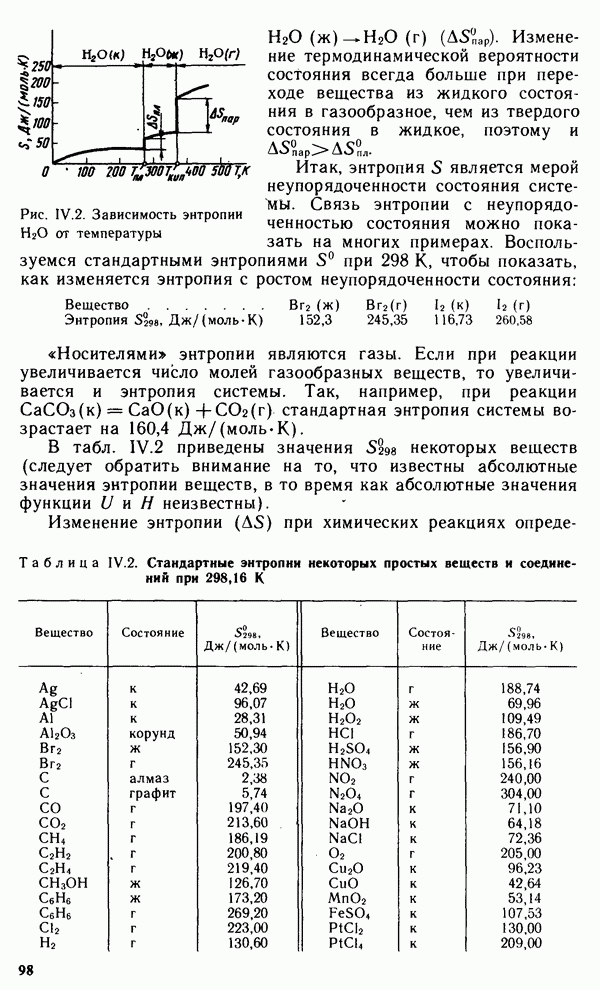
Процесс отрыва частиц адсорбата от поверхности адсорбента, т. е. явление, обратное адсорбции, называют десорбцией. Если в системе адсорбат — адсорбент при заданных условиях скорость адсорбции равна скорости десорбции, состояние системы называют адсорбционным равновесием. Адсорбционное равновесие подвижно и может быть смещено в ту или другую сторону в соответствии с принципом Ле Шателье.
Количественно адсорбцию можно выражать в молях адсорбата на единицу площади поверхности адсорбента,  Адсорбция зависит от природы адсорбента и адсорбата, температуры и концентрации или давления адсорбата. Кривую зависимости величины адсорбции Г от равновесных концентраций С или давлений
Адсорбция зависит от природы адсорбента и адсорбата, температуры и концентрации или давления адсорбата. Кривую зависимости величины адсорбции Г от равновесных концентраций С или давлений  адсорбата при постоянной температуре Т называют
адсорбата при постоянной температуре Т называют
изотермой адсорбции:  или
или  при
при 
Поверхность адсорбентов обычно неоднородна. Это связано с особенностями их строения и получения. Неоднородность поверхности адсорбента очень усложняет математические зависимости, описывающие адсорбцию. Поэтому для получения простейших закономерностей обращаются к физической адсорбции идеального газа однородной поверхностью адсорбента. К адсорбентам с практически однородной поверхностью относится сажа, прокаленная при 3000 °С. При адсорбции газа на саже образуется мономолекулярный адсорбционный слой, толщина которого определяется размерами молекул адсорбата и их ориентацией на поверхности адсорбента.
Поверхность адсорбента, на которой могут размещаться молекулы адсорбата, ограничена. При условии мономолекулярности адсорбционного слоя ограничена и его толщина  Поэтому адсорбция не может превышать предельного значения
Поэтому адсорбция не может превышать предельного значения  Изотерма адсорбции на однородной поверхности адсорбента была выведена американским ученым Дж. Лэнгмюром. Он предполагал, что адсорбция локализована и идеально обратима. Согласно этому предположению, молекулы газа адсорбируются только на свободных от адсорбата местах поверхности адсорбента, в то время как десорбция молекул осуществляется только с занятых мест. Связь адсорбата с адсорбентом должна быть достаточно прочной для того, чтобы адсорбционный комплекс не перемещался вдоль поверхности адсорбента (локализованная адсорбция).
Изотерма адсорбции на однородной поверхности адсорбента была выведена американским ученым Дж. Лэнгмюром. Он предполагал, что адсорбция локализована и идеально обратима. Согласно этому предположению, молекулы газа адсорбируются только на свободных от адсорбата местах поверхности адсорбента, в то время как десорбция молекул осуществляется только с занятых мест. Связь адсорбата с адсорбентом должна быть достаточно прочной для того, чтобы адсорбционный комплекс не перемещался вдоль поверхности адсорбента (локализованная адсорбция).
Для вывода уравнения изотермы монослойной локализованной адсорбции рассмотрим обратимый процесс: молекула газа  свободное место на поверхности адсорбента локализованный адсорбционный комплекс
свободное место на поверхности адсорбента локализованный адсорбционный комплекс
Назовем соотношение  степенью заполнения поверхности адсорбента данным адсорбатом 0:
степенью заполнения поверхности адсорбента данным адсорбатом 0:

Соответственно  будет обозначением доли свободной от адсорбата площади поверхности.
будет обозначением доли свободной от адсорбата площади поверхности.
Чтобы произошла адсорбция молекулы газа поверхностью адсорбента, молекула должна удариться о поверхность и попасть при этом на свободное место. Число ударов пропорционально концентрации молекул газа С в объемной фазе, а вероятность попасть на свободное место — доле свободных мест  . Поэтому скорость процесса адсорбции уадс равна
. Поэтому скорость процесса адсорбции уадс равна

где  — константа скорости адсорбции.
— константа скорости адсорбции.
Скорость десорбции удес пропорциональна степени заполнения поверхности адсорбента, так как десорбция идет только с занятых адсорбционным комплексом мест поверхности:

где  — константа скорости десорбции.
— константа скорости десорбции.
Адсорбционное равновесие характеризуется равенством  На основании уравнений (V.40) и (V.41) при равенстве скоростей рассматриваемых процессов имеем
На основании уравнений (V.40) и (V.41) при равенстве скоростей рассматриваемых процессов имеем

или

где К — константа адсорбционного равновесия при заданной температуре.
Преобразовав уравнение (V.42), получим уравнение изотермы адсорбции Лэнгмюра:

Учитывая соотношение (V.39), уравнение изотермы адсорбции Лэнгмюра можно записать и в виде

или

где  — равновесное парциальное давление адсорбата (газа);
— равновесное парциальное давление адсорбата (газа);  — константа адсорбционного равновесия.
— константа адсорбционного равновесия.
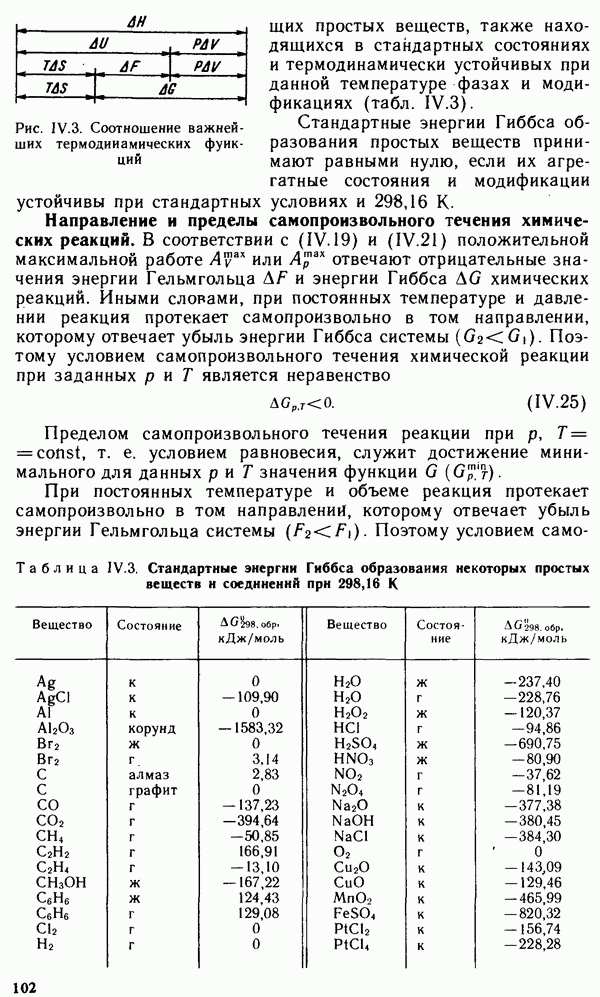
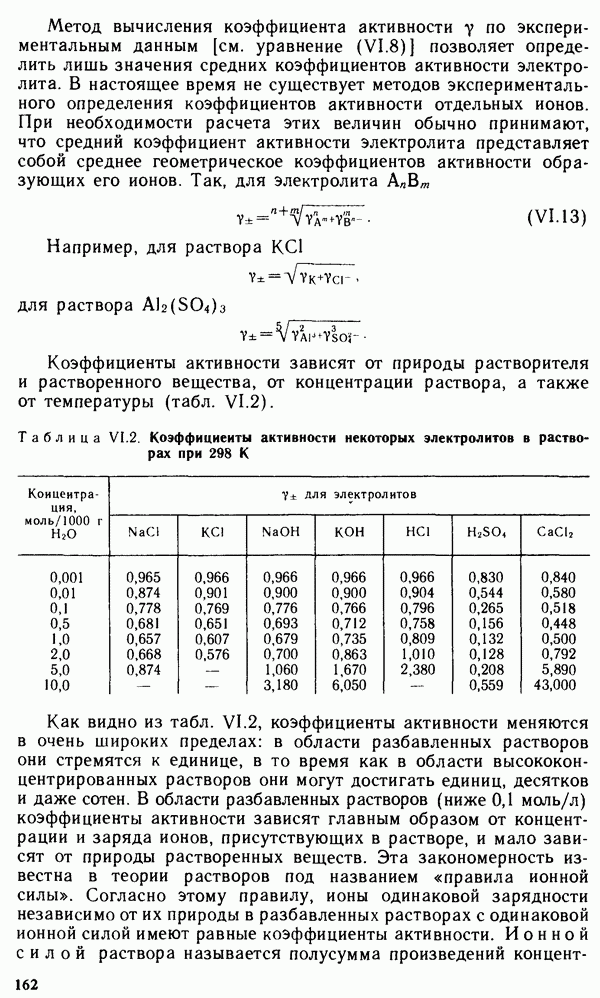
Графически изотерма адсорбции Лэнгмюра, построенная  координатах
координатах  или
или  представляет собой гиперболу (рис. V.12). В области малых равновесных концентраций (давлений) газа, когда слагаемым
представляет собой гиперболу (рис. V.12). В области малых равновесных концентраций (давлений) газа, когда слагаемым  в уравнениях (V.44) и (V.45) можно пренебречь, уравнение Лэнгмюра принимает вид
в уравнениях (V.44) и (V.45) можно пренебречь, уравнение Лэнгмюра принимает вид

В области больших концентраций (давлений) газа, когда в уравнениях (V.44) и (V.45) можно пренебречь единицей, так как  уравнение Лэнгмюра принимает вид
уравнение Лэнгмюра принимает вид 
Изотерму адсорбции на неоднородной поверхности обычно получают эмпирическим путем. Одной из подобных изотерм является изотерма Фрейндлиха

где  — постоянные для данной системы величины.
— постоянные для данной системы величины.
Хроматография.
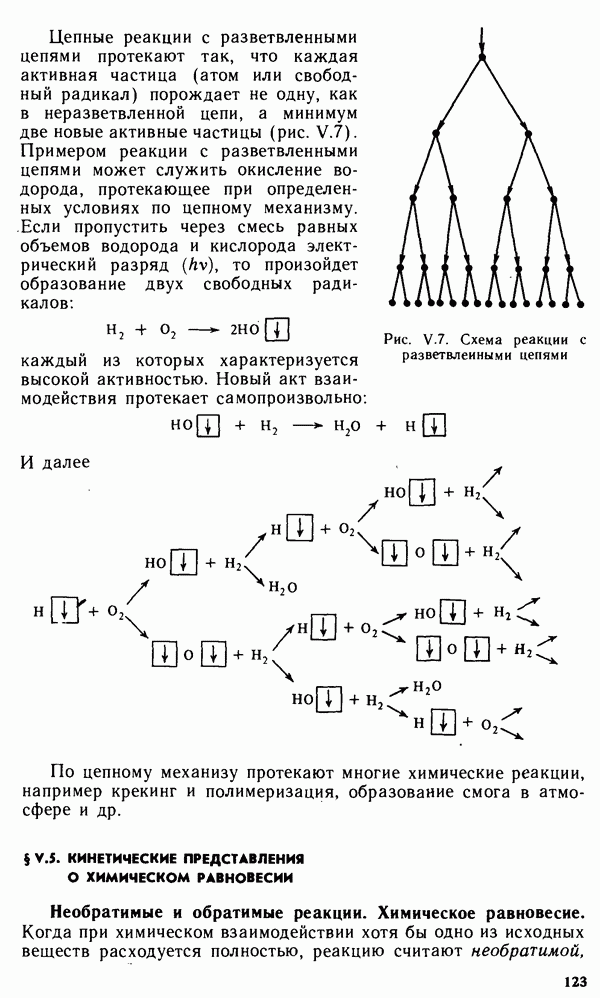
Если адсорбция вещества слоем сорбента осуществляется из потока жидкости или газа, то такая адсорбция называется динамической. На явлении динамической адсорбции основан метод разделения сложных смесей веществ, открытый в 1903 г. русским ученым М. С. Цветом и названный им хроматографическим.

Рис. V.12. Изотерма адсорбции Лэнгмюра
Хроматографическим методом (хроматографией) называют метод разделения, при котором компоненты смеси распределяются между неподвижным слоем твердого поглотителя и потоком газа или раствора.
В качестве твердых поглотителей применяют силикагель, оксид алюминия, активированные угли, а также иониты, как природные, так и синтетические (ионообменные смолы). В последние годы применяют и жидкие поглотители (на твердом носителе).
В настоящее время предложен целый ряд хроматографических методов, которые можно классифицировать по агрегатным состояниям разделяемой смеси и поглотителя (жидкостно-ад-сорбционная хроматография и др.), по форме осуществления процесса (проявительный, вытеснительный и фронтальный методы), по характеру взаимодействия, лежащего в основе метода (адсорбционный метод, осадочный метод и др.).
Хроматография широко применяется для анализа сложных смесей компонентов, выделения и разделения разнообразных веществ, получения веществ высокой степени чистоты. Например, метод хроматографии используют в производстве трансурановых элементов, в очистке полупроводниковых материалов, для удаления примесей из газов и т. п.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- § 1. ПРЕДМЕТ ХИМИИ
- § 2. ЗНАЧЕНИЕ ХИМИИ В ИЗУЧЕНИИ ПРИРОДЫ И РАЗВИТИИ ТЕХНИКИ
- 1. СТРОЕНИЕ ВЕЩЕСТВА
- Глава I. СТРОЕНИЕ АТОМА И СИСТЕМАТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- § 1.2. КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА
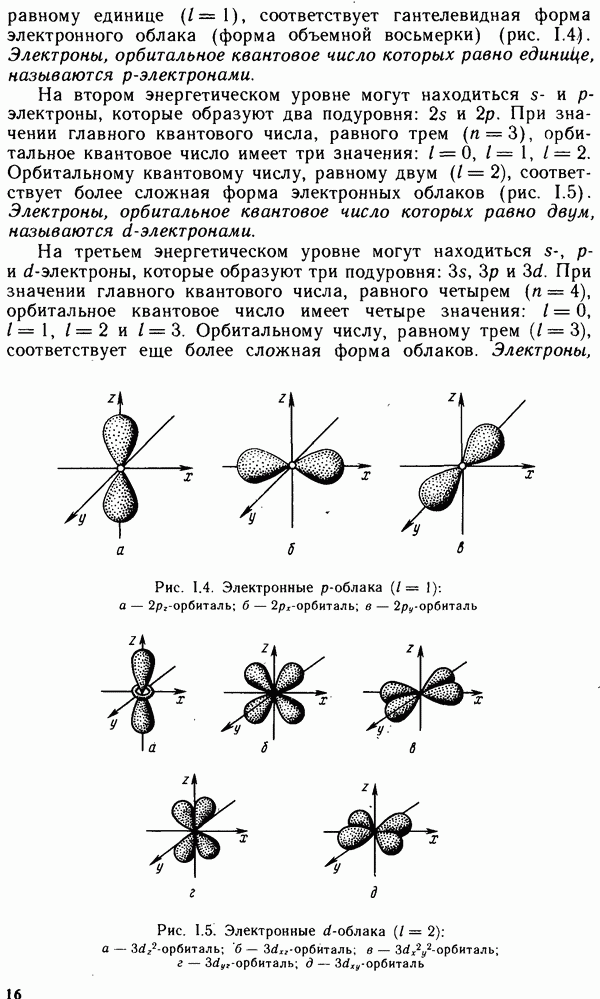
- § 1.3. КВАНТОВЫЕ ЧИСЛА И АТОМНЫЕ ОРБИТАЛИ
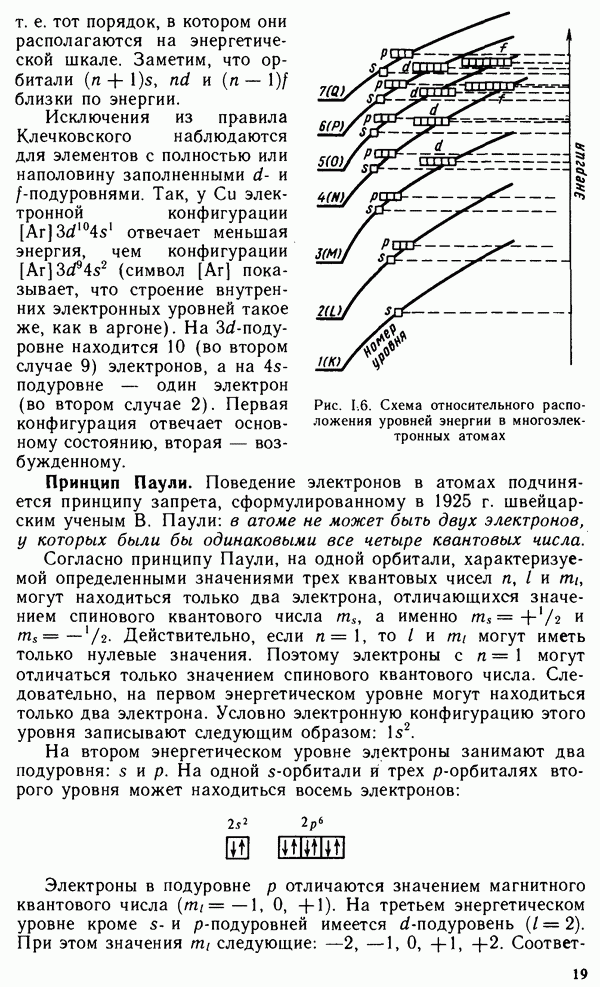
- § 1.4. МНОГОЭЛЕКТРОННЫЕ АТОМЫ
- § 1.5. ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
- § 1.6. ПЕРИОДИЧЕСКОЕ ИЗМЕНЕНИЕ СВОЙСТВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Глава II. ХИМИЧЕСКАЯ СВЯЗЬ
- § II.1. ОСНОВНЫЕ ВИДЫ И ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ
- § II.2. МЕТОД ВАЛЕНТНЫХ СВЯЗЕЙ. ВАЛЕНТНОСТЬ
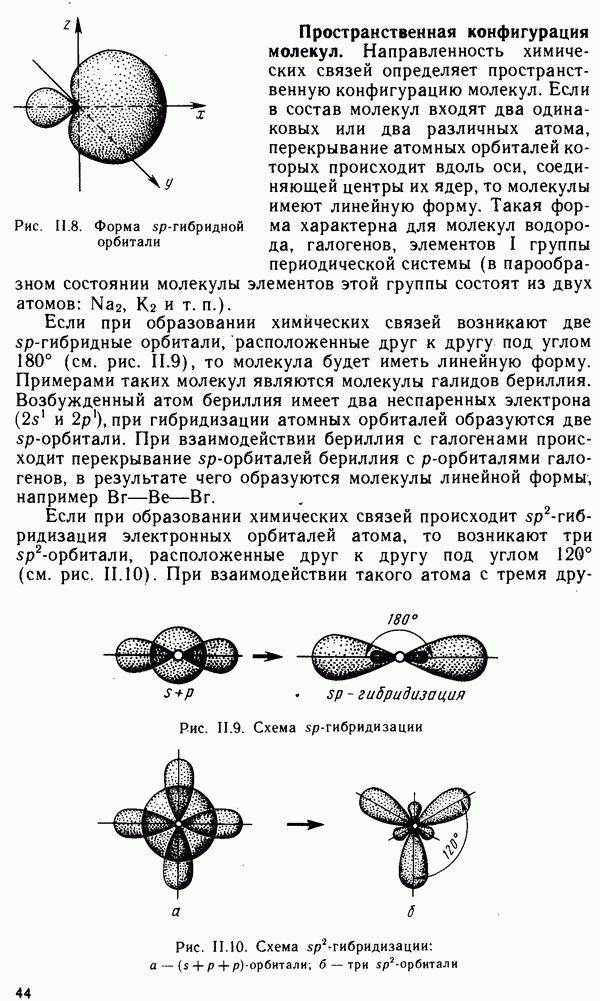
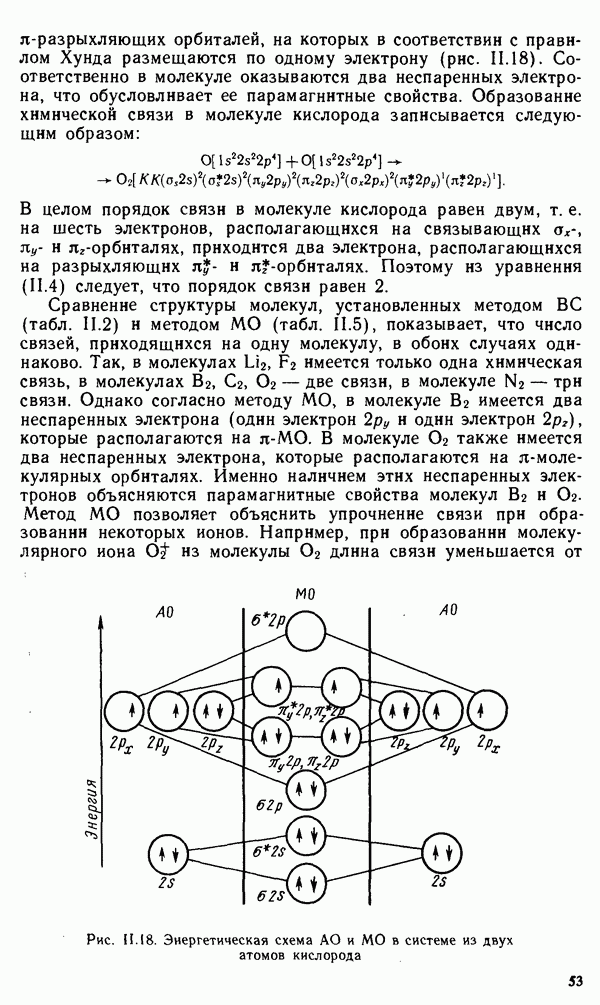
- § II.3. НАПРАВЛЕННОСТЬ КОВАЛЕНТНОЙ СВЯЗИ. ПРОСТРАНСТВЕННАЯ СТРУКТУРА МОЛЕКУЛ
- § 11.4. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ
- § 11.5. ЭЛЕКТРОННАЯ СТРУКТУРА НЕКОТОРЫХ МОЛЕКУЛ
- Глава III. ТИПЫ ВЗАИМОДЕЙСТВИЯ МОЛЕКУЛ. КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ ВЕЩЕСТВА
- § III.1. ВЗАИМОДЕЙСТВИЕ МЕЖДУ МОЛЕКУЛАМИ
- § III.2. СВОЙСТВА ВЕЩЕСТВ В РАЗЛИЧНЫХ СОСТОЯНИЯХ
- § III.3. СТРОЕНИЕ КРИСТАЛЛОВ. ХИМИЧЕСКАЯ СВЯЗЬ В ТВЕРДЫХ ТЕЛАХ
- § III.4. МЕТАЛЛЫ, ПОЛУПРОВОДНИКИ И ДИЭЛЕКТРИКИ
- § III.5. РЕАЛЬНЫЕ КРИСТАЛЛЫ
- 2. ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ХИМИЧЕСКИХ ПРОЦЕССОВ
- Глава IV. ЭНЕРГЕТИКА ХИМИЧЕСКИХ ПРОЦЕССОВ. ХИМИЧЕСКОЕ СРОДСТВО
- § IV.2. ЭНЕРГЕТИЧЕСКИЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ И ФАЗОВЫХ ПРЕВРАЩЕНИЙ. ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ
- § IV.3. ЭНТАЛЬПИЯ ОБРАЗОВАНИЯ ХИМИЧЕСКИХ СОЕДИНЕНИЙ. ТЕРМОХИМИЧЕСКИЕ РАСЧЕТЫ
- § IV.4. ЭНТРОПИЯ. НАПРАВЛЕНИЕ И ПРЕДЕЛ ПРОТЕКАНИЯ ПРОЦЕССОВ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
- § IV.5. ЭНЕРГИЯ ГИББСА И ЭНЕРГИЯ ГЕЛЬМГОЛЬЦА ХИМИЧЕСКОЙ РЕАКЦИИ
- Глава V. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- § V.2. СКОРОСТЬ ГЕТЕРОГЕННЫХ ХИМИЧЕСКИХ РЕАКЦИЙ
- § V.3. ЗАВИСИМОСТЬ СКОРОСТИ ХИМИЧЕСКОЙ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- § V.4. ФИЗИЧЕСКИЕ ВОЗДЕЙСТВИЯ НА ХИМИЧЕСКИЕ РЕАКЦИИ. ЦЕПНЫЕ РЕАКЦИИ
- § V.5. КИНЕТИЧЕСКИЕ ПРЕДСТАВЛЕНИЯ О ХИМИЧЕСКОМ РАВНОВЕСИИ
- § V.6. ФАЗОВЫЕ РАВНОВЕСИЯ ПРАВИЛО ФАЗ
- § V.7. АДСОРБЦИОННОЕ РАВНОВЕСИЕ
- § V.8. КАТАЛИЗ
- 3. РАСТВОРЫ ДИСПЕРСНЫЕ СИСТЕМЫ ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- VI.1. ОБЩИЕ ПОНЯТИЯ О РАСТВОРАХ
- § VI.2. ОСНОВНЫЕ ХАРАКТЕРИСТИКИ ЖИДКИХ РАСТВОРОВ
- § VI.3. ХИМИЧЕСКОЕ РАВНОВЕСИЕ В РАСТВОРАХ
- § VI.4. ВОДНЫЕ РАСТВОРЫ ЭЛЕКТРОЛИТОВ
- § VI.5. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ВОДЫ. ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ
- § VI.6. РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- § VI.7. ДИСПЕРСНЫЕ СИСТЕМЫ. КОЛЛОИДНЫЕ РАСТВОРЫ
- § VI.8. УСТОЙЧИВОСТЬ И КОАГУЛЯЦИЯ КОЛЛОИДНЫХ СИСТЕМ
- Глава VII. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ И ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.1. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ
- § VII.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
- § VII.3. ПОТЕНЦИАЛЫ МЕТАЛЛИЧЕСКИХ И ГАЗОВЫХ ЭЛЕКТРОДОВ
- § VII.4. ПОТЕНЦИАЛЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ (РЕДОКСИ-) ЭЛЕКТРОДОВ
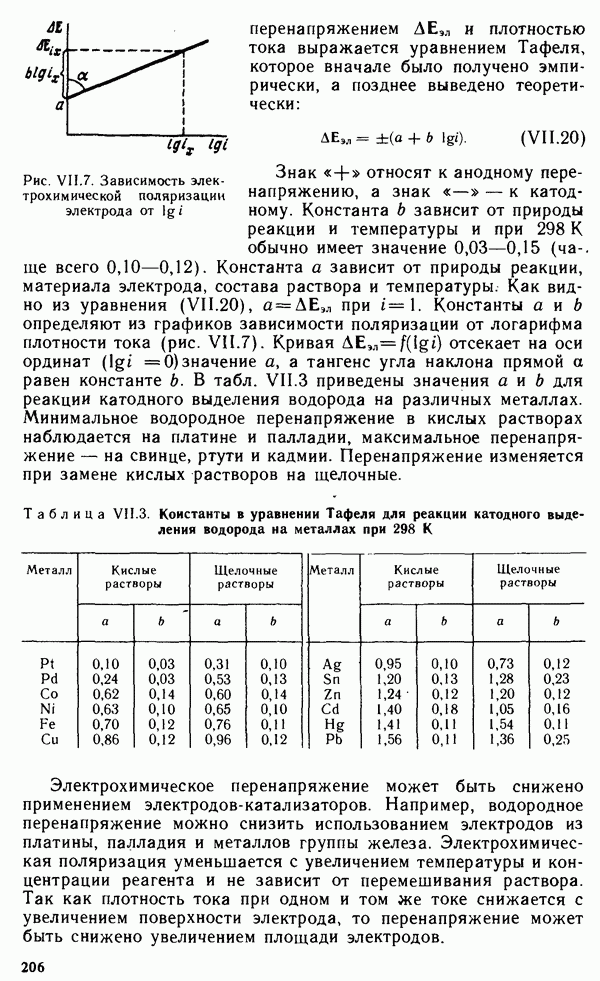
- § VII.5. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ. ПОЛЯРИЗАЦИЯ
- § VII.6. ЭЛЕКТРОЛИЗ
- Глава VIII. КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
- § VIII.1. ОПРЕДЕЛЕНИЕ И КЛАССИФИКАЦИЯ КОРРОЗИОННЫХ ПРОЦЕССОВ
- § VIII.2. ХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.3. ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
- § VIII.4. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
- 4. ОБЩАЯ ХАРАКТЕРИСТИКА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- Глава IX. ПРОСТЫЕ ВЕЩЕСТВА И ДВОЙНЫЕ СОЕДИНЕНИЯ. КРАТКИЙ ОБЗОР ХИМИЧЕСКИХ СВОЙСТВ s- И р-ЭЛЕМЕНТОВ
- § IX.2. МЕТАЛЛЫ И СПЛАВЫ. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКОГО АНАЛИЗА
- § IX.3. ДВОЙНЫЕ СОЕДИНЕНИЯ
- § IX.4. СВОЙСТВА МЕТАЛЛОВ ГЛАВНЫХ ПОДГРУПП I И II ГРУПП
- § IX.5. СВОЙСТВА р-ЭЛЕМЕНТОВ III ГРУППЫ
- § IX.6. СВОЙСТВА р-ЭЛЕМЕНТОВ IV ГРУППЫ
- § IX.7. СВОЙСТВА р-ЭЛЕМЕНТОВ V, VI И VII ГРУПП ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
- Глава Х. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
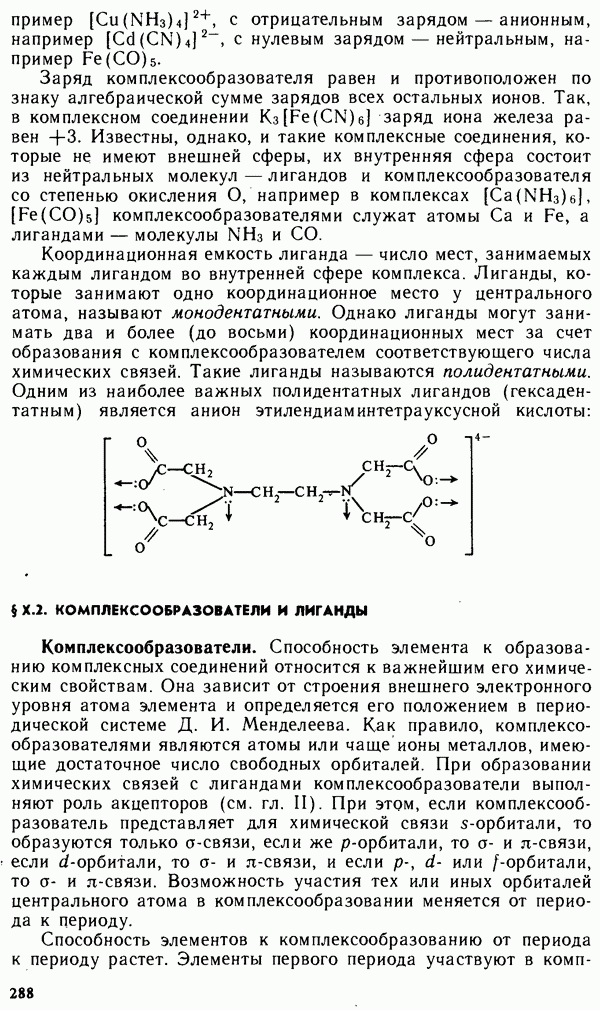
- § Х.1. СТРУКТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИИ
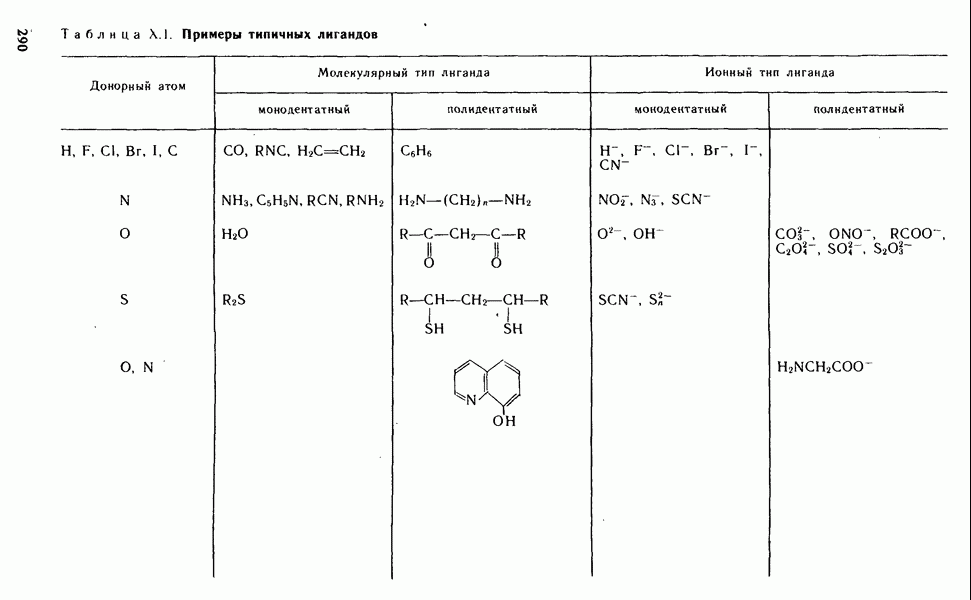
- § Х.2. КОМПЛЕКСООБРАЗОВАТЕЛИ И ЛИГАНДЫ
- § Х.3. НОМЕНКЛАТУРА И КЛАССИФИКАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- § Х.4. МЕТОДЫ РАСЧЕТА ХИМИЧЕСКИХ СВЯЗЕЙ В КОМПЛЕКСНЫХ СОЕДИНЕНИЯХ
- § Х.5. УСТОЙЧИВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
- Глава XI. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- § XI.1. ОСОБЕННОСТИ. ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ И КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- § XI.2. УГЛЕВОДОРОДЫ
- § ХI.3. ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- 5. СПЕЦИАЛЬНЫЕ ВОПРОСЫ ХИМИИ
- Глава XII. ХИМИЯ КОНСТРУКЦИОННЫХ И ЭЛЕКТРОТЕХНИЧЕСКИХ МАТЕРИАЛОВ
- § XII.2. СВОЙСТВА ПЕРЕХОДНЫХ МЕТАЛЛОВ VIII ГРУППЫ
- § ХII.3. СВОЙСТВА ЭЛЕМЕНТОВ I И II ГРУПП
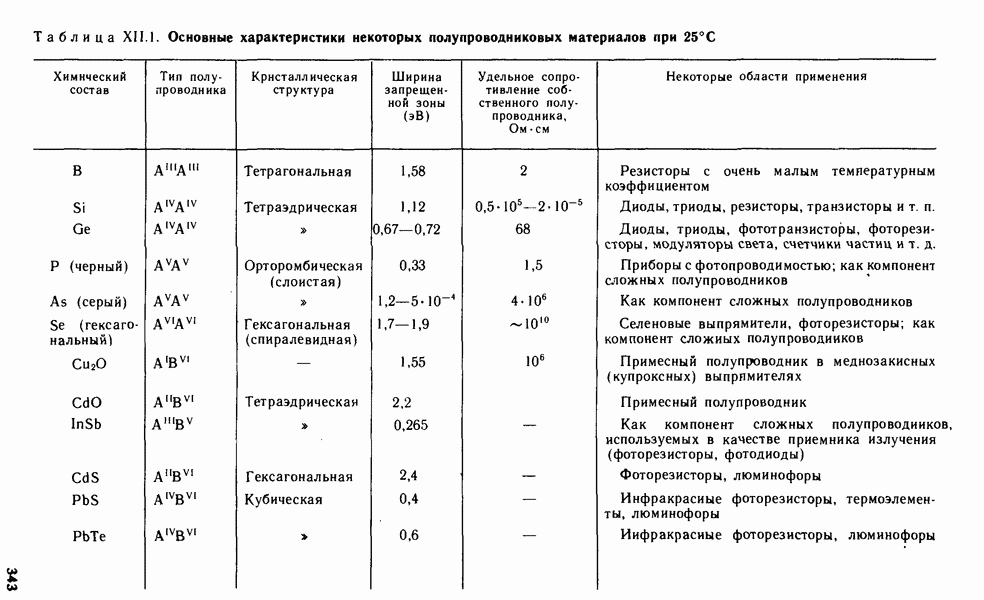
- § XII.4. ХИМИЯ ПОЛУПРОВОДНИКОВЫХ МАТЕРИАЛОВ
- § XII.5. МЕТОДЫ ПОЛУЧЕНИЯ МАТЕРИАЛОВ ВЫСОКОЙ ЧИСТОТЫ
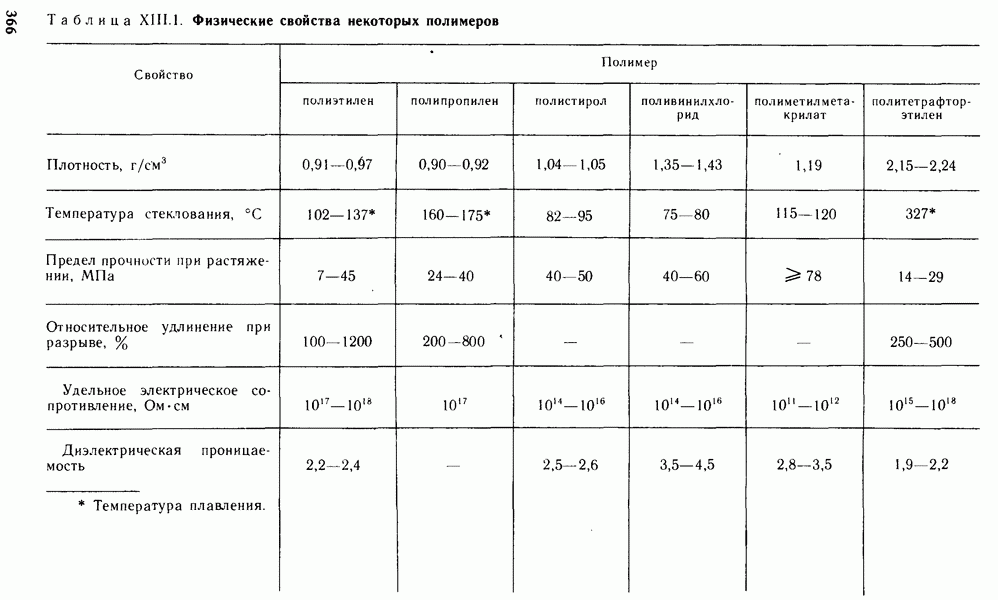
- Глава XIII. ПОЛИМЕРНЫЕ МАТЕРИАЛЫ И ИХ ПРИМЕНЕНИЕ В ЭНЕРГЕТИКЕ
- § XIII.1. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИМЕРОВ
- § XIII.2. СТРОЕНИЕ ПОЛИМЕРОВ
- § XIII.3. СВОЙСТВА ПОЛИМЕРОВ
- § XIII.4. ПРИМЕНЕНИЕ ПОЛИМЕРОВ
- Глава XIV. ХИМИЯ ВОДЫ И ТОПЛИВА. ХИМИЯ И ОХРАНА ОКРУЖАЮЩЕЙ СРЕДЫ
- § XIV.1. СТРОЕНИЕ И СВОЙСТВА ВОДЫ
- § XIV.2. ПРИРОДНЫЕ ВОДЫ
- § ХIV.3. ОСНОВНЫЕ МЕТОДЫ ОЧИСТКИ ВОДЫ
- § XIV.4. СОСТАВ И СВОЙСТВА ОРГАНИЧЕСКОГО ТОПЛИВА
- § XIV.5. ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ ОБЩЕСТВА
- § XIV.6. ОХРАНА ВОЗДУШНОГО БАССЕЙНА
- § XIV.7. ОХРАНА ВОДНОГО БАССЕЙНА
- Глава XV. ЯДЕРНАЯ ХИМИЯ И РАДИОХИМИЯ
- § XV.1. АТОМНОЕ ЯДРО. РАДИОАКТИВНОСТЬ
- § XV.2. ЯДЕРНЫЕ РЕАКЦИИ
- § XV.3. ЯДЕРНАЯ ЭНЕРГЕТИКА
- § XV.4. ХИМИЧЕСКИЕ СВОЙСТВА РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
- Глава XVI. ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ В ЭНЕРГЕТИКЕ, ЭЛЕКТРОНИКЕ И АВТОМАТИКЕ
- § ХVI.1. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА. ЭЛЕКТРОХИМИЧЕСКИЕ ЭНЕРГОУСТАНОВКИ
- § XVI.2. ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ (ХЕМОТРОНЫ)
- § ХVI.3. ЭЛЕКТРОХИМИЧЕСКАЯ АНОДНАЯ ОБРАБОТКА МЕТАЛЛОВ И СПЛАВОВ
- § XVI.4. ПОЛУЧЕНИЕ И СВОЙСТВА ГАЛЬВАНОПОКРЫТИИ
- ЗАКЛЮЧЕНИЕ