| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
1.2. Ферменты — белковые катализаторы и регуляторы
Ферменты [1-9] представляют собой высокоэффективные белковые катализаторы, ускоряющие течение биохимических реакций в  раз по сравнению со скоростью тех же реакций, идущих без ферментов при прочих равных условиях [10]. Молекулы ферментов имеют обычно глобулярное строение [6, с. 65] и молекулярный вес от
раз по сравнению со скоростью тех же реакций, идущих без ферментов при прочих равных условиях [10]. Молекулы ферментов имеют обычно глобулярное строение [6, с. 65] и молекулярный вес от  до
до  [11]. Непосредственно в катализе биохимических реакций принимает участие лишь очень небольшая часть молекулы фермента, называемая активным, или каталитическим, центром. Активным центром называется каталитически активный участок молекулы фермента, образованный специфическим взаимным пространственным расположением нескольких боковых групп остатков аминокислот полипептидных цепей (или одной цепи) [6, с. 62] и небольших молекул, ковалентно связанных с полипептидными цепями (или с одной цепью) молекулы фермента.
[11]. Непосредственно в катализе биохимических реакций принимает участие лишь очень небольшая часть молекулы фермента, называемая активным, или каталитическим, центром. Активным центром называется каталитически активный участок молекулы фермента, образованный специфическим взаимным пространственным расположением нескольких боковых групп остатков аминокислот полипептидных цепей (или одной цепи) [6, с. 62] и небольших молекул, ковалентно связанных с полипептидными цепями (или с одной цепью) молекулы фермента.
Любое ферментативное превращение начинается со связывания молекул субстратов с несколькими группами активного центра и завершается разрывом связей, удерживающих молекулы продуктов с активным центром. Между двумя этими событиями фермент находится в форме лабильного активного фермент-субстратного комплекса, который, в отличие от активированного комплекса элементарной химической реакции [10], представляет собой очень неустойчивые химические соединения субстратов реакции с ферментом.
Гипотеза об образовании лабильного фермент-субстратного комплекса в ходе ферментативной реакции была впервые высказана в 1902 г. Брауном [12] и Анри [13].
Пытаясь дать количественное толкование явлению насыщения амилазных  реакций субстратами, Анри [14] в 1904 г. рассмотрел кинетическую модель
реакций субстратами, Анри [14] в 1904 г. рассмотрел кинетическую модель

в которой  полисахарид,
полисахарид,  продукты его гидролиза,
продукты его гидролиза,  амилаза,
амилаза,  фермент-субстратный комплекс. Для упрощения анализа модели (1.1) Анри допустил, что реакция образования фермент-субстратного комплекса
фермент-субстратный комплекс. Для упрощения анализа модели (1.1) Анри допустил, что реакция образования фермент-субстратного комплекса

находится в равновесии, определяемом константой диссоциации комплекса  Это позволило ему вывести уравнение начальной скорости реакции (1.1) в следующем виде:
Это позволило ему вывести уравнение начальной скорости реакции (1.1) в следующем виде:

Уравнение (1.3) описывает достижение максимальной скорости  при
при  К такому же уравнению (1.3) и при тех же допущениях пришли в 1913 г. Михаэлис и Ментен [15], обобщив свои наблюдения над кинетикой действия фруктофураноэидазы
К такому же уравнению (1.3) и при тех же допущениях пришли в 1913 г. Михаэлис и Ментен [15], обобщив свои наблюдения над кинетикой действия фруктофураноэидазы  Работа [15] приобрела широкую известность — уравнение (1.3) стали называть уравнением Михаэлиса — Ментен, а комплекс
Работа [15] приобрела широкую известность — уравнение (1.3) стали называть уравнением Михаэлиса — Ментен, а комплекс  комплексом Михаэлиса.
комплексом Михаэлиса.
В 1925 г. Ериггс и Холдейн [16] рассмотрели кинетическую модель (1.1) при более общем допущении. Они приняли, что в реакции (1.1) выполняется условие  в котором
в котором  Считая, что из-за малости огношения
Считая, что из-за малости огношения  скорость изменения концентрации фермент-субстратного комплекса
скорость изменения концентрации фермент-субстратного комплекса  должна быть много больше скорости изменения концентрации субстрата
должна быть много больше скорости изменения концентрации субстрата  Бриггс и Холдейн приняли, что в реакции (1.1) быстро устанавливается квазистационарное состояние, в котором
Бриггс и Холдейн приняли, что в реакции (1.1) быстро устанавливается квазистационарное состояние, в котором  Это допущение привело их к следующему выражению для квазистационарной начальной скорости реакции (1.1):
Это допущение привело их к следующему выражению для квазистационарной начальной скорости реакции (1.1):

где  константа Михаэлиса, а
константа Михаэлиса, а  максимальная скорость.
максимальная скорость.  имеет размерность концентрации. Этот параметр может быть определен, как концентрация:
имеет размерность концентрации. Этот параметр может быть определен, как концентрация:  при которой
при которой 
Гипотеза о существовании фермент-субстратного комплекса долгое время не находила прямого экспериментального подтверждения. Малые концентрации, в которых образуется комплекс в ходе ферментативного катализа и нестойкость комплекса, затрудняли его экспериментальное обнаружение. В 1943 г. Чансу [17] удалось спектрофотометрически продемонстрировать образование фермент-субстратного комплекса и проследить за изменением его концентрации в ходе реакции, катализируемой гемосодержащим [6, с. 437] ферментом пероксидазой  Он исследовал поведение математической модели этой реакции на механическом дифференциальном анализаторе и показал, что теория этой реакции, основанная на допущении существования фермент-субстратного комплекса и законе действующих масс, способна с высокой точностью описать динамику пероксидазной реакции, наблюдавшуюся в эксперименте [17]. В 1962 г. Яги и Озава [18, 19] получили
Он исследовал поведение математической модели этой реакции на механическом дифференциальном анализаторе и показал, что теория этой реакции, основанная на допущении существования фермент-субстратного комплекса и законе действующих масс, способна с высокой точностью описать динамику пероксидазной реакции, наблюдавшуюся в эксперименте [17]. В 1962 г. Яги и Озава [18, 19] получили
стабильные в анаэробных условиях кристаллы фермент-субстратного комплекса оксидазы  -аминокислот
-аминокислот  В настоящее время существует множество различных экспериментальных доказательств реальности существования фермент-субстратных комплексов в ферментативных реакциях [4, с. 177; 6, с. 203].
В настоящее время существует множество различных экспериментальных доказательств реальности существования фермент-субстратных комплексов в ферментативных реакциях [4, с. 177; 6, с. 203].
В 1930 г. Холдейн [20], распространив теоретические представления о фермент-субстратном комплексе [12—15] на случай двухсубстратных и обратимых реакций, постулировал существование различных фермент-субстратных, фермент-продуктных и фермент-ингибиторных промежуточных комплексов. Так, для объяснения механизма двухсубстратной реакции

Холдейну пришлось ввести предположение о существовании трех различных фермент-субстратных комплексов: двух бинарных  и одного тройного комплекса
и одного тройного комплекса  образующихся в реакциях
образующихся в реакциях

Для объяснения механизма субстратного угнетения Холдейн [20] предложил кинетическую модель

согласно которой активный фермент-субстратный комплекс  присоединяя к себе избыточную молекулу субстрата
присоединяя к себе избыточную молекулу субстрата  превращается в пассивный фермент-субстратный комплекс
превращается в пассивный фермент-субстратный комплекс  не способный распадаться с образованием продукта
не способный распадаться с образованием продукта  Используя метод квазистационарных концентраций, Холдейн получил следующее выражение для квазистационарной начальной скорости
Используя метод квазистационарных концентраций, Холдейн получил следующее выражение для квазистационарной начальной скорости  реакции
реакции  описываемой кинетической моделью (1.7):
описываемой кинетической моделью (1.7):

где  — максимальная скорость реакции, достигаемая только при
— максимальная скорость реакции, достигаемая только при  константа Михаэлиса,
константа Михаэлиса,  константа субстратного угнетения,
константа субстратного угнетения,  полная концентрация фермента.
полная концентрация фермента.
Явление субстратного угнетения, теоретически проанализированное Холдейном с помощью модели (1.8), было впервые
обнаружено в 1924 г. Диксоном и Терлоу [21] при исследовании кинетики действия ксантиноксидазы  Этот фермент сильно угнетался высокими концентрациями субстрата (ксантина или гипоксантина).
Этот фермент сильно угнетался высокими концентрациями субстрата (ксантина или гипоксантина).
После работы Холдейна [20] стало ясно, что для объяснения механизмов сложных реакций — реакций с большим числом реактантов — следует допустить, что в ходе таких реакций образуется не один, а множество различных фермент-субстратных комплексов. И действительно, по данным В. И. Иванова и М. Я. Карпейского [22], в реакции трансаминирования, катализируемой аспартатами-нотрансферазой  ферментом, механизм действия активного центра которого изучен в настоящее время весьма детально, образуется более десяти различных форм фермент-субстратных комплексом.
ферментом, механизм действия активного центра которого изучен в настоящее время весьма детально, образуется более десяти различных форм фермент-субстратных комплексом.
Следует заметить, что экспериментальное обнаружение и идентификация всех теоретически мыслимых форм ферментных комплексов в каждой изучаемой реакции представляют собой нерешенную до сих пор проблему. Поэтому число и порядок взаимопревращений ферментных комплексов в подавляющем большинстве известных в настоящее время ферментативных реакций неясны.
Специфическое расположение атомов и атомных группировок, взаимодействующих в активном центре с молекулами реактантов, обеспечивается определенной пространственной укладкой полипептидных цепей фермента, характерной для данного фермента и называемой конформацией фермента [6, с. 65]. Изменения химического состава и физических характеристик среды, окружающей молекулу фермента, могут вызывать конформационные изменения — изменения взаимного расположения атомов и групп атомов в молекуле фермента. Эти конформационные изменения часто сопровождаются деформацией структуры активного центра, следствием чего может быть существенное изменение его активности и даже специфичности по отношению к реагентам.
Вещества, вызывающие изменения активности и (или) специфичности каталитических центров ферментов, называются модификаторами, регуляторами или модуляторами. Природные модификаторы ферментов, обладающие высокой специфичностью и эффективностью воздействия на фермент, называют (также регуляторами или эффекторами ферментов. Модификаторы, если они не являются участниками катализируемой ферментом реакции, в реакции не расходуются.
Различают два класса модификаторов — активаторы и ингибиторы. Молекулы активаторов, присоединяясь к ферменту, вызывают увеличение скорости катализируемой ферментом реакции или сродства фермента к субстрату, а молекулы ингибиторов — уменьшение скорости или этого сродства.
Молекулы модификаторов могут связываться как в активном центре фермента, так и в участках молекулы фермента, находящихся на значительном удалении от активного центра. Основной причиной того, что модификатор связывается в активном центре, является структурное сходство (иначе стерическое соответствие) между молекулой модификатора и субстрата. Поэтому модификаторы, присоединяющиеся к активному центру фермента, называются изостерическими.
В противоположность изостерическим модификаторам модификаторы, молекулы которых присоединяются к ферменту в участке, отличном от активного центра, называются аллостерическими модификаторами [23, 24]; место связывания такого модификатора называется аллостерическим, или регуляторным, центром, а фермент, имеющий аллостерический центр — аллостерическим, или регуляторным, ферментом.
Очевидно, что присоединение модификатора к аллостерическому центру может вызвать изменение активности и специфичности каталитического центра лишь путем изменения конформации фермента. Это допущение и лежит в основе теории механизма действия аллостерических ферментов, предложенной в 1965 г. Моно, Уайменом и Шанжё [25].
Регуляторные ферменты выполняют разнообразные нехимические функции в системах клеточной авторегуляции. Авторегуляцией [26, 27] называется процесс закономерного изменения или поддержания в заданных пределах определенных биологических величин, таких, как концентрации, скорости синтеза и распада различных клеточных веществ, активности ферментов и генов, рН, осмотическое давление, мембранная проницаемость, трансмембранная разность электрических потенциалов и т. д. Типичным механизмом биохимической авторегуляции является механизм угнетения ферментов конечным продуктом, открытый в 1954 г. Новиком и Сциллардом [28] в форме угнетения триптофаном одного из ферментов, участвующих в синтезе предшественников триптофана. Подобные механизмы были обнаружены впоследствии практически во всех участках обмена бактериальных, растительных и животных клеток [23, 24, 29—34]. Основное назначение механизмов угнетения ферментов конечным продуктом — стабилизация концентраций важнейших промежуточных веществ клеточного обмена.
Молекулы ферментов могут иметь один или несколько активных центров и один или несколько регуляторных центров. Условимся называть ферменты, имеющие только один активный центр, одноцентровыми, а ферменты с несколькими активными центрами — многоцентровыми ферментами.
Участие в ферментативной реакции нескольких субстратов, продуктов и модификаторов неизбежно приводит к тому, что
уравнение, описывающее зависимость квазистадионарной скорости такой реакции от концентраций реактантов и модификаторов, оказывается очень сложным и непригодным для использования в моделях полиферментных систем. Учитывая это обстоятельство, при разработке математических моделей ферментативных реакций приходится сознательно идти на ряд упрощений, вводящих некоторую погрешность в математическое описание кинетики реакций. Эта погрешность в описании реакций есть неизбежная плата за возможность представления многостадийных полиферментных систем математическими моделями обозримой сложности. Насколько должна быть упрощена модель той или иной ферментативной реакции, можно решить лишь в процессе анализа модели всей полиферментной системы, когда становится ясным, какие из свойств реакции существенны для понимания свойств изучаемой полиферментной системы. Поэтому многие из выводимых в последующих разделах моделей ферментативных реакций приводятся с некоторой избыточной подробностью, от которой легко избавиться, внеся в них необходимые упрощения.
| << Предыдущий параграф | Следующий параграф >> |
- ОТ АВТОРОВ
- ВВЕДЕНИЕ
- 1. МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ БИОХИМИЧЕСКИХ СИСТЕМ
- Глава первая. МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ НЕПРОТОЧНЫХ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- 1.2. Ферменты — белковые катализаторы и регуляторы
- 1.3. Метод графов
- 1.4. Модели реакций, катализируемых одноцентровыми ферментами
- 1.5. Модели реакций, катализируемых олигомерными ферментами
- 1.6. Свойства реакции …
- 1.7. Свойства двухсубстратной реакции
- Глава вторая. МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ПРОТОЧНЫХ ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
- 2.2. Модель открытой реакции … с субстратным угнетением
- 2.3. Модель двухсубстратной реакции с субстратным угнетением
- 2.4. Динамика открытых реакций, катализируемых олигомерными ферментами
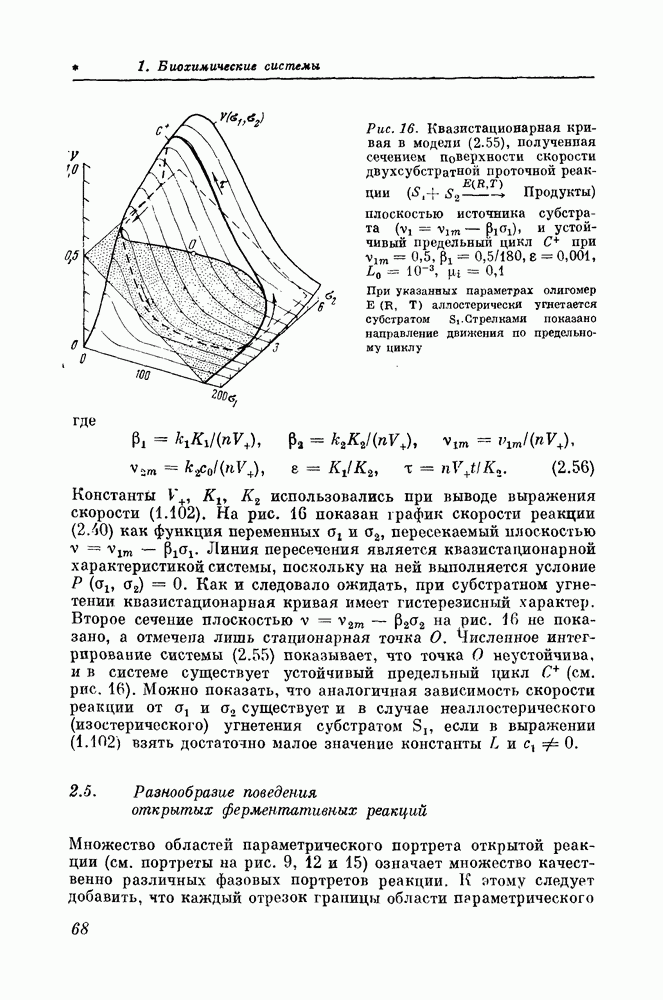
- 2.5. Разнообразие поведения открытых ферментативных реакций
- 2.6. Эквивалентные математические и кинетические модели
- 2.7. Эффект депонирования
- Глава третья. МОДЕЛИРОВАНИЕ ПОЛИФЕРМЕНТНЫХ СИСТЕМ
- 3.1. Полиферментные системы и их модели
- 3.2. Уровни функциональной организации полиферментных систем
- 3.3. Простая модель стехиометрической структуры энергетического метаболизма
- 3.4. Два класса аллостерических регуляторных связей, контролирующих энергетический метаболизм
- 2. МАТЕМАТИЧЕСКИЕ МОДЕЛИ ВОЗБУДИМЫХ МЕМБРАН
- Глава четвертая. КАЧЕСТВЕННЫЕ МЕТОДЫ В ИССЛЕДОВАНИИ МОДЕЛЕЙ МЕМБРАН
- 4.1. Построение уравнений второго порядка для моделей Ходжкина — Хаксли и Побла
- 4.2. Фаэовые портреты систем второго порядка
- 4.3. Исследование основных режимов мембраны аксона кальмара с помощью качественных методов
- 4.4. Исследование основных режимов мембраны волокна Пуркинье сердца с помощью качественных методов
- 4.5. Математические детали асимптотического сведения уравнений Ходжкина — Хаксли к системе второго порядка Н-Н2
- Глава пятая. БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА, ИОННЫЕ ТОКИ И ЭЛЕКТРОФИЗИОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ МЕМБРАН
- 5.2. Техника анализа мембран по записям ионных токов
- 5.3. Фазовые портреты мембран сердечной, нервной и мышечной клеток
- 5.4. Анализ действия веществ на мембраны
- 5.5. Предсказание электрофизиологических эффектов с помощью качественных методов
- 5.6. Границы применимости анализа, мембран по фазовому портрету
- 5.7. Оценка на математических моделях мембран точности построения фазового портрета по записям ионных токов
- 3. ВОЗБУДИМЫЕ СРЕДЫ. ВОЛНЫ И АВТОВОЛНОВЫЕ ПРОЦЕССЫ
- 6.1. Автоволновые процессы в возбудимых средах
- 6.2. Распространение волн в однородной среде. Спиральная волна, вращающаяся вокруг отверстия, и ревербератор
- 6.3. Возникновение ревербератора в простейшей неоднородной среде
- 6.4. Ревербератор в более детальных моделях
- 6.5. Свойства ревербератора как источника волн. Размножение ревербераторов в неоднородной среде. Бремя жизни
- 6.6. Ревербератор и сердечные аритмии. Уязвимость сердечной ткани
- Глава седьмая. ЭХО — ИСТОЧНИК КОНЦЕНТРИЧЕСКИХ ВОЛН В ВОЗБУДИМЫХ СРЕДАХ
- 7.1. Эхо в простейших моделях. Источник эха и ревербератор
- 7.2. Источник эха в моделях, описываемых обыкновенными дифференциальными уравнениями
- 7.3. Эхо в непрерывных возбудимых средах
- 7.4. Эхо в модели клеток сердца. Уязвимость
- Глава восьмая. ВЗАИМОДЕЙСТВИЕ ИСТОЧНИКОВ ВОЛН. АВТОВОЛНОВЫЕ ПРОЦЕССЫ И СЕРДЕЧНЫЕ АРИТМИИ
- 8.2. Синхронизация при взаимодействии источников волн
- 8.3. Размножение ревербераторов и фибрилляция
- 8.4. Взаимодействие источников эха
- 8.5. Связь параметров возбудимых сред с характеристиками дифференциального уравнения мембраны
- 8.6. Стационарные и нестационарные режимы распространения
- 8.7. Результаты микроэлектродного исследования уязвимости
- 8.8. О параметрах, контролирующих уязвимость в математических моделях и в миокарде
- 8.9. Следствия из моделей для антиаритмических веществ
- 4. ПРОСТРАНСТВЕННАЯ ОРГАНИЗАЦИЯ БИОЛОГИЧЕСКИХ СТРУКТУР
- Глава девятая. МОДЕЛИРОВАНИЕ ОБЪЕМНЫХ КЛЕТОЧНЫХ СТРУКТУР. ВИРУСЫ, ФЕРМЕНТЫ
- 9.2. Математические основы объемной реконструкции
- 9.3. Модель трехмерной структуры отростка бактериофага
- 9.4. Голографический синтез объемного изображения поверхности клеточной мембраны
- 9.5. Моделирование структуры биологических макромолекул
- Глава десятая. АНАЛИЗ КЛЕТОЧНЫХ СТРУКТУР ПО ИХ ИЗОБРАЖЕНИЯМ. ГЛИЯ—СОСУДЫ, ХРОМОСОМЫ
- 10.1. Преобразование изображений клеток в цифровую форму
- 10.2. Определение морфометрических параметров клеток и клеточных структур
- 10.3. Исследование глиально-сосудистой системы головного мозга
- 10.4. Модель сокращения длины хромосом в митозе
- Глава одиннадцатая. ВОССТАНОВЛЕНИЕ ЛИНЕЙНОЙ СТРУКТУРЫ БИОПОЛИМЕРОВ
- 11.1. Анализ первичной последовательности нуклеиновых кислот
- 11.2. Математическая постановка проблемы
- 11.3. Восстановление слов по составу второго ранга
- 11.4. Метод подстановки при восстановлении слов
- 11.5. Оптимизация биохимического эксперимента