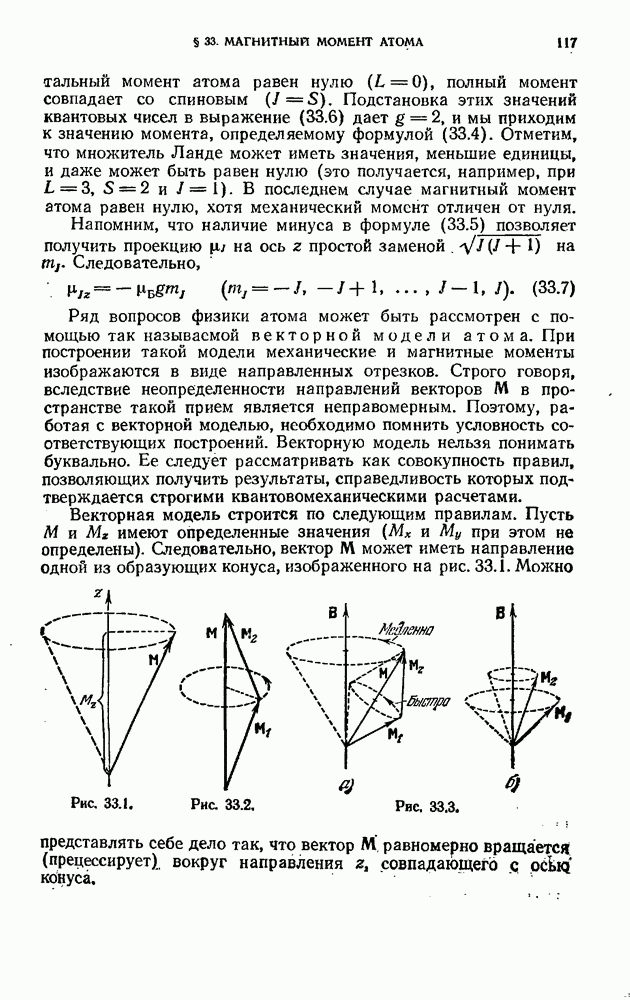
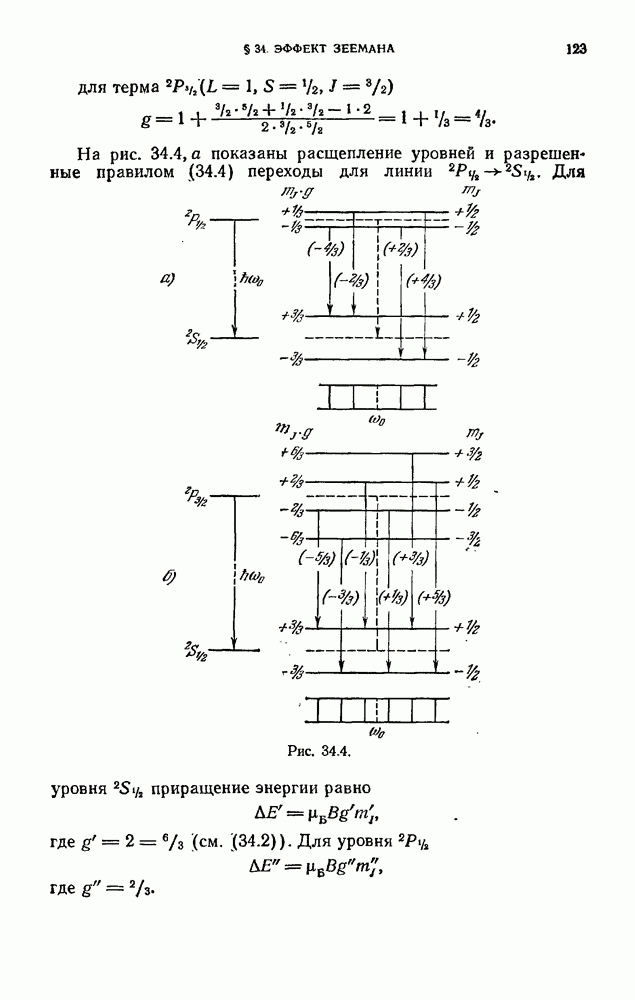
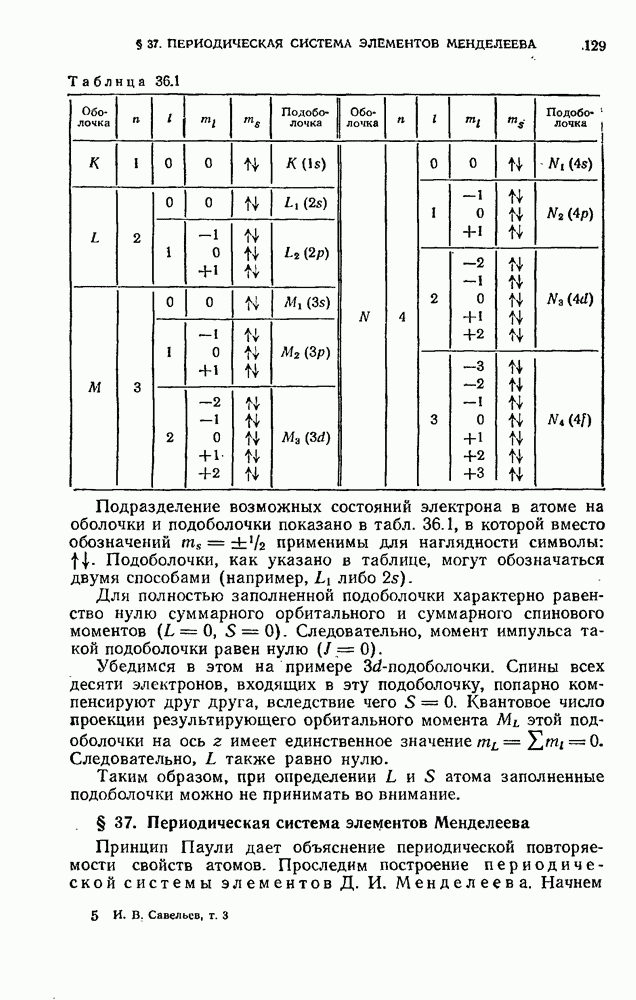
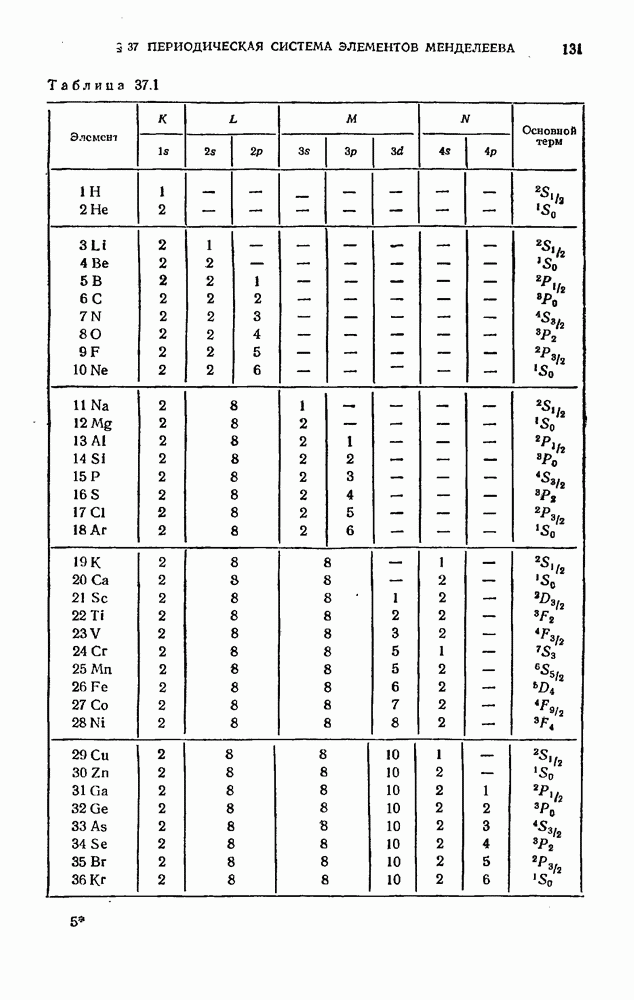
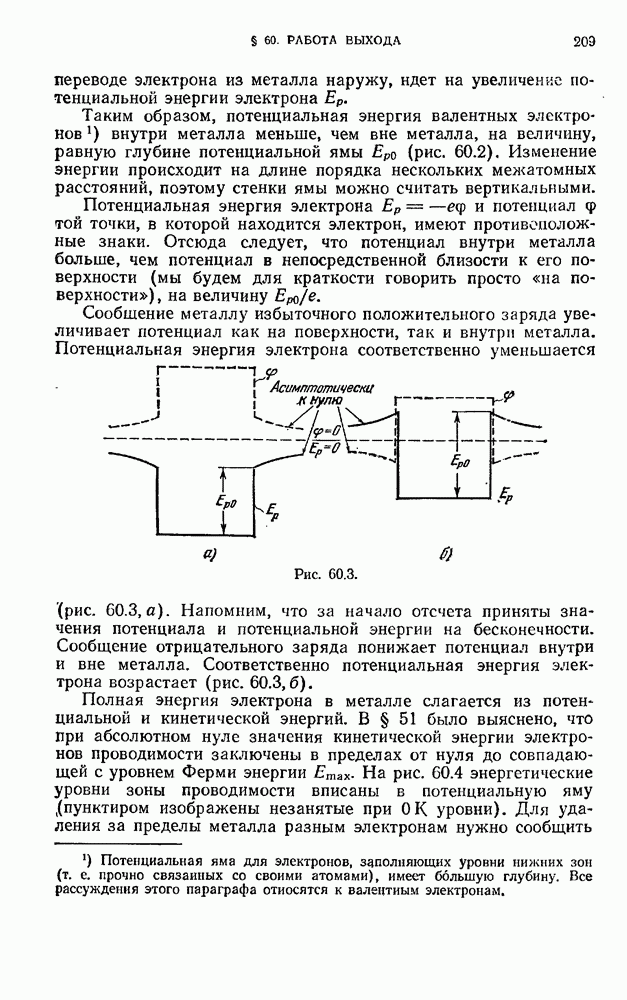
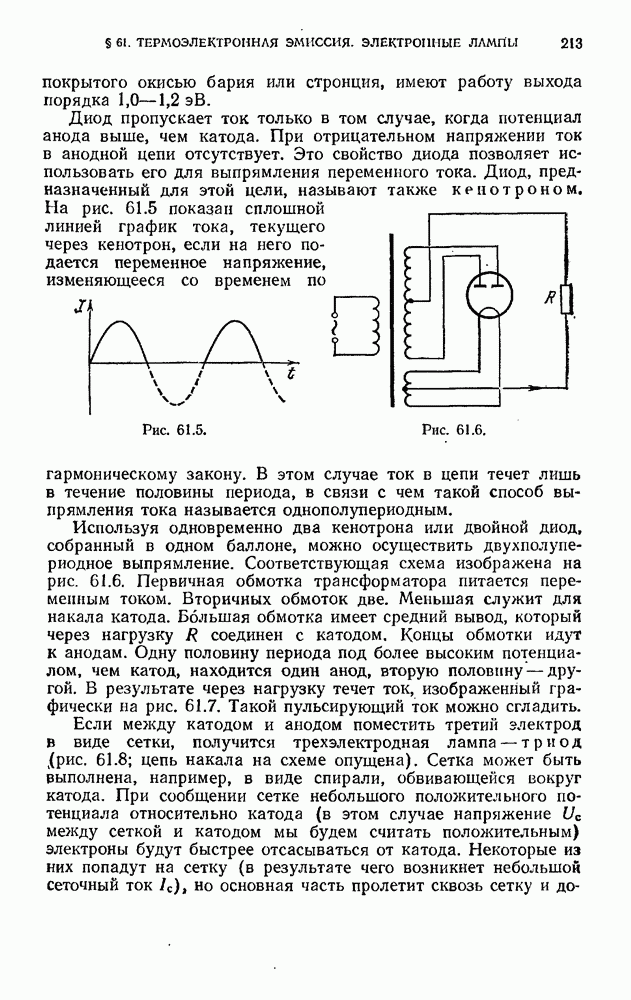
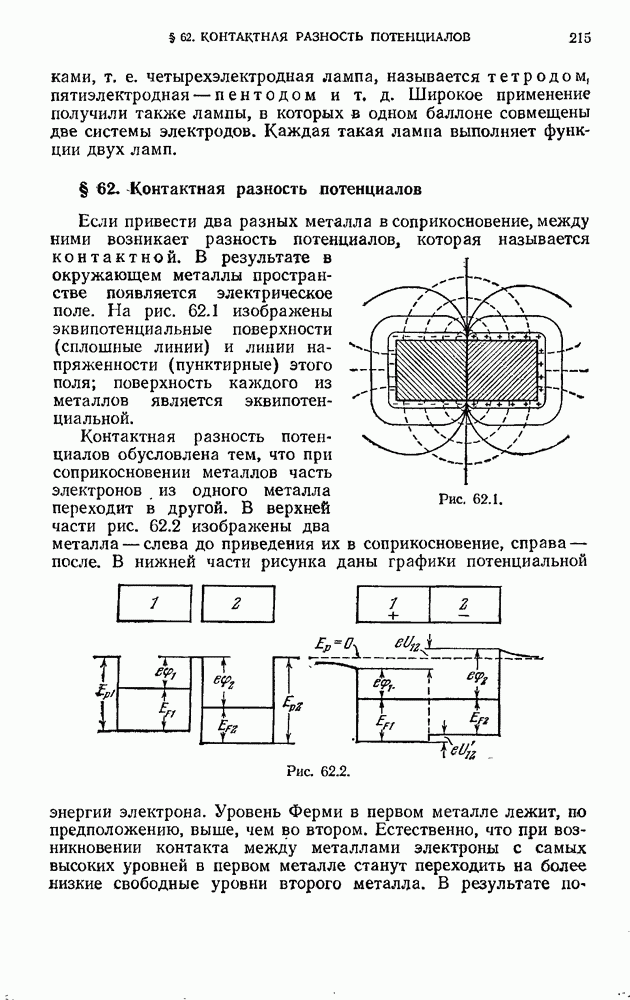
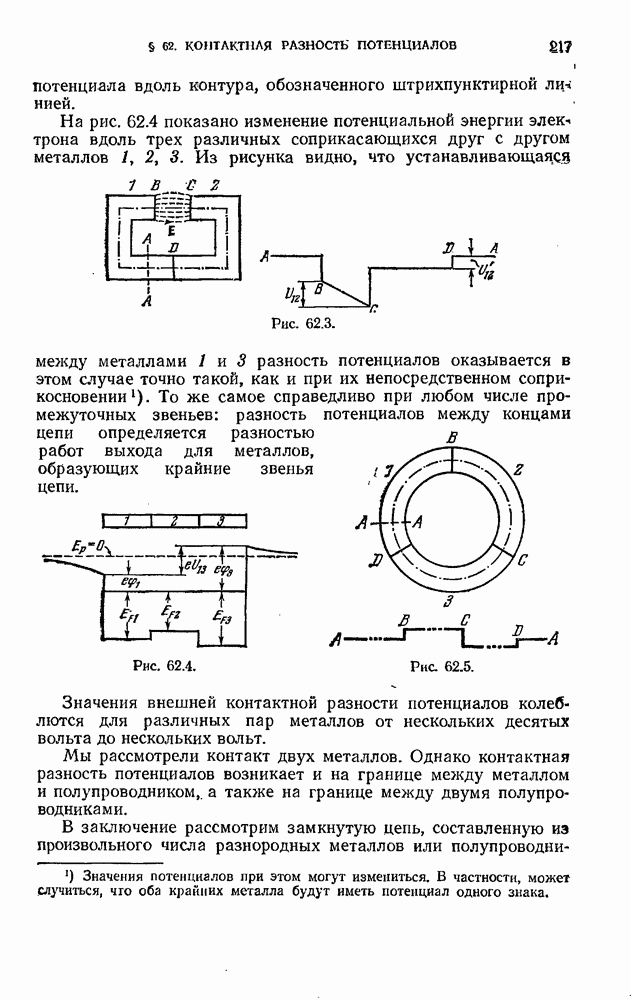
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ЧАСТЬ 2. АТОМНАЯ ФИЗИКА
ГЛАВА III. БОРОВСКАЯ ТЕОРИЯ АТОМА
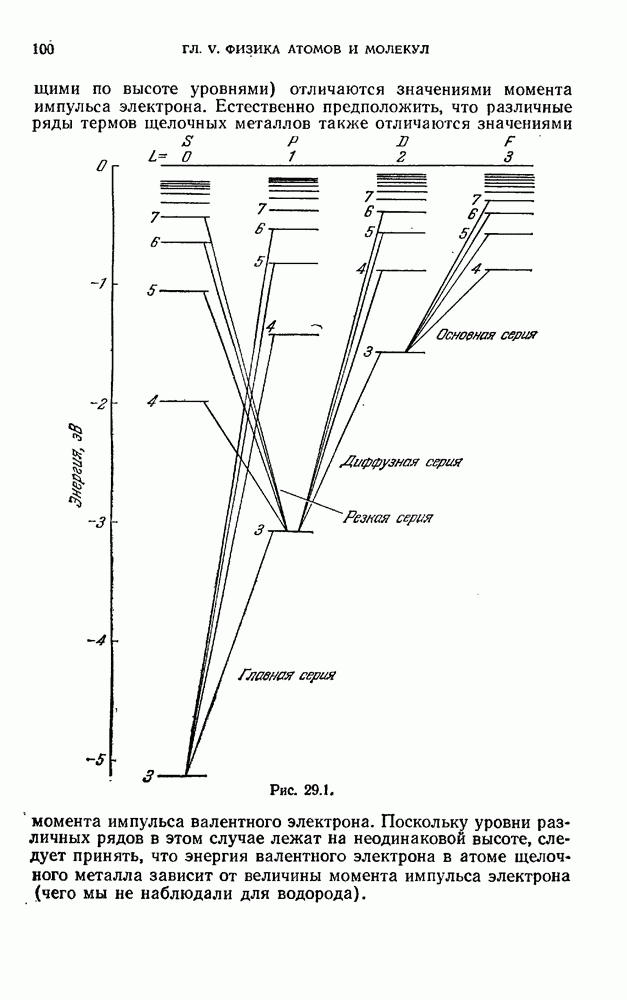
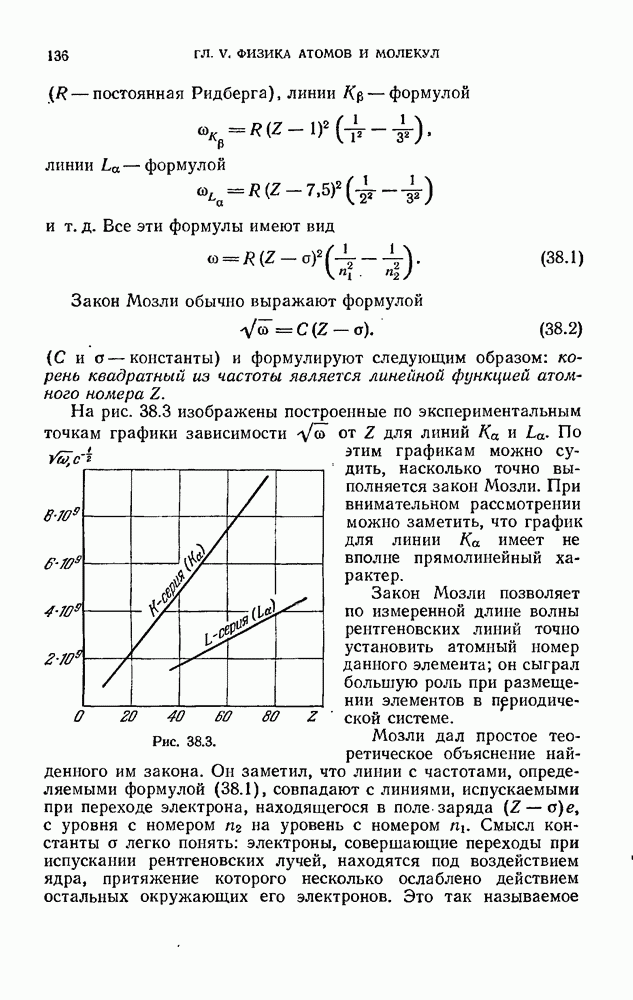
§ 12. Закономерности в атомных спектрах
Излучение невзаимодействующих друг с другом атомов состоит из отдельных спектральных линий. В соответствии с этим спектр испускания атомов называется линейчатым.

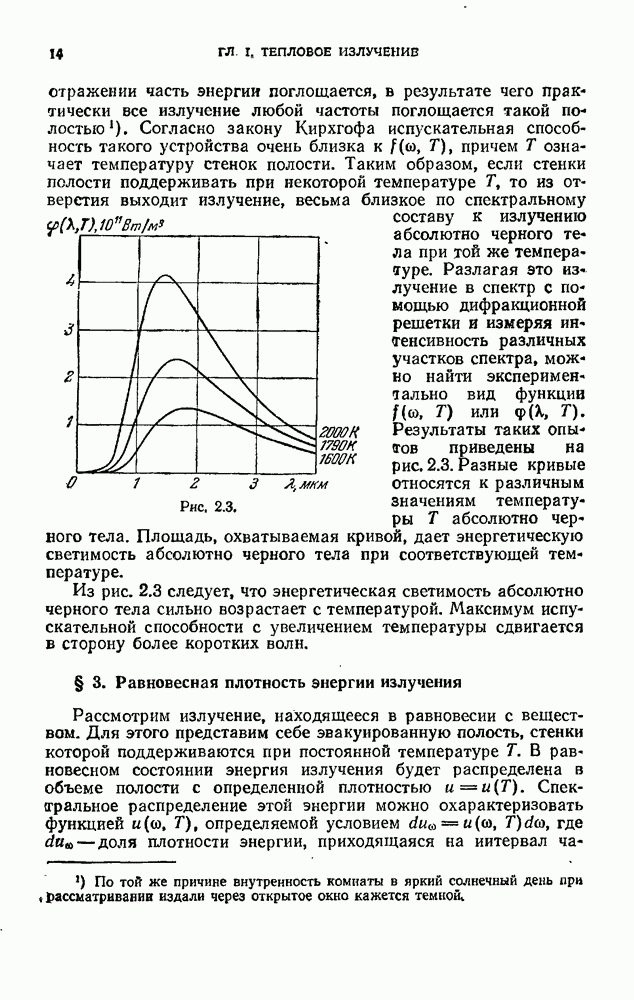
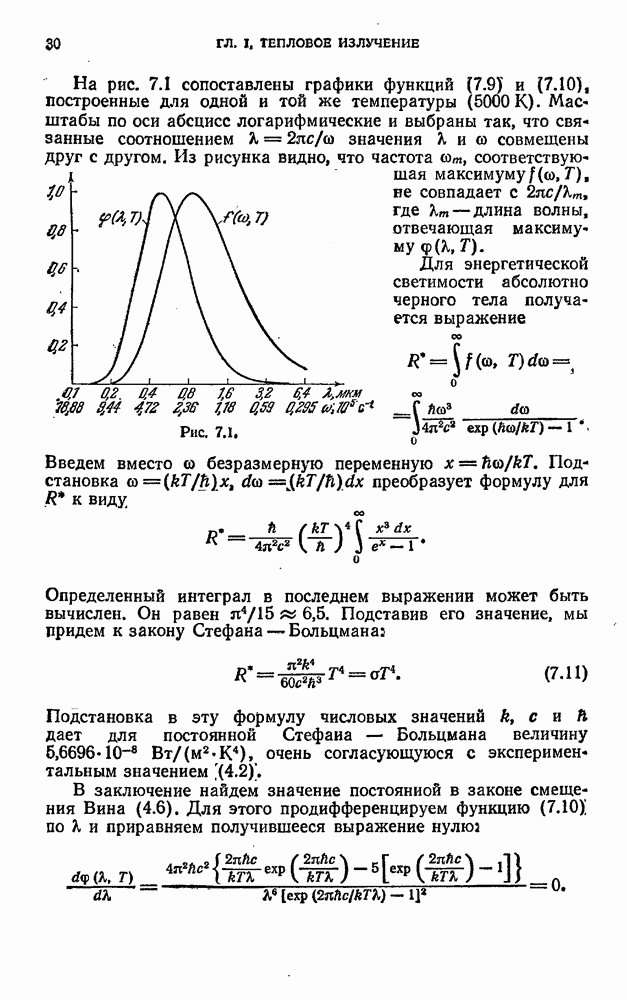
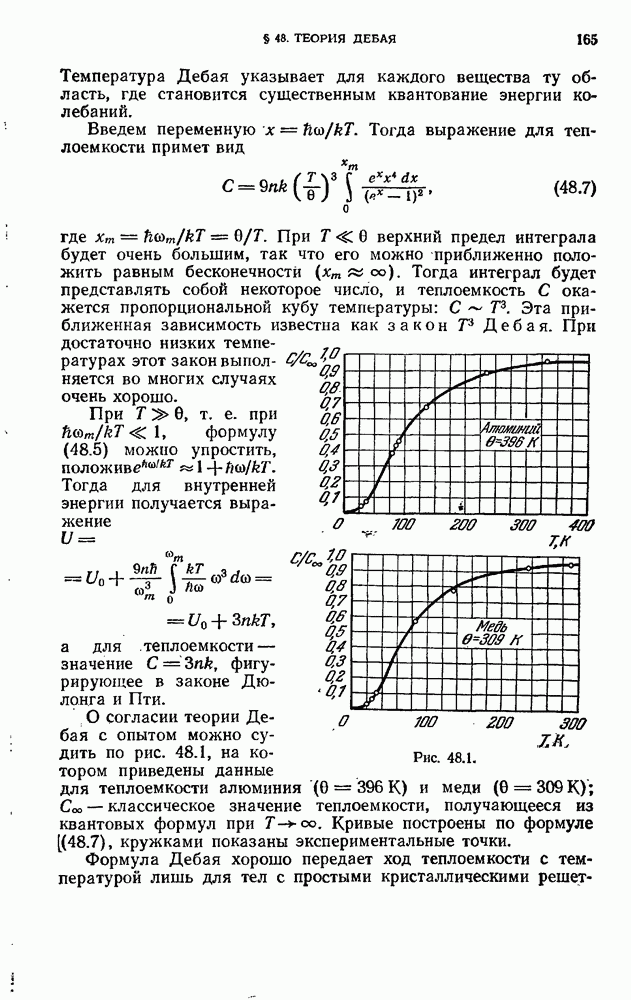
Рис. 12.1.
На рис. 12.1 показан спектр испускания паров ртути. Такой же характер имеют и спектры других атомов.
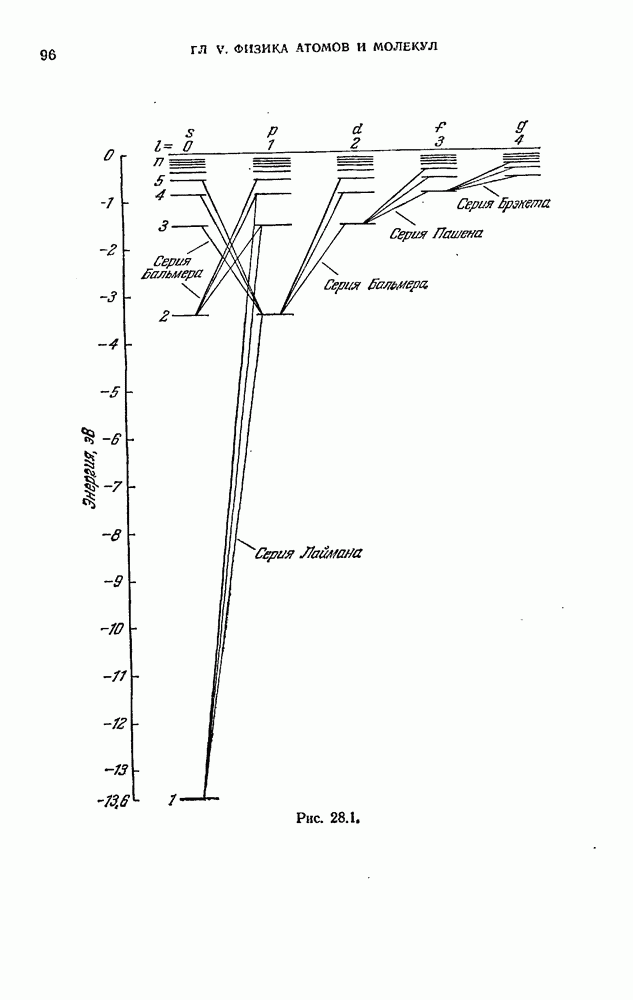
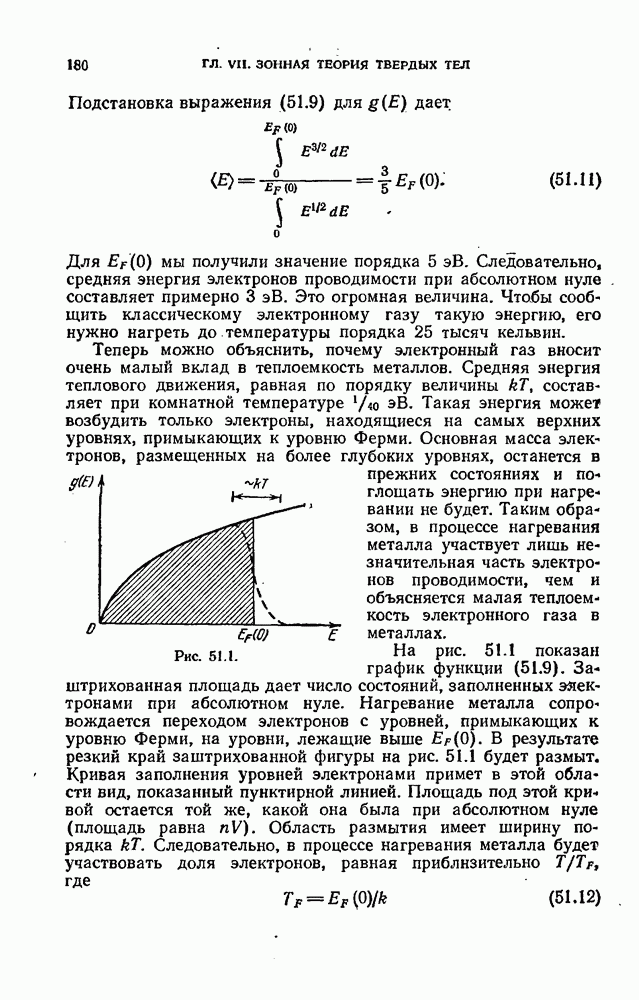
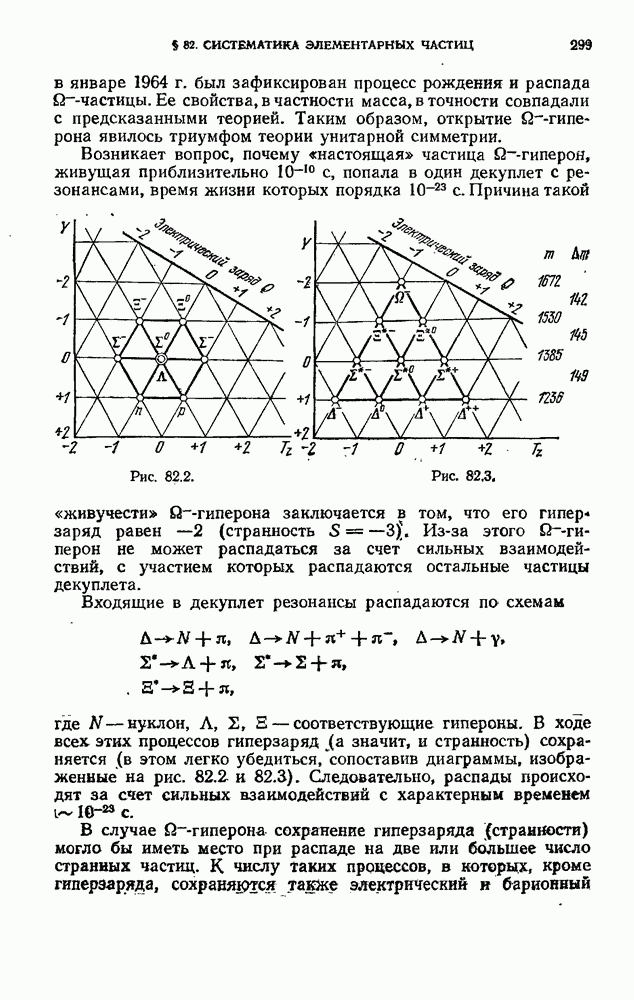
Изучение атомных спектров послужило ключом к позианию строения атомов. Прежде всего было замечено, что линии в спектрах атомов расположены не беспорядочно, а объединяются в группы или, как их называют, серии линий. Отчетливее всего это обнаруживается в спектре простейшего атома — водорода. На рис. 12.2 представлена часть спектра атомарного водорода в видимой и близкой ультрафиолетовой области. Символами  обозначены видимые линии,
обозначены видимые линии,  указывает границу серии (см. ниже). Очевидно, что линии располагаются в определенном порядке. Расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким.
указывает границу серии (см. ниже). Очевидно, что линии располагаются в определенном порядке. Расстояние между линиями закономерно убывает по мере перехода от более длинных волн к более коротким.
Швейцарский физик Бальмер (1885) обнаружил, что длины волн этой серии линий водорода могут быть точно представлены формулой

где  — константа,
— константа,  — целое число, принимающее значения 3, 4, 5 и т. д.
— целое число, принимающее значения 3, 4, 5 и т. д.
Если перейти в (12,1) от длины волны к частоте, получится формула

где  — константа, называемая в честь шведского спектроскописта постоянной Ридберга. Она равна
— константа, называемая в честь шведского спектроскописта постоянной Ридберга. Она равна


Рис. 12.2.
Формула (12.2) называется формулой Бальмера, а соответствующая серия спектральных линий водородного атома — серией Бальмера. Дальнейшие исследования показали, что в спектре водорода имеется еще несколько серий. В ультрафиолетовой части спектра находится серия Лаймана. Остальные серии лежат в инфракрасной области. Линии этих серий могут быть представлены в виде формул, аналогичных (12.2):

Частоты всех линий спектра водородного атома можно представить одной формулой:

где  имеет значение 1 для серии Лаймана, 2— для серии Бальмера и т. д. При заданном
имеет значение 1 для серии Лаймана, 2— для серии Бальмера и т. д. При заданном  число
число  принимает все целочисленные значения, начиная с
принимает все целочисленные значения, начиная с  Выражение (12.4) называют обобщенной формулой Бальмера.
Выражение (12.4) называют обобщенной формулой Бальмера.
При возрастании  частота линии в каждой серии стремится к предельному значению
частота линии в каждой серии стремится к предельному значению  которое называется границей серии (на рис. 12.2 символом
которое называется границей серии (на рис. 12.2 символом  отмечена граница серии Бальмера).
отмечена граница серии Бальмера).
Возьмем ряд значений выражения 

Частота любой линии спектра водорода может быть представлена в виде разности двух чисел ряда (12.5). Эти числа называют спектральными термами или просто термами. Так, например, частота первой линии серии Бальмера равна  второй линии серии Пфунда
второй линии серии Пфунда  и т. д.
и т. д.
Изучение спектров других атомов показало, что частоты линий и в этом случае могут быть представлены в виде разностей двух термов:

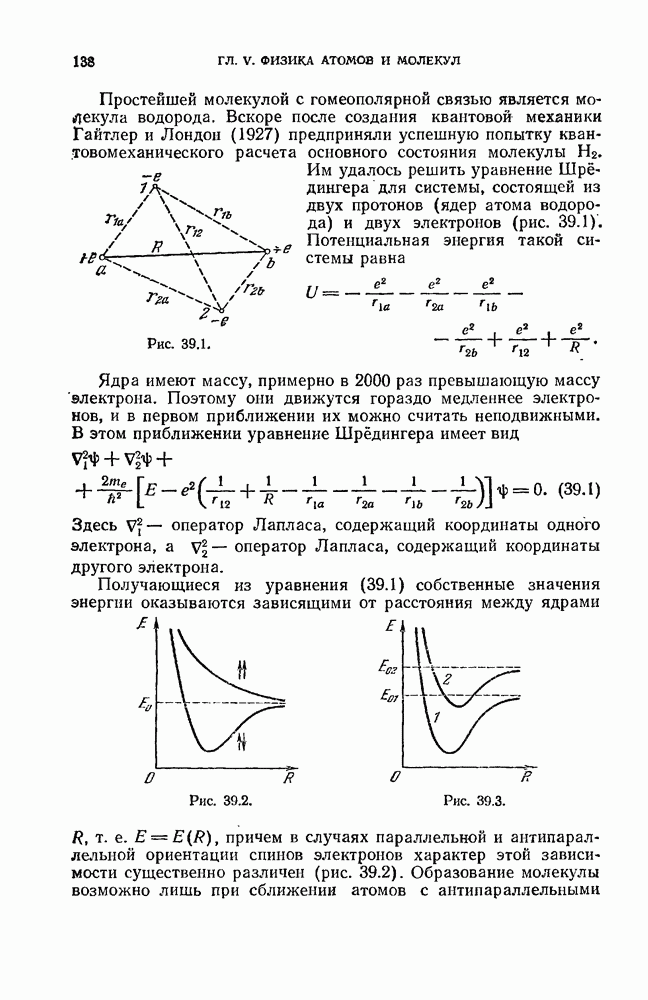
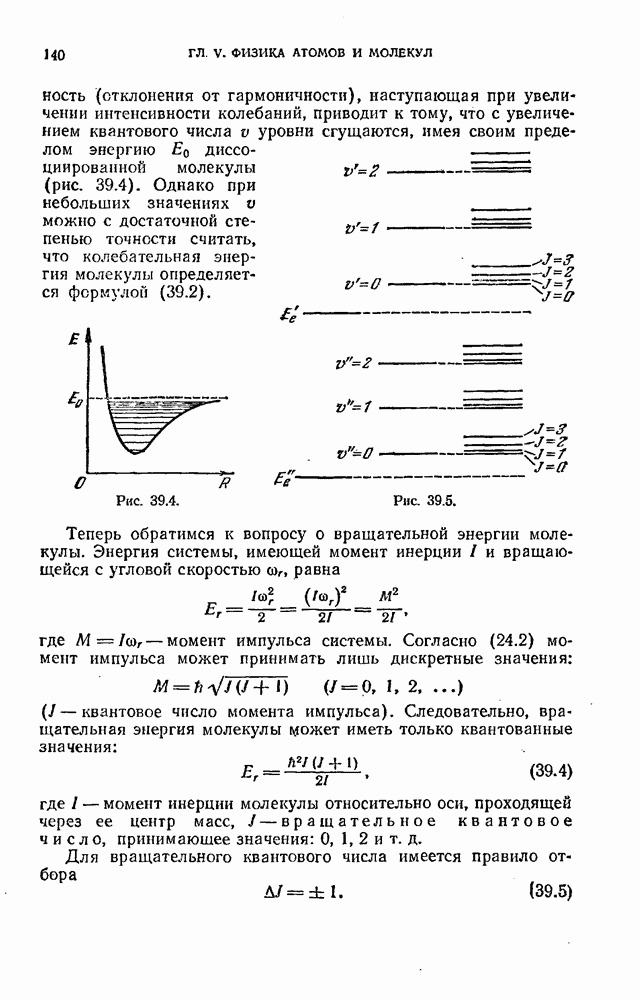
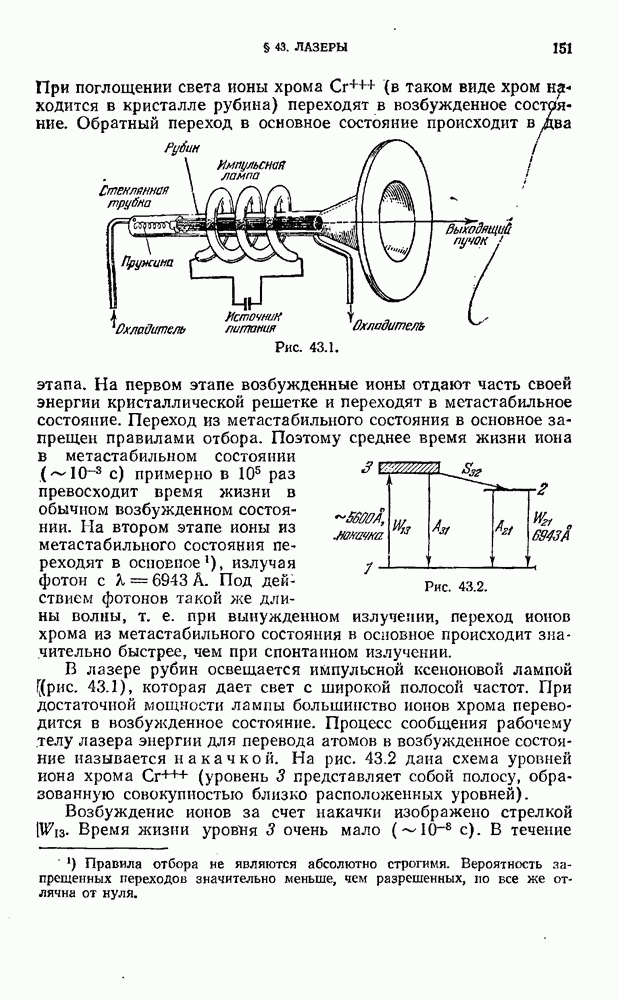
Однако терм  обычно имеет более сложный вид, чем для водородного атома. Кроме того, первый и второй члены формулы (12.6) берутся из различных рядов термов.
обычно имеет более сложный вид, чем для водородного атома. Кроме того, первый и второй члены формулы (12.6) берутся из различных рядов термов.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
- ЧАСТЬ 1. КВАНТОВАЯ ОПТИКА
- § 1. Тепловое излучение и люминесценция
- § 2. Закон Кирхгофа
- § 3. Равновесная плотность энергии излучения
- § 4. Закон Стефана — Больцмана и закон Вина
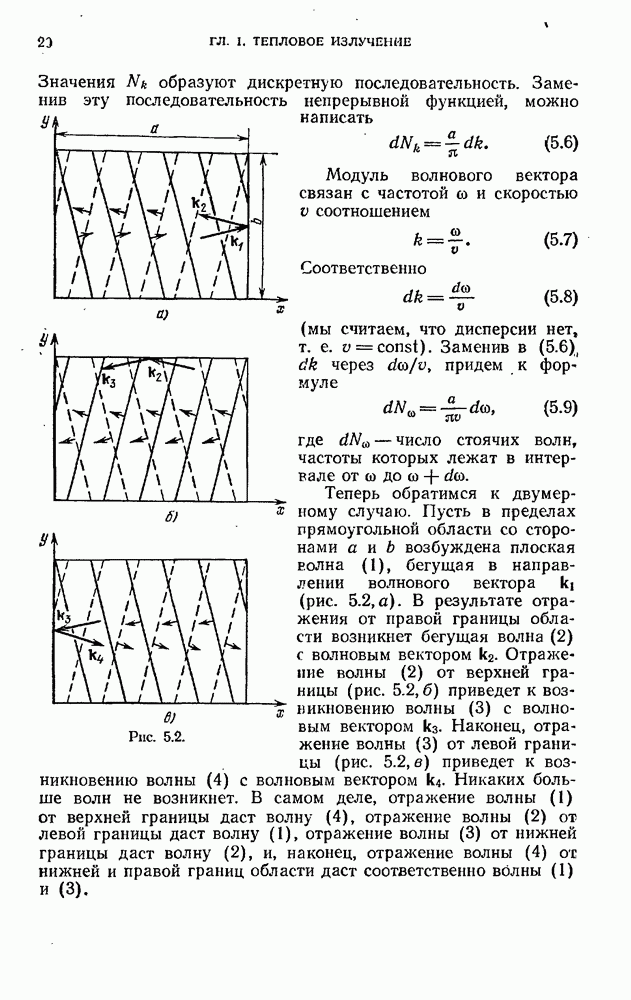
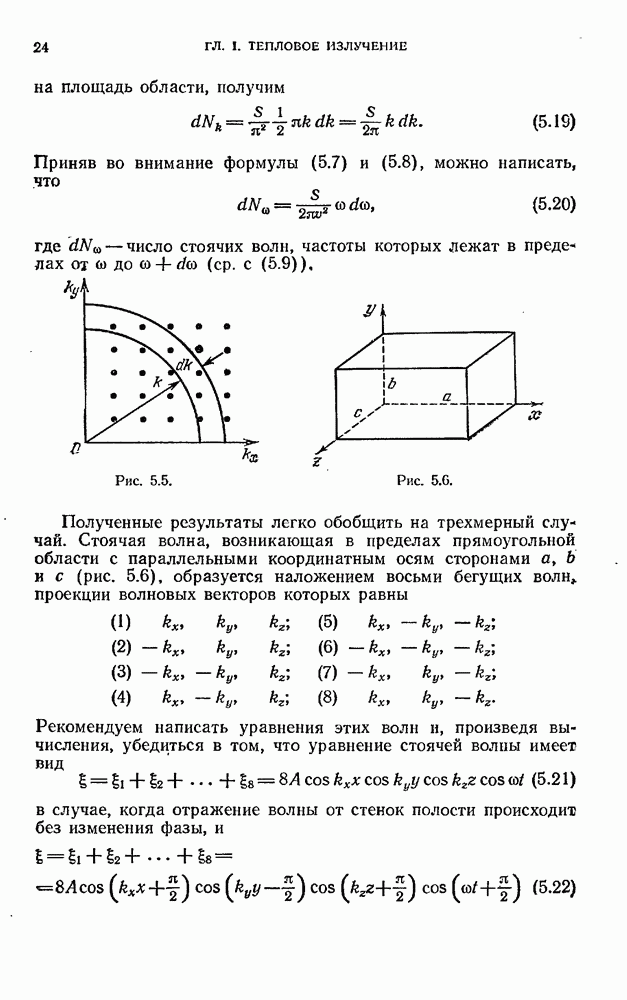
- § 5. Стоячие волны в пространстве трех измерений
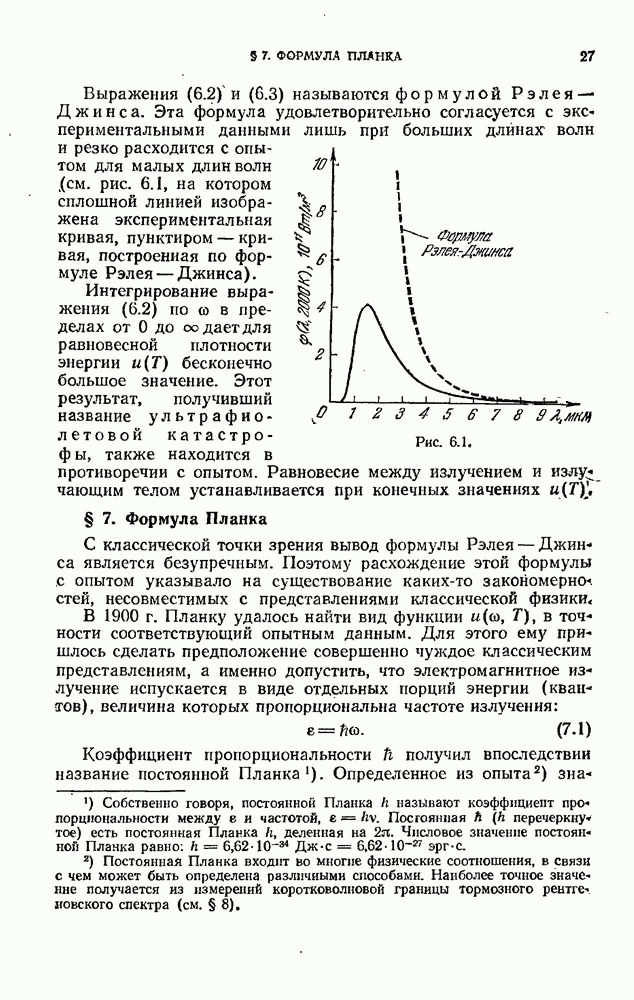
- § 6. Формула Рэлея — Джинса
- § 7. Формула Планка
- ГЛАВА II. ФОТОНЫ
- § 8. Тормозное рентгеновское излучение
- § 9. Фотоэффект
- § 10. Опыт Боте. Фотоны
- § 11. Эффект Комптона
- ЧАСТЬ 2. АТОМНАЯ ФИЗИКА
- § 12. Закономерности в атомных спектрах
- § 13. Модель атома Томсона
- § 14. Опыты по рассеянию а-частиц. Ядерная модель атома
- § 15. Постулаты Бора. Опыт Франка и Герца
- § 16. Правило квантования круговых орбит
- § 17. Элементарная боровская теория водородного атома
- ГЛАВА IV. ЭЛЕМЕНТЫ КВАНТОВОЙ МЕХАНИКИ
- § 18. Гипотеза де-Бройля. Волновые свойства вещества
- § 19. Необычные свойства микрочастиц
- § 20. Принцип неопределенности
- § 21. Уравнение Шрёдингера
- § 22. Смысл пси-функции
- § 23. Квантование энергии
- § 24. Квантование момента импульса
- § 25. Принцип суперпозиции
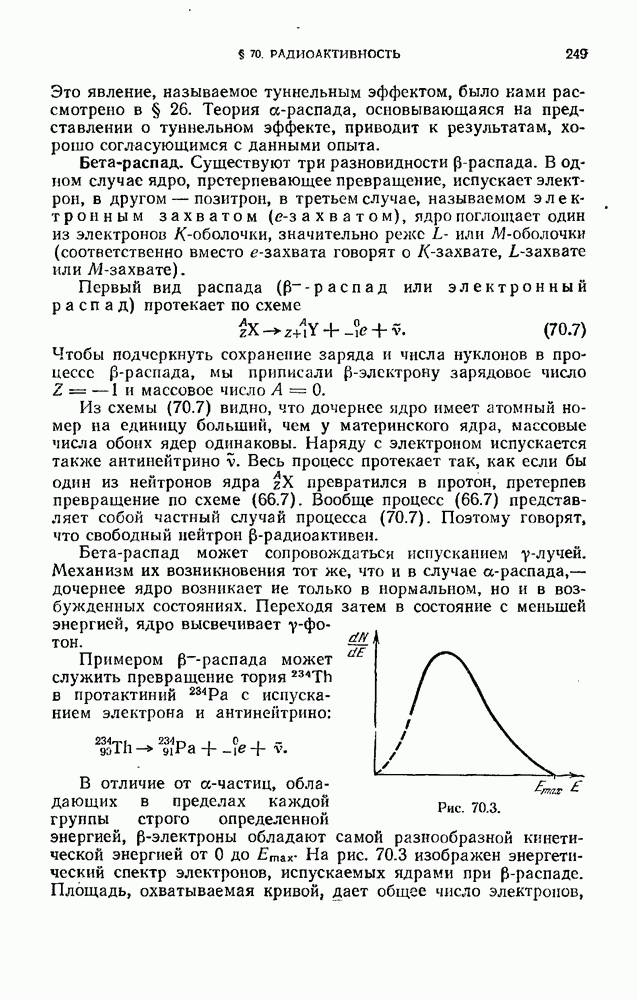
- § 26. Прохождение частиц через потенциальный барьер
- § 27. Гармонический осциллятор
- ГЛАВА V. ФИЗИКА АТОМОВ И МОЛЕКУЛ
- § 28. Атом водорода
- § 29. Спектры щелочных металлов
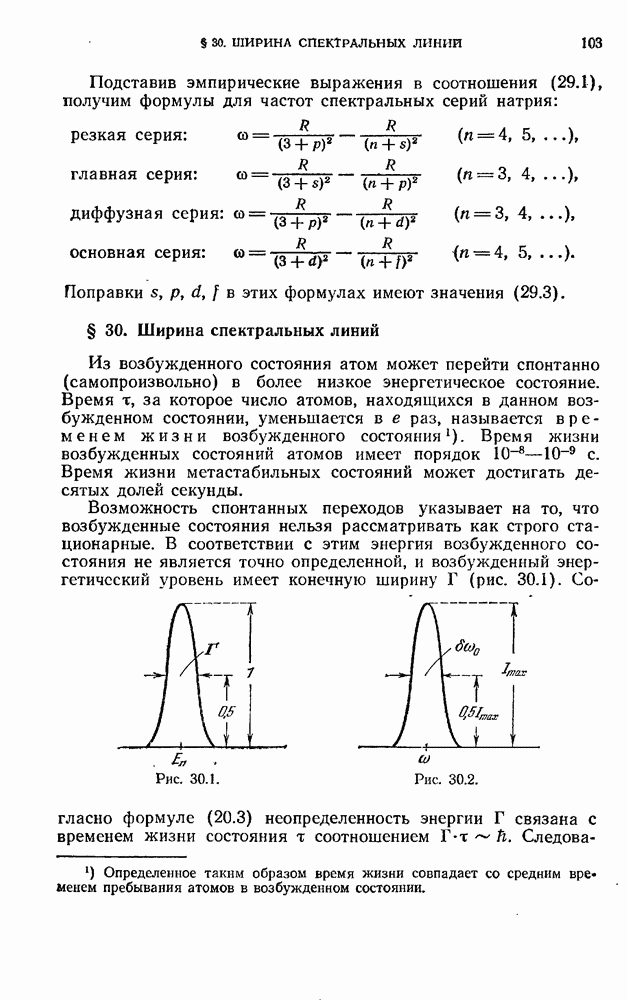
- § 30. Ширина спектральных линий
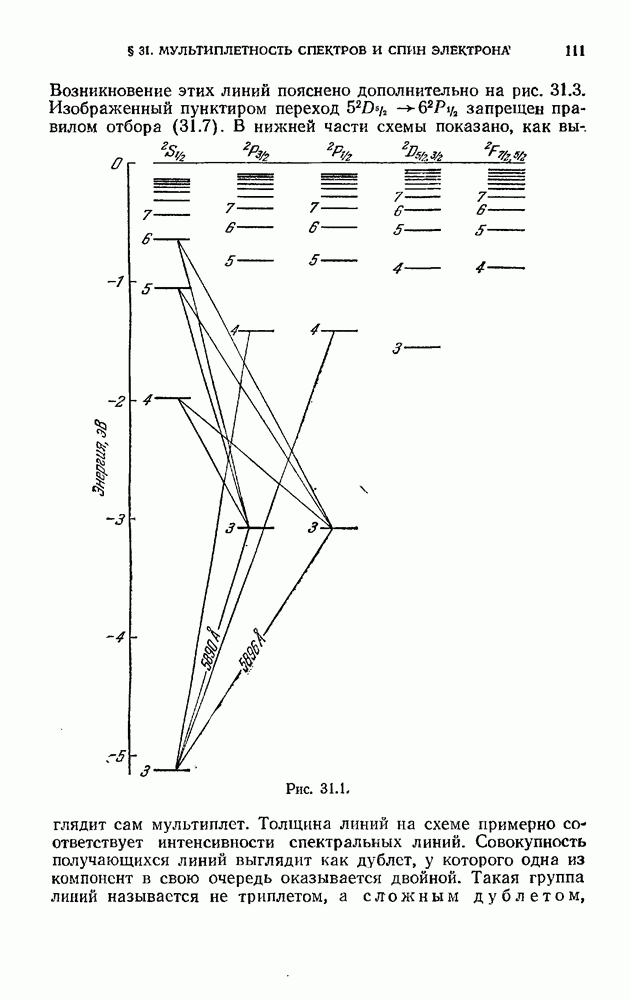
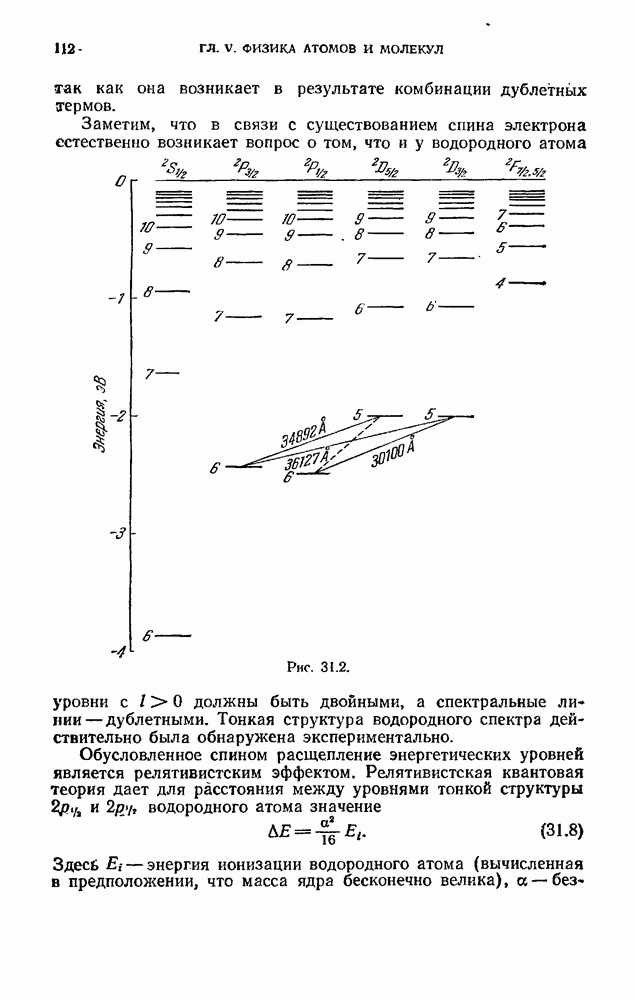
- § 31. Мультиплетность спектров и спин электрона
- § 32. Результирующий механический момент многоэлектронного атома
- § 33. Магнитный момент атома
- § 34. Эффект Зеемана
- § 35. Электронный парамагнитный резонанс
- § 36. Принцип Паули. Распределение электронов по энергетическим уровням атома
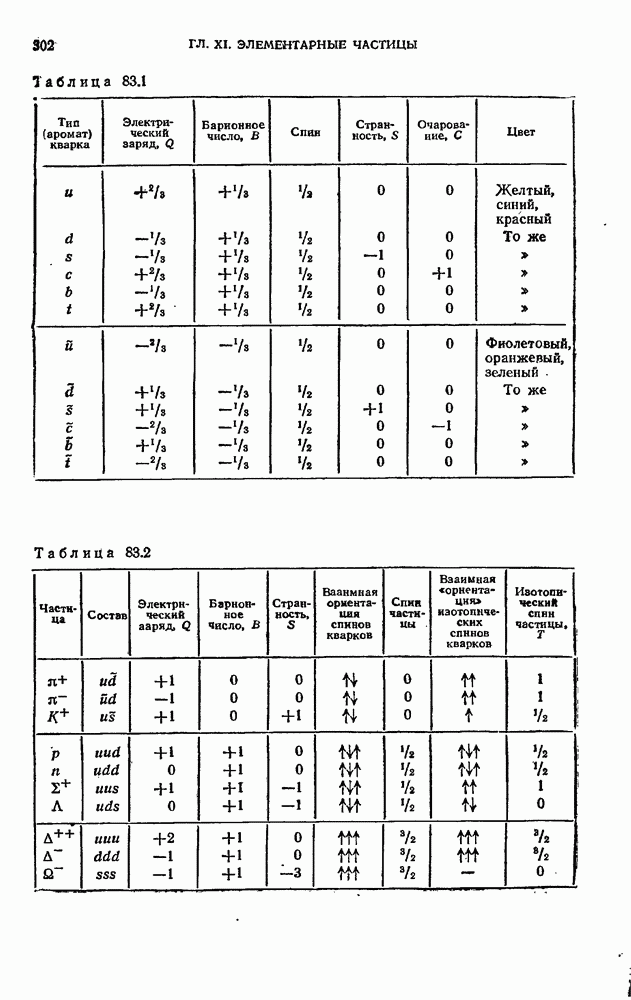
- § 37. Периодическая система элементов Менделеева
- § 38. Рентгеновские спектры
- § 39. Энергия молекулы
- § 40. Молекулярные спектры
- § 41. Комбинационное рассеяние света
- § 42. Вынужденное излучение
- § 43. Лазеры
- § 44. Нелинейная оптика
- ЧАСТЬ 3. ФИЗИКА ТВЕРДОГО ТЕЛА
- § 45. Кристаллическая решетка. Индексы Миллера
- § 46. Теплоемкость кристаллов. Теория Эйнштейна
- § 47. Колебания систем с большим числом степеней свободы
- § 48. Теория Дебая
- § 49. Фононы
- § 50. Эффект Мёссбауэра
- ГЛАВА VII. ЗОННАЯ ТЕОРИЯ ТВЕРДЫХ ТЕЛ
- § 51. Квантовая теория свободных электронов в металле
- § 52. Распределение Ферми — Дирака
- § 53. Энергетические зоны в кристаллах
- § 54. Динамика электронов в кристаллической решетке
- ГЛАВА VIII. ЭЛЕКТРОПРОВОДНОСТЬ МЕТАЛЛОВ И ПОЛУПРОВОДНИКОВ
- § 55. Электропроводность металлов
- § 56. Сверхпроводимость
- § 57. Полупроводники
- § 58. Собственная проводимость полупроводников
- § 59. Примесная проводимость полупроводников
- ГЛАВА IX. КОНТАКТНЫЕ И ТЕРМОЭЛЕКТРИЧЕСКИЕ ЯВЛЕНИЯ
- § 60. Работа выхода
- § 61. Термоэлектронная эмиссия. Электронные лампы
- § 62. Контактная разность потенциалов
- § 63. Термоэлектрические явления
- § 64. Полупроводниковые диоды и триоды
- § 65. Внутренний фотоэффект
- ЧАСТЬ 4. ФИЗИКА АТОМНОГО ЯДРА И ЭЛЕМЕНТАРНЫХ ЧАСТИЦ
- § 66. Состав и характеристики атомного ядра
- § 67. Масса и энергия связи ядра
- § 68. Модели атомного ядра
- § 69. Ядерные силы
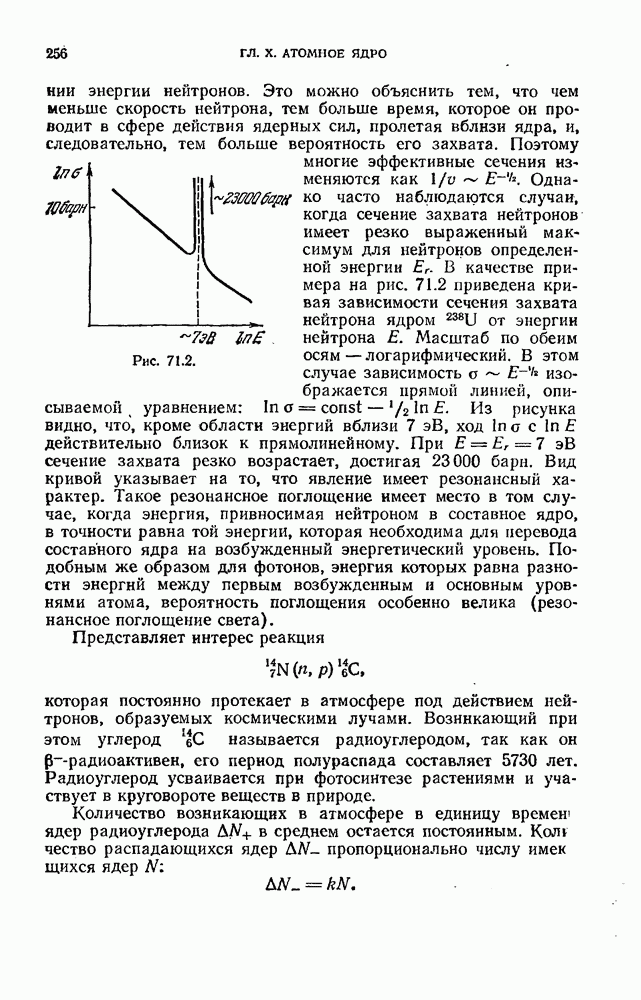
- § 70. Радиоактивность
- § 71. Ядерные реакции
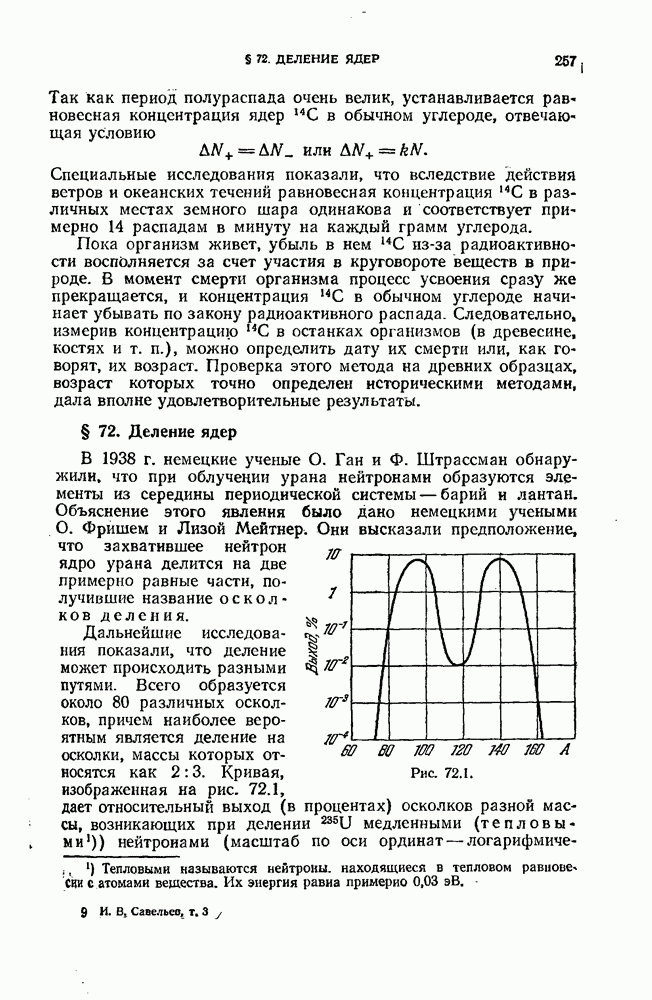
- § 72. Деление ядер
- § 73. Термоядерные реакции
- ГЛАВА XI. ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
- § 74. Виды взаимодействий и классы элементарных частиц
- § 75. Методы регистрации элементарных частиц
- § 76. Космические лучи
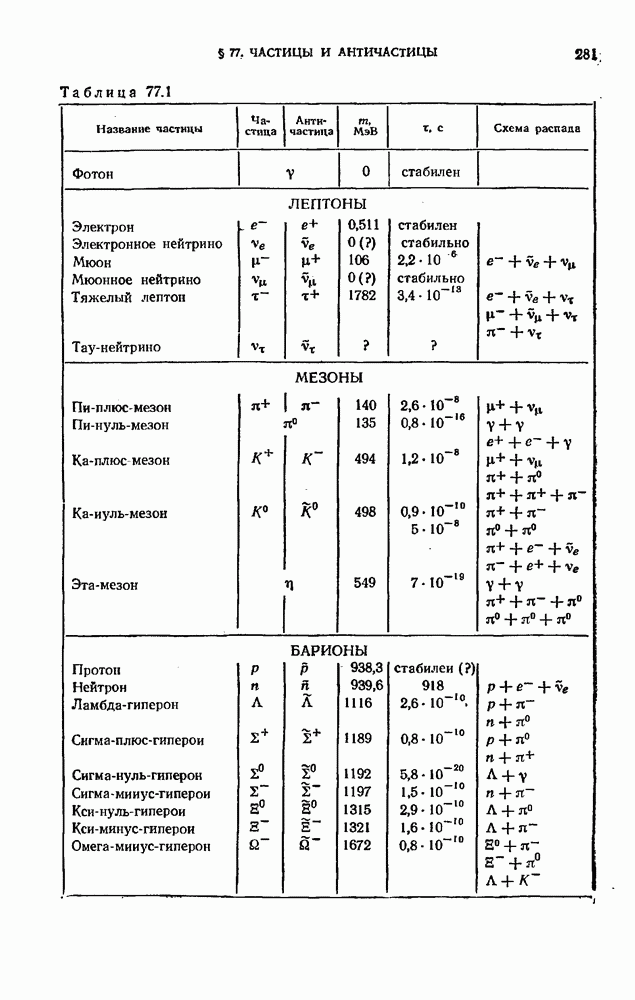
- § 77. Частицы и античастицы
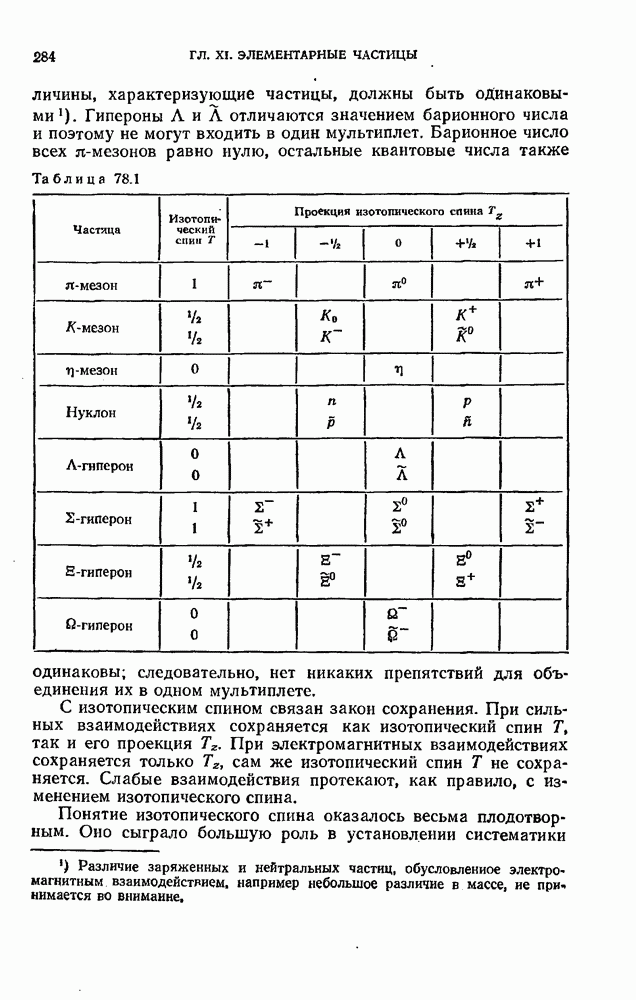
- § 78. Изотопический спин
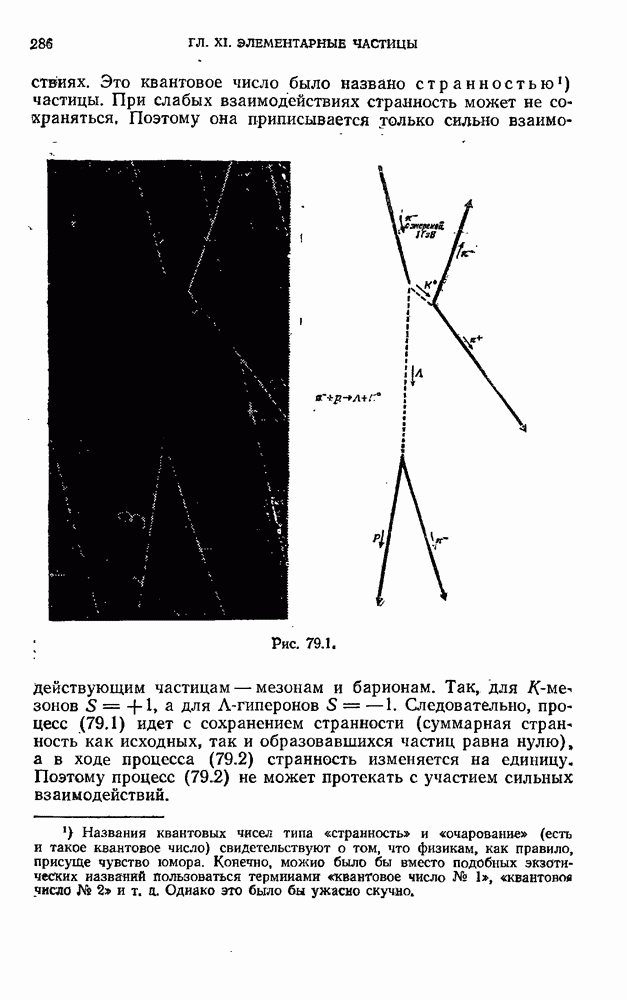
- § 79. Странные частицы
- § 80. Несохранение четности в слабых взаимодействиях
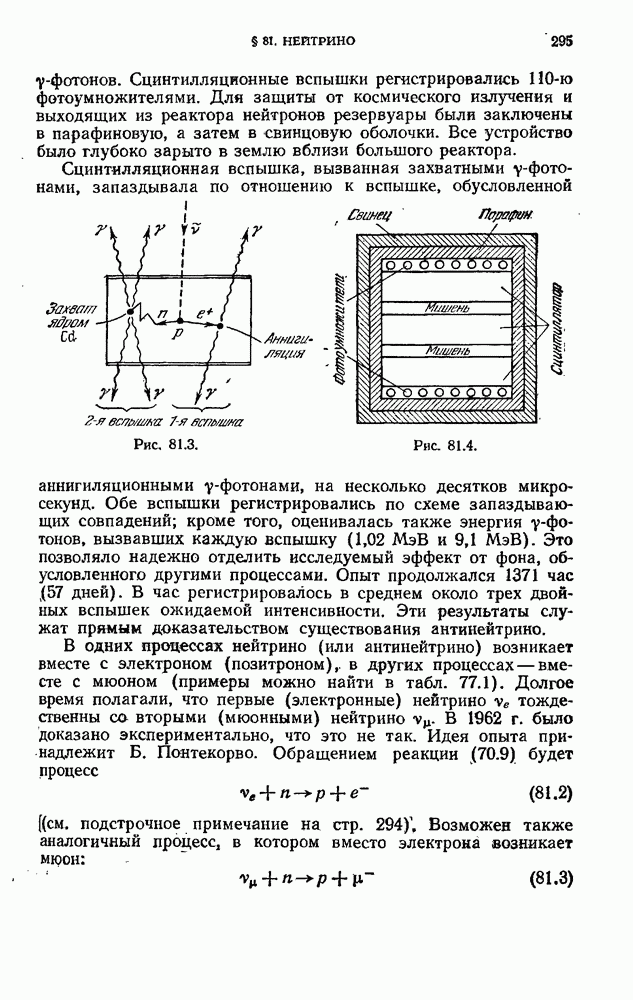
- § 81. Нейтрино
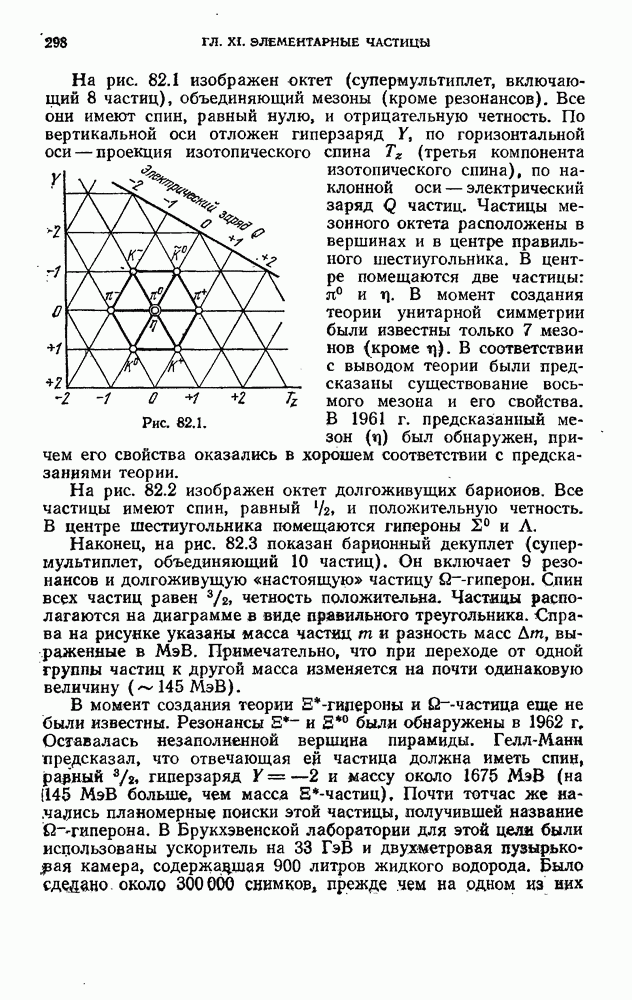
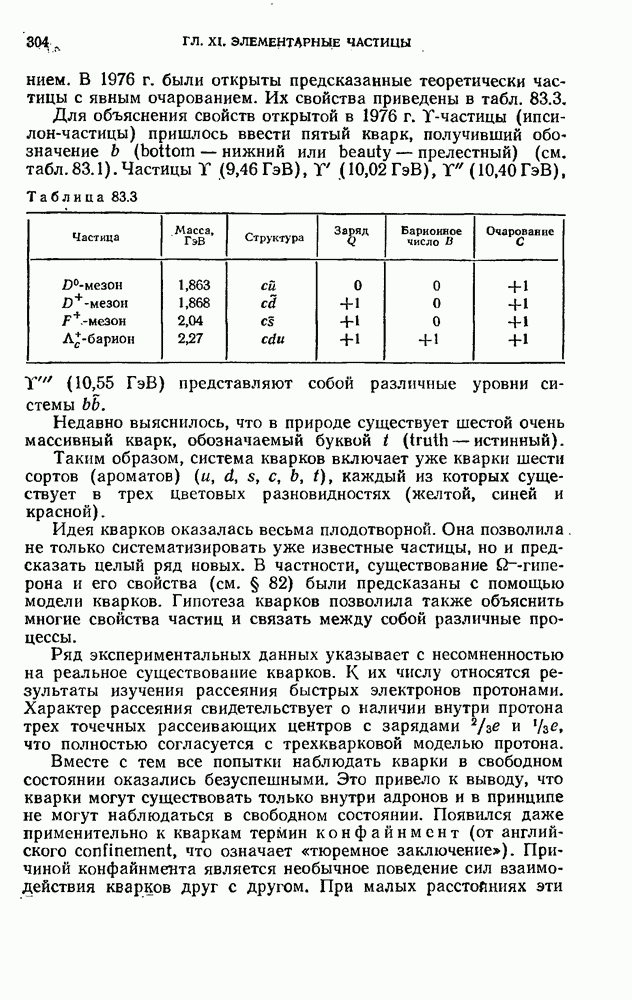
- § 82. Систематика элементарных частиц
- § 83. Кварки
- § 84. Великое объединение
- ПРИЛОЖЕНИЯ
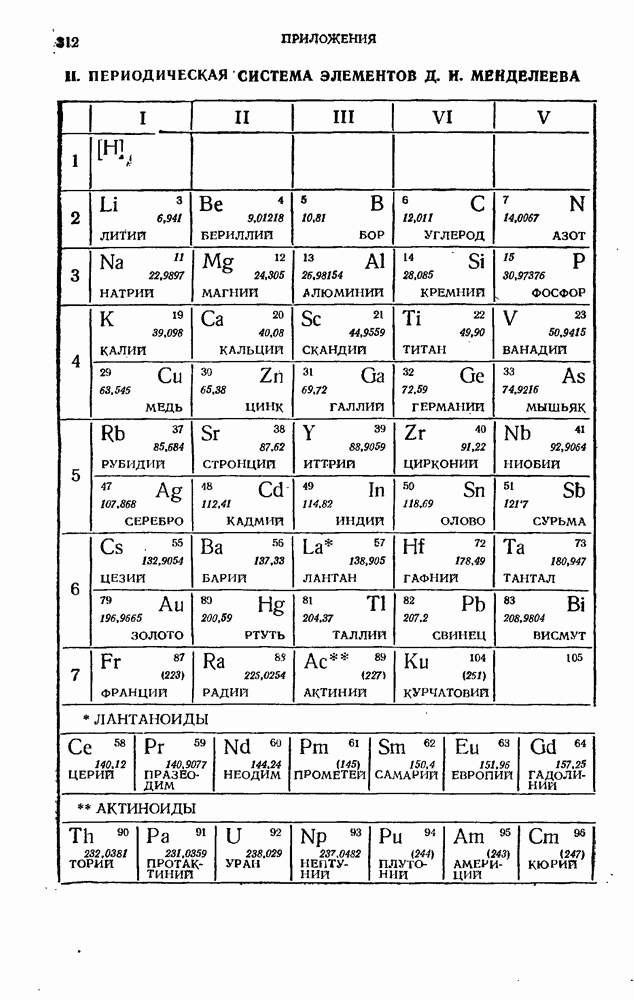
- I. ГРАВИТАЦИОННОЕ ВЗАИМОДЕЙСТВИЕ