| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Непредельные кислоты
Строение, номенклатура. Одноосновные непредельный (ненасыщенные) кислоты наиболее часто носят исторически сложившиеся названия.
Простейщая кислота этиленового ряда называется акриловой кислотой:

Следующий представитель этого, ряда, содержащий 4 углеродных атома, может существовать уже в трек изомерных
формах:

Положение двойной связи в непредельных кислотах по отношению к карбоксильной группе обозначается буквами греческого алфавита, указывающими места атомов углерода, между которыми находится двойная связь, с добавлением слов непредельная кислота. Так, например, винилуксусная кислота является  — непредельной кислотой, а акриловая, кротоновая и метакриловая
— непредельной кислотой, а акриловая, кротоновая и метакриловая  - непредельными кислотами.
- непредельными кислотами.
Из структурных формул этих кислот видно, что изомерия непредельных кислот зависит от разветвленности уцепи углеродных атомов и положения двойной связи.
На примере непредельных органических кислот мы познакомимся еще с одним бидом изомерии, которой обладают различные непредельные органические соединения — геометрической изомерией (или, как ее часто называют, цис-транс-изомерией).

Рис. 16. Модель молекулы этана.
Если изобразить пространственное строение молекулы предельного углеводорода этана, то можно видеть, что валентности углеродных атомов этана расположены не в одной плоскости, а под некоторым углом друг к другу (рис. 16).
В молекуле этана возможно свободное вращение атомов углерода вокруг направления ординарной связи  без ее разрыва. Ясно, что как бы ни перемещались при этом атомы водорода вокруг связи
без ее разрыва. Ясно, что как бы ни перемещались при этом атомы водорода вокруг связи  мы всегда будем иметь одно и то же строение.
мы всегда будем иметь одно и то же строение.
Рассмотрим теперь пространственное строение молекулы кротонойой кислоты 
В молекуле кротоновой кислоты свободное вращение атомов углерода, как в молекуле этана, уже невозможно, так как при этом произошел бы разрыв двойной связи между углеродными атомами.
Если в пространственной модели кротоновой кислоты (рис. 17, а) мы Переменим местами правый водород и карбоксильную группу так, чтобы водород находился под плоскостью двойной связи, а карбоксильная группа над плоскостью, то получим иную пространственную мрдель (рис. 17, б).
Эти две пространственные модели отличаются друг от друга тем, что в первой из них оба атома водорода находятся по одну сторону от плоскости, проходящей черёз углеродные атомы и двойную связь, а во второй — по разные стороны от нее. Может показаться, что будет еще третий изомер кротоновой кислоты, если в первой пространственной модели поменять местами атом водорода и метильную группу (рис. 17,в). Однако нетрудно убедиться, что эта модель совершенно аналогична второй, если всю молекулу, изображенную последней пространственной моделью, повернуть вокруг плоскости двойной связи на 180°.

Рис. 17. Пространственные модели молекулы кротоновой кислоты.
Для удобства условились при изображении пространственных моделей пользоваться так называемыми проекционными формулами, которые получаются при проектировании пространственных моделей на плоскость. Тогда формулы кротоновой кислоты будут иметь вид:

Такие формулы часто изображают несколько иначе, располагая атомы углерода по вертикали:

Изомеры, у которых одинаковые атомы или атомные группы (в данном случае атомы водорода) направлены в одну сторону от плоскости двойной связи, называются цис-изомерами, если эти заместители направлены в разный стороны, — транс-изомерами.
Таким образом, геометрическая йзомерия является одним из видов пространственной изомерии и зависит от расположения атомов или групп атомов по отношению к плоскости двойной связи.
Пространственные изомеры отличаются между собой и по свойствам. Так, например, кротоновая кислота (транс-изомер) представляет собой твердое вещество с темп.  изокротоновая кислбта (цис-изомер) — при обычных условиях жидкость с темп.
изокротоновая кислбта (цис-изомер) — при обычных условиях жидкость с темп. 
Обычно один из пространственных изомеров бывает устойчивым (стабильным), а другой — неустойчивым (лабильным), причем неустойчивый изрмер под влиянием нагревания, света или химических воздействий легко переходит в устойчивый изомер. Так, изокротоновая кислота весьма неустойчива и легко переходит при повышенной температуре и при действии солнечного света в устойчивую кротоновую кислоту.
Свойства. Низшие представители непредельных кислот — жидкости с резким запахом, хорошо растворимые в воде. Высшие непредельные кислоты — твердые вещества, без запаха, нерастворимые в воде.
Для непредельных кислот характерно большинство реакций кислот предельного ряда (образование солей, сложных эфиров, ангидридов, галоидпроизводных и т. д.) и, кроме того, ряд реакций, свойственных непредельным углеводородам.
При присоединении водорода в присутствии катализаторов из ненасыщенной кислоты образуется кислота предельного ряда:

При энергичном окислении углеродная цепь непредельной кислоты разрывается по месту двойной связи, и получаются обычцо две кислоты — одноосновная и двухосновная:

При нагревании  -непредельных кислот с разбавленными минеральными кислотами образуются так называемые лактоны — внутренние циклические эфиры оксикислот (см. стр. 169).
-непредельных кислот с разбавленными минеральными кислотами образуются так называемые лактоны — внутренние циклические эфиры оксикислот (см. стр. 169).
Например, из винилуксусной кислоты в этих условиях образуется у-бутиролактон:

Существуют и другие способы получения лактонов.
Способы получения непредельных кислот аналогичны способам получения предельных кислот. Так, например, непредельные кислоты получаются при осторожном окислении соответствующих непредельных спиртов и альдегидов:

Акриловая кислота  . Жидкость с резким запахом, тяжелее воды; темп.
. Жидкость с резким запахом, тяжелее воды; темп.  Из производных акриловой кислоты большое значение имеют ее нитрил (стр. 148) и различные эфиры. Ее можно получать из аллилового спирта.
Из производных акриловой кислоты большое значение имеют ее нитрил (стр. 148) и различные эфиры. Ее можно получать из аллилового спирта.
В настоящее время в промышленности акриловая кислота получается нагреванием этиленциангидрина с разбавленной серной кислотой: 

Метакриловая кислота  получается аналогичным способом из ацетонциангидрина
получается аналогичным способом из ацетонциангидрина  (стр. 153). Большое значение для изготовления органического стекла (стр. 326) имеет ее метиловый эфир (метилметакрилат).
(стр. 153). Большое значение для изготовления органического стекла (стр. 326) имеет ее метиловый эфир (метилметакрилат).
Олеиновая кислота. Ее строение выражается формулой  Это маслянистая жидкость (плотность
Это маслянистая жидкость (плотность  без запаха; темп.
без запаха; темп.  Вместе с пальмитиновой и стеариновой кислотами входит в состав жиров. Олеиновая кислота в особенно больших количествах входит в состав оливкового, миндального и подсолнечного масел.
Вместе с пальмитиновой и стеариновой кислотами входит в состав жиров. Олеиновая кислота в особенно больших количествах входит в состав оливкового, миндального и подсолнечного масел.
При восстановлении водородом в присутствии катализаторов превращается в кислоту предельного ряда — стеариновую. Этот процесс играет важную роль при производстве маргарина (стр. 139).
При действии небольших количеств азотистой кислоты олеиновая кислота превращается в твердый изомер — элаидиновую кислоту.
Олеиновая и элаидиновая кислоты являются цис-транс-изомерами:

Из непредельных кислот с двумя двойными связями наибольшее практическое значение имеет сорбиновая кислота. Благодаря эффективным бактерицидным свойствам и отсутствию какого-либо нежелательного побочного действия на организм человека и животных сорбиновая кислота и ее соли нашли применение в качестве консервирующих средств в пищевой и других отраслях промышленности.
Сорбиновая кислота получается взаимодействием кетена (стр. 134) с кротоновым альдегидом в присутствии бутирата цинка. При этой реакции образуется полиэфир 3-оксигексановой кислоты:

При обработке образующегося полиэфира соляной кислотой при 70 °С получается сорбиновая кислота:

| << Предыдущий параграф | Следующий параграф >> |
- ВВЕДЕНИЕ
- АЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ (АЛИФАТИЧЕСКИЕ, ИЛИ ЖИРНЫЕ, СОЕДИНЕНИЯ
- 1. ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
- 2. НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
- Углеводороды ряда этилена (олефины, алкены)
- Углеводороды ряда ацетилена (алкины)
- Углеводороды с двумя этиленовыми связями. (диолефины, диены)
- 3. НЕФТЬ. ПРИРОДНЫЕ ГАЗЫ И ГАЗЫ НЕФТЕПЕРАРАБОТКИ
- Природные газы и газы нефтепереработки как сырье для получения химических веществ
- 4. ГАЛОИДПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
- Галоидпроизводные этиленовых углеводородов
- 5. СПИРТЫ И ИХ ПРОИЗВОДНЫЕ
- Непредельные спирты
- Многоатомные спирты
- Простые эфиры
- Эпоксиды
- 6. ТИОСПИРТЫ И ТИОЭФИРЫ
- 7. АЛЬДЕГИДЫ И КЕТОНЫ
- 8. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
- Непредельные кислоты
- Галоидангидриды кислот
- Ангидриды кислот
- Сложные эфиры минеральных кислот
- Сложные эфиры карбоновых кислот
- Жиры
- Мыла
- Синтетические моющие средства
- Амиды кислот
- Нитрилы кислот
- Предельные двухосновные кислоты
- 9. СОЕДИНЕНИЯ ЦИАНА И ПРОИЗВОДНЫЕ УГОЛЬНОЙ КИСЛОТЫ
- Производные угольной кислоты
- 10. НИТРОСОЕДИНЕНИЯ
- 11. АМИНЫ
- Диамины
- 12. ЭЛЕМЕНТООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- Кремнийорганические соединения
- Фосфорорганические соединения
- Мышьякорганические соединения
- 13. ОКСИКИСЛОТЫ
- Двухосновные оксикислоты
- 14. АЛЬДЕГИДОКИСЛОТЫ И КЕТОНОКИСЛОТЫ
- 15. УГЛЕВОДЫ (САХАРА)
- Простые углеводы (моносахариды, монозы)
- Сложные углеводы (полисахариды)
- 16. АМИНОКИСЛОТЫ
- ЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- 17. АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- Терпены
- 18. АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
- Ароматические углеводороды ряда бензола
- Ароматические углеводороды с непредельными боковыми цепями
- 19. ГАЛОИДПРОИЗВОДНЫЕ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
- Галоидпроизводные ароматических углеводородов, содержащие галоид в боковой цепи
- 20. НИТРОСОЕДИНЕНИЯ АРОМАТИЧЕСКОГО РЯДА
- 21. СУЛЬФОКИСЛОТЫ АРОМАТИЧЕСКОГО РЯДА
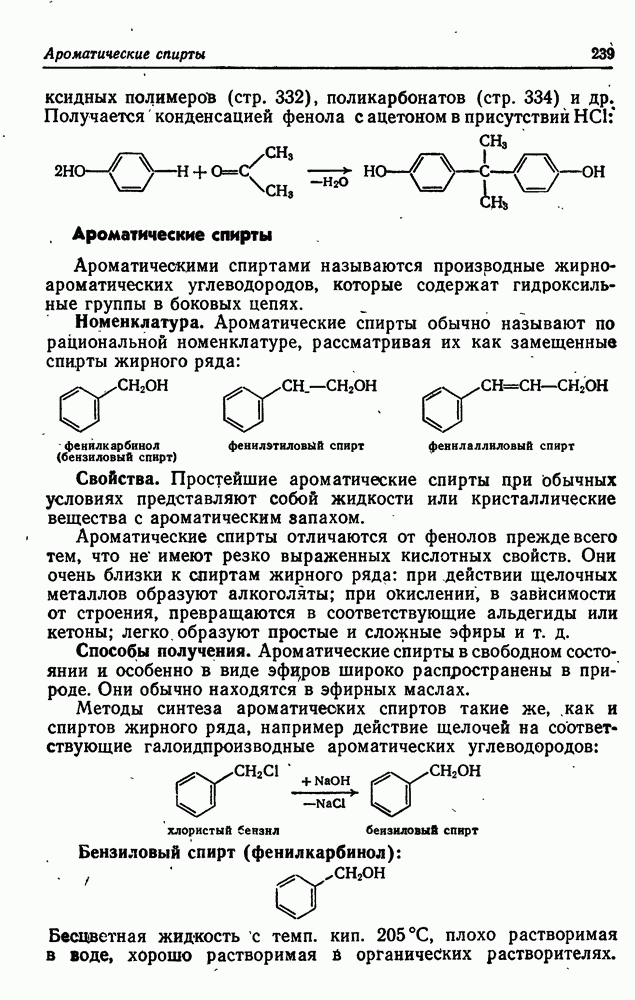
- 22. ФЕНОЛЫ И АРОМАТИЧЕСКИЕ СПИРТЫ
- Ароматические спирты
- 23. ХИНОНЫ И ХИНОНИМИНЫ
- 24. АРОМАТИЧЕСКИЕ АЛЬДЕГИДЫ И КЕТОНЫ
- Ароматические кетоны
- 25. АРОМАТИЧЕСКИЕ КИСЛОТЫ
- Двухосновные кислоты ряда бензола
- 26. АРОМАТИЧЕСКИЕ АМИНЫ
- Ароматические амины с аминогруппой в боковой цепи
- Ароматические диамины
- Хинониминовые красители
- 27. АРОМАТИЧЕСКИЕ ДИАЗОСОЕДИНЕНИЯ И АЗОКРАСИТЕЛИ
- Азокрасители
- Активные красители
- О зависимости между строением и окраской органических соединений
- 28. МНОГОЯДЕРНЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- Трифенилметановые красители
- Ароматические соединения с конденсированными ядрами
- 29. ХИМИЧЕСКИЕ СРЕДСТВА ЗАЩИТЫ РАСТЕНИЯ И ЖИВОТНЫХ (ПЕСТИЦИДЫ)
- Средства борьбы с болезнями растений (фунгициды и протравители)
- Средства борьбы с сорной растительностью (гербициды)
- Регуляторы роста растений
- Химические средства защиты животных
- 30. ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
- Пятичленные гетероциклические соединения
- Шестичленные гетероциклические соединения
- Алкалоиды
- ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ
- 31. ОСНОВНЫЕ СВЕДЕНИЯ О ХИМИИ И ТЕХНОЛОГИЯ ПОЛИМЕРОВ
- Понятие о синтезе полимеров
- Понятие о технологии полимеров
- 32. ПЛАСТИЧЕСКИЕ МАССЫ
- 33. СИНТЕТИЧЕСКИЕ ИОНИТЫ
- 34. ЭЛЕМЕНТООРГАНИЧЕСКИЕ ПОЛИМЕРЫ
- 35. ХИМИЧЕСКИЕ ВОЛОКНА (ИСКУССТВЕННЫЕ И СИНТЕТИЧЕСКИЕ)
- Понятие о технологии изготовления химических волокон
- Искусственные волокна
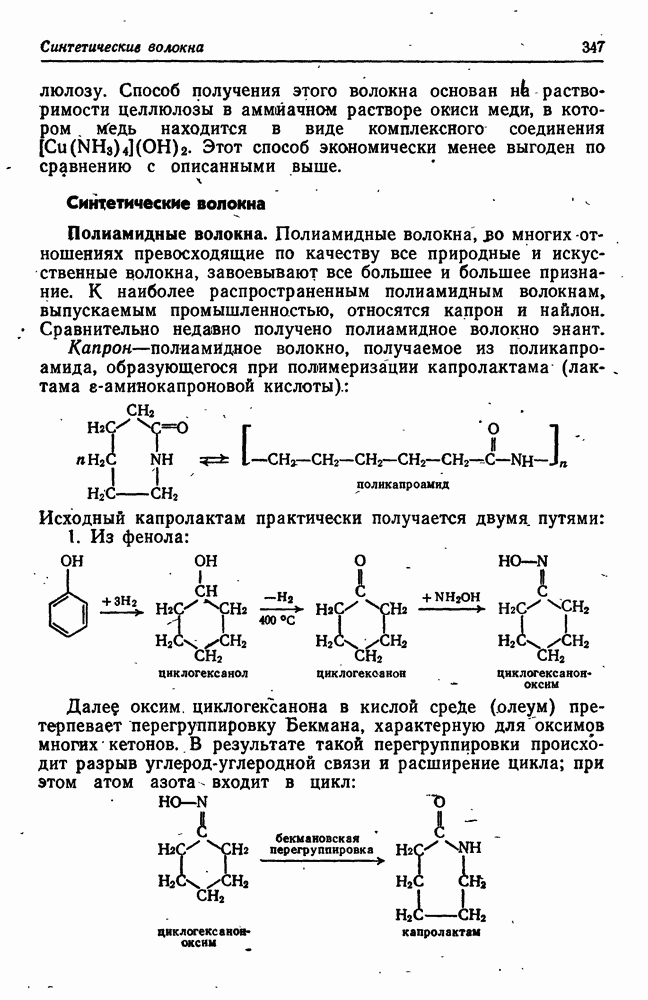
- Синтетические волокна
- 36. КАУЧУКИ
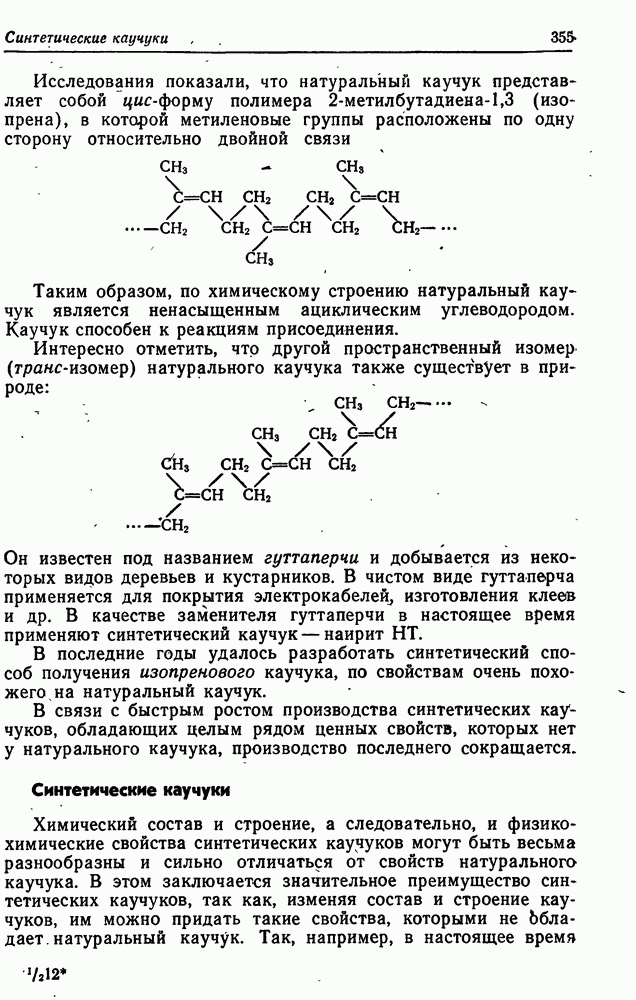
- Натуральный каучук
- Синтетические каучуки
- Синтетические латексы
- 37. СИНТЕТИЧЕСКИЕ КЛЕИ
- ХИМИЧЕСКИЕ ОСНОВЫ ЖИЗНЕДЕЯТЕЛЬНОСТИ
- 38. БЕЛКИ
- 39. НУКЛЕИНОВЫЕ КИСЛОТЫ
- 40. ЖИРЫ И УГЛЕВОДЫ
- 41. РОЛЬ БЕЛКОВ В ПРОЦЕССАХ ЖИЗНЕДЕЯТЕЛЬНОСТИ
- 42. СИНТЕЗ БЕЛКА В ОРГАНИЗМЕ
- ФИЗИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА
- 43. ВИТАМИНЫ
- Витамин А
- Витамин С (аскорбиновая кислота)
- Витамины группы D
- 44. ГОРМОНЫ
- 45. АНТИБИОТИКИ