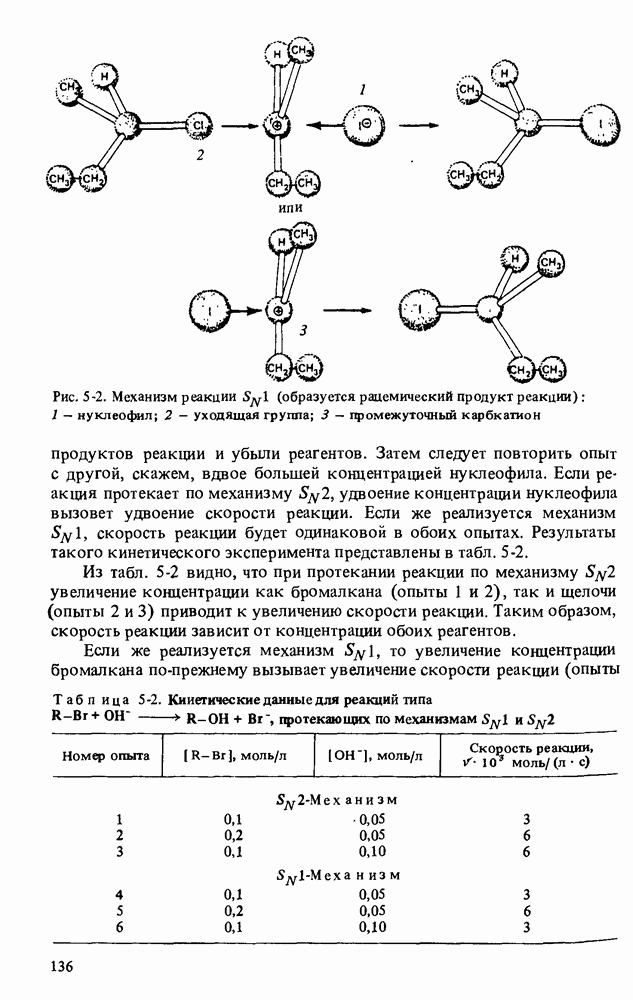
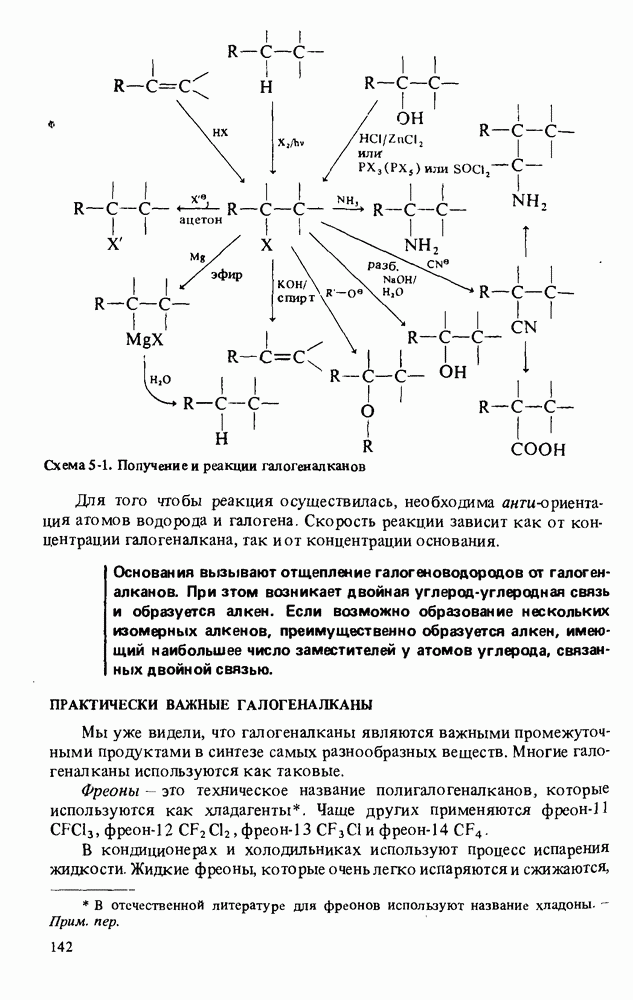
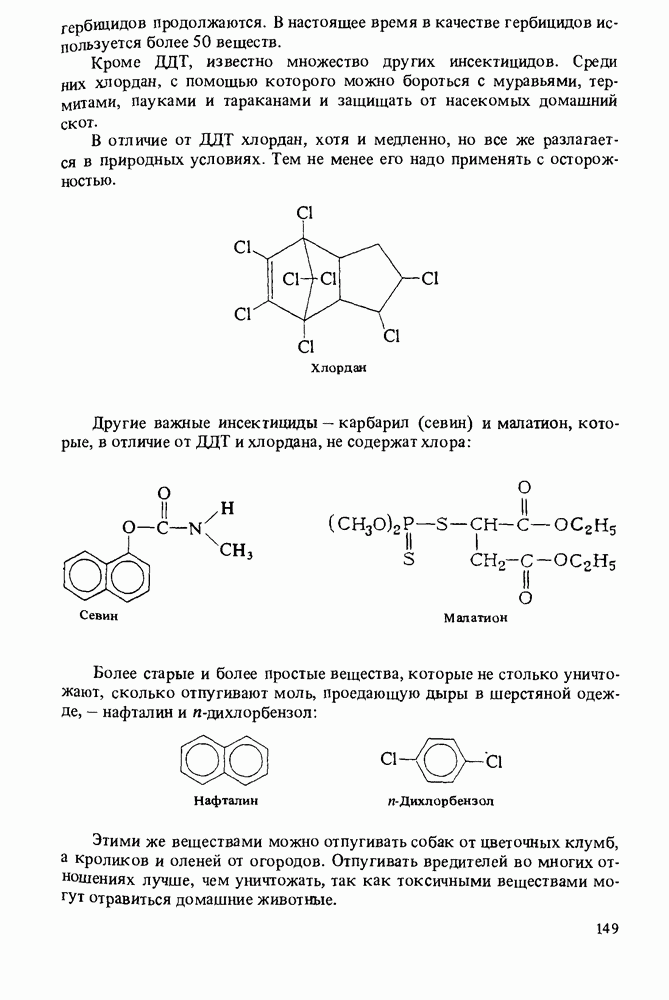
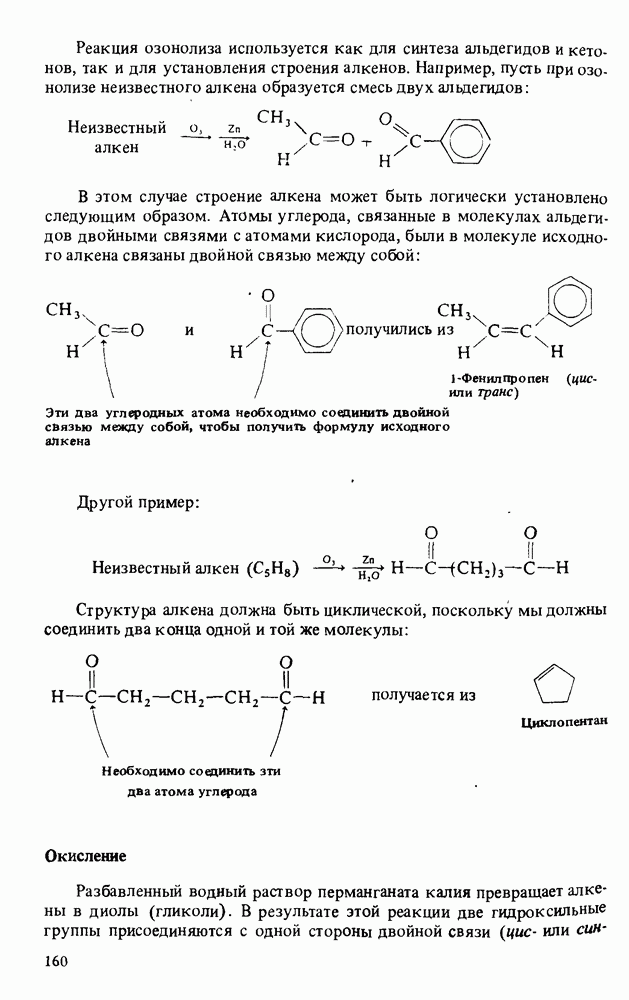
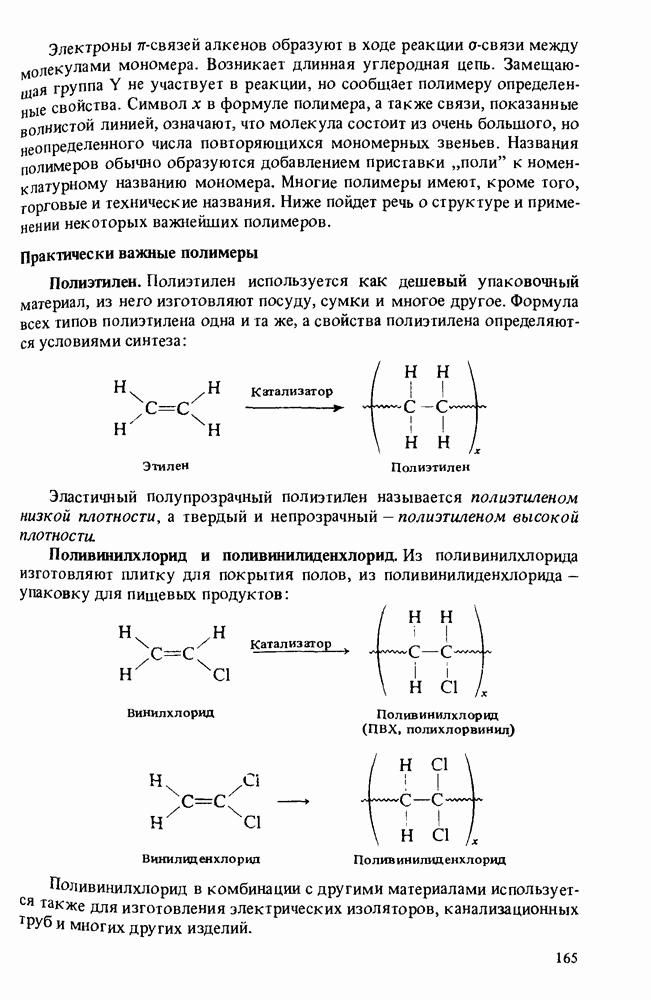
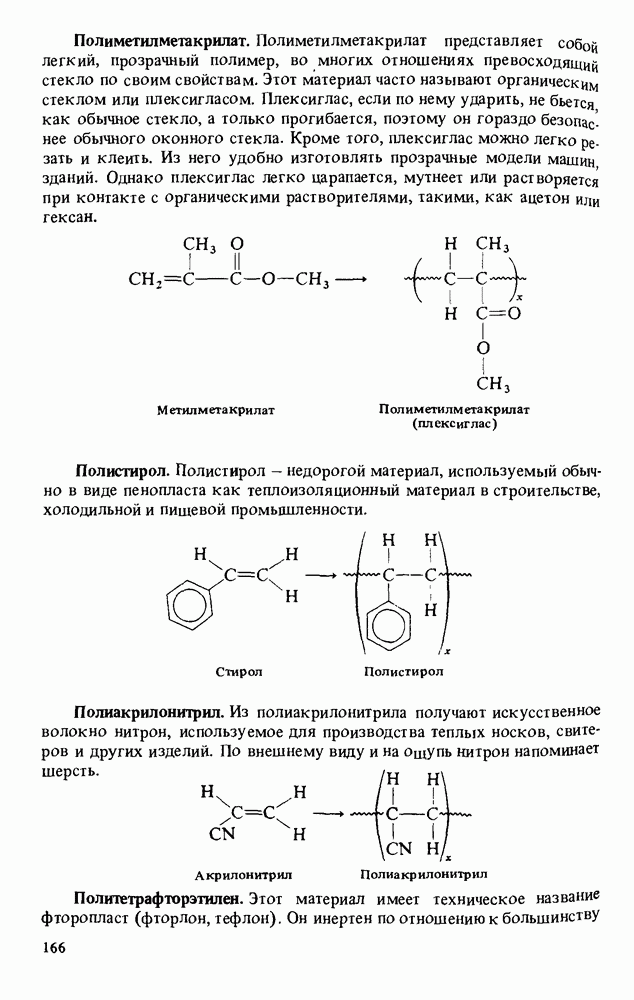
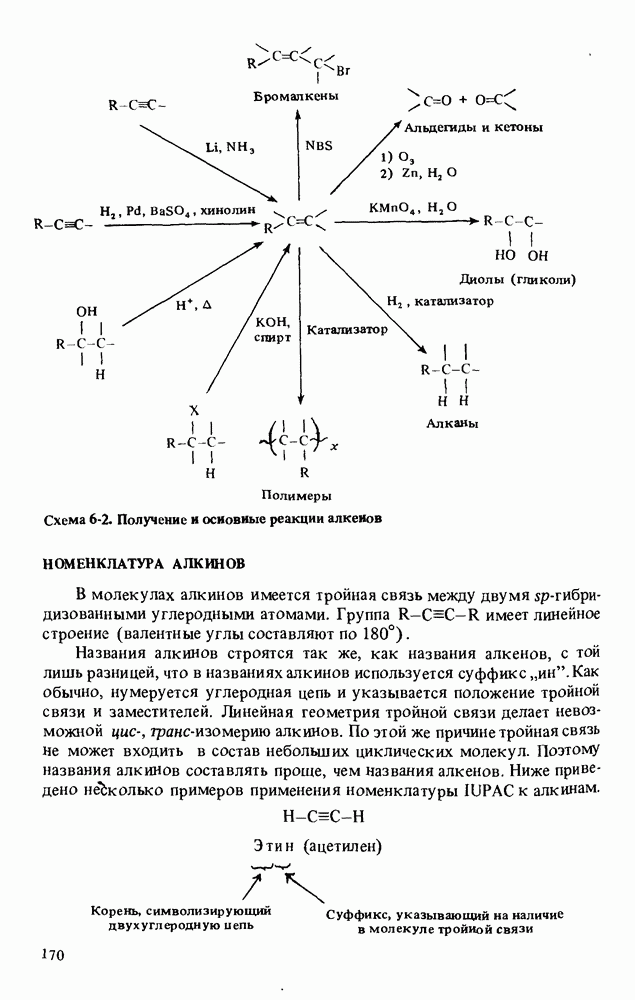
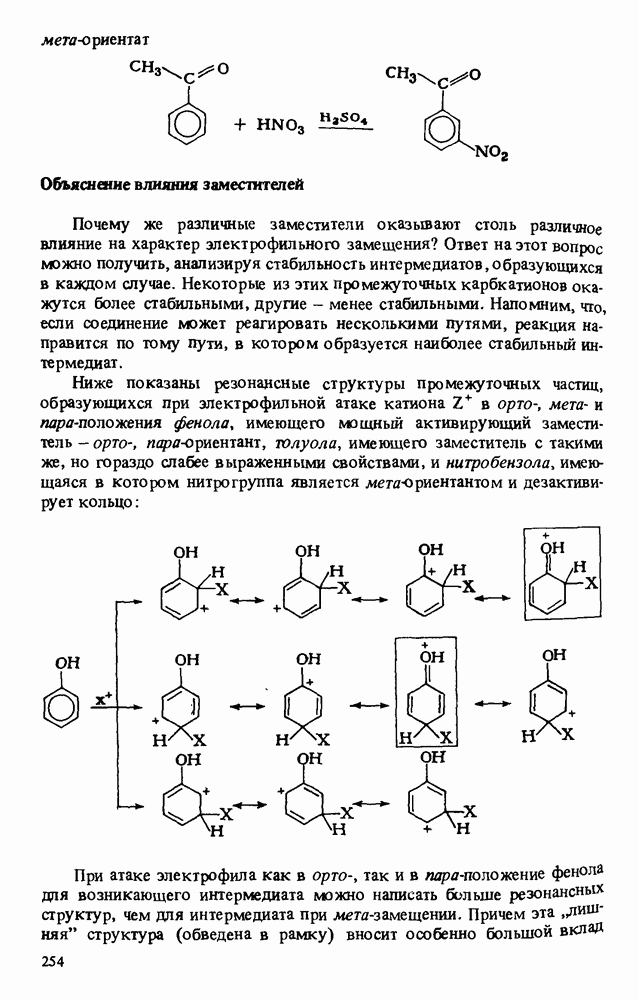
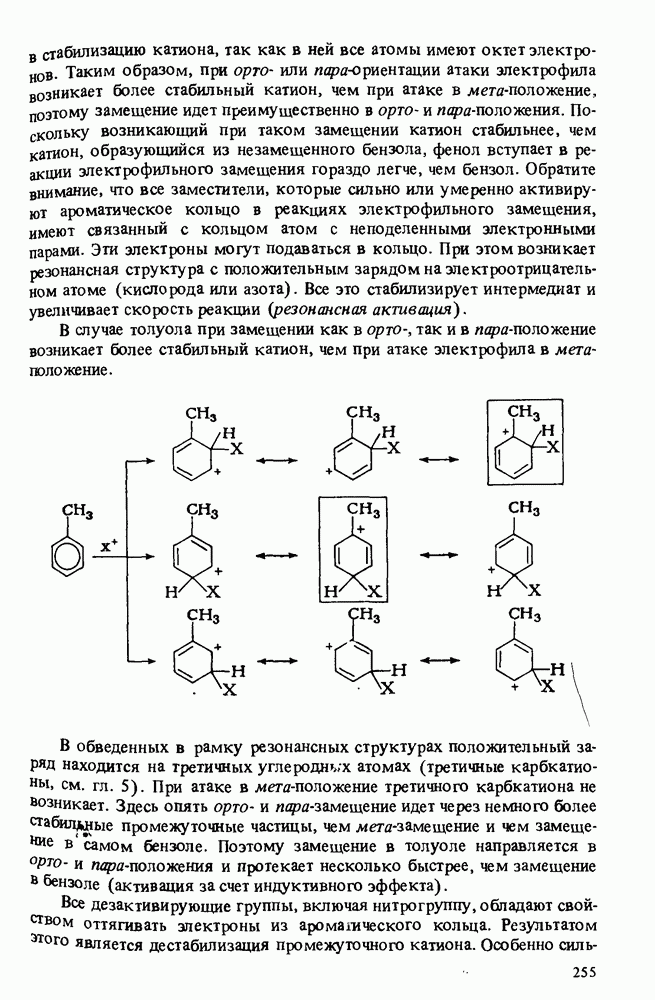
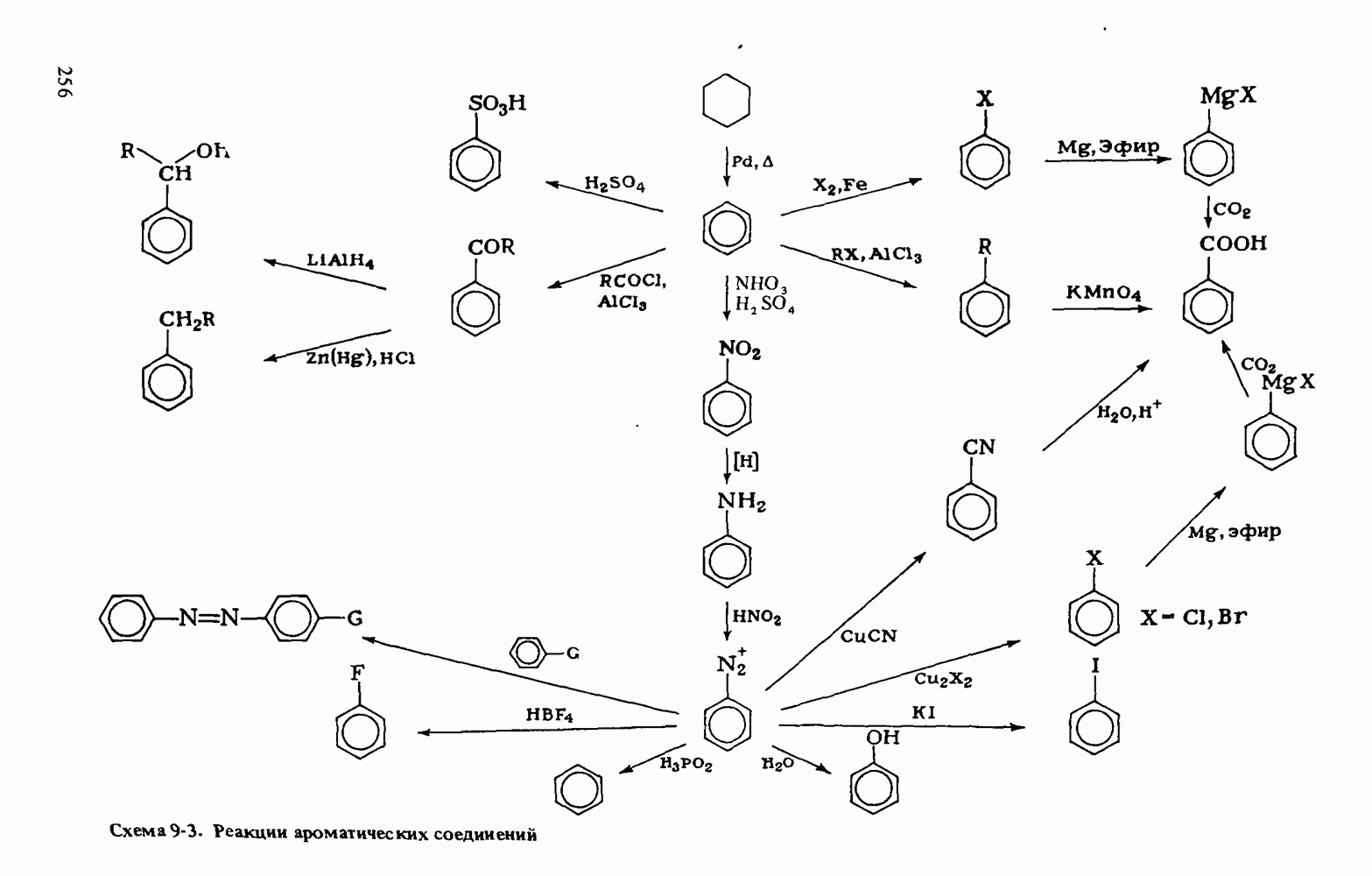
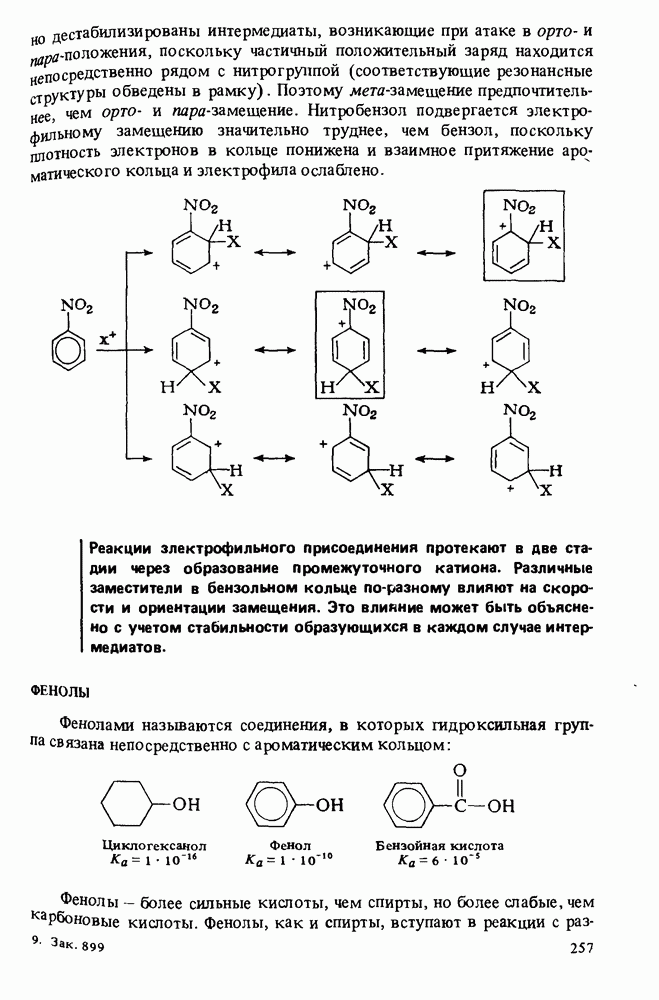
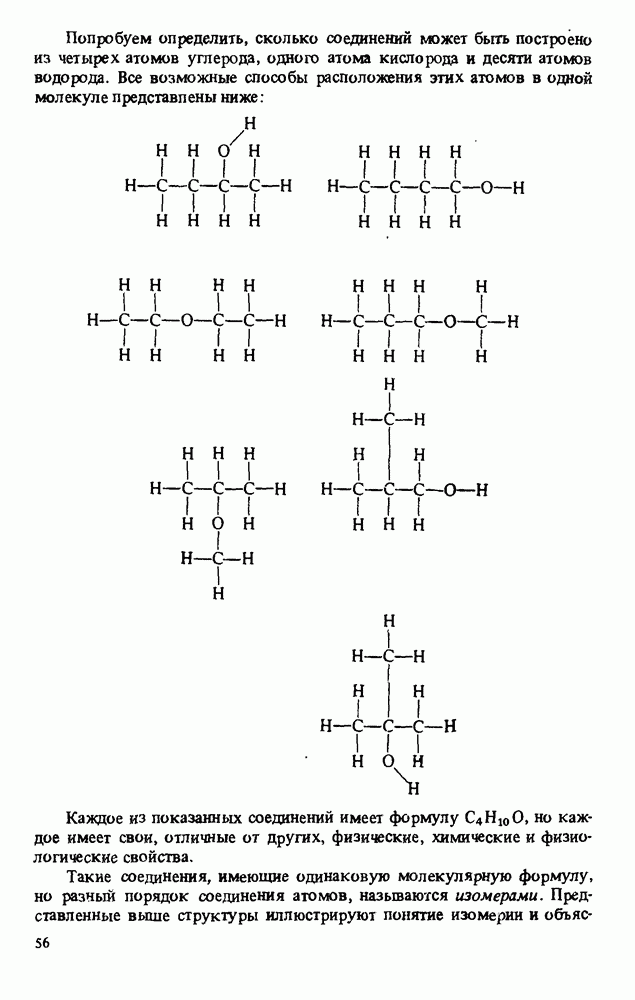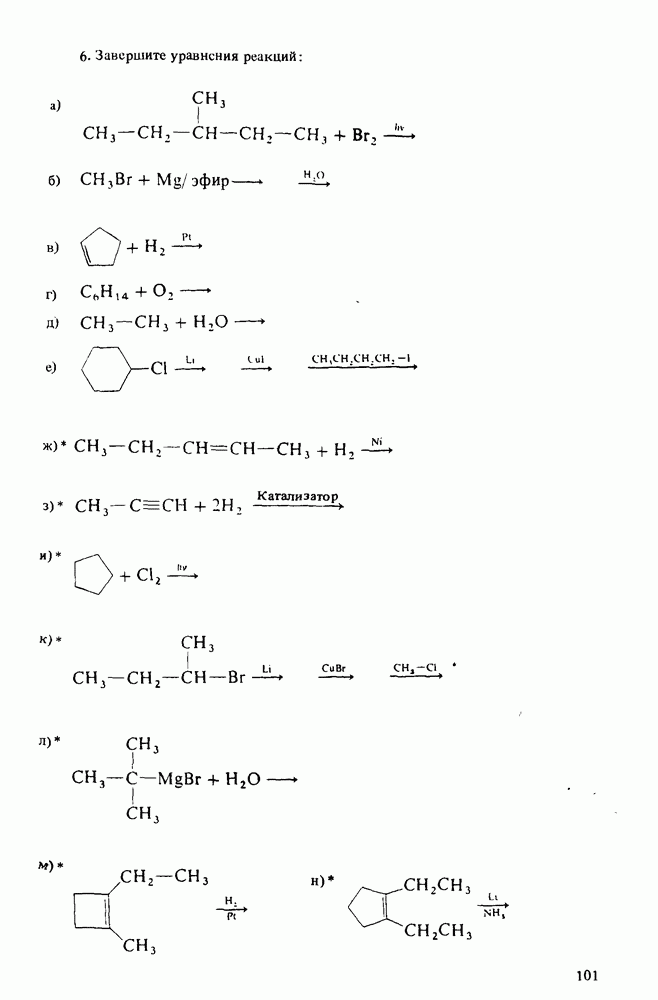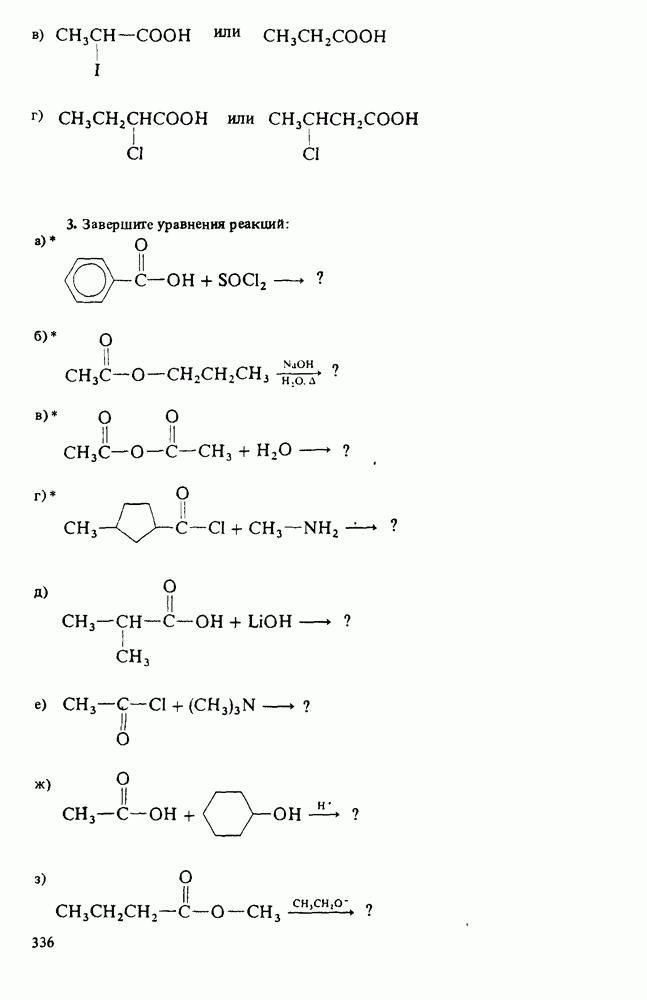| << Предыдущий параграф | Следующий параграф >> |
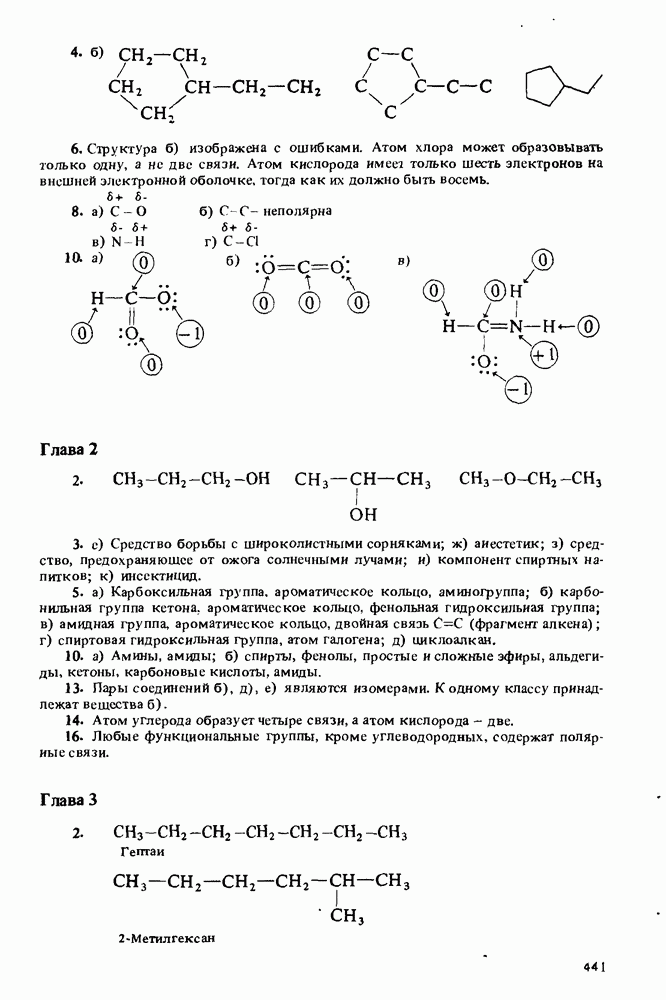
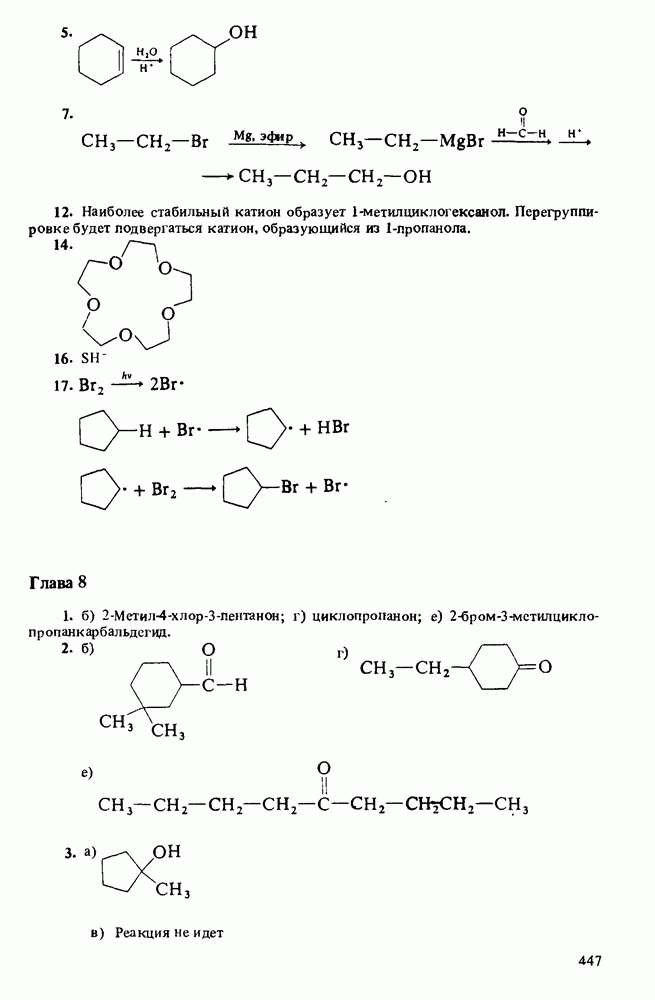
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
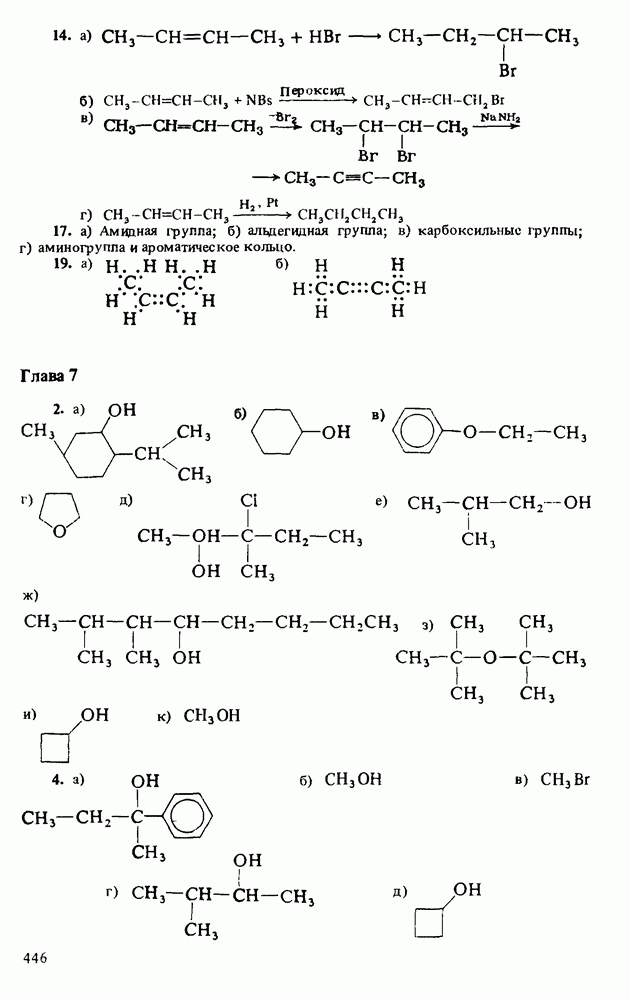
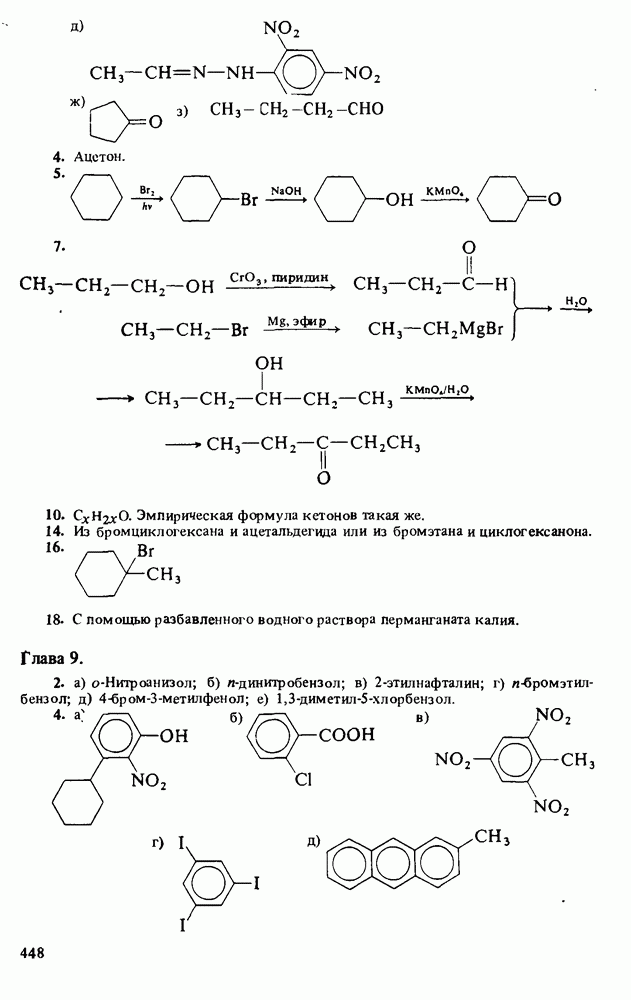
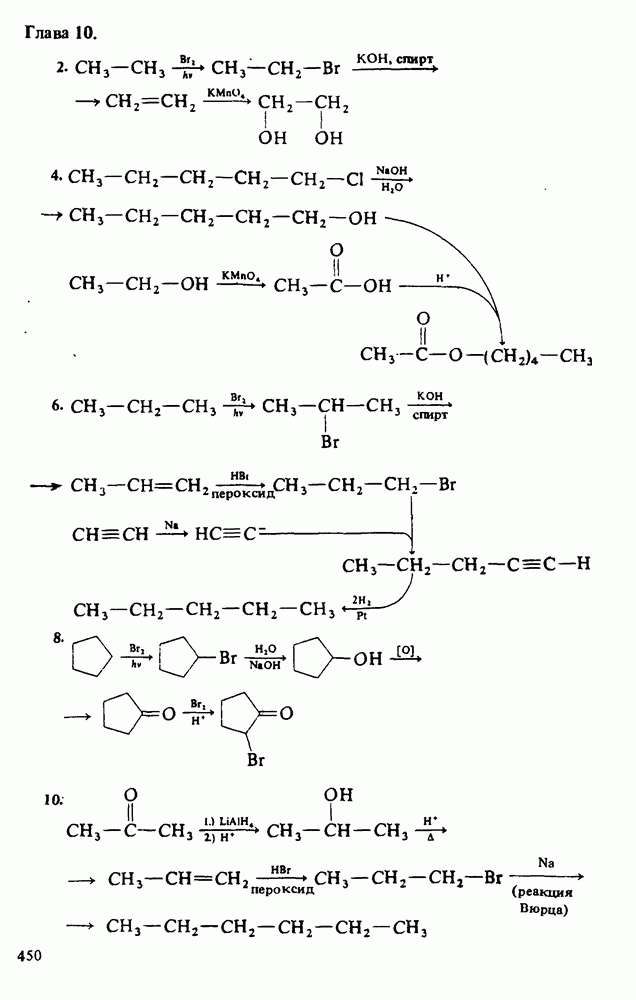
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
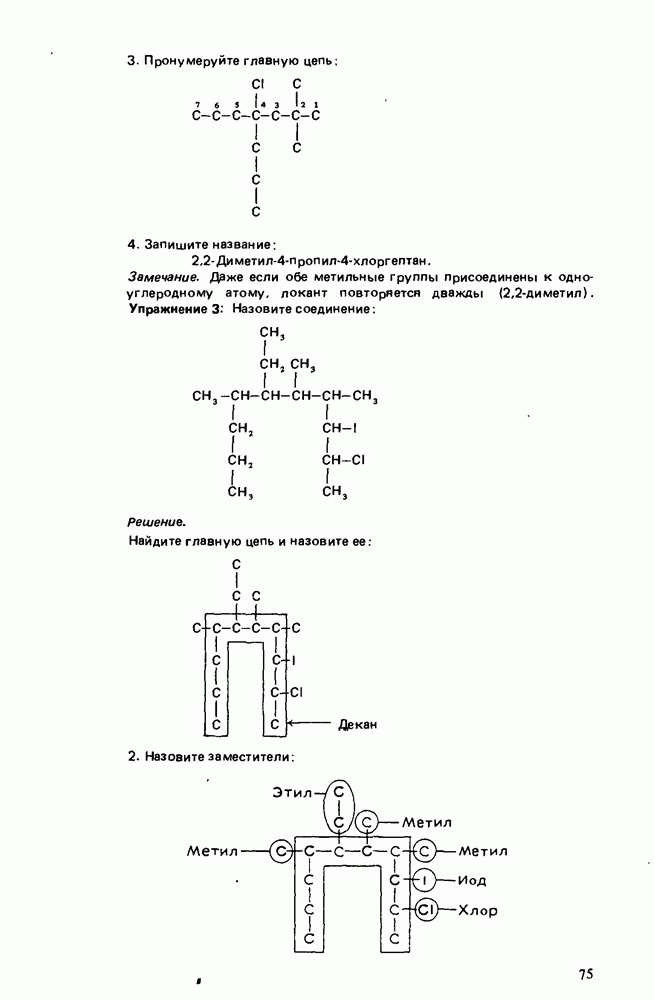
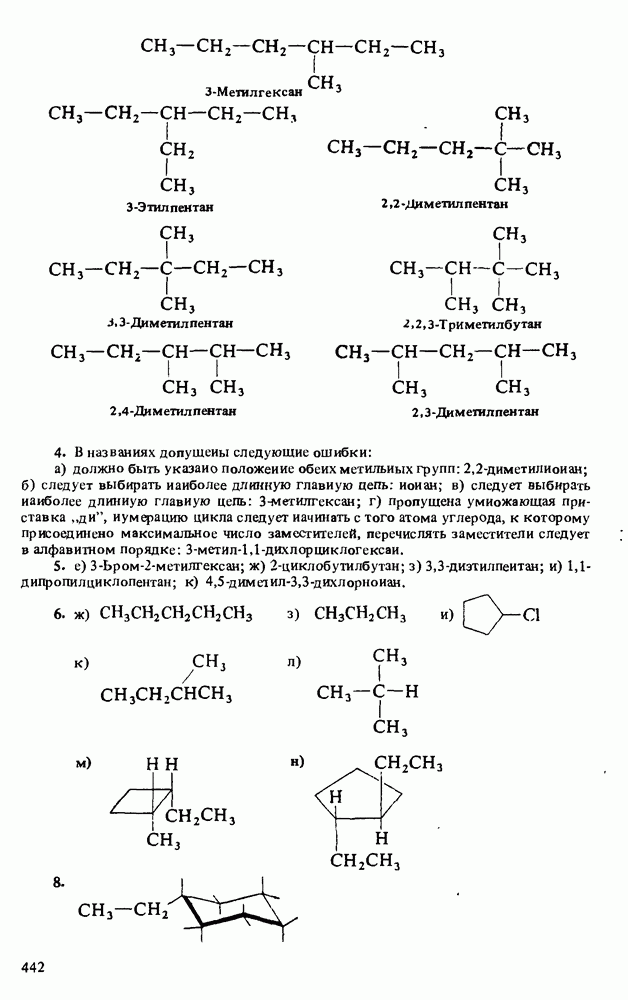
Глава 12. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
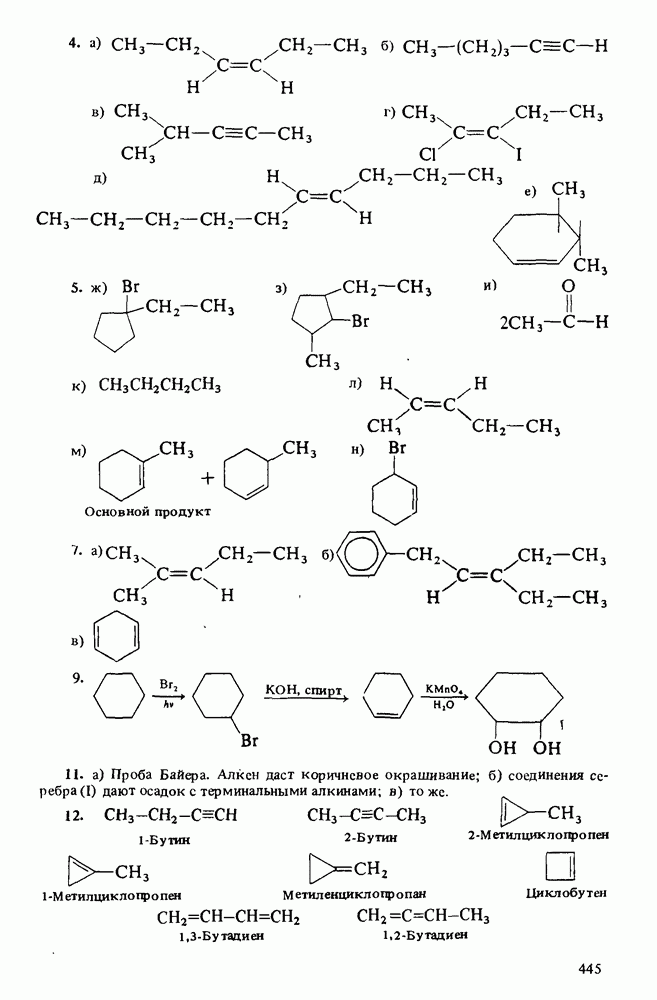
ЦЕЛИ ИЗУЧЕНИЯ
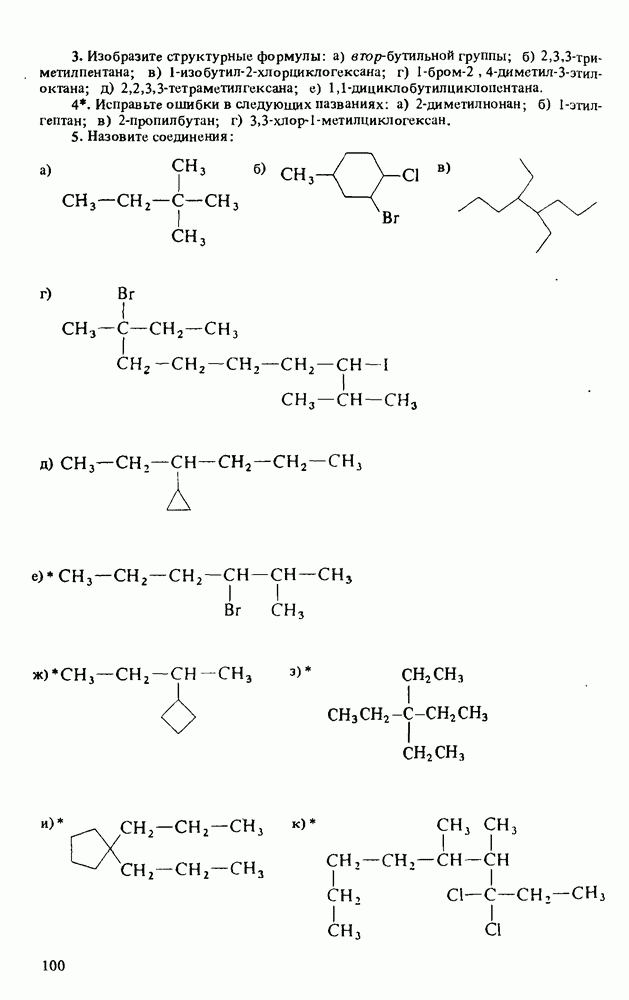
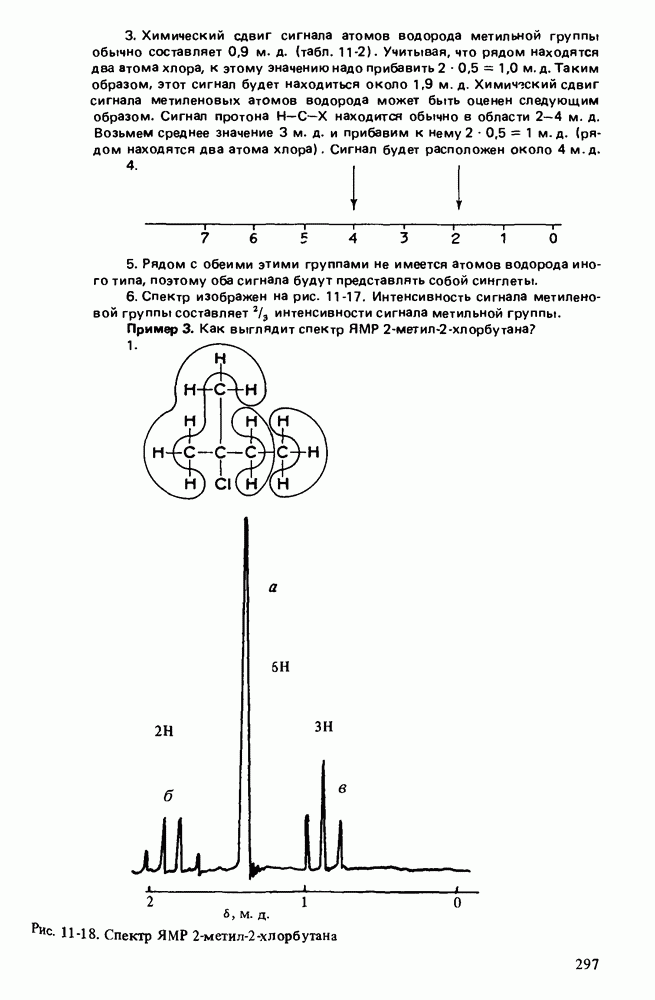
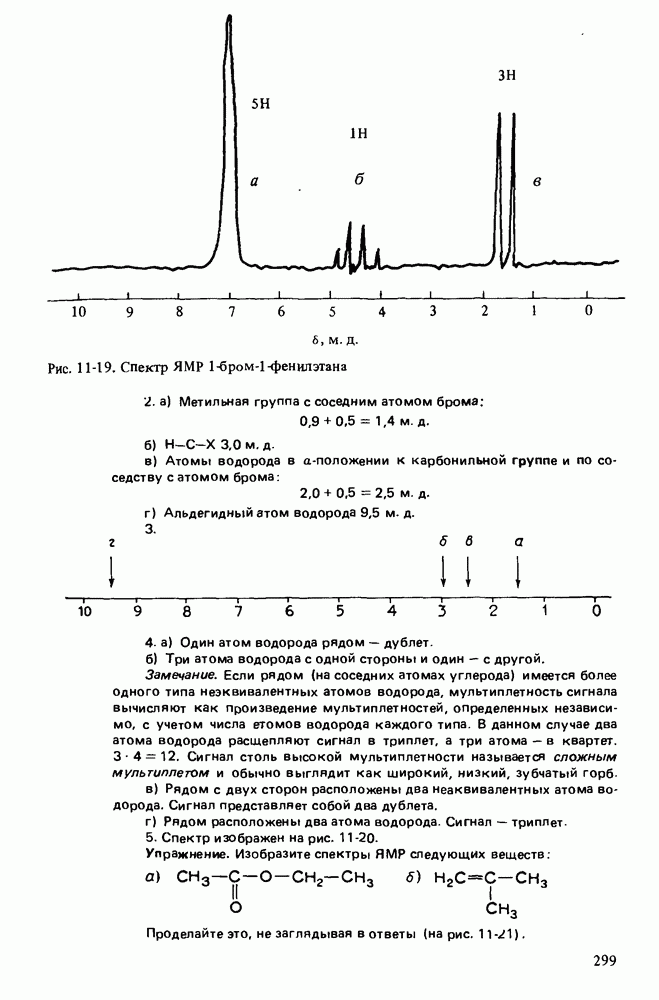
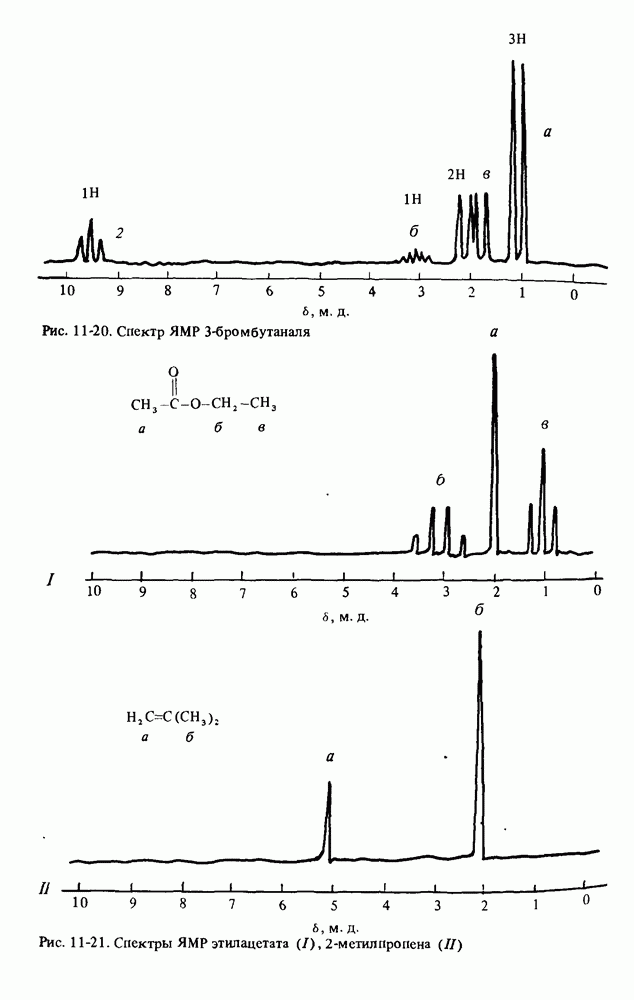
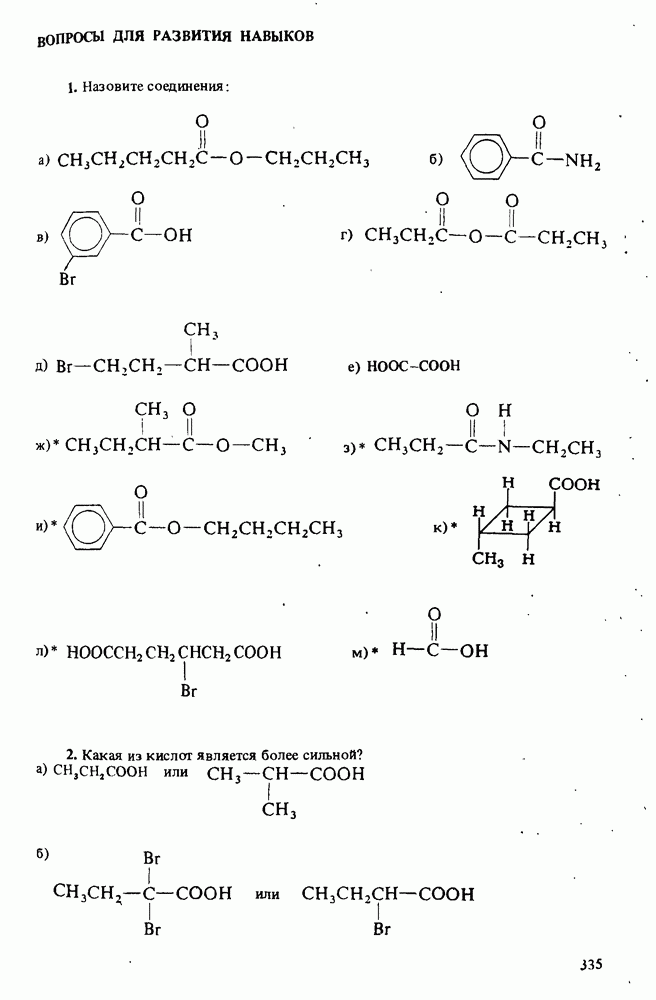
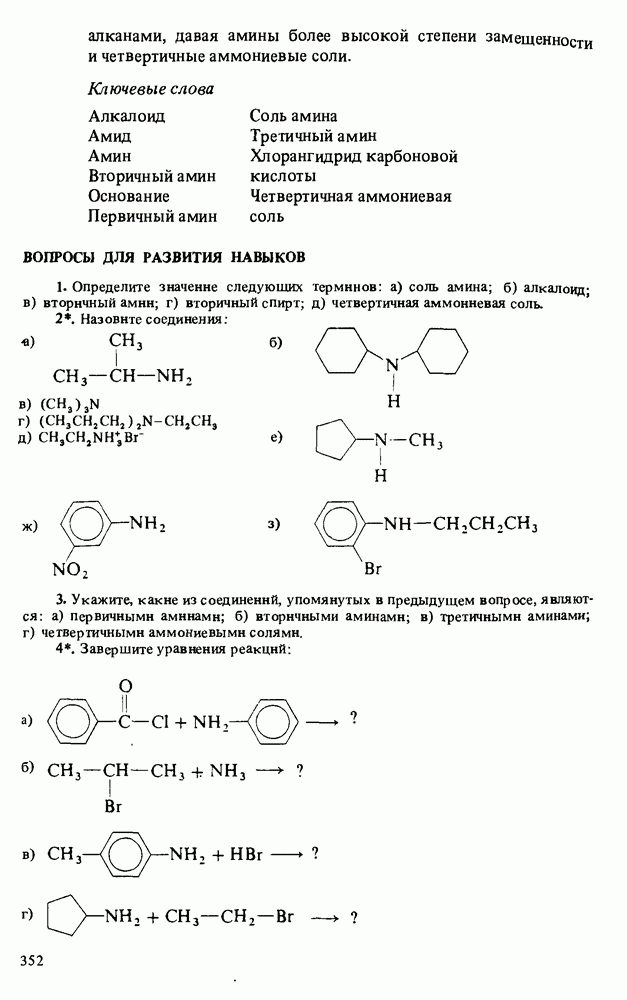
1. Научиться называть карбоновые кислоты, их эфиры, амиды, соли, ангидриды и галогенангидриды.
2. Уяснить связь кислотности и молекулярной структуры карбоновых кислот.
3. Познакомиться с методами получения карбоновых кислот и путями превращения их в сложные эфиры, амиды, хлорангидриды и ангидриды.
4. Изучить реакции карбоновых кислот, амидов и сложных эфиров.
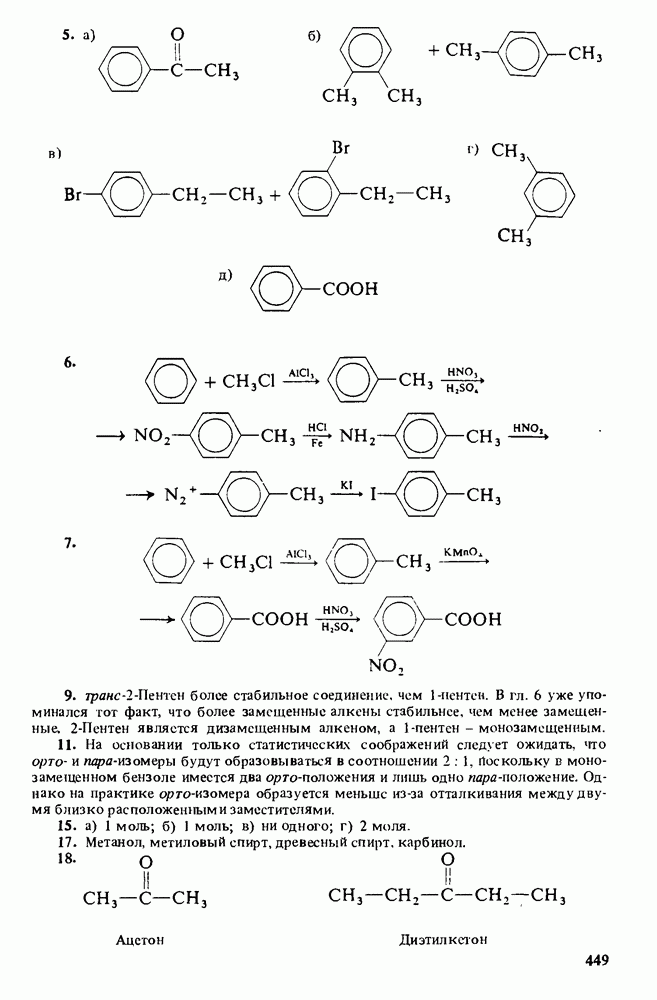
5. Познакомиться со строением карбоновых кислот и их производных, обладающих биологической активностью или применяемых в быту и технике.
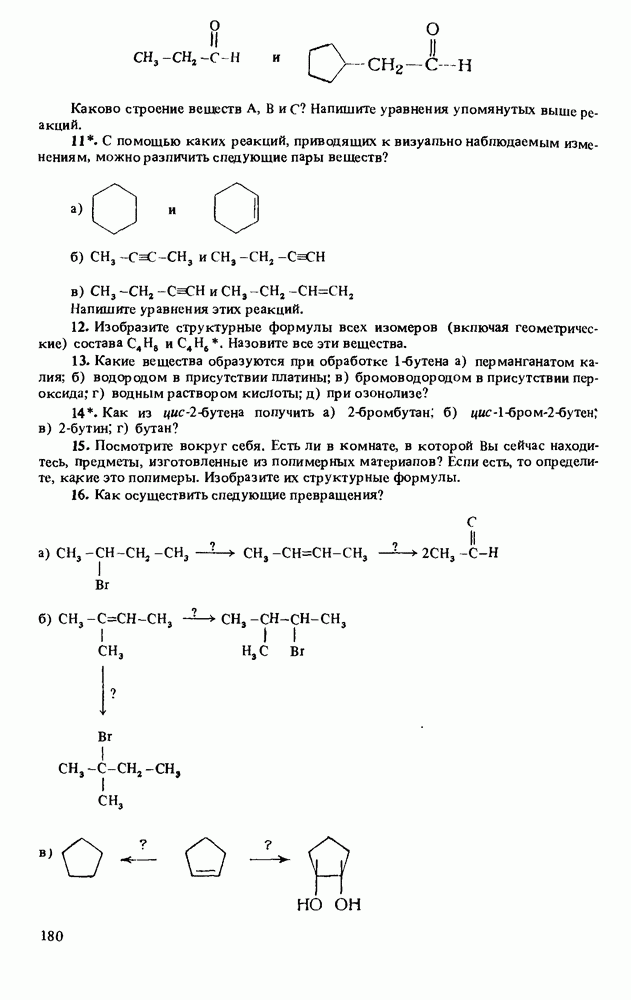
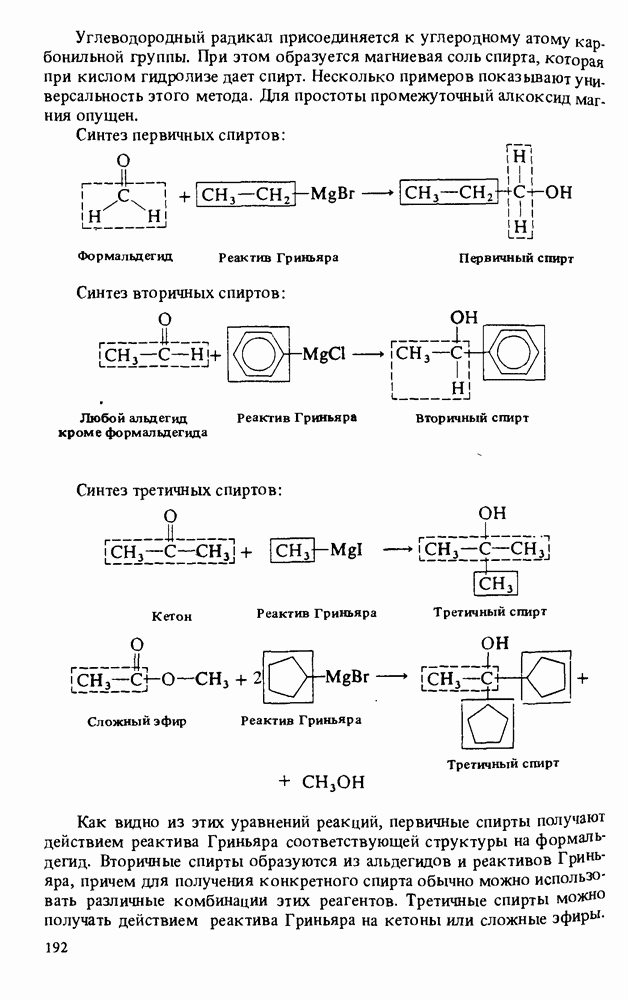
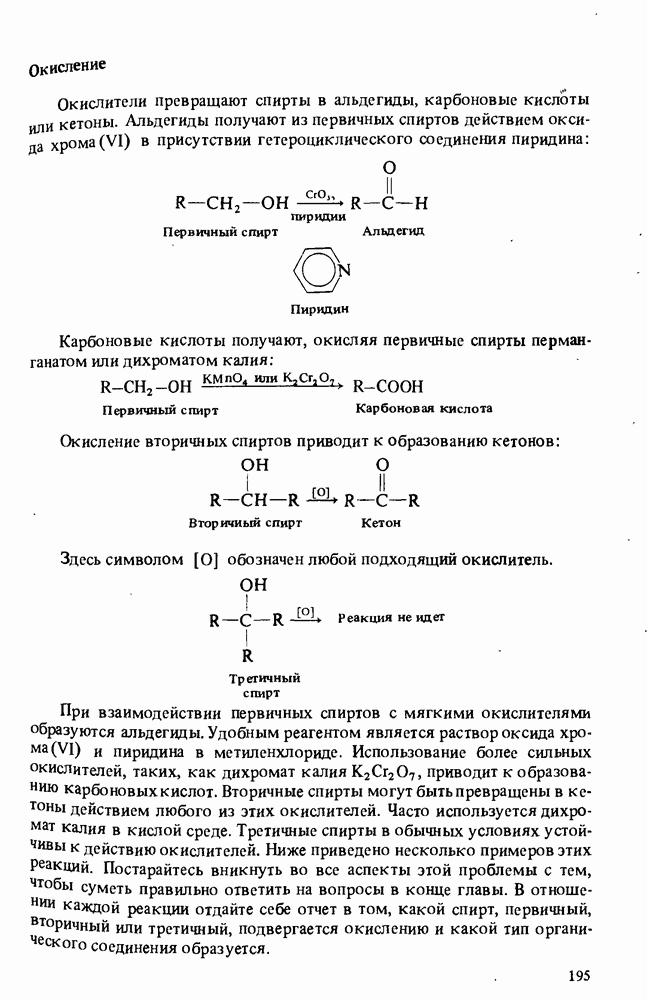
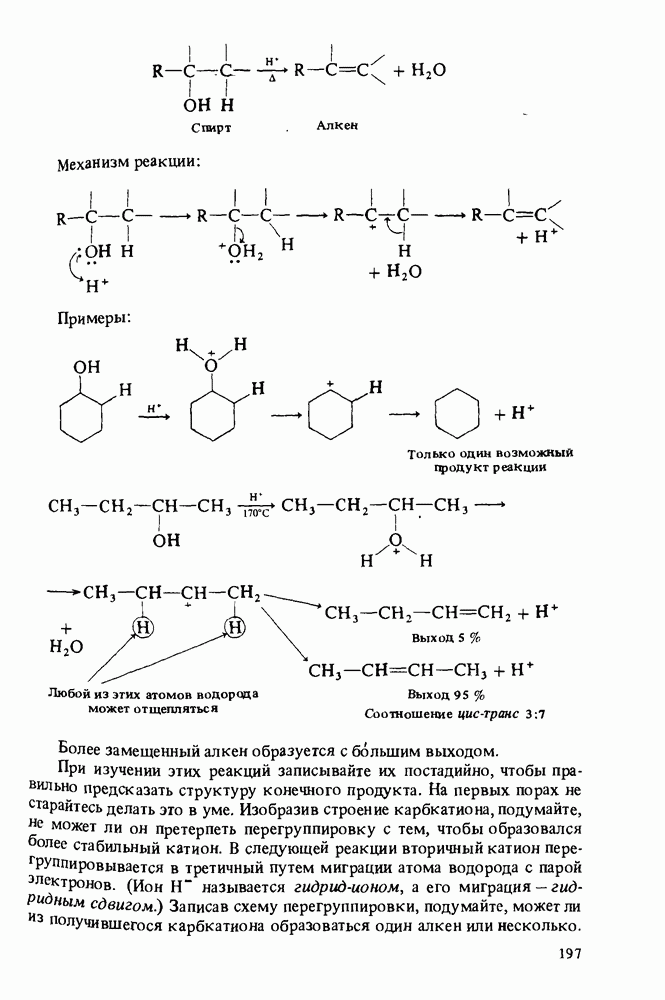
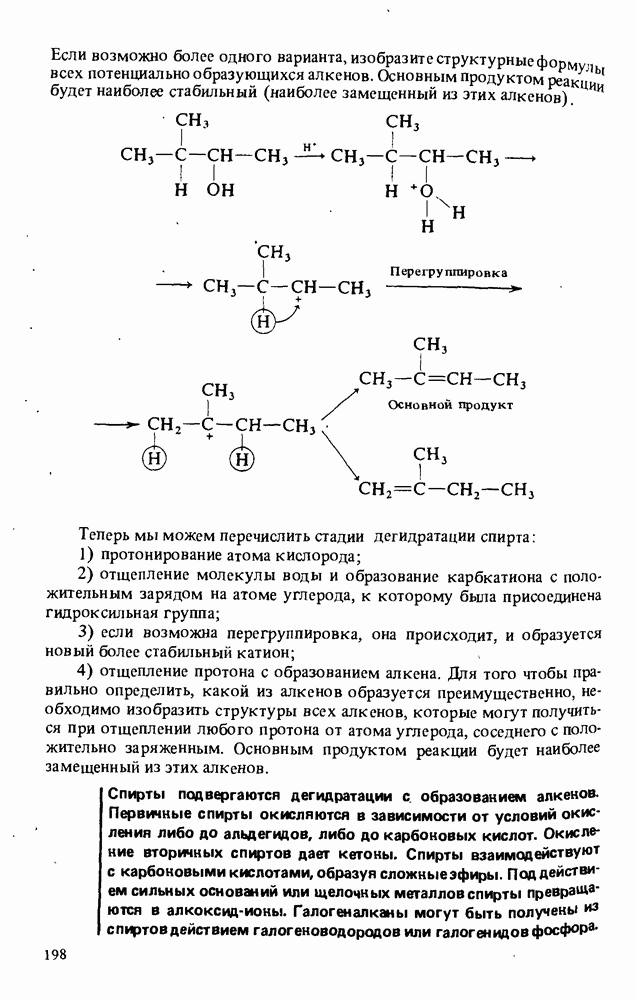
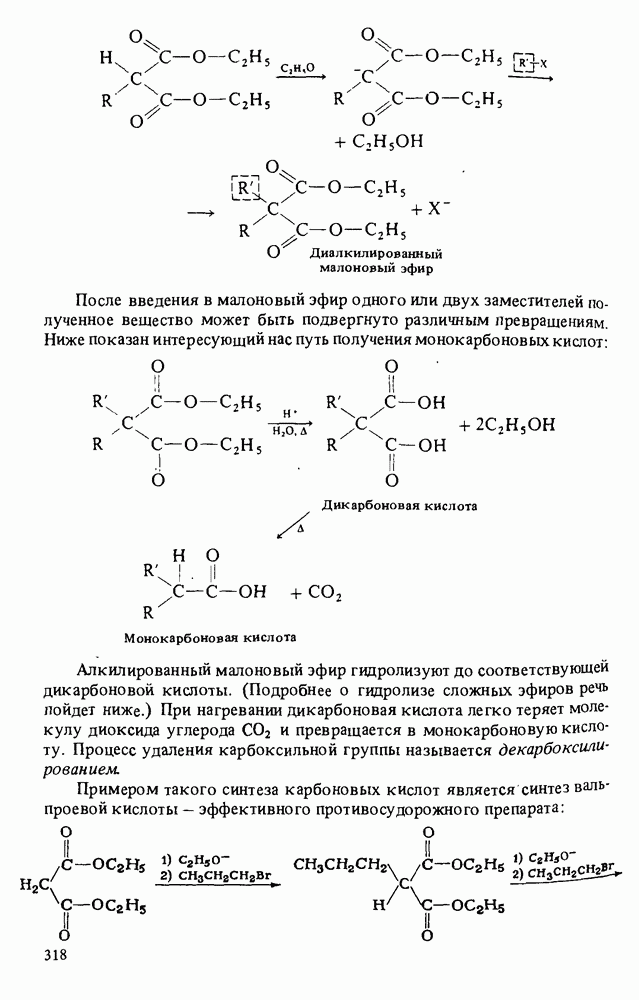
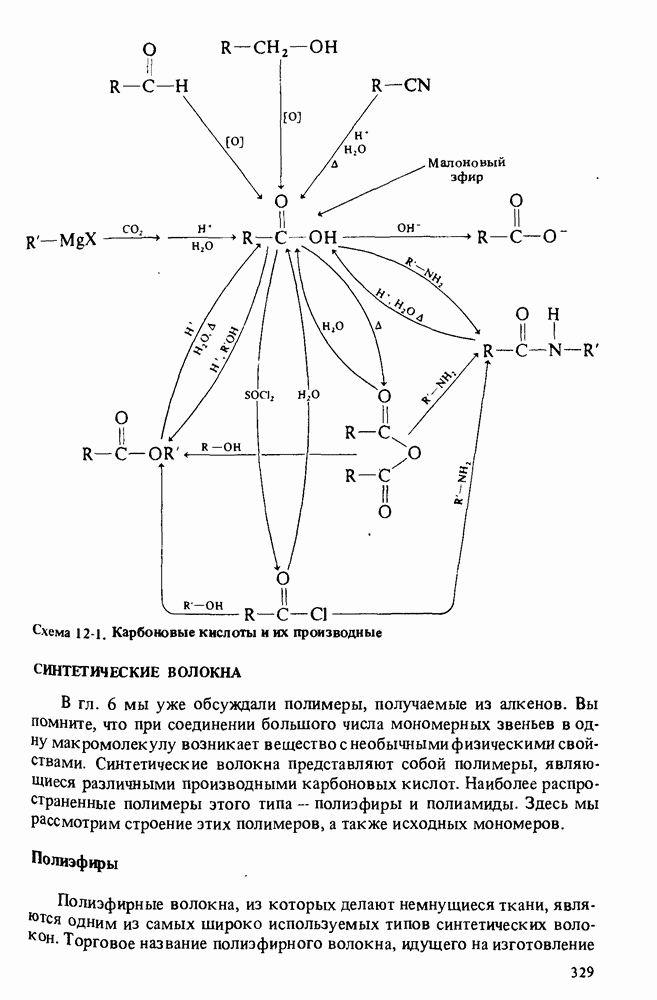
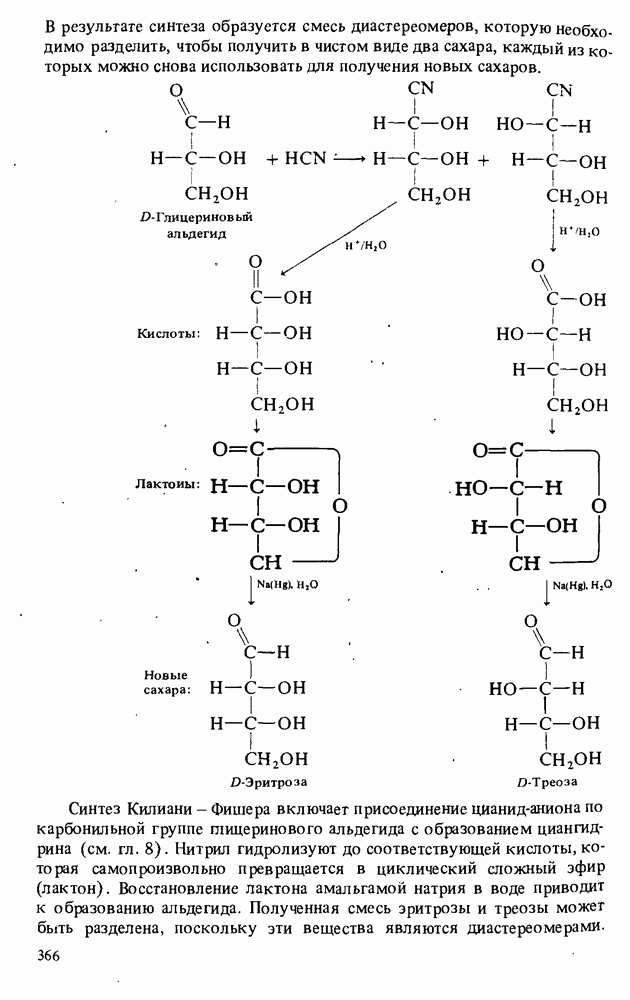
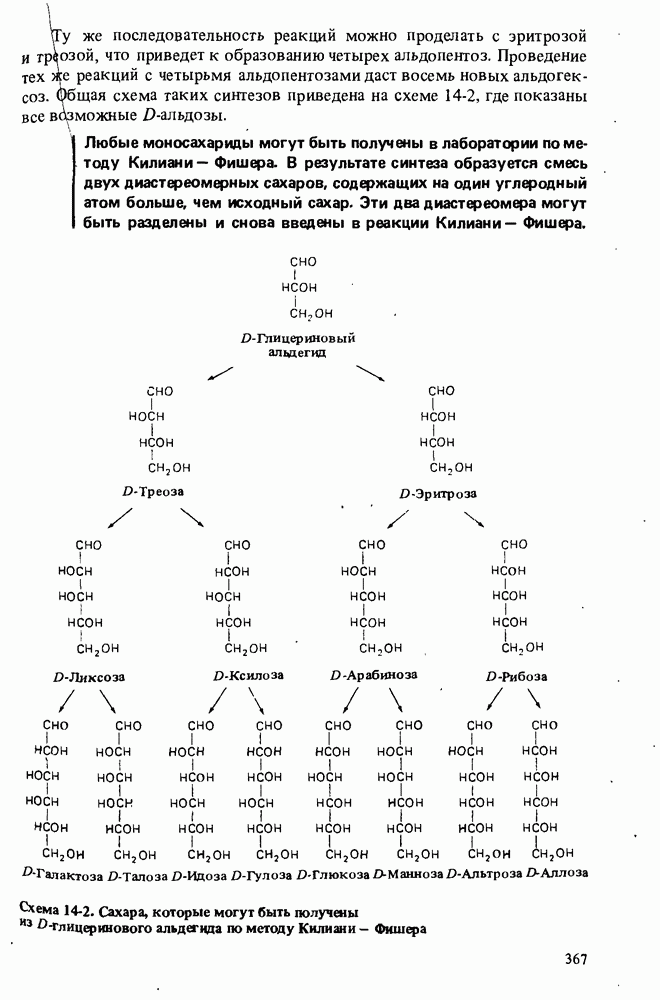
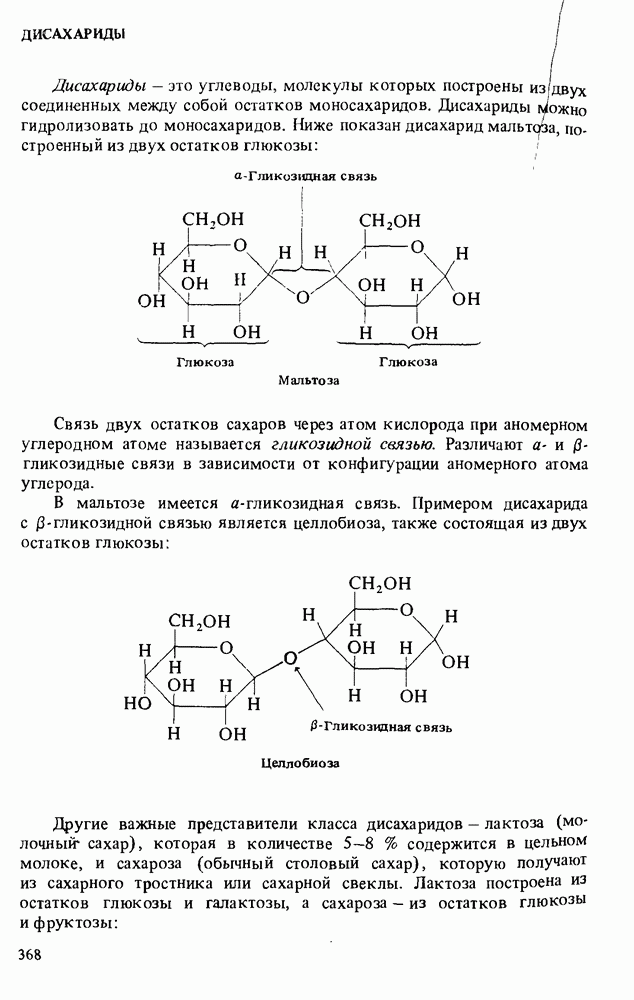
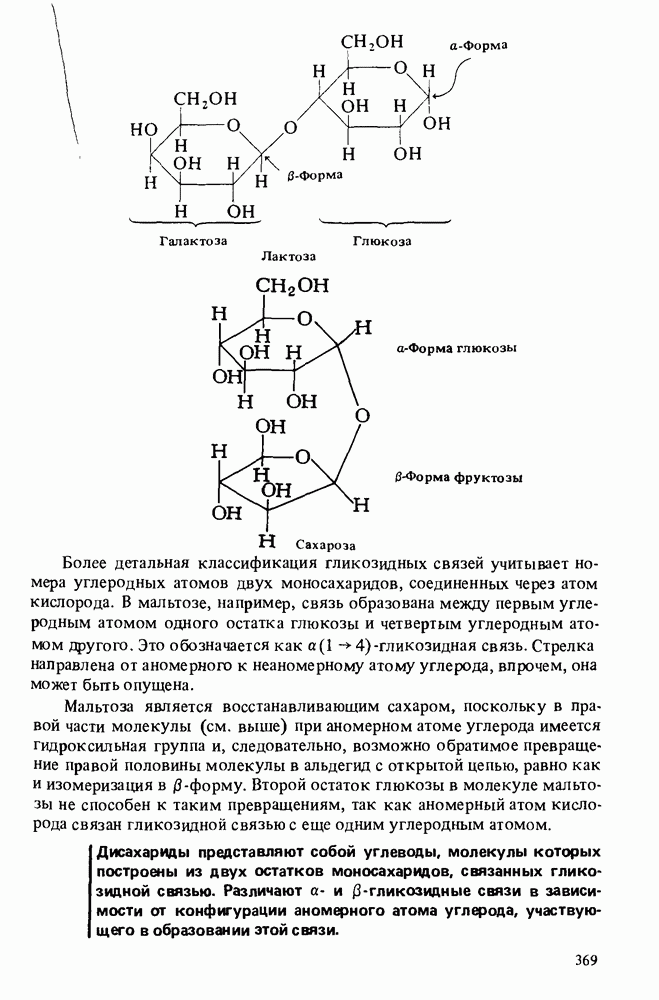
В этой главе мы будем заниматься изучением карбоновых кислот и некоторых родственных им соединений. Эти соединения обычно получают из карбоновых кислот и потому называют производными кислот. Мы подробно остановимся на следующих трех классах соединений:

Еще три класса производных кислот будут рассмотрены довольно

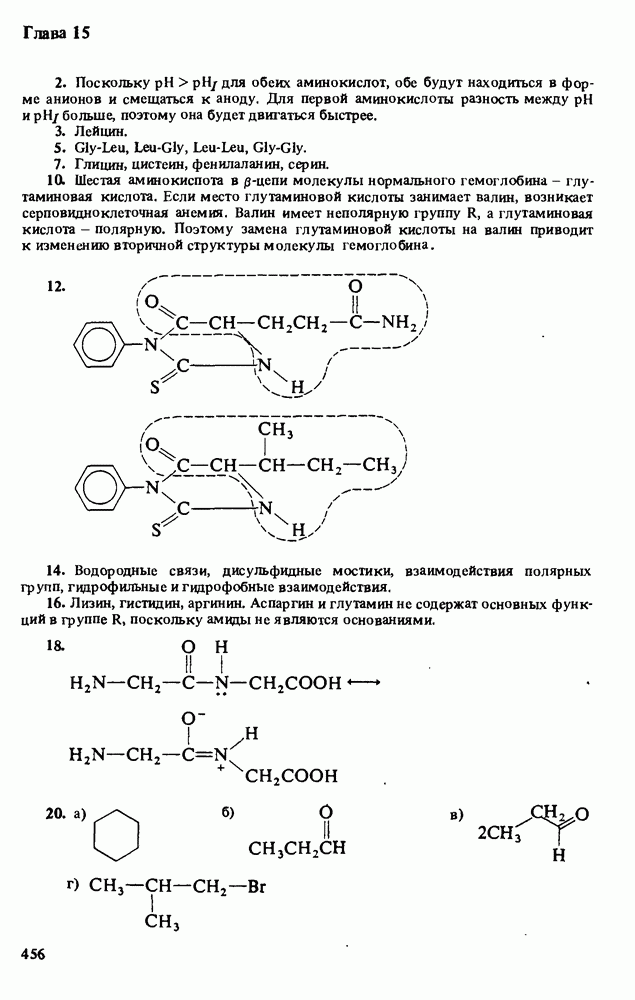
Таблица 12-1. (см. скан) Определение кислот и оснований
Поскольку эти шесть функциональных групп имеют много общих черт, поначалу Вы можете испытывать некоторые трудности в том, чтобы отличить один класс производных кислот от другого. Поэтому, прежде чем двигаться дальше, потратьте некоторое время на то, чтобы запомнить строение функциональных групп, обведенных в рамку, и названия соответствующих классов соединений.
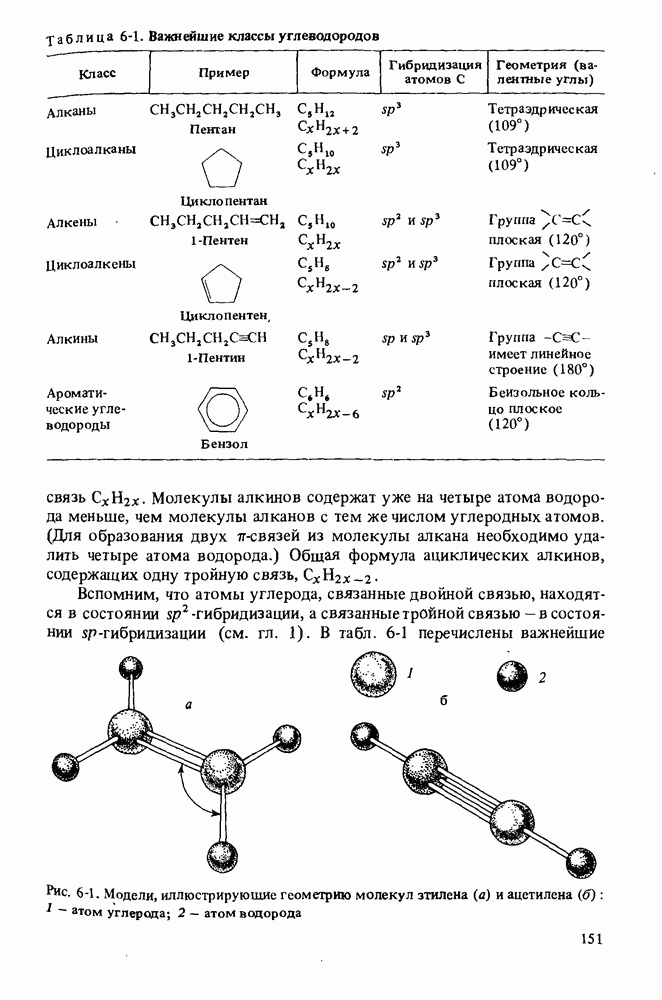
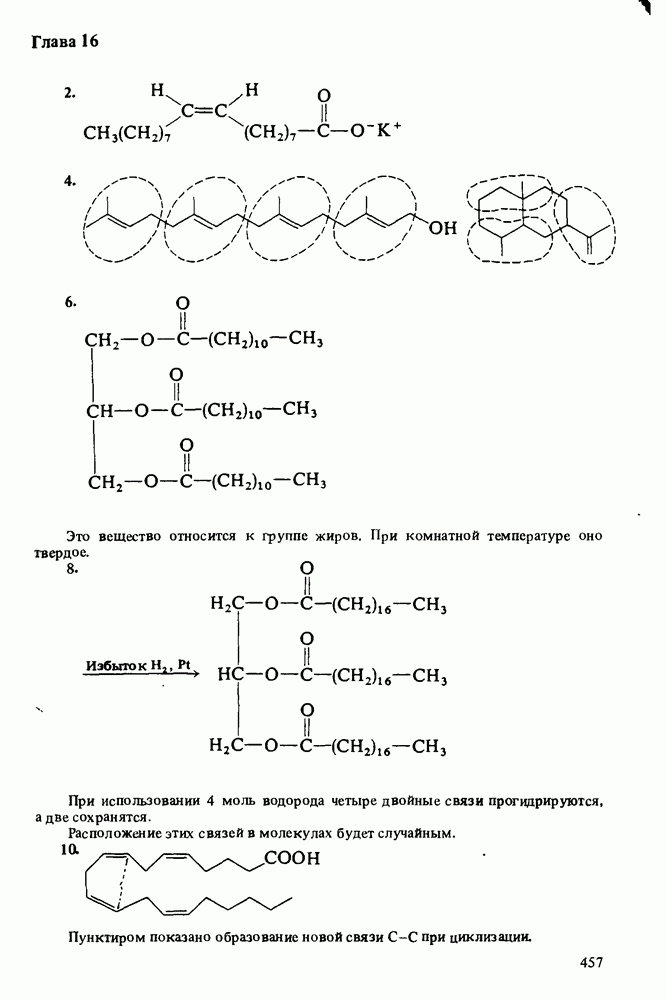
КАРБОНОВЫЕ КИСЛОТЫ
Карбоновые кислоты называются кислотами потому, что при растворении в воде они диссоциируют с образованием ионов  В соответствии с определениями Аррениуса и Бренстеда кислотами называются соединения, являющиеся в водном растворе донорами протонов. Табл. 12-1 напомнит Вам различные определения кислот и оснований.
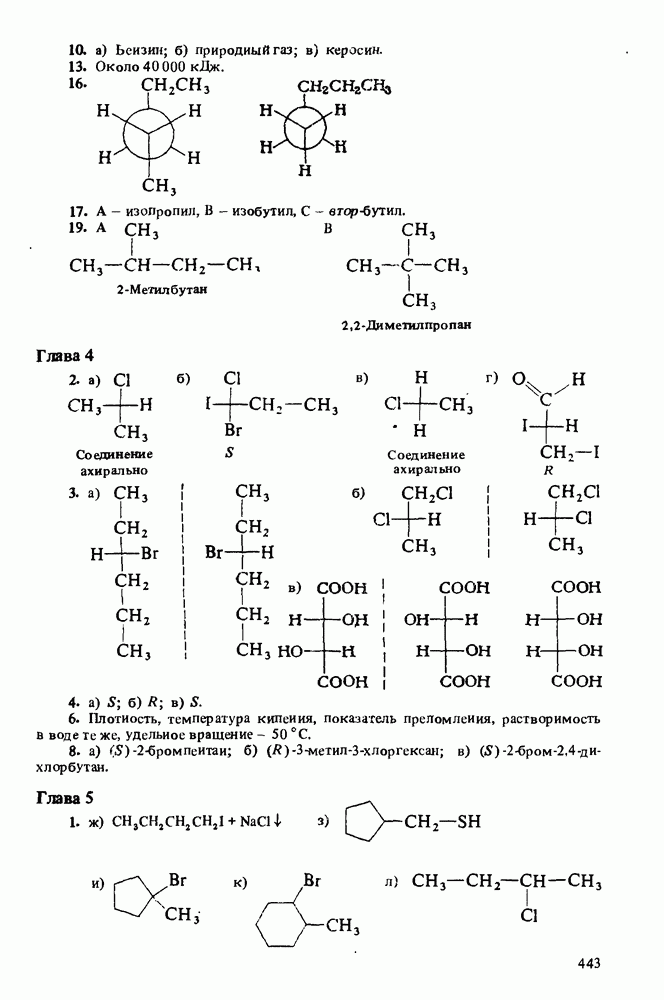
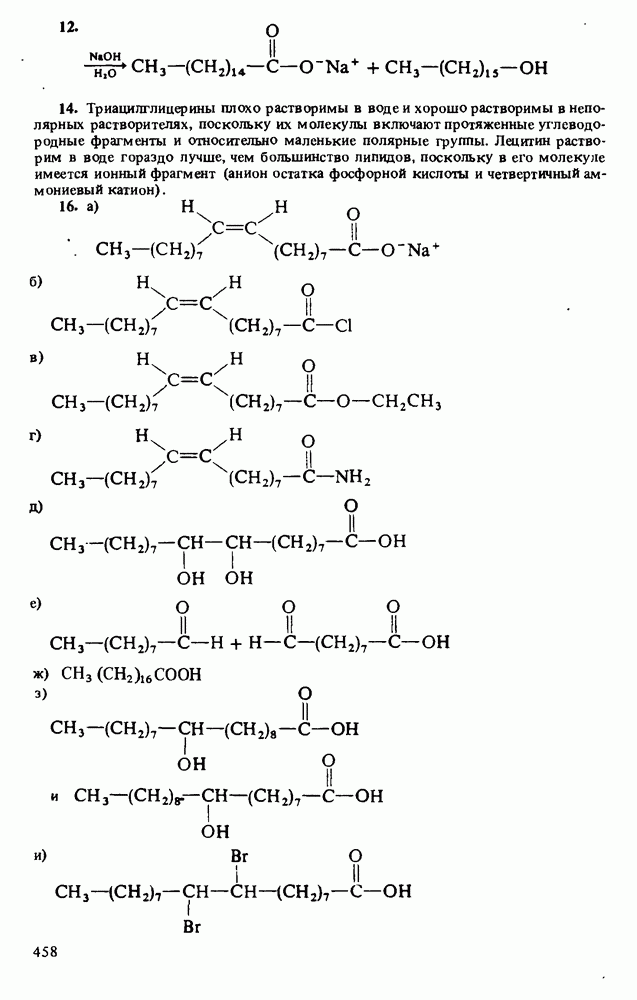
В соответствии с определениями Аррениуса и Бренстеда кислотами называются соединения, являющиеся в водном растворе донорами протонов. Табл. 12-1 напомнит Вам различные определения кислот и оснований.

Карбоновые кислоты — более слабые кислоты, чем сильные неорганические, такие, как соляная, азотная или серная, но они являются самыми кислыми соединениями среди обычно встречающихся органических веществ. Причиной легкой диссоциации карбоновых кислот является резонансная стабилизация карбоксилат-аниона (показан выше в прямых скобках). Если частица может быть представлена в виде нескольких резонансных форм, это свидетельствует о ее относительно высокой стабильности, а чем более устойчивы продукты, тем легче протекает химическая реакция.
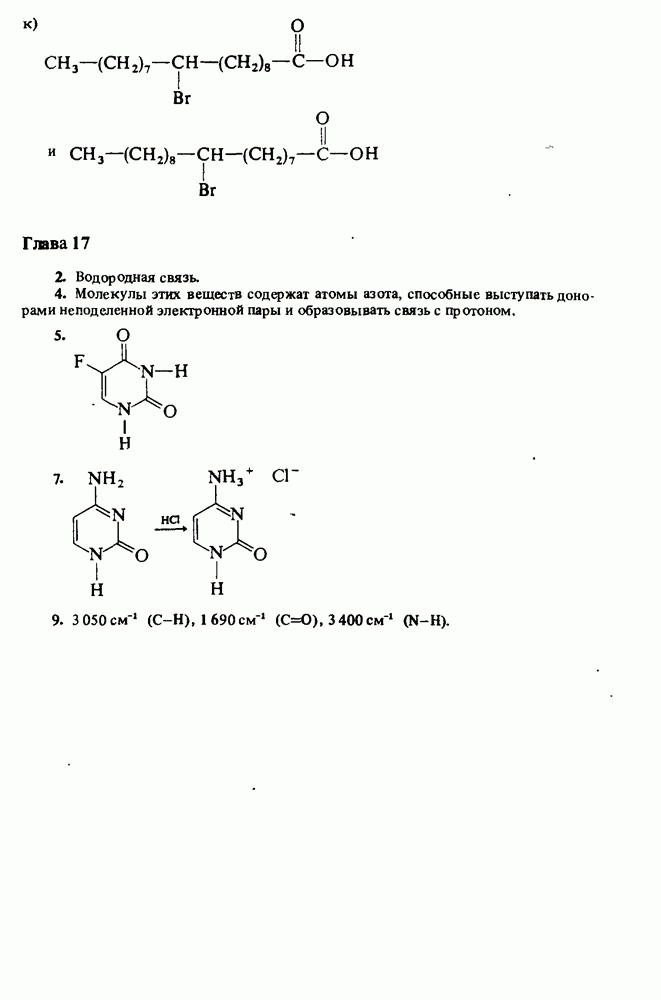
Сравнительная кислотность карбоновых кислот
Карбоновые кислоты различаются по своей кислотности. Более сильные из них легче диссоциируют и соответственно имеют более высокое численное значение константы кислотности  Величина
Величина 
представляет собой константу равновесия кислотной диссоциации

Чем выше равновесная концентрация продуктов по отношению к концентрации реагентов, тем больше значение константы равновесия. В случае, когда продуктом реакции являются ионы  величина
величина  характеризует способность кислоты образовывать протоны в водном растворе
характеризует способность кислоты образовывать протоны в водном растворе
Сила кислоты определяется природой радикала  Если в качестве радикала R выступает группа, способная оттягивать электроны и дополнительно стабилизировать анион, то такая кислота является сравнительно более сильной и ей соответствует большее значение
Если в качестве радикала R выступает группа, способная оттягивать электроны и дополнительно стабилизировать анион, то такая кислота является сравнительно более сильной и ей соответствует большее значение  Электроноакцепторные группы должны иметь в своем составе электроотрицательные атомы, например атомы галогенов, или функциональные группы с такими атомами, например группы
Электроноакцепторные группы должны иметь в своем составе электроотрицательные атомы, например атомы галогенов, или функциональные группы с такими атомами, например группы  Чем ближе к карбоксильной группе
Чем ближе к карбоксильной группе  находится электроотрицательный атом, тем заметнее его влияние на силу кислоты, и чем больше таких атомов имеется в молекуле кислоты, тем выше ее кислотность.
находится электроотрицательный атом, тем заметнее его влияние на силу кислоты, и чем больше таких атомов имеется в молекуле кислоты, тем выше ее кислотность.
Наоборот, алкильные группы, обладающие электронодонорными свойствами, уменьшают силу кислоты, поскольку они подают электроны на карбоксильную группу  и дестабилизируют карбоксилат-анион. Действие такого индуктивного эффекта показано ниже:
и дестабилизируют карбоксилат-анион. Действие такого индуктивного эффекта показано ниже:

Таблица 12-2. (см. скан) Константы кислотности некоторых карбоновых кислот
В табл. 12-2 приведены данные о кислотности некоторых карбоновых кислот, иллюстрирующие тенденции, о которых шла речь выше. Посмотрите внимательно на эту таблицу, обращая внимание на зависимость кислотности от структуры. Вы найдете в таблице подтверждение основных закономерностей, но найдете и исключения.
Карбоновые кислоты являются слабыми кислотами. Однако это наиболее кислые вещества среди обычных органических соединений. Кислотность карбоновых кислот определяется свойствами заместителей, имеющихся в молекуле кислоты. Алкильные группы ослабляют кислотность, тогда как введение электроотрицательных атомов усиливает кислые свойства.
Номенклатура
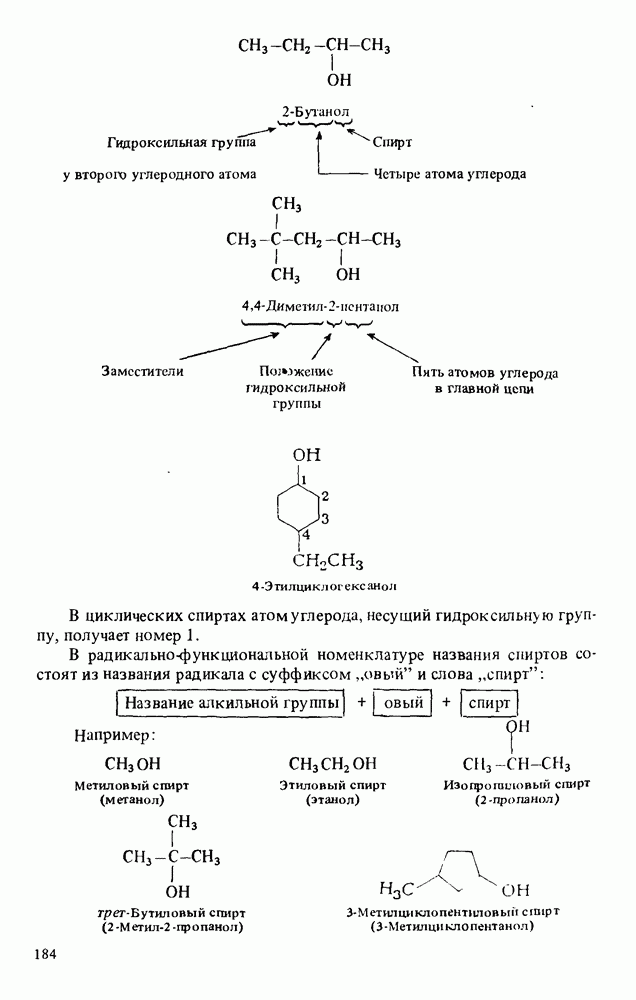
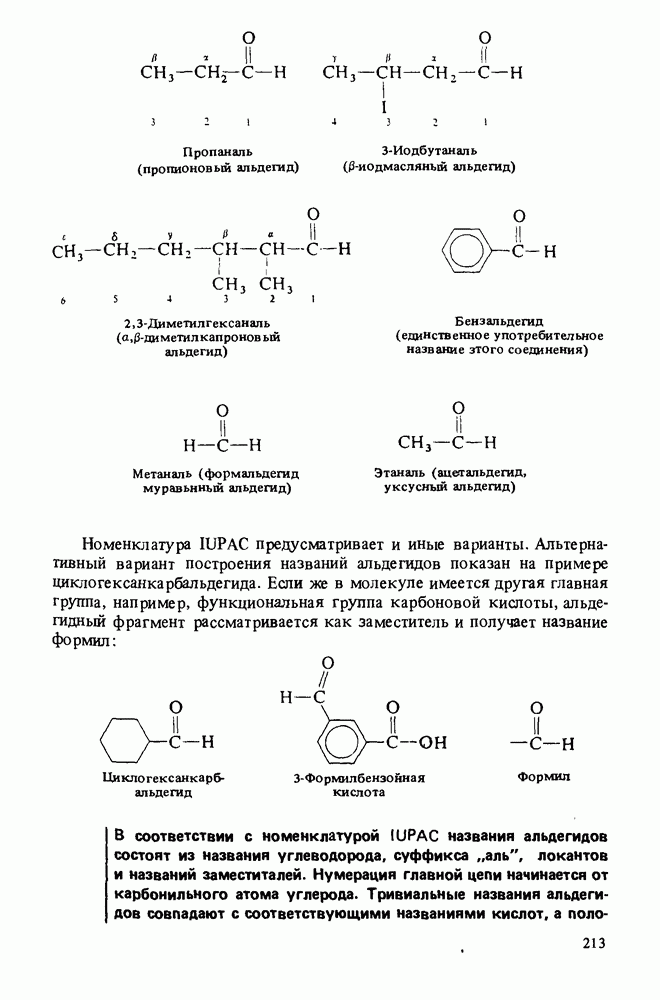
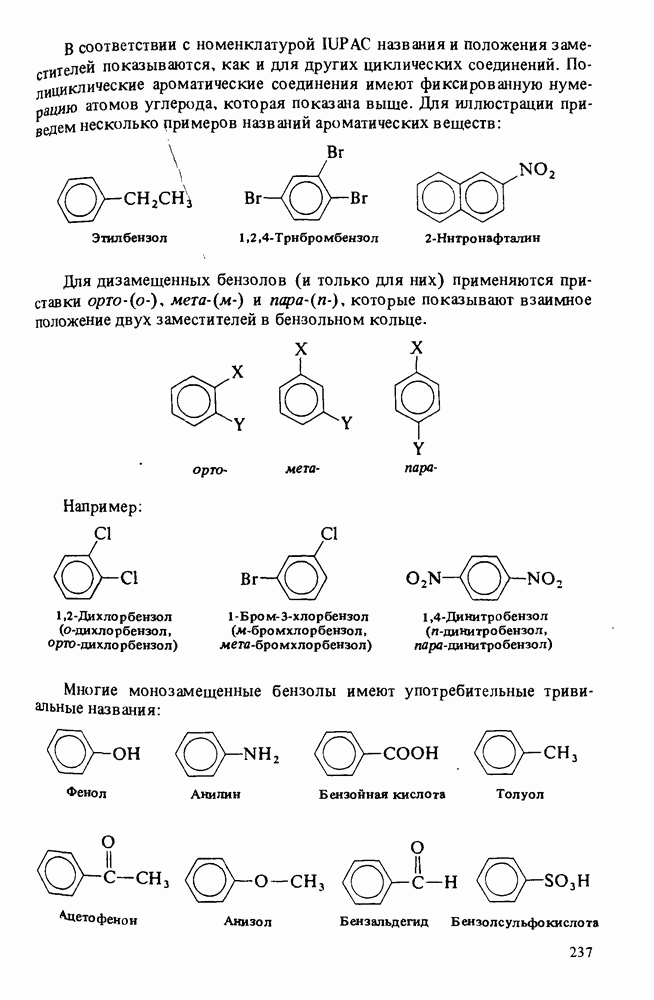
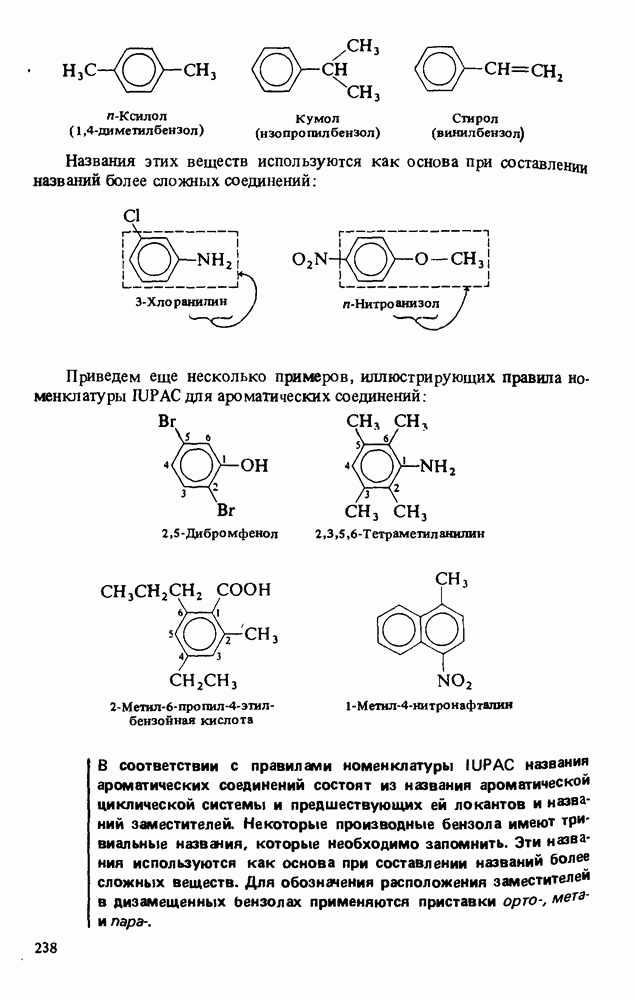
В соответствии с правилами номенклатуры IUPAC названия карбоновых кислот строятся путем добавления окончания "овая кислота" к названию углеводорода. Широко используются также тривиальные названия (ниже приведены в скобках):


Нумерация в номенклатуре IUPAC начинается с карбоксильного атома углерода. При составлении полутривиальных названий для обозначения положения заместителей используют греческие буквы. Оба типа названий показаны ниже:

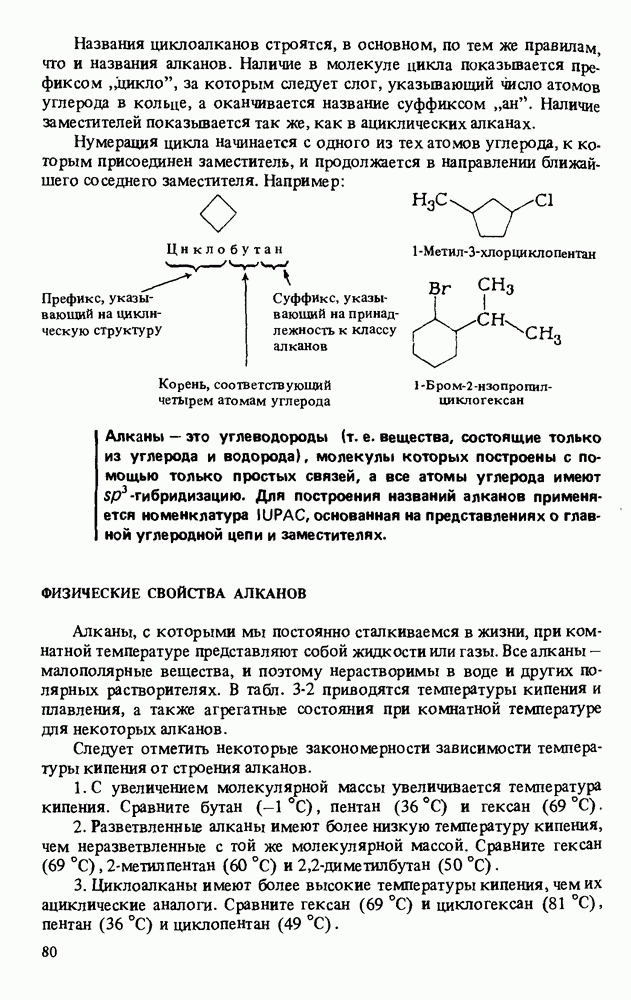
Названия циклических карбоновых кислот образуются путем добавления окончания "карбоновая кислота" к названию циклического углеводорода:

Ароматические карбоновые кислоты называют так же, как и другие циклические кислоты. В этом случае тривиальные и полутривиальные названия особенно употребительны.


Названия ациклических дикарбоновых кислот строятся путем добавления окончания "диовая кислота" к названию углеводорода:

Наиболее часто встречающаяся дикарбоновая кислота — щавелевая — сильно ядовита. Она встречается в вялых вишневых листьях. Поедание таких листьев домашним скотом может вызвать гибель животных. Щавелевая кислота образуется в организме при ферментативном окислении 1,2-этандиола (антифриза), что и обусловливает токсичность последнего. Щавелевую кислоту используют для удаления ржавчины и чернильных пятен с ковров, одежды и дерева.
В соответствии с правилами номенклатуры IUPAC карбоновые кислоты получают названия алкановых кислот. Широко применяются и тривиальные названия. Положение заместителей указывается цифровым локантом (нумерация начинается от карбоксильного атома углерода) или греческими буквами ( -атомом считается атом углерода, соседний с карбоксильной группой).
-атомом считается атом углерода, соседний с карбоксильной группой).
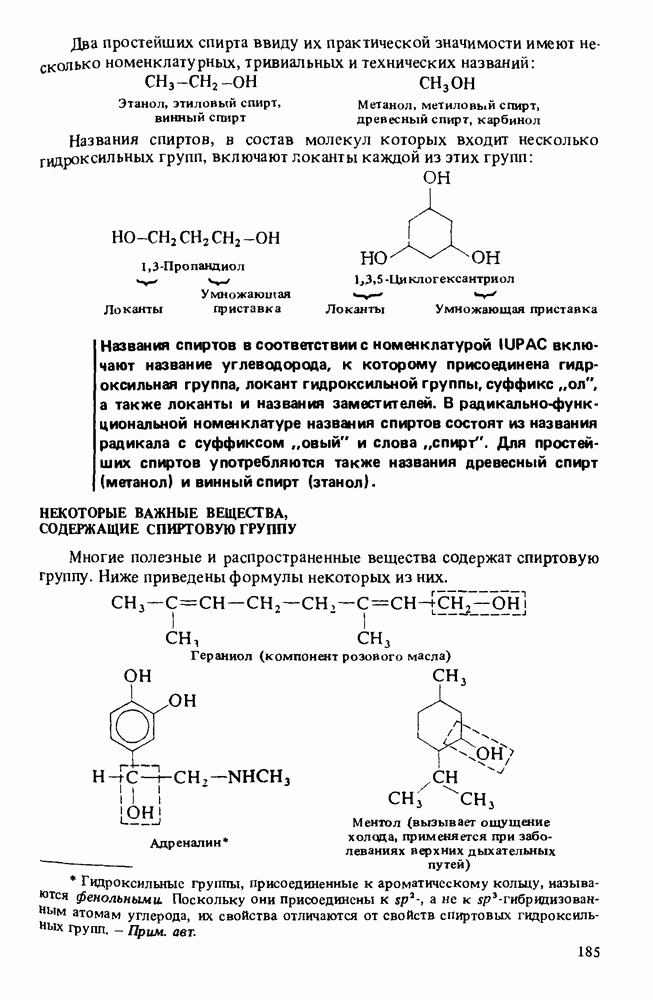
Практически значимые карбоновые кислоты
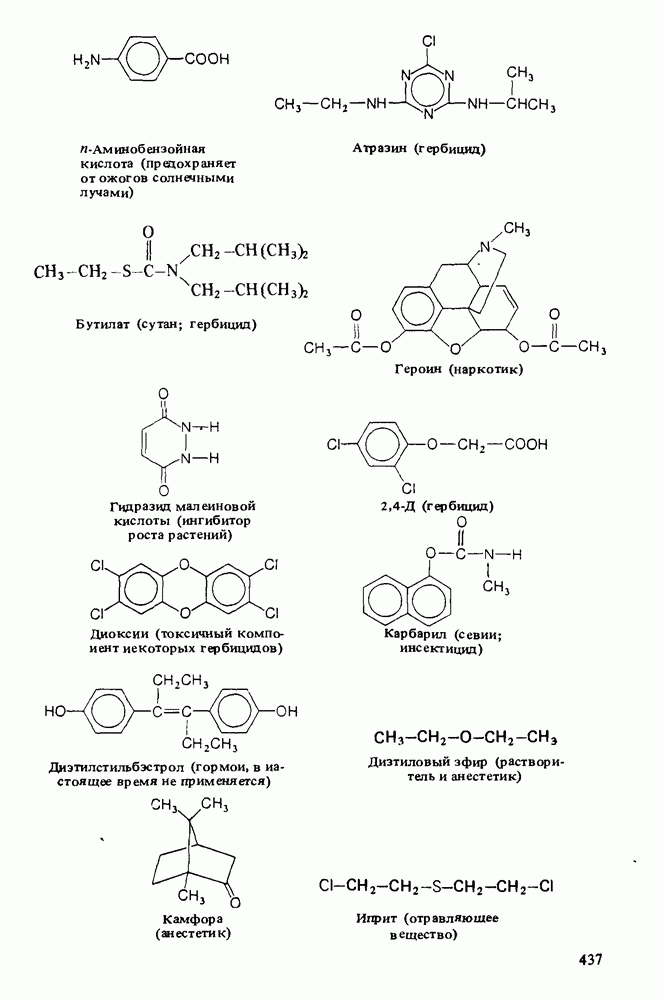
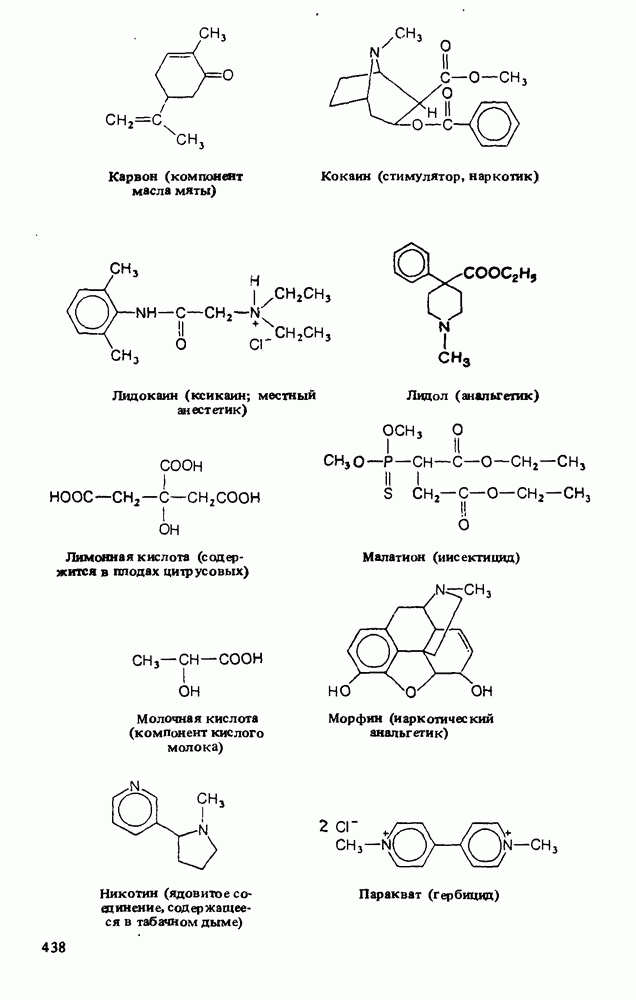
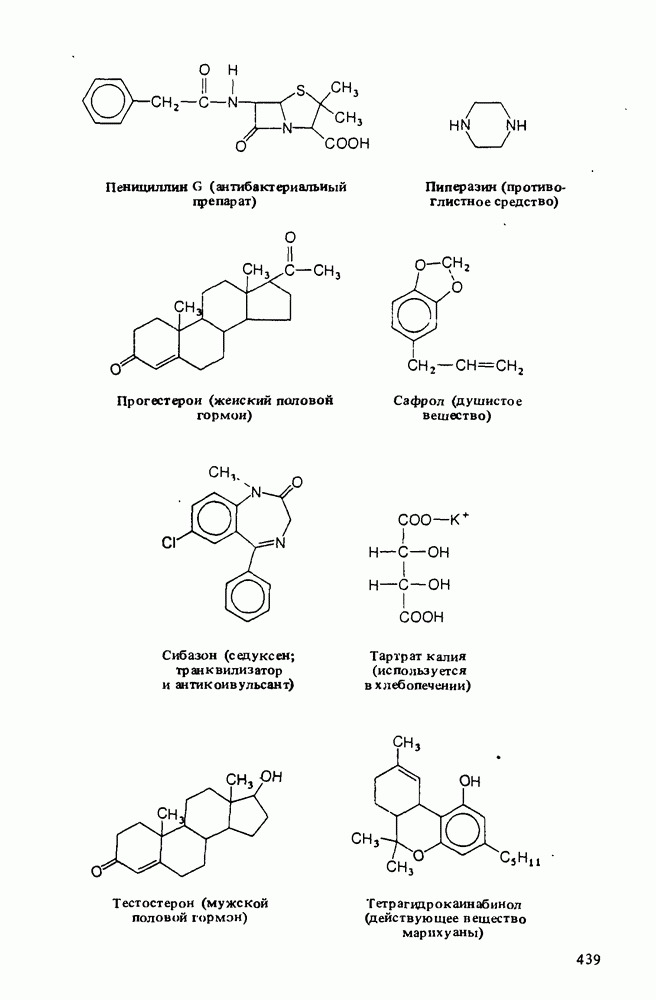
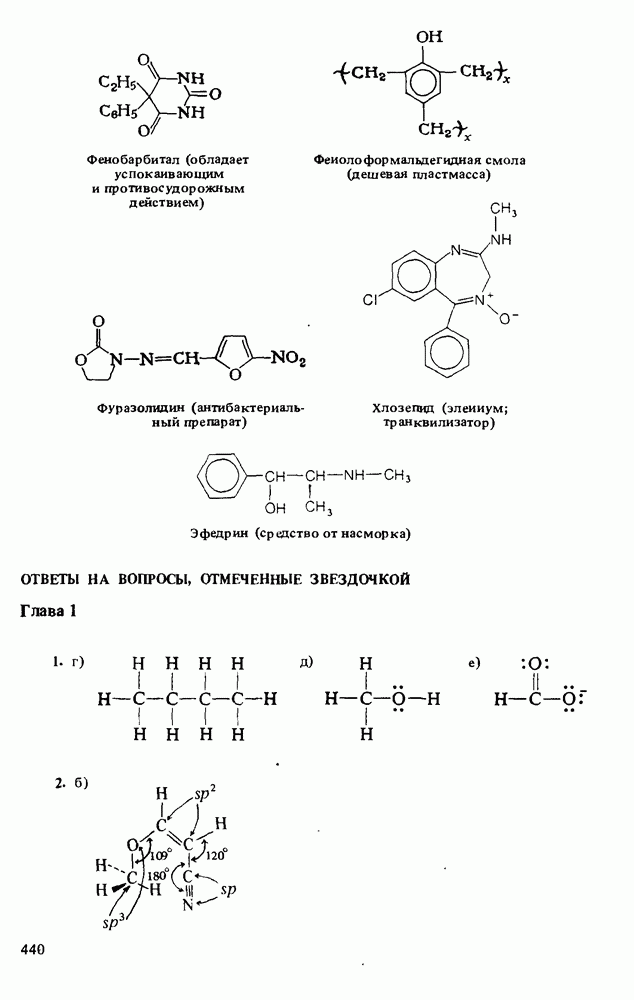
Ниже приведены некоторые кислоты, находящие практическое применение или встречающиеся в природе:


| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- Глава 1. КЛЮЧЕВЫЕ ПОНЯТИЯ ХИМИИ
- АТОМНАЯ ТЕОРИЯ
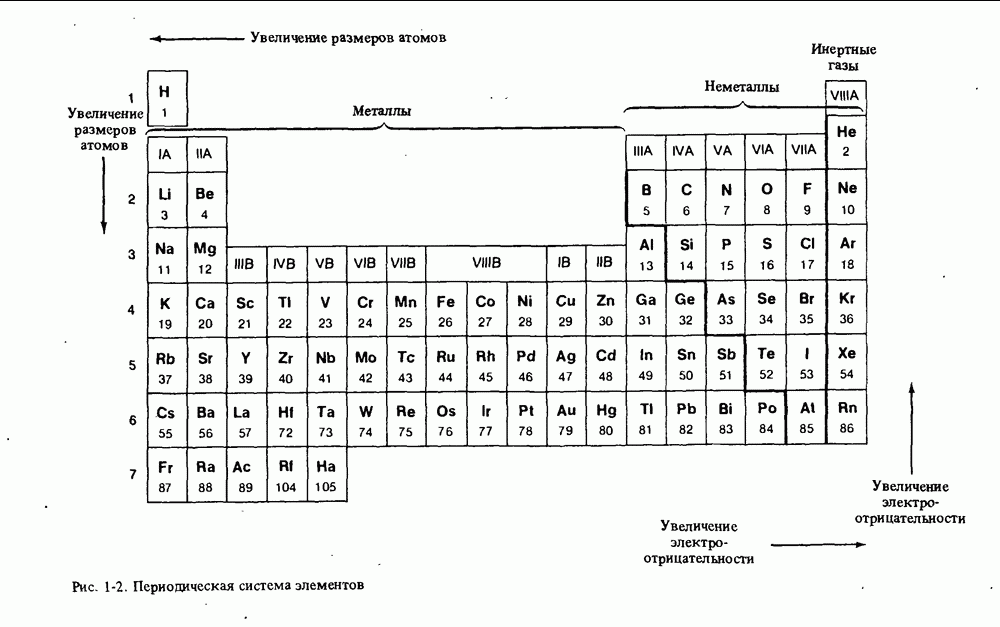
- ПЕРИОДИЧЕСКАЯ СИСТЕМА
- ХИМИЧЕСКАЯ СВЯЗЬ
- ФОРМУЛЫ ЛЬЮИСА
- ФОРМАЛЬНЫЙ ЗАРЯД
- РЕЗОНАНС
- ГЕОМЕТРИЯ МОЛЕКУЛ
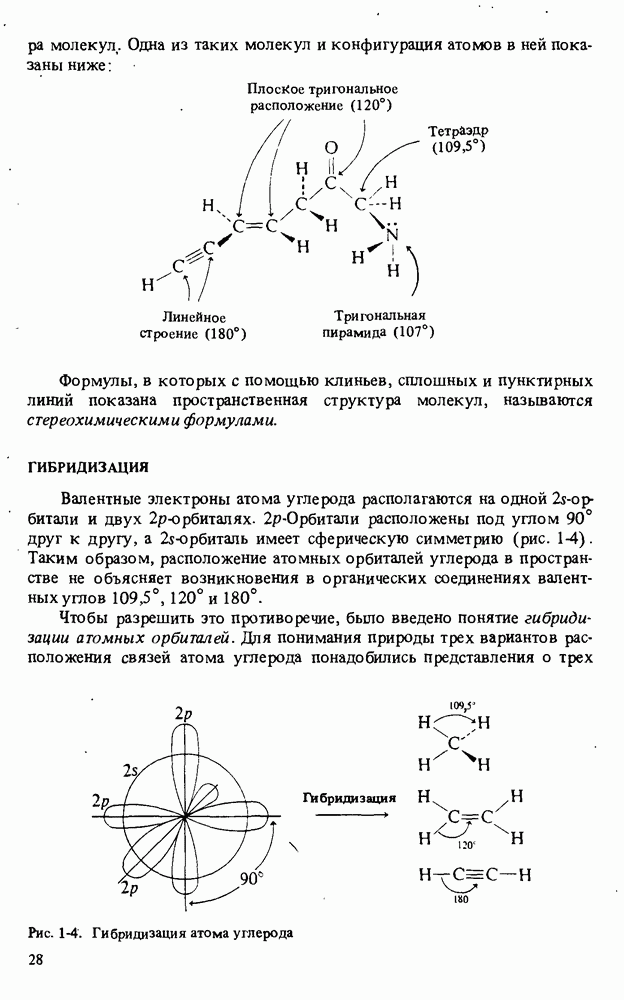
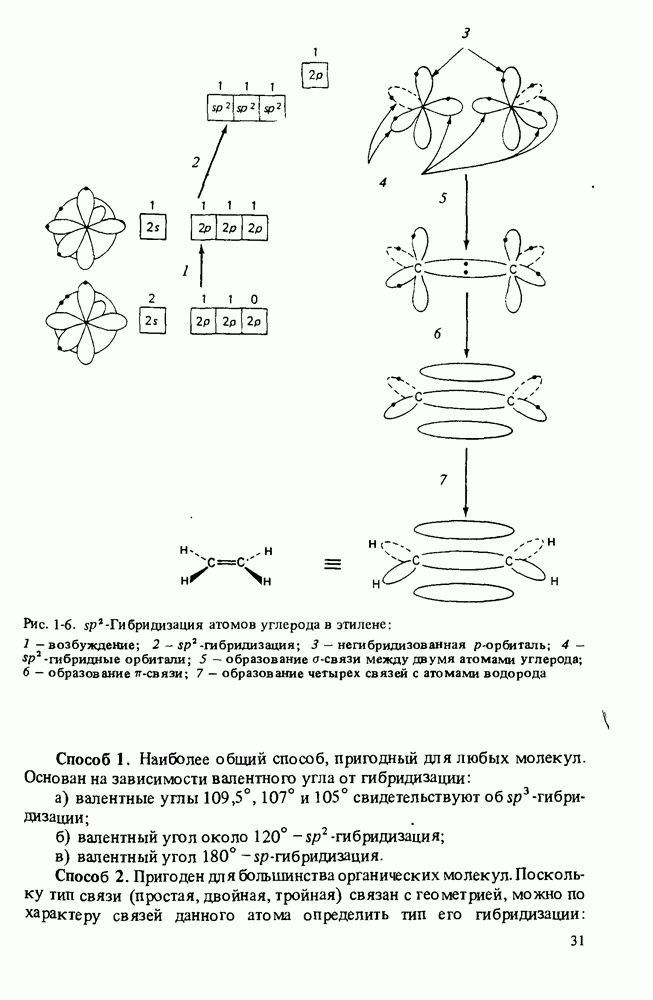
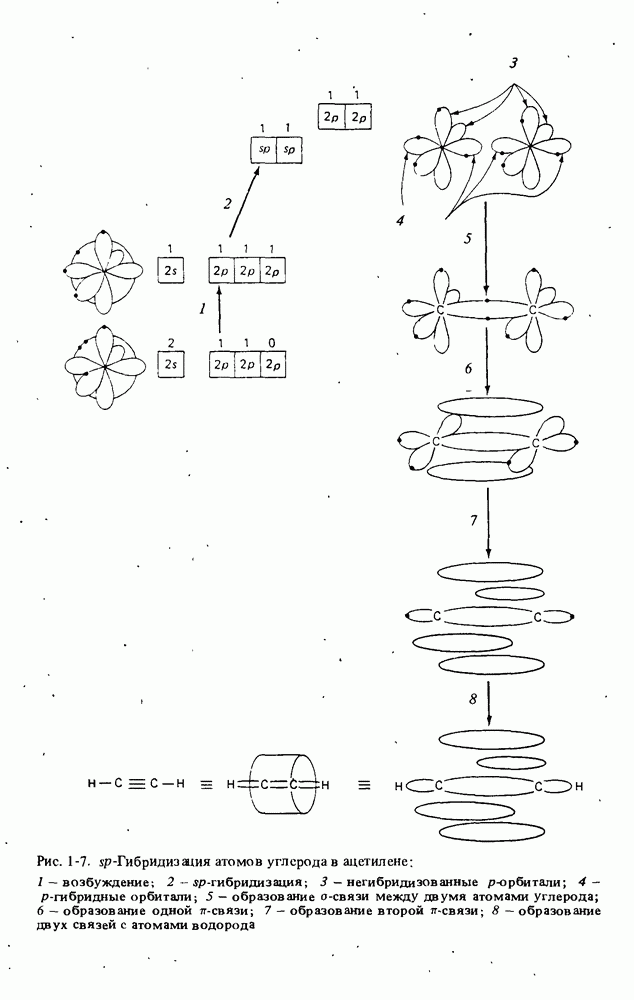
- ГИБРИДИЗАЦИЯ
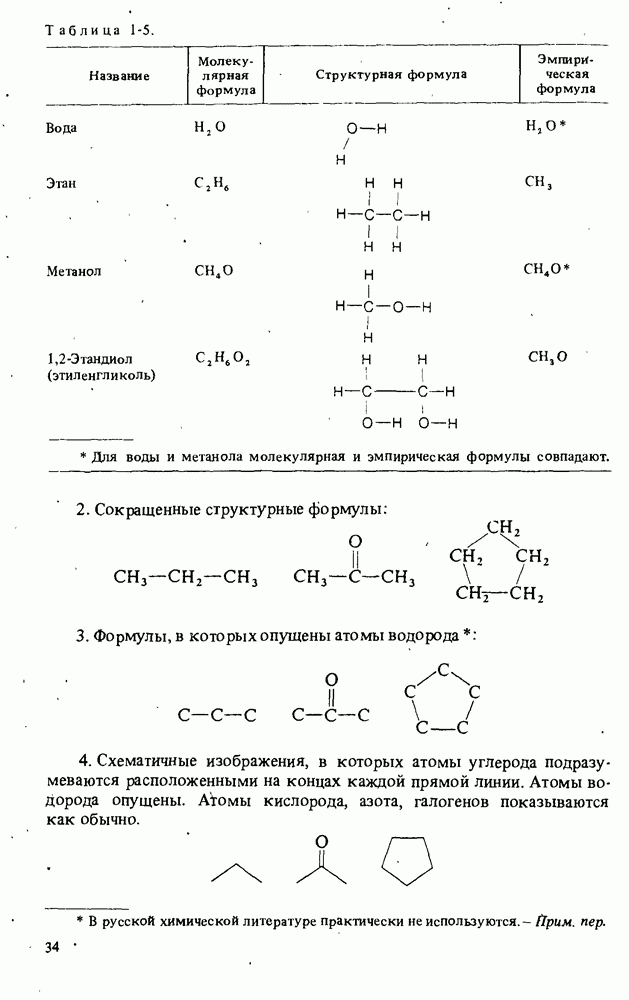
- ХИМИЧЕСКИЕ ФОРМУЛЫ
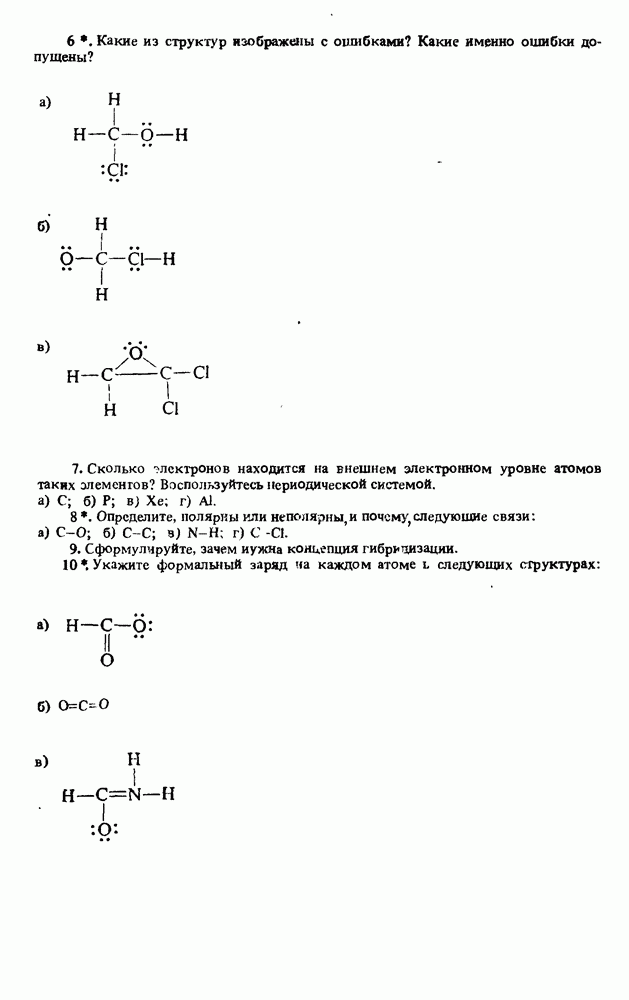
- СОВЕТЫ ИЗУЧАЮЩЕМУ ОРГАНИЧЕСКУЮ ХИМИЮ
- СВОДКА ОСНОВНЫХ ПОЛОЖЕНИЙ ГЛ. 1
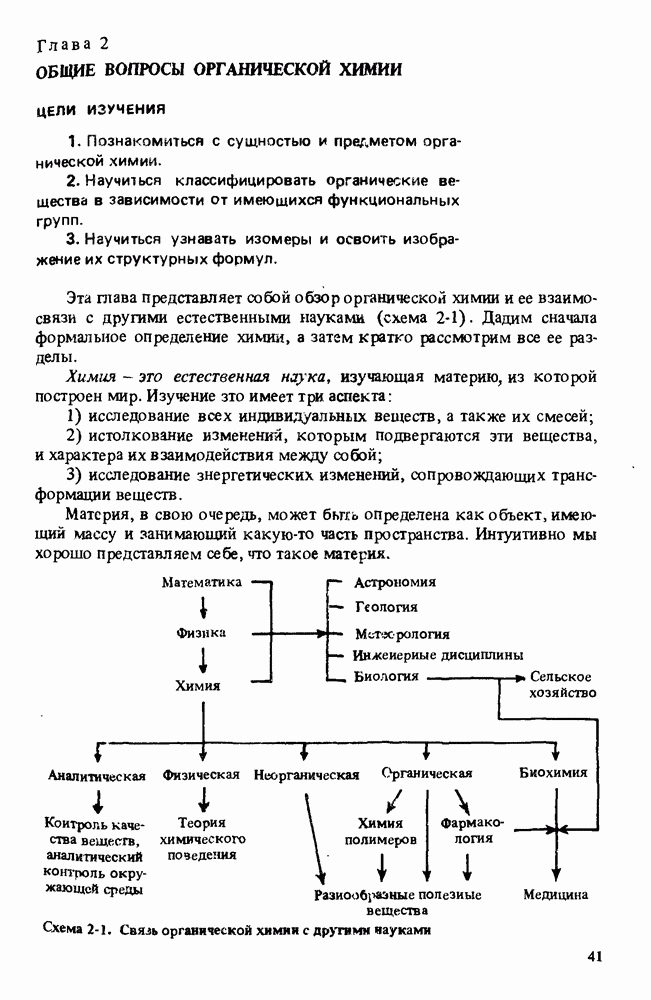
- Глава 2. ОБЩИЕ ВОПРОСЫ ОРГАНИЧЕСКОЙ ХИМИИ
- РАЗДЕЛЫ ХИМИИ
- СИНТЕТИЧЕСКАЯ ОРГАНИЧЕСКАЯ ХИМИЯ
- ПОЛЕЗНЫЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
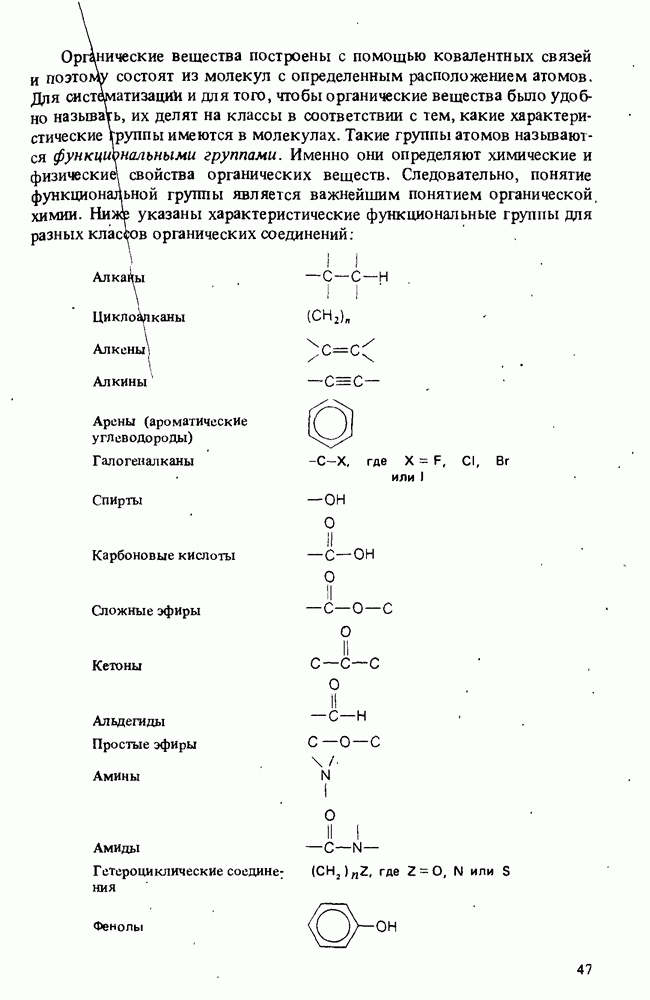
- КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
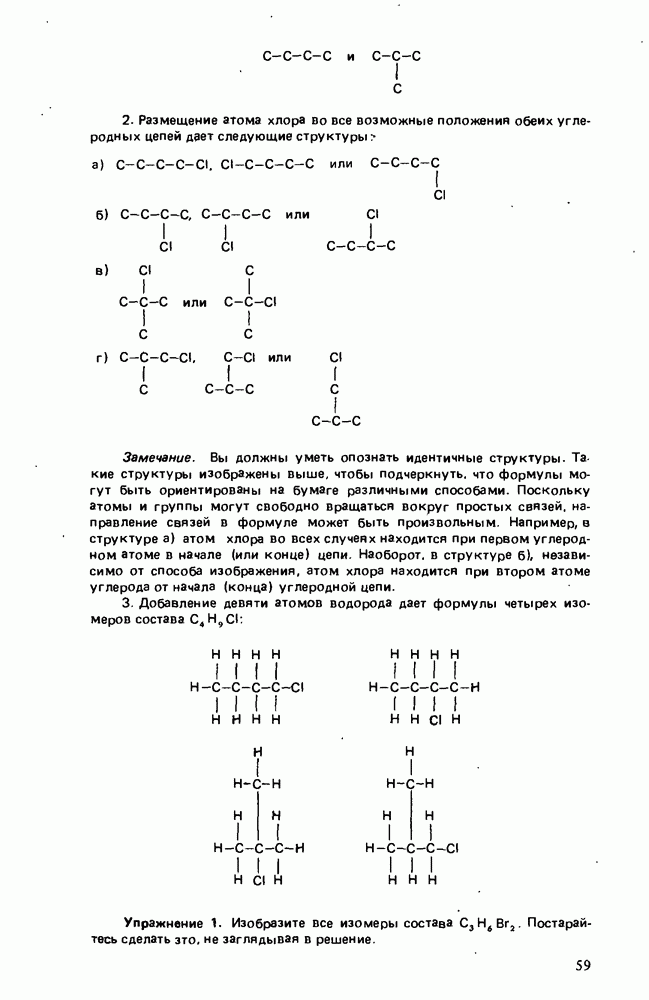
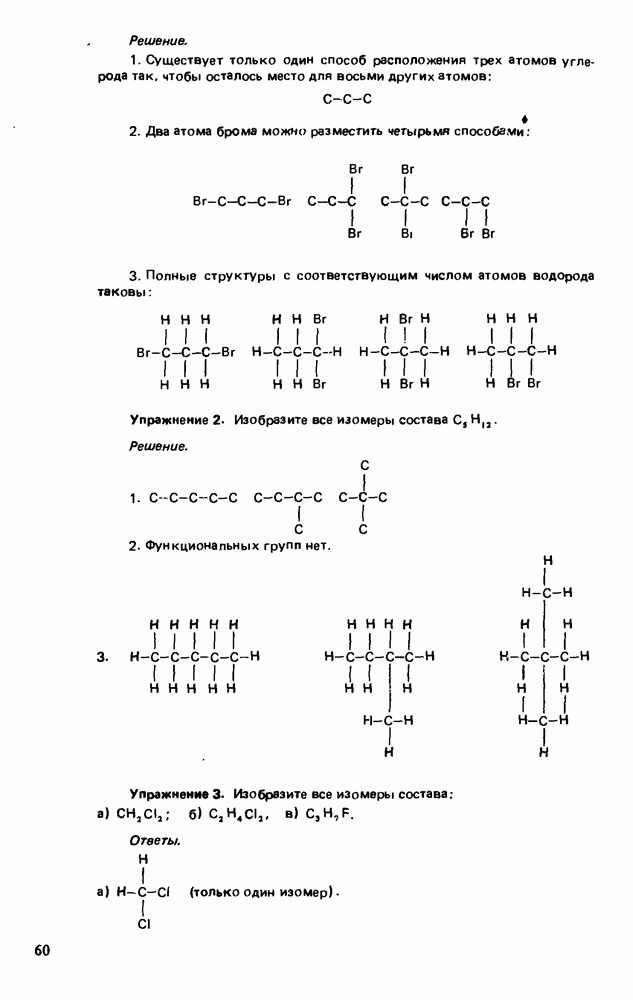
- ИЗОМЕРИЯ
- СВОДКА ОСНОВНЫХ ПОЛОЖЕНИЙ ГЛ. 2
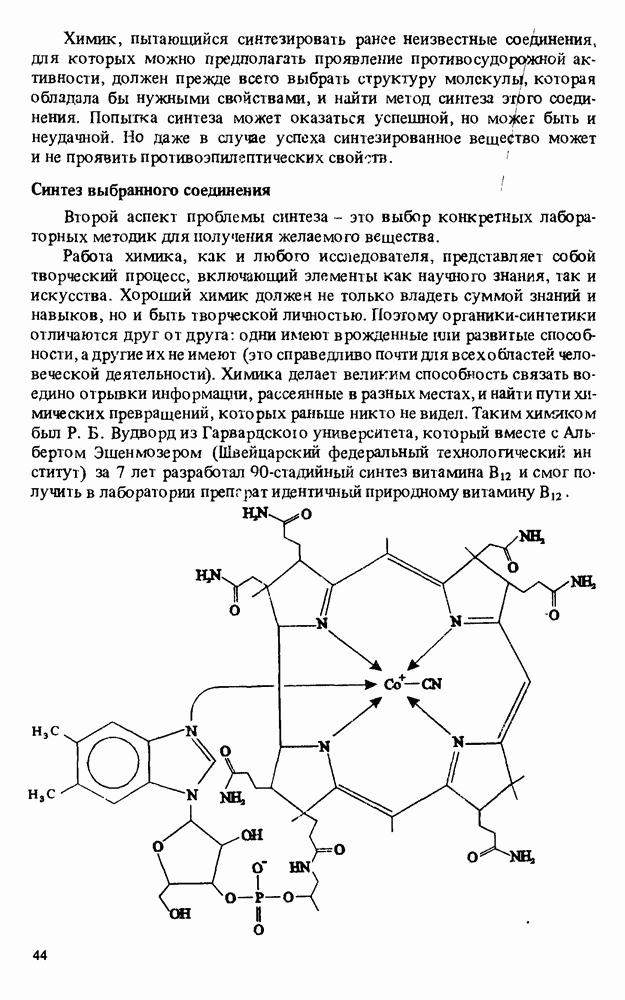
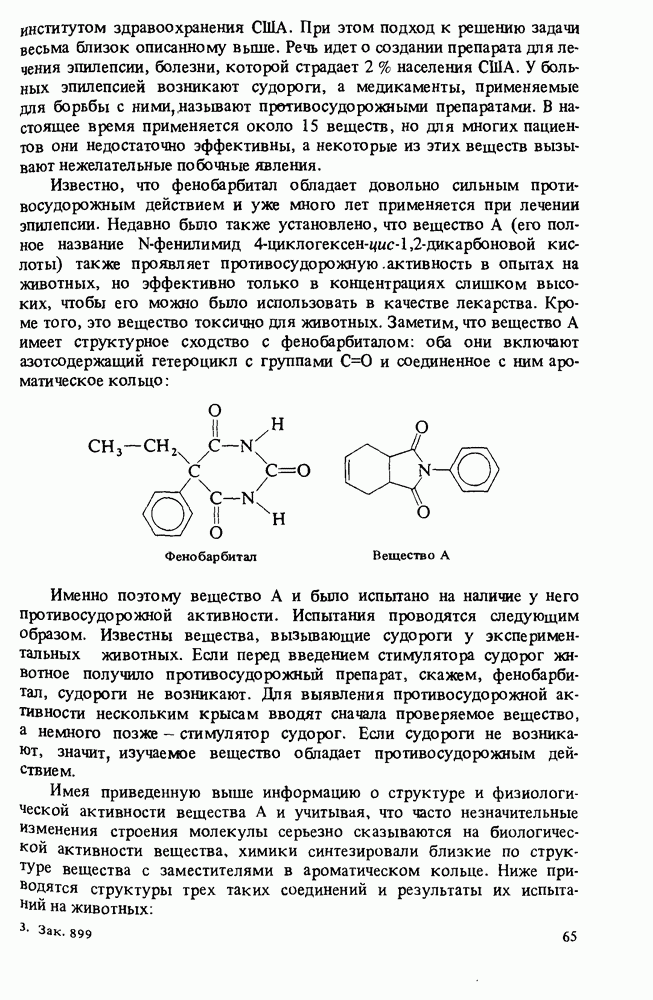
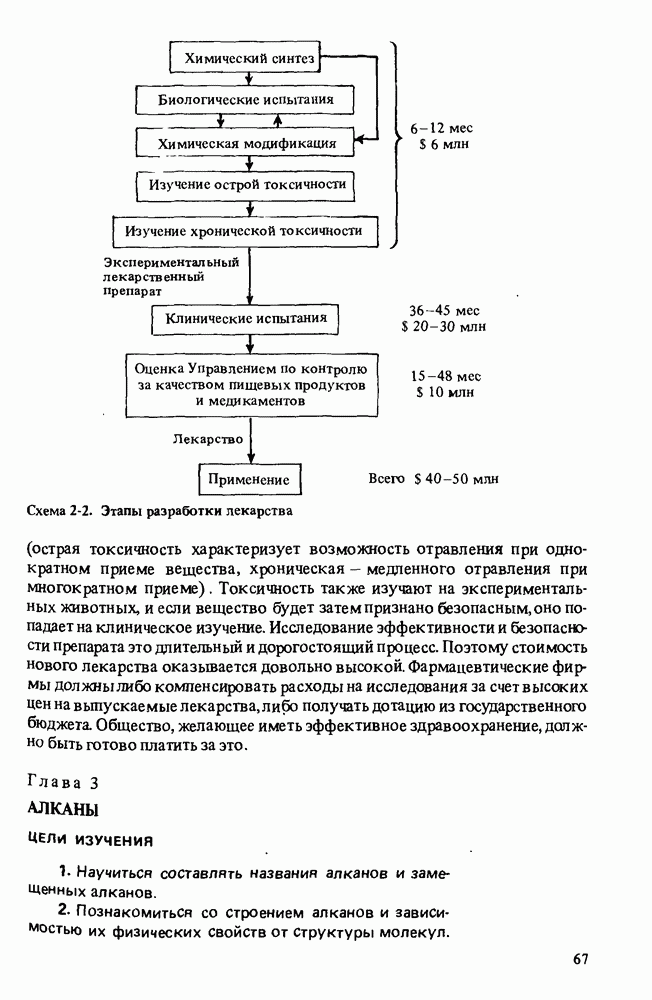
- Прикладная органическая химия: ХИМИЧЕСКИЙ СИНТЕЗ И МЕДИЦИНСКИЕ ИССЛЕДОВАНИЯ
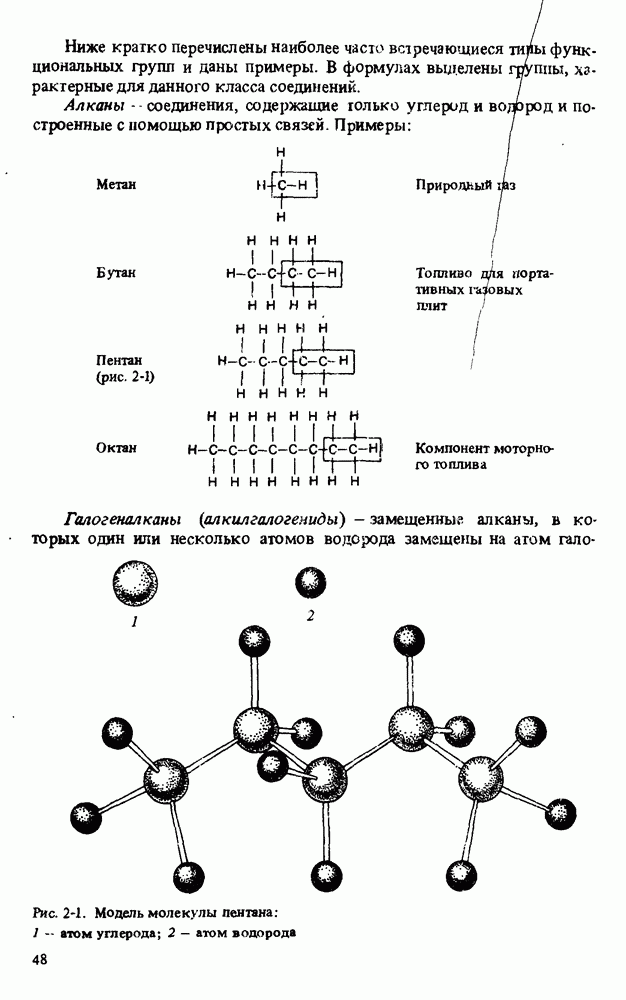
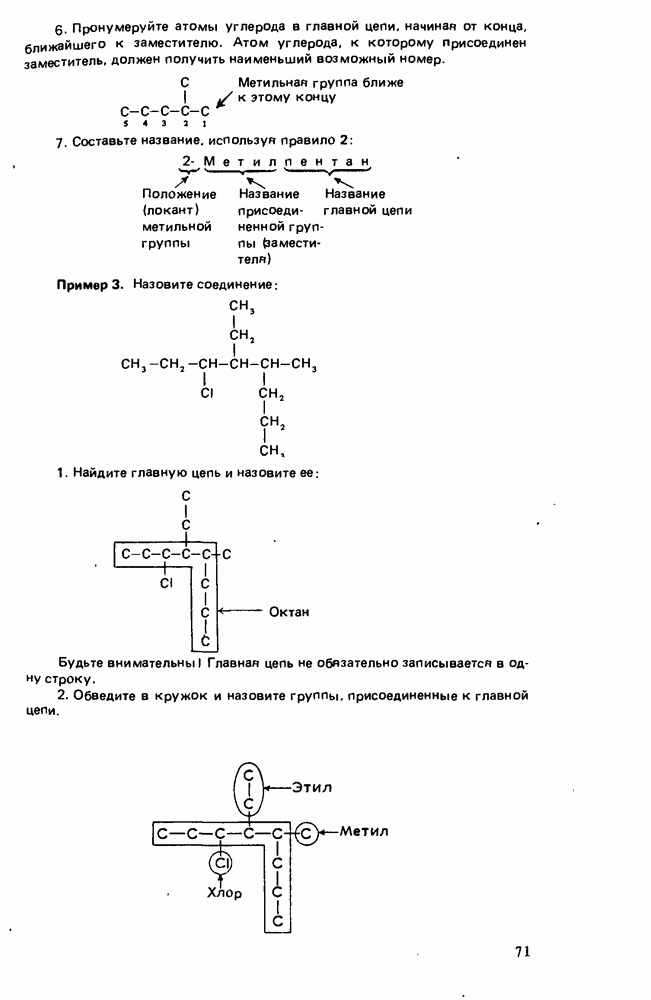
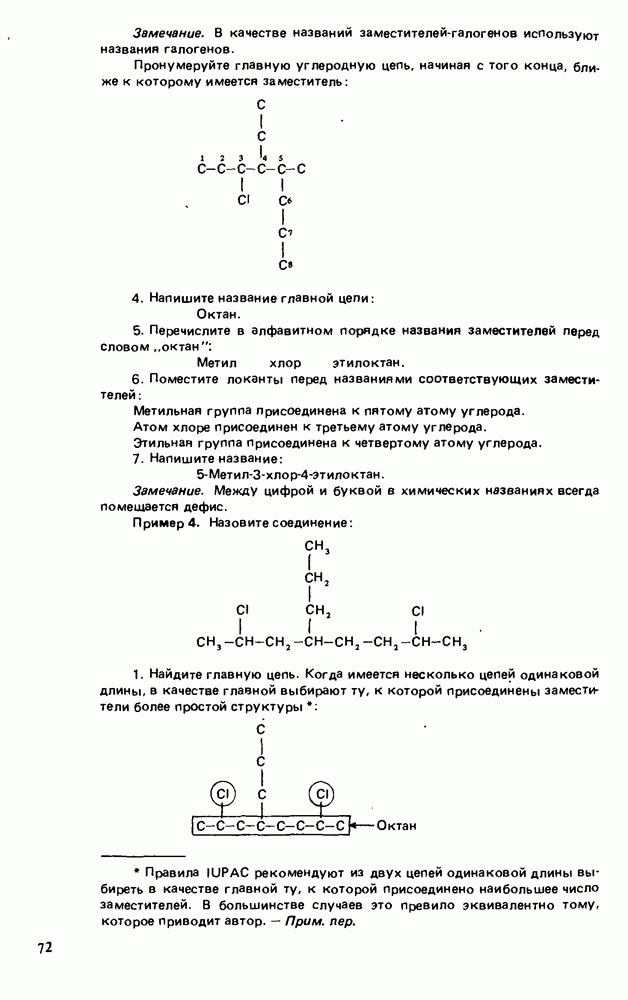
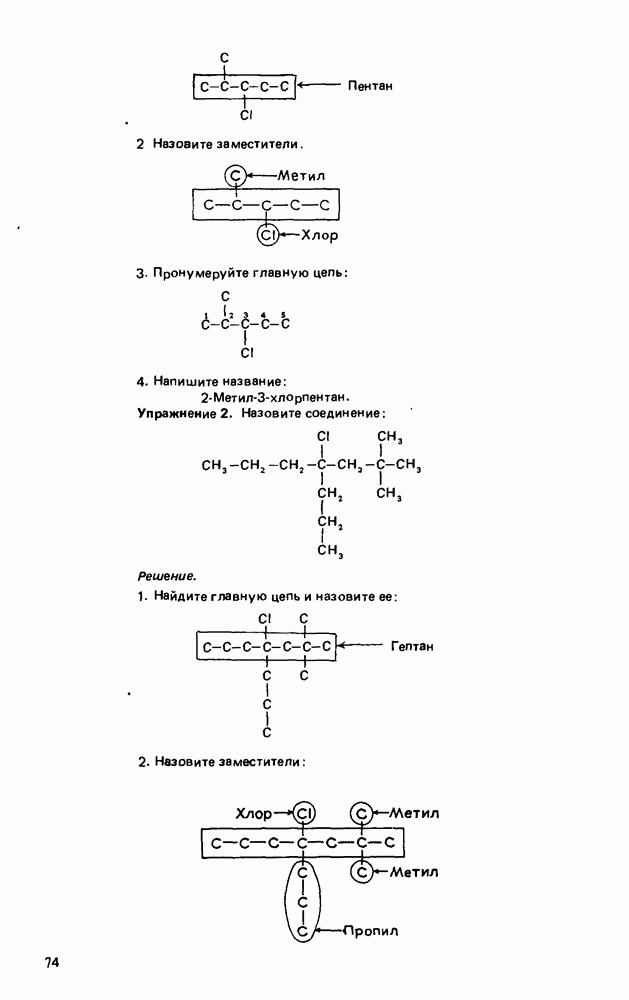
- Глава 3. АЛКАНЫ
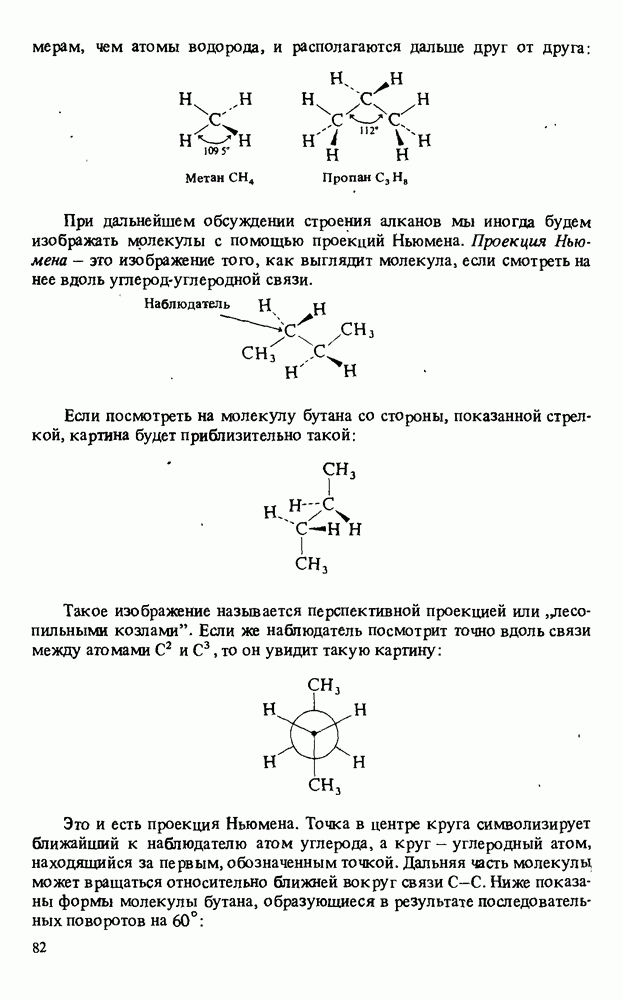
- ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
- СТРОЕНИЕ АЛКАНОВ
- ПОЛУЧЕНИЕ АЛКАНОВ
- РЕАКЦИИ АЛКАНОВ
- ХИМИЯ НЕФТИ
- СОВЕТЫ ИЗУЧАЮЩЕМУ ОРГАНИЧЕСКУЮ ХИМИЮ. ИЗУЧЕНИЕ РЕАКЦИЙ
- Глава 4. СТЕРЕОХИМИЯ И ОПТИЧЕСКАЯ АКТИВНОСТЬ
- СПОСОБЫ ИЗОБРАЖЕНИЯ ЭНАНТИОМЕРОВ
- ОБОЗНАЧЕНИЕ АБСОЛЮТНОЙ КОНФИГУРАЦИИ
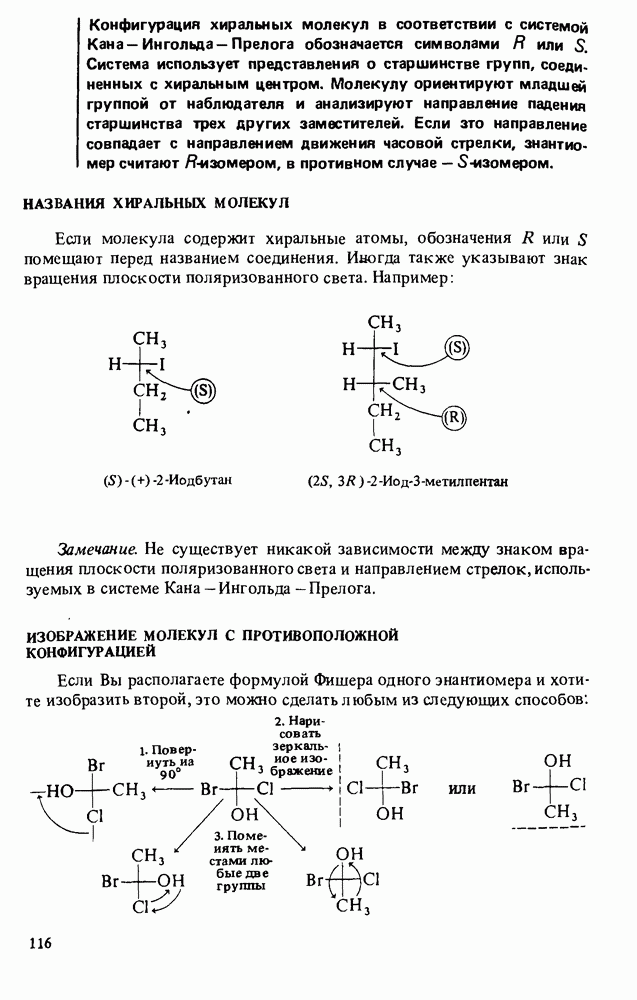
- НАЗВАНИЯ ХИРАЛЬНЫХ МОЛЕКУЛ
- ИЗОБРАЖЕНИЕ МОЛЕКУЛ С ПРОТИВОПОЛОЖНОЙ КОНФИГУРАЦИЕЙ
- D,L-НОМЕНКЛАТУРА ЭНАНТИОМЕРОВ
- ТЕРМИНОЛОГИЯ, ПРИМЕНЯЕМАЯ В СТЕРЕОХИМИИ
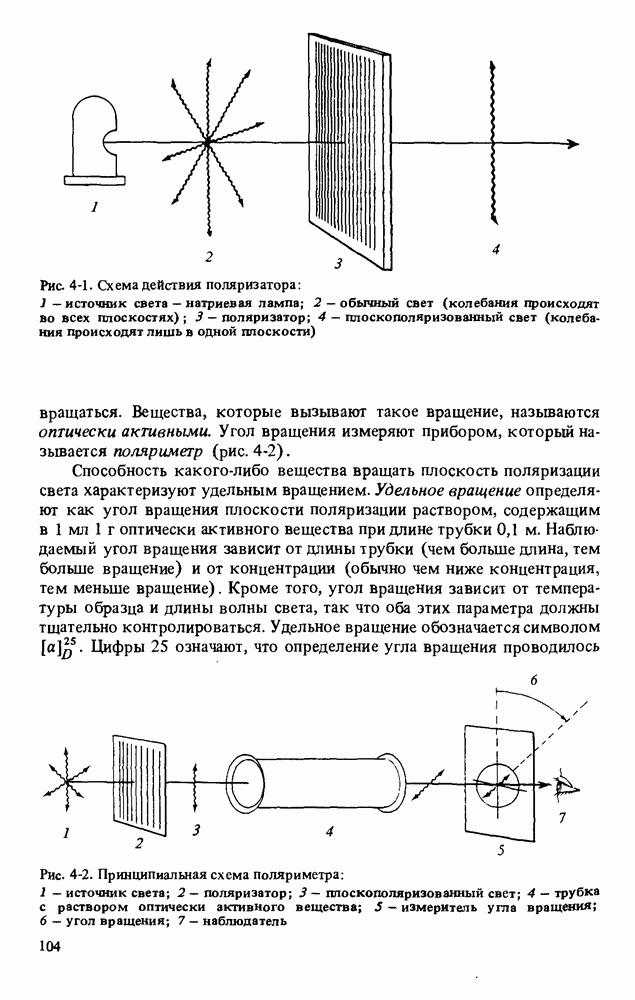
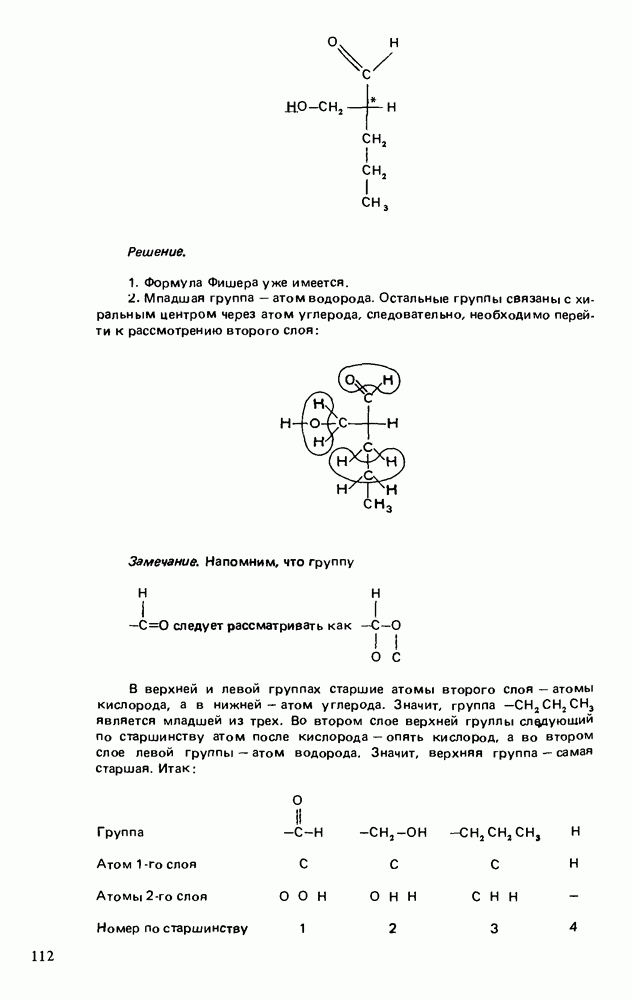
- ЗНАЧЕНИЕ ОПТИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ
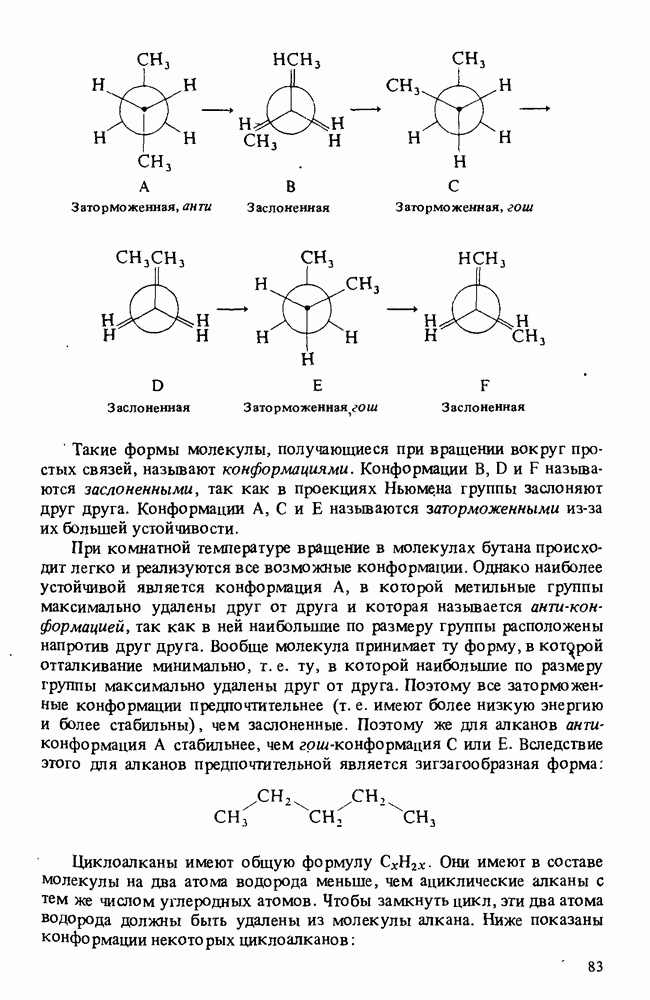
- Глава 5. ОРГАНИЧЕСКИЕ ГАЛОГЕНСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
- ПОЛУЧЕНИЕ ГАЛОГЕНАЛКАНОВ
- РЕАКЦИИ ГАЛОГЕНАЛКАНОВ
- ПРАКТИЧЕСКИ ВАЖНЫЕ ГАЛОГЕНАЛКАНЫ
- Прикладная органическая химия: ОРГАНИЧЕСКИЕ ПЕСТИЦИДЫ
- Глава 6. НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
- НОМЕНКЛАТУРА АЛКЕНОВ
- ПОЛУЧЕНИЕ АЛКЕНОВ
- ОСНОВНЫЕ РЕАКЦИИ АЛКЕНОВ
- ПОЛИМЕРЫ
- НОМЕНКЛАТУРА АЛКИНОВ
- ПОЛУЧЕНИЕ АЛКИНОВ
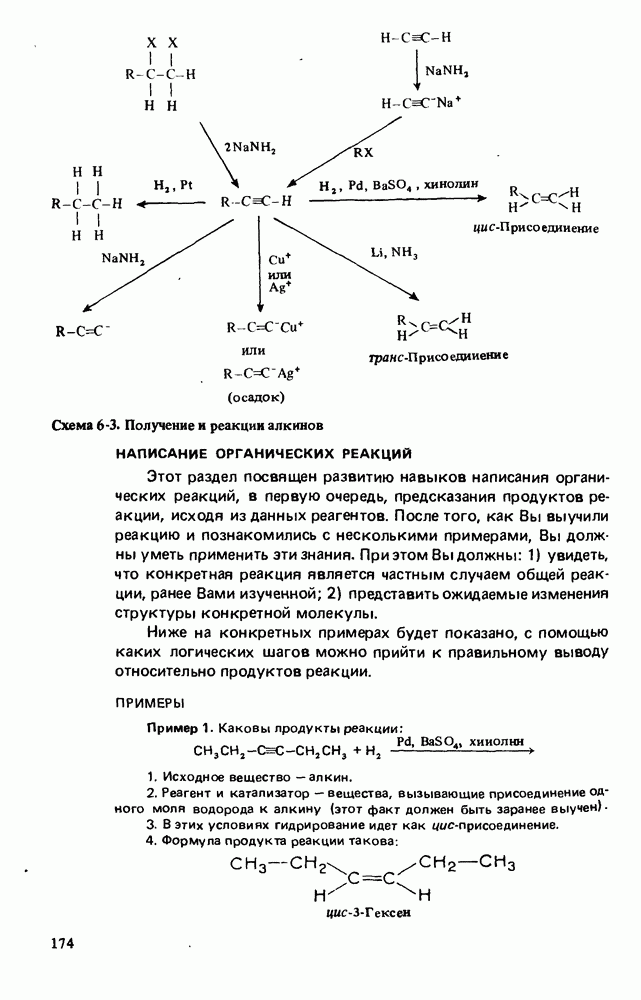
- РЕАКЦИИ АЛКИНОВ
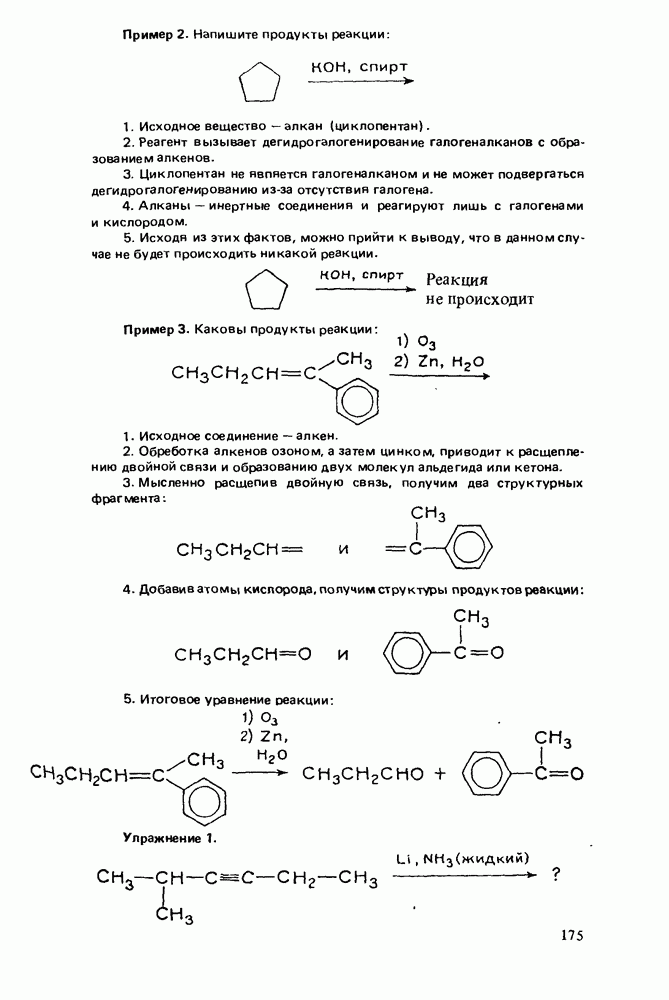
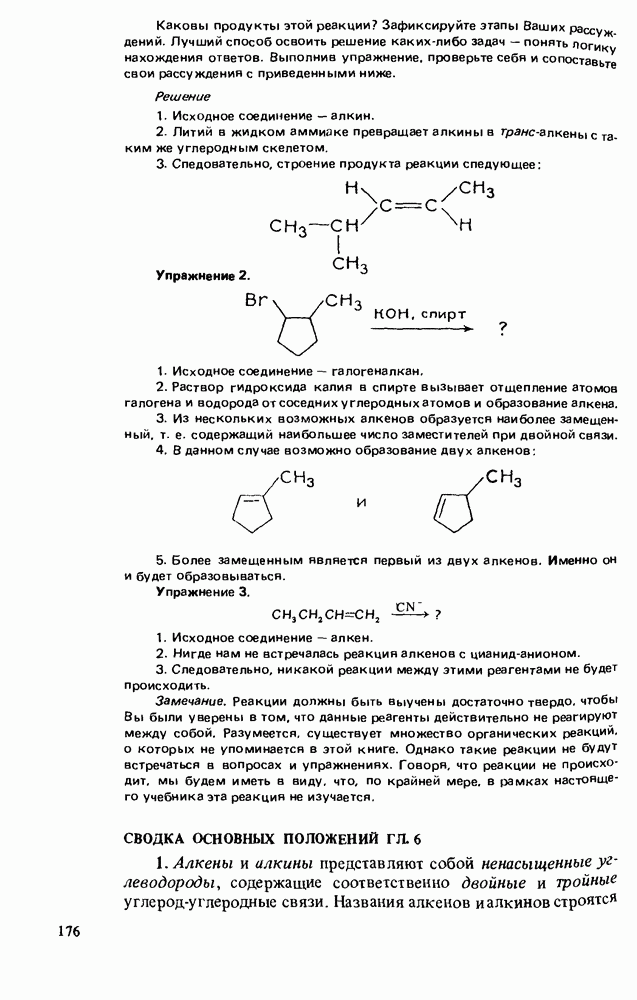
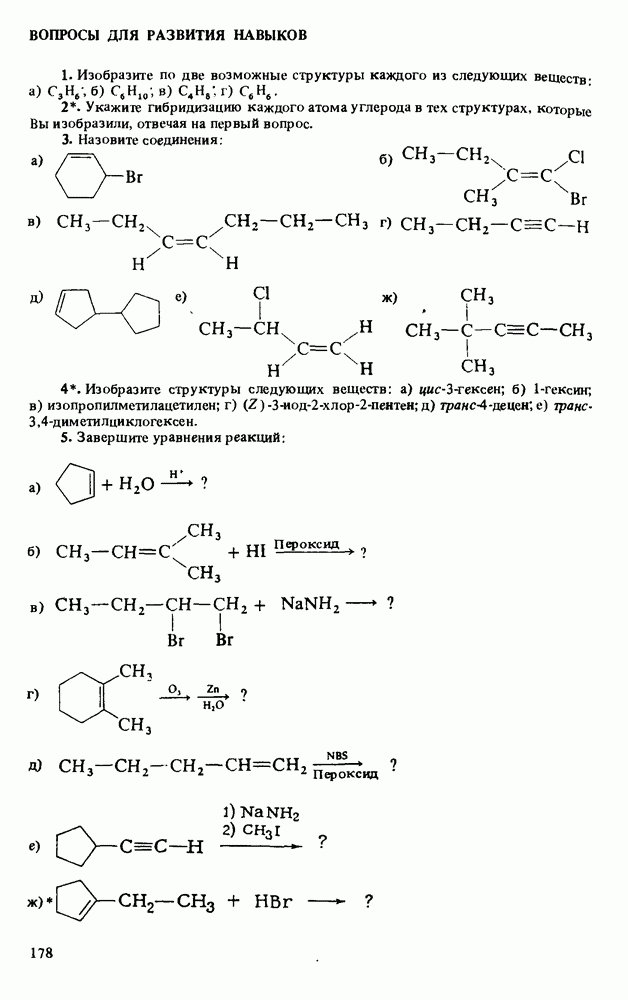
- НАПИСАНИЕ ОРГАНИЧЕСКИХ РЕАКЦИЙ
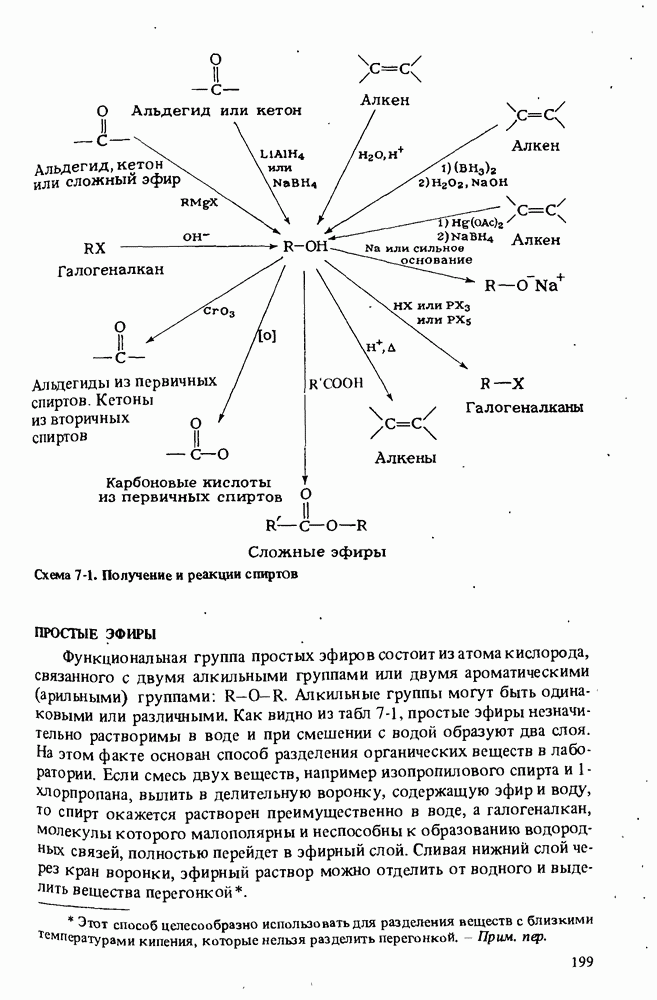
- Глава 7. СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
- НОМЕНКЛАТУРА СПИРТОВ
- НЕКОТОРЫЕ ВАЖНЫЕ ВЕЩЕСТВА, СОДЕРЖАЩИЕ СПИРТОВУЮ ГРУППУ
- ЭТИЛОВЫЙ СПИРТ. ПРОИЗВОДСТВО СПИРТНЫХ НАПИТКОВ
- ПОЛУЧЕНИЕ СПИРТОВ
- РЕАКЦИИ СПИРТОВ
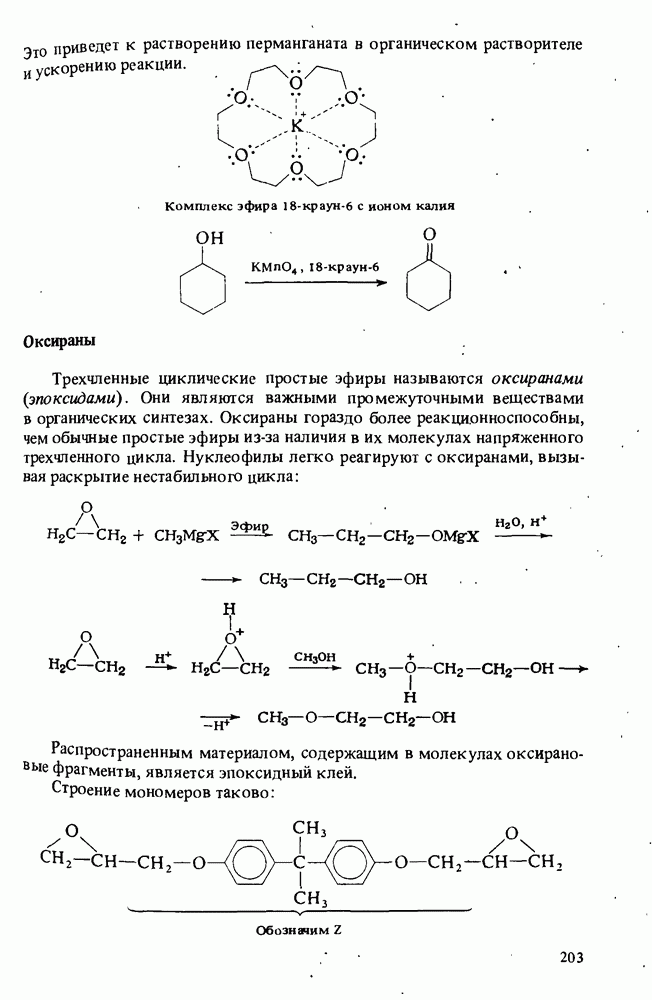
- ПРОСТЫЕ ЭФИРЫ
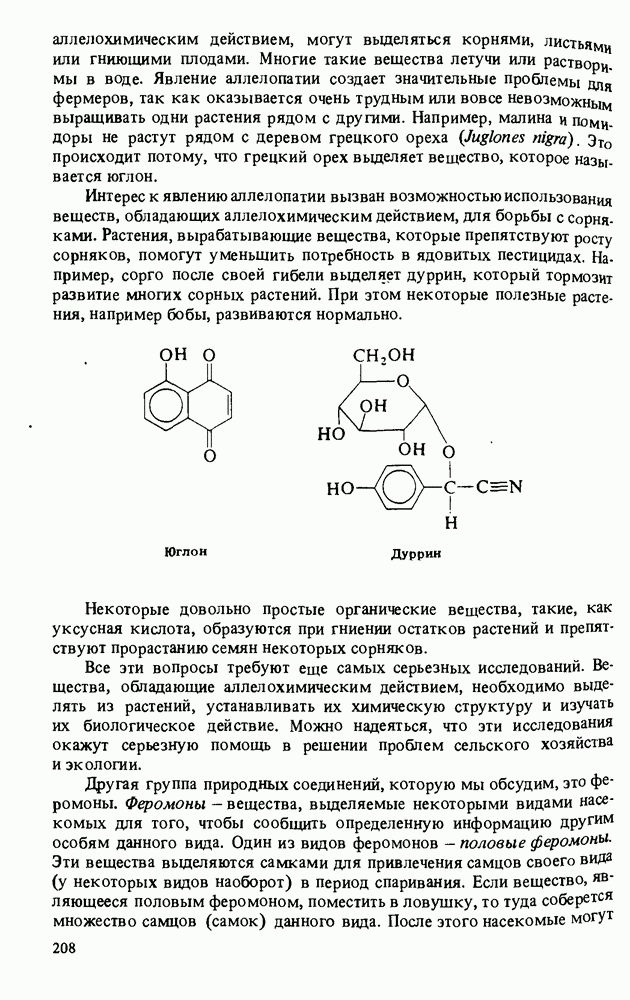
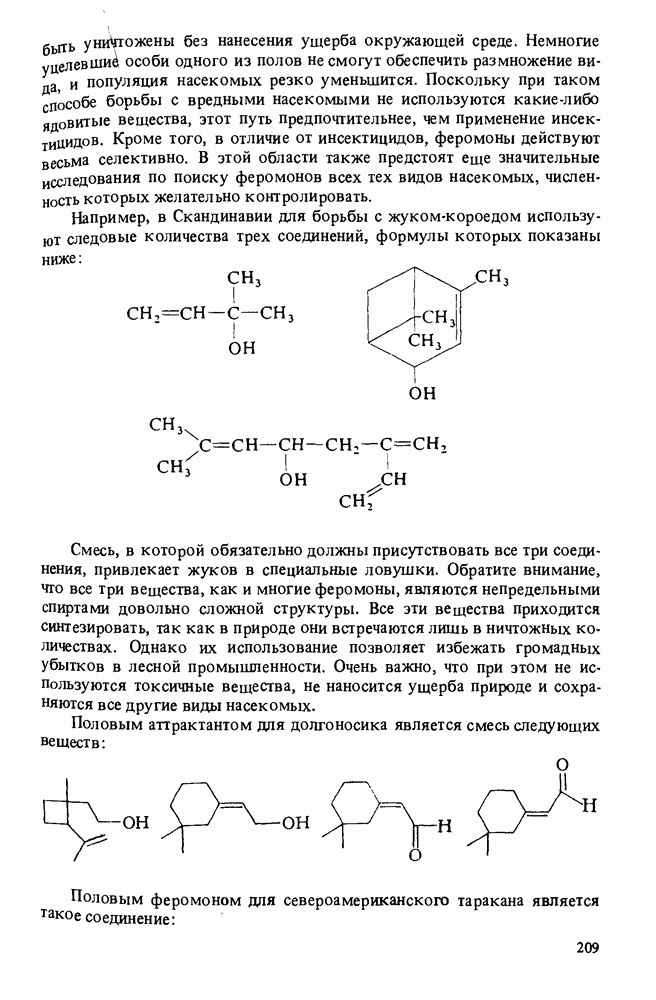
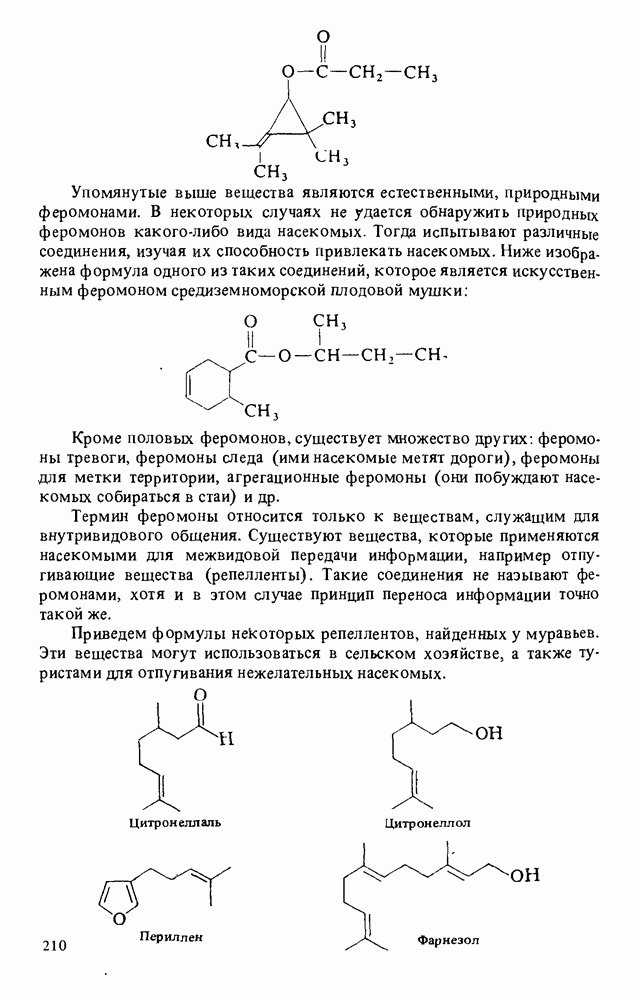
- Прикладная органическая химия: ВЕЩЕСТВА, ОБЛАДАЮЩИЕ АЛЛЕЛОХИМИЧЕСКИМ ДЕЙСТВИЕМ. ФЕРОМОНЫ
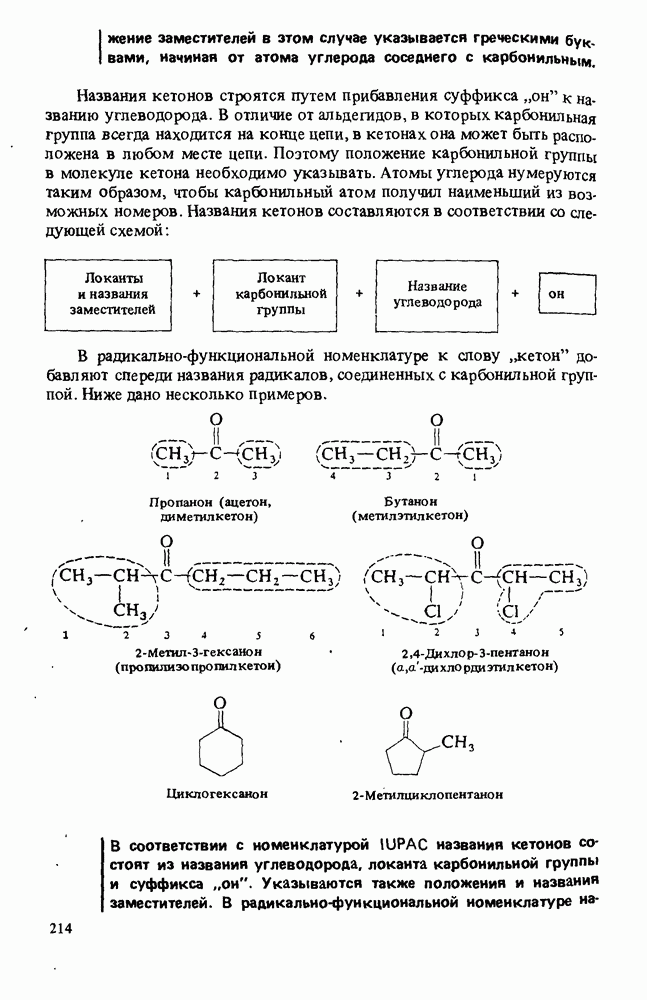
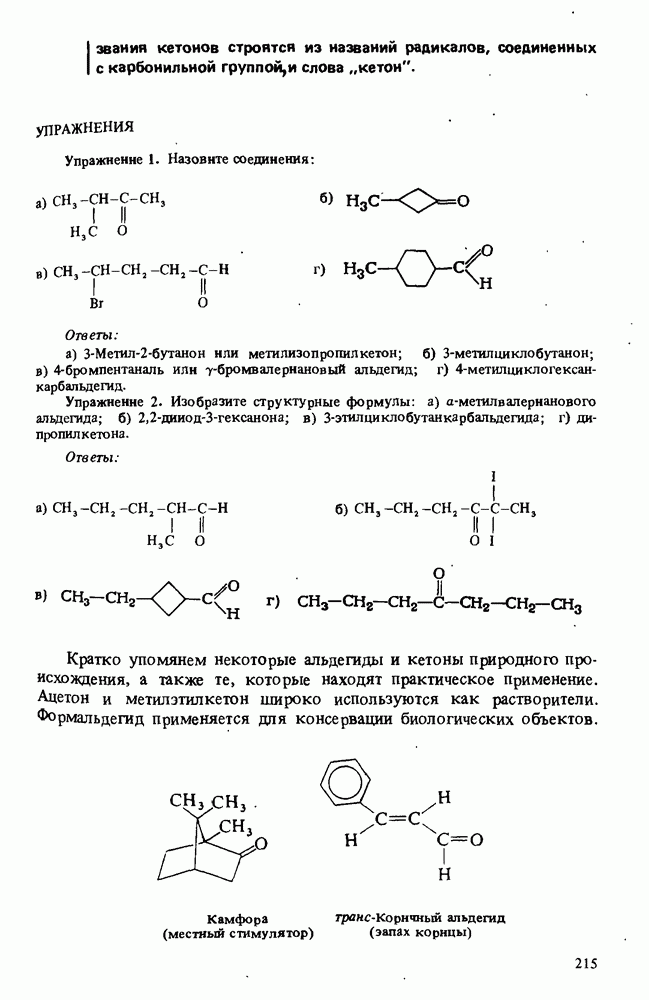
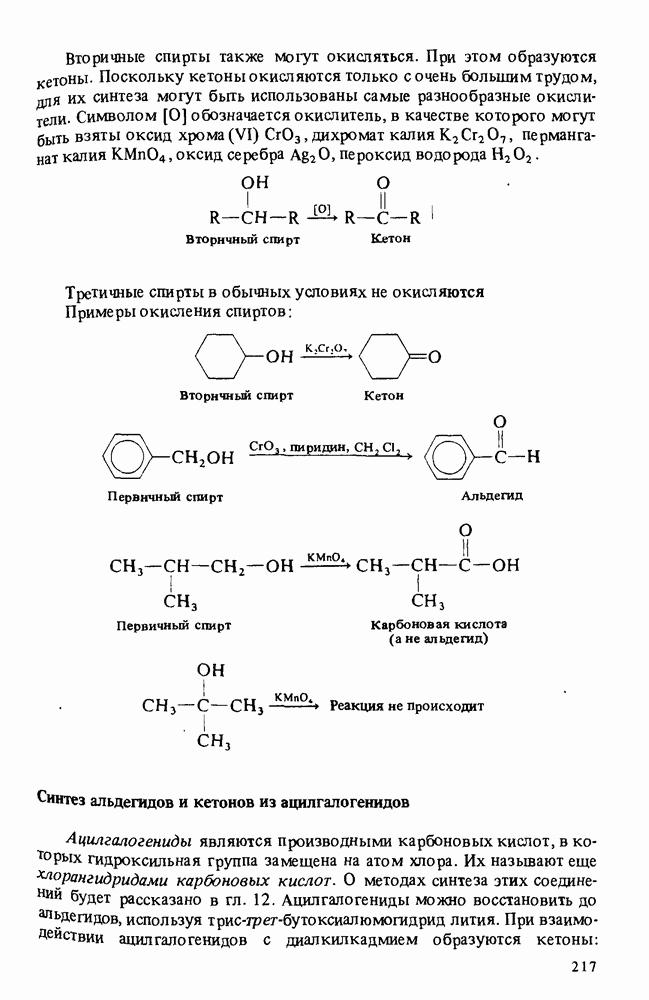
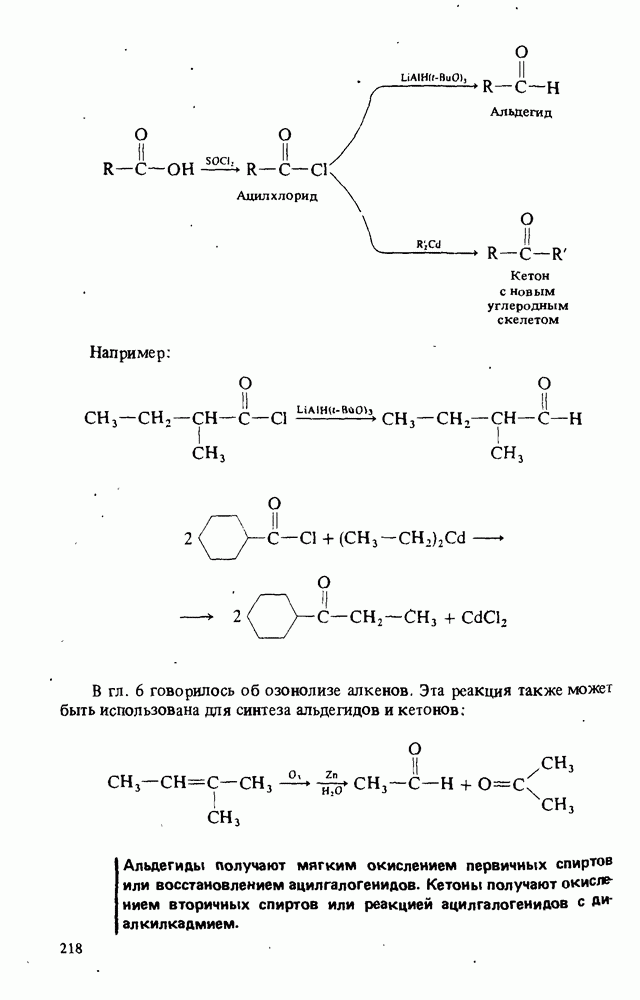
- Глава 8. АЛЬДЕГИДЫ И КЕТОНЫ
- ПОЛУЧЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ
- РЕАКЦИИ АЛЬДЕГИДОВ И КЕТОНОВ
- Глава 9. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- НОМЕНКЛАТУРА АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
- ПРИМЕНЕНИЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ В ПРОМЫШЛЕННОСТИ И В БЫТУ
- АРОМАТИЧНОСТЬ
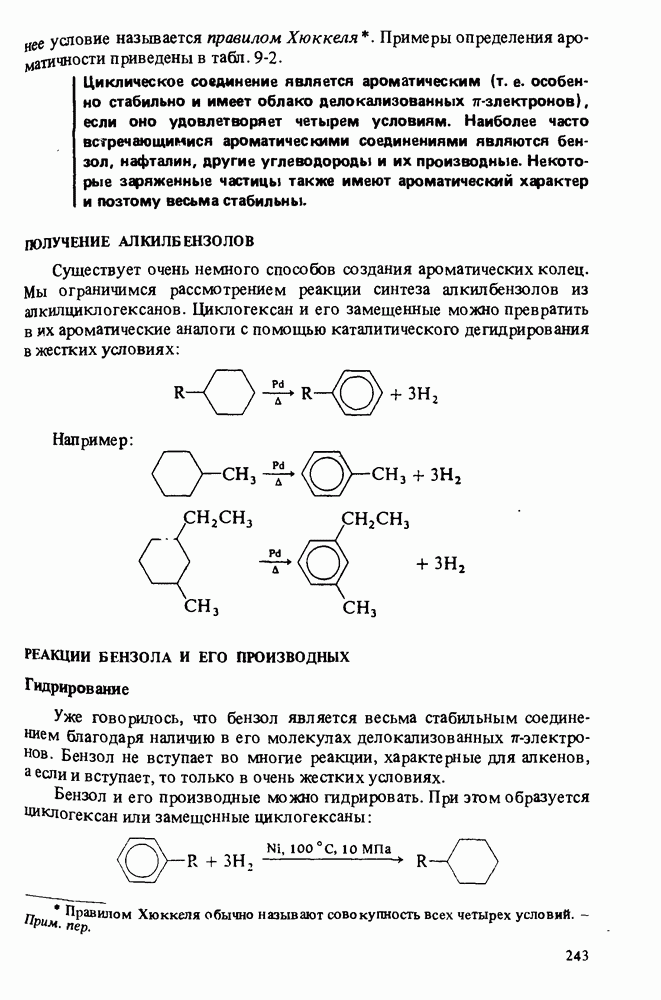
- ПОЛУЧЕНИЕ АЛКИЛЬБЕНЗОЛОВ
- РЕАКЦИИ БЕНЗОЛА И ЕГО ПРОИЗВОДНЫХ
- АРОМАТИЧЕСКОЕ ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ
- ФЕНОЛЫ
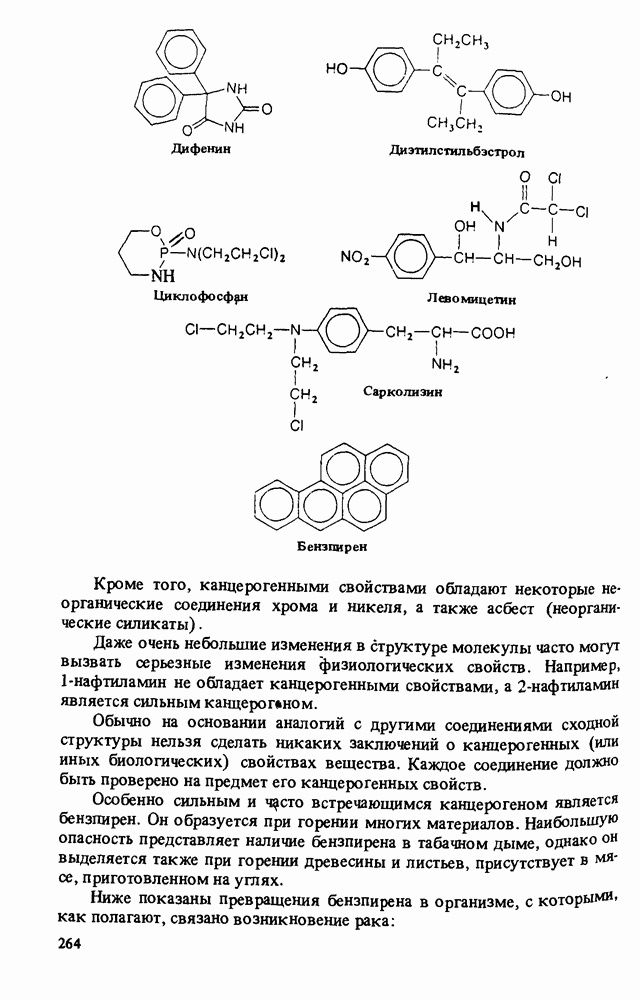
- Прикладная органическая химия: КАНЦЕРОГЕННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- Глава 10. ОРГАНИЧЕСКИЙ СИНТЕЗ
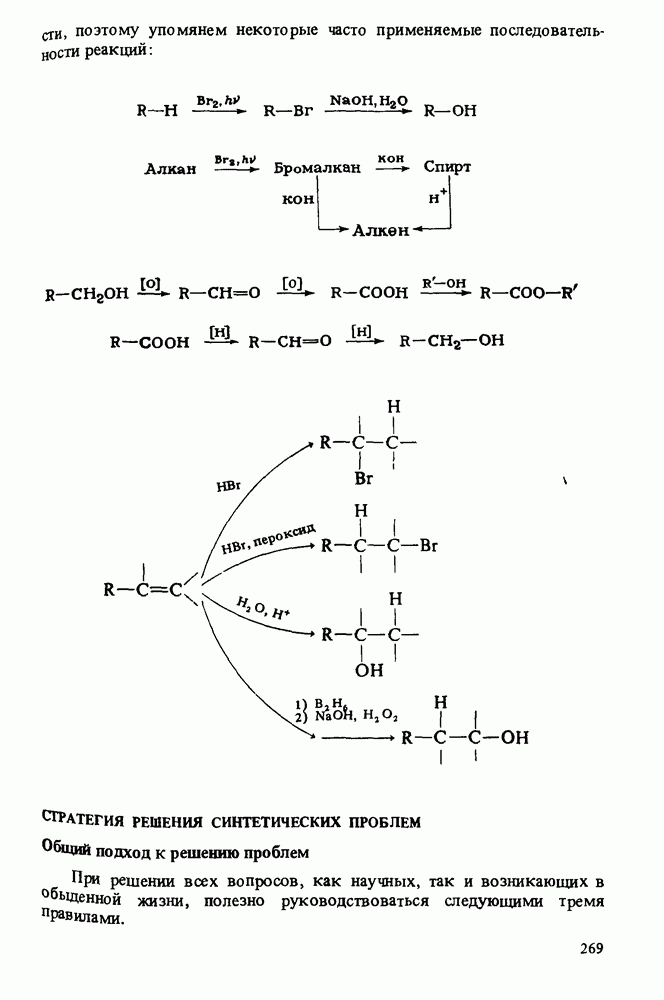
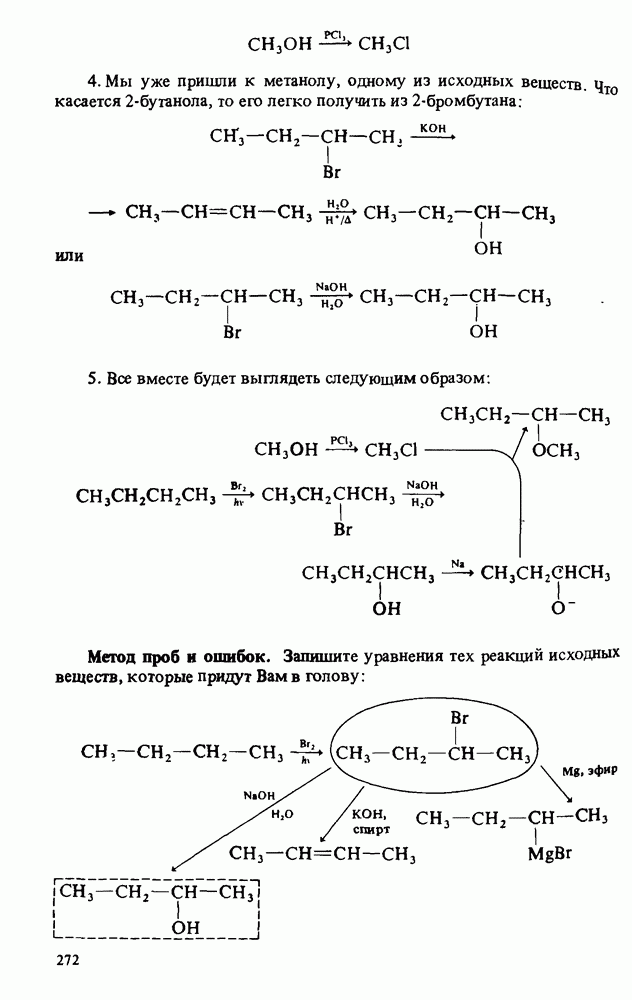
- СТРАТЕГИЯ РЕШЕНИЯ СИНТЕТИЧЕСКИХ ПРОБЛЕМ
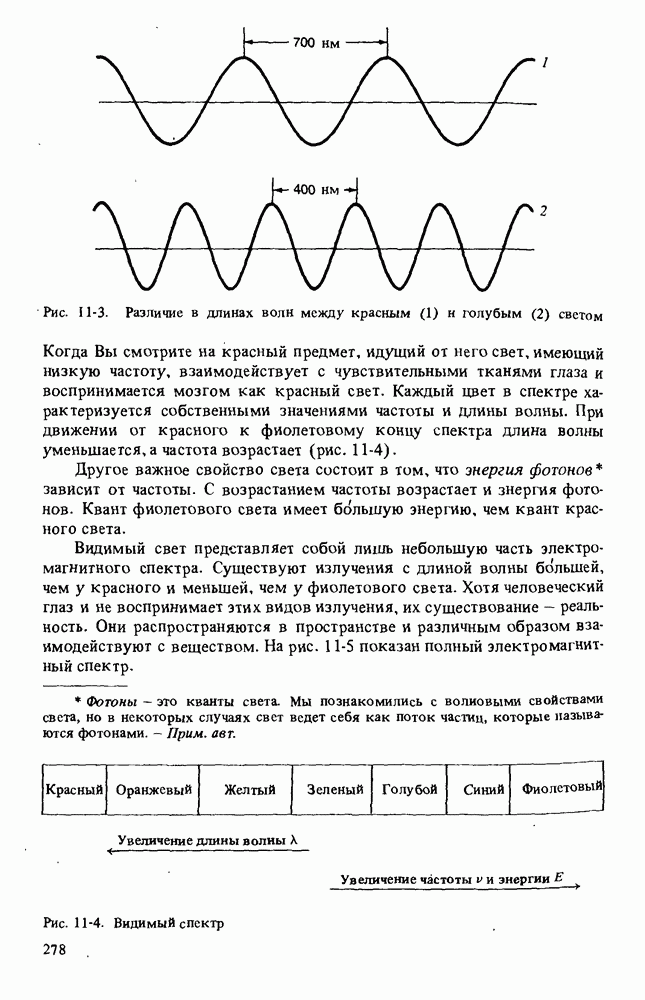
- Глава 11. МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ
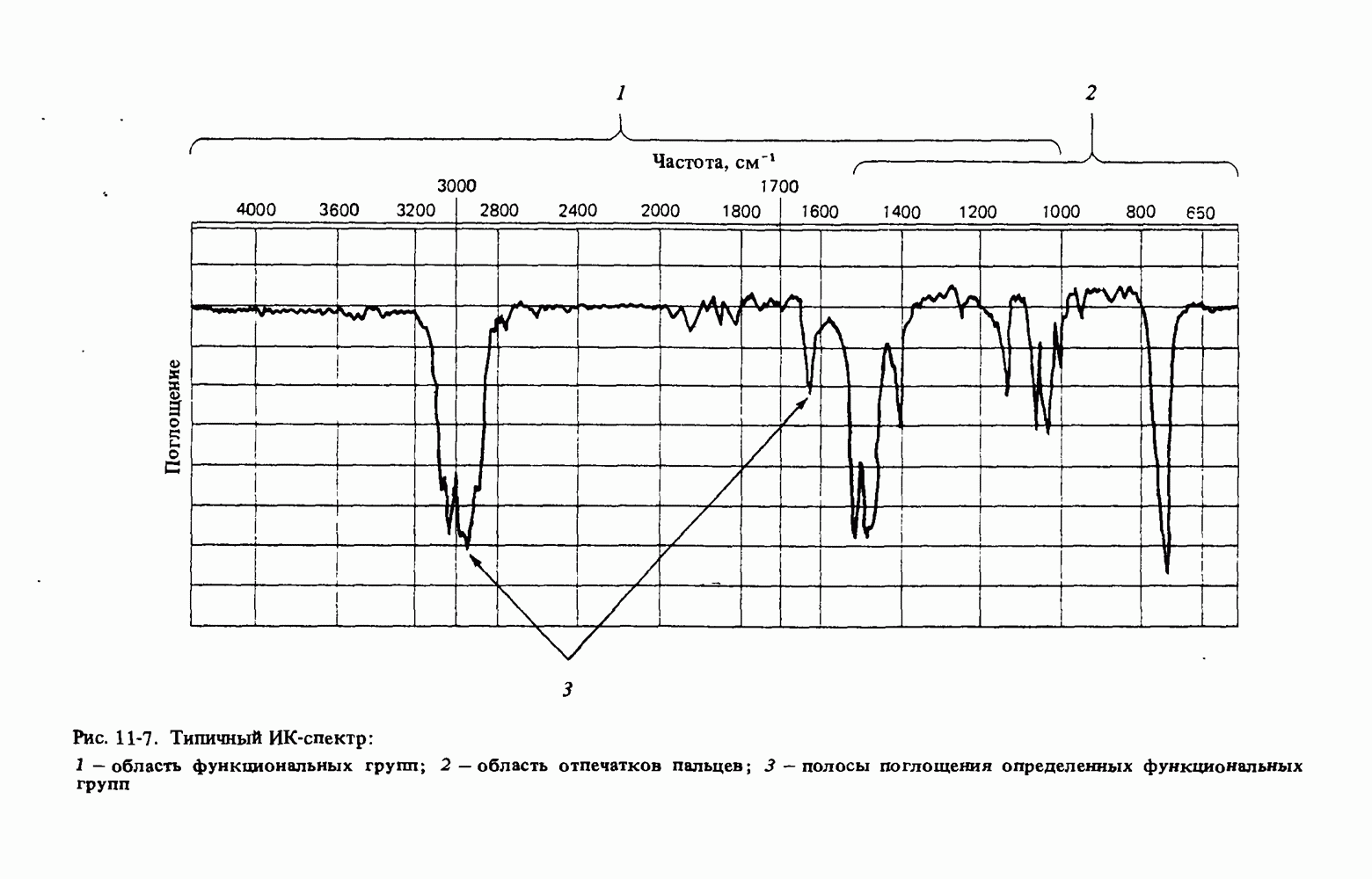
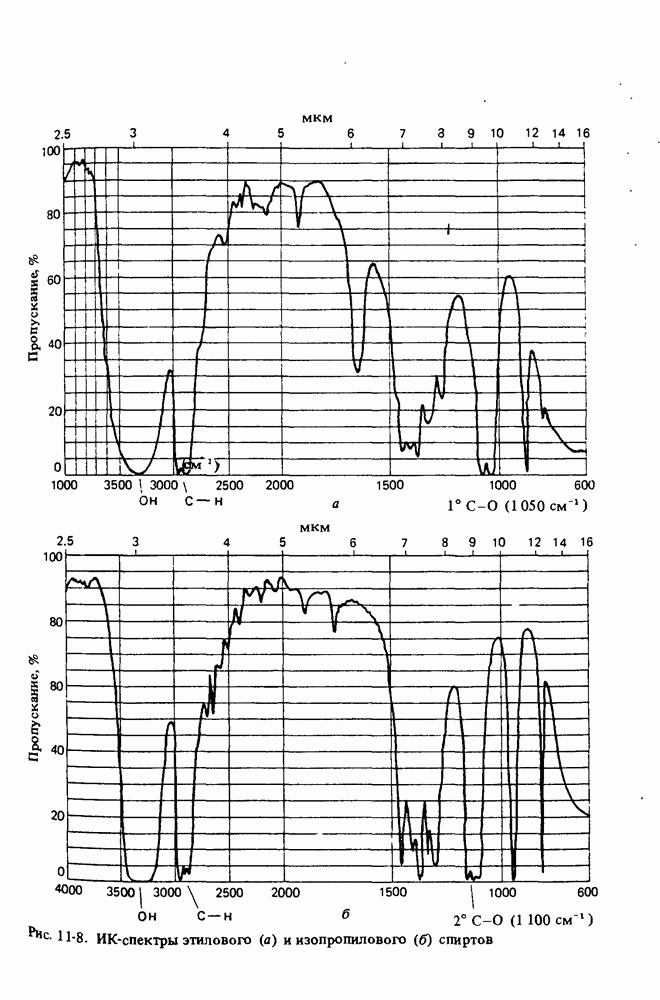
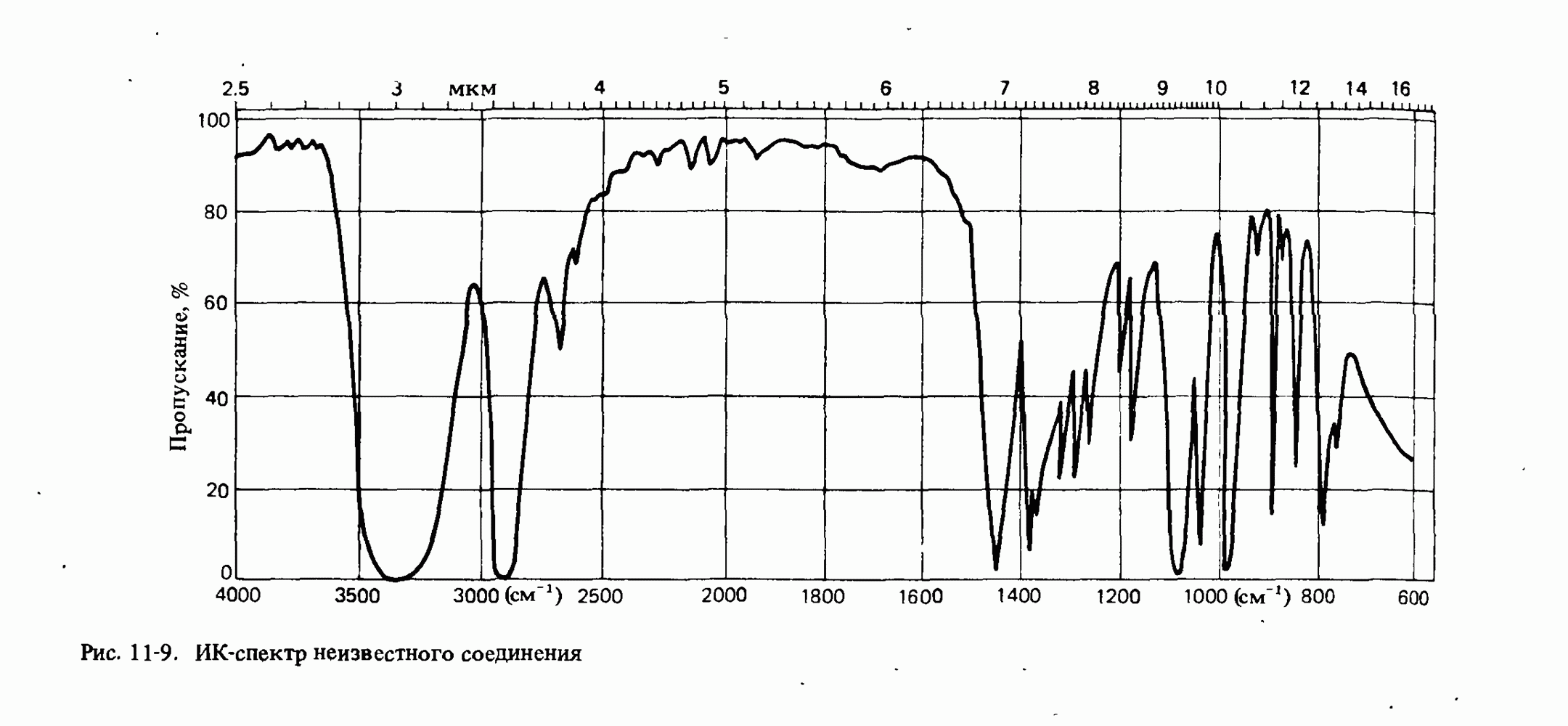
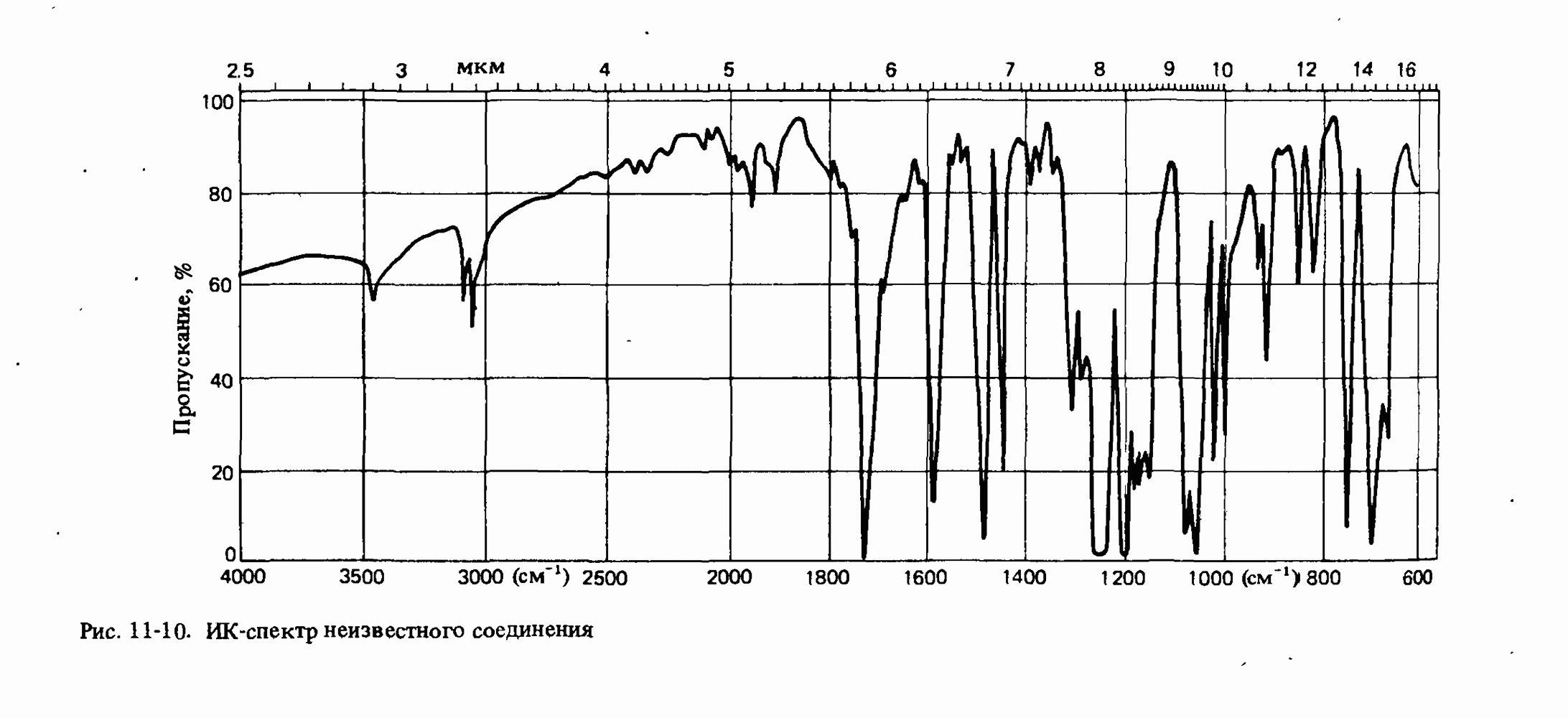
- ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ
- СПЕКТРОСКОПИЯ ЯДЕРНОГО МАГНИТНОГО РЕЗОНАНСА
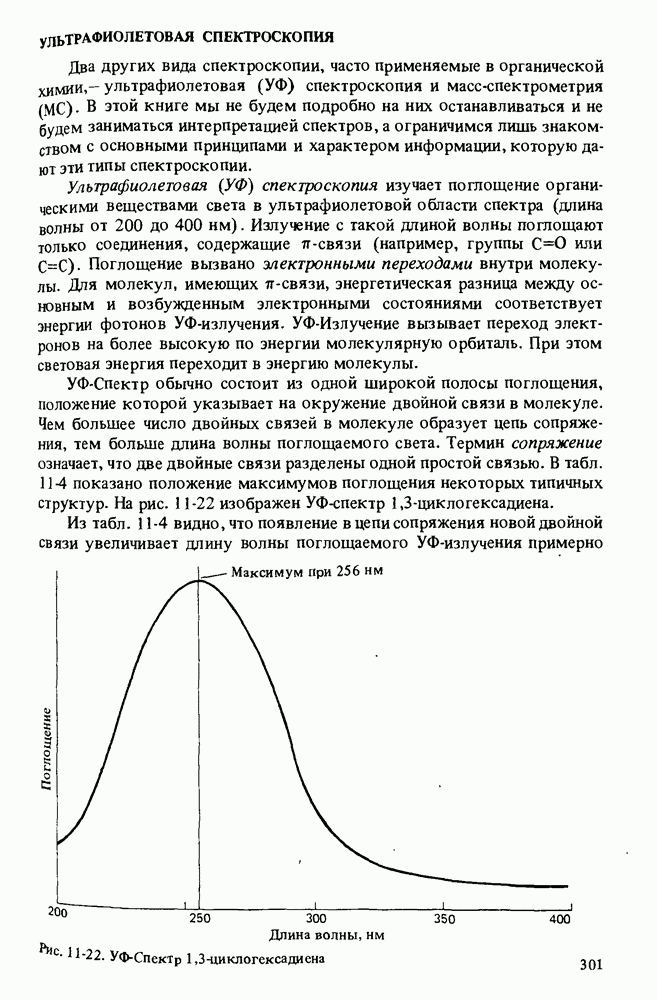
- УЛЬТРАФИОЛЕТОВАЯ СПЕКТРОСКОПИЯ
- МАСС-СПЕКТРОМЕТРИЯ
- ОПРЕДЕЛЕНИЕ СТРУКТУРЫ ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ
- Прикладная органическая химия: ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ АЛКОГОЛЯ В КРОВИ
- Глава 12. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
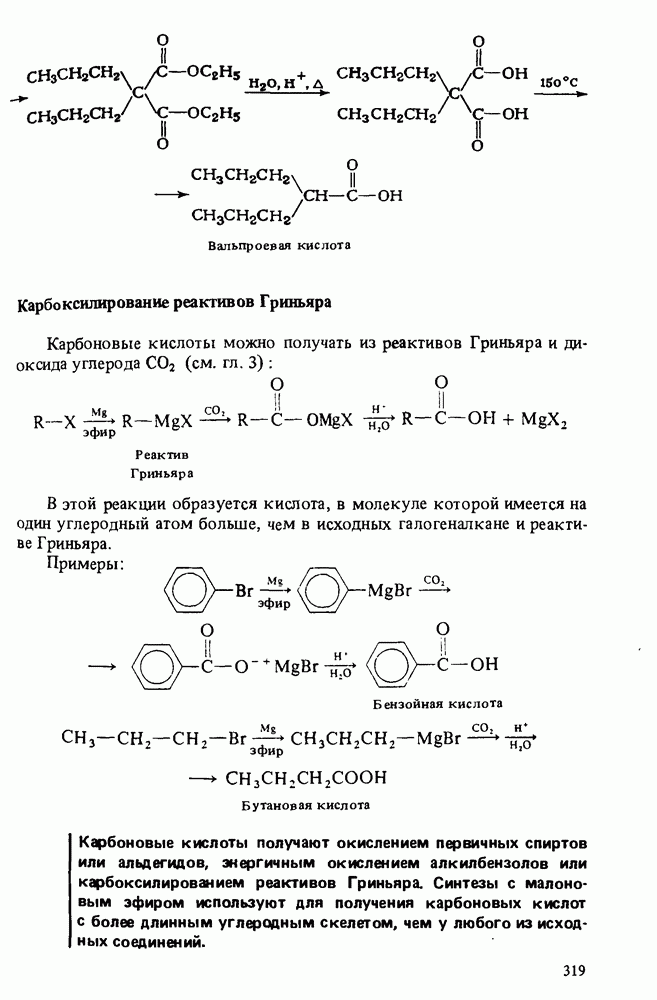
- ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ
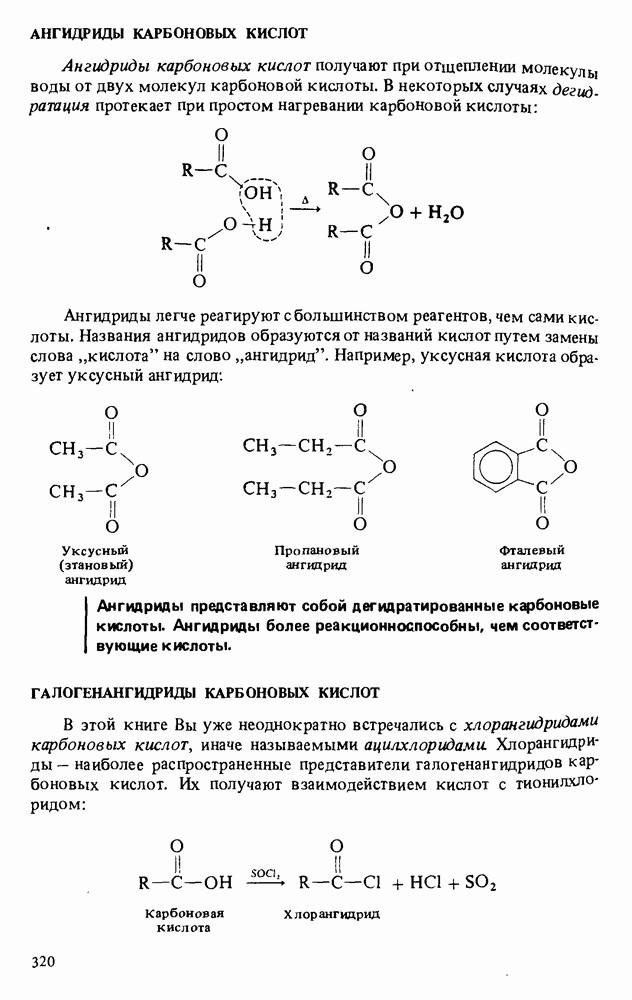
- АНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
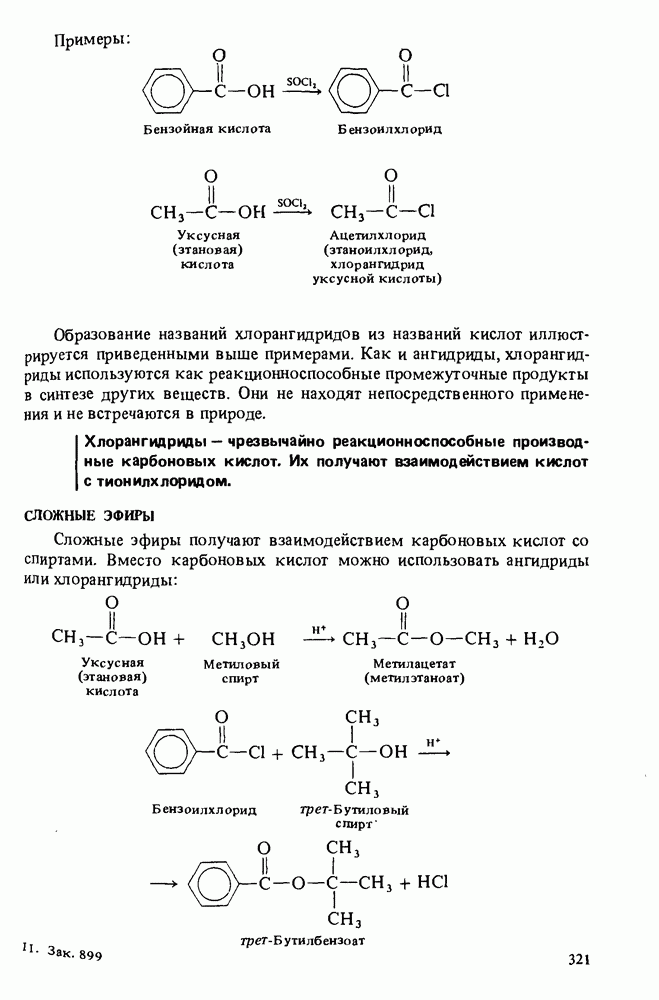
- ГАЛОГЕНАНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
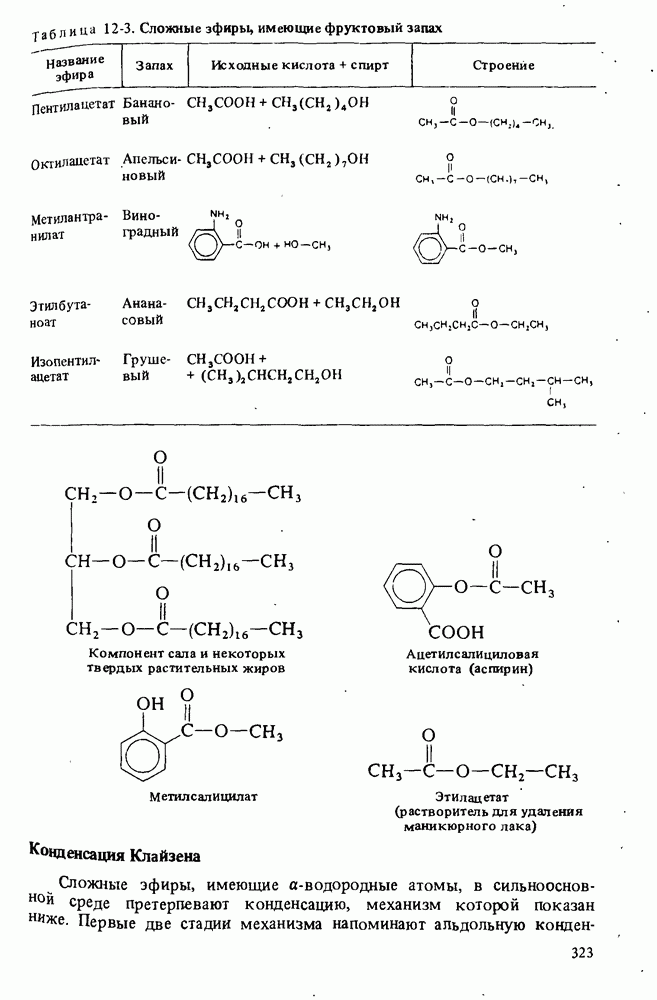
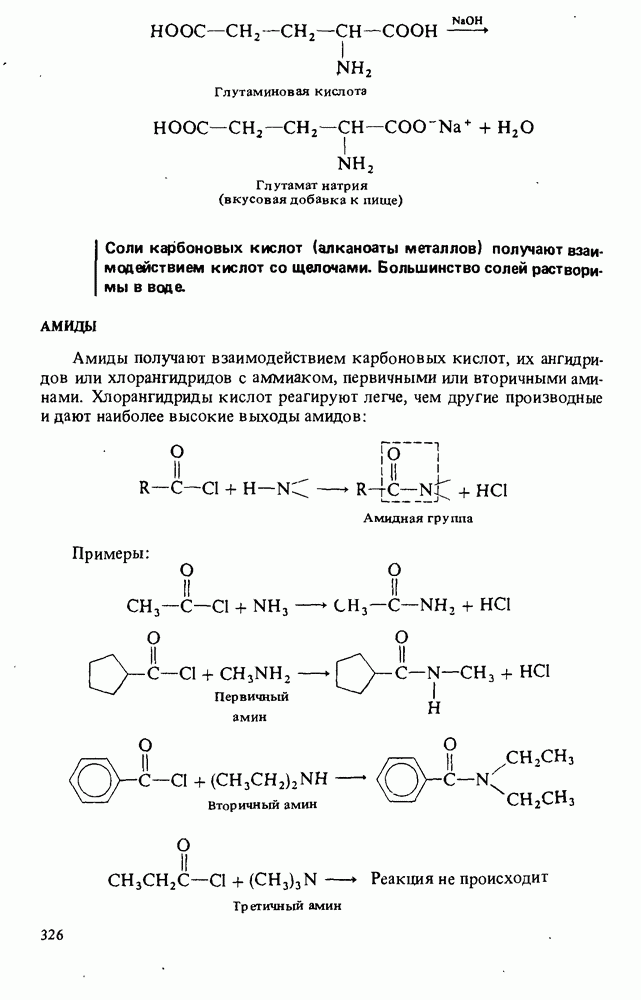
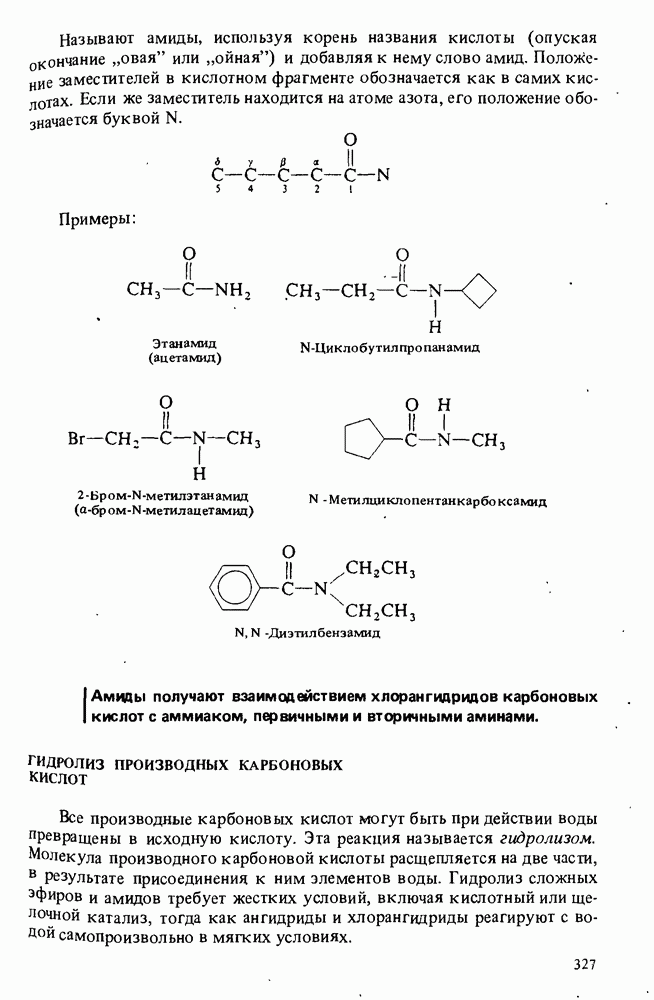
- СЛОЖНЫЕ ЭФИРЫ
- СОЛИ
- АМИДЫ
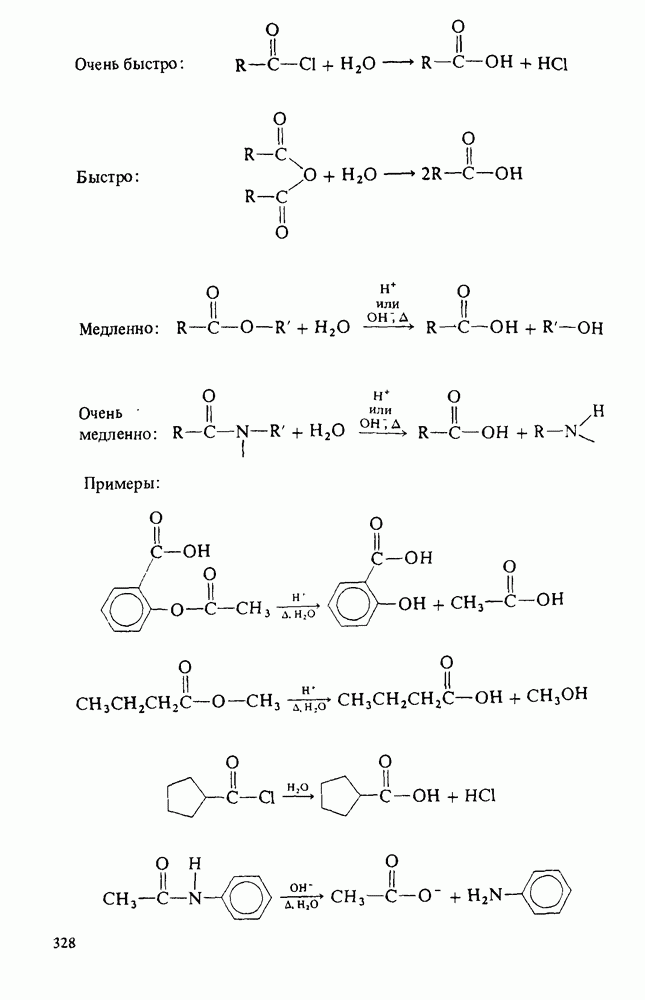
- ГИДРОЛИЗ ПРОИЗВОДНЫХ КАРБОНОВЫХ КИСЛОТ
- СИНТЕТИЧЕСКИЕ ВОЛОКНА
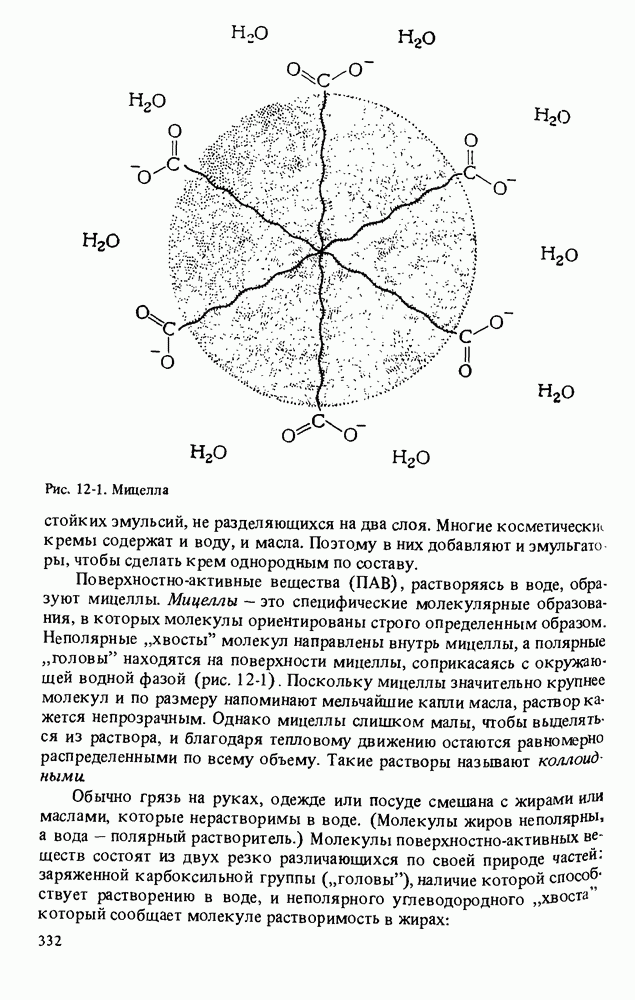
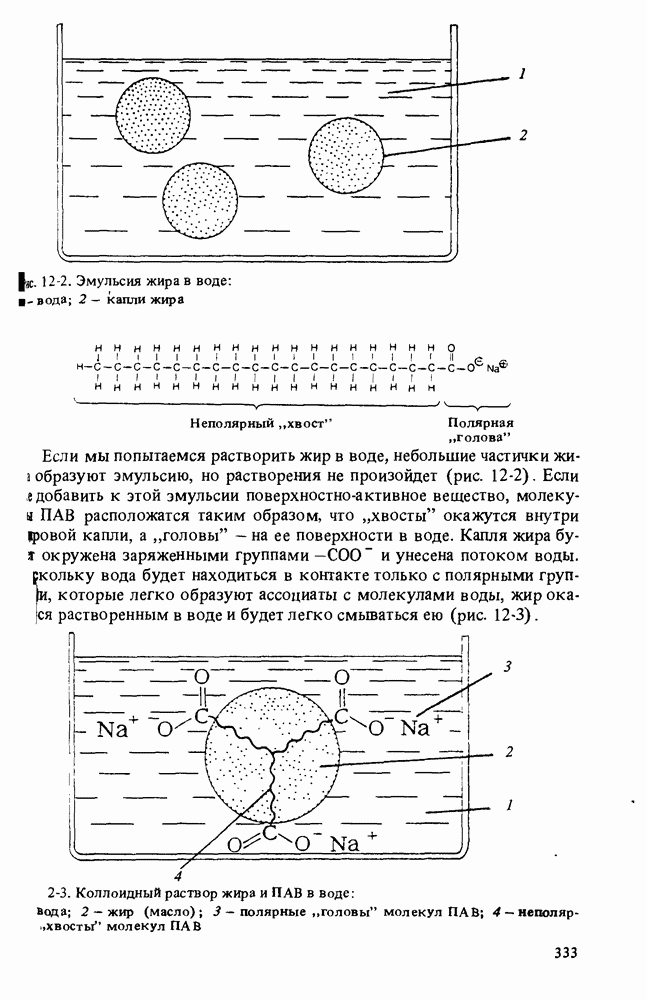
- МОЮЩИЕ СРЕДСТВА
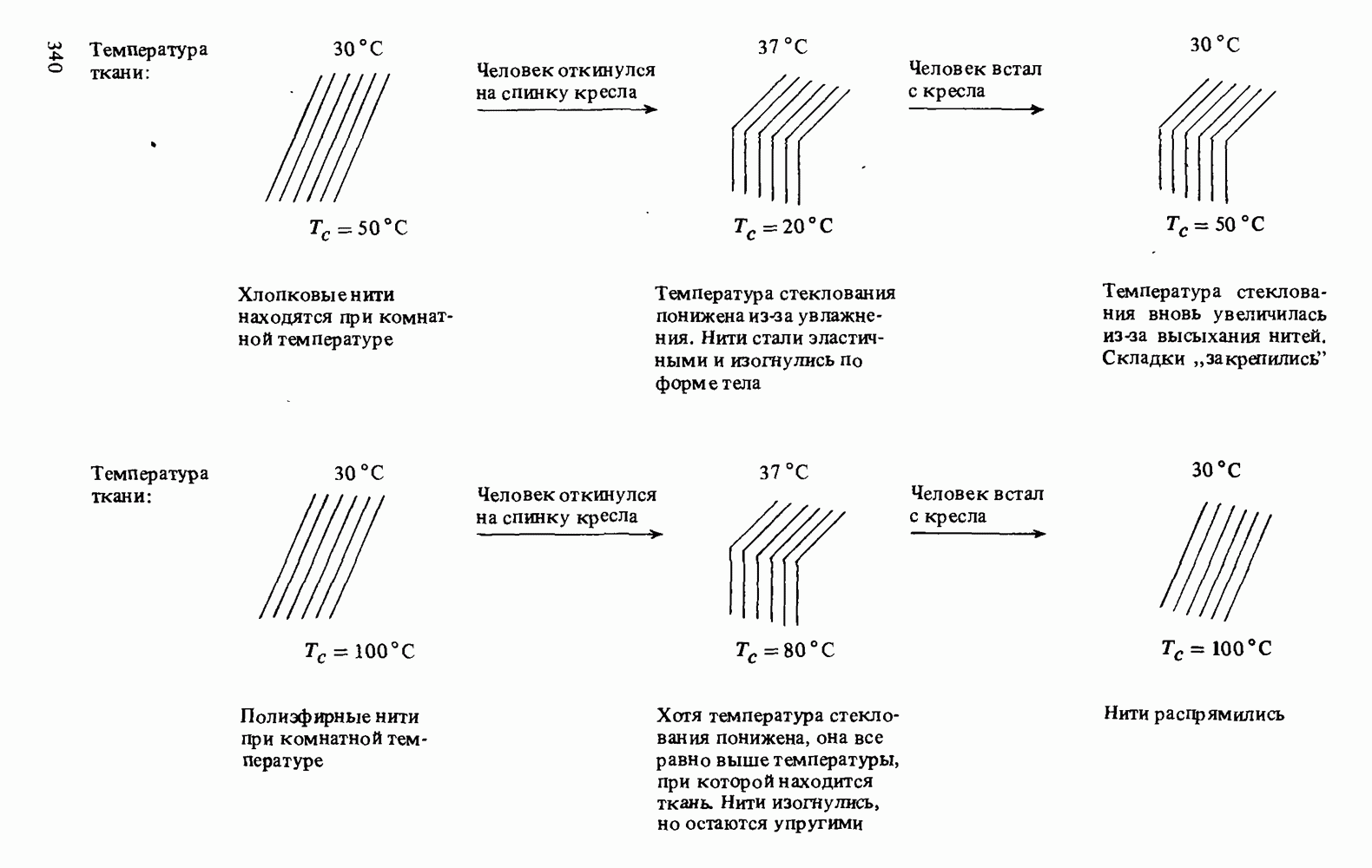
- Прикладная органическая химия: СВОЙСТВА ВОЛОКОН
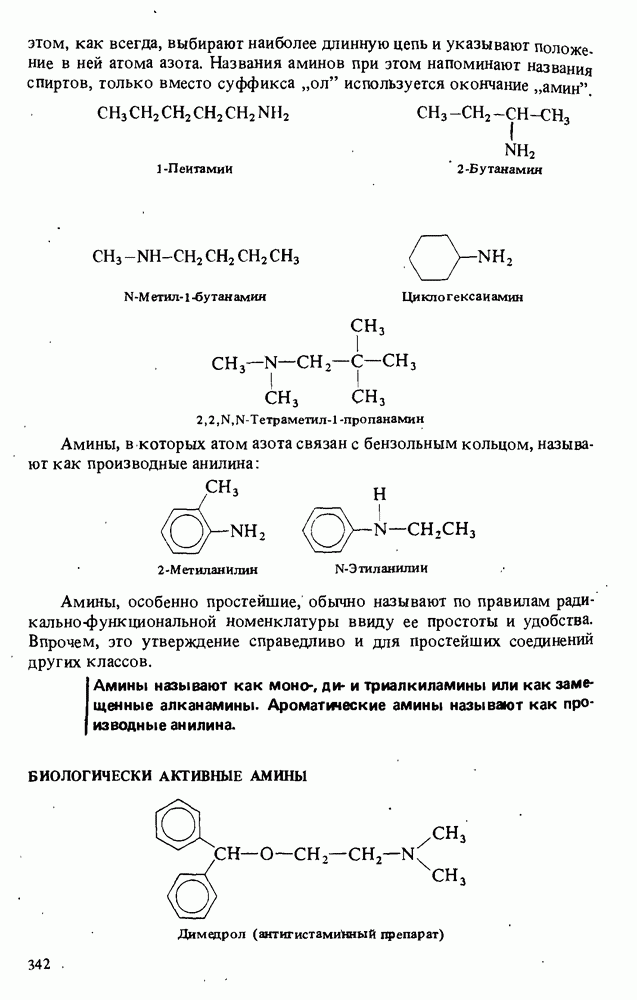
- Глава 13. АМИНЫ
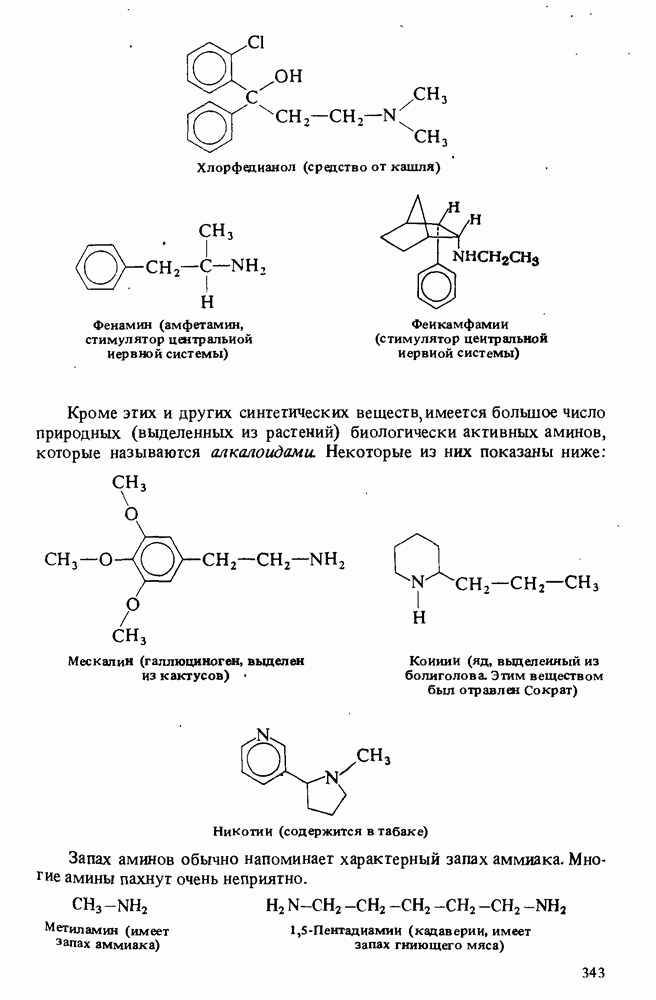
- БИОЛОГИЧЕСКИ АКТИВНЫЕ АМИНЫ
- ОСНОВНОСТЬ АМИНОВ
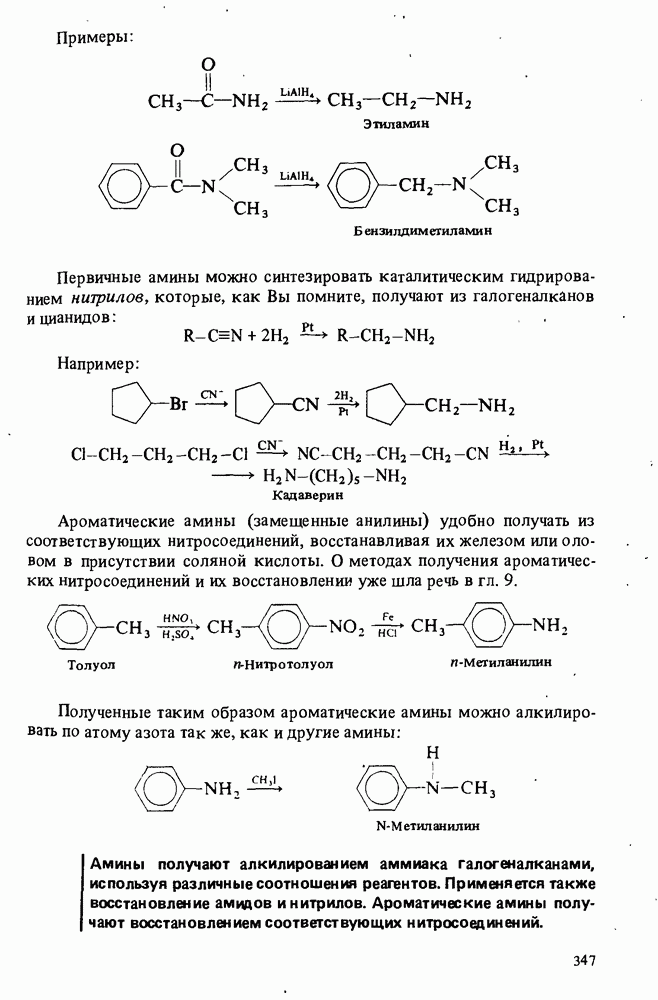
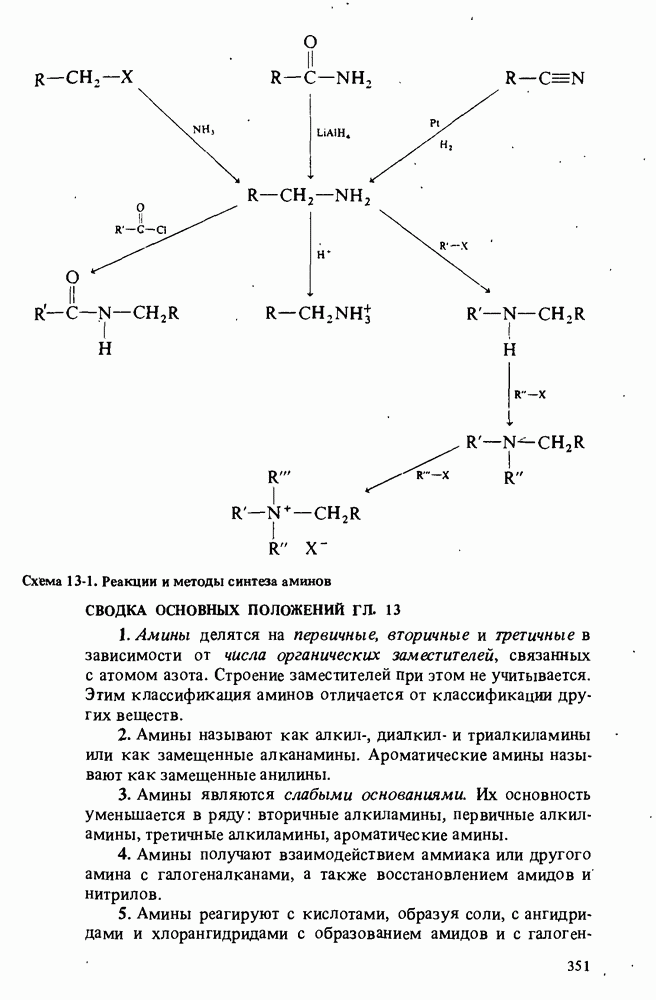
- ПОЛУЧЕНИЕ АМИНОВ
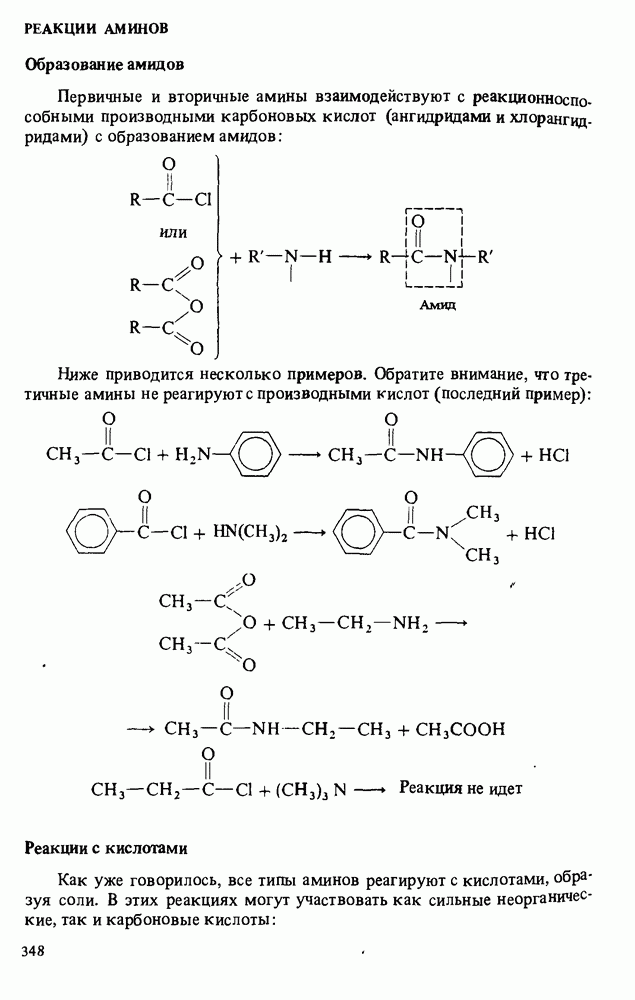
- РЕАКЦИИ АМИНОВ
- Прикладная органическая химия: ПОЛИМЕРЫ, ПОДВЕРГАЮЩИЕСЯ БИОЛОГИЧЕСКОЙ ДЕСТРУКЦИИ
- Глава 14. УГЛЕВОДЫ
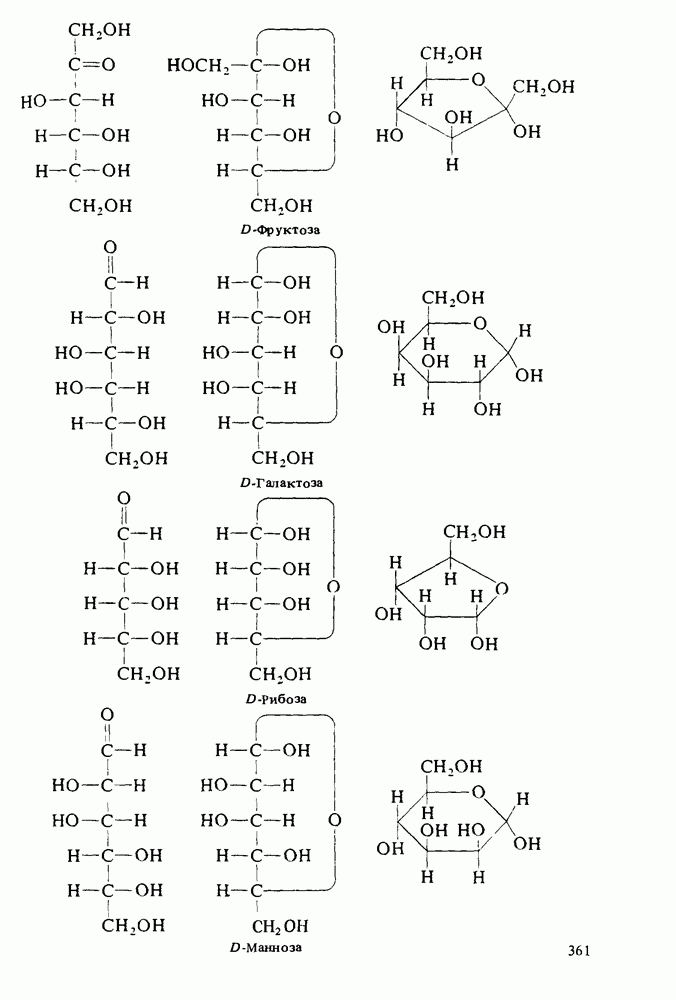
- МОНОСАХАРИДЫ
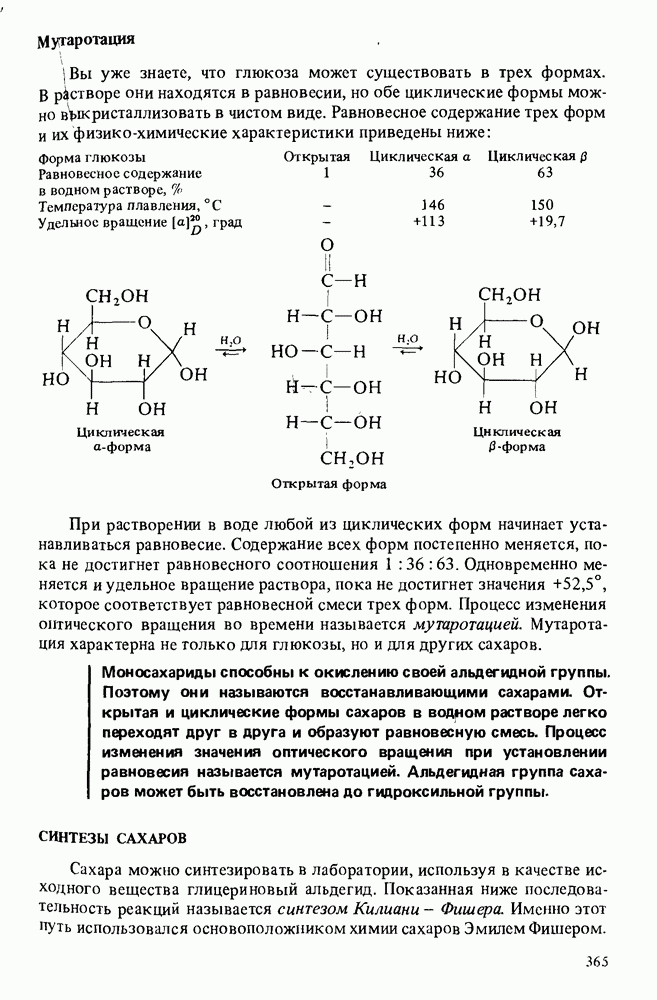
- РЕАКЦИИ МОНОСАХАРИДОВ
- СИНТЕЗЫ САХАРОВ
- ДИСАХАРИДЫ
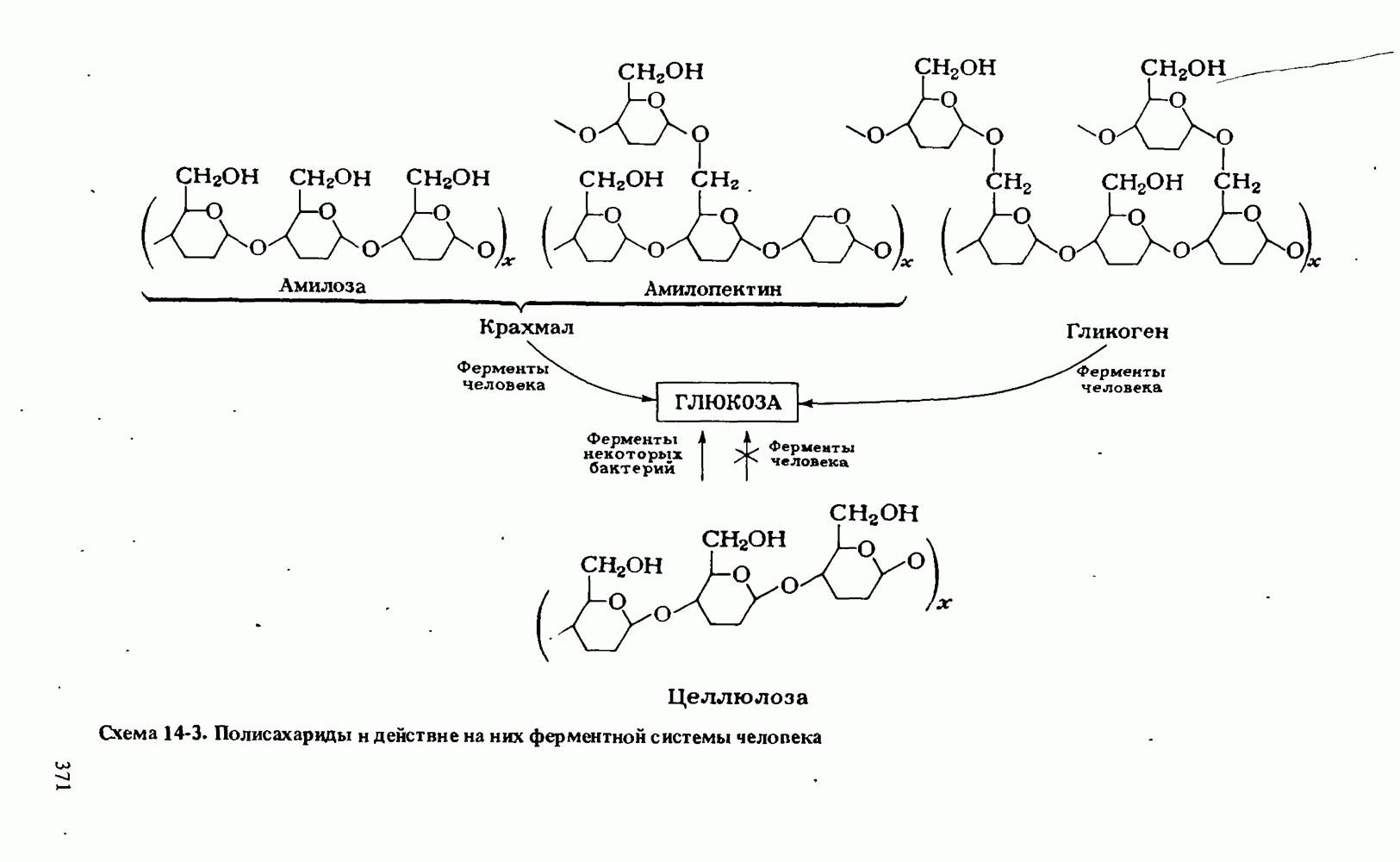
- ПОЛИСАХАРИДЫ
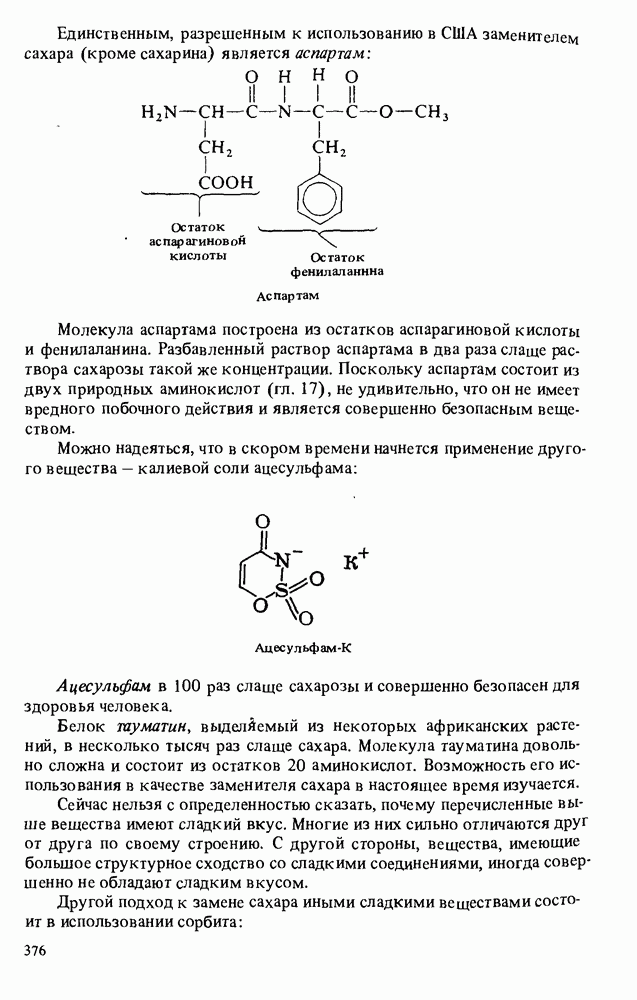
- Прикладная органическая химия: ПИЩЕВЫЕ СВОЙСТВА УГЛЕВОДОВ
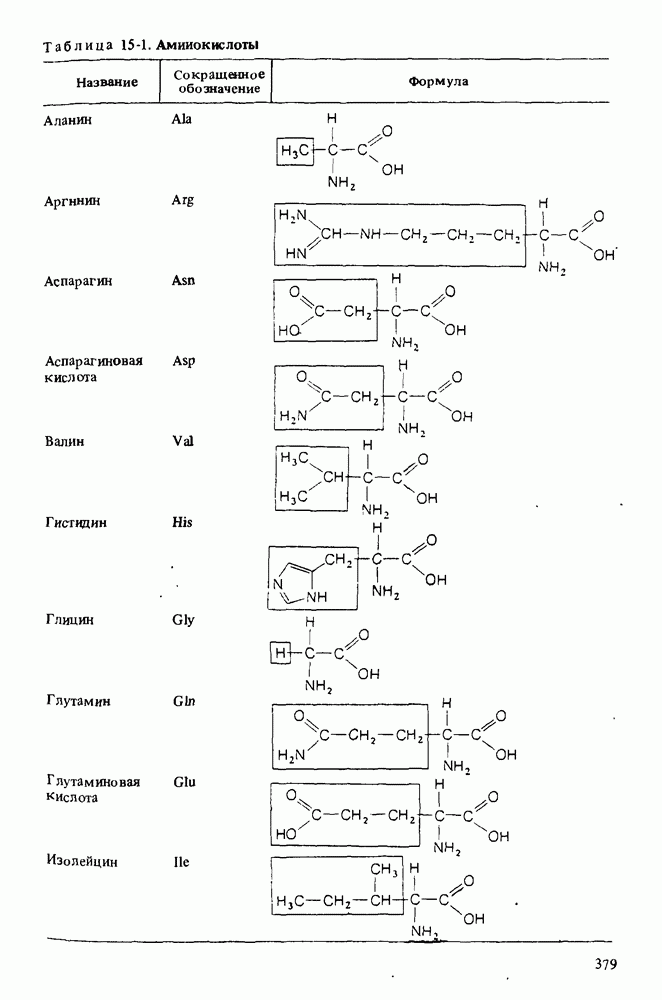
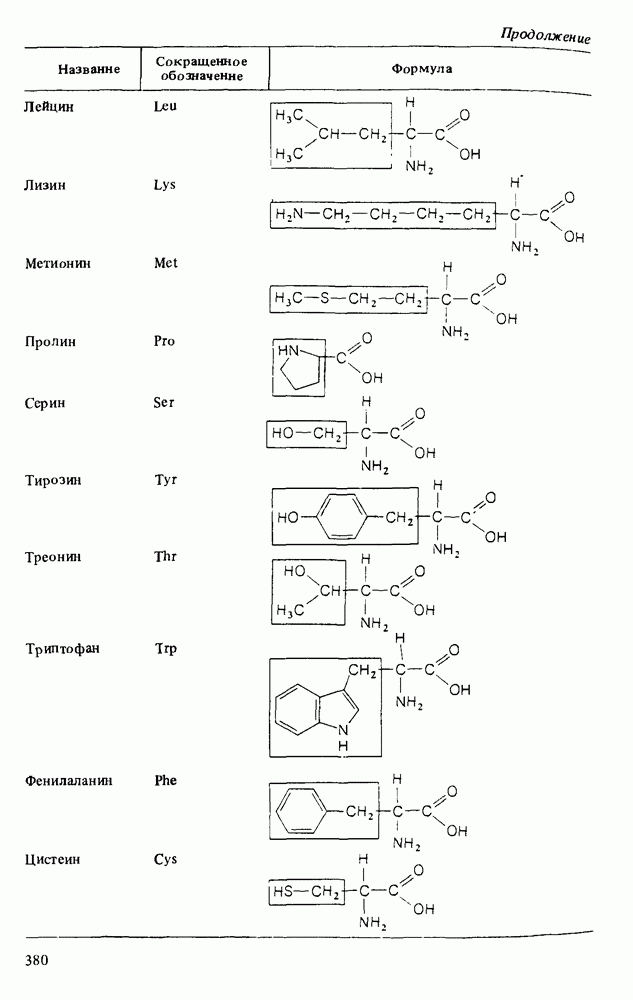
- Глава 15. АМИНОКИСЛОТЫ И БЕЛКИ
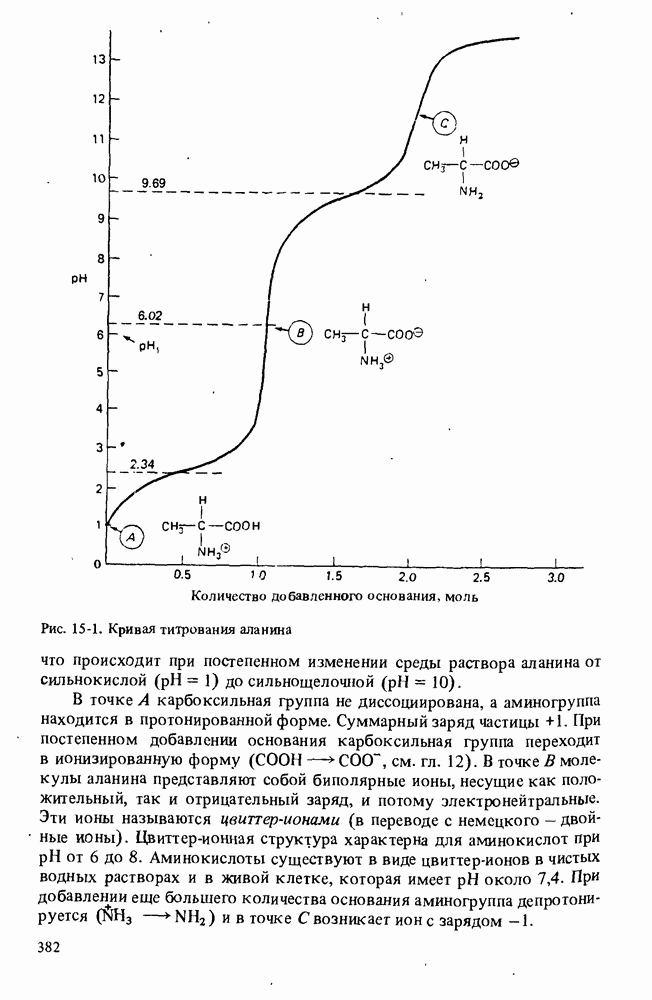
- КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ
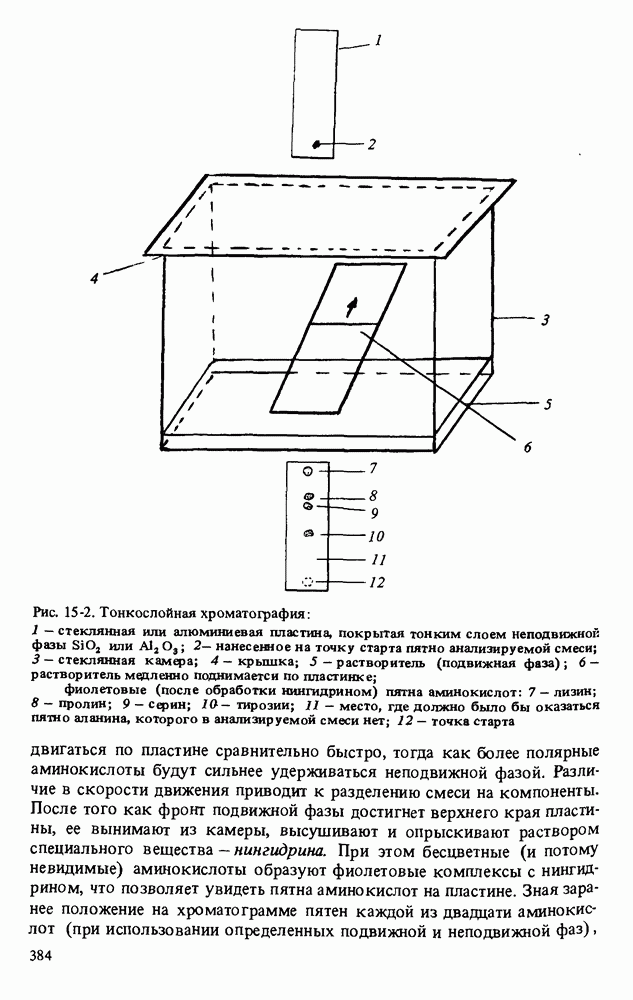
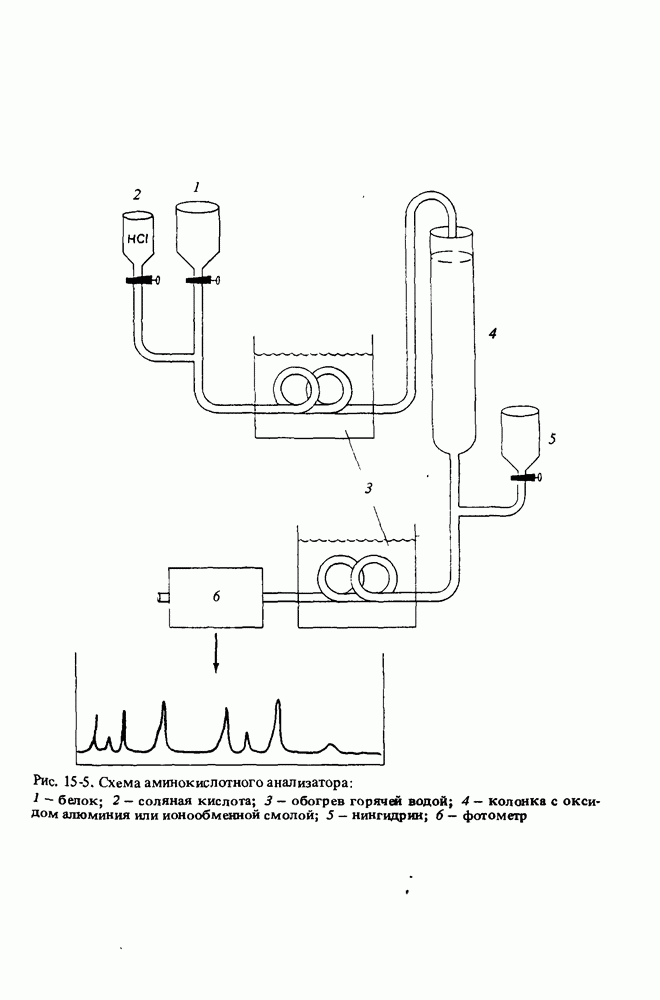
- АНАЛИЗ АМИНОКИСЛОТ
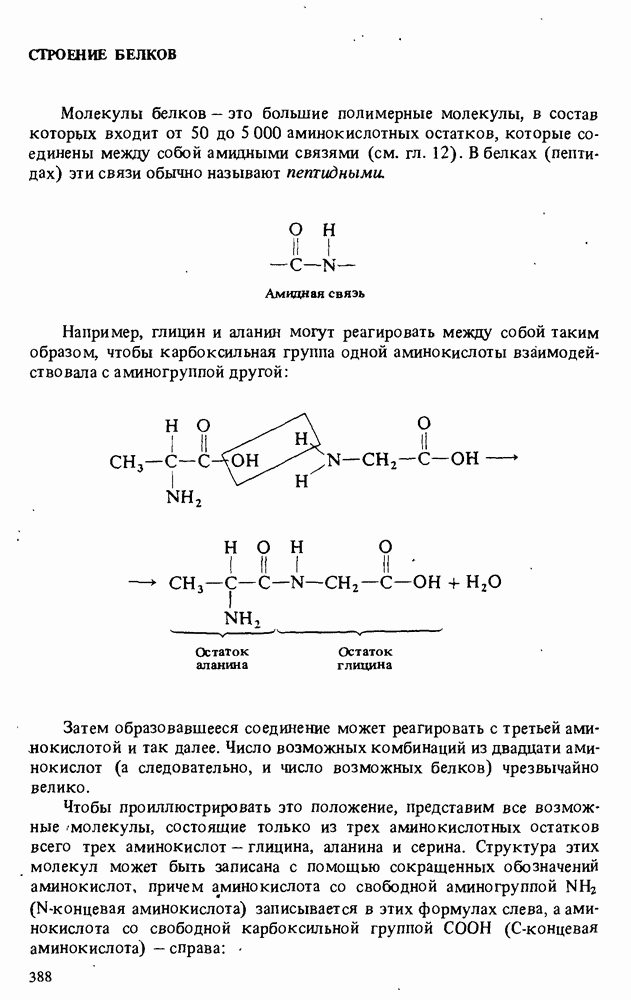
- СТРОЕНИЕ БЕЛКОВ
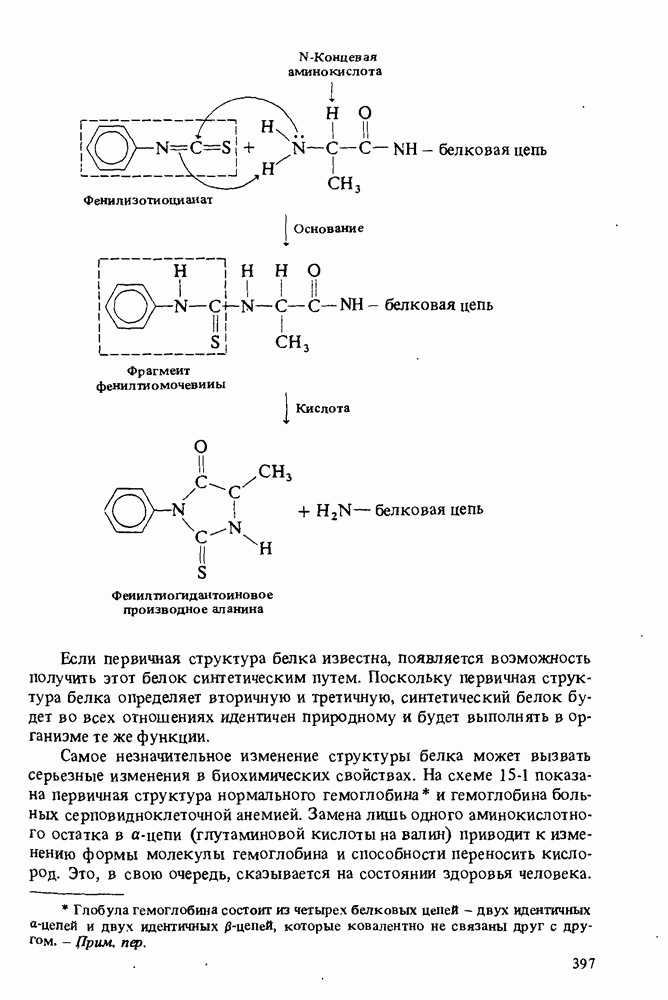
- УСТАНОВЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКОВ
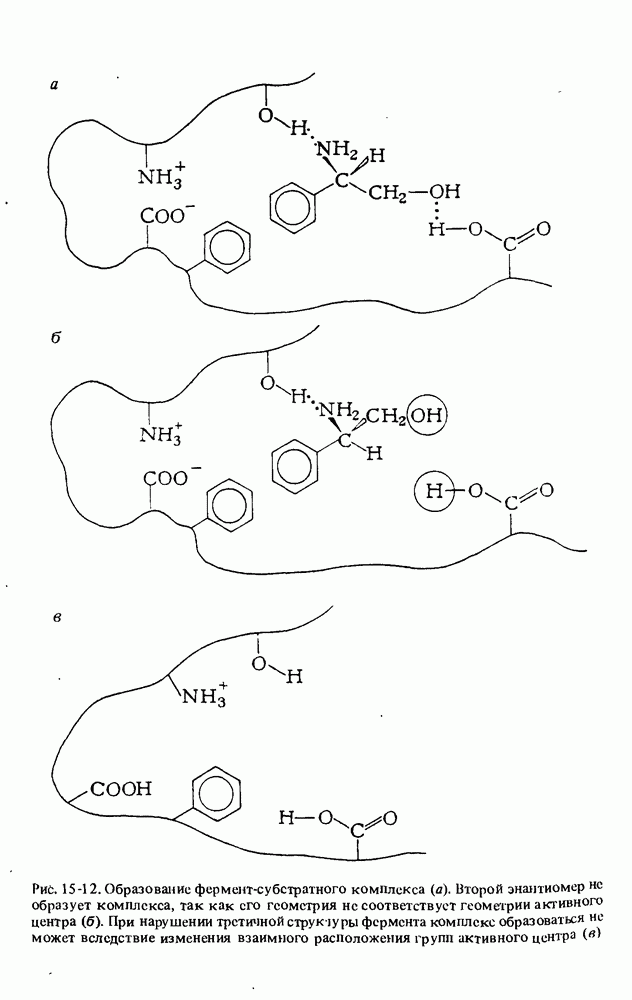
- ФЕРМЕНТЫ
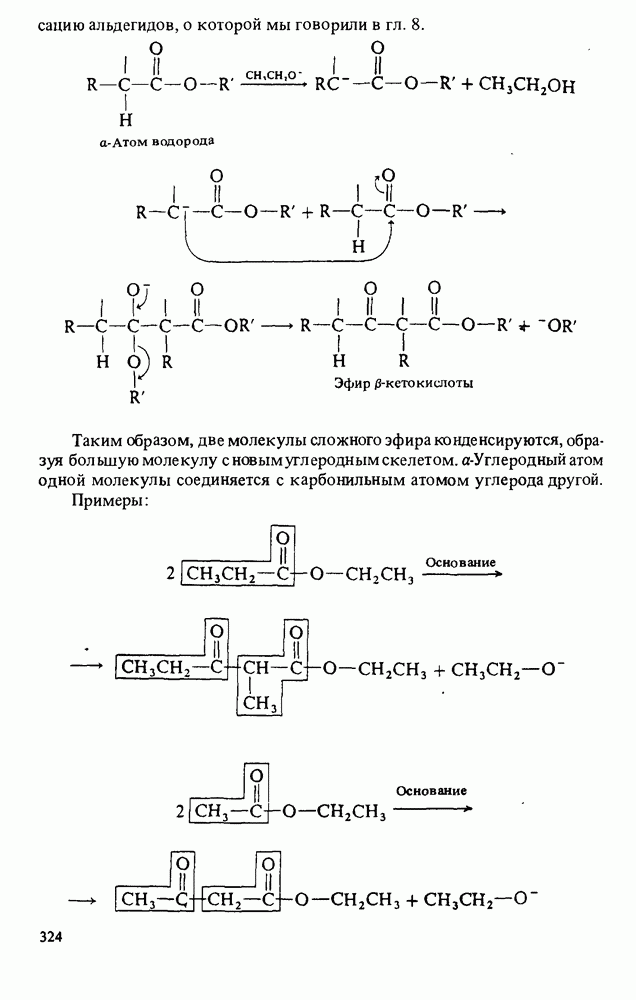
- Глава 16. ЛИПИДЫ
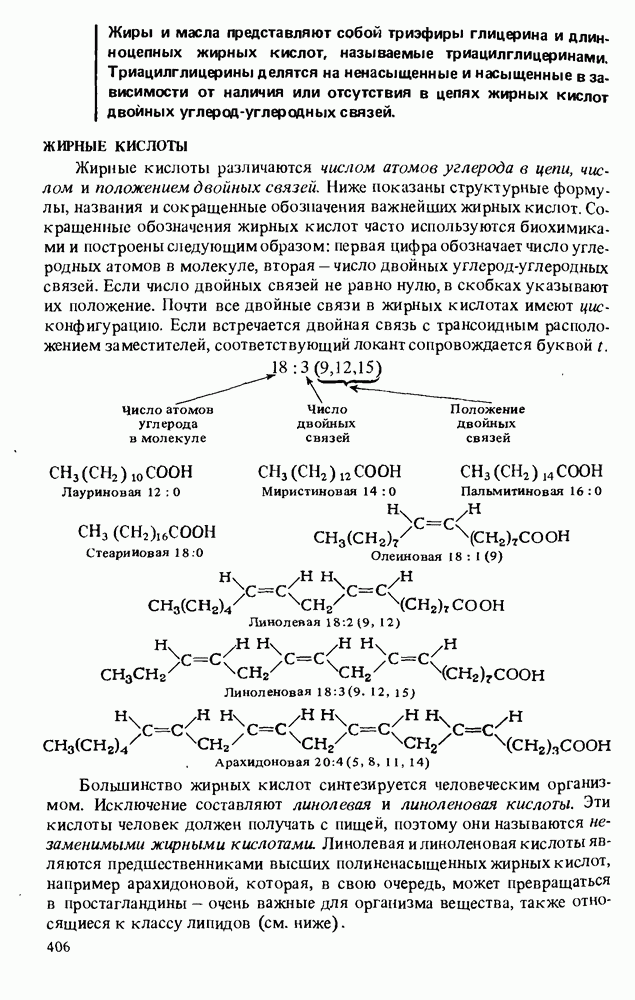
- ЖИРНЫЕ КИСЛОТЫ
- НАЗВАНИЯ ТРИАЦИЛГЛИЦЕРИНОВ
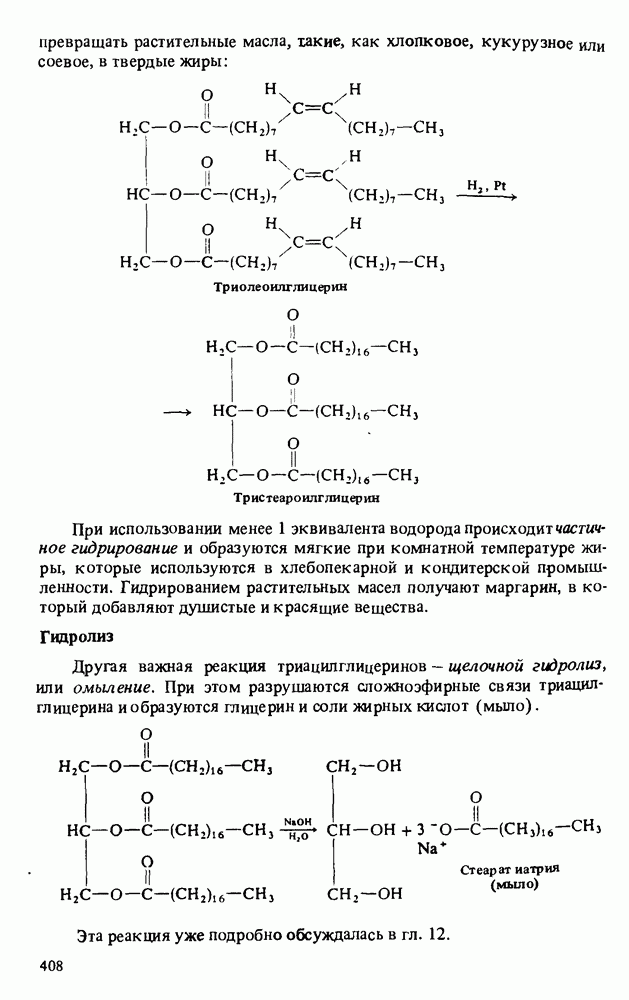
- РЕАКЦИИ ТРИАЦИЛГЛИЦЕРИНОВ
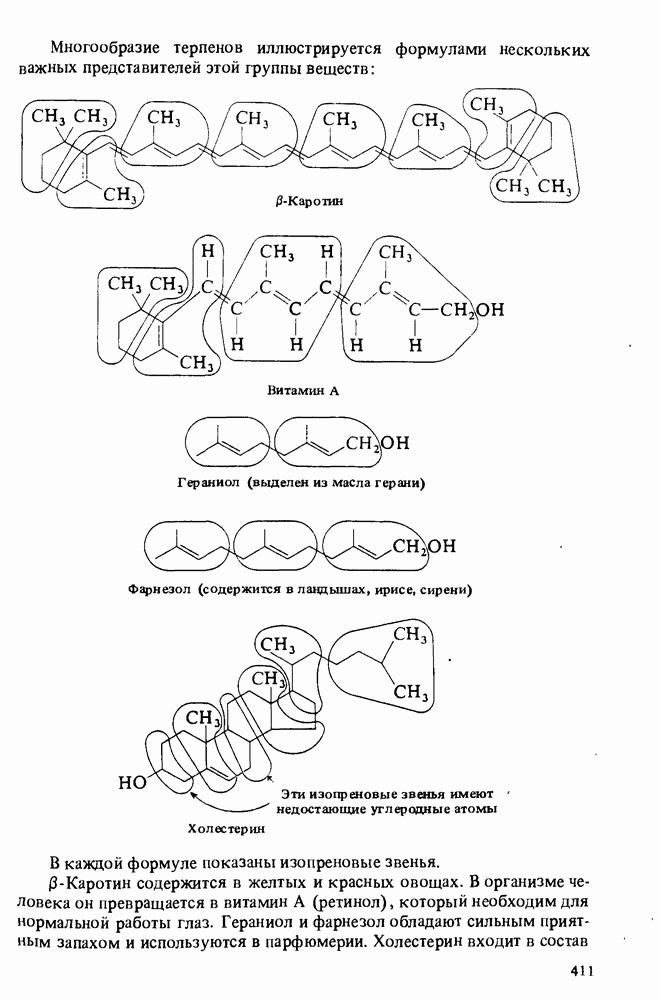
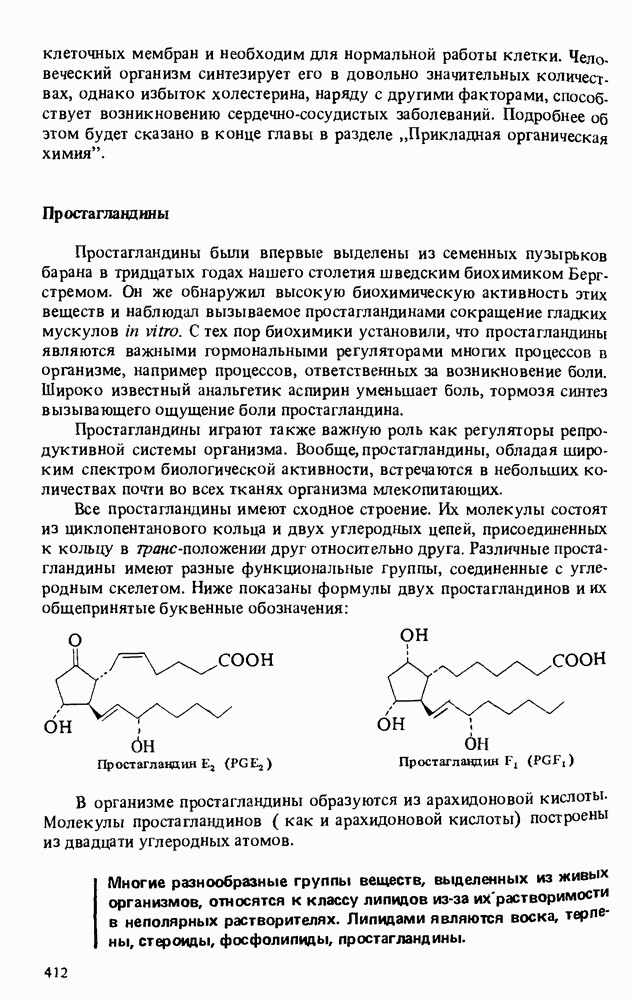
- ЛИПИДЫ, ОТЛИЧНЫЕ ОТ ТРИАЦИЛГЛИЦЕРИНОВ
- Прикладная органическая химия: ПИЩЕВЫЕ СВОЙСТВА ЛИПИДОВ
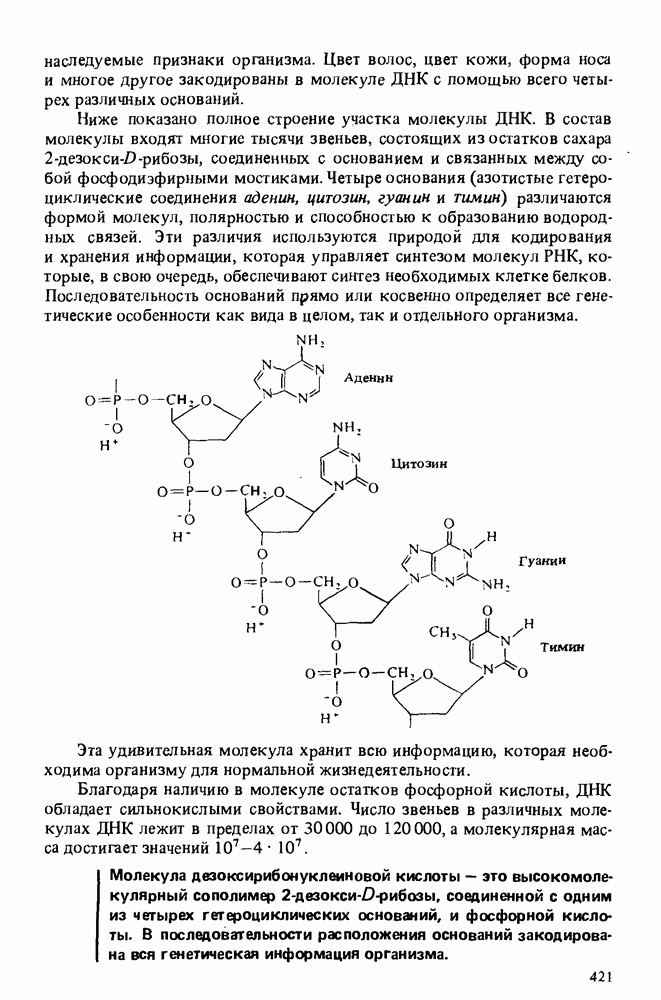
- Глава 17. НУКЛЕИНОВЫЕ КИСЛОТЫ
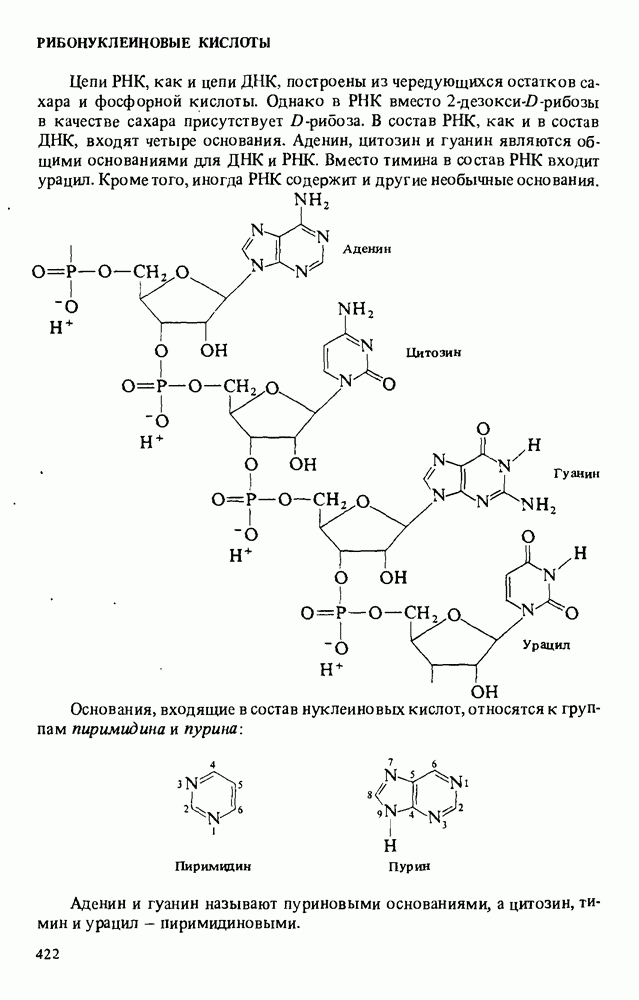
- РИБОНУКЛЕИНОВЫЕ КИСЛОТЫ
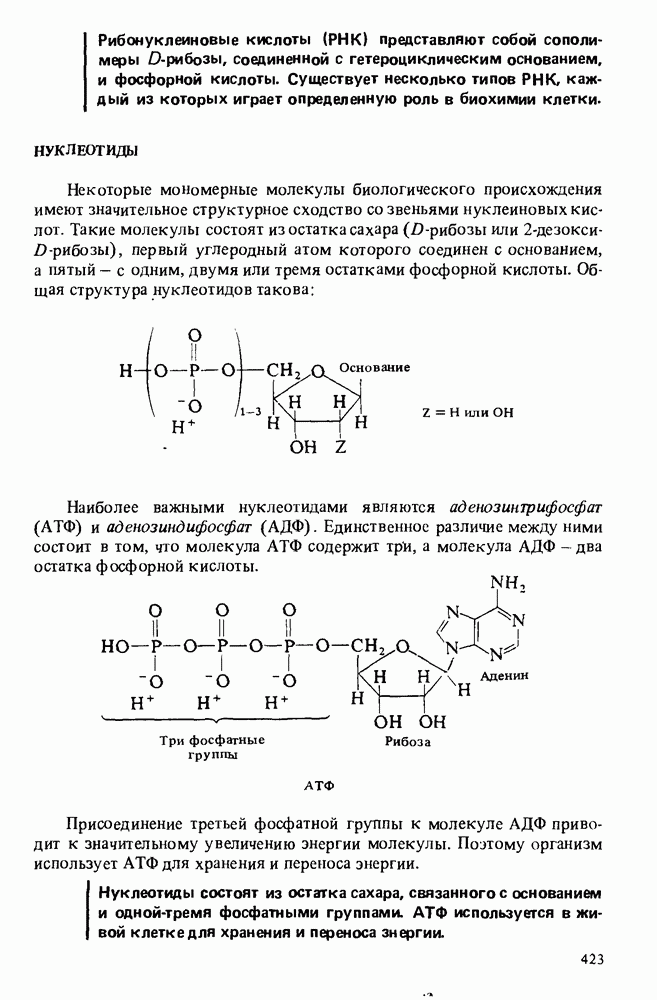
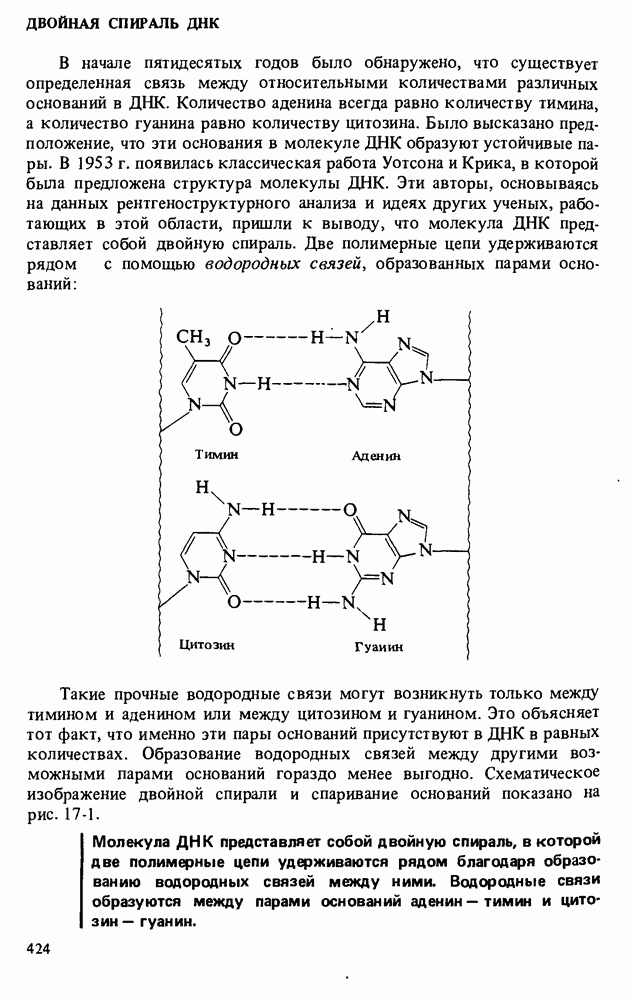
- НУКЛЕОТИДЫ
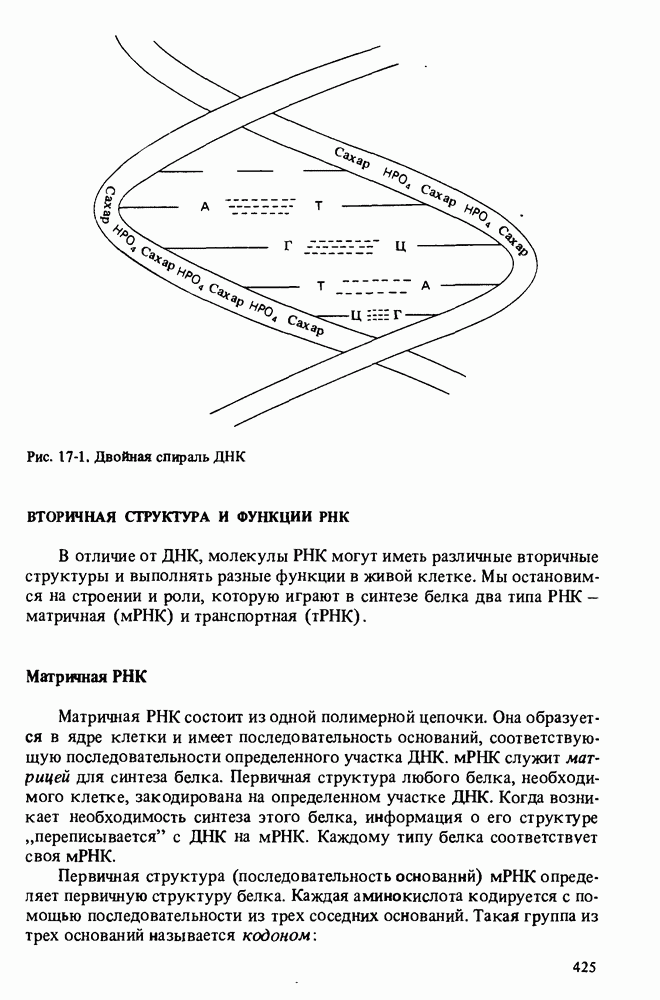
- ДВОЙНАЯ СПИРАЛЬ ДНК
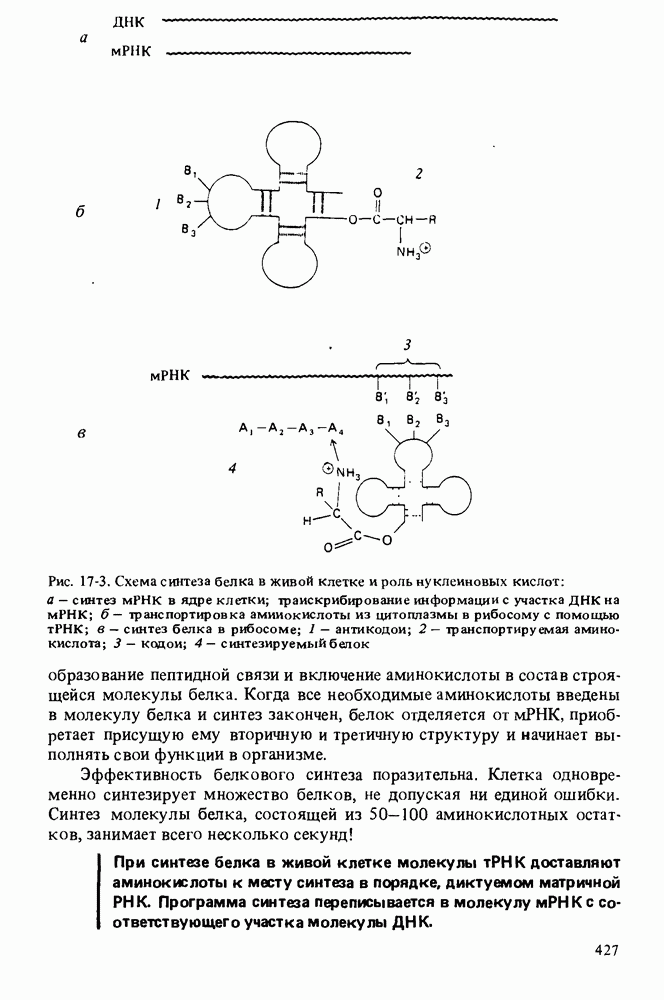
- ВТОРИЧНАЯ СТРУКТУРА И ФУНКЦИИ РНК
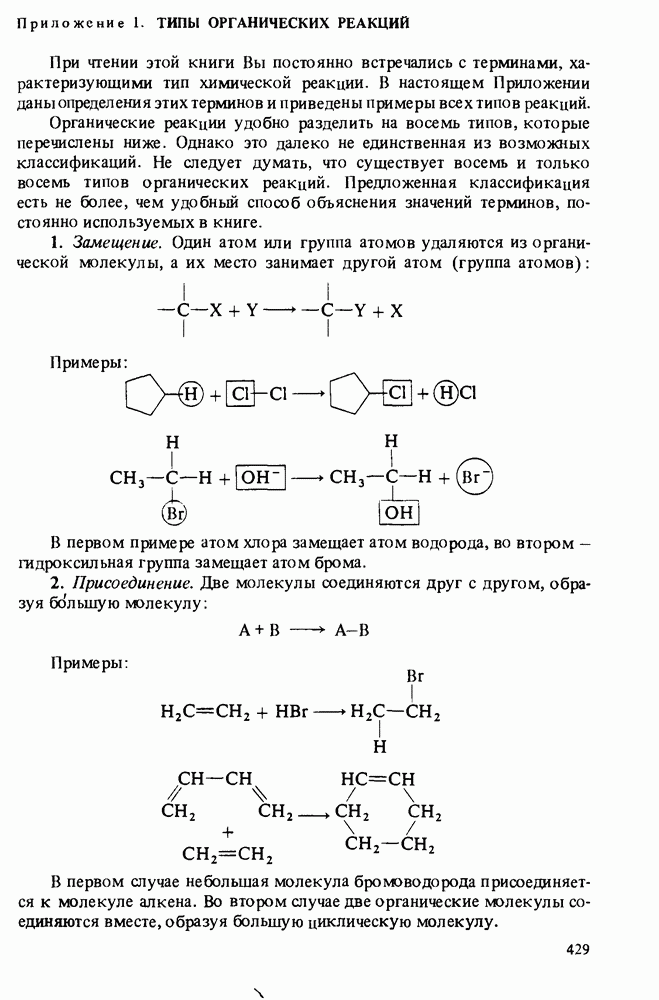
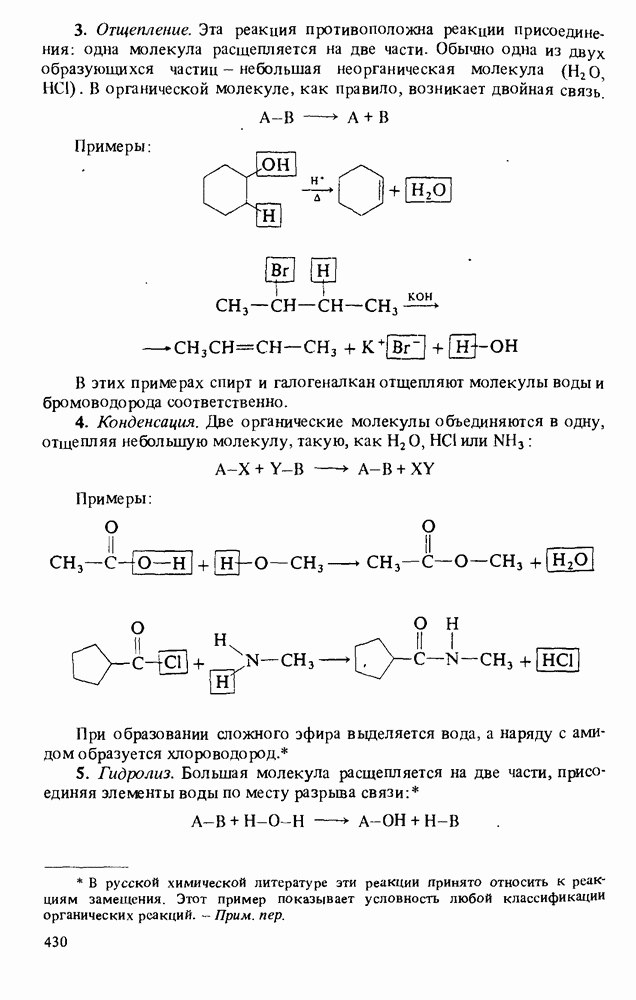
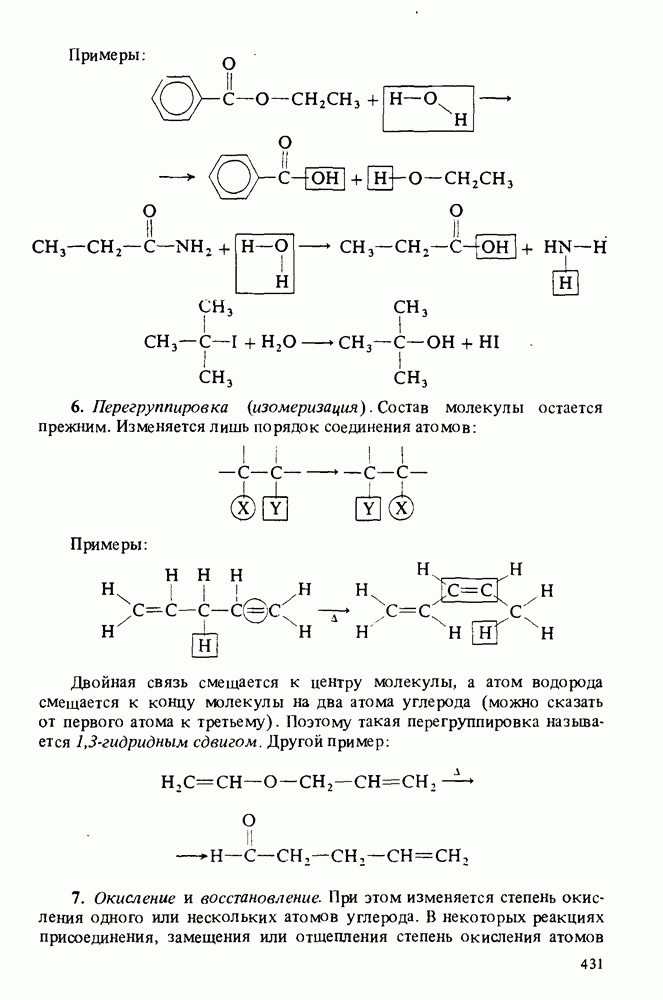
- Приложение 1. ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
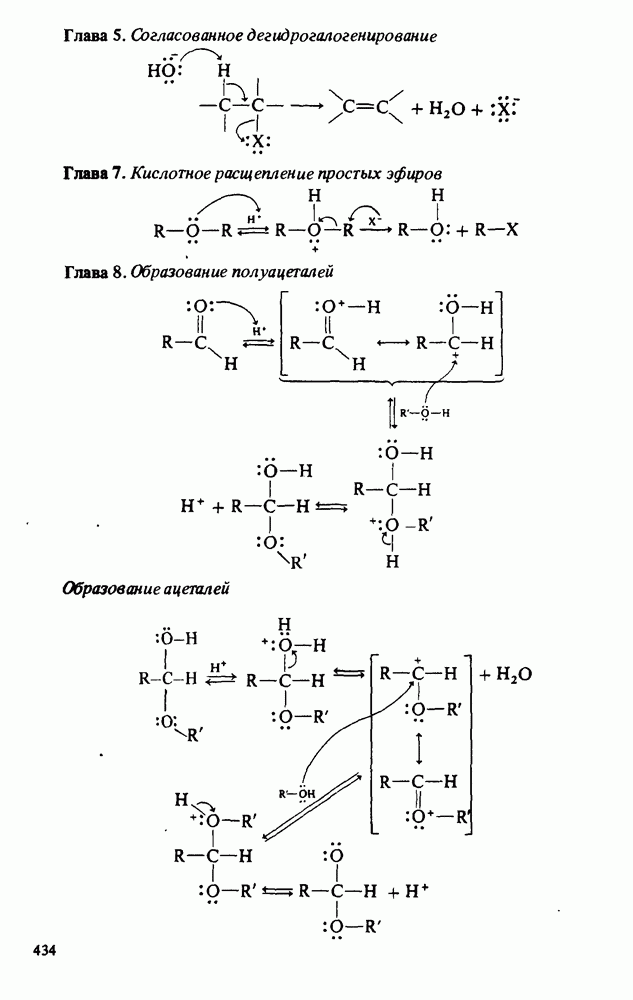
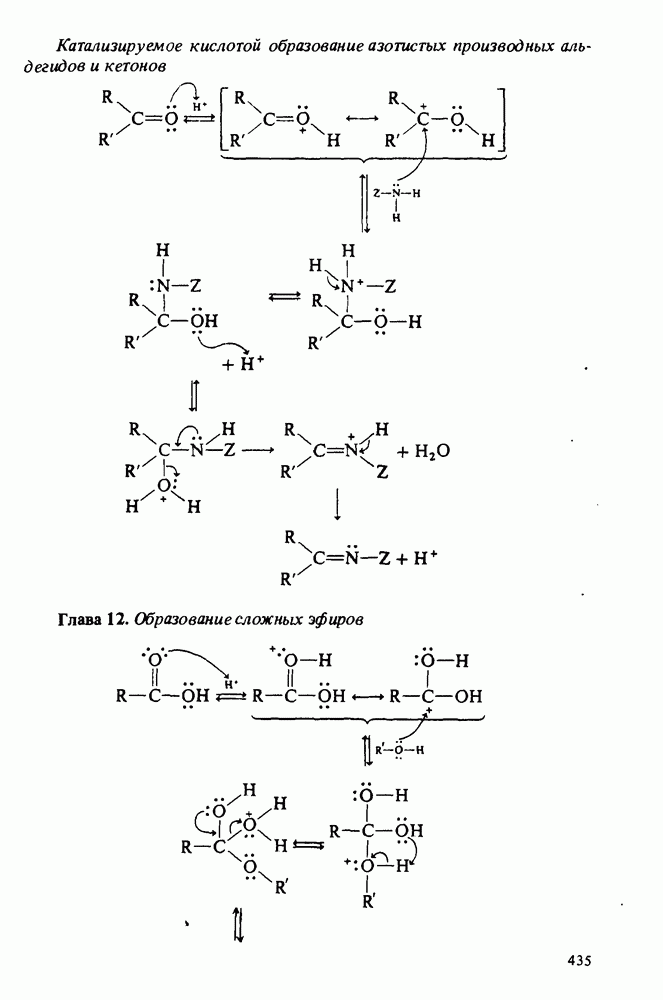
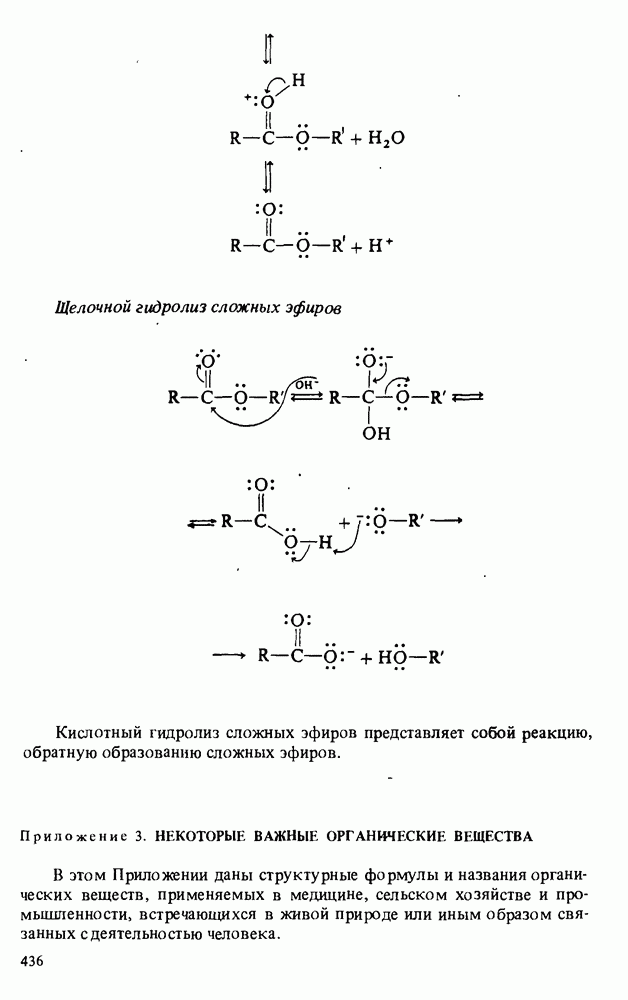
- Приложение 2. МЕХАНИЗМЫ НЕКОТОРЫХ РЕАКЦИЙ
- Приложение 3. НЕКОТОРЫЕ ВАЖНЫЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА