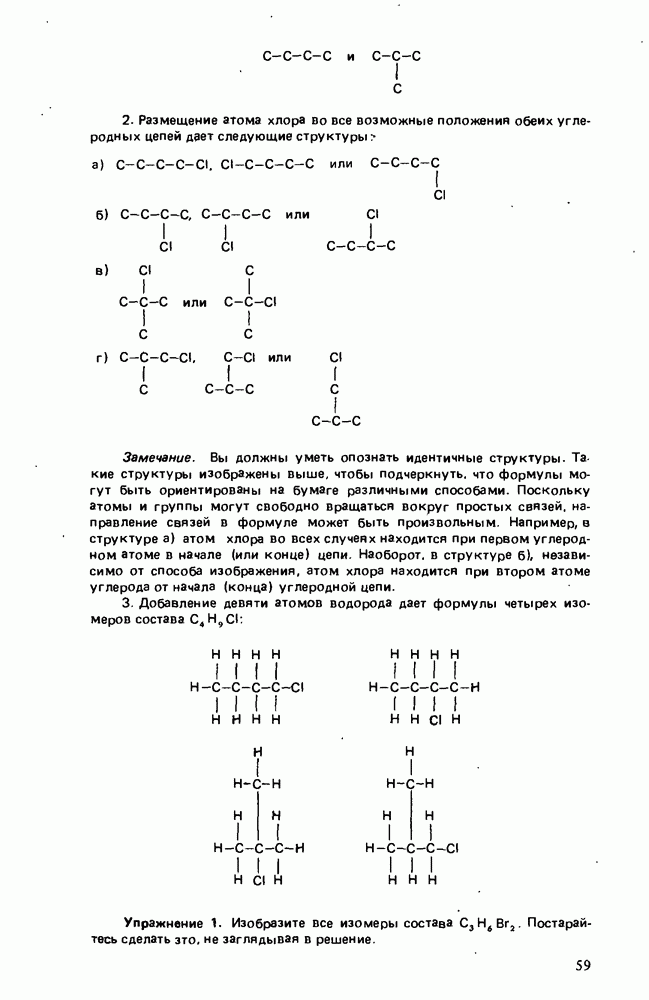
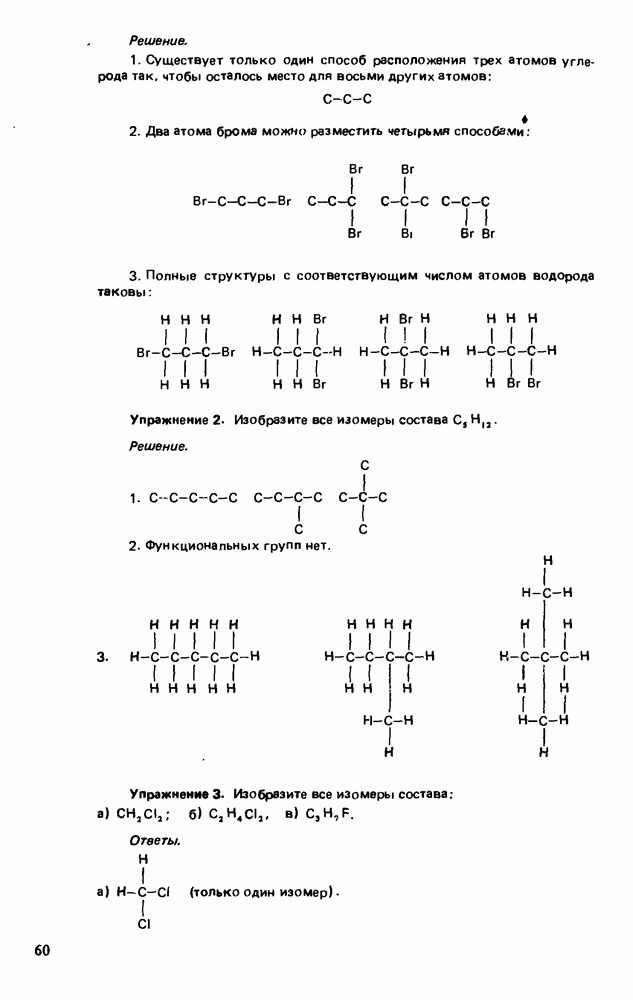
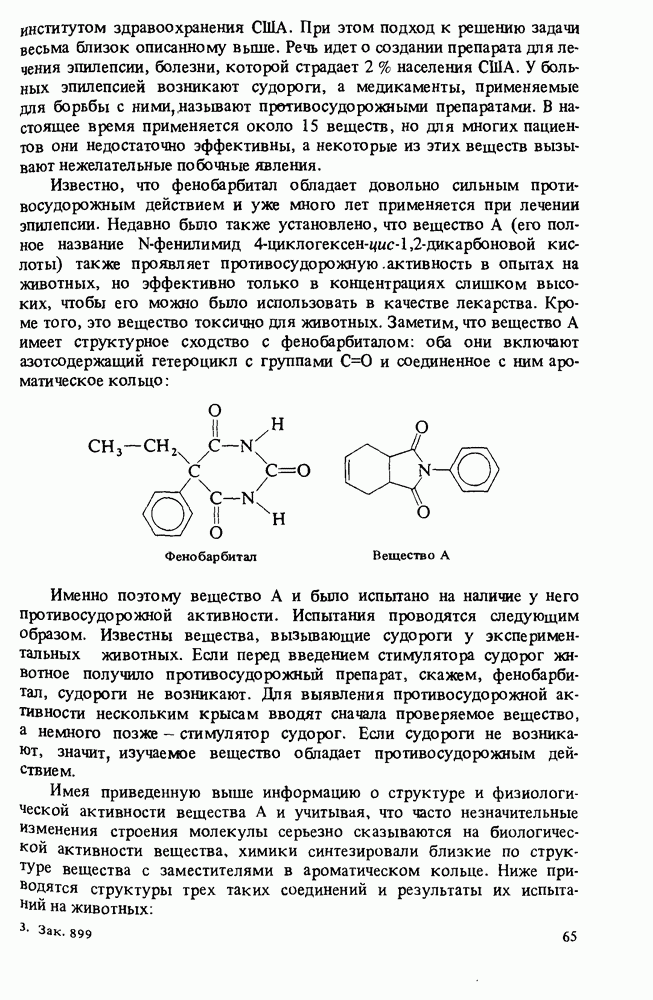
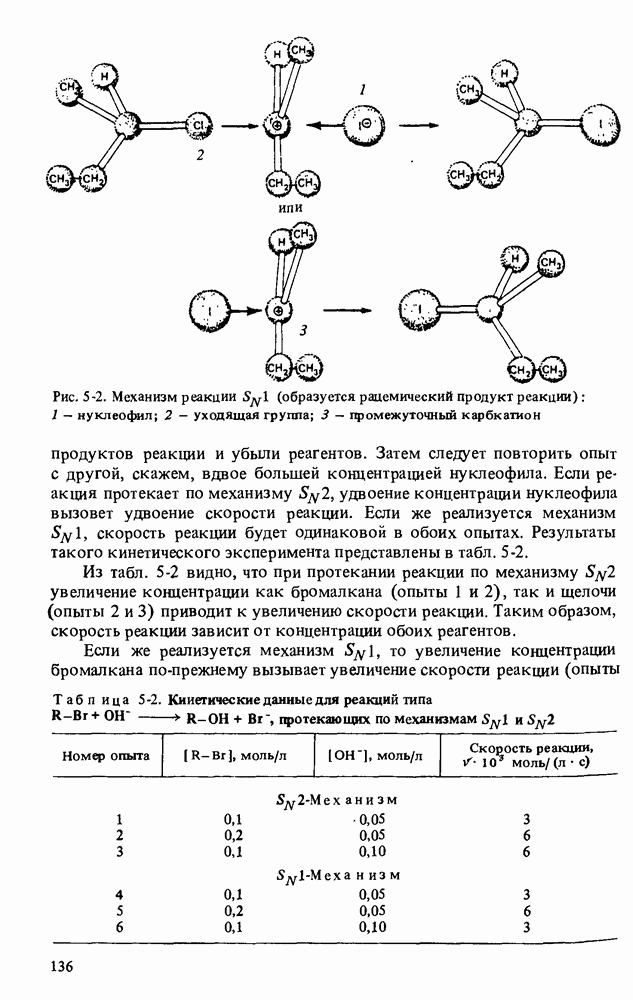
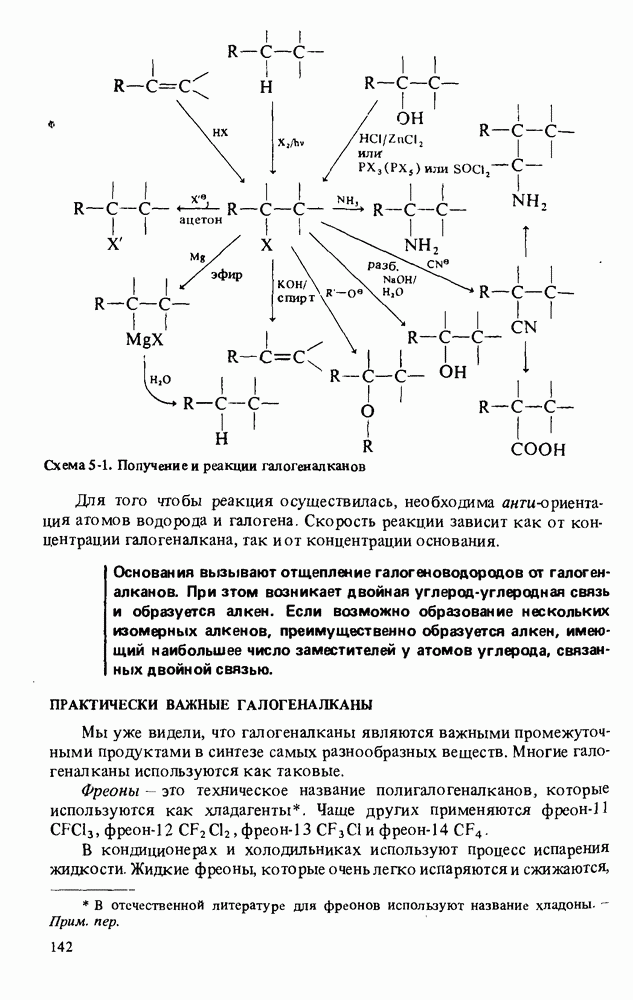
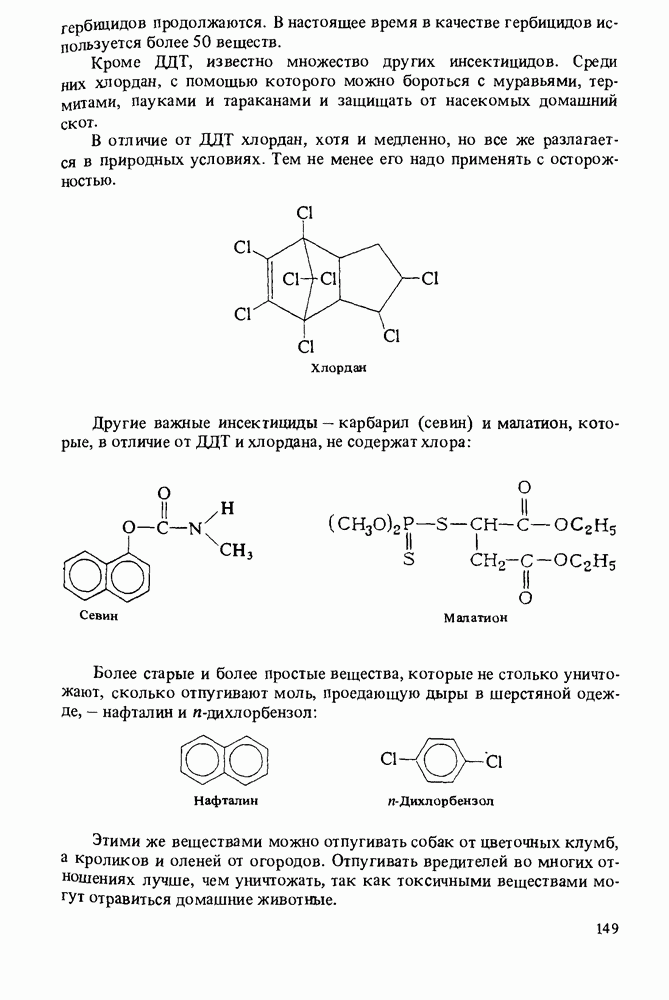
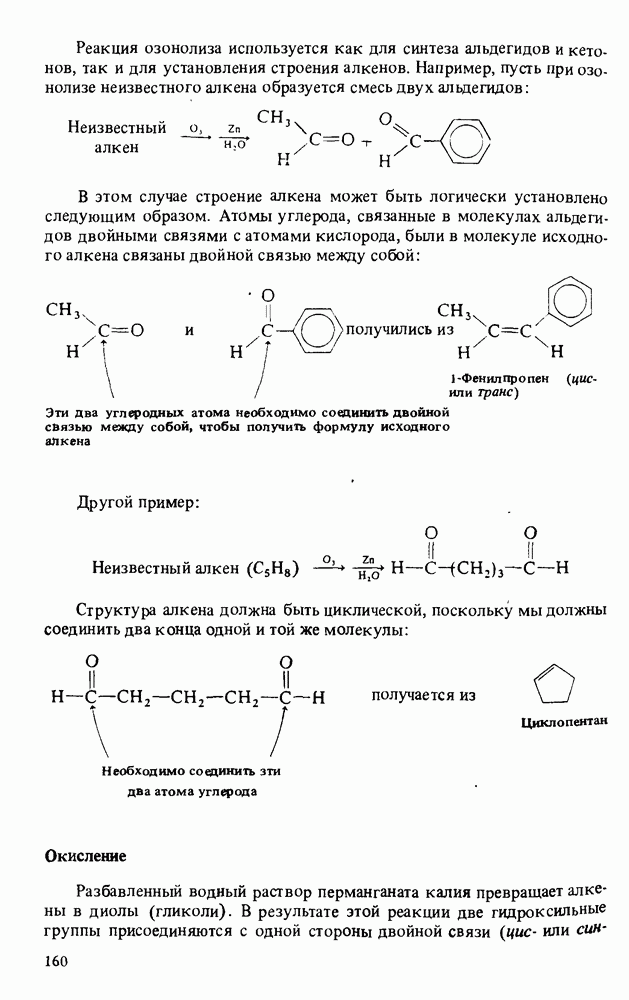
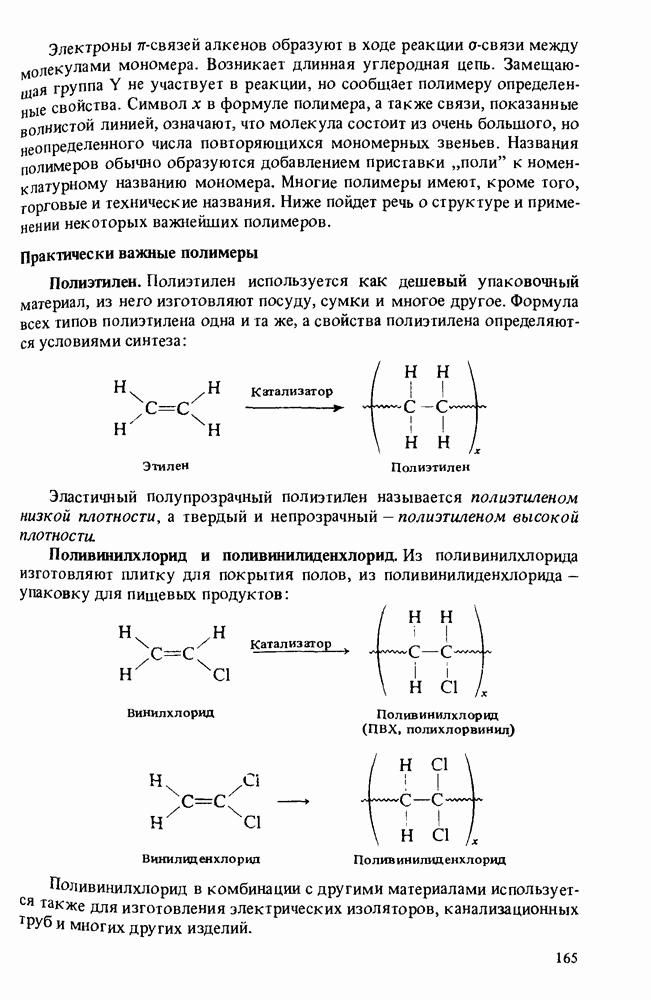
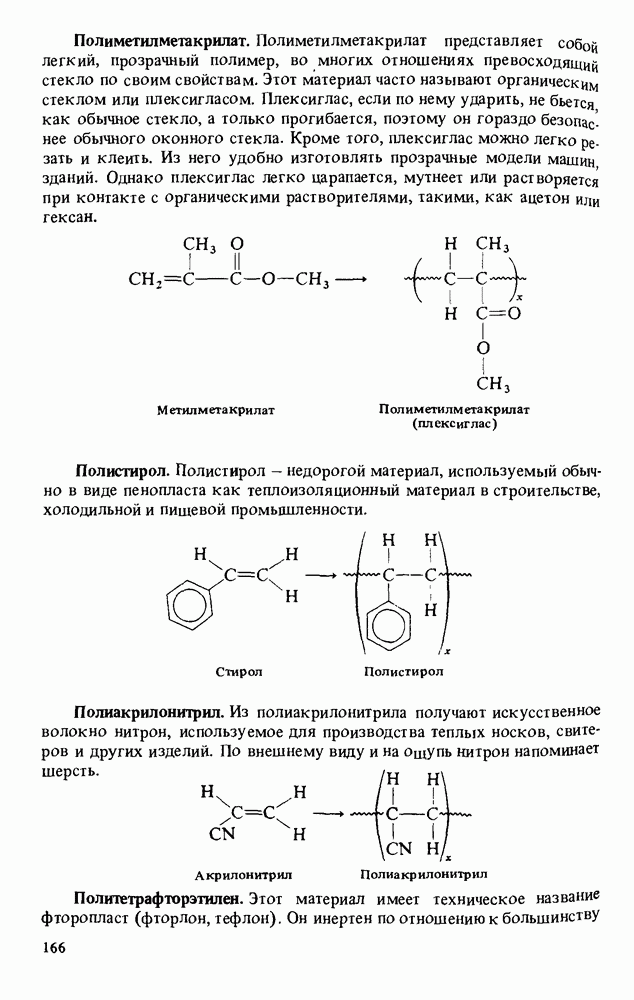
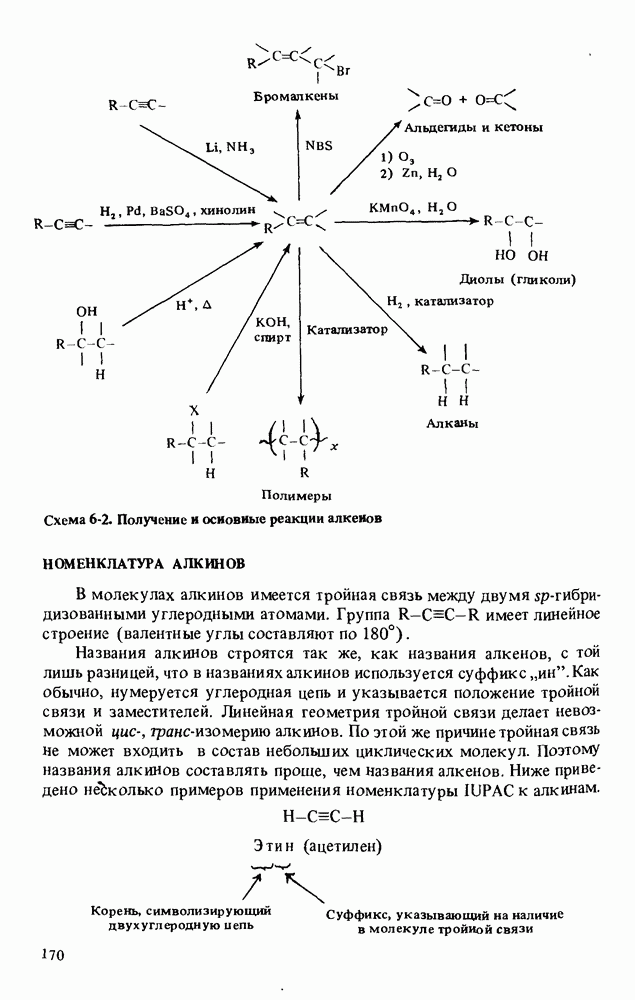
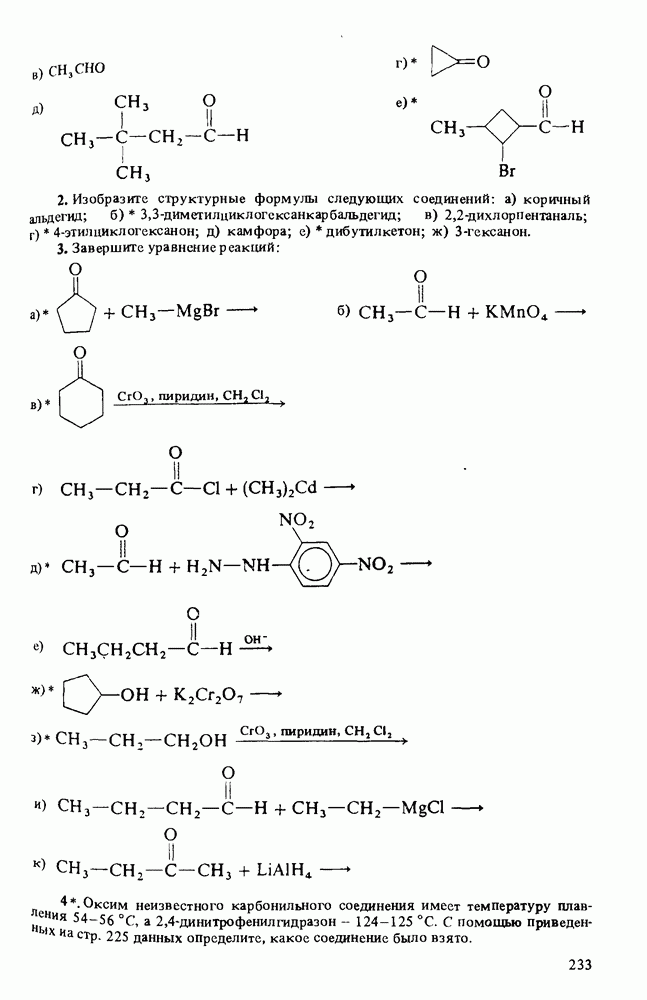
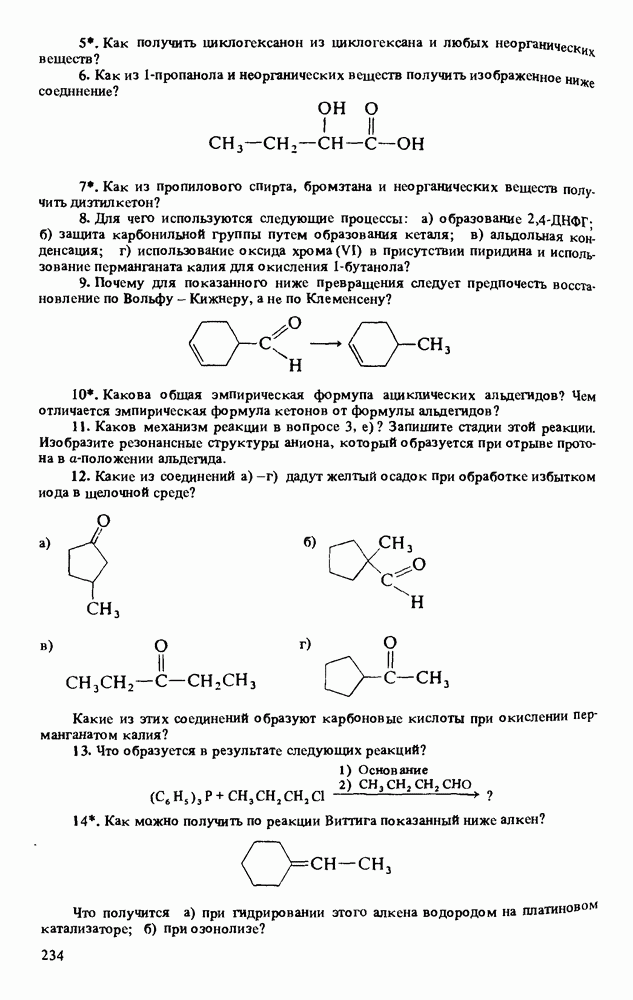
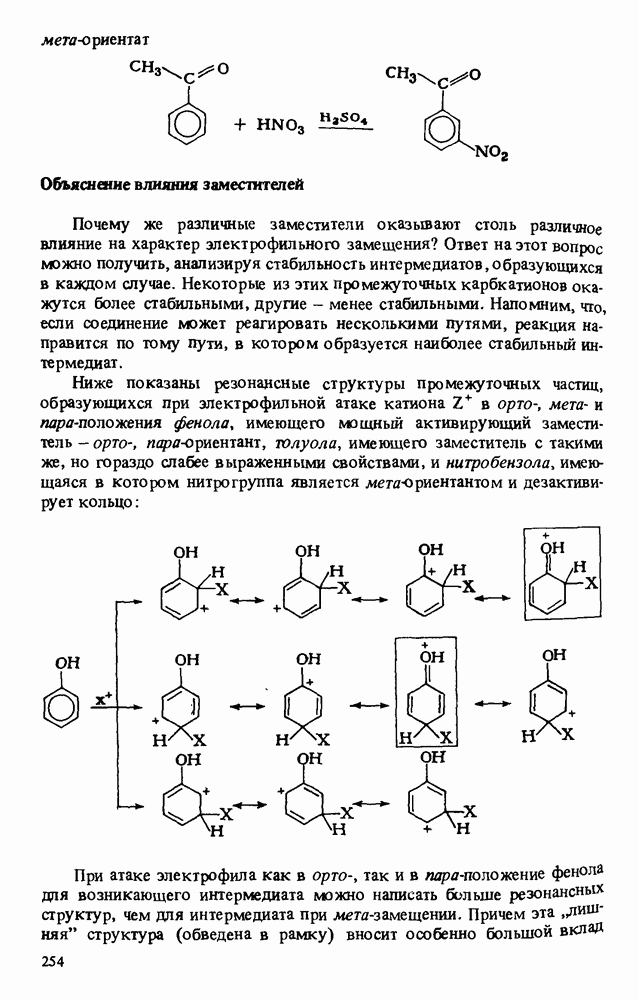
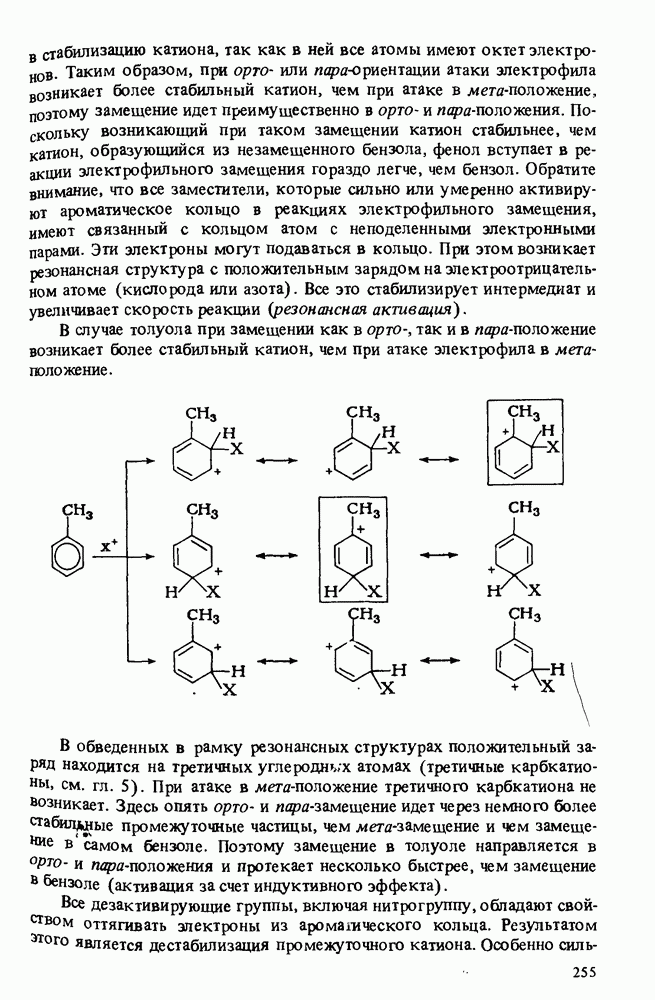
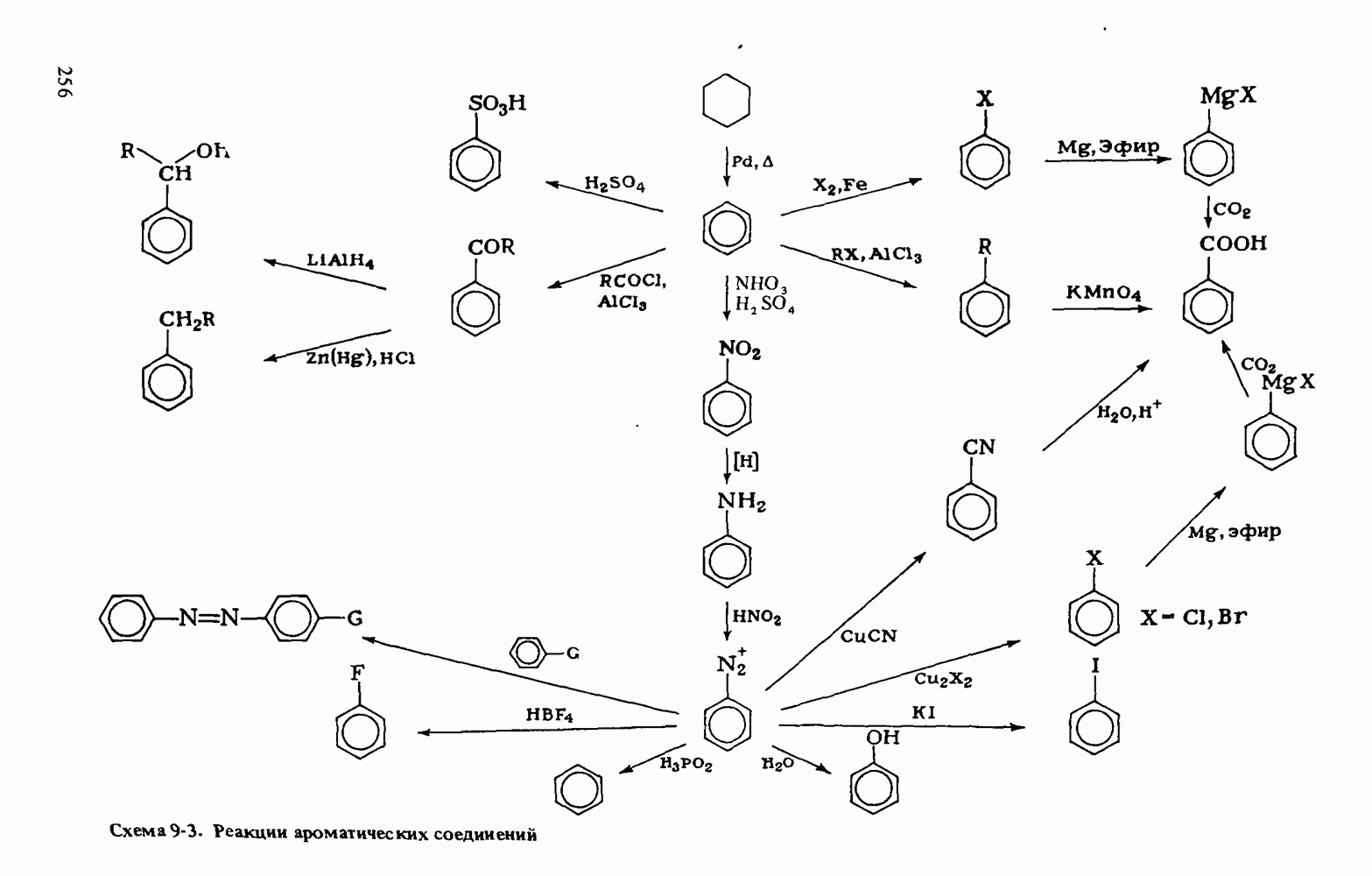
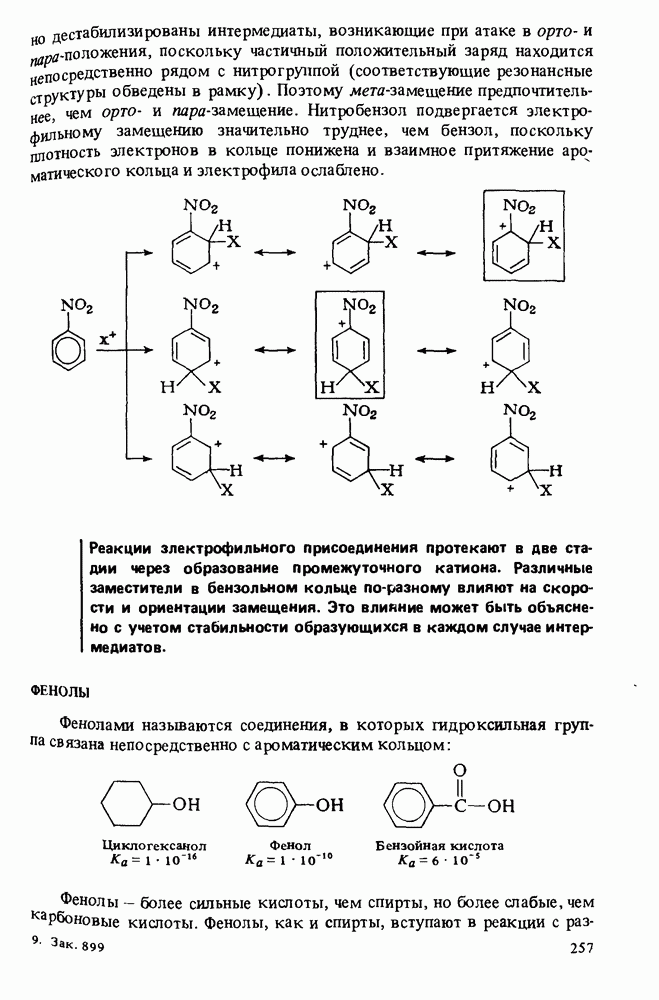
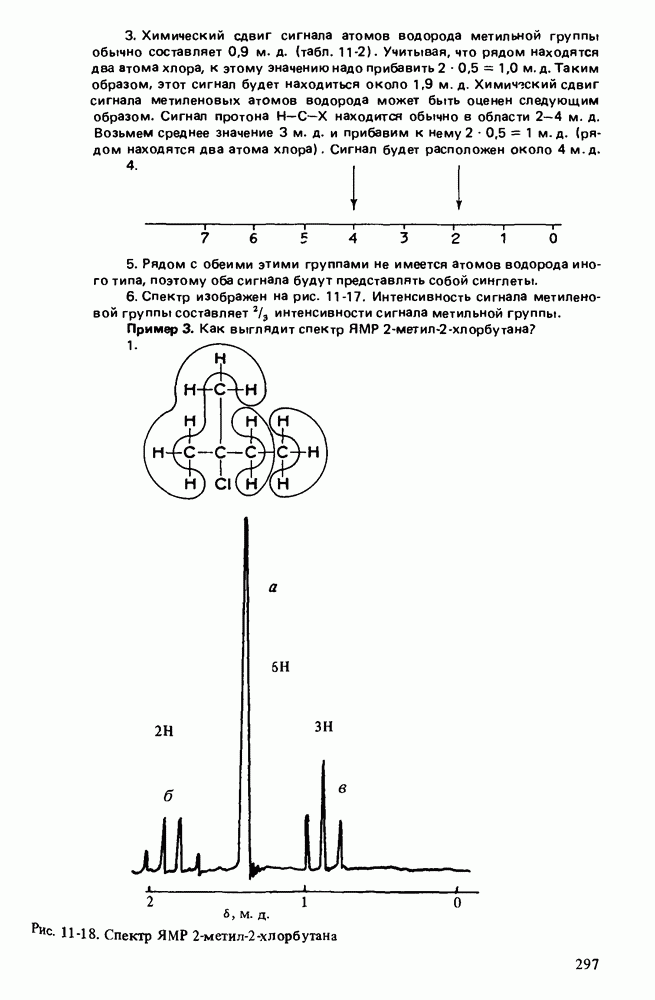
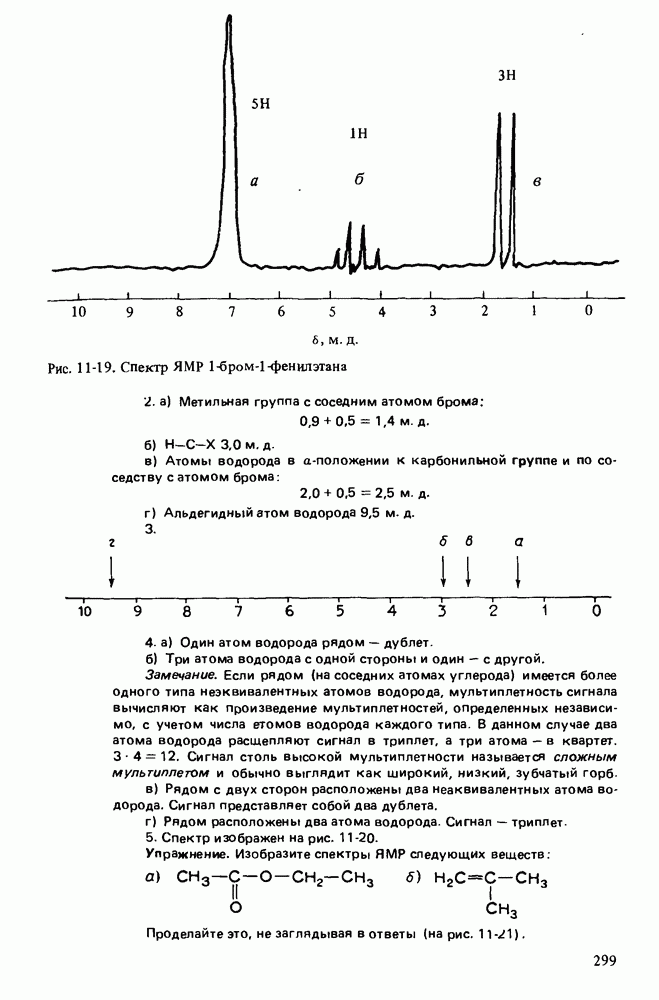
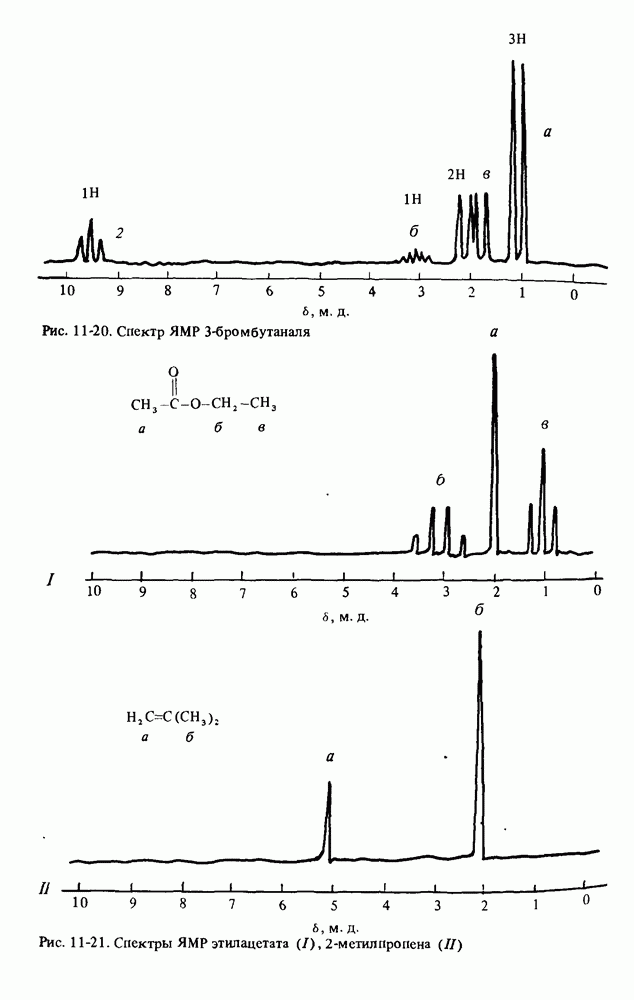
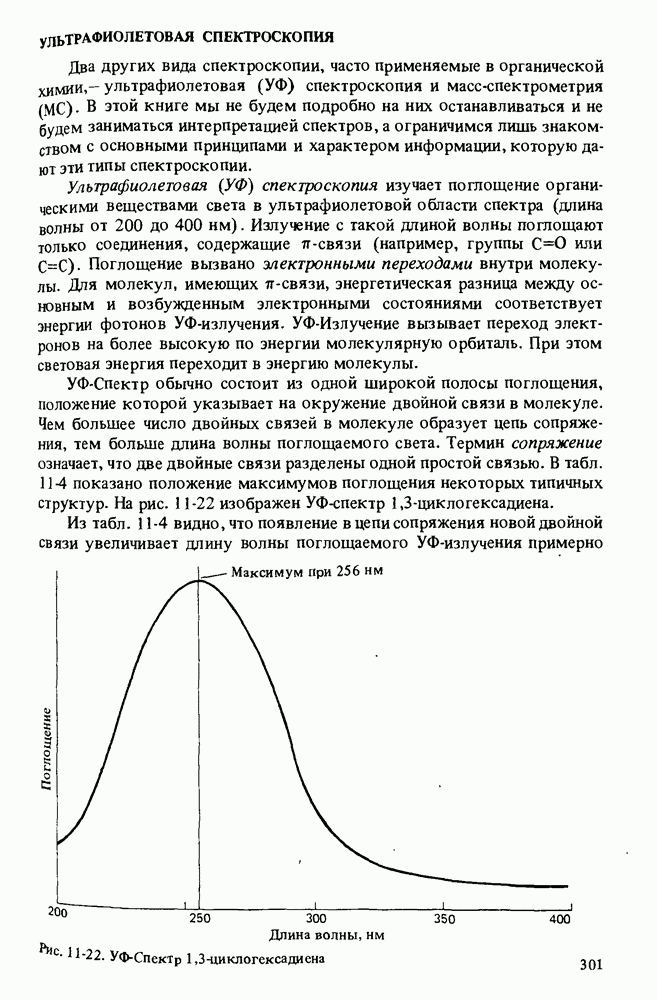
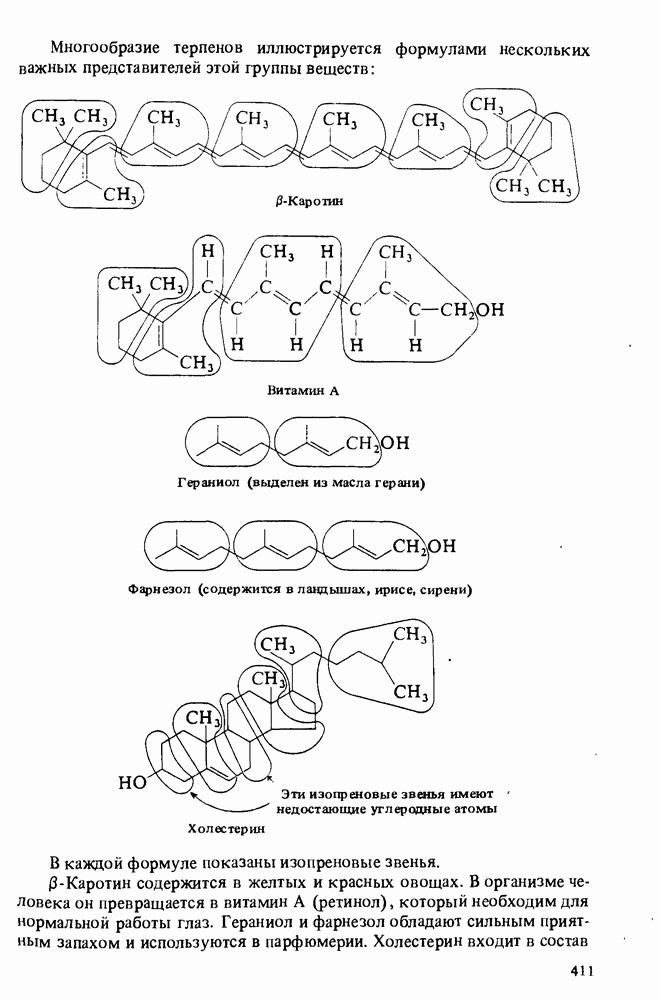
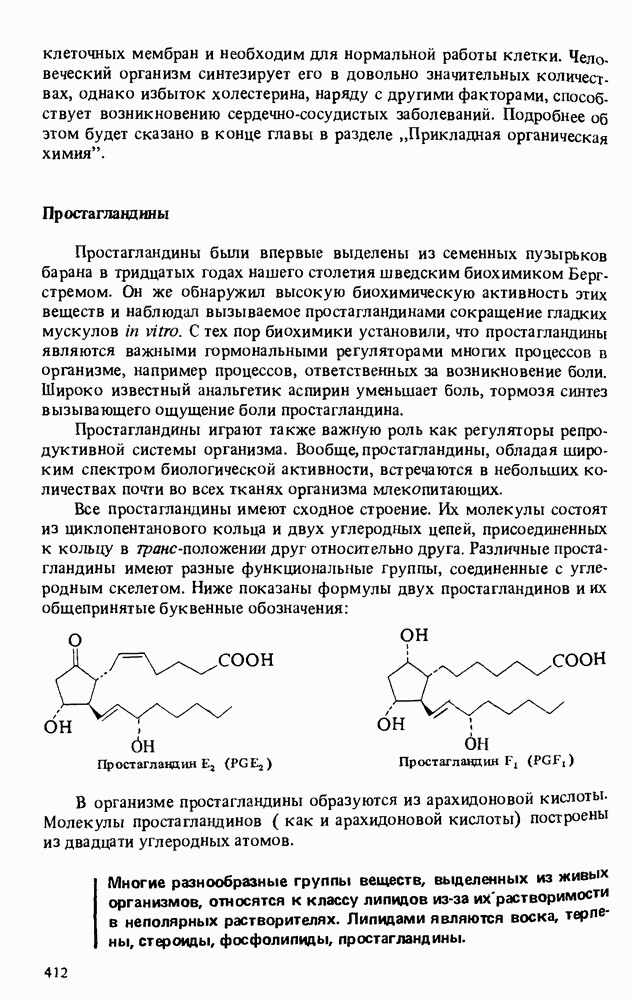
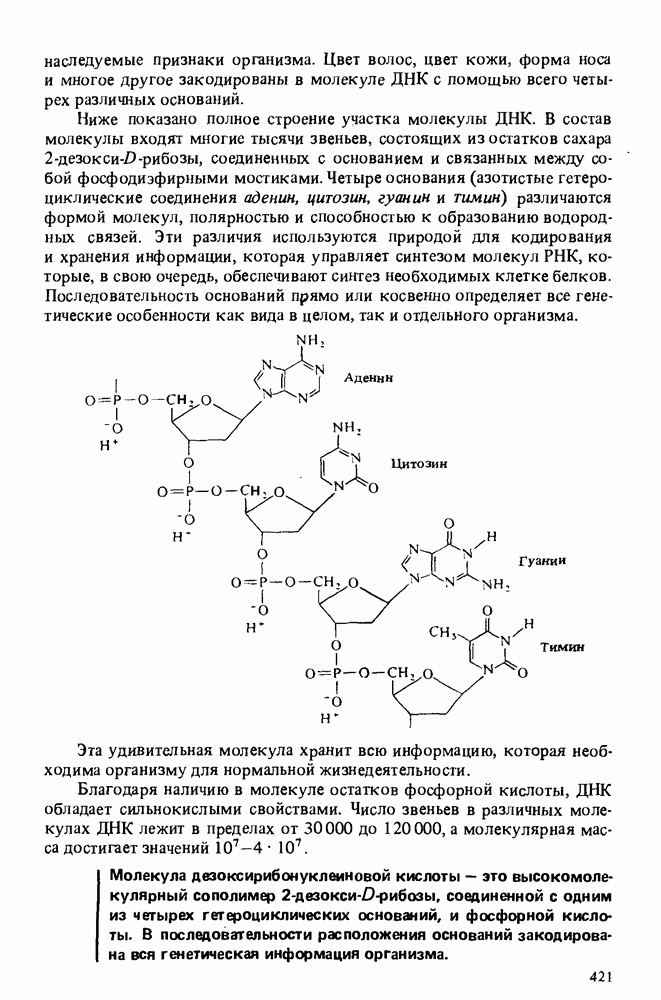
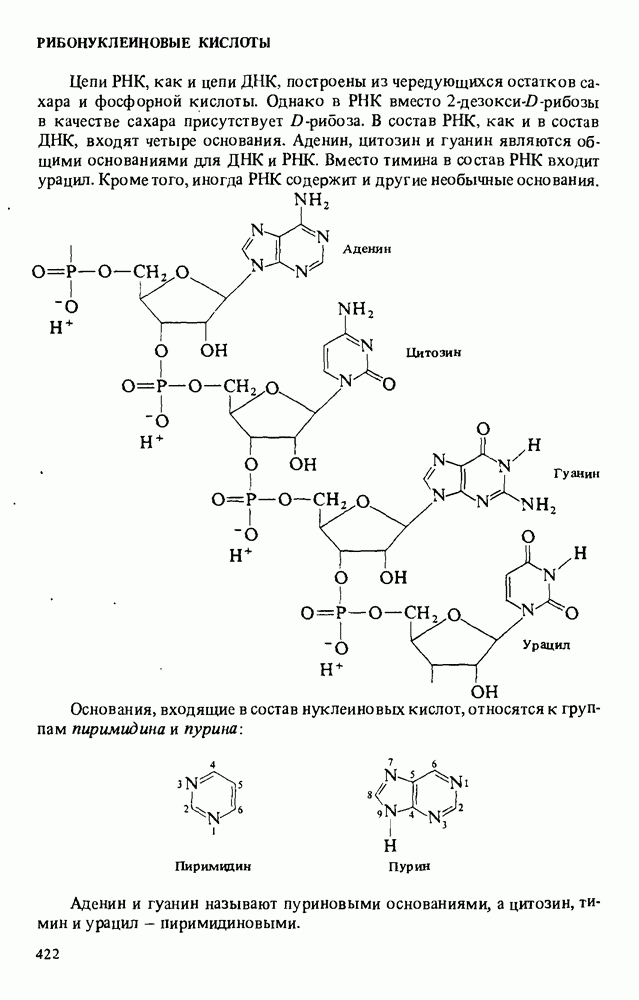
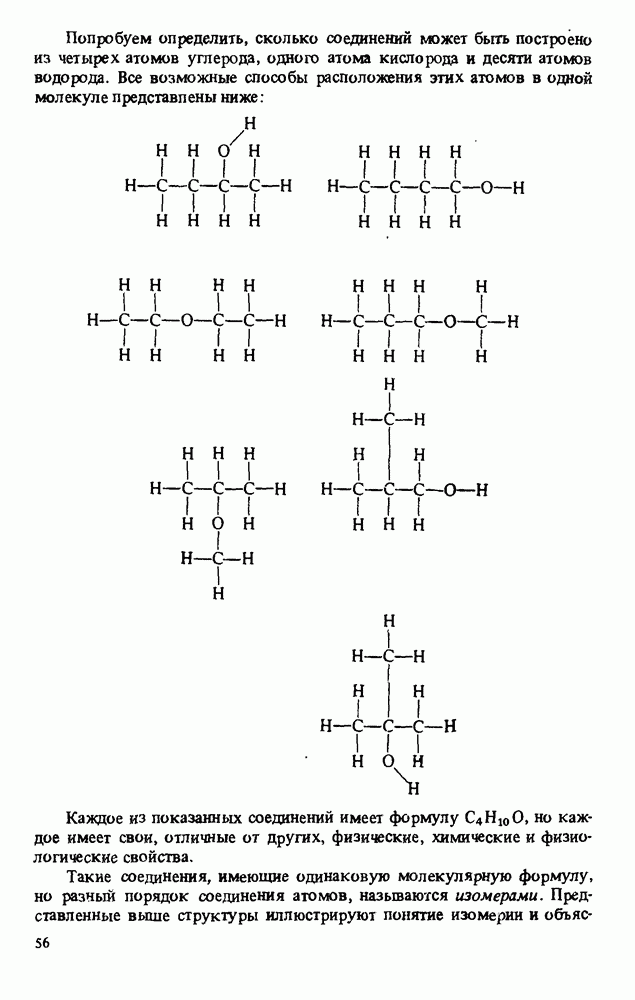| << Предыдущий параграф | Следующий параграф >> |
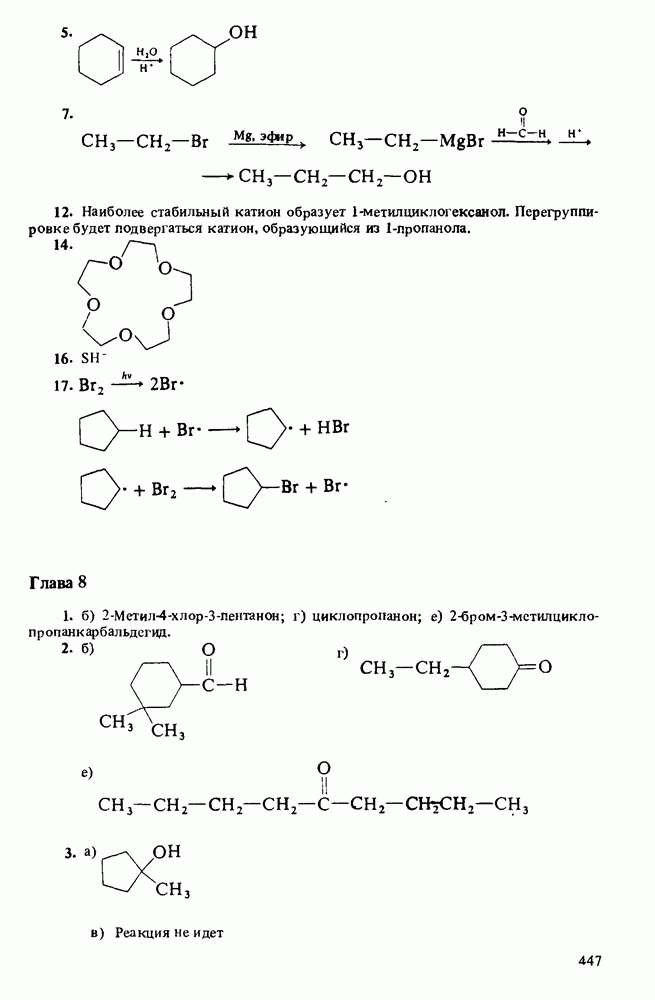
Пред.
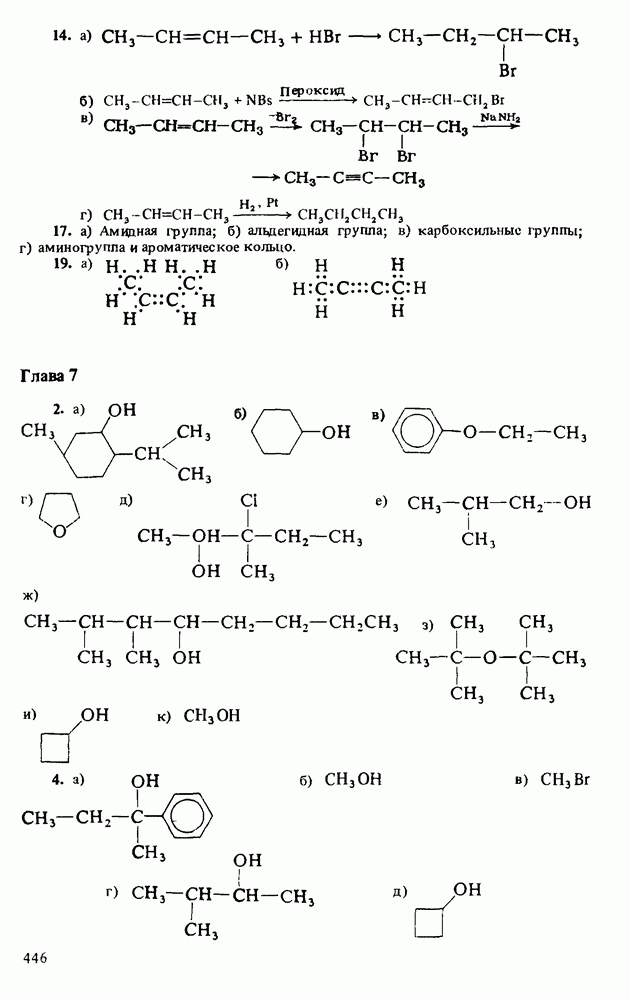
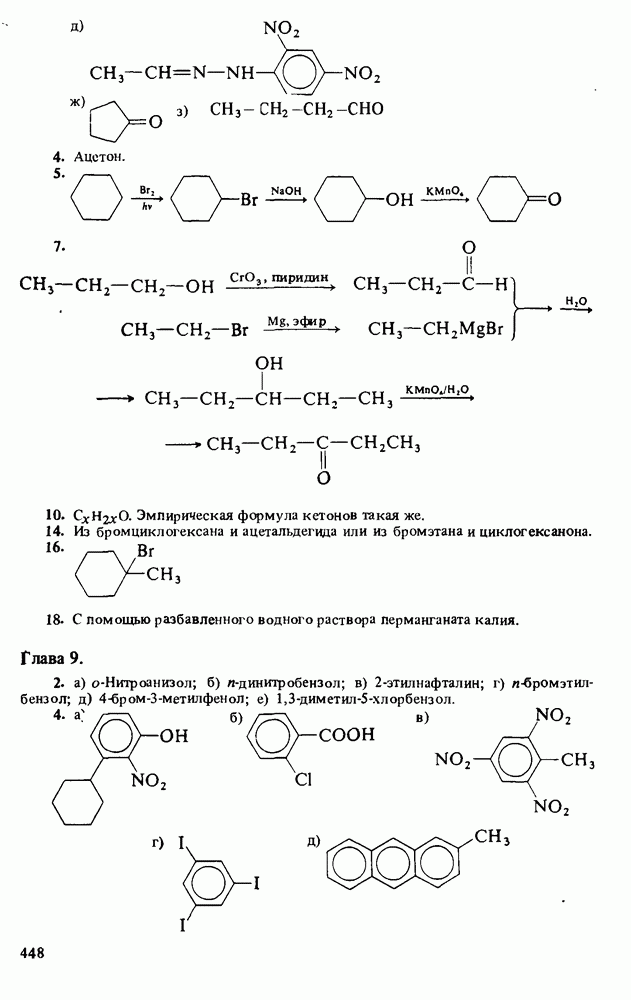
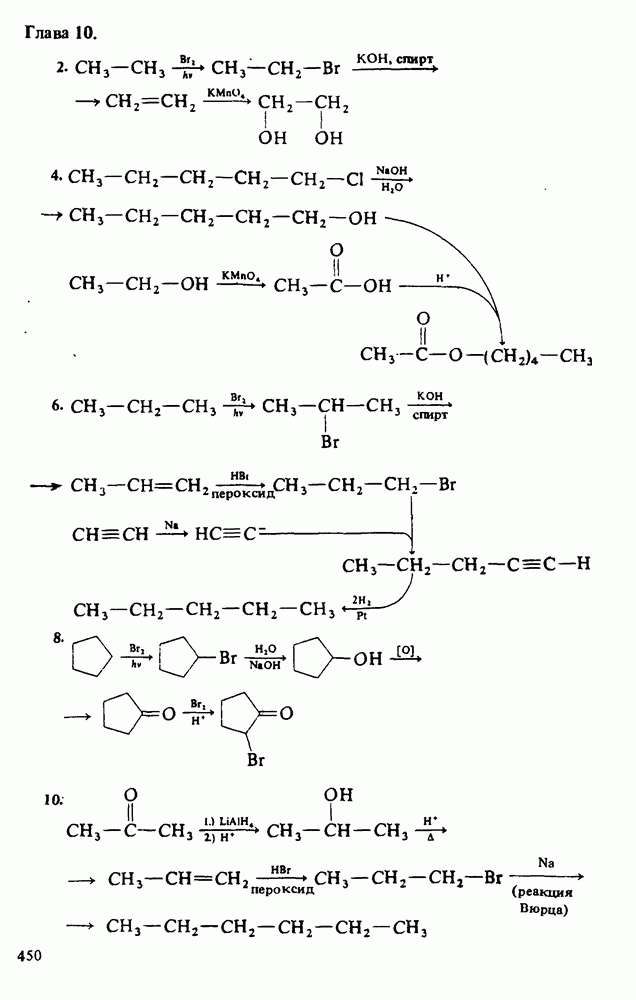
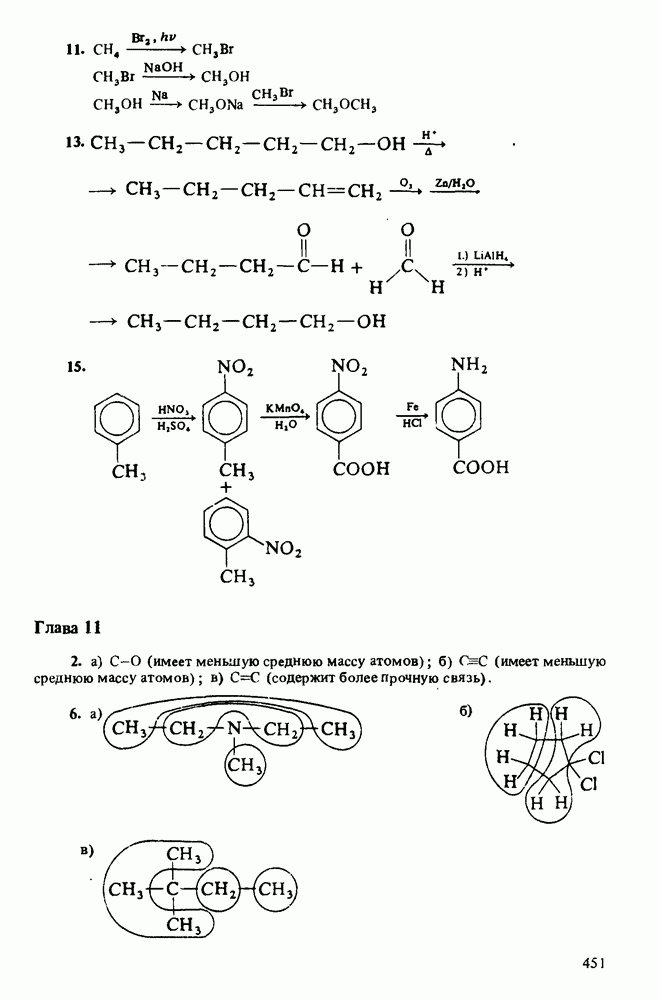
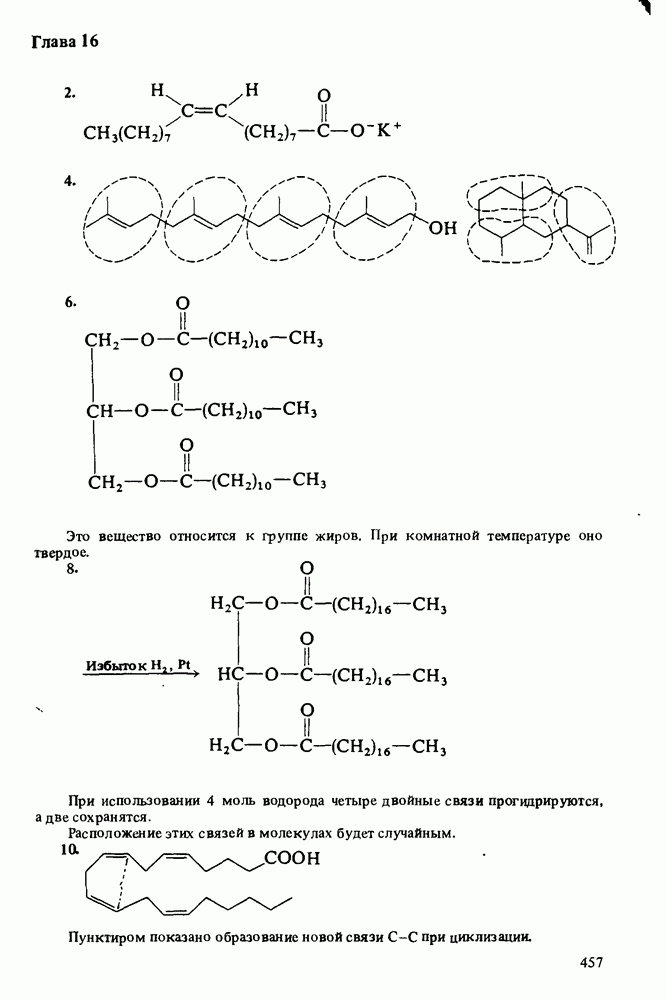
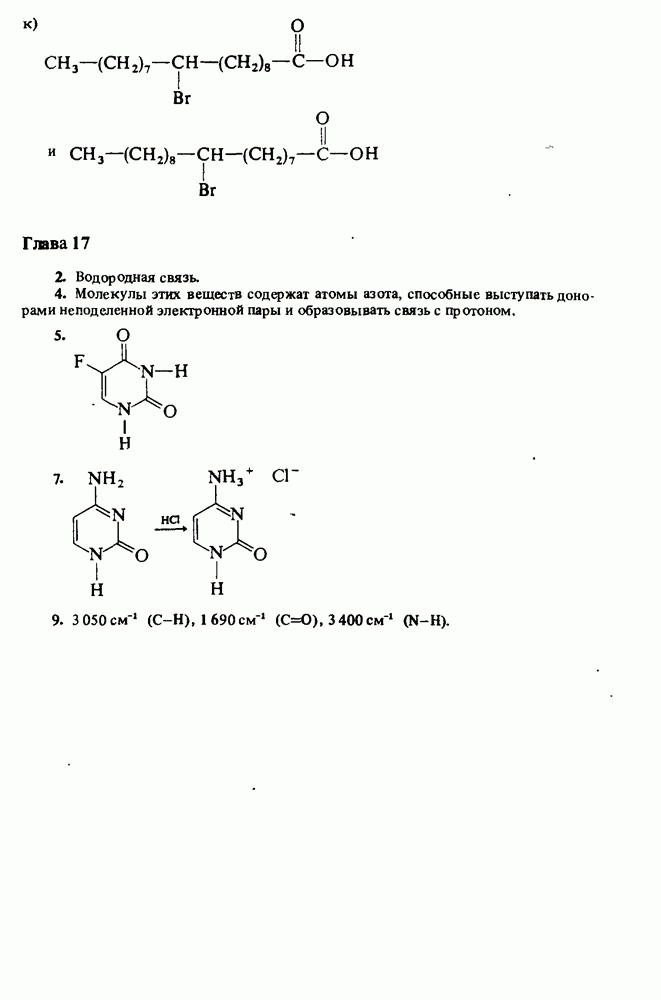
След.
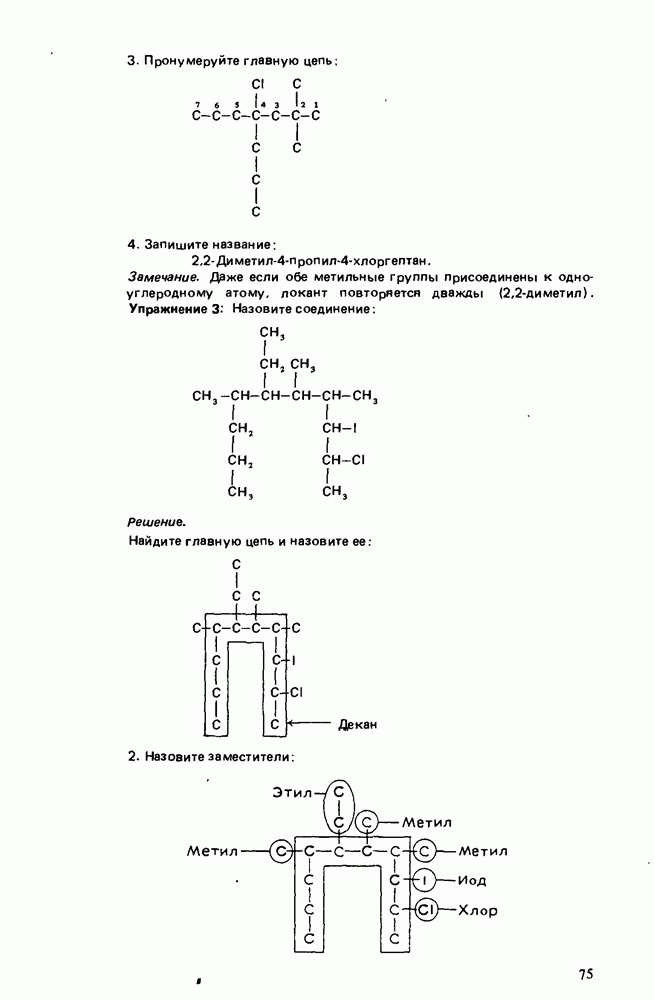
Макеты страниц
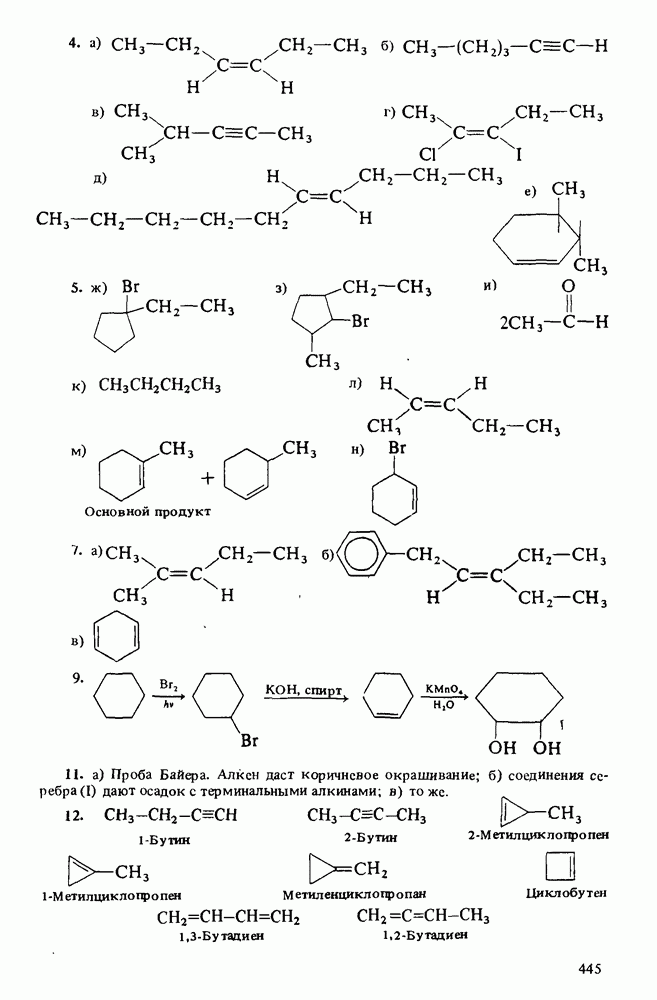
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
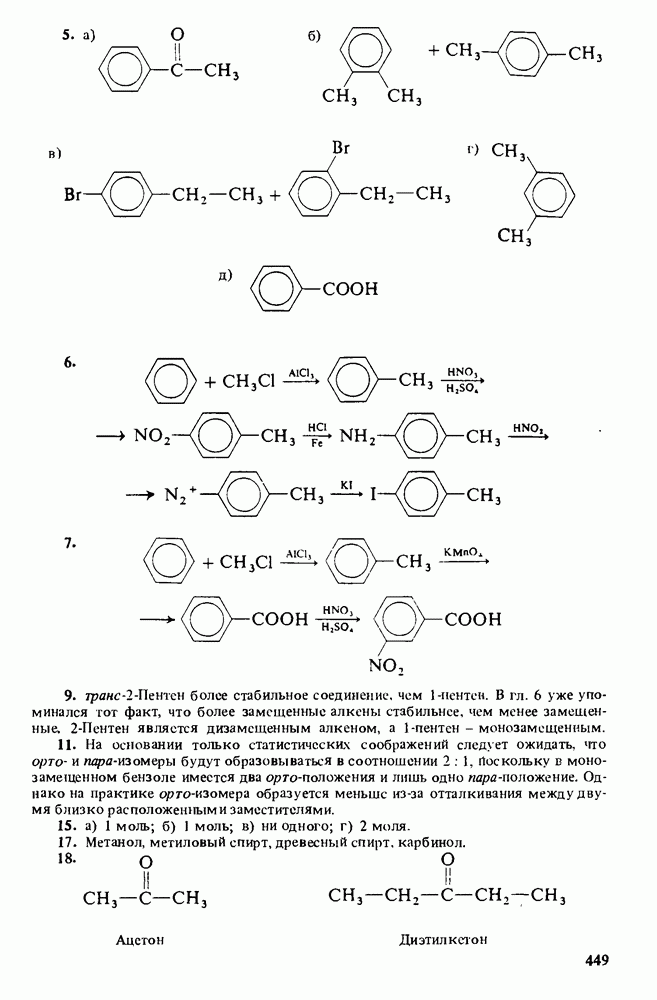
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
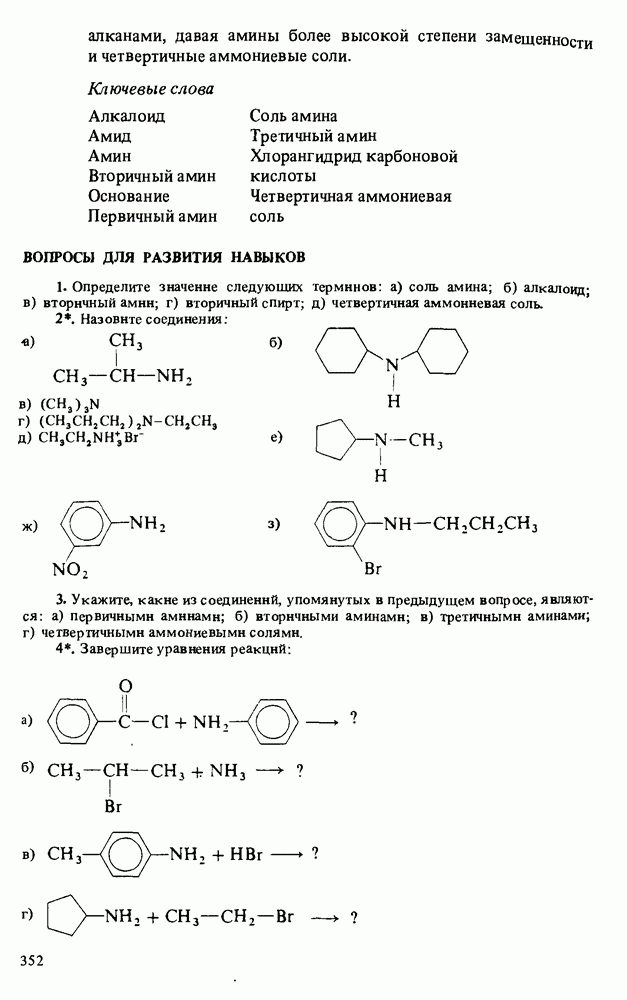
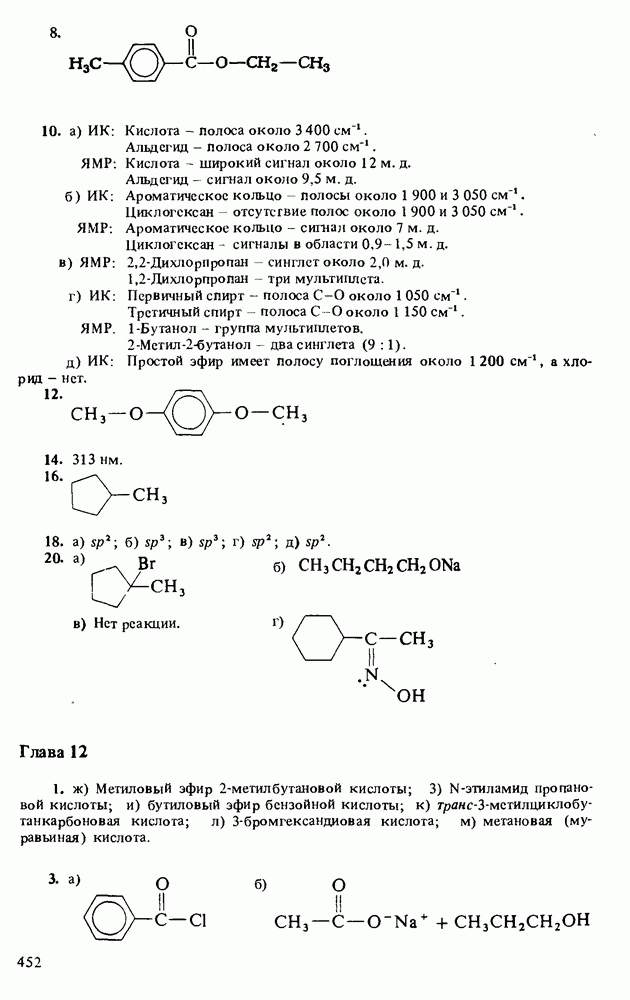
ОСНОВНОСТЬ АМИНОВ
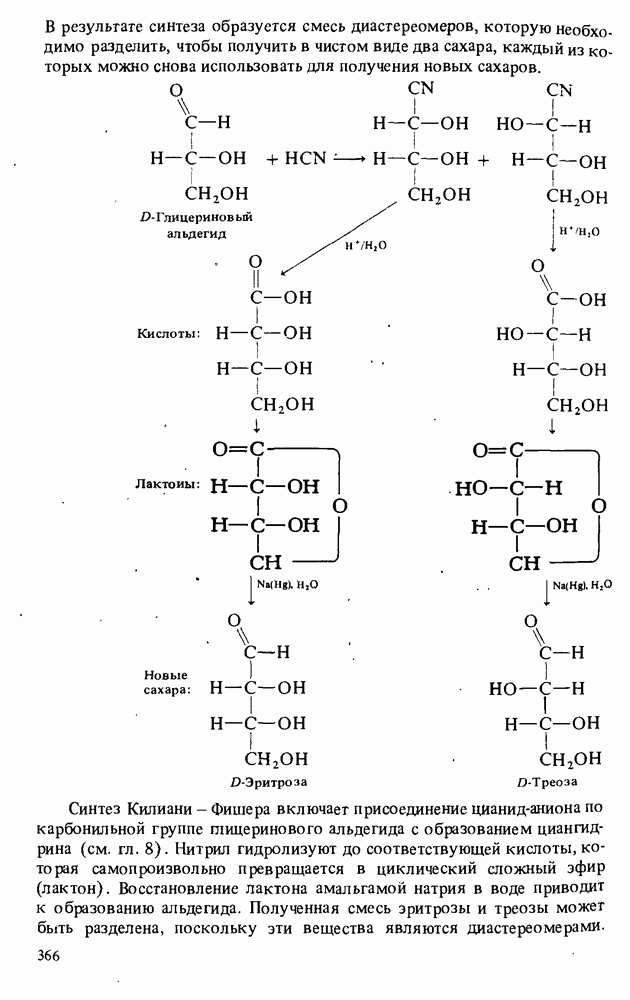
Амины являются единственным классом органических соединений обладающих заметной основностью. Однако амины — слабые основания. Теперь будет полезным вернуться к табл. 12-1, чтобы вспомнить три определения кислот и оснований. В соответствии с тремя определениями основности можно выделить три аспекта химического поведения аминов.
1. Амины реагируют с кислотами, выступая как акцепторы протонов:

Поэтому амины являются основаниями Бренстеда. 2. Амины являются донорами электронной пары (основаниями Льюиса):

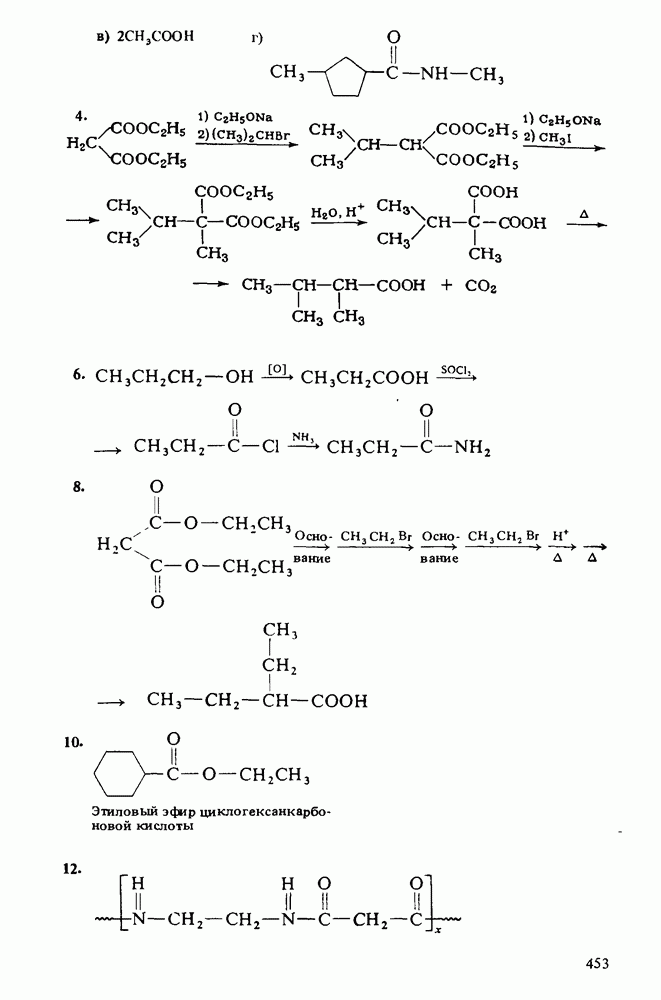
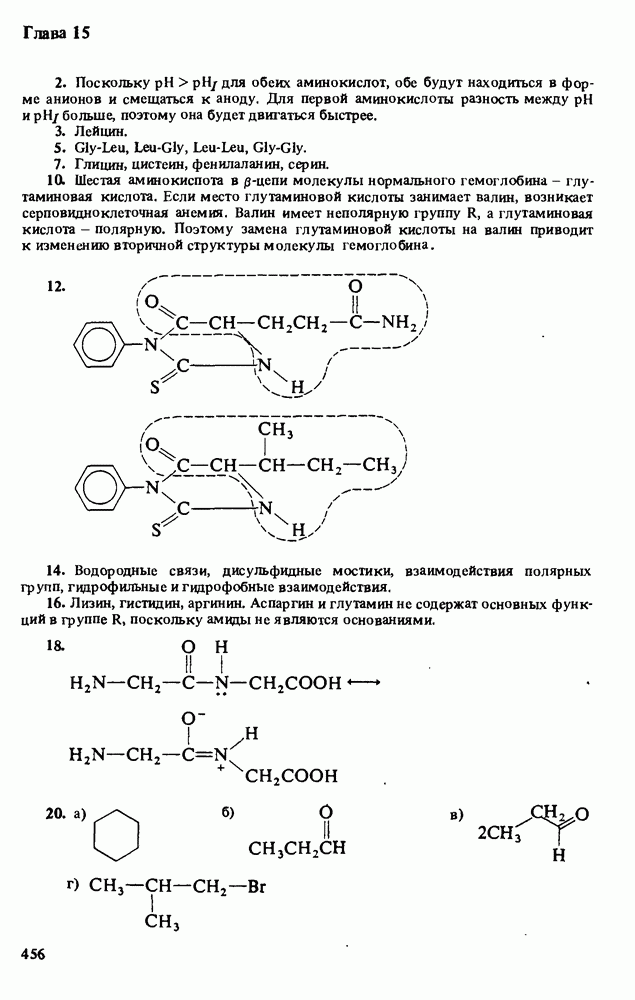
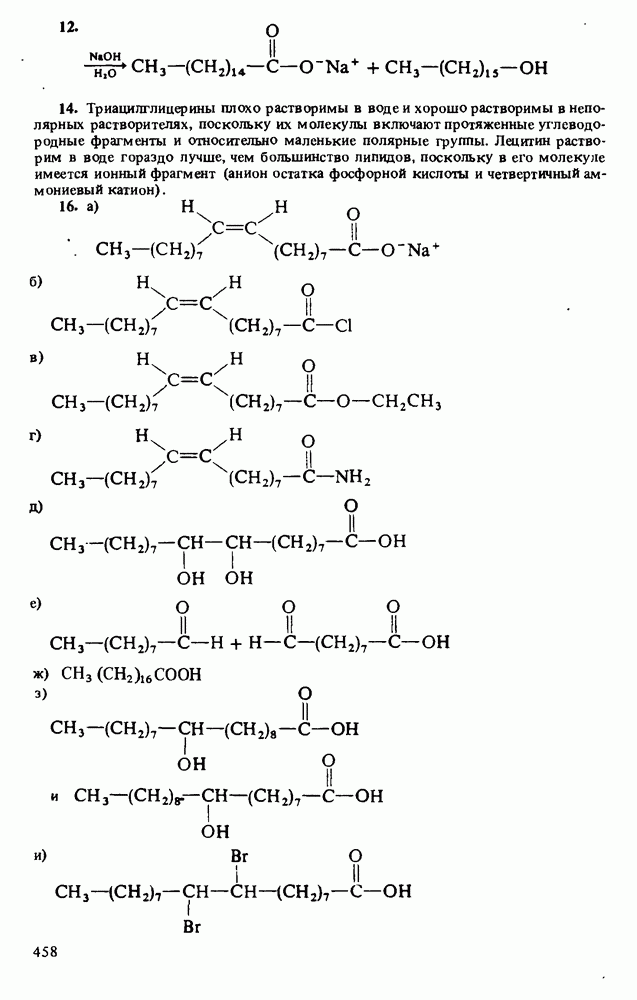
3. Водные растворы аминов имеют  следовательно, амины при взаимодействии с водой способны генерировать гидроксид-анионы
следовательно, амины при взаимодействии с водой способны генерировать гидроксид-анионы 

Поэтому амины являются основаниями Аррениуса. Хотя все амины являются слабыми основаниями, их основность зависит от природы и числа углеводородных радикалов, связанных с атомом азота. Алкиламины гораздо основнее, чем ароматические амины. Среди алкиламинов наиболее основными являются вторичные, несколько менее основны первичные, затем идут третичные амины и аммиак. В целом основность убывает в ряду:

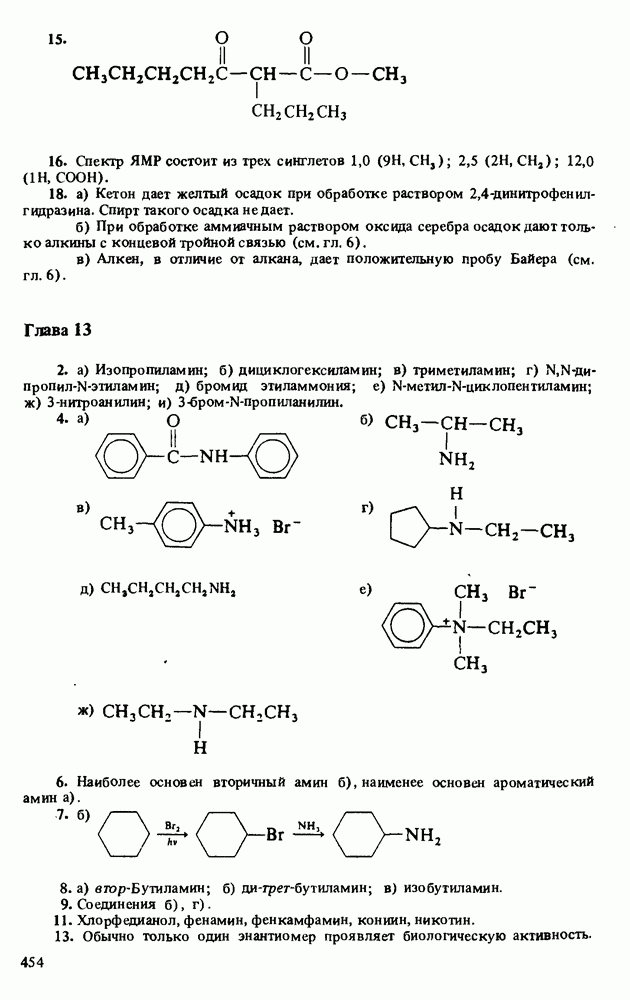
Мерой основности вещества является константа основности  которая представляет собой константу равновесия взаимодействия амина с водой (см. выше определение основности по Аррениусу). Поскольку вода присутствует в большом избытке, ее концентрация не фигурирует в выражении константы основности:
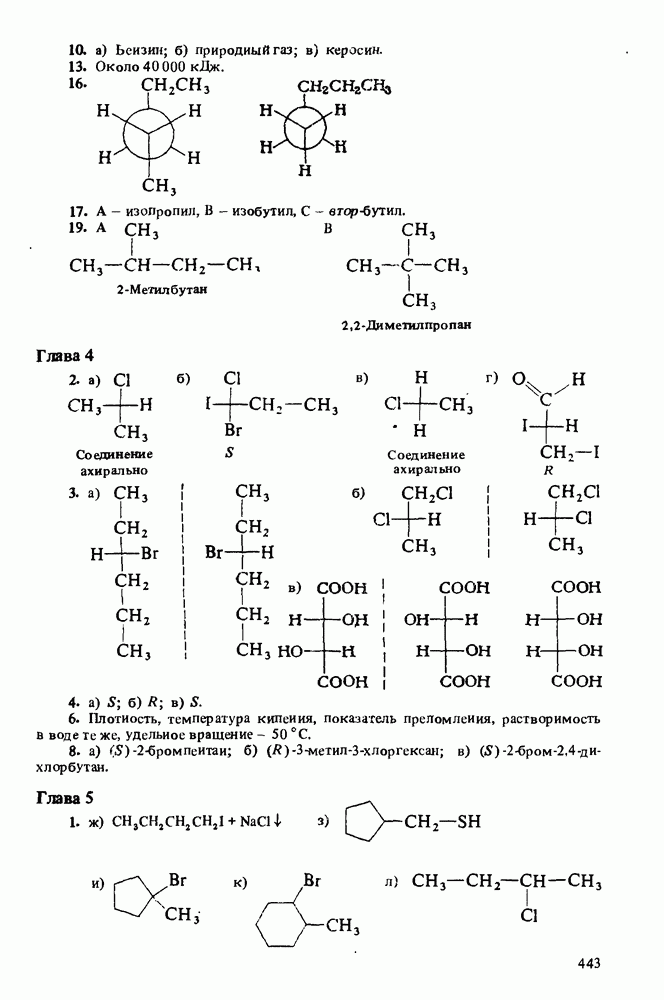
которая представляет собой константу равновесия взаимодействия амина с водой (см. выше определение основности по Аррениусу). Поскольку вода присутствует в большом избытке, ее концентрация не фигурирует в выражении константы основности:

Чем сильнее основание, тем большее число протонов будет оторвано от молекул воды и тем выше будет концентрация гидроксид-ионов в растворе. Таким образом, более сильные основания характеризуются
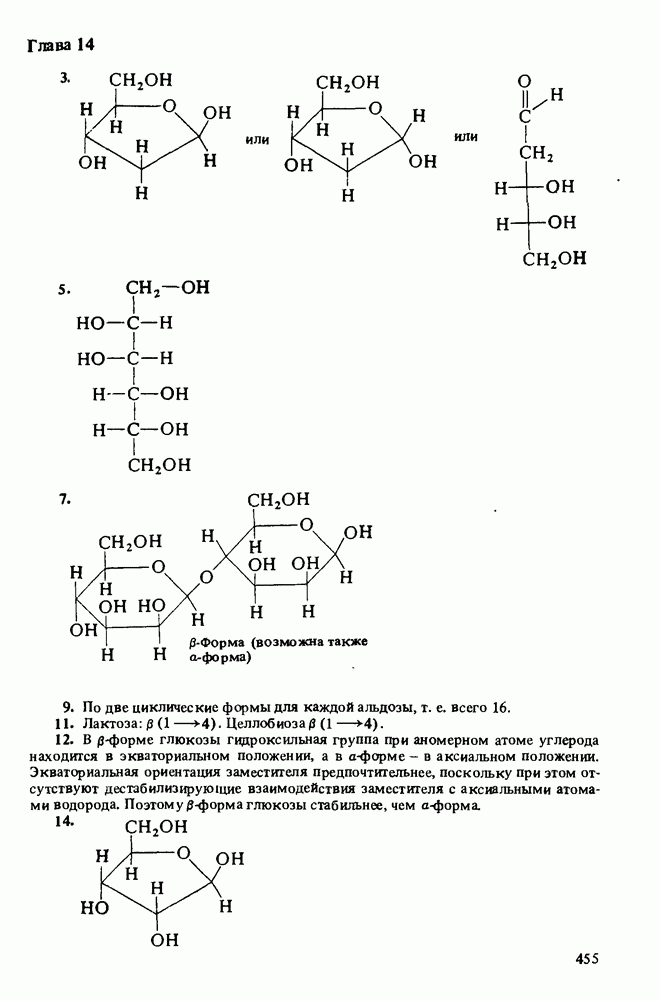
большими значениями К Значения  для некоторых аминов приведены ниже:
для некоторых аминов приведены ниже:

Эти величины иллюстрируют ту связь основности аминов с их строением, о которой шла речь выше. Наиболее сильным основанием является вторичный диметиламин, а наиболее слабым—ароматический амин анилин.
Ароматические амины являются весьма слабыми основаниями, поскольку неподеленная электронная пара атома азота (которая и определяет основные свойства аминов) взаимодействует с  -электронным облаком ароматического ядра и вследствие этого менее доступна для протона (или другой кислоты). Более высокая основность вторичных аминов по сравнению с первичными объясняется тем, что алкильные группы, благодаря наличию у них положительного индуктивного эффекта, подают электроны по
-электронным облаком ароматического ядра и вследствие этого менее доступна для протона (или другой кислоты). Более высокая основность вторичных аминов по сравнению с первичными объясняется тем, что алкильные группы, благодаря наличию у них положительного индуктивного эффекта, подают электроны по  -связям на атом азота, что облегчает обобществление неподеленной электронной пары. Две алкильные группы подают электроны на атом азота сильнее, чем одна, поэтому вторичные амины являются более сильными основаниями. Исходя из этого, можно было бы ожидать, что третичные амины - еще более сильные основания, чем вторичные. Однако это предположение оправдывается только для газовой фазы, а в водном растворе основность третичных аминов не столь велика. Вероятно, это объясняется эффектами сольватации.
-связям на атом азота, что облегчает обобществление неподеленной электронной пары. Две алкильные группы подают электроны на атом азота сильнее, чем одна, поэтому вторичные амины являются более сильными основаниями. Исходя из этого, можно было бы ожидать, что третичные амины - еще более сильные основания, чем вторичные. Однако это предположение оправдывается только для газовой фазы, а в водном растворе основность третичных аминов не столь велика. Вероятно, это объясняется эффектами сольватации.
Амины являются слабыми органическими основаниями. Их основность определяется числом и природой органических заместителей, соединенных с атомом азота. Наличие ароматического кольца резко понижает основность (величину  аминов, Вторичные амины являются более сильными основаниями, чем первичные и третичные.
аминов, Вторичные амины являются более сильными основаниями, чем первичные и третичные.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ
- Глава 1. КЛЮЧЕВЫЕ ПОНЯТИЯ ХИМИИ
- АТОМНАЯ ТЕОРИЯ
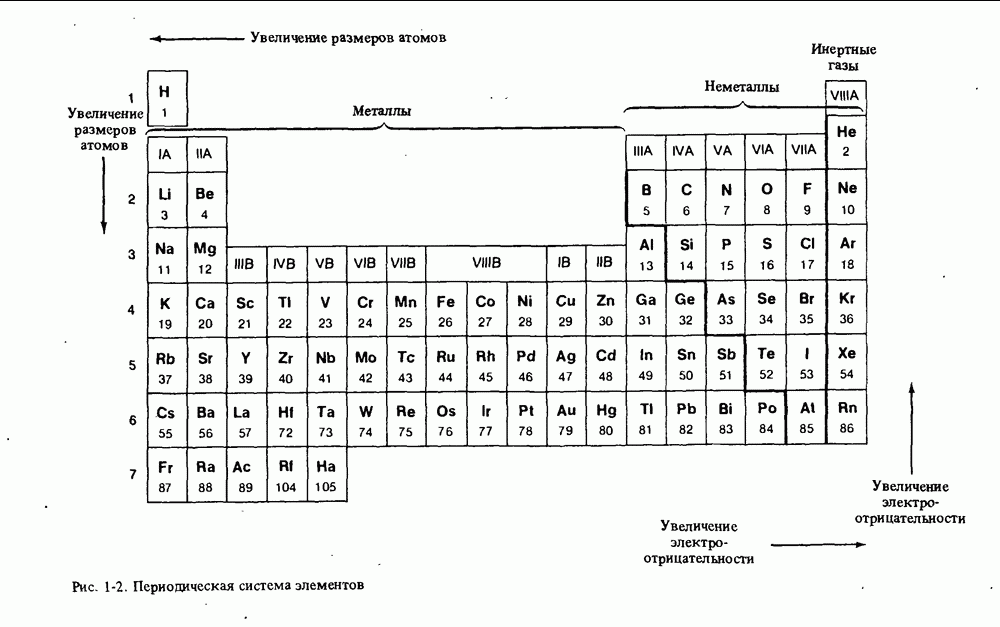
- ПЕРИОДИЧЕСКАЯ СИСТЕМА
- ХИМИЧЕСКАЯ СВЯЗЬ
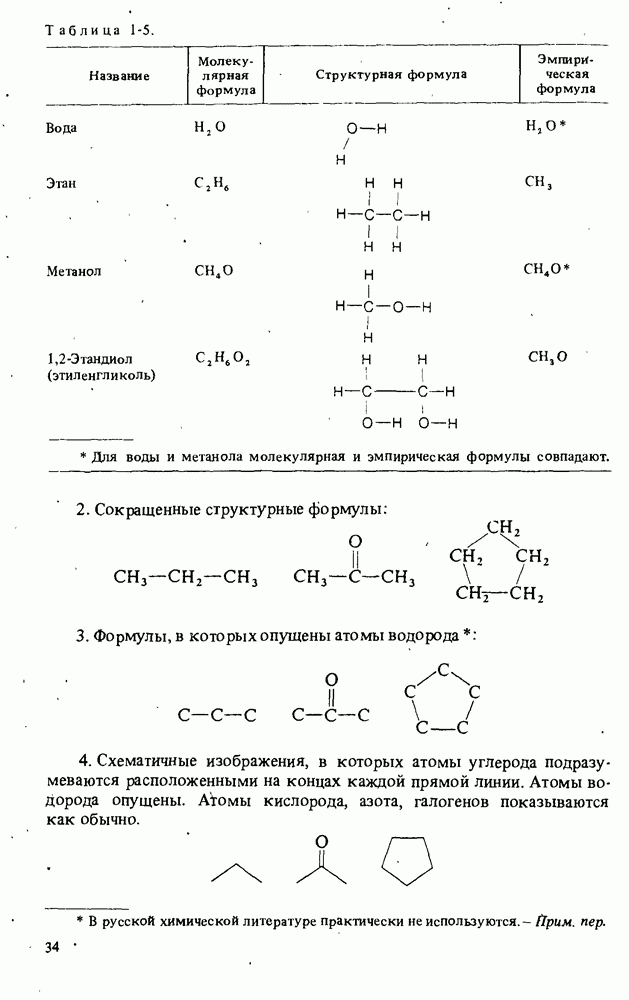
- ФОРМУЛЫ ЛЬЮИСА
- ФОРМАЛЬНЫЙ ЗАРЯД
- РЕЗОНАНС
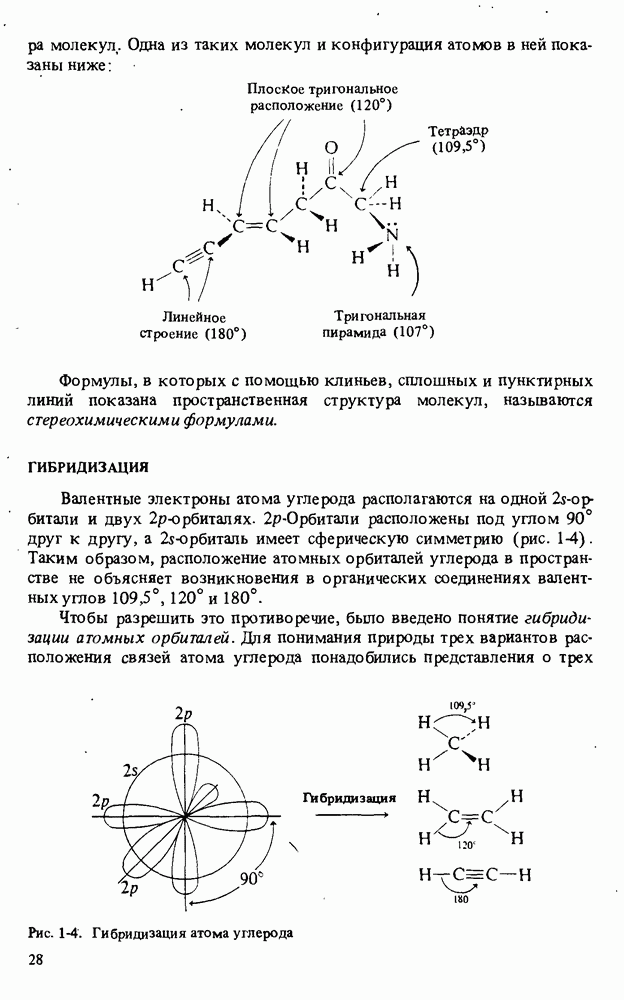
- ГЕОМЕТРИЯ МОЛЕКУЛ
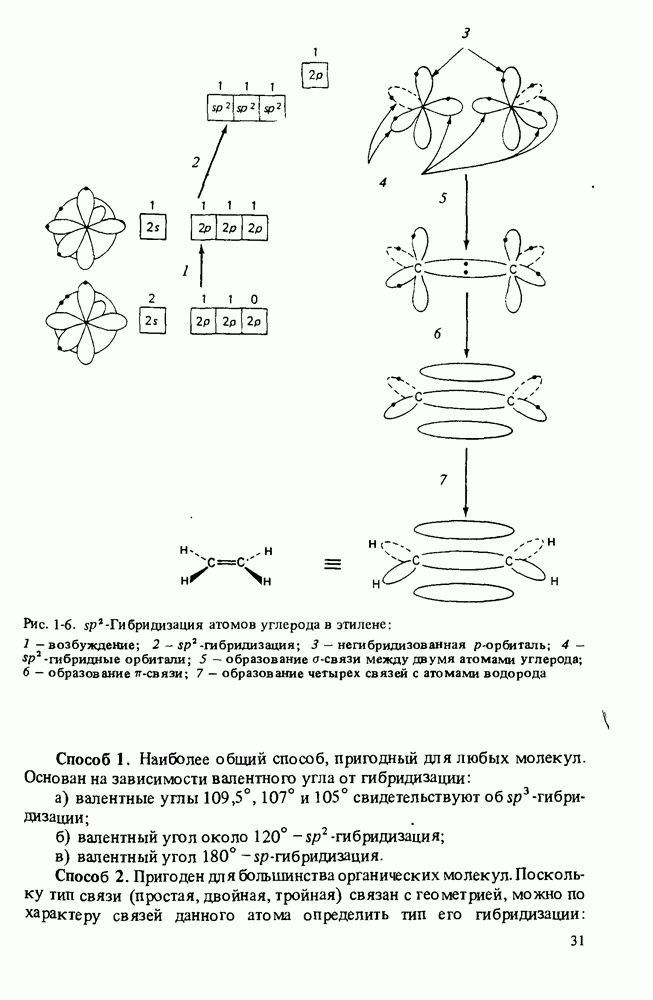
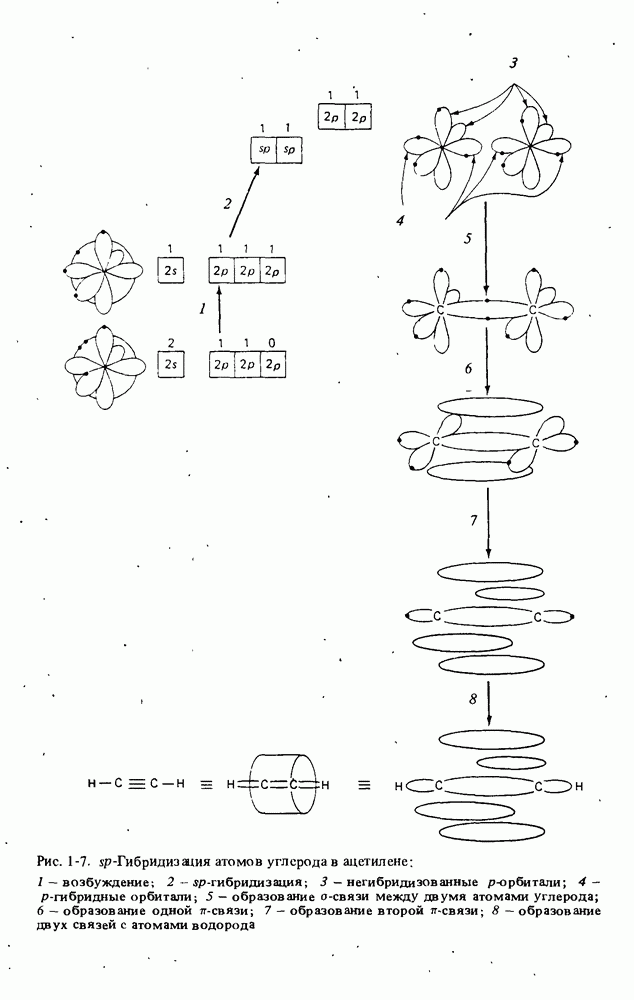
- ГИБРИДИЗАЦИЯ
- ХИМИЧЕСКИЕ ФОРМУЛЫ
- СОВЕТЫ ИЗУЧАЮЩЕМУ ОРГАНИЧЕСКУЮ ХИМИЮ
- СВОДКА ОСНОВНЫХ ПОЛОЖЕНИЙ ГЛ. 1
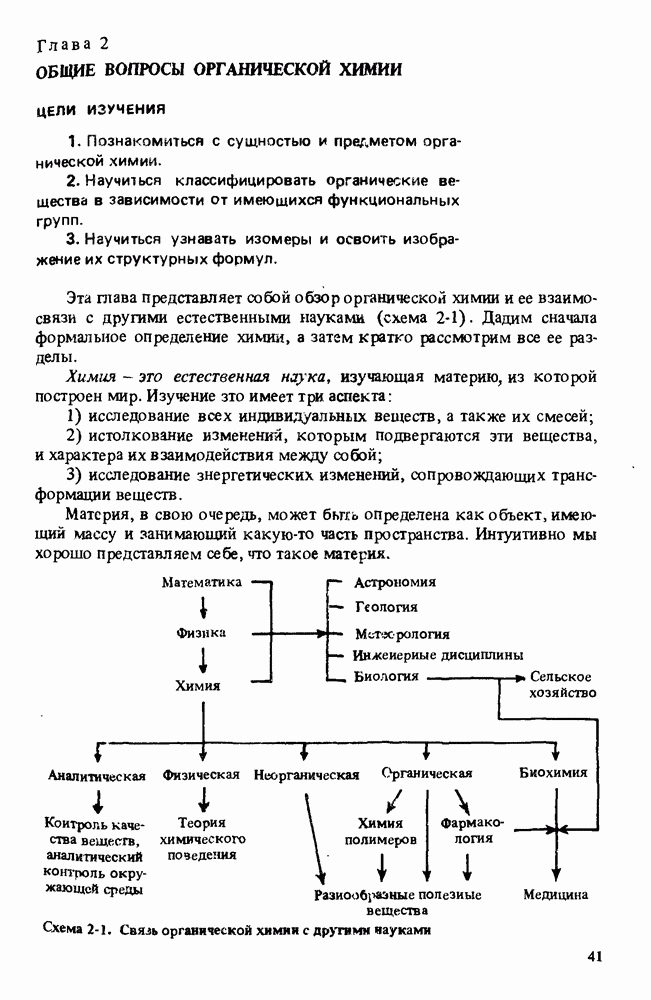
- Глава 2. ОБЩИЕ ВОПРОСЫ ОРГАНИЧЕСКОЙ ХИМИИ
- РАЗДЕЛЫ ХИМИИ
- СИНТЕТИЧЕСКАЯ ОРГАНИЧЕСКАЯ ХИМИЯ
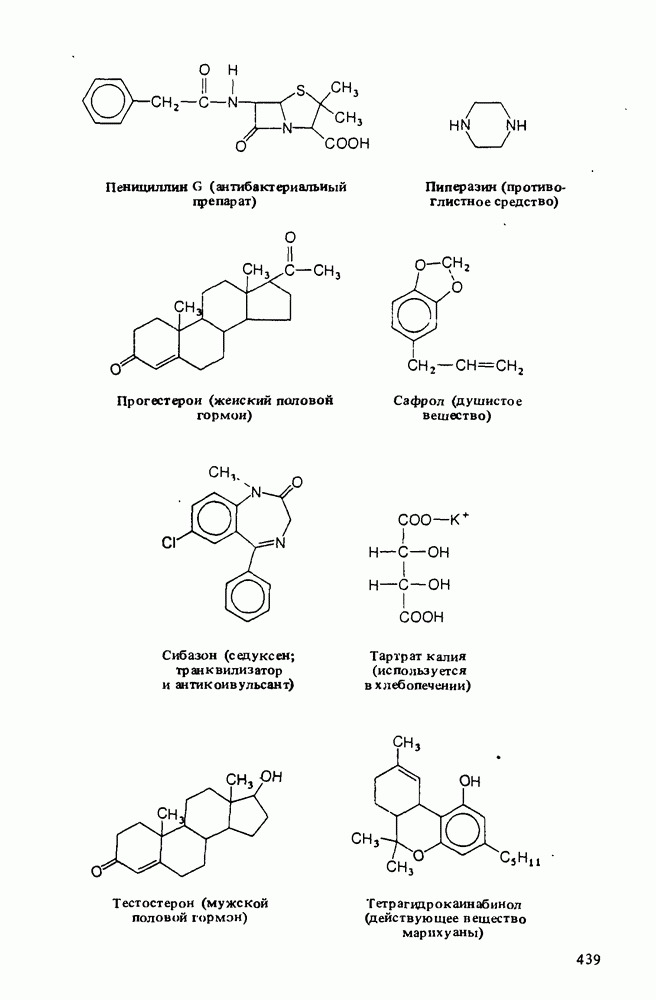
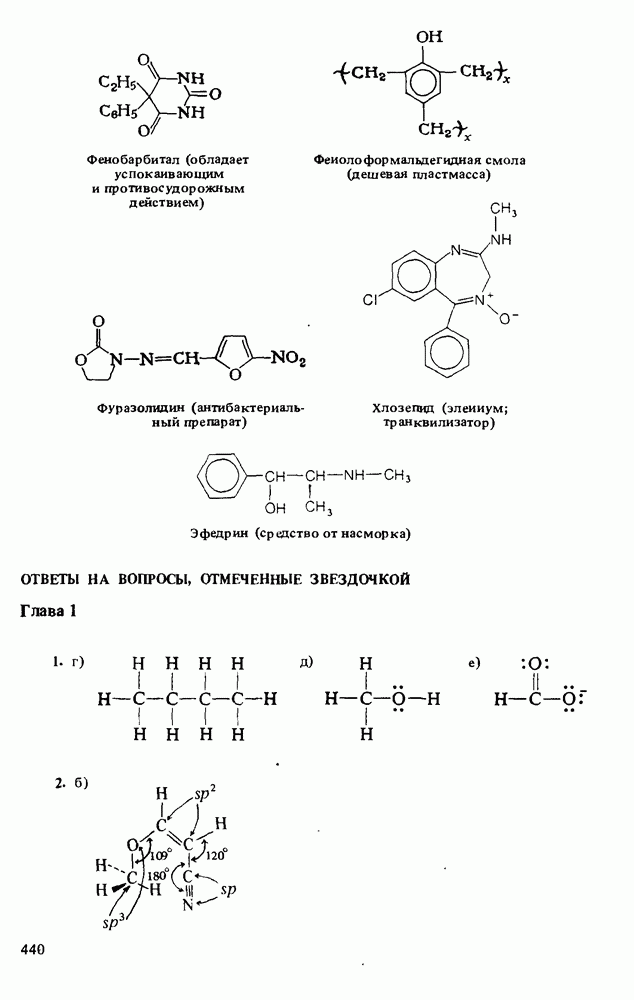
- ПОЛЕЗНЫЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
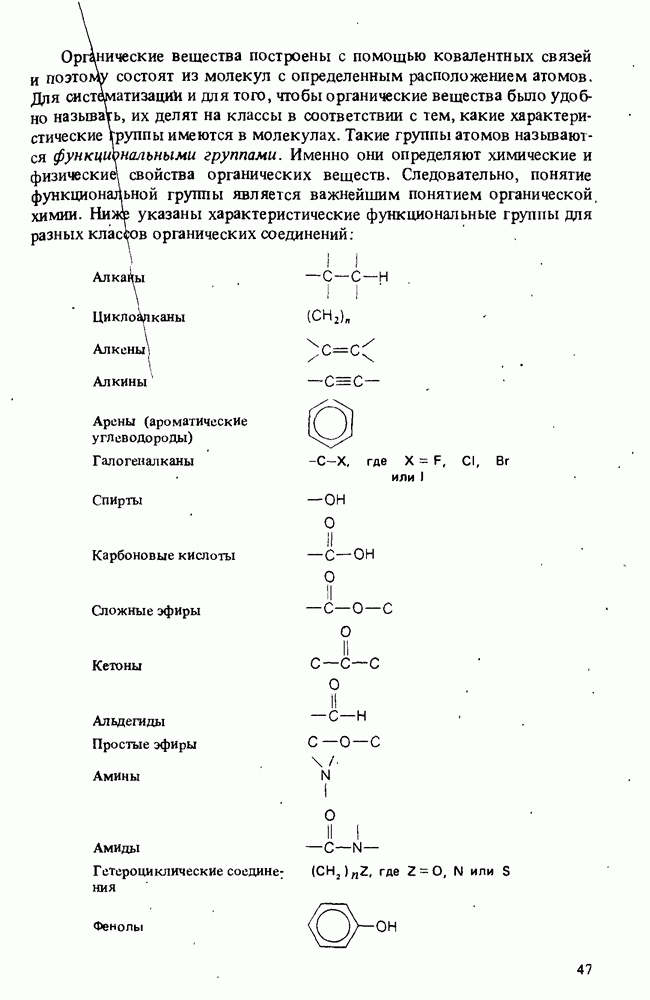
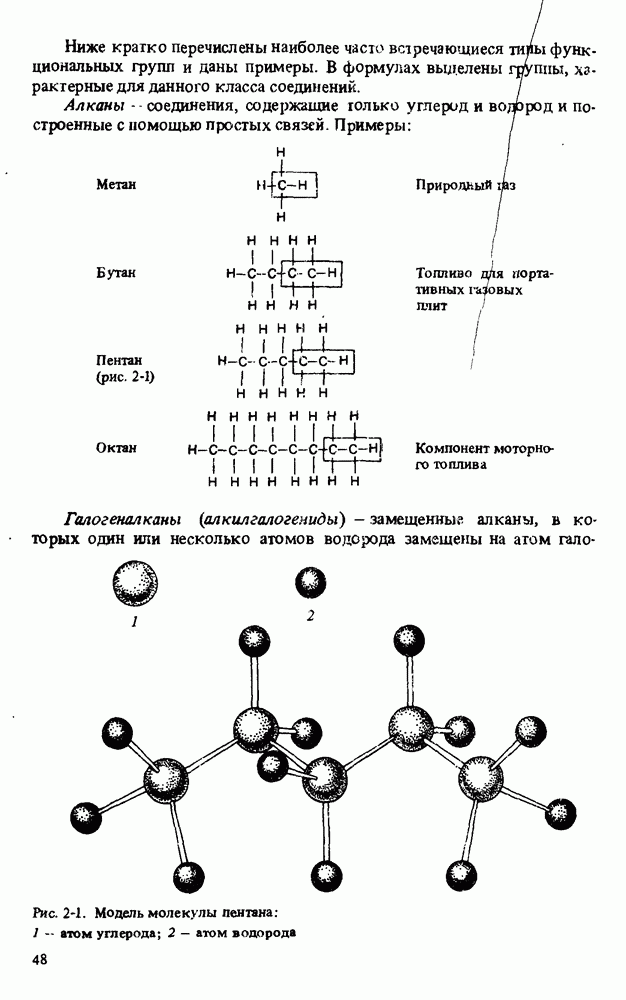
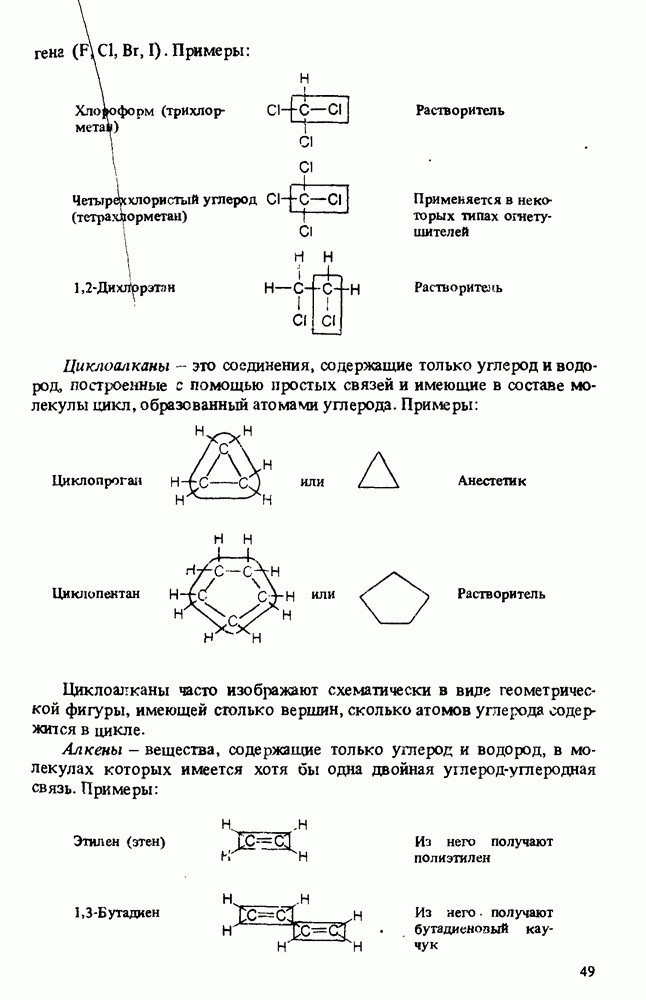
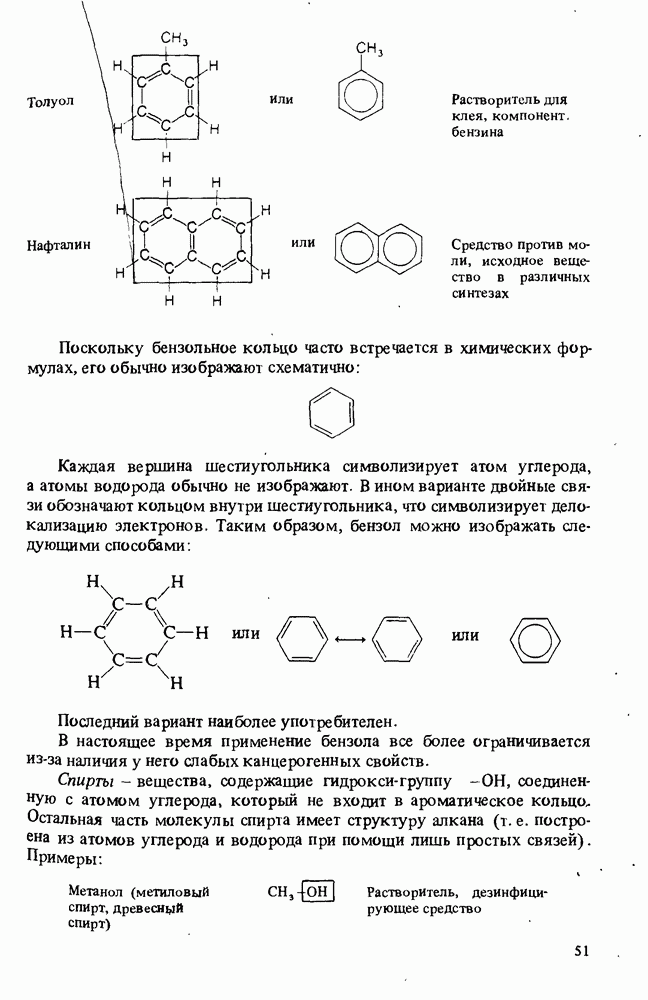
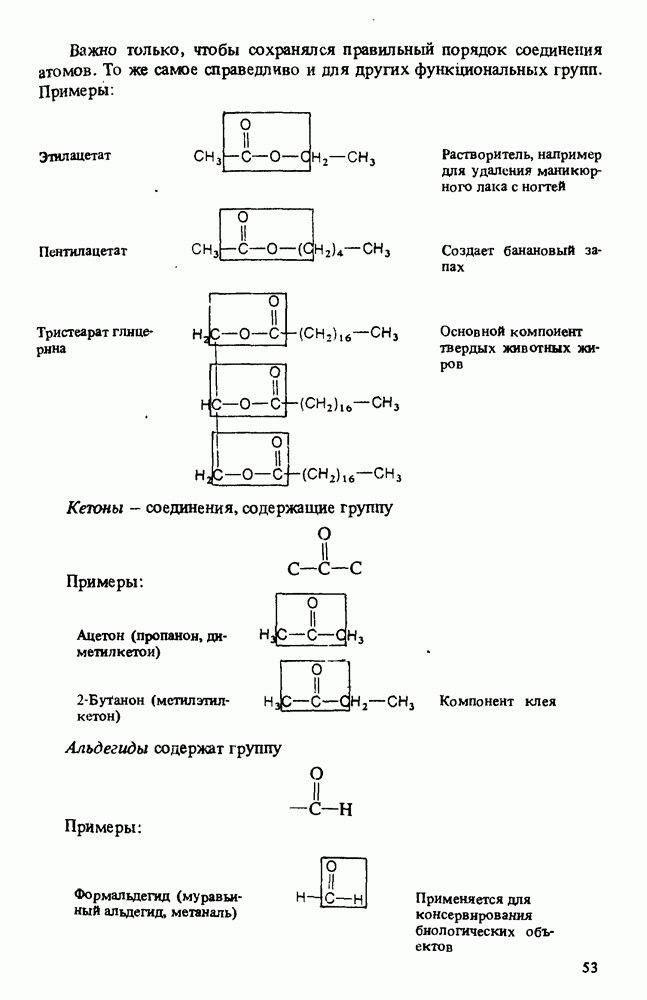
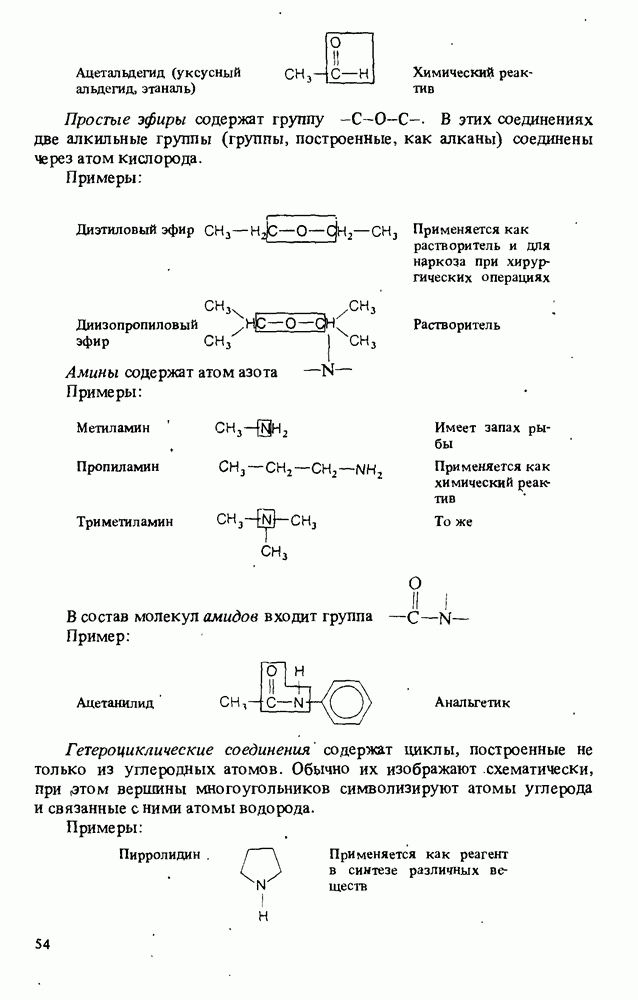
- КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
- ИЗОМЕРИЯ
- СВОДКА ОСНОВНЫХ ПОЛОЖЕНИЙ ГЛ. 2
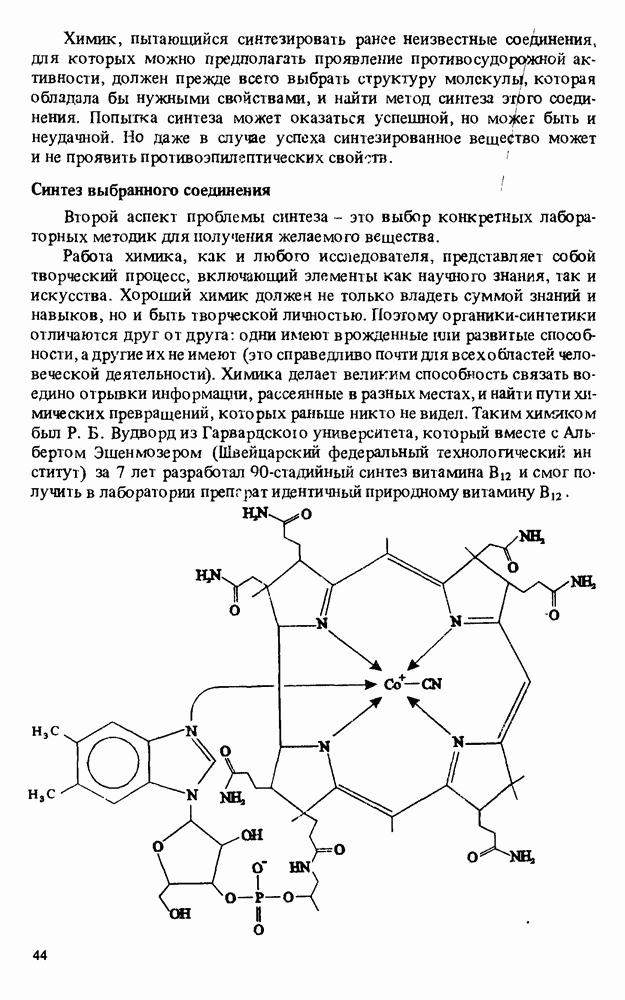
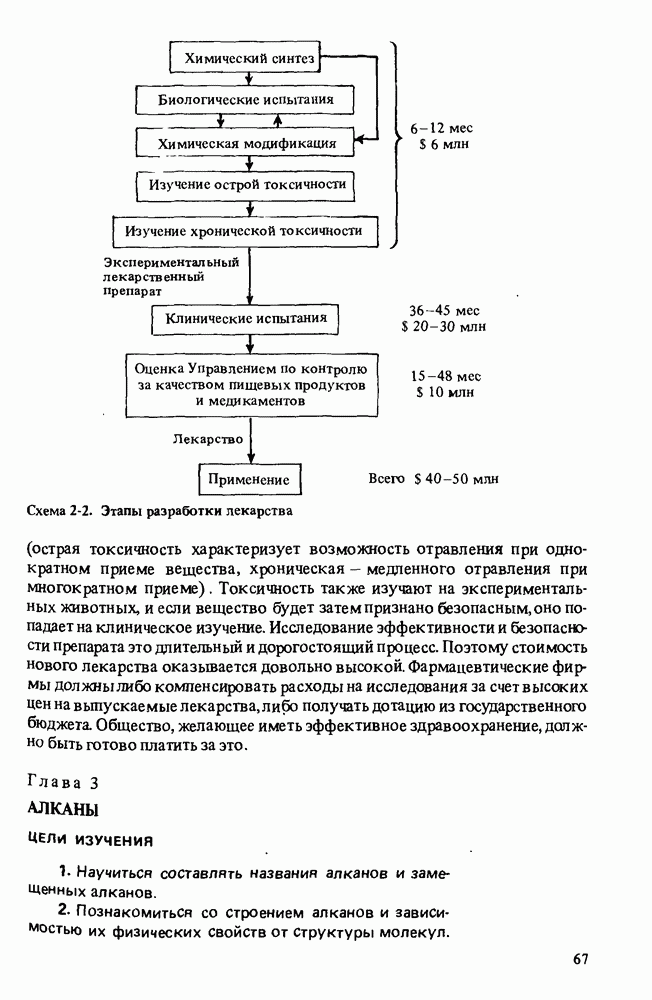
- Прикладная органическая химия: ХИМИЧЕСКИЙ СИНТЕЗ И МЕДИЦИНСКИЕ ИССЛЕДОВАНИЯ
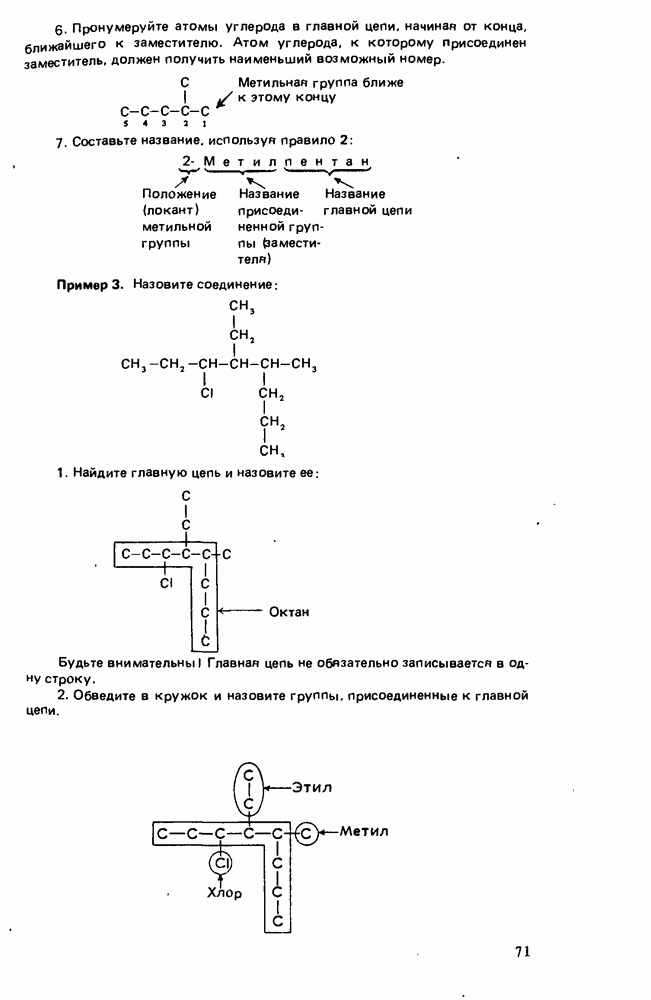
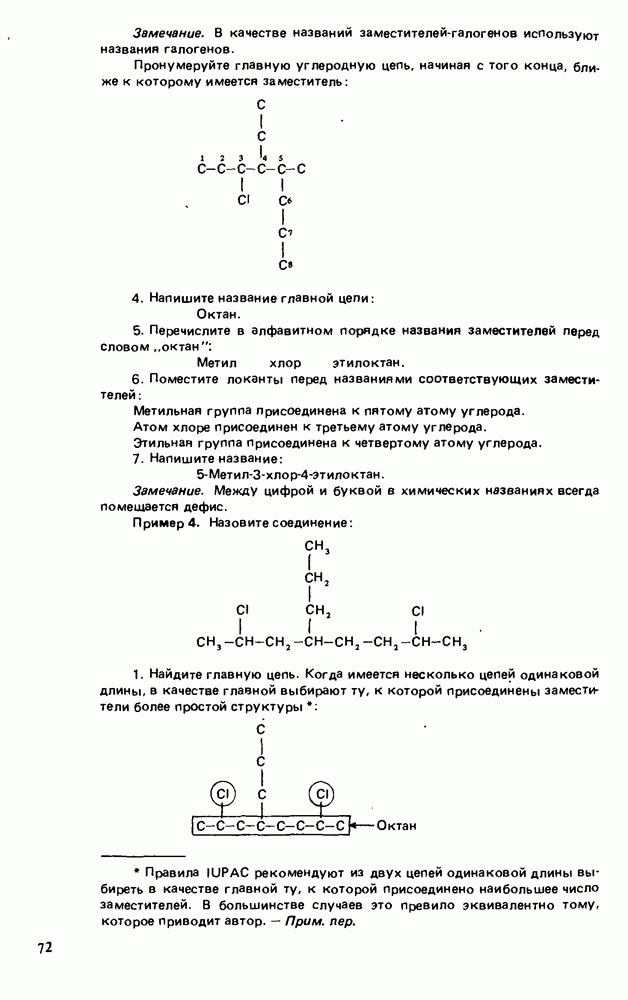
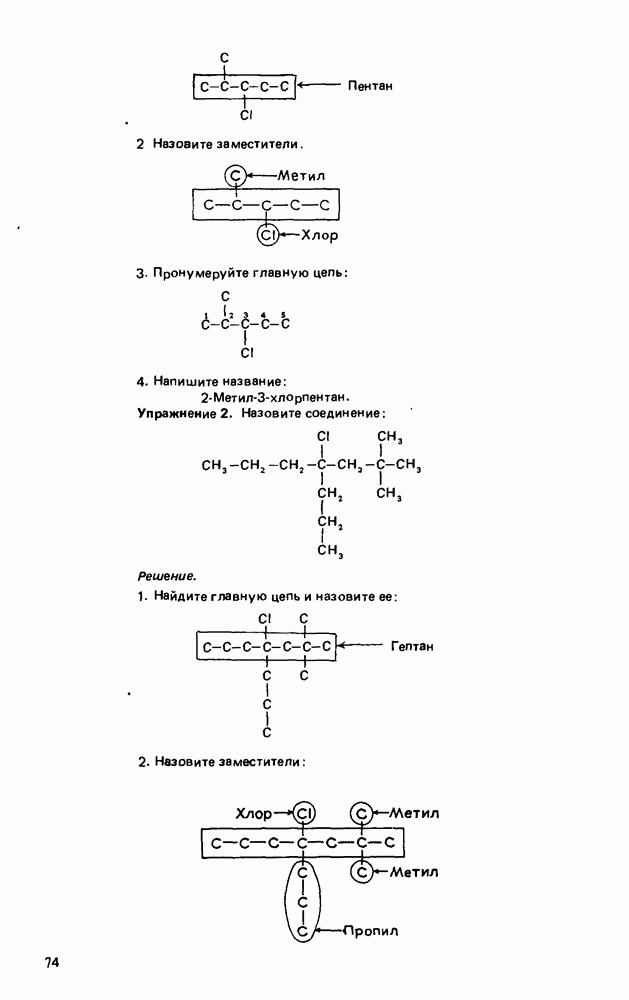
- Глава 3. АЛКАНЫ
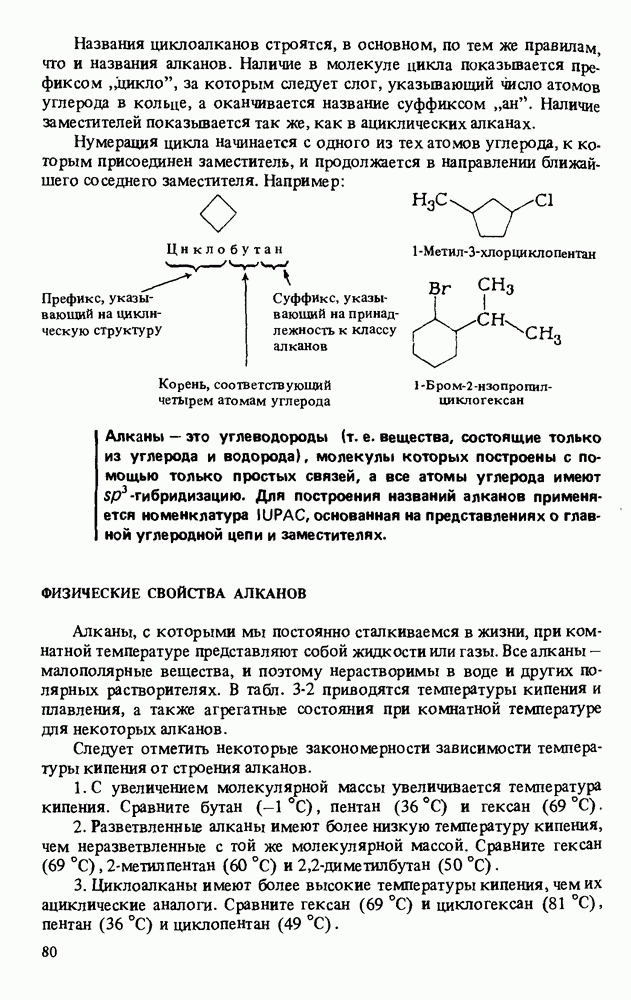
- ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
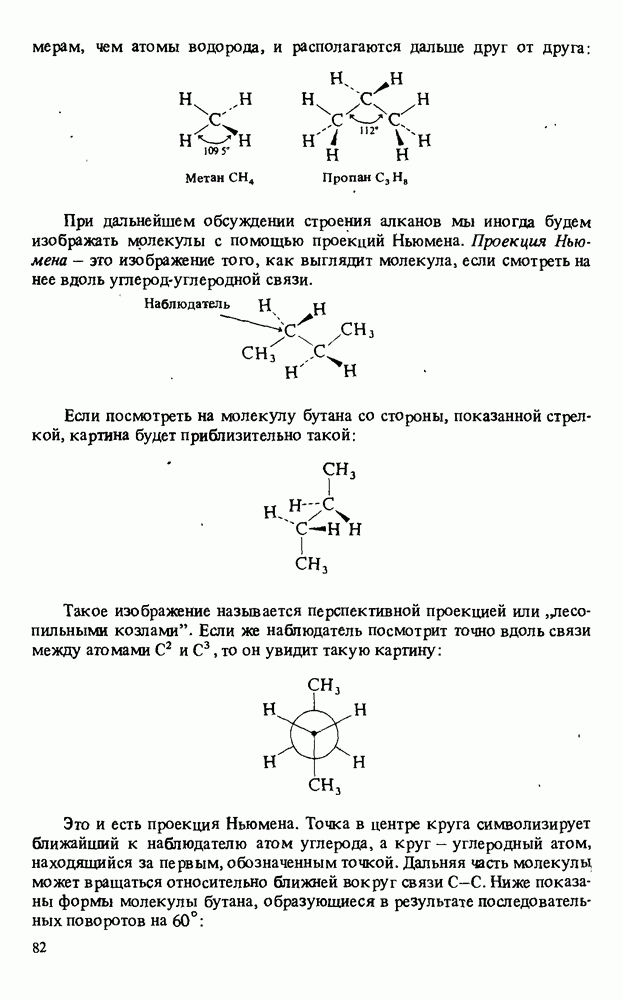
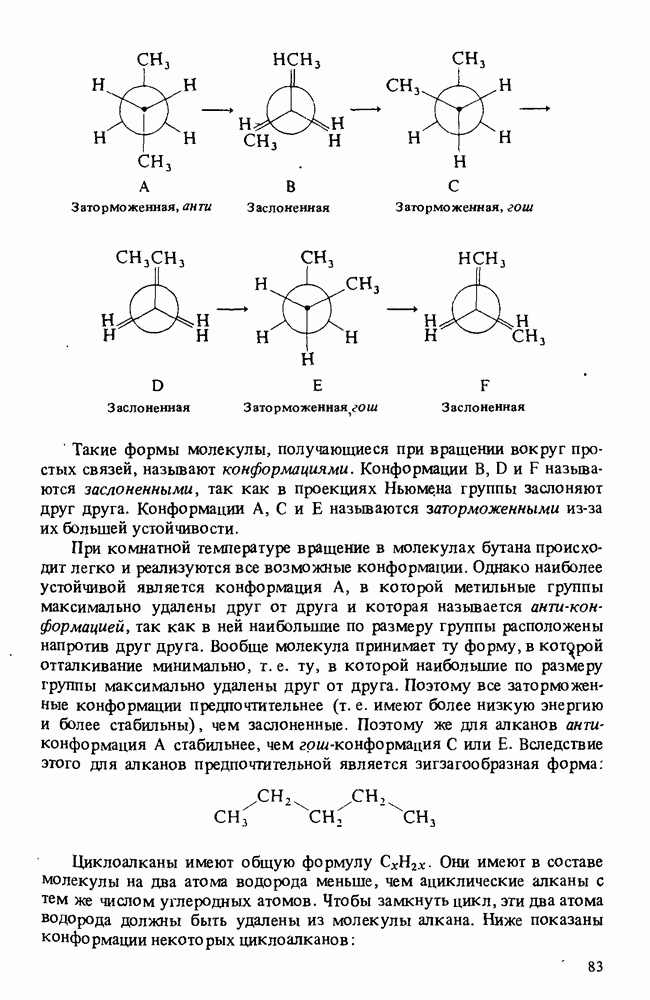
- СТРОЕНИЕ АЛКАНОВ
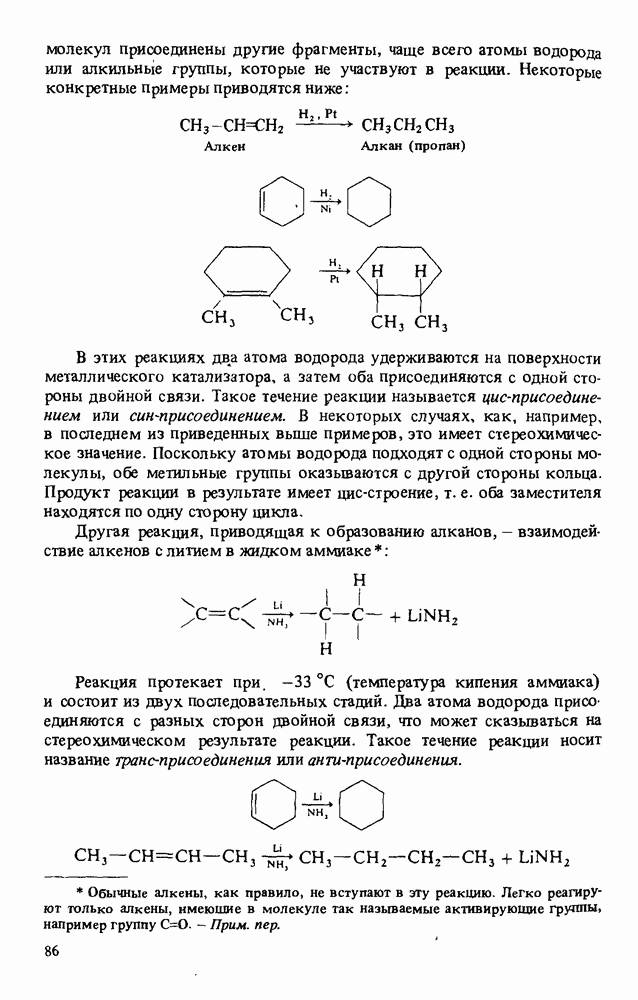
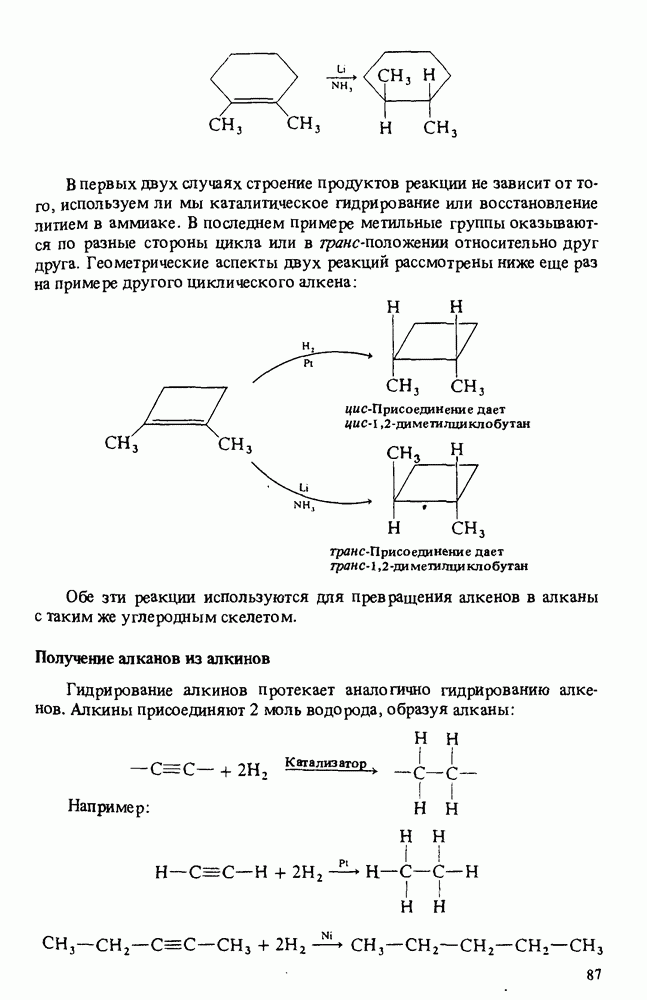
- ПОЛУЧЕНИЕ АЛКАНОВ
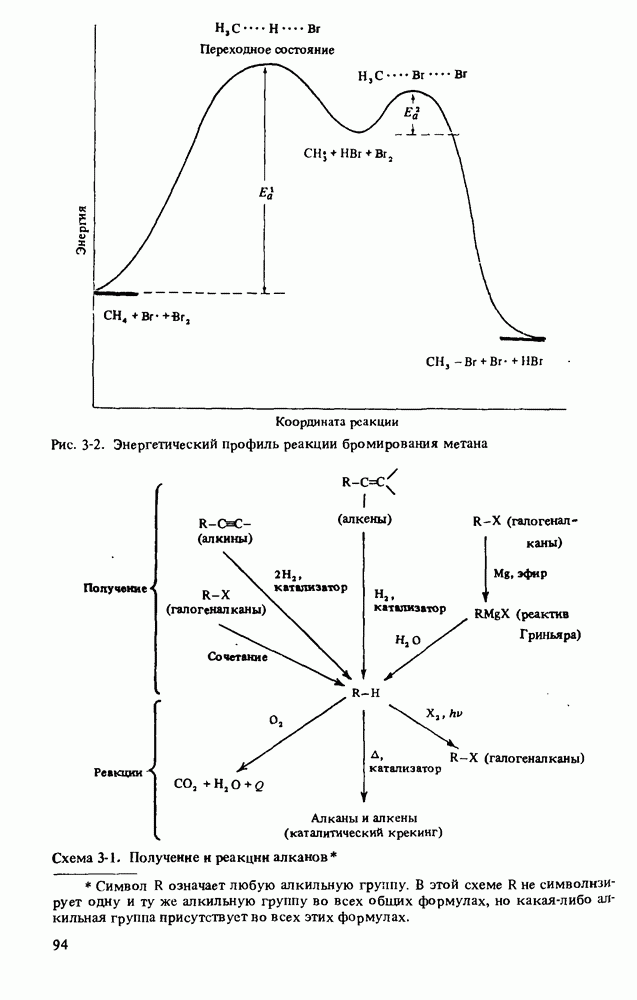
- РЕАКЦИИ АЛКАНОВ
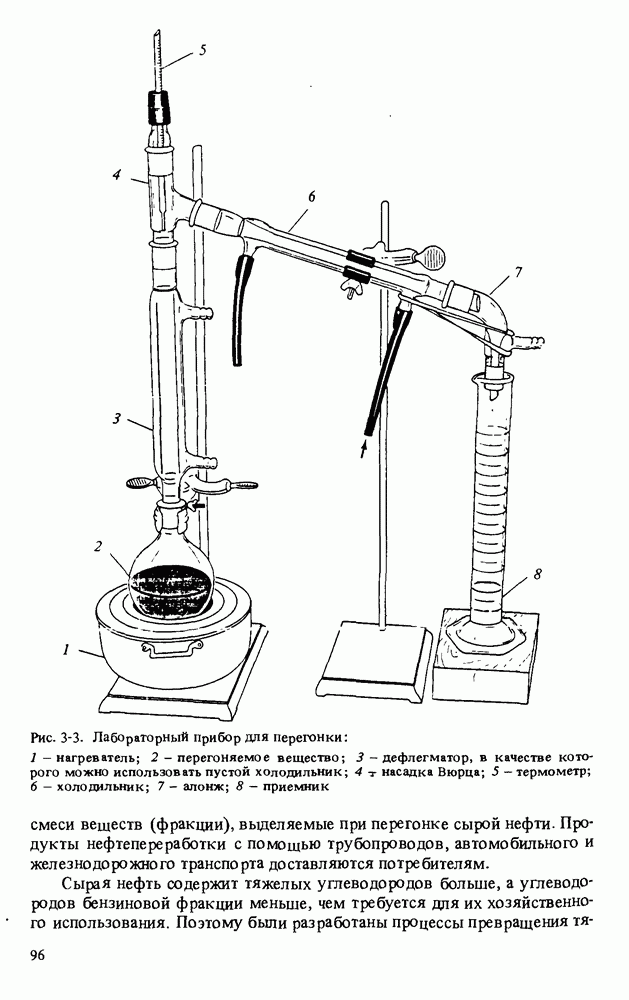
- ХИМИЯ НЕФТИ
- СОВЕТЫ ИЗУЧАЮЩЕМУ ОРГАНИЧЕСКУЮ ХИМИЮ. ИЗУЧЕНИЕ РЕАКЦИЙ
- Глава 4. СТЕРЕОХИМИЯ И ОПТИЧЕСКАЯ АКТИВНОСТЬ
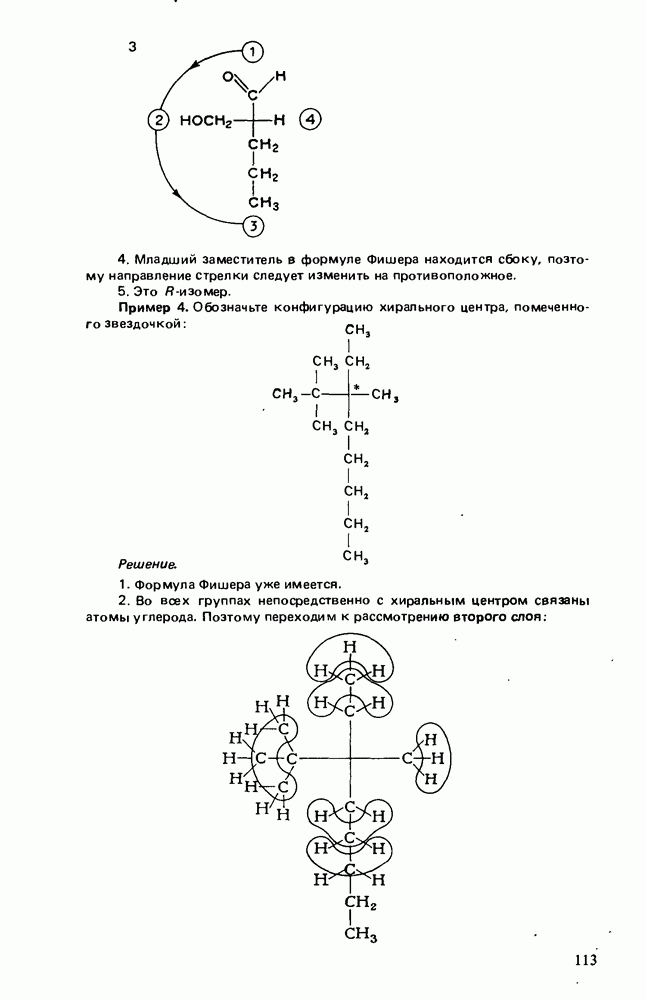
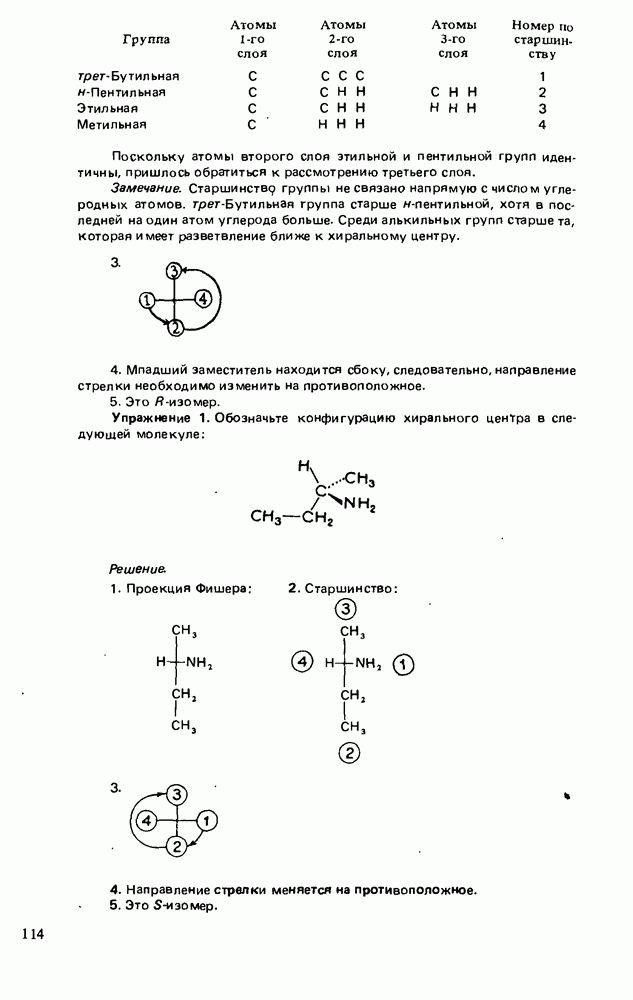
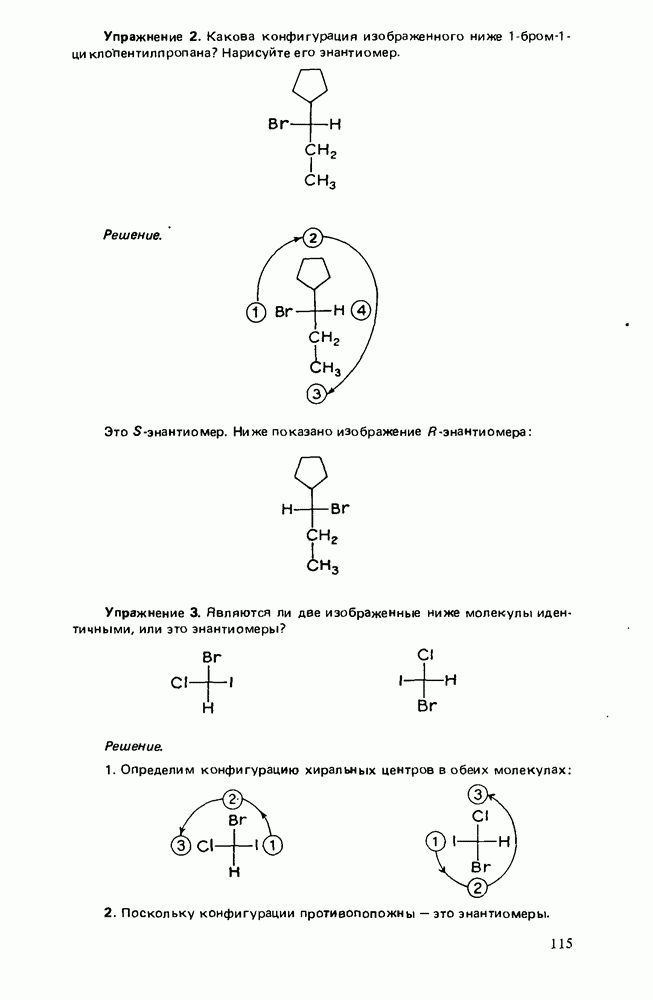
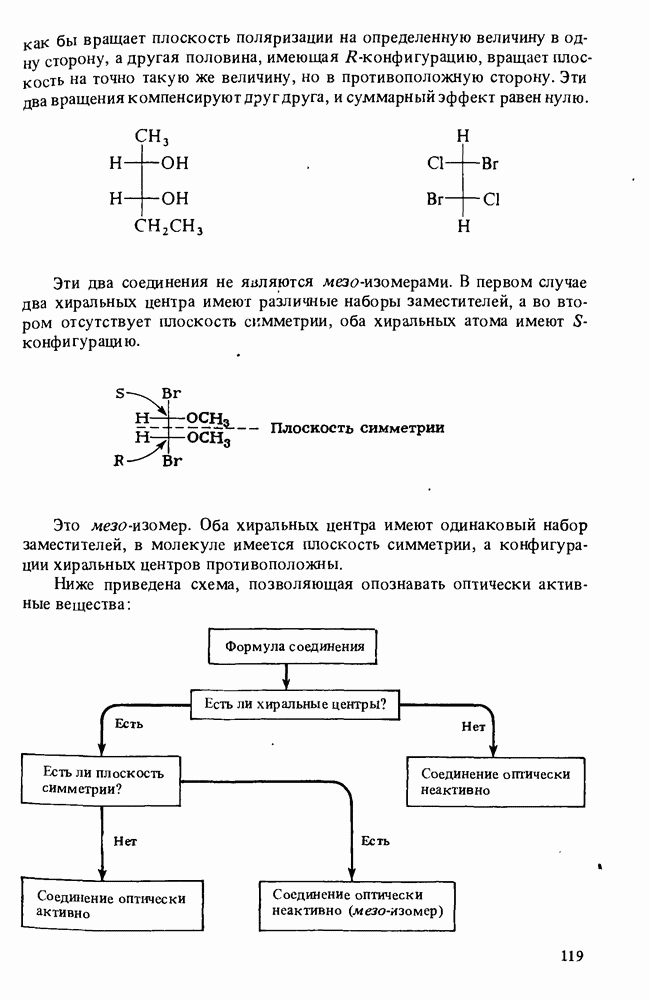
- СПОСОБЫ ИЗОБРАЖЕНИЯ ЭНАНТИОМЕРОВ
- ОБОЗНАЧЕНИЕ АБСОЛЮТНОЙ КОНФИГУРАЦИИ
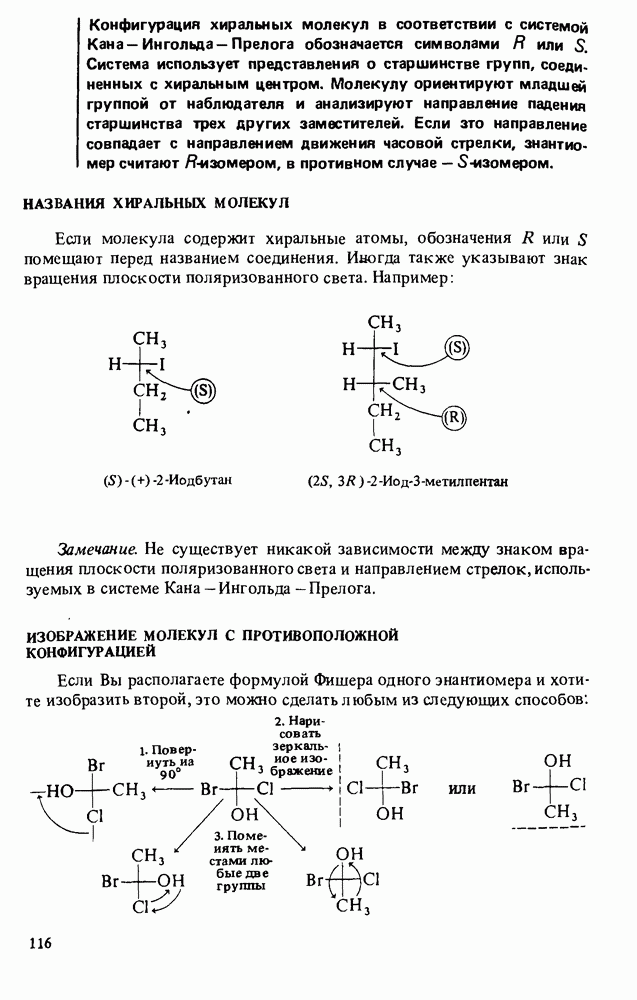
- НАЗВАНИЯ ХИРАЛЬНЫХ МОЛЕКУЛ
- ИЗОБРАЖЕНИЕ МОЛЕКУЛ С ПРОТИВОПОЛОЖНОЙ КОНФИГУРАЦИЕЙ
- D,L-НОМЕНКЛАТУРА ЭНАНТИОМЕРОВ
- ТЕРМИНОЛОГИЯ, ПРИМЕНЯЕМАЯ В СТЕРЕОХИМИИ
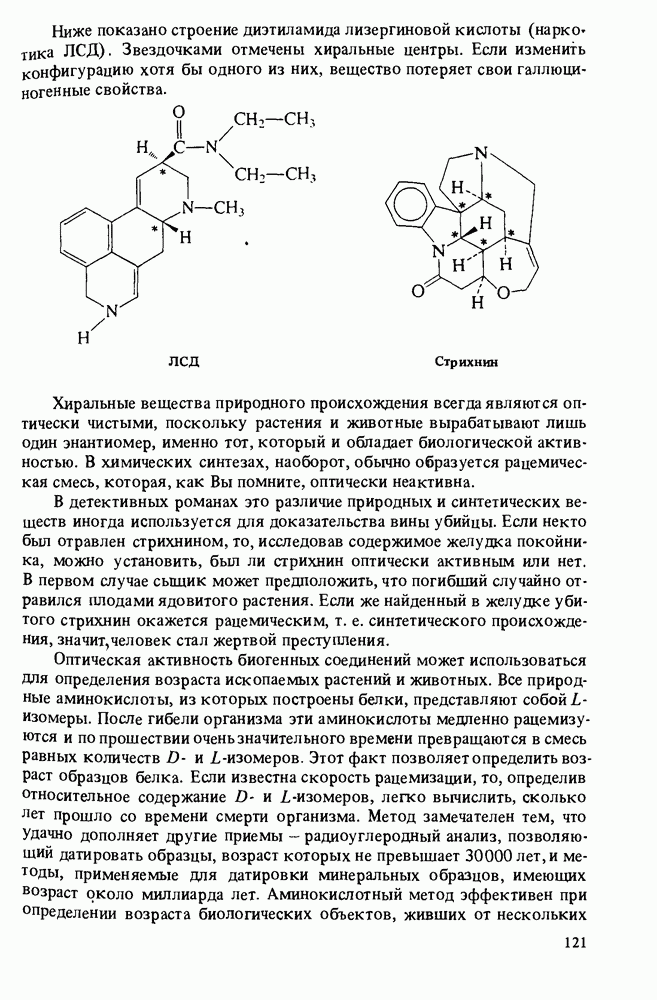
- ЗНАЧЕНИЕ ОПТИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ
- Глава 5. ОРГАНИЧЕСКИЕ ГАЛОГЕНСОДЕРЖАЩИЕ СОЕДИНЕНИЯ
- ПОЛУЧЕНИЕ ГАЛОГЕНАЛКАНОВ
- РЕАКЦИИ ГАЛОГЕНАЛКАНОВ
- ПРАКТИЧЕСКИ ВАЖНЫЕ ГАЛОГЕНАЛКАНЫ
- Прикладная органическая химия: ОРГАНИЧЕСКИЕ ПЕСТИЦИДЫ
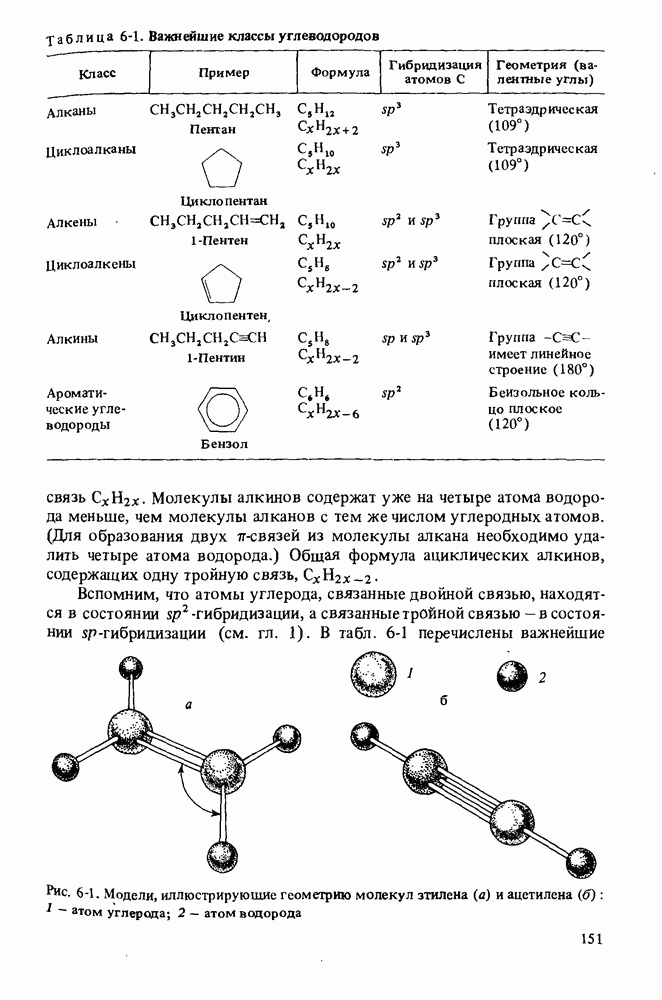
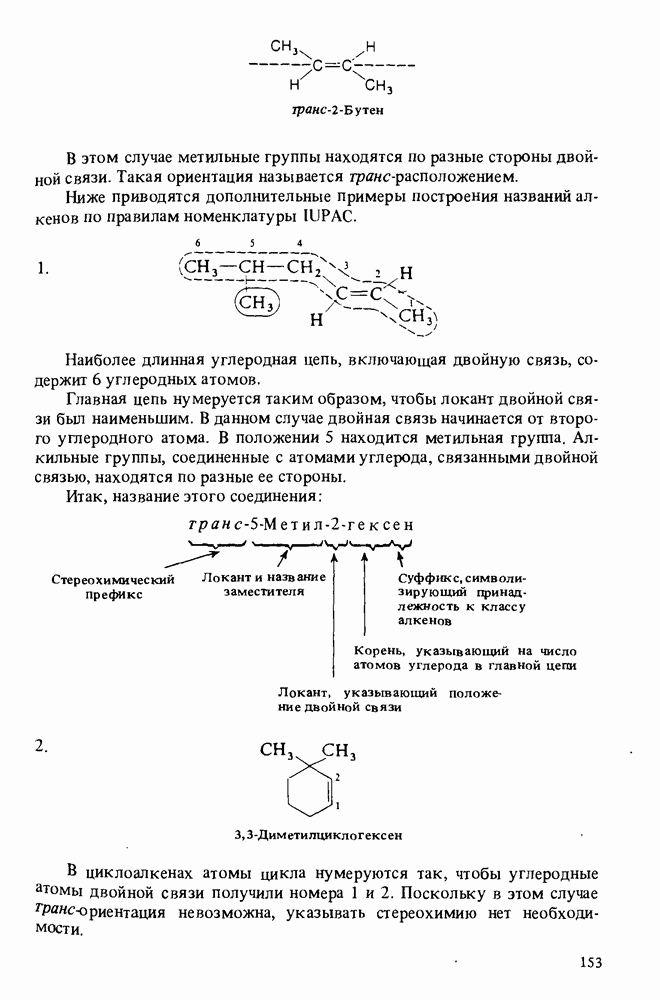
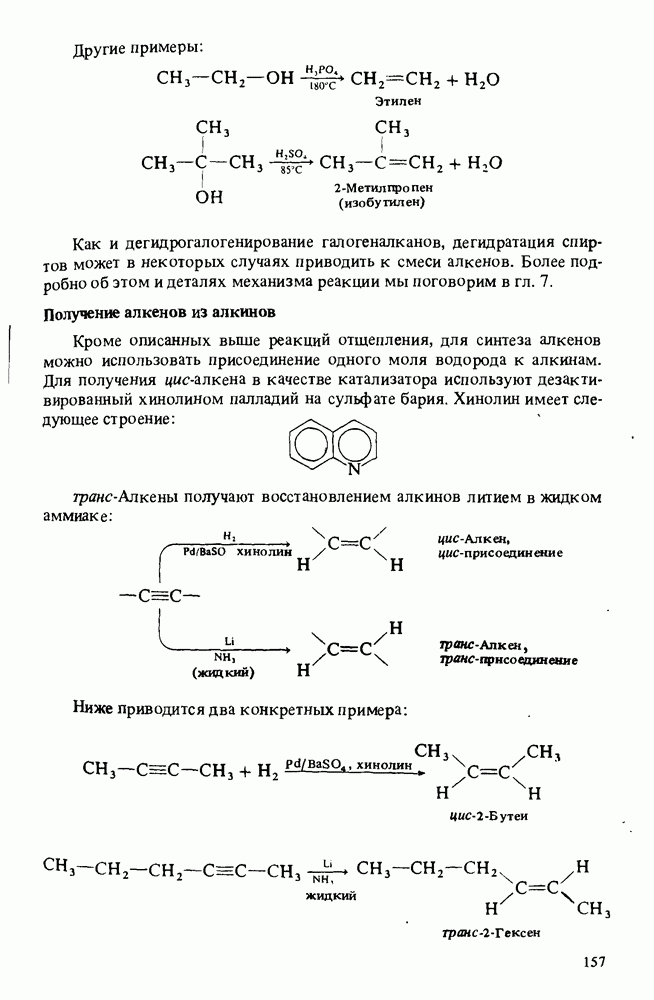
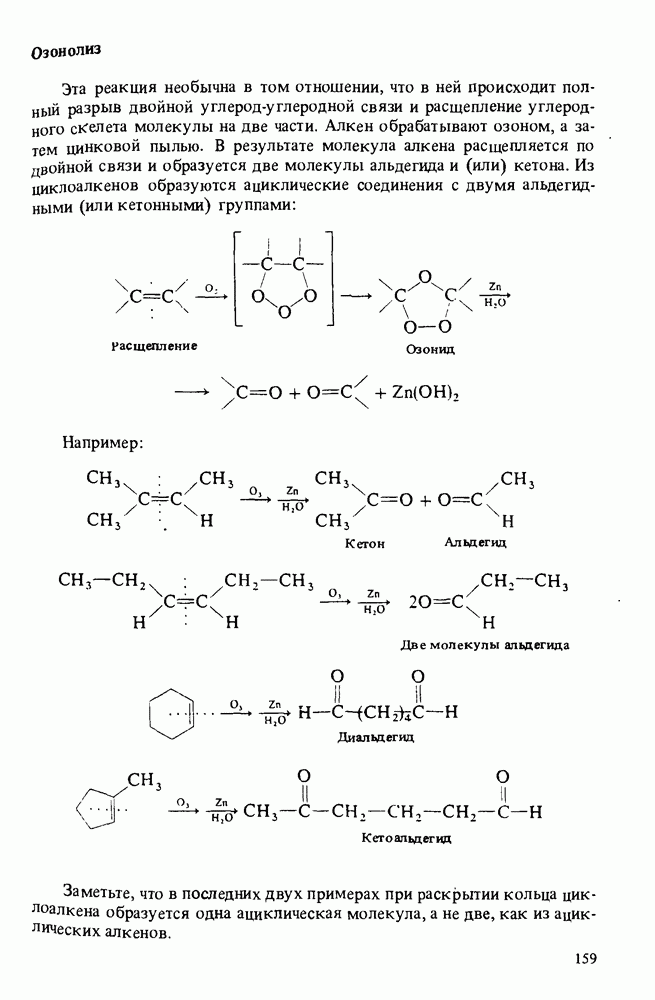
- Глава 6. НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
- НОМЕНКЛАТУРА АЛКЕНОВ
- ПОЛУЧЕНИЕ АЛКЕНОВ
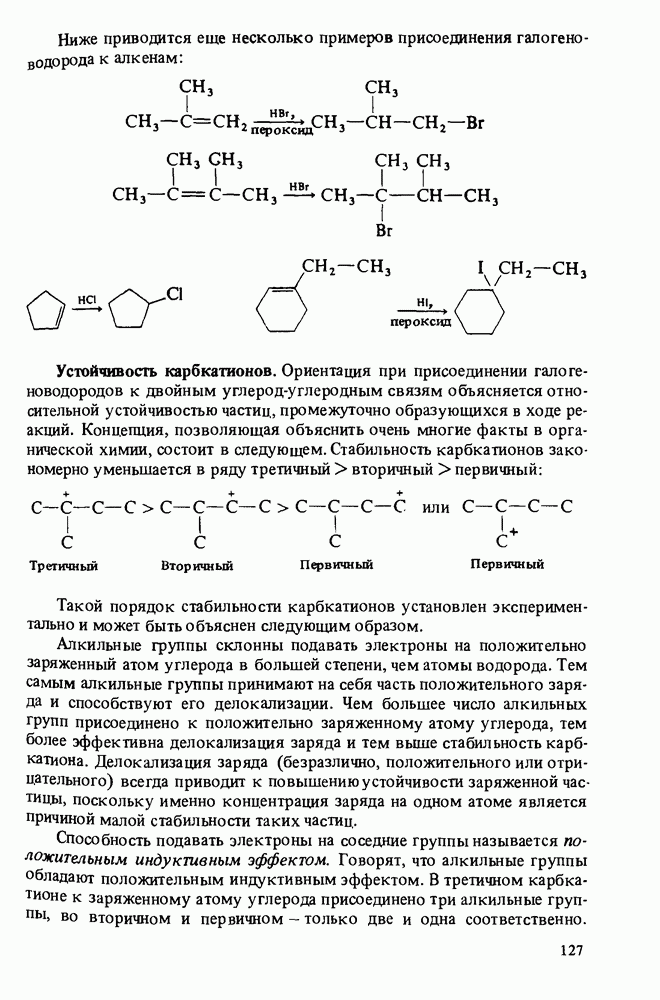
- ОСНОВНЫЕ РЕАКЦИИ АЛКЕНОВ
- ПОЛИМЕРЫ
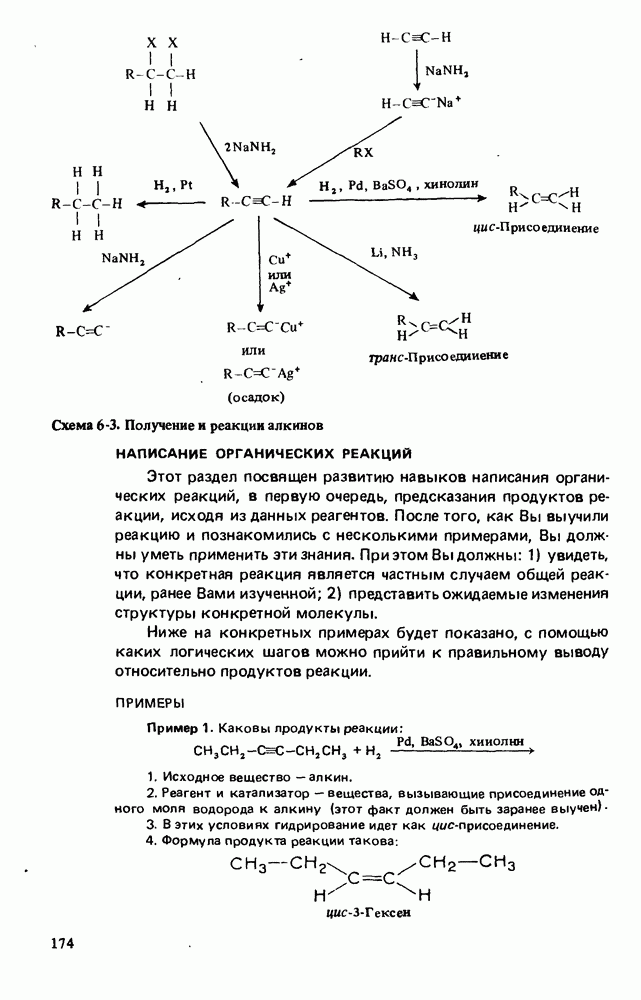
- НОМЕНКЛАТУРА АЛКИНОВ
- ПОЛУЧЕНИЕ АЛКИНОВ
- РЕАКЦИИ АЛКИНОВ
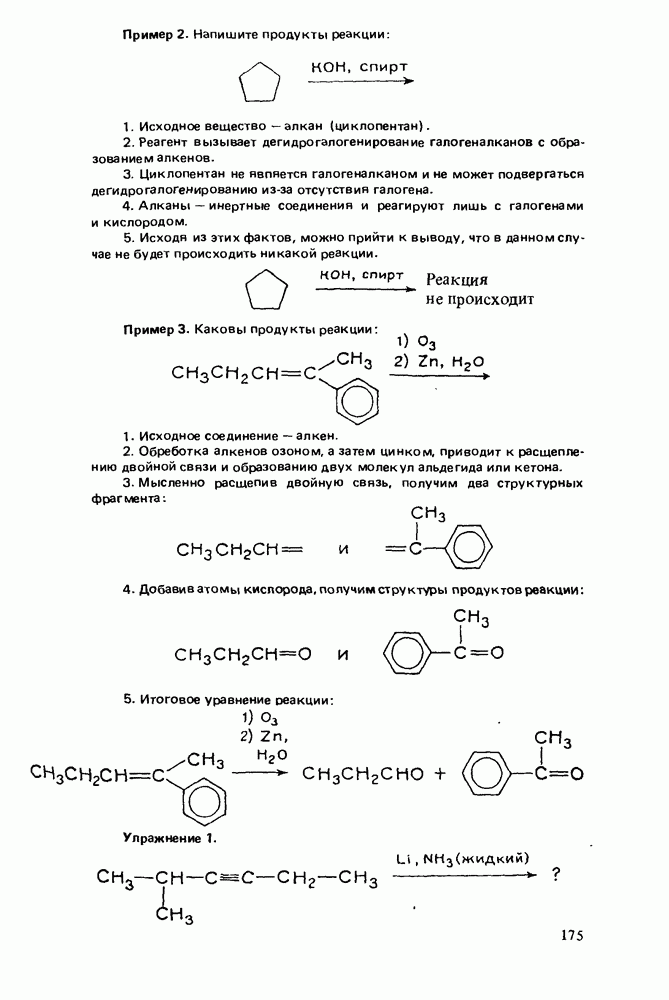
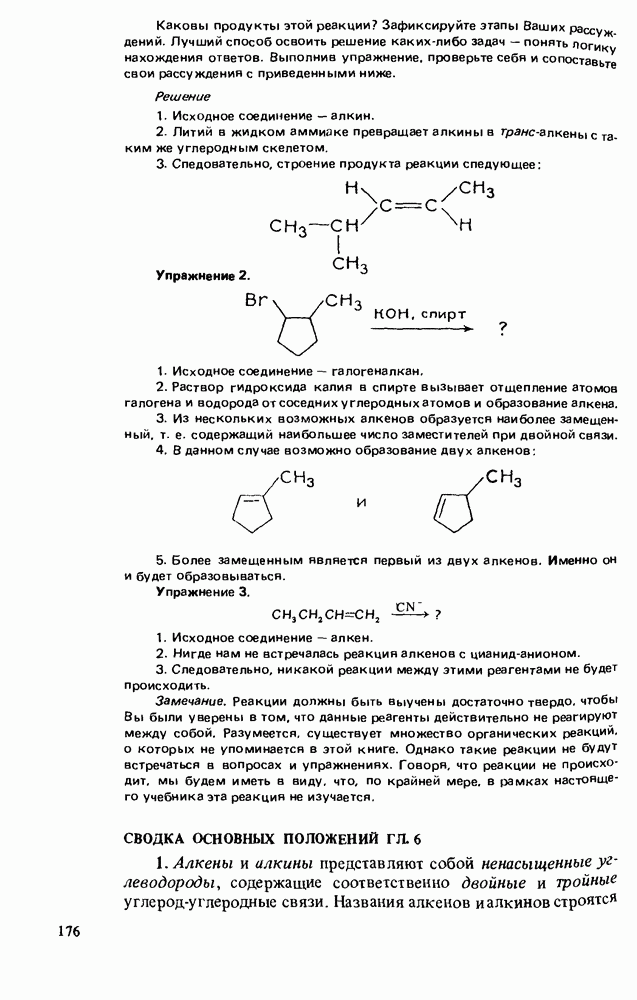
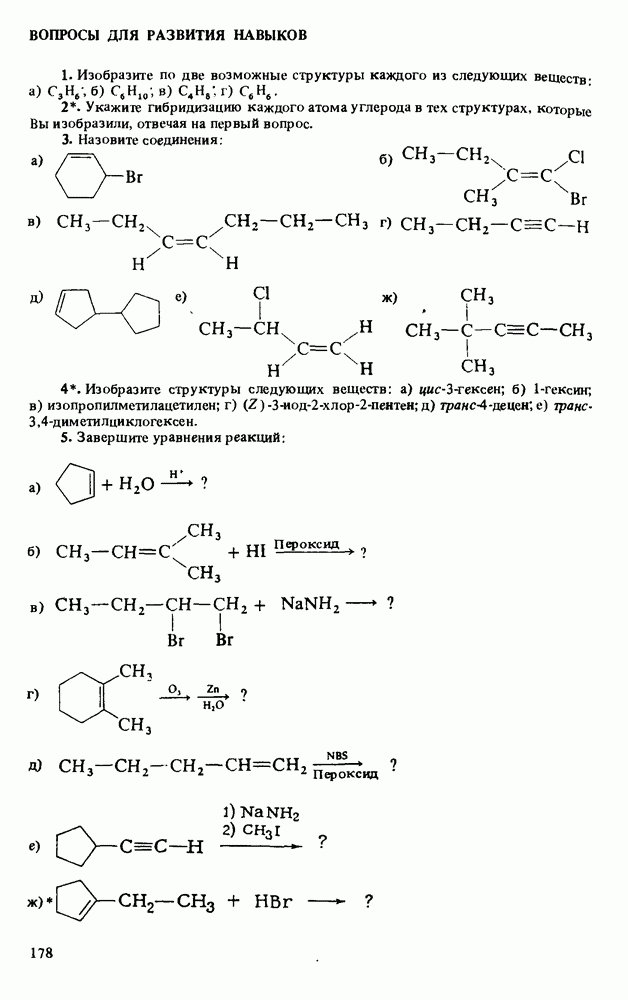
- НАПИСАНИЕ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- Глава 7. СПИРТЫ И ПРОСТЫЕ ЭФИРЫ
- НОМЕНКЛАТУРА СПИРТОВ
- НЕКОТОРЫЕ ВАЖНЫЕ ВЕЩЕСТВА, СОДЕРЖАЩИЕ СПИРТОВУЮ ГРУППУ
- ЭТИЛОВЫЙ СПИРТ. ПРОИЗВОДСТВО СПИРТНЫХ НАПИТКОВ
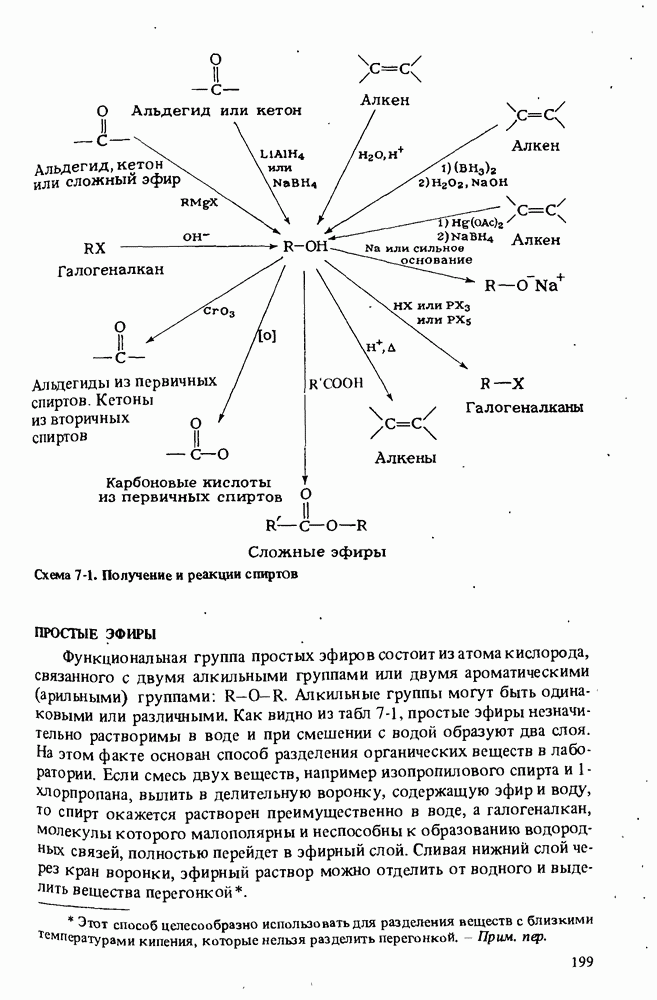
- ПОЛУЧЕНИЕ СПИРТОВ
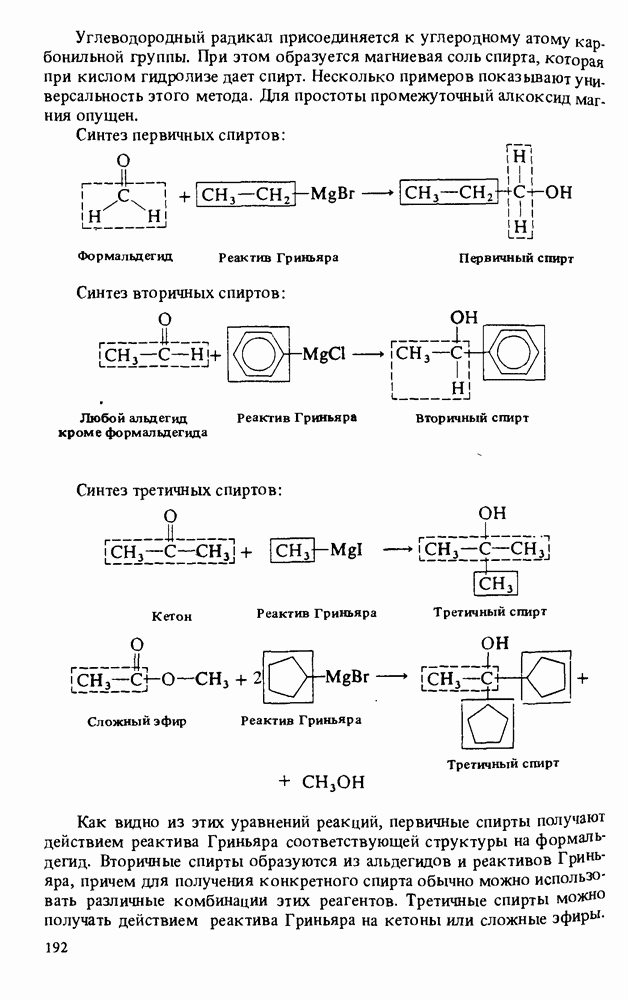
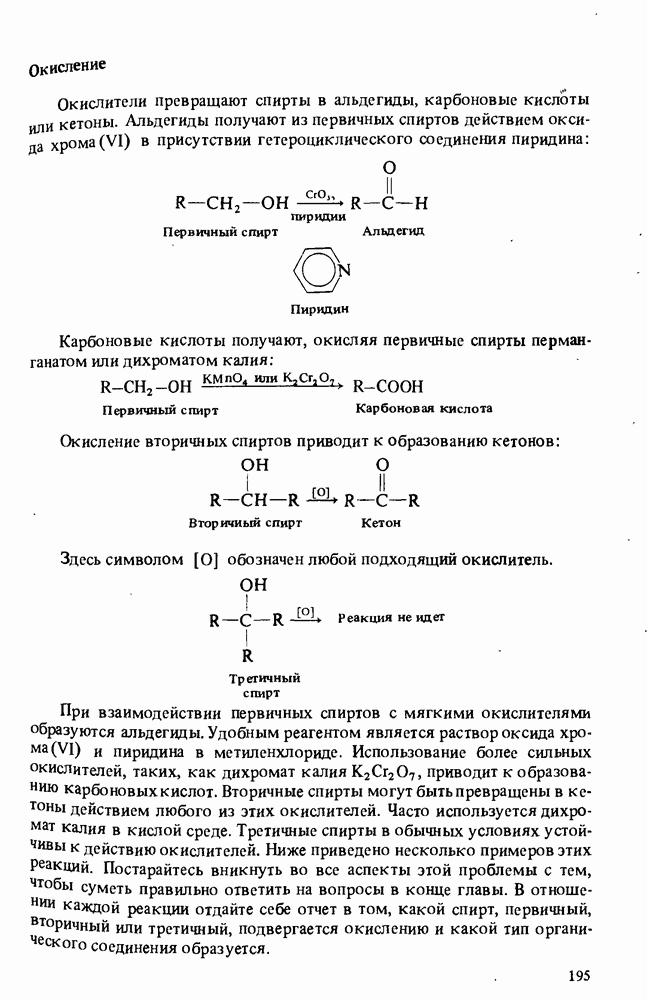
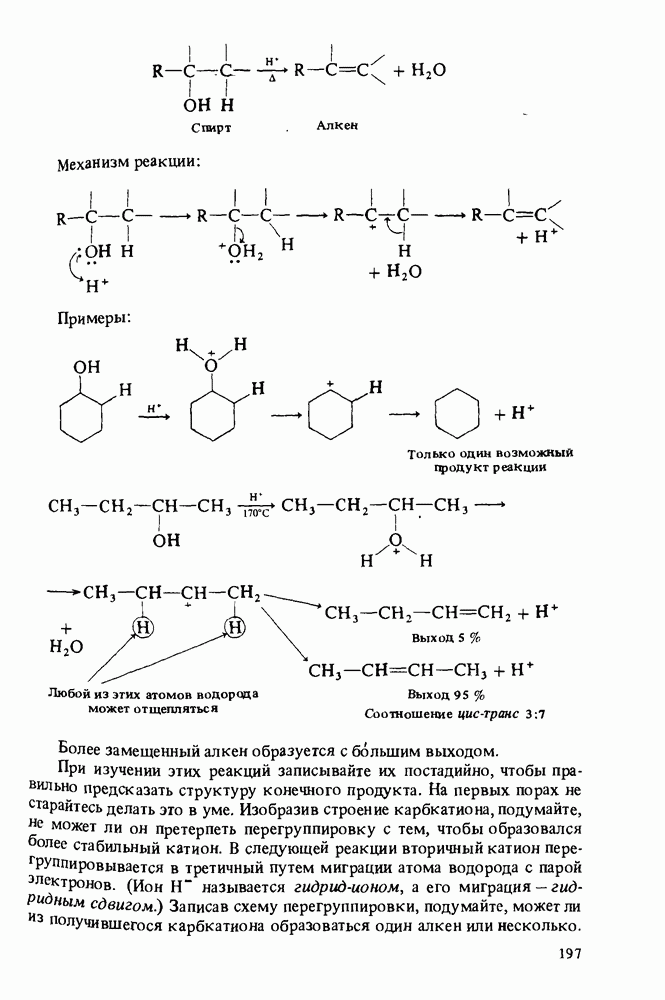
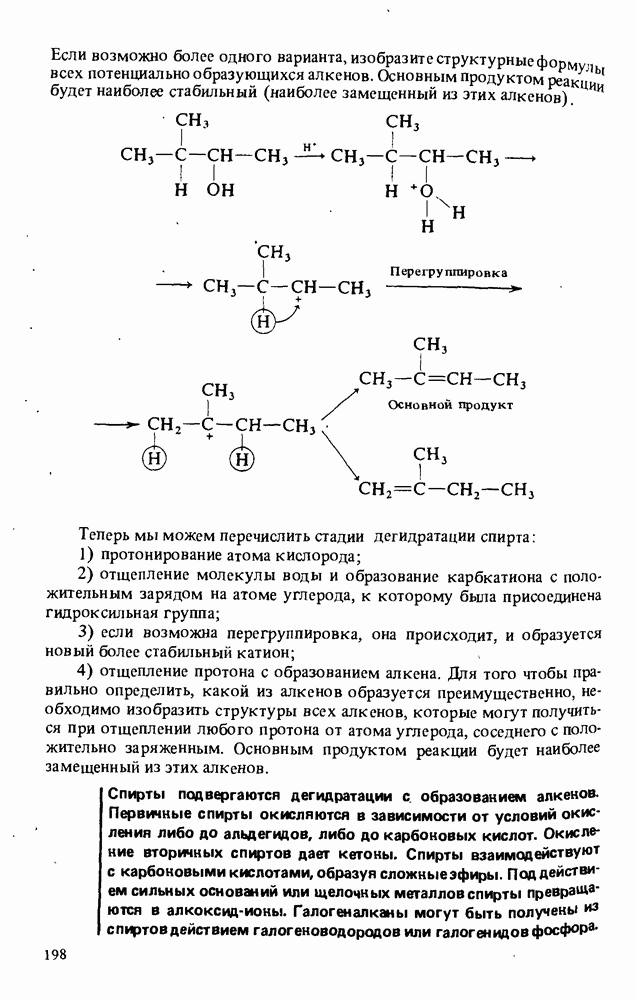
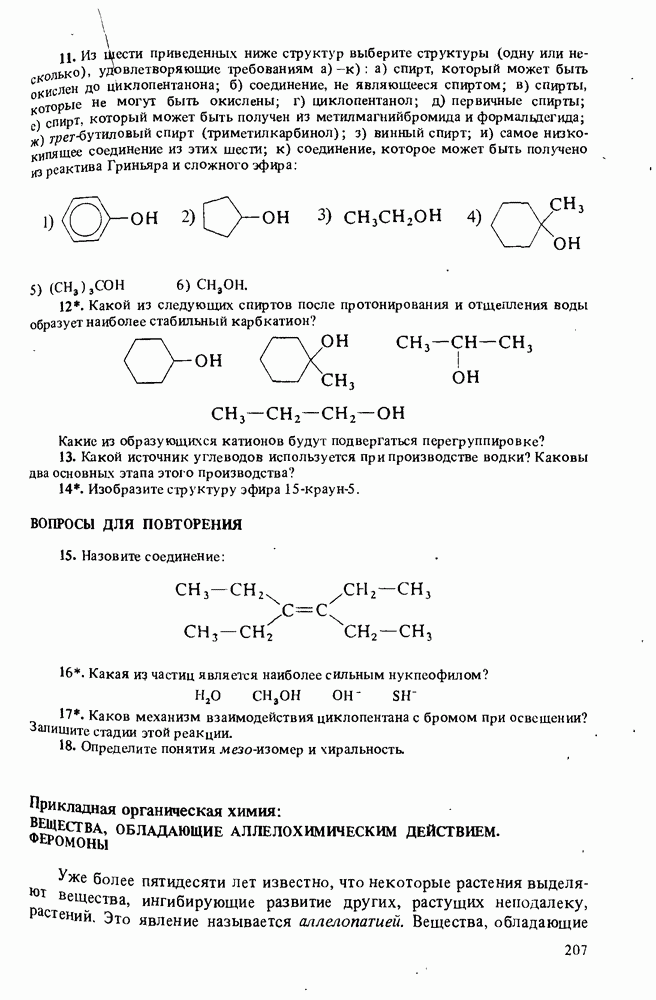
- РЕАКЦИИ СПИРТОВ
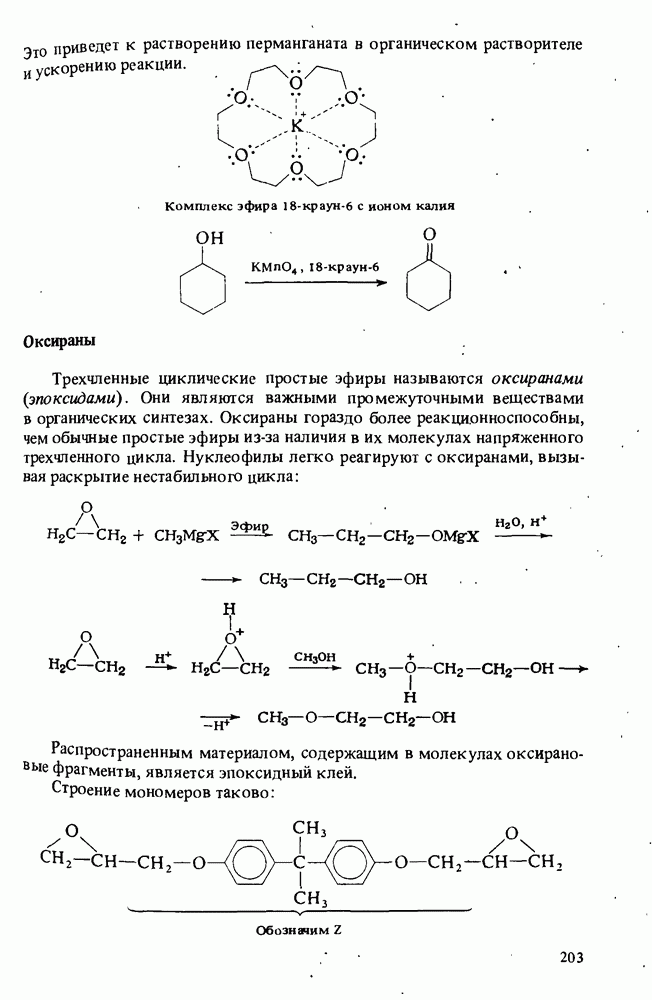
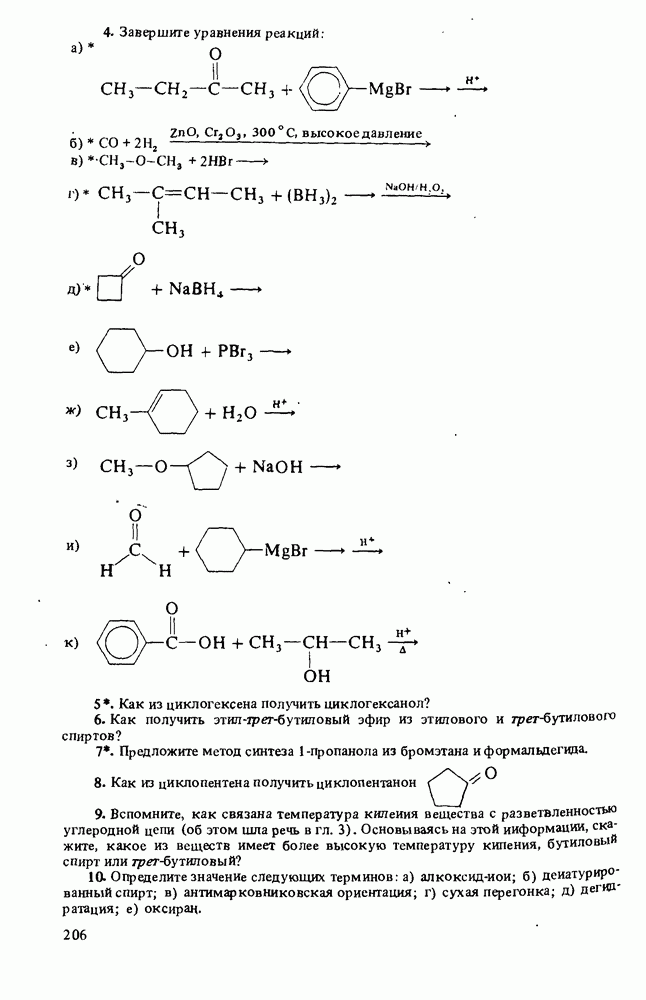
- ПРОСТЫЕ ЭФИРЫ
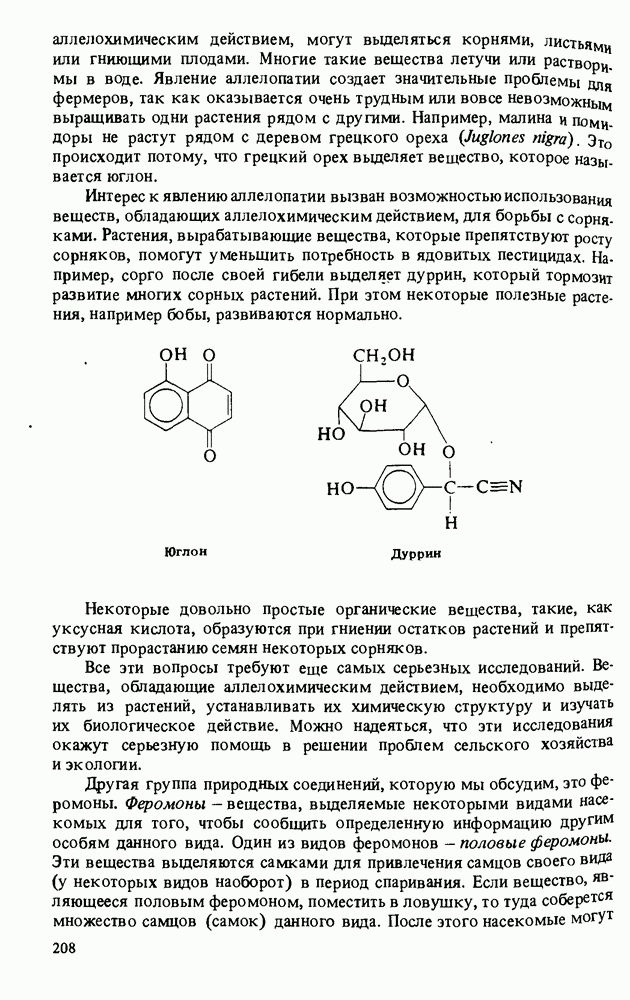
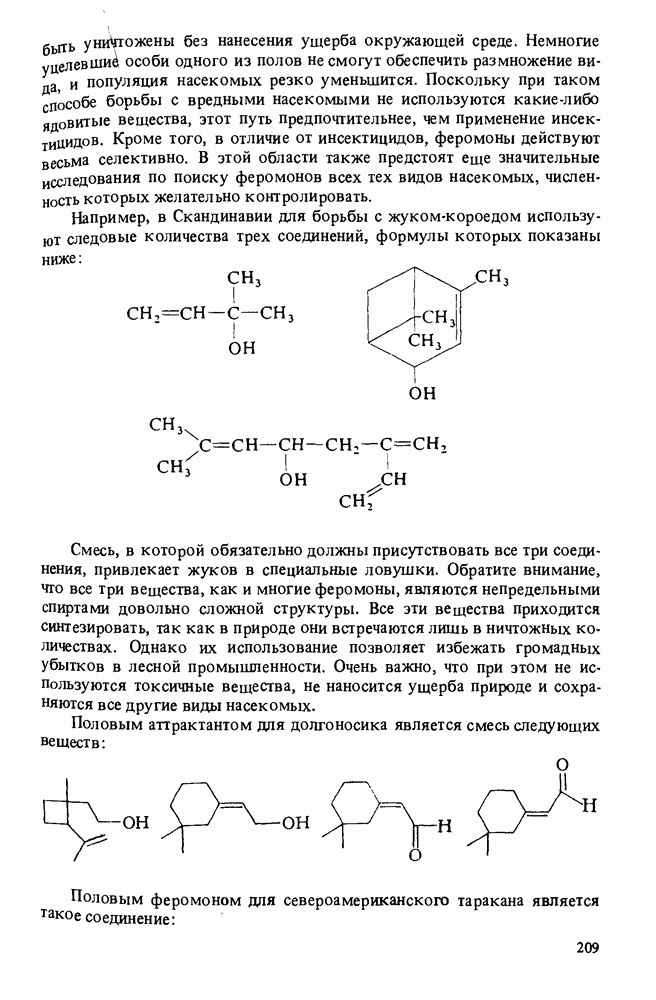
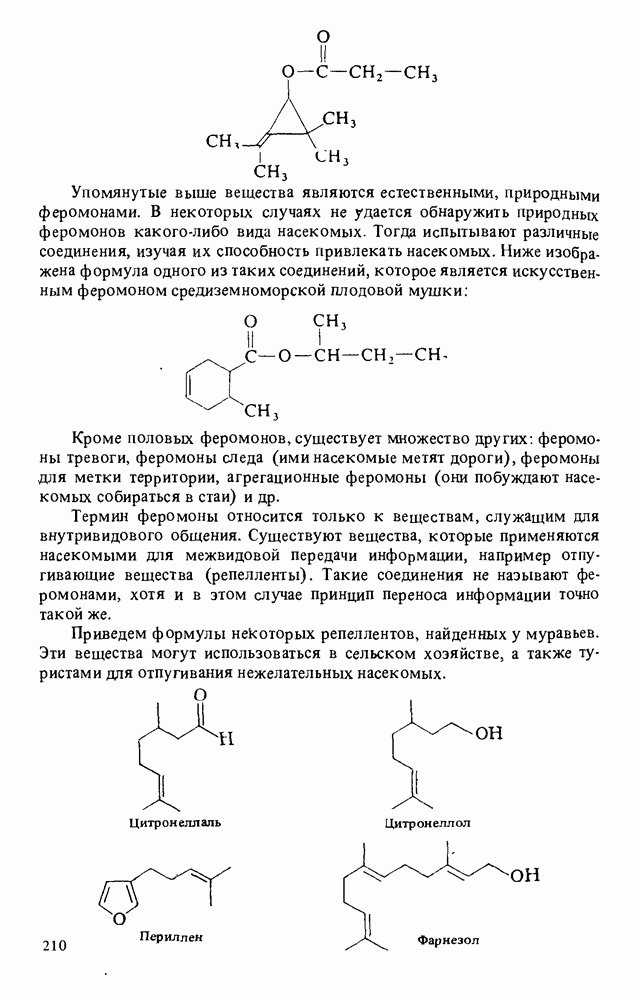
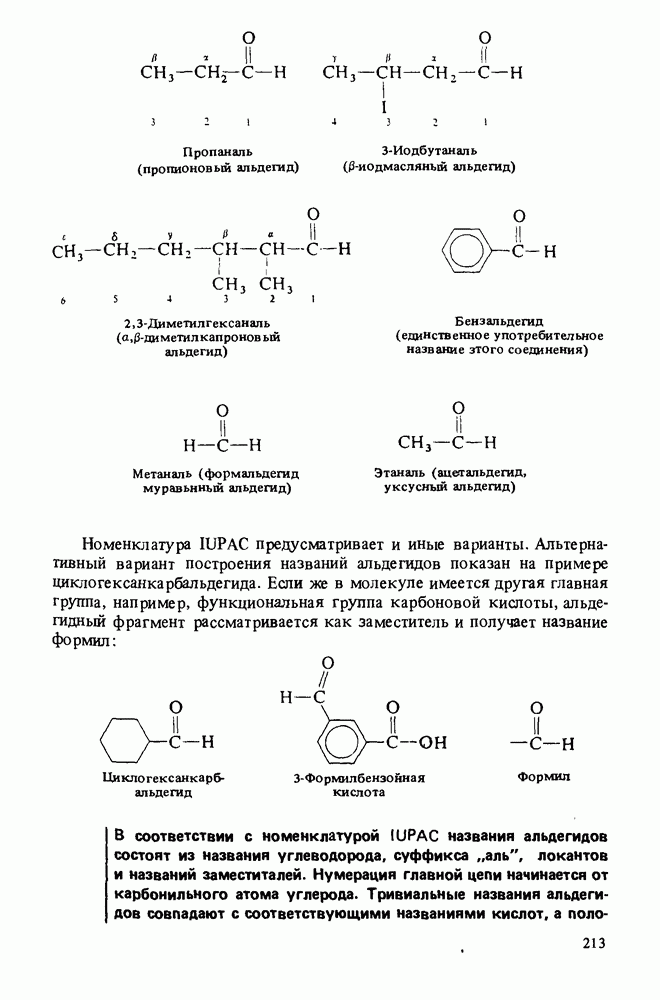
- Прикладная органическая химия: ВЕЩЕСТВА, ОБЛАДАЮЩИЕ АЛЛЕЛОХИМИЧЕСКИМ ДЕЙСТВИЕМ. ФЕРОМОНЫ
- Глава 8. АЛЬДЕГИДЫ И КЕТОНЫ
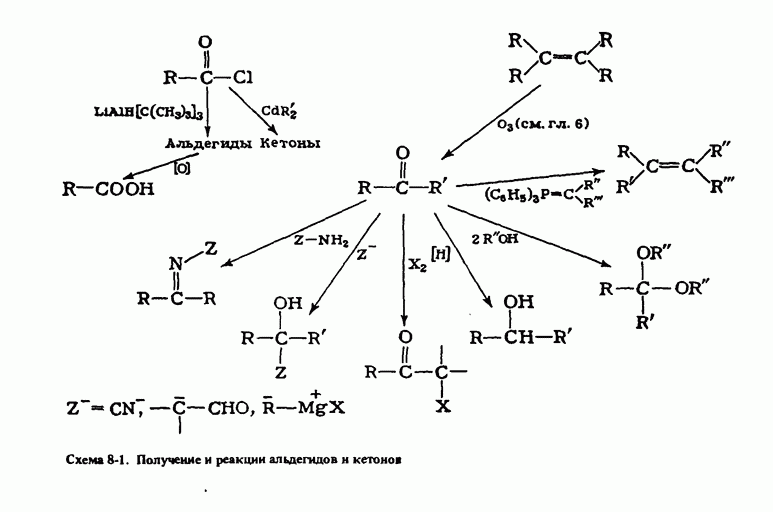
- ПОЛУЧЕНИЕ АЛЬДЕГИДОВ И КЕТОНОВ
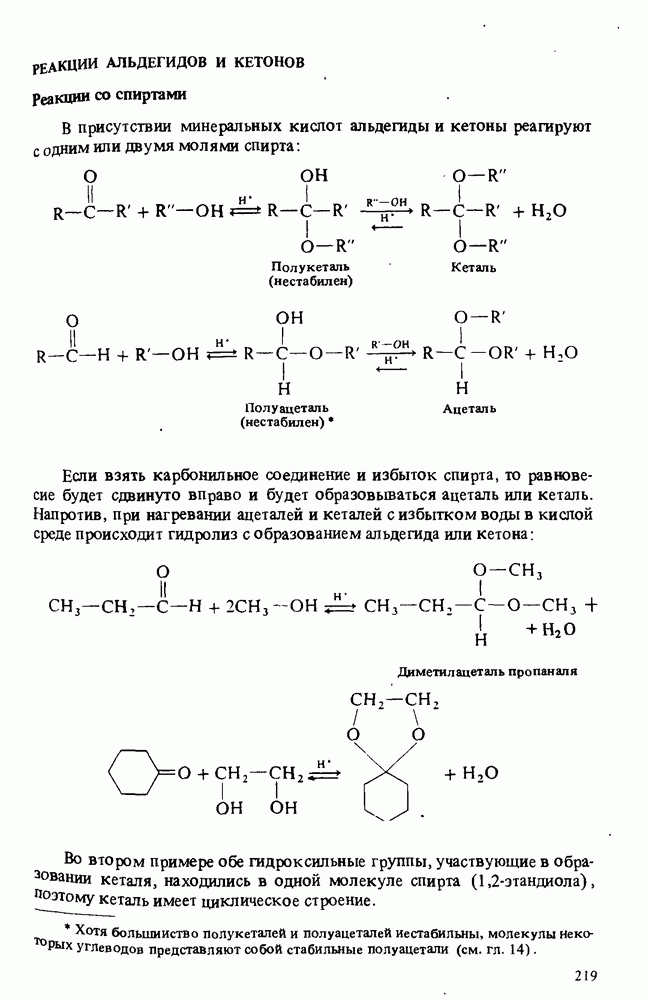
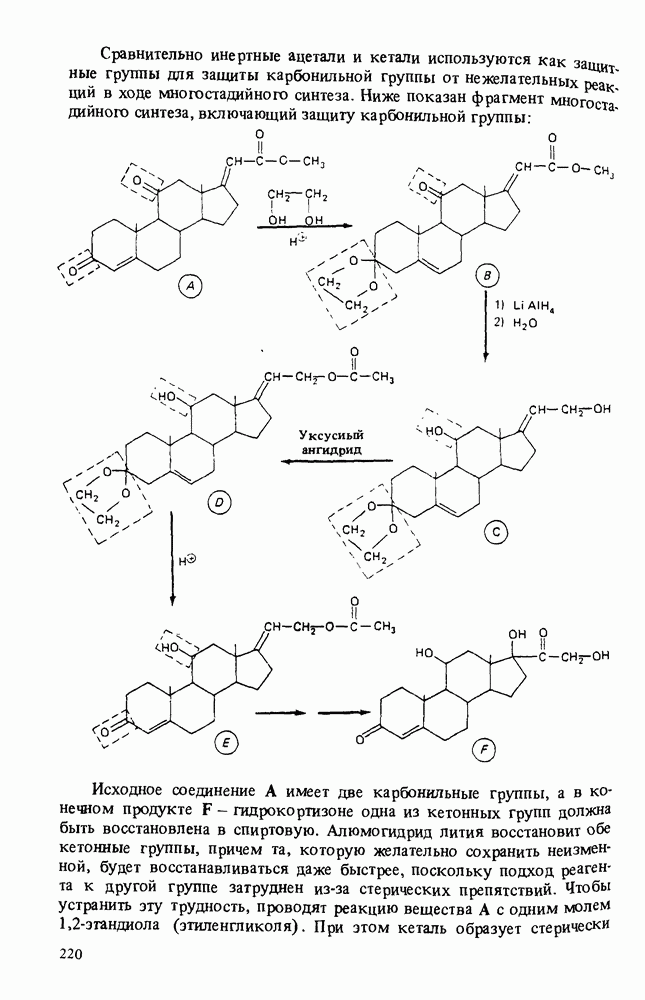
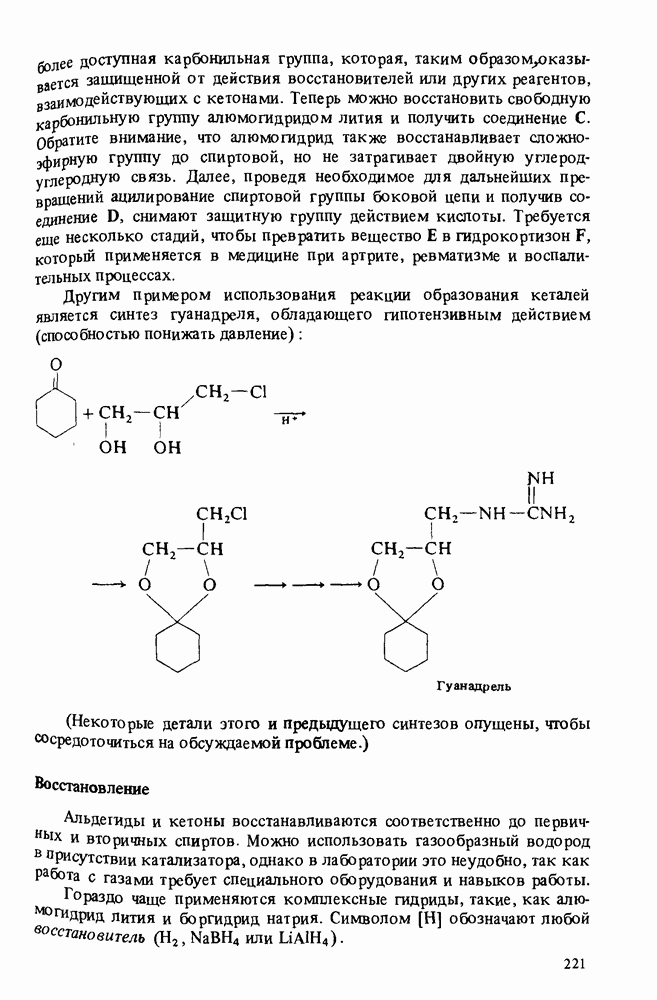
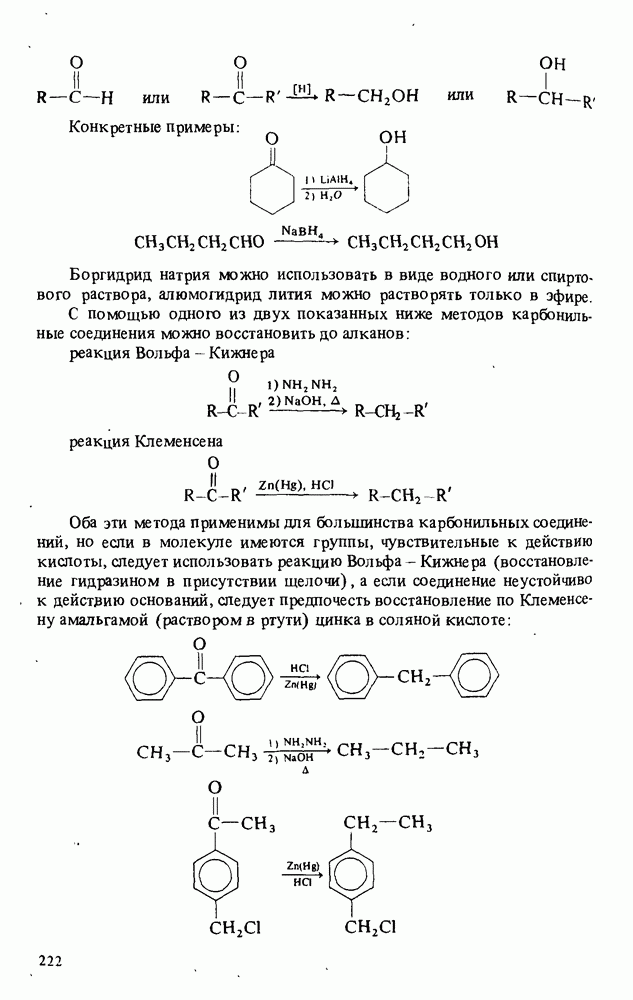
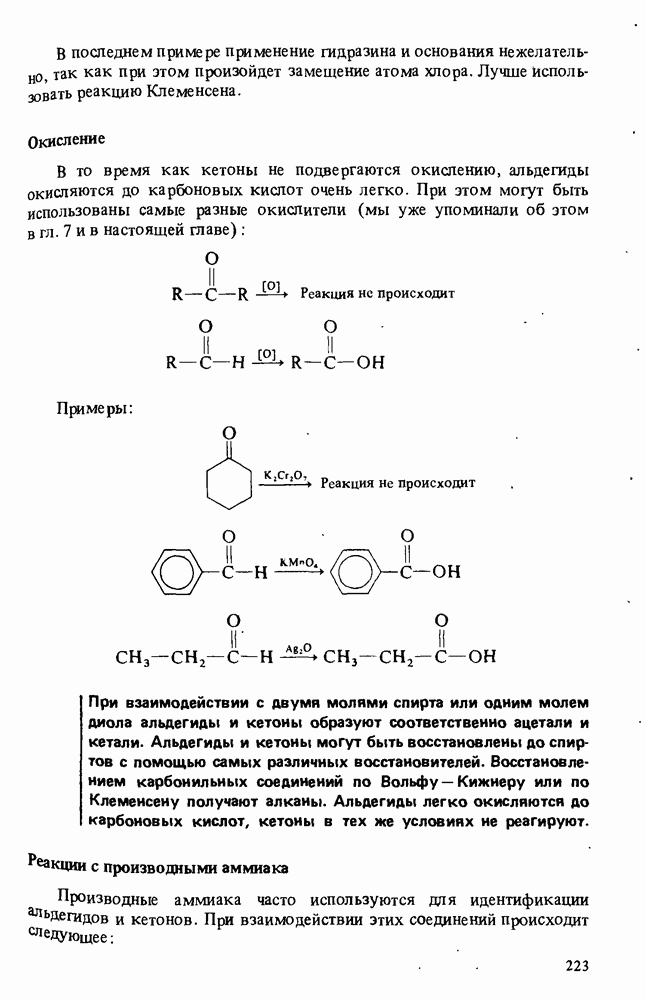
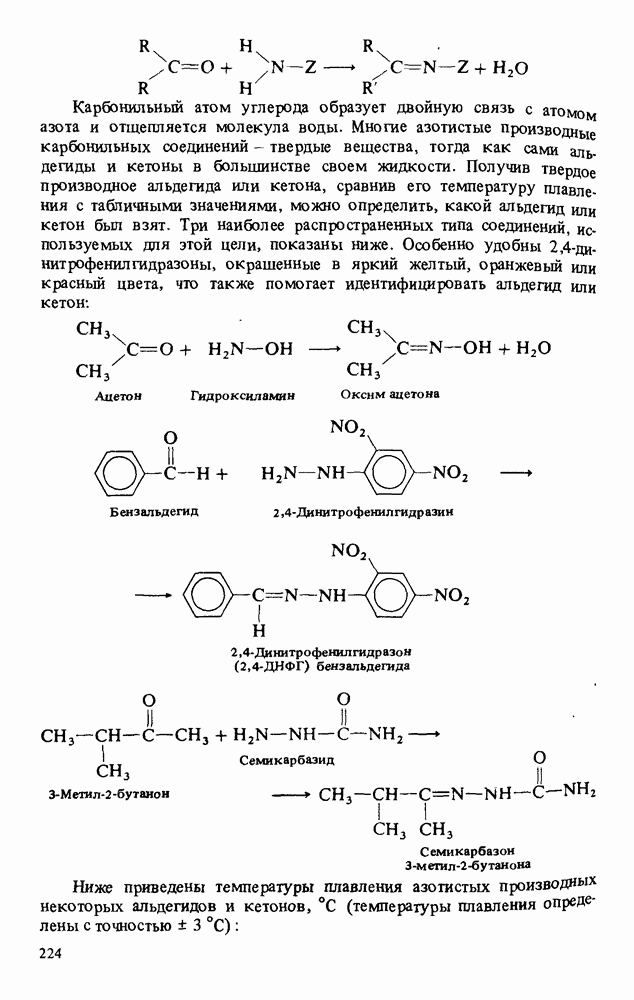
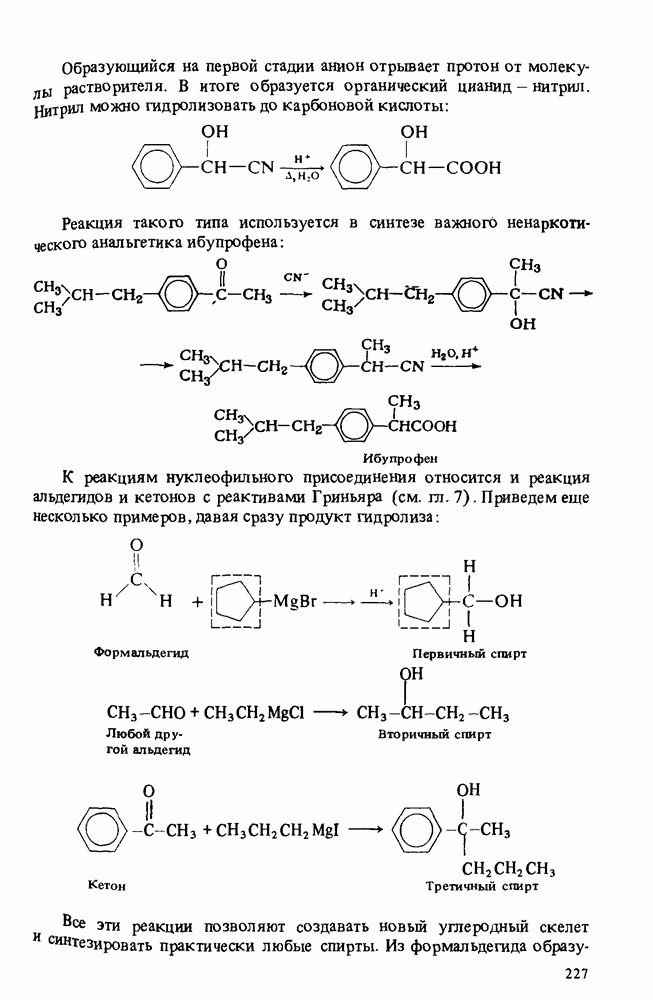
- РЕАКЦИИ АЛЬДЕГИДОВ И КЕТОНОВ
- Глава 9. АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
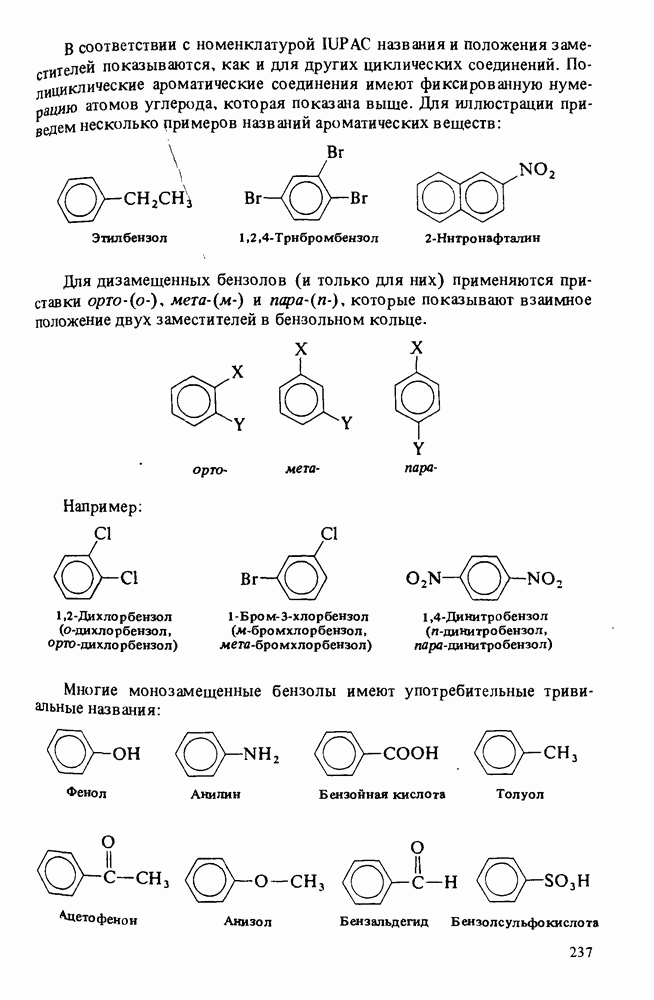
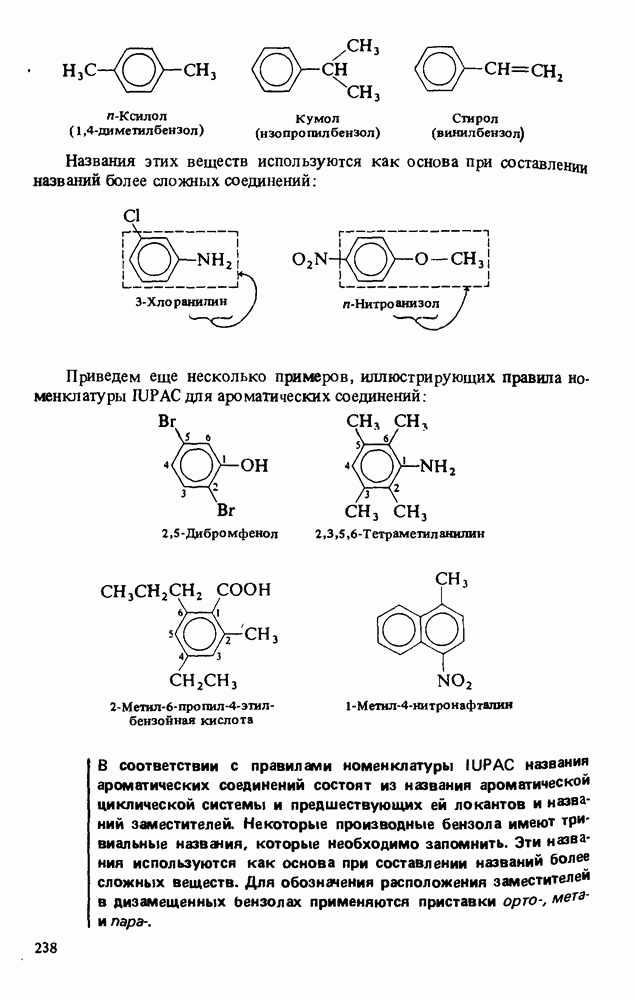
- НОМЕНКЛАТУРА АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
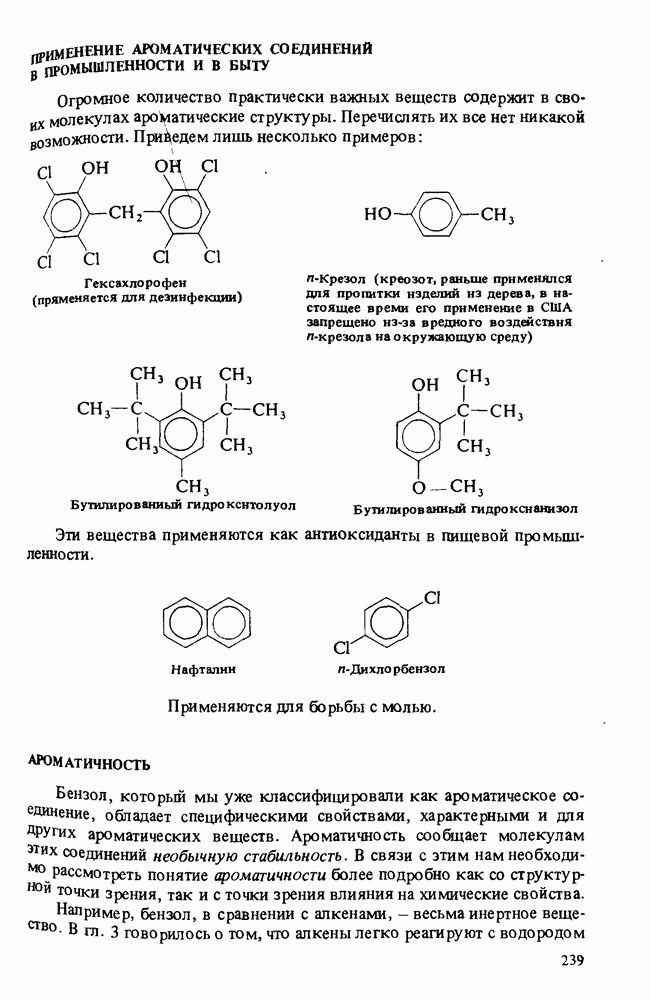
- ПРИМЕНЕНИЕ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ В ПРОМЫШЛЕННОСТИ И В БЫТУ
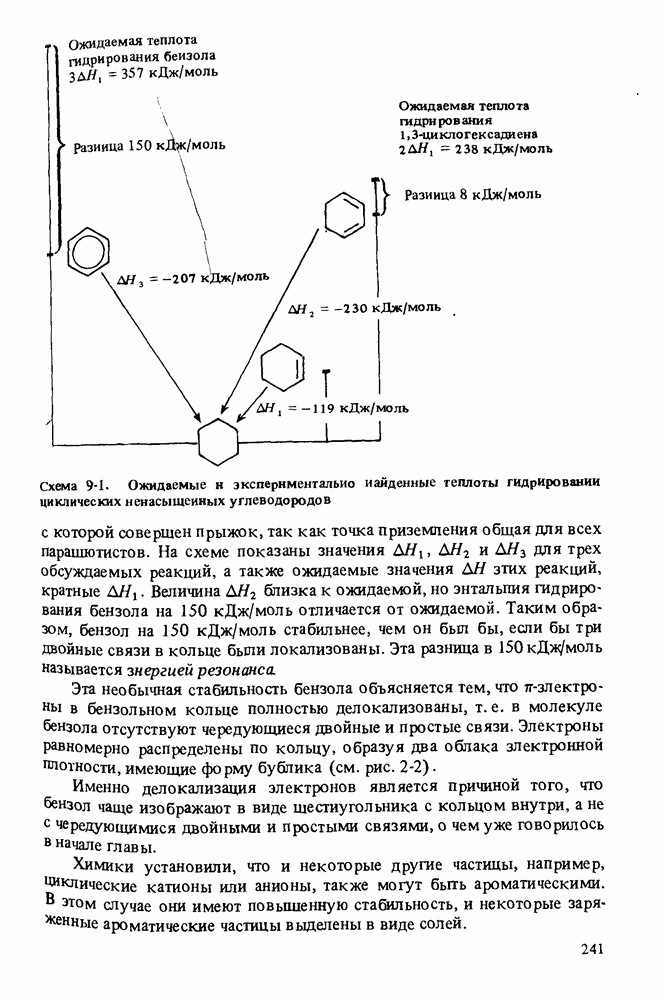
- АРОМАТИЧНОСТЬ
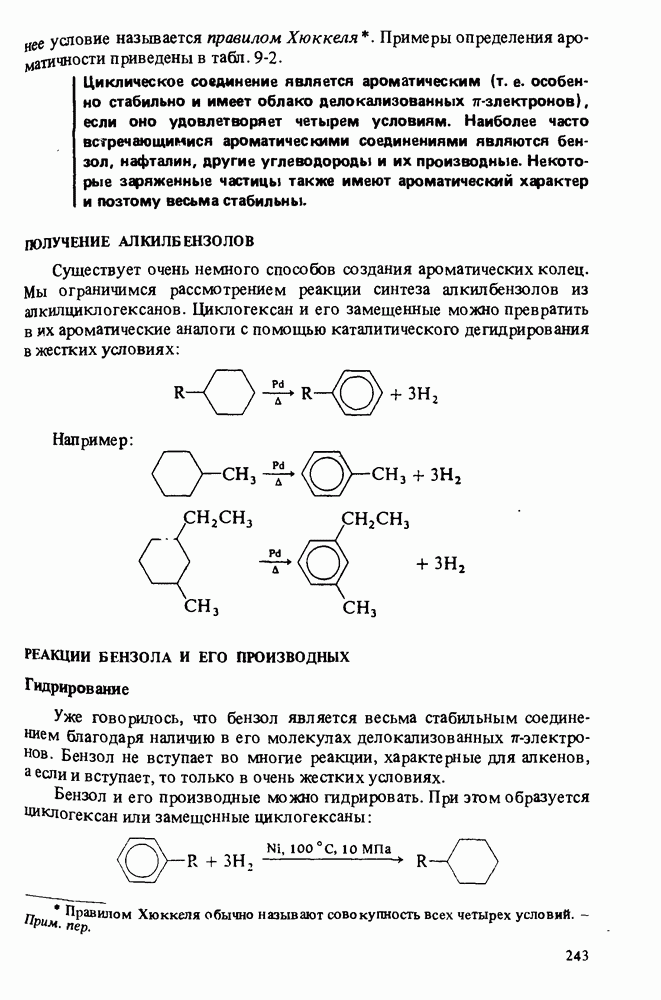
- ПОЛУЧЕНИЕ АЛКИЛЬБЕНЗОЛОВ
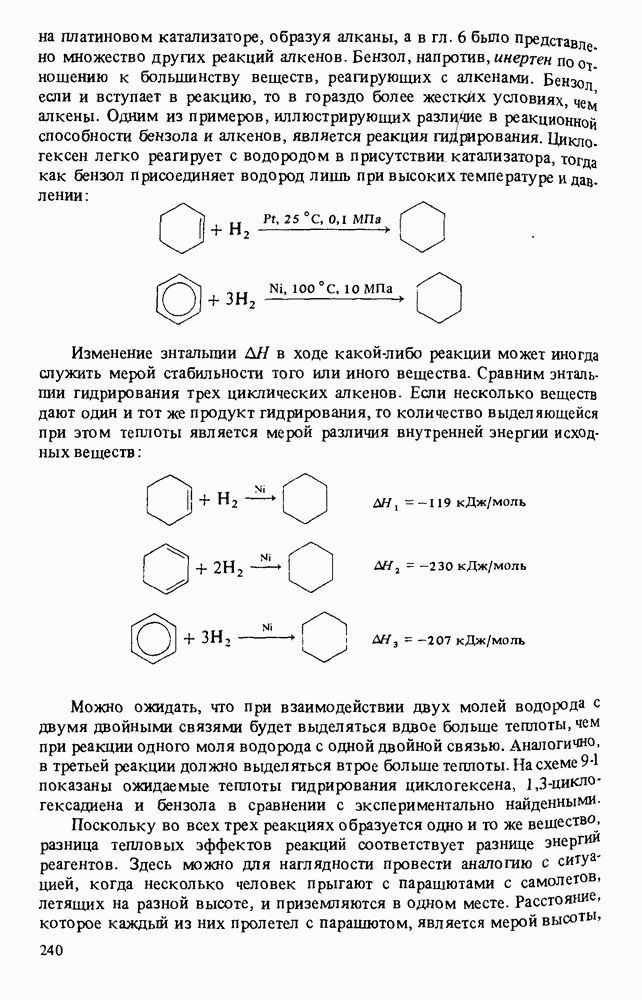
- РЕАКЦИИ БЕНЗОЛА И ЕГО ПРОИЗВОДНЫХ
- АРОМАТИЧЕСКОЕ ЭЛЕКТРОФИЛЬНОЕ ЗАМЕЩЕНИЕ
- ФЕНОЛЫ
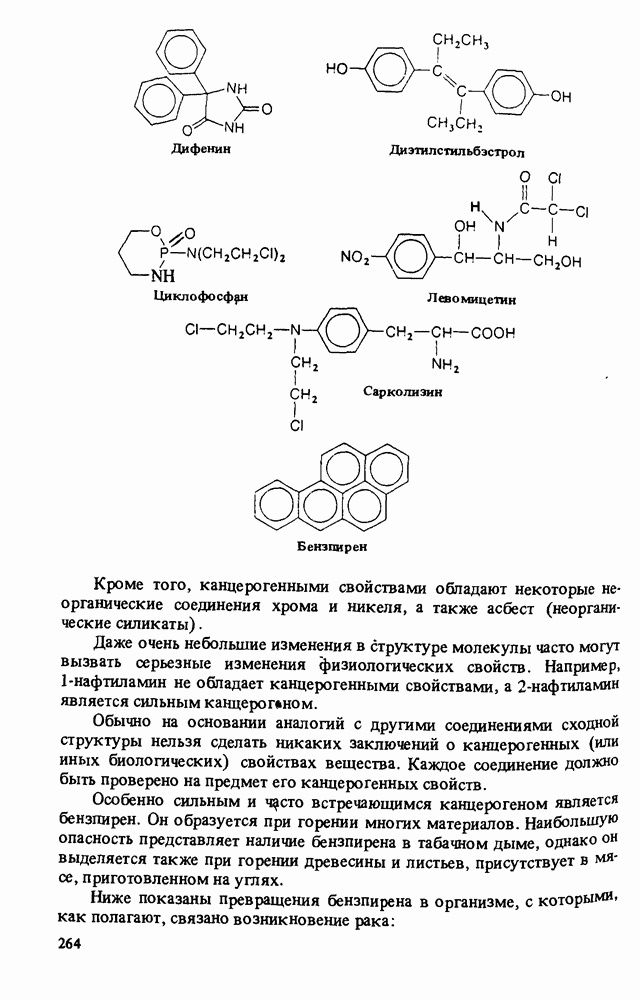
- Прикладная органическая химия: КАНЦЕРОГЕННЫЕ АРОМАТИЧЕСКИЕ СОЕДИНЕНИЯ
- Глава 10. ОРГАНИЧЕСКИЙ СИНТЕЗ
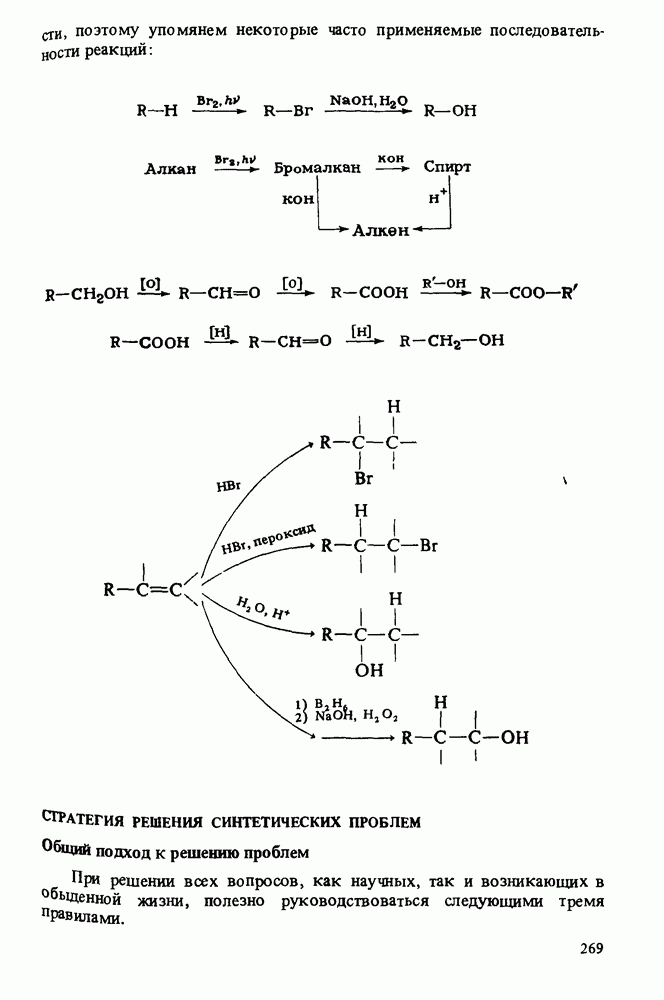
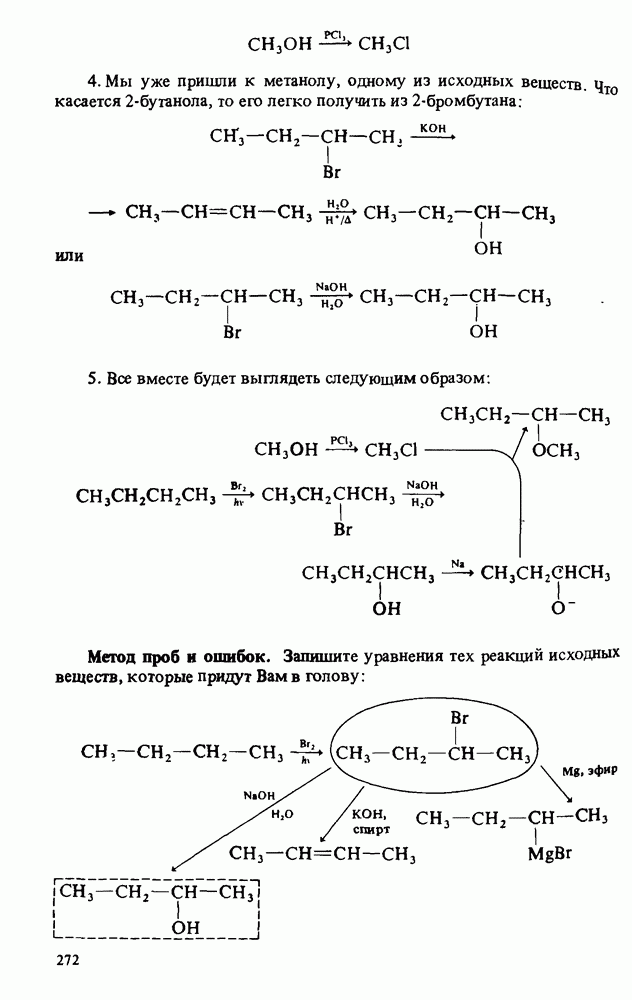
- СТРАТЕГИЯ РЕШЕНИЯ СИНТЕТИЧЕСКИХ ПРОБЛЕМ
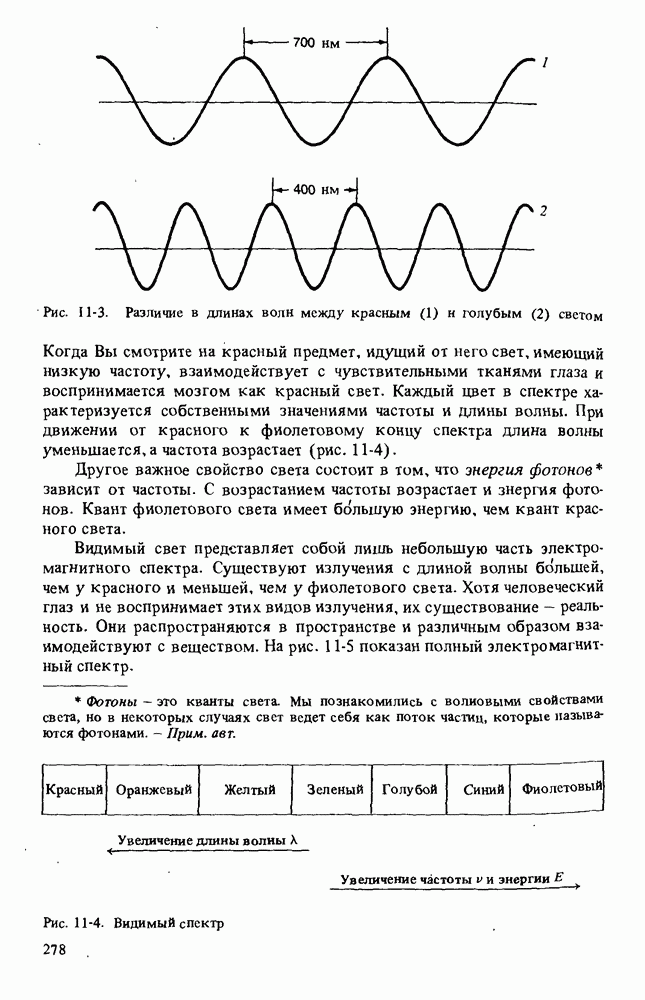
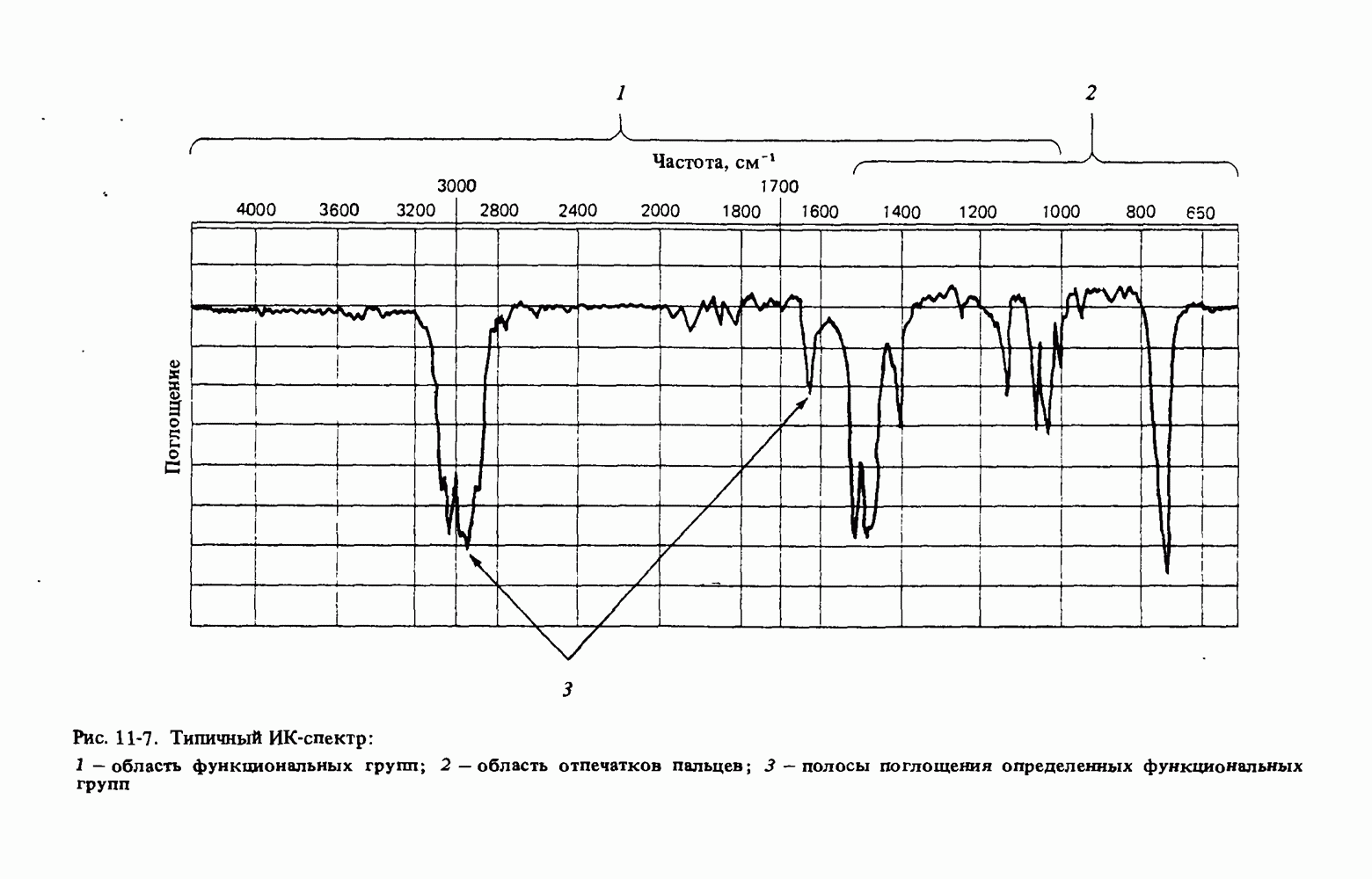
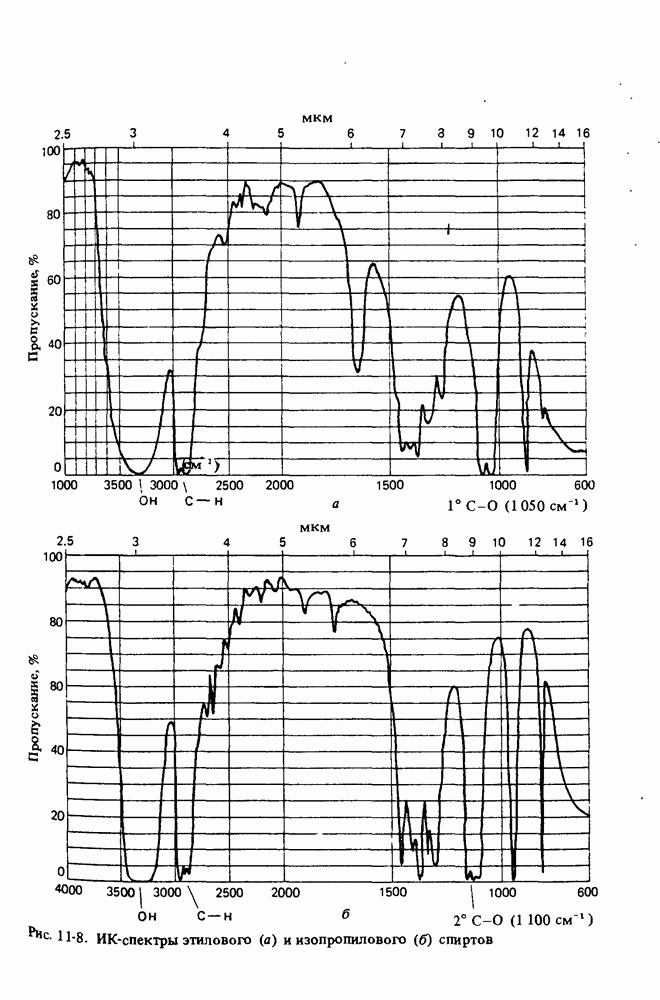
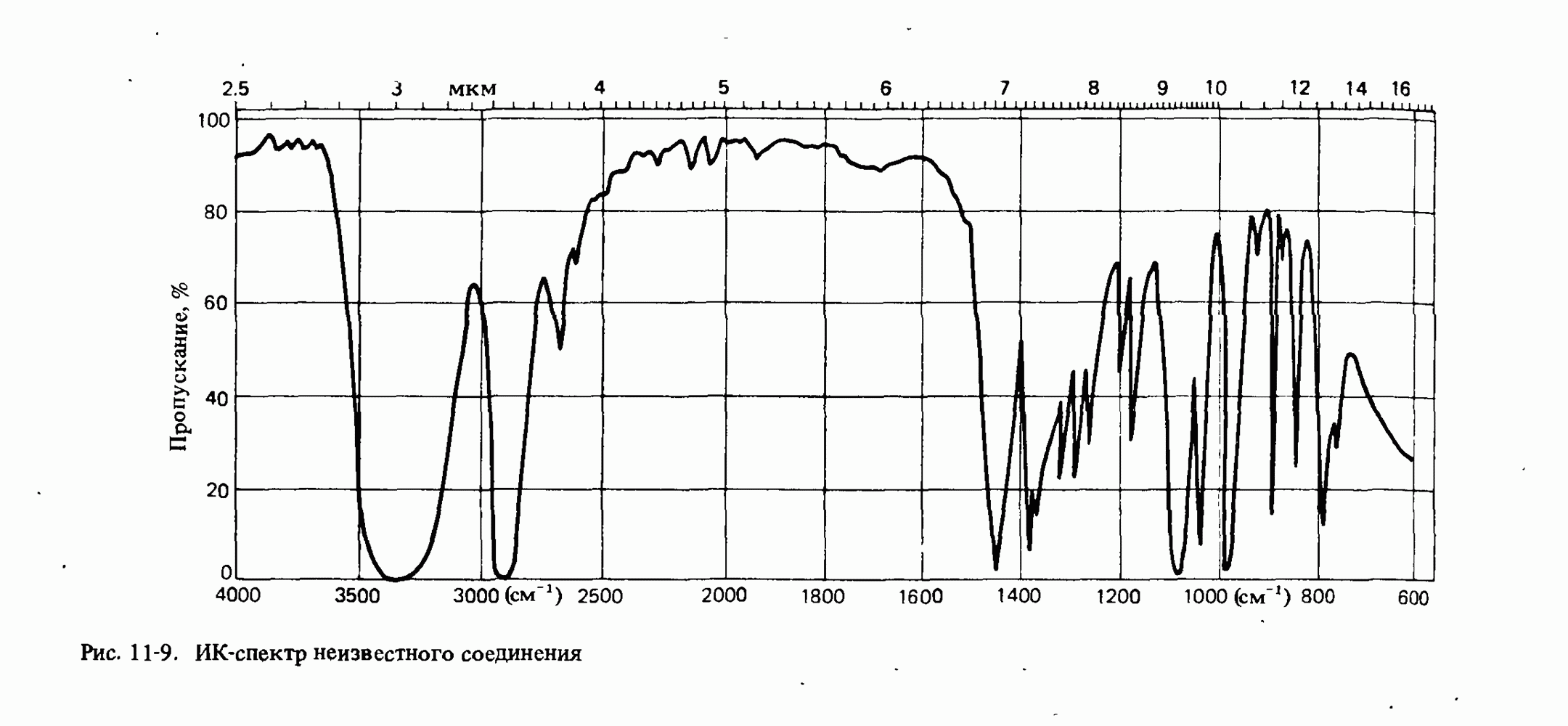
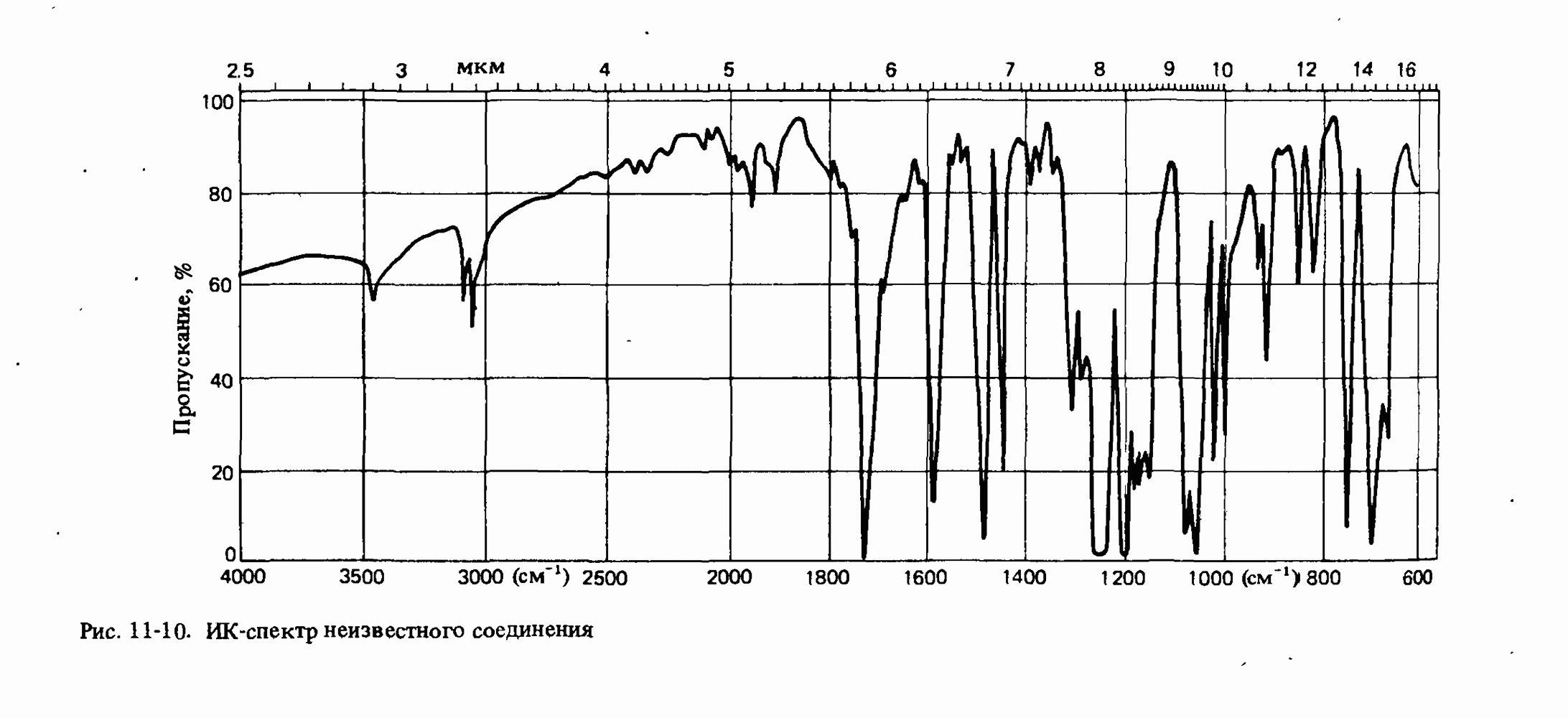
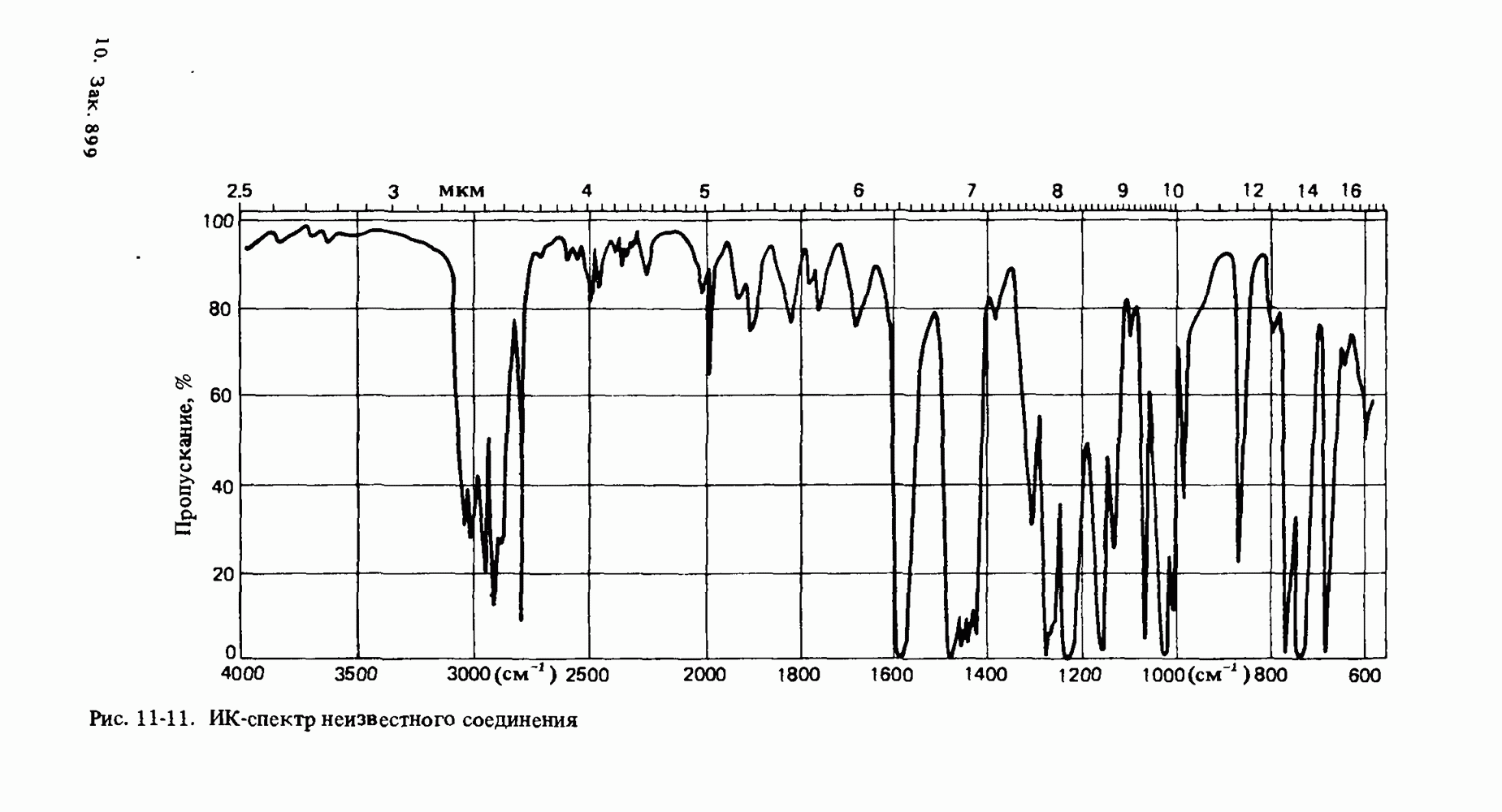
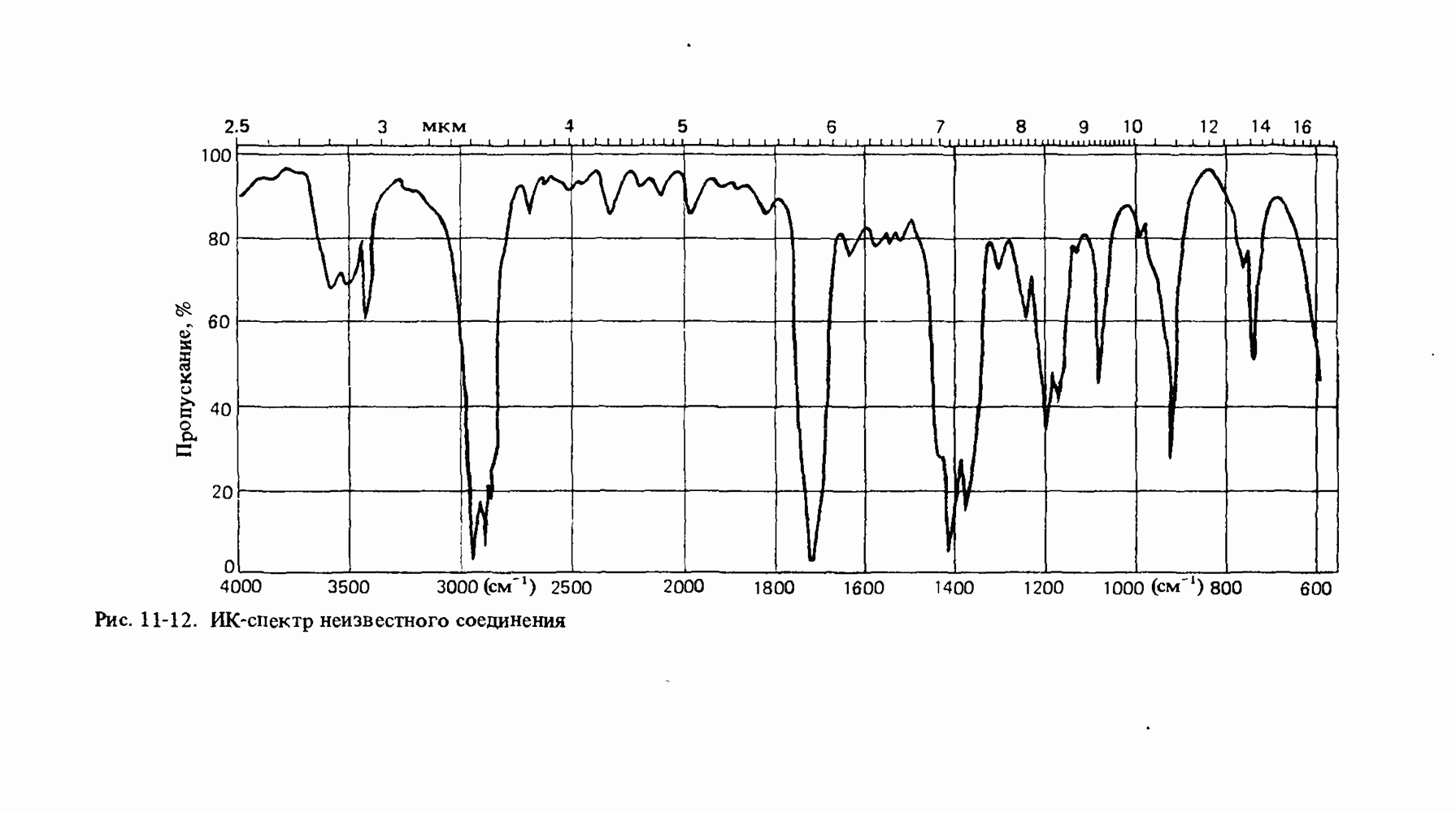
- Глава 11. МОЛЕКУЛЯРНАЯ СПЕКТРОСКОПИЯ
- ИНФРАКРАСНАЯ СПЕКТРОСКОПИЯ
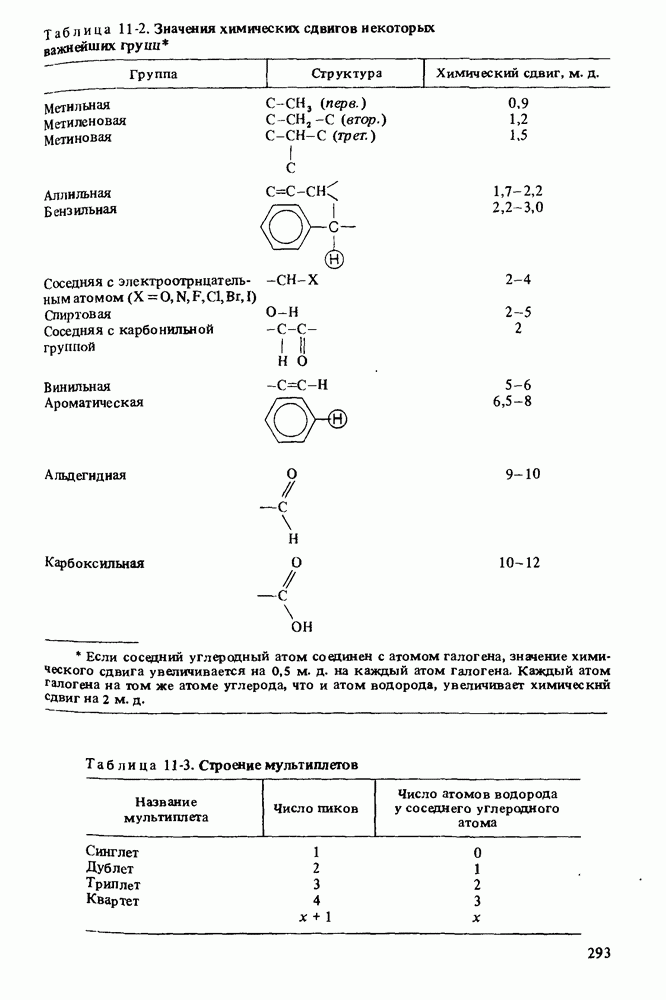
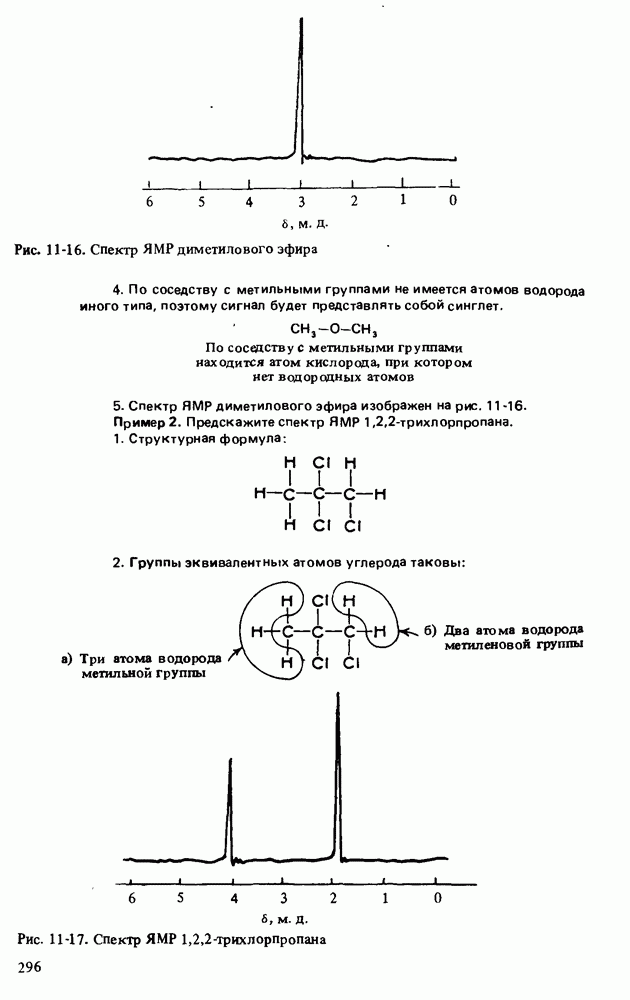
- СПЕКТРОСКОПИЯ ЯДЕРНОГО МАГНИТНОГО РЕЗОНАНСА
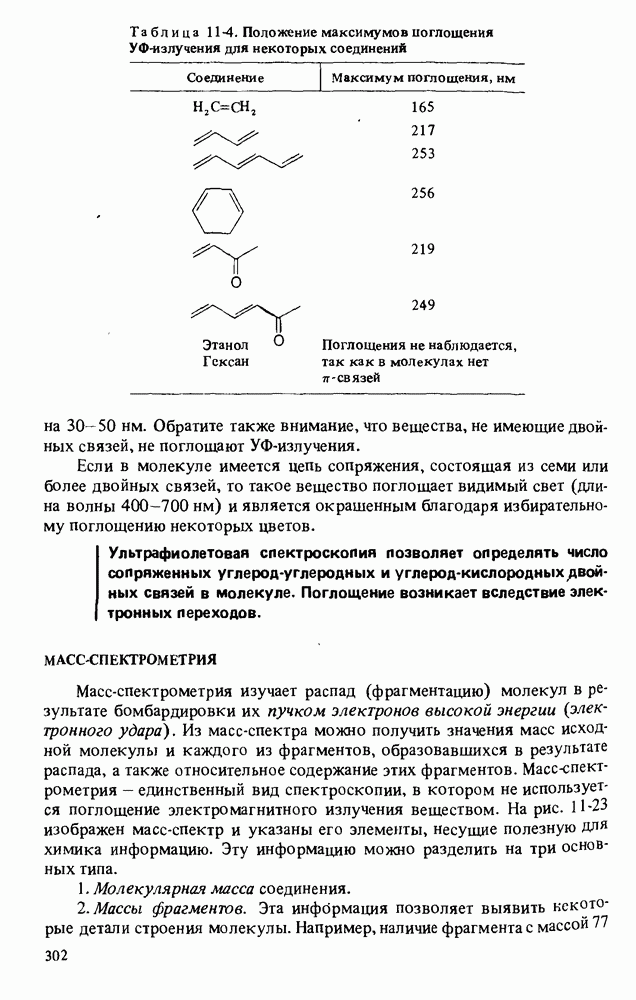
- УЛЬТРАФИОЛЕТОВАЯ СПЕКТРОСКОПИЯ
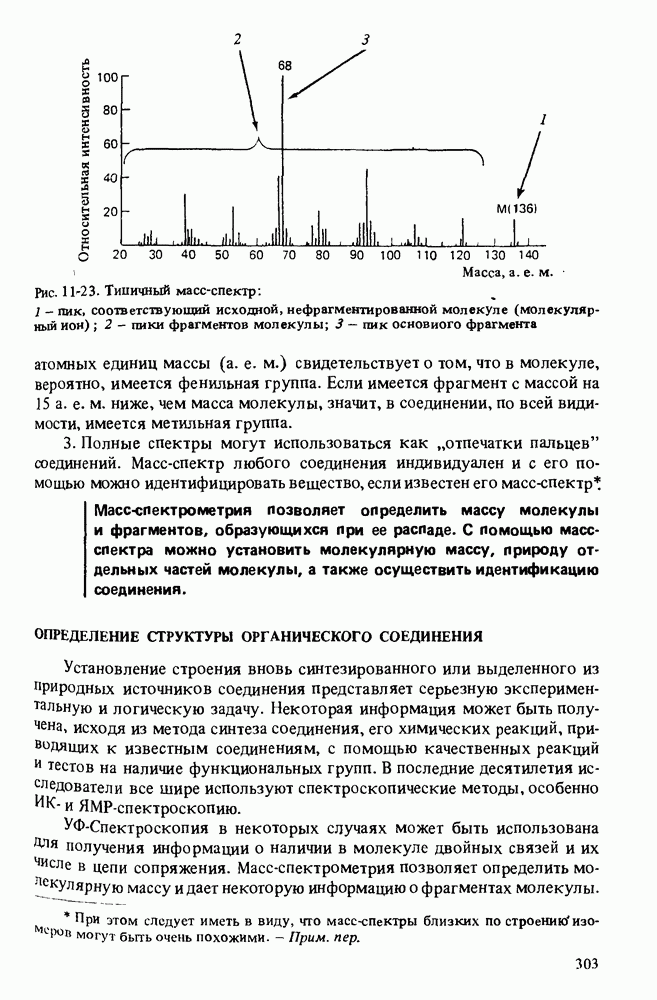
- МАСС-СПЕКТРОМЕТРИЯ
- ОПРЕДЕЛЕНИЕ СТРУКТУРЫ ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ
- Прикладная органическая химия: ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ АЛКОГОЛЯ В КРОВИ
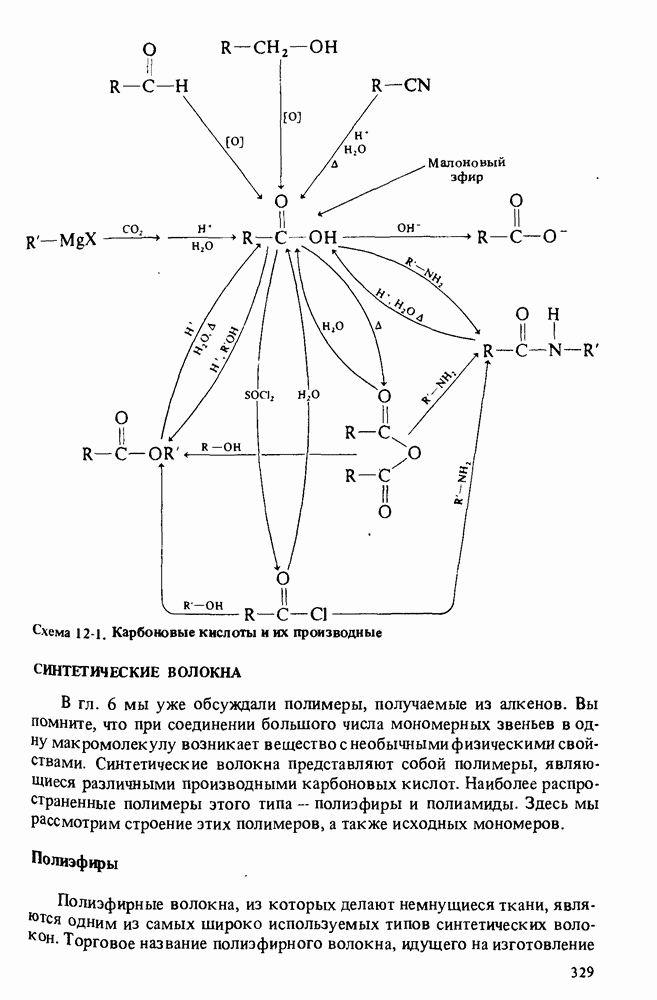
- Глава 12. КАРБОНОВЫЕ КИСЛОТЫ И ИХ ПРОИЗВОДНЫЕ
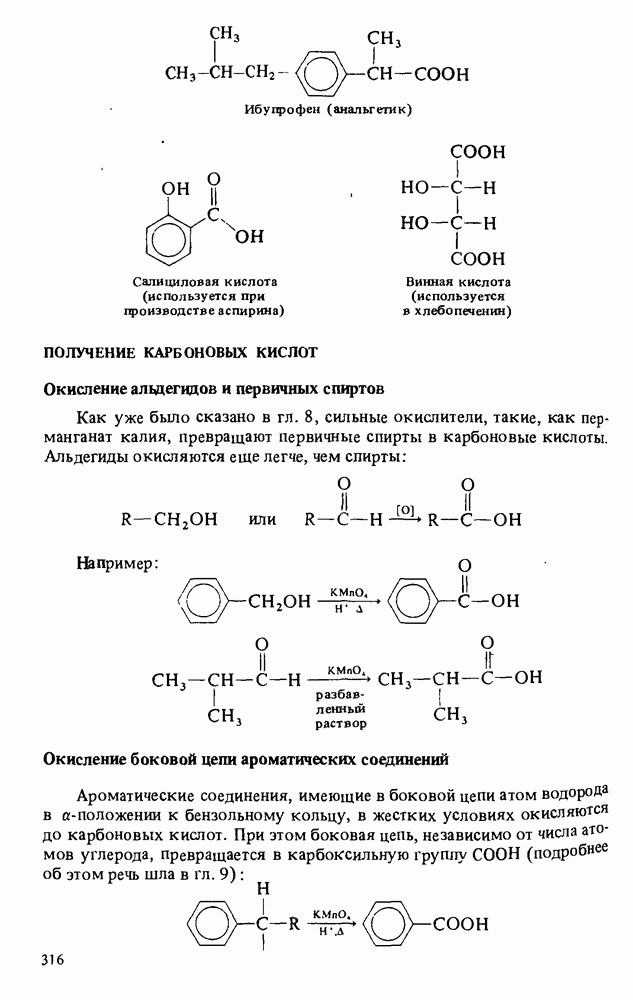
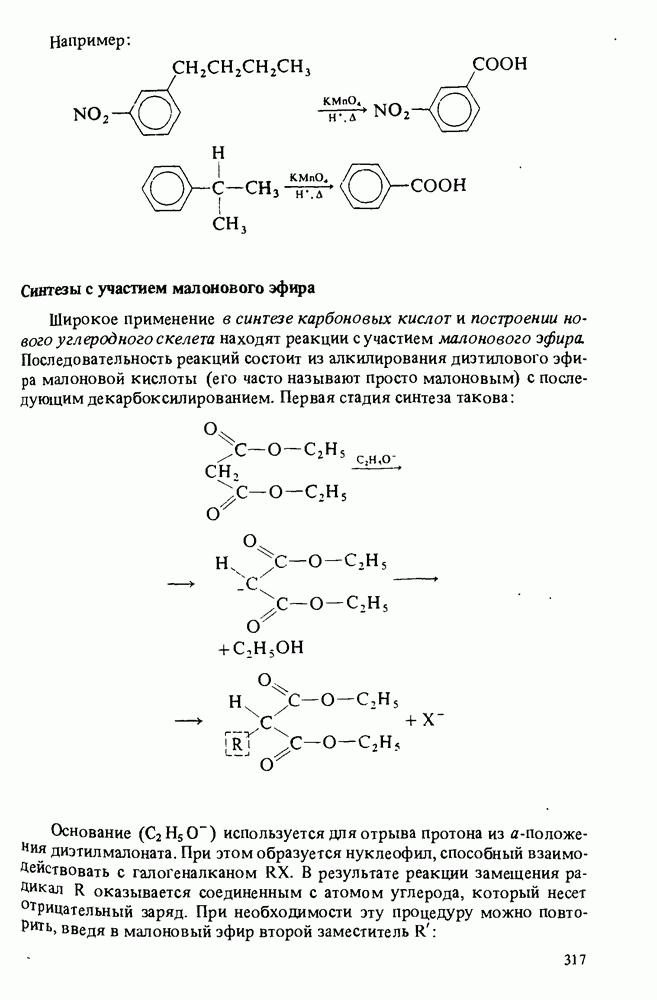
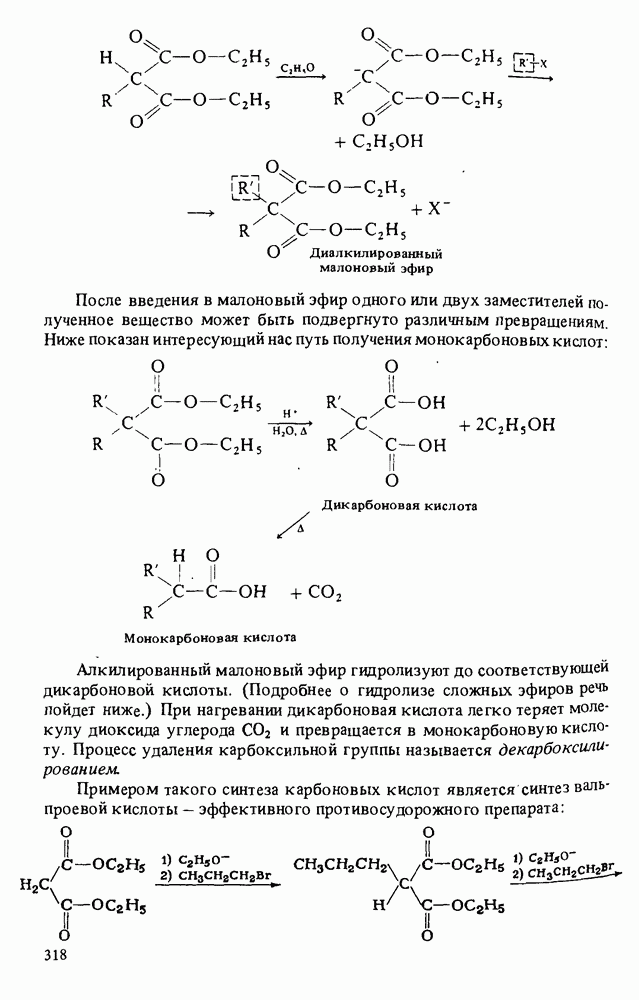
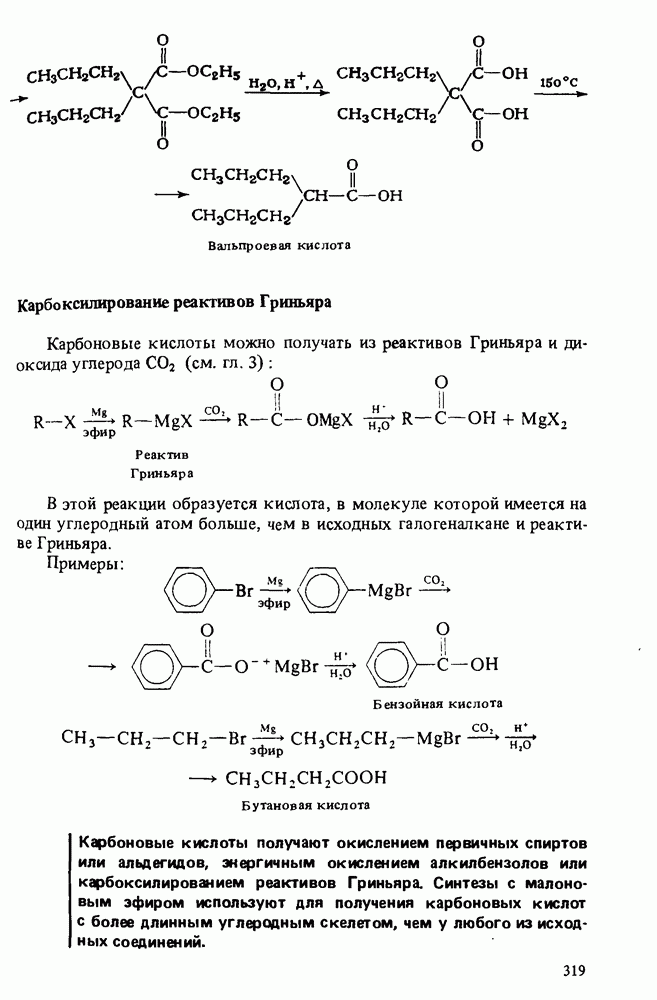
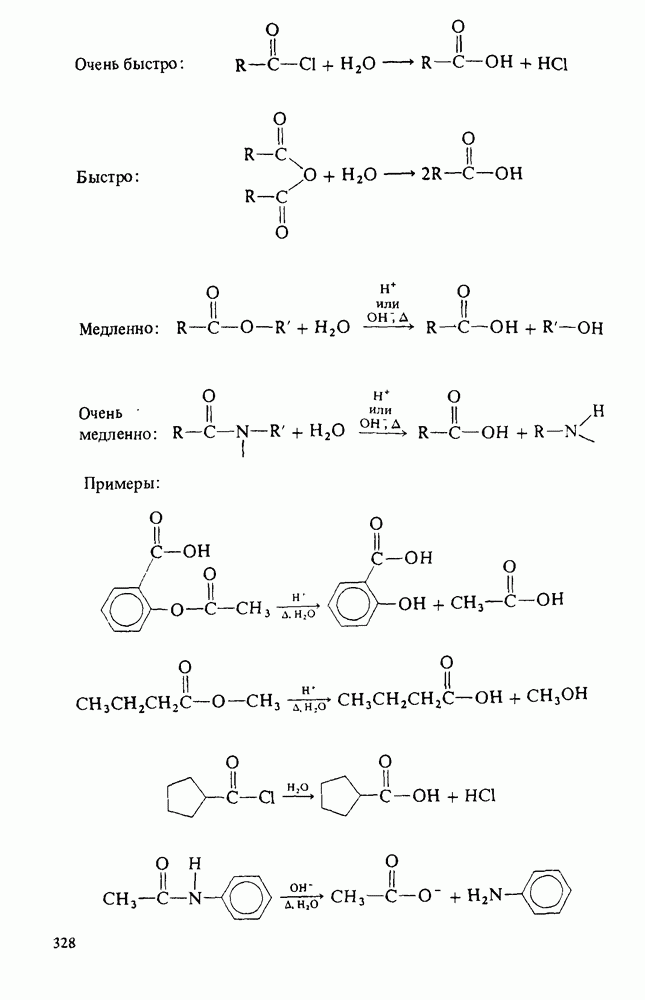
- ПОЛУЧЕНИЕ КАРБОНОВЫХ КИСЛОТ
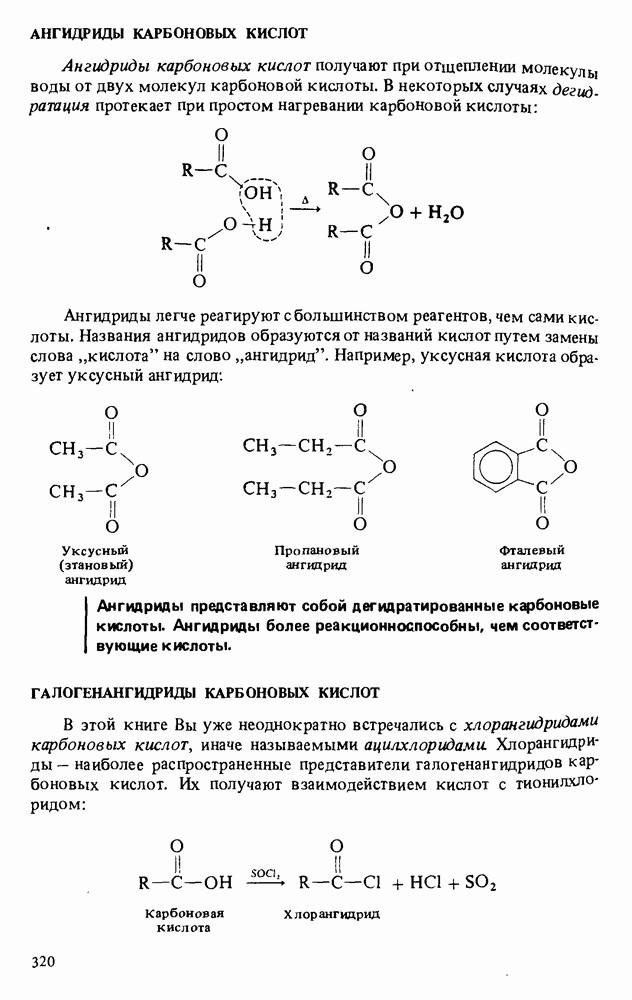
- АНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
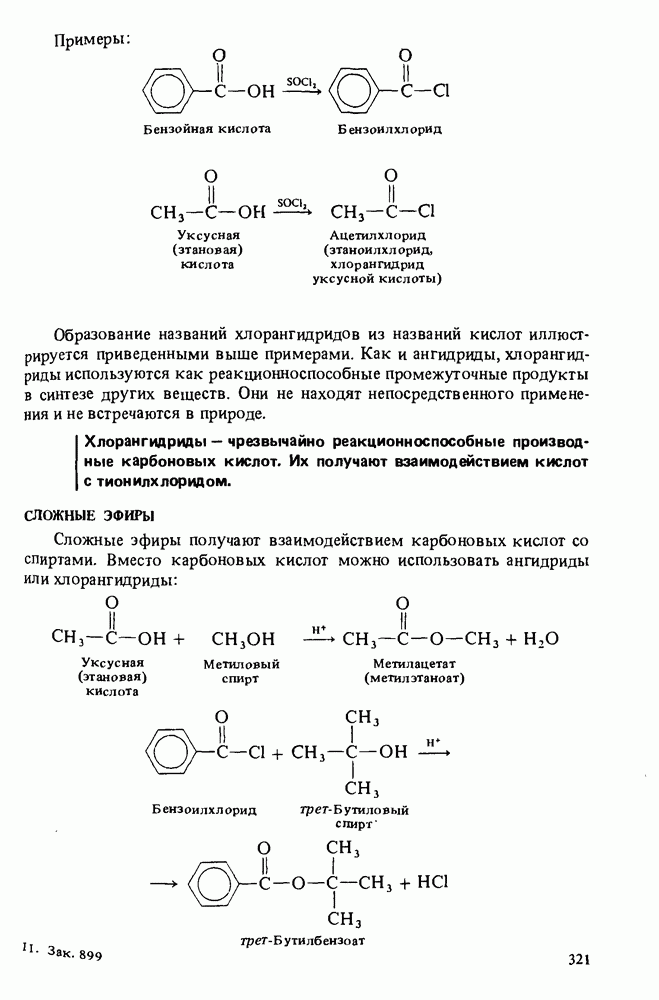
- ГАЛОГЕНАНГИДРИДЫ КАРБОНОВЫХ КИСЛОТ
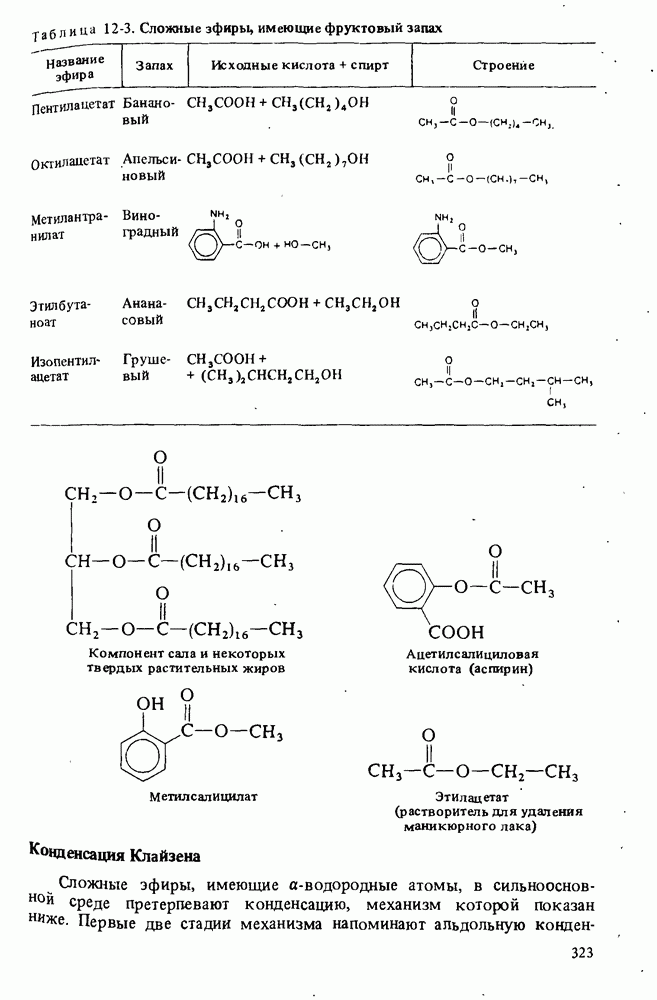
- СЛОЖНЫЕ ЭФИРЫ
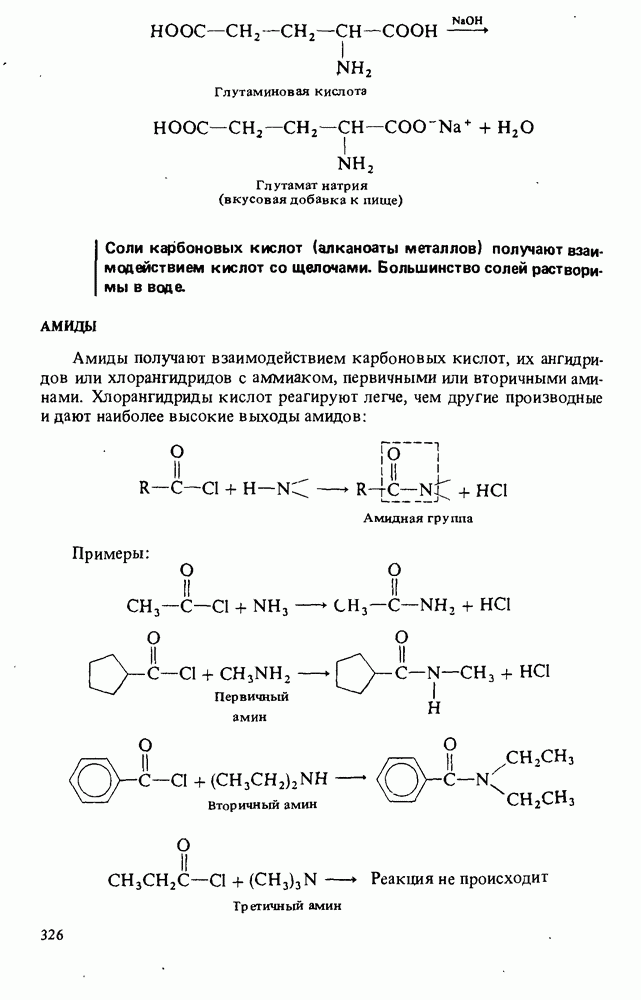
- СОЛИ
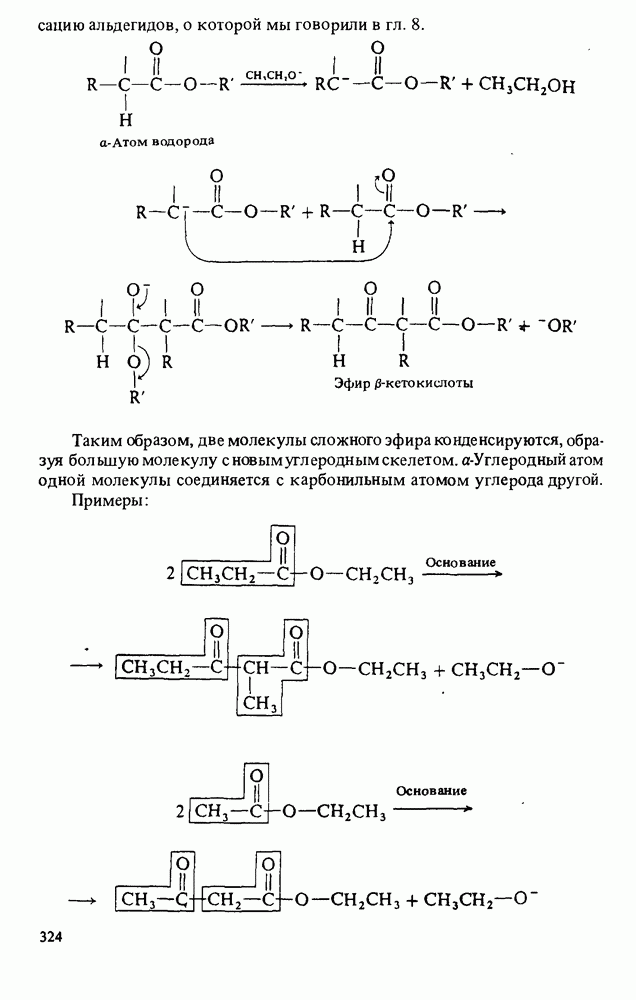
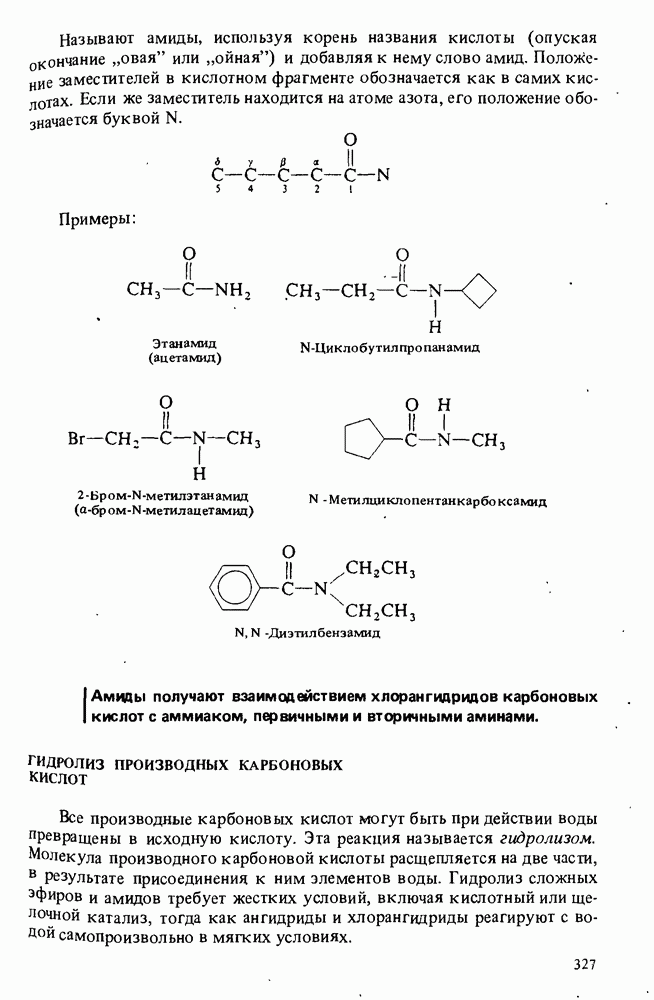
- АМИДЫ
- ГИДРОЛИЗ ПРОИЗВОДНЫХ КАРБОНОВЫХ КИСЛОТ
- СИНТЕТИЧЕСКИЕ ВОЛОКНА
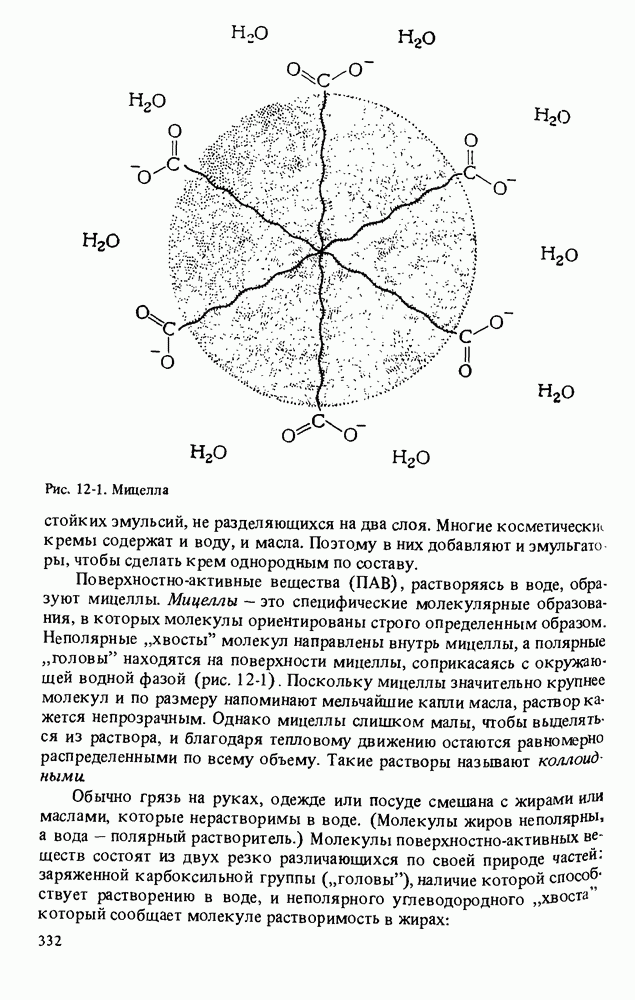
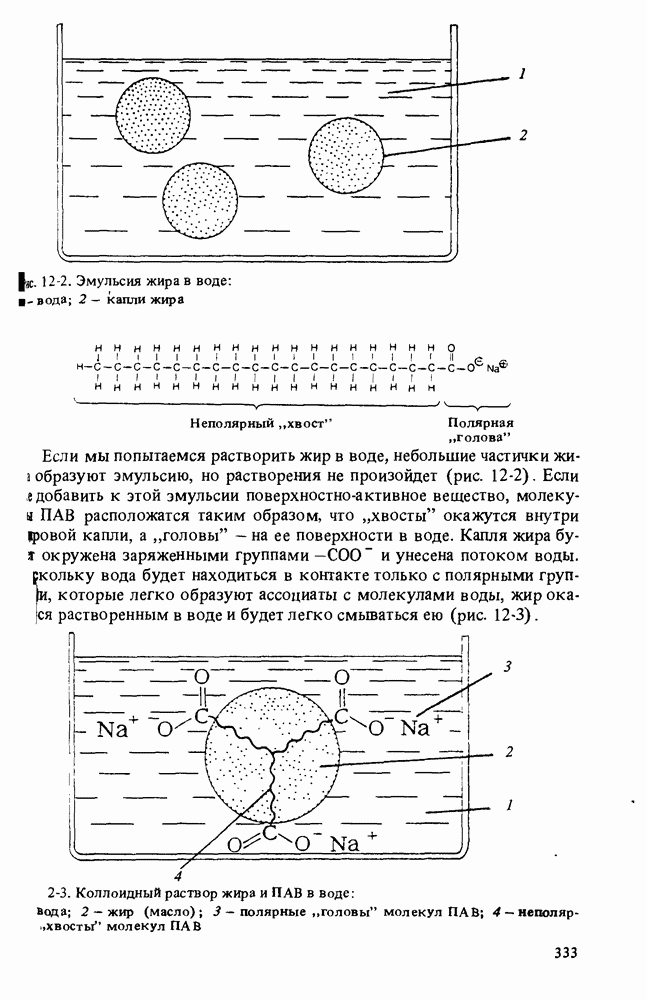
- МОЮЩИЕ СРЕДСТВА
- Прикладная органическая химия: СВОЙСТВА ВОЛОКОН
- Глава 13. АМИНЫ
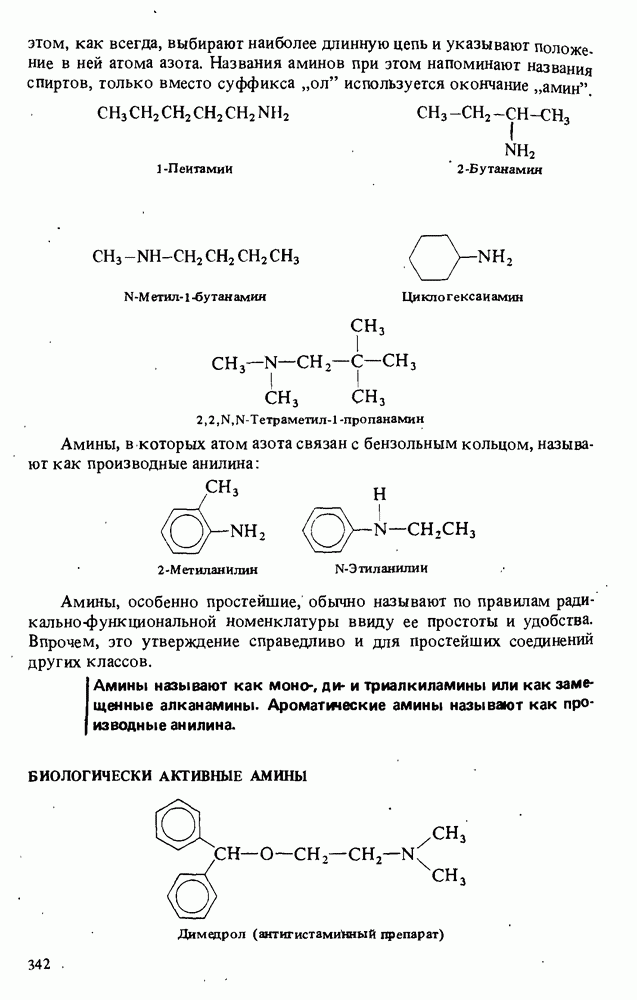
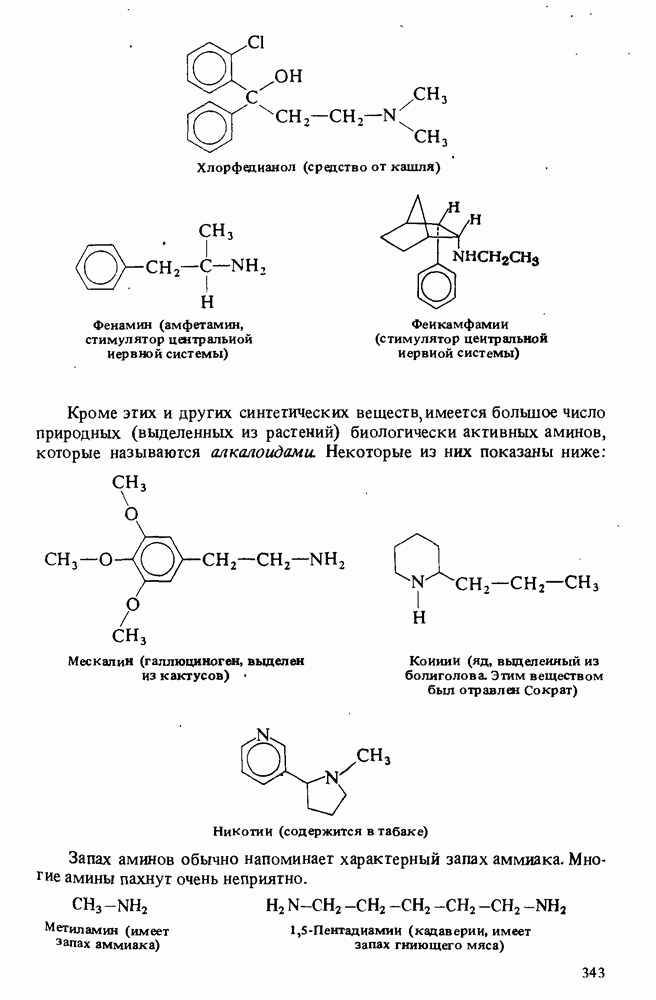
- БИОЛОГИЧЕСКИ АКТИВНЫЕ АМИНЫ
- ОСНОВНОСТЬ АМИНОВ
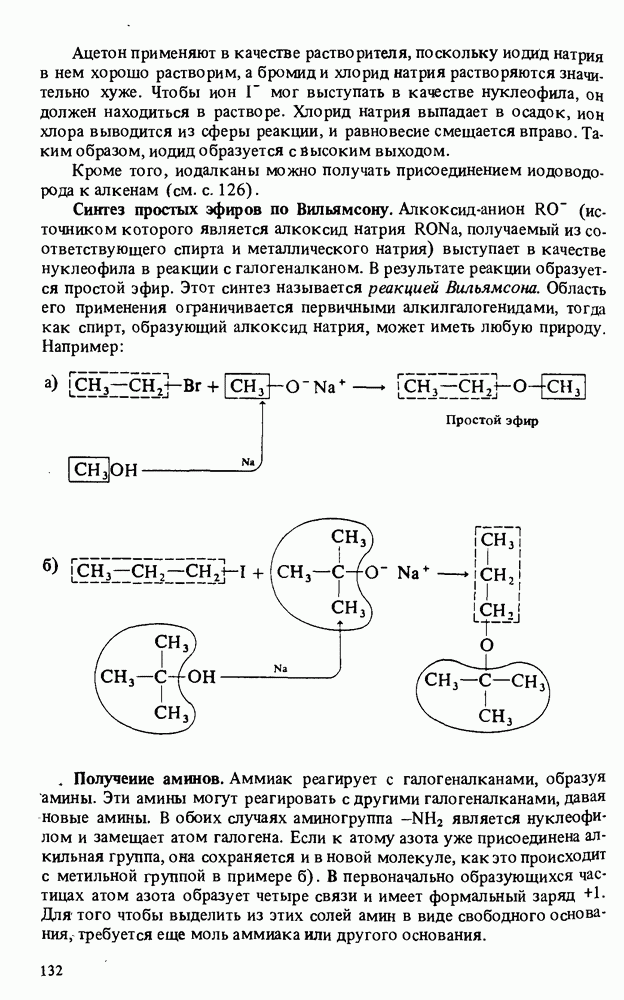
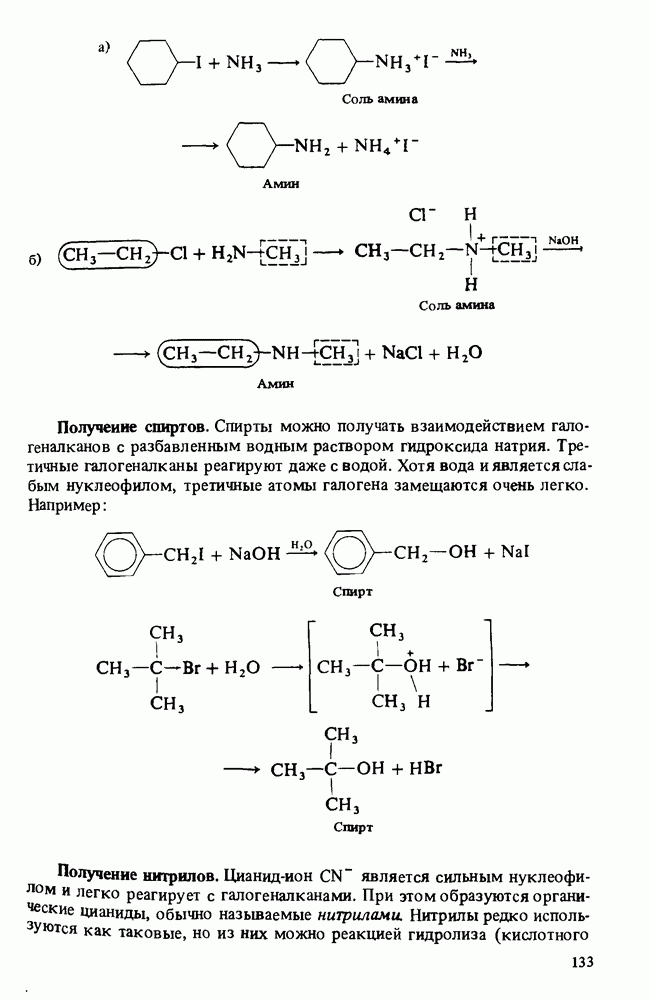
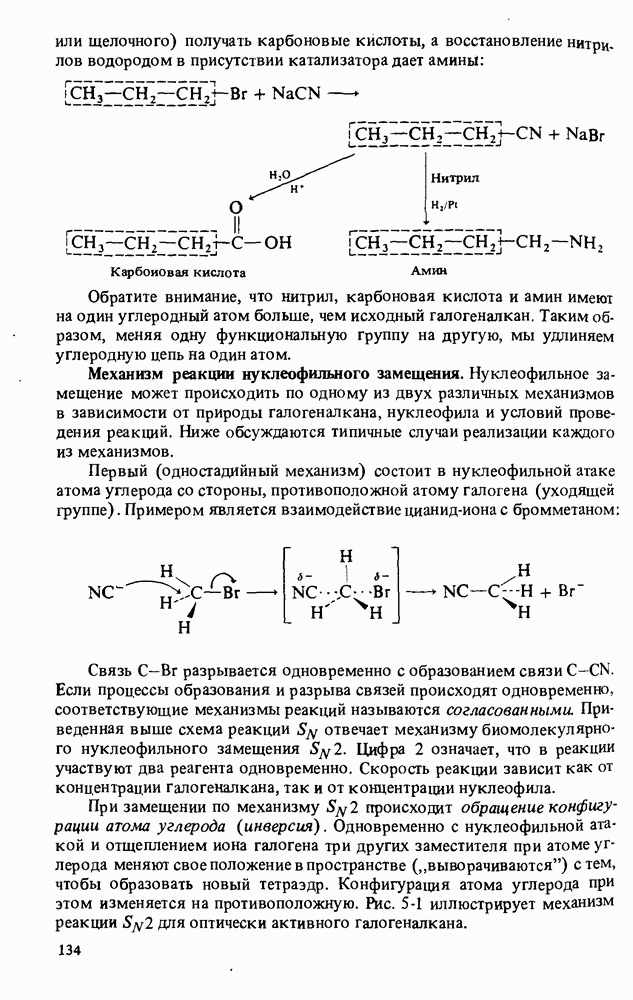
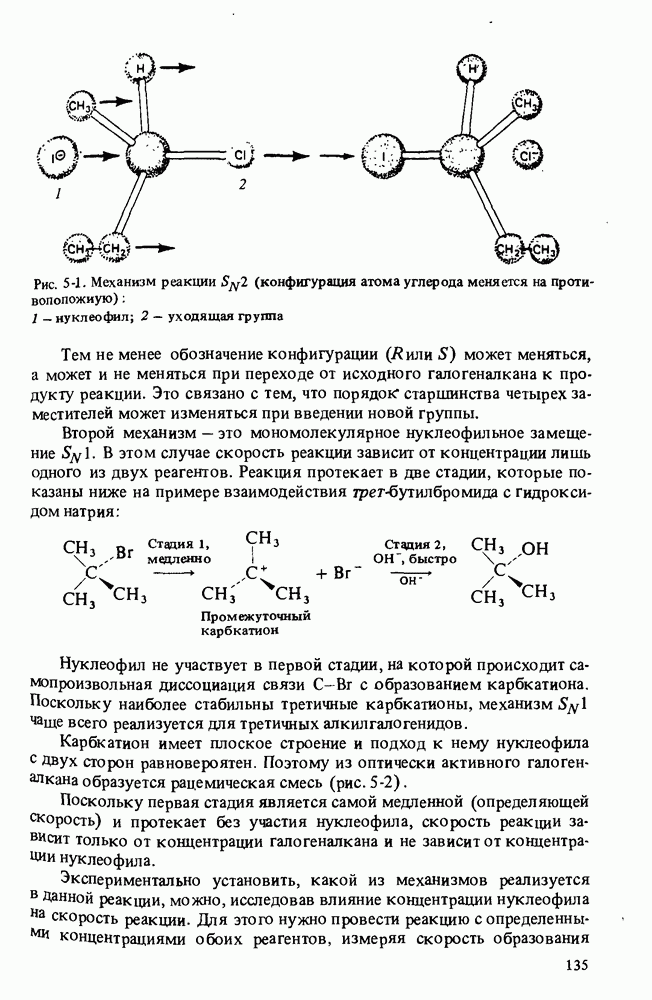
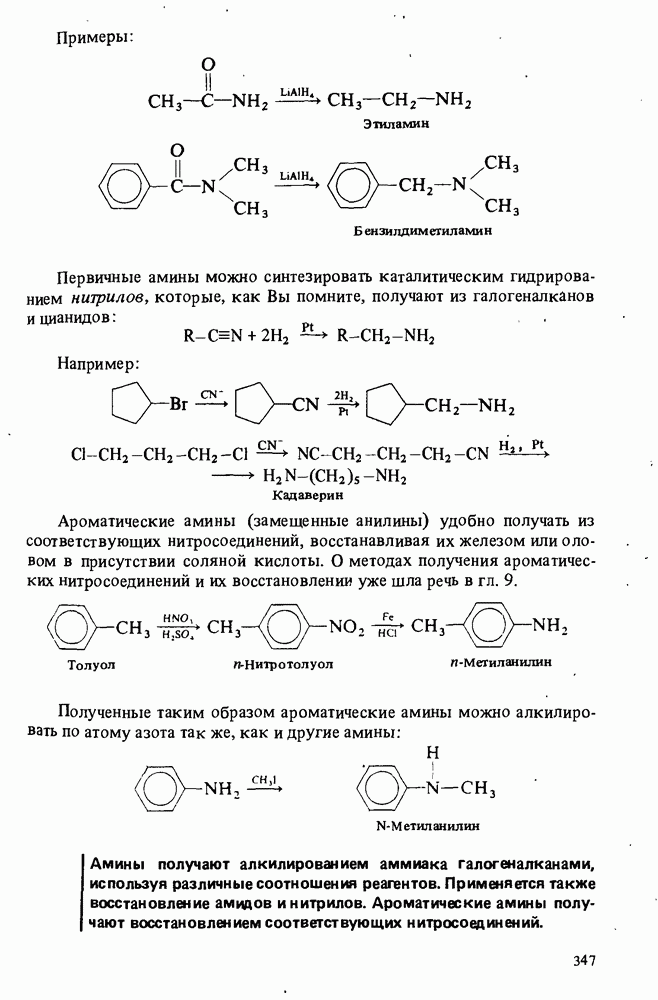
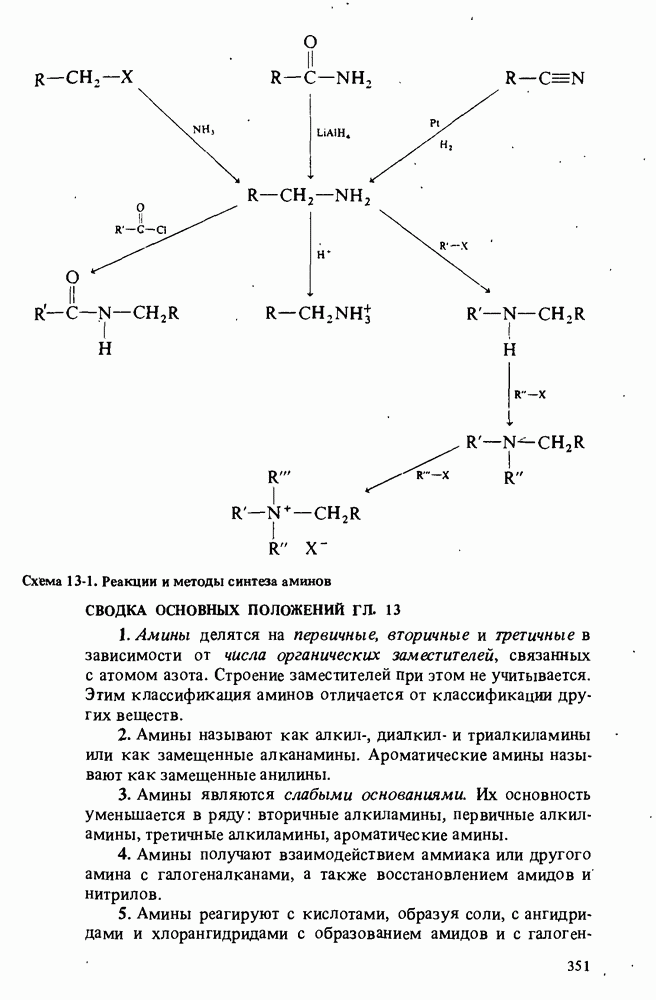
- ПОЛУЧЕНИЕ АМИНОВ
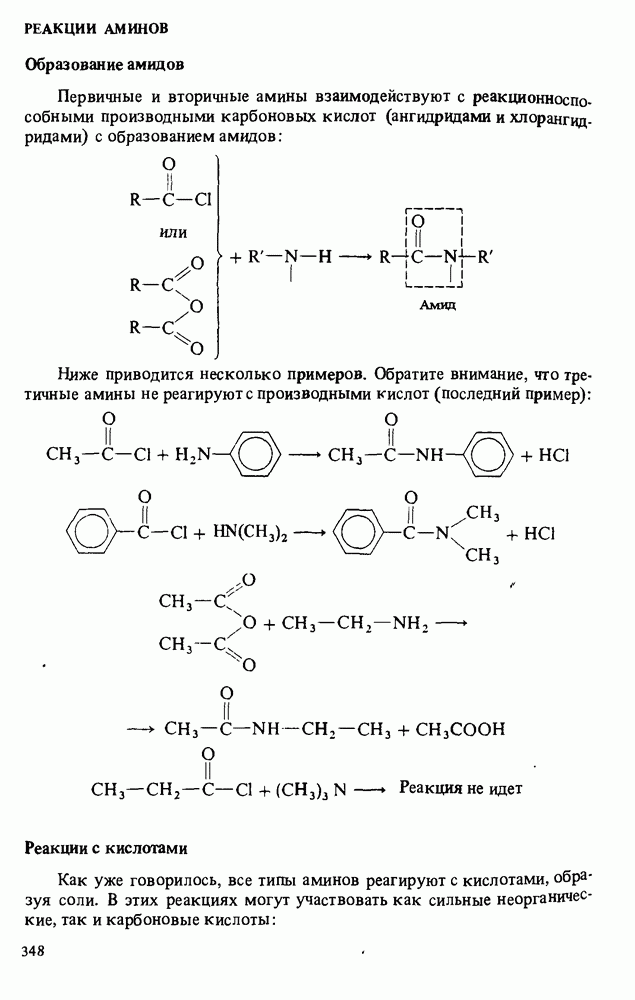
- РЕАКЦИИ АМИНОВ
- Прикладная органическая химия: ПОЛИМЕРЫ, ПОДВЕРГАЮЩИЕСЯ БИОЛОГИЧЕСКОЙ ДЕСТРУКЦИИ
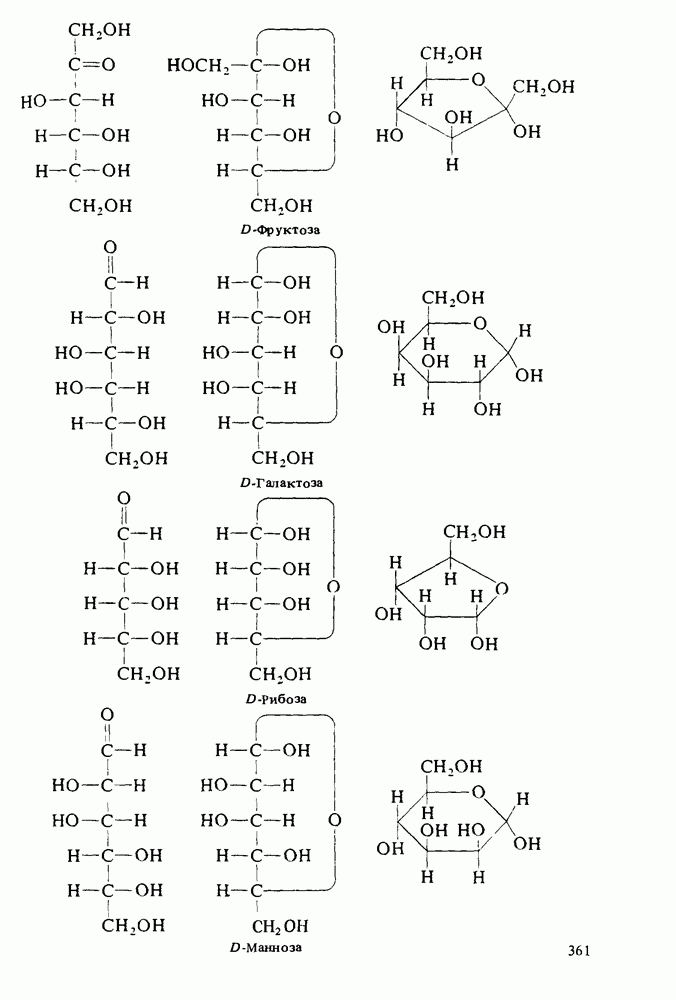
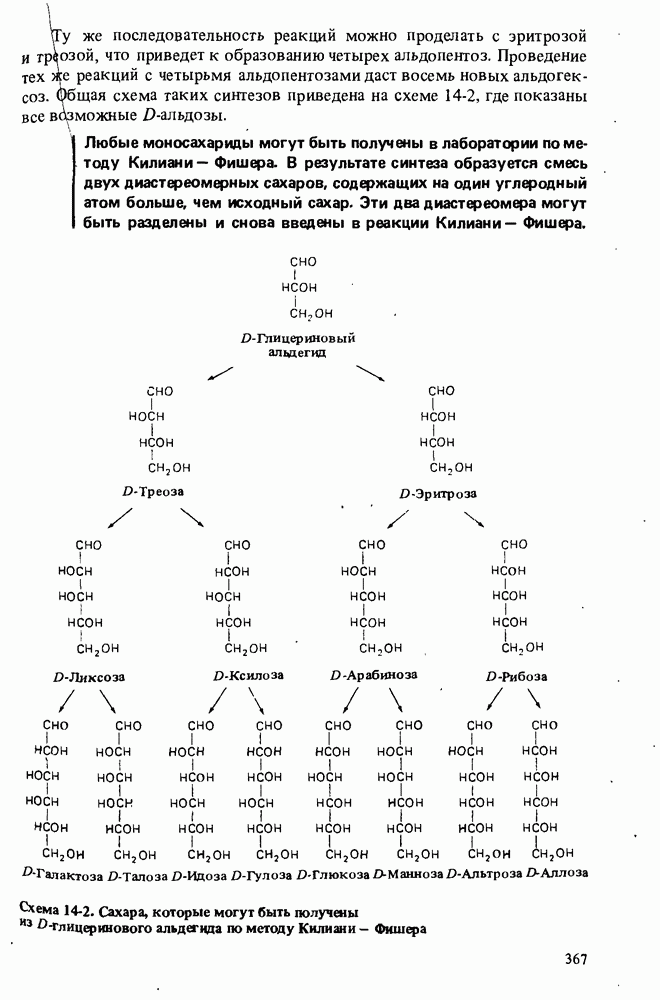
- Глава 14. УГЛЕВОДЫ
- МОНОСАХАРИДЫ
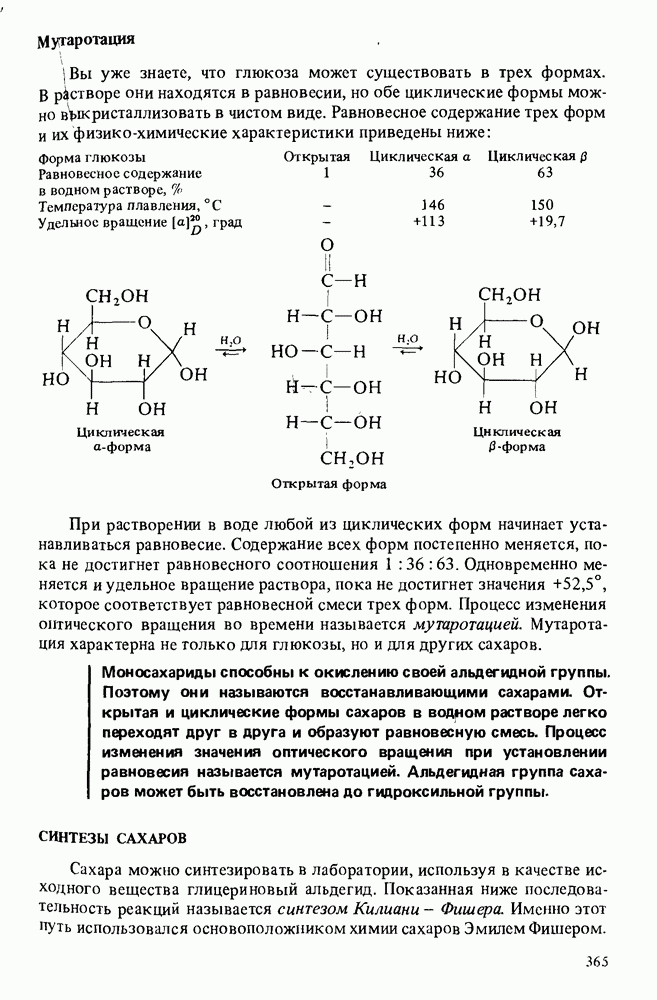
- РЕАКЦИИ МОНОСАХАРИДОВ
- СИНТЕЗЫ САХАРОВ
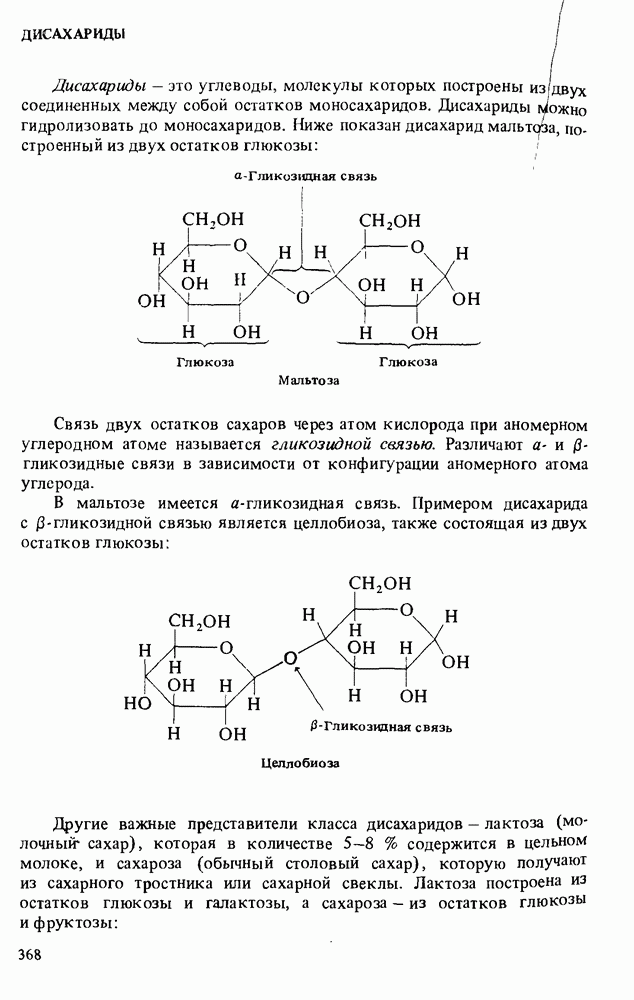
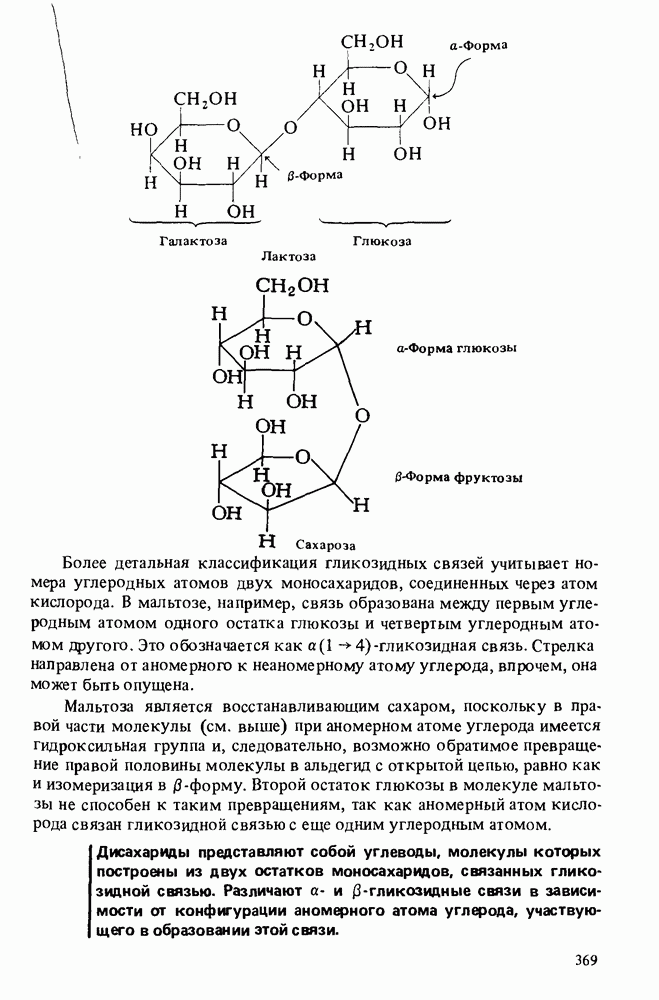
- ДИСАХАРИДЫ
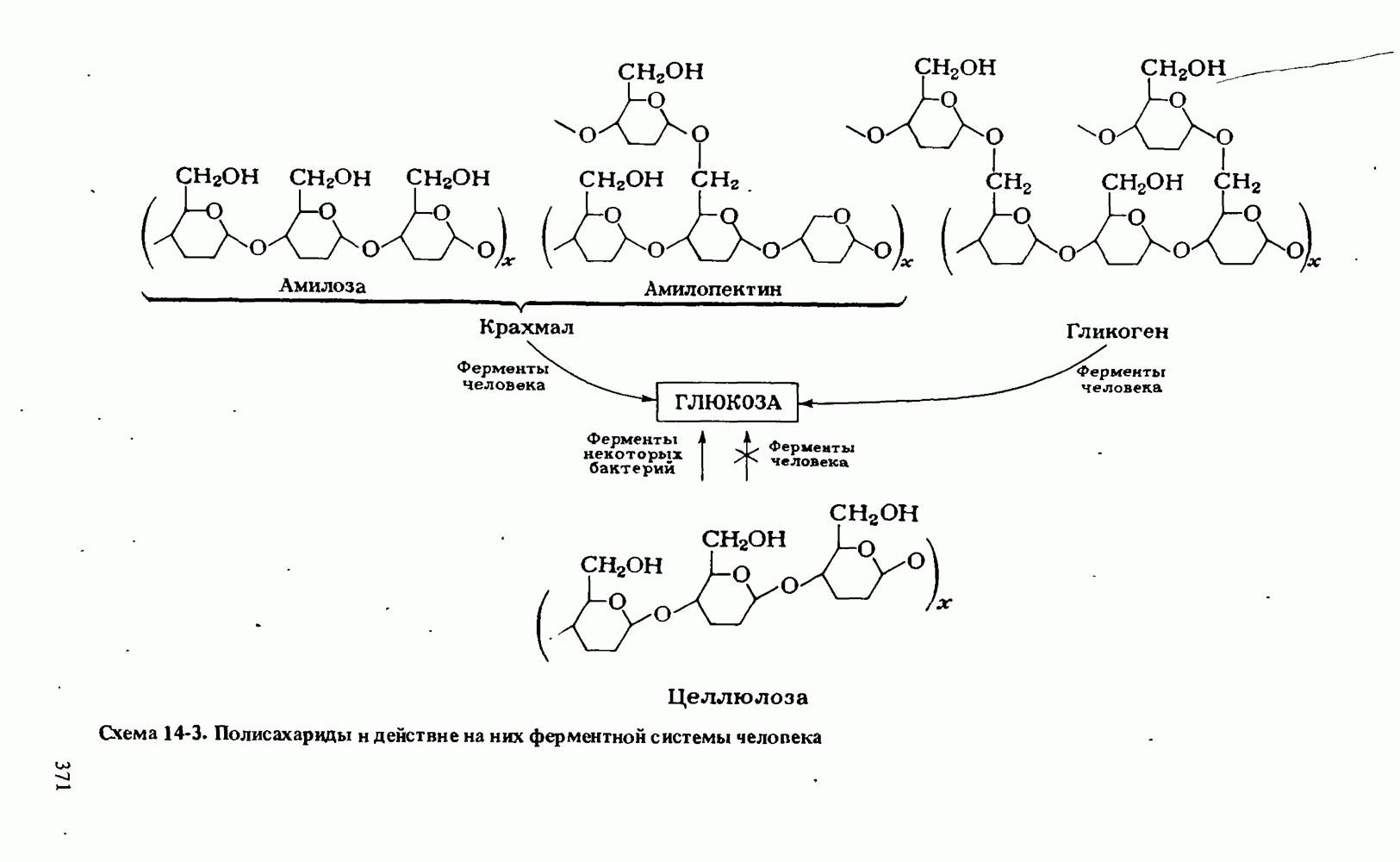
- ПОЛИСАХАРИДЫ
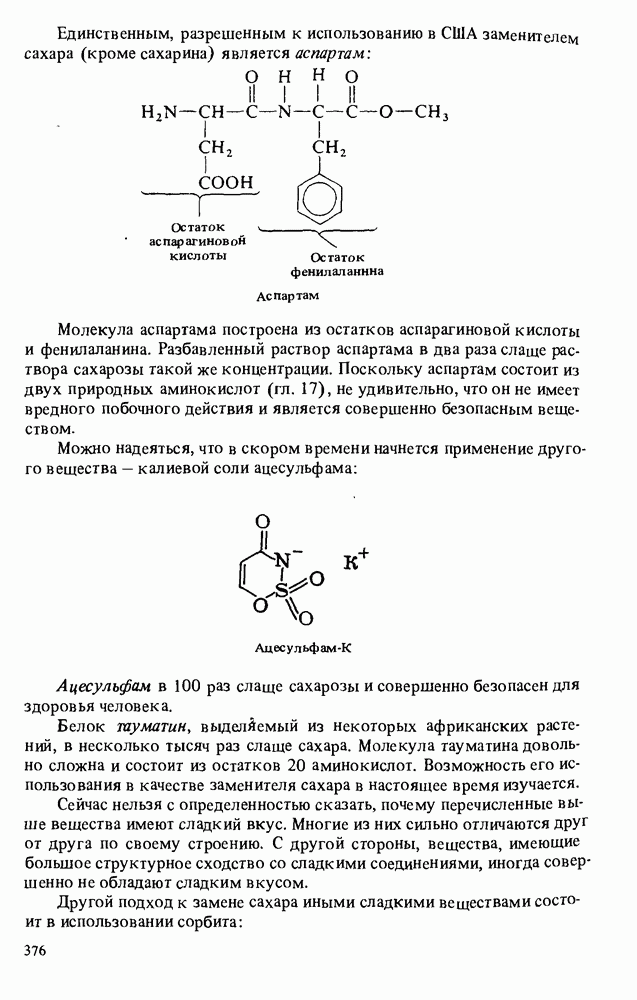
- Прикладная органическая химия: ПИЩЕВЫЕ СВОЙСТВА УГЛЕВОДОВ
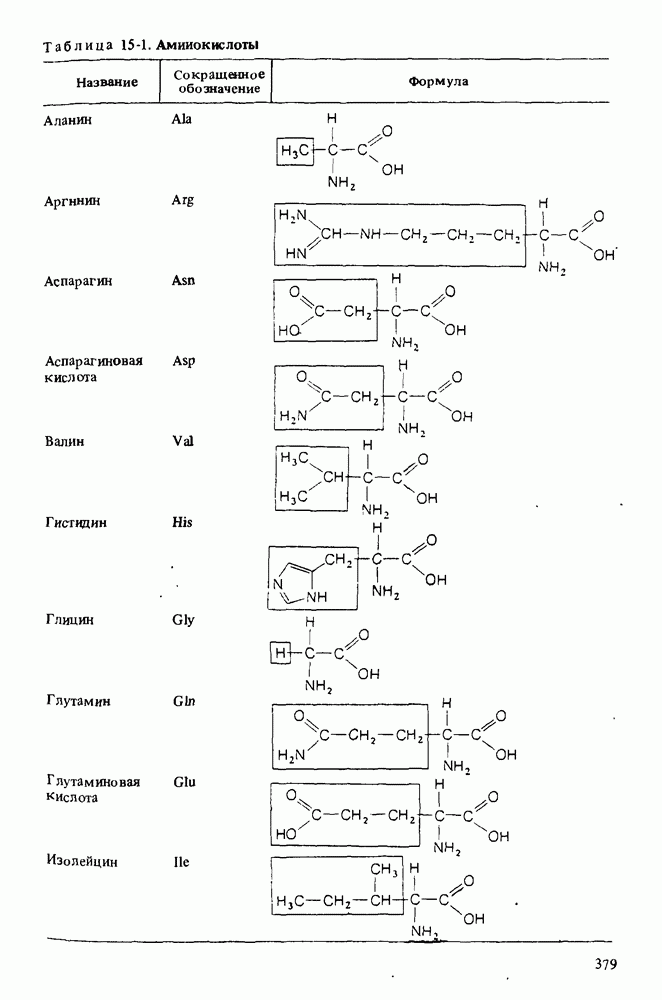
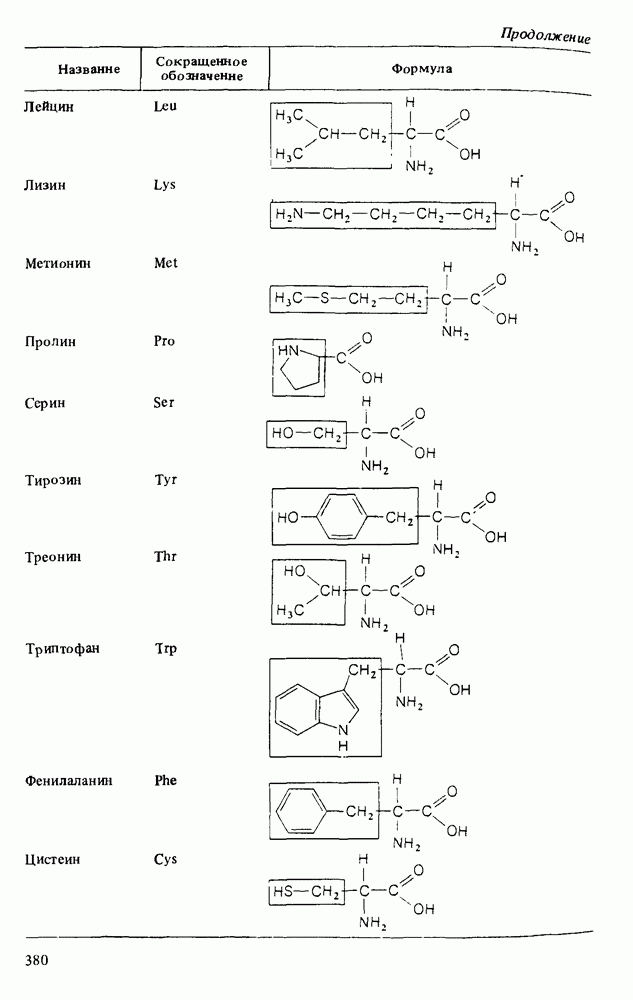
- Глава 15. АМИНОКИСЛОТЫ И БЕЛКИ
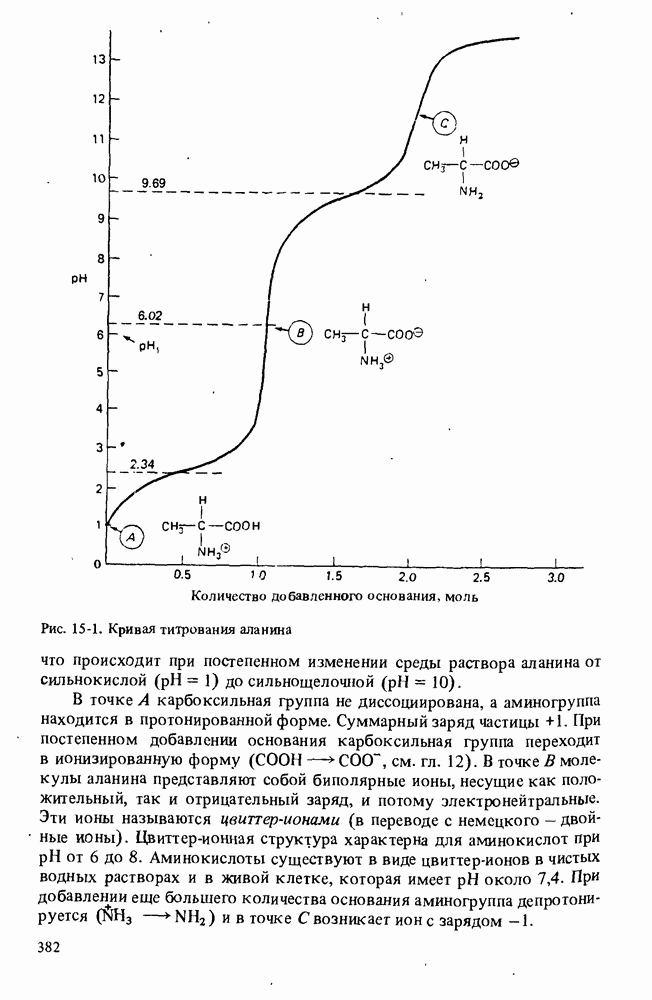
- КИСЛОТНО-ОСНОВНЫЕ СВОЙСТВА АМИНОКИСЛОТ
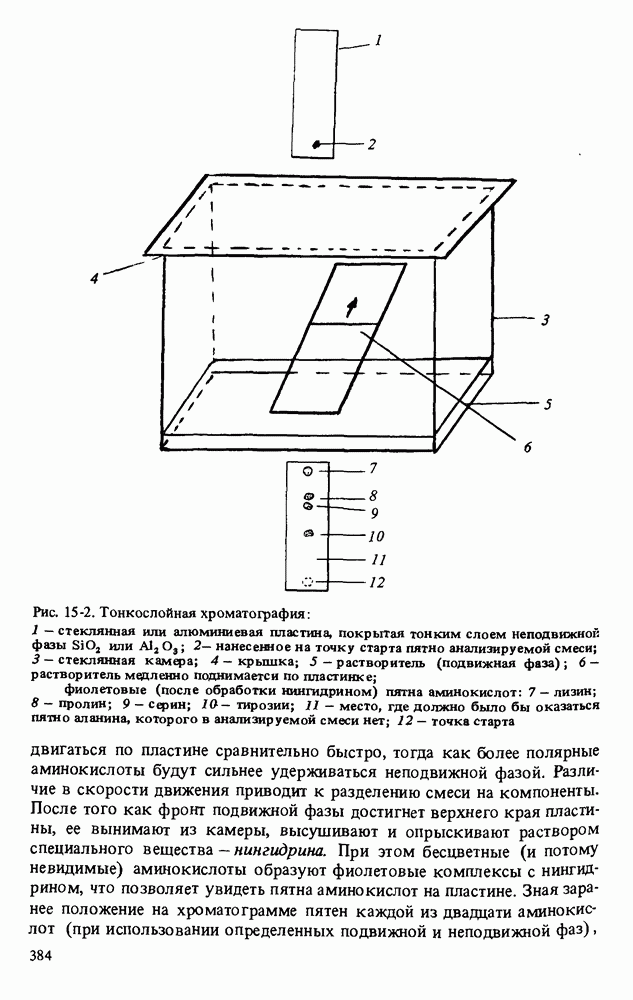
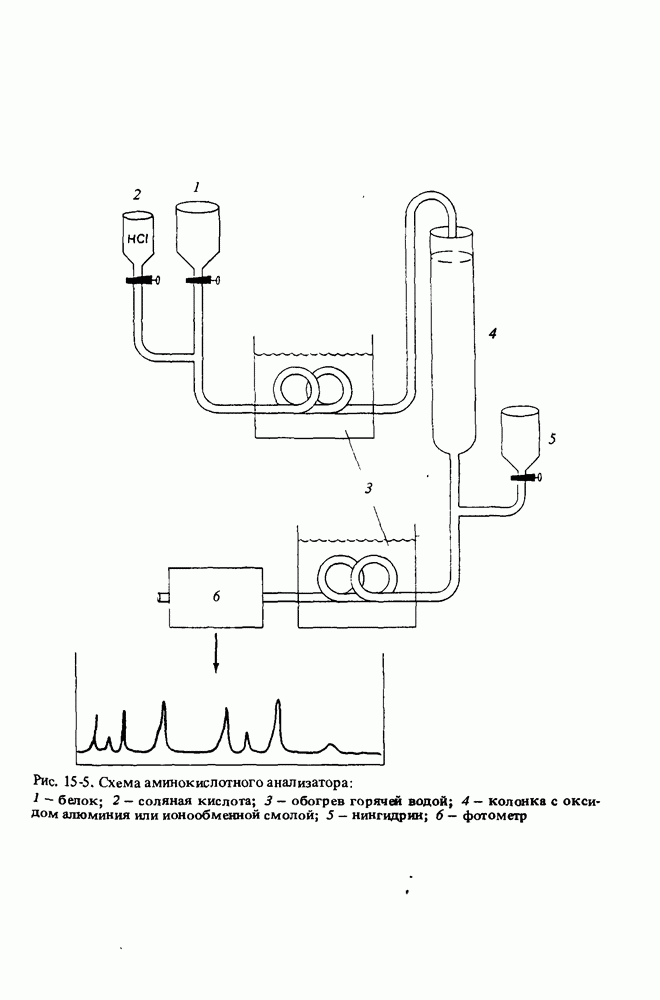
- АНАЛИЗ АМИНОКИСЛОТ
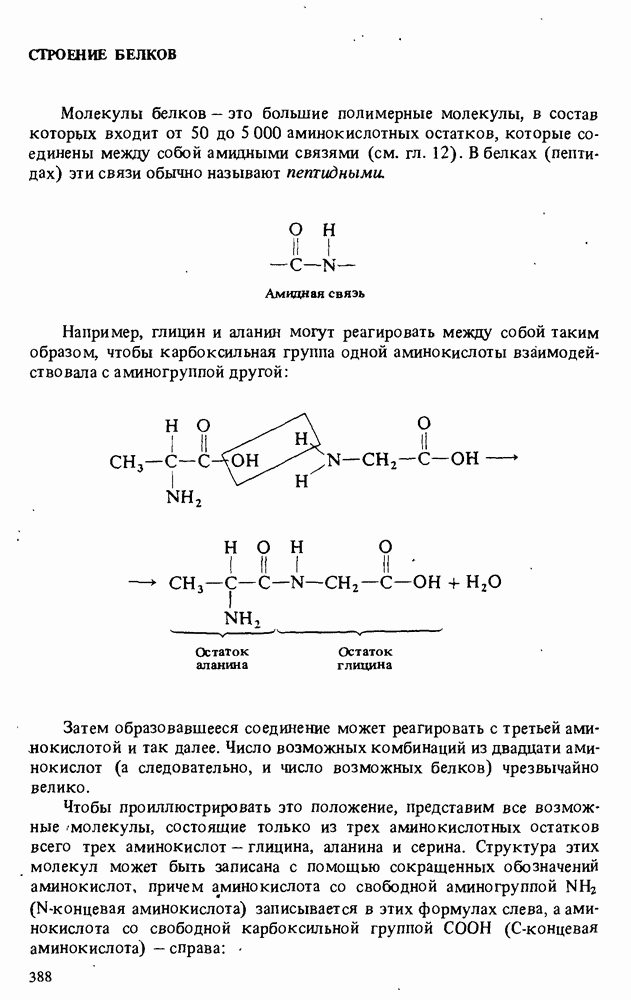
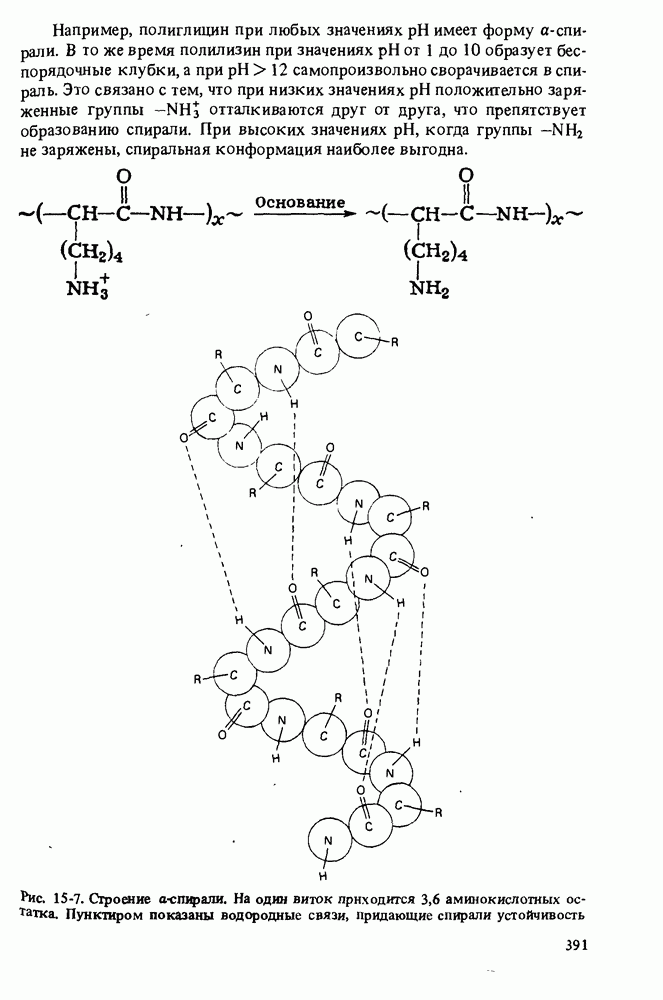
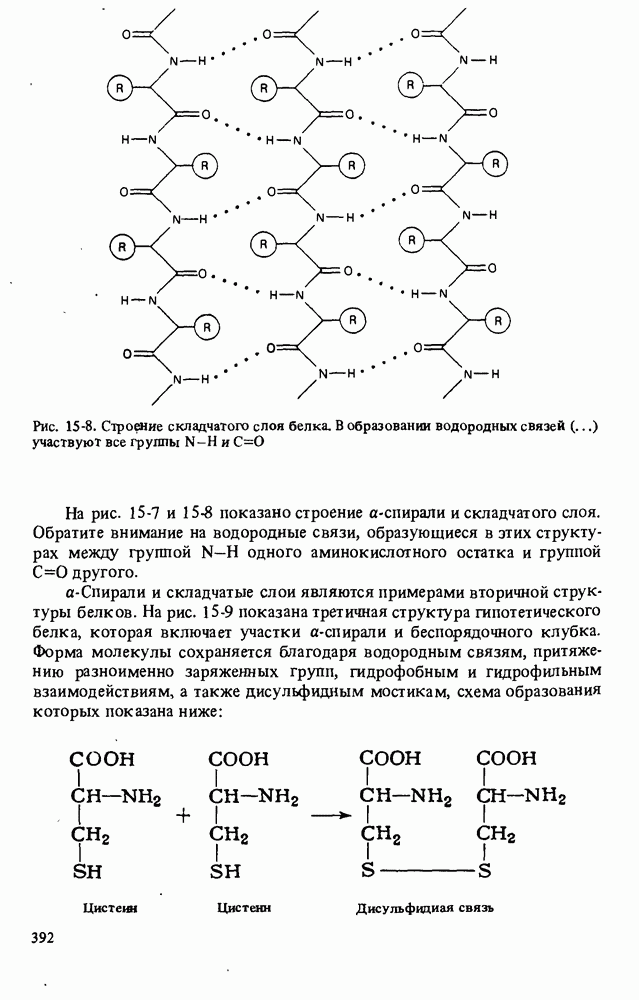
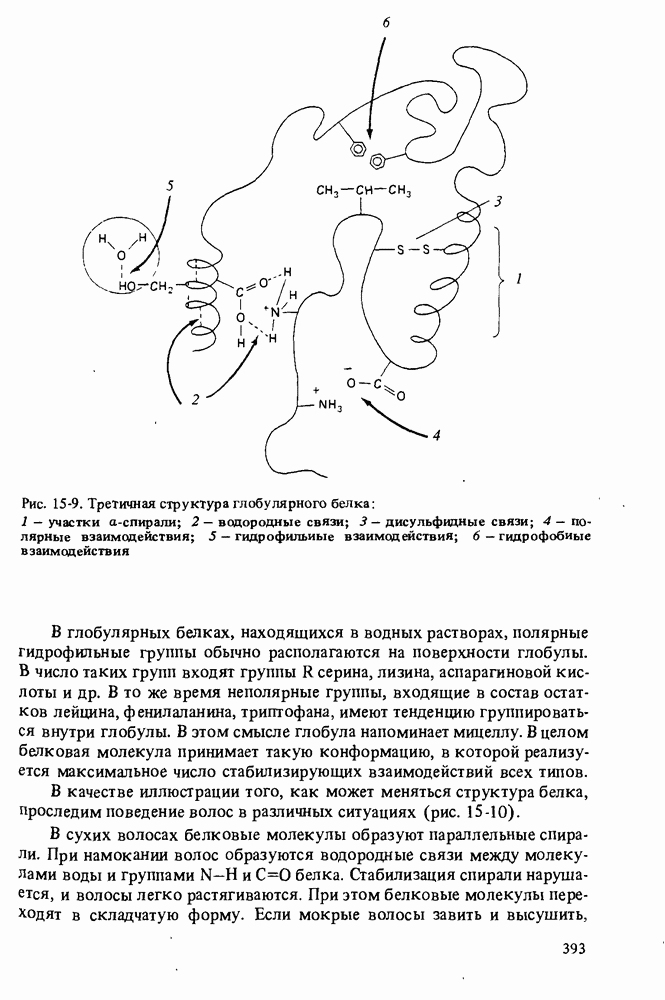
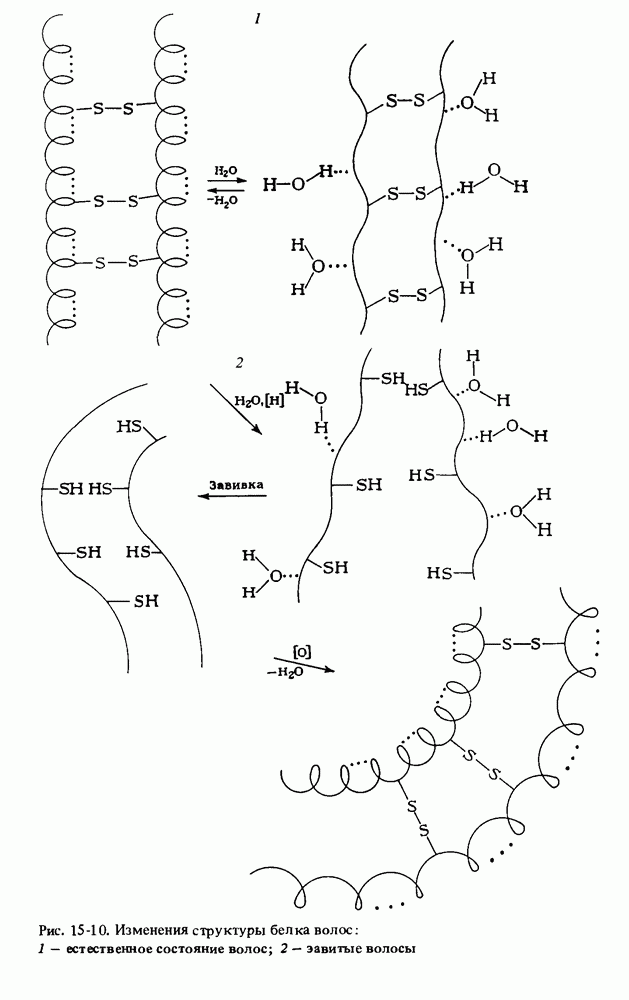
- СТРОЕНИЕ БЕЛКОВ
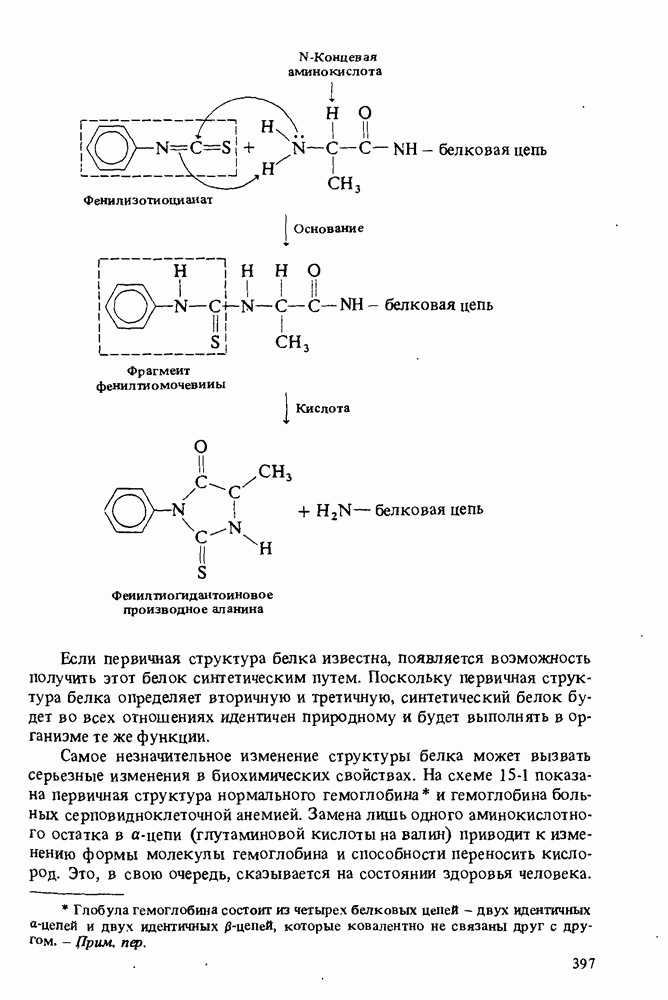
- УСТАНОВЛЕНИЕ ПЕРВИЧНОЙ СТРУКТУРЫ БЕЛКОВ
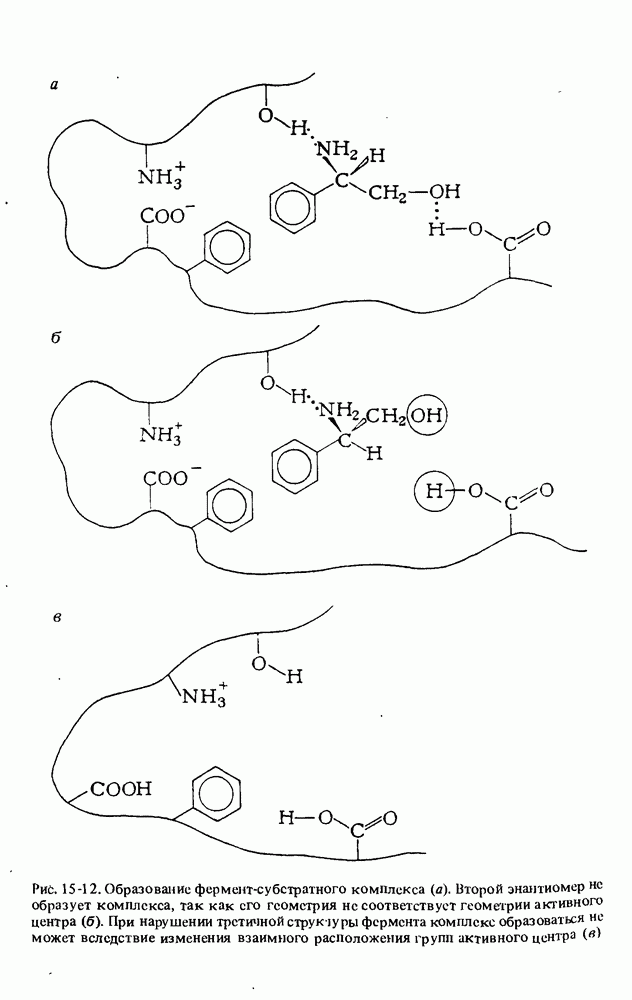
- ФЕРМЕНТЫ
- Глава 16. ЛИПИДЫ
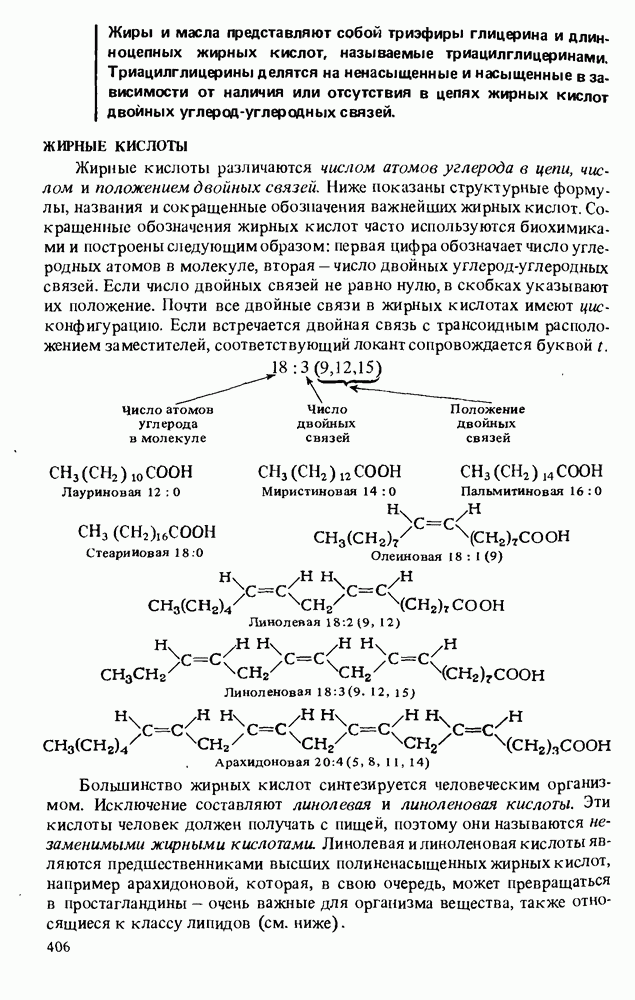
- ЖИРНЫЕ КИСЛОТЫ
- НАЗВАНИЯ ТРИАЦИЛГЛИЦЕРИНОВ
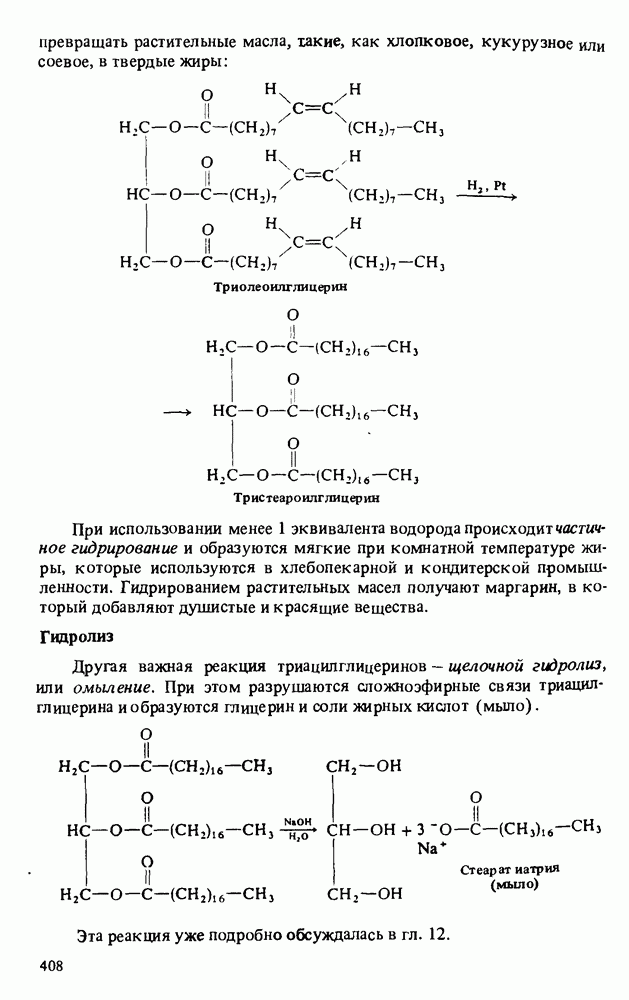
- РЕАКЦИИ ТРИАЦИЛГЛИЦЕРИНОВ
- ЛИПИДЫ, ОТЛИЧНЫЕ ОТ ТРИАЦИЛГЛИЦЕРИНОВ
- Прикладная органическая химия: ПИЩЕВЫЕ СВОЙСТВА ЛИПИДОВ
- Глава 17. НУКЛЕИНОВЫЕ КИСЛОТЫ
- РИБОНУКЛЕИНОВЫЕ КИСЛОТЫ
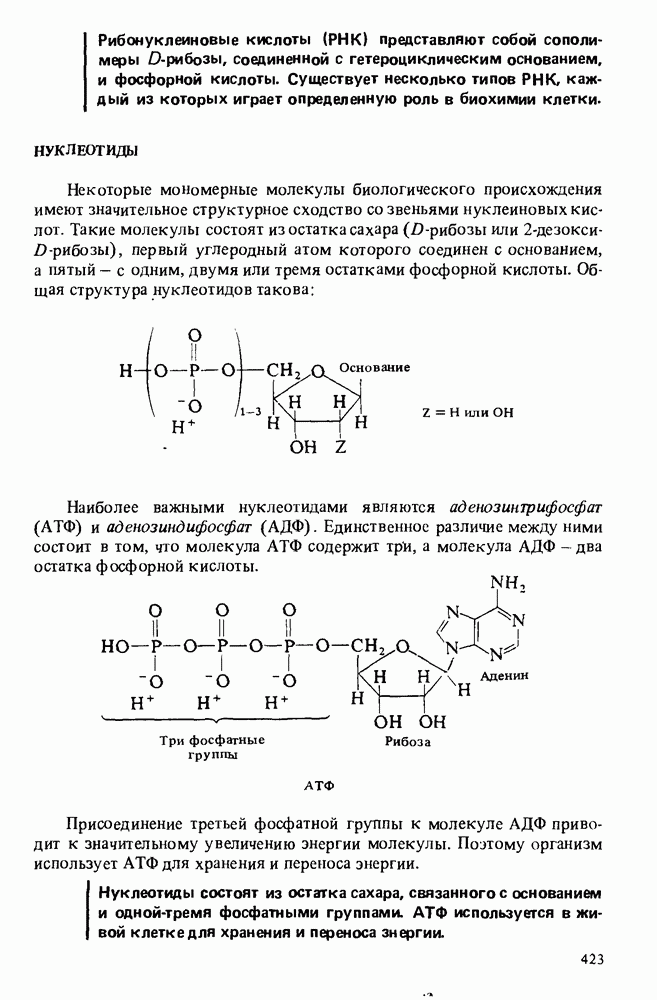
- НУКЛЕОТИДЫ
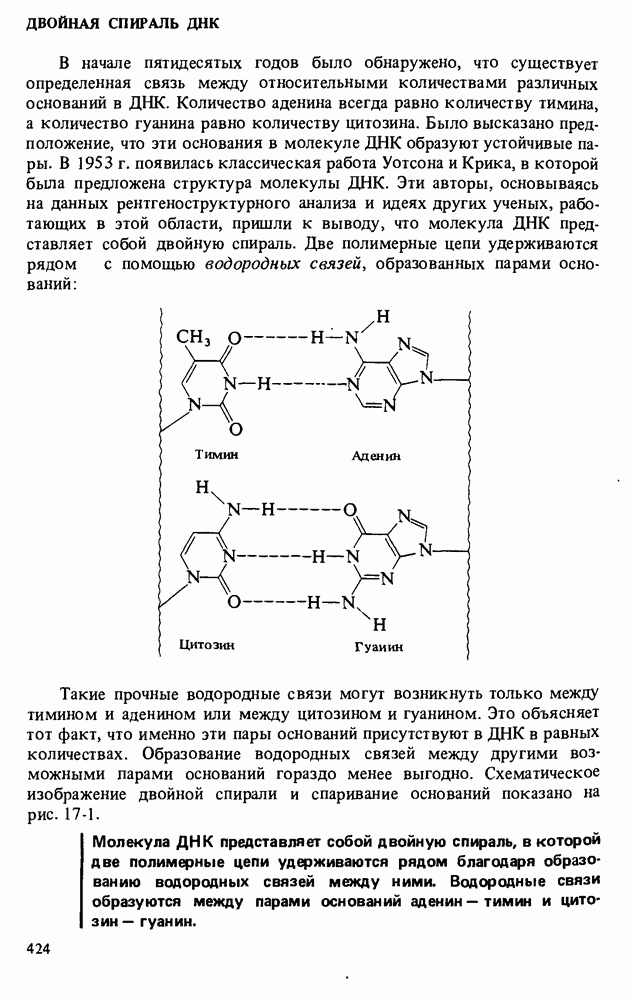
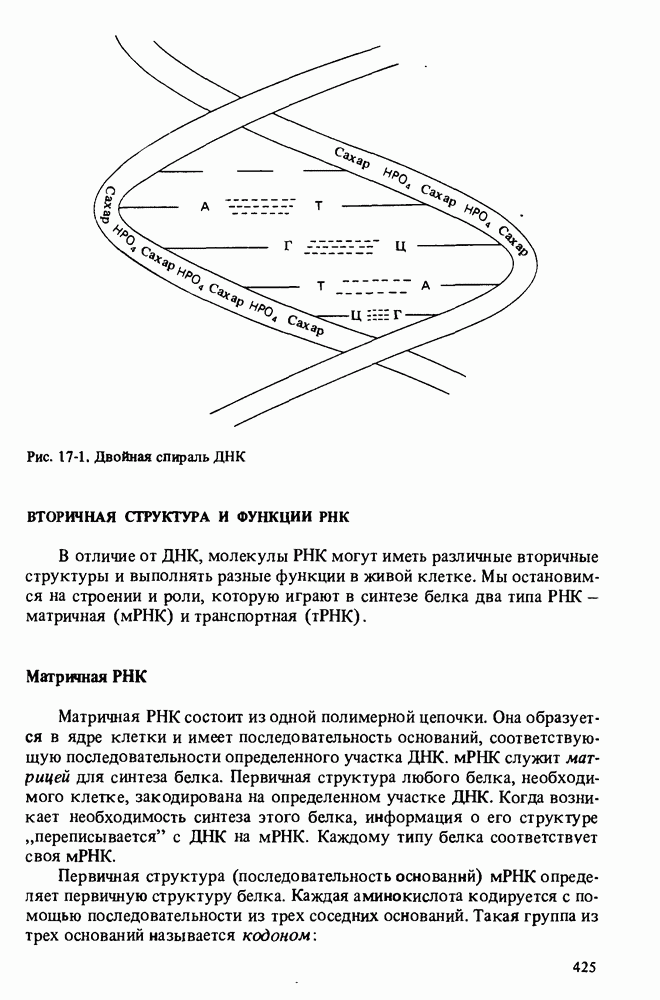
- ДВОЙНАЯ СПИРАЛЬ ДНК
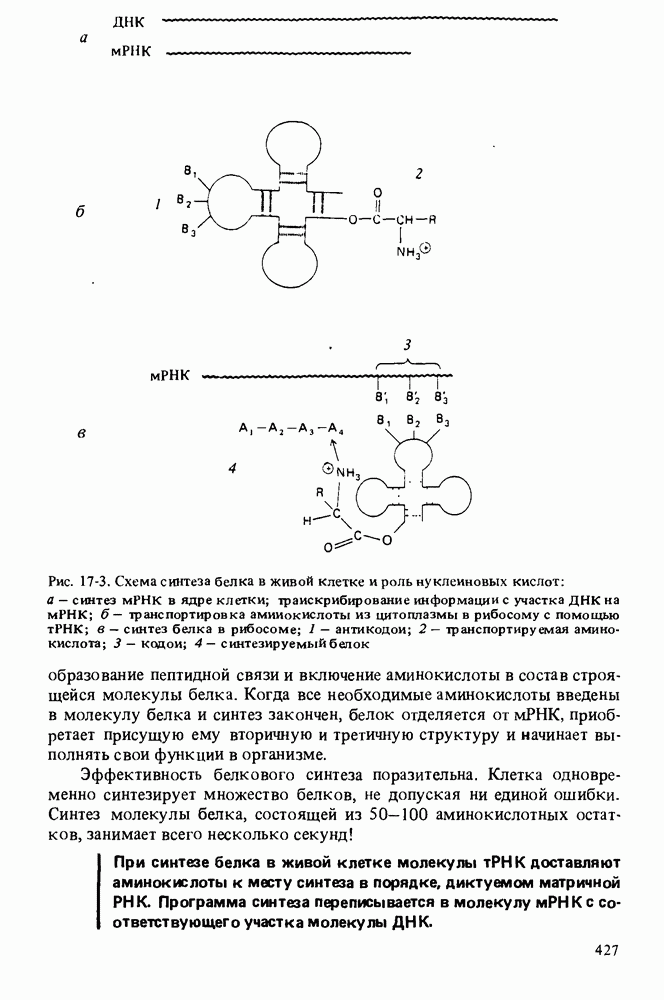
- ВТОРИЧНАЯ СТРУКТУРА И ФУНКЦИИ РНК
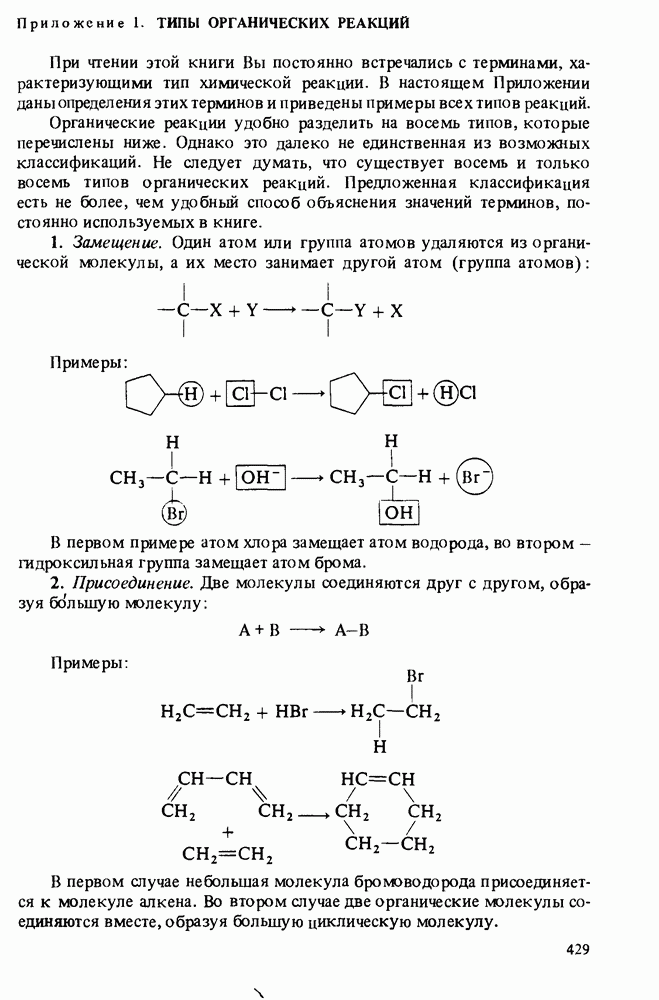
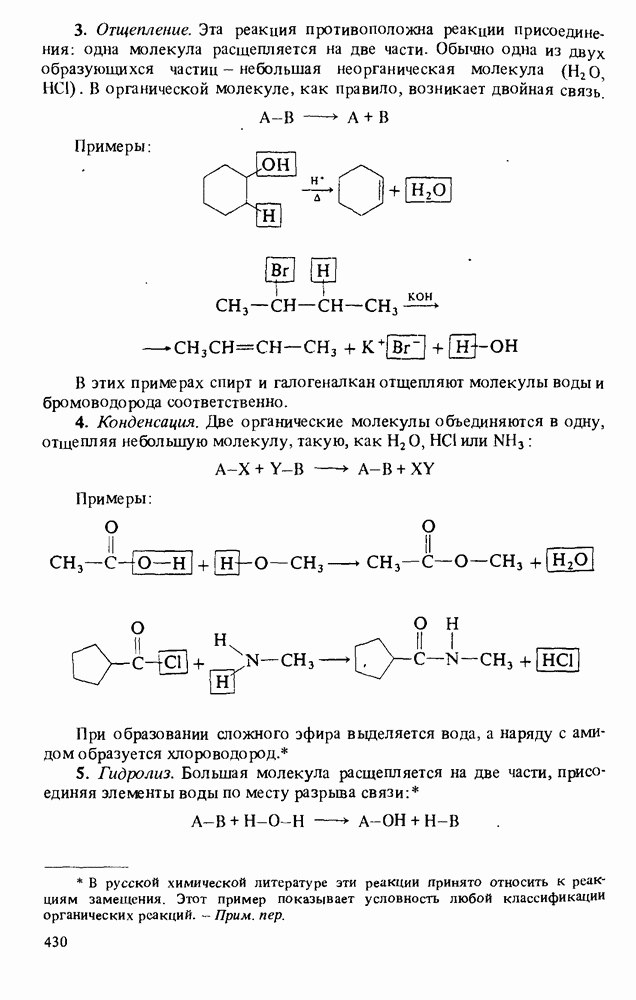
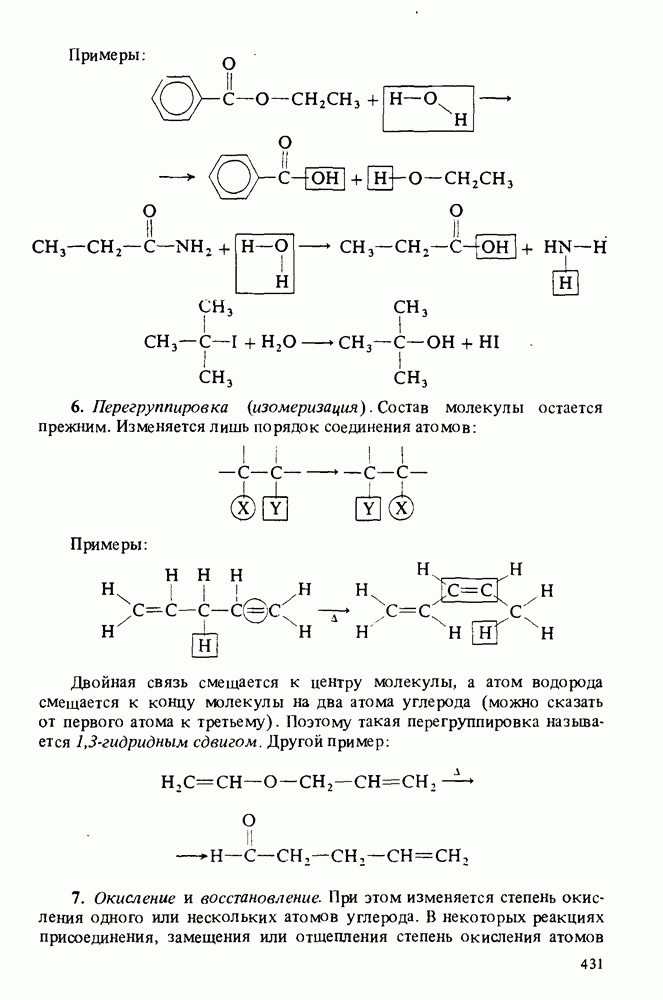
- Приложение 1. ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
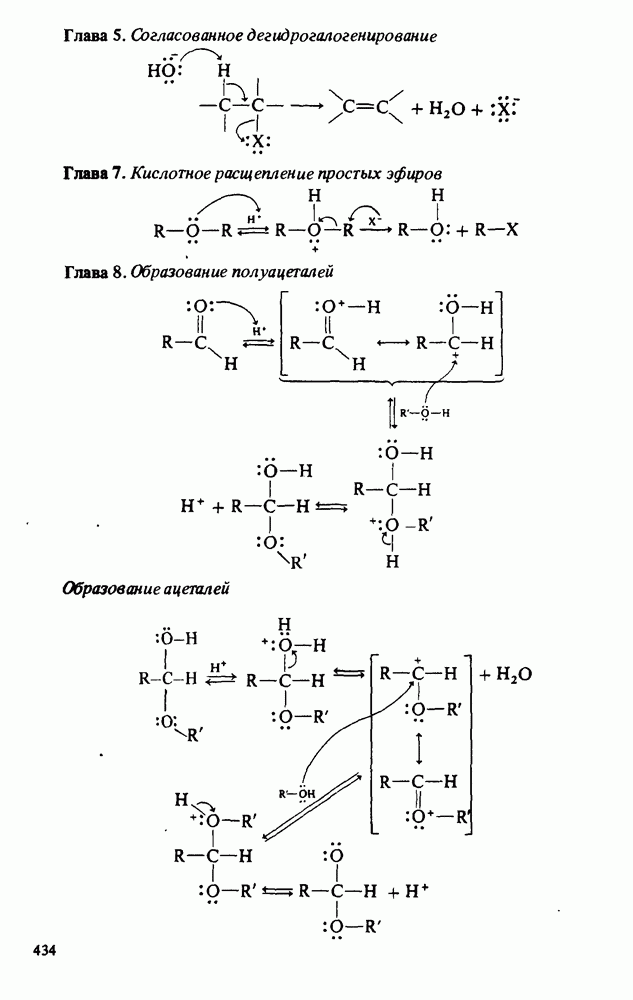
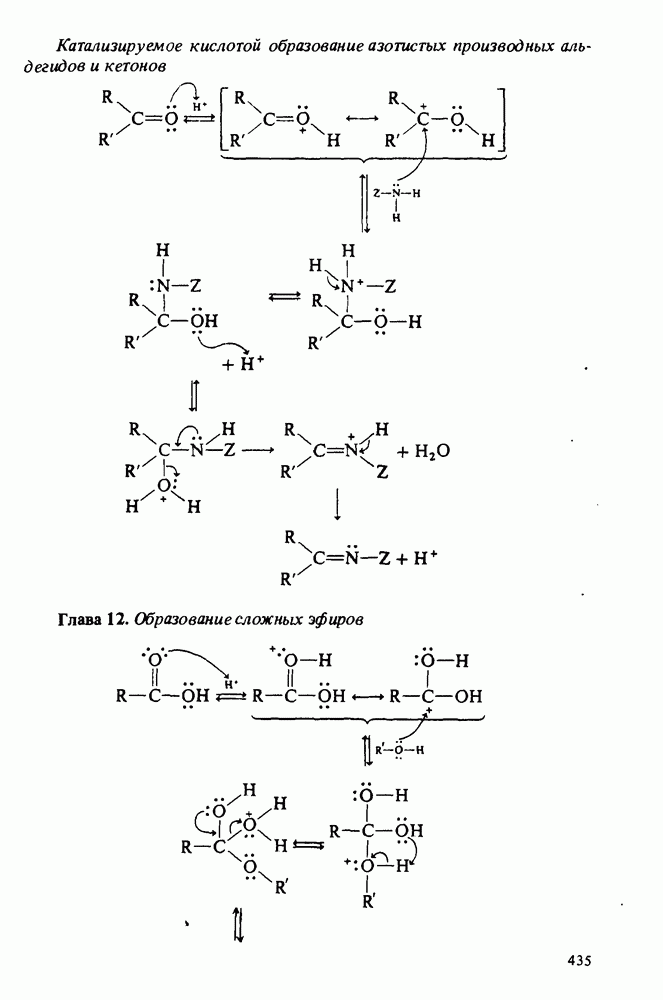
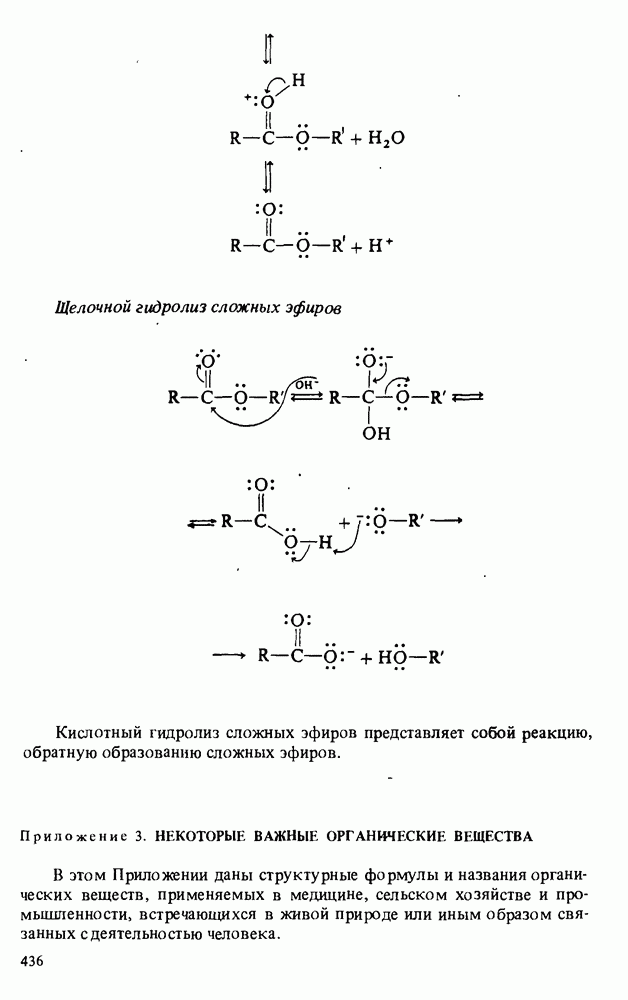
- Приложение 2. МЕХАНИЗМЫ НЕКОТОРЫХ РЕАКЦИЙ
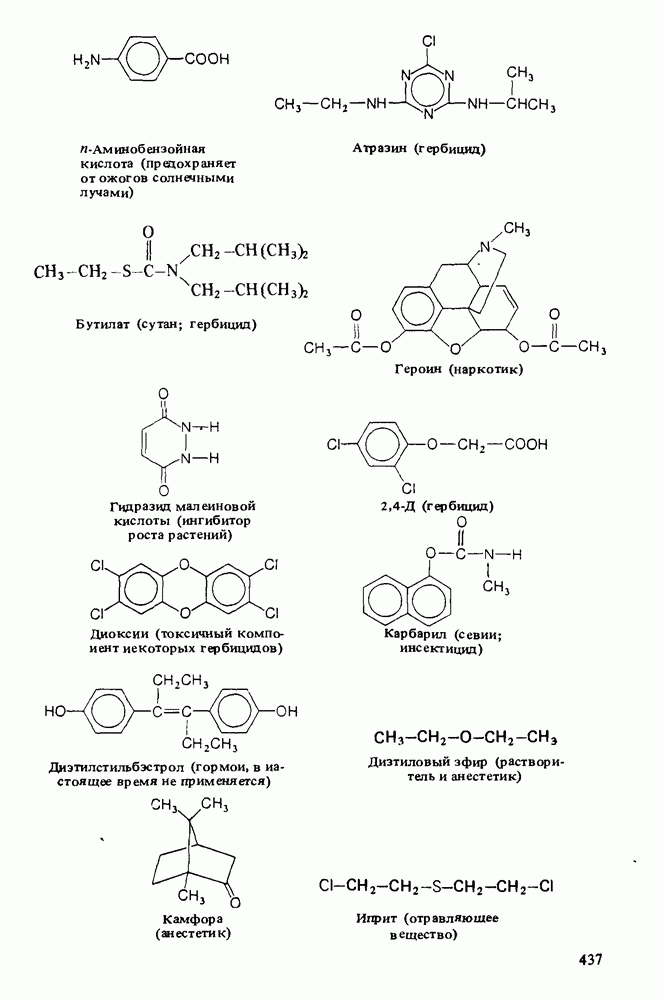
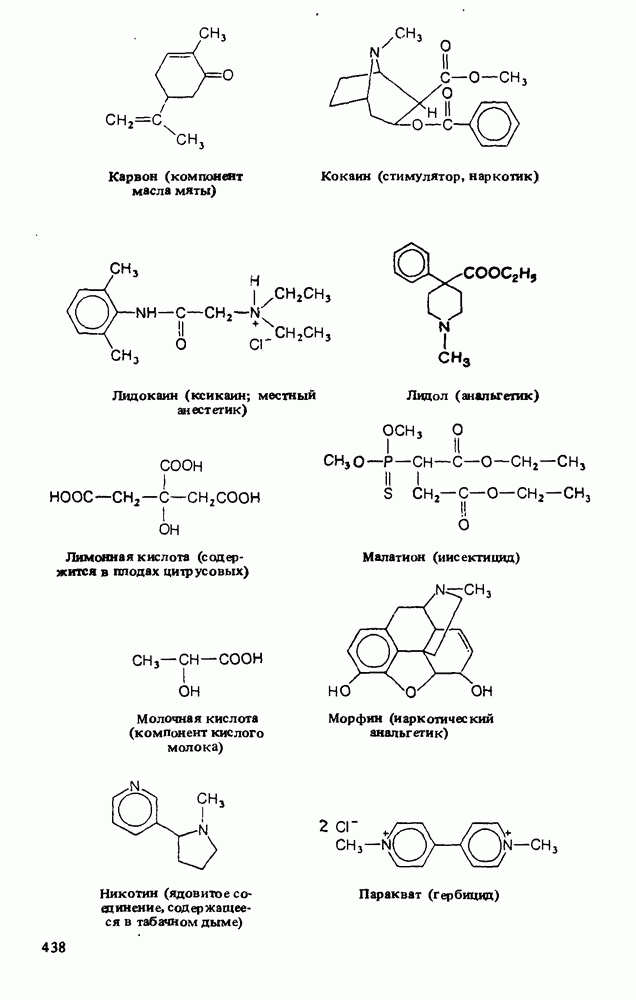
- Приложение 3. НЕКОТОРЫЕ ВАЖНЫЕ ОРГАНИЧЕСКИЕ ВЕЩЕСТВА