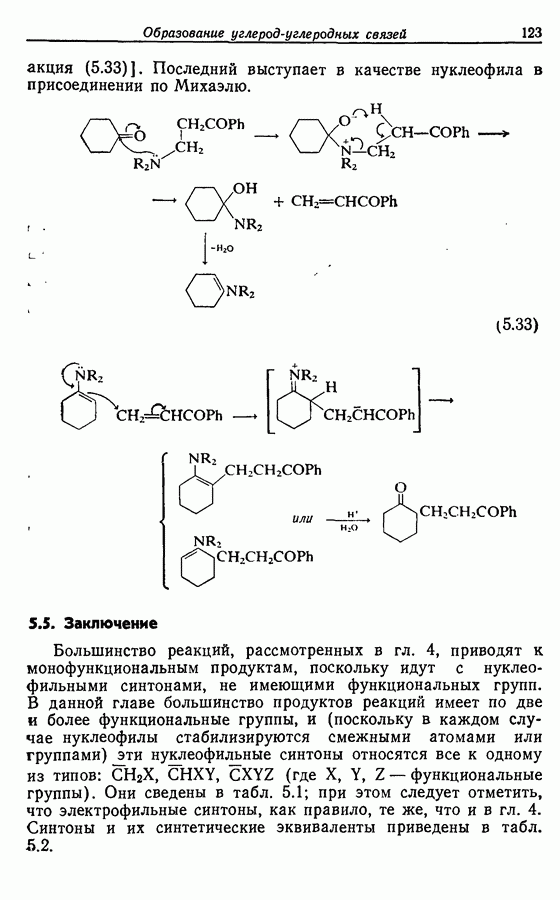
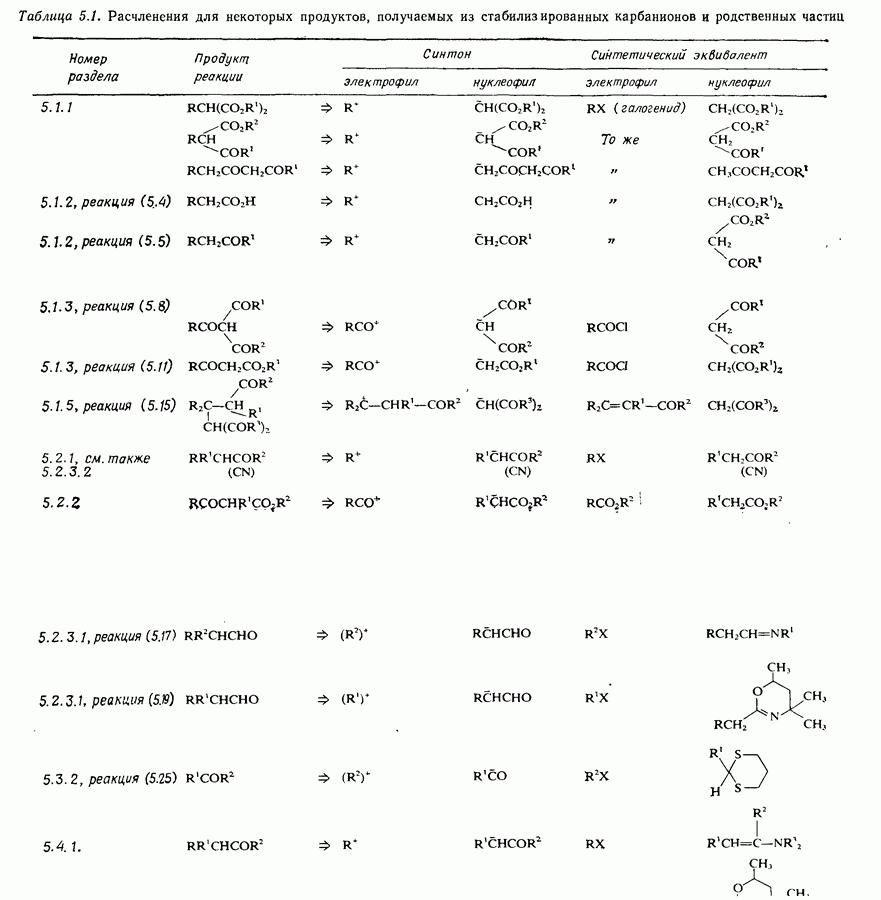
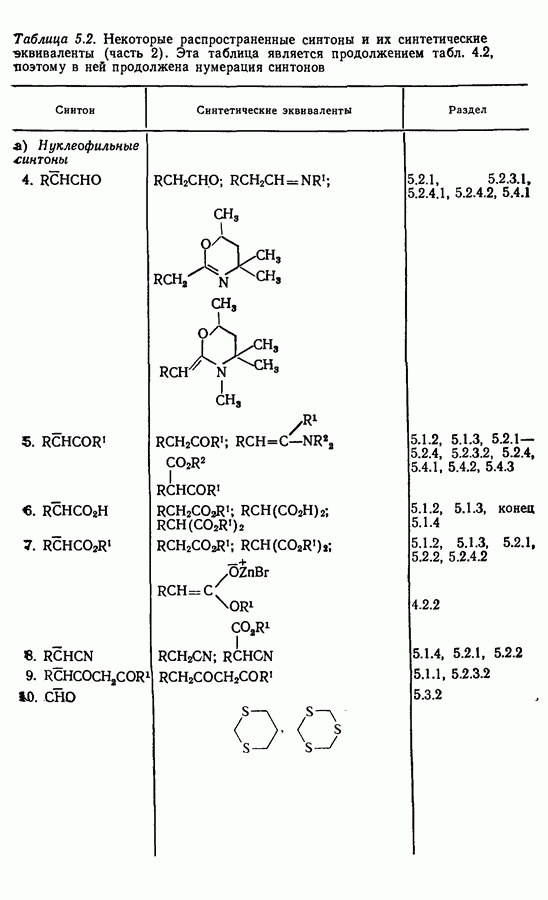
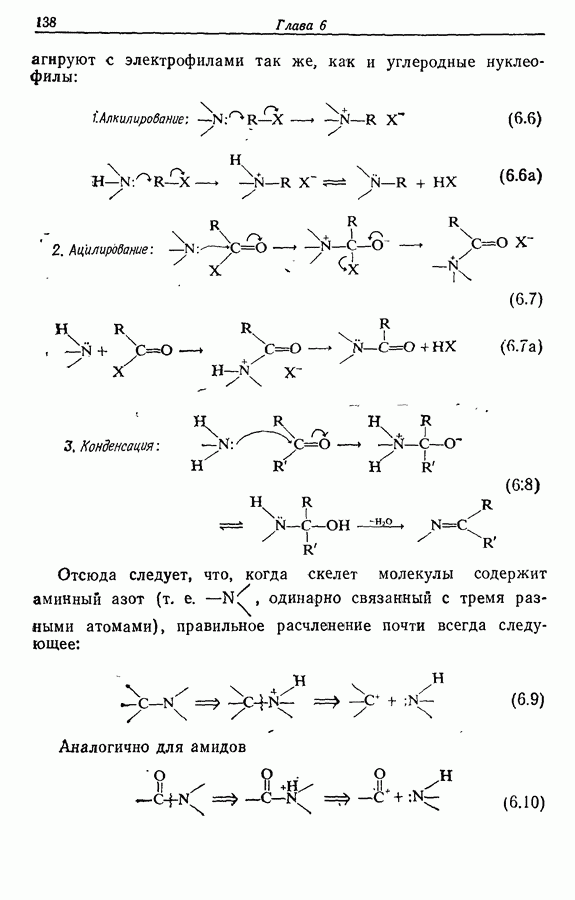
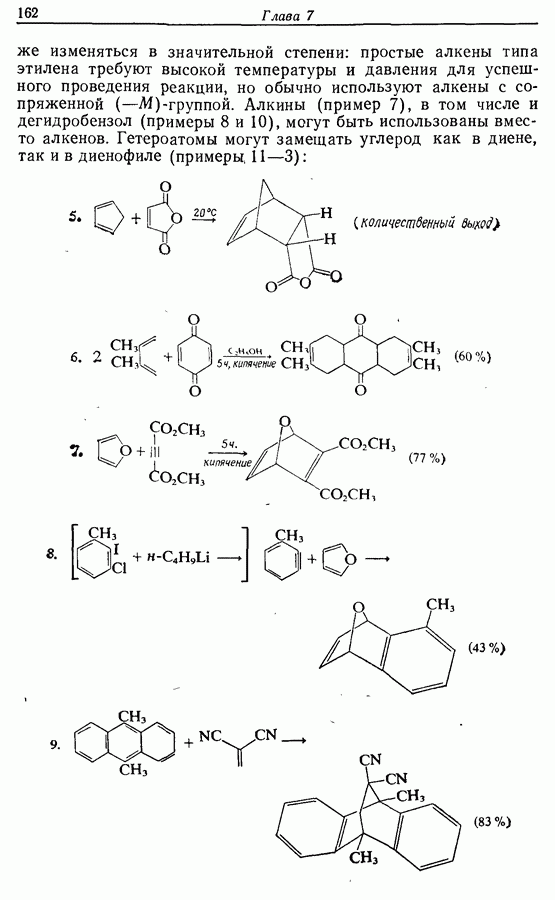
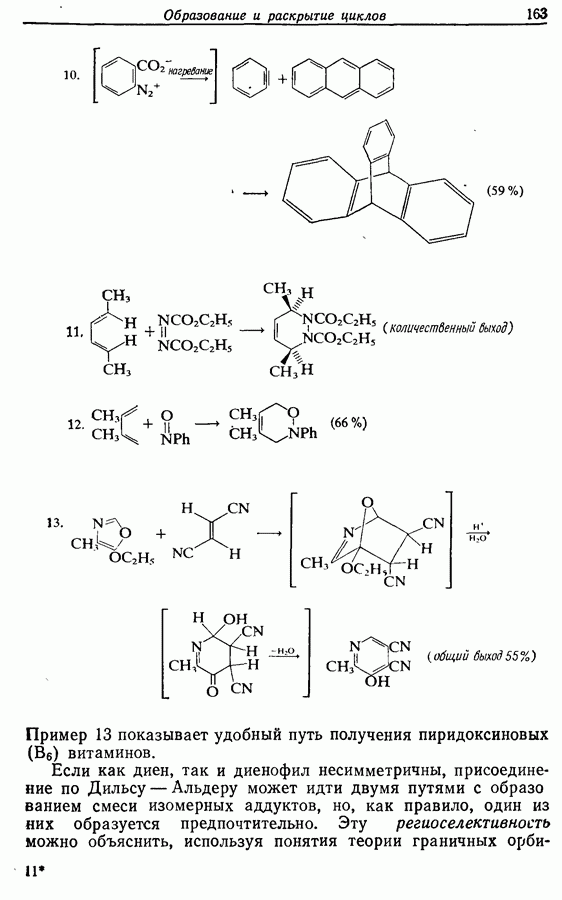
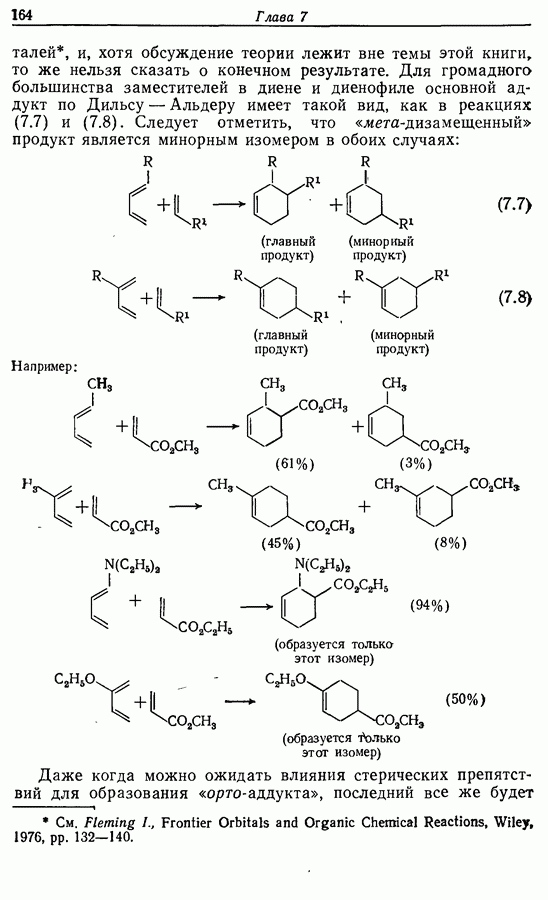
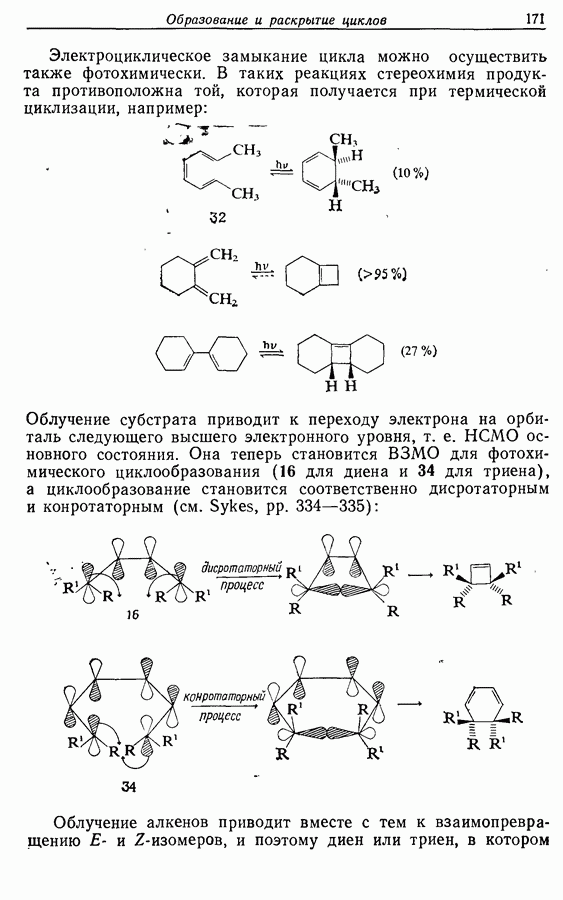
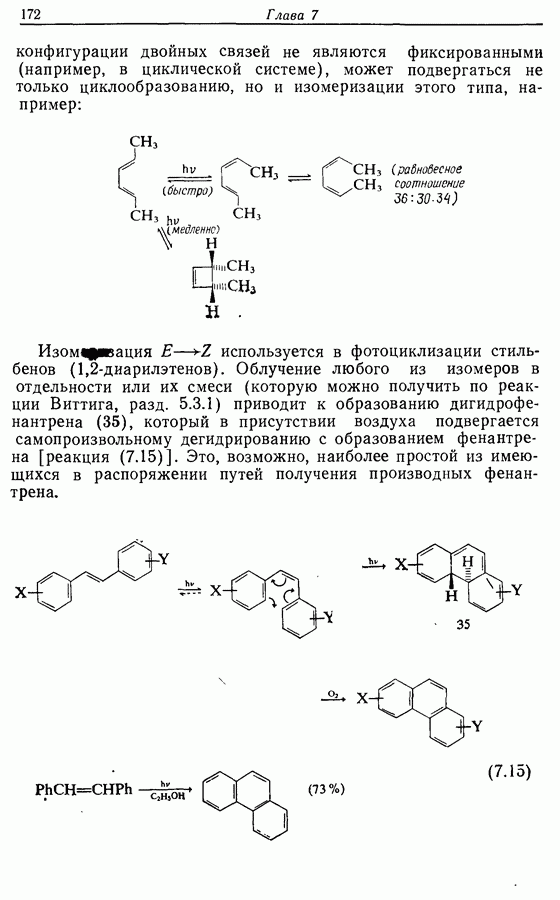
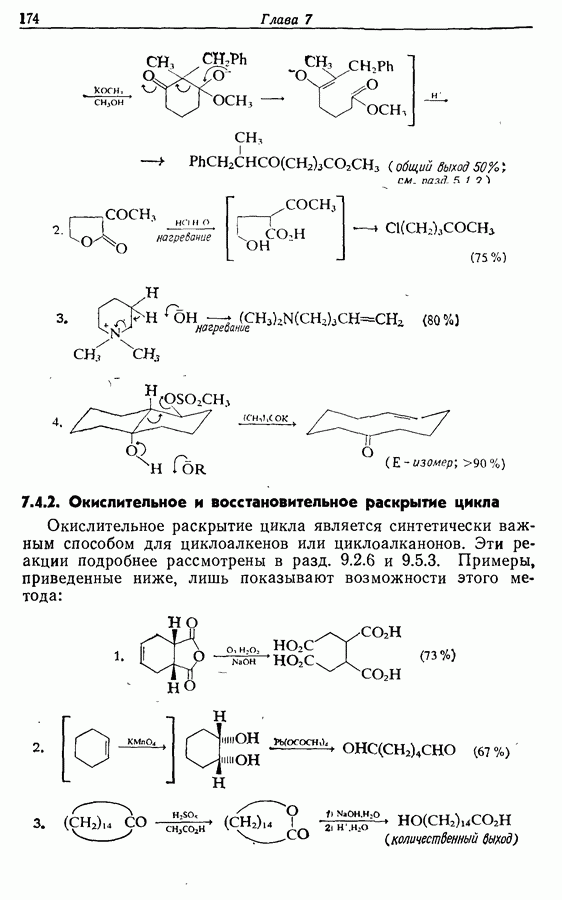
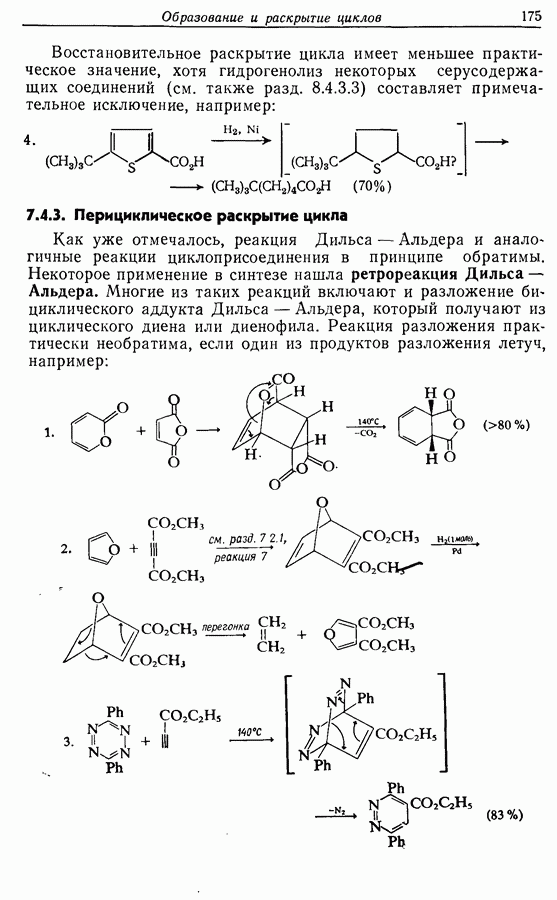
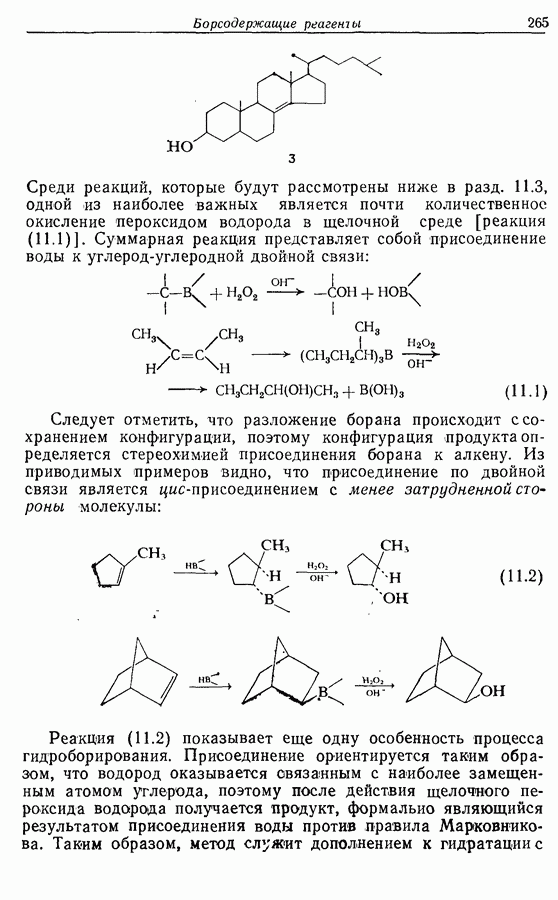
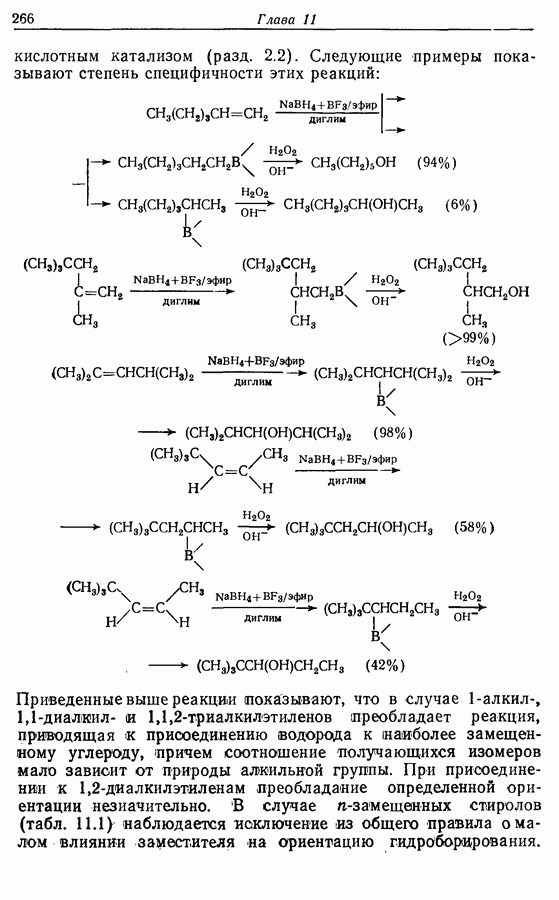
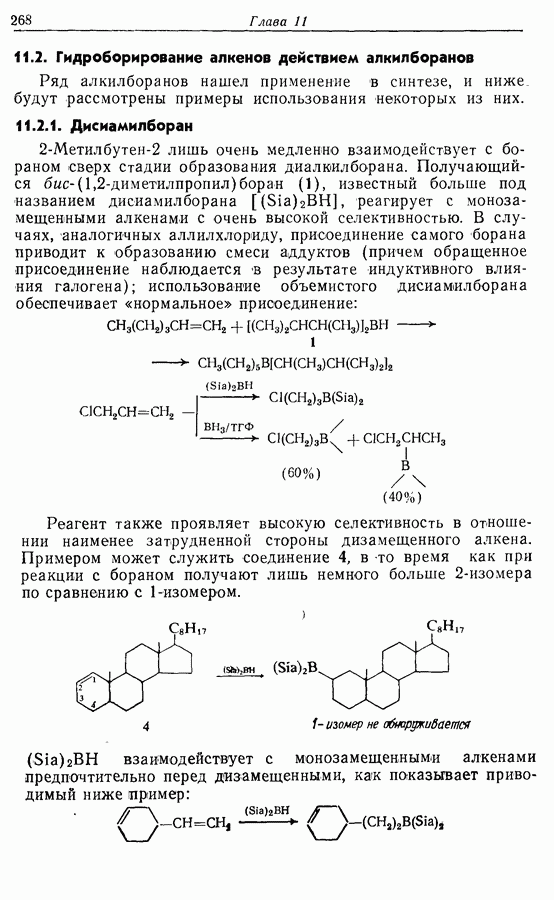
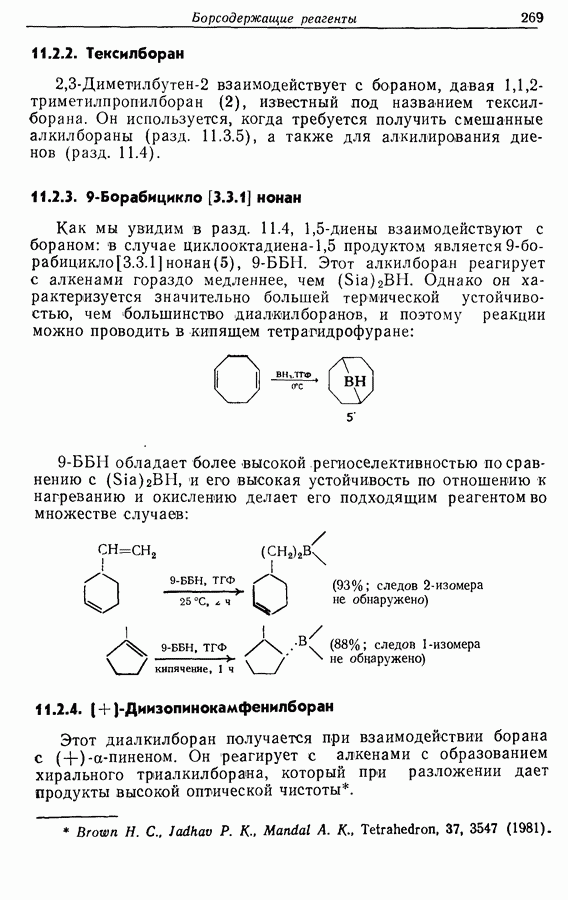
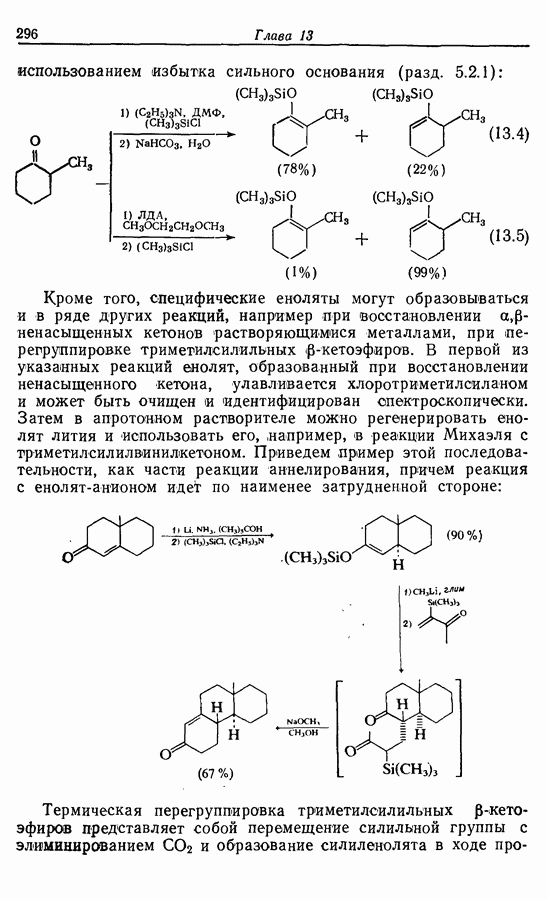
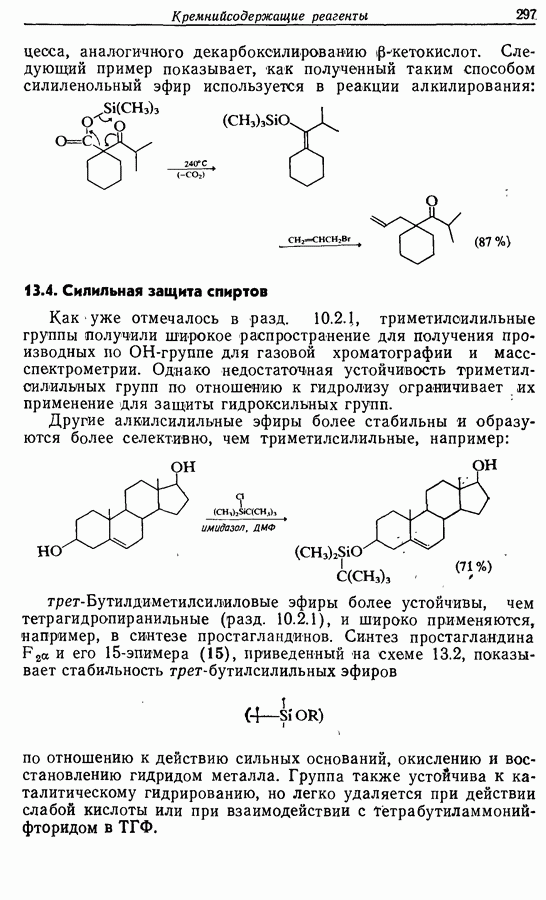
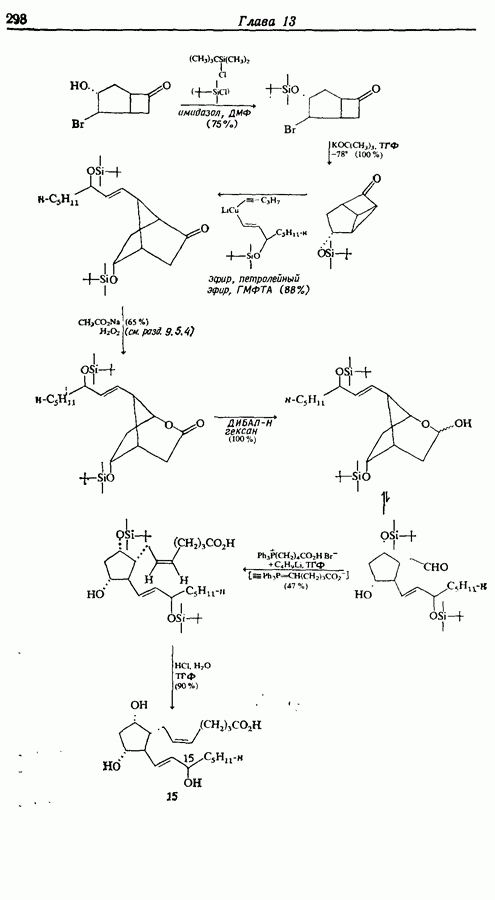
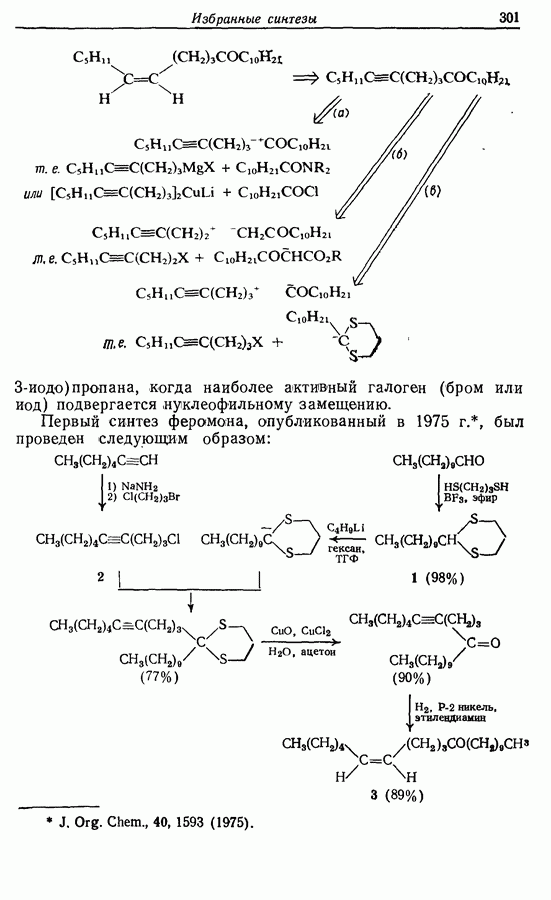
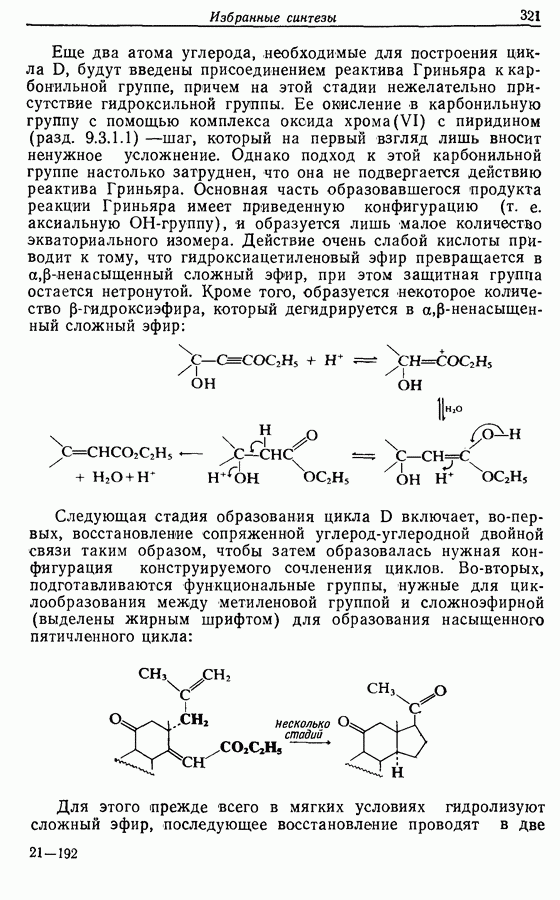
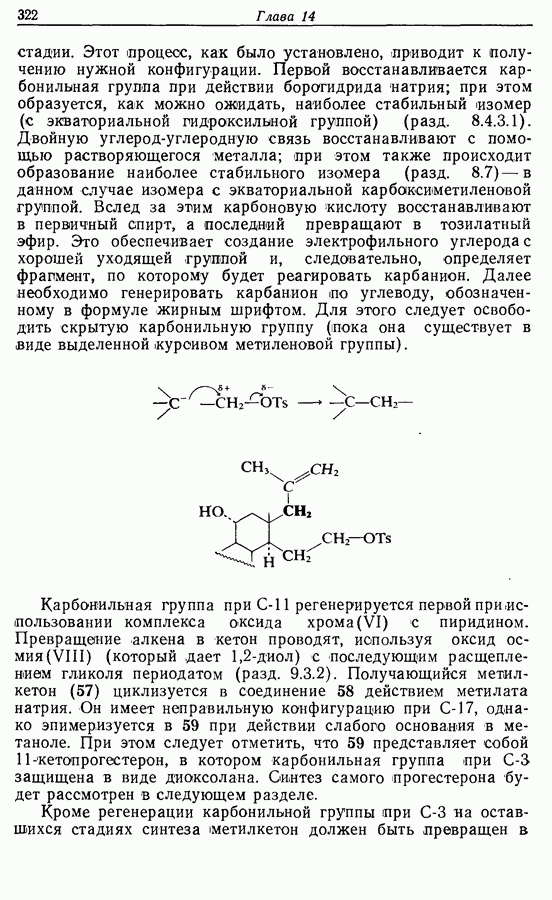
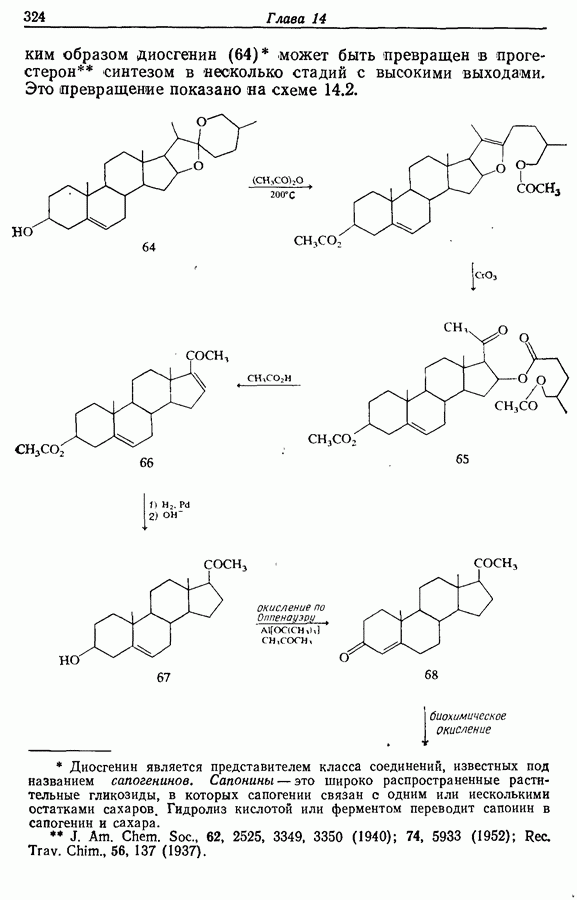
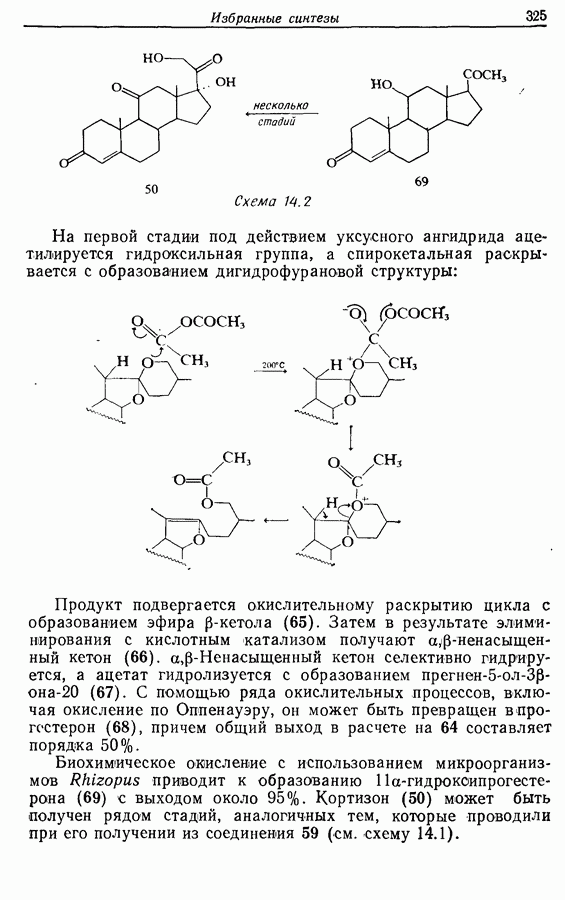
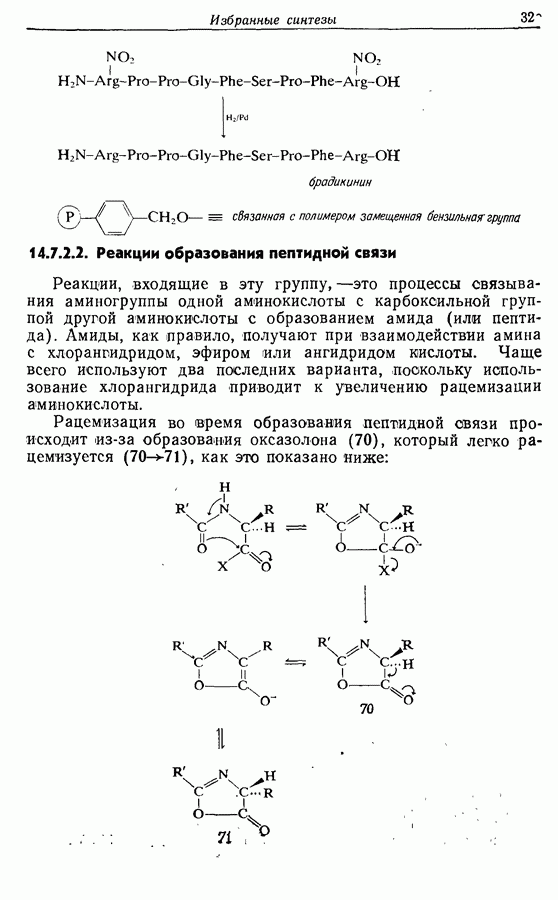
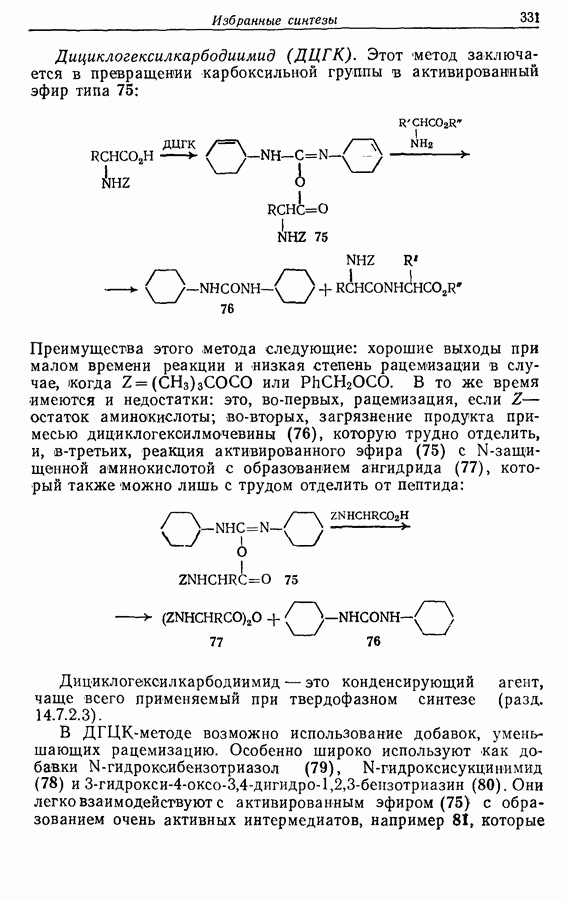
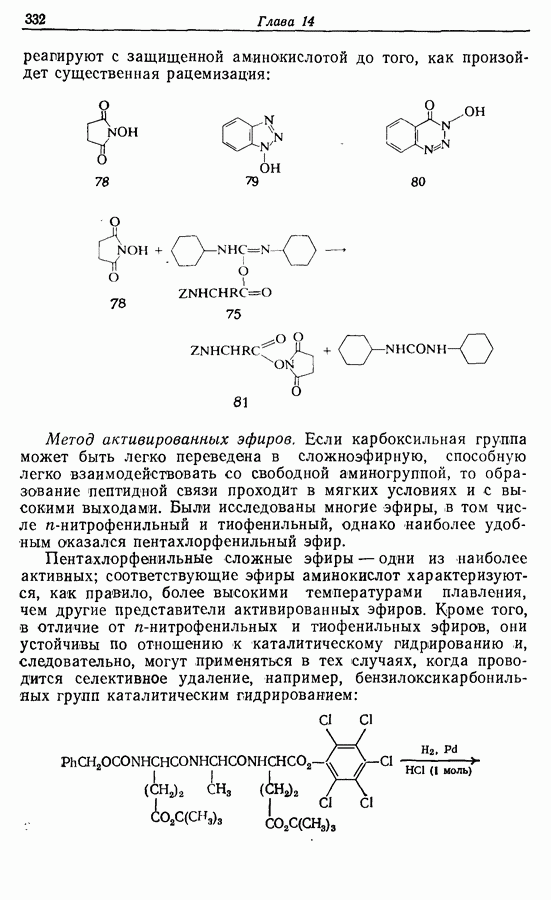
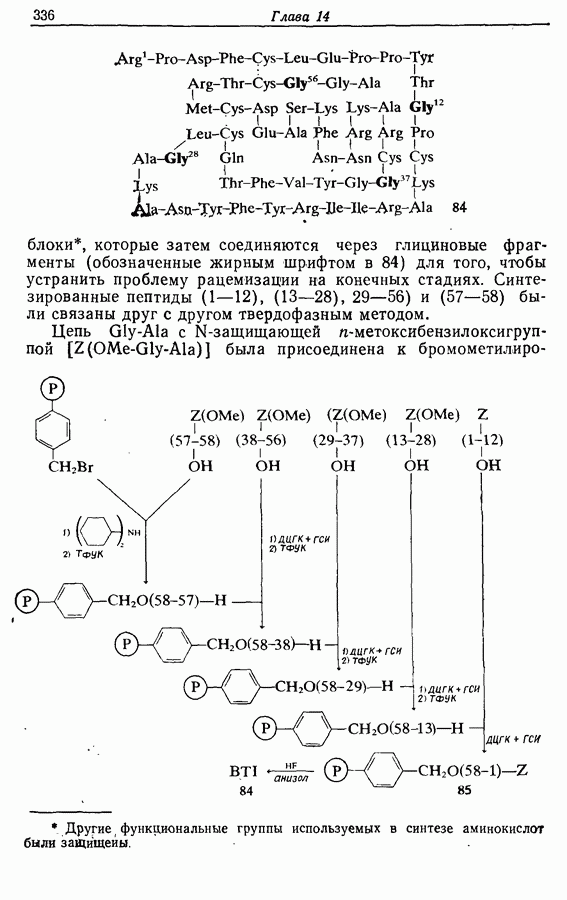
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
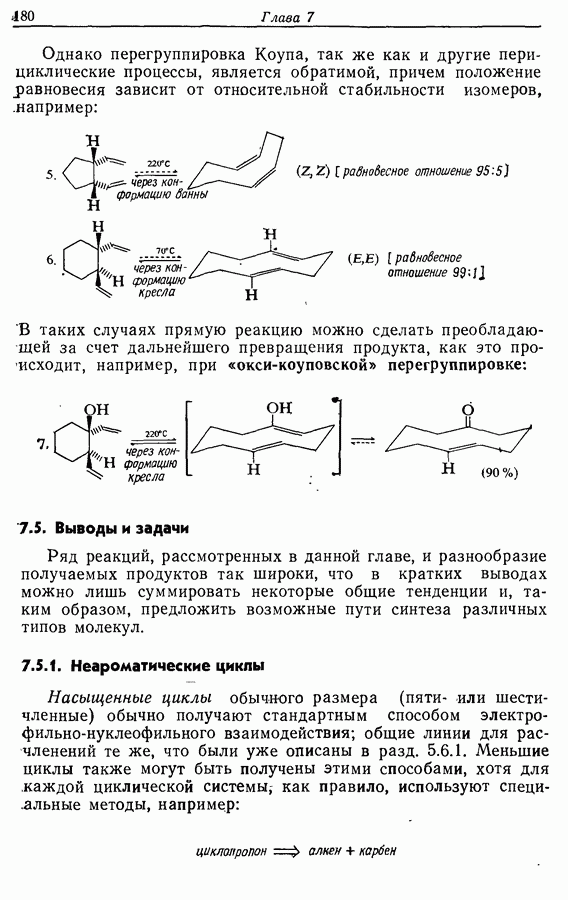
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
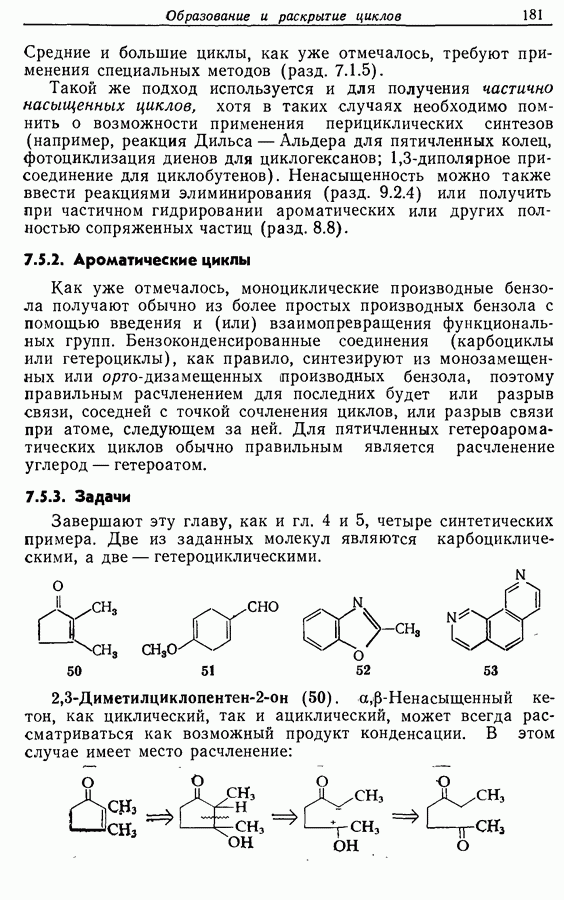
ZADANIA.TO
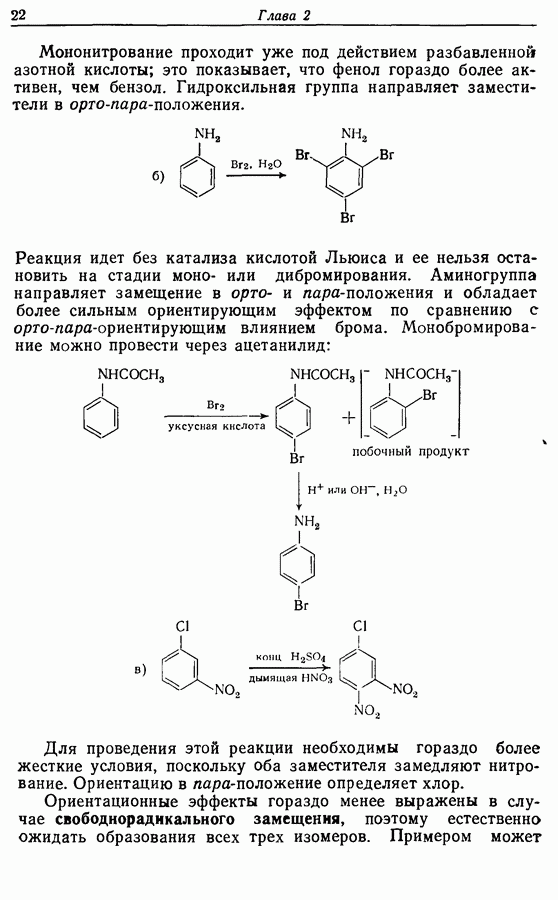
9.4. Окисление фенолов
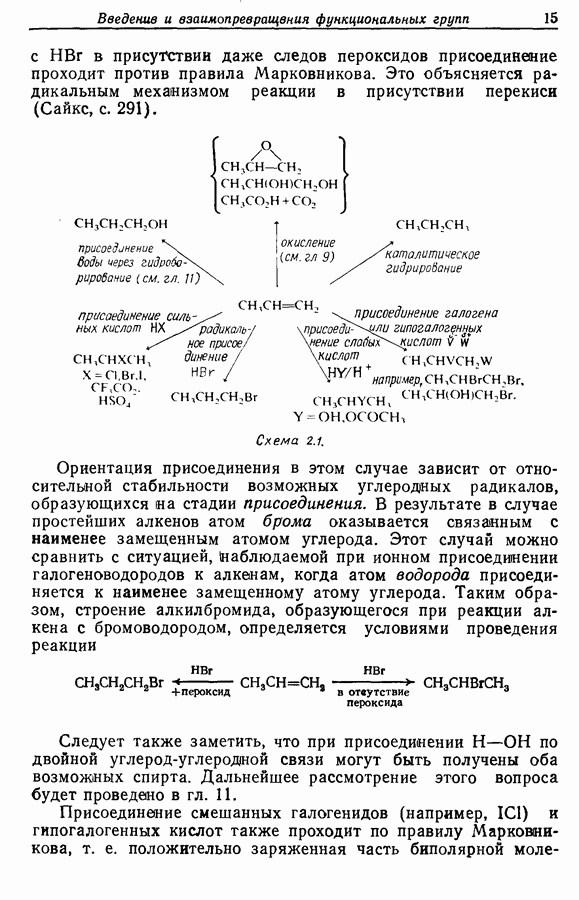
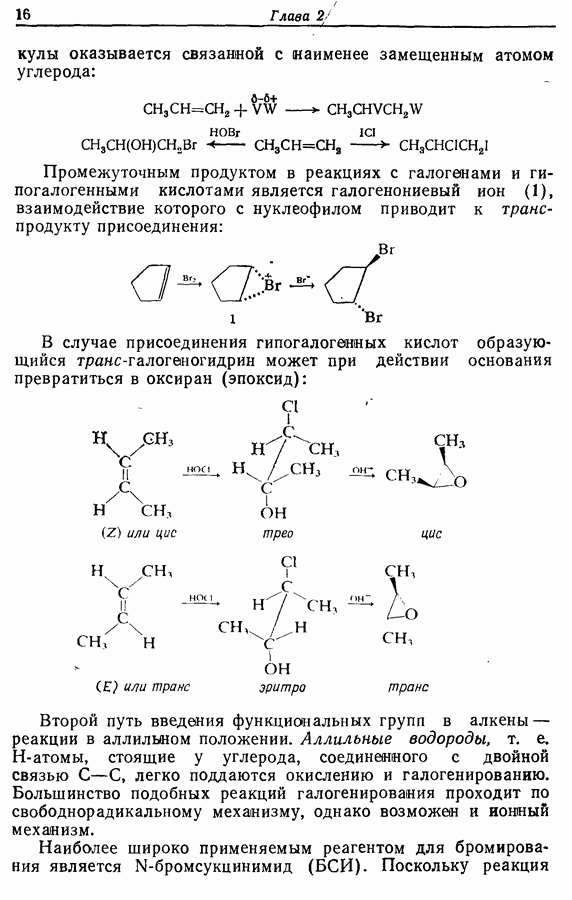
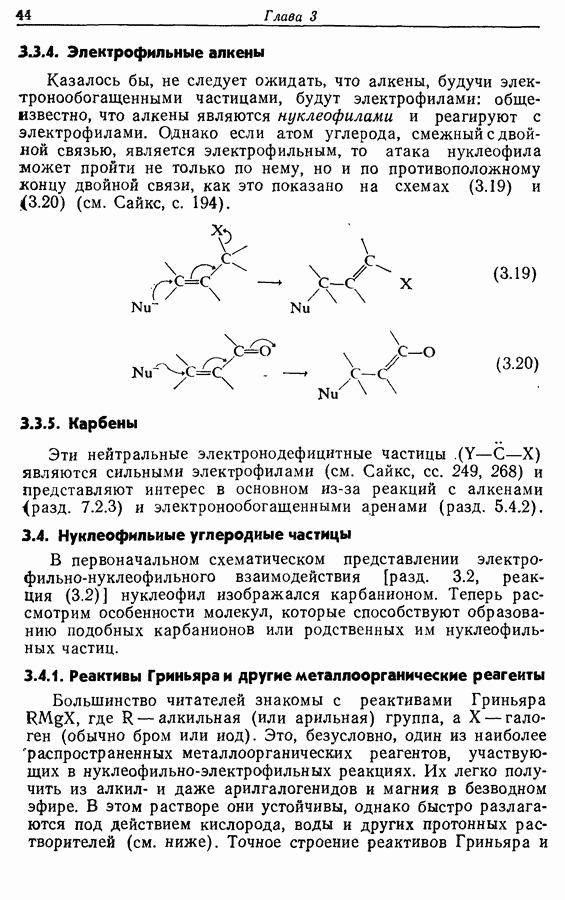
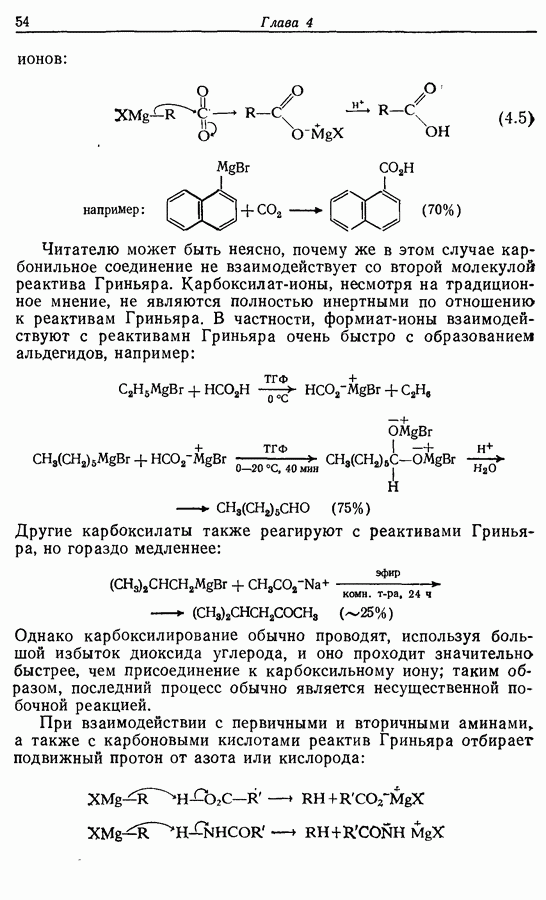
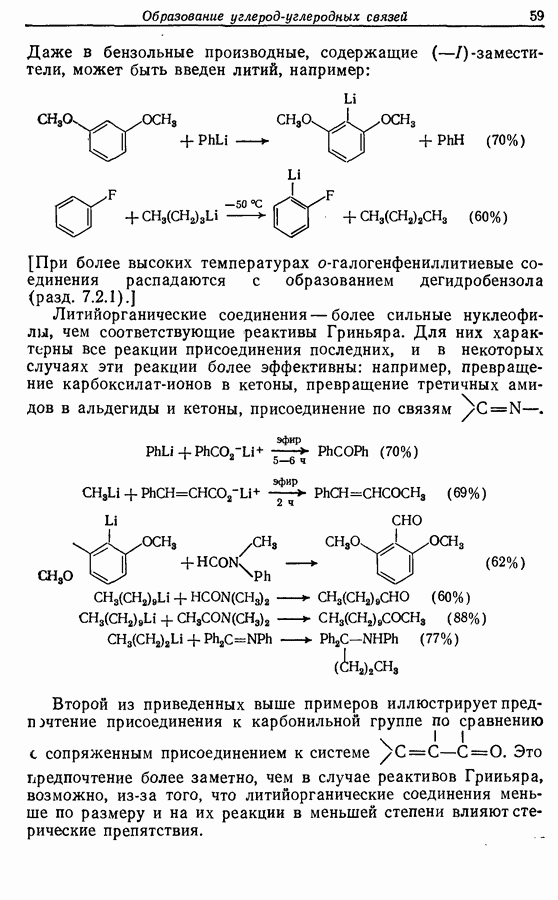
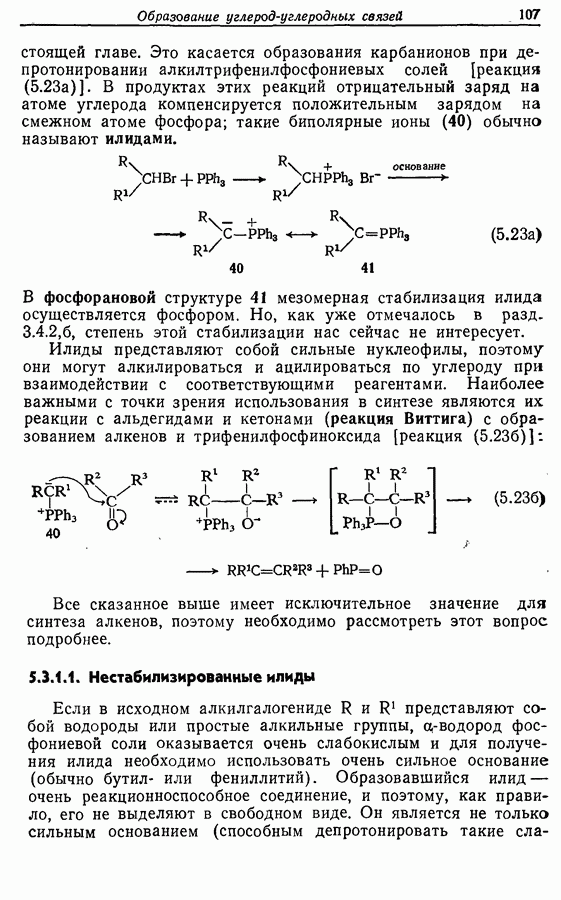
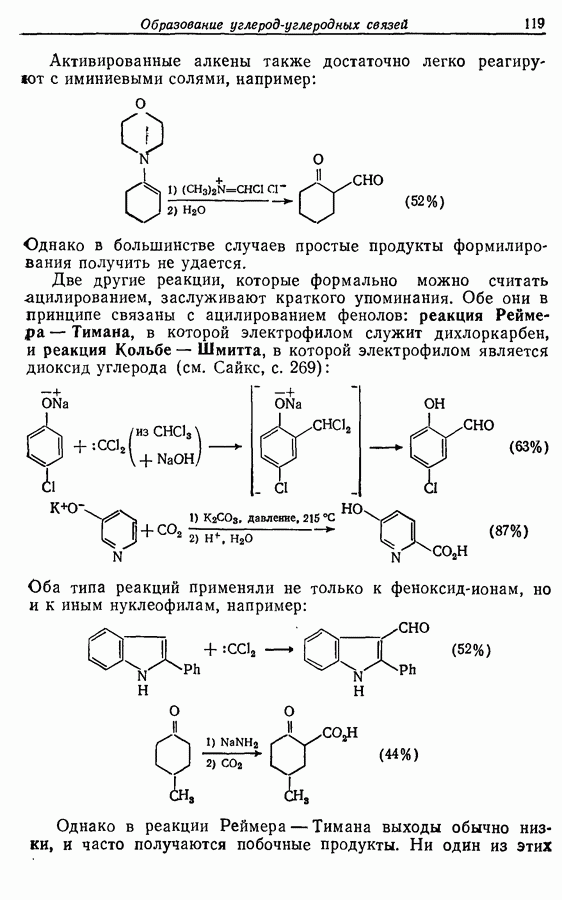
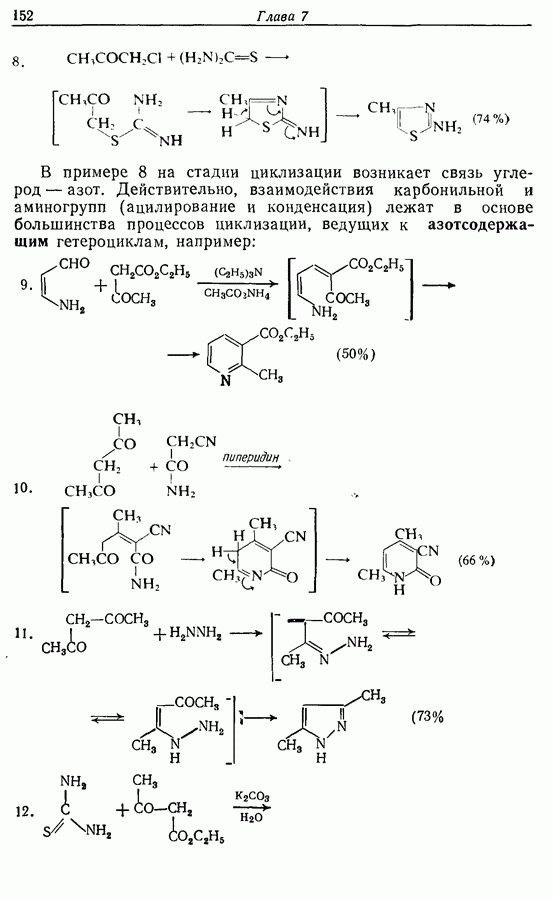
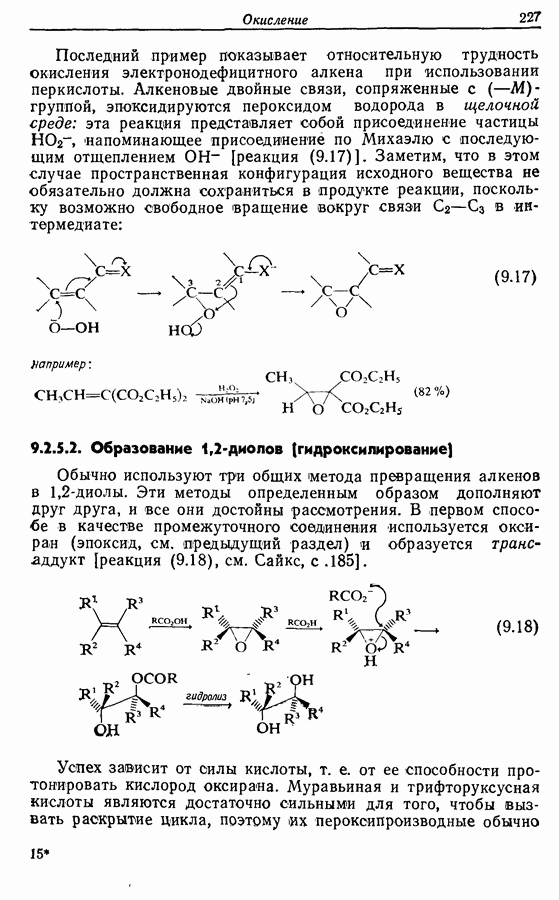
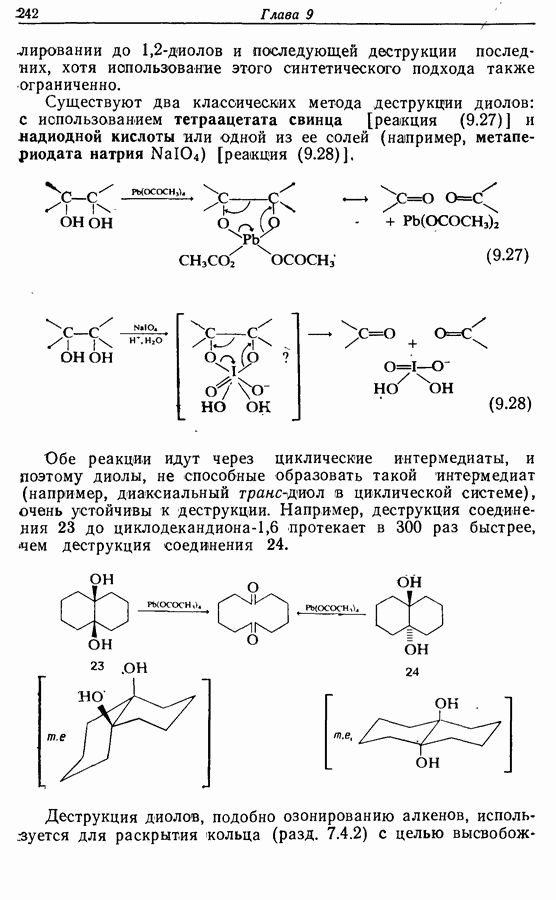
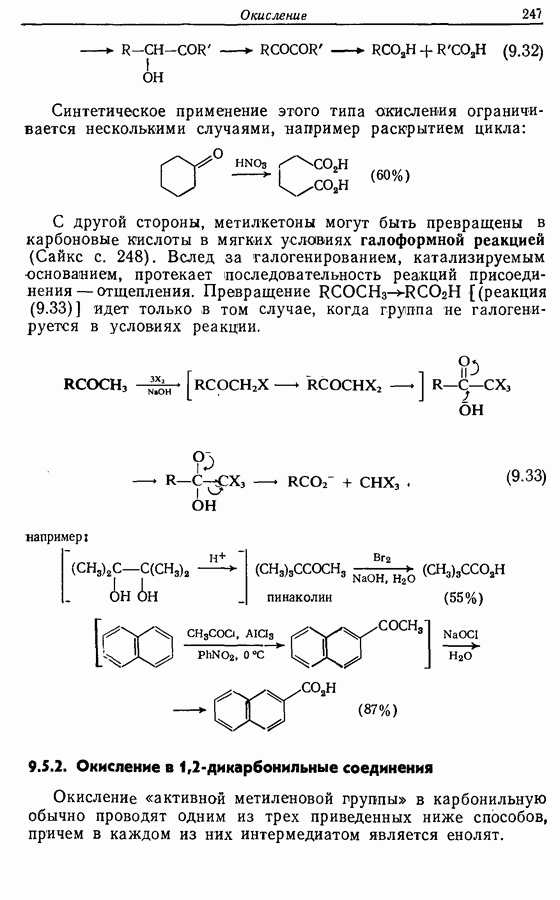
В химии фенолов существуют две главные особенности: стабилизация феноксид-аниона (и фенокси-радикала) соседним ароматическим циклом и стабилизация положительного заряда в кольце гидроксильной группой. Первая из этих особенностей проявляется в легком удалении гидроксильного водорода в виде протона или радикала, а вторая — в высокой реакционной активности (особенно в орто- и паралположениях) по отношению к электрофилам (см. разд. 2.5).
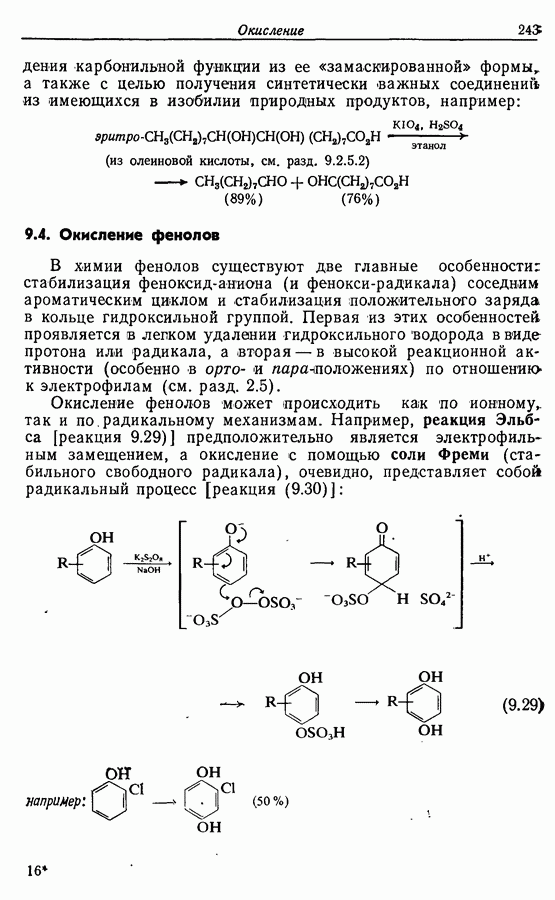
Окисление фенолов может происходить как по ионному, так и по радикальному механизмам. Например, реакция Эльбса [реакция 9.29)] предположительно является электрофильным замещением, а окисление с помощью соли Фреми (стабильного свободного радикала), очевидно, представляет собой радикальный процесс [реакция (9.30)]:

(см. скан)
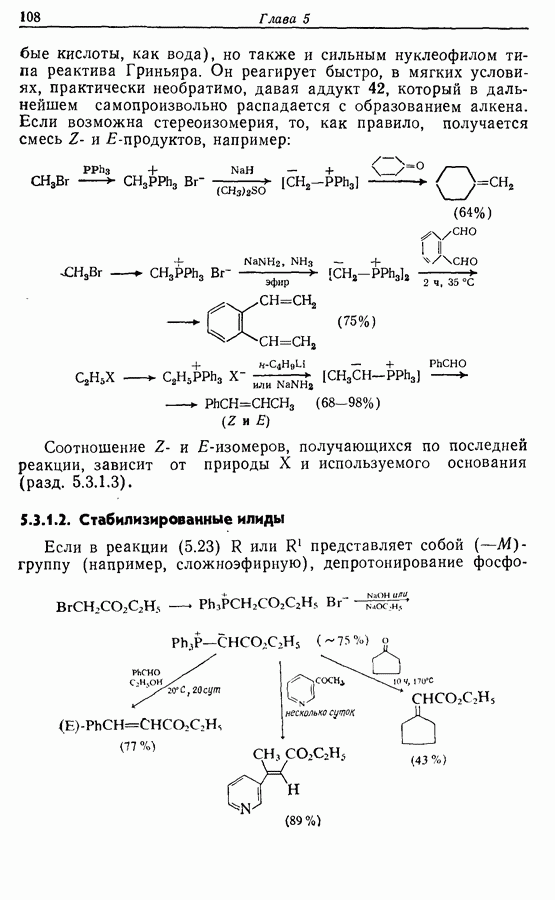
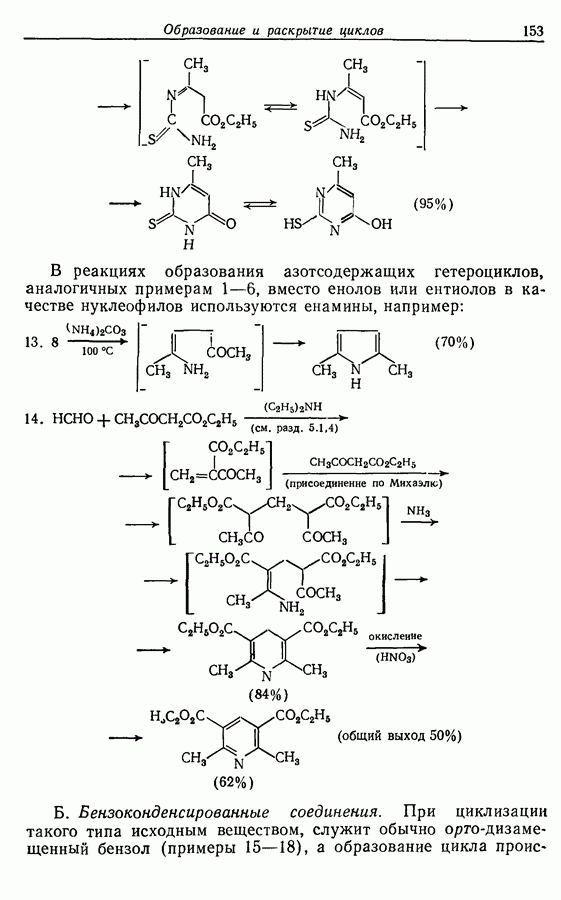
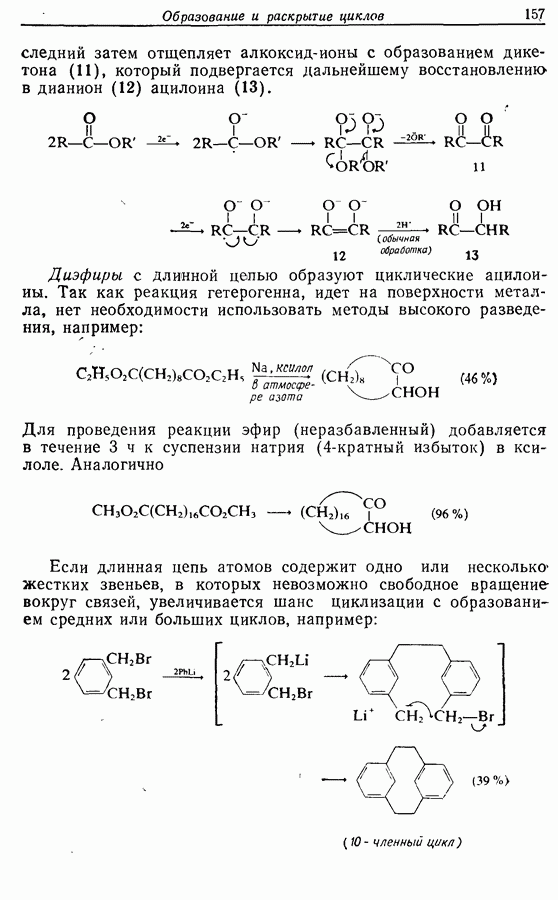
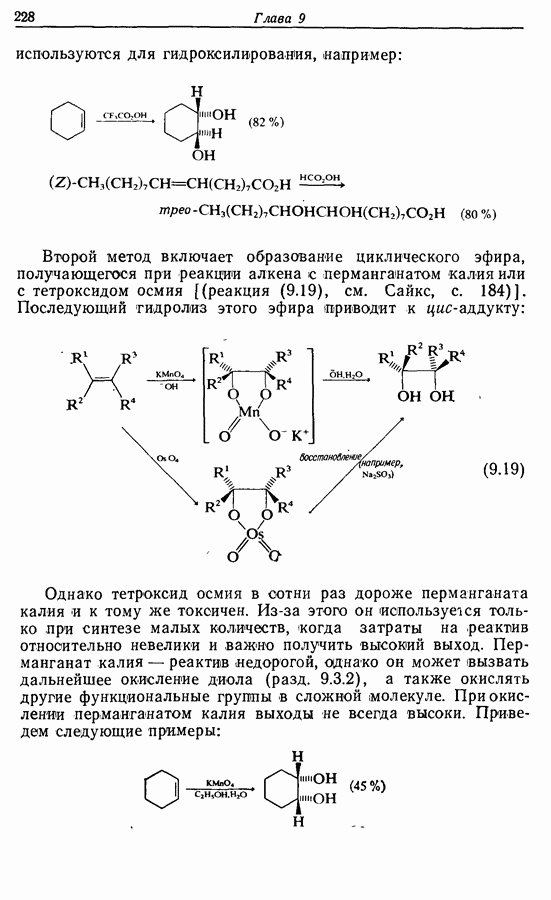
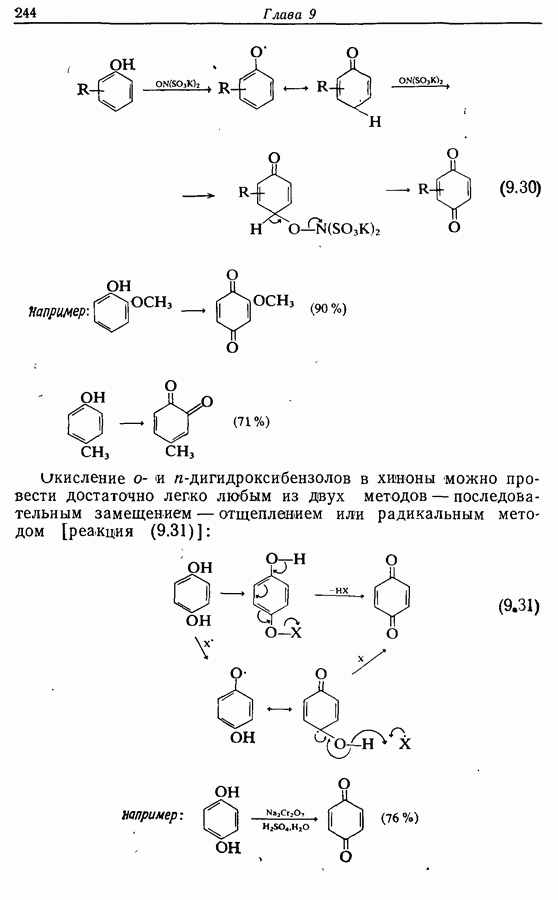
икисление  и
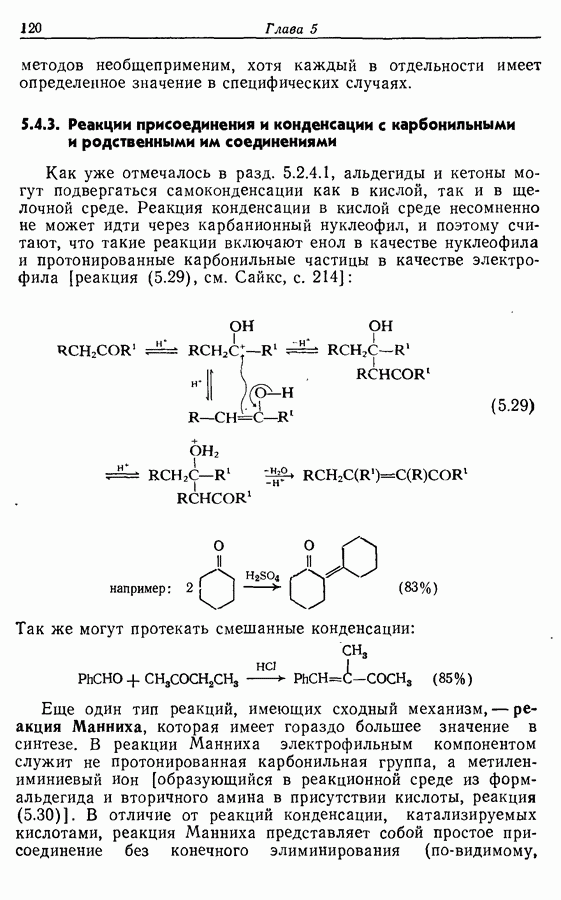
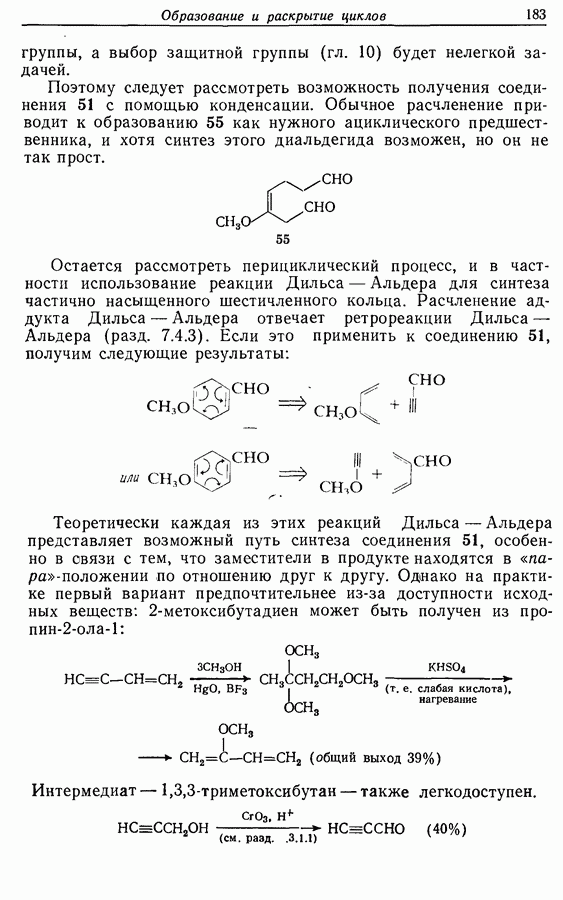
и  -дигидроксибензолов в хшюны можно провести достаточно легко любым из двух методов — последовательным замещением — отщеплением или радикальным методом [реакция (9.31)]:
-дигидроксибензолов в хшюны можно провести достаточно легко любым из двух методов — последовательным замещением — отщеплением или радикальным методом [реакция (9.31)]:

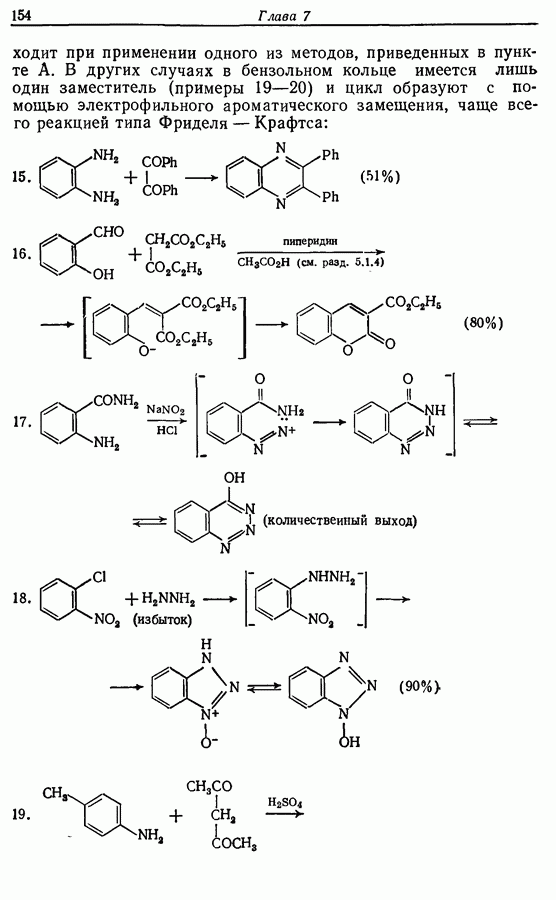
Соответствующее окисление аминофенолов приводит к образованию хинониминов, а из «их — хинонов и аммиака.
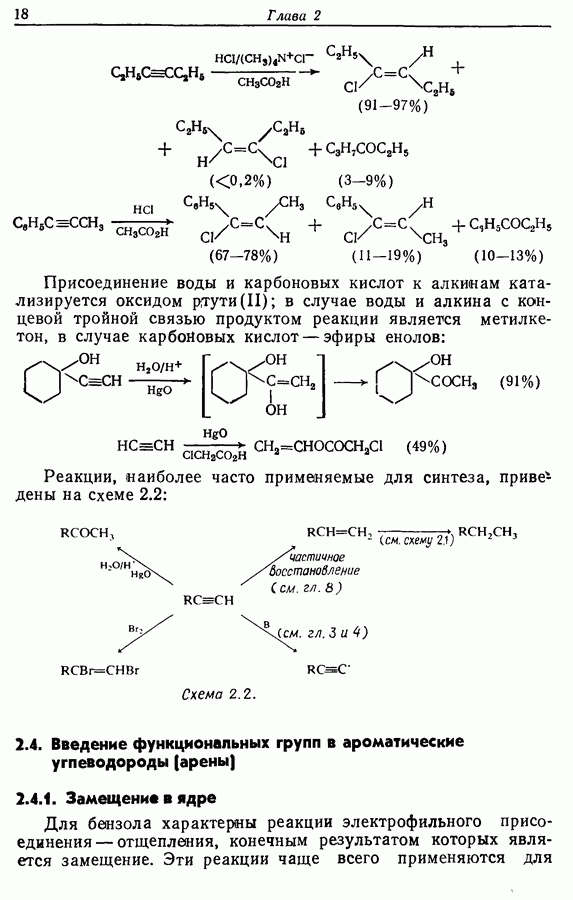
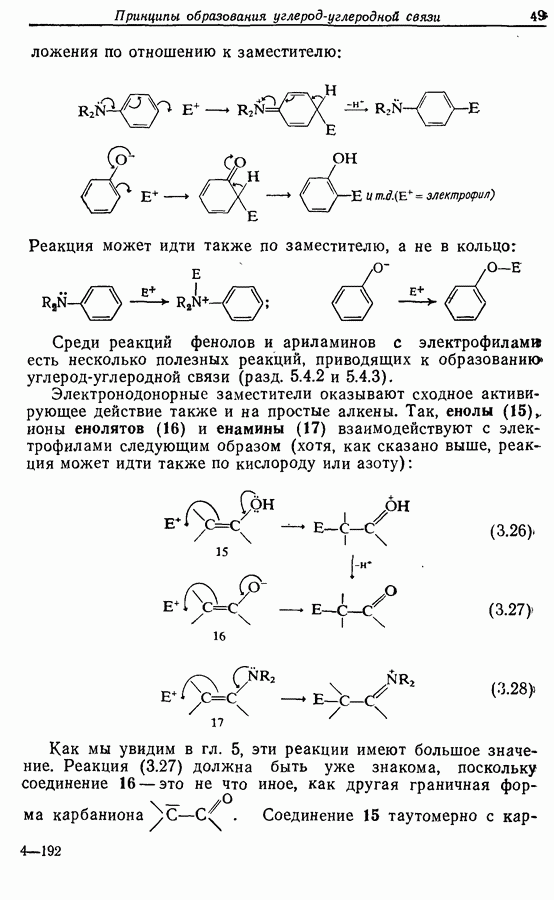
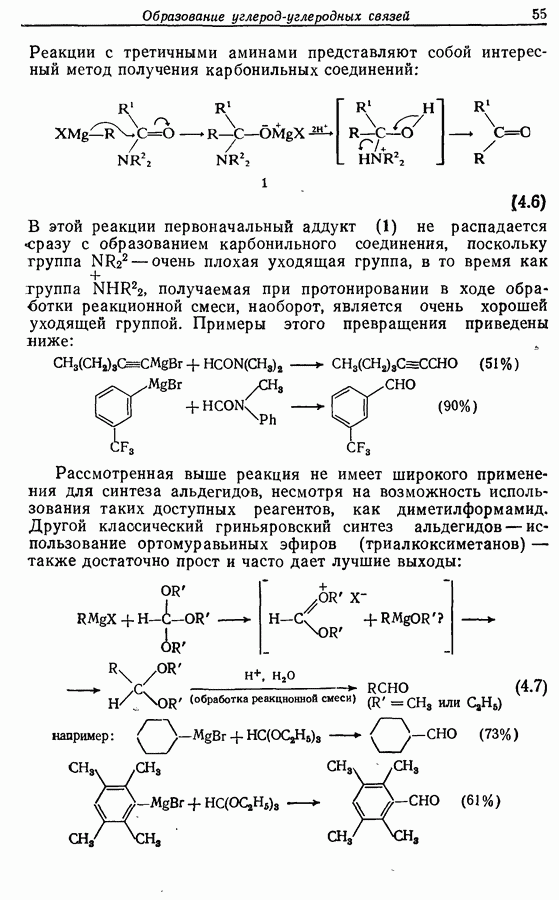
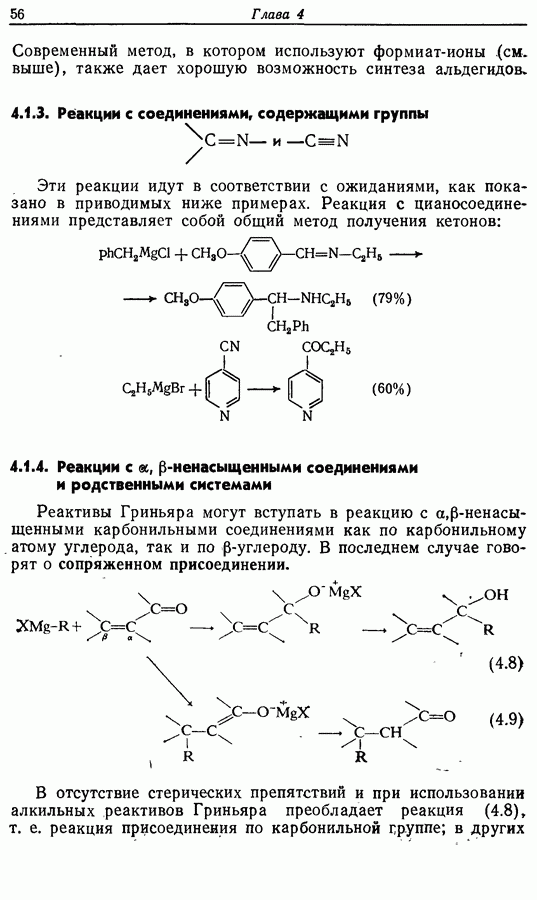
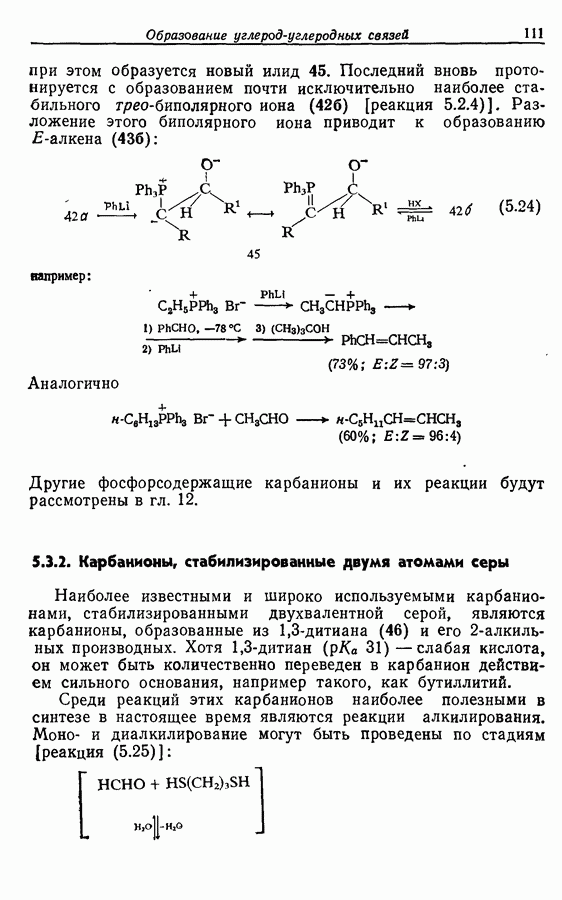
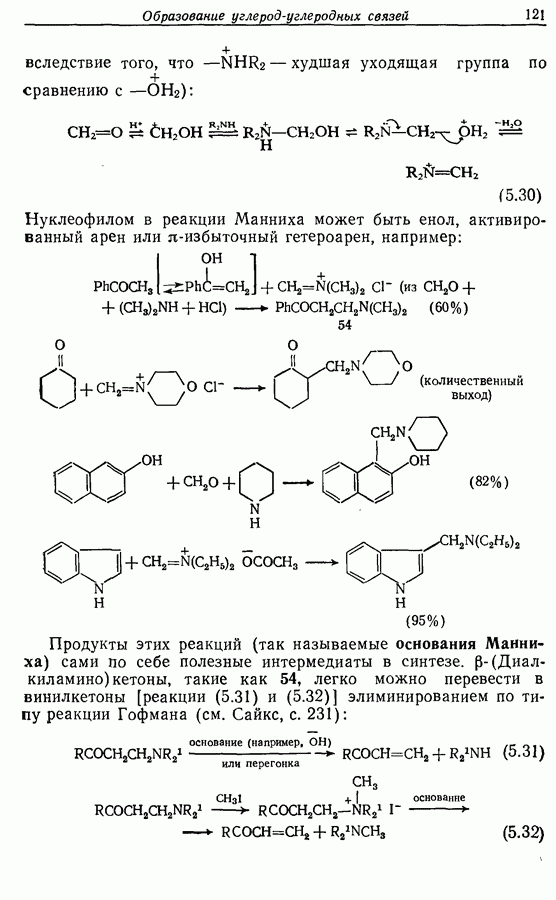
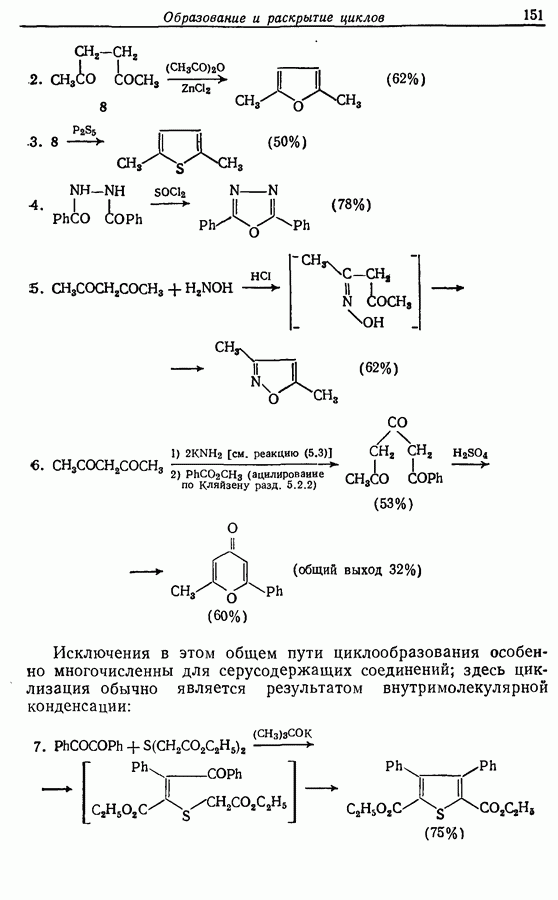
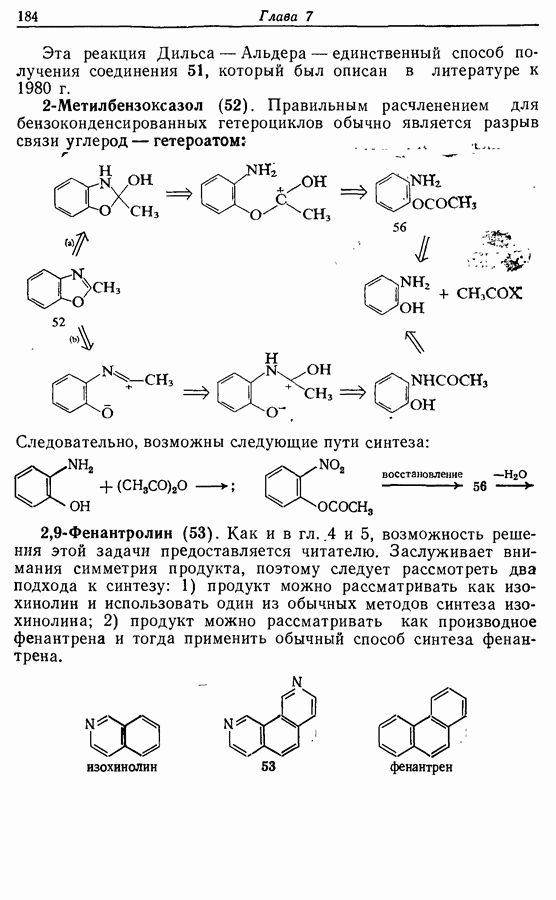
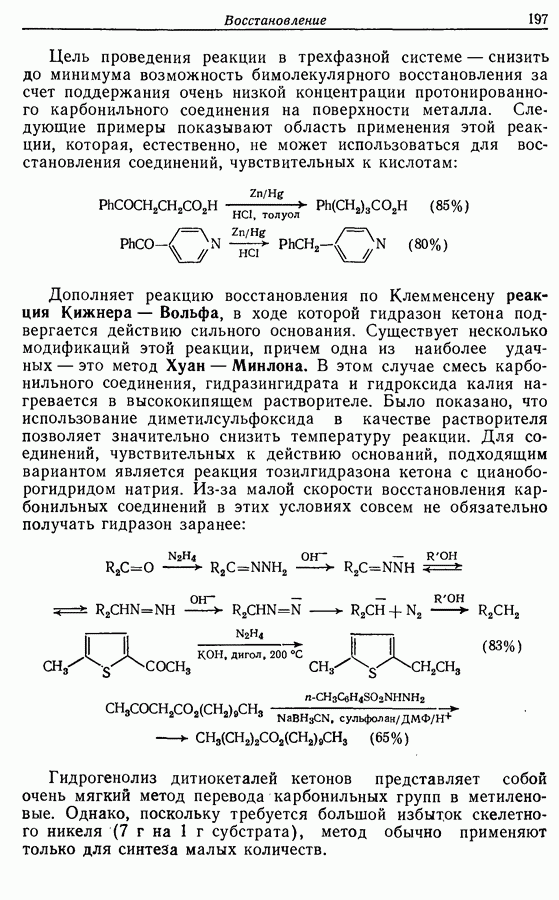
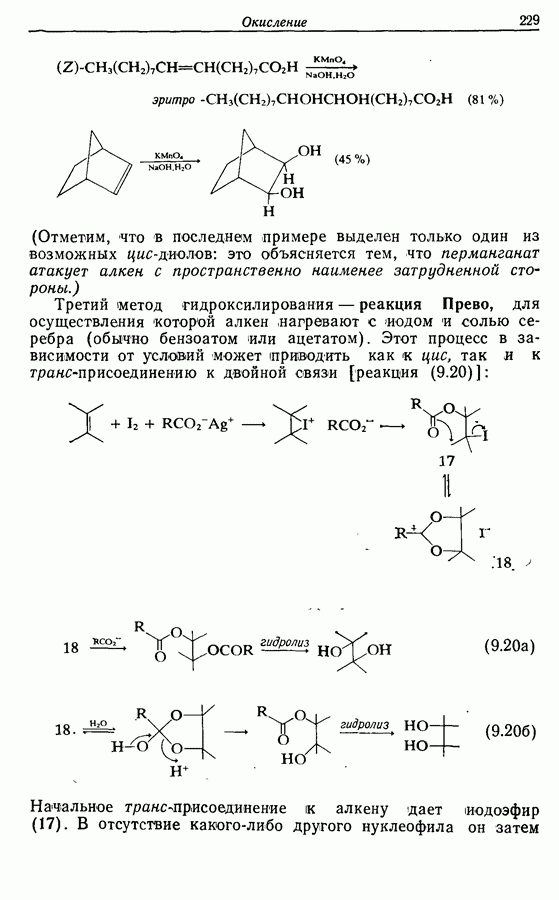
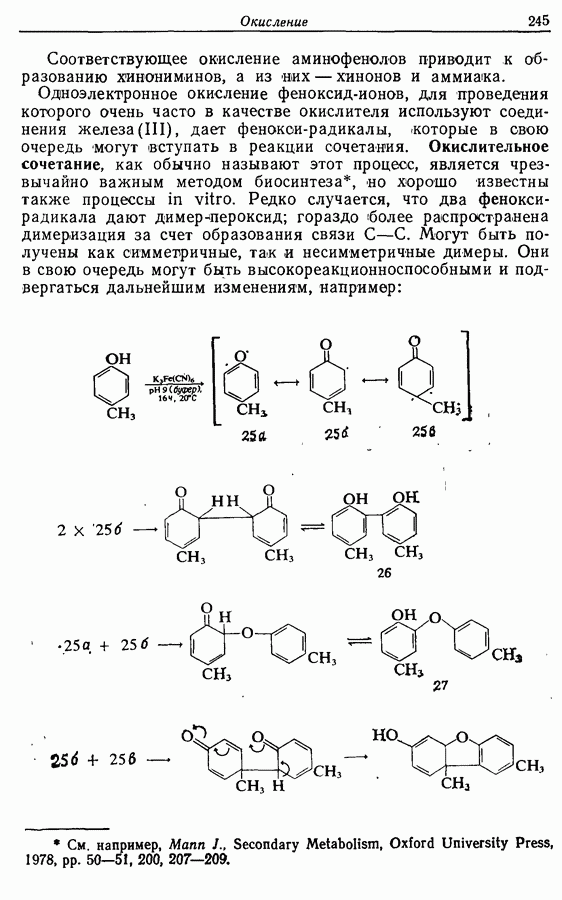
Одаоэлектронное окисление феноксид-ионов, для проведения которого очень часто в качестве окислителя используют соединения железа (III), дает фенокси-радикалы, которые в свою очередь могут вступать в реакции сочетания. Окислительное сочетание, как обычно называют этот процесс, является чрезвычайно важным методом биосинтеза, но хорошо известны также процессы  Редко случается, что два фенокси-радикала дают димер-пероксид; гораздо (более распространена димеризация за счет образования связи
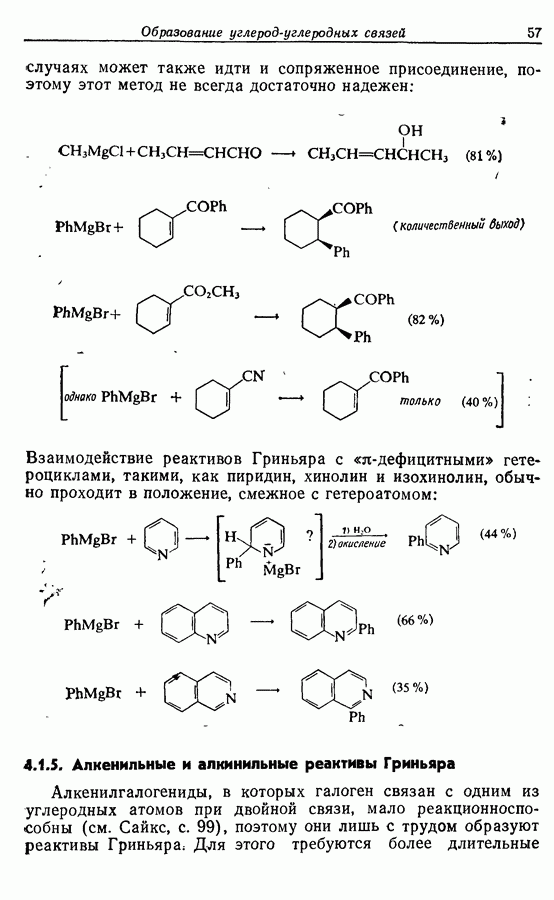
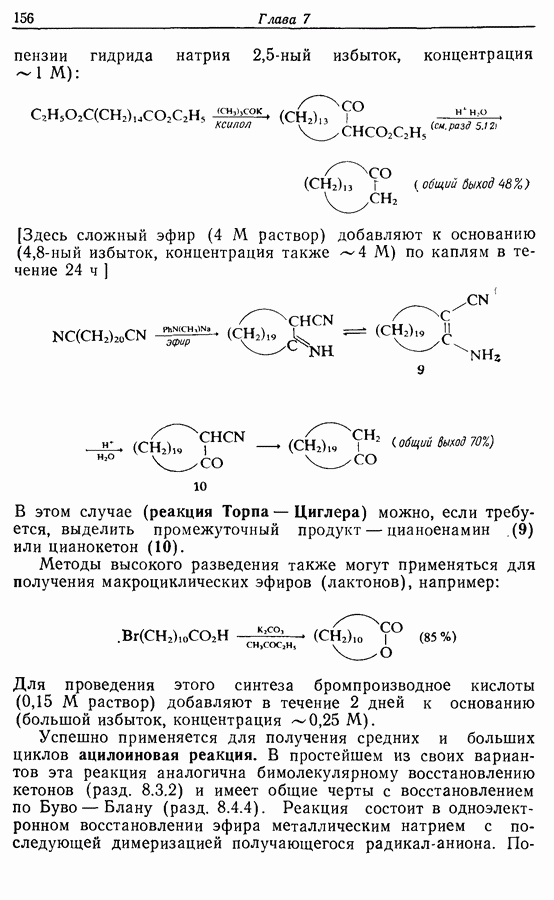
Редко случается, что два фенокси-радикала дают димер-пероксид; гораздо (более распространена димеризация за счет образования связи  Могут быть получены как симметричные, так и несимметричные димеры. Они в свою очередь могут быть высокореакционноспособными и подвергаться дальнейшим изменениям, например:
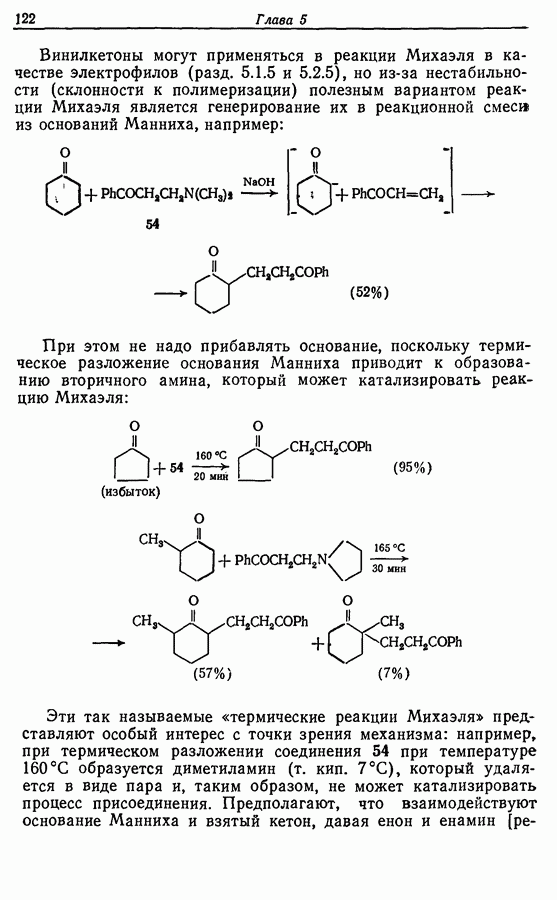
Могут быть получены как симметричные, так и несимметричные димеры. Они в свою очередь могут быть высокореакционноспособными и подвергаться дальнейшим изменениям, например:
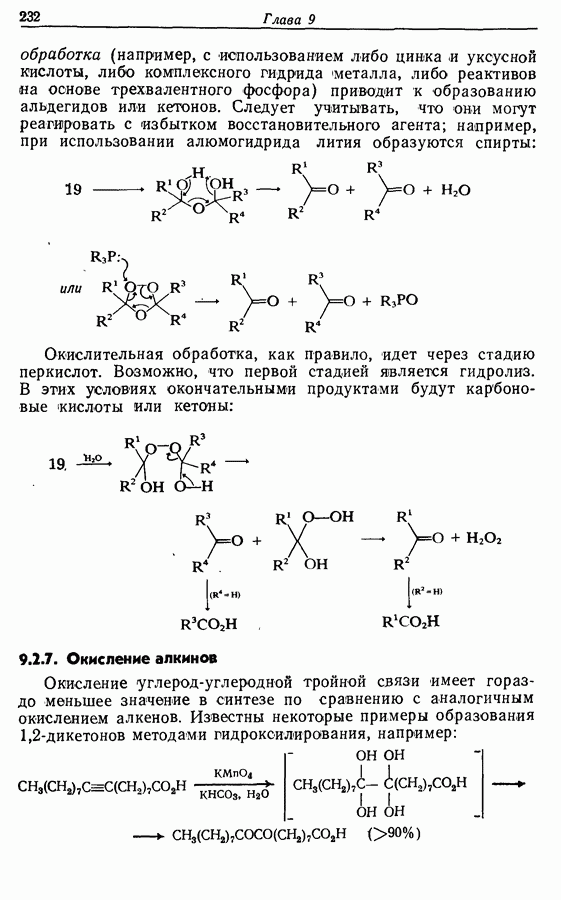
(см. скан)

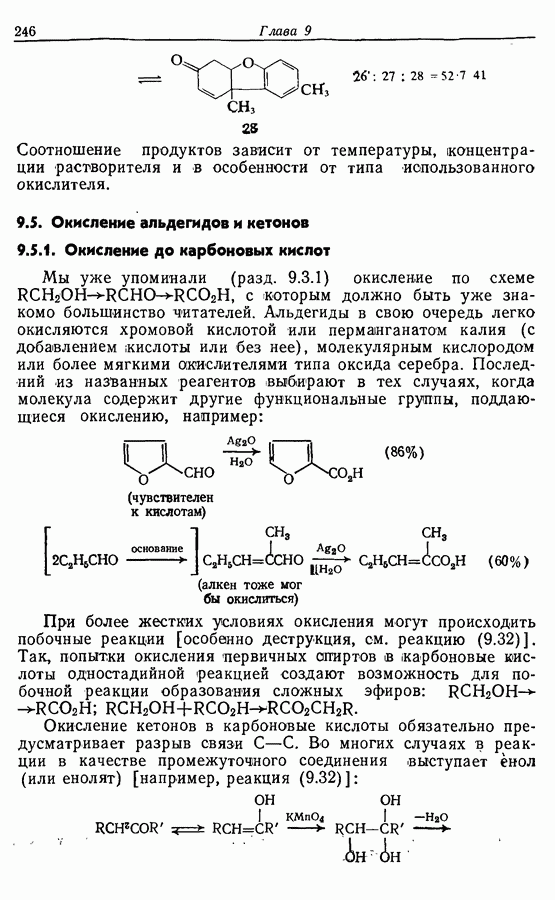
Соотношение продуктов зависит от температуры, концентрации растворителя и в особенности от типа использованного окислителя.
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- 1. ВВЕДЕНИЕ
- 2. ВВЕДЕНИЕ И ВЗАИМОПРЕВРАЩЕНИЯ ФУНКЦИОНАЛЬНЫХ ГРУПП
- 2.1. Введение функциональных групп в апканы
- 2.2. Введение функциональных групп в алкены
- 2.3. Введение функциональных групп в апкины
- 2.4. Введение функциональных групп в ароматические углеводороды (арены)
- 2.5. Введение функциональных групп в производные бензола
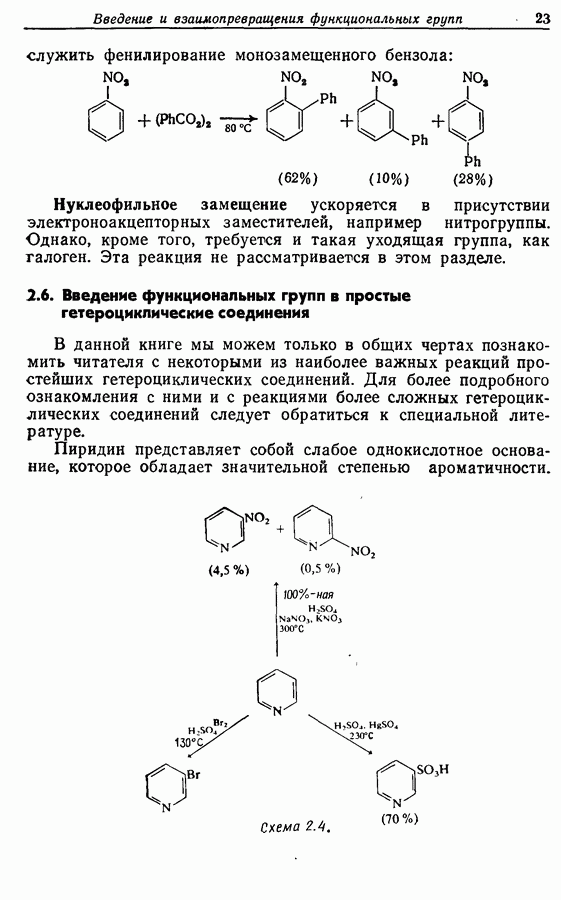
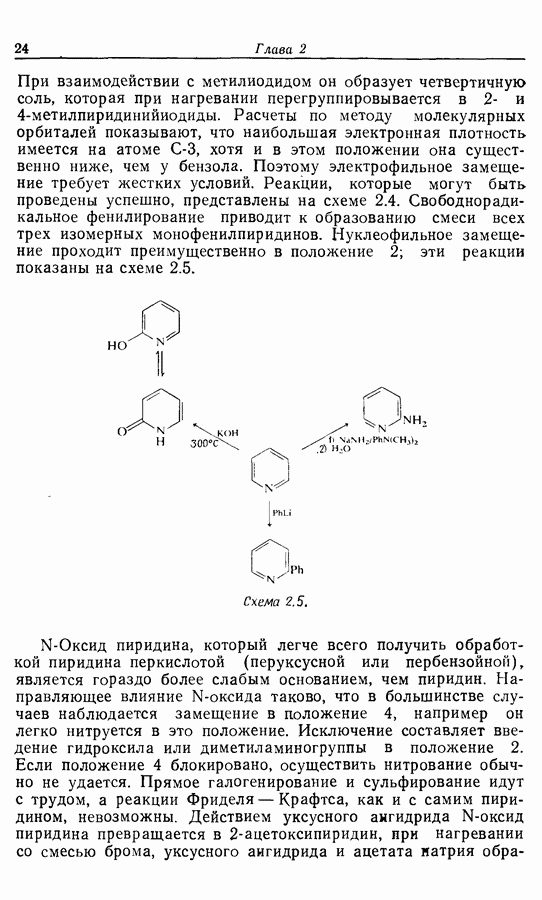
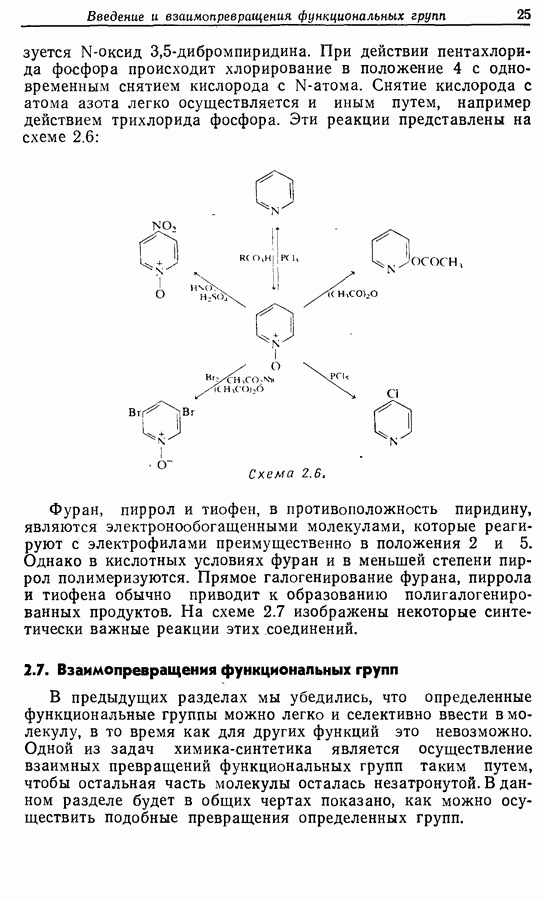
- 2.6. Введение функциональных групп в простые гетероциклические соединения
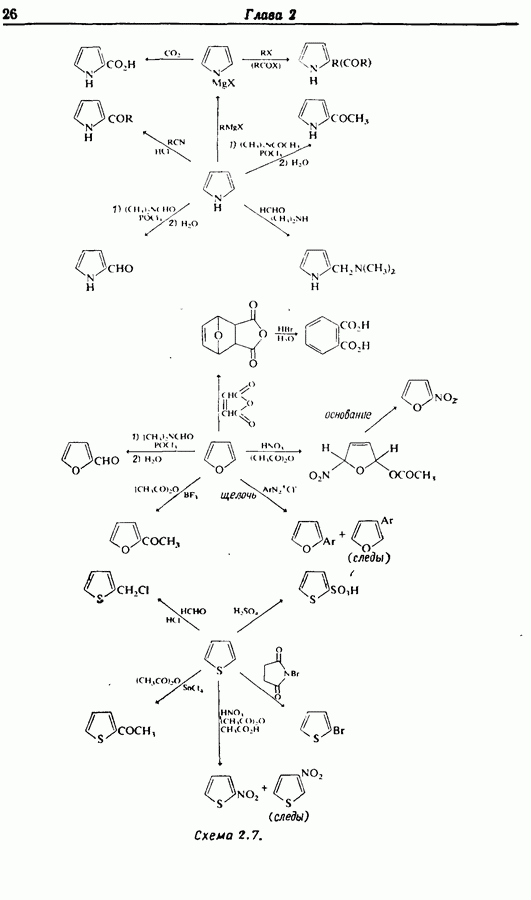
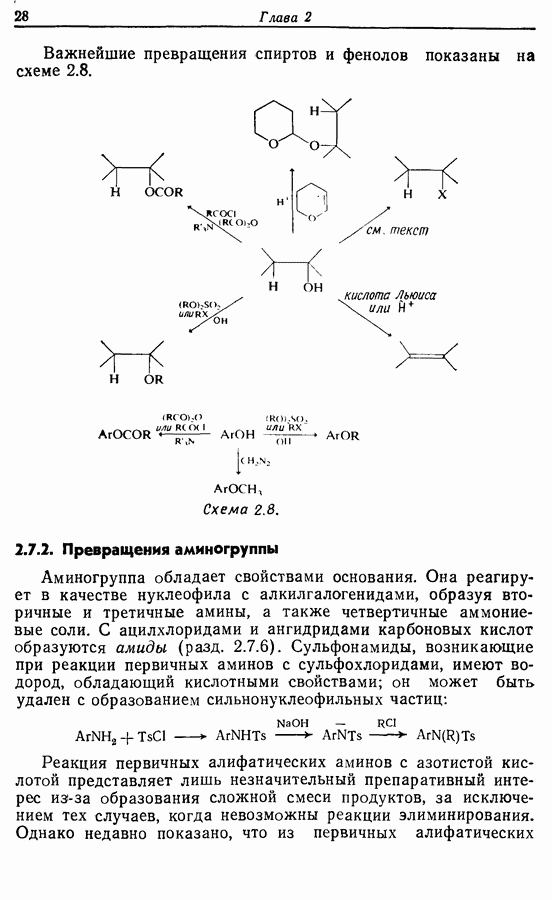
- 2.7. Взаимопревращения функциональных групп
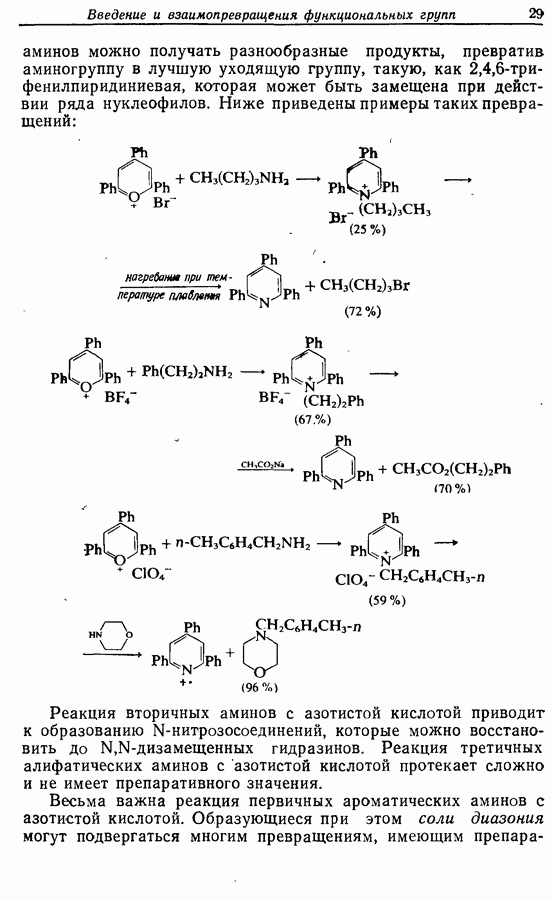
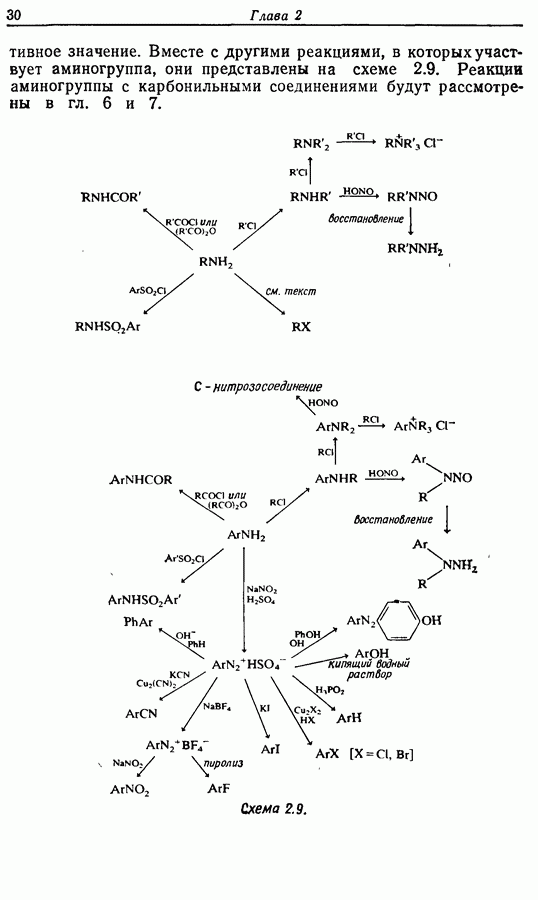
- 2.7.2. Превращения аминогруппы
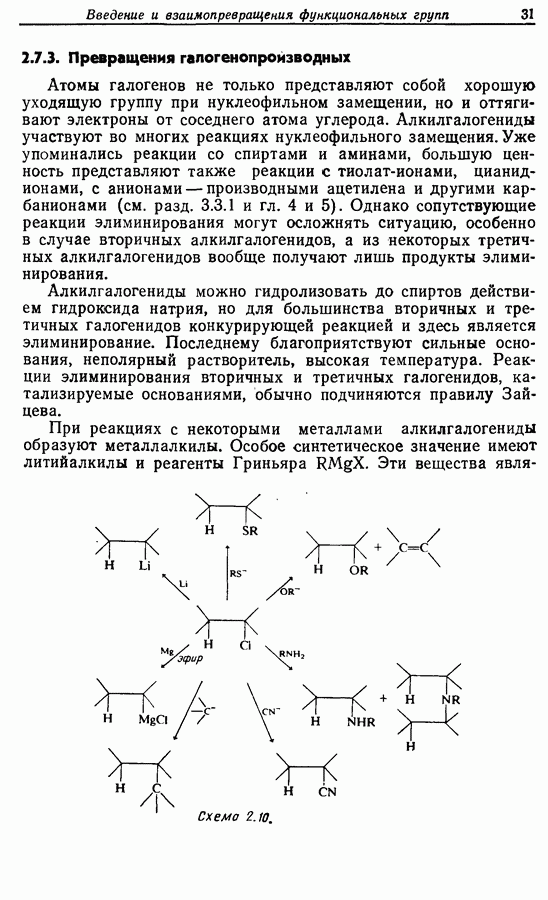
- 2.7.3. Превращения галогенопроизводных
- 2.7.4. Превращения нитросоединений
- 2.7.5. Превращения альдегидов и кетонов
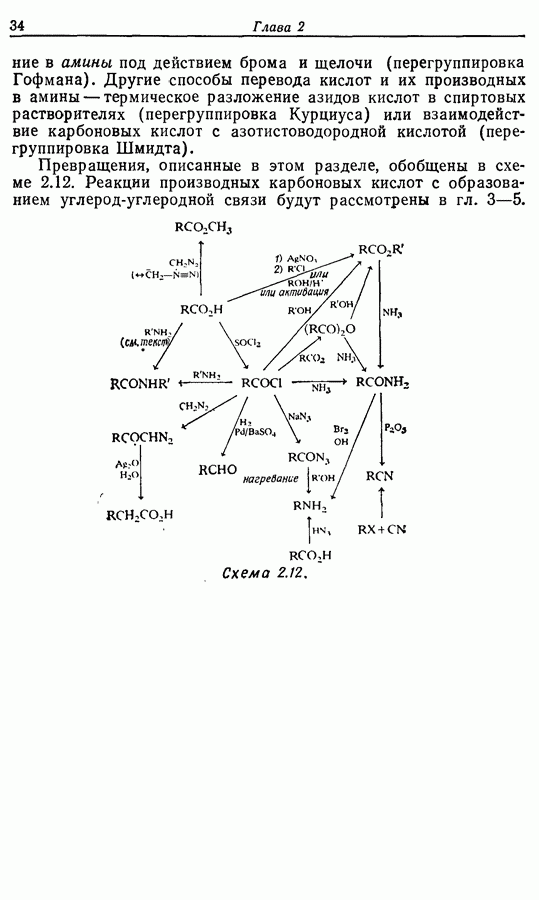
- 2.7.6. Превращения кислот и их производных
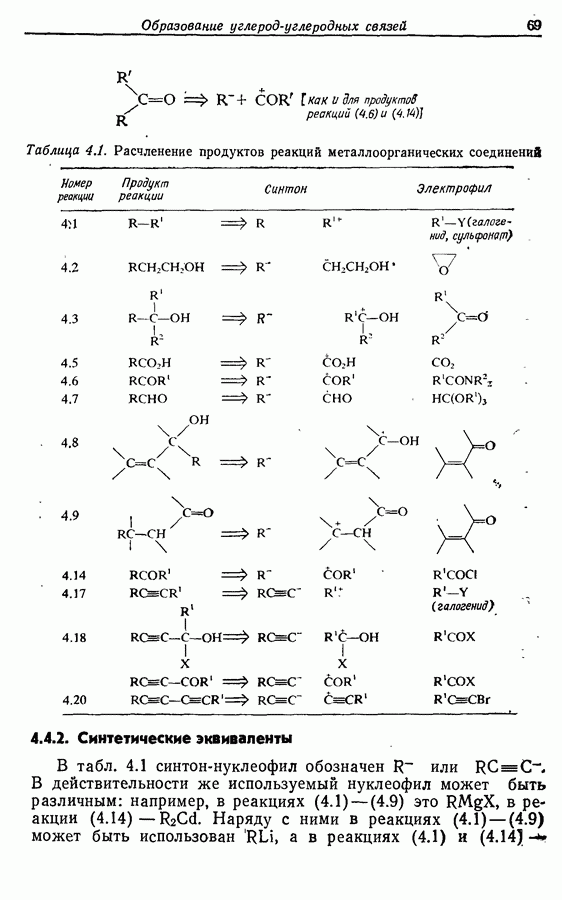
- 3. ПРИНЦИПЫ ОБРАЗОВАНИЯ УГЛЕРОД-УГЛЕРОДНОЙ СВЯЗИ
- 3.2. Расчленение и синтоны
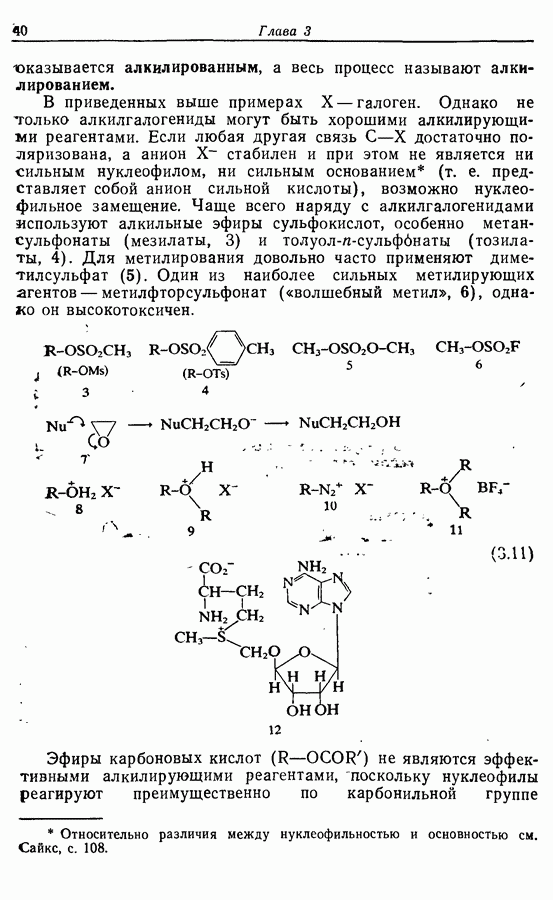
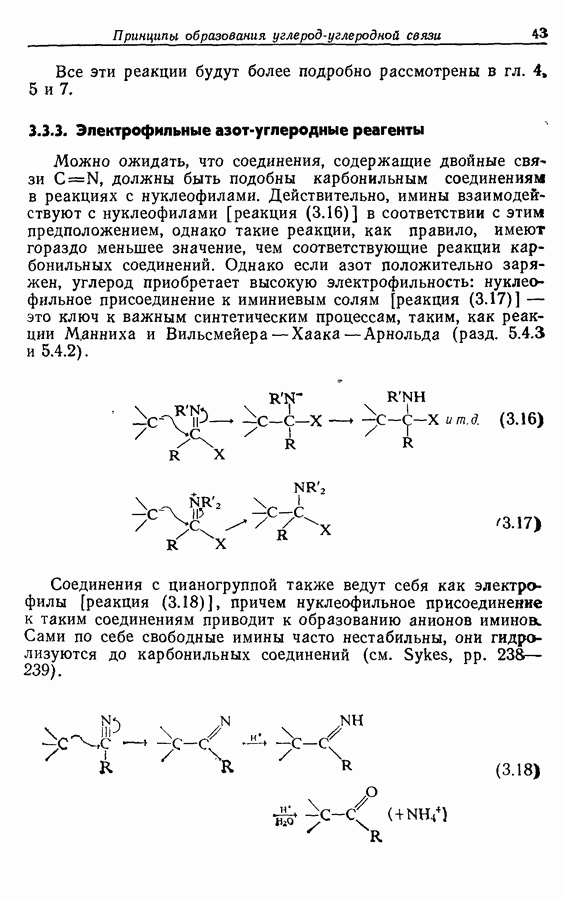
- 3.3. Электрофильные углеродные частицы
- 3.4. Нуклеофильиые углеродные частицы
- 3.4.2. Стабилизированные карбанионы
- 3.4.3. Алкены, арены и гетероарены
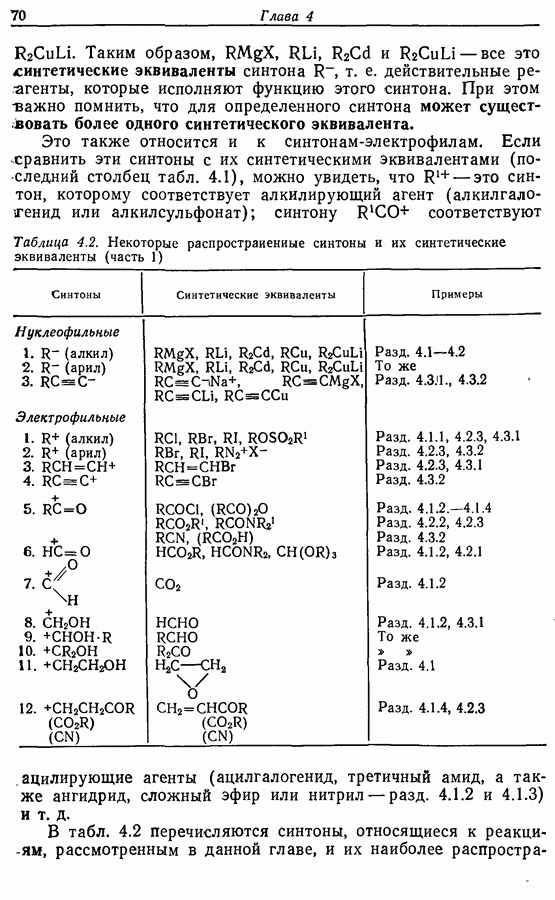
- 4. ОБРАЗОВАНИЕ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ: РЕАКЦИИ МЕТАЛЛООРГАНИЧЕСКИХ СОЕДИНЕНИЙ
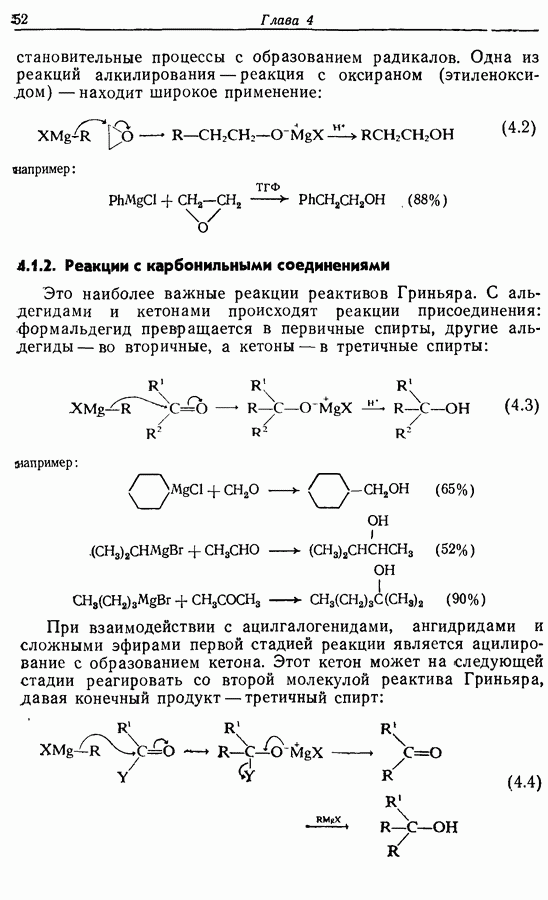
- 4.1. Реактивы Гриньяра и электрофилы
- 4.2. Другие металлоорганические реактивы и электрофилы
- 4.2.2. Цинк- и кадмийорганические соединения
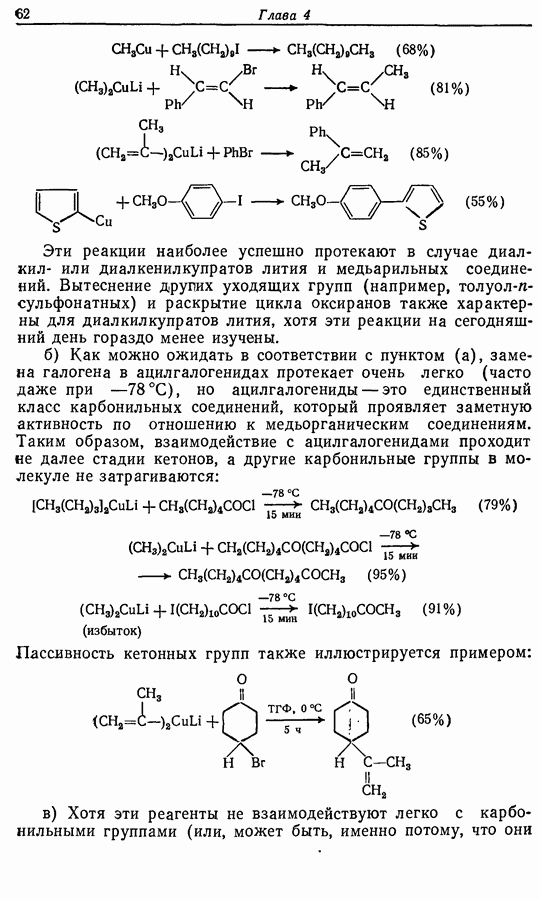
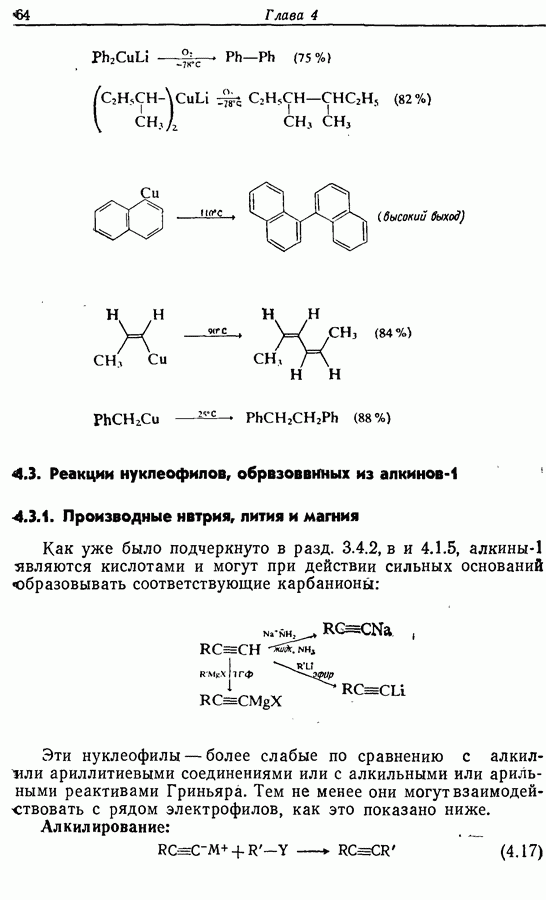
- 4.2.3. Органические соединения меди (I)
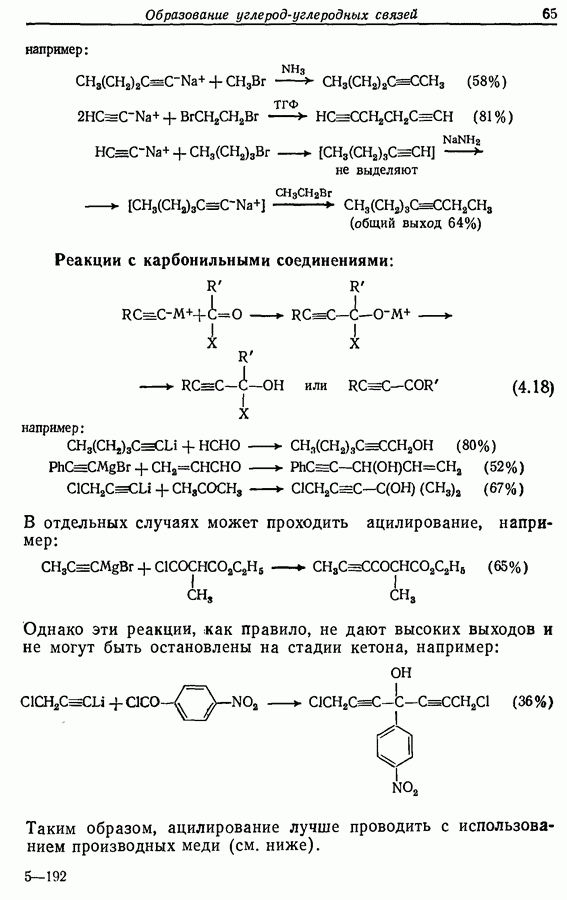
- 4.3. Реакции нуклеофилов, образованных из алкинов-1
- 4.3.2. Алкинильные соединения меди (I)
- 4.4. Выводы
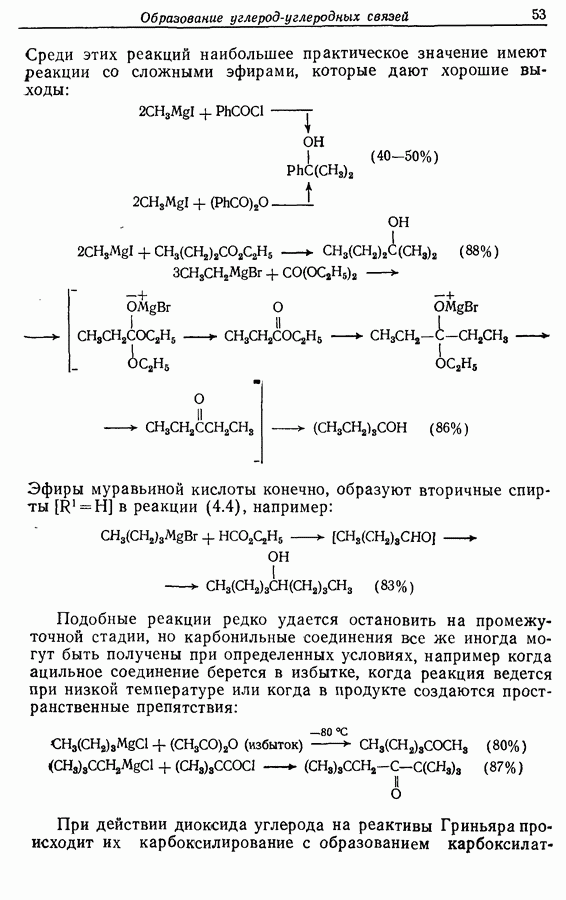
- 4.5. Примеры
- 5. ОБРАЗОВАНИЕ УГЛЕРОД-УГЛЕРОДНЫХ СВЯЗЕЙ: ИСПОЛЬЗОВАНИЕ СТАБИЛИЗИРОВАННЫХ КАРБАНИОНОВ И РОДСТВЕННЫХ НУКЛЕОФИЛОВ
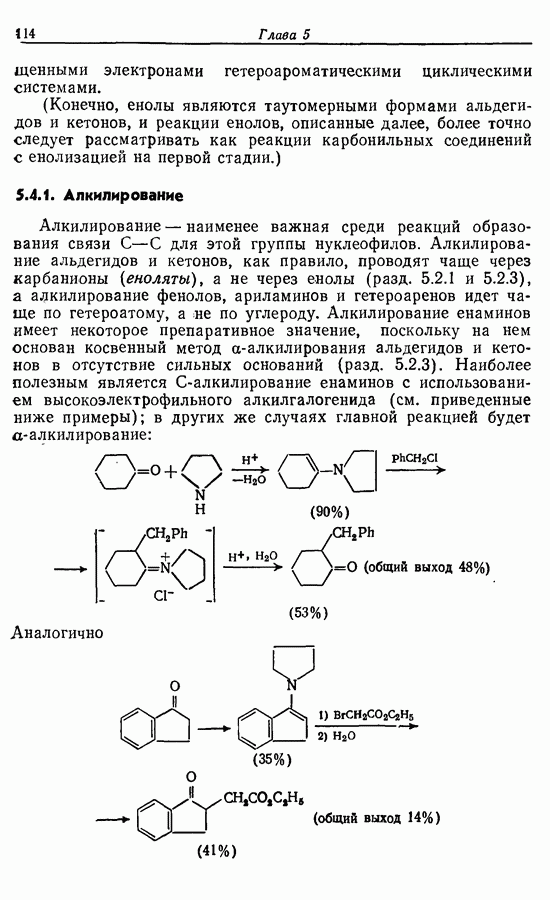
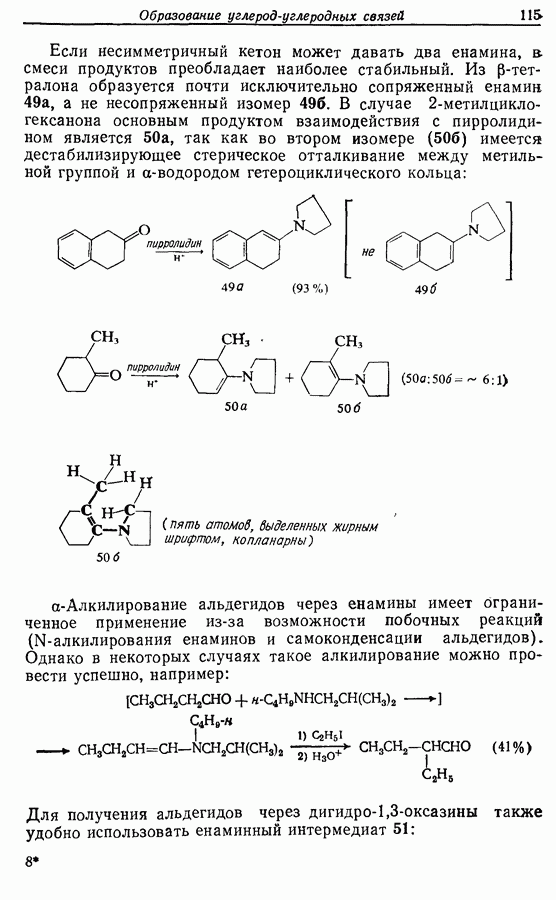
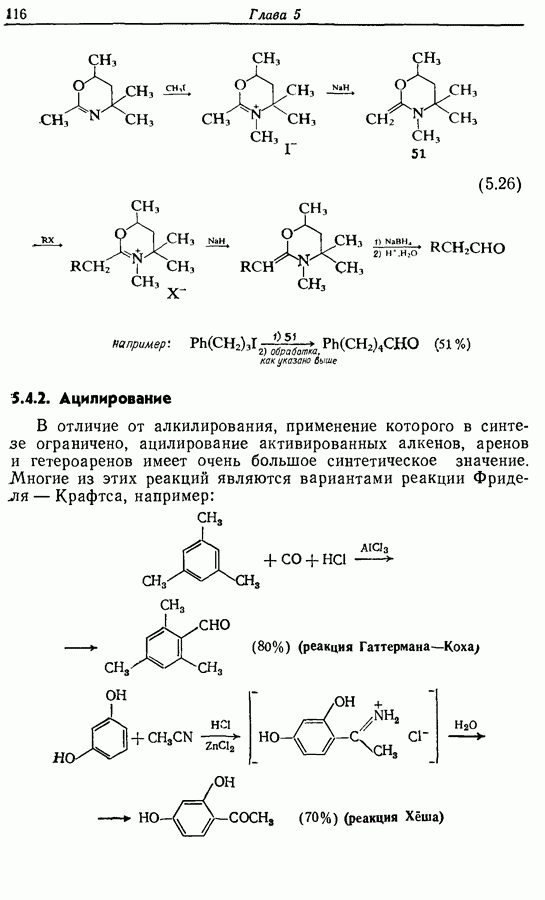
- 5.1.1. Алкилирование
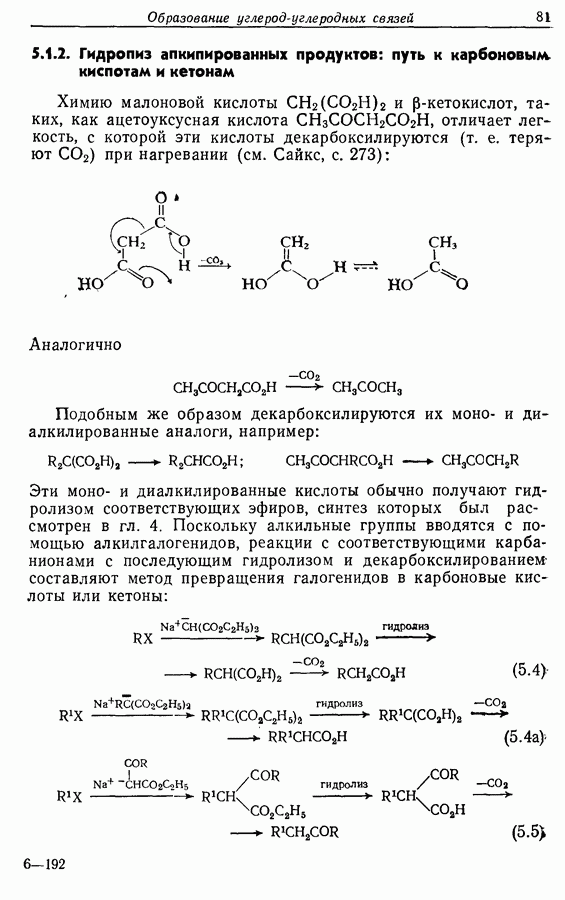
- 5.1.2. Гидролиз алкинированных продуктов: путь к карбоновым кислотам и кетонам
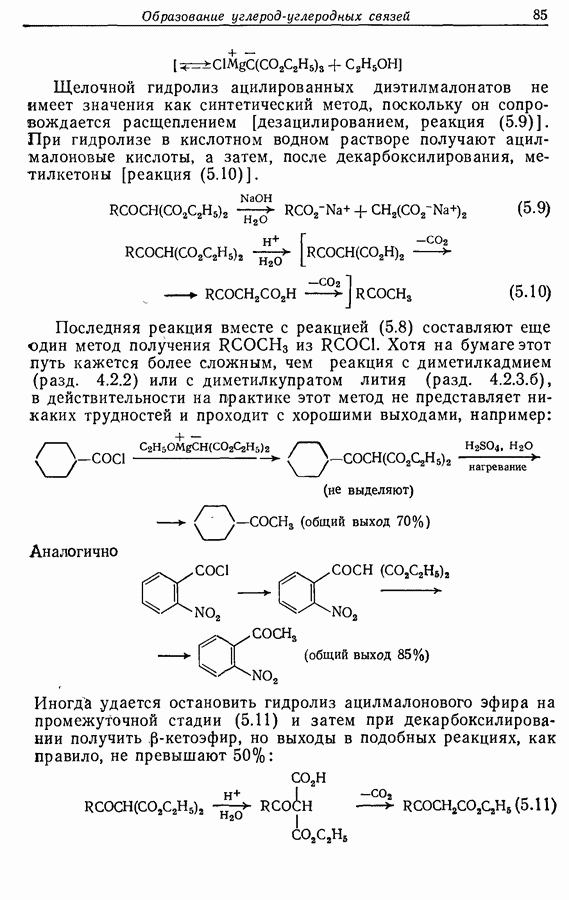
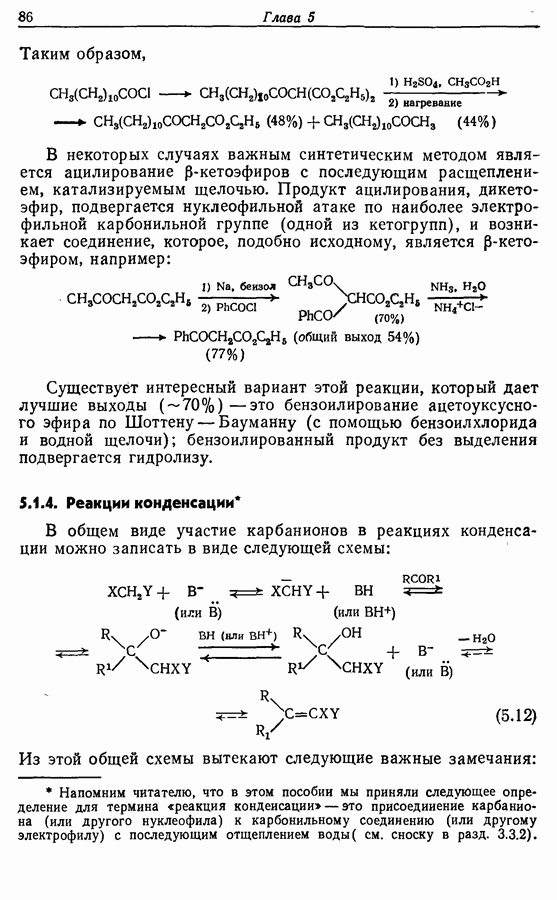
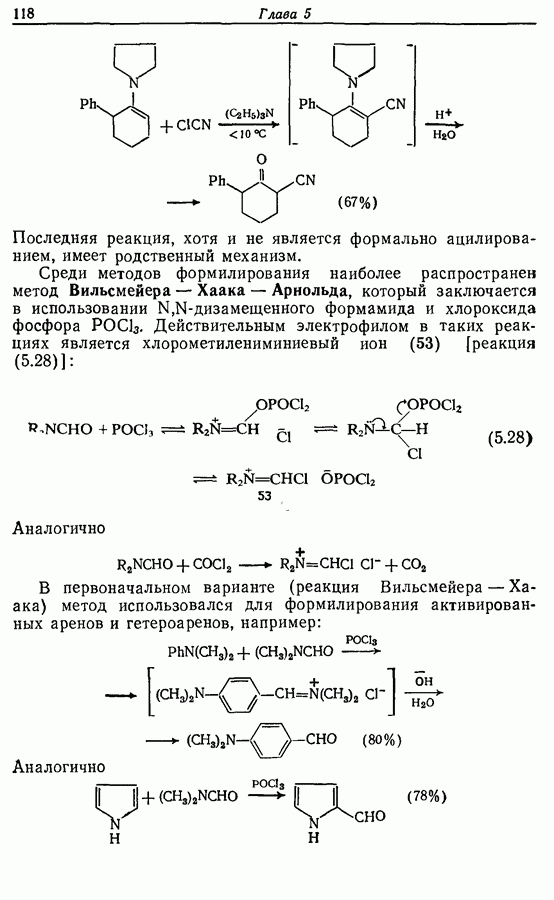
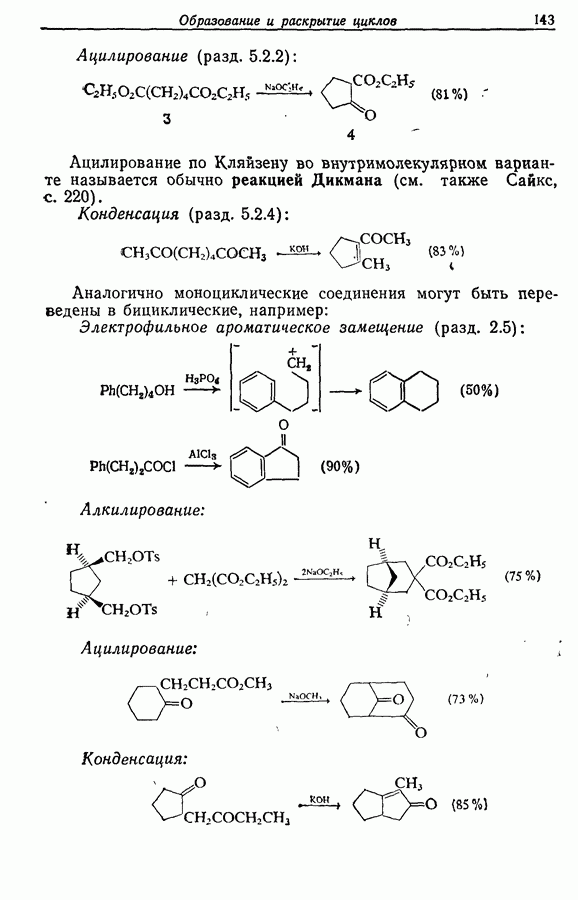
- 5.1.3. Ацилирование
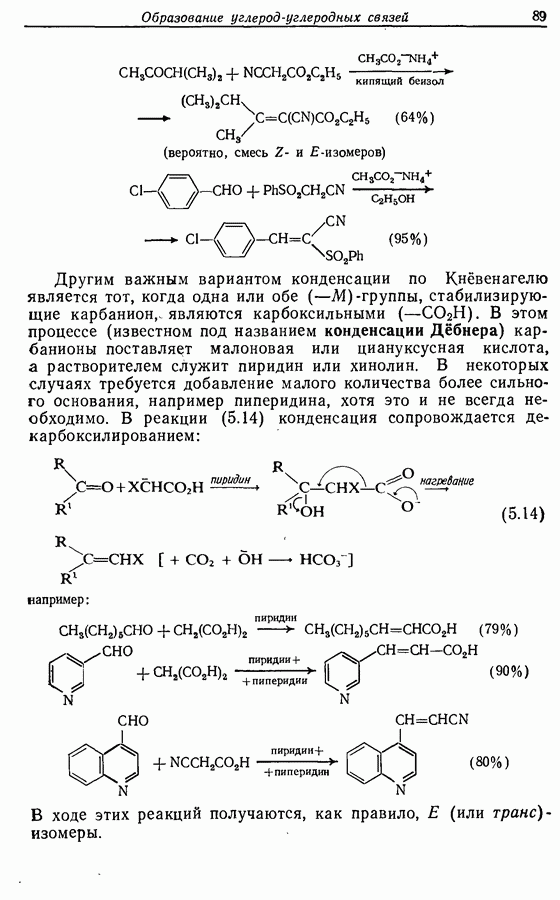
- 5.1.4. Реакции конденсации
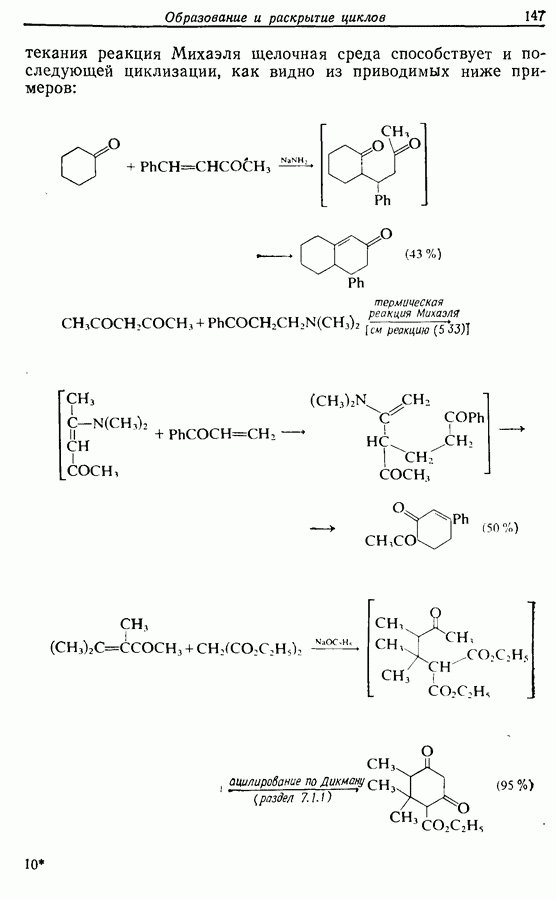
- 5.1.5. Реакции с соединениями типа … и родственными системами: реакция Михаэля
- 5.2. Карбанионы, стабилизированные одной (-М)-группой
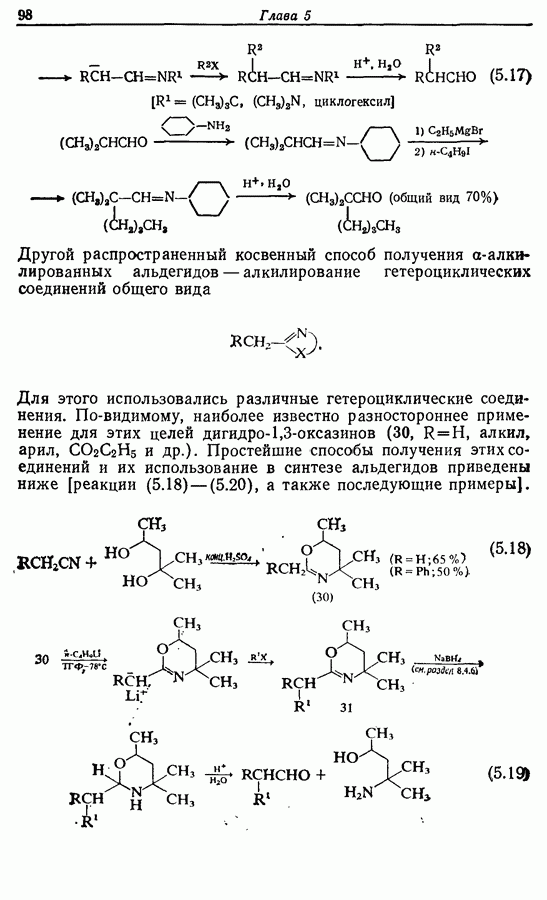
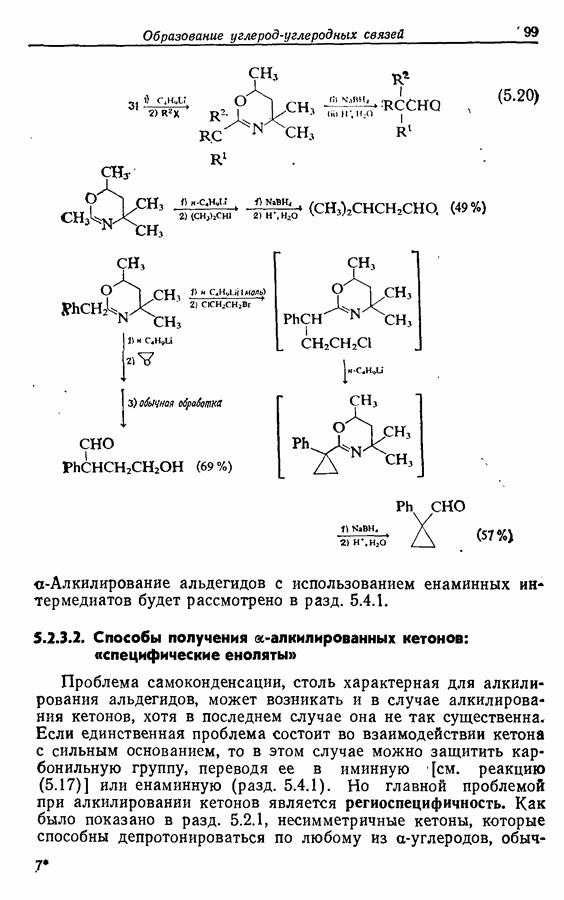
- 5.2.3. Косвенные пути получения a-алкилированных альдегидов и кетонов
- 5.2.4. Реакции конденсации
- 5.2.5. Реакция Михаэля
- 5.3. Карбанионы, стабилизированные соседними атомами фосфора или серы
- 5.3.2. Карбанионы, стабилизированные двумя атомами серы
- 5.4. Алкены, арены и гетероарены как нуклеофилы
- 5.4.3. Реакции присоединения и конденсации с карбонильными и родственными им соединениями
- 5.5. Заключение
- 5.6. Задачи
- 6. ОБРАЗОВАНИЕ СВЯЗЕЙ УГЛЕРОДА С ГЕТЕРОАТОМОМ: ОСНОВНЫЕ ПРИНЦИПЫ
- 6.1. Связи углерод — галоген
- 6.2. Связи углерод — кислород и углерод — сера
- 6.3. Связи углерод — азот
- 6.3.2. Электрофильный азот и нуклеофильный углерод
- 6.3.3. Нитрозосоединения, включая нитриты
- 7. ОБРАЗОВАНИЕ И РАСКРЫТИЕ ЦИКЛОВ
- 7.1. Внутримолекулярная циклизация в результате электрофильно-нуклеофильного взаимодействия
- 7.1.2. Условия внутримолекулярного циклообразования. Правила Болдуина
- 7.1.3. Присоединение по Михаэлю в процессах циклизации
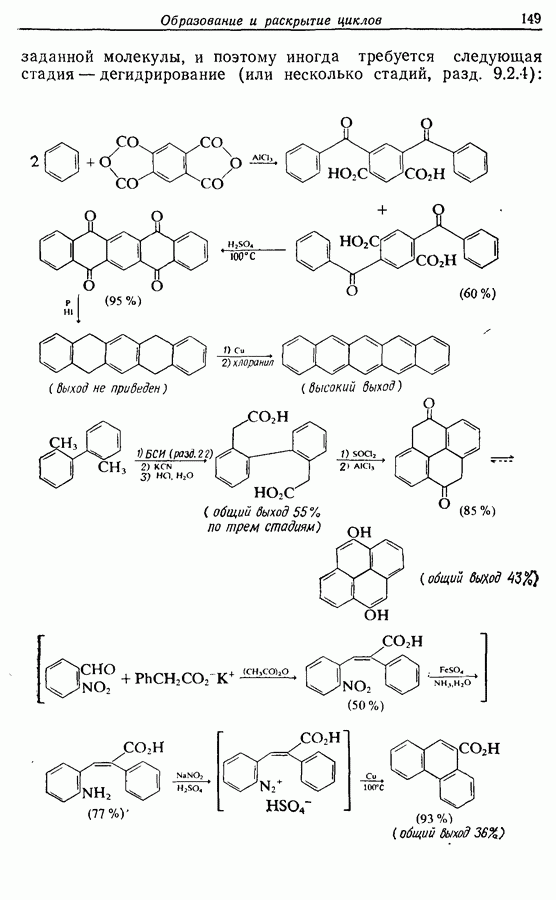
- 7.1.4. Образование ароматических и гетероароматических циклов
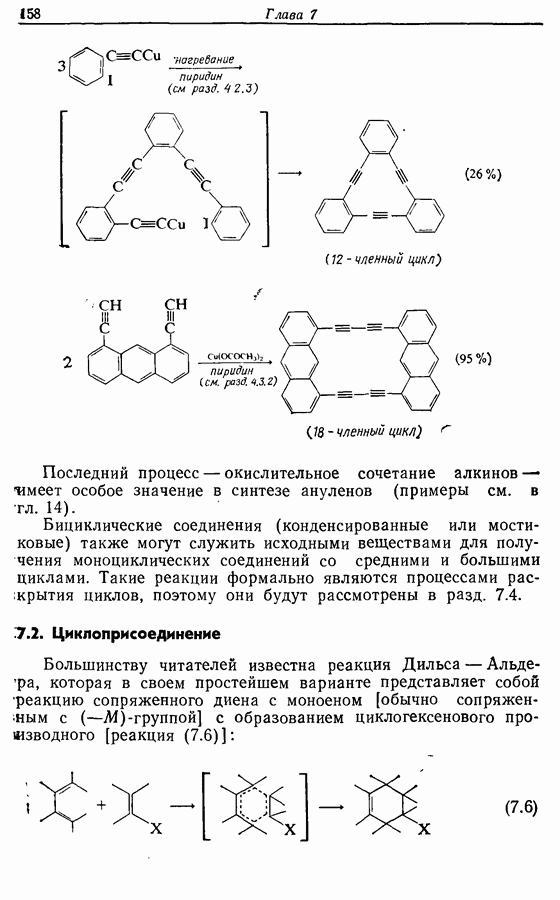
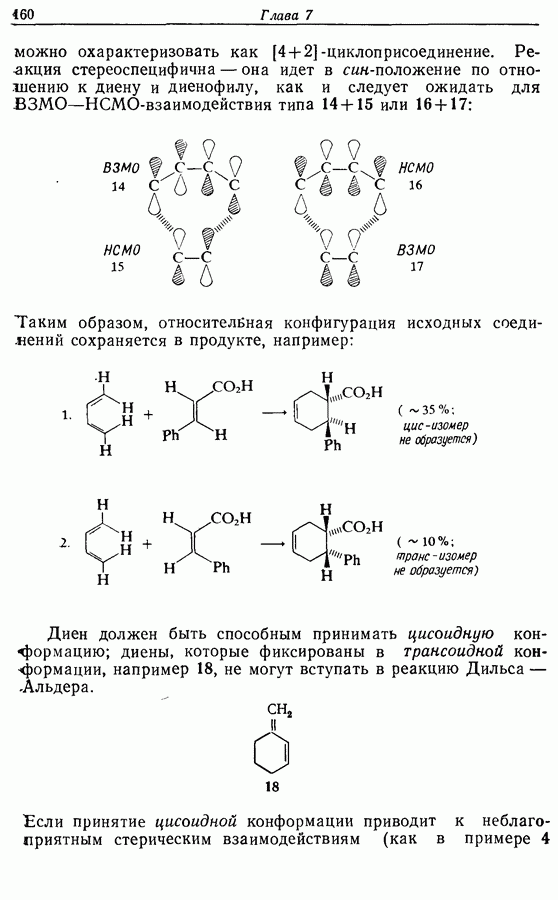
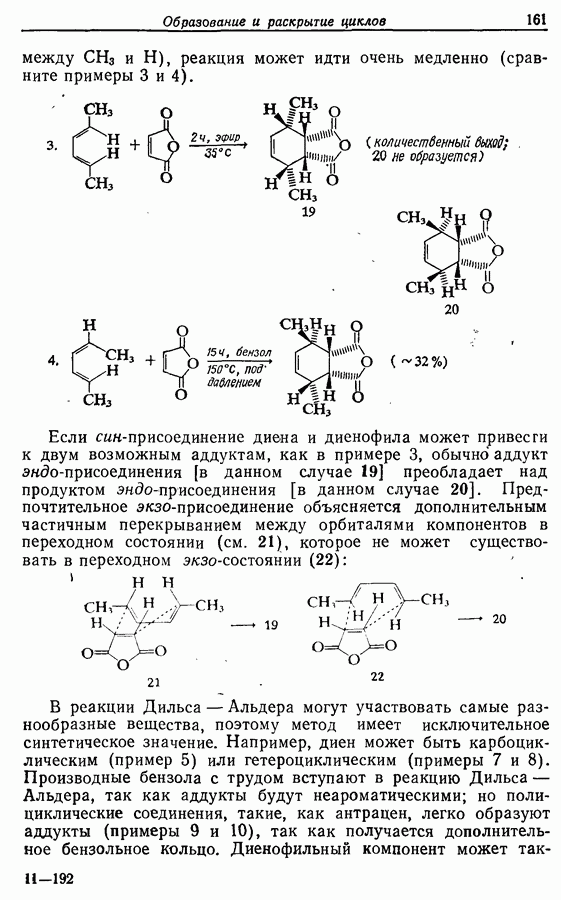
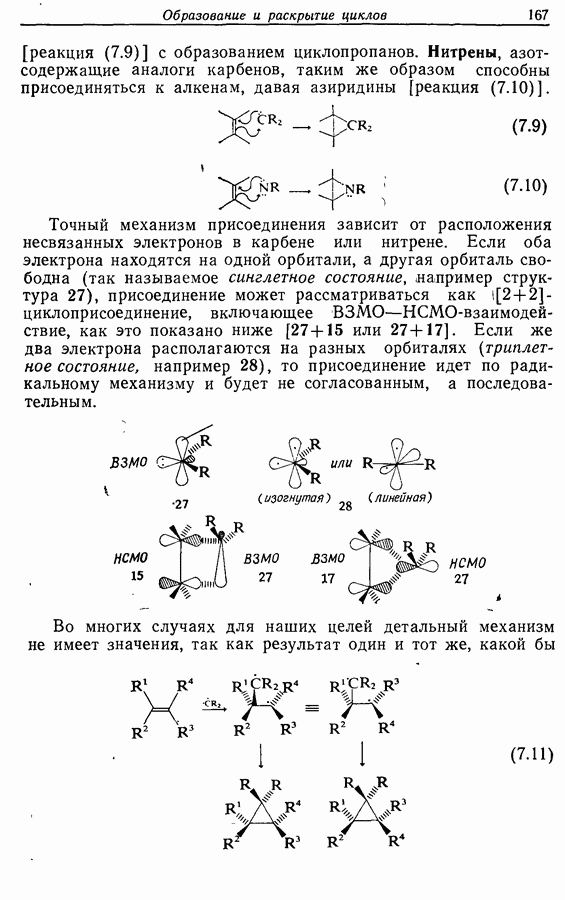
- 7.2. Циклоприсоединение
- 7.2.2. 1,3-Диполярное циклоприсоединение
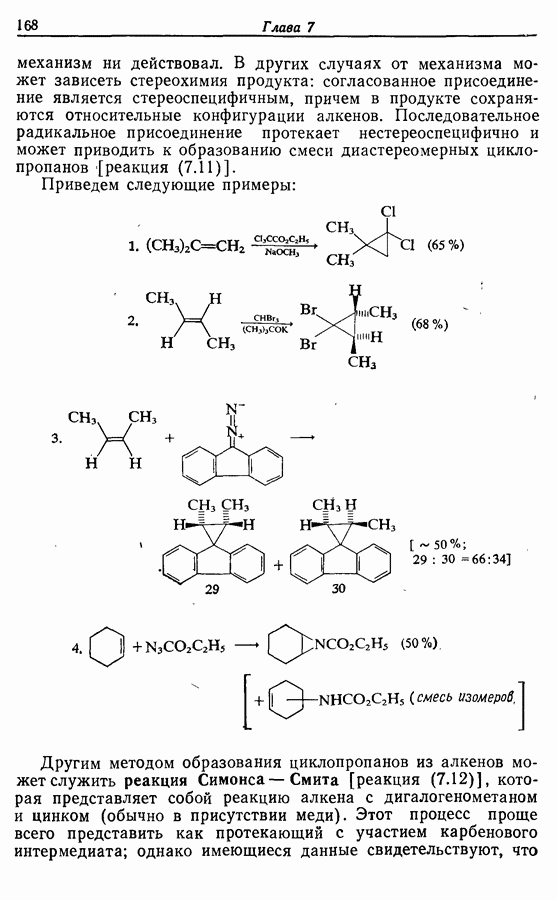
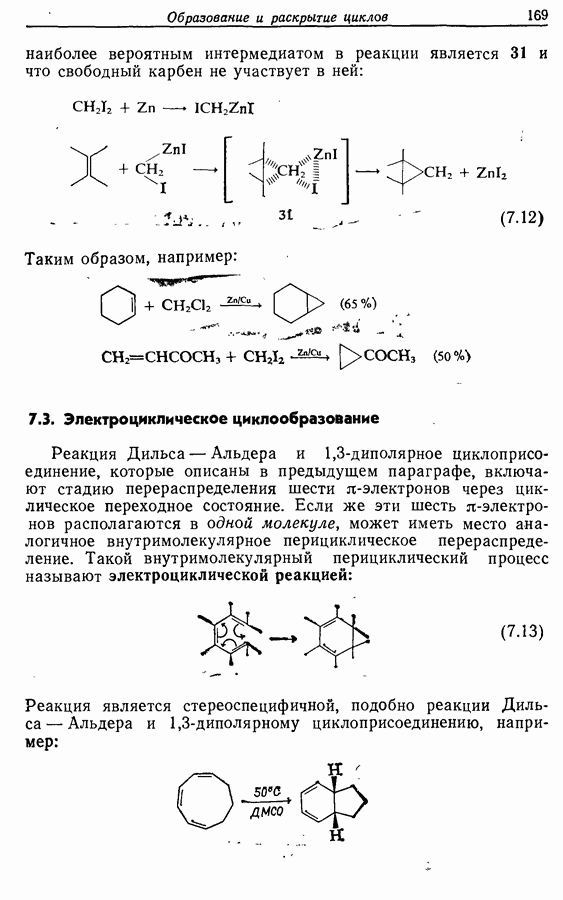
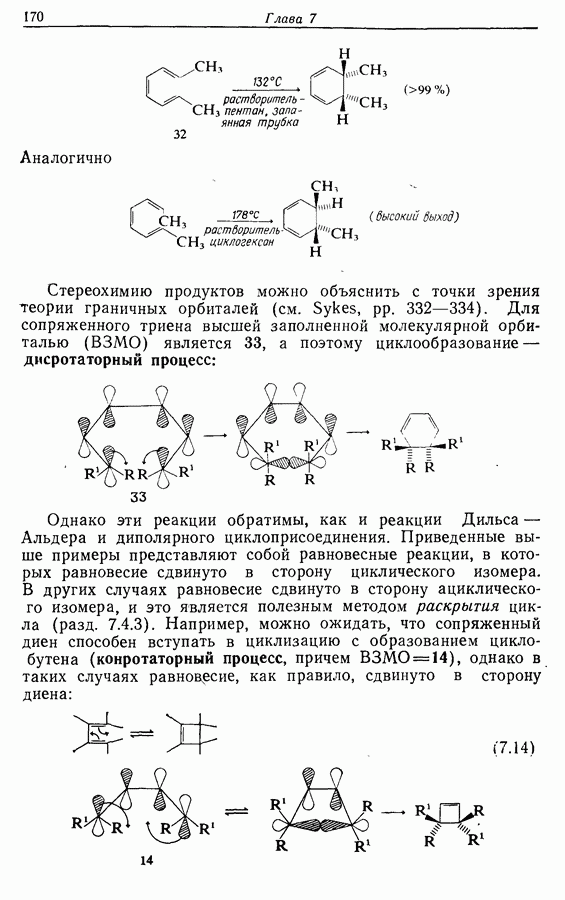
- 7.2.3. Присоединение карбенов и нитренов к алкенам
- 7.3. Электроциклическое циклообразование
- 7.4. Раскрытие цикла
- 7.5. Выводы и задачи
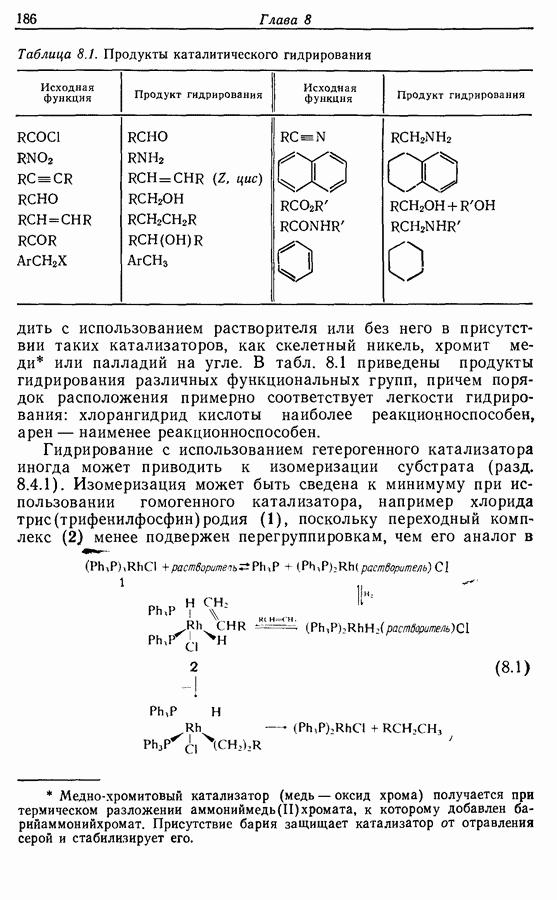
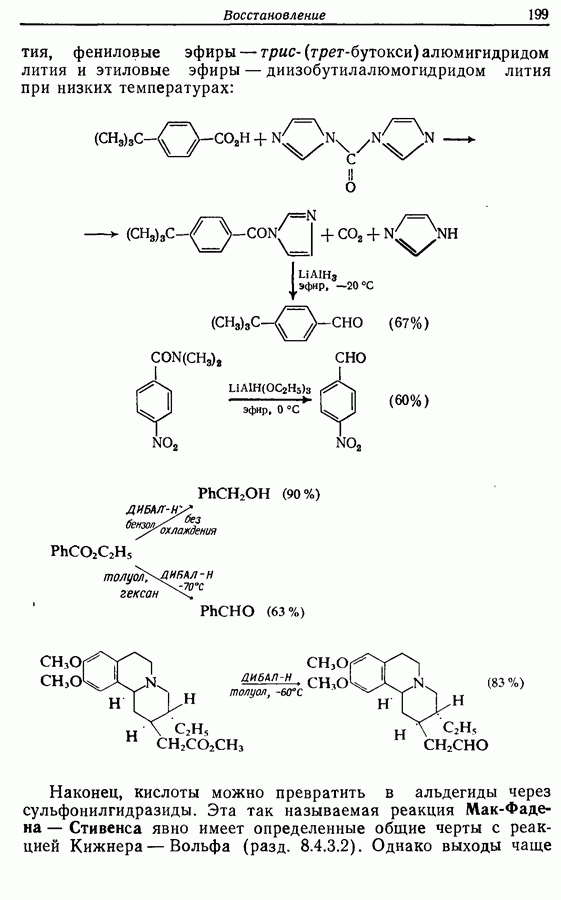
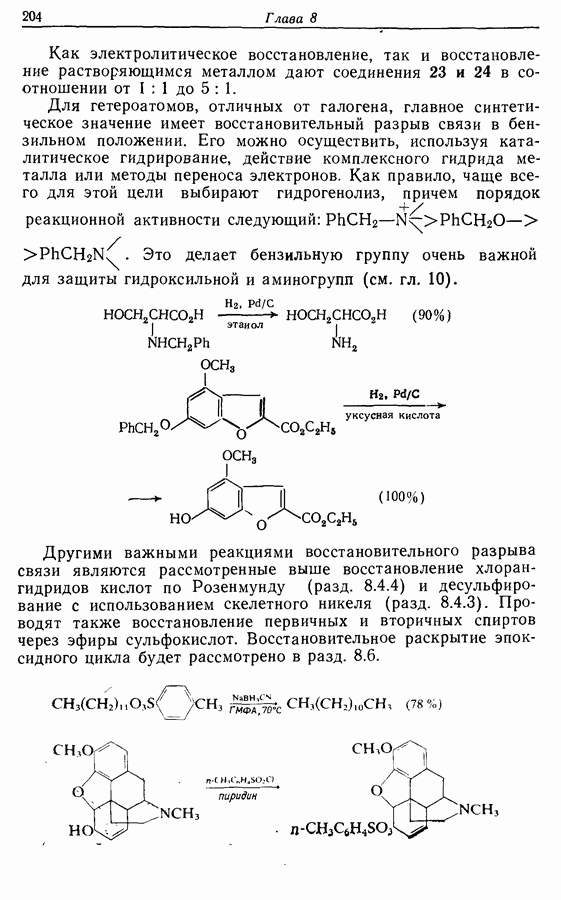
- 8. ВОССТАНОВЛЕНИЕ
- 8.1. Каталитическое гидрирование
- 8.2. Восстановление гидридами металлов
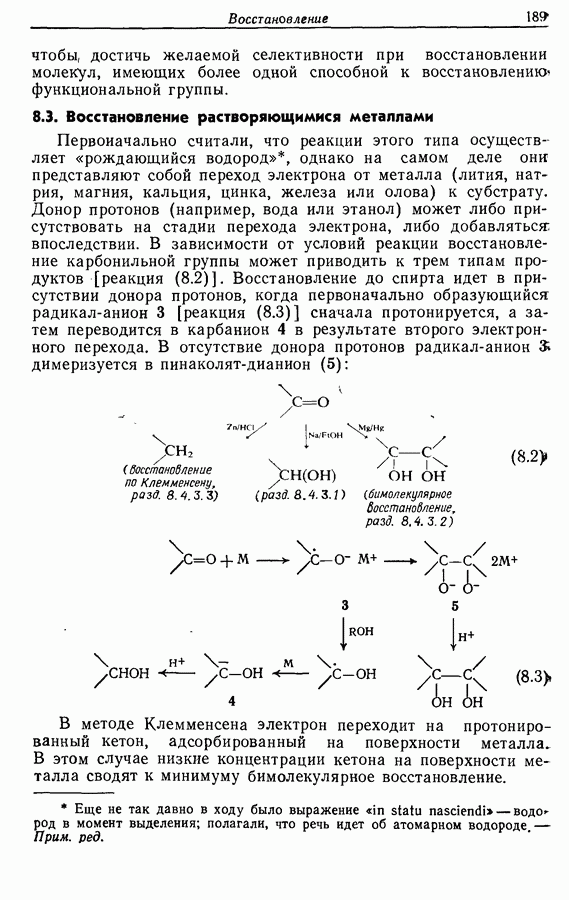
- 8.3. Восстановление растворяющимися металлами
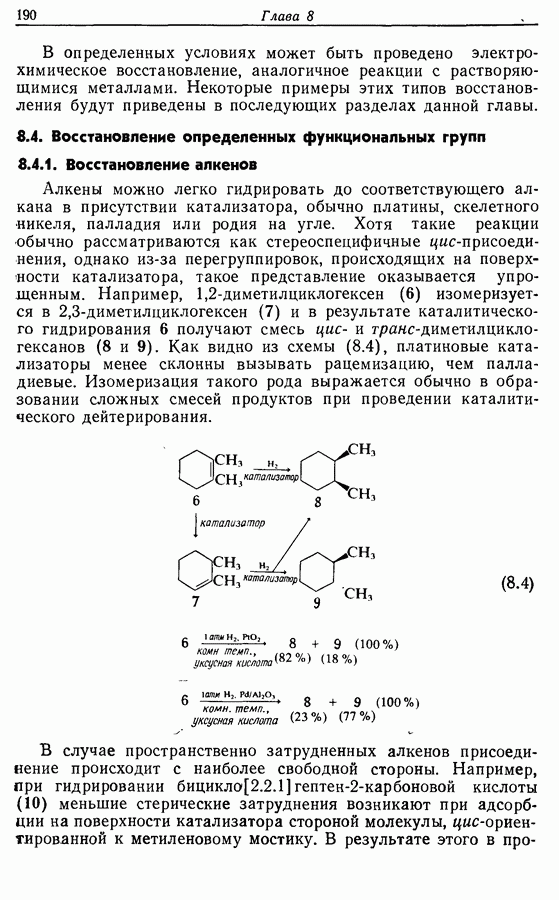
- 8.4. Восстановление определенных функциональных групп
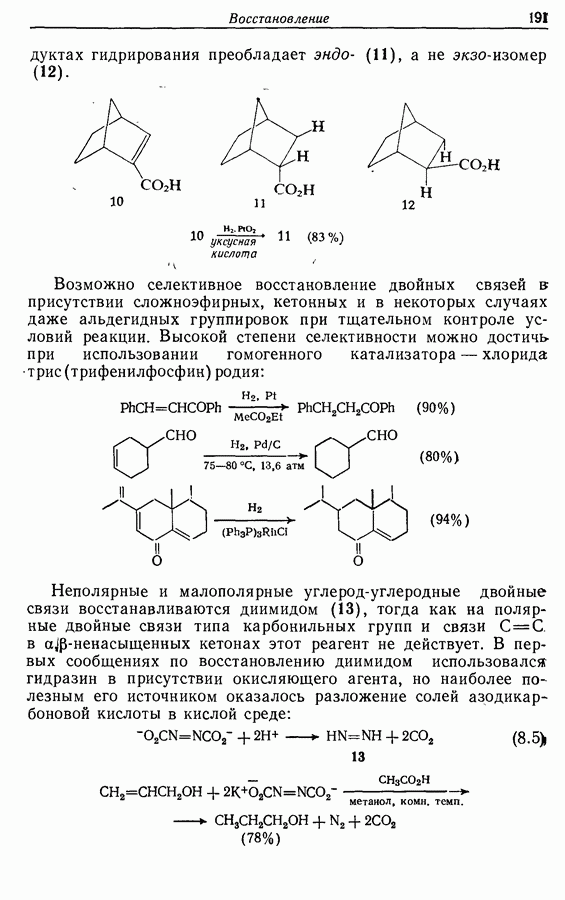
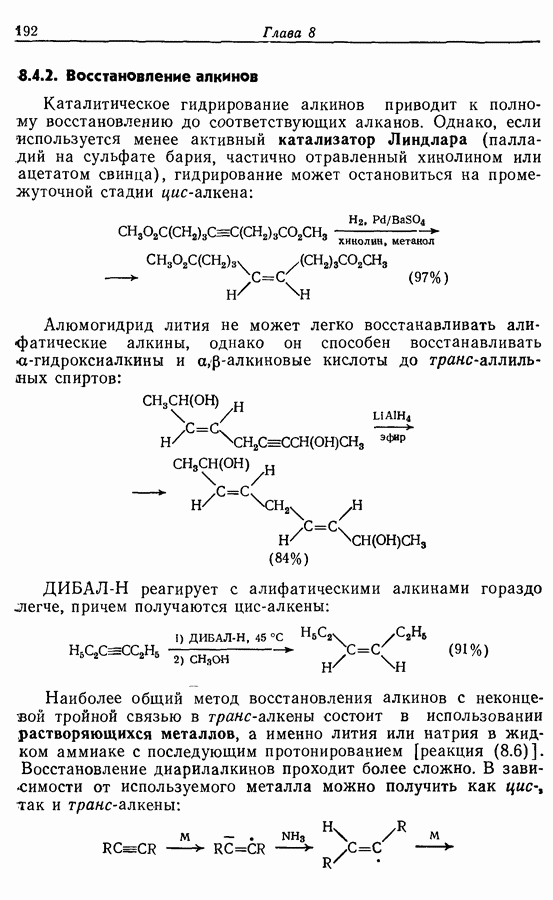
- 8.4.2. Восстановление алкинов
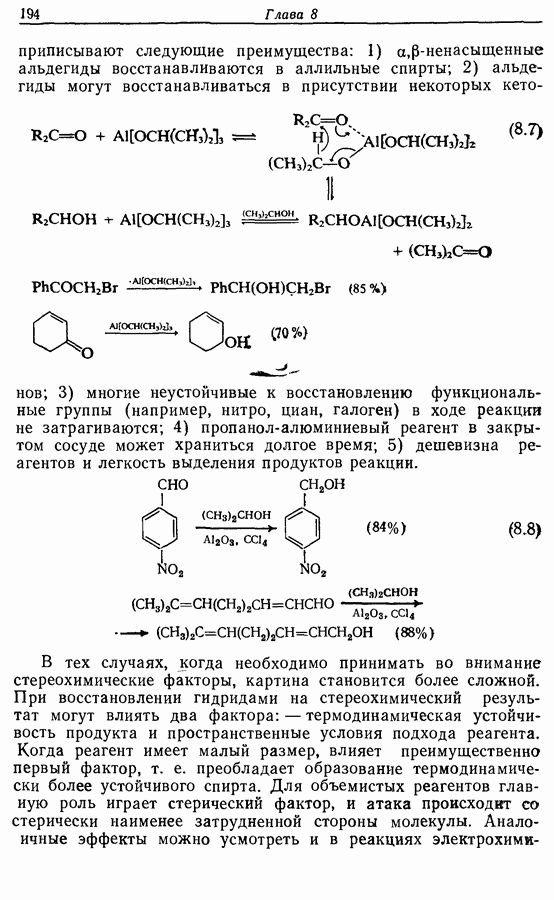
- 8.4.3. Восстановление альдегидов и кетонов
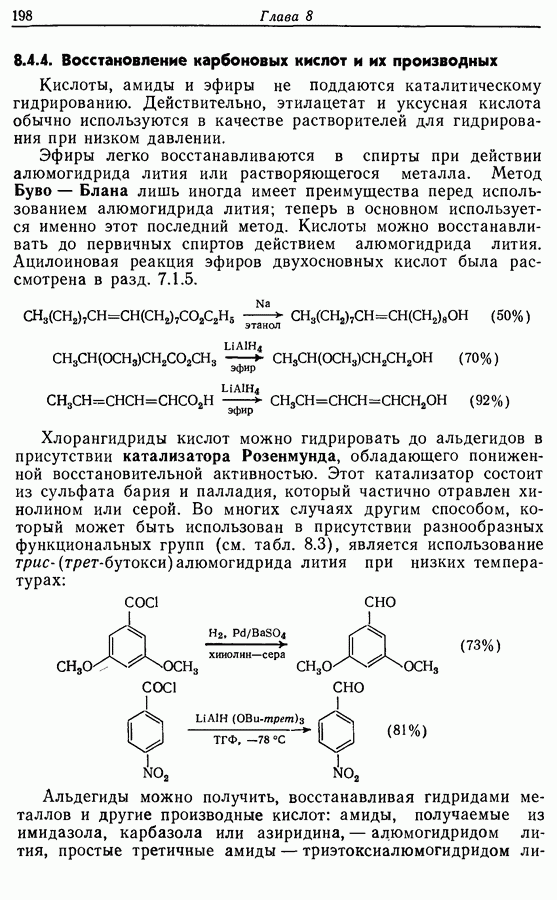
- 8.4.4. Восстановление карбоновых кислот и их производных
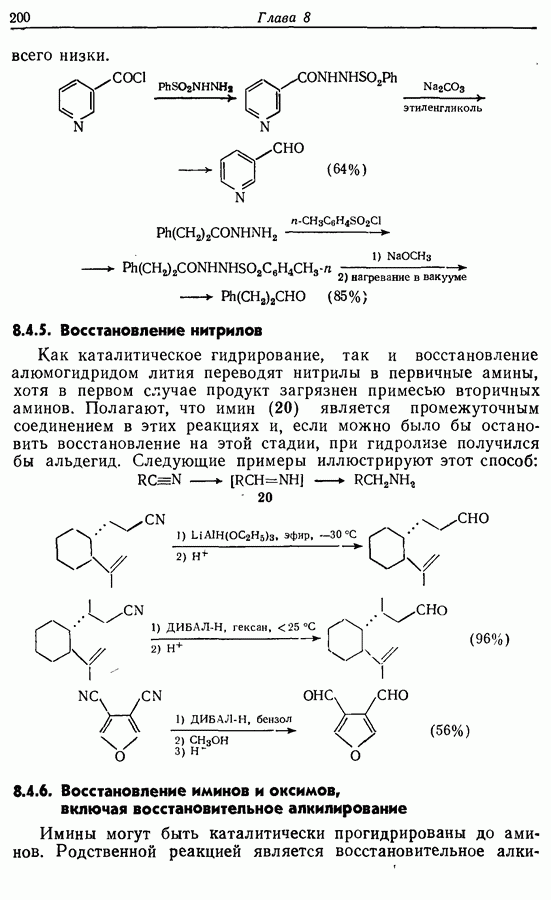
- 8.4.5. Восстановление нитрилов
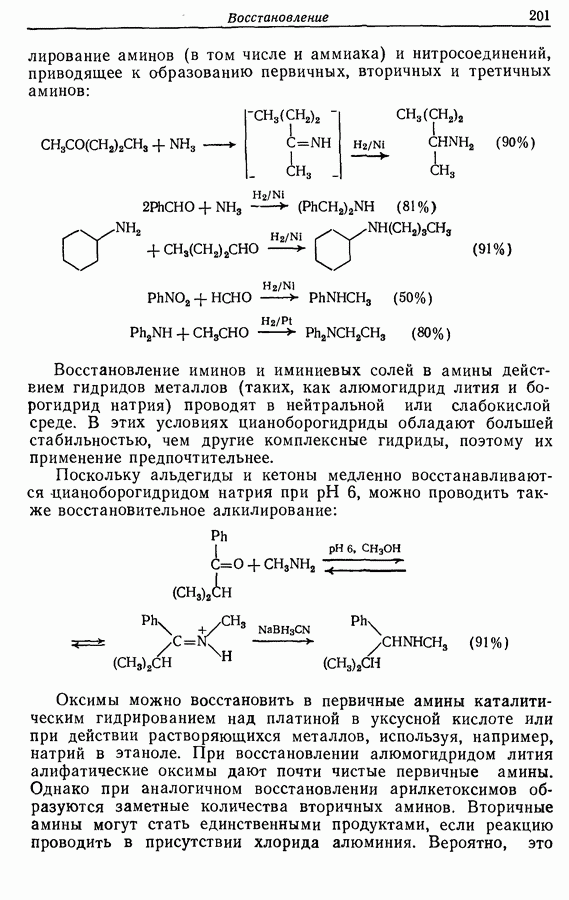
- 8.4.6. Восстановление иминов и оксимов, включая восстановительное алкилирование
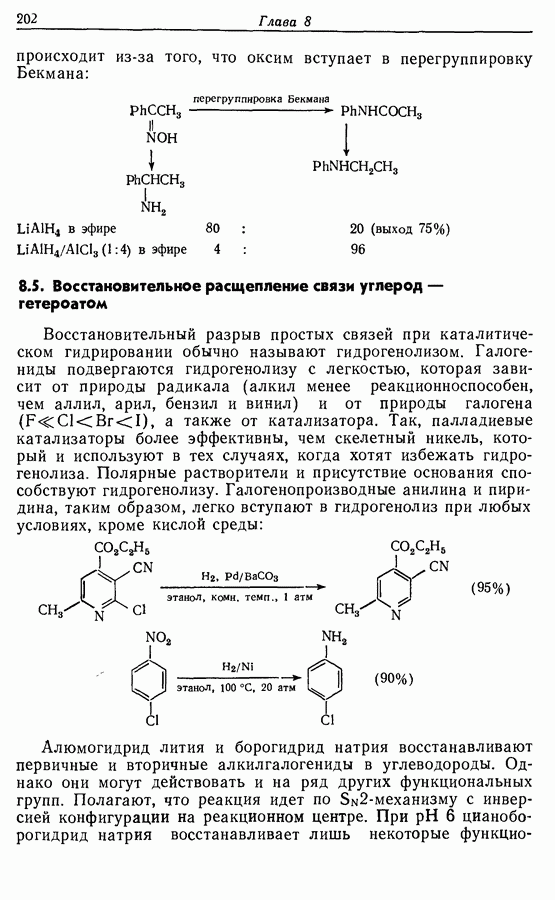
- 8.5. Восстановительное расщепление связи углерод — гетероатом
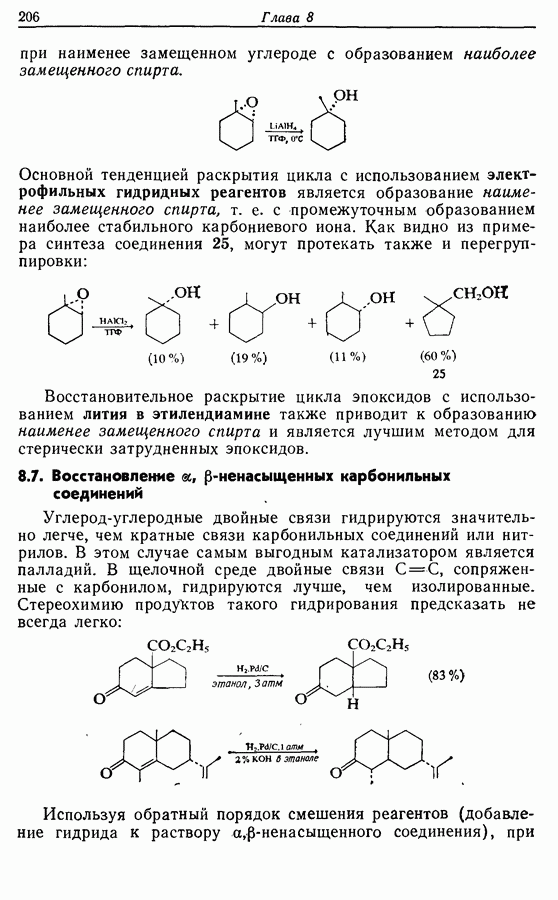
- 8.6. Восстановительное раскрытие цикла в эпоксидах
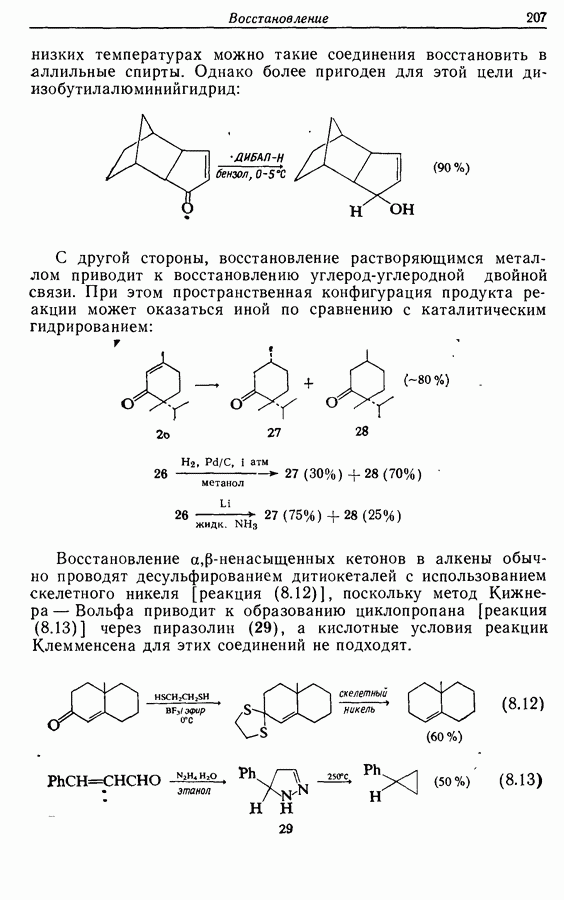
- 8.7. Восстановление a,b-ненасыщенных карбонильных соединений
- 8.8. Восстановление сопряженных диенов
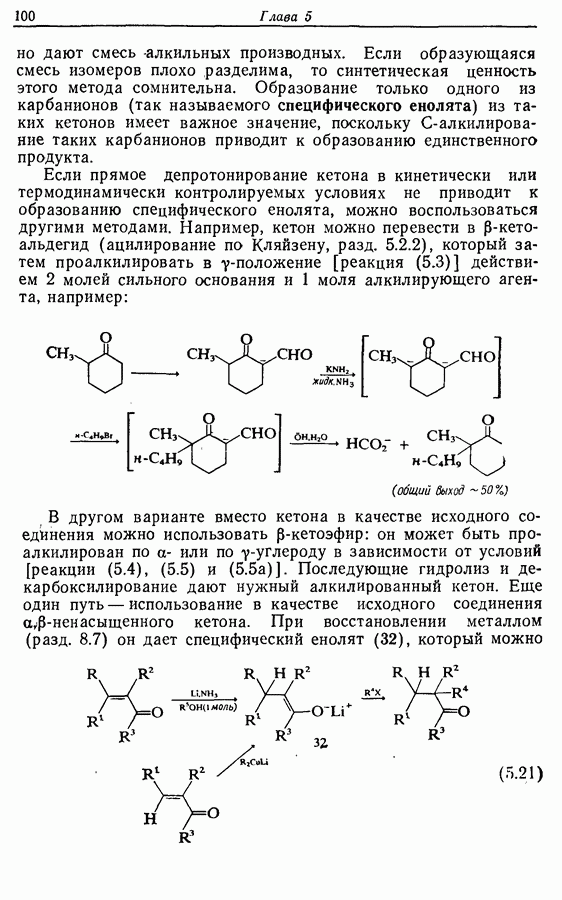
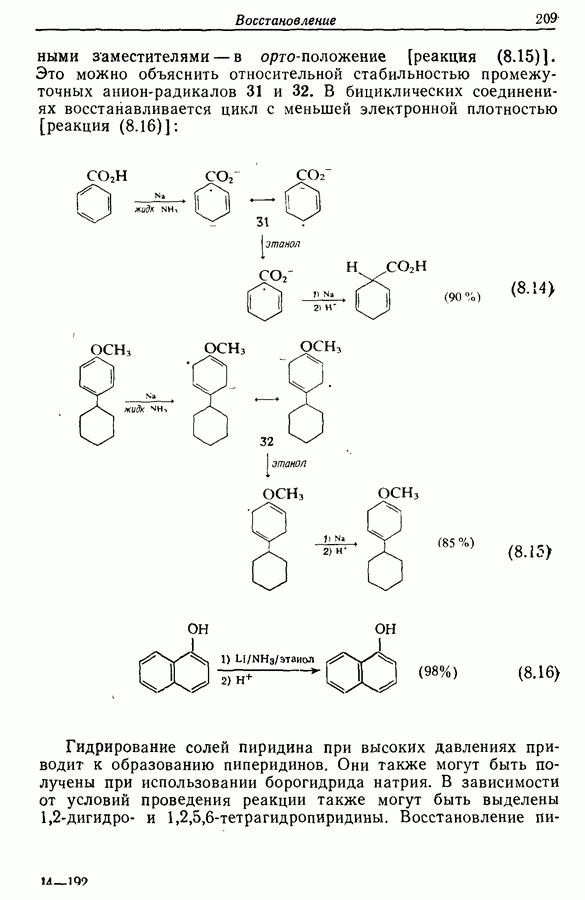
- 8.9. Восстановление ароматических и гетероароматических соединений
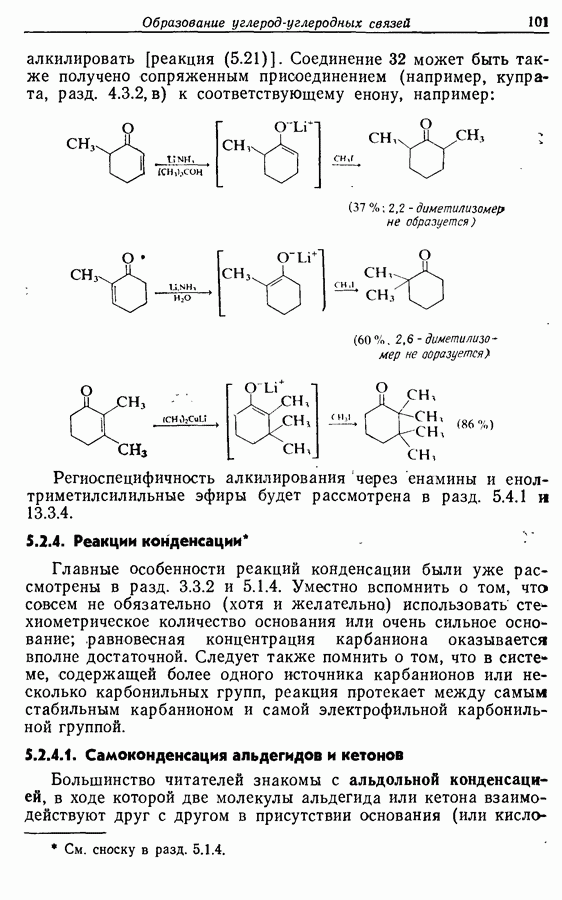
- 9. ОКИСЛЕНИЕ
- 9.2. Окисление углеводородов
- 9.2.2. Аллильное окисление
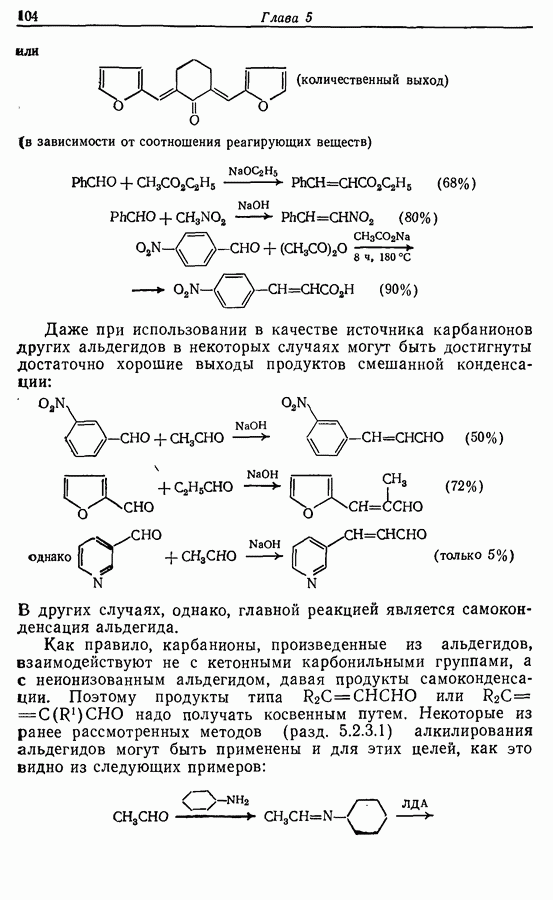
- 9.2.3. Бензильное окисление
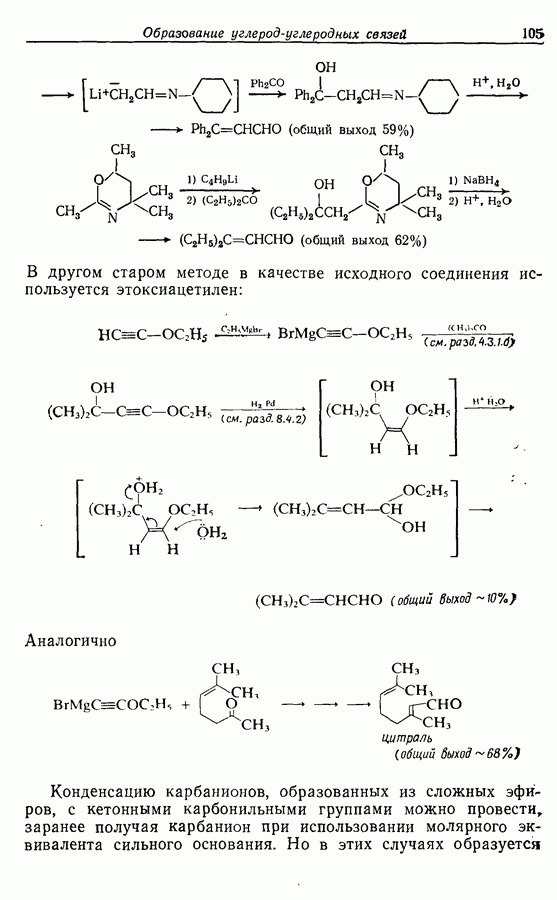
- 9.2.4. Дегидрирование алканов, алкильных групп и алкенов
- 9.2.5. Окислительное присоединение к алкенам
- 9.2.6. Окислительная деструкция алкенов
- 9.2.7. Окисление алкинов
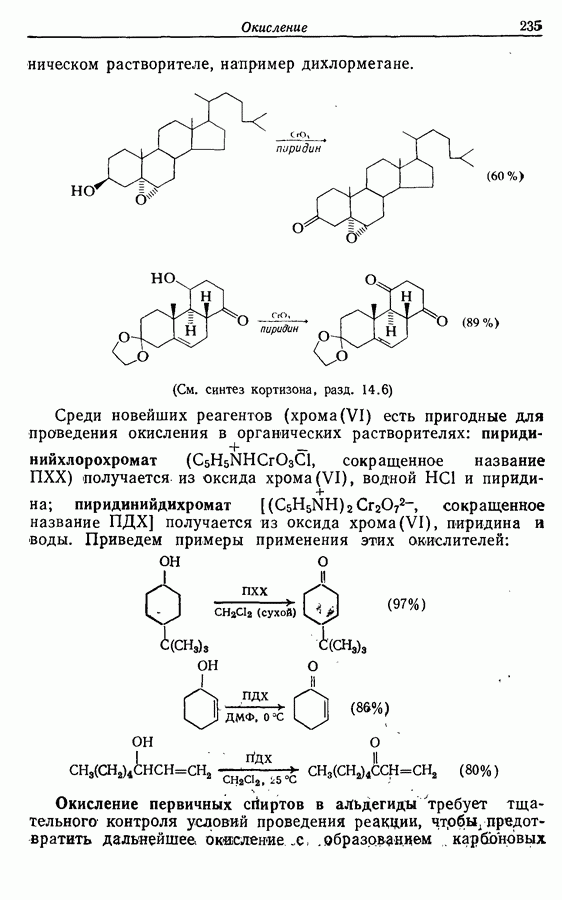
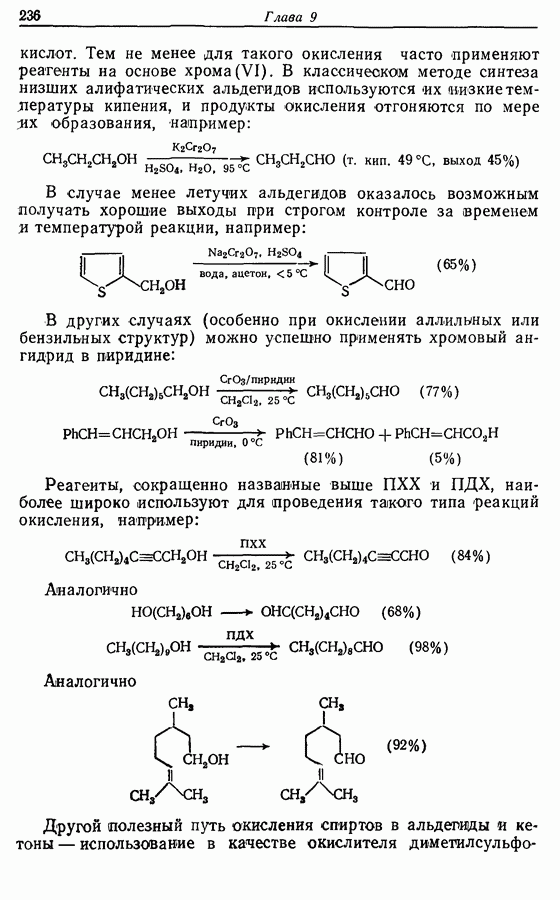
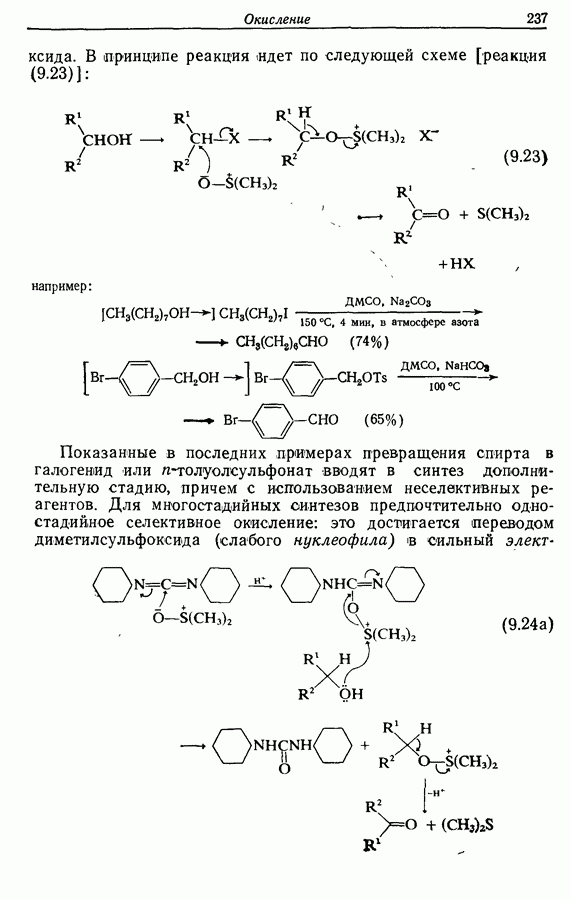
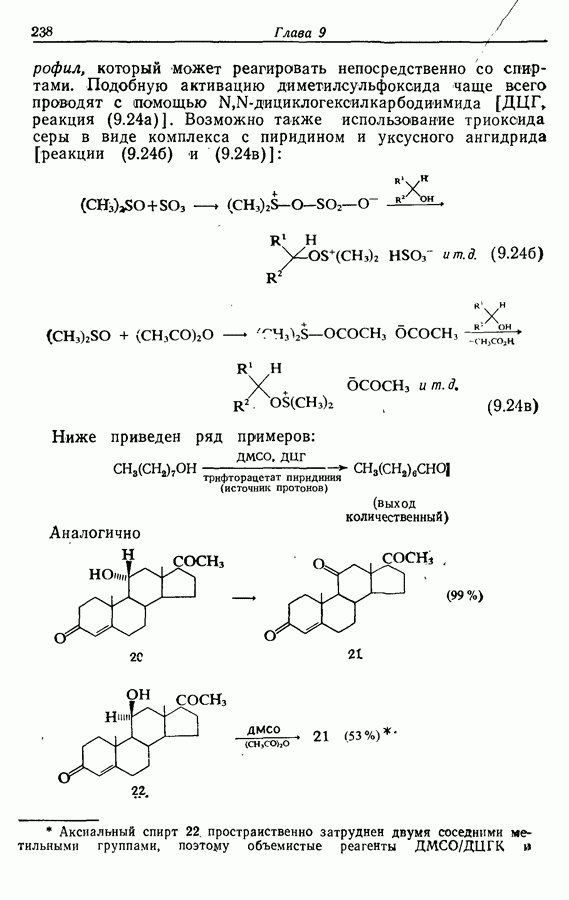
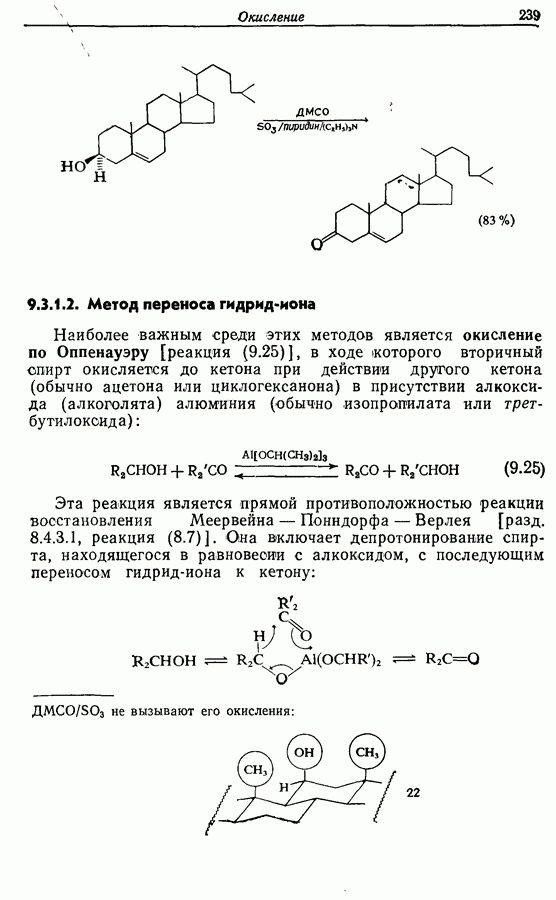
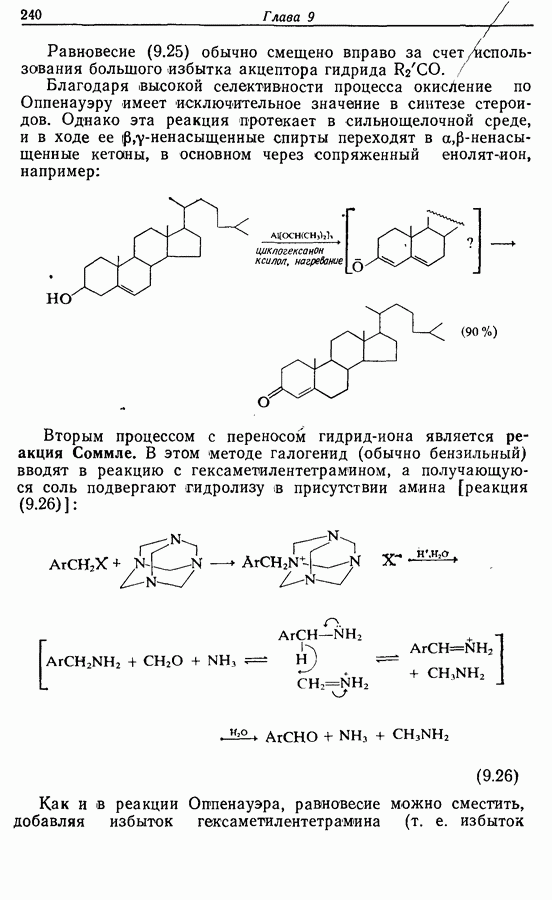
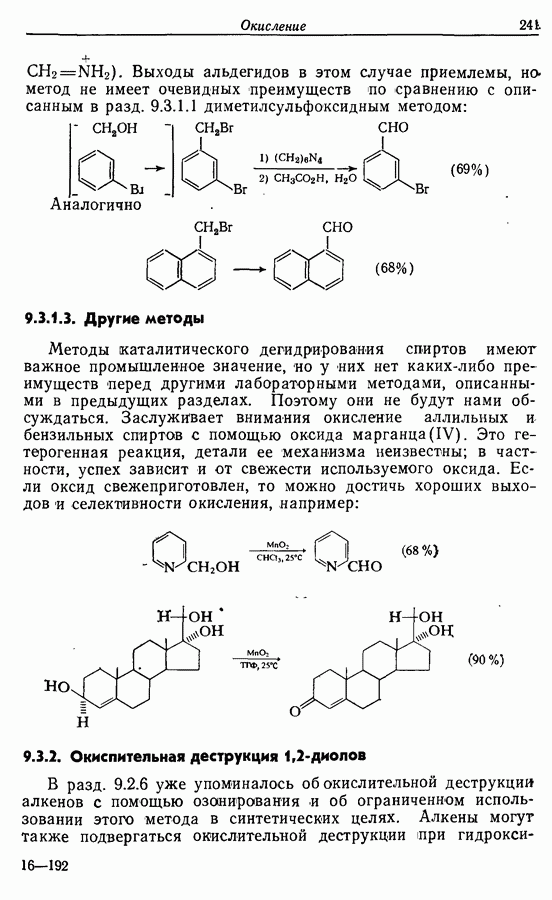
- 9.3. Окисление спиртов и их производных
- 9.3.2. Окислительная деструкция 1,2-диолов
- 9.4. Окисление фенолов
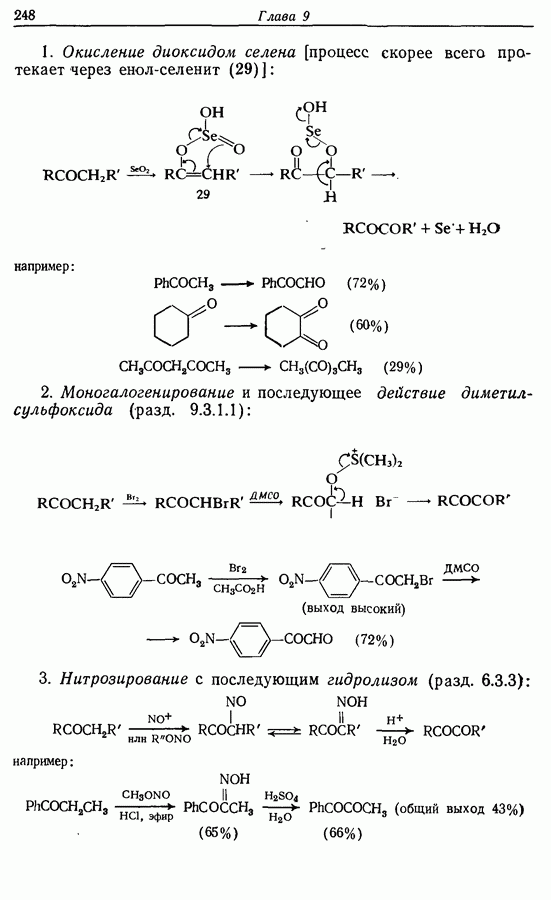
- 9.5. Окисление альдегидов и кетонов
- 9.5.2. Окисление в 1,2-дикарбонильные соединения
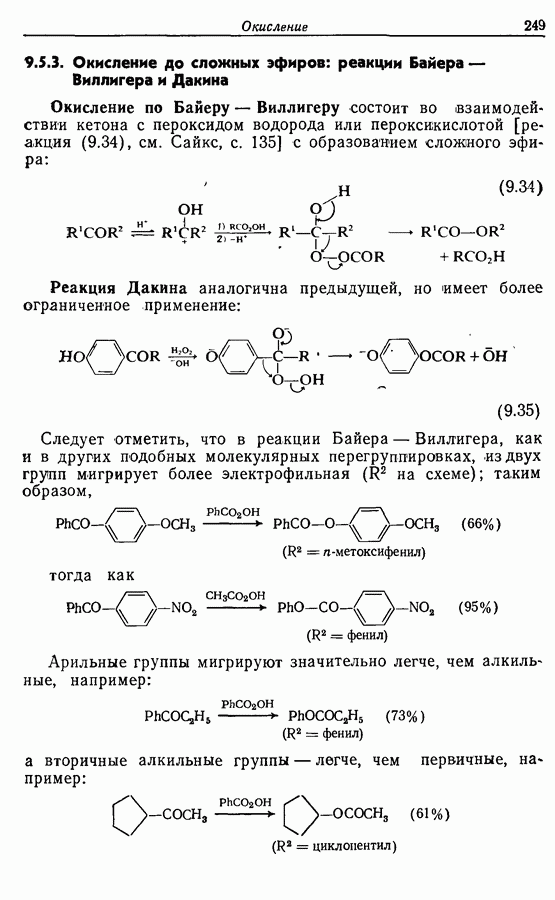
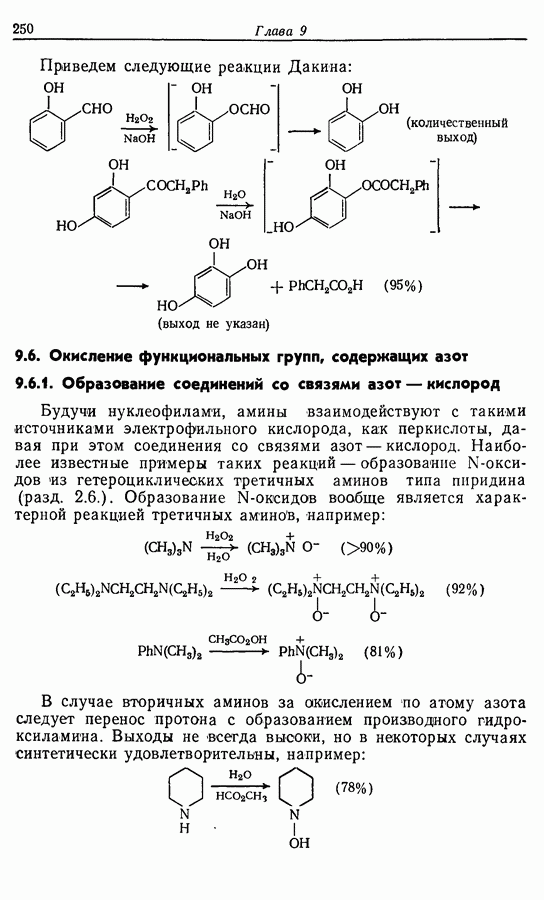
- 9.5.3. Окисление до сложных эфиров: реакции Байера — Виллигера и Дакина
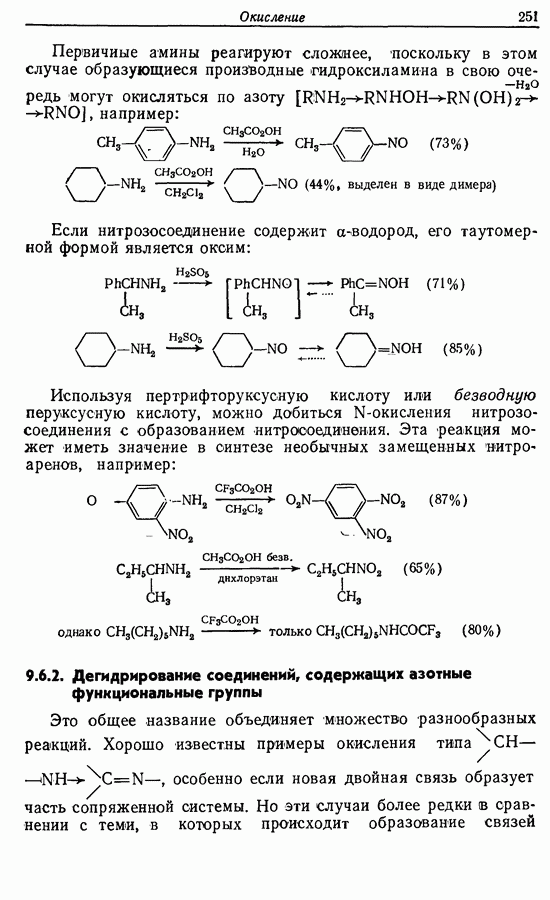
- 9.6. Окисление функциональных групп, содержащих азот
- 9.6.2. Дегидрирование соединений, содержащих азотные функциональные группы
- 9.7. Окисление серусодержащих функциональных групп
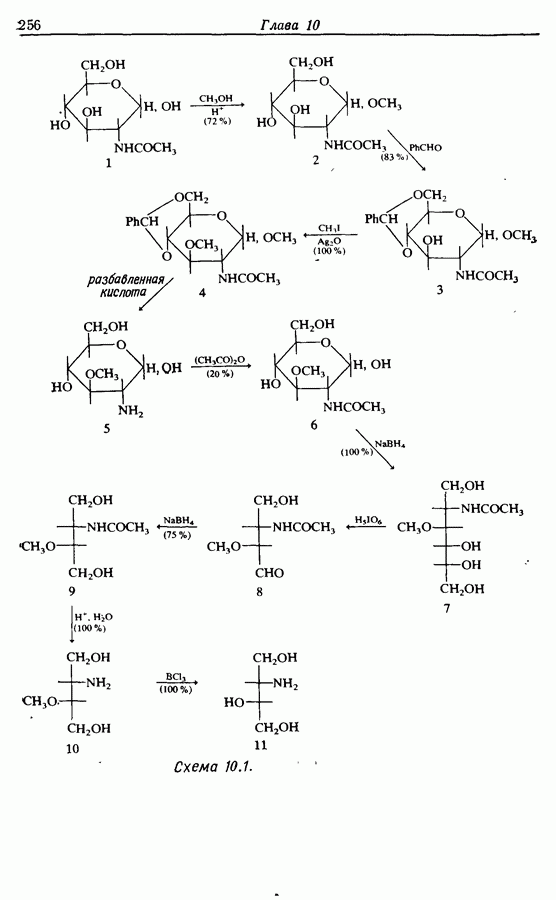
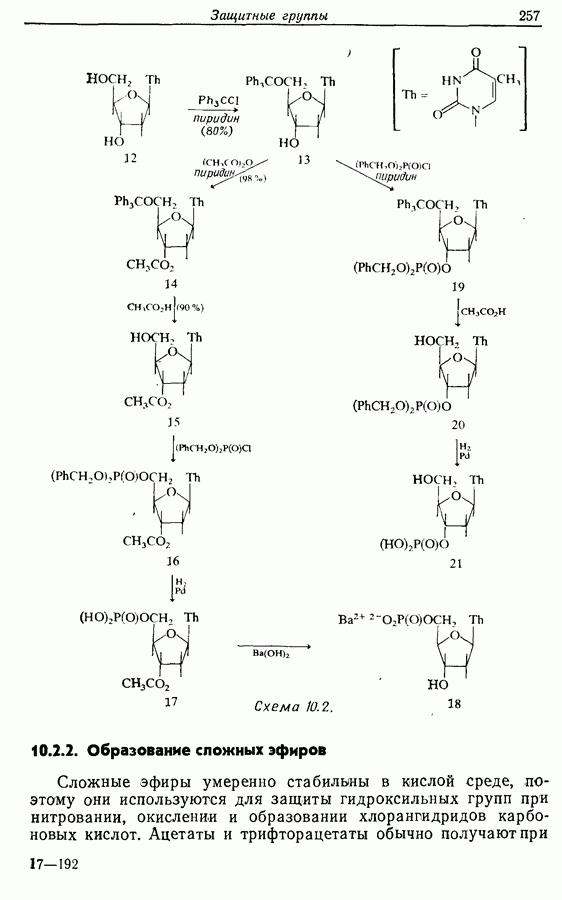
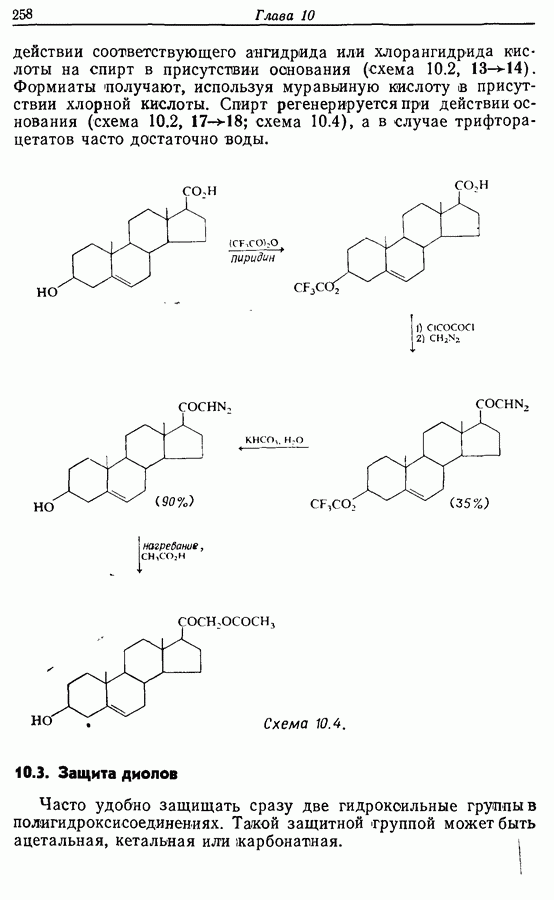
- 10. ЗАЩИТНЫЕ ГРУППЫ
- 10.2. Защита спиртов
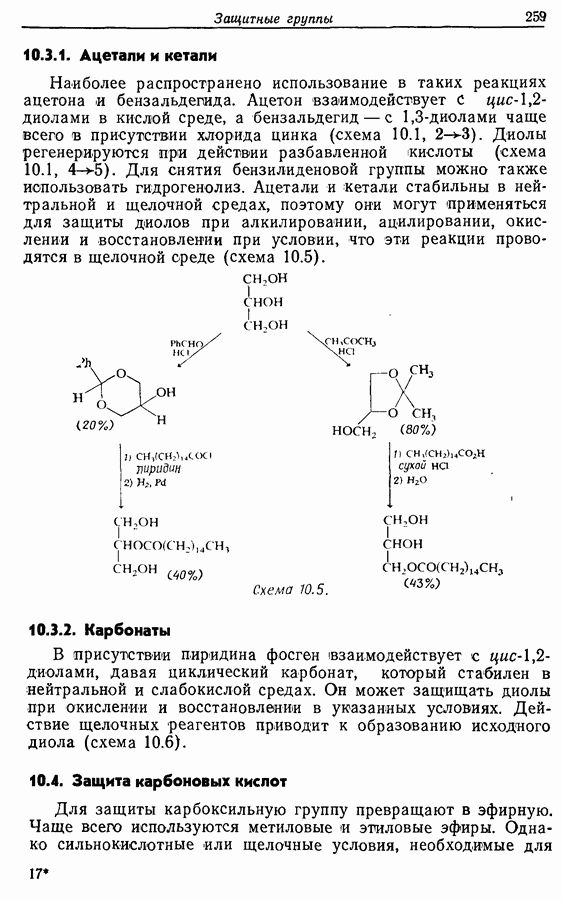
- 10.3. Защита диолов
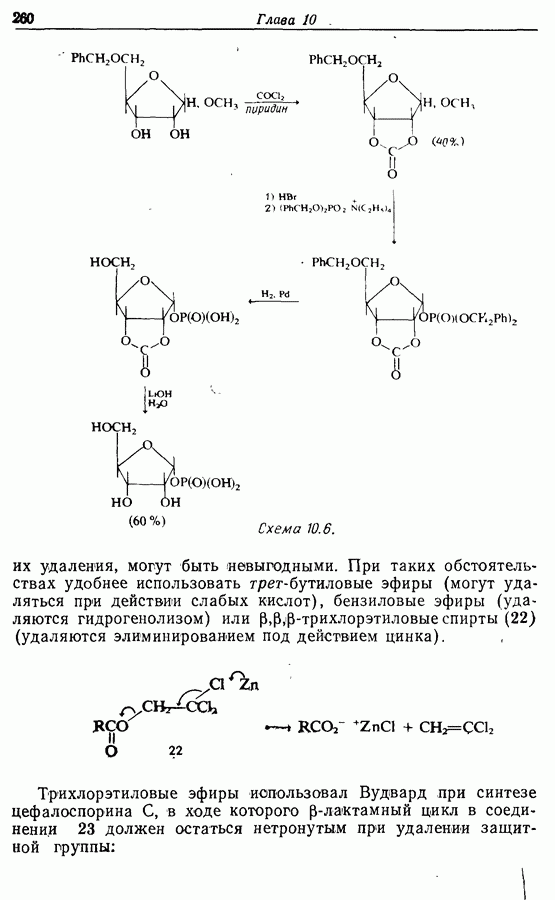
- 10.4. Защита карбоновых кислот
- 10.5. Защита аминогрупп
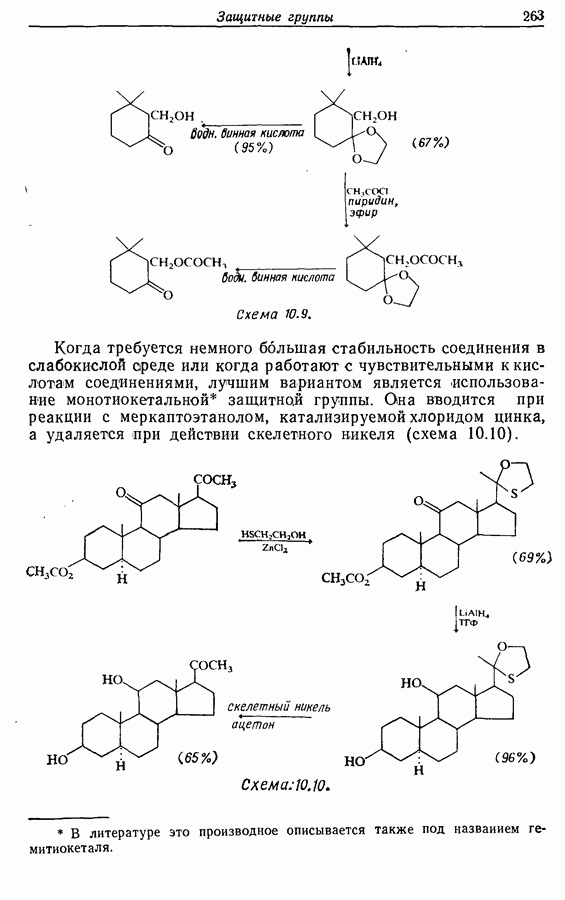
- 10.6. Защита карбонильных групп
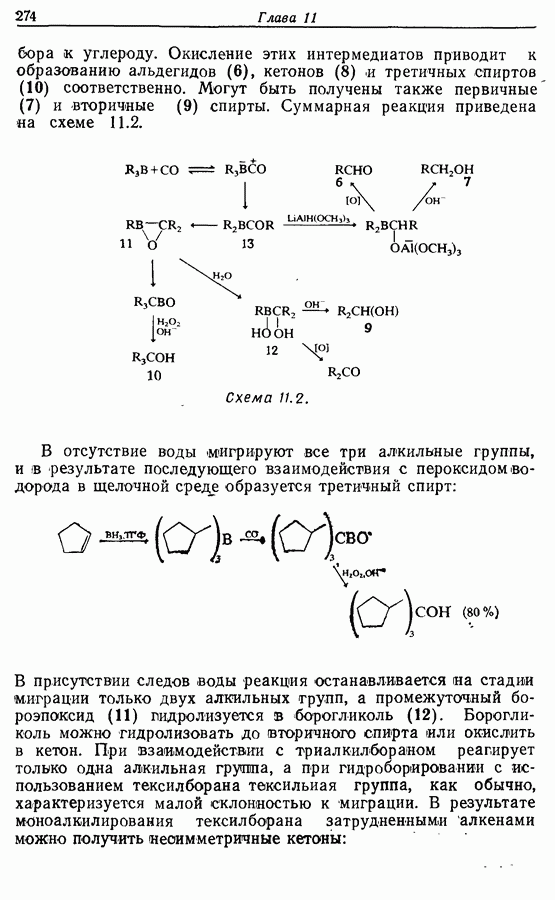
- 11. БОРСОДЕРЖАЩИЕ РЕАГЕНТЫ
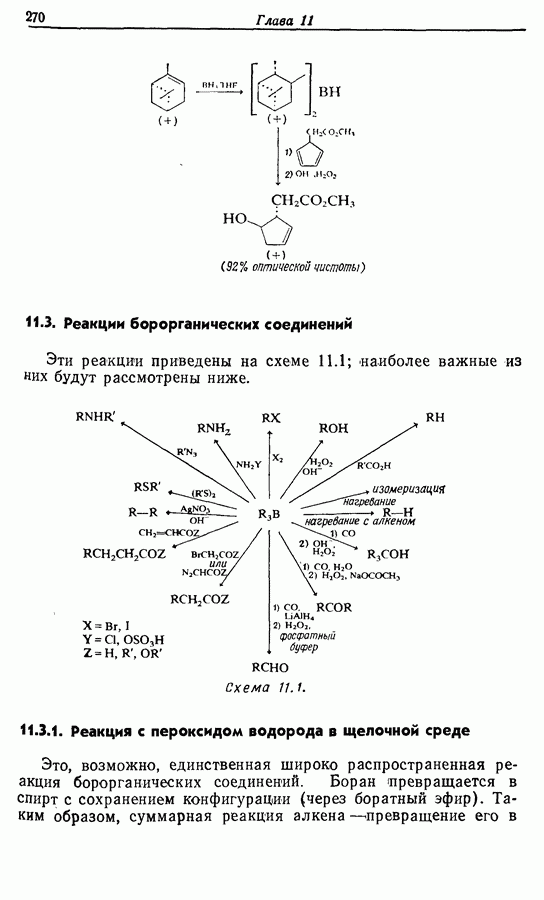
- 11.1. Гидроборирование алкенов при действии борана
- 11.2. Гидроборирование алкенов действием алкилборанов
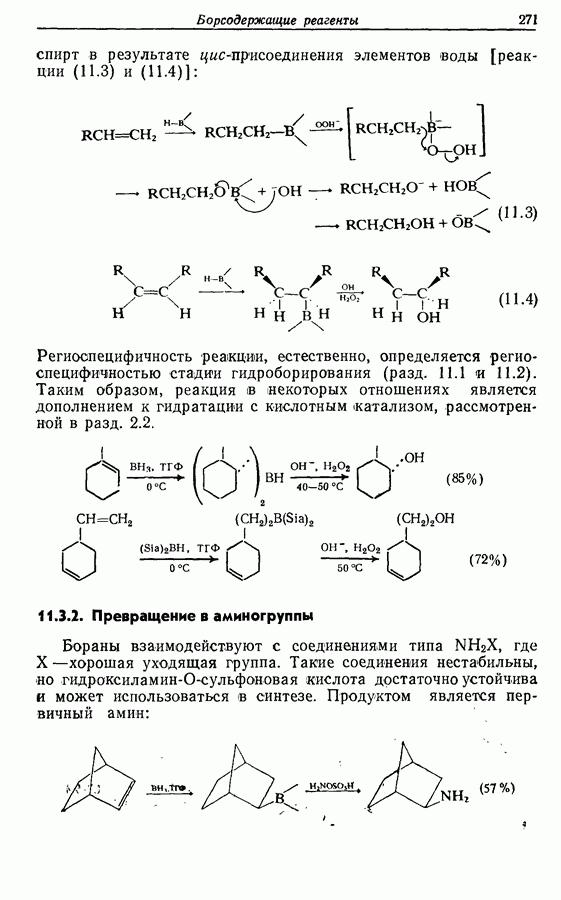
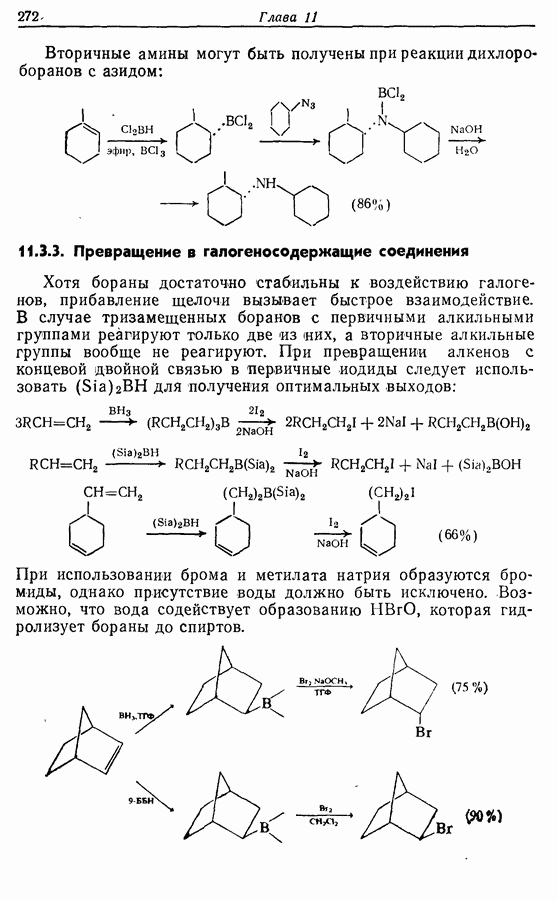
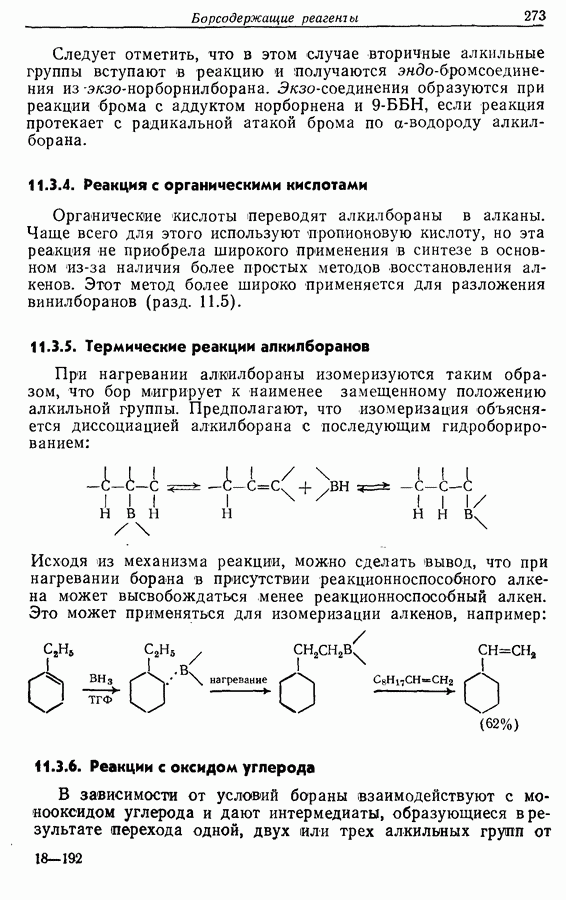
- 11.3. Реакции борорганических соединений
- 11.4. Гидроборирование диенов
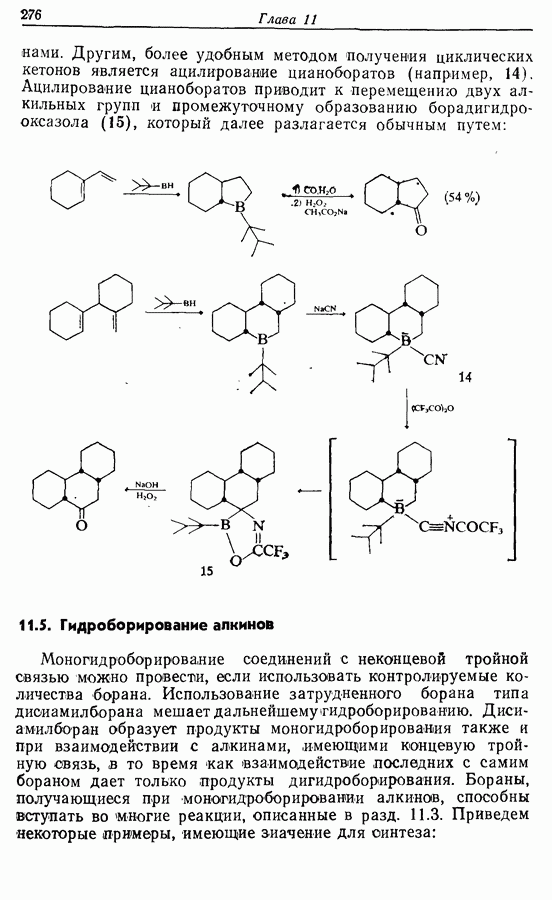
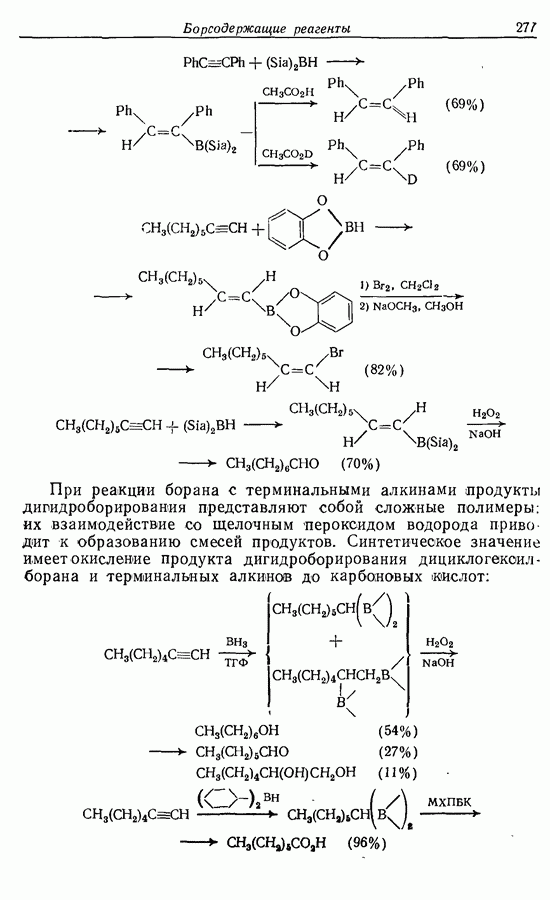
- 11.5. Гидроборирование алкинов
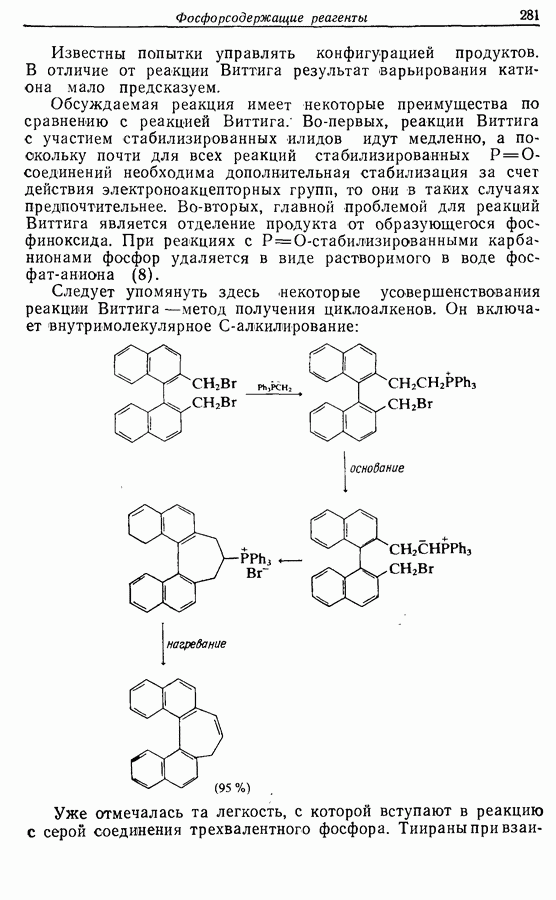
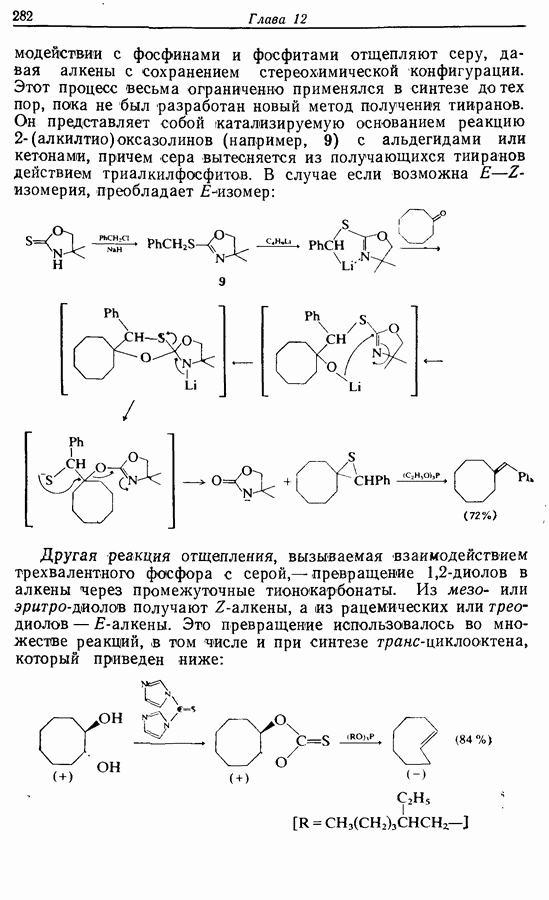
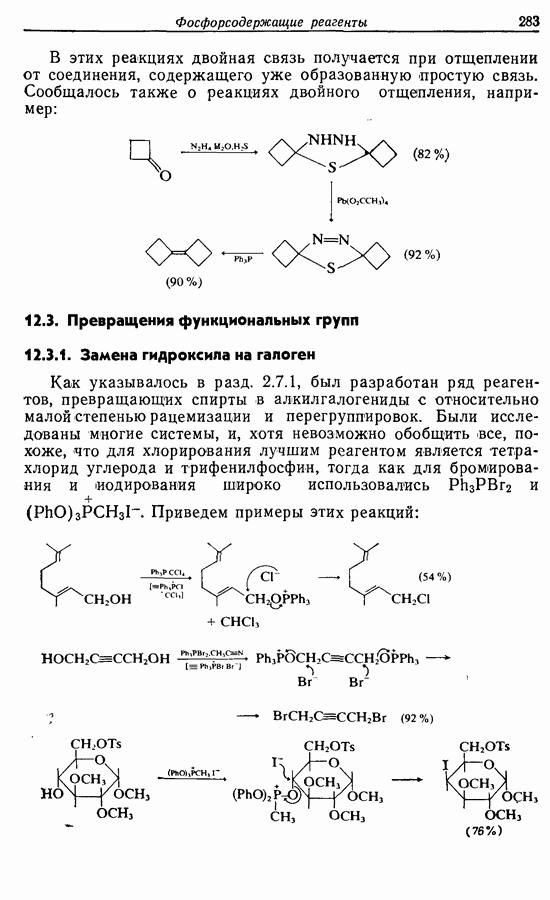
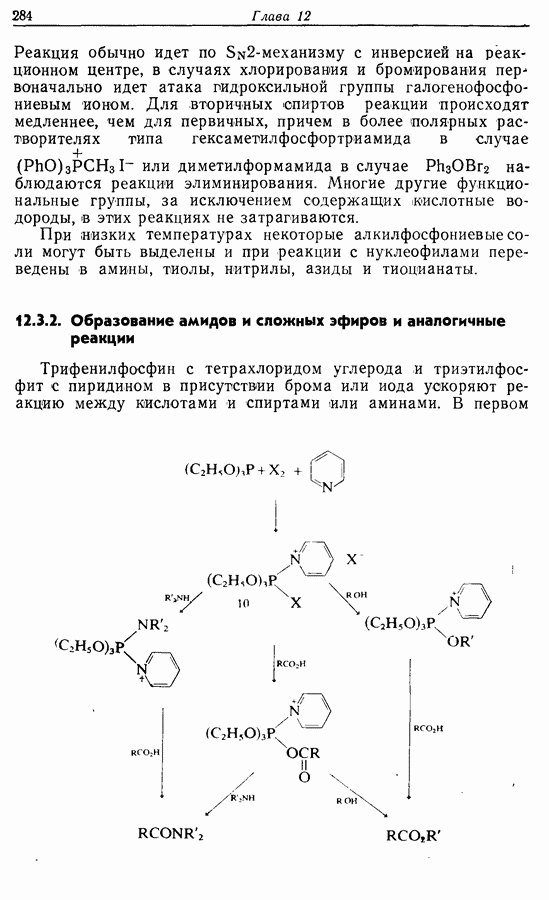
- 12. ФОСФОРСОДЕРЖАЩИЕ РЕАГЕНТЫ
- 12.1. Введение в химию фосфорорганических соединений
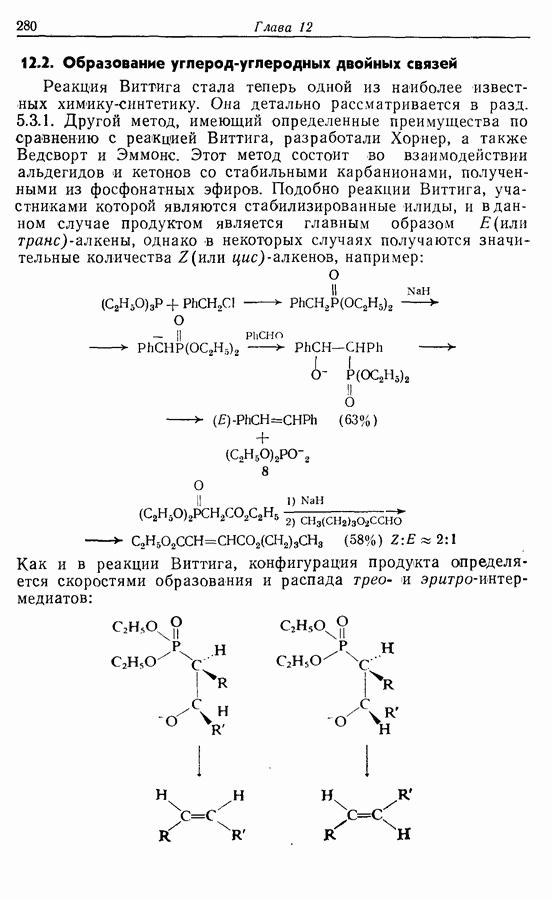
- 12.2. Образование углерод-углеродных двойных связей
- 12.3. Превращения функциональных групп
- 12.4. Реакции дезоксигенирования
- 13. КРЕМНИЙСОДЕРЖАЩИЕ РЕАГЕНТЫ
- 13.1. Введение в химию кремнийорганических соединений
- 13.2. Синтез кремнийорганических соединений
- 13.3. Реакции с образованием углерод-углеродных связей
- 13.4. Синильная защита спиртов
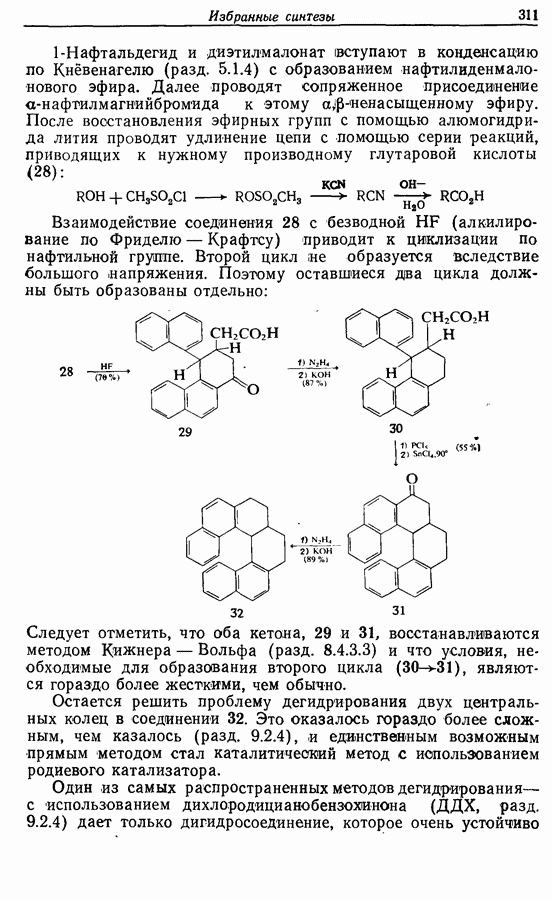
- 14. ИЗБРАННЫЕ СИНТЕЗЫ
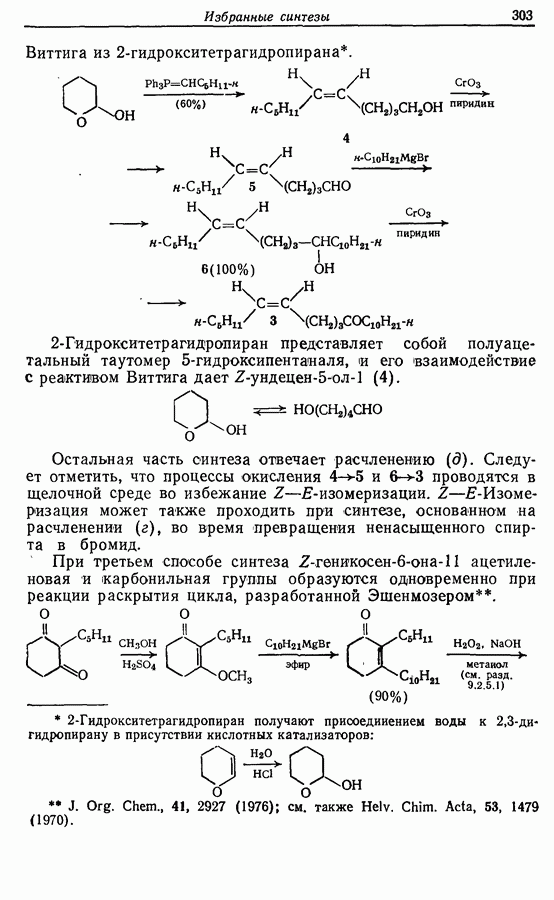
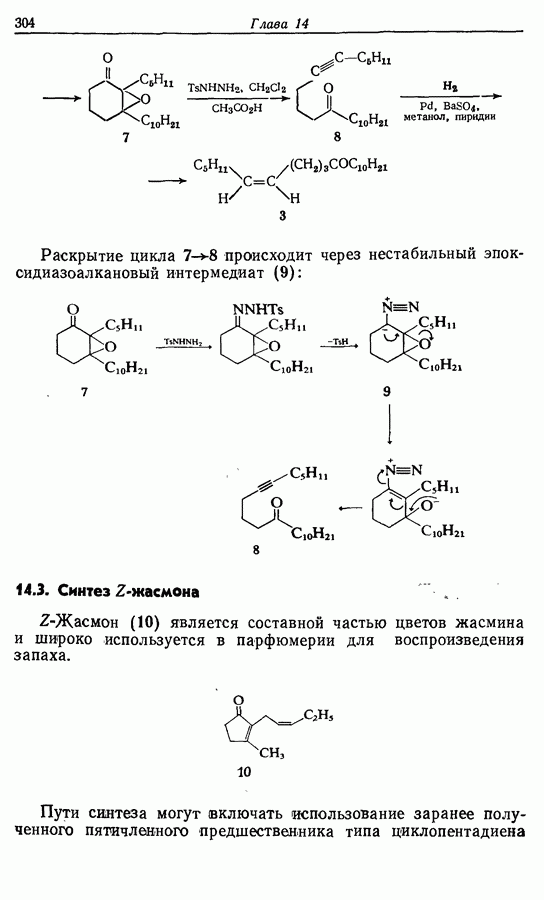
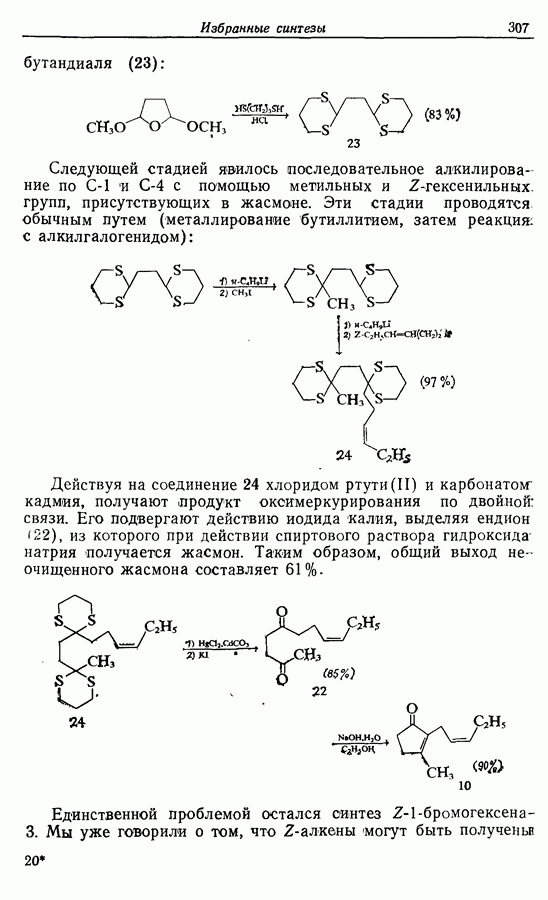
- 14.2. Z-Геникосен-6-он-11
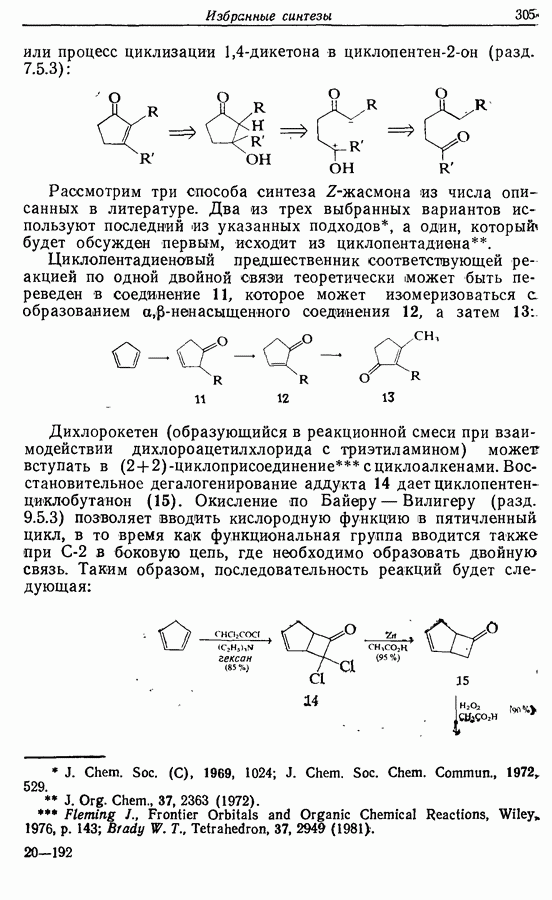
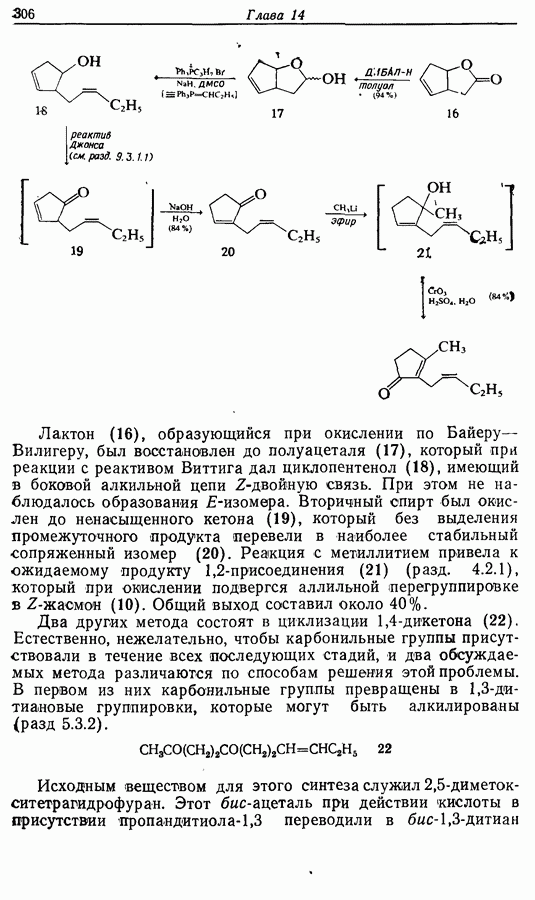
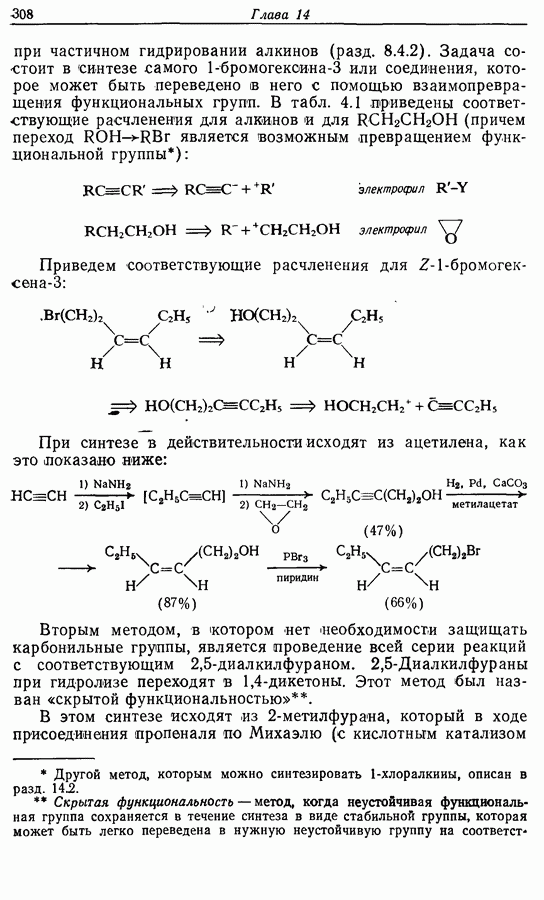
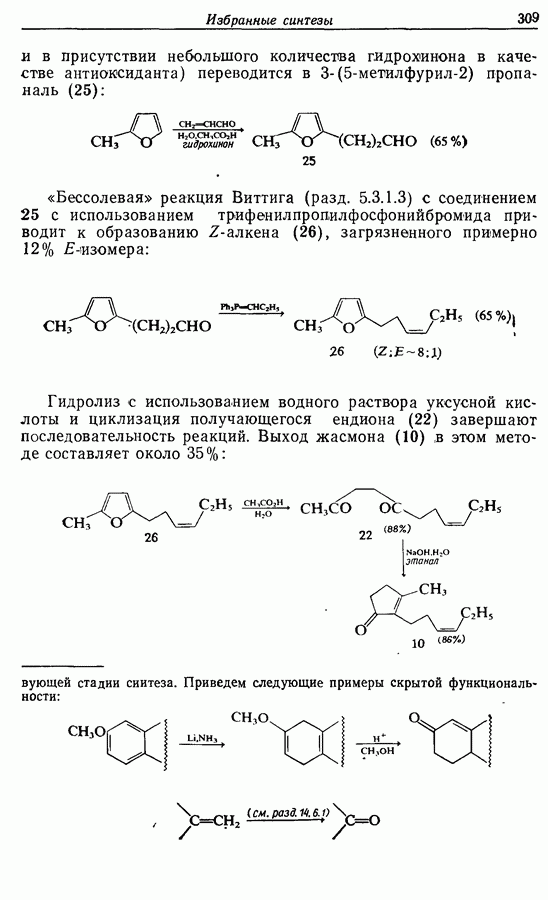
- 14.3. Синтез Z-жасмона
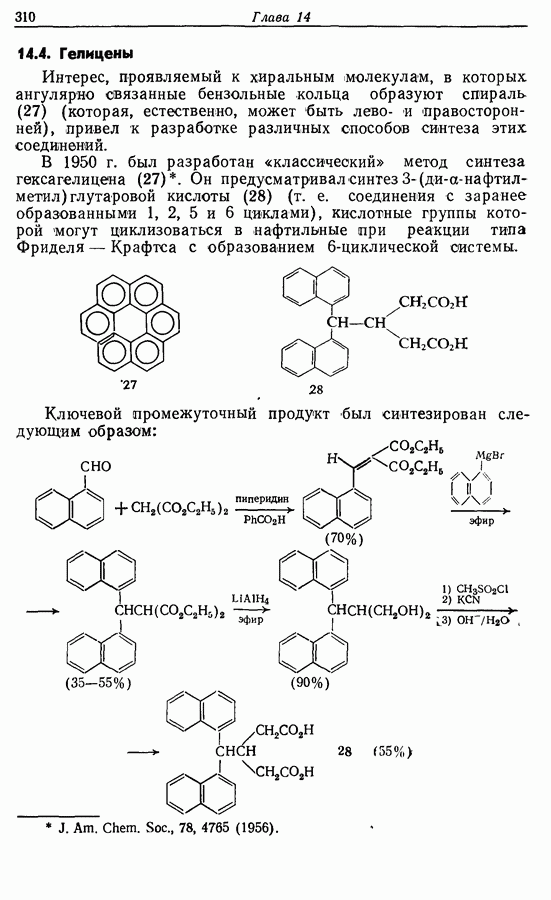
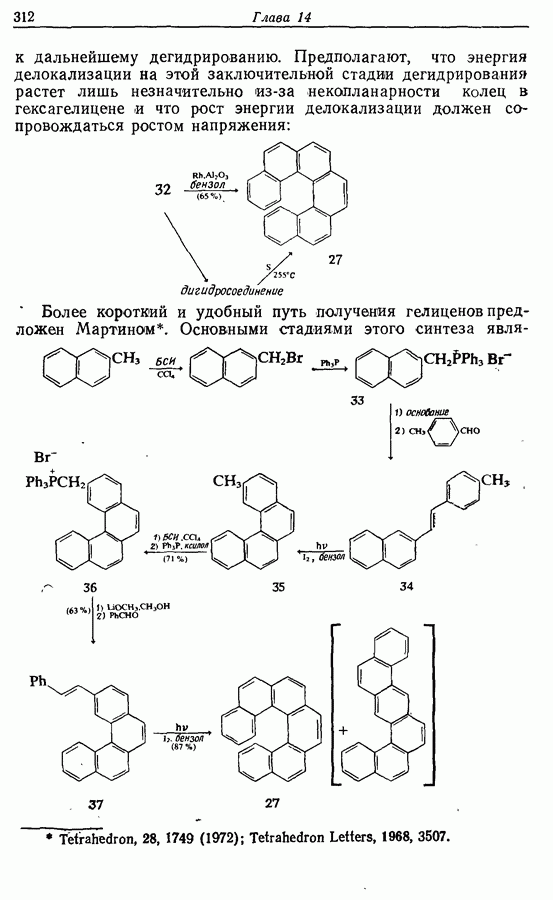
- 14.4. Гелицены
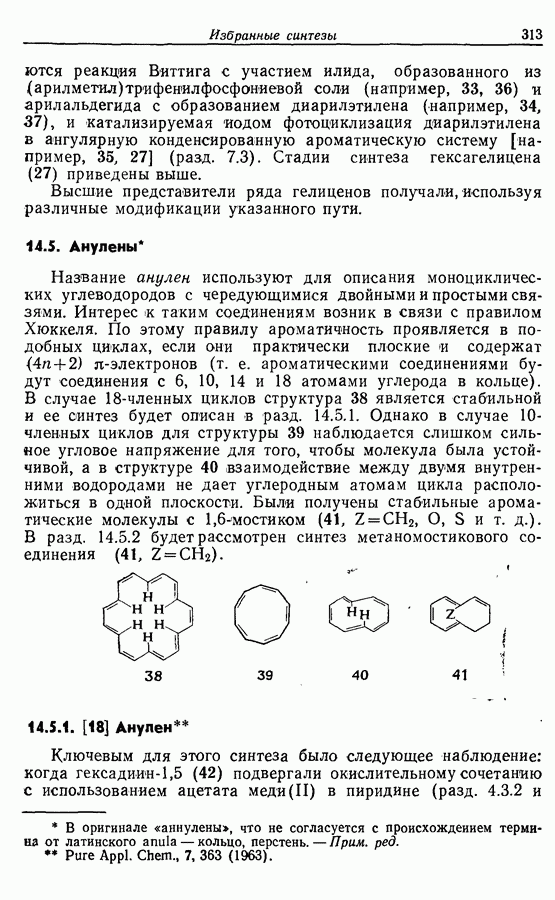
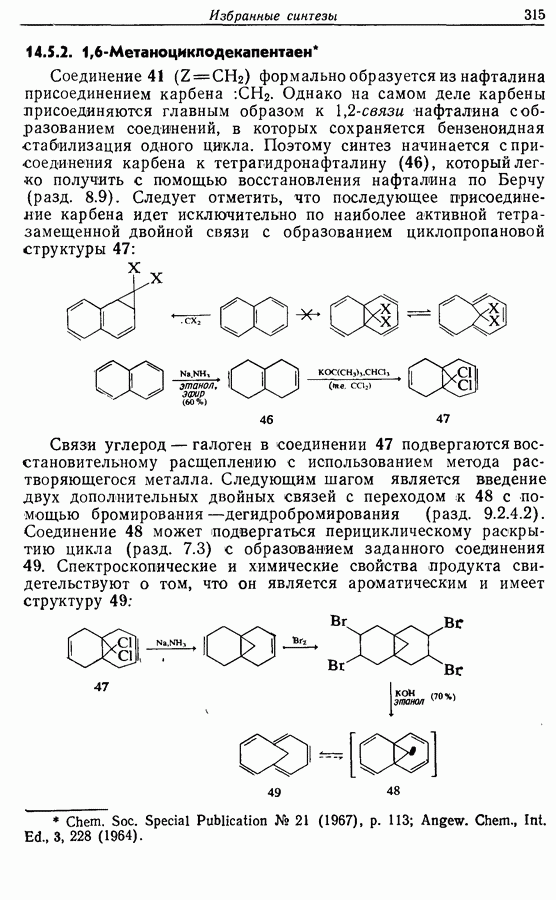
- 14.5. Анулены
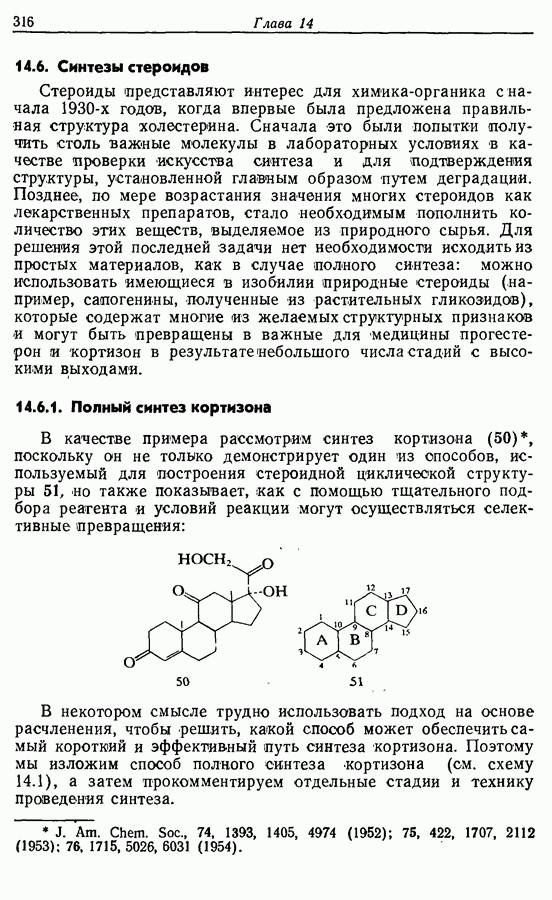
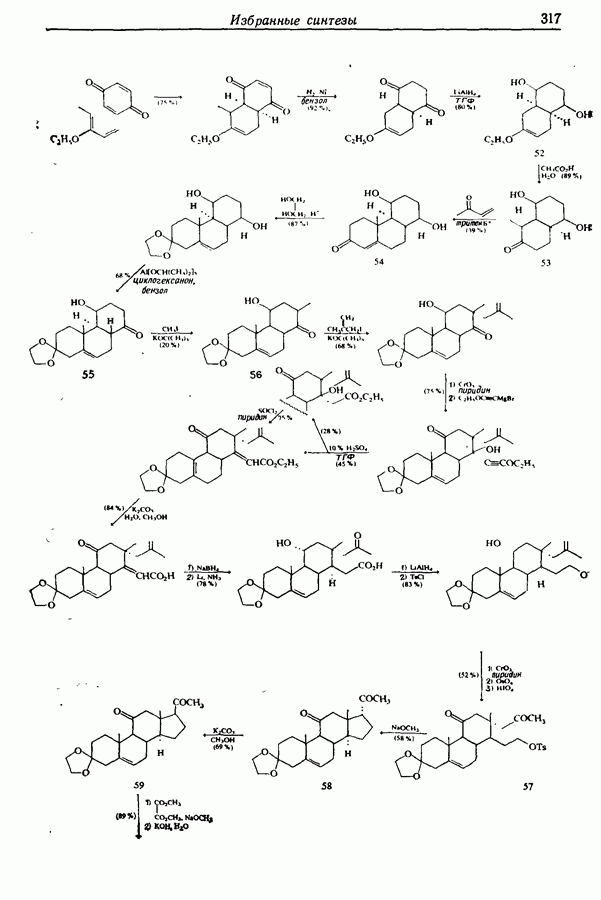
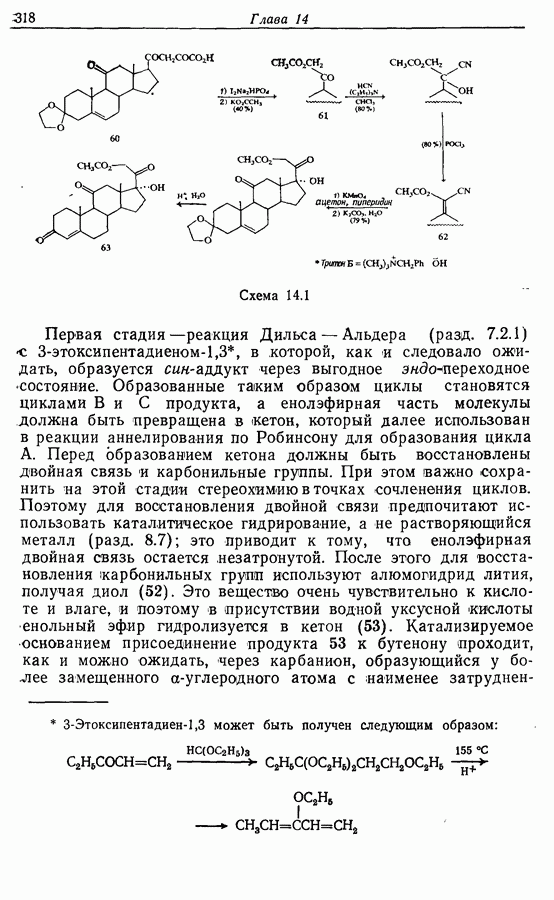
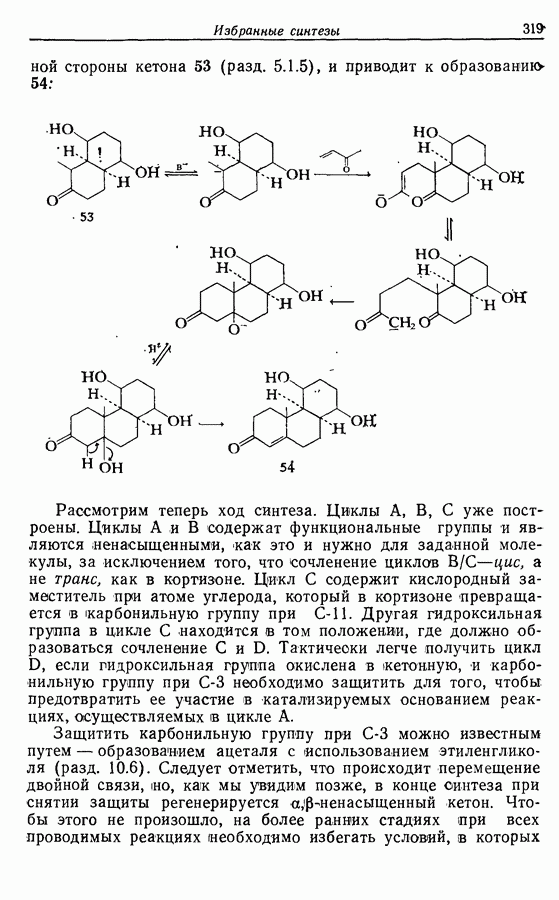
- 14.6. Синтезы стероидов
- 14.6.2. Превращение растительных стероидов в стероидные гормоны
- 14.7. Синтез пептидов
- 14.7.2. Техника синтеза пептидов
- ЛИТЕРАТУРА