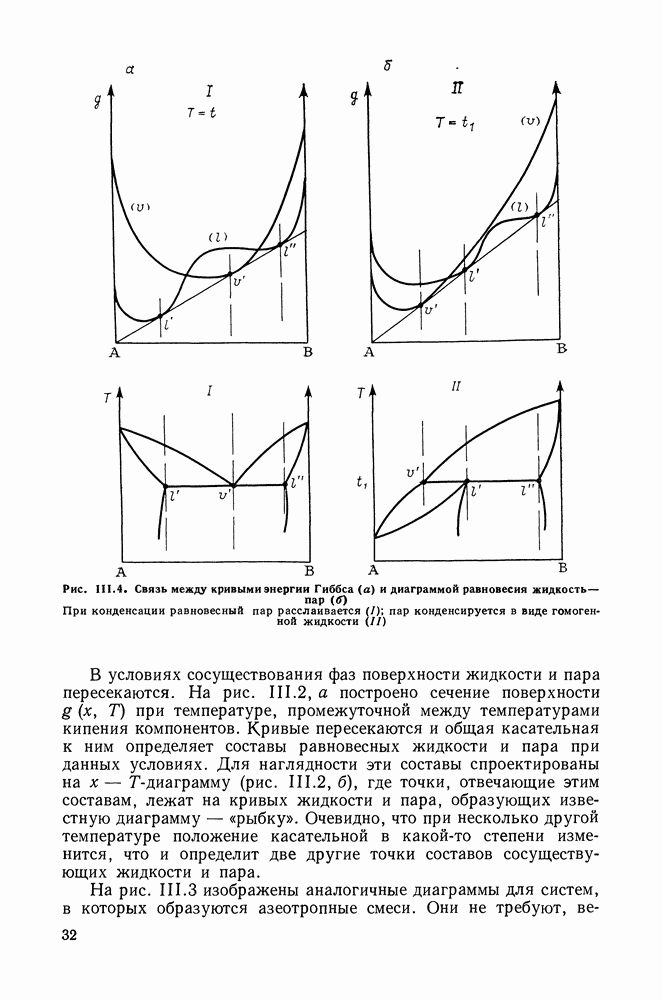
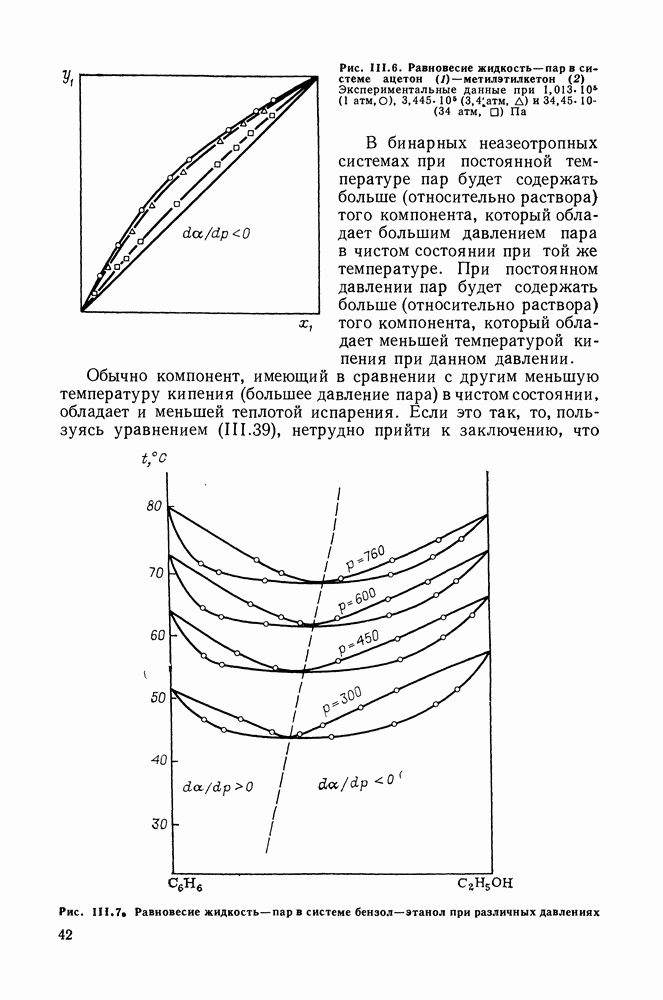
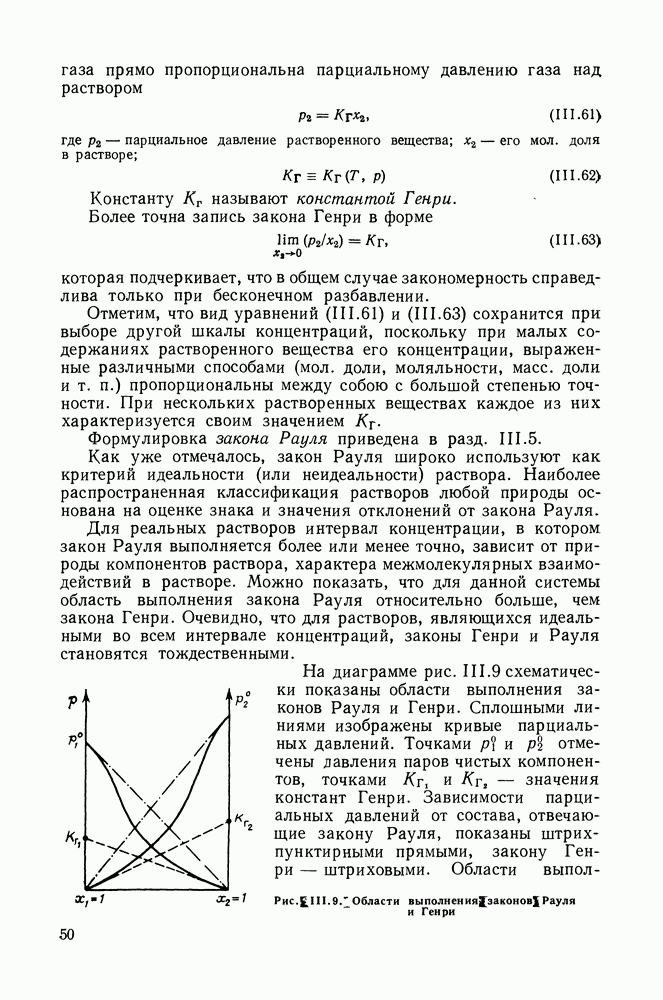
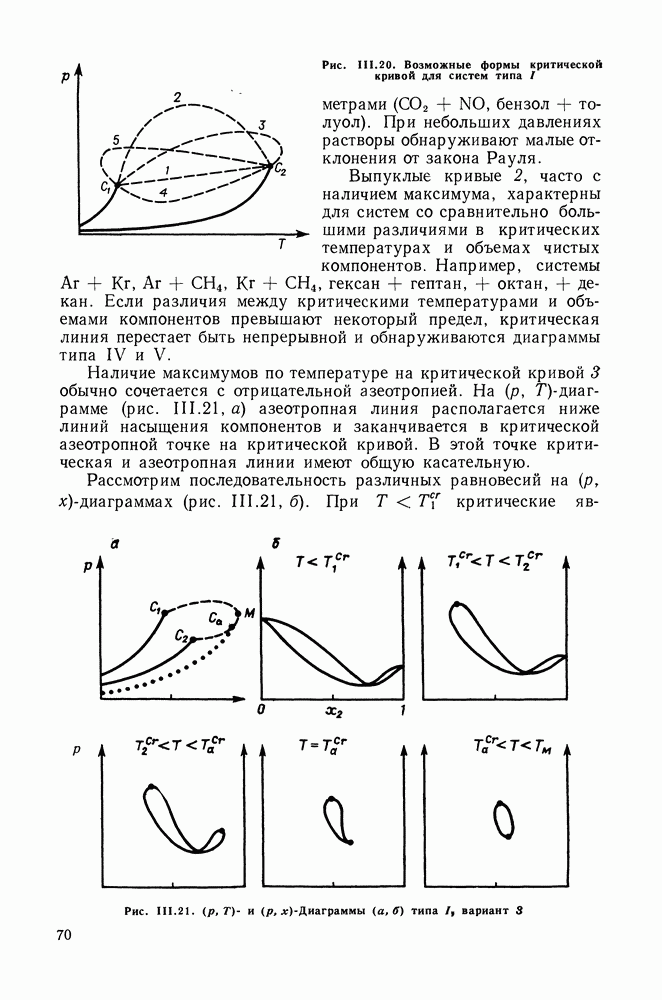
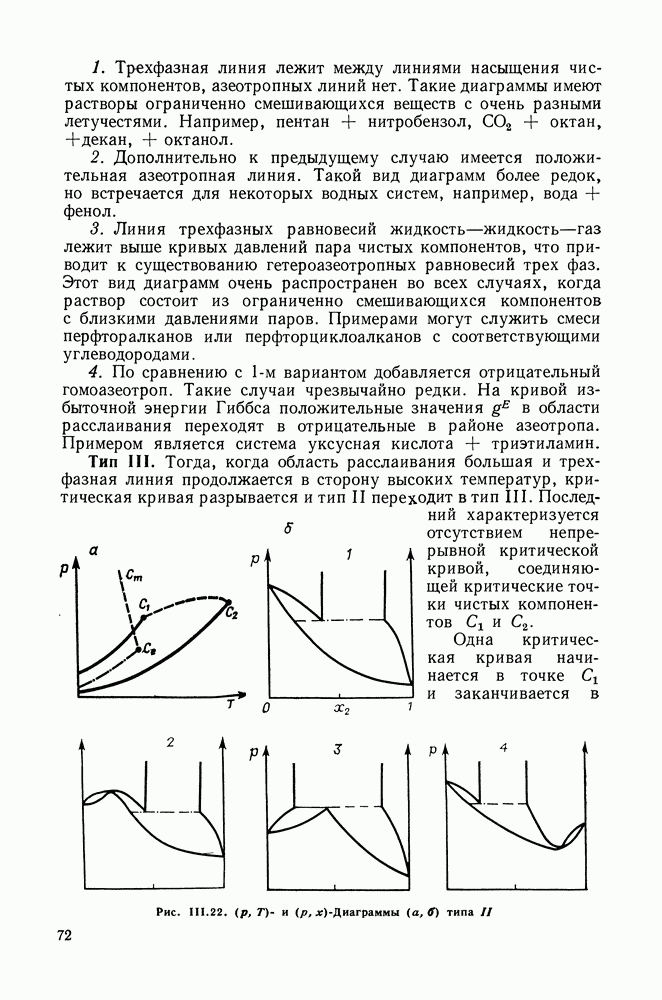
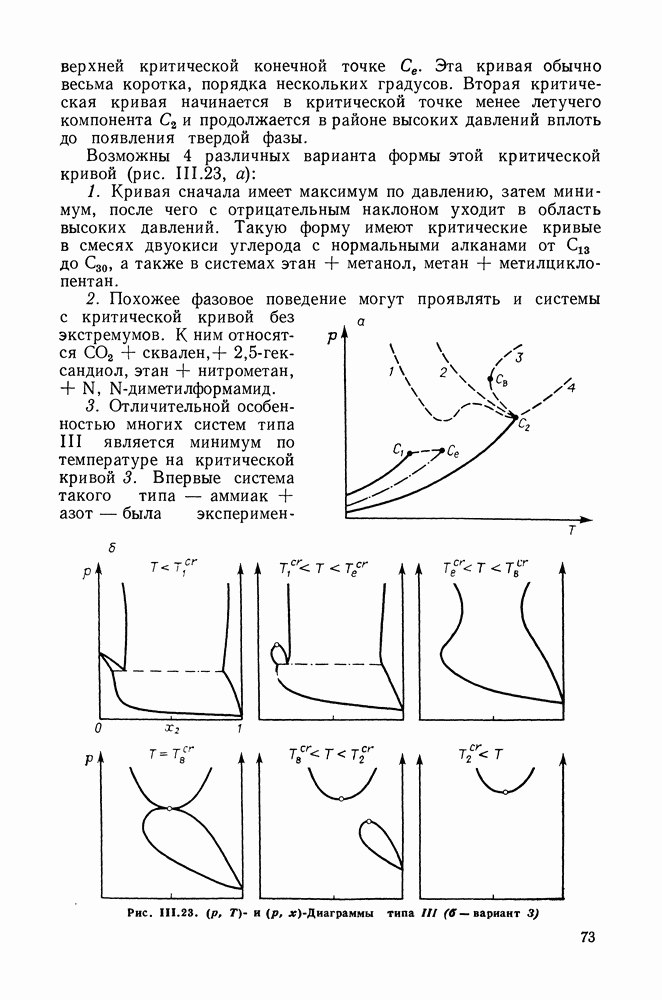
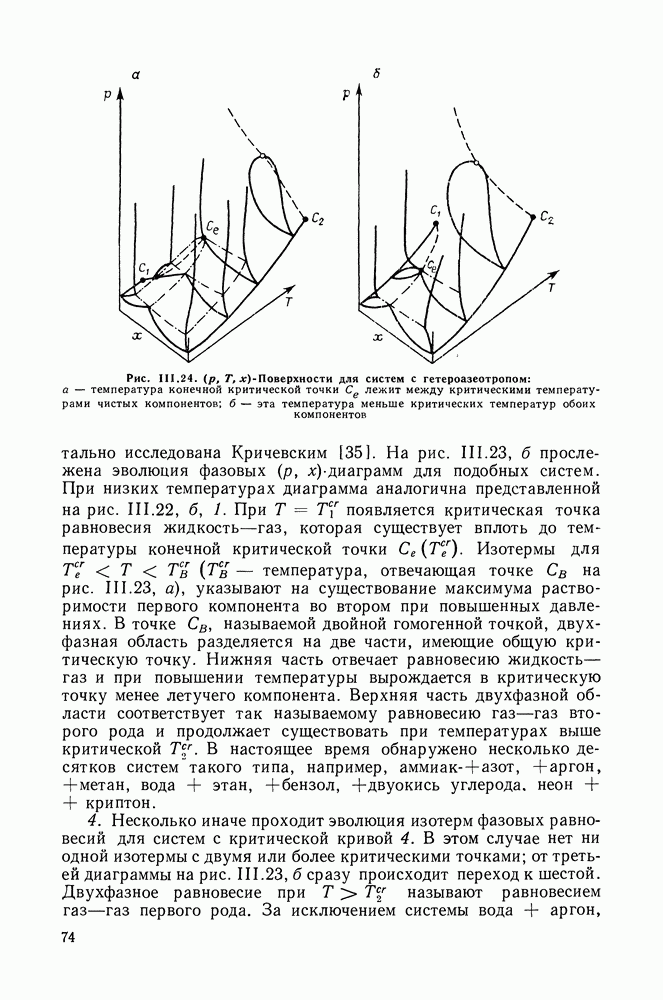
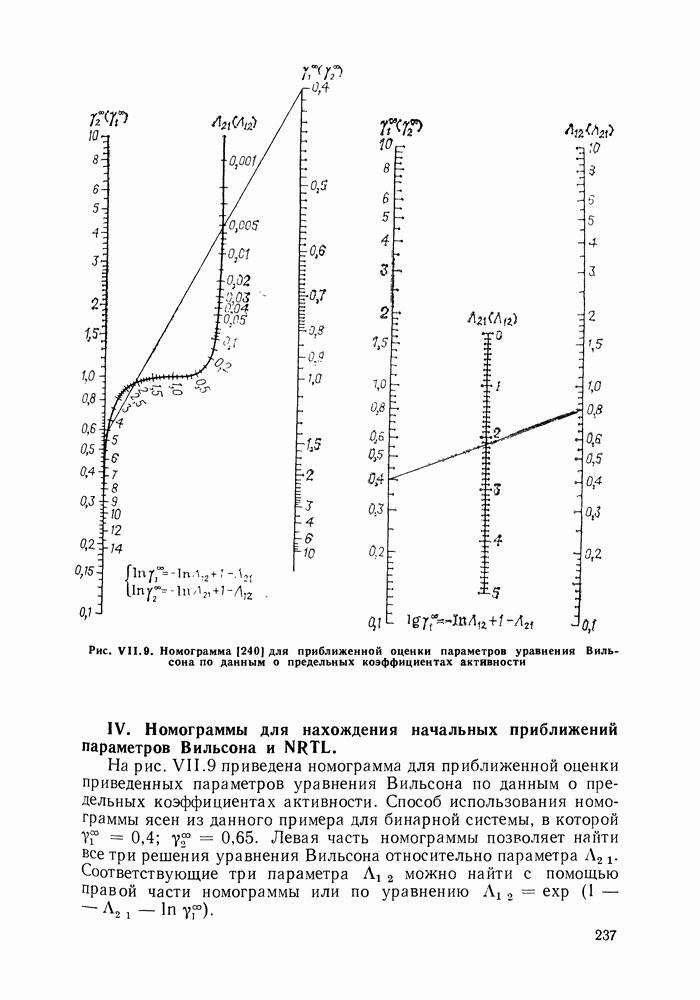
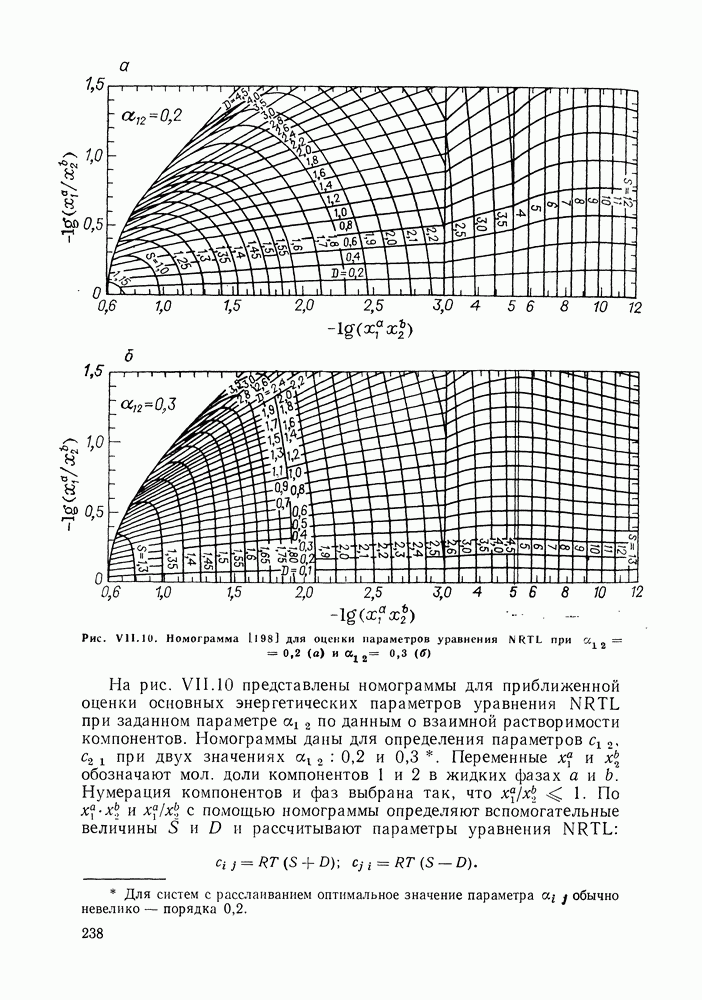
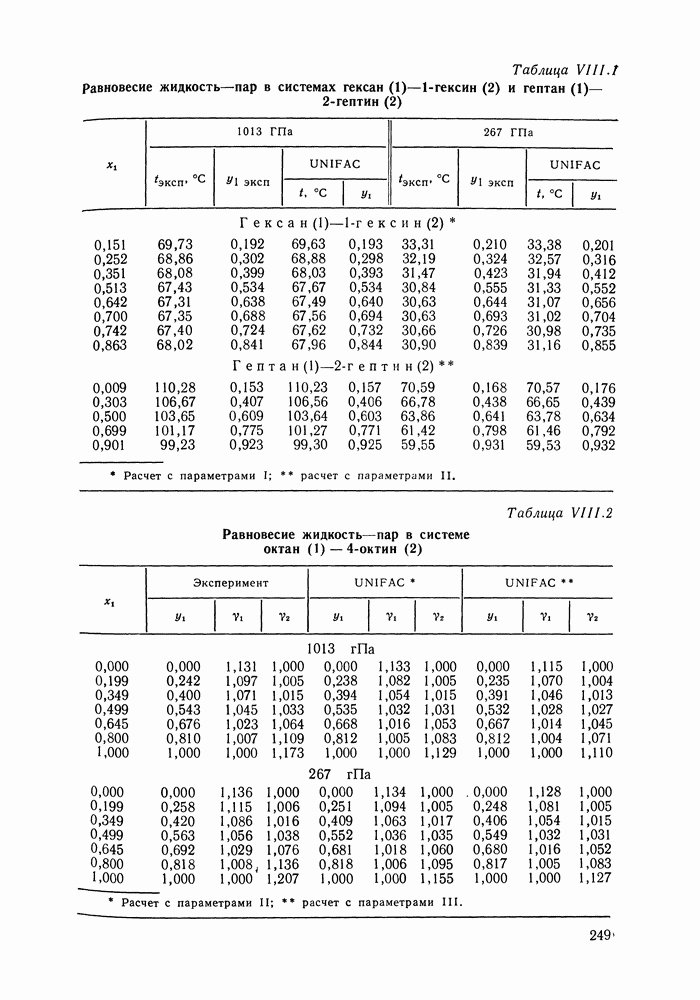
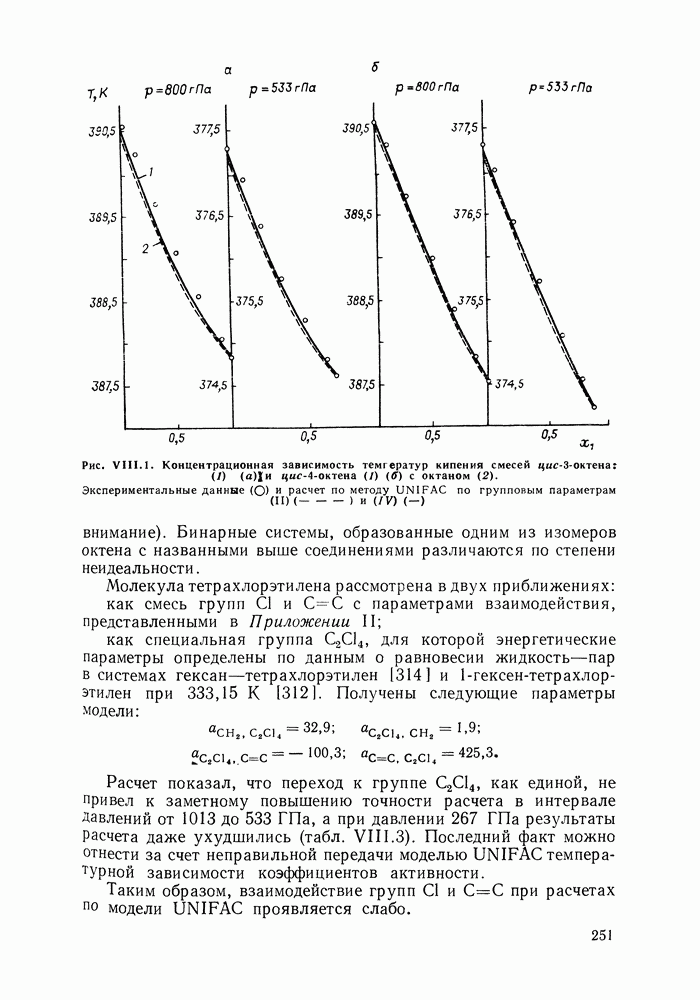
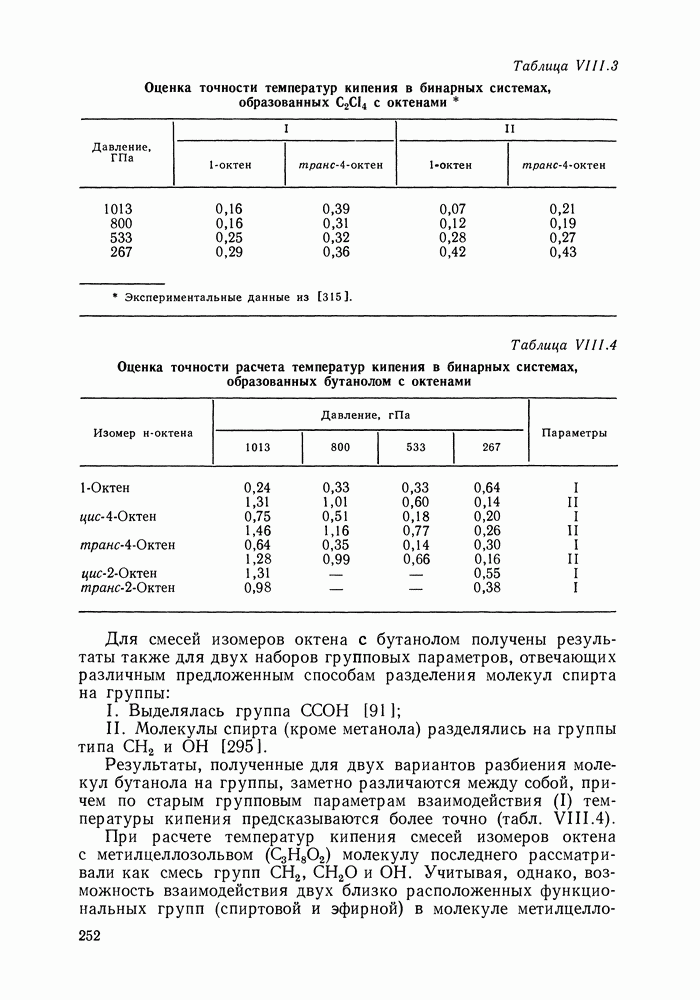
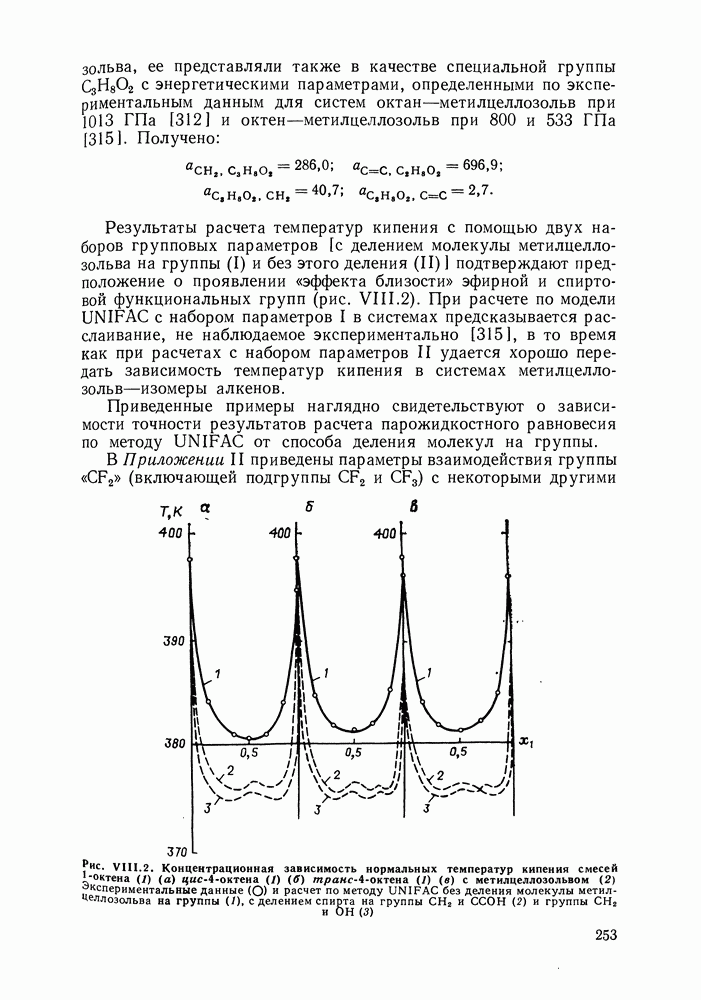
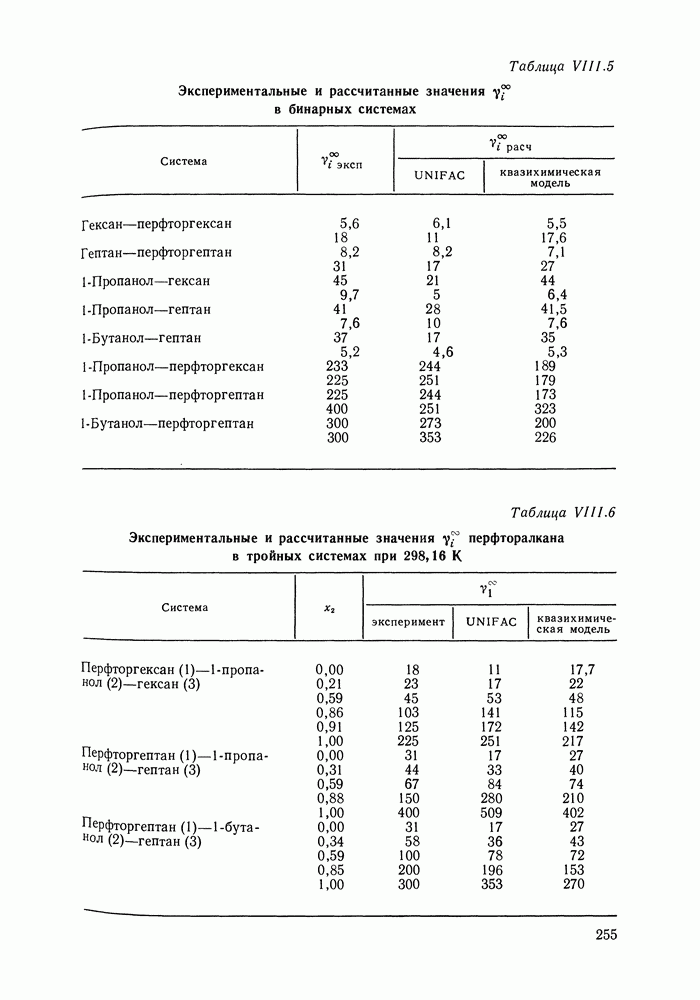
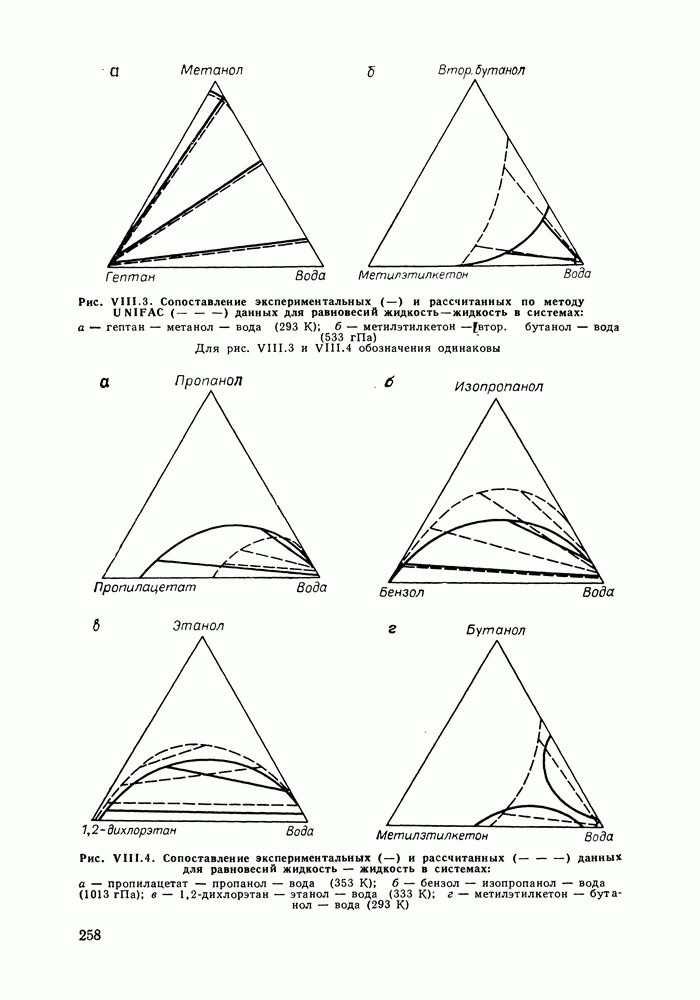
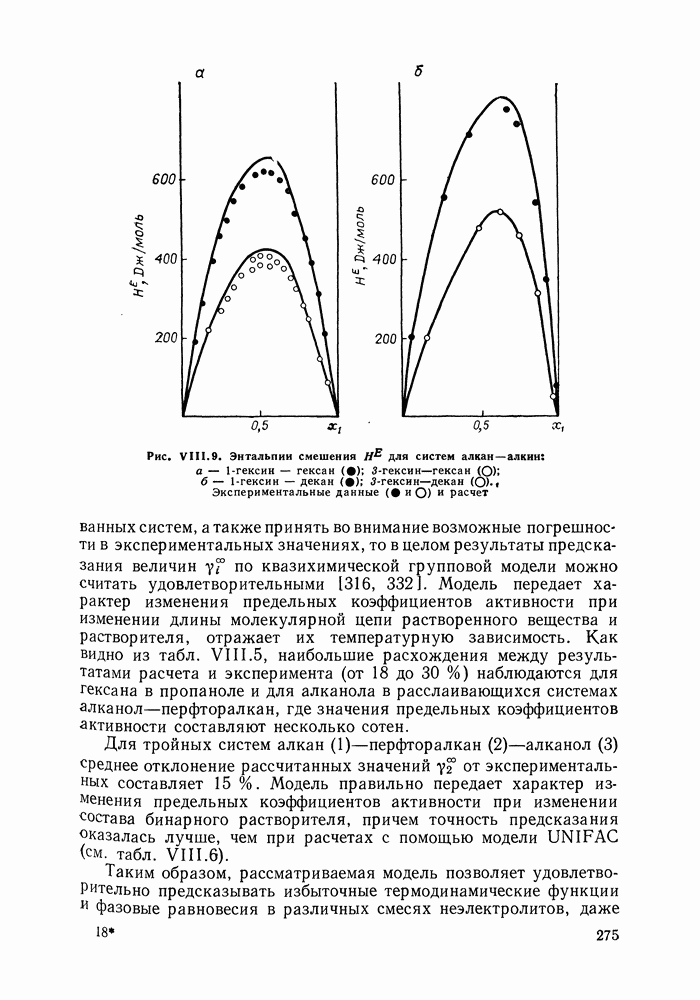
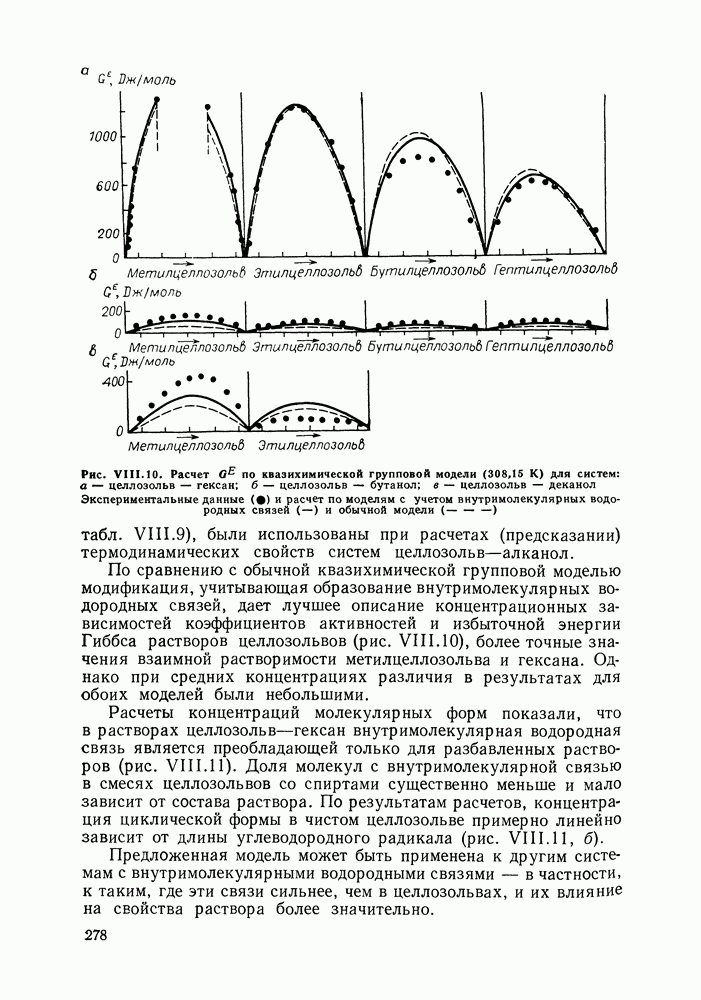
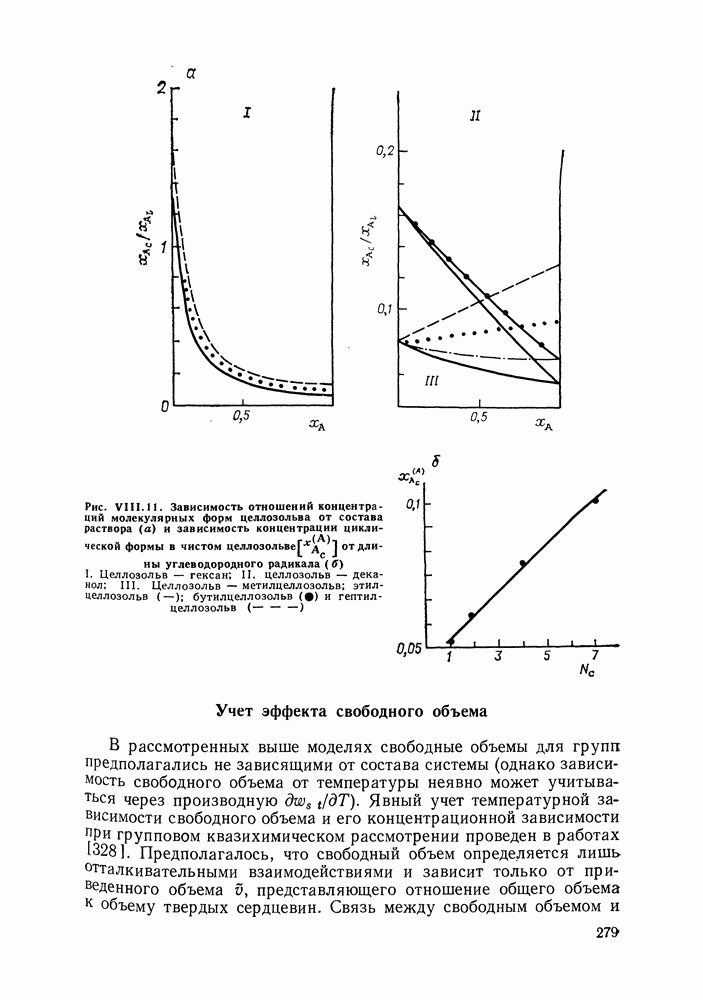
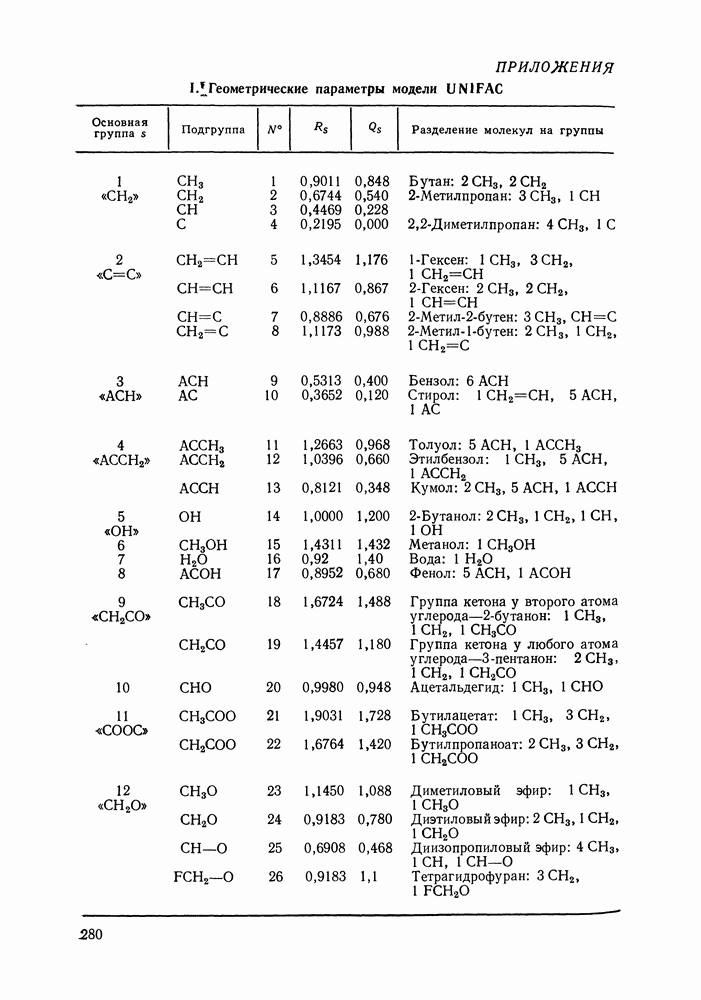
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
III.3. ЗАКОНЫ КОНОВАЛОВА
Законы Коновалова устанавливают связи между изменениями состава, давления и температуры в двойных двухфазных системах, они лежат в основе теории перегонки и ректификации бинарных смесей. Законы были обоснованы Коноваловым [19] путем оригинального, строго термодинамического рассмотрения.
Законы Коновалова непосредственно следуют из дифференциального уравнения Ван-дер-Ваальса.
Первый закон Коновалова формулируется так:
давление пара раствора возрастает (уменьшается) при увеличении концентрации того компонента, содержание которого в паре больше (меньше), чем в растворе; температура кипения раствора возрастает (уменьшается) при увеличении концентрации того компонента, содержание которого в паре меньше (больше), чем в растворе.
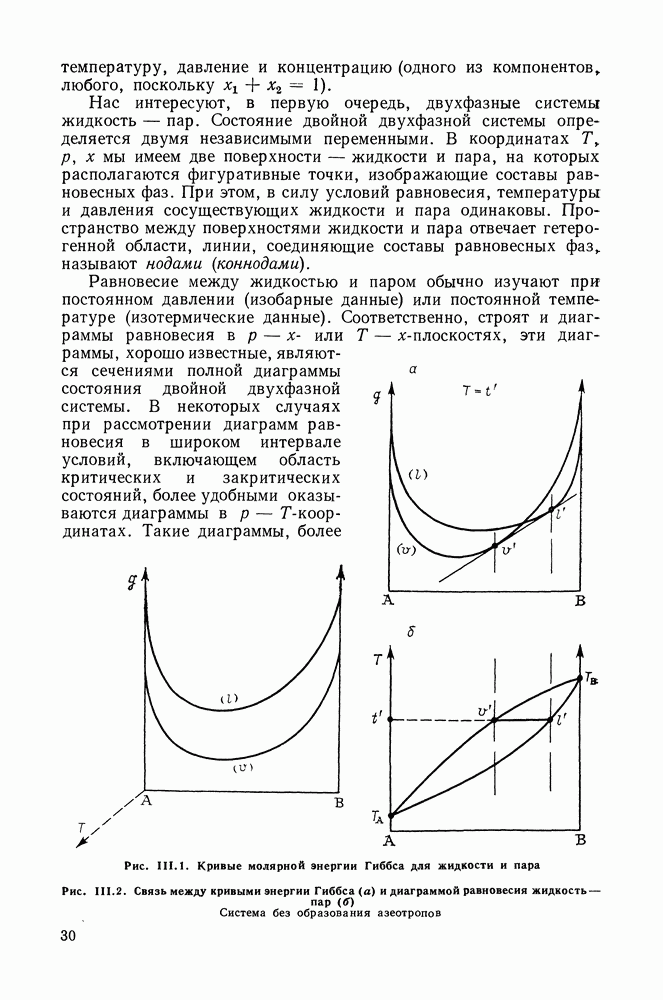
Из уравнения Ван-дер-Ваальса, записанного для жидкой и паровой фаз (II 1.23) и (II 1.24), получим соответствующие производные:

В этих уравнениях вторые производные энергии Гиббса по составу положительны в силу условий устойчивости, знаки объемных
и тепловых эффектов конденсации и испарения в обычных условиях вполне определенны, а именно:

Следовательно, знаки производных в (II 1.25)-(II 1.28) определяются знаками разности концентраций компонента в жидкости и паре:

Соотношения (111.30) представляют собою формулировку первого закона Коновалова для изотермических условий, (III.31) — для изобарных. Эти соотношения могут быть нарушены в том случае, если не выполнены условия (II 1.29), что для систем жидкость — пар возможно вблизи критических состояний.
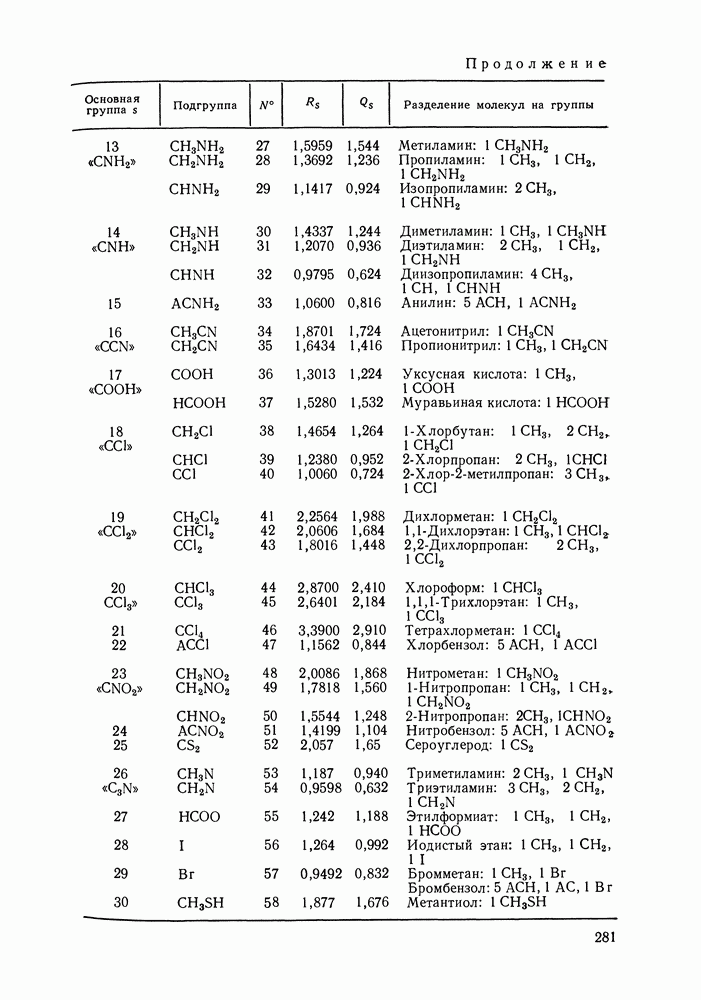
Второй закон Коновалова формулируется так:
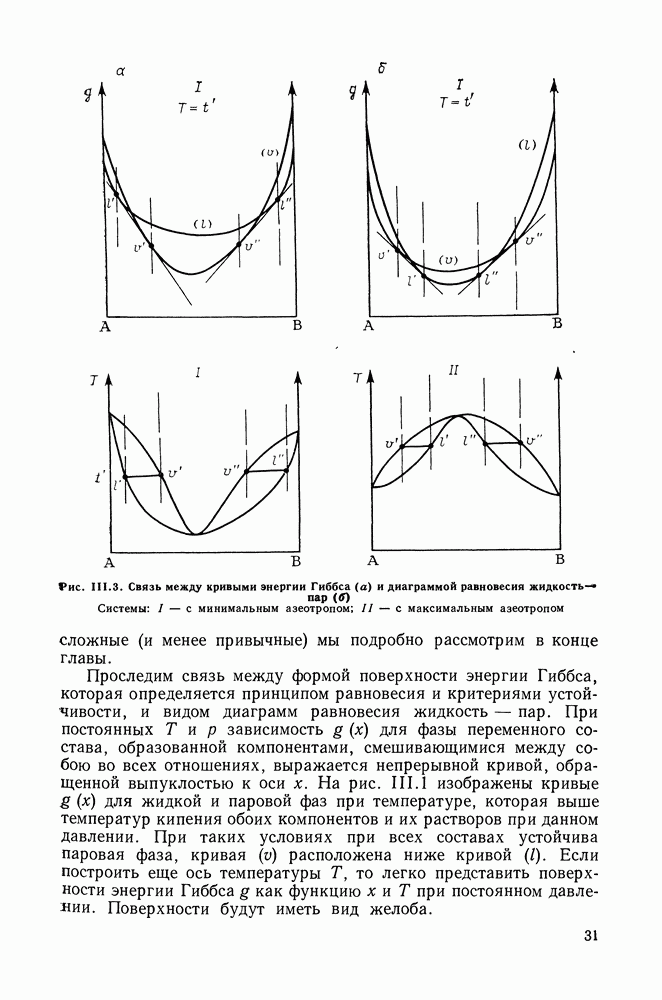
если давление и температура сосуществования двух бинарных фаз имеют экстремум (максимум или минимум), то составы фаз одинаковы.
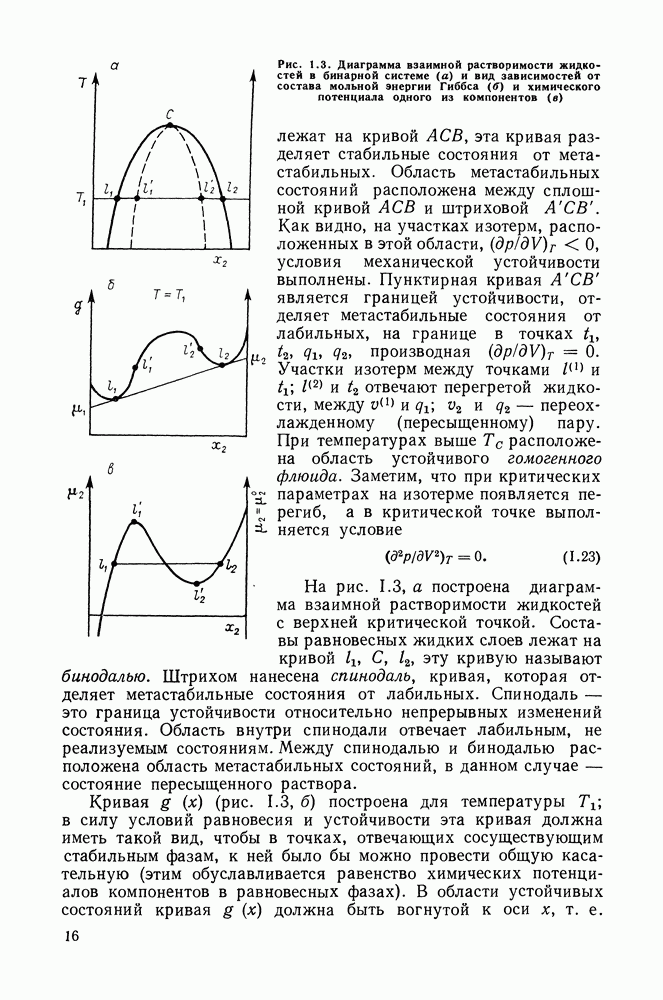
Это утверждение справедливо для фаз любой природы. В случае систем жидкость — пар второй закон Коновалова определяет основное свойство азеотропов. Он сразу же следует из уравнения (II 1.25)-(II 1.28), так как очевидно, что только при условии равенства составов жидкости и пара производные левой части уравнений могут иметь нулевые значения.
Положение о симбатности изменений составов раствора и пара в изотермических или изобарных условиях называют третьим законом Коновалова (иногда это положение определяют как следствие первого закона). Действительно, из сопоставления уравнений (II 1.25) с (111.26) и (111.27) с (111.28) сразу же получаем:

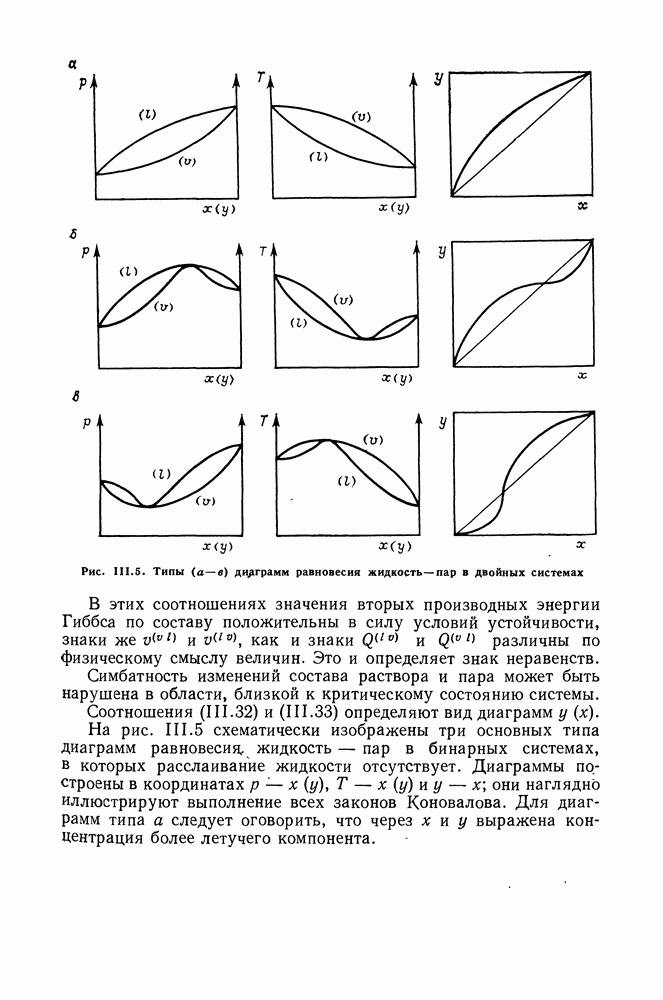
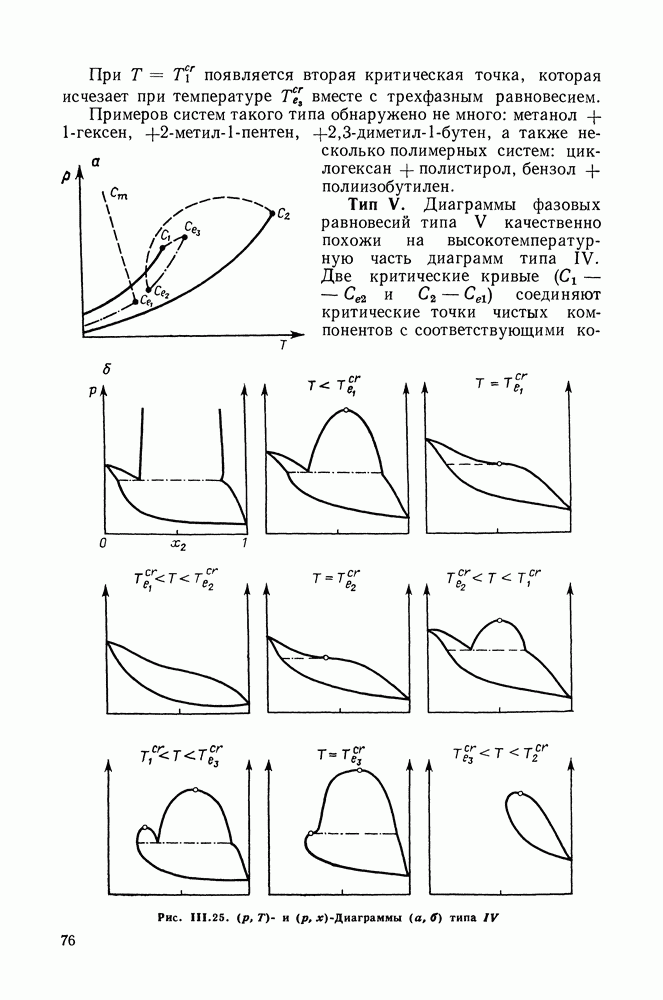
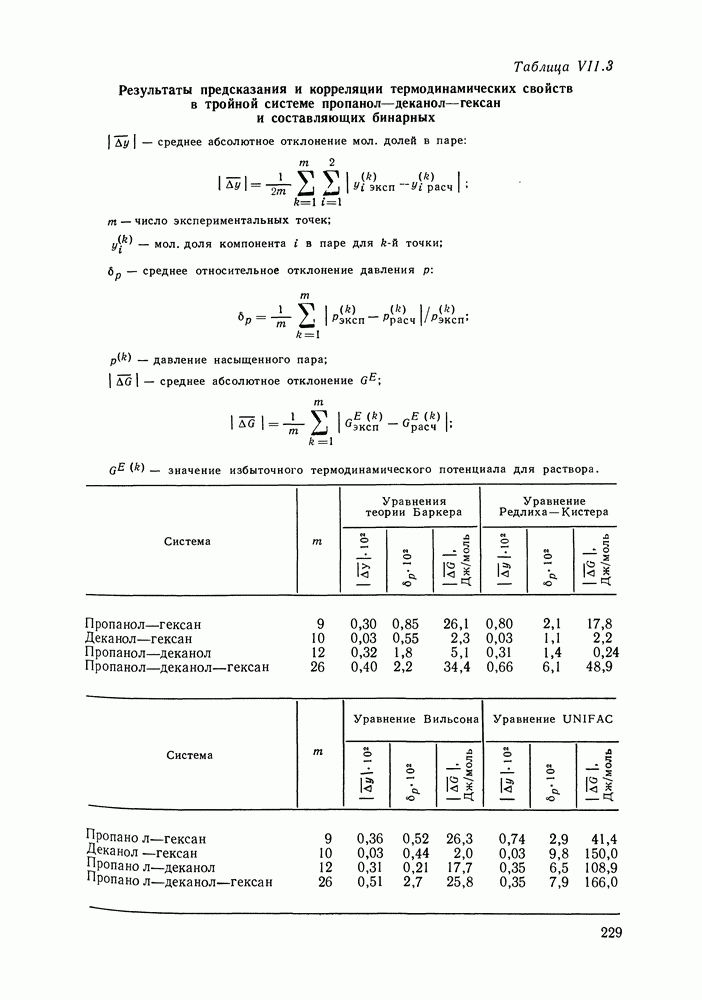
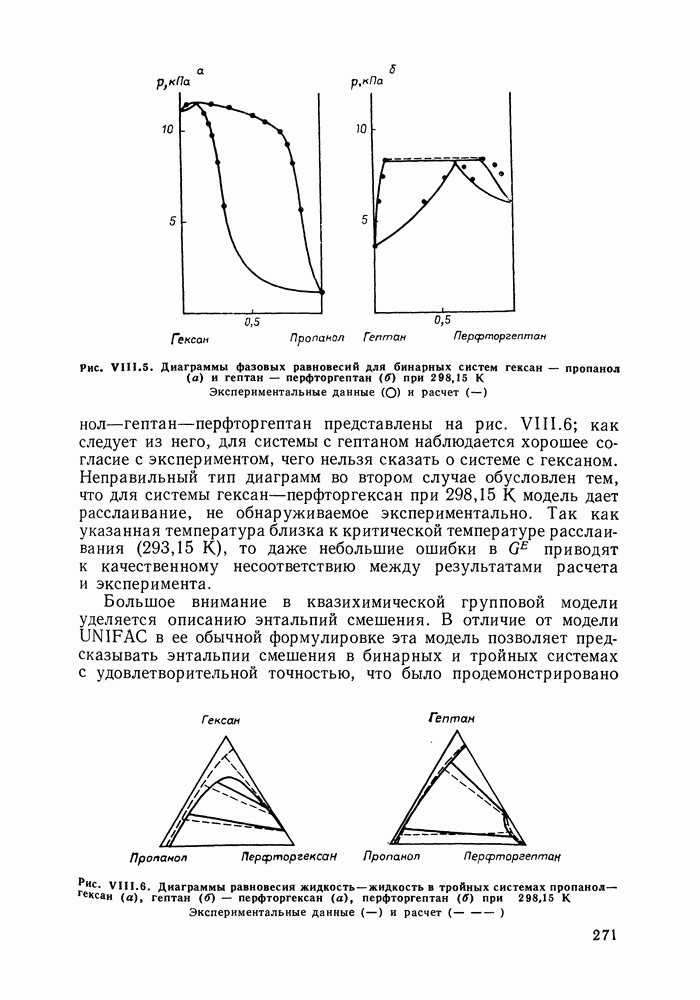
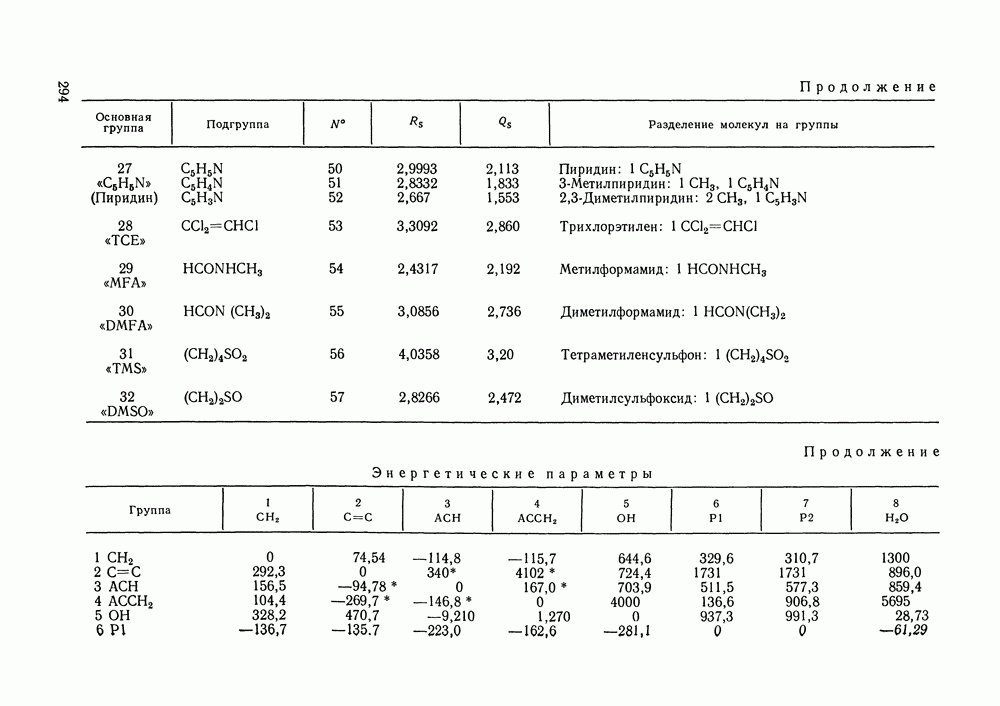
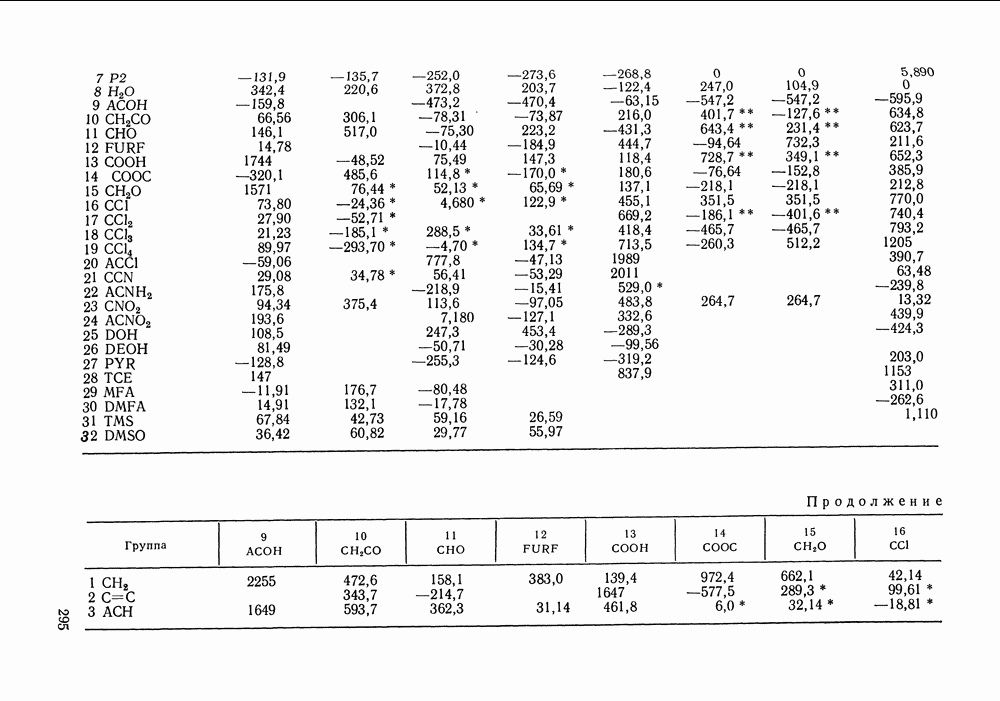
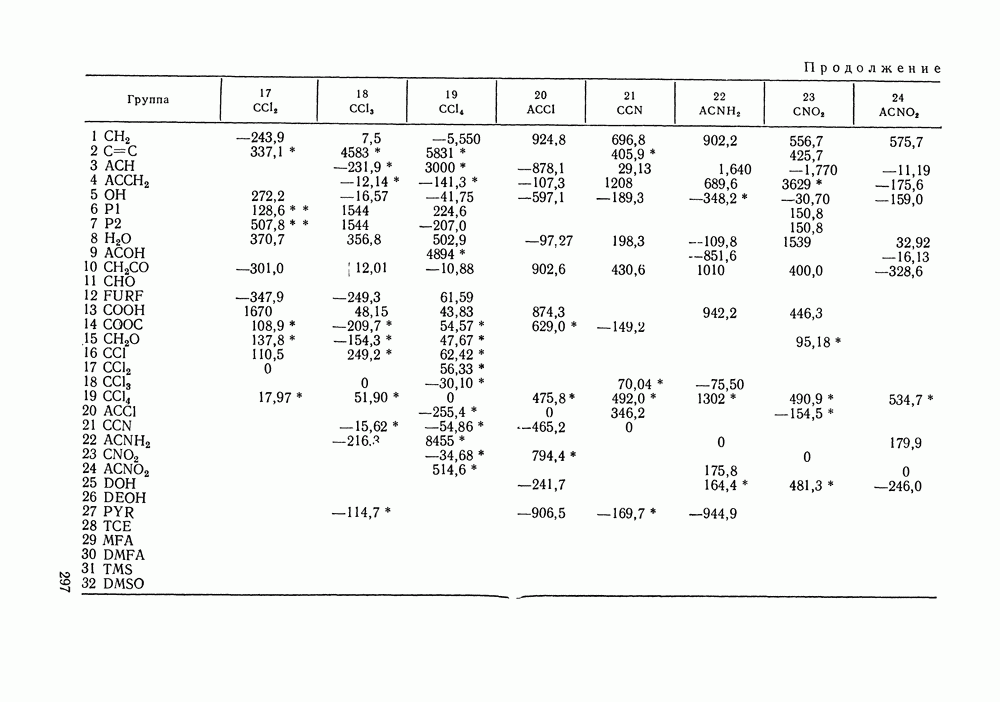
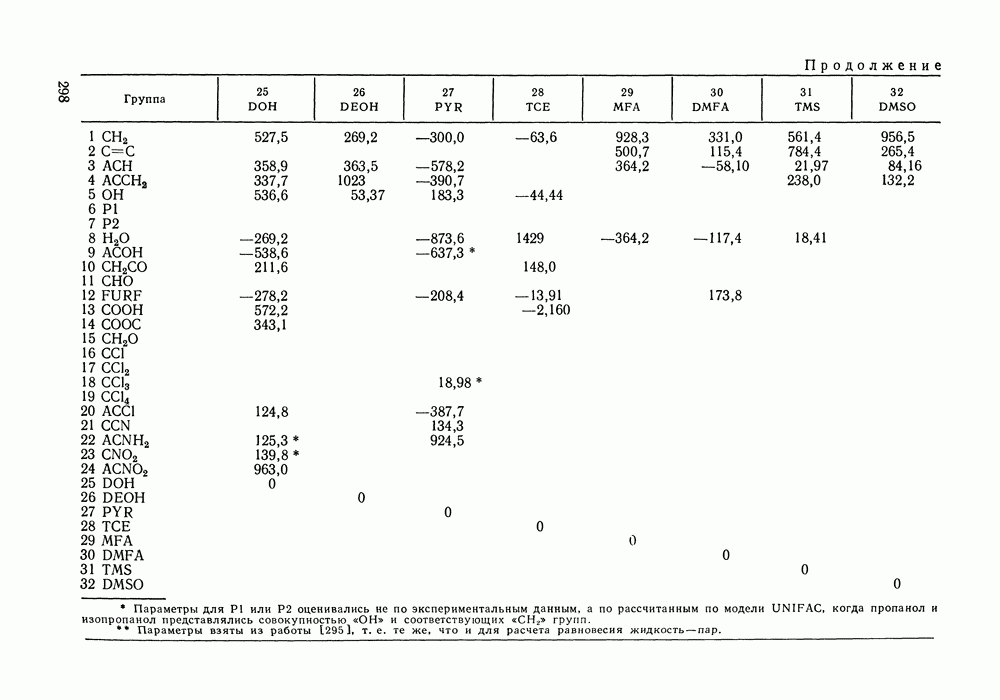
Рис. 111.5. (см. скан) Типы (а-в) диаграмм равновесия жидкость—пар в двойных системах
В этих соотношениях значения вторых производных энергии Гиббса по составу положительны в силу условий устойчивости, знаки же и  как и знаки
как и знаки  и различны по физическому смыслу величин. Это и определяет знак неравенств.
и различны по физическому смыслу величин. Это и определяет знак неравенств.
Симбатность изменений состава раствора и пара может быть нарушена в области, близкой к критическому состоянию системы.
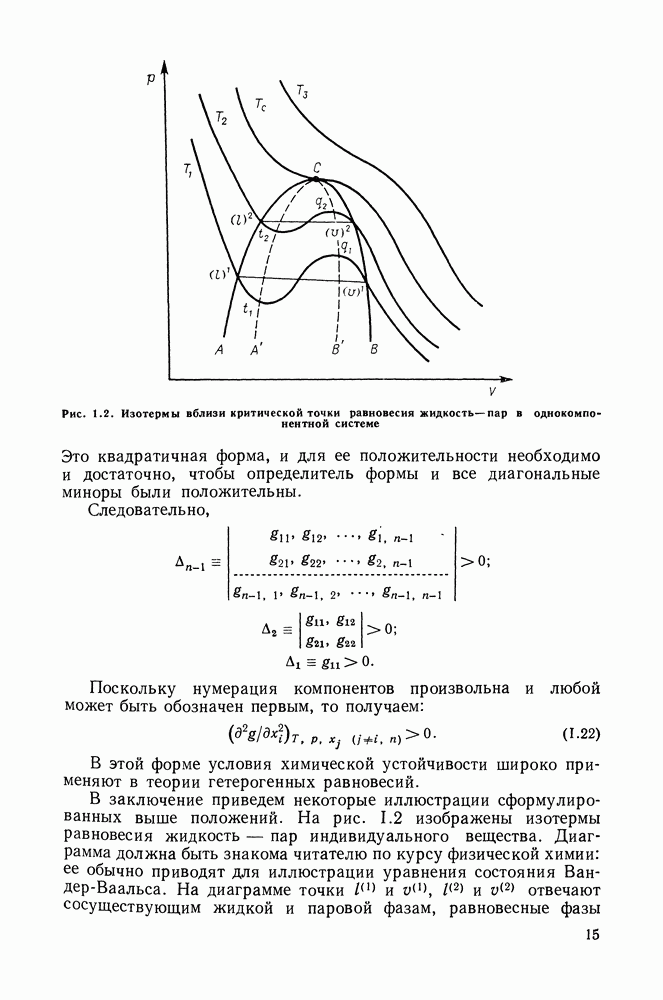
Соотношения (III.32) и (III.33) определяют вид диаграмм 
На рис. III.5 схематически изображены три основных типа диаграмм равновесия, жидкость — пар в бинарных системах, в которых расслаивание жидкости отсутствует. Диаграммы построены в координатах  они наглядно иллюстрируют выполнение всех законов Коновалова. Для диаграмм типа а следует оговорить, что через х и у выражена концентрация более летучего компонента.
они наглядно иллюстрируют выполнение всех законов Коновалова. Для диаграмм типа а следует оговорить, что через х и у выражена концентрация более летучего компонента.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА
- Глава I. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕРМОДИНАМИКИ ГЕТЕРОГЕННЫХ РАВНОВЕСИЙ
- 1.2. УСЛОВИЯ РАВНОВЕСИЯ ГЕТЕРОГЕННЫХ СИСТЕМ
- 1.3. ТИПЫ РАВНОВЕСИЙ
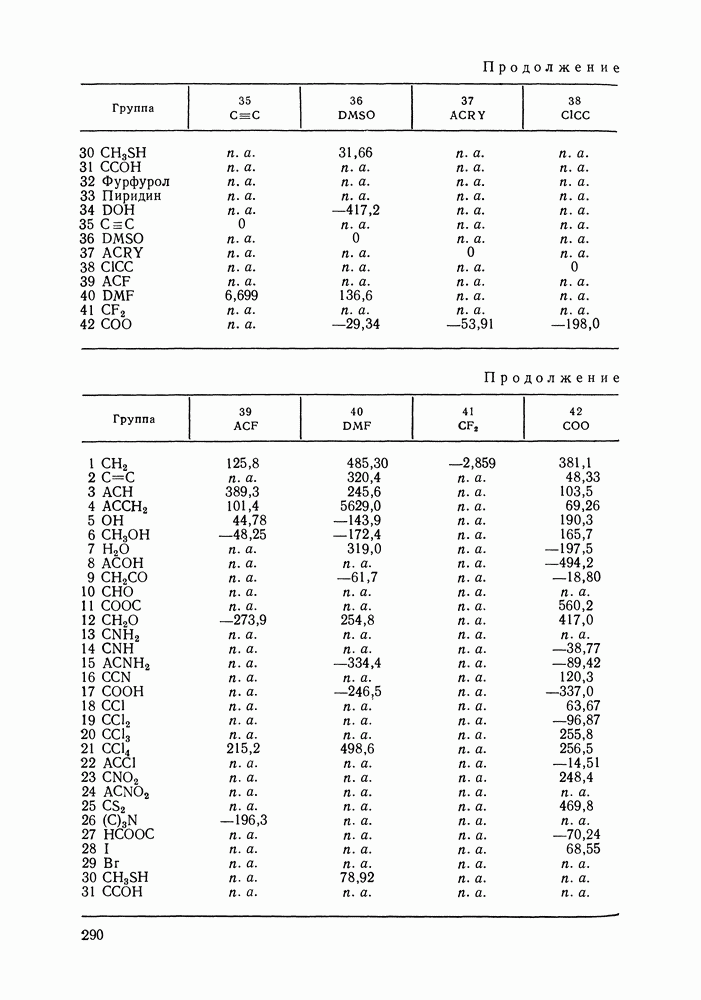
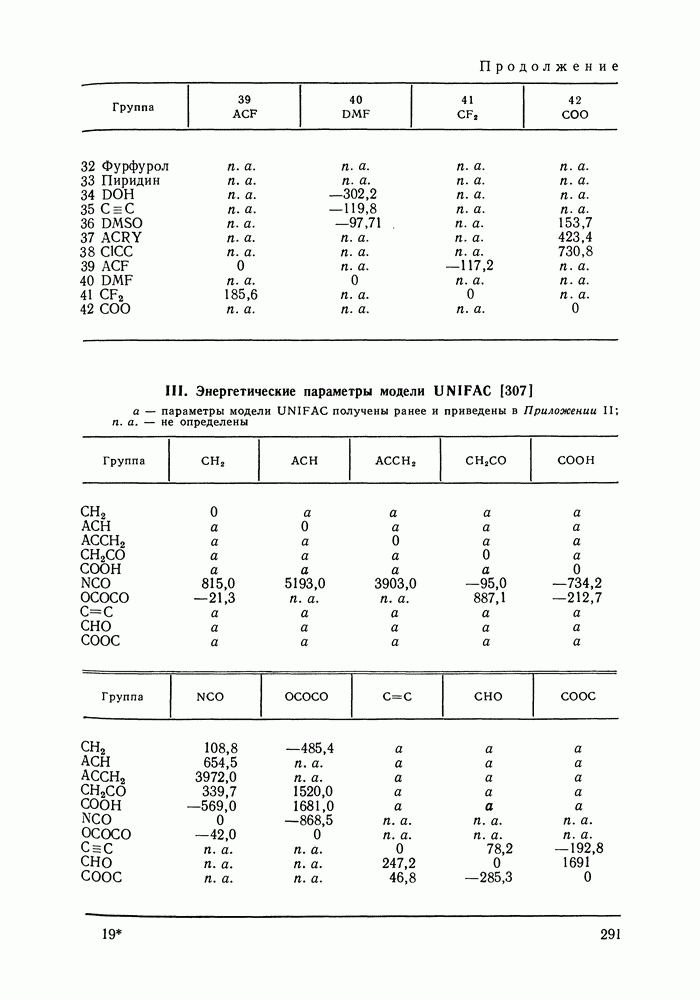
- 1.4. УСЛОВИЯ УСТОЙЧИВОСТИ
- 1.5. ПРАВИЛО ФАЗ
- Глава II. ОДНОКОМПОНЕНТНЫЕ СИСТЕМЫ
- II.1. ДИАГРАММЫ СОСТОЯНИЯ
- II.2. УРАВНЕНИЕ КЛАУЗИУСА—КЛАПЕЙРОНА
- II.3. ЗАВИСИМОСТЬ ДАВЛЕНИЯ ОТ ТЕМПЕРАТУРЫ. УРАВНЕНИЕ АНТУАНА
- II.4. ЗАКОН СООТВЕТСТВЕННЫХ СОСТОЯНИЙ
- II.5. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА. ДРУГИЕ АНАЛИТИЧЕСКИЕ УРАВНЕНИЯ СОСТОЯНИЯ
- II.6. ВИРИАЛЬНОЕ УРАВНЕНИЕ СОСТОЯНИЯ
- Глава III. ДВОЙНЫЕ СИСТЕМЫ
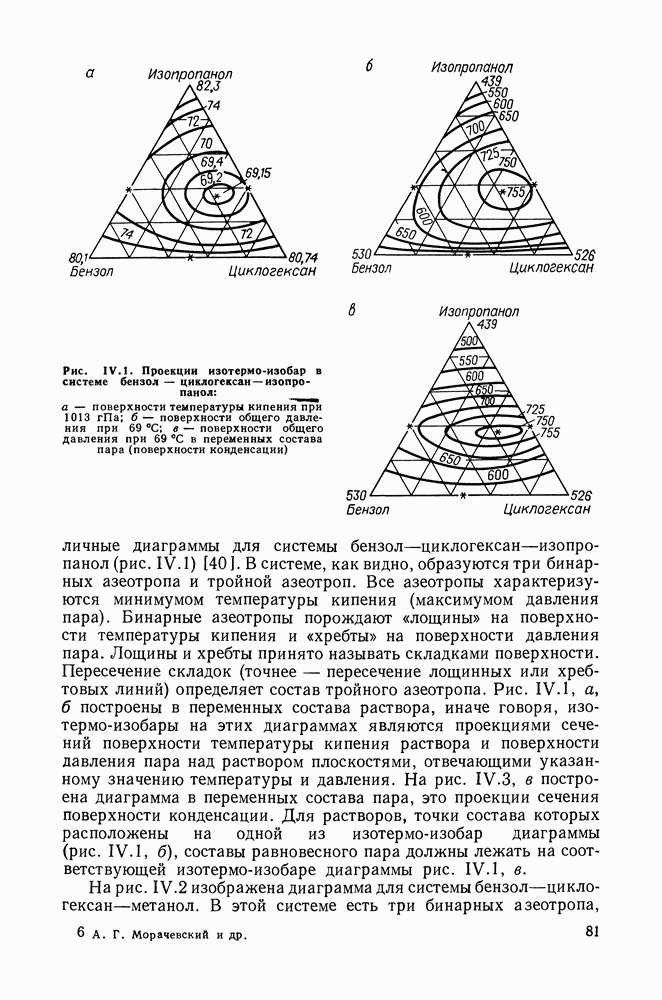
- III.1. ДИАГРАММЫ РАВНОВЕСИЯ ДЛЯ ДВОЙНЫХ СИСТЕМ
- III.2. ОБОБЩЕННОЕ ДИФФЕРЕНЦИАЛЬНОЕ УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- III.3. ЗАКОНЫ КОНОВАЛОВА
- III.4. ЗАКОНЫ ВРЕВСКОГО
- III.5. ИДЕАЛЬНЫЕ СИСТЕМЫ
- III.6. РАЗБАВЛЕННЫЕ РАСТВОРЫ
- III.7 РЕАЛЬНЫЕ СИСТЕМЫ
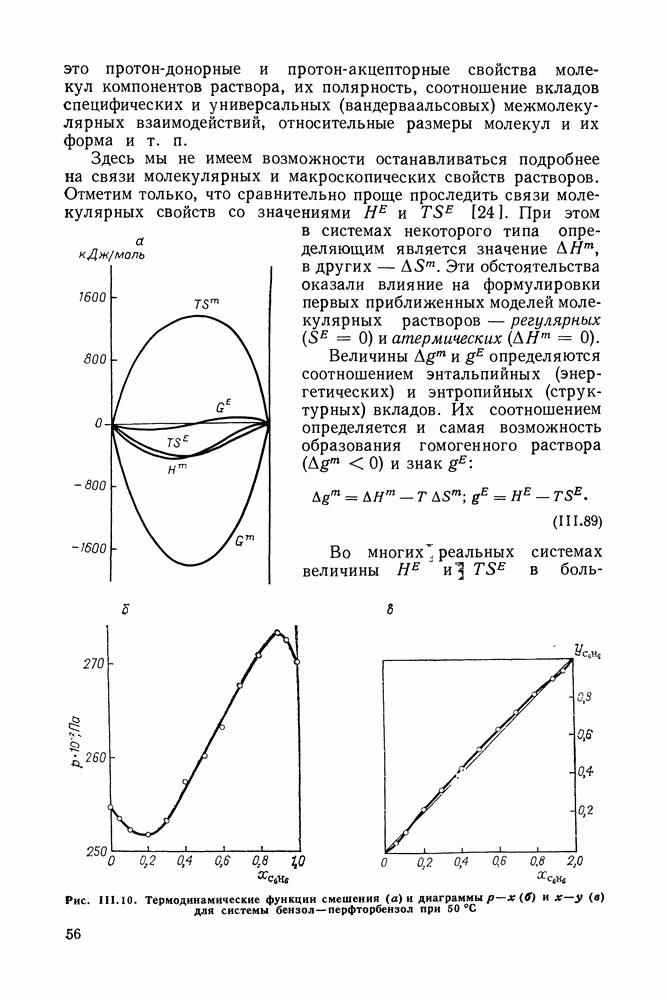
- III.8. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СМЕШЕНИЯ И РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР
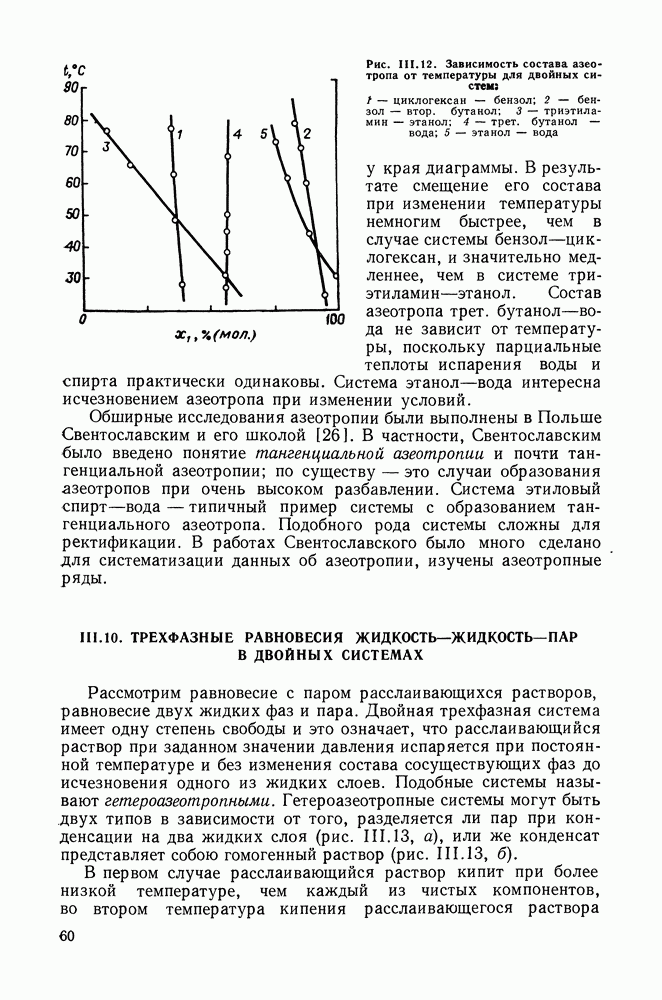
- III.9. ОБ АЗЕОТРОПИИ В БИНАРНЫХ СИСТЕМАХ
- III.10. ТРЕХФАЗНЫЕ РАВНОВЕСИЯ ЖИДКОСТЬ—ЖИДКОСТЬ—ПАР В ДВОЙНЫХ СИСТЕМАХ
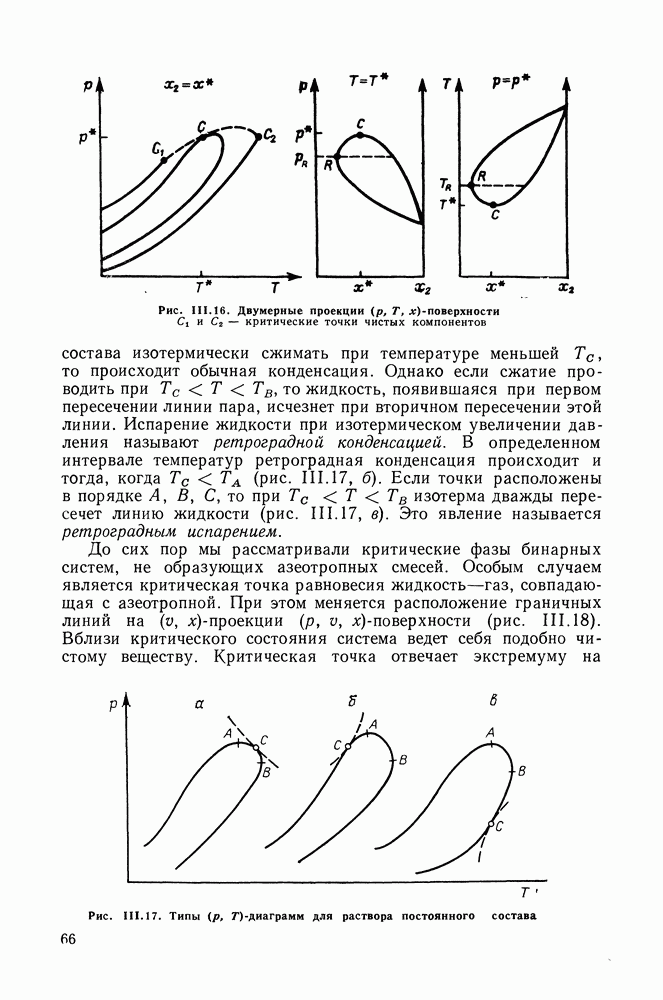
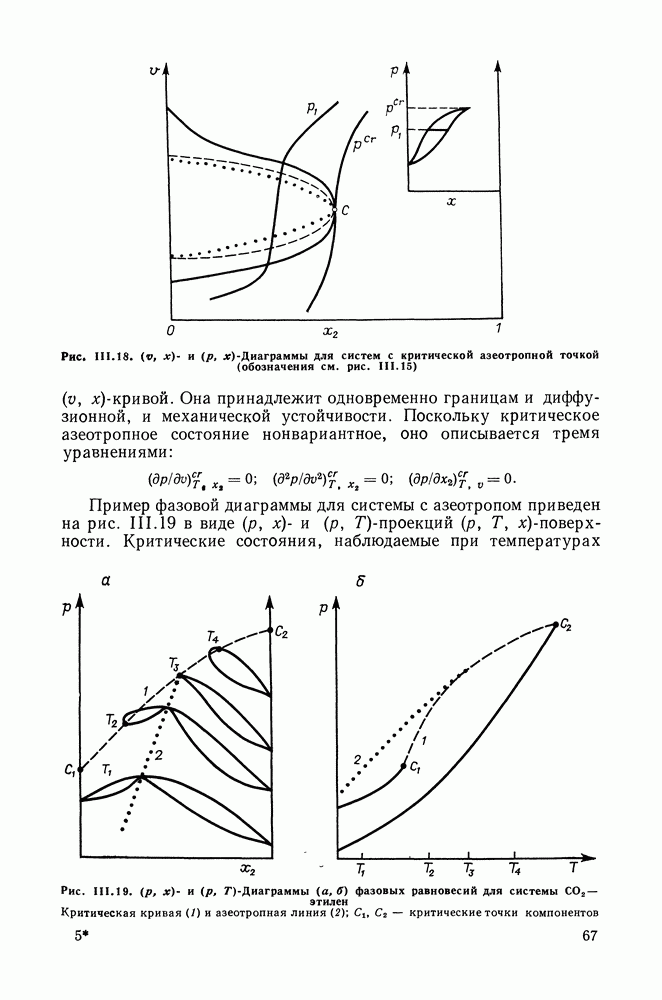
- III.11. ФАЗОВЫЕ ДИАГРАММЫ БИНАРНЫХ СИСТЕМ В ШИРОКОМ ИНТЕРВАЛЕ ТЕМПЕРАТУР И ДАВЛЕНИЙ
- Глава IV. ТРОЙНЫЕ И МНОГОКОМПОНЕНТНЫЕ СИСТЕМЫ
- IV.2. ПРОЯВЛЕНИЕ ЗАКОНОВ КОНОВАЛОВА И ВРЕВСКОГО В ТРОЙНЫХ И МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ
- IV.3. ОТКРЫТЫЕ ФАЗОВЫЕ ПРОЦЕССЫ. ТЕРМОДИНАМИКО-ТОПОЛОГИЧЕСКИЕ ЗАКОНОМЕРНОСТИ
- Глава V. МЕТОДЫ ЭКСПЕРИМЕНТАЛЬНОГО ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР
- V.I. ЦИРКУЛЯЦИОННЫЙ МЕТОД
- V.2. МЕТОД ОТКРЫТОГО ИСПАРЕНИЯ
- V.3. МЕТОД СТРУИ ИНЕРТНОГО ГАЗА
- V.4. СТАТИЧЕСКИЙ МЕТОД
- V.5. ИЗОПИЕСТИЧЕСКИЙ МЕТОД
- V.6. ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
- V.7. РАСЧЕТ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР ПО ЗАВИСИМОСТИ ДАВЛЕНИЯ ПАРА ОТ СОСТАВА РАСТВОРА ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ
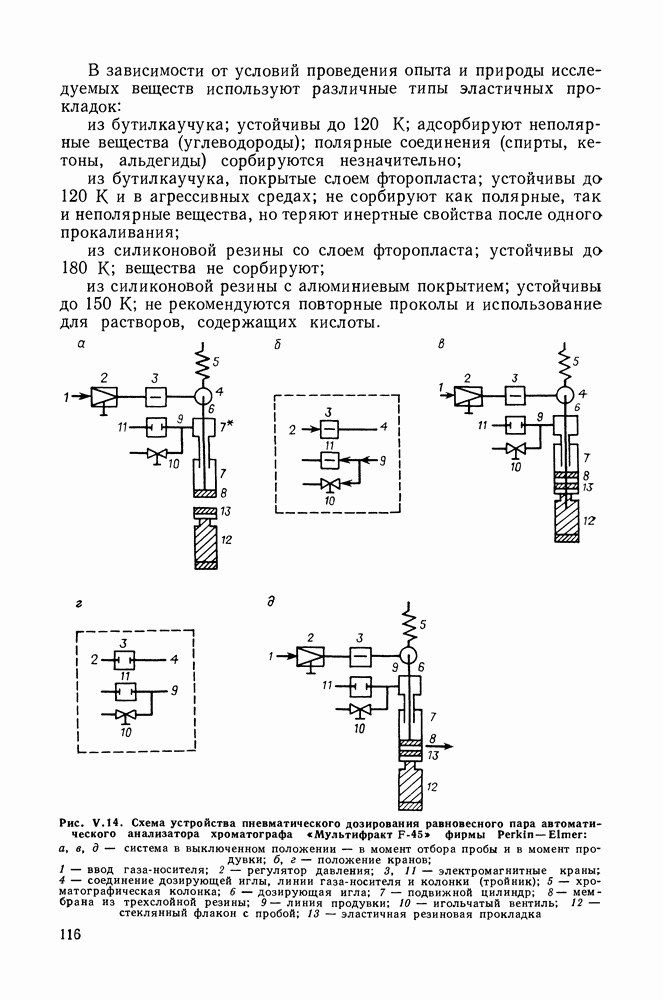
- V.8. МЕТОДЫ ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР С ПОМОЩЬЮ ГАЗОВОЙ ХРОМАТОГРАФИИ
- V.9. РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР ДЛЯ РАЗБАВЛЕННЫХ РАСТВОРОВ
- Глава VI. МЕТОДЫ ПРОВЕРКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ-ПАР
- VI.2. ОБЩАЯ ОЦЕНКА ТЕРМОДИНАМИЧЕСКИХ МЕТОДОВ ПРОВЕРКИ И ИСПРАВЛЕНИЯ ДАННЫХ
- VI.3. ПРОВЕРКА ДАННЫХ С ПОМОЩЬЮ УРАВНЕНИЙ ГИББСА—ДЮГЕМА И ДЮГЕМА—МАРГУЛЕСА
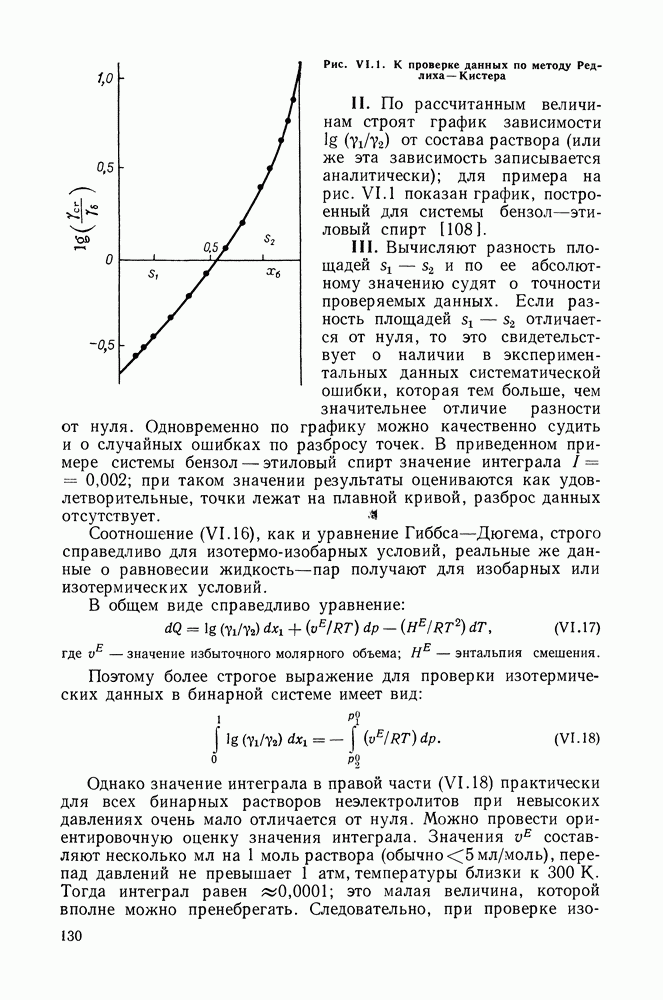
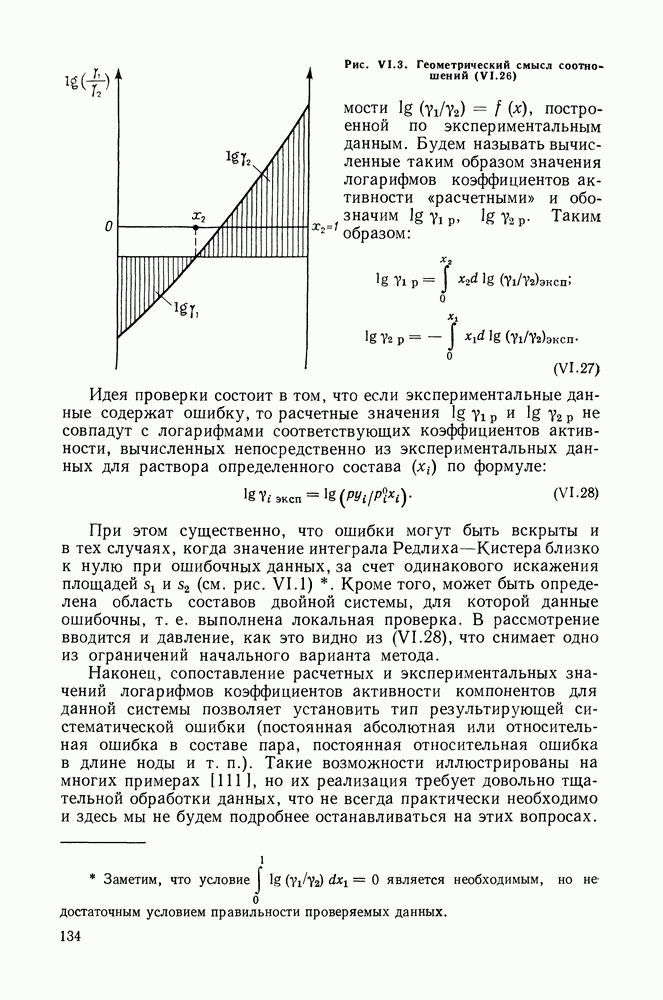
- VI.4. МЕТОД РЕДЛИХА—КИСТЕРА
- VI.5. МЕТОД ВАН-НЕССА
- VI.6. СТАТИСТИЧЕСКИЕ МЕТОДЫ ОБРАБОТКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР
- VI.7. МЕТОДЫ ПРОВЕРКИ ТЕРМОДИНАМИЧЕСКОЙ СОГЛАСОВАННОСТИ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР В ТРОЙНЫХ СИСТЕМАХ
- VI.8. СОПОСТАВЛЕНИЕ МЕТОДОВ РЕДЛИХА—КИСТЕРА И ВАН-НЕССА
- Глава VII. МЕТОДЫ РАСЧЕТА РАВНОВЕСИЙ ЖИДКОСТЬ—ПАР
- VII. 1. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ РАВНОВЕСНЫХ ЖИДКОСТИ И ПАРА
- VII.2. АЛГОРИТМЫ РАСЧЕТА ФАЗОВЫХ РАВНОВЕСИЙ
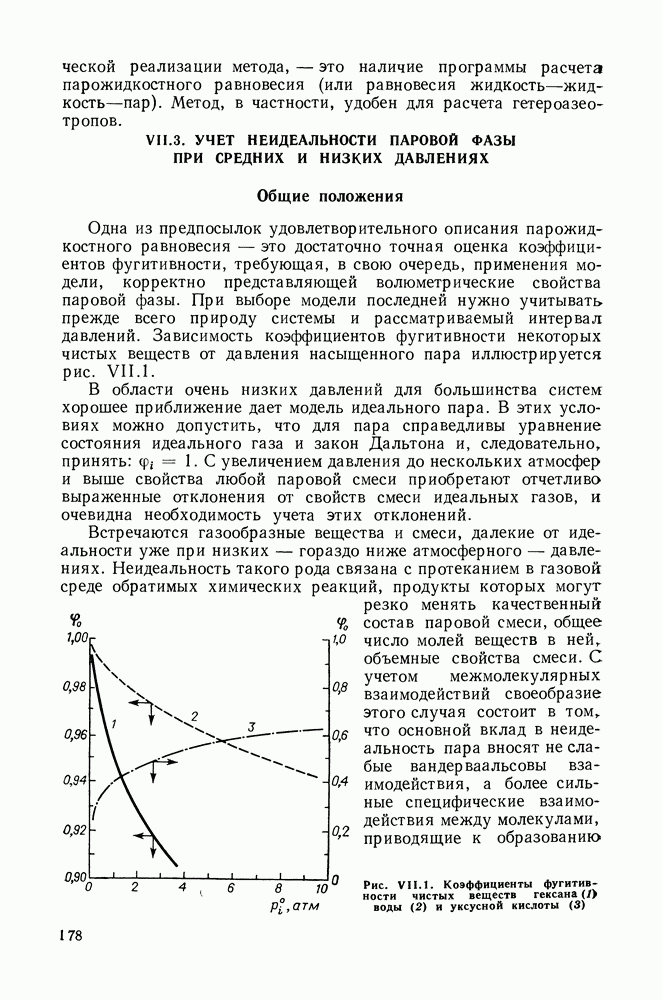
- VII.3. УЧЕТ НЕИДЕАЛЬНОСТИ ПАРОВОЙ ФАЗЫ ПРИ СРЕДНИХ И НИЗКИХ ДАВЛЕНИЯХ
- VII.4. ПОЛИНОМИАЛЬНЫЕ УРАВНЕНИЯ ДЛЯ КОЭФФИЦИЕНТОВ АКТИВНОСТИ И УРАВНЕНИЕ ВАН-ЛААРА
- VII.5. МОДЕЛИ ЛОКАЛЬНОГО СОСТАВА
- VII.6. ОЦЕНКА ПАРАМЕТРОВ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ
- VII.7. СОПОСТАВЛЕНИЕ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ ПРИ ОПИСАНИИ ФАЗОВЫХ РАВНОВЕСИЙ
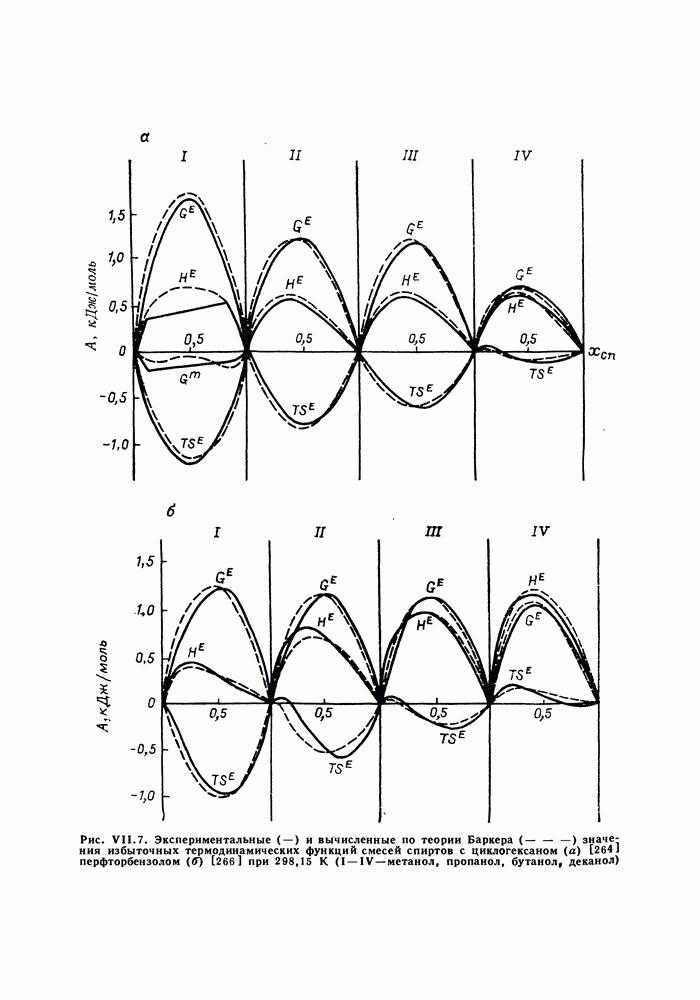
- VII.8. РЕШЕТОЧНЫЕ МОДЕЛИ. МОДЕЛЬ БАРКЕРА
- Глава VIII. ГРУППОВЫЕ МОДЕЛИ РАСТВОРОВ
- VIII.1. ОСНОВНЫЕ ОСОБЕННОСТИ ГРУППОВЫХ МОДЕЛЕЙ РАСТВОРОВ
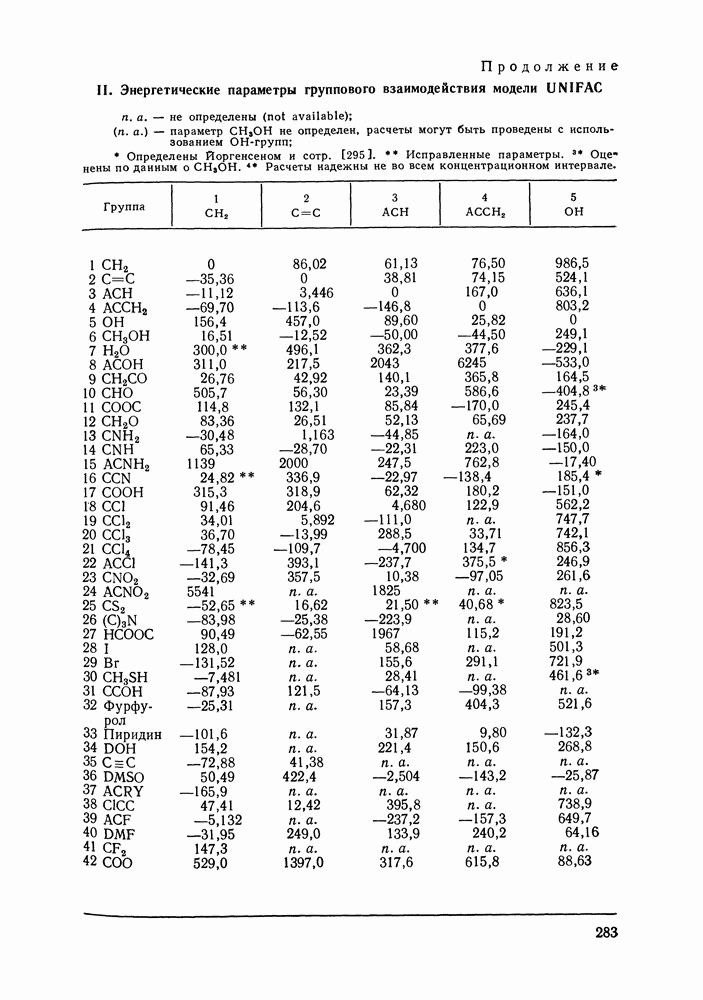
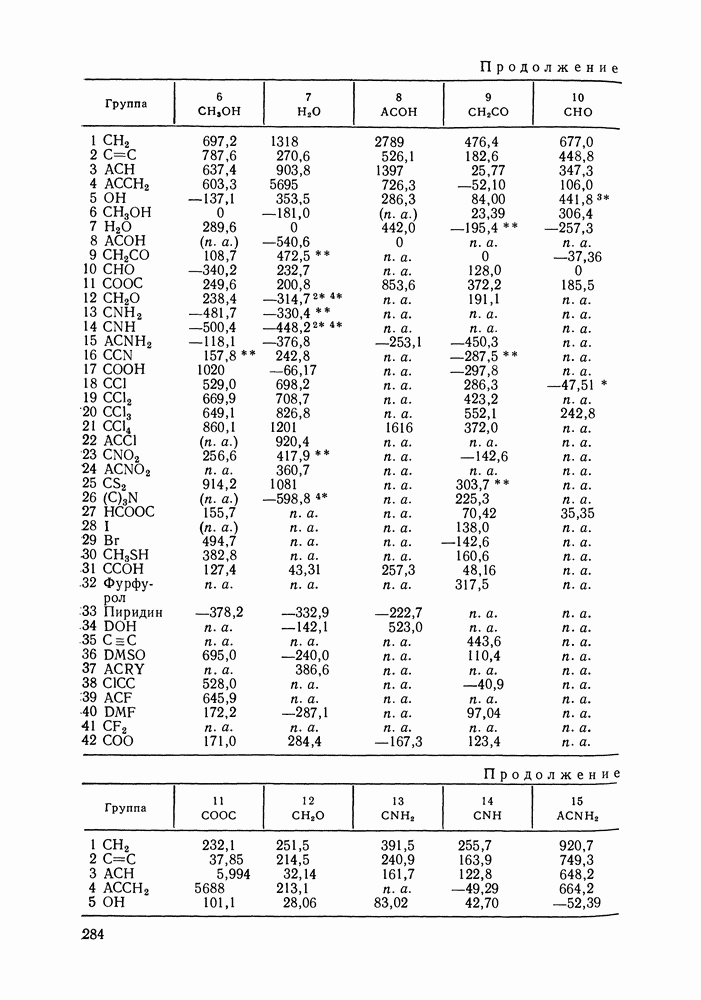
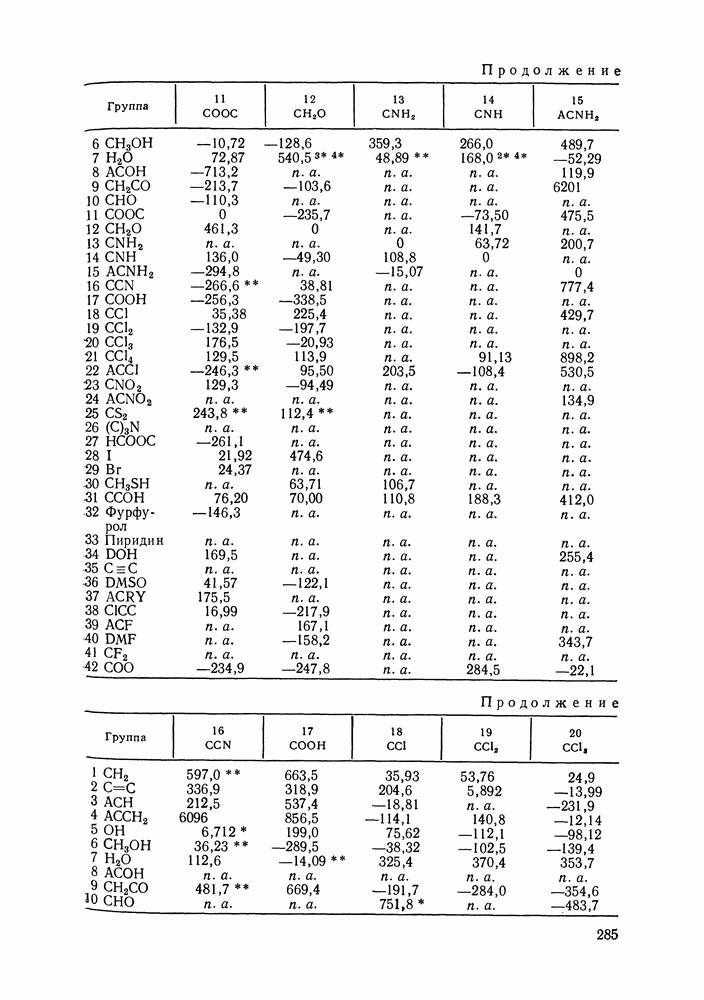
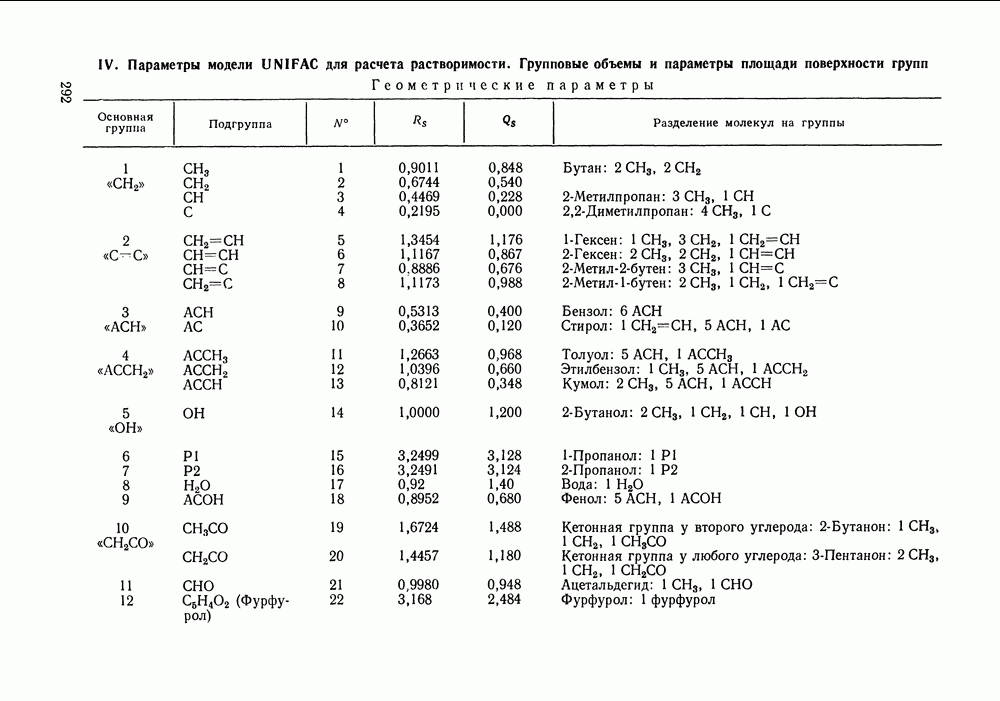
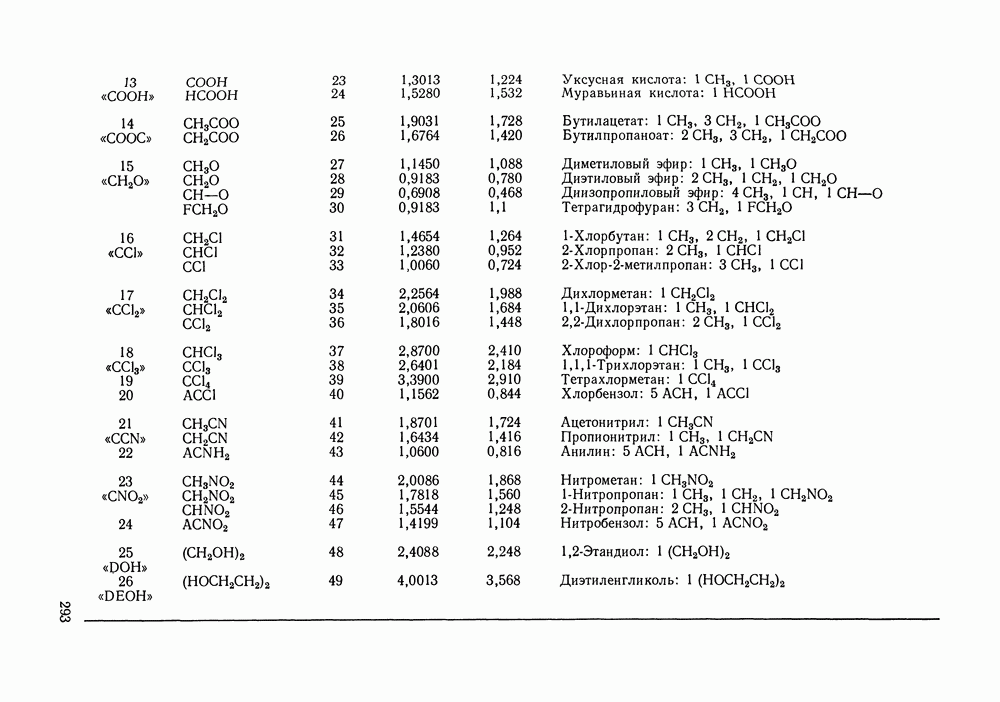
- VIII.2. МОДЕЛЬ UNIFAC
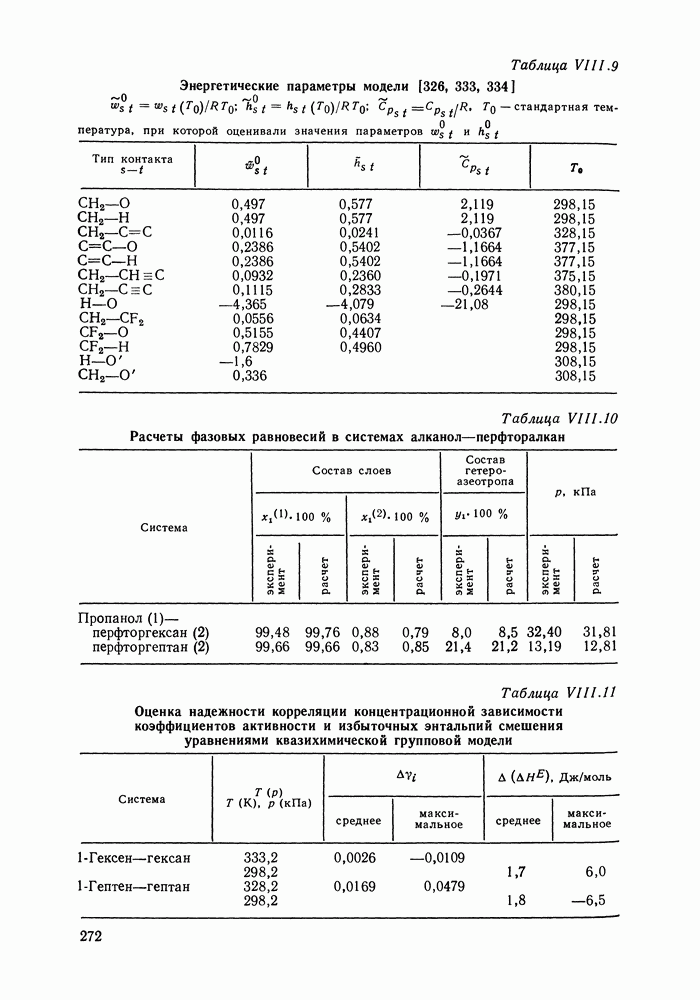
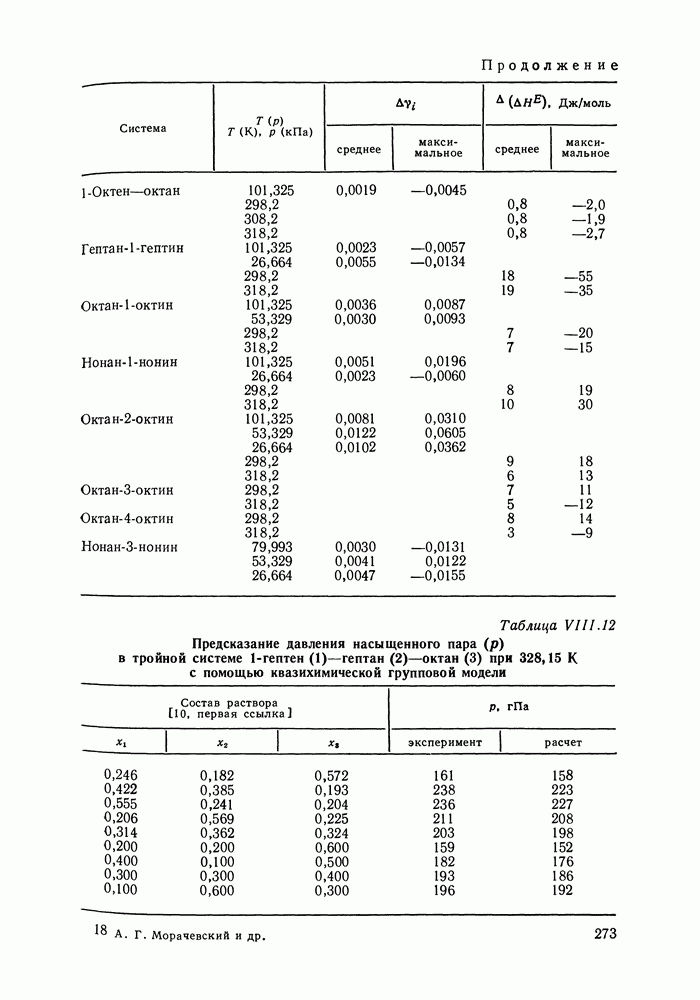
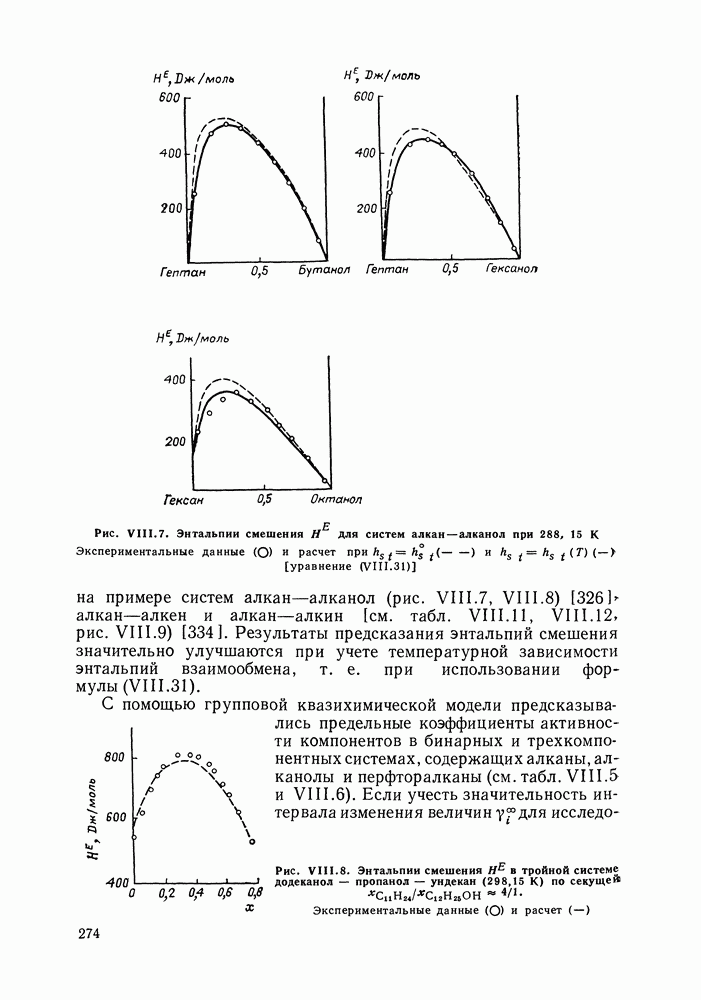
- VIII.3. КВАЗИХИМИЧЕСКИЕ ГРУППОВЫЕ МОДЕЛИ
- Глава IX. ДЫРОЧНАЯ РЕШЕТОЧНАЯ КВАЗИХИМИЧЕСКАЯ МОДЕЛЬ, ЕЕ ГРУППОВОЙ ВАРИАНТ
- IX.2. ФОРМУЛИРОВКА ДЫРОЧНОЙ КВАЗИХИМИЧЕСКОЙ МОДЕЛИ
- IX.3. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СИСТЕМЫ
- IX.4. О МЕТОДИКЕ РАСЧЕТА
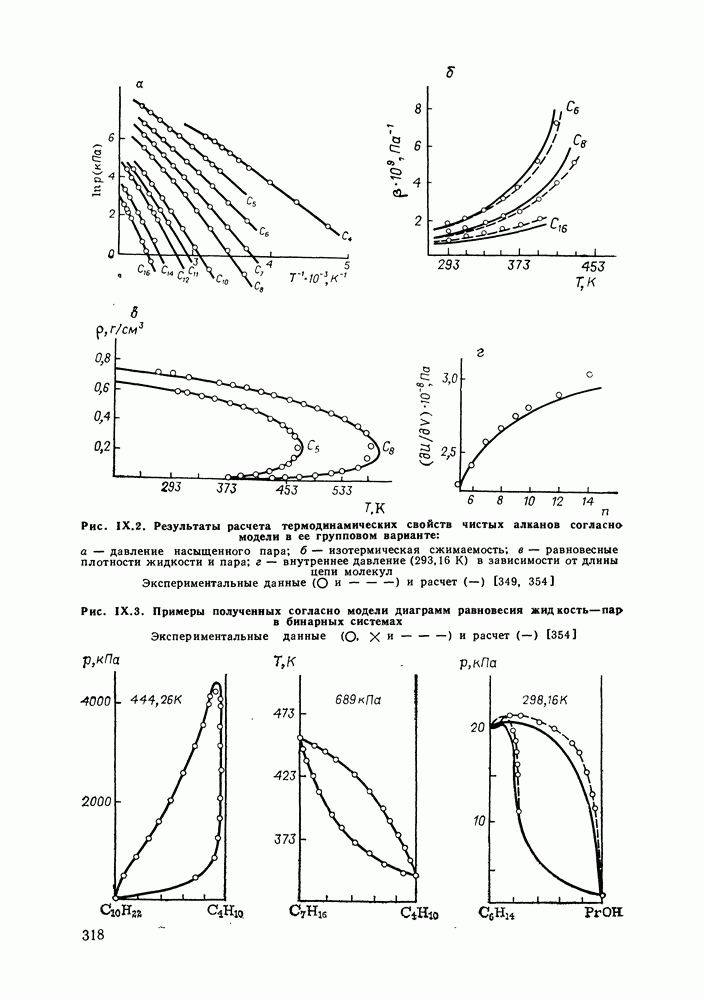
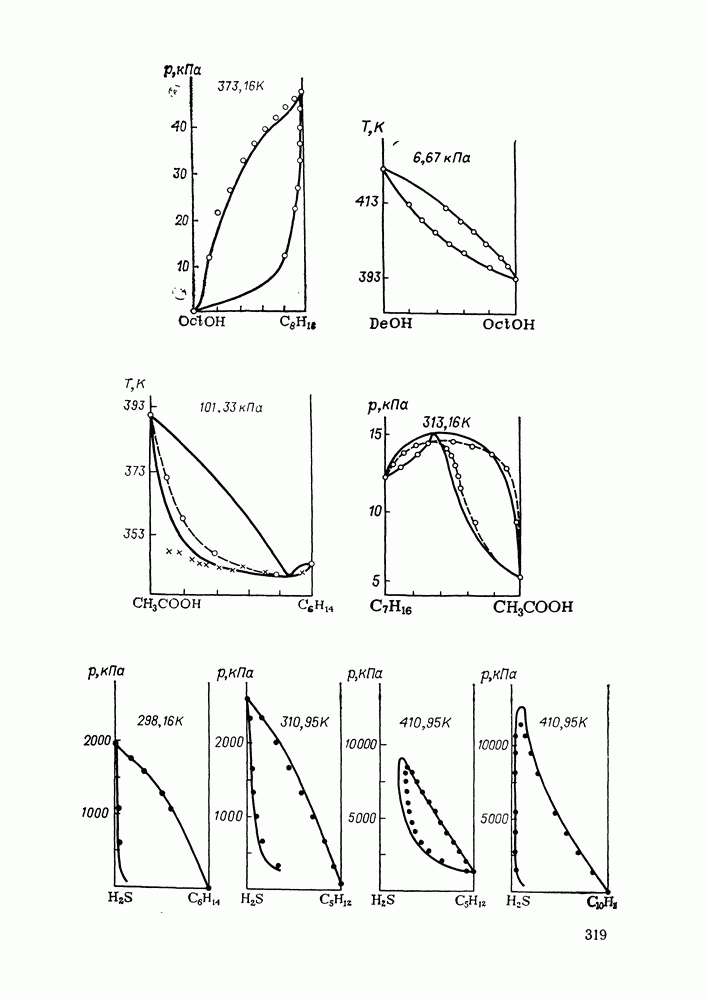
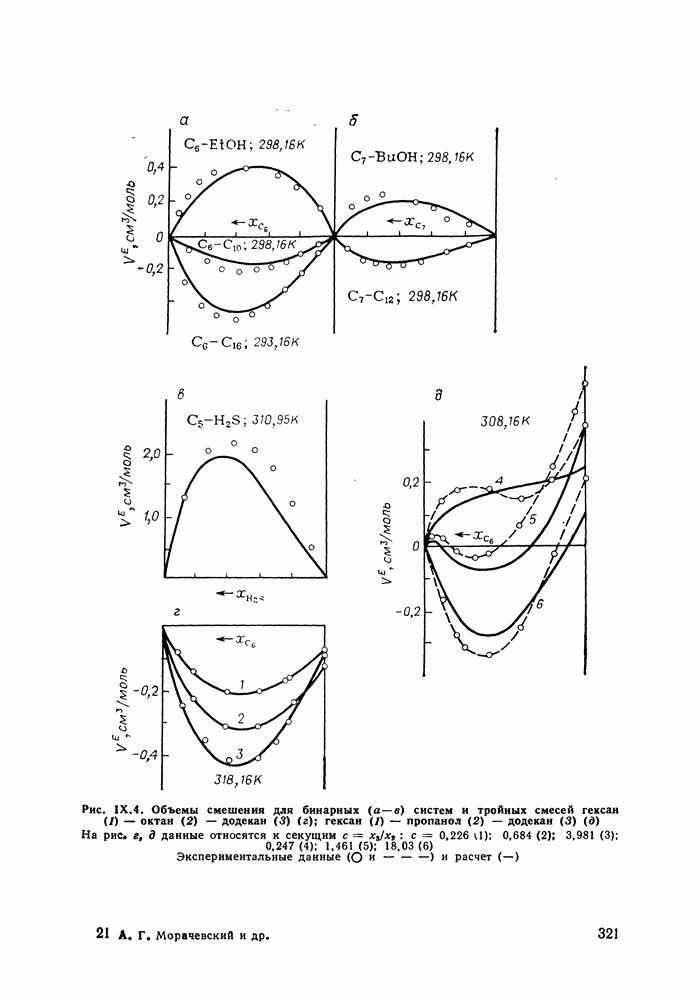
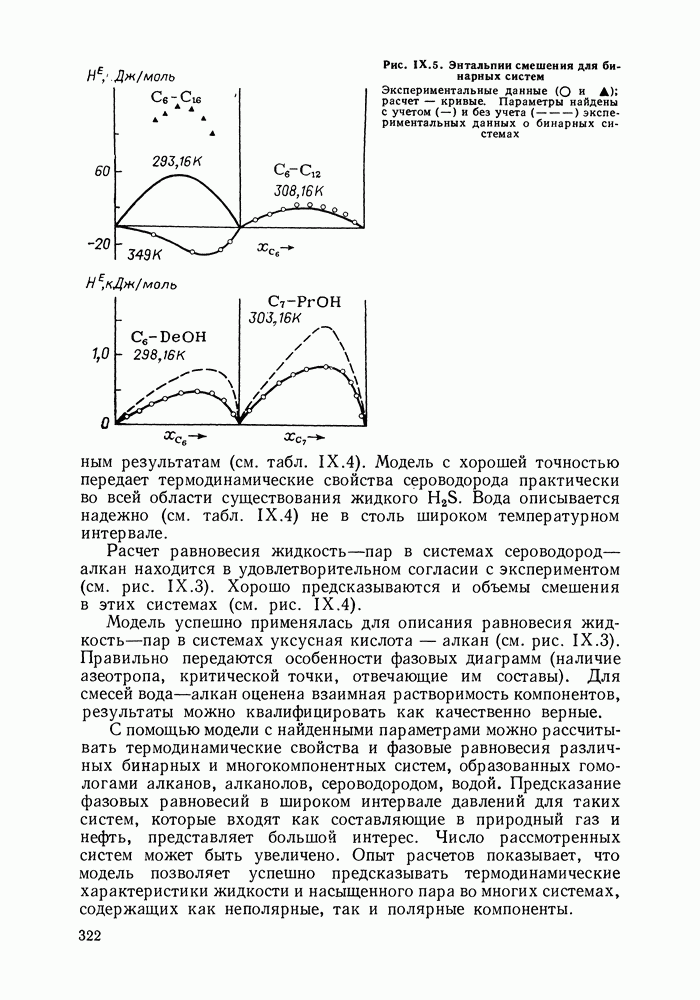
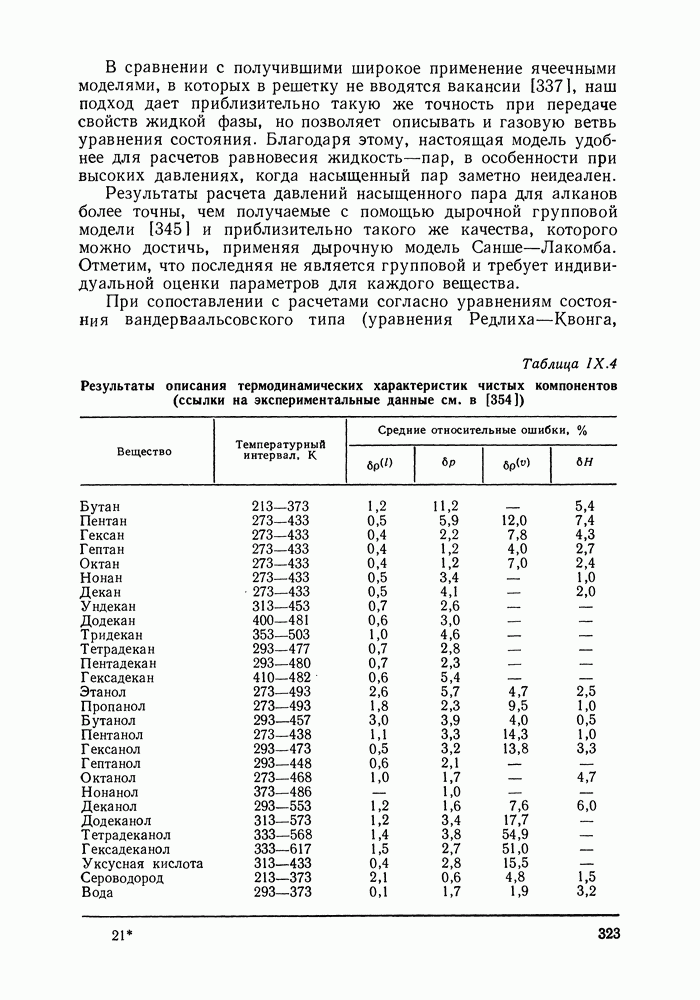
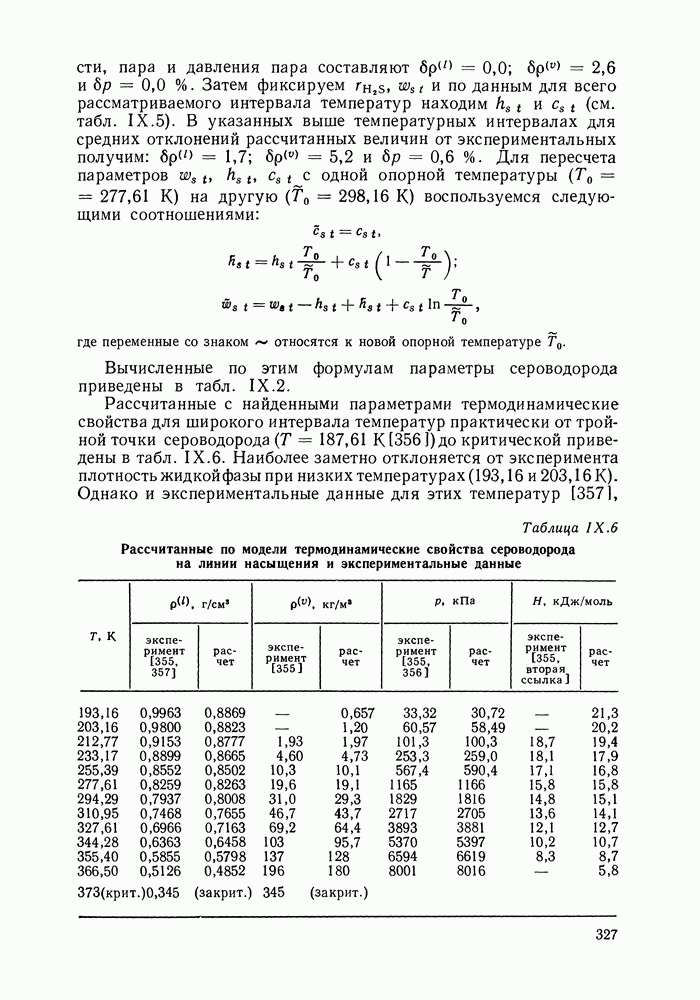
- IX.5. РЕЗУЛЬТАТЫ РАСЧЕТОВ И ВОЗМОЖНОСТИ МОДЕЛИ
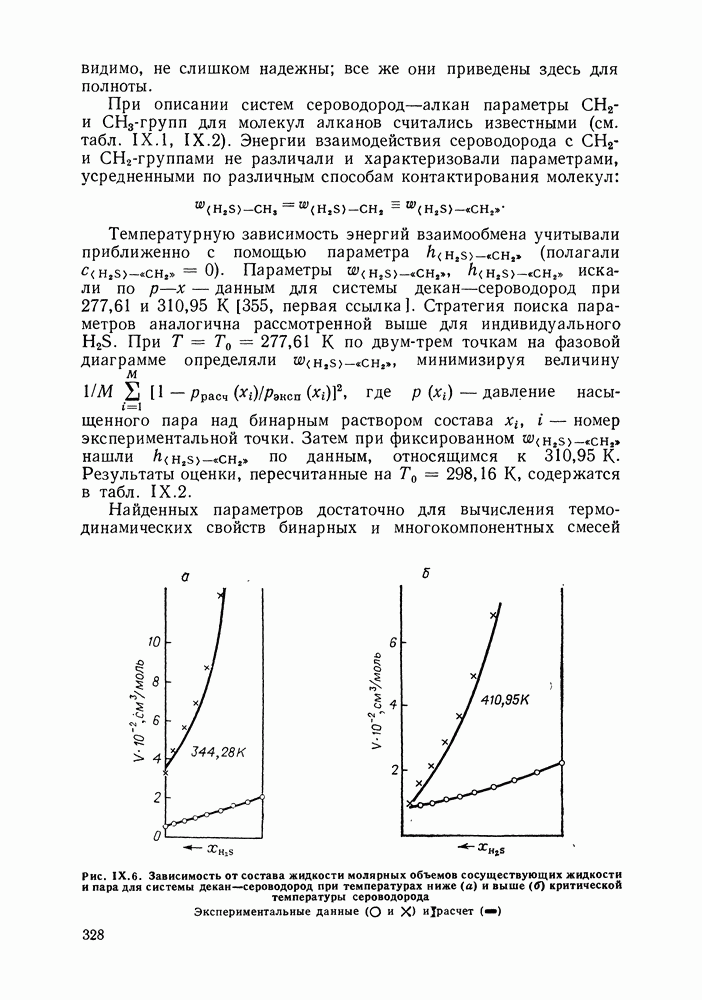
- IX.6. ПРИМЕРЫ РАСЧЕТА