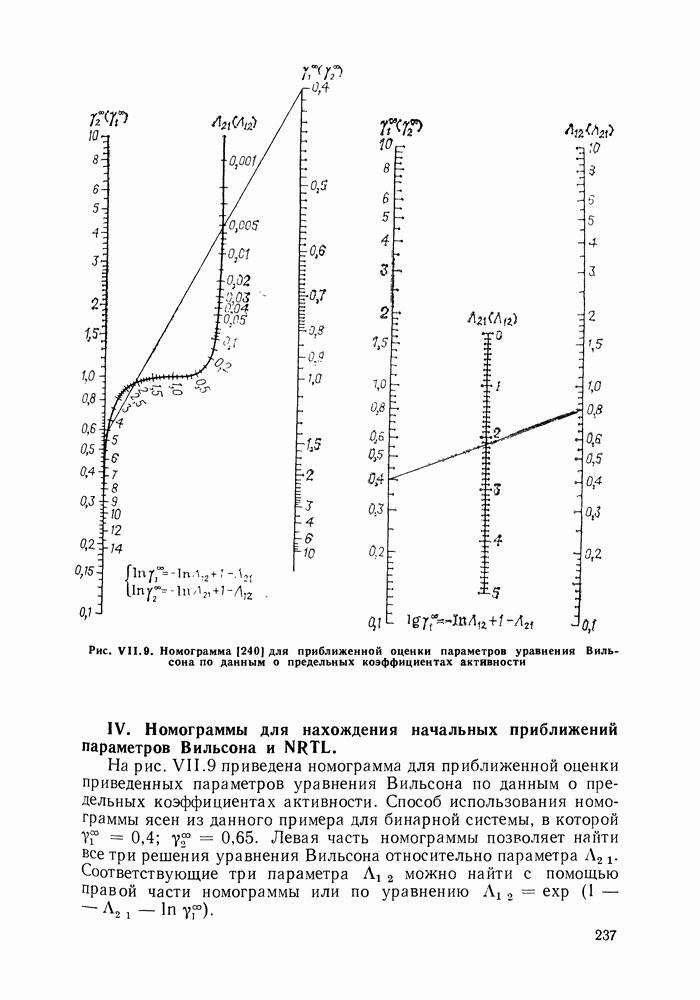
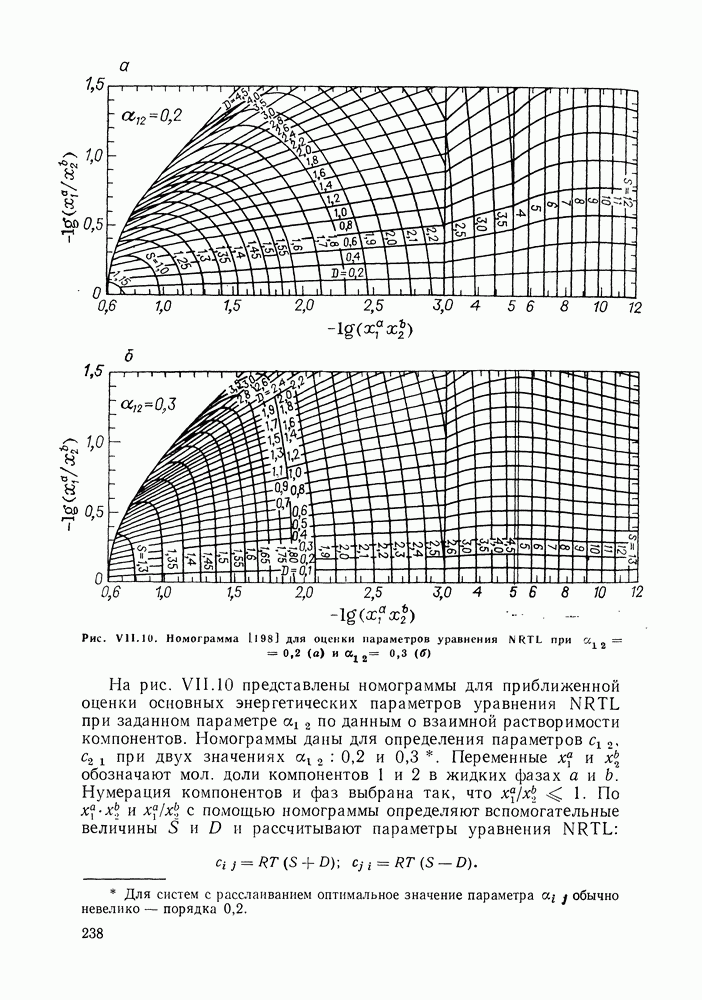
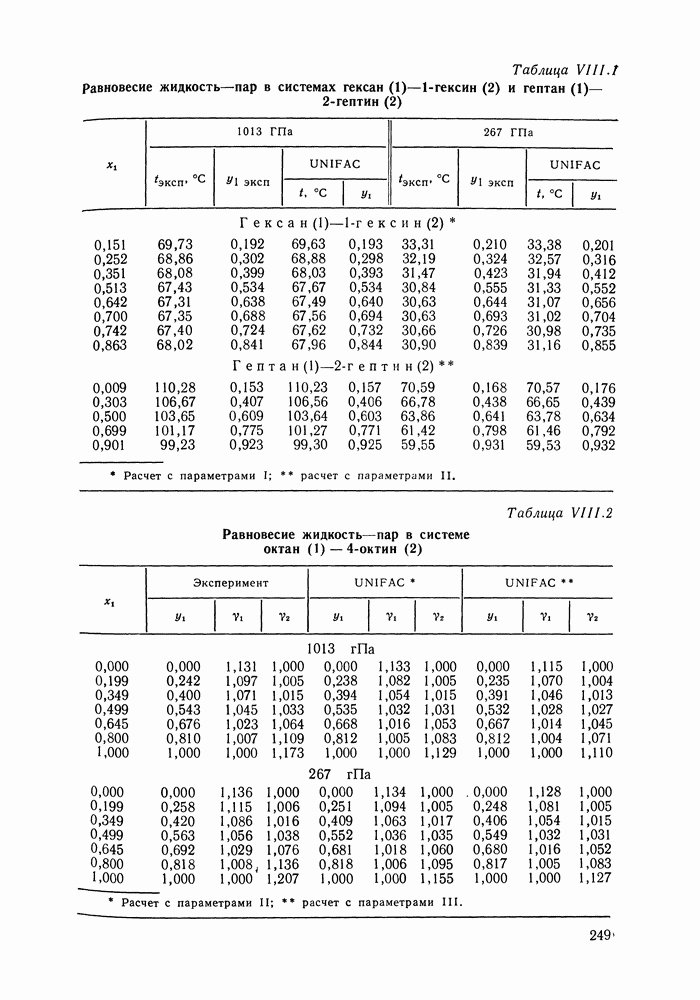
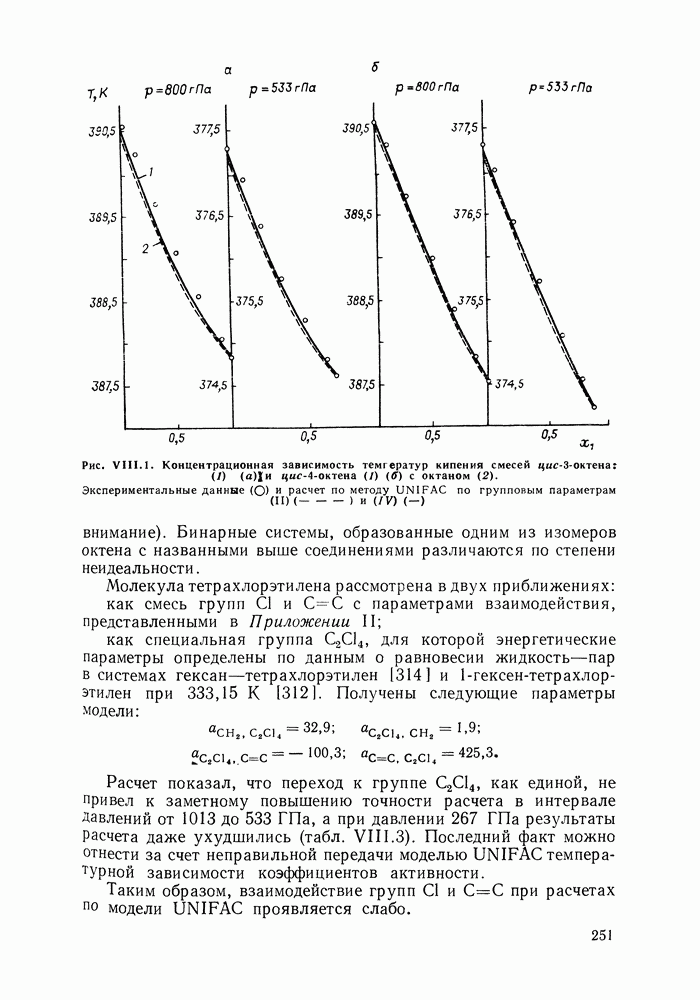
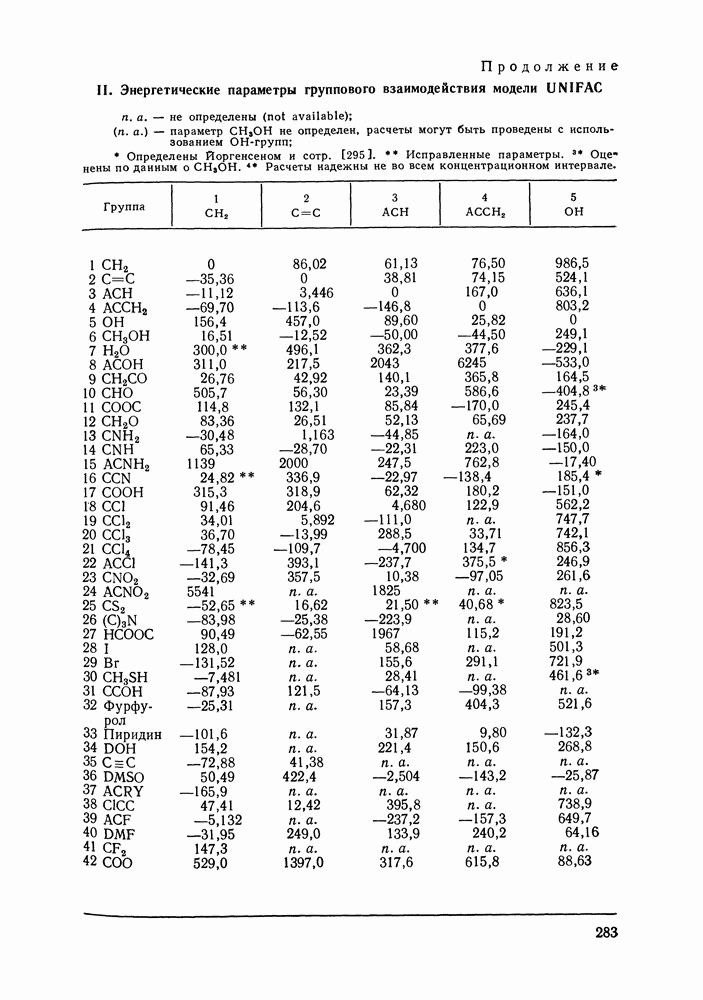
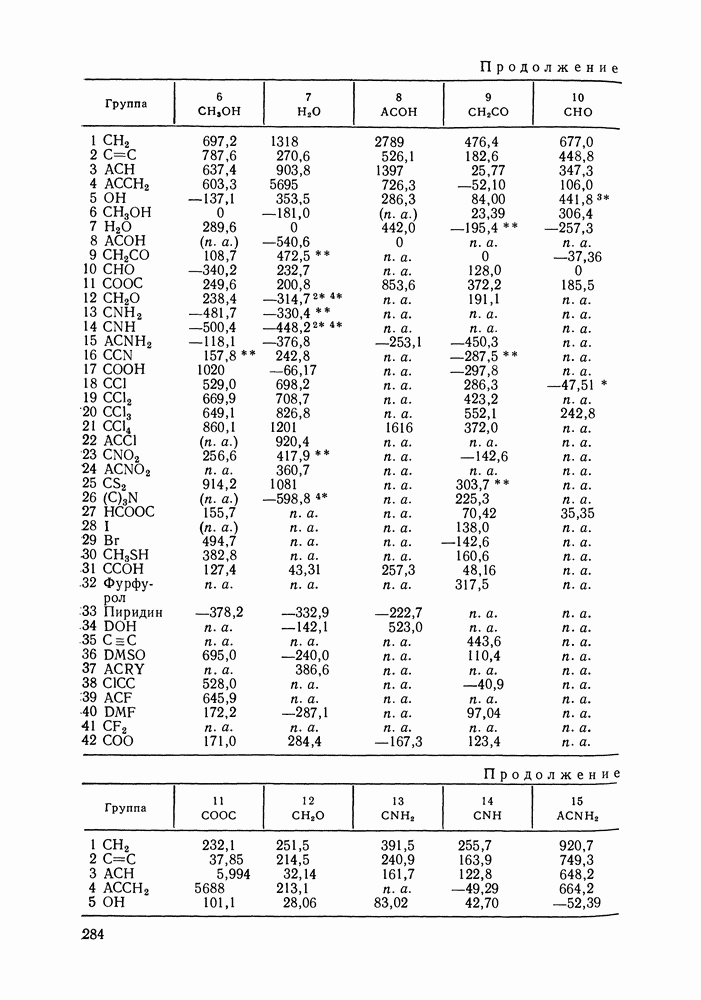
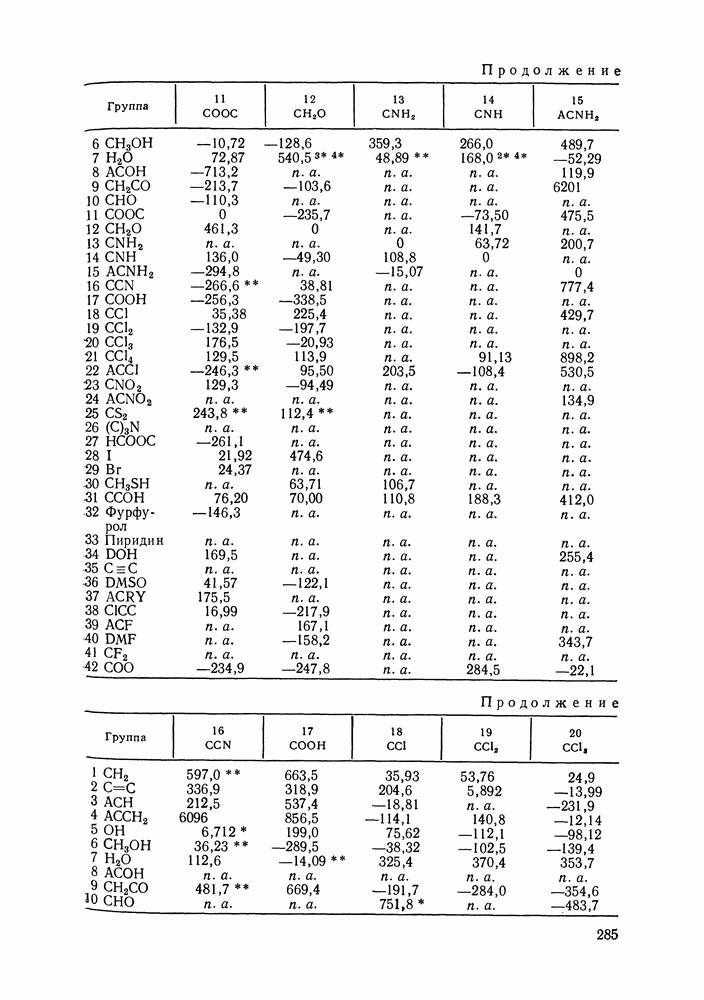
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
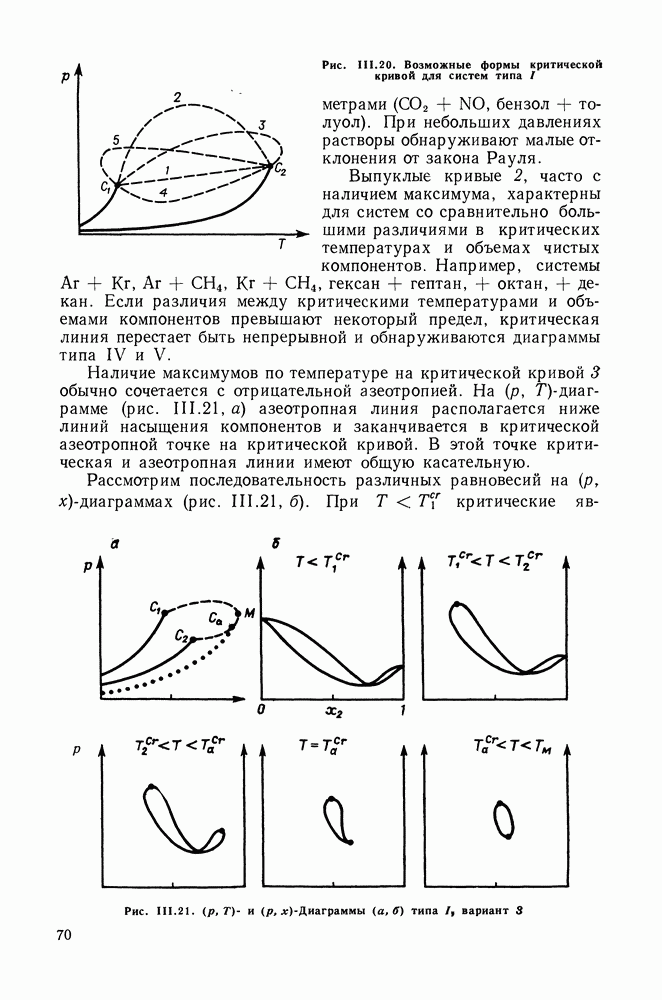
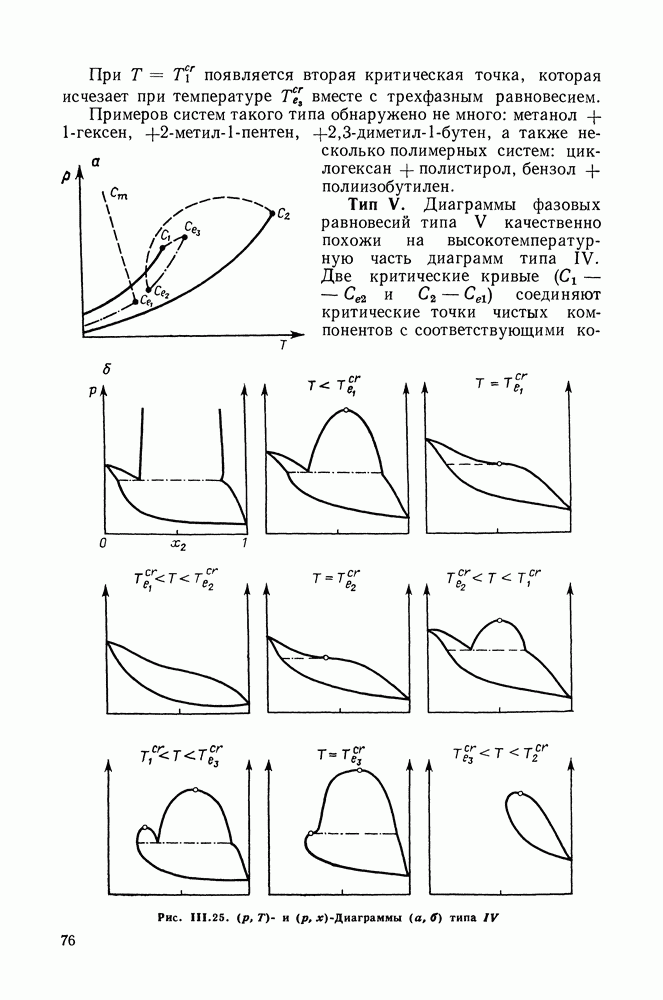
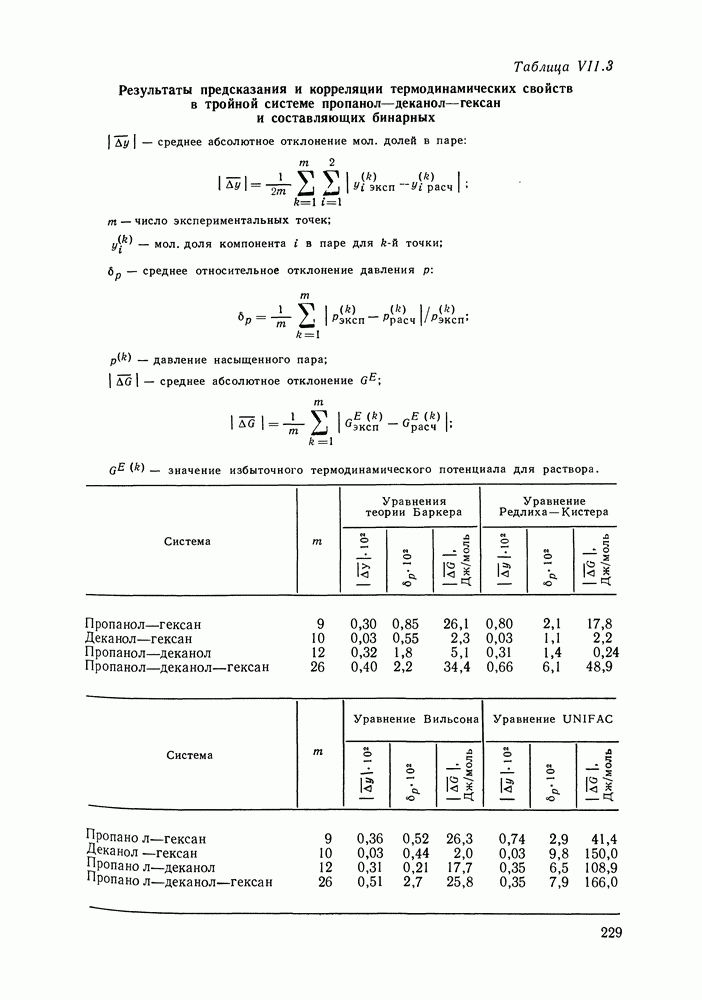
IV.2. ПРОЯВЛЕНИЕ ЗАКОНОВ КОНОВАЛОВА И ВРЕВСКОГО В ТРОЙНЫХ И МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ
Законы Коновалова и Вревского устанавливают взаимосвязь между изменениями параметров состояния системы — состава, температуры и давления, лежат в основе теории и практики перегонки и ректификации двойных систем. Очевидно, что закономерности, аналогичные законам Коновалова и Вревского, существенны и для систем с большим числом компонентов.
Второй закон Коновалова (закон Гиббса-Коновалова), утверждающий равенство составов сосуществующих фаз при условиях экстремума температуры и давления, применим к двухфазным системам любой природы и с любым числом компонентов, это положение известно давно.
Вопрос о проявлении первого закона Коновалова в многокомпонентных и, в частности, тройных системах был исследован в работах Сторонкина и его сотр. Формулировки первого закона Коновалова (III.30) и (111.31) следуют из уравнения Ван-дер-Ваальса для двойных систем, для многокомпонентных систем
рассмотрение основывается на обобщенном уравнении (III. 17), которое в случае тройных систем принимает вид:

где

Уравнение  записано в переменных состава раствора; при постоянной температуре это будет уравнение поверхности давления пара, при постоянном давлении — поверхности температуры кипения. Если же уравнение Ван-дер-Ваальса записать в переменных состава пара, то получим уравнения поверхностей конденсации.
записано в переменных состава раствора; при постоянной температуре это будет уравнение поверхности давления пара, при постоянном давлении — поверхности температуры кипения. Если же уравнение Ван-дер-Ваальса записать в переменных состава пара, то получим уравнения поверхностей конденсации.
Специфика многокомпонентных систем состоит в том, что в них можно осуществить бесконечное множество способов изменения состава, тогда как в двойных системах возможен только один способ  Рассмотрим для простоты тройные системы. Каждому способу изменения состава тройного раствора в концентрационном треугольнике отвечает семейство кривых составов, уравнение которого в общем виде можно записать так:
Рассмотрим для простоты тройные системы. Каждому способу изменения состава тройного раствора в концентрационном треугольнике отвечает семейство кривых составов, уравнение которого в общем виде можно записать так:

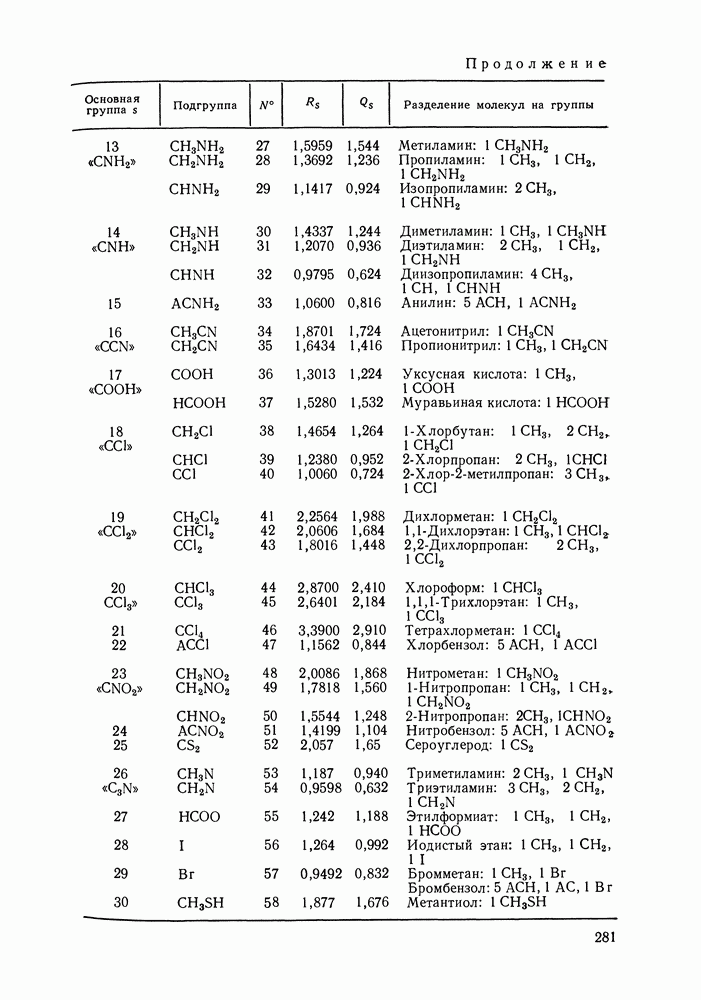
где с — параметр, путем варьирования значений которого можно получить уравнение любой кривой семейства.
Вопрос о применимости первого закона Коновалова к тройным системам должен решаться конкретно для каждого способа изменения состава раствора. Примем, что закон выполняется, если справедливы следующие простые неравенства, аналогичные (III.30) и 

Уравнение  описывает влияние изменения состава тройного раствора на давление и температуру сосуществования раствора и пара при любом способе изменения состава. Накладывая на
описывает влияние изменения состава тройного раствора на давление и температуру сосуществования раствора и пара при любом способе изменения состава. Накладывая на  условие
условие  мы получим ответ на интересующий нас вопрос.
мы получим ответ на интересующий нас вопрос.
Наиболее интересны такие пути изменения состава раствора, которые задаются ходом каких-либо естественных или технологических процессов. В работе [48] было показано, что при практически важном способе изменения состава путем добавления одного
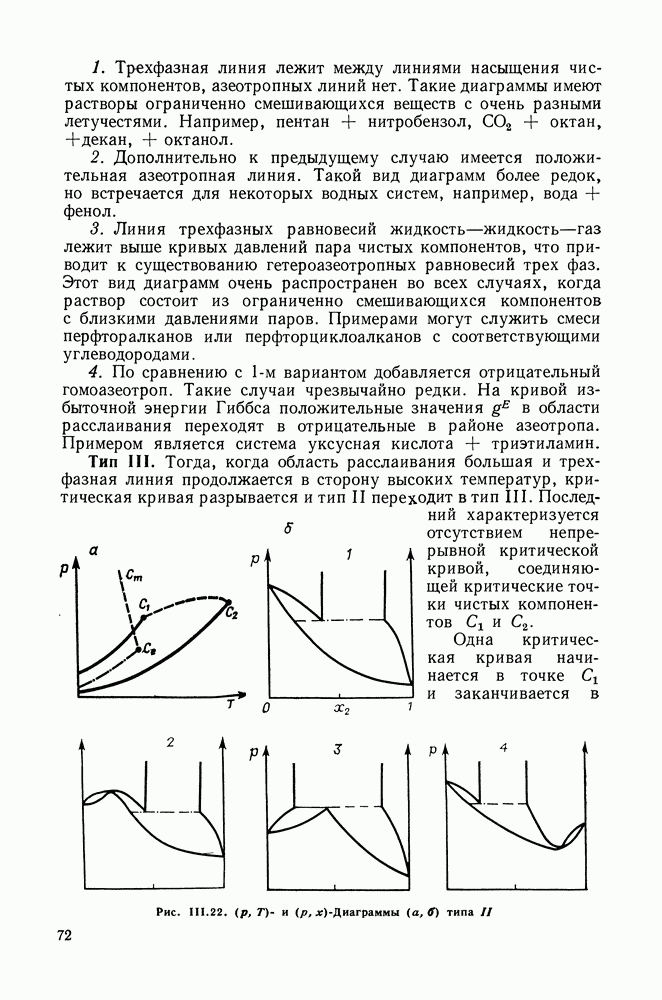
из компонентов (движение по секущим треугольника концентраций) соотношения  могут быть нарушены. Иначе говоря, возможны случаи, когда в какой-то области составов раствора добавление компонента, содержание которого в паре больше, чем в растворе, приведет не к повышению, а к понижению давления пара. Существование таких областей связано со складками на поверхностях давления и температуры, они возможны только в тройных (многокомпонентных) системах, в которых образуются азеотропные смеси. Размеры этих областей весьма различны, в некоторых системах они значительны [49].
могут быть нарушены. Иначе говоря, возможны случаи, когда в какой-то области составов раствора добавление компонента, содержание которого в паре больше, чем в растворе, приведет не к повышению, а к понижению давления пара. Существование таких областей связано со складками на поверхностях давления и температуры, они возможны только в тройных (многокомпонентных) системах, в которых образуются азеотропные смеси. Размеры этих областей весьма различны, в некоторых системах они значительны [49].
Соотношения  с неизбежностью выполняются при изменении состава по кривым открытого испарения, в ходе непрерывных открытых фазовых процессов (уравнение кривых открытого испарения в разд. IV.3). Эта закономерность была установлена Шрейнемакерсом еще в начале века, подробно обоснована Хаазе [50].
с неизбежностью выполняются при изменении состава по кривым открытого испарения, в ходе непрерывных открытых фазовых процессов (уравнение кривых открытого испарения в разд. IV.3). Эта закономерность была установлена Шрейнемакерсом еще в начале века, подробно обоснована Хаазе [50].
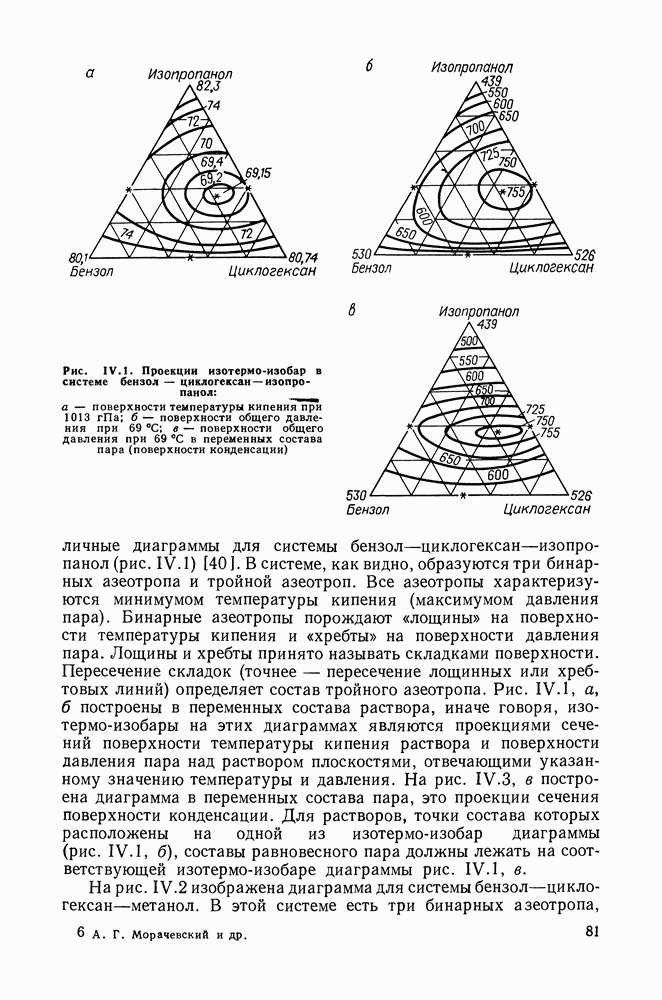
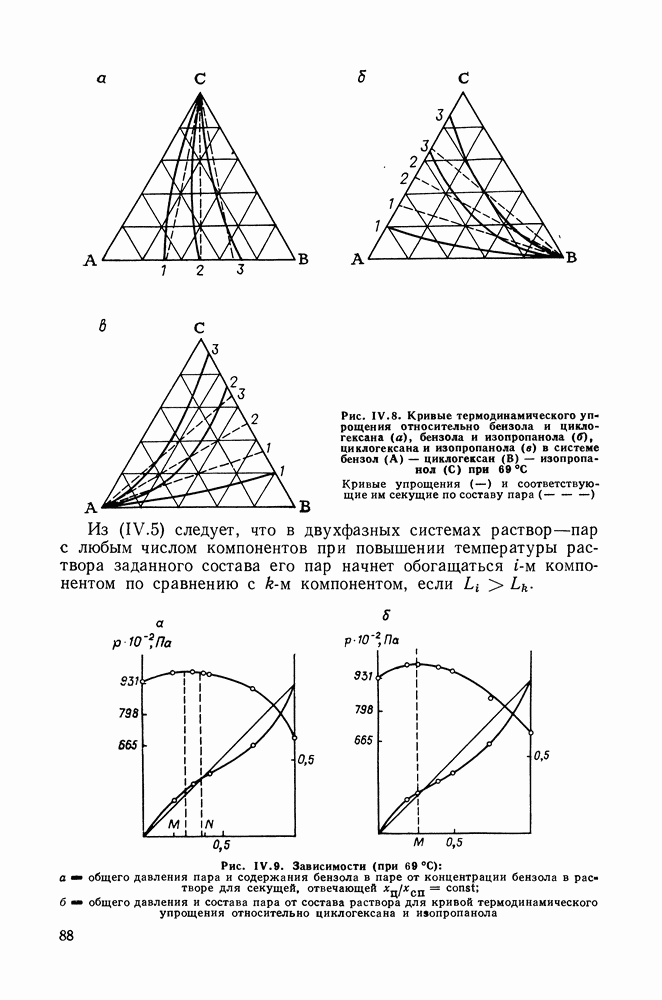
Остановимся еще на одном способе изменения состава раствора — по кривым термодинамического упрощения, понятие о которых было введено Сторонкиным. Кривые упрощения — это линии, при движении по которым химические потенциалы двух компонентов из трех (в случае тройных систем) изменяются на равные величины. На кривых упрощения соотношения закона Коновалова строго выполняются [40, 48, 49]. Кривые термодинамического упрощения интересны тем, что именно при изменении состава по ним тройная система ведет себя подобно бинарной, смесь двух компонентов можно рассматривать как один. Ход кривых упрощения, их отклонение от секущих концентрационного треугольника, дает наглядное представление о степени неидеальности раствора (в случае идеального раствора кривые упрощения будут совпадать с секущими).
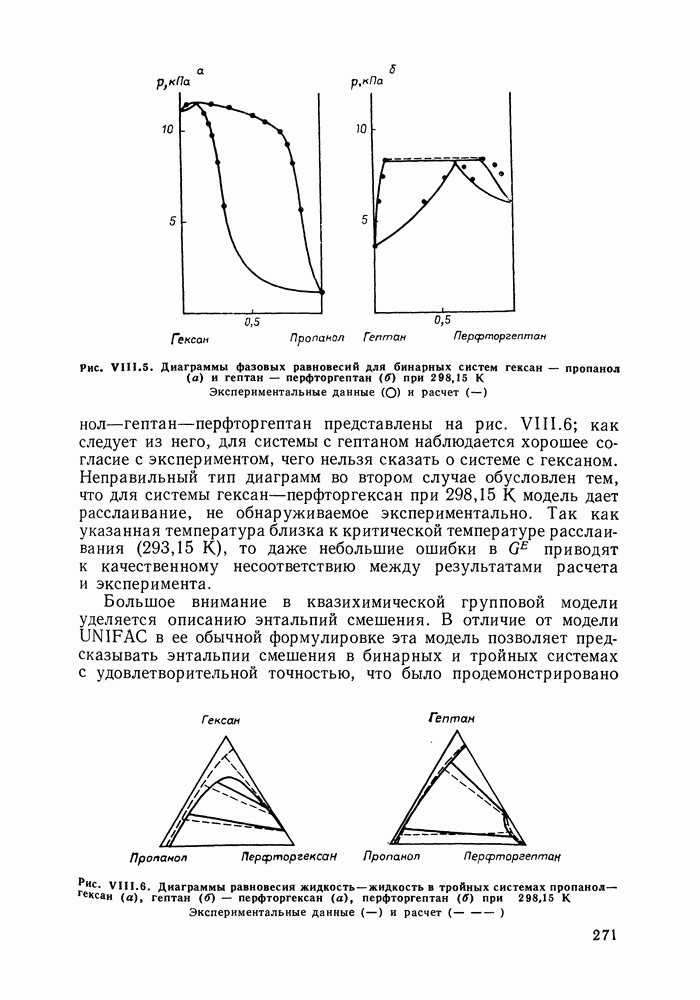
Для иллюстрации сказанного приведены диаграммы на рис. IV.8 и IV.9. На рис. IV.9, а видна область составов, где добавление к раствору бензола, содержание которого в паре больше, чем растворе, приводит к некоторому снижению общего давления. Диаграмма (рис. IV.9, б) вполне подобна диаграммам для двойных систем.
Различными путями можно показать, что закономерности, аналогичные первому закону Вревского, справедливы для двухфазных систем жидкость—пар с любым числом компонентов. Такой вывод следует, по существу, из полученного ранее уравнения (III.35), которое может быть записано для системы с любым числом компонентов:

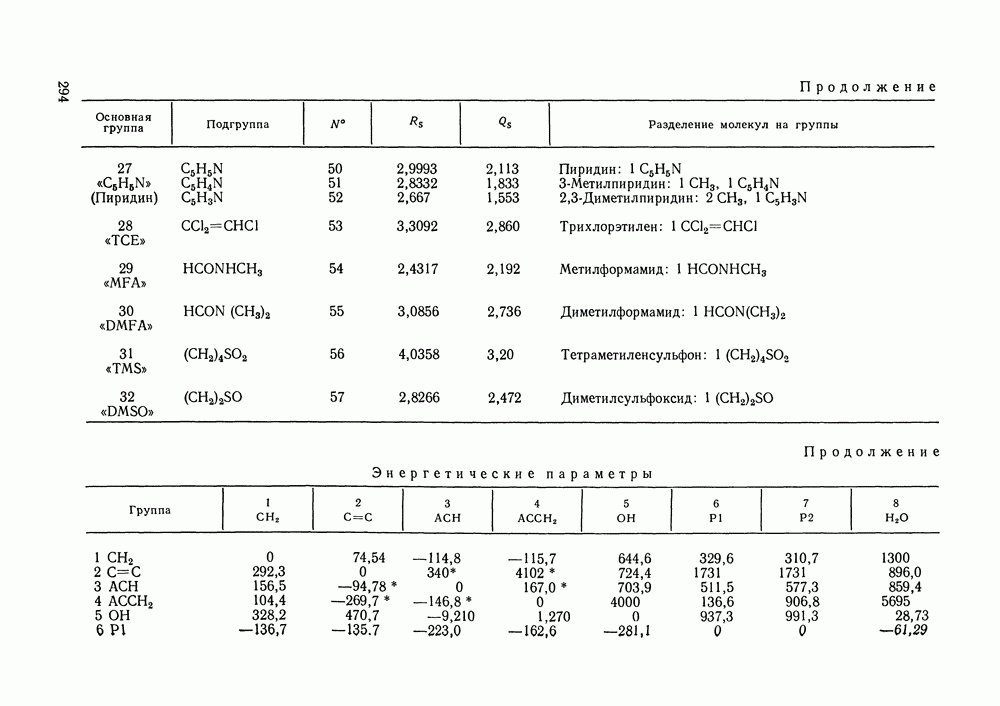
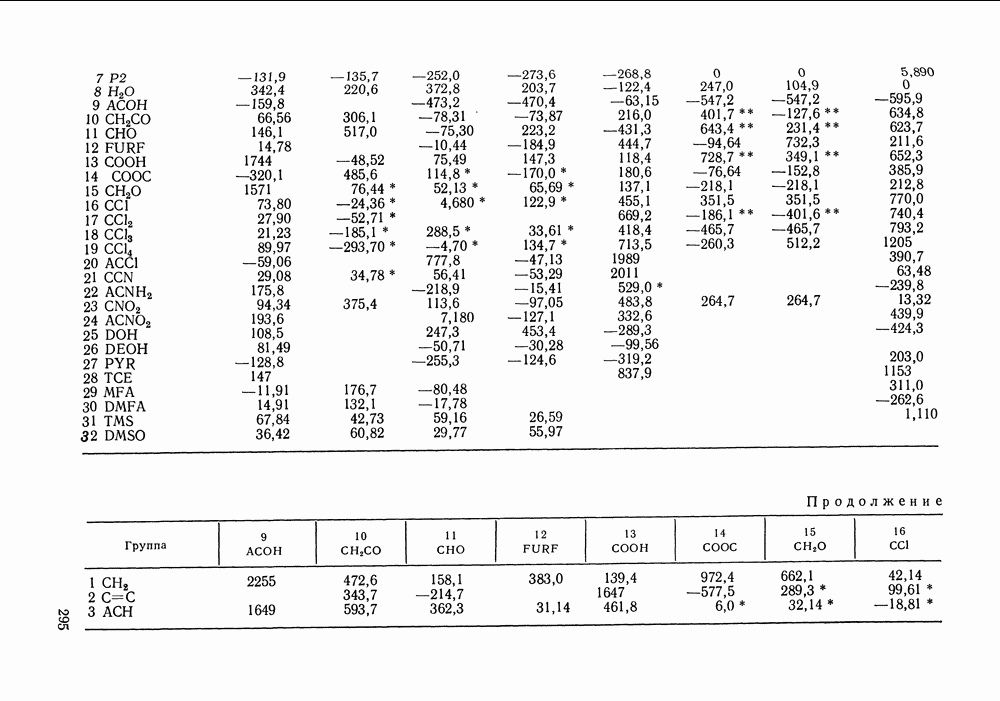
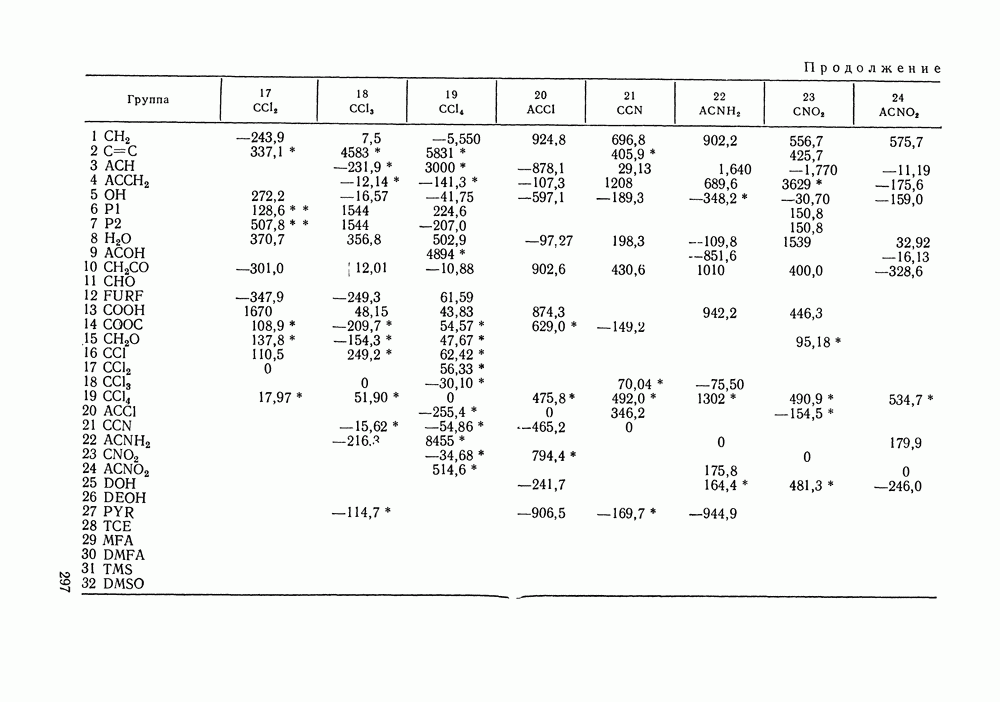
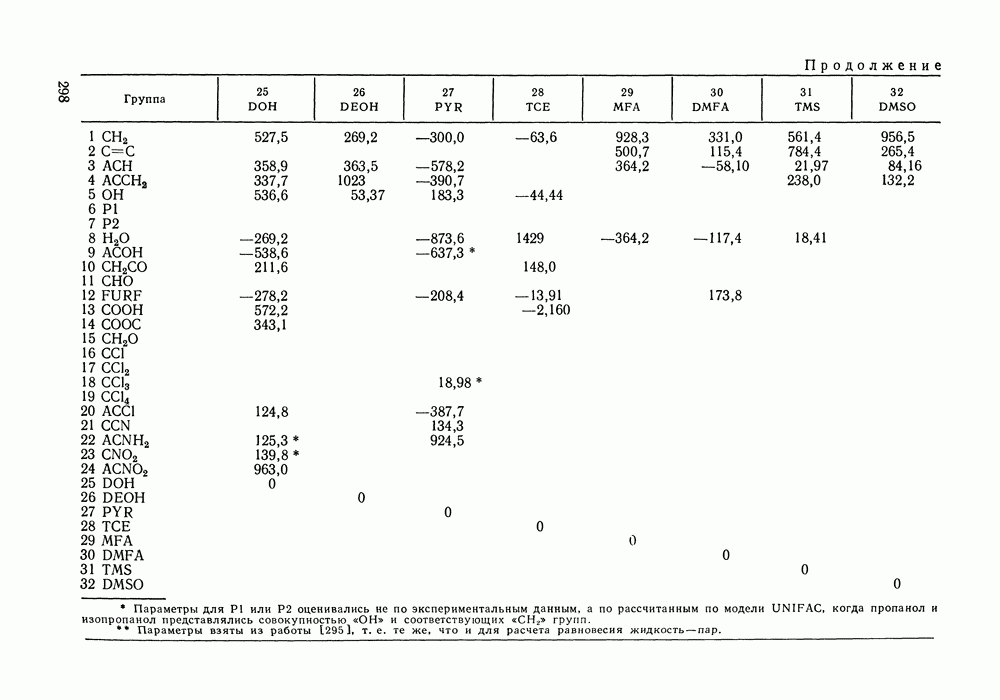
Используя  нетрудно получить соотношение:
нетрудно получить соотношение:

Рис. IV.8. (см. скан) Кривые термодинамического упрощения относительно бензола и циклогексан а  бензола и изопропанола
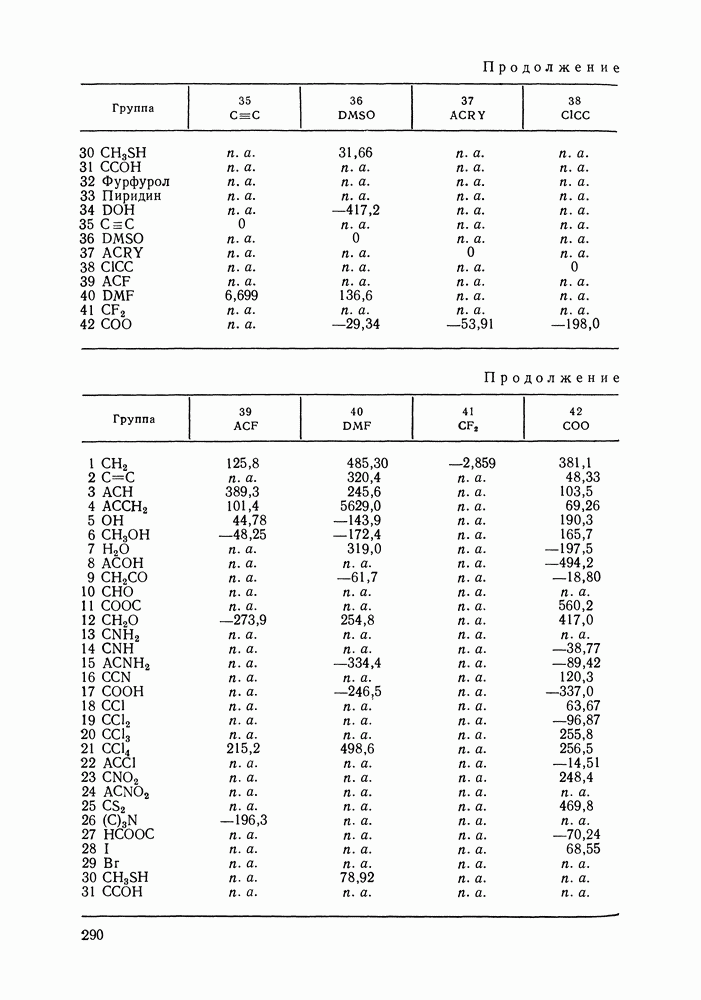
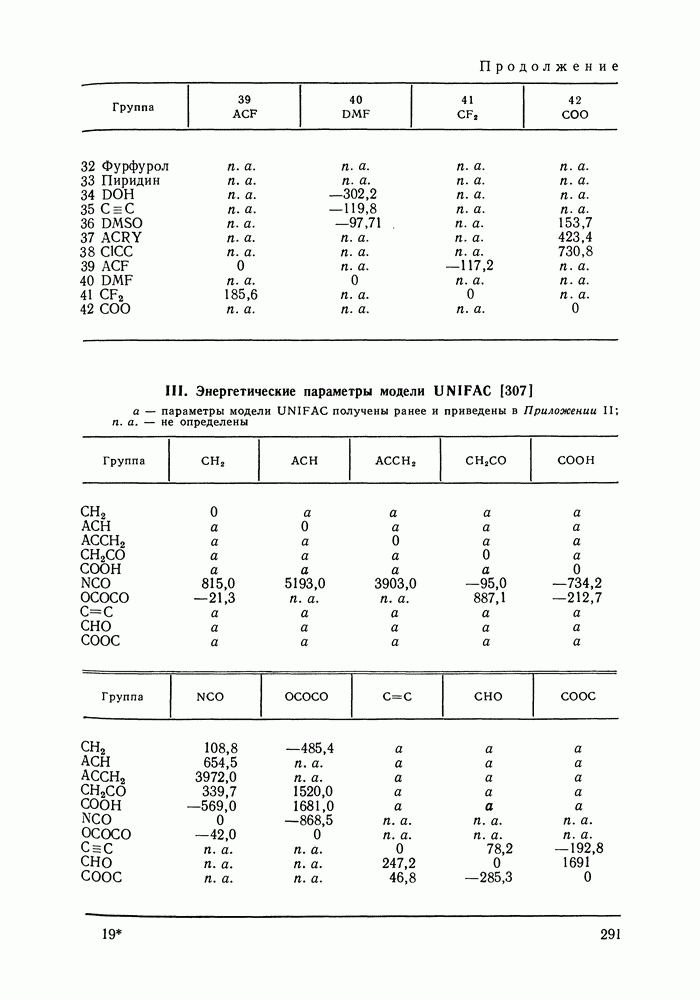
бензола и изопропанола  циклогексана и изопропанола
циклогексана и изопропанола  в системе бензол
в системе бензол  циклогексан
циклогексан  изопропанол
изопропанол  при
при  Кривые упрощения
Кривые упрощения  и соответствующие им секущие по составу пара
и соответствующие им секущие по составу пара 
Из  следует, что в двухфазных системах раствор—пар с любым числом компонентов при повышении температуры раствора заданного состава его пар начнет обогащаться
следует, что в двухфазных системах раствор—пар с любым числом компонентов при повышении температуры раствора заданного состава его пар начнет обогащаться  компонентом по сравнению с
компонентом по сравнению с  компонентом, если
компонентом, если 

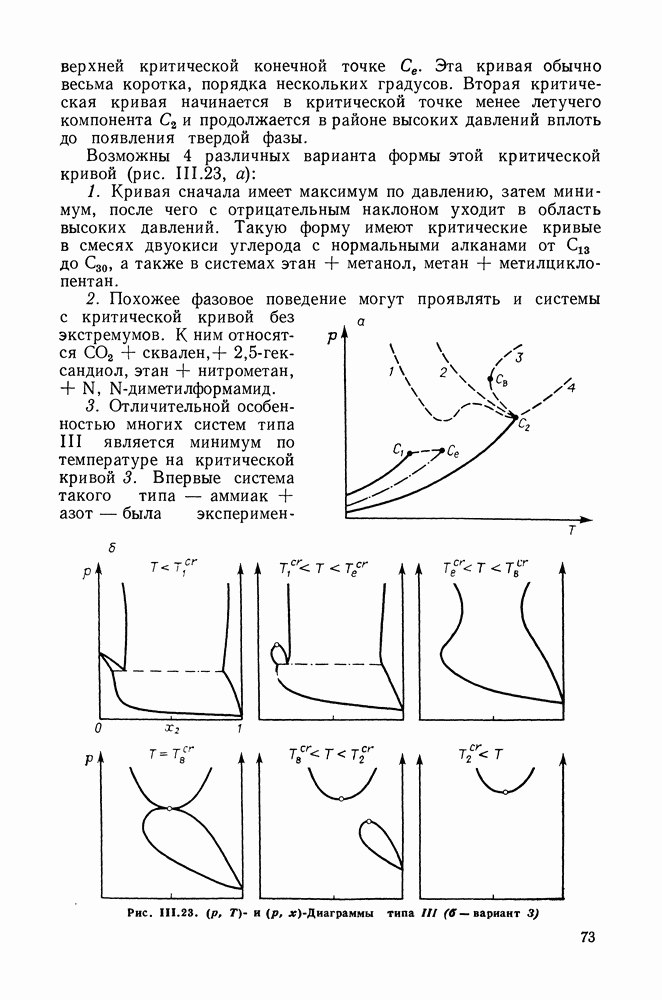
Рис. IV.9. Зависимости (при  общего давления пара и содержания бензола в паре от концентрации бензола в растворе для секущей, отвечающей
общего давления пара и содержания бензола в паре от концентрации бензола в растворе для секущей, отвечающей  общего давления и состава пара от состава раствора для кривой термодинамического упрощения относительно циклогексана и изопропанола
общего давления и состава пара от состава раствора для кривой термодинамического упрощения относительно циклогексана и изопропанола

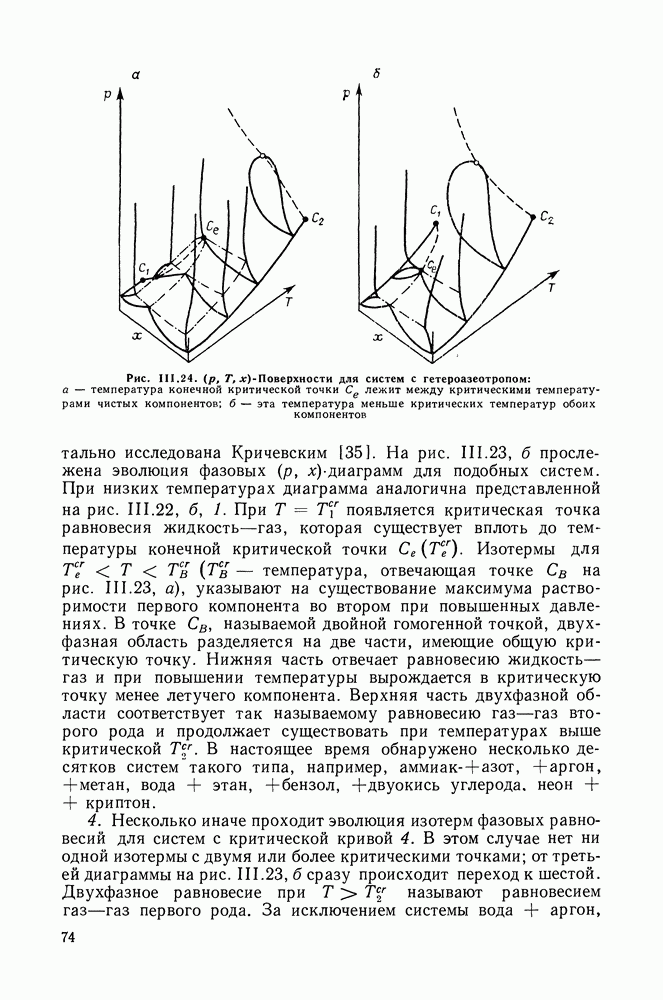
Рис. IV. 10. Смещение состава тройного азеотропа в системе бензол—циклогексан—изопропанол  равные 30,3;
равные 30,3;  парциальные молярные теплоты испарения компонентов из азеотропа;
парциальные молярные теплоты испарения компонентов из азеотропа; 
В разд. III.4 мы уже приводили формулу (III.37), из которой следует, что повышение температуры многокомпонентного раствора заданного состава сопровождается обогащением равновесного пара теми компонентами, для которых парциальная молярная теплота испарения больше дифференциальной молярной теплоты испарения раствора.
Можно показать, что первый закон Вревского применим и в случае трехфазных равновесий жидкость—жидкость—пар в тройных и многокомпонентных системах [511. Будет справедливо соотношение

где  означает постоянство общего состава расслаивающегося раствора;
означает постоянство общего состава расслаивающегося раствора;  парциальная молярная теплота испарения
парциальная молярная теплота испарения  компонента из расслаивающегося раствора.
компонента из расслаивающегося раствора.
Для тройных расслаивающихся растворов

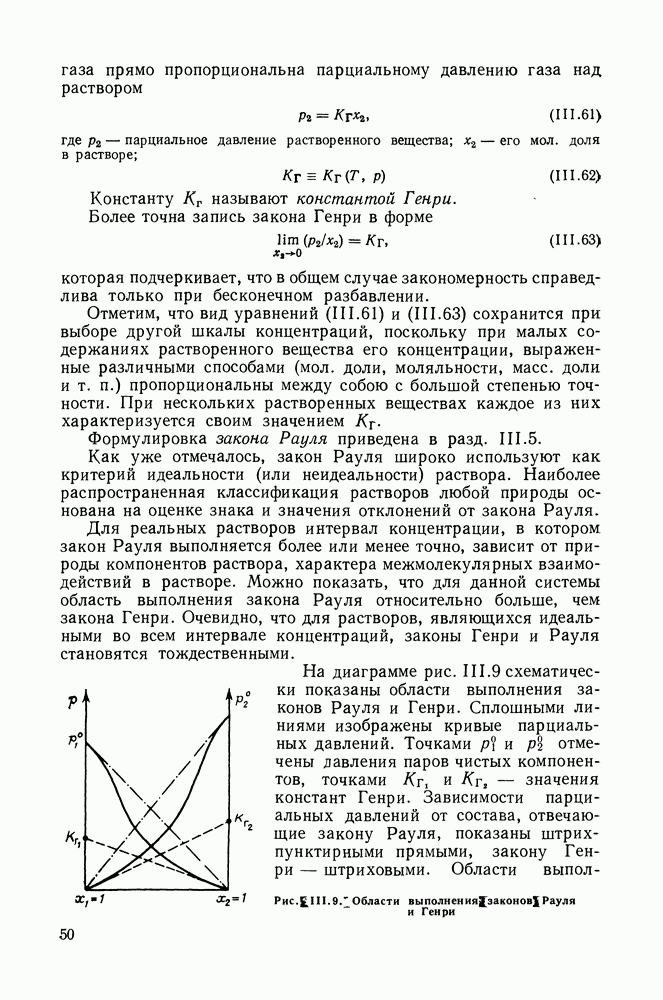
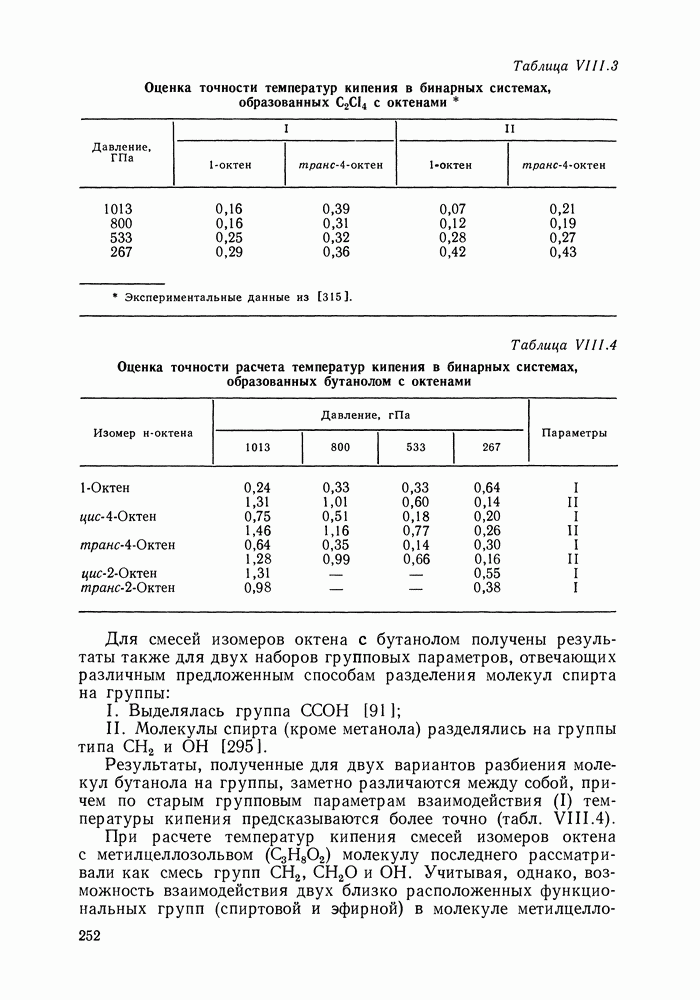
Если первый закон Вревского применим к двойным и многокомпонентным системам по существу в одинаковой формулировке, то иное положение со вторым законом, определяющим влияние - изменений температуры на смещение состава азеотропных смесей. Оказалось, что направление смещения состава тройного азеотропа не определяется полностью значениями парциальных теплот испарения компонентов [52]. Аналогичный вывод справедлив и для тройных гетероазеотропных систем [53].
Для примера на рис. IV. 10 приведены экспериментальные данные о смещении состава тройного азеотропа в системе бензол—циклогексан—изопропанол. Теплоты испарения бензола и циклогексана очень близки между собою, однако, если при повышении температуры содержание бензола в составе азеотропа резко уменьшается, то содержание циклогексана вначале несколько уменьшается, проходит через минимальное значение и медленно
увеличивается. Рис. IV. 10 также показывает, что направления смещения состава азеотропа (левая линия) и состава пара раствора постоянного состава  значительно различаются.
значительно различаются.
Уравнения, определяющие смещение состава тройных азеотропов, полученные в работах [52, 53], были применены авторами для количественных расчетов, с хорошим результатом. Такие расчеты возможны, если есть данные о парциальных теплотах испарения компонентов и данные о равновесии жидкость—пар, или изобарные, или изотермические.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА
- Глава I. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕРМОДИНАМИКИ ГЕТЕРОГЕННЫХ РАВНОВЕСИЙ
- 1.2. УСЛОВИЯ РАВНОВЕСИЯ ГЕТЕРОГЕННЫХ СИСТЕМ
- 1.3. ТИПЫ РАВНОВЕСИЙ
- 1.4. УСЛОВИЯ УСТОЙЧИВОСТИ
- 1.5. ПРАВИЛО ФАЗ
- Глава II. ОДНОКОМПОНЕНТНЫЕ СИСТЕМЫ
- II.1. ДИАГРАММЫ СОСТОЯНИЯ
- II.2. УРАВНЕНИЕ КЛАУЗИУСА—КЛАПЕЙРОНА
- II.3. ЗАВИСИМОСТЬ ДАВЛЕНИЯ ОТ ТЕМПЕРАТУРЫ. УРАВНЕНИЕ АНТУАНА
- II.4. ЗАКОН СООТВЕТСТВЕННЫХ СОСТОЯНИЙ
- II.5. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА. ДРУГИЕ АНАЛИТИЧЕСКИЕ УРАВНЕНИЯ СОСТОЯНИЯ
- II.6. ВИРИАЛЬНОЕ УРАВНЕНИЕ СОСТОЯНИЯ
- Глава III. ДВОЙНЫЕ СИСТЕМЫ
- III.1. ДИАГРАММЫ РАВНОВЕСИЯ ДЛЯ ДВОЙНЫХ СИСТЕМ
- III.2. ОБОБЩЕННОЕ ДИФФЕРЕНЦИАЛЬНОЕ УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- III.3. ЗАКОНЫ КОНОВАЛОВА
- III.4. ЗАКОНЫ ВРЕВСКОГО
- III.5. ИДЕАЛЬНЫЕ СИСТЕМЫ
- III.6. РАЗБАВЛЕННЫЕ РАСТВОРЫ
- III.7 РЕАЛЬНЫЕ СИСТЕМЫ
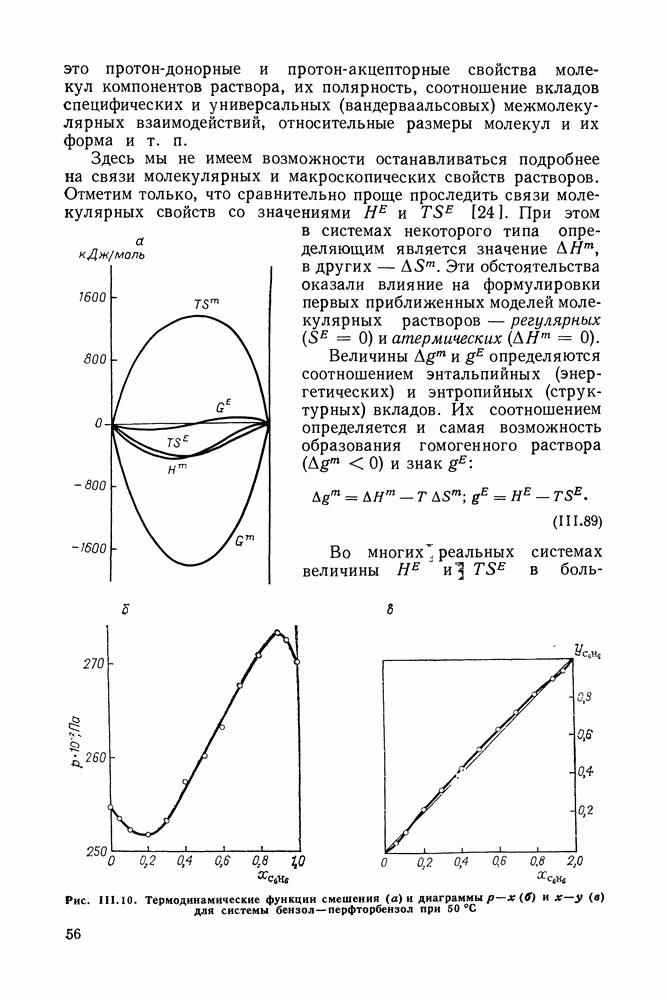
- III.8. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СМЕШЕНИЯ И РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР
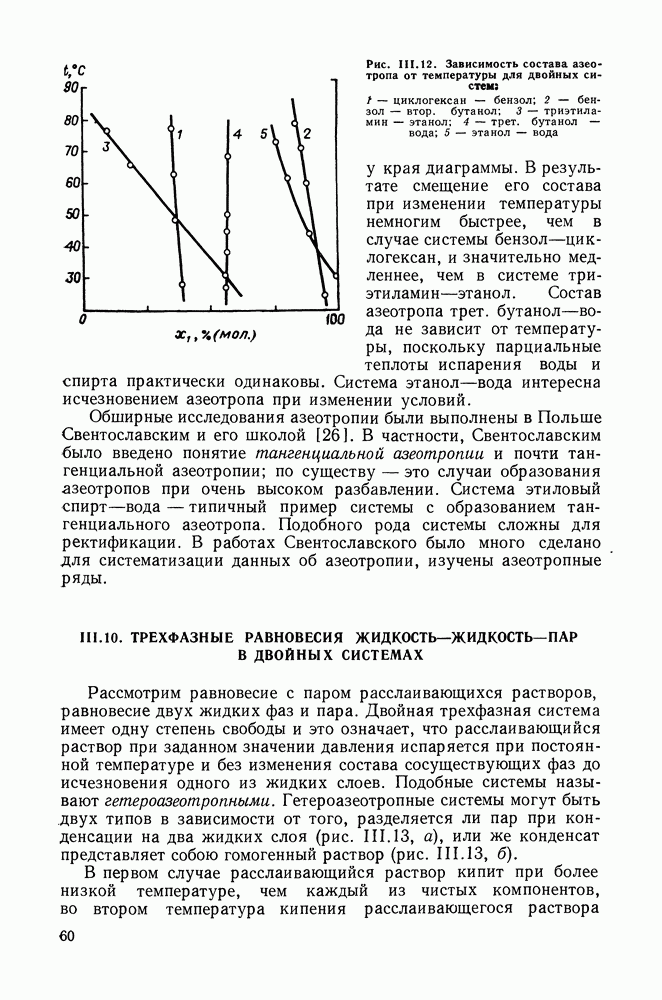
- III.9. ОБ АЗЕОТРОПИИ В БИНАРНЫХ СИСТЕМАХ
- III.10. ТРЕХФАЗНЫЕ РАВНОВЕСИЯ ЖИДКОСТЬ—ЖИДКОСТЬ—ПАР В ДВОЙНЫХ СИСТЕМАХ
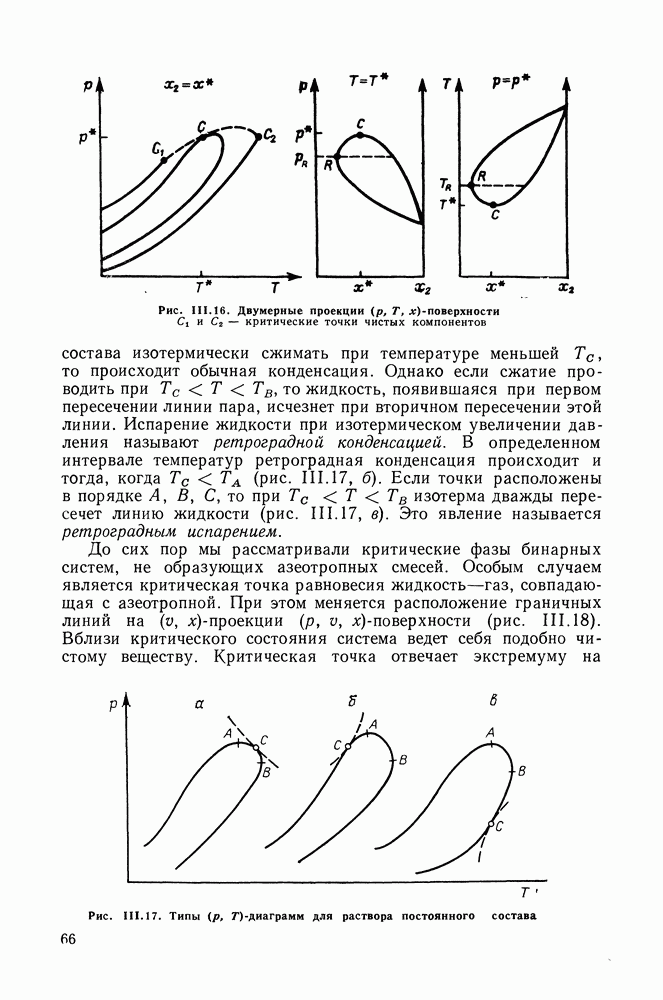
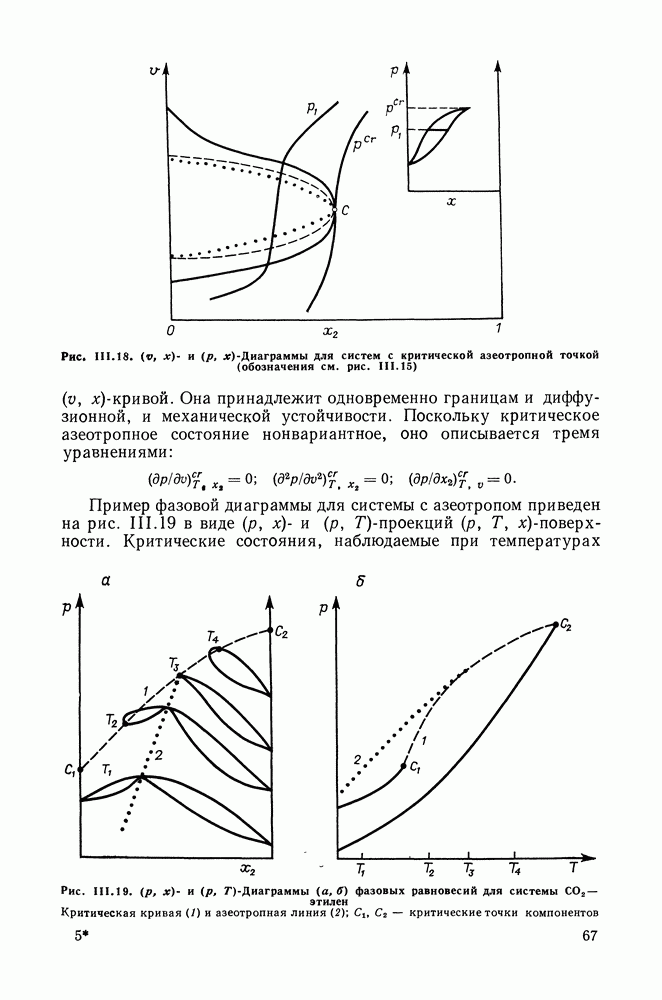
- III.11. ФАЗОВЫЕ ДИАГРАММЫ БИНАРНЫХ СИСТЕМ В ШИРОКОМ ИНТЕРВАЛЕ ТЕМПЕРАТУР И ДАВЛЕНИЙ
- Глава IV. ТРОЙНЫЕ И МНОГОКОМПОНЕНТНЫЕ СИСТЕМЫ
- IV.2. ПРОЯВЛЕНИЕ ЗАКОНОВ КОНОВАЛОВА И ВРЕВСКОГО В ТРОЙНЫХ И МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ
- IV.3. ОТКРЫТЫЕ ФАЗОВЫЕ ПРОЦЕССЫ. ТЕРМОДИНАМИКО-ТОПОЛОГИЧЕСКИЕ ЗАКОНОМЕРНОСТИ
- Глава V. МЕТОДЫ ЭКСПЕРИМЕНТАЛЬНОГО ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР
- V.I. ЦИРКУЛЯЦИОННЫЙ МЕТОД
- V.2. МЕТОД ОТКРЫТОГО ИСПАРЕНИЯ
- V.3. МЕТОД СТРУИ ИНЕРТНОГО ГАЗА
- V.4. СТАТИЧЕСКИЙ МЕТОД
- V.5. ИЗОПИЕСТИЧЕСКИЙ МЕТОД
- V.6. ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
- V.7. РАСЧЕТ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР ПО ЗАВИСИМОСТИ ДАВЛЕНИЯ ПАРА ОТ СОСТАВА РАСТВОРА ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ
- V.8. МЕТОДЫ ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР С ПОМОЩЬЮ ГАЗОВОЙ ХРОМАТОГРАФИИ
- V.9. РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР ДЛЯ РАЗБАВЛЕННЫХ РАСТВОРОВ
- Глава VI. МЕТОДЫ ПРОВЕРКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ-ПАР
- VI.2. ОБЩАЯ ОЦЕНКА ТЕРМОДИНАМИЧЕСКИХ МЕТОДОВ ПРОВЕРКИ И ИСПРАВЛЕНИЯ ДАННЫХ
- VI.3. ПРОВЕРКА ДАННЫХ С ПОМОЩЬЮ УРАВНЕНИЙ ГИББСА—ДЮГЕМА И ДЮГЕМА—МАРГУЛЕСА
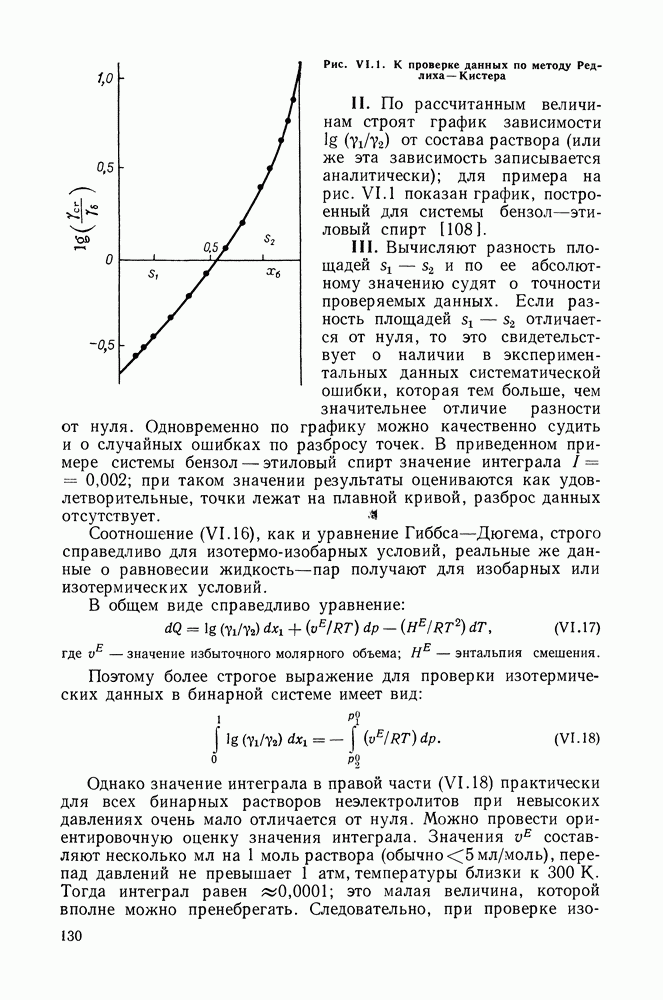
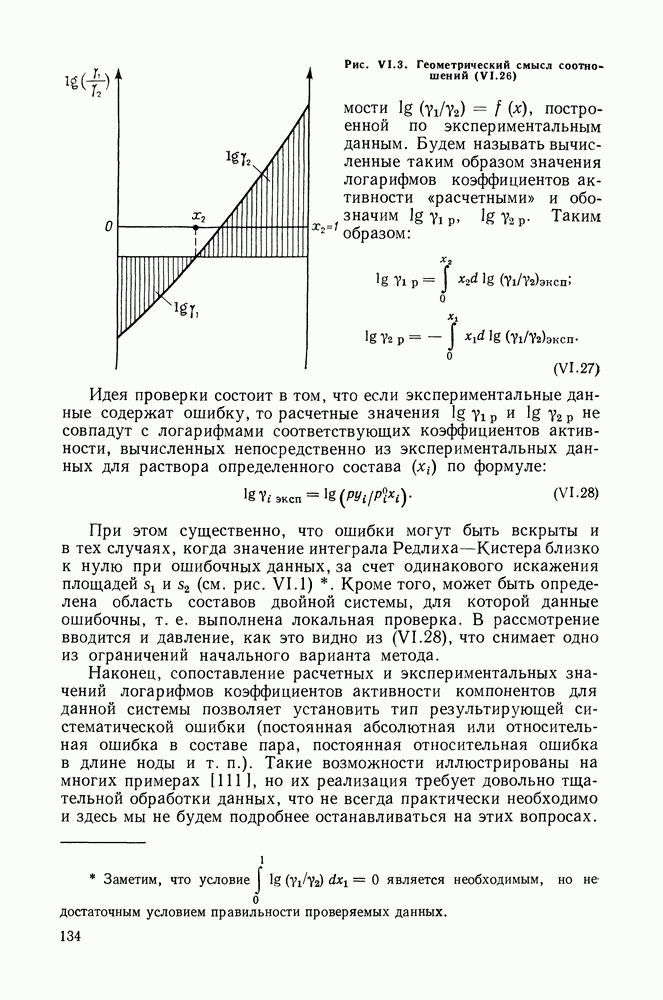
- VI.4. МЕТОД РЕДЛИХА—КИСТЕРА
- VI.5. МЕТОД ВАН-НЕССА
- VI.6. СТАТИСТИЧЕСКИЕ МЕТОДЫ ОБРАБОТКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР
- VI.7. МЕТОДЫ ПРОВЕРКИ ТЕРМОДИНАМИЧЕСКОЙ СОГЛАСОВАННОСТИ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР В ТРОЙНЫХ СИСТЕМАХ
- VI.8. СОПОСТАВЛЕНИЕ МЕТОДОВ РЕДЛИХА—КИСТЕРА И ВАН-НЕССА
- Глава VII. МЕТОДЫ РАСЧЕТА РАВНОВЕСИЙ ЖИДКОСТЬ—ПАР
- VII. 1. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ РАВНОВЕСНЫХ ЖИДКОСТИ И ПАРА
- VII.2. АЛГОРИТМЫ РАСЧЕТА ФАЗОВЫХ РАВНОВЕСИЙ
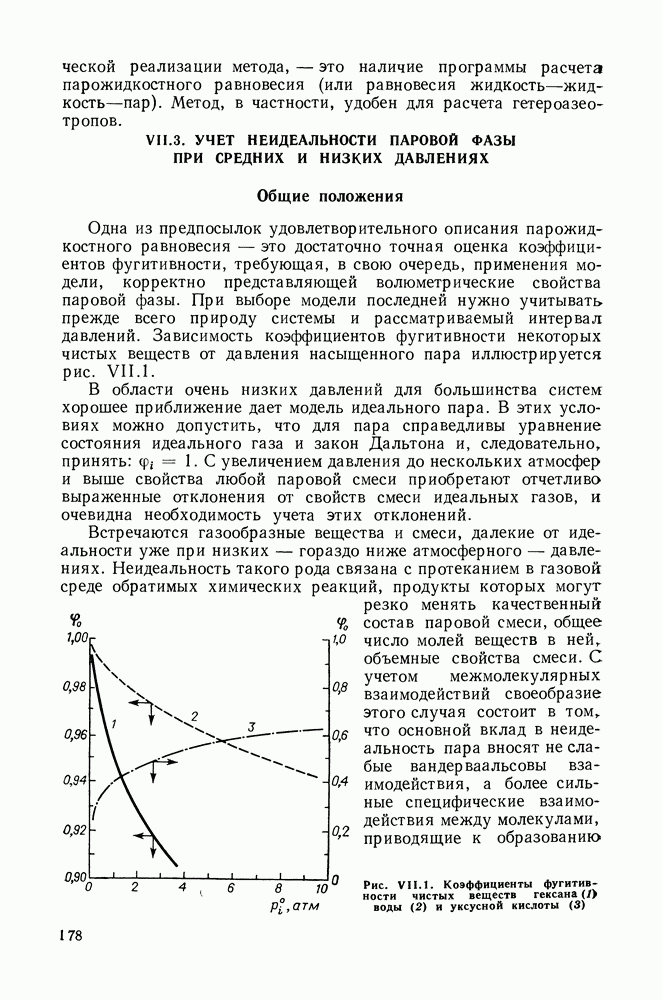
- VII.3. УЧЕТ НЕИДЕАЛЬНОСТИ ПАРОВОЙ ФАЗЫ ПРИ СРЕДНИХ И НИЗКИХ ДАВЛЕНИЯХ
- VII.4. ПОЛИНОМИАЛЬНЫЕ УРАВНЕНИЯ ДЛЯ КОЭФФИЦИЕНТОВ АКТИВНОСТИ И УРАВНЕНИЕ ВАН-ЛААРА
- VII.5. МОДЕЛИ ЛОКАЛЬНОГО СОСТАВА
- VII.6. ОЦЕНКА ПАРАМЕТРОВ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ
- VII.7. СОПОСТАВЛЕНИЕ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ ПРИ ОПИСАНИИ ФАЗОВЫХ РАВНОВЕСИЙ
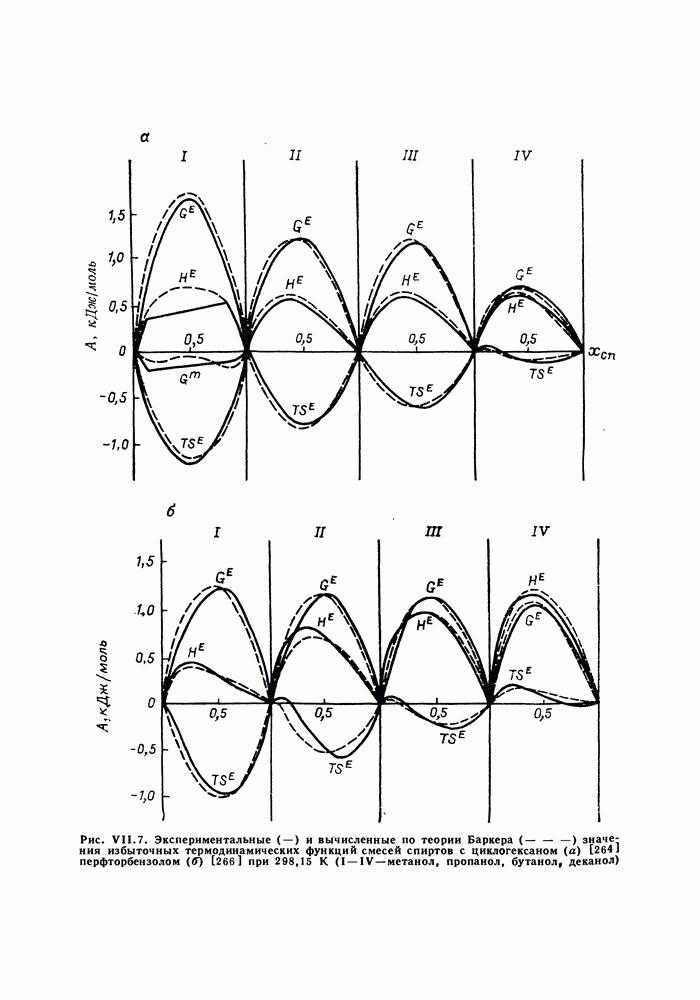
- VII.8. РЕШЕТОЧНЫЕ МОДЕЛИ. МОДЕЛЬ БАРКЕРА
- Глава VIII. ГРУППОВЫЕ МОДЕЛИ РАСТВОРОВ
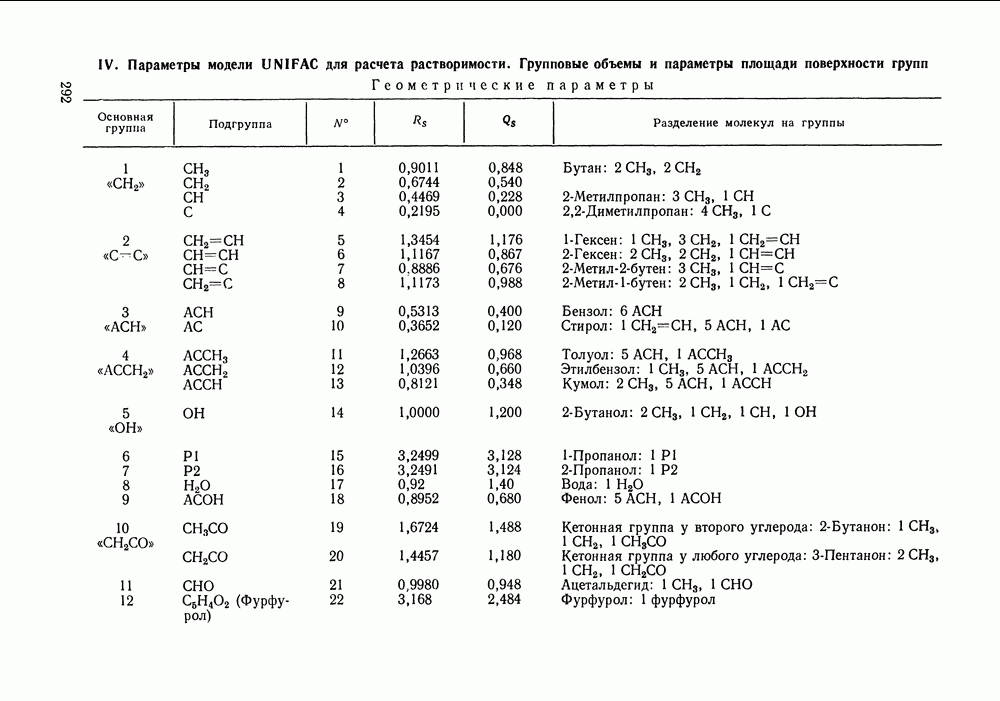
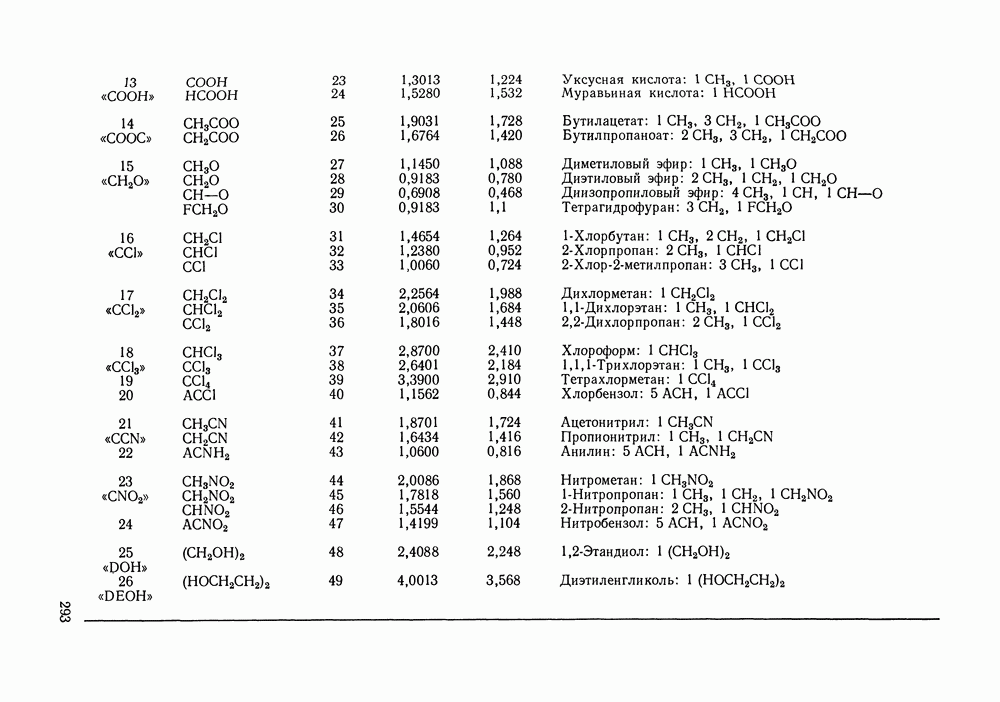
- VIII.1. ОСНОВНЫЕ ОСОБЕННОСТИ ГРУППОВЫХ МОДЕЛЕЙ РАСТВОРОВ
- VIII.2. МОДЕЛЬ UNIFAC
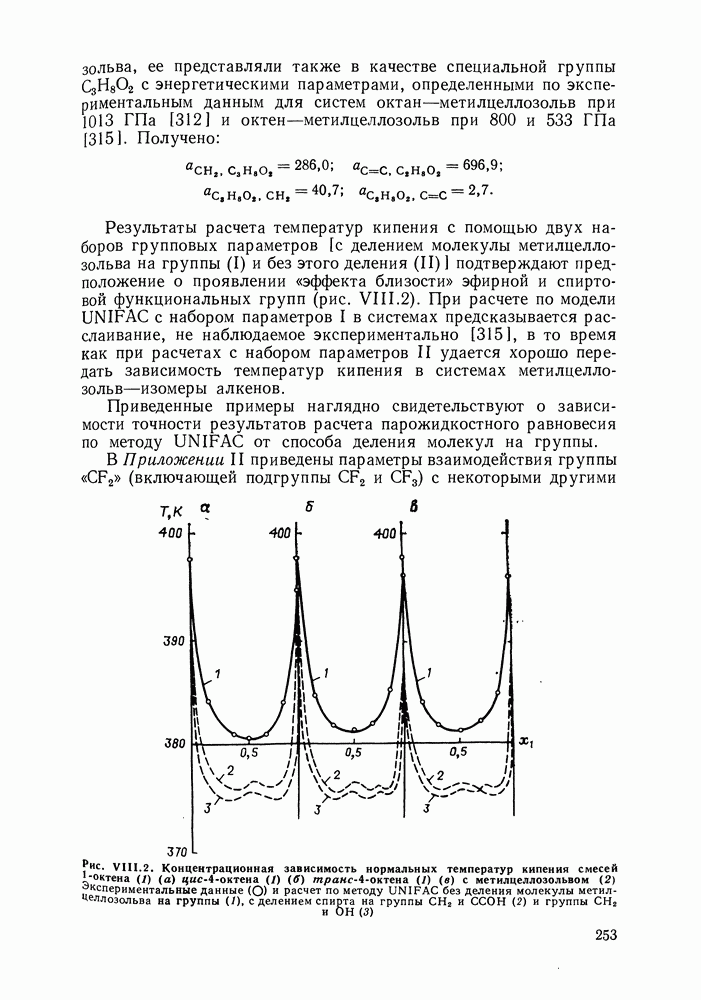
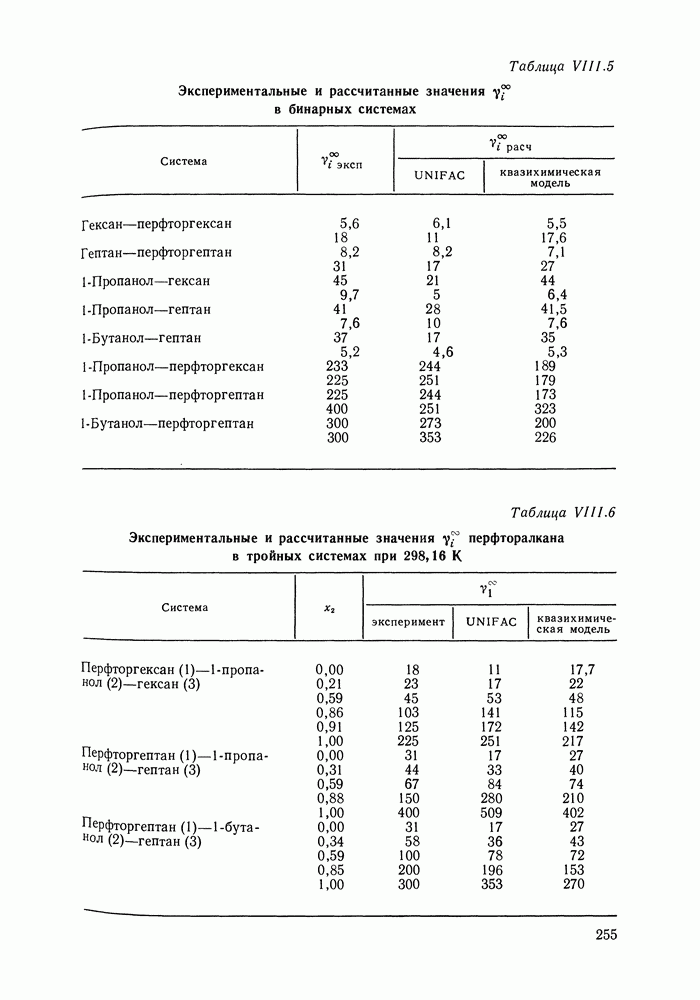
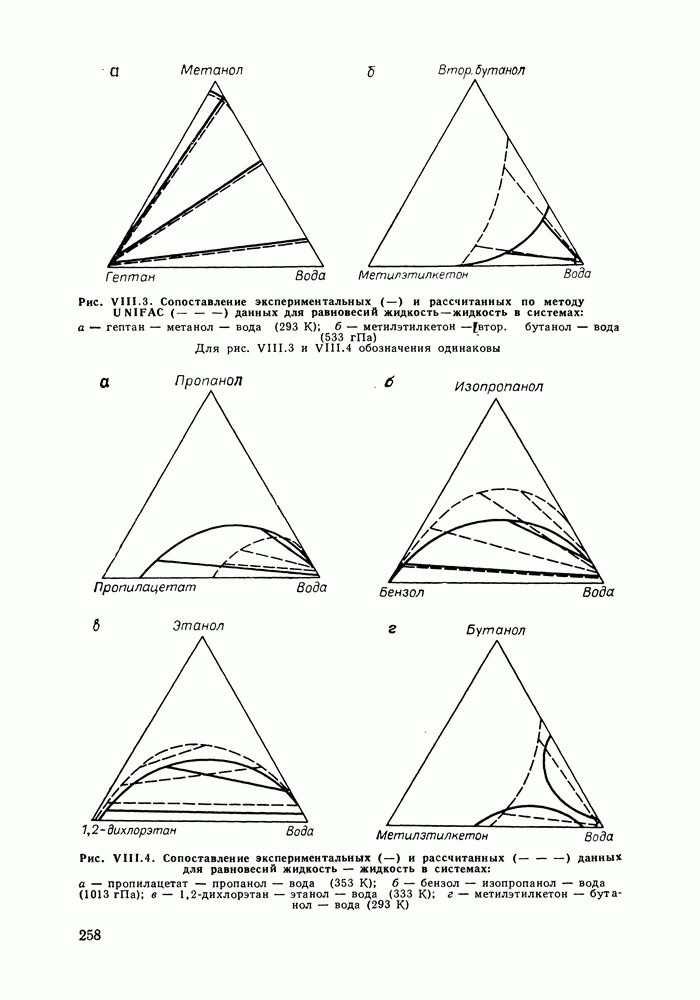
- VIII.3. КВАЗИХИМИЧЕСКИЕ ГРУППОВЫЕ МОДЕЛИ
- Глава IX. ДЫРОЧНАЯ РЕШЕТОЧНАЯ КВАЗИХИМИЧЕСКАЯ МОДЕЛЬ, ЕЕ ГРУППОВОЙ ВАРИАНТ
- IX.2. ФОРМУЛИРОВКА ДЫРОЧНОЙ КВАЗИХИМИЧЕСКОЙ МОДЕЛИ
- IX.3. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СИСТЕМЫ
- IX.4. О МЕТОДИКЕ РАСЧЕТА
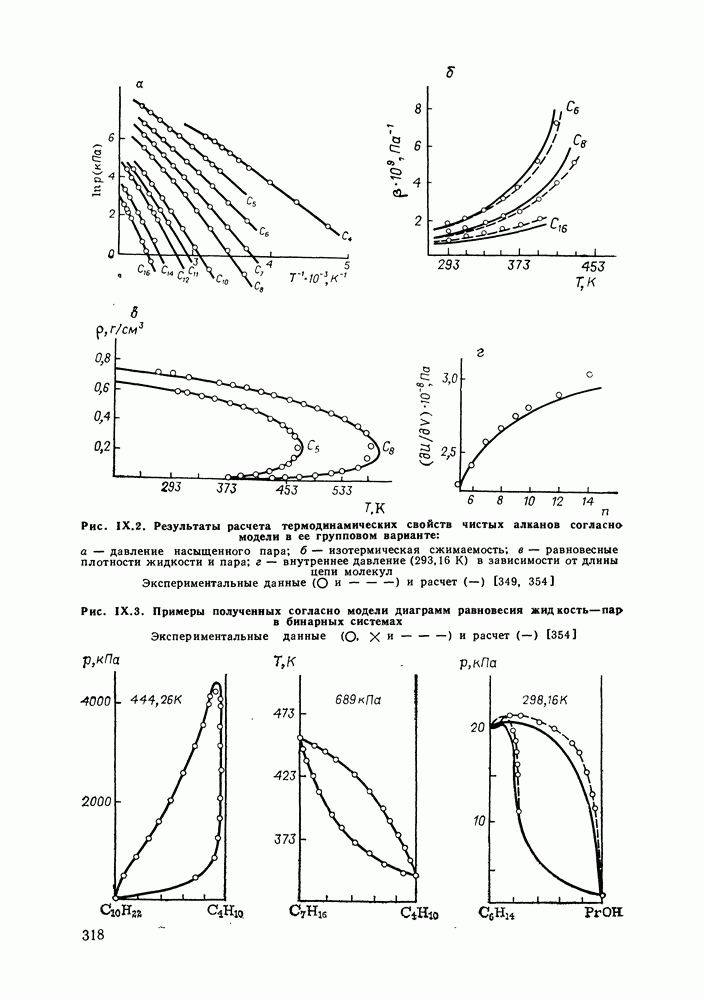
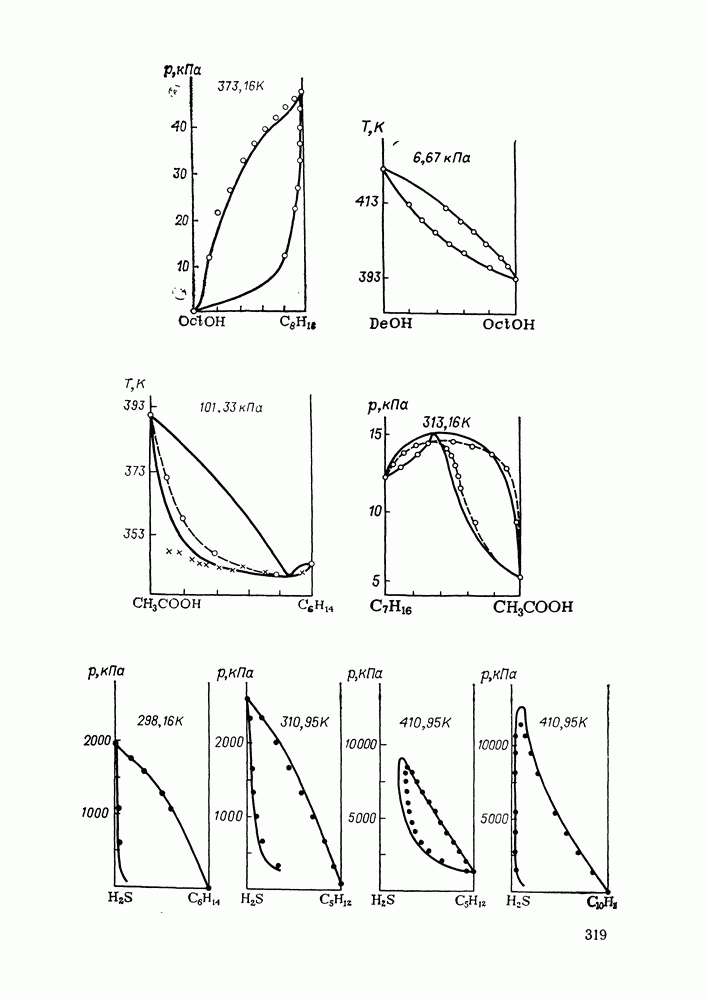
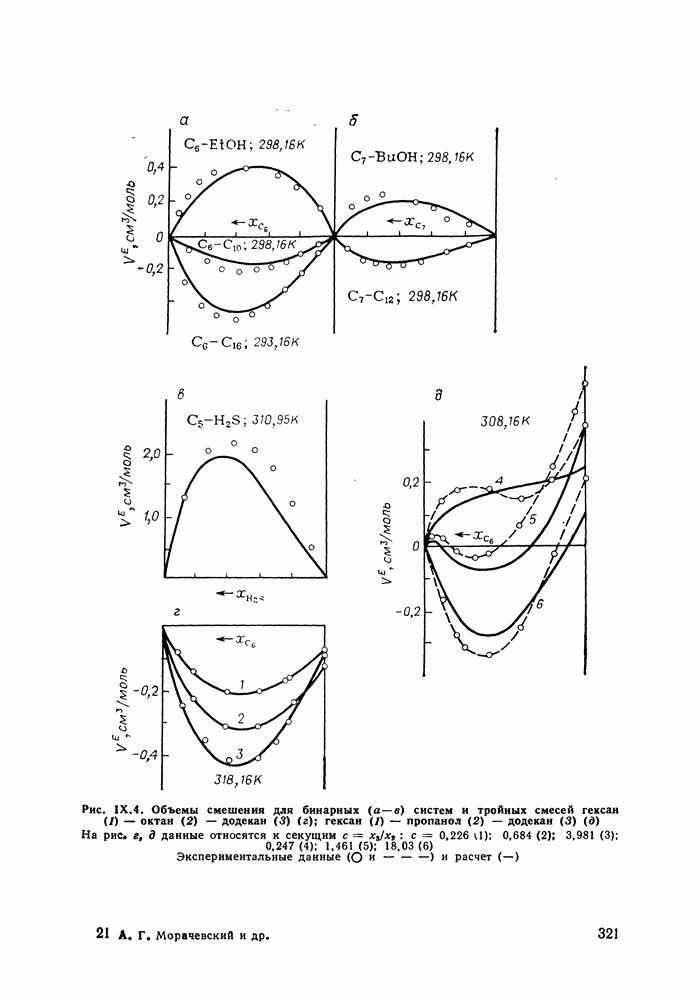
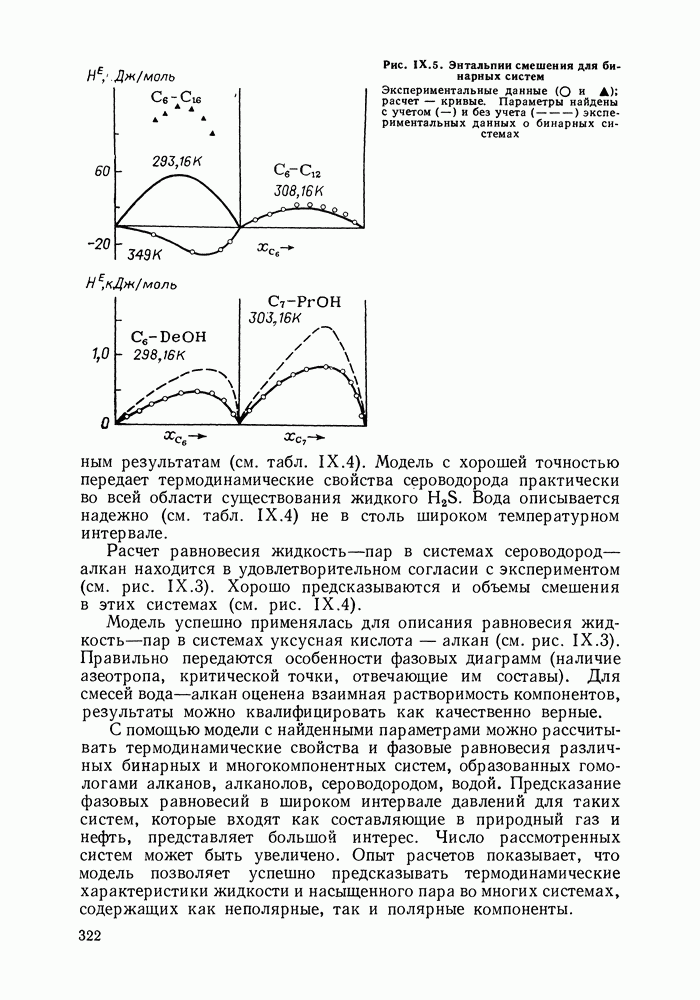
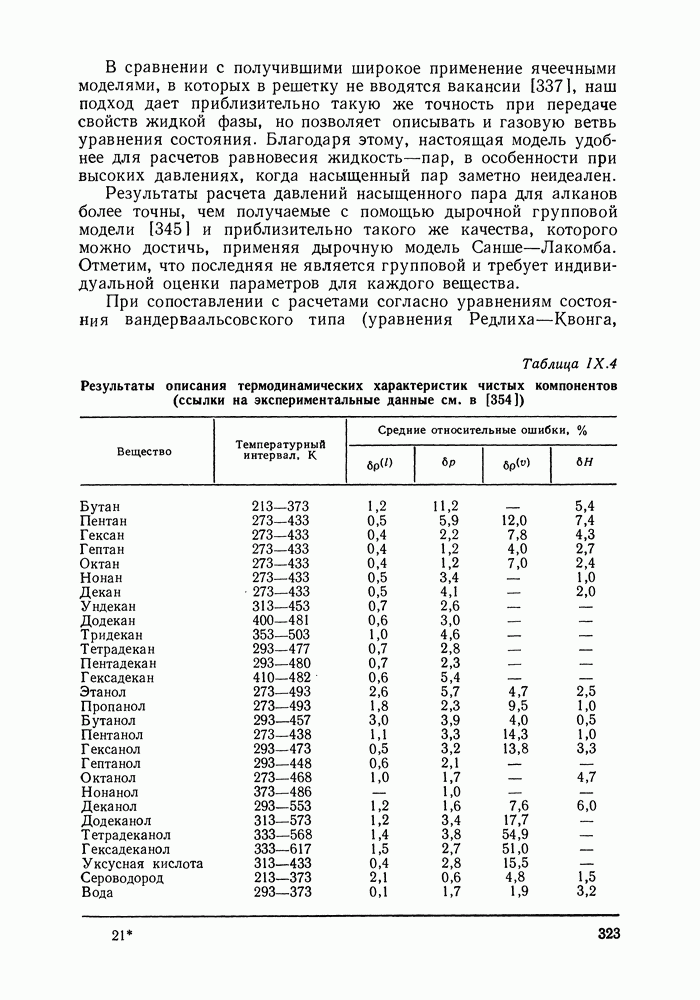
- IX.5. РЕЗУЛЬТАТЫ РАСЧЕТОВ И ВОЗМОЖНОСТИ МОДЕЛИ
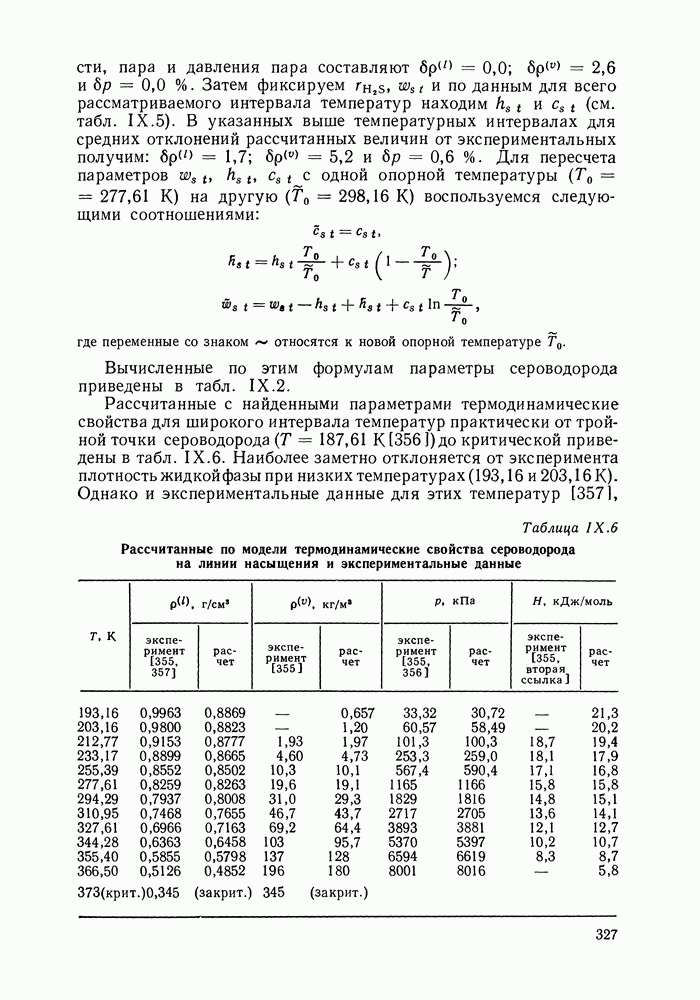
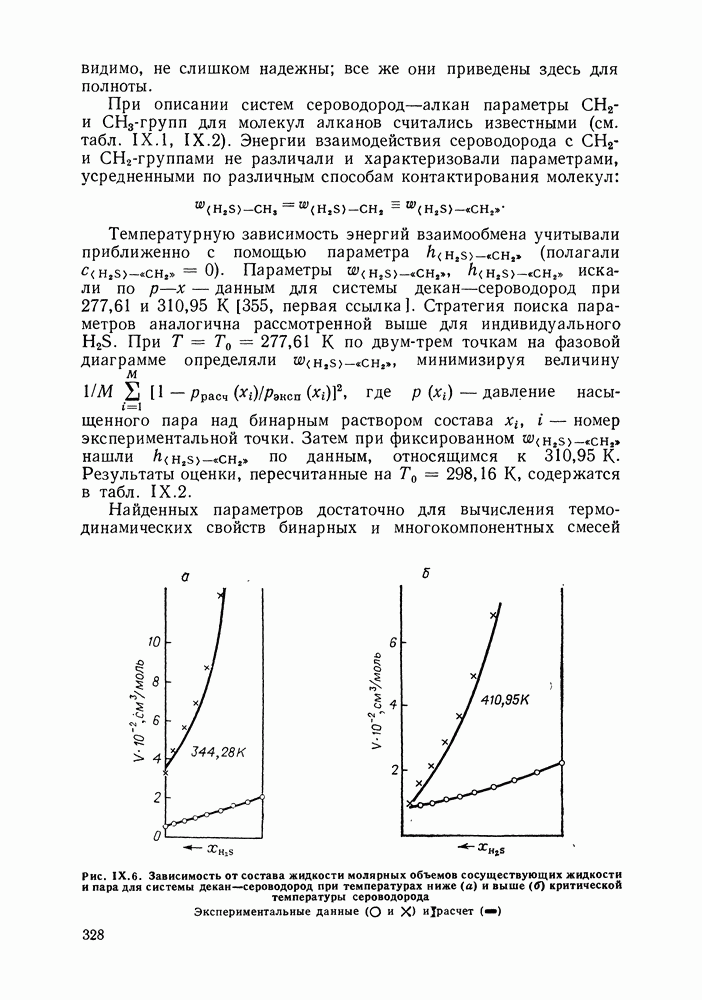
- IX.6. ПРИМЕРЫ РАСЧЕТА