| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
Глава VIII. ГРУППОВЫЕ МОДЕЛИ РАСТВОРОВ
VIII.1. ОСНОВНЫЕ ОСОБЕННОСТИ ГРУППОВЫХ МОДЕЛЕЙ РАСТВОРОВ
В последние годы наибольшее развитие получили приближенные модели растворов, известные под названием групповых. Общая черта этих моделей — представление молекул в виде совокупностей некоторых химических групп, которые, как предполагается, дают аддитивные вклады в свойства системы. Эта идея была впервые высказана Лэнгмюром [2841 еще в 20-е гг. для интерпретации свойств жидких систем. Однако только в 60— 70-е гг. начался новый этап в развитии группового подхода, обусловленный общим подъемом интереса к молекулярным моделям растворов и методам расчета фазовых равновесий, а также накоплением большого числа экспериментальных данных по фазовым равновесиям и термодинамическим свойствам растворов. Основные направления развития групповых моделей охарактеризованы в [145; 297].
Особый интерес к групповым моделям оказался вполне закономерным и был вызван практическими потребностями описания и предсказания фазовых равновесий и термодинамических свойств растворов. Привлекательность групповых моделей состоит в том, что свойства огромного многообразия органических соединений удается определить через ограниченное число параметров, характеризующих вклады отдельных групп. При групповом описании существенно уменьшается число типов пар, для которых надо знать энергетические характеристики взаимодействия, чтобы рассчитать термодинамические функции раствора. Допущение о постоянстве вкладов групп независимо от природы других групп в молекуле, сделанное на феноменологическом уровне, является достаточно грубым. Неточность групповых моделей корректируется путем подгонки их параметров, определяющих взаимодействие между парами групп в системе.
При выборе групп учитывается ряд обстоятельств. Прежде всего, деление на группы не должно быть слишком индивидуальным, чтобы не утерять основную привлекательность группового подхода, позволяющего оценивать свойства большого числа растворов на основании данных для небольшого числа структурных единиц. С другой стороны, слишком грубое деление, не учитывающее взаимное влияние близкорасположенных полярных групп, заведомо приводит к искаженным результатам, так как в этом случае нарушается исходное предположение модели об аддитивности вкладов групп.
Групповые модели растворов базируются на предположенной Вильсоном и Дилом [235] связи коэффициентов активности компонентов с групповыми характеристиками раствора. Логарифм коэффициента активности (избыточный химический потенциал  компонента представляется в виде двух составляющих — комбинаторного вклада, обусловленного различиями в размерах молекул, и остаточного, связанного с различиями в энергетике межгрупповых взаимодействий:
компонента представляется в виде двух составляющих — комбинаторного вклада, обусловленного различиями в размерах молекул, и остаточного, связанного с различиями в энергетике межгрупповых взаимодействий:

Комбинаторная составляющая  может быть передана формулами, предложенными в теории растворов для учета связей между коэффициентом активности компонента и геометрией молекул, в частности, формулами атермического раствора Флори — Хаггинса [212] или Гуггенгейма-Ставермана [218]. Так, в работе [235] используется приближение Флори — Хаггинса:
может быть передана формулами, предложенными в теории растворов для учета связей между коэффициентом активности компонента и геометрией молекул, в частности, формулами атермического раствора Флори — Хаггинса [212] или Гуггенгейма-Ставермана [218]. Так, в работе [235] используется приближение Флори — Хаггинса:

где  об. доля компонента
об. доля компонента  его мол. доля;
его мол. доля;  характеристика Хразмера молекулы (например, число неводородных атомов в молекуле [235], число образующих молекулу структурных единиц, т. е. групп и др.).
характеристика Хразмера молекулы (например, число неводородных атомов в молекуле [235], число образующих молекулу структурных единиц, т. е. групп и др.).
Формулы для оценки комбинаторного вклада в некоторых других приближениях будут приведены позднее.
Остаточная (энергетическая) часть коэффициента активности компонента в групповых моделях представляется суммой вкладов групп, входящих в молекулу 

где — число групп  в молекуле
в молекуле  остаточные коэффициенты активности группы
остаточные коэффициенты активности группы  в растворе и в чистой жидкости
в растворе и в чистой жидкости 
При подстановке вклада группы  как разности значений
как разности значений  для раствора и чистой жидкости
для раствора и чистой жидкости  в формуле (VIII.4) учитывается нормировка коэффициентов активности компонентов
в формуле (VIII.4) учитывается нормировка коэффициентов активности компонентов  при
при  Стандартное состояние для группы, вообще говоря, может быть выбрано произвольно, поскольку изменение стандартного состояния не влияет на значение разности
Стандартное состояние для группы, вообще говоря, может быть выбрано произвольно, поскольку изменение стандартного состояния не влияет на значение разности  Обычно за стандартное состояние для группы
Обычно за стандартное состояние для группы  принимают гипотетическую чистую жидкость
принимают гипотетическую чистую жидкость 
Коэффициент активности  зависит от группового состава раствора и температуры. Различия между существующими вариантами групповых моделей заключаются главным образом в форме представления зависимости коэффициентов активности
зависит от группового состава раствора и температуры. Различия между существующими вариантами групповых моделей заключаются главным образом в форме представления зависимости коэффициентов активности  от состава раствора групп
от состава раствора групп

где  «мол. доля» группы
«мол. доля» группы  общее число типов групп;
общее число типов групп;  число компонентов.
число компонентов.
Концентрационная зависимость  часто выражается одним из уравнений локального состава, хорошо зарекомендовавших себя при описании и предсказании фазовых равновесий (об этих уравнениях подробно говорилось в разд. VII.5). О различных формах описания
часто выражается одним из уравнений локального состава, хорошо зарекомендовавших себя при описании и предсказании фазовых равновесий (об этих уравнениях подробно говорилось в разд. VII.5). О различных формах описания  будет сказано при обсуждении конкретных групповых моделей.
будет сказано при обсуждении конкретных групповых моделей.
Помимо расчета коэффициентов активности компонентов, а следовательно, фазовых равновесий жидкость — пар и жидкость — жидкость групповые модели растворов позволяют описывать и избыточную энтальпию растворов. Парциальную молярную избыточную энтальпию  компонента найдем по формуле
компонента найдем по формуле

продифференцировав выражение (VIII. 1) по обратной температуре. Так как комбинаторный вклад от температуры не зависит, получим

где  парциальная молярная избыточная энтальпия группы
парциальная молярная избыточная энтальпия группы  в растворе; величина относится к чистой жидкости
в растворе; величина относится к чистой жидкости 
Таким образом, парциальная избыточная энтальпия композита представляется как сумма групповых вкладов. Подстановка выражения (VIII.6) в соотношение  дает молярную избыточную энтальпию раствора.
дает молярную избыточную энтальпию раствора.
В первых работах по групповым моделям представление о Растворе групп было использовано для расчетов избыточных энтальпий в системах с неполярными и слабополярными композитами [285]. При этом основное внимание уделялось получению парциальных избыточных энтальпий при бесконечном
разбавлении. Основные черты группового подхода в применении к расчету коэффициентов активности были описаны позднее [235].
Для вычисления коэффициентов активности компонентов согласно соотношениям  или избыточных энтальпий согласно соотношению (VIII.6) необходимо знать зависимости величин
или избыточных энтальпий согласно соотношению (VIII.6) необходимо знать зависимости величин  от состава группового раствора. Для установления таких зависимостей обязательно требуются экспериментальные данные о термодинамических свойствах растворов, содержащих исследуемое сочетание групп. Однако подход к определению зависимостей может быть либо чисто эмпирическим, либо основываться на некоторых модельных представлениях.
от состава группового раствора. Для установления таких зависимостей обязательно требуются экспериментальные данные о термодинамических свойствах растворов, содержащих исследуемое сочетание групп. Однако подход к определению зависимостей может быть либо чисто эмпирическим, либо основываться на некоторых модельных представлениях.
В первых работах эмпирического характера исследовали исключительно системы, содержащие группы двух типов. Из экспериментальных величин  с помощью соотношений
с помощью соотношений  рассчитывали значения
рассчитывали значения  для различных составов раствора и зависимость
для различных составов раствора и зависимость  представляли графически. Полученные графики использовали для расчетов коэффициентов активности
представляли графически. Полученные графики использовали для расчетов коэффициентов активности  в других растворах с тем же набором групп. Такой метод был применен к растворам спиртов с алканами и водой, растворам спиртов с ароматическими углевородами, к системам кетон—алкан [235, 286].
в других растворах с тем же набором групп. Такой метод был применен к растворам спиртов с алканами и водой, растворам спиртов с ароматическими углевородами, к системам кетон—алкан [235, 286].
Однако графическое описание, а также аппроксимация концентрационной зависимости в виде полинома, которую проводили, например, в работах [287], имеют ряд недостатков. Они требуют весьма подробных экспериментальных данных, применение этих способов описания затруднительно при наличии в растворе более двух групп. Естественной поэтому была попытка применения к групповому раствору тех соотношений, которые успешно служат при описании концентрационных зависимостей термодинамических свойств растворов в случае обычного, не группового рассмотрения. Эти соотношения, основанные на некоторых модельных представлениях, подробно рассмотрены в разд. VII.5.
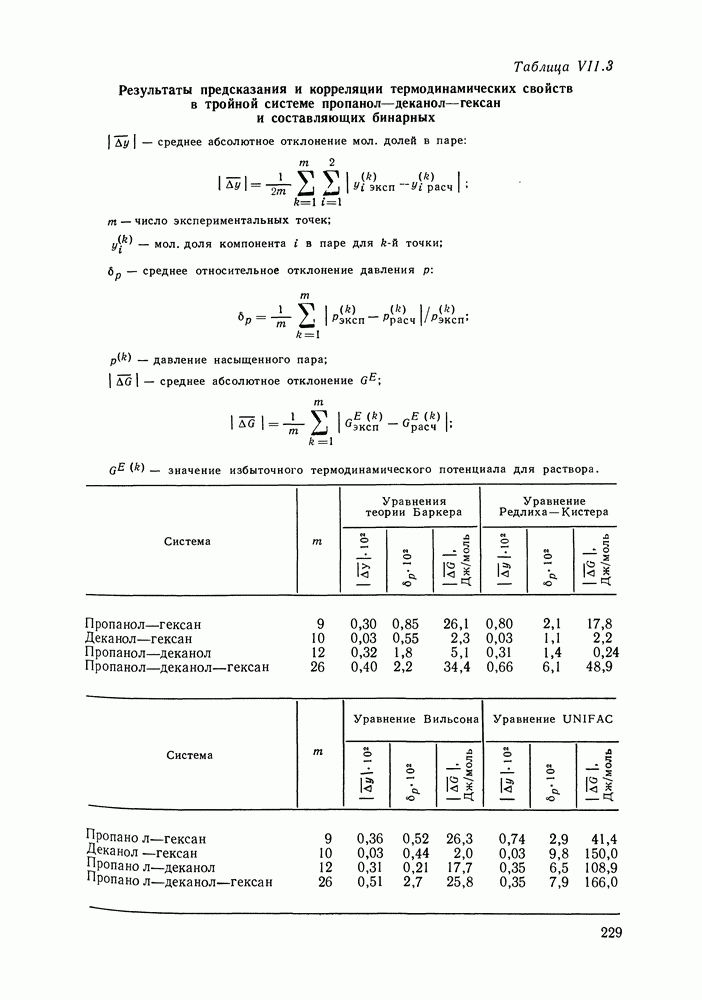
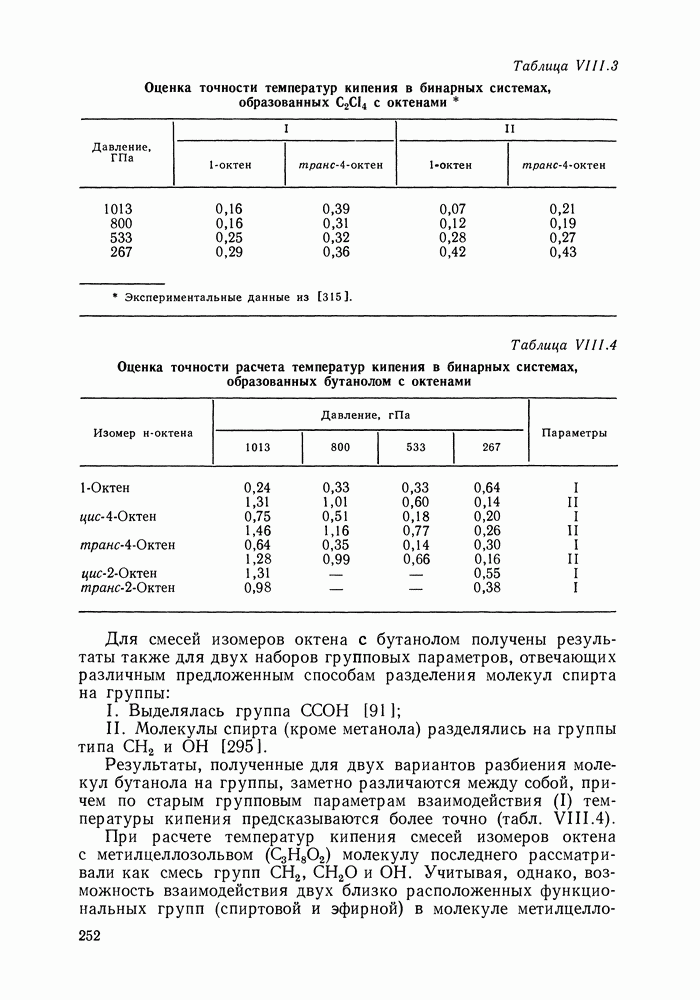
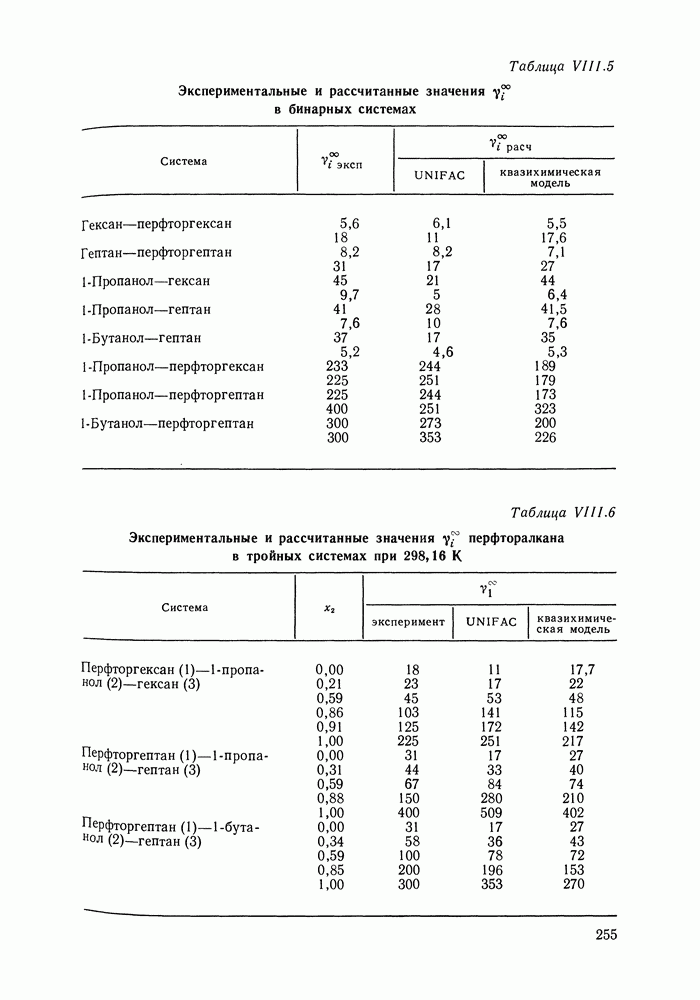
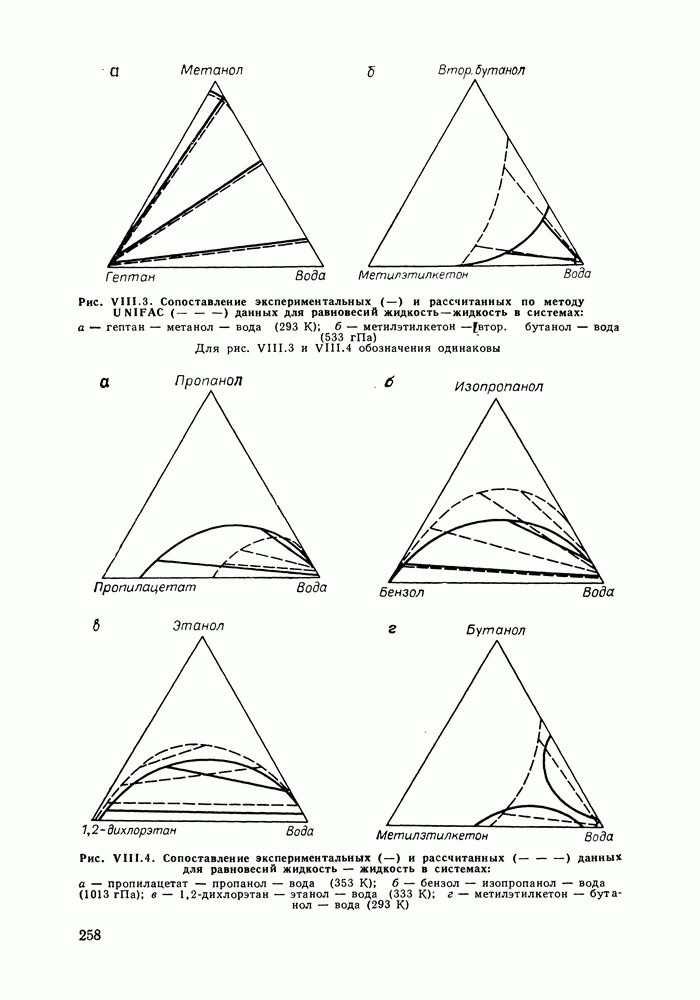
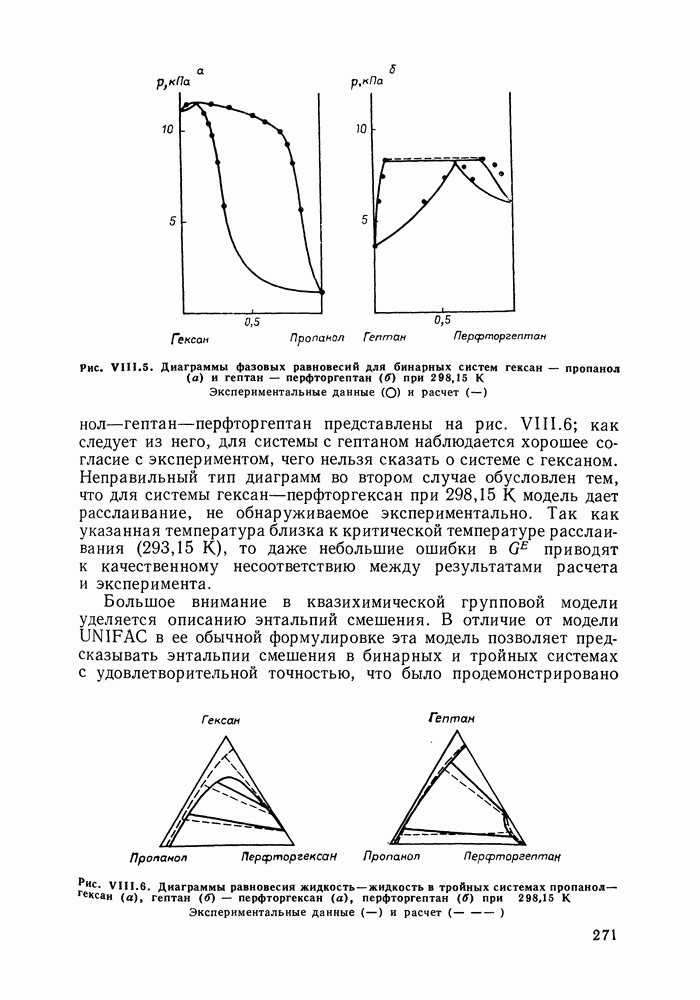
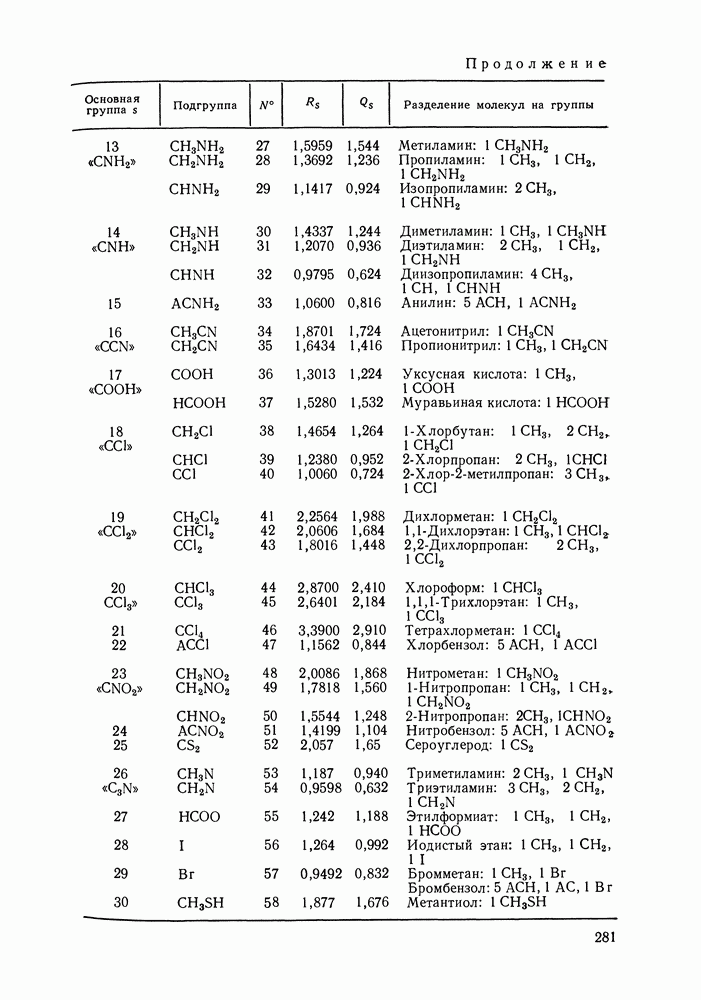
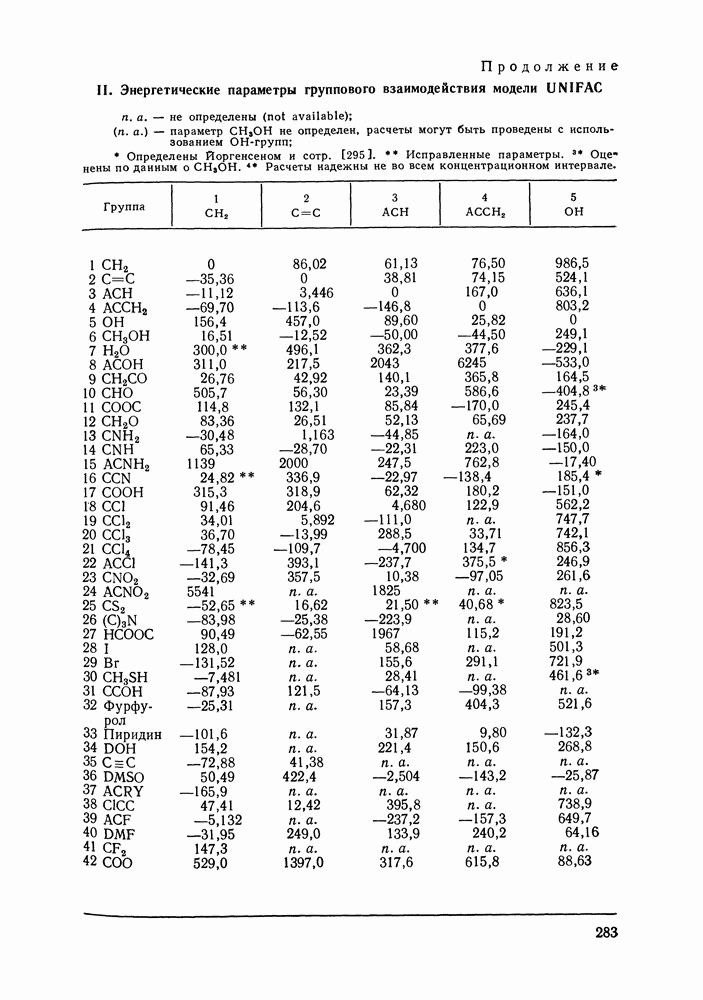
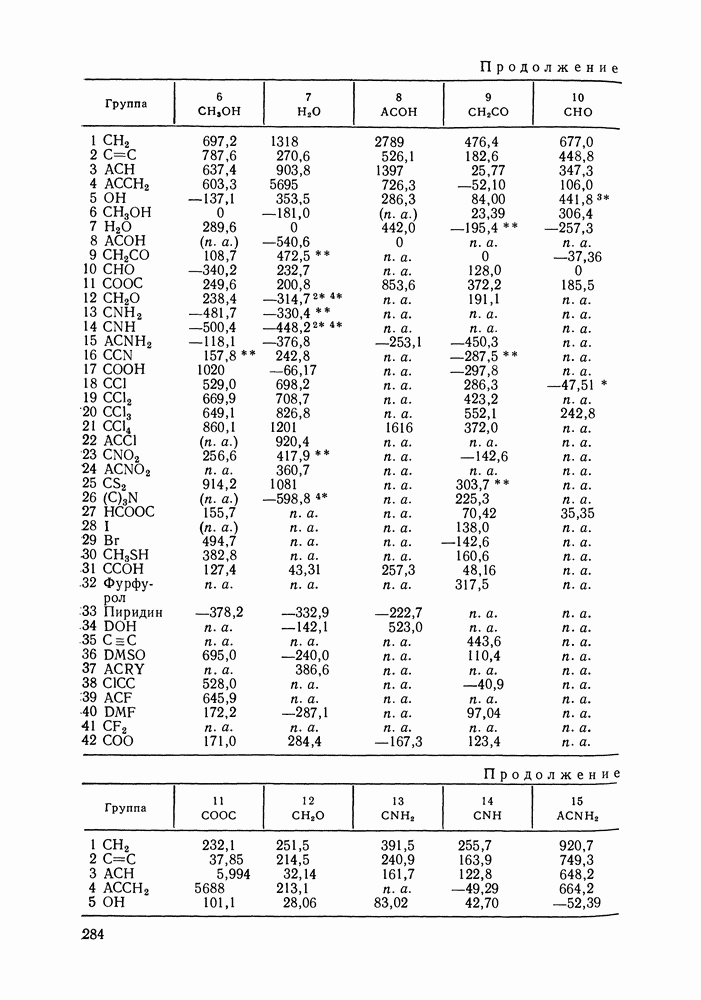
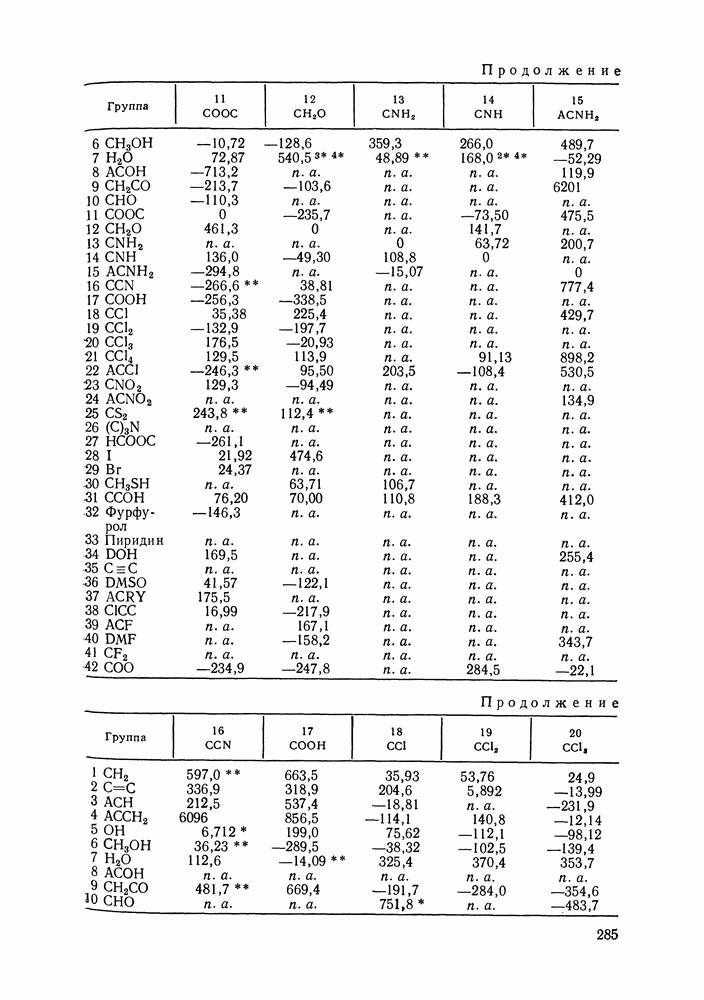
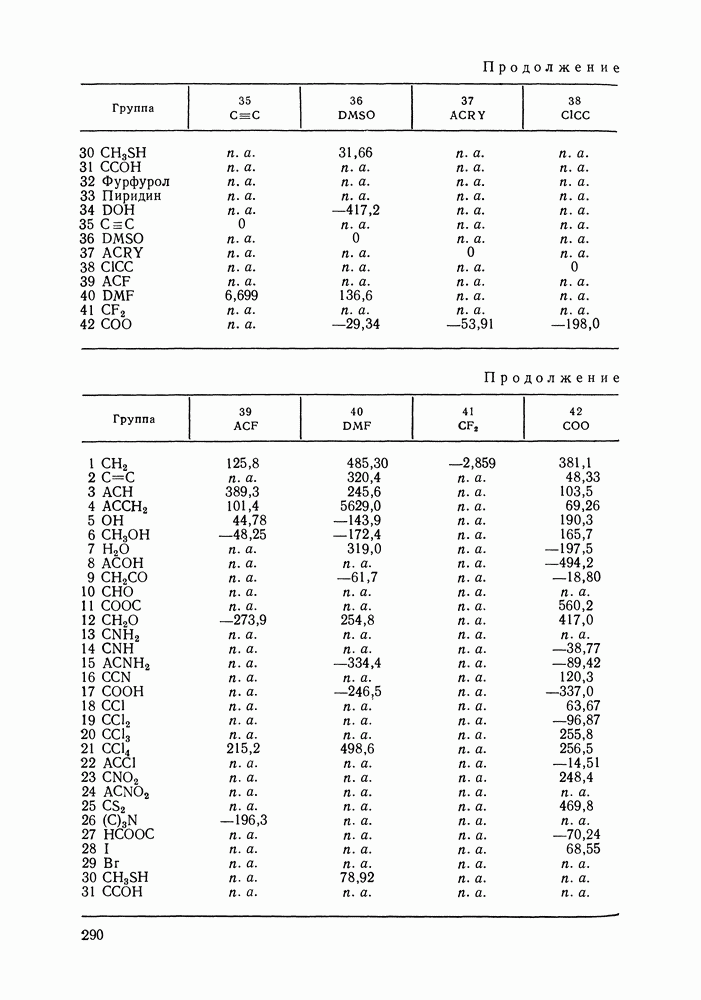
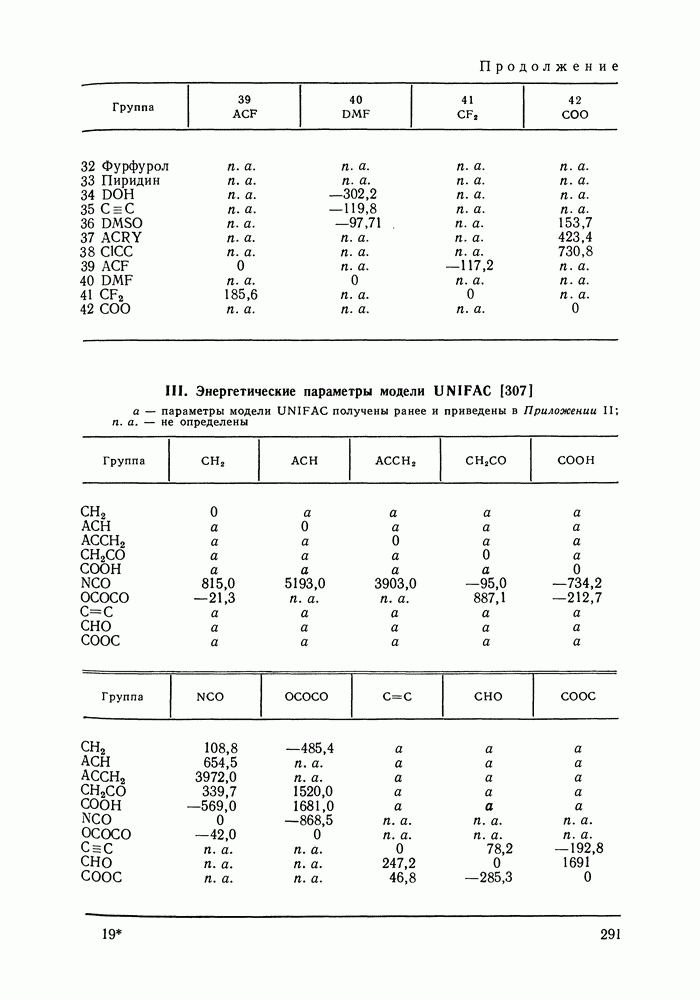
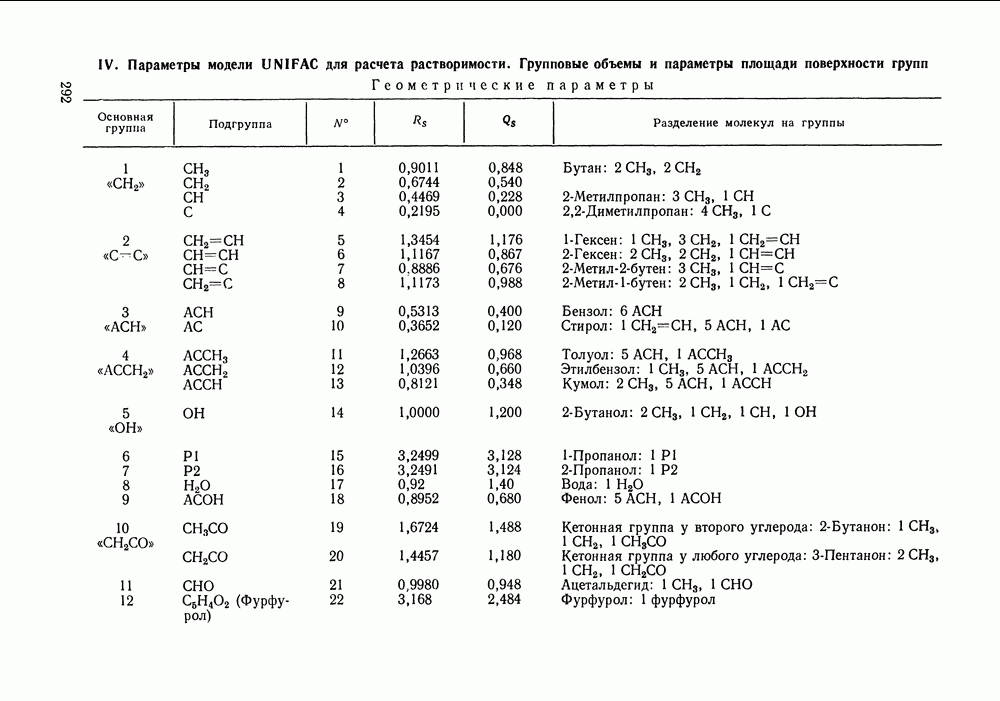
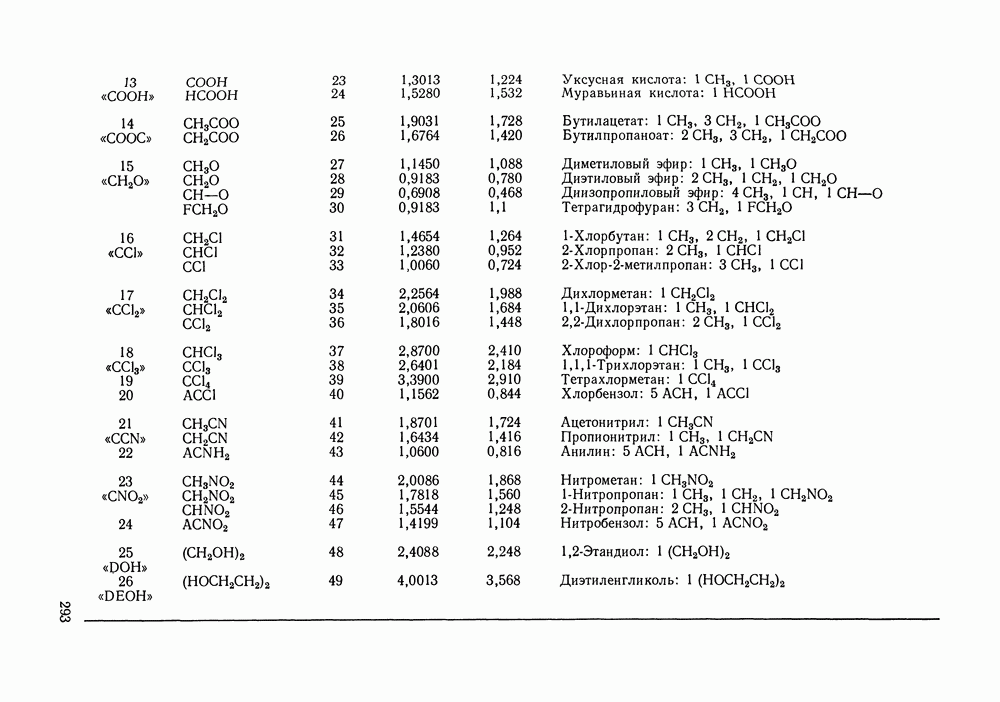
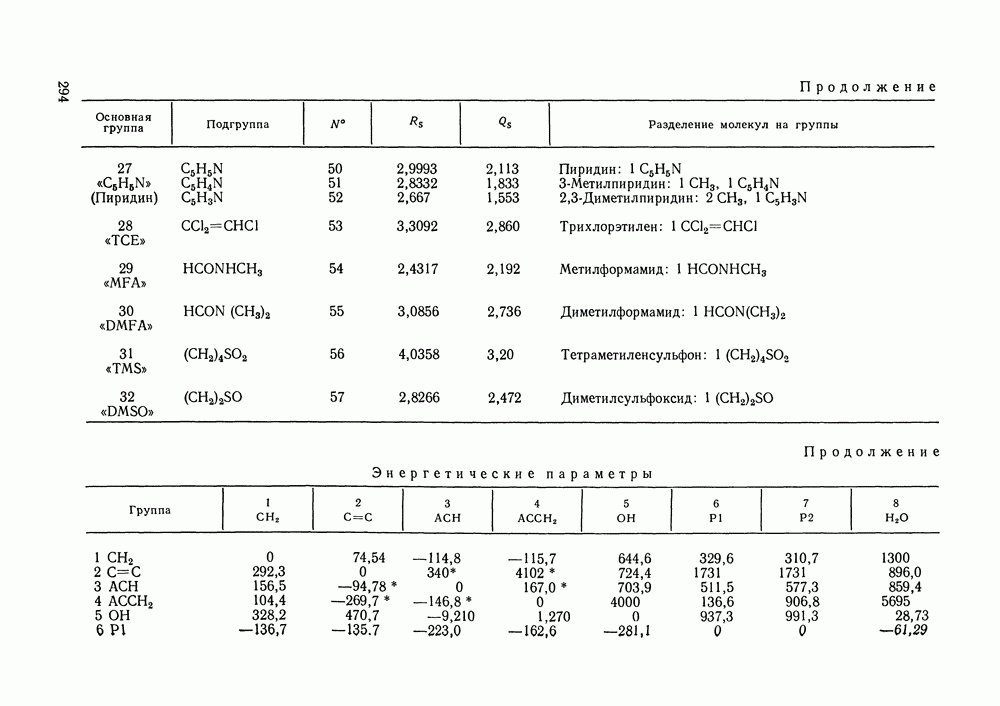
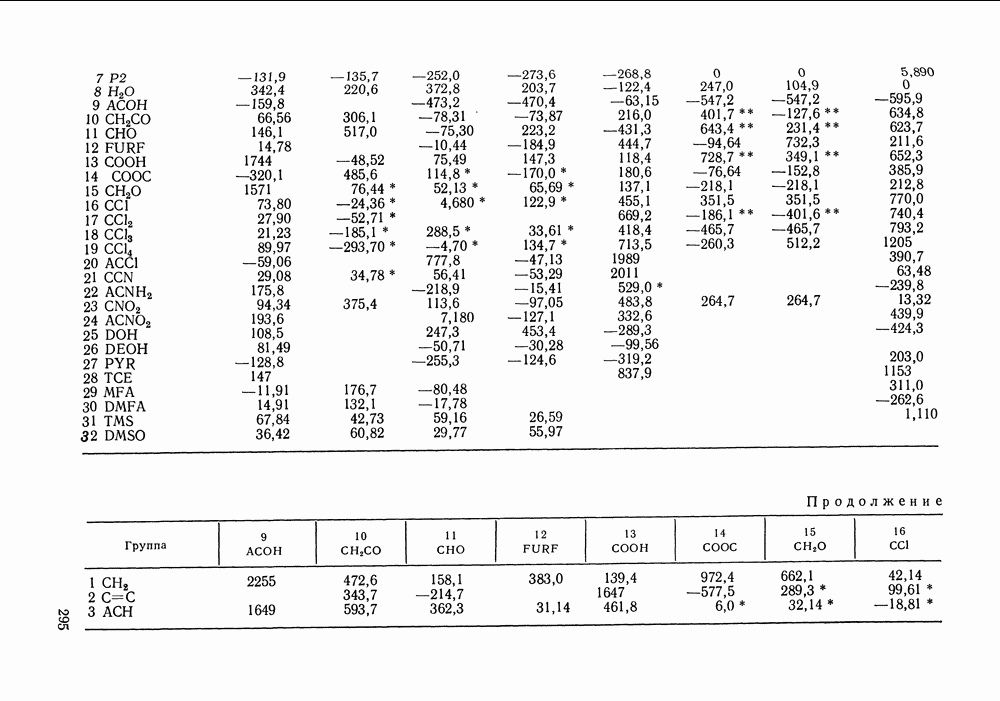
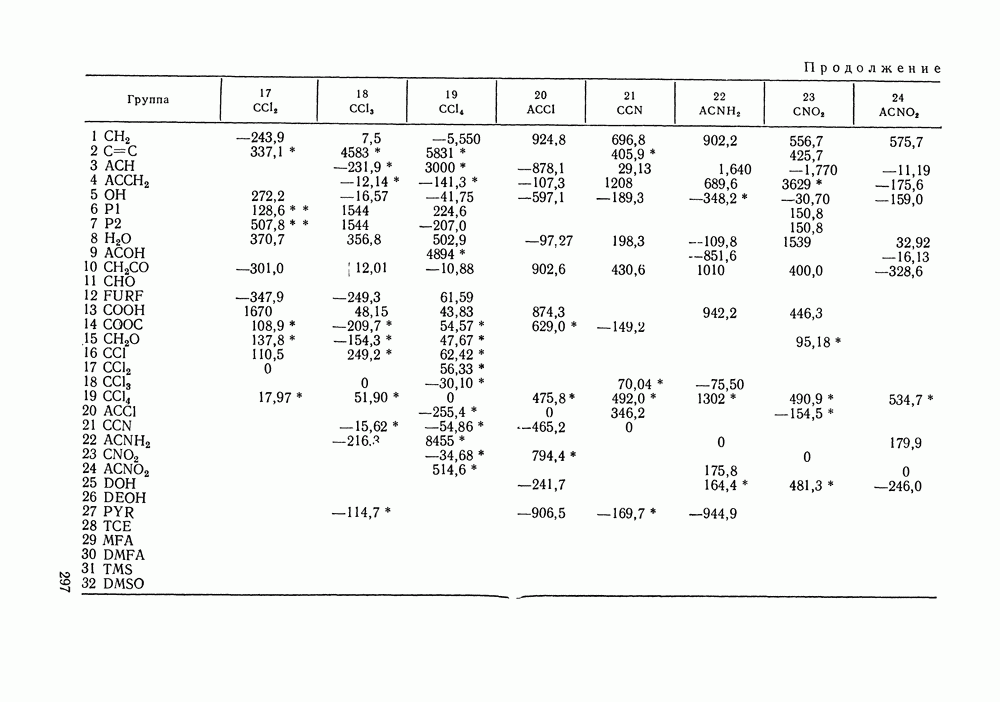
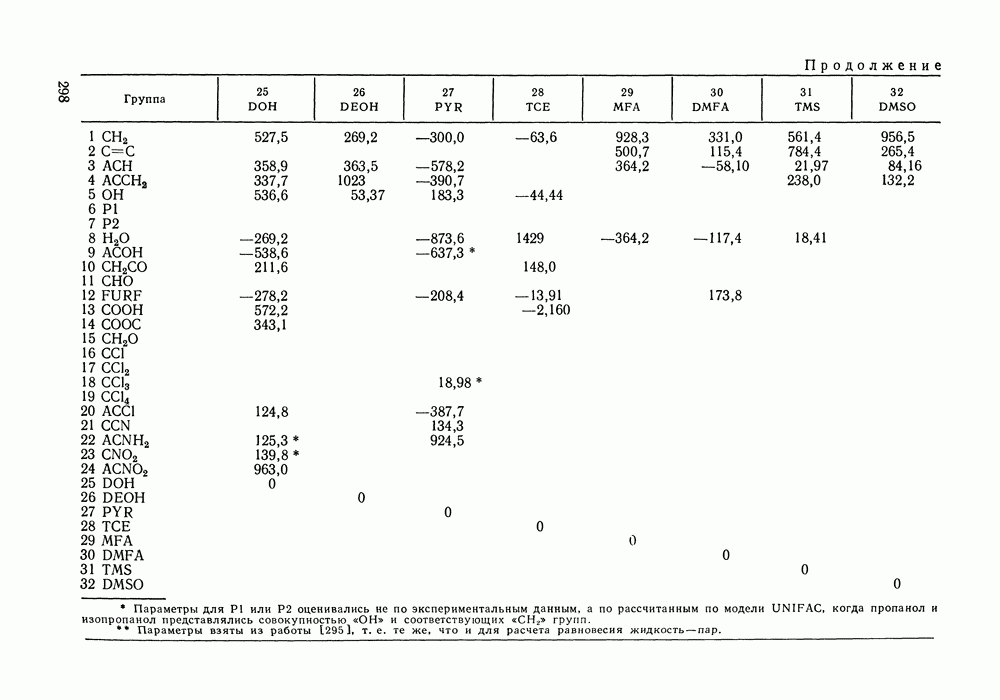
Наибольшее применение в групповых моделях нашли два уравнения для коэффициентов активности: уравнение Вильсона (VII. 121) и уравнение UNIQUAC (VII.132). Уравнение Вильсона используют для описания зависимости групповых коэффициентов активности от состава группового раствора в модели ASOG (Analytical Solution of Groups) [288]; на уравнении UNIQUAC основана модель UNIFAC (UNIQUAC Functional-group Activity Coefficients) [91, 289]. Обе эти модели далее рассмотрим подробно. Кроме указанных выше групповых моделей растворов, в последние годы широкое развитие и применение получили квазихимические групповые модели, которые теоретически наиболее обоснованы и, по-видимому, являются перспективными (о них см. в разд. VIII.3).
В модели ASOG комбинаторная составляющая величины  записывается в форме (VIII.2)
записывается в форме (VIII.2)  или в следующей форме
или в следующей форме
(скелетный вклад) [290]

где  число неводородных атомов в молекуле
число неводородных атомов в молекуле  ; В — зависящий от температуры параметр.
; В — зависящий от температуры параметр.
Коэффициент активности группы определяется уравнением Вильсона:

где  параметры уравнения, относящиеся к паре
параметры уравнения, относящиеся к паре 
Температурная зависимость параметров  учитывается в форме
учитывается в форме

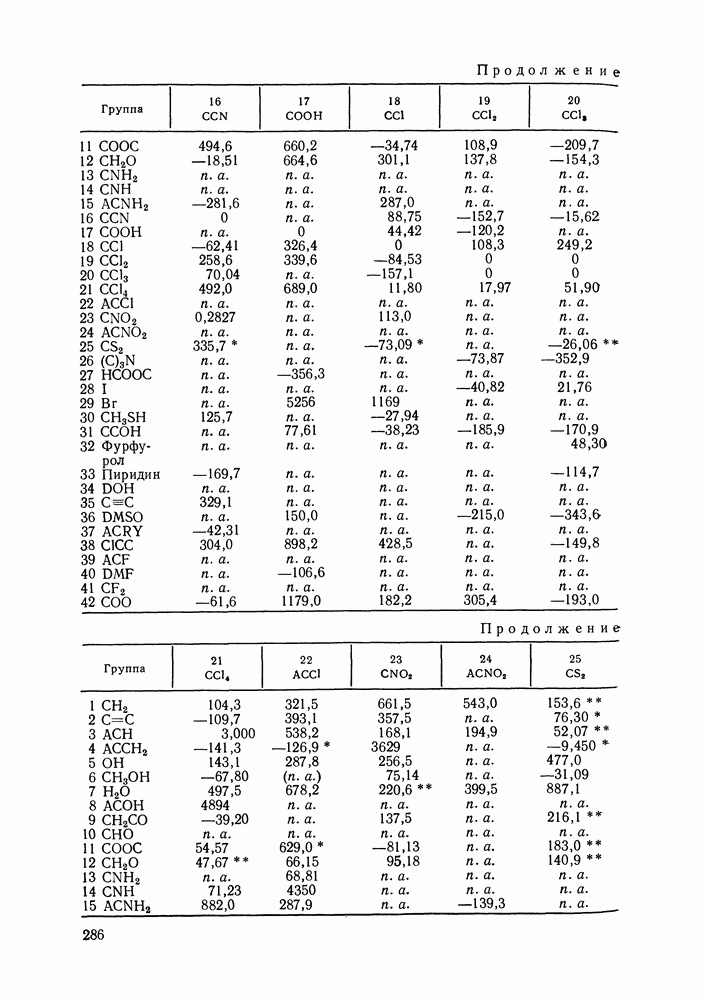
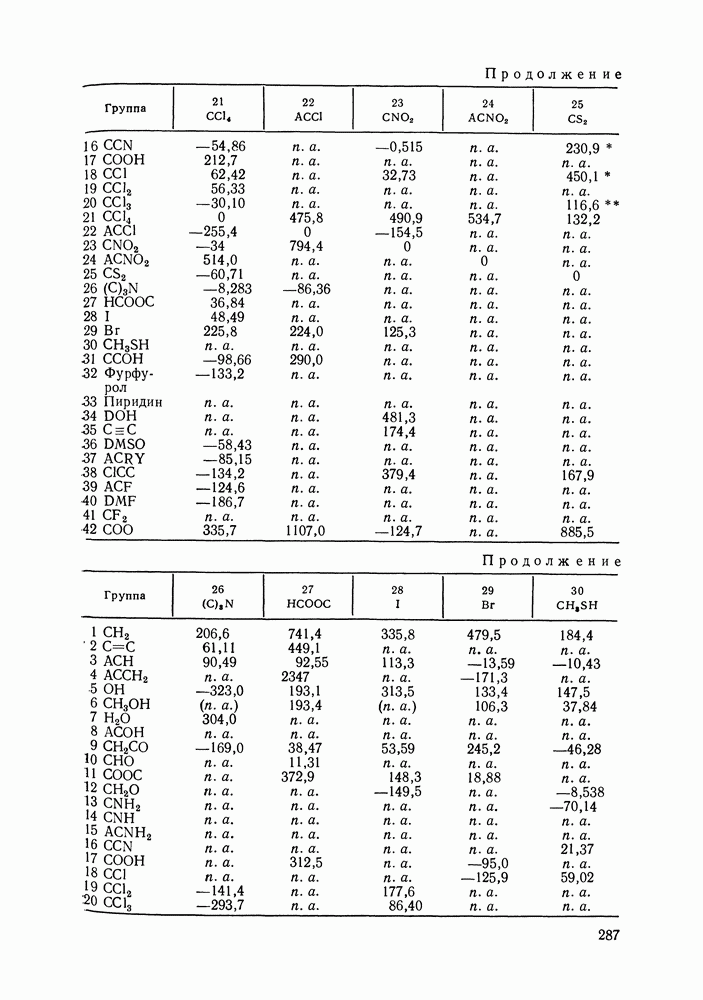
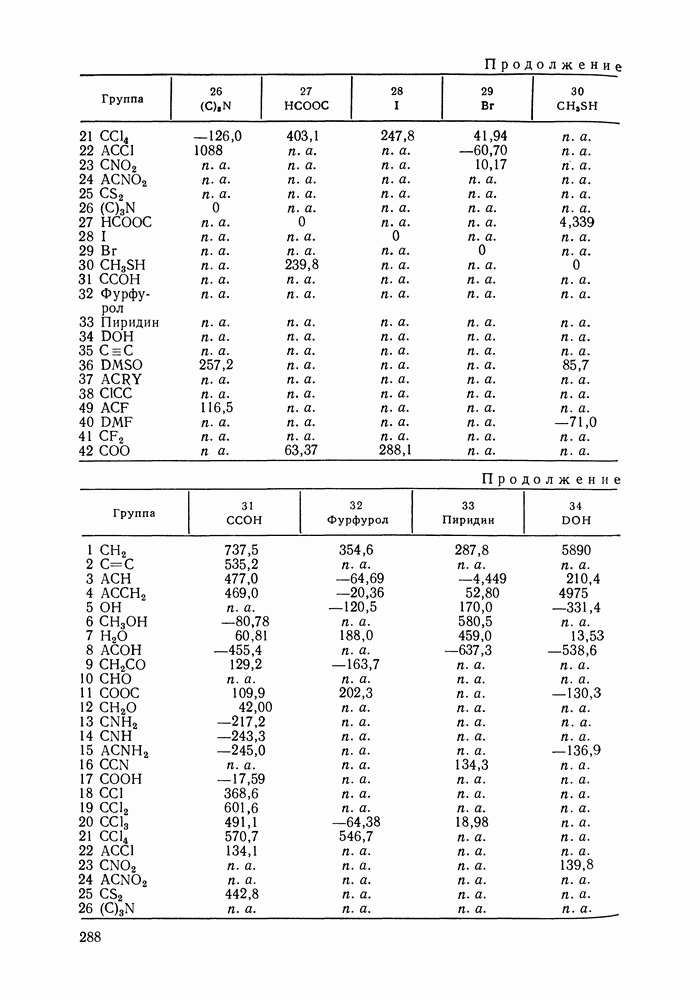
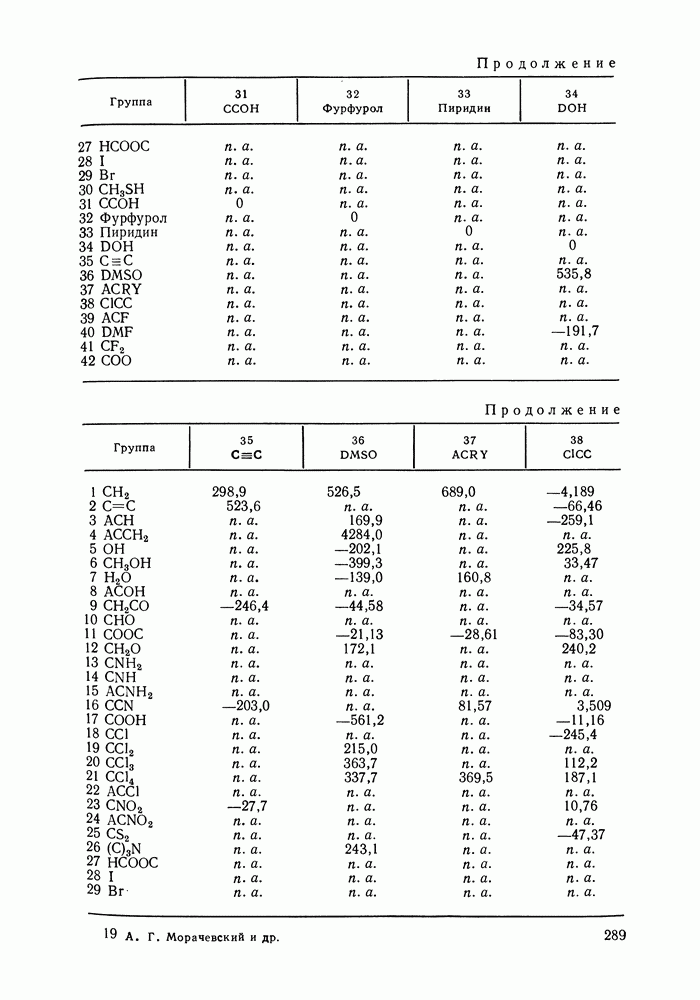
Энергетические параметры модели ASOG оценены для многих пар групп, образующих алифатические и ароматические углеводороды, спирты, кетоны, моно- и диэфиры, хлориды и др. [288, 290, 291]. Эти параметры использовали для предсказания коэффициентов активности компонентов в различных системах, образованных указанными выше компонентами, в частности, для систем каучук—растворитель. Кроме того, рассчитывали предельные коэффициенты активности и фазовые равновесия жидкость—пар. Результаты оказались вполне удовлетворительными. Расчеты равновесия жидкость—жидкость по модели ASOG дали лишь качественное согласие с экспериментом [291, 292].
Распространение модели ASOG на расчеты избыточных энтальпий состоит в следующем. Продифференцировав выражение (VIII.8) по температуре, получим  и
и

где 
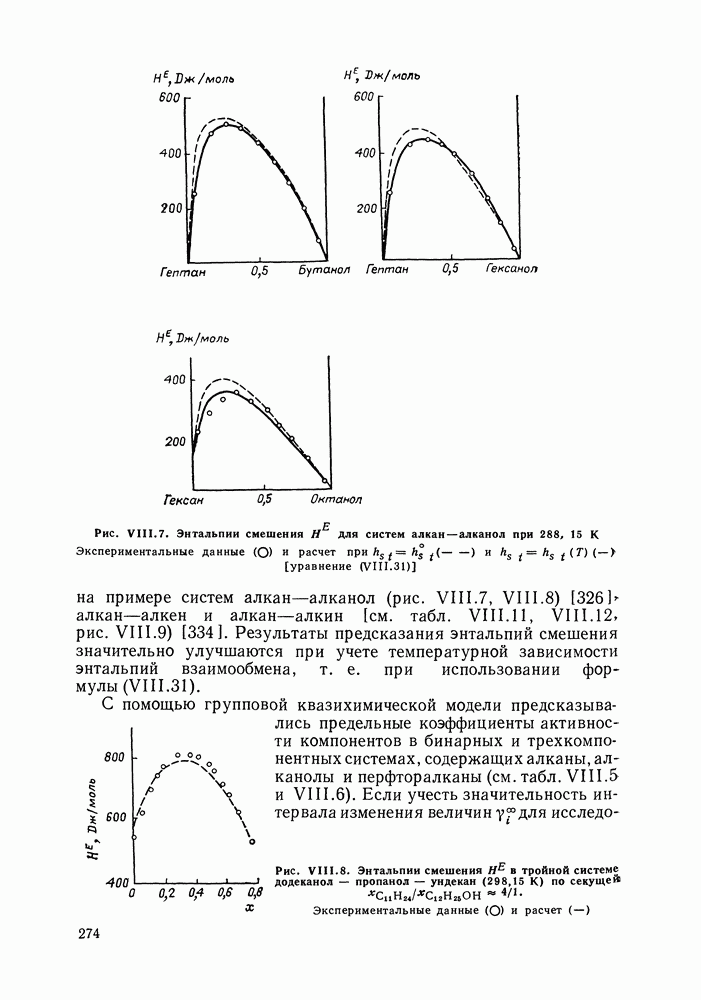
Связь парциальных избыточных энтальпий компонентов с энтальпиями групп определяется уравнением (VIII.6). Соотношения (VIII.6) и (VIII. 10) успешно использовали для предсказания энтальпий смешения во многих системах (точность описания составляла  [293]. Значения параметров при этом оценивали По данным об энтальпиях смешения. Однако групповые параметры
[293]. Значения параметров при этом оценивали По данным об энтальпиях смешения. Однако групповые параметры
 для определения теплот смешения отличаются от параметров модели для предсказания коэффициентов активности.
для определения теплот смешения отличаются от параметров модели для предсказания коэффициентов активности.
Модель ASOG нашла весьма широкое применение для предсказания равновесий жидкость—пар, жидкость—жидкость, при оценках энтальпий смешения. Она обеспечивает приблизительно такую же точность, что и модель UNIFAC. Однако метод UNIFAC имеет то преимущество, что он разработан значительно более систематически, чем метод ASOG; для него имеются обширные таблицы параметров, позволяющие предсказывать свойства многих практически важных смесей. Именно поэтому в последние годы метод UNIFAC приобрел более широкое распространение, чем другие групповые модели.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА
- Глава I. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕРМОДИНАМИКИ ГЕТЕРОГЕННЫХ РАВНОВЕСИЙ
- 1.2. УСЛОВИЯ РАВНОВЕСИЯ ГЕТЕРОГЕННЫХ СИСТЕМ
- 1.3. ТИПЫ РАВНОВЕСИЙ
- 1.4. УСЛОВИЯ УСТОЙЧИВОСТИ
- 1.5. ПРАВИЛО ФАЗ
- Глава II. ОДНОКОМПОНЕНТНЫЕ СИСТЕМЫ
- II.1. ДИАГРАММЫ СОСТОЯНИЯ
- II.2. УРАВНЕНИЕ КЛАУЗИУСА—КЛАПЕЙРОНА
- II.3. ЗАВИСИМОСТЬ ДАВЛЕНИЯ ОТ ТЕМПЕРАТУРЫ. УРАВНЕНИЕ АНТУАНА
- II.4. ЗАКОН СООТВЕТСТВЕННЫХ СОСТОЯНИЙ
- II.5. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА. ДРУГИЕ АНАЛИТИЧЕСКИЕ УРАВНЕНИЯ СОСТОЯНИЯ
- II.6. ВИРИАЛЬНОЕ УРАВНЕНИЕ СОСТОЯНИЯ
- Глава III. ДВОЙНЫЕ СИСТЕМЫ
- III.1. ДИАГРАММЫ РАВНОВЕСИЯ ДЛЯ ДВОЙНЫХ СИСТЕМ
- III.2. ОБОБЩЕННОЕ ДИФФЕРЕНЦИАЛЬНОЕ УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- III.3. ЗАКОНЫ КОНОВАЛОВА
- III.4. ЗАКОНЫ ВРЕВСКОГО
- III.5. ИДЕАЛЬНЫЕ СИСТЕМЫ
- III.6. РАЗБАВЛЕННЫЕ РАСТВОРЫ
- III.7 РЕАЛЬНЫЕ СИСТЕМЫ
- III.8. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СМЕШЕНИЯ И РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР
- III.9. ОБ АЗЕОТРОПИИ В БИНАРНЫХ СИСТЕМАХ
- III.10. ТРЕХФАЗНЫЕ РАВНОВЕСИЯ ЖИДКОСТЬ—ЖИДКОСТЬ—ПАР В ДВОЙНЫХ СИСТЕМАХ
- III.11. ФАЗОВЫЕ ДИАГРАММЫ БИНАРНЫХ СИСТЕМ В ШИРОКОМ ИНТЕРВАЛЕ ТЕМПЕРАТУР И ДАВЛЕНИЙ
- Глава IV. ТРОЙНЫЕ И МНОГОКОМПОНЕНТНЫЕ СИСТЕМЫ
- IV.2. ПРОЯВЛЕНИЕ ЗАКОНОВ КОНОВАЛОВА И ВРЕВСКОГО В ТРОЙНЫХ И МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ
- IV.3. ОТКРЫТЫЕ ФАЗОВЫЕ ПРОЦЕССЫ. ТЕРМОДИНАМИКО-ТОПОЛОГИЧЕСКИЕ ЗАКОНОМЕРНОСТИ
- Глава V. МЕТОДЫ ЭКСПЕРИМЕНТАЛЬНОГО ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР
- V.I. ЦИРКУЛЯЦИОННЫЙ МЕТОД
- V.2. МЕТОД ОТКРЫТОГО ИСПАРЕНИЯ
- V.3. МЕТОД СТРУИ ИНЕРТНОГО ГАЗА
- V.4. СТАТИЧЕСКИЙ МЕТОД
- V.5. ИЗОПИЕСТИЧЕСКИЙ МЕТОД
- V.6. ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
- V.7. РАСЧЕТ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР ПО ЗАВИСИМОСТИ ДАВЛЕНИЯ ПАРА ОТ СОСТАВА РАСТВОРА ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ
- V.8. МЕТОДЫ ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР С ПОМОЩЬЮ ГАЗОВОЙ ХРОМАТОГРАФИИ
- V.9. РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР ДЛЯ РАЗБАВЛЕННЫХ РАСТВОРОВ
- Глава VI. МЕТОДЫ ПРОВЕРКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ-ПАР
- VI.2. ОБЩАЯ ОЦЕНКА ТЕРМОДИНАМИЧЕСКИХ МЕТОДОВ ПРОВЕРКИ И ИСПРАВЛЕНИЯ ДАННЫХ
- VI.3. ПРОВЕРКА ДАННЫХ С ПОМОЩЬЮ УРАВНЕНИЙ ГИББСА—ДЮГЕМА И ДЮГЕМА—МАРГУЛЕСА
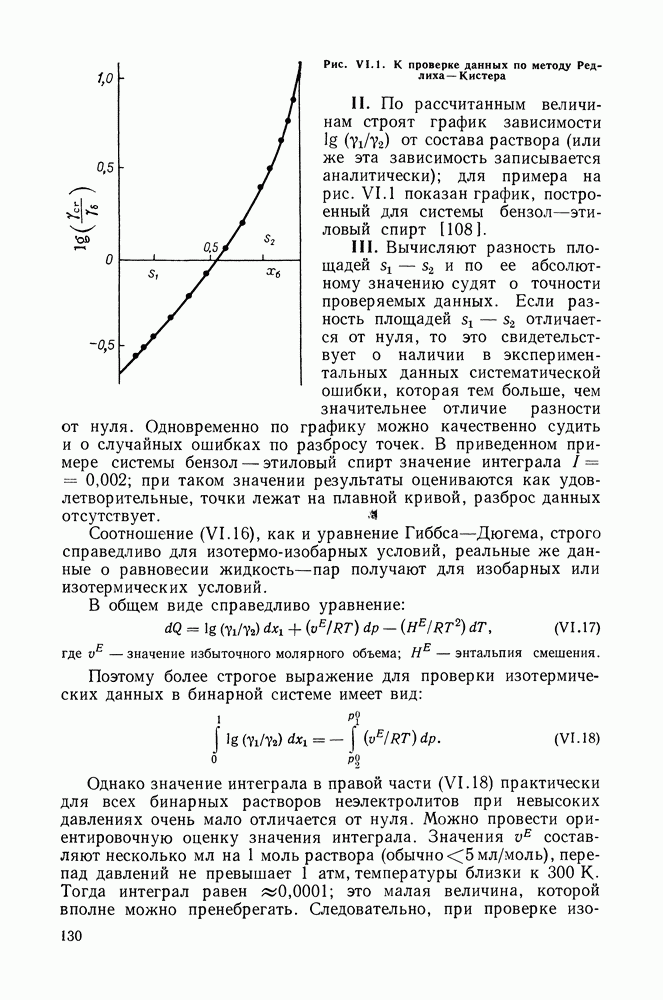
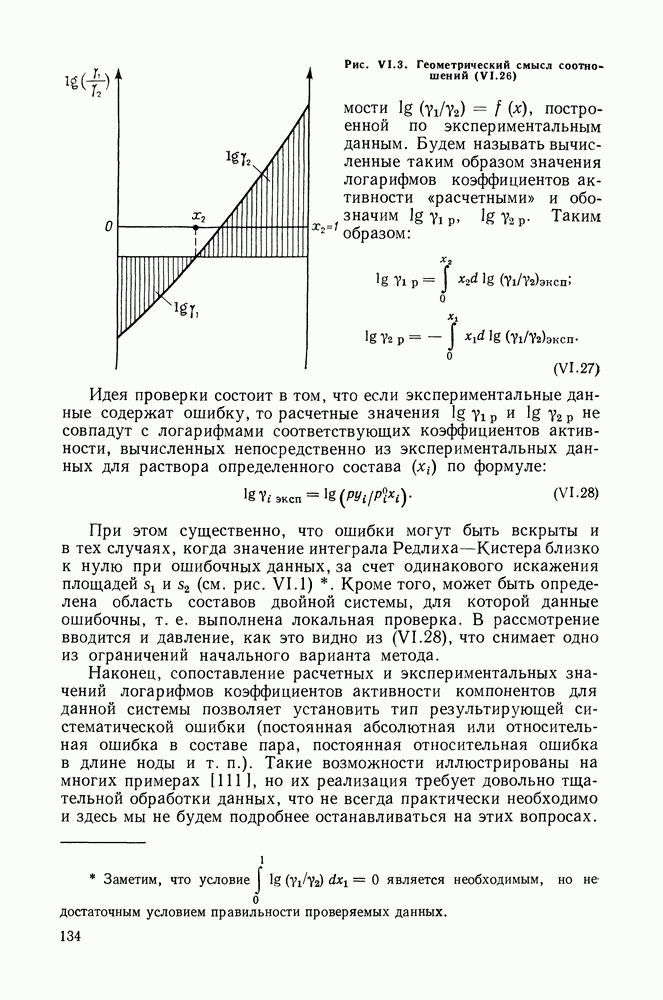
- VI.4. МЕТОД РЕДЛИХА—КИСТЕРА
- VI.5. МЕТОД ВАН-НЕССА
- VI.6. СТАТИСТИЧЕСКИЕ МЕТОДЫ ОБРАБОТКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР
- VI.7. МЕТОДЫ ПРОВЕРКИ ТЕРМОДИНАМИЧЕСКОЙ СОГЛАСОВАННОСТИ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР В ТРОЙНЫХ СИСТЕМАХ
- VI.8. СОПОСТАВЛЕНИЕ МЕТОДОВ РЕДЛИХА—КИСТЕРА И ВАН-НЕССА
- Глава VII. МЕТОДЫ РАСЧЕТА РАВНОВЕСИЙ ЖИДКОСТЬ—ПАР
- VII. 1. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ РАВНОВЕСНЫХ ЖИДКОСТИ И ПАРА
- VII.2. АЛГОРИТМЫ РАСЧЕТА ФАЗОВЫХ РАВНОВЕСИЙ
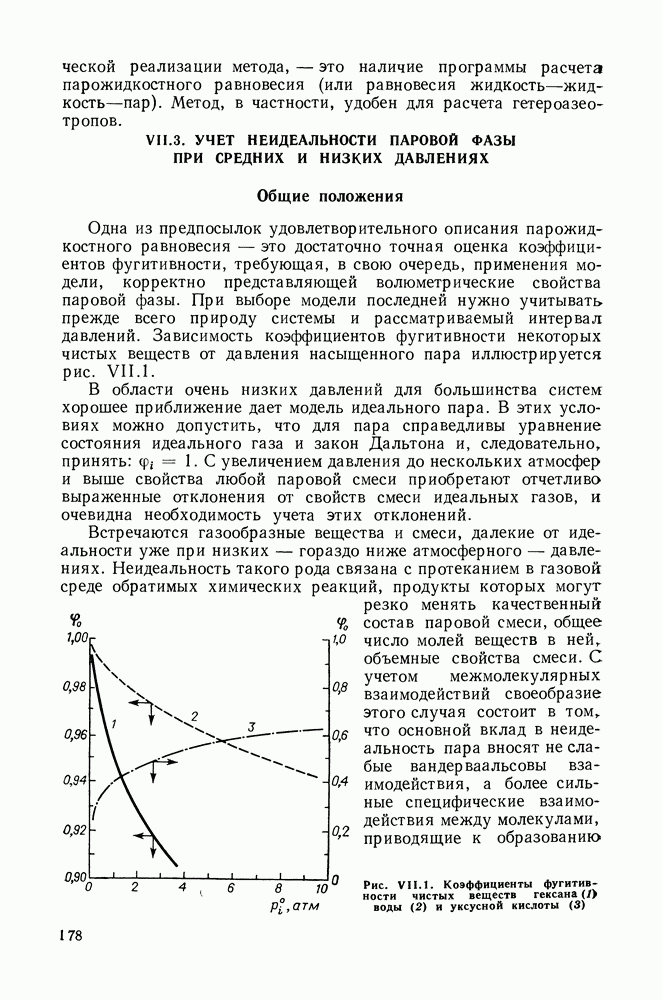
- VII.3. УЧЕТ НЕИДЕАЛЬНОСТИ ПАРОВОЙ ФАЗЫ ПРИ СРЕДНИХ И НИЗКИХ ДАВЛЕНИЯХ
- VII.4. ПОЛИНОМИАЛЬНЫЕ УРАВНЕНИЯ ДЛЯ КОЭФФИЦИЕНТОВ АКТИВНОСТИ И УРАВНЕНИЕ ВАН-ЛААРА
- VII.5. МОДЕЛИ ЛОКАЛЬНОГО СОСТАВА
- VII.6. ОЦЕНКА ПАРАМЕТРОВ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ
- VII.7. СОПОСТАВЛЕНИЕ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ ПРИ ОПИСАНИИ ФАЗОВЫХ РАВНОВЕСИЙ
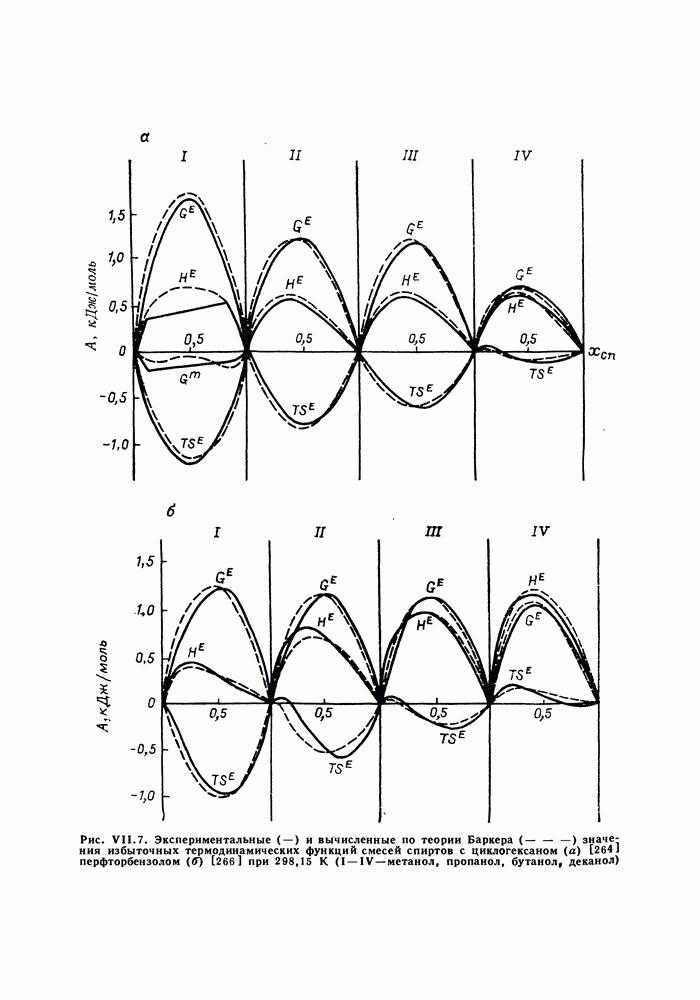
- VII.8. РЕШЕТОЧНЫЕ МОДЕЛИ. МОДЕЛЬ БАРКЕРА
- Глава VIII. ГРУППОВЫЕ МОДЕЛИ РАСТВОРОВ
- VIII.1. ОСНОВНЫЕ ОСОБЕННОСТИ ГРУППОВЫХ МОДЕЛЕЙ РАСТВОРОВ
- VIII.2. МОДЕЛЬ UNIFAC
- VIII.3. КВАЗИХИМИЧЕСКИЕ ГРУППОВЫЕ МОДЕЛИ
- Глава IX. ДЫРОЧНАЯ РЕШЕТОЧНАЯ КВАЗИХИМИЧЕСКАЯ МОДЕЛЬ, ЕЕ ГРУППОВОЙ ВАРИАНТ
- IX.2. ФОРМУЛИРОВКА ДЫРОЧНОЙ КВАЗИХИМИЧЕСКОЙ МОДЕЛИ
- IX.3. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СИСТЕМЫ
- IX.4. О МЕТОДИКЕ РАСЧЕТА
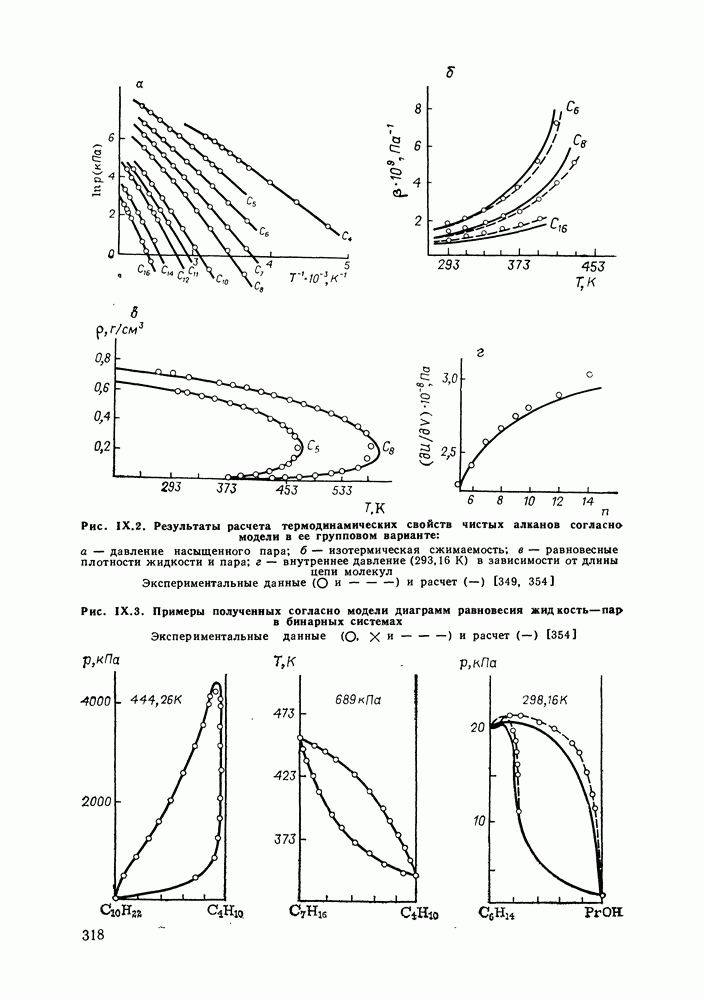
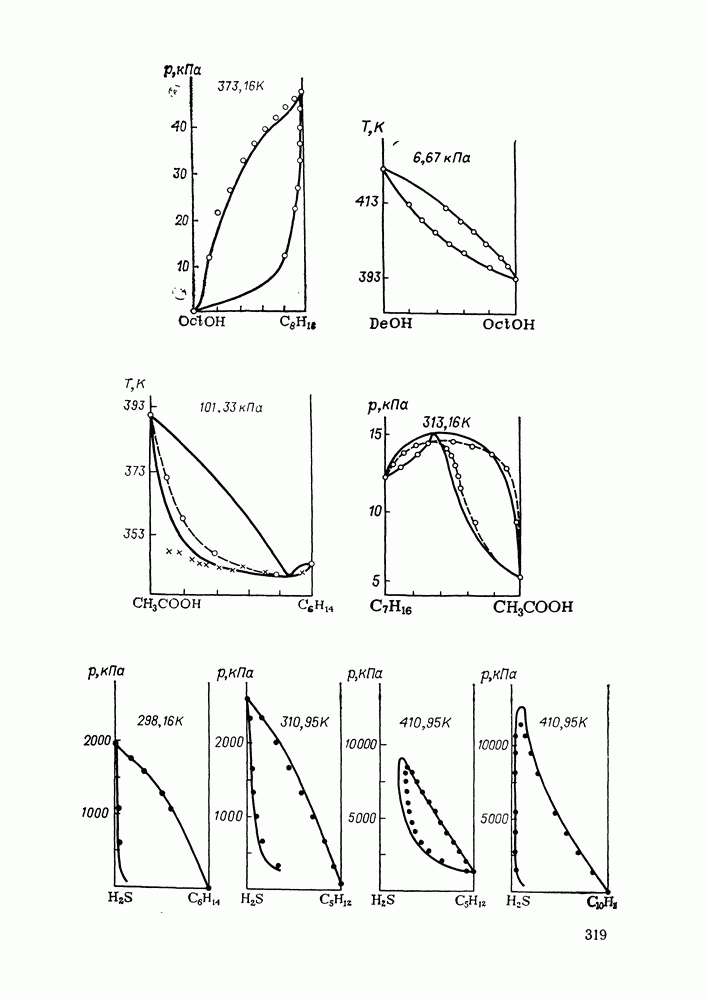
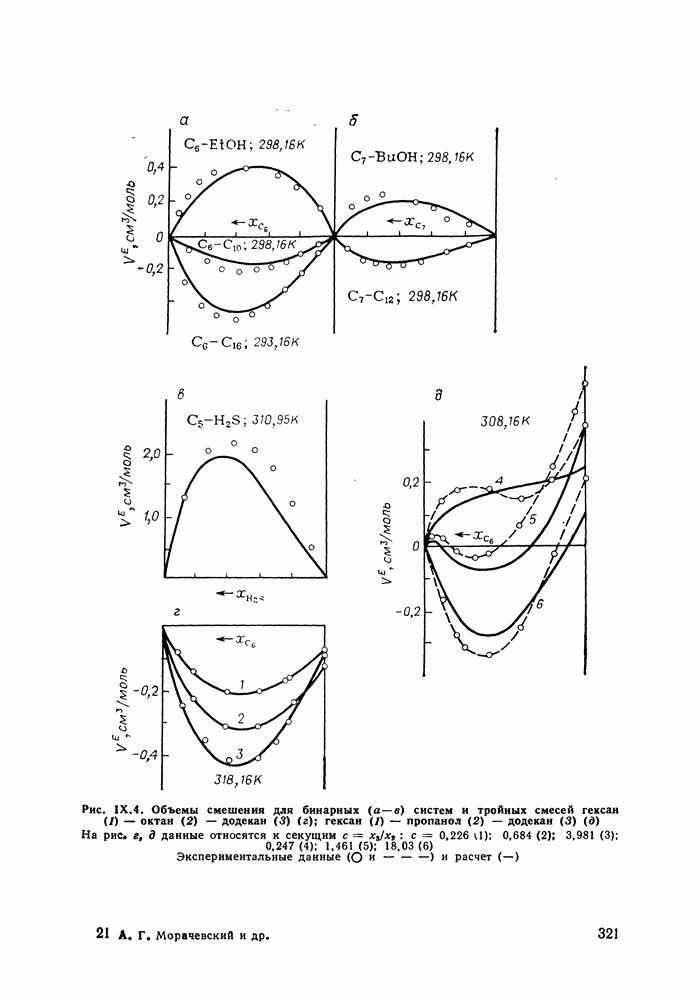
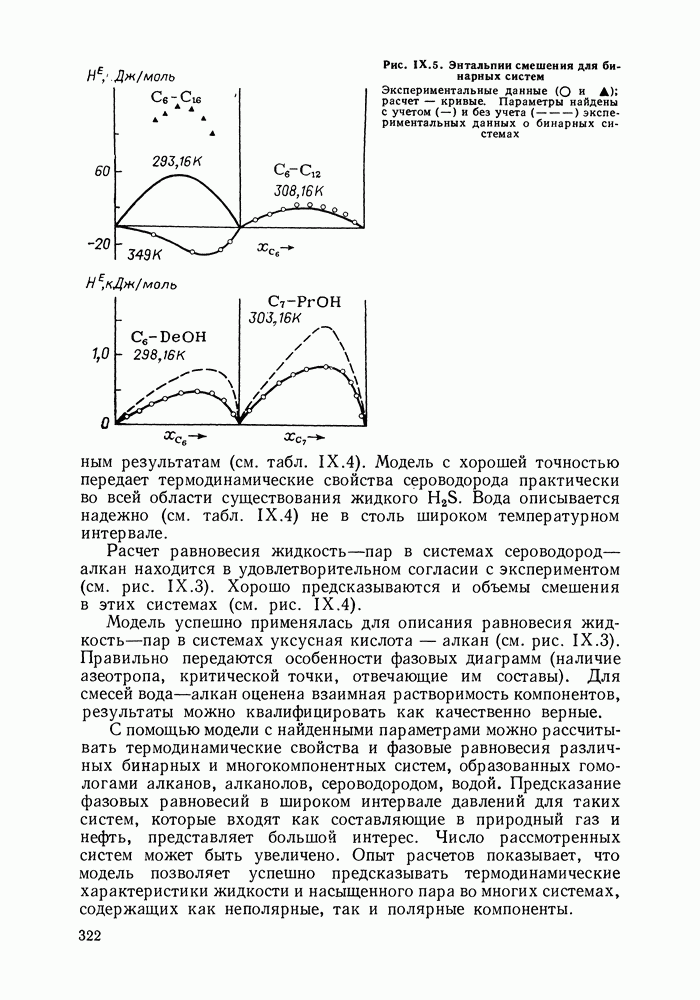
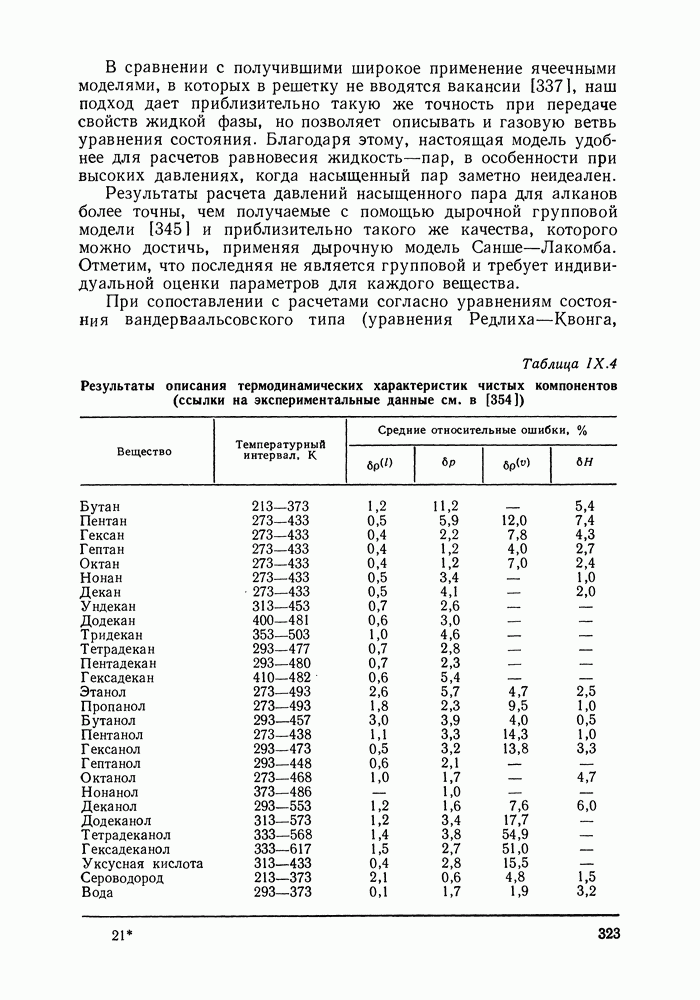
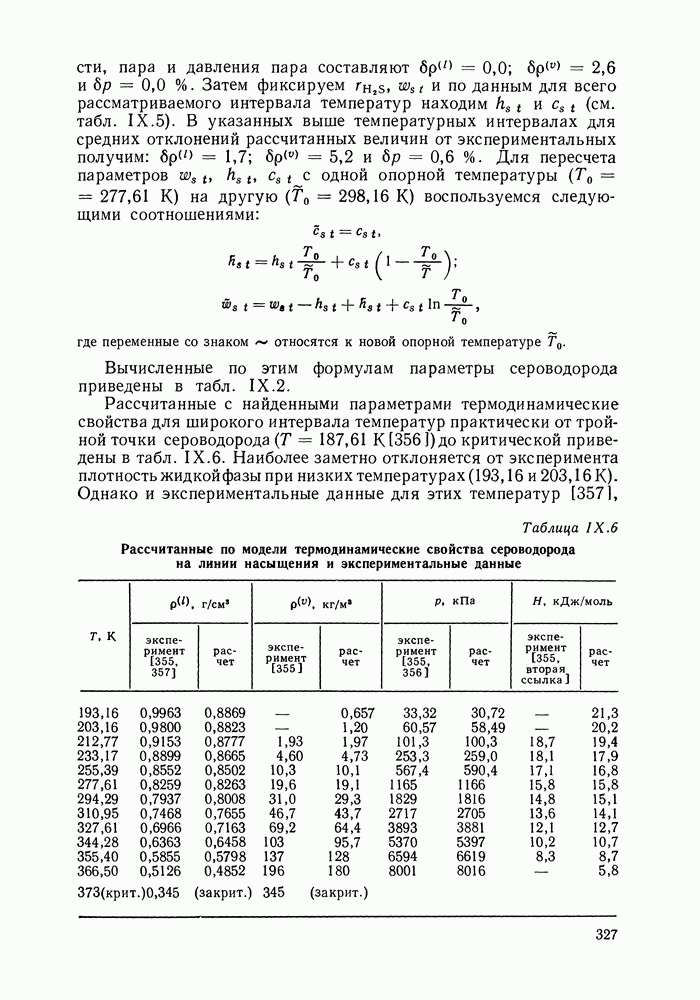
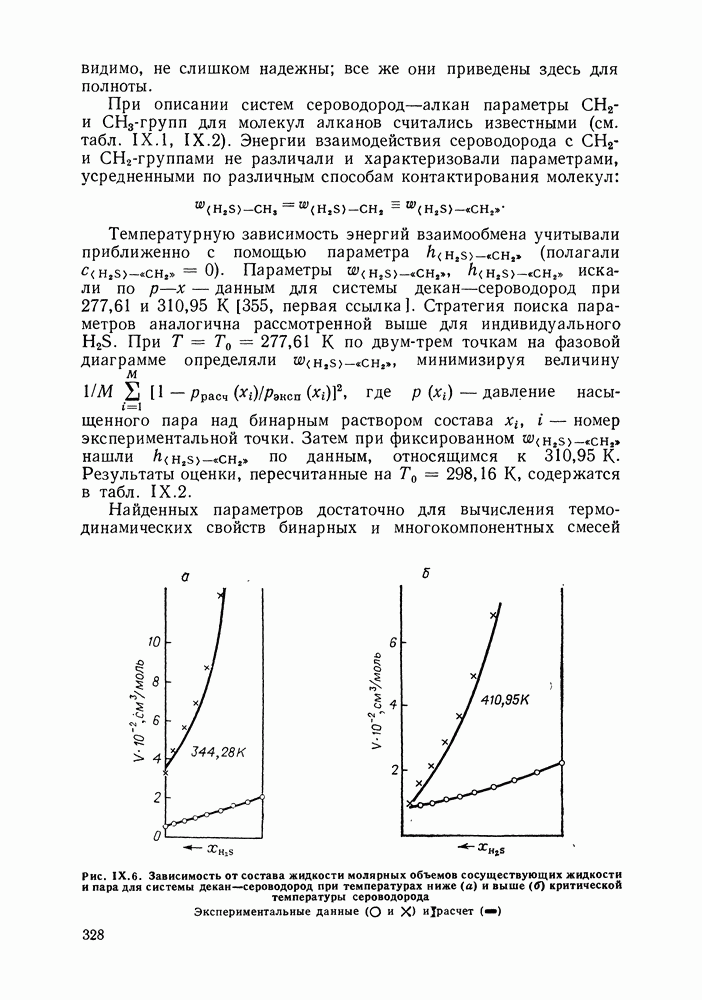
- IX.5. РЕЗУЛЬТАТЫ РАСЧЕТОВ И ВОЗМОЖНОСТИ МОДЕЛИ
- IX.6. ПРИМЕРЫ РАСЧЕТА