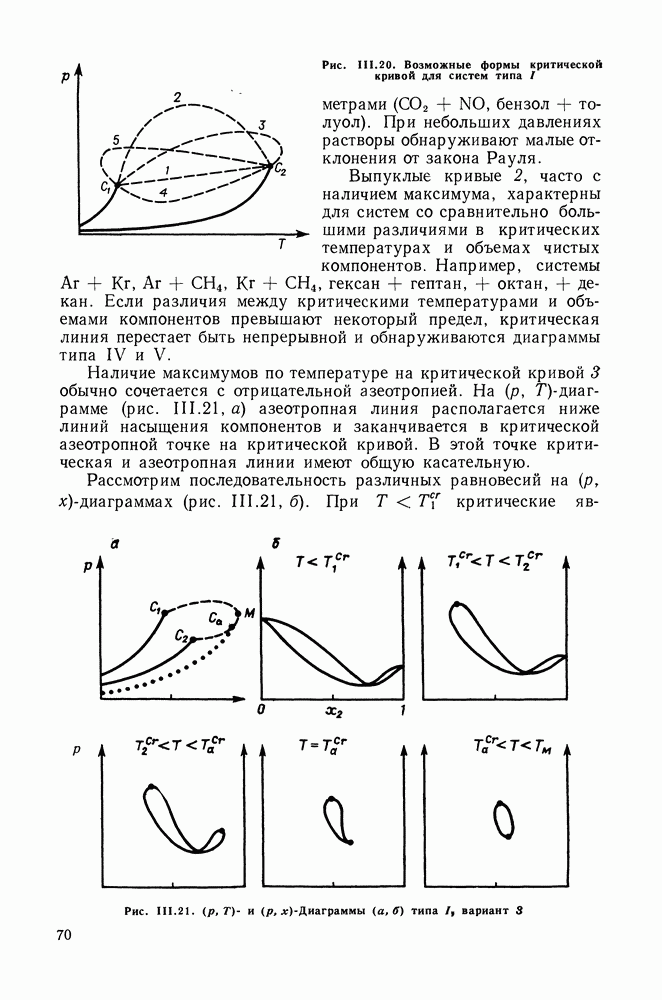
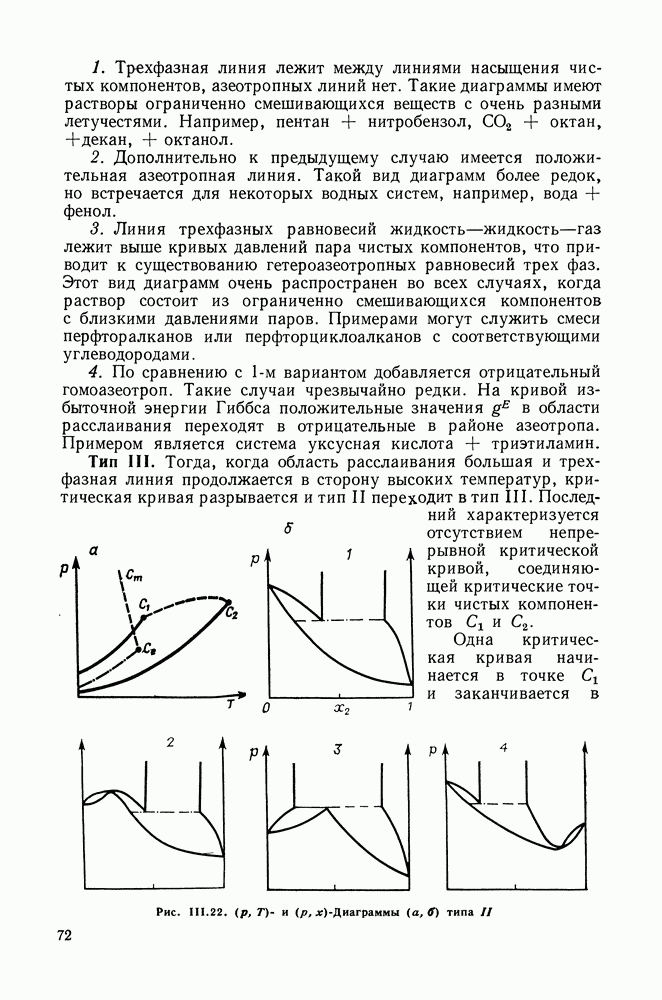
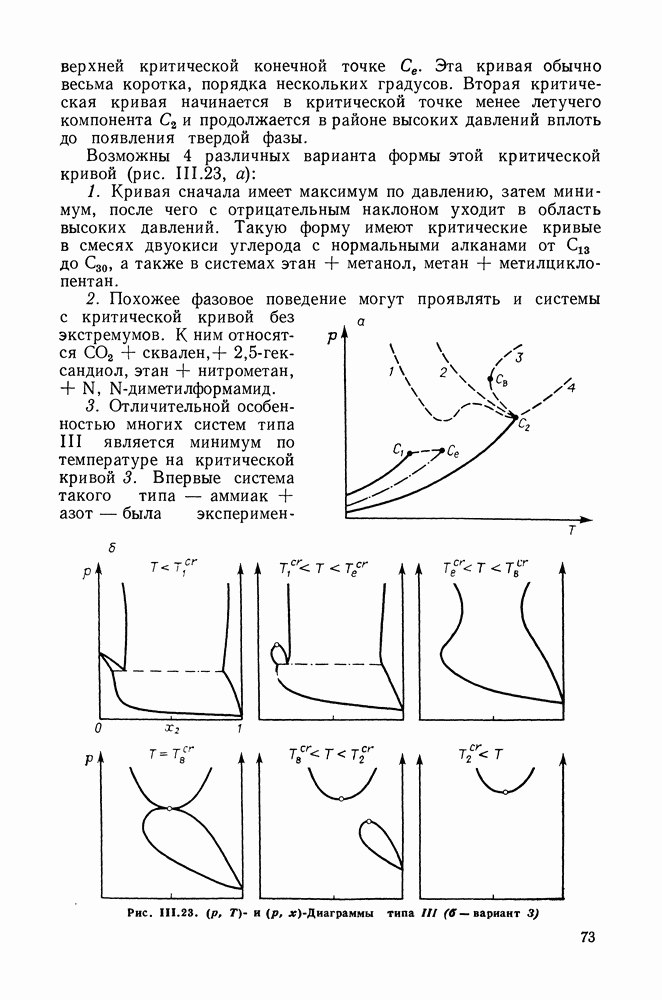
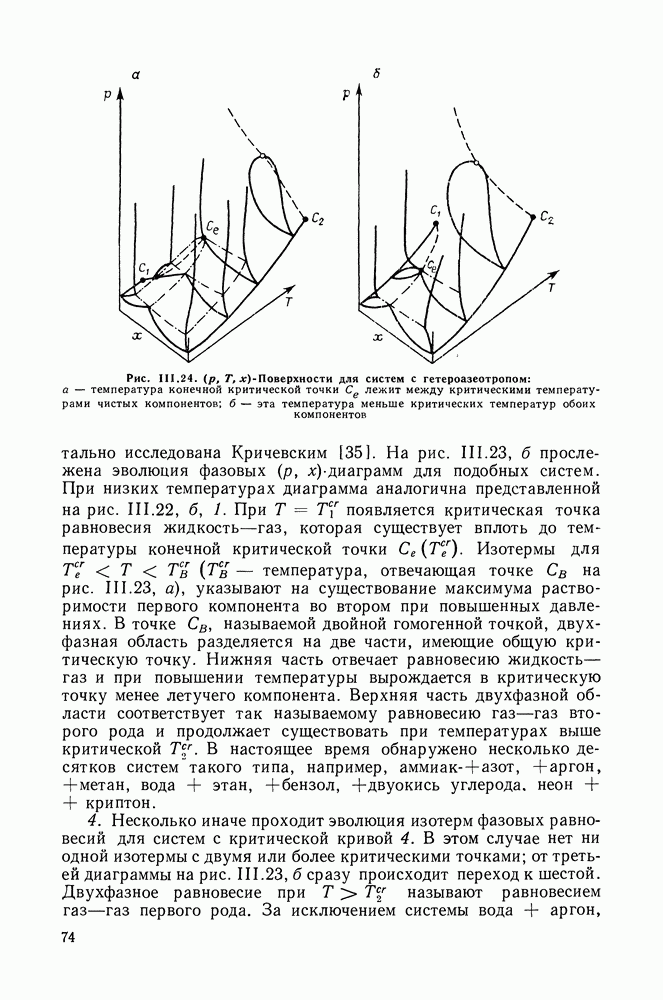
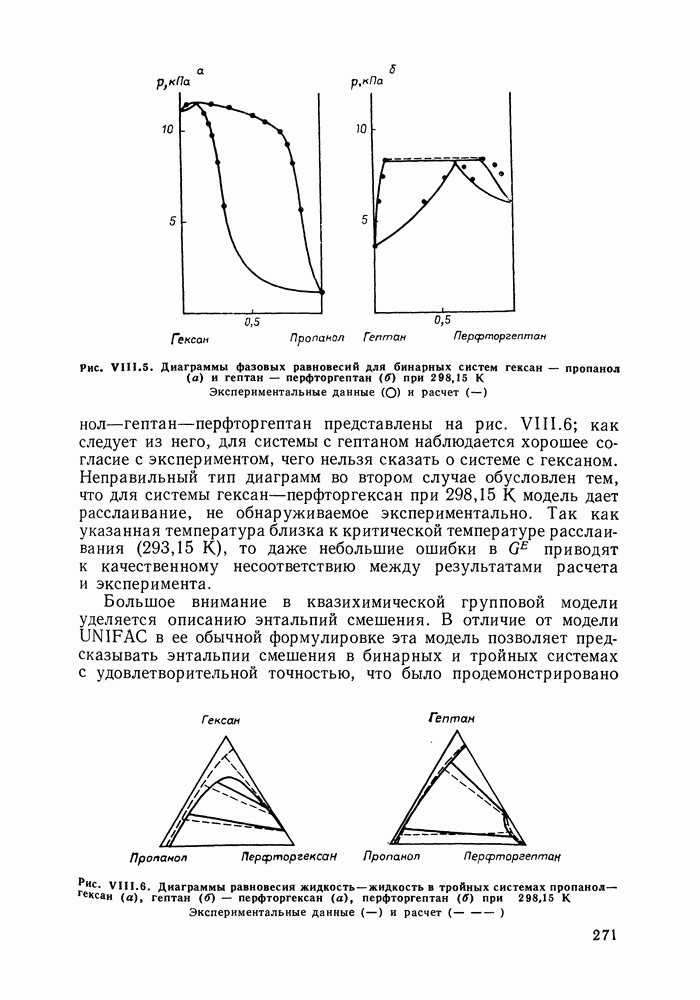
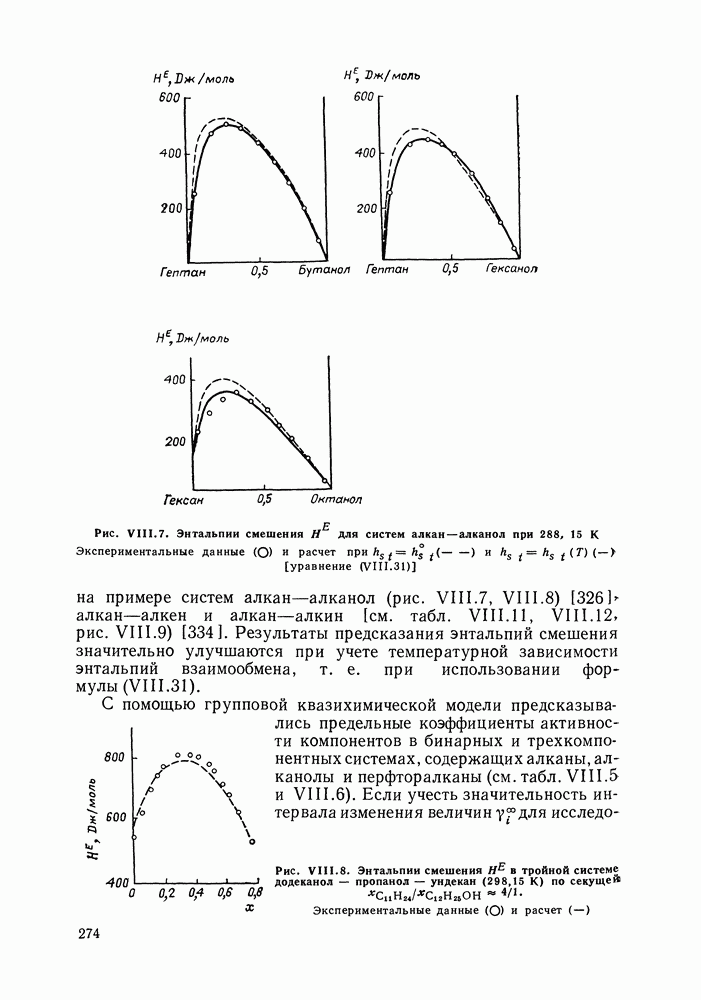
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
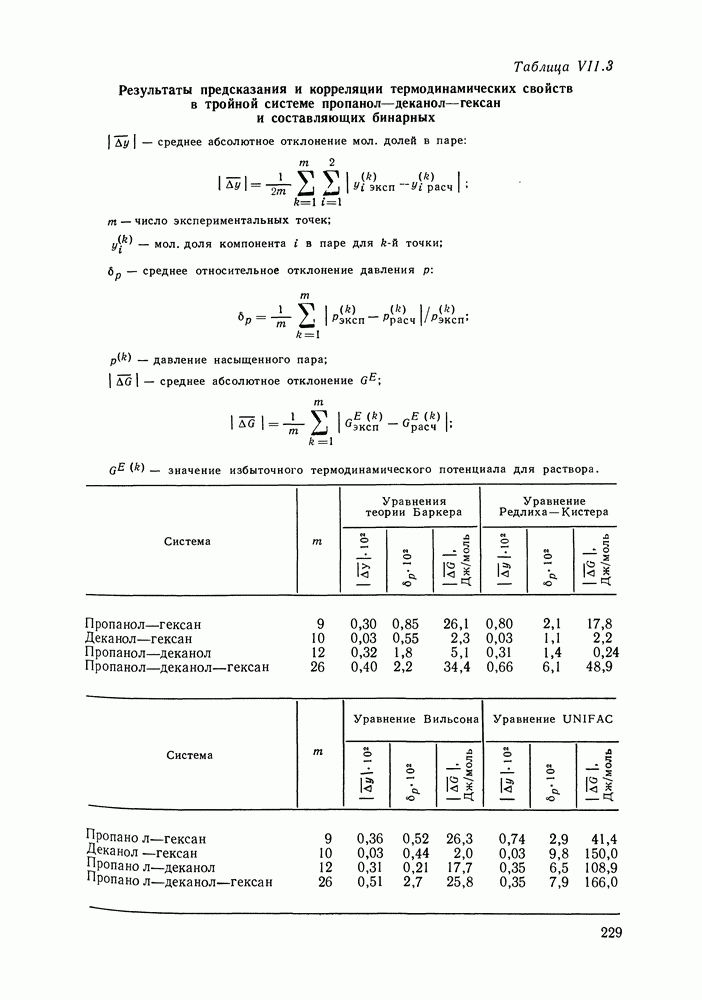
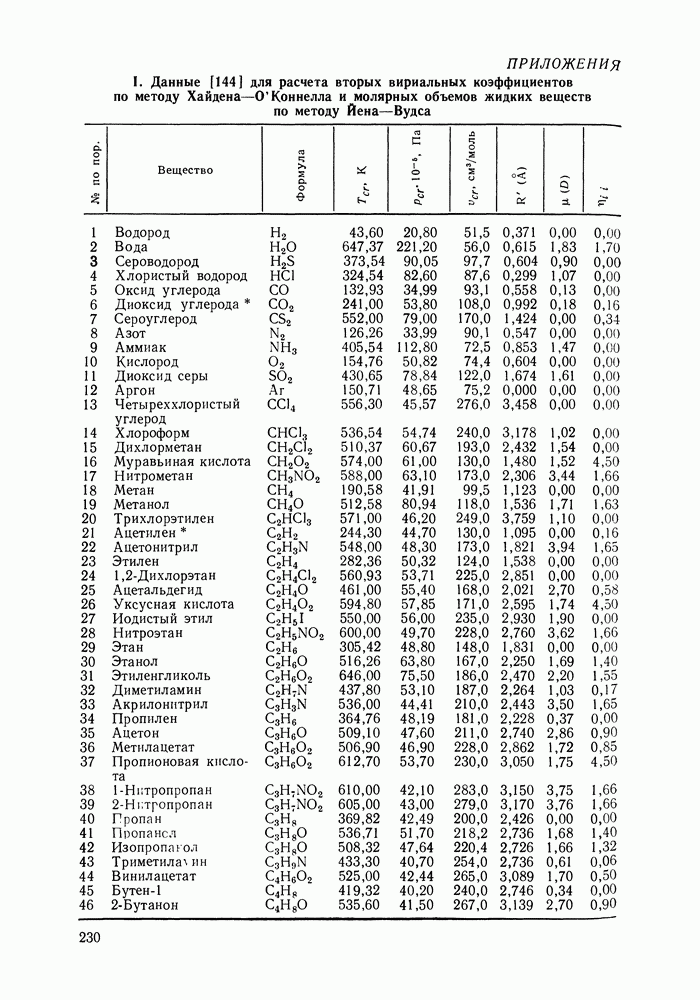
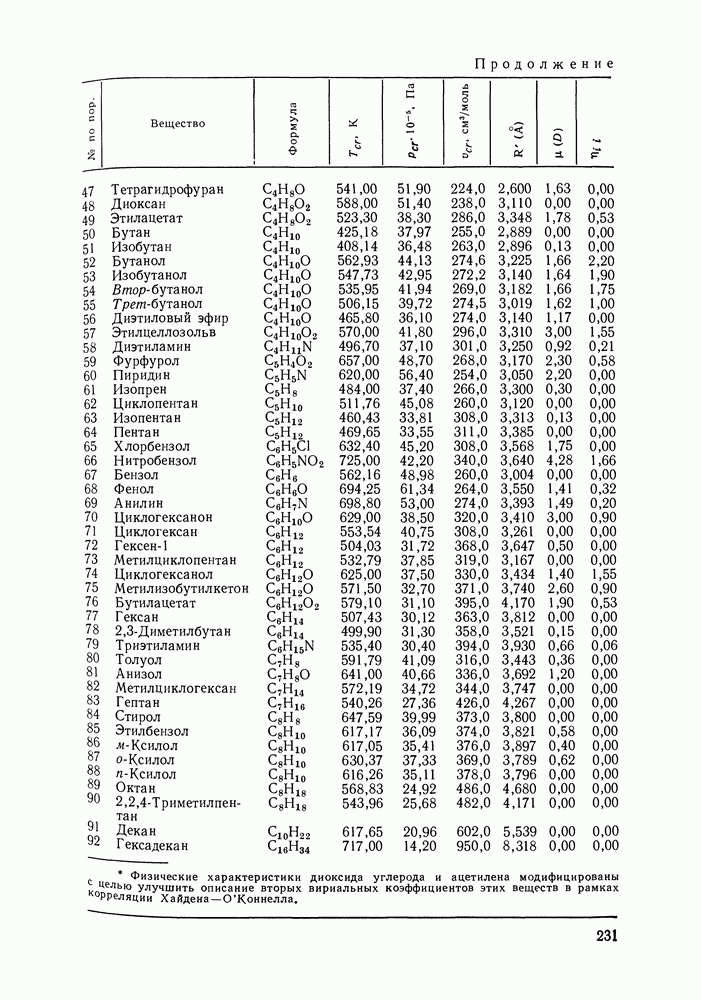
VII.4. ПОЛИНОМИАЛЬНЫЕ УРАВНЕНИЯ ДЛЯ КОЭФФИЦИЕНТОВ АКТИВНОСТИ И УРАВНЕНИЕ ВАН-ЛААРА
Многие предложенные ранее уравнения для избыточной энергии Гиббса и коэффициентов активности реализуют обычное математическое средство корреляции экспериментальных данных — представление функциональной зависимости в виде полинома. Наибольшее применение нашли уравнения Маргулеса [141, 203, 204] и Редлиха — Кистера [106]. Оба уравнения в различной форме описывают одну и ту же функциональную связь избыточной энергии Гиббса с составом раствора и, следовательно, эквивалентны по качеству описания экспериментальных данных.
Уравнения Маргулеса и Редлиха — Кистера для  бинарного раствора можно свести к разложению по степеням концентраций следующего общего вида:
бинарного раствора можно свести к разложению по степеням концентраций следующего общего вида:

 зависящие от температуры эмпирически определяемые коэффициенты (константы, параметры);
зависящие от температуры эмпирически определяемые коэффициенты (константы, параметры);  степень полинома.
степень полинома.
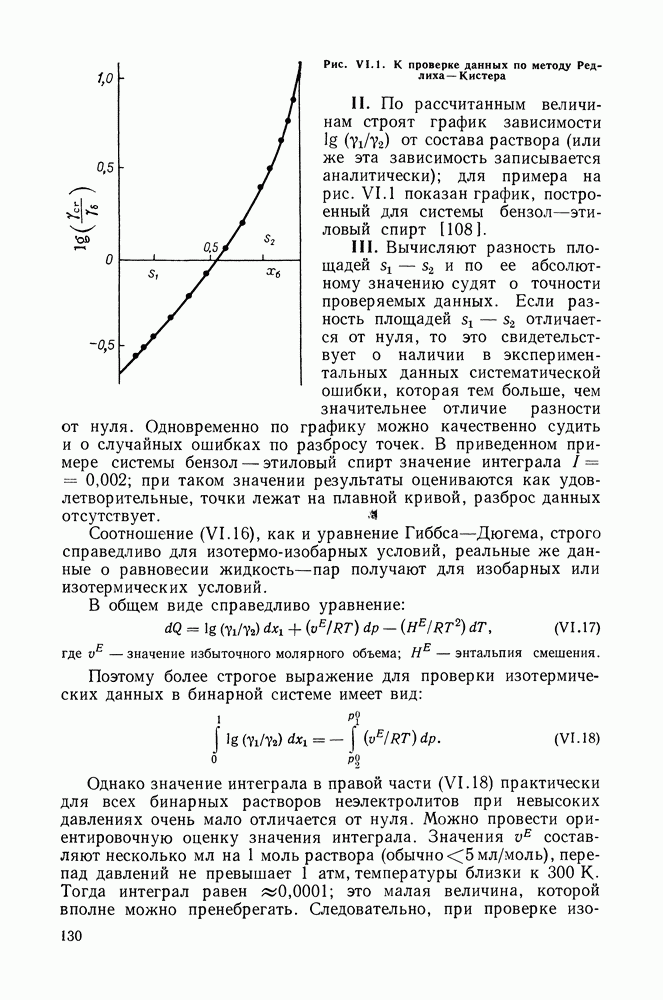
Степень полинома, необходимая для адекватного описания экспериментальных данных, определяется, в первую очередь, формой экспериментальной кривой  и может служить своеобразным показателем сложности взаимодействий в системе. Так, уравнение второй степени (с одной константой
и может служить своеобразным показателем сложности взаимодействий в системе. Так, уравнение второй степени (с одной константой  описывает зависимость
описывает зависимость  в виде симметричной параболы с экстремумом в середине концентрационного интервала и дает при всех составах
в виде симметричной параболы с экстремумом в середине концентрационного интервала и дает при всех составах
постоянное значение функции  равное
равное  Эта картина типична для простых жидкостей, образованных близкими по природе и по размерам молекул компонентами.
Эта картина типична для простых жидкостей, образованных близкими по природе и по размерам молекул компонентами.
Уравнение третьей степени (с двумя константами) описывает асимметричную кривую для  и дает линейную концентрационную зависимость
и дает линейную концентрационную зависимость  с тангенсом угла наклона
с тангенсом угла наклона  По виду экспериментальной зависимости
По виду экспериментальной зависимости  от состава растворов легко можно судить о применимости уравнений Маргулеса и Редлиха — Кистера второго и третьего порядков к той или иной системе. Уравнения четвертой и более высоких степеней способны описать весьма сложные концентрационные зависимости избыточной энергии Гиббса.
от состава растворов легко можно судить о применимости уравнений Маргулеса и Редлиха — Кистера второго и третьего порядков к той или иной системе. Уравнения четвертой и более высоких степеней способны описать весьма сложные концентрационные зависимости избыточной энергии Гиббса.
Уравнение Маргулеса четвертого порядка для  бинарного раствора (в модификации Воля) имеет вид:
бинарного раствора (в модификации Воля) имеет вид:

где  эмпирические константы уравнения.
эмпирические константы уравнения.
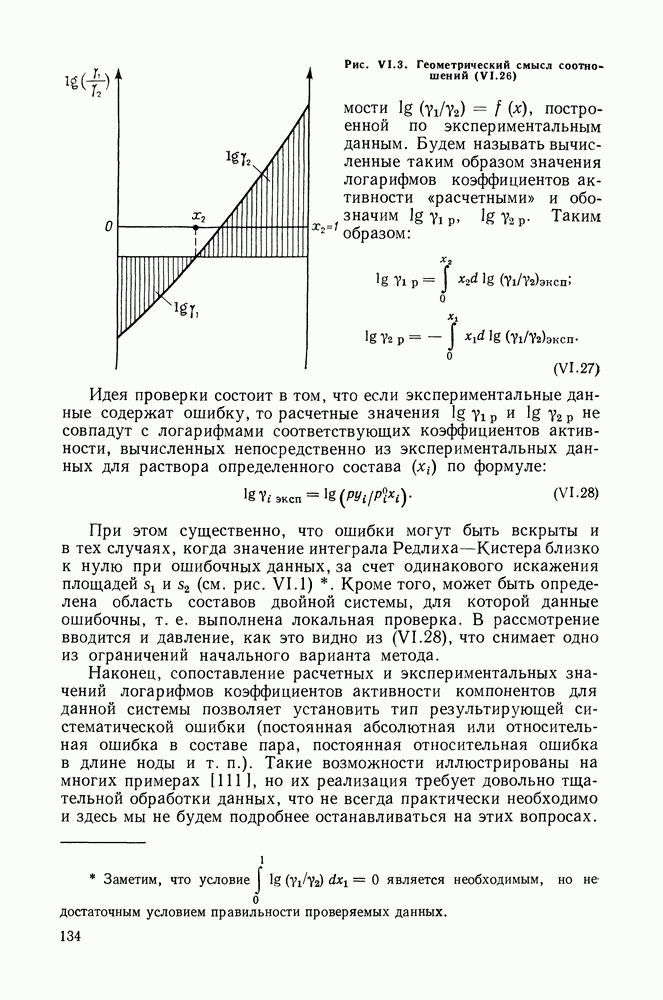
Подстановка (VII. 105) в (VII.27) дает следующие уравнения для коэффициентов активности:

При  уравнения (VII.105) и (VII. 106) обращаются в двухпараметрические уравнения Маргулеса — Карлсона — Кольборна третьего порядка.
уравнения (VII.105) и (VII. 106) обращаются в двухпараметрические уравнения Маргулеса — Карлсона — Кольборна третьего порядка.
Константы  это логарифмы предельных коэффициентов активности
это логарифмы предельных коэффициентов активности  Действительно, при
Действительно, при  из (VII. 106) следует:
из (VII. 106) следует:

Уравнения Редлиха — Кистера для и  бинарного раствора имеют вид
бинарного раствора имеют вид

Для граничных концентраций из (VII. 109) получаем:

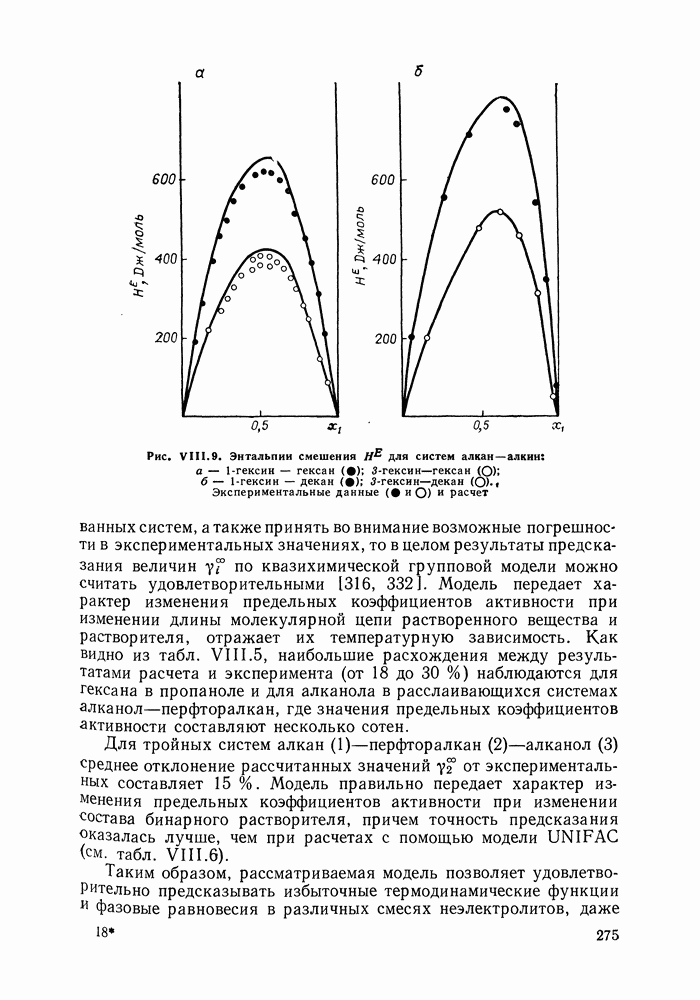
Уравнение (VII. 108) используют для аппроксимации и других избыточных свойств бинарных смесей, в частности, энтальпии смешения растворов.
Замена в уравнениях Маргулеса и Редлиха — Кистера для  переменной
переменной  на
на  и группировка слагаемых при одинаковых степенях
и группировка слагаемых при одинаковых степенях  приводит к их общей форме (VII.104), при этом обнаруживается однозначная связь констант обсуждаемых уравнений:
приводит к их общей форме (VII.104), при этом обнаруживается однозначная связь констант обсуждаемых уравнений:

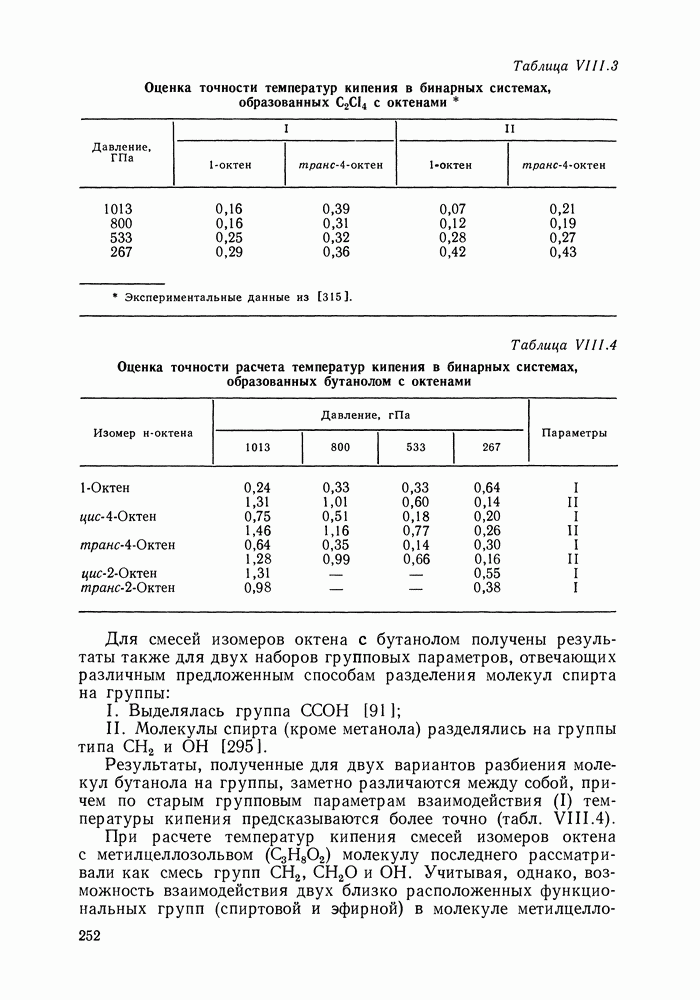
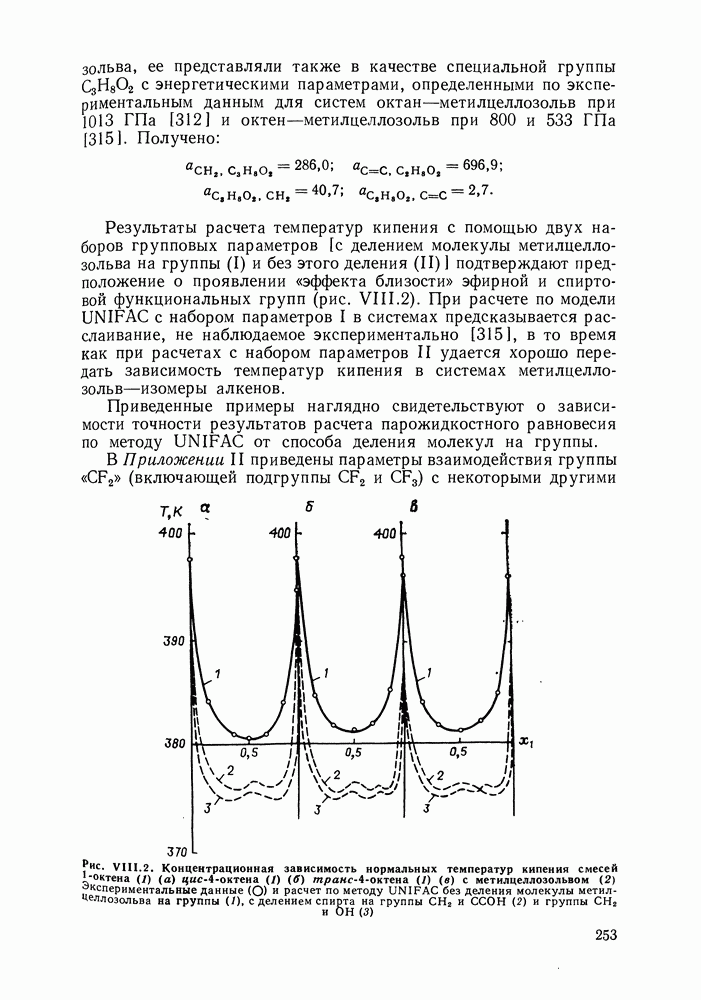
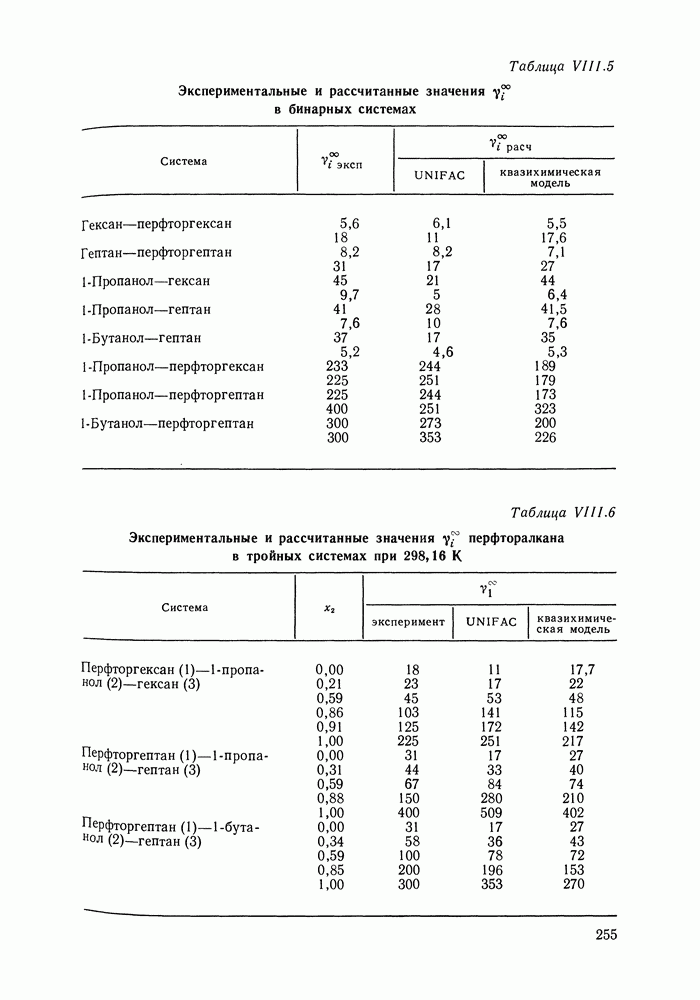
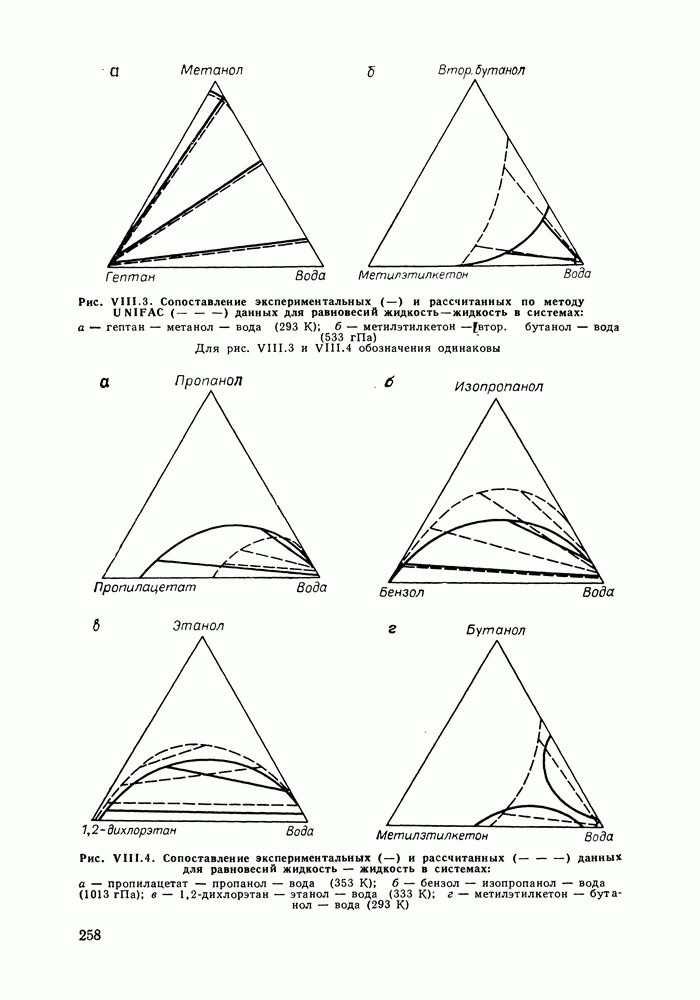
Полиномиальные уравнения, хотя и не несут в себе физического содержания, при описании бинарных систем обладают ценным качеством: при достаточном числе оцениваемых параметров они могут воспроизвести весьма сложные термодинамические согласованные концентрационные зависимости экспериментальных коэффициентов активности. В подобных случаях они могут превосходить по качеству корреляции бинарных данных другие более поздние и современные модели растворов [205].
На практике чаще всего используют уравнения Маргулеса и Редлиха — Кистера третьего или четвертого порядков (двух-или трехпараметрические). Уравнения высших порядков применяют к подробным и прецизионным данным при сложной концентрационной зависимости коэффициентов активности и повышенных требованиях к точности описания системы. Использовать уравнения высших порядков для корреляции малочисленных экспериментальных данных не целесообразно, так как повышение степени полинома может привести к осцилляции расчетных зависимостей (при описании систем с малыми отклонениями от идеальности такая осцилляция наглядно проявляется в появлении необоснованных экстремумов на кривых  Повышение степени полинома резко снижает и надежность концентрационной экстраполяции данных.
Повышение степени полинома резко снижает и надежность концентрационной экстраполяции данных.
Обобщения уравнений Маргулеса и Редлиха — Кистера на случай многокомпонентных систем [206] содержат, наряду с бинарными параметрами, параметры, оцениваемые по данным для многокомпонентной системы. Хотя этими дополнительными параметрами часто пренебрегают, неспособность теоретически обоснованно описать свойства многокомпонентного раствора по данным только для бинарных систем — наиболее существенный недостаток полиномиальных уравнений.
Другие недостатки уравнений Маргулеса и Редлиха — Кистера — неопределенность в необходимом числе параметров и отсутствие учета влияния температуры на коэффициенты активности. Последнее ограничивает возможность температурной экстраполяции данных о фазовых равновесиях с помощью этих Уравнений.
Итак, полиномиальные модели можно оценить как полезное средство корреляции экспериментальных данных для бинарных систем, в том числе систем со сложным характером межмолекулярных взаимодействий, в ограниченном интервале температур. В этом качестве они и сейчас сохраняют свое значение. Их недостатки при описании многокомпонентных систем вряд ли устранимы и, хотя математический подход к проблеме время от времени продолжает развиваться [207], наибольшее признание получают модели, выведенные из определенных физических предпосылок.
Уравнение Ван-Лаара [63] — вероятно, первое уравнение
рассматриваемого типа, выведенное с помощью физических представлений о свойствах растворов. Ван-Лаар рассмотрел изобарный процесс образования жидкого раствора из компонентов, включающий стадии испарения чистых веществ, их смешения в разреженном идеальном газовом состоянии и последующего сжатия и конденсации смеси до исходного давления. Он допускал нулевые значения избыточных объемов и энтропии процесса (соответственно, избыточная энергия Гиббса равна избыточной внутренней энергии) и подчинение флюидных фаз уравнению состояния Ван-дер-Ваальса, причем константы этого уравнения для смесей он представил с помощью простых комбинационных правил на основе констант для чистых компонентов. Ван-Лаар просуммировал изменение внутренней энергии на отдельных стадиях процесса образования раствора, результат может быть представлен в виде следующих уравнений для  в бинарной системе:
в бинарной системе:

В модели Ван-Лаара величины  аналитически связаны с константами уравнения Ван-дер-Ваальса, однако выяснилось, что последние не обеспечивают адекватное описание систем, в частности, из-за большой чувствительности модели к произвольно выбранным комбинационным правилам для констант уравнения состояния. Если же рассматривать величины
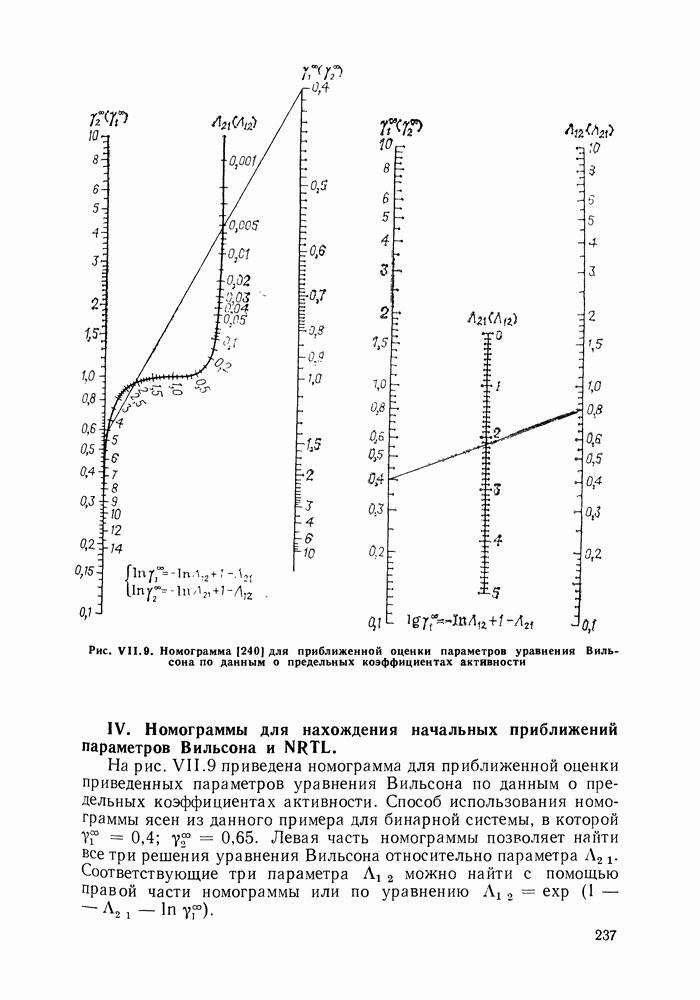
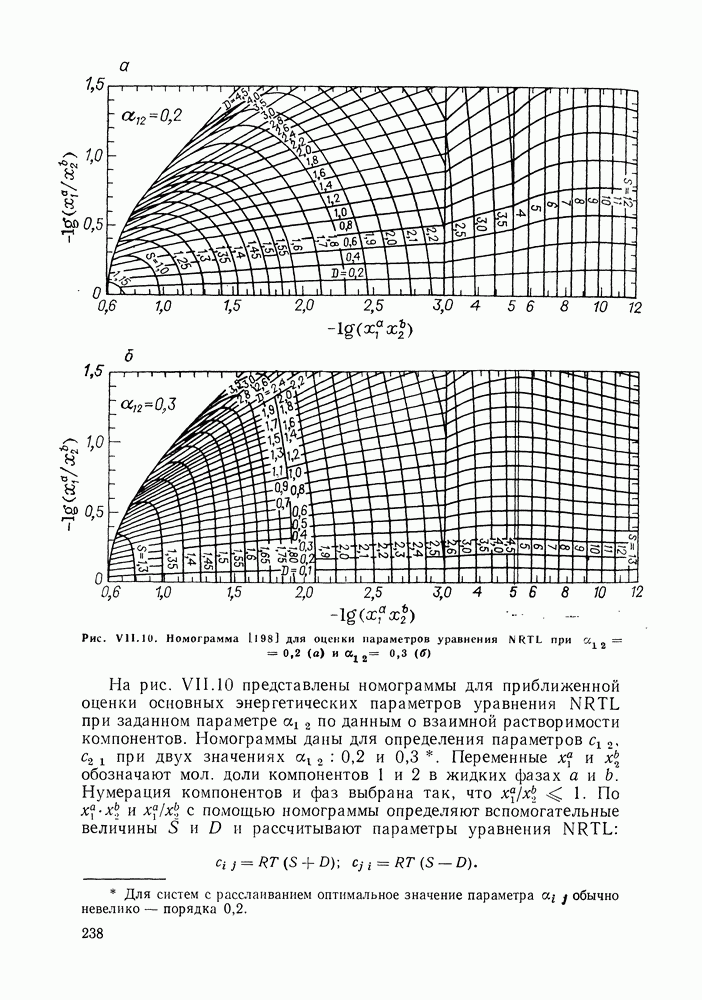
аналитически связаны с константами уравнения Ван-дер-Ваальса, однако выяснилось, что последние не обеспечивают адекватное описание систем, в частности, из-за большой чувствительности модели к произвольно выбранным комбинационным правилам для констант уравнения состояния. Если же рассматривать величины  как самостоятельные эмпирические параметры, оцениваемые по экспериментальным данным о бинарной системе, соотношения (VII.112) и (VII.113) превращаются в простые корреляционные уравнения, удовлетворительно описывающие многие системы. В таком виде они нашли широкое применение (например, уравнение Ван-Лаара является одним из стандартных уравнений при описании парожидкостного равновесия в обширном собрании экспериментальных данных [208]). Воль [141, 204] распространил это уравнение на многокомпонентные системы.
как самостоятельные эмпирические параметры, оцениваемые по экспериментальным данным о бинарной системе, соотношения (VII.112) и (VII.113) превращаются в простые корреляционные уравнения, удовлетворительно описывающие многие системы. В таком виде они нашли широкое применение (например, уравнение Ван-Лаара является одним из стандартных уравнений при описании парожидкостного равновесия в обширном собрании экспериментальных данных [208]). Воль [141, 204] распространил это уравнение на многокомпонентные системы.
В уравнениях Ван-Лаара характер связи избыточных термодинамических функций с составом иной, чем в двухпараметрических уравнениях Маргулеса и Редлиха — Кистера: уравнение (VII.112) связывает величину  с составом раствора нелинейно, и линейно связывает с составом обратную величину,
с составом раствора нелинейно, и линейно связывает с составом обратную величину,  . Последнее и определяет область применимости уравнений Ван-Лаара. В среднем же это уравнение и двухпараметрические уравнения-полиномы — уравнения одного класса точности. Их точность обычно вполне удовлетворительна для систем малой или умеренной неидеальности и недостаточна для систем с большими отклонениями от идеального поведения.
. Последнее и определяет область применимости уравнений Ван-Лаара. В среднем же это уравнение и двухпараметрические уравнения-полиномы — уравнения одного класса точности. Их точность обычно вполне удовлетворительна для систем малой или умеренной неидеальности и недостаточна для систем с большими отклонениями от идеального поведения.
Ряд ранних уравнений, в том числе и Маргулеса, и Ван-Лаара, входят как частные случаи в более общее уравнение Воля [141, 204]. Однако само оно, будучи более сложным по форме, особых преимуществ перед ними не обнаружило и получило ограниченное применение. Дополнительные сведения об этих уравнениях можно почерпнуть в [17, 63, 209].
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА
- Глава I. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕРМОДИНАМИКИ ГЕТЕРОГЕННЫХ РАВНОВЕСИЙ
- 1.2. УСЛОВИЯ РАВНОВЕСИЯ ГЕТЕРОГЕННЫХ СИСТЕМ
- 1.3. ТИПЫ РАВНОВЕСИЙ
- 1.4. УСЛОВИЯ УСТОЙЧИВОСТИ
- 1.5. ПРАВИЛО ФАЗ
- Глава II. ОДНОКОМПОНЕНТНЫЕ СИСТЕМЫ
- II.1. ДИАГРАММЫ СОСТОЯНИЯ
- II.2. УРАВНЕНИЕ КЛАУЗИУСА—КЛАПЕЙРОНА
- II.3. ЗАВИСИМОСТЬ ДАВЛЕНИЯ ОТ ТЕМПЕРАТУРЫ. УРАВНЕНИЕ АНТУАНА
- II.4. ЗАКОН СООТВЕТСТВЕННЫХ СОСТОЯНИЙ
- II.5. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА. ДРУГИЕ АНАЛИТИЧЕСКИЕ УРАВНЕНИЯ СОСТОЯНИЯ
- II.6. ВИРИАЛЬНОЕ УРАВНЕНИЕ СОСТОЯНИЯ
- Глава III. ДВОЙНЫЕ СИСТЕМЫ
- III.1. ДИАГРАММЫ РАВНОВЕСИЯ ДЛЯ ДВОЙНЫХ СИСТЕМ
- III.2. ОБОБЩЕННОЕ ДИФФЕРЕНЦИАЛЬНОЕ УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- III.3. ЗАКОНЫ КОНОВАЛОВА
- III.4. ЗАКОНЫ ВРЕВСКОГО
- III.5. ИДЕАЛЬНЫЕ СИСТЕМЫ
- III.6. РАЗБАВЛЕННЫЕ РАСТВОРЫ
- III.7 РЕАЛЬНЫЕ СИСТЕМЫ
- III.8. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СМЕШЕНИЯ И РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР
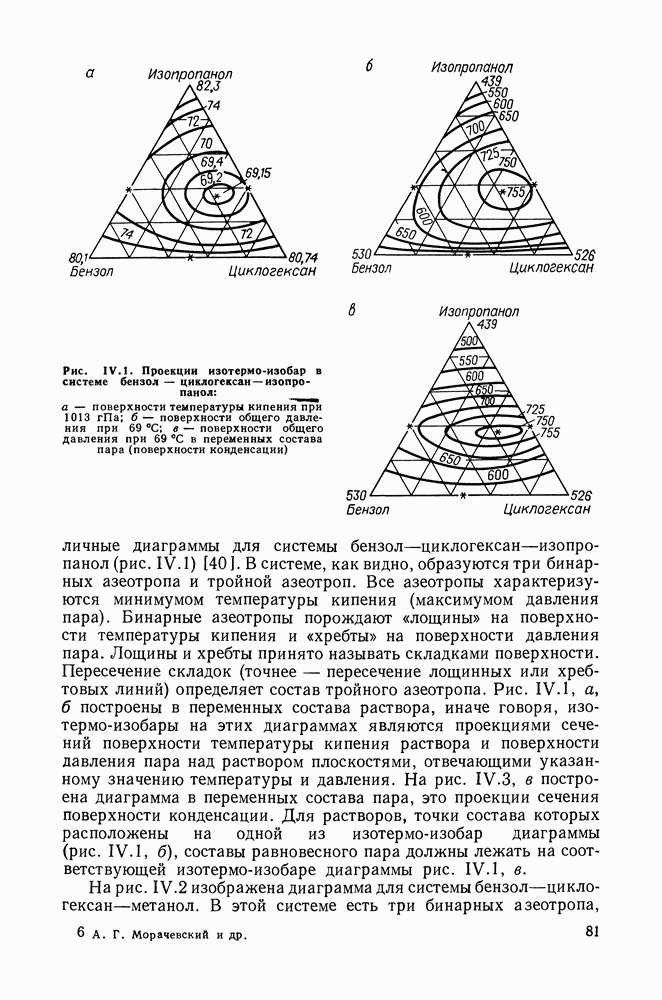
- III.9. ОБ АЗЕОТРОПИИ В БИНАРНЫХ СИСТЕМАХ
- III.10. ТРЕХФАЗНЫЕ РАВНОВЕСИЯ ЖИДКОСТЬ—ЖИДКОСТЬ—ПАР В ДВОЙНЫХ СИСТЕМАХ
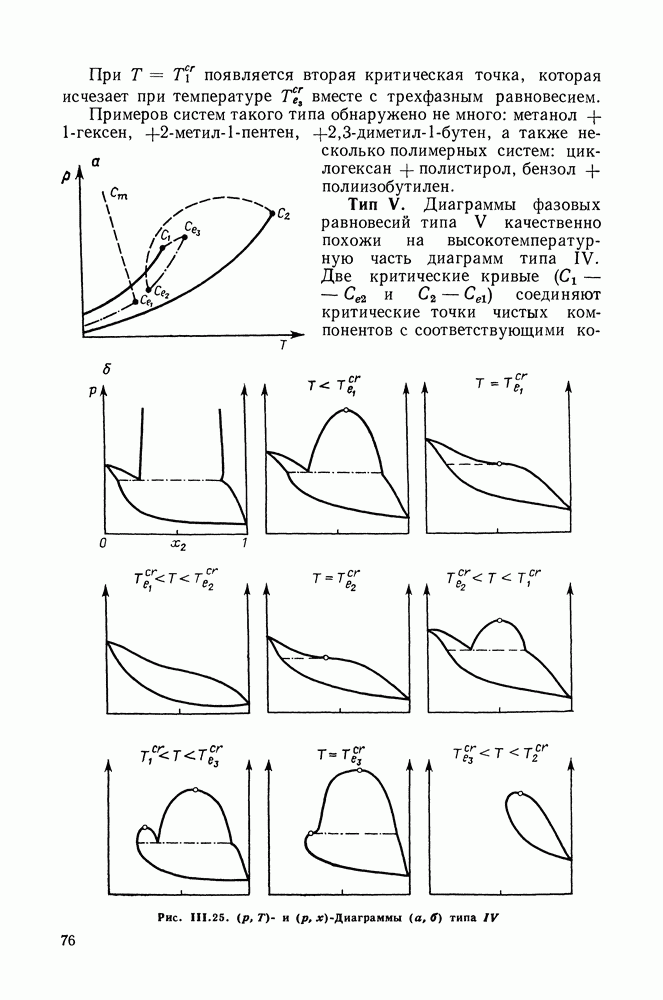
- III.11. ФАЗОВЫЕ ДИАГРАММЫ БИНАРНЫХ СИСТЕМ В ШИРОКОМ ИНТЕРВАЛЕ ТЕМПЕРАТУР И ДАВЛЕНИЙ
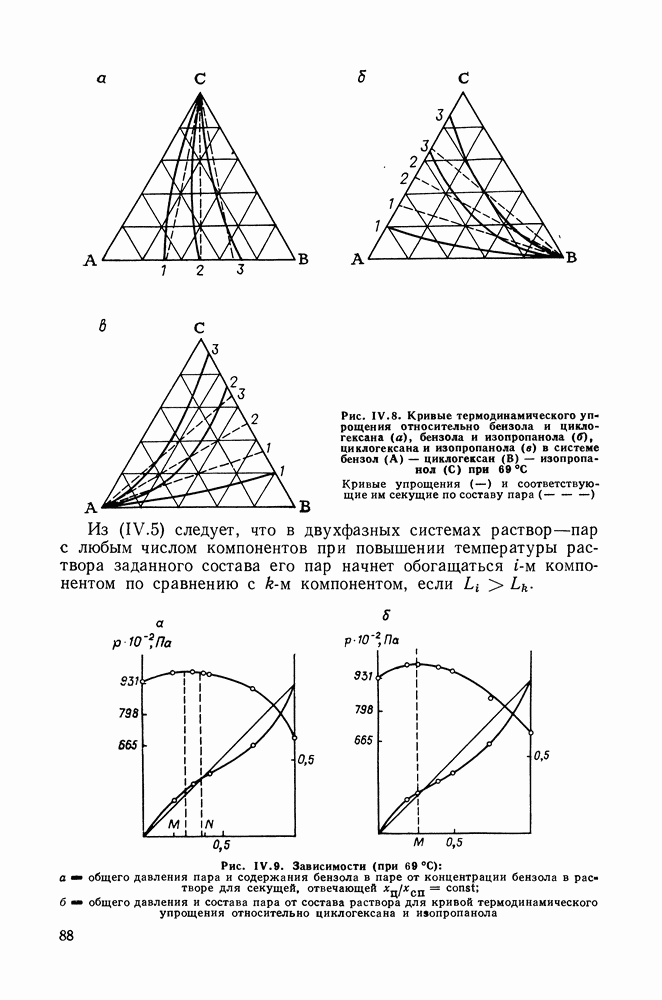
- Глава IV. ТРОЙНЫЕ И МНОГОКОМПОНЕНТНЫЕ СИСТЕМЫ
- IV.2. ПРОЯВЛЕНИЕ ЗАКОНОВ КОНОВАЛОВА И ВРЕВСКОГО В ТРОЙНЫХ И МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ
- IV.3. ОТКРЫТЫЕ ФАЗОВЫЕ ПРОЦЕССЫ. ТЕРМОДИНАМИКО-ТОПОЛОГИЧЕСКИЕ ЗАКОНОМЕРНОСТИ
- Глава V. МЕТОДЫ ЭКСПЕРИМЕНТАЛЬНОГО ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР
- V.I. ЦИРКУЛЯЦИОННЫЙ МЕТОД
- V.2. МЕТОД ОТКРЫТОГО ИСПАРЕНИЯ
- V.3. МЕТОД СТРУИ ИНЕРТНОГО ГАЗА
- V.4. СТАТИЧЕСКИЙ МЕТОД
- V.5. ИЗОПИЕСТИЧЕСКИЙ МЕТОД
- V.6. ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
- V.7. РАСЧЕТ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР ПО ЗАВИСИМОСТИ ДАВЛЕНИЯ ПАРА ОТ СОСТАВА РАСТВОРА ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ
- V.8. МЕТОДЫ ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР С ПОМОЩЬЮ ГАЗОВОЙ ХРОМАТОГРАФИИ
- V.9. РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР ДЛЯ РАЗБАВЛЕННЫХ РАСТВОРОВ
- Глава VI. МЕТОДЫ ПРОВЕРКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ-ПАР
- VI.2. ОБЩАЯ ОЦЕНКА ТЕРМОДИНАМИЧЕСКИХ МЕТОДОВ ПРОВЕРКИ И ИСПРАВЛЕНИЯ ДАННЫХ
- VI.3. ПРОВЕРКА ДАННЫХ С ПОМОЩЬЮ УРАВНЕНИЙ ГИББСА—ДЮГЕМА И ДЮГЕМА—МАРГУЛЕСА
- VI.4. МЕТОД РЕДЛИХА—КИСТЕРА
- VI.5. МЕТОД ВАН-НЕССА
- VI.6. СТАТИСТИЧЕСКИЕ МЕТОДЫ ОБРАБОТКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР
- VI.7. МЕТОДЫ ПРОВЕРКИ ТЕРМОДИНАМИЧЕСКОЙ СОГЛАСОВАННОСТИ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР В ТРОЙНЫХ СИСТЕМАХ
- VI.8. СОПОСТАВЛЕНИЕ МЕТОДОВ РЕДЛИХА—КИСТЕРА И ВАН-НЕССА
- Глава VII. МЕТОДЫ РАСЧЕТА РАВНОВЕСИЙ ЖИДКОСТЬ—ПАР
- VII. 1. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ РАВНОВЕСНЫХ ЖИДКОСТИ И ПАРА
- VII.2. АЛГОРИТМЫ РАСЧЕТА ФАЗОВЫХ РАВНОВЕСИЙ
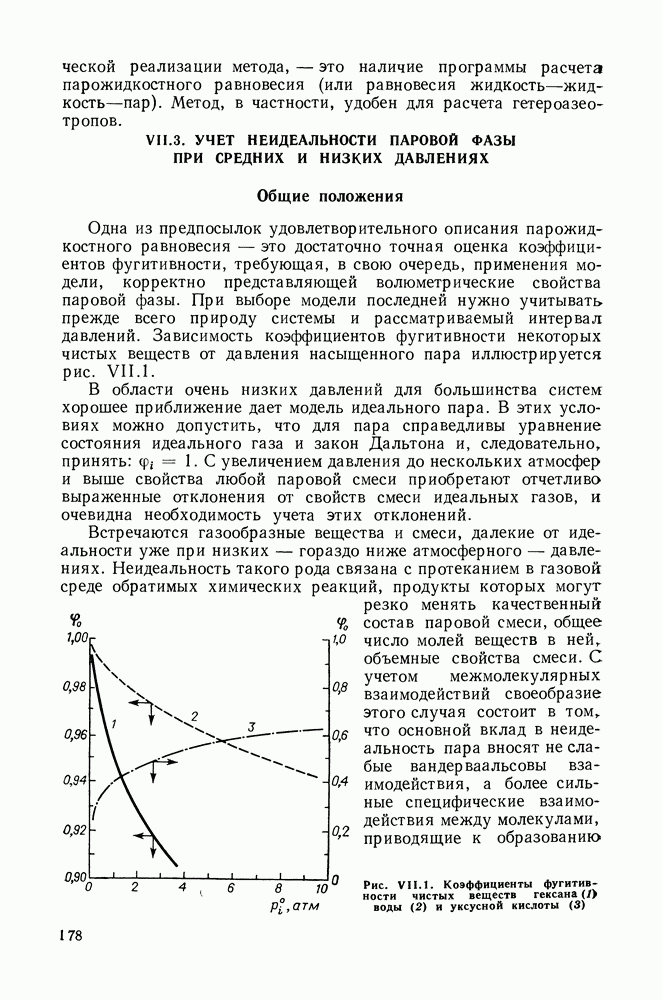
- VII.3. УЧЕТ НЕИДЕАЛЬНОСТИ ПАРОВОЙ ФАЗЫ ПРИ СРЕДНИХ И НИЗКИХ ДАВЛЕНИЯХ
- VII.4. ПОЛИНОМИАЛЬНЫЕ УРАВНЕНИЯ ДЛЯ КОЭФФИЦИЕНТОВ АКТИВНОСТИ И УРАВНЕНИЕ ВАН-ЛААРА
- VII.5. МОДЕЛИ ЛОКАЛЬНОГО СОСТАВА
- VII.6. ОЦЕНКА ПАРАМЕТРОВ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ
- VII.7. СОПОСТАВЛЕНИЕ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ ПРИ ОПИСАНИИ ФАЗОВЫХ РАВНОВЕСИЙ
- VII.8. РЕШЕТОЧНЫЕ МОДЕЛИ. МОДЕЛЬ БАРКЕРА
- Глава VIII. ГРУППОВЫЕ МОДЕЛИ РАСТВОРОВ
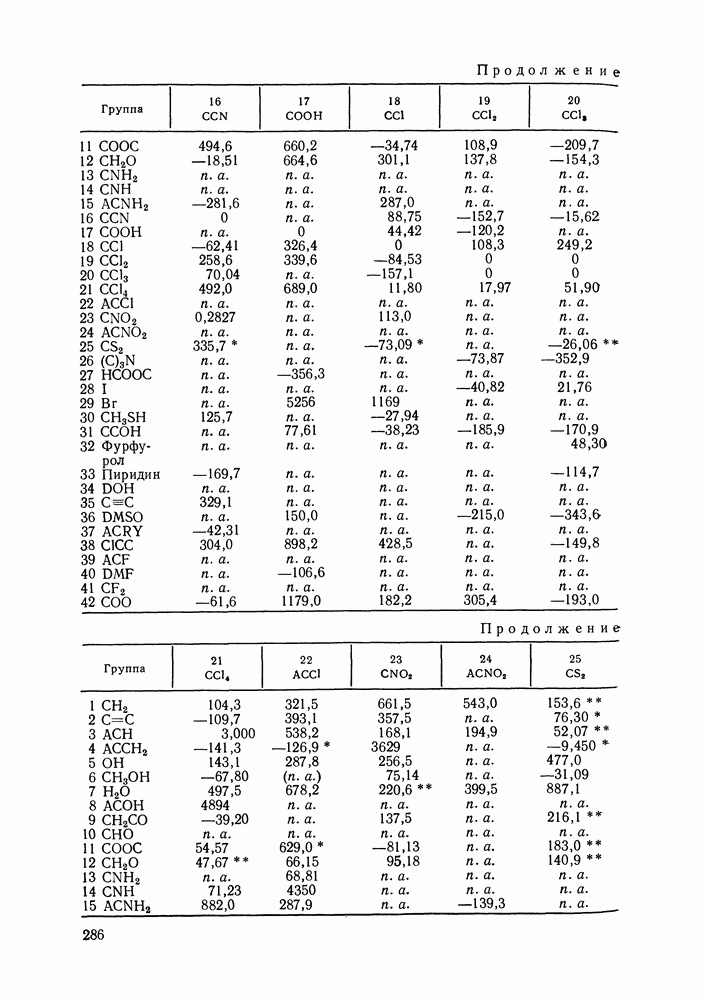
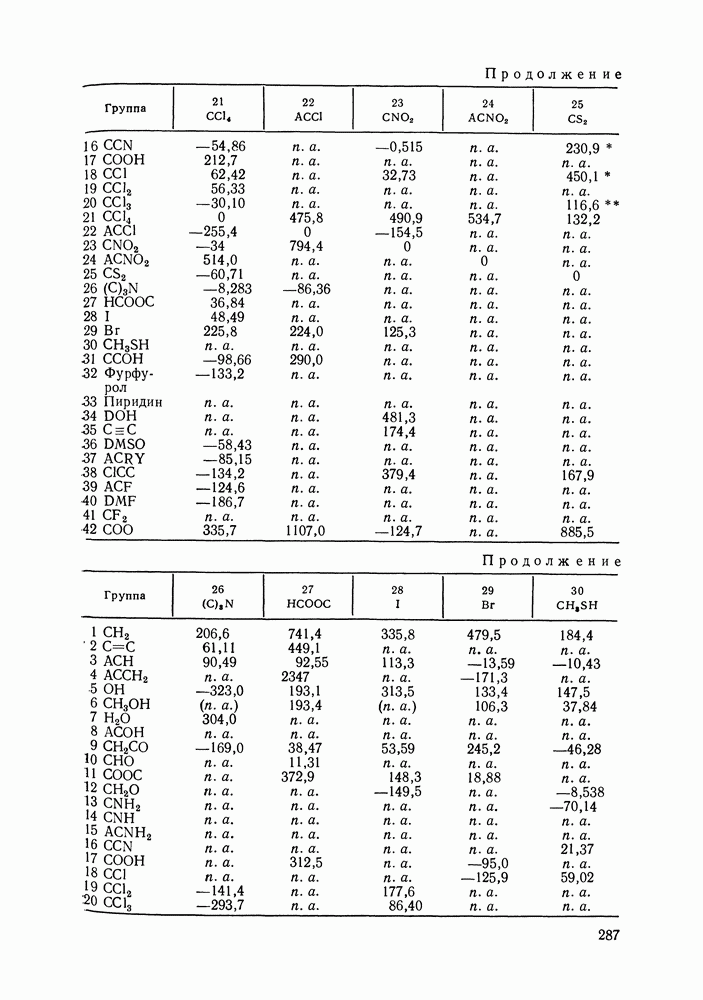
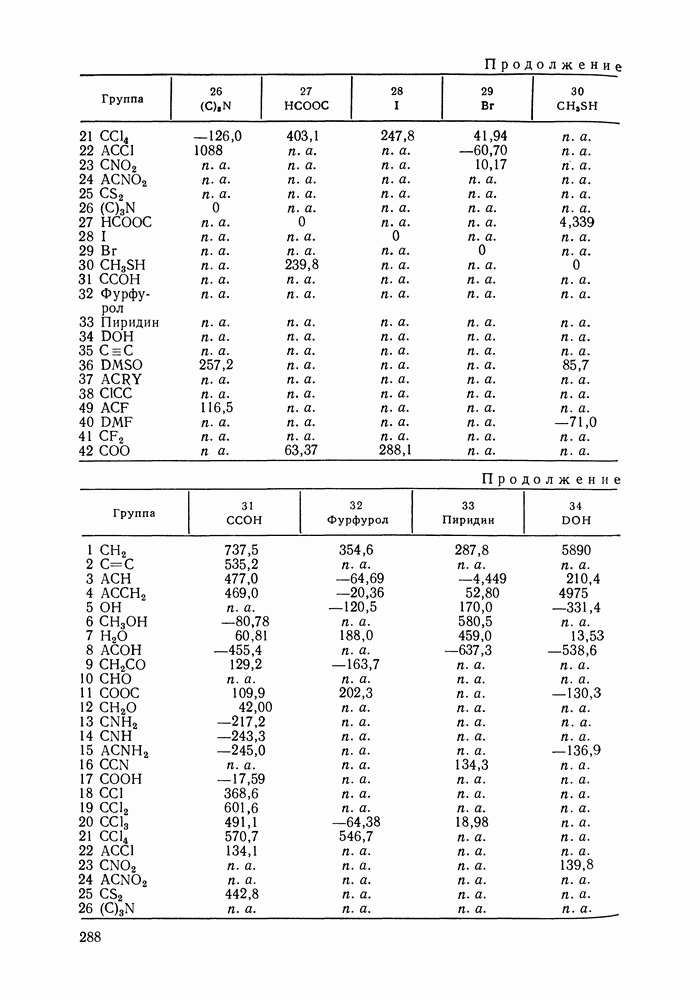
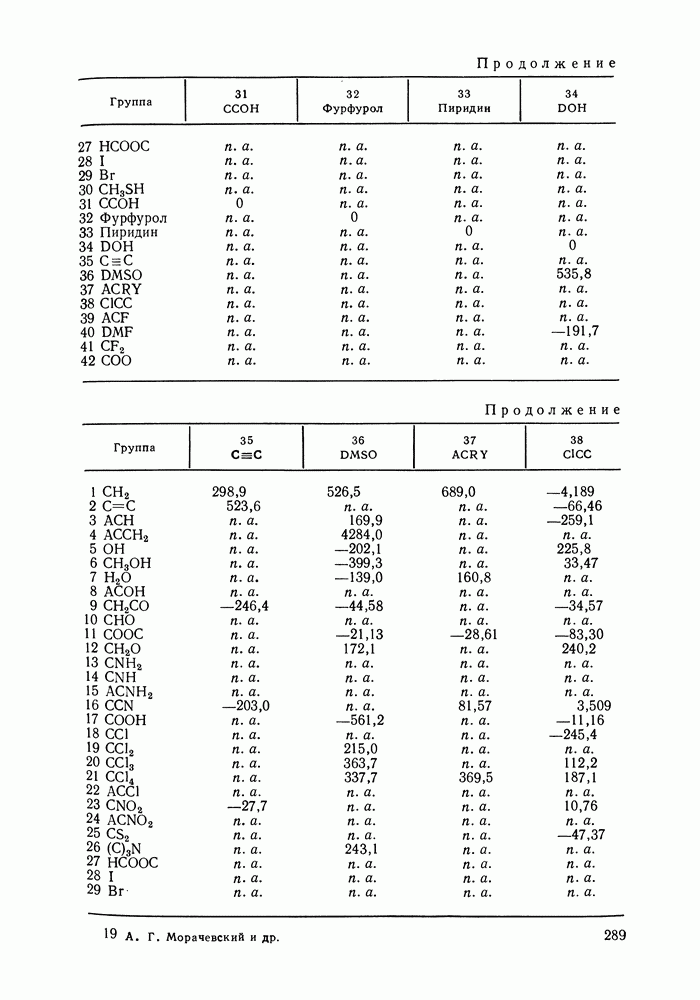
- VIII.1. ОСНОВНЫЕ ОСОБЕННОСТИ ГРУППОВЫХ МОДЕЛЕЙ РАСТВОРОВ
- VIII.2. МОДЕЛЬ UNIFAC
- VIII.3. КВАЗИХИМИЧЕСКИЕ ГРУППОВЫЕ МОДЕЛИ
- Глава IX. ДЫРОЧНАЯ РЕШЕТОЧНАЯ КВАЗИХИМИЧЕСКАЯ МОДЕЛЬ, ЕЕ ГРУППОВОЙ ВАРИАНТ
- IX.2. ФОРМУЛИРОВКА ДЫРОЧНОЙ КВАЗИХИМИЧЕСКОЙ МОДЕЛИ
- IX.3. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СИСТЕМЫ
- IX.4. О МЕТОДИКЕ РАСЧЕТА
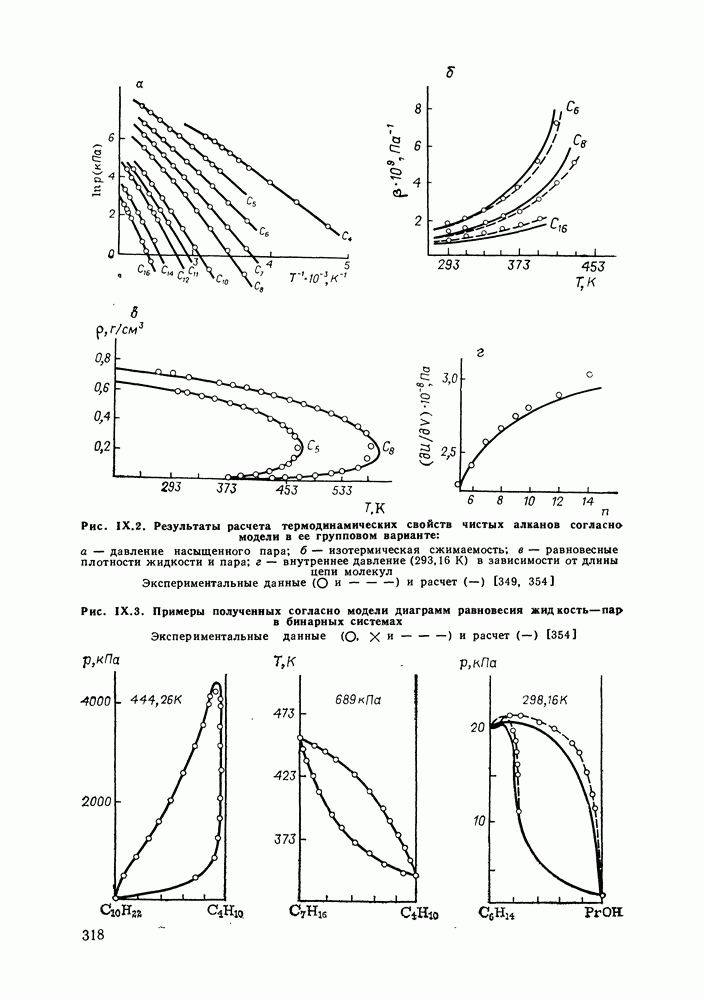
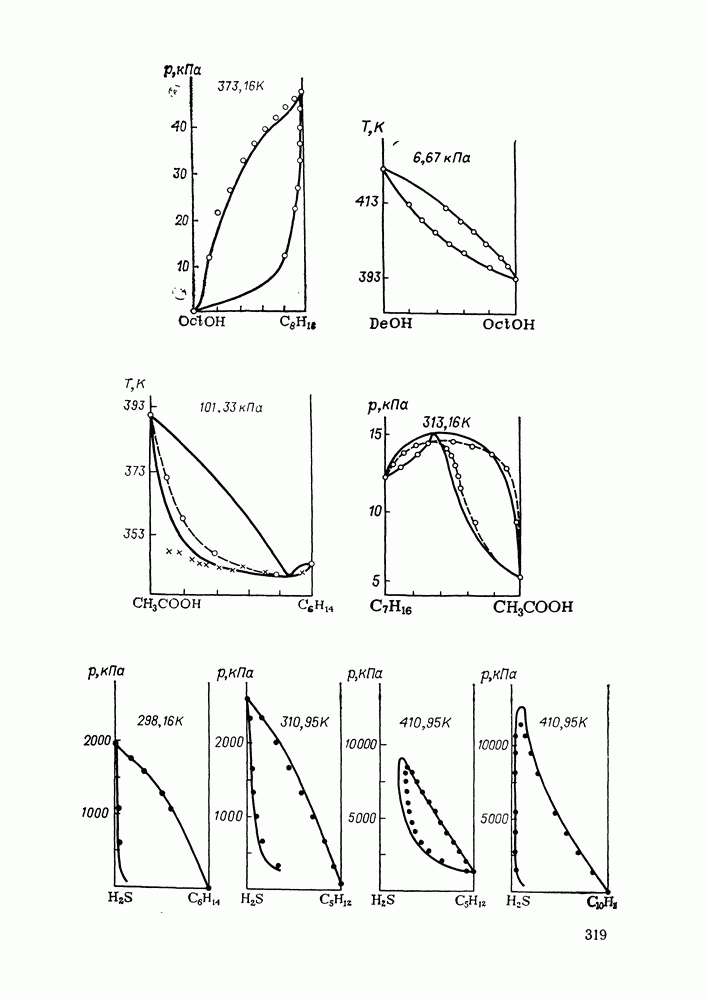
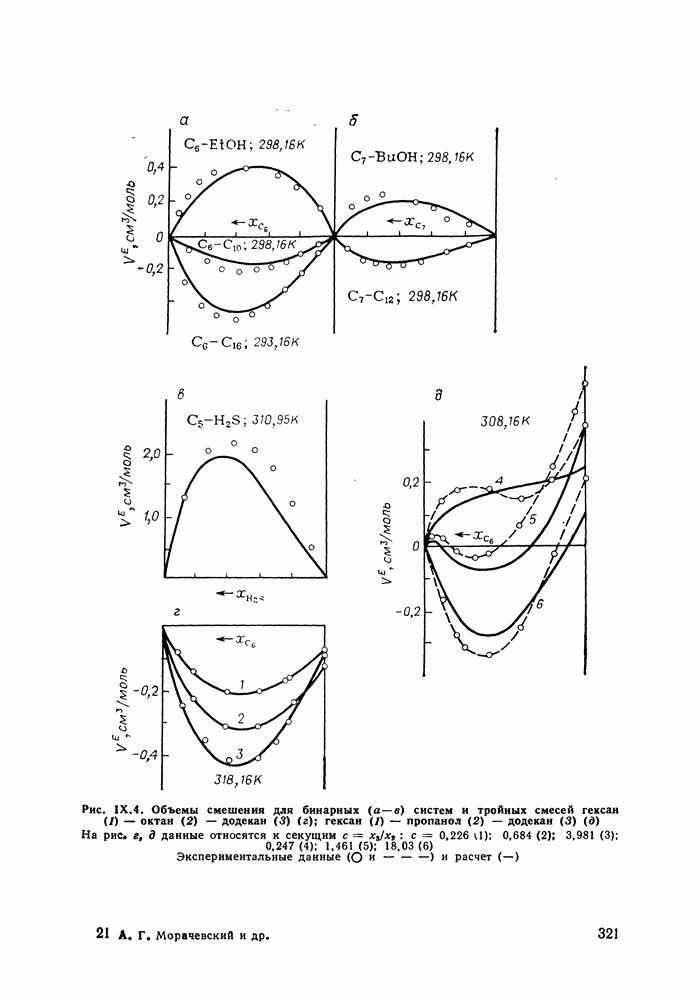
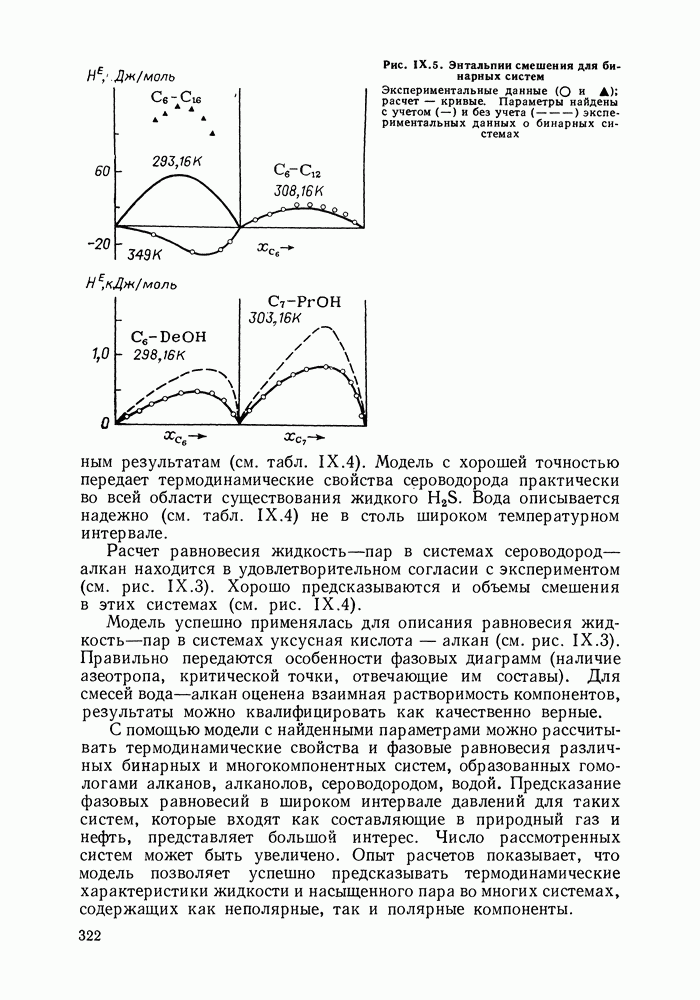
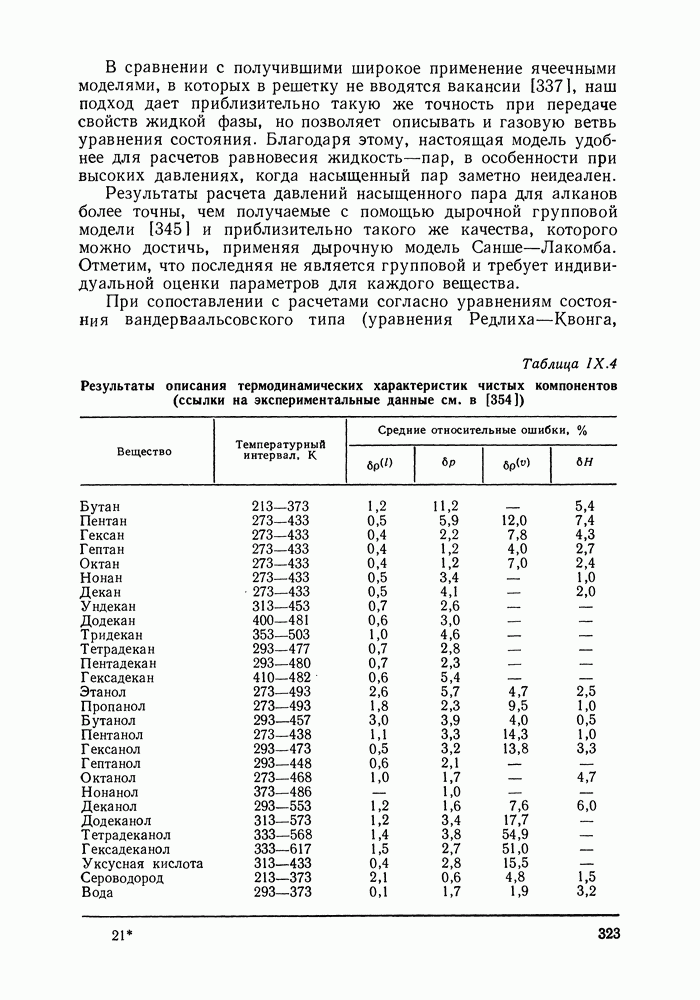
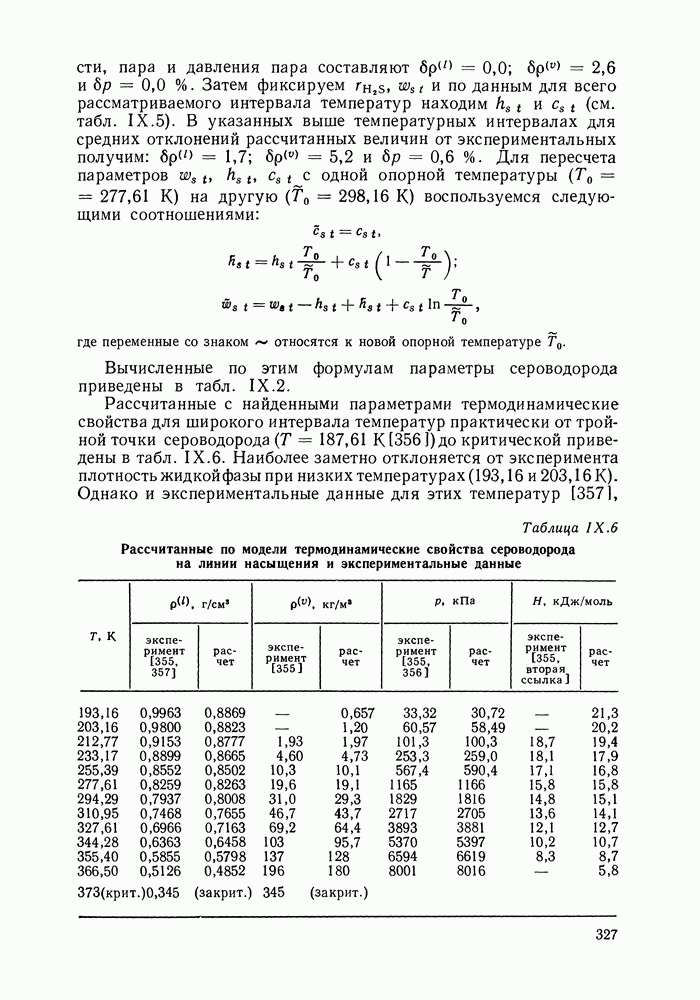
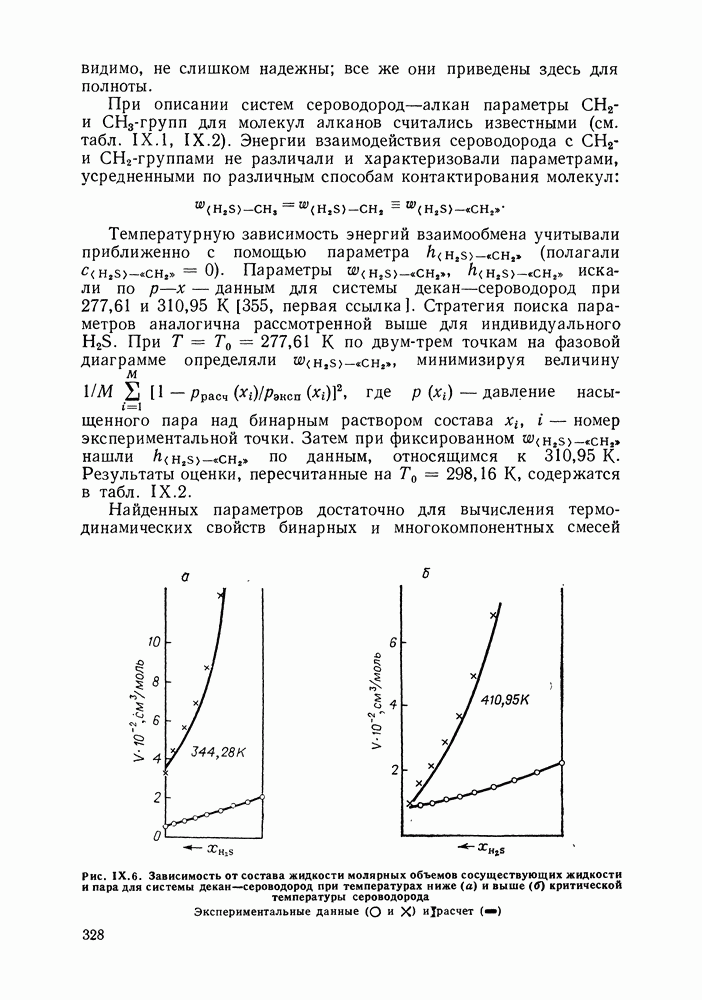
- IX.5. РЕЗУЛЬТАТЫ РАСЧЕТОВ И ВОЗМОЖНОСТИ МОДЕЛИ
- IX.6. ПРИМЕРЫ РАСЧЕТА