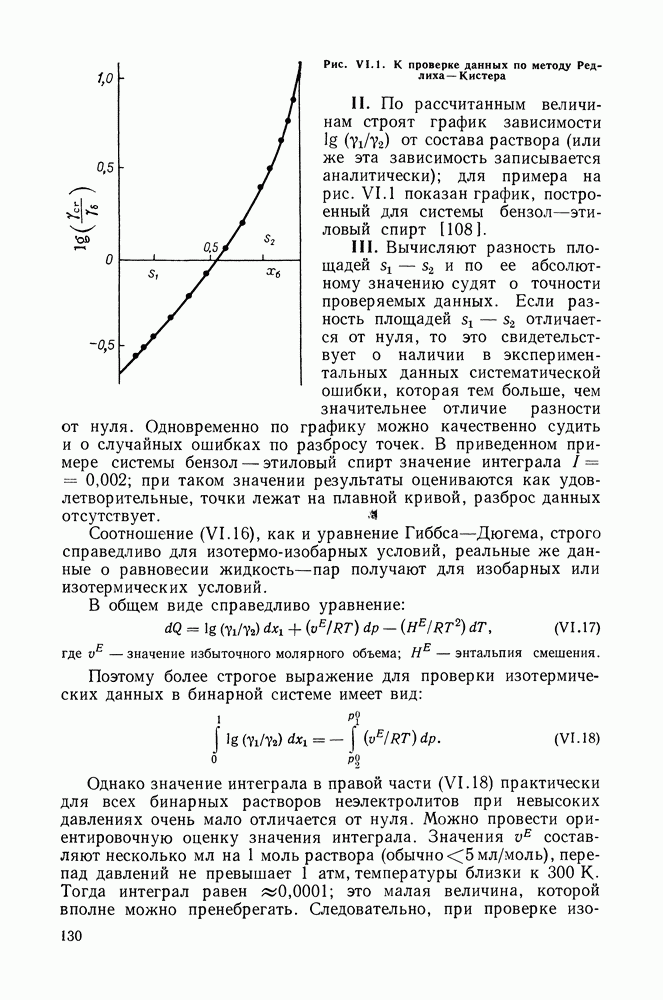
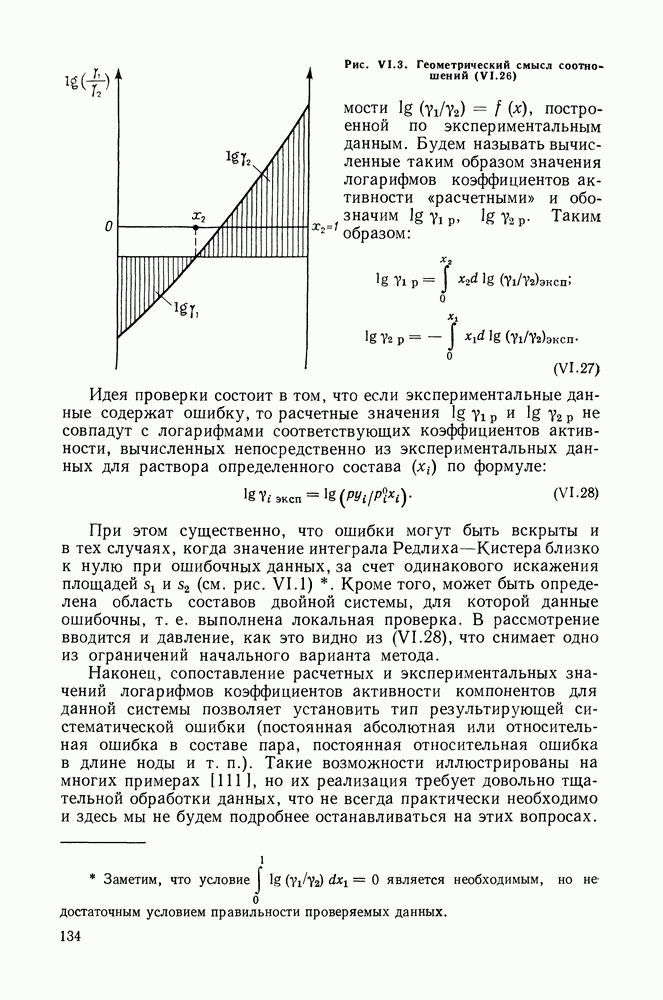
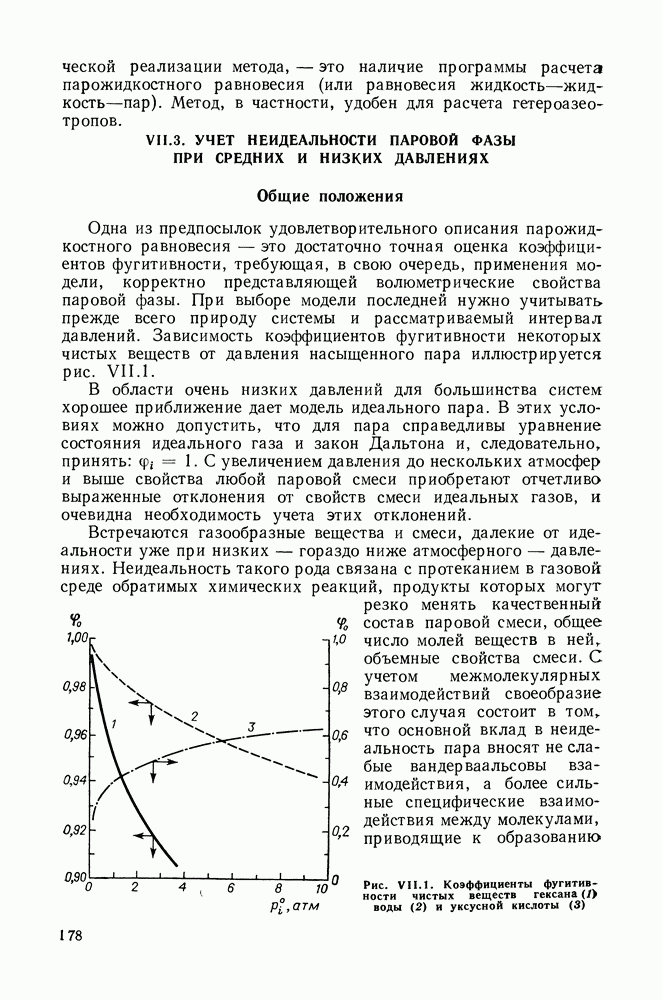
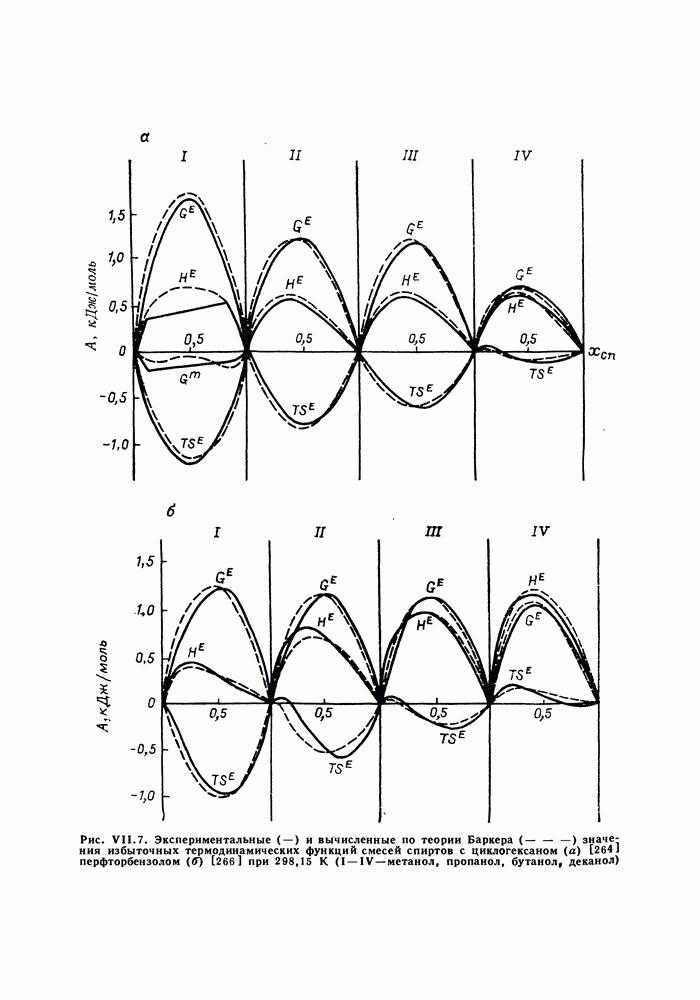
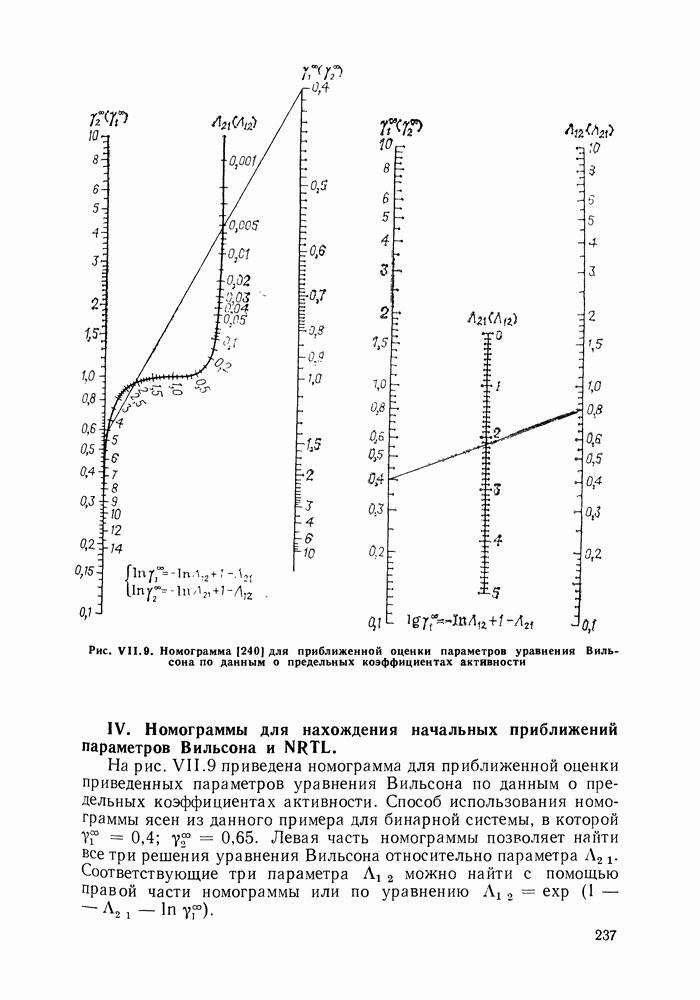
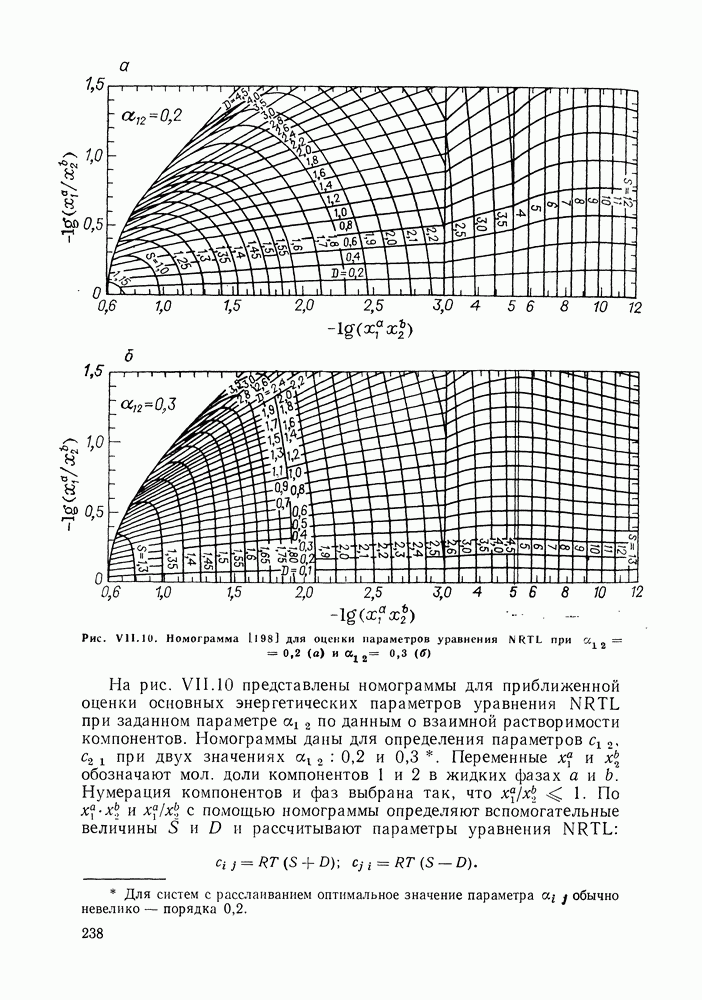
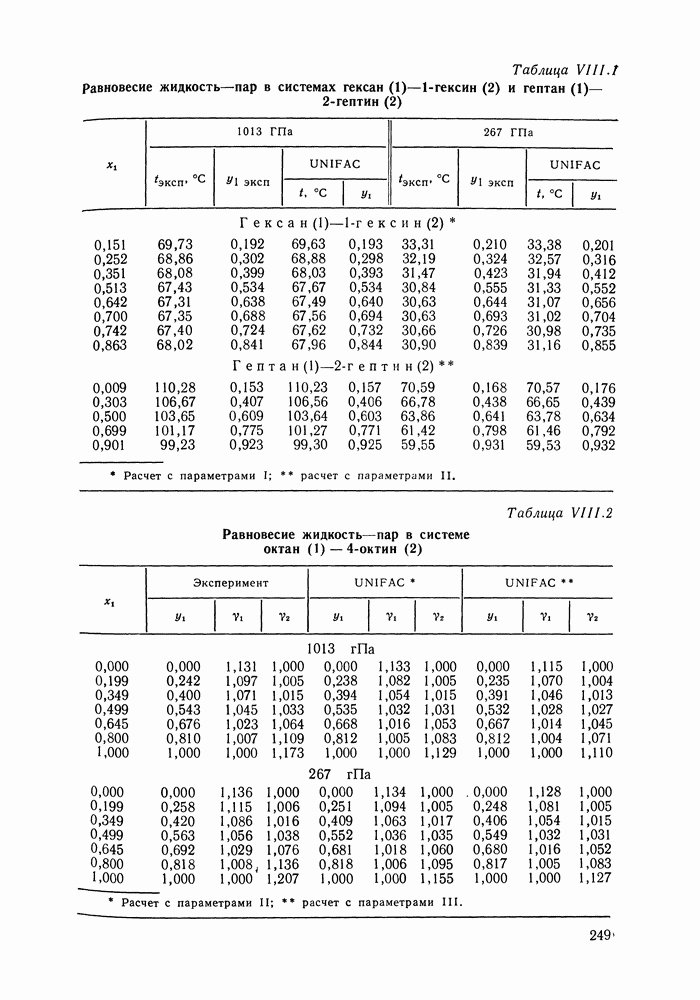
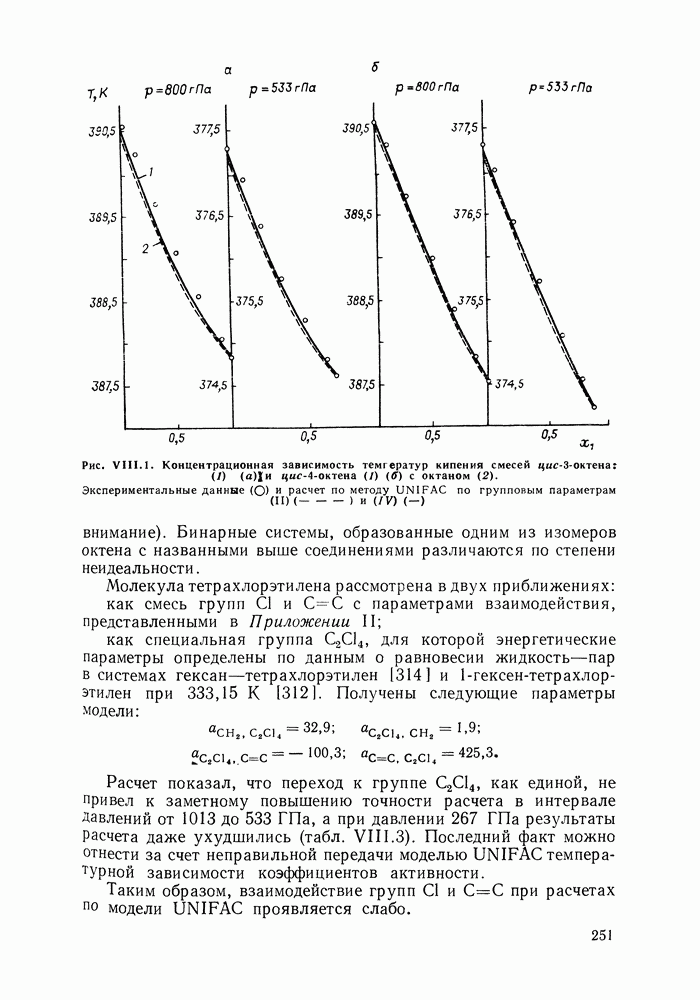
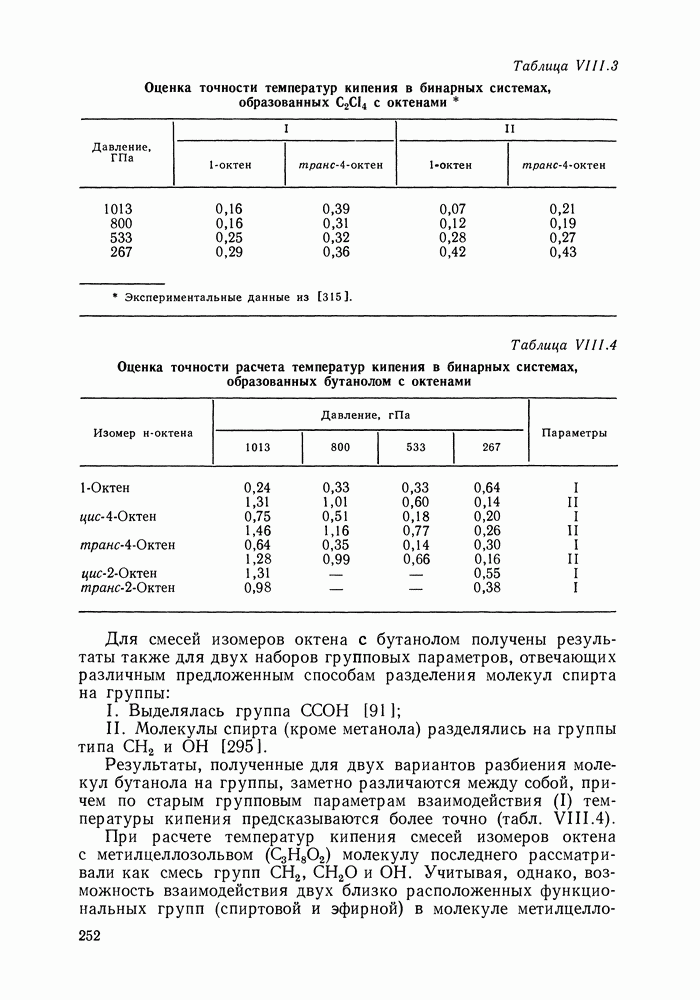
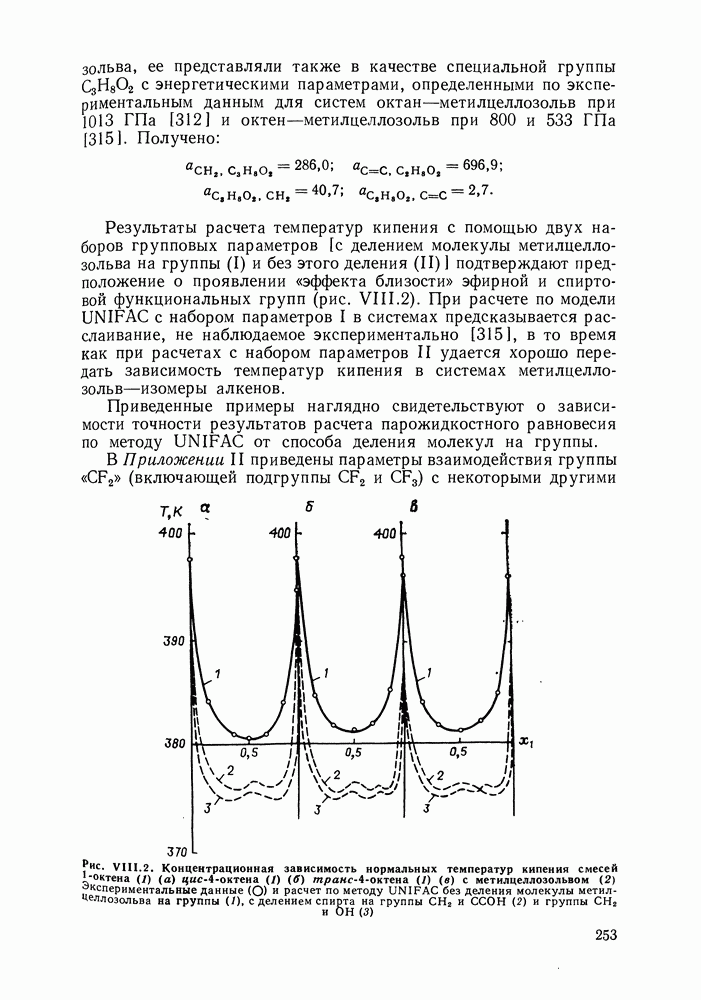
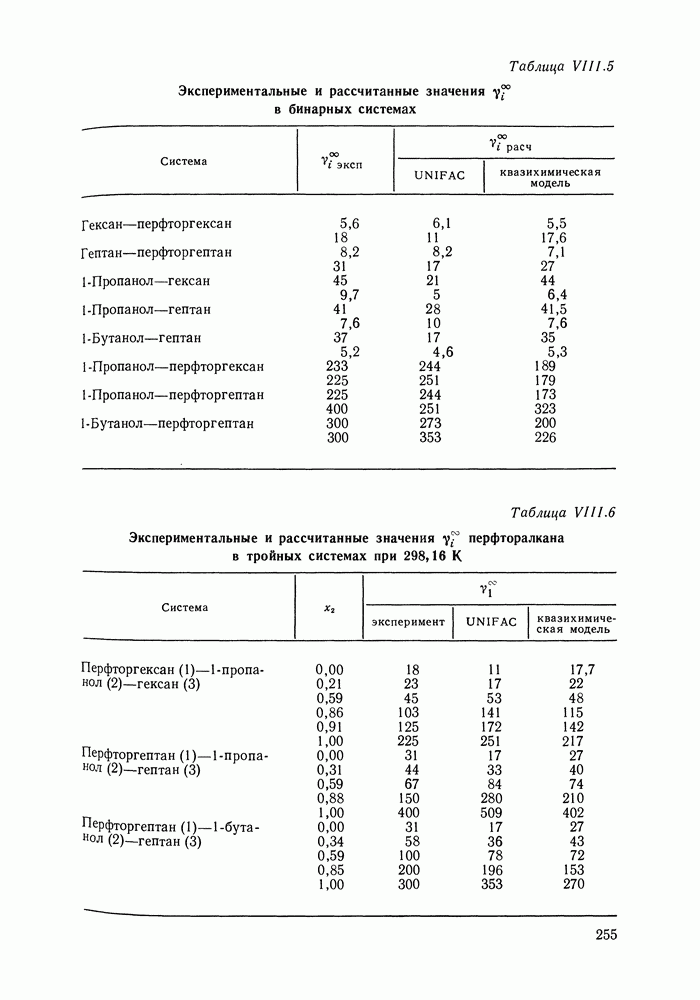
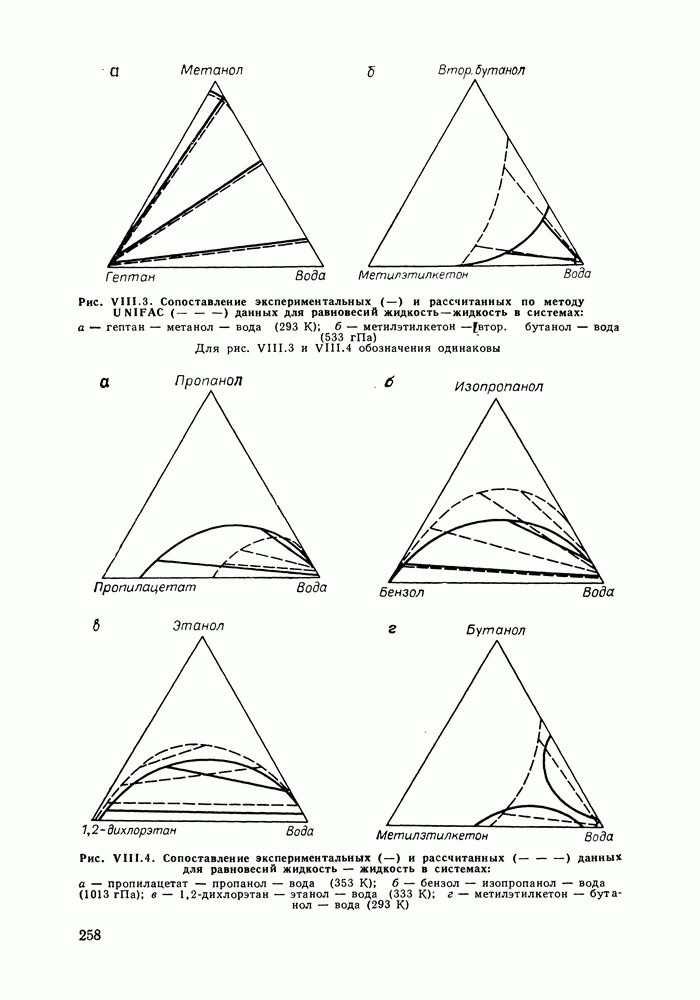
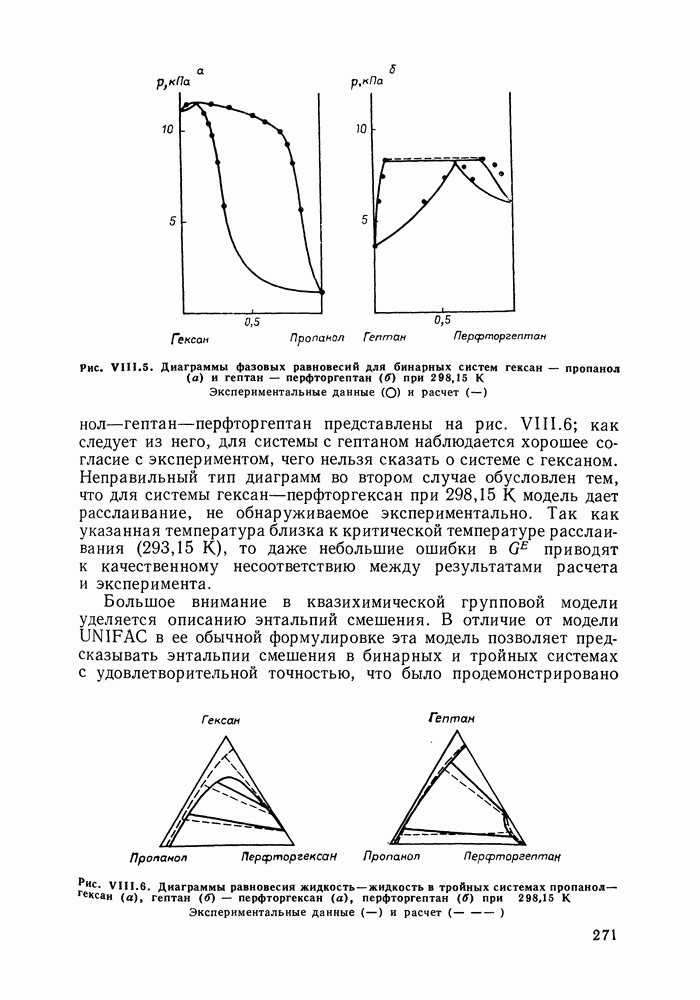
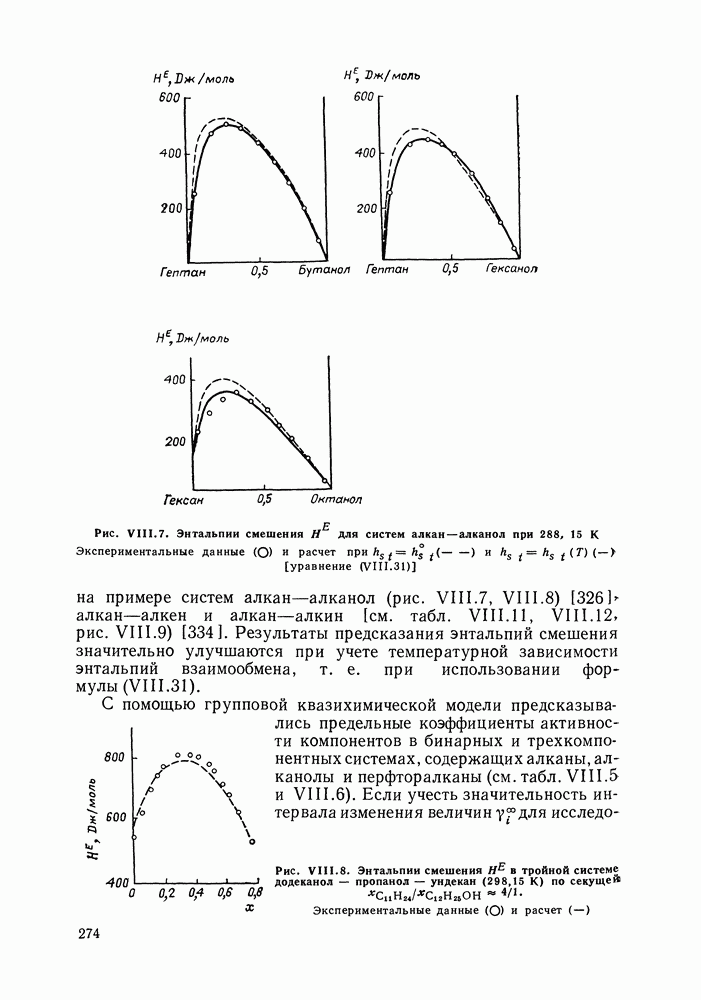
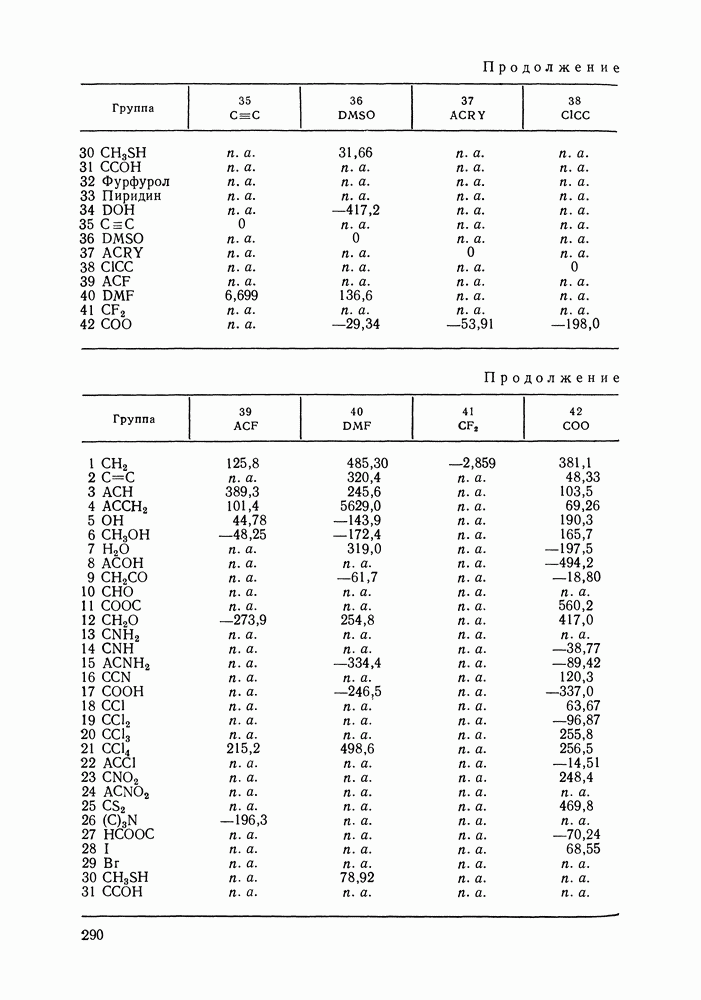
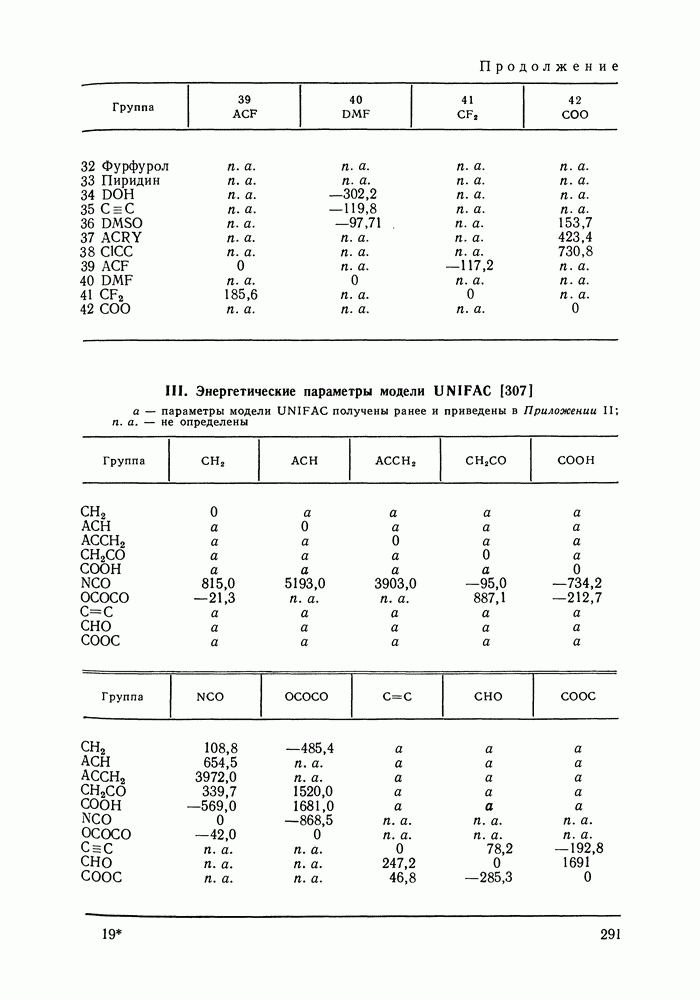
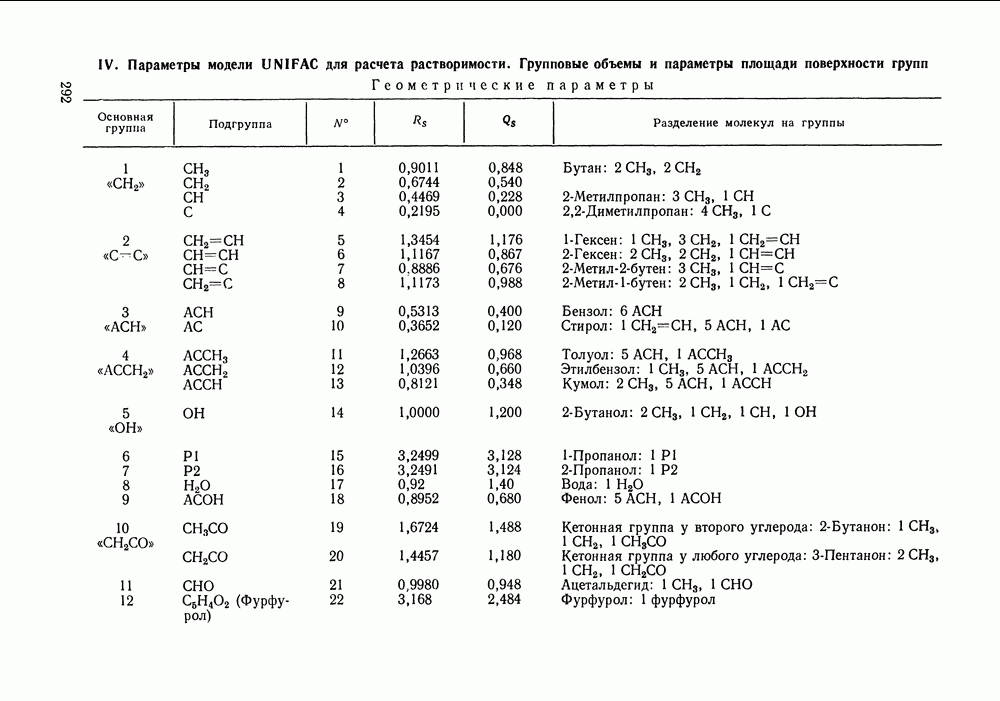
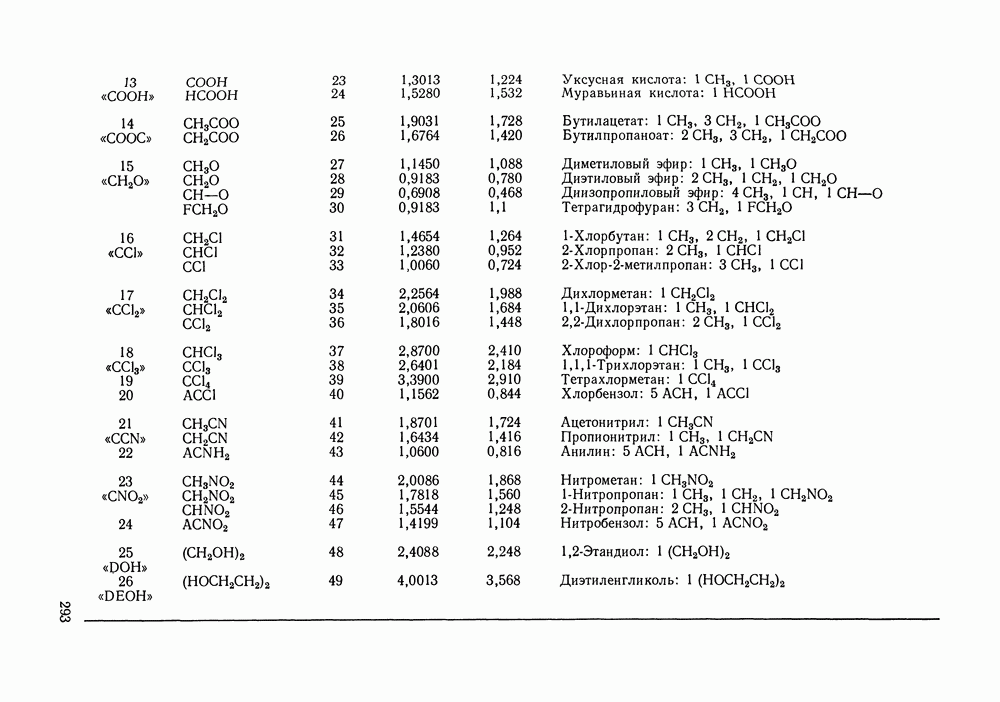
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
III.11. ФАЗОВЫЕ ДИАГРАММЫ БИНАРНЫХ СИСТЕМ В ШИРОКОМ ИНТЕРВАЛЕ ТЕМПЕРАТУР И ДАВЛЕНИЙ
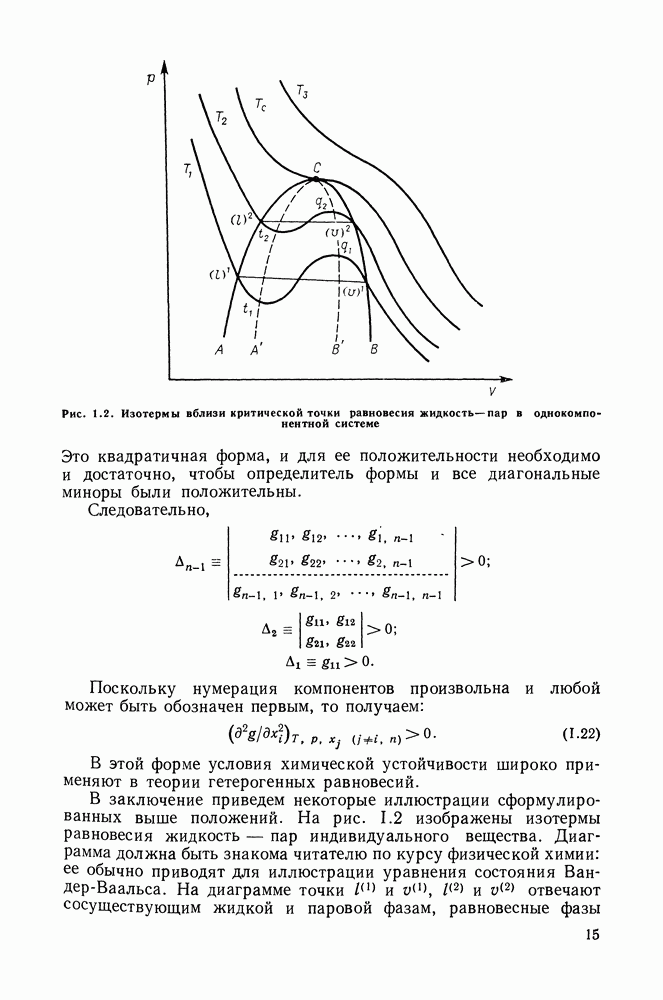
Ранее мы рассматривали диаграммы фазовых равновесий при умеренных давлениях. В тех случаях, когда достигнуты значения критических параметров для чистых компонентов или для смесей какого-либо состава, возникают особенности в структуре фазовых диаграмм. Остановимся кратко на термодинамических соотношениях для критического состояния равновесия жидкость — газ.
Напомним, что критическое состояние — это конечное состояние двухфазного равновесия, при котором сосуществующие фазы становятся полностью тождественными, различия всех термодинамических свойств исчезают. Критическая фаза имеет на две степени свободы меньше, т. е. при подсчете числа степеней свободы она учитывается троекратно. Это означает, что критическая фаза подчиняется двум особым уравнениям, называемым уравнениями
критической фазы. Однокомпонентная критическая фаза нонвариантна и графически изображается точкой, называемой критической. Критическая фаза двухкомпонентной системы является моновариантной. Поэтому совокупность всех ее состояний графически будет изображаться критической кривой.
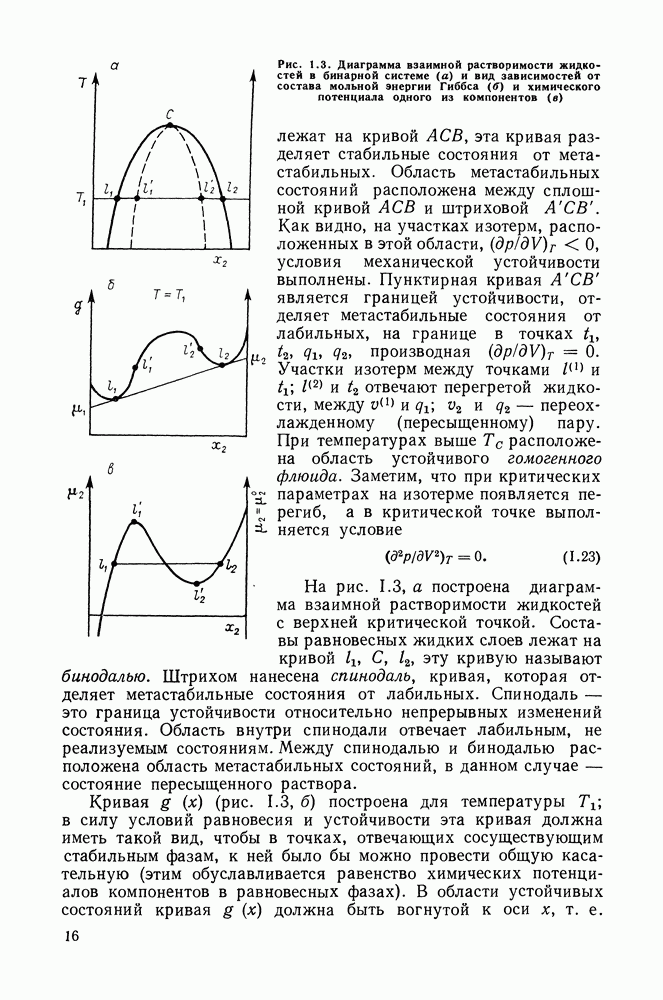
В критической точке сходятся поля диаграмм, отвечающих стабильному, метастабильному и лабильному состояниям. Таким образом, она принадлежит одновременно двум границам устойчивости: относительно непрерывных изменений состояния (граница между метастабильными и лабильными состояниями — спинодаль) и относительно конечных изменений (граница между метастабильными и стабильными состояниями — бинодаль).
Уравнения критической фазы можно получить из критерия устойчивости, записанного через энергию Гельмгольца:

В случае однокомпонентных систем, как уже было показано, критическая точка лежит на границе механической устойчивости и удовлетворяет уравнениям:

Из соотношения (III.93) следует, что для бинарной системы, устойчивой относительно флуктуаций плотности и состава, определитель

должен быть положителен, или в другой записи, после преобразований:

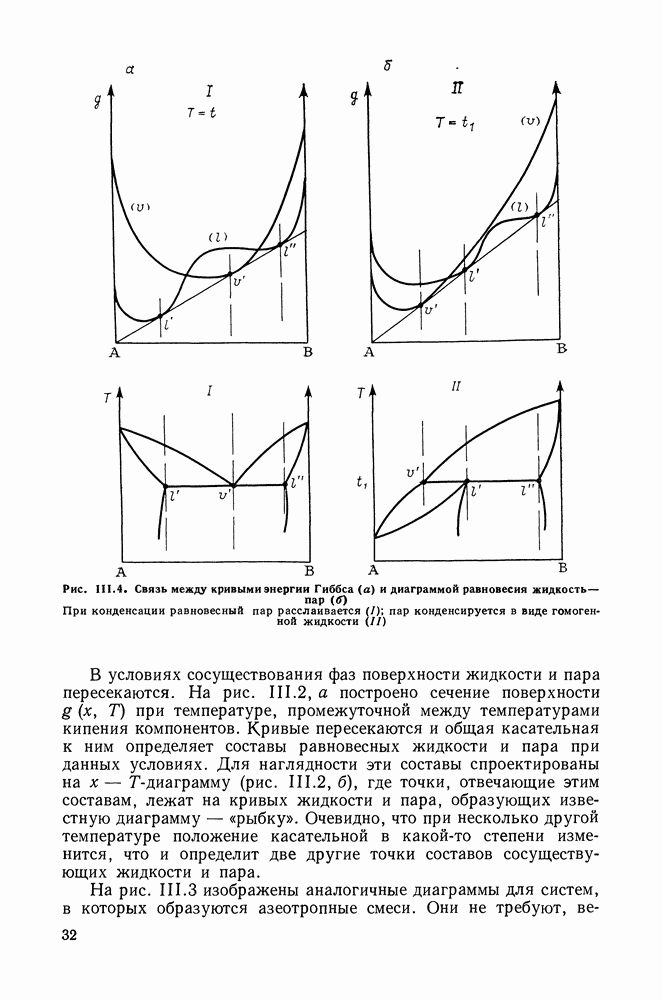
Если система теряет механическую или диффузионную устойчивость, определитель  становится равным нулю. Однако можно показать, что при переходе из области устойчивых состояний в область неустойчивых первым нарушается условие диффузионной устойчивости. Это проиллюстрировано на рис. III.15, где изображена
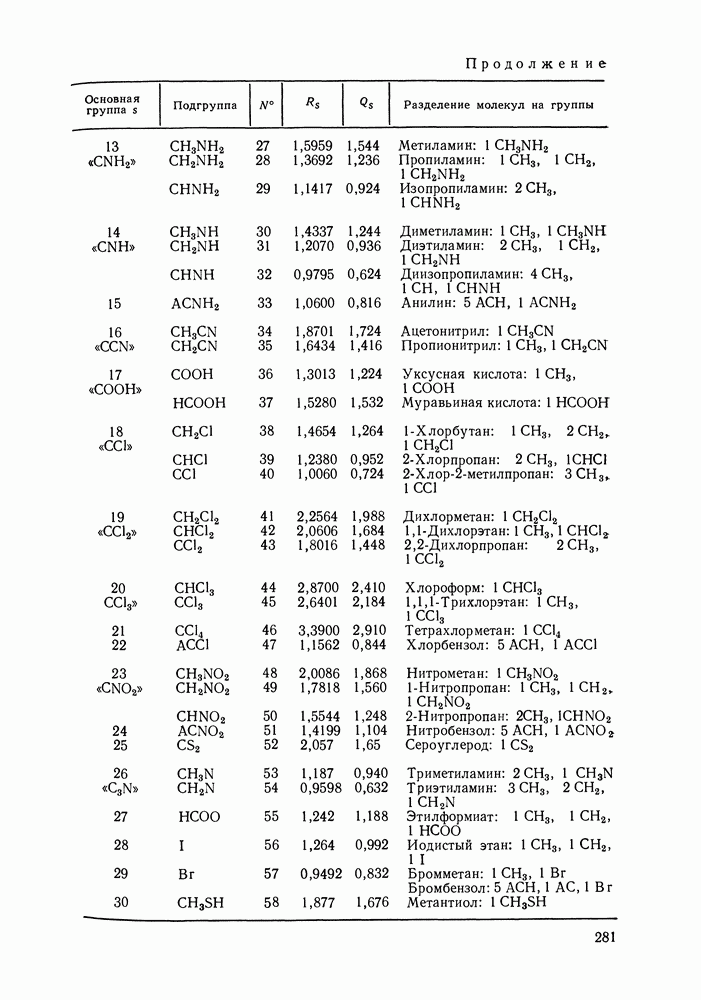
становится равным нулю. Однако можно показать, что при переходе из области устойчивых состояний в область неустойчивых первым нарушается условие диффузионной устойчивости. Это проиллюстрировано на рис. III.15, где изображена  -проекция
-проекция  -поверхности. Внешняя кривая 1 — линия сосуществования равновесных фаз (бинодаль). Она соприкасается в критической точке С со спинодалью 2, являющейся границей диффузионной устойчивости. Область механической неустойчивости (ограничена кривой 3) лежит внутри области неустойчивости диффузионной. Границы этих областей сливаются только при
-поверхности. Внешняя кривая 1 — линия сосуществования равновесных фаз (бинодаль). Она соприкасается в критической точке С со спинодалью 2, являющейся границей диффузионной устойчивости. Область механической неустойчивости (ограничена кривой 3) лежит внутри области неустойчивости диффузионной. Границы этих областей сливаются только при  т. е. в случае однокомпонентной системы.
т. е. в случае однокомпонентной системы.
Таким образом, критическое состояние жидкость—газ бинарной системы определяется только условием устойчивости по

Рис. III.15.  Проекции
Проекции  -поверхности при температурах выше критической температуры второго компонента
-поверхности при температурах выше критической температуры второго компонента
Бинодаль (1) и граница диффузионной (2) и механической (3) устойчивостей; С — критическая точка
отношению к диффузии, т. е. описывается теми же термодинамическими соотношениями, что и критическое состояние равновесия жидкость—жидкость.
Уравнения критической фазы имеют вид:

Условие устойчивости самой критической фазы определяет знак первой ненулевой производной:

В эквивалентной форме эти уравнения можно записать на языке химических потенциалов:

Типичные фазовые диаграммы системы с надкритическим компонентом представлены в виде двумерных проекций  -поверхности на рис. III. 16. Критическая точка С всегда соответствует максимальному значению
-поверхности на рис. III. 16. Критическая точка С всегда соответствует максимальному значению  (при
(при  или минимальному значению
или минимальному значению  (при
(при  Заметим, что при давлениях, больших
Заметим, что при давлениях, больших  перестает выполняться первый закон Коновалова при изотермических условиях. Соответственно, при изобарных условиях он становится недействительным при температурах меньших
перестает выполняться первый закон Коновалова при изотермических условиях. Соответственно, при изобарных условиях он становится недействительным при температурах меньших 
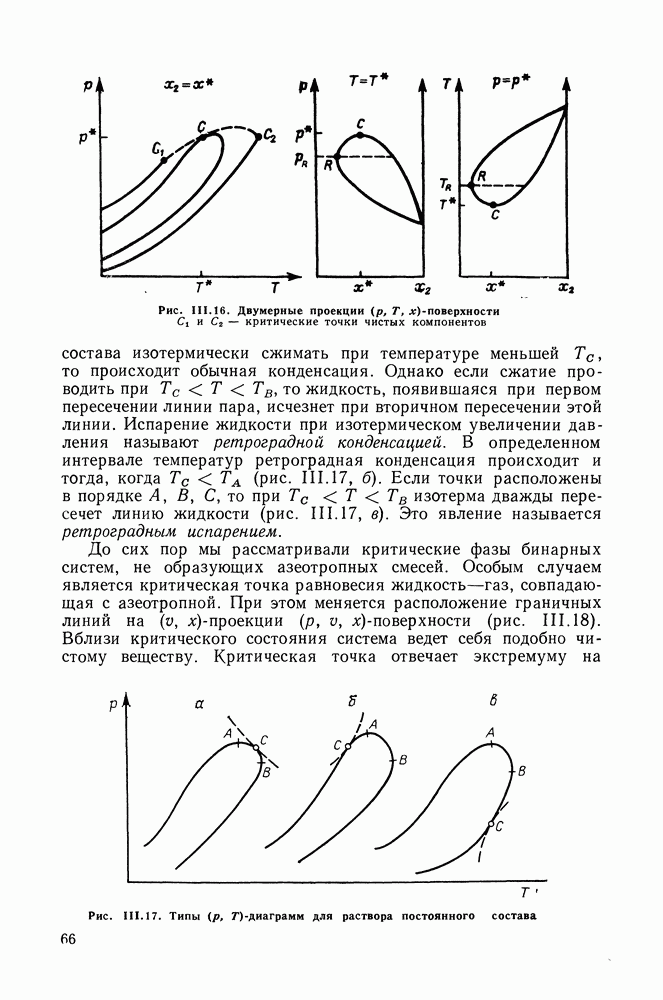
Производная  в общем случае в критической точке нулю не равна. Рассмотрим возможные типы
в общем случае в критической точке нулю не равна. Рассмотрим возможные типы  -диаграмм для раствора постоянного состава (рис. 111.17). На рис. 111.17, а критическая точка С лежит между точкой максимального давления А и точкой максимальной температуры В. Если смесь такого
-диаграмм для раствора постоянного состава (рис. 111.17). На рис. 111.17, а критическая точка С лежит между точкой максимального давления А и точкой максимальной температуры В. Если смесь такого

Рис. III.16. Двумерные проекции  -поверхности
-поверхности  критические точки чистых компонентов
критические точки чистых компонентов
состава изотермически сжимать при температуре меньшей  то происходит обычная конденсация. Однако если сжатие проводить при
то происходит обычная конденсация. Однако если сжатие проводить при  то жидкость, появившаяся при первом пересечении линии пара, исчезнет при вторичном пересечении этой линии. Испарение жидкости при изотермическом увеличении давления называют ретроградной конденсацией. В определенном интервале температур ретроградная конденсация происходит и тогда, когда
то жидкость, появившаяся при первом пересечении линии пара, исчезнет при вторичном пересечении этой линии. Испарение жидкости при изотермическом увеличении давления называют ретроградной конденсацией. В определенном интервале температур ретроградная конденсация происходит и тогда, когда  (рис. III. 17, б). Если точки расположены в порядке
(рис. III. 17, б). Если точки расположены в порядке  то при
то при  изотерма дважды пересечет линию жидкости (рис. III. 17, в). Это явление называется ретроградным испарением.
изотерма дважды пересечет линию жидкости (рис. III. 17, в). Это явление называется ретроградным испарением.
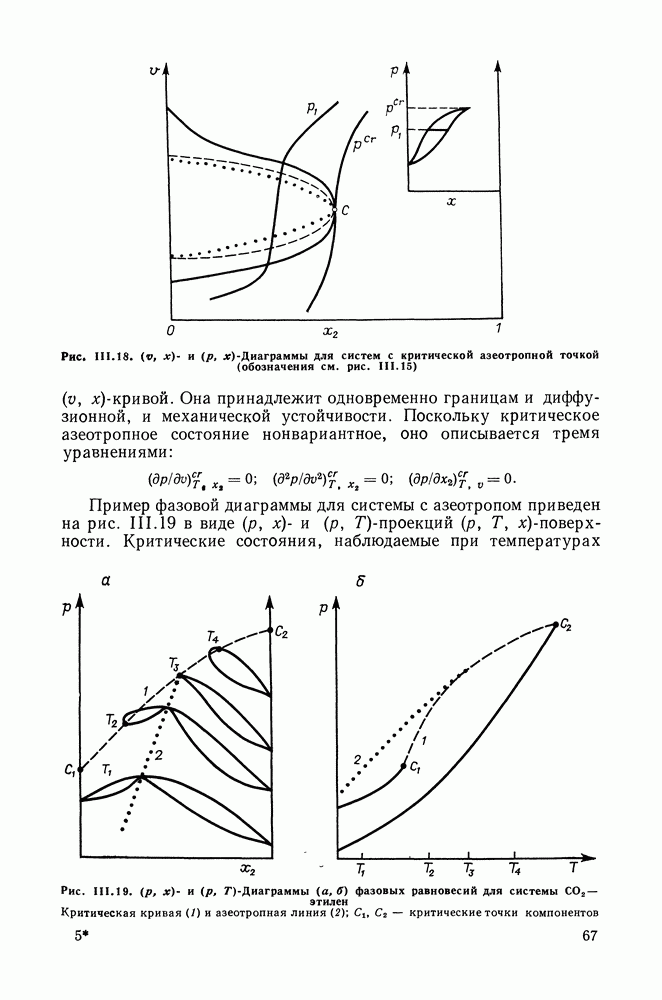
До сих пор мы рассматривали критические фазы бинарных систем, не образующих азеотропных смесей. Особым случаем является критическая точка равновесия жидкость—газ, совпадающая с азеотропной. При этом меняется расположение граничных линий на  -проекции
-проекции  -поверхности (рис. 111.18). Вблизи критического состояния система ведет себя подобно чистому веществу. Критическая точка отвечает экстремуму на
-поверхности (рис. 111.18). Вблизи критического состояния система ведет себя подобно чистому веществу. Критическая точка отвечает экстремуму на

Рис. III.17. Типы  -диаграмм для раствора постоянного состава
-диаграмм для раствора постоянного состава

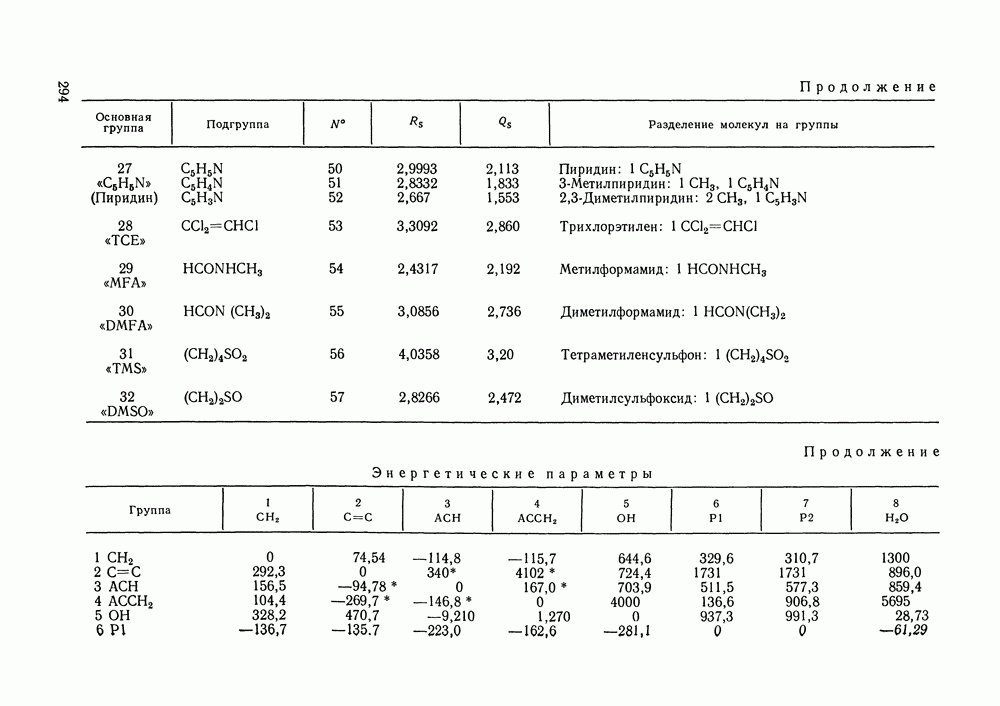
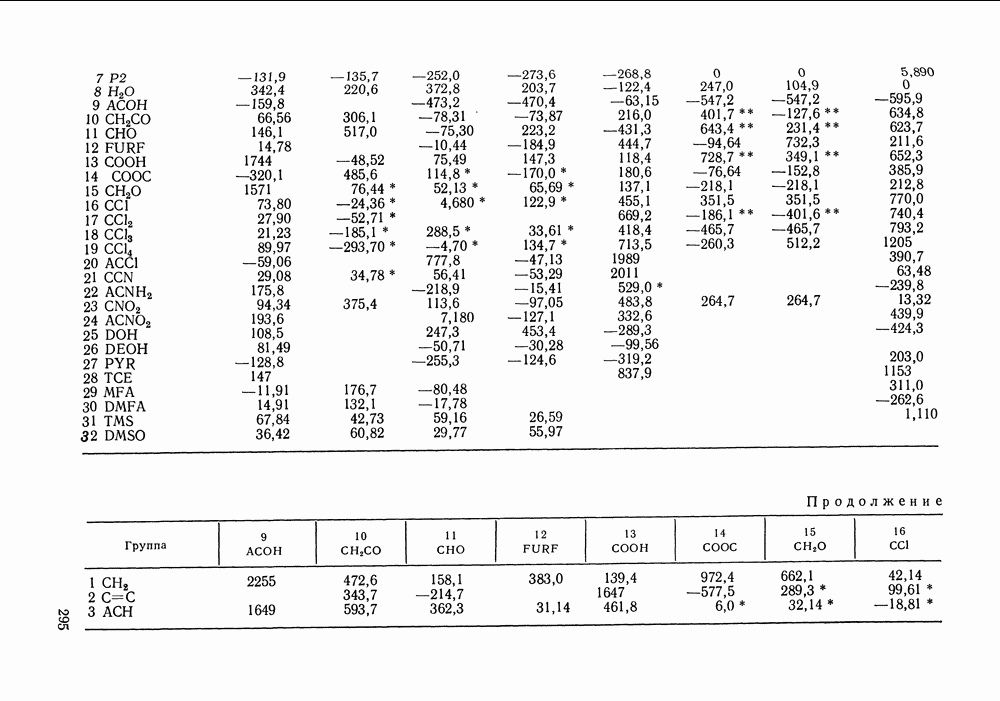
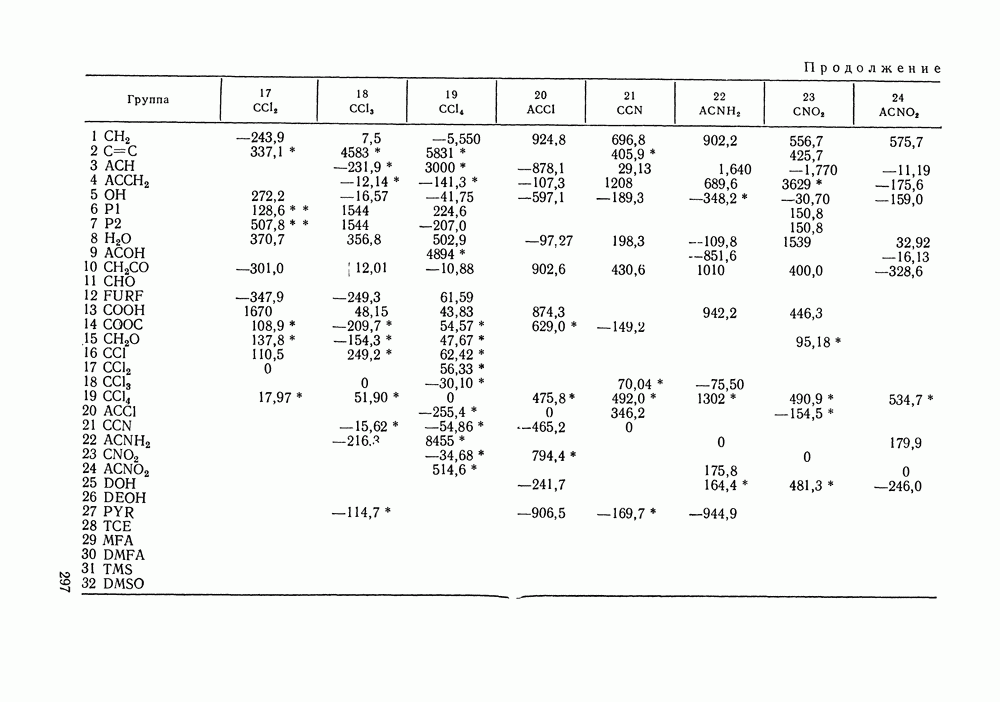
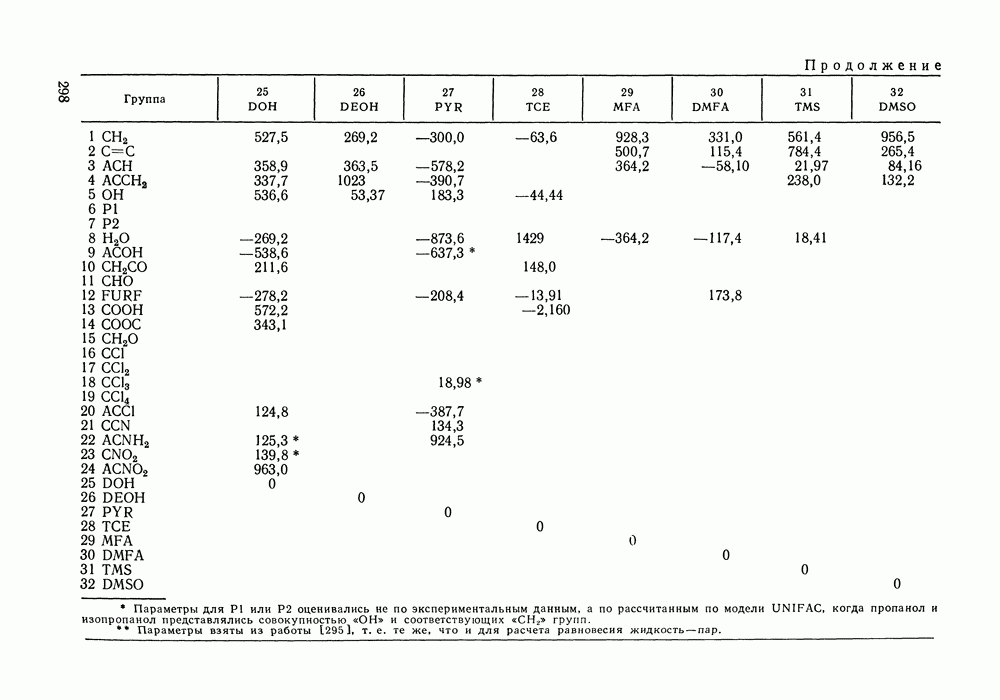
Рис. III.18.  и
и  -Диаграммы для систем с критической азеотропной точкой (обозначения см. рис. III. 15)
-Диаграммы для систем с критической азеотропной точкой (обозначения см. рис. III. 15)
 -кривой. Она принадлежит одновременно границам и диффузионной, и механической устойчивости. Поскольку критическое азеотропное состояние нонвариантное, оно описывается тремя уравнениями:
-кривой. Она принадлежит одновременно границам и диффузионной, и механической устойчивости. Поскольку критическое азеотропное состояние нонвариантное, оно описывается тремя уравнениями:

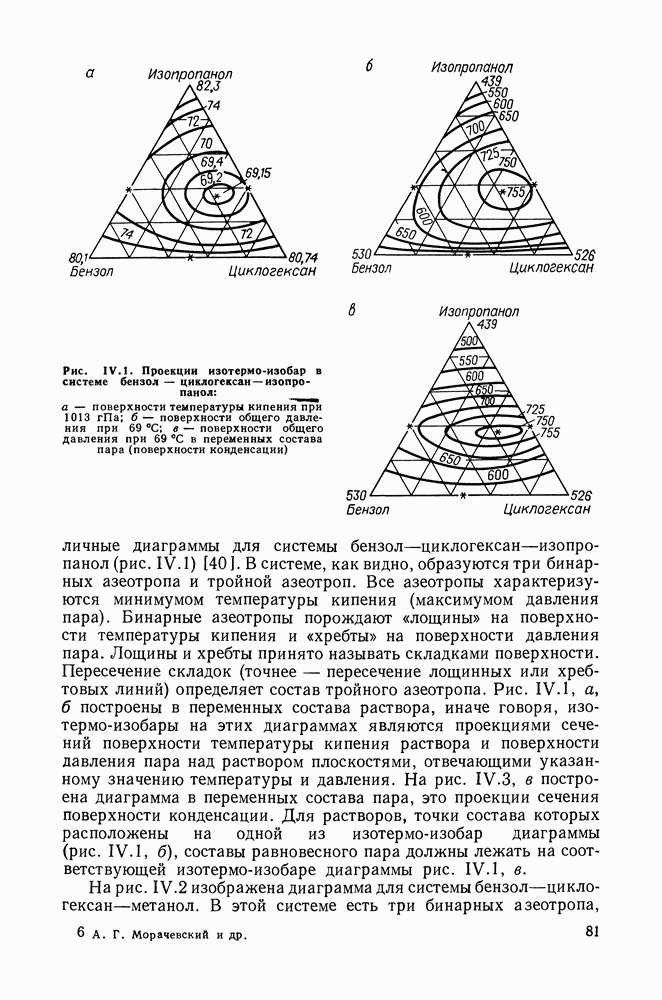
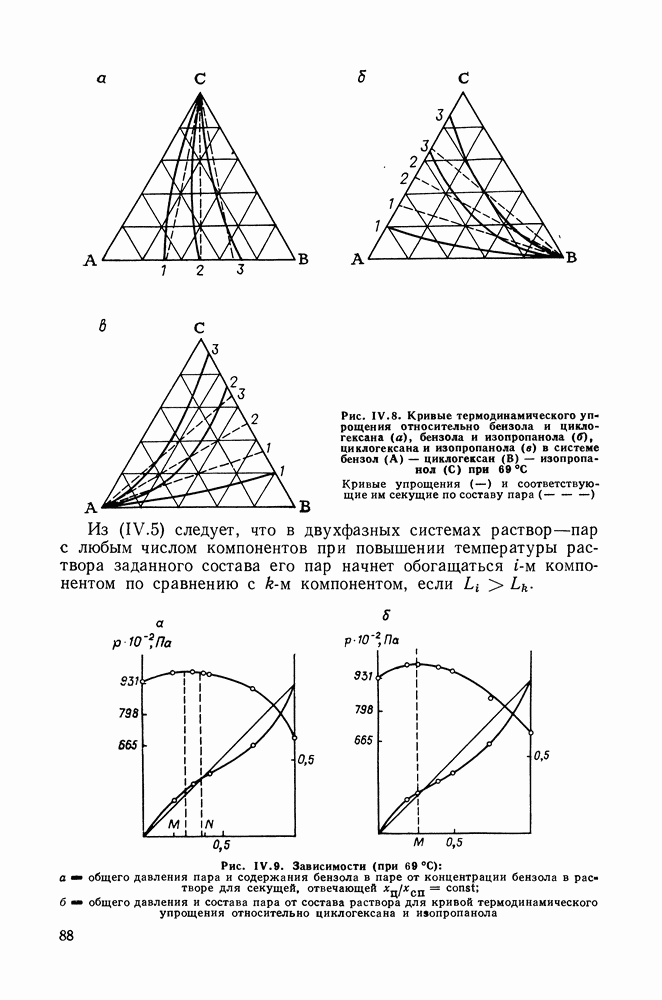
Пример фазовой диаграммы для системы с азеотропом приведен на рис. III. 19 в виде  и
и  -проекций
-проекций  -поверхности. Критические состояния, наблюдаемые при температурах
-поверхности. Критические состояния, наблюдаемые при температурах

Рис. III.19.  и
и  -Диаграммы
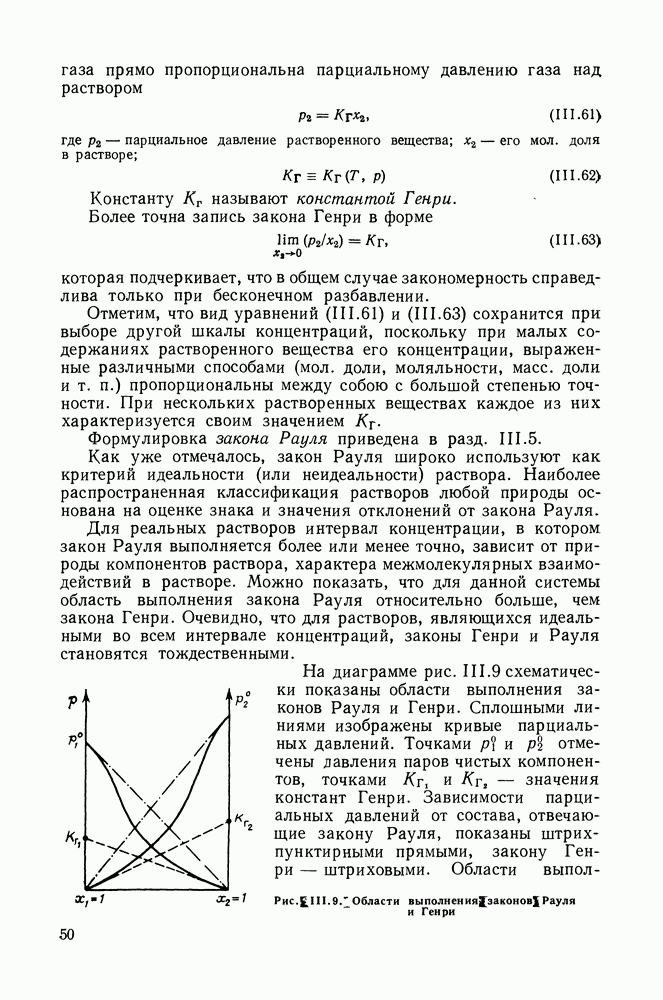
-Диаграммы  фазовых равновесий для системы
фазовых равновесий для системы  этилен Критическая кривая (1) и азеотропная линия (2);
этилен Критическая кривая (1) и азеотропная линия (2);  критические точки компонентов
критические точки компонентов
ниже  (температура
(температура  ), отвечают минимуму на кривых
), отвечают минимуму на кривых  При температурах выше
При температурах выше  критическая точка, как и в неазеотропных системах, соответствует максимальному значению
критическая точка, как и в неазеотропных системах, соответствует максимальному значению  (температура
(температура  ).
).
Систематическое исследование фазовых равновесий в системах с надкритическими компонентами было начато еще в начале века работами голландских физиков Ван-дер-Ваальса, Камерлинг-Онесса, Куенена и др. В последние десятилетия интерес к исследованию фазового поведения растворов при высоких давлениях необычайно возрос. Это обусловлено практическими потребностями, прежде всего, эксплуатации нефтегазовых месторождений, переработки нефти и газа. При высоких давлениях проводятся многие процессы абсорбционного разделения веществ.
Большой вклад в изучение фазовых равновесий при высоких давлениях сделали Кричевский и его школа [30—32]. В [30, первая ссылка], ставшей классической, подробно рассмотрены теоретические вопросы критических явлений, растворимости газов в жидкостях под давлением, растворимости жидкостей в сжатых газах. Теоретические результаты широко иллюстрируются экспериментальными данными.
Термодинамика бесконечно разбавленных критических фаз разработана Кричевским в [30, вторая ссылка]. Показано, что если предельное состояние бесконечно разбавленного раствора представляет собой критическую фазу чистого растворителя, то значения ряда свойств такого раствора при  сильно зависит от пути подхода системы к своему пределу. Например, вдоль пути «критическая кривая»
сильно зависит от пути подхода системы к своему пределу. Например, вдоль пути «критическая кривая»  на других путях, ведущих к критической фазе чистого растворителя, эта величина может быть только меньше (по абсолютному значению) или равно
на других путях, ведущих к критической фазе чистого растворителя, эта величина может быть только меньше (по абсолютному значению) или равно 
Кричевский с сотрудниками первыми экспериментально обнаружили явление расслаивания газовых смесей. Этому вопросу посвящена книга Циклиса  Результаты экспериментальных и теоретических исследований азеотропных смесей при высоких давлениях изложены в [32].
Результаты экспериментальных и теоретических исследований азеотропных смесей при высоких давлениях изложены в [32].
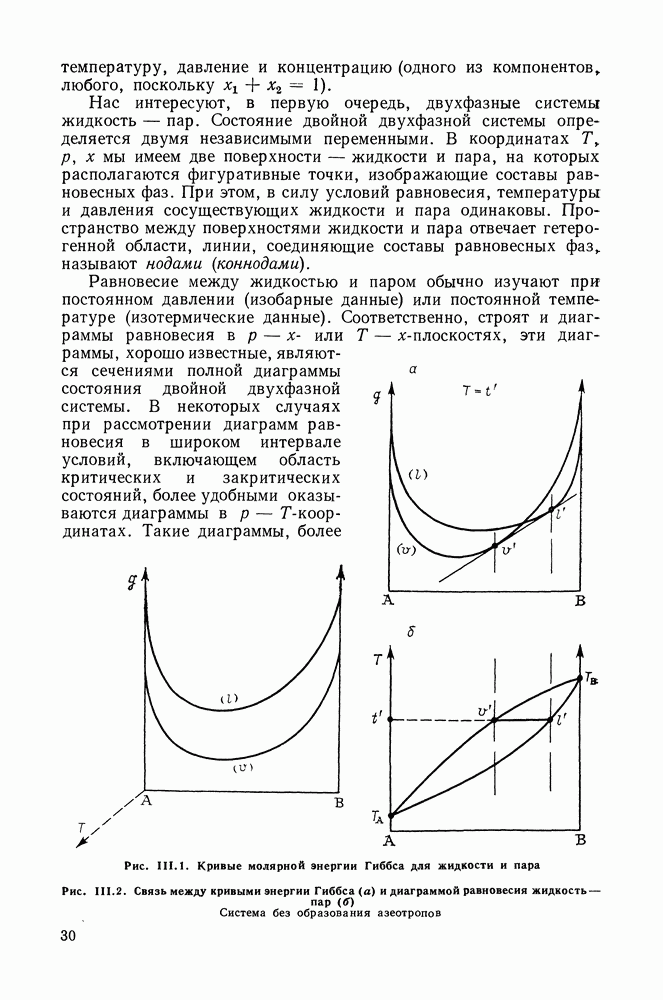
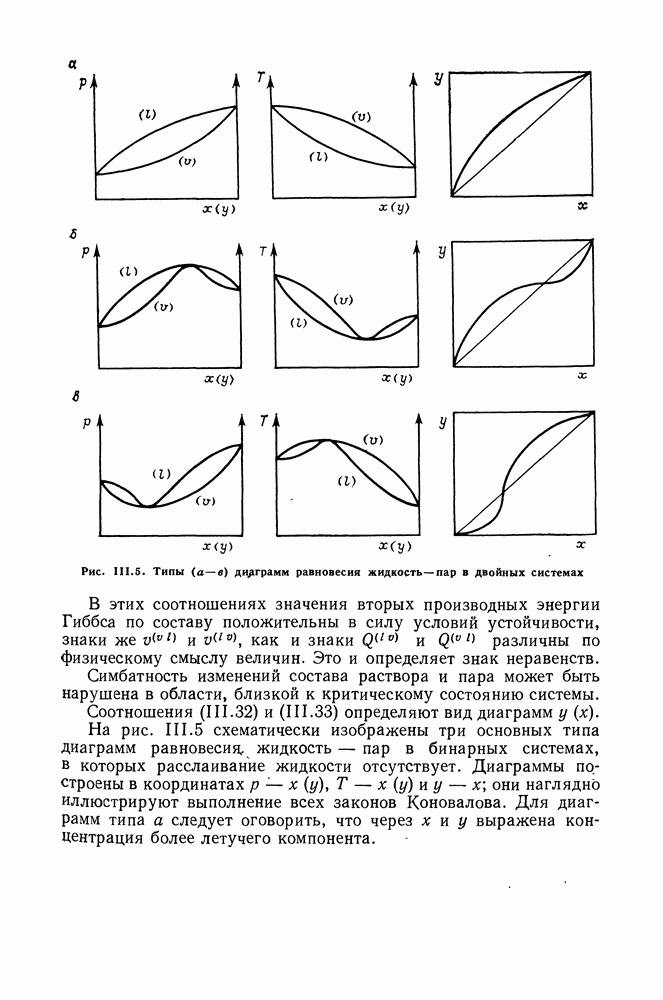
В этом разделе представлены типы обобщенных диаграмм фазовых равновесий как при низких, так и при высоких давлениях. Поиск общих закономерностей фазового поведения смесей в широком интервале температур и давлений связан с классификацией поверхностей равновесия в координатах  Обычно анализ этой трехмерной поверхности заменяют рассмотрением ее двумерных проекций. В этом случае для бинарных систем наиболее удобна
Обычно анализ этой трехмерной поверхности заменяют рассмотрением ее двумерных проекций. В этом случае для бинарных систем наиболее удобна  -проекция, поскольку фазовые
-проекция, поскольку фазовые  или
или  -диаграммы не отражают последовательности осуществления различных типов равновесий.
-диаграммы не отражают последовательности осуществления различных типов равновесий.
На  -диаграммах изображают линии моновариантных равновесий и нонвариантные точки. Каждый чистый компонент
-диаграммах изображают линии моновариантных равновесий и нонвариантные точки. Каждый чистый компонент
представлен линией давления пара, которая заканчивается в критической точке равновесия жидкость — газ. (На рисунках эта критическая точка для компонента  обозначается как
обозначается как  второй компонент является менее летучим).
второй компонент является менее летучим).
В бинарной системе критическая фаза обладает одной степенью свободы. Геометрическим местом критических точек, соответствующих последовательности смесей различного состава, является критическая кривая в  -координатах. Так же будем называть и ее проекцию на плоскость
-координатах. Так же будем называть и ее проекцию на плоскость  В зависимости от типа системы на фазовой диаграмме могут быть одна или несколько критических кривых.
В зависимости от типа системы на фазовой диаграмме могут быть одна или несколько критических кривых.
На  -диаграммах бинарных систем с ограниченной взаимной растворимостью жидкостей изображают кривую, отвечающую моновариантным трехфазным равновесиям жидкость — жидкость — газ. Эту кривую называют трех фазной линией, а точку пересечения ее с критической кривой — критической конечной точкой
-диаграммах бинарных систем с ограниченной взаимной растворимостью жидкостей изображают кривую, отвечающую моновариантным трехфазным равновесиям жидкость — жидкость — газ. Эту кривую называют трех фазной линией, а точку пересечения ее с критической кривой — критической конечной точкой 
Моновариантными являются азеотропные равновесия жидкость — газ. Они изображаются на диаграммах линиями, называемыми азеотропными. При этом линии, отвечающие положительным азеотропам, в дальнейшем для краткости будем называть «положительными азеотропными линиями», а отвечающие отрицательным азеотропам — «отрицательными азеотропными линиями». Точку пересечения азеотропной линии с критической кривой называют критической азеотропной точкой 
Таким образом, на  -диаграммах бинарных систем могут присутствовать следующие линии, отвечающие равновесиям флюидных фаз: линии насыщения для чистых компонентов, критические кривые, линии трехфазных равновесий жидкость — жидкость — газ, азеотропные линии. На приводимых далее диаграммах указываются лишь эти линии; равновесия флюидных и твердых фаз не рассматриваются.
-диаграммах бинарных систем могут присутствовать следующие линии, отвечающие равновесиям флюидных фаз: линии насыщения для чистых компонентов, критические кривые, линии трехфазных равновесий жидкость — жидкость — газ, азеотропные линии. На приводимых далее диаграммах указываются лишь эти линии; равновесия флюидных и твердых фаз не рассматриваются.
Классификация фазовых диаграмм предложена Скоттом и Ван-Кониненбергом [33] и получила дальнейшее развитие в [34]. Анализ топологических свойств фазовых диаграмм экспериментально изученных систем позволяет выделить 6 основных типов фазового поведения, которые описываются ниже. Примеры экспериментально исследованных бинарных смесей, приводимые для иллюстрации, заимствованы из [34].
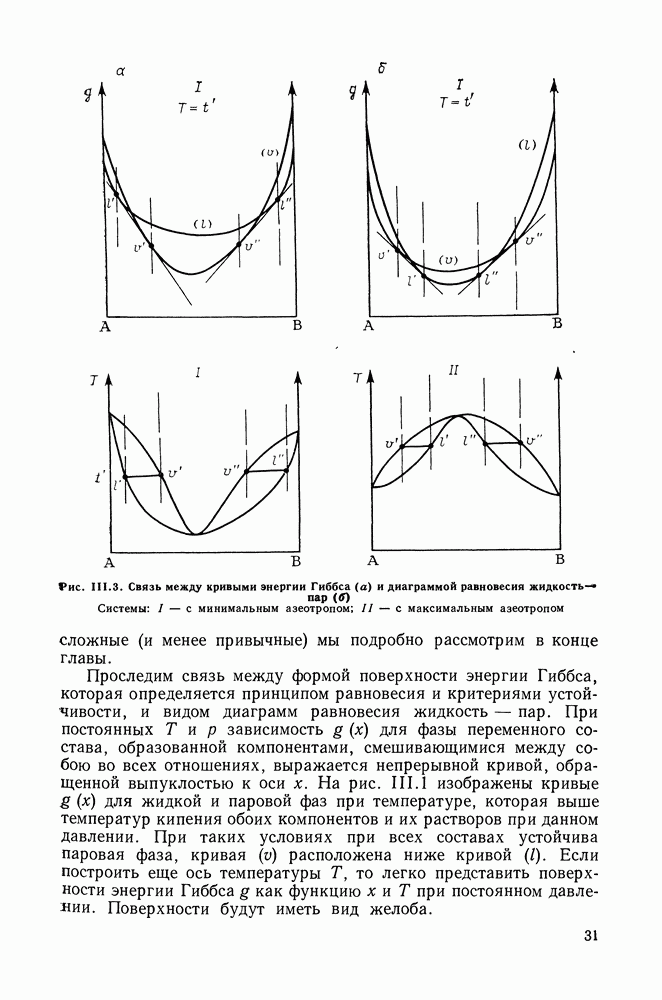
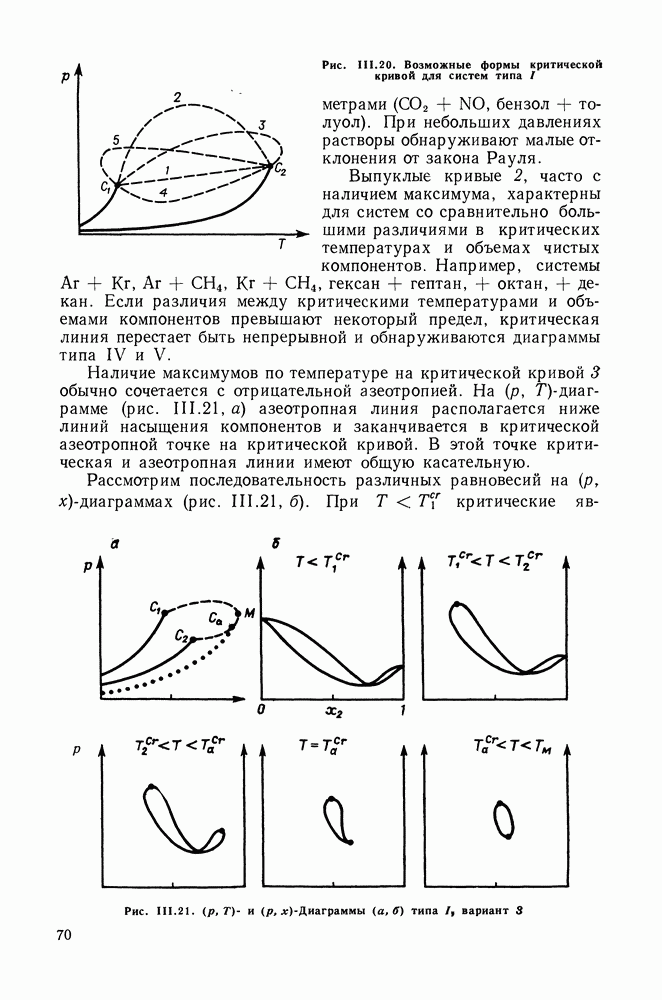
Тип  Основная особенность диаграмм этого типа — наличие одной непрерывной критической кривой, соединяющей критические точки чистых компонентов, и отсутствие области расслаивания жидких растворов. На рис. 111.20 показаны возможные формы критической кривой. Фазовые диаграммы типа I обычно присущи системам, образованным веществами близкой химической природы и (или) имеющими критические параметры одного порядка.
Основная особенность диаграмм этого типа — наличие одной непрерывной критической кривой, соединяющей критические точки чистых компонентов, и отсутствие области расслаивания жидких растворов. На рис. 111.20 показаны возможные формы критической кривой. Фазовые диаграммы типа I обычно присущи системам, образованным веществами близкой химической природы и (или) имеющими критические параметры одного порядка.
Почти линейная критическая кривая 1 характерна для смесей, образованных веществами с очень близкими критическими

Рис. III.20. Возможные формы критической кривой для систем типа 
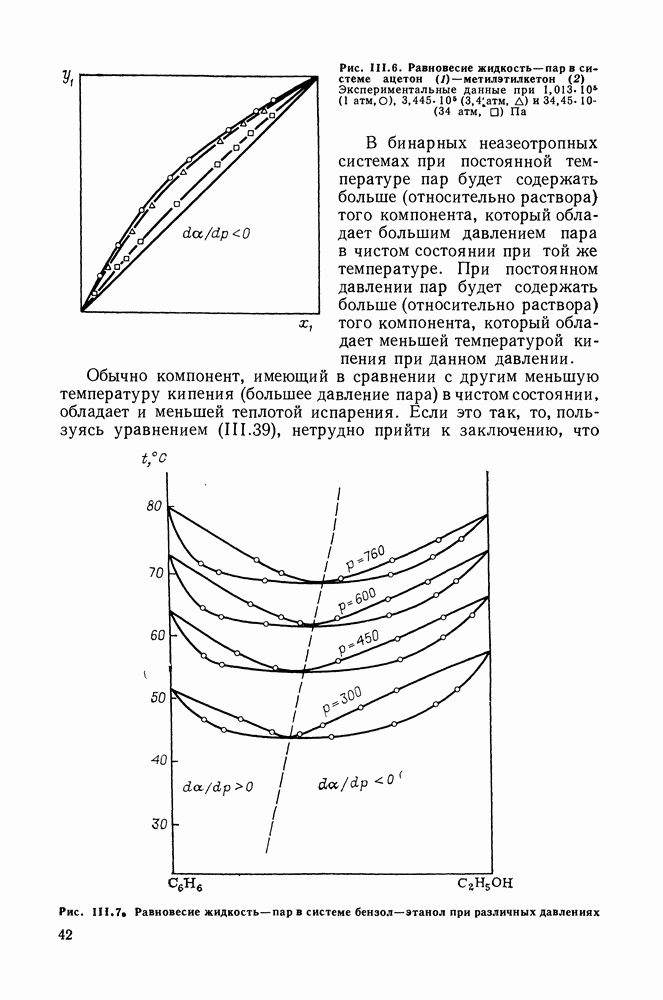
параметрами  бензол + толуол). При небольших давлениях растворы обнаруживают малые отклонения от закона Рауля.
бензол + толуол). При небольших давлениях растворы обнаруживают малые отклонения от закона Рауля.
Выпуклые кривые 2, часто с наличием максимума, характерны для систем со сравнительно большими различиями в критических температурах и объемах чистых компонентов. Например, системы  гексан + гептан, + октан, + декан. Если различия между критическими температурами и объемами компонентов превышают некоторый предел, критическая линия перестает быть непрерывной и обнаруживаются диаграммы типа IV и
гексан + гептан, + октан, + декан. Если различия между критическими температурами и объемами компонентов превышают некоторый предел, критическая линия перестает быть непрерывной и обнаруживаются диаграммы типа IV и 
Наличие максимумов по температуре на критической кривой 3 обычно сочетается с отрицательной азеотропией. На  -диаграмме (рис. 111.21, а) азеотропная линия располагается ниже линий насыщения компонентов и заканчивается в критической азеотропной точке на критической кривой. В этой точке критическая и азеотропная линии имеют общую касательную.
-диаграмме (рис. 111.21, а) азеотропная линия располагается ниже линий насыщения компонентов и заканчивается в критической азеотропной точке на критической кривой. В этой точке критическая и азеотропная линии имеют общую касательную.
Рассмотрим последовательность различных равновесий на  -диаграммах (рис. III.21, б). При
-диаграммах (рис. III.21, б). При  критические
критические

Рис. III.21.  -Диаграммы
-Диаграммы  типа
типа  вариант
вариант 
явления отсутствуют; температура  отвечает критической точке первого компонента. Дальнейшее повышение температуры приводит к отделению двухфазной области от оси
отвечает критической точке первого компонента. Дальнейшее повышение температуры приводит к отделению двухфазной области от оси  При
При  на диаграмме появляется вторая критическая точка — критическая точка второго компонента. При более высоких температурах
на диаграмме появляется вторая критическая точка — критическая точка второго компонента. При более высоких температурах  на изотерме равновесия присутствуют две критические точки; при
на изотерме равновесия присутствуют две критические точки; при  точка с большим значением
точка с большим значением  отвечает критическому азеотропному состоянию. Наблюдаемое в системах типа I, вариант 3 равновесное сосуществование двух флюидных фаз при температуре, выше критической температуры менее летучего компонента, Скотт назвал расслаиванием газ—газ третьего рода. Системы с критической кривой типа I, вариант 3 встречаются очень редко. Примером могут служить
отвечает критическому азеотропному состоянию. Наблюдаемое в системах типа I, вариант 3 равновесное сосуществование двух флюидных фаз при температуре, выше критической температуры менее летучего компонента, Скотт назвал расслаиванием газ—газ третьего рода. Системы с критической кривой типа I, вариант 3 встречаются очень редко. Примером могут служить  циклопентан + тетраэтилсилан.
циклопентан + тетраэтилсилан.
Вогнутые критические кривые, часто с наличием минимума по давлению (вариант 4), характерны для смесей полярных веществ с неполярными и для некоторых смесей ароматических углеводородов с алифатическими или алициклическими углеводородами. К этому типу принадлежат системы  метанол + бензол, гексан + толуол, циклогексан + бензол. Для растворов наблюдаются положительные отклонения от закона Рауля, часто значительные.
метанол + бензол, гексан + толуол, циклогексан + бензол. Для растворов наблюдаются положительные отклонения от закона Рауля, часто значительные.
Минимум по температуре на критической кривой (вариант 5) обычно сочетается с наличием положительной азеотропной линии. Как и в варианте 3 азеотропная линия в критической азеотропной точке касается критической кривой. Примерами таких систем являются ацетон + пентан, +гексан, +гептан, вода + пропанол, 
Рис. III.20 не исчерпывает всех возможных форм критической кривой для систем типа I, т. е. систем, где эта кривая непрерывна. Так более сложную форму имеют критические кривые для смесей аммиак  -триметилпентан, метан + бутан.
-триметилпентан, метан + бутан.
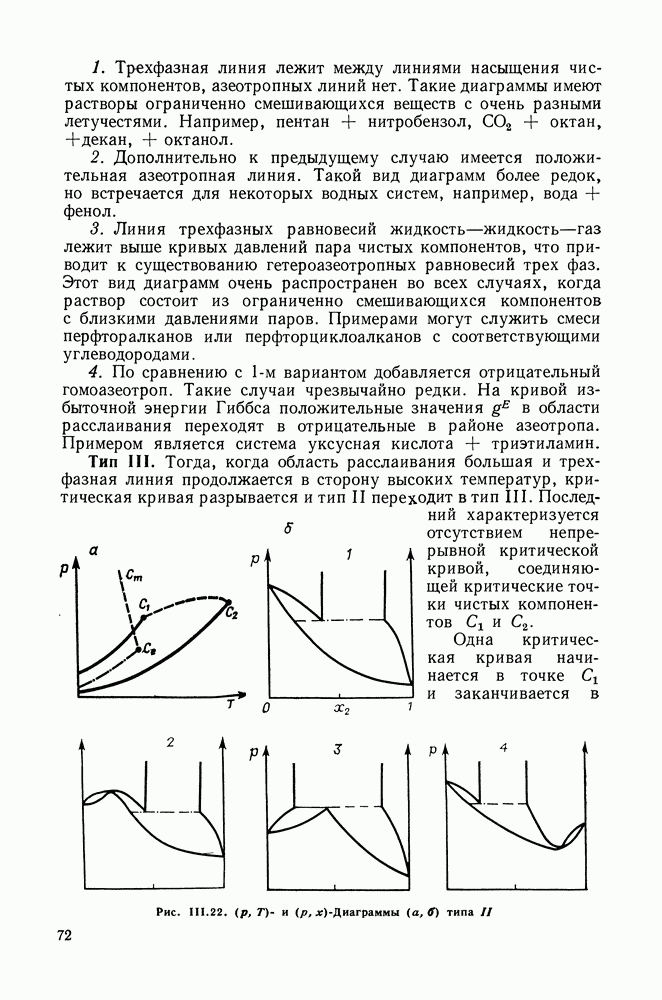
Тип II. Системы, относимые к типу II, в отличие от предыдущих, характеризуются наличием расслаивания жидких растворов. Это приводит к появлению на  -диаграмме (рис. 111.22, а) линии трехфазных равновесий жидкость—жидкость—газ и второй критической кривой (для равновесия жидкость—жидкость), которая начинается от верхней критической конечной точки
-диаграмме (рис. 111.22, а) линии трехфазных равновесий жидкость—жидкость—газ и второй критической кривой (для равновесия жидкость—жидкость), которая начинается от верхней критической конечной точки  и продолжается до точки
и продолжается до точки  отвечающей критическому жидкому раствору в равновесии с твердой фазой. Наклон кривой
отвечающей критическому жидкому раствору в равновесии с твердой фазой. Наклон кривой  может быть как положительным, так и отрицательным. Трехфазная линия может лежать не только между линиями насыщения чистых компонентов, как изображено на рисунке, но и располагаться выше их. Однако всегда
может быть как положительным, так и отрицательным. Трехфазная линия может лежать не только между линиями насыщения чистых компонентов, как изображено на рисунке, но и располагаться выше их. Однако всегда  Фазовые диаграммы могут быть усложнены положительными или отрицательными азеотропными линиями. Вследствие этого при низких температурах и давлениях можно выделить 4 варианта
Фазовые диаграммы могут быть усложнены положительными или отрицательными азеотропными линиями. Вследствие этого при низких температурах и давлениях можно выделить 4 варианта  -диаграмм (рис. 111.22,б):
-диаграмм (рис. 111.22,б):
1. Трехфазная линия лежит между линиями насыщения чистых компонентов, азеотропных линий нет. Такие диаграммы имеют растворы ограниченно смешивающихся веществ с очень разными летучестями. Например, пентан + нитробензол,  + октан, +декан, + октанол.
+ октан, +декан, + октанол.
2. Дополнительно к предыдущему случаю имеется положительная азеотропная линия. Такой вид диаграмм более редок, но встречается для некоторых водных систем, например, вода + фенол.
3. Линия трехфазных равновесий жидкость—жидкость—газ лежит выше кривых давлений пара чистых компонентов, что приводит к существованию гетероазеотропных равновесий трех фаз. Этот вид диаграмм очень распространен во всех случаях, когда раствор состоит из ограниченно смешивающихся компонентов с близкими давлениями паров. Примерами могут служить смеси перфторалканов или перфторциклоалканов с соответствующими углеводородами.
4. По сравнению с  вариантом добавляется отрицательный гомоазеотроп. Такие случаи чрезвычайно редки. На кривой избыточной энергии Гиббса положительные значения
вариантом добавляется отрицательный гомоазеотроп. Такие случаи чрезвычайно редки. На кривой избыточной энергии Гиббса положительные значения  в области расслаивания переходят в отрицательные в районе азеотропа. Примером является система уксусная кислота + триэтиламин.
в области расслаивания переходят в отрицательные в районе азеотропа. Примером является система уксусная кислота + триэтиламин.
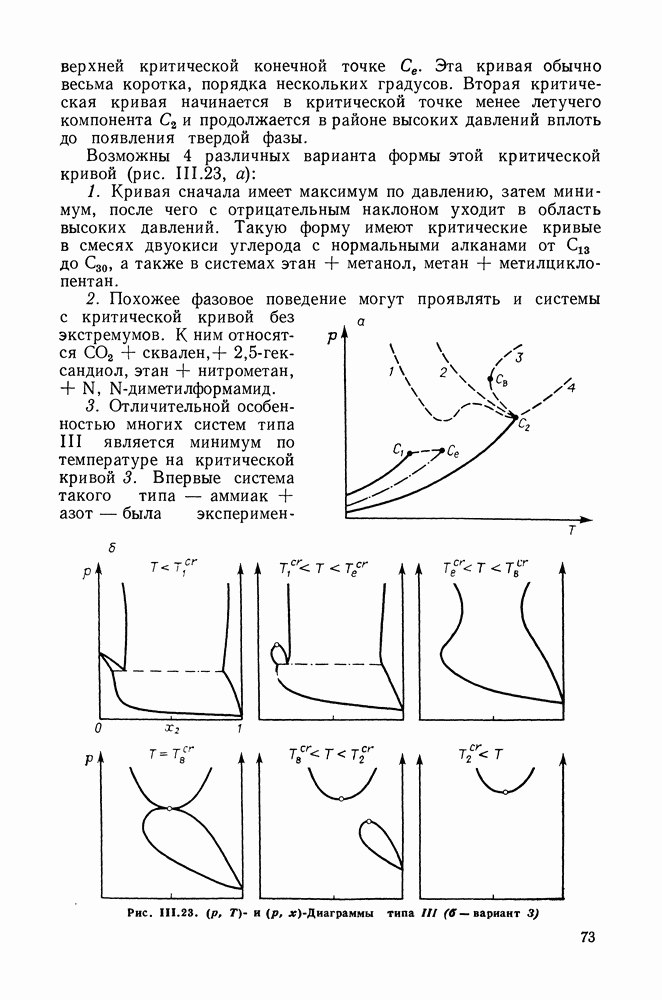
Тип III. Тогда, когда область расслаивания большая и трехфазная линия продолжается в сторону высоких температур, критическая кривая разрывается и тип II переходит в тип III. Последний характеризуется отсутствием непрерывной критической кривой, соединяющей критические точки чистых компонентов 
Одна критическая кривая начинается в точке  и заканчивается в
и заканчивается в
Рис. III.22. (см. скан)  -Диаграммы
-Диаграммы  типа
типа 
верхней критической конечной точке  Эта кривая обычно весьма коротка, порядка нескольких градусов. Вторая критическая кривая начинается в критической точке менее летучего компонента
Эта кривая обычно весьма коротка, порядка нескольких градусов. Вторая критическая кривая начинается в критической точке менее летучего компонента  и продолжается в районе высоких давлений вплоть до появления твердой фазы.
и продолжается в районе высоких давлений вплоть до появления твердой фазы.
Возможны 4 различных варианта формы этой критической кривой (рис. III.23, а):
1. Кривая сначала имеет максимум по давлению, затем минимум, после чего с отрицательным наклоном уходит в область высоких давлений. Такую форму имеют критические кривые в смесях двуокиси углерода с нормальными алканами от  до
до  а также в системах этан + метанол, метан + метилциклопентан.
а также в системах этан + метанол, метан + метилциклопентан.
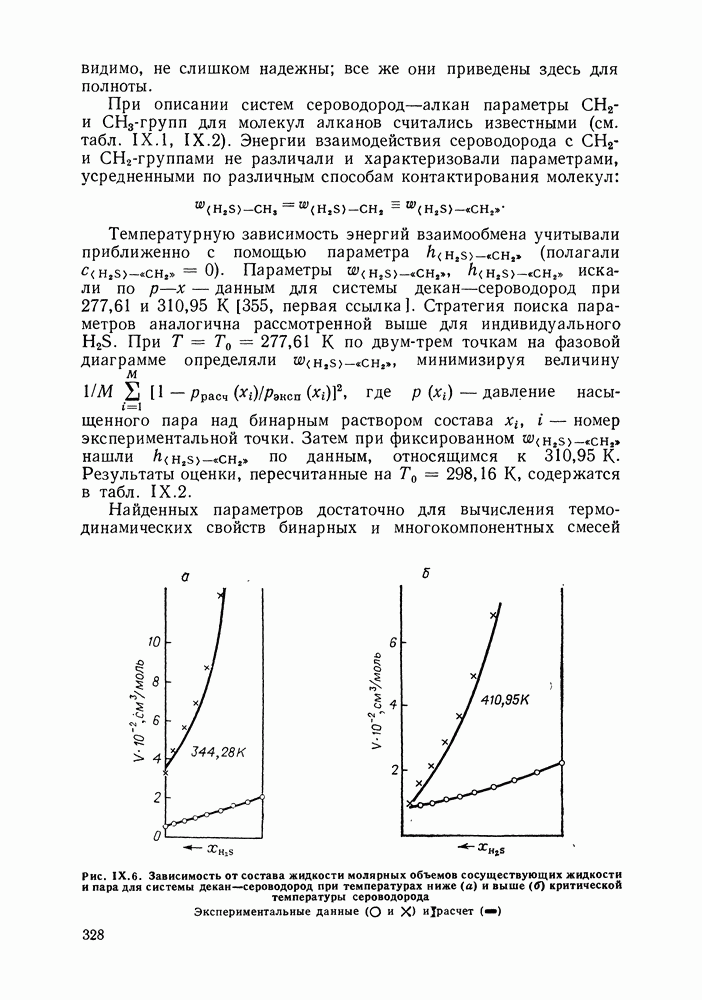
2. Похожее фазовое поведение могут проявлять и системы с критической кривой без экстремумов. К ним относятся  -гек-сандиол, этан + нитрометан,
-гек-сандиол, этан + нитрометан, 
3. Отличительной особенностью многих систем типа III является минимум по температуре на критической кривой 3. Впервые система такого типа — аммиак + азот — была
Рис. III.23. (см. скан) 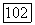 и
и 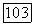 -Диаграммы типа
-Диаграммы типа 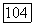 вариант 3)
вариант 3)

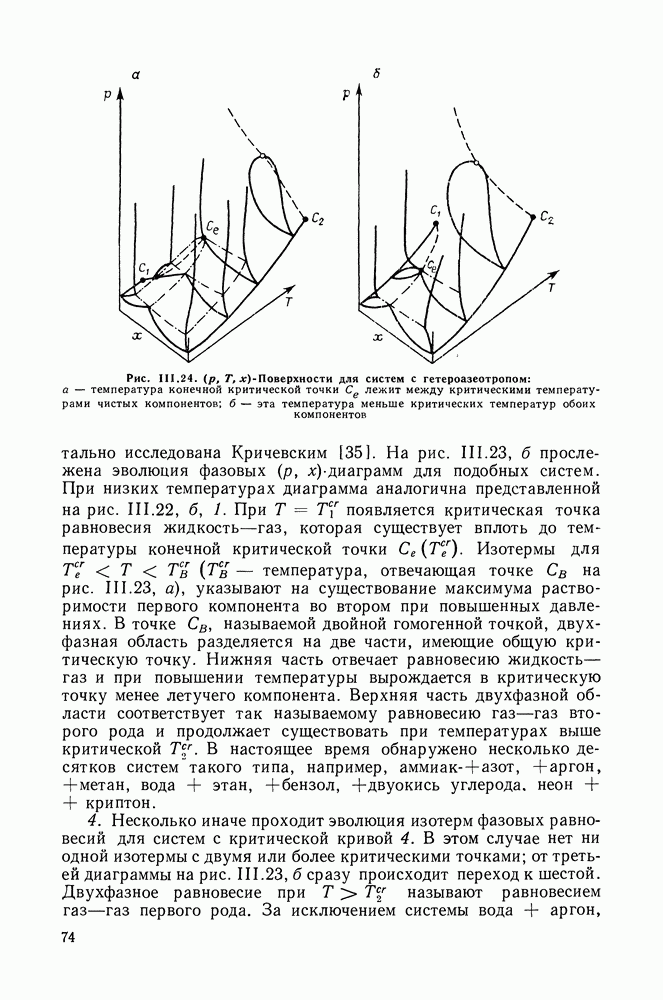
Рис. III.24. 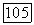 -Поверхности для систем с гетероазеотропом: а — температура конечной критической точки
-Поверхности для систем с гетероазеотропом: а — температура конечной критической точки 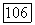 лежит между критическими температурами чистых компонентов;
лежит между критическими температурами чистых компонентов; 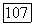 эта температура меньше критических температур обоих компонентов
эта температура меньше критических температур обоих компонентов
экспериментально исследована Кричевским [35]. На рис. 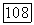 прослежена эволюция фазовых
прослежена эволюция фазовых 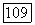 -диаграмм для подобных систем. При низких температурах диаграмма аналогична представленной на рис. 111.22, б, 1. При
-диаграмм для подобных систем. При низких температурах диаграмма аналогична представленной на рис. 111.22, б, 1. При 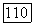 появляется критическая точка равновесия жидкость—газ, которая существует вплоть до температуры конечной критической точки
появляется критическая точка равновесия жидкость—газ, которая существует вплоть до температуры конечной критической точки 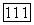 Изотермы для
Изотермы для 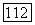 температура, отвечающая точке
температура, отвечающая точке 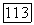 на рис. III.23, а), указывают на существование максимума растворимости первого компонента во втором при повышенных давлениях. В точке
на рис. III.23, а), указывают на существование максимума растворимости первого компонента во втором при повышенных давлениях. В точке 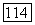 называемой двойной гомогенной точкой, двухфазная область разделяется на две части, имеющие общую критическую точку. Нижняя часть отвечает равновесию жидкость—газ и при повышении температуры вырождается в критическую точку менее летучего компонента. Верхняя часть двухфазной области соответствует так называемому равновесию газ—газ второго рода и продолжает существовать при температурах выше критической
называемой двойной гомогенной точкой, двухфазная область разделяется на две части, имеющие общую критическую точку. Нижняя часть отвечает равновесию жидкость—газ и при повышении температуры вырождается в критическую точку менее летучего компонента. Верхняя часть двухфазной области соответствует так называемому равновесию газ—газ второго рода и продолжает существовать при температурах выше критической 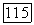 В настоящее время обнаружено несколько десятков систем такого типа, например, аммиак- + азот, +аргон, +метан, вода + этан, +бензол, +Двуокись углерода, неон + криптон.
В настоящее время обнаружено несколько десятков систем такого типа, например, аммиак- + азот, +аргон, +метан, вода + этан, +бензол, +Двуокись углерода, неон + криптон.
4. Несколько иначе проходит эволюция изотерм фазовых равновесий для систем с критической кривой 4. В этом случае нет ни одной изотермы с двумя или более критическими точками; от третьей диаграммы на рис. 111.23, б сразу происходит переход к шестой. Двухфазное равновесие при 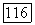 называют равновесием газ—газ первого рода. За исключением системы вода + аргон,
называют равновесием газ—газ первого рода. За исключением системы вода + аргон,
все системы этого типа содержат в качестве одного из компонентов гелий.
Заметим, что термин «равновесие газ—газ, предложенный Камерлинг-Оннесом является, по-видимому, не совсем удачным и многие исследователи считают более предпочтительным термин «равновесие флюид—флюид» [36].
В рассмотренных вариантах типа III трехфазная линия располагалась между кривыми давления паров чистых компонентов. В некоторых случаях она лежит выше линий насыщения компонентов, что свидетельствует о гетероазеотропии. При этом возможны две ситуации, изображенные на рис. III.24: а — трехфазная линия доходит до температуры более высокой, чем температура критической точки первого компонента; 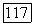 температура конечной критической точки
температура конечной критической точки 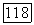 меньше критических температур обоих чистых компонентов. Интересной особенностью систем, имеющих диаграммы этого типа, является то, что давление пара при гетероазеотропном равновесии вблизи верхней конечной критической точки больше суммы давлений паров чистых компонентов при той же температуре.
меньше критических температур обоих чистых компонентов. Интересной особенностью систем, имеющих диаграммы этого типа, является то, что давление пара при гетероазеотропном равновесии вблизи верхней конечной критической точки больше суммы давлений паров чистых компонентов при той же температуре.
Системы вода + диэтиловый эфир, 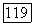 -бутен, +этоксиэтанол имеют диаграммы, изображенные на рис. III.24. а. Для водных растворов пентана, гексана, гептана, циклогексана наблюдаются диаграммы, представленные на рис. 111.24, б.
-бутен, +этоксиэтанол имеют диаграммы, изображенные на рис. III.24. а. Для водных растворов пентана, гексана, гептана, циклогексана наблюдаются диаграммы, представленные на рис. 111.24, б.
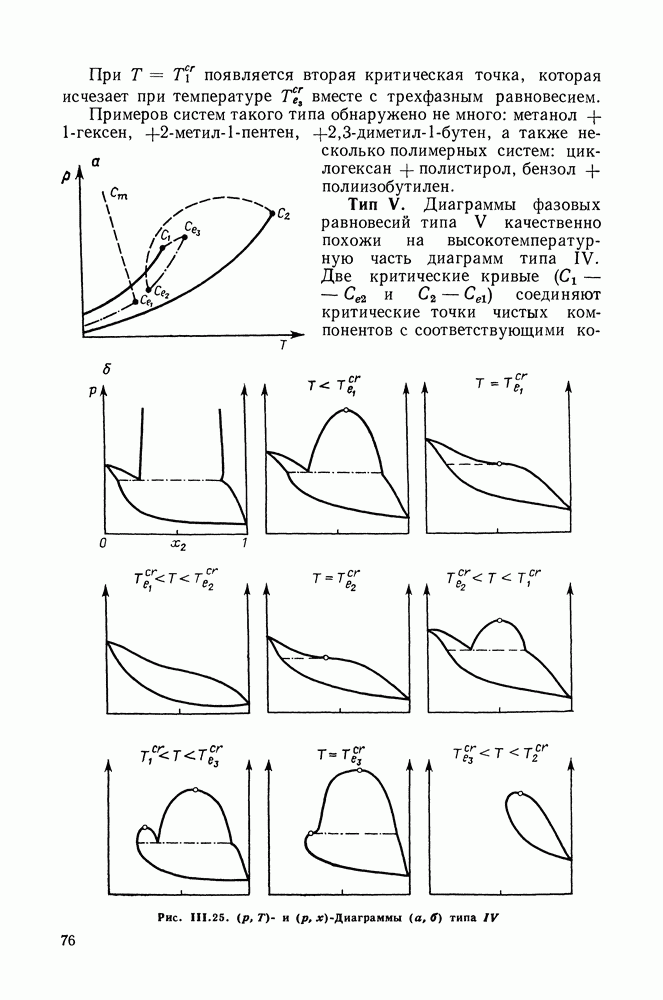
Тип IV. Системы, относящиеся к этому типу, отличаются особенно сложным фазовым поведением (рис. 111.25). Критическая кривая, начинающаяся в критической точке менее летучего компонента 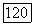 заканчивается в нижней конечной критической точке
заканчивается в нижней конечной критической точке 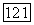 на трехфазной линии. Таким образом, в начале это критическая кривая равновесия жидкость—газ, затем, меняя непрерывно свой характер, она становится критической кривой равновесия жидкость—жидкость. Линия трехфазных равновесий
на трехфазной линии. Таким образом, в начале это критическая кривая равновесия жидкость—газ, затем, меняя непрерывно свой характер, она становится критической кривой равновесия жидкость—жидкость. Линия трехфазных равновесий 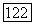 обычно очень коротка. Верхняя конечная критическая точка
обычно очень коротка. Верхняя конечная критическая точка 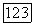 связана небольшой критической кривой с критической точкой первого компонента
связана небольшой критической кривой с критической точкой первого компонента 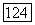 В низкотемпературной области есть еще одна трехфазная линия, заканчивающаяся верхней конечной критической точкой
В низкотемпературной области есть еще одна трехфазная линия, заканчивающаяся верхней конечной критической точкой 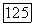 этой точке начинается третья критическая линия
этой точке начинается третья критическая линия 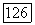 Сот, которая продолжается в область высоких давлений до границы, отвечающей критическому жидкому раствору в равновесии с твердой фазой. Более ясное представление о фазовом поведении типа IV можно получить, рассматривая
Сот, которая продолжается в область высоких давлений до границы, отвечающей критическому жидкому раствору в равновесии с твердой фазой. Более ясное представление о фазовом поведении типа IV можно получить, рассматривая 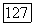 -диаграммы при различных температурах (рис. 111.25, б). При температурах
-диаграммы при различных температурах (рис. 111.25, б). При температурах 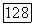 растворы расслаиваются; при
растворы расслаиваются; при 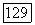 расслаивание исчезает и появляется вновь при
расслаивание исчезает и появляется вновь при 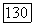 В области температур от
В области температур от 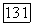 до
до 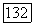 происходит эволюция критической точки равновесия жидкость—жидкость в критическую точку равновесия жидкость—газ менее летучего компонента.
происходит эволюция критической точки равновесия жидкость—жидкость в критическую точку равновесия жидкость—газ менее летучего компонента.
При 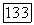 появляется вторая критическая точка, которая исчезает при температуре
появляется вторая критическая точка, которая исчезает при температуре 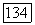 вместе с трехфазным равновесием.
вместе с трехфазным равновесием.
Примеров систем такого типа обнаружено не много: метанол 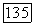 -гексен, +2-метил-1-пентен, +2,3-диметил-
-гексен, +2-метил-1-пентен, +2,3-диметил-  -бутен, а также несколько полимерных систем: циклогексан + полистирол, бензол + полиизобутилен.
-бутен, а также несколько полимерных систем: циклогексан + полистирол, бензол + полиизобутилен.
Тип V. Диаграммы фазовых равновесий типа V качественно похожи на высокотемпературную часть диаграмм типа IV. Две критические кривые 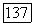 соединяют критические точки чистых компонентов с соответствующими
соединяют критические точки чистых компонентов с соответствующими
Рис. III.25. (см. скан)  и
и  -Диаграммы
-Диаграммы  типа IV
типа IV

Рис. III.26.  -Диаграмма типа
-Диаграмма типа 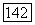 и
и 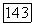
конечными критическими точками на единственной трехфазной линии 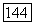 (рис. III.26, а). Заметим, что нижняя конечная критическая точка может отвечать температуре как ниже, так и выше Тип V фазового поведения достаточно распространен среди систем, компоненты которых значительно различаются по критическим параметрам:
(рис. III.26, а). Заметим, что нижняя конечная критическая точка может отвечать температуре как ниже, так и выше Тип V фазового поведения достаточно распространен среди систем, компоненты которых значительно различаются по критическим параметрам: 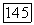 -бутанол, метан
-бутанол, метан 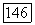 гексан,
гексан, 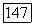 -метилпентан. При невысоких температурах жидкие растворы являются гомогенными во всей концентрационной области. Но около критической точки более летучего компонента существует температурный интервал, в котором происходит расслаивание жидкого раствора.
-метилпентан. При невысоких температурах жидкие растворы являются гомогенными во всей концентрационной области. Но около критической точки более летучего компонента существует температурный интервал, в котором происходит расслаивание жидкого раствора.
Иногда критическая кривая 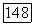 заканчивается в области существования твердой фазы и нижняя конечная критическая точка
заканчивается в области существования твердой фазы и нижняя конечная критическая точка  становится метастабильной.
становится метастабильной.
Для характеристики взаимной растворимости жидкостей в таких системах Роулинсон предложил термин абсолютная несмешиваемость: ни при какой температуре (от границы твердая фаза—жидкость до критической кривой жидкость—газ) полная смешиваемость жидкостей отсутствует. Примерами являются системы метан 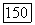 гептан,
гептан, 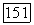 -метил гексан,
-метил гексан, 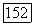
Тип VI. Фазовые диаграммы типа VI во многом похожи на диаграммы типа II и отличаются от них только наличием нижней конечной критической точки (рис. 111.26, б). Такое фазовое поведение обнаруживается для систем сложной химической природы, где оба компонента или один из них способны и к самоассоциации, и к образованию смешанных ассоциатов. Обычно одним из компонентов этих систем является вода или тяжелая вода.
Критические кривые на рис. II 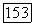 начинающиеся в конечных критических точках
начинающиеся в конечных критических точках 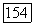 соединяются в точке верхнего критического давления (гиперкритической точке, где
соединяются в точке верхнего критического давления (гиперкритической точке, где 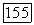 . При более высоких давлениях раствор остается гомогенным во всей области концентраций. Диаграммы, подобные изображенным на рис. II
. При более высоких давлениях раствор остается гомогенным во всей области концентраций. Диаграммы, подобные изображенным на рис. II 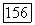 обнаружены в системах вода
обнаружены в системах вода 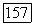 -бутанол,
-бутанол, 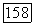 -бутоксиэтанол.
-бутоксиэтанол.
Возможен вариант, когда критические кривые, идущие из точек 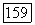 расходятся и не образуют замкнутой куполообразной области. В этом случае область несмешиваемости увеличивается с возрастанием давления. Известны две такие системы: тяжелая вода
расходятся и не образуют замкнутой куполообразной области. В этом случае область несмешиваемости увеличивается с возрастанием давления. Известны две такие системы: тяжелая вода 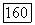
В системах 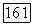 пиридин,
пиридин, 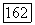 тяжелая вода
тяжелая вода 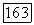 при низких давлениях растворы остаются гомогенными. Расслаивание возникает только при высоких давлениях. Куполообразная область ограниченной смешиваемости жидкостей на рис.
при низких давлениях растворы остаются гомогенными. Расслаивание возникает только при высоких давлениях. Куполообразная область ограниченной смешиваемости жидкостей на рис. 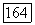 в этом случае обращена вниз.
в этом случае обращена вниз.
Наконец, возможна комбинация последнего варианта с первым. Область расслаивания существует при низких и высоких давлениях, а при средних компоненты смешиваются во всех соотношениях. Единственным примером служит система тяжелая вода 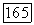 -метил пиридин.
-метил пиридин.
Мы рассмотрели типы фазовых диаграмм экспериментально исследованных бинарных систем. В ряде работ сделаны успешные попытки описать типы фазового поведения на основе уравнений состояния. Скотт и Ван-Кониненберг [33] показали возможность применения одножидкостной модели уравнения состояния Ван-ден-Ваальса для качественного описания наблюдаемых типов фазовых диаграмм. Они выделили области значений параметров модели, соответствующих каждому типу (кроме типа VI), и предсказали существование новых, экспериментально еще не обнаруженных типов фазовых диаграмм.
На основе одножидкостной модели уравнения состояния в 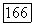 изучено фазовое поведение бинарных леннард-джонсовских систем. Несмотря на некоторые упрощения, эта модель качественно верно описывает фазовые диаграммы большинства реальных смесей. Выявлены некоторые новые типы диаграмм, в частности, установлена возможность сосуществования одной газовой и трех жидких фаз в четырехфазной точке бинарной системы. Эта ситуация реализуется в пяти типах фазовых диаграмм, которые пока экспериментально не обнаружены. В результате анализа зависимостей фазового поведения бинарных систем от межмолекулярного взаимодействия компонентов точно локализованы границы между типами в пространстве параметров модели.
изучено фазовое поведение бинарных леннард-джонсовских систем. Несмотря на некоторые упрощения, эта модель качественно верно описывает фазовые диаграммы большинства реальных смесей. Выявлены некоторые новые типы диаграмм, в частности, установлена возможность сосуществования одной газовой и трех жидких фаз в четырехфазной точке бинарной системы. Эта ситуация реализуется в пяти типах фазовых диаграмм, которые пока экспериментально не обнаружены. В результате анализа зависимостей фазового поведения бинарных систем от межмолекулярного взаимодействия компонентов точно локализованы границы между типами в пространстве параметров модели.
Бошкову [38] удалось определить область значений параметров уравнения состояния, описывающего фазовое поведение типа VI.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА
- Глава I. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕРМОДИНАМИКИ ГЕТЕРОГЕННЫХ РАВНОВЕСИЙ
- 1.2. УСЛОВИЯ РАВНОВЕСИЯ ГЕТЕРОГЕННЫХ СИСТЕМ
- 1.3. ТИПЫ РАВНОВЕСИЙ
- 1.4. УСЛОВИЯ УСТОЙЧИВОСТИ
- 1.5. ПРАВИЛО ФАЗ
- Глава II. ОДНОКОМПОНЕНТНЫЕ СИСТЕМЫ
- II.1. ДИАГРАММЫ СОСТОЯНИЯ
- II.2. УРАВНЕНИЕ КЛАУЗИУСА—КЛАПЕЙРОНА
- II.3. ЗАВИСИМОСТЬ ДАВЛЕНИЯ ОТ ТЕМПЕРАТУРЫ. УРАВНЕНИЕ АНТУАНА
- II.4. ЗАКОН СООТВЕТСТВЕННЫХ СОСТОЯНИЙ
- II.5. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА. ДРУГИЕ АНАЛИТИЧЕСКИЕ УРАВНЕНИЯ СОСТОЯНИЯ
- II.6. ВИРИАЛЬНОЕ УРАВНЕНИЕ СОСТОЯНИЯ
- Глава III. ДВОЙНЫЕ СИСТЕМЫ
- III.1. ДИАГРАММЫ РАВНОВЕСИЯ ДЛЯ ДВОЙНЫХ СИСТЕМ
- III.2. ОБОБЩЕННОЕ ДИФФЕРЕНЦИАЛЬНОЕ УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
- III.3. ЗАКОНЫ КОНОВАЛОВА
- III.4. ЗАКОНЫ ВРЕВСКОГО
- III.5. ИДЕАЛЬНЫЕ СИСТЕМЫ
- III.6. РАЗБАВЛЕННЫЕ РАСТВОРЫ
- III.7 РЕАЛЬНЫЕ СИСТЕМЫ
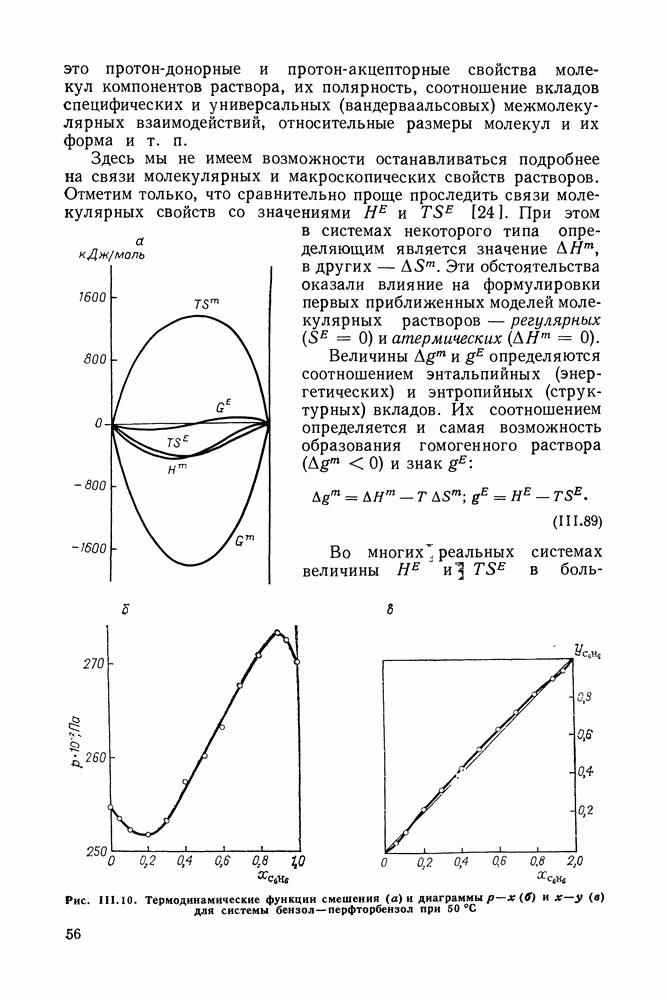
- III.8. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СМЕШЕНИЯ И РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР
- III.9. ОБ АЗЕОТРОПИИ В БИНАРНЫХ СИСТЕМАХ
- III.10. ТРЕХФАЗНЫЕ РАВНОВЕСИЯ ЖИДКОСТЬ—ЖИДКОСТЬ—ПАР В ДВОЙНЫХ СИСТЕМАХ
- III.11. ФАЗОВЫЕ ДИАГРАММЫ БИНАРНЫХ СИСТЕМ В ШИРОКОМ ИНТЕРВАЛЕ ТЕМПЕРАТУР И ДАВЛЕНИЙ
- Глава IV. ТРОЙНЫЕ И МНОГОКОМПОНЕНТНЫЕ СИСТЕМЫ
- IV.2. ПРОЯВЛЕНИЕ ЗАКОНОВ КОНОВАЛОВА И ВРЕВСКОГО В ТРОЙНЫХ И МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ
- IV.3. ОТКРЫТЫЕ ФАЗОВЫЕ ПРОЦЕССЫ. ТЕРМОДИНАМИКО-ТОПОЛОГИЧЕСКИЕ ЗАКОНОМЕРНОСТИ
- Глава V. МЕТОДЫ ЭКСПЕРИМЕНТАЛЬНОГО ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР
- V.I. ЦИРКУЛЯЦИОННЫЙ МЕТОД
- V.2. МЕТОД ОТКРЫТОГО ИСПАРЕНИЯ
- V.3. МЕТОД СТРУИ ИНЕРТНОГО ГАЗА
- V.4. СТАТИЧЕСКИЙ МЕТОД
- V.5. ИЗОПИЕСТИЧЕСКИЙ МЕТОД
- V.6. ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
- V.7. РАСЧЕТ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР ПО ЗАВИСИМОСТИ ДАВЛЕНИЯ ПАРА ОТ СОСТАВА РАСТВОРА ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ
- V.8. МЕТОДЫ ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР С ПОМОЩЬЮ ГАЗОВОЙ ХРОМАТОГРАФИИ
- V.9. РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР ДЛЯ РАЗБАВЛЕННЫХ РАСТВОРОВ
- Глава VI. МЕТОДЫ ПРОВЕРКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ-ПАР
- VI.2. ОБЩАЯ ОЦЕНКА ТЕРМОДИНАМИЧЕСКИХ МЕТОДОВ ПРОВЕРКИ И ИСПРАВЛЕНИЯ ДАННЫХ
- VI.3. ПРОВЕРКА ДАННЫХ С ПОМОЩЬЮ УРАВНЕНИЙ ГИББСА—ДЮГЕМА И ДЮГЕМА—МАРГУЛЕСА
- VI.4. МЕТОД РЕДЛИХА—КИСТЕРА
- VI.5. МЕТОД ВАН-НЕССА
- VI.6. СТАТИСТИЧЕСКИЕ МЕТОДЫ ОБРАБОТКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР
- VI.7. МЕТОДЫ ПРОВЕРКИ ТЕРМОДИНАМИЧЕСКОЙ СОГЛАСОВАННОСТИ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР В ТРОЙНЫХ СИСТЕМАХ
- VI.8. СОПОСТАВЛЕНИЕ МЕТОДОВ РЕДЛИХА—КИСТЕРА И ВАН-НЕССА
- Глава VII. МЕТОДЫ РАСЧЕТА РАВНОВЕСИЙ ЖИДКОСТЬ—ПАР
- VII. 1. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ РАВНОВЕСНЫХ ЖИДКОСТИ И ПАРА
- VII.2. АЛГОРИТМЫ РАСЧЕТА ФАЗОВЫХ РАВНОВЕСИЙ
- VII.3. УЧЕТ НЕИДЕАЛЬНОСТИ ПАРОВОЙ ФАЗЫ ПРИ СРЕДНИХ И НИЗКИХ ДАВЛЕНИЯХ
- VII.4. ПОЛИНОМИАЛЬНЫЕ УРАВНЕНИЯ ДЛЯ КОЭФФИЦИЕНТОВ АКТИВНОСТИ И УРАВНЕНИЕ ВАН-ЛААРА
- VII.5. МОДЕЛИ ЛОКАЛЬНОГО СОСТАВА
- VII.6. ОЦЕНКА ПАРАМЕТРОВ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ
- VII.7. СОПОСТАВЛЕНИЕ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ ПРИ ОПИСАНИИ ФАЗОВЫХ РАВНОВЕСИЙ
- VII.8. РЕШЕТОЧНЫЕ МОДЕЛИ. МОДЕЛЬ БАРКЕРА
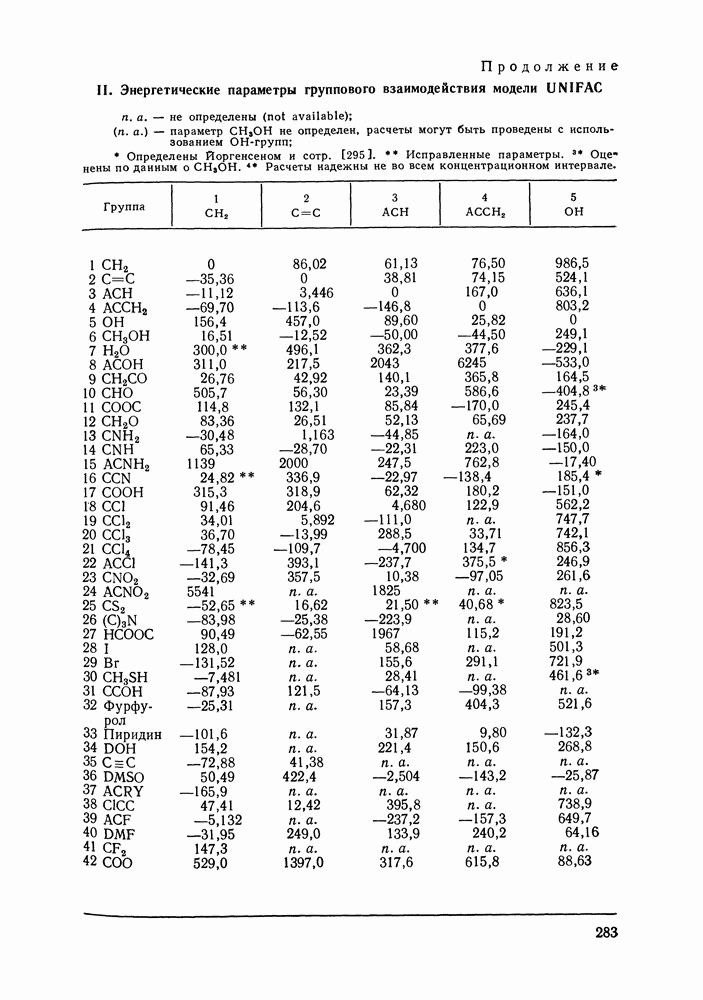
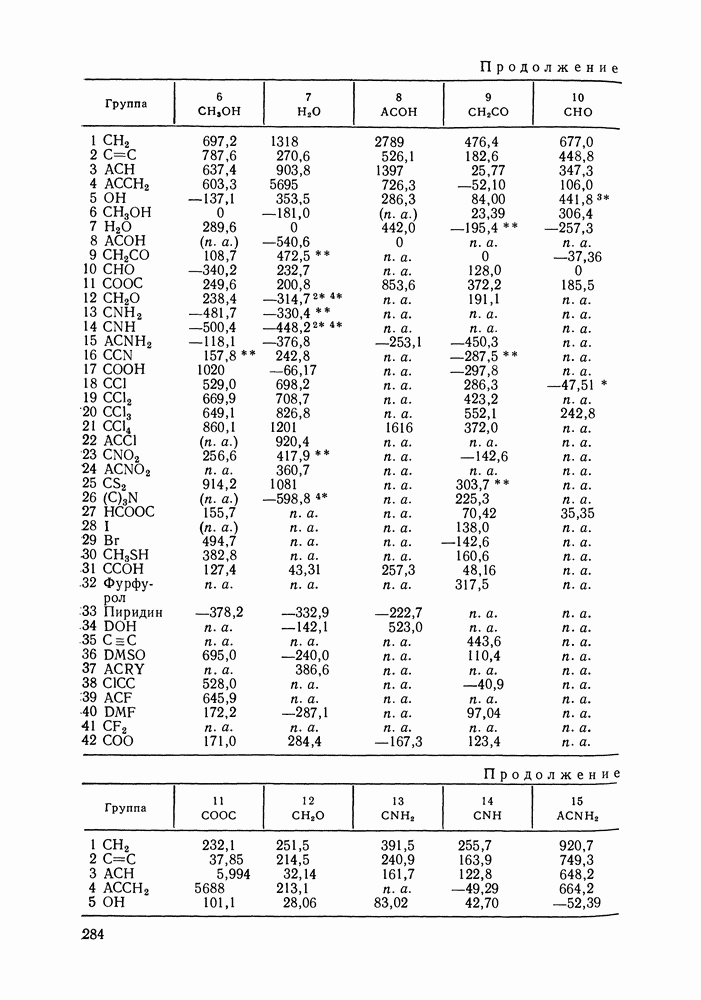
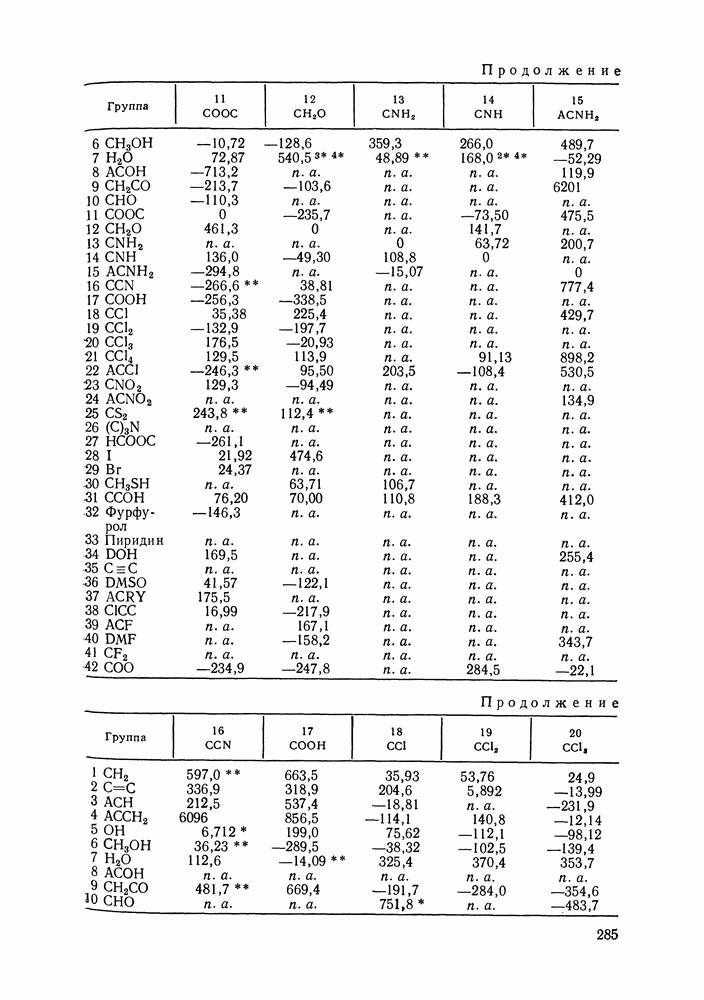
- Глава VIII. ГРУППОВЫЕ МОДЕЛИ РАСТВОРОВ
- VIII.1. ОСНОВНЫЕ ОСОБЕННОСТИ ГРУППОВЫХ МОДЕЛЕЙ РАСТВОРОВ
- VIII.2. МОДЕЛЬ UNIFAC
- VIII.3. КВАЗИХИМИЧЕСКИЕ ГРУППОВЫЕ МОДЕЛИ
- Глава IX. ДЫРОЧНАЯ РЕШЕТОЧНАЯ КВАЗИХИМИЧЕСКАЯ МОДЕЛЬ, ЕЕ ГРУППОВОЙ ВАРИАНТ
- IX.2. ФОРМУЛИРОВКА ДЫРОЧНОЙ КВАЗИХИМИЧЕСКОЙ МОДЕЛИ
- IX.3. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СИСТЕМЫ
- IX.4. О МЕТОДИКЕ РАСЧЕТА
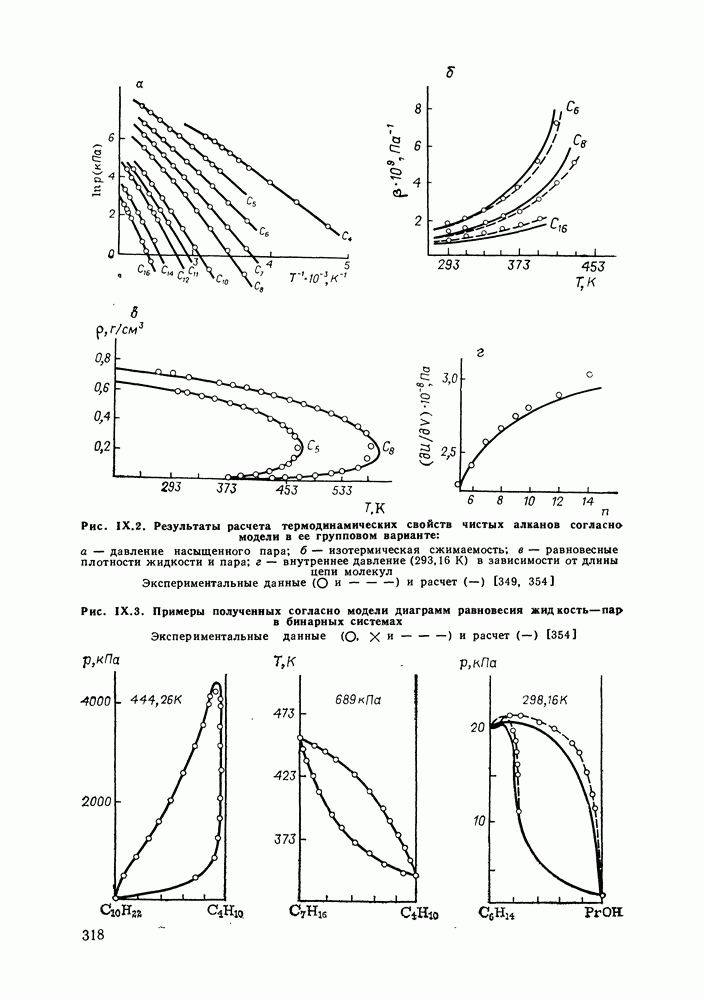
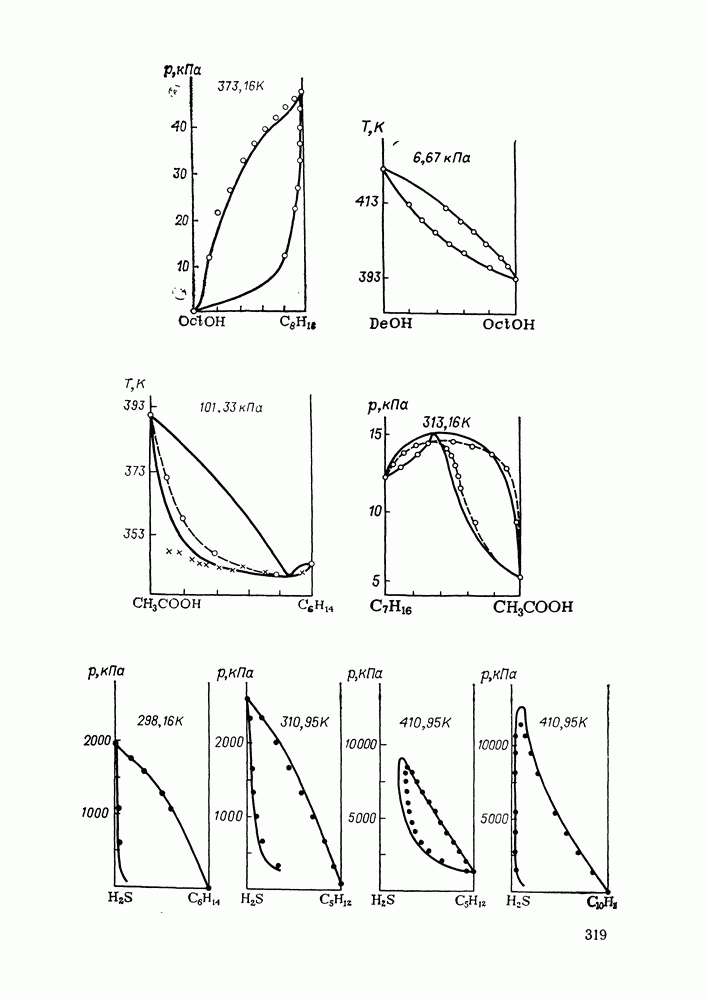
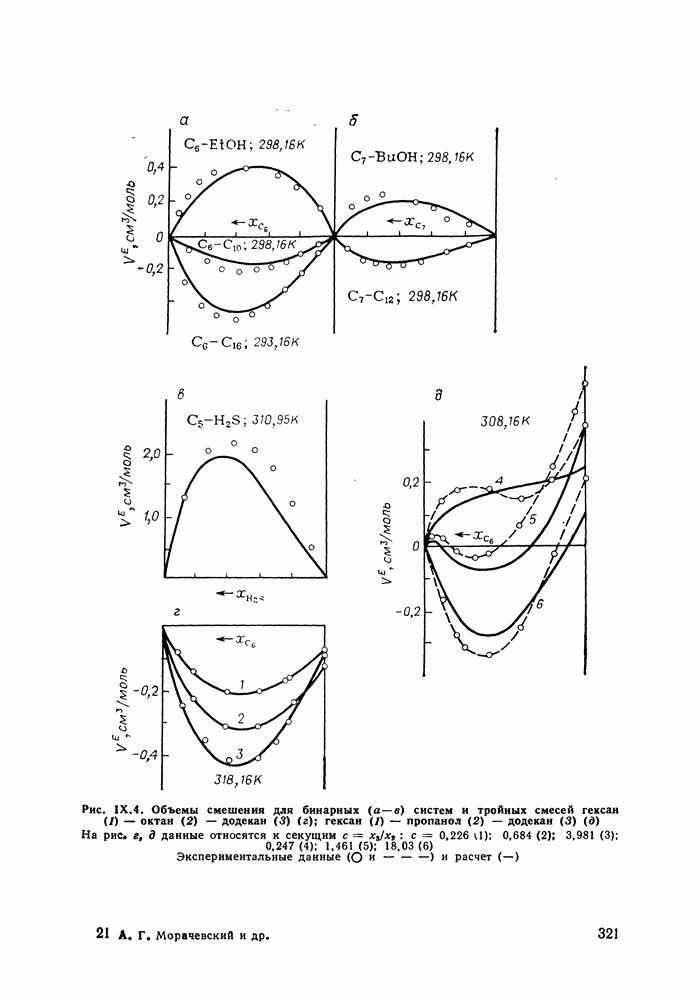
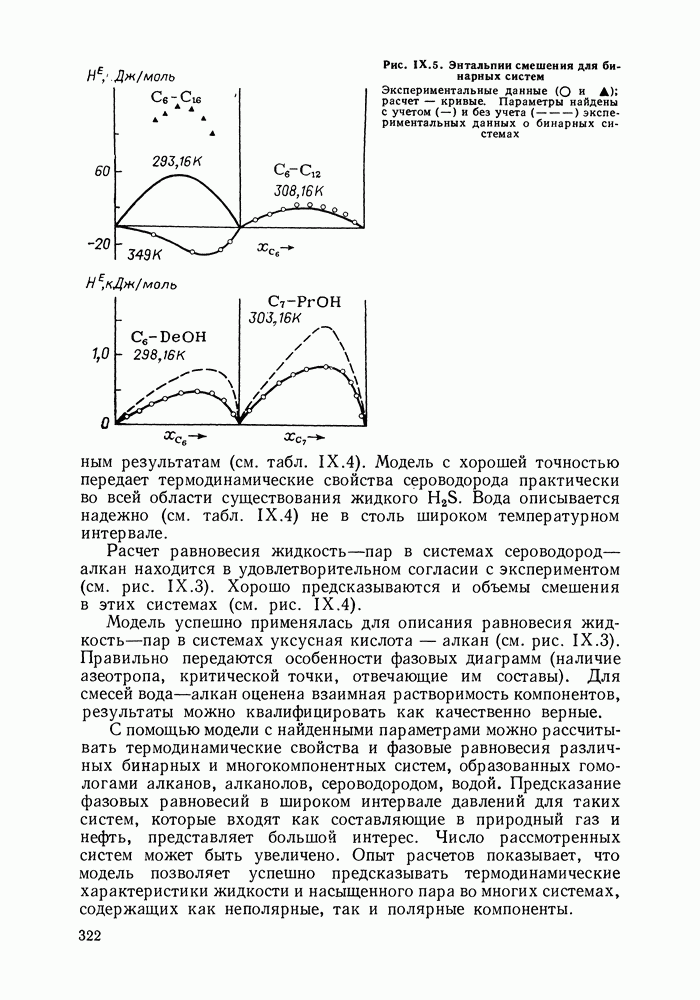
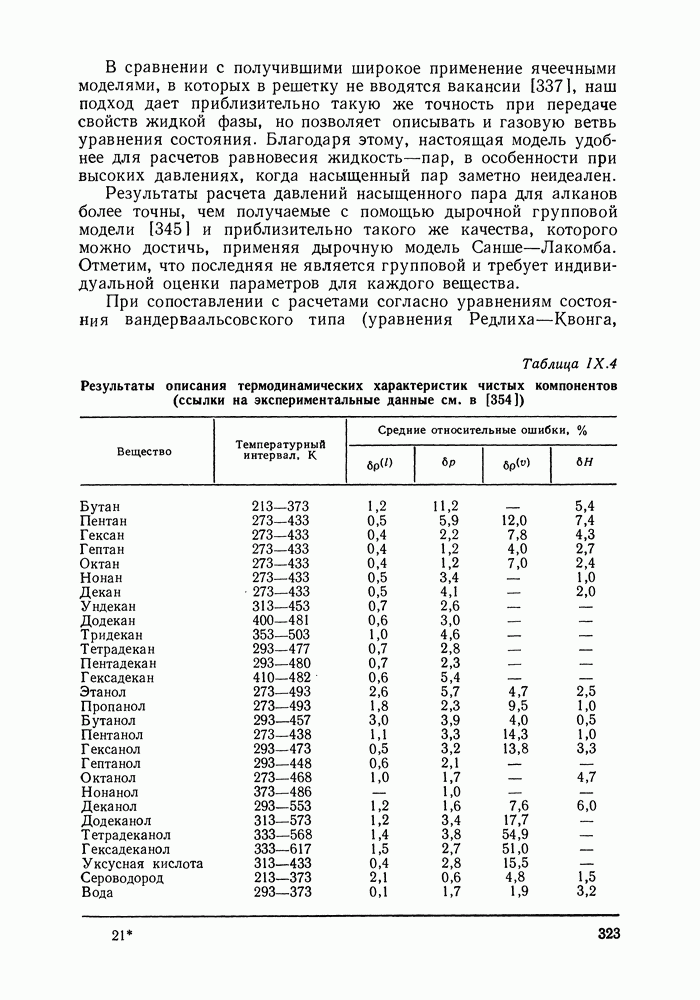
- IX.5. РЕЗУЛЬТАТЫ РАСЧЕТОВ И ВОЗМОЖНОСТИ МОДЕЛИ
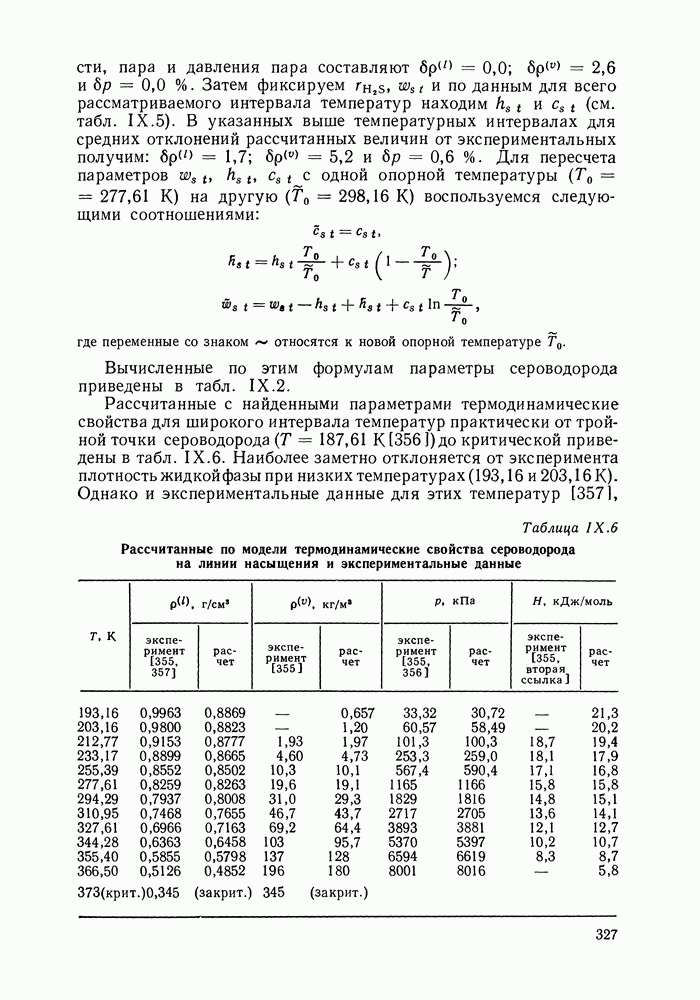
- IX.6. ПРИМЕРЫ РАСЧЕТА