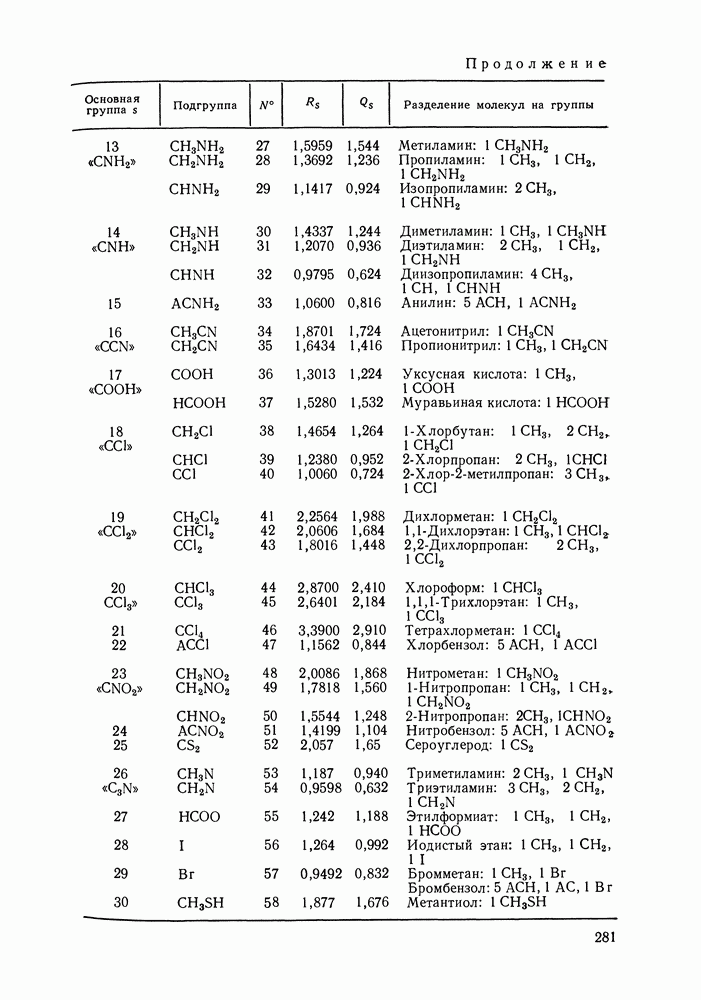
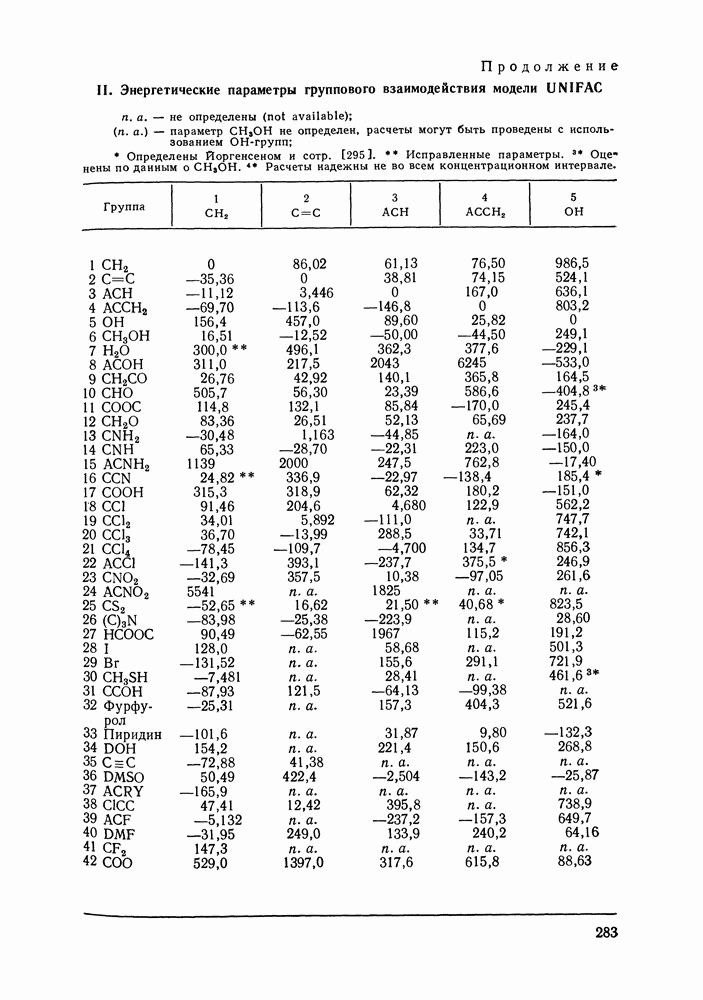
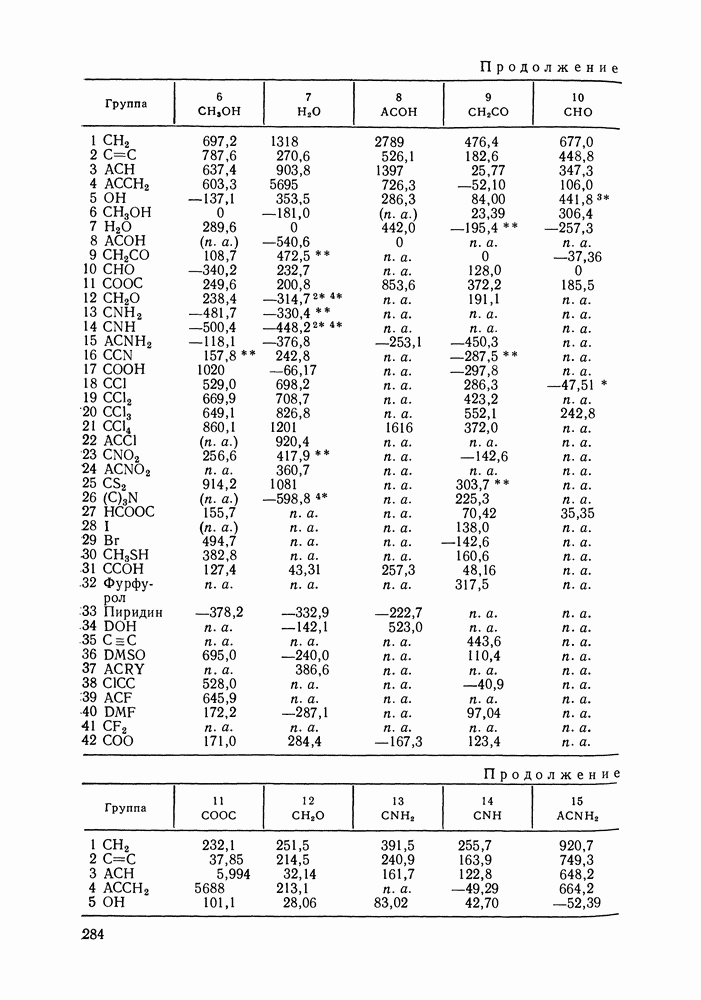
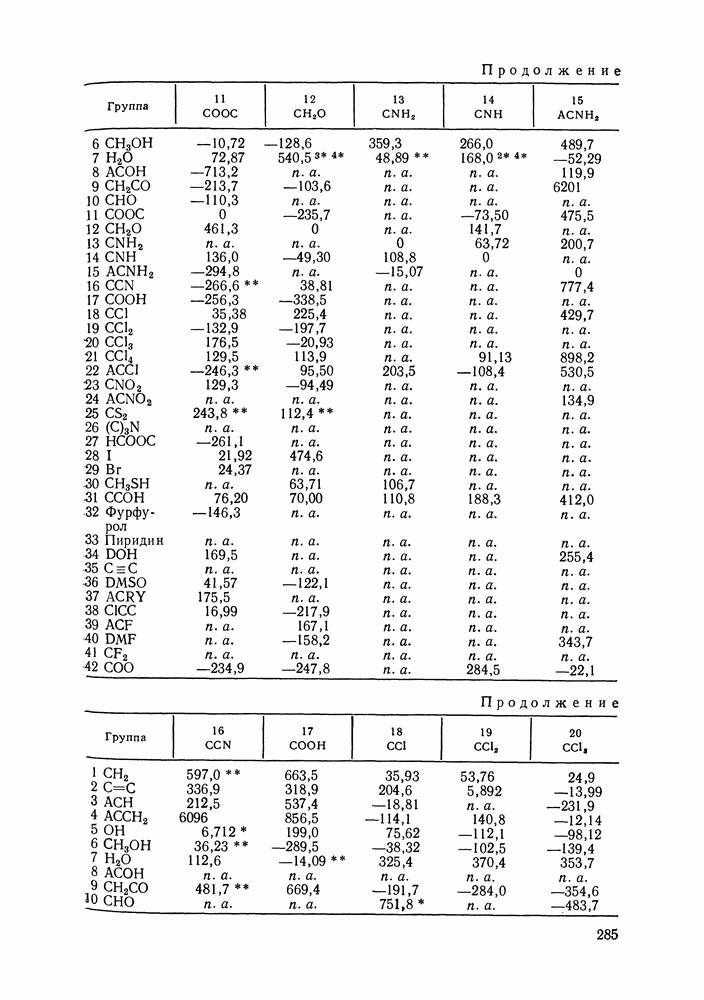
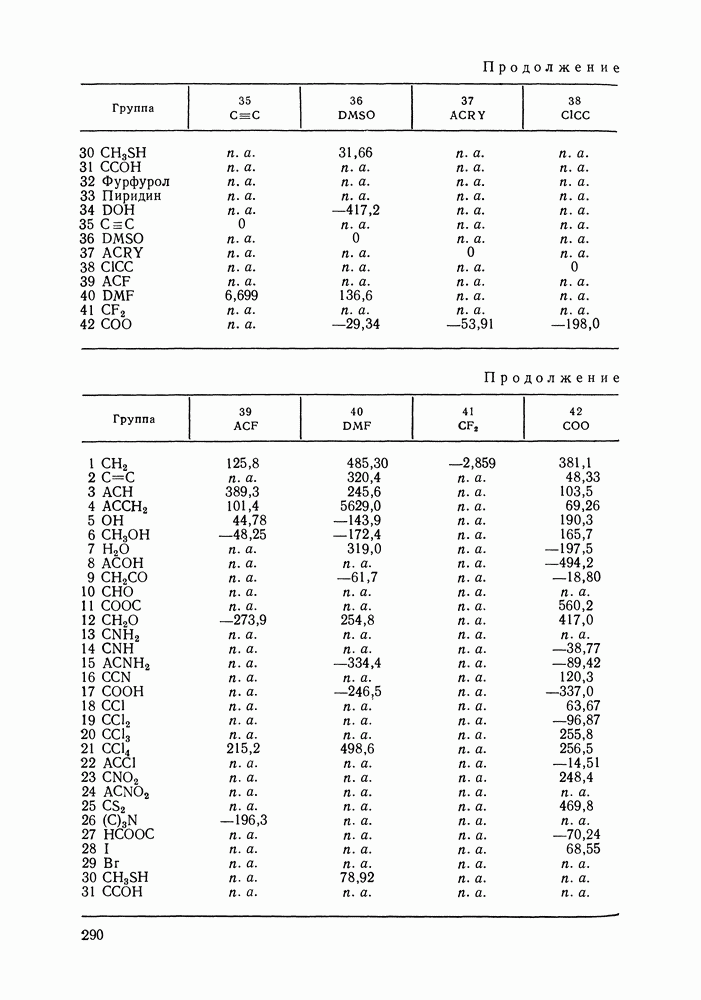
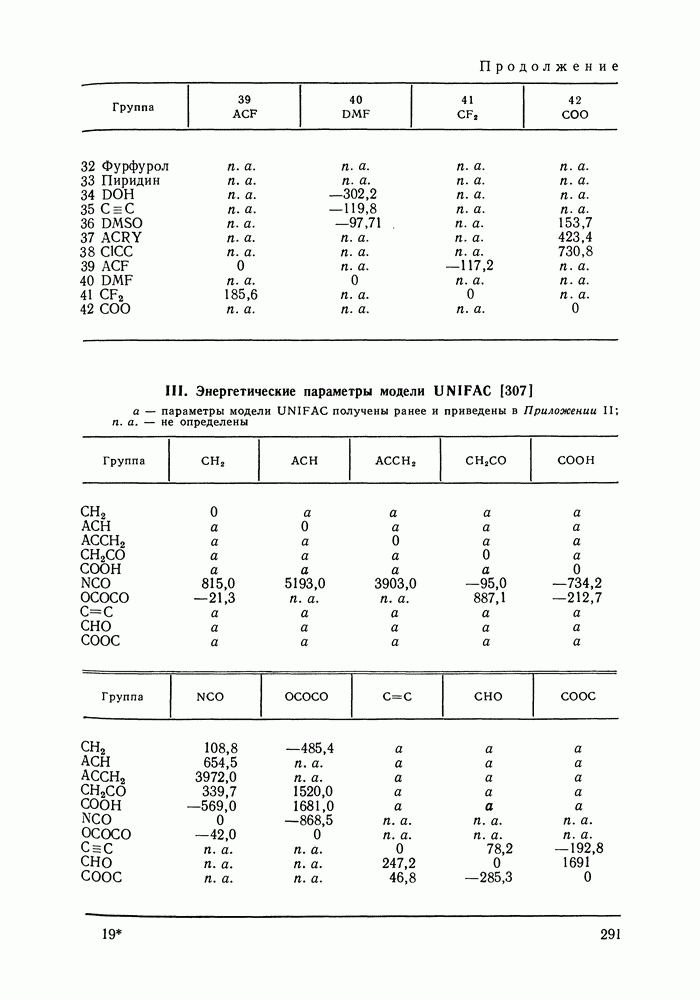
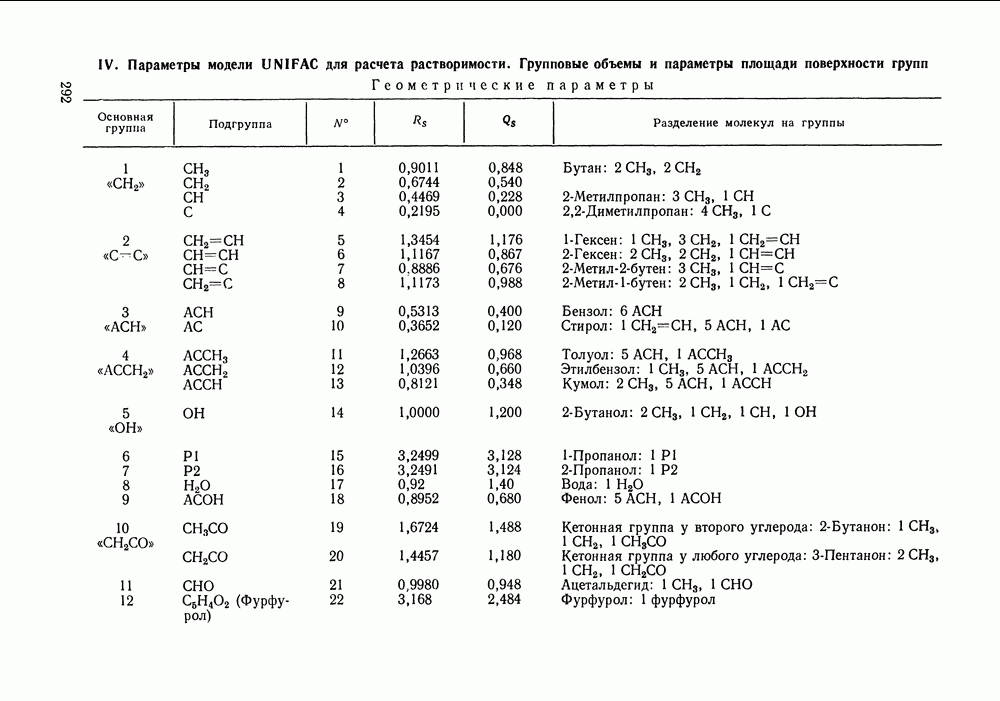
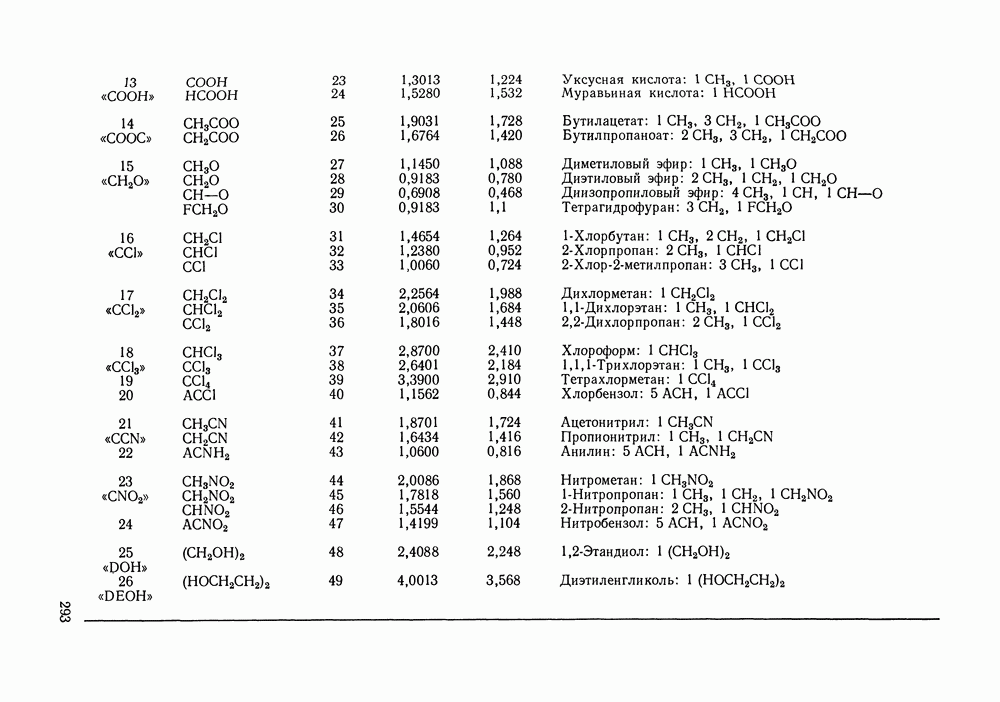
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
III.8. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СМЕШЕНИЯ И РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР
Термодинамические свойства неидеального раствора принято характеризовать избыточными термодинамическими функциями, которые представляют собою разность между функциями смешения данного раствора и идеального. Избыточные функции обозначают символом  По определению:
По определению:

Для индивидуальных веществ (чистых компонентов) все функции смешения равны нулю и, соответственно,  Значения функций смешения идеального раствора были определены ранее [см. (111.50)-(111.54)]. Для реального раствора любой природы имеем:
Значения функций смешения идеального раствора были определены ранее [см. (111.50)-(111.54)]. Для реального раствора любой природы имеем:

Для изучения равновесий жидкость—пар особое значение имеют избыточная энергия Гиббса и избыточный химический потенциал,
которые прямо связаны с активностями и коэффициентами активности:

Подчеркнем, что при вычислении функций смешения пользуются симметричной системой нормировки. Значение и знак  определяют характер и степень отклонения раствора от идеального поведения.
определяют характер и степень отклонения раствора от идеального поведения.
Для идеального раствора, когда  выполняется закон Рауля:
выполняется закон Рауля:  Для неидеального раствора (но при условии применимости к пару законов идеальных газов):
Для неидеального раствора (но при условии применимости к пару законов идеальных газов):

При отклонениях от закона Рауля:

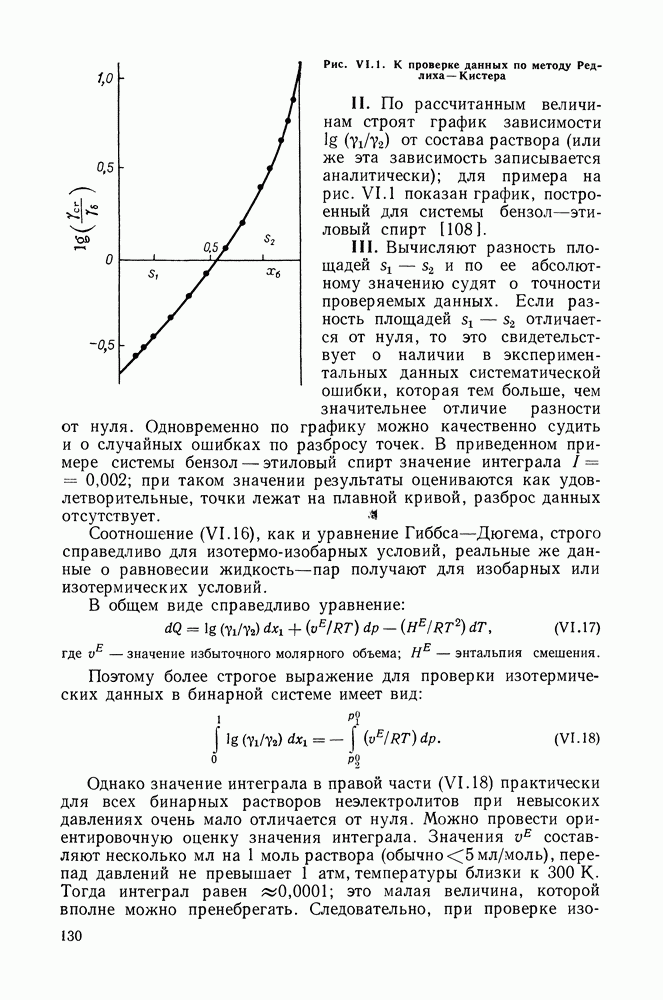
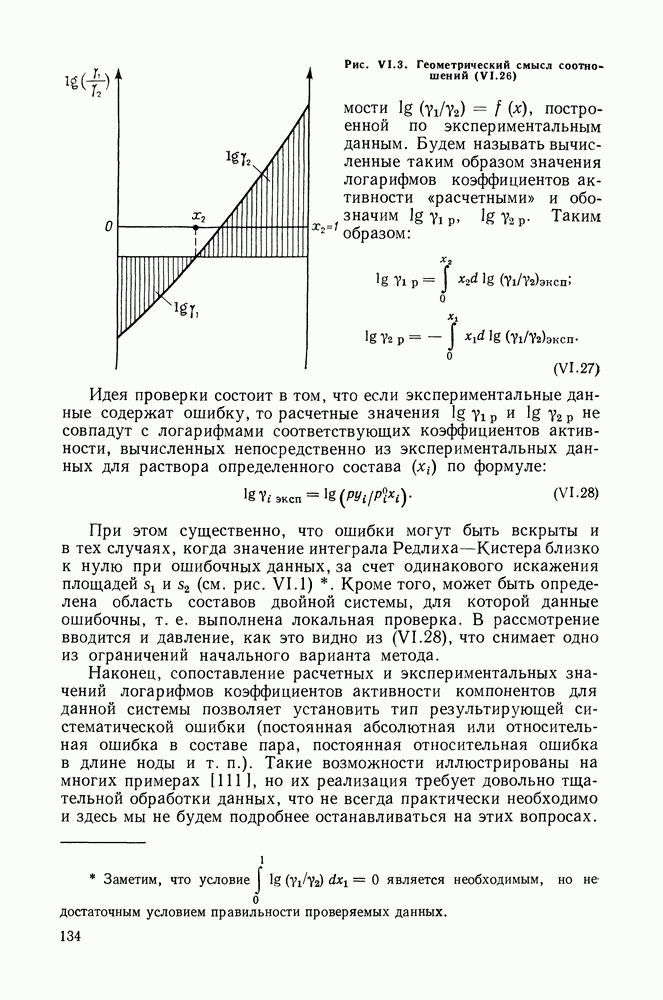
Очевидно, что если для двойной или многокомпонентной систем при небольших давлениях каким-либо путем, из эксперимента или расчетом, вычислены значения  то это означает, что получены полные данные о равновесии жидкость—пар.
то это означает, что получены полные данные о равновесии жидкость—пар.
С другой стороны, и это важно, для растворов неэлектролитов изотермические данные о равновесии жидкость — пар являются основным, а для очень многих систем и единственным источником получения сведений о значениях коэффициента активности,  Если же получены политермические данные о равновесии жидкость—пар, то по ним, пользуясь формулами разд. III.7, можно вычислить и другие избыточные функции смешения —
Если же получены политермические данные о равновесии жидкость—пар, то по ним, пользуясь формулами разд. III.7, можно вычислить и другие избыточные функции смешения — 
К настоящему времени основной объем данных о термодинамических функциях смешения для растворов неэлектролитов накоплен или сочетанием исследования равновесия жидкость—пар в изотермических условиях с калориметрическими измерениями тепловых эффектов смешения, или же на основании политермических исследований равновесий жидкость—пар и соответствующей обработки полученных данных.
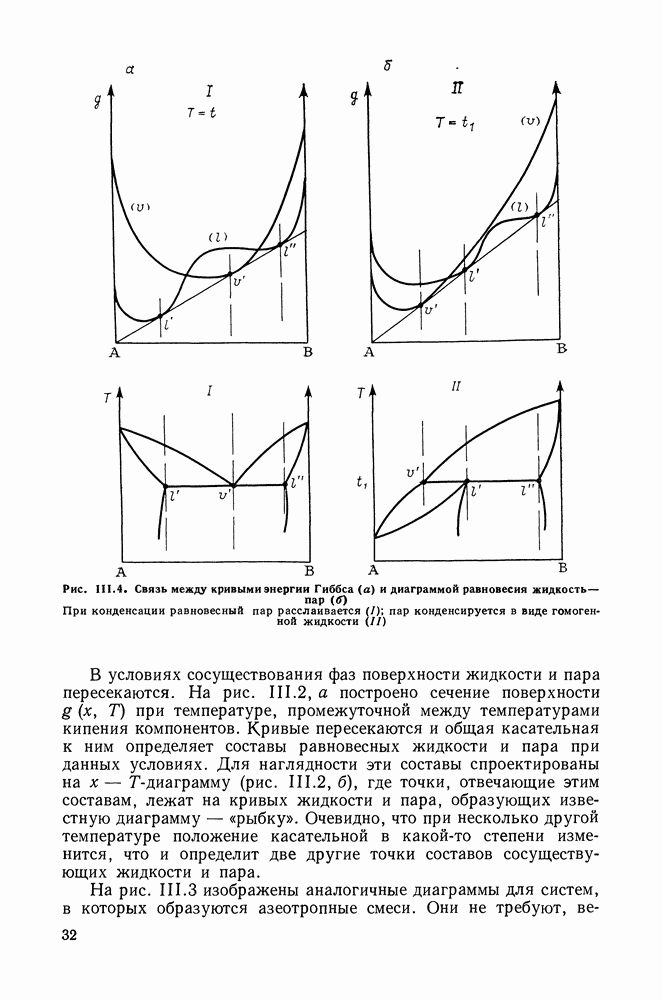
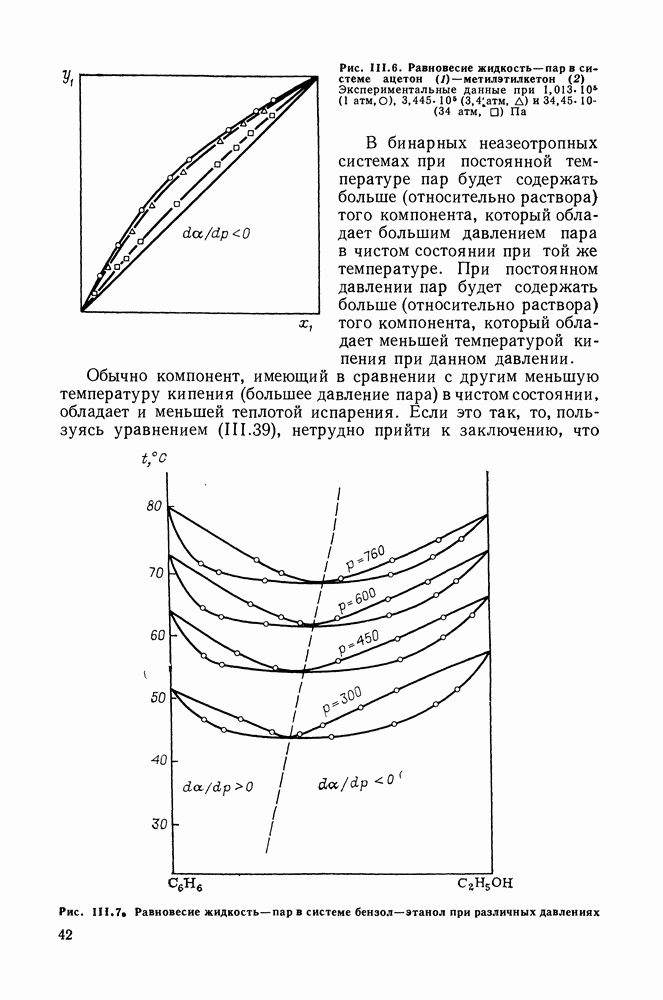
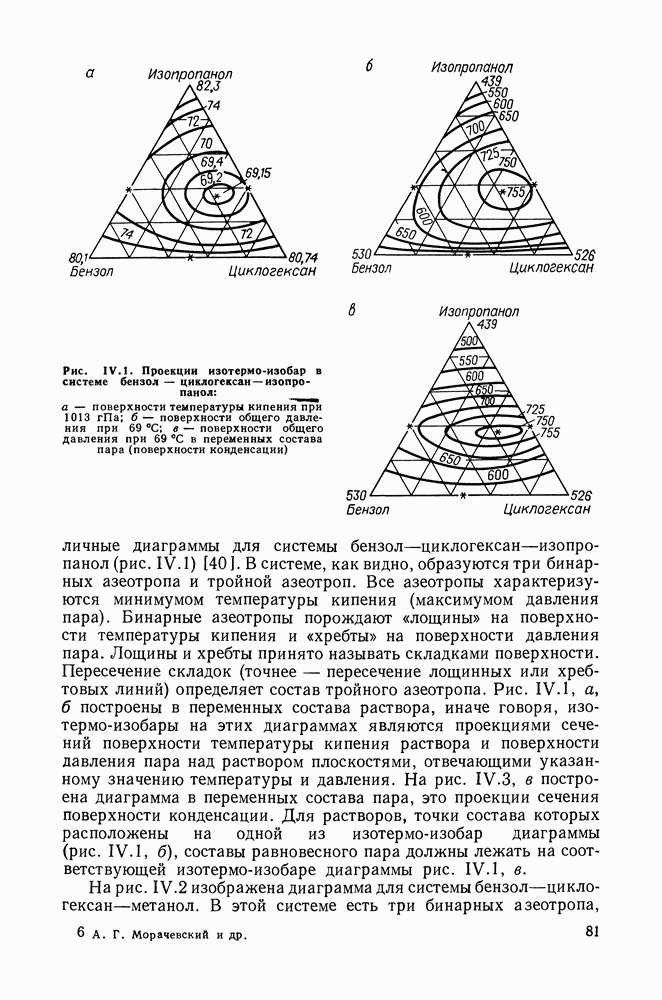
Сопоставим характер диаграмм равновесия жидкость—пар со значениями функций смешения. Первые работы в этой области были выполнены Долежалеком, который связал положительные отклонения от закона Рауля с диссоциацией ассоциированного компонента, а отрицательные — с образованием соединения.
В общем, положения Долежалека остаются справедливыми. Но следует иметь в виду, что значения функций смешения определяются совокупным влиянием многих факторов, в первую очередь
это протон-донорные и протон-акцепторные свойства молекул компонентов раствора, их полярность, соотношение вкладов специфических и универсальных (вандерваальсовых) межмолеку-лярных взаимодействий, относительные размеры молекул и их форма и т. п.
Здесь мы не имеем возможности останавливаться подробнее на связи молекулярных и макроскопических свойств растворов. Отметим только, что сравнительно проще проследить связи молекулярных свойств со значениями  и
и  [24]. При этом в системах некоторого типа определяющим является значение
[24]. При этом в системах некоторого типа определяющим является значение  в других —
в других —  Эти обстоятельства оказали влияние на формулировки первых приближенных моделей молекулярных растворов — регулярных
Эти обстоятельства оказали влияние на формулировки первых приближенных моделей молекулярных растворов — регулярных  и атермических
и атермических 
Величины  определяются соотношением энтальпийных (энергетических) и энтропийных (структурных) вкладов. Их соотношением определяется и самая возможность образования гомогенного раствора
определяются соотношением энтальпийных (энергетических) и энтропийных (структурных) вкладов. Их соотношением определяется и самая возможность образования гомогенного раствора  и знак
и знак 

Во многих реальных системах величины  и
и  в
в
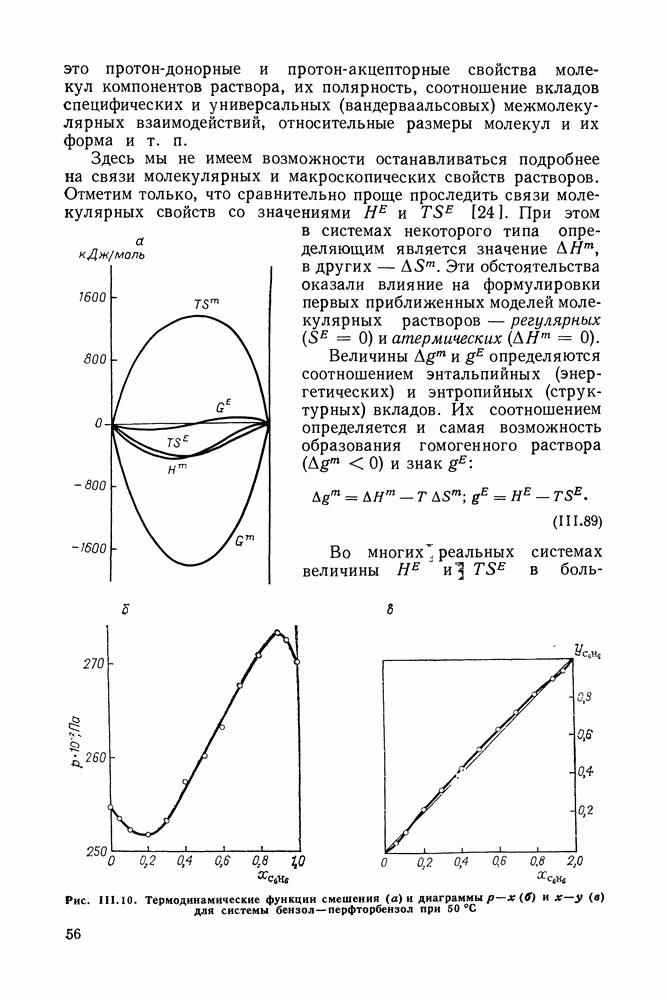
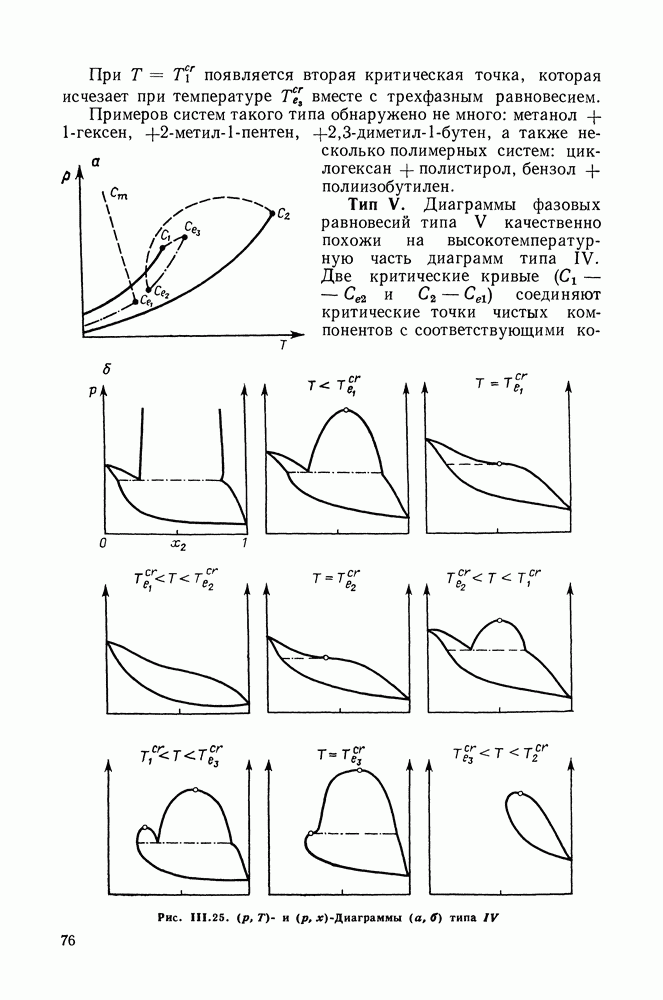
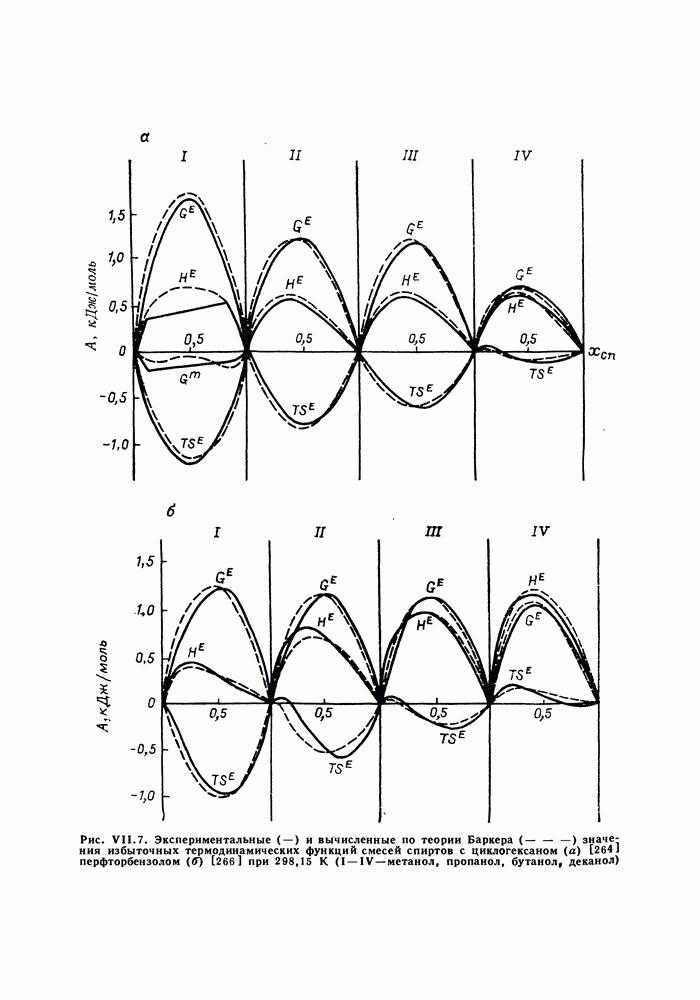
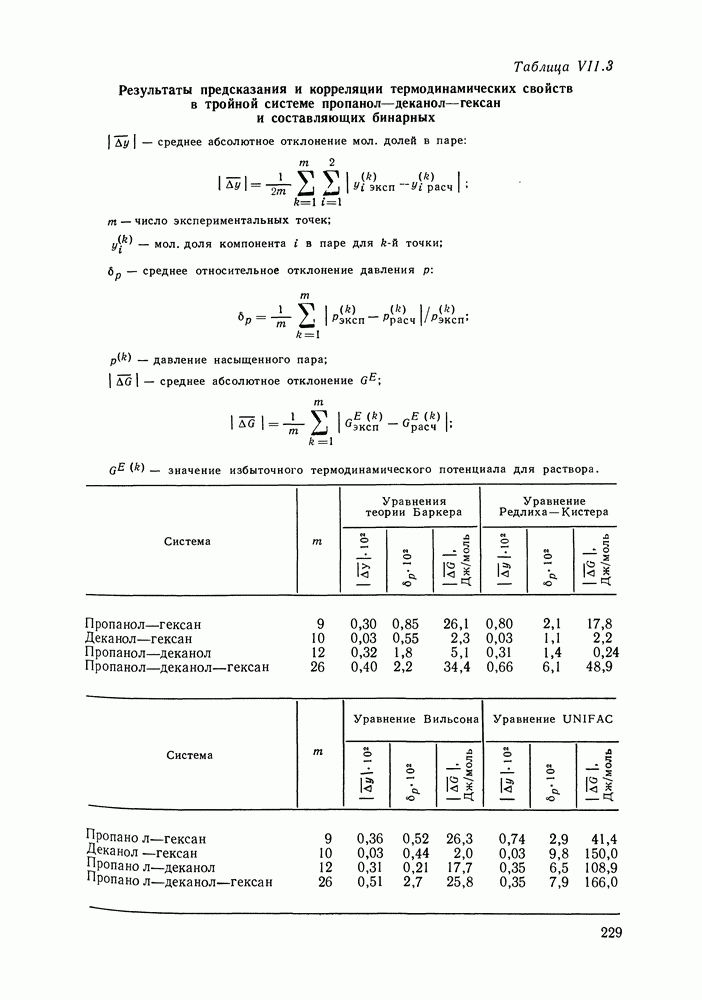
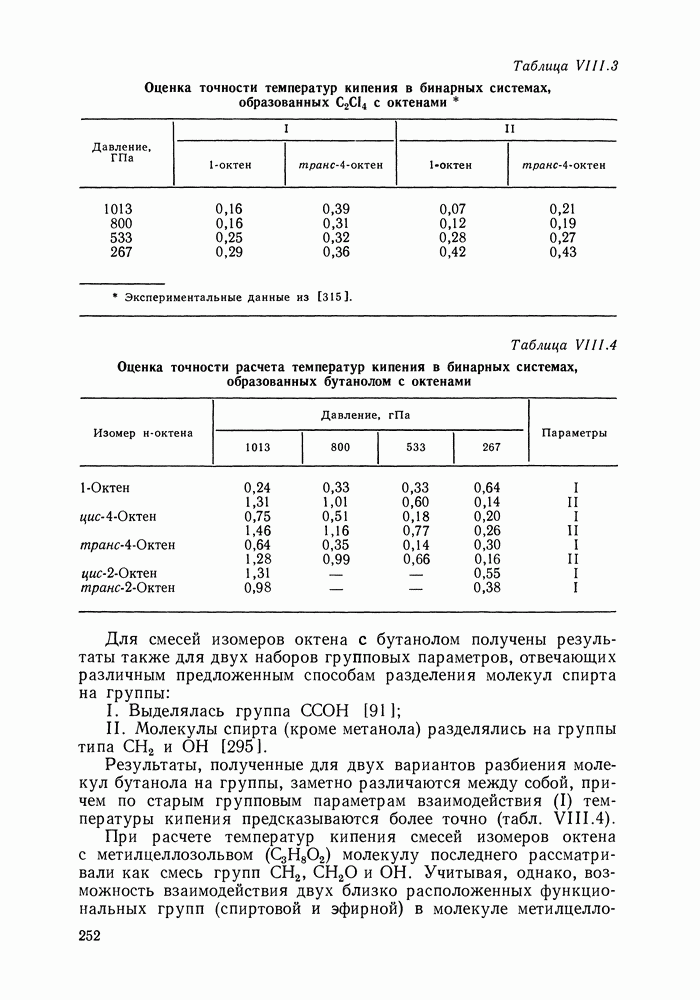
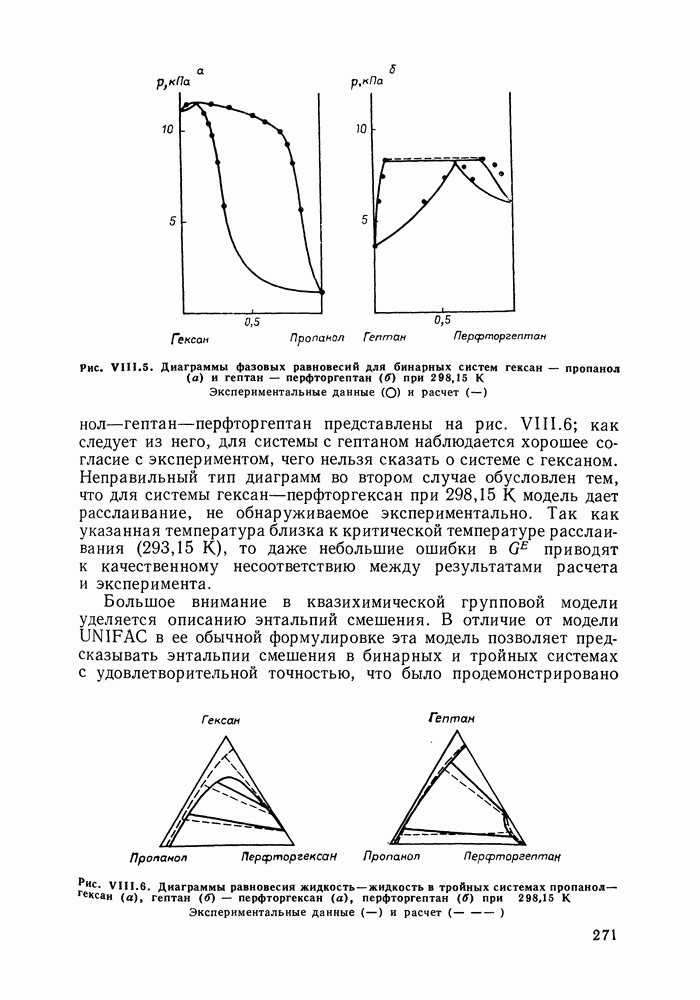
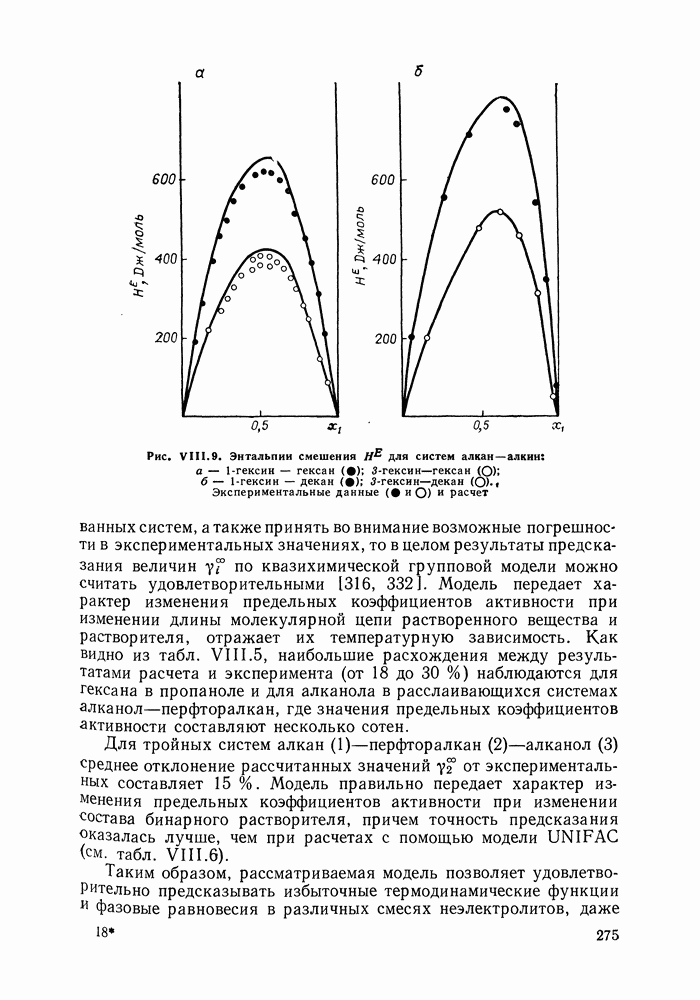
Рис. III.10 (см. скан) Термодинамические функции смешения (а) и диаграммы  для системы бензол—перфторбензол при
для системы бензол—перфторбензол при 
большей или меньшей степени компенсируют друг друга, уменьшая абсолютные значения  Показателен пример системы бензол-перфторбензол [23], которая отличается сложным характером межмолекулярных взаимодействий. Но для этой системы значения
Показателен пример системы бензол-перфторбензол [23], которая отличается сложным характером межмолекулярных взаимодействий. Но для этой системы значения  и
и  очень близки, значение
очень близки, значение  очень мало и система близка к идеальной. Но по характеру равновесия система необычна — в ней образуются два азеотропа и это, насколько нам известно, единственный пример бинарной системы из неэлектролитов, для которой установлен факт образования двух азеотропов (рис. III.10). На рис. 111.10, а построены функции смешения для этой системы, а на рис. III.10, б, в — диаграммы равновесия жидкость—пар.
очень мало и система близка к идеальной. Но по характеру равновесия система необычна — в ней образуются два азеотропа и это, насколько нам известно, единственный пример бинарной системы из неэлектролитов, для которой установлен факт образования двух азеотропов (рис. III.10). На рис. 111.10, а построены функции смешения для этой системы, а на рис. III.10, б, в — диаграммы равновесия жидкость—пар.
Для выполнения практических расчетов по равновесиям жидкость — пар особое значение имеют сведения об энтальпиях смешения. В этой главе ранее приводились уравнения, которые определяют влияние изменений температуры и давления на состав пара, на относительную летучесть смесей, на смещение состава азеотропных смесей и т. п. В эти уравнения входили значения парциальных молярных теплот испарения компонентов  которые, как правило, находят по теплотам испарения чистых веществ
которые, как правило, находят по теплотам испарения чистых веществ  и парциальным теплотам смешения
и парциальным теплотам смешения 
Прямых калориметрических измерений теплот испарения растворов очень мало. В гл. II были указаны источники сведений о теплотах испарения индивидуальных веществ.
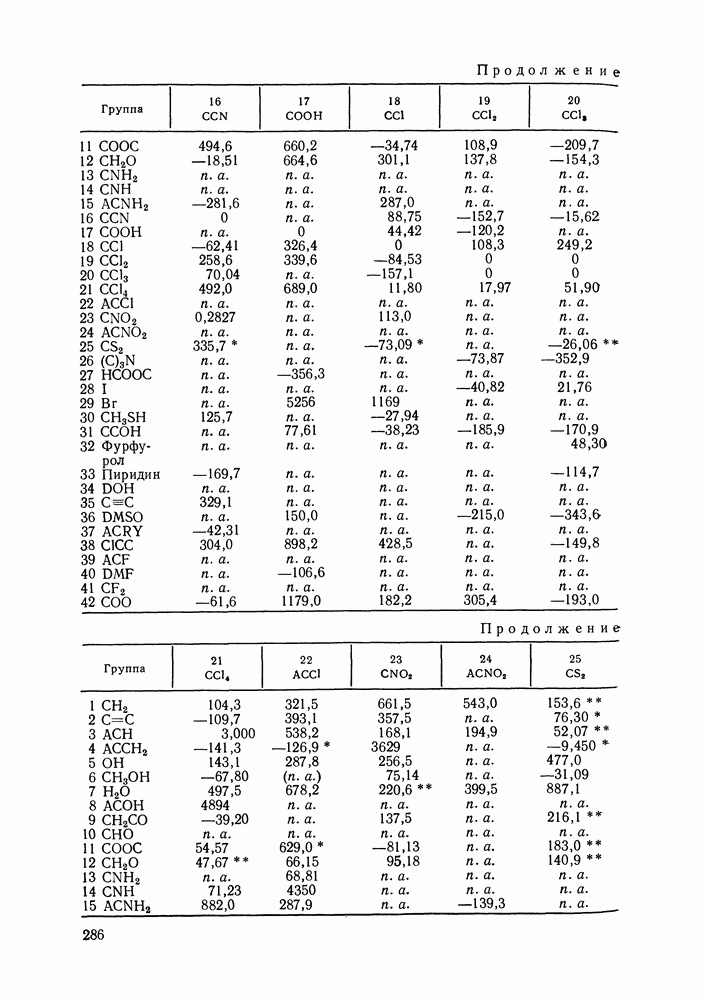
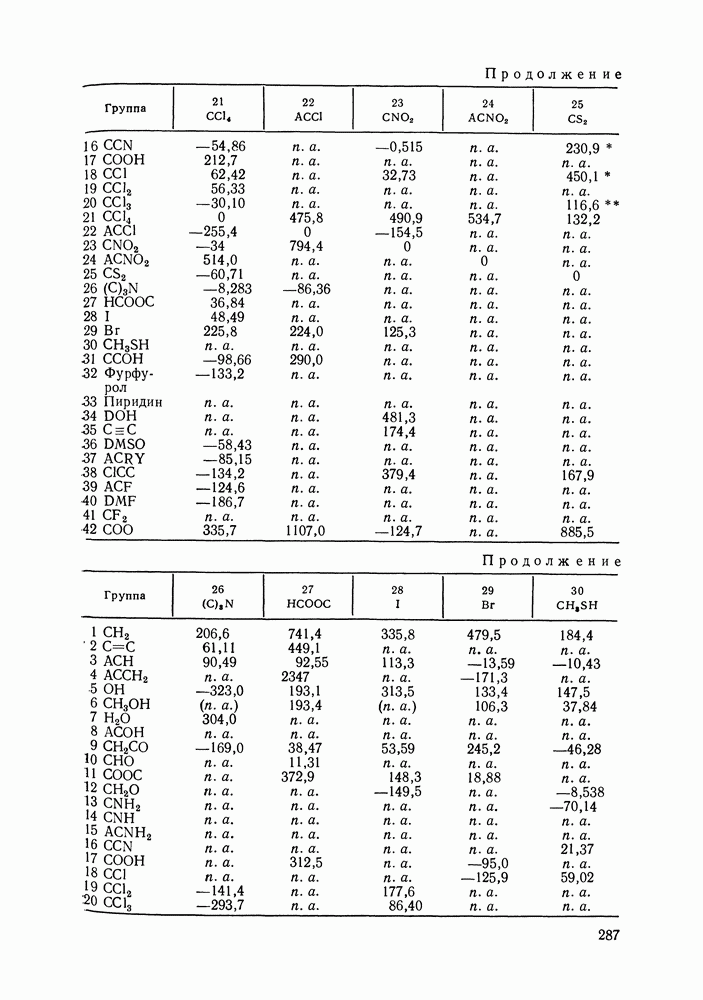
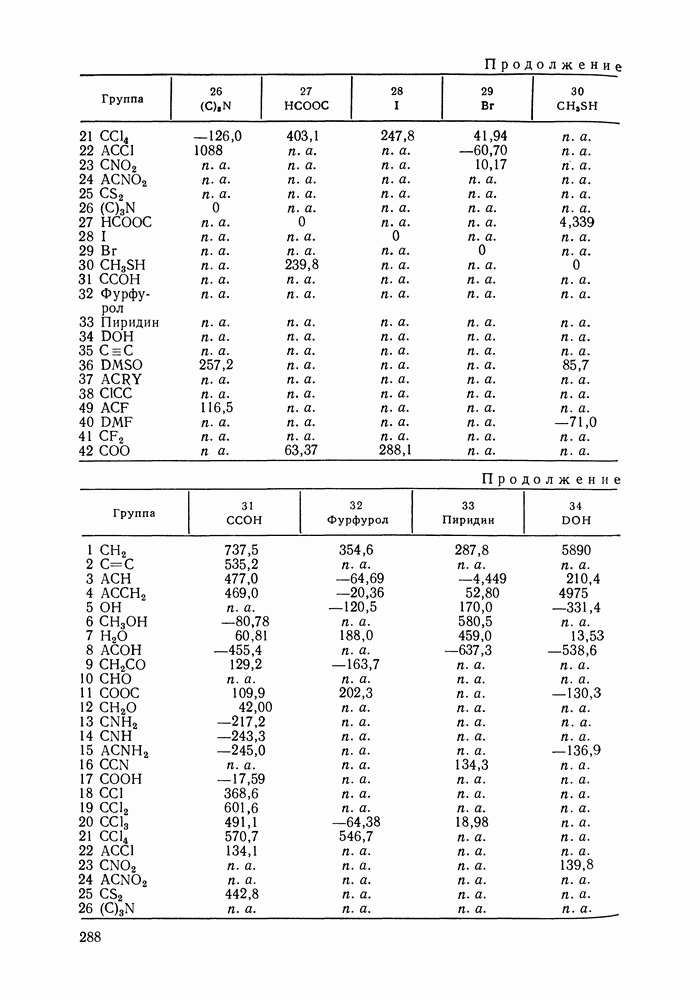
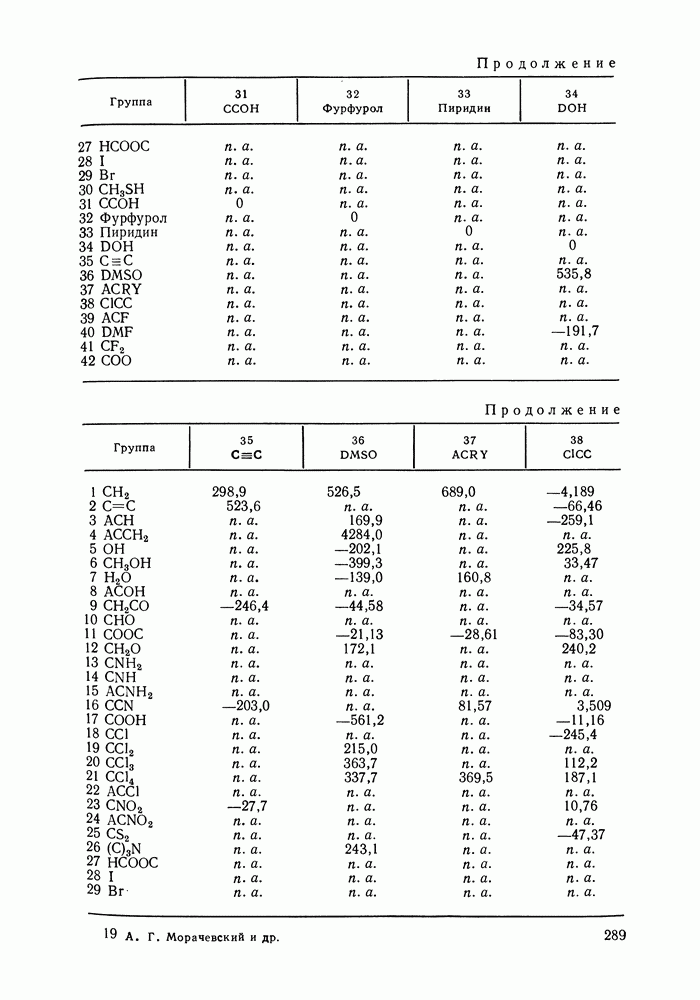
Данных о теплотах смешения неэлектролитов в литературе много, они собраны и обобщены в справочных изданиях [24, 25]. В [24], кроме справочных таблиц, обсуждены величины  в системах различной химической природы, закономерности изменения
в системах различной химической природы, закономерности изменения  в рядах родственных систем, точность расчета тепловых эффектов из политермических данных о равновесии жидкость—пар.
в рядах родственных систем, точность расчета тепловых эффектов из политермических данных о равновесии жидкость—пар.
Данных о теплотах смешения много, но все же меньше, чем о теплотах испарения чистых веществ (последние значительно легче и определить при необходимости), поэтому для целей практических расчетов привлекательна возможность замены  на
на  Это можно сделать достаточно часто, поскольку в уравнения обычно входит разность
Это можно сделать достаточно часто, поскольку в уравнения обычно входит разность  и замена вполне допустима, когда
и замена вполне допустима, когда 
Соотношение слагаемых зависит не только от природы системы, но и от состава раствора, для которого выполняется расчет. Энтальпии  это парциальные молярные величины, и они равны между собою в экстремуме
это парциальные молярные величины, и они равны между собою в экстремуме  их разность мала в окрестности точки экстремума, которая обычно лежит в области
их разность мала в окрестности точки экстремума, которая обычно лежит в области
средних концентраций, вблизи от эквимолярного состава. Значения  и
и  для растворенных веществ и их разность почти всегда будут велики для разбавленных растворов. Подробнее об этих вопросах см. в [24].
для растворенных веществ и их разность почти всегда будут велики для разбавленных растворов. Подробнее об этих вопросах см. в [24].
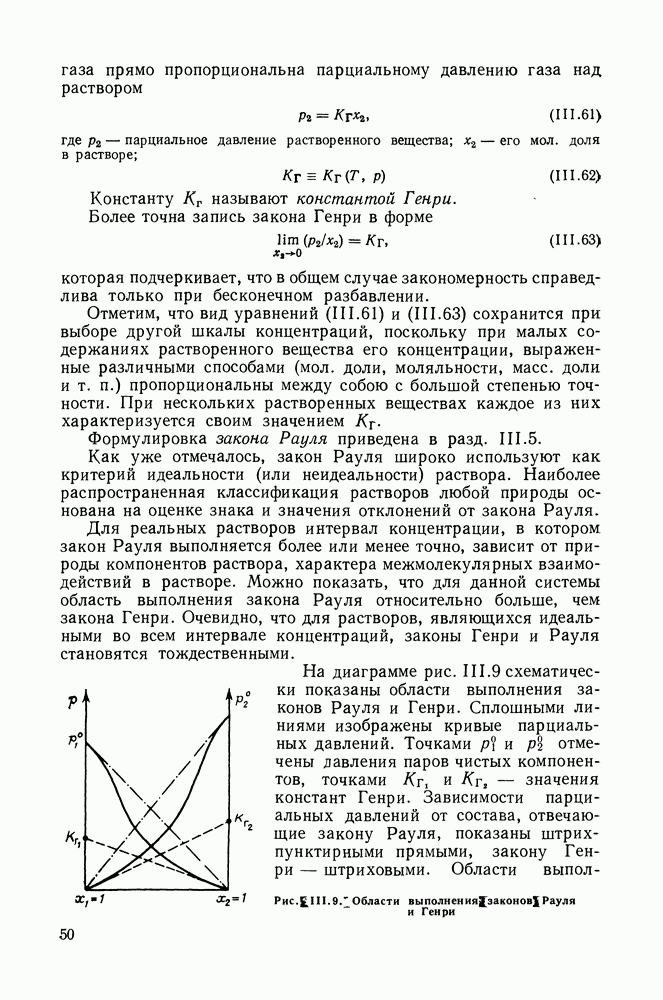
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА
- Глава I. ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕРМОДИНАМИКИ ГЕТЕРОГЕННЫХ РАВНОВЕСИЙ
- 1.2. УСЛОВИЯ РАВНОВЕСИЯ ГЕТЕРОГЕННЫХ СИСТЕМ
- 1.3. ТИПЫ РАВНОВЕСИЙ
- 1.4. УСЛОВИЯ УСТОЙЧИВОСТИ
- 1.5. ПРАВИЛО ФАЗ
- Глава II. ОДНОКОМПОНЕНТНЫЕ СИСТЕМЫ
- II.1. ДИАГРАММЫ СОСТОЯНИЯ
- II.2. УРАВНЕНИЕ КЛАУЗИУСА—КЛАПЕЙРОНА
- II.3. ЗАВИСИМОСТЬ ДАВЛЕНИЯ ОТ ТЕМПЕРАТУРЫ. УРАВНЕНИЕ АНТУАНА
- II.4. ЗАКОН СООТВЕТСТВЕННЫХ СОСТОЯНИЙ
- II.5. УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА. ДРУГИЕ АНАЛИТИЧЕСКИЕ УРАВНЕНИЯ СОСТОЯНИЯ
- II.6. ВИРИАЛЬНОЕ УРАВНЕНИЕ СОСТОЯНИЯ
- Глава III. ДВОЙНЫЕ СИСТЕМЫ
- III.1. ДИАГРАММЫ РАВНОВЕСИЯ ДЛЯ ДВОЙНЫХ СИСТЕМ
- III.2. ОБОБЩЕННОЕ ДИФФЕРЕНЦИАЛЬНОЕ УРАВНЕНИЕ ВАН-ДЕР-ВААЛЬСА
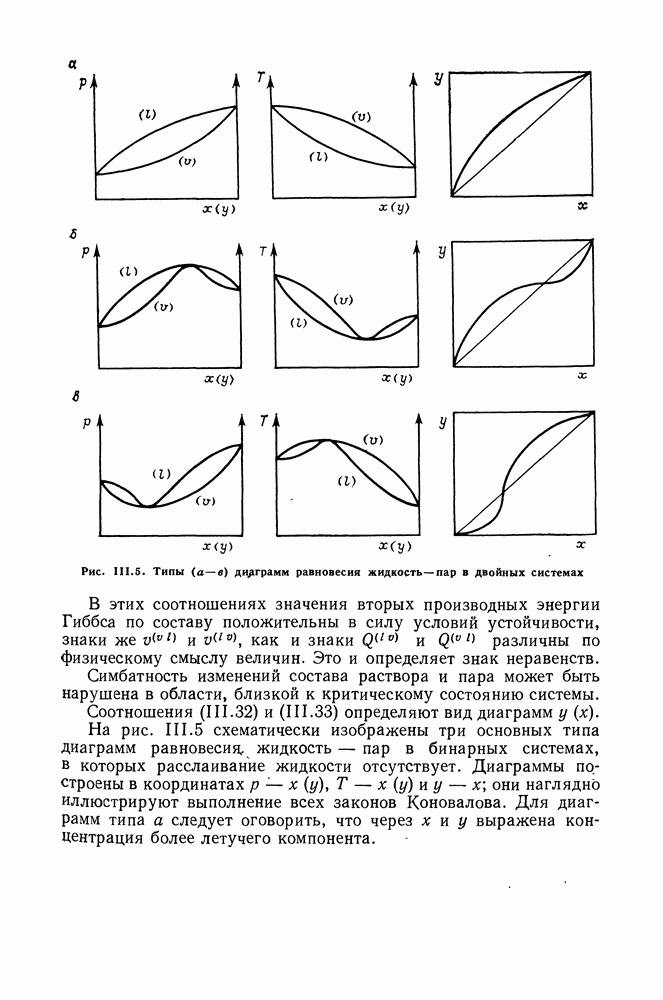
- III.3. ЗАКОНЫ КОНОВАЛОВА
- III.4. ЗАКОНЫ ВРЕВСКОГО
- III.5. ИДЕАЛЬНЫЕ СИСТЕМЫ
- III.6. РАЗБАВЛЕННЫЕ РАСТВОРЫ
- III.7 РЕАЛЬНЫЕ СИСТЕМЫ
- III.8. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СМЕШЕНИЯ И РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР
- III.9. ОБ АЗЕОТРОПИИ В БИНАРНЫХ СИСТЕМАХ
- III.10. ТРЕХФАЗНЫЕ РАВНОВЕСИЯ ЖИДКОСТЬ—ЖИДКОСТЬ—ПАР В ДВОЙНЫХ СИСТЕМАХ
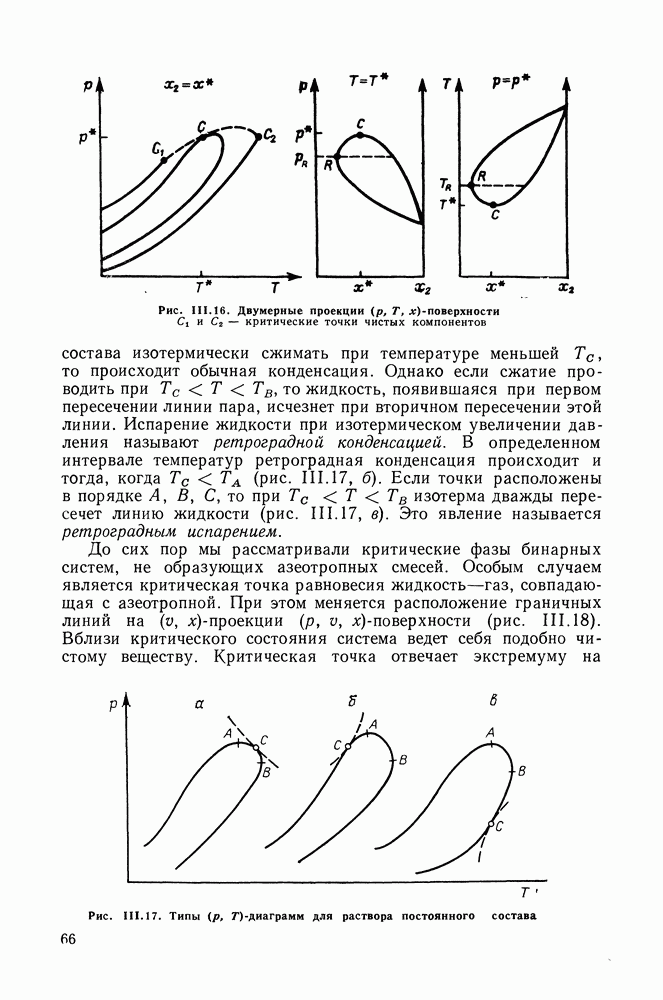
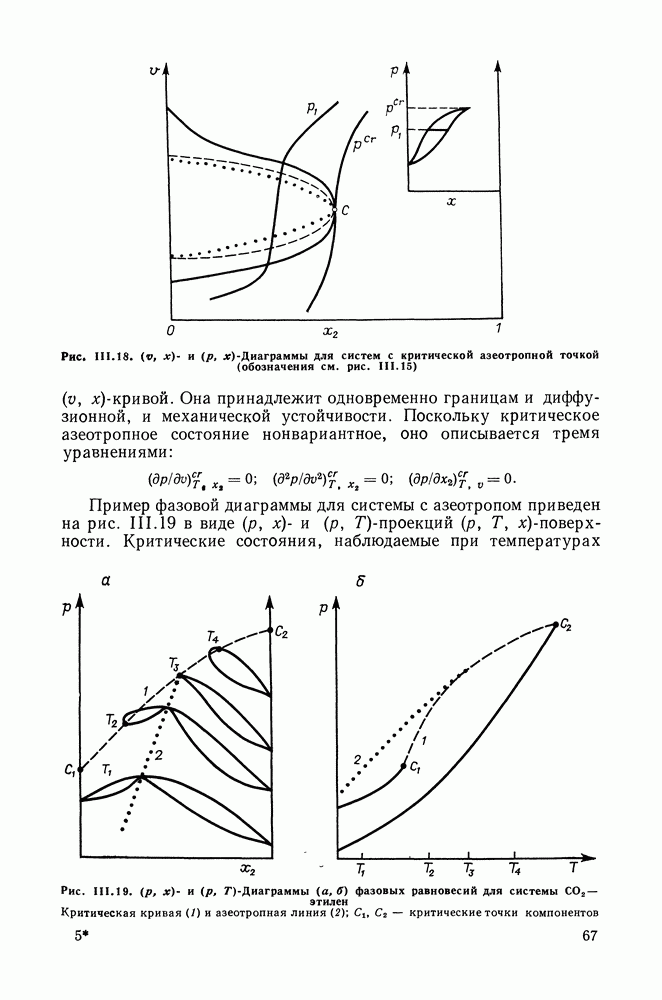
- III.11. ФАЗОВЫЕ ДИАГРАММЫ БИНАРНЫХ СИСТЕМ В ШИРОКОМ ИНТЕРВАЛЕ ТЕМПЕРАТУР И ДАВЛЕНИЙ
- Глава IV. ТРОЙНЫЕ И МНОГОКОМПОНЕНТНЫЕ СИСТЕМЫ
- IV.2. ПРОЯВЛЕНИЕ ЗАКОНОВ КОНОВАЛОВА И ВРЕВСКОГО В ТРОЙНЫХ И МНОГОКОМПОНЕНТНЫХ СИСТЕМАХ
- IV.3. ОТКРЫТЫЕ ФАЗОВЫЕ ПРОЦЕССЫ. ТЕРМОДИНАМИКО-ТОПОЛОГИЧЕСКИЕ ЗАКОНОМЕРНОСТИ
- Глава V. МЕТОДЫ ЭКСПЕРИМЕНТАЛЬНОГО ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР
- V.I. ЦИРКУЛЯЦИОННЫЙ МЕТОД
- V.2. МЕТОД ОТКРЫТОГО ИСПАРЕНИЯ
- V.3. МЕТОД СТРУИ ИНЕРТНОГО ГАЗА
- V.4. СТАТИЧЕСКИЙ МЕТОД
- V.5. ИЗОПИЕСТИЧЕСКИЙ МЕТОД
- V.6. ИЗМЕРЕНИЕ ТЕМПЕРАТУРЫ КИПЕНИЯ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
- V.7. РАСЧЕТ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР ПО ЗАВИСИМОСТИ ДАВЛЕНИЯ ПАРА ОТ СОСТАВА РАСТВОРА ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ
- V.8. МЕТОДЫ ИССЛЕДОВАНИЯ РАВНОВЕСИЯ ЖИДКОСТЬ—ПАР С ПОМОЩЬЮ ГАЗОВОЙ ХРОМАТОГРАФИИ
- V.9. РАВНОВЕСИЕ ЖИДКОСТЬ—ПАР ДЛЯ РАЗБАВЛЕННЫХ РАСТВОРОВ
- Глава VI. МЕТОДЫ ПРОВЕРКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ-ПАР
- VI.2. ОБЩАЯ ОЦЕНКА ТЕРМОДИНАМИЧЕСКИХ МЕТОДОВ ПРОВЕРКИ И ИСПРАВЛЕНИЯ ДАННЫХ
- VI.3. ПРОВЕРКА ДАННЫХ С ПОМОЩЬЮ УРАВНЕНИЙ ГИББСА—ДЮГЕМА И ДЮГЕМА—МАРГУЛЕСА
- VI.4. МЕТОД РЕДЛИХА—КИСТЕРА
- VI.5. МЕТОД ВАН-НЕССА
- VI.6. СТАТИСТИЧЕСКИЕ МЕТОДЫ ОБРАБОТКИ ЭКСПЕРИМЕНТАЛЬНЫХ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР
- VI.7. МЕТОДЫ ПРОВЕРКИ ТЕРМОДИНАМИЧЕСКОЙ СОГЛАСОВАННОСТИ ДАННЫХ О РАВНОВЕСИИ ЖИДКОСТЬ—ПАР В ТРОЙНЫХ СИСТЕМАХ
- VI.8. СОПОСТАВЛЕНИЕ МЕТОДОВ РЕДЛИХА—КИСТЕРА И ВАН-НЕССА
- Глава VII. МЕТОДЫ РАСЧЕТА РАВНОВЕСИЙ ЖИДКОСТЬ—ПАР
- VII. 1. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ РАВНОВЕСНЫХ ЖИДКОСТИ И ПАРА
- VII.2. АЛГОРИТМЫ РАСЧЕТА ФАЗОВЫХ РАВНОВЕСИЙ
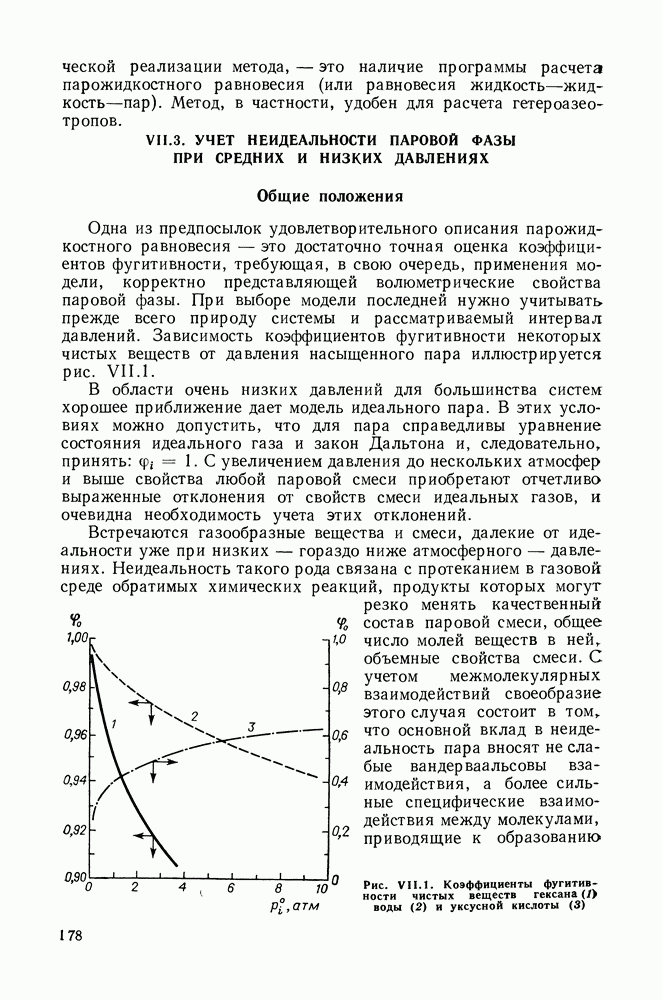
- VII.3. УЧЕТ НЕИДЕАЛЬНОСТИ ПАРОВОЙ ФАЗЫ ПРИ СРЕДНИХ И НИЗКИХ ДАВЛЕНИЯХ
- VII.4. ПОЛИНОМИАЛЬНЫЕ УРАВНЕНИЯ ДЛЯ КОЭФФИЦИЕНТОВ АКТИВНОСТИ И УРАВНЕНИЕ ВАН-ЛААРА
- VII.5. МОДЕЛИ ЛОКАЛЬНОГО СОСТАВА
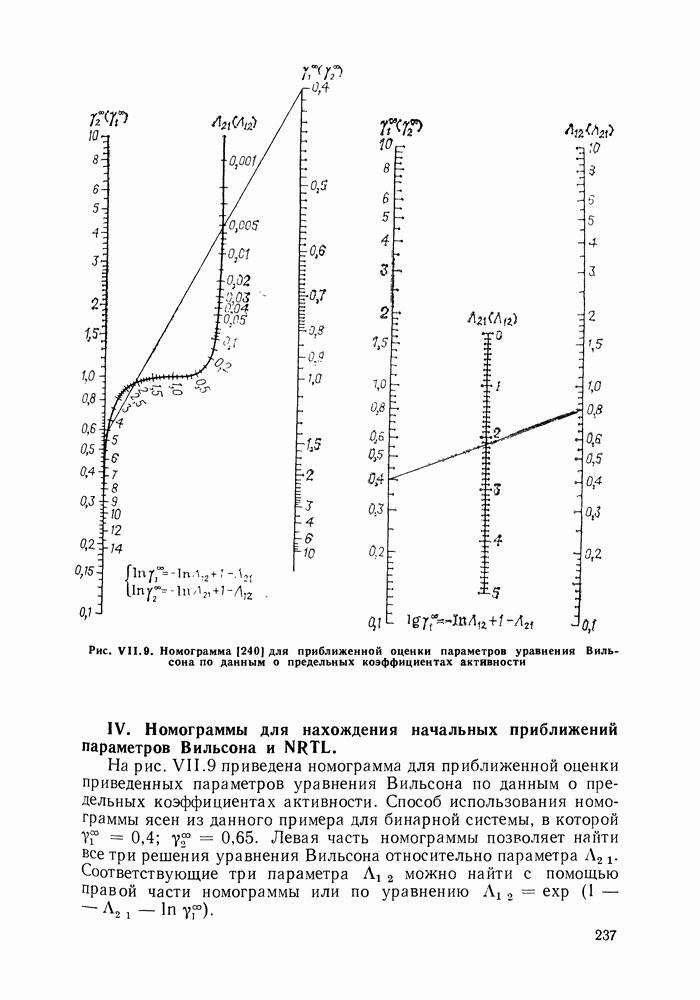
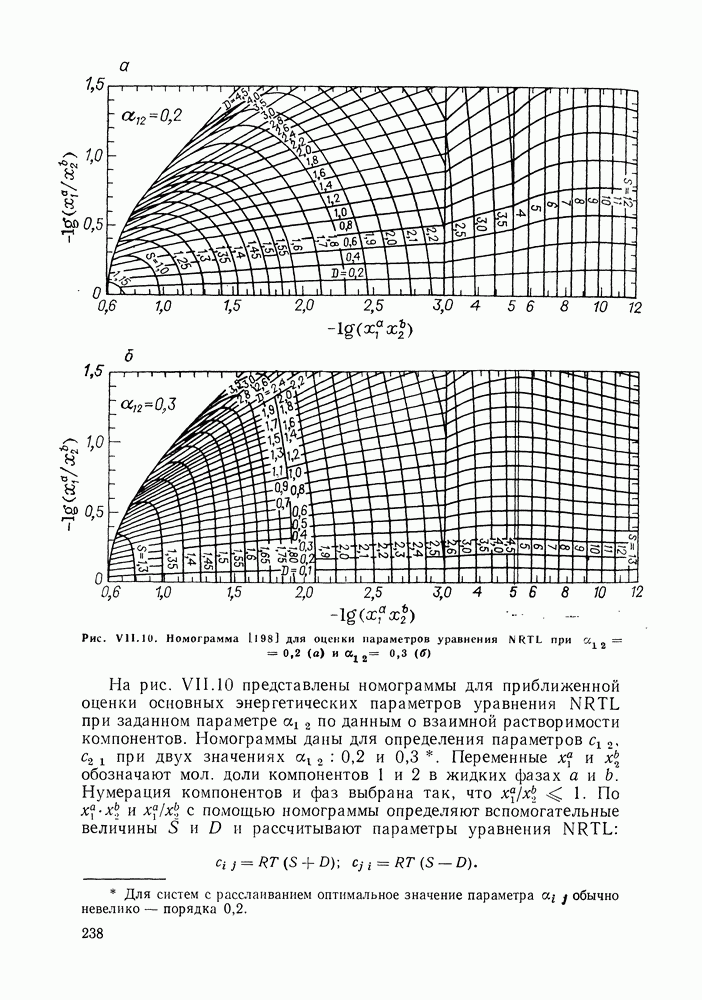
- VII.6. ОЦЕНКА ПАРАМЕТРОВ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ
- VII.7. СОПОСТАВЛЕНИЕ МОДЕЛЕЙ ЖИДКОЙ ФАЗЫ ПРИ ОПИСАНИИ ФАЗОВЫХ РАВНОВЕСИЙ
- VII.8. РЕШЕТОЧНЫЕ МОДЕЛИ. МОДЕЛЬ БАРКЕРА
- Глава VIII. ГРУППОВЫЕ МОДЕЛИ РАСТВОРОВ
- VIII.1. ОСНОВНЫЕ ОСОБЕННОСТИ ГРУППОВЫХ МОДЕЛЕЙ РАСТВОРОВ
- VIII.2. МОДЕЛЬ UNIFAC
- VIII.3. КВАЗИХИМИЧЕСКИЕ ГРУППОВЫЕ МОДЕЛИ
- Глава IX. ДЫРОЧНАЯ РЕШЕТОЧНАЯ КВАЗИХИМИЧЕСКАЯ МОДЕЛЬ, ЕЕ ГРУППОВОЙ ВАРИАНТ
- IX.2. ФОРМУЛИРОВКА ДЫРОЧНОЙ КВАЗИХИМИЧЕСКОЙ МОДЕЛИ
- IX.3. ТЕРМОДИНАМИЧЕСКИЕ ФУНКЦИИ СИСТЕМЫ
- IX.4. О МЕТОДИКЕ РАСЧЕТА
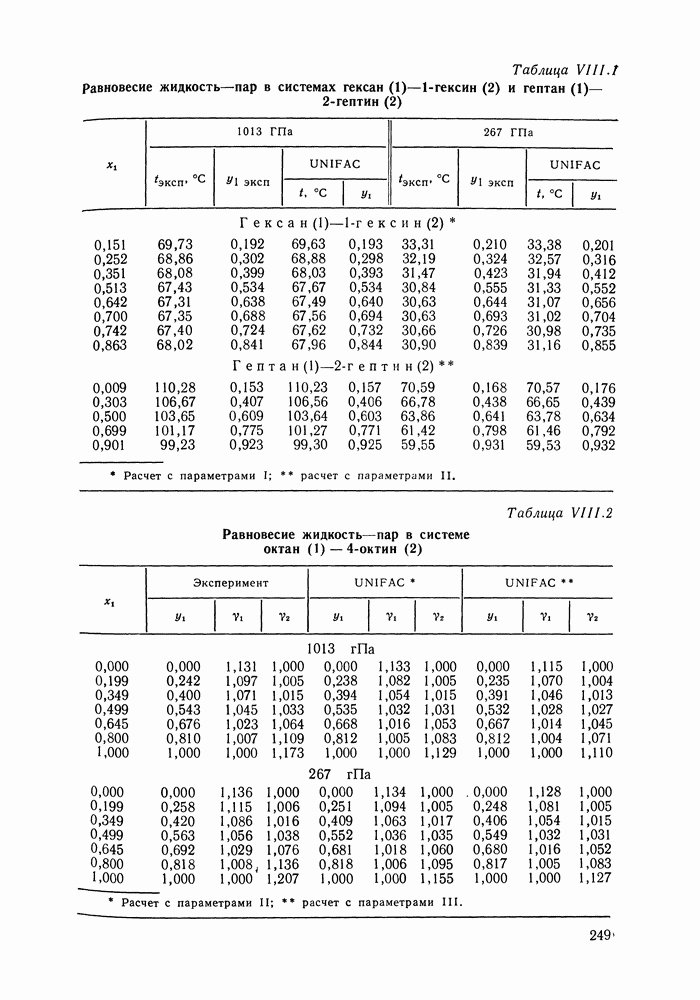
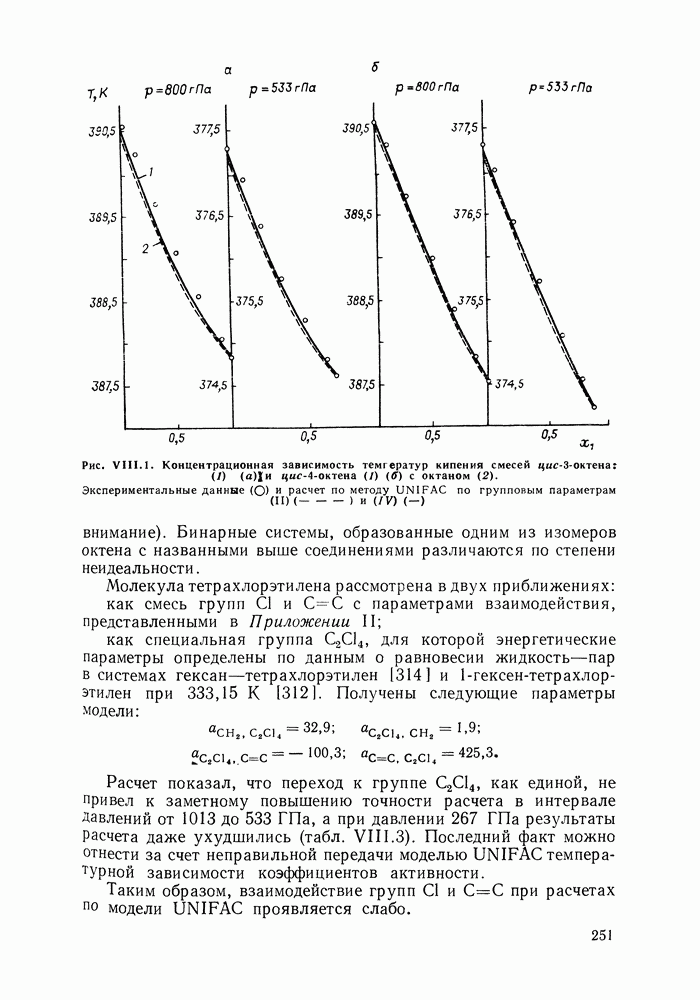
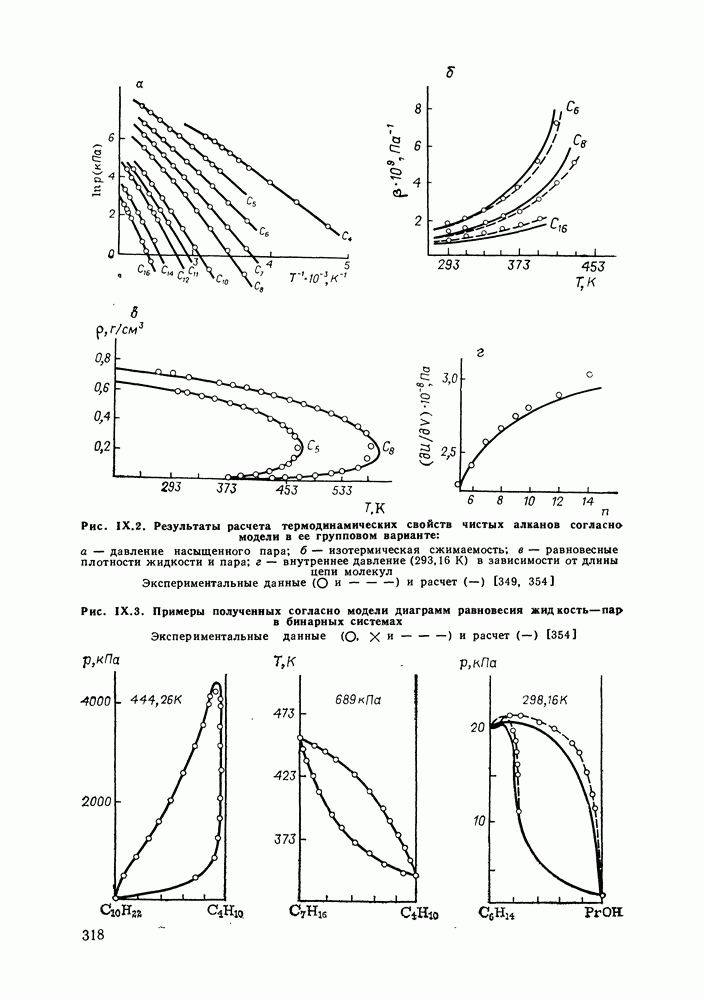
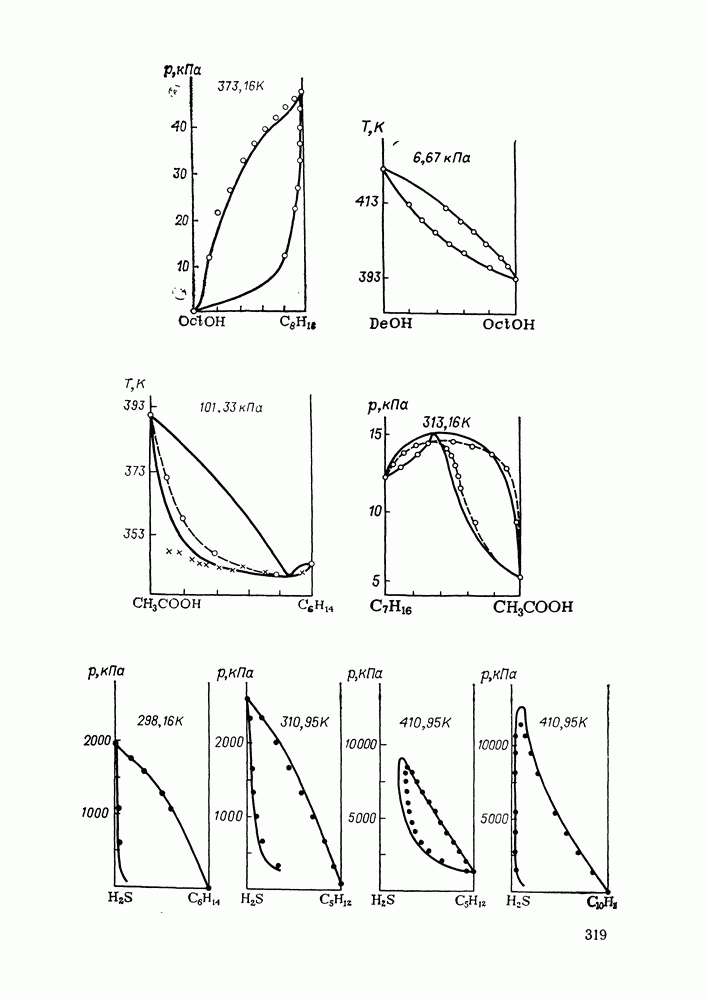
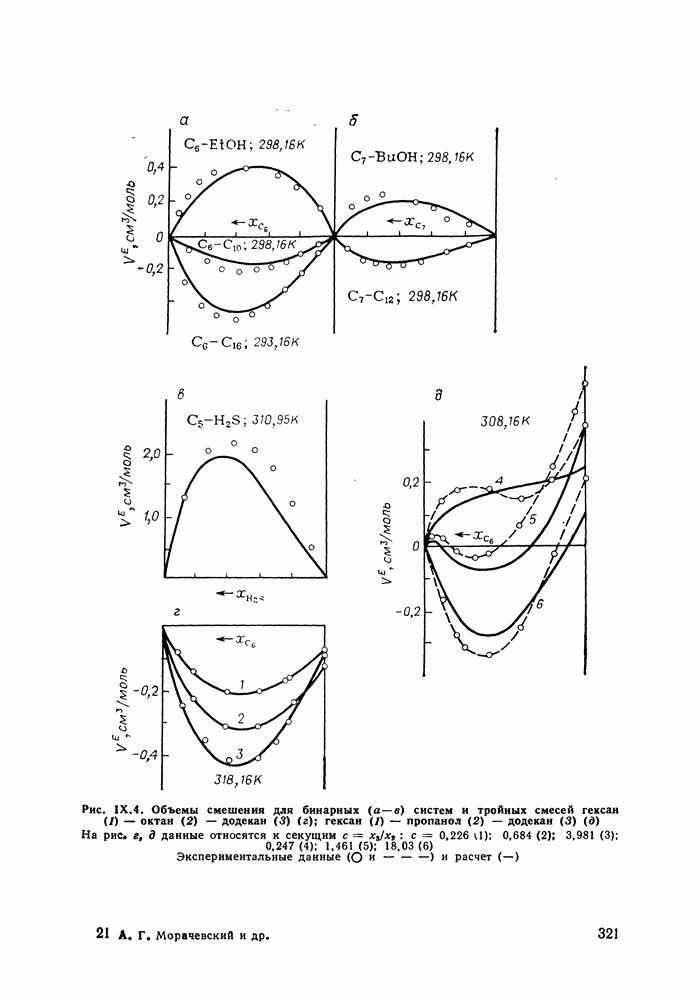
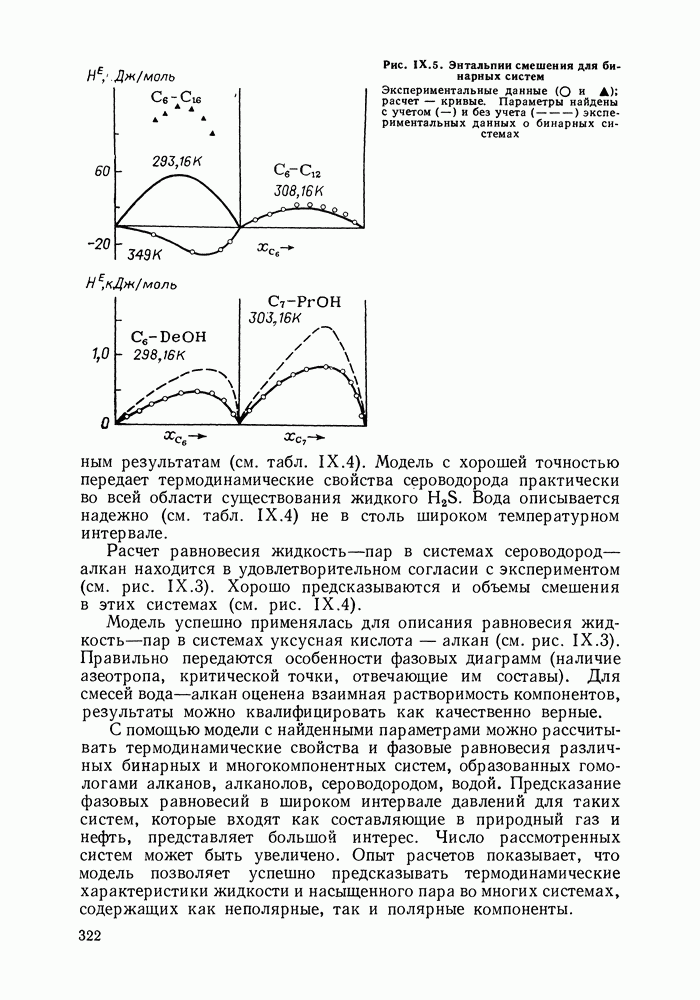
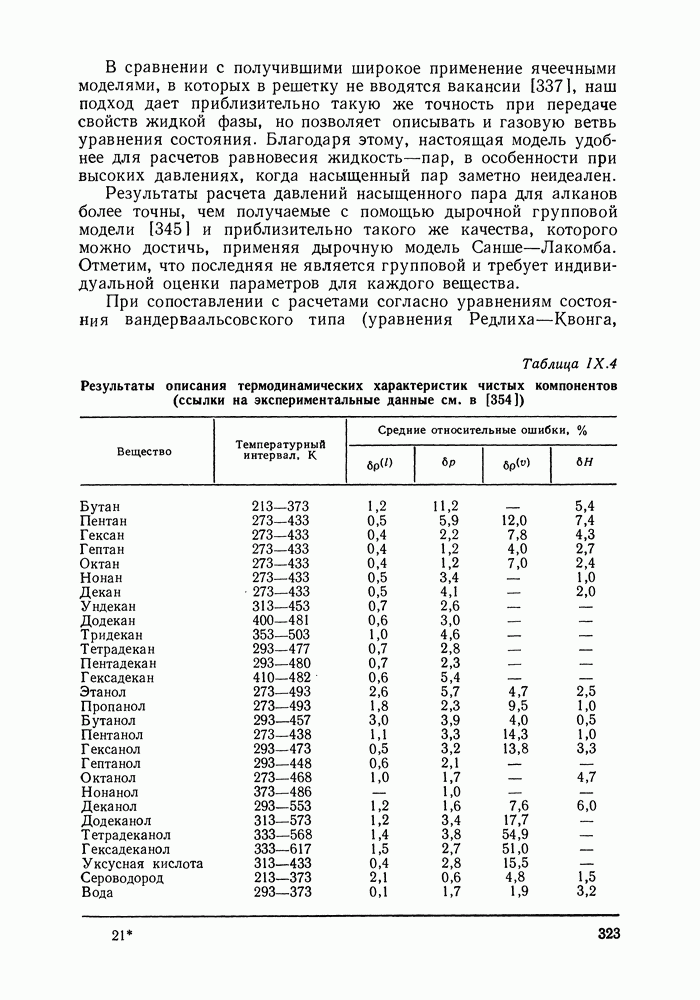
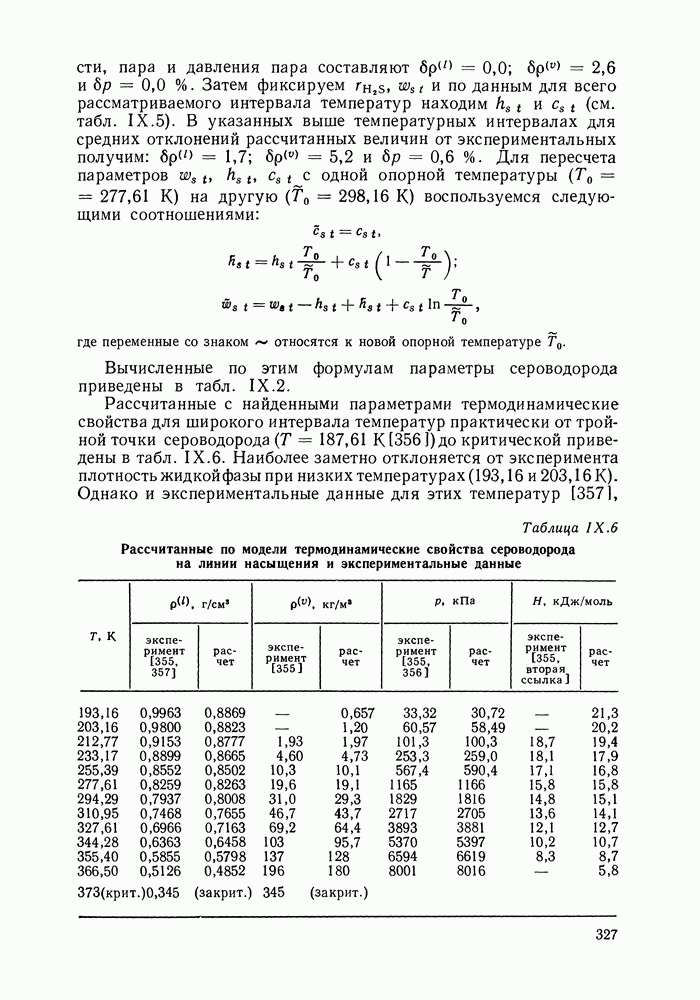
- IX.5. РЕЗУЛЬТАТЫ РАСЧЕТОВ И ВОЗМОЖНОСТИ МОДЕЛИ
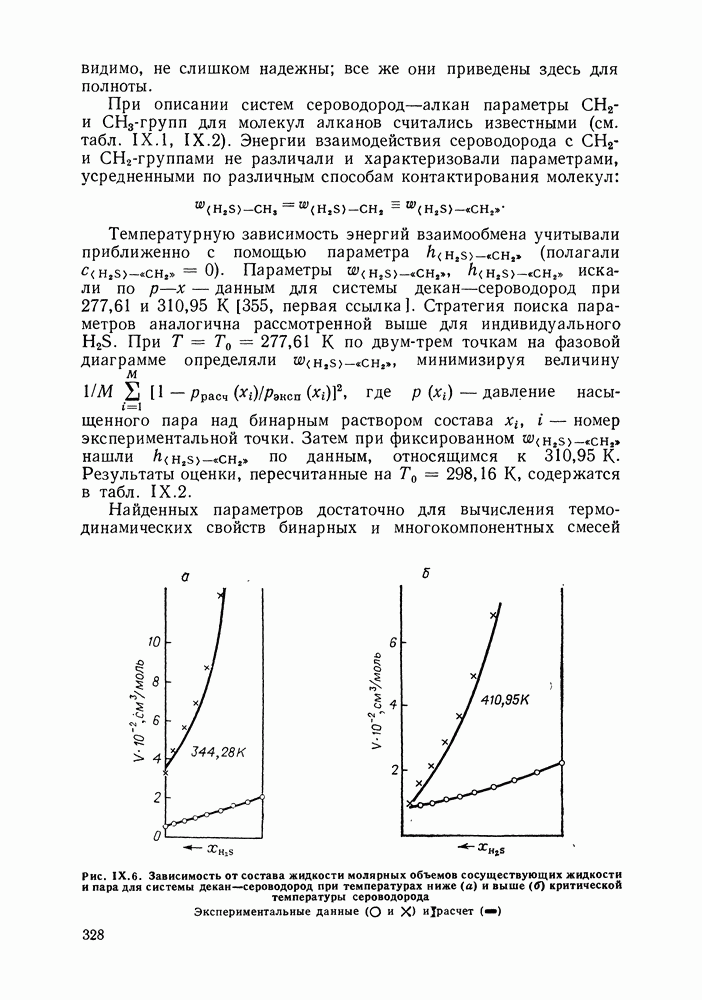
- IX.6. ПРИМЕРЫ РАСЧЕТА