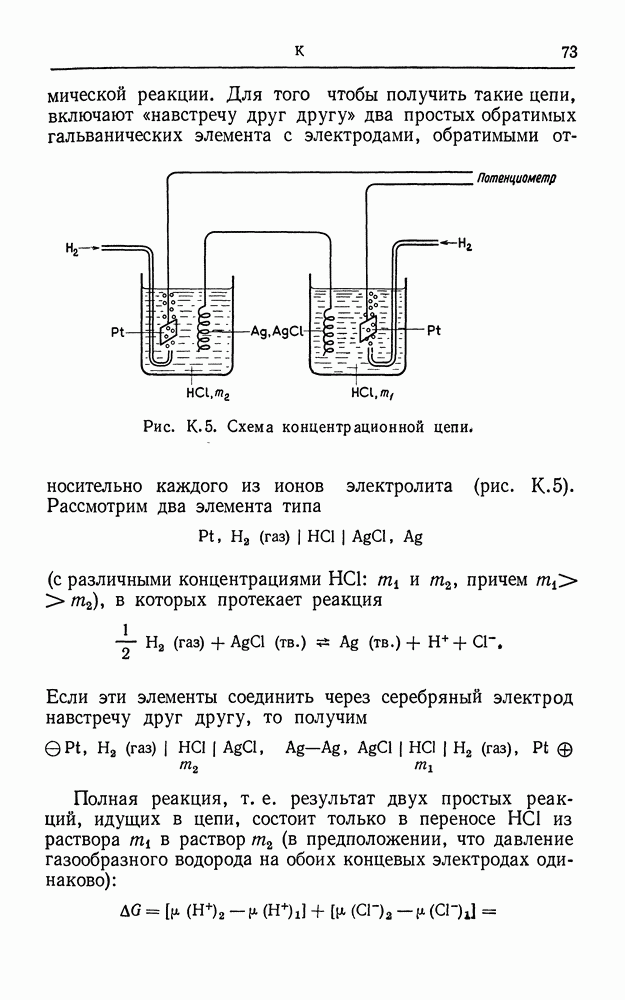
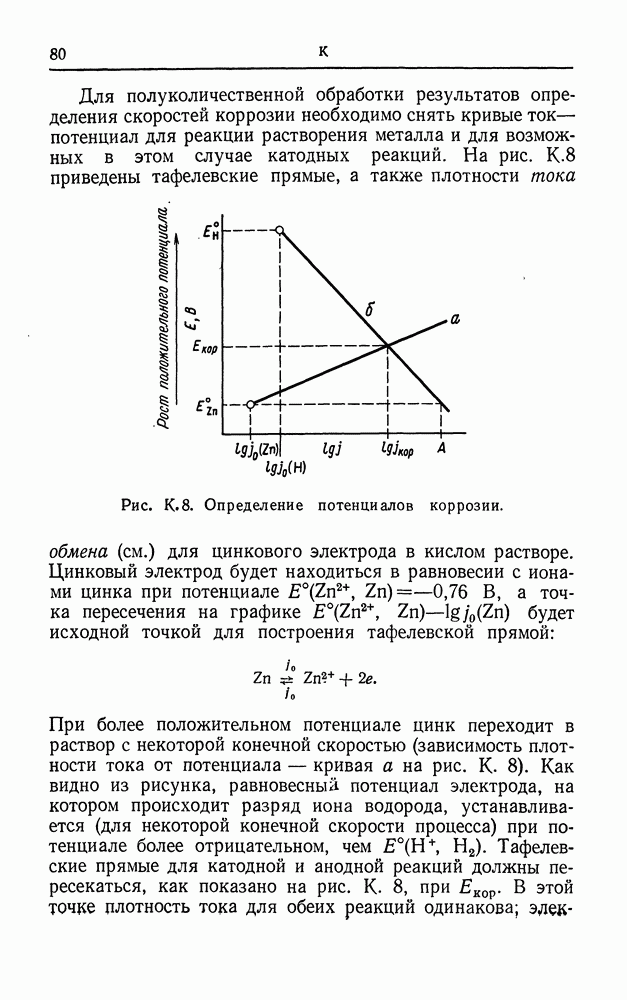
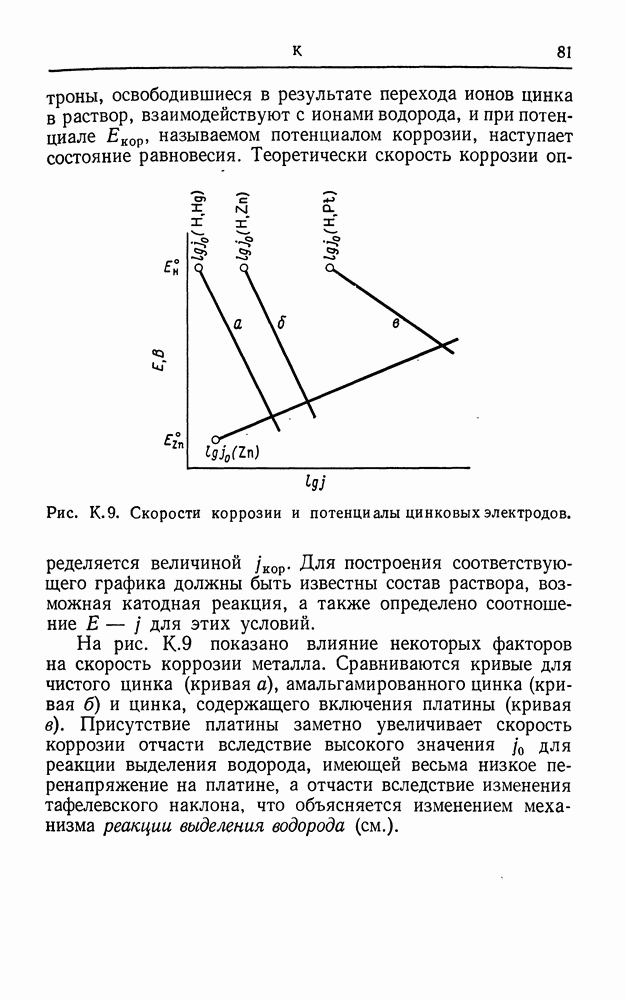
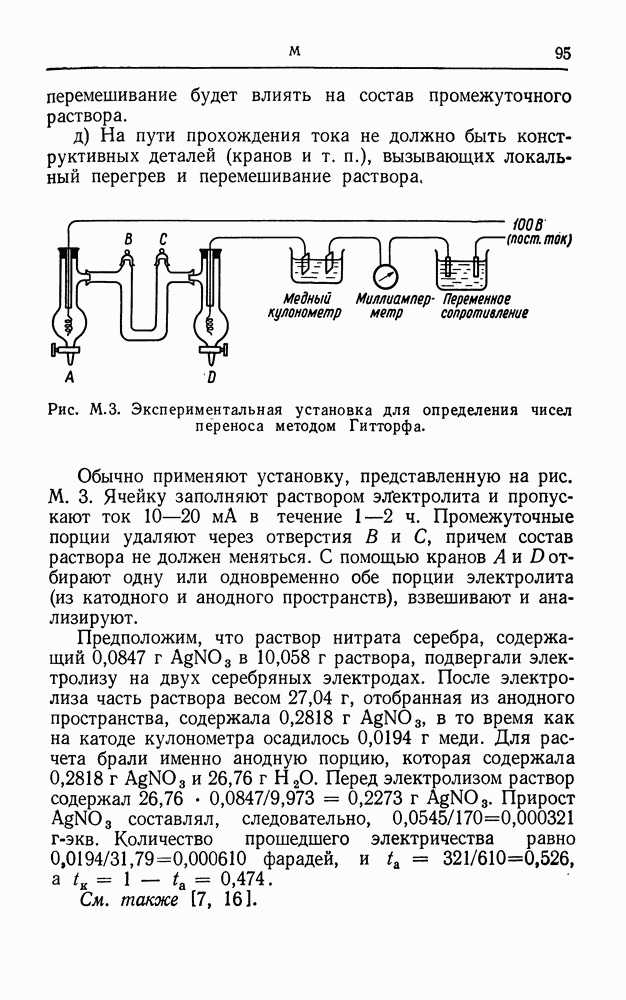
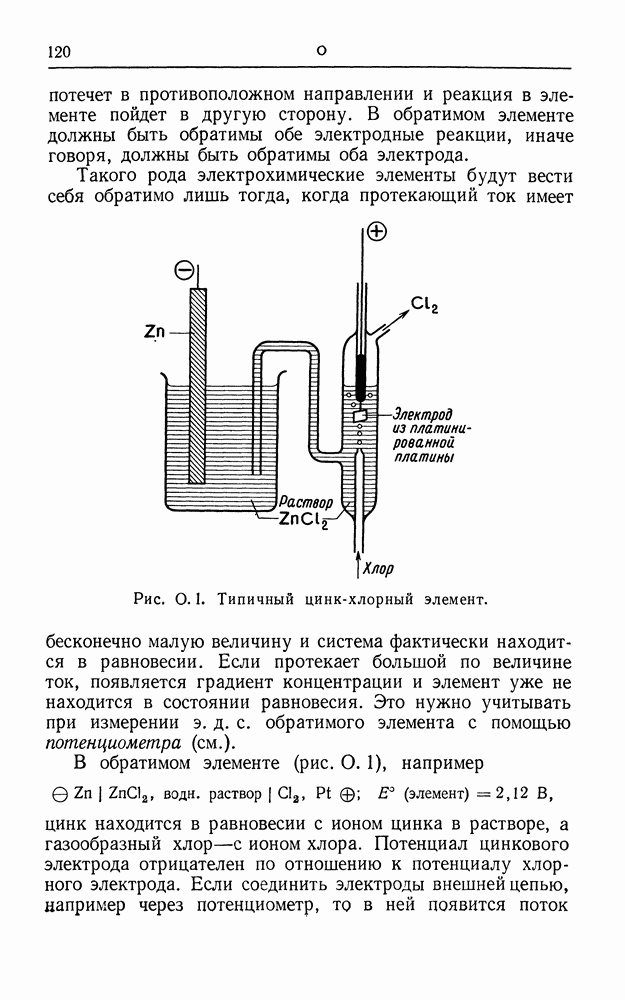
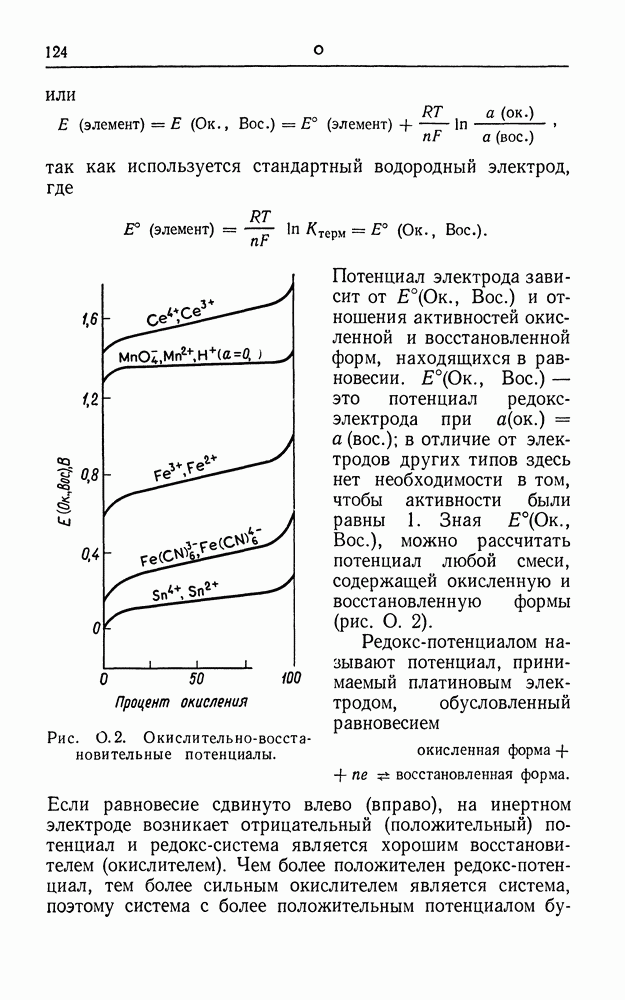
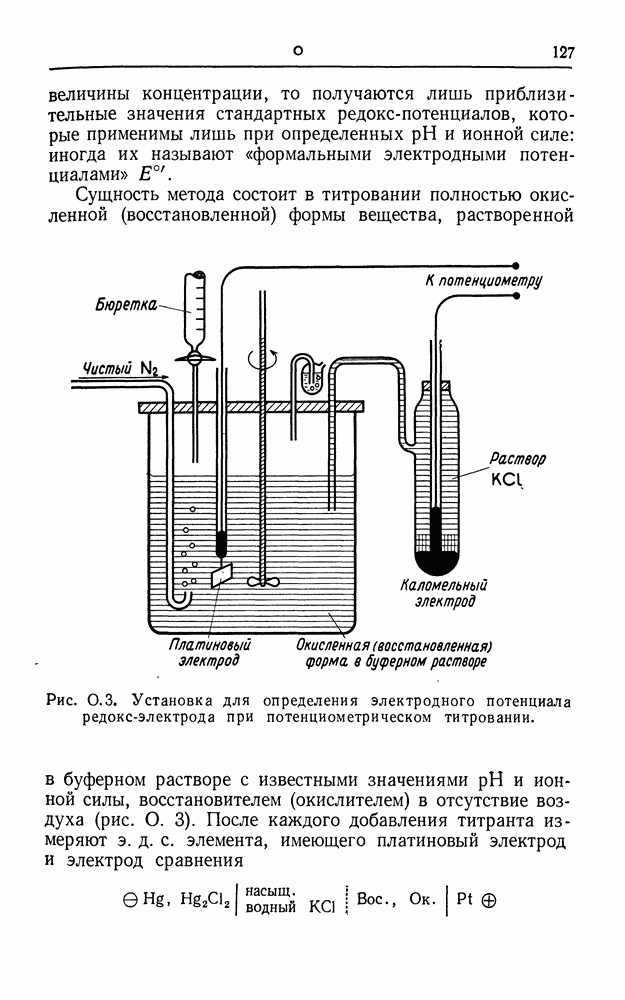
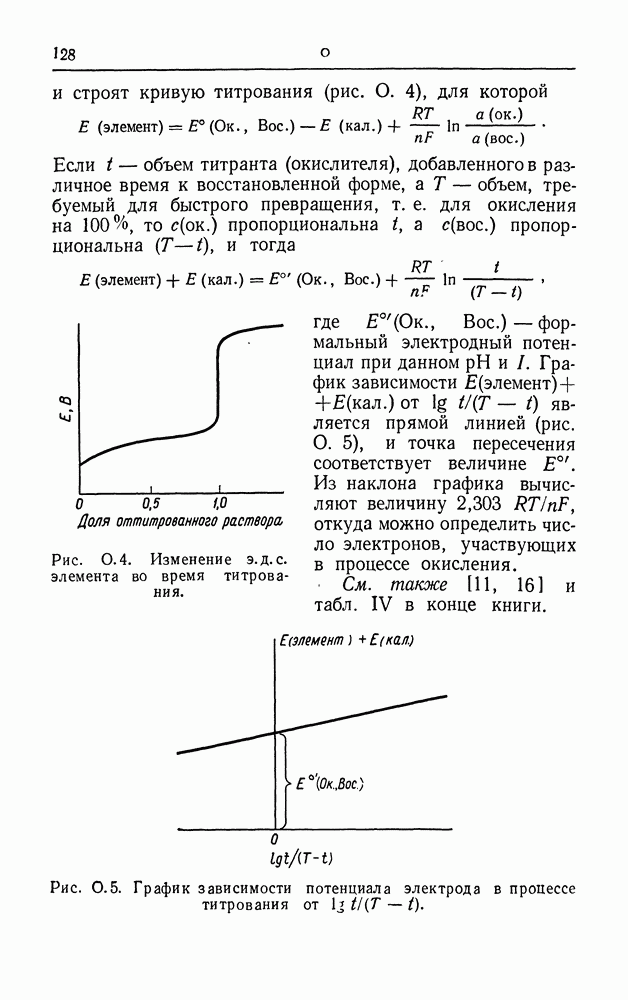
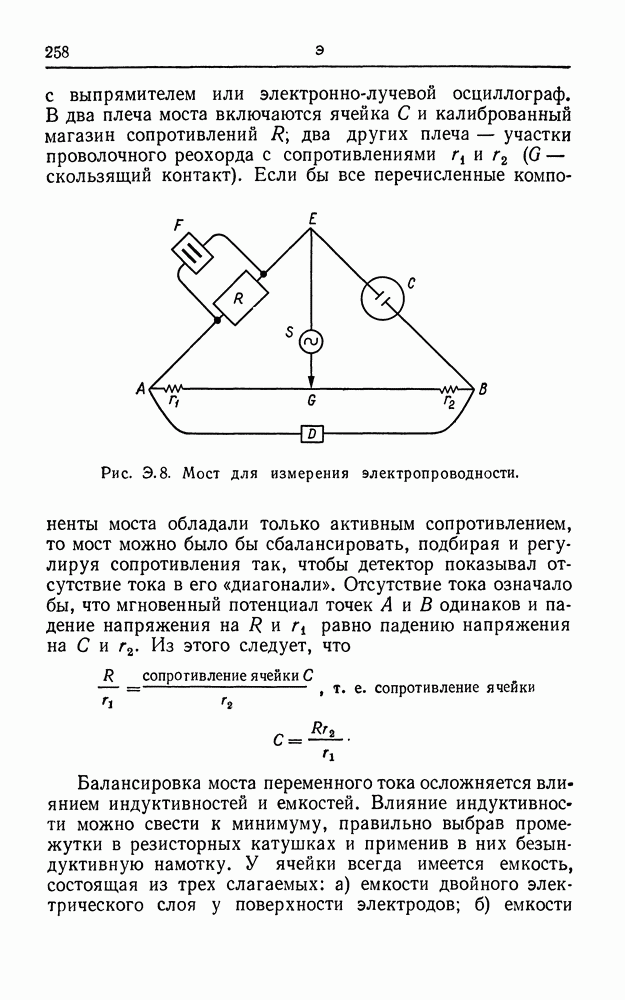
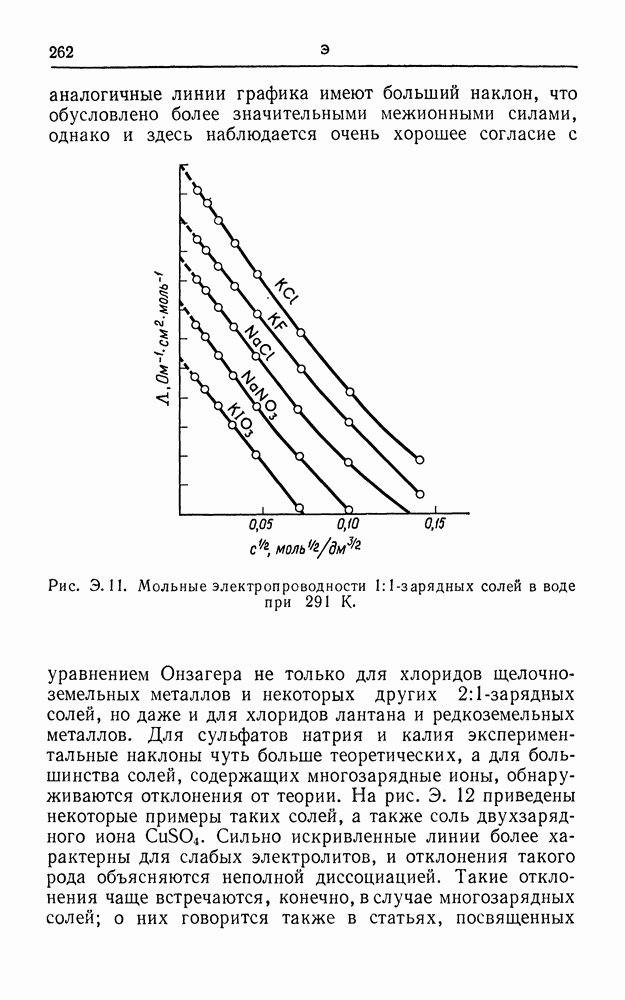
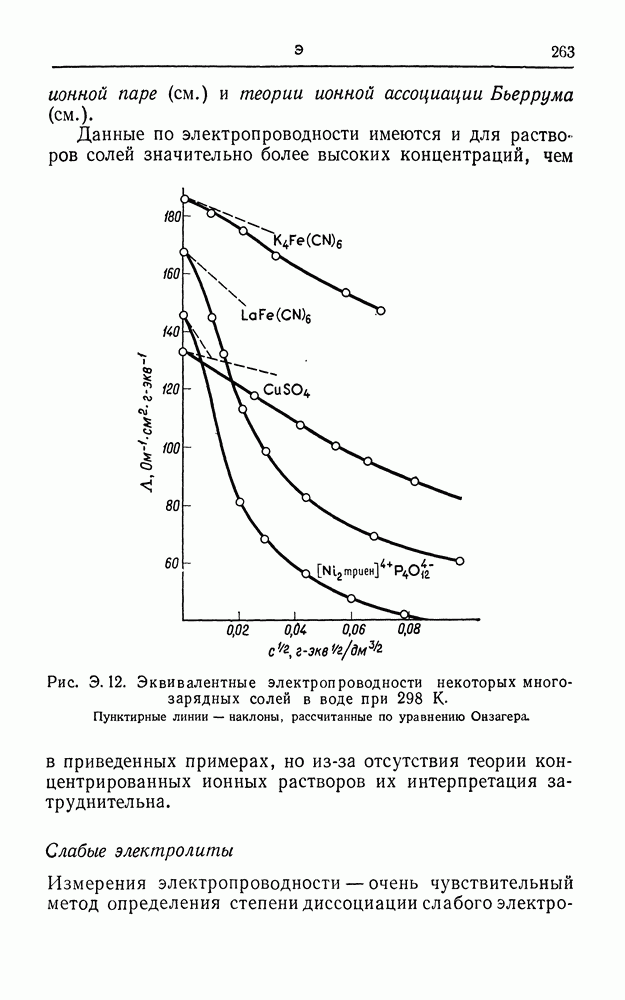
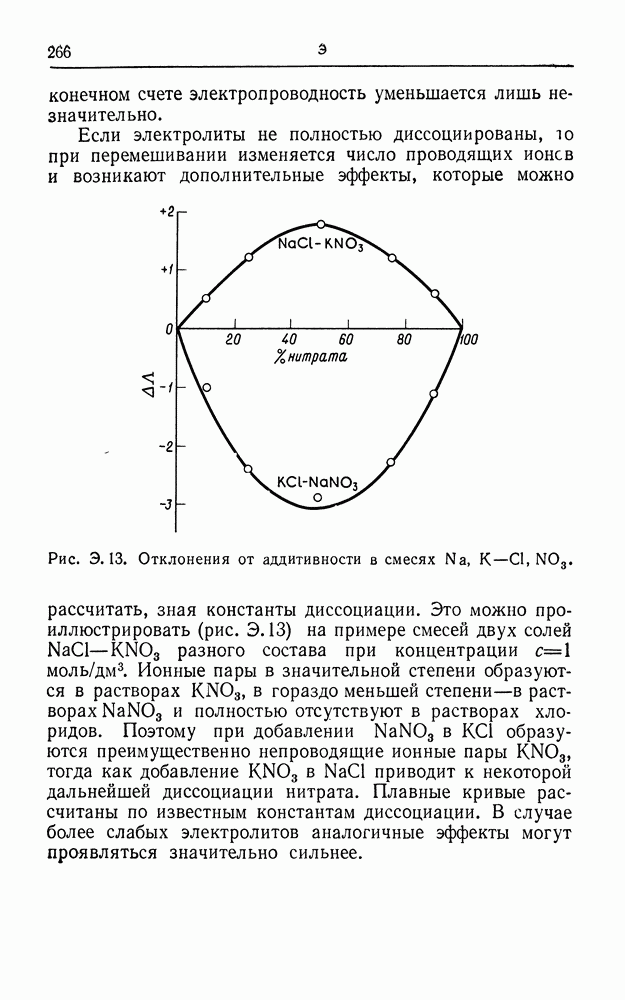
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
РЕАКЦИЯ ВЫДЕЛЕНИЯ ВОДОРОДА
Так как электродные потенциалы отсчитывают по водородной шкале, то можно ожидать, что из кислых растворов будут осаждаться только металлы, имеющие положительный стандартный электродный потенциал; в присутствии других катионов, таких, как  или
или  , в первую очередь будет разряжаться водород. Нарушения этого правила обусловлены высоким активационным перенапряжением (см.) водорода на многих металлах. Значения
, в первую очередь будет разряжаться водород. Нарушения этого правила обусловлены высоким активационным перенапряжением (см.) водорода на многих металлах. Значения  полученные при плотности тока
полученные при плотности тока  изменяются от 0,01 В на платинированной платине вплоть до величины больше 0,67 В на свинце и 1,04 В на ртути.
изменяются от 0,01 В на платинированной платине вплоть до величины больше 0,67 В на свинце и 1,04 В на ртути.
Водород разряжается из кислых растворов по суммарной реакции:

а из щелочных растворов по реакции

Кислые растворы наиболее изучены, и отдельные стадии, составляющие суммарный процесс разряда водорода, можно описать следующим образом:
1. Ионы водорода из объема раствора перемещаются к внешней плоскости двойного электрического слоя (см.).
2. Ионы водорода проходят через двойной слой, принимают электрон и дегидратируются, образуя атом водорода, который адсорбируется на поверхности электрода.
3. Образуются молекулы водорода; хотя процесс, очевидно, можно описать реакцией  , протекающей на поверхности электрода, однако вероятен и другой механизм реакции — диффузия второго иона водорода к тому участку поверхности, на котором адсорбирован атом водорода:
, протекающей на поверхности электрода, однако вероятен и другой механизм реакции — диффузия второго иона водорода к тому участку поверхности, на котором адсорбирован атом водорода:  (б).
(б).
4. Молекулы водорода десорбируются.
5. Образующиеся пузырьки газообразного водорода удаляются из раствора.
Некоторые из этих реакций можно исключить из рассмотрения как второстепенные. Если стадия 1 становится скоростьопределяющей в условиях эксперимента, то говорят о концентрационном перенапряжении (см.). Тогда стадия 4 будет несущественной, так как сразу же образуется молекулярный водород, который, как известно, легко десорбируется с поверхности электрода. На стадии 5 наблюдаются небольшие флуктуации потенциала в некоторых точках катода, так как удаляются пузырьки газа и образуются новые пузырьки, однако этот эффект не оказывает существенного влияния.
Наибольший интерес представляют выяснение механизма реакции 3 и вопрос о том, какая из реакций (а или б) скоростьопределяющая. Показано, что на ртути, свинце и кадмии, т. е. на металлах с высоким перенапряжением водорода — скоростьопределяющей стадией является замедленный разряд ионов водорода 3 (б). На других металлах, таких, например, как платина или родий, протон разряжается более быстро и стадия разряда не является медленной 3 (а). На металлах с промежуточным значением перенапряжения, например на никеле или золоте, протон
разряжается по реакции 3 (б), которая и лимитирует процесс.
Основные методы исследования реакции разряда водорода описаны в статье механизмы электродных реакций (см.). К ним прежде всего относится построение поляризационных кривых  которые дают значение тафелевского наклона b и, следовательно, коэффициент переноса а, так как
которые дают значение тафелевского наклона b и, следовательно, коэффициент переноса а, так как  (см. активационное перенапряжение). Если скорость процесса выделения водорода определяется стадией разряда протона, то а будет представлять собой коэффициент симметрии
(см. активационное перенапряжение). Если скорость процесса выделения водорода определяется стадией разряда протона, то а будет представлять собой коэффициент симметрии  , и если
, и если  , то b будет иметь значение 0,118 (найдено для таких металлов, как ртуть).
, то b будет иметь значение 0,118 (найдено для таких металлов, как ртуть).
Если скоростьопределяющей является стадия  , то протоны легко разряжаются и на поверхности электрода образуется монослой адсорбированных атомов. В состоянии устойчивого равновесия число атомов, достигающих поверхности, равно числу атомов, реагирующих с образованием молекулы водорода, плюс некоторое число атомов, из которых вновь образуются ионы. Такая ситуация характерна для металлов с большой плотностью тока обмена (см.), и реакцию
, то протоны легко разряжаются и на поверхности электрода образуется монослой адсорбированных атомов. В состоянии устойчивого равновесия число атомов, достигающих поверхности, равно числу атомов, реагирующих с образованием молекулы водорода, плюс некоторое число атомов, из которых вновь образуются ионы. Такая ситуация характерна для металлов с большой плотностью тока обмена (см.), и реакцию  можно рассматривать как равновесную. Если в качестве меры активности адсорбированных водородных атомов принять степень заполнения поверхности адсорбированным веществом 0, то условия равновесия можно выразить уравнением
можно рассматривать как равновесную. Если в качестве меры активности адсорбированных водородных атомов принять степень заполнения поверхности адсорбированным веществом 0, то условия равновесия можно выразить уравнением

так что

Если степень заполнения поверхности невелика, то последнее выражение переходит в следующее:

Скорость потенциалопределяющей стадии  таким образом, для тока получим выражение
таким образом, для тока получим выражение

и тафелевский наклон будет в четыре раза меньше, чем в предыдущем случае.
Если имеет место процесс 3 (б), то предполагают, что водородные атомы достигают поверхности в результате разряда ионов и удаляются с нее или в результате ионизации или же путем взаимодействия с протоном. Скорости этих трех процессов можно записать так:

По этому механизму протекает разряд ионов водорода на металлах, которые плохо катализируют реакцию  и на которых плотность тока обмена имеет небольшую величину. Если сначала устанавливается достаточно высокая степень заполнения поверхности адсорбированными атомами водорода Надс, то
и на которых плотность тока обмена имеет небольшую величину. Если сначала устанавливается достаточно высокая степень заполнения поверхности адсорбированными атомами водорода Надс, то  образуется по реакции (3). Тогда в предположении, что для реакции
образуется по реакции (3). Тогда в предположении, что для реакции  получим уравнение, не отличимое от того, которым описан выше первый из рассматриваемых здесь механизмов
получим уравнение, не отличимое от того, которым описан выше первый из рассматриваемых здесь механизмов  Однако для металлов с более высокой плотностью тока обмена реакции (1) и (2) можно рассматривать как равновесные:
Однако для металлов с более высокой плотностью тока обмена реакции (1) и (2) можно рассматривать как равновесные:

Для  это дает
это дает

и с учетом последней величины и реакции (3) получаем

Если  согласно описываемому здесь механизму, получатся уже другие значения:
согласно описываемому здесь механизму, получатся уже другие значения:  которые найдены для ряда металлов.
которые найдены для ряда металлов.
Выводы, сделанные на основании тафелевского наклона, можно дополнить другими данными. Предположение об адсорбции водорода на поверхности электрода было подтверждено опытами с быстрым изменением потенциала рабочего электрода до значения, при котором адсорбированный
водород способен ионизоваться. Для определения степени заполнения поверхности водородом измеряют площадь под кривой ток — время, в течение которого полностью удаляется адсорбционный слой. Ценную информацию можно получить из изотопных эффектов. Теоретические модели для переходных состояний, соответствующих различным скоростьопределяющим стадиям, дают набор коэффициентов разделения водород — тритий, с которыми можно сравнивать экспериментальные величины. См. также [4].
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- ПРЕДИСЛОВИЕ
- О ПОЛЬЗОВАНИИ СЛОВАРЕМ
- СПИСОК ОСНОВНЫХ ОБОЗНАЧЕНИЙ
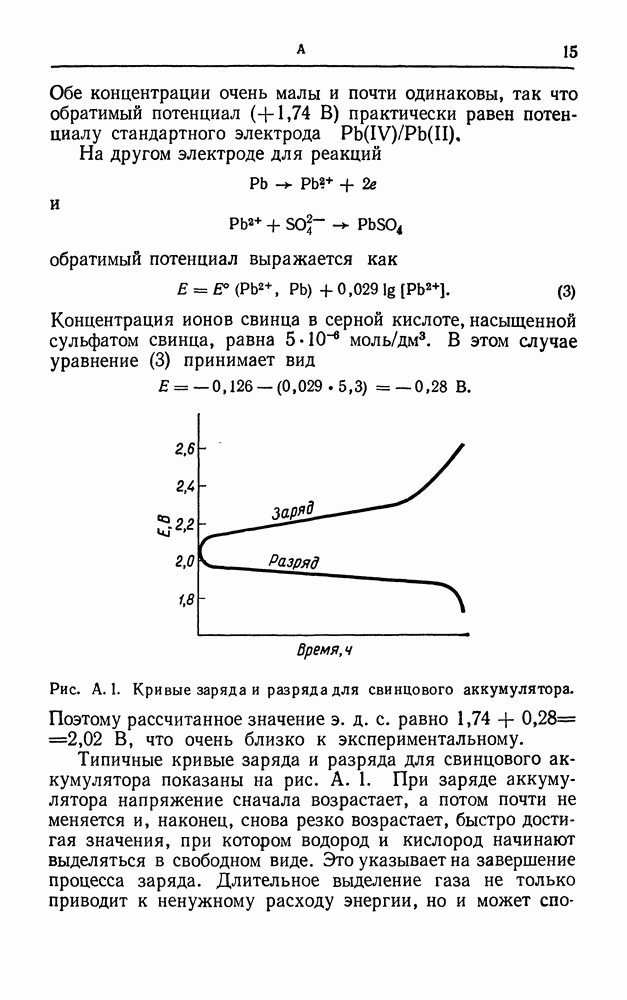
- АККУМУЛЯТОР
- АКТИВАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
- АКТИВНОСТЬ
- АЛЮМИНИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- АМАЛЬГАМНЫЙ ЭЛЕКТРОД
- АМПЕР
- АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- АМПЕРОСТАТ
- АНИОН
- АНОД
- АНОДИРОВАНИЕ
- БАТАРЕЯ
- БЕРИЛЛИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- БИПОЛЯРНЫЙ ЭЛЕКТРОД
- БЛЕСКООБРАЗОВАТЕЛИ
- БУФЕРНЫЙ РАСТВОР
- ВАГНЕРОВСКОЕ ЗАЗЕМЛЕНИЕ
- ВНУТРЕННИЙ ЭЛЕКТРОЛИЗ
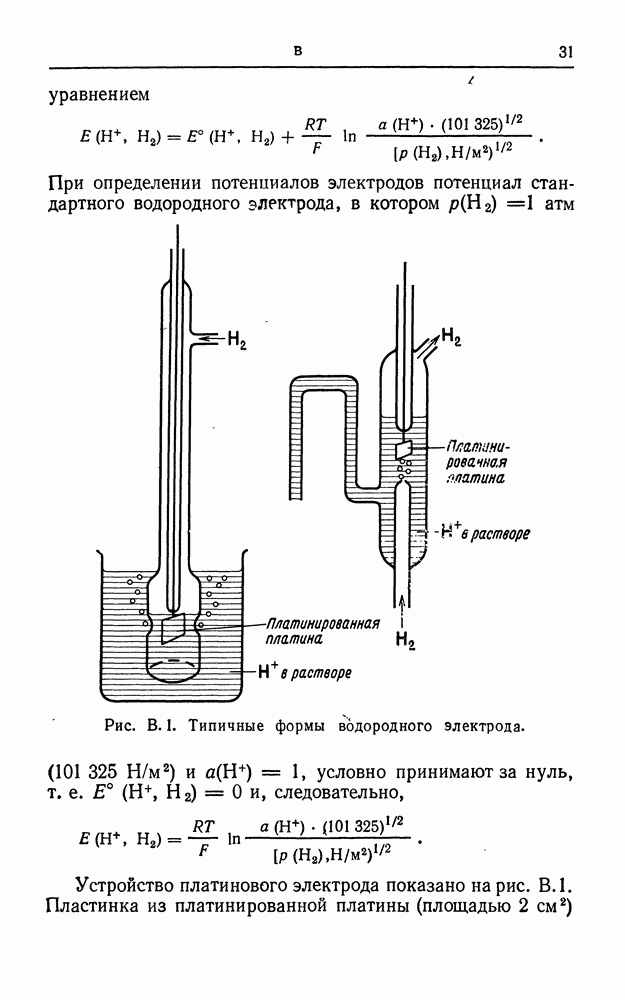
- ВОДОРОДНЫЙ ЭЛЕКТРОД
- ВОЛЬТ
- ВОЛЬФРАМОВЫЙ ЭЛЕКТРОД
- ВЫХОД ПО ТОКУ
- ГАЗОВЫЙ ЭЛЕКТРОД
- ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- ГАЛЬВАНОПЛАСТИКА
- ГАЛЬВАНОСТАТ
- ГАЛЬВАНОСТЕГИЯ
- ГИДРАТАЦИЯ ИОНОВ
- ДАТЧИК АММИАКА
- ДАТЧИК СЕРНИСТОГО ГАЗА
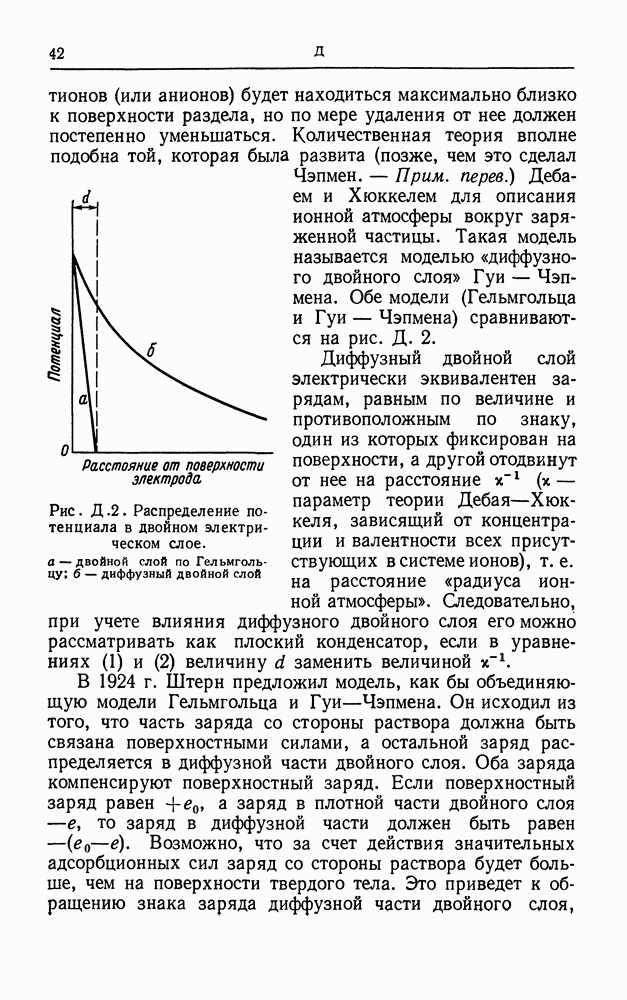
- ДВОЙНОЙ СЛОЙ
- ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
- ДЗЕТА-ПОТЕНЦИАЛ
- ДИФФУЗИОННЫЙ ПОТЕНЦИАЛ
- ДИФФУЗИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- ДИЭЛЕКТРИЧЕСКАЯ ПОСТОЯННАЯ
- ДИЭЛЕКТРИЧЕСКАЯ ПРОНИЦАЕМОСТЬ
- ЗАКОН КОЛЬРАУША
- ЗАКОН РАЗВЕДЕНИЯ ОСТВАЛЬДА
- ЗАКОНЫ ФАРАДЕЯ
- ИНДИКАТОР
- ИНДИКАТОРНЫЙ ЭЛЕКТРОД
- ИНДИФФЕРЕНТНЫЙ (ФОНОВЫЙ) ЭЛЕКТРОЛИТ
- ИОДНЫЙ КУЛОНОМЕТР
- ИОННАЯ АТМОСФЕРА
- ИОННЫЕ ПАРЫ
- ИОННЫЕ РАСПЛАВЫ
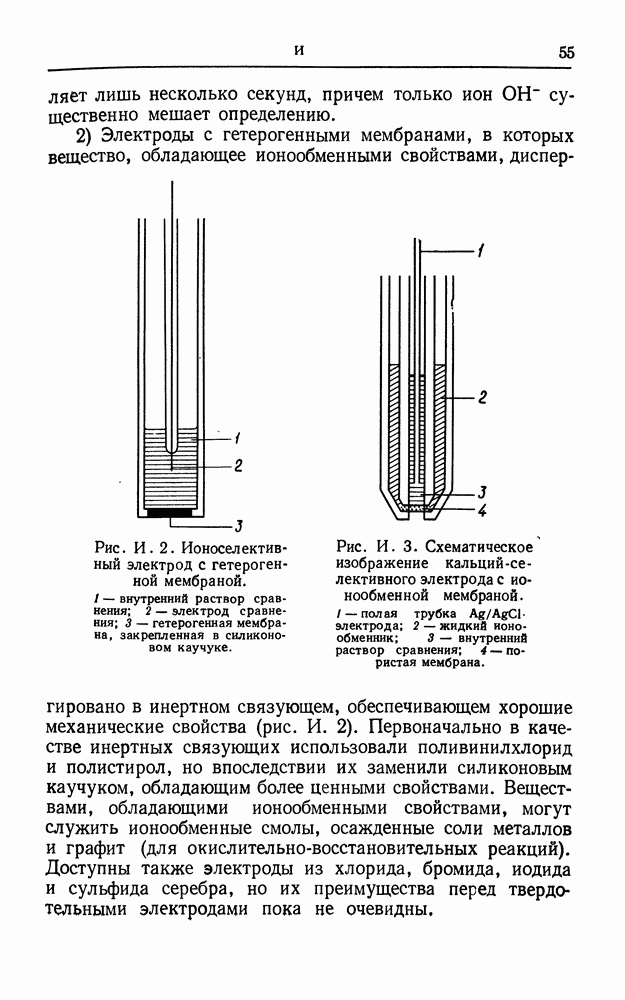
- ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ
- КАДМИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД
- КАЛЬЦИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- КАПИЛЛЯР ЛУГГИНА
- КАТИОН
- КАТИОНОСЕЛЕКТИВНЫЙ ЭЛЕКТРОД
- КАТОД
- КАТОДНАЯ ЗАЩИТА
- КИСЛОРОДНОЕ ПЕРЕНАПРЯЖЕНИЕ
- КИСЛОРОДНЫЙ ЭЛЕКТРОД (КИСЛОРОДНЫЙ ЗОНД)
- КОМПЛЕКСНЫЕ ИОНЫ
- КОНВЕНЦИЯ О ЗНАКАХ
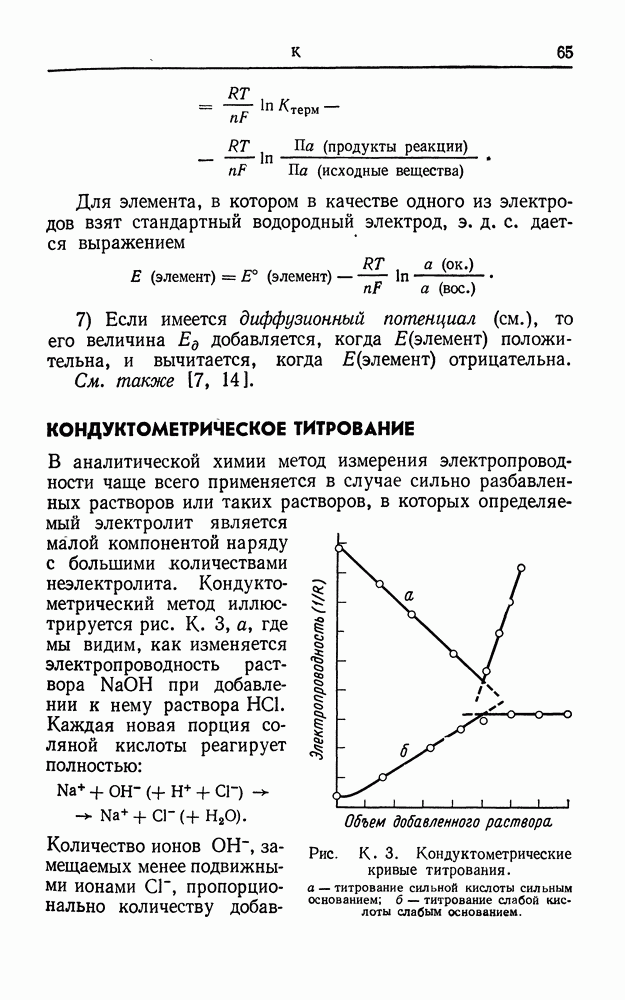
- КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- КОНСТАНТА ДИССОЦИАЦИИ
- КОНТАКТНАЯ РАЗНОСТЬ ПОТЕНЦИАЛОВ
- КОНЦЕНТРАЦИОННАЯ ЦЕПЬ
- КОНЦЕНТРАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
- КОРРОЗИЯ
- КОЭФФИЦИЕНТ АКТИВНОСТИ
- КУЛОН
- КУЛОНОМЕТР
- КУЛОНОМЕТРИЯ
- ЛИТИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- МАГНИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- МЕДНООКИСНЫЙ ЭЛЕМЕНТ
- МЕДНЫЙ КУЛОНОМЕТР
- МЕДЬ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- МЕМБРАННЫЙ ЭЛЕКТРОД
- МЕТАЛЛИЧЕСКИЙ ЭЛЕКТРОД
- МЕТАЛЛООКИСНЫЙ ЭЛЕКТРОД
- МЕТОД ГИТТОРФА
- МЕТОД ДВИЖУЩЕЙСЯ ГРАНИЦЫ
- МЕХАНИЗМЫ ЭЛЕКТРОДНЫХ РЕАКЦИЙ
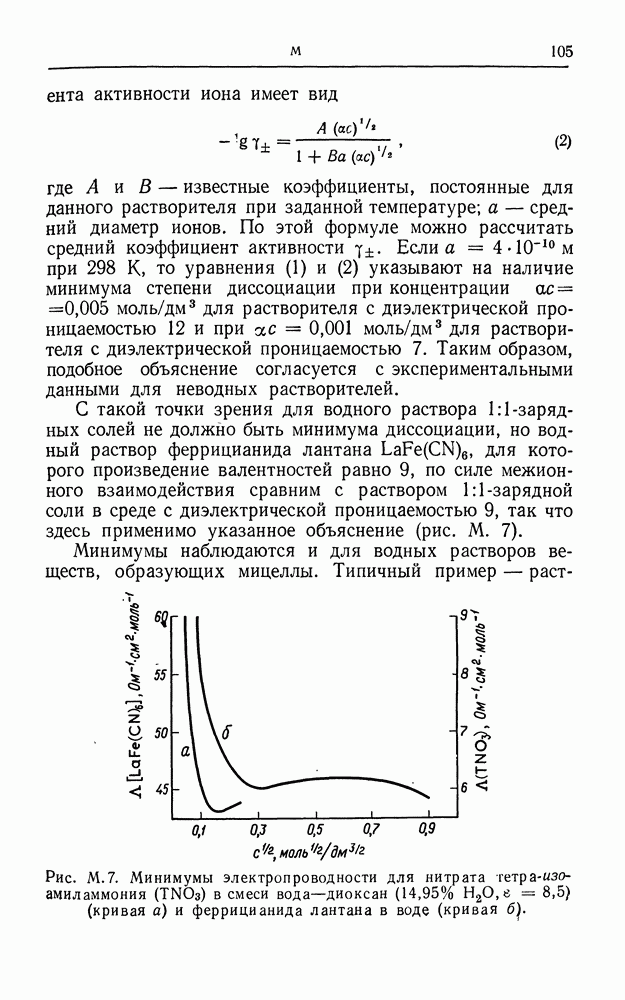
- МИНИМУМЫ ЭЛЕКТРОПРОВОДНОСТИ
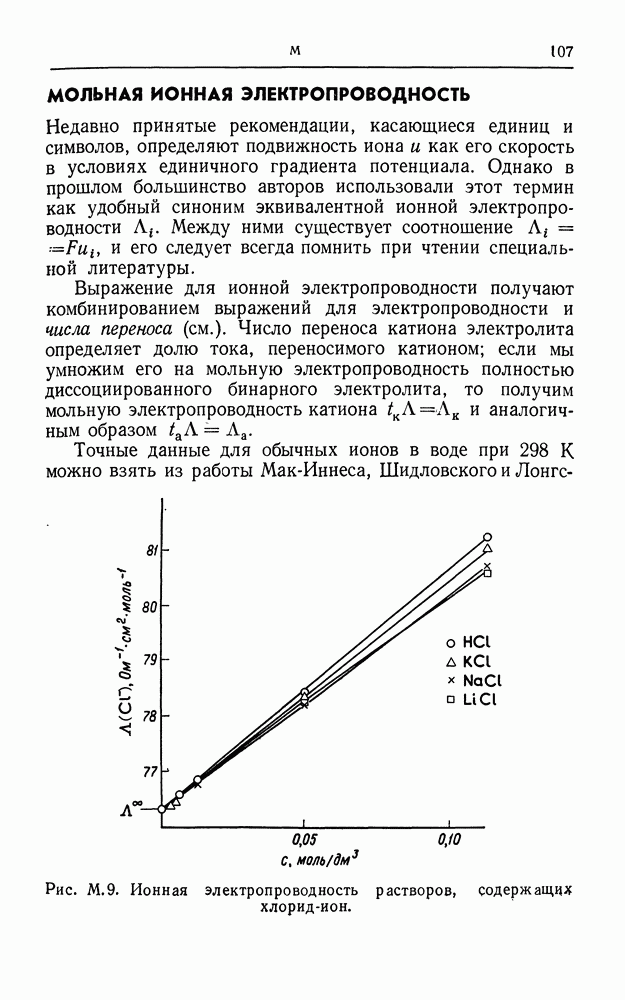
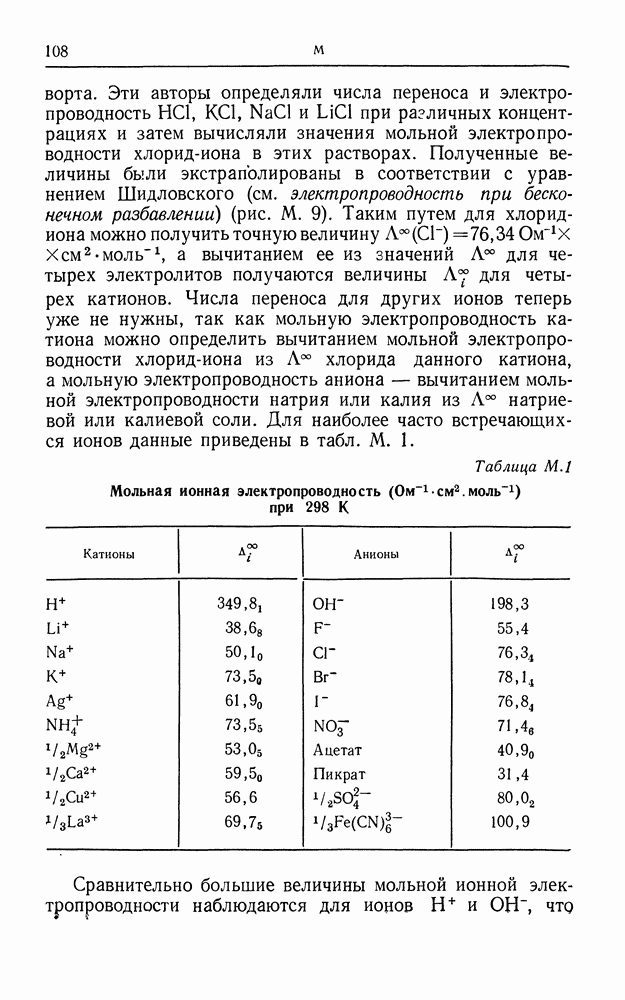
- МОЛЬНАЯ ИОННАЯ ЭЛЕКТРОПРОВОДНОСТЬ
- МОСТ УИТСТОНА
- НАПРЯЖЕНИЕ РАЗЛОЖЕНИЯ
- НЕВОДНЫЕ РАСТВОРЫ
- НИКЕЛЬ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- ОБРАТИМЫЙ ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ (РЕДОКС) ЭЛЕКТРОДНАЯ СИСТЕМА
- ОМ
- ОПРЕСНЕНИЕ ВОДЫ
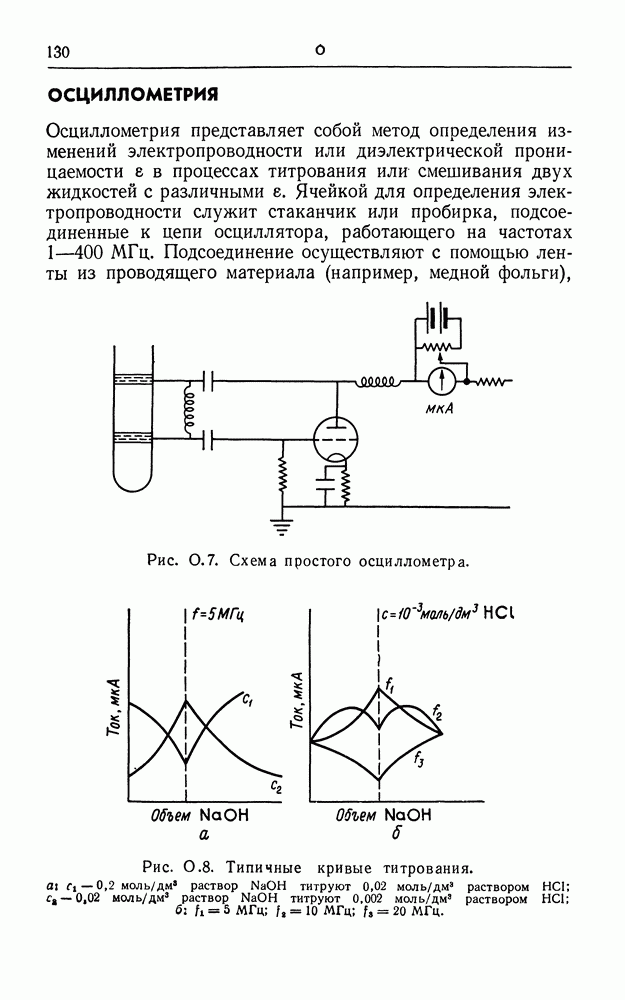
- ОСЦИЛЛОМЕТРИЯ
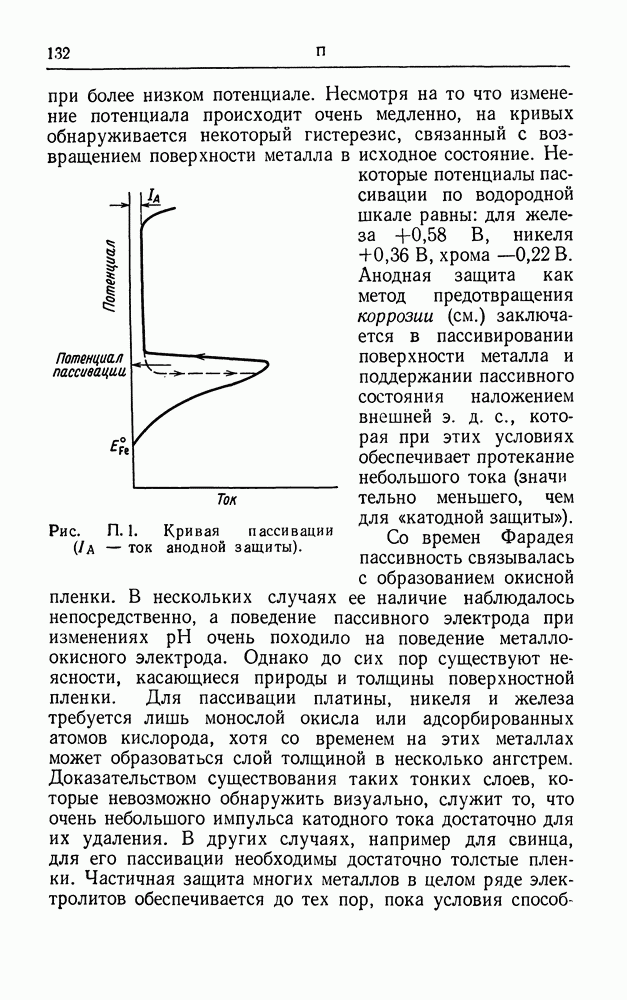
- ПАССИВНОСТЬ
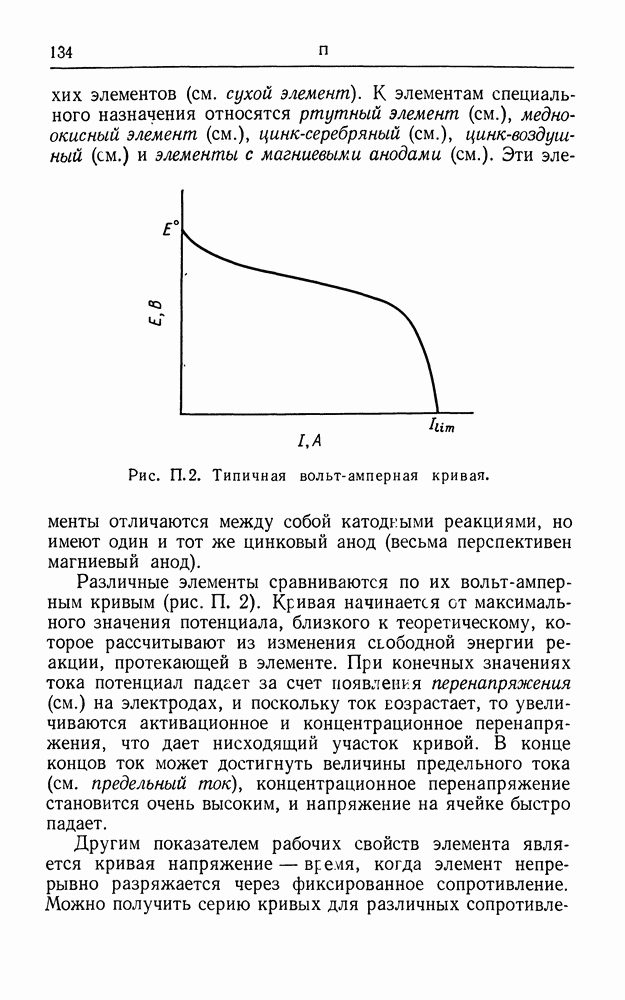
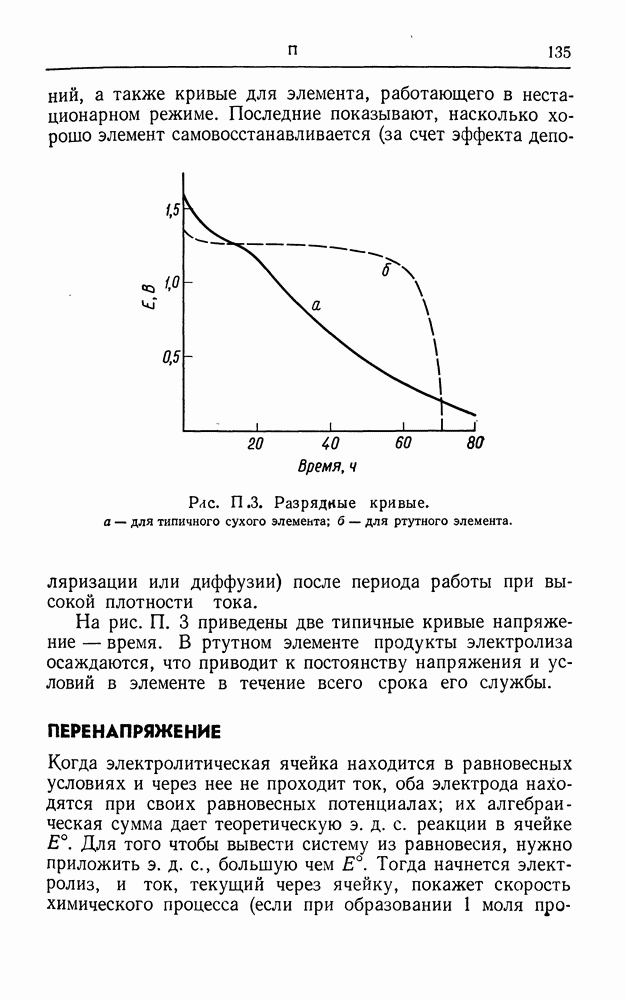
- ПЕРВИЧНЫЙ ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- ПЕРЕНАПРЯЖЕНИЕ
- ПЕРЕНАПРЯЖЕНИЕ ВОДОРОДА
- ПЕРЕХОДНОЕ ВРЕМЯ
- ПЕРСОЛИ
- ПЛАТИНОВЫЕ И ЗОЛОТЫЕ ЭЛЕКТРОДЫ
- рН-МЕТР
- ПОДВИЖНОСТЬ
- ПОДВИЖНОСТЬ ИОНОВ
- ПОЛУЭЛЕМЕНТ
- ПОЛЯРИЗАЦИОННЫЕ КРИВЫЕ
- ПОЛЯРИЗАЦИЯ
- ПОЛЯРИЗУЕМЫЕ ЭЛЕКТРОДЫ
- ПОЛЯРОГРАФИЯ
- ПОПРАВКА НА ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРИТЕЛЯ
- ПОСТОЯННАЯ ЯЧЕЙКИ
- ПОТЕНЦИАЛ, ОБРАТИМЫЕ ЭЛЕКТРОДЫ
- ПОТЕНЦИАЛ ПОЛУВОЛНЫ
- ПОТЕНЦИАЛ СЕДИМЕНТАЦИИ
- ПОТЕНЦИАЛ ТЕЧЕНИЯ
- ПОТЕНЦИОМЕТР
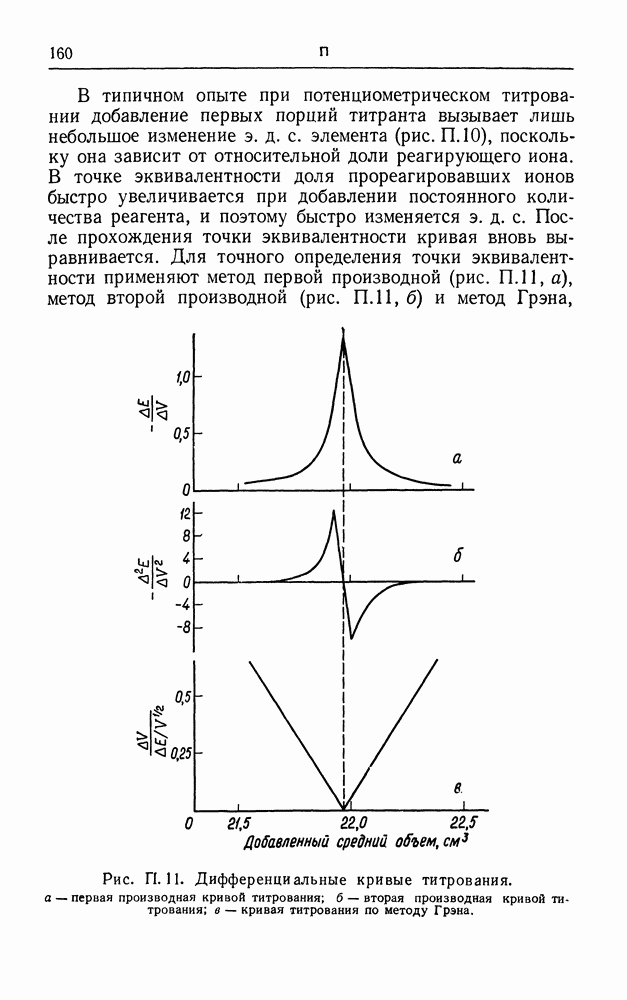
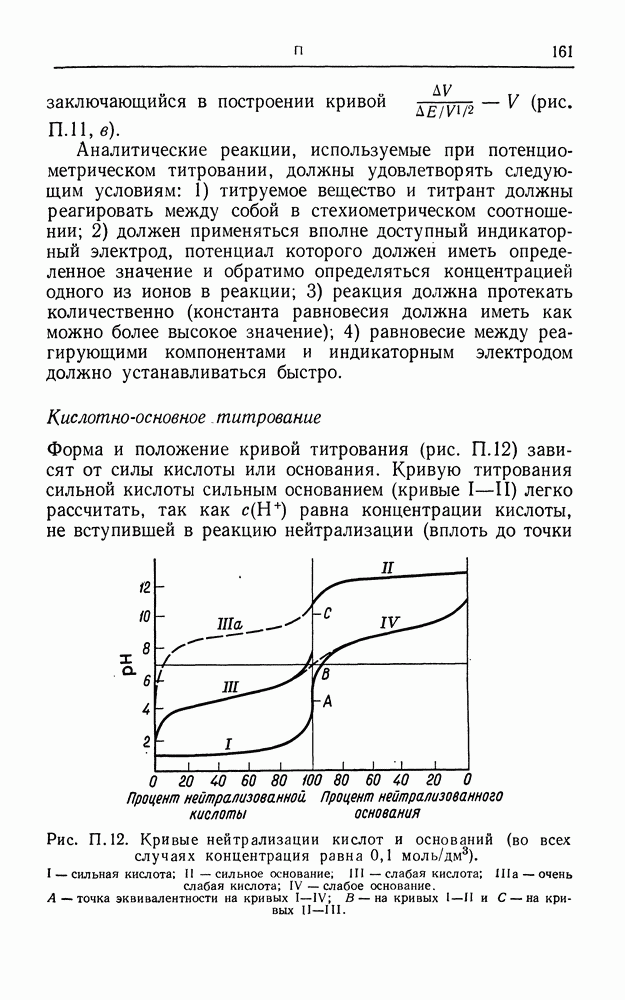
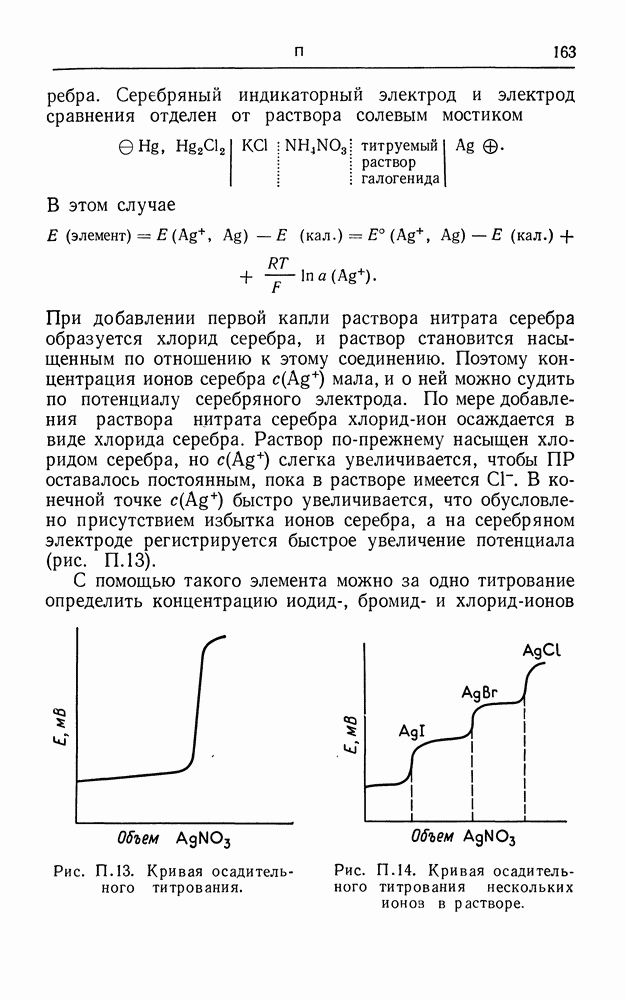
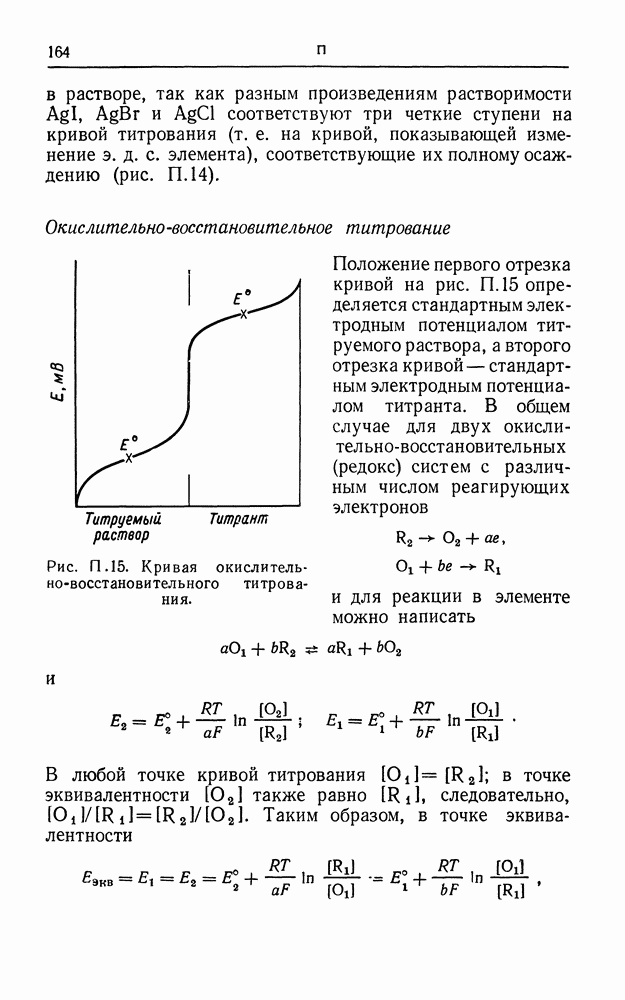
- ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- ПОТЕНЦИОСТАТ
- ПРАВИЛО ВАЛЬДЕНА
- ПРЕДЕЛЬНЫЙ ТОК
- ПРОТЕКТОРНАЯ ЗАЩИТА
- РАСПЛАВЫ СОЛЕЙ
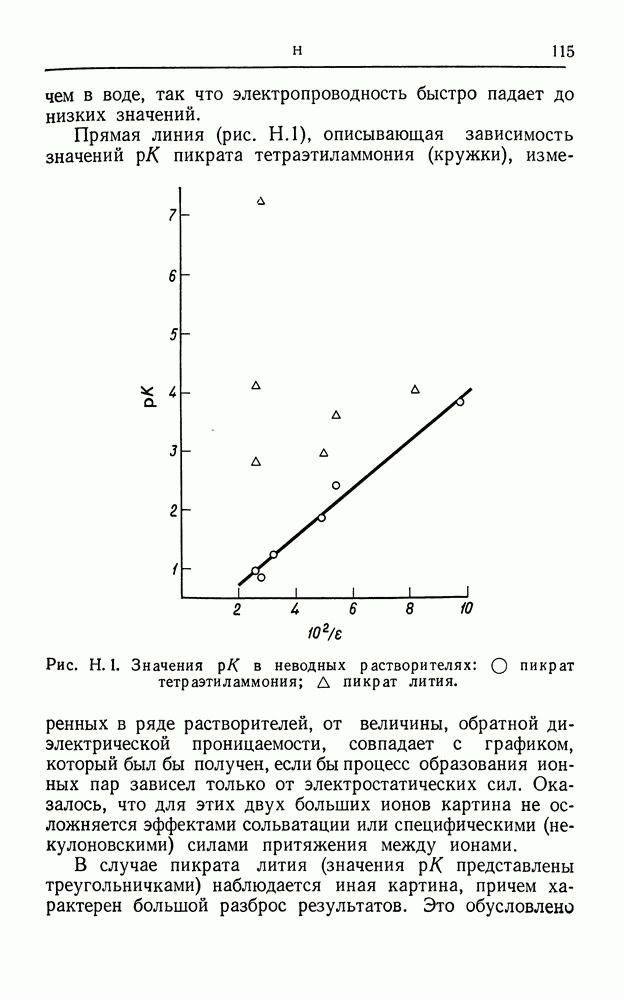
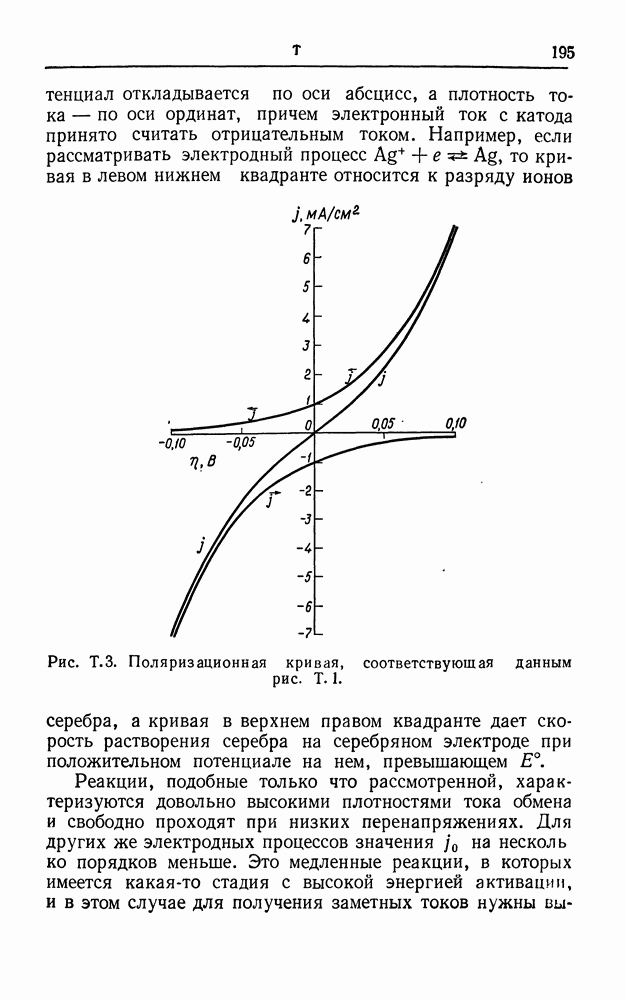
- РЕАКЦИЯ ВЫДЕЛЕНИЯ ВОДОРОДА
- РТУТНЫЙ ЭЛЕМЕНТ
- РЯД ПОТЕНЦИАЛОВ
- СВИНЦОВЫЙ АККУМУЛЯТОР
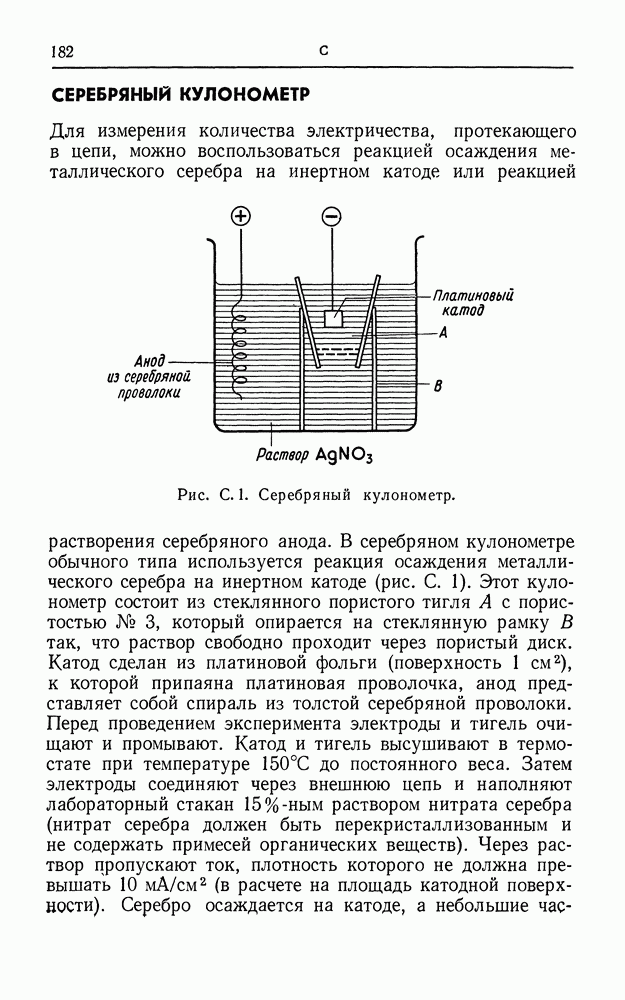
- СЕРЕБРЯНЫЙ КУЛОНОМЕТР
- СЕРЕБРЯНЫЙ ЭЛЕКТРОД
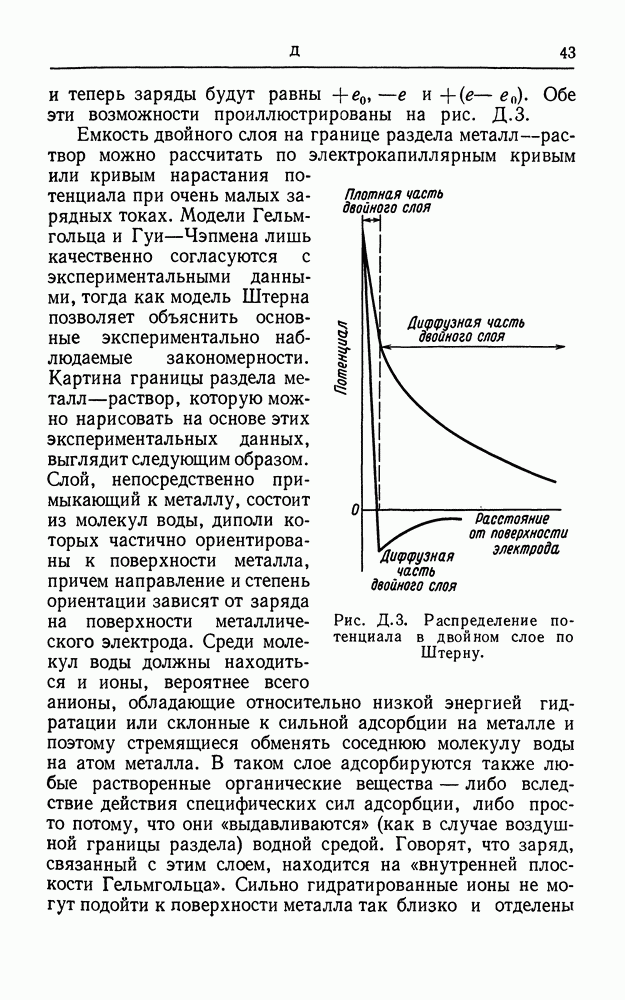
- СЛОЙ ГЕЛЬМГОЛЬЦА
- СЛОЙ ГУИ
- СОЛЕВОЙ МОСТИК
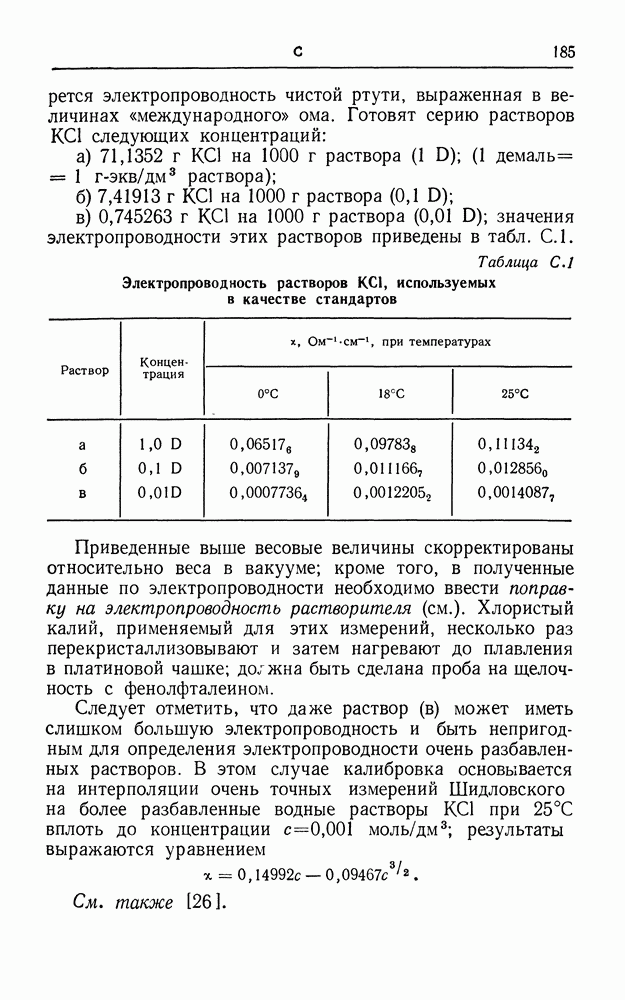
- СТАНДАРТНЫЕ РАСТВОРЫ ДЛЯ ЭЛЕКТРОПРОВОДНОСТИ
- СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
- СТАНДАРТНЫЙ ЭЛЕМЕНТ
- СТЕКЛЯННЫЙ ЭЛЕКТРОД
- СУРЬМЯНЫЙ ЭЛЕКТРОД
- СУХОЙ ЭЛЕМЕНТ
- ТЕОРИЯ ИОННОЙ АССОЦИАЦИИ БЬЕРРУМА
- ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ АРРЕНИУСА
- ТЕРМОДИНАМИКА ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
- ТОК ОБМЕНА
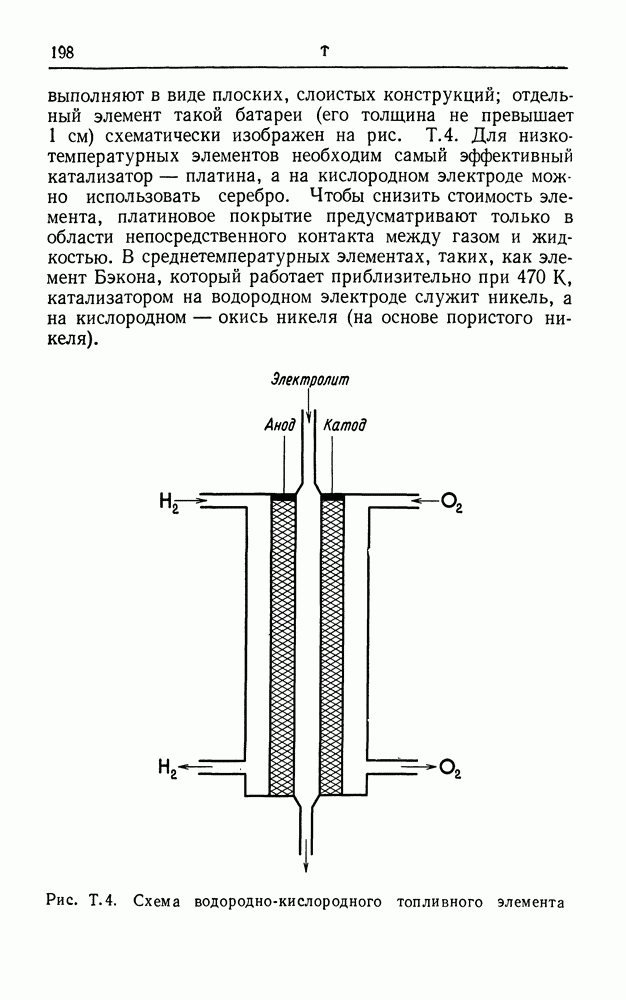
- ТОПЛИВНЫЙ ЭЛЕМЕНТ
- УРАВНЕНИЕ БРЕНСТЕДА—БЬЕРРУМА
- УРАВНЕНИЕ ДЕБАЯ — ХЮККЕЛЯ
- УРАВНЕНИЕ ИЛЬКОВИЧА
- УРАВНЕНИЕ НЕРНСТА
- УРАВНЕНИЕ ОНЗАГЕРА
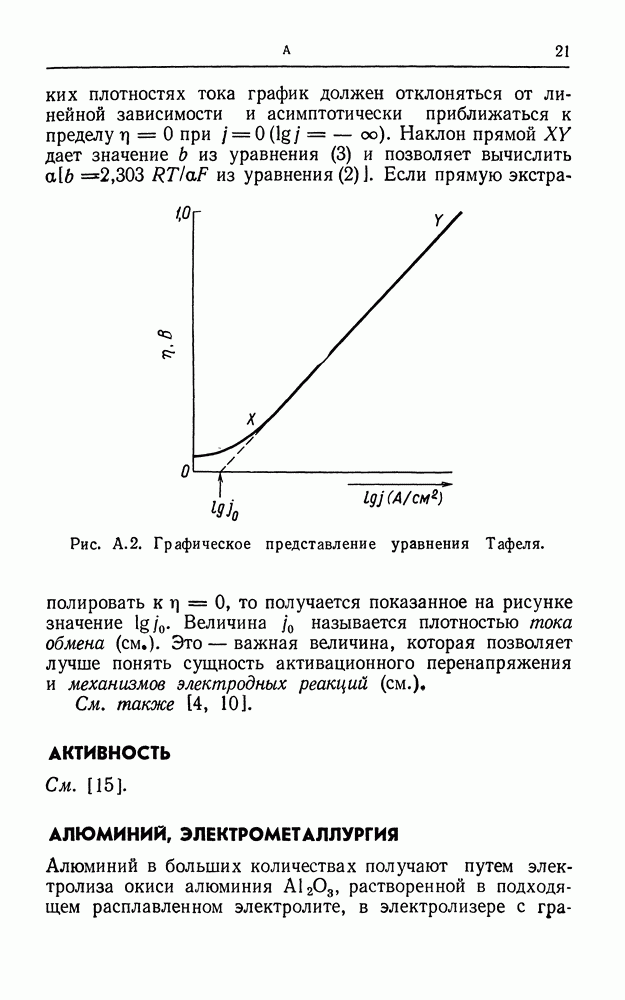
- УРАВНЕНИЕ ТАФЕЛЯ
- УРАВНЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ ПИТТСА
- УРАВНЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ ФУОССА
- УРАВНЕНИЯ ЭЛЕКТРОПРОВОДНОСТИ
- ХЕМОТРОНЫ
- ХИНГИДРОННЫЙ ЭЛЕКТРОД
- ХЛОРНЫЙ ЭЛЕКТРОД
- ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД
- ХРОНОАМПЕРОМЕТРИЯ
- ХРОНОПОТЕНЦИОМЕТРИЯ
- ЦИНК-ВОЗДУШНЫЙ ЭЛЕМЕНТ
- ЦИНК-СЕРЕБРЯНЫЙ ЭЛЕМЕНТ
- ЦИНК, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- ЦИФРОВОЙ ВОЛЬТМЕТР
- ЧАСТОТНАЯ ЗАВИСИМОСТЬ ЭЛЕКТРОПРОВОДНОСТИ
- ЧИСЛА ПЕРЕНОСА
- ЧИСЛО ФАРАДЕЯ
- ЩЕЛОЧНЫЕ АККУМУЛЯТОРЫ
- ЭЛЕКТРИЧЕСКАЯ ЕМКОСТЬ
- ЭЛЕКТРИЧЕСКИЕ ЕДИНИЦЫ ИЗМЕРЕНИЯ
- ЭЛЕКТРОВЕСОВОЙ АНАЛИЗ
- ЭЛЕКТРОД
- ЭЛЕКТРОДВИЖУЩАЯ СИЛА (Э.Д.С.)
- ЭЛЕКТРОДИАЛИЗ
- ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
- ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ
- ЭЛЕКТРОЛИЗ ВОДЫ
- ЭЛЕКТРОЛИЗЕР
- ЭЛЕКТРОЛИЗ РАСТВОРА ПОВАРЕННОЙ СОЛИ
- ЭЛЕКТРОЛИТИЧЕСКАЯ ОЧИСТКА (РАФИНИРОВАНИЕ)
- ЭЛЕКТРОЛИТИЧЕСКОЕ ВОССТАНОВЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ЭЛЕКТРОЛИТИЧЕСКОЕ ОКИСЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛИРОВАНИЕ
- ЭЛЕКТРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- ЭЛЕКТРООСАЖДЕНИЕ МЕТАЛЛОВ
- ЭЛЕКТРООСАЖДЕНИЕ СПЛАВОВ
- ЭЛЕКТРООСМОС
- ЭЛЕКТРОПРОВОДНОСТЬ
- ЭЛЕКТРОПРОВОДНОСТЬ ВОДНЫХ РАСТВОРОВ
- ЭЛЕКТРОПРОВОДНОСТЬ НА ВЫСОКИХ ЧАСТОТАХ
- ЭЛЕКТРОПРОВОДНОСТЬ НЕВОДНЫХ РАСТВОРОВ
- ЭЛЕКТРОПРОВОДНОСТЬ ПРИ БЕСКОНЕЧНОМ РАЗБАВЛЕНИИ
- ЭЛЕКТРОПРОВОДНОСТЬ ПРИ ВЫСОКИХ НАПРЯЖЕННОСТЯХ ПОЛЯ
- ЭЛЕКТРОПРОВОДНОСТЬ РАСПЛАВОВ СОЛЕЙ
- ЭЛЕКТРОФОРЕЗ
- ЭЛЕКТРОХИМИЧЕСКАЯ РАЗМЕРНАЯ ОБРАБОТКА МЕТАЛЛОВ
- ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ ИНФОРМАЦИИ
- ЭЛЕКТРОХИМИЧЕСКИЙ ЭКВИВАЛЕНТ
- ЭЛЕМЕНТ ВЕСТОНА
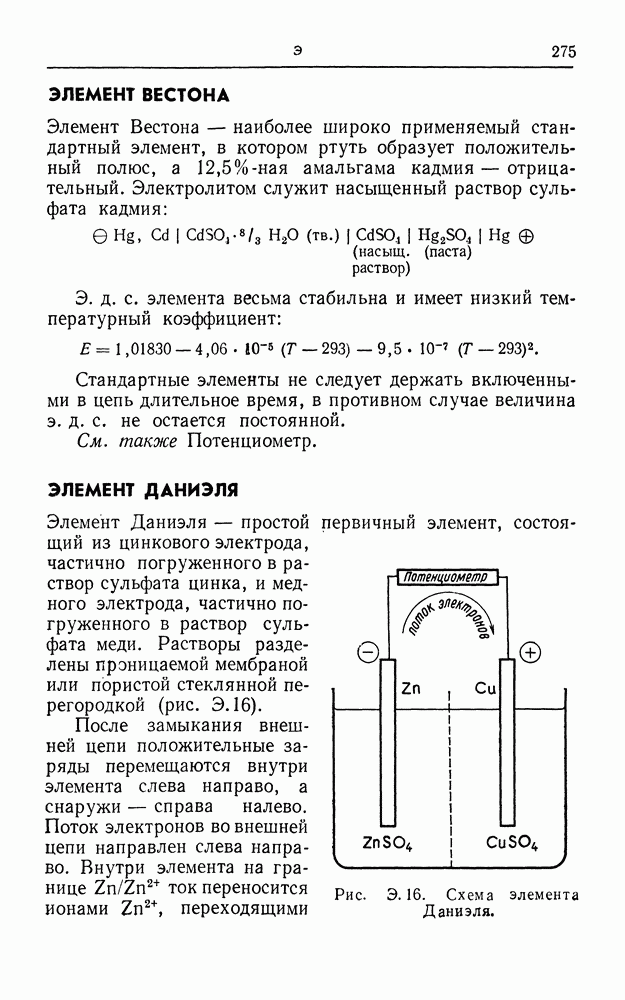
- ЭЛЕМЕНТ ДАНИЭЛЯ
- ЭЛЕМЕНТ КЛАРКА
- ЭЛЕМЕНТЫ С МАГНИЕВЫМИ АНОДАМИ
- ЭФФЕКТ ВИНА
- ЭФФЕКТ ДОРНА
- ЭФФЕКТ ФАЛЬКЕНГАГЕНА
- СПИСОК ЛИТЕРАТУРЫ