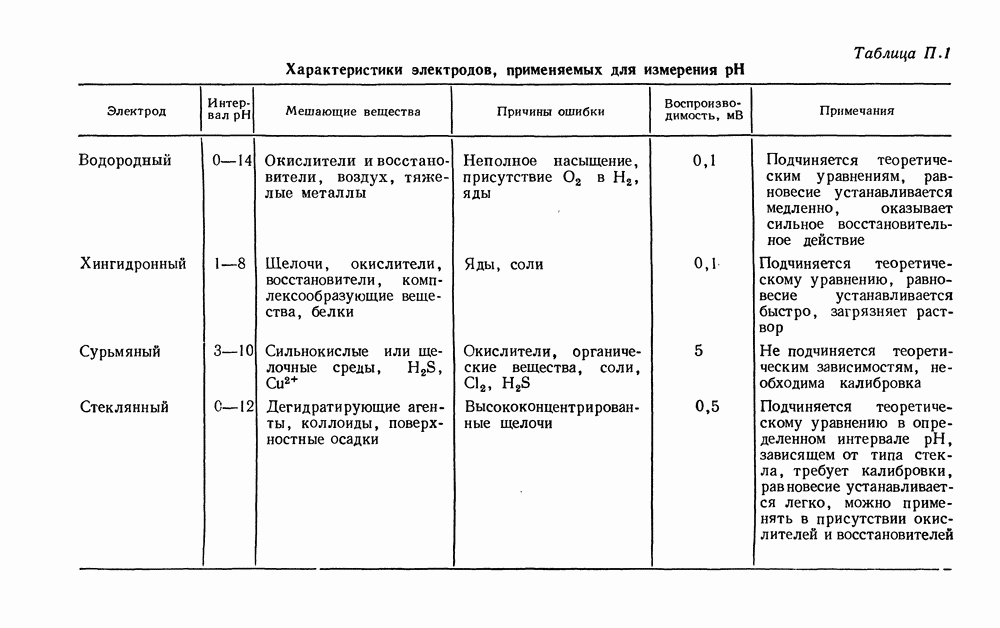
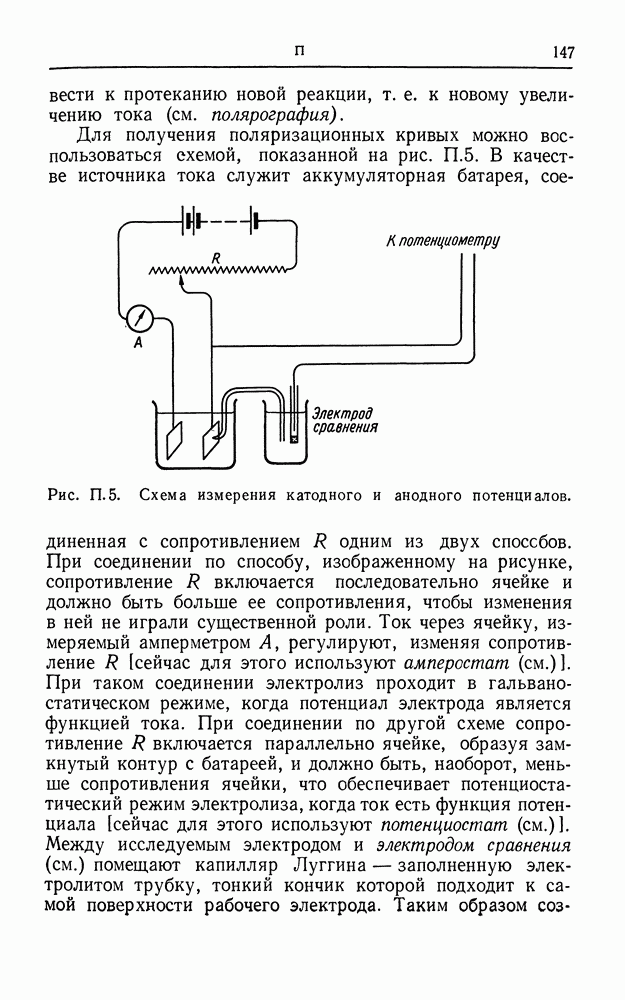
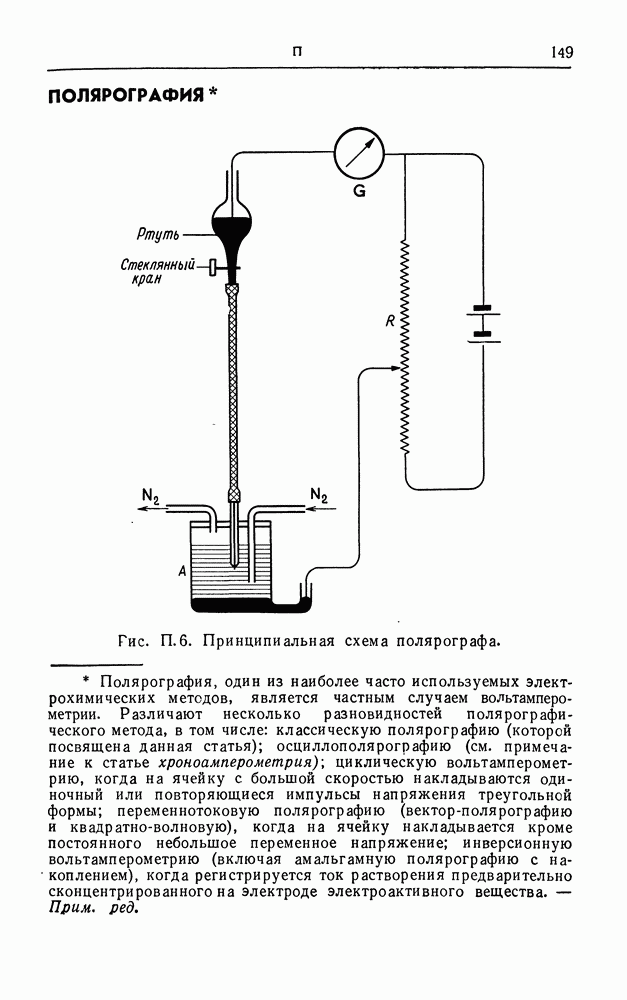
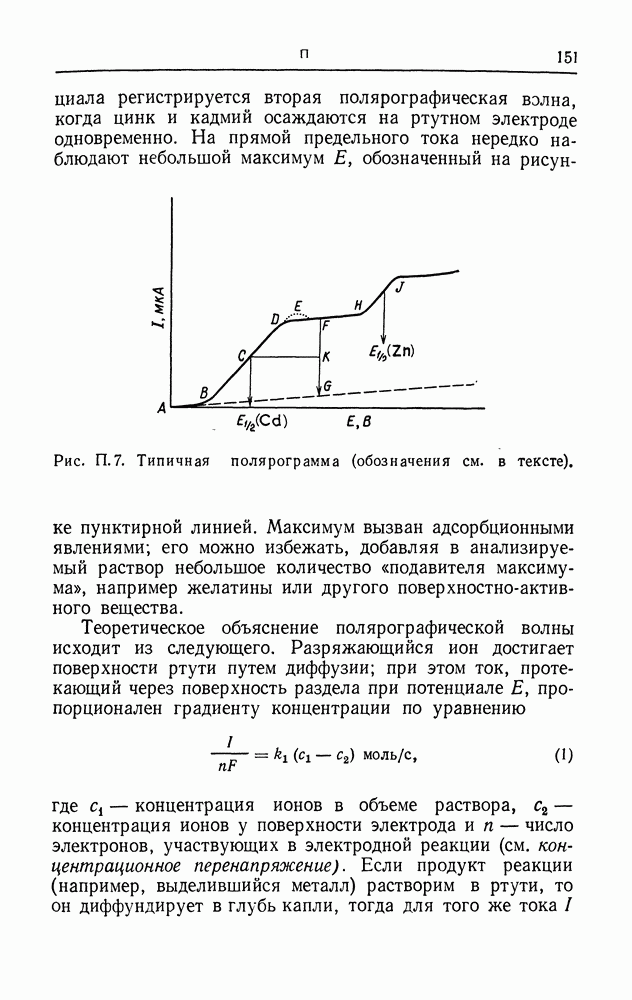
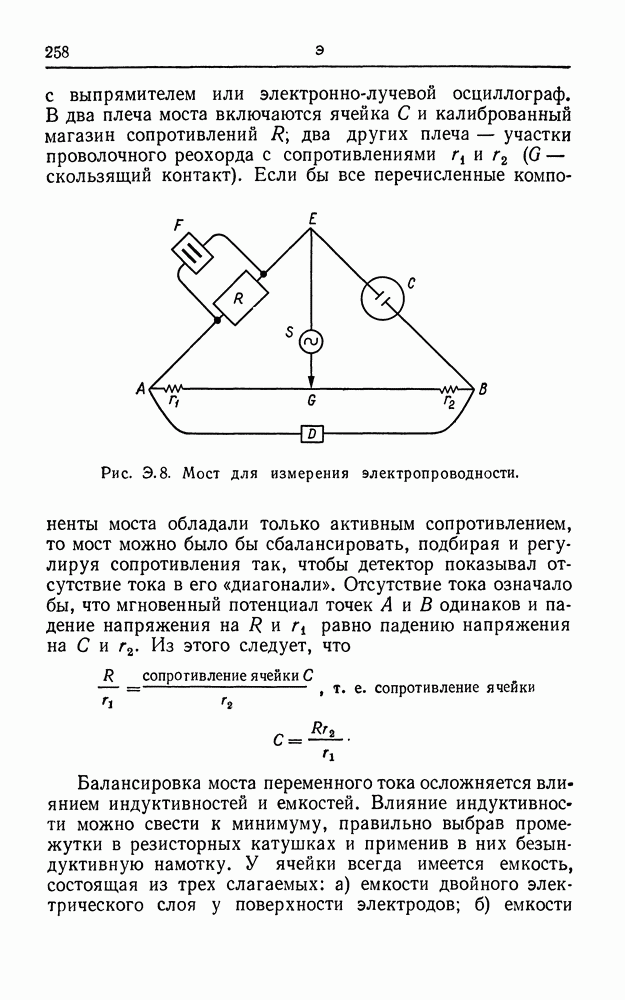
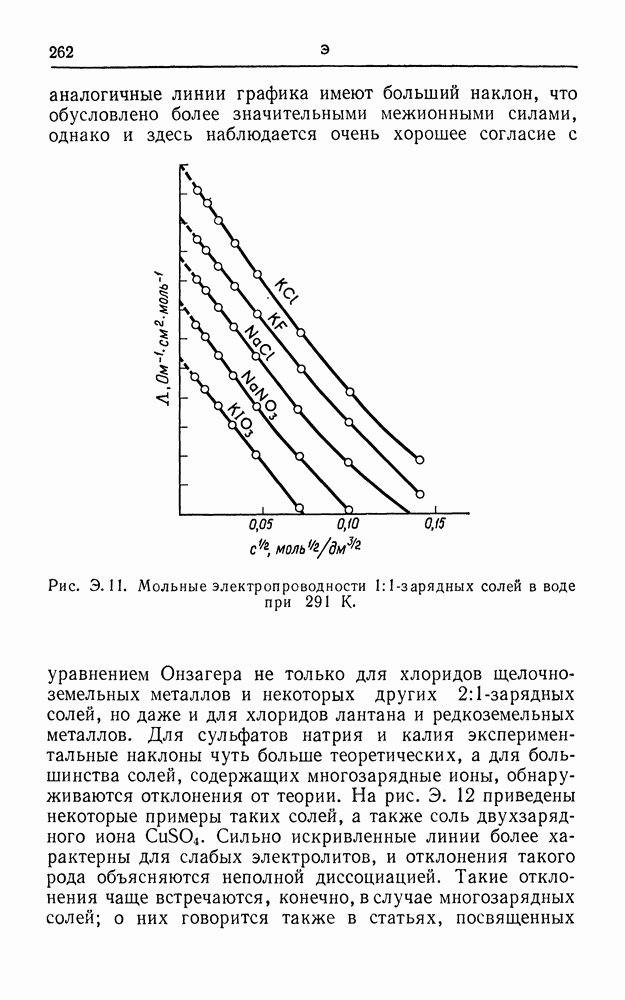
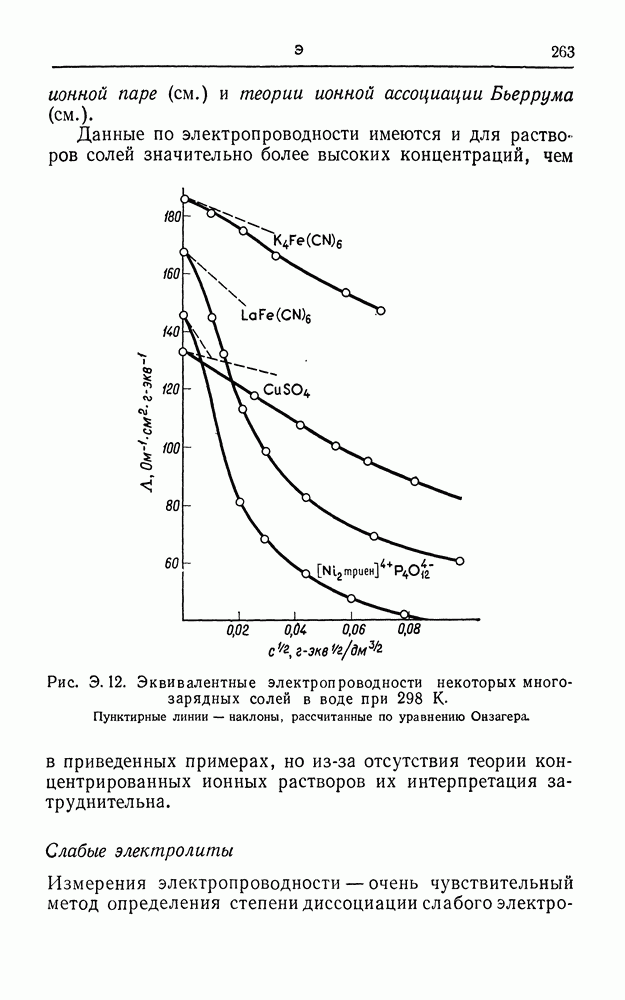
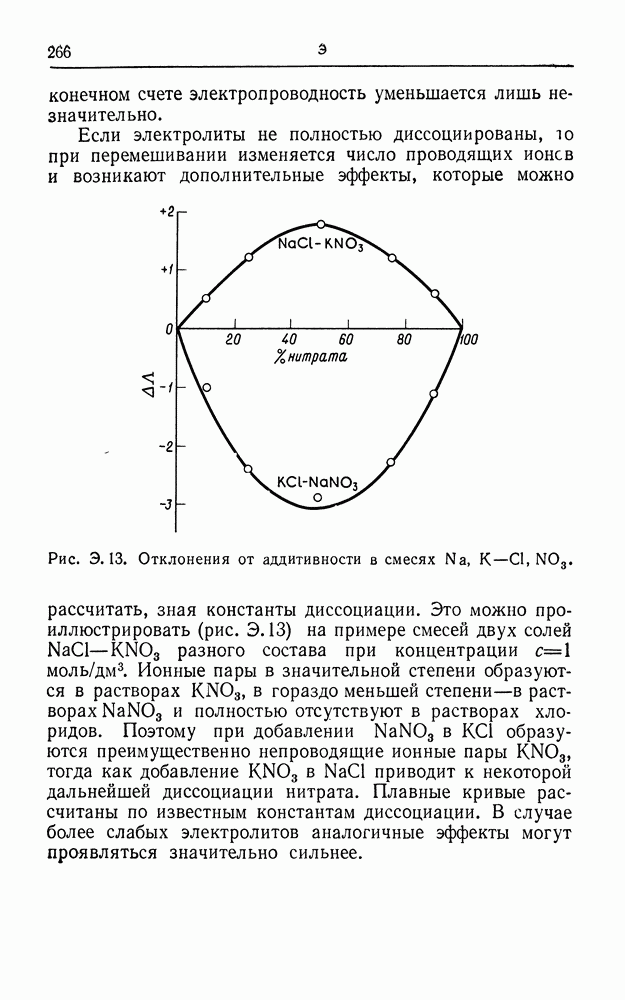
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
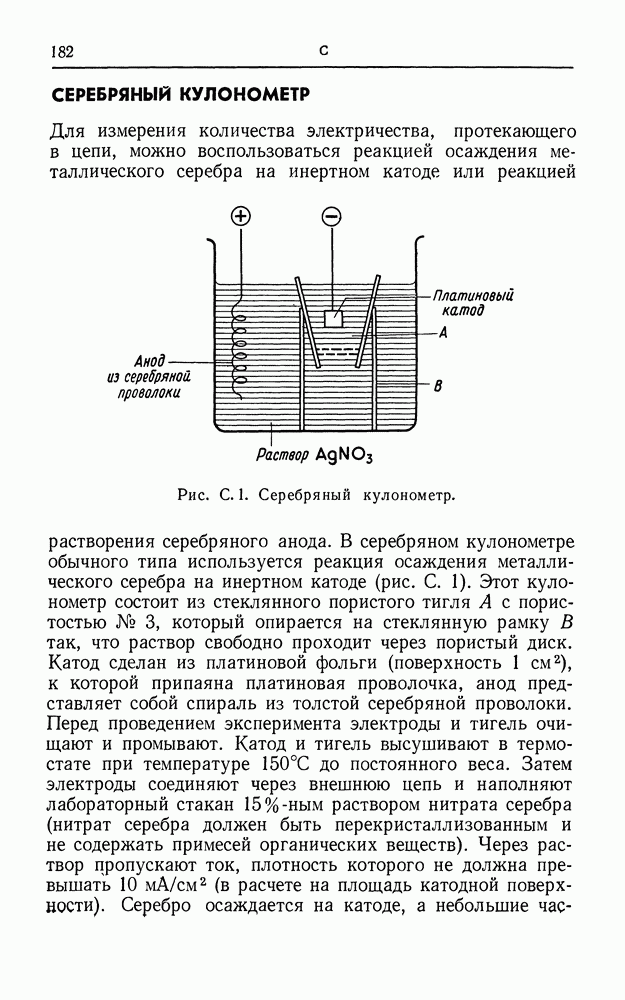
КУЛОНОМЕТР
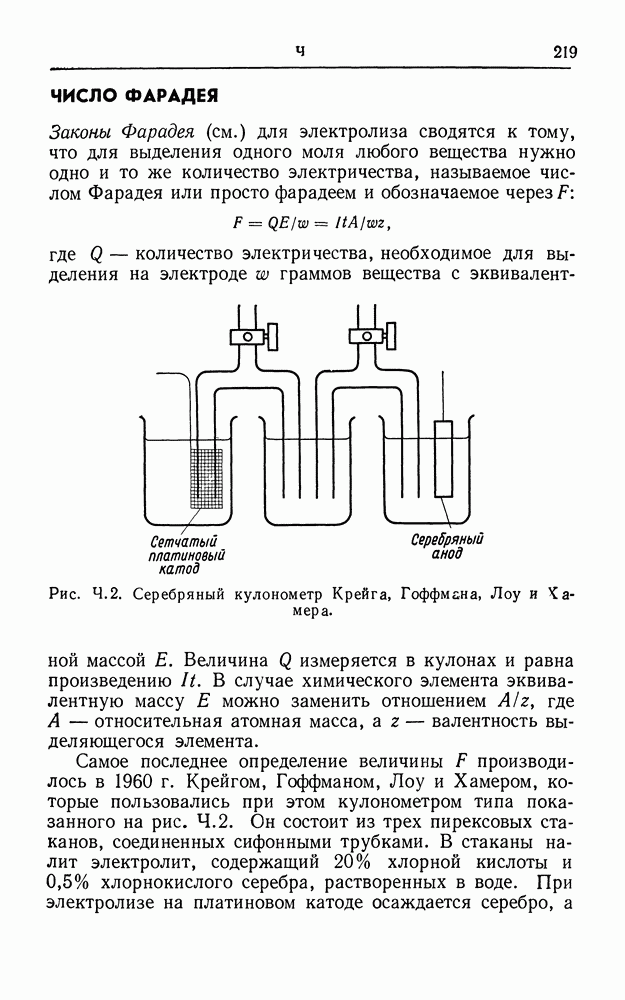
Количество электричества, прошедшее через электролитическую ячейку, можно определить, построив кривую зависимости тока от времени: оно равно площади под кривой. Для этого пользуются градуированным гальванометром с малой постоянной времени или химическим кулонометром. Последний представляет собой электролитическую ячейку, соединенную последовательно с экспериментальной ячейкой, так что через обе ячейки проходит одинаковое количество электричества. На катоде или аноде (или на обоих электродах) кулонометра химическая реакция должна протекать со  -ным выходом по току и должна быть такой, чтобы ее можно было легко и точно рассчитать. Осаждение серебра на катоде серебряного кулонометра (см.), анодное растворение серебра (см. число Фарадея) и реакция
-ным выходом по току и должна быть такой, чтобы ее можно было легко и точно рассчитать. Осаждение серебра на катоде серебряного кулонометра (см.), анодное растворение серебра (см. число Фарадея) и реакция  в йодном кулонометре (см.) — все они удовлетворяют этим требованиям. Широко распространен также такой удобный прибор, как медный кулонометр (см.).
в йодном кулонометре (см.) — все они удовлетворяют этим требованиям. Широко распространен также такой удобный прибор, как медный кулонометр (см.).
При малых количествах электричества более чувствителен колориметрический метод. Он применяется, в частности, при измерении количества иода, образующегося в йодном кулонометре, и количества серебра, получающегося при анодном растворении (серебро определяется в виде дитизоната серебра). Можно также использовать объемный анализ. Например, при электролизе воды в катодном отделении происходит реакция  и образующуюся щелочь можно оттитровать стандартной кислотой:
и образующуюся щелочь можно оттитровать стандартной кислотой:  кислоты с концентрацией
кислоты с концентрацией  эквивалентен 0,9649 Кл. Наконец, реакцию разложения воды можно применять в газометрии. В ячейках, в которых катодные и анодные отделения можно соединить, для протекания реакции
эквивалентен 0,9649 Кл. Наконец, реакцию разложения воды можно применять в газометрии. В ячейках, в которых катодные и анодные отделения можно соединить, для протекания реакции  потребуется 4 фарадея электричества. При этом по общему объему выделившегося
потребуется 4 фарадея электричества. При этом по общему объему выделившегося
(из насыщенного раствора) газа удается точно рассчитать количество электричества до 10 Кл (при нормальных условиях  ).
).
| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- ПРЕДИСЛОВИЕ
- О ПОЛЬЗОВАНИИ СЛОВАРЕМ
- СПИСОК ОСНОВНЫХ ОБОЗНАЧЕНИЙ
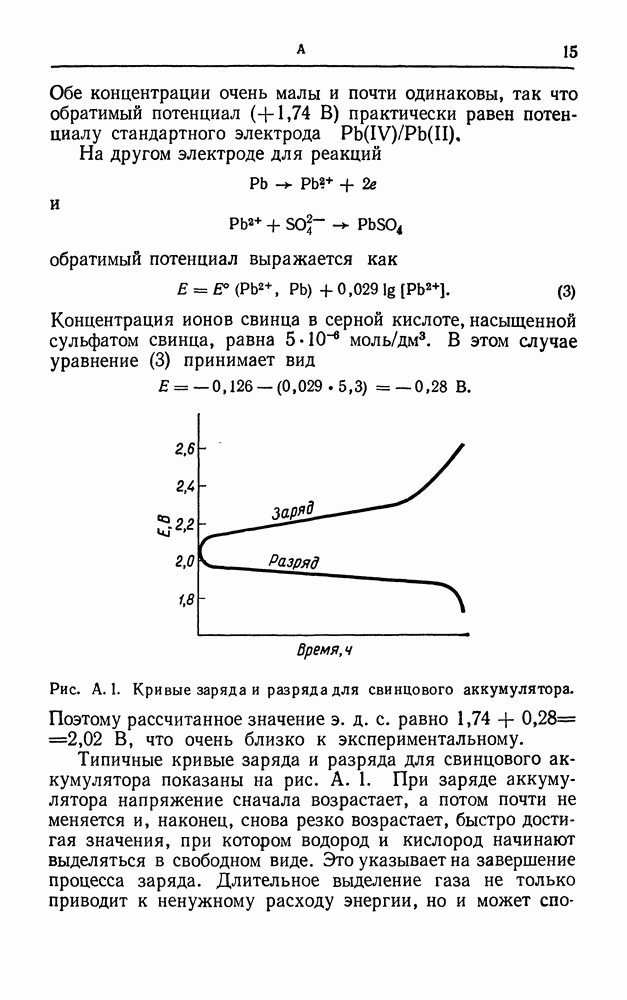
- АККУМУЛЯТОР
- АКТИВАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
- АКТИВНОСТЬ
- АЛЮМИНИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- АМАЛЬГАМНЫЙ ЭЛЕКТРОД
- АМПЕР
- АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- АМПЕРОСТАТ
- АНИОН
- АНОД
- АНОДИРОВАНИЕ
- БАТАРЕЯ
- БЕРИЛЛИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- БИПОЛЯРНЫЙ ЭЛЕКТРОД
- БЛЕСКООБРАЗОВАТЕЛИ
- БУФЕРНЫЙ РАСТВОР
- ВАГНЕРОВСКОЕ ЗАЗЕМЛЕНИЕ
- ВНУТРЕННИЙ ЭЛЕКТРОЛИЗ
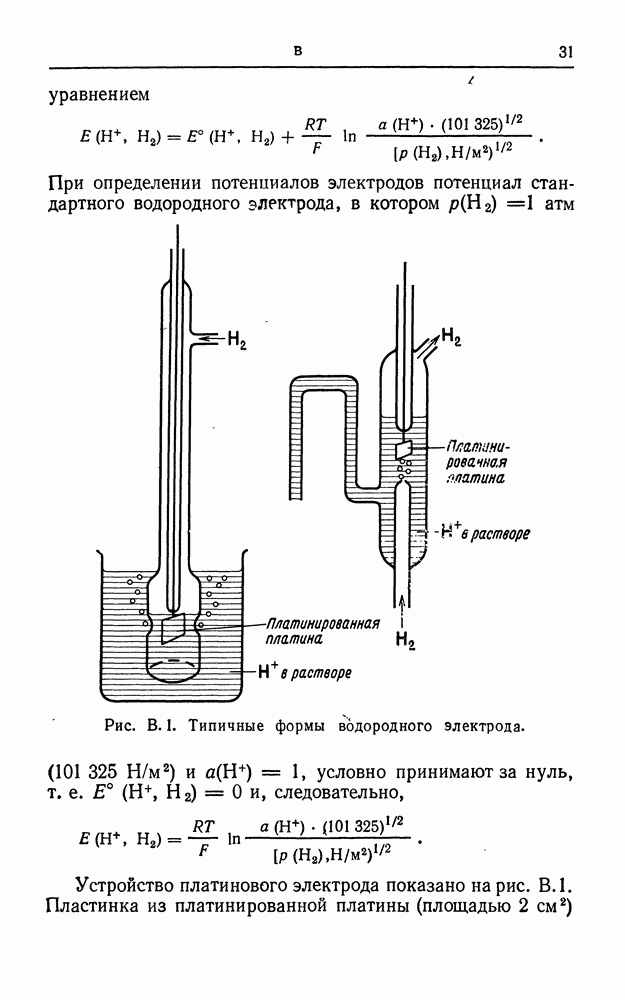
- ВОДОРОДНЫЙ ЭЛЕКТРОД
- ВОЛЬТ
- ВОЛЬФРАМОВЫЙ ЭЛЕКТРОД
- ВЫХОД ПО ТОКУ
- ГАЗОВЫЙ ЭЛЕКТРОД
- ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- ГАЛЬВАНОПЛАСТИКА
- ГАЛЬВАНОСТАТ
- ГАЛЬВАНОСТЕГИЯ
- ГИДРАТАЦИЯ ИОНОВ
- ДАТЧИК АММИАКА
- ДАТЧИК СЕРНИСТОГО ГАЗА
- ДВОЙНОЙ СЛОЙ
- ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
- ДЗЕТА-ПОТЕНЦИАЛ
- ДИФФУЗИОННЫЙ ПОТЕНЦИАЛ
- ДИФФУЗИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- ДИЭЛЕКТРИЧЕСКАЯ ПОСТОЯННАЯ
- ДИЭЛЕКТРИЧЕСКАЯ ПРОНИЦАЕМОСТЬ
- ЗАКОН КОЛЬРАУША
- ЗАКОН РАЗВЕДЕНИЯ ОСТВАЛЬДА
- ЗАКОНЫ ФАРАДЕЯ
- ИНДИКАТОР
- ИНДИКАТОРНЫЙ ЭЛЕКТРОД
- ИНДИФФЕРЕНТНЫЙ (ФОНОВЫЙ) ЭЛЕКТРОЛИТ
- ИОДНЫЙ КУЛОНОМЕТР
- ИОННАЯ АТМОСФЕРА
- ИОННЫЕ ПАРЫ
- ИОННЫЕ РАСПЛАВЫ
- ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ
- КАДМИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД
- КАЛЬЦИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- КАПИЛЛЯР ЛУГГИНА
- КАТИОН
- КАТИОНОСЕЛЕКТИВНЫЙ ЭЛЕКТРОД
- КАТОД
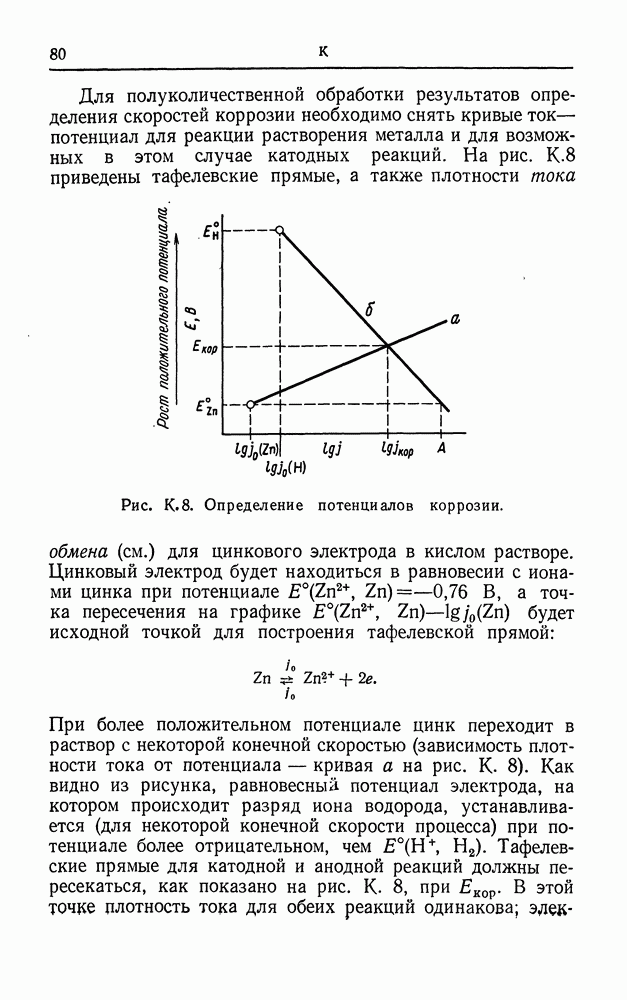
- КАТОДНАЯ ЗАЩИТА
- КИСЛОРОДНОЕ ПЕРЕНАПРЯЖЕНИЕ
- КИСЛОРОДНЫЙ ЭЛЕКТРОД (КИСЛОРОДНЫЙ ЗОНД)
- КОМПЛЕКСНЫЕ ИОНЫ
- КОНВЕНЦИЯ О ЗНАКАХ
- КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- КОНСТАНТА ДИССОЦИАЦИИ
- КОНТАКТНАЯ РАЗНОСТЬ ПОТЕНЦИАЛОВ
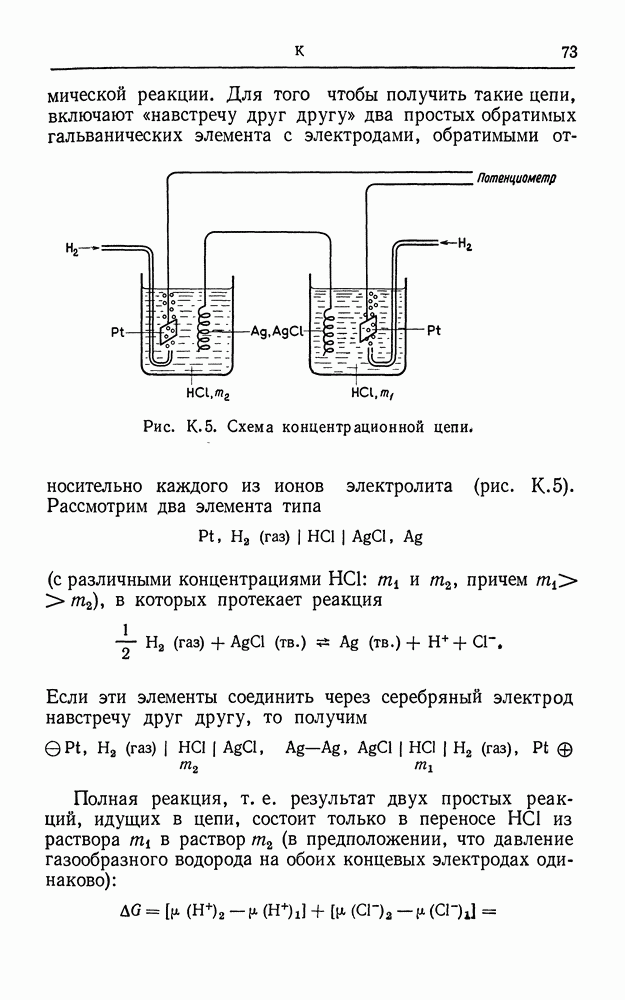
- КОНЦЕНТРАЦИОННАЯ ЦЕПЬ
- КОНЦЕНТРАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
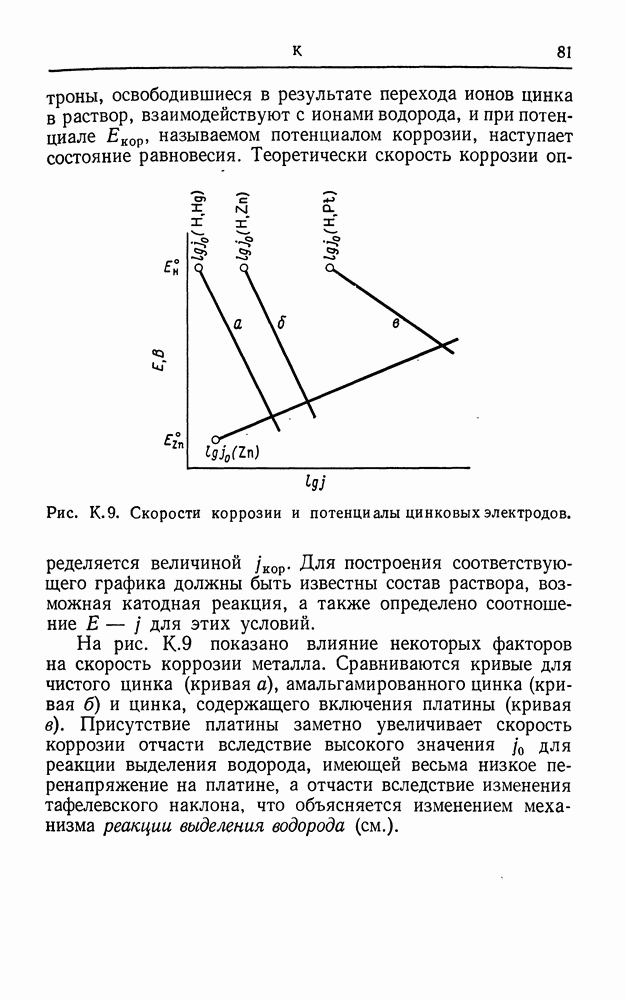
- КОРРОЗИЯ
- КОЭФФИЦИЕНТ АКТИВНОСТИ
- КУЛОН
- КУЛОНОМЕТР
- КУЛОНОМЕТРИЯ
- ЛИТИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- МАГНИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- МЕДНООКИСНЫЙ ЭЛЕМЕНТ
- МЕДНЫЙ КУЛОНОМЕТР
- МЕДЬ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- МЕМБРАННЫЙ ЭЛЕКТРОД
- МЕТАЛЛИЧЕСКИЙ ЭЛЕКТРОД
- МЕТАЛЛООКИСНЫЙ ЭЛЕКТРОД
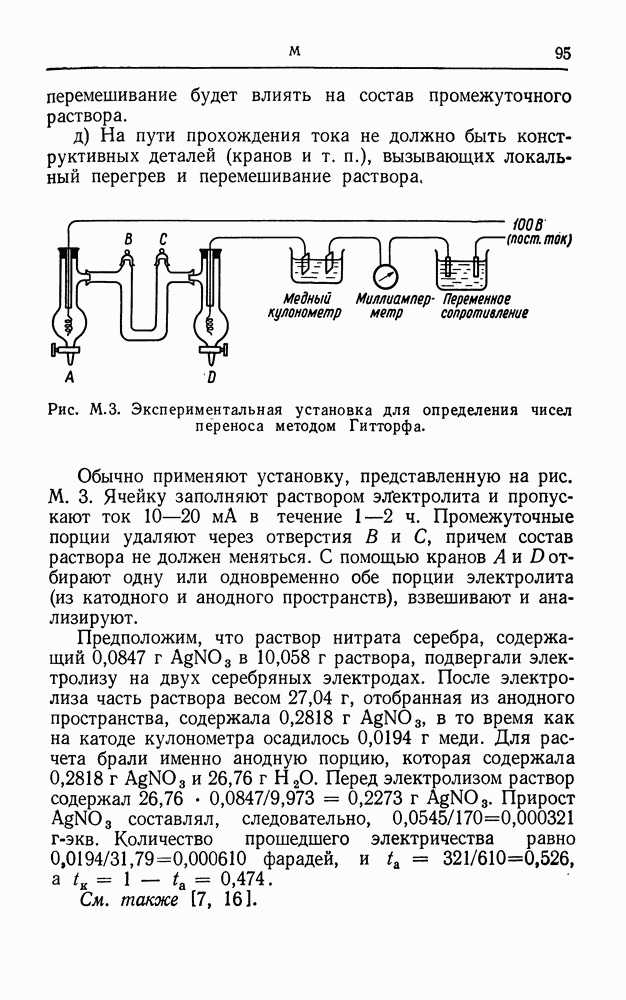
- МЕТОД ГИТТОРФА
- МЕТОД ДВИЖУЩЕЙСЯ ГРАНИЦЫ
- МЕХАНИЗМЫ ЭЛЕКТРОДНЫХ РЕАКЦИЙ
- МИНИМУМЫ ЭЛЕКТРОПРОВОДНОСТИ
- МОЛЬНАЯ ИОННАЯ ЭЛЕКТРОПРОВОДНОСТЬ
- МОСТ УИТСТОНА
- НАПРЯЖЕНИЕ РАЗЛОЖЕНИЯ
- НЕВОДНЫЕ РАСТВОРЫ
- НИКЕЛЬ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
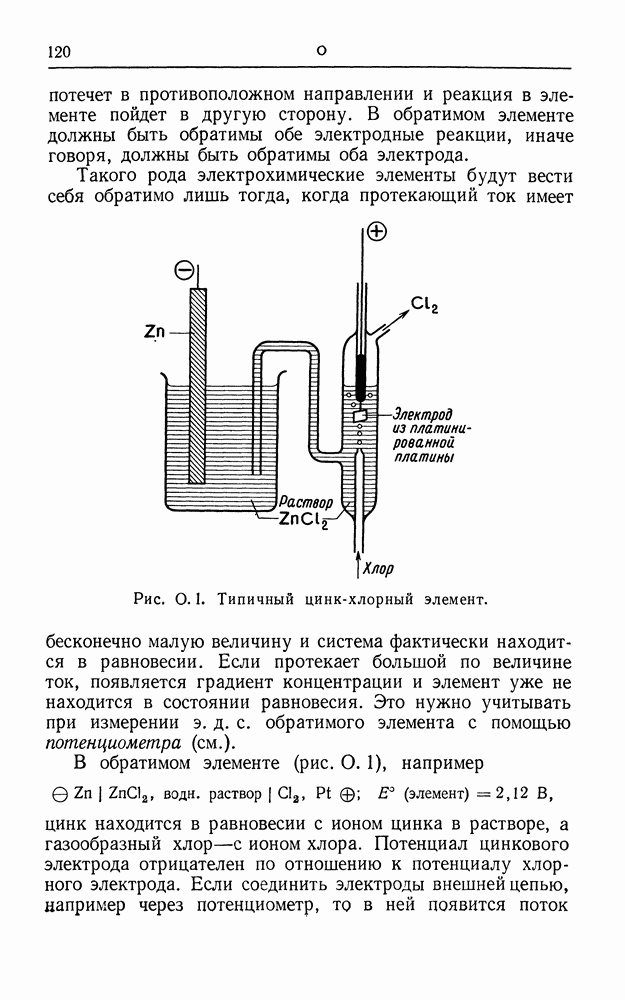
- ОБРАТИМЫЙ ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
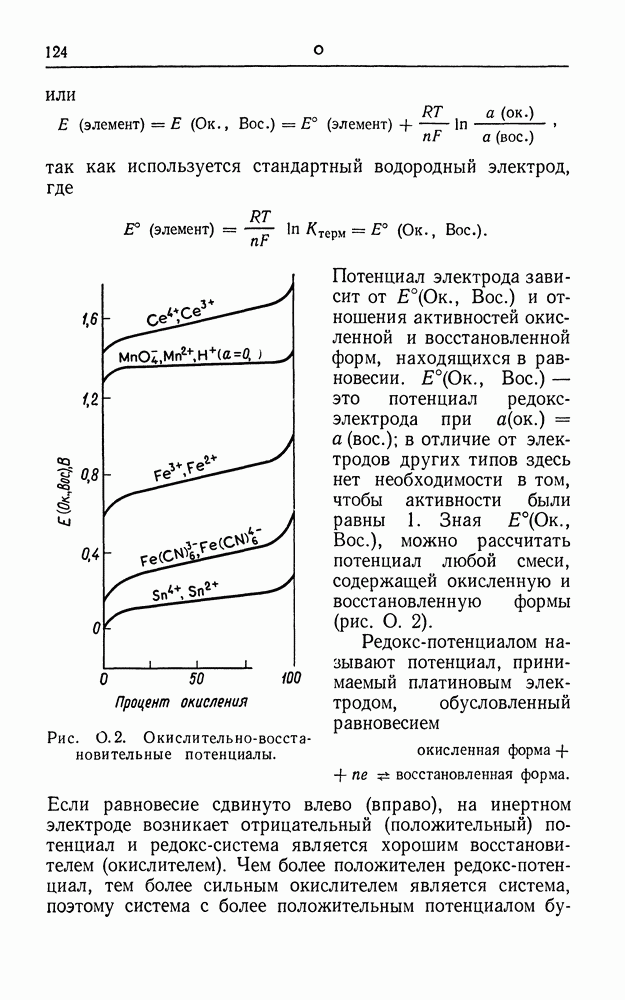
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ (РЕДОКС) ЭЛЕКТРОДНАЯ СИСТЕМА
- ОМ
- ОПРЕСНЕНИЕ ВОДЫ
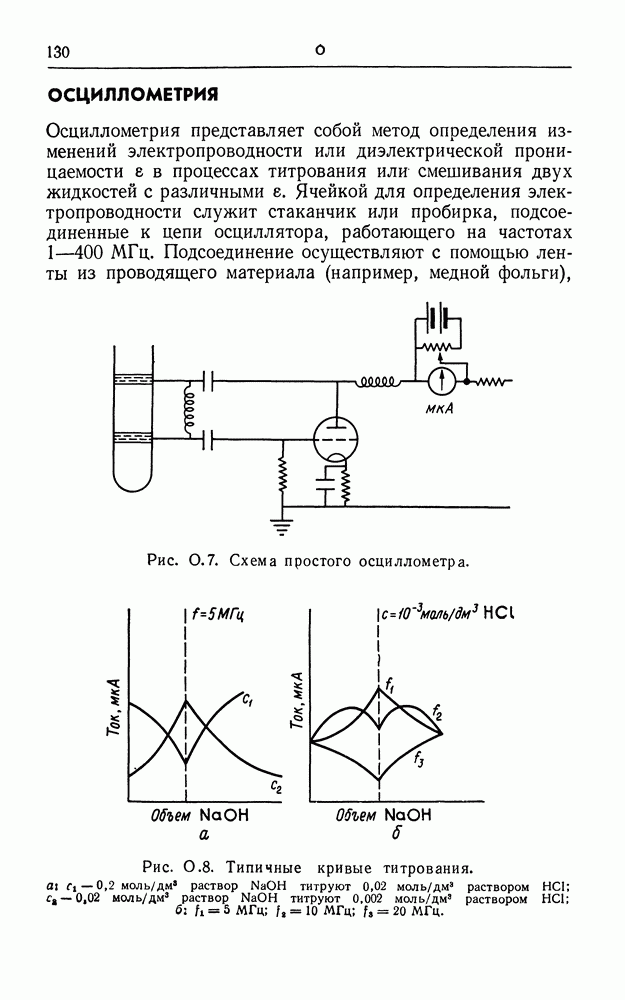
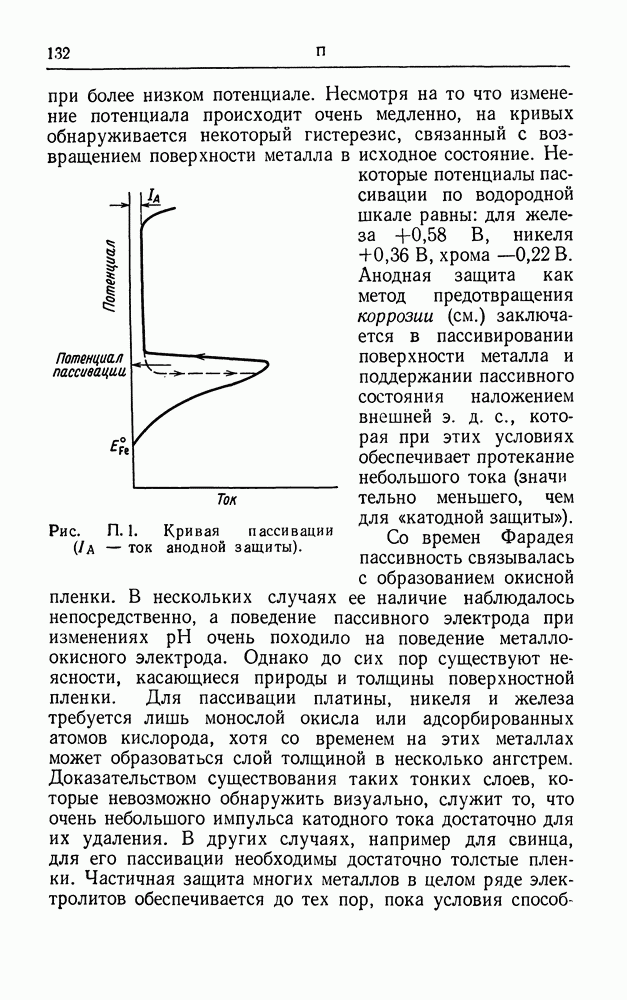
- ОСЦИЛЛОМЕТРИЯ
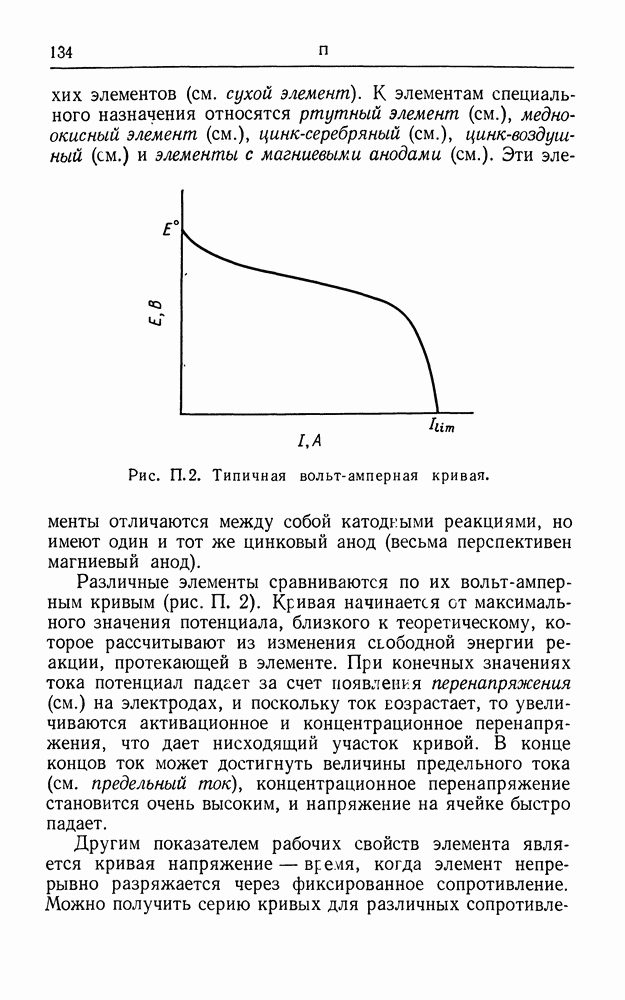
- ПАССИВНОСТЬ
- ПЕРВИЧНЫЙ ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- ПЕРЕНАПРЯЖЕНИЕ
- ПЕРЕНАПРЯЖЕНИЕ ВОДОРОДА
- ПЕРЕХОДНОЕ ВРЕМЯ
- ПЕРСОЛИ
- ПЛАТИНОВЫЕ И ЗОЛОТЫЕ ЭЛЕКТРОДЫ
- рН-МЕТР
- ПОДВИЖНОСТЬ
- ПОДВИЖНОСТЬ ИОНОВ
- ПОЛУЭЛЕМЕНТ
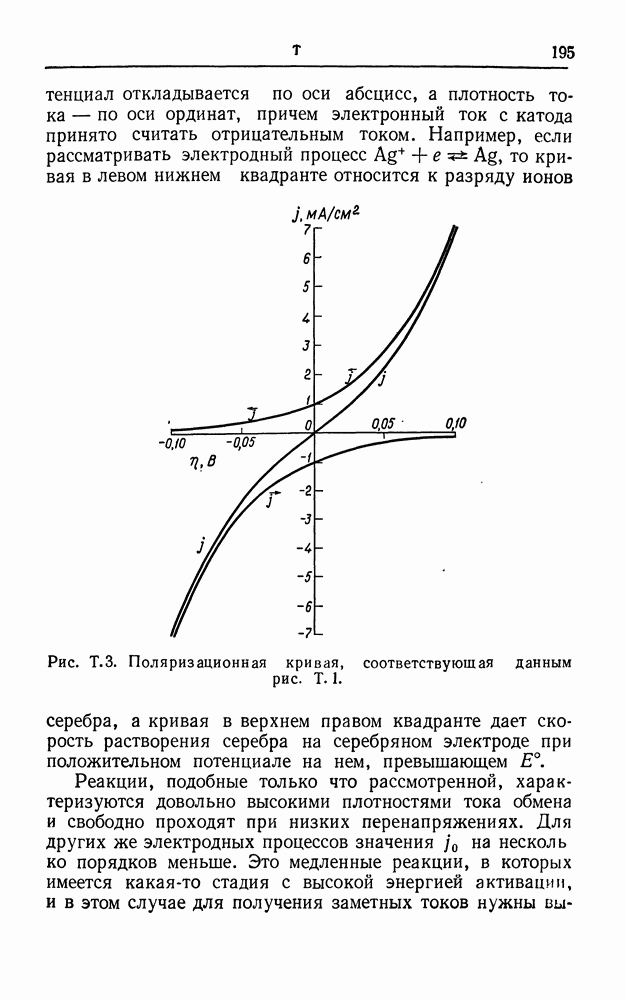
- ПОЛЯРИЗАЦИОННЫЕ КРИВЫЕ
- ПОЛЯРИЗАЦИЯ
- ПОЛЯРИЗУЕМЫЕ ЭЛЕКТРОДЫ
- ПОЛЯРОГРАФИЯ
- ПОПРАВКА НА ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРИТЕЛЯ
- ПОСТОЯННАЯ ЯЧЕЙКИ
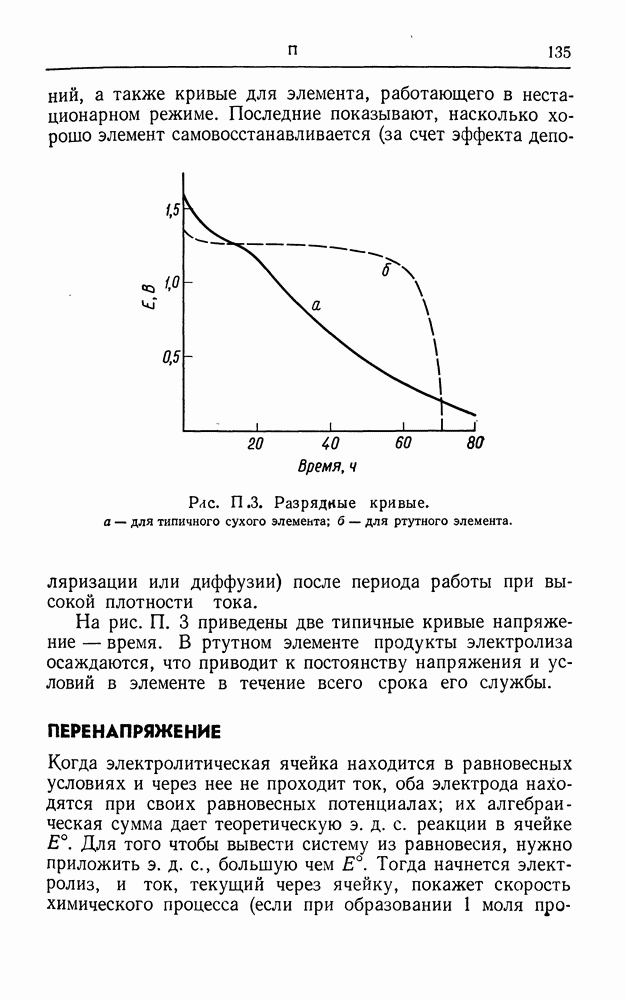
- ПОТЕНЦИАЛ, ОБРАТИМЫЕ ЭЛЕКТРОДЫ
- ПОТЕНЦИАЛ ПОЛУВОЛНЫ
- ПОТЕНЦИАЛ СЕДИМЕНТАЦИИ
- ПОТЕНЦИАЛ ТЕЧЕНИЯ
- ПОТЕНЦИОМЕТР
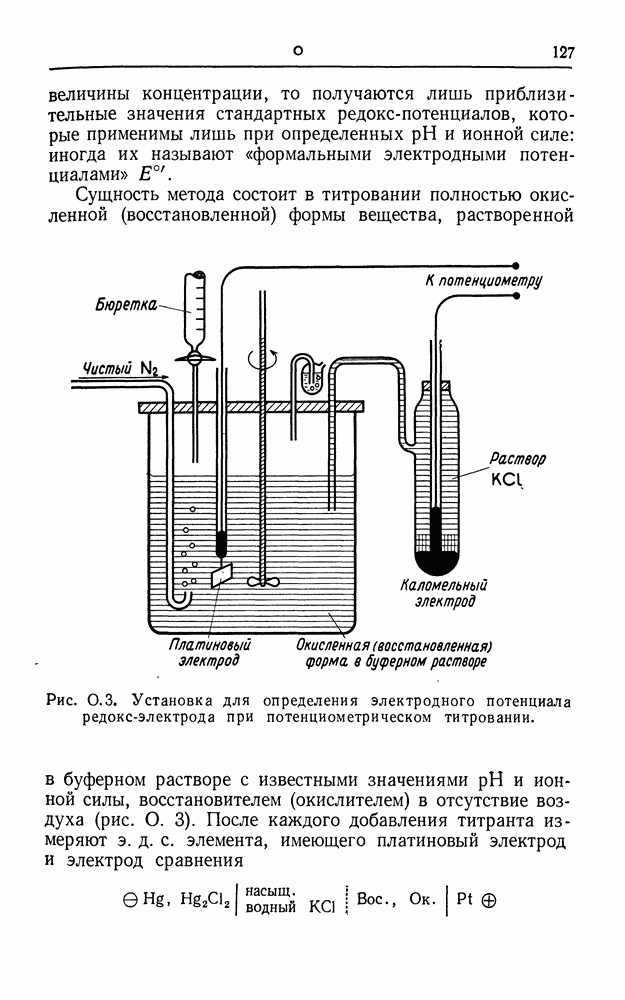
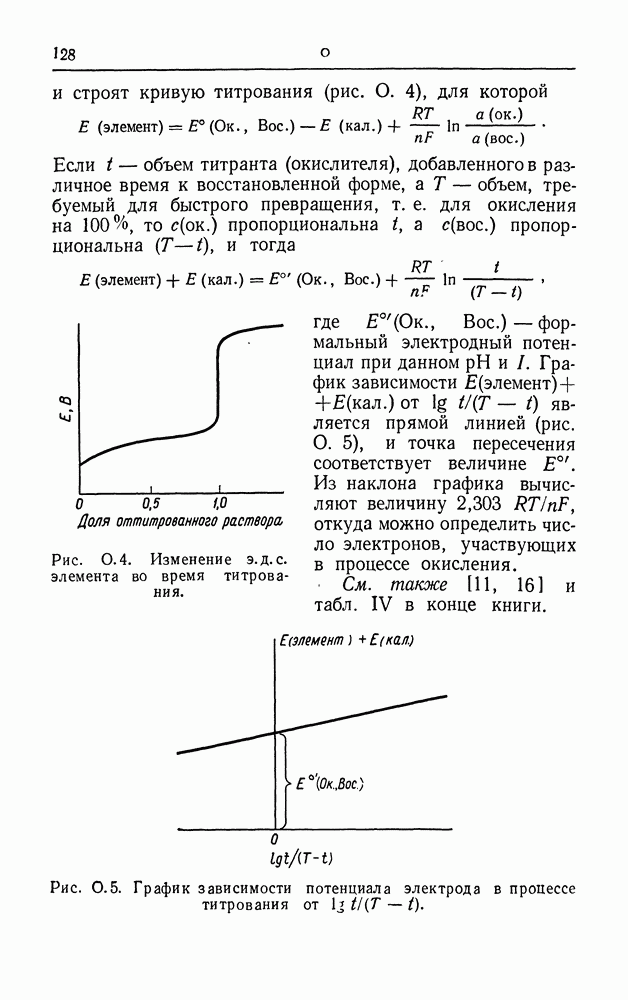
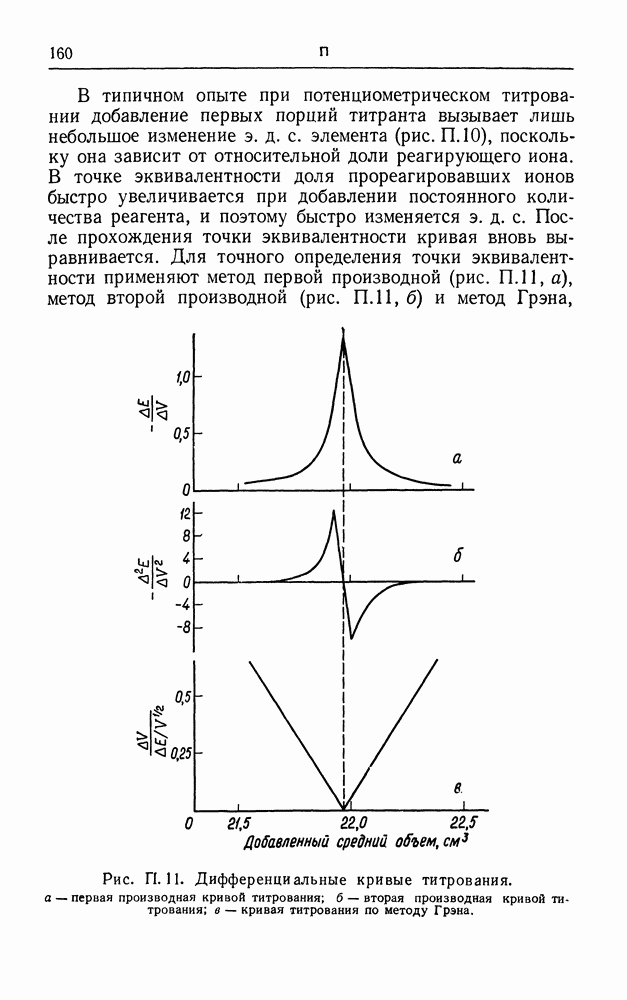
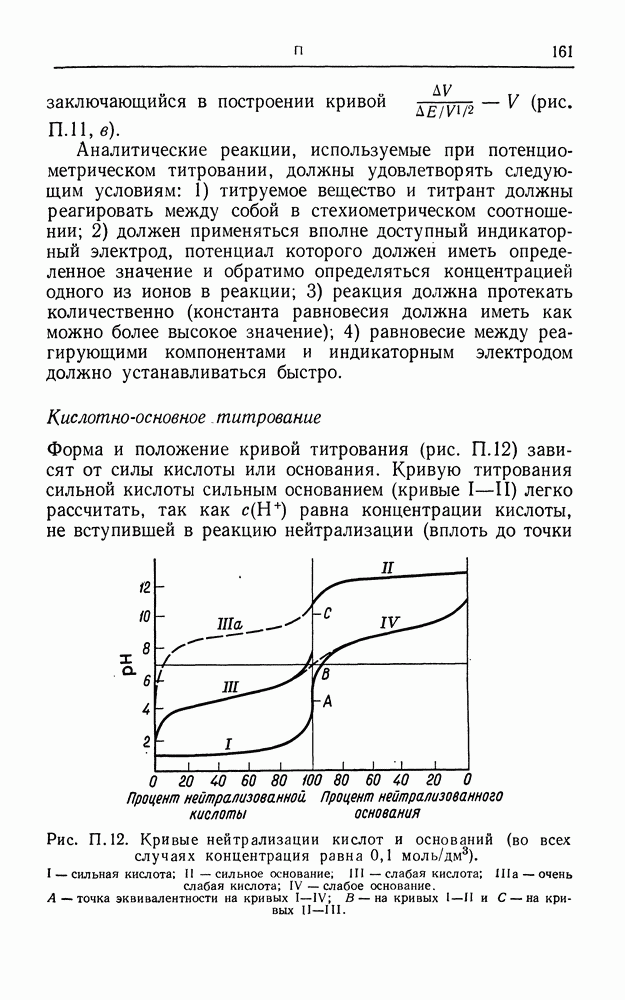
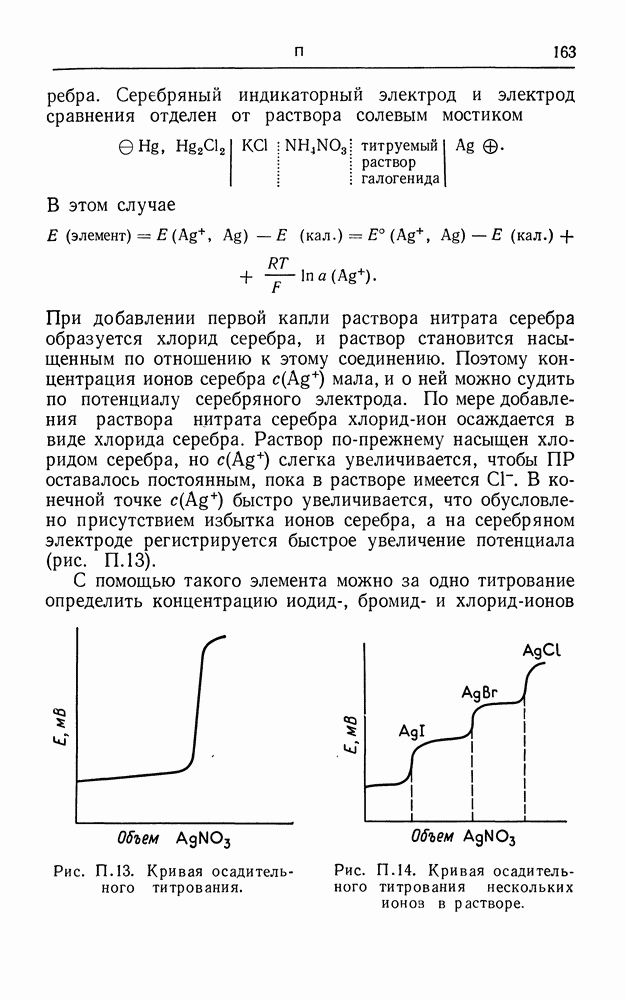
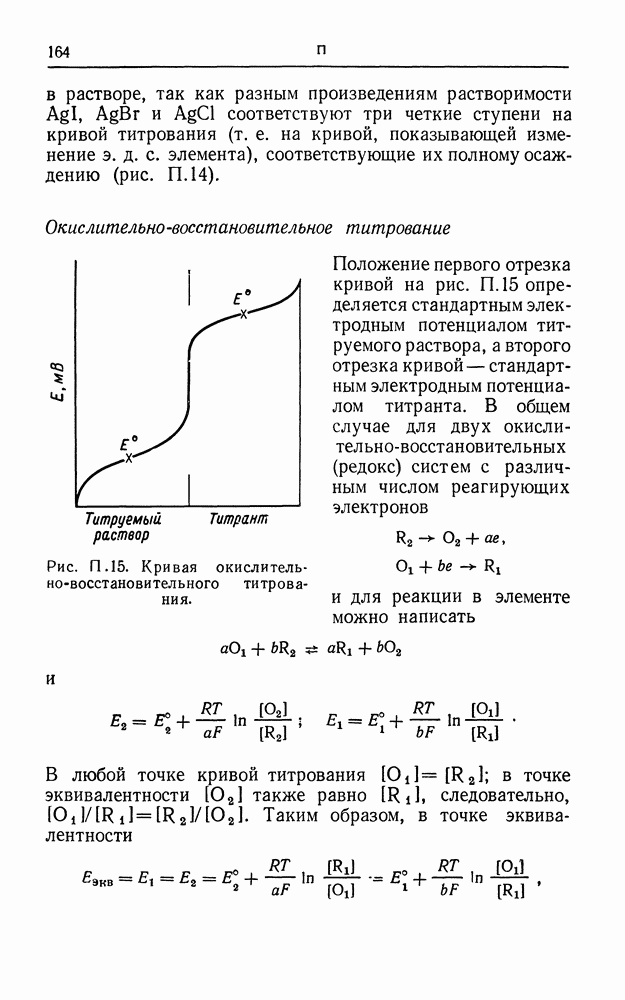
- ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- ПОТЕНЦИОСТАТ
- ПРАВИЛО ВАЛЬДЕНА
- ПРЕДЕЛЬНЫЙ ТОК
- ПРОТЕКТОРНАЯ ЗАЩИТА
- РАСПЛАВЫ СОЛЕЙ
- РЕАКЦИЯ ВЫДЕЛЕНИЯ ВОДОРОДА
- РТУТНЫЙ ЭЛЕМЕНТ
- РЯД ПОТЕНЦИАЛОВ
- СВИНЦОВЫЙ АККУМУЛЯТОР
- СЕРЕБРЯНЫЙ КУЛОНОМЕТР
- СЕРЕБРЯНЫЙ ЭЛЕКТРОД
- СЛОЙ ГЕЛЬМГОЛЬЦА
- СЛОЙ ГУИ
- СОЛЕВОЙ МОСТИК
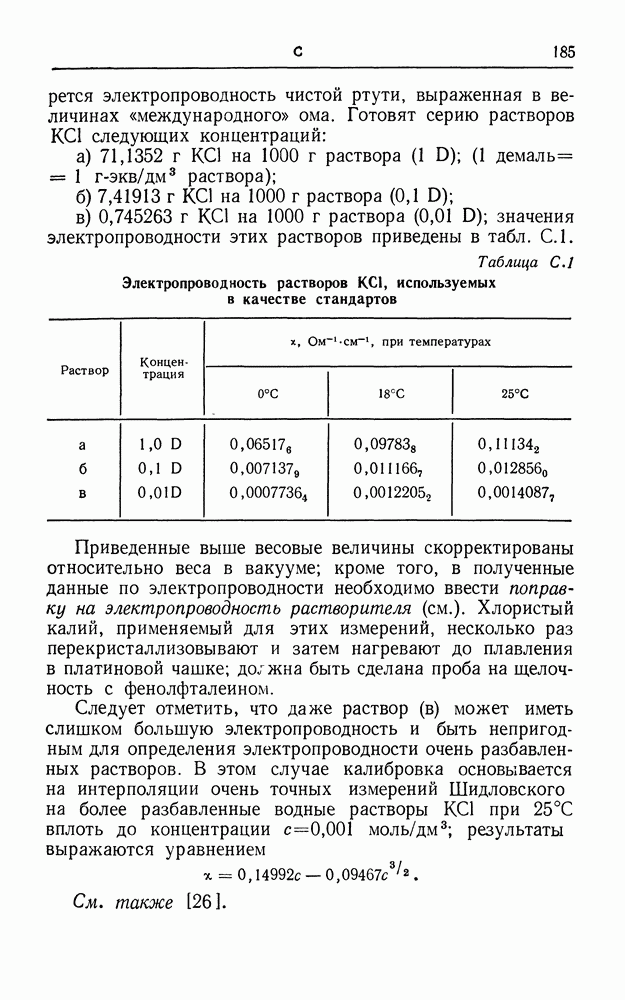
- СТАНДАРТНЫЕ РАСТВОРЫ ДЛЯ ЭЛЕКТРОПРОВОДНОСТИ
- СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
- СТАНДАРТНЫЙ ЭЛЕМЕНТ
- СТЕКЛЯННЫЙ ЭЛЕКТРОД
- СУРЬМЯНЫЙ ЭЛЕКТРОД
- СУХОЙ ЭЛЕМЕНТ
- ТЕОРИЯ ИОННОЙ АССОЦИАЦИИ БЬЕРРУМА
- ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ АРРЕНИУСА
- ТЕРМОДИНАМИКА ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
- ТОК ОБМЕНА
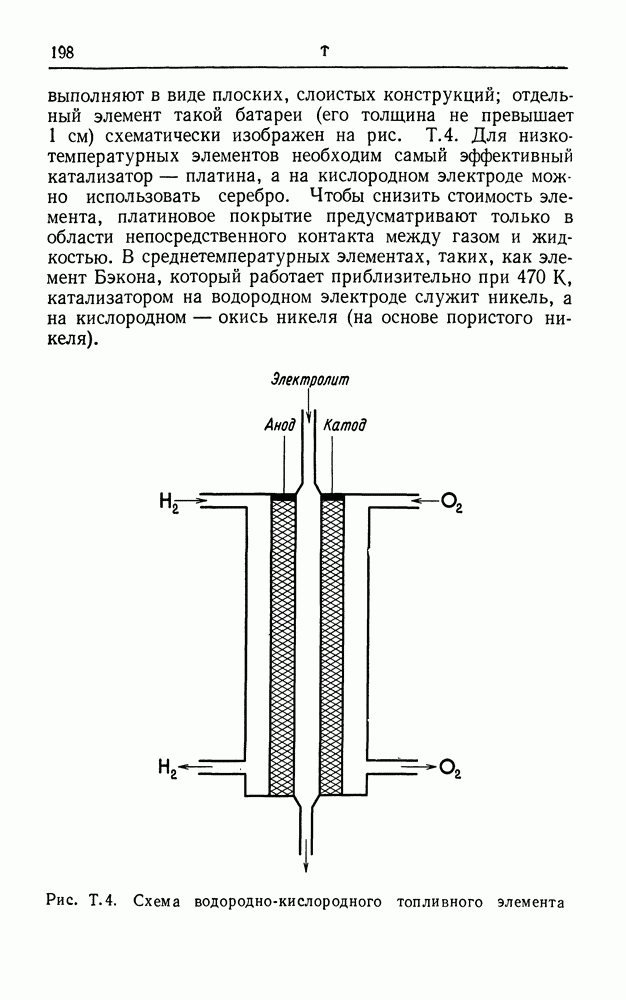
- ТОПЛИВНЫЙ ЭЛЕМЕНТ
- УРАВНЕНИЕ БРЕНСТЕДА—БЬЕРРУМА
- УРАВНЕНИЕ ДЕБАЯ — ХЮККЕЛЯ
- УРАВНЕНИЕ ИЛЬКОВИЧА
- УРАВНЕНИЕ НЕРНСТА
- УРАВНЕНИЕ ОНЗАГЕРА
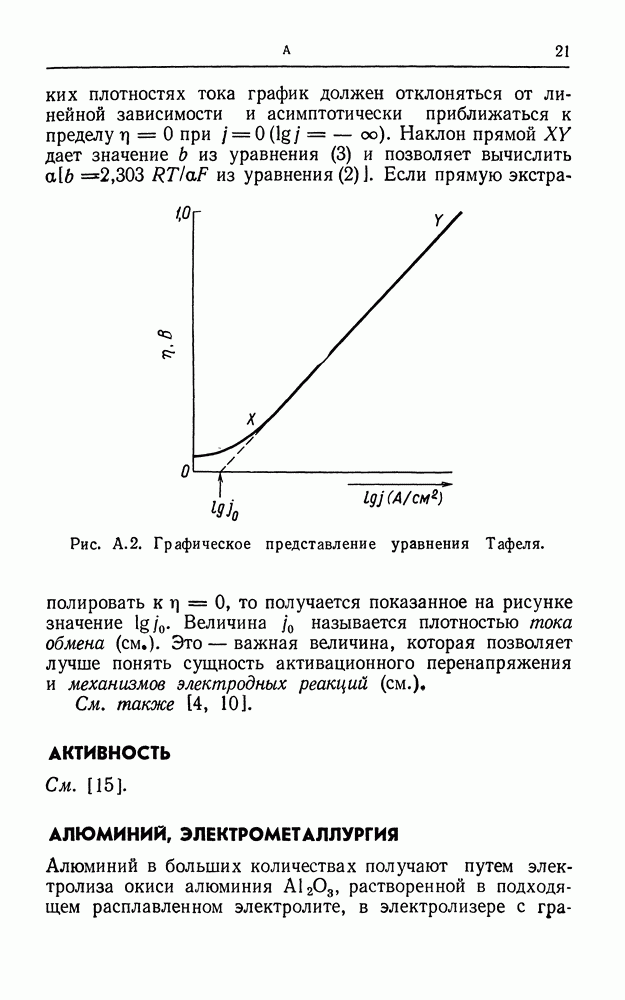
- УРАВНЕНИЕ ТАФЕЛЯ
- УРАВНЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ ПИТТСА
- УРАВНЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ ФУОССА
- УРАВНЕНИЯ ЭЛЕКТРОПРОВОДНОСТИ
- ХЕМОТРОНЫ
- ХИНГИДРОННЫЙ ЭЛЕКТРОД
- ХЛОРНЫЙ ЭЛЕКТРОД
- ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД
- ХРОНОАМПЕРОМЕТРИЯ
- ХРОНОПОТЕНЦИОМЕТРИЯ
- ЦИНК-ВОЗДУШНЫЙ ЭЛЕМЕНТ
- ЦИНК-СЕРЕБРЯНЫЙ ЭЛЕМЕНТ
- ЦИНК, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- ЦИФРОВОЙ ВОЛЬТМЕТР
- ЧАСТОТНАЯ ЗАВИСИМОСТЬ ЭЛЕКТРОПРОВОДНОСТИ
- ЧИСЛА ПЕРЕНОСА
- ЧИСЛО ФАРАДЕЯ
- ЩЕЛОЧНЫЕ АККУМУЛЯТОРЫ
- ЭЛЕКТРИЧЕСКАЯ ЕМКОСТЬ
- ЭЛЕКТРИЧЕСКИЕ ЕДИНИЦЫ ИЗМЕРЕНИЯ
- ЭЛЕКТРОВЕСОВОЙ АНАЛИЗ
- ЭЛЕКТРОД
- ЭЛЕКТРОДВИЖУЩАЯ СИЛА (Э.Д.С.)
- ЭЛЕКТРОДИАЛИЗ
- ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
- ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ
- ЭЛЕКТРОЛИЗ ВОДЫ
- ЭЛЕКТРОЛИЗЕР
- ЭЛЕКТРОЛИЗ РАСТВОРА ПОВАРЕННОЙ СОЛИ
- ЭЛЕКТРОЛИТИЧЕСКАЯ ОЧИСТКА (РАФИНИРОВАНИЕ)
- ЭЛЕКТРОЛИТИЧЕСКОЕ ВОССТАНОВЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ЭЛЕКТРОЛИТИЧЕСКОЕ ОКИСЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛИРОВАНИЕ
- ЭЛЕКТРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- ЭЛЕКТРООСАЖДЕНИЕ МЕТАЛЛОВ
- ЭЛЕКТРООСАЖДЕНИЕ СПЛАВОВ
- ЭЛЕКТРООСМОС
- ЭЛЕКТРОПРОВОДНОСТЬ
- ЭЛЕКТРОПРОВОДНОСТЬ ВОДНЫХ РАСТВОРОВ
- ЭЛЕКТРОПРОВОДНОСТЬ НА ВЫСОКИХ ЧАСТОТАХ
- ЭЛЕКТРОПРОВОДНОСТЬ НЕВОДНЫХ РАСТВОРОВ
- ЭЛЕКТРОПРОВОДНОСТЬ ПРИ БЕСКОНЕЧНОМ РАЗБАВЛЕНИИ
- ЭЛЕКТРОПРОВОДНОСТЬ ПРИ ВЫСОКИХ НАПРЯЖЕННОСТЯХ ПОЛЯ
- ЭЛЕКТРОПРОВОДНОСТЬ РАСПЛАВОВ СОЛЕЙ
- ЭЛЕКТРОФОРЕЗ
- ЭЛЕКТРОХИМИЧЕСКАЯ РАЗМЕРНАЯ ОБРАБОТКА МЕТАЛЛОВ
- ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ ИНФОРМАЦИИ
- ЭЛЕКТРОХИМИЧЕСКИЙ ЭКВИВАЛЕНТ
- ЭЛЕМЕНТ ВЕСТОНА
- ЭЛЕМЕНТ ДАНИЭЛЯ
- ЭЛЕМЕНТ КЛАРКА
- ЭЛЕМЕНТЫ С МАГНИЕВЫМИ АНОДАМИ
- ЭФФЕКТ ВИНА
- ЭФФЕКТ ДОРНА
- ЭФФЕКТ ФАЛЬКЕНГАГЕНА
- СПИСОК ЛИТЕРАТУРЫ