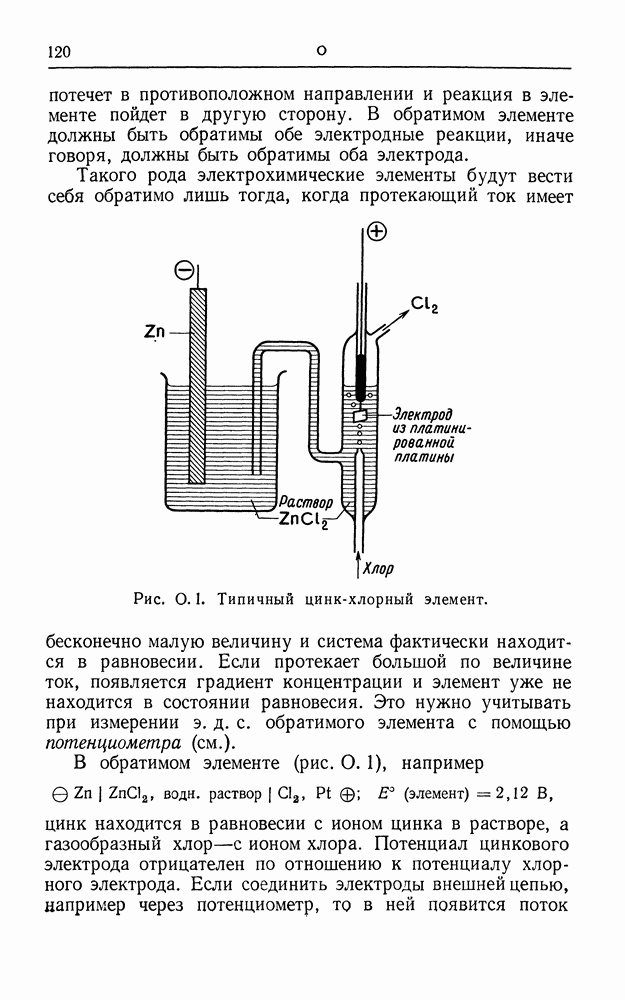
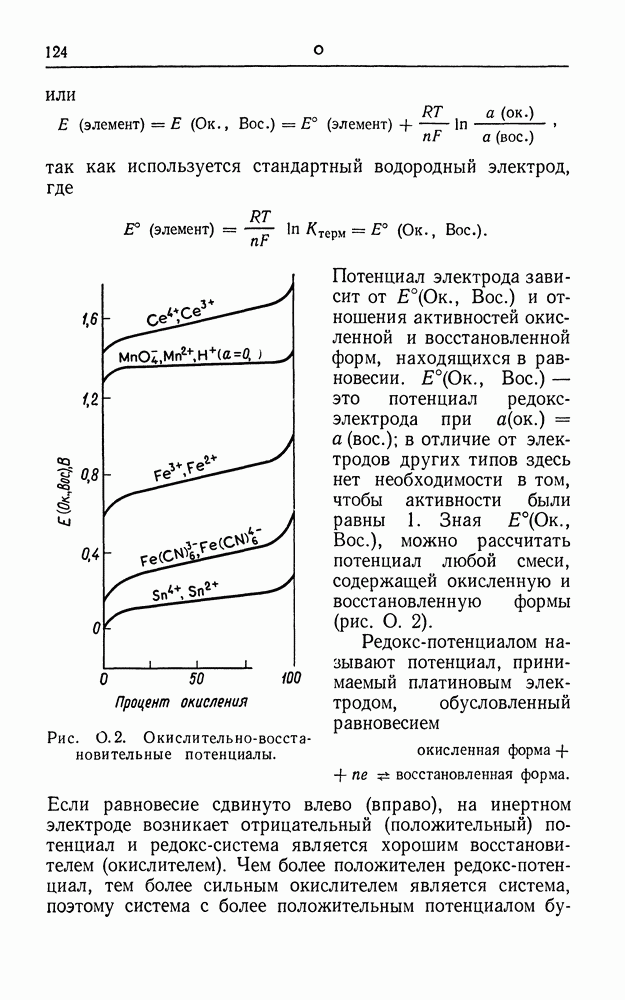
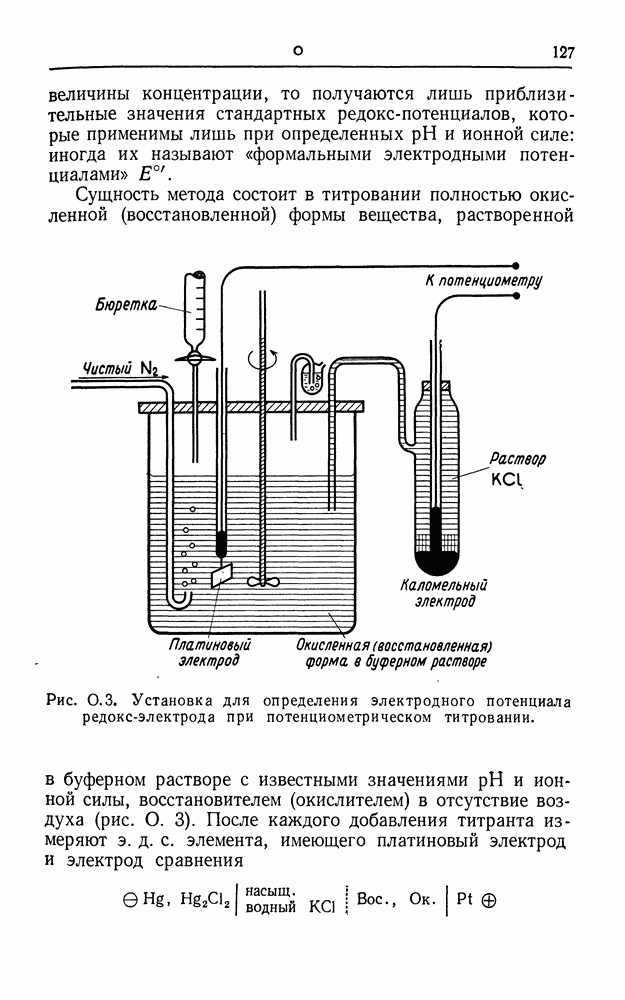
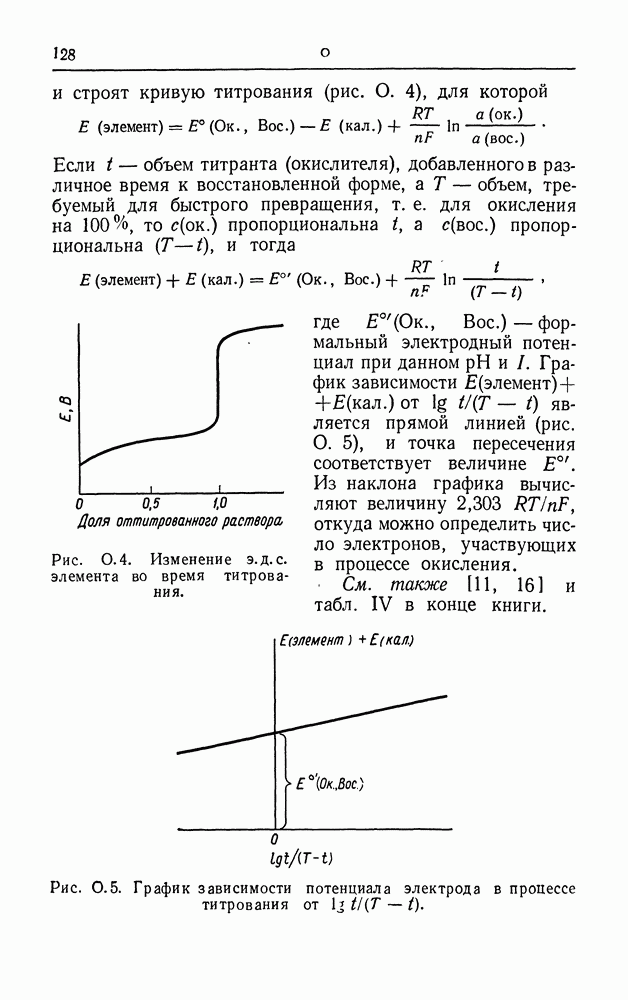
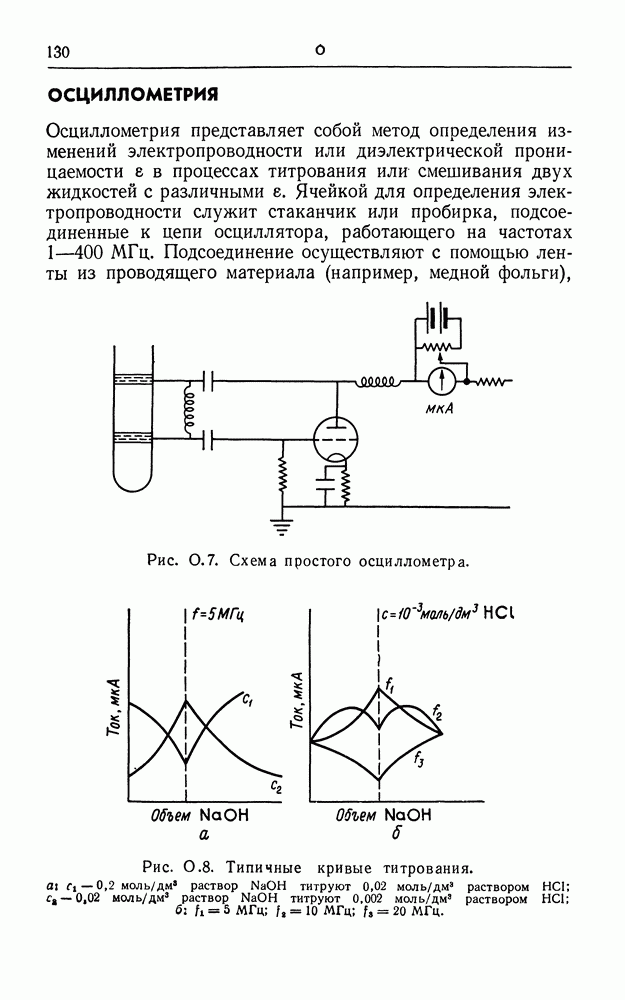
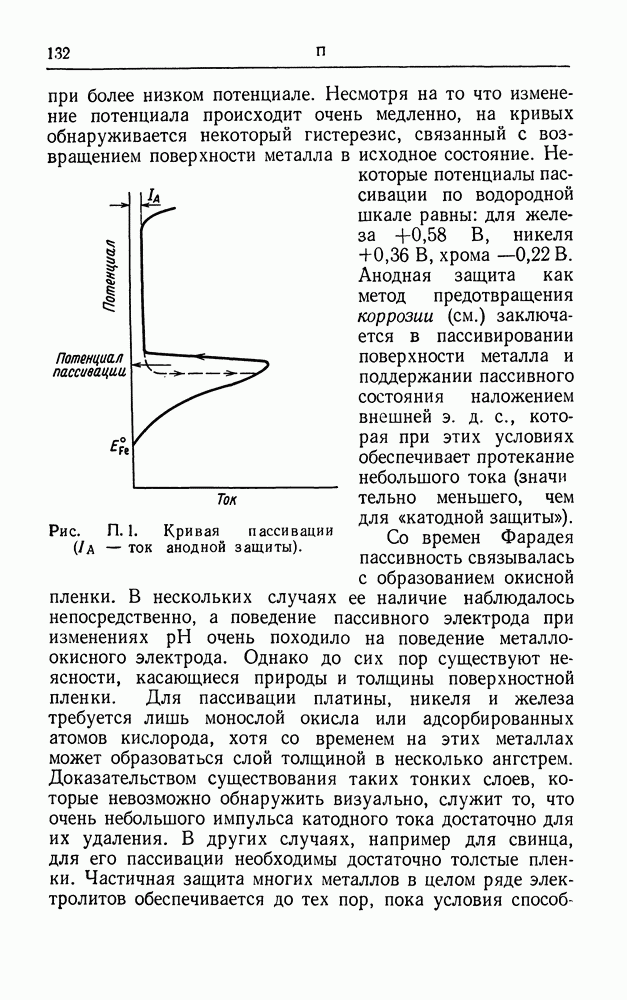
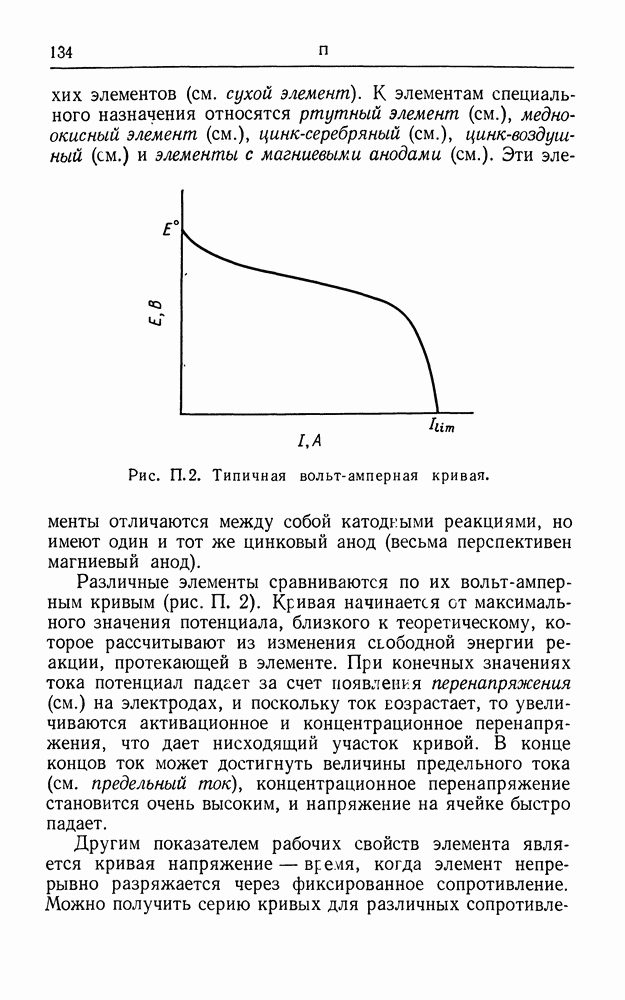
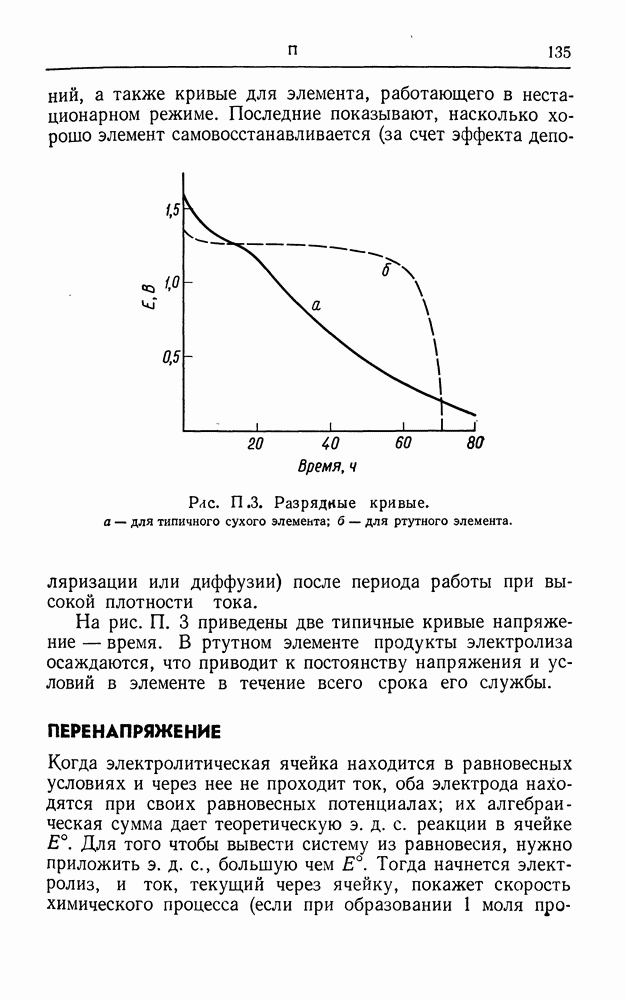
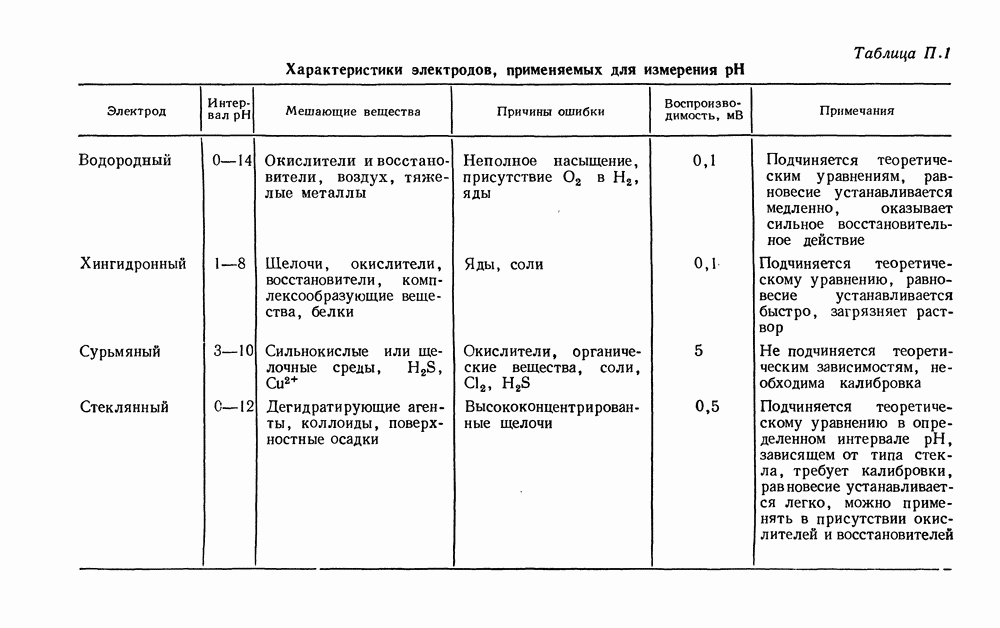
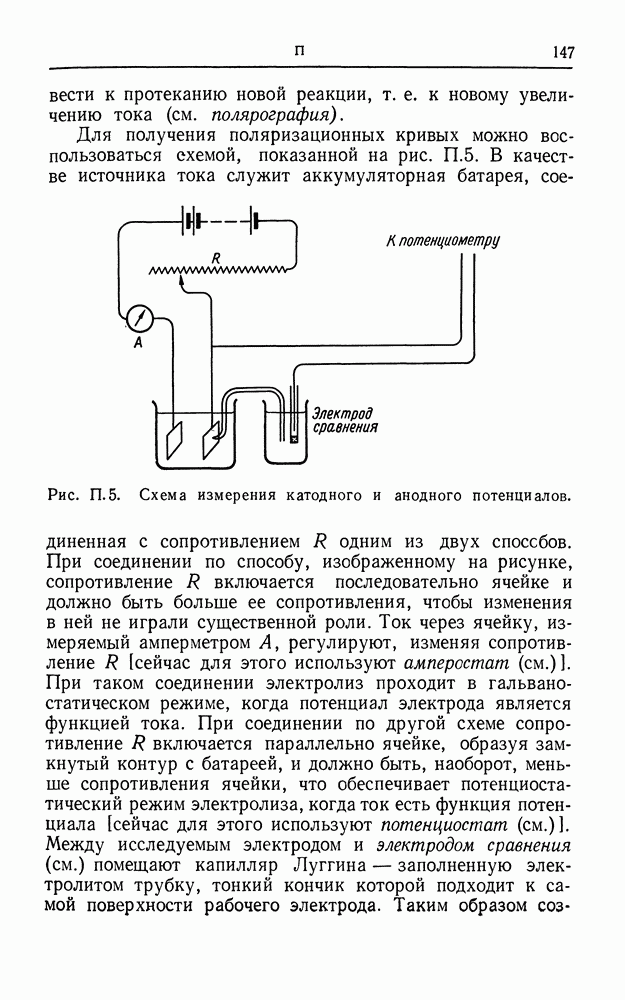
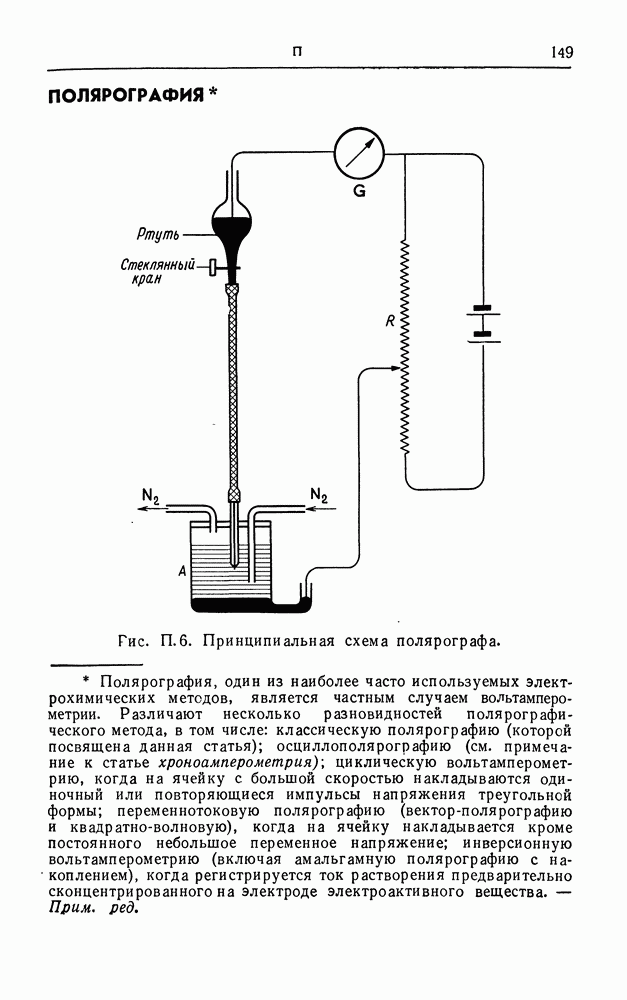
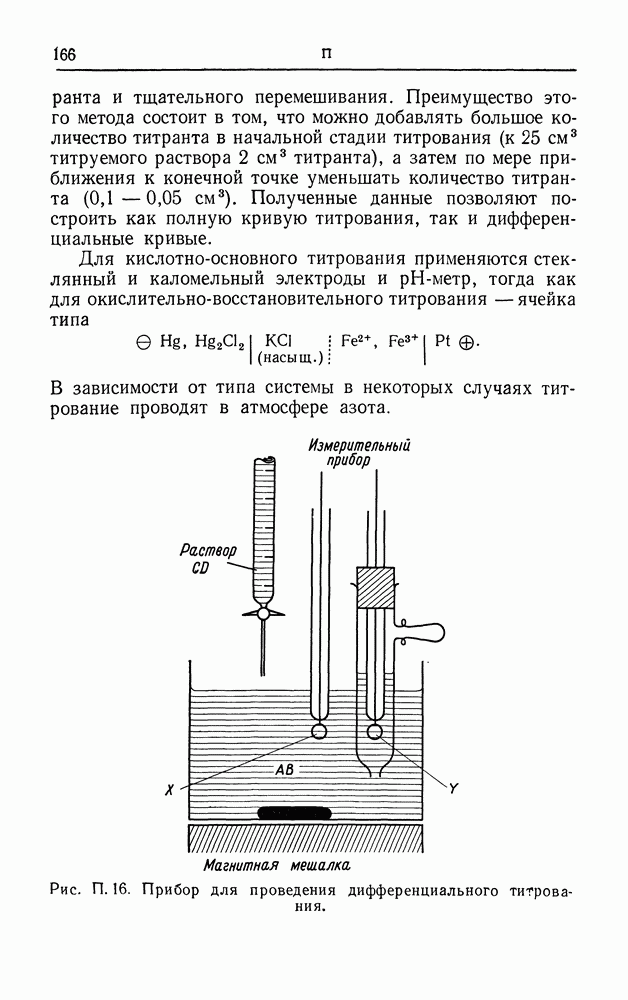
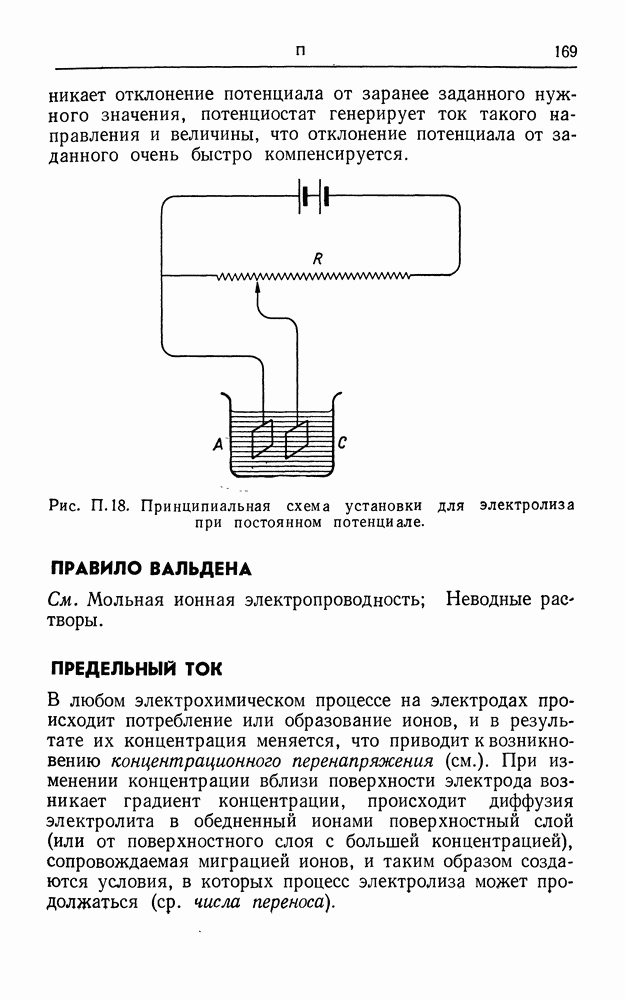
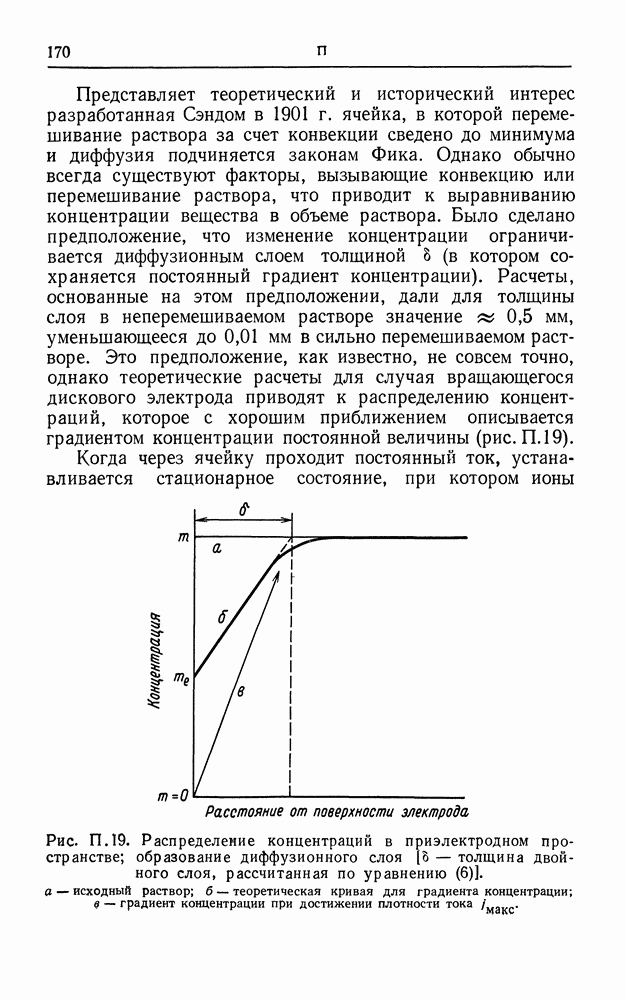
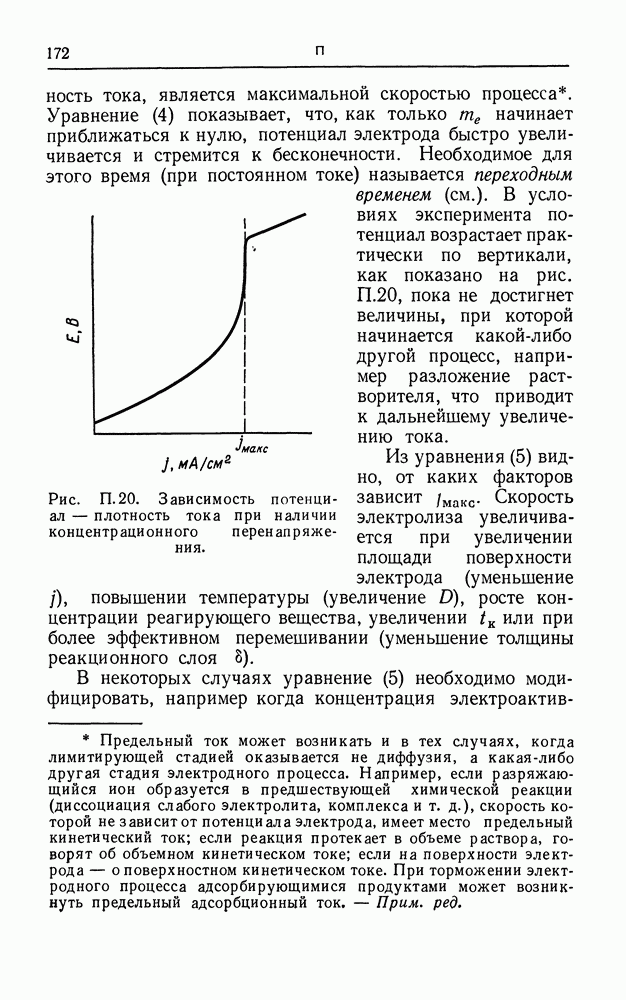
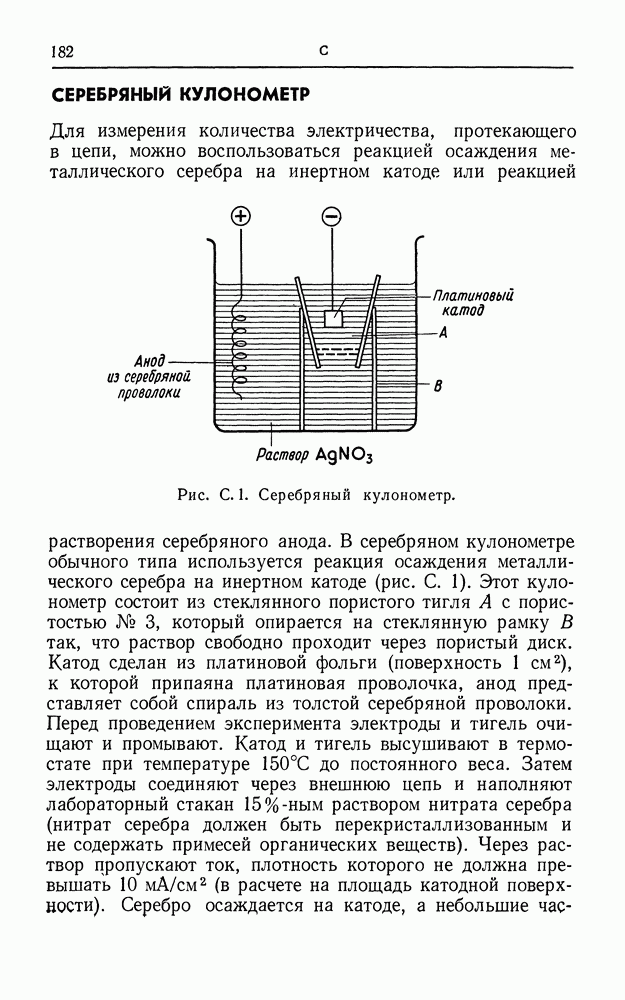
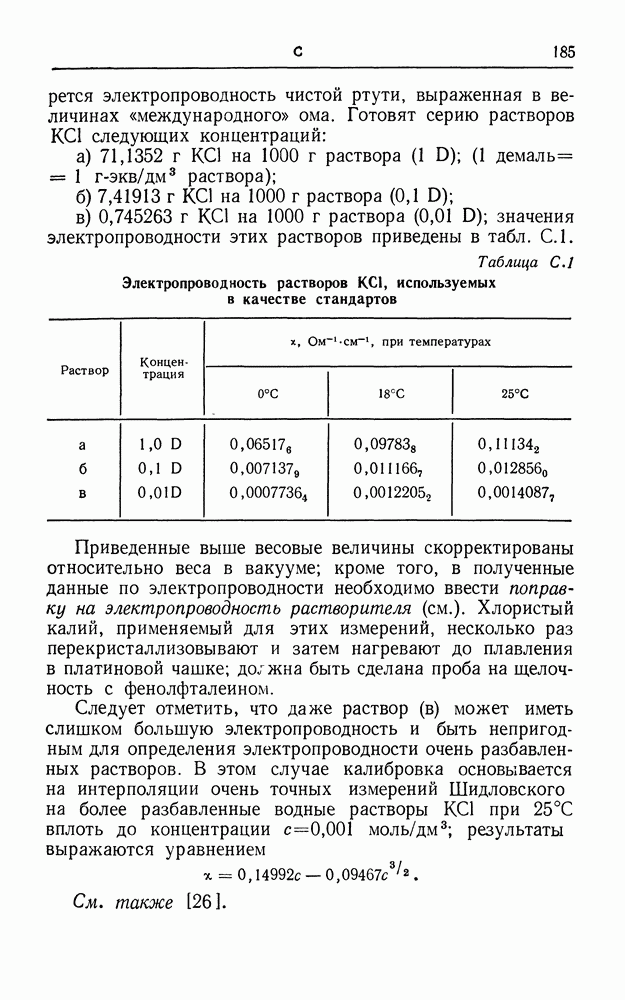
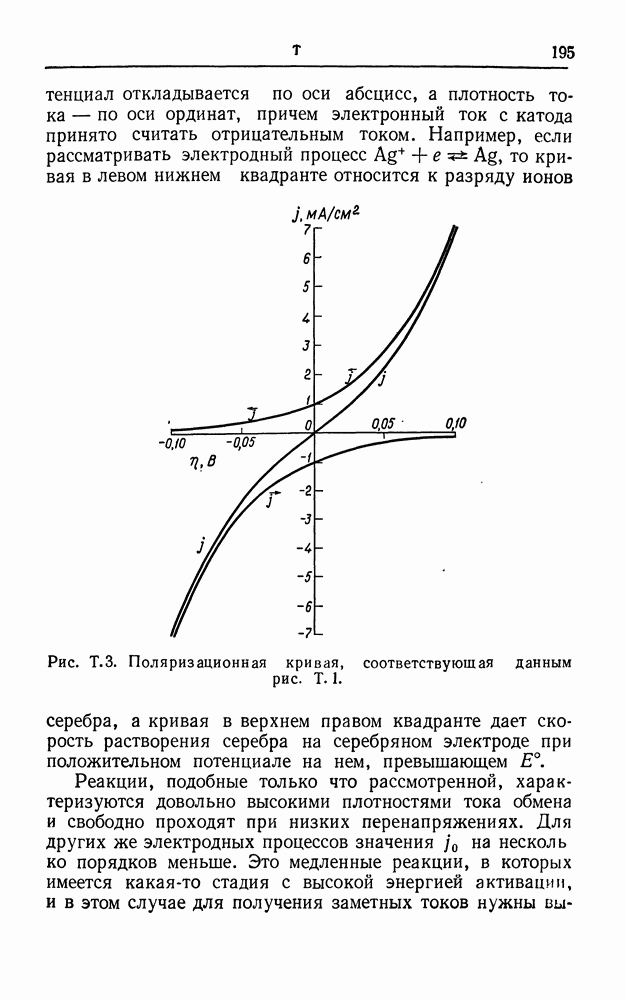
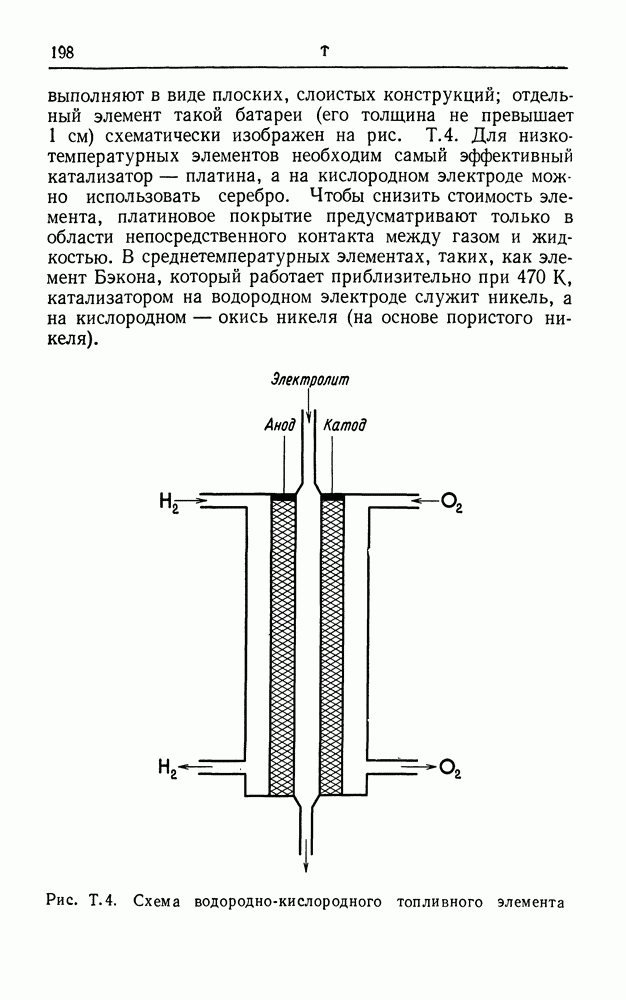
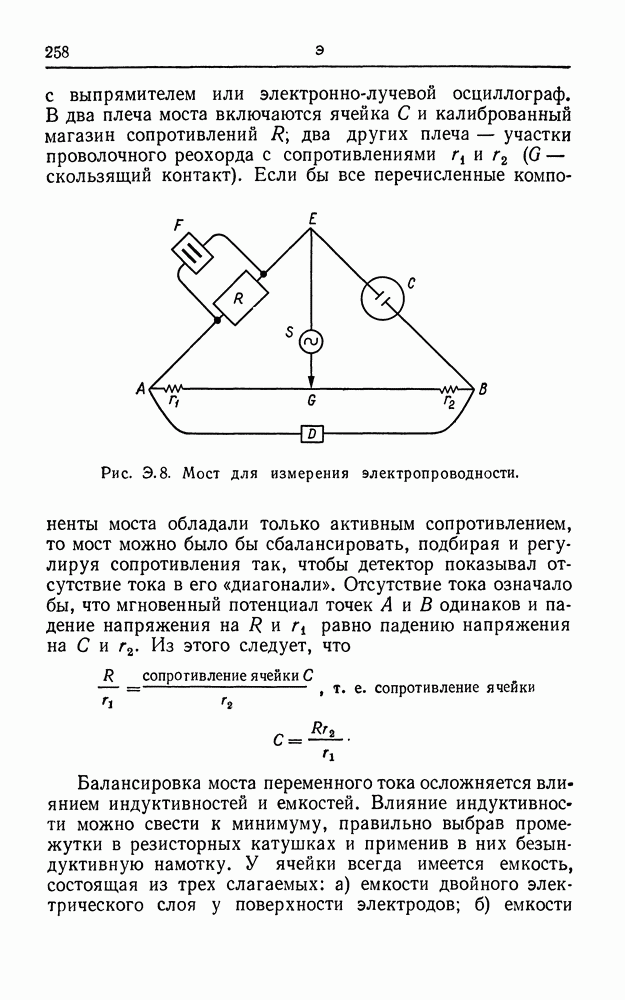
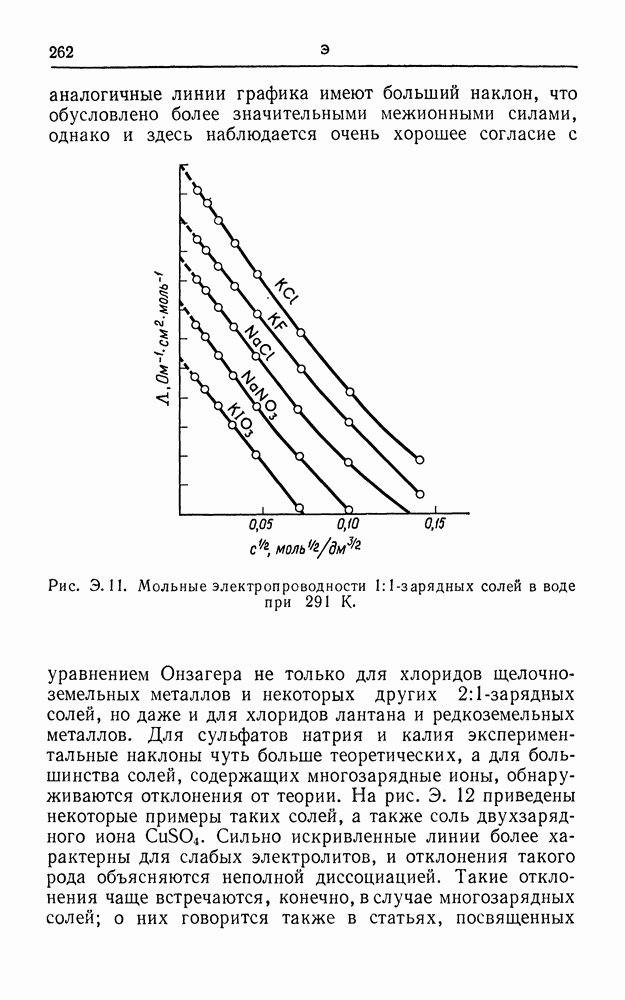
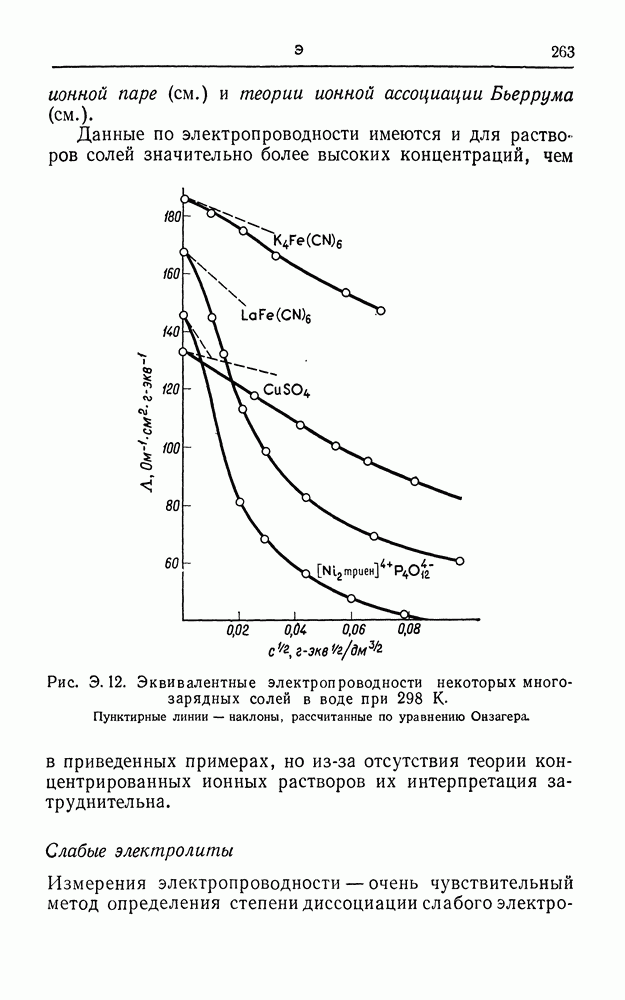
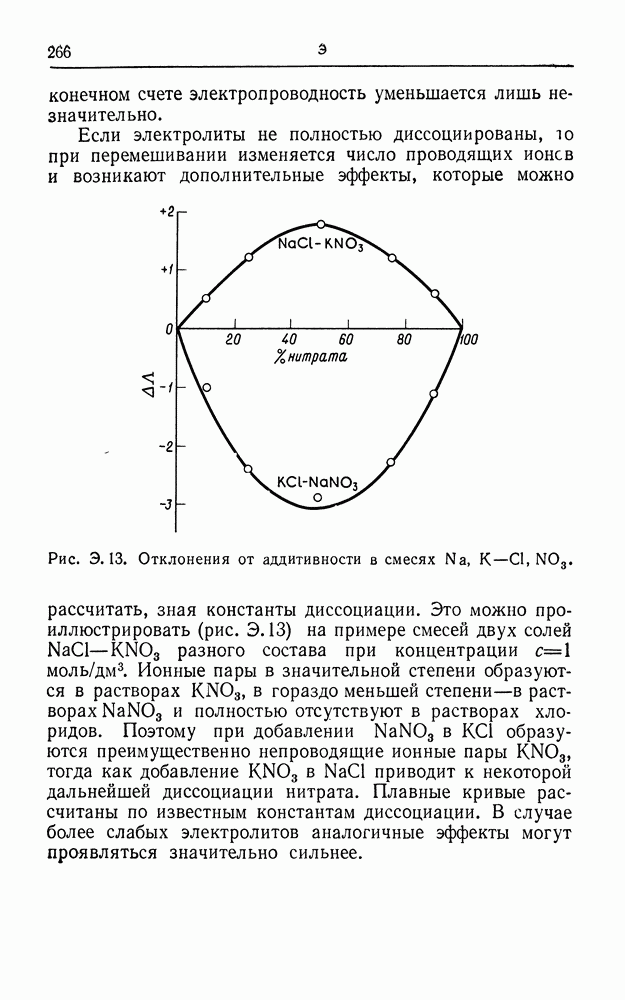
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
КОРРОЗИЯ
Электрохимические аспекты коррозионных процессов можно рассмотреть на примере образца цинка, содержащего включения металлов, имеющих более положительный стандартный потенциал, например меди. Если на поверхности образца имеется пленка влаги, содержащая ионы металлов, то протекают процессы внутреннего электролиза (см.), т. е. реакции, идущие в элементе Даниэля (см.). Ионы цинка при этом переходят в раствор, а освобождающиеся электроны перемещаются в металле по направлению к локальным участкам с более положительным потенциалом, где ионы меди разряжаются, принимая электроны. Таким образом, коррозия цинка протекает практически непрерывно. Такого типа коррозионные процессы наблюдаются в тех случаях, когда два различных металла находятся в электрическом контакте с поверхностной пленкой атмосферной влаги, которая является электролитом. Присутствие второго металла в этих случаях не является необходимым:
участки, имеющие несколько более положительный или чуть более отрицательный потенциал, могут образовываться за счет различной активности атомов поверхности. Например, потенциал металла, подвергнутого холодной обработке, обычно несколько более отрицателен, чем потенциал металла после отжига; в одном и том же образце границы зерен (или две разные поверхности кристалла) могут представлять собою два полюса гальванического элемента.
Однако и неоднородность поверхности металла не обязательно приводит к коррозии. Для протекания электролитического процесса необходим анод (где освобождаются электроны), имеющий электрический контакт с катодом (на котором электроны потребляются, принимая участие в образовании новых химических соединений), а также электролит, например в виде пленки атмосферной влаги или другой жидкой фазы, в которой ионы могут перемещаться, осуществляя тем самым перенос электрического тока. Анодная реакция коррозионного процесса — это процесс растворения металла. На катоде, однако, может протекать не только разряд иона металла, как было описано выше; в водных растворах возможно восстановление кислорода

или

и выделение водорода

При наличии других восстанавливающихся примесей могут идти и другие реакции. Поскольку потенциал поверхности чистого металла более положителен, чем стандартный потенциал, и более отрицателен, чем равновесный потенциал любого возможного катодного процесса, как катодные, так и анодные реакции могут протекать самопроизвольно и поверхность металла может корродировать в любых точках. В том случае, если катодная реакция протекает достаточно быстро, скорость коррозионного процесса в целом Определяется скоростью анодной реакции,
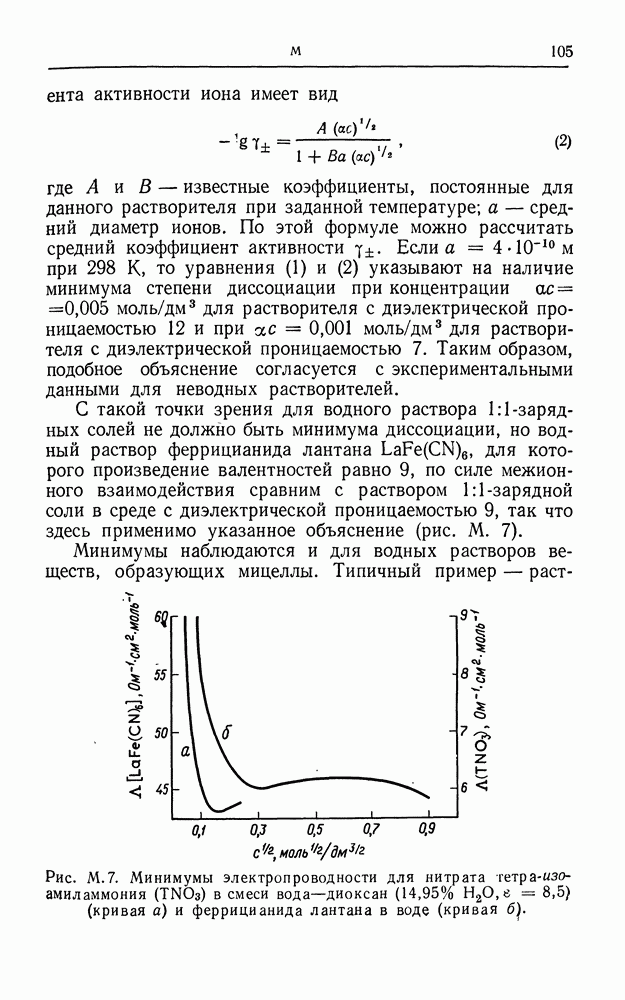
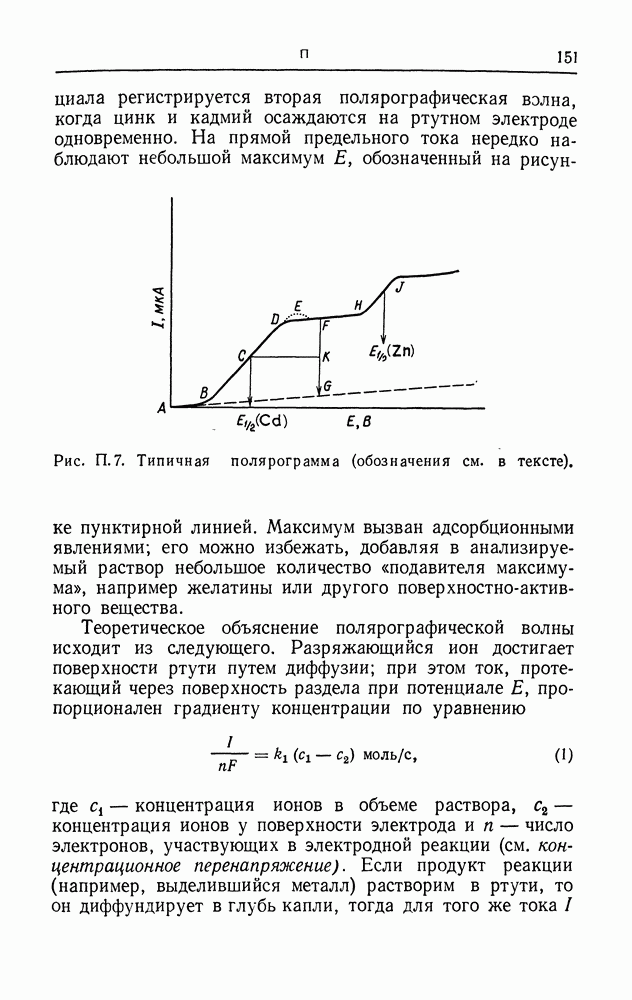
Помимо указанных выше причин коррозию могут вызывать локальные изменения концентрации растворов, т. е. эффект того же типа, что и в концентрационной цепи (см.). Один из обычных примеров такого эффекта приведен на рис. К. 6, изображающем стальную конструкцию, погруженную в морскую воду. С увеличением глубины концентрация кислорода в воде уменьшается и на определенном расстоянии от ватерлинии в каком-то месте конструкции будет достигнут равновесный потенциал реакции восстановления кислорода. Как следствие этого, поверхность металла, находящаяся ближе к ватерлинии, ведет себя как катод, а в некоторых точках поверхности, удаленных от ватерлинии, происходит растворение металла. Аналогичный эффект наблюдается и для находящегося в земле трубопровода, если концентрация кислорода в грунте различна. Этот случай иллюстрирует рис. К. 7, где показана капля влаги, находящаяся на поверхности корродируемого металла. Кислород быстрее проникает к тем участкам поверхности металла, которые прилегают к периферии капли, где он восстанавливается; в центре капли происходит растворение металла и образуются ионы металла, которые в конце концов, как правило, осаждаются в виде гидроокисей.

Рис. К. 6. Коррозия металла в глубине раствора.

Рис. К. 7. Возникновение коррозии в результате неодинаковрй аэрации капли воды.
Для полуколичественной обработки результатов определения скоростей коррозии необходимо снять кривые ток—потенциал для реакции растворения металла и для возможных в этом случае катодных реакций. На рис. К. 8 приведены тафелевские прямые, а также плотности тока обмена (см.) для цинкового электрода в кислом растворе.

Рис. К. 8. Определение потенциалов коррозии.
Цинковый электрод будет находиться в равновесии с ионами цинка при потенциале  , а точка пересечения на графике
, а точка пересечения на графике  будет исходной точкой для построения тафелевской прямой:
будет исходной точкой для построения тафелевской прямой:

При более положительном потенциале цинк переходит в раствор с некоторой конечной скоростью (зависимость плотности тока от потенциала — кривая а на рис. К. 8). Как видно из рисунка, равновесный потенциал электрода, на котором происходит разряд иона водорода, устанавливается (для некоторой конечной скорости процесса) при потенциале более отрицательном, чем  . Тафелевские прямые для катодной и анодной реакций должны пересекаться, как показано на рис. К. 8, при Екор. В этой точке плотность тока для обеих реакций одинакова; электроны,
. Тафелевские прямые для катодной и анодной реакций должны пересекаться, как показано на рис. К. 8, при Екор. В этой точке плотность тока для обеих реакций одинакова; электроны,
освободившиеся в результате перехода ионов цинка в раствор, взаимодействуют с ионами водорода, и при потенциале  называемом потенциалом коррозии, наступает состояние равновесия. Теоретически скорость коррозии определяется величиной
называемом потенциалом коррозии, наступает состояние равновесия. Теоретически скорость коррозии определяется величиной 

Рис. К. 9. Скорости коррозии и потенциалы цинковых электродов.
Для построения соответствующего графика должны быть известны состав раствора, возможная катодная реакция, а также определено соотношение  для этих условий.
для этих условий.
На рис. К. 9. показано влияние некоторых факторов на скорость коррозии металла. Сравниваются кривые для чистого цинка (кривая а), амальгамированного цинка (кривая б) и цинка, содержащего включения платины (кривая в). Присутствие платины заметно увеличивает скорость коррозии отчасти вследствие высокого значения  для реакции выделения водорода, имеющей весьма низкое перенапряжение на платине, а отчасти вследствие изменения тафелевского наклона, что объясняется изменением механизма реакции выделения водорода (см.).
для реакции выделения водорода, имеющей весьма низкое перенапряжение на платине, а отчасти вследствие изменения тафелевского наклона, что объясняется изменением механизма реакции выделения водорода (см.).
Защита от коррозии
Для предотвращения коррозии необходимо контролировать среду (например, контролировать влажность, проводить деаэрацию растворов, добавлять ингибиторы, замедляющие катодный процесс) или обрабатывать поверхность металла или сплава (наносить защитные, например гальванические, покрытия или слои, имеющие высокую стойкость к коррозии, которые получаются, например, при фосфатировании сталей).
Рассмотрим два чисто электрохимических метода защиты от коррозии. Металл, который нужно защитить от коррозии, присоединяют к более активному металлу, имеющему более отрицательное значение  Тогда анодная реакция протекает преимущественно на поверхности металла-протектора, который постепенно растворяется, а его ионы переходят в раствор. Это пример протекторной защиты.
Тогда анодная реакция протекает преимущественно на поверхности металла-протектора, который постепенно растворяется, а его ионы переходят в раствор. Это пример протекторной защиты.
Второй метод — наложение на защищаемый металл потенциала от внешнего источника тока, для того чтобы потенциал его поверхности был более отрицательным, чем  При этих условиях металл не будет корродировать. Энергию, требуемую для защиты от коррозии, для какого-либо частного случая можно вычислить, пользуясь рис. К. 8. При втором методе защиты электроны, потребляемые в катодном процессе, поставляются не корродирующим металлом, а внешним источником тока. Величину защитного потенциала (плотности тока) находят, экстраполируя кривую б на рис. К. 8 до точки с потенциалом
При этих условиях металл не будет корродировать. Энергию, требуемую для защиты от коррозии, для какого-либо частного случая можно вычислить, пользуясь рис. К. 8. При втором методе защиты электроны, потребляемые в катодном процессе, поставляются не корродирующим металлом, а внешним источником тока. Величину защитного потенциала (плотности тока) находят, экстраполируя кривую б на рис. К. 8 до точки с потенциалом  Соответствующая данному потенциалу плотность тока (точка А) — это минимальный ток, который должен протекать между защищаемым металлом и вторым (инертным) электродом и обеспечивать такое электронное состояние металла, чтобы металл практически не растворялся.
Соответствующая данному потенциалу плотность тока (точка А) — это минимальный ток, который должен протекать между защищаемым металлом и вторым (инертным) электродом и обеспечивать такое электронное состояние металла, чтобы металл практически не растворялся.
См. также Пассивность; [8, 10].
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- ПРЕДИСЛОВИЕ
- О ПОЛЬЗОВАНИИ СЛОВАРЕМ
- СПИСОК ОСНОВНЫХ ОБОЗНАЧЕНИЙ
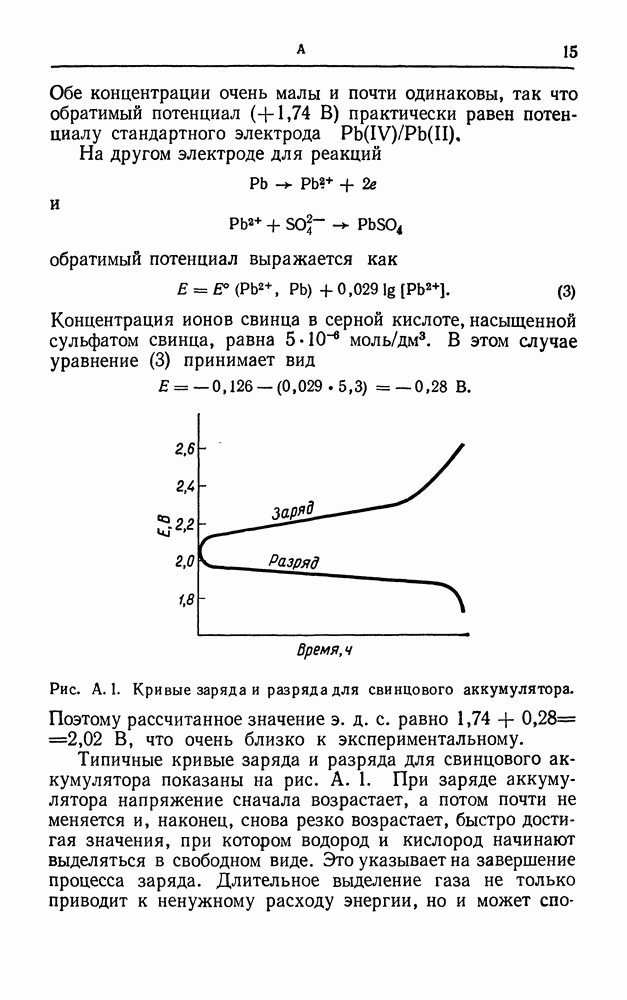
- АККУМУЛЯТОР
- АКТИВАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
- АКТИВНОСТЬ
- АЛЮМИНИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- АМАЛЬГАМНЫЙ ЭЛЕКТРОД
- АМПЕР
- АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
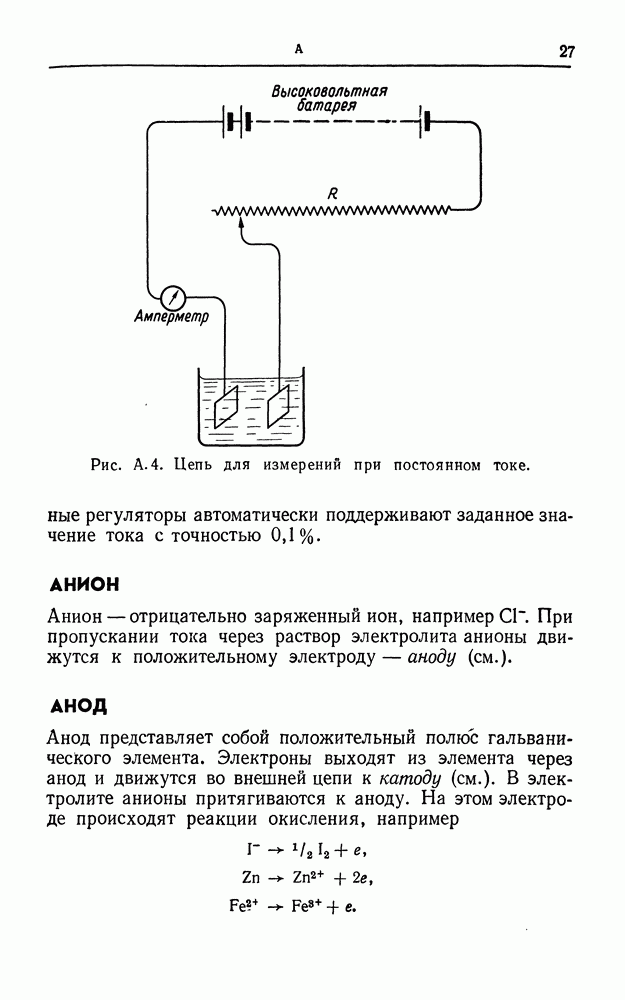
- АМПЕРОСТАТ
- АНИОН
- АНОД
- АНОДИРОВАНИЕ
- БАТАРЕЯ
- БЕРИЛЛИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- БИПОЛЯРНЫЙ ЭЛЕКТРОД
- БЛЕСКООБРАЗОВАТЕЛИ
- БУФЕРНЫЙ РАСТВОР
- ВАГНЕРОВСКОЕ ЗАЗЕМЛЕНИЕ
- ВНУТРЕННИЙ ЭЛЕКТРОЛИЗ
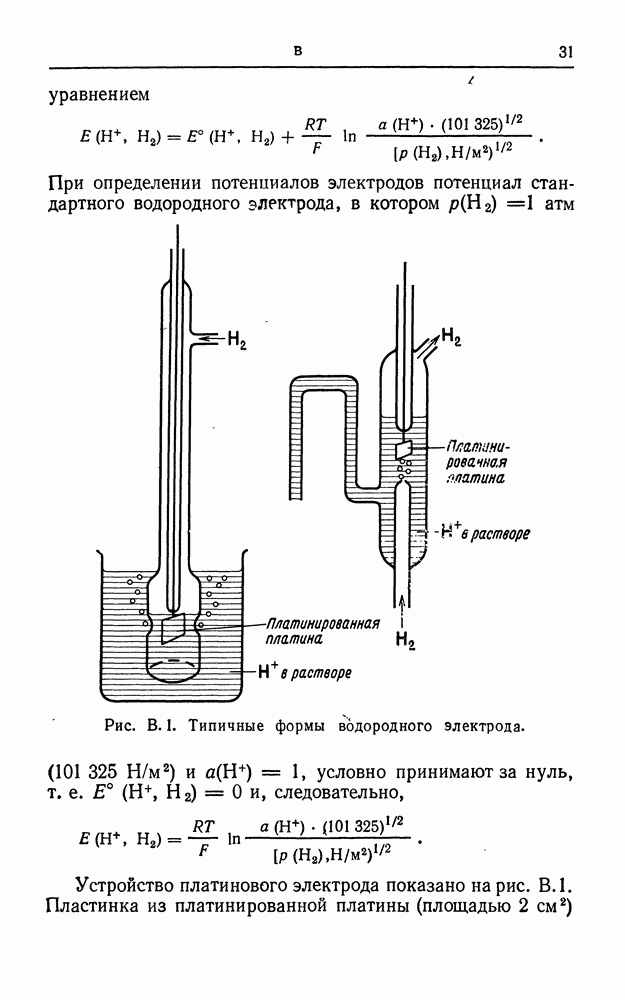
- ВОДОРОДНЫЙ ЭЛЕКТРОД
- ВОЛЬТ
- ВОЛЬФРАМОВЫЙ ЭЛЕКТРОД
- ВЫХОД ПО ТОКУ
- ГАЗОВЫЙ ЭЛЕКТРОД
- ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- ГАЛЬВАНОПЛАСТИКА
- ГАЛЬВАНОСТАТ
- ГАЛЬВАНОСТЕГИЯ
- ГИДРАТАЦИЯ ИОНОВ
- ДАТЧИК АММИАКА
- ДАТЧИК СЕРНИСТОГО ГАЗА
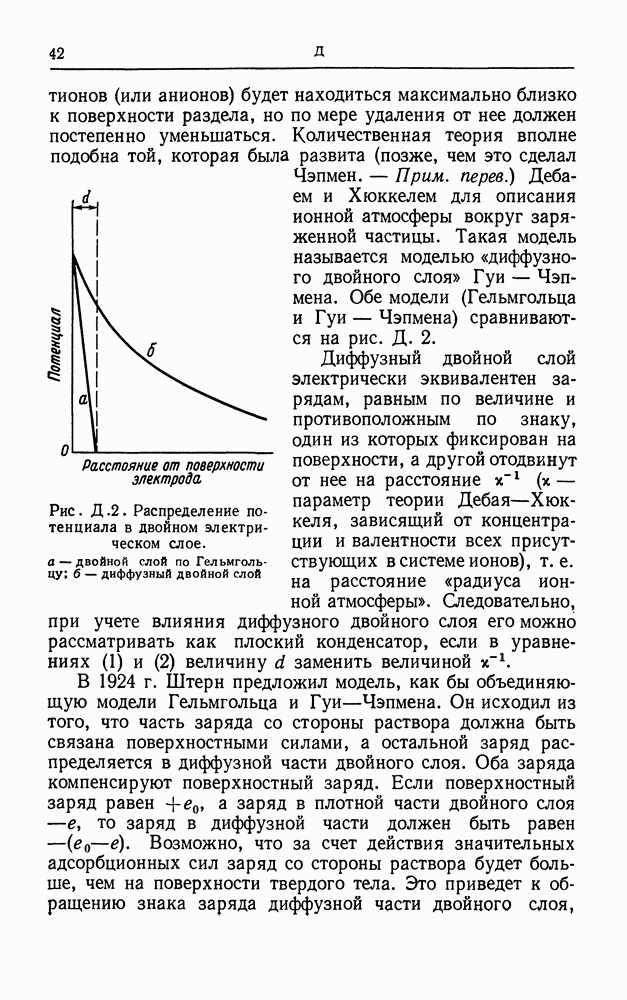
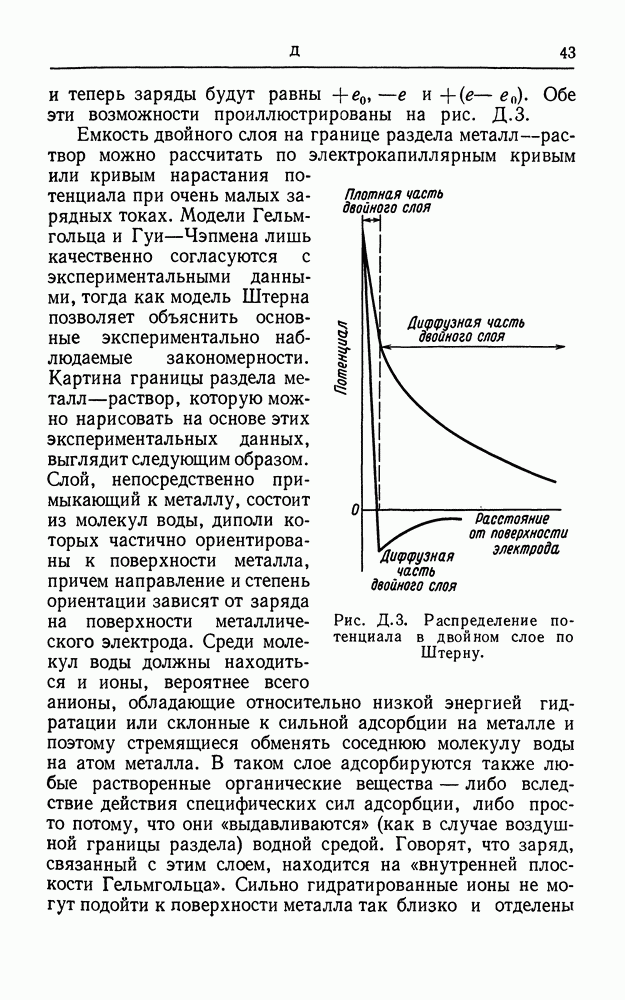
- ДВОЙНОЙ СЛОЙ
- ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
- ДЗЕТА-ПОТЕНЦИАЛ
- ДИФФУЗИОННЫЙ ПОТЕНЦИАЛ
- ДИФФУЗИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- ДИЭЛЕКТРИЧЕСКАЯ ПОСТОЯННАЯ
- ДИЭЛЕКТРИЧЕСКАЯ ПРОНИЦАЕМОСТЬ
- ЗАКОН КОЛЬРАУША
- ЗАКОН РАЗВЕДЕНИЯ ОСТВАЛЬДА
- ЗАКОНЫ ФАРАДЕЯ
- ИНДИКАТОР
- ИНДИКАТОРНЫЙ ЭЛЕКТРОД
- ИНДИФФЕРЕНТНЫЙ (ФОНОВЫЙ) ЭЛЕКТРОЛИТ
- ИОДНЫЙ КУЛОНОМЕТР
- ИОННАЯ АТМОСФЕРА
- ИОННЫЕ ПАРЫ
- ИОННЫЕ РАСПЛАВЫ
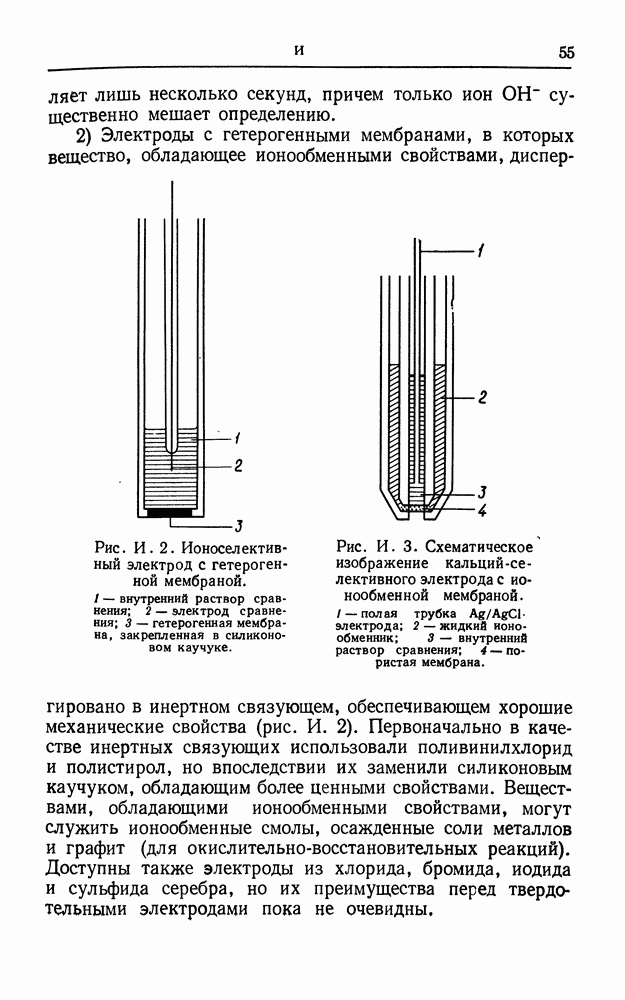
- ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ
- КАДМИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД
- КАЛЬЦИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- КАПИЛЛЯР ЛУГГИНА
- КАТИОН
- КАТИОНОСЕЛЕКТИВНЫЙ ЭЛЕКТРОД
- КАТОД
- КАТОДНАЯ ЗАЩИТА
- КИСЛОРОДНОЕ ПЕРЕНАПРЯЖЕНИЕ
- КИСЛОРОДНЫЙ ЭЛЕКТРОД (КИСЛОРОДНЫЙ ЗОНД)
- КОМПЛЕКСНЫЕ ИОНЫ
- КОНВЕНЦИЯ О ЗНАКАХ
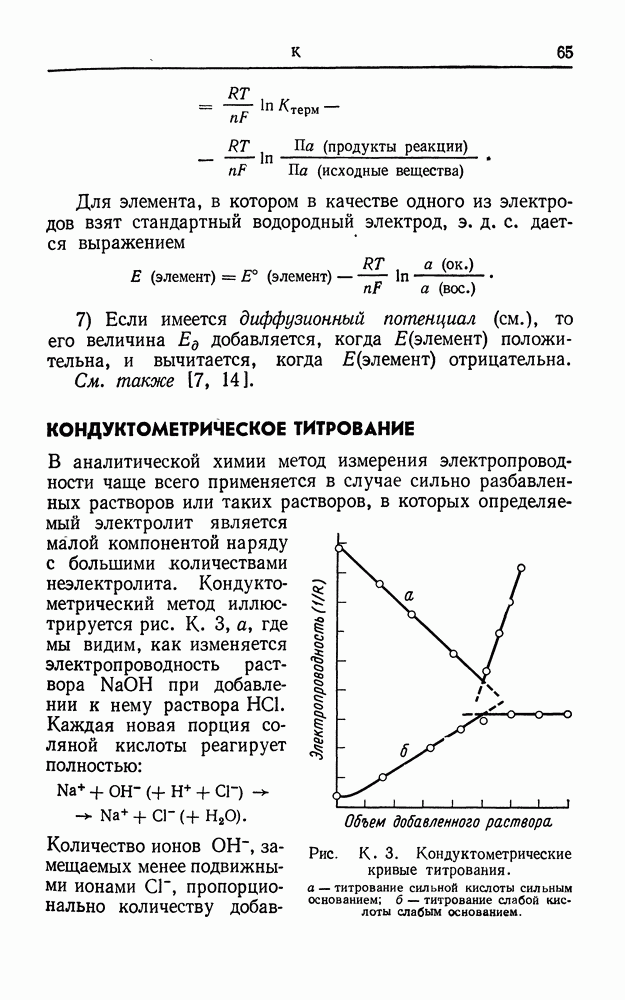
- КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- КОНСТАНТА ДИССОЦИАЦИИ
- КОНТАКТНАЯ РАЗНОСТЬ ПОТЕНЦИАЛОВ
- КОНЦЕНТРАЦИОННАЯ ЦЕПЬ
- КОНЦЕНТРАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
- КОРРОЗИЯ
- КОЭФФИЦИЕНТ АКТИВНОСТИ
- КУЛОН
- КУЛОНОМЕТР
- КУЛОНОМЕТРИЯ
- ЛИТИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- МАГНИЙ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- МЕДНООКИСНЫЙ ЭЛЕМЕНТ
- МЕДНЫЙ КУЛОНОМЕТР
- МЕДЬ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- МЕМБРАННЫЙ ЭЛЕКТРОД
- МЕТАЛЛИЧЕСКИЙ ЭЛЕКТРОД
- МЕТАЛЛООКИСНЫЙ ЭЛЕКТРОД
- МЕТОД ГИТТОРФА
- МЕТОД ДВИЖУЩЕЙСЯ ГРАНИЦЫ
- МЕХАНИЗМЫ ЭЛЕКТРОДНЫХ РЕАКЦИЙ
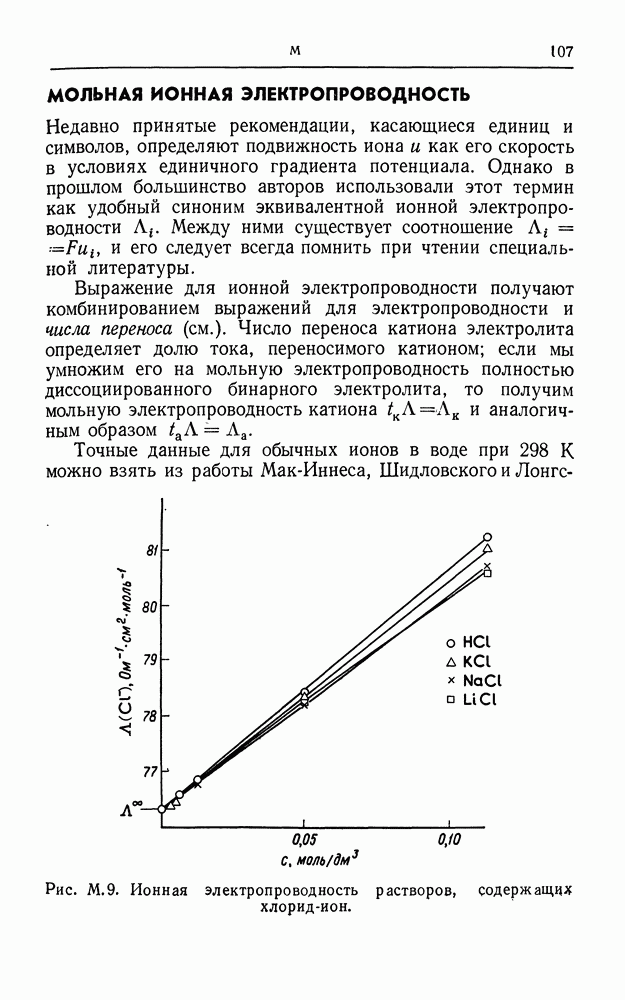
- МИНИМУМЫ ЭЛЕКТРОПРОВОДНОСТИ
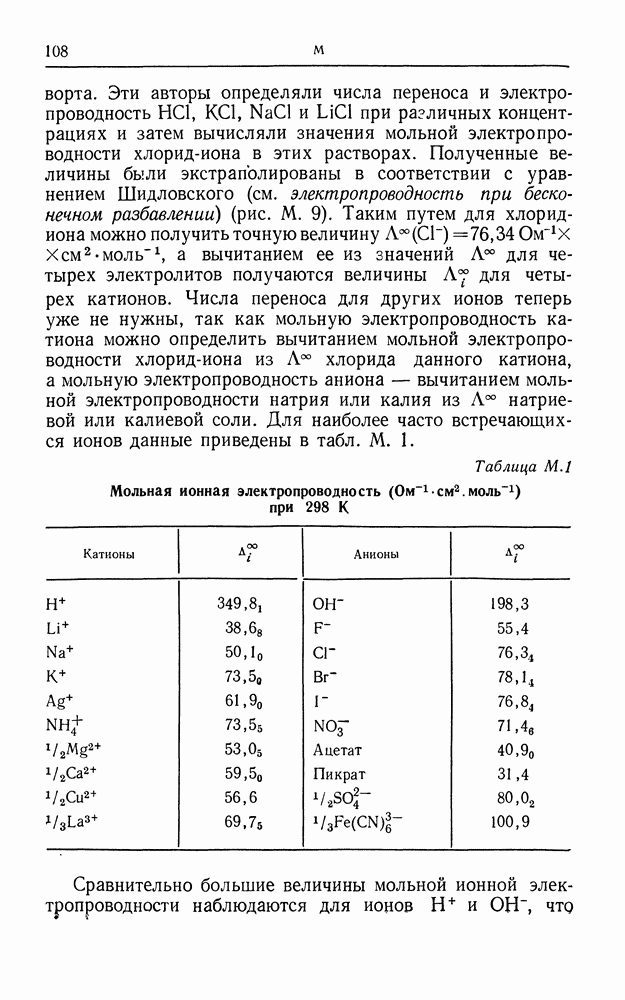
- МОЛЬНАЯ ИОННАЯ ЭЛЕКТРОПРОВОДНОСТЬ
- МОСТ УИТСТОНА
- НАПРЯЖЕНИЕ РАЗЛОЖЕНИЯ
- НЕВОДНЫЕ РАСТВОРЫ
- НИКЕЛЬ, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- ОБРАТИМЫЙ ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНАЯ (РЕДОКС) ЭЛЕКТРОДНАЯ СИСТЕМА
- ОМ
- ОПРЕСНЕНИЕ ВОДЫ
- ОСЦИЛЛОМЕТРИЯ
- ПАССИВНОСТЬ
- ПЕРВИЧНЫЙ ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- ПЕРЕНАПРЯЖЕНИЕ
- ПЕРЕНАПРЯЖЕНИЕ ВОДОРОДА
- ПЕРЕХОДНОЕ ВРЕМЯ
- ПЕРСОЛИ
- ПЛАТИНОВЫЕ И ЗОЛОТЫЕ ЭЛЕКТРОДЫ
- рН-МЕТР
- ПОДВИЖНОСТЬ
- ПОДВИЖНОСТЬ ИОНОВ
- ПОЛУЭЛЕМЕНТ
- ПОЛЯРИЗАЦИОННЫЕ КРИВЫЕ
- ПОЛЯРИЗАЦИЯ
- ПОЛЯРИЗУЕМЫЕ ЭЛЕКТРОДЫ
- ПОЛЯРОГРАФИЯ
- ПОПРАВКА НА ЭЛЕКТРОПРОВОДНОСТЬ РАСТВОРИТЕЛЯ
- ПОСТОЯННАЯ ЯЧЕЙКИ
- ПОТЕНЦИАЛ, ОБРАТИМЫЕ ЭЛЕКТРОДЫ
- ПОТЕНЦИАЛ ПОЛУВОЛНЫ
- ПОТЕНЦИАЛ СЕДИМЕНТАЦИИ
- ПОТЕНЦИАЛ ТЕЧЕНИЯ
- ПОТЕНЦИОМЕТР
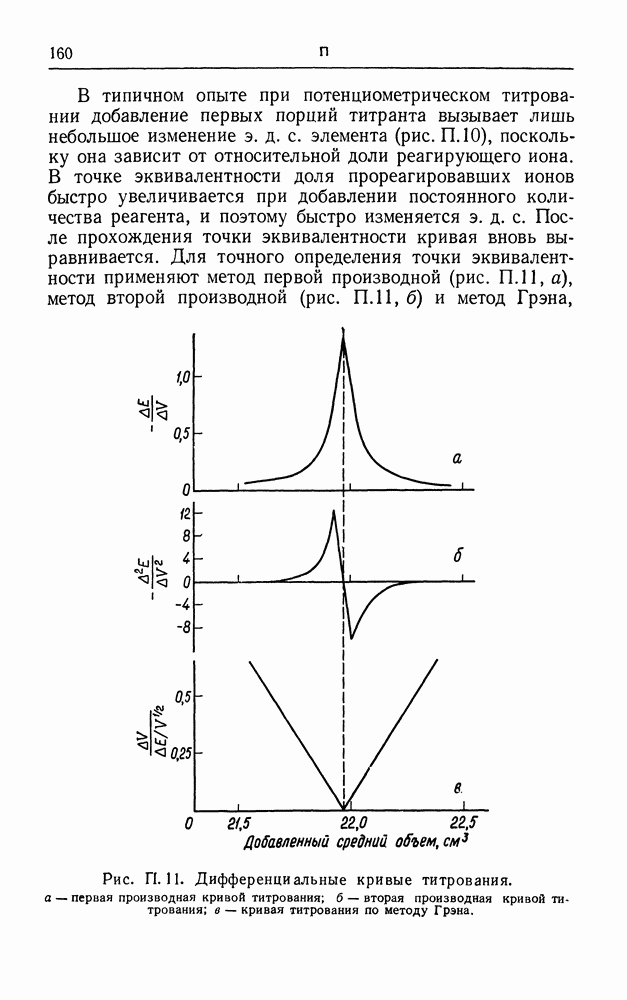
- ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- ПОТЕНЦИОСТАТ
- ПРАВИЛО ВАЛЬДЕНА
- ПРЕДЕЛЬНЫЙ ТОК
- ПРОТЕКТОРНАЯ ЗАЩИТА
- РАСПЛАВЫ СОЛЕЙ
- РЕАКЦИЯ ВЫДЕЛЕНИЯ ВОДОРОДА
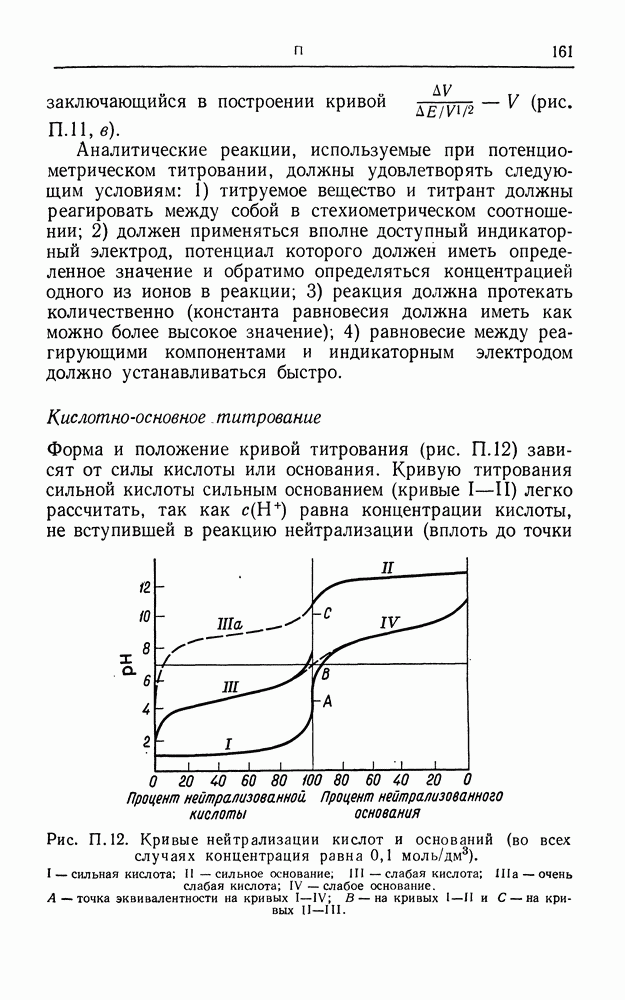
- РТУТНЫЙ ЭЛЕМЕНТ
- РЯД ПОТЕНЦИАЛОВ
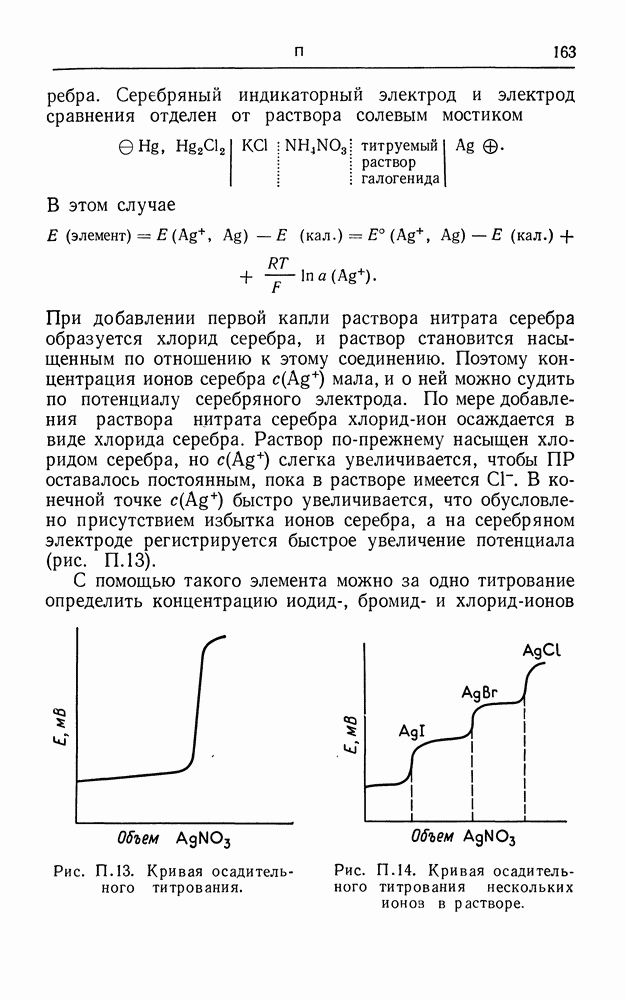
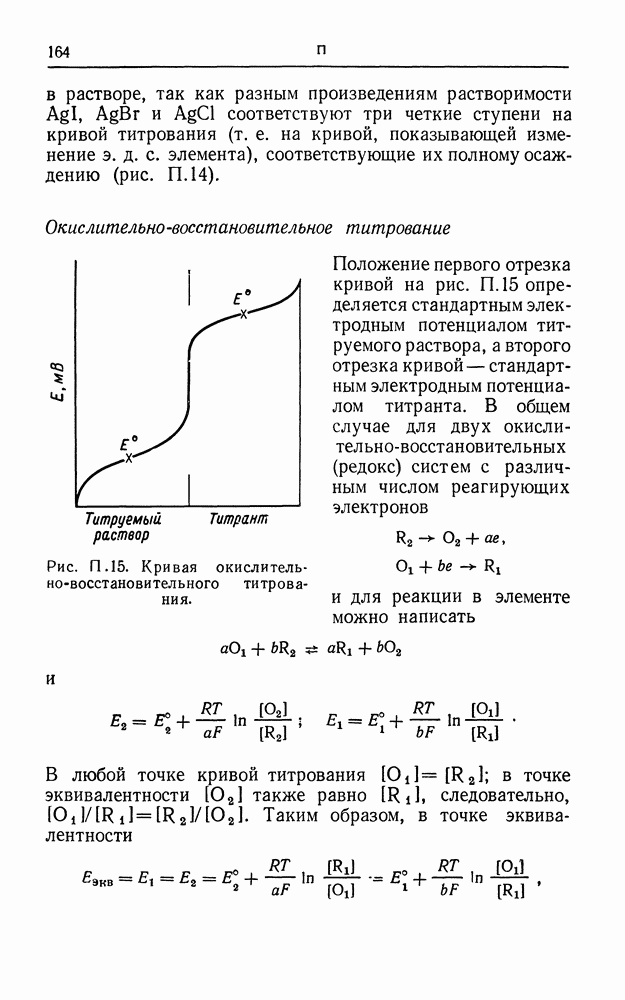
- СВИНЦОВЫЙ АККУМУЛЯТОР
- СЕРЕБРЯНЫЙ КУЛОНОМЕТР
- СЕРЕБРЯНЫЙ ЭЛЕКТРОД
- СЛОЙ ГЕЛЬМГОЛЬЦА
- СЛОЙ ГУИ
- СОЛЕВОЙ МОСТИК
- СТАНДАРТНЫЕ РАСТВОРЫ ДЛЯ ЭЛЕКТРОПРОВОДНОСТИ
- СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
- СТАНДАРТНЫЙ ЭЛЕМЕНТ
- СТЕКЛЯННЫЙ ЭЛЕКТРОД
- СУРЬМЯНЫЙ ЭЛЕКТРОД
- СУХОЙ ЭЛЕМЕНТ
- ТЕОРИЯ ИОННОЙ АССОЦИАЦИИ БЬЕРРУМА
- ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ АРРЕНИУСА
- ТЕРМОДИНАМИКА ГАЛЬВАНИЧЕСКИХ ЭЛЕМЕНТОВ
- ТОК ОБМЕНА
- ТОПЛИВНЫЙ ЭЛЕМЕНТ
- УРАВНЕНИЕ БРЕНСТЕДА—БЬЕРРУМА
- УРАВНЕНИЕ ДЕБАЯ — ХЮККЕЛЯ
- УРАВНЕНИЕ ИЛЬКОВИЧА
- УРАВНЕНИЕ НЕРНСТА
- УРАВНЕНИЕ ОНЗАГЕРА
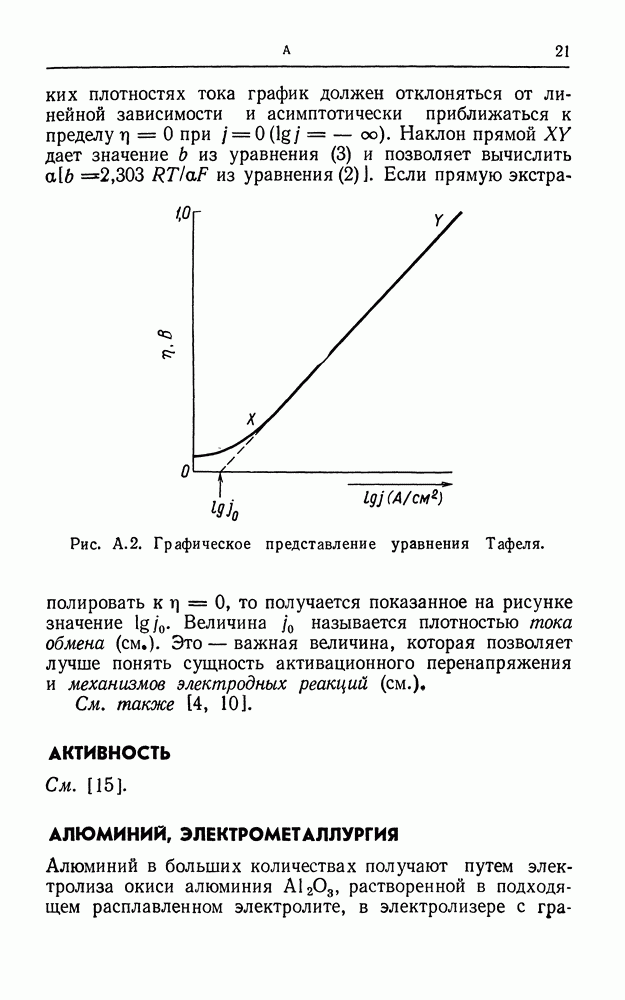
- УРАВНЕНИЕ ТАФЕЛЯ
- УРАВНЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ ПИТТСА
- УРАВНЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ ФУОССА
- УРАВНЕНИЯ ЭЛЕКТРОПРОВОДНОСТИ
- ХЕМОТРОНЫ
- ХИНГИДРОННЫЙ ЭЛЕКТРОД
- ХЛОРНЫЙ ЭЛЕКТРОД
- ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД
- ХРОНОАМПЕРОМЕТРИЯ
- ХРОНОПОТЕНЦИОМЕТРИЯ
- ЦИНК-ВОЗДУШНЫЙ ЭЛЕМЕНТ
- ЦИНК-СЕРЕБРЯНЫЙ ЭЛЕМЕНТ
- ЦИНК, ЭЛЕКТРОМЕТАЛЛУРГИЯ
- ЦИФРОВОЙ ВОЛЬТМЕТР
- ЧАСТОТНАЯ ЗАВИСИМОСТЬ ЭЛЕКТРОПРОВОДНОСТИ
- ЧИСЛА ПЕРЕНОСА
- ЧИСЛО ФАРАДЕЯ
- ЩЕЛОЧНЫЕ АККУМУЛЯТОРЫ
- ЭЛЕКТРИЧЕСКАЯ ЕМКОСТЬ
- ЭЛЕКТРИЧЕСКИЕ ЕДИНИЦЫ ИЗМЕРЕНИЯ
- ЭЛЕКТРОВЕСОВОЙ АНАЛИЗ
- ЭЛЕКТРОД
- ЭЛЕКТРОДВИЖУЩАЯ СИЛА (Э.Д.С.)
- ЭЛЕКТРОДИАЛИЗ
- ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
- ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ
- ЭЛЕКТРОЛИЗ ВОДЫ
- ЭЛЕКТРОЛИЗЕР
- ЭЛЕКТРОЛИЗ РАСТВОРА ПОВАРЕННОЙ СОЛИ
- ЭЛЕКТРОЛИТИЧЕСКАЯ ОЧИСТКА (РАФИНИРОВАНИЕ)
- ЭЛЕКТРОЛИТИЧЕСКОЕ ВОССТАНОВЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ЭЛЕКТРОЛИТИЧЕСКОЕ ОКИСЛЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ЭЛЕКТРОЛИТИЧЕСКОЕ ПОЛИРОВАНИЕ
- ЭЛЕКТРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- ЭЛЕКТРООСАЖДЕНИЕ МЕТАЛЛОВ
- ЭЛЕКТРООСАЖДЕНИЕ СПЛАВОВ
- ЭЛЕКТРООСМОС
- ЭЛЕКТРОПРОВОДНОСТЬ
- ЭЛЕКТРОПРОВОДНОСТЬ ВОДНЫХ РАСТВОРОВ
- ЭЛЕКТРОПРОВОДНОСТЬ НА ВЫСОКИХ ЧАСТОТАХ
- ЭЛЕКТРОПРОВОДНОСТЬ НЕВОДНЫХ РАСТВОРОВ
- ЭЛЕКТРОПРОВОДНОСТЬ ПРИ БЕСКОНЕЧНОМ РАЗБАВЛЕНИИ
- ЭЛЕКТРОПРОВОДНОСТЬ ПРИ ВЫСОКИХ НАПРЯЖЕННОСТЯХ ПОЛЯ
- ЭЛЕКТРОПРОВОДНОСТЬ РАСПЛАВОВ СОЛЕЙ
- ЭЛЕКТРОФОРЕЗ
- ЭЛЕКТРОХИМИЧЕСКАЯ РАЗМЕРНАЯ ОБРАБОТКА МЕТАЛЛОВ
- ЭЛЕКТРОХИМИЧЕСКИЕ ПРЕОБРАЗОВАТЕЛИ ИНФОРМАЦИИ
- ЭЛЕКТРОХИМИЧЕСКИЙ ЭКВИВАЛЕНТ
- ЭЛЕМЕНТ ВЕСТОНА
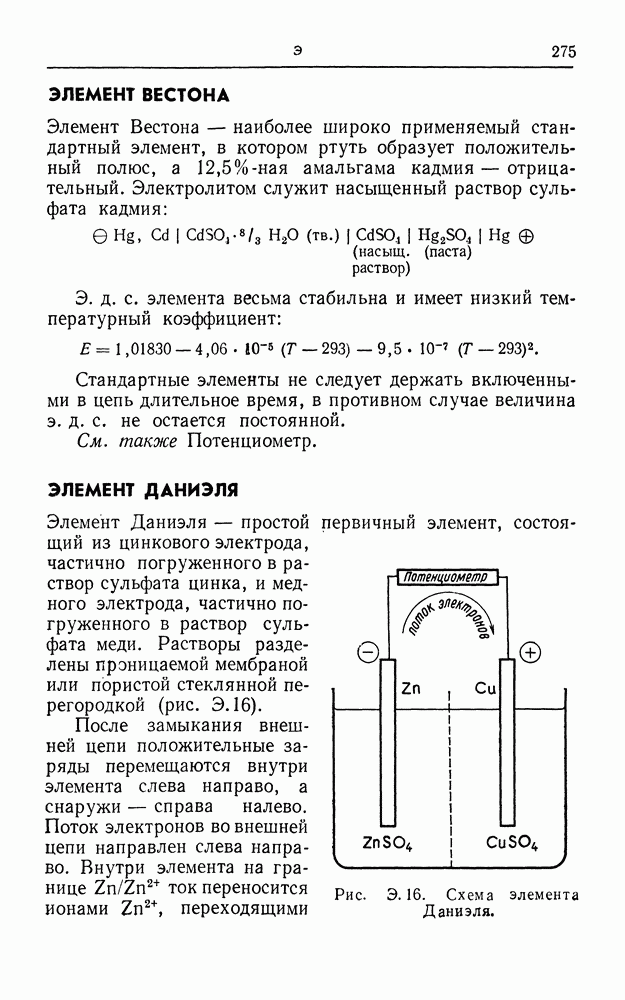
- ЭЛЕМЕНТ ДАНИЭЛЯ
- ЭЛЕМЕНТ КЛАРКА
- ЭЛЕМЕНТЫ С МАГНИЕВЫМИ АНОДАМИ
- ЭФФЕКТ ВИНА
- ЭФФЕКТ ДОРНА
- ЭФФЕКТ ФАЛЬКЕНГАГЕНА
- СПИСОК ЛИТЕРАТУРЫ