| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
5.3. Теория столкновений
Согласно простой теории столкновений, реагирующие молекулы рассматривают как жесткие шарики, не обладающие силами притяжения друг к другу. Считается, что реакция двух молекул происходит только при их столкновении и что скорость реакции зависит от частоты столкновений  Для того чтобы после столкновения двух молекул могла произойти химическая реакция, необходимо, чтобы энергия соударяющихся молекул была
Для того чтобы после столкновения двух молекул могла произойти химическая реакция, необходимо, чтобы энергия соударяющихся молекул была
равна (или больше) энергии активации  В соответствии с распределением энергии Больцмана доля молекул
В соответствии с распределением энергии Больцмана доля молекул  обладающих необходимой энергией, определяется как
обладающих необходимой энергией, определяется как

А для того чтобы столкновение могло привести к химическим изменениям, молекулы в момент удара должны быть благоприятным образом ориентированы в пространстве. Относительное число столкновений, при которых молекулы имеют подходящую ориентацию, определяется фактором вероятности  называемым также стерическим фактором. Тогда константа скорости дается выражением
называемым также стерическим фактором. Тогда константа скорости дается выражением

Число столкновений  на один кубический сантиметр в секунду между разными молекулами
на один кубический сантиметр в секунду между разными молекулами  можно вывести из законов статистической механики:
можно вывести из законов статистической механики:

где  число Авогадро,
число Авогадро,  радиусы реагентов, а
радиусы реагентов, а  приведенная масса,
приведенная масса,  измеряется в
измеряется в  Хотя теория столкновений была развита для газофазных реакций, для большого числа реакций второго порядка в растворах экспериментально определенные константы скорости близки к константам, предсказанным этой теорией. Таким образом, оказывается, что эффективное число столкновений в растворе сравнимо с соответствующим числом в газовой фазе. Это кажется удивительным, поскольку число столкновений должно уменьшаться в присутствии молекул растворителя. Предполагается, что растворитель окружает соударяющиеся частицы клеткой, которая удерживает их некоторое время, достаточное для того, чтобы могли произойти повторные столкновения [82].
Хотя теория столкновений была развита для газофазных реакций, для большого числа реакций второго порядка в растворах экспериментально определенные константы скорости близки к константам, предсказанным этой теорией. Таким образом, оказывается, что эффективное число столкновений в растворе сравнимо с соответствующим числом в газовой фазе. Это кажется удивительным, поскольку число столкновений должно уменьшаться в присутствии молекул растворителя. Предполагается, что растворитель окружает соударяющиеся частицы клеткой, которая удерживает их некоторое время, достаточное для того, чтобы могли произойти повторные столкновения [82].
Для мономолекулярных реакций также можно вывести выражение, аналогичное (5-16). В этом случае, естественно, стерический фактор неуместен, а частотный фактор уже не может быть нормальной частотой столкновений: довольно трудно представить, как столкновение может «активировать» молекулу, поскольку соударяющиеся молекулы имеют ббльшую энергию, но не реагируют. Поэтому для мономолекулярных реакций частотный фактор не является частотой столкновений, которая, согласно (5-17), пропорциональна  а принимает вид средней колебательной частоты, которую, по крайней мере в некоторых условиях [91], можно принять равной
а принимает вид средней колебательной частоты, которую, по крайней мере в некоторых условиях [91], можно принять равной  Последнее отношение входит в уравнение
Последнее отношение входит в уравнение  выведенное в теории активированного комплекса.
выведенное в теории активированного комплекса.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- 1. ВВЕДЕНИЕ
- 2. ОБЩИЕ ТИПЫ РЕАКЦИЙ
- 2.1. Простая реакция первого порядка
- 2.2. Простая реакция второго порядка
- 2.3. Две параллельные реакции первого порядка
- 2.4. Две параллельные реакции первого порядка с общим продуктом
- 2.5. Последовательность двух реакций первого порядка
- 2.6. Последовательность трех реакций первого порядка
- 2.7. Последовательность реакций смешанного (второго и первого) порядка
- 2.8. Обратимая реакция первого порядка
- 2.9. Обратимая реакция второго порядка
- 2.10. Обратимая реакция смешанного (первого и второго) порядка
- 2.11. Последовательность двух реакций первого порядка с обратимой первой стадией
- 2.12. Последовательность двух обратимых реакций первого порядка
- 2.13. Две параллельные обратимые реакции первого порядка с общим продуктом
- 2.14. Последовательность двух реакций второго и первого порядков с обратимой первой стадией
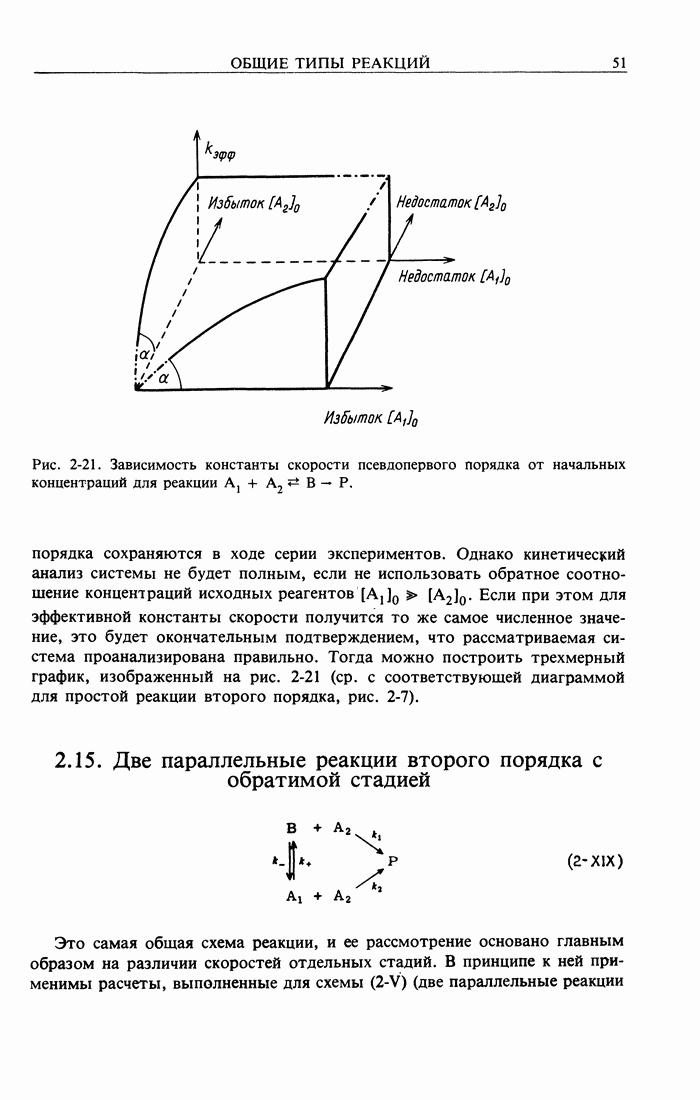
- 2.15. Две параллельные реакции второго порядка с обратимой стадией
- 3. ГОМОГЕННЫЕ КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
- 3.2. Каталитическая реакция первого порядка
- 3.3. Реакция нулевого порядка
- 3.4. Ингибирование катализатора
- 3.4.1. Обратимое ингибирование
- 3.4.2. Необратимое ингибирование
- 3.5. Автокаталитические реакции
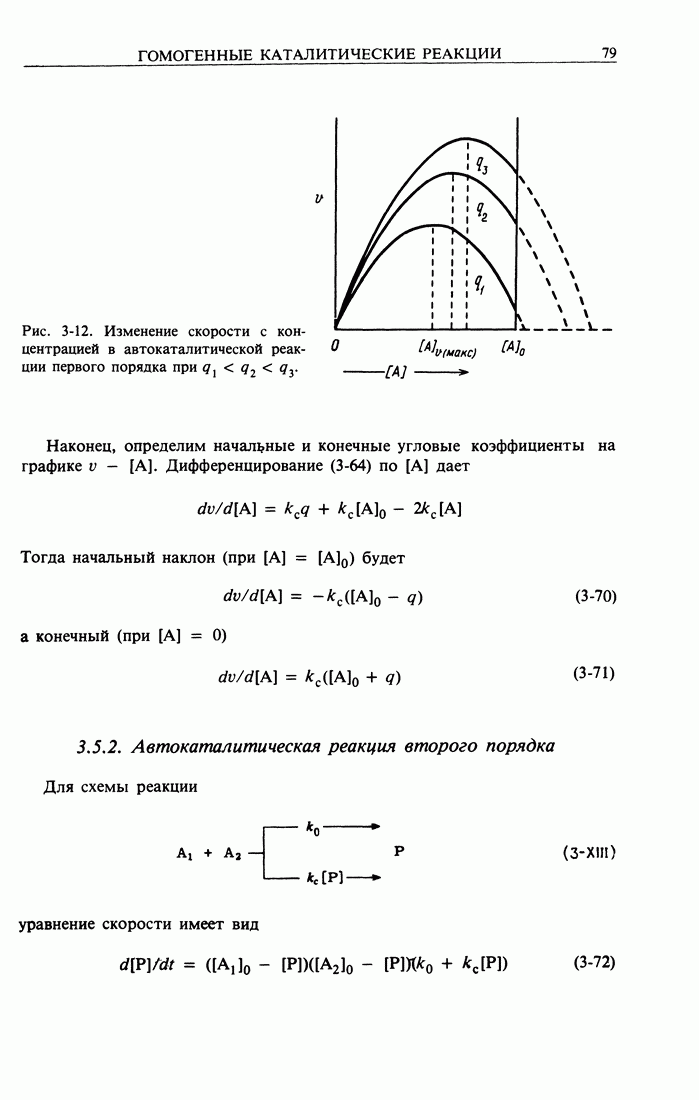
- 3.5.2. Автокаталитическая реакция второго порядка
- 4. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ: СИСТЕМАТИЧЕСКИЙ КИНЕТИЧЕСКИЙ АНАЛИЗ
- 4.2. Выбор условий эксперимента
- 4.3. Методы анализа кривых зависимости концентрации от времени
- 4.4. Порядок реакции и его значение
- 4.5. Математическая модель реакции
- 4.5.2. Из второй серии опытов
- 4.5.3. Из последующих серий опытов
- 4.6. Физическая модель реакции
- 4.7. Выводы
- 4.8. Схема и механизм реакции
- 5. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 5.1. Уравнение Аррениуса
- 5.2. Теория активированного комплекса
- 5.3. Теория столкновений
- 5.4. Сравнение выведенных уравнений
- 5.5. Физический смысл энтропии активации
- 5.6. Физический смысл энергии активации
- 5.7. Формы аррениусовских графиков
- 6. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
- 7. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
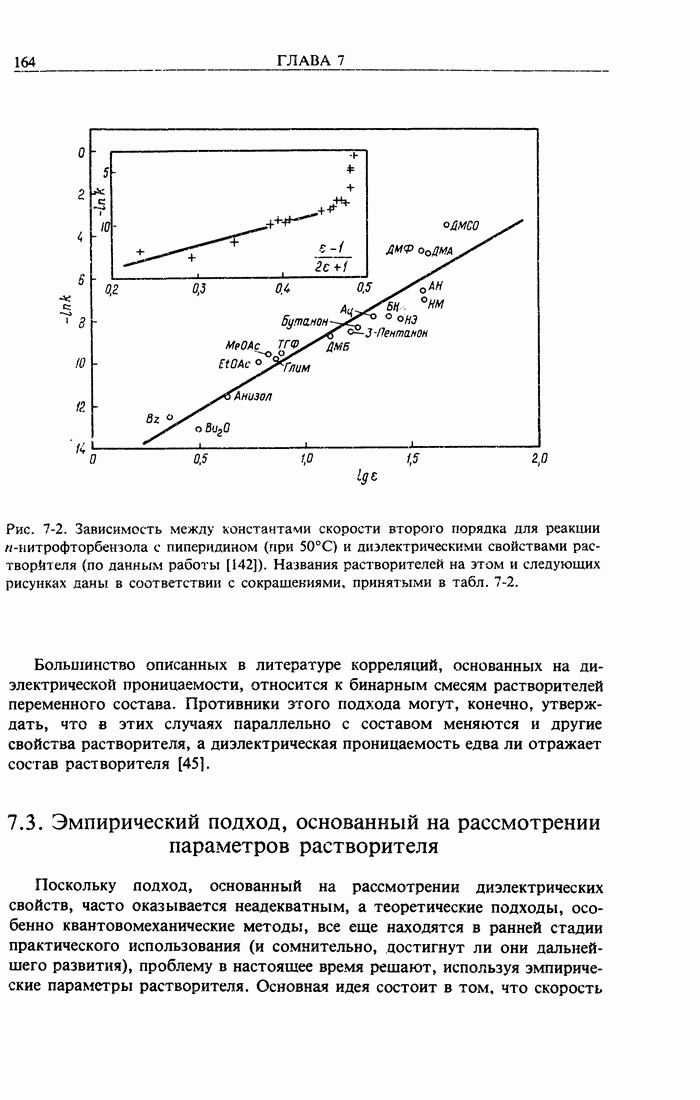
- 7.2. Подход, основанный на рассмотрении диэлектрической проницаемости
- 7.3. Эмпирический подход, основанный на рассмотрении параметров растворителя
- 7.5.2. Корреляции между донорными числами и другими шкалами
- 7.3.3. Корреляции между акцепторными числами и другими шкалами
- 7.3.4. Выводы
- 7.4. Согласование двух подходов
- 7.5. Современная ситуация
- 7.6. Экспериментальные доказательства
- 7.7. Влияние ионной силы растворителя
- 7.8. Сравнительная шкала донорной и акцепторной способности
- 8. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 8.2. Электронные эффекты
- 8.3. Стерические эффекты
- 8.4. Сведения о механизмах реакций
- 9. ПРИЛОЖЕНИЕ К ГЛАВАМ 7 И 8
- 10. ФИЗИЧЕСКОЕ ОБОСНОВАНИЕ ЭМПИРИЧЕСКИХ КОРРЕЛЯЦИЙ
- 10.2. Принцип линейности свободных энергий (принцип ЛСЭ)
- 10.3. Изокинетическое соотношение (ИКС)
- 10.3.1. Метод Экснера для установления ИКС
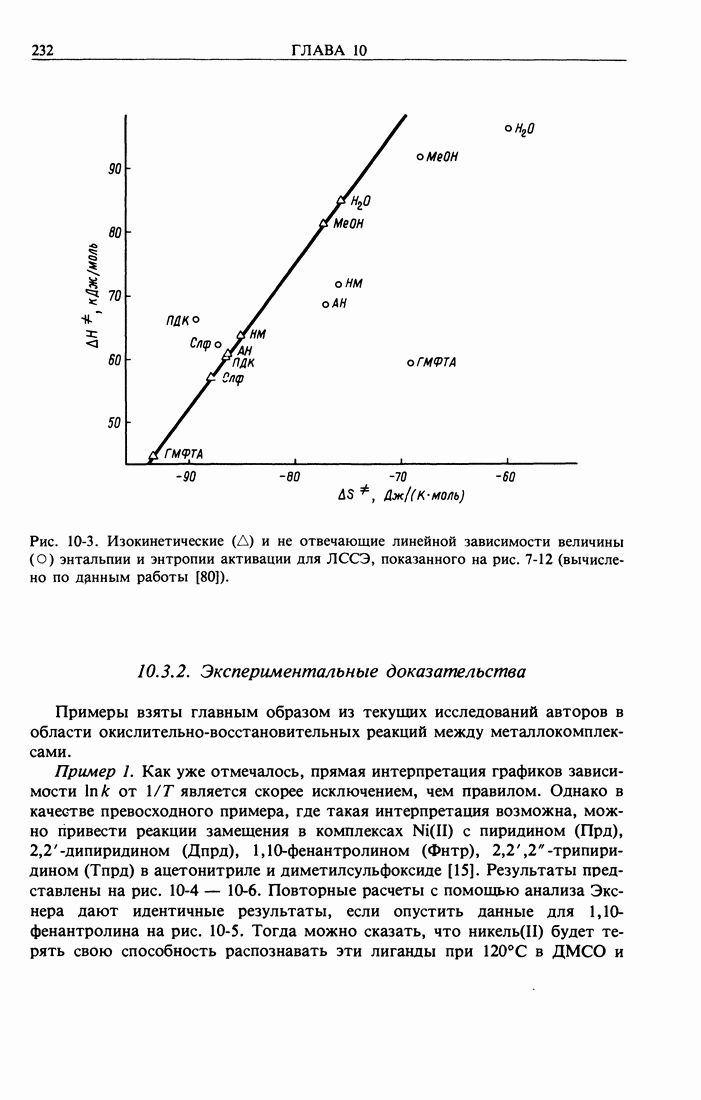
- 10.3.2. Экспериментальные доказательства
- 10.3.3. Практические следствия из изокинетических соотношений