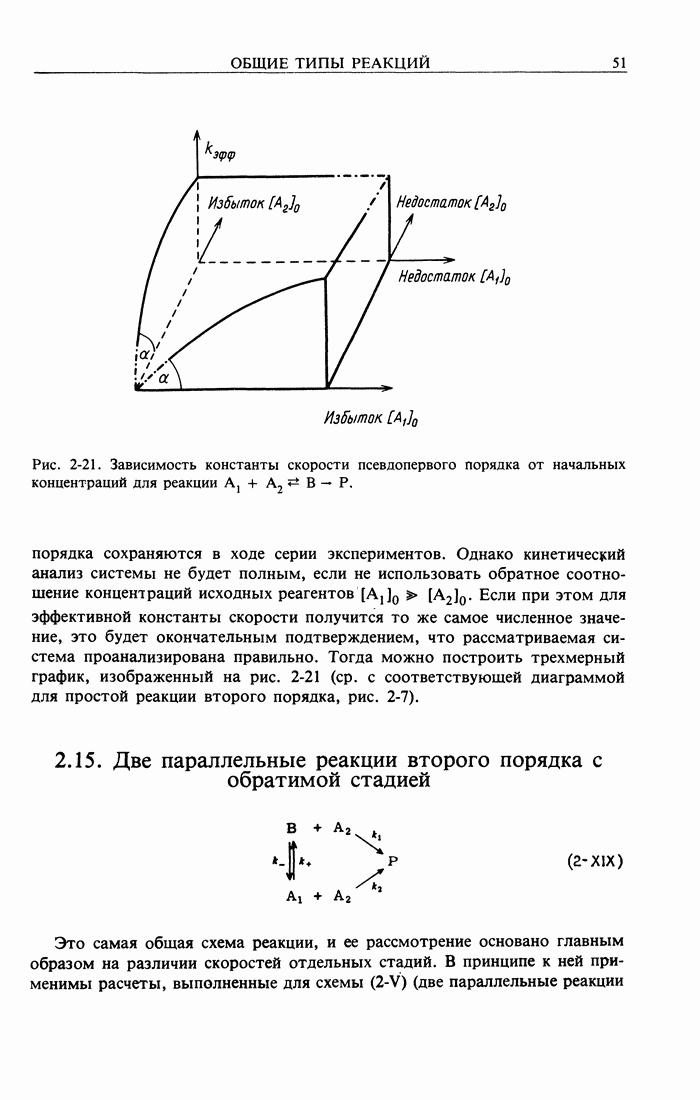
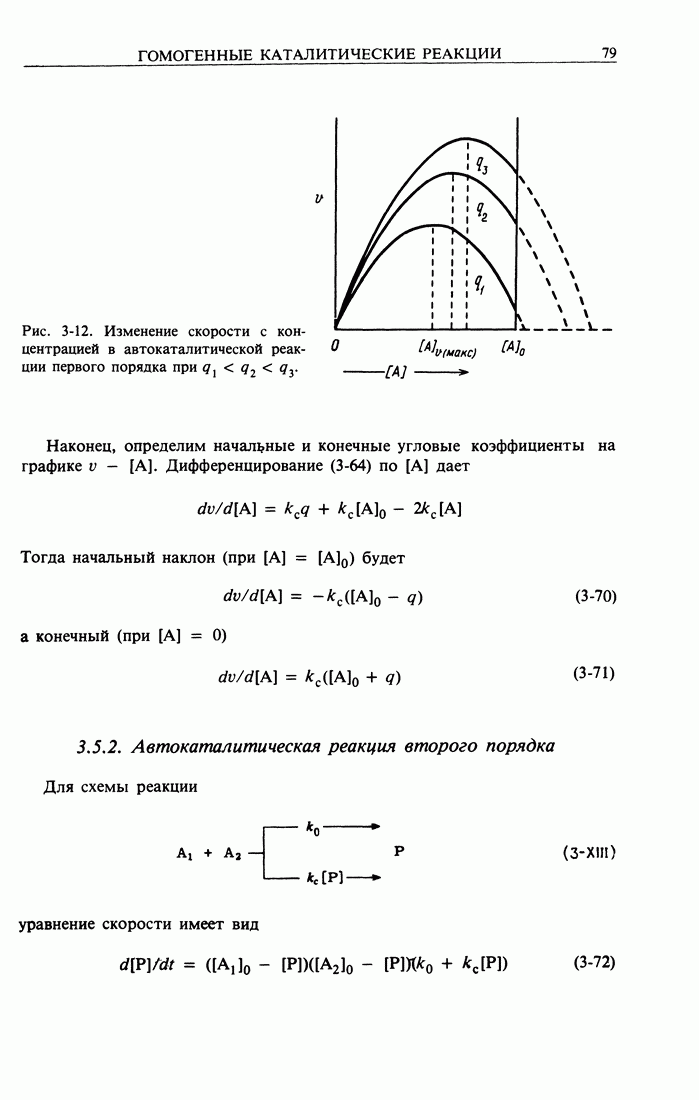
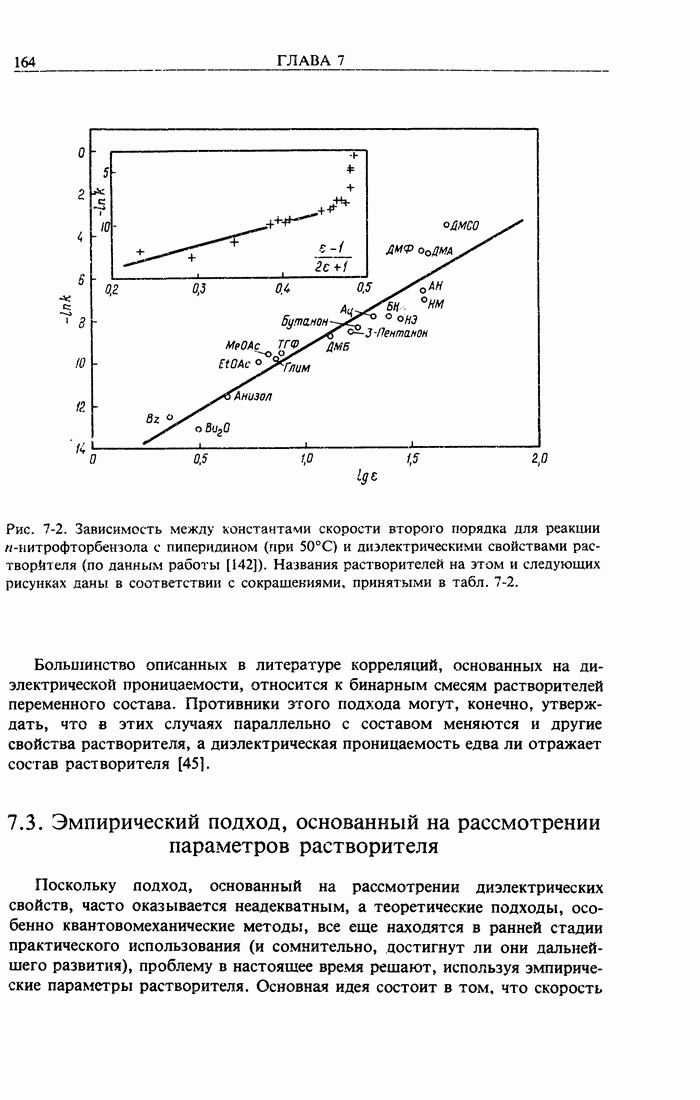
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
7. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
7.1. Основные положения
Для рассмотрения влияния растворителя на скорость реакции может быть успешно использована физическая интерпретация влияния температуры на скорость, основанная на теории активированного комплекса. Поскольку важным фактором наряду с энергией активации является и энтропия активации, на диаграмме энергии, соответствующей рис. 5-1, по ординате откладывают свободную энергию Гиббса  Действительно, нередко встречаются реакции, энергии активации которых близки, но скорости заметно различаются при одной и той же температуре. Это должно быть связано с разницей энтропий активации. В качестве ориентира полезно помнить, что сдвиг
Действительно, нередко встречаются реакции, энергии активации которых близки, но скорости заметно различаются при одной и той же температуре. Это должно быть связано с разницей энтропий активации. В качестве ориентира полезно помнить, что сдвиг  на
на  или
или  на
на  при комнатной температуре соответствует изменению константы скорости на один порядок. Таким образом, очевидно, что влияние растворителя на скорость необходимо обсудить с точки зрения свободной энергии. Могут наблюдаться следующие явления:
при комнатной температуре соответствует изменению константы скорости на один порядок. Таким образом, очевидно, что влияние растворителя на скорость необходимо обсудить с точки зрения свободной энергии. Могут наблюдаться следующие явления:
1. Свободная энергия иона сильно уменьшается при переходе от газообразного состояния к раствору. Другими словами, ион стабилизируется.
2. Для каждого растворителя характерна определенная степень уменьшения свободной энергии, т.е. перенос ионов в растворителях сопровождается изменением свободной энергии. Это видно, например, по величинам Паркера для свободной энергии переноса ионов калия и хлора в растворителях  эти величины, выражаемые в
эти величины, выражаемые в  могут меняться на несколько порядков [84, 105]. Изменение свободной энергии возрастает с увеличением поверхностного заряда иона. Это означает, что чем меньше размер и больше заряд иона, тем сильнее он сольватирован. Величины Паркера
могут меняться на несколько порядков [84, 105]. Изменение свободной энергии возрастает с увеличением поверхностного заряда иона. Это означает, что чем меньше размер и больше заряд иона, тем сильнее он сольватирован. Величины Паркера  для некоторых ионов можно найти в работе [105].
для некоторых ионов можно найти в работе [105].
3. Изменение свободной энергии происходит и при переносе в растворителе незаряженных полярных частиц, хотя в этом случае оно и менее выражено. К примеру, свободная энергия переноса  -бутилхлорида значительно меньше, чем хлорид-иона. Чем выше полярность молекулы, тем чувствительнее она к сольватации.
-бутилхлорида значительно меньше, чем хлорид-иона. Чем выше полярность молекулы, тем чувствительнее она к сольватации.
4. Относительное понижение свободной энергии растворенных веществ при переносе из газовой фазы в определенный растворитель обычно уменьшается в ряду

Следует, однако, отметить, что ион необязательно более способен к сольватации, чем нейтральная молекула, поскольку поверхностный заряд иона может быть меньше, чем поверхностный заряд электронообогащенного или электронодефицитного центра диполя. Например, поверхностный заряд иодид-иона намного меньше, чем поверхностный заряд кислорода в незаряженном амиде гексаметилфосфорной кислоты [44].
Рассматривая эти четыре положения как полезные и удобные правила, можно исследовать зависимость скорости от растворителя с точки зрения изменения  вызываемого различной степенью сольватации активированного комплекса и исходных реагентов. Это показано пунктирными линиями на рис. 7-1. Подобная обработка данных по влиянию растворителя на скорость была предложена Паркером [104, 105]. Основной момент такого подхода состоит в том, чтобы разницу свободных энергий сольватации исходных веществ и активированного комплекса смоделировать реальным химическим равновесием, т.е. рассматривать активированный комплекс как химическое соединение. Очевидно, перенос растворителя влияет также на свободную энергию реакции
вызываемого различной степенью сольватации активированного комплекса и исходных реагентов. Это показано пунктирными линиями на рис. 7-1. Подобная обработка данных по влиянию растворителя на скорость была предложена Паркером [104, 105]. Основной момент такого подхода состоит в том, чтобы разницу свободных энергий сольватации исходных веществ и активированного комплекса смоделировать реальным химическим равновесием, т.е. рассматривать активированный комплекс как химическое соединение. Очевидно, перенос растворителя влияет также на свободную энергию реакции  а следовательно, и на константу равновесия, но этот вопрос выходит за рамки настоящей книги.
а следовательно, и на константу равновесия, но этот вопрос выходит за рамки настоящей книги.
Разница в степени сольватации активированного комплекса и реагентов должна наблюдаться, если имели место адекватные изменения полярности

Рис. 7-1. Изменение свободной энергии активации, связанное с изменениями свободных энергий начального и переходного состояний.
связей, т.е. изменения относительных зарядов участвующих в реакции атомов. Как правило, элементарные реакции (обычно рассматриваемые как лимитирующие стадии сложных реакций), в которых заряд либо образуется, либо локализуется, происходят быстрее в среде с большей сольватирующей способностью и наоборот. Это дает основания предположить, что по своей природе активированный комплекс занимает промежуточное положение между начальным и конечным состояниями. Разделим элементарные реакции по типам зарядов следующим образом.
Скорость может увеличиваться при переходе в среду с большей сольватирующей способностью, если 1) нейтральные молекулы образуют высокополярный активированный комплекс, например при гетеролизе ковалентных связей; 2) два иона с зарядами одного знака движутся вместе. Тогда увеличение скорости происходит благодаря концентрации заряда. Например, двухвалентный ион, как правило, более чувствителен к переносу растворителем, чем два одновалентных иона (ср. с чувствительностью катионов к переносу растворителем в зависимости от заряда в табл. III работы [105]).
Скорость может уменьшаться при переходе в среду с большей сольватирующей способностью, если 1) две полярные молекулы образуют активированный комплекс со значительно меньшим относительным зарядом; 2) ион реагирует с нейтральной молекулой. Понижение скорости обусловлено размазыванием заряда, иными словами, уменьшением поверхностного заряда; 3) два иона противоположного знака движутся вместе (исчезновение заряда).
Прежде чем перейти к рассмотрению экспериментальных доказательств, необходимо охарактеризовать сольватирующую способность растворителей. Это один из тех вопросов, в которых имеется очень много противоречий и неясностей. В последующих разделах будут затронуты некоторые исторические аспекты.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- 1. ВВЕДЕНИЕ
- 2. ОБЩИЕ ТИПЫ РЕАКЦИЙ
- 2.1. Простая реакция первого порядка
- 2.2. Простая реакция второго порядка
- 2.3. Две параллельные реакции первого порядка
- 2.4. Две параллельные реакции первого порядка с общим продуктом
- 2.5. Последовательность двух реакций первого порядка
- 2.6. Последовательность трех реакций первого порядка
- 2.7. Последовательность реакций смешанного (второго и первого) порядка
- 2.8. Обратимая реакция первого порядка
- 2.9. Обратимая реакция второго порядка
- 2.10. Обратимая реакция смешанного (первого и второго) порядка
- 2.11. Последовательность двух реакций первого порядка с обратимой первой стадией
- 2.12. Последовательность двух обратимых реакций первого порядка
- 2.13. Две параллельные обратимые реакции первого порядка с общим продуктом
- 2.14. Последовательность двух реакций второго и первого порядков с обратимой первой стадией
- 2.15. Две параллельные реакции второго порядка с обратимой стадией
- 3. ГОМОГЕННЫЕ КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
- 3.2. Каталитическая реакция первого порядка
- 3.3. Реакция нулевого порядка
- 3.4. Ингибирование катализатора
- 3.4.1. Обратимое ингибирование
- 3.4.2. Необратимое ингибирование
- 3.5. Автокаталитические реакции
- 3.5.2. Автокаталитическая реакция второго порядка
- 4. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ: СИСТЕМАТИЧЕСКИЙ КИНЕТИЧЕСКИЙ АНАЛИЗ
- 4.2. Выбор условий эксперимента
- 4.3. Методы анализа кривых зависимости концентрации от времени
- 4.4. Порядок реакции и его значение
- 4.5. Математическая модель реакции
- 4.5.2. Из второй серии опытов
- 4.5.3. Из последующих серий опытов
- 4.6. Физическая модель реакции
- 4.7. Выводы
- 4.8. Схема и механизм реакции
- 5. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 5.1. Уравнение Аррениуса
- 5.2. Теория активированного комплекса
- 5.3. Теория столкновений
- 5.4. Сравнение выведенных уравнений
- 5.5. Физический смысл энтропии активации
- 5.6. Физический смысл энергии активации
- 5.7. Формы аррениусовских графиков
- 6. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
- 7. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
- 7.2. Подход, основанный на рассмотрении диэлектрической проницаемости
- 7.3. Эмпирический подход, основанный на рассмотрении параметров растворителя
- 7.5.2. Корреляции между донорными числами и другими шкалами
- 7.3.3. Корреляции между акцепторными числами и другими шкалами
- 7.3.4. Выводы
- 7.4. Согласование двух подходов
- 7.5. Современная ситуация
- 7.6. Экспериментальные доказательства
- 7.7. Влияние ионной силы растворителя
- 7.8. Сравнительная шкала донорной и акцепторной способности
- 8. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 8.2. Электронные эффекты
- 8.3. Стерические эффекты
- 8.4. Сведения о механизмах реакций
- 9. ПРИЛОЖЕНИЕ К ГЛАВАМ 7 И 8
- 10. ФИЗИЧЕСКОЕ ОБОСНОВАНИЕ ЭМПИРИЧЕСКИХ КОРРЕЛЯЦИЙ
- 10.2. Принцип линейности свободных энергий (принцип ЛСЭ)
- 10.3. Изокинетическое соотношение (ИКС)
- 10.3.1. Метод Экснера для установления ИКС
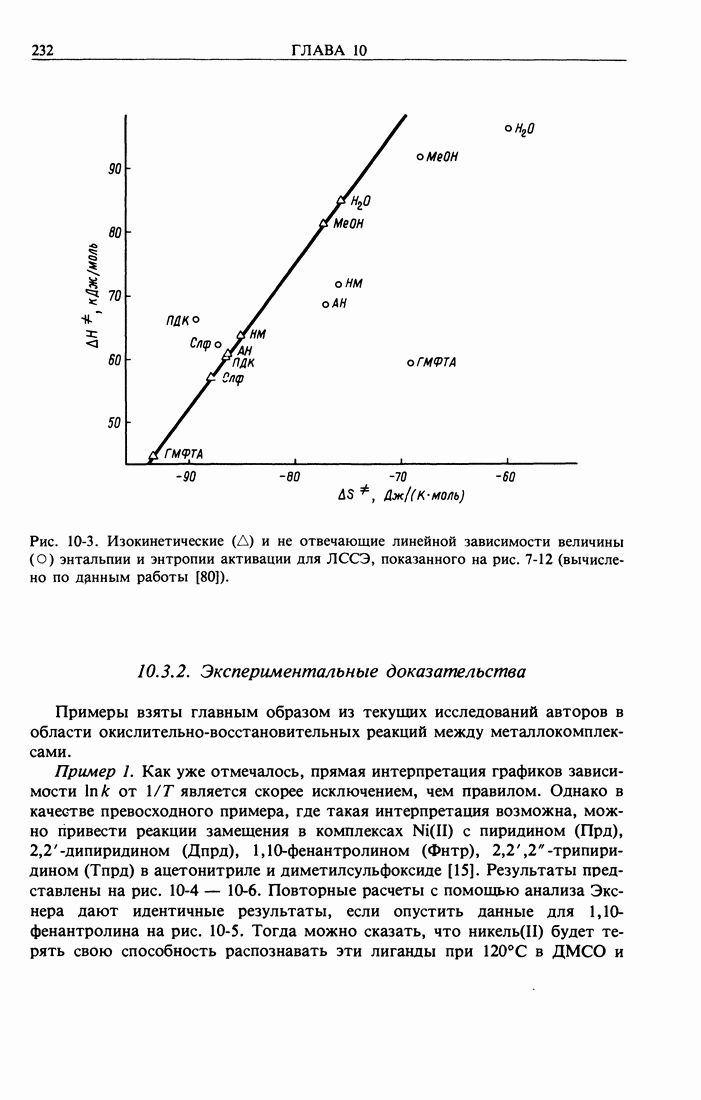
- 10.3.2. Экспериментальные доказательства
- 10.3.3. Практические следствия из изокинетических соотношений