| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
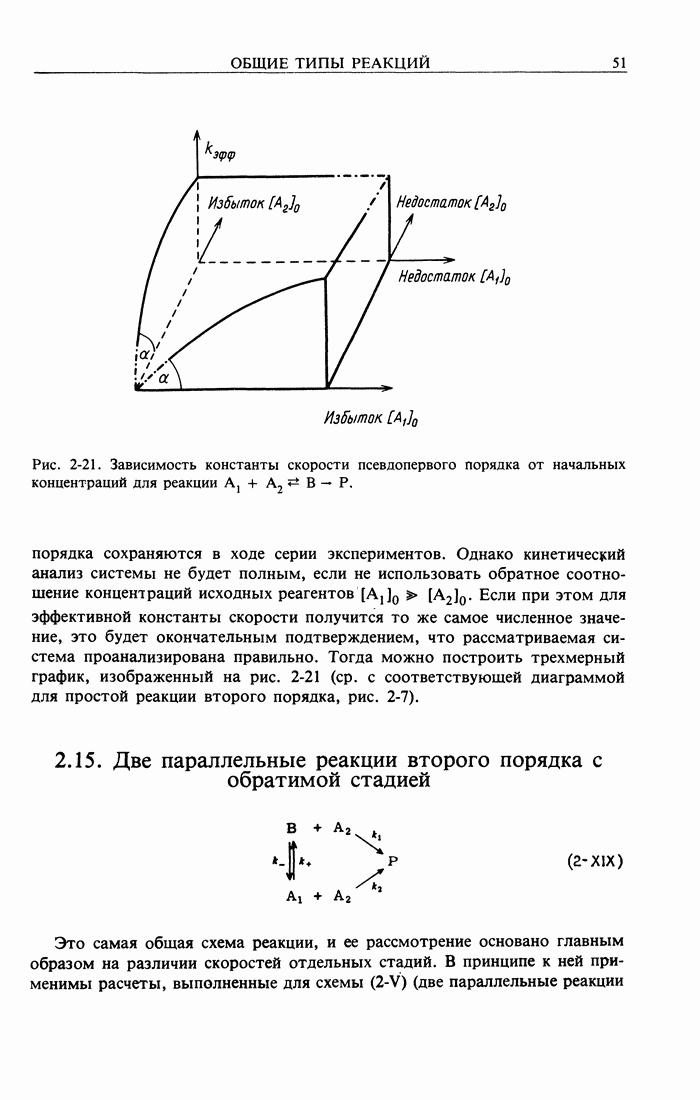
2.15. Две параллельные реакции второго порядка с обратимой стадией

Это самая общая схема реакции, и ее рассмотрение основано главным образом на различии скоростей отдельных стадий. В принципе к ней применимы расчеты, выполненные для схемы  (две параллельные реакции
(две параллельные реакции
первого порядка с общим продуктом) и для схемы (2-XIV) (обратимая реакция первого порядка с последующей реакцией первого порядка).
Допустим, что в растворе вещества  обратимая реакция
обратимая реакция  В достигает положения равновесия
В достигает положения равновесия

и при добавлении  начинается образование
начинается образование  В условиях псевдопервого порядка
В условиях псевдопервого порядка  график зависимости
график зависимости  от времени имеет форму кривой, которая может перейти в прямую на конечных стадиях (ср. с рис. 2-9, б), причем ее отрицательный угловой коэффициент представляет эффективную константу скорости первого порядка в виде суммы (если
от времени имеет форму кривой, которая может перейти в прямую на конечных стадиях (ср. с рис. 2-9, б), причем ее отрицательный угловой коэффициент представляет эффективную константу скорости первого порядка в виде суммы (если  ):
):

Продолжив линейную часть кривой в обратном направлении  можно разделить
можно разделить  добавленное в начале реакции, на равновесные концентрации
добавленное в начале реакции, на равновесные концентрации

и таким образом вычислить константу равновесия. Эффективную константу скорости  можно получить из кривой, соответствующей ранним стадиям реакции, с помощью процедуры линеаризации, аналогичной той, что показана на рис. 2-9, б и 2-19. Затем, используя различные избытки
можно получить из кривой, соответствующей ранним стадиям реакции, с помощью процедуры линеаризации, аналогичной той, что показана на рис. 2-9, б и 2-19. Затем, используя различные избытки  можно определить реальные константы скорости. Наклон прямой, выражающей зависимость
можно определить реальные константы скорости. Наклон прямой, выражающей зависимость  от
от  дает
дает  Зависимость
Зависимость  от
от  также линейна, но прямая не проходит через начало координат; ее наклон и участок, отсекаемый на координатной оси, дают
также линейна, но прямая не проходит через начало координат; ее наклон и участок, отсекаемый на координатной оси, дают  соответственно. Наконец, зная К и к
соответственно. Наконец, зная К и к  можно вычислить
можно вычислить 
Рассмотрим теперь начальные скорости. Соответствующие уравнения имеют вид

где при 
Начальные скорости можно выразить через равновесные концентрации:

или через начальные концентрации:

Очевидно, что в любом случае значение  постоянно. Практически обычно контролируют
постоянно. Практически обычно контролируют  поэтому
поэтому

Трактовка реакции, происходящей по рассматриваемой схеме, упрощается при возрастании разности скоростей отдельных стадий. Например, если отношение  имеет достаточную величину и В намного более реакционноспособно, чем
имеет достаточную величину и В намного более реакционноспособно, чем  то кривые зависимости концентрации от времени
то кривые зависимости концентрации от времени  разделяются для двух различимых стадий, которые можно проанализировать по отдельности. Примером служит восстановление гексаакважелеза
разделяются для двух различимых стадий, которые можно проанализировать по отдельности. Примером служит восстановление гексаакважелеза  трис(3,4,7,8-тетраметил-1,10-фенантро-лин)железом(П) (Т2+) в растворителях с низкой координирующей способностью, таких, как нитрометан
трис(3,4,7,8-тетраметил-1,10-фенантро-лин)железом(П) (Т2+) в растворителях с низкой координирующей способностью, таких, как нитрометан  ацетонитрил
ацетонитрил  пропиленкарбонат
пропиленкарбонат  [124]:
[124]:

На рис. 2-22 показана осциллограмма образования  при
при  полученная для соотношения реагентов
полученная для соотношения реагентов  в
в  Тот факт, что существуют две стадии реакции, включающие по-разному активные гидраты
Тот факт, что существуют две стадии реакции, включающие по-разному активные гидраты  скажем
скажем  следует из наблюдения, что вклад быстрой стадии в общее изменение спектральной поглощательной способности не зависит от
следует из наблюдения, что вклад быстрой стадии в общее изменение спектральной поглощательной способности не зависит от  взятого в избытке, но увеличивается при добавлении избытка гидрата. При более чем двукратном избытке гидрата медленная стадия вообще исчезает. Далее, о равновесии между
взятого в избытке, но увеличивается при добавлении избытка гидрата. При более чем двукратном избытке гидрата медленная стадия вообще исчезает. Далее, о равновесии между  свидетельствует появление быстрой стадии, даже в том случае, когда используется раствор
свидетельствует появление быстрой стадии, даже в том случае, когда используется раствор  содержащий точно такое количество
содержащий точно такое количество  которое необходимо для разрушения
которое необходимо для разрушения 

Рис. 2-22. Осциллограмма реакции  для эквимолярной смеси
для эквимолярной смеси  реагентов по полосе поглощения при
реагентов по полосе поглощения при  Развертка по оси времени 5 с/дюйм и
Развертка по оси времени 5 с/дюйм и  чувствительность 0,1 В/см.
чувствительность 0,1 В/см.
Из рис. 2-22 видно, что в шкале времени, подходящей для отображения первой стадия, изменение поглощения, связанное со второй стадией, практически линейно. Эту прямую рассматривают как касательную и непосредственно обрабатывают данные, относящиеся к первой стадии. Эта прямая позволяет также оценить константу равновесия, которая оказывается независимой от концентрации. Так, в пропиленкарбонате  (рис. 2-22). В нитрометане
(рис. 2-22). В нитрометане  и ацетонитриле
и ацетонитриле  начальная концентрация
начальная концентрация  намного меньше, и вычисленные значения К составляют 0,02 и 0,04 соответственно. С помощью методов, описанных в разд. 2.2, показано, что быстрая стадия во всех трех растворителях имеет второй порядок: первый по каждому из реагентов
намного меньше, и вычисленные значения К составляют 0,02 и 0,04 соответственно. С помощью методов, описанных в разд. 2.2, показано, что быстрая стадия во всех трех растворителях имеет второй порядок: первый по каждому из реагентов  С другой стороны, кинетика второй стадии в выбранных растворителях различается следующим образом.
С другой стороны, кинетика второй стадии в выбранных растворителях различается следующим образом.
В  при стехиометрическом соотношении реагентов эта стадия имеет первый порядок. Серия измерений с недостатком
при стехиометрическом соотношении реагентов эта стадия имеет первый порядок. Серия измерений с недостатком  дает кривые зависимости
дает кривые зависимости  от времени, которые более или менее резко обрываются (ср. с рис. 3-1, в и г), что указывает на нулевой порядок реакции по
от времени, которые более или менее резко обрываются (ср. с рис. 3-1, в и г), что указывает на нулевой порядок реакции по  Это точно такая же ситуация, которая была описана для схемы (2-XV) в случае, когда образование интермедиата является лимитирующей стадией. Соответственно
Это точно такая же ситуация, которая была описана для схемы (2-XV) в случае, когда образование интермедиата является лимитирующей стадией. Соответственно  медленно превращается в
медленно превращается в  который затем быстро реагирует с
который затем быстро реагирует с  давая
давая  Таким образом, константа скорости первого
Таким образом, константа скорости первого
порядка, получаемая при соотношении реагентов  а также при небольшом (для осуществления второй стадии) избытке
а также при небольшом (для осуществления второй стадии) избытке  относится к образованию
относится к образованию  с уравнением (2-110)]. В отличие от этого в
с уравнением (2-110)]. В отличие от этого в  вторая стадия имеет второй порядок: первый по каждому из реагентов
вторая стадия имеет второй порядок: первый по каждому из реагентов  Затем
Затем  реагирует, по крайней мере преимущественно, непосредственно с
реагирует, по крайней мере преимущественно, непосредственно с  образуя конечный продукт. В серии измерений в
образуя конечный продукт. В серии измерений в  с избытком
с избытком  проявляется реакция второго порядка, но конверсия не превышает 50—60%. Далее порядок реакции усложняется, а разрыв в кривых снова указывает на реакцию нулевого порядка по
проявляется реакция второго порядка, но конверсия не превышает 50—60%. Далее порядок реакции усложняется, а разрыв в кривых снова указывает на реакцию нулевого порядка по  По-видимому, разные реакции, наблюдаемые в
По-видимому, разные реакции, наблюдаемые в  и
и  происходят одновременно в
происходят одновременно в  Это подтверждается графиком зависимости констант скоростей псевдопервого порядка от
Это подтверждается графиком зависимости констант скоростей псевдопервого порядка от  избытке), который представляет собой прямую, не проходящую через начало координат. По наклону прямой и пересечению с координатной осью рассчитывают константы скорости соответственно для образования
избытке), который представляет собой прямую, не проходящую через начало координат. По наклону прямой и пересечению с координатной осью рассчитывают константы скорости соответственно для образования  и для реакции
и для реакции 
Поскольку последние участки (приблизительно 3—5%) кинетических кривых в  также имеют некоторый излом, а, с другой стороны, кривые в
также имеют некоторый излом, а, с другой стороны, кривые в  сглажены, представляется вероятной следующая общая схема реакции в трех рассмотренных растворителях:
сглажены, представляется вероятной следующая общая схема реакции в трех рассмотренных растворителях:

где для  и
и  могут быть установлены только верхние предельные значения
могут быть установлены только верхние предельные значения  соответственно. Подробные сведения об этом можно найти в статье, которая обсуждалась здесь. Иногда замена растворителя может помочь установлению более общих схем реакции.
соответственно. Подробные сведения об этом можно найти в статье, которая обсуждалась здесь. Иногда замена растворителя может помочь установлению более общих схем реакции.
Схема (2-XIX) применима также к органическим реакциям, например к реакциям смешанного  механизма. В этом случае стадия
механизма. В этом случае стадия  В является реакцией диссоциации с участием растворителя, протекающей по псевдопервому порядку (ср. с разд. 7.6). В сущности, чистые реакции
В является реакцией диссоциации с участием растворителя, протекающей по псевдопервому порядку (ср. с разд. 7.6). В сущности, чистые реакции  или
или  проявляются только как предельные случаи.
проявляются только как предельные случаи.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- 1. ВВЕДЕНИЕ
- 2. ОБЩИЕ ТИПЫ РЕАКЦИЙ
- 2.1. Простая реакция первого порядка
- 2.2. Простая реакция второго порядка
- 2.3. Две параллельные реакции первого порядка
- 2.4. Две параллельные реакции первого порядка с общим продуктом
- 2.5. Последовательность двух реакций первого порядка
- 2.6. Последовательность трех реакций первого порядка
- 2.7. Последовательность реакций смешанного (второго и первого) порядка
- 2.8. Обратимая реакция первого порядка
- 2.9. Обратимая реакция второго порядка
- 2.10. Обратимая реакция смешанного (первого и второго) порядка
- 2.11. Последовательность двух реакций первого порядка с обратимой первой стадией
- 2.12. Последовательность двух обратимых реакций первого порядка
- 2.13. Две параллельные обратимые реакции первого порядка с общим продуктом
- 2.14. Последовательность двух реакций второго и первого порядков с обратимой первой стадией
- 2.15. Две параллельные реакции второго порядка с обратимой стадией
- 3. ГОМОГЕННЫЕ КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
- 3.2. Каталитическая реакция первого порядка
- 3.3. Реакция нулевого порядка
- 3.4. Ингибирование катализатора
- 3.4.1. Обратимое ингибирование
- 3.4.2. Необратимое ингибирование
- 3.5. Автокаталитические реакции
- 3.5.2. Автокаталитическая реакция второго порядка
- 4. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ: СИСТЕМАТИЧЕСКИЙ КИНЕТИЧЕСКИЙ АНАЛИЗ
- 4.2. Выбор условий эксперимента
- 4.3. Методы анализа кривых зависимости концентрации от времени
- 4.4. Порядок реакции и его значение
- 4.5. Математическая модель реакции
- 4.5.2. Из второй серии опытов
- 4.5.3. Из последующих серий опытов
- 4.6. Физическая модель реакции
- 4.7. Выводы
- 4.8. Схема и механизм реакции
- 5. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 5.1. Уравнение Аррениуса
- 5.2. Теория активированного комплекса
- 5.3. Теория столкновений
- 5.4. Сравнение выведенных уравнений
- 5.5. Физический смысл энтропии активации
- 5.6. Физический смысл энергии активации
- 5.7. Формы аррениусовских графиков
- 6. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
- 7. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
- 7.2. Подход, основанный на рассмотрении диэлектрической проницаемости
- 7.3. Эмпирический подход, основанный на рассмотрении параметров растворителя
- 7.5.2. Корреляции между донорными числами и другими шкалами
- 7.3.3. Корреляции между акцепторными числами и другими шкалами
- 7.3.4. Выводы
- 7.4. Согласование двух подходов
- 7.5. Современная ситуация
- 7.6. Экспериментальные доказательства
- 7.7. Влияние ионной силы растворителя
- 7.8. Сравнительная шкала донорной и акцепторной способности
- 8. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 8.2. Электронные эффекты
- 8.3. Стерические эффекты
- 8.4. Сведения о механизмах реакций
- 9. ПРИЛОЖЕНИЕ К ГЛАВАМ 7 И 8
- 10. ФИЗИЧЕСКОЕ ОБОСНОВАНИЕ ЭМПИРИЧЕСКИХ КОРРЕЛЯЦИЙ
- 10.2. Принцип линейности свободных энергий (принцип ЛСЭ)
- 10.3. Изокинетическое соотношение (ИКС)
- 10.3.1. Метод Экснера для установления ИКС
- 10.3.2. Экспериментальные доказательства
- 10.3.3. Практические следствия из изокинетических соотношений