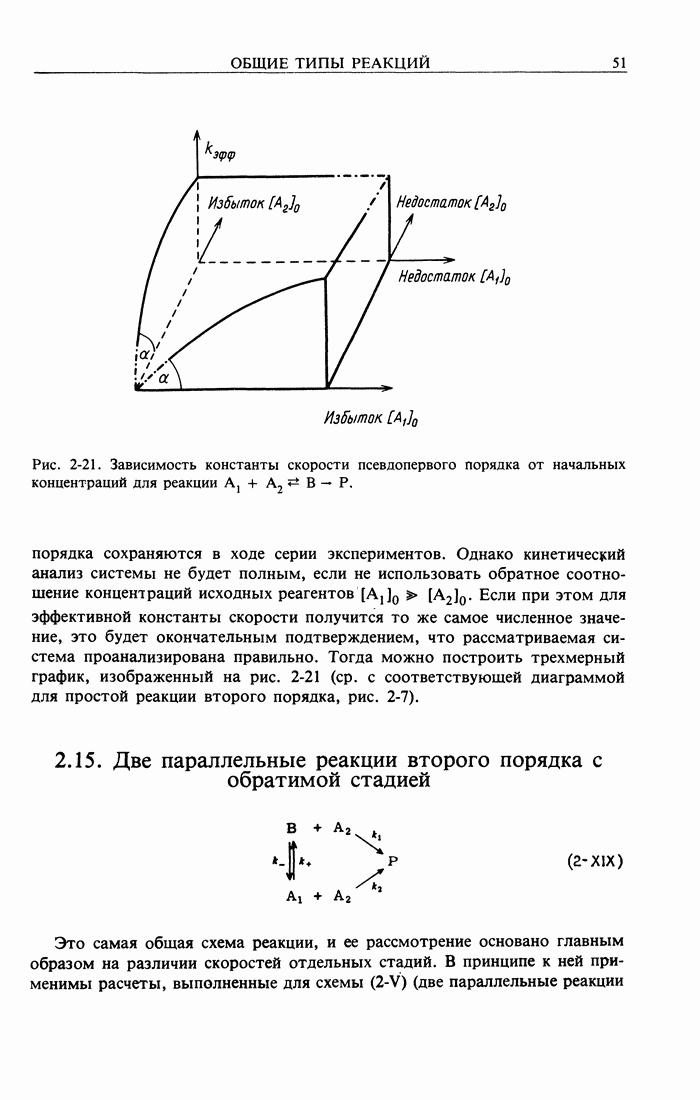
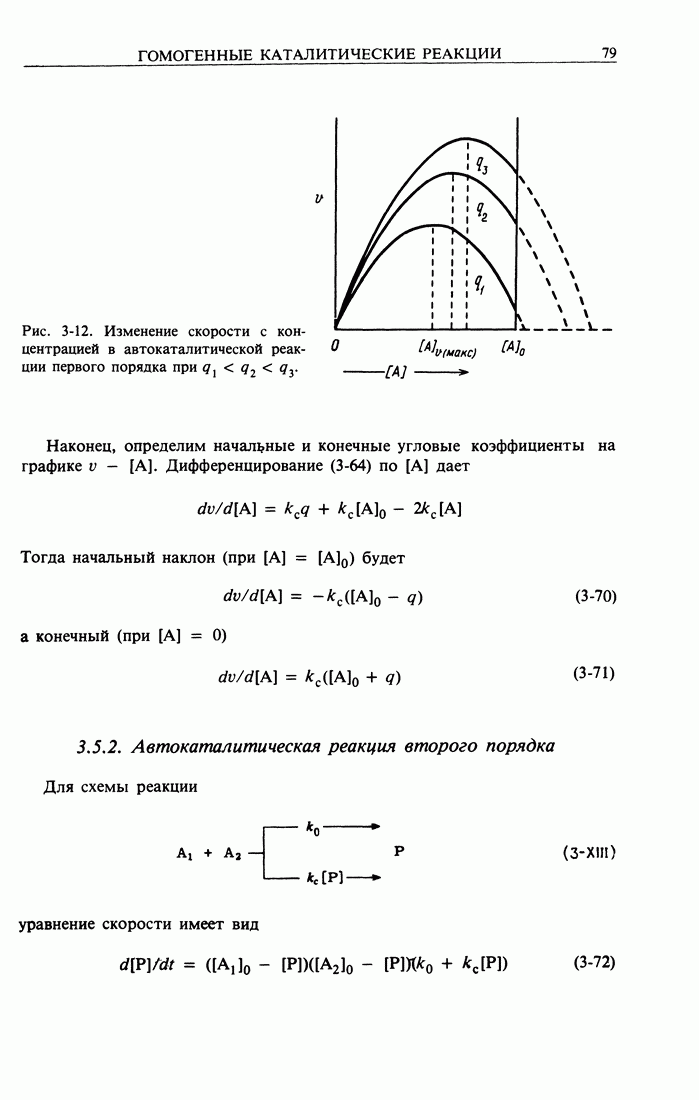
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
6. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
В последнее время стало ясно, что большое значение имеет и третья величина, характеризующая переходное состояние, а именно активационный объем, который выводится из зависимости констант скорости от давления. По этому вопросу имеются авторитетные обзорные работы, касающиеся как органических [67, 94, 152], так и неорганических систем [141] (см. также [95, 102]); здесь мы ограничимся лишь некоторыми общими моментами. В частности, представляется интересным сравнить энтропию активации и активационный объем.
В соответствии с теорией переходного состояния зависимость константы скорости одностадийной жидкофазной реакции от давления можно выразить следующим уравнением [ср. с уравнением (5-5)]:

где  активационный объем, т.е. изменение объема, связанное с процессом аквации. Строго говоря, уравнение
активационный объем, т.е. изменение объема, связанное с процессом аквации. Строго говоря, уравнение  справедливо только для констант к, выраженных через моляльность или мольные доли. Если используются обычные константы скорости, измеренные по концентрации, то увеличение концентрации за счет сжатия раствора также должно учитываться:
справедливо только для констант к, выраженных через моляльность или мольные доли. Если используются обычные константы скорости, измеренные по концентрации, то увеличение концентрации за счет сжатия раствора также должно учитываться:

Здесь  порядок реакции,
порядок реакции,  коэффициент изотермической сжимаемости растворителя [7]. Таким образом, для реакции первого порядка уравнение
коэффициент изотермической сжимаемости растворителя [7]. Таким образом, для реакции первого порядка уравнение  сводится к уравнению
сводится к уравнению  Это следует также из того факта, что константа скорости первого порядка не зависит от концентрации. Для процесса активации второго порядка
Это следует также из того факта, что константа скорости первого порядка не зависит от концентрации. Для процесса активации второго порядка  (Аактивационный объем выражается как
(Аактивационный объем выражается как

При 25° С и 1 атм член  должен составлять
должен составлять  что сравнимо с величиной активационных объемов, обычно лежащей в интервале
что сравнимо с величиной активационных объемов, обычно лежащей в интервале  Очевидно, приведенные выше (и далее) уравнения справедливы при постоянной температуре.
Очевидно, приведенные выше (и далее) уравнения справедливы при постоянной температуре.
Уравнениям  и
и  должны соответствовать линейные графики зависимости
должны соответствовать линейные графики зависимости  от
от  Однако практически часто получаются явные кривые, что указывает на зависимость
Однако практически часто получаются явные кривые, что указывает на зависимость  от давления. Поэтому сравнения обычно основываются на активационных объемах при нулевом давлении
от давления. Поэтому сравнения обычно основываются на активационных объемах при нулевом давлении  Эти величины либо вычисляют графическими методами, определяя начальный наклон кривой зависимости
Эти величины либо вычисляют графическими методами, определяя начальный наклон кривой зависимости  от
от  либо находят путем сравнения экспериментальных точек с уравнением, добиваясь наилучшего соответствия:
либо находят путем сравнения экспериментальных точек с уравнением, добиваясь наилучшего соответствия:

Обратимся теперь к сравнению энтропии активации и активационного объема. Как уже отмечалось ранее, необходима осторожность при интерпретации численных значений  если нет других независимых критериев. Понятие активационного объема легче представить на элементарном уровне, поскольку изменение объема связано только с изменением положений ядер, тогда как изменение энтропии следует и из изменения положений ядер, и из изменения энергии. Однако интерпретация активационных объемов с точки зрения механизма не всегда ясна. Кроме того, аналогично
если нет других независимых критериев. Понятие активационного объема легче представить на элементарном уровне, поскольку изменение объема связано только с изменением положений ядер, тогда как изменение энтропии следует и из изменения положений ядер, и из изменения энергии. Однако интерпретация активационных объемов с точки зрения механизма не всегда ясна. Кроме того, аналогично  сложность заключается в том, что величина
сложность заключается в том, что величина  отражает [как и уравнение (5-28) для
отражает [как и уравнение (5-28) для  не только истинную, внутреннюю разницу молекулярных размеров переходного состояния и реагентов, но и разницу в степени их сольватации (см., например,
не только истинную, внутреннюю разницу молекулярных размеров переходного состояния и реагентов, но и разницу в степени их сольватации (см., например, 

Та часть изменения объема, которая относится к истинным размерам молекул  будет положительной для разрыва связей и отрицательной для образования связей. Та часть, которая относится к сольватации
будет положительной для разрыва связей и отрицательной для образования связей. Та часть, которая относится к сольватации  будет положительной, если в переходном состоянии десольватация сопровождается диссипацией плотности заряда, и отрицательной, если на пути к переходному состоянию образуется избыточный заряд (теория электрострикции) [18, 20]. Вклад
будет положительной, если в переходном состоянии десольватация сопровождается диссипацией плотности заряда, и отрицательной, если на пути к переходному состоянию образуется избыточный заряд (теория электрострикции) [18, 20]. Вклад  в суммарную величину
в суммарную величину  может быть весьма существенным, что еще больше затрудняет интерпретацию. Так, для реакции триметилфениламмониевого иона с фенолятом, несмотря на то что в переходном состоянии происходит образование связи,
может быть весьма существенным, что еще больше затрудняет интерпретацию. Так, для реакции триметилфениламмониевого иона с фенолятом, несмотря на то что в переходном состоянии происходит образование связи,

акгивационный объем составляет  [12], по-видимому, из-за релаксации и объемного расширения растворителя. Таким образом,
[12], по-видимому, из-за релаксации и объемного расширения растворителя. Таким образом,
Таблица 6-1. (см. скан) Некоторые данные по активационным объемам
наиболее отрицательные значения активационных объемов следует ожидать для реакций, включающих одновременное образование связи и ионизацию. Например, для реакции Меншуткина между бензил бромидом и пиридином в толуоле (см. разд. 7.6)  [68]. Для интерпретации численных значений
[68]. Для интерпретации численных значений  с точки зрения механизма реакций могут быть полезны некоторые ориентировочные цифры, приведенные в табл. 6-1 [58].
с точки зрения механизма реакций могут быть полезны некоторые ориентировочные цифры, приведенные в табл. 6-1 [58].
Эти цифры найдены для органических реакций, механизмы которых хорошо известны. Несколько иная ситуация возникает для неорганических реакций с участием комплексных ионов. Рассмотрим один из фундаментальных процессов — обмен растворителя при сольватированных катионах. Этот обмен не сопровождается ни каким-либо изменением формального заряда иона, ни существенным изменением сольватации в ходе реакции. Это должно означать, что активационный объем всецело определяется внутренним эффектом, отражающим изменения связей при образовании переходного состояния. Поэтому интерпретация однозначна: отрицательная или положительная величина  прямо указывает на ассоциативный или диссоциативный механизм обмена соответственно [101, 141]. В отличие от
прямо указывает на ассоциативный или диссоциативный механизм обмена соответственно [101, 141]. В отличие от  по абсолютной величине
по абсолютной величине  нельзя сделать непосредственных выводов [143]. Кроме того, определение
нельзя сделать непосредственных выводов [143]. Кроме того, определение  менее точно, и для значений, близких к нулю, даже невозможно с уверенностью установить знак. В табл. 6-2 приведены параметры активации для процесса обмена воды в гидратированных катионах металлов. Положительный активационный объем для обмена воды в
менее точно, и для значений, близких к нулю, даже невозможно с уверенностью установить знак. В табл. 6-2 приведены параметры активации для процесса обмена воды в гидратированных катионах металлов. Положительный активационный объем для обмена воды в  указывает на диссоциативный механизм:
указывает на диссоциативный механизм:

Нужно заметить, что теоретический расчет для диссоциативного перехода водного лиганда из первой гидратной оболочки во вторую предсказывает,
Таблица 6-2. (см. скан) Параметры активации для процесса обмена воды в гидратированных катионах металлов
что  должно быть равно
должно быть равно  [141]. С другой стороны, ясно, что обмен воды в аналогичном катионе, содержащем хром, происходит по ассоциативному механизму. Наблюдается все больше случаев, когда А К успешно используется при установлении механизма неорганических реакций в качестве критерия для различения ассоциативного и диссоциативного путей. Следует также отметить, что измерения
[141]. С другой стороны, ясно, что обмен воды в аналогичном катионе, содержащем хром, происходит по ассоциативному механизму. Наблюдается все больше случаев, когда А К успешно используется при установлении механизма неорганических реакций в качестве критерия для различения ассоциативного и диссоциативного путей. Следует также отметить, что измерения  дают более подробные сведения о молекулярных перегруппировках в процессах переноса электронов во внешней оболочке [141].
дают более подробные сведения о молекулярных перегруппировках в процессах переноса электронов во внешней оболочке [141].
До последнего времени нелинейный характер зависимости  : от давления считался лишь помехой в определении
: от давления считался лишь помехой в определении  Теперь для зависимости активационного объема от давления используется новая величина — активационный коэффициент сжимаемости
Теперь для зависимости активационного объема от давления используется новая величина — активационный коэффициент сжимаемости  [141], позволяющий получить дополнительную информацию о механизме процесса. Этот коэффициент выводится из уравнения
[141], позволяющий получить дополнительную информацию о механизме процесса. Этот коэффициент выводится из уравнения  :
:

Изменение А К с давлением для одностадийной реакции можно вкратце объяснить следующим образом. Внутримолекулярные связи гораздо менее сжимаемы, чем масса растворителя. Это должно быть справедливо также для ионов металлов, включающих и первую, и вторую гидратные оболочки [141]. Поэтому кривизну зависимости  от
от  можно связать с изменением реакционной способности массы растворителя, вызванным внешним давлением, т.е. изменением сольватирующей способности (см. также следующую главу) за счет изменения длин связей, а следовательно, и полярности связей [43]. Таким образом, сильная зависимость
можно связать с изменением реакционной способности массы растворителя, вызванным внешним давлением, т.е. изменением сольватирующей способности (см. также следующую главу) за счет изменения длин связей, а следовательно, и полярности связей [43]. Таким образом, сильная зависимость  от давления свидетельствует об участии молекул из массы растворителя. Либо молекулы из массы растворителя, либо фрагменты реагентов включаются в активированный комплекс и сольватируются растворителем.
от давления свидетельствует об участии молекул из массы растворителя. Либо молекулы из массы растворителя, либо фрагменты реагентов включаются в активированный комплекс и сольватируются растворителем.
Теперь вспомним, что для реакций, сопровождающихся ощутимыми изменениями плотности заряда, активационный объем в значительной мере оказывается результатом изменения в объеме сольватированных молекул при образовании активированного комплекса. Поэтому было бы
естественно поискать корреляции между  так как факторы, влияющие и на знак, и на величину активационного объема, непосредственно связаны с изменением степеней свободы движения при переходе от сольватированных исходных веществ к сольватированному активированному комплексу. Следовательно, большой отрицательный активационный объем должен соответствовать большой отрицательной энтропии активации. Это предположение неоднократно подтверждалось, а недавно было получено доказательство прямой зависимости между этими двумя параметрами [149]. Однако такая зависимость необязательна, и известны также исключения из правила. Например, для некоторых реакций замещения в комплексах железа
так как факторы, влияющие и на знак, и на величину активационного объема, непосредственно связаны с изменением степеней свободы движения при переходе от сольватированных исходных веществ к сольватированному активированному комплексу. Следовательно, большой отрицательный активационный объем должен соответствовать большой отрицательной энтропии активации. Это предположение неоднократно подтверждалось, а недавно было получено доказательство прямой зависимости между этими двумя параметрами [149]. Однако такая зависимость необязательна, и известны также исключения из правила. Например, для некоторых реакций замещения в комплексах железа  наблюдается значительное изменение
наблюдается значительное изменение  в то время как
в то время как  остается практически постоянным [75]. Это указывает на то, что не все вклады в энтропию активации, например вращательное или круговое смещение, должны также давать вклад и в активационный объем. Сообщалось также [152], что циклизация и стерическое затруднение существенно не влияют на
остается практически постоянным [75]. Это указывает на то, что не все вклады в энтропию активации, например вращательное или круговое смещение, должны также давать вклад и в активационный объем. Сообщалось также [152], что циклизация и стерическое затруднение существенно не влияют на 
Значительный вклад Дльв в суммарную величину  должен наводить на мысль о том, чтобы найти зависимость между активационным объемом и сольватирующей способностью растворителя. К этому интересному вопросу мы вернемся в приложении к гл. 7 и 8 после обсуждения влияния растворителя и заместителей на скорость реакции.
должен наводить на мысль о том, чтобы найти зависимость между активационным объемом и сольватирующей способностью растворителя. К этому интересному вопросу мы вернемся в приложении к гл. 7 и 8 после обсуждения влияния растворителя и заместителей на скорость реакции.
Следует отметить, что все рассуждения в настоящей главе относятся только к элементарным реакциям. Использование эффективных констант скорости должно сильно усложнить предмет, так же как и нелинейные графики Аррениуса, Кривые зависимости  от
от  могут быть еще более разнообразными, поскольку повышение давления может как ускорять, так и тормозить реакцию в отличие от повышения температуры, при котором скорость обычно увеличивается. Некоторые усложнения в графиках
могут быть еще более разнообразными, поскольку повышение давления может как ускорять, так и тормозить реакцию в отличие от повышения температуры, при котором скорость обычно увеличивается. Некоторые усложнения в графиках  к
к  для сложных реакций обсуждаются в работе [67], где рассматривается также особый случай зависимости от давления процессов, контролируемых диффузией.
для сложных реакций обсуждаются в работе [67], где рассматривается также особый случай зависимости от давления процессов, контролируемых диффузией.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- 1. ВВЕДЕНИЕ
- 2. ОБЩИЕ ТИПЫ РЕАКЦИЙ
- 2.1. Простая реакция первого порядка
- 2.2. Простая реакция второго порядка
- 2.3. Две параллельные реакции первого порядка
- 2.4. Две параллельные реакции первого порядка с общим продуктом
- 2.5. Последовательность двух реакций первого порядка
- 2.6. Последовательность трех реакций первого порядка
- 2.7. Последовательность реакций смешанного (второго и первого) порядка
- 2.8. Обратимая реакция первого порядка
- 2.9. Обратимая реакция второго порядка
- 2.10. Обратимая реакция смешанного (первого и второго) порядка
- 2.11. Последовательность двух реакций первого порядка с обратимой первой стадией
- 2.12. Последовательность двух обратимых реакций первого порядка
- 2.13. Две параллельные обратимые реакции первого порядка с общим продуктом
- 2.14. Последовательность двух реакций второго и первого порядков с обратимой первой стадией
- 2.15. Две параллельные реакции второго порядка с обратимой стадией
- 3. ГОМОГЕННЫЕ КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
- 3.2. Каталитическая реакция первого порядка
- 3.3. Реакция нулевого порядка
- 3.4. Ингибирование катализатора
- 3.4.1. Обратимое ингибирование
- 3.4.2. Необратимое ингибирование
- 3.5. Автокаталитические реакции
- 3.5.2. Автокаталитическая реакция второго порядка
- 4. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ: СИСТЕМАТИЧЕСКИЙ КИНЕТИЧЕСКИЙ АНАЛИЗ
- 4.2. Выбор условий эксперимента
- 4.3. Методы анализа кривых зависимости концентрации от времени
- 4.4. Порядок реакции и его значение
- 4.5. Математическая модель реакции
- 4.5.2. Из второй серии опытов
- 4.5.3. Из последующих серий опытов
- 4.6. Физическая модель реакции
- 4.7. Выводы
- 4.8. Схема и механизм реакции
- 5. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 5.1. Уравнение Аррениуса
- 5.2. Теория активированного комплекса
- 5.3. Теория столкновений
- 5.4. Сравнение выведенных уравнений
- 5.5. Физический смысл энтропии активации
- 5.6. Физический смысл энергии активации
- 5.7. Формы аррениусовских графиков
- 6. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
- 7. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
- 7.2. Подход, основанный на рассмотрении диэлектрической проницаемости
- 7.3. Эмпирический подход, основанный на рассмотрении параметров растворителя
- 7.5.2. Корреляции между донорными числами и другими шкалами
- 7.3.3. Корреляции между акцепторными числами и другими шкалами
- 7.3.4. Выводы
- 7.4. Согласование двух подходов
- 7.5. Современная ситуация
- 7.6. Экспериментальные доказательства
- 7.7. Влияние ионной силы растворителя
- 7.8. Сравнительная шкала донорной и акцепторной способности
- 8. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 8.2. Электронные эффекты
- 8.3. Стерические эффекты
- 8.4. Сведения о механизмах реакций
- 9. ПРИЛОЖЕНИЕ К ГЛАВАМ 7 И 8
- 10. ФИЗИЧЕСКОЕ ОБОСНОВАНИЕ ЭМПИРИЧЕСКИХ КОРРЕЛЯЦИЙ
- 10.2. Принцип линейности свободных энергий (принцип ЛСЭ)
- 10.3. Изокинетическое соотношение (ИКС)
- 10.3.1. Метод Экснера для установления ИКС
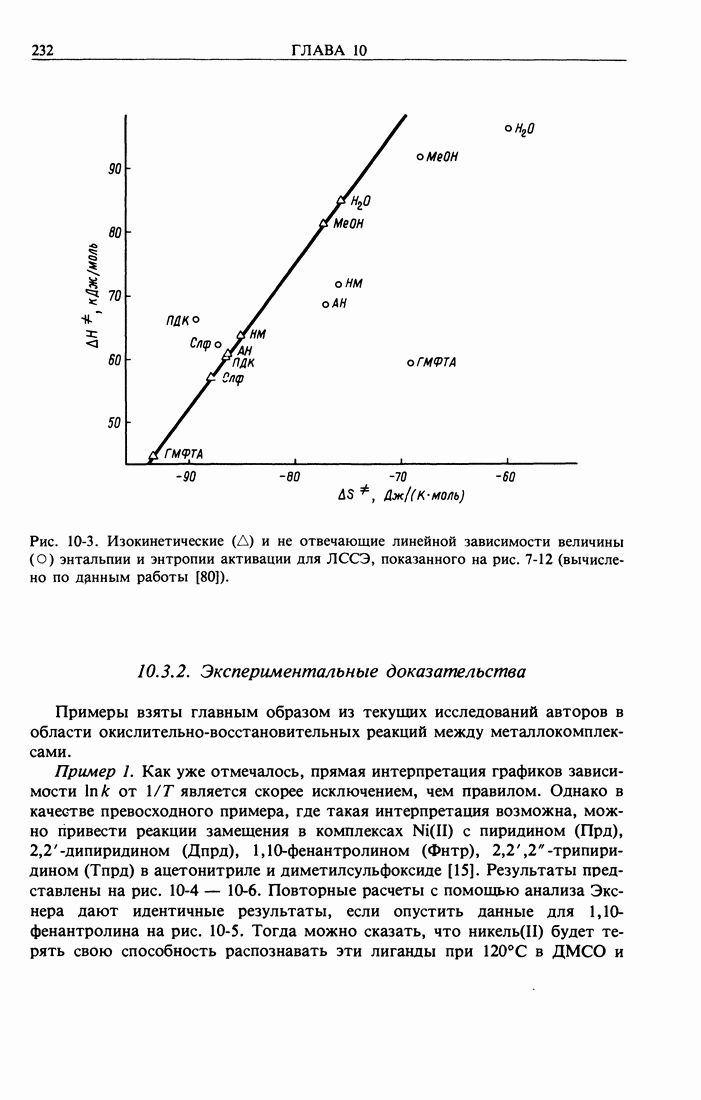
- 10.3.2. Экспериментальные доказательства
- 10.3.3. Практические следствия из изокинетических соотношений