| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
9. ПРИЛОЖЕНИЕ К ГЛАВАМ 7 И 8
В двух предшествующих главах рассмотрено влияние растворителей и заместителей на скорость реакции. Когда в реагирующей системе варьируют одну переменную, характеризующую реакцию, скажем среду, заместитель и т.п., оставляя все остальные практически постоянными, говорят, что получают серию реакций (не путать с «последовательностью реакций», которой обозначают схему двух или нескольких последовательных реакций). Серию реакций следует отличать от серии экспериментов, когда варьируют концентрацию одного из компонентов реакции (см. гл. 4).
Теперь хотелось бы обратить внимание читателя на некоторые противоречия в обсуждении как эффектов растворителей, так и эффектов заместителей.  соответствующих главах мы начинали обсуждение этих эффектов в термодинамических терминах свободной энергии. Однако затем интерпретация основывалась на электронных представлениях, т.е. на энергии активации; при этом делалбсь различие между акцепторными растворителями и акцепторными заместителями, с одной стороны, и донорными растворителями и донорными заместителями — с другой.
соответствующих главах мы начинали обсуждение этих эффектов в термодинамических терминах свободной энергии. Однако затем интерпретация основывалась на электронных представлениях, т.е. на энергии активации; при этом делалбсь различие между акцепторными растворителями и акцепторными заместителями, с одной стороны, и донорными растворителями и донорными заместителями — с другой.  действительности изменения энтальпии не обязательно доминируют в выражении для свободной энергии активации. Следует напомнить, что, согласно уравнению (5-11), влияние изменения энтропии также может быть весьма существенным:
действительности изменения энтальпии не обязательно доминируют в выражении для свободной энергии активации. Следует напомнить, что, согласно уравнению (5-11), влияние изменения энтропии также может быть весьма существенным:

Здесь 5 означает изменения, возникающие при варьировании параметров в данной серии реакций. Для физически осмысленной интерпретации эффектов растворителя и заместителя необходимо точно знать вклады энтальпии и энтропии. Их можно определить путем изучения температурной зависимости соответствующих эффектов от скорости реакции. Тогда свободная энергия активации делится на две части: зависимую от температуры  и не зависимую От нее
и не зависимую От нее  сущности,
сущности,  означает изменение прочности связей в серии реакций, что соответствует классическому электронному эффекту.
означает изменение прочности связей в серии реакций, что соответствует классическому электронному эффекту.  то же время величину
то же время величину  можно представить как изменение формы начального и переходного состояний. Нужно избегать поспешной интерпретации изменений реакционной способности в электронных терминах, что иллюстрируют следующие два примера.
можно представить как изменение формы начального и переходного состояний. Нужно избегать поспешной интерпретации изменений реакционной способности в электронных терминах, что иллюстрируют следующие два примера.
Первый пример относится к эффекту заместителя. Тот факт, что скорость щелочного гидролиза эфиров муравьиной кислоты в несколько сотен раз превышает скорость гидролиза эфиров уксусной кислоты, легко объясняется электронодонорными свойствами метильной группы по сравнению с водородом [56]. Согласно этой точке зрения, повышение электронной плотности на группе  за счет смещения электронов вызывает отталкивание гидроксильных ионов, что влечет за собой увеличение энергии активации. Известно также, что величины
за счет смещения электронов вызывает отталкивание гидроксильных ионов, что влечет за собой увеличение энергии активации. Известно также, что величины  для этих двух реакций почти одинаковы, а большая разница в скорости связана с различием в энтропиях активации:
для этих двух реакций почти одинаковы, а большая разница в скорости связана с различием в энтропиях активации:

В этом случае природу эффекта метильной группы нельзя объяснить электронными факторами. По-видимому, введение гидроксильной группы стерически затруднено, и активированный комплекс находится в состоянии стерического напряжения [58].
Второй пример относится к эффекту растворителя. В случае реакции Меншуткина между бензилбромидом и пиридином увеличение скорости с ростом акцепторного числа растворителя (ср. с рис. 7-14) оказывается легко объяснимым с точки зрения сольватации образующегося бромид-иона, приводящей к ослаблению связи  Акцепторный растворитель.
Акцепторный растворитель.
Если это так, можно ожидать, что в растворителях с более слабыми акцепторными свойствами энтропия активации будет более положительной, так как при переходе к активированному комплексу восстановление степеней свободы молекул растворителя будет меньше. Однако экспериментальные данные говорят об обратном [68]. Объяснение аналогичного примера было предложено Пирсоном еще в 1952 г. [107]; оно основано на рассмотрении ориентации растворителя вокруг ионного активированного комплекса [18]. Полярные растворители благодаря сильным взаимодействиям между молекулами уже в самом начале реакции существуют в состоянии низкой энтропии («низкоэнтропийные растворители»). Поэтому при образовании активированного комплекса потеря энтропии не так велика, как для неполярных растворителей, т.е. растворителей со слабыми акцепторными свойствами, молекулы которых лишь незначительно взаимодействуют друг с другом. Таким образом, в рассматриваемом случае акцепторное число растворителя скорее может служить мерой взаимодействия растворитель — растворительу чем мерой электроноакцепторной способности по
отношению к растворенному веществу. Это согласуется с результатами, полученными при измерениях активационного объема, — для растворителей со слабыми акцепторными свойствами найдены более отрицательные значения  соответствующие сжатию реагирующей системы благодаря увеличению сольватации активированного комплекса [68]. Это должно указывать на то, что предполагаемое повышение скорости с увеличением акцепторной способности растворителя является результатом совпадения двух, возможно, неожиданных обстоятельств: 1) процесс сольватации образующегося бромид-иона препятствует реакции Меншуткина, воздействуя на энтропию; 2) степень такой сольватации выше в растворителях с низкой координирующей способностью (при условии, что они способны к поляризации так же, как ароматические растворители).
соответствующие сжатию реагирующей системы благодаря увеличению сольватации активированного комплекса [68]. Это должно указывать на то, что предполагаемое повышение скорости с увеличением акцепторной способности растворителя является результатом совпадения двух, возможно, неожиданных обстоятельств: 1) процесс сольватации образующегося бромид-иона препятствует реакции Меншуткина, воздействуя на энтропию; 2) степень такой сольватации выше в растворителях с низкой координирующей способностью (при условии, что они способны к поляризации так же, как ароматические растворители).
Совершенно очевидно, как важно изучать зависимость влияния растворителей на скорость от температуры (и при возможности от давления), чтобы прийти к имеющей физический смысл интерпретации корреляций. Дальнейшие исследования в этой области покажут, можно ли применить приведенное выше толкование реакционной способности к другим типам реакций. По мнению авторов, взаимодействия растворитель — растворитель и их изменения в ходе химической реакции главным образом ответственны за известный разброс на диаграммах, коррелирующих реакционную способность с эмпирическими параметрами растворителя.
Помимо рассмотрения абсолютных величин параметров активации особый интерес представляет проверка наличия взаимосвязей между энтальпией активации и энтропией активации в данной серии реакций. Этому вопросу посвящена следующая, заключительная глава.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- 1. ВВЕДЕНИЕ
- 2. ОБЩИЕ ТИПЫ РЕАКЦИЙ
- 2.1. Простая реакция первого порядка
- 2.2. Простая реакция второго порядка
- 2.3. Две параллельные реакции первого порядка
- 2.4. Две параллельные реакции первого порядка с общим продуктом
- 2.5. Последовательность двух реакций первого порядка
- 2.6. Последовательность трех реакций первого порядка
- 2.7. Последовательность реакций смешанного (второго и первого) порядка
- 2.8. Обратимая реакция первого порядка
- 2.9. Обратимая реакция второго порядка
- 2.10. Обратимая реакция смешанного (первого и второго) порядка
- 2.11. Последовательность двух реакций первого порядка с обратимой первой стадией
- 2.12. Последовательность двух обратимых реакций первого порядка
- 2.13. Две параллельные обратимые реакции первого порядка с общим продуктом
- 2.14. Последовательность двух реакций второго и первого порядков с обратимой первой стадией
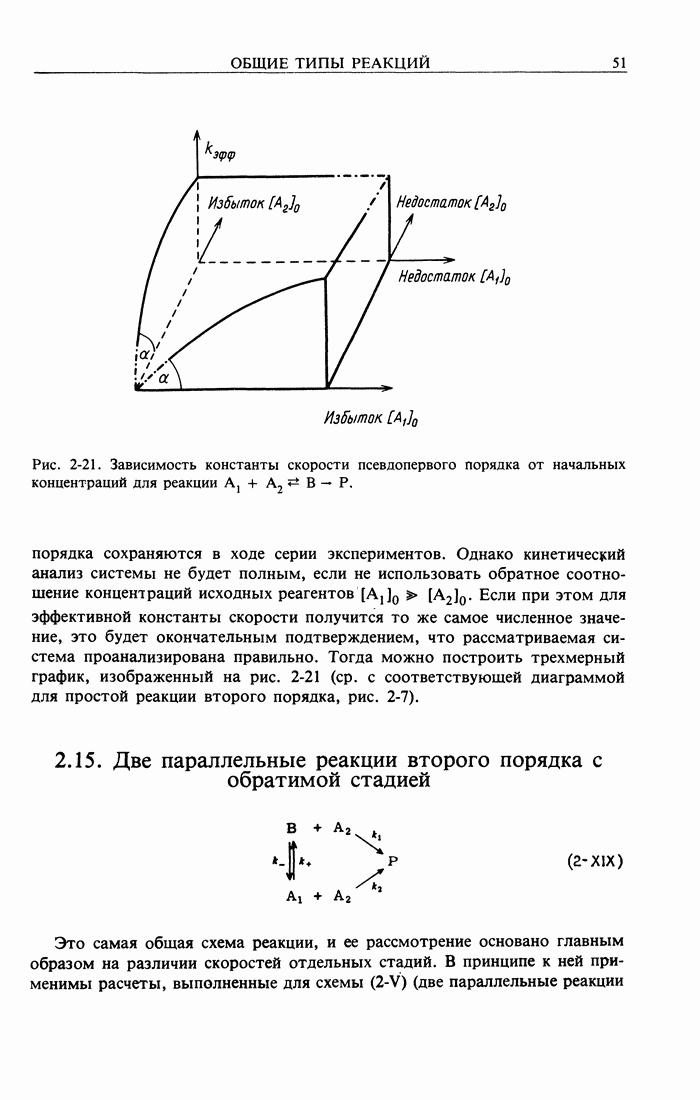
- 2.15. Две параллельные реакции второго порядка с обратимой стадией
- 3. ГОМОГЕННЫЕ КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
- 3.2. Каталитическая реакция первого порядка
- 3.3. Реакция нулевого порядка
- 3.4. Ингибирование катализатора
- 3.4.1. Обратимое ингибирование
- 3.4.2. Необратимое ингибирование
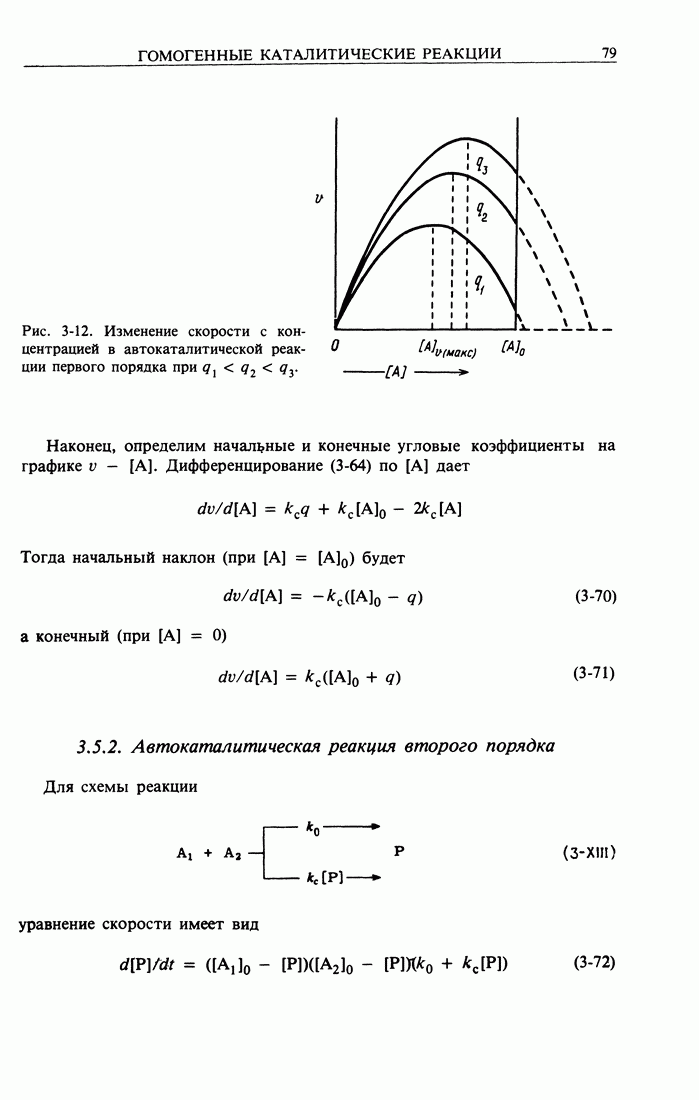
- 3.5. Автокаталитические реакции
- 3.5.2. Автокаталитическая реакция второго порядка
- 4. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ: СИСТЕМАТИЧЕСКИЙ КИНЕТИЧЕСКИЙ АНАЛИЗ
- 4.2. Выбор условий эксперимента
- 4.3. Методы анализа кривых зависимости концентрации от времени
- 4.4. Порядок реакции и его значение
- 4.5. Математическая модель реакции
- 4.5.2. Из второй серии опытов
- 4.5.3. Из последующих серий опытов
- 4.6. Физическая модель реакции
- 4.7. Выводы
- 4.8. Схема и механизм реакции
- 5. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 5.1. Уравнение Аррениуса
- 5.2. Теория активированного комплекса
- 5.3. Теория столкновений
- 5.4. Сравнение выведенных уравнений
- 5.5. Физический смысл энтропии активации
- 5.6. Физический смысл энергии активации
- 5.7. Формы аррениусовских графиков
- 6. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
- 7. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
- 7.2. Подход, основанный на рассмотрении диэлектрической проницаемости
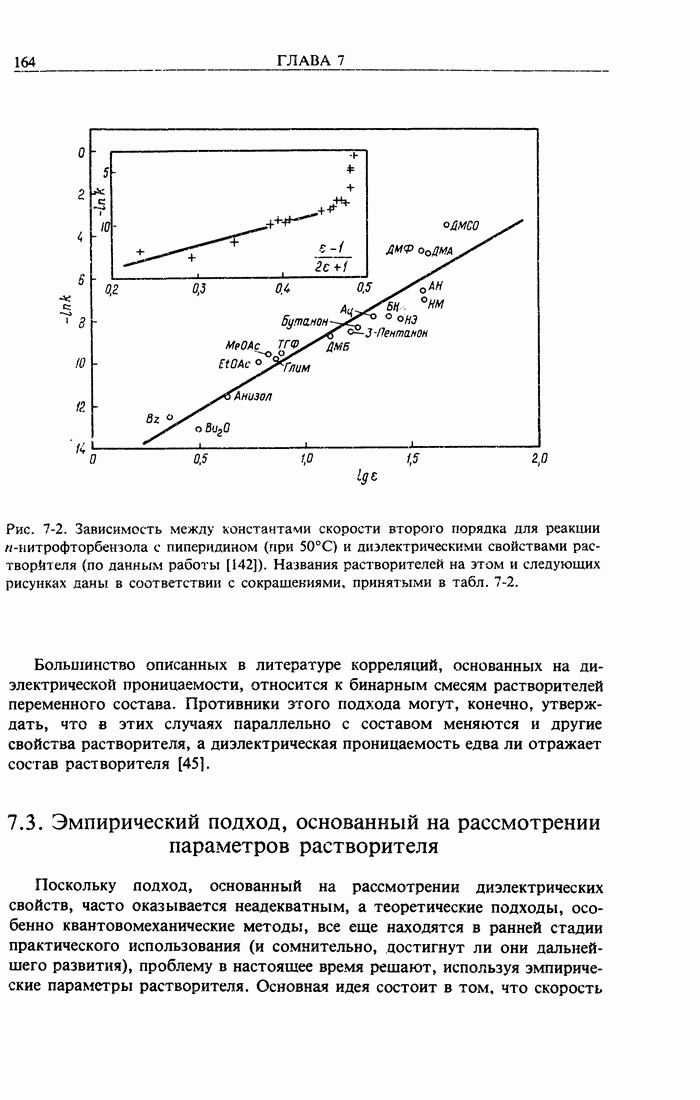
- 7.3. Эмпирический подход, основанный на рассмотрении параметров растворителя
- 7.5.2. Корреляции между донорными числами и другими шкалами
- 7.3.3. Корреляции между акцепторными числами и другими шкалами
- 7.3.4. Выводы
- 7.4. Согласование двух подходов
- 7.5. Современная ситуация
- 7.6. Экспериментальные доказательства
- 7.7. Влияние ионной силы растворителя
- 7.8. Сравнительная шкала донорной и акцепторной способности
- 8. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 8.2. Электронные эффекты
- 8.3. Стерические эффекты
- 8.4. Сведения о механизмах реакций
- 9. ПРИЛОЖЕНИЕ К ГЛАВАМ 7 И 8
- 10. ФИЗИЧЕСКОЕ ОБОСНОВАНИЕ ЭМПИРИЧЕСКИХ КОРРЕЛЯЦИЙ
- 10.2. Принцип линейности свободных энергий (принцип ЛСЭ)
- 10.3. Изокинетическое соотношение (ИКС)
- 10.3.1. Метод Экснера для установления ИКС
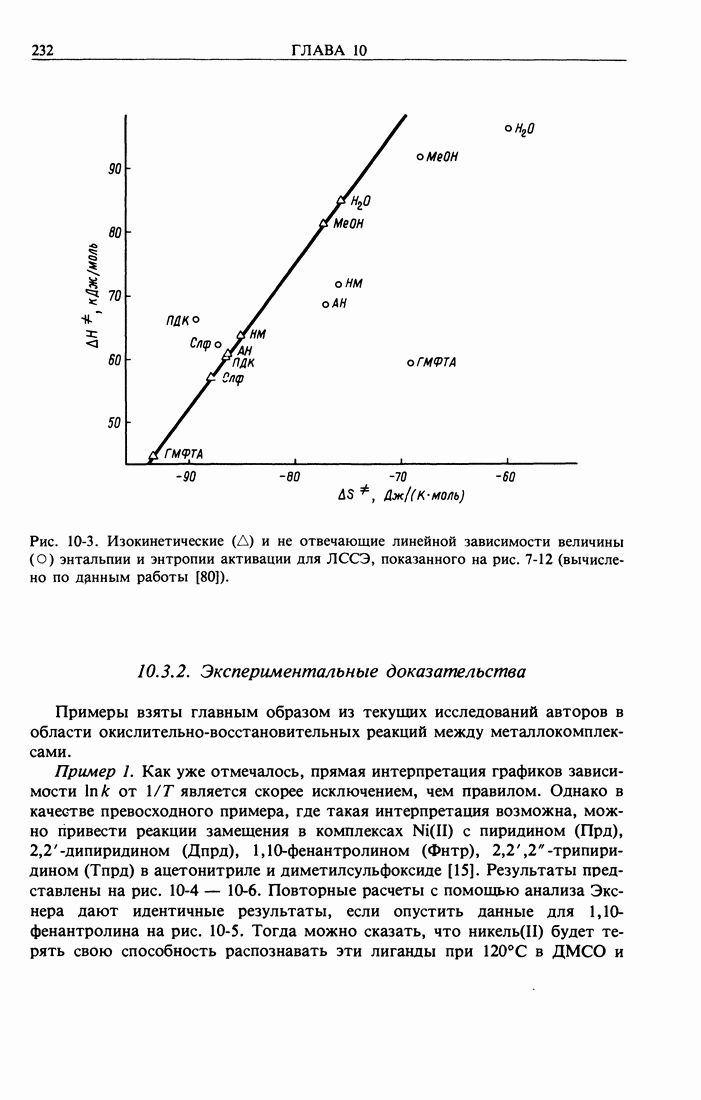
- 10.3.2. Экспериментальные доказательства
- 10.3.3. Практические следствия из изокинетических соотношений