| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
2.2. Простая реакция второго порядка

Уравнение скорости имеет вид

Множитель 2 появляется потому, что в каждом элементарном акте удаляются две молекулы А. Интегрирование дает

или

При построении зависимости обратной концентрации от времени соотношение принимает форму прямой линии с положительным наклоном, равным  При построении зависимостей для разных начальных
При построении зависимостей для разных начальных

Рис. 2-5. График реакции второго порядка (тип 1).
концентраций получается набор параллельных прямых (рис. 2-5). Единицей измерения константы скорости второго порядка является 
Константу скорости можно вычислить, подставляя экспериментальные значения  при разных значениях времени
при разных значениях времени  в преобразованное уравнение (2-16):
в преобразованное уравнение (2-16):

имея в виду, что к постоянна. Однако подстановку или численный метод следует применять только в том случае, если предварительно установлено, что реакция действительно является реакцией второго порядка, иначе небольшие отклонения могут быть интерпретированы как ошибки эксперимента. Уже из графического представления легко определить возможную кривизну, которая должна указывать на более сложный характер реакции.
Период полупревращения для А получают после подстановки  вместо
вместо  в уравнение (2-15):
в уравнение (2-15):

Таким образом, в отличие от кинетики первого порядка период полупревращения в реакции второго порядка меняется в зависимости от концентрации, как показано на рис. 2-6. Интересно, что точки пересечения с абсциссой на рис. 2-5 являются периодами полупревращения, относящимися к соответствующим начальным концентрациям.
Проверяя свойства инвариантности, мы сразу же замечаем, что дифференциальное уравнение реакции второго порядка не остается неизменным при умножении  на
на  если дифференциал
если дифференциал  также не делить на то же самое
также не делить на то же самое 


Рис. 2-6. Зависимость периода полупревращения от концентрации для реакции второго порядка типа 1.
Теперь  можно сократить и вернуться к исходному уравнению. Практическим следствием этого является то, что кривые для различных начальных концентраций
можно сократить и вернуться к исходному уравнению. Практическим следствием этого является то, что кривые для различных начальных концентраций  можно совместить с произвольно выбранной стандартной кривой, соответствующей
можно совместить с произвольно выбранной стандартной кривой, соответствующей  путем умножения ординат этих кривых на отношение
путем умножения ординат этих кривых на отношение  а соответствующих абсцисс на обратное отношение
а соответствующих абсцисс на обратное отношение  Другими словами, стандартная кривая получается из ряда экспериментальных данных при линейном уменьшении и увеличении масштабов с- и
Другими словами, стандартная кривая получается из ряда экспериментальных данных при линейном уменьшении и увеличении масштабов с- и  -осей соответственно по отношению к начальным концентрациям. Такое свойство называют инвариантом II в отличие от инварианта I (см. также разд. 4.3.3).
-осей соответственно по отношению к начальным концентрациям. Такое свойство называют инвариантом II в отличие от инварианта I (см. также разд. 4.3.3).
В действительности более важной реакцией второго порядка является реакция, включающая не единственный реагент, а два исходных вещества, скажем 

Эту реакцию полезно рассмотреть в разных условиях.
а) Стехиометричесйие начальные концентрации равны:  Этот случай математически сводится к типу 1, но тогда вместр
Этот случай математически сводится к типу 1, но тогда вместр  в предыдущих уравнениях [например, (2-15)] в нашем случае появляется просто k. Поэтому наклон графика зависимости
в предыдущих уравнениях [например, (2-15)] в нашем случае появляется просто k. Поэтому наклон графика зависимости  или
или  от
от  непосредственно дает константу скорости второго порядка:
непосредственно дает константу скорости второго порядка:

б) Один из реагентов берется в большом избытке, так что его концентрация остается практически постоянной в ходе реакции. Допустим  тогда уравнение скорости
тогда уравнение скорости

упрощается и принимает вид

где кэфф — эффективная константа скорости, равная

Уравнение (2-21) представляет собой уравнение скорости первого порядка [ср. с уравнением (2-11)]. Поэтому говорят, что реакция происходит в условиях псевдопервого порядка (по отношению к  Тогда для получения величины
Тогда для получения величины  применимы все методы кинетики реакции первого порядка. Поскольку константа скорости первого порядка не зависит от концентрации, изменение концентрации реагента
применимы все методы кинетики реакции первого порядка. Поскольку константа скорости первого порядка не зависит от концентрации, изменение концентрации реагента  взятого в недостатке, не может влиять на
взятого в недостатке, не может влиять на  Минимальное относительное количество избыточного реагента необходимое для поддержания условий псёвдопервого порядка, будет рассмотрено в разд. 4.4.2. Далее, согласно уравнению (2-22), кэфф линейно возрастает с увеличением
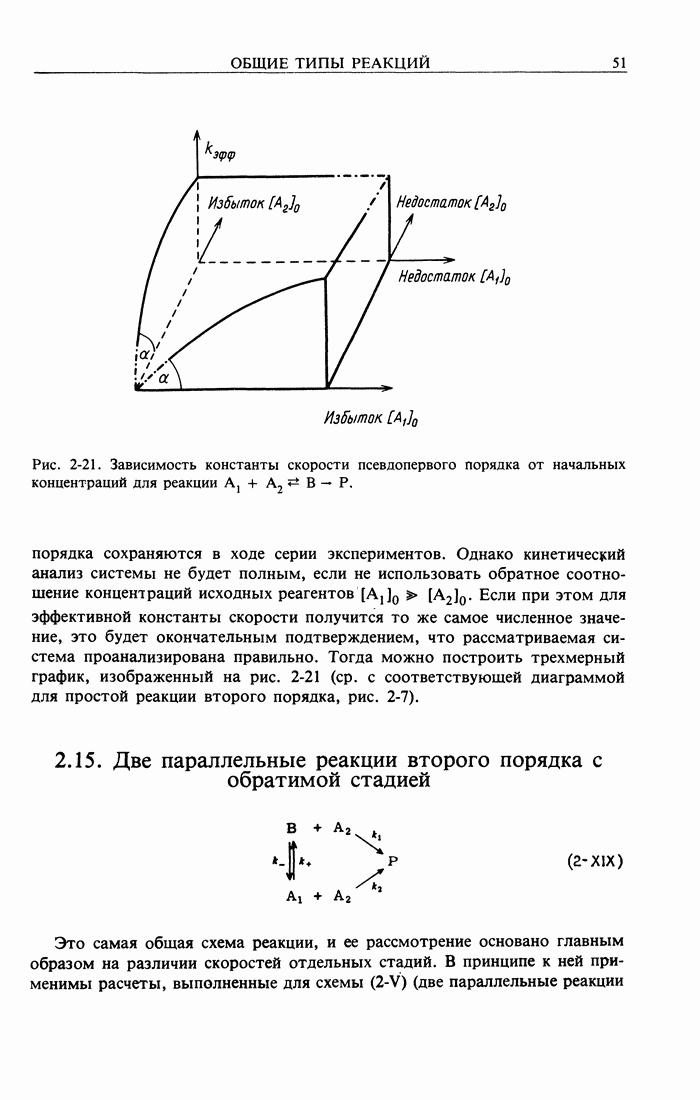
Минимальное относительное количество избыточного реагента необходимое для поддержания условий псёвдопервого порядка, будет рассмотрено в разд. 4.4.2. Далее, согласно уравнению (2-22), кэфф линейно возрастает с увеличением  По этому выражению и определяют k. Существенно также пересечение с координатами (ср. со схемой 2-XIII). Однако для получения четкого подтверждения в случае простой реакции второго порядка необходимо, чтобы обратное соотношение концентраций
По этому выражению и определяют k. Существенно также пересечение с координатами (ср. со схемой 2-XIII). Однако для получения четкого подтверждения в случае простой реакции второго порядка необходимо, чтобы обратное соотношение концентраций  давало те же самые константы скорости псевдопервого порядка, соответствующие трехмерному графику (рис. 2-7).
давало те же самые константы скорости псевдопервого порядка, соответствующие трехмерному графику (рис. 2-7).

Рис. 2-7. Зависимость констант скорости псевдопервого порядка от начальных концентраций для простой реакции второго порядка (штрихпунктирные линии указывают предельные условия псевдопфвого порядка).
Следовательно, чтобы удостовериться в том, что реакция является простой реакцией второго порядка, должно быть выполнено не менее четырех серий экспериментов с помощью метода псевдопервого порядка.
в) Третий метод пригоден для случая, когда  т.е. когда начальные концентрации реагентов и не одинаковы, и не соответствуют условиям псевдопервого порядка. Интегрирование (2-20) по частям и оценка постоянной интегрирования по начальным условиям при
т.е. когда начальные концентрации реагентов и не одинаковы, и не соответствуют условиям псевдопервого порядка. Интегрирование (2-20) по частям и оценка постоянной интегрирования по начальным условиям при  дают
дают

График отношения левой части к  представляет собой прямую с наклоном, равным k. Если величина к постоянна для нескольких различных начальных концентраций, то это служит доказательством протекания реакции первого порядка по отношению к каждому из двух реагентов. Совершенно очевидно, что уравнение (2-23) неприменимо в тех случаях, когда начальные концентрации равны.
представляет собой прямую с наклоном, равным k. Если величина к постоянна для нескольких различных начальных концентраций, то это служит доказательством протекания реакции первого порядка по отношению к каждому из двух реагентов. Совершенно очевидно, что уравнение (2-23) неприменимо в тех случаях, когда начальные концентрации равны.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- 1. ВВЕДЕНИЕ
- 2. ОБЩИЕ ТИПЫ РЕАКЦИЙ
- 2.1. Простая реакция первого порядка
- 2.2. Простая реакция второго порядка
- 2.3. Две параллельные реакции первого порядка
- 2.4. Две параллельные реакции первого порядка с общим продуктом
- 2.5. Последовательность двух реакций первого порядка
- 2.6. Последовательность трех реакций первого порядка
- 2.7. Последовательность реакций смешанного (второго и первого) порядка
- 2.8. Обратимая реакция первого порядка
- 2.9. Обратимая реакция второго порядка
- 2.10. Обратимая реакция смешанного (первого и второго) порядка
- 2.11. Последовательность двух реакций первого порядка с обратимой первой стадией
- 2.12. Последовательность двух обратимых реакций первого порядка
- 2.13. Две параллельные обратимые реакции первого порядка с общим продуктом
- 2.14. Последовательность двух реакций второго и первого порядков с обратимой первой стадией
- 2.15. Две параллельные реакции второго порядка с обратимой стадией
- 3. ГОМОГЕННЫЕ КАТАЛИТИЧЕСКИЕ РЕАКЦИИ
- 3.2. Каталитическая реакция первого порядка
- 3.3. Реакция нулевого порядка
- 3.4. Ингибирование катализатора
- 3.4.1. Обратимое ингибирование
- 3.4.2. Необратимое ингибирование
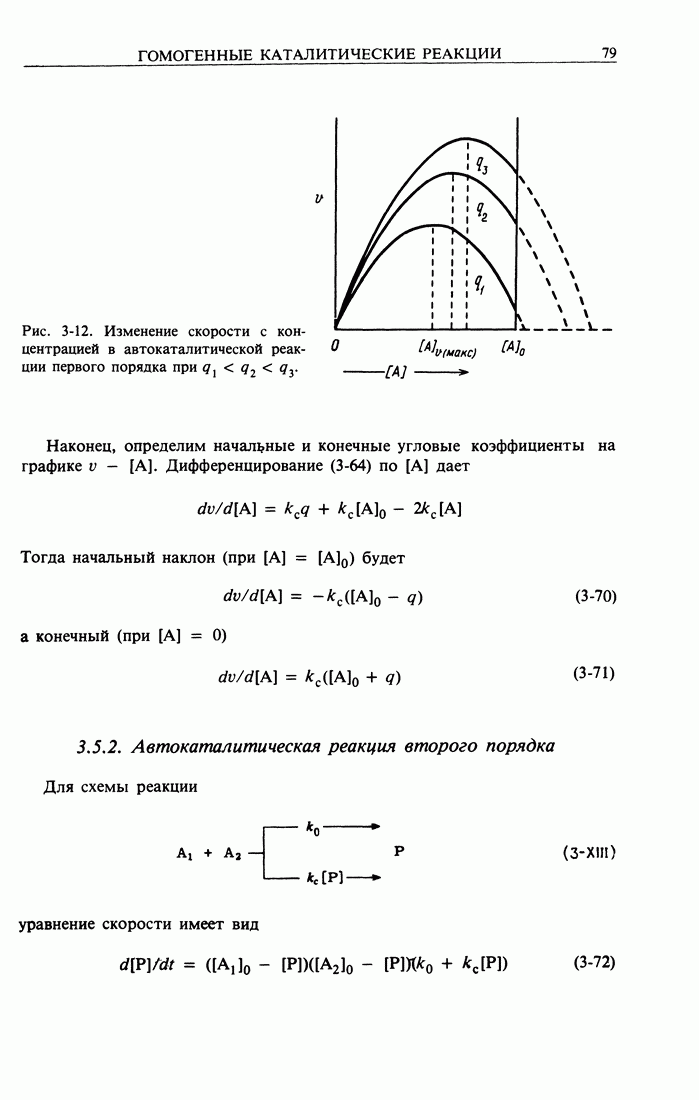
- 3.5. Автокаталитические реакции
- 3.5.2. Автокаталитическая реакция второго порядка
- 4. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ: СИСТЕМАТИЧЕСКИЙ КИНЕТИЧЕСКИЙ АНАЛИЗ
- 4.2. Выбор условий эксперимента
- 4.3. Методы анализа кривых зависимости концентрации от времени
- 4.4. Порядок реакции и его значение
- 4.5. Математическая модель реакции
- 4.5.2. Из второй серии опытов
- 4.5.3. Из последующих серий опытов
- 4.6. Физическая модель реакции
- 4.7. Выводы
- 4.8. Схема и механизм реакции
- 5. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 5.1. Уравнение Аррениуса
- 5.2. Теория активированного комплекса
- 5.3. Теория столкновений
- 5.4. Сравнение выведенных уравнений
- 5.5. Физический смысл энтропии активации
- 5.6. Физический смысл энергии активации
- 5.7. Формы аррениусовских графиков
- 6. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
- 7. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ РАСТВОРИТЕЛЯ
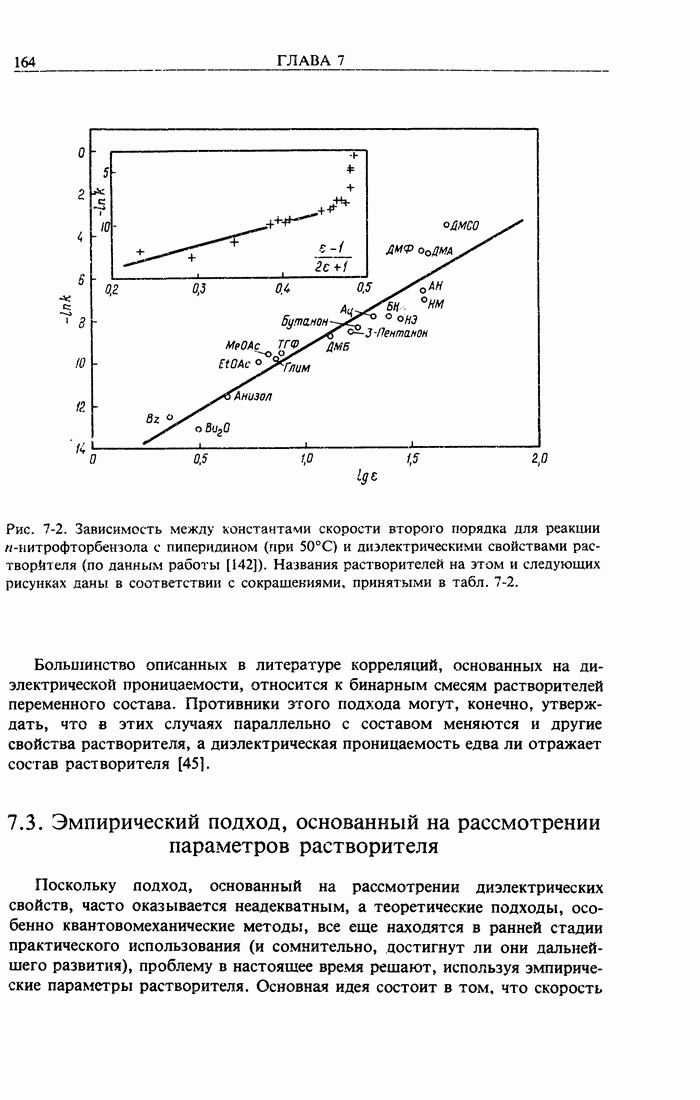
- 7.2. Подход, основанный на рассмотрении диэлектрической проницаемости
- 7.3. Эмпирический подход, основанный на рассмотрении параметров растворителя
- 7.5.2. Корреляции между донорными числами и другими шкалами
- 7.3.3. Корреляции между акцепторными числами и другими шкалами
- 7.3.4. Выводы
- 7.4. Согласование двух подходов
- 7.5. Современная ситуация
- 7.6. Экспериментальные доказательства
- 7.7. Влияние ионной силы растворителя
- 7.8. Сравнительная шкала донорной и акцепторной способности
- 8. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
- 8.2. Электронные эффекты
- 8.3. Стерические эффекты
- 8.4. Сведения о механизмах реакций
- 9. ПРИЛОЖЕНИЕ К ГЛАВАМ 7 И 8
- 10. ФИЗИЧЕСКОЕ ОБОСНОВАНИЕ ЭМПИРИЧЕСКИХ КОРРЕЛЯЦИЙ
- 10.2. Принцип линейности свободных энергий (принцип ЛСЭ)
- 10.3. Изокинетическое соотношение (ИКС)
- 10.3.1. Метод Экснера для установления ИКС
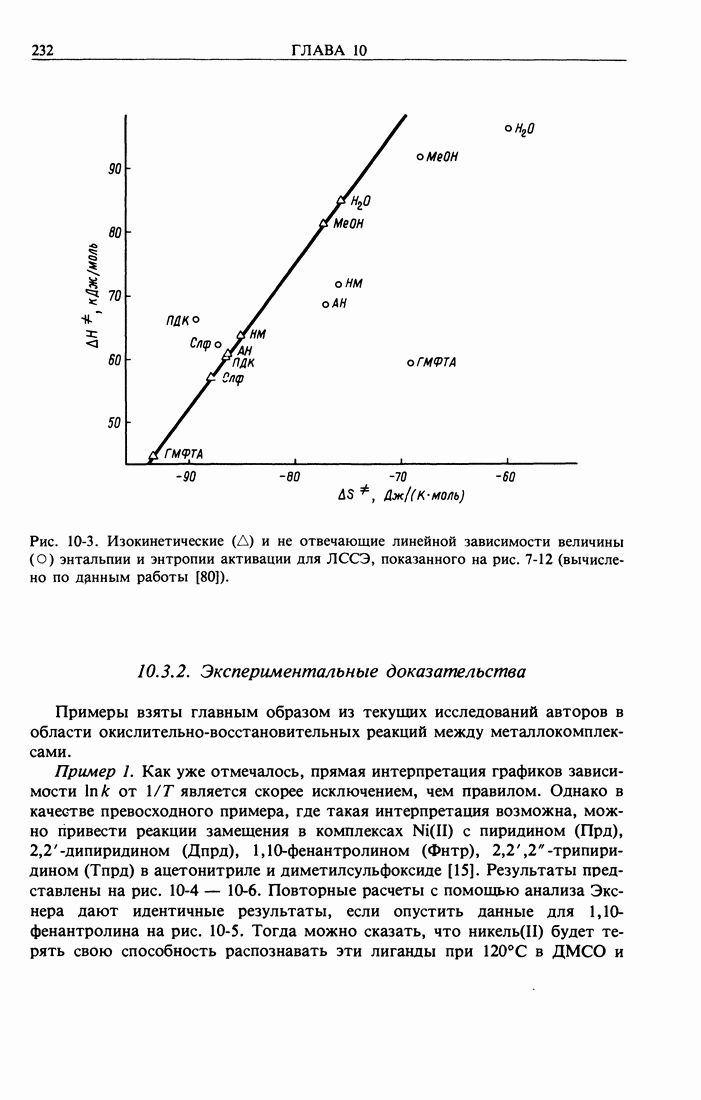
- 10.3.2. Экспериментальные доказательства
- 10.3.3. Практические следствия из изокинетических соотношений