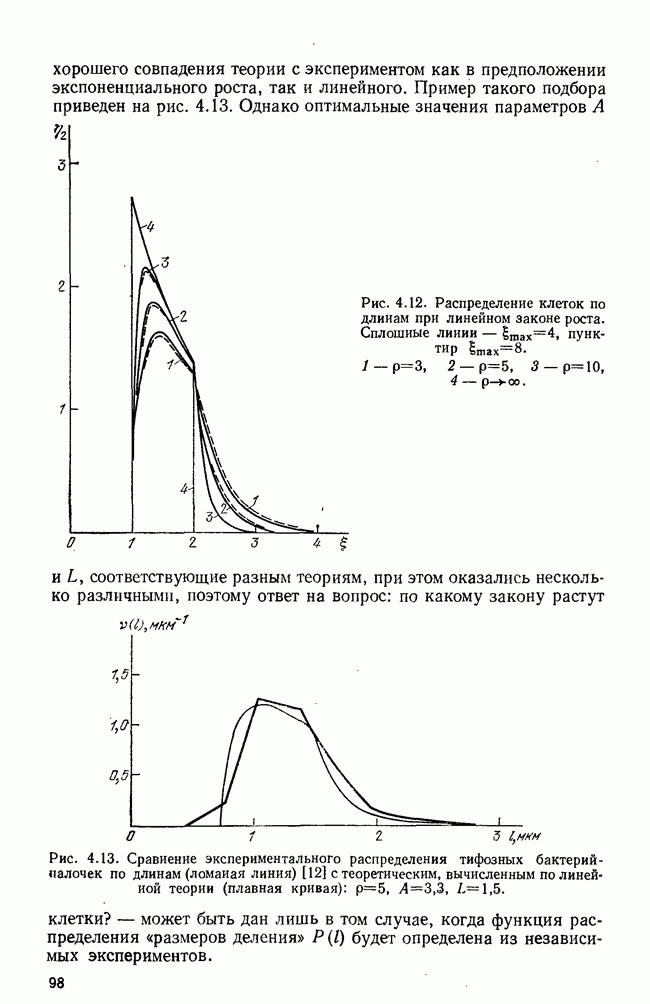
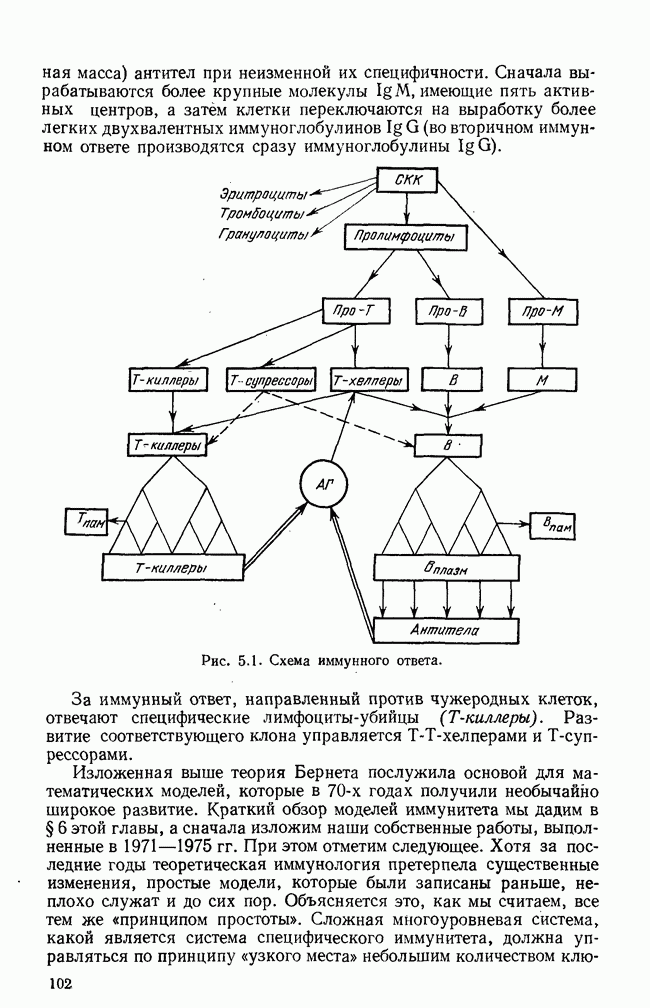
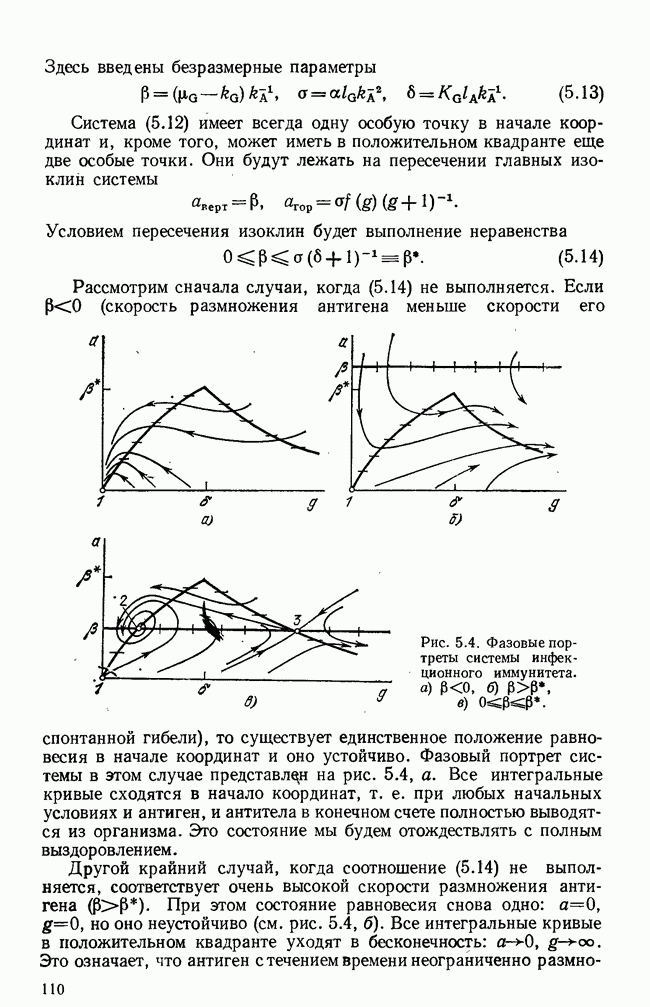
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ГЛАВА 5. ДИНАМИКА ИММУННОЙ РЕАКЦИИ
§ 1. Популяции иммунных клеток в организме
Изложенные в предыдущих главах модели динамики клеточных популяций могут относиться к некоторым группам клеток в организме животного и, прежде всего, к клеткам крови, как «красным» — эритроцитам, так и «белым» — лимфоцитам, макрофагам и пр. Колонии этих клеток существуют в организме в условиях, подобных проточному культиватору: они рождаются из клеток костного мозга, некоторое время (от нескольких суток до нескольких месяцев) циркулируют в кровеносной или лимфатической системе, выполняя свои физиологические функции, а затем погибают; в каждый данный момент (в норме) осуществляется динамическое равновесие между погибающими и нарождающимися клетками.
Конечно, система кроветворения не обособлена от всего организма — управление скоростями роста клеток осуществляется на разных уровнях: от местных химических стимуляторов до гормональной и нервной систем. Однако некоторые функции клеток крови можно рассматривать без учета механизма центрального управления соответствующими реакциями. Это относится в значительной мере к реакциям специфического иммунитета, который связан с определенными группами клеток белой крови — лимфоцитами.
Понятие иммунитета объединяет целый набор различных ответов организма на вторжение чужеродных «агентов» (от отдельных белковых молекул до вирусов и бактерий). Эти агенты — антигены — несут на своей поверхности специфические конфигурации — антигенные детерминанты, не свойственные данному организму и определяемые им однозначно как «чужие» (см., например, [1-4]).
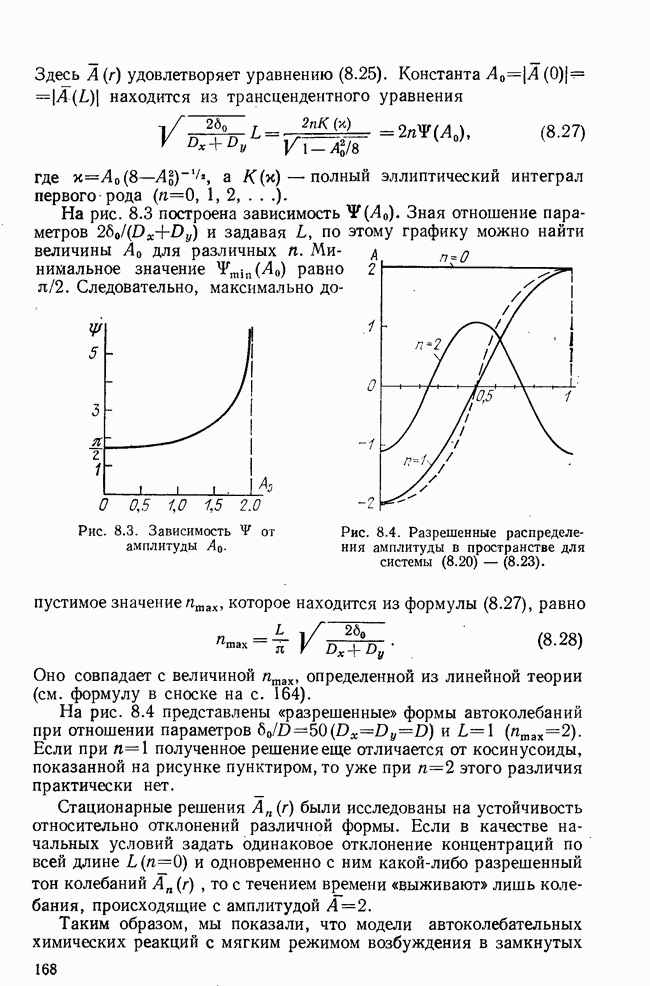
Первая реакция организма на присутствие антигена (неспецифическая) развивается в течение первых суток и заключается в том, что макрофаги с помощью специальных ферментов пытаются «переварить» чужеродное вещество. Однако обычно этой неспецифической реакции бывает недостаточно, и вступают в строй другие способы защиты; так, против вирусов вырабатывается специальный
белок — интерферон, блокирующий их размножение. И наконец, в реакцию вступает самая важная из иммунных систем млекопитающих — специфическая иммунная система, вырабатывающая специализированное оружие против данного антигена.
Эта реакция может проходить на двух уровнях — молекулярном и клеточном. В первом случае специальные плазматические клетки вырабатывают в большом количестве белковые молекулы — антитела, имеющие пространственную конфигурацию, комплементарную к антигенной детерминанте. Антитела, как минимум, двухвалентны, а антиген несет несколько активных детерминант, поэтому в результате взаимодействия антиген — антитело образуются большие агрегаты, которые выводятся затем из организма. Другая форма иммунного ответа, применяемая организмом, в основном, против чужеродных клеток (при трансплантации тканей и органов, при злокачественном перерождении), — клеточный иммунитет — заключается в выработке специфических «клеток-убийц» (киллеров), присоединяющихся к «клеткам-врагам» и уничтожающих их (путем лизиса).
Работа этого сложного и удивительно целесообразного механизма давно волнует исследователей. Со времен спора Мечникова (сторонника клеточной теории иммунитета) и Эрлиха (приверженца гуморальной, сывороточной теории), в котором, как обычно, оба были правы (и оба были одновременно удостоены Нобелевской премии), и до настоящего времени предлагается и обсуждается огромное количество разнообразных теорий иммунитета. И это неудивительно, так как теория должна непротиворечиво объяснить широкий спектр явлений: динамику накопления антител в крови с максимумом, приходящимся на 7—10-й день, и иммунную память — более быстрый и значительный ответ на повторное появление того же антигена; толерантность высокой и низкой доз, т. е. отсутствие реакции при очень малых и очень больших концентрациях антигена; возможность отличения «своего» от «чужого», т. е. отсутствие реакции на ткани хозяина, и аутоиммунные заболевания, когда такая реакция все же происходит; иммунологическую реактивность при раке и недостаточную эффективность иммунитета, когда раковому заболеванию удается ускользнуть из-под контроля организма.
Наиболее популярной является в настоящее время клонально-селекционная теория Бернета [1], который предположил, что каждый вид антител синтезируется определенным клоном лимфоцитов, несущих на своей поверхности рецепторы, комплементарные к активным участкам данного антигена. Когда чужеродный белок — антиген попадает в организм, он «выбирает» клетки-предшественники, рецепторы которых имеют к нему наибольшее сродство, и стимулирует их к усиленному размножению. Таким образом, клон родственных клеток, специализированных на массовом производстве антител, взаимодействующих с данным антигеном, сильно разрастается. При повторном введении того же антигена иммунный ответ возникает гораздо раньше и протекает более интенсивно, так как некоторое количество «памятных» клеток осталось в организме после
первого иммунного ответа, и они даже через большие промежутки времени узнают «свой» антиген и сразу начинают интенсивно вырабатывать антитела.
В дальнейшем были обнаружены две существенно различные субпопуляции лимфоцитов, одни из которых обязательно проходят через тимус  -лимфоциты), а другие —
-лимфоциты), а другие —  -лимфоциты — из костного мозга попадают сразу в лимфатические узлы. Плазматические клетки, вырабатывающие антитела, являются потомками
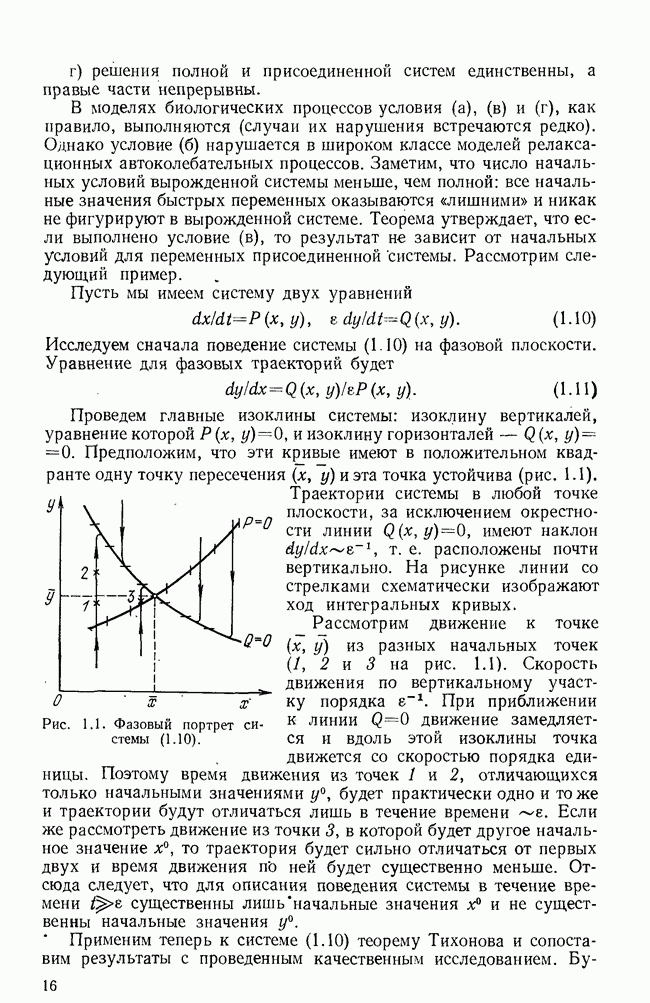
-лимфоциты — из костного мозга попадают сразу в лимфатические узлы. Плазматические клетки, вырабатывающие антитела, являются потомками  -лимфоци-гов;
-лимфоци-гов;  -клетки играют важную роль в распознавании антигена, инструктировании
-клетки играют важную роль в распознавании антигена, инструктировании  -клеток, регуляции иммунного ответа, а также являются предшественниками клеток-убийц
-клеток, регуляции иммунного ответа, а также являются предшественниками клеток-убийц  -киллеров).
-киллеров).
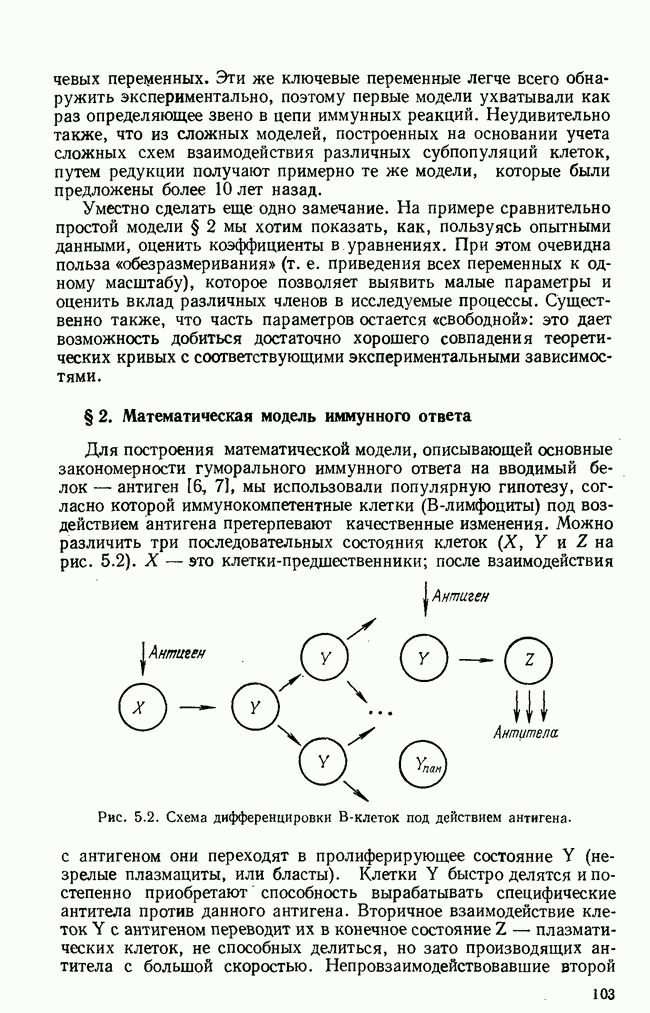
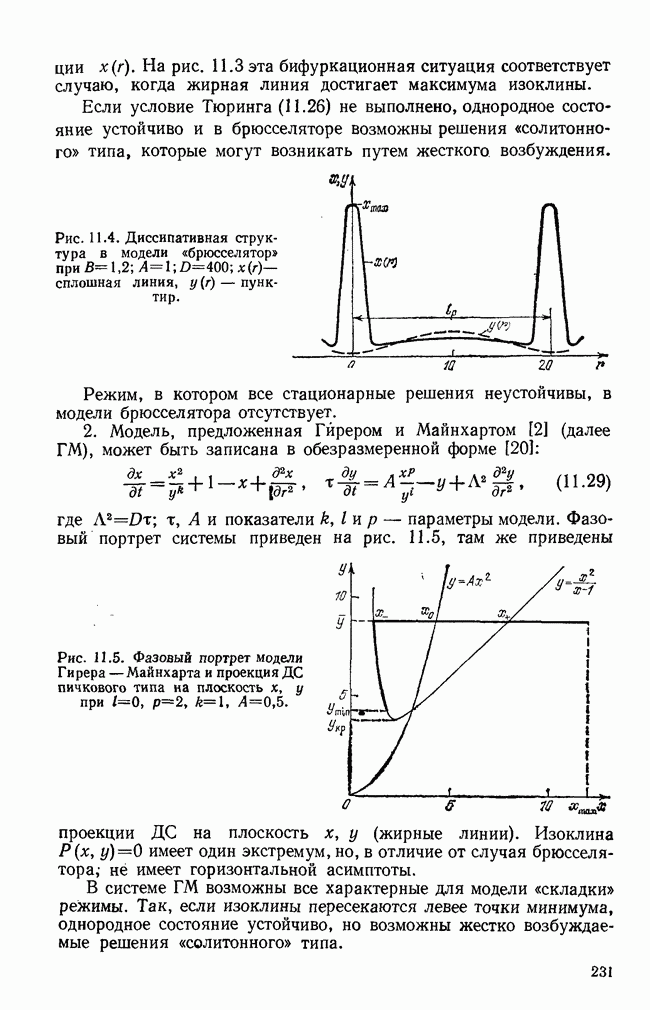
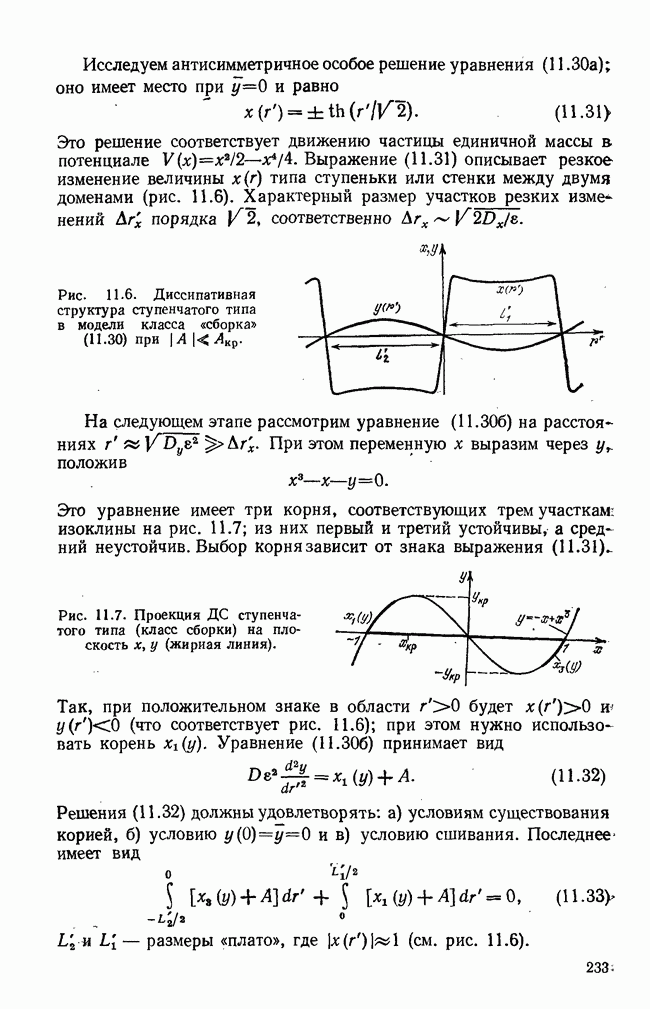
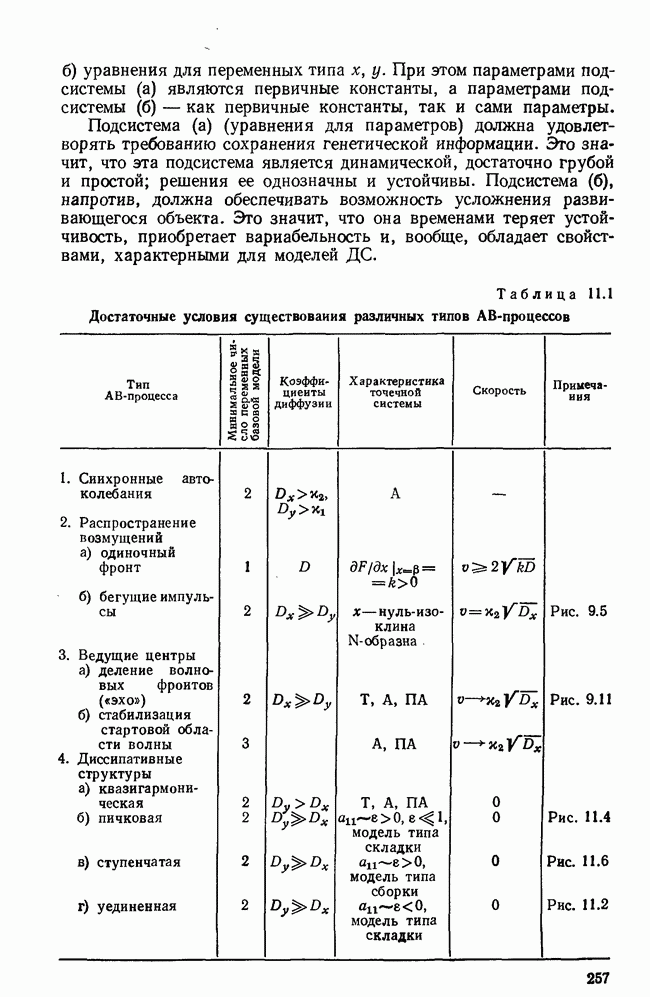
Упрощенная схема современного понимания динамики иммунного ответа на определенный антиген приведена на рис. 5.1 (см. [5]). Здесь показаны клоны  и
и  -лимфоцитов, возникающие из поли-потентных стволовых кроветворных клеток
-лимфоцитов, возникающие из поли-потентных стволовых кроветворных клеток  Первые этапы дифференцировки—образование клеток-предшественников
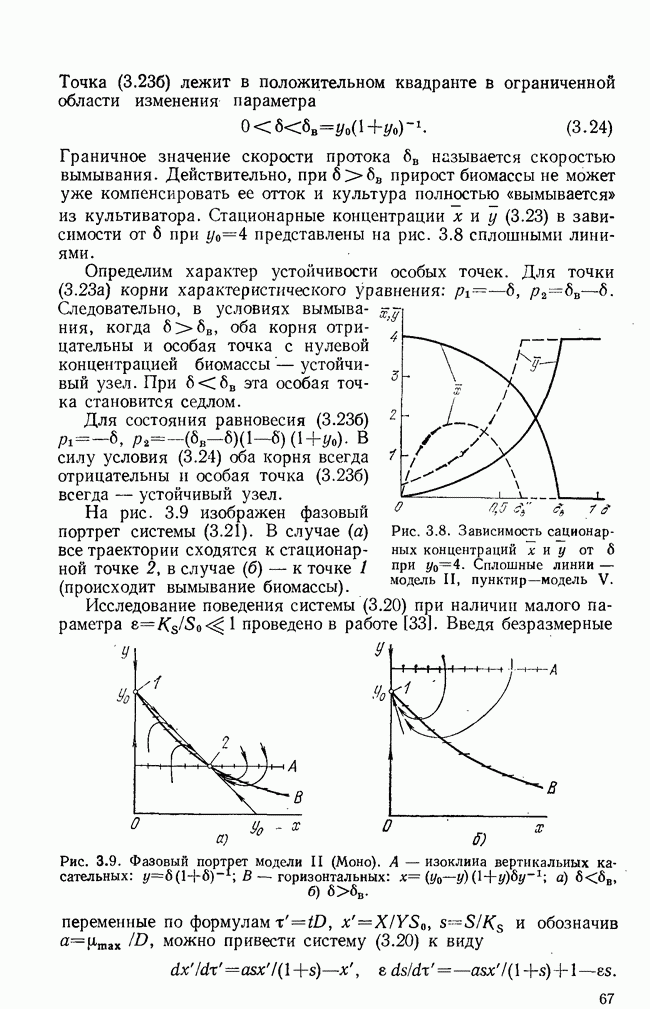
Первые этапы дифференцировки—образование клеток-предшественников  происходят независимо от присутствия антигена. Клетки-предшественники лимфоцитов (пролимфоциты) находятся, по-видимому, в
происходят независимо от присутствия антигена. Клетки-предшественники лимфоцитов (пролимфоциты) находятся, по-видимому, в  -фазе и получают сигнал к дифференцировке и (или) пролиферации от антигена (АГ), который взаимодействует с рецепторами, находящимися на поверхности этих клеток. Для стимуляции
-фазе и получают сигнал к дифференцировке и (или) пролиферации от антигена (АГ), который взаимодействует с рецепторами, находящимися на поверхности этих клеток. Для стимуляции  -клеток
-клеток  антиген должен быть предварительно «обработан»
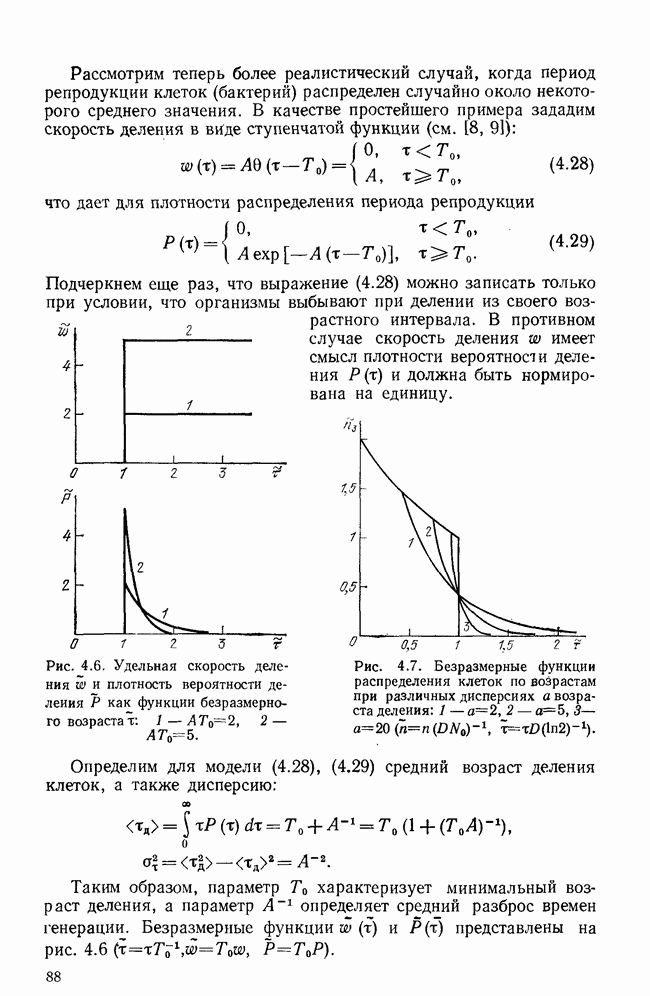
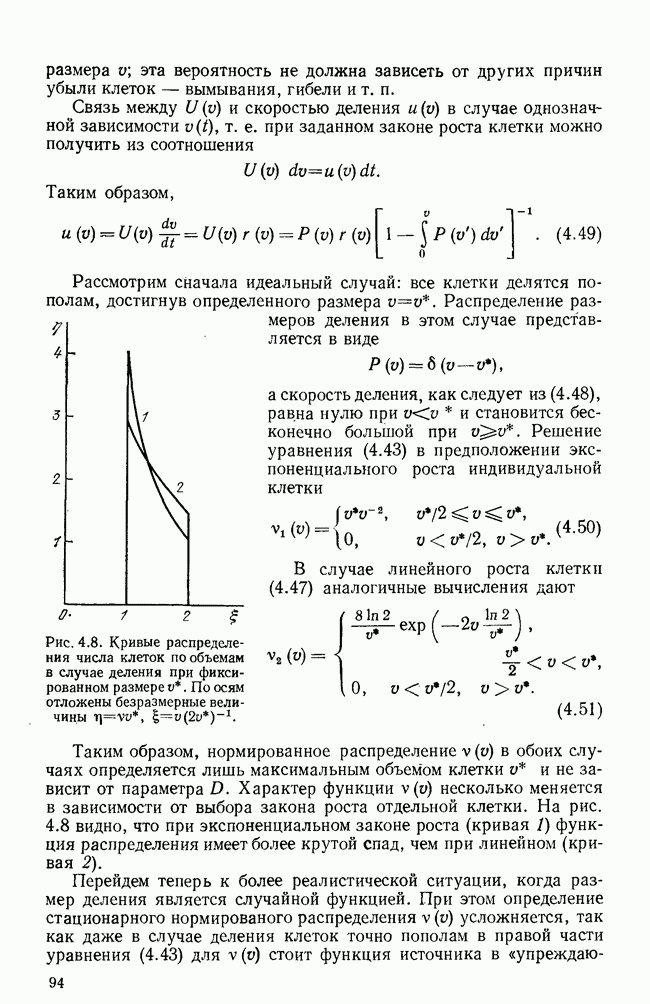
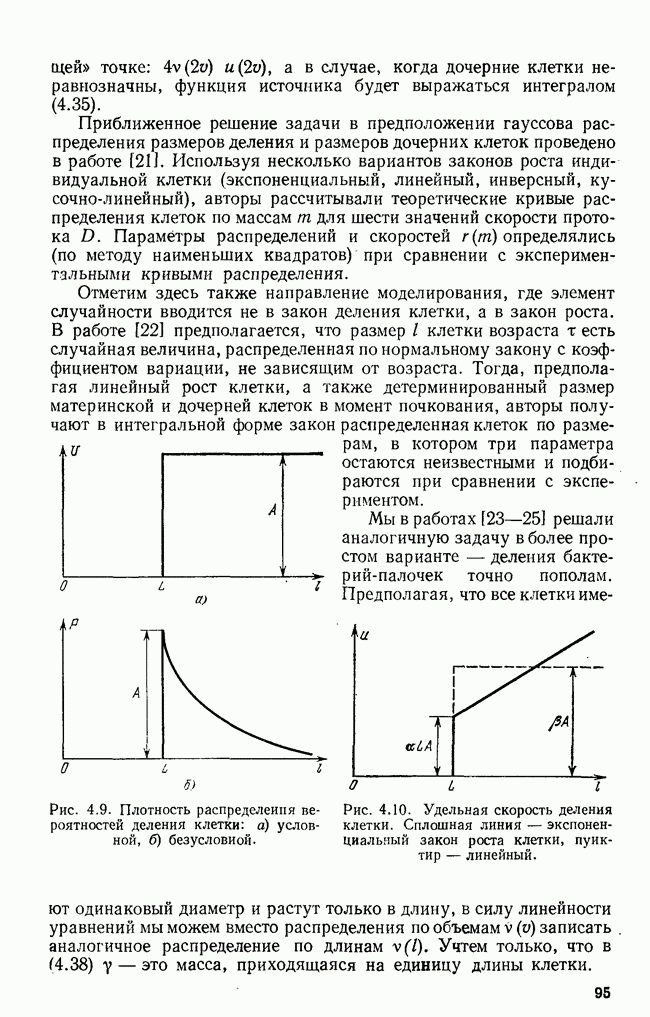
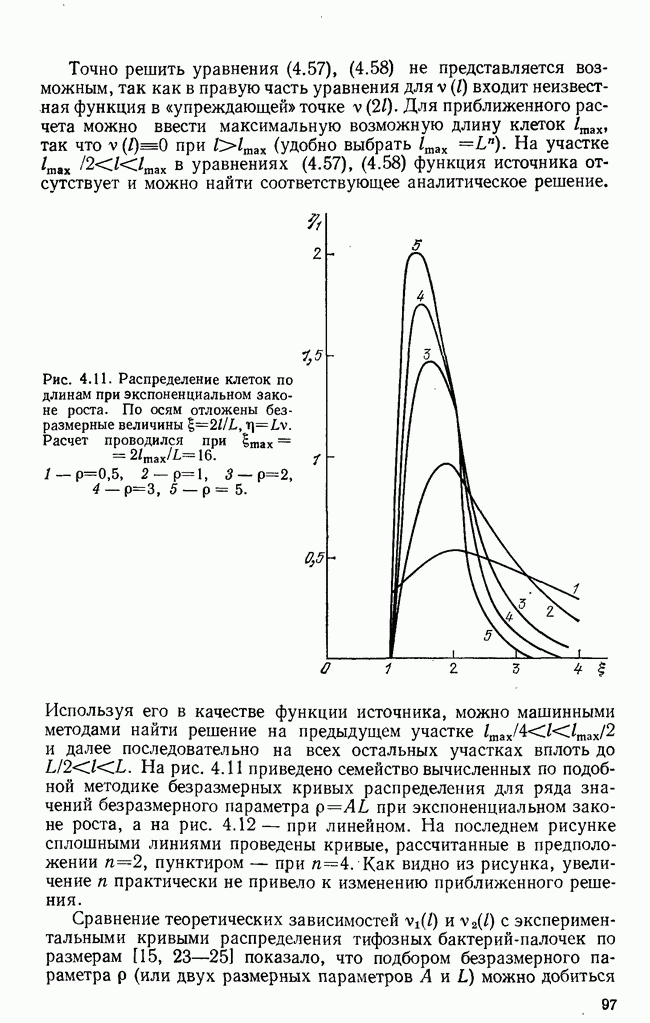
антиген должен быть предварительно «обработан»  -клетками-помощниками
-клетками-помощниками  -хелперы) и макрофагами
-хелперы) и макрофагами  как, по-видимому,
как, по-видимому,  -клетки реагируют только на компактную группу идентичных антигенных детерминант, которые образуются на поверхности макрофагов из антигена и специальных белков, вырабатываемых
-клетки реагируют только на компактную группу идентичных антигенных детерминант, которые образуются на поверхности макрофагов из антигена и специальных белков, вырабатываемых  -хелперами. Этот этап обозначен на схеме как взаимодействие
-хелперами. Этот этап обозначен на схеме как взаимодействие  -хелперов и
-хелперов и  . После антигенной стимуляции
. После антигенной стимуляции  -лимфоциты начинают интенсивное размножение на протяжении нескольких генераций, затем происходит конечный этап дифференцировки — превращение в неразмножающиеся коротко живущие плазматические клетки
-лимфоциты начинают интенсивное размножение на протяжении нескольких генераций, затем происходит конечный этап дифференцировки — превращение в неразмножающиеся коротко живущие плазматические клетки  способные с большой скоростью производить специфические белки — антитела. Строго говоря, антитела
способные с большой скоростью производить специфические белки — антитела. Строго говоря, антитела  вырабатывают и пролиферирующие
вырабатывают и пролиферирующие  -клетки, но с меньшей скоростью. Нужен ли для конечной стадии дифференцировки еще один антигенный стимул — пока точно не известно.
-клетки, но с меньшей скоростью. Нужен ли для конечной стадии дифференцировки еще один антигенный стимул — пока точно не известно.
На схеме рис. 5.1 пунктиром указано регулирующее действие  -клеток-супрессоров
-клеток-супрессоров  -супрессоры), подавляющих в определенных условиях пролиферацию как
-супрессоры), подавляющих в определенных условиях пролиферацию как  так и
так и  -лимфоцитов. Считается, что именно действием супрессоров объясняется отсутствие реакции на антигены организма-хозяина, а подавление соответствующего клона супрессоров вызывает аутоиммунные заболевания. На последней стадии развития иммунного ответа образуются
-лимфоцитов. Считается, что именно действием супрессоров объясняется отсутствие реакции на антигены организма-хозяина, а подавление соответствующего клона супрессоров вызывает аутоиммунные заболевания. На последней стадии развития иммунного ответа образуются  и
и  -памятные клетки
-памятные клетки  которые сохраняют память о данном антигене в течение долгого времени и обеспечивают более быстрый иммунный ответ на повторное его введение.
которые сохраняют память о данном антигене в течение долгого времени и обеспечивают более быстрый иммунный ответ на повторное его введение.
На нашей упрощенной схеме все антитела, вырабатываемые данным клоном  -клеток, считаются одинаковыми. На самом деле на протяжении иммунного ответа меняется валентность (и
-клеток, считаются одинаковыми. На самом деле на протяжении иммунного ответа меняется валентность (и
молекулярная масса) антител при неизменной их специфичности. Сначала вырабатываются более крупные молекулы  имеющие пять активных центров, а затем клетки переключаются на выработку более легких двухвалентных иммуноглобулинов
имеющие пять активных центров, а затем клетки переключаются на выработку более легких двухвалентных иммуноглобулинов  вторичном иммунном ответе производятся сразу иммуноглобулины
вторичном иммунном ответе производятся сразу иммуноглобулины 

Рис. 5.1. Схема иммунного ответа.
За иммунный ответ, направленный против чужеродных клеток, отвечают специфические лимфоциты-убийцы  -киллеры). Развитие соответствующего клона управляется
-киллеры). Развитие соответствующего клона управляется  -хелперами и
-хелперами и  -суп-рессорами.
-суп-рессорами.
Изложенная выше теория Бернета послужила основой для математических моделей, которые в 70-х годах получили необычайно широкое развитие. Краткий обзор моделей иммунитета мы дадим в § 6 этой главы, а сначала изложим наши собственные работы, выполненные в 1971-1975 гг. При этом отметим следующее. Хотя за последние годы теоретическая иммунология претерпела существенные изменения, простые модели, которые были записаны раньше, неплохо служат и до сих пор. Объясняется это, как мы считаем, все тем же «принципом простоты». Сложная многоуровневая система, какой является система специфического иммунитета, должна управляться по принципу «узкого места» небольшим количеством
ключевых переменных. Эти же ключевые переменные легче всего обнаружить экспериментально, поэтому первые модели ухватывали как раз определяющее звено в цепи иммунных реакций. Неудивительно также, что из сложных моделей, построенных на основании учета сложных схем взаимодействия различных субпопуляций клеток, путем редукции получают примерно те же модели, которые были предложены более 10 лет назад.
Уместно сделать еще одно замечание. На примере сравнительно простой модели § 2 мы хотим показать, как, пользуясь опытными данными, оценить коэффициенты в уравнениях. При этом очевидна польза «обезразмеривания» (т. е. приведения всех переменных к одному масштабу), которое позволяет выявить малые параметры и оценить вклад различных членов в исследуемые процессы. Существенно также, что часть параметров остается «свободной»: это дает возможность добиться достаточно хорошего совпадения теоретических кривых с соответствующими экспериментальными зависимостями.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ЧАСТЬ I. МАТЕМАТИЧЕСКИЕ МОДЕЛИ БИОФИЗИЧЕСКОЙ КИНЕТИКИ
- § 1. Особенности биологической кинетики
- § 2. Элементы качественной теории динамических систем второго порядка
- § 3. Методы упрощения систем кинетических уравнений
- § 4. Редукция систем и теория катастроф
- ГЛАВА 2. МАТЕМАТИЧЕСКИЕ МОДЕЛИ ЭВОЛЮЦИИ И РАЗВИТИЯ
- § 1. Первичный гиперцикл
- § 2. Проблема выбора единого кода
- § 3. Дивергентная эволюция
- § 4. Модели развития организма
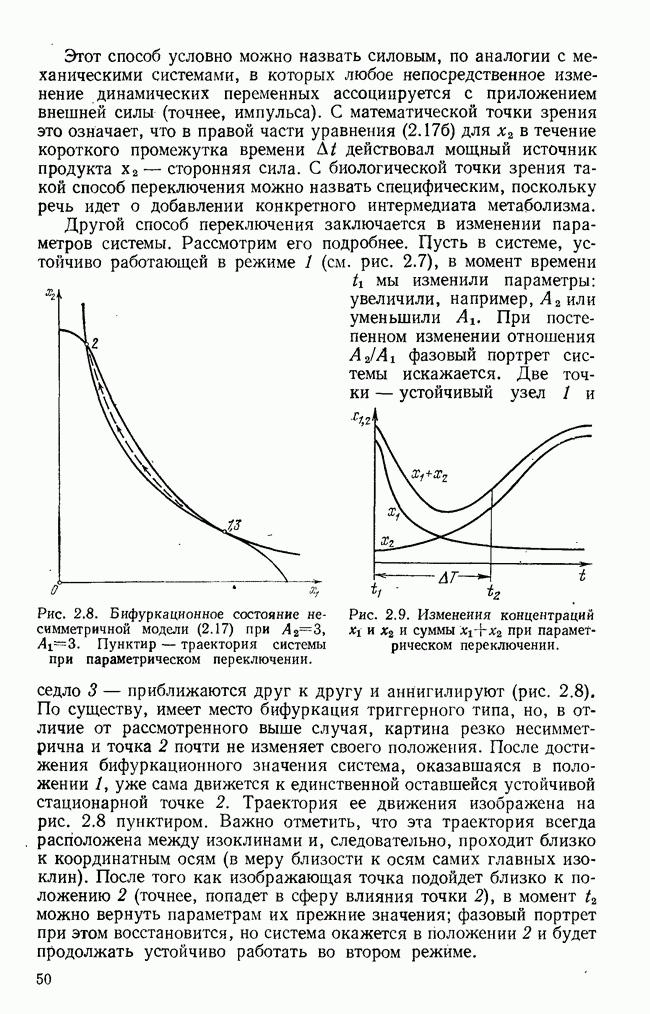
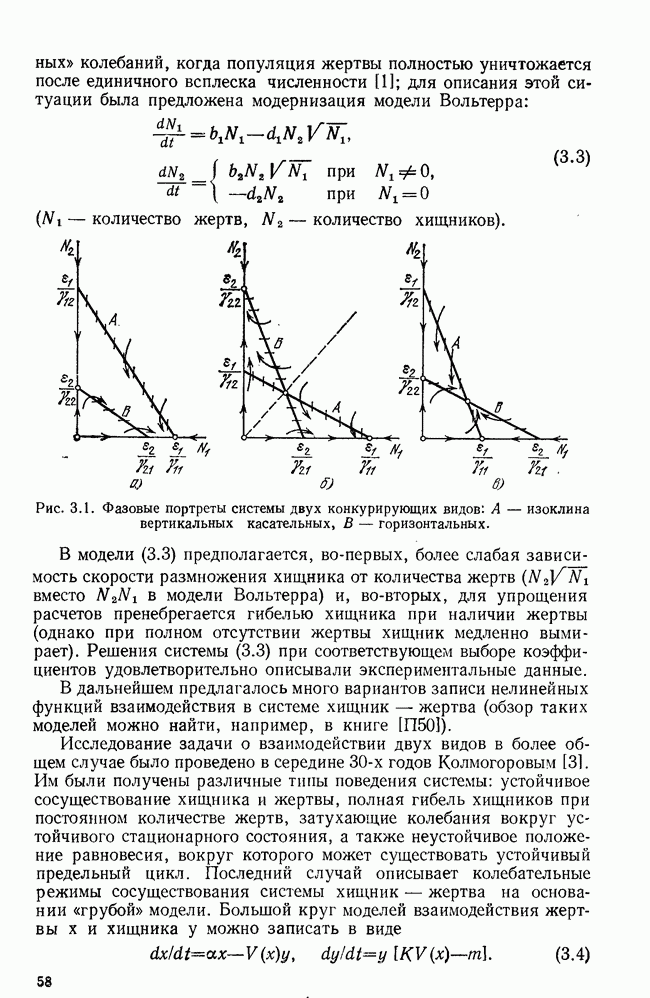
- § 5. Силовое и параметрическое переключение
- ГЛАВА 3. ДИНАМИЧЕСКИЕ МОДЕЛИ КЛЕТОЧНЫХ ПОПУЛЯЦИЙ
- § 1. Простейшие популяционные модели
- § 2. Влияние среды на рост популяций
- § 3. Математические модели в микробиологии
- § 4. Проблема биологической инерционности
- ГЛАВА 4. РАСПРЕДЕЛЕНИЕ КЛЕТОК ПО ВОЗРАСТАМ
- § 1. Двухвозрастная модель клеточной популяции
- § 2. Непрерывные возрастные модели
- § 3. Функции распределения клеток по размерам
- ГЛАВА 5. ДИНАМИКА ИММУННОЙ РЕАКЦИИ
- § 1. Популяции иммунных клеток в организме
- § 2. Математическая модель иммунного ответа
- § 3. Кооперативное взаимодействие лимфоцитов
- § 4. Инфекционные болезни
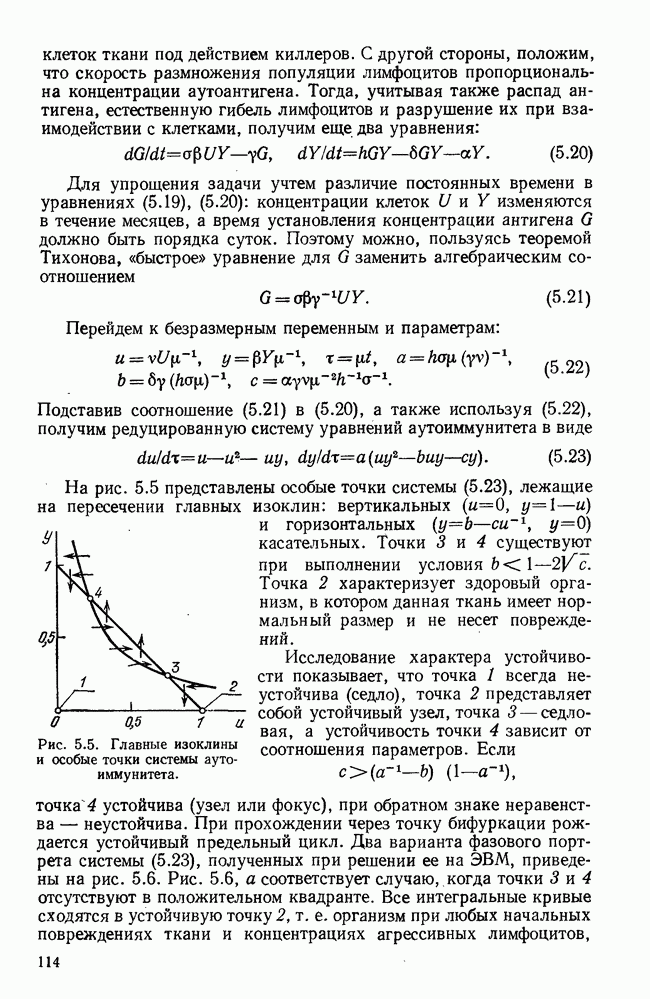
- § 5. Проблема аутоиммунитета
- § 6. Краткий обзор математических моделей иммунитета
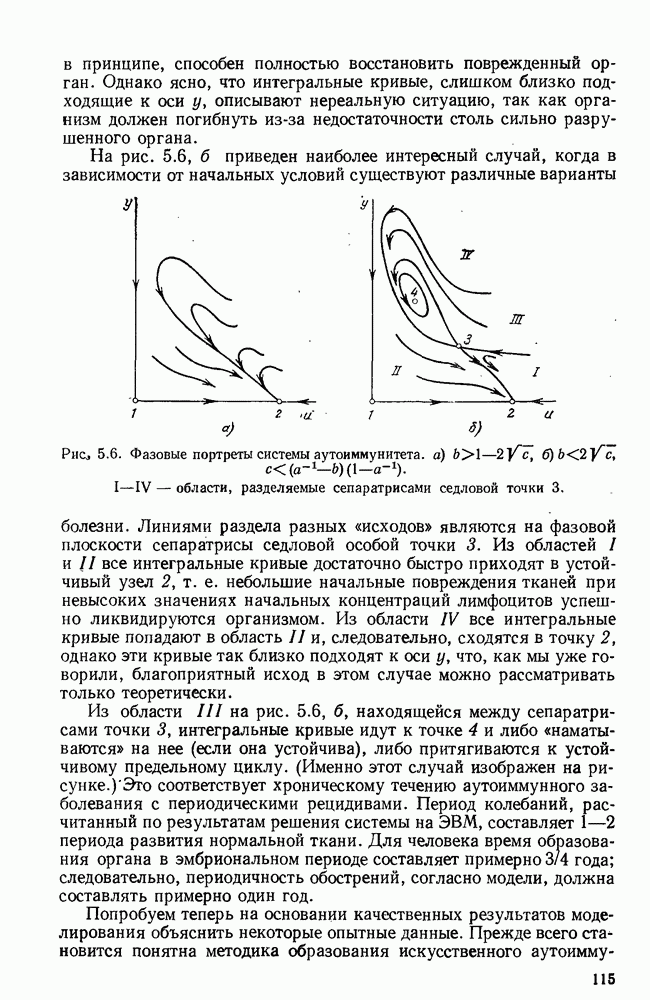
- ГЛАВА 6. СПЕЦИФИЧЕСКИЙ ИММУНИТЕТ И РАК
- § 2. Модели взаимодействия опухоли и организма
- § 3. Системное действие опухоли на организм
- § 4. Краткий обзор математических моделей
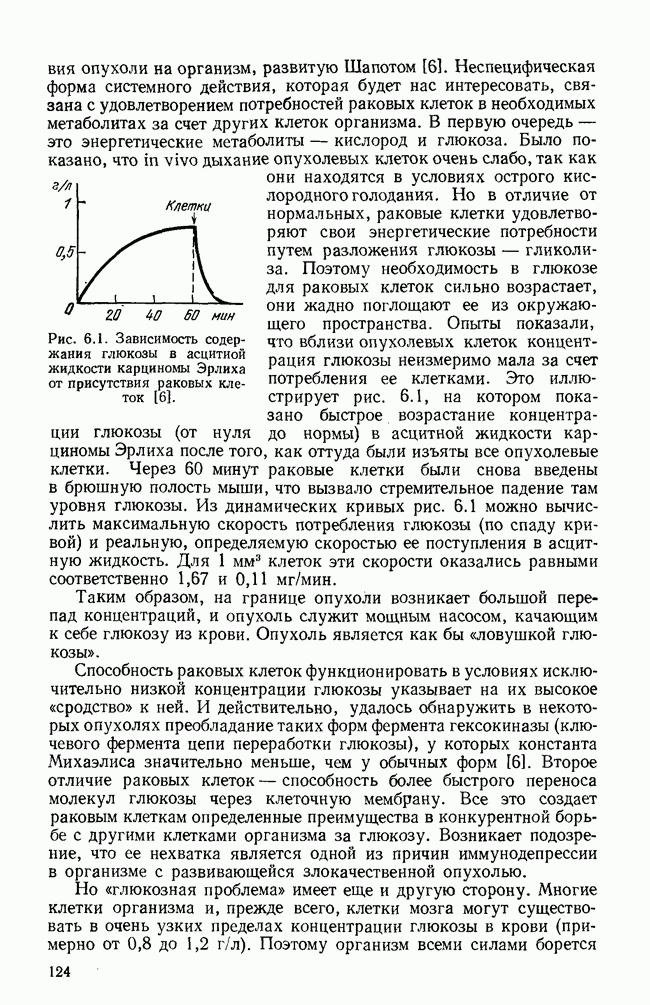
- ГЛАВА 7. МОДЕЛИ РЕГУЛЯЦИИ КЛЕТОЧНОГО ЦИКЛА
- § 2. Тип модели и основные гипотезы
- § 3. Модель регуляции клеточного цикла
- § 4. Биологические следствия
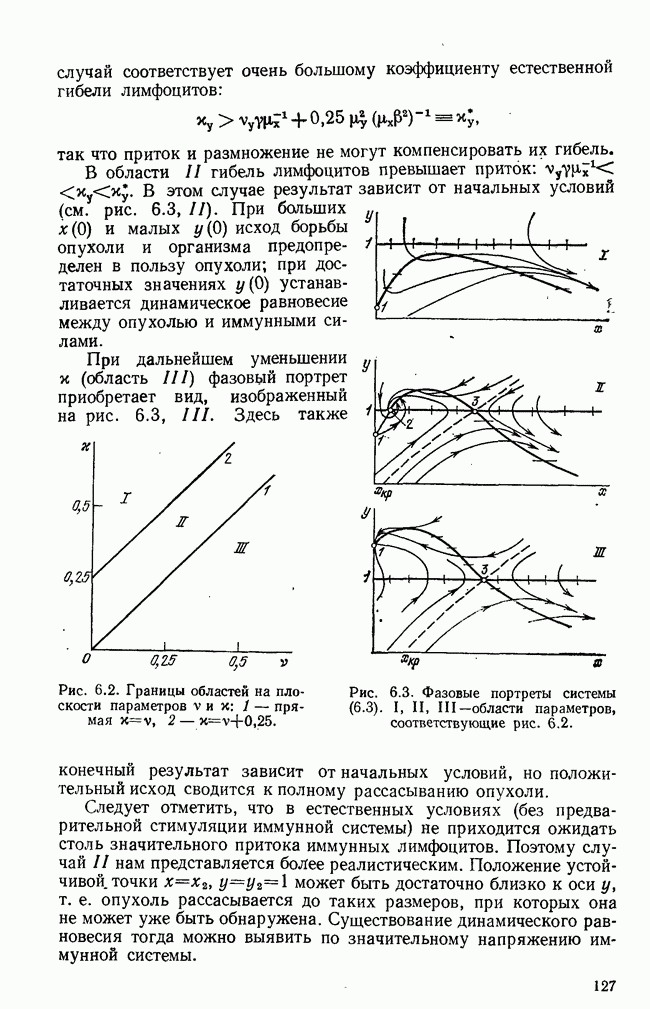
- ЧАСТЬ II. РАСПРЕДЕЛЕННЫЕ КИНЕТИЧЕСКИЕ СИСТЕМЫ И БИОЛОГИЧЕСКАЯ СИНЕРГЕТИКА
- ГЛАВА 8. МАТЕМАТИЧЕСКИЕ МОДЕЛИ АВТОВОЛНОВЫХ ПРОЦЕССОВ
- § 1. Математическая модель распределенной системы
- § 2. Стационарные однородные решения и их устойчивость
- § 3. Автоколебания и диссипативные структуры в почти гармонических системах
- § 4. Классификация автоволновых процессов и основные экспериментальные данные
- ГЛАВА 9. РАСПРОСТРАНЕНИЕ ВОЗМУЩЕНИЙ В ВОЗБУДИМЫХ СРЕДАХ
- § 1. Распространение фронта возмущения
- § 2. Базовая модель релаксационных возбудимых сред
- § 3. Стационарные бегущие импульсы
- § 4. Процесс установления бегущего импульса
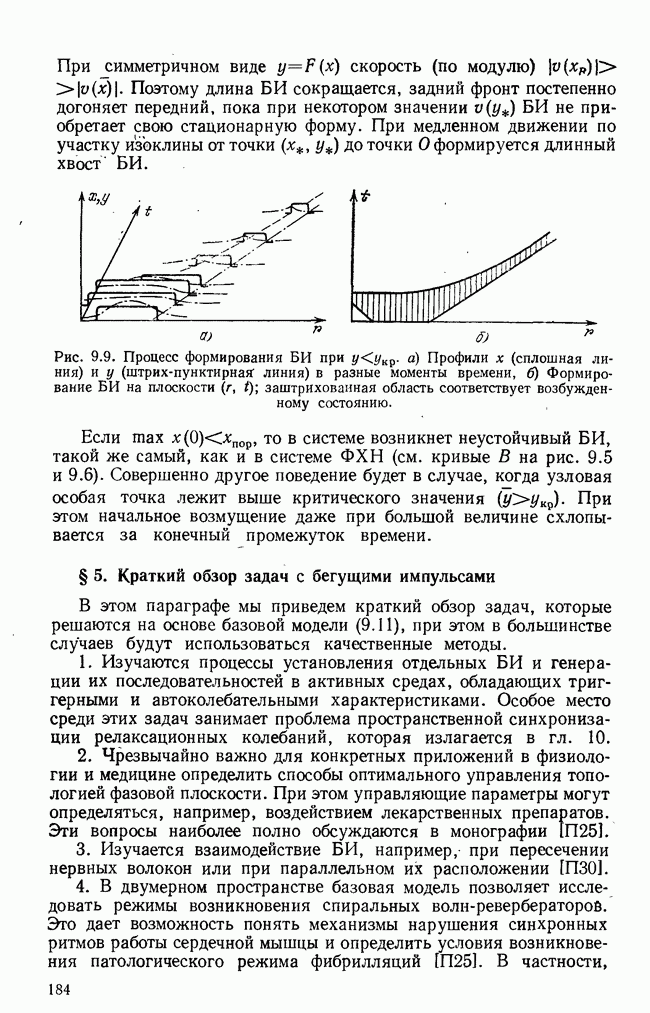
- § 5. Краткий обзор задач с бегущими импульсами
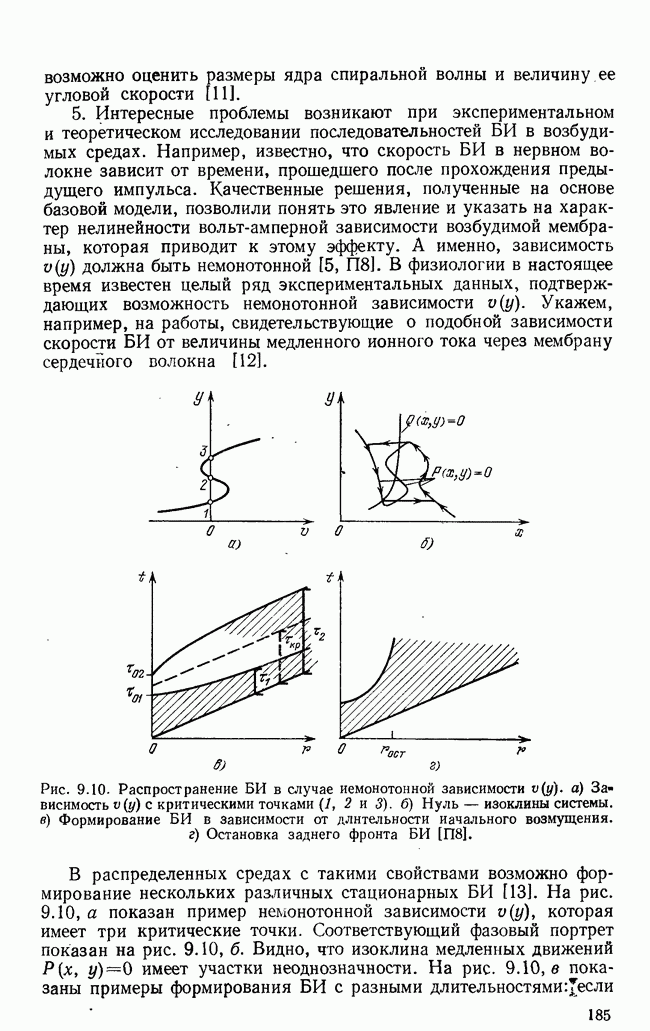
- § 6. Автономные источники волн в гомогенной активной среде
- ГЛАВА 10. СИНХРОНИЗАЦИЯ АВТОКОЛЕБАНИЙ В НЕОДНОРОДНОМ ПРОСТРАНСТВЕ
- § 1. Базовая модель неоднородной распределенной системы
- § 2. Синхронизация в квазигармонической системе
- § 3. Случай релаксационной системы
- § 4. Приложения в химии и биологии
- § 5. Процессы установления синхронного режима
- § 6. Шумы и синхронизация
- § 7. Автоколебательные системы, связанные через общую среду
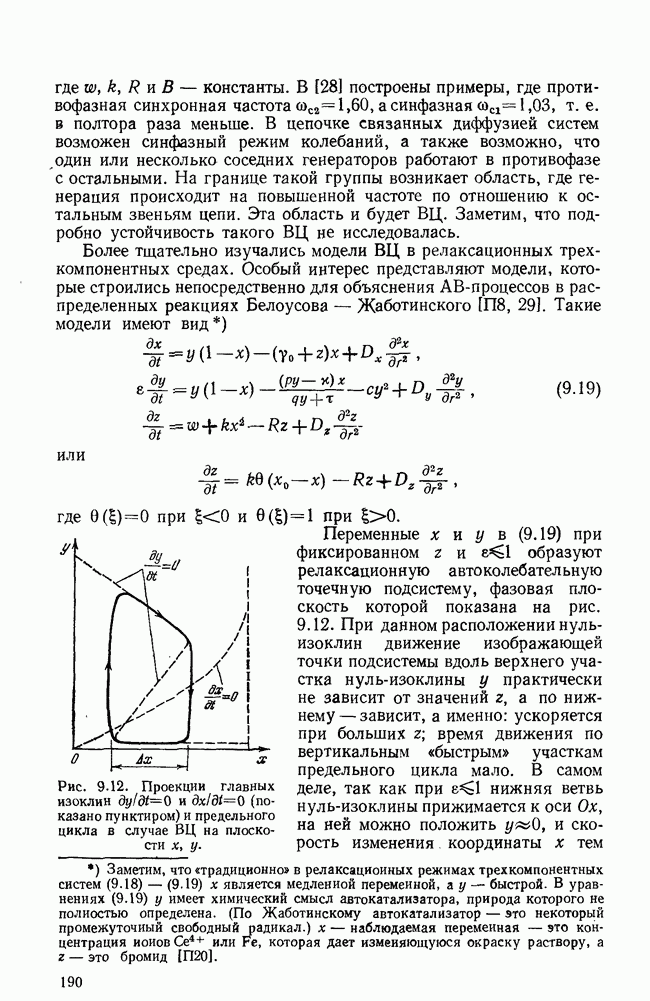
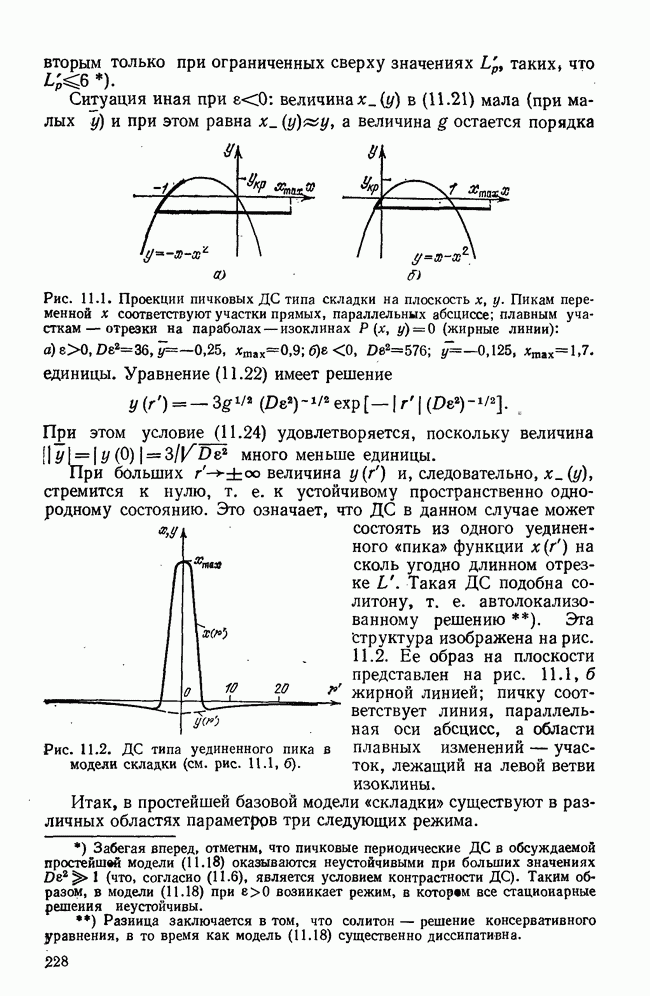
- ГЛАВА 11. ДИССИПАТИВНЫЕ СТРУКТУРЫ И ПРОБЛЕМЫ САМООРГАНИЗАЦИИ
- § 2. Контрастные диссипативные структуры; базовые модели
- § 3. Стационарные контрастные ДС типа складки
- § 4. Стационарные ДС типа сборки
- § 5. Устойчивость диссипативных структур
- § 6. Конкретные модели диссипативных структур
- § 7. Кинетика образования ДС
- § 8. Некоторые выводы
- ГЛАВА 12. ТЕРМОДИНАМИКА, ИНФОРМАЦИЯ, БИОЛОГИЯ
- § 1. Механика и статистика
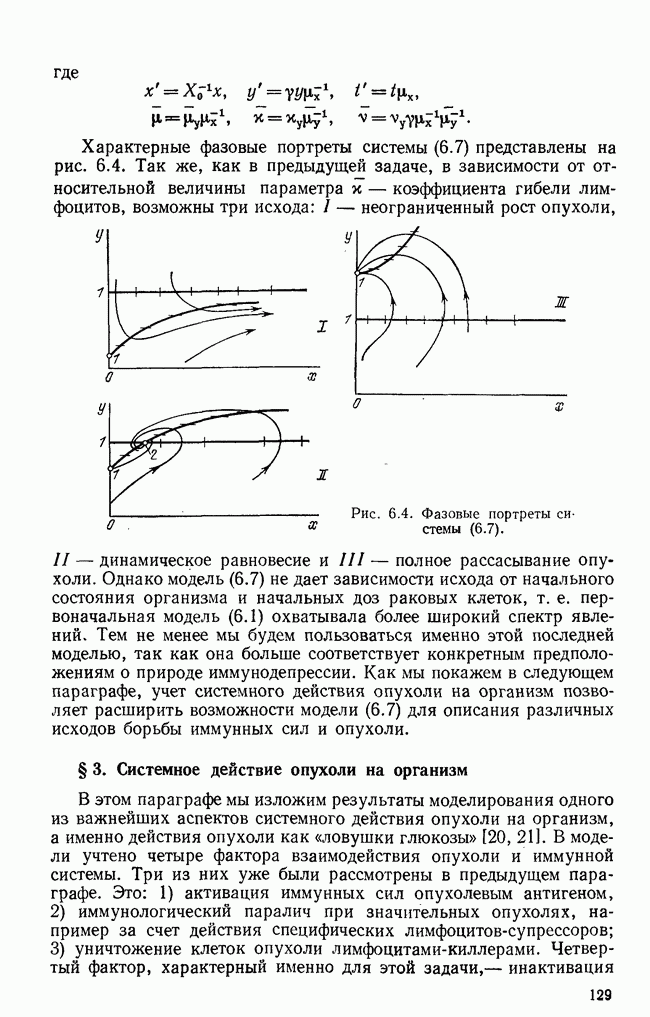
- § 2. Информация и энтропия
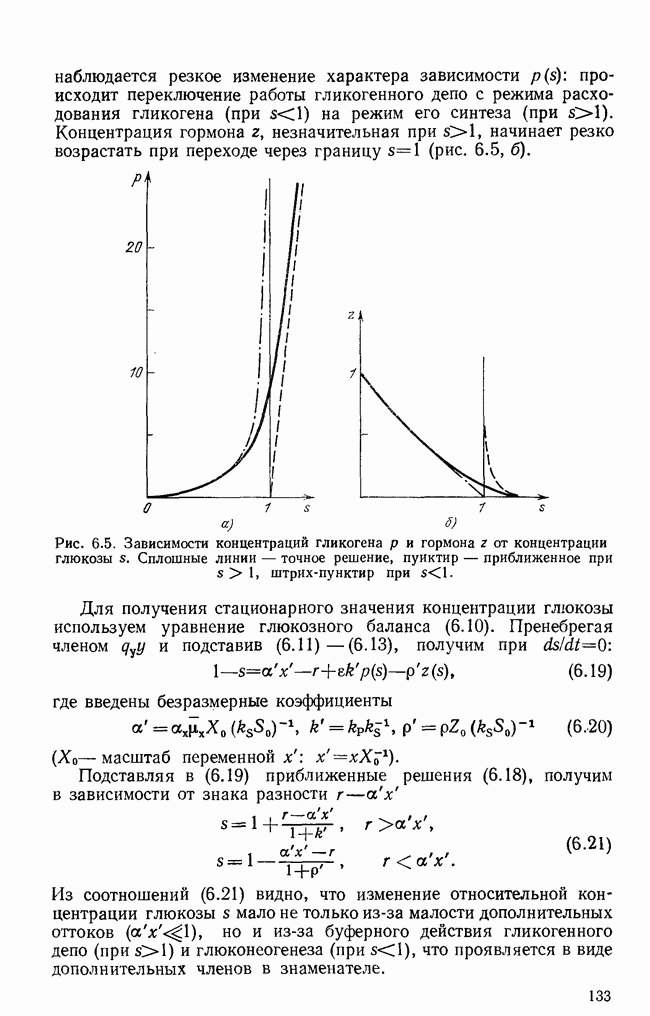
- § 3. Ценность информации
- § 4. Биологическая информация
- § 5. Эффективность биологической информации
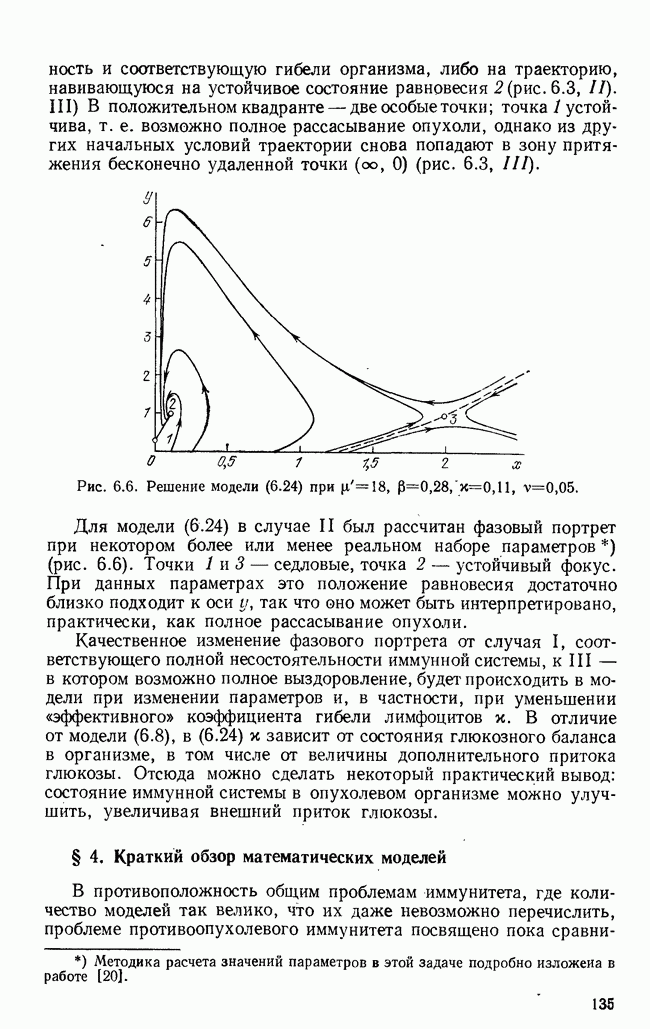
- ЗАКЛЮЧЕНИЕ