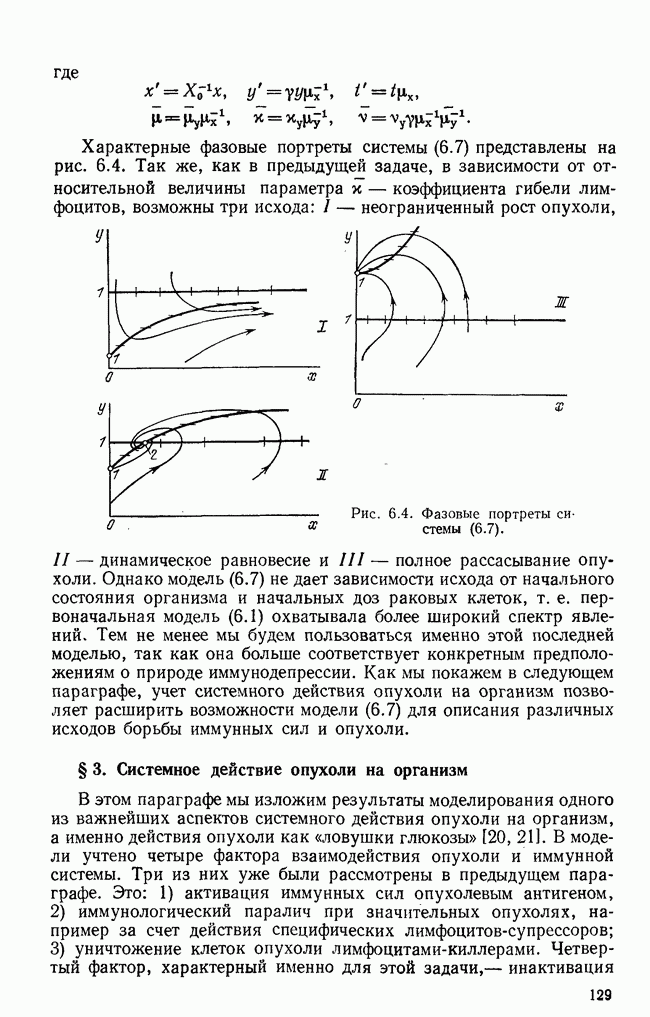
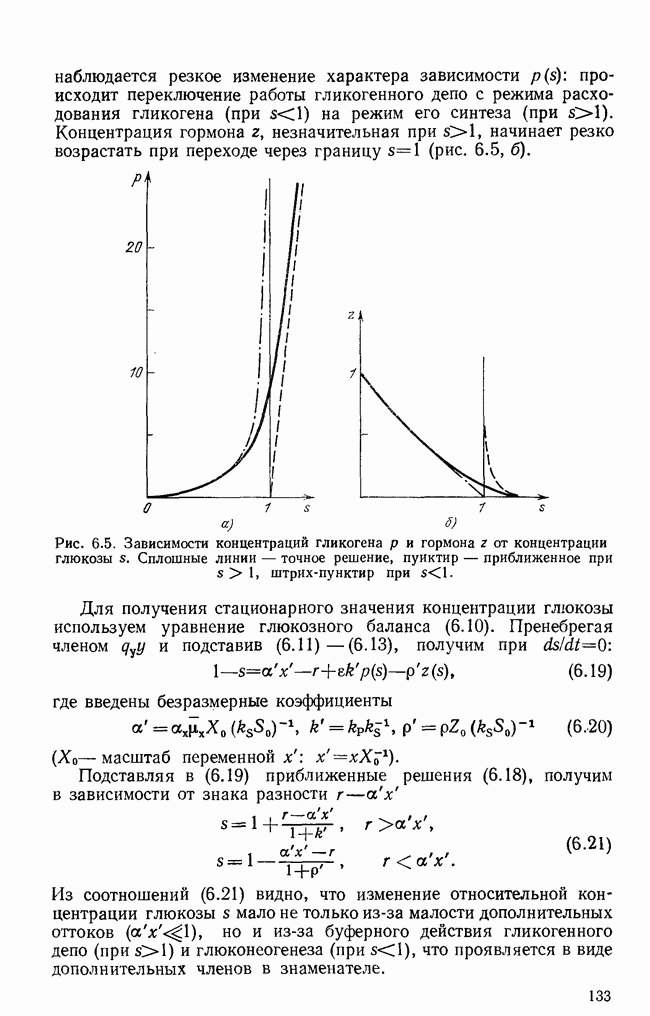
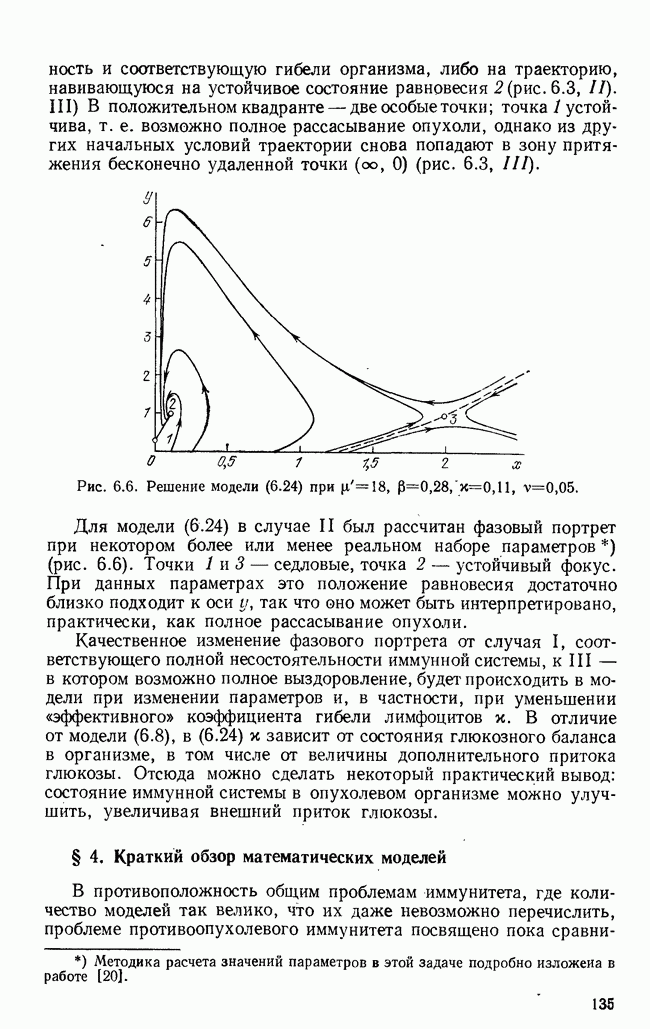
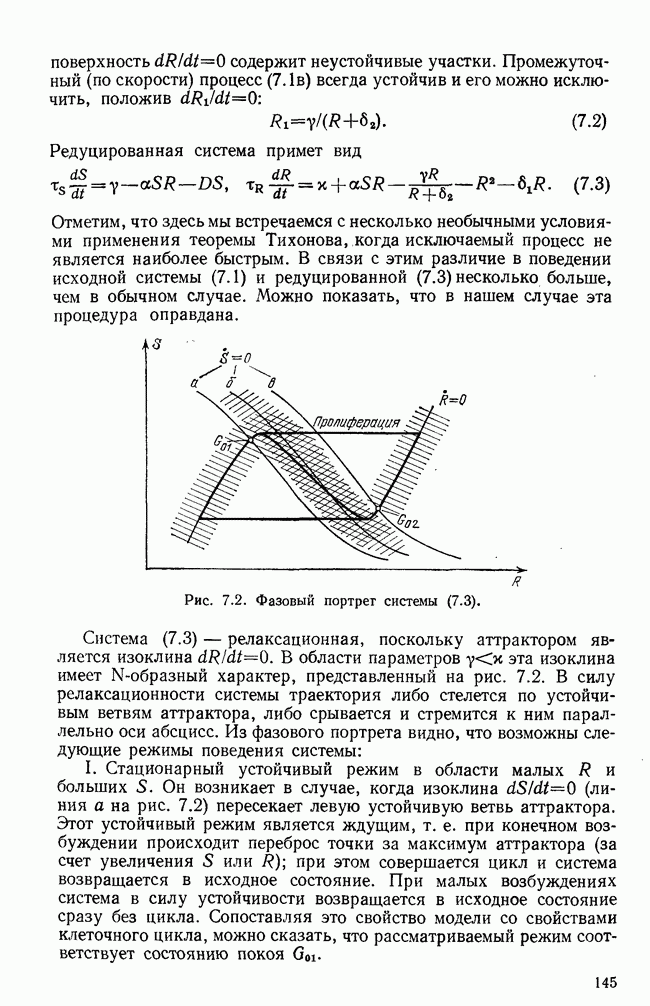
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
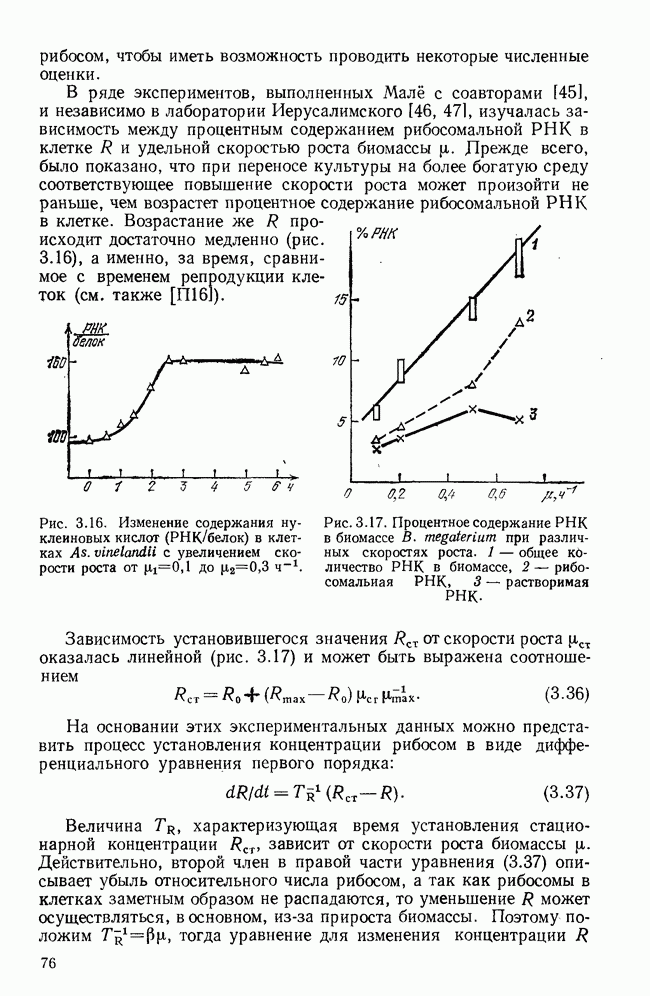
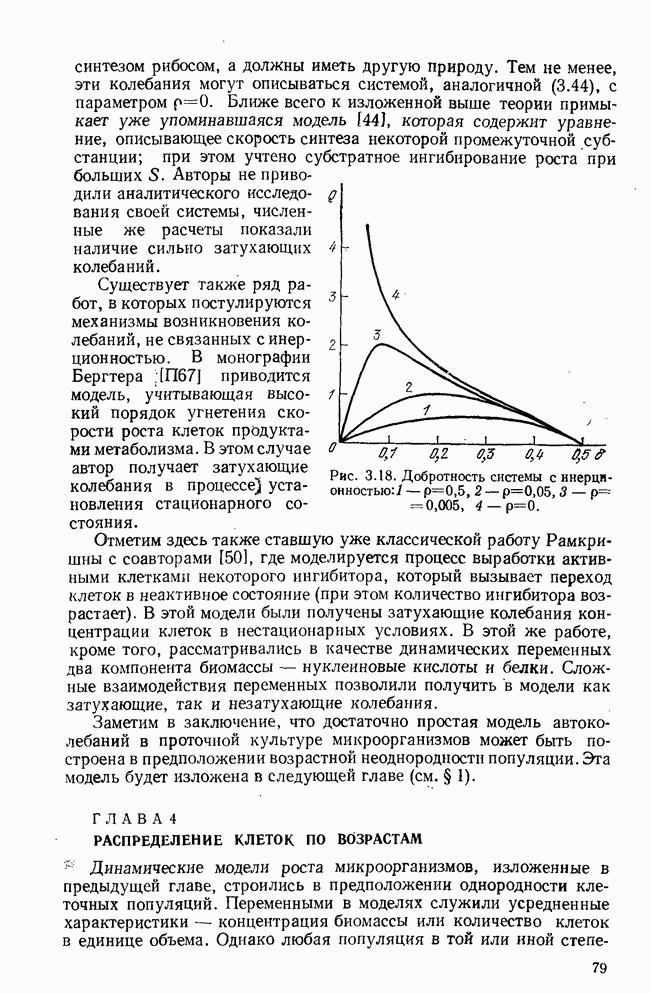
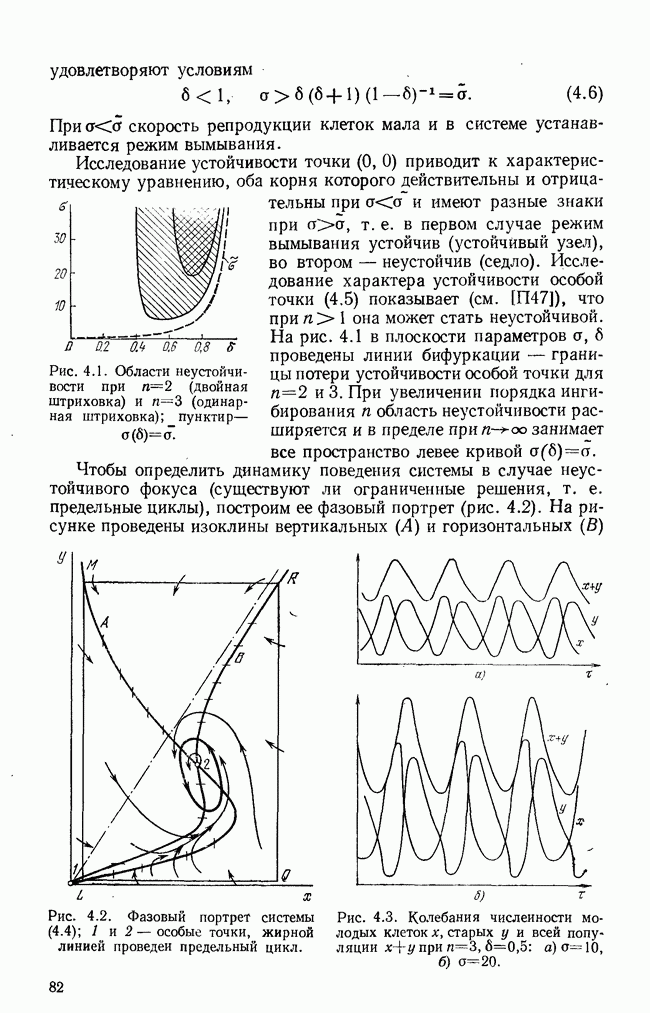
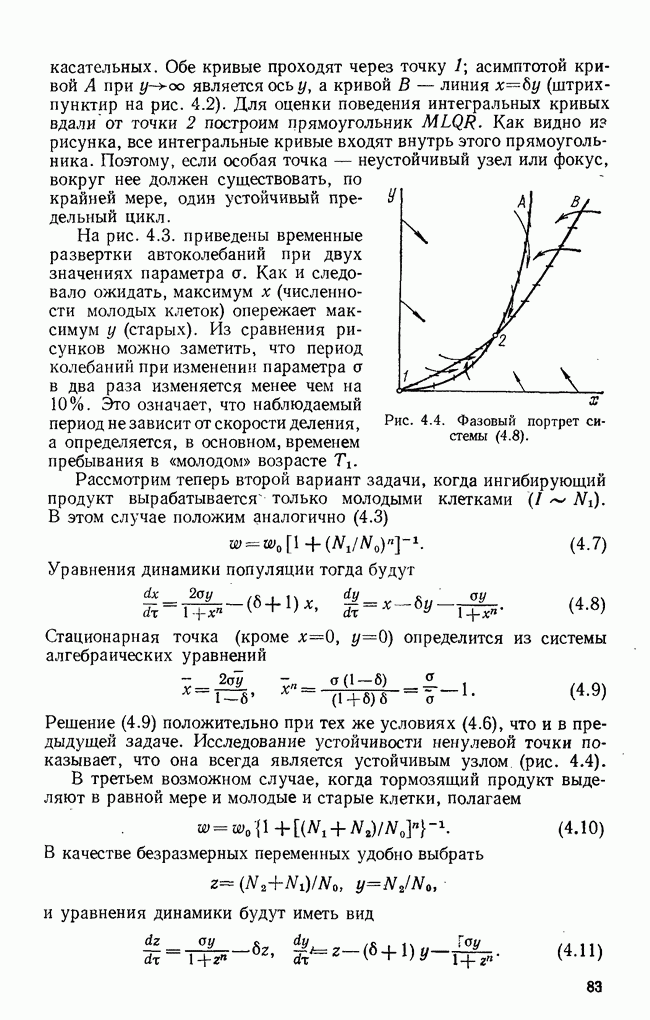
§ 6. Краткий обзор математических моделей иммунитета
Бурное развитие математического моделирования в иммунологии началось немногим более 10 лет назад — до этого известна практически одна попытка математически связать динамику антитело-образования с количеством плазматических клеток [18]. В самом начале 70-х годов появились работы Молчанова [19, 20], которые, как нам кажется, предвосхитили многие более поздние результаты. Пользуясь такими обобщенными понятиями, как «инфекционное начало»  и «иммунное начало»
и «иммунное начало»  автор построил систему дифференциальных уравнений второго порядка, описывающих течение
автор построил систему дифференциальных уравнений второго порядка, описывающих течение
иммунной реакции:

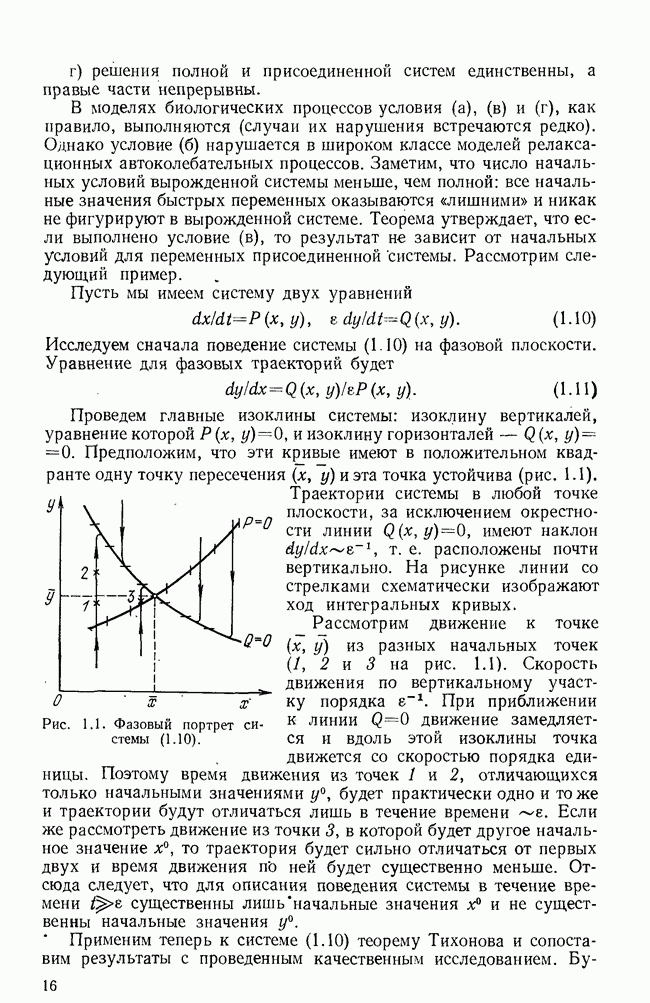
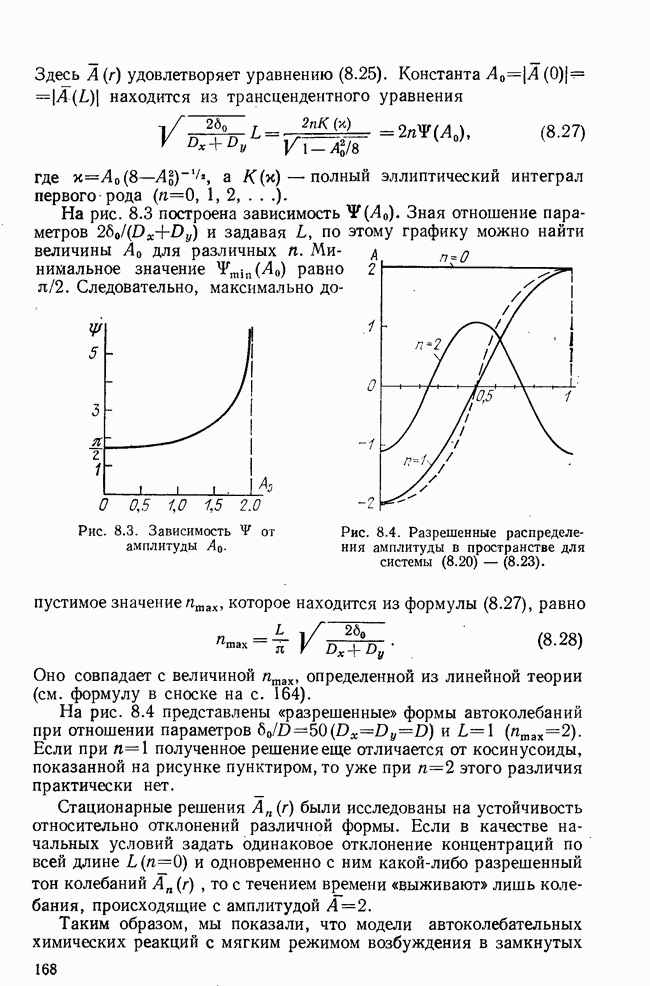
Скорость производства иммунных сил была представлена в виде пороговой (или даже многоуровневой) функции  Решение системы исследовалось на фазовой плоскости
Решение системы исследовалось на фазовой плоскости  было получено большое количество фазовых портретов, соответствующих различным исходам болезни. Недавно предложено развитие модели (5.24) на случай, когда коэффициенты
было получено большое количество фазовых портретов, соответствующих различным исходам болезни. Недавно предложено развитие модели (5.24) на случай, когда коэффициенты  являются периодическими функциями времени, отражающими периодичность в заболеваемости туберкулезом [21].
являются периодическими функциями времени, отражающими периодичность в заболеваемости туберкулезом [21].
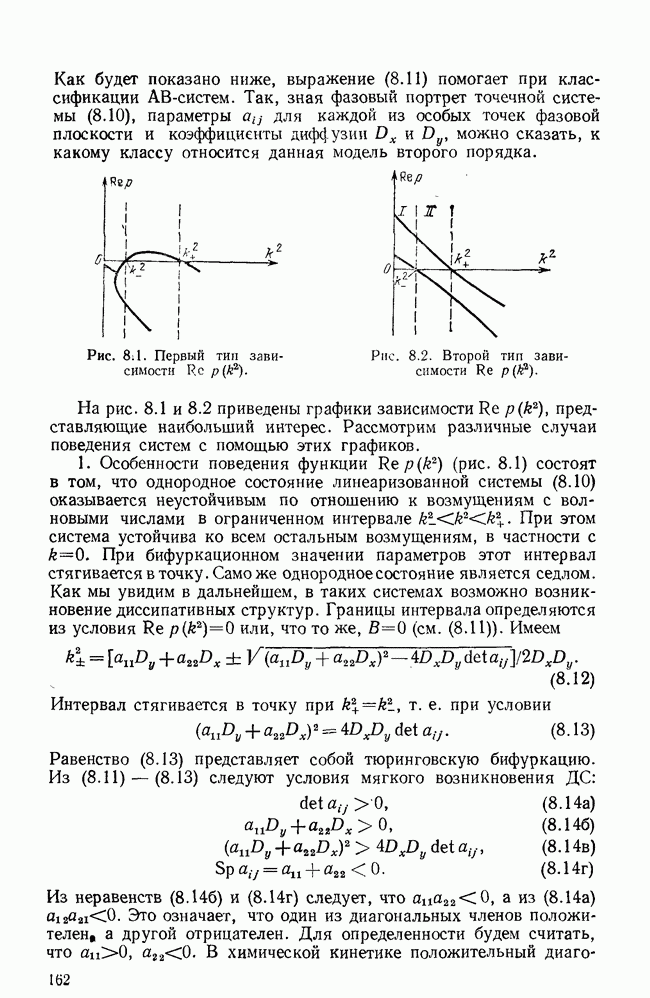
Также в начале 70-х годов в США выходит обширная серия моделей иммунитета, развитая Беллом [22—25] (с его работами по распределенным моделям в микробиологии мы познакомились в предыдущей главе). Основные положения теории Белла очень схожи с изложенной выше (в § 2) моделью иммунитета, созданной нами независимо и опубликованной впервые в 1971 г. [6]. Обе модели содержат практически те же самые динамические переменные: клетки-предшественники, размножающиеся лимфоциты, плазматические и памятные клетки, антитела и антиген. Основное отличие состоит в способе задания функций перехода клеток из одной фазы в другую: в наших работах вероятности перехода линейно зависят от концентрации антигена, а у Белла — это сложные нелинейные функции от доли клеточных рецепторов, занятых антигеном.
Первая модель Белла [22] содержала шесть дифференциальных уравнений и описывала динамику иммунной реакции в целом. Далее [23, 24] модель последовательно усложнялась для описания действия мультивалентных антигенов, толерантности высокой и низкой доз (для чего вводились пороговые ограничения сверху и снизу); рассмотрена также модель, содержащая несколько клонов лимфоцитов, различающихся по константам связи с антигеном (авидности). Системы уравнений становились все более высокого порядка (даже до 96-го!) и уже не поддавались аналитическому исследованию. Наверное поэтому в 1973 г. появилась работа [25], содержащая всего два уравнения для концентраций антигена  и антител
и антител  модель типа хищник — жертва:
модель типа хищник — жертва:

причем концентрация комплекса  определялась приближенно из условия химического равновесия:
определялась приближенно из условия химического равновесия:

Аналитическому исследованию модели (5.25), а также более сложной модели третьего порядка посвящены работы Пимбли [26, 27],
где основное внимание уделяется периодическим решениям. Следует заметить, что последние работы носят уже чисто формальный математический характер, как и работы Мерилла [28], где система иммунитета сводится к модели с кубической нелинейностью третьего порядка; автор исследует бифуркации в системе и проводит аналогию с теорией катастроф Тома.
Развитием идеи Белла о различии антител по величине связи с антигеном служат работы Бруни с соавторами (см., например, [29]), где вместо численностей популяций лимфоцитов в уравнения входят плотности их распределения по константам связи  Эти модели хорошо описывают временную селекцию клонов: увеличение авидности в течение иммунного ответа.
Эти модели хорошо описывают временную селекцию клонов: увеличение авидности в течение иммунного ответа.
Все это направление моделирования гуморального иммунитета обобщено в книге «Теоретическая иммунология», вышедшей в Нью-Йорке в 1978 г. под редакцией Дж. Белла, А. Перельсона и Дж. Пимбли 
Второе направление моделирования иммунных явлений, определившееся в середине 70-х годов и развивавшееся, в основном, в нашей стране, — это модели, в которые в явном виде входит запаздывание. Здесь прежде всего отметим обширный цикл работ Диброва, Лифшица и Волькенштейна, посвященный проблемам гуморального иммунитета [П10, 30-35]. Исходная модель содержит три дифференциальных уравнения для антител а, антигена  и клеток-предшественников х. Предполагается, что производство антител в момент
и клеток-предшественников х. Предполагается, что производство антител в момент  пропорционально произведению числа клеток х и концентрации антигена
пропорционально произведению числа клеток х и концентрации антигена  в момент
в момент  функция с запаздывающим аргументом
функция с запаздывающим аргументом  учитывает пополнение пула клеток-предшественников за счет памятных клеток. При различных предположениях исходная модель сводится к системе второго порядка либо для
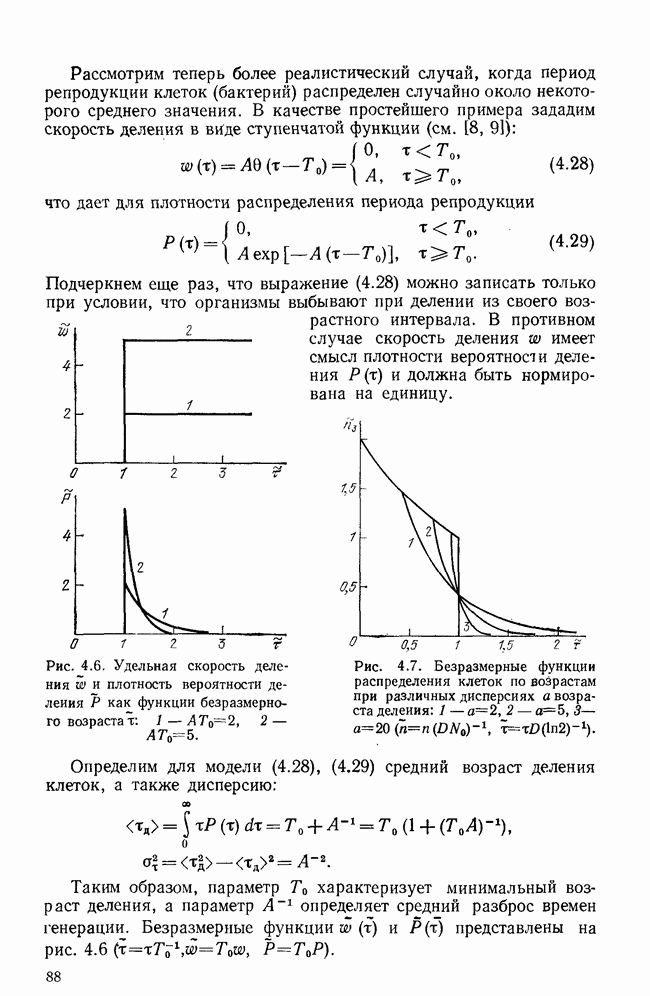
учитывает пополнение пула клеток-предшественников за счет памятных клеток. При различных предположениях исходная модель сводится к системе второго порядка либо для  либо для
либо для  Подробно исследуется роль величины запаздывания в качественном и количественном отношении. Получены условия, при которых в модели наблюдается асимптотическое или быстрое, практически за конечное время, исчезновение антигена, условия возникновения предельного цикла на плоскости
Подробно исследуется роль величины запаздывания в качественном и количественном отношении. Получены условия, при которых в модели наблюдается асимптотическое или быстрое, практически за конечное время, исчезновение антигена, условия возникновения предельного цикла на плоскости  а также неограниченного размножения антигена, моделирующего гибель организма. Рассмотрен также стохастический аспект для определения вероятности исчезновения антигена при малых его концентрациях.
а также неограниченного размножения антигена, моделирующего гибель организма. Рассмотрен также стохастический аспект для определения вероятности исчезновения антигена при малых его концентрациях.
Тщательная разработка модели позволила авторам получить (аналитически или путем численного эксперимента) практически все возможные режимы протекания гуморальной иммунной реакции. Однако все эти работы выполнены в абстрактном плане и не содержат конкретных примеров применения модели креальным процессам.
Широкий круг явлений иммунитета охватывают модели инфекционных болезней, развиваемые в группе Марчука [36-38, П32, П35] (см. также сборник [П70], с. 69-86, 114—120).
Простейшая математическая модель инфекционного заболевания записывается в виде системы четвертого порядка с
запаздыванием:

где V — концентрация обобщенного «вируса», С — плазмацитов,  обобщенных антител (это могут быть и эффекторные клетки). Четвертое уравнение описывает в явном виде динамику пораженного вирусом органа — мишени:
обобщенных антител (это могут быть и эффекторные клетки). Четвертое уравнение описывает в явном виде динамику пораженного вирусом органа — мишени:  доля пораженной части органа,
доля пораженной части органа,  В модели (5.27) может учитываться влияние температуры тела на динамику иммунной реакций: коэффициент размножения вируса
В модели (5.27) может учитываться влияние температуры тела на динамику иммунной реакций: коэффициент размножения вируса  падает при увеличении температуры
падает при увеличении температуры  а коэффициент стимуляции плазмацитов
а коэффициент стимуляции плазмацитов  возрастает.
возрастает.
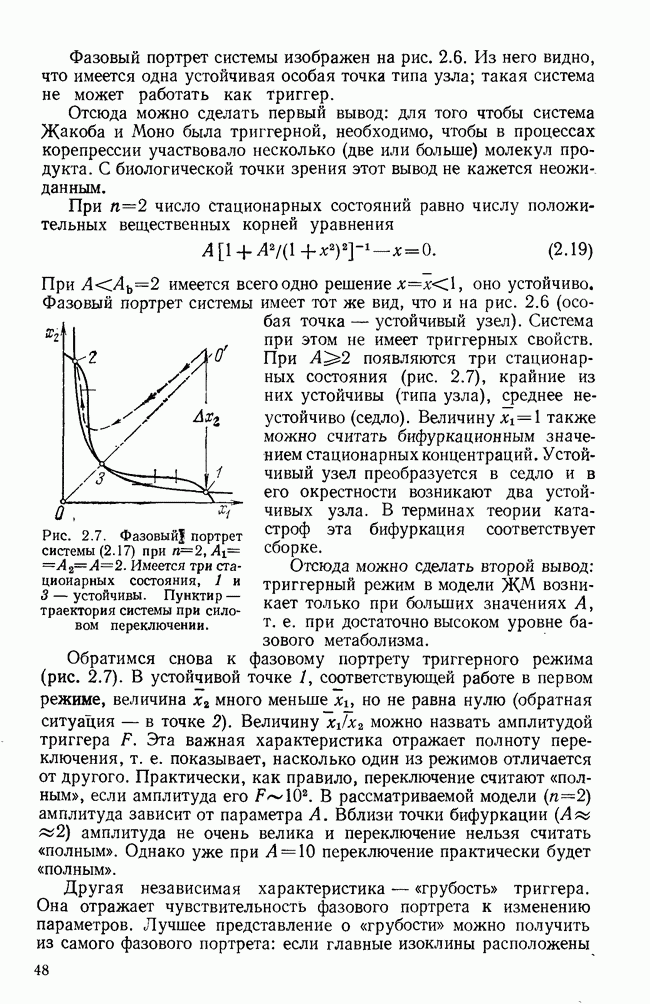
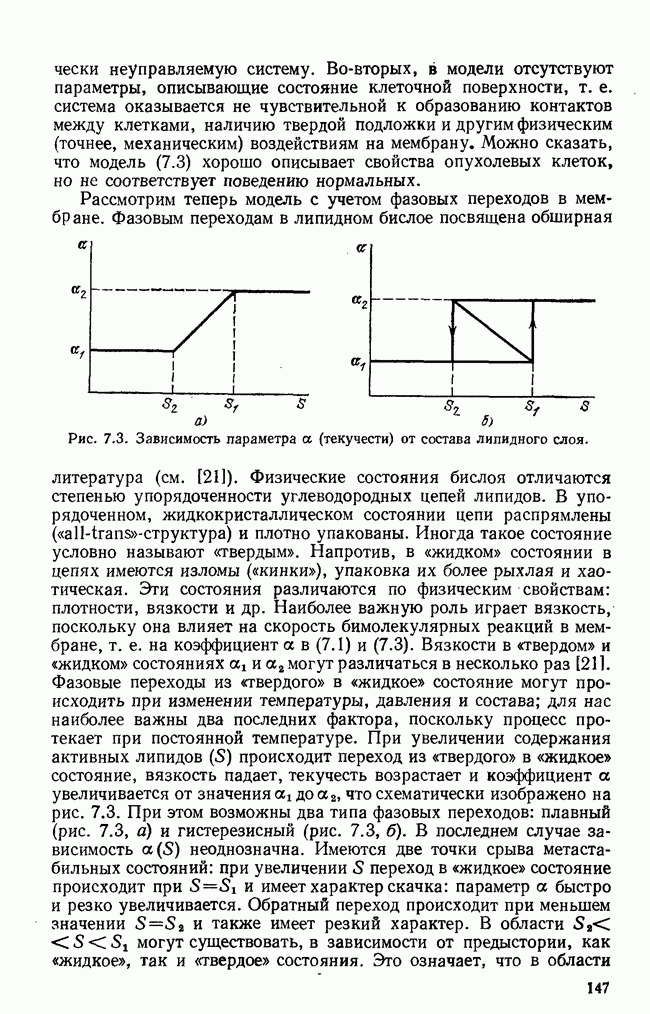
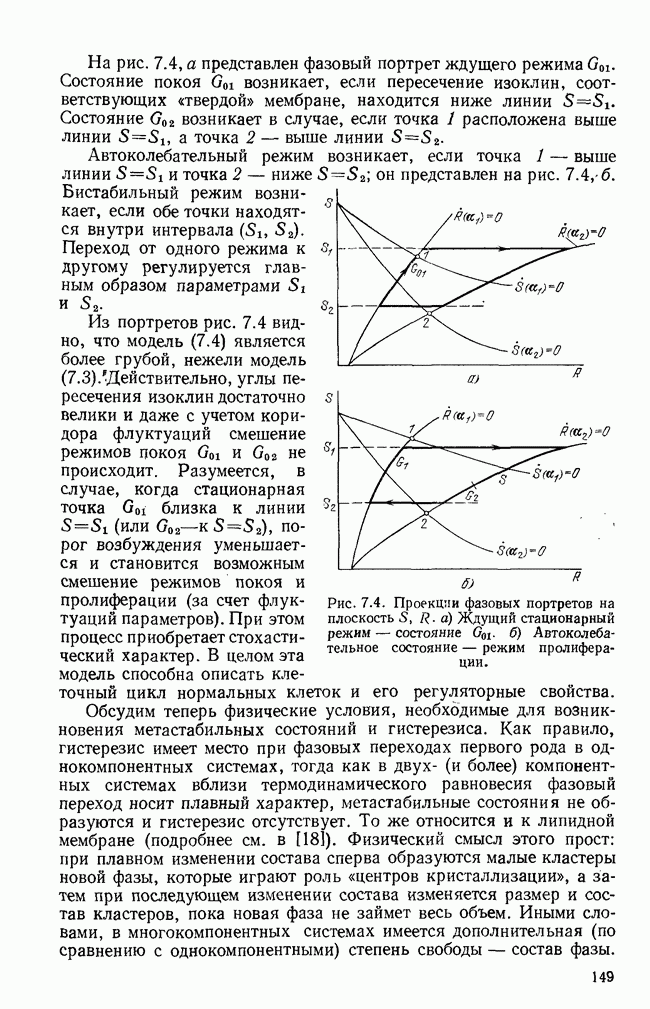
Исследование характера решений системы (5.27) позволило выделить четыре основные формы протекания инфекционного заболевания: 1) легчайшая, когда  при
при  ; 2) острая — резкий спад
; 2) острая — резкий спад  после роста; 3) хроническая —
после роста; 3) хроническая —  ; 4) летальная —
; 4) летальная —  при
при 
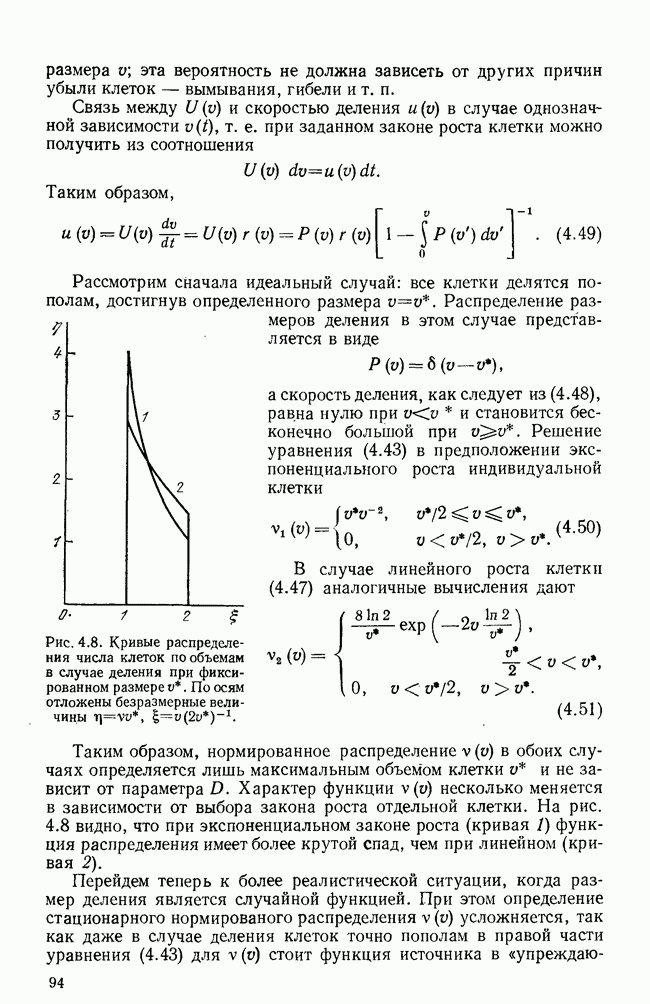
Большой интерес представляет выдвинутое авторами предложение лечения хронических заболеваний путем перевода их в острую форму. С помощью численных экспериментов показано, что этого можно достичь как с помощью температурного эффекта, так и введением биостимулятора — конкурирующего неразмножающегося непатогенного антигена. В этом случае временно ослабевает противовирусный иммунитет, вирус получает возможность размножаться и, после выведения биостимулятора, вызывает усиленный иммунный ответ, приводящий к быстрому выздоровлению.
Кроме простейшей модели (5.27) в указанных работах развивается также уточненная модель инфекционного заболевания, включающая динамику стволовых клеток,  и
и  -лимфоцитов, макрофагов, различных видов антител (всего 11 уравнений). Эта модель изучается, в частности, с целью выявления особенностей динамики иммунного ответа в случае блокировки одной из систем (
-лимфоцитов, макрофагов, различных видов антител (всего 11 уравнений). Эта модель изучается, в частности, с целью выявления особенностей динамики иммунного ответа в случае блокировки одной из систем ( или В).
или В).
Еще более полную систему уравнений, охватывающую почти все аспекты современной теории иммунитета (взаимодействие  -лимфоцитов с
-лимфоцитов с  -хелперами,
-хелперами,  -супрессорами и т. п.), можно найти в работах Альперина и Исавиной [39, 40]. Большое количество параметров, многие из которых принципиально не могут быть измерены, снижает, на наш взгляд, эвристическую ценность этих моделей. Гораздо более интересной нам представляется попытка тех же авторов описать динамику аутоиммунных заболеваний системой второго порядка с запаздыванием [40]. Подробная модель для описания кооперативных эффектов в иммунитете, содержащая семь уравнений, содержится в работе Вериго и Скотниковой [41].
-супрессорами и т. п.), можно найти в работах Альперина и Исавиной [39, 40]. Большое количество параметров, многие из которых принципиально не могут быть измерены, снижает, на наш взгляд, эвристическую ценность этих моделей. Гораздо более интересной нам представляется попытка тех же авторов описать динамику аутоиммунных заболеваний системой второго порядка с запаздыванием [40]. Подробная модель для описания кооперативных эффектов в иммунитете, содержащая семь уравнений, содержится в работе Вериго и Скотниковой [41].
Третье направление математических моделей в иммунологии — это «пороговые» модели, развиваемые в работах Вальтмана и Фридмана [42, 43]. Предполагается существование двух порогов: для начала пролиферации лимфоцитов и для начала производства антител.
Первый порог заключается в накоплении достаточного количества антигена для стимуляции клеток-предшественников, второй — в достижении лимфоцитами заданного порогового уровня.
Четвертое направление содержит работы, в которых выработка антител рассматривается как задача оптимальной стратегии организма. Например, в интересной работе Перельсона [44] рассматривается задача оптимальной стратегии: как распределить общую клеточную популяцию между размножающимися лимфоцитами и тупиковыми плазматическими клетками, чтобы элиминация антигена произошла за минимальное время. Для задачи, содержащей три дифференциальных уравнения: для лимфоцитов, плазмацитов и антител, рассмотрена оптимальная стратегия при различных дозах вводимого антигена. Оказалось, что для малых доз достаточно тех антител, которые производят лимфоциты, и организму выгодно плазмацитов не производить совсем. При больших дозах выгодно переключение: на начальном участке производятся только пролиферирующие лимфоциты, а после переключения — превращение всех больших лимфоцитов в плазматические клетки. Работа [44] интересна также потому, что в ней проводятся аналогии между задачей оптимальной стратегии в иммунитете и в других областях биофизики.
Новый подход к биологическим системам демонстрируется в работах Глушкова, Иванова, Яненко [45, 46, П15], где используется класс динамических моделей, первоначально созданных для экономики. А именно, динамическая система представляется интегрально-функциональными соотношениями в виде равенств и неравенств. В простейшем случае «двухпродуктовая модель» записывается следующим образом:

Здесь  скорость образования иммунных клеток,
скорость образования иммунных клеток,  доля клеток, идущая на размножение,
доля клеток, идущая на размножение,  доля клеток, взаимодействующих с антигеном, с
доля клеток, взаимодействующих с антигеном, с  скорость уничтожения антигена,
скорость уничтожения антигена,  -показатели эффективности по каналам
-показатели эффективности по каналам  временная граница, левее которой ранее созданные клетки не функционируют. На отрезке
временная граница, левее которой ранее созданные клетки не функционируют. На отрезке  все функции заданы. Для иммунной системы формулируется задача оптимального самоподдержания клона стволовых клеток, дающих начало клонам иммунно-компетентных клеток различных специфичностей.
все функции заданы. Для иммунной системы формулируется задача оптимального самоподдержания клона стволовых клеток, дающих начало клонам иммунно-компетентных клеток различных специфичностей.
В последние годы широкое развитие получила сетевая теория Ерне (см. [47—49, 51]). Ерне предположил, что антитела, кроме детерминанты, комплементарной к антигену, имеют другие детерминанты (идиотипы), действующие как аутоантигены. К этим идиотипам тоже образуются антиидиотипические антитела и т. д., т. е. создаются целые иммунные сети (network). Существование иммунных сетей в настоящее время не вызывает сомнения, так как
антиантитела обнаружены экспериментально. Однако объяснить все особенности иммунитета только взаимодействием отдельных звеньев этих цепей не удается.
Несколько в стороне от перечисленных здесь динамических моделей стоят работы Жилека, развивающего стохастические модели иммунного ответа, на которых мы здесь останавливаться не будем (соответствующие ссылки см. в [П70], с. 15-25).
Упомянем также цикл работ Леви (см., например, [50]), в которых на основании анализа обширного экспериментального материала определяется функциональная связь между количеством плазматических клеток и концентрацией антигена.
В заключение этого параграфа отметим, что поток моделей в иммунологии нисколько не скудеет, а все более расширяется (обширную библиографию можно найти в обзорах [51, 52], а также в сборнике [П70]). Однако большинство моделей, как мы видели, носят теоретический характер и не могут быть сразу приложены к конкретным задачам. Более того, проблеме определения коэффициентов моделей почти не уделяется внимания (пожалуй, кроме первой модели Белла [22]). Поэтому мы в своем изложении (см. § 2) остановились довольно подробно на обезразмеривании модели и адекватном определении констант из опытных данных.
Второе замечание касается проблемы явного введения запаздывания или порогового эффекта. Нам кажется, что введение функций с запаздывающим аргументом иногда приводит к значительному усложнению модели и невозможности ее аналитического исследования, тогда как учет лишней ступени дифференцировки клеток, т. е. введение лишнего дифференциального уравнения позволяет получить те же результаты более простым путем. Однако это вопрос не принципов, а, скорее, вкуса. Что же касается явного введения порога, то и это нам кажется не всегда оправданным: многие модели обходятся без порогов и в то же время достаточно хорошо описывают динамику иммунного ответа.
И последнее, что хотелось бы еще раз подчеркнуть. Мы являемся противниками громоздких моделей, содержащих десятки дифференциальных уравнений, и глубоко убеждены, что такие модели не помогают, а, скорее, мешают в понимании исследуемых явлений. Модели должны быть простыми, «минимальными» для данной конкретной задачи и, конечно, не могут служить во всех возможных ситуациях.
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ЧАСТЬ I. МАТЕМАТИЧЕСКИЕ МОДЕЛИ БИОФИЗИЧЕСКОЙ КИНЕТИКИ
- § 1. Особенности биологической кинетики
- § 2. Элементы качественной теории динамических систем второго порядка
- § 3. Методы упрощения систем кинетических уравнений
- § 4. Редукция систем и теория катастроф
- ГЛАВА 2. МАТЕМАТИЧЕСКИЕ МОДЕЛИ ЭВОЛЮЦИИ И РАЗВИТИЯ
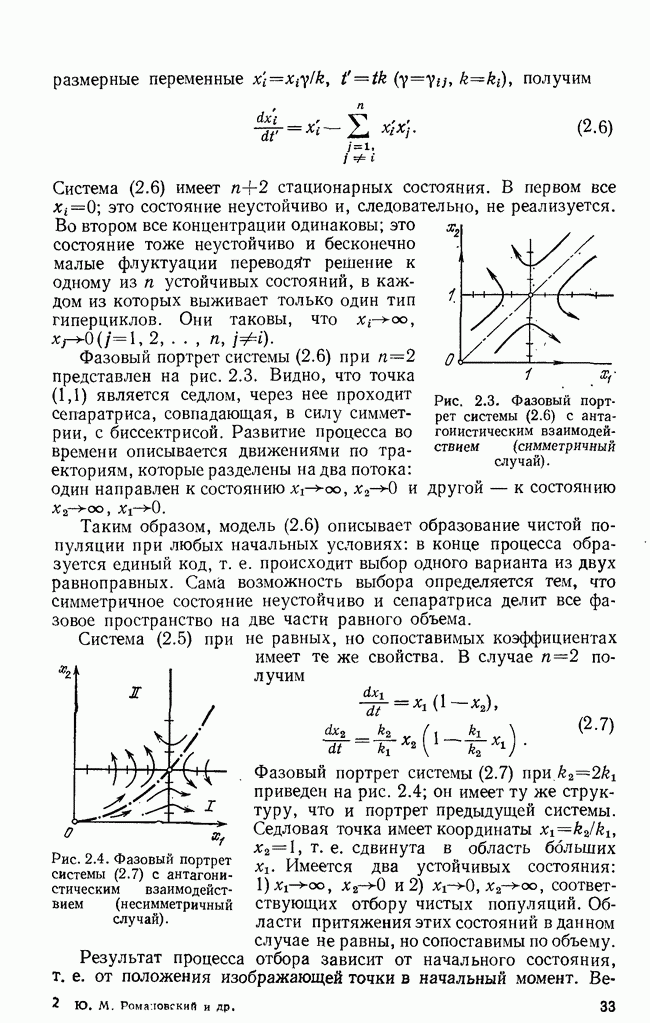
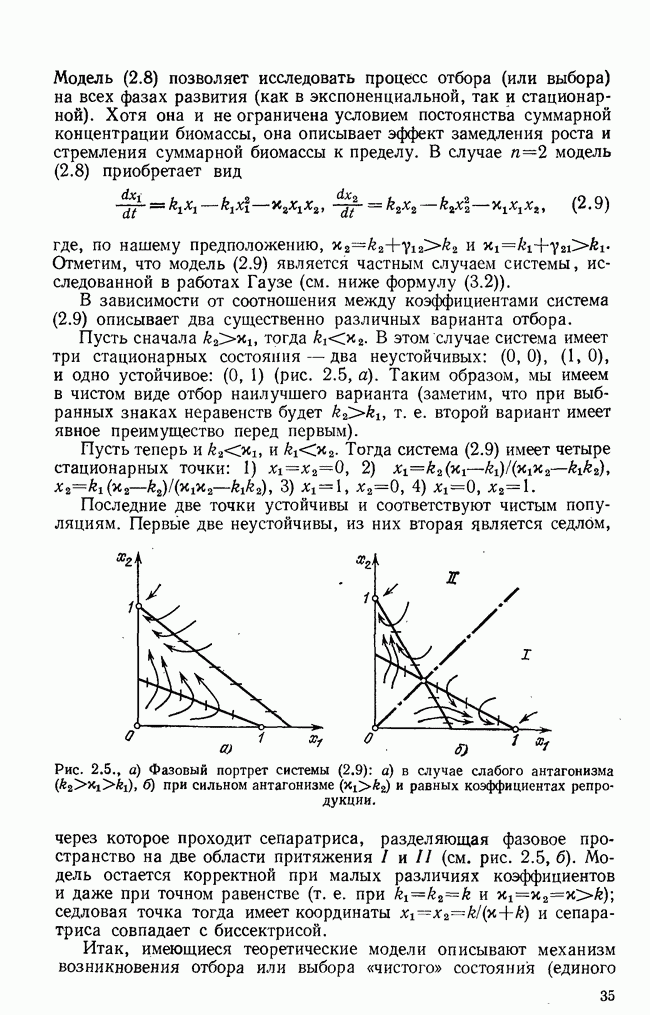
- § 1. Первичный гиперцикл
- § 2. Проблема выбора единого кода
- § 3. Дивергентная эволюция
- § 4. Модели развития организма
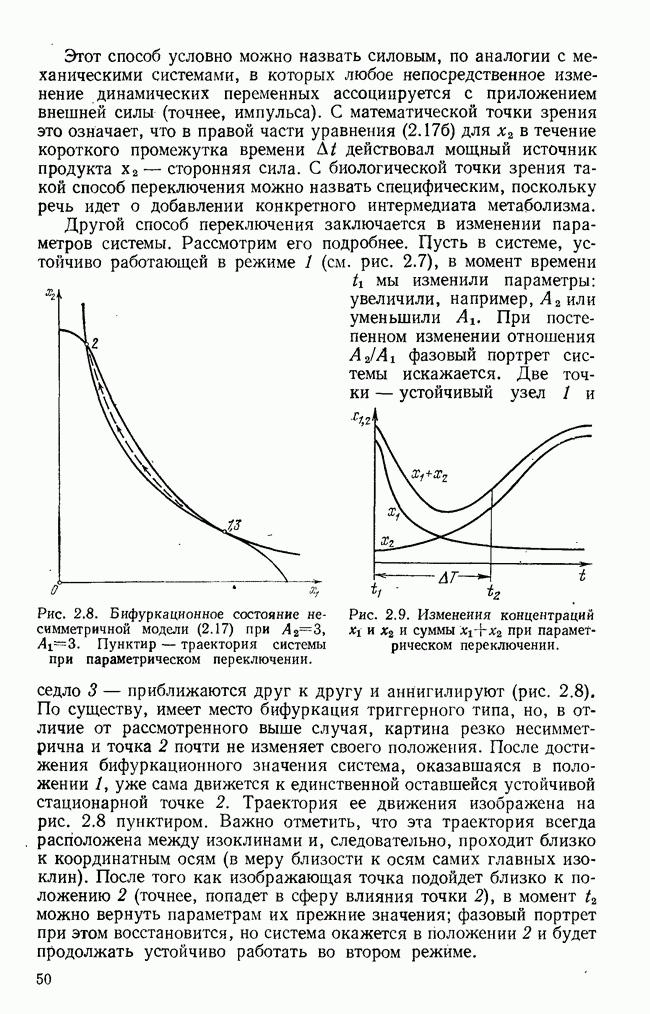
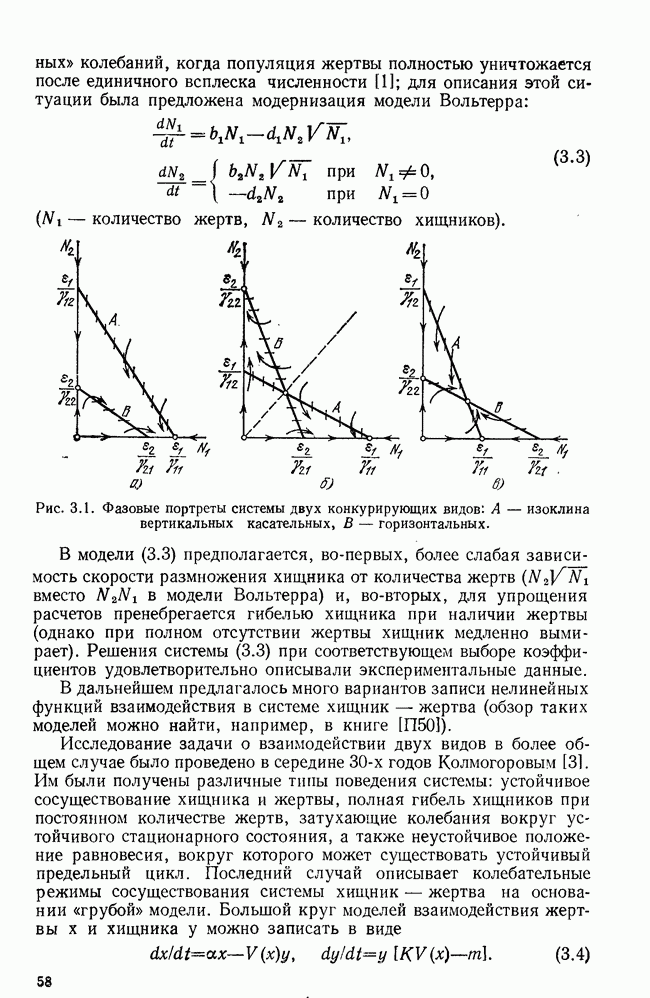
- § 5. Силовое и параметрическое переключение
- ГЛАВА 3. ДИНАМИЧЕСКИЕ МОДЕЛИ КЛЕТОЧНЫХ ПОПУЛЯЦИЙ
- § 1. Простейшие популяционные модели
- § 2. Влияние среды на рост популяций
- § 3. Математические модели в микробиологии
- § 4. Проблема биологической инерционности
- ГЛАВА 4. РАСПРЕДЕЛЕНИЕ КЛЕТОК ПО ВОЗРАСТАМ
- § 1. Двухвозрастная модель клеточной популяции
- § 2. Непрерывные возрастные модели
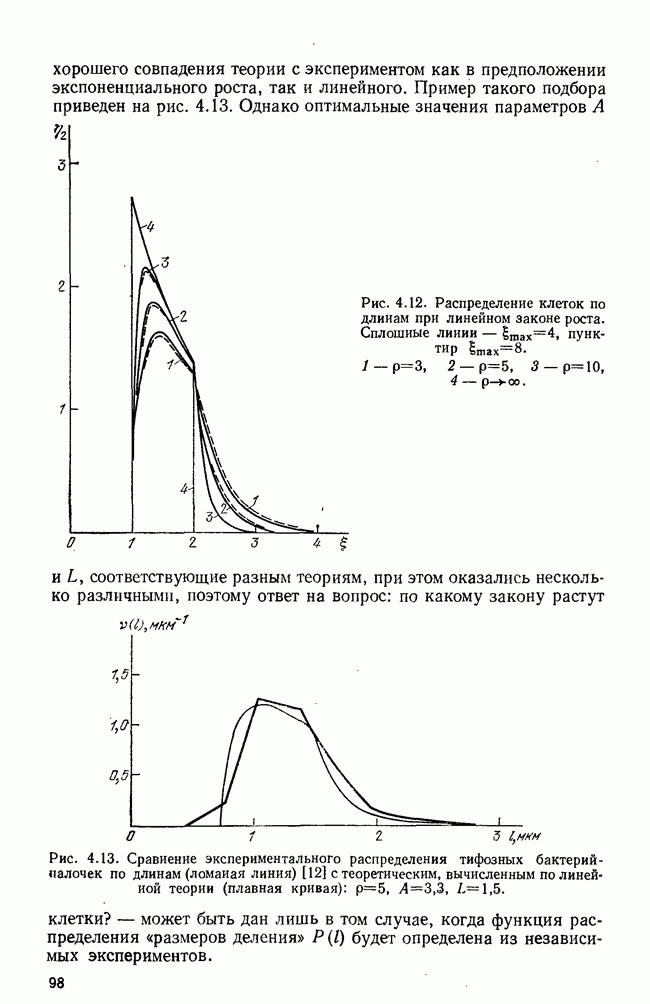
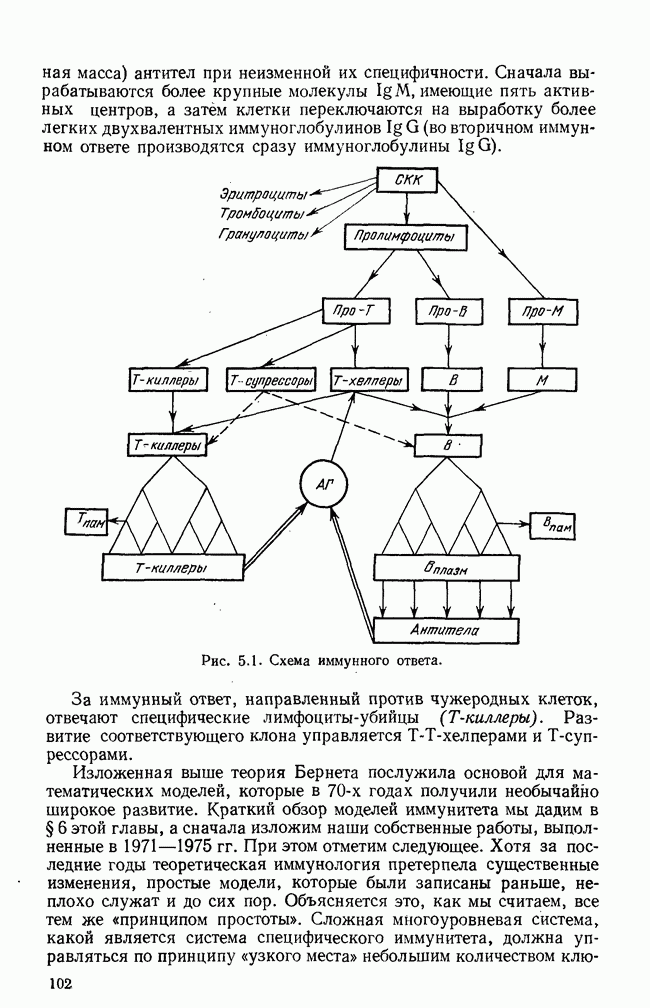
- § 3. Функции распределения клеток по размерам
- ГЛАВА 5. ДИНАМИКА ИММУННОЙ РЕАКЦИИ
- § 1. Популяции иммунных клеток в организме
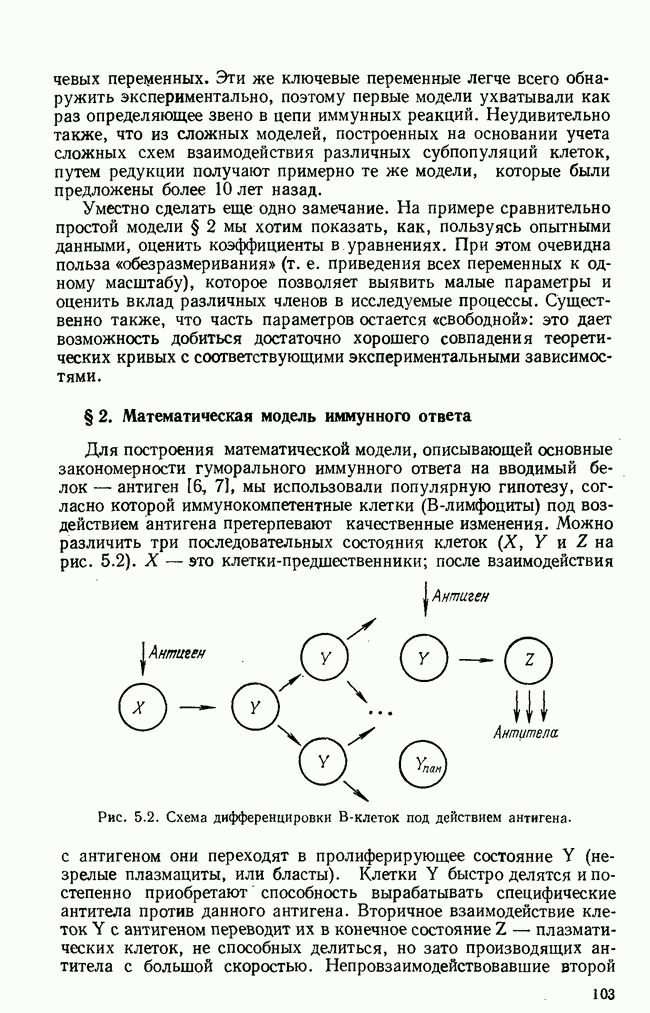
- § 2. Математическая модель иммунного ответа
- § 3. Кооперативное взаимодействие лимфоцитов
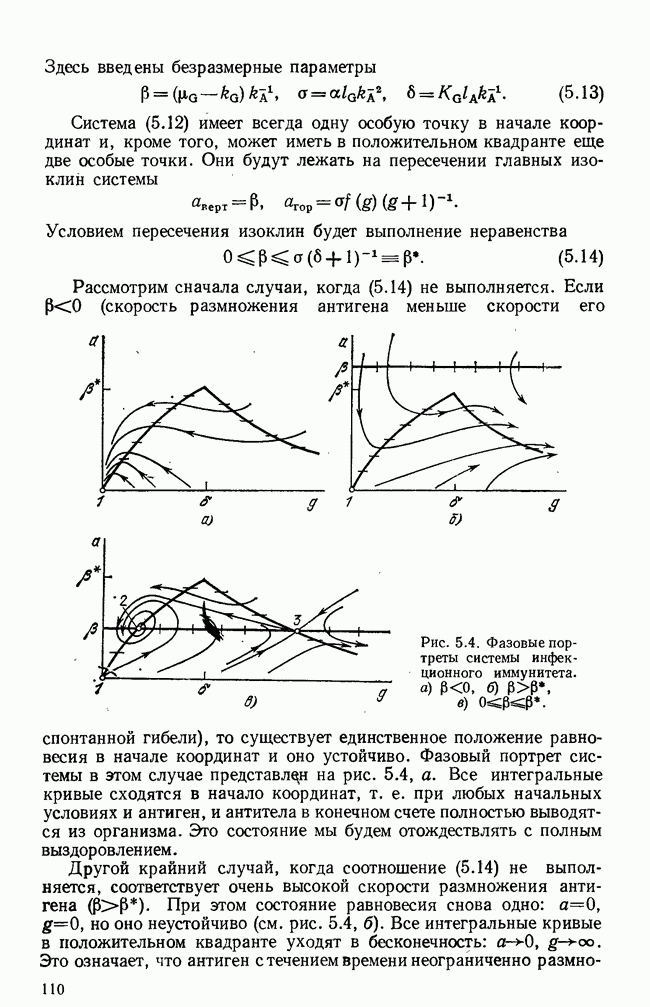
- § 4. Инфекционные болезни
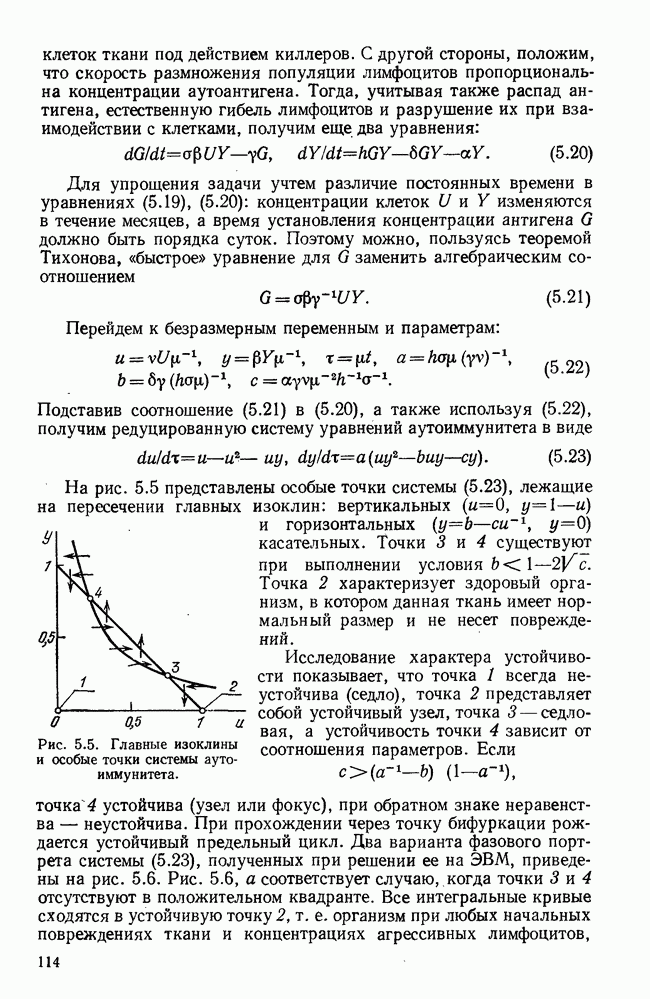
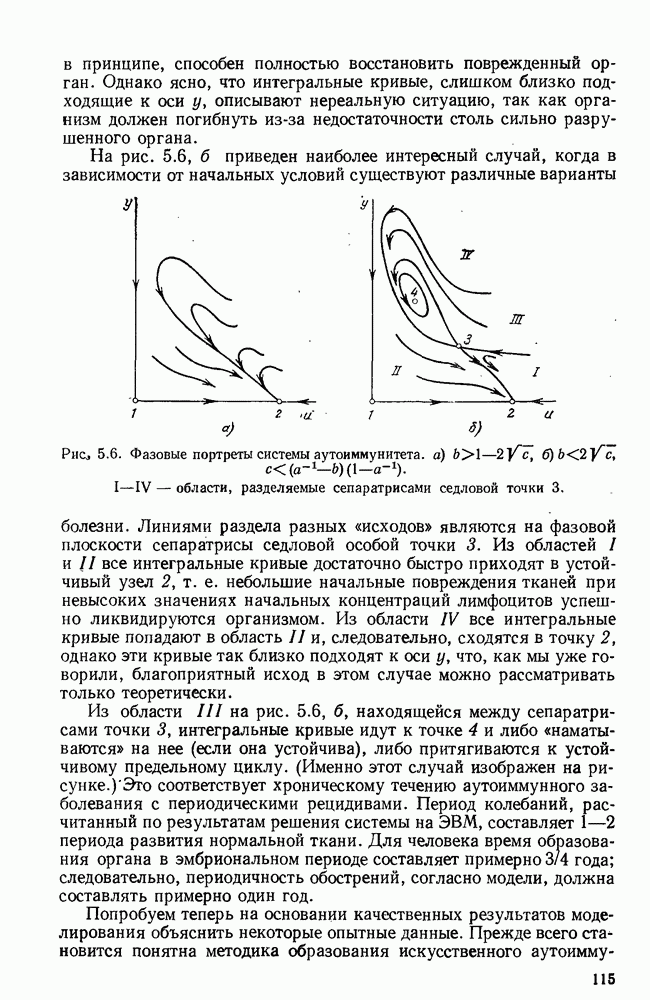
- § 5. Проблема аутоиммунитета
- § 6. Краткий обзор математических моделей иммунитета
- ГЛАВА 6. СПЕЦИФИЧЕСКИЙ ИММУНИТЕТ И РАК
- § 2. Модели взаимодействия опухоли и организма
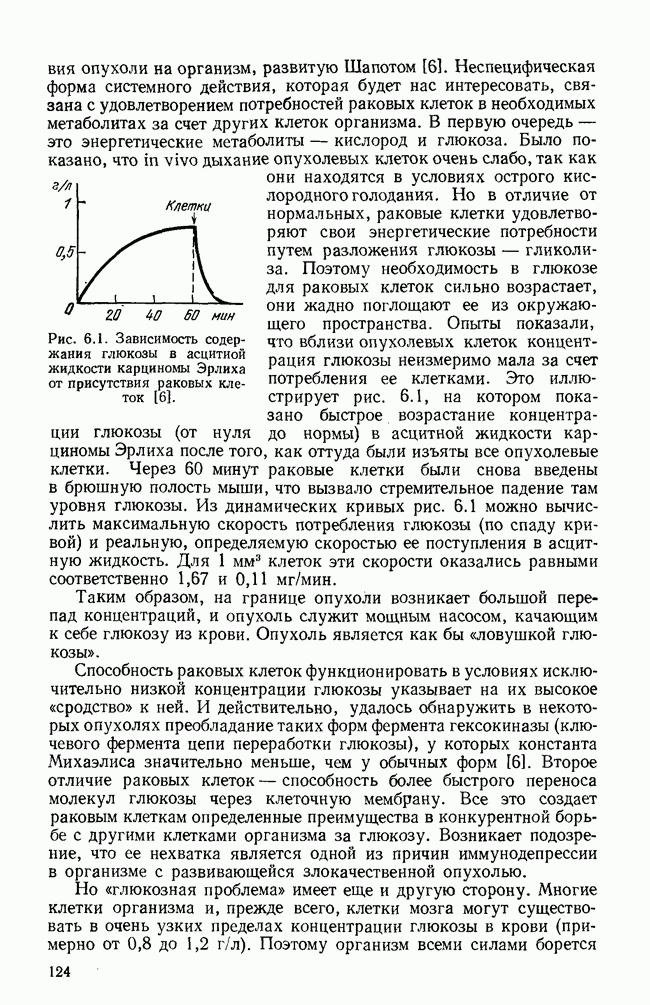
- § 3. Системное действие опухоли на организм
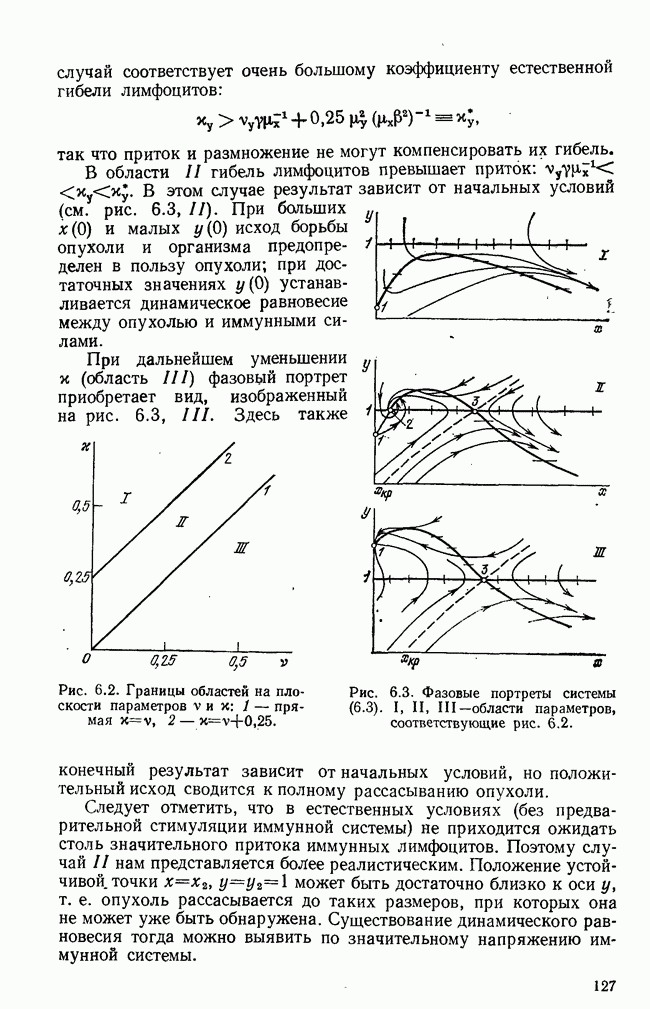
- § 4. Краткий обзор математических моделей
- ГЛАВА 7. МОДЕЛИ РЕГУЛЯЦИИ КЛЕТОЧНОГО ЦИКЛА
- § 2. Тип модели и основные гипотезы
- § 3. Модель регуляции клеточного цикла
- § 4. Биологические следствия
- ЧАСТЬ II. РАСПРЕДЕЛЕННЫЕ КИНЕТИЧЕСКИЕ СИСТЕМЫ И БИОЛОГИЧЕСКАЯ СИНЕРГЕТИКА
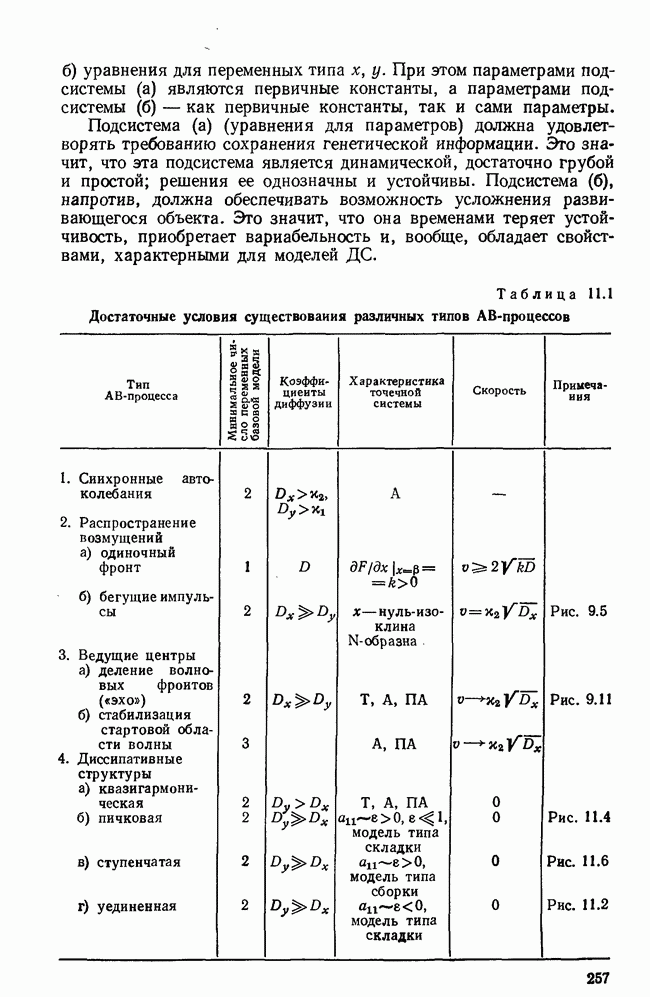
- ГЛАВА 8. МАТЕМАТИЧЕСКИЕ МОДЕЛИ АВТОВОЛНОВЫХ ПРОЦЕССОВ
- § 1. Математическая модель распределенной системы
- § 2. Стационарные однородные решения и их устойчивость
- § 3. Автоколебания и диссипативные структуры в почти гармонических системах
- § 4. Классификация автоволновых процессов и основные экспериментальные данные
- ГЛАВА 9. РАСПРОСТРАНЕНИЕ ВОЗМУЩЕНИЙ В ВОЗБУДИМЫХ СРЕДАХ
- § 1. Распространение фронта возмущения
- § 2. Базовая модель релаксационных возбудимых сред
- § 3. Стационарные бегущие импульсы
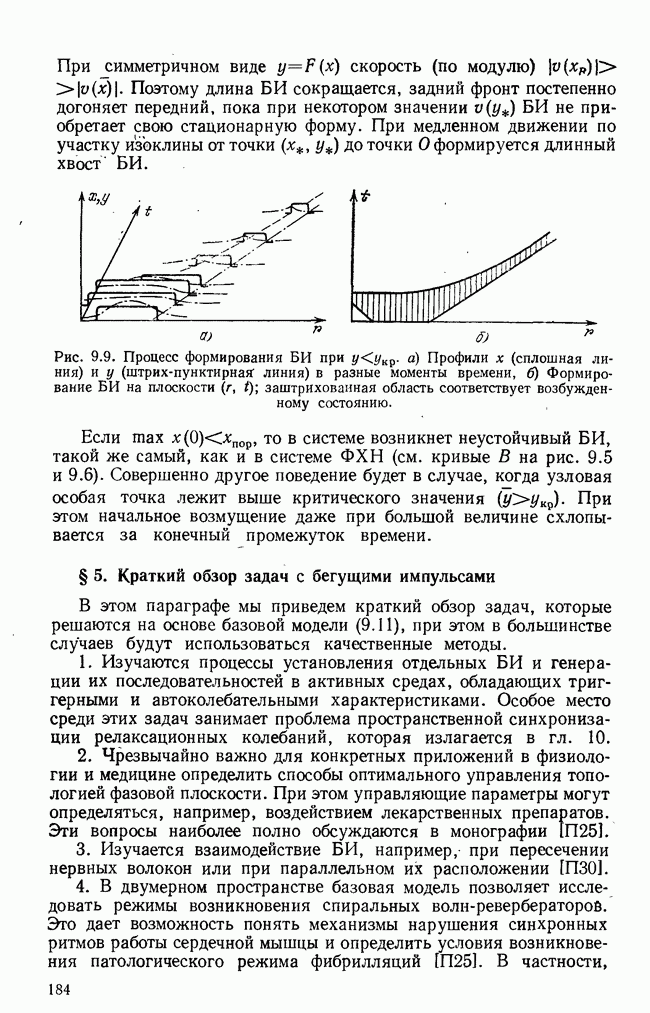
- § 4. Процесс установления бегущего импульса
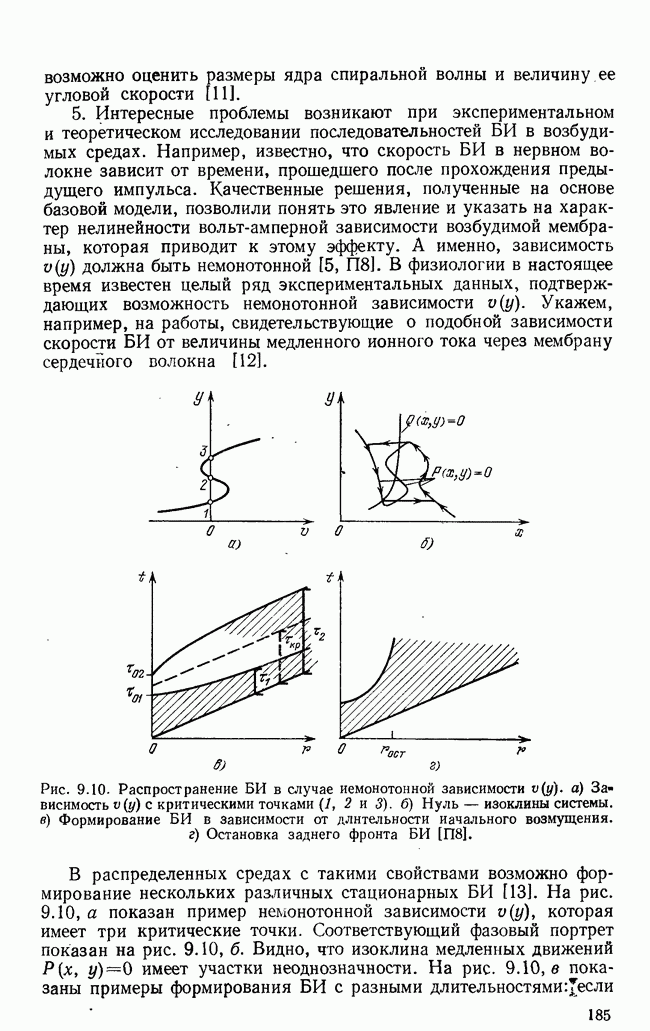
- § 5. Краткий обзор задач с бегущими импульсами
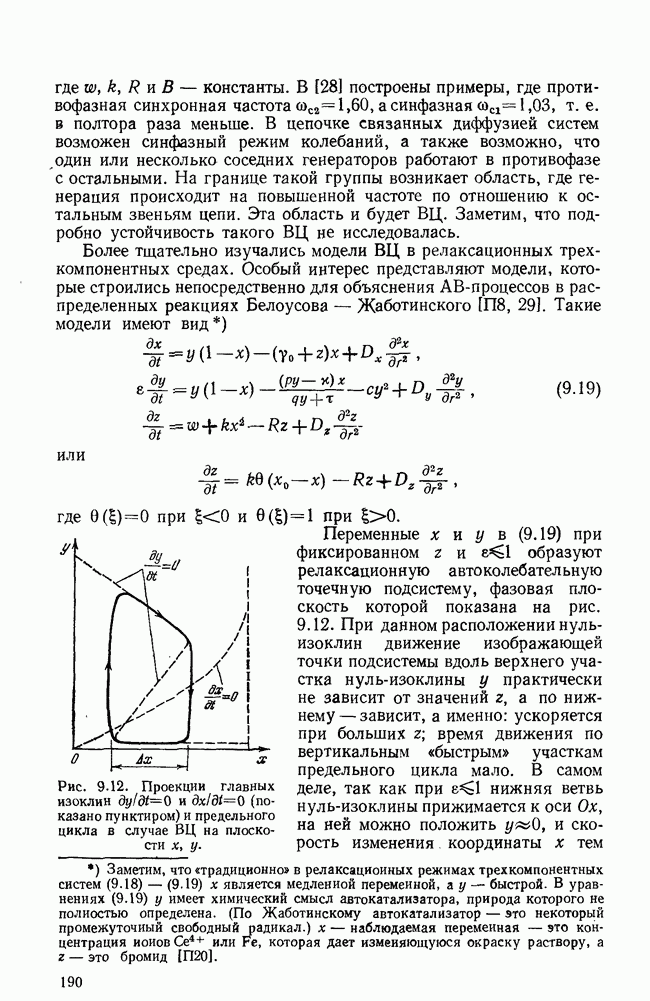
- § 6. Автономные источники волн в гомогенной активной среде
- ГЛАВА 10. СИНХРОНИЗАЦИЯ АВТОКОЛЕБАНИЙ В НЕОДНОРОДНОМ ПРОСТРАНСТВЕ
- § 1. Базовая модель неоднородной распределенной системы
- § 2. Синхронизация в квазигармонической системе
- § 3. Случай релаксационной системы
- § 4. Приложения в химии и биологии
- § 5. Процессы установления синхронного режима
- § 6. Шумы и синхронизация
- § 7. Автоколебательные системы, связанные через общую среду
- ГЛАВА 11. ДИССИПАТИВНЫЕ СТРУКТУРЫ И ПРОБЛЕМЫ САМООРГАНИЗАЦИИ
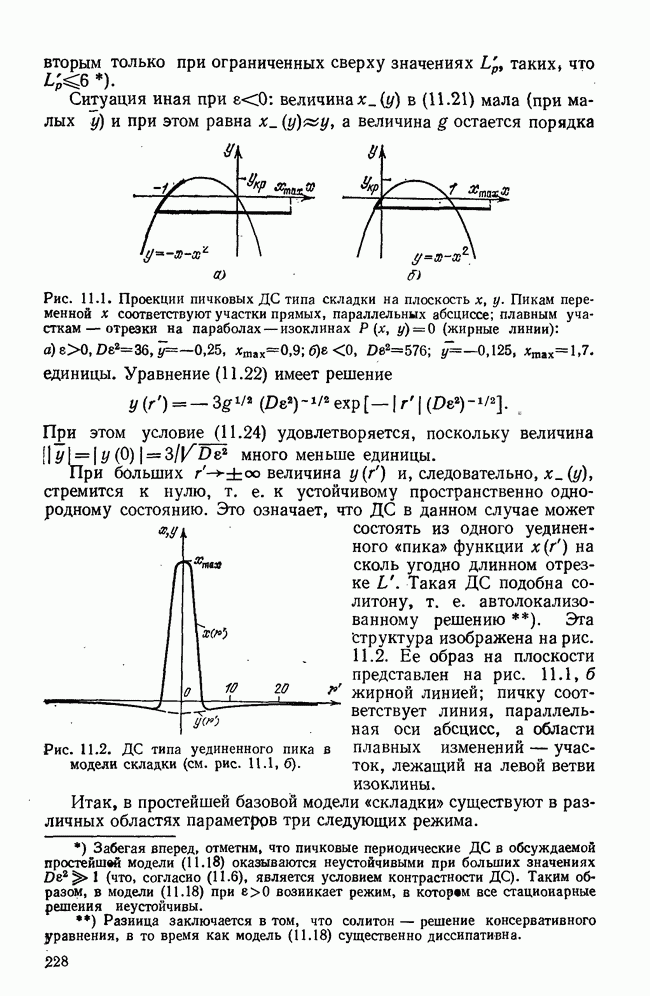
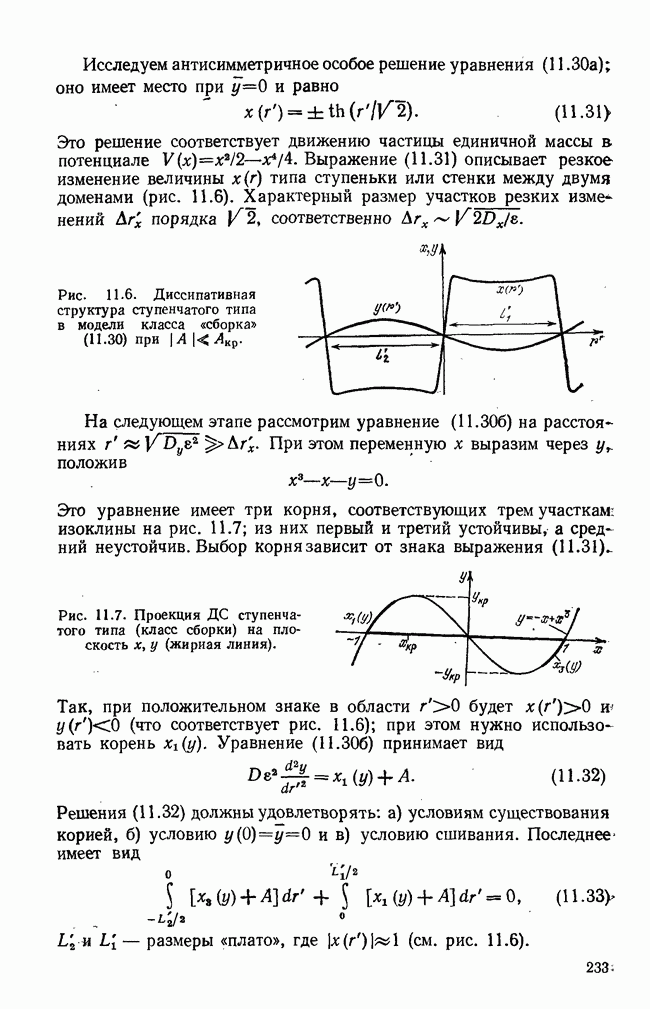
- § 2. Контрастные диссипативные структуры; базовые модели
- § 3. Стационарные контрастные ДС типа складки
- § 4. Стационарные ДС типа сборки
- § 5. Устойчивость диссипативных структур
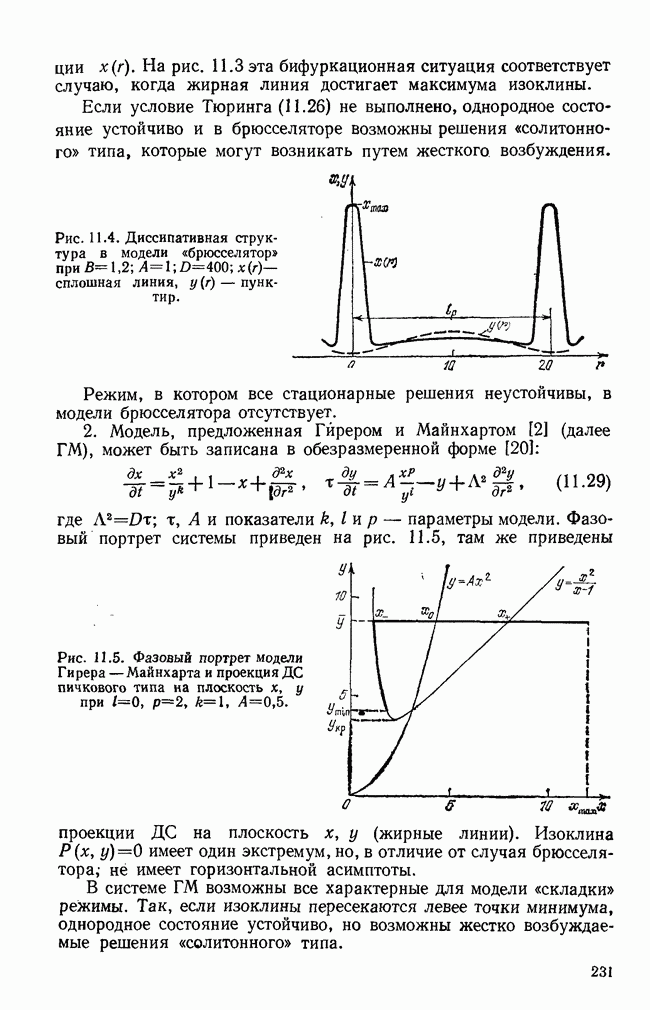
- § 6. Конкретные модели диссипативных структур
- § 7. Кинетика образования ДС
- § 8. Некоторые выводы
- ГЛАВА 12. ТЕРМОДИНАМИКА, ИНФОРМАЦИЯ, БИОЛОГИЯ
- § 1. Механика и статистика
- § 2. Информация и энтропия
- § 3. Ценность информации
- § 4. Биологическая информация
- § 5. Эффективность биологической информации
- ЗАКЛЮЧЕНИЕ