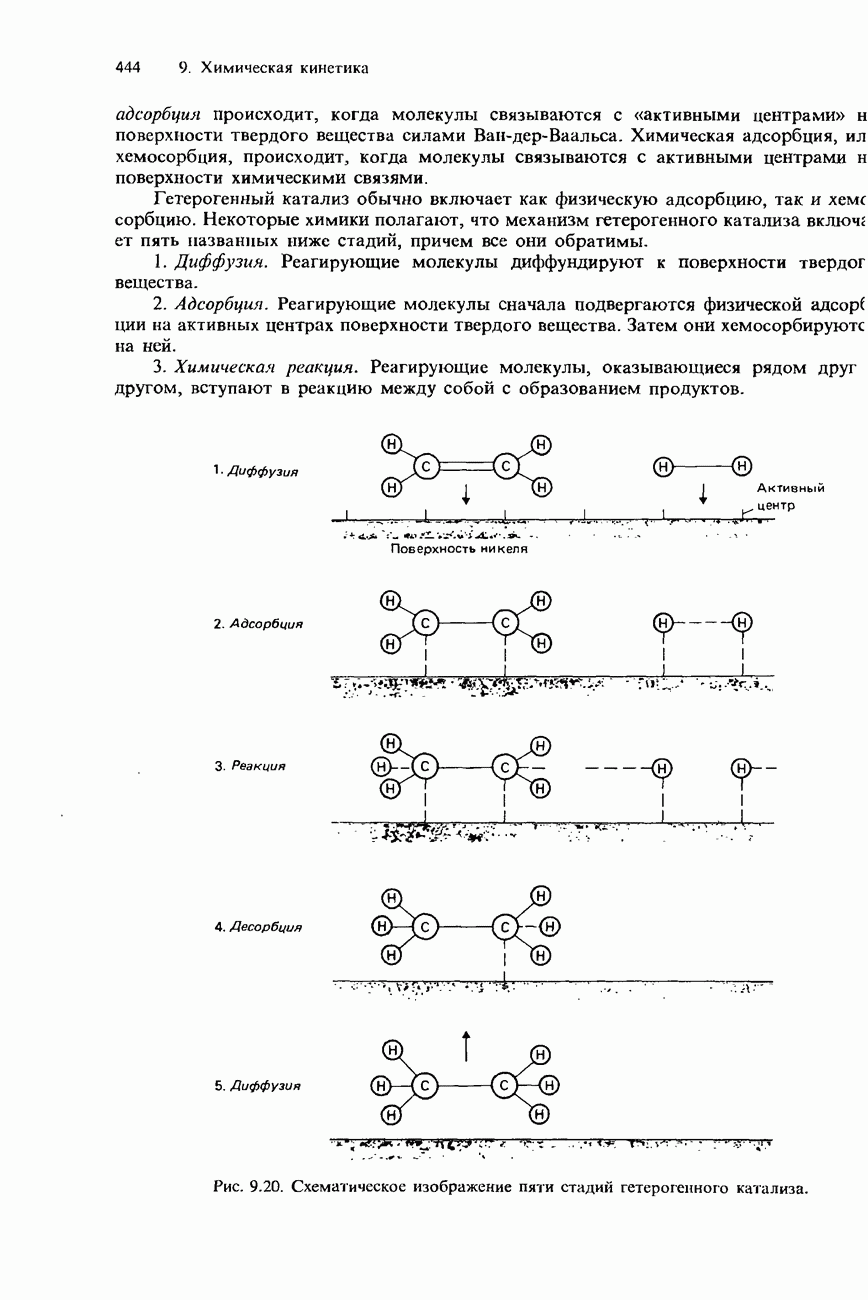
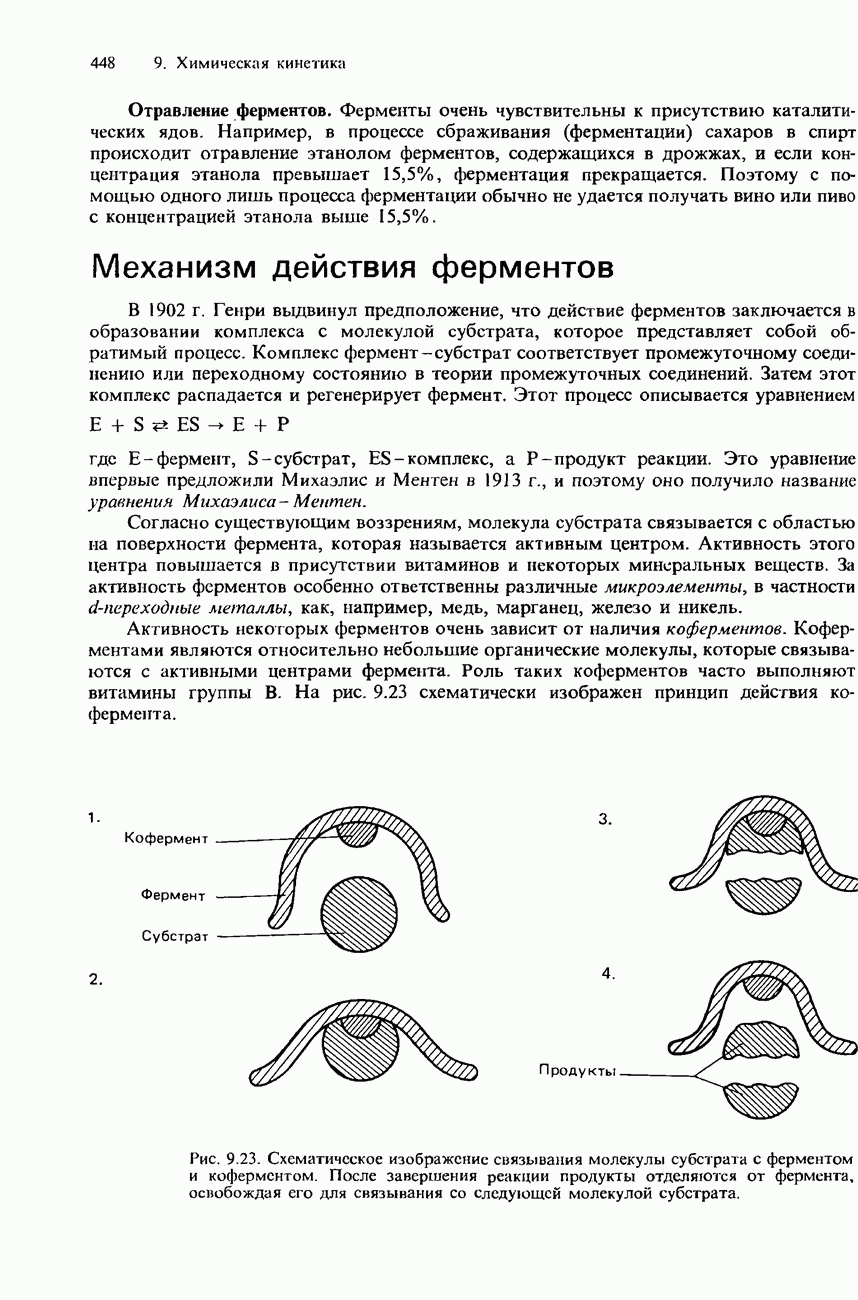
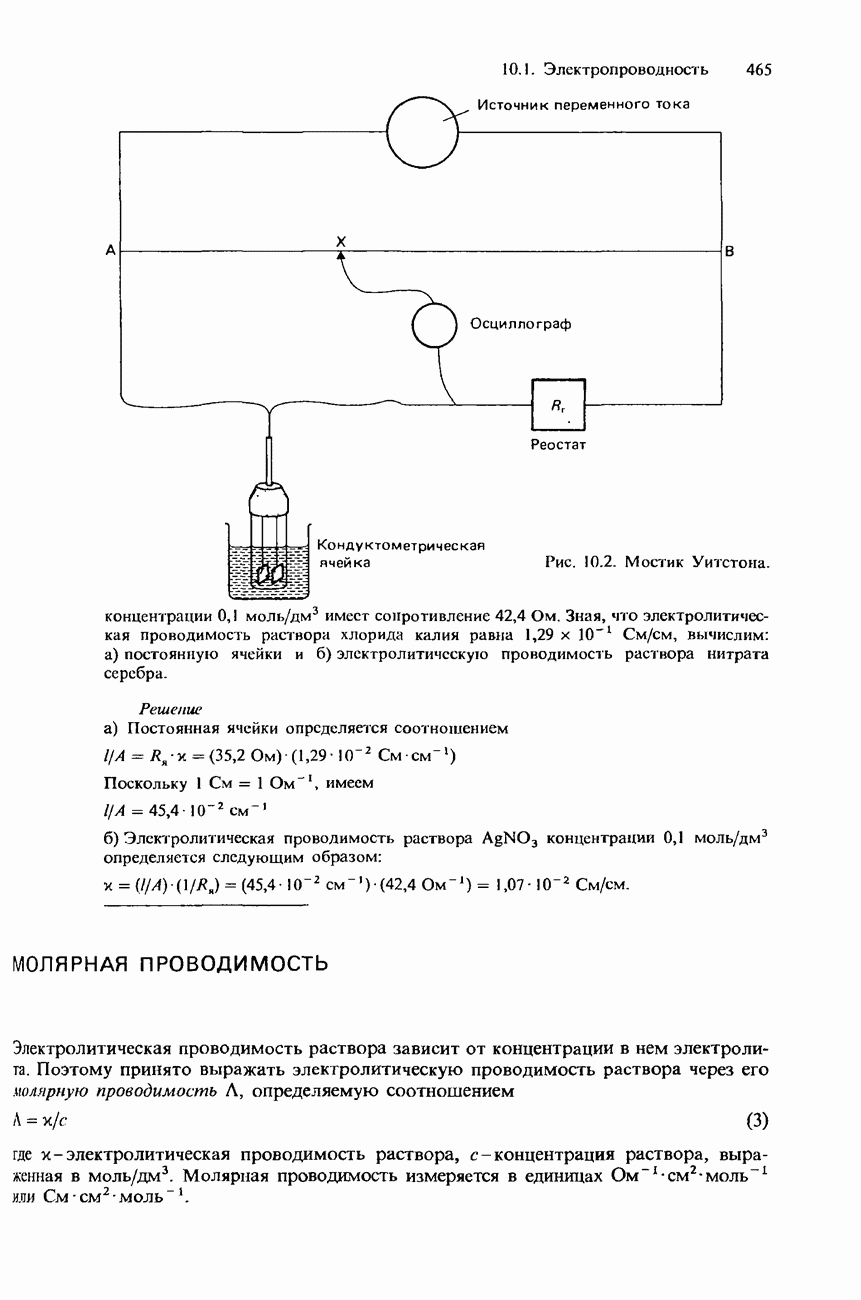
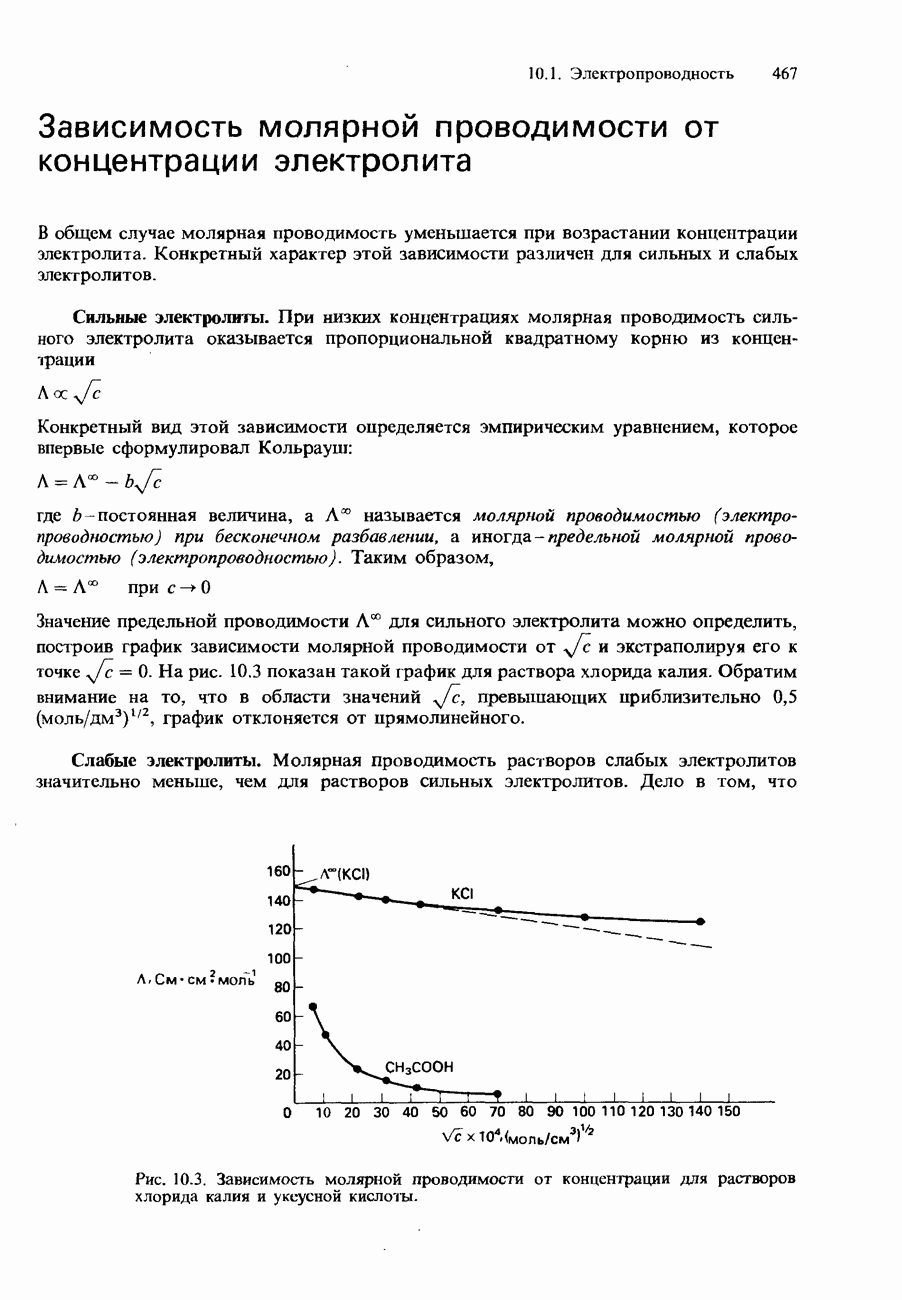
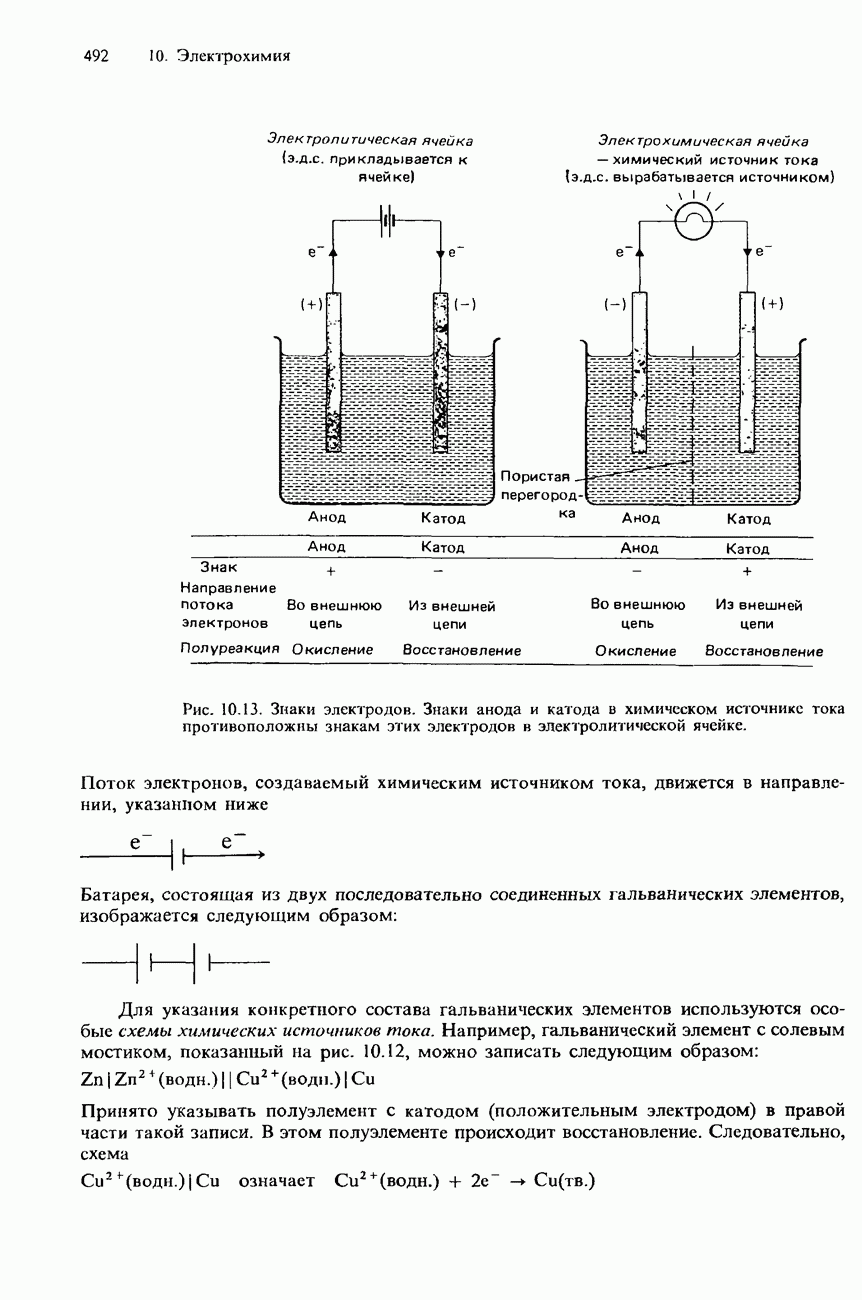
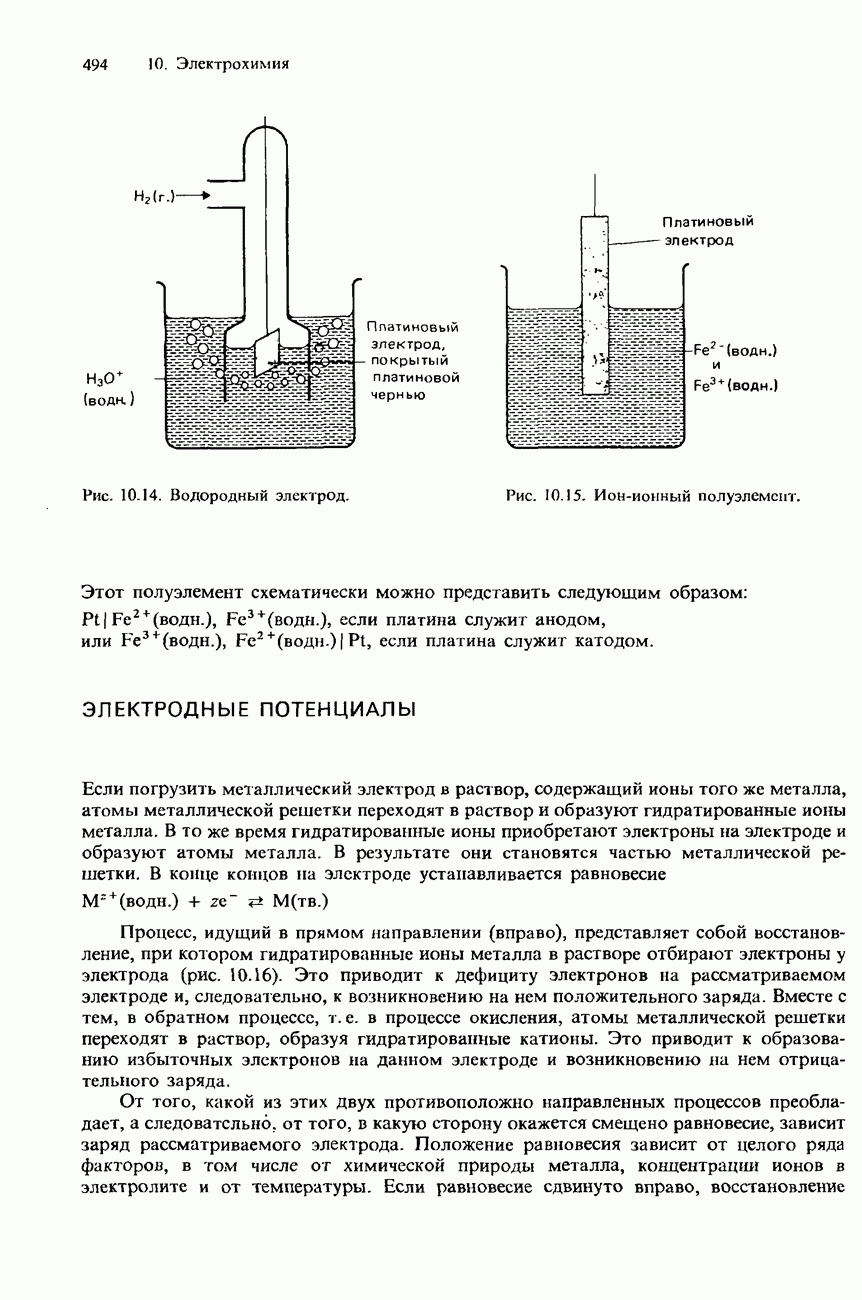
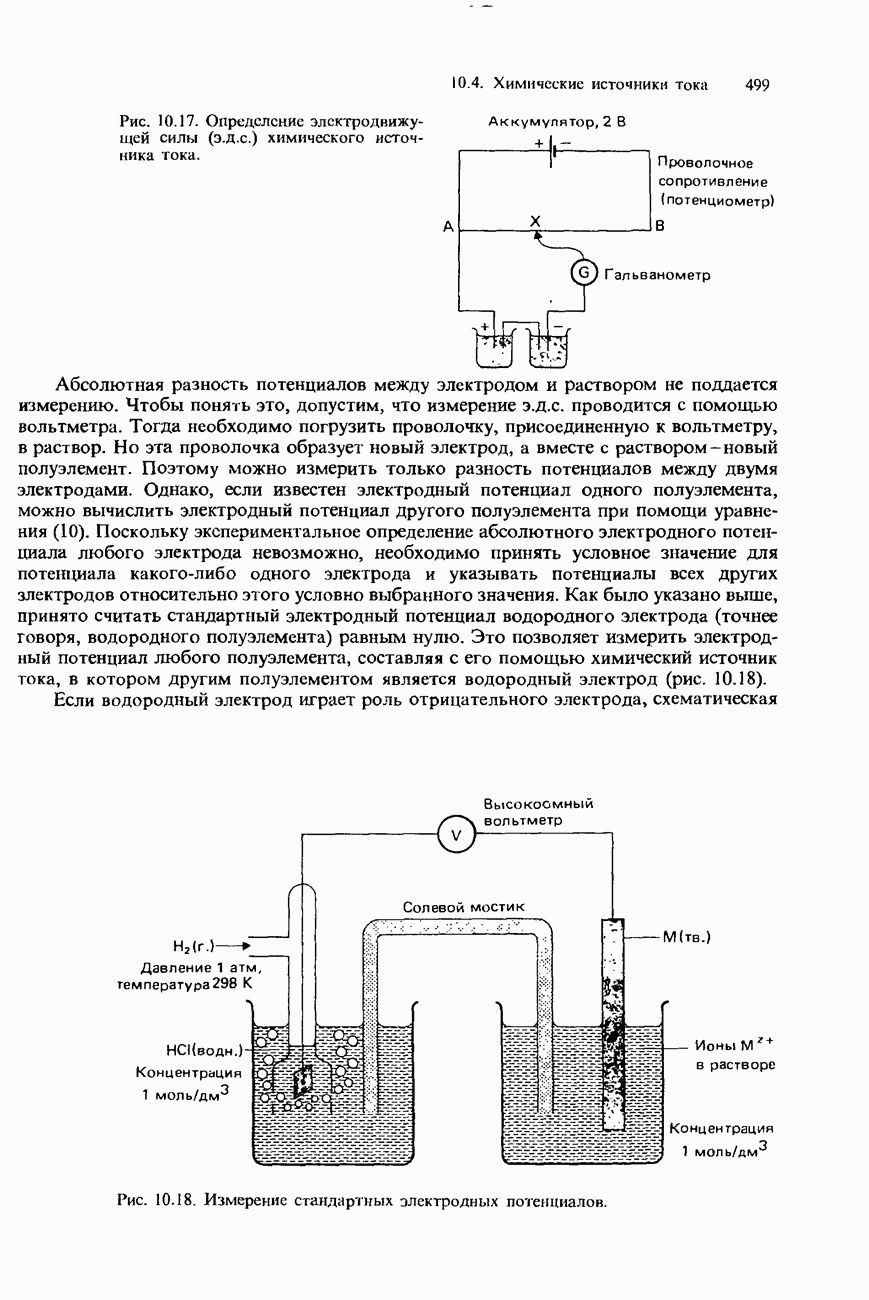
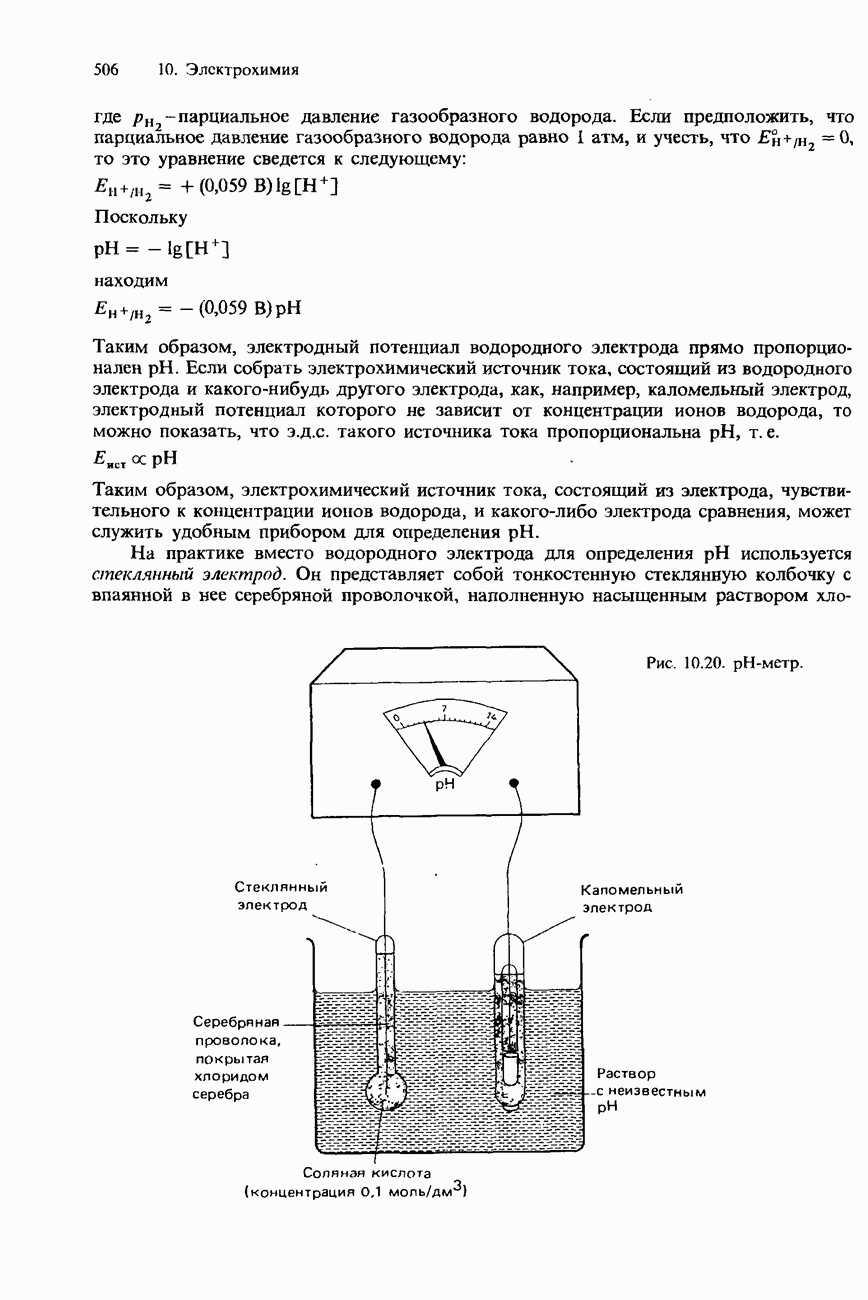
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
СТАНДАРТНЫЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ
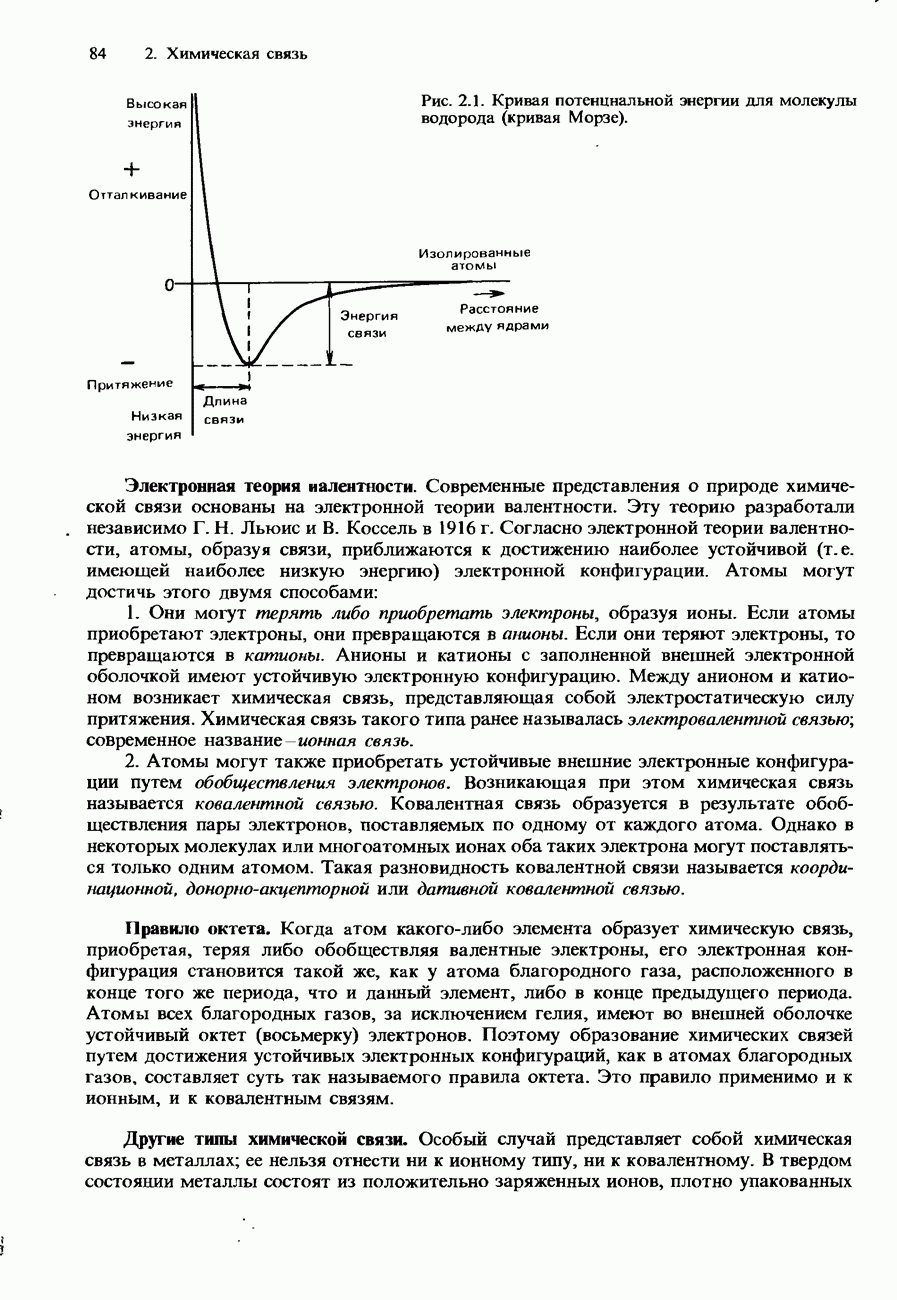
Изменения энтальпии, происходящие при химической реакции или фазовом превращении, могут варьировать в зависимости от температуры, давления и физического состояния веществ, участвующих в рассматриваемом процессе. Кроме того, изменения энтальпии зависят от количества этих веществ. Поэтому принято характеризовать каждый конкретный процесс стандартным изменением молярной энтальпии, или короче - стандартной молярной энтальпией.
Стандартная молярная энтальпия реакции это изменение энтальпии при стандартных условиях в расчете на моль реакции, т.е. в соответствии с тем, как она описывается стехиометрическим (сбалансированным) химическим уравнением. В качестве стандартных условий обычно принимаются температура 298 К и давление 1 атм. Предполагается, что при этих условиях каждый из реагентов и продуктов находится в своем стандартном (нормальном) физическом состоянии. Например, стандартным физическим состоянием водорода является газообразное состояние, тогда как стандартным физическим состоянием воды является жидкое состояние.
Для записи стандартной молярной энтальпии реакции используется обозначение  . Важно отметить, что величина
. Важно отметить, что величина  должна однозначно соответствовать конкретному химическому уравнению либо формуле. Например,
должна однозначно соответствовать конкретному химическому уравнению либо формуле. Например,


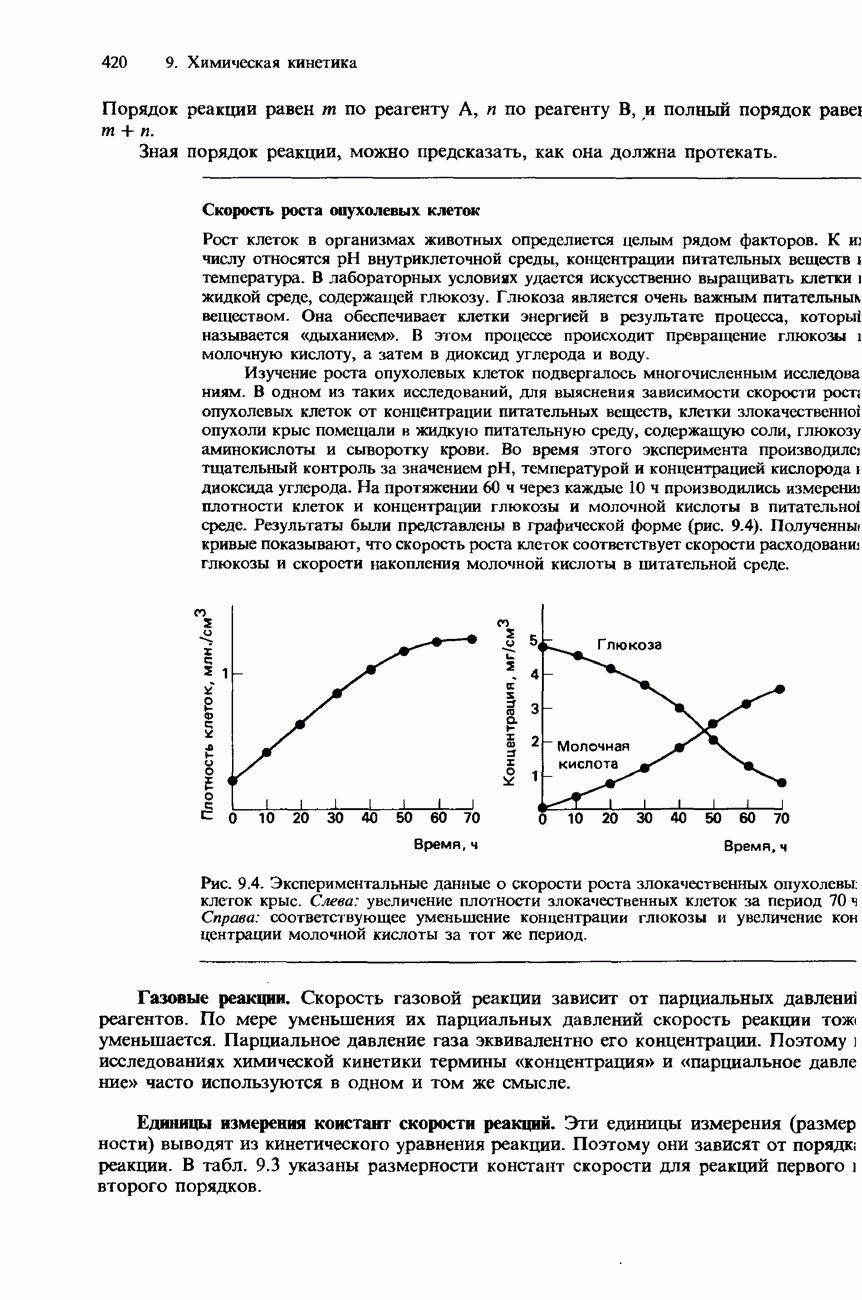
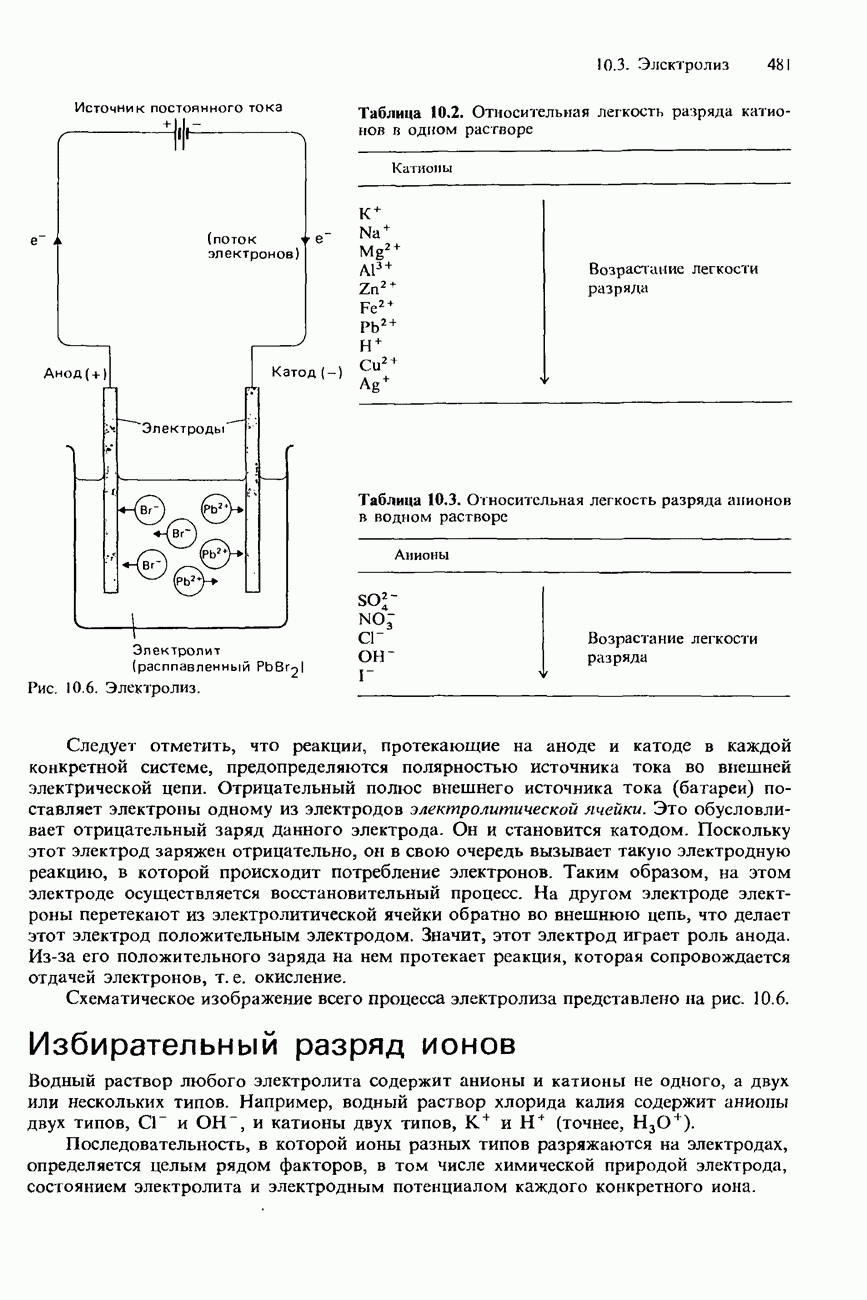
Рис. 5.4. Экзотермическая и эндотермическая реакции.
Эта запись указывает, что если два моля газообразного водорода  соединяются с одним молем газообразного кислорода
соединяются с одним молем газообразного кислорода  образуя два моля жидкой воды
образуя два моля жидкой воды  при давлении одна атмосфера и температуре 298 К, то такая реакция сопровождается изменением энтальпии, равным —571,6 кДж. Отрицательный знак изменения энтальпии означает, что реакция экзотермическая, т. е. происходит с выделением тепла.
при давлении одна атмосфера и температуре 298 К, то такая реакция сопровождается изменением энтальпии, равным —571,6 кДж. Отрицательный знак изменения энтальпии означает, что реакция экзотермическая, т. е. происходит с выделением тепла.
Если теперь ту же реакцию представить записанным ниже уравнением, то стандартная молярная энтальпия этой реакции оказывается равной половине приведенного выше значения:

После формулы каждого вещества, участвующего в реакции, следует обязательно указывать (в скобках) его физическое состояние. Чтобы проиллюстрировать, насколько это важно, сравним, например, стандартную молярную энтальпию реакции (б) со стандартной молярной энтальпией следующей реакции:

В реакции (б) вода образуется в жидком состоянии, а в реакции (в) она образуется в виде газа (пара). Различие в стандартных молярных энтальпиях между этими двумя реакциями, равное 44,0 кДж/моль, представляет собой стандартную молярную энтальпию (точнее, стандартное изменение молярной энтальпии) испарения воды.
Сказанное позволяет понять, что такие выражения, как «стандартная молярная энтальпия окисления водорода» нельзя считать однозначными, и поэтому их следует избегать. Стандартная молярная энтальпия окисления кислорода может соответствовать любому из трех приведенных выше стехиометрических уравнений и, следовательно, может иметь любое из трех указанных выше значений, существенно отличающихся друг от друга.
Стандартная молярная энтальпия образования
Стандартной молярной энтальпией образования вещества АН  называется изменение энтальпии при образовании одного моля данного вещества из входящих в него элементов в их стандартных состояниях при температуре 298 К и давлении одна атмосфера.
называется изменение энтальпии при образовании одного моля данного вещества из входящих в него элементов в их стандартных состояниях при температуре 298 К и давлении одна атмосфера.
Сопоставим это определение с приведенными выше примерами. Мы убедились,
что окисление водорода можно представить по меньшей мере тремя различными стехиометрическими уравнениями. Таким образом, нам известны по меньшей мере три разные стандартные молярные энтальпии:

Какое же из этих значений соответствует стандартной молярной энтальпии образования воды? Значение (в) не может соответствовать ему, поскольку стандартным состоянием воды при 298 К не является парообразное (газообразное) состояние, соответствующее обозначению  . Стандартная молярная энтальпия образования воды может иметь одно из двух оставшихся значений, различие между которыми определяется тем, как записано уравнение реакции. Однако, поскольку в приведенном выше определении стандартной молярной энтальпии образования указано, что оно соответствует изменению энтальпии в расчете на один моль образующегося вещества, следует выбрать вариант (б). Таким образом, стандартная молярная энтальпия образования воды
. Стандартная молярная энтальпия образования воды может иметь одно из двух оставшихся значений, различие между которыми определяется тем, как записано уравнение реакции. Однако, поскольку в приведенном выше определении стандартной молярной энтальпии образования указано, что оно соответствует изменению энтальпии в расчете на один моль образующегося вещества, следует выбрать вариант (б). Таким образом, стандартная молярная энтальпия образования воды  .
.
В табл. 5.1 указаны стандартные молярные энтальпии образования некоторых распространенных веществ в их стандартных состояниях. Обратим внимание, что в таблицу включены не только вещества, но и некоторые ионы. Ионы и многие соединения не могут быть получены прямым синтезом из образующих их элементов. Однако их стандартные энтальпии образования можно вычислить с помощью закона Гесса (с которым мы познакомимся в разд. 5.3).
Большинство соединений характеризуются отрицательными энтальпиями образования. Поэтому их называют экзотермическими соединениями. Лишь немногие соединения имеют положительную энтальпию образования. Они называются эндотермическими соединениями. Примером эндотермического соединения является бензол.
Следует обратить внимание на то обстоятельство, что энтальпии образования твердых соединений, как правило, имеют большие (по абсолютной величине) отрицательные значения, чем энтальпии образования газов. Стандартная молярная энтальпия образования какого-либо вещества или иона является мерой его устойчивости по сравнению с элементами, образующими данное соединение. Чем больше (по абсолютной величине) отрицательное значение энтальпии образования соединения, тем устойчивее это соединение.
По определению стандартная молярная энтальпия образования любого элемента в его стандартном состоянии при 298 К равна нулю. Например,  .
.
Таблица 5.1. Стандартные молярные энтальпии образования

Стандартная молярная энтальпия сгорания
Стандартной молярной энтальпией сгорания вещества  называется изменение энтальпии при полном сгорании в кислороде одного моля данного вещества в его стандартном состояниипри температуре 298 К и давлении 1 атм.
называется изменение энтальпии при полном сгорании в кислороде одного моля данного вещества в его стандартном состояниипри температуре 298 К и давлении 1 атм.
Например, стандартная молярная теплота сгорания пропана равна —2219,7 кДж на моль пропана. Это утверждение записывается следующим образом:

В табл. 5.2 указаны стандартные молярные энтальпии сгорания некоторых соединений.
Таблица 5.2. Стандартные молярные энтальпии сгорания

Стандартная молярная энтальпия нейтрализации
Стандартной молярной энтальпией нейтрализации  называется изменение энтальпии при образовании одного моля воды в результате нейтрализации каких-либо кислоты и щелочи при температуре 298 К и давлении одна атмосфера.
называется изменение энтальпии при образовании одного моля воды в результате нейтрализации каких-либо кислоты и щелочи при температуре 298 К и давлении одна атмосфера.
В случае нейтрализации сильной кислоты, такой, как соляной (хлороводородной) кислоты  и сильной щелочи, такой, как гидроксид натрия
и сильной щелочи, такой, как гидроксид натрия  стандартная молярная энтальпия нейтрализации почти всегда равна
стандартная молярная энтальпия нейтрализации почти всегда равна  . Дело в том, что любые реакции нейтрализации сильных кислот и сильных щелочей можно описать одним и тем же ионным уравнением
. Дело в том, что любые реакции нейтрализации сильных кислот и сильных щелочей можно описать одним и тем же ионным уравнением

Исключением из этого правила является нейтрализация  кислоты
кислоты  и гидроксида калия. Эта реакция нейтрализации более экзотермична, чем все остальные, вследствие того что в ней происходит осаждение
и гидроксида калия. Эта реакция нейтрализации более экзотермична, чем все остальные, вследствие того что в ней происходит осаждение  калия
калия  . Осаждение представляет собой экзотермический процесс.
. Осаждение представляет собой экзотермический процесс.
| << Предыдущий параграф | Следующий параграф >> |
- ОТ ПЕРЕВОДЧИКА
- ПРЕДИСЛОВИЕ АВТОРА К РУССКОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ
- 1. СТРОЕНИЕ АТОМА
- 1.1. Субатомные частицы
- Модели атома
- Новые элементарные частицы
- МАССА АТОМА
- МАСС-СПЕКТРОМЕТРИЯ
- 1.2 Электронное строение атомов
- Связь между спектральными линиями и электронами (открытие Бора)
- Применение возбуждения электронов на практике
- Атомный спектр испускания водорода
- ЭНЕРГИИ ИОНИЗАЦИИ
- Рассмотрение энергий ионизации в рамках модели атома, предложенной Бором
- ВОЛНОВАЯ ПРИРОДА ЭЛЕКТРОНА
- Орбитали
- КВАНТОВЫЕ ЧИСЛА
- ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
- 1.3 Радиоактивность
- ИОНИЗИРУЮЩЕЕ ИЗЛУЧЕНИЕ
- Обнаружение и измерение радиоактивности
- УСТОЙЧИВЫЕ И НЕУСТОЙЧИВЫЕ ИЗОТОПЫ
- Зона устойчивости
- Период полураспада
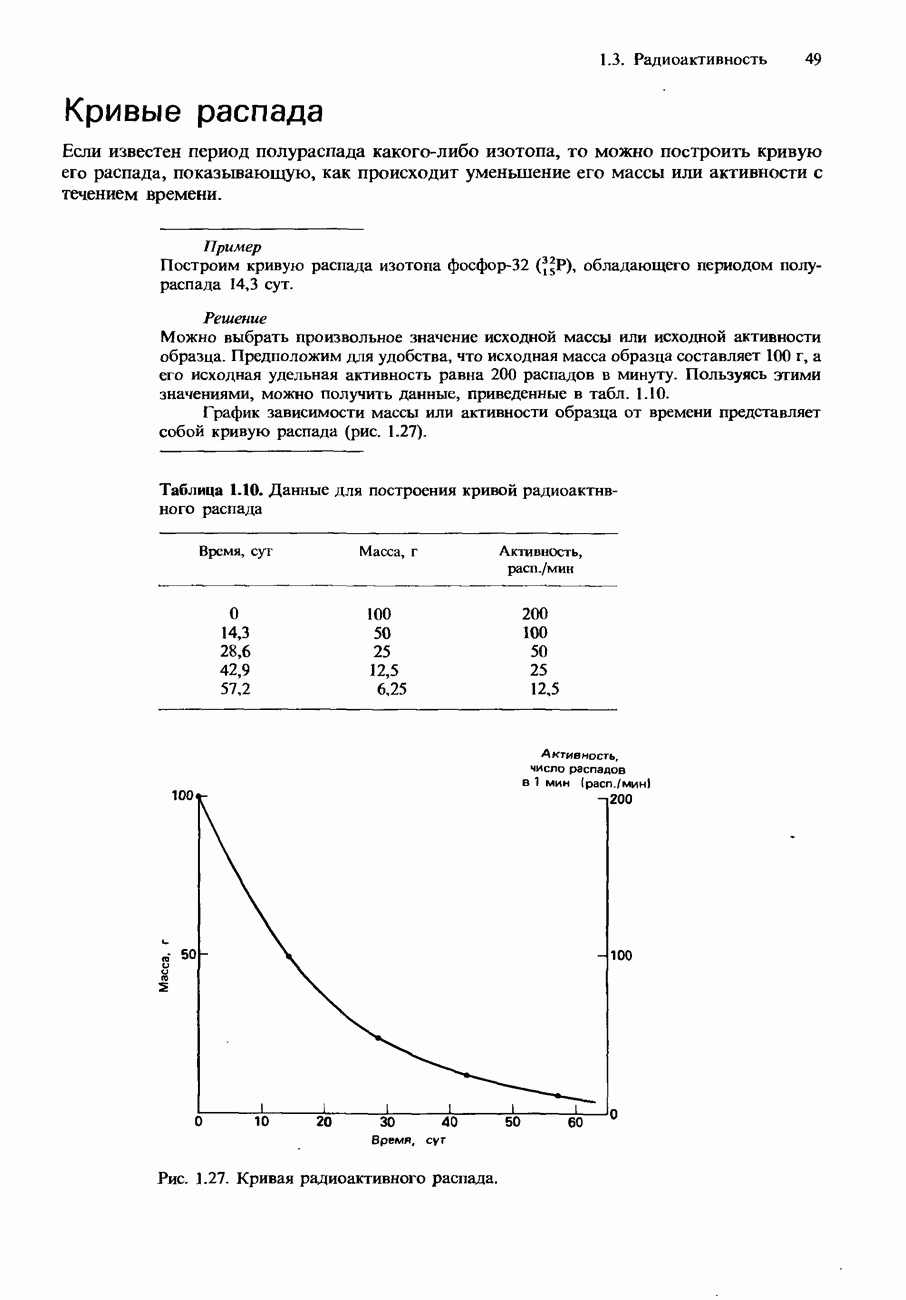
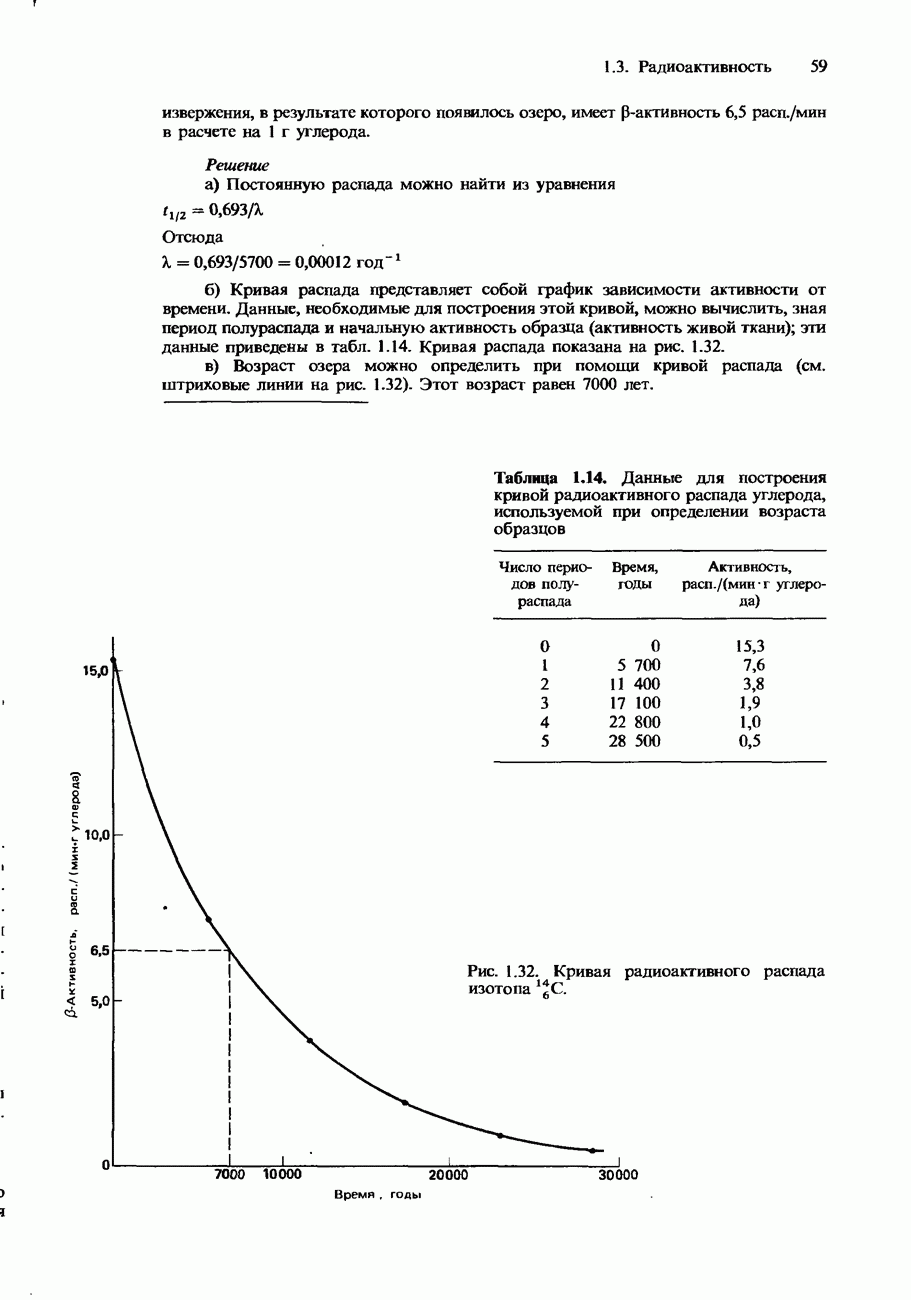
- Кривые распада
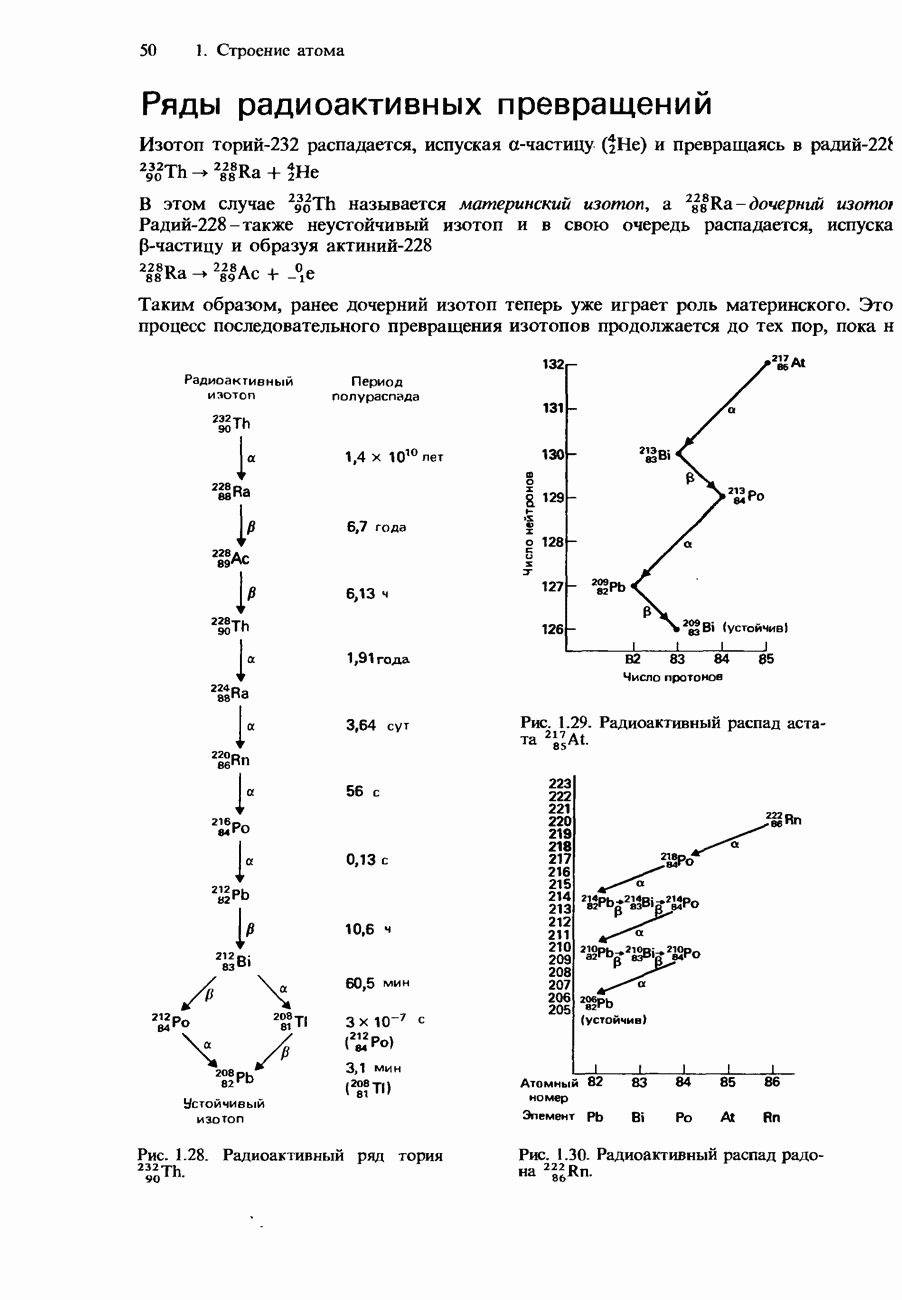
- Ряды радиоактивных превращений
- Естественные радиоизотопы
- ИСКУССТВЕННЫЕ ЯДЕРНЫЕ ПРЕВРАЩЕНИЯ
- Ускорители элементарных частиц
- Трансурановые элементы
- ПРИМЕНЕНИЯ ИЗОТОПОВ
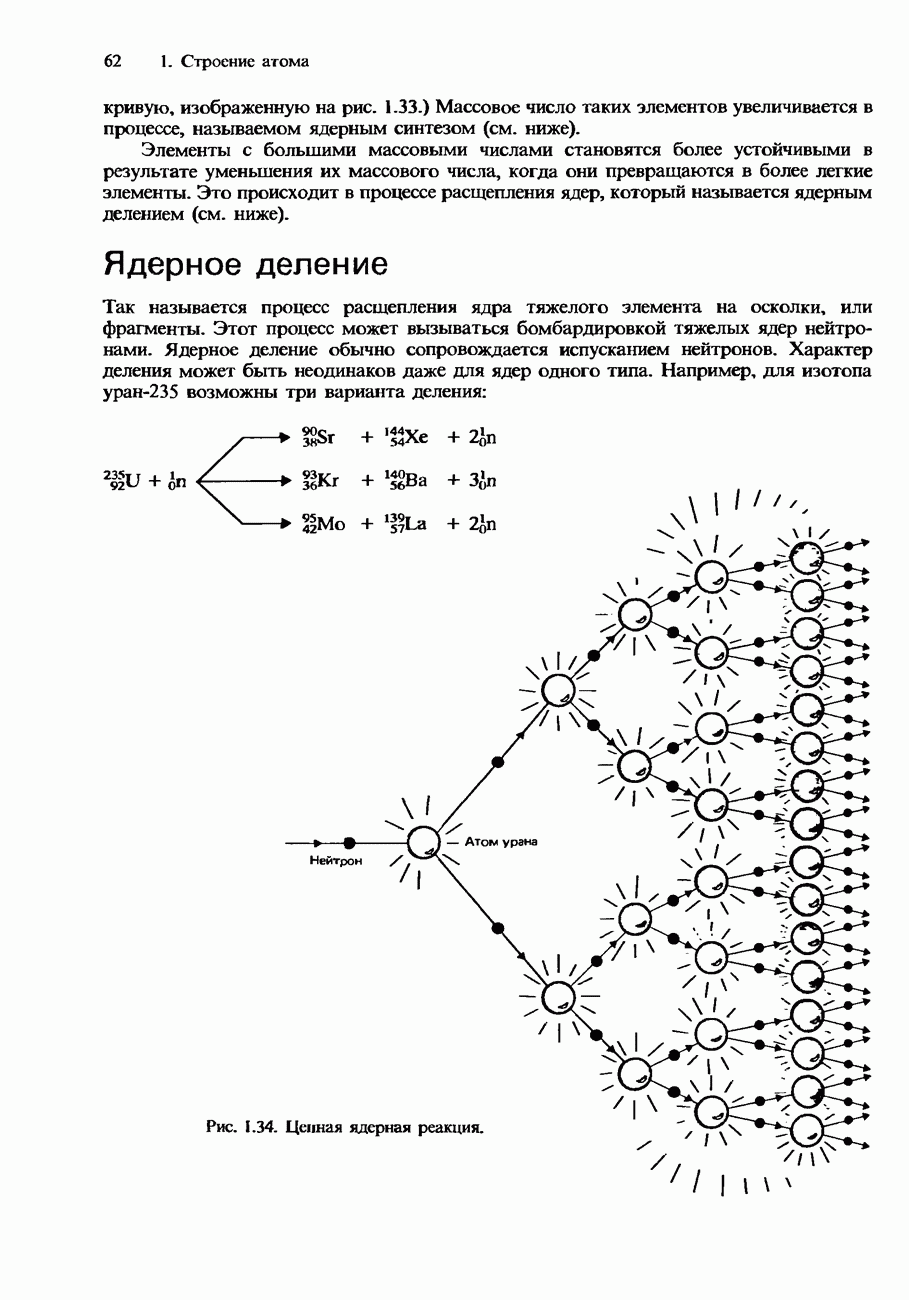
- ЯДЕРНОЕ ДЕЛЕНИЕ И ЯДЕРНЫЙ СИНТЕЗ
- Ядерное деление
- Ядерный синтез
- Ядерный синтез в звездах
- ЯДЕРНАЯ ЭНЕРГИЯ
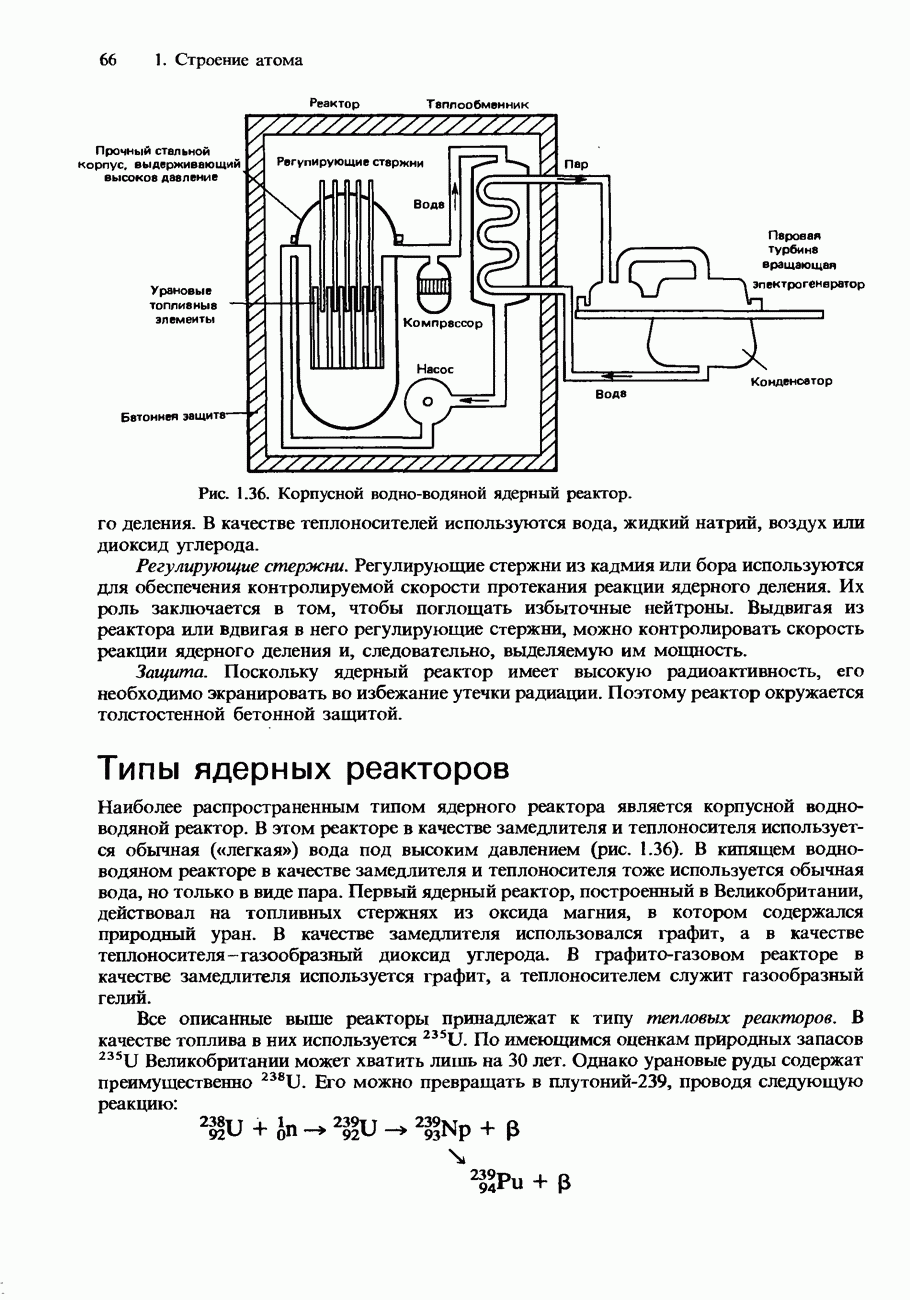
- Типы ядерных реакторов
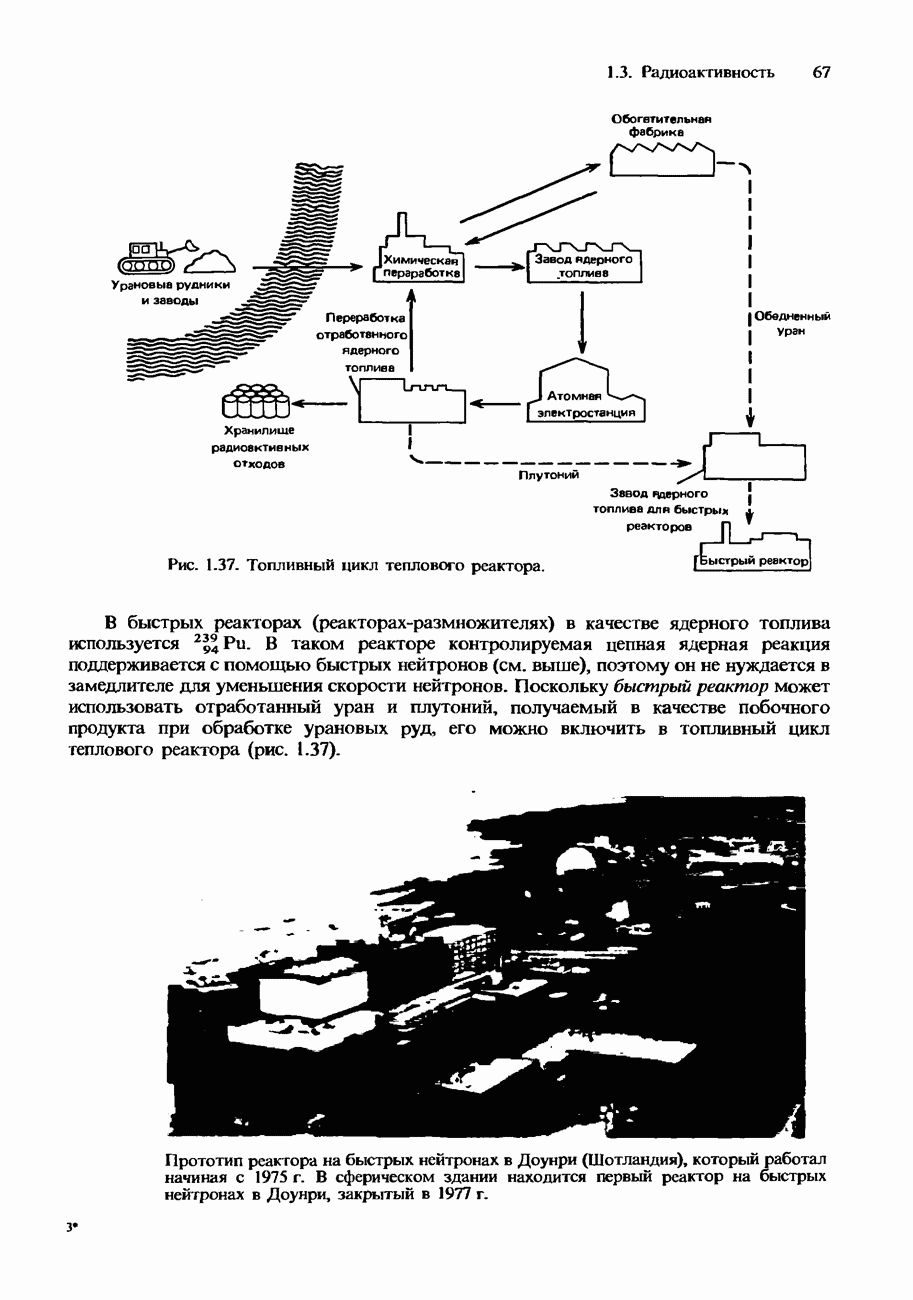
- Радиоактивные ядерные отходы и их переработка
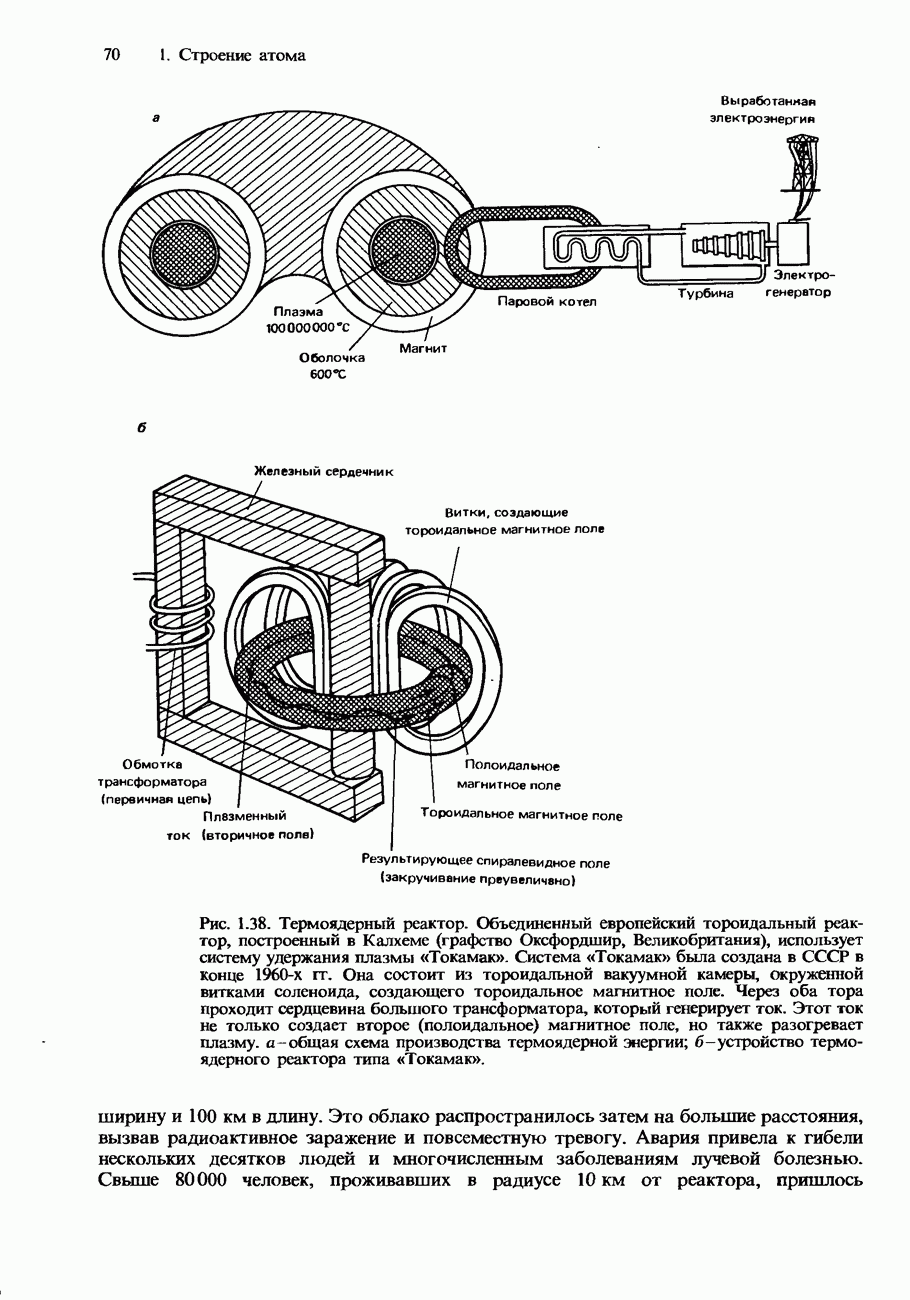
- Термоядерные реакторы
- Аргументы против использования ядерной энергии
- ЯДЕРНОЕ ОРУЖИЕ
- Ядерное разоружение
- ИСТОЧНИКИ РАДИАЦИИ И ЕЕ ВОЗДЕЙСТВИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 2. ХИМИЧЕСКАЯ СВЯЗЬ
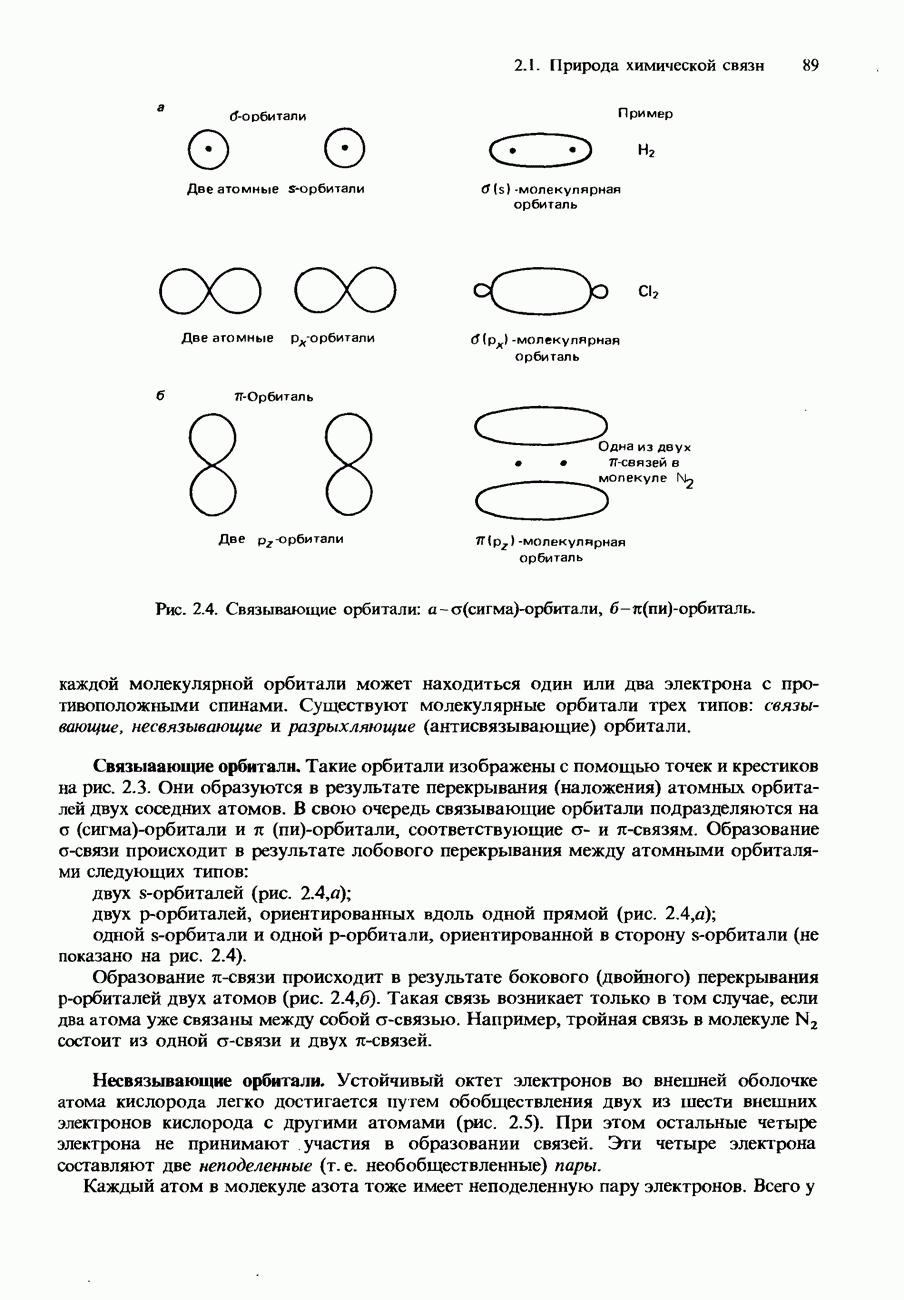
- 2.1. Природа химической связи
- ИОННАЯ СВЯЗЬ
- Устойчивость ионных соединений
- КОВАЛЕНТНАЯ СВЯЗЬ
- Молекулярные орбитали
- Гибридные атомные орбитали
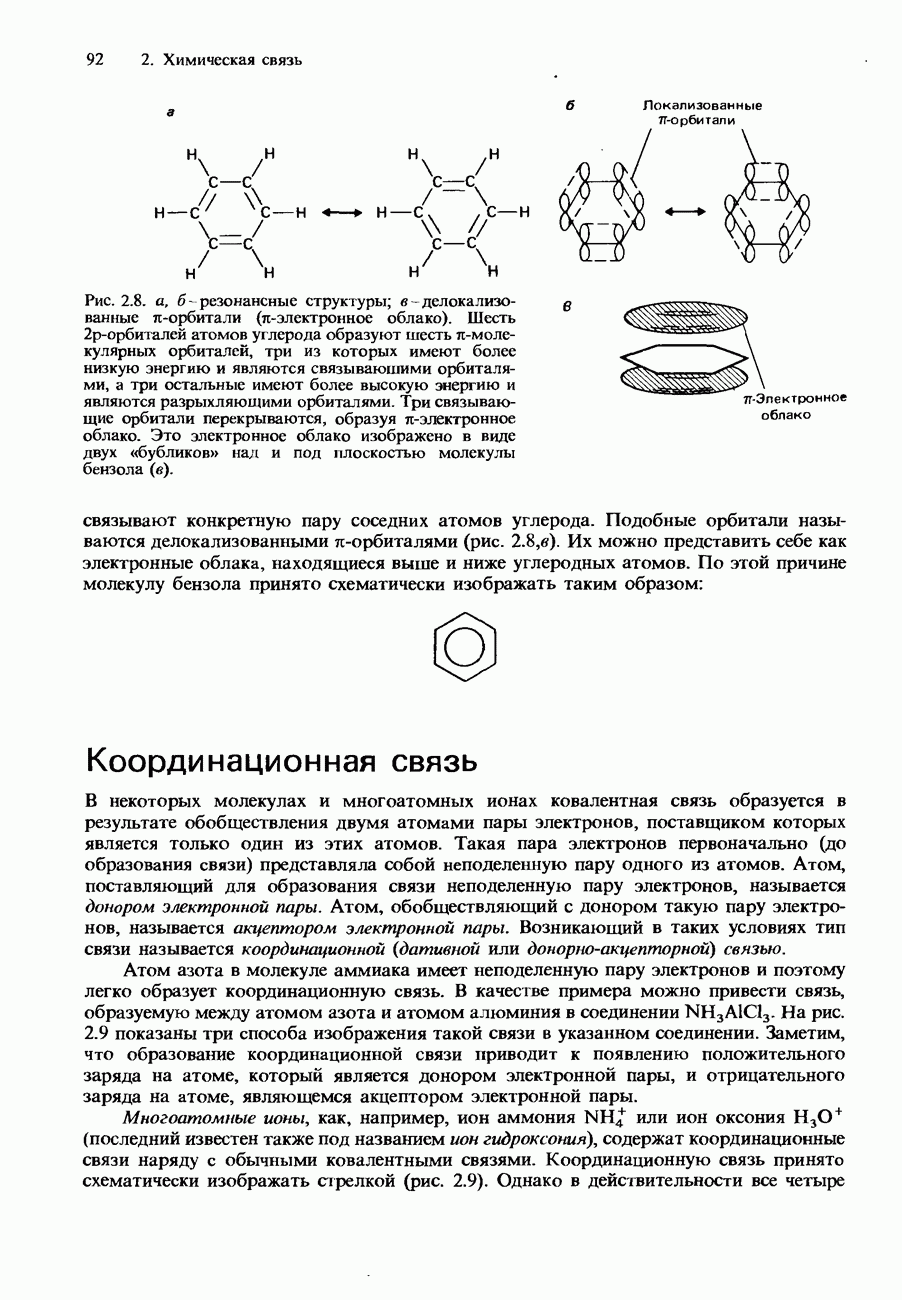
- Делокализованные орбитали
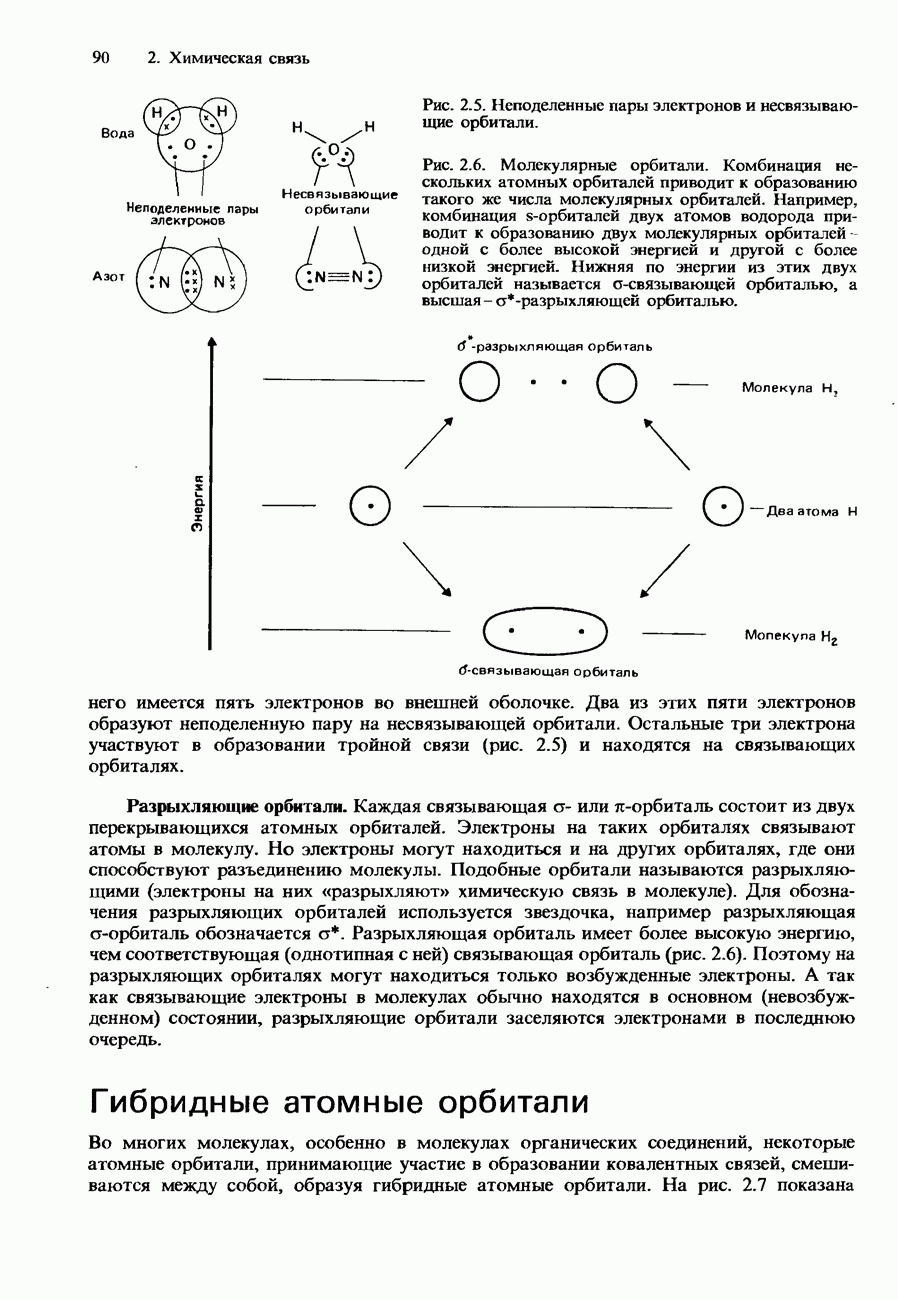
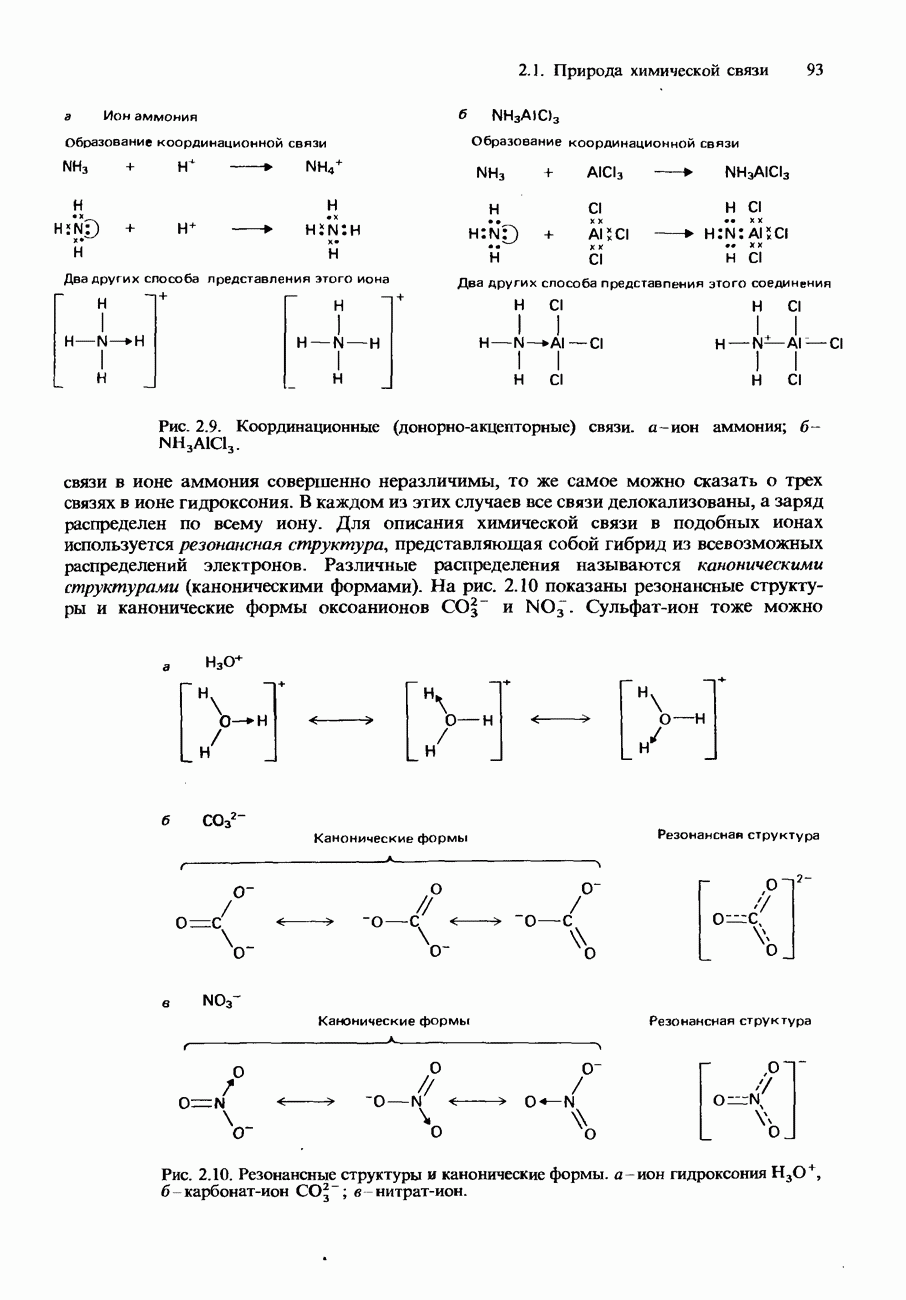
- Координационная связь
- ИОННЫЙ И КОВАЛЕНТНЫЙ ХАРАКТЕР СВЯЗИ
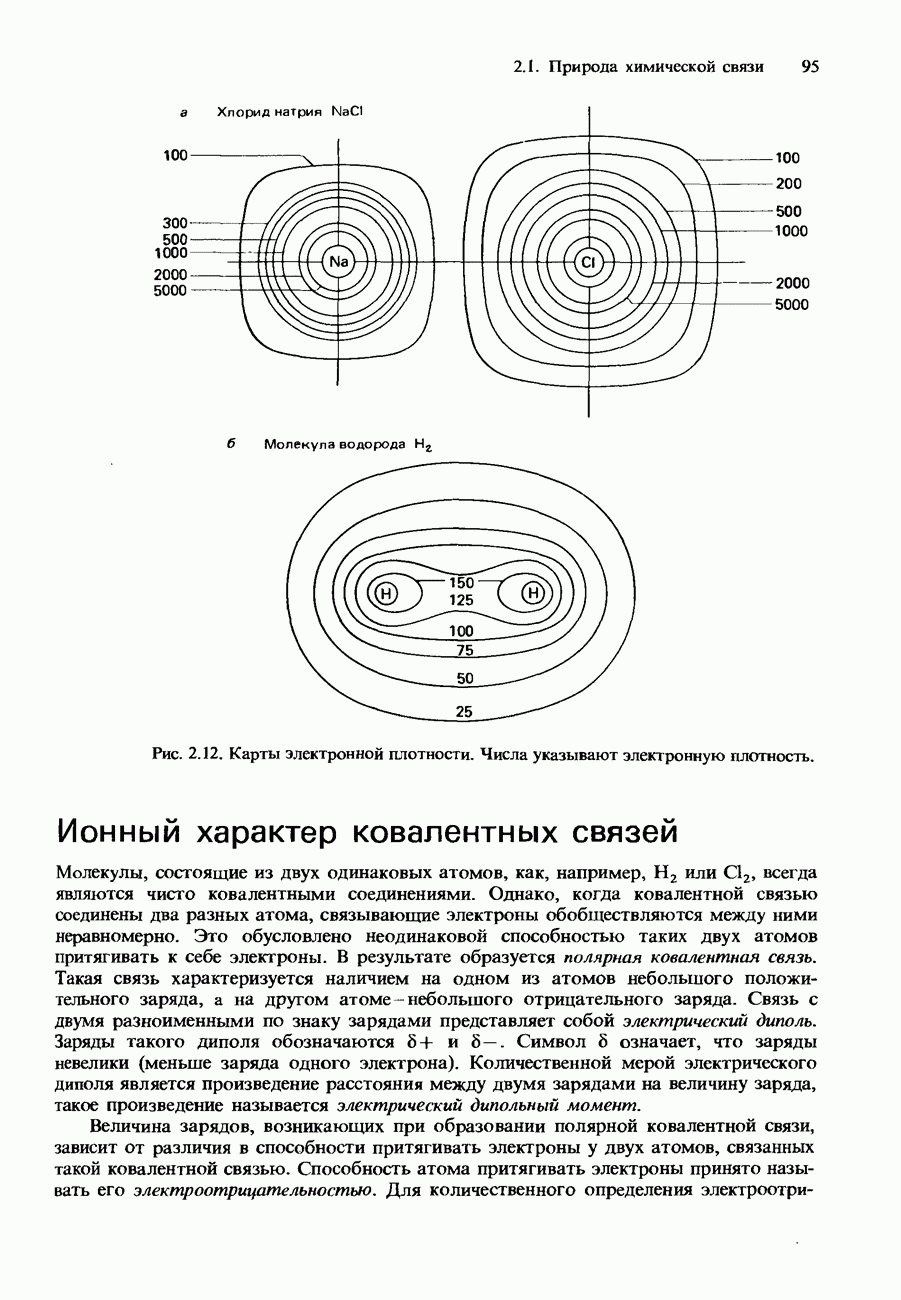
- Ионный характер ковалентных связей
- Ионные и ковалентные соединения
- МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
- Валентная зона и зона проводимости
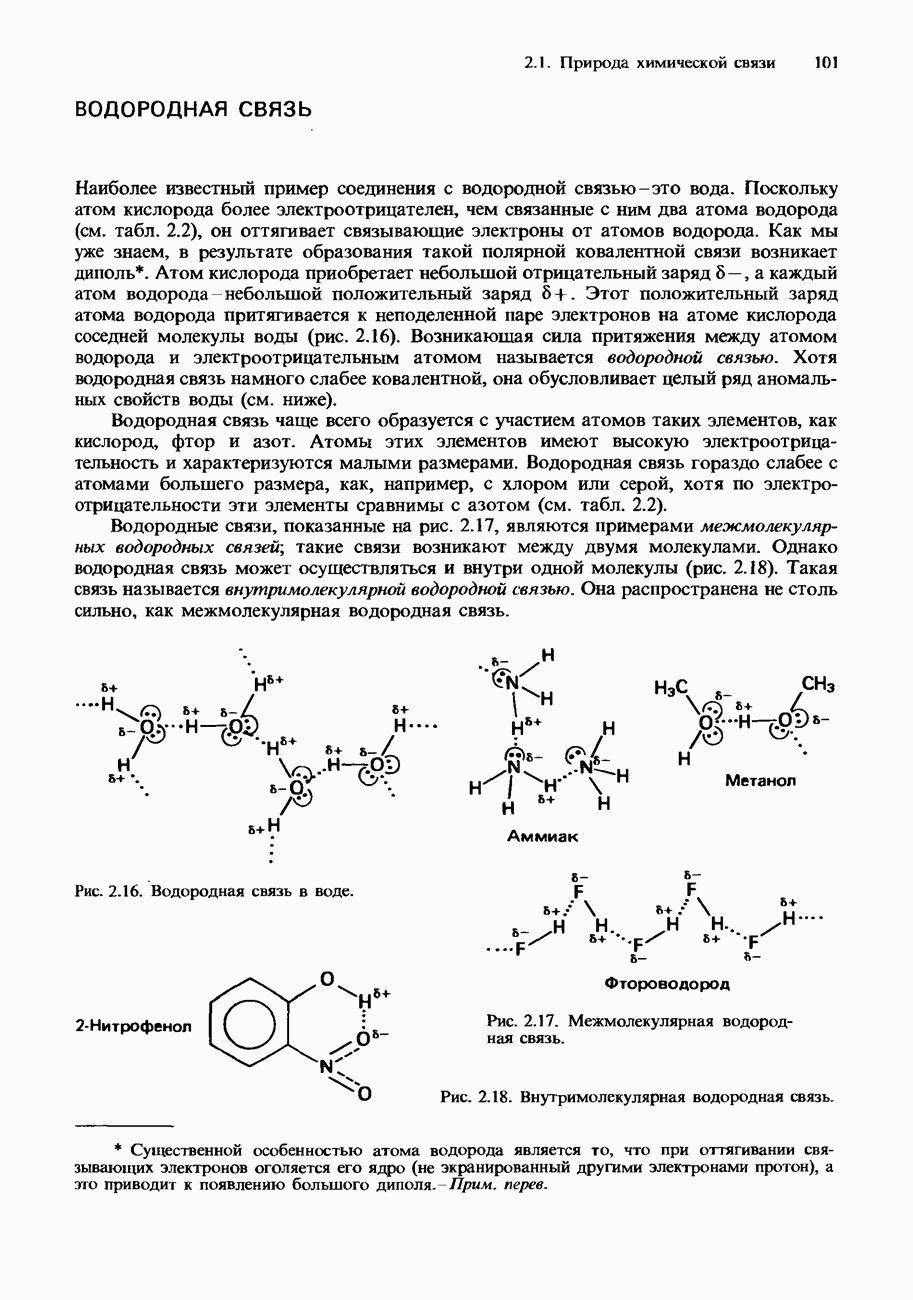
- ВОДОРОДНАЯ СВЯЗЬ
- ВАНДЕРВААЛЬСОВЫ СИЛЫ
- Притяжение типа диполь-индуцированный диполь (индукционное)
- Что понимается под вандерваальсовыми силами
- 2.2. Влияние химической связи на свойства соединений
- Атомные радиусы
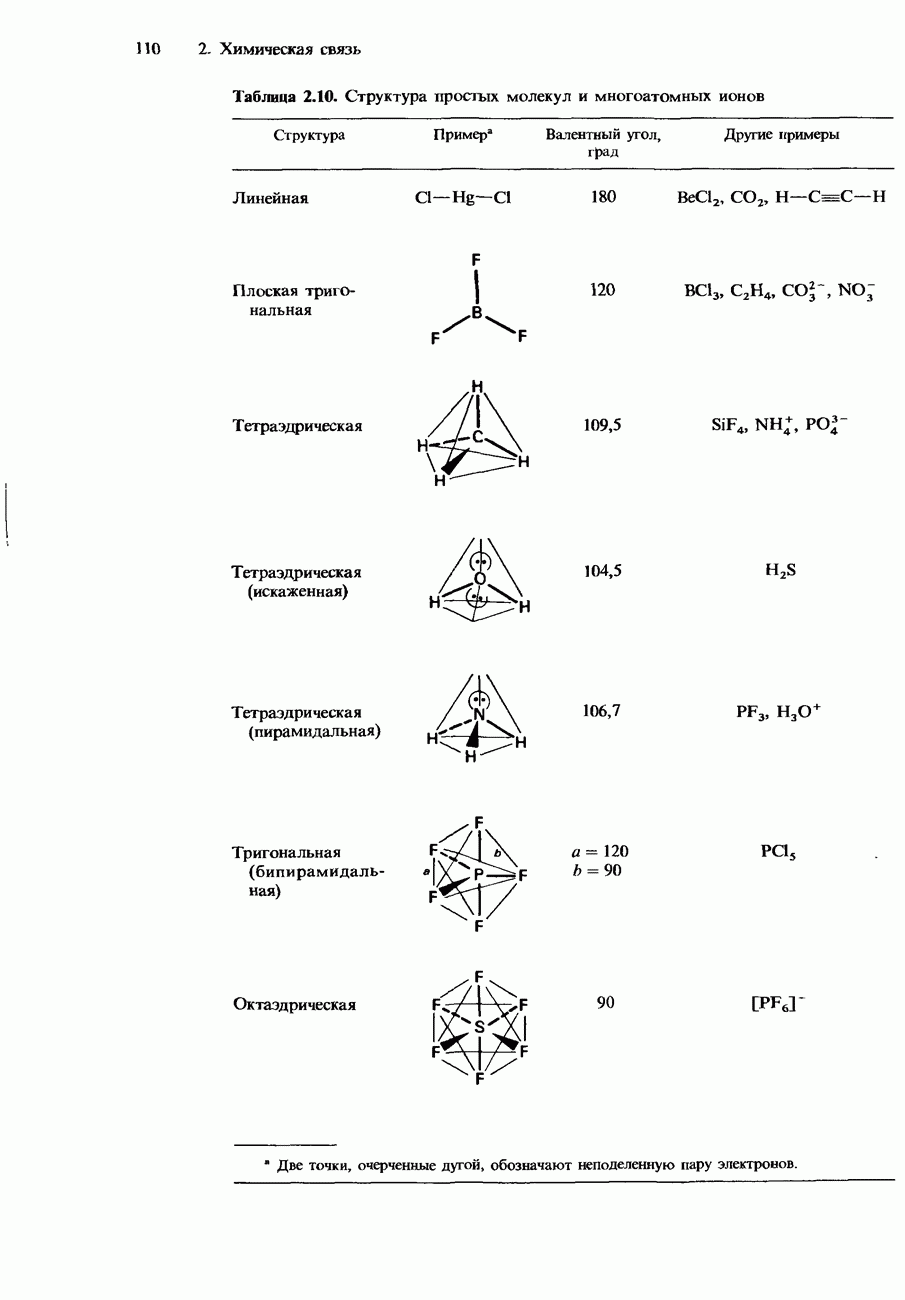
- ФОРМА ПРОСТЫХ МОЛЕКУЛ И МНОГОАТОМНЫХ ИОНОВ
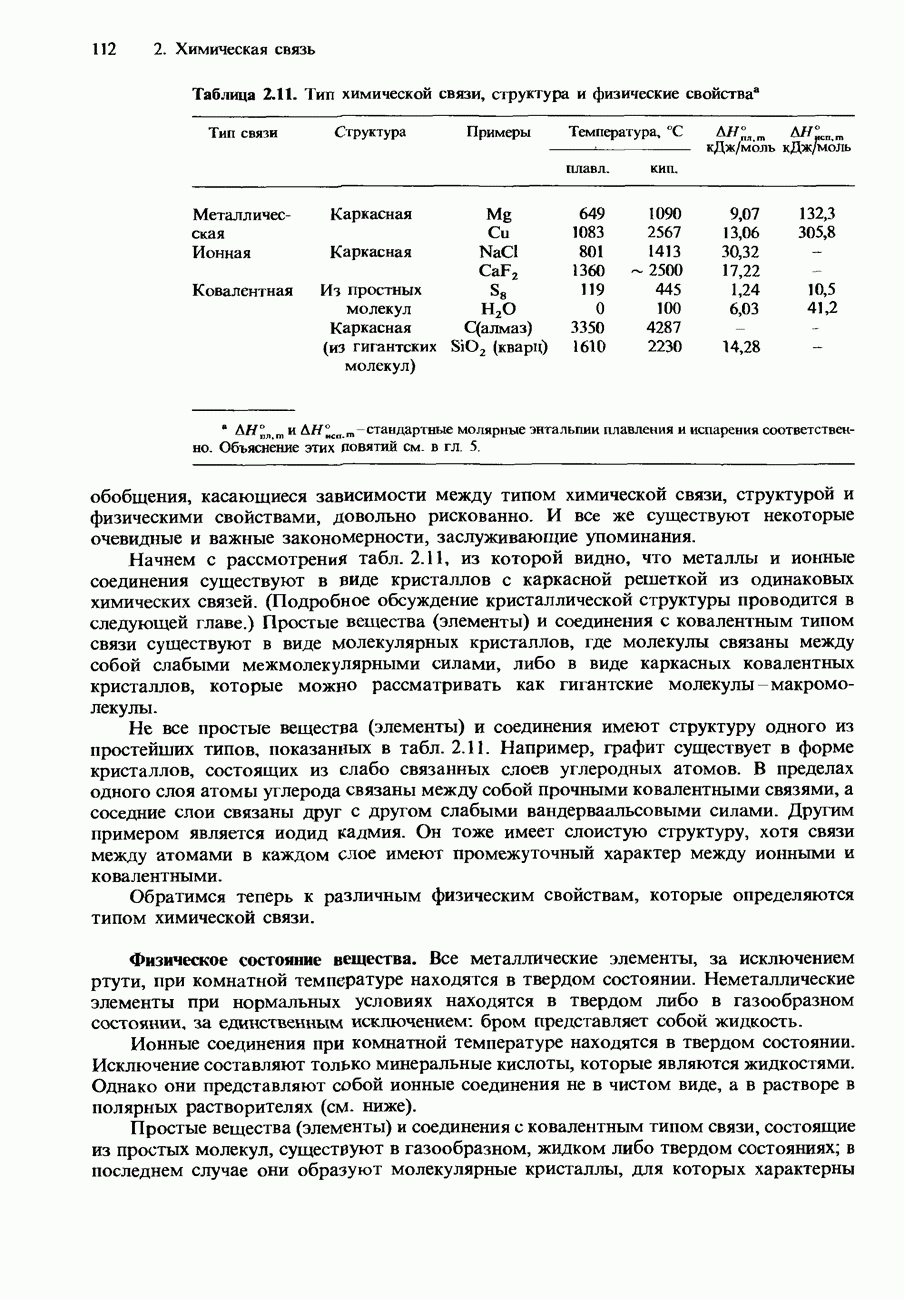
- ТИП ХИМИЧЕСКОЙ СВЯЗИ, СТРУКТУРА И ФИЗИЧЕСКИЕ СВОЙСТВА
- ТИП СВЯЗИ И ХИМИЧЕСКИЕ СВОЙСТВА
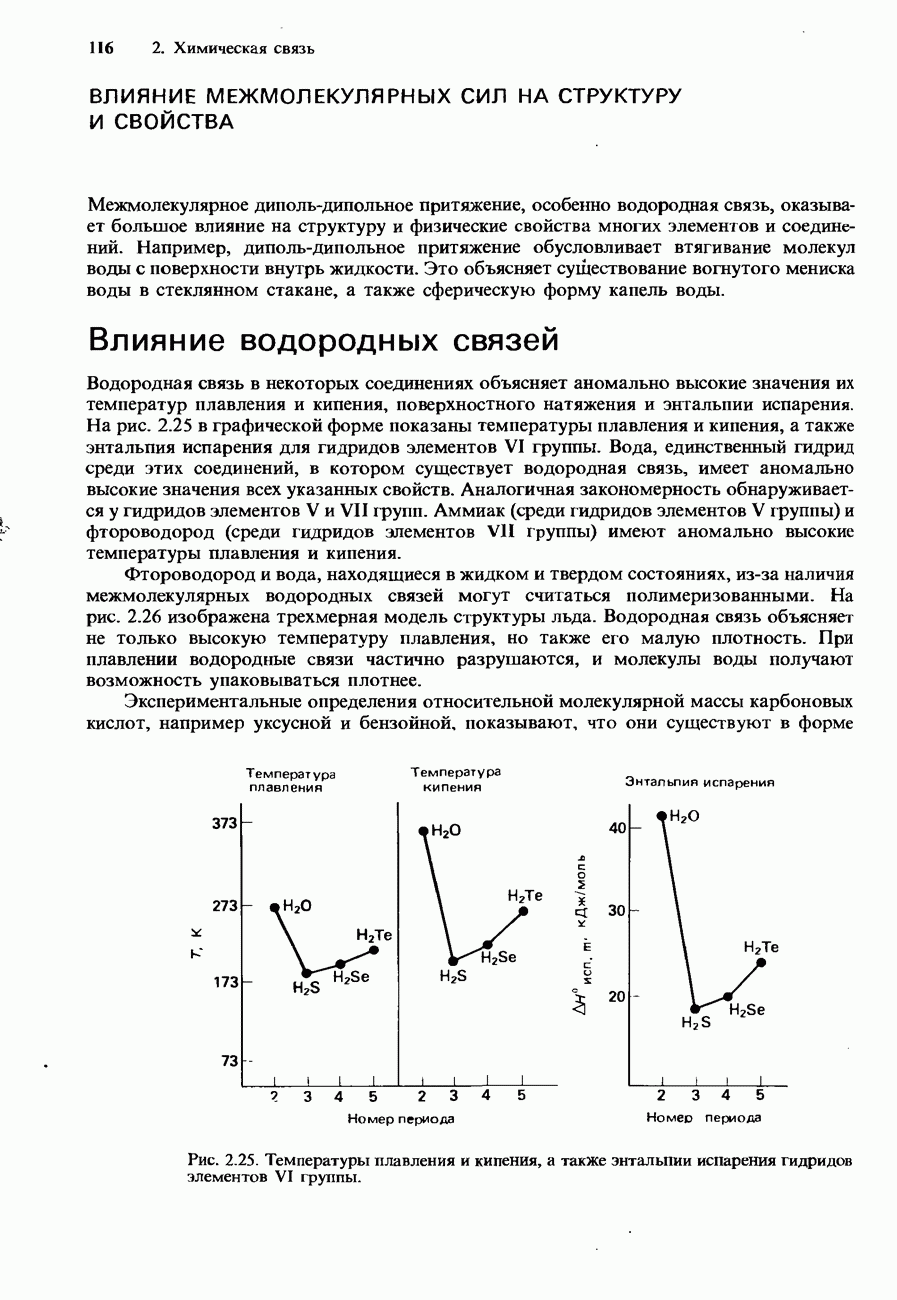
- ВЛИЯНИЕ МЕЖМОЛЕКУЛЯРНЫХ СИЛ НА СТРУКТУРУ И СВОЙСТВА
- ВЛИЯНИЕ ВАНДЕРВААЛЬСОВЫХ СИЛ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
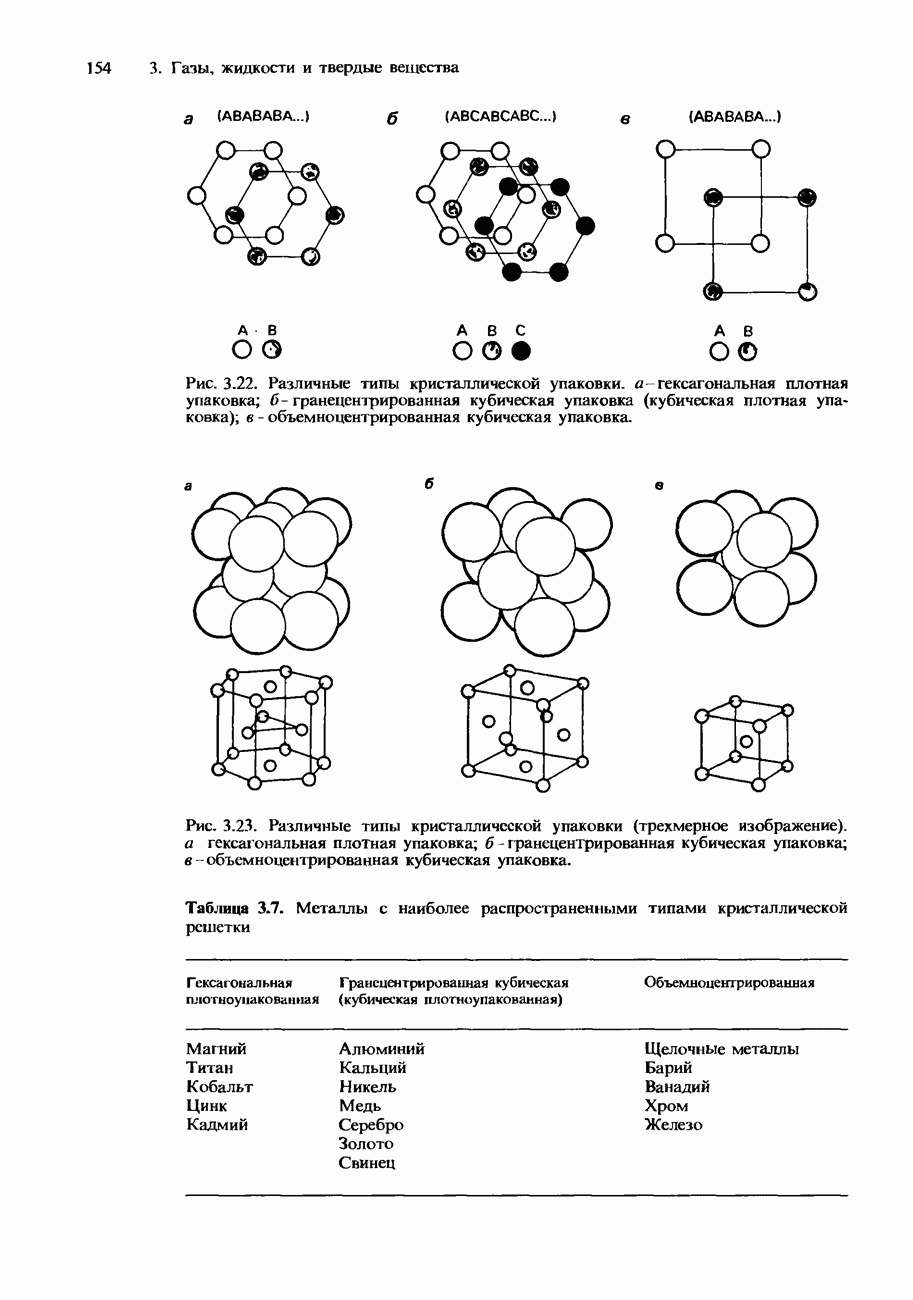
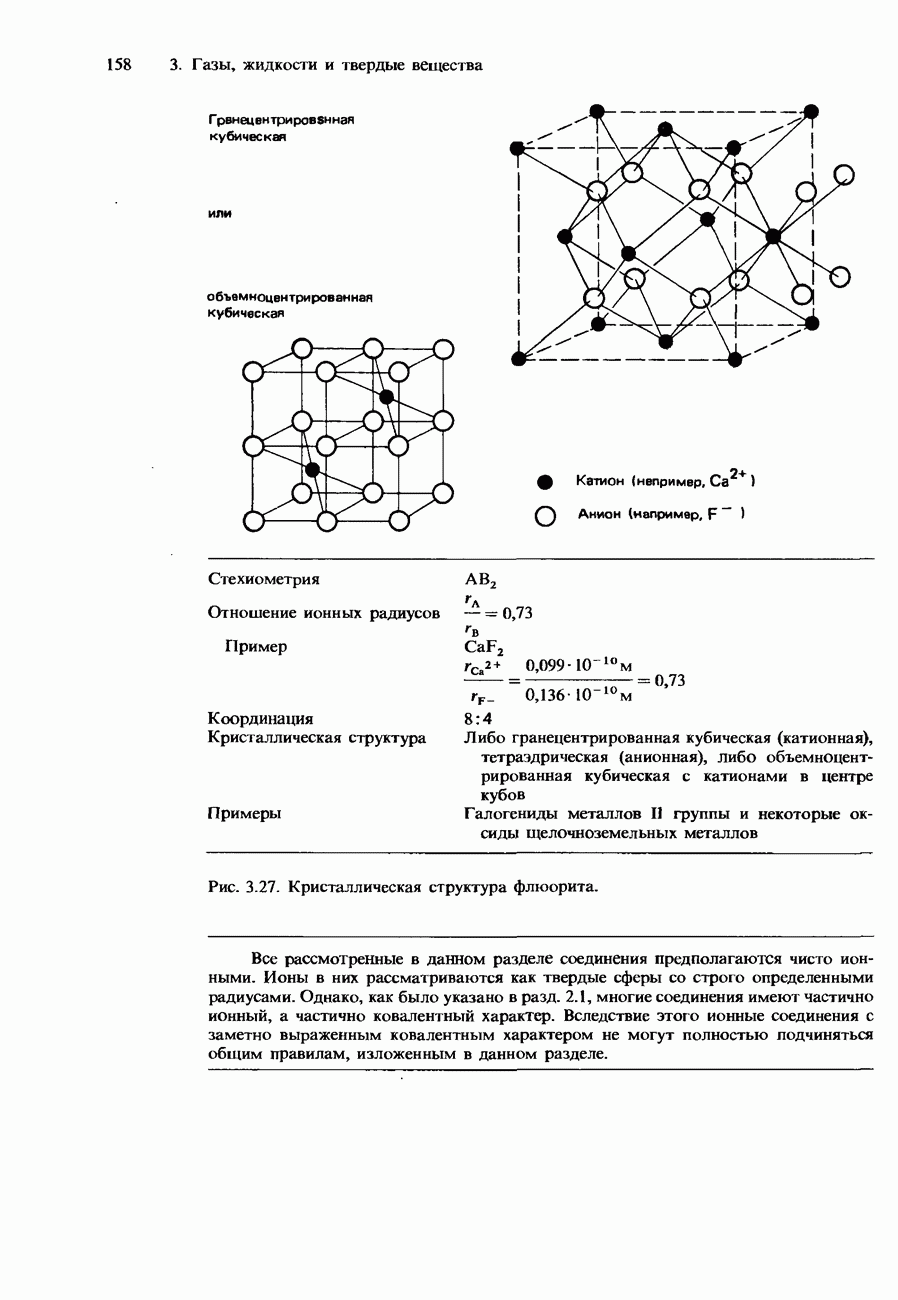
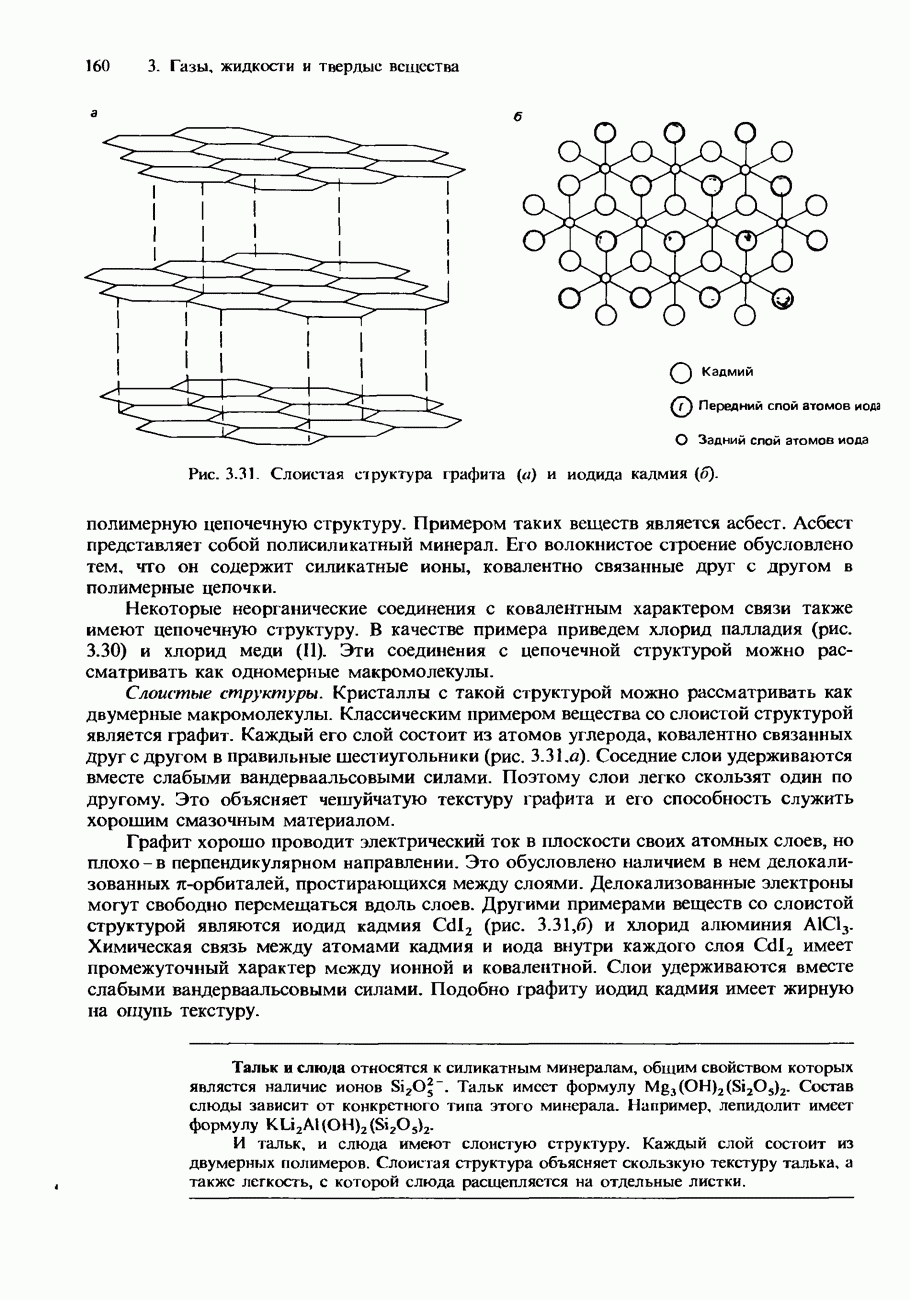
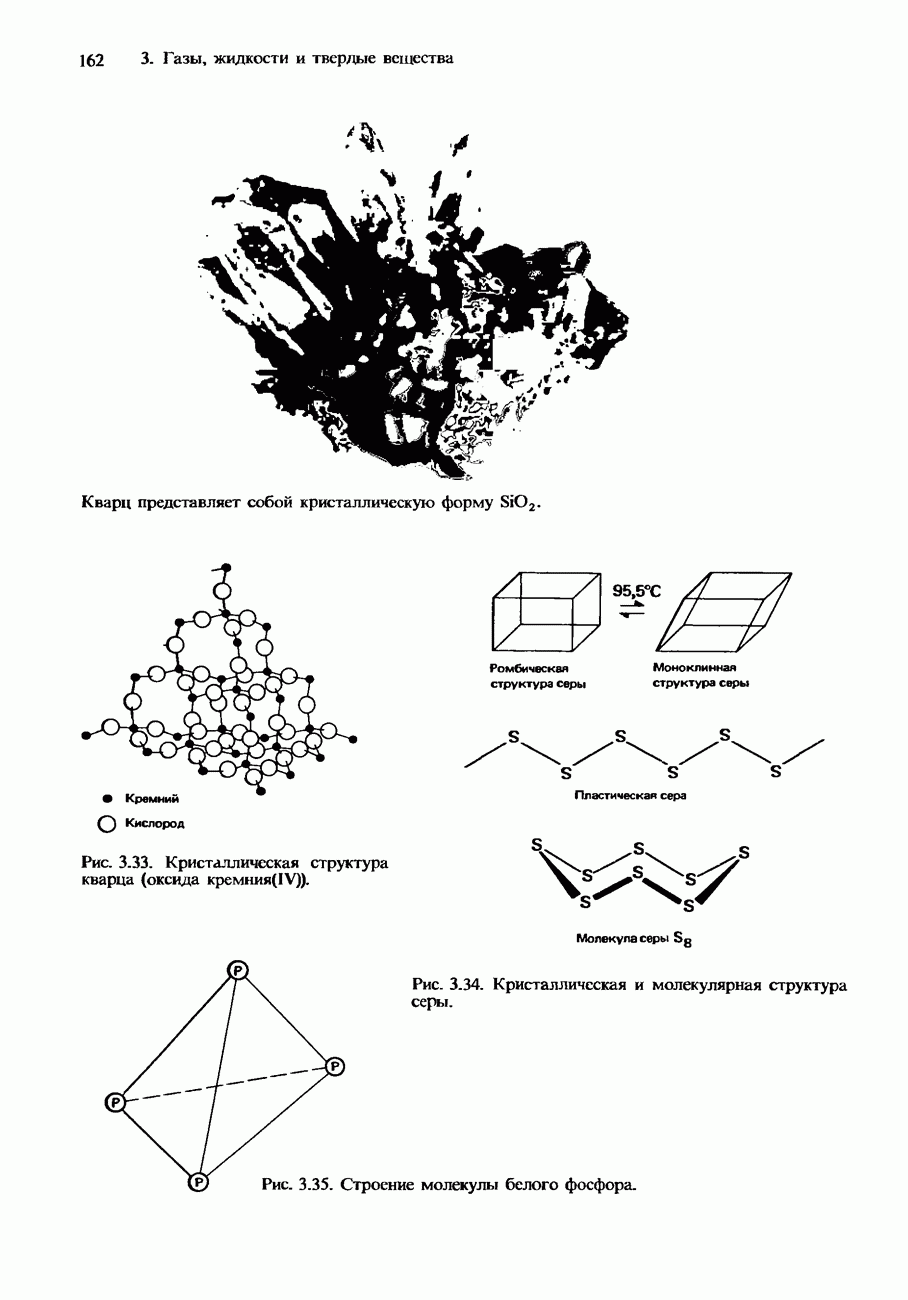
- 3 ГАЗЫ, ЖИДКОСТИ И ТВЕРДЫЕ ВЕЩЕСТВА
- 3.1. Газы и жидкости
- ГАЗОВЫЕ ЗАКОНЫ
- Закон Бойля-Мариотта
- Закон Гей-Люссака (закон Шарля)
- Объединенный газовый закон
- Закон Авогадро
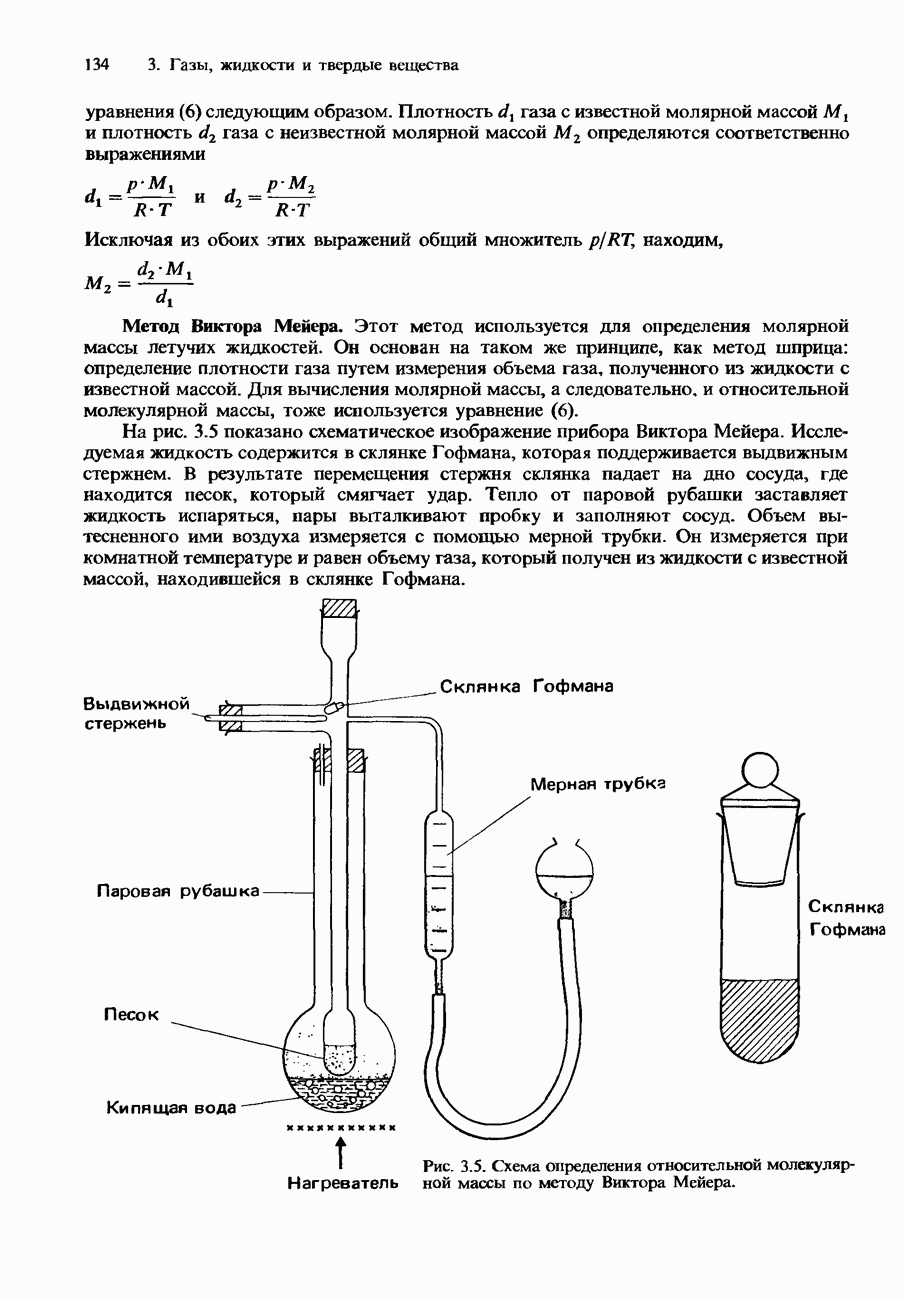
- Экспериментальное определение относительной молекулярной массы
- Закон парциальных давлений газов (закон Дальтона)
- Законы Грэхема
- КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
- Скорости молекул
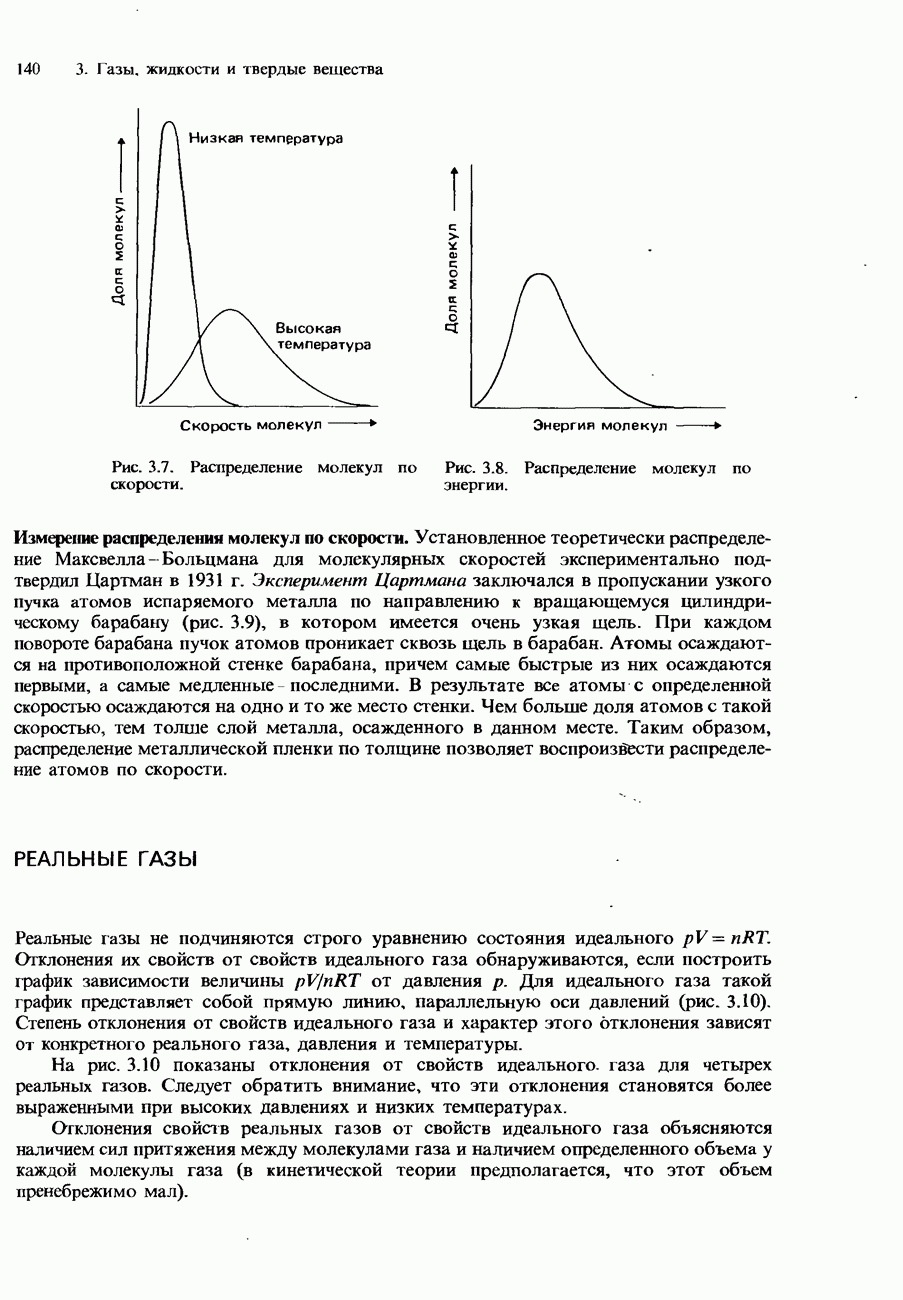
- Распределение Максвелла-Больцмана
- РЕАЛЬНЫЕ ГАЗЫ
- Уравнение Ван-дер-Ваальса
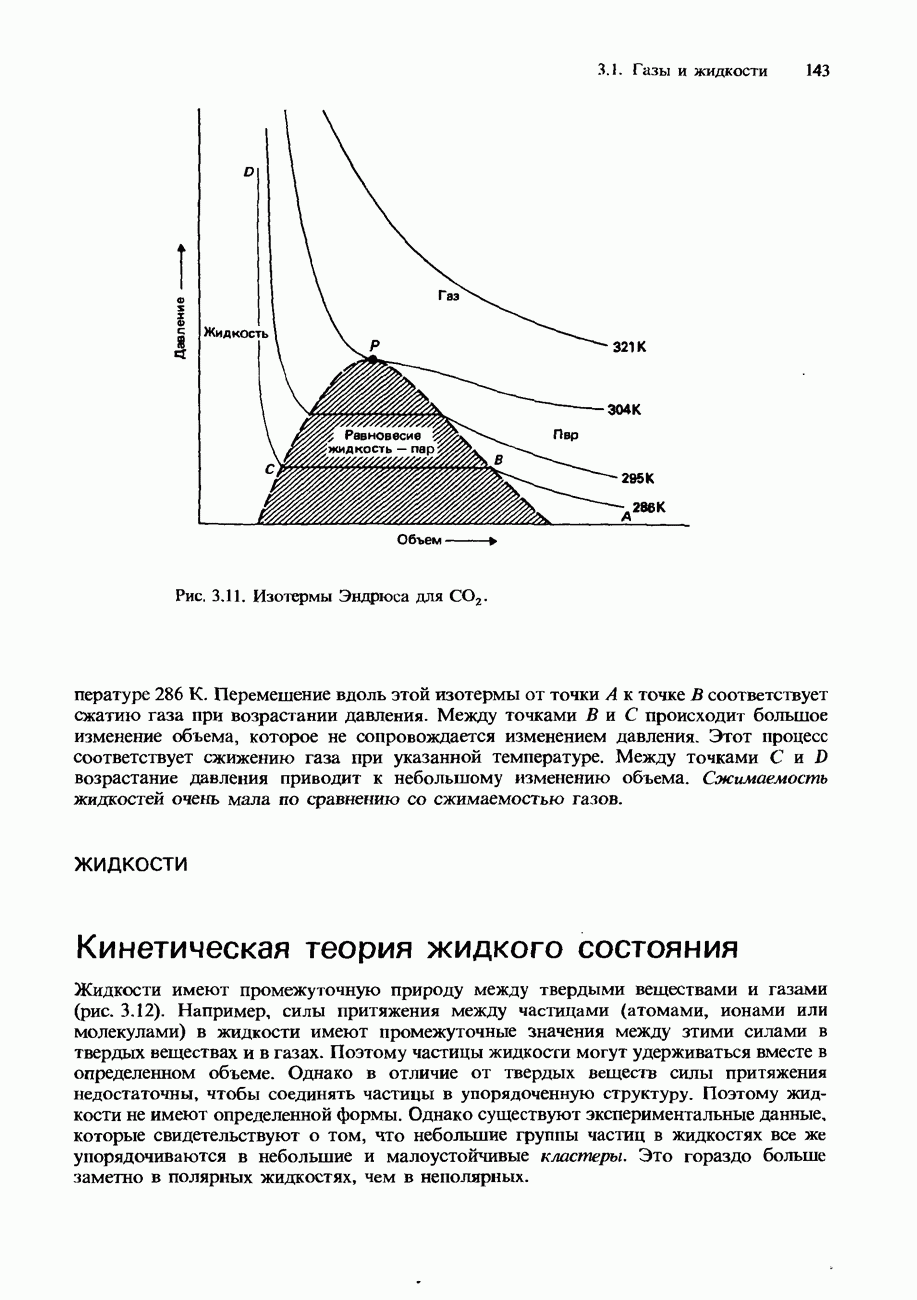
- Сжижение газов
- ЖИДКОСТИ
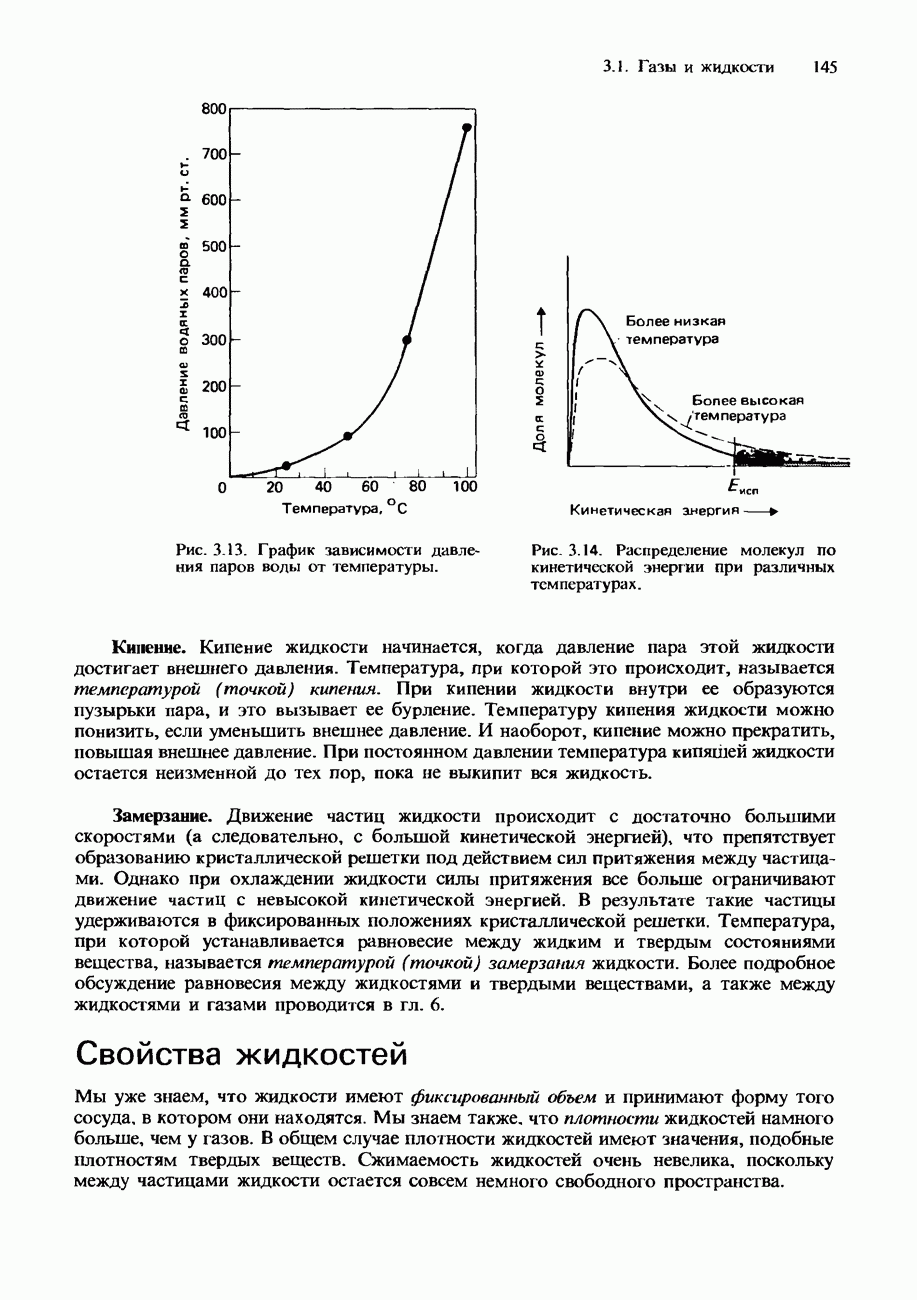
- Свойства жидкостей
- 3.2. Твердые вещества
- КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА
- Металлические кристаллы
- Ионные кристаллы
- Ковалентные кристаллы
- ИЗОМОРФИЗМ. ПОЛИМОРФИЗМ И АЛЛОТРОПИЯ
- СВОЙСТВА ТВЕРДЫХ ВЕЩЕСТВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 4. СТЕХИОМЕТРИЯ
- 4.1. Стехиометрия и номенклатура
- Химические вещества
- Количественные законы химии
- Вес и масса
- НАЗВАНИЯ И ФОРМУЛЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
- Химические формулы
- НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- Степень окисления (состояние окисления)
- Элементы
- Бинарные соединения
- 4.2 Стехиометрические вычисления
- Молярная масса
- Число частиц вещества
- Процентный состав соединения
- Эмпирическая формула соединения
- Молярные постоянные и молярные величины
- Состав гомогенных смесей
- ХИМИЧЕСКИЕ УРАВНЕНИЯ
- ВЫХОД РЕАКЦИИ
- ПРОМЫШЛЕННАЯ СТЕХИОМЕТРИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 5. ЭНЕРГЕТИКА
- 5.1. Термодинамика
- ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
- 5.2. Энтальпия
- СТАНДАРТНЫЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ
- ДРУГИЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ
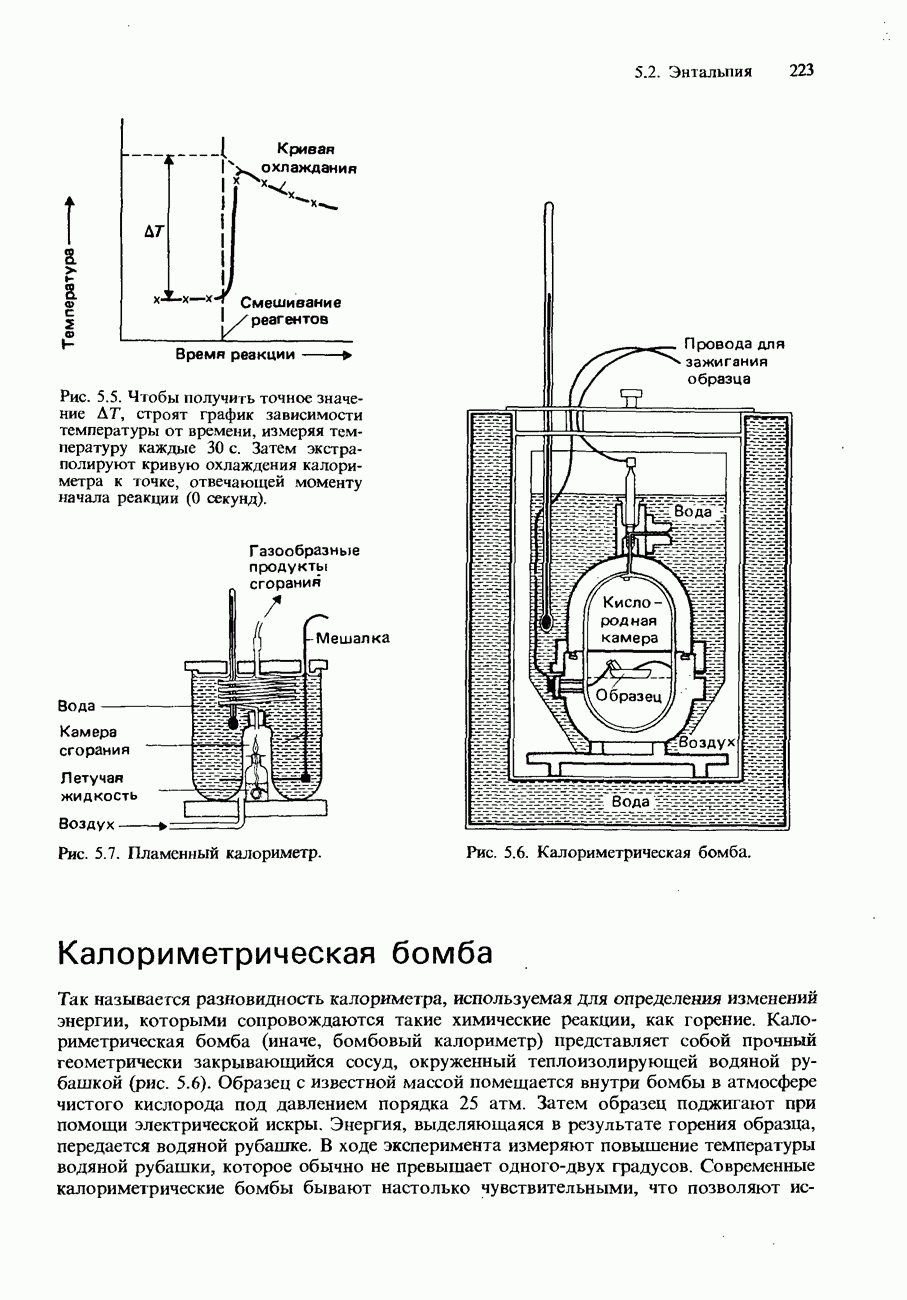
- КАЛОРИМЕТРИЯ
- КАЛОРИЙНОСТЬ ПИЩИ
- ЗАКОН ГЕССА
- 5.3 Энергия и структура
- ЭНТАЛЬПИЯ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
- Энтальпии растворения и гидратации
- ЭНТРОПИЯ
- СВОБОДНАЯ ЭНЕРГИЯ ГИББСА
- О ЧЕМ ПОЗВОЛЯЕТ СУДИТЬ ИЗМЕНЕНИЕ СВОБОДНОЙ ЭНЕРГИИ СИСТЕМЫ
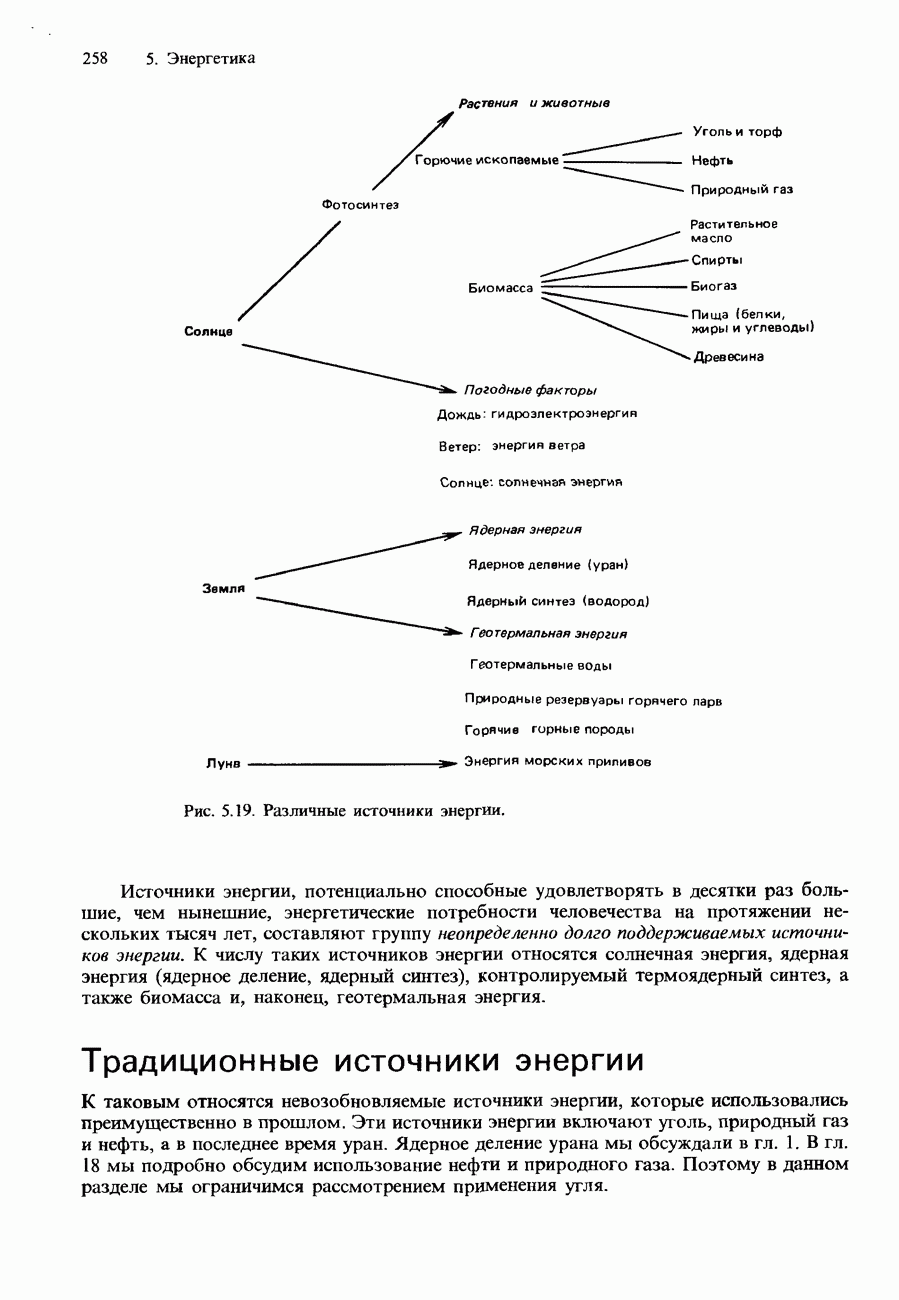
- 5.4. Источники энергии
- НЕТРАДИЦИОННЫЕ ИСТОЧНИКИ ЭНЕРГИИ
- ЗАПАСАНИЕ ЭНЕРГИИ
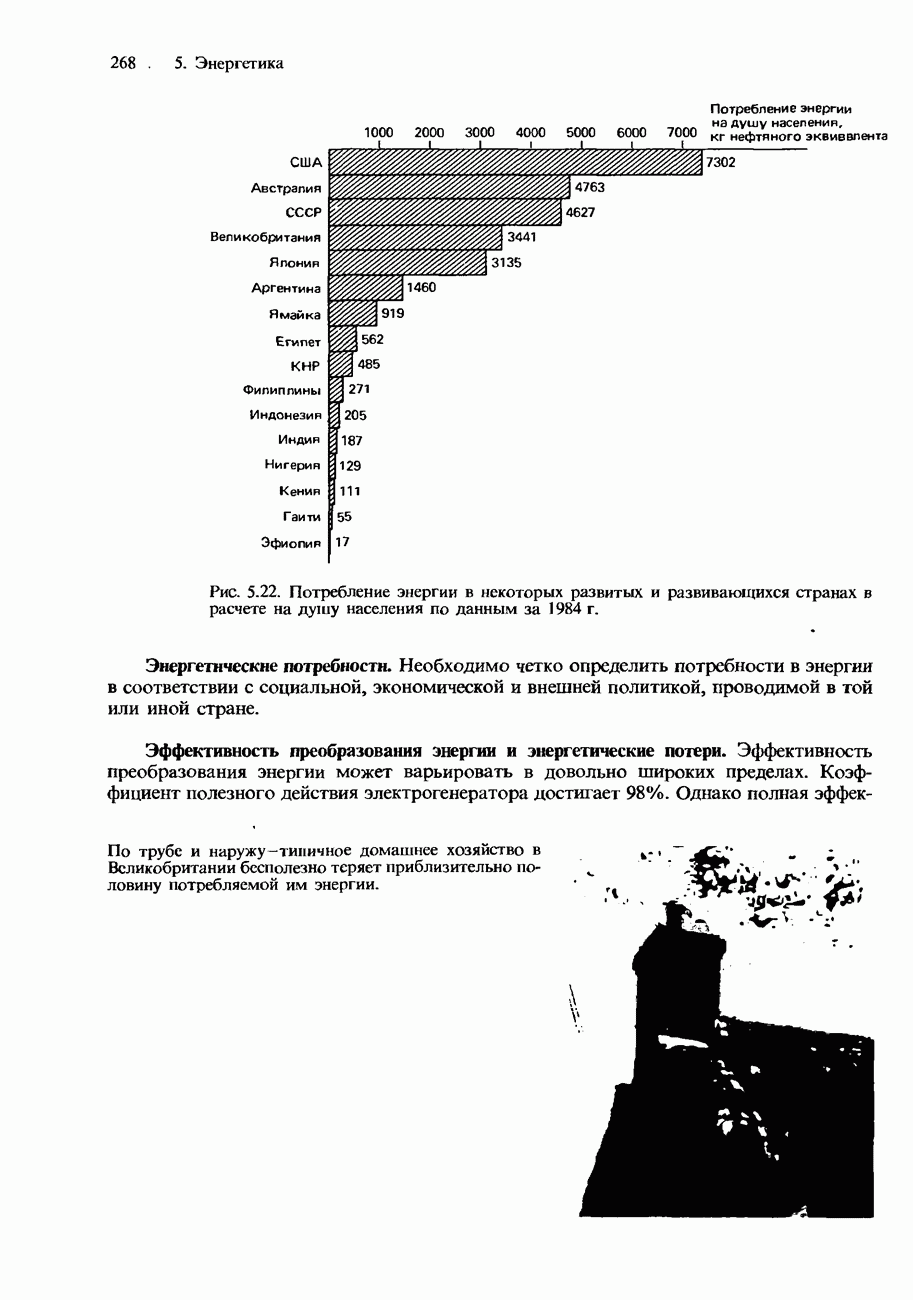
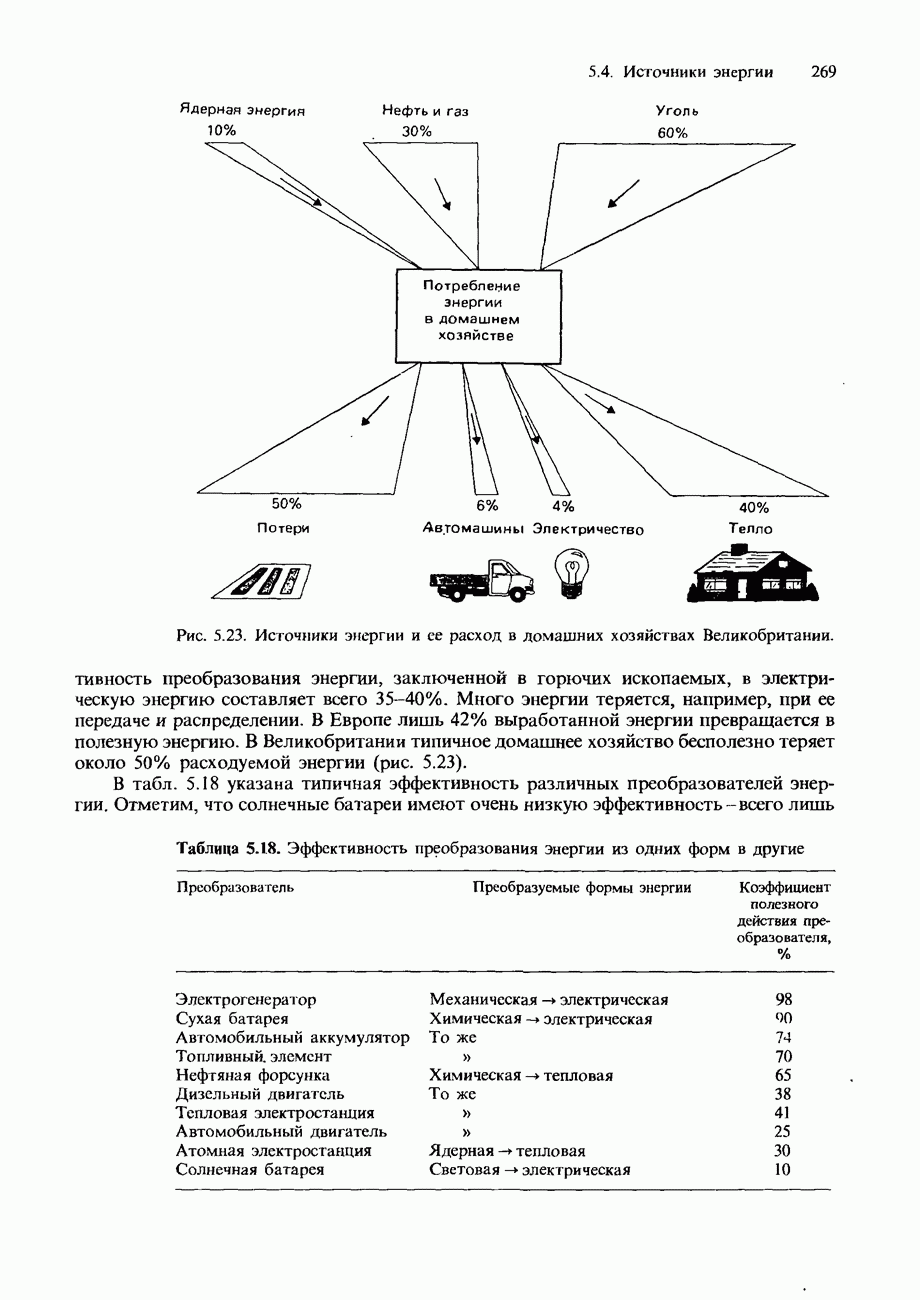
- ПОТРЕБЛЕНИЕ ЭНЕРГИИ В ПРОШЛОМ, НАСТОЯЩЕМ И БУДУЩЕМ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 6. ФАЗОВЫЕ РАВНОВЕСИЯ
- 6.1. Равновесия и фазы
- ФАЗЫ И КОМПОНЕНТЫ
- Фазы
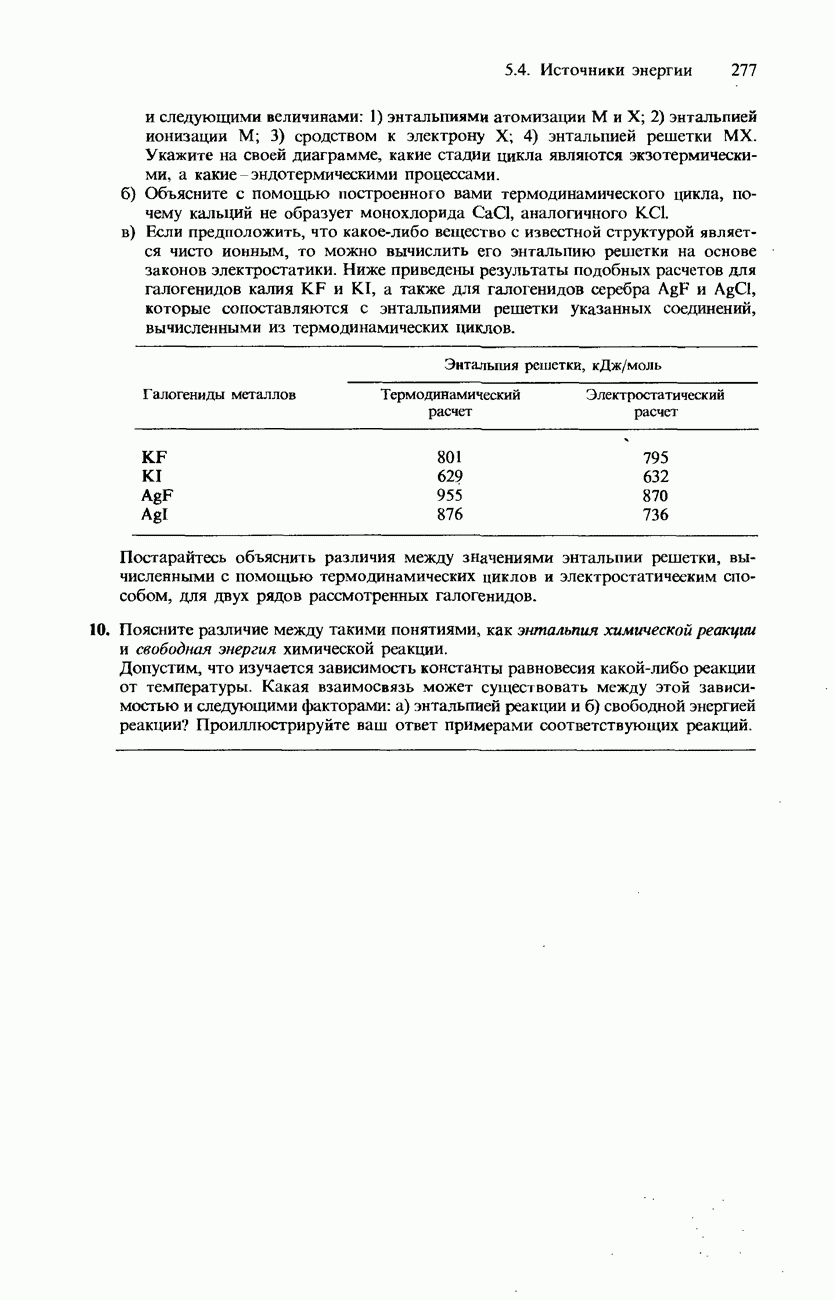
- ФАЗОВАЯ ДИАГРАММА ВОДЫ
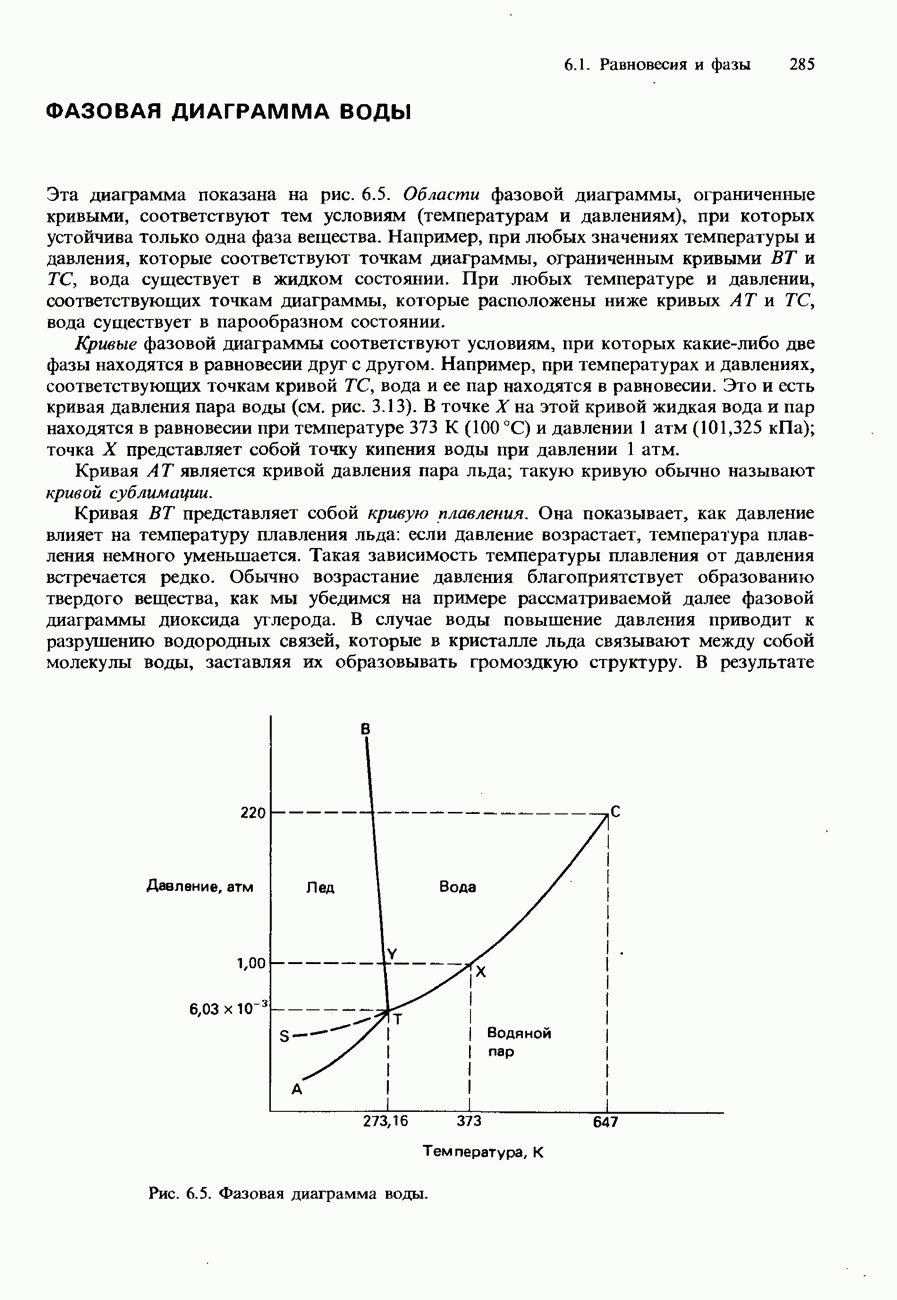
- ФАЗОВАЯ ДИАГРАММА ДИОКСИДА УГЛЕРОДА
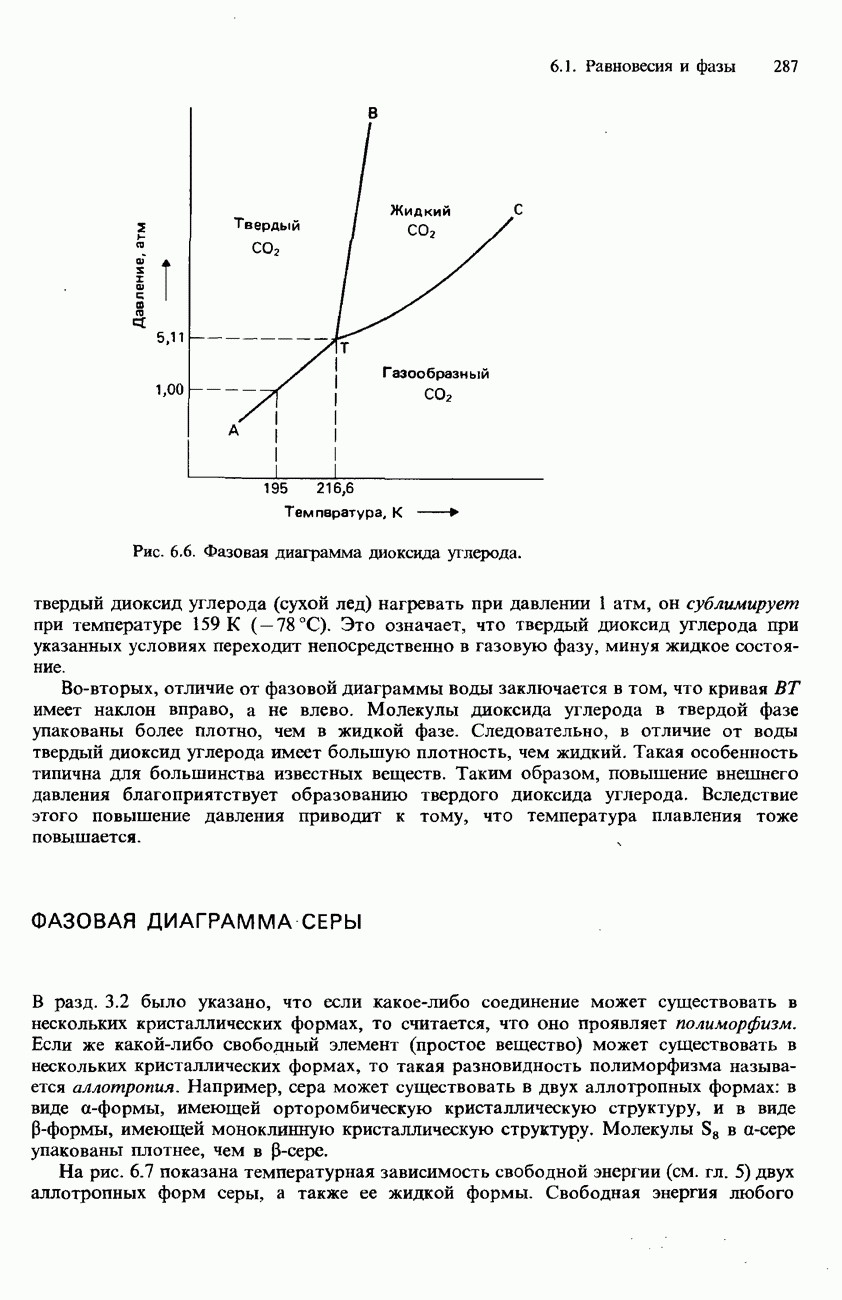
- ФАЗОВАЯ ДИАГРАММА СЕРЫ
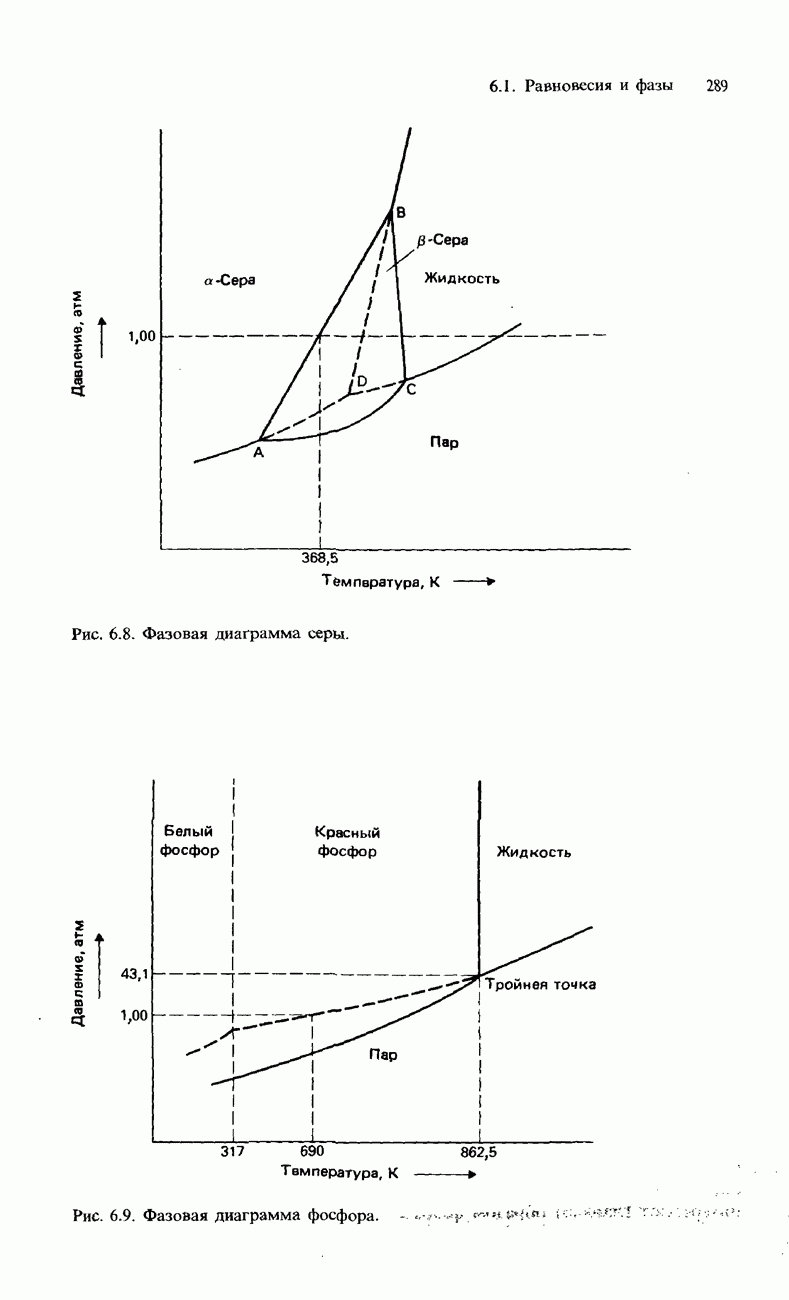
- ФАЗОВАЯ ДИАГРАММА ФОСФОРА
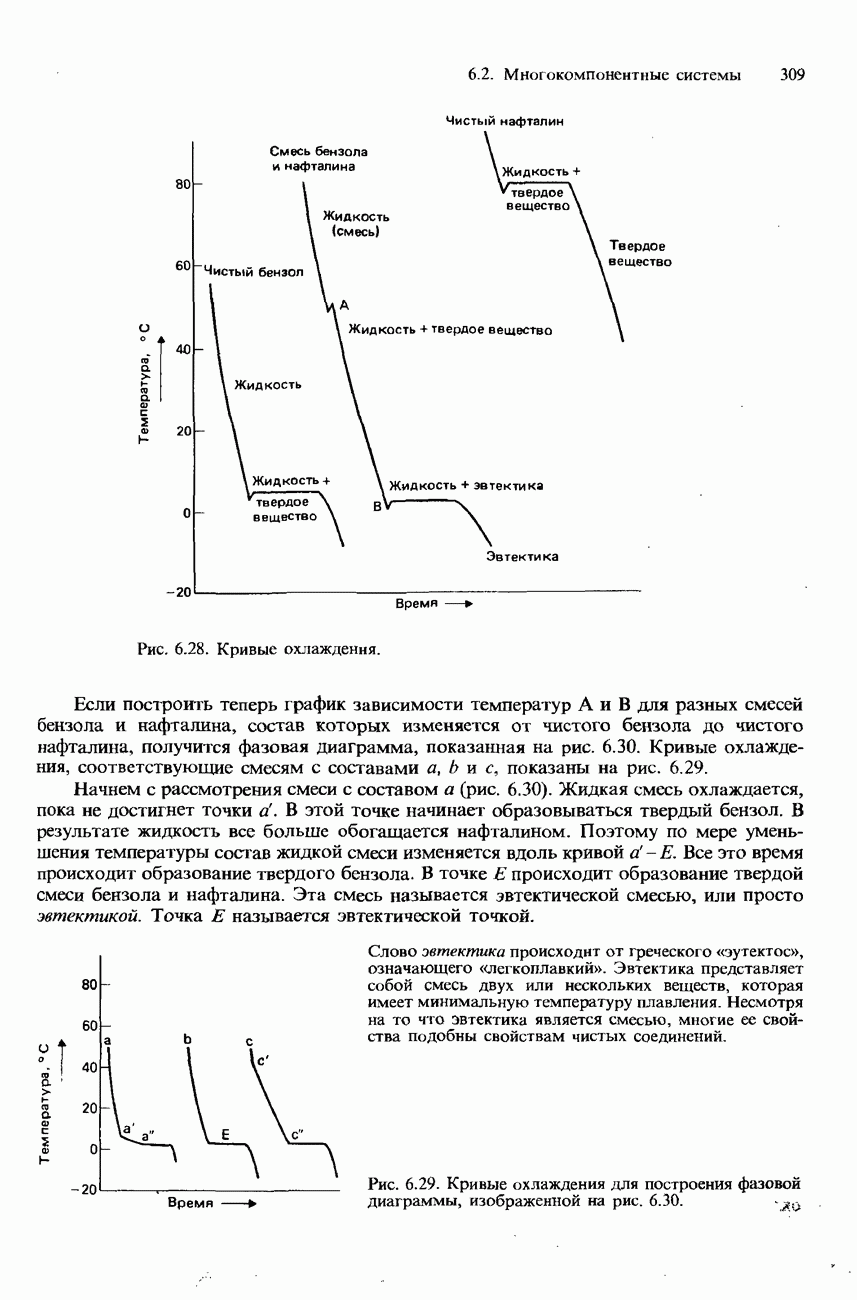
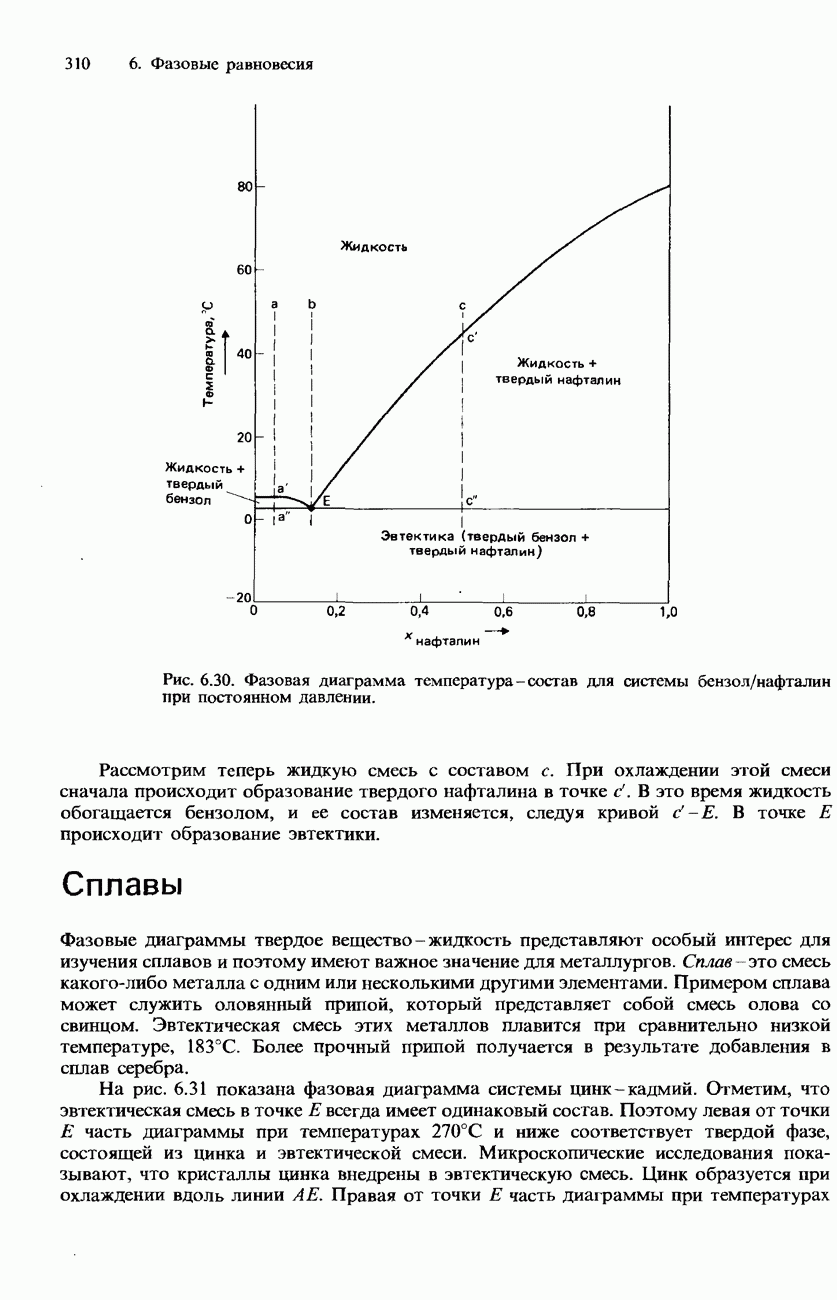
- 6.2. Многокомпонентные системы
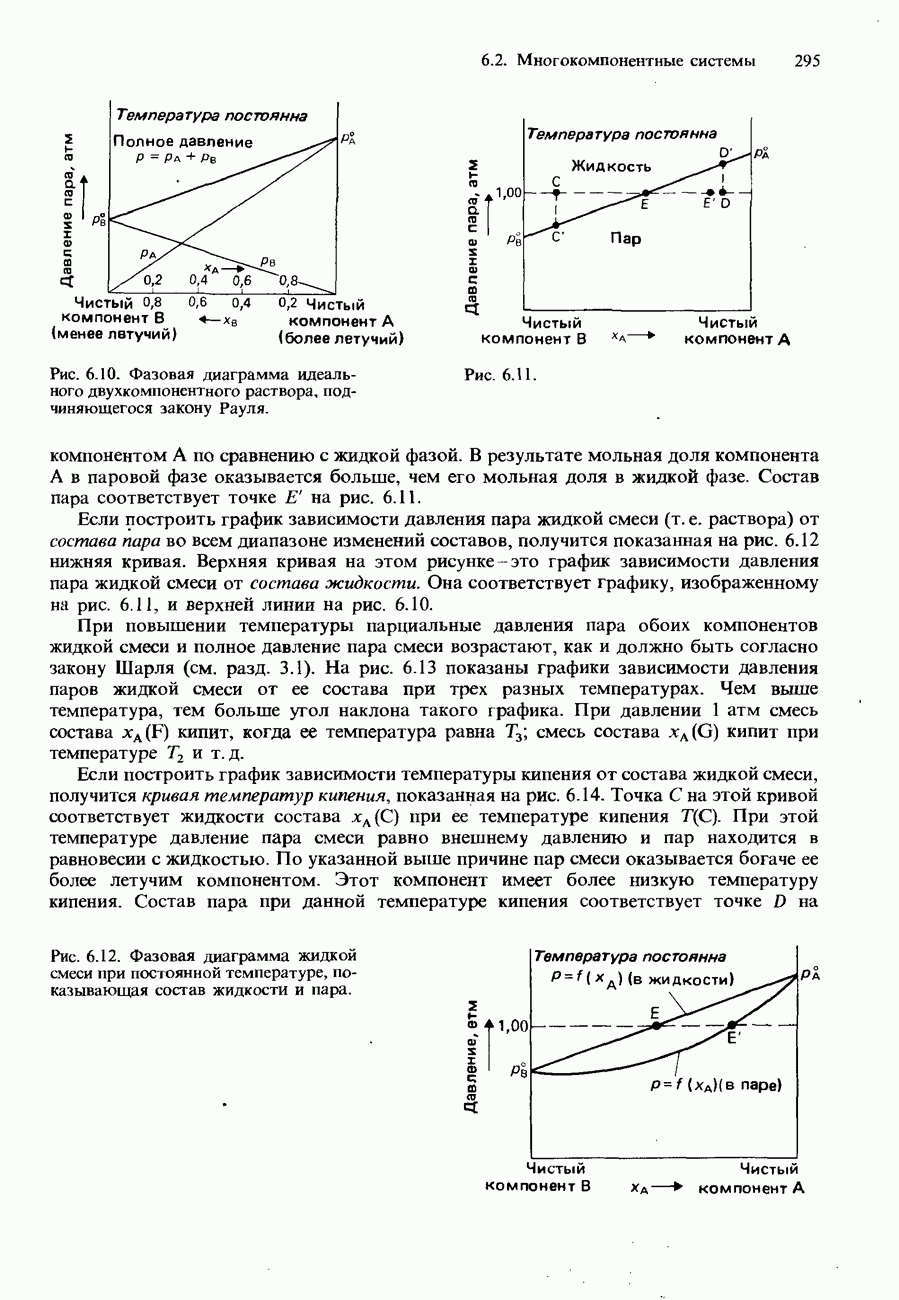
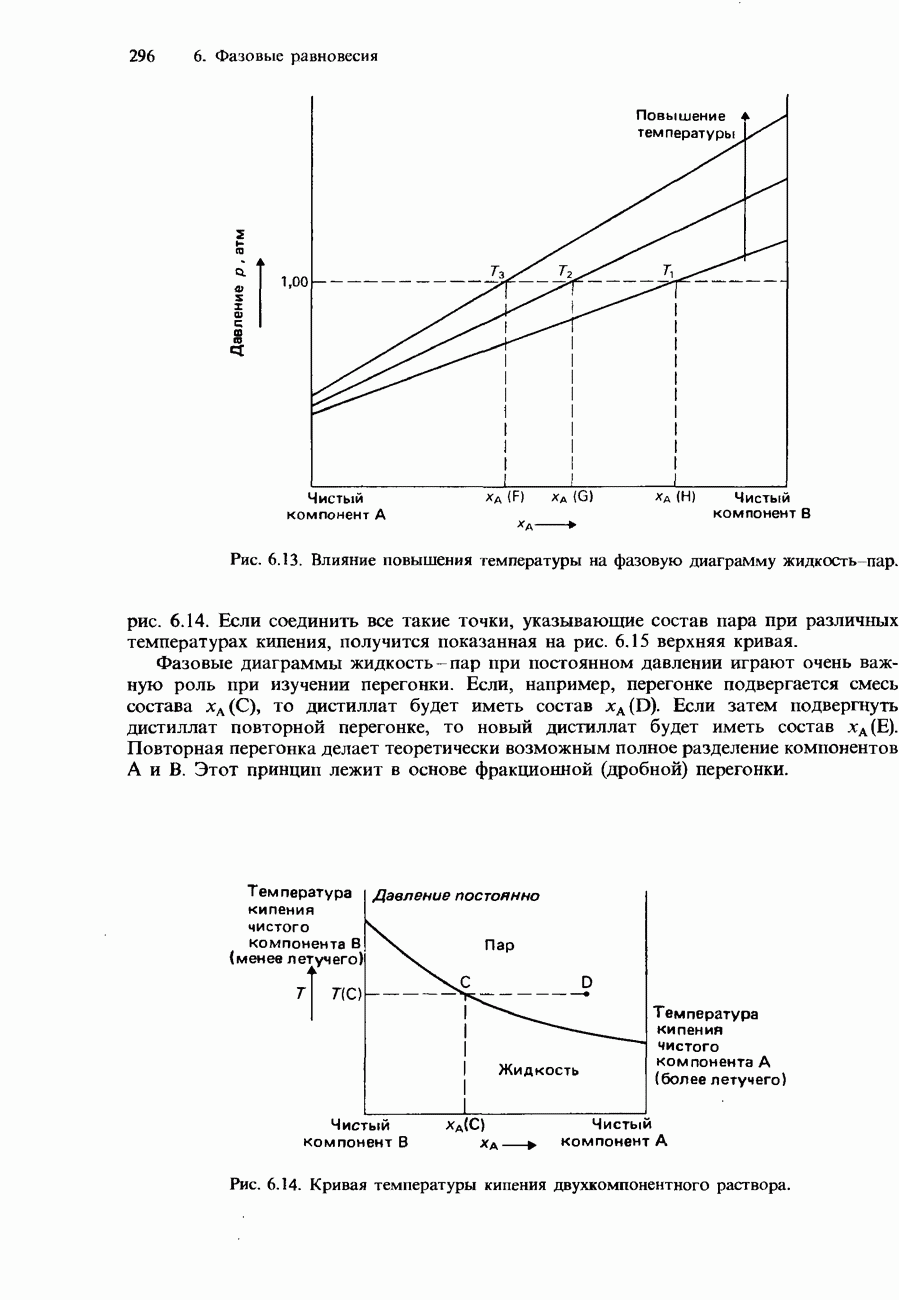
- ДВУХКОМПОНЕНТНЫЕ ЖИДКИЕ СМЕСИ
- ПОЛНОСТЬЮ СМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
- Фазовые диаграммы полностью смешивающихся жидкостей
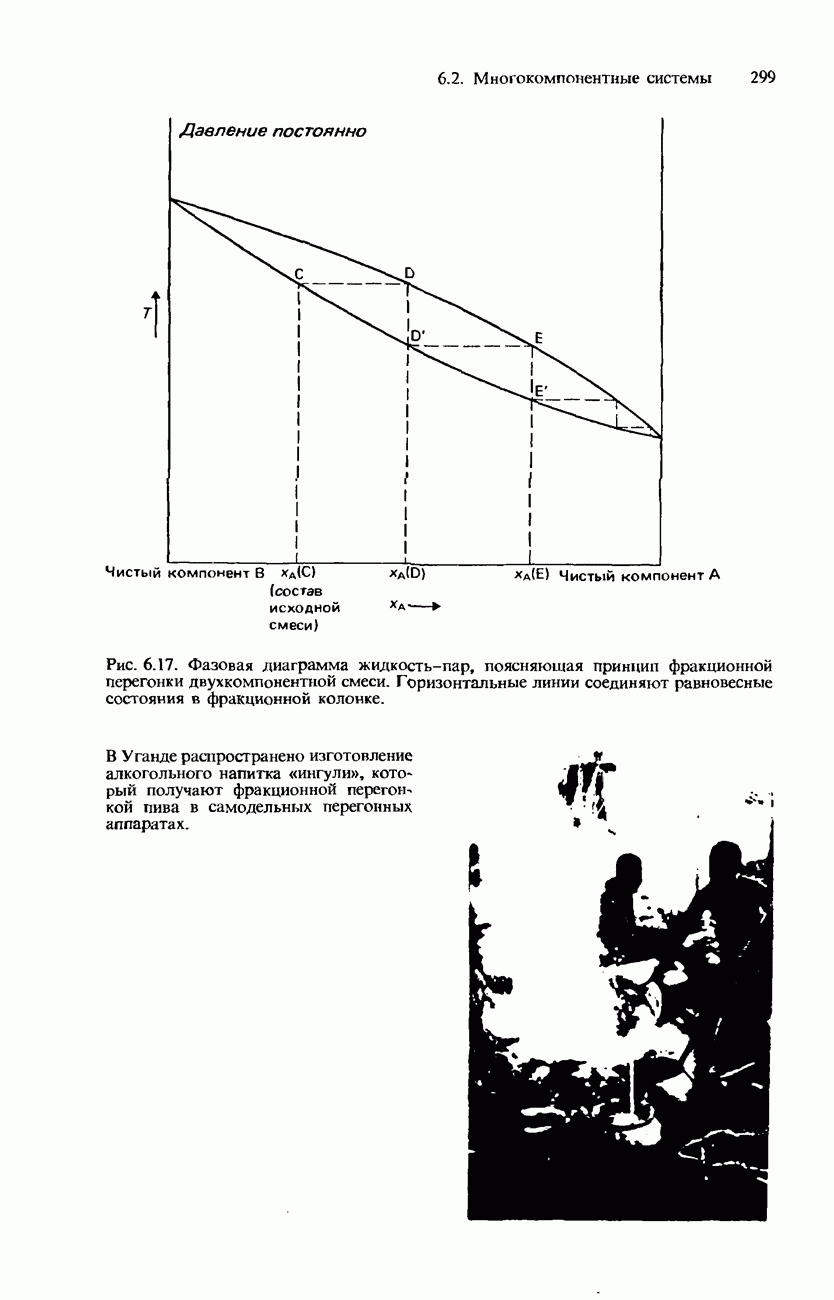
- Фракционная перегонка
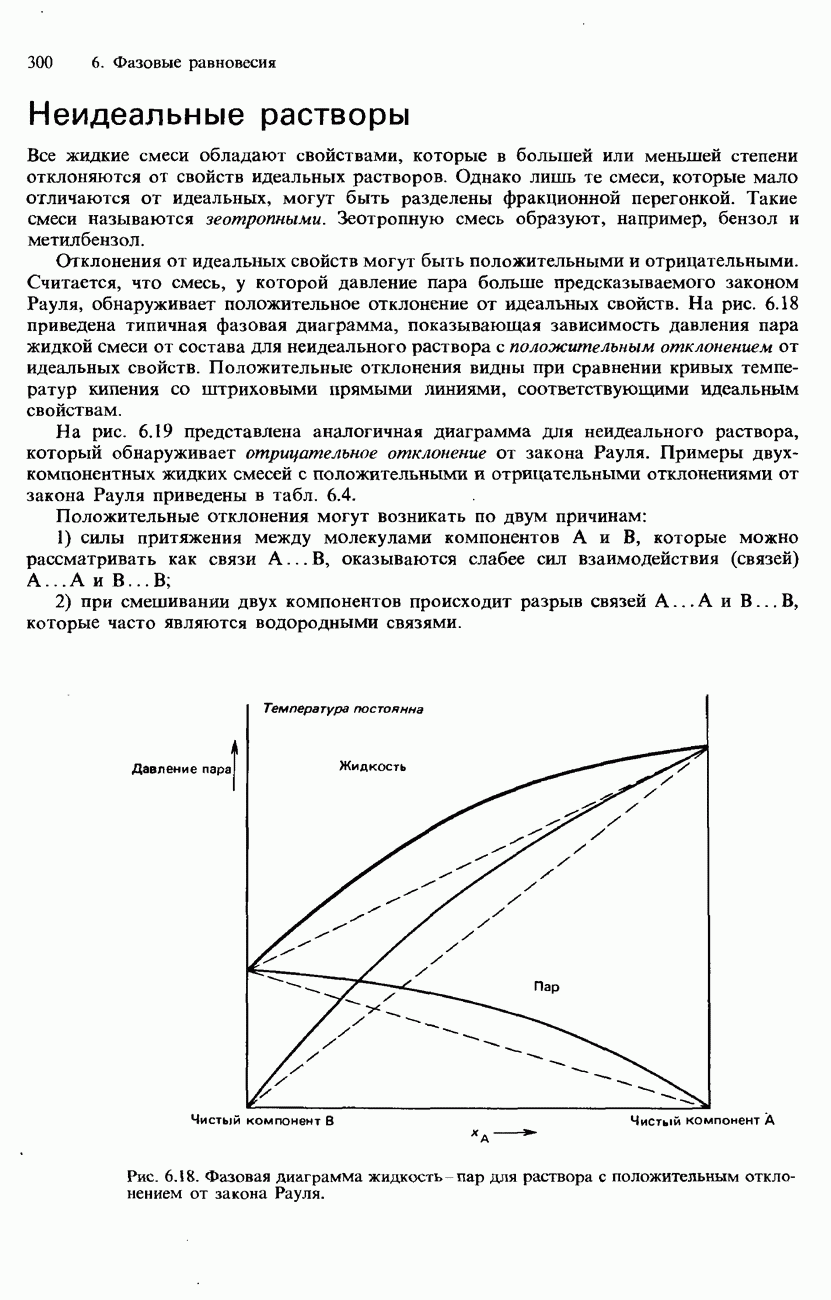
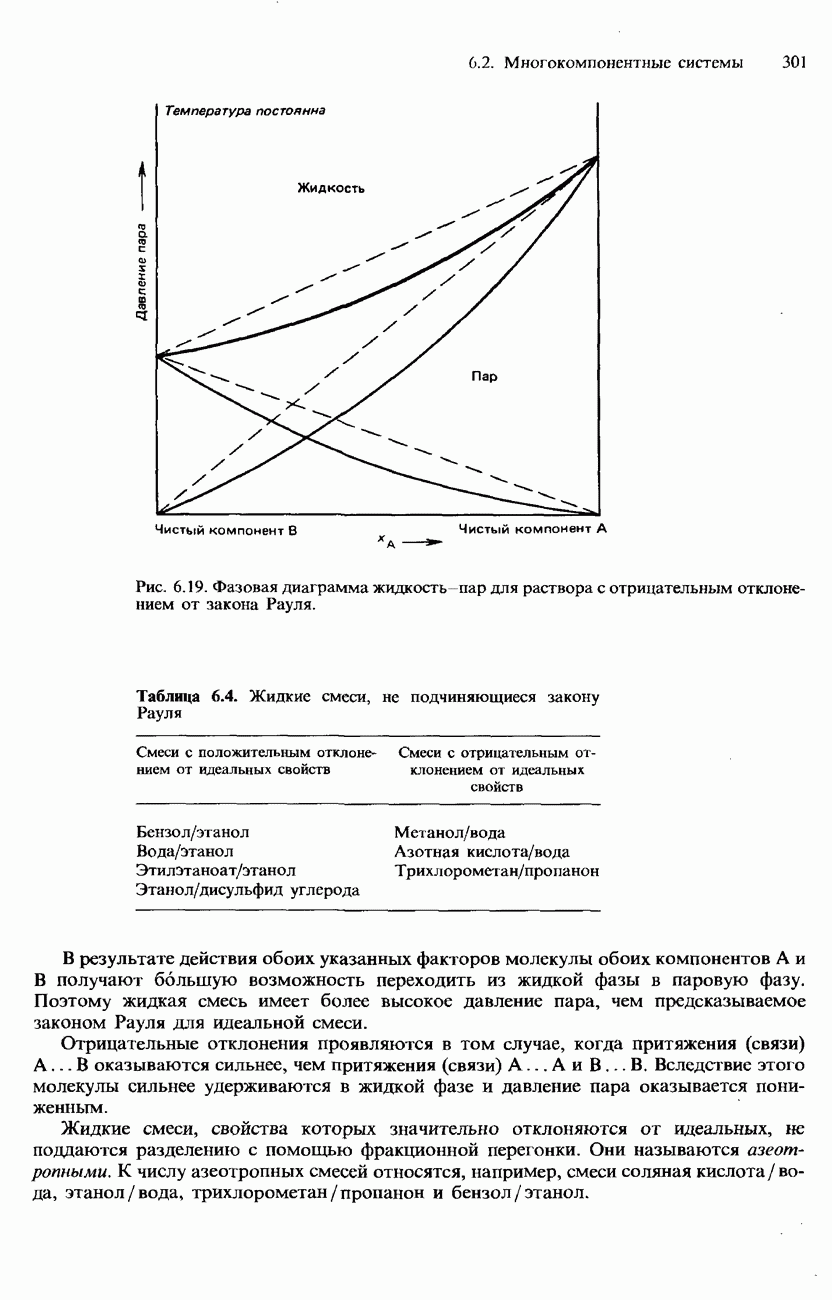
- Неидеальные растворы
- ЧАСТИЧНО СМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
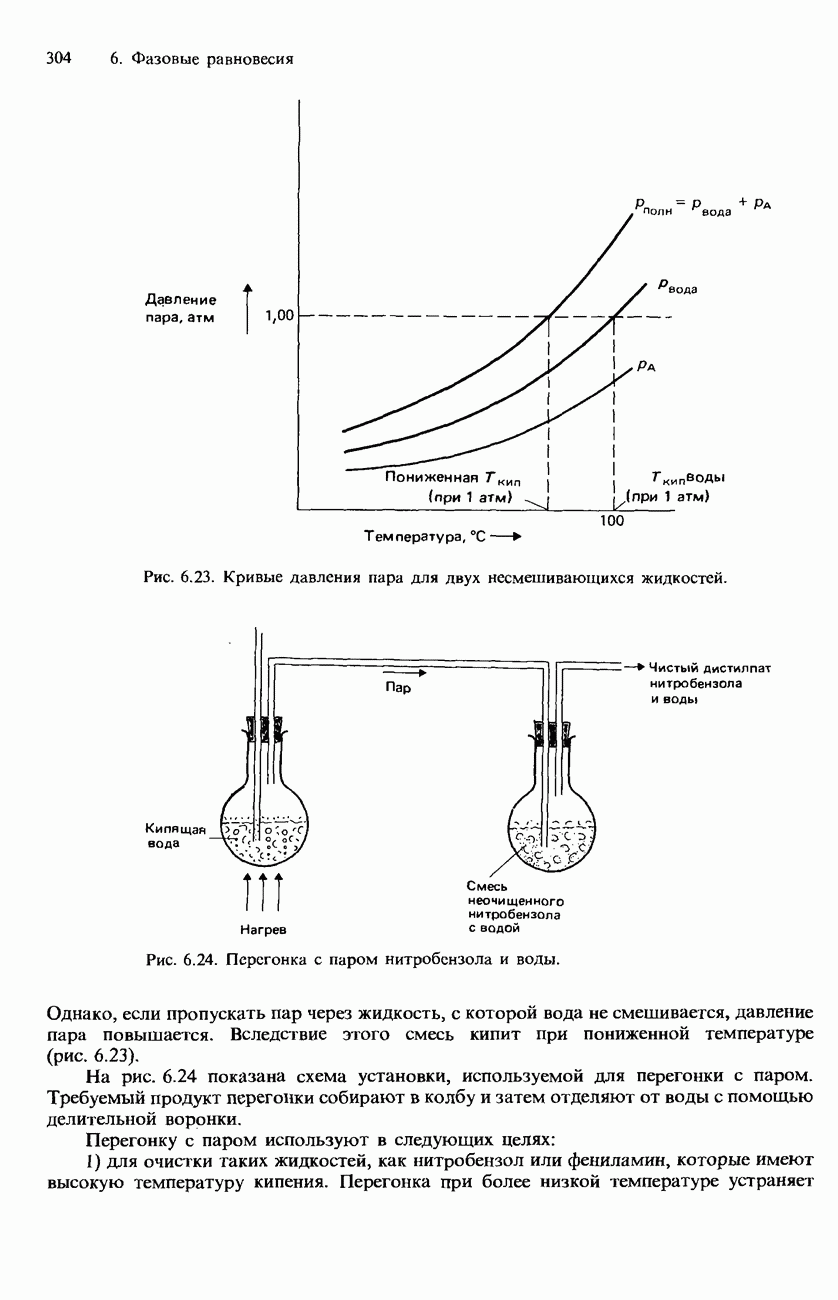
- НЕСМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
- РАВНОВЕСИЯ ТВЕРДОЕ ВЕЩЕСТВО-ЖИДКОСТЬ
- 6.3. Коллигативные свойства растворов. Коллоиды Хроматография
- КОЛЛОИДЫ
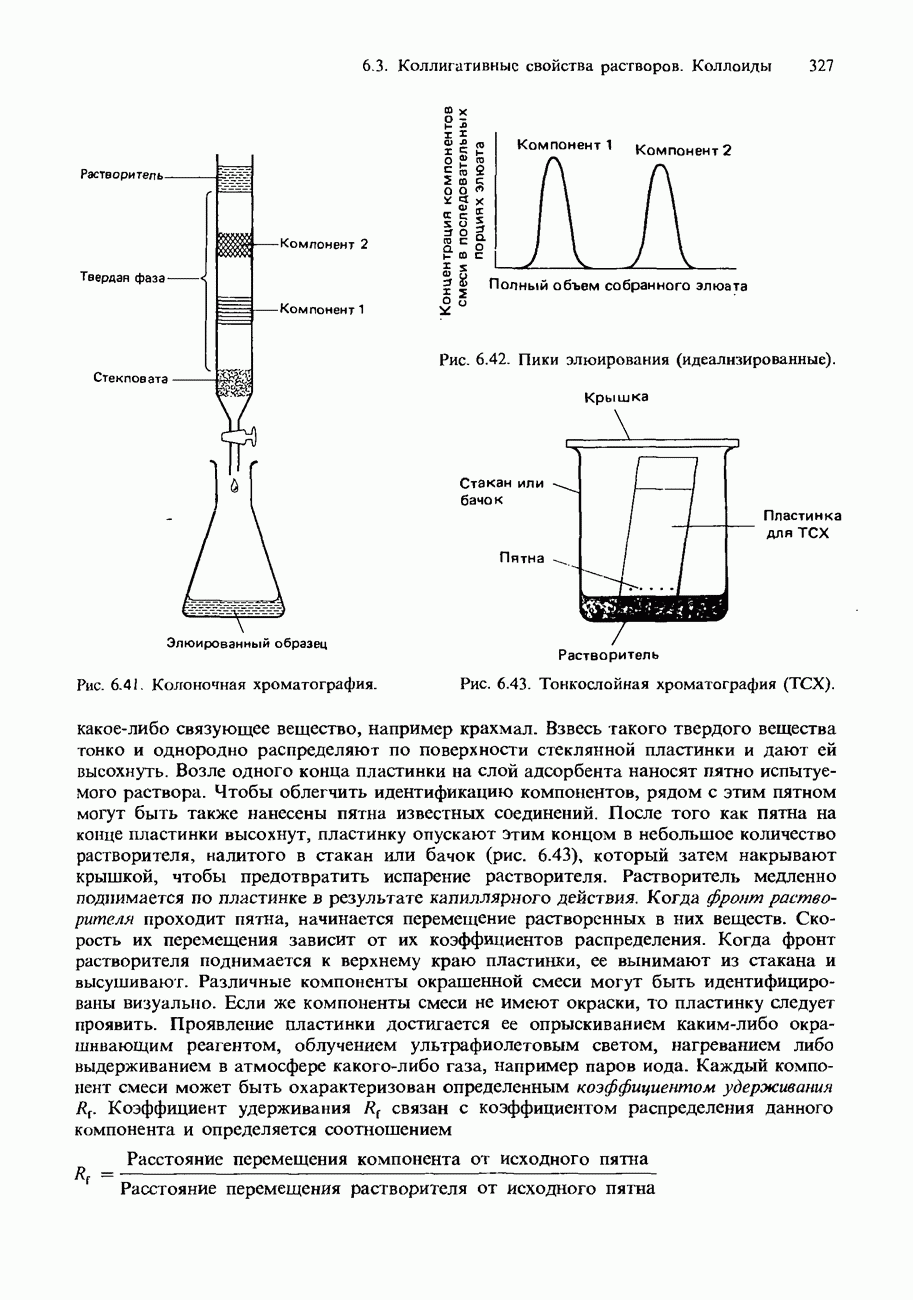
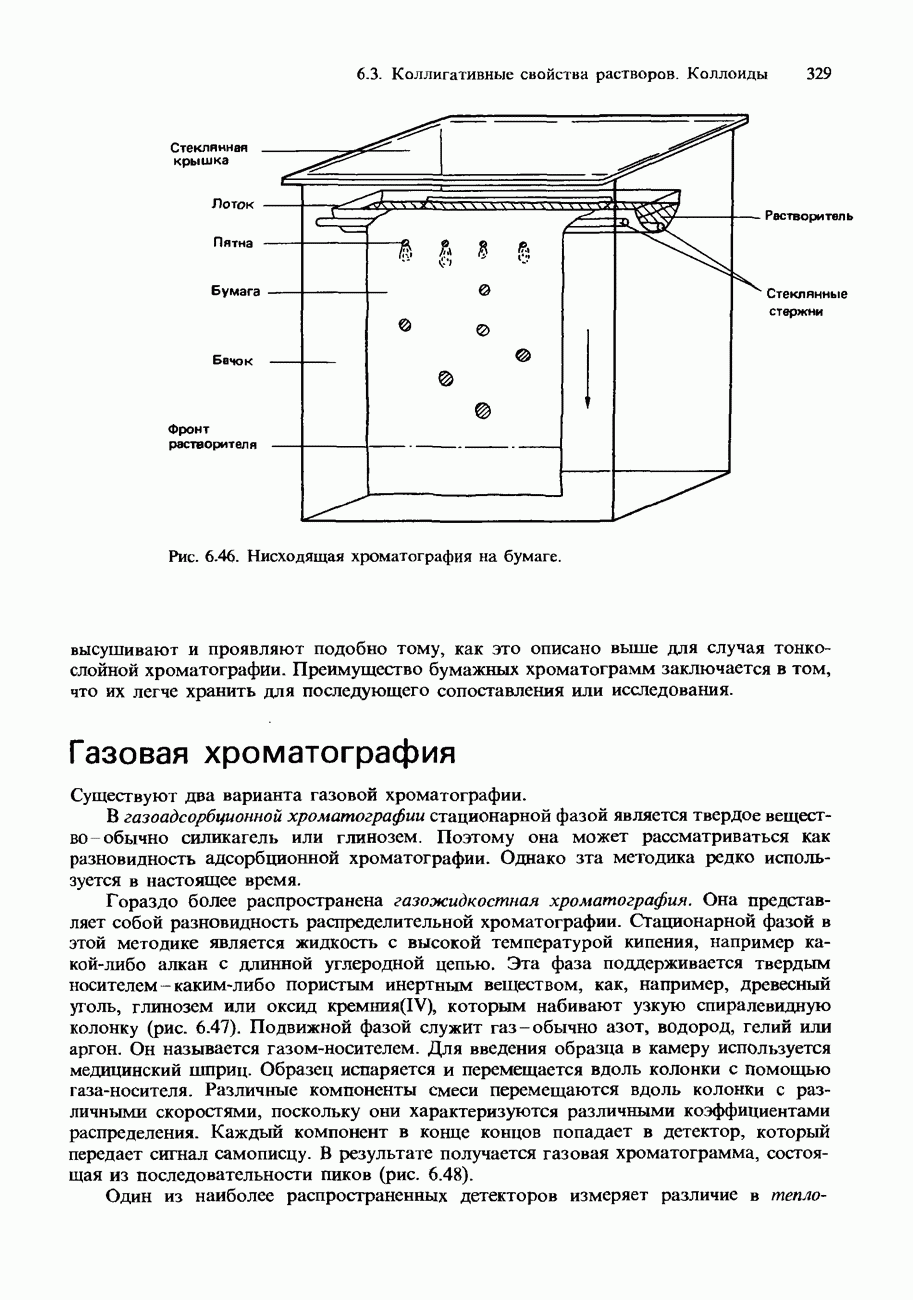
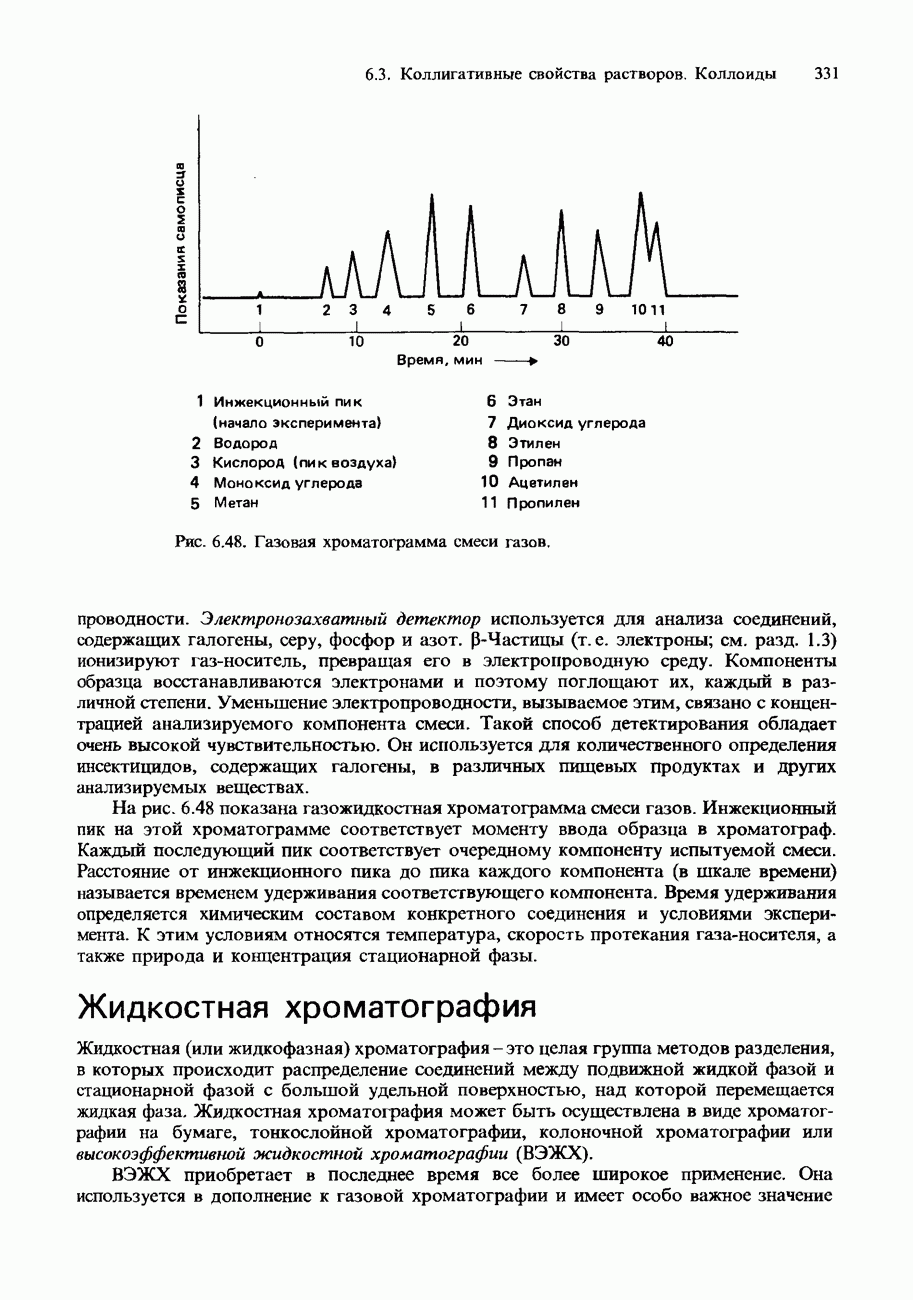
- ХРОМАТОГРАФИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 7.1. Константа равновесия
- ЗАКОН ДЕЙСТВУЮЩИХ МАСС
- ВЛИЯНИЕ УСЛОВИЙ ПРОТЕКАНИЯ РЕАКЦИИ НА ПОЛОЖЕНИЕ РАВНОВЕСИЯ
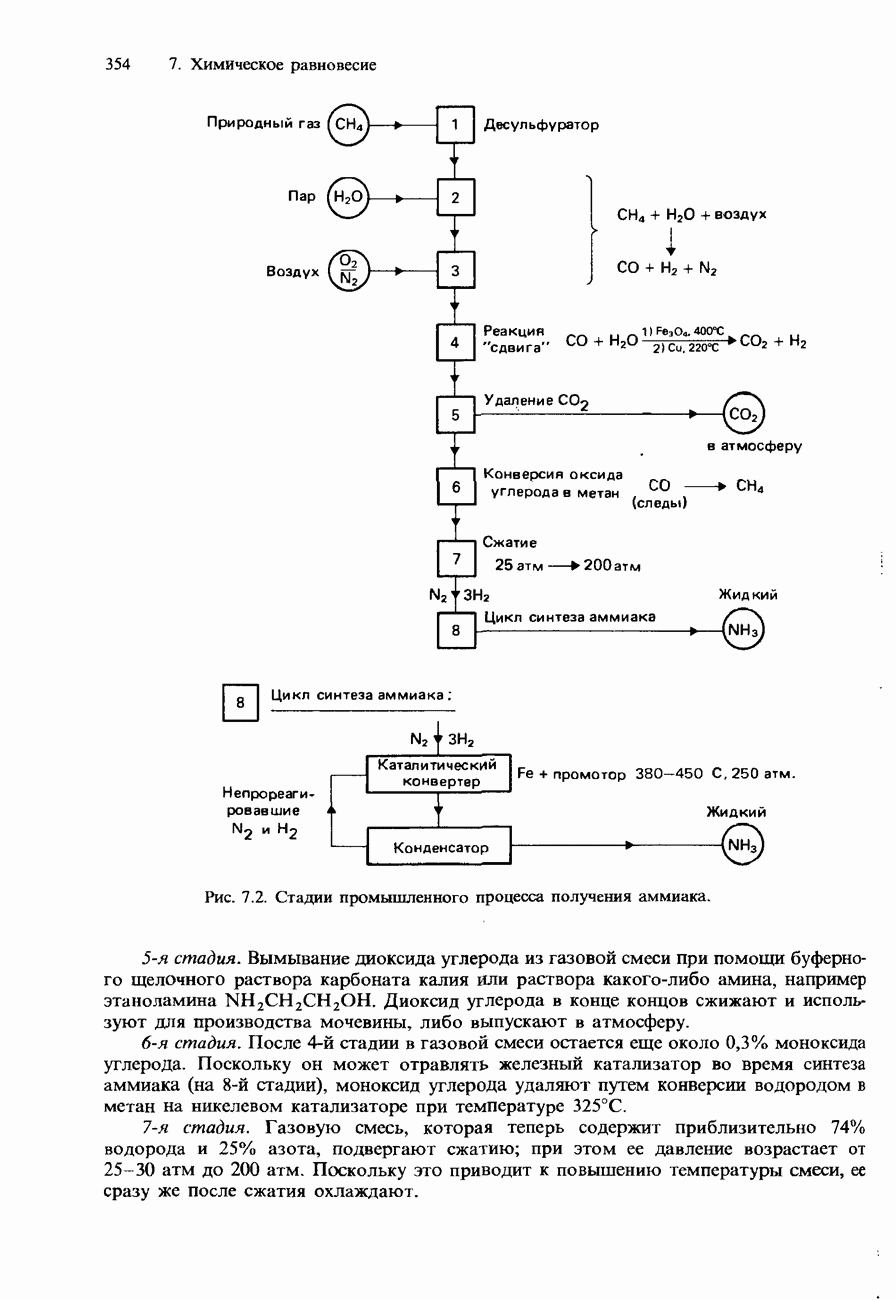
- 7.2. Получение аммиака и серной кислоты
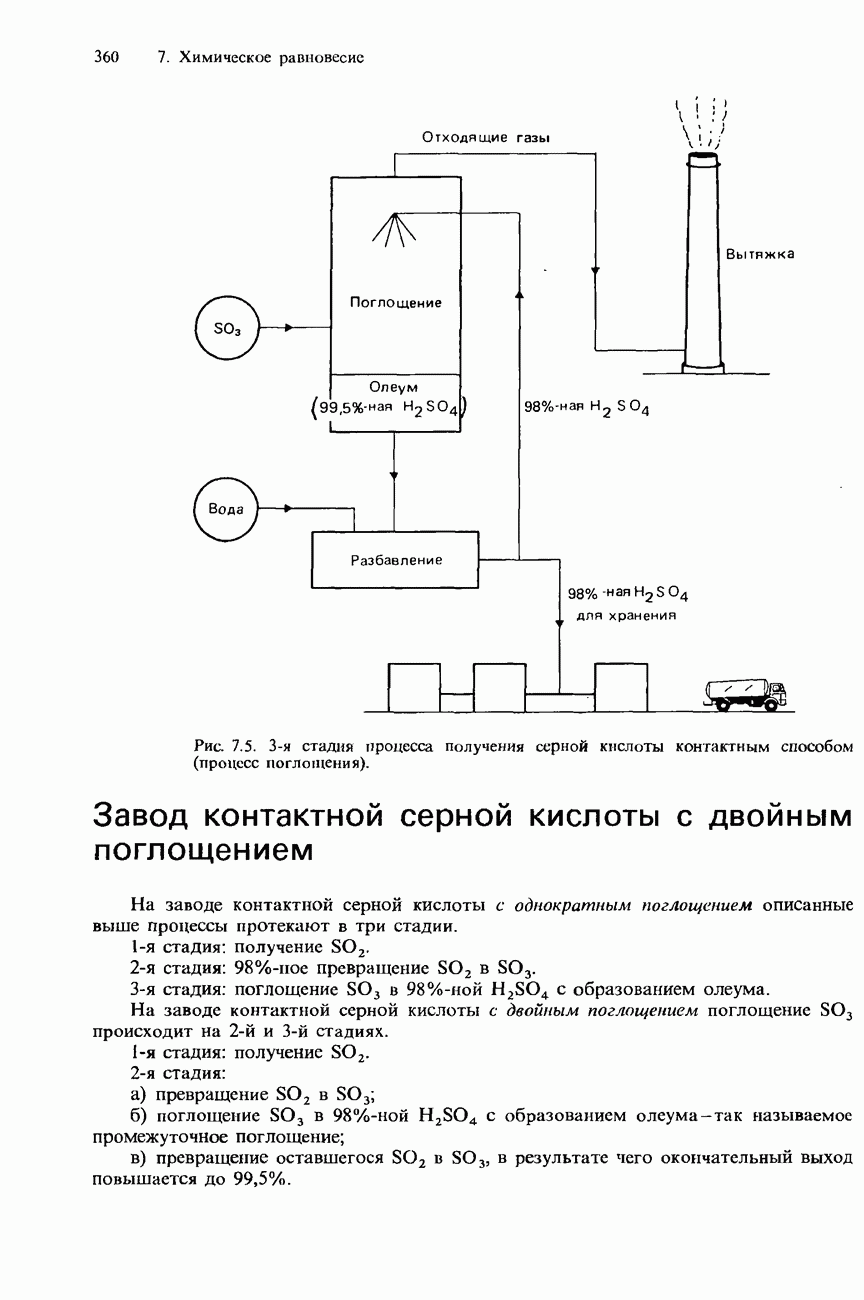
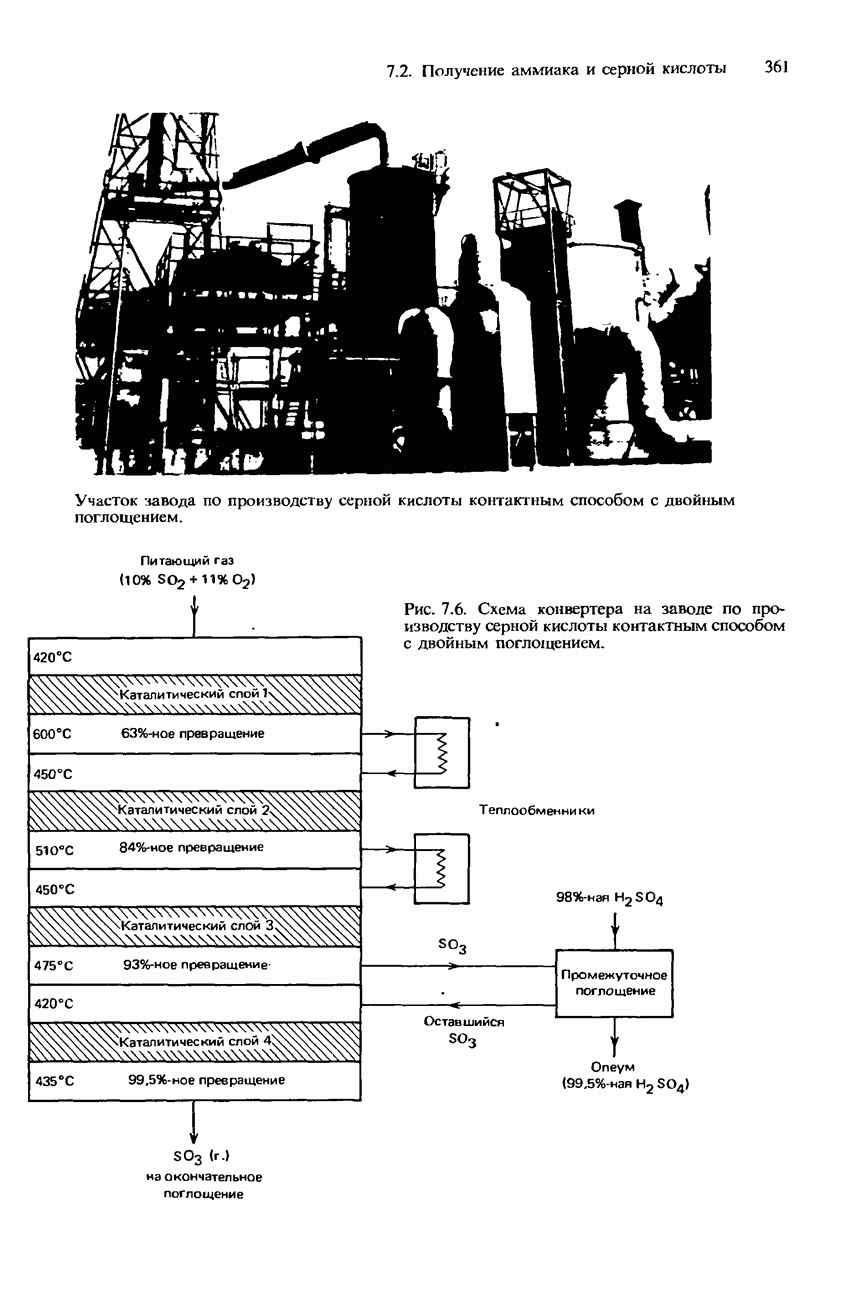
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СЕРНОЙ КИСЛОТЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 8. ИОНЫ
- 8.1. Кислоты и основания
- ЭЛЕКТРОЛИТЫ
- КИСЛОТЫ И ОСНОВАНИЯ
- КОНСТАНТЫ ДИССОЦИАЦИИ
- ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ pH ШКАЛА ЕГО ЗНАЧЕНИЙ
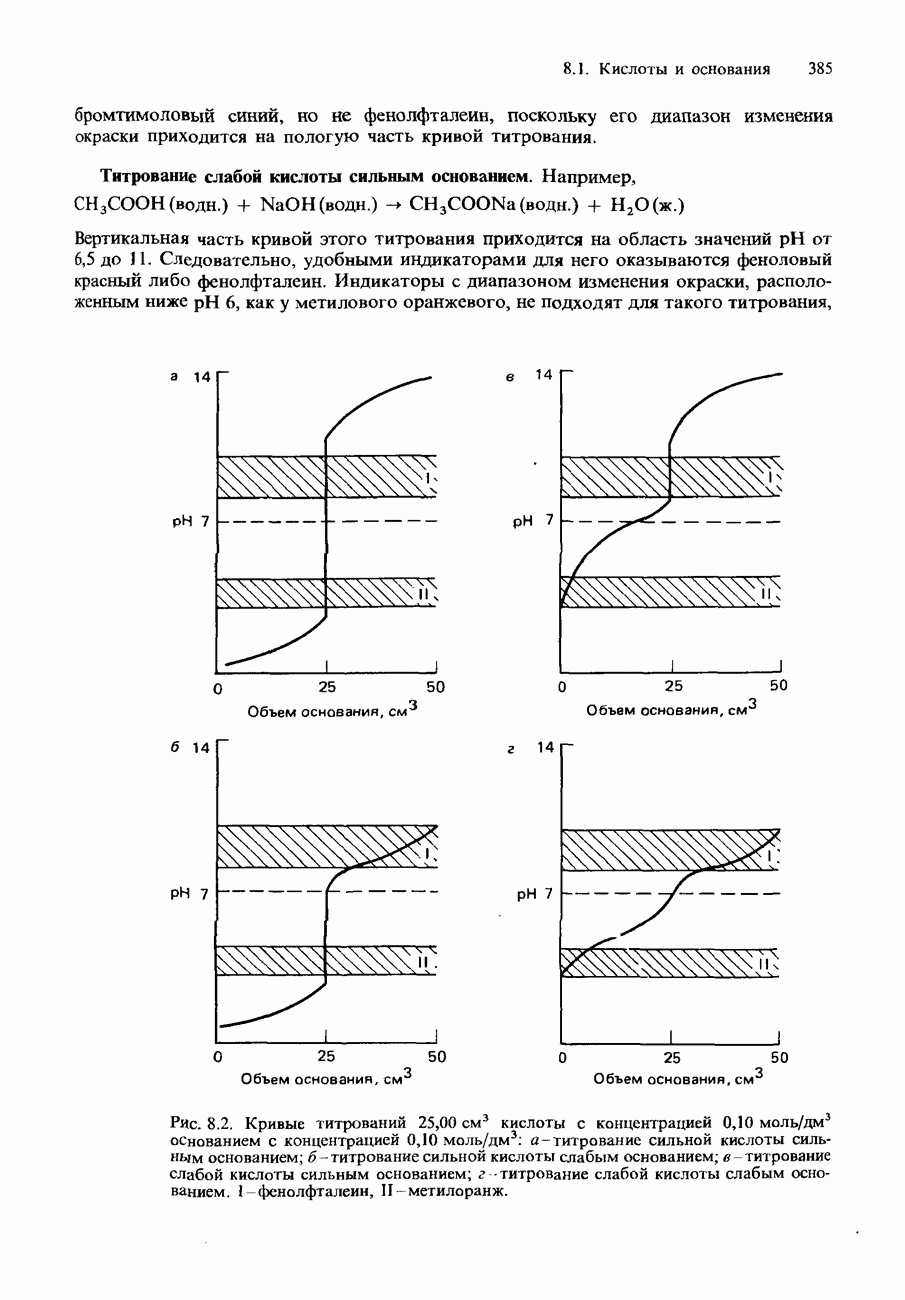
- КИСЛОТНО-ОСНОВНЫЕ ИНДИКАТОРЫ И ТИТРОВАНИЕ
- 8.2. Соли, растворимость и устойчивость
- БУФЕРНЫЕ РАСТВОРЫ
- РАСТВОРИМОСТЬ
- РАВНОВЕСИЯ С УЧАСТИЕМ КОМПЛЕКСНЫХ ИОНОВ
- ИОННЫЙ ОБМЕН
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 9. ХИМИЧЕСКАЯ КИНЕТИКА
- 9.1. Скорость химической реакции
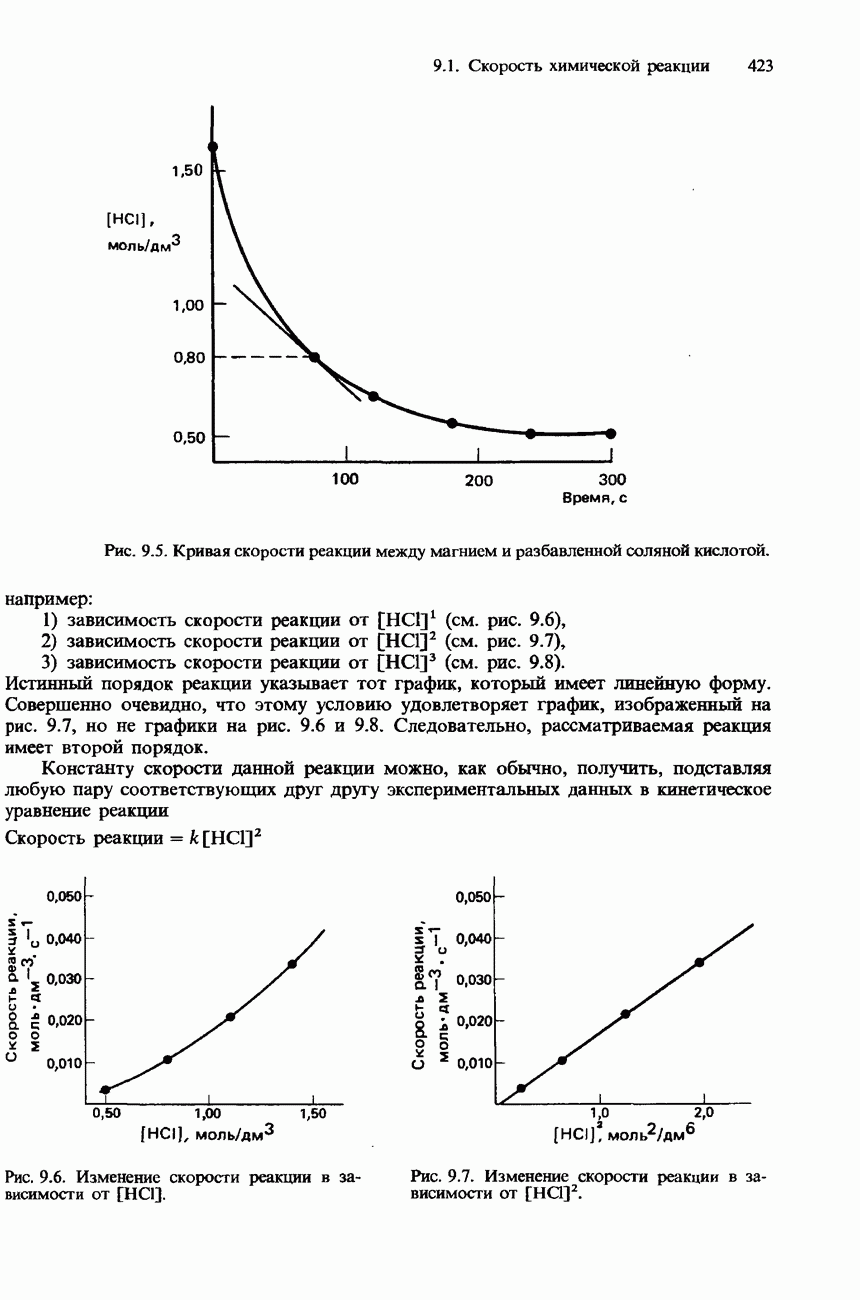
- МЕТОДЫ ИЗМЕРЕНИЯ СКОРОСТИ РЕАКЦИЙ
- СКОРОСТЬ РЕАКЦИИ И КОНЦЕНТРАЦИИ РЕАГЕНТОВ
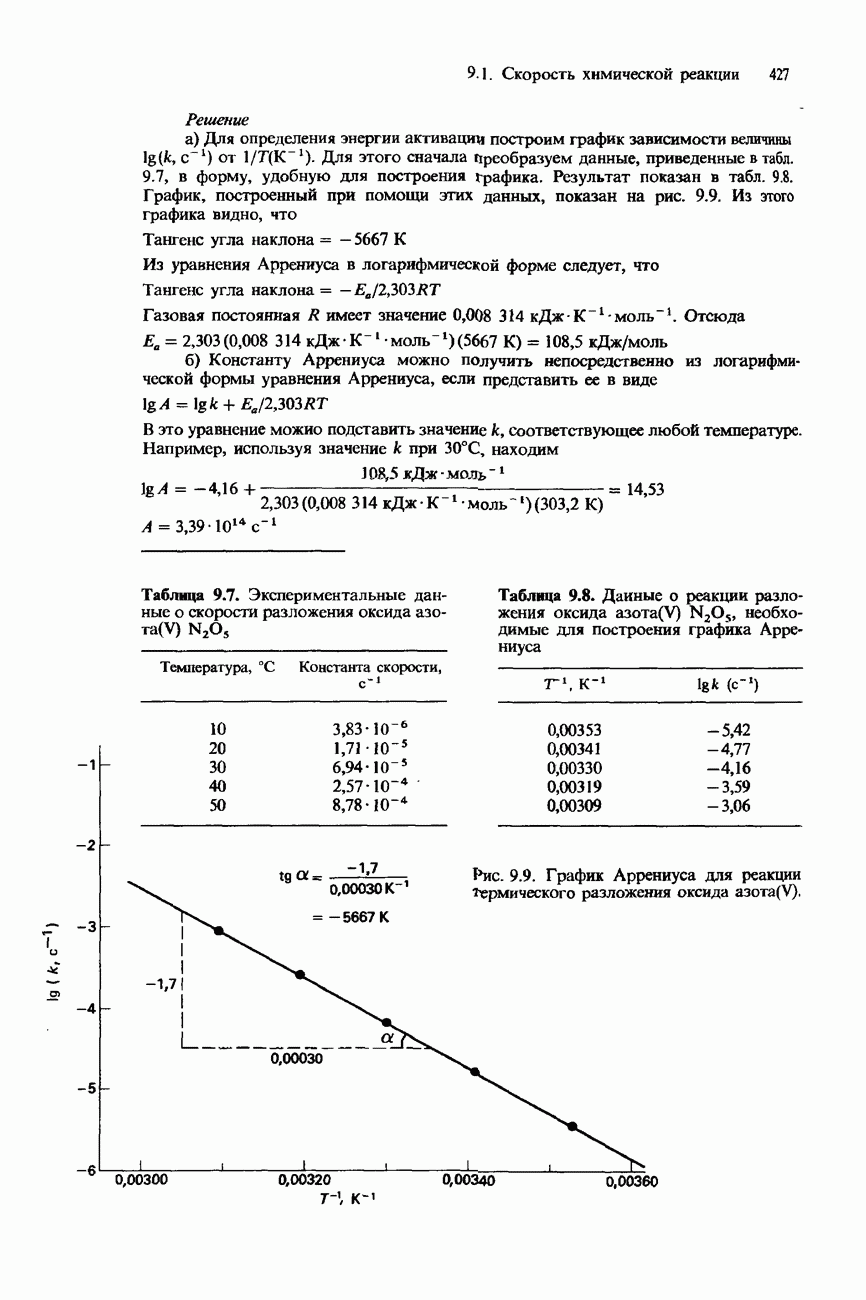
- ЗАВИСИМОСТЬ КОНСТАНТЫ СКОРОСТИ ОТ ТЕМПЕРАТУРЫ УРАВНЕНИЕ АРРЕНИУСА
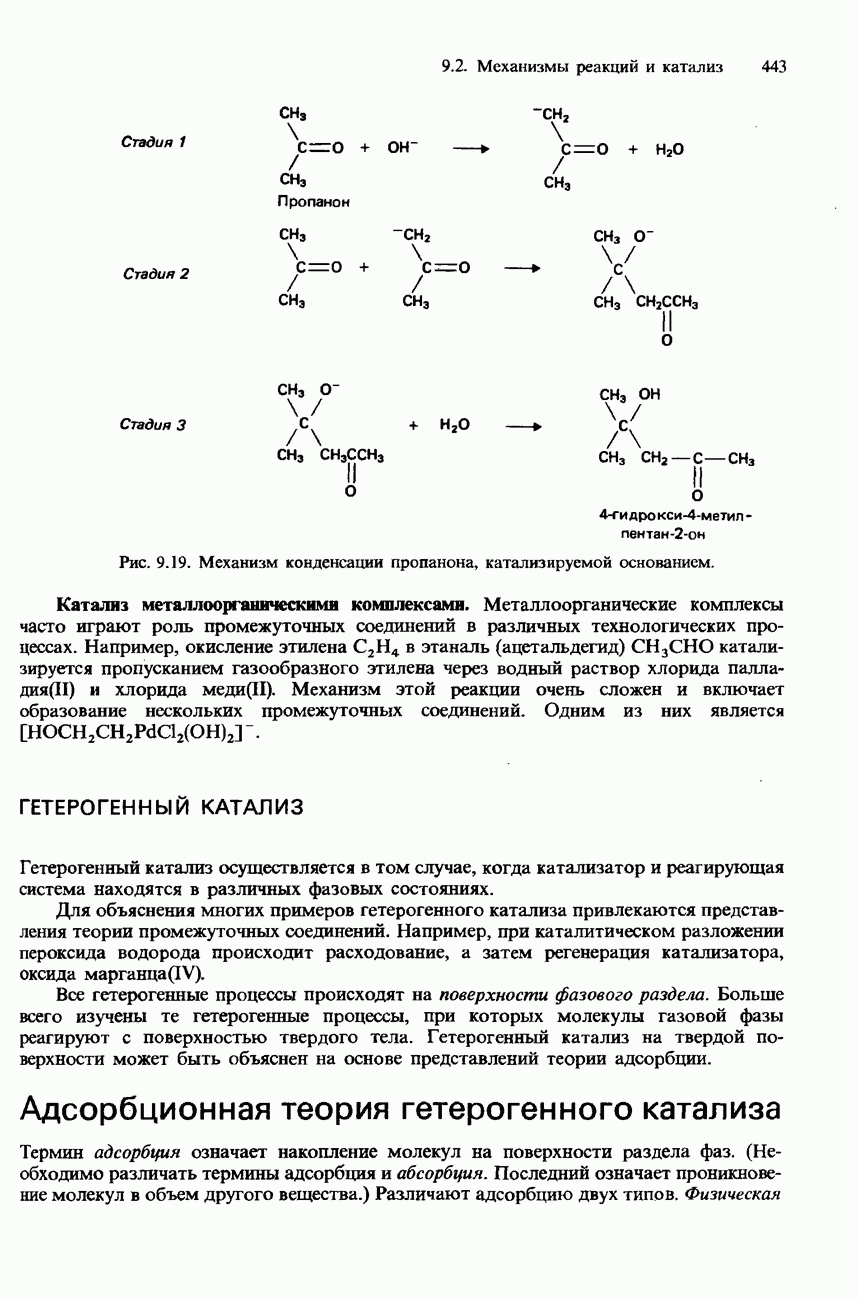
- 9.2. Механизмы реакций и катализ
- ТЕОРИЯ СТОЛКНОВЕНИЙ
- ТЕОРИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ
- ЦЕПНЫЕ РЕАКЦИИ
- КАТАЛИЗ
- ТИПЫ КАТАЛИЗАТОРОВ
- ГОМОГЕННЫЙ КАТАЛИЗ
- ГЕТЕРОГЕННЫЙ КАТАЛИЗ
- ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 10. ЭЛЕКТРОХИМИЯ
- 10.1. Электропроводность
- ПРОВОДНИКИ ЭЛЕКТРИЧЕСКОГО ТОКА И ЭЛЕКТРОПРОВОДНОСТЬ
- МОЛЯРНАЯ ПРОВОДИМОСТЬ
- КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- 10.2. Окислительно-восстановительные процессы
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- ОПРЕДЕЛЕНИЕ СТЕХИОМЕТРИЧЕСКИХ КОЭФФИЦИЕНТОВ
- СТЕПЕНЬ ОКИСЛЕНИЯ
- ОКИСЛИТЕЛИ
- ВОССТАНОВИТЕЛИ
- ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
- 10.3. Электролиз
- ЗАКОНЫ ЭЛЕКТРОЛИЗА ФАРАДЕЯ
- ПРОМЫШЛЕННЫЕ ПРИМЕНЕНИЯ ЭЛЕКТРОЛИЗА
- 10.4. Химические источники тока
- СХЕМЫ ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА
- ТИПЫ ПОЛУЭЛЕМЕНТОВ
- ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
- ЭЛЕКТРОДВИЖУЩАЯ СИЛА ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА
- ИЗМЕРЕНИЕ Э.Д.С. ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА И ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ
- 10.5. Применения электрохимии
- ВЫЧИСЛЕНИЕ КОНСТАНТ РАВНОВЕСИЯ ДЛЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
- ОПРЕДЕЛЕНИЕ pH РАСТВОРА
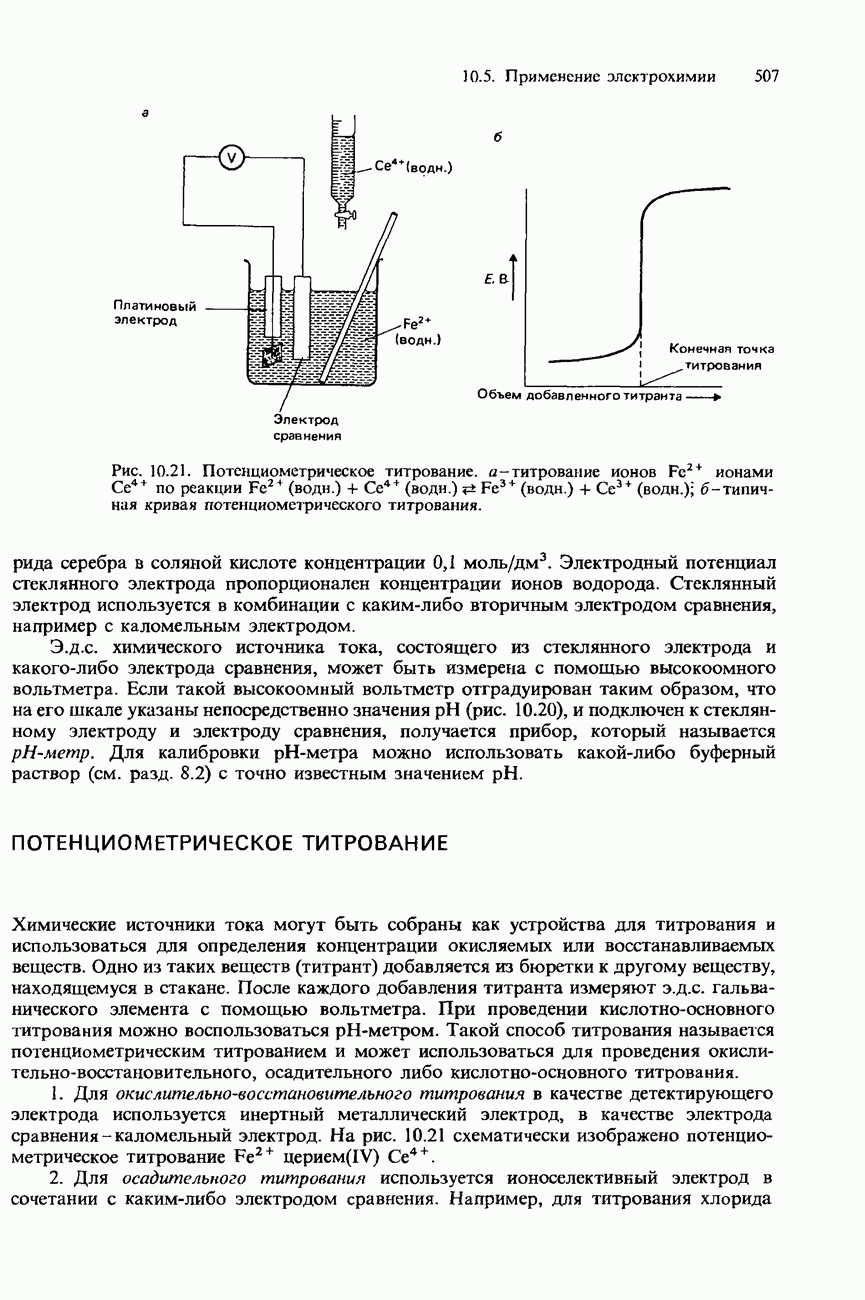
- ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- ОСУЩЕСТВИМОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
- ОПРЕДЕЛЕНИЕ ВЕЛИЧИНЫ AG
- БАТАРЕИ И ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ ТОКА
- МЕТАЛЛУРГИЯ
- КОРРОЗИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ