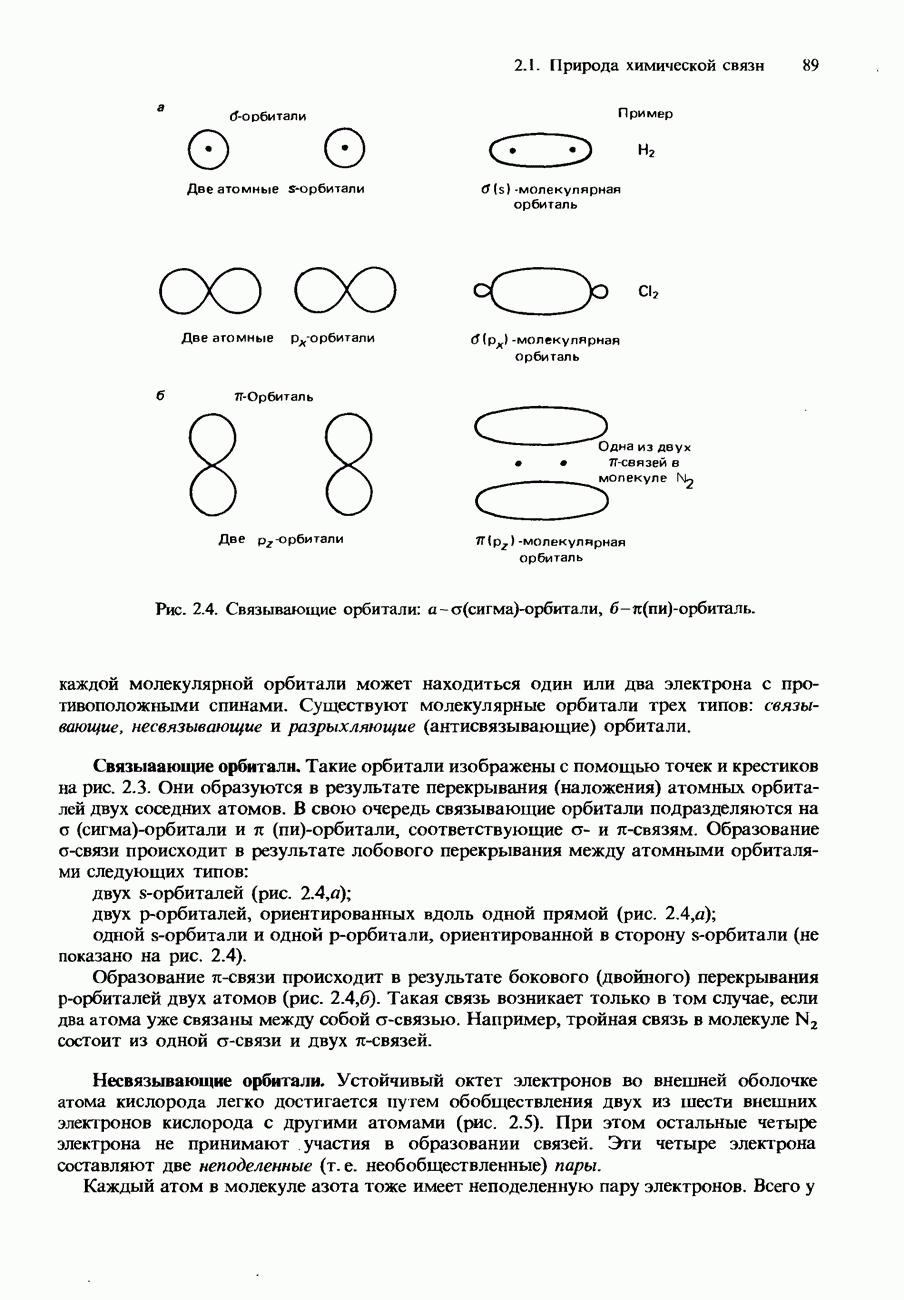
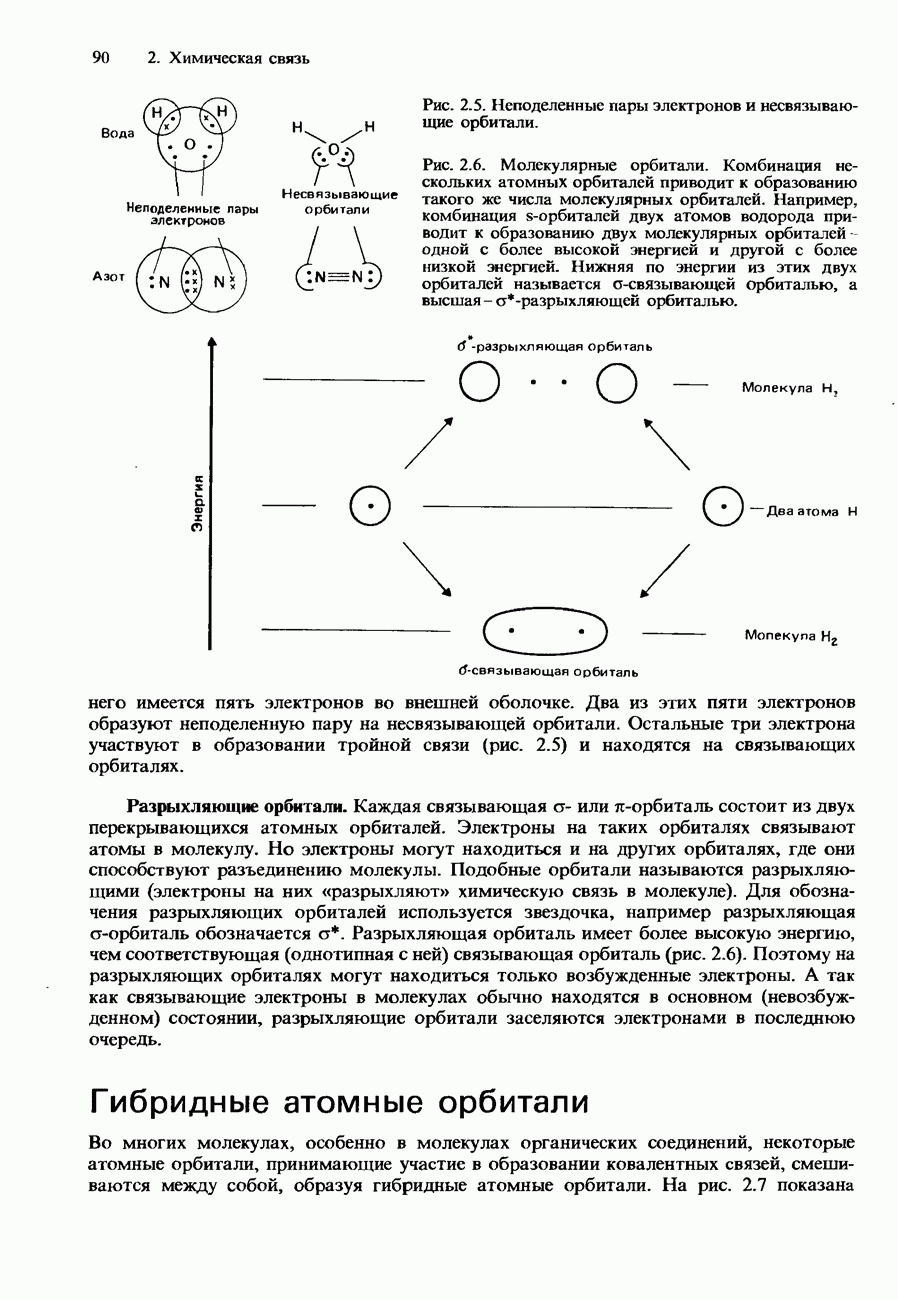
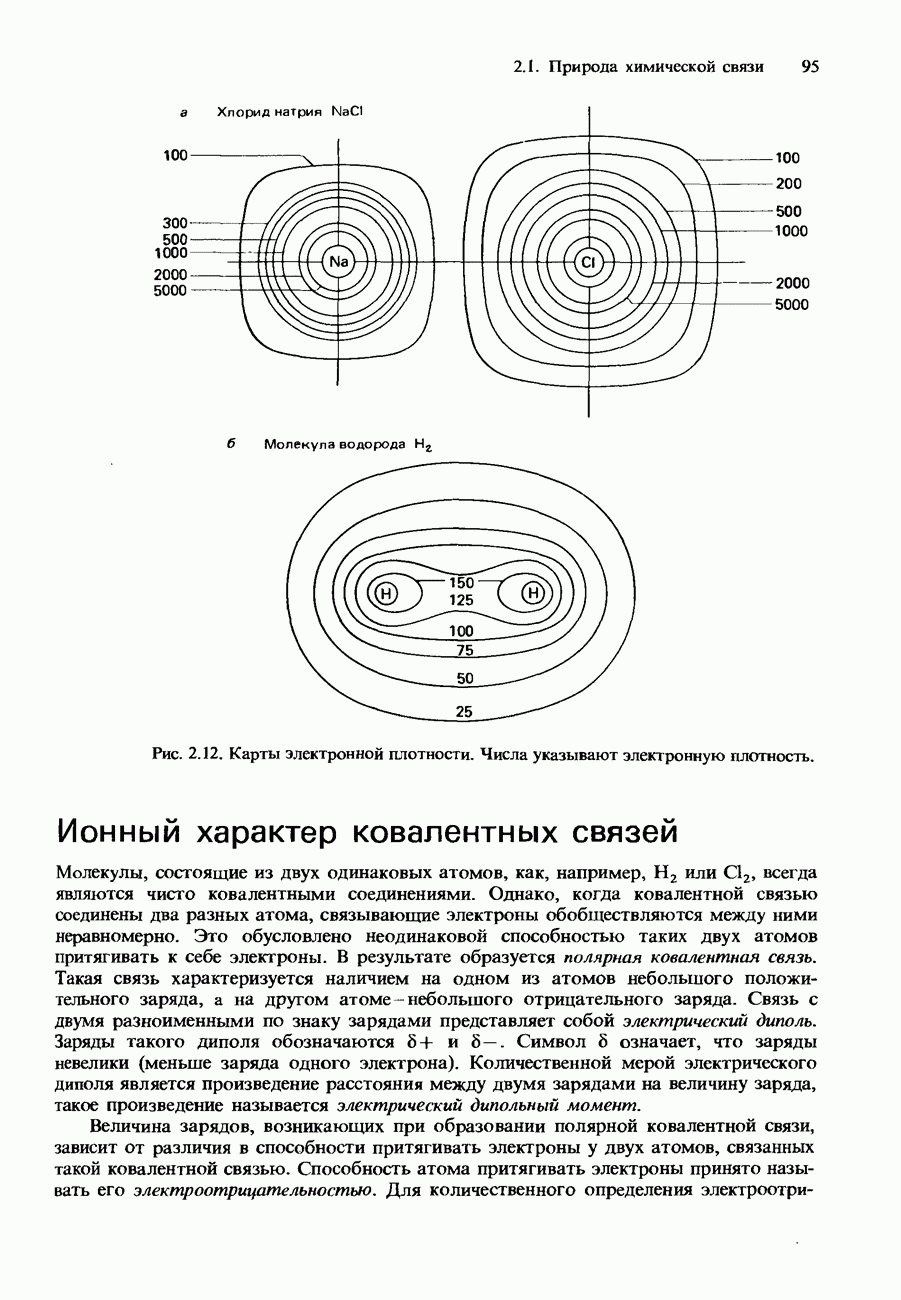
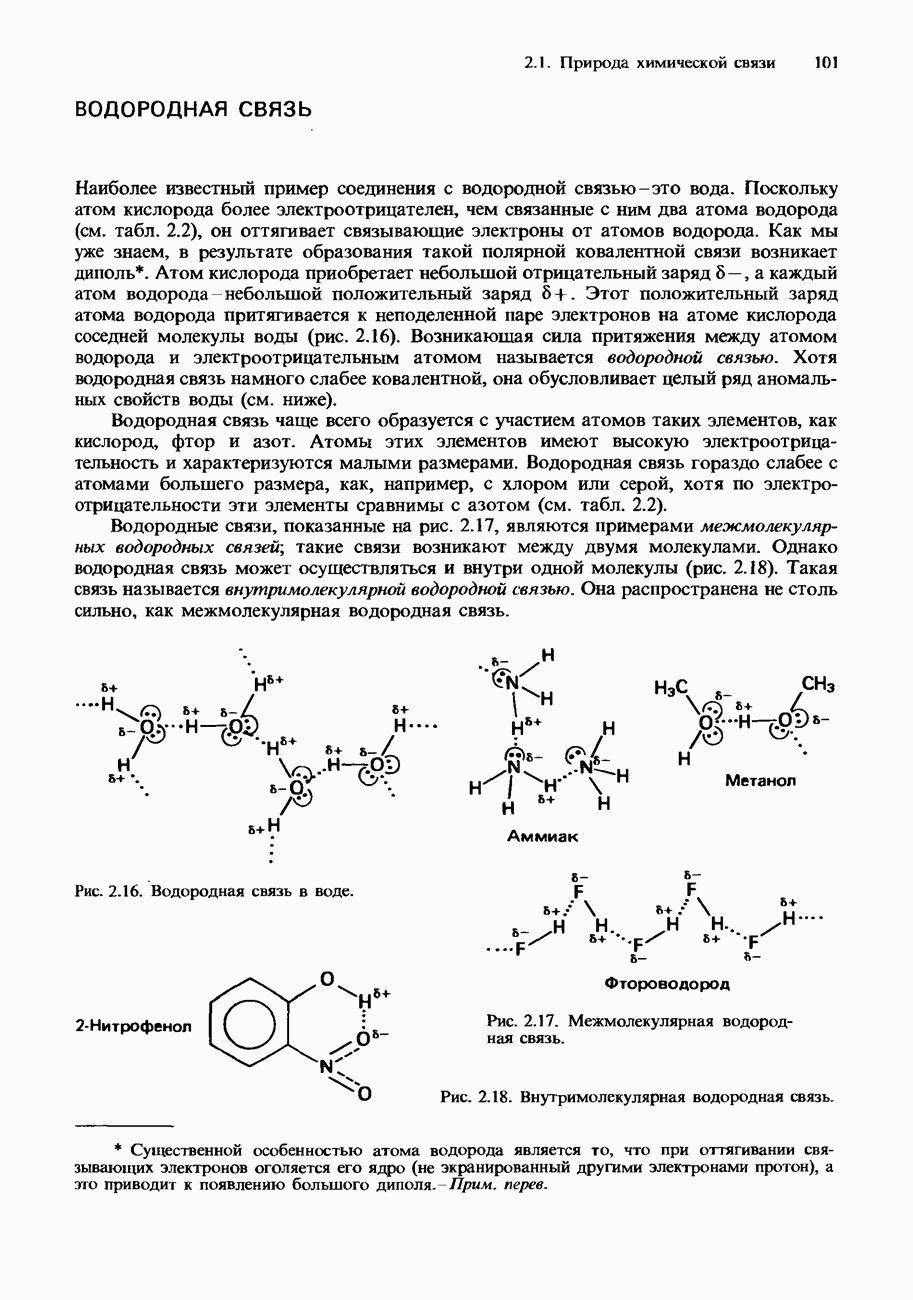
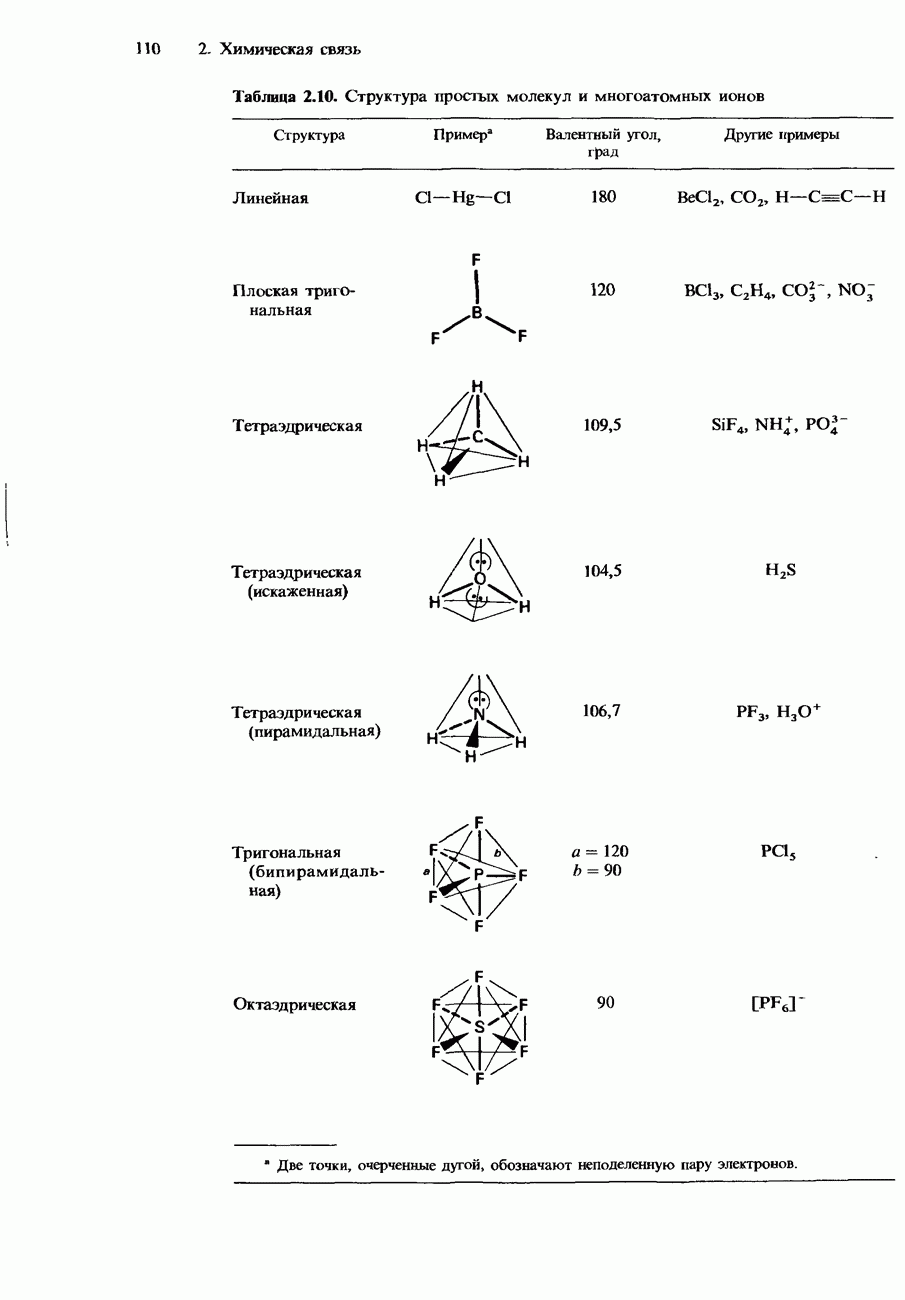
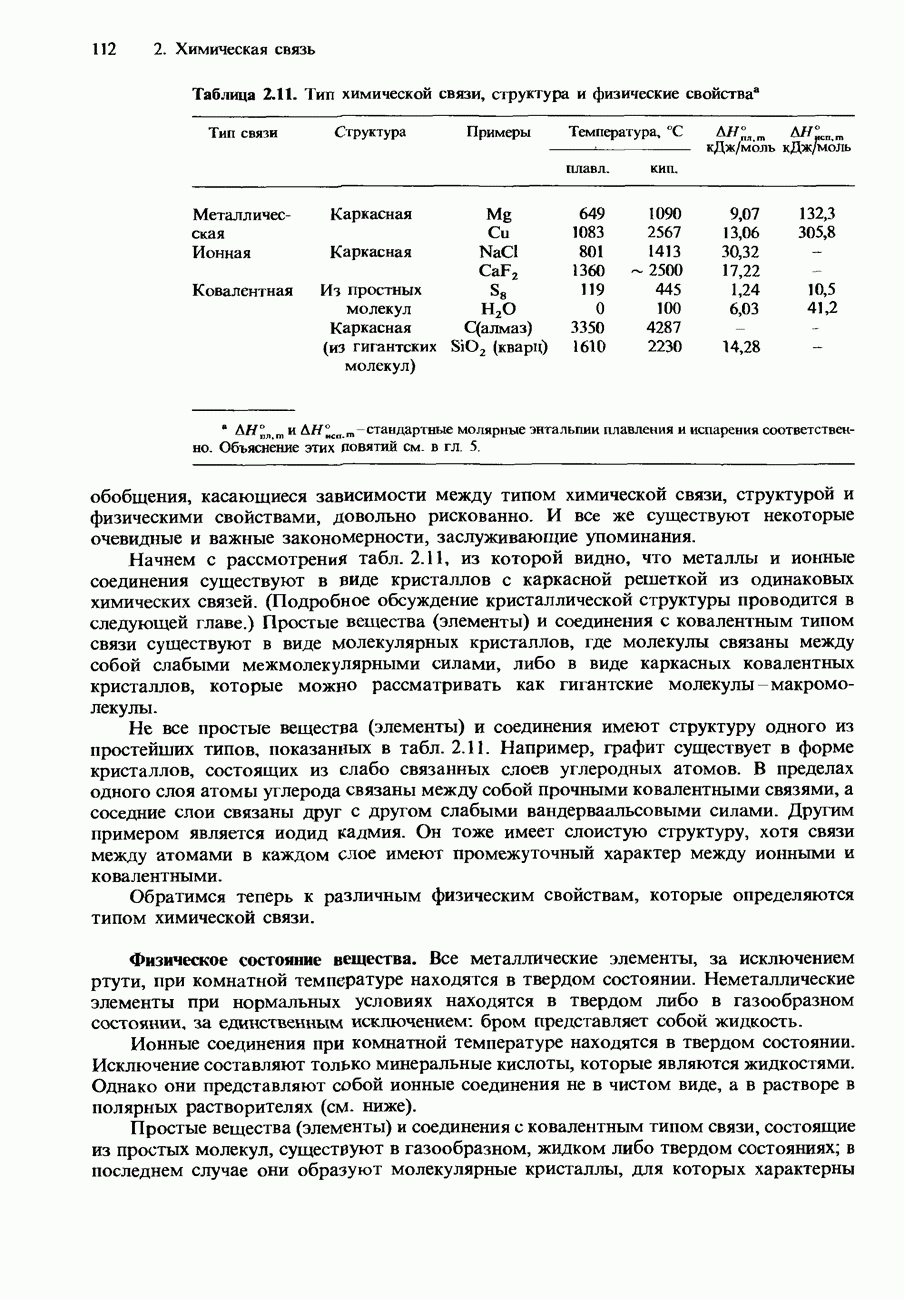
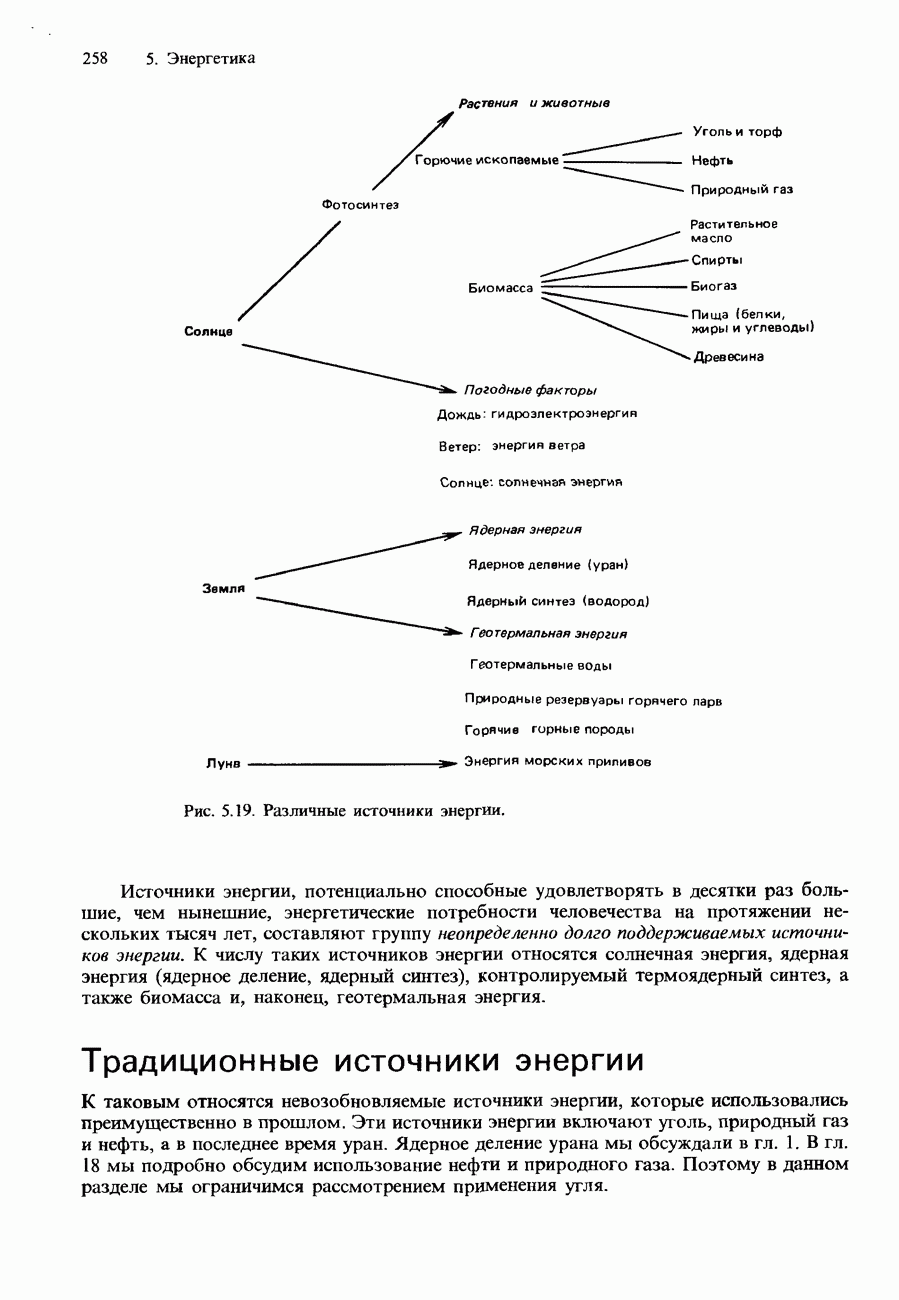
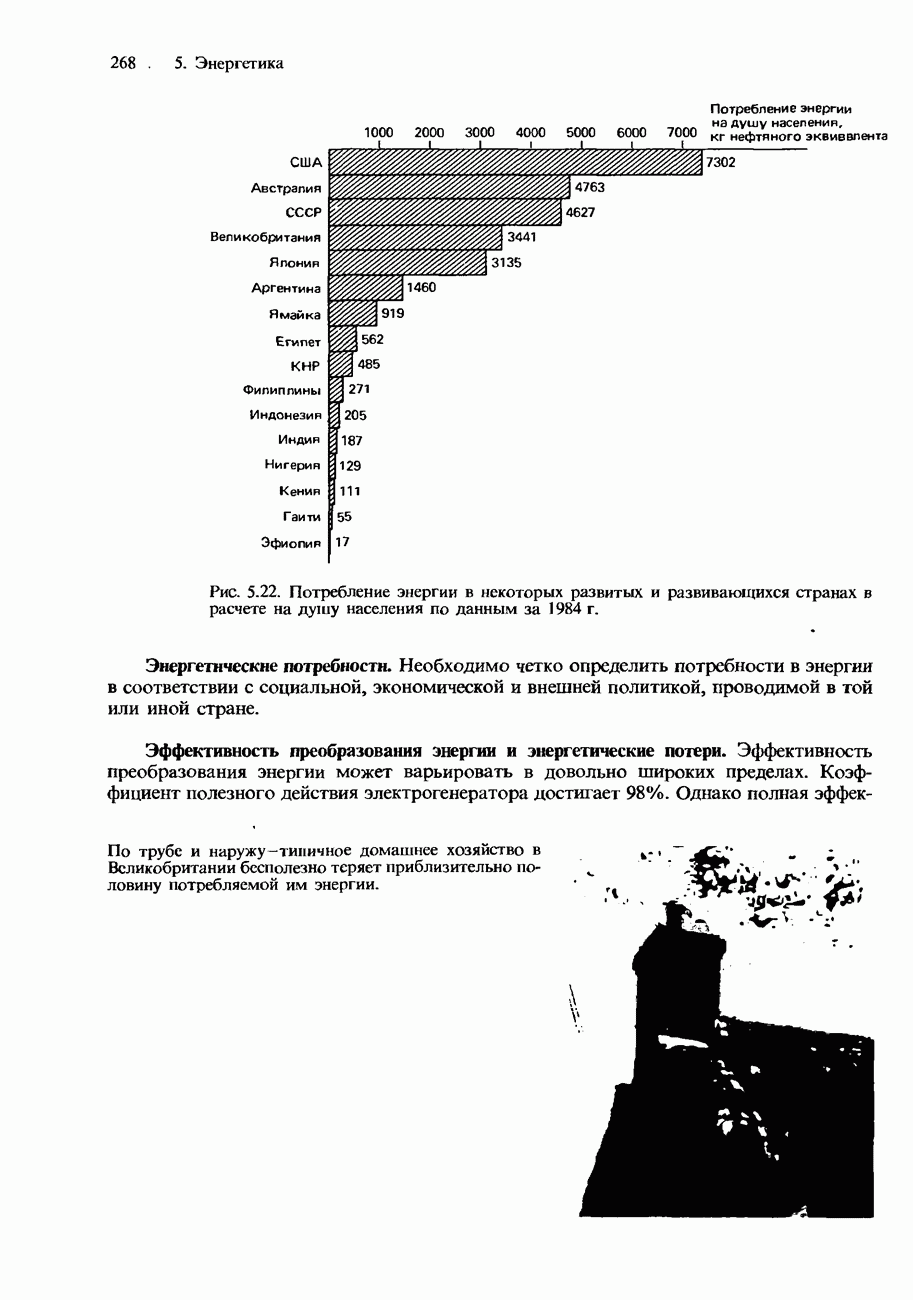
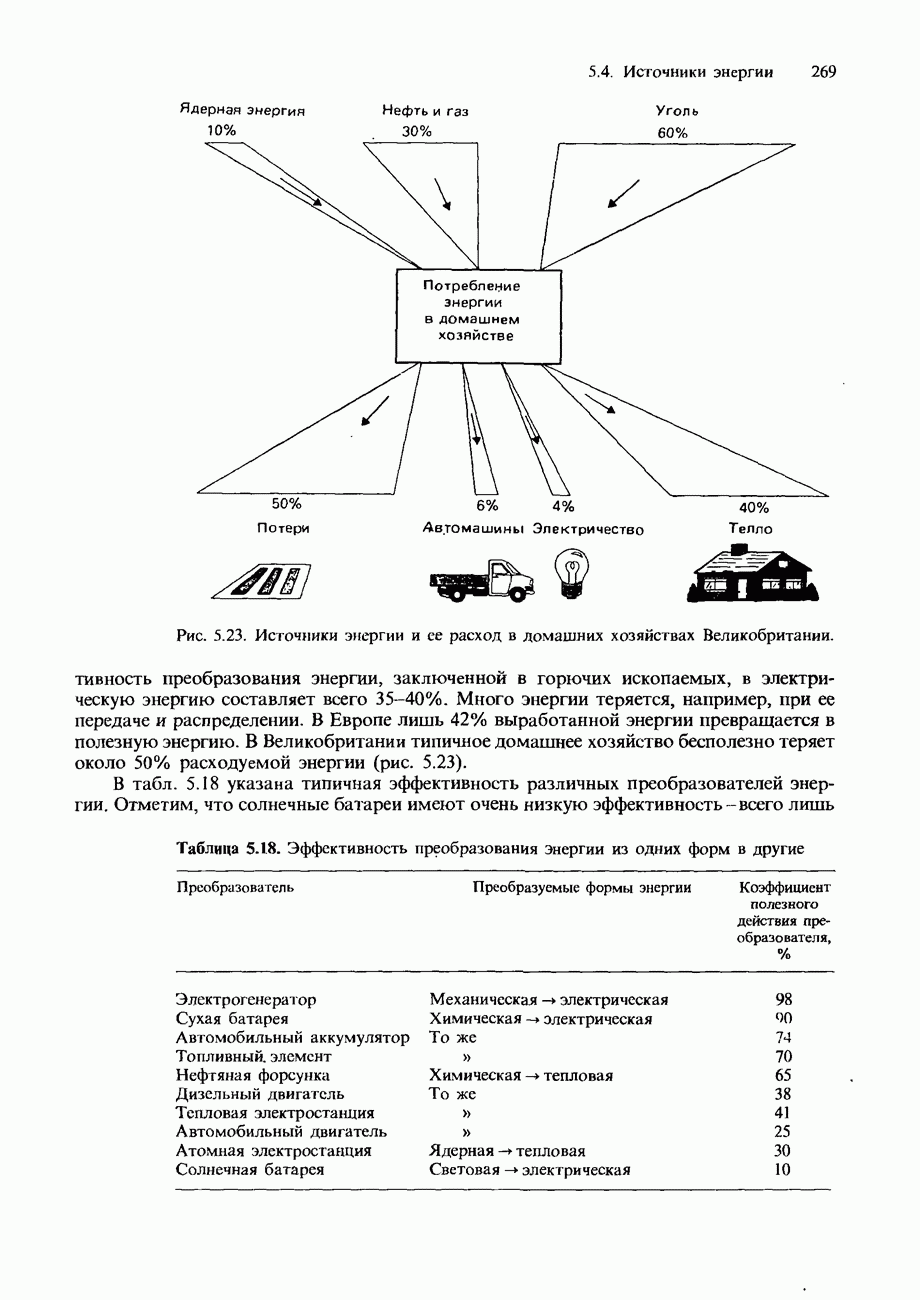
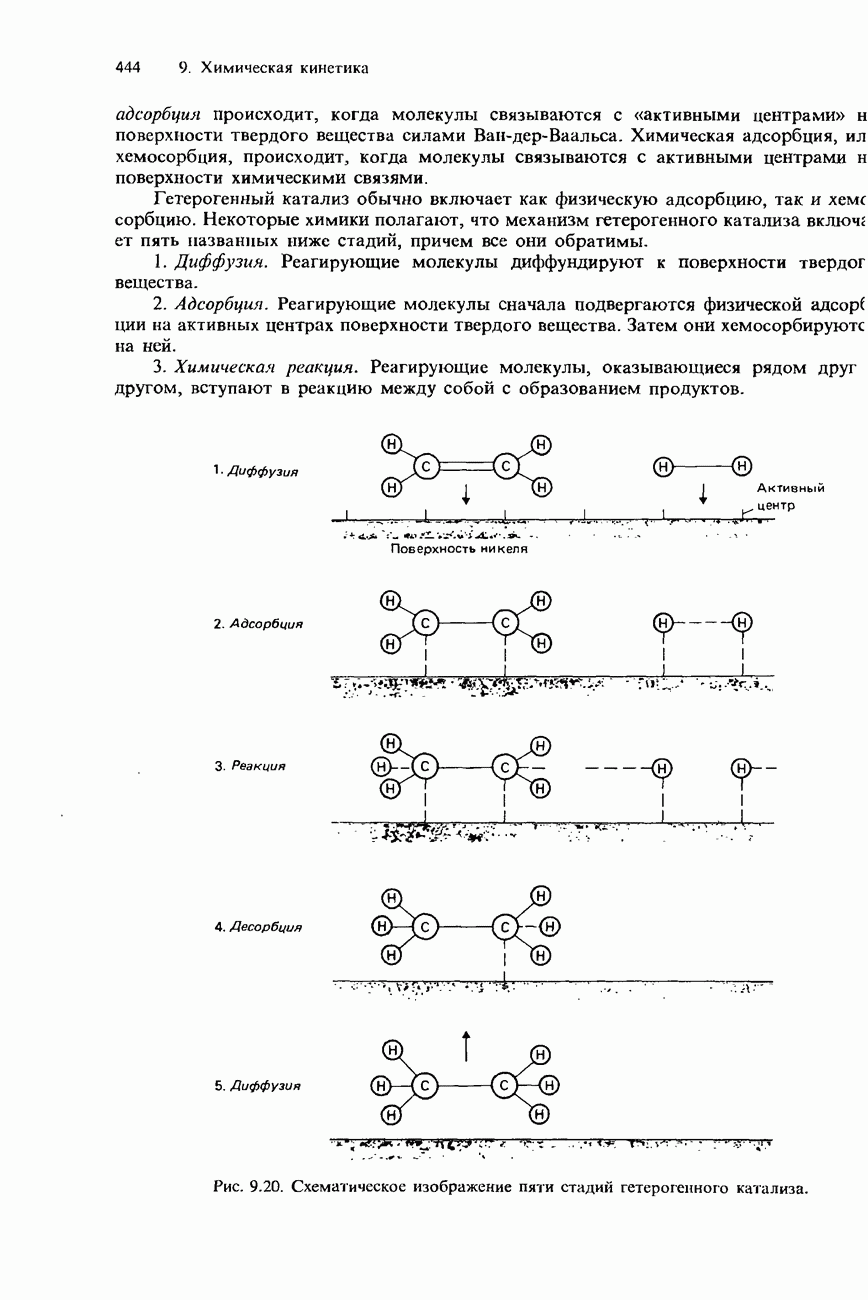
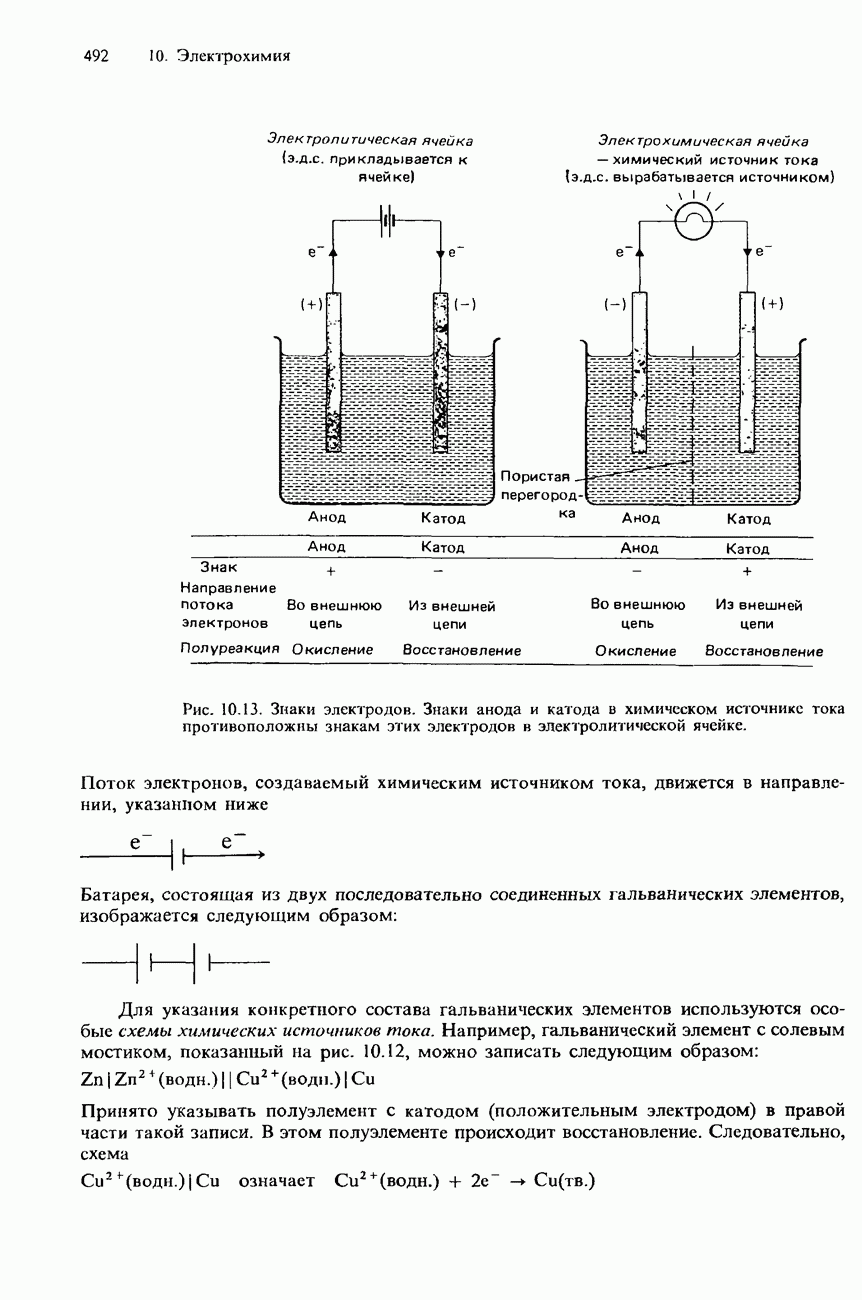
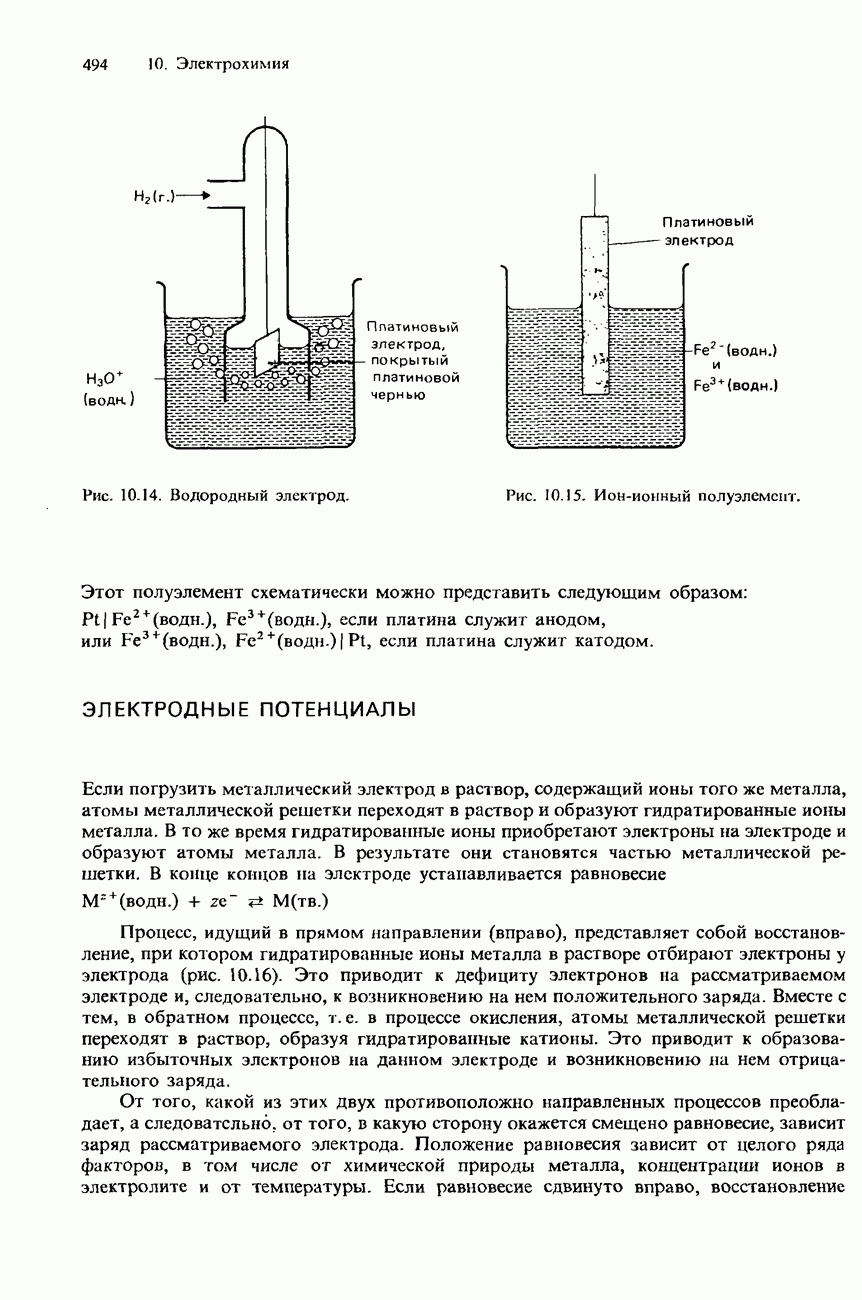
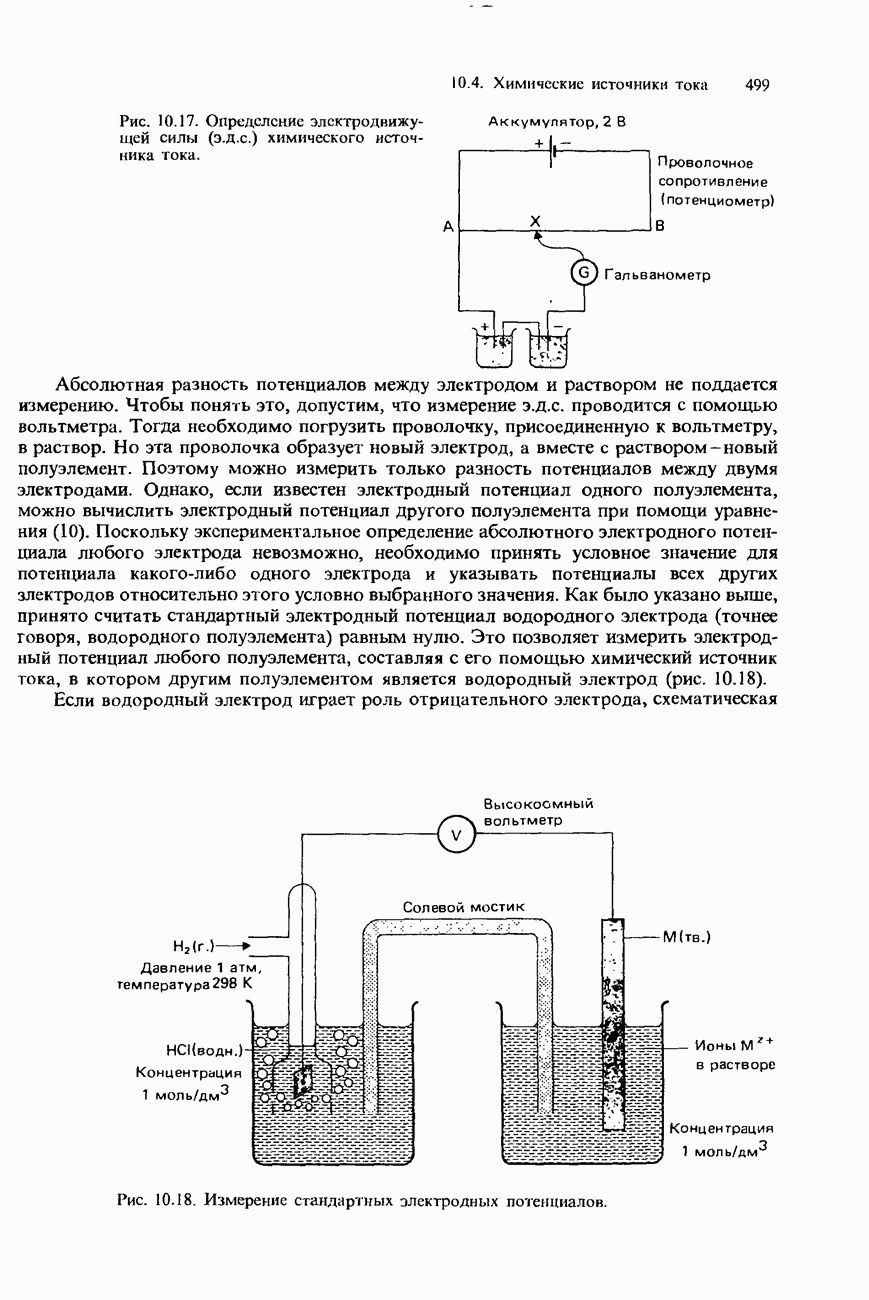
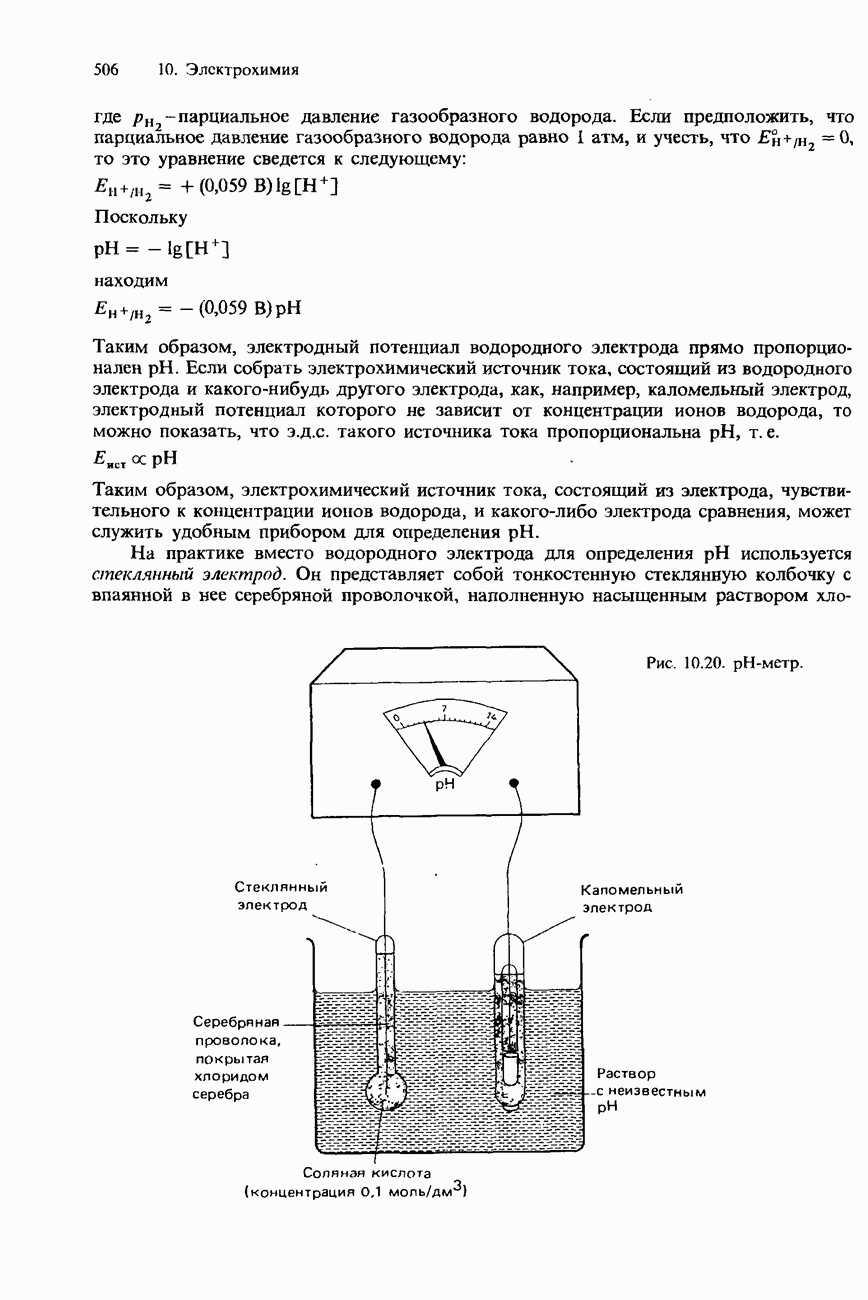
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ
Ферменты (энзимы) - это белковые молекулы, которые катализируют химические реакции в биологических системах. Их часто называют биологическими катализаторами или биокатализаторами. Без их действия большинство биохимических реакций протекало бы слишком медленно, что препятствовало бы нормальному функционированию живого организма.
Свойства ферментов
Ферменты обладают целым рядом специфических свойств и характеристик. Наиболее важные из них перечислены ниже.
Размер. Относительная молекулярная масса ферментов имеет значения от  до
до  . По своему размеру молекулы ферментов попадают в область коллоидных частиц (см. разд. 6.3), что не дает возможности отнести их ни к гомогенным, ни к гетерогенным катализаторам. Поэтому их выделяют в самостоятельный класс катализаторов.
. По своему размеру молекулы ферментов попадают в область коллоидных частиц (см. разд. 6.3), что не дает возможности отнести их ни к гомогенным, ни к гетерогенным катализаторам. Поэтому их выделяют в самостоятельный класс катализаторов.
Селективность. Ферменты могут характеризоваться различной специфичностью). Ферменты с низкой степенью специфичности катализируют сравнительно широкий круг биохимических реакций. В отличие от этого ферменты с высокой степенью специфичности способны катализировать лишь ограниченный круг реакций.
Например, ферменты из группы липаз характеризуются сравнительно низкой степенью специфичности. Они катализируют гидролиз большинства сложных эфиров. В отличие от этого фермент  очень специфичен. Он катализирует гидролиз
очень специфичен. Он катализирует гидролиз  -глюкозидов, но не
-глюкозидов, но не  -глюкозидов (см. гл. 20). Другим примером очень специфичного фермента является уреаза. Этот фермент обнаруживается в соевых бобах. Он катализирует гидролиз мочевины (карбамида)
-глюкозидов (см. гл. 20). Другим примером очень специфичного фермента является уреаза. Этот фермент обнаруживается в соевых бобах. Он катализирует гидролиз мочевины (карбамида)

Однако этот фермент не катализирует гидролиз замещенных мочевин.
Вообще говоря, ферменты обладают высокой селективностью, и каждый из них способен катализировать только одну специфическую реакцию или реакцию одного типа.
Эффективность. Некоторые ферменты обладают высокой эффективностью даже в очень небольших количествах. Такая высокая эффективность объясняется тем, что молекулы ферментов в процессе своей каталитической активности непрерывно регенерируют. Типичная молекула фермента может регенерировать миллионы раз за минуту.
Примером может служить фермент реннин, вырабатываемый слизистой оболочкой сычуга (отдела желудка жвачных). Реннин используется в сыроделии. Он способен вызывать коагуляцию (свертывание) белков молока в количествах, в миллионы раз превышающих его собственную массу.
Другой пример высокой эффективности ферментов дает каталаза. Одна молекула этого фермента при 0°С разлагает за секунду около 50000 молекул пероксида водорода:

Действие каталазы на пероксид водорода заключается в снижении энергии активации этой реакции приблизительно от 75 кДж/моль до 21 кДж/моль. Если же для катализирования этой реакции используется коллоидная платина, удается снизить энергию активации только до 50 кДж/моль.
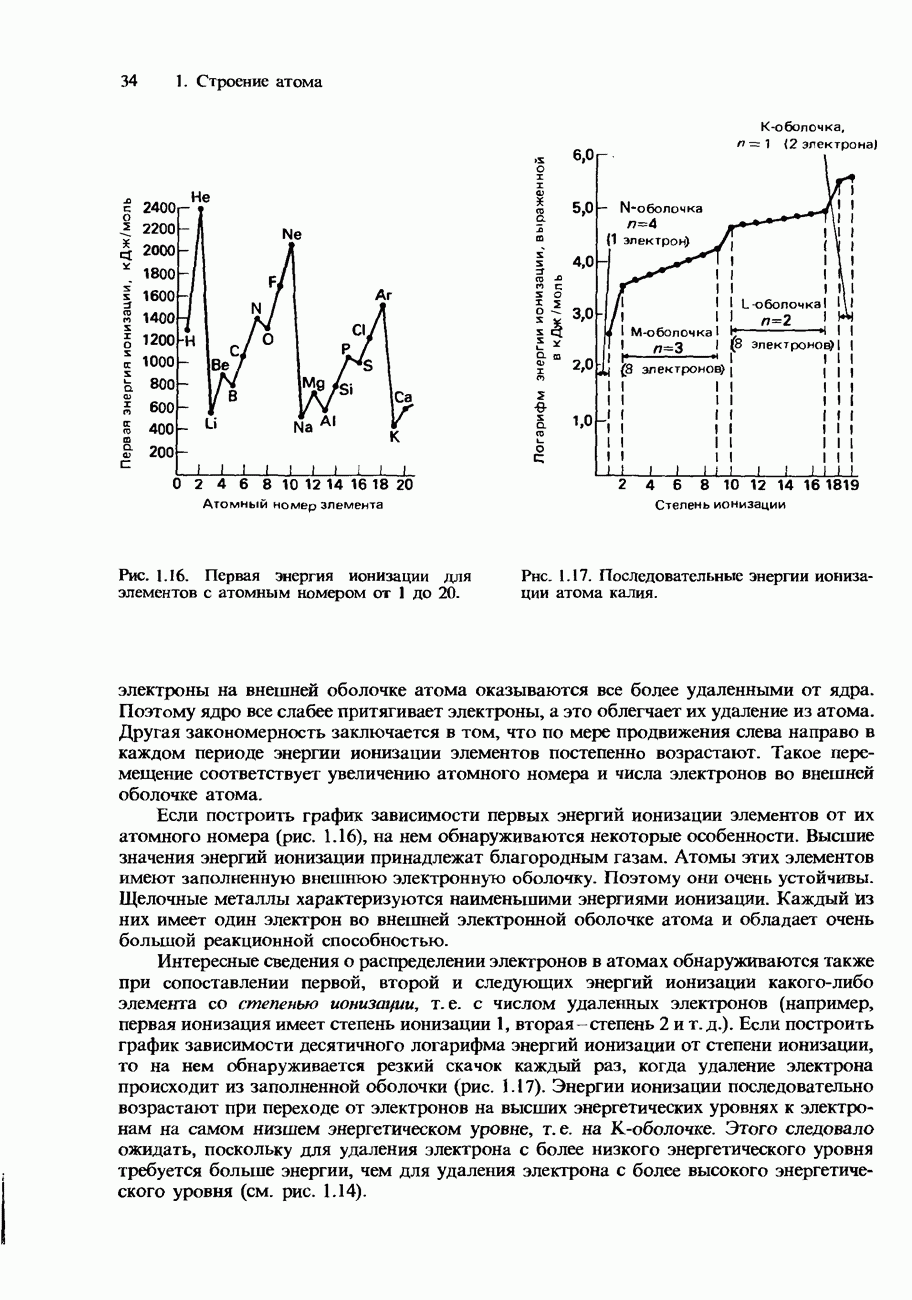
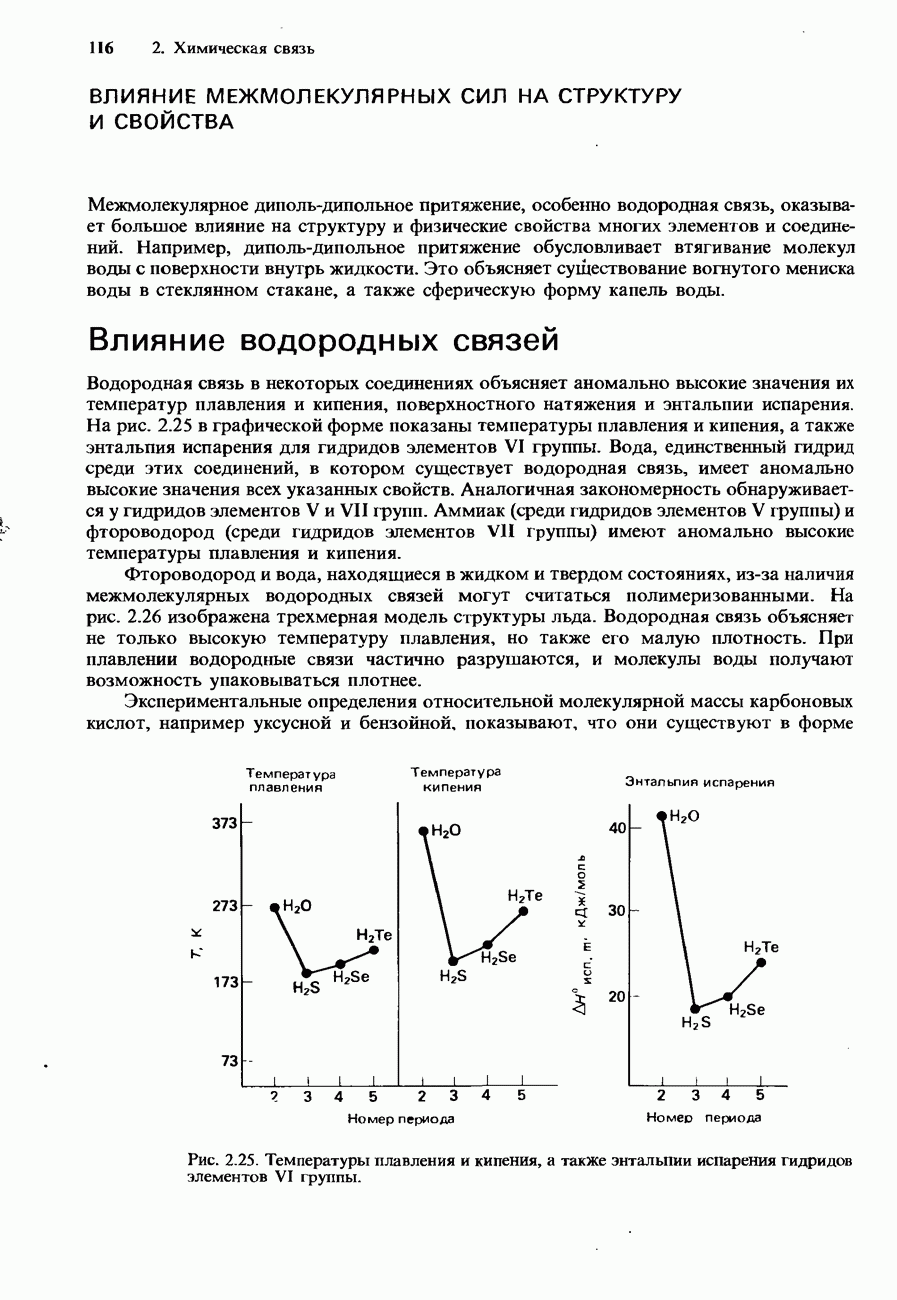
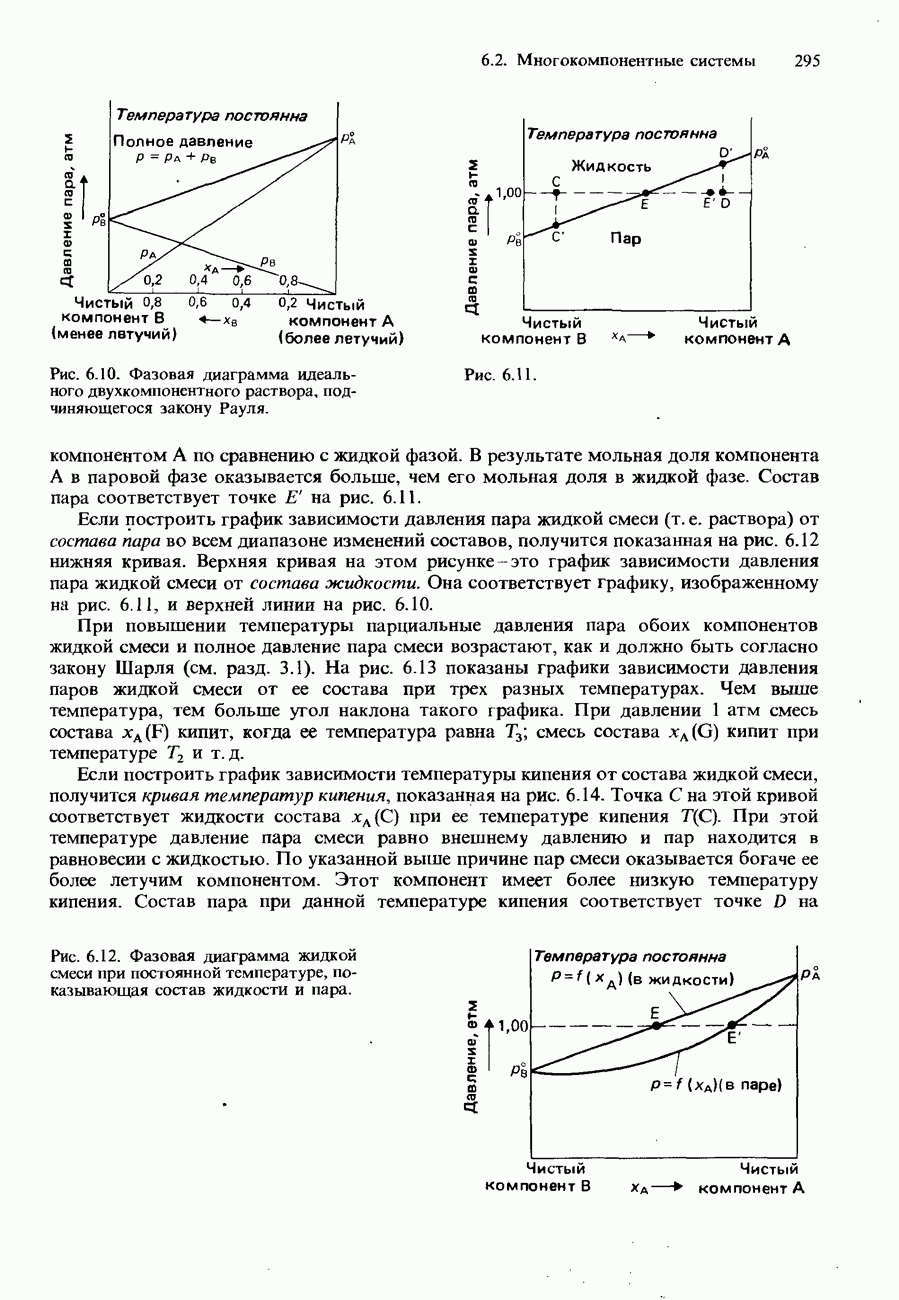
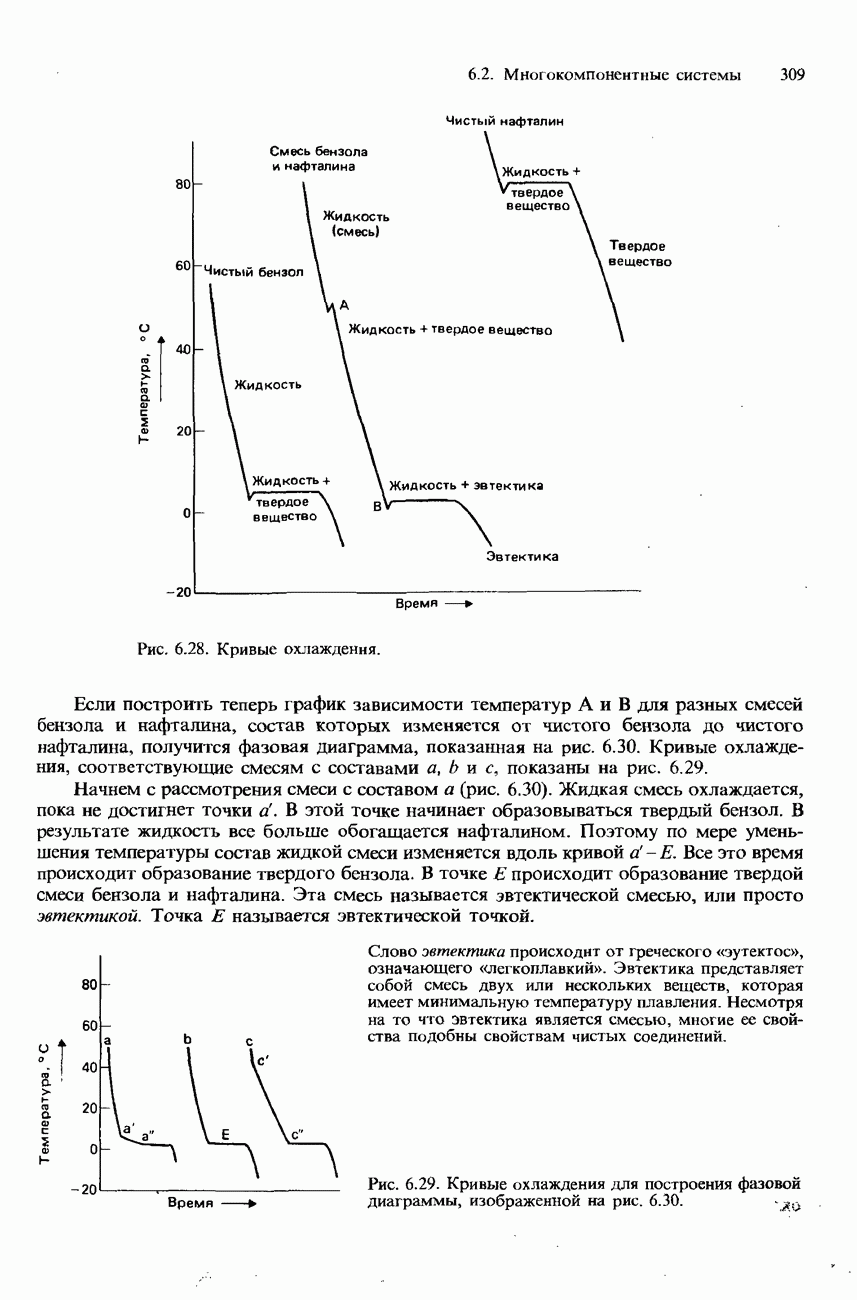
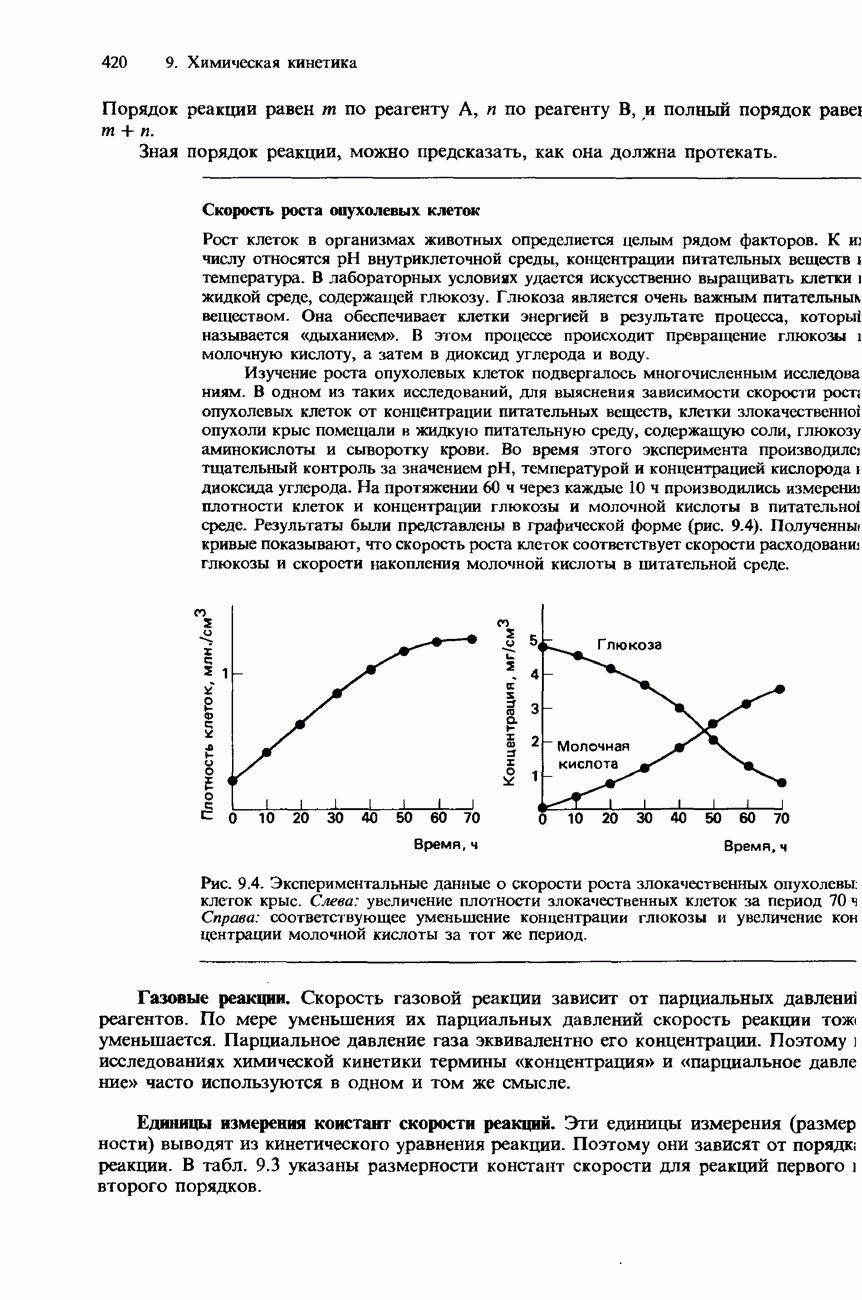
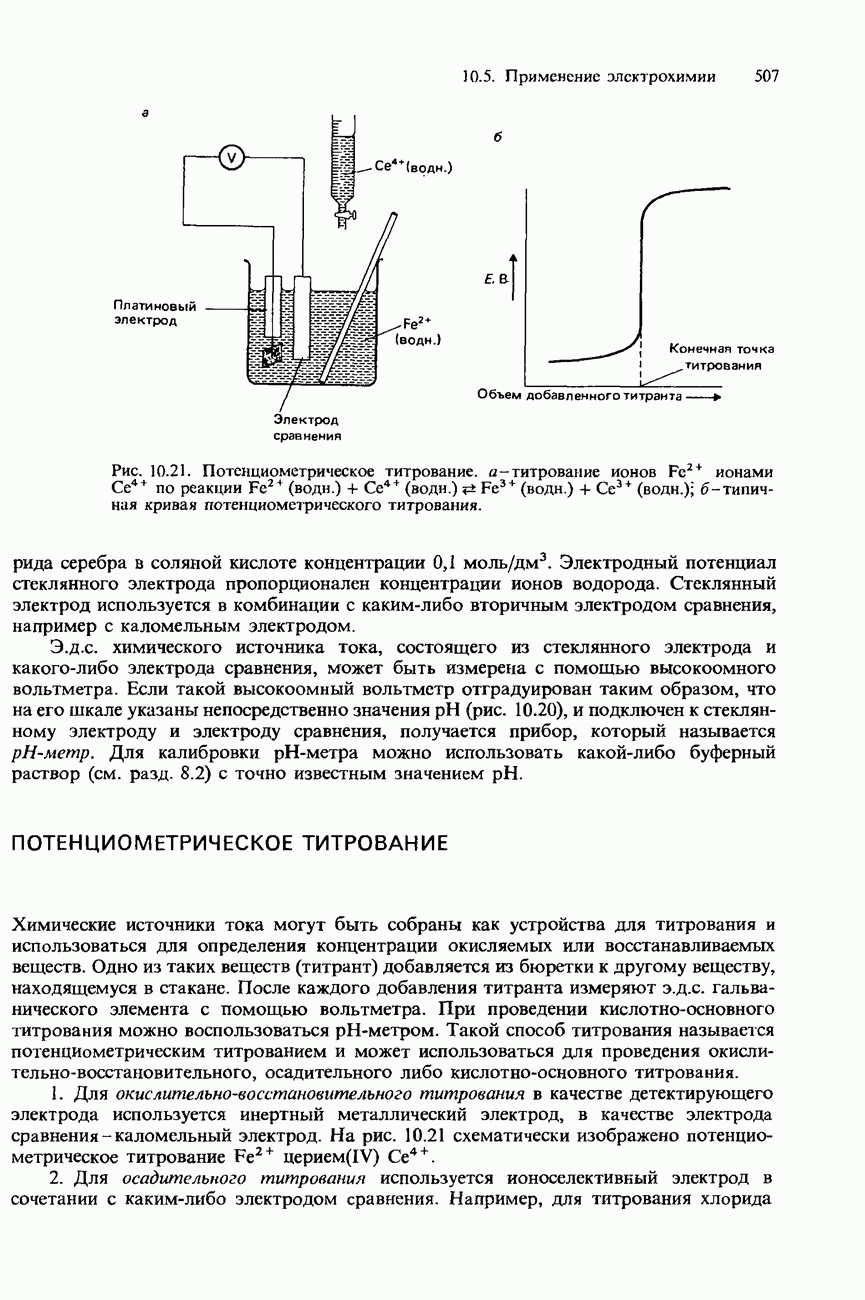
Зависимость от температуры. Ферменты обладают наибольшей эффективностью при температуре человеческого тела, т. е. приблизительно при 37°С. При повышении температуры выше 50-60°С они разрушаются и поэтому становятся неактивными. На рис. 9.22 изображен график зависимости скорости реакции от температуры для типичной реакции, катализируемой ферментами.

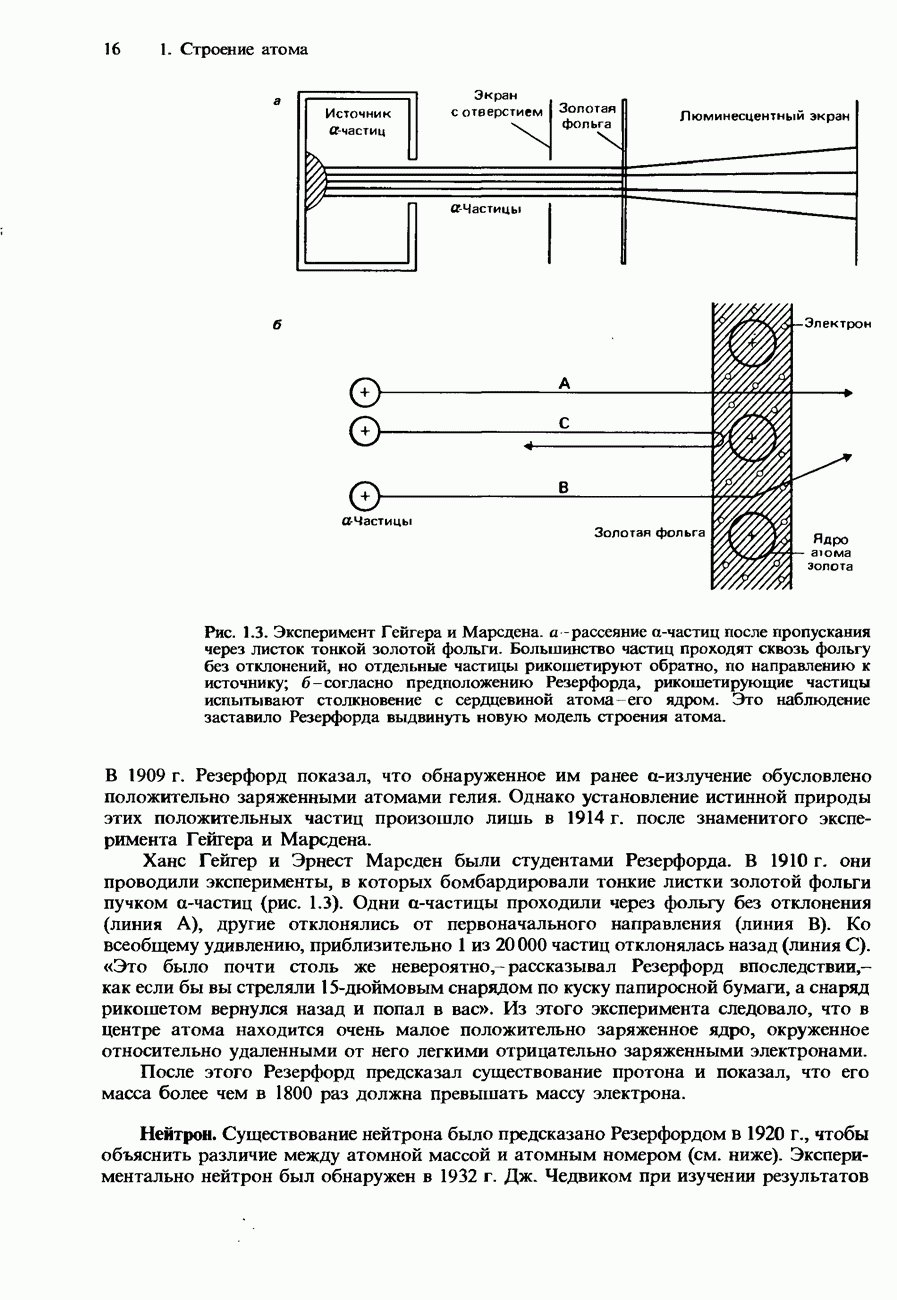
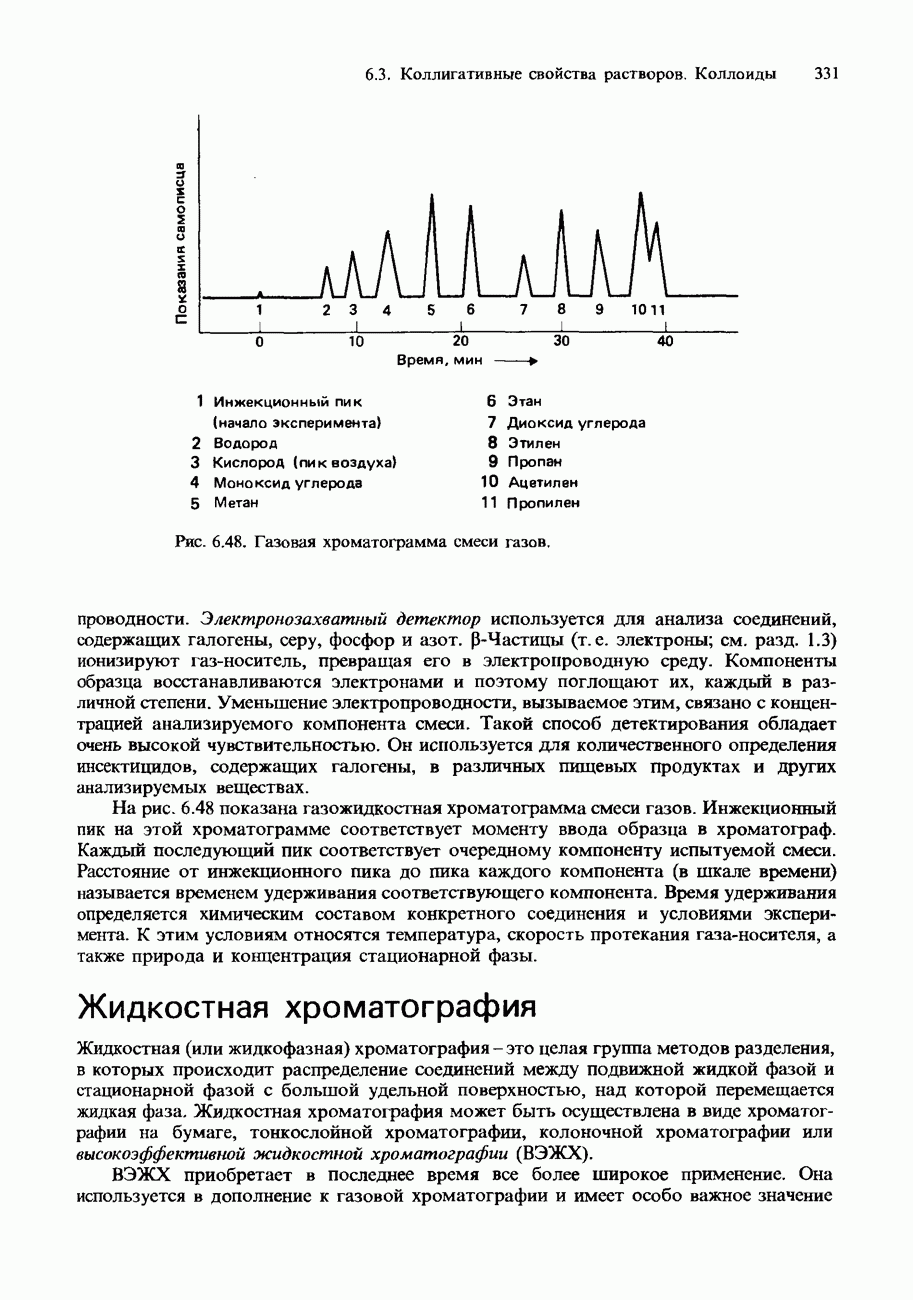
Рис. 9.22. Зависимость скорости реакции от температуры для обычной ферментативной реакции.
Отравление ферментов. Ферменты очень чувствительны к присутствию каталитических ядов. Например, в процессе сбраживания (ферментации) сахаров в спирт происходит отравление этанолом ферментов, содержащихся в дрожжах, и если концентрация этанола превышает 15,5%, ферментация прекращается. Поэтому с помощью одного лишь процесса ферментации обычно не удается получать вино или пиво с концентрацией этанола выше 15,5%.
Механизм действия ферментов
В 1902 г. Генри выдвинул предположение, что действие ферментов заключается в образовании комплекса с молекулой субстрата, которое представляет собой обратимый процесс. Комплекс фермент-субстрат соответствует промежуточному соединению или переходному состоянию в теории промежуточных соединений. Затем этот комплекс распадается и регенерирует фермент. Этот процесс описывается уравнением

где Е - фермент, S - субстрат, ES - комплекс, а  — продукт реакции. Это уравнение впервые предложили Михаэлис и Ментен в 1913 г., и поэтому оно получило название уравнения Михаэлиса - Ментен.
— продукт реакции. Это уравнение впервые предложили Михаэлис и Ментен в 1913 г., и поэтому оно получило название уравнения Михаэлиса - Ментен.
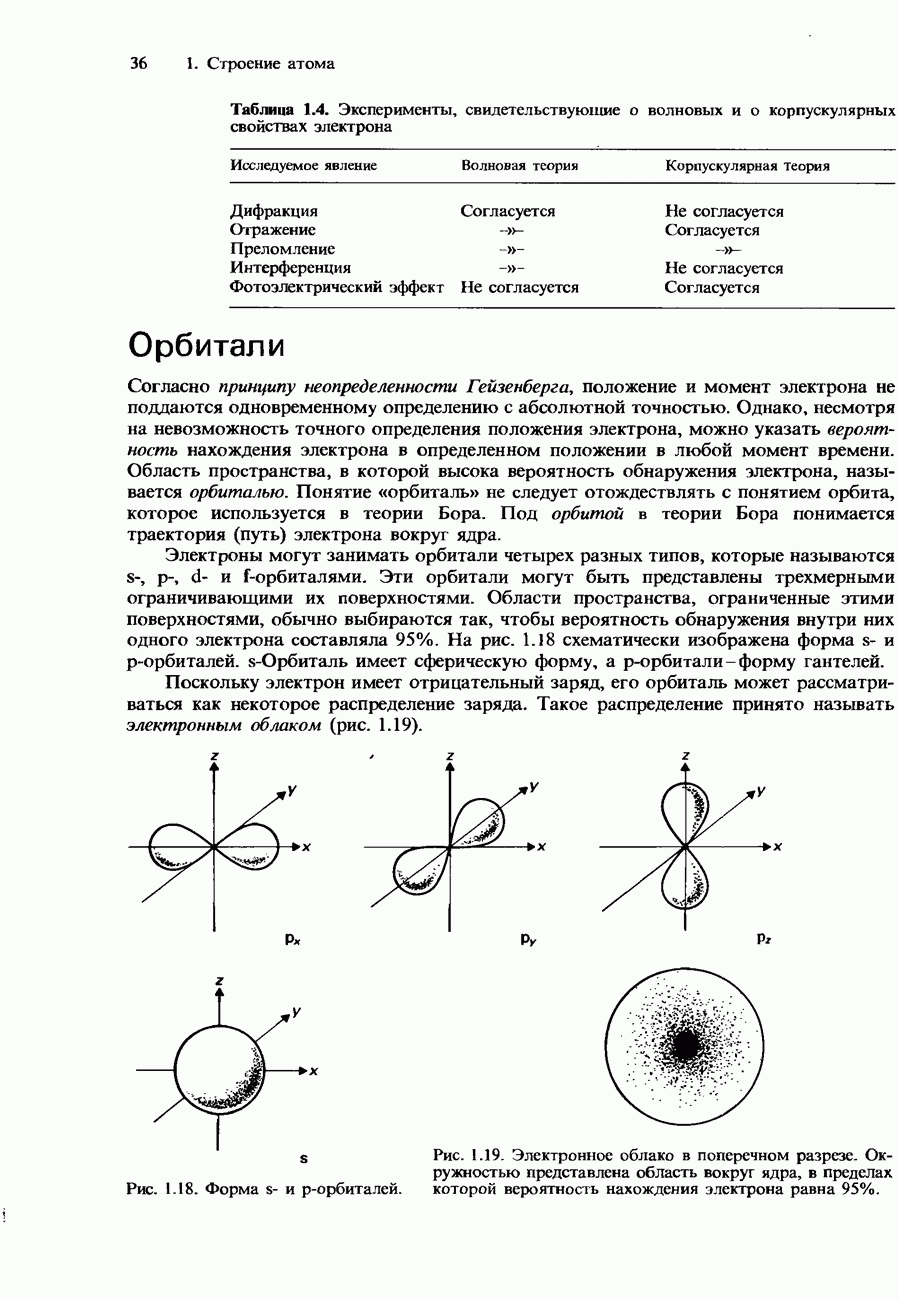
Согласно существующим воззрениям, молекула субстрата связывается с областью на поверхности фермента, которая называется активным центром. Активность этого центра повышается в присутствии витаминов и некоторых минеральных веществ. За активность ферментов особенно ответственны различные микроэлементы, в частности  -переходиые металлы, как, например, медь, марганец, железо и никель.
-переходиые металлы, как, например, медь, марганец, железо и никель.
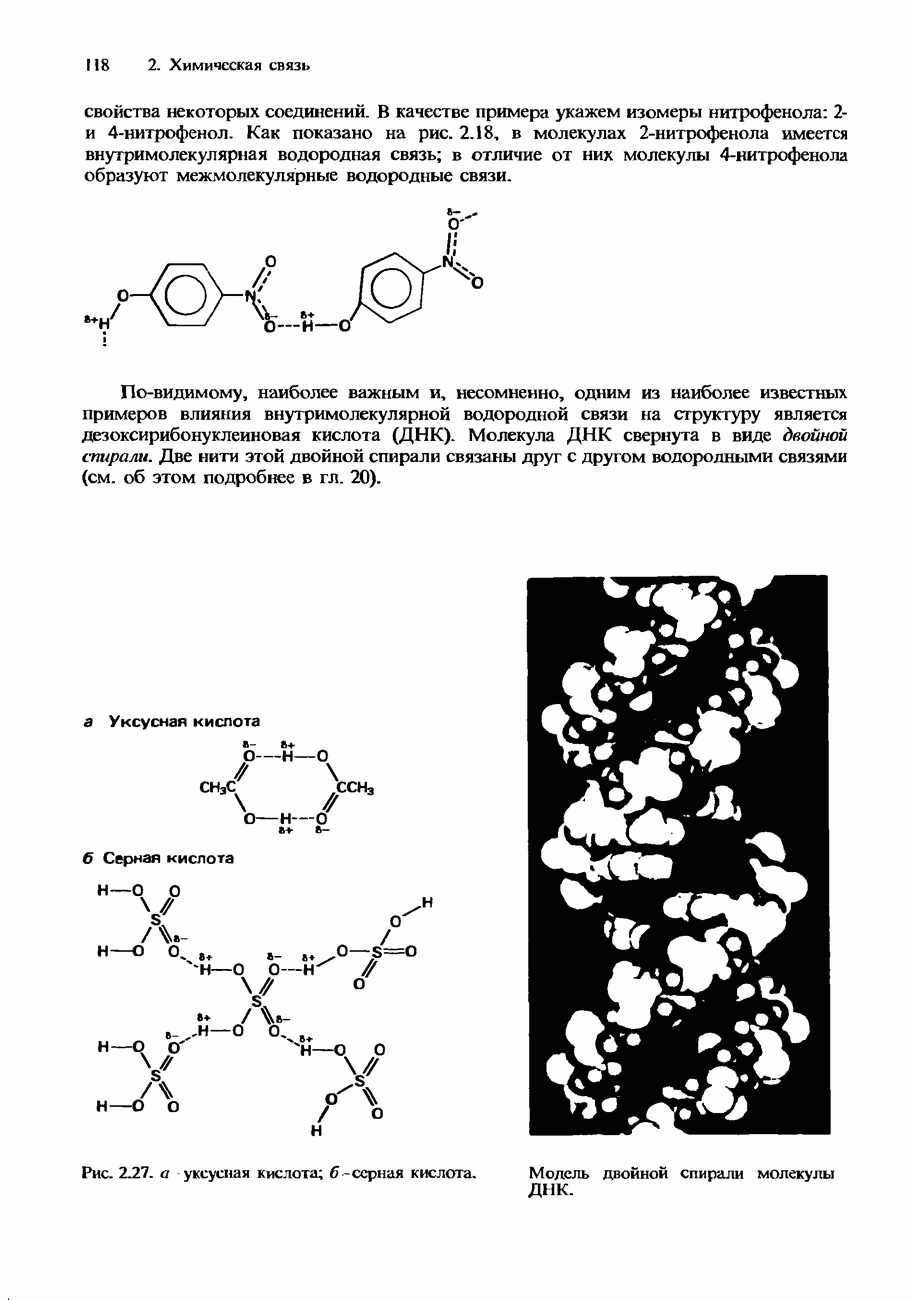
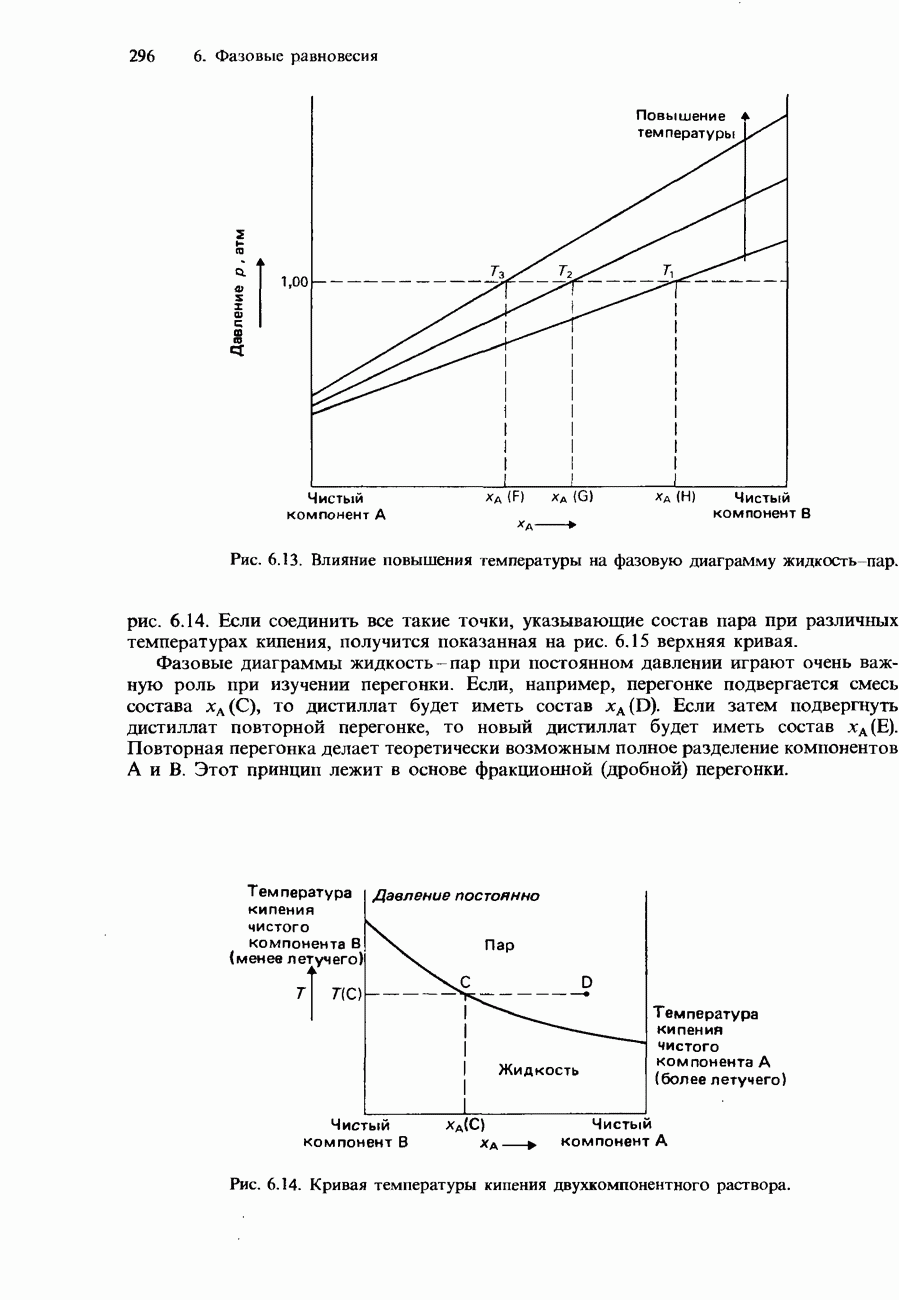
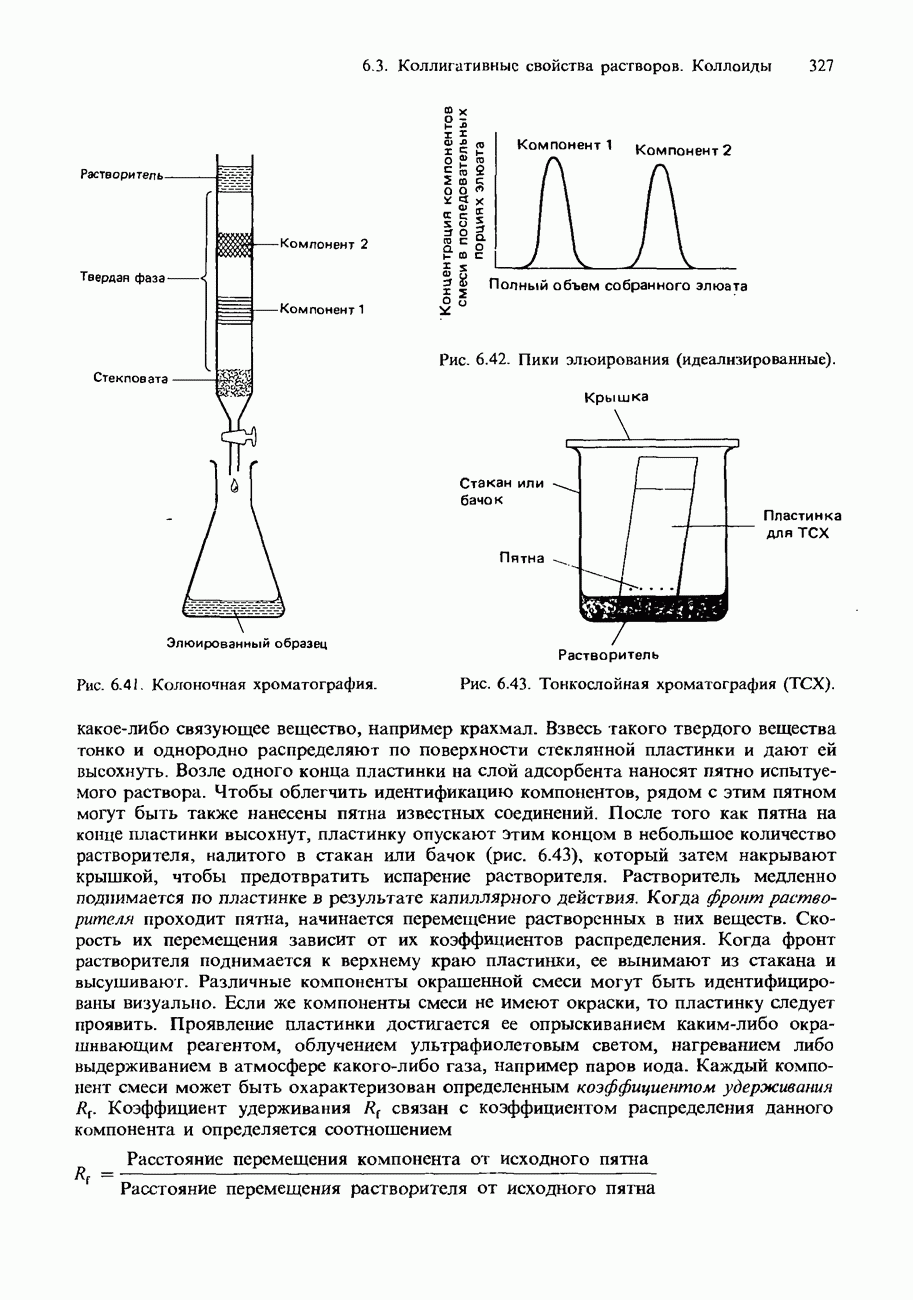
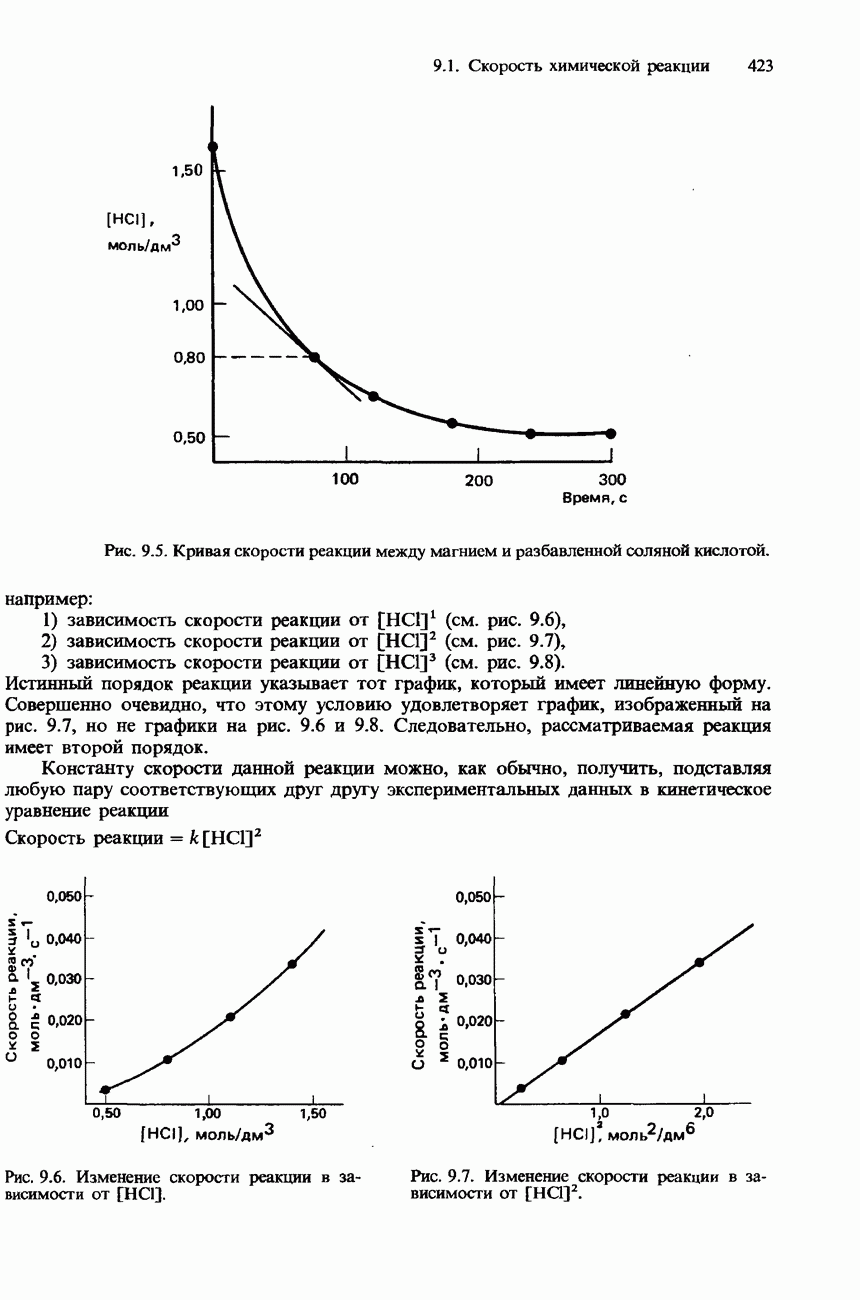
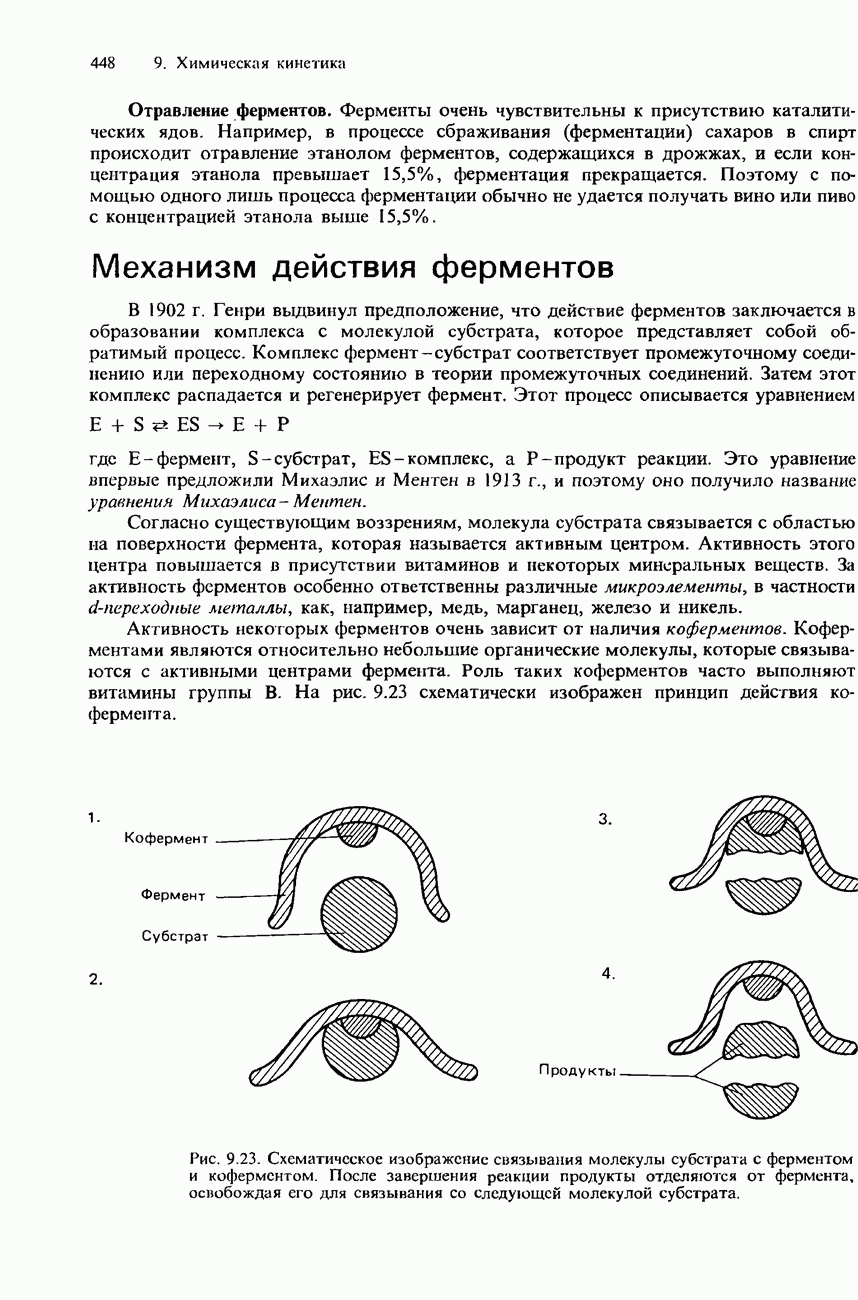
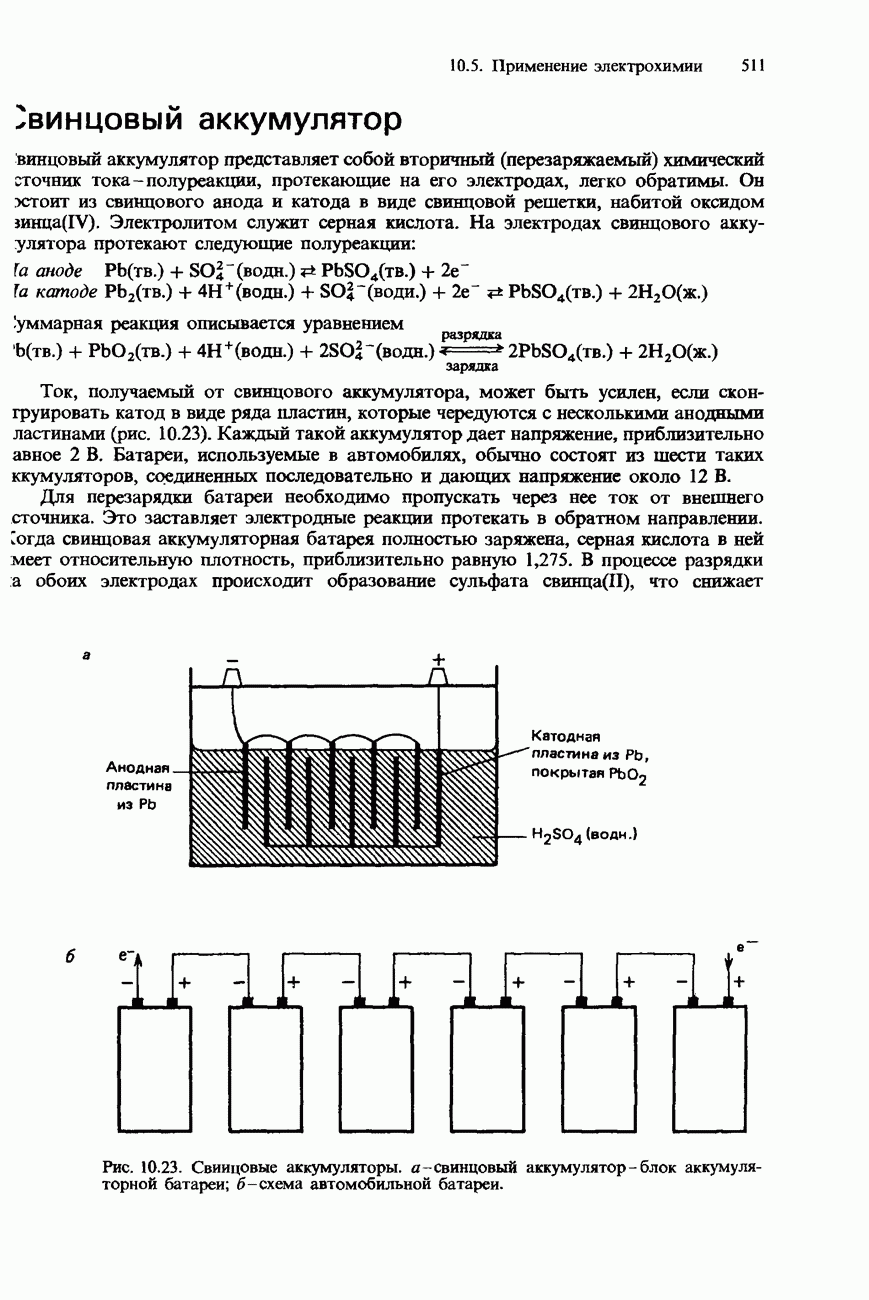
Активность некоторых ферментов очень зависит от наличия коферментов. Коферментами являются относительно небольшие органические молекулы, которые связываются с активными центрами фермента. Роль таких коферментов часто выполняют витамины группы В. На рис. 9.23 схематически изображен принцип действия кофермента.

Рис. 9.23. Схематическое изображение связывания молекулы субстрата с ферментом и коферментом. После завершения реакции продукты отделяются от фермента, освобождая его для связывания со следующей молекулой субстрата.
Роль ферментов в различных процессах
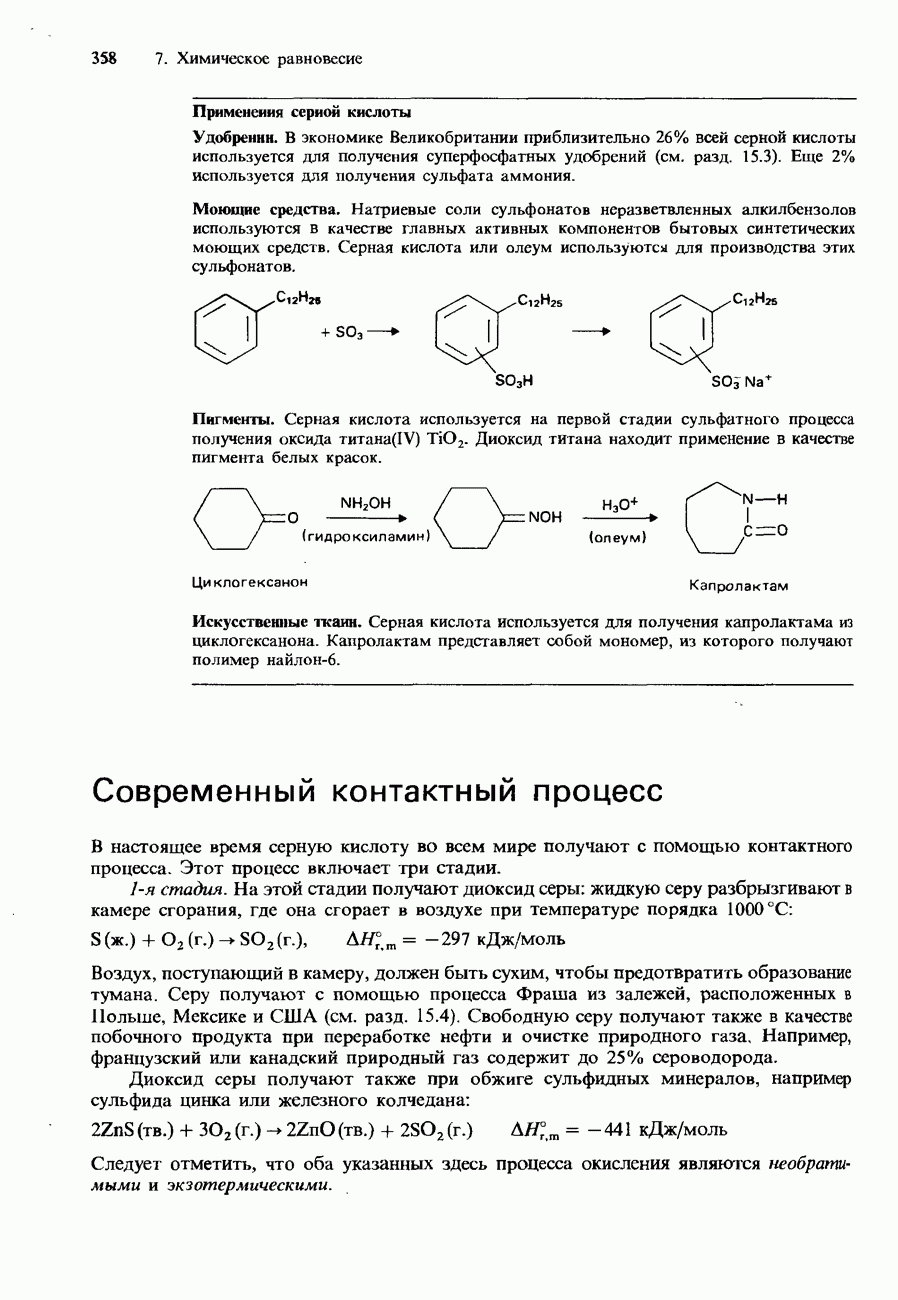
Ферменты играют важную роль в протекании химических реакций, которые осуществляются в биологических системах. Например, в человеческом организме ежесекундно осуществляются тысячи ферментативных химических реакций. Кроме того, ферменты играют важную роль и в проведении многих технологических процессов. Они используются, например, в процессах приготовления пищи, в производстве пищевых продуктов и напитков, фармацевтических препаратов, моющих средств, текстильных изделий, кожи и бумаги.
Ферменты в пищеварительной системе человека. В пищеварительной системе происходит превращение таких питательных веществ, как белки, углеводы и жиры, в продукты, способные легко усваиваться клетками живого организма. Эти превращения тоже происходят с участием ферментов.
Например, фермент амилаза, который содержится в выделениях слюнных желез и тонкого кишечника, помогает превращению крахмала в мальтозу. Затем мальтоза превращается в глюкозу в тонком кишечнике с помощью другого фермента-мальтазы. В желудке и тонком кишечнике такие ферменты, как пепсин и трипсин, превращают белки в пептиды. Затем эти пептиды превращаются в тонком кишечнике в аминокислоты под действием ферментов, которые называются пептидазами. В тонком кишечнике содержится еще один фермент-липаза. Он гидролизует жиры (липиды), образующие жирные кислоты.
Метаболические процессы. Так называются химические процессы, протекающие в живых клетках. Типичная живая клетка состоит из ядра, окруженного цитоплазмой. Клетка ограничена клеточной мембраной. Цитоплазма участвует в процессе обмена веществ, используя и запасая энергию питательных веществ и образуя соединения, необходимые для функционирования других клеток. Одним из ферментов, которые обнаруживаются в цитоплазме, является цитохромоксидаза. Цитохромы - разновидность белков, которые содержат железо в форме гема. Вместе с такими ферментами, как цитохромоксидаза, они играют важную роль в процессе дыхания. Эта роль заключается в окислении питательных веществ и запасании энергии. Цитохромоксидаза содержит микроэлемент медь, в отсутствие которого невозможен эффективный обмен веществ в организме. В растительных клетках цитохромы находятся в хлоропластах, которые играют важную роль в фотосинтезе.
Болезни, связанные с недостатком или избытком ферментов в организме
Некоторые заболевания вызываются недостаточным или избыточным содержанием ферментов. Например, наследственное заболевание фенилкетонурия обусловлено недостаточным содержанием в организме фермента фепиламиногидроксилазы. Это заболевание приводит к накоплению в организме вредных соединений, которые вызывают разрушение клеток мозга и замедление умственного развития. Чтобы предотвратить разрушение клеток мозга, больным фенилкетонурией необходимо придерживаться диеты с низким содержанием аминокислоты фенилаланина. Заболевание альбинизм, связанное с недостатком в организме фермента тирозиназы, проявляется в отсутствии пигмента в кожных покровах. В обоих рассмотренных случаях недостаток фермента обусловлен генетической мутацией.
Сердечные приступы могут приводит к значительному повышению уровня концентрации ферментов в крови. Это обусловлено просачиванием ферментов из клеток разрушенной сердечной ткани.
Ферменты используются для лечения некоторых заболеваний, например, таких, как сердечная недостаточность. Нередко сердечные приступы вызываются тромбами
крови, образующимися в коронарной артерии. Современный способ лечения такого заболевания основан на растворении тромбов с помощью фермента стрептокиназы, вводимого непосредственно в сердце.
Проферменты. Эти вещества известны также под названием зимогены. Они представляют собой образующиеся в организме растений и животных некаталитические вещества, которые превращаются в ферменты по мере необходимости. Например, в крови человека содержится протромбин, который при необходимости превращается в тромбин-фермент свертывания крови. Он катализирует превращение растворимого белка фиброногена, содержащегося в крови, в нерастворимый белок фибрин.
Ферментация (брожение)
Так называется химический процесс, в котором под воздействием определенных микроорганизмов, таких, как дрожжи и некоторые бактерии, из сахара получают этиловый спирт и другие продукты. Ферментация глюкозы с образованием этанола может быть описана уравнением

Этот процесс имеет сложный механизм. Одним из его главных интермедиатов является 2-оксопропановая (пировиноградная) кислота:

Процесс состоит из 12 стадий, причем для протекания каждой стадии необходим специфический фермент. Зимаза - один из 12 (или близкого к этому числа) ферментов, обнаруживаемых в типичных дрожжах.
Промышленное получение этанола может осуществляться путем ферментации тростникового сахара с последующей перегонкой. Тростниковый сахар содержит приблизительно 50% сахарозы  Перед ферментацией сахарный сироп, который называется патокой, разбавляют водой. В процессе ферментации сахароза превращается в глюкозу и фруктозу. Этот процесс катализируется ферментом инвертазой.
Перед ферментацией сахарный сироп, который называется патокой, разбавляют водой. В процессе ферментации сахароза превращается в глюкозу и фруктозу. Этот процесс катализируется ферментом инвертазой.
Пиво получают ферментацией смеси солода и хмеля. Хмель добавляют для придания пиву специфического вкуса. Солод получают из хлебных злаков, обычно ячменя. Крахмал, содержащийся в солоде, превращается в мальтозу под действием фермента диастазы. Затем другой фермент, содержащийся в дрожжах, мальтаза, катализирует превращение мальтозы в глюкозу. Осветление пива осуществляется с помощью фермента папаина, который гидролизует белки, обусловливающие наличие мути в пиве. Папаин может использоваться также в процессе варки мяса для его умягчения.
В процессе получения вин превращение сахаров, содержащихся в виноградном соке, в этанол осуществляется благодаря наличию в кожице виноградин природных дрожжей. Иногда в виноградный сок добавляют также культурные дрожжи. Если ферментацию проводить до полного завершения, получается сухое вино. Если ферментация приостанавливается преждевременно, получается более сладкое вино.
Из-за того, что растворы, содержащие более 15,5% этанола, подавляют действие ферментов в дрожжах, получение крепленых алкагольных напитков требует проведения перегонки. Другой способ получения крепленых вин заключается в добавлении спирта, например в виде водки или бренди.
Ферментирующие дрожжи, как, например, винодельческие дрожжи Saccharomyces ellipsoideus, обладают способностью ферментировать сахара лишь до тех пор, пока не образуется раствор, содержащий 15,5% этанола по объему. Дикие дрожжи позволяют проводить ферментацию лишь до получения растворов с содержанием этанола до 5,5% но объему. Пленочные дрожжи, как, например, те, которые используются для получения шерри, позволяют проводить ферментацию вплоть до получения раствора, содержащего 20% этанола но объему.
Итак, повторим еще раз!
1. Механизм реакции — это последовательность стадий, предлагаемая обычно на основании экспериментально установленных данных о скорости реакции и на экспериментально обнаруженных интермедиатах реакции (промежуточных продуктах).
2. Лимитирующей стадией (скоростьопределяющей стадией) механизма реакции является самая медленная стадия этого механизма.
3. Молекулярностъ какой-либо стадии механизма реакции определяется числом частиц, которые япляются реагентами на этой стадии.
4. Теория столкновений позволяет объяснить влияние концентрации и температуры на скорости реакций.
5. Теория переходного состояния рассматривает изменения в геометрическом расположении атомов реагирующих молекул как единой системы.
6. Переходным состоянием или активированным комплексом называется критическая конфигурация, которой соответствует максимум потенциальной энергии вдоль координаты реакции. Реагирующие молекулы, которые достигают этой критической конфигурации, образуют молекулы продуктов.
7. Цепные реакции включают три стадии: а) инициирование, б) развитие цепи, в) обрыв цепи.
8. Катализатор - это такое вещество, которое увеличивает скорость химической реакции, но само не расходуется в этомпроцессе.
9. Теория образования промежуточных соединений, используемая для объяснения катализа, основана на предположении, что действие катализаторов заключается в образовании промежуточного соединения с субстратом.
10. Вещество, которое уменьшает скорость химической реакции, называется ингибитором.
11. Гомогенный катализатор действует в той же фазе, что и реакционная система.
12. Гетерогенный катализатор находится не в той же фазе, что и реакционная система. Он действует на поверхности фазового раздела.
13. Физическая адсорбция происходит, когда молекулы связываются с активными центрами поверхности твердого вещества вандерваальсовыми силами.
14. Химическая адсорбция, или хемосорбция, происходит, когда молекулы связываются с активными центрами на поверхности твердого вещества химическими связями.
15. Ферменты - это такие белки, которые катализируют протекание химических реакций в биологических системах.
16. Коферменты помогают ферментам выполнять их функцию. Они связываются с активными центрами ферментов.
| << Предыдущий параграф | Следующий параграф >> |
- ОТ ПЕРЕВОДЧИКА
- ПРЕДИСЛОВИЕ АВТОРА К РУССКОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ
- 1. СТРОЕНИЕ АТОМА
- 1.1. Субатомные частицы
- Модели атома
- Новые элементарные частицы
- МАССА АТОМА
- МАСС-СПЕКТРОМЕТРИЯ
- 1.2 Электронное строение атомов
- Связь между спектральными линиями и электронами (открытие Бора)
- Применение возбуждения электронов на практике
- Атомный спектр испускания водорода
- ЭНЕРГИИ ИОНИЗАЦИИ
- Рассмотрение энергий ионизации в рамках модели атома, предложенной Бором
- ВОЛНОВАЯ ПРИРОДА ЭЛЕКТРОНА
- Орбитали
- КВАНТОВЫЕ ЧИСЛА
- ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
- 1.3 Радиоактивность
- ИОНИЗИРУЮЩЕЕ ИЗЛУЧЕНИЕ
- Обнаружение и измерение радиоактивности
- УСТОЙЧИВЫЕ И НЕУСТОЙЧИВЫЕ ИЗОТОПЫ
- Зона устойчивости
- Период полураспада
- Кривые распада
- Ряды радиоактивных превращений
- Естественные радиоизотопы
- ИСКУССТВЕННЫЕ ЯДЕРНЫЕ ПРЕВРАЩЕНИЯ
- Ускорители элементарных частиц
- Трансурановые элементы
- ПРИМЕНЕНИЯ ИЗОТОПОВ
- ЯДЕРНОЕ ДЕЛЕНИЕ И ЯДЕРНЫЙ СИНТЕЗ
- Ядерное деление
- Ядерный синтез
- Ядерный синтез в звездах
- ЯДЕРНАЯ ЭНЕРГИЯ
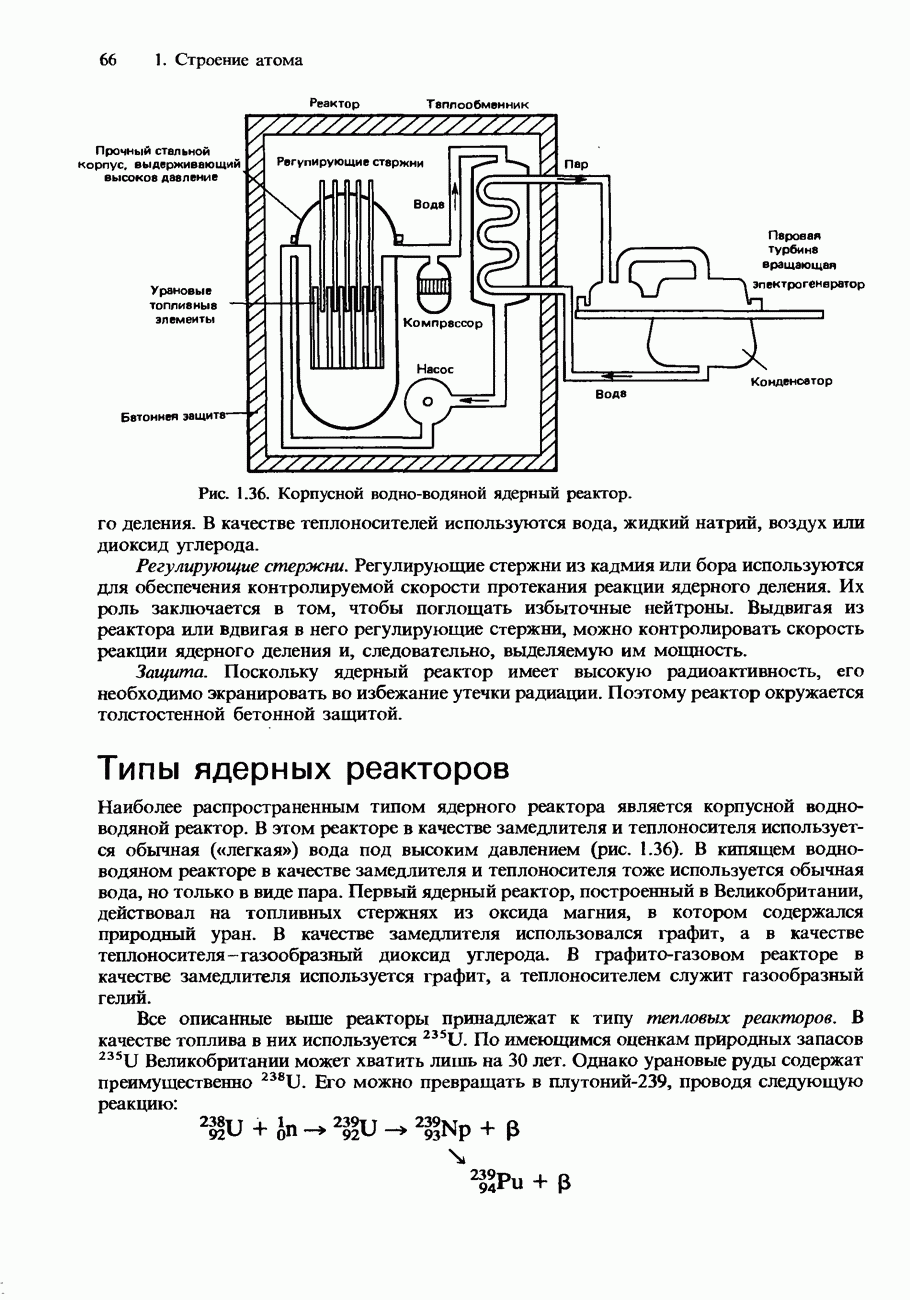
- Типы ядерных реакторов
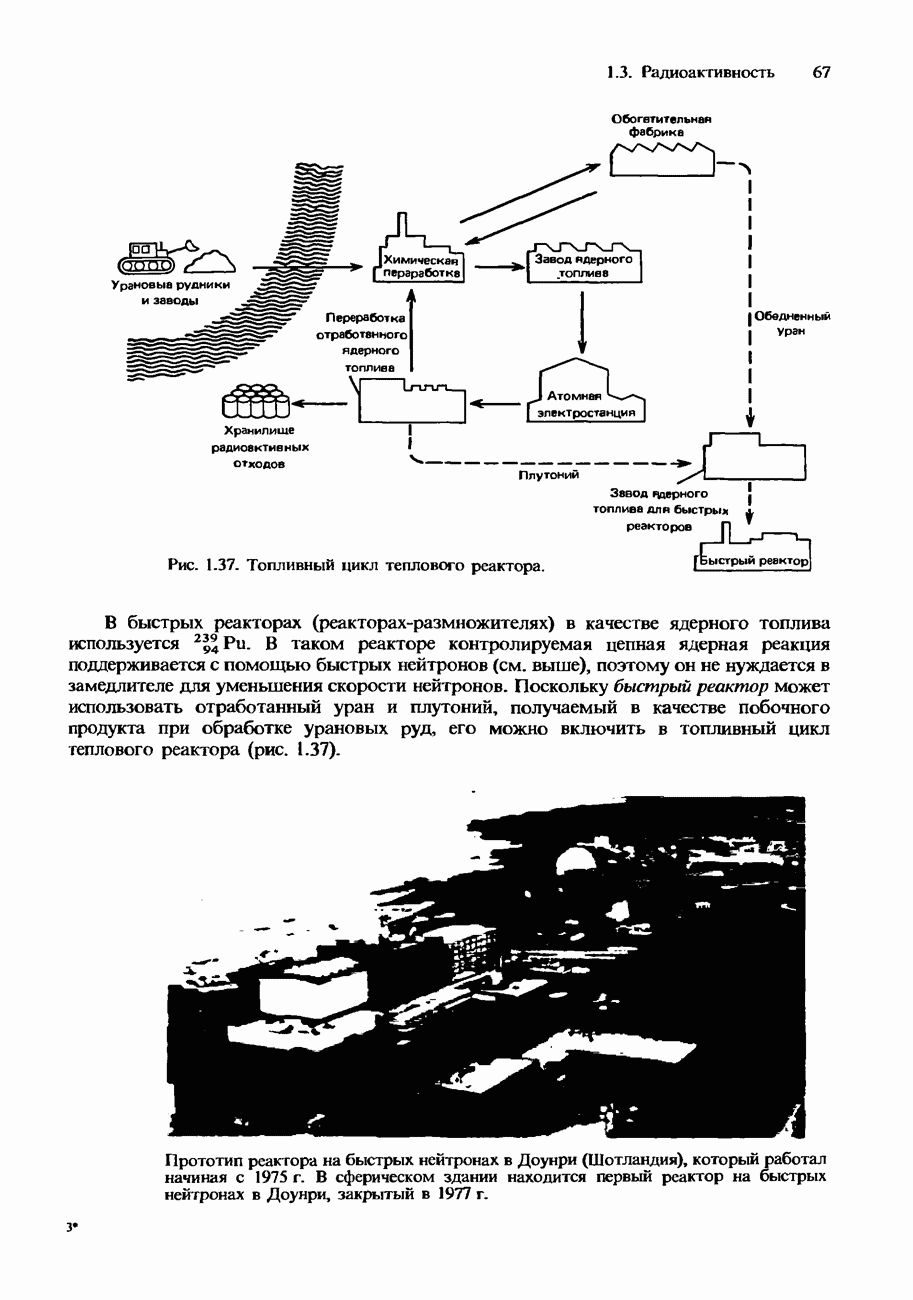
- Радиоактивные ядерные отходы и их переработка
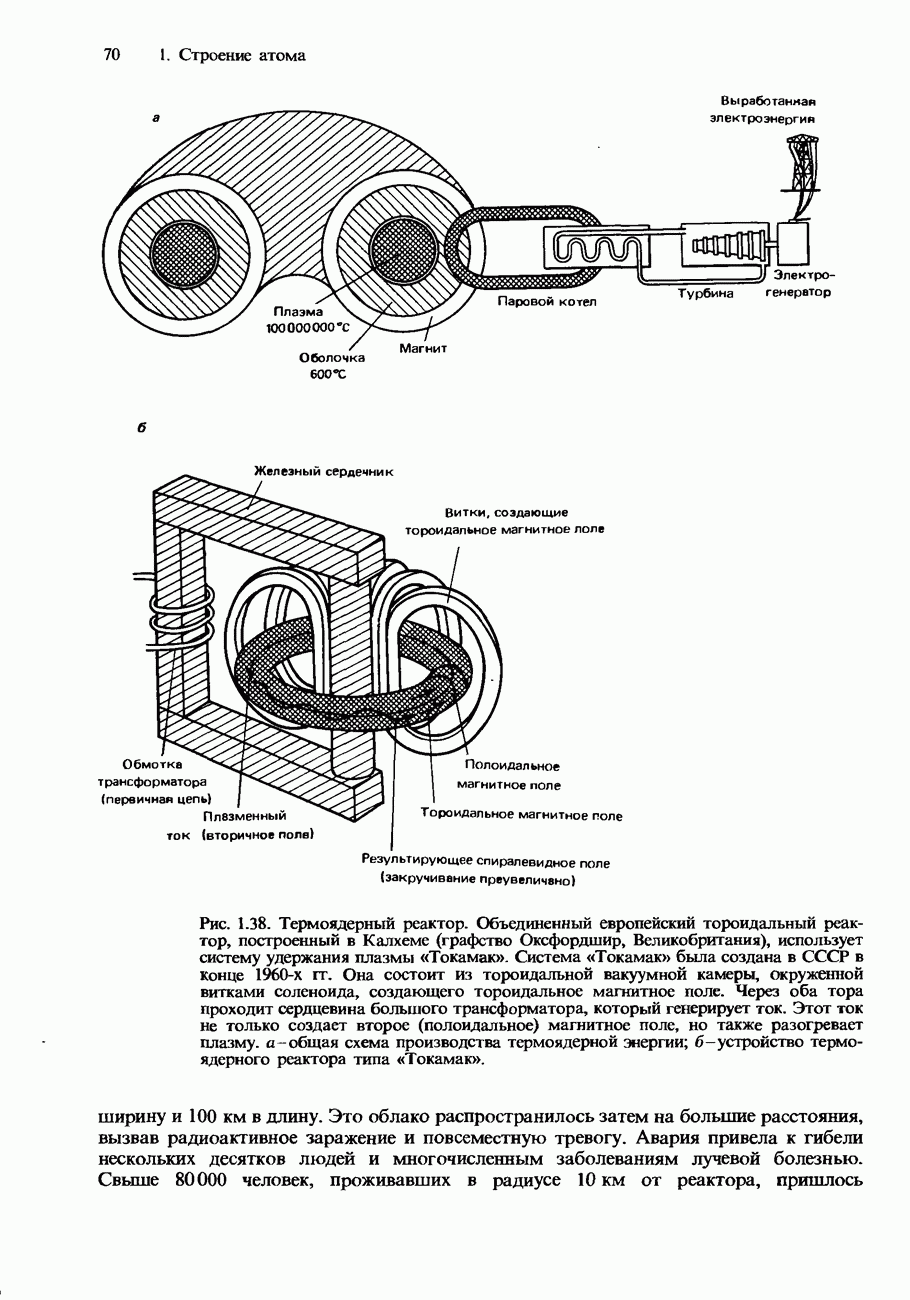
- Термоядерные реакторы
- Аргументы против использования ядерной энергии
- ЯДЕРНОЕ ОРУЖИЕ
- Ядерное разоружение
- ИСТОЧНИКИ РАДИАЦИИ И ЕЕ ВОЗДЕЙСТВИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 2. ХИМИЧЕСКАЯ СВЯЗЬ
- 2.1. Природа химической связи
- ИОННАЯ СВЯЗЬ
- Устойчивость ионных соединений
- КОВАЛЕНТНАЯ СВЯЗЬ
- Молекулярные орбитали
- Гибридные атомные орбитали
- Делокализованные орбитали
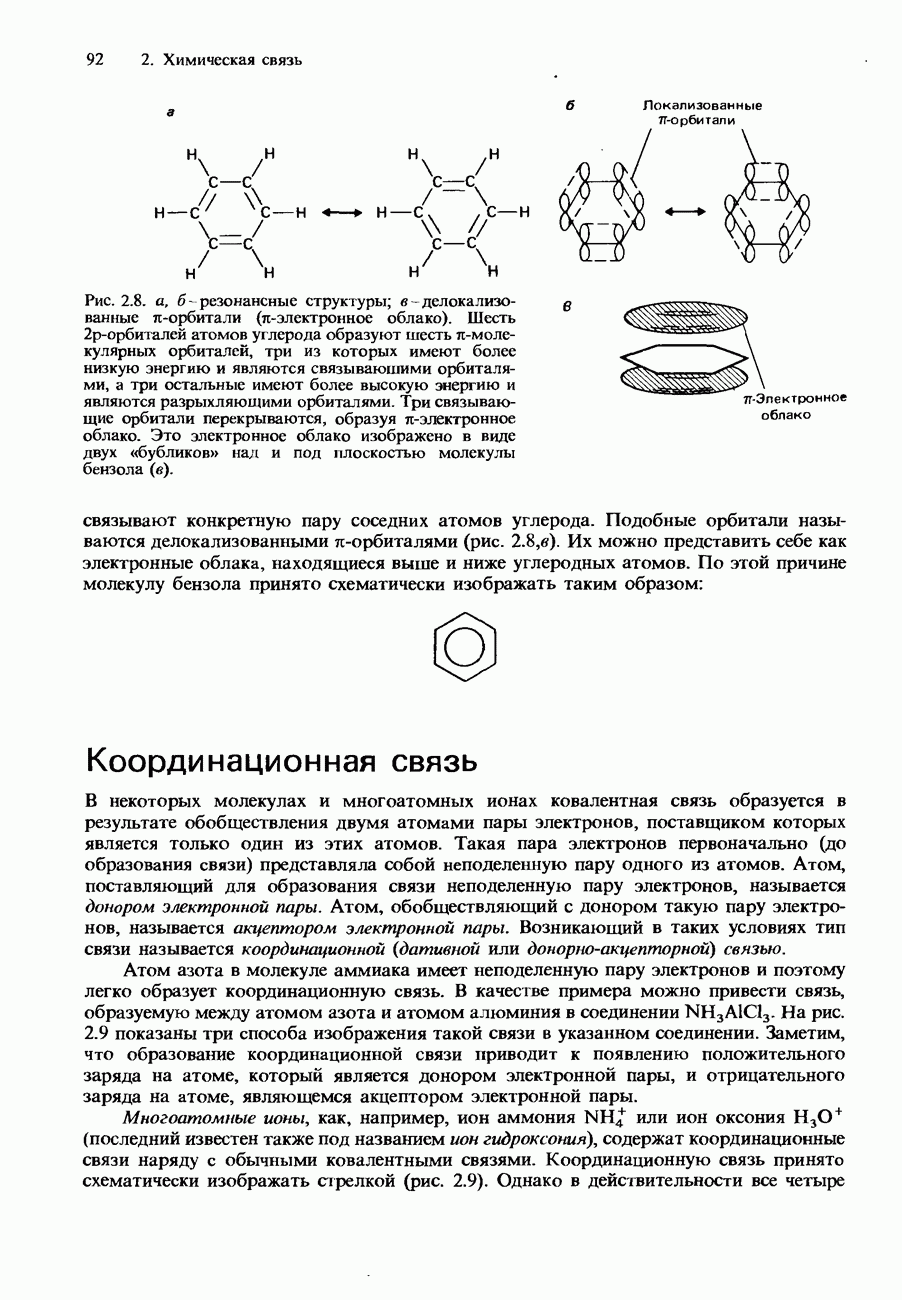
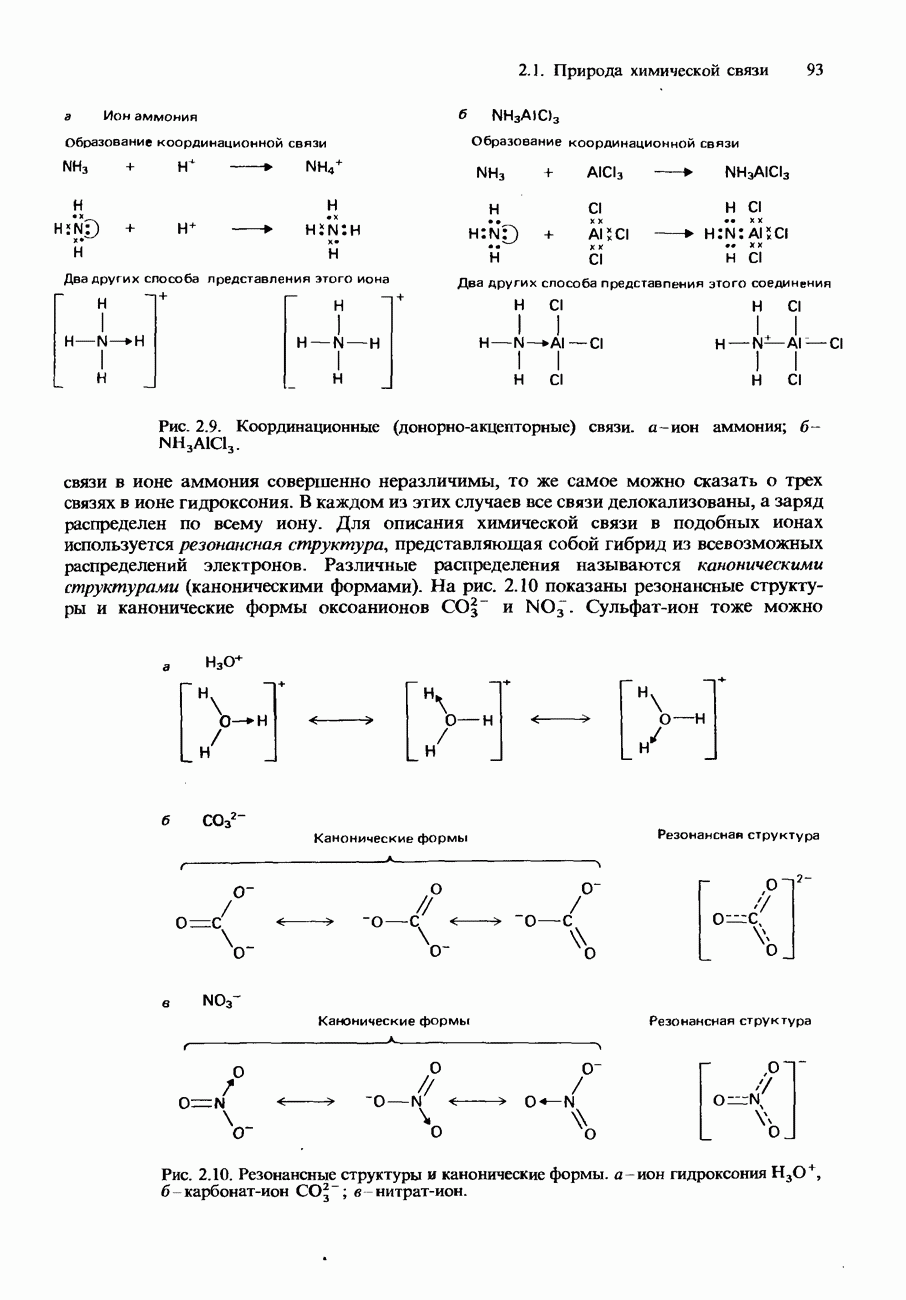
- Координационная связь
- ИОННЫЙ И КОВАЛЕНТНЫЙ ХАРАКТЕР СВЯЗИ
- Ионный характер ковалентных связей
- Ионные и ковалентные соединения
- МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
- Валентная зона и зона проводимости
- ВОДОРОДНАЯ СВЯЗЬ
- ВАНДЕРВААЛЬСОВЫ СИЛЫ
- Притяжение типа диполь-индуцированный диполь (индукционное)
- Что понимается под вандерваальсовыми силами
- 2.2. Влияние химической связи на свойства соединений
- Атомные радиусы
- ФОРМА ПРОСТЫХ МОЛЕКУЛ И МНОГОАТОМНЫХ ИОНОВ
- ТИП ХИМИЧЕСКОЙ СВЯЗИ, СТРУКТУРА И ФИЗИЧЕСКИЕ СВОЙСТВА
- ТИП СВЯЗИ И ХИМИЧЕСКИЕ СВОЙСТВА
- ВЛИЯНИЕ МЕЖМОЛЕКУЛЯРНЫХ СИЛ НА СТРУКТУРУ И СВОЙСТВА
- ВЛИЯНИЕ ВАНДЕРВААЛЬСОВЫХ СИЛ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 3 ГАЗЫ, ЖИДКОСТИ И ТВЕРДЫЕ ВЕЩЕСТВА
- 3.1. Газы и жидкости
- ГАЗОВЫЕ ЗАКОНЫ
- Закон Бойля-Мариотта
- Закон Гей-Люссака (закон Шарля)
- Объединенный газовый закон
- Закон Авогадро
- Экспериментальное определение относительной молекулярной массы
- Закон парциальных давлений газов (закон Дальтона)
- Законы Грэхема
- КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
- Скорости молекул
- Распределение Максвелла-Больцмана
- РЕАЛЬНЫЕ ГАЗЫ
- Уравнение Ван-дер-Ваальса
- Сжижение газов
- ЖИДКОСТИ
- Свойства жидкостей
- 3.2. Твердые вещества
- КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА
- Металлические кристаллы
- Ионные кристаллы
- Ковалентные кристаллы
- ИЗОМОРФИЗМ. ПОЛИМОРФИЗМ И АЛЛОТРОПИЯ
- СВОЙСТВА ТВЕРДЫХ ВЕЩЕСТВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 4. СТЕХИОМЕТРИЯ
- 4.1. Стехиометрия и номенклатура
- Химические вещества
- Количественные законы химии
- Вес и масса
- НАЗВАНИЯ И ФОРМУЛЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
- Химические формулы
- НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- Степень окисления (состояние окисления)
- Элементы
- Бинарные соединения
- 4.2 Стехиометрические вычисления
- Молярная масса
- Число частиц вещества
- Процентный состав соединения
- Эмпирическая формула соединения
- Молярные постоянные и молярные величины
- Состав гомогенных смесей
- ХИМИЧЕСКИЕ УРАВНЕНИЯ
- ВЫХОД РЕАКЦИИ
- ПРОМЫШЛЕННАЯ СТЕХИОМЕТРИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 5. ЭНЕРГЕТИКА
- 5.1. Термодинамика
- ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
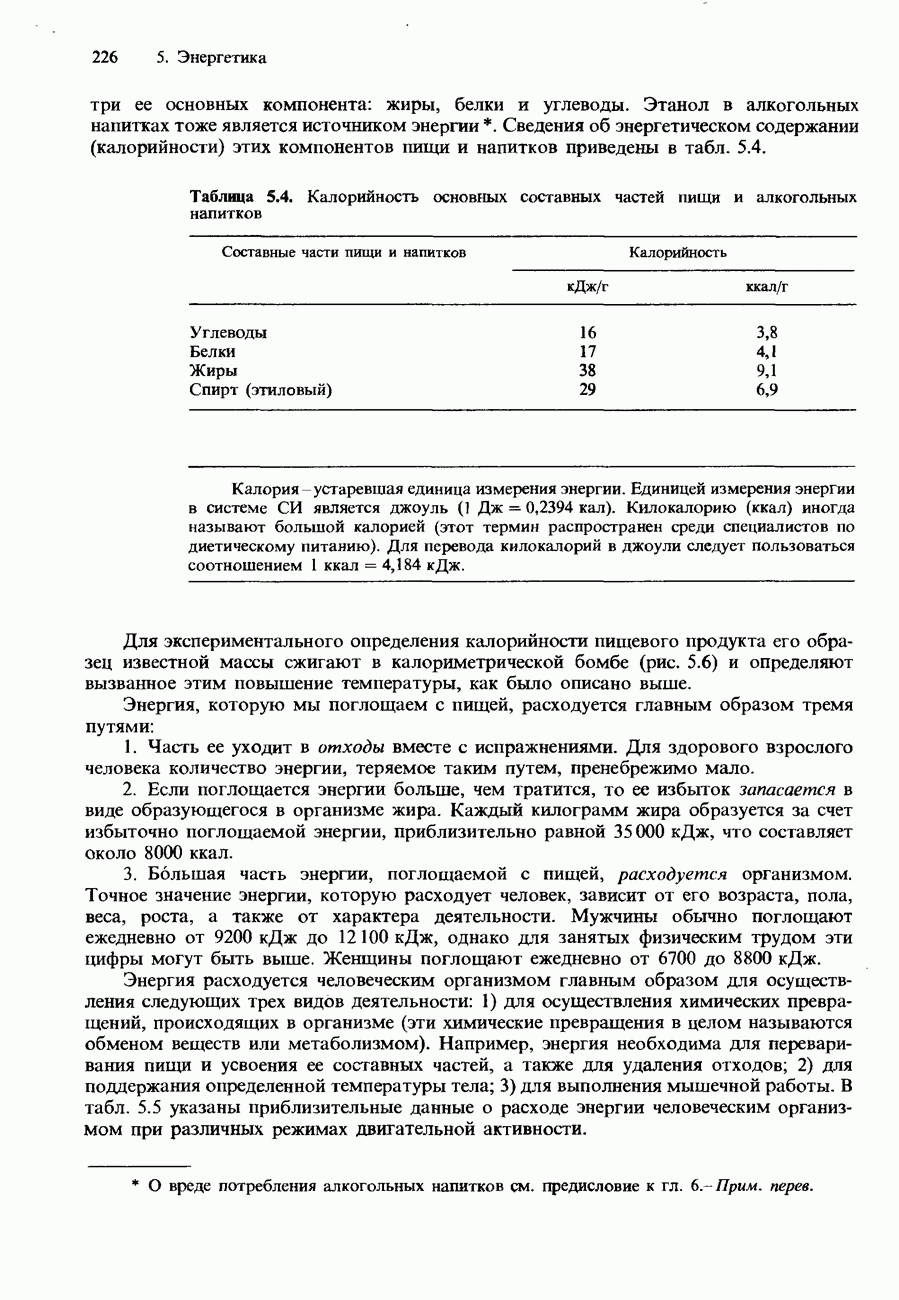
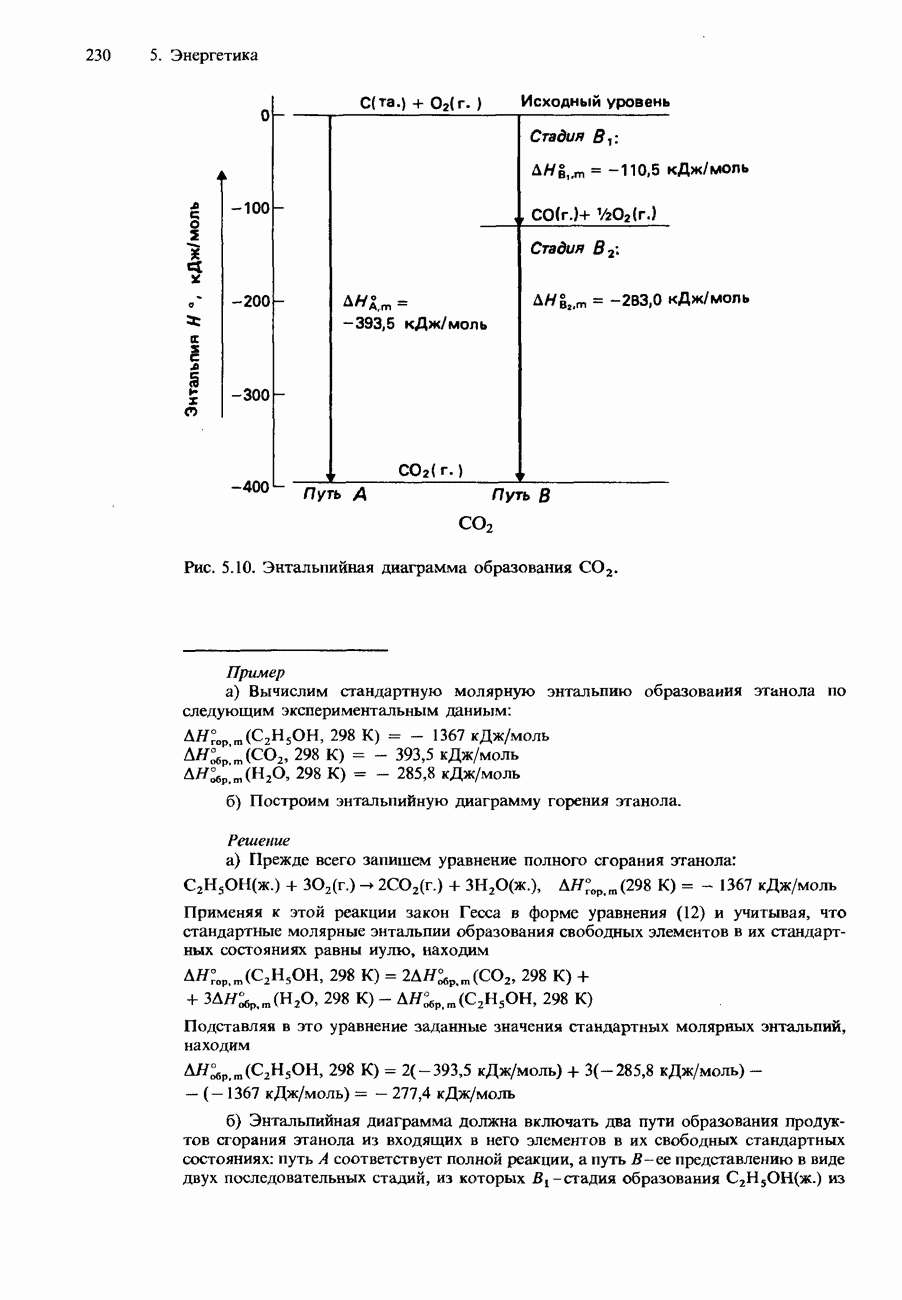
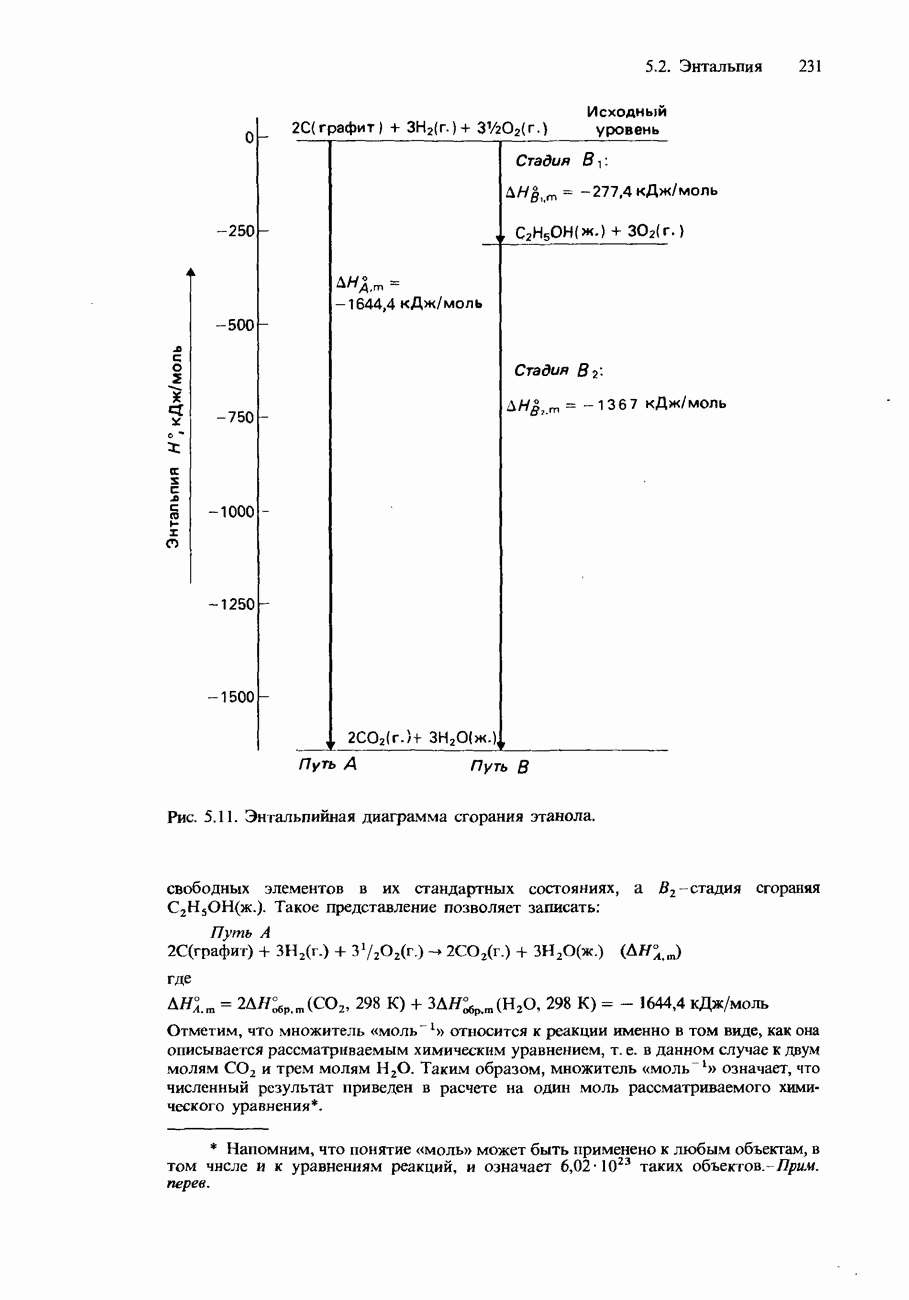
- 5.2. Энтальпия
- СТАНДАРТНЫЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ
- ДРУГИЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ
- КАЛОРИМЕТРИЯ
- КАЛОРИЙНОСТЬ ПИЩИ
- ЗАКОН ГЕССА
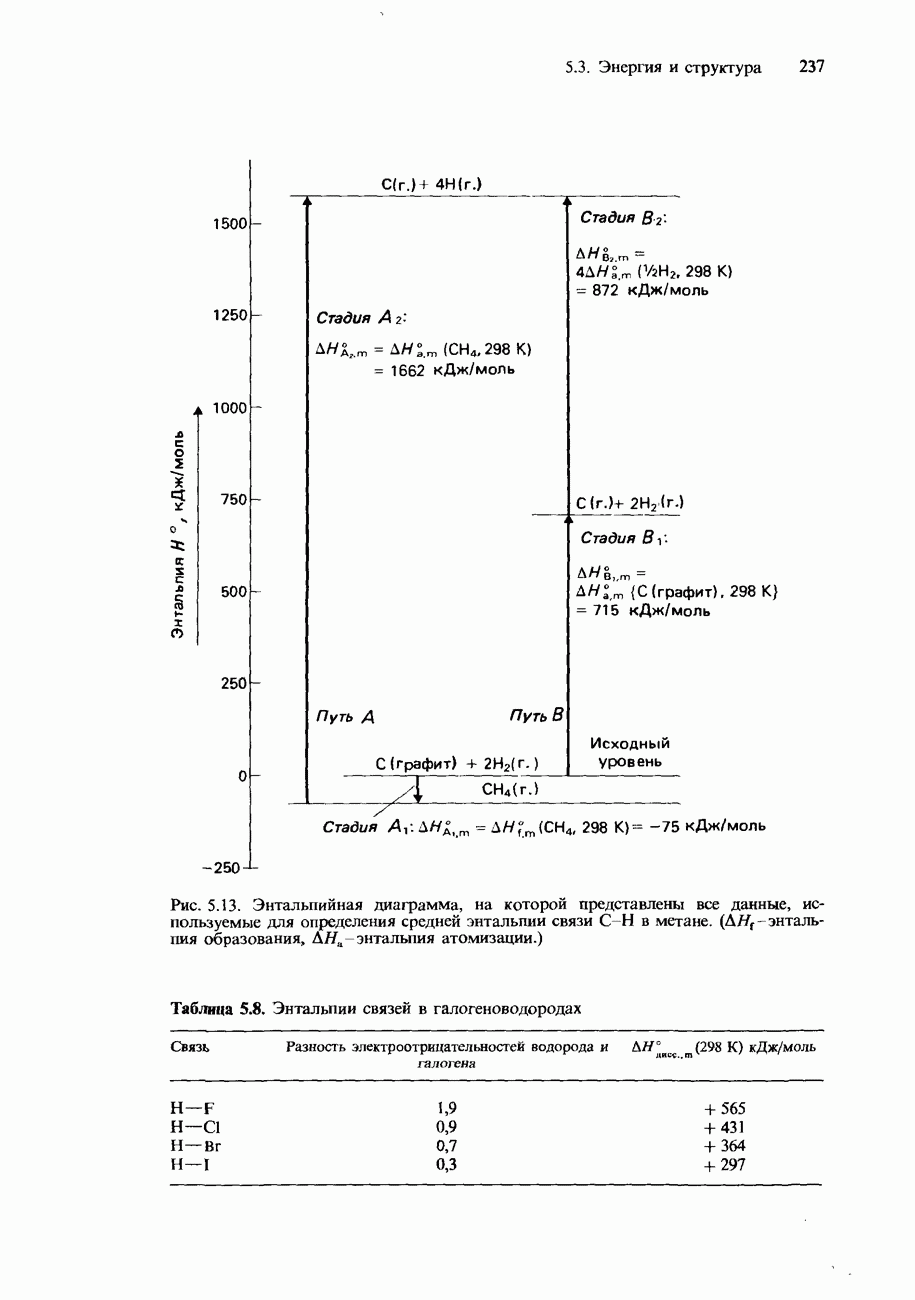
- 5.3 Энергия и структура
- ЭНТАЛЬПИЯ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
- Энтальпии растворения и гидратации
- ЭНТРОПИЯ
- СВОБОДНАЯ ЭНЕРГИЯ ГИББСА
- О ЧЕМ ПОЗВОЛЯЕТ СУДИТЬ ИЗМЕНЕНИЕ СВОБОДНОЙ ЭНЕРГИИ СИСТЕМЫ
- 5.4. Источники энергии
- НЕТРАДИЦИОННЫЕ ИСТОЧНИКИ ЭНЕРГИИ
- ЗАПАСАНИЕ ЭНЕРГИИ
- ПОТРЕБЛЕНИЕ ЭНЕРГИИ В ПРОШЛОМ, НАСТОЯЩЕМ И БУДУЩЕМ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 6. ФАЗОВЫЕ РАВНОВЕСИЯ
- 6.1. Равновесия и фазы
- ФАЗЫ И КОМПОНЕНТЫ
- Фазы
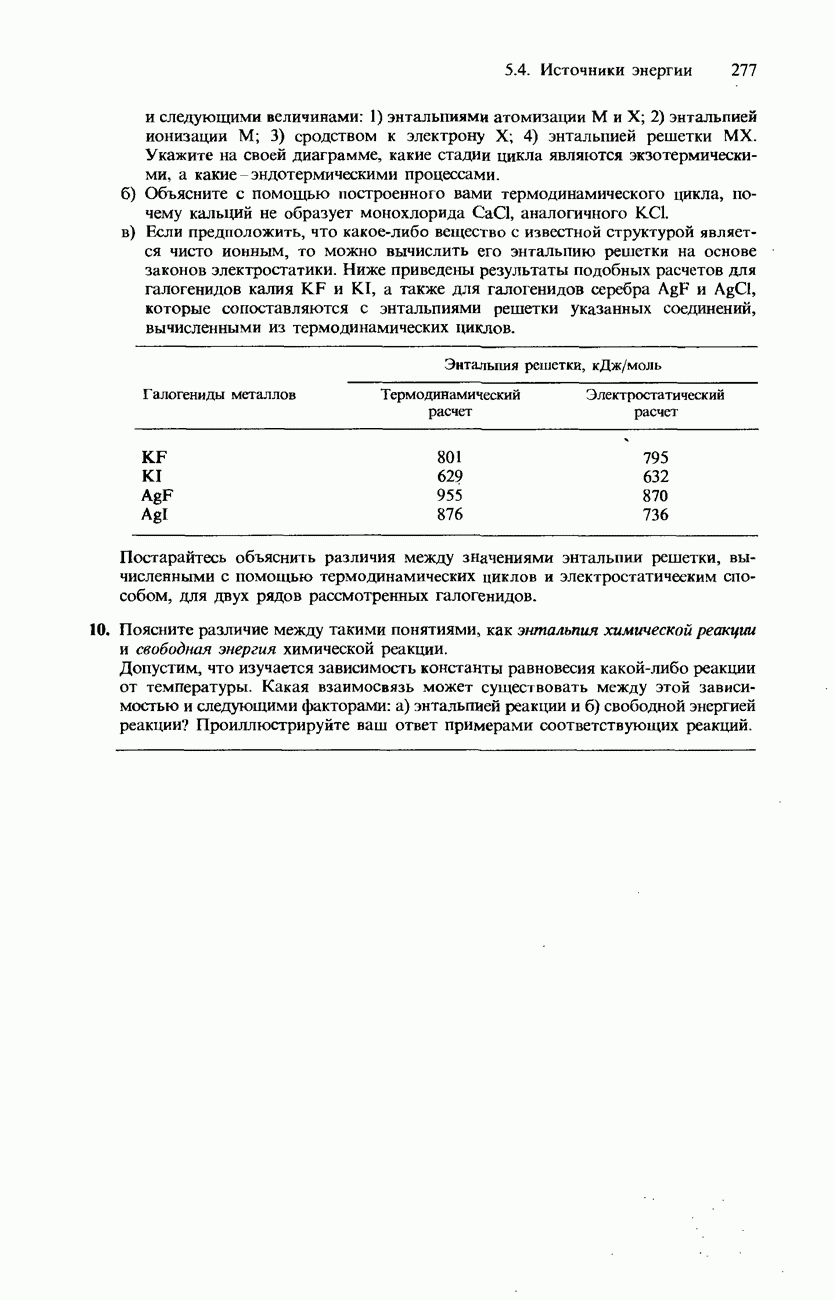
- ФАЗОВАЯ ДИАГРАММА ВОДЫ
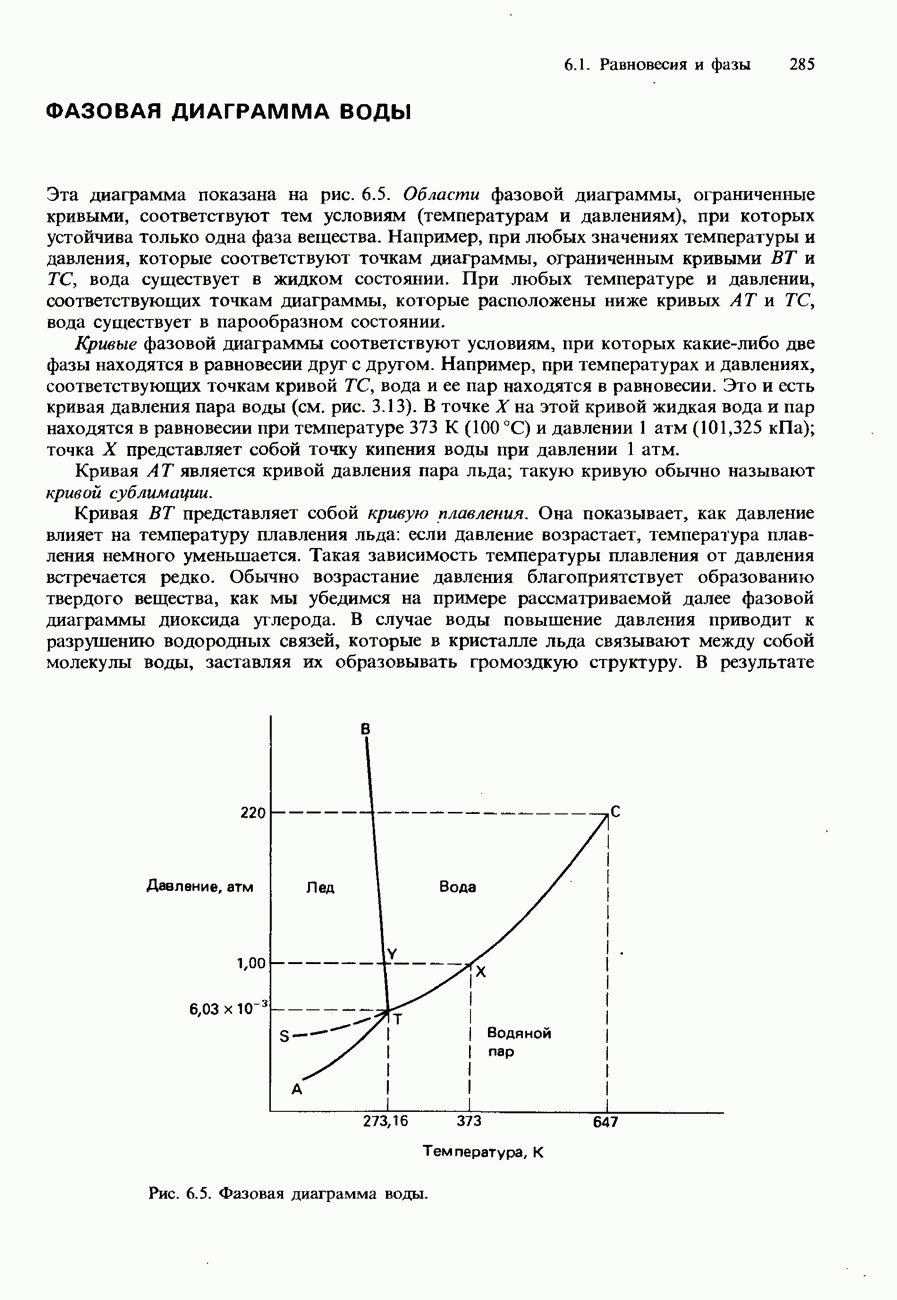
- ФАЗОВАЯ ДИАГРАММА ДИОКСИДА УГЛЕРОДА
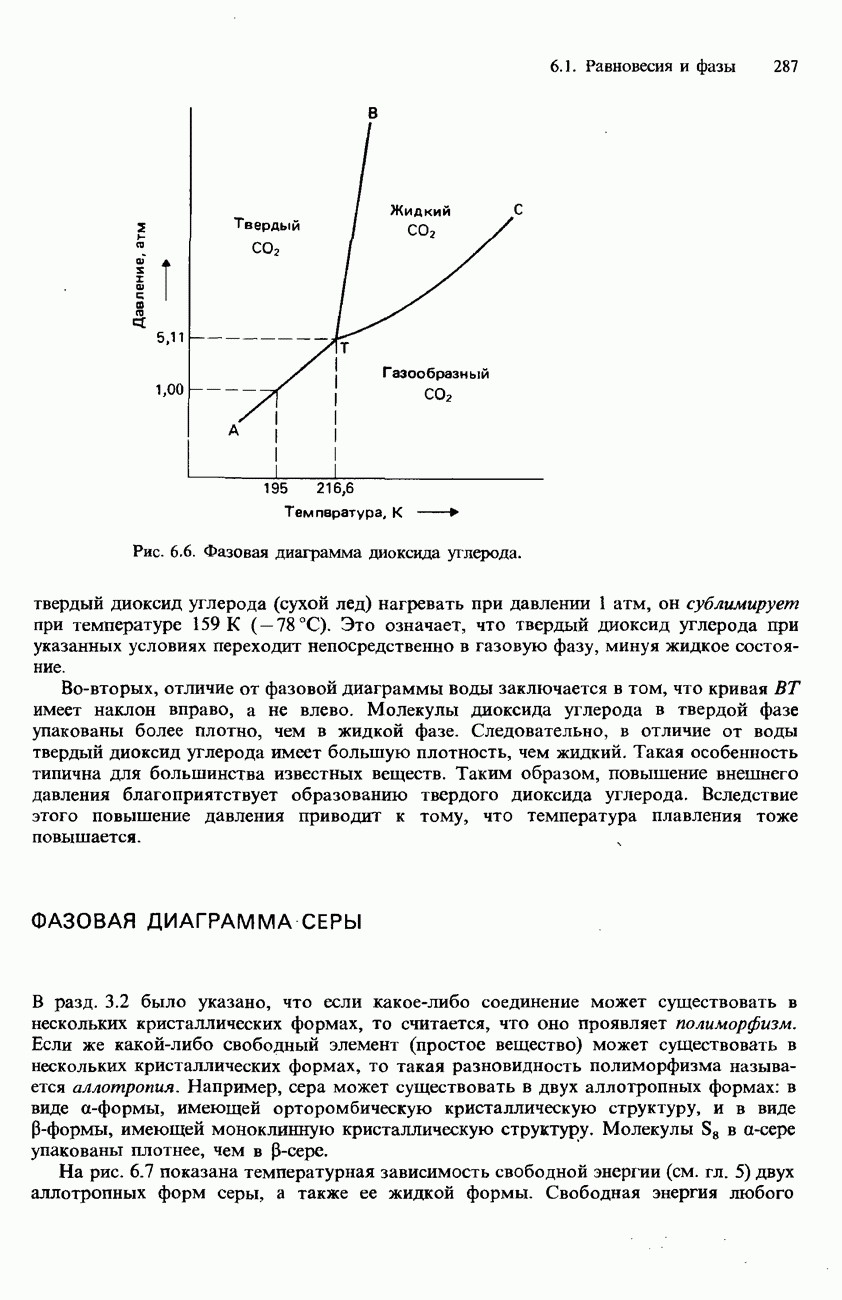
- ФАЗОВАЯ ДИАГРАММА СЕРЫ
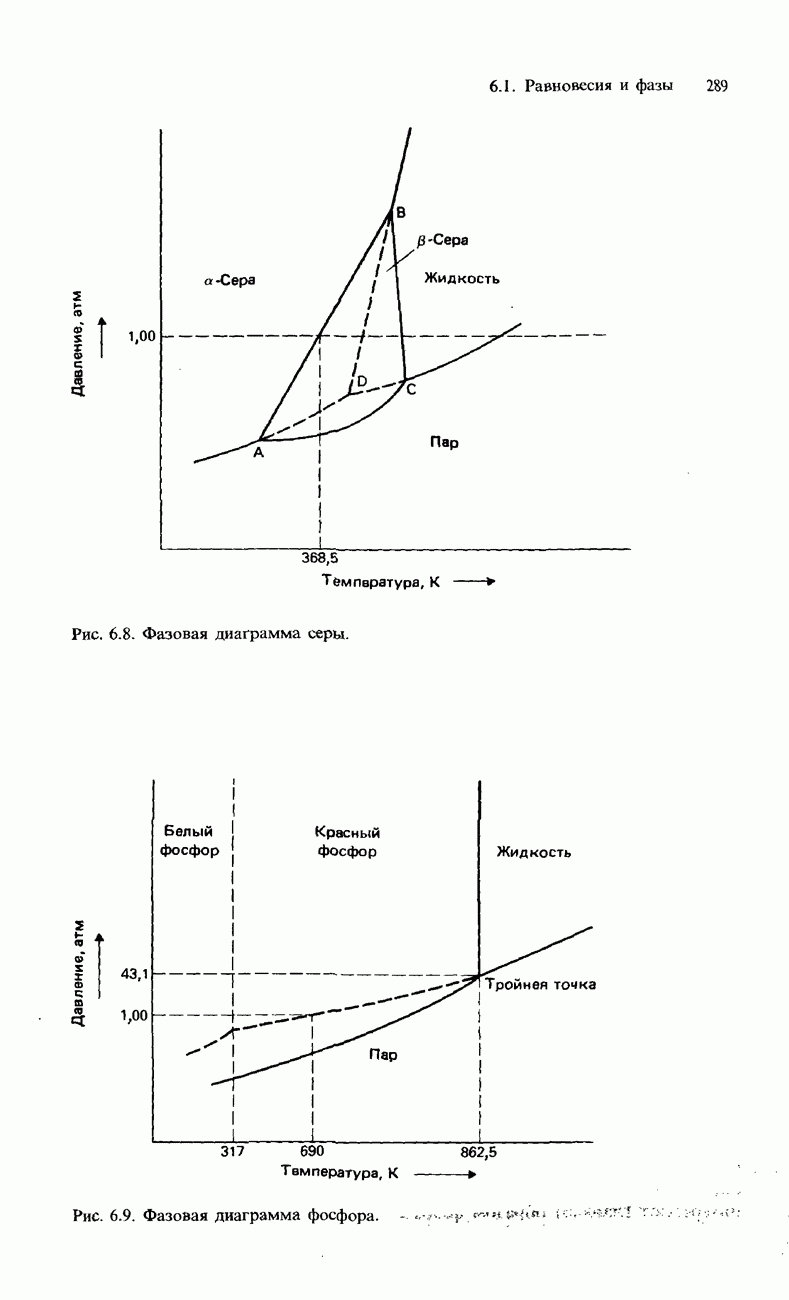
- ФАЗОВАЯ ДИАГРАММА ФОСФОРА
- 6.2. Многокомпонентные системы
- ДВУХКОМПОНЕНТНЫЕ ЖИДКИЕ СМЕСИ
- ПОЛНОСТЬЮ СМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
- Фазовые диаграммы полностью смешивающихся жидкостей
- Фракционная перегонка
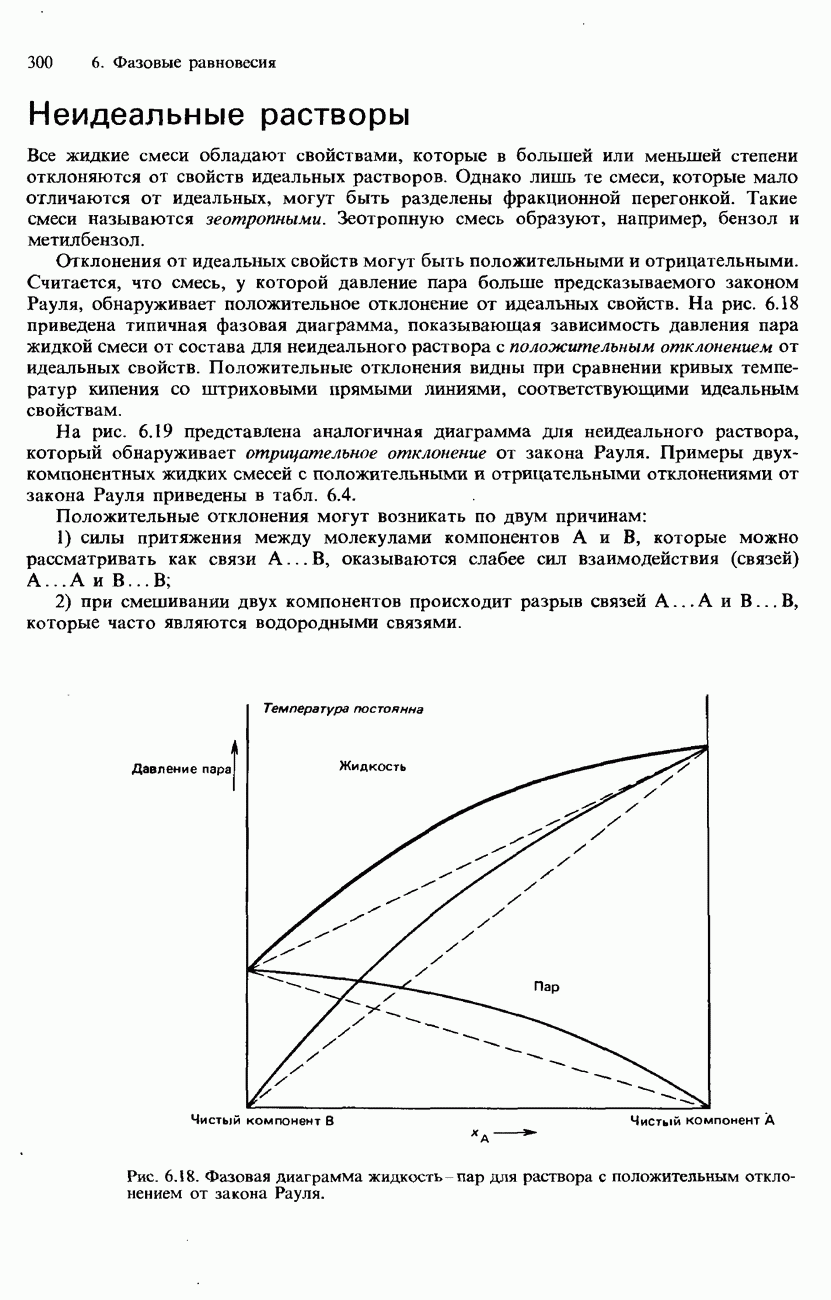
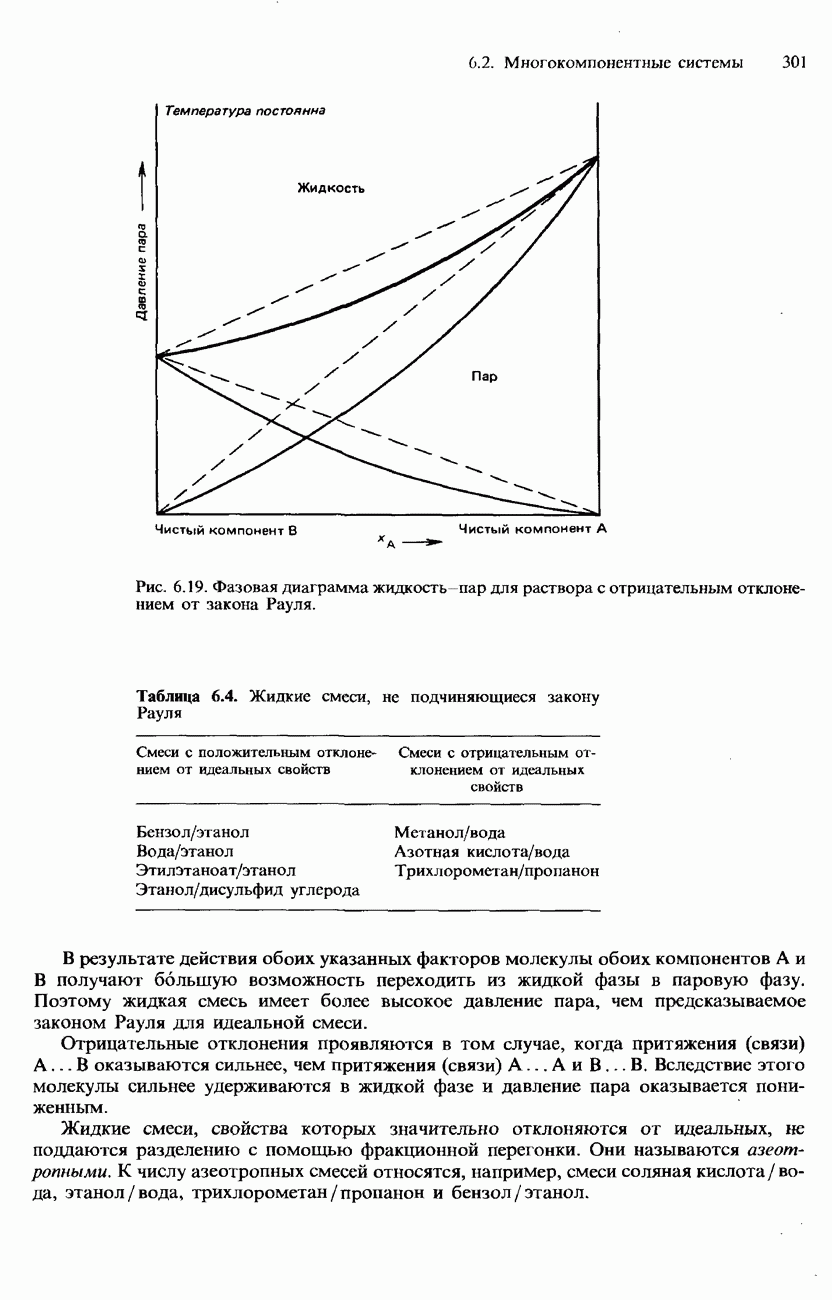
- Неидеальные растворы
- ЧАСТИЧНО СМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
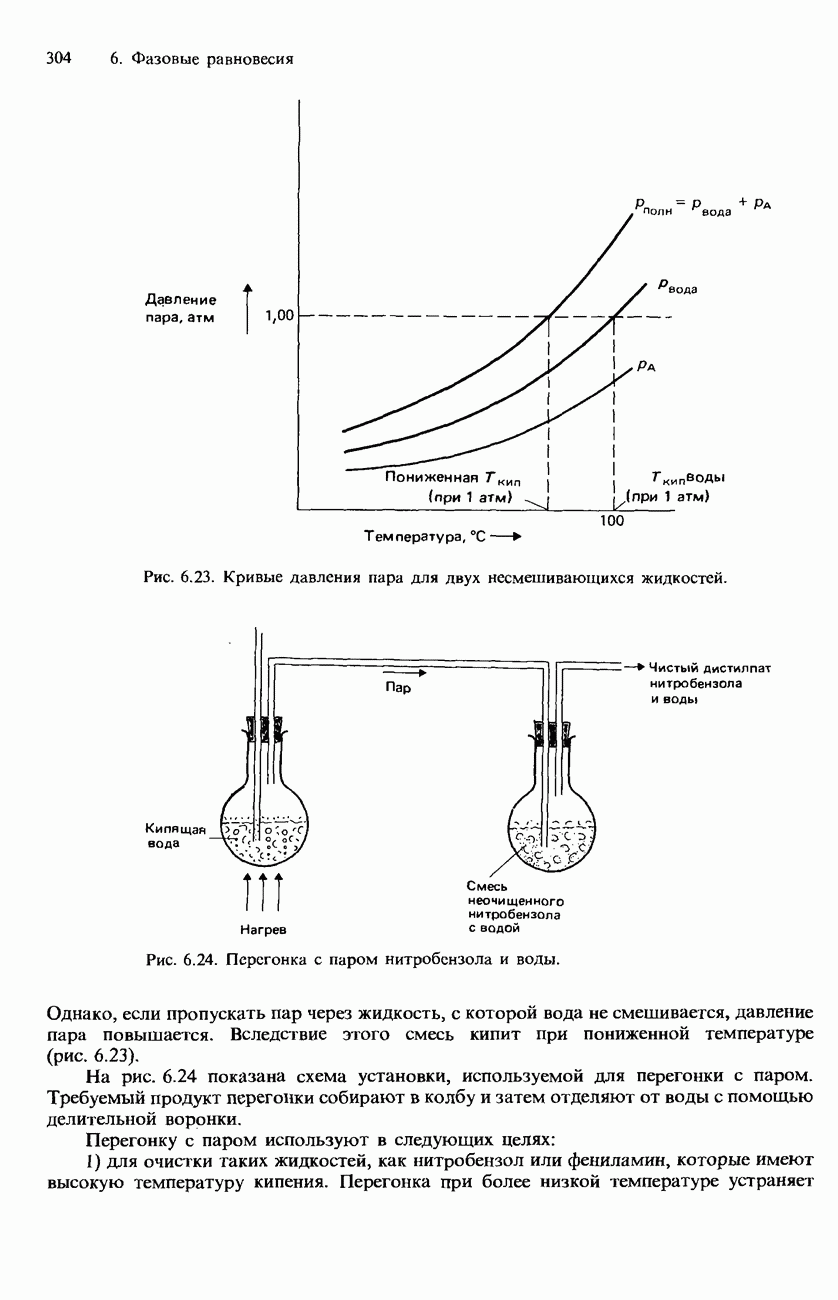
- НЕСМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
- РАВНОВЕСИЯ ТВЕРДОЕ ВЕЩЕСТВО-ЖИДКОСТЬ
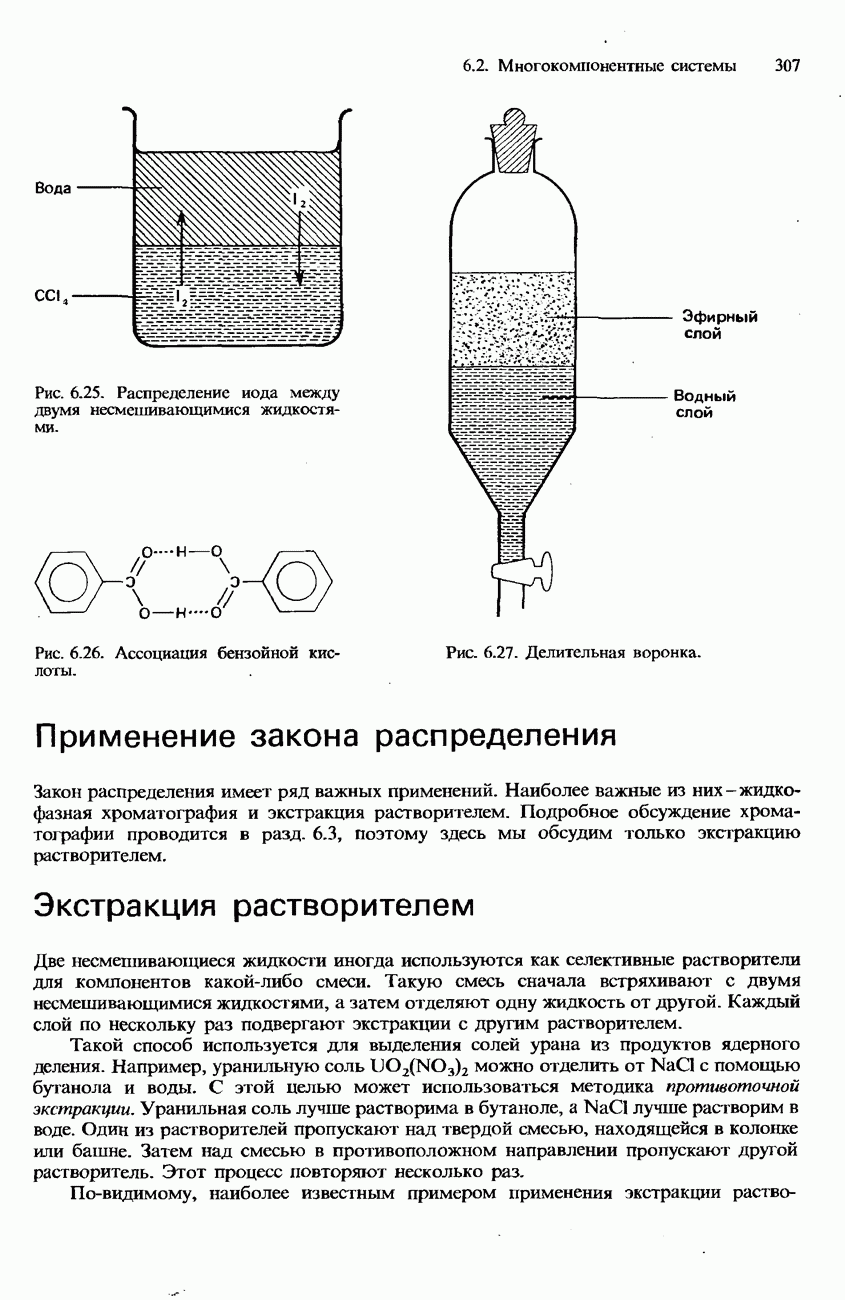
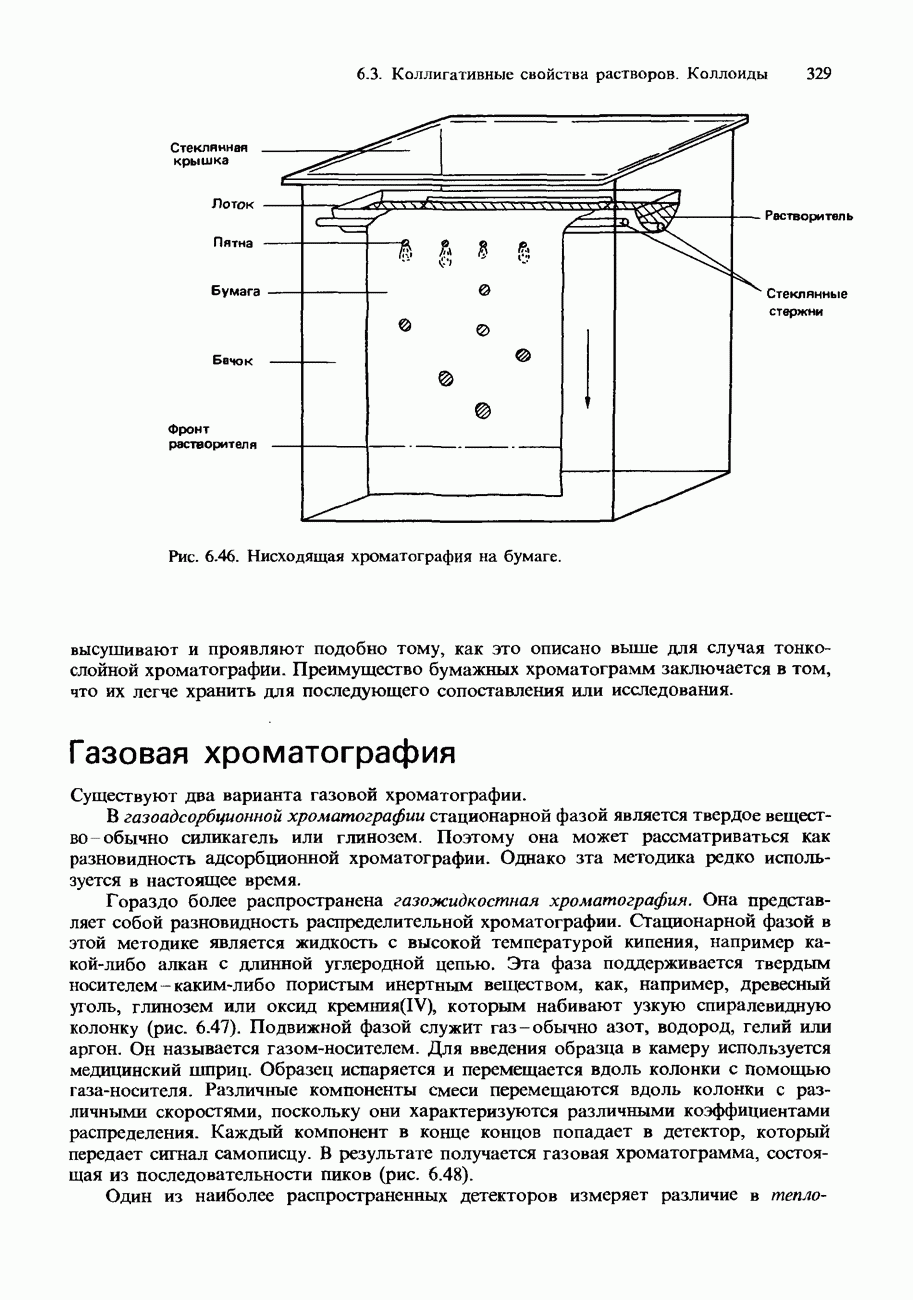
- 6.3. Коллигативные свойства растворов. Коллоиды Хроматография
- КОЛЛОИДЫ
- ХРОМАТОГРАФИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 7.1. Константа равновесия
- ЗАКОН ДЕЙСТВУЮЩИХ МАСС
- ВЛИЯНИЕ УСЛОВИЙ ПРОТЕКАНИЯ РЕАКЦИИ НА ПОЛОЖЕНИЕ РАВНОВЕСИЯ
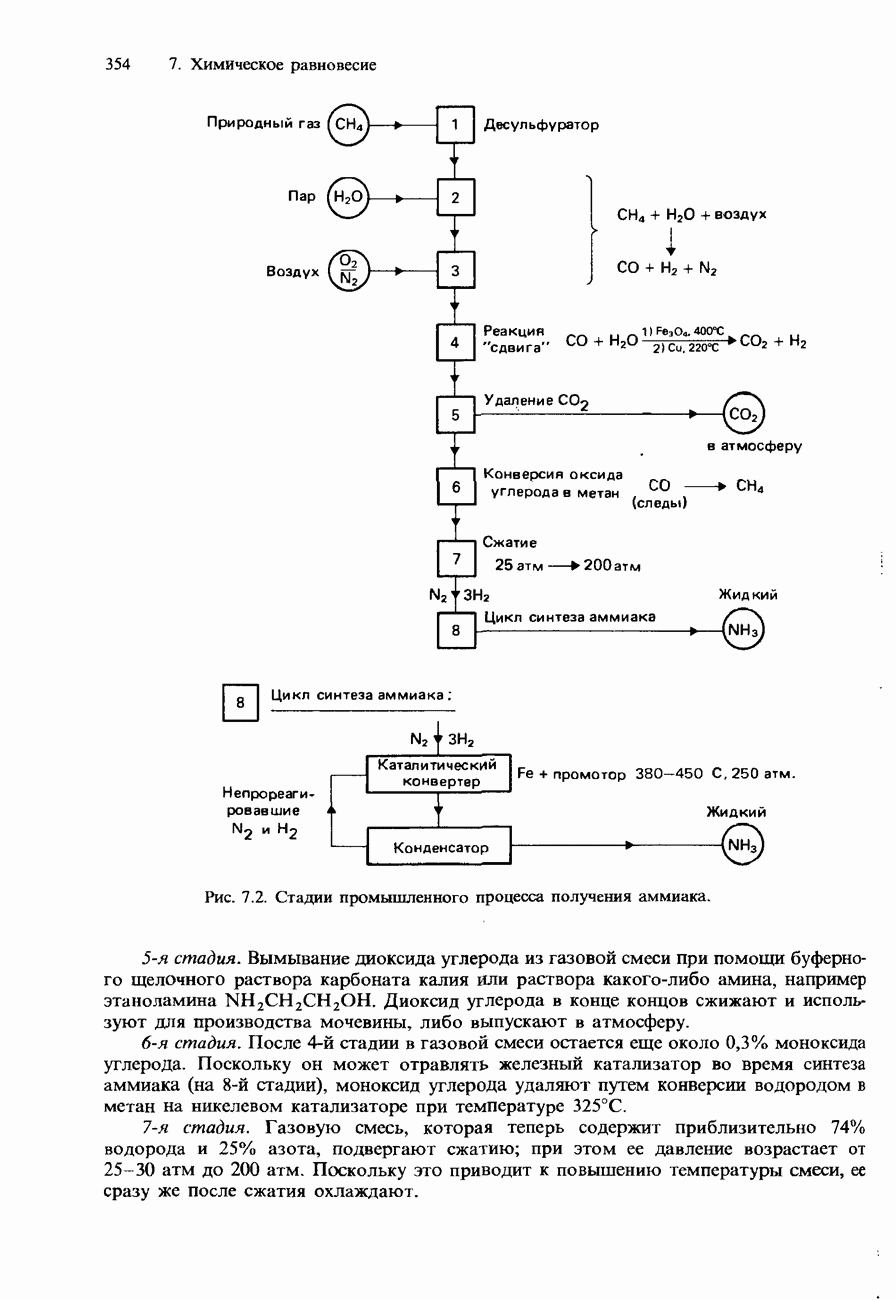
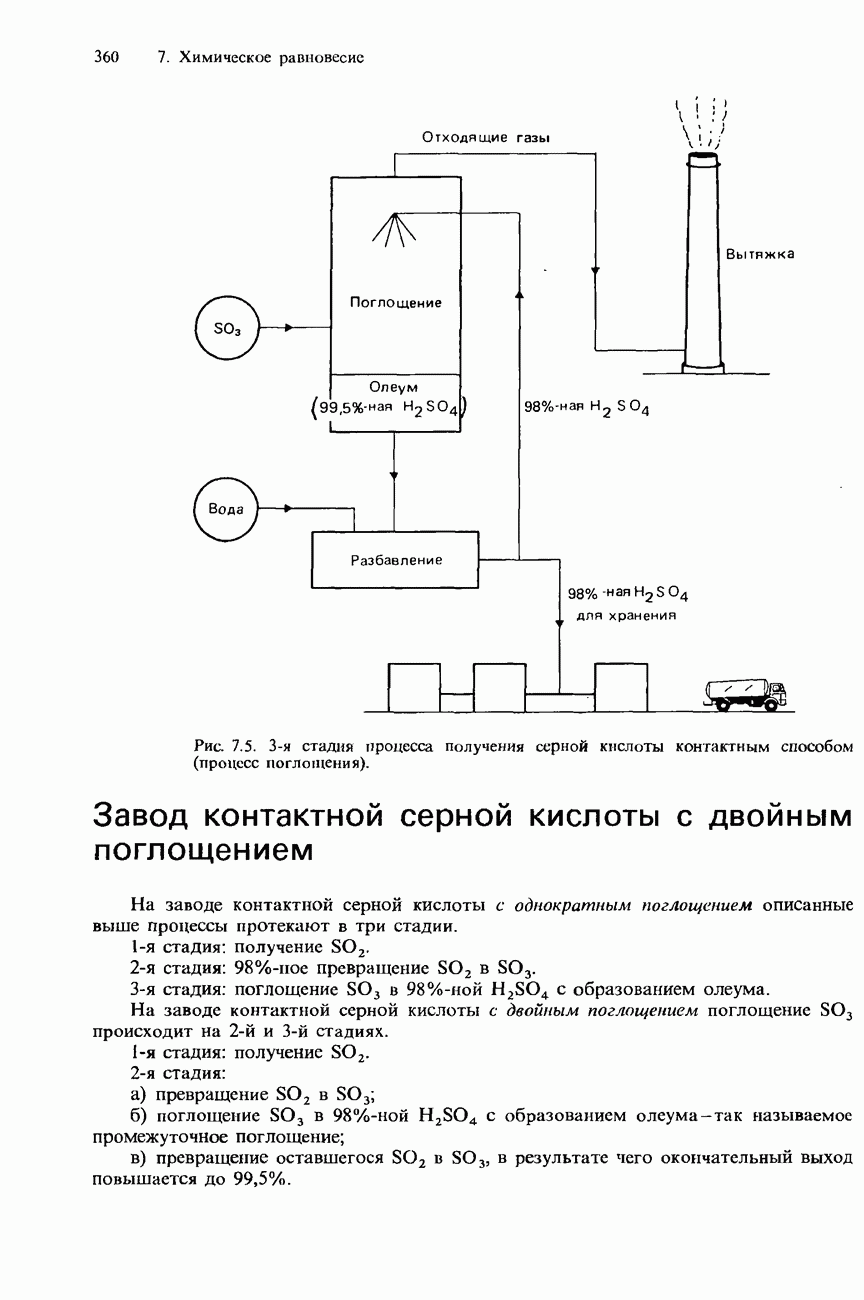
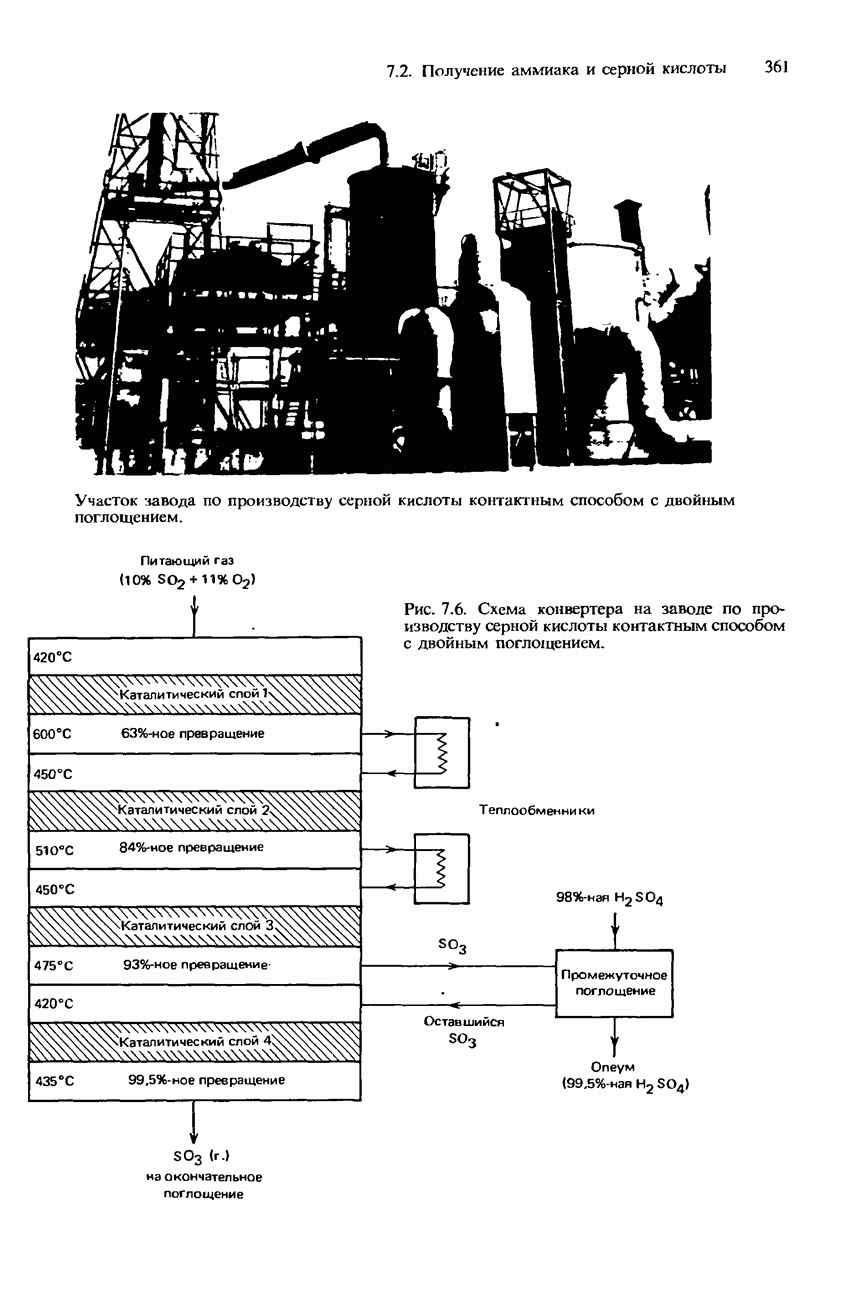
- 7.2. Получение аммиака и серной кислоты
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СЕРНОЙ КИСЛОТЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 8. ИОНЫ
- 8.1. Кислоты и основания
- ЭЛЕКТРОЛИТЫ
- КИСЛОТЫ И ОСНОВАНИЯ
- КОНСТАНТЫ ДИССОЦИАЦИИ
- ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ pH ШКАЛА ЕГО ЗНАЧЕНИЙ
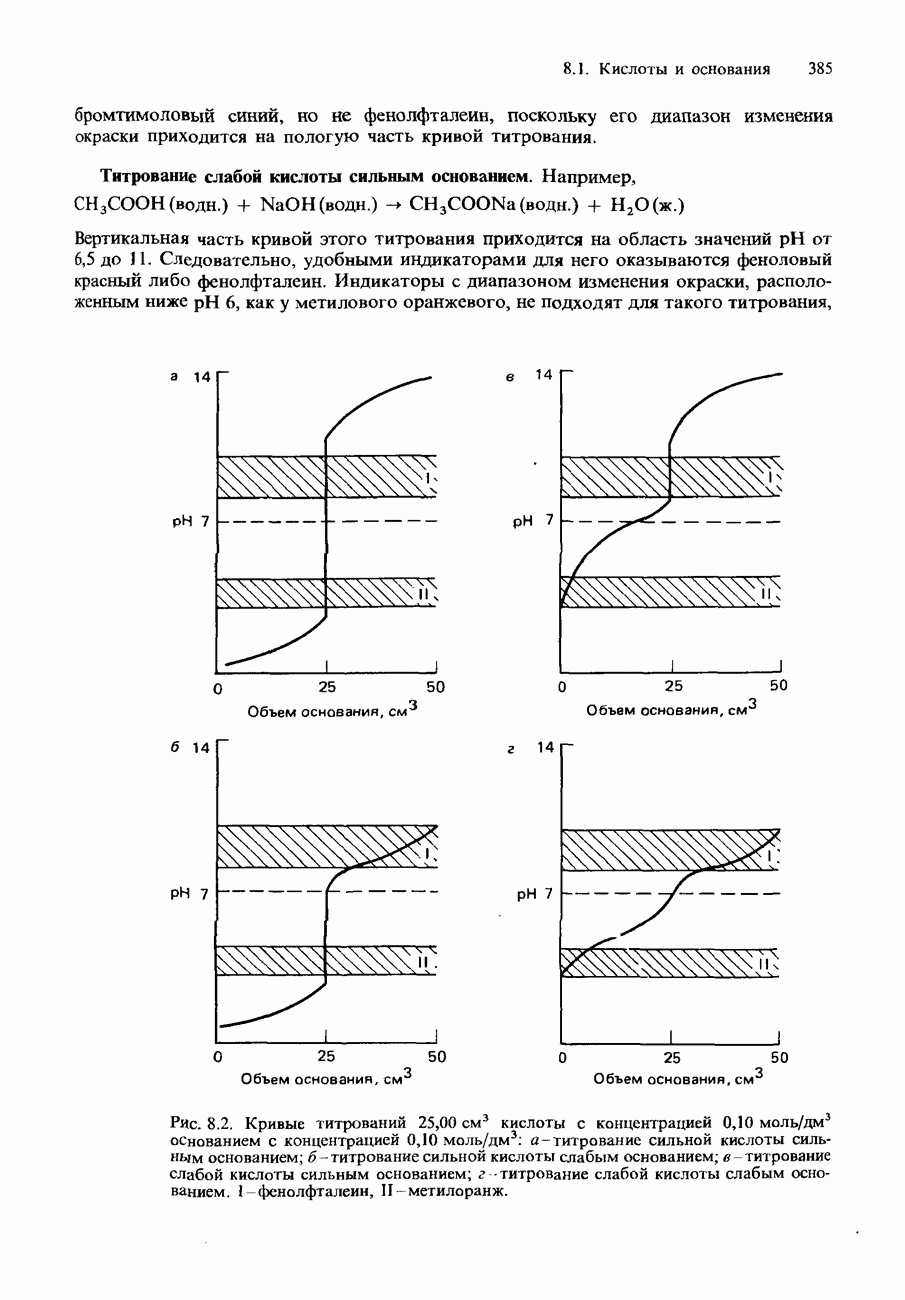
- КИСЛОТНО-ОСНОВНЫЕ ИНДИКАТОРЫ И ТИТРОВАНИЕ
- 8.2. Соли, растворимость и устойчивость
- БУФЕРНЫЕ РАСТВОРЫ
- РАСТВОРИМОСТЬ
- РАВНОВЕСИЯ С УЧАСТИЕМ КОМПЛЕКСНЫХ ИОНОВ
- ИОННЫЙ ОБМЕН
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 9. ХИМИЧЕСКАЯ КИНЕТИКА
- 9.1. Скорость химической реакции
- МЕТОДЫ ИЗМЕРЕНИЯ СКОРОСТИ РЕАКЦИЙ
- СКОРОСТЬ РЕАКЦИИ И КОНЦЕНТРАЦИИ РЕАГЕНТОВ
- ЗАВИСИМОСТЬ КОНСТАНТЫ СКОРОСТИ ОТ ТЕМПЕРАТУРЫ УРАВНЕНИЕ АРРЕНИУСА
- 9.2. Механизмы реакций и катализ
- ТЕОРИЯ СТОЛКНОВЕНИЙ
- ТЕОРИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ
- ЦЕПНЫЕ РЕАКЦИИ
- КАТАЛИЗ
- ТИПЫ КАТАЛИЗАТОРОВ
- ГОМОГЕННЫЙ КАТАЛИЗ
- ГЕТЕРОГЕННЫЙ КАТАЛИЗ
- ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 10. ЭЛЕКТРОХИМИЯ
- 10.1. Электропроводность
- ПРОВОДНИКИ ЭЛЕКТРИЧЕСКОГО ТОКА И ЭЛЕКТРОПРОВОДНОСТЬ
- МОЛЯРНАЯ ПРОВОДИМОСТЬ
- КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- 10.2. Окислительно-восстановительные процессы
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- ОПРЕДЕЛЕНИЕ СТЕХИОМЕТРИЧЕСКИХ КОЭФФИЦИЕНТОВ
- СТЕПЕНЬ ОКИСЛЕНИЯ
- ОКИСЛИТЕЛИ
- ВОССТАНОВИТЕЛИ
- ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
- 10.3. Электролиз
- ЗАКОНЫ ЭЛЕКТРОЛИЗА ФАРАДЕЯ
- ПРОМЫШЛЕННЫЕ ПРИМЕНЕНИЯ ЭЛЕКТРОЛИЗА
- 10.4. Химические источники тока
- СХЕМЫ ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА
- ТИПЫ ПОЛУЭЛЕМЕНТОВ
- ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
- ЭЛЕКТРОДВИЖУЩАЯ СИЛА ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА
- ИЗМЕРЕНИЕ Э.Д.С. ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА И ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ
- 10.5. Применения электрохимии
- ВЫЧИСЛЕНИЕ КОНСТАНТ РАВНОВЕСИЯ ДЛЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
- ОПРЕДЕЛЕНИЕ pH РАСТВОРА
- ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- ОСУЩЕСТВИМОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
- ОПРЕДЕЛЕНИЕ ВЕЛИЧИНЫ AG
- БАТАРЕИ И ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ ТОКА
- МЕТАЛЛУРГИЯ
- КОРРОЗИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ