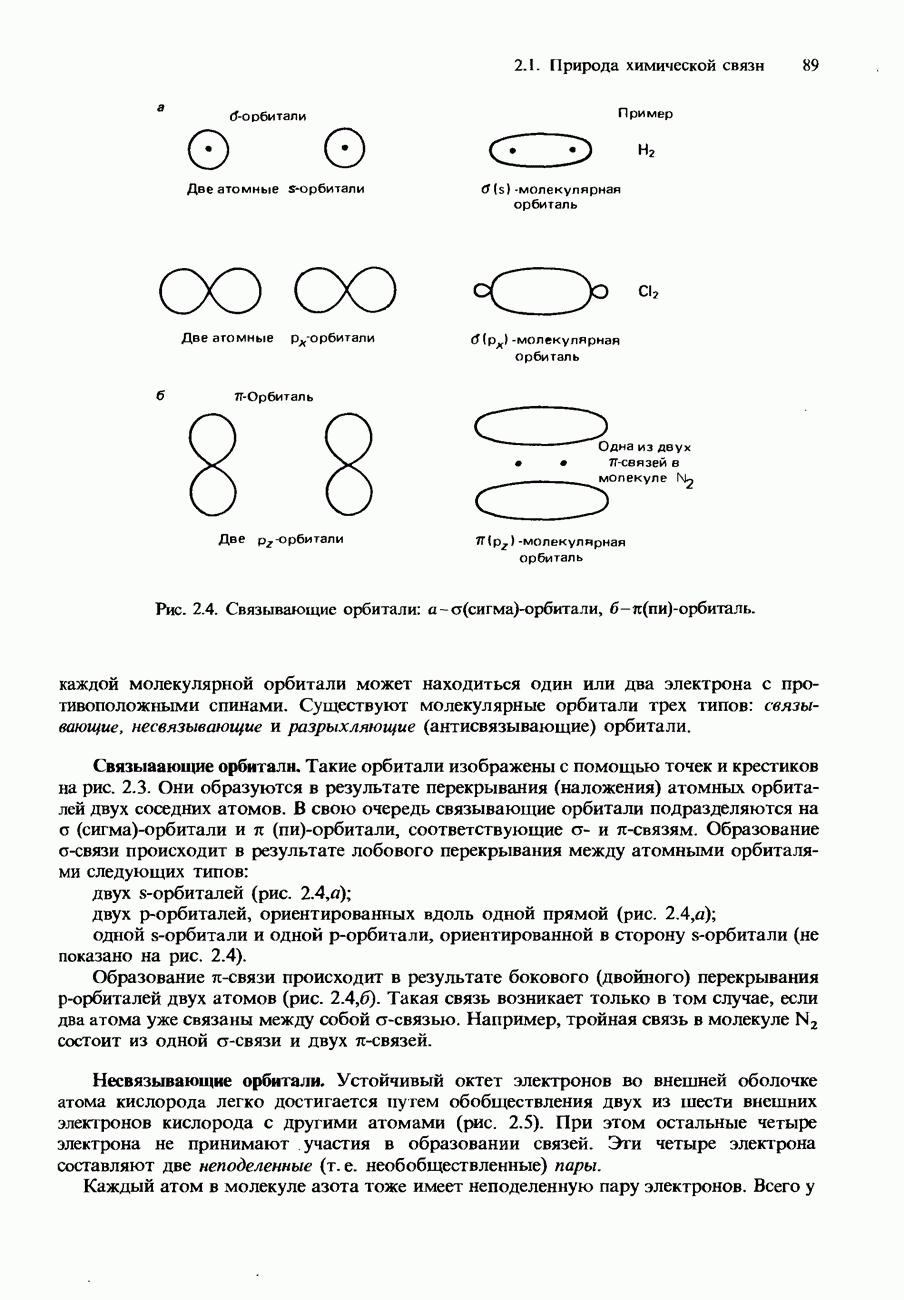
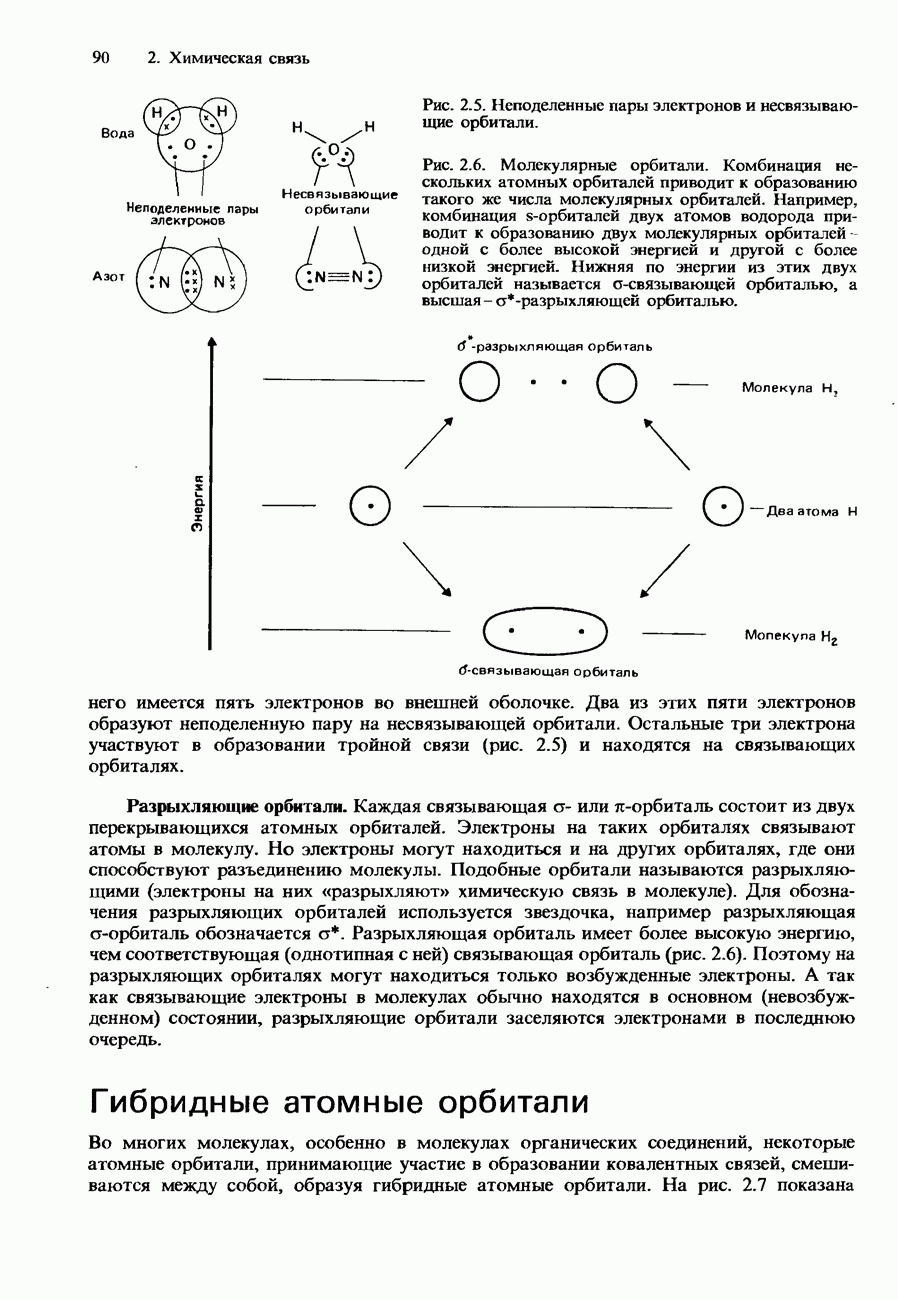
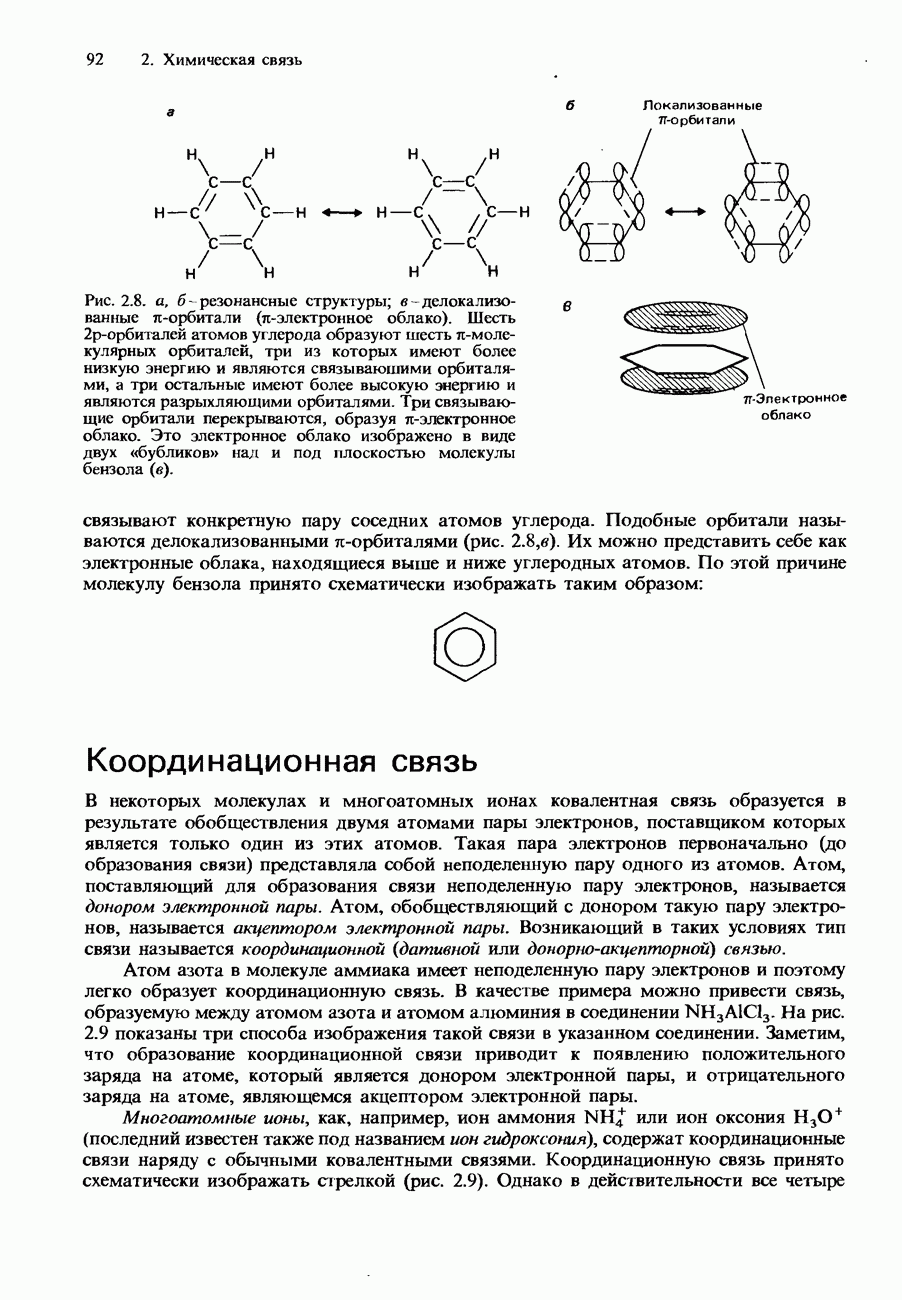
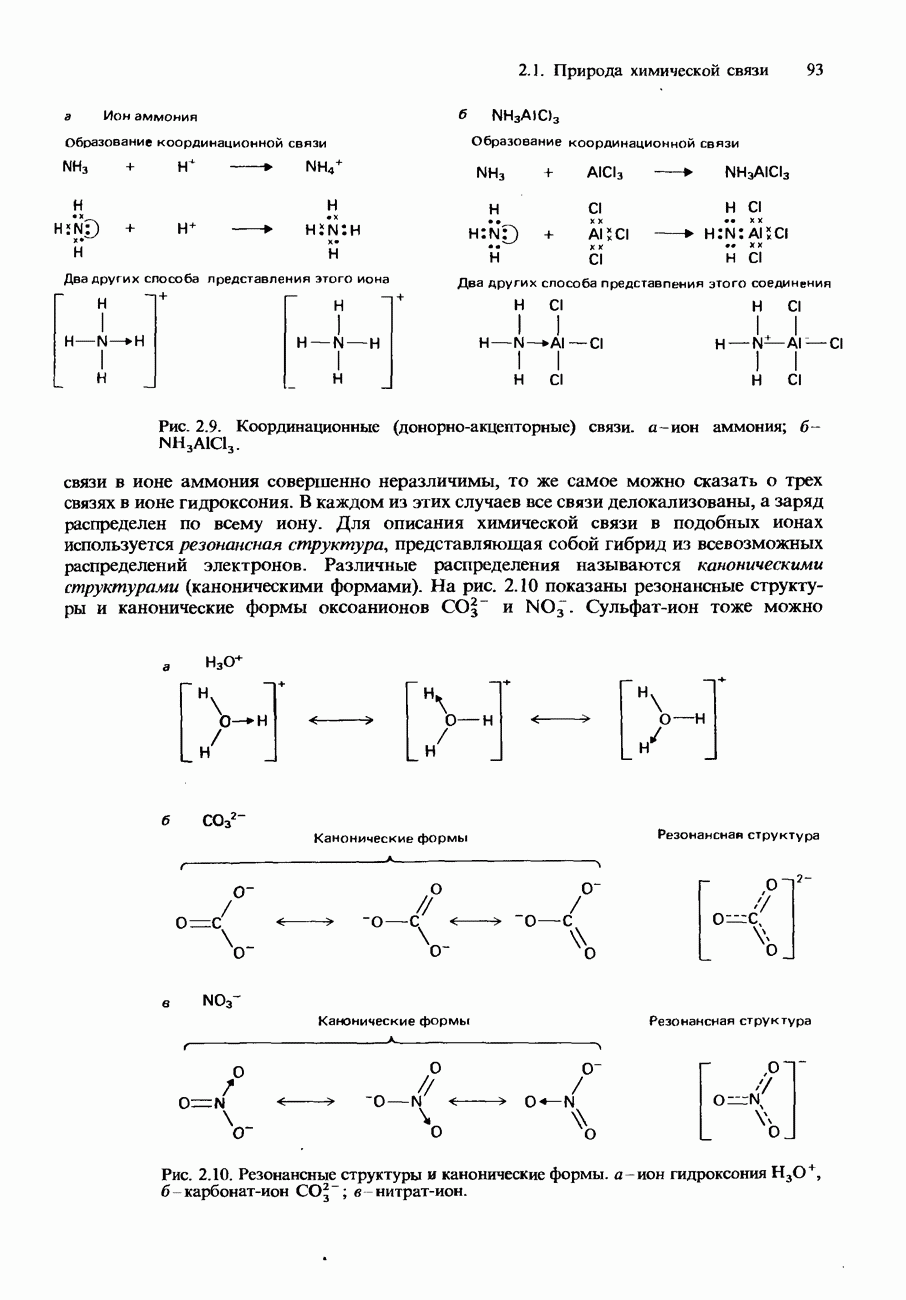
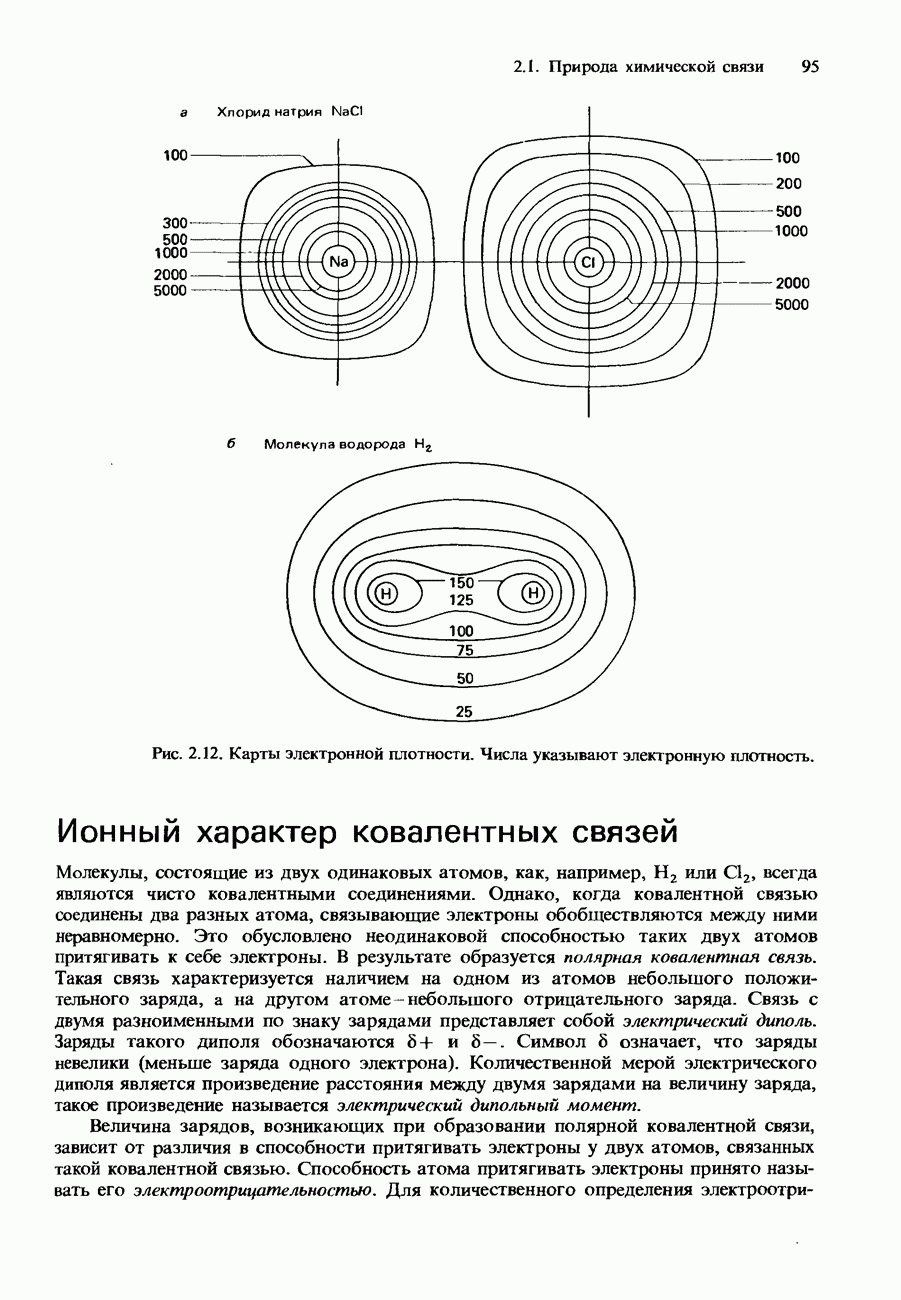
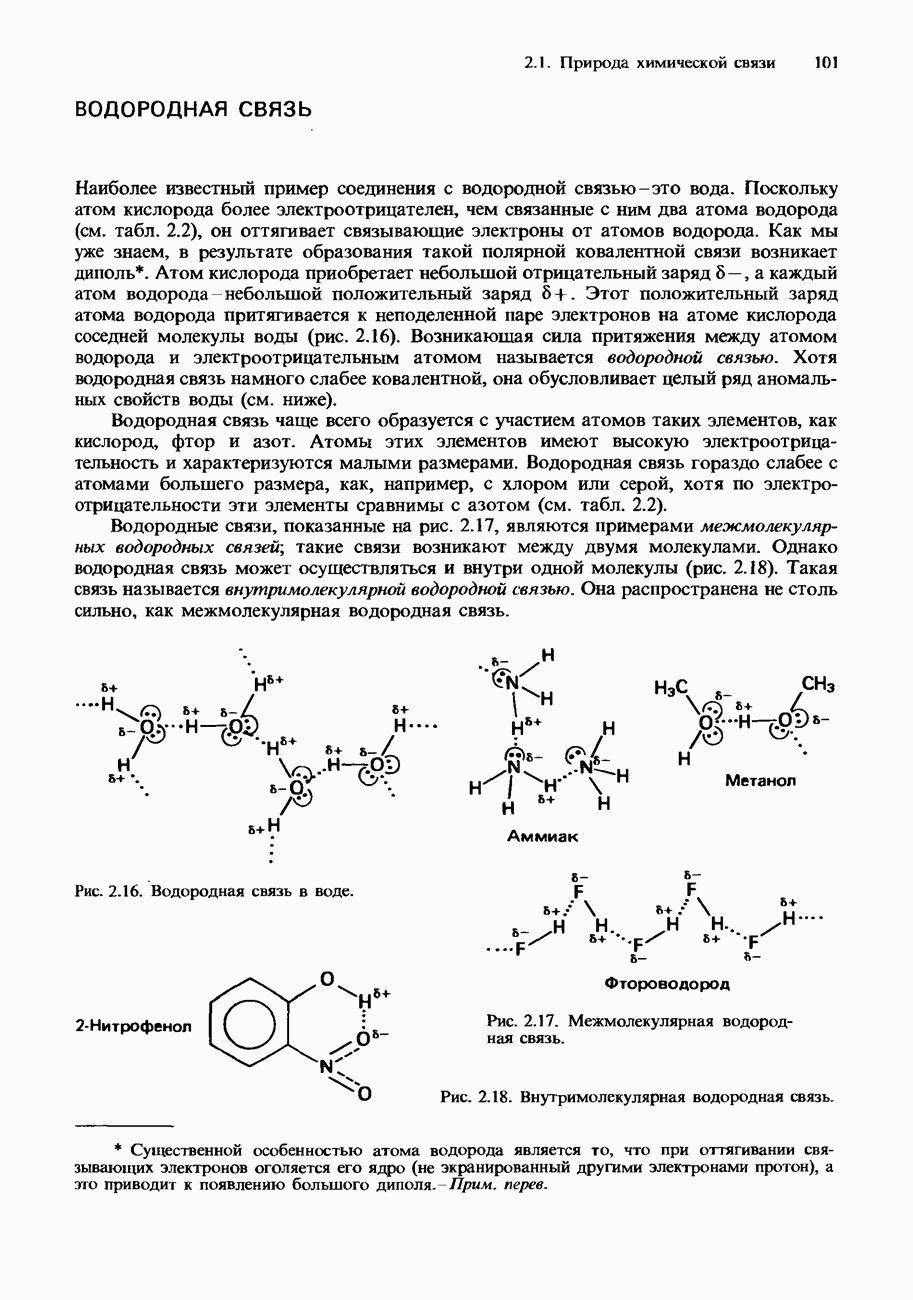
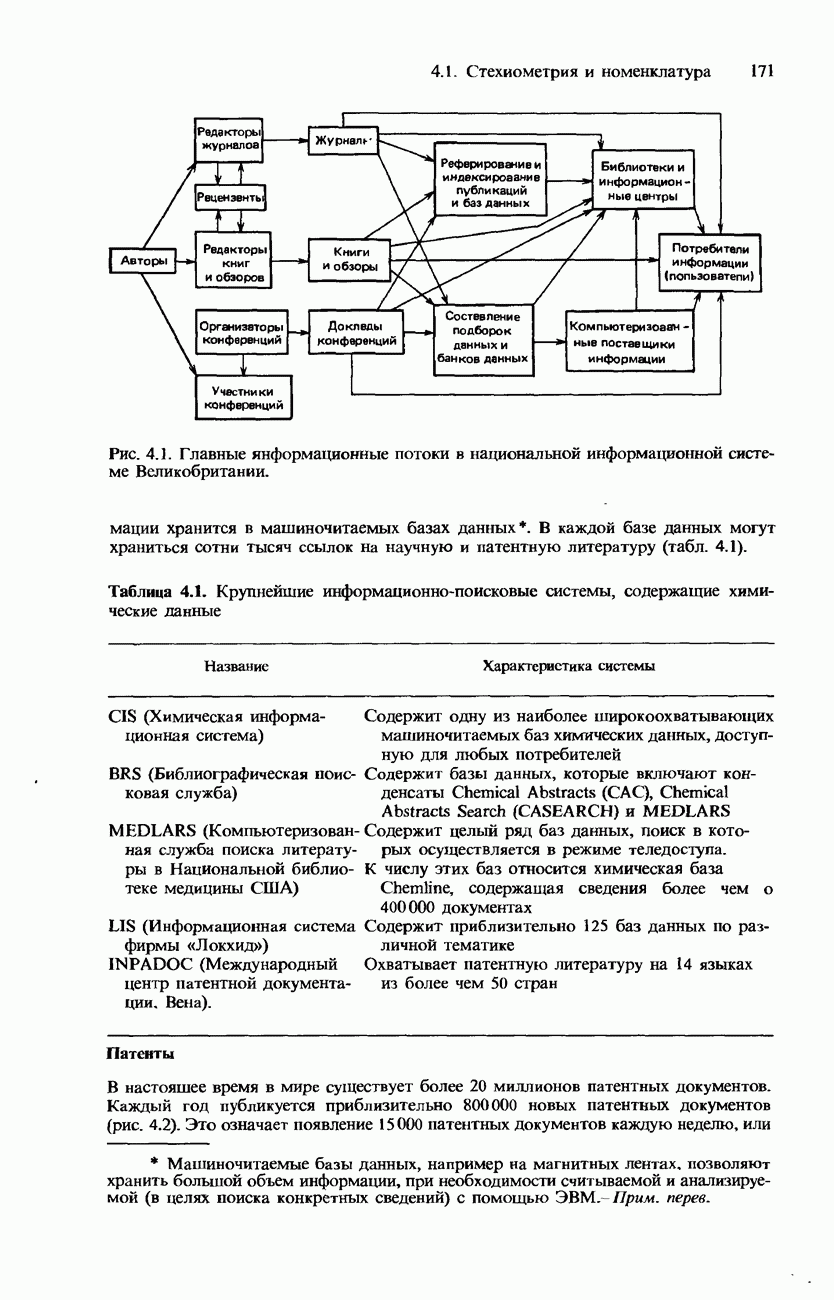
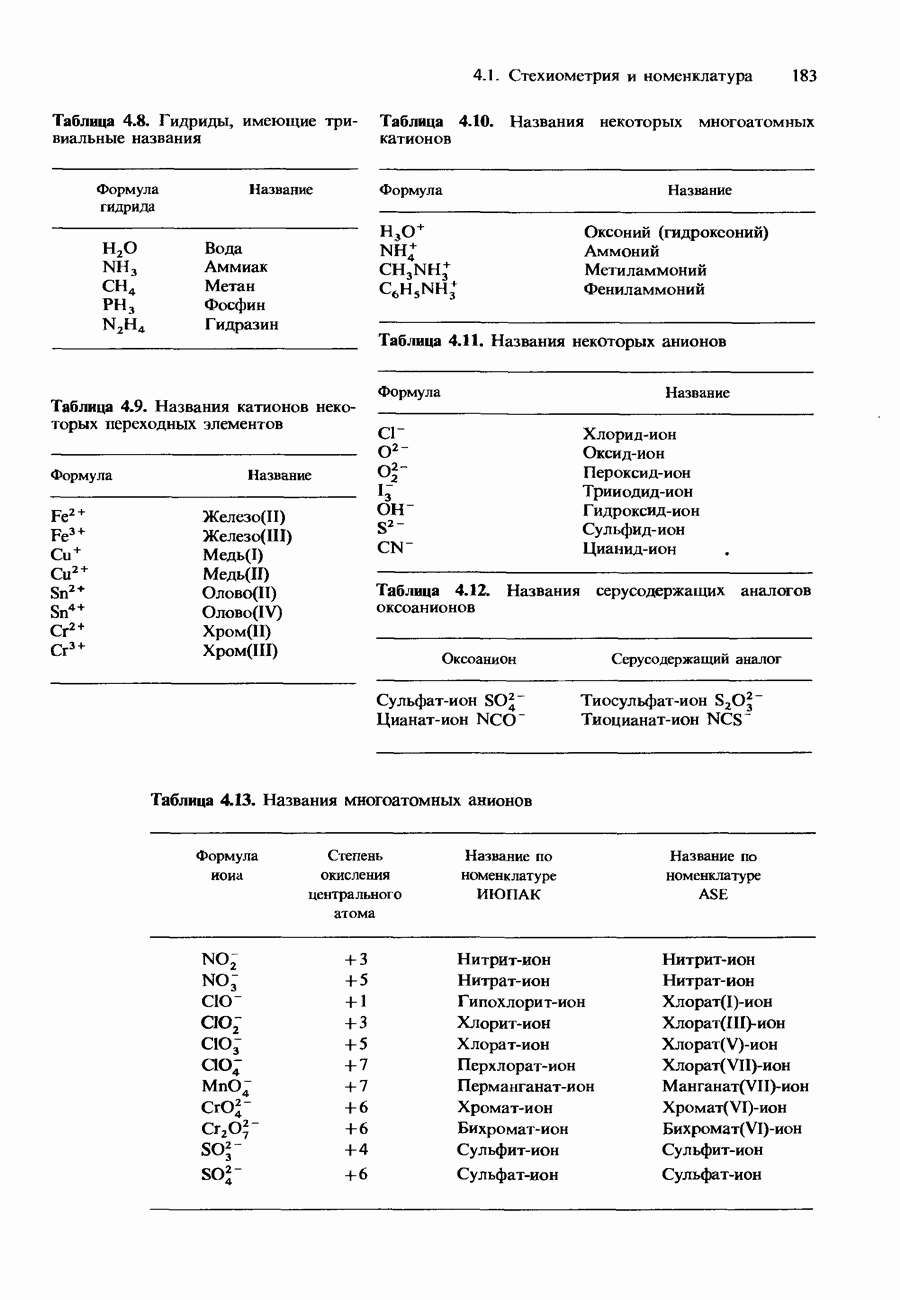
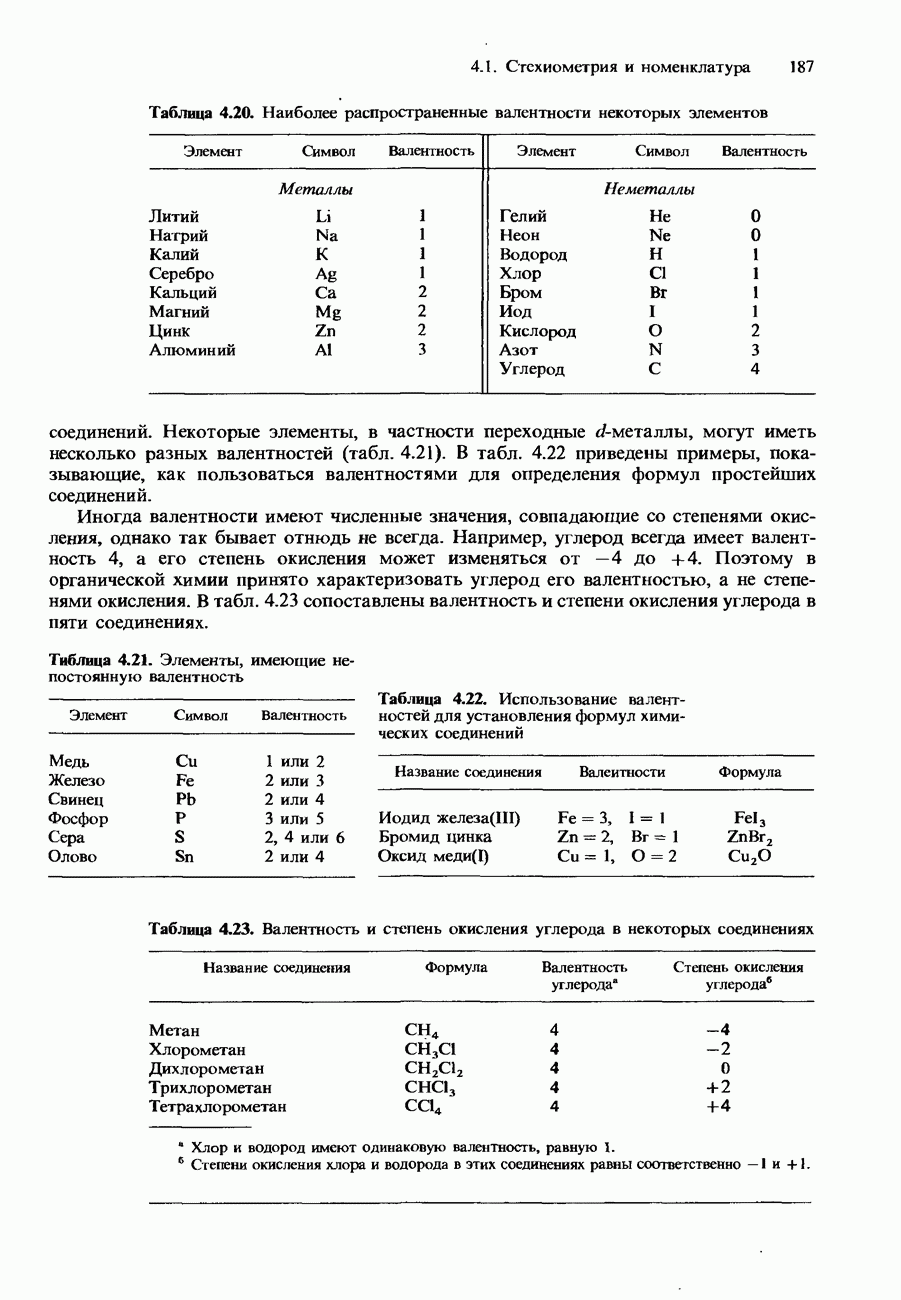
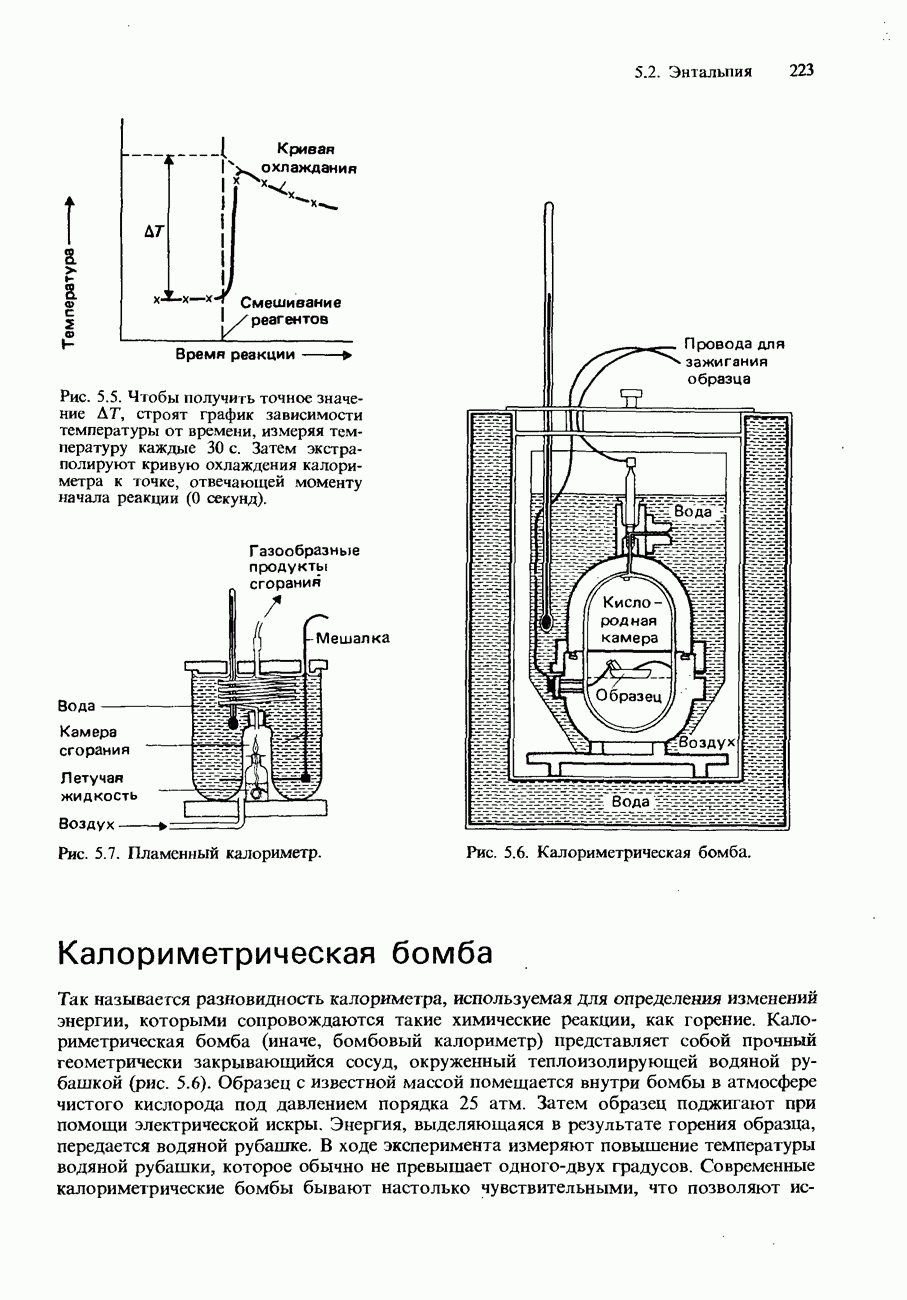
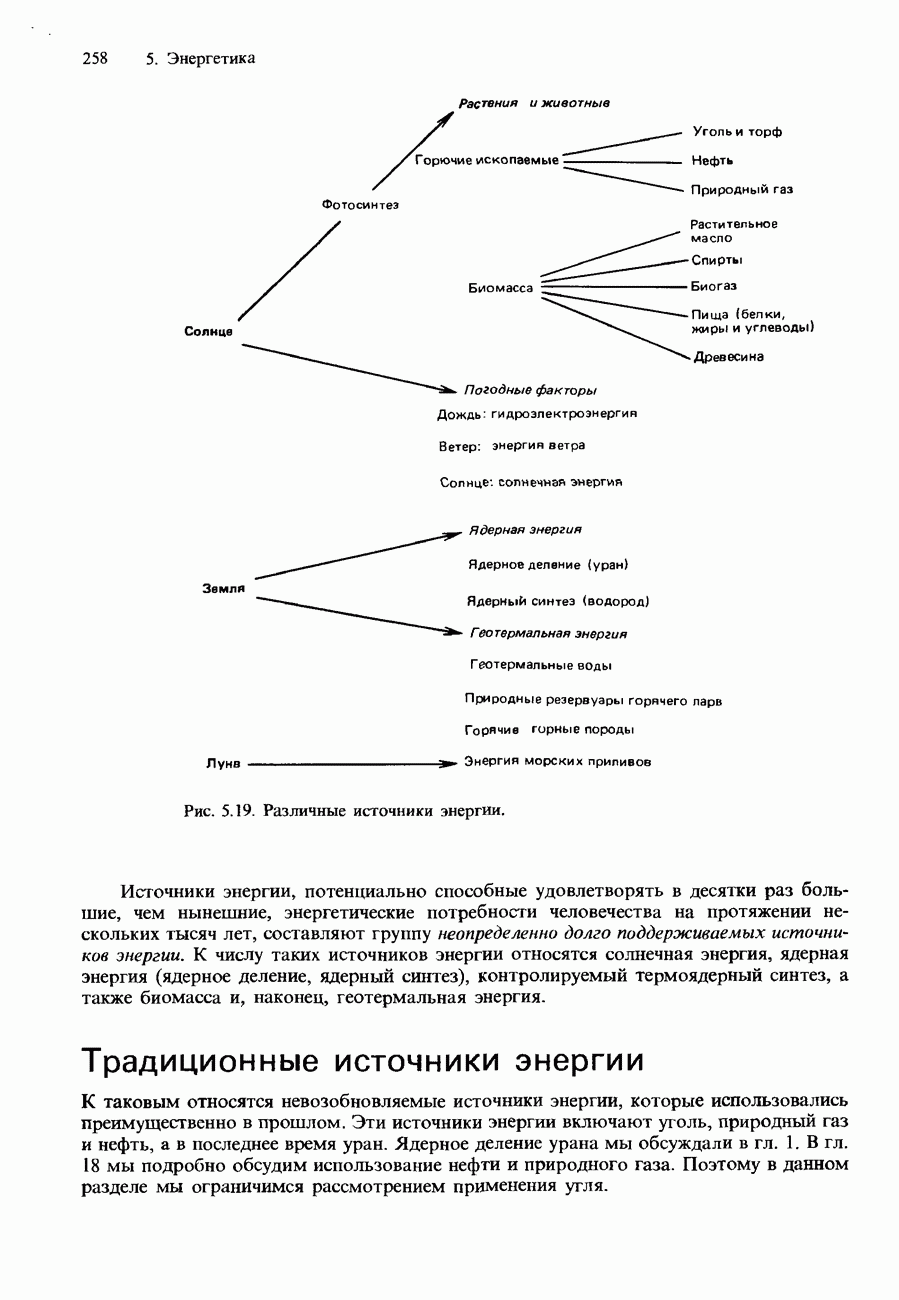
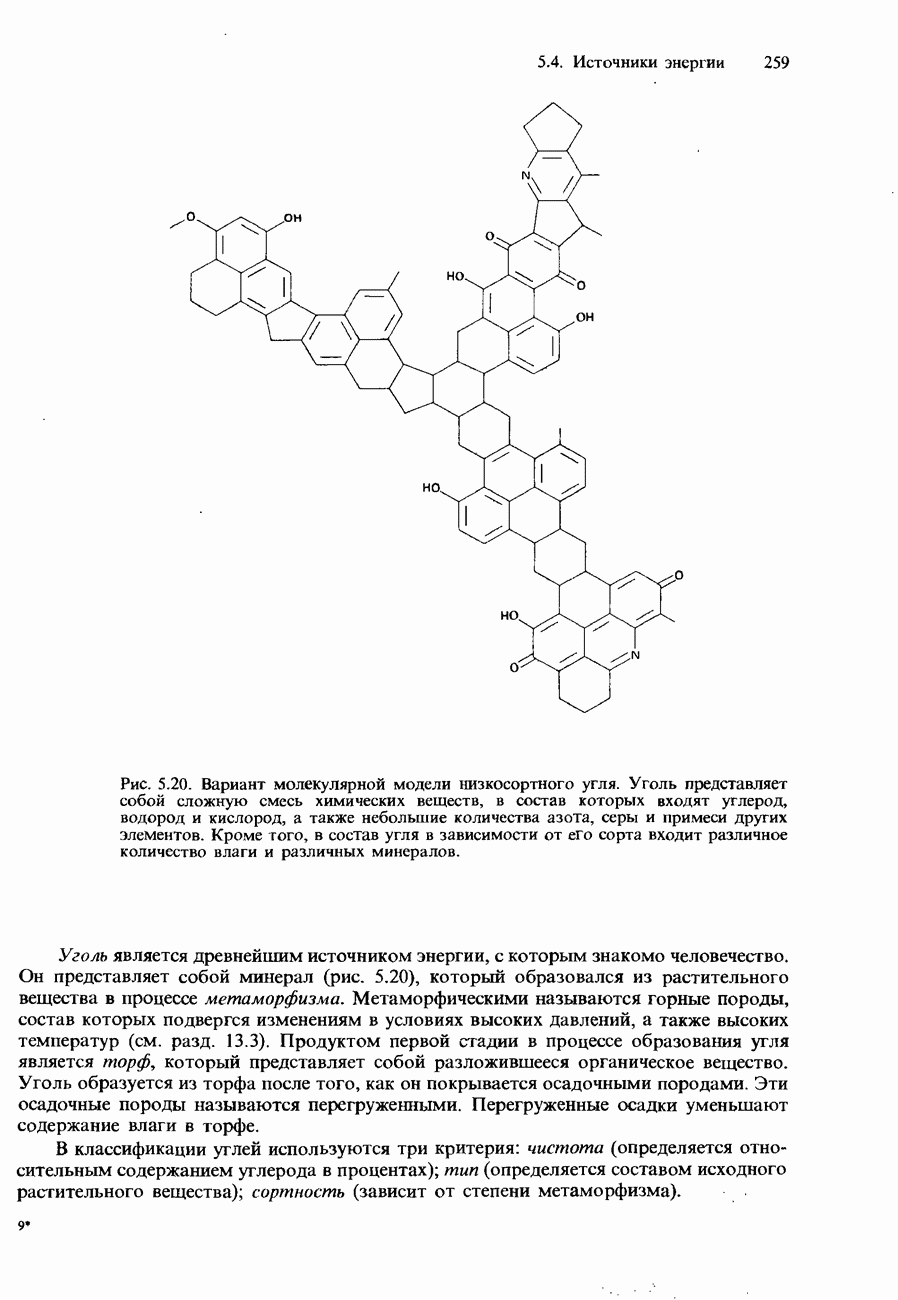
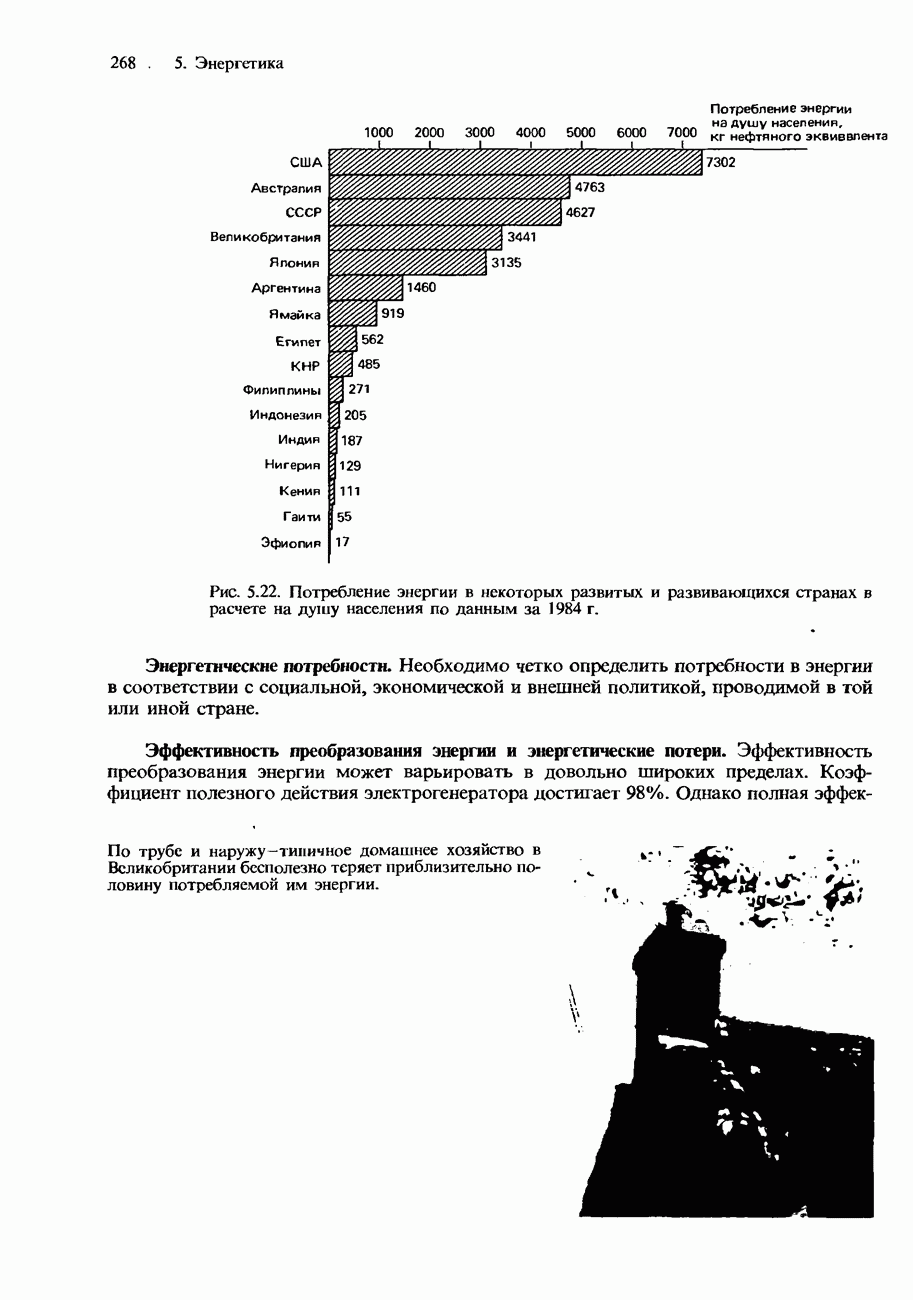
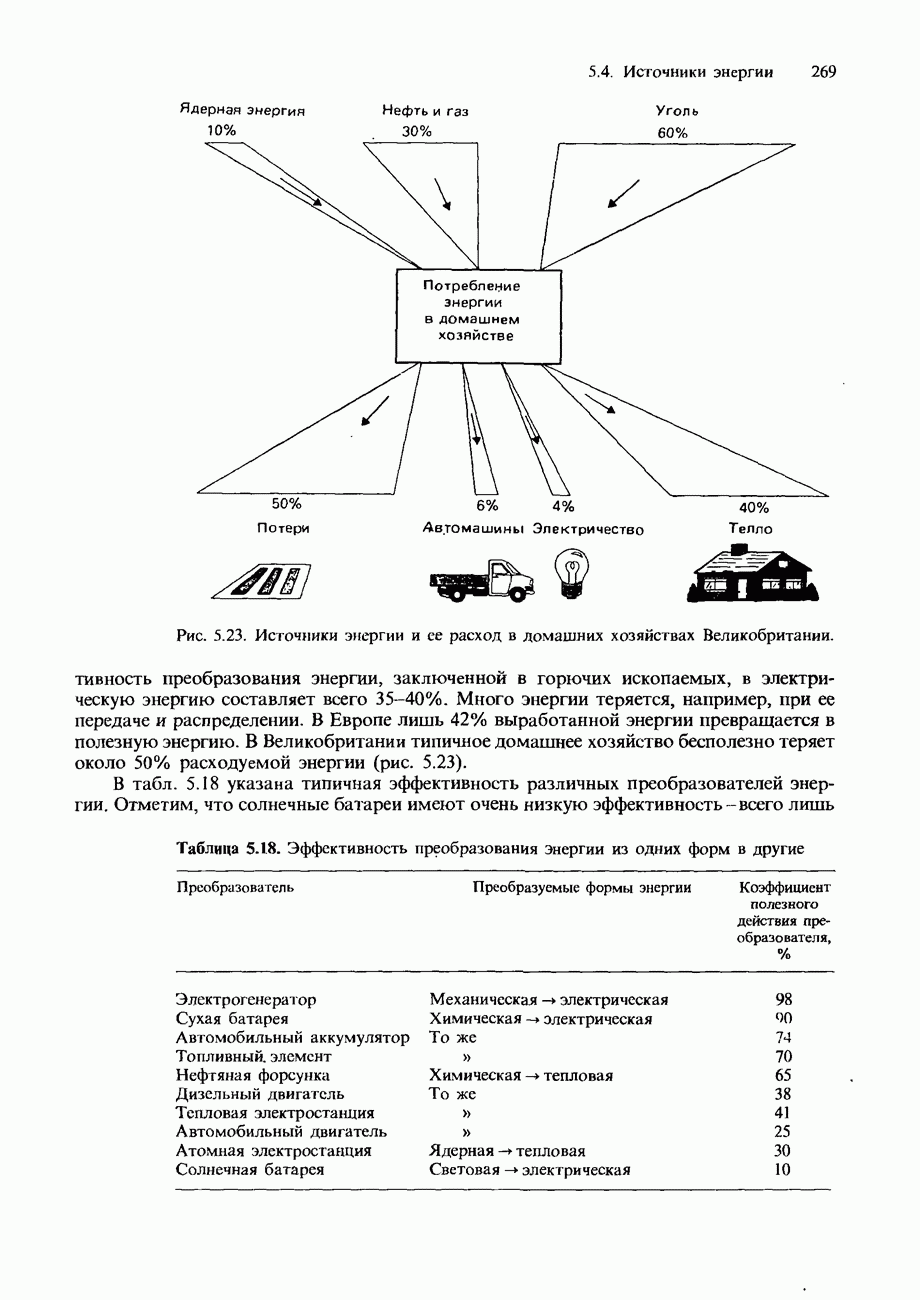
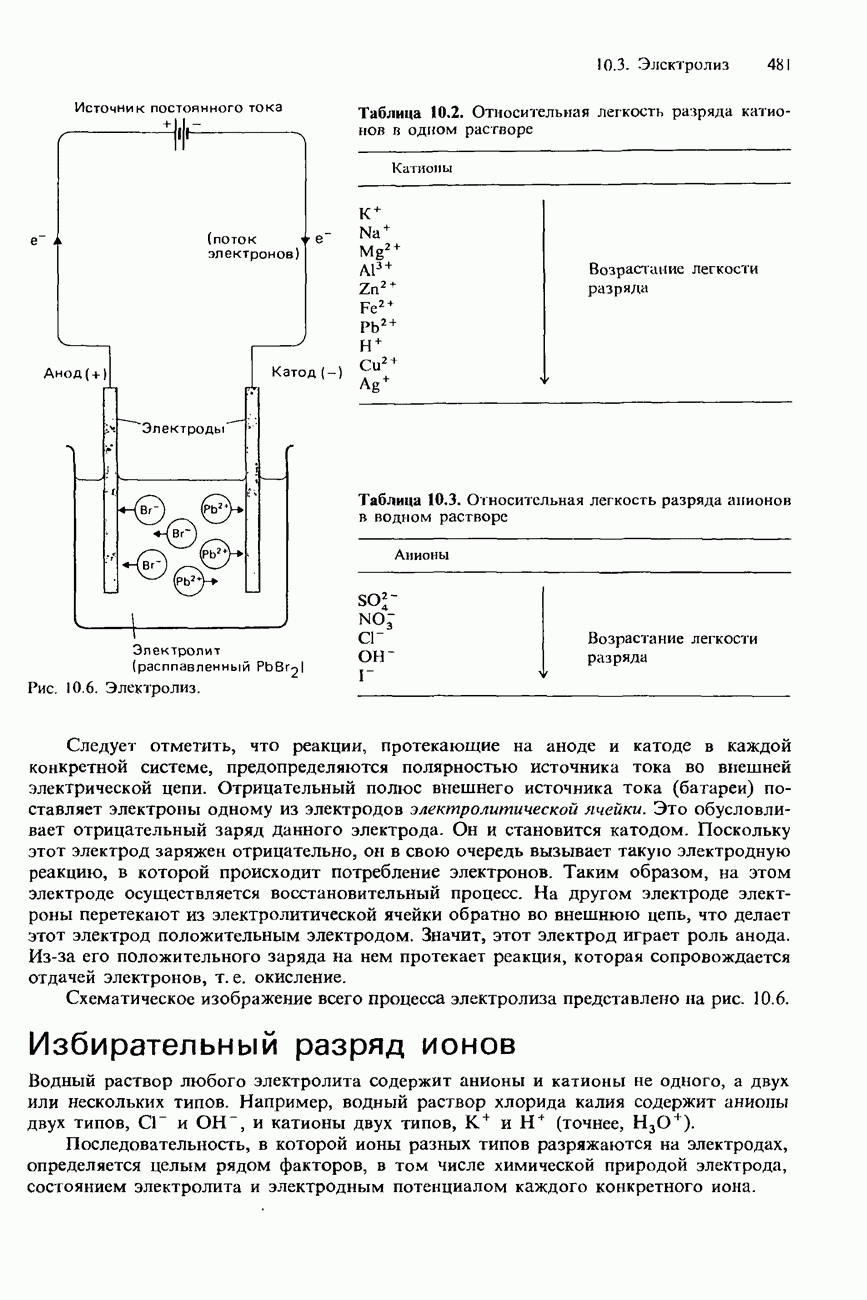
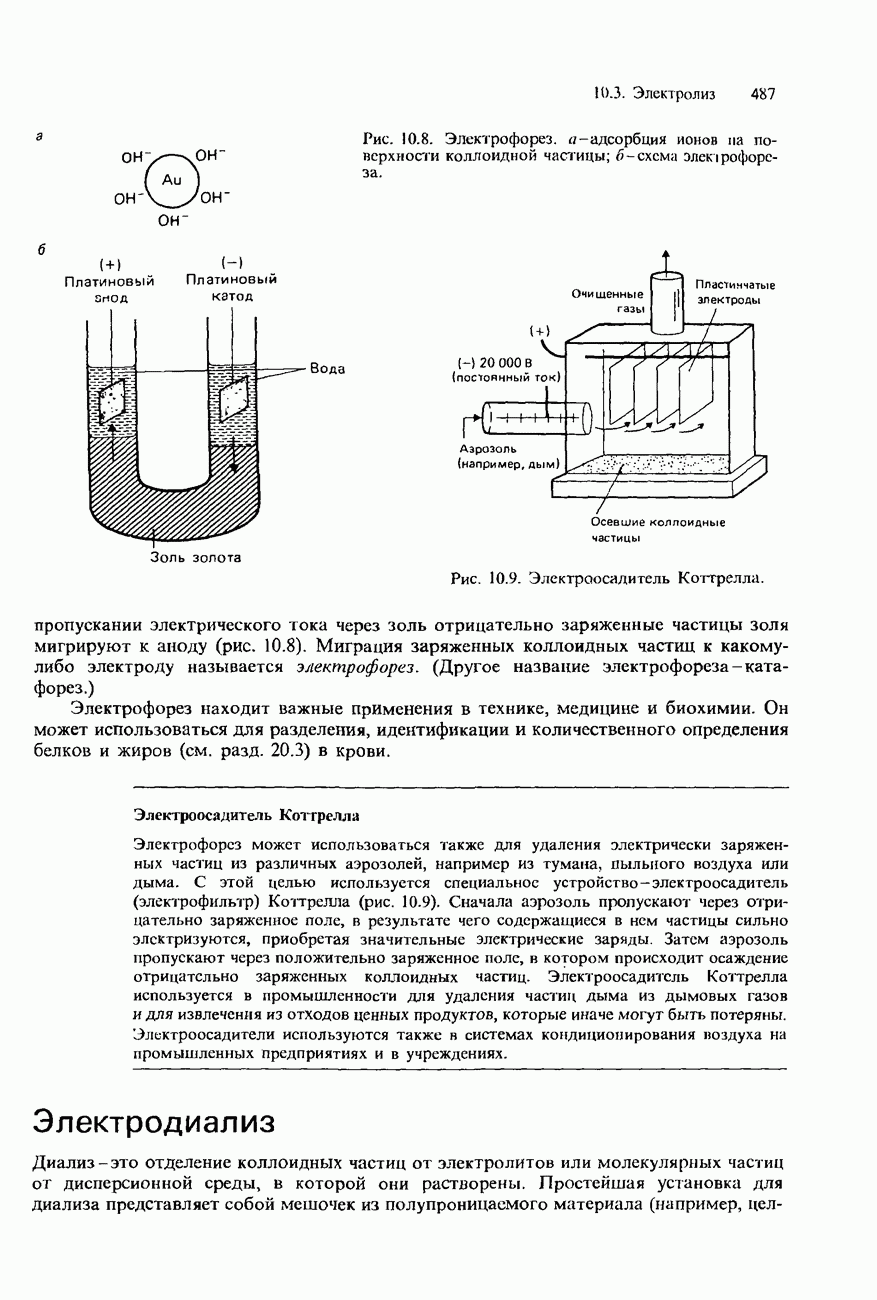
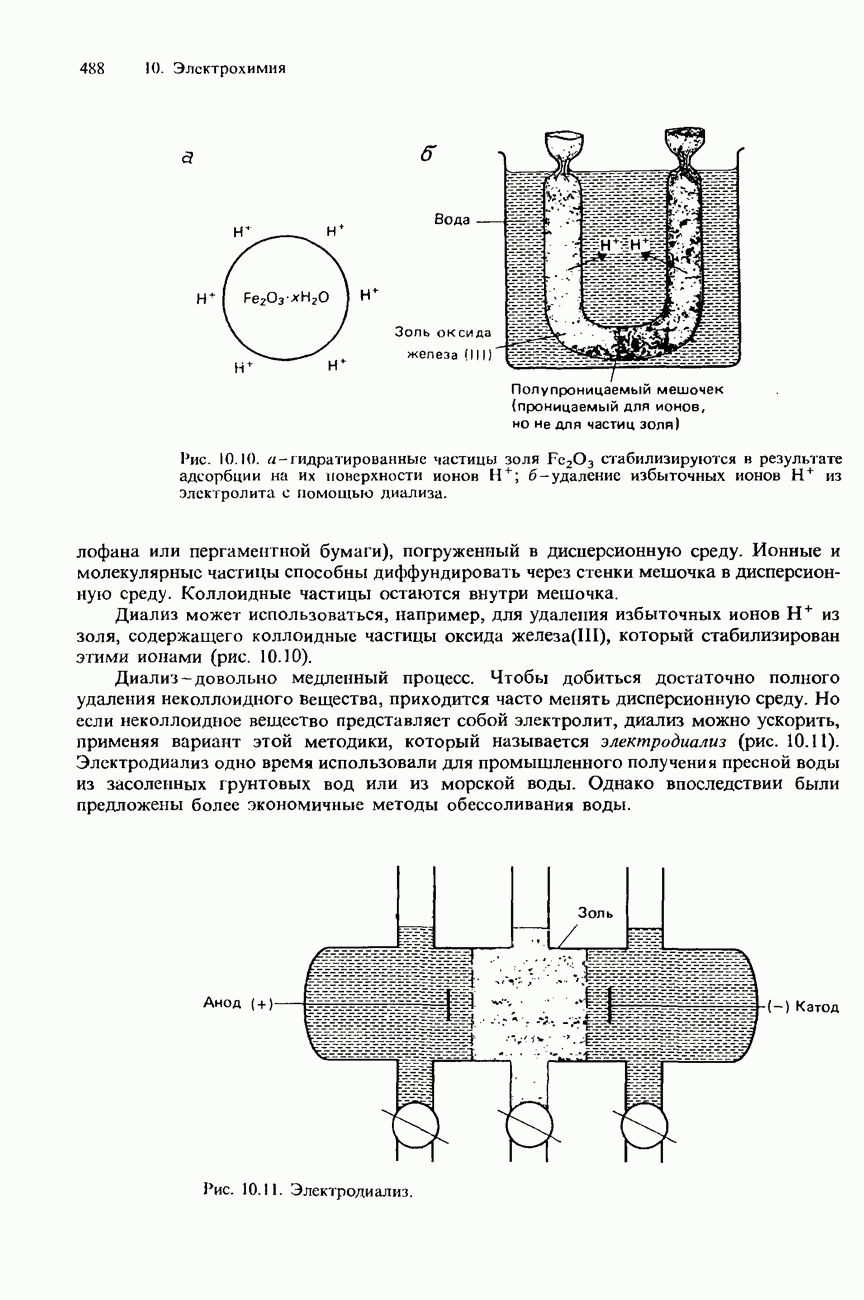
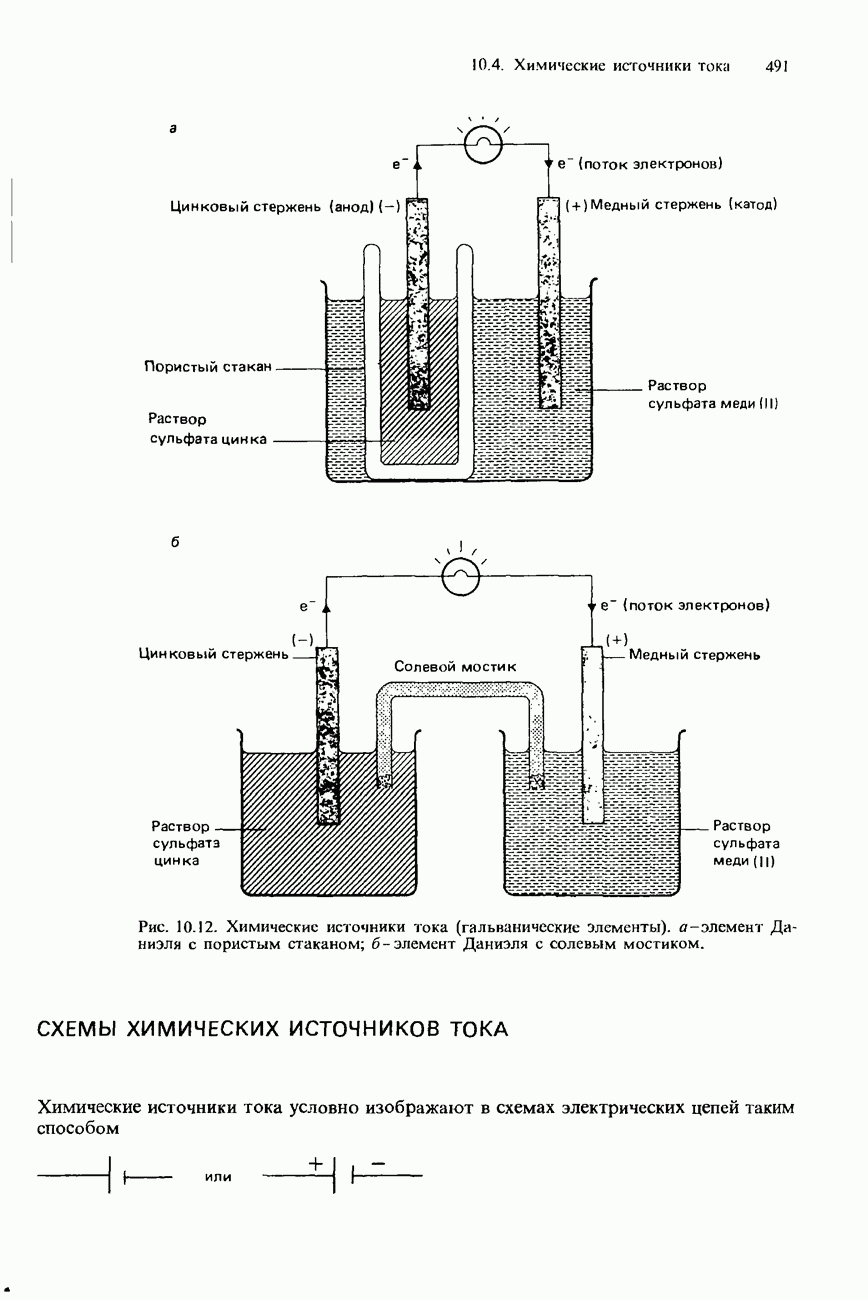
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
КИСЛОТНО-ОСНОВНЫЕ ИНДИКАТОРЫ И ТИТРОВАНИЕ
Кислотно-основные индикаторы (иначе их называют индикаторы  - это вещества, которые изменяют свою окраску в зависимости от
- это вещества, которые изменяют свою окраску в зависимости от  среды, где они находятся. Обычно такими веществами являются слабые кислоты либо слабые основания. При растворении в воде они слабо диссоциируют, образуя ионы. В качестве примера рассмотрим индикатор, который представляет собой слабую кислоту, имеющую формулу общего вида
среды, где они находятся. Обычно такими веществами являются слабые кислоты либо слабые основания. При растворении в воде они слабо диссоциируют, образуя ионы. В качестве примера рассмотрим индикатор, который представляет собой слабую кислоту, имеющую формулу общего вида  При растворении в воде между этой слабой кислотой и сопряженным ей основанием устанавливается следующее равновесие:
При растворении в воде между этой слабой кислотой и сопряженным ей основанием устанавливается следующее равновесие:

В качестве индикатора используется такая кислота, окраска которой заметно отличается от окраски сопряженного ей основания. При низких значениях  концентрация иона
концентрация иона  в растворе высока, и, следовательно, положение равновесия сдвинуто влево. При этих условиях равновесный раствор имеет окраску А. При высоких
в растворе высока, и, следовательно, положение равновесия сдвинуто влево. При этих условиях равновесный раствор имеет окраску А. При высоких

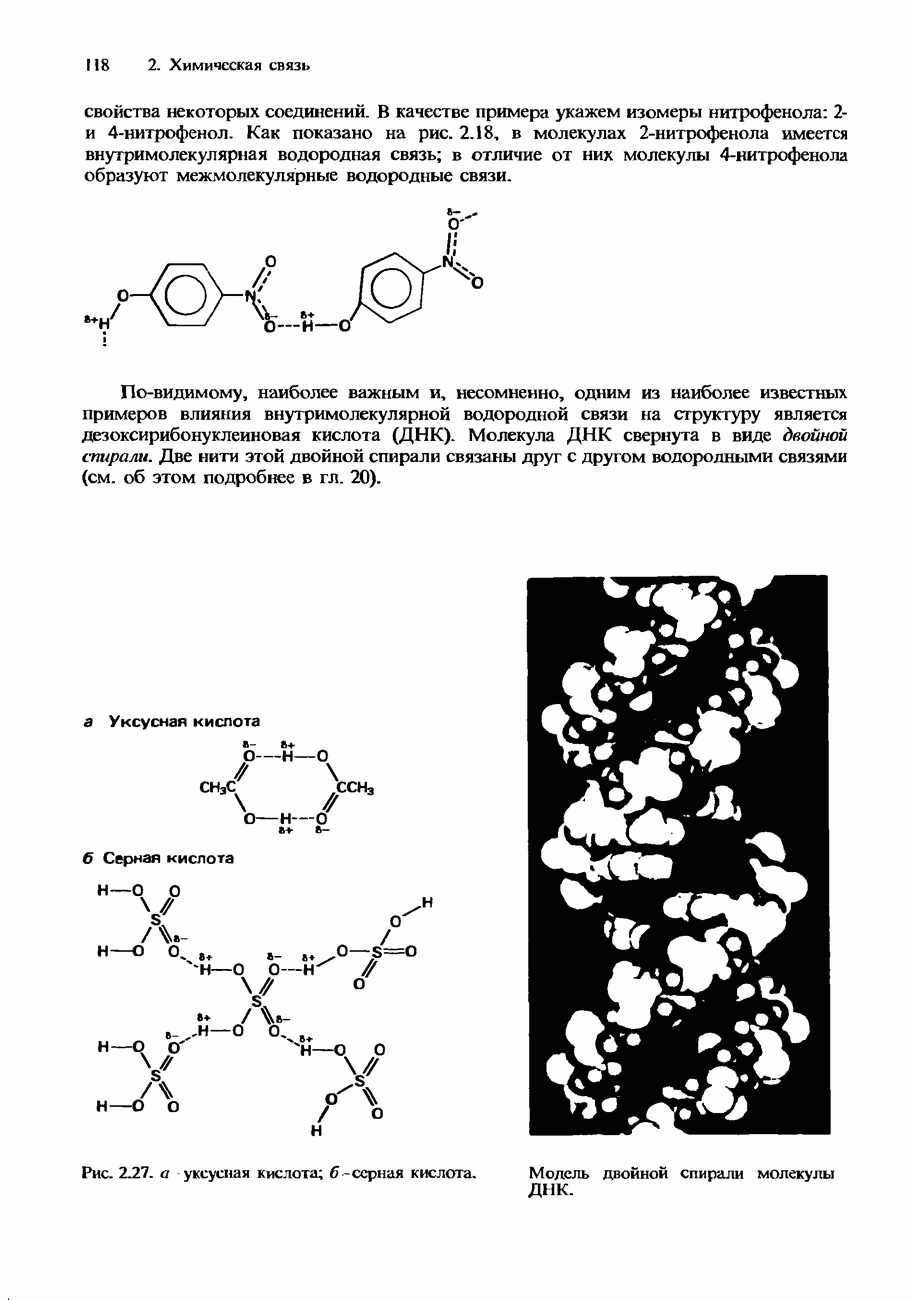
Рис. 8.1. Фенолфталеин.
значениях pH концентрация  в растворе мала, и, следовательно, положение равновесия сдвинуто вправо, а значит, равновесный раствор имеет окраску В.
в растворе мала, и, следовательно, положение равновесия сдвинуто вправо, а значит, равновесный раствор имеет окраску В.
Примером индикатора, в водном растворе которого устанавливается равновесие такого типа, является фенолфталеин (рис. 8.1). Фенолфталеин - это бесцветная слабая кислота, которая при растворении в воде образует анионы, имеющие розовую окраску. В кислой среде равновесие между кислотой и ее анионом сдвинуто влево. Концентрация анионов оказывается настолько низкой, что их розовая окраска незаметна. Однако в щелочной (основной) среде равновесие сдвигается вправо, и концентрация анионов становится достаточной для того, чтобы обнаружилась их розовая окраска.
Если применить к равновесию индикатора в водном растворе закон действующих масс, то в общем случае для индикатора, представляющего собой слабую кислоту, получается такое выражение для константы равновесия:

Величина  называется константой диссоциации индикатора.
называется константой диссоциации индикатора.
Окраска индикатора изменяется от А к В в некоторой точке перехода окраски. В этой точке

Следовательно, из уравнения (5)

Значение pH раствора в точке перехода окраски индикатора обозначается  . Таким образом,
. Таким образом,  представляет собой такое значение pH, при котором половина индикатора находится в форме кислоты, а половина - в форме сопряженного ей основания.
представляет собой такое значение pH, при котором половина индикатора находится в форме кислоты, а половина - в форме сопряженного ей основания.
Диапазон изменения окраски индикатора
При низких значениях  индикатор, представляющий собой слабую кислоту, почти полностью находится в форме
индикатор, представляющий собой слабую кислоту, почти полностью находится в форме  и, следовательно, в растворе преобладает окраска этой формы. По мере возрастания
и, следовательно, в растворе преобладает окраска этой формы. По мере возрастания  интенсивность окраски А, присущей форме
интенсивность окраски А, присущей форме  уменьшается, а равновесие, описываемое уравнением (4), сдвигается вправо. Таким образом, интенсивность окраски В, присущей форме
уменьшается, а равновесие, описываемое уравнением (4), сдвигается вправо. Таким образом, интенсивность окраски В, присущей форме  возрастает. Наблюдаемое изменение окраски от А к В в действительности происходит в некотором диапазоне изменения значений
возрастает. Наблюдаемое изменение окраски от А к В в действительности происходит в некотором диапазоне изменения значений  Индикатор наиболее эффективен, если отчетливое наблюдаемое
Индикатор наиболее эффективен, если отчетливое наблюдаемое
Таблица 8.5. Индикаторы

мое изменение окраски происходит в узком диапазоне значений  Для большинства индикаторов этот диапазон находится в границах
Для большинства индикаторов этот диапазон находится в границах  от значения
от значения  (табл. 8.5).
(табл. 8.5).
Универсальным индикатором называется смесь индикаторов, которая дает постепенное изменение окраски в широком диапазоне изменений  Если добавить в раствор несколько капель универсального индикатора, то по окраске раствора можно приблизительно определить его
Если добавить в раствор несколько капель универсального индикатора, то по окраске раствора можно приблизительно определить его 
Кислотно-основные титрования
Кислотно-основное титрование - это экспериментальная методика определения концентрации кислоты либо основания, используемая преимущественно в количественном химическом анализе. Обычно кислоту с известной концентрацией постепенно добавляют из бюретки в щелочной раствор неизвестной концентрации, находящийся в конической колбе. Точка эквивалентности титрования достигается в тот момент, когда к основанию добавлено точно стехиометрическое количество кислоты. В этой точке вся щелочь нейтрализована, и в растворе нет ни избытка кислоты, ни избытка основания. Раствор состоит только из соли и воды. Например, при добавлении соляной кислоты с концентрацией  раствора гидроксида натрия с концентрацией
раствора гидроксида натрия с концентрацией  точка эквивалентности титрования достигается в тот момент, когда в раствор добавлено точно
точка эквивалентности титрования достигается в тот момент, когда в раствор добавлено точно  соляной кислоты. Это следует из стехиометрическо-го уравнения
соляной кислоты. Это следует из стехиометрическо-го уравнения

При проведении кислотно-основных титрований для определения точки эквивалентности часто пользуются индикаторами. Однако точку эквивалентности можно определять также потенциометрически с помощью  -метра или кондуктометрическими методами (см. гл. 10).
-метра или кондуктометрическими методами (см. гл. 10).
Допустим теперь, что титрование осуществляется путем добавления основания к кислоте. Если построить график изменения  раствора по мере возрастания объема добавляемого основания, то в зависимости от того, сильными или слабыми являются кислота и основание, будут получаться кривые четырех типов. Эти четыре типа кривых титрования показаны на рис. 8.2. Следует обратить внимание, что достижение точки эквивалентности характеризуется резким возрастанием
раствора по мере возрастания объема добавляемого основания, то в зависимости от того, сильными или слабыми являются кислота и основание, будут получаться кривые четырех типов. Эти четыре типа кривых титрования показаны на рис. 8.2. Следует обратить внимание, что достижение точки эквивалентности характеризуется резким возрастанием  Исключением в этом отношении является только титрование слабой кислоты слабым основанием. Если для
Исключением в этом отношении является только титрование слабой кислоты слабым основанием. Если для
определения точки эквивалентности кислотно-основного титрования приходится пользоваться индикатором, то его следует подобрать так, чтобы диапазон pH, в котором происходит изменение окраски, приходился на вертикальную часть кривой титрования. Это обеспечивает резкое изменение окраски индикатора в момент достижения точки эквивалентности титрования.
Титрование сильной кислоты сильным основанием. Например,

Вертикальная часть кривой этого титрования приходится на область изменений pH от 4 до 10. Следовательно, в точке эквивалентности титрования добавление к кислоте еще одной капли основания вызывает возрастание pH сразу на 6 единиц. Значит, для такого титрования можно воспользоваться индикаторами, имеющими диапазон изменения окраски между значениями pH 4 и 10. Примерами таких индикаторов являются краситель метиловый красный и фенолфталеин. Отметим, что если в качестве индикатора титрования сильной кислоты сильным основанием использовать метиловый оранжевый, то изменение окраски оказывается не столь резким.
Титрование сильной кислоты слабым основанием. Например,

Вертикальная часть кривой этого титрования приходится на область изменений pH от 4 до 8. Удобными индикаторами для него являются метиловый красный либо
бромтимоловый синий, но не фенолфталеин, поскольку его диапазон изменения окраски приходится на пологую часть кривой титрования.
Титрование слабой кислоты сильным основанием. Например,

Вертикальная часть кривой этого титрования приходится на область значений pH от 6,5 до 11. Следовательно, удобными индикаторами для него оказываются феноловый красный либо фенолфталеин. Индикаторы с диапазоном изменения окраски, расположенным ниже pH 6, как у метилового оранжевого, не подходят для такого титрования,

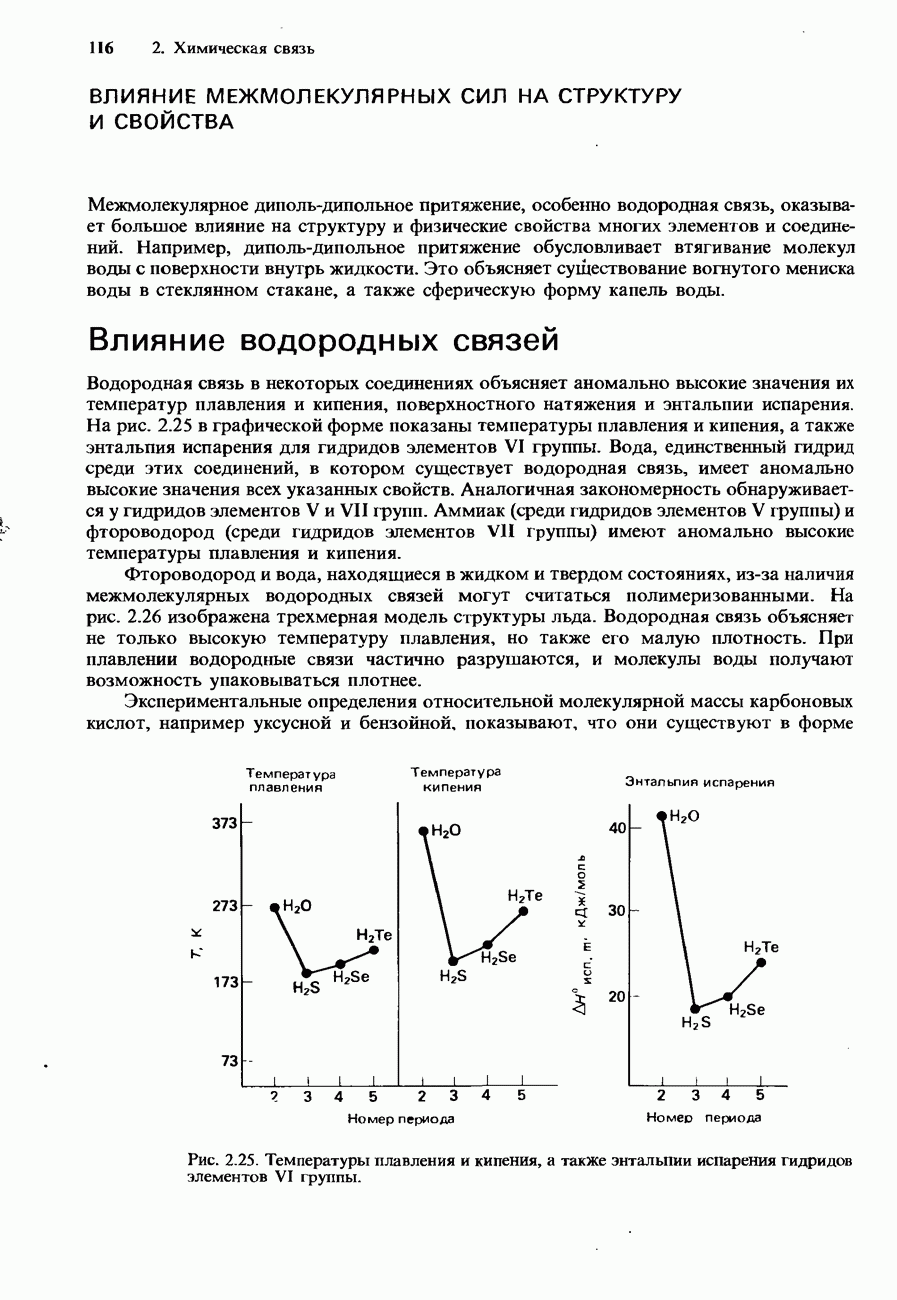
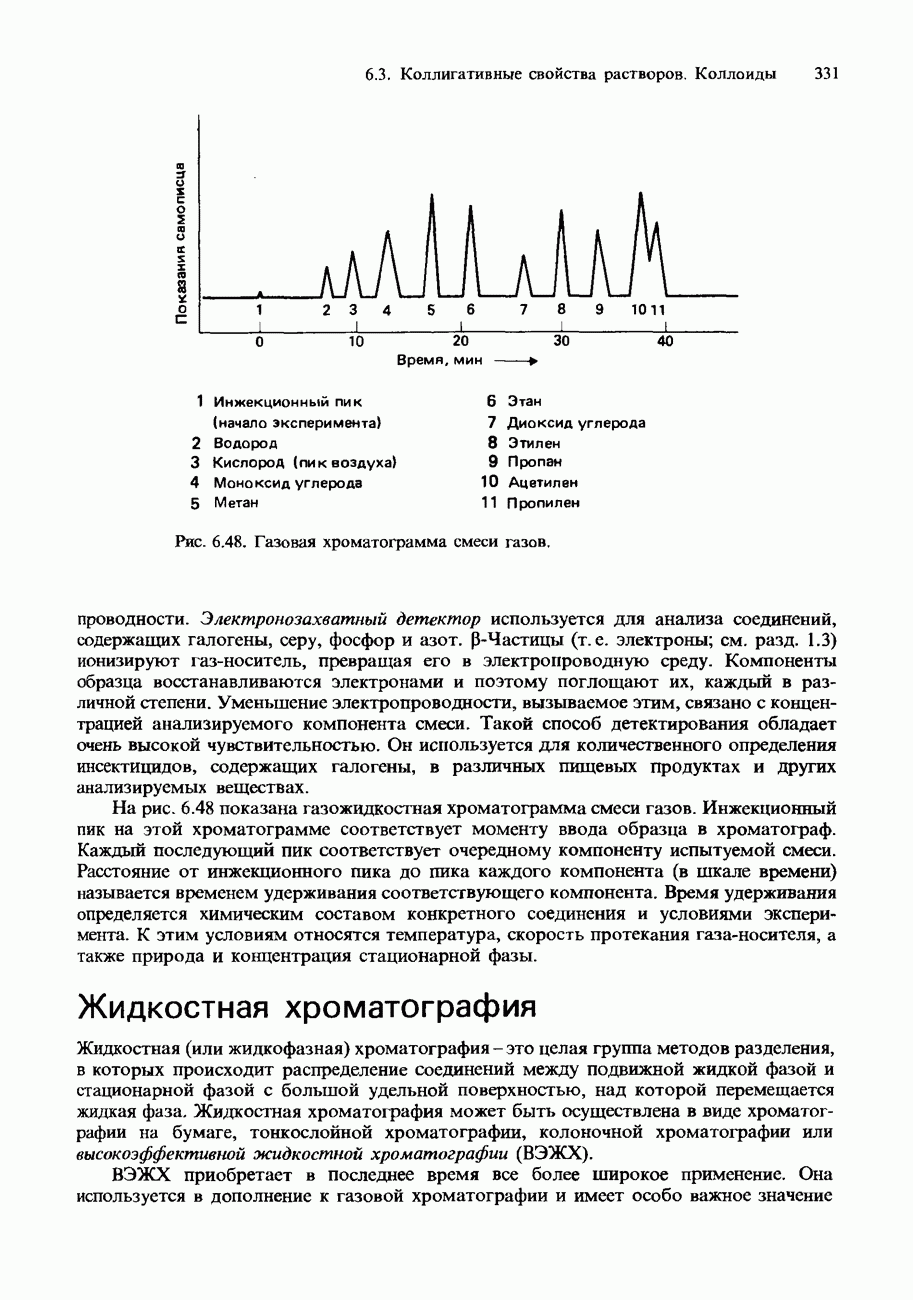
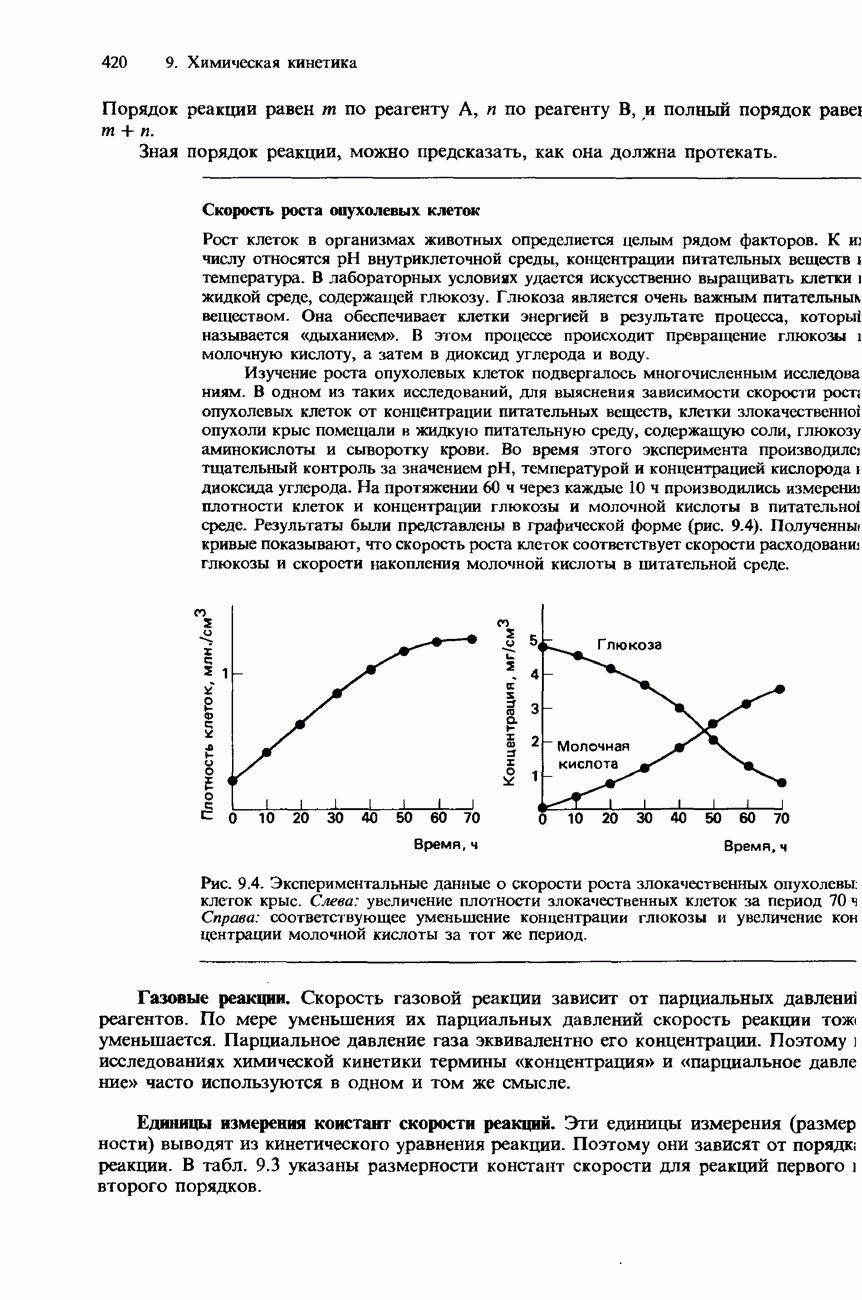
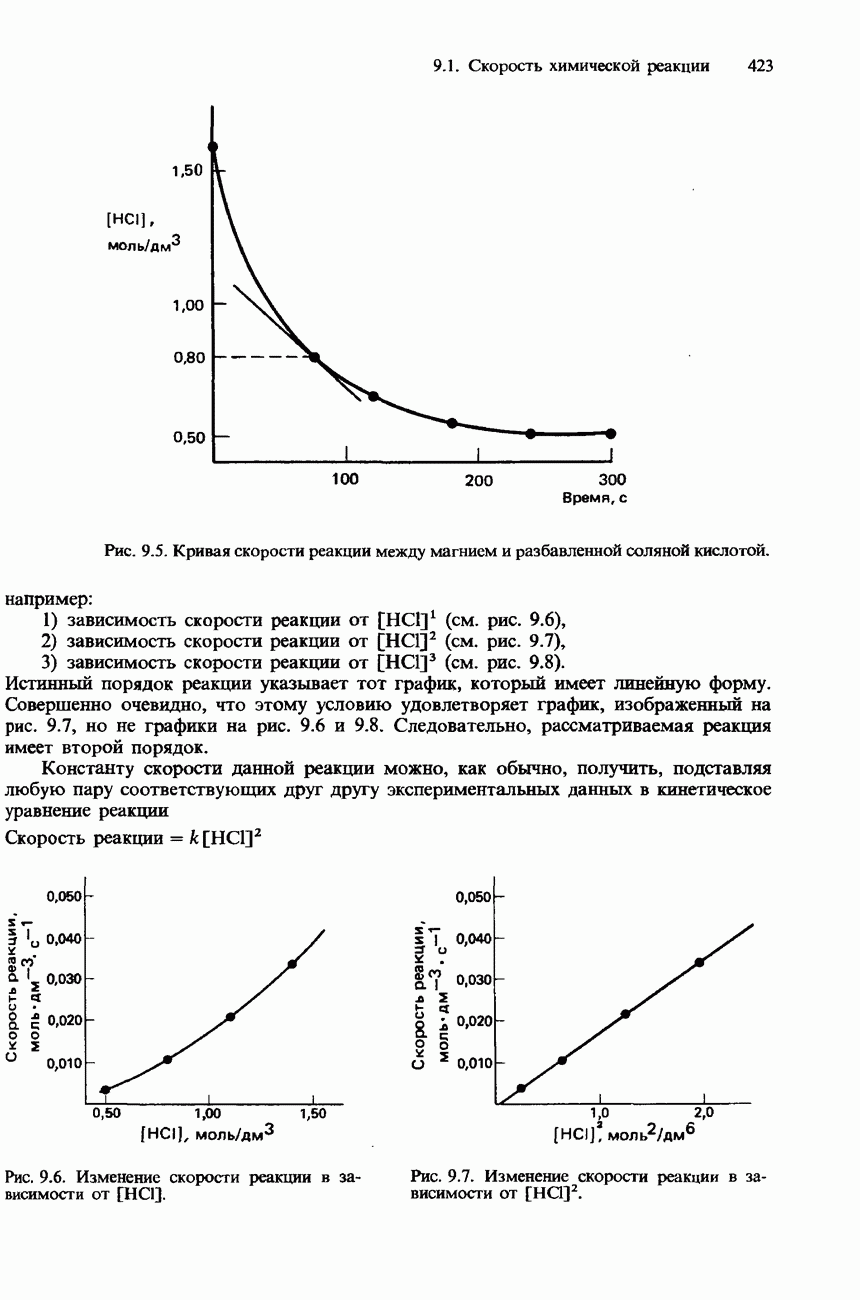
Рис. 8.2. Кривые титрований 25,00 см3 кислоты с концентрацией 0,10 моль/дм3 основанием с концентрацией 0,10 моль/дм3: а - титрование сильной кислоты сильным основанием; б - титрование сильной кислоты слабым основанием; в - титрование слабой кислоты сильным основанием; г - титрование слабой кислоты слабым основанием. I-фенолфталеин, II-метилоранж.
поскольку их диапазон изменения окраски приходится на пологую часть кривой титрования и, следовательно, не позволяет точно обнаружить точку эквивалентности.
Титронание слабой кислоты слабым основанием. Например,

Титрование этого типа характеризуется отсутствием резкого изменения pH в момент достижения точки эквивалентности. Изменения pH происходят плавно во всей области принимаемых значений. Поэтому для титрований такого типа невозможно подобрать индикатор.
Итак, повторим еще раз
1. Сильный электролит при растворении или в расплавленном состоянии полностью ионизируется.
2. Слабый электролит при растворении или в расплавленном состоянии диссоциирует на ионы лишь частично.
3. Закон разбавления Оствальда связывает константу диссоциации  электролита с его степенью диссоциации а и концентрацией с:
электролита с его степенью диссоциации а и концентрацией с:

4. Согласно теории Бренстеда-Лоури, кислота - это вещество, которое донирует (отдает) протоны, а основание - это вещество, которое акцептирует (присоединяет) протоны.
5. Сильная кислота имеет слабое сопряженное основание.
6. Слабая кислота имеет сильное сопряженное основание.
7. Амфотерное вещество способно реагировать и как кислота, и как основание.
8. Льюисова кислота - это вещество, способное акцептировать электронную пару, предоставляемую основанием.
9. Льюисово основание - это вещество, обладающее неподеленной электронной парой.
10.  где константа диссоциации кислоты.
где константа диссоциации кислоты.
11.  , где
, где  константа диссоциации основания.
константа диссоциации основания.
12.  , где ионное произведение воды.
, где ионное произведение воды.

16. Равновесие в водном растворе индикатора, представляющего собой слабую кислоту, определяется уравнением

17. Точка эквивалентности кислотно-основного титрования достигается в тот момент, когда к кислоте добавлено стехиометрическое количество основания.
18. Диапазон изменения окраски визуального индикатора должен приходиться на вертикальную часть кривой титрования.
| << Предыдущий параграф | Следующий параграф >> |
- ОТ ПЕРЕВОДЧИКА
- ПРЕДИСЛОВИЕ АВТОРА К РУССКОМУ ИЗДАНИЮ
- ПРЕДИСЛОВИЕ
- 1. СТРОЕНИЕ АТОМА
- 1.1. Субатомные частицы
- Модели атома
- Новые элементарные частицы
- МАССА АТОМА
- МАСС-СПЕКТРОМЕТРИЯ
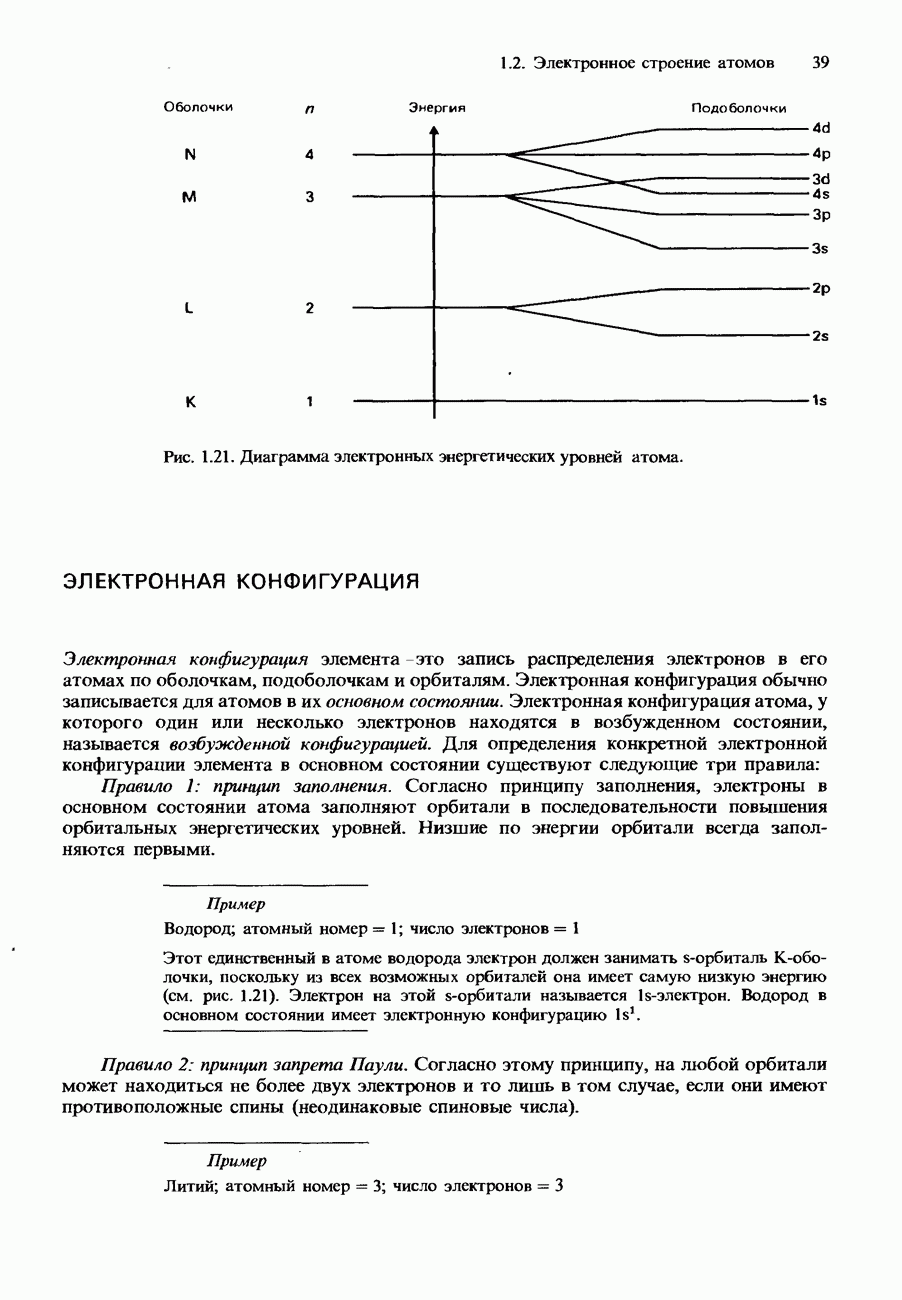
- 1.2 Электронное строение атомов
- Связь между спектральными линиями и электронами (открытие Бора)
- Применение возбуждения электронов на практике
- Атомный спектр испускания водорода
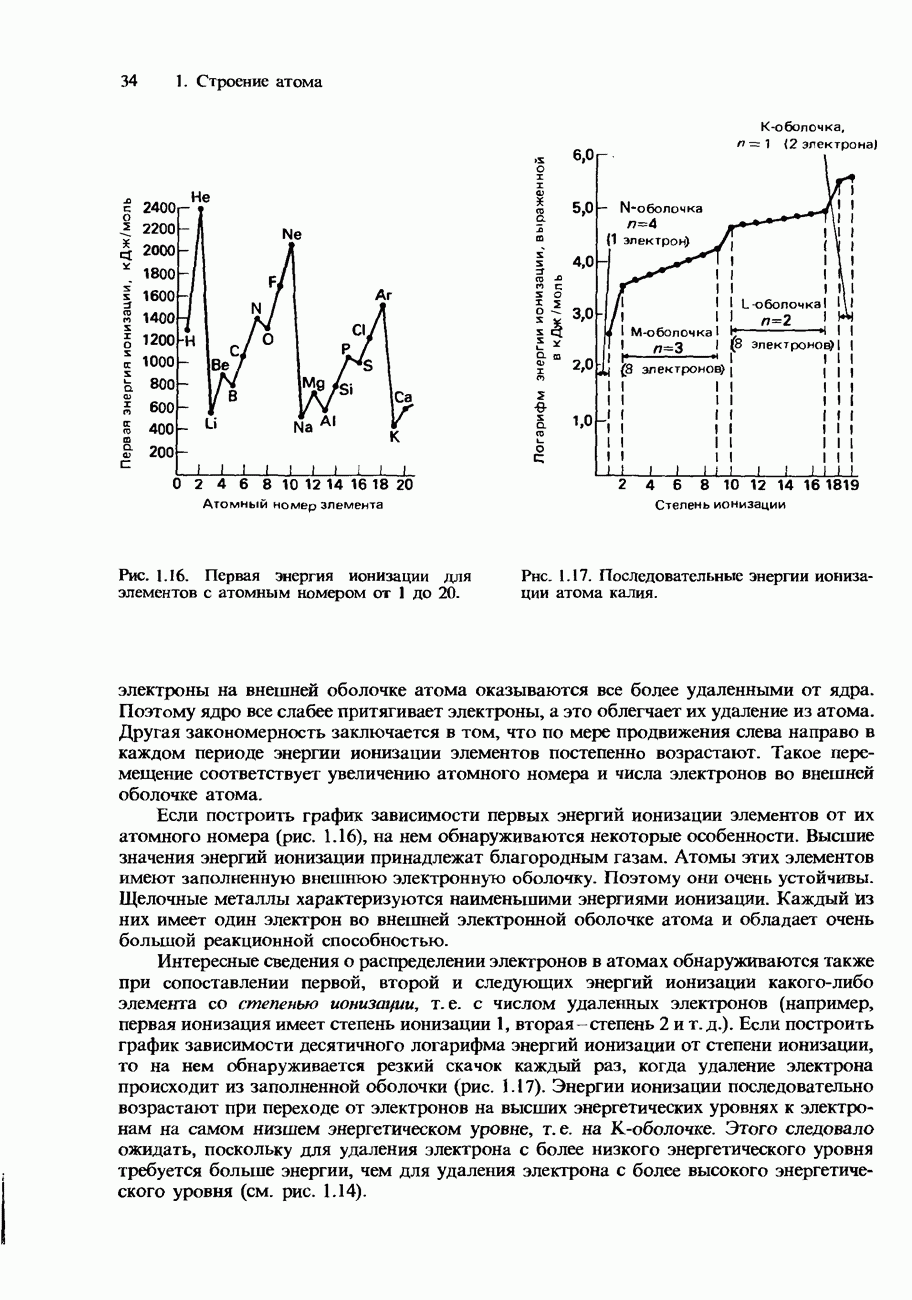
- ЭНЕРГИИ ИОНИЗАЦИИ
- Рассмотрение энергий ионизации в рамках модели атома, предложенной Бором
- ВОЛНОВАЯ ПРИРОДА ЭЛЕКТРОНА
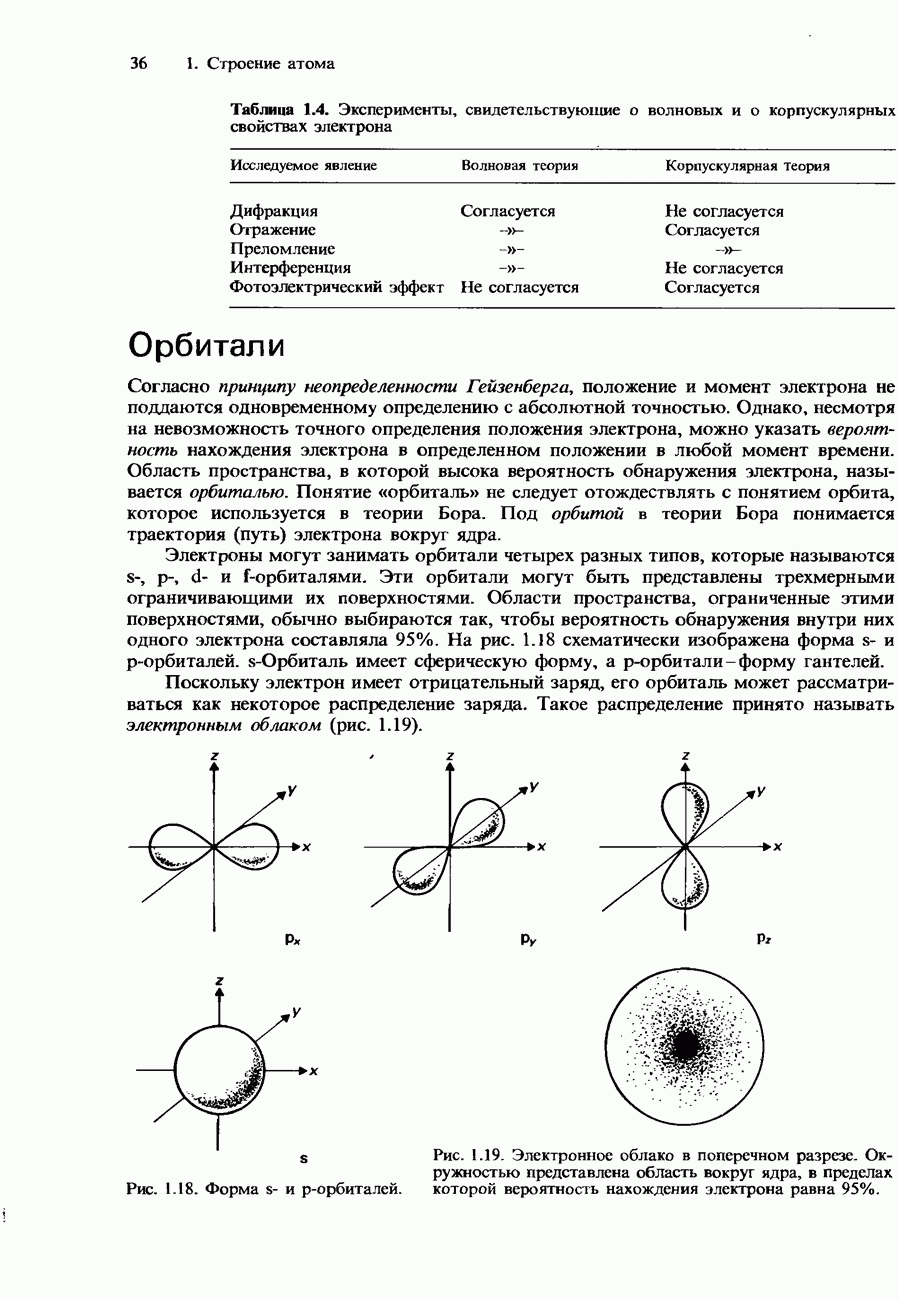
- Орбитали
- КВАНТОВЫЕ ЧИСЛА
- ЭЛЕКТРОННАЯ КОНФИГУРАЦИЯ
- 1.3 Радиоактивность
- ИОНИЗИРУЮЩЕЕ ИЗЛУЧЕНИЕ
- Обнаружение и измерение радиоактивности
- УСТОЙЧИВЫЕ И НЕУСТОЙЧИВЫЕ ИЗОТОПЫ
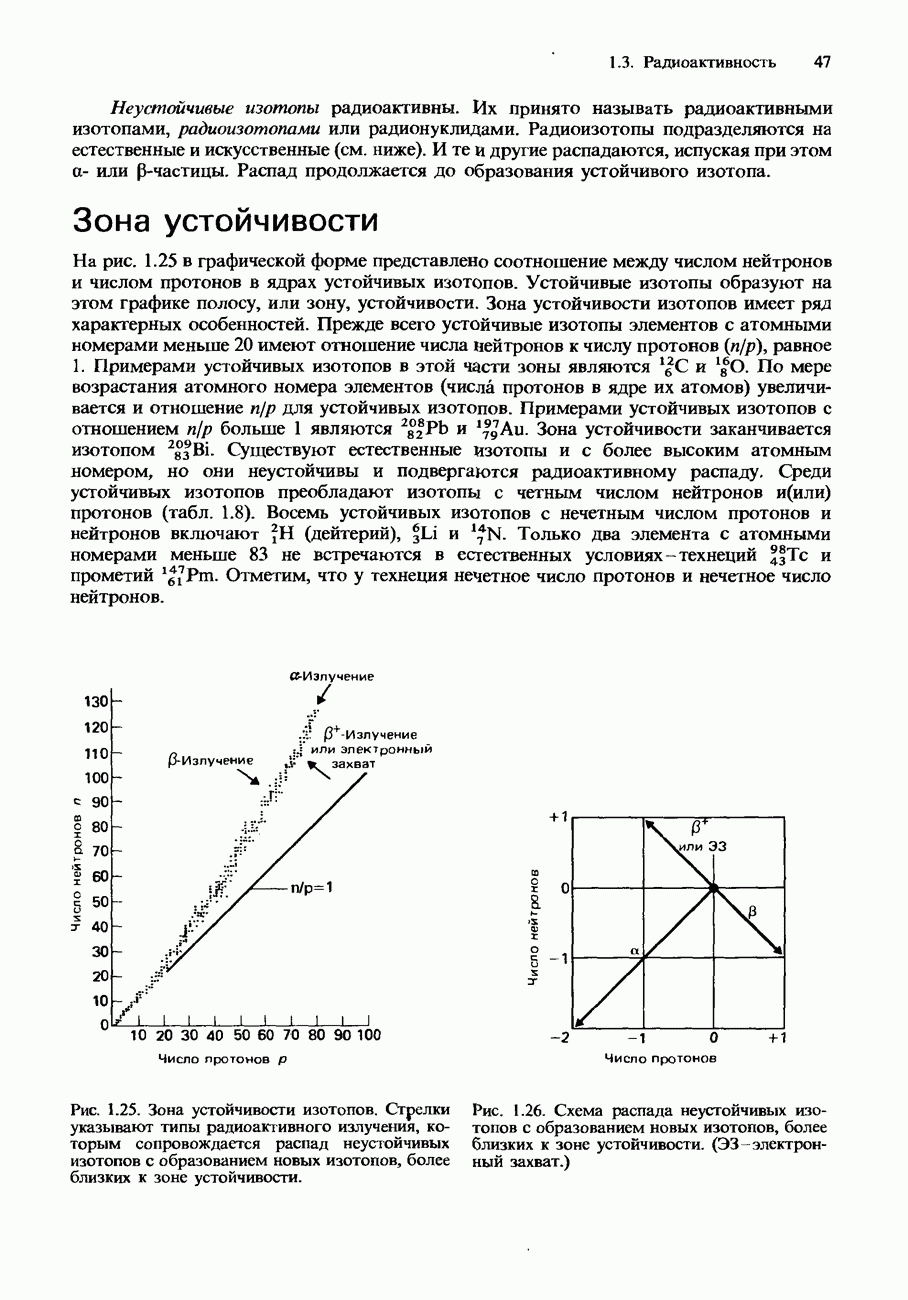
- Зона устойчивости
- Период полураспада
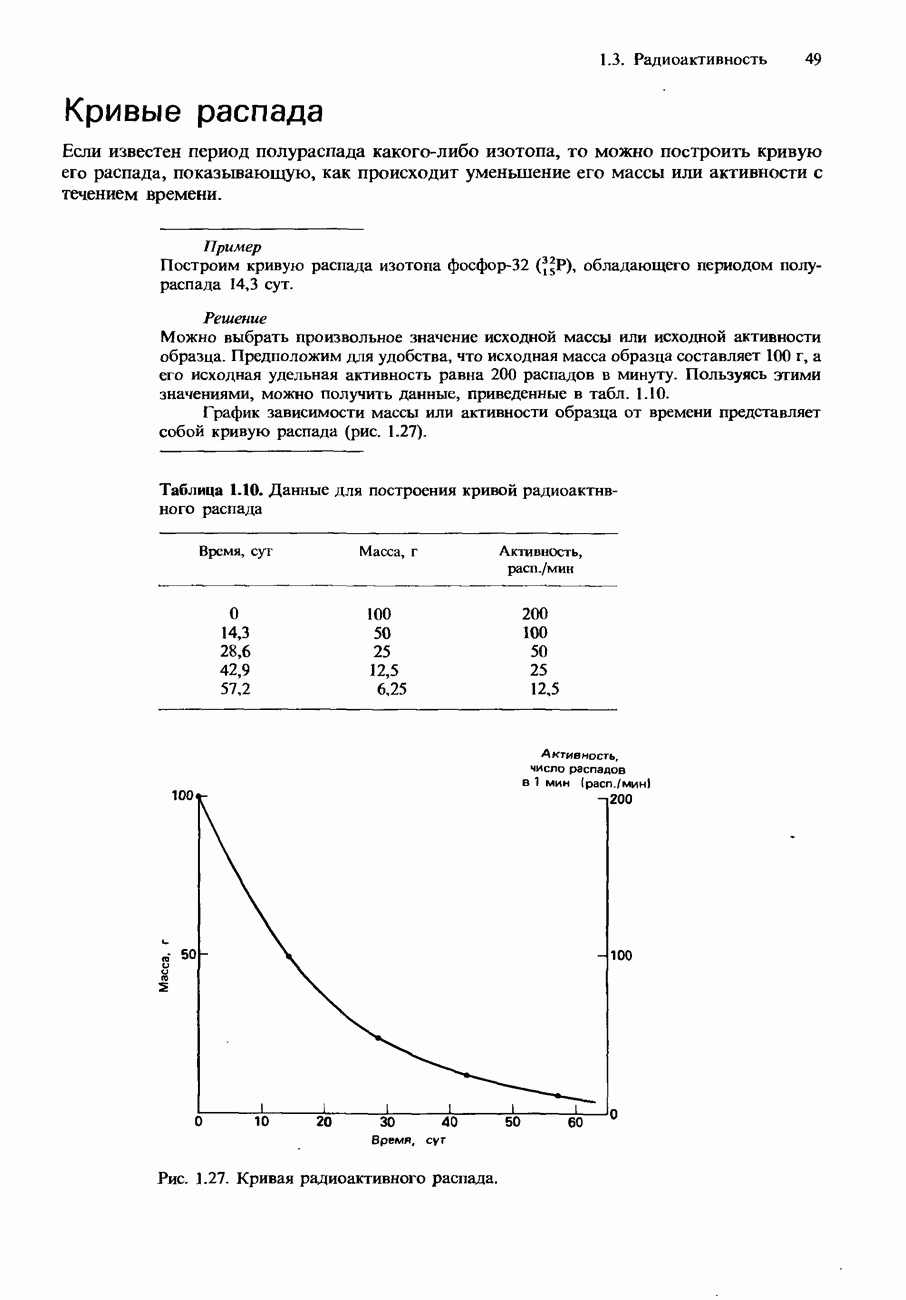
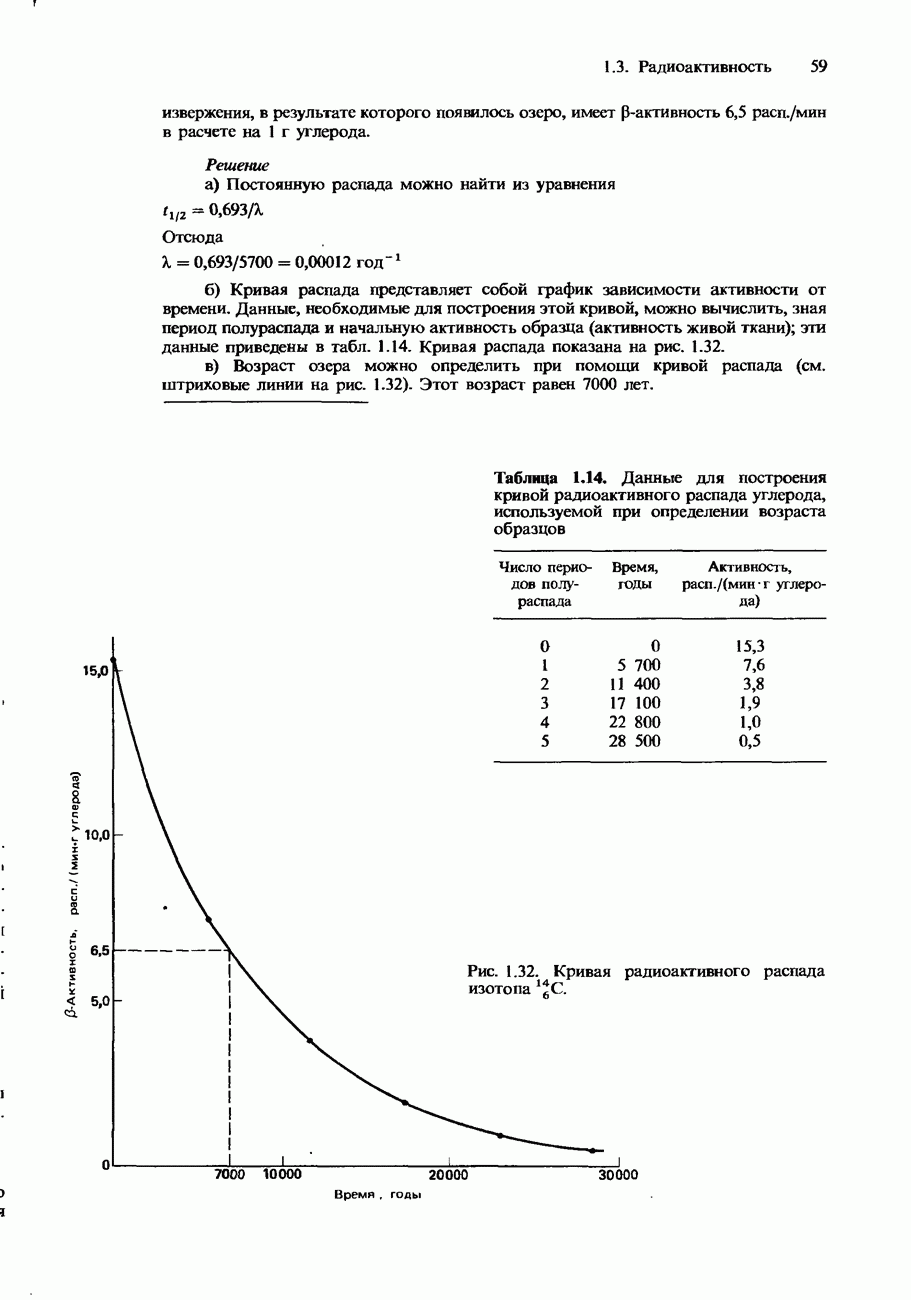
- Кривые распада
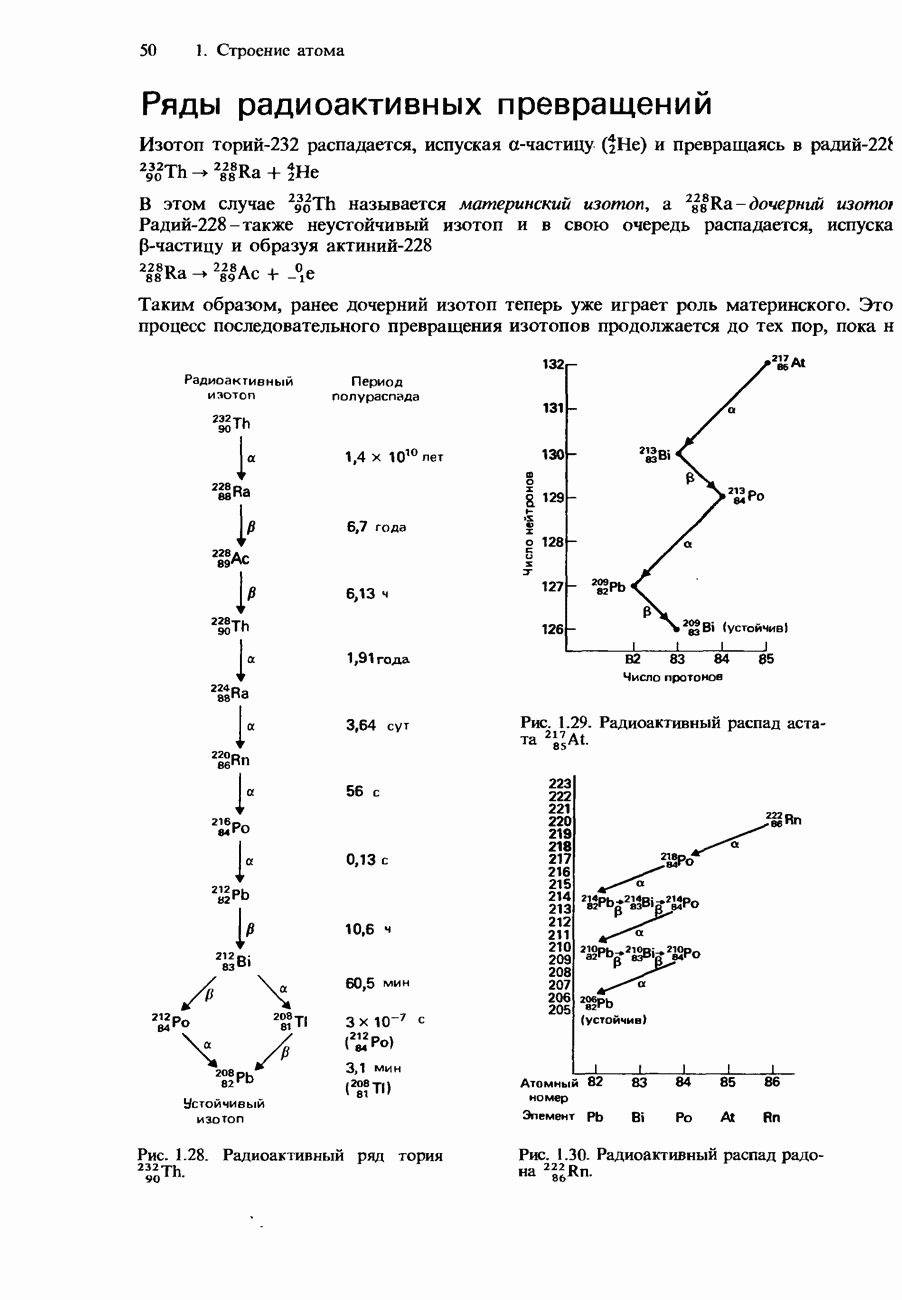
- Ряды радиоактивных превращений
- Естественные радиоизотопы
- ИСКУССТВЕННЫЕ ЯДЕРНЫЕ ПРЕВРАЩЕНИЯ
- Ускорители элементарных частиц
- Трансурановые элементы
- ПРИМЕНЕНИЯ ИЗОТОПОВ
- ЯДЕРНОЕ ДЕЛЕНИЕ И ЯДЕРНЫЙ СИНТЕЗ
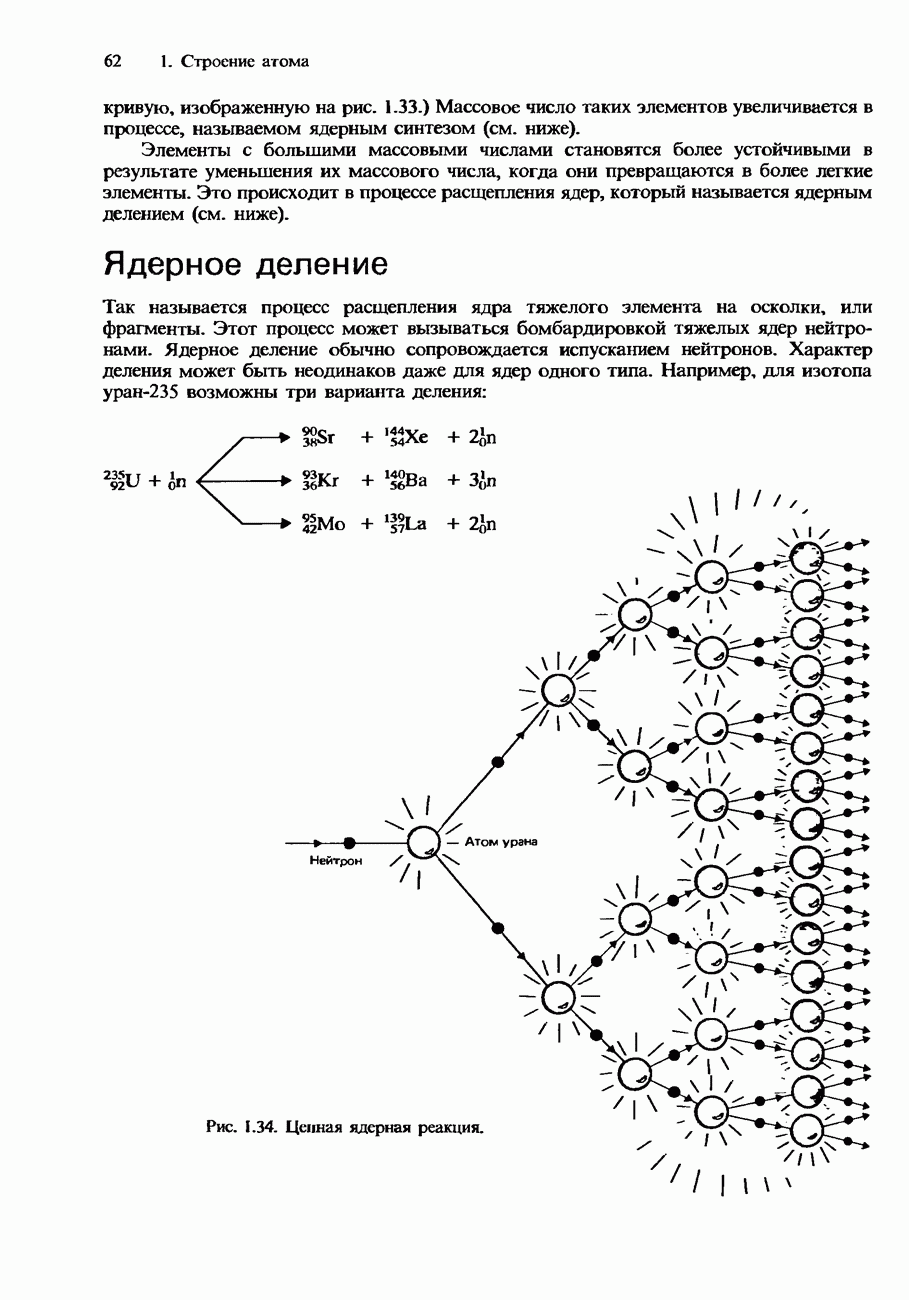
- Ядерное деление
- Ядерный синтез
- Ядерный синтез в звездах
- ЯДЕРНАЯ ЭНЕРГИЯ
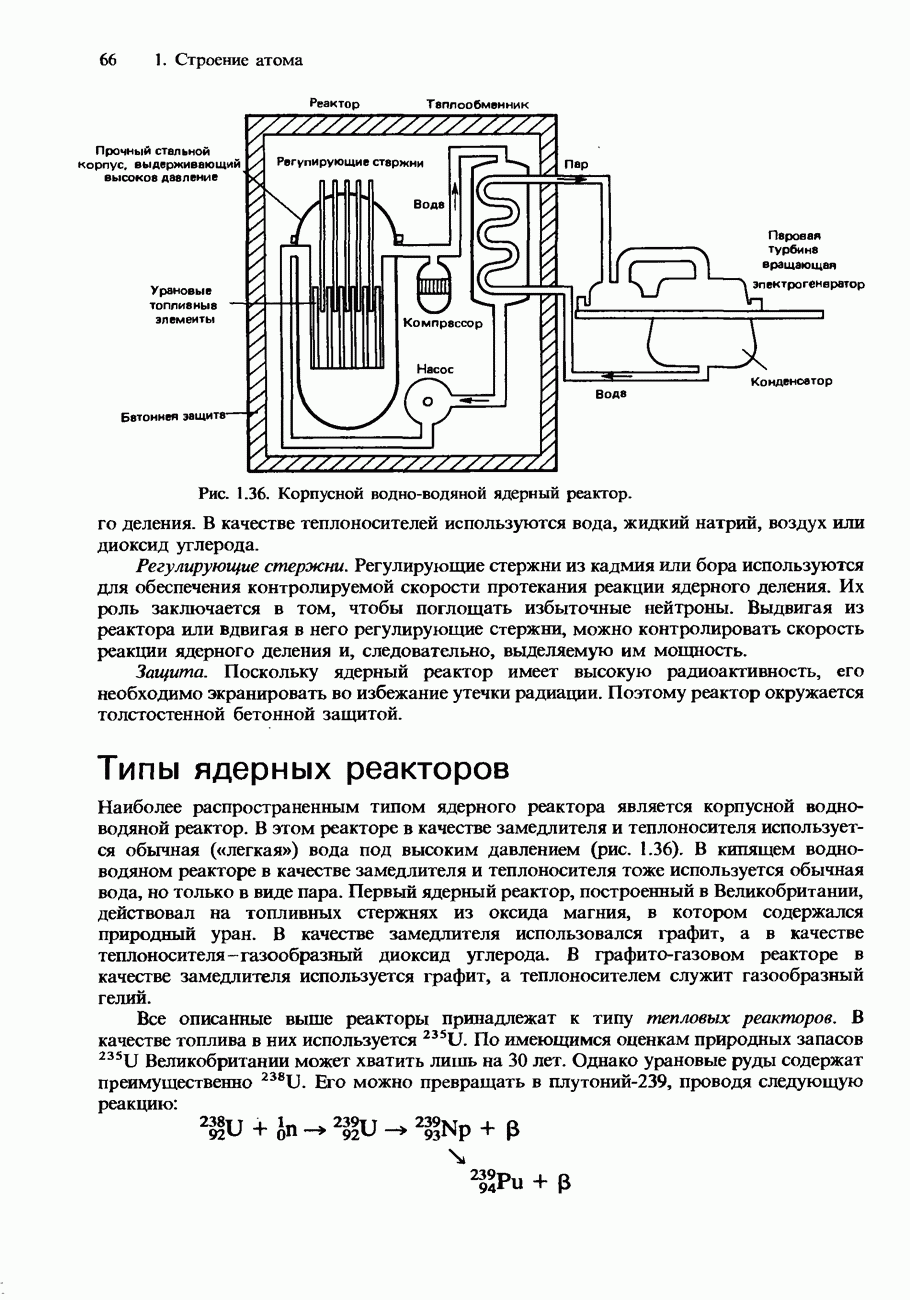
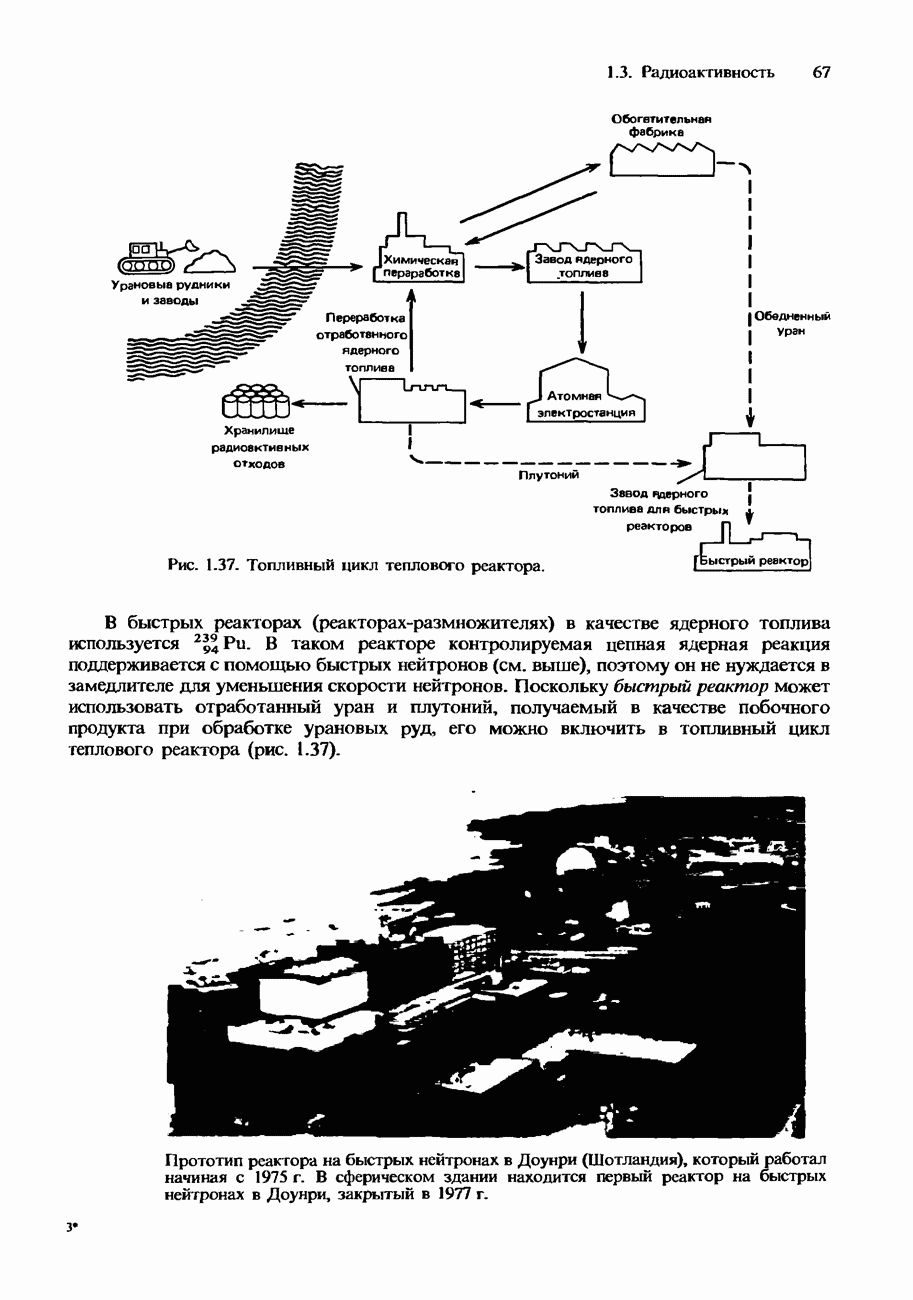
- Типы ядерных реакторов
- Радиоактивные ядерные отходы и их переработка
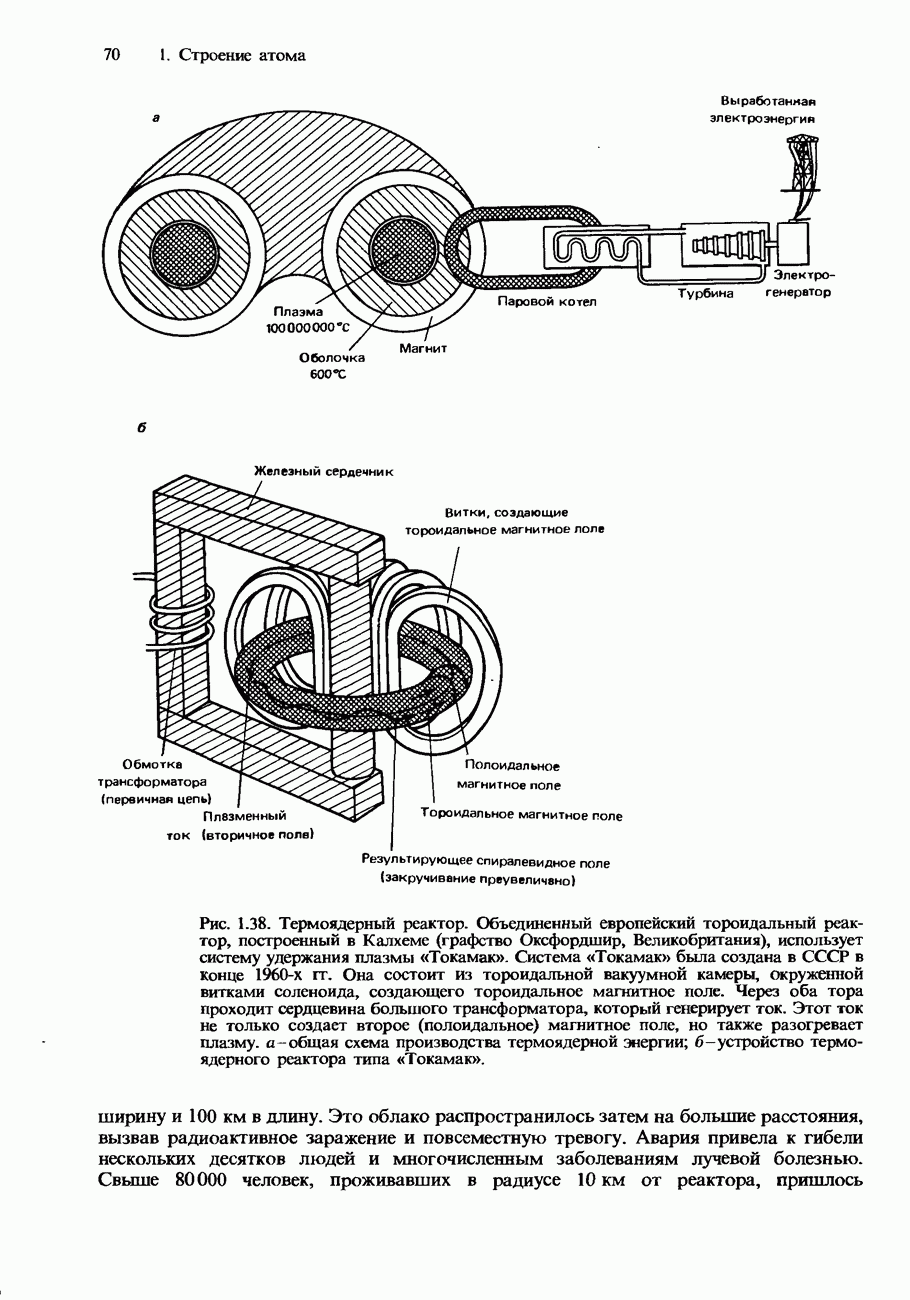
- Термоядерные реакторы
- Аргументы против использования ядерной энергии
- ЯДЕРНОЕ ОРУЖИЕ
- Ядерное разоружение
- ИСТОЧНИКИ РАДИАЦИИ И ЕЕ ВОЗДЕЙСТВИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 2. ХИМИЧЕСКАЯ СВЯЗЬ
- 2.1. Природа химической связи
- ИОННАЯ СВЯЗЬ
- Устойчивость ионных соединений
- КОВАЛЕНТНАЯ СВЯЗЬ
- Молекулярные орбитали
- Гибридные атомные орбитали
- Делокализованные орбитали
- Координационная связь
- ИОННЫЙ И КОВАЛЕНТНЫЙ ХАРАКТЕР СВЯЗИ
- Ионный характер ковалентных связей
- Ионные и ковалентные соединения
- МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
- Валентная зона и зона проводимости
- ВОДОРОДНАЯ СВЯЗЬ
- ВАНДЕРВААЛЬСОВЫ СИЛЫ
- Притяжение типа диполь-индуцированный диполь (индукционное)
- Что понимается под вандерваальсовыми силами
- 2.2. Влияние химической связи на свойства соединений
- Атомные радиусы
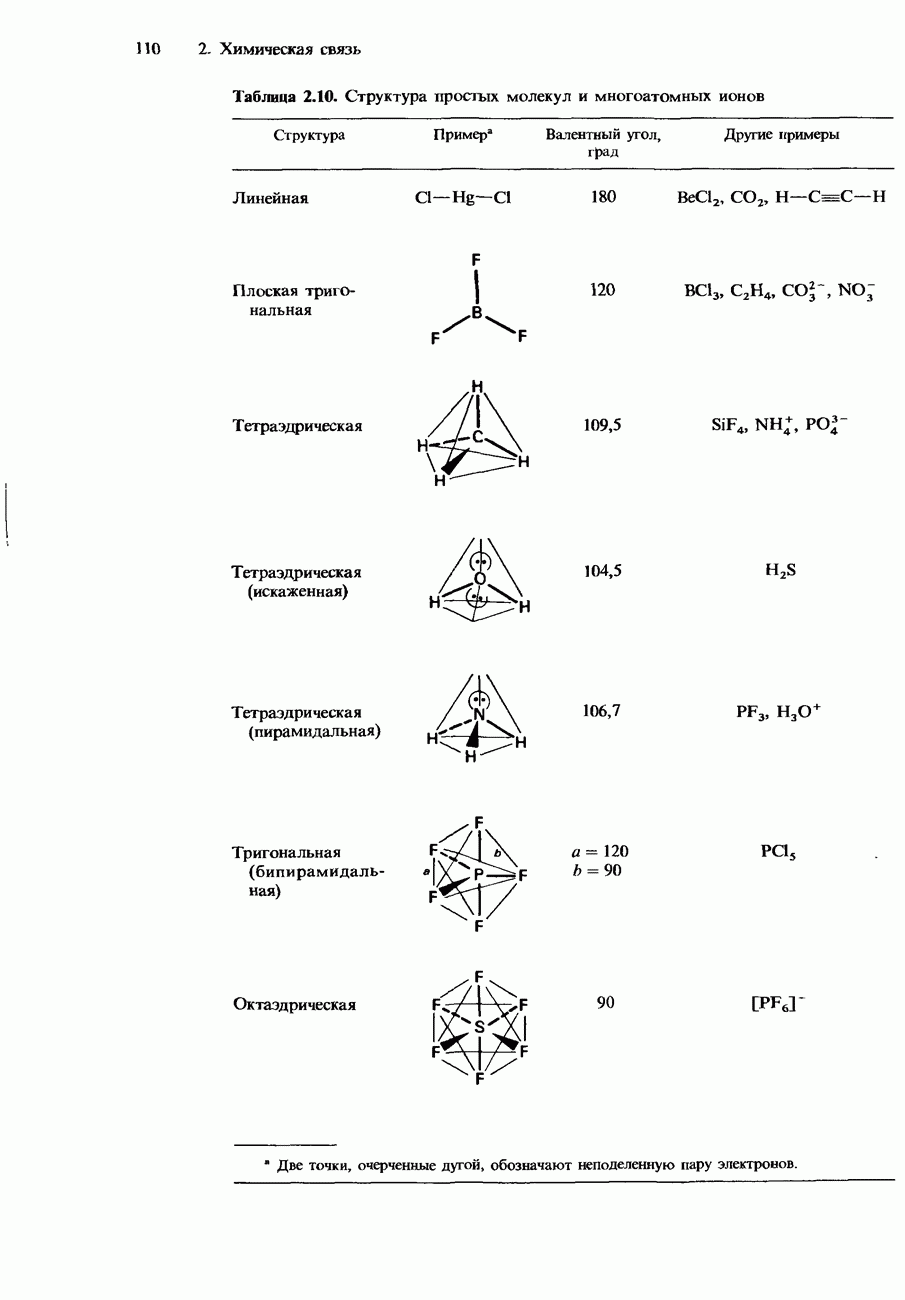
- ФОРМА ПРОСТЫХ МОЛЕКУЛ И МНОГОАТОМНЫХ ИОНОВ
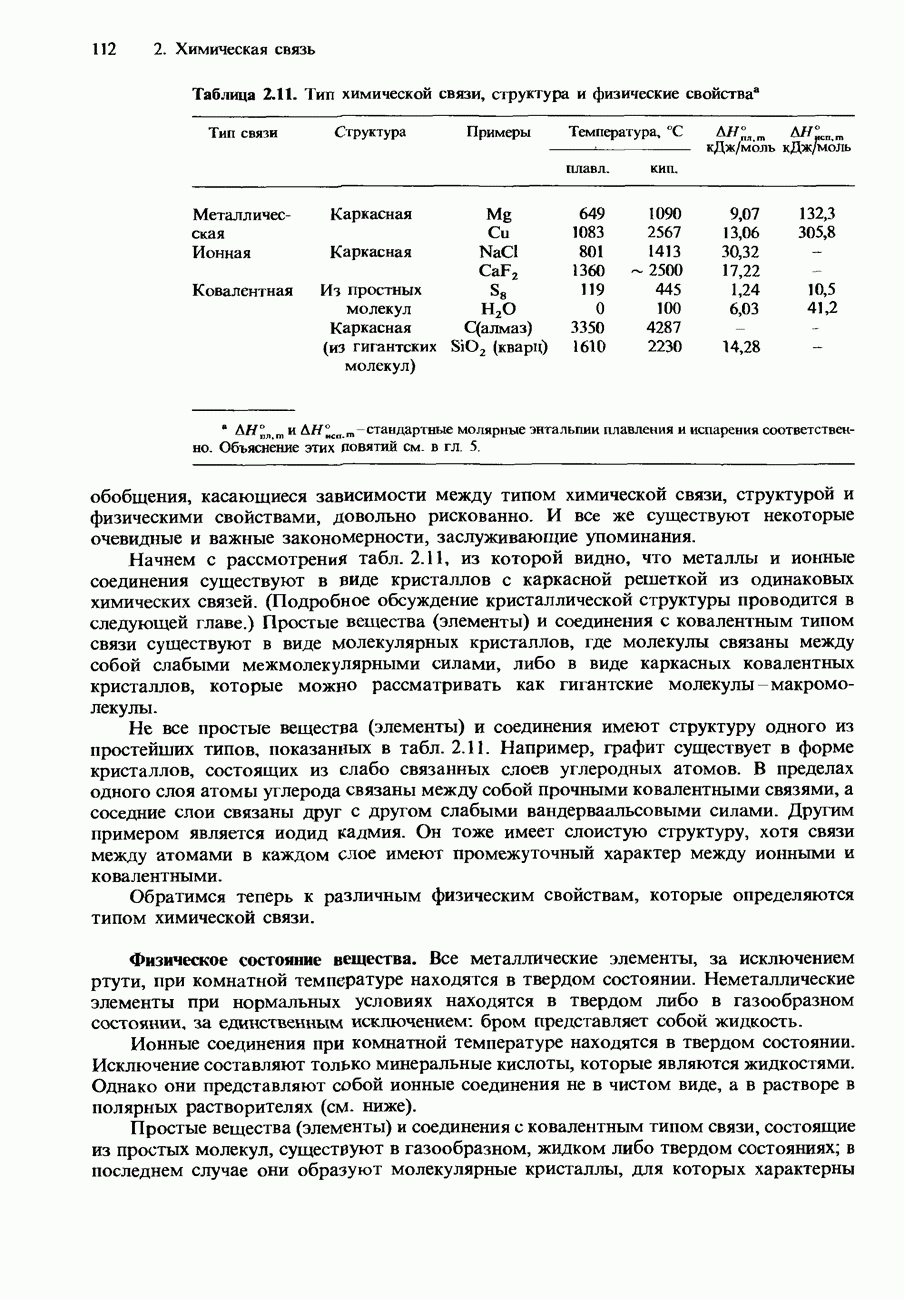
- ТИП ХИМИЧЕСКОЙ СВЯЗИ, СТРУКТУРА И ФИЗИЧЕСКИЕ СВОЙСТВА
- ТИП СВЯЗИ И ХИМИЧЕСКИЕ СВОЙСТВА
- ВЛИЯНИЕ МЕЖМОЛЕКУЛЯРНЫХ СИЛ НА СТРУКТУРУ И СВОЙСТВА
- ВЛИЯНИЕ ВАНДЕРВААЛЬСОВЫХ СИЛ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 3 ГАЗЫ, ЖИДКОСТИ И ТВЕРДЫЕ ВЕЩЕСТВА
- 3.1. Газы и жидкости
- ГАЗОВЫЕ ЗАКОНЫ
- Закон Бойля-Мариотта
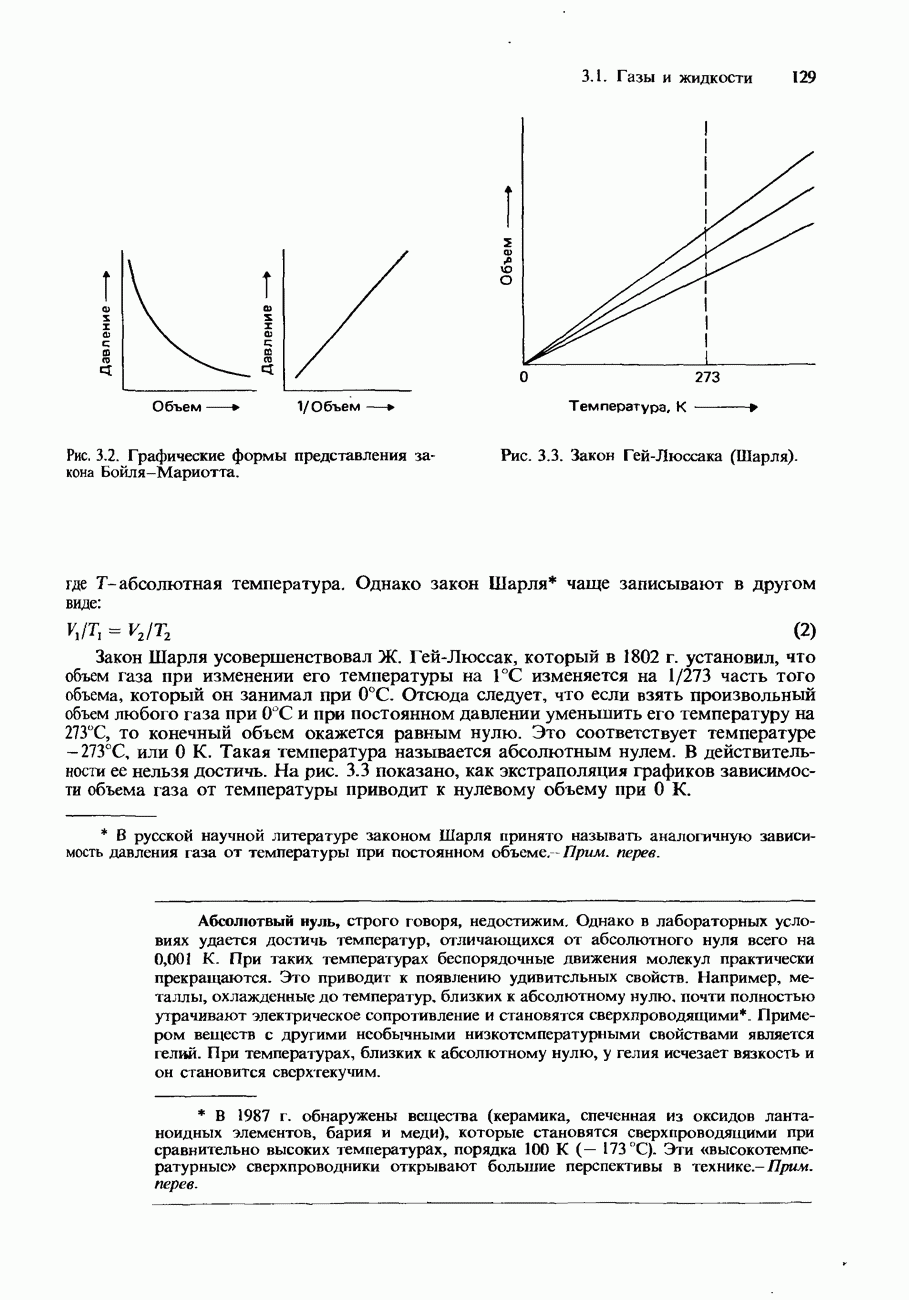
- Закон Гей-Люссака (закон Шарля)
- Объединенный газовый закон
- Закон Авогадро
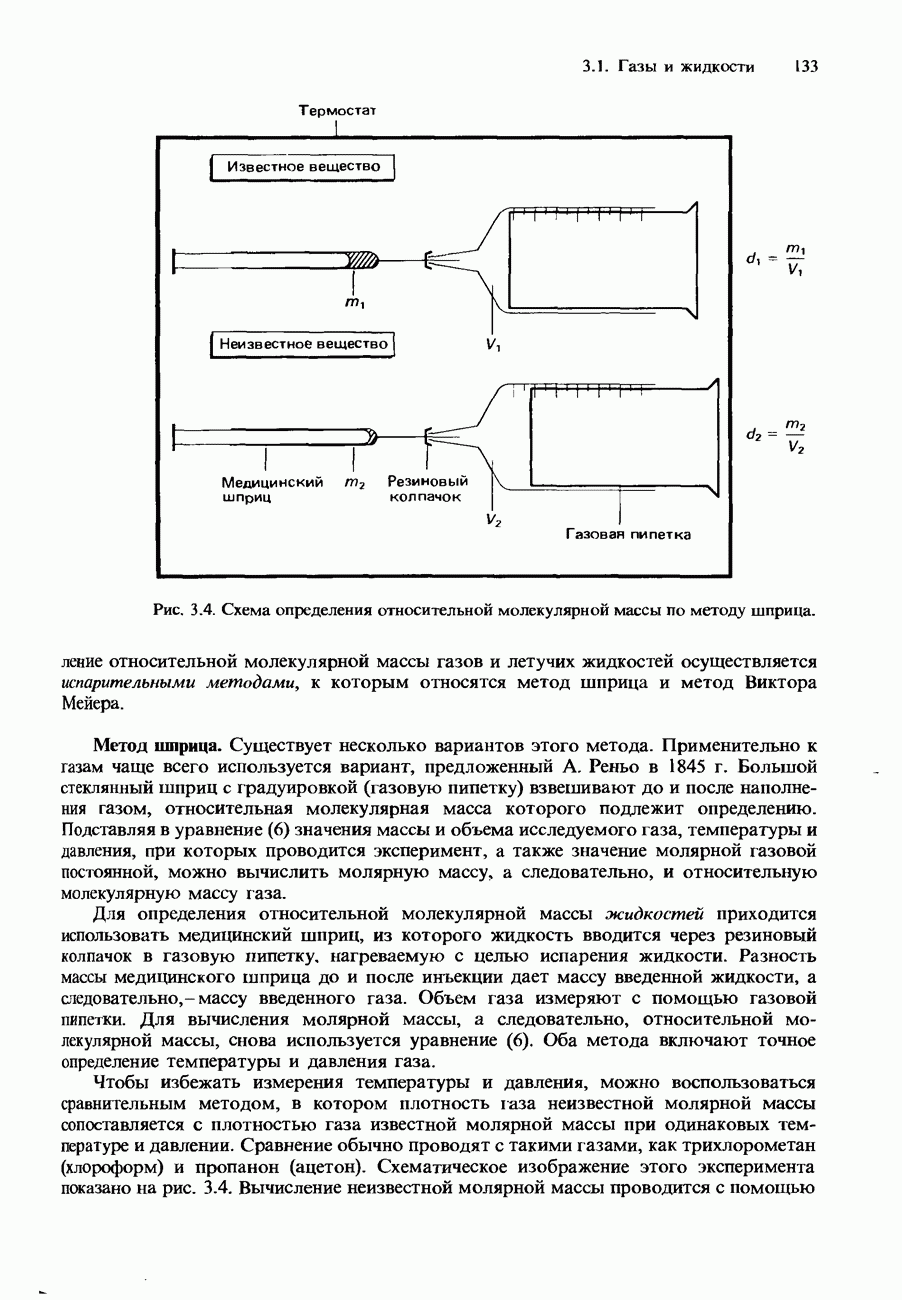
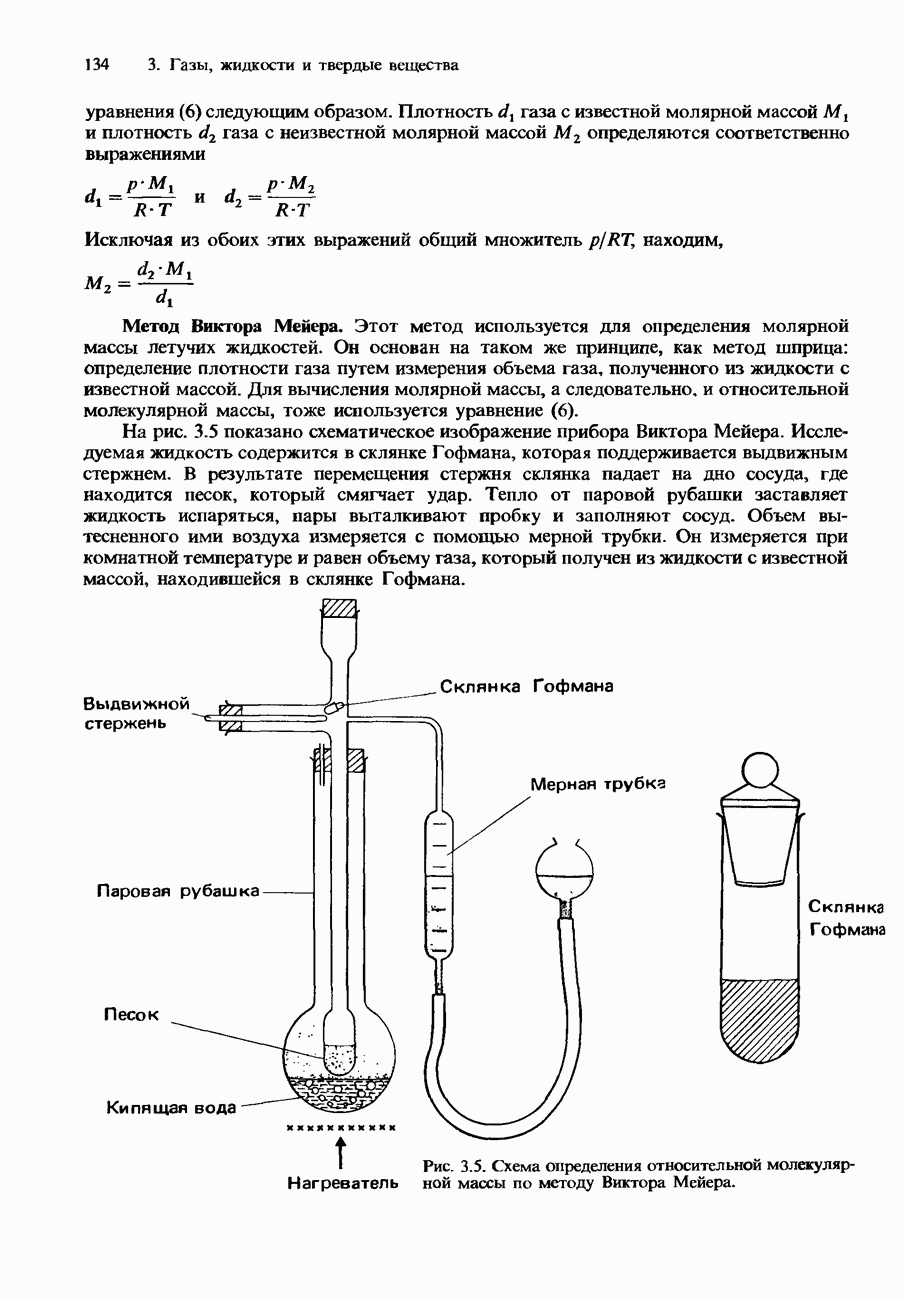
- Экспериментальное определение относительной молекулярной массы
- Закон парциальных давлений газов (закон Дальтона)
- Законы Грэхема
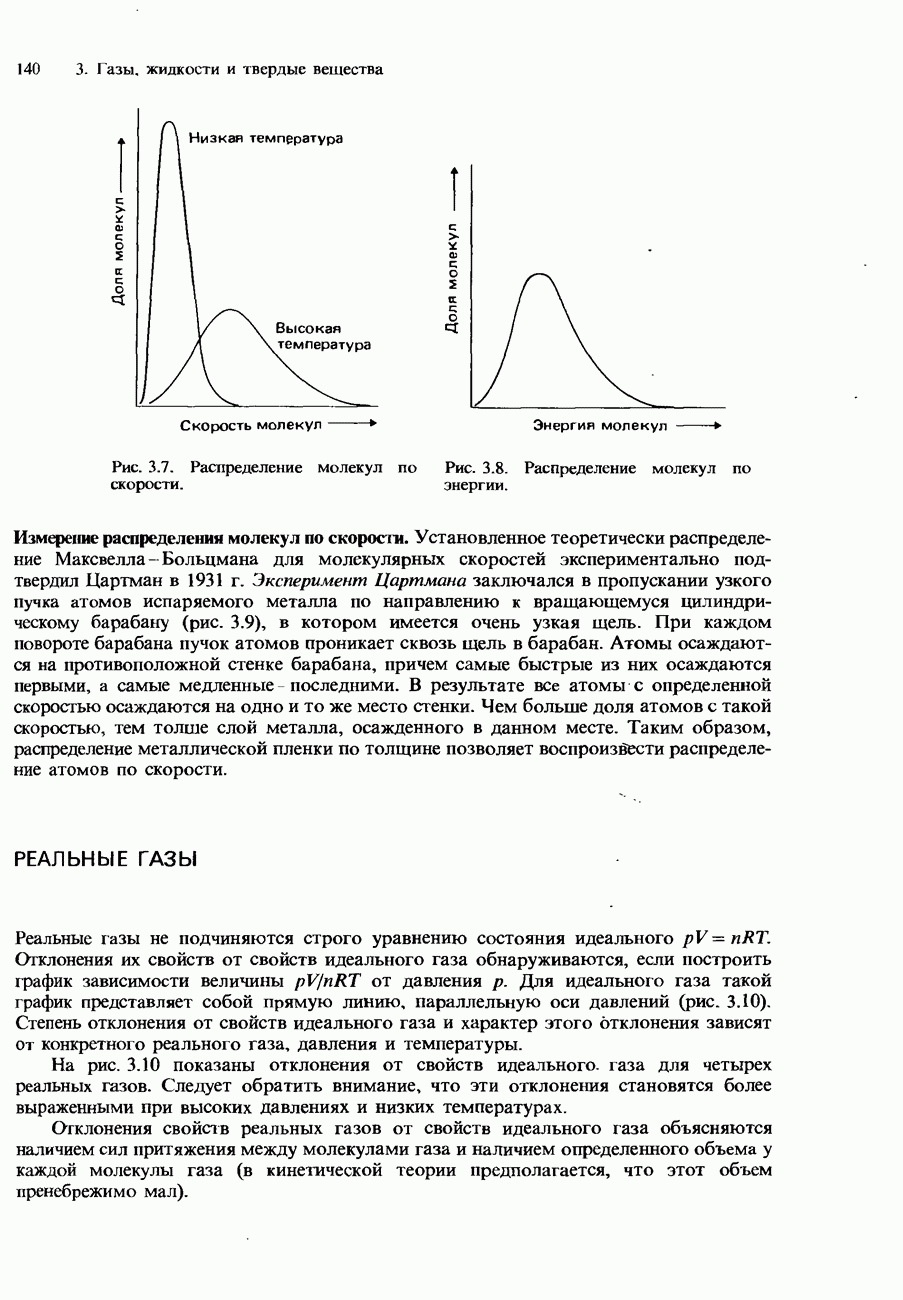
- КИНЕТИЧЕСКАЯ ТЕОРИЯ ГАЗОВ
- Скорости молекул
- Распределение Максвелла-Больцмана
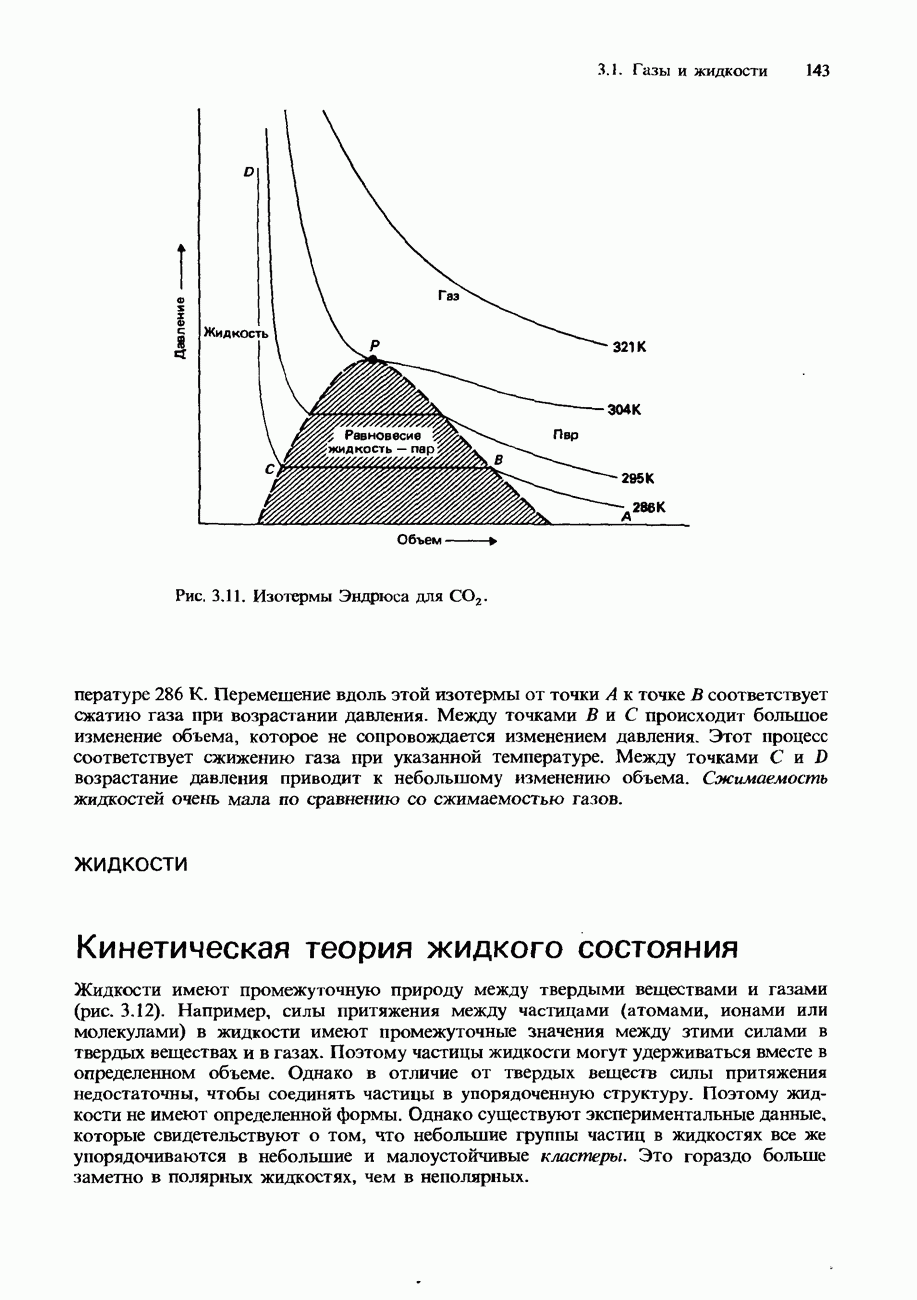
- РЕАЛЬНЫЕ ГАЗЫ
- Уравнение Ван-дер-Ваальса
- Сжижение газов
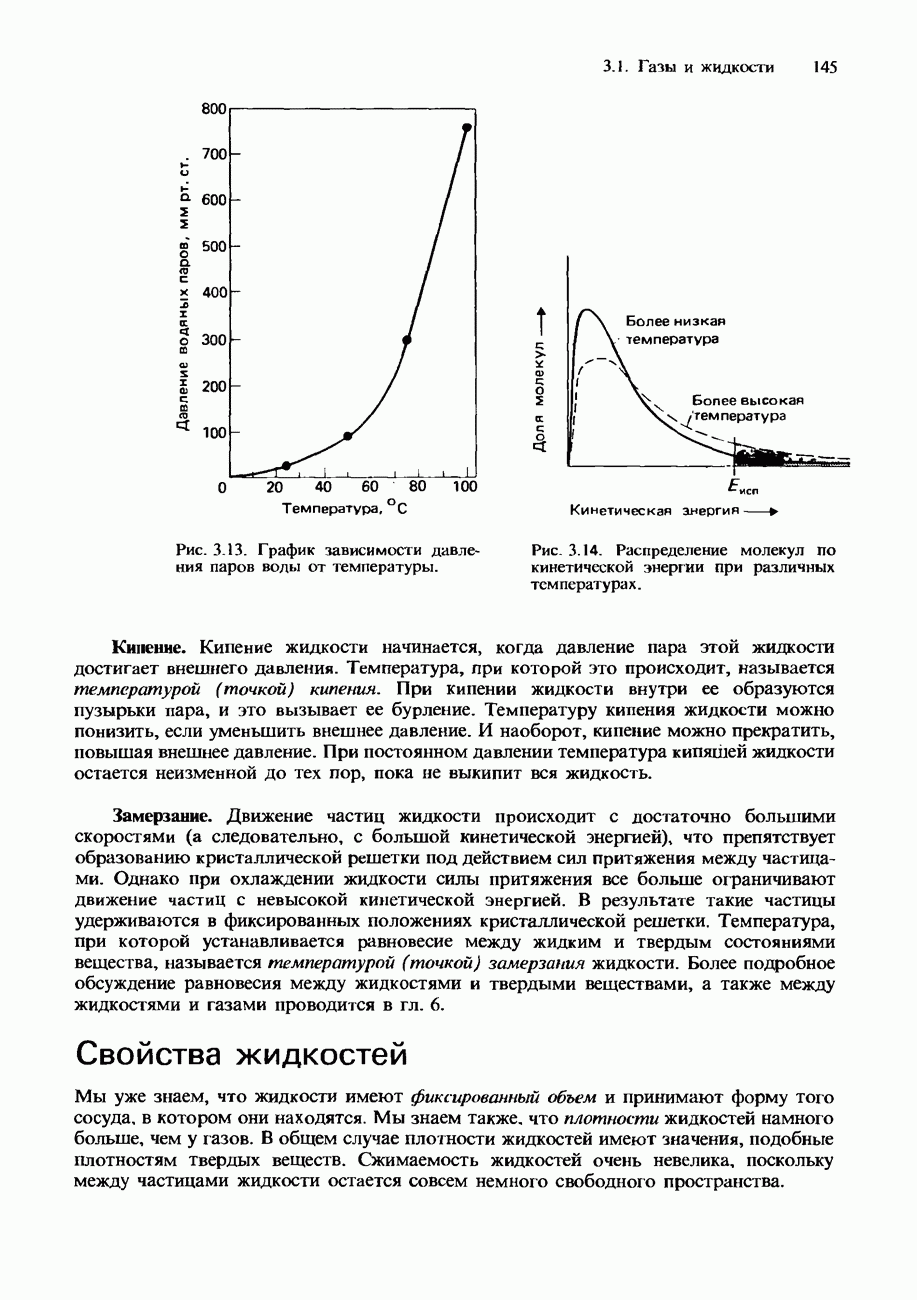
- ЖИДКОСТИ
- Свойства жидкостей
- 3.2. Твердые вещества
- КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА
- Металлические кристаллы
- Ионные кристаллы
- Ковалентные кристаллы
- ИЗОМОРФИЗМ. ПОЛИМОРФИЗМ И АЛЛОТРОПИЯ
- СВОЙСТВА ТВЕРДЫХ ВЕЩЕСТВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 4. СТЕХИОМЕТРИЯ
- 4.1. Стехиометрия и номенклатура
- Химические вещества
- Количественные законы химии
- Вес и масса
- НАЗВАНИЯ И ФОРМУЛЫ ХИМИЧЕСКИХ СОЕДИНЕНИЙ
- Химические формулы
- НОМЕНКЛАТУРА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- Степень окисления (состояние окисления)
- Элементы
- Бинарные соединения
- 4.2 Стехиометрические вычисления
- Молярная масса
- Число частиц вещества
- Процентный состав соединения
- Эмпирическая формула соединения
- Молярные постоянные и молярные величины
- Состав гомогенных смесей
- ХИМИЧЕСКИЕ УРАВНЕНИЯ
- ВЫХОД РЕАКЦИИ
- ПРОМЫШЛЕННАЯ СТЕХИОМЕТРИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 5. ЭНЕРГЕТИКА
- 5.1. Термодинамика
- ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ
- 5.2. Энтальпия
- СТАНДАРТНЫЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ
- ДРУГИЕ ИЗМЕНЕНИЯ ЭНТАЛЬПИИ
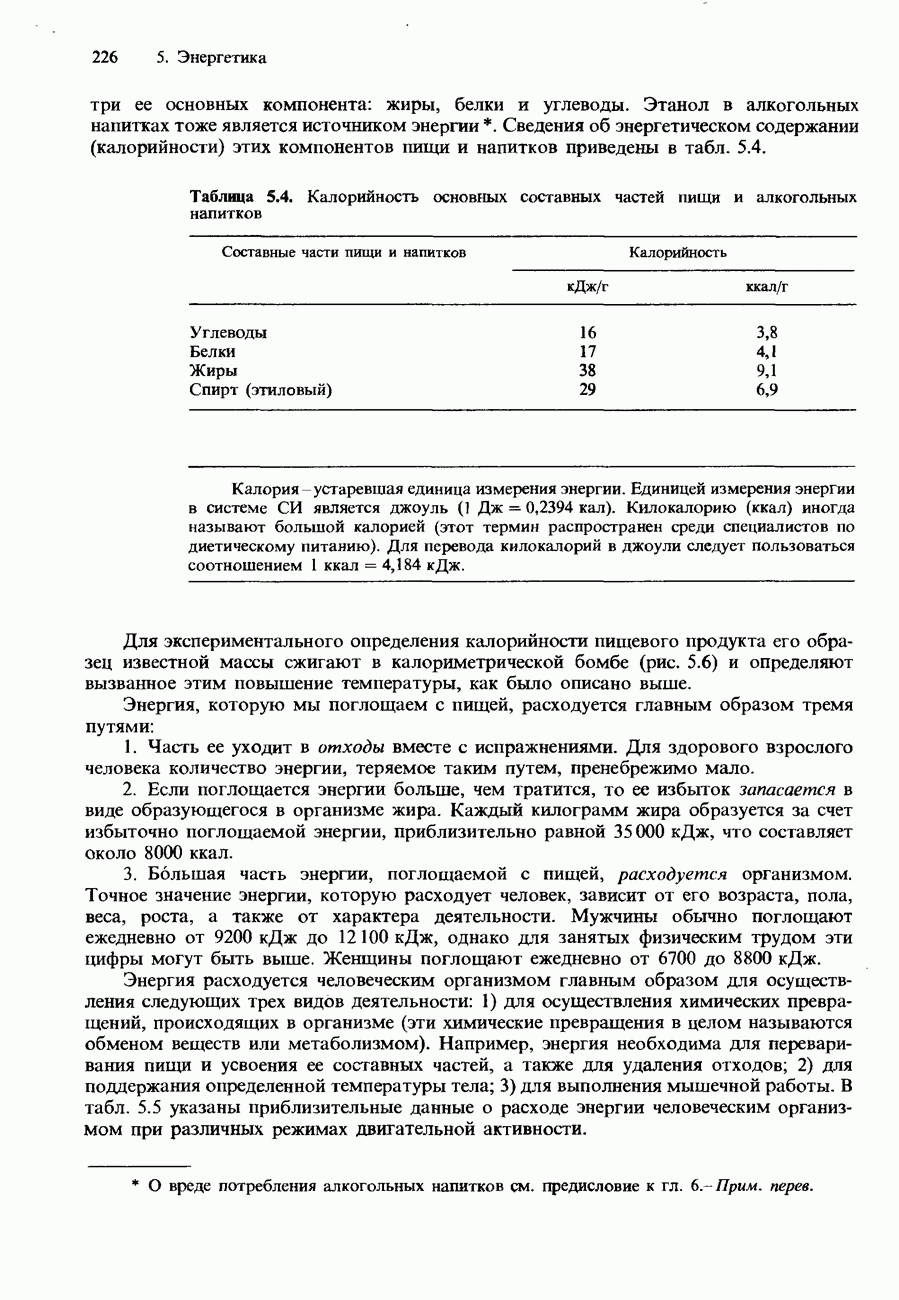
- КАЛОРИМЕТРИЯ
- КАЛОРИЙНОСТЬ ПИЩИ
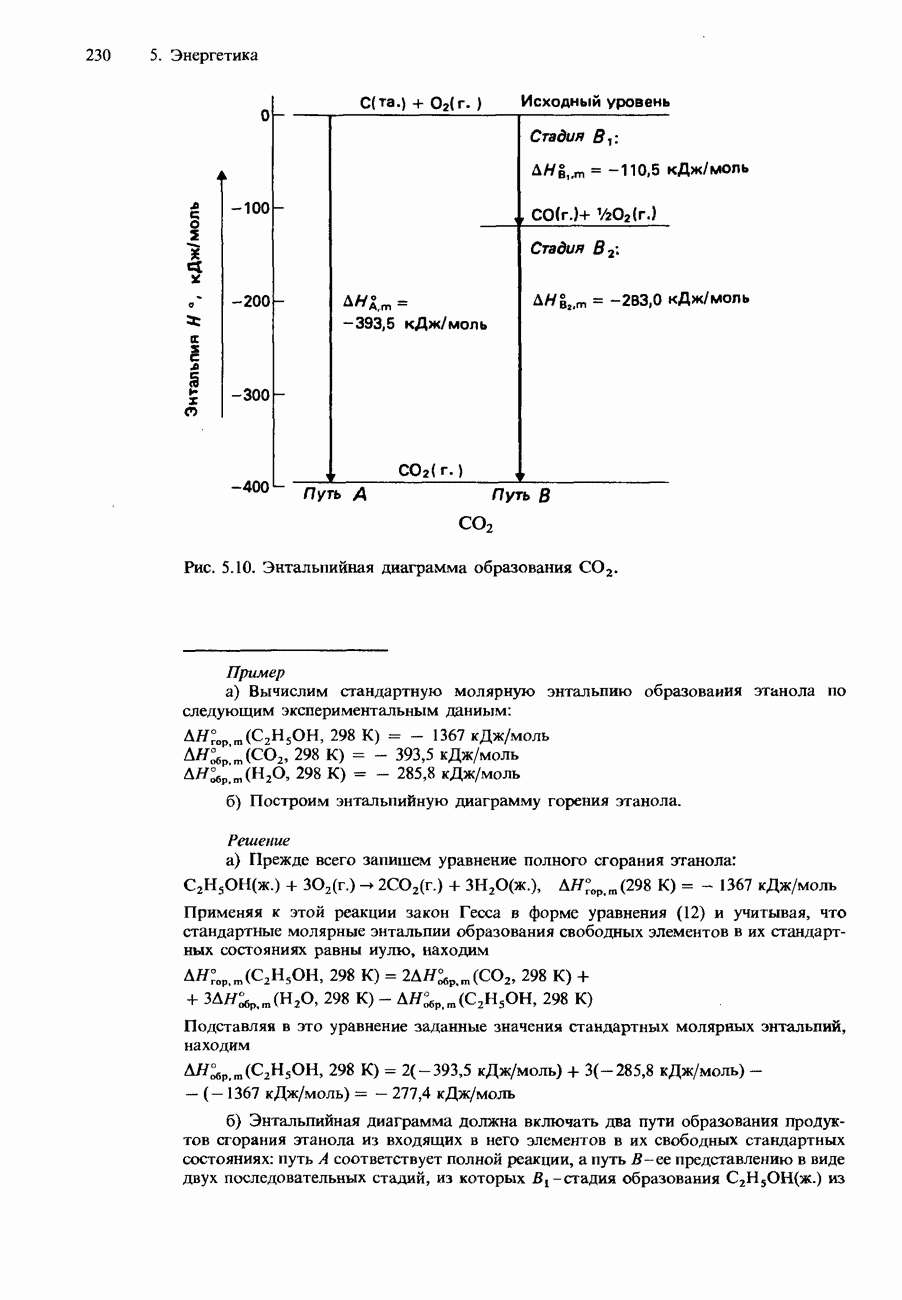
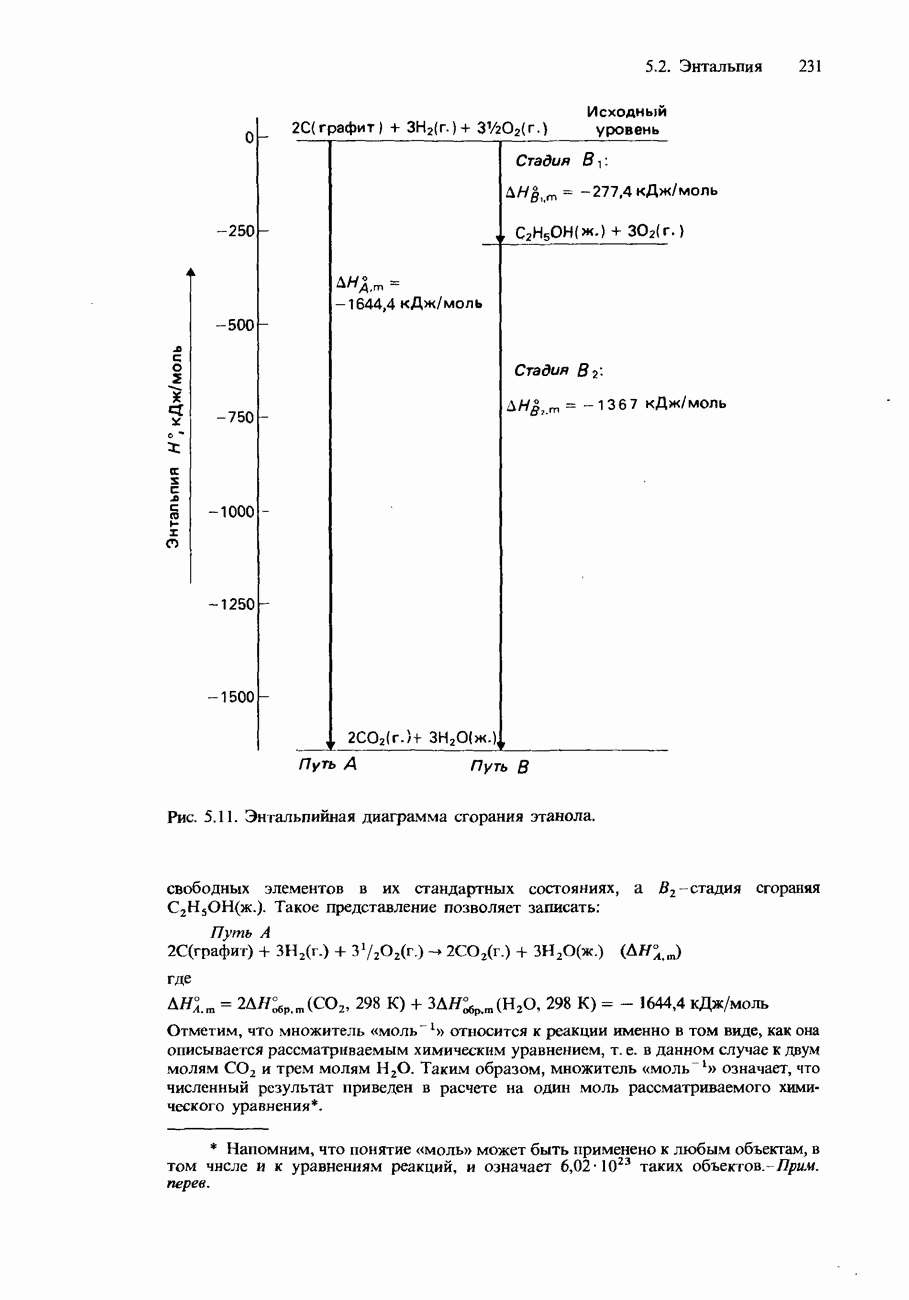
- ЗАКОН ГЕССА
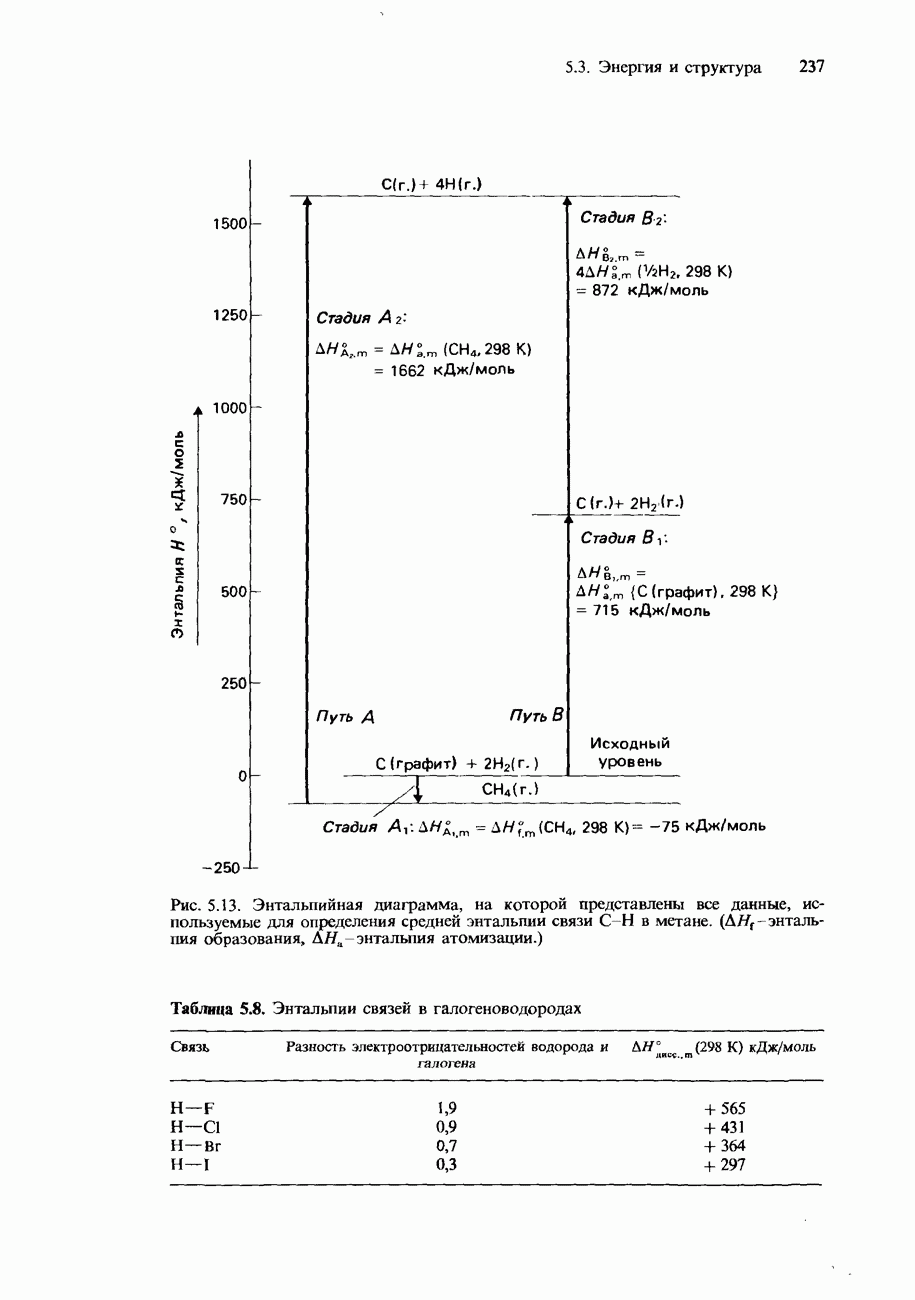
- 5.3 Энергия и структура
- ЭНТАЛЬПИЯ КРИСТАЛЛИЧЕСКОЙ РЕШЕТКИ
- Энтальпии растворения и гидратации
- ЭНТРОПИЯ
- СВОБОДНАЯ ЭНЕРГИЯ ГИББСА
- О ЧЕМ ПОЗВОЛЯЕТ СУДИТЬ ИЗМЕНЕНИЕ СВОБОДНОЙ ЭНЕРГИИ СИСТЕМЫ
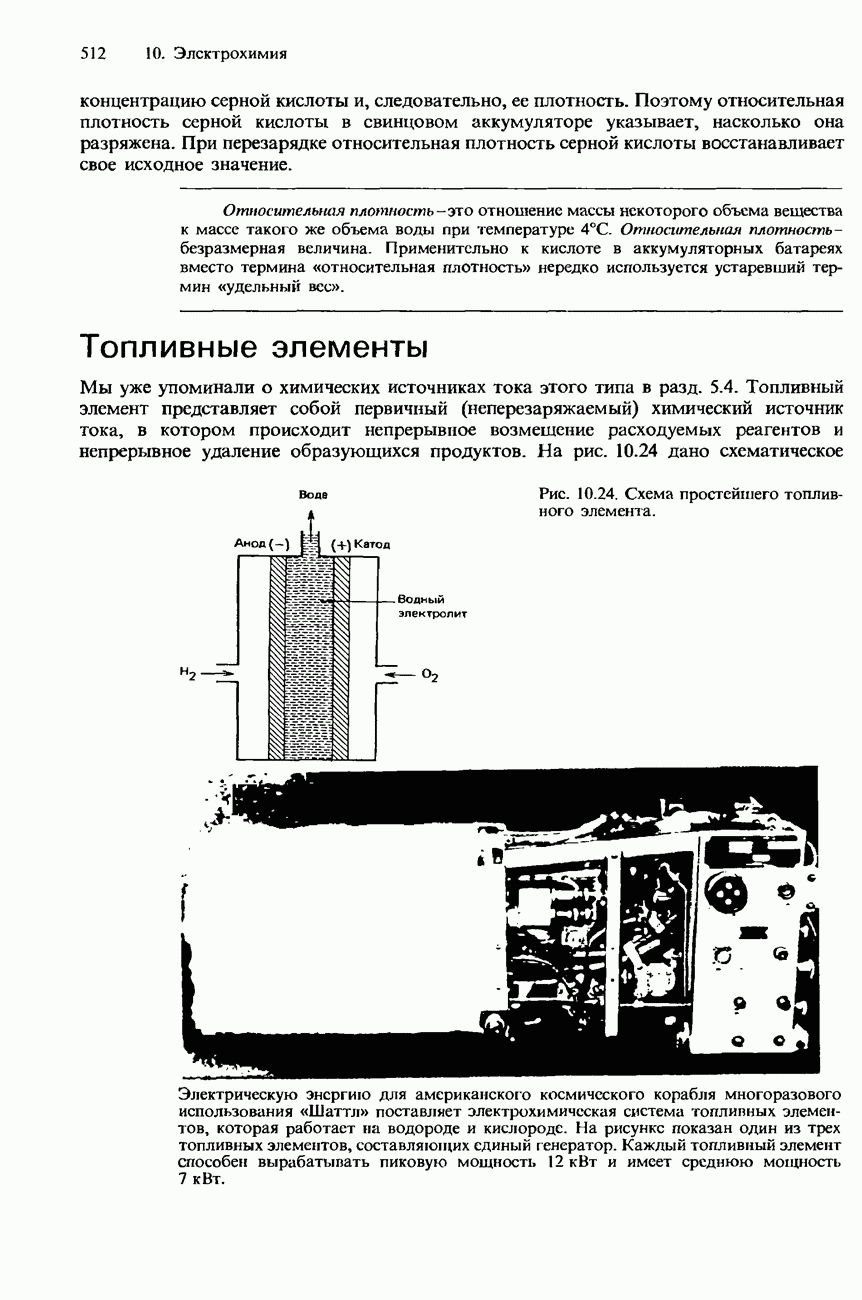
- 5.4. Источники энергии
- НЕТРАДИЦИОННЫЕ ИСТОЧНИКИ ЭНЕРГИИ
- ЗАПАСАНИЕ ЭНЕРГИИ
- ПОТРЕБЛЕНИЕ ЭНЕРГИИ В ПРОШЛОМ, НАСТОЯЩЕМ И БУДУЩЕМ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 6. ФАЗОВЫЕ РАВНОВЕСИЯ
- 6.1. Равновесия и фазы
- ФАЗЫ И КОМПОНЕНТЫ
- Фазы
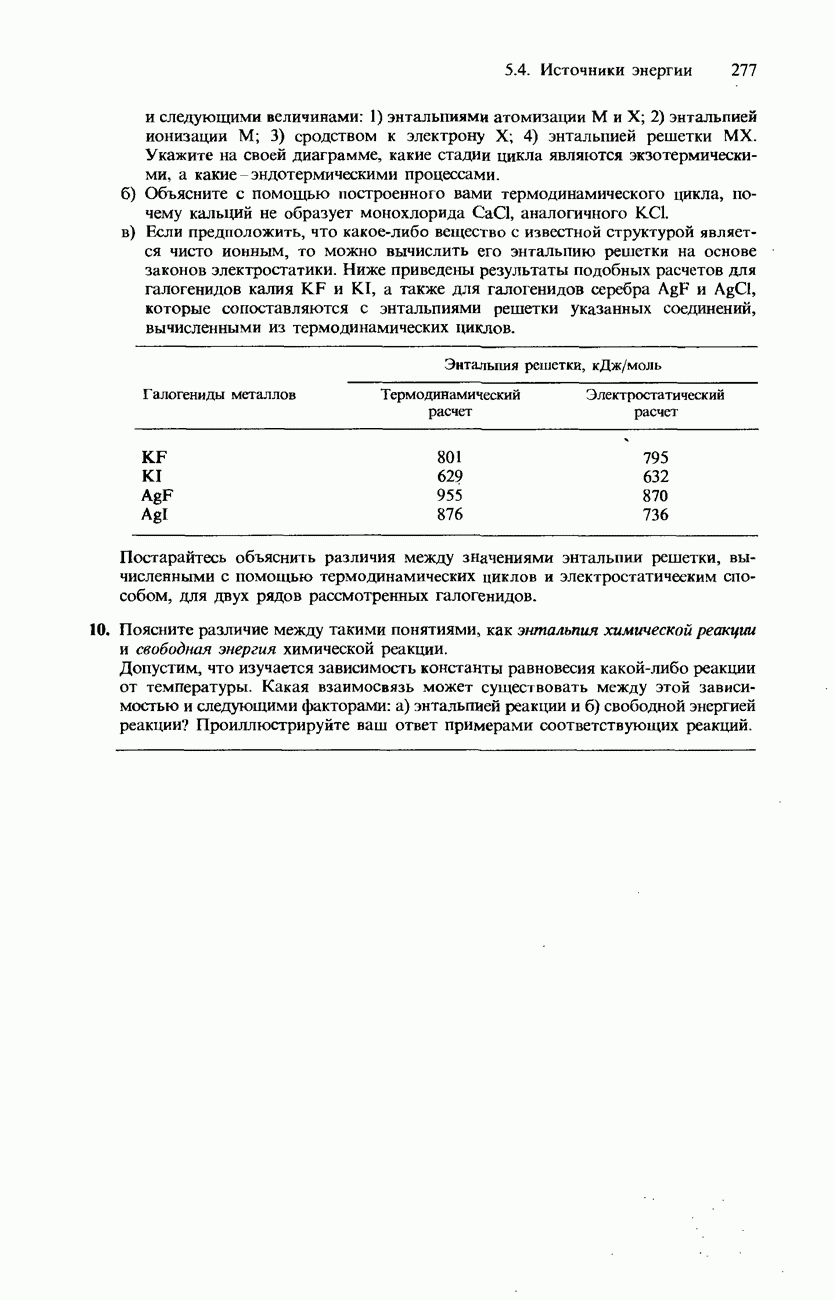
- ФАЗОВАЯ ДИАГРАММА ВОДЫ
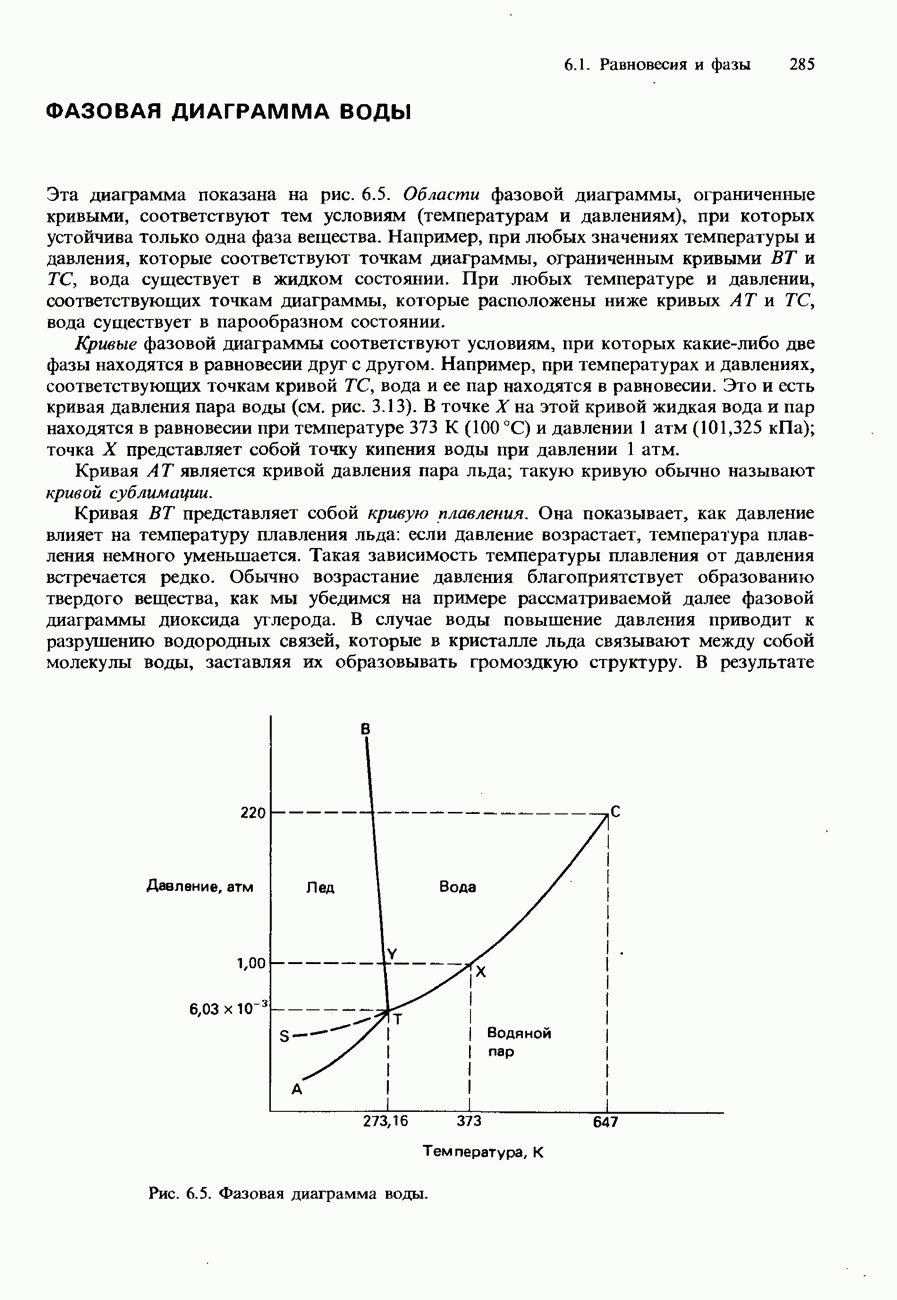
- ФАЗОВАЯ ДИАГРАММА ДИОКСИДА УГЛЕРОДА
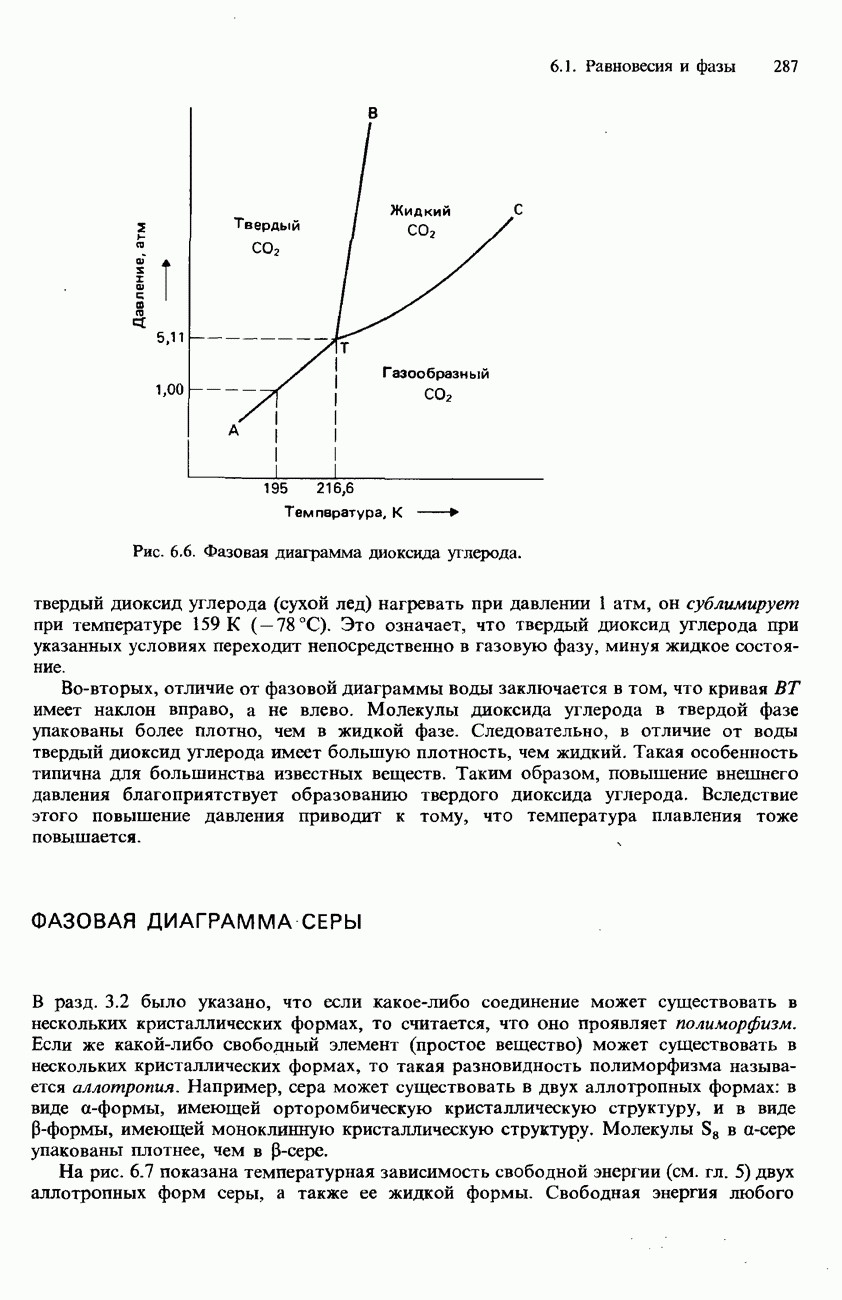
- ФАЗОВАЯ ДИАГРАММА СЕРЫ
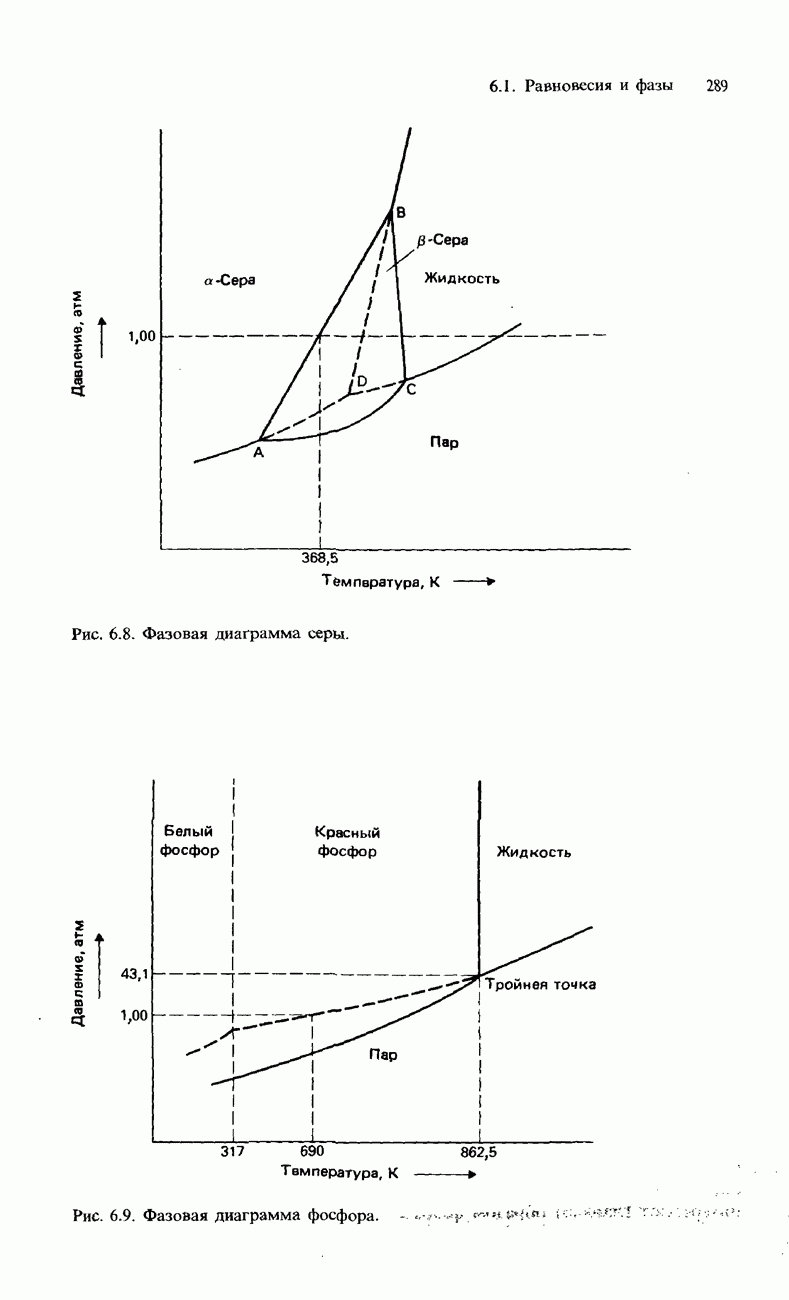
- ФАЗОВАЯ ДИАГРАММА ФОСФОРА
- 6.2. Многокомпонентные системы
- ДВУХКОМПОНЕНТНЫЕ ЖИДКИЕ СМЕСИ
- ПОЛНОСТЬЮ СМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
- Фазовые диаграммы полностью смешивающихся жидкостей
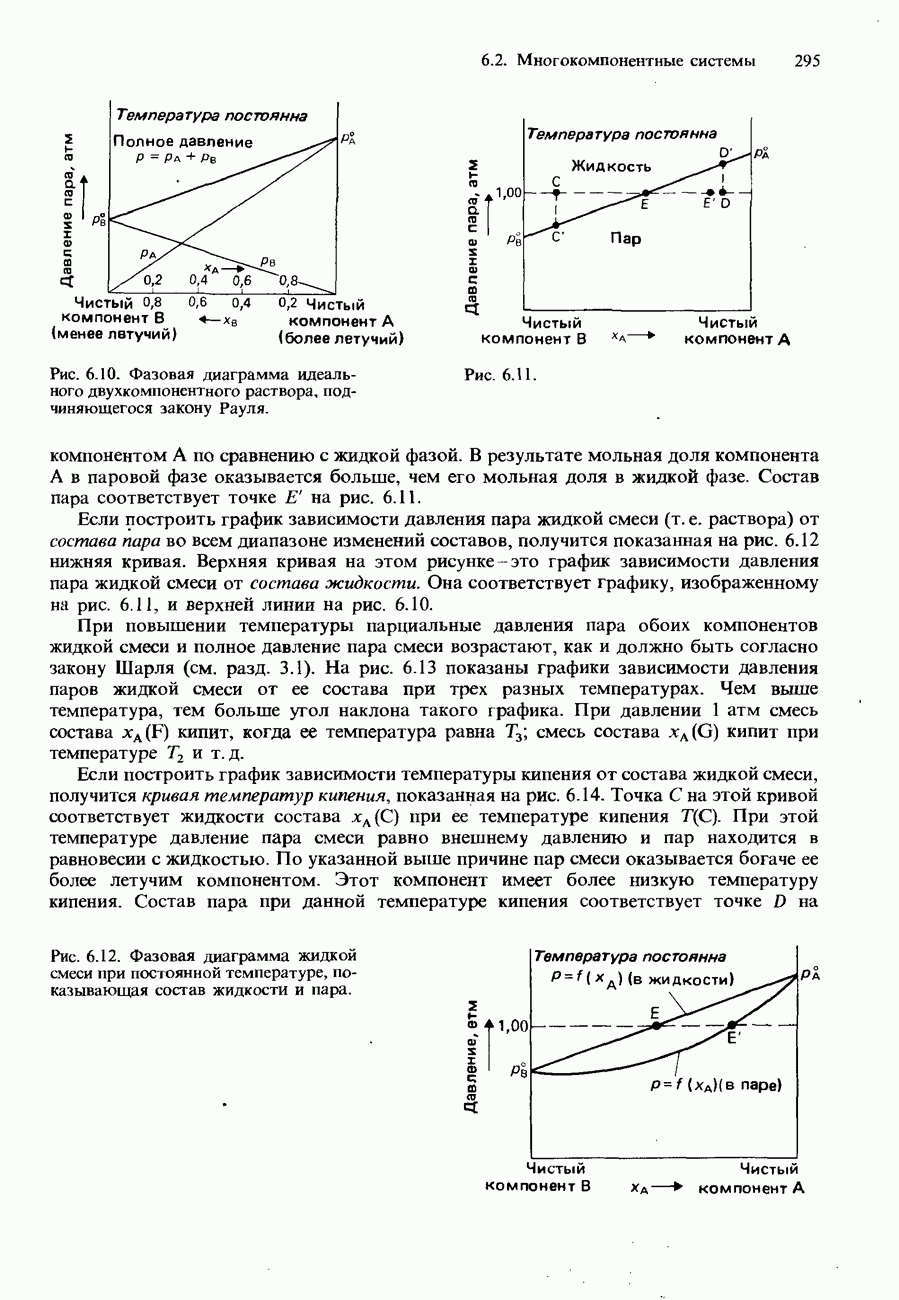
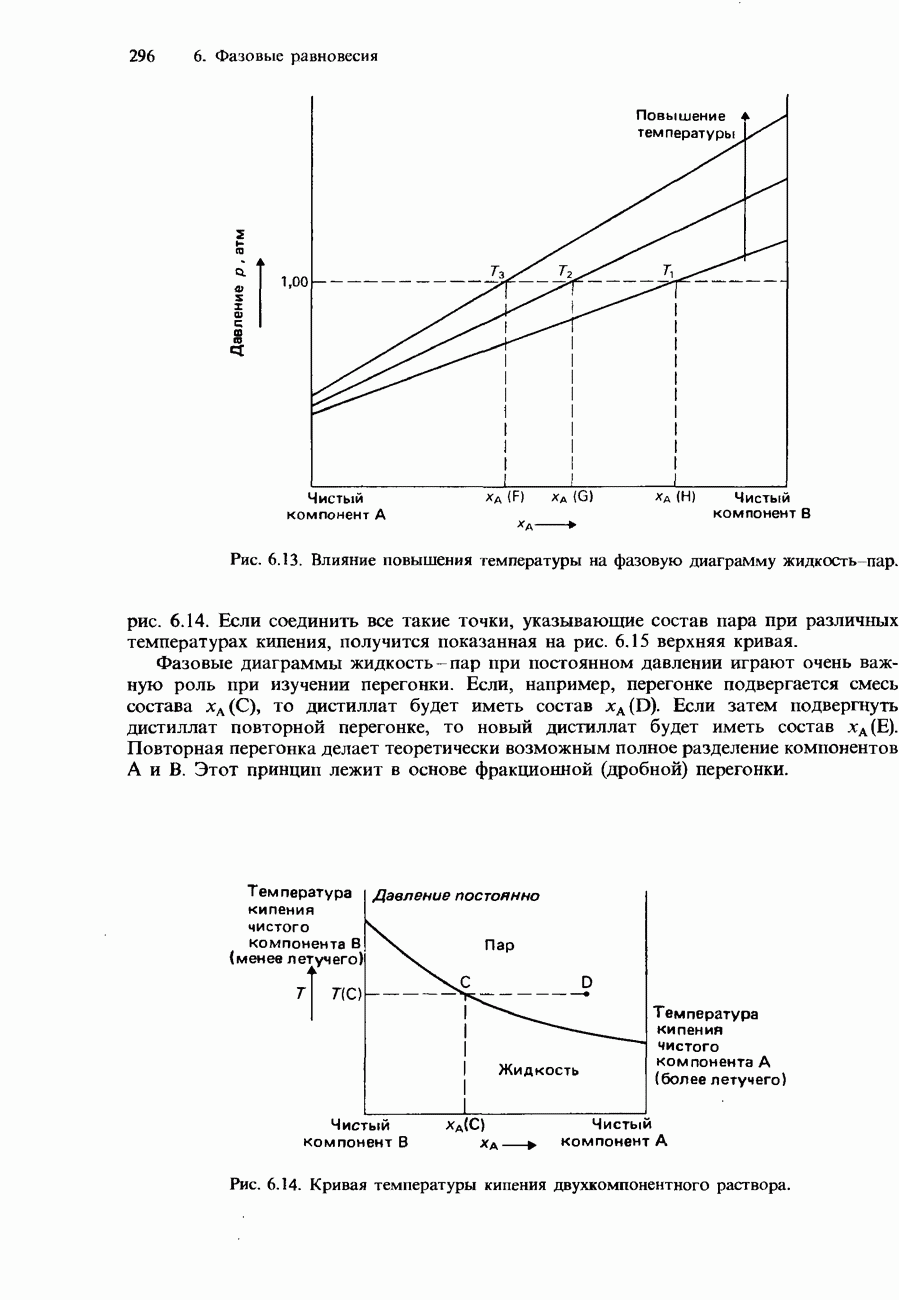
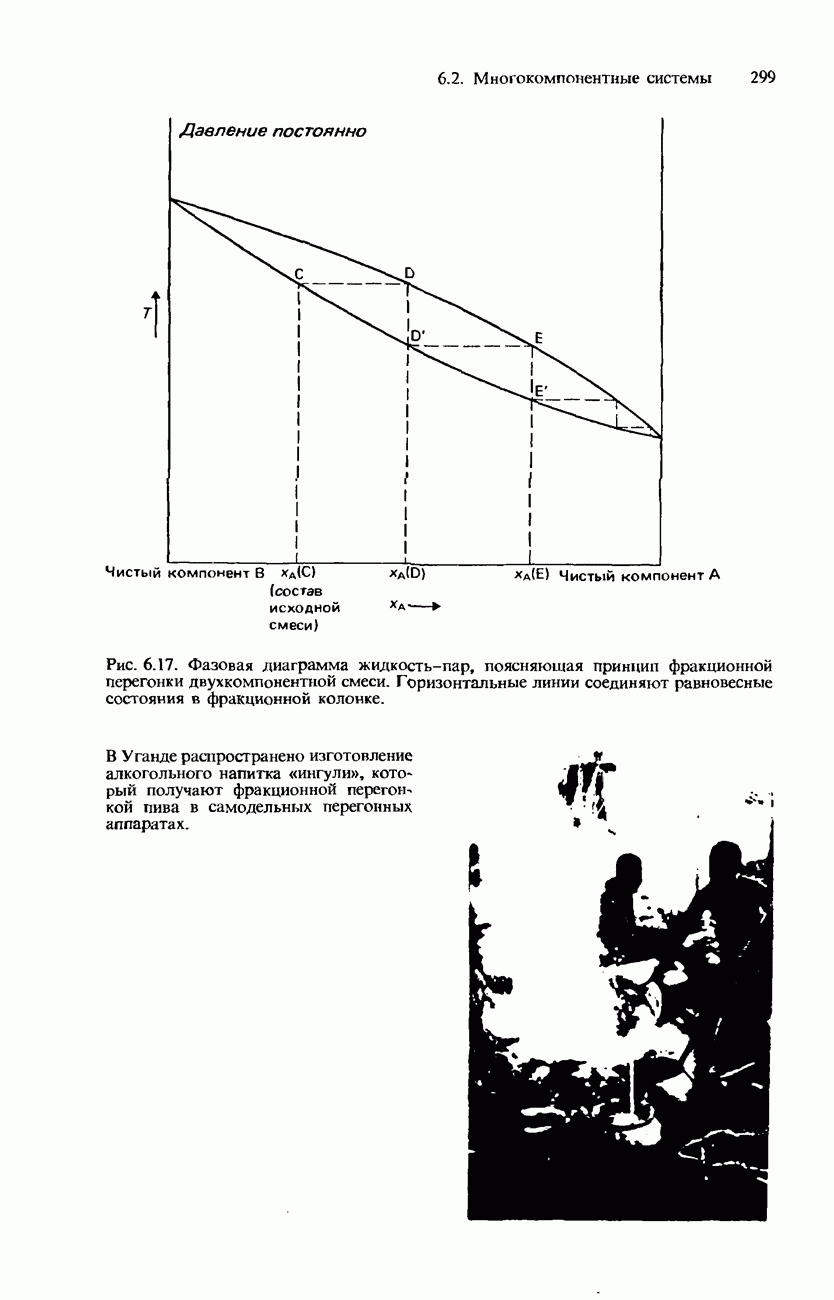
- Фракционная перегонка
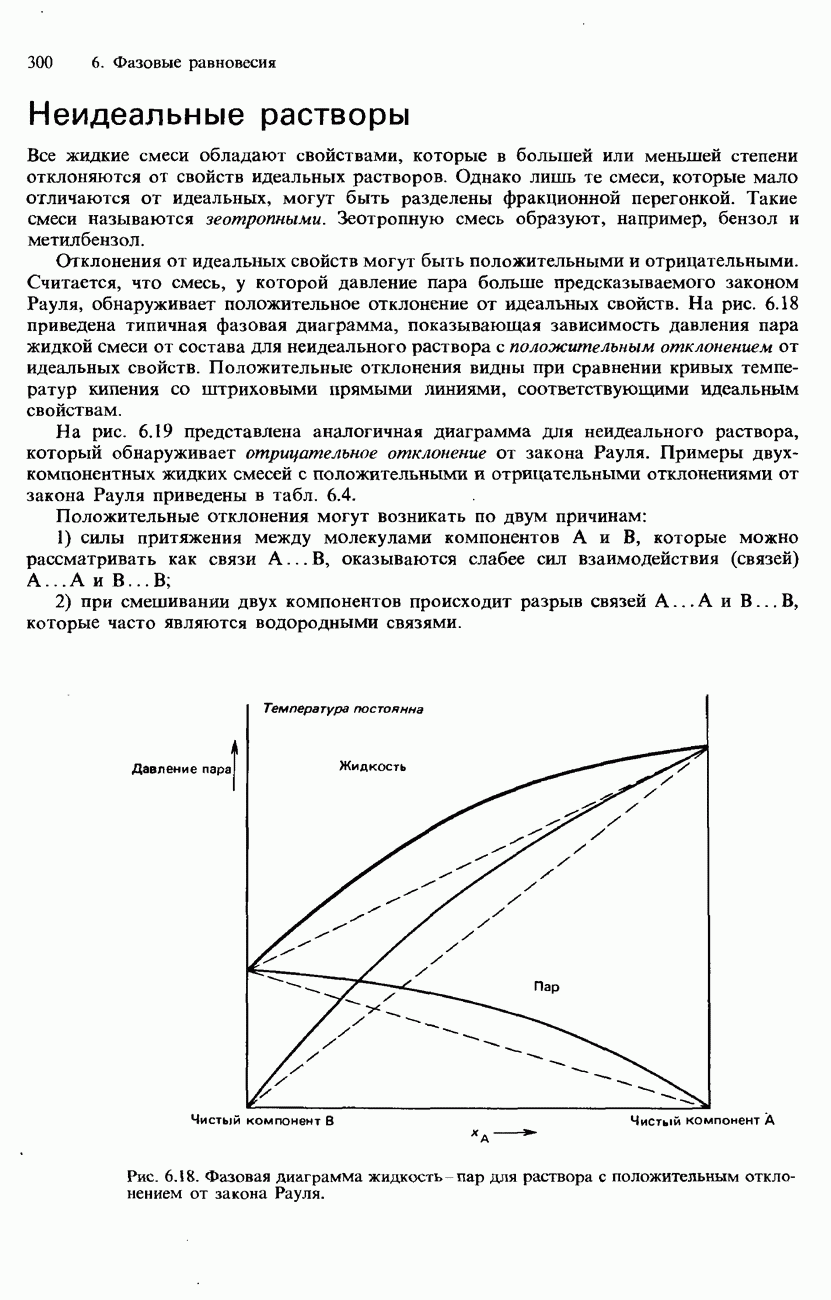
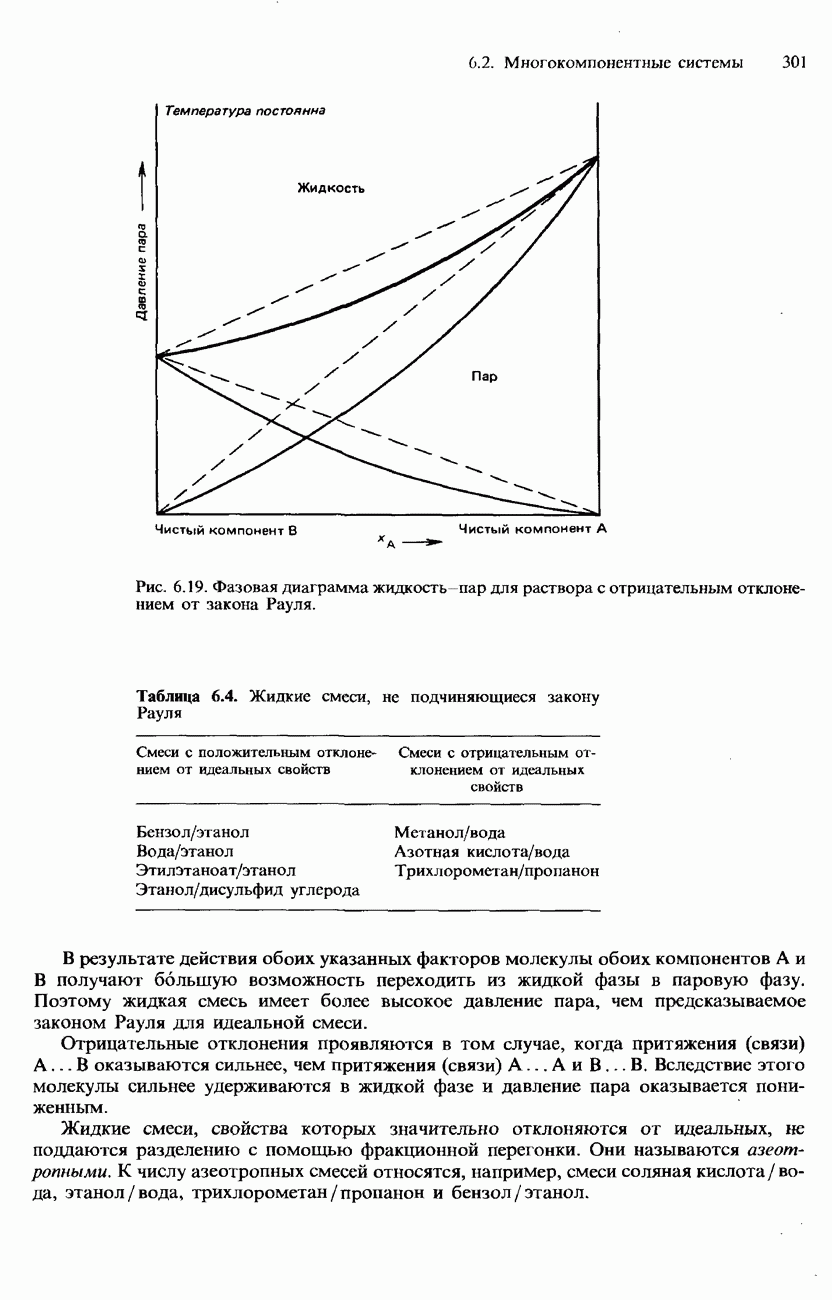
- Неидеальные растворы
- ЧАСТИЧНО СМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
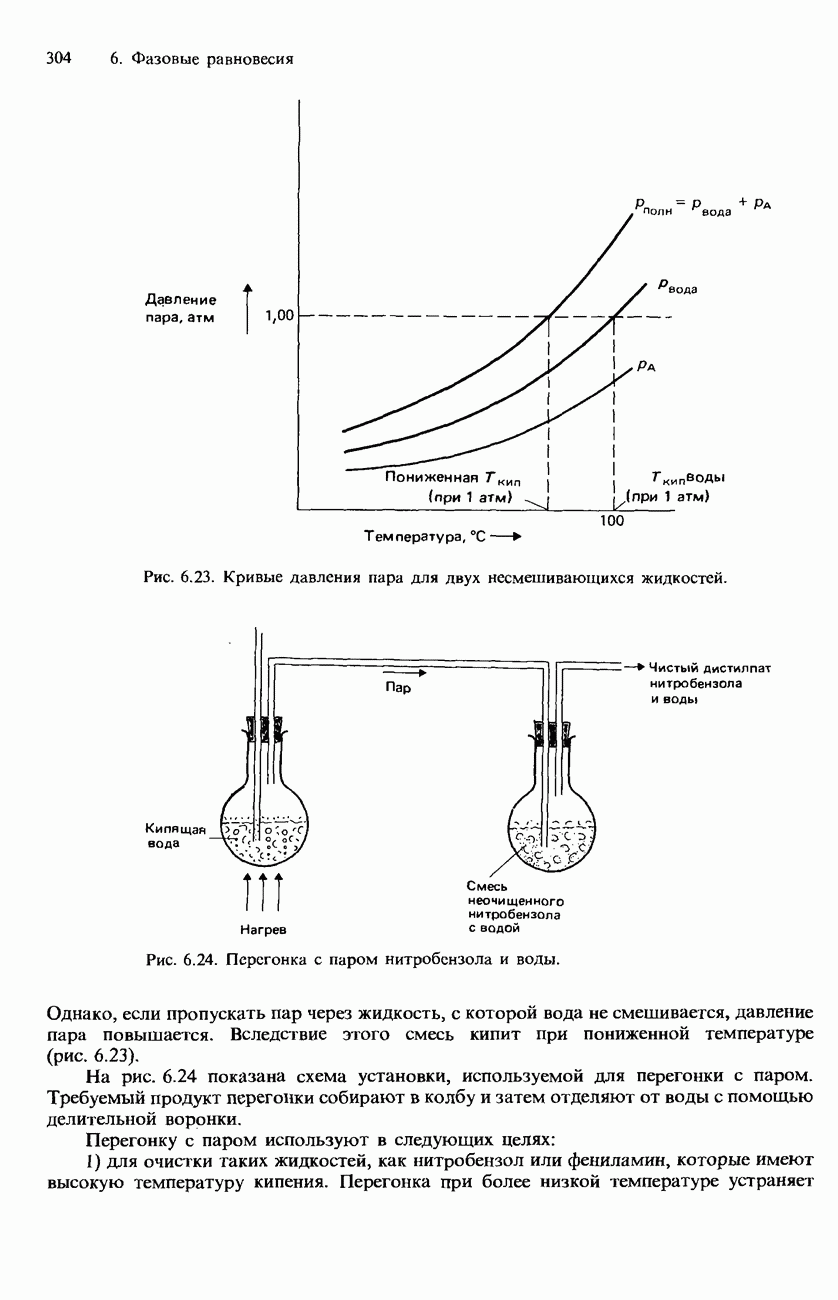
- НЕСМЕШИВАЮЩИЕСЯ ЖИДКОСТИ
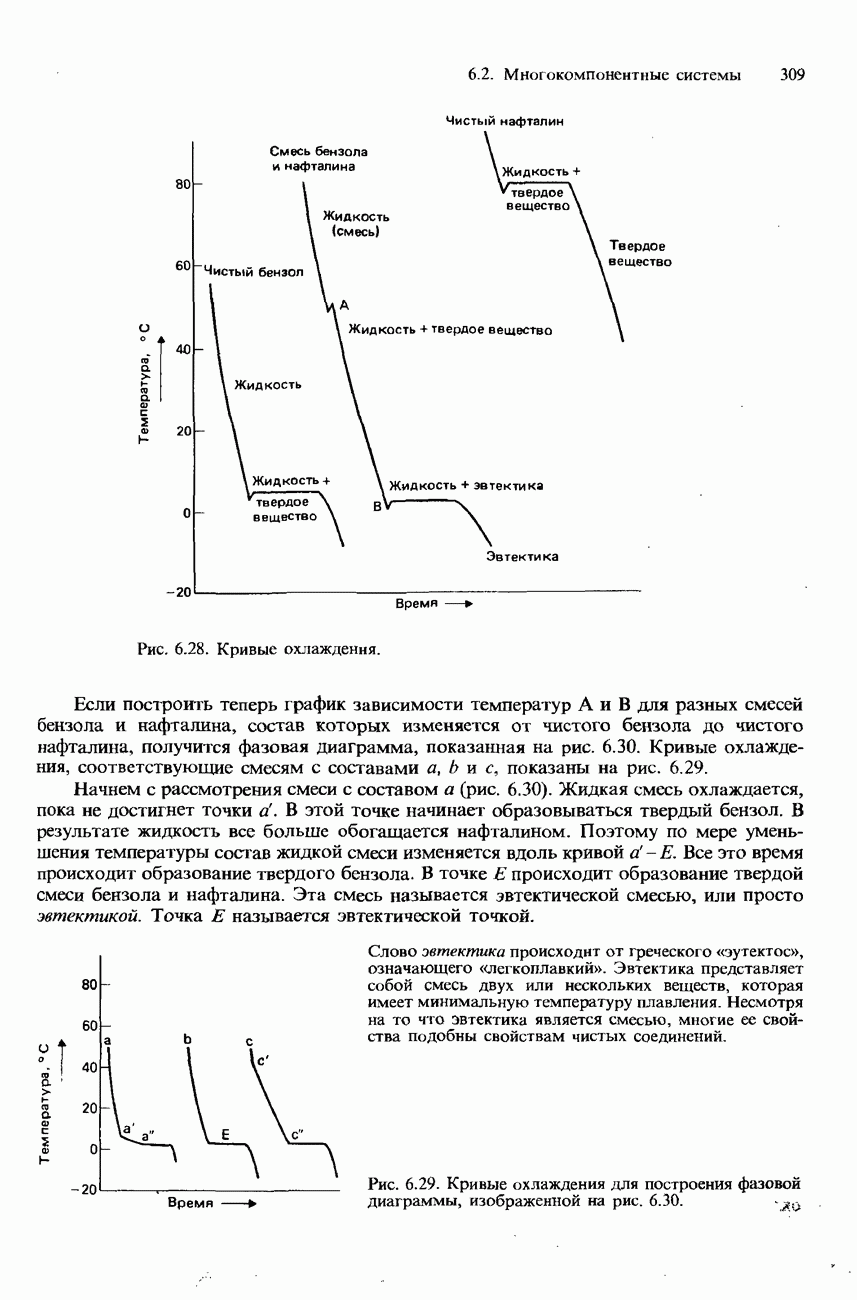
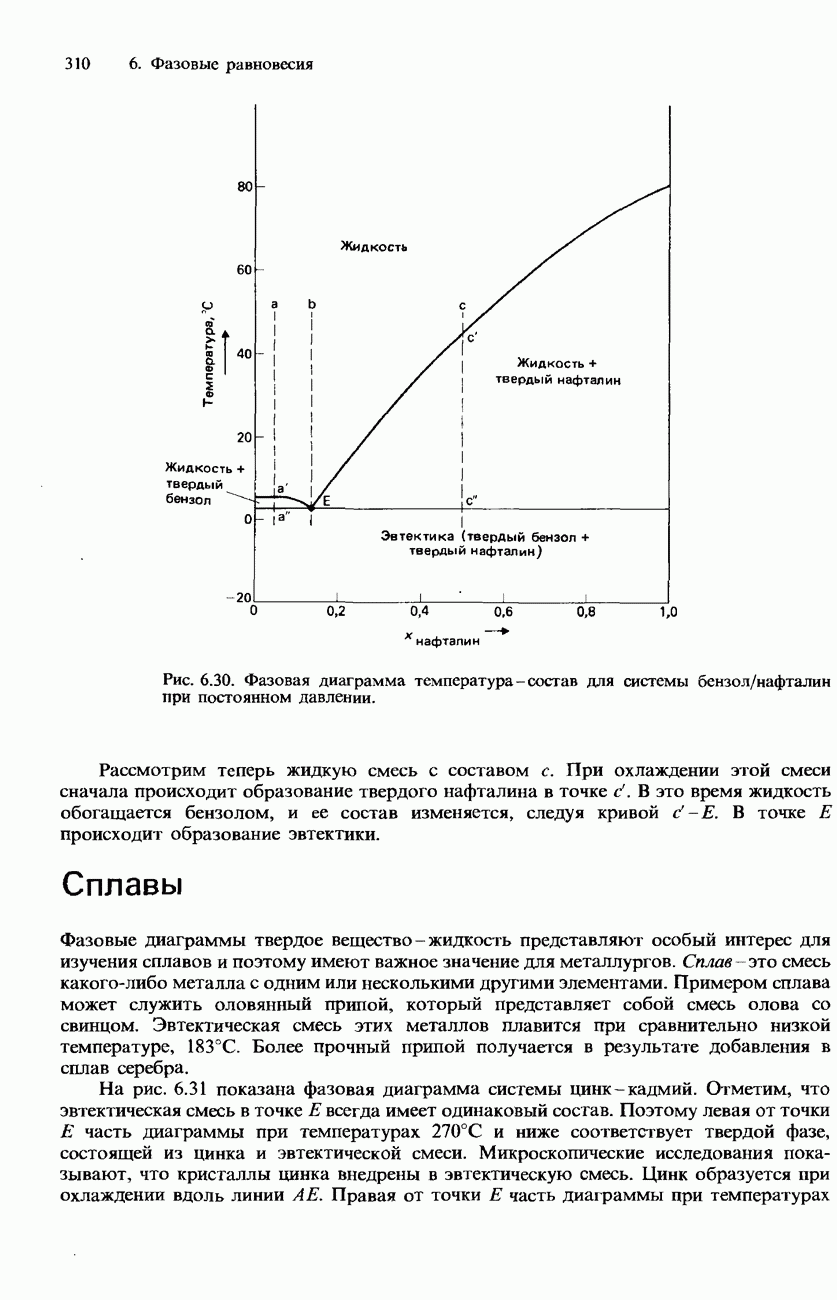
- РАВНОВЕСИЯ ТВЕРДОЕ ВЕЩЕСТВО-ЖИДКОСТЬ
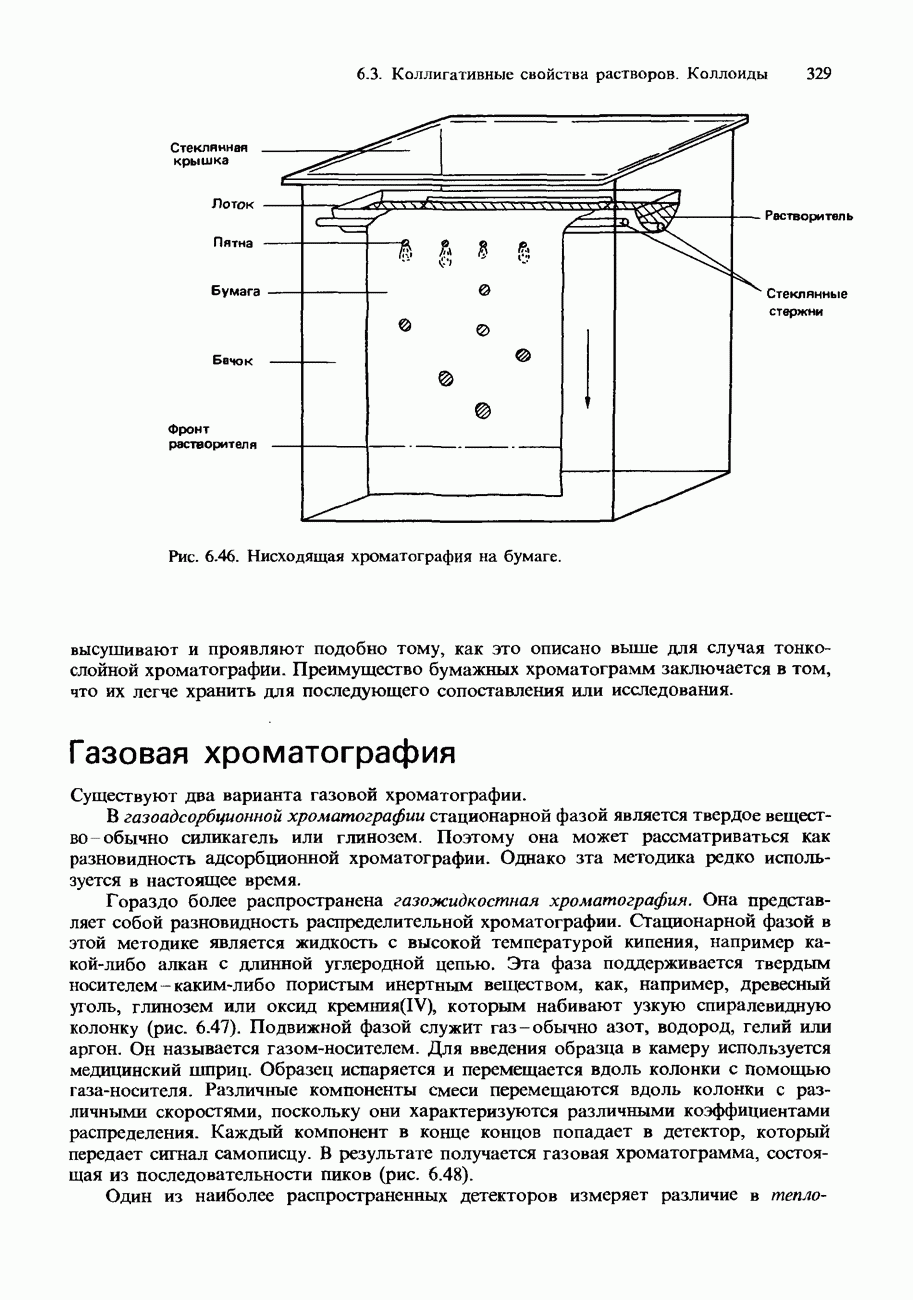
- 6.3. Коллигативные свойства растворов. Коллоиды Хроматография
- КОЛЛОИДЫ
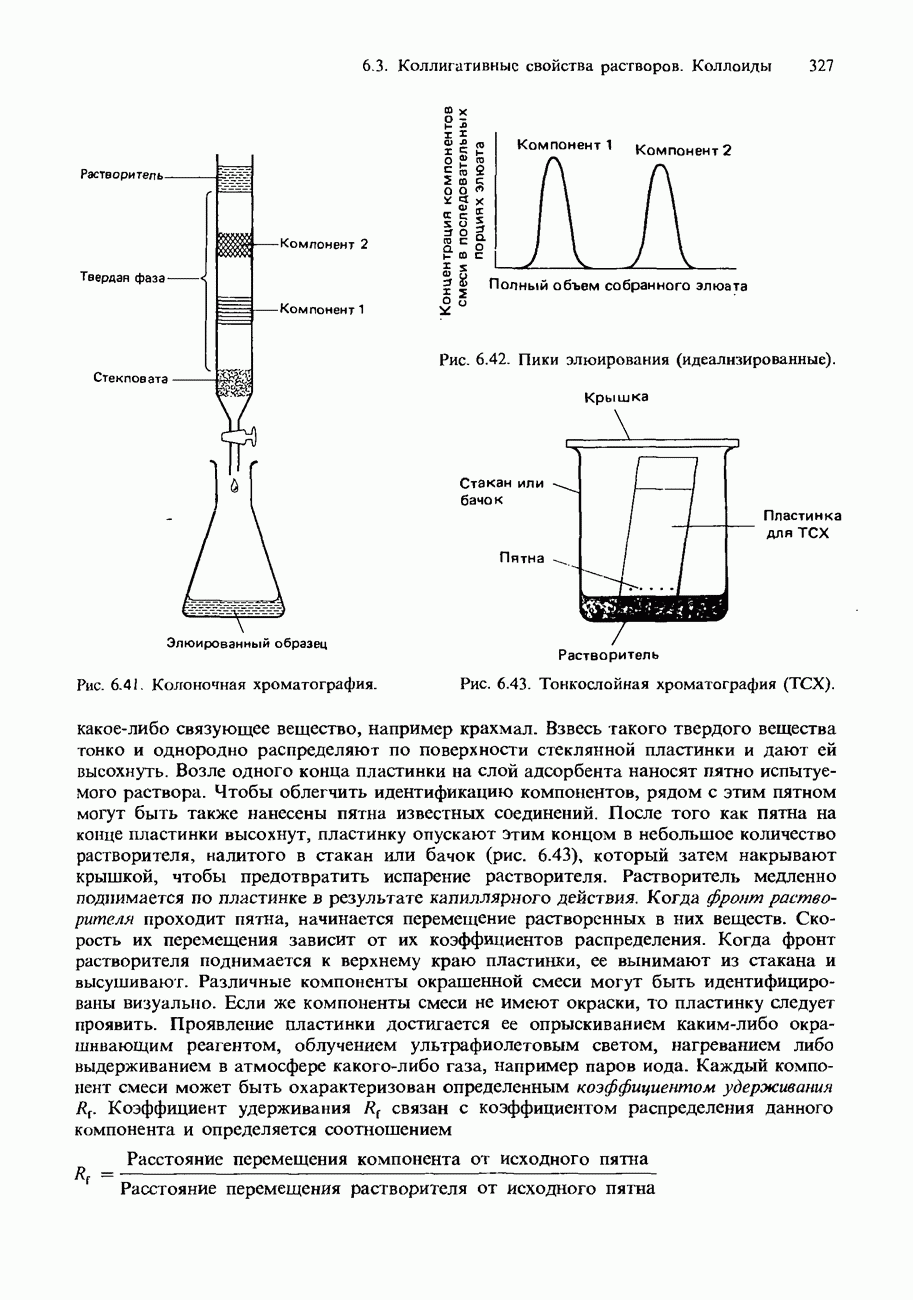
- ХРОМАТОГРАФИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 7. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
- 7.1. Константа равновесия
- ЗАКОН ДЕЙСТВУЮЩИХ МАСС
- ВЛИЯНИЕ УСЛОВИЙ ПРОТЕКАНИЯ РЕАКЦИИ НА ПОЛОЖЕНИЕ РАВНОВЕСИЯ
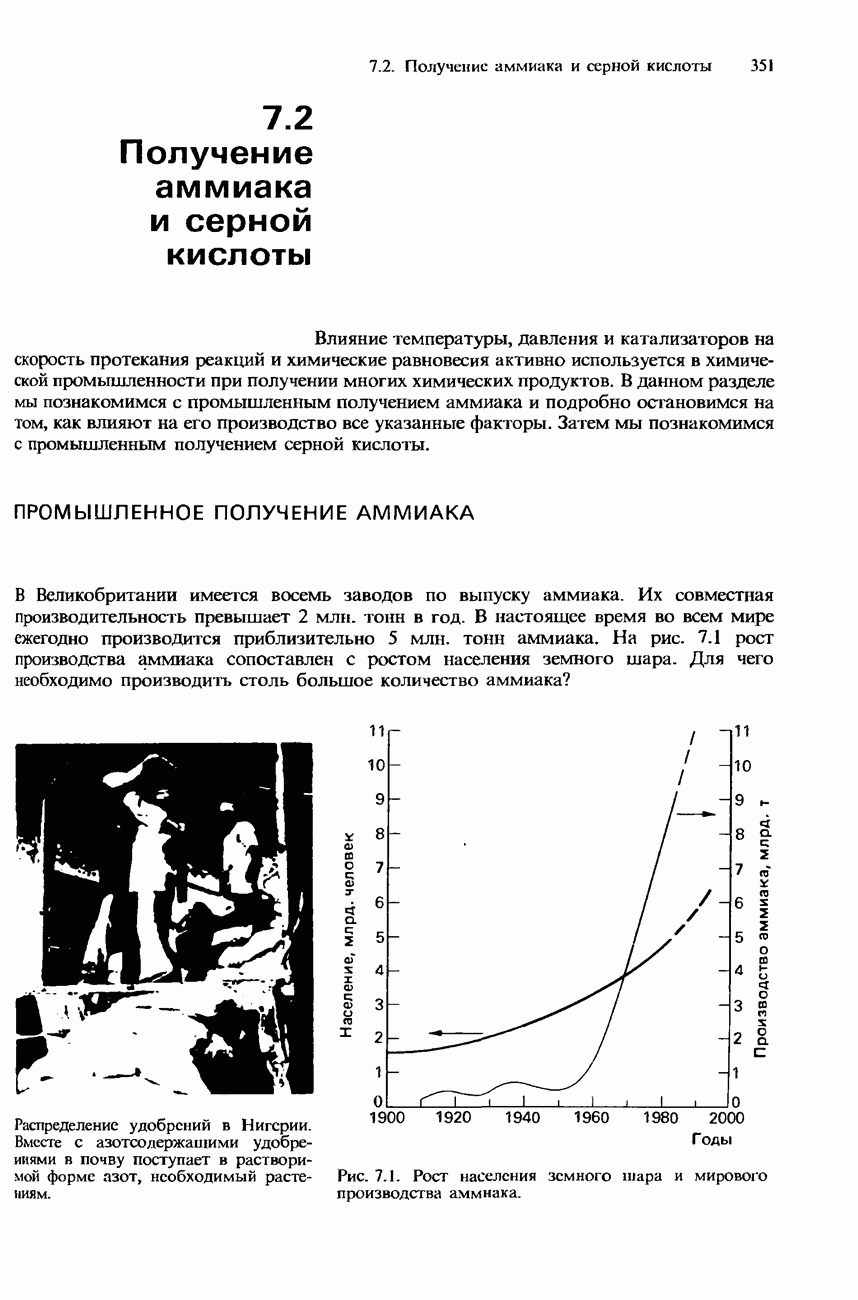
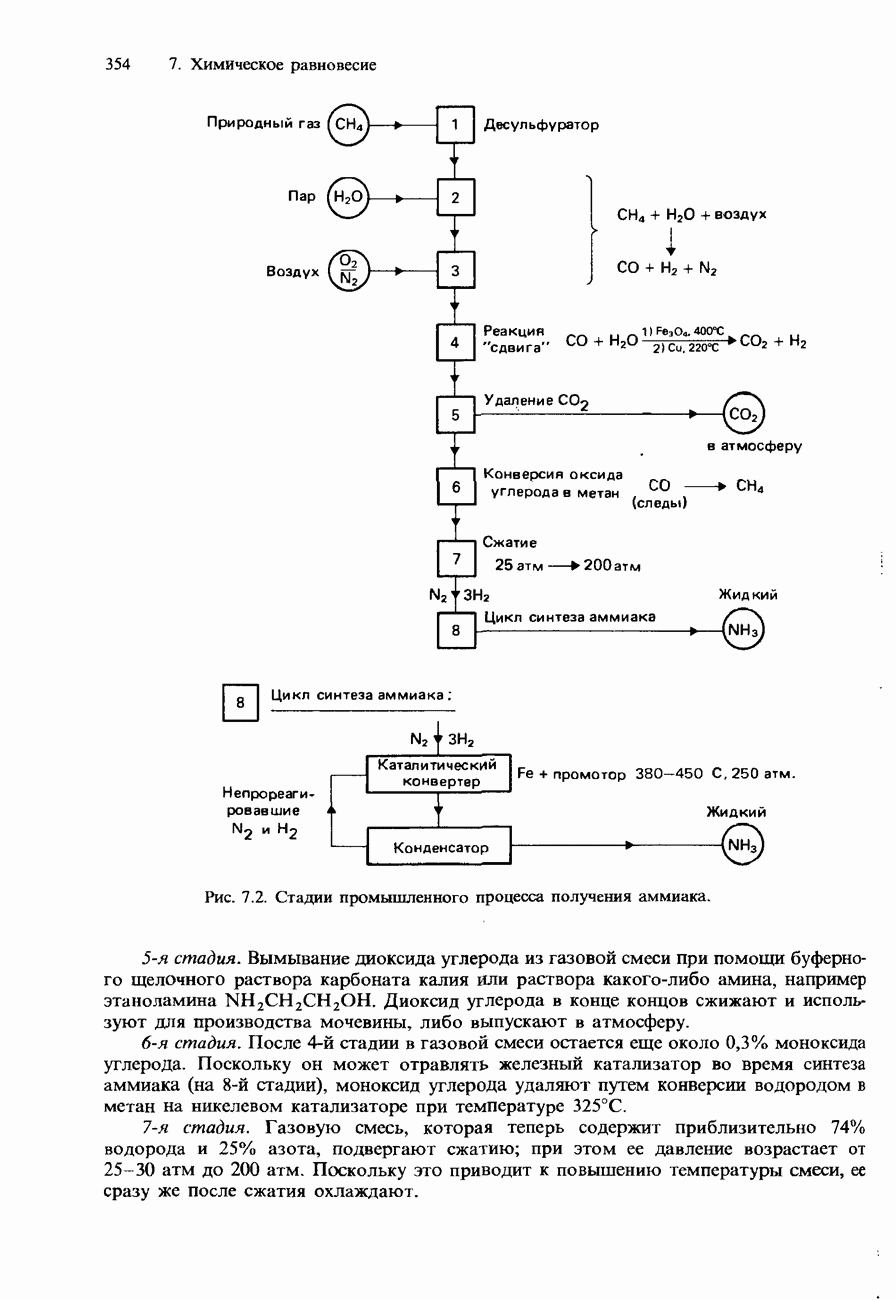
- 7.2. Получение аммиака и серной кислоты
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СЕРНОЙ КИСЛОТЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 8. ИОНЫ
- 8.1. Кислоты и основания
- ЭЛЕКТРОЛИТЫ
- КИСЛОТЫ И ОСНОВАНИЯ
- КОНСТАНТЫ ДИССОЦИАЦИИ
- ВОДОРОДНЫЙ ПОКАЗАТЕЛЬ pH ШКАЛА ЕГО ЗНАЧЕНИЙ
- КИСЛОТНО-ОСНОВНЫЕ ИНДИКАТОРЫ И ТИТРОВАНИЕ
- 8.2. Соли, растворимость и устойчивость
- БУФЕРНЫЕ РАСТВОРЫ
- РАСТВОРИМОСТЬ
- РАВНОВЕСИЯ С УЧАСТИЕМ КОМПЛЕКСНЫХ ИОНОВ
- ИОННЫЙ ОБМЕН
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 9. ХИМИЧЕСКАЯ КИНЕТИКА
- 9.1. Скорость химической реакции
- МЕТОДЫ ИЗМЕРЕНИЯ СКОРОСТИ РЕАКЦИЙ
- СКОРОСТЬ РЕАКЦИИ И КОНЦЕНТРАЦИИ РЕАГЕНТОВ
- ЗАВИСИМОСТЬ КОНСТАНТЫ СКОРОСТИ ОТ ТЕМПЕРАТУРЫ УРАВНЕНИЕ АРРЕНИУСА
- 9.2. Механизмы реакций и катализ
- ТЕОРИЯ СТОЛКНОВЕНИЙ
- ТЕОРИЯ ПЕРЕХОДНОГО СОСТОЯНИЯ
- ЦЕПНЫЕ РЕАКЦИИ
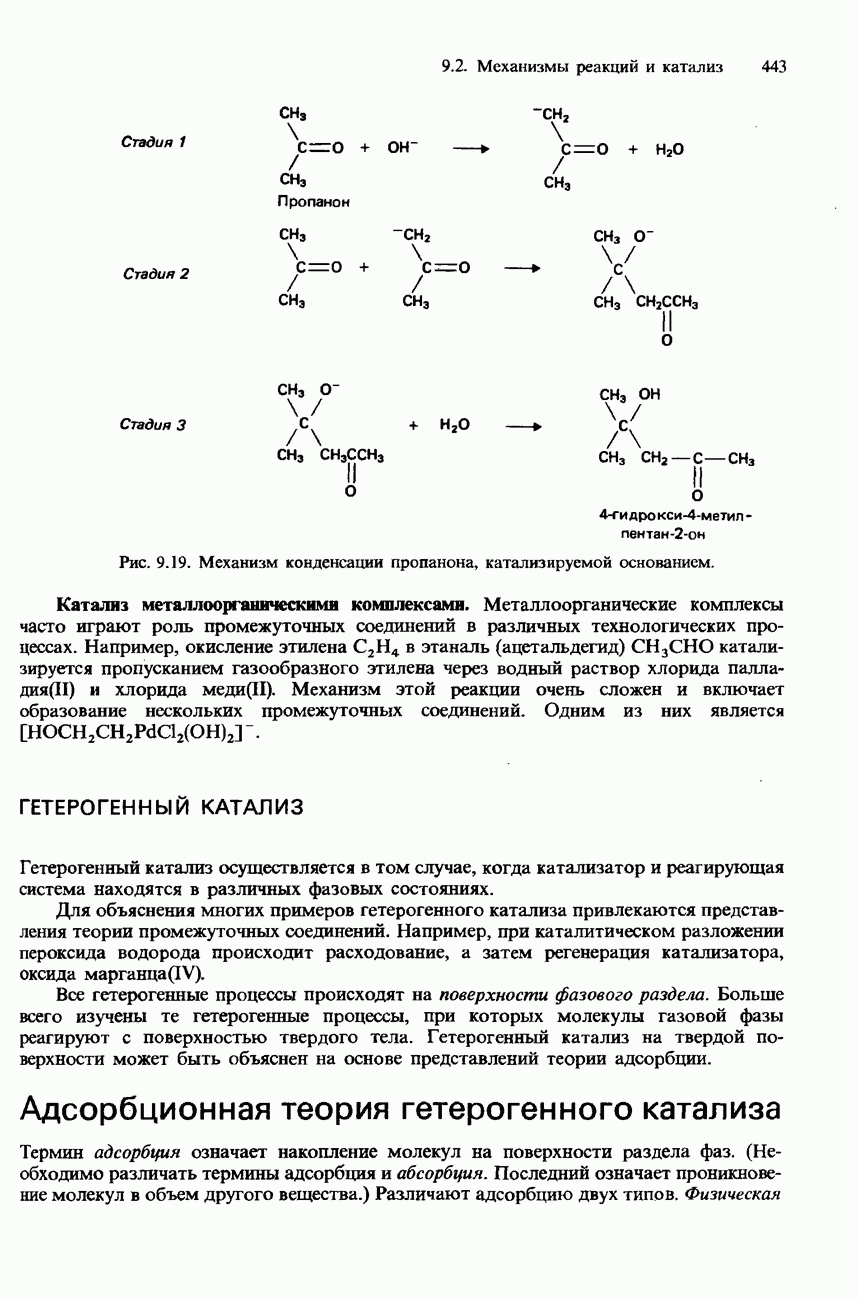
- КАТАЛИЗ
- ТИПЫ КАТАЛИЗАТОРОВ
- ГОМОГЕННЫЙ КАТАЛИЗ
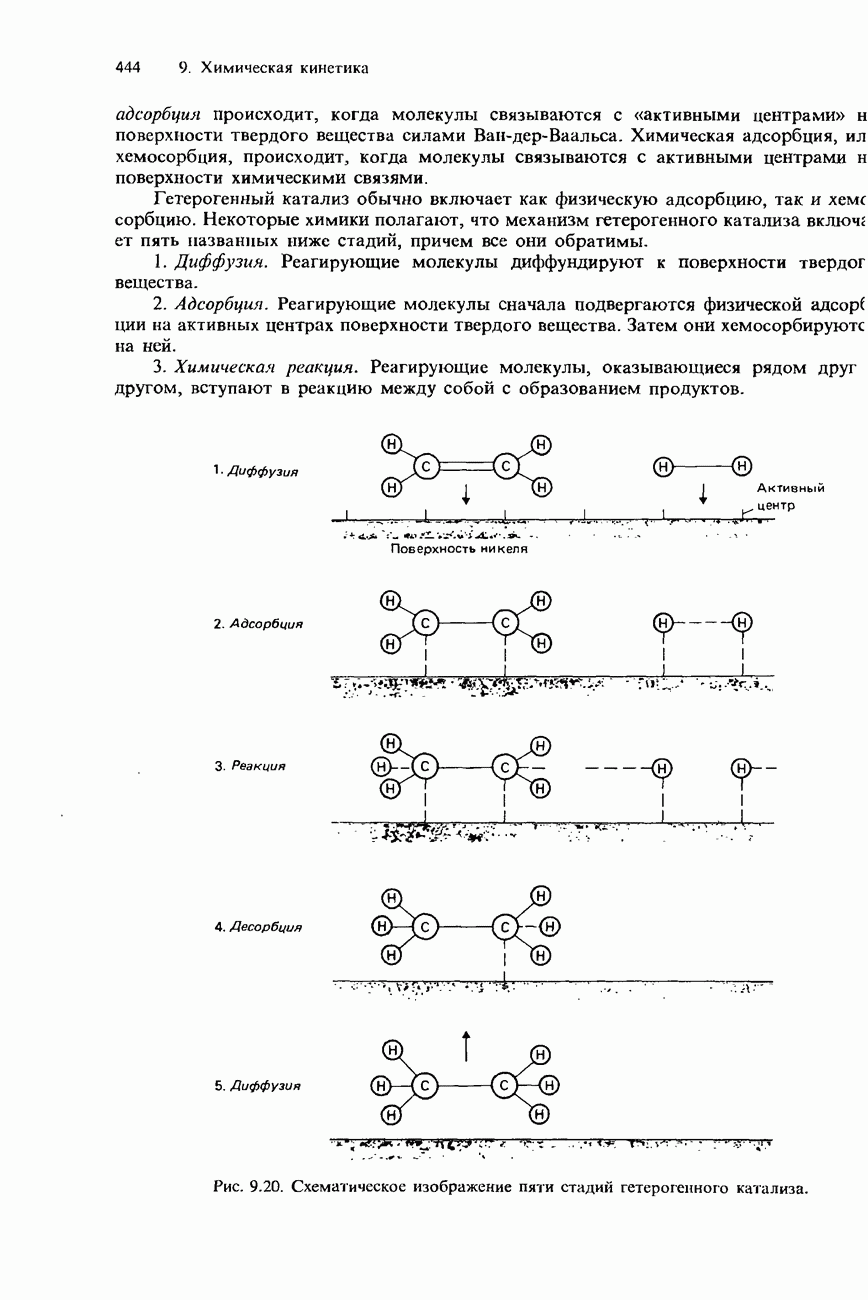
- ГЕТЕРОГЕННЫЙ КАТАЛИЗ
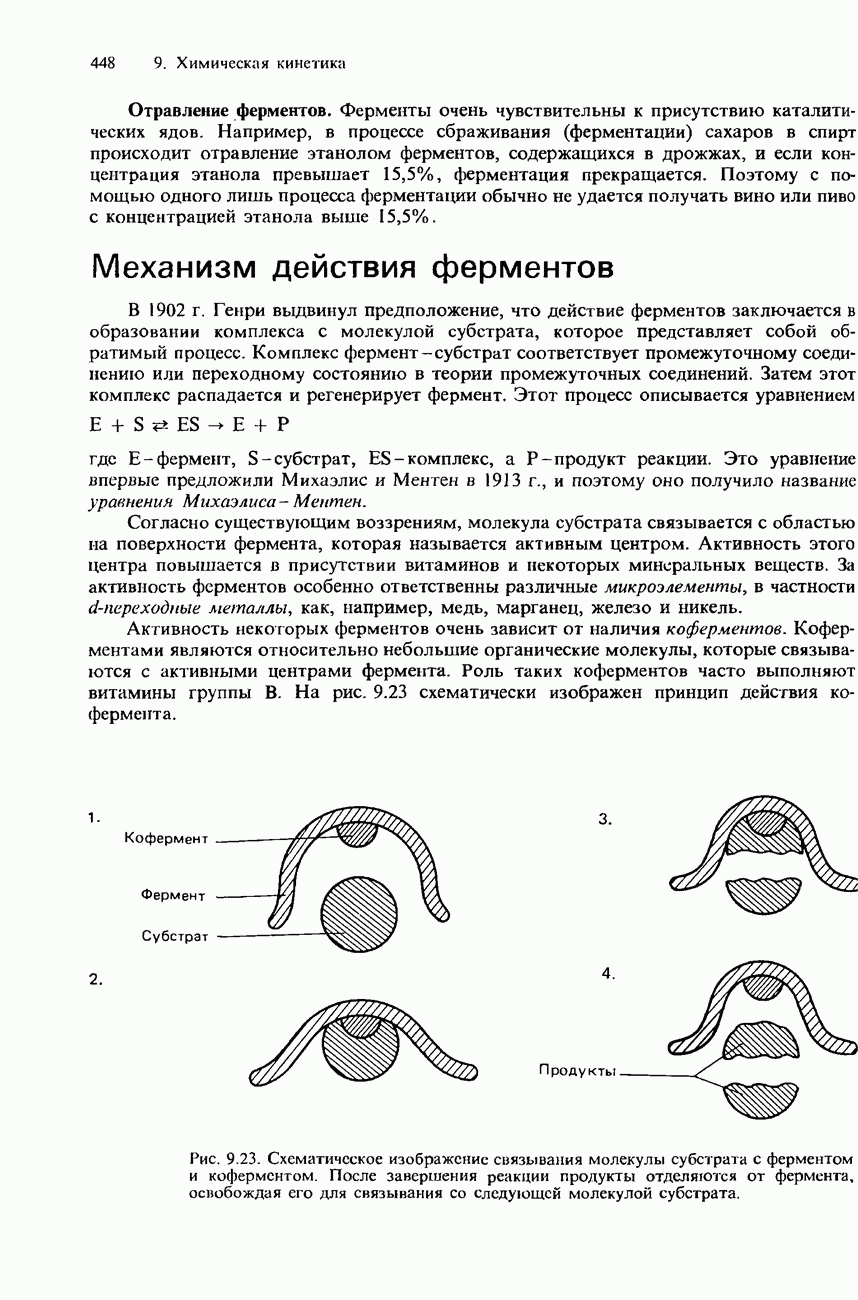
- ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 10. ЭЛЕКТРОХИМИЯ
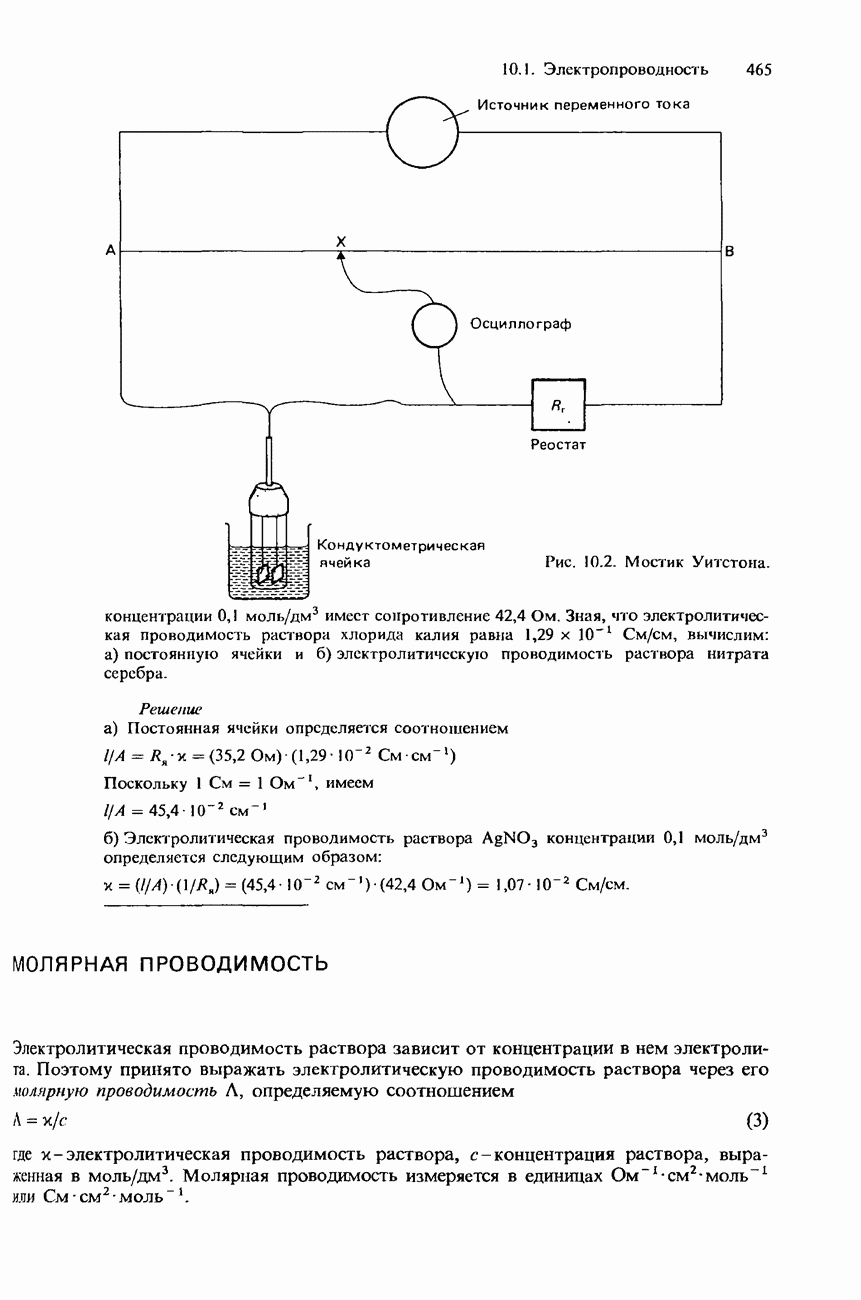
- 10.1. Электропроводность
- ПРОВОДНИКИ ЭЛЕКТРИЧЕСКОГО ТОКА И ЭЛЕКТРОПРОВОДНОСТЬ
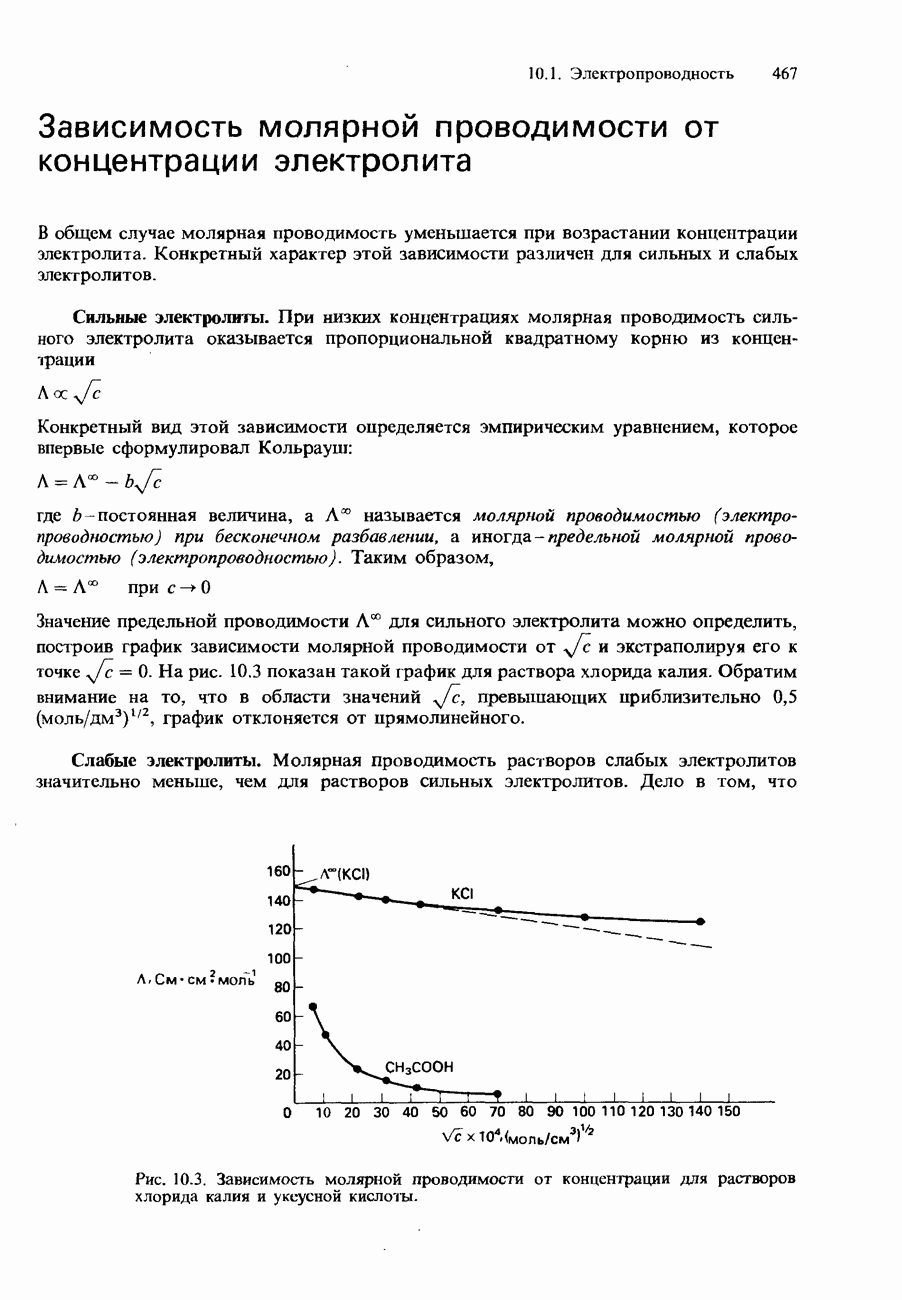
- МОЛЯРНАЯ ПРОВОДИМОСТЬ
- КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- 10.2. Окислительно-восстановительные процессы
- ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
- ОПРЕДЕЛЕНИЕ СТЕХИОМЕТРИЧЕСКИХ КОЭФФИЦИЕНТОВ
- СТЕПЕНЬ ОКИСЛЕНИЯ
- ОКИСЛИТЕЛИ
- ВОССТАНОВИТЕЛИ
- ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ
- 10.3. Электролиз
- ЗАКОНЫ ЭЛЕКТРОЛИЗА ФАРАДЕЯ
- ПРОМЫШЛЕННЫЕ ПРИМЕНЕНИЯ ЭЛЕКТРОЛИЗА
- 10.4. Химические источники тока
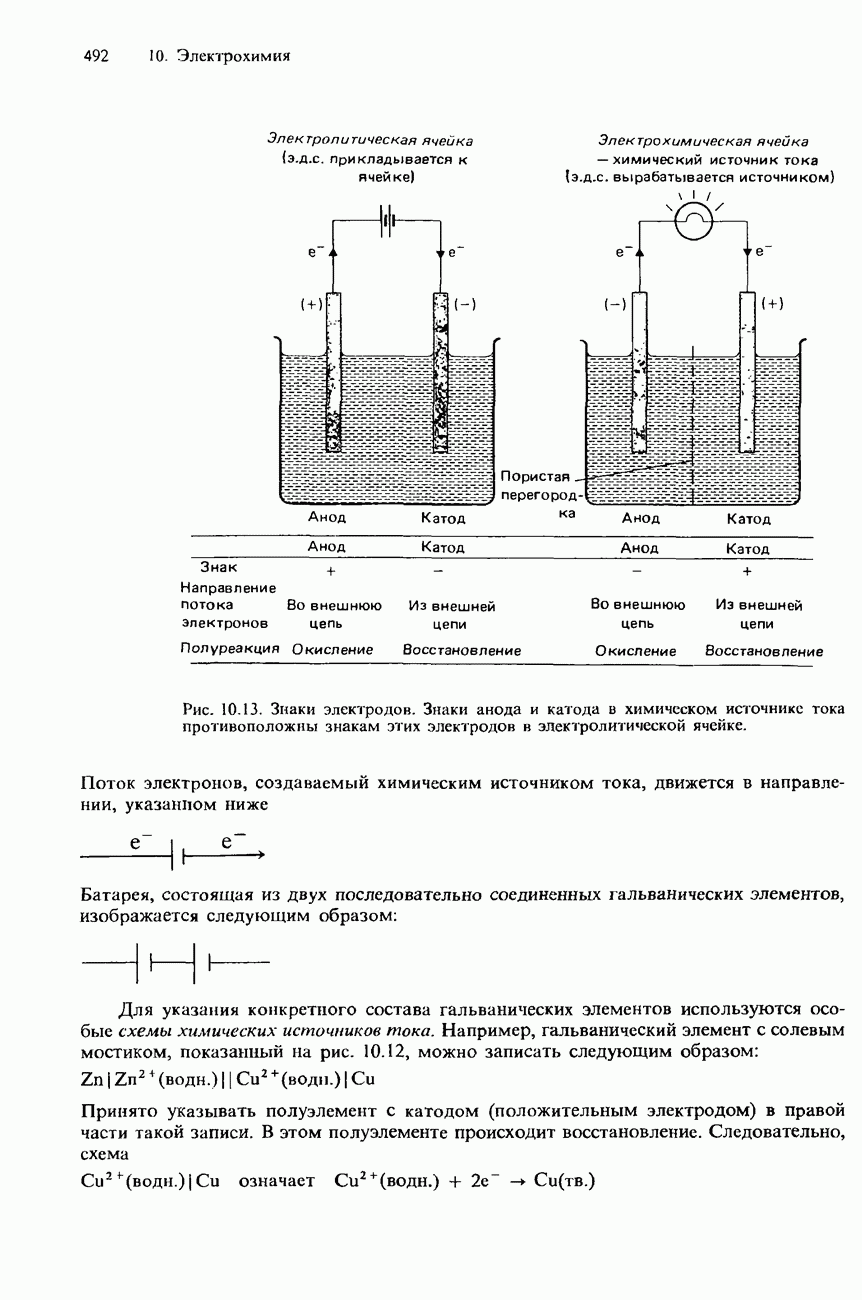
- СХЕМЫ ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА
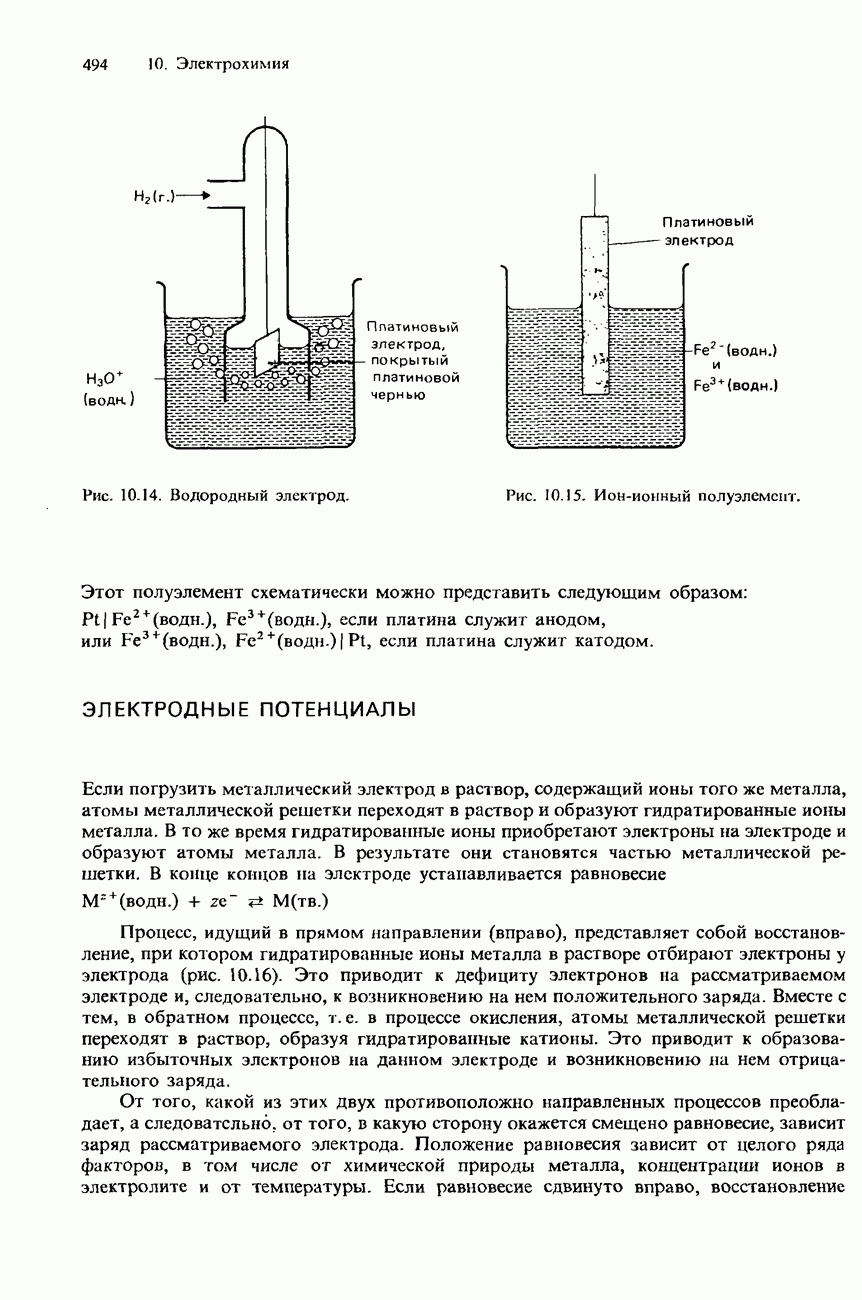
- ТИПЫ ПОЛУЭЛЕМЕНТОВ
- ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ
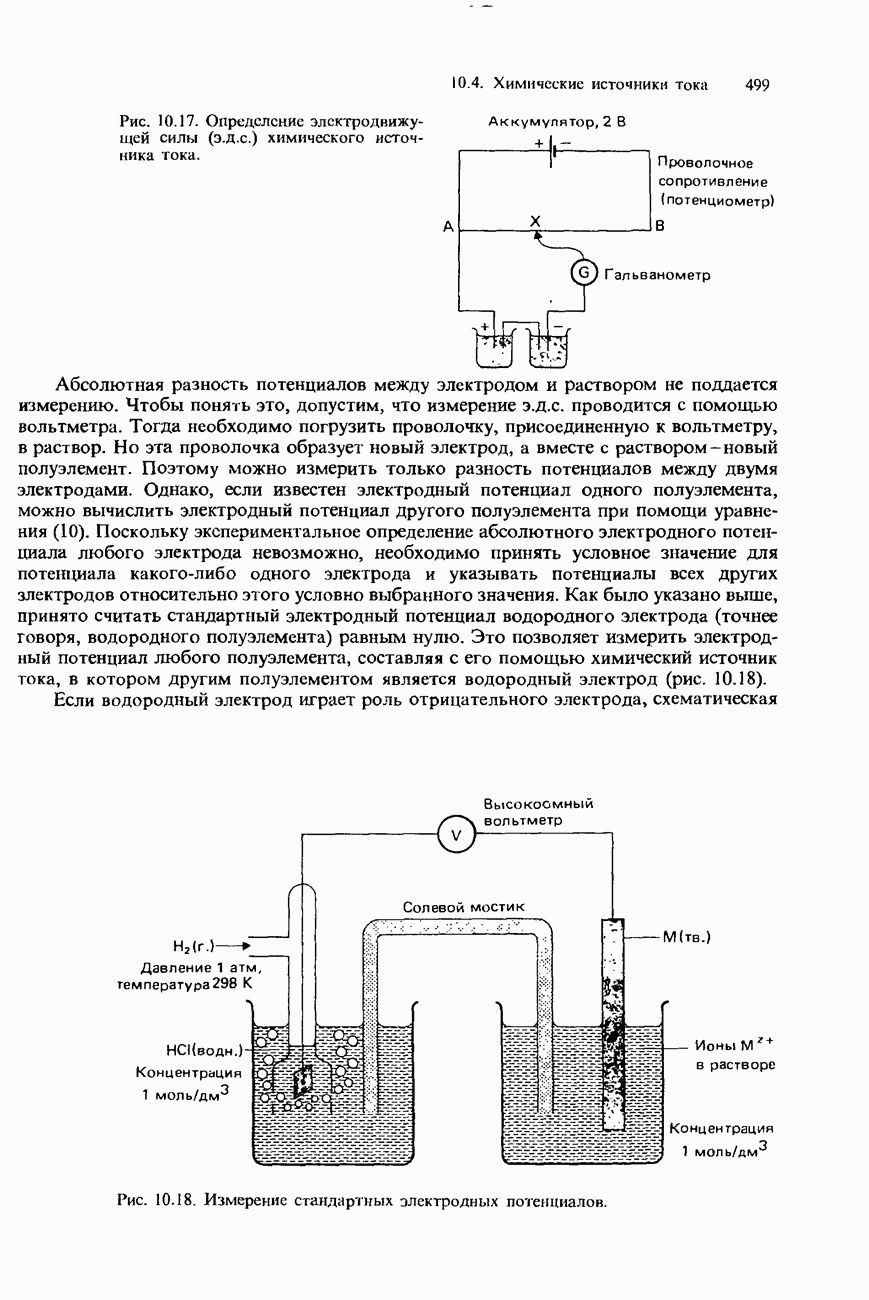
- ЭЛЕКТРОДВИЖУЩАЯ СИЛА ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА
- ИЗМЕРЕНИЕ Э.Д.С. ХИМИЧЕСКИХ ИСТОЧНИКОВ ТОКА И ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ
- 10.5. Применения электрохимии
- ВЫЧИСЛЕНИЕ КОНСТАНТ РАВНОВЕСИЯ ДЛЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
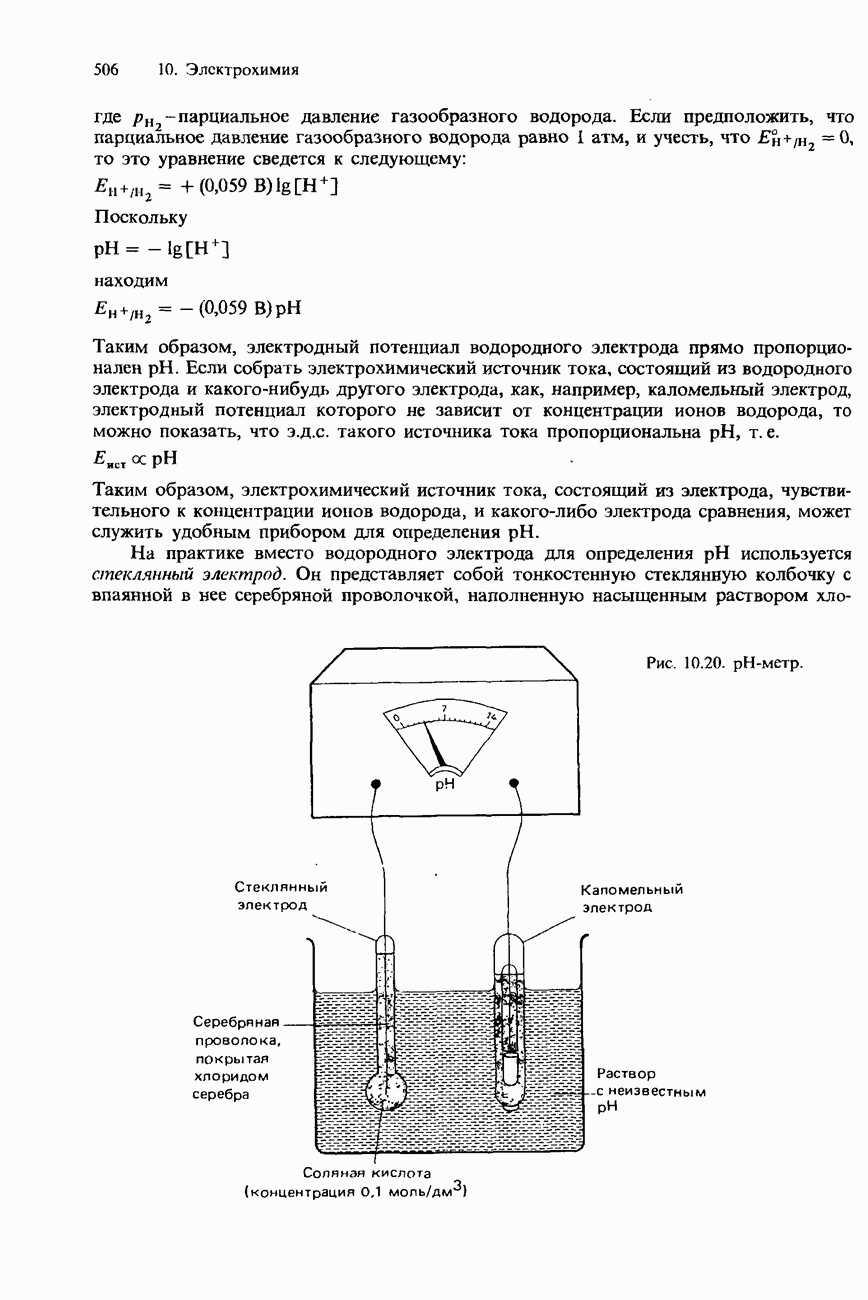
- ОПРЕДЕЛЕНИЕ pH РАСТВОРА
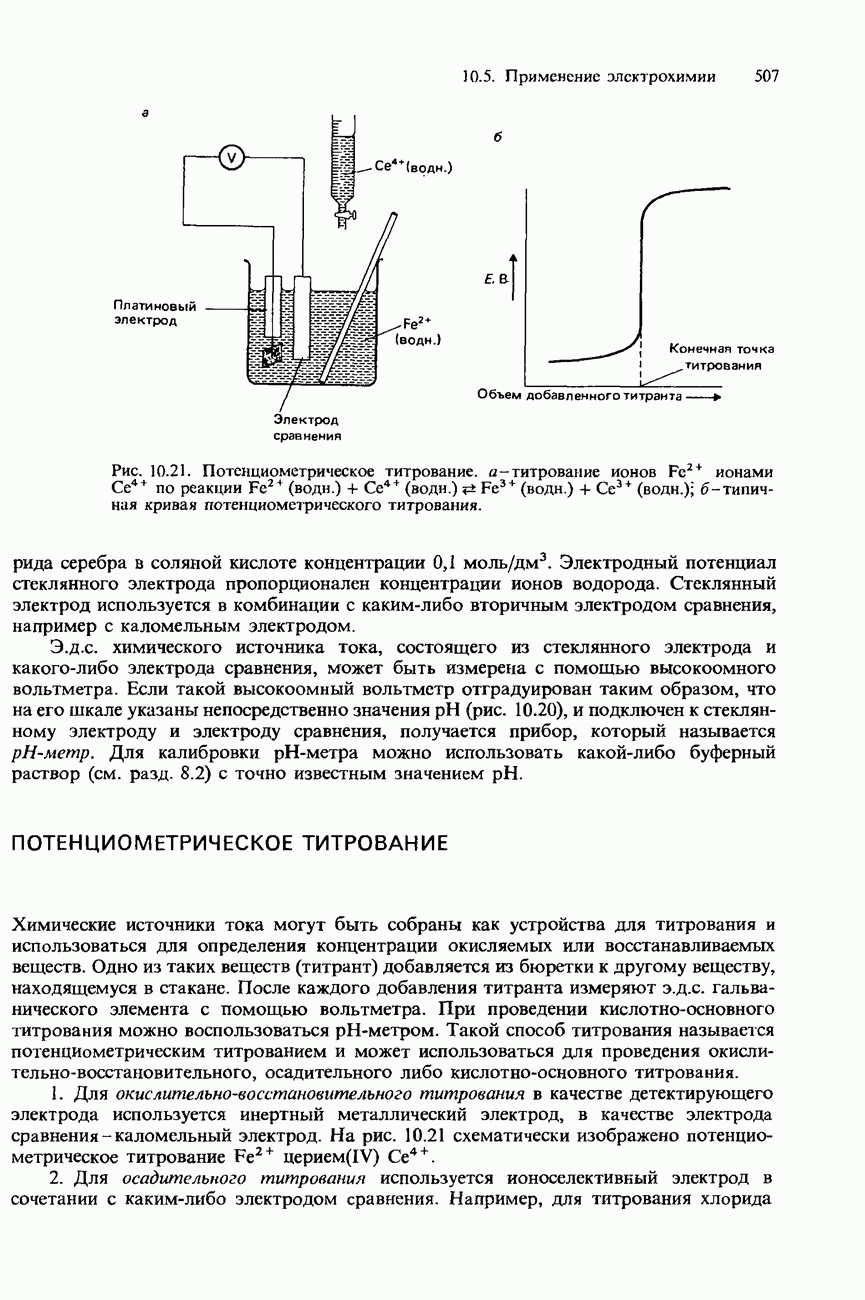
- ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- ОСУЩЕСТВИМОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
- ОПРЕДЕЛЕНИЕ ВЕЛИЧИНЫ AG
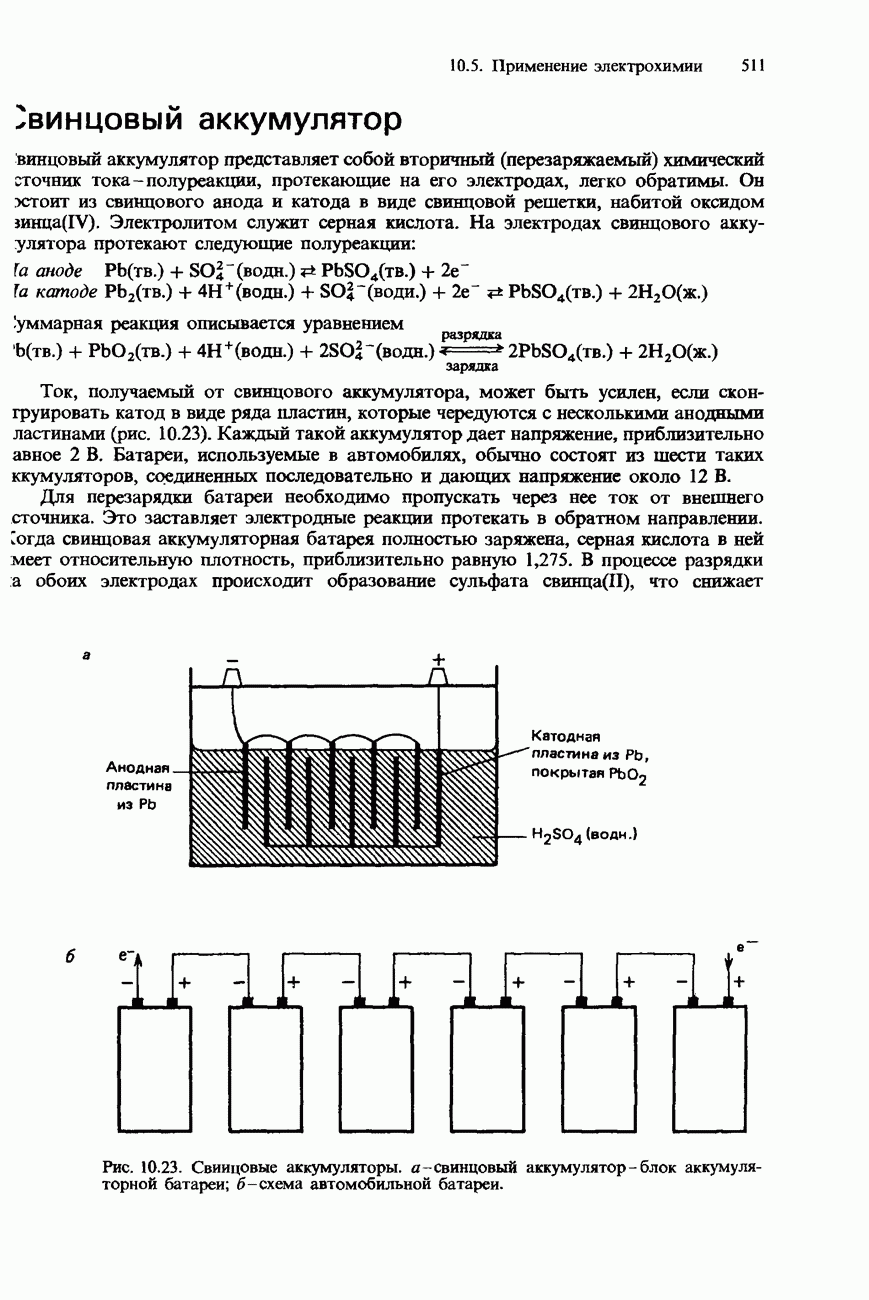
- БАТАРЕИ И ПРОМЫШЛЕННЫЕ ИСТОЧНИКИ ТОКА
- МЕТАЛЛУРГИЯ
- КОРРОЗИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ