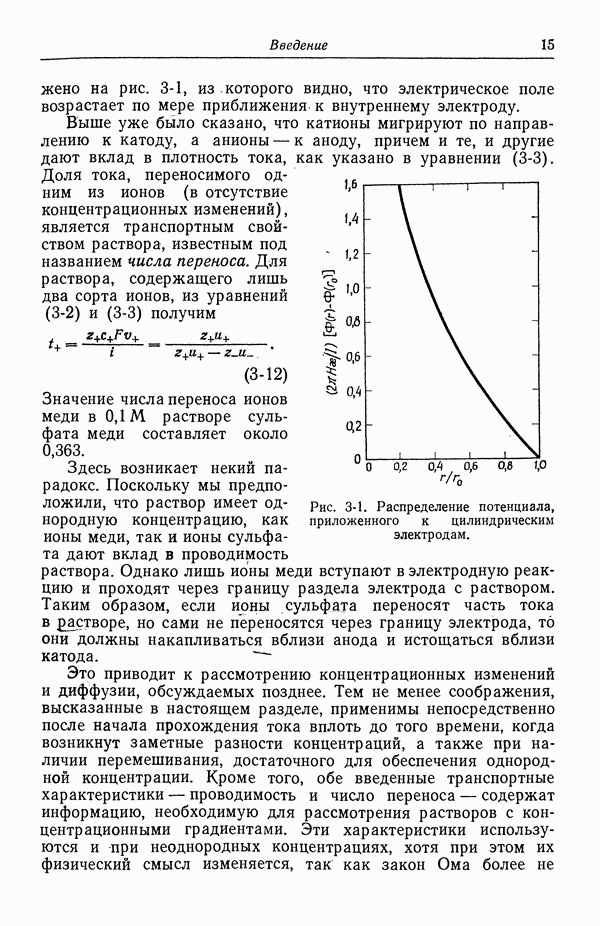
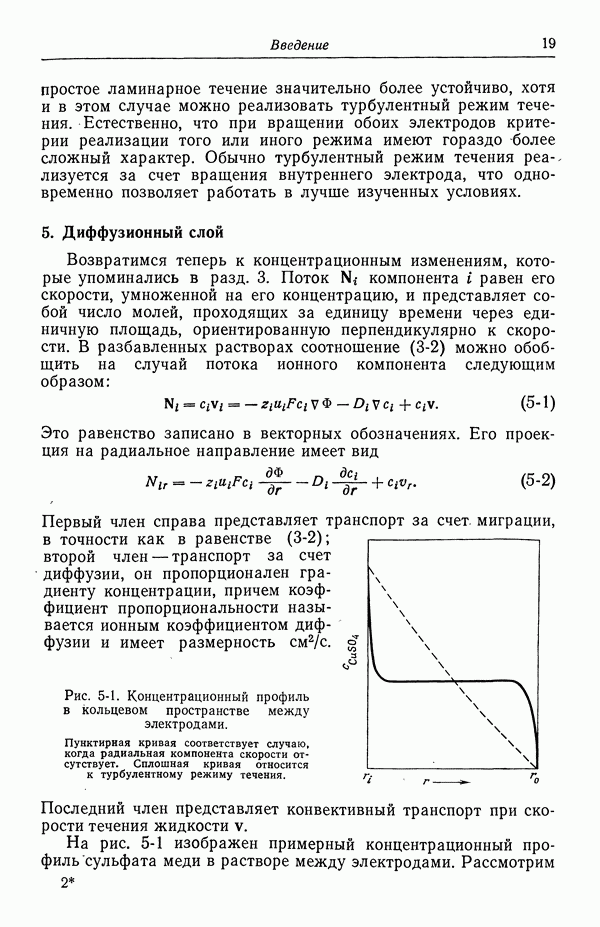
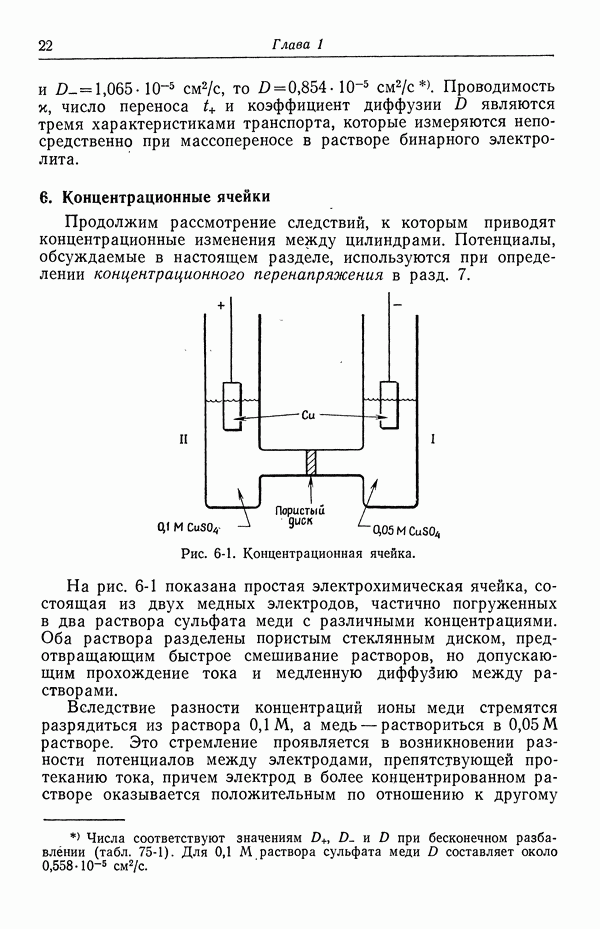
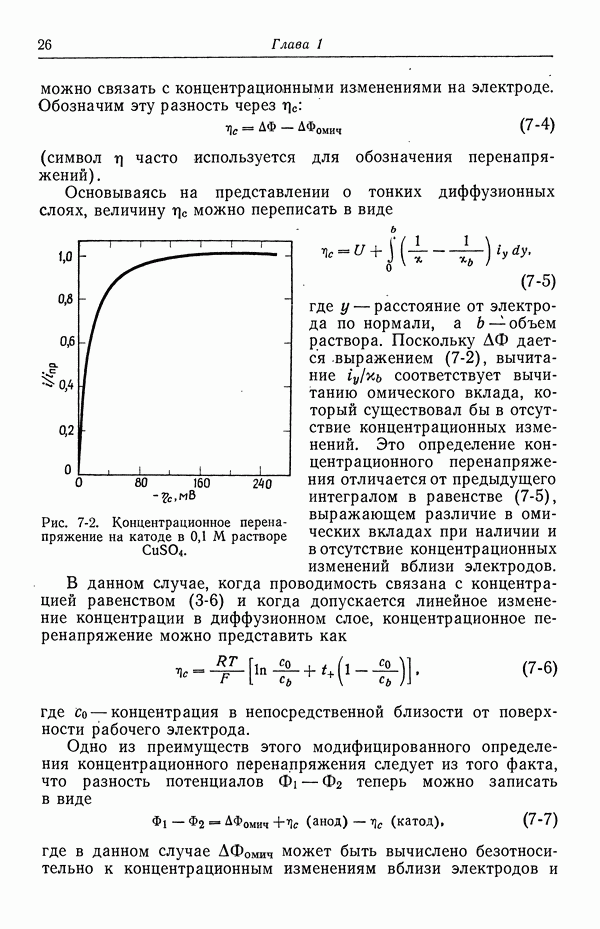
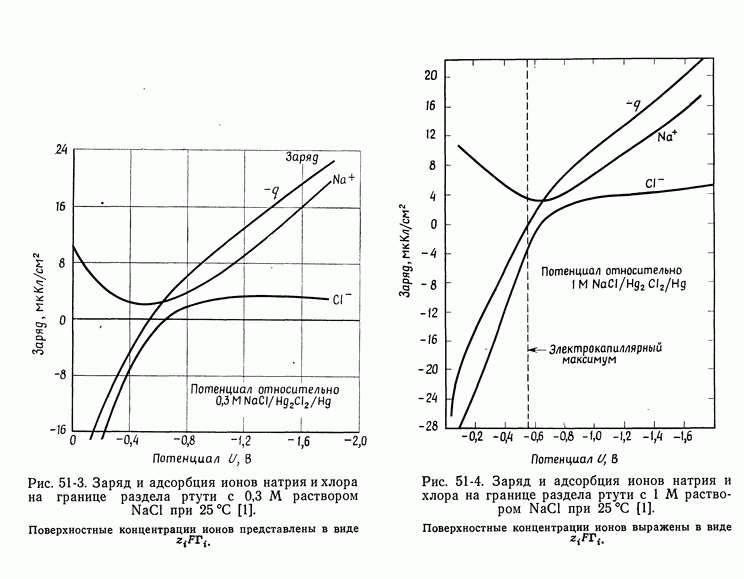
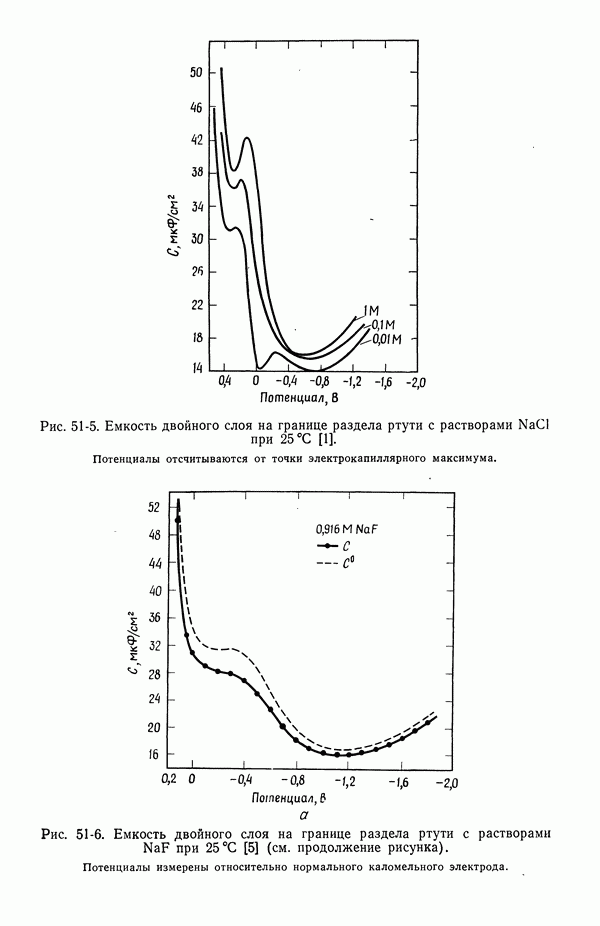
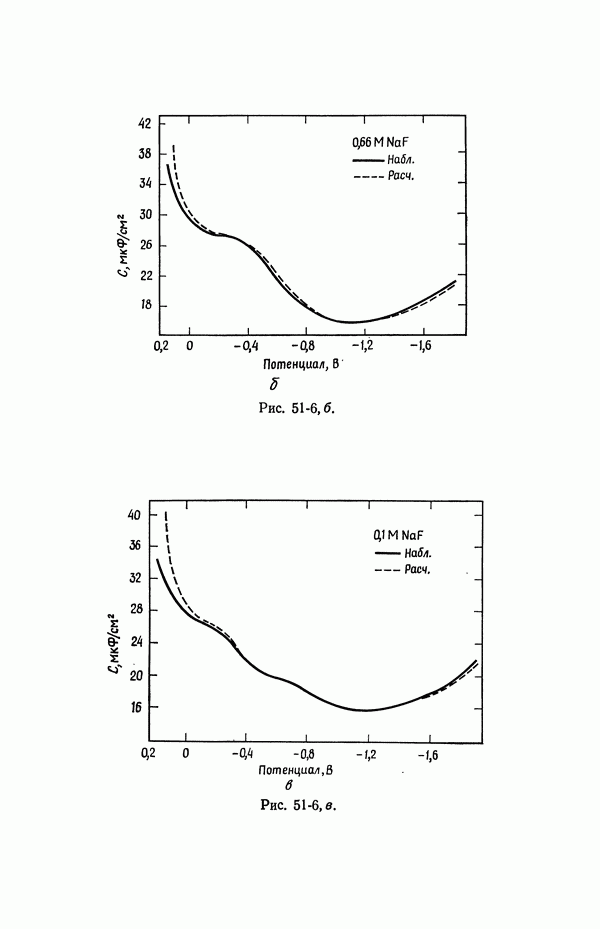
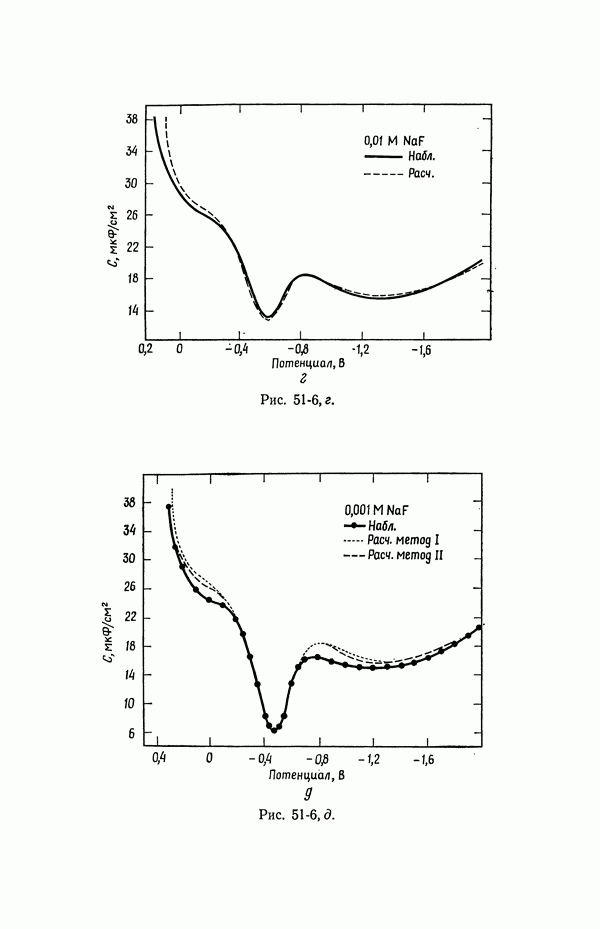
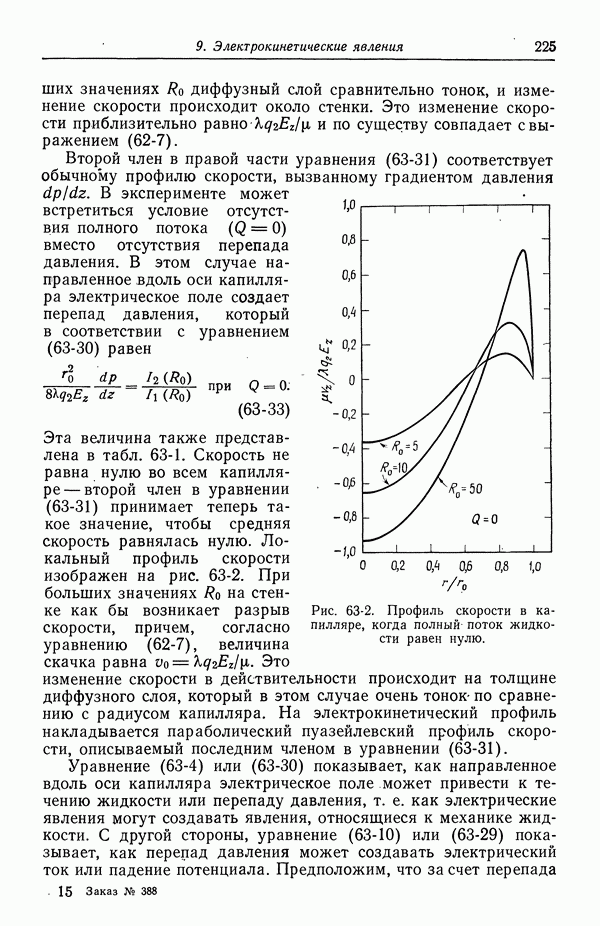
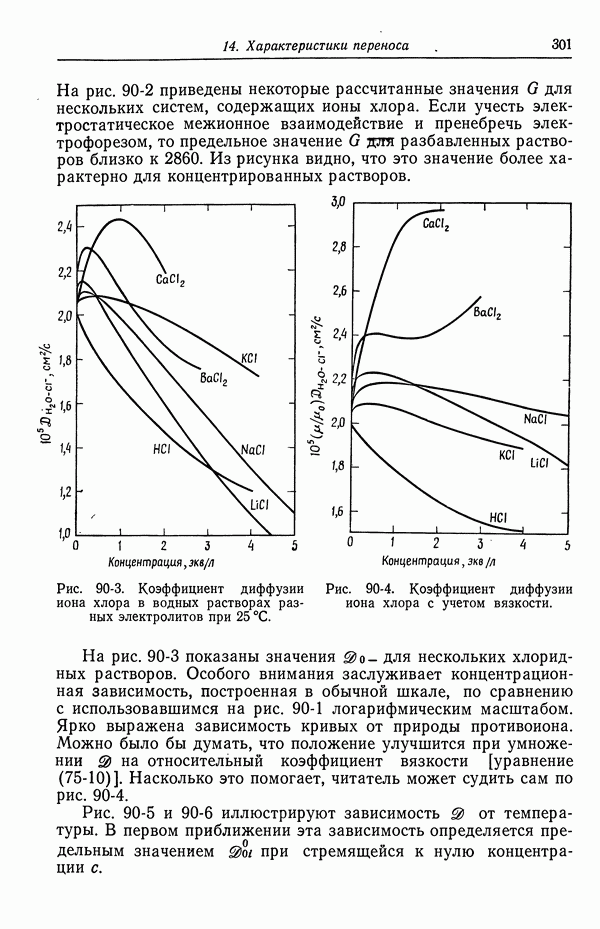
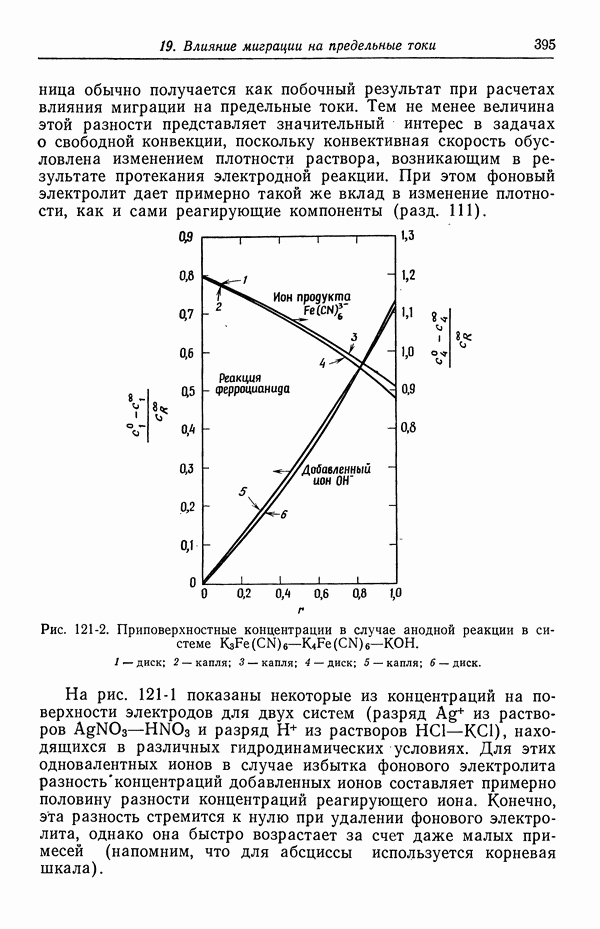
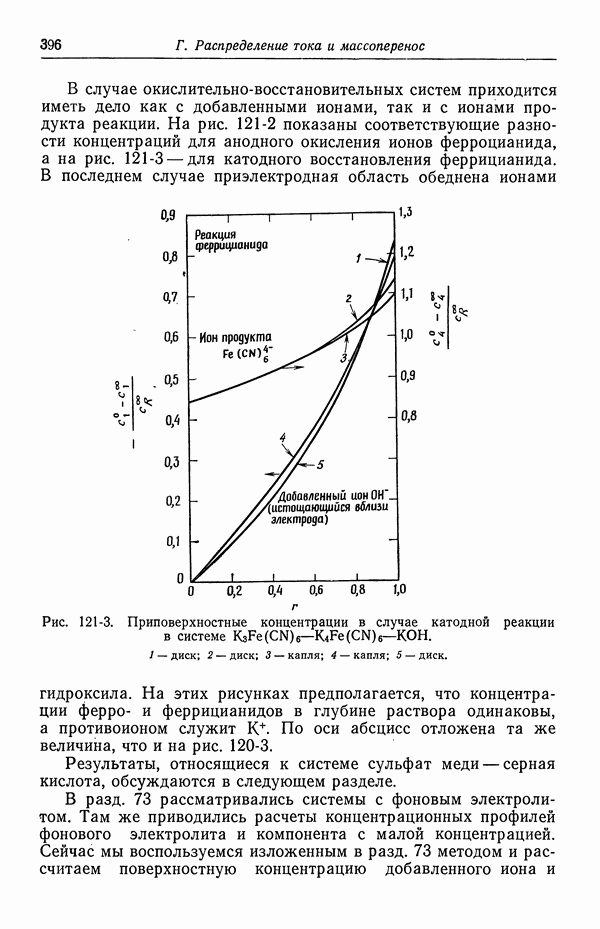
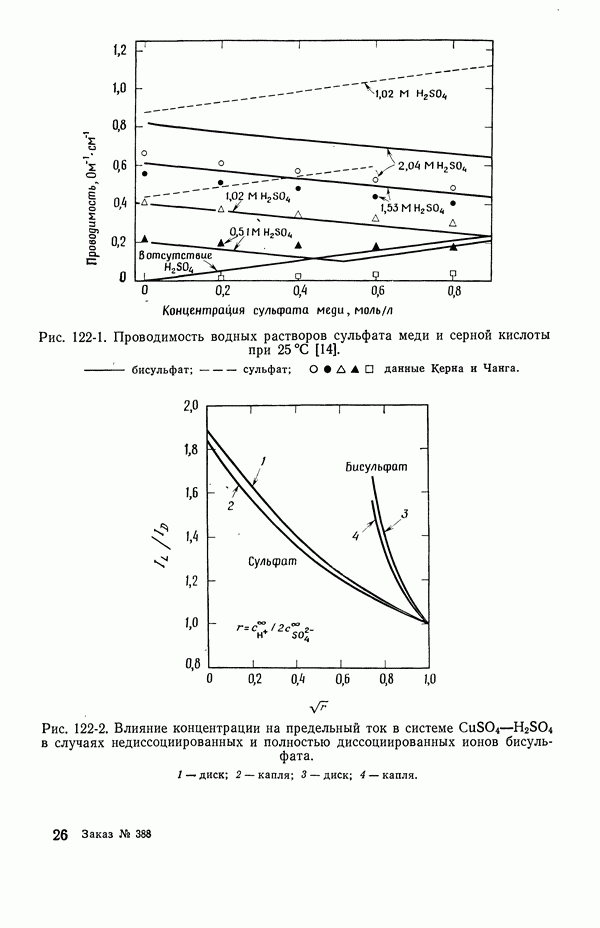
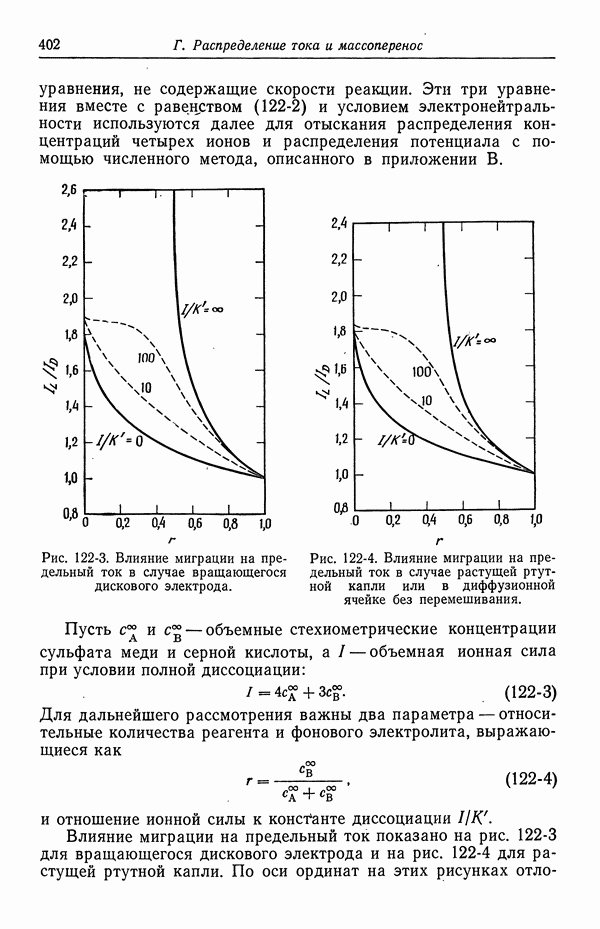
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
32. Измерение коэффициентов активности
Коэффициенты активности растворов электролитов можно определять методами, которые применимы к растворам неэлектролитов. В частности, мы имеем в виду измерения точки замерзания и давления паров, а также изопиестические методы. Остальные методы основаны на измерениях потенциалов гальванических ячеек и свойственны исключительно растворам электролитов. Эти и другие методы рассматриваются в книгах [13, 14].
Измерять понижение точки замерзания удобно в тех случаях, когда раствор может существовать в равновесии с чистым твердым растворителем. Тогда при точке замерзания растворителя

где  — химический потенциал твердого растворителя. Далее, необходимо ввести в химические потенциалы поправки на температуру (поскольку данные получаются при точках замерзания растворов), приводя их обычно к температуре замерзания
— химический потенциал твердого растворителя. Далее, необходимо ввести в химические потенциалы поправки на температуру (поскольку данные получаются при точках замерзания растворов), приводя их обычно к температуре замерзания
чистого растворителя  Это осуществляется с помощью соотношения
Это осуществляется с помощью соотношения

где  — парциальная молярная энтальпия компонента i в рассматриваемой фазе. Тогда
— парциальная молярная энтальпия компонента i в рассматриваемой фазе. Тогда

и

где, как мы отметили, чистый растворитель находится в равновесии с твердым растворителем при  Следовательно,
Следовательно,

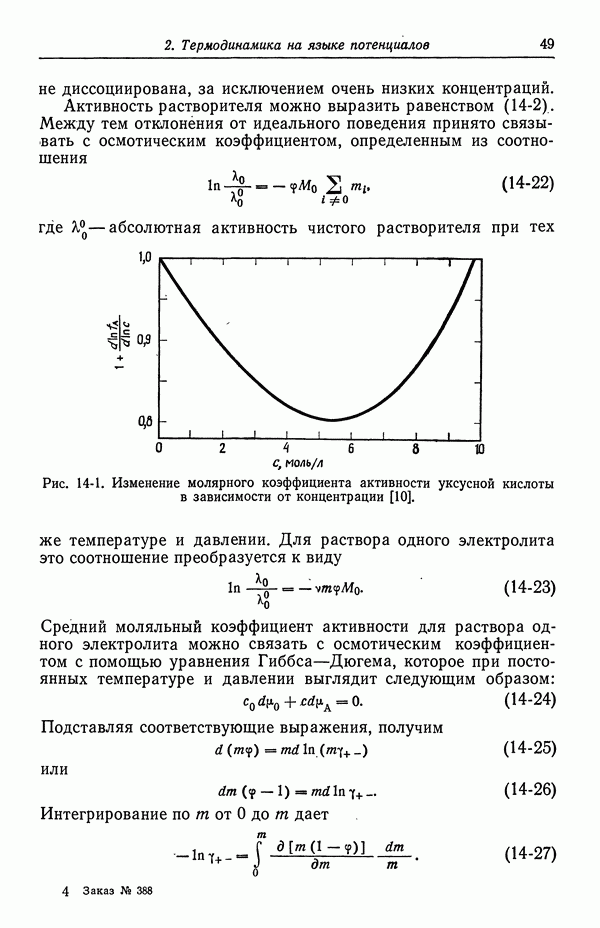
Измерения дают точки замерзания растворов моляльности т. В таком случае из приведенного выше расчета получается осмотический коэффициент для раствора моляльности m в точке замерзания  чистого растворителя. Наконец, осмотические коэффициенты можно перевести в коэффициенты активности с помощью соотношения Гиббса—Дюгема (14-24). Измерения понижения точки замерзания — важный источник точных значений коэффициентов активности растворов электролитов, в особенности разбавленных. Соответствующие вычисления выполнены Льюисом и Рендаллом [19] и подробно описаны Питцером и Брюером [13], включая термические свойства раствора.
чистого растворителя. Наконец, осмотические коэффициенты можно перевести в коэффициенты активности с помощью соотношения Гиббса—Дюгема (14-24). Измерения понижения точки замерзания — важный источник точных значений коэффициентов активности растворов электролитов, в особенности разбавленных. Соответствующие вычисления выполнены Льюисом и Рендаллом [19] и подробно описаны Питцером и Брюером [13], включая термические свойства раствора.
Многие электролиты нелетучи, и измерение давления паров позволяет определить химический потенциал растворителя в растворе, откуда непосредственно получается осмотический коэффициент. Измерение абсолютного давления пара необходимо лишь для одной системы. После этого для других систем нужны лишь изопиестические измерения. Такими измерениями определяют концентрацию раствора, при которой давление пара совпадает с давлением пара раствора стандартной системы, для которой активность растворителя уже известна. Изопиестическим методом определялись осмотические коэффициенты
растворов многих электролитов, хотя при моляльности менее 0,1 точность была невысокой.
Потенциалы электрохимических ячеек в условиях разомкнутой цепи подробно обсуждались в гл. 2. С их помощью можно найти химический потенциал растворенного вещества. Рассмотрим ячейку (18-12):

Если пренебречь разностью электрохимических потенциалов ионов хлора между растворами  , то потенциал ячейки можно выразить в виде [равенство (18-13)]
, то потенциал ячейки можно выразить в виде [равенство (18-13)]

где

Следует подбирать такую систему, чтобы пренебрегаемый член  был как можно меньшим. Для данной системы, где растворимость хлорида серебра низка, табл. 18-1 показывает, что для концентраций
был как можно меньшим. Для данной системы, где растворимость хлорида серебра низка, табл. 18-1 показывает, что для концентраций  выше 10-4 (в моляльной шкале) ошибка не превышает
выше 10-4 (в моляльной шкале) ошибка не превышает 
Равенство (32-7) можно использовать для непосредственного вычисления  из измеренных потенциалов ячеек. Однако при этом необходимо знать стандартный потенциал ячейки
из измеренных потенциалов ячеек. Однако при этом необходимо знать стандартный потенциал ячейки  связанный с определением вторичного стандартного состояния (14-5). Для наиболее точного проведения экстраполяции к бесконечному разбавлению пользуются тем фактом, что в разбавленных растворах коэффициент активности описывается выражением [уравнения (30-3) и (30-5)]
связанный с определением вторичного стандартного состояния (14-5). Для наиболее точного проведения экстраполяции к бесконечному разбавлению пользуются тем фактом, что в разбавленных растворах коэффициент активности описывается выражением [уравнения (30-3) и (30-5)]

где а — постоянная Дебая—Хюккеля, являющаяся известной величиной [уравнение (28-18)]. Следовательно, модифицированный потенциал U определяется из соотношения

где m обозначает  Тогда до тех пор, пока применимо
Тогда до тех пор, пока применимо
уравнение (32-9), величина U в разбавленных растворах описывается формулой

График зависимости  от
от  вблизи
вблизи  должен быть линейным. Отсекаемый этой прямой линией от оси ординат отрезок равен
должен быть линейным. Отсекаемый этой прямой линией от оси ординат отрезок равен  а ее наклон составляет
а ее наклон составляет  Эта процедура, позволяющая наиболее точно экстраполировать данные к бесконечному разбавлению, по-видимому, впервые применена Шамбом и др. [26]. Теперь уравнение (32-7) можно использовать для вычисления значений
Эта процедура, позволяющая наиболее точно экстраполировать данные к бесконечному разбавлению, по-видимому, впервые применена Шамбом и др. [26]. Теперь уравнение (32-7) можно использовать для вычисления значений  , соответствующих вторичному стандартному состоянию (14-5).
, соответствующих вторичному стандартному состоянию (14-5).
Для некоторых электролитов либо невозможно найти обратимые по обоим ионам электроды, либо с такими электродами трудно работать. Тогда можно обратиться к ячейке (17-23) с жидкостным соединением, содержащей электроды одинакового типа:

Потенциал этой ячейки дается выражением

Если известно число переноса  , то измерения потенциала этой ячейки можно использовать для изучения коэффициента активности и осмотического коэффициента данного раствора.
, то измерения потенциала этой ячейки можно использовать для изучения коэффициента активности и осмотического коэффициента данного раствора.
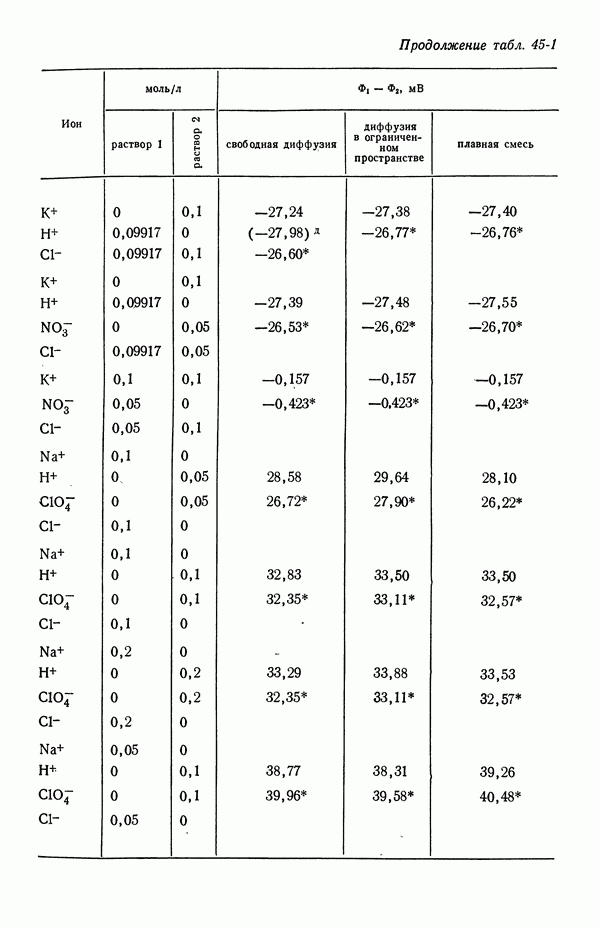
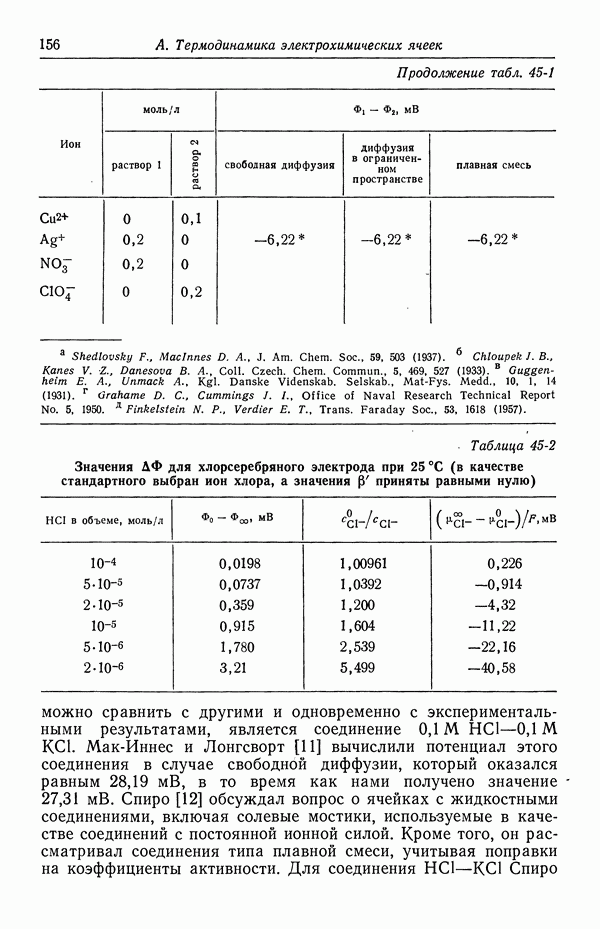
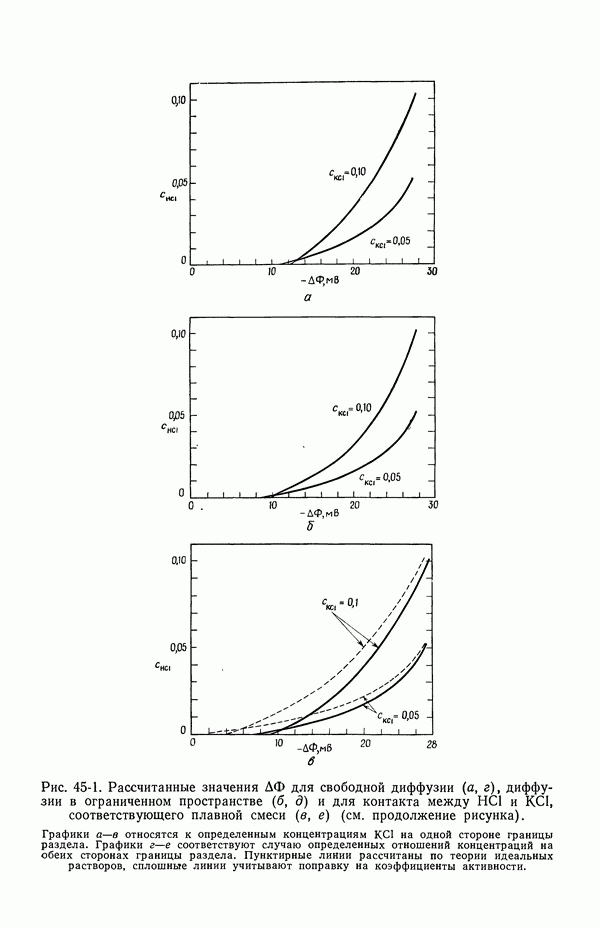
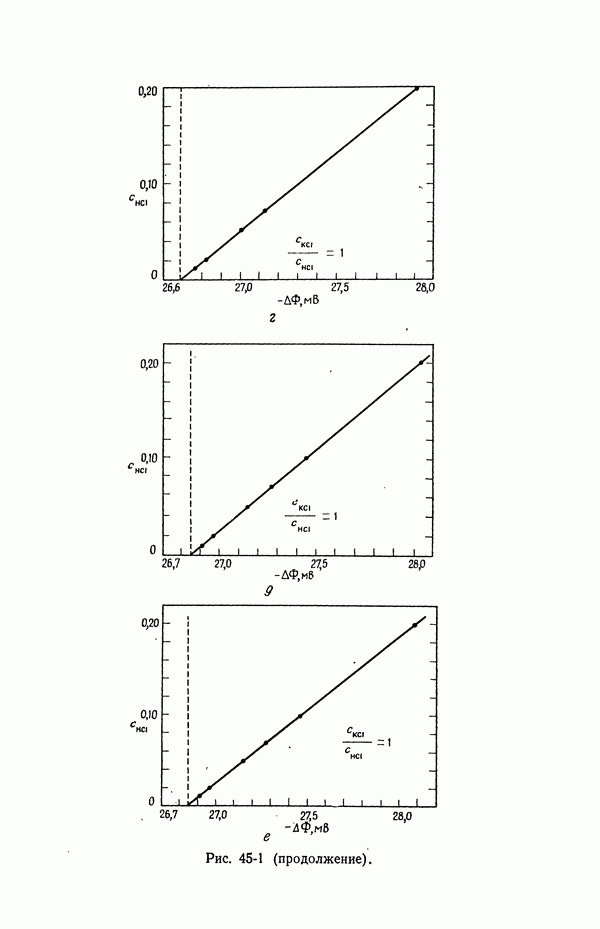
В термодинамических измерениях обычно следует избегать ячеек с жидкостным соединением. Однако, когда в контакте находятся растворы лишь одного электролита, потенциал ячейки не зависит от способа образования контакта и может быть однозначно выражен через термодинамические и транспортные свойства в соответствии с уравнением (32-13).
| << Предыдущий параграф | Следующий параграф >> |
- ПРЕДИСЛОВИЕ
- ПРЕДИСЛОВИЕ АВТОРА
- Глава 1. ВВЕДЕНИЕ
- 1. Термодинамика, кинетика электродных процессов и процессы переноса
- 2. Вращающиеся цилиндры
- 3. Прохождение тока в электролитах
- 4. Течение жидкости
- 5. Диффузионный слой
- 6. Концентрационные ячейки
- 7. Концентрационное перенапряжение
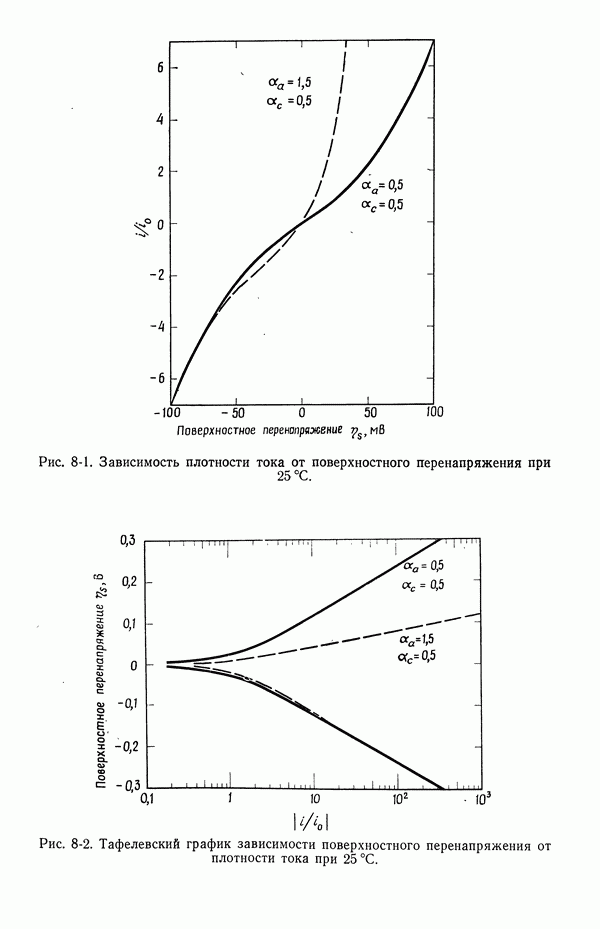
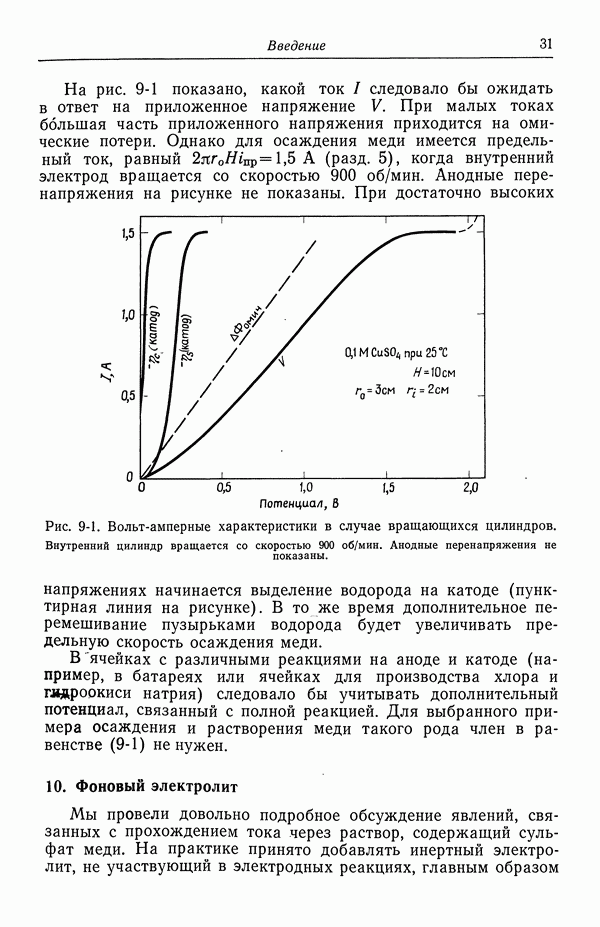
- 8. Поверхностное перенапряжение
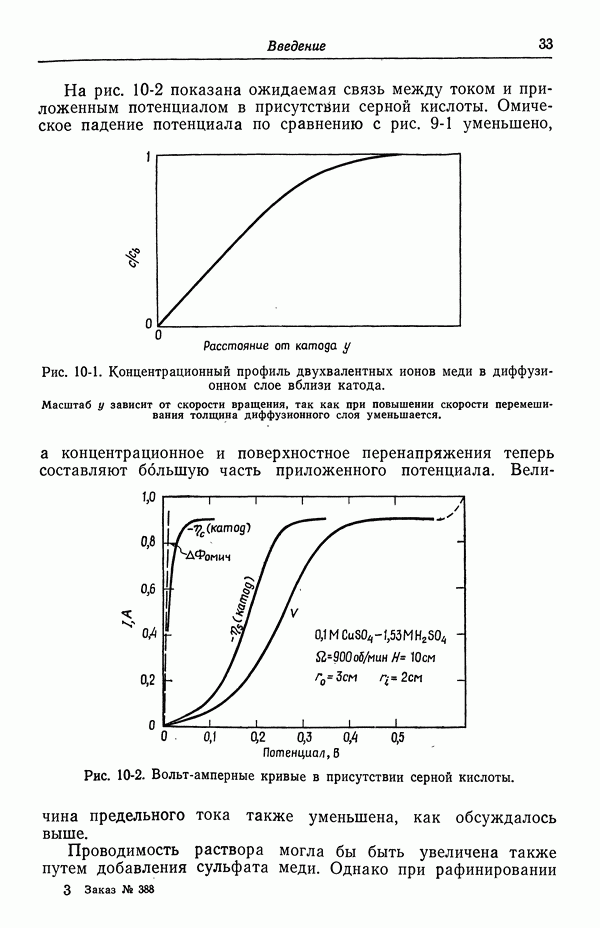
- 9. Потенциал ячейки
- 10. Фоновый электролит
- 11. Свободная конвекция
- СПИСОК ОБОЗНАЧЕНИЙ
- Часть А. ТЕРМОДИНАМИКА ЭЛЕКТРОХИМИЧЕСКИХ ЯЧЕЕК
- Глава 2. ТЕРМОДИНАМИКА НА ЯЗЫКЕ ЭЛЕКТРОХИМИЧЕСКИХ ПОТЕНЦИАЛОВ
- 12. Равновесие фаз
- 13. Химический и электрохимический потенциалы
- 14. Определение некоторых термодинамических функций
- 15. Ячейка с раствором однородной концентрации
- 16. Процессы переноса в областях контакта
- 17. Ячейка с одним электролитом переменной концентрации
- 18. Ячейка с двумя электролитами, концентрация одного из которых почти однородна
- 19. Ячейка с двумя электролитами переменной концентрации
- 20. Стандартный потенциал ячейки и коэффициенты активности
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Глава 3. ЭЛЕКТРИЧЕСКИЙ ПОТЕНЦИАЛ
- 22. Электростатический потенциал
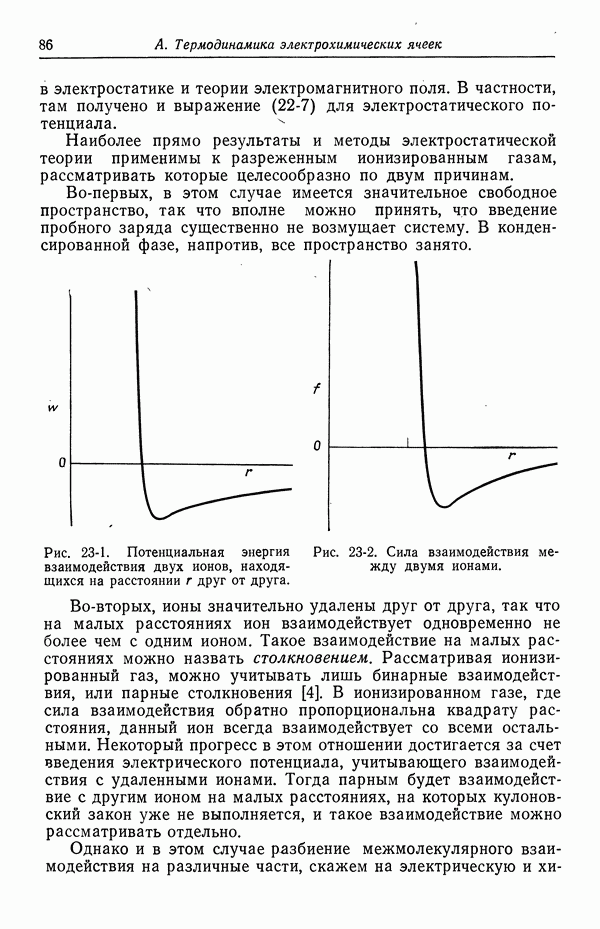
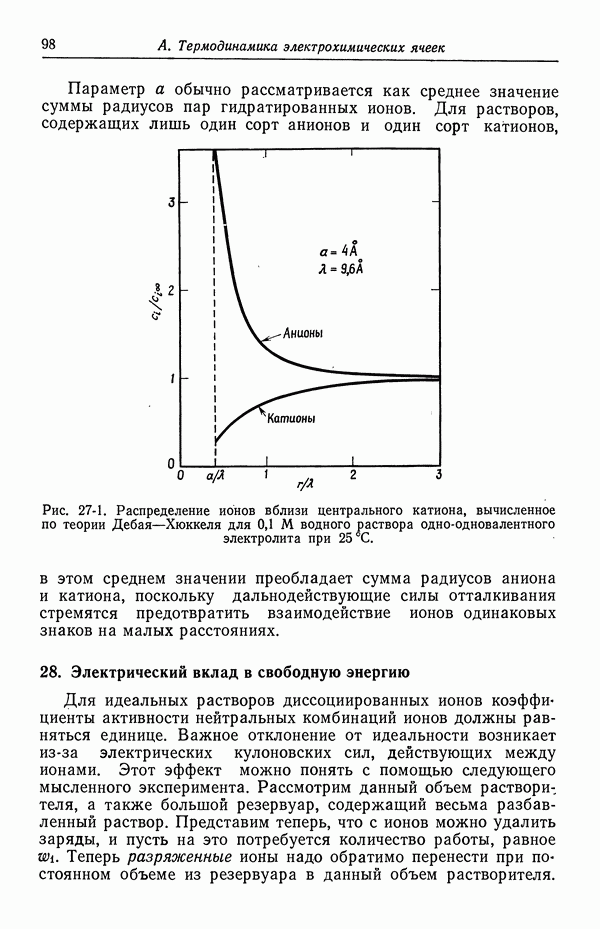
- 23. Межмолекулярные силы
- 24. Внешний и внутренний потенциалы
- 25. Потенциалы электродов сравнения
- 26. Электрический потенциал в термодинамике
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Глава 4. КОЭФФИЦИЕНТЫ АКТИВНОСТИ
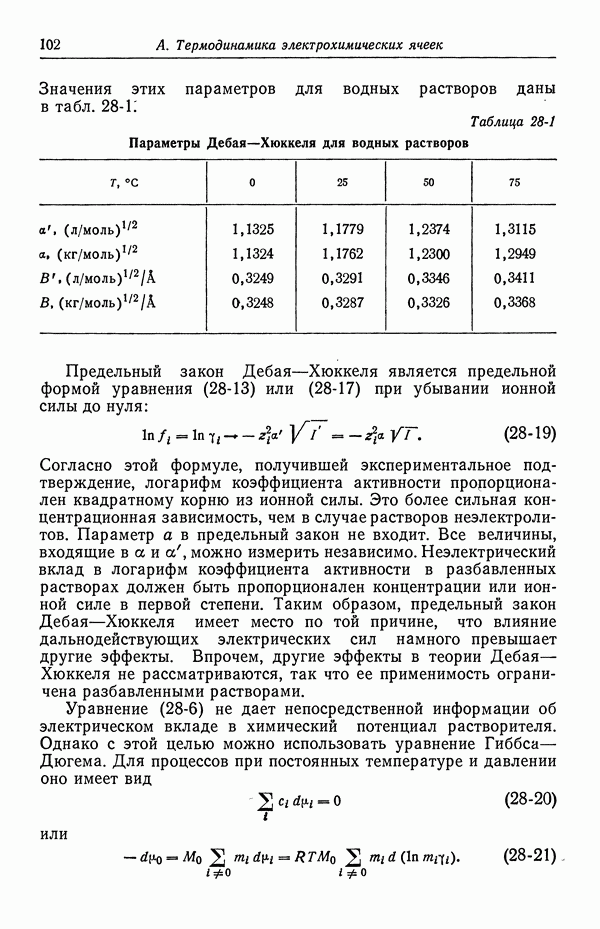
- 27. Распределение ионов в разбавленных растворах
- 28. Электрический вклад в свободную энергию
- 29. Недостатки модели Дебая—Хюккеля
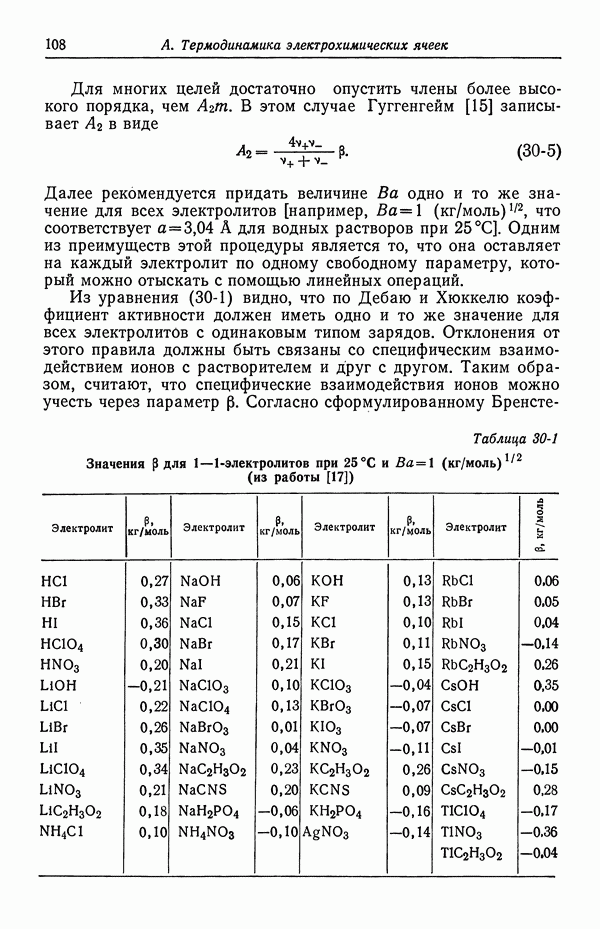
- 30. Растворы бинарных электролитов
- 31. Многокомпонентные растворы
- 32. Измерение коэффициентов активности
- 33. Слабые электролиты
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Глава 5. ЭЛЕКТРОДЫ СРАВНЕНИЯ
- 34. Критерии выбора электродов сравнения
- 35. Экспериментальные факторы, влияющие на выбор электродов сравнения
- 36. Водородный электрод
- 37. Каломельный электрод и другие электроды типа ртуть—соль ртути
- 38. Окиснортутный электрод
- 39. Электроды типа серебро—галогенид серебра
- 40. Потенциалы относительно данного электрода сравнения
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 6. ПОТЕНЦИАЛЫ ЯЧЕЕК С ПЕРЕНОСОМ
- 41. Уравнение Нернста
- 42. Типы жидкостных соединений
- 43. Формулы для потенциалов жидкостных соединений
- 44. Определение концентрационных профилей
- 45. Численные результаты
- 46. Ячейки с жидкостным соединением
- 47. Поправки к уравнению Нернста
- 48. Мембранные потенциалы
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Часть Б. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ И ДРУГИЕ ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
- Глава 7. СТРОЕНИЕ ЭЛЕКТРИЧЕСКОГО ДВОЙНОГО СЛОЯ
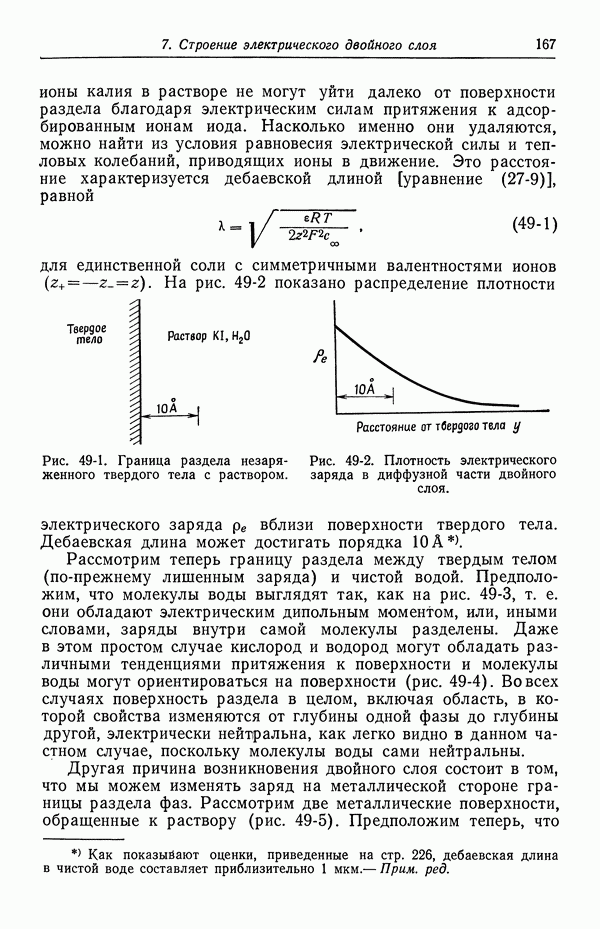
- 49. Качественное описание двойных слоев
- 50. Изотерма адсорбции Гиббса
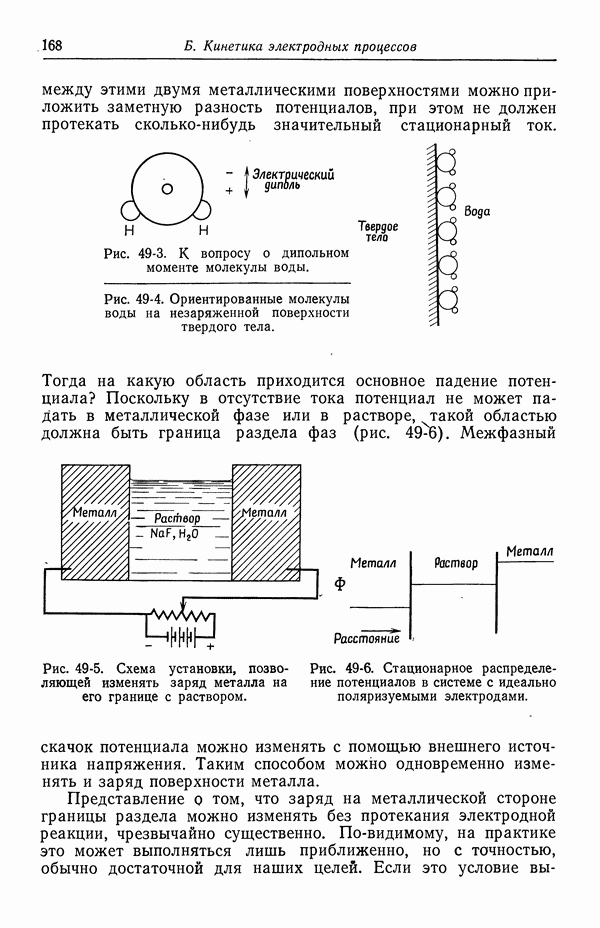
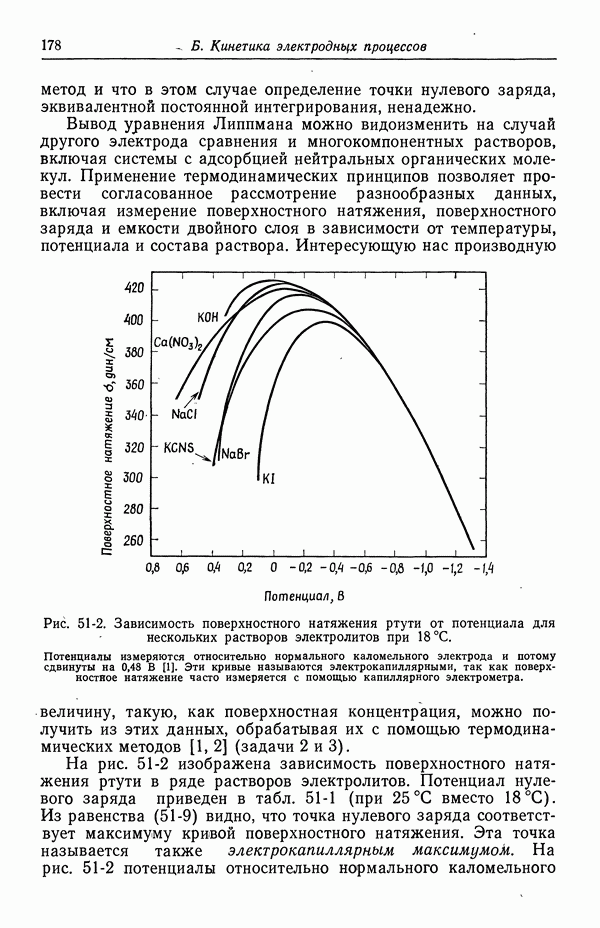
- 51. Уравнение Липпмана
- 52. Диффузная часть двойного слоя
- 53. Емкость двойного слоя в отсутствие специфической адсорбции
- 54. Специфическая адсорбция на границе раздела электрод — раствор
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 8. КИНЕТИКА ЭЛЕКТРОДНЫХ ПРОЦЕССОВ
- 55. Гетерогенные электродные реакции
- 56. Зависимость плотности тока от поверхностного перенапряжения
- 57. Модели в кинетике электродных процессов
- 58. Влияние строения двойного слоя
- 59. Кислородный электрод
- 60. Методы измерения
- 61. Одновременно протекающие реакции
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Глава 9. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ
- 62. Разрывная скорость на границе раздела
- 63. Электроосмос и потенциал течения
- 64. Электрофорез
- 65. Потенциал осаждения
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 10. ЭЛЕКТРОКАПИЛЛЯРНЫЕ ЯВЛЕНИЯ
- 66. Динамика границы раздела
- 67. Электрокапиллярное движение ртутных капель
- 68. Потенциалы осаждения для падающих ртутных капель
- СПИСОК ОБОЗНАЧЕНИЙ
- Часть В. ПРОЦЕССЫ ПЕРЕНОСА В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
- Глава 11. БЕСКОНЕЧНО РАЗБАВЛЕННЫЕ РАСТВОРЫ
- 69. Законы переноса
- 70. Проводимость, диффузионные потенциалы и числа переноса
- 71. Сохранение заряда
- 72. Бинарный электролит
- 73. Фоновый электролит
- 74. Многокомпонентная диффузия, возникающая при исключении электрического поля
- 75. Подвижности и коэффициенты диффузии
- 76. Электронейтральность и уравнение Лапласа
- 77. Умеренно разбавленные растворы
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 12. КОНЦЕНТРИРОВАННЫЕ РАСТВОРЫ
- 78. Законы переноса
- 79. Бинарный электролит
- 80. Стандартные скорости
- 81. Потенциал
- 82. Связь с теорией разбавленных растворов
- 83. Многокомпонентный транспорт
- 84. Потенциалы жидкостного соединения
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 13. ТЕПЛОВЫЕ ЭФФЕКТЫ
- 85. Термодиффузия
- 86. Выделение и перенос тепла
- 87. Тепловыделение на границе раздела фаз
- 88. Термогальванические ячейки
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 14. ХАРАКТЕРИСТИКИ ПЕРЕНОСА
- 89. Бесконечно разбавленные растворы
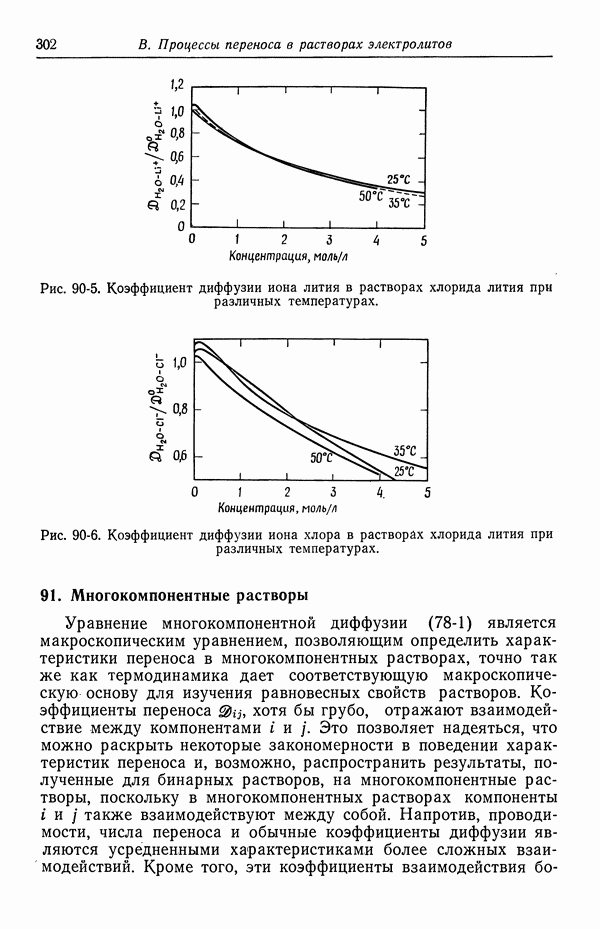
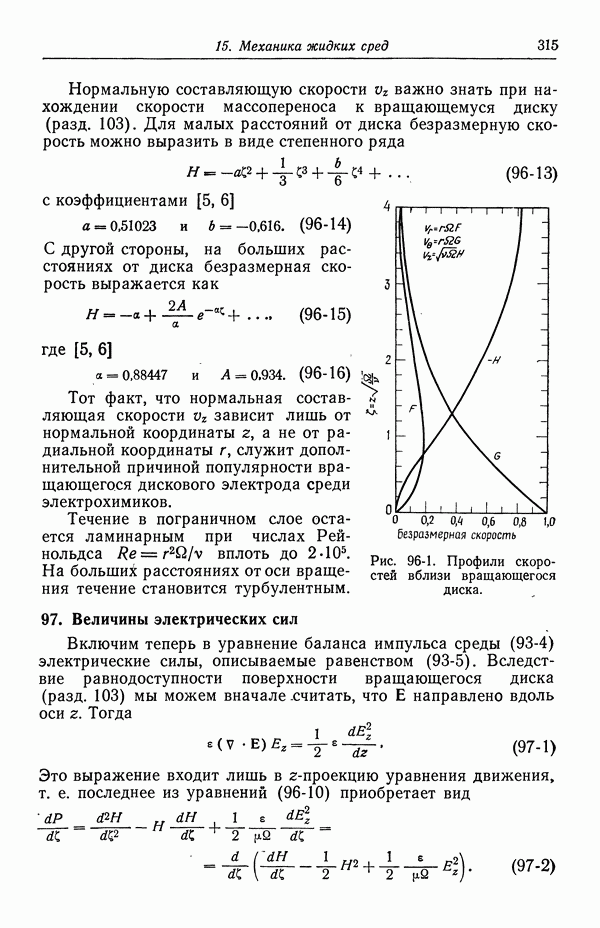
- 90. Растворы, содержащие одну соль
- 92. Интегральные коэффициенты диффузии
- ЗАДАЧА
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 15. МЕХАНИКА ЖИДКИХ СРЕД
- 94. Напряжение в ньютоновской жидкости
- 95. Граничные условия
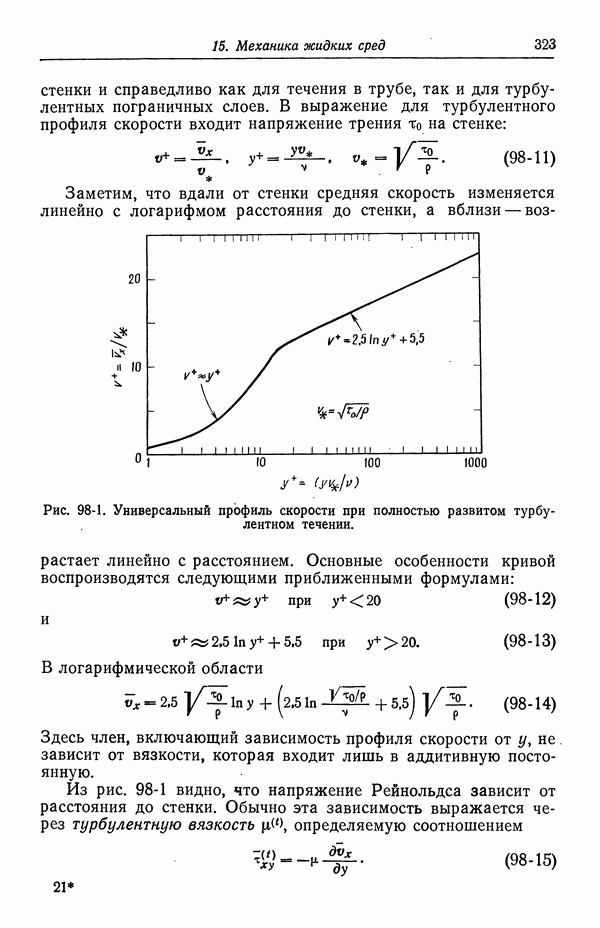
- 96. Течение жидкости к вращающемуся диску
- 97. Величины электрических сил
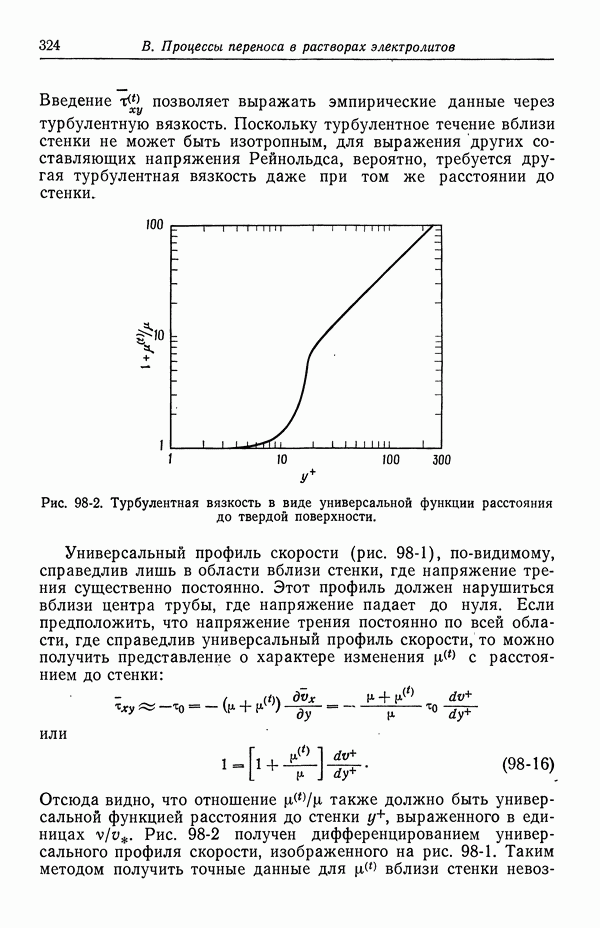
- 98. Турбулентное течение
- 99. Массоперенос в турбулентном потоке
- СПИСОК ОБОЗНАЧЕНИЙ
- СПИСОК ЛИТЕРАТУРЫ
- Часть Г. РАСПРЕДЕЛЕНИЕ ТОКА И МАССОПЕРЕНОС В ЭЛЕКТРОХИМИЧЕСКИХ СИСТЕМАХ
- Глава 16. ОСНОВНЫЕ УРАВНЕНИЯ
- 100. Перенос в разбавленных растворах
- 101. Кинетика электродных процессов
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 17. ЗАДАЧИ КОНВЕКТИВНОЙ ДИФФУЗИИ
- 102. Упрощенное описание конвективной диффузии
- 103. Вращающийся диск
- 104. Задача Граца
- 105. Кольцевой зазор
- 106. Двумерные диффузионные слои при вынужденной ламинарной конвекции
- 107. Осесимметричные диффузионные слои при вынужденной ламинарной конвекции
- 109. Вращающиеся цилиндры
- 110. Растущие ртутные капли
- 111. Свободная конвекция
- 112. Наложение свободной и вынужденной конвекции
- 113. Ограничения за счет поверхностных реакций
- 114. Бинарные и концентрированные растворы
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 18. ПРИЛОЖЕНИЯ ТЕОРИИ ПОТЕНЦИАЛА
- 115. Упрощения в задачах теории потенциала
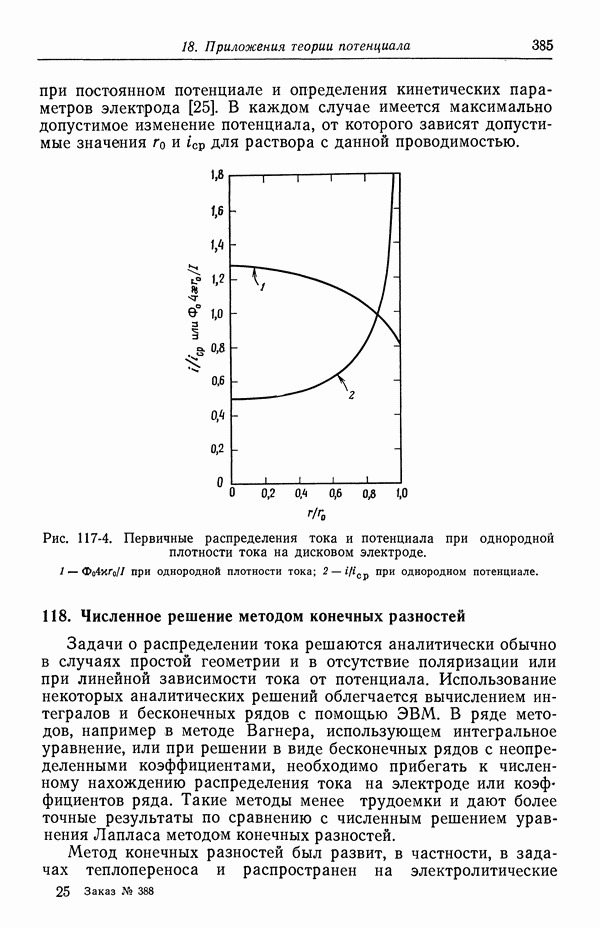
- 116. Первичное распределение тока
- 117. Вторичное распределение тока
- 118. Численное решение методом конечных разностей
- СПИСОК ОБОЗНАЧЕНИЙ
- ГЛАВА 19. ВЛИЯНИЕ МИГРАЦИИ НА ПРЕДЕЛЬНЫЕ ТОКИ
- 119. Решение задачи
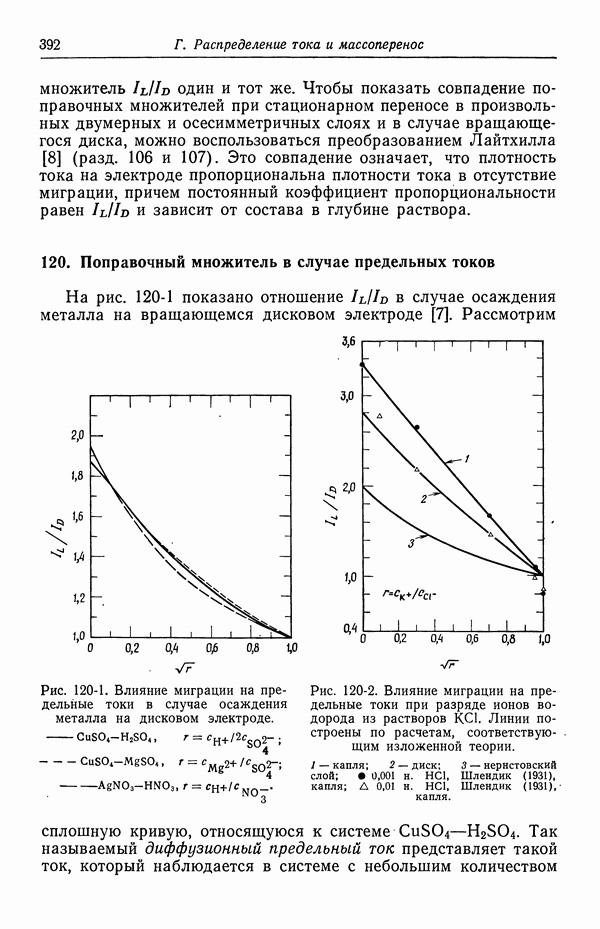
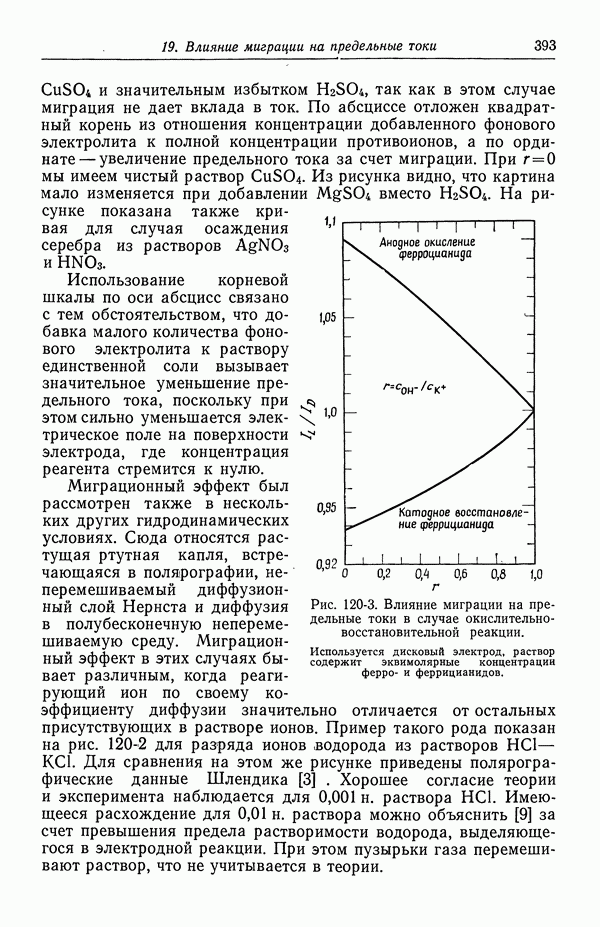
- 120. Поправочный множитель в случае предельных токов
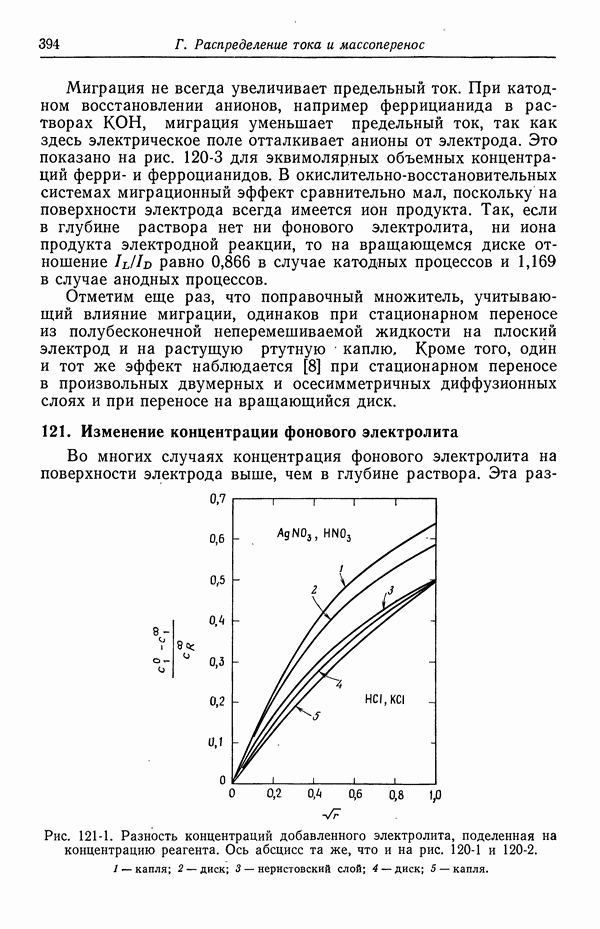
- 121. Изменение концентрации фонового электролита
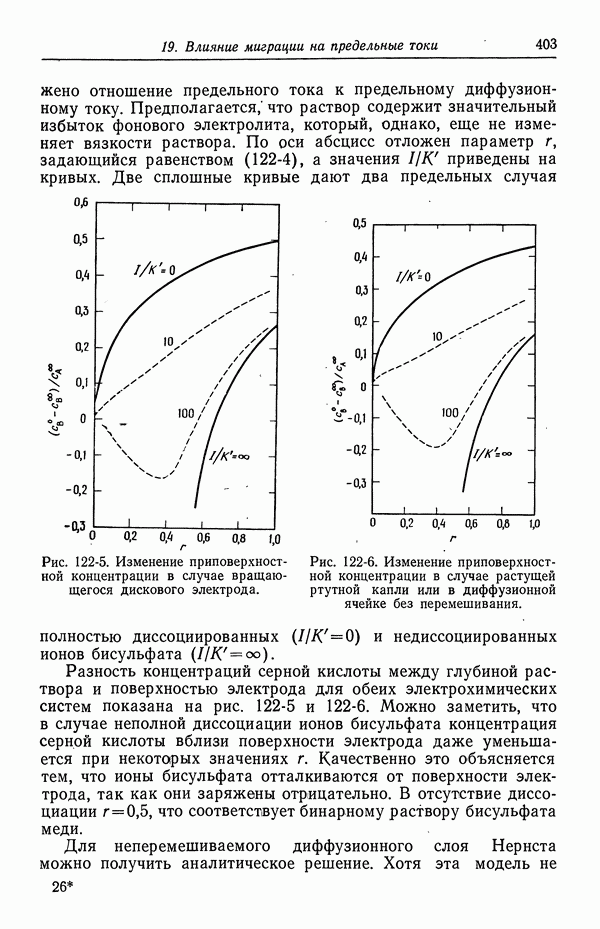
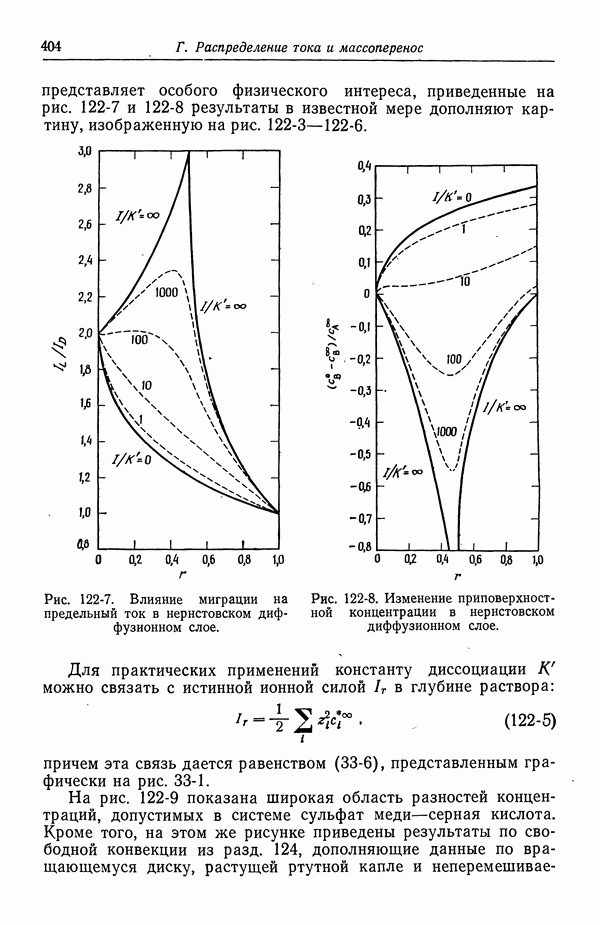
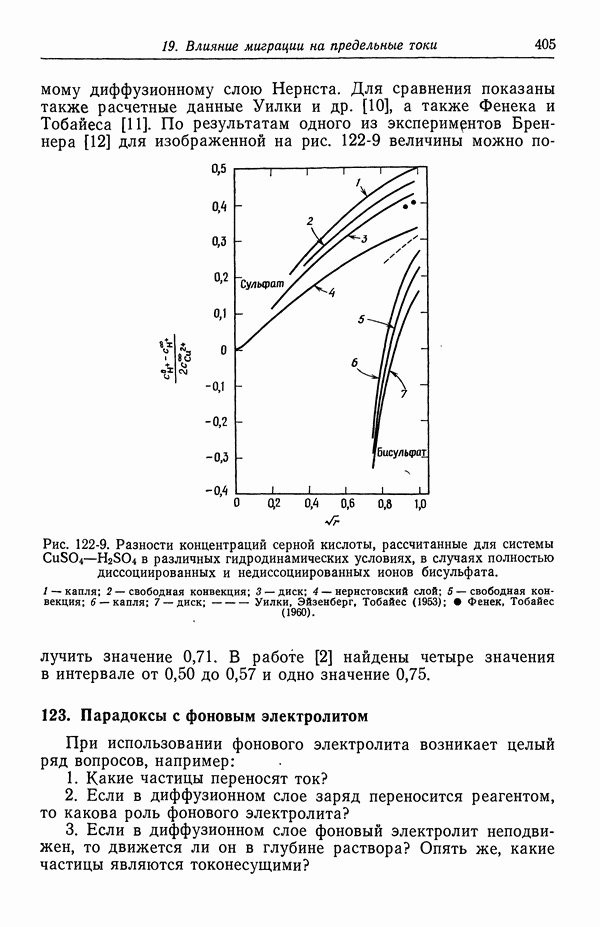
- 122. Роль ионов бисульфата
- 123. Парадоксы с фоновым электролитом
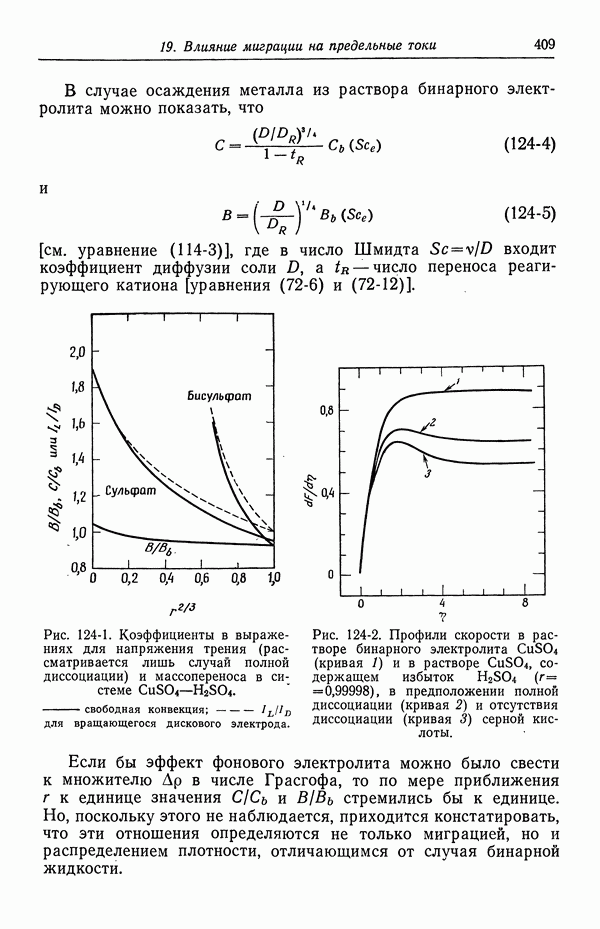
- 124. Предельные токи в случае свободной конвекции
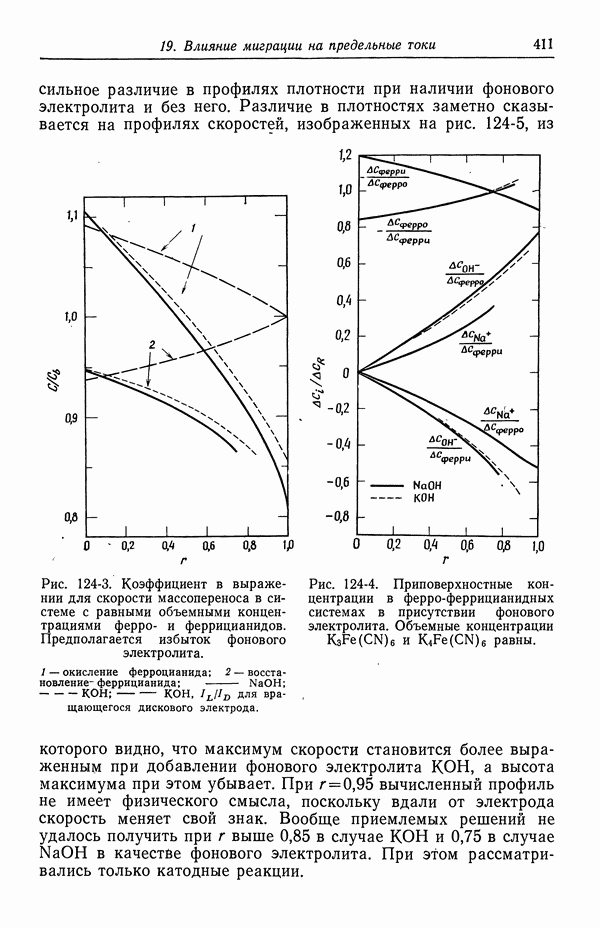
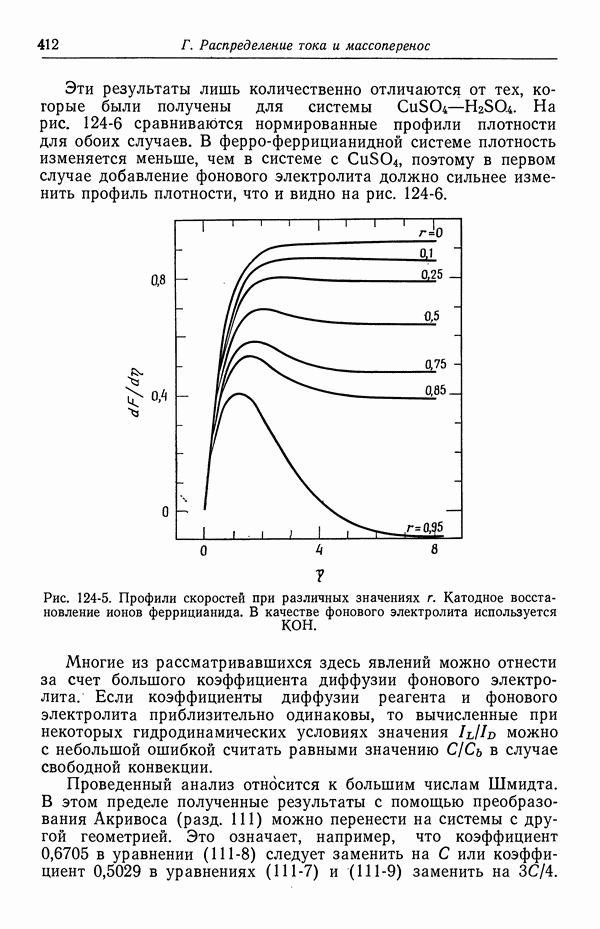
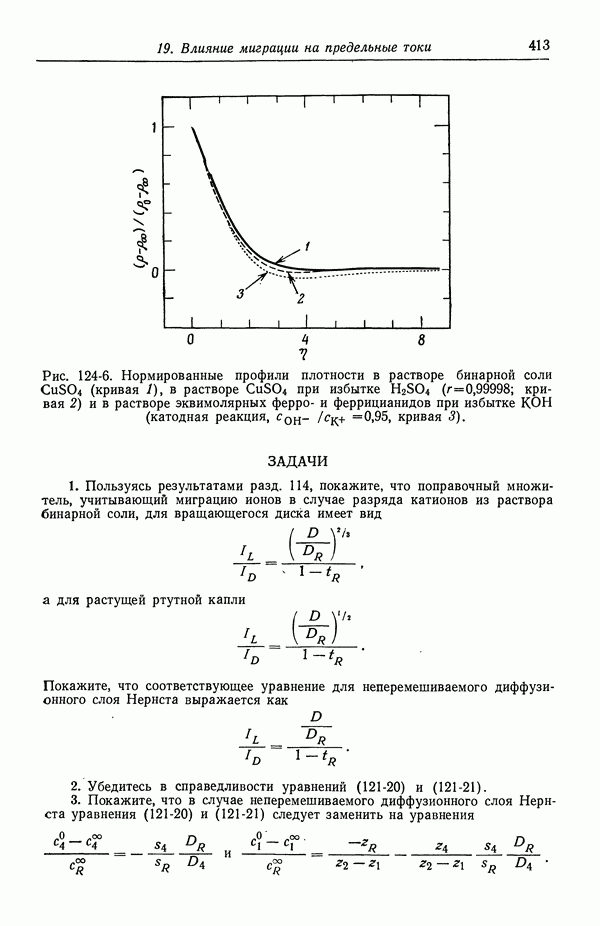
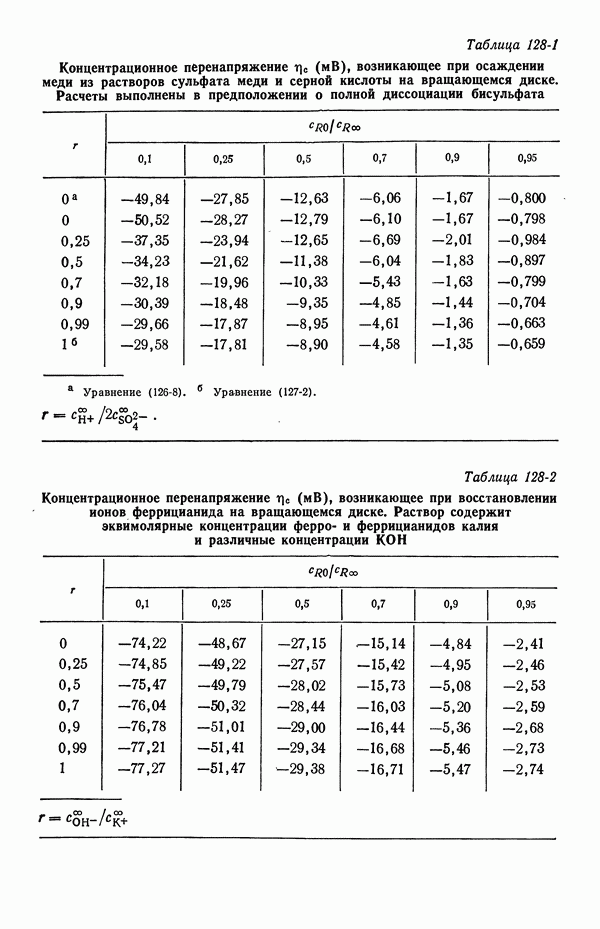
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 20. КОНЦЕНТРАЦИОННОЕ ПЕРЕНАПРЯЖЕНИЕ
- 126. Бинарный электролит
- 127. Фоновый электролит
- 128. Численные расчеты
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Глава 21. ДОПРЕДЕЛЬНЫЕ ТОКИ
- 129. Объем раствора
- 130. Диффузионные слои
- 131. Граничные условия и метод решения
- 132. Результаты для вращающегося диска
- ЗАДАЧИ
- СПИСОК ОБОЗНАЧЕНИЙ
- Приложение А. ПАРЦИАЛЬНЫЕ МОЛЯРНЫЕ ОБЪЕМЫ
- Приложение Б. ВЕКТОРЫ И ТЕНЗОРЫ
- Приложение В. ЧИСЛЕННОЕ РЕШЕНИЕ СИСТЕМЫ ОБЫКНОВЕННЫХ ДИФФЕРЕНЦИАЛЬНЫХ УРАВНЕНИЙ