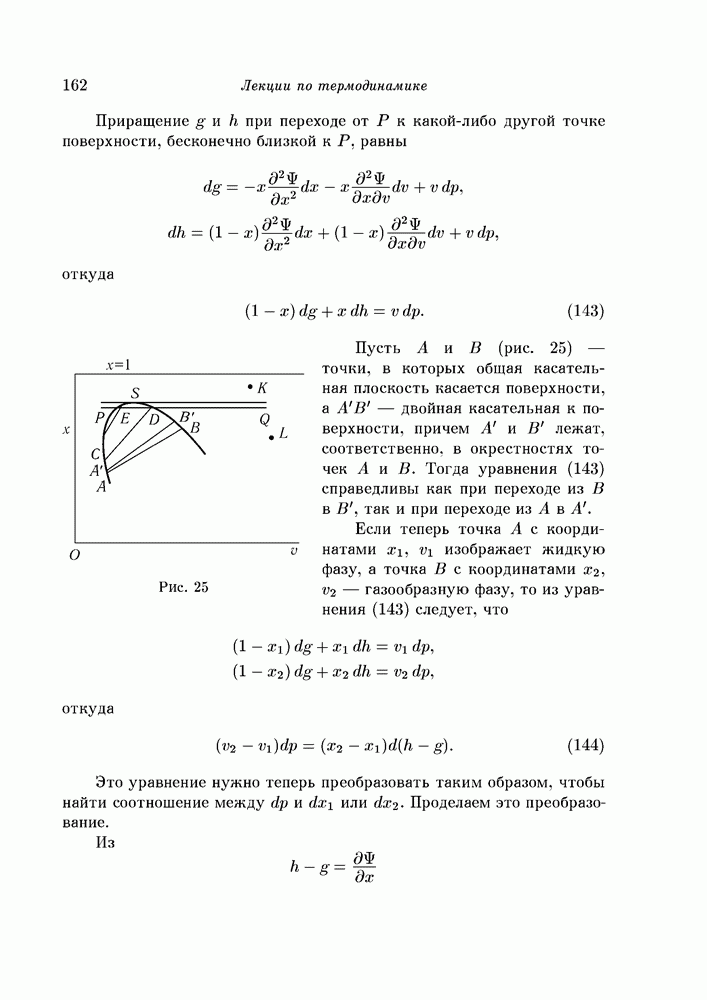
| << Предыдущий параграф | Следующий параграф >> |
Пред.
След.
Макеты страниц
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
ДЛЯ СТУДЕНТОВ И ШКОЛЬНИКОВ ЕСТЬ
ZADANIA.TO
§ 45. Система жидкость-пар
Для отыскания условий равновесия такой системы с помощью свободной энергии будем считать температуру системы постоянной, а стенки баллона, содержащего нашу систему, неподвижными (и абсолютно твердыми), так что работа внешних сил равна нулю.
Обозначим через  массу, удельный объем и удельную свободную энергию первой фазы, а через
массу, удельный объем и удельную свободную энергию первой фазы, а через  — те же величины для второй фазы. В состоянии равновесия
— те же величины для второй фазы. В состоянии равновесия  достигает минимума, поэтому
достигает минимума, поэтому

для всех вариаций  , удовлетворяющих условиям
, удовлетворяющих условиям

Первое из этих трех уравнений дает

второе —

и, наконец, третье —

или

Подставляя в уравнение (59) полученные выражения для  , находим
, находим

Условия равновесия, в силу произвольности  , примут вид
, примут вид

и

или, согласно равенству (60),

Таким образом, в состоянии равновесия давление и удельный термодинамический потенциал в обеих фазах должны быть одинаковы.
Тот же результат получим, пользуясь свойствами энтропии. За независимые переменные возьмем тогда удельный объем v и удельную внутреннюю энергию  каждой фазы; объем всей системы будем считать постоянным.
каждой фазы; объем всей системы будем считать постоянным.
В состоянии равновесия  имеет максимум для вариаций переменных, соответствующих адиабатным условиям, т. е. (ибо в нашем случае объем постоянен) постоянству энергии. Искомое уравнение равновесия есть
имеет максимум для вариаций переменных, соответствующих адиабатным условиям, т. е. (ибо в нашем случае объем постоянен) постоянству энергии. Искомое уравнение равновесия есть

при дополнительных условиях

Дальнейшие выкладки предоставляются читателю.
Тот же вопрос можно рассматривать и при помощи термодинамического потенциала. Тогда надо себе представить, что система заключена в сосуд, закрытый поршнем, находящимся под постоянным давлением, и температура системы постоянна. При переходе  единиц массы из второй фазы в первую термодинамический потенциал всей системы получает приращение
единиц массы из второй фазы в первую термодинамический потенциал всей системы получает приращение  . Для состояния равновесия это приращение должно равняться нулю, т. е.
. Для состояния равновесия это приращение должно равняться нулю, т. е.

Пусть  . Уравнение
. Уравнение  . Дает тогда некоторое соотношение между
. Дает тогда некоторое соотношение между  . Выразить
. Выразить  , как функции
, как функции  , — задача довольно сложная и мы предпочтем вывести из уравнения
, — задача довольно сложная и мы предпочтем вывести из уравнения  новое уравнение, связывающее друг с другом не сами
новое уравнение, связывающее друг с другом не сами  , а их одновременные приращения. Сравним между собой два равновесных состояния системы, причем первое из них характеризуется значениями давления и температуры
, а их одновременные приращения. Сравним между собой два равновесных состояния системы, причем первое из них характеризуется значениями давления и температуры  , а второе значениями p + dp и Т + dT. Тогда
, а второе значениями p + dp и Т + dT. Тогда

Вычитая первое уравнение из второго, находим

откуда, по (47),

В § 26 было выведено уравнение Клапейрона

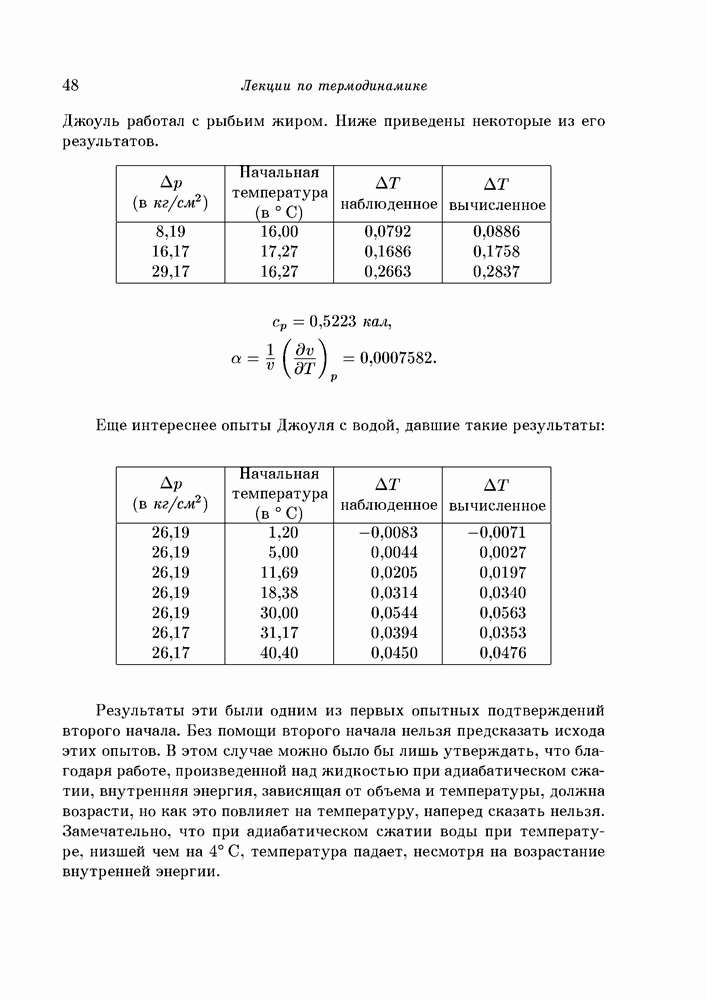
Уравнение (62) должно совпасть с уравнением Клапейрона, ибо они оба представляют собой следствия второго начала. В этом легко убедиться, рассмотрев переход единицы массы из второй фазы в первую при постоянной температуре и давлении, соответствующем состоянию равновесия. Процесс этот обратим, поэтому можно применить формулу (37) в виде равенства, и следовательно,

| << Предыдущий параграф | Следующий параграф >> |
Оглавление
- Предисловие редактора к первому изданию
- § 1. Основные понятия термодинамики
- § 2. Первое начало термодинамики
- § 3. Другой пример вычисления работы
- § 4. Приложение к идеальным газам
- § 5. Стационарный ток жидкости через трубу с переменным сечением
- § 6. Однородное тело
- § 7. Применение первого начала к химии: теплота реакции и температура
- § 8. Второе начало термодинамики
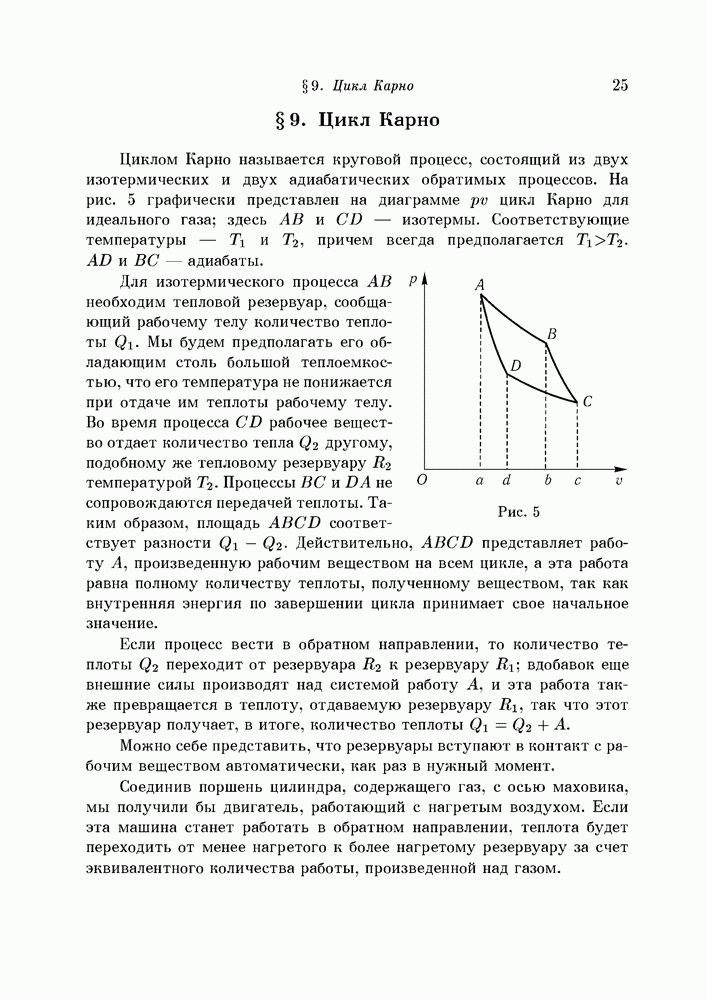
- § 9. Цикл Карно
- § 10. Коэффициент полезного действия. Универсальная функция температуры
- § 11. Другой способ определения универсальной функции температуры
- § 12. Второе начало для обратимых процессов
- § 13. Второе начало для обратимых процессов [общий случай]
- § 14. Различные обратимые пути между двумя состояниями. Энтропия
- § 15. Несколько простейших приложений
- § 16. Отношение теплоемкостей
- § 17. Система с произвольным числом параметров
- § 18. Значение полученных общих формул
- § 19. Значение второго начала
- § 20. Приложения второго начала к адиабатическим процессам
- § 21. Сжатие жидкостей
- § 22. Опыты по адиабатическому растяжению проволок
- § 23. Непосредственный вывод уравнения адиабатических процессов
- § 24. Применение к жидким пленкам
- § 25. Применение к гальваническому элементу
- § 26. Уравнение Клапейрона
- § 27. Опытная проверка уравнения Клапейрона (Клаузиус)
- § 28. Опыты де-Виссера с уксусной кислотой
- § 29. Режеляция льда
- § 30. Закон Стефана-Больцмана
- § 31. Другие выражения второго начала
- § 32. Свойства энтропии
- § 33. Свободная энергия
- § 34. Термодинамический потенциал
- § 35. Свободная энергия идеального газа
- § 36. Неравновесные состояния
- § 37. Необратимые процессы
- § 38. Изотермический процесс
- § 39. Свободная энергия и работа
- § 40. Обобщенные силы
- § 41. Условия равновесия
- § 42. Система в поле консервативных сил
- § 43. Газ или жидкость в поле силы тяжести
- § 44. Решение того же вопроса с помощью энтропии
- § 45. Система жидкость-пар
- § 46. Равновесие трехфазной системы
- § 47. Упругость пара над разбавленным раствором
- § 48. Различие в давлении пара над чистой водой и над раствором
- § 49. Смеси
- § 50. Двухкомпонентная система
- § 51. Устойчивые и неустойчивые жидкие фазы; равновесие между двумя жидкими фазами
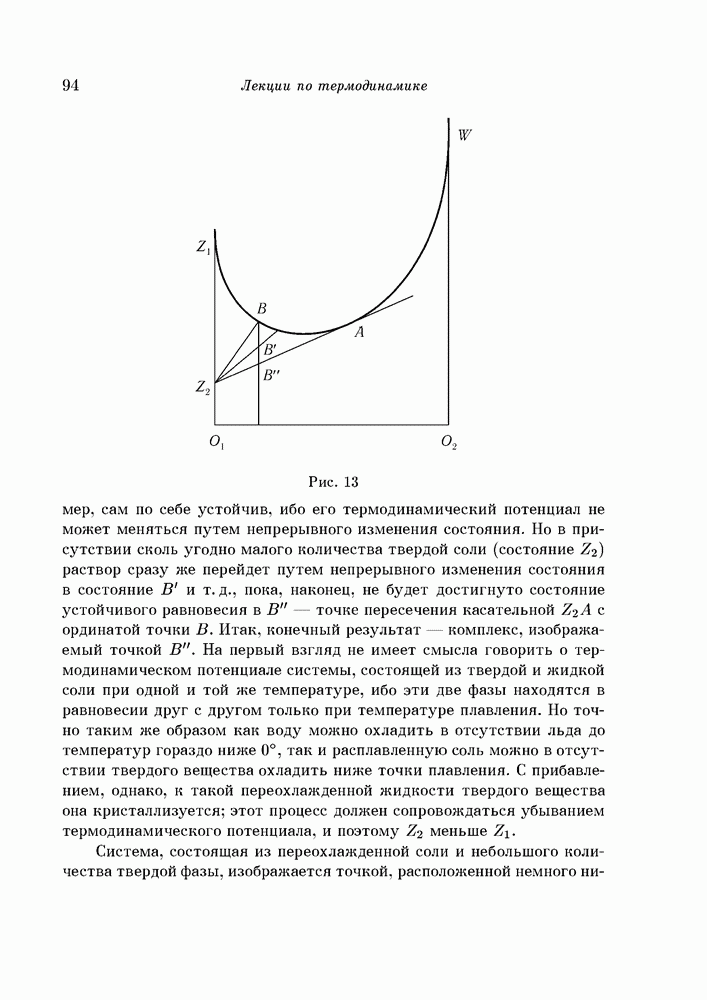
- § 52. Равновесие между твердой и жидкой фазами; переохлаждение
- § 53. Равновесие трехфазной системы, состоящей из двух компонент
- § 54. Равновесие раствора соли с ее твердым гидратом
- § 55. Равновесие между двумя растворами различной концентрации
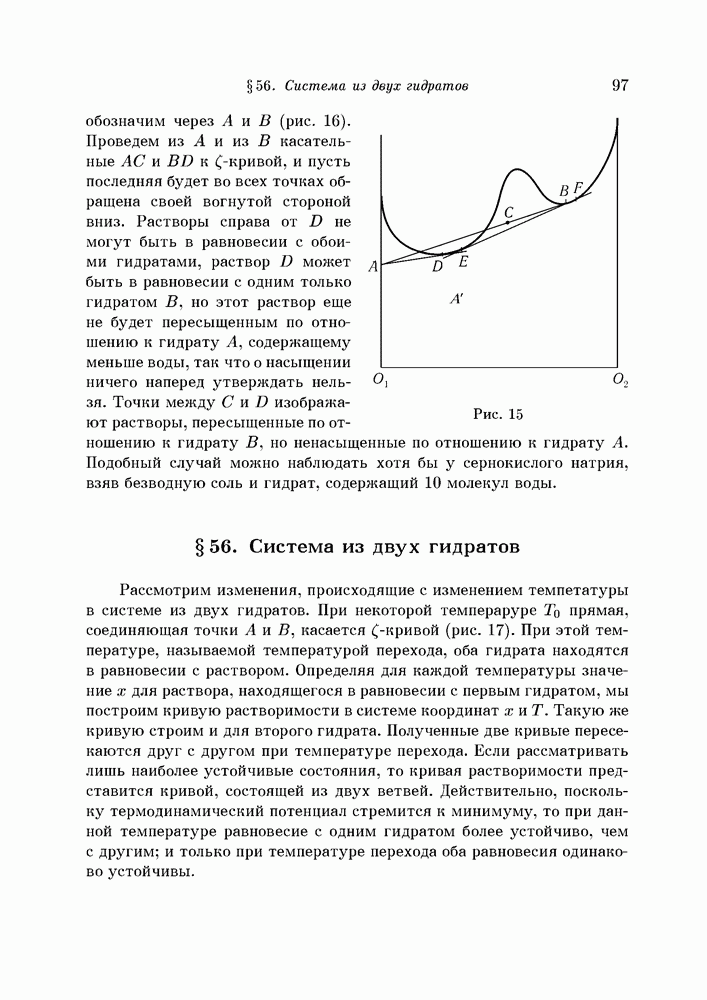
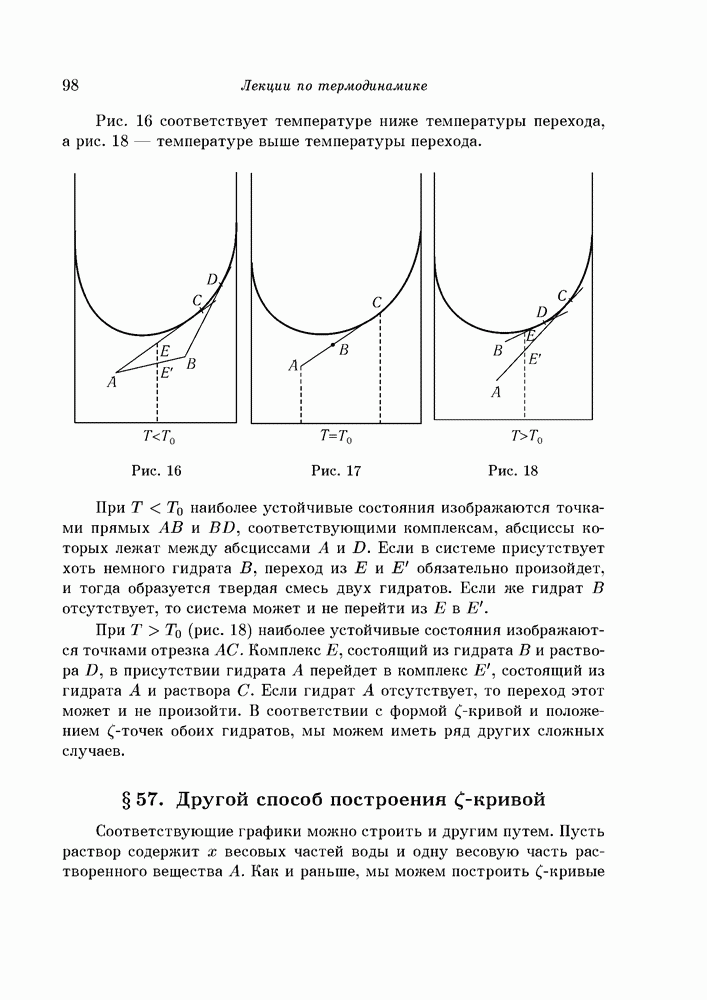
- § 56. Система из двух гидратов
- § 57. Другой способ построения кривой
- § 58. Трехкомпонентные системы
- § 59. Трехфазная система из трех компонент
- § 60. Форма поверхности
- § 61. Условия равновесия между твердой и жидкой фазами
- § 62. Равновесие двух твердых фаз с жидкими фазами
- § 63. Равновесие между двумя жидкими фазами
- § 64. Другие способы построения поверхности
- § 65. Смешанные кристаллы
- § 66. Равновесие между смесями и растворами
- § 67. Неопределенность в выражении термодинамического потенциала
- § 68. Смесь газов в поле силы тяжести
- § 69. Смешение и разделение двух газов
- § 70. Парадокс Гиббса
- § 71. Обобщение теоремы Гиббса на случай трех и более газов
- § 72. Уменьшение свободной энергии при смешении двух газов
- § 73. Свободная энергия жидкой смеси
- § 74. Общее выражение для свободной энергии смеси
- § 75. Случай, когда одна из компонент присутствует в весьма малом количестве
- § 76. Равновесие двух фаз, каждая из которых состоит из двух компонент
- § 77. Смесь под действием внешних сил
- § 78. Вывод уравнений равновесия
- § 79. Второй пример системы под действием внешних сил
- § 80. Осмотическое давление. Закон вант-Гоффа
- § 81. Другой вывод закона вант-Гоффа
- § 82. Общие условия равновесия многофазных систем
- § 83. Равновесие трех фаз
- § 84. Вывод условий равновесия с помощью термодинамического потенциала
- § 85. Число независимых условий равновесия
- § 86. Сравнение между собой двух состояний равновесия
- § 87. Общее соотношение между двумя состояниями равновесия
- § 88. Смысл полученного соотношения
- § 89. Добавление некоторого весьма малого количества новой компоненты
- § 90. Несколько заключительных замечаний
- § 91. Диссоциация газа
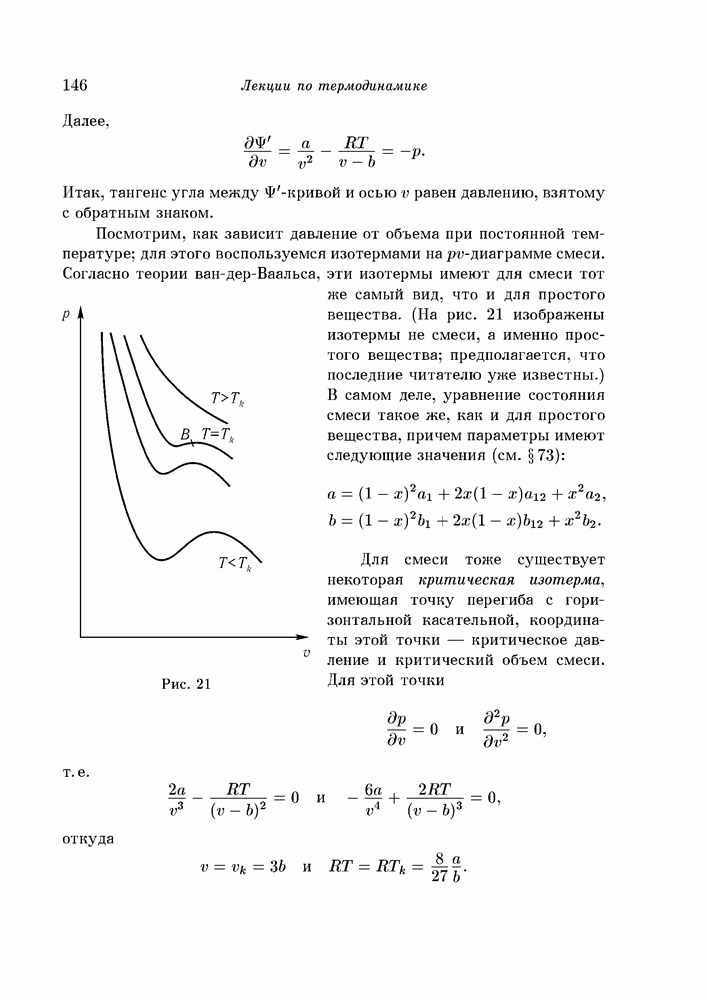
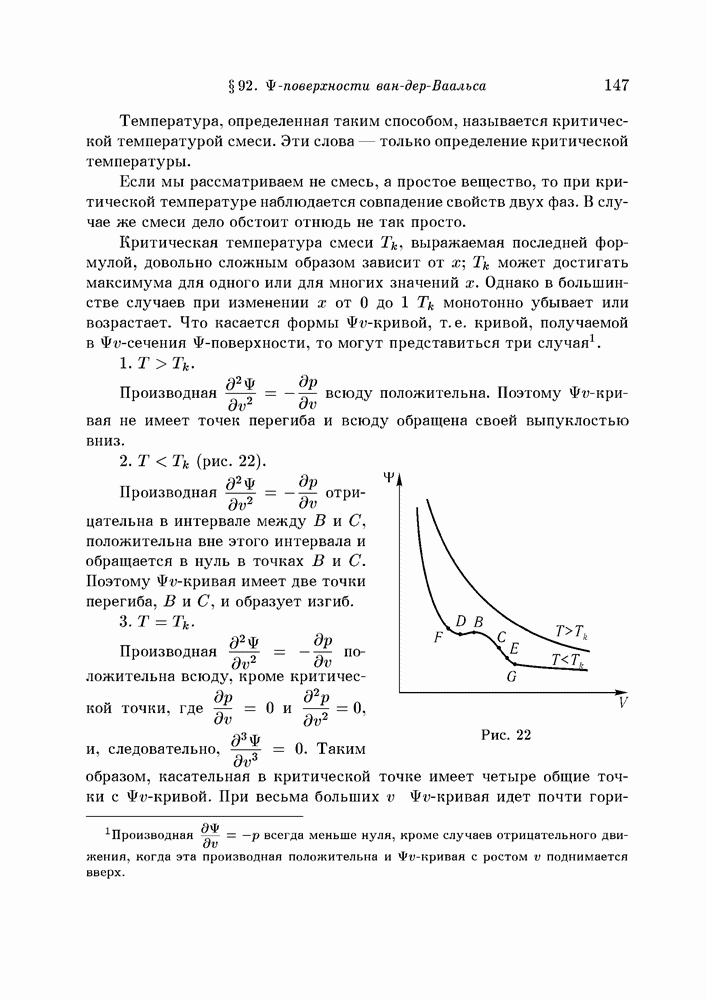
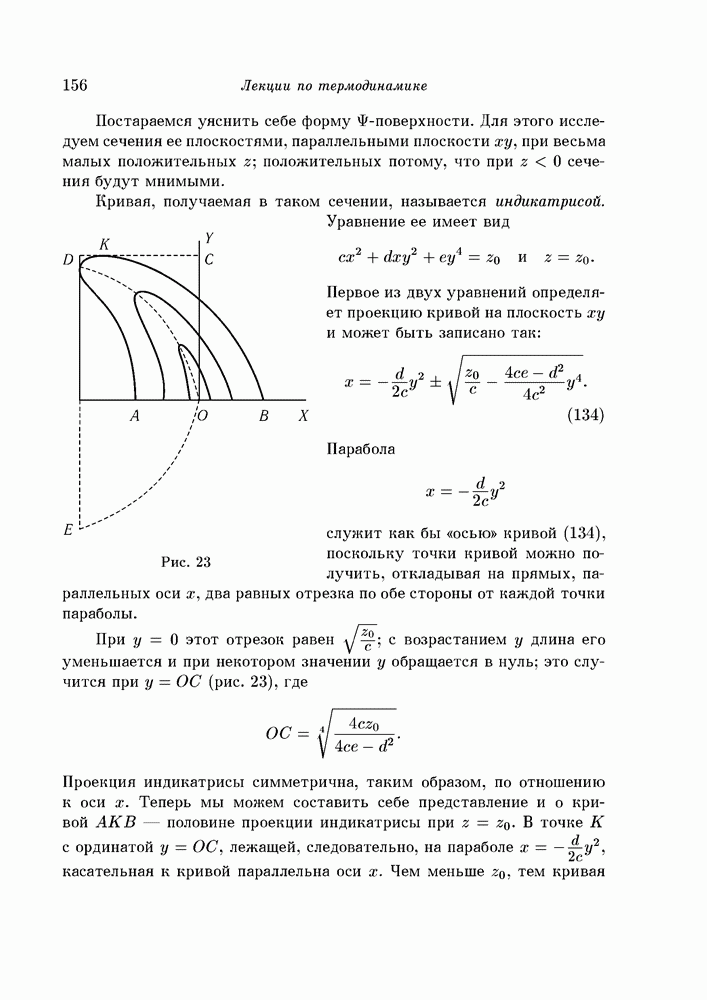
- § 92. поверхности ван-дер-Ваальса
- § 93. Изменение формы поверхности с температурой
- § 94. Сечения Ф-поверхности
- § 95. Условия равновесия
- § 96. Сосуществующие фазы
- § 97. Математическая теория конечных точек складки
- § 98. Исследование Ф-поверхности в окрестности конечной точки складки
- § 99. Конечная точка складки первого рода
- § 100. Индикатриса, бинодаль и спинодаль
- § 101. Определение координат конечной точки складки непосредственно из самого уравнения Ф-поверхности
- § 102. Кривая конечных точек складки
- § 103. Изменение давления при бесконечно малом изменении состояния
- § 104. Зависимость давления от состава смеси
- § 105. Изобары
- § 106. Изотермическое сжатие смесей
- § 107. Обратная конденсация