| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
§ 51. Устойчивые и неустойчивые жидкие фазы; равновесие между двумя жидкими фазами
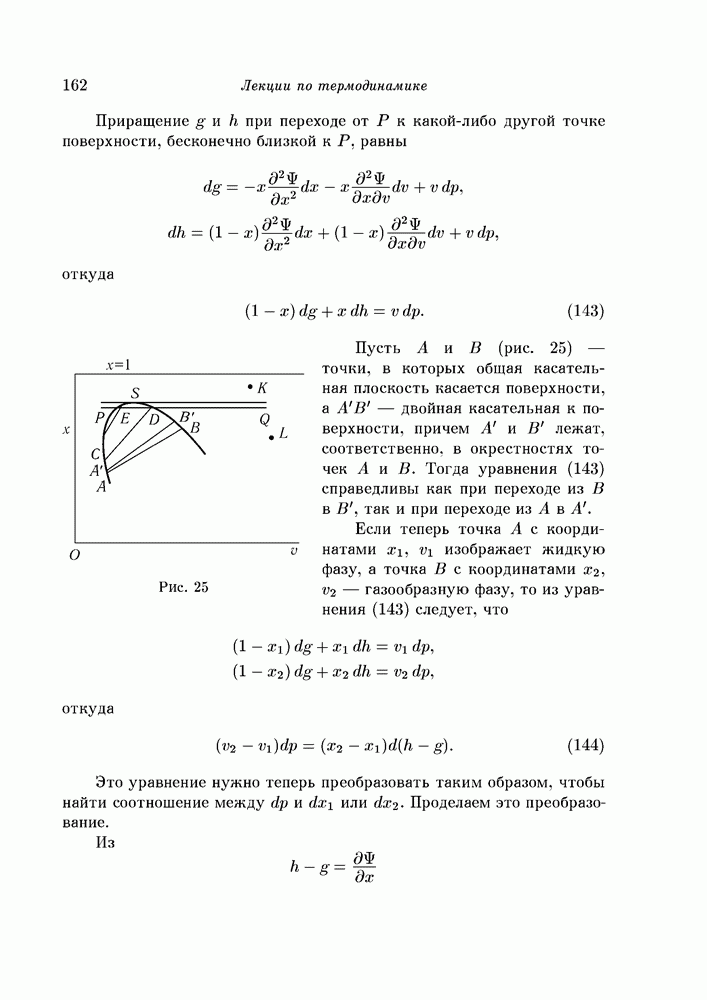
Если  - кривая в точке А (рис. 11) обращена к оси
- кривая в точке А (рис. 11) обращена к оси  выпуклой стороной, то точка А расположена под хордой, соединяющей любые две точки А и
выпуклой стороной, то точка А расположена под хордой, соединяющей любые две точки А и  , взятые справа и слева от точки А, но на достаточно малом расстоянии от нее. В этом случае термодинамический потенциал для однородной смеси меньше, чем для соответствующего комплекса, состоящего из фаз А' и А". Итак, если фазы А" и А' приведены в соприкосновение друг с другом, то они смешиваются между собой с уменьшением термодинамического потенциала и образуют однофазную систему А. Система же А не может распасться на две фазы
, взятые справа и слева от точки А, но на достаточно малом расстоянии от нее. В этом случае термодинамический потенциал для однородной смеси меньше, чем для соответствующего комплекса, состоящего из фаз А' и А". Итак, если фазы А" и А' приведены в соприкосновение друг с другом, то они смешиваются между собой с уменьшением термодинамического потенциала и образуют однофазную систему А. Система же А не может распасться на две фазы  , ибо в таком случае термодинамический потенциал увеличился бы, что невозможно. Пусть теперь в точке
, ибо в таком случае термодинамический потенциал увеличился бы, что невозможно. Пусть теперь в точке  - кривая обращена к оси
- кривая обращена к оси  своей вогнутой стороной. В и В" — любые две точки, взятые на кривой справа и слева от точки В, но на достаточно малом от нее расстоянии. Тогда точка В расположена над хордой
своей вогнутой стороной. В и В" — любые две точки, взятые на кривой справа и слева от точки В, но на достаточно малом от нее расстоянии. Тогда точка В расположена над хордой  , и фазы В и В" при смешивании не дают устойчивой однородной смеси. Система В, наоборот, легко распадается с уменьшением термодинамического потенциала на фазы В и В".
, и фазы В и В" при смешивании не дают устойчивой однородной смеси. Система В, наоборот, легко распадается с уменьшением термодинамического потенциала на фазы В и В".
Равновесие в состоянии А называется устойчивым, а в состоянии В — неустойчивым.
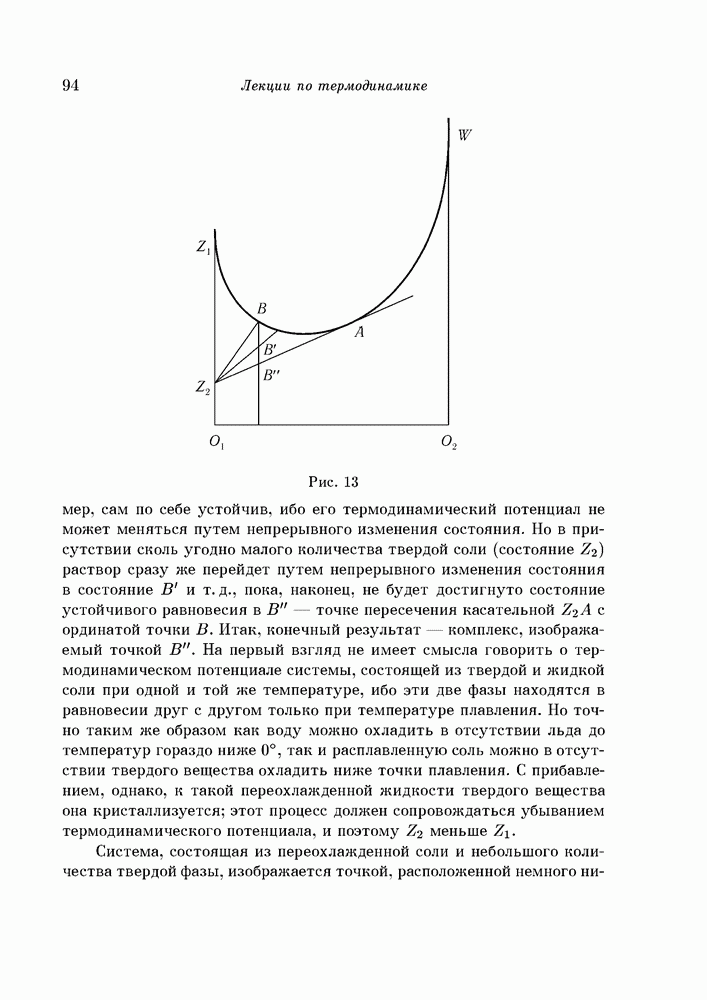
Хотя термодинамический потенциал и может уменьшаться при рассмотренных выше превращениях, но надо еще выяснить, действительно ли он станет уменьшаться, будет ли иметь место соответствующий процесс. Оказывается, что такой процесс, действительно, будет иметь место, если только изменение состояния при этом является непрерывным, если же где-либо в течение этого процесса для перехода от одного состояния к другому, с меньшим термодинамическим потенциалом, необходим некоторый скачок, то сам по себе, без внешнего воздействия, процесс начаться не может (пример — явления пересыщения и переохлаждения).
Из всего предыдущего видно, что если устойчивая жидкая фаза возможна при любом значении  то
то  -кривая должна быть всюду обращена своей выпуклой стороной вниз, иными словами, производная должна быть положительна при всяком
-кривая должна быть всюду обращена своей выпуклой стороной вниз, иными словами, производная должна быть положительна при всяком  . В тех точках, где
. В тех точках, где  - кривая обращена вниз своей вогнутостью, так что производная
- кривая обращена вниз своей вогнутостью, так что производная  отрицательна, соответствующая однофазная система неустойчива и ее нельзя получить смешиванием двух других жидких фаз. Такой случай изображен на рис. 11; так ведут себя в действительности вода и эфир.
отрицательна, соответствующая однофазная система неустойчива и ее нельзя получить смешиванием двух других жидких фаз. Такой случай изображен на рис. 11; так ведут себя в действительности вода и эфир.

Рис. 11
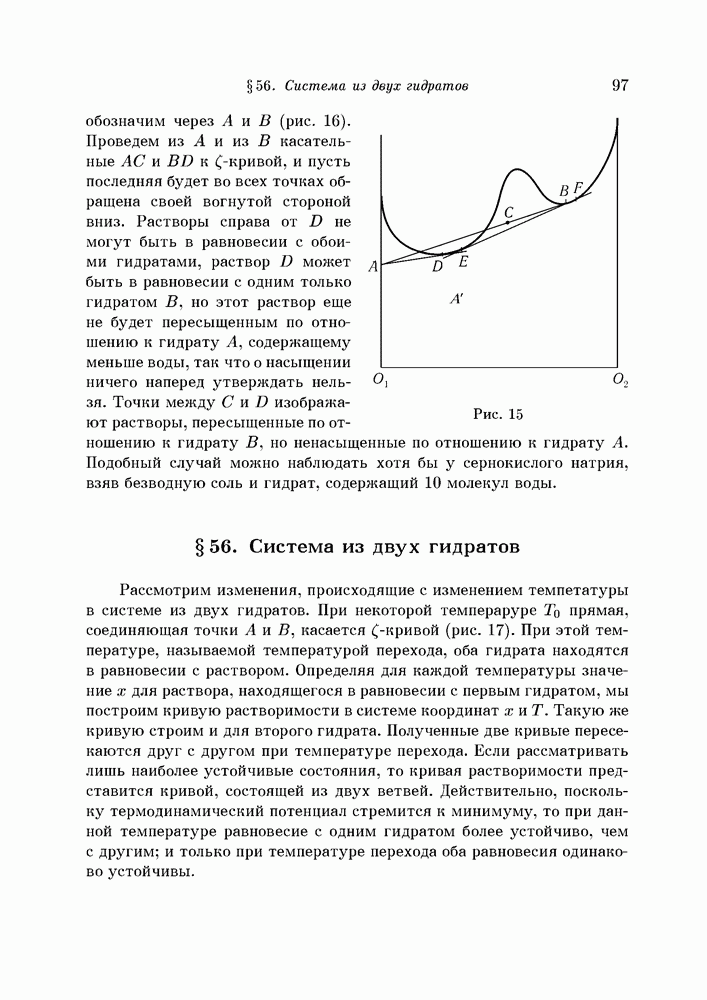
Сливая эти две жидкости, получаем два слоя, один из которых содержит больше воды, а другой — больше эфира. В подобных случаях  -кривая имеет две точки перегиба С и D. Точки кривой CBD нельзя осуществить на опыте, ибо однофазная система, вроде системы В, сразу же распадется на две фазы
-кривая имеет две точки перегиба С и D. Точки кривой CBD нельзя осуществить на опыте, ибо однофазная система, вроде системы В, сразу же распадется на две фазы  бесконечно близкие к В, а каждая из этих фаз распадется, в свою очередь, на две другие фазы, и этот процесс будет продолжаться до тех пор, пока не будет достигнуто состояние равновесия. Как это будет показано в дальнейшем, состояние равновесия будет достигнуто лишь в точке L, расположенной на прямой НК, общей касательной к
бесконечно близкие к В, а каждая из этих фаз распадется, в свою очередь, на две другие фазы, и этот процесс будет продолжаться до тех пор, пока не будет достигнуто состояние равновесия. Как это будет показано в дальнейшем, состояние равновесия будет достигнуто лишь в точке L, расположенной на прямой НК, общей касательной к  - кривой в точках Н и К. Участки
- кривой в точках Н и К. Участки  - кривой PC и QD, как уже было сказано в начале этого параграфа, изображают состояния устойчивого равновесия, а состояния между С и D, хотя и возможные с точки зрения молекулярной теории, — это состояния неустойчивого равновесия. Легко видеть, что все комплексы, изображаемые точками общей касательной НК, лежащими между Н и К, точно так же находятся в состоянии устойчивого равновесия, ибо невозможны процессы, выводящие из этих состояний и сопровождающиеся уменьшением термодинамического потенциала. Итак, Н и К — две жидкие фазы, которые могут находиться в равновесии друг с другом.
- кривой PC и QD, как уже было сказано в начале этого параграфа, изображают состояния устойчивого равновесия, а состояния между С и D, хотя и возможные с точки зрения молекулярной теории, — это состояния неустойчивого равновесия. Легко видеть, что все комплексы, изображаемые точками общей касательной НК, лежащими между Н и К, точно так же находятся в состоянии устойчивого равновесия, ибо невозможны процессы, выводящие из этих состояний и сопровождающиеся уменьшением термодинамического потенциала. Итак, Н и К — две жидкие фазы, которые могут находиться в равновесии друг с другом.
Но каковы точки, лежащие между точкой касания Н и точкой перегиба С, как, например, точка S? Однородная смесь, соответствующая этой точке, может перейти, с уменьшением термодинамического потенциала, в комплекс, состоящий из фаз Н и К. Однако, если состояние S может непрерывным образом перейти в состояние Н, то состояние К, напротив, не может быть достигнуто из S без некоторого скачка. Присутствие же хотя бы весьма малого количества фазы К превращает этот скачок в непрерывный процесс. В самом деле, соединим точку К рядом прямых со всеми точками  -кривой от
-кривой от  до
до  (рис. 12). Тогда при переходе одной части первоначальной системы S через все промежуточные состояния S,
(рис. 12). Тогда при переходе одной части первоначальной системы S через все промежуточные состояния S,  и т. д., от S к Н масса фазы К, присутствующей в системе с самого начала, будет расти непрерывным образом.
и т. д., от S к Н масса фазы К, присутствующей в системе с самого начала, будет расти непрерывным образом.

Рис. 12
Итак, точки, расположенные между точкой Н и точкой перегиба С, изображают состояния мало устойчивые; наиболее устойчивые состояния изображаются точками кривой PH, прямой НК и кривой КQ (рис. 11).
| << Предыдущий параграф | Следующий параграф >> |
- Предисловие редактора к первому изданию
- § 1. Основные понятия термодинамики
- § 2. Первое начало термодинамики
- § 3. Другой пример вычисления работы
- § 4. Приложение к идеальным газам
- § 5. Стационарный ток жидкости через трубу с переменным сечением
- § 6. Однородное тело
- § 7. Применение первого начала к химии: теплота реакции и температура
- § 8. Второе начало термодинамики
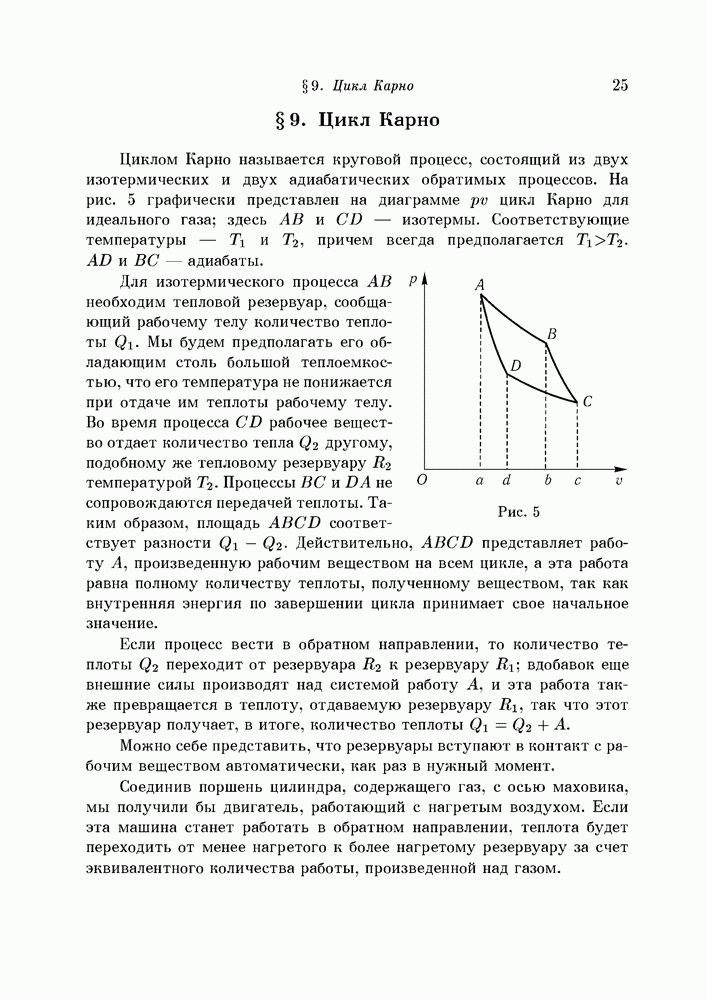
- § 9. Цикл Карно
- § 10. Коэффициент полезного действия. Универсальная функция температуры
- § 11. Другой способ определения универсальной функции температуры
- § 12. Второе начало для обратимых процессов
- § 13. Второе начало для обратимых процессов [общий случай]
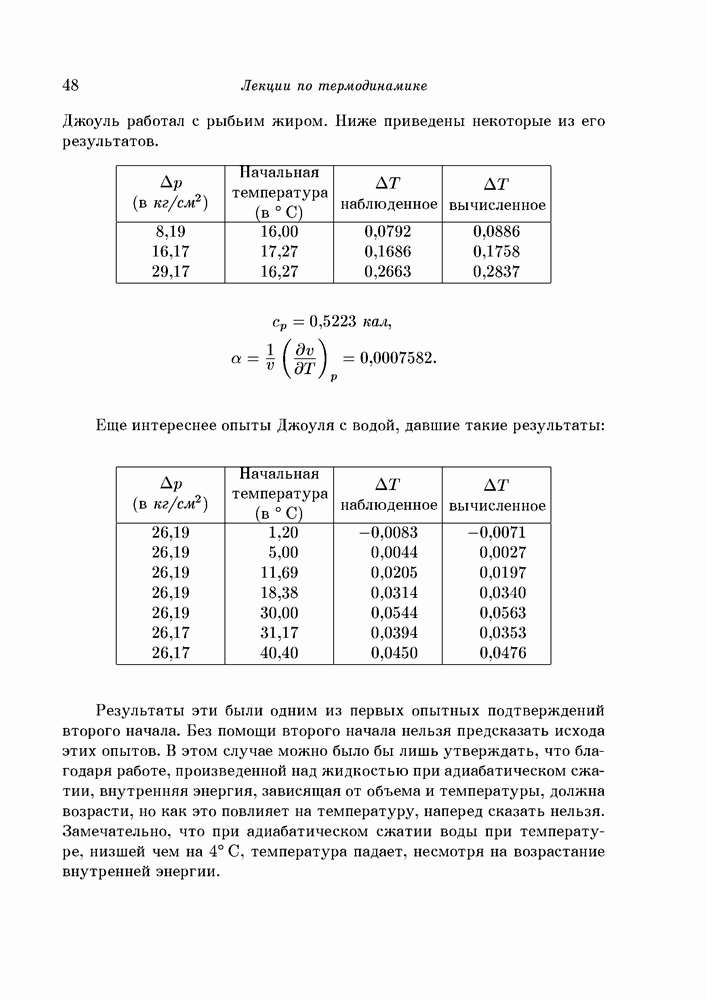
- § 14. Различные обратимые пути между двумя состояниями. Энтропия
- § 15. Несколько простейших приложений
- § 16. Отношение теплоемкостей
- § 17. Система с произвольным числом параметров
- § 18. Значение полученных общих формул
- § 19. Значение второго начала
- § 20. Приложения второго начала к адиабатическим процессам
- § 21. Сжатие жидкостей
- § 22. Опыты по адиабатическому растяжению проволок
- § 23. Непосредственный вывод уравнения адиабатических процессов
- § 24. Применение к жидким пленкам
- § 25. Применение к гальваническому элементу
- § 26. Уравнение Клапейрона
- § 27. Опытная проверка уравнения Клапейрона (Клаузиус)
- § 28. Опыты де-Виссера с уксусной кислотой
- § 29. Режеляция льда
- § 30. Закон Стефана-Больцмана
- § 31. Другие выражения второго начала
- § 32. Свойства энтропии
- § 33. Свободная энергия
- § 34. Термодинамический потенциал
- § 35. Свободная энергия идеального газа
- § 36. Неравновесные состояния
- § 37. Необратимые процессы
- § 38. Изотермический процесс
- § 39. Свободная энергия и работа
- § 40. Обобщенные силы
- § 41. Условия равновесия
- § 42. Система в поле консервативных сил
- § 43. Газ или жидкость в поле силы тяжести
- § 44. Решение того же вопроса с помощью энтропии
- § 45. Система жидкость-пар
- § 46. Равновесие трехфазной системы
- § 47. Упругость пара над разбавленным раствором
- § 48. Различие в давлении пара над чистой водой и над раствором
- § 49. Смеси
- § 50. Двухкомпонентная система
- § 51. Устойчивые и неустойчивые жидкие фазы; равновесие между двумя жидкими фазами
- § 52. Равновесие между твердой и жидкой фазами; переохлаждение
- § 53. Равновесие трехфазной системы, состоящей из двух компонент
- § 54. Равновесие раствора соли с ее твердым гидратом
- § 55. Равновесие между двумя растворами различной концентрации
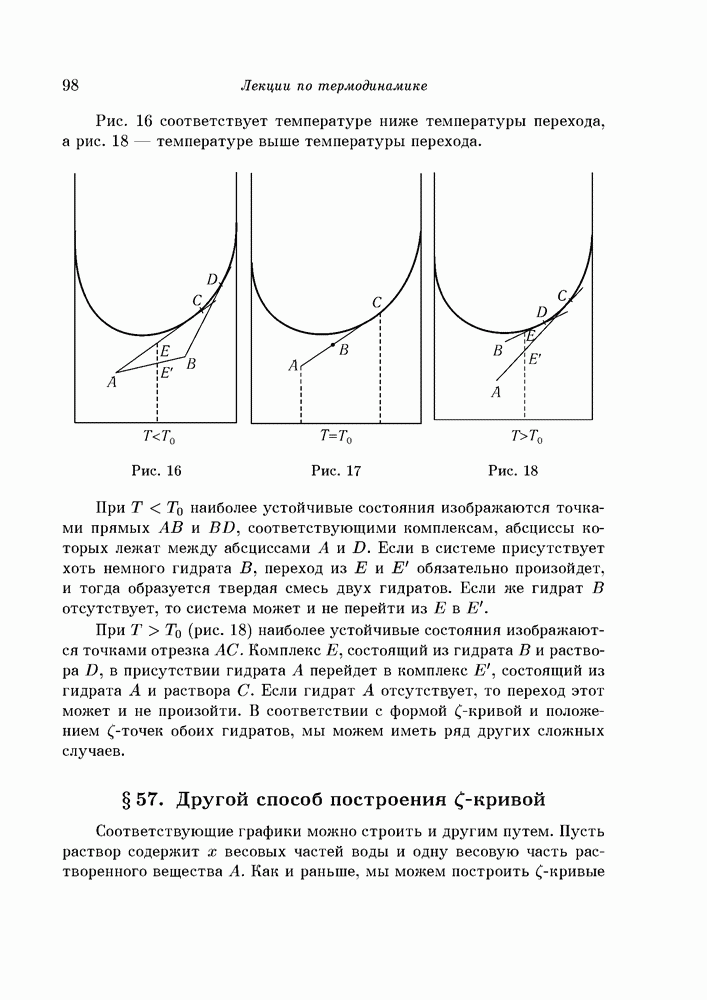
- § 56. Система из двух гидратов
- § 57. Другой способ построения кривой
- § 58. Трехкомпонентные системы
- § 59. Трехфазная система из трех компонент
- § 60. Форма поверхности
- § 61. Условия равновесия между твердой и жидкой фазами
- § 62. Равновесие двух твердых фаз с жидкими фазами
- § 63. Равновесие между двумя жидкими фазами
- § 64. Другие способы построения поверхности
- § 65. Смешанные кристаллы
- § 66. Равновесие между смесями и растворами
- § 67. Неопределенность в выражении термодинамического потенциала
- § 68. Смесь газов в поле силы тяжести
- § 69. Смешение и разделение двух газов
- § 70. Парадокс Гиббса
- § 71. Обобщение теоремы Гиббса на случай трех и более газов
- § 72. Уменьшение свободной энергии при смешении двух газов
- § 73. Свободная энергия жидкой смеси
- § 74. Общее выражение для свободной энергии смеси
- § 75. Случай, когда одна из компонент присутствует в весьма малом количестве
- § 76. Равновесие двух фаз, каждая из которых состоит из двух компонент
- § 77. Смесь под действием внешних сил
- § 78. Вывод уравнений равновесия
- § 79. Второй пример системы под действием внешних сил
- § 80. Осмотическое давление. Закон вант-Гоффа
- § 81. Другой вывод закона вант-Гоффа
- § 82. Общие условия равновесия многофазных систем
- § 83. Равновесие трех фаз
- § 84. Вывод условий равновесия с помощью термодинамического потенциала
- § 85. Число независимых условий равновесия
- § 86. Сравнение между собой двух состояний равновесия
- § 87. Общее соотношение между двумя состояниями равновесия
- § 88. Смысл полученного соотношения
- § 89. Добавление некоторого весьма малого количества новой компоненты
- § 90. Несколько заключительных замечаний
- § 91. Диссоциация газа
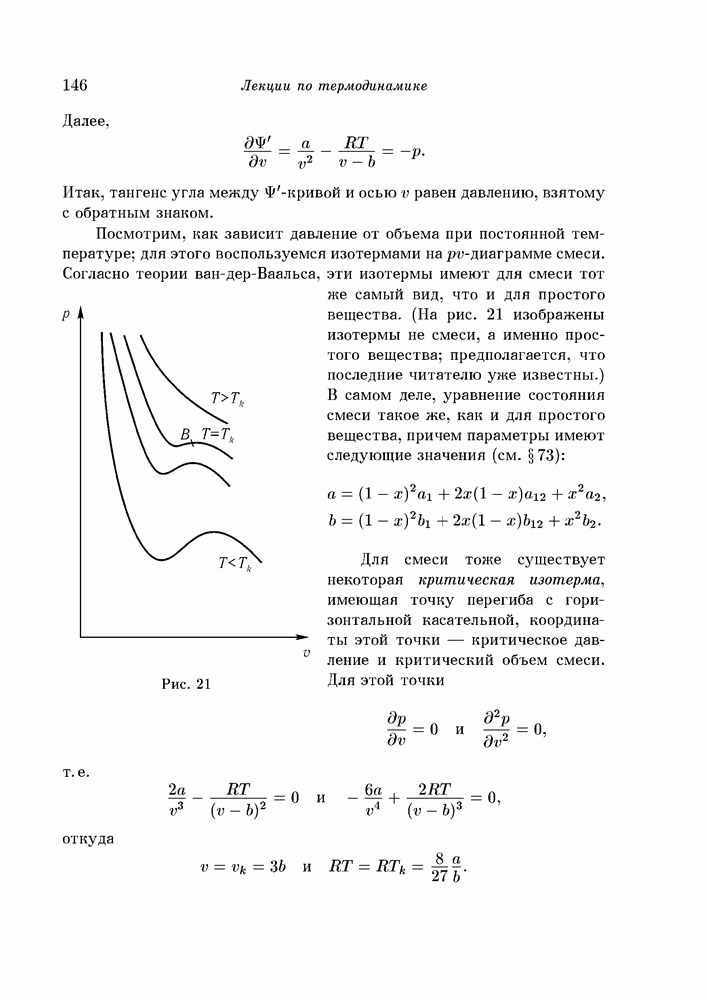
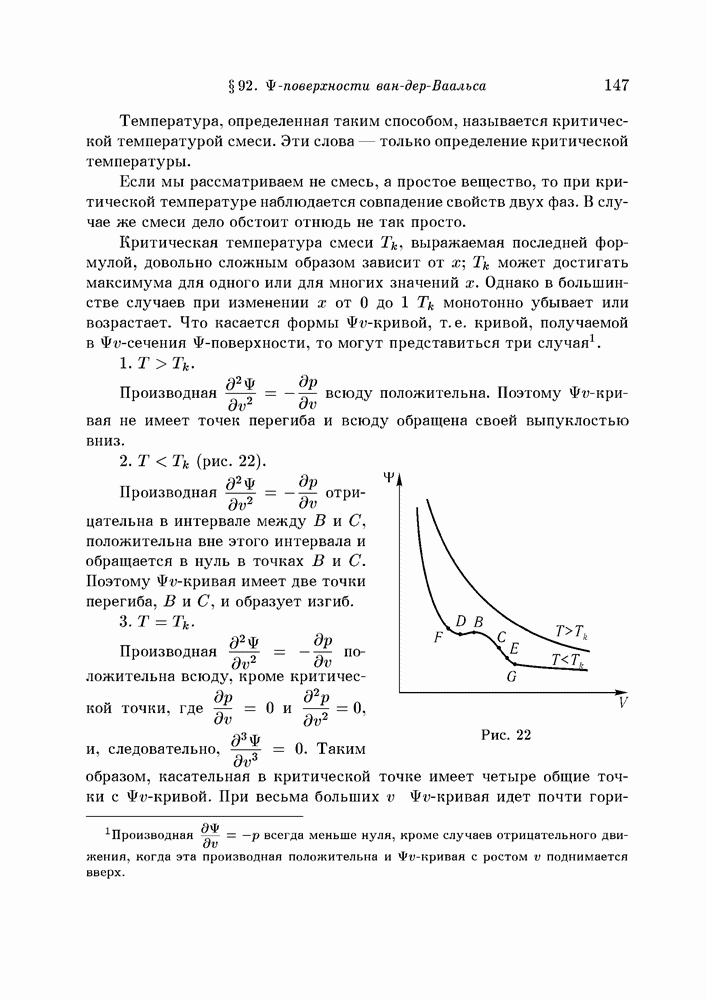
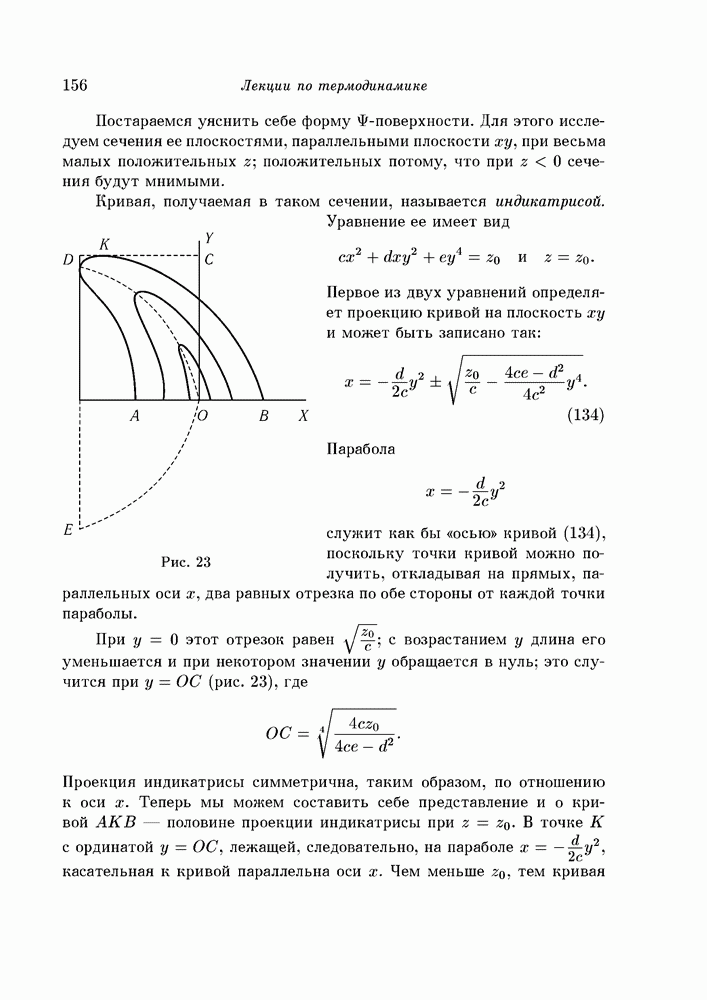
- § 92. поверхности ван-дер-Ваальса
- § 93. Изменение формы поверхности с температурой
- § 94. Сечения Ф-поверхности
- § 95. Условия равновесия
- § 96. Сосуществующие фазы
- § 97. Математическая теория конечных точек складки
- § 98. Исследование Ф-поверхности в окрестности конечной точки складки
- § 99. Конечная точка складки первого рода
- § 100. Индикатриса, бинодаль и спинодаль
- § 101. Определение координат конечной точки складки непосредственно из самого уравнения Ф-поверхности
- § 102. Кривая конечных точек складки
- § 103. Изменение давления при бесконечно малом изменении состояния
- § 104. Зависимость давления от состава смеси
- § 105. Изобары
- § 106. Изотермическое сжатие смесей
- § 107. Обратная конденсация