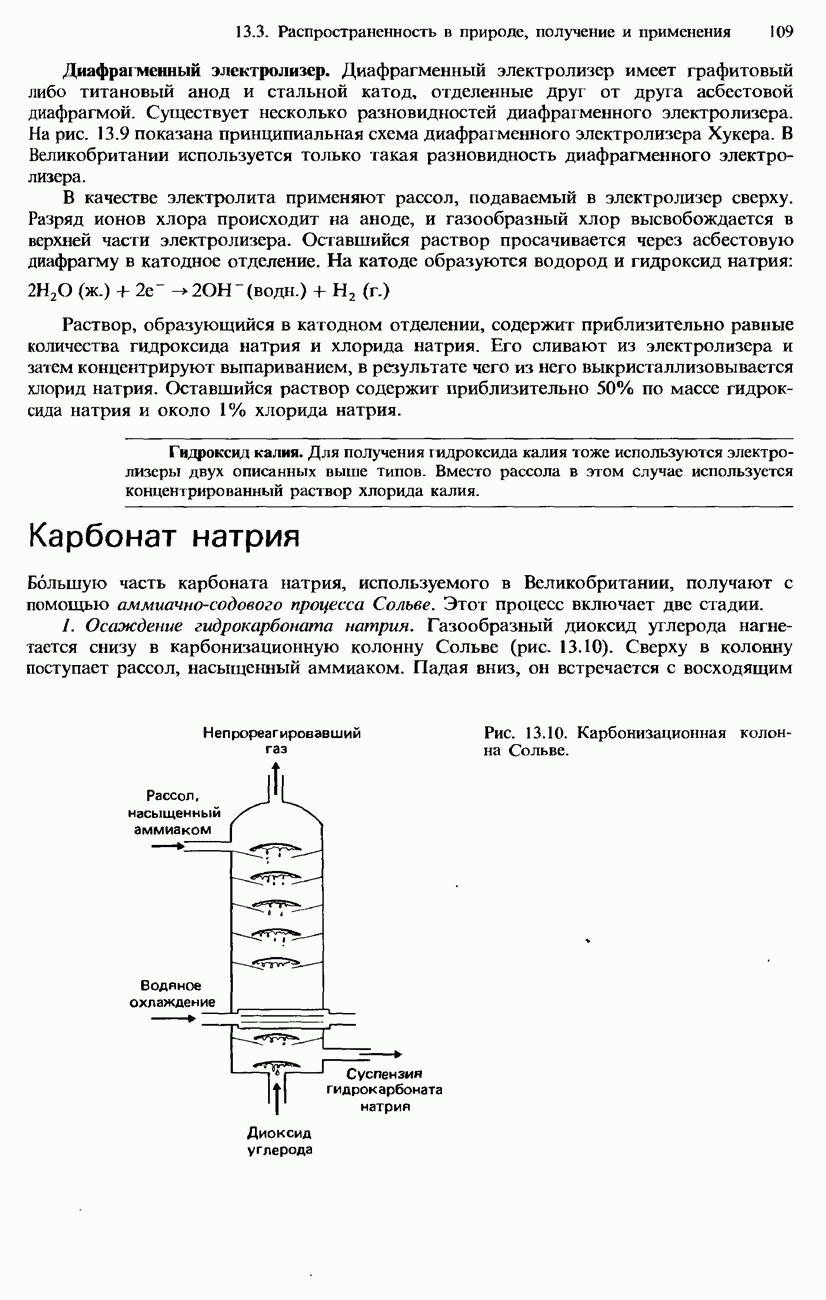
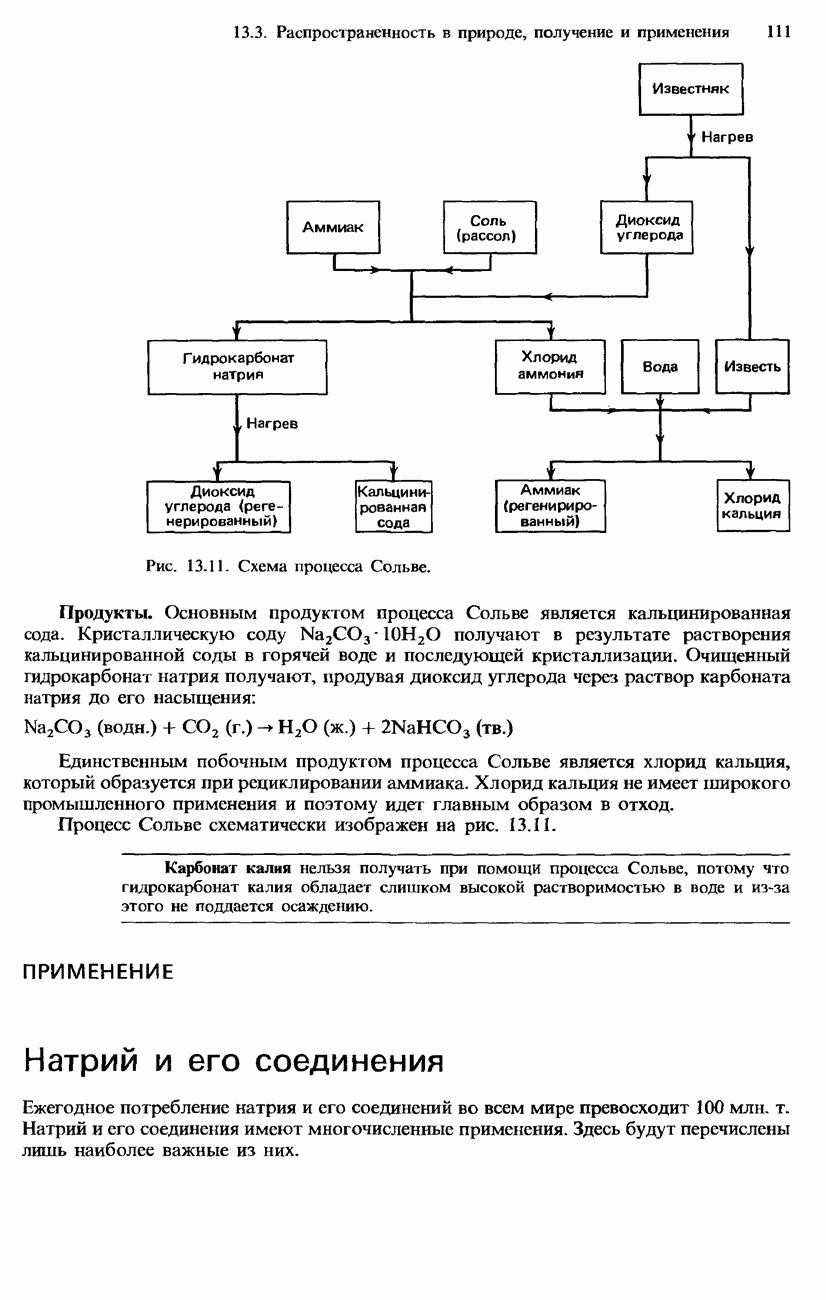
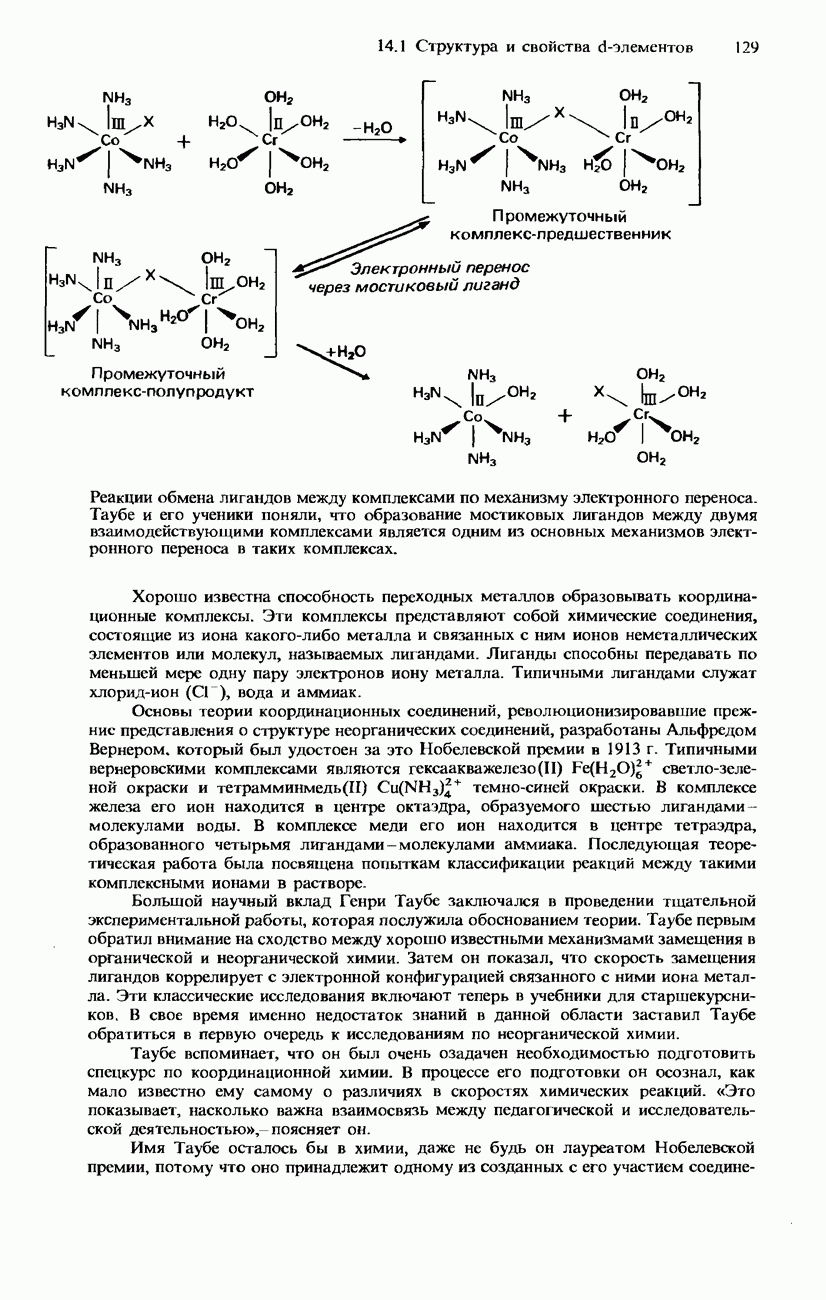
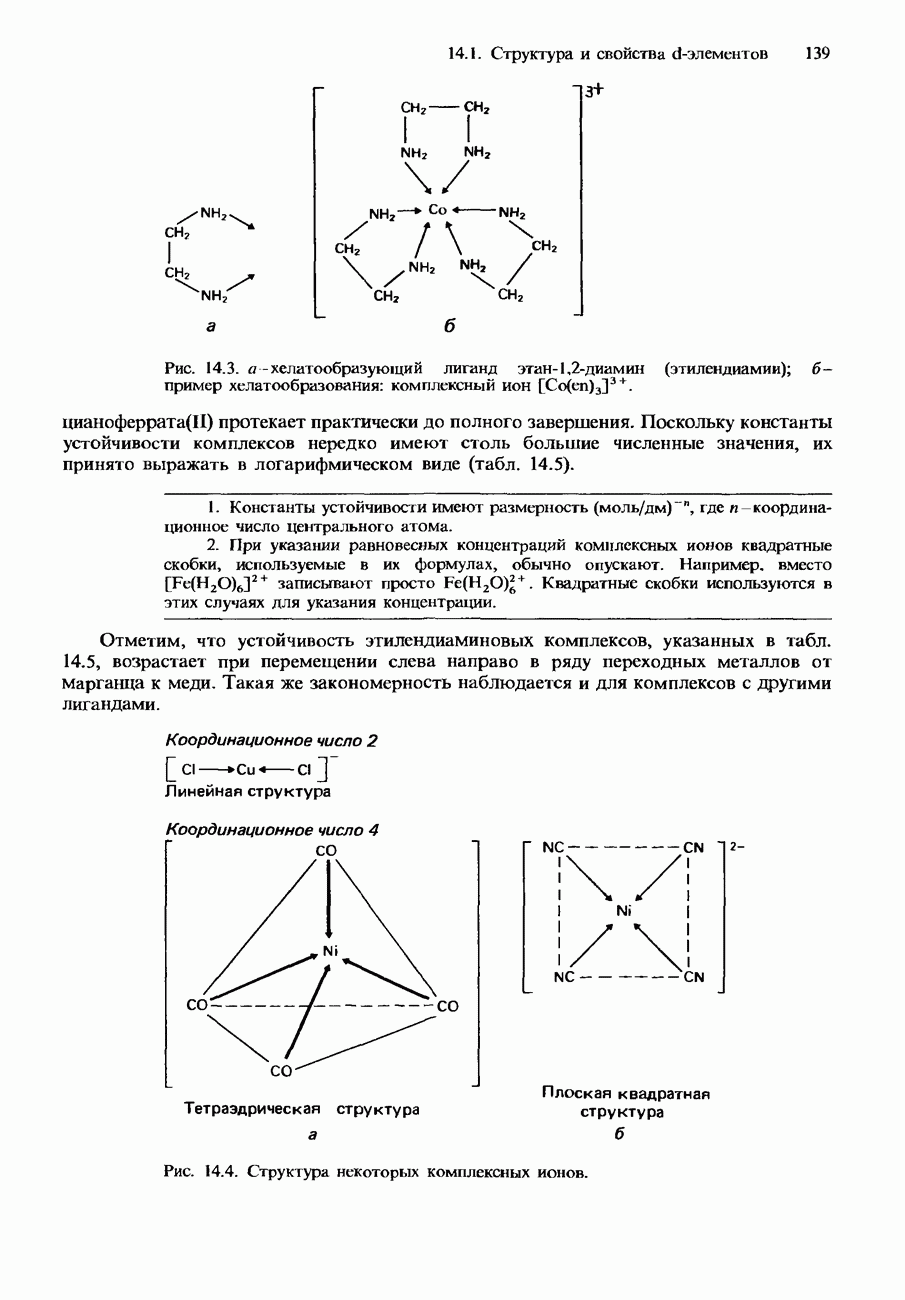
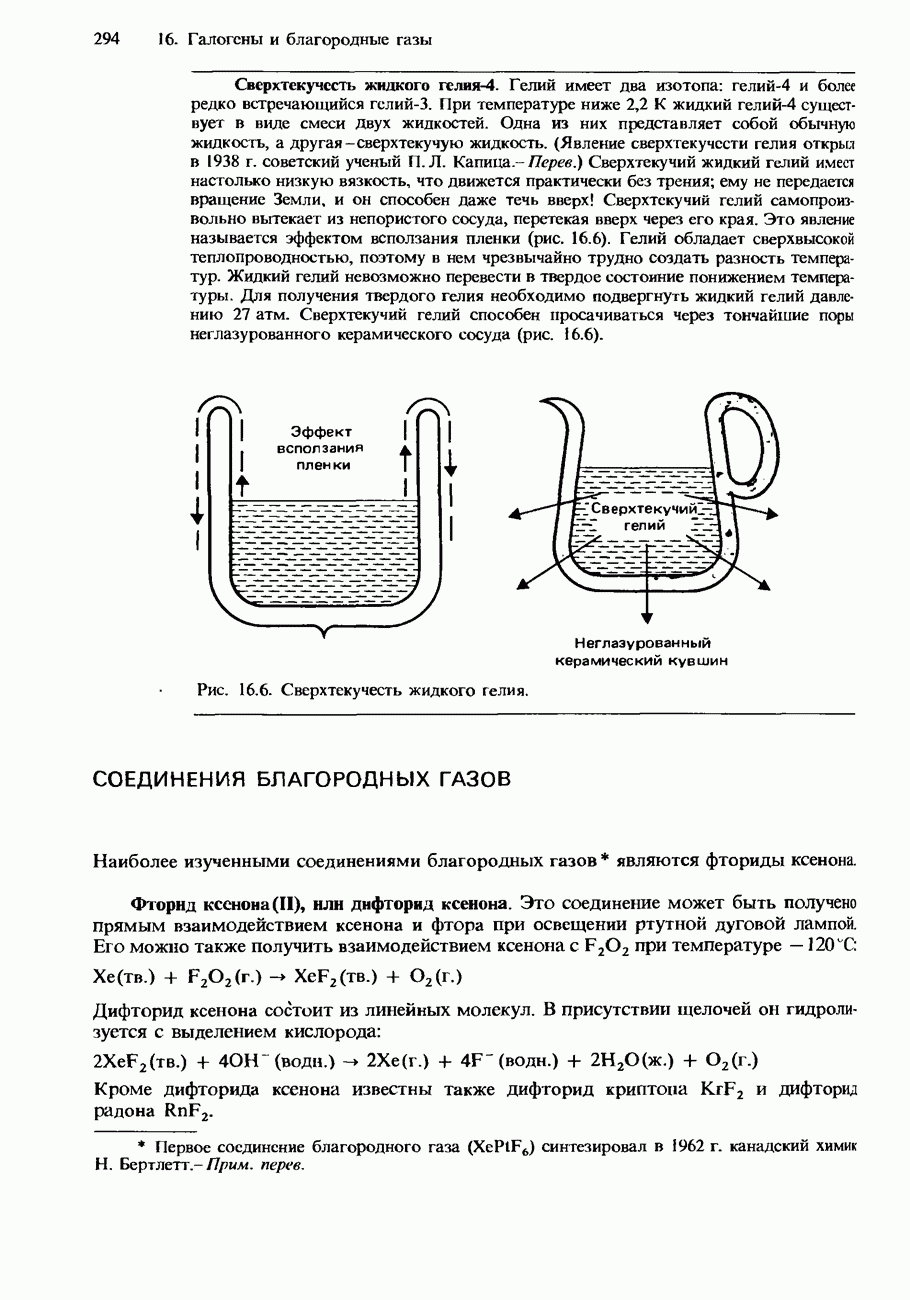
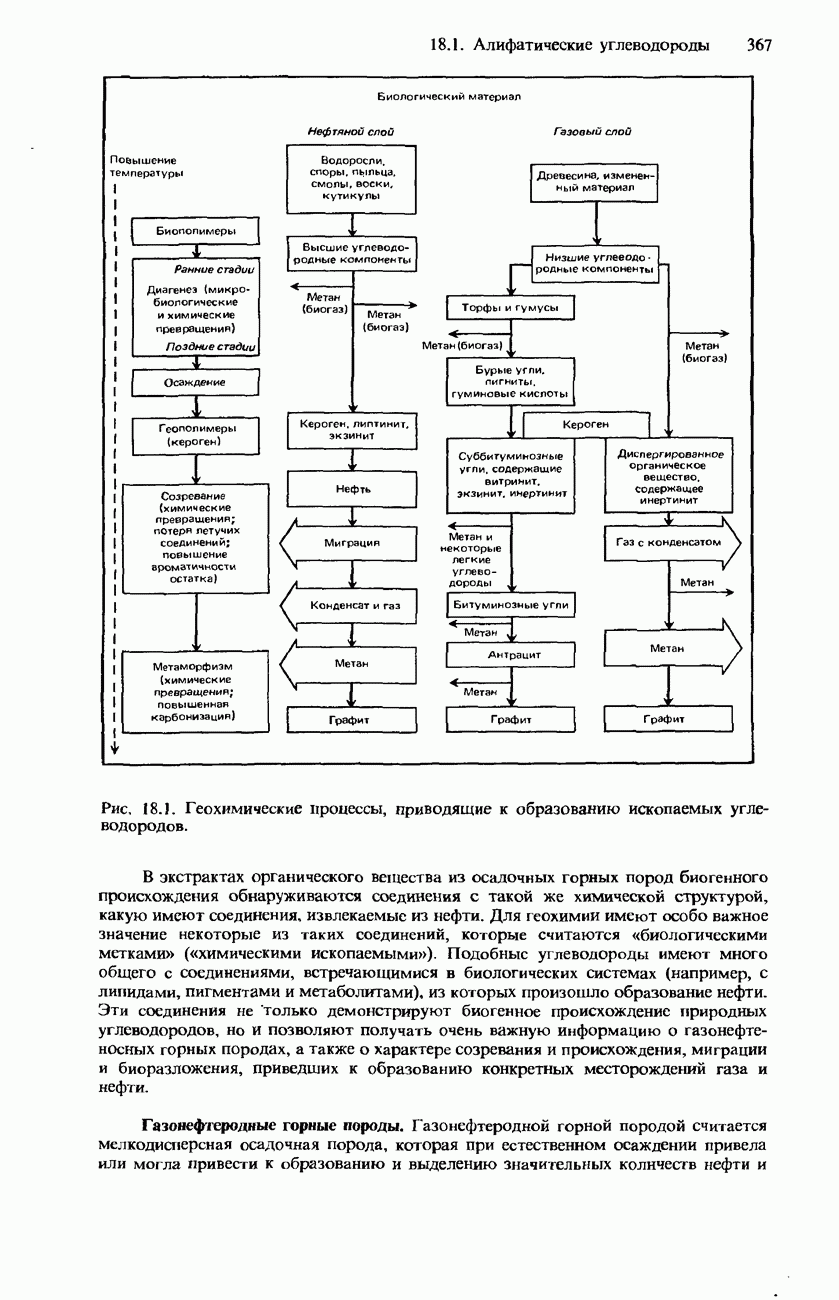
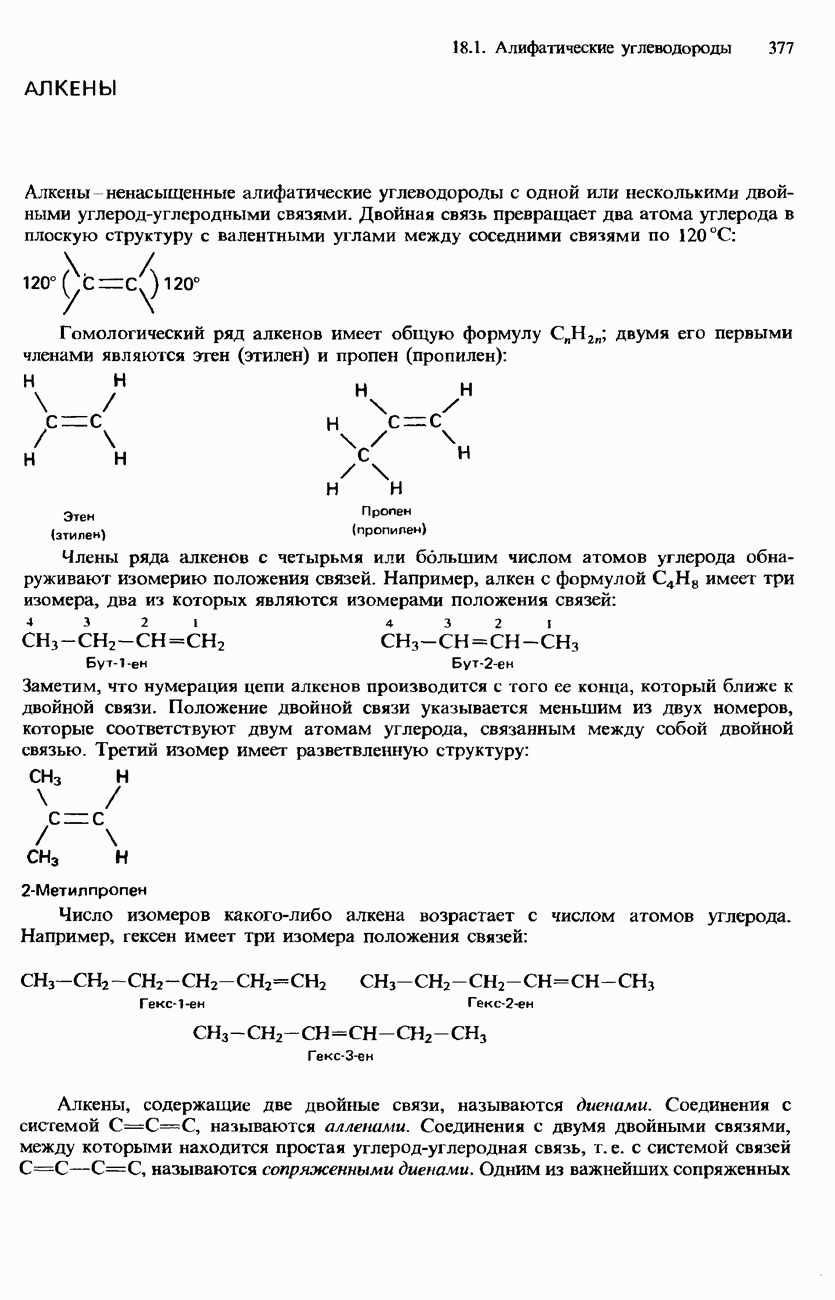
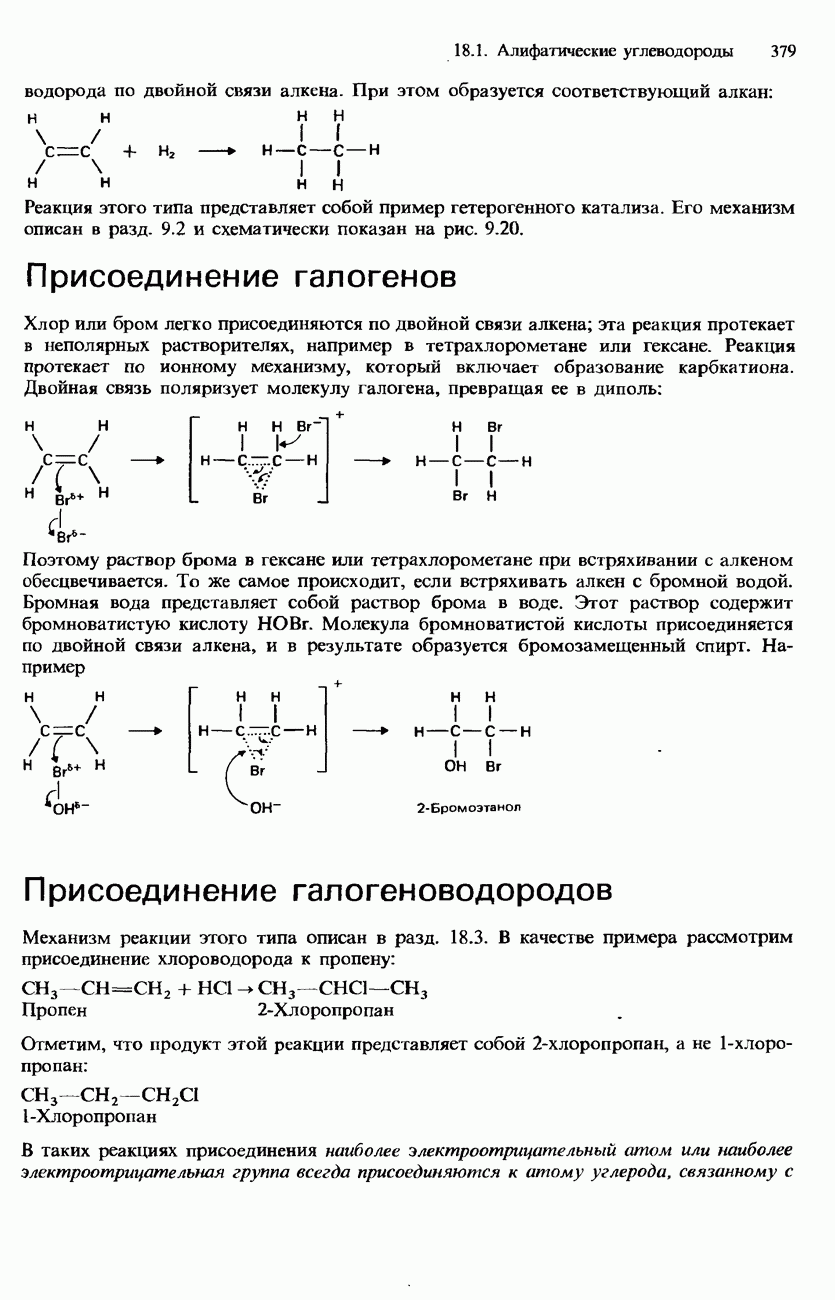
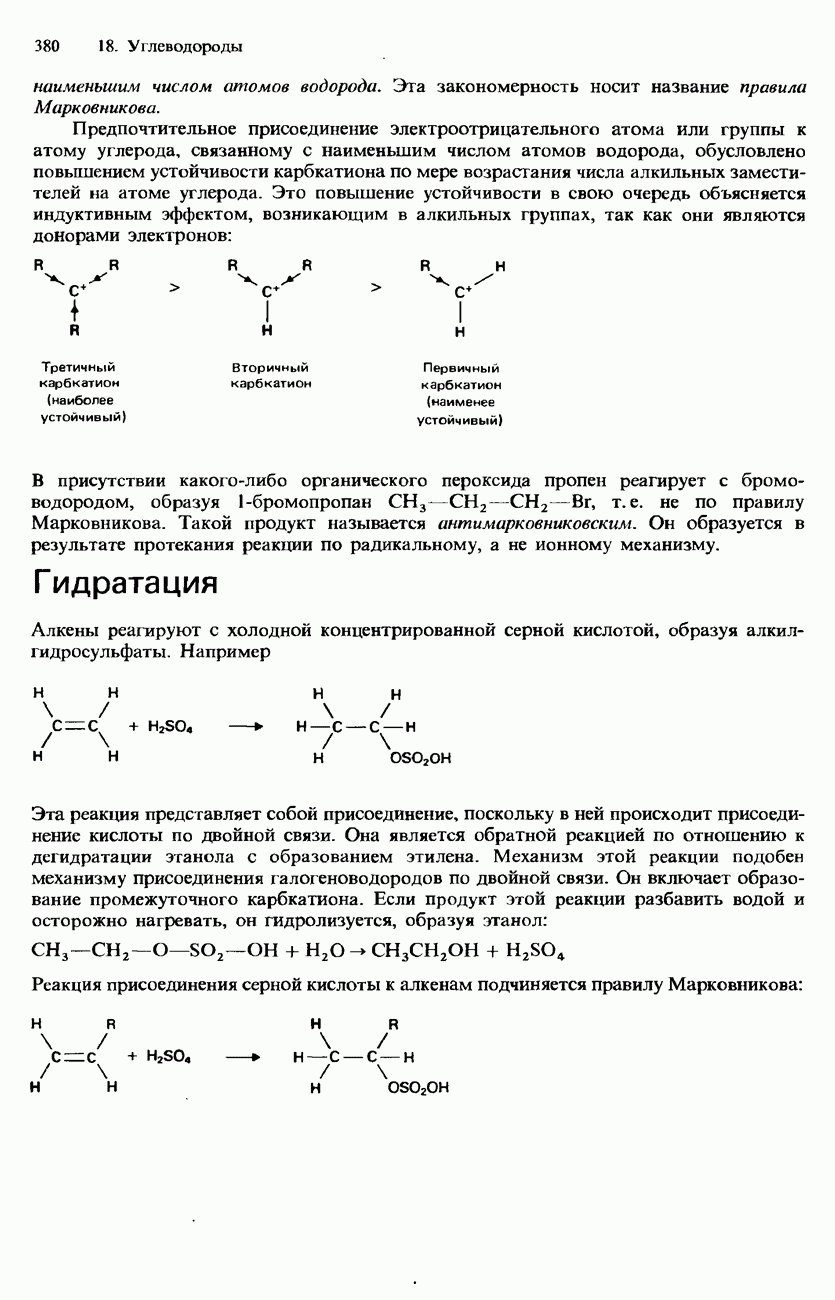
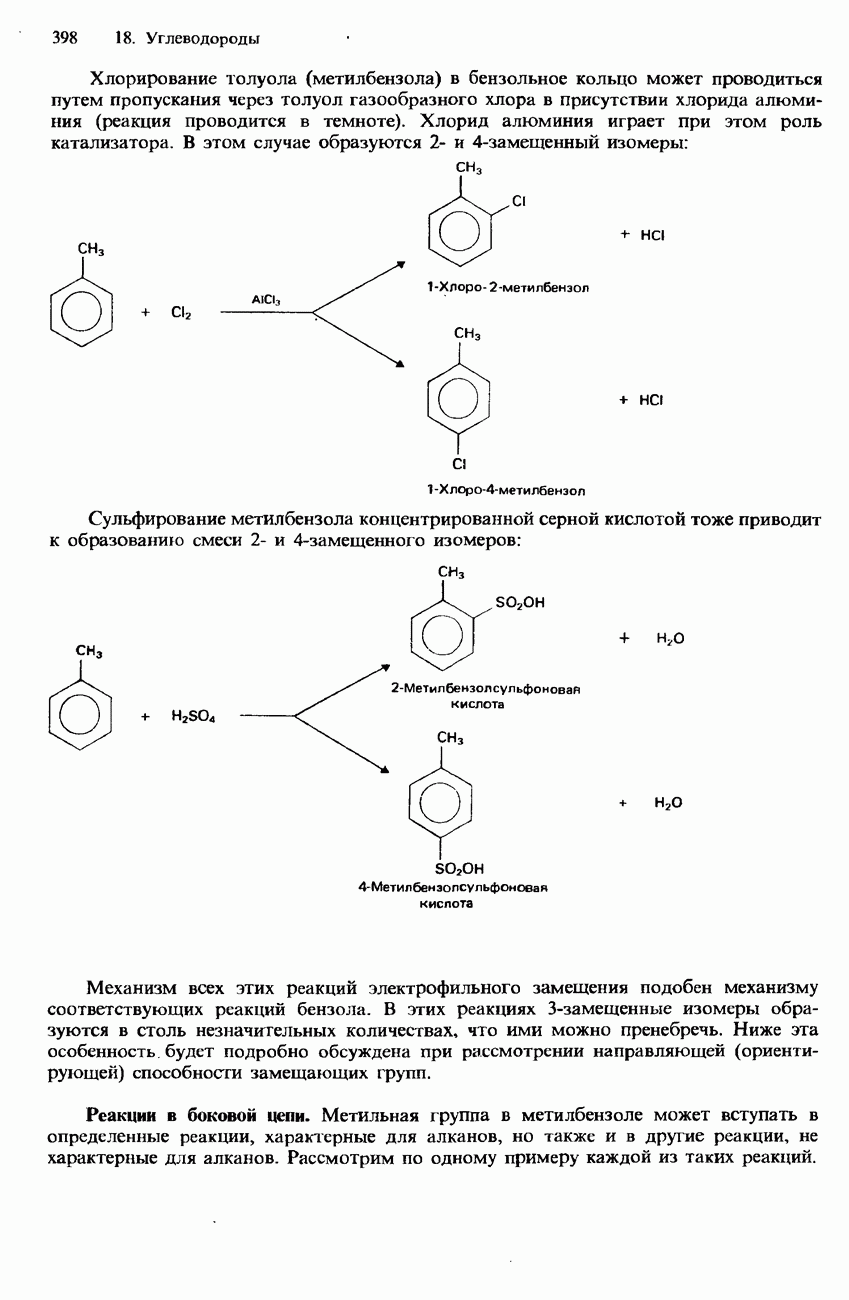
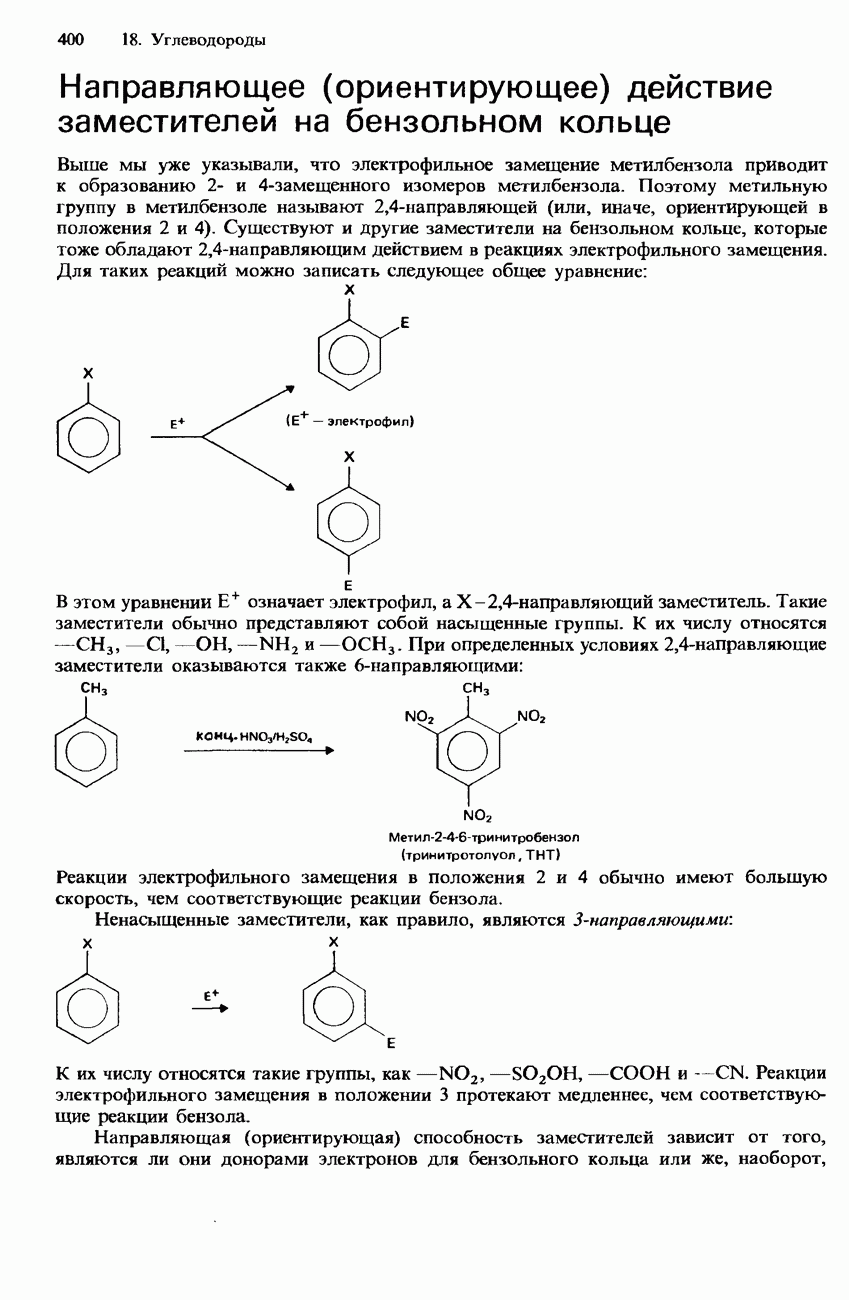
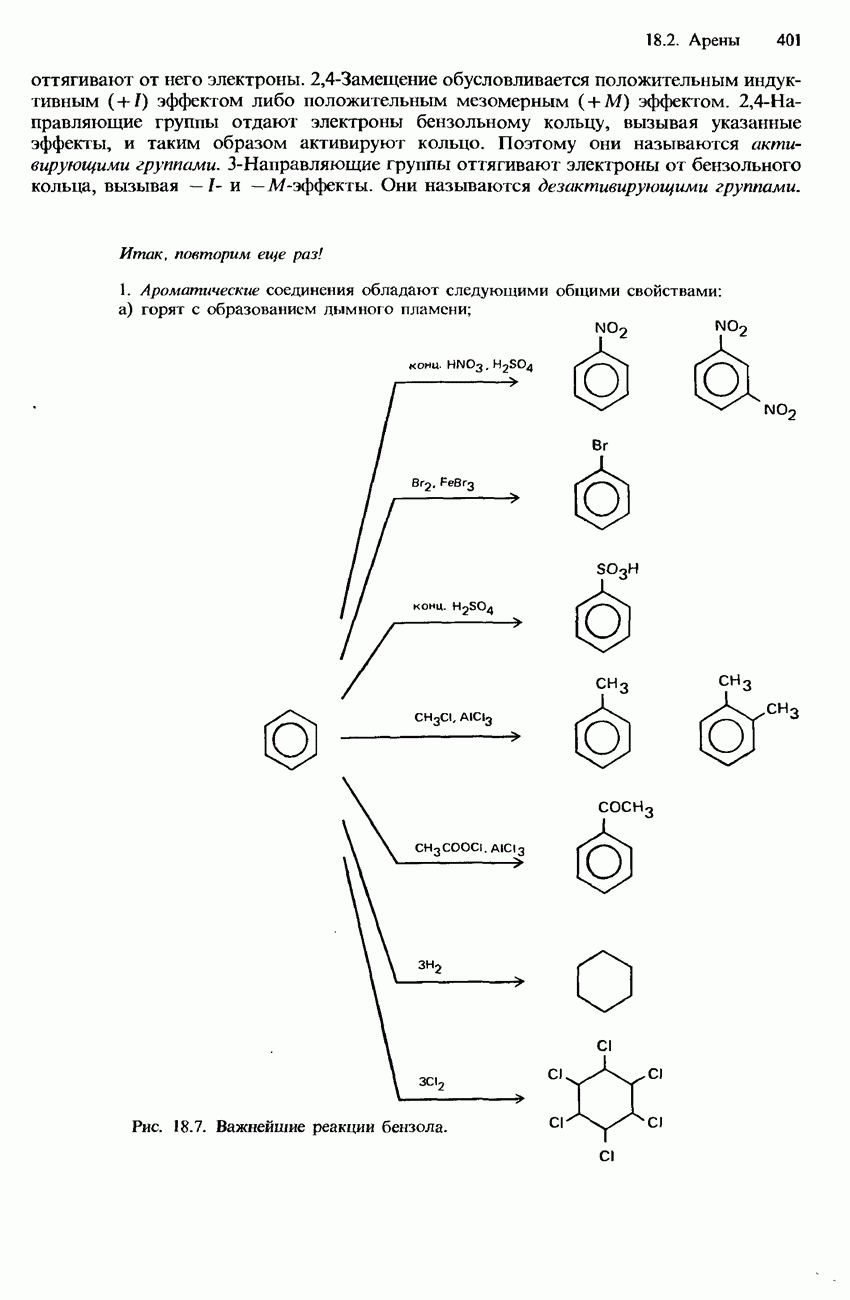
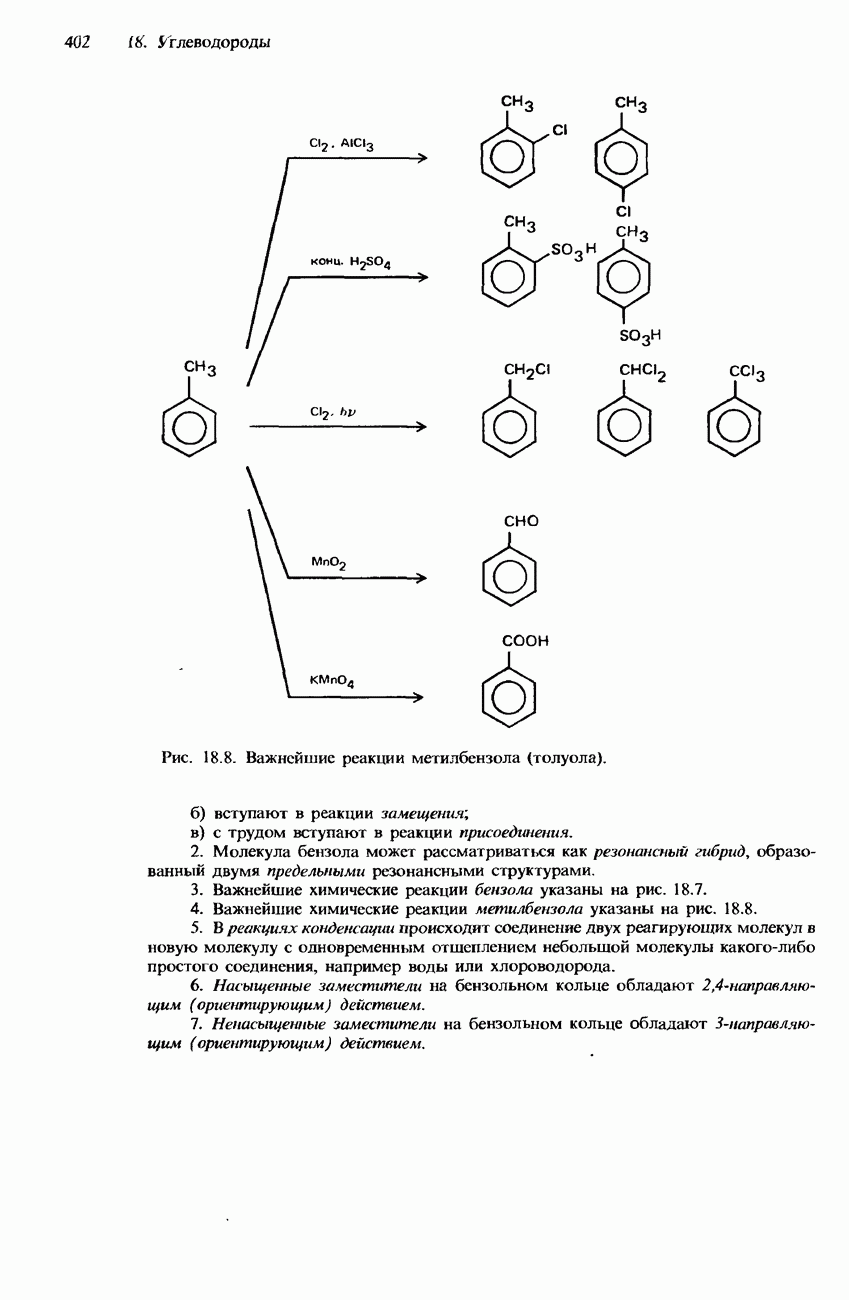
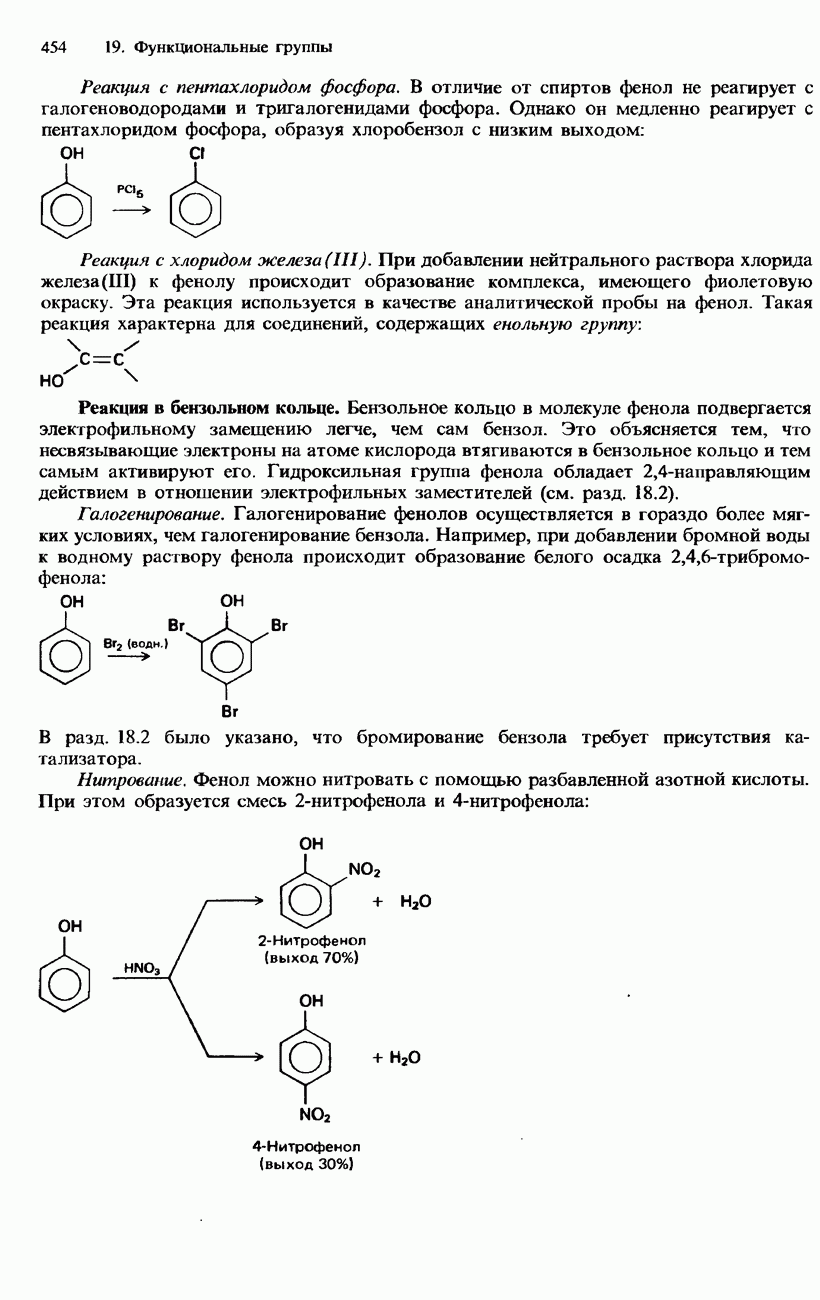
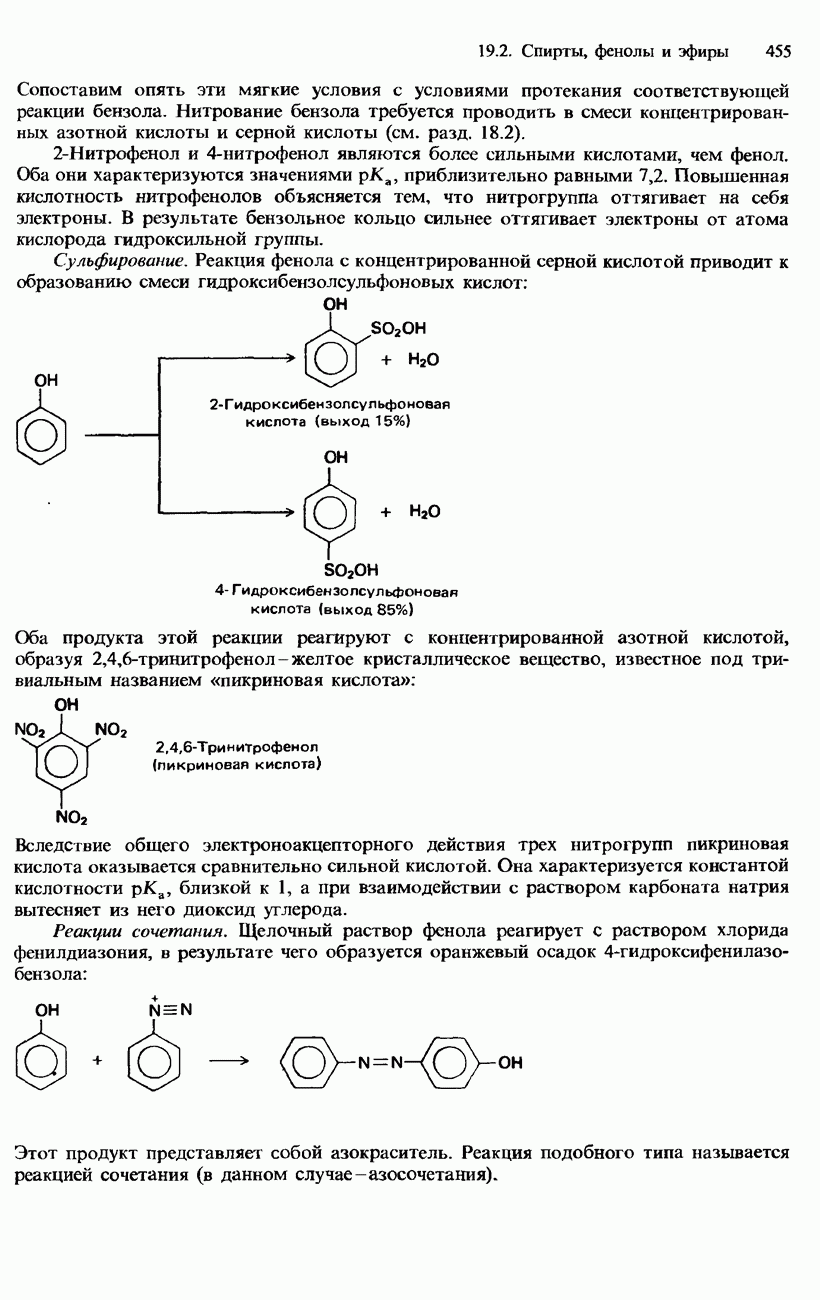
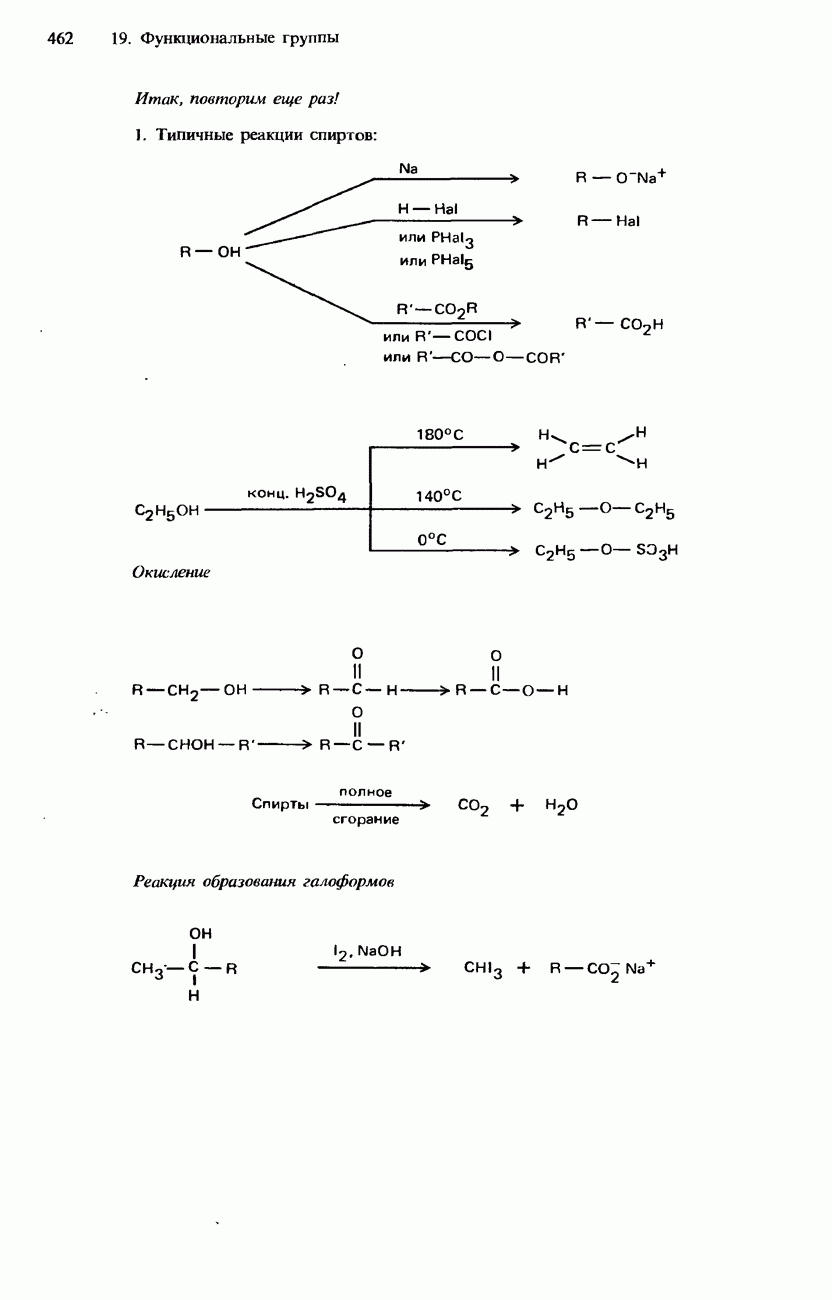
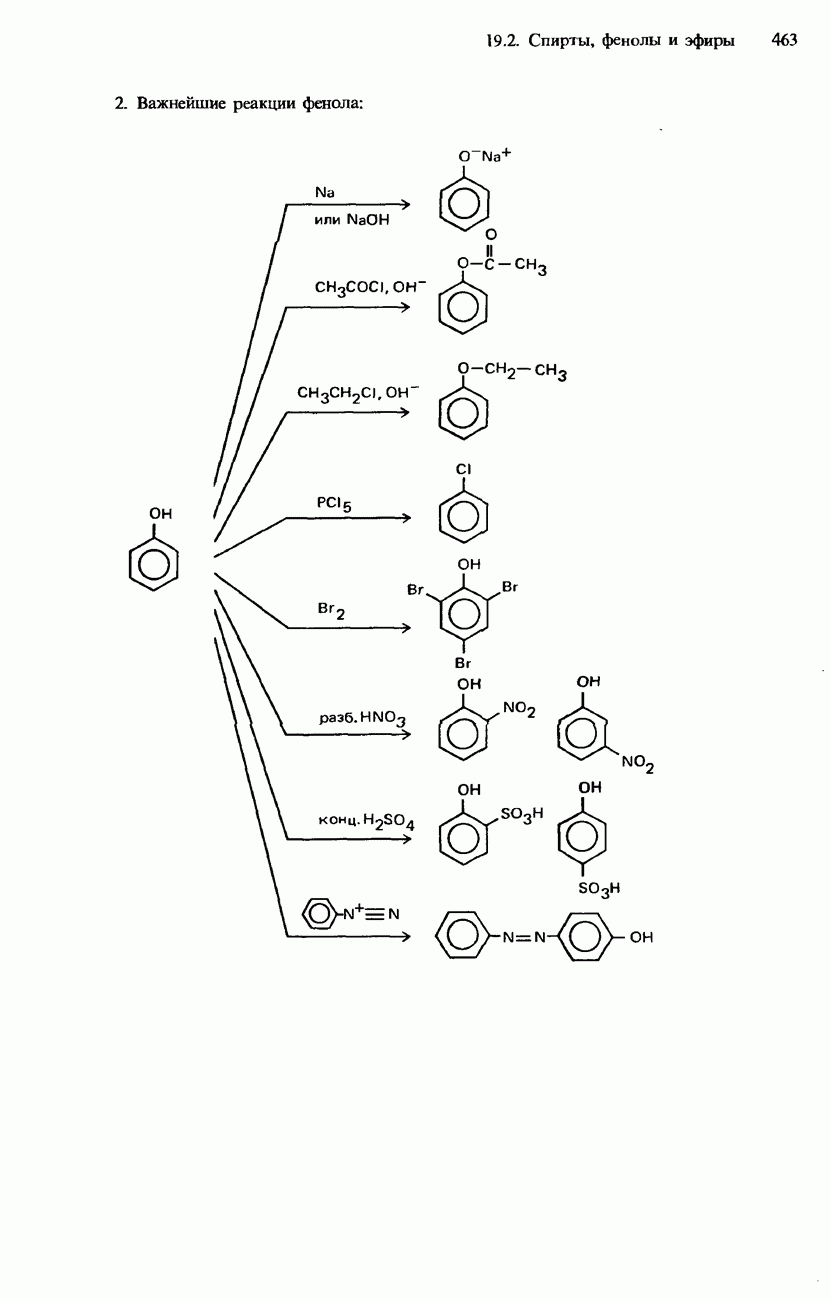
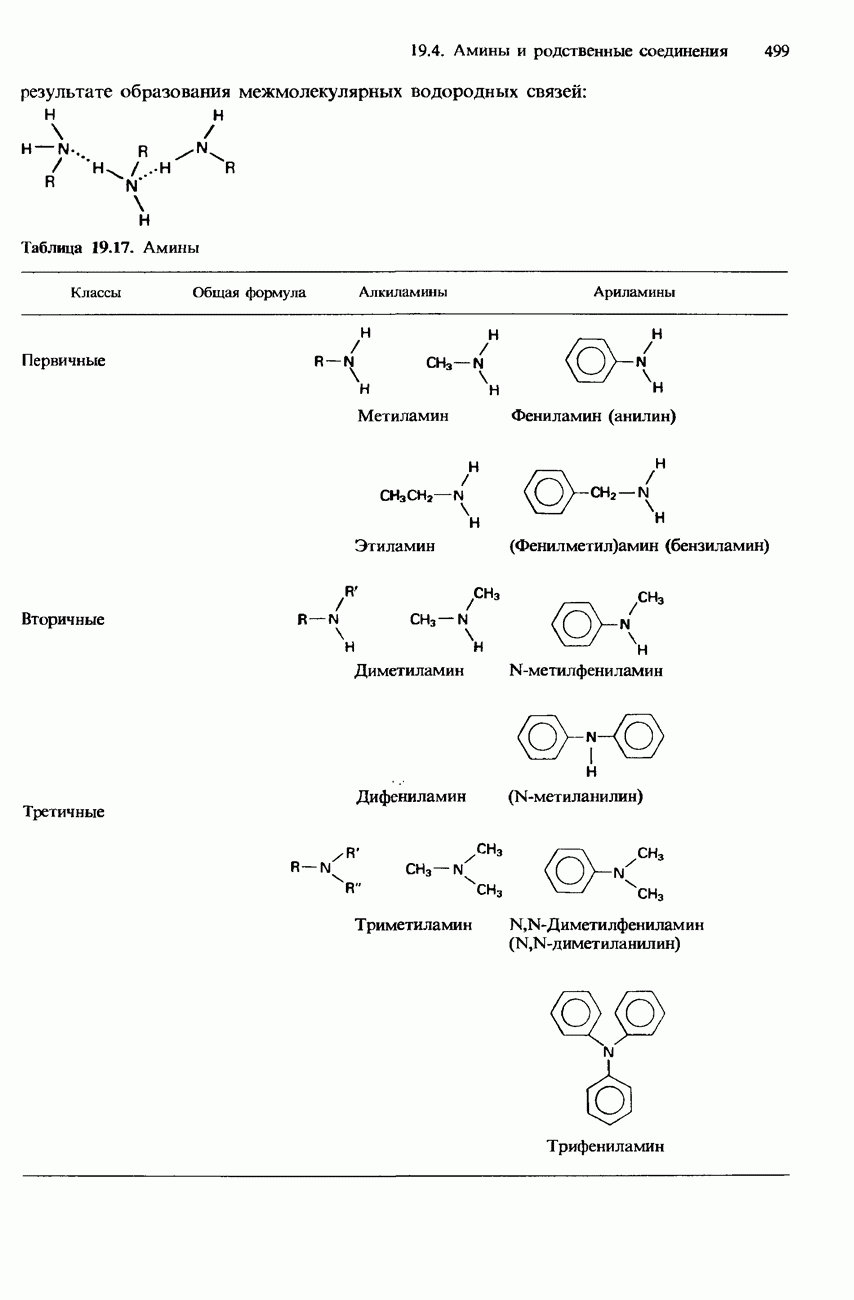
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА
Изотопы
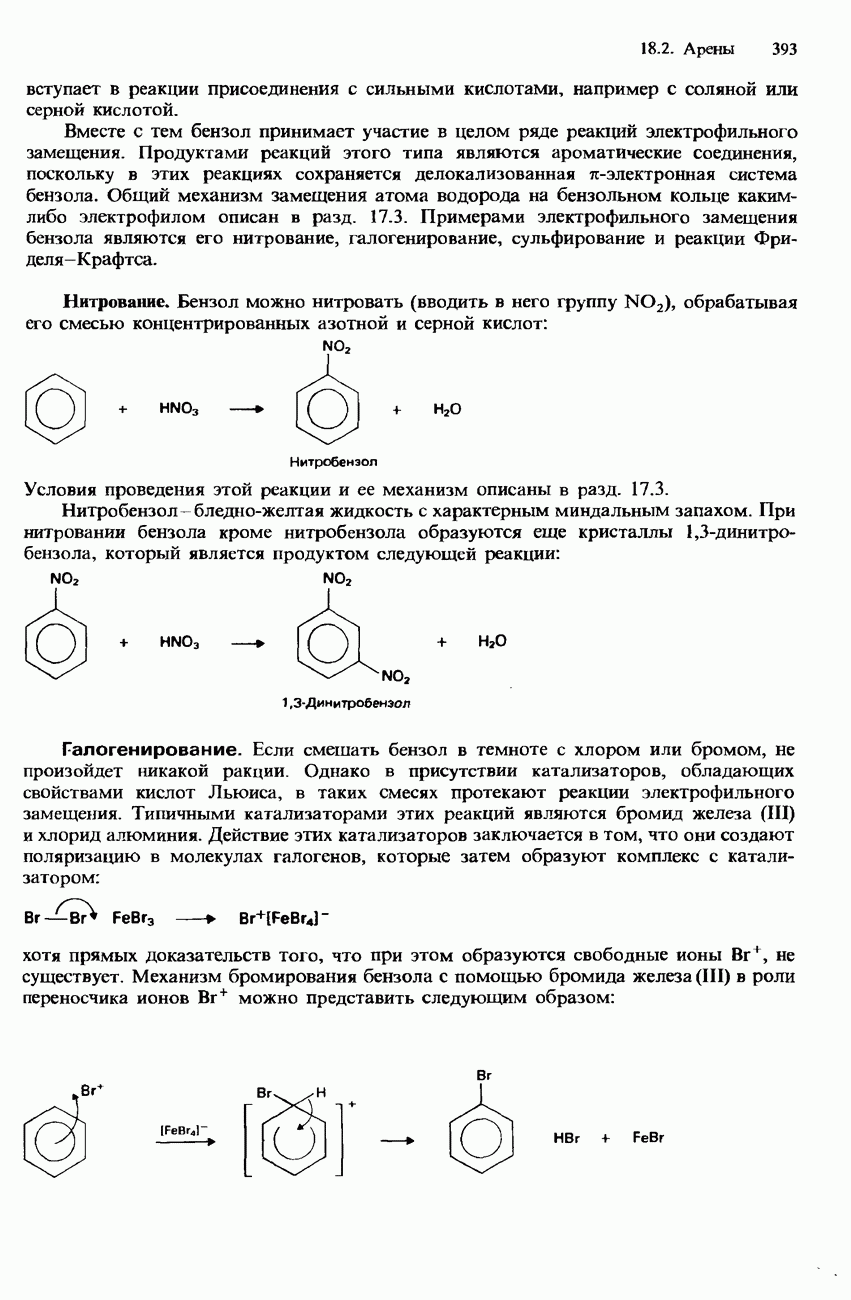
Существуют три изотопные формы водорода: протий  дейтерий
дейтерий  и тритий
и тритий  разд. 1.1 и 4.1). В природном водороде содержится 99,985% изотопа
разд. 1.1 и 4.1). В природном водороде содержится 99,985% изотопа  , остальные 0,015% приходятся на долю дейтерия. Тритий представляет собой неустойчивый радиоактивный изотоп и поэтому встречается лишь в виде следов. Он испускает Р-частицы и имеет период полураспада 12,3 года (см. разд. 1.3).
, остальные 0,015% приходятся на долю дейтерия. Тритий представляет собой неустойчивый радиоактивный изотоп и поэтому встречается лишь в виде следов. Он испускает Р-частицы и имеет период полураспада 12,3 года (см. разд. 1.3).
Все изотопные формы водорода обладают практически одинаковыми химическими свойствами. Однако они различаются по физическим свойствам. В табл. 12.4 указаны некоторые физические свойства водорода и дейтерия.
Таблица 12.4. Физические свойства 

Для каждого соединения водорода существует его дейтериевый аналог. Важнейшим из них является оксид дейтерия  так называемая тяжелая вода. Она используется в качестве замедлителя в ядерных реакторах некоторых типов (см. разд. 1.3).
так называемая тяжелая вода. Она используется в качестве замедлителя в ядерных реакторах некоторых типов (см. разд. 1.3).
Оксид дейтерия получают электролизом воды. По мере того как на катоде происходит выделение  остающаяся вода обогащается оксидом дейтерия. В среднем этот метод позволяет получать из 100 л воды
остающаяся вода обогащается оксидом дейтерия. В среднем этот метод позволяет получать из 100 л воды  .
.
Другие соединения дейтерия обычно получают из оксида дейтерия, например

Атомарный водород
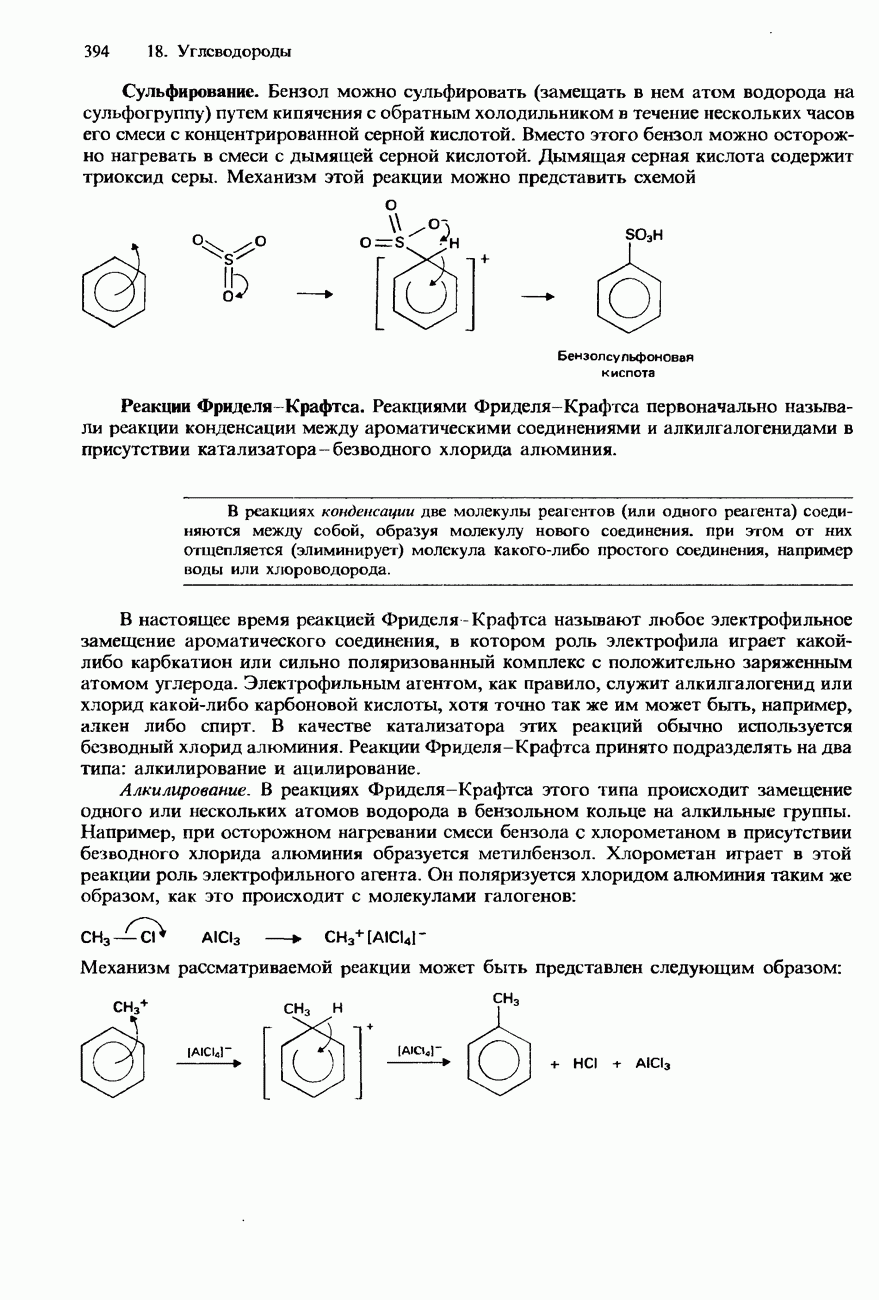
Водород, получаемый описанными выше лабораторными методами, во всех случаях представляет собой газ, состоящий из двухатомных молекул  , т. е. молекулярный водород. Его можно диссоциировать на агомы, используя какой-либо источник высокой энергии, например газоразрядную трубку, содержащую водород при низком давлении. Водород можно также атомизировать в электрической дуге, образуемой между вольфрамовыми электродами. Атомы водорода рекомбинируют на поверхности металла, и при этом выделяется столь большая энергия, что это приводит к
, т. е. молекулярный водород. Его можно диссоциировать на агомы, используя какой-либо источник высокой энергии, например газоразрядную трубку, содержащую водород при низком давлении. Водород можно также атомизировать в электрической дуге, образуемой между вольфрамовыми электродами. Атомы водорода рекомбинируют на поверхности металла, и при этом выделяется столь большая энергия, что это приводит к
повышению температуры приблизительно до 3500°С. Этот эффект используется для водородно-дуговой сварки металлов.
Атомарный водород - сильный восстановитель. Он восстанавливает оксиды и хлориды металлов до свободных металлов.
Водород в момент выделения
Газообразный водород, т. е. молекулярный водород, является плохим восстановителем. Это обусловлено его большой энергией связи, равной  Например, при пропускании газообразного водорода через раствор, содержащий ионы
Например, при пропускании газообразного водорода через раствор, содержащий ионы  их восстановления не происходит. Однако, если образование водорода происходит непосредственно в растворе, содержащем ионы
их восстановления не происходит. Однако, если образование водорода происходит непосредственно в растворе, содержащем ионы  эти ионы немедленно восстанавливаются в ионы
эти ионы немедленно восстанавливаются в ионы 

Для того чтобы водород образовывался непосредственно в растворе, содержащем ионы  туда добавляют разбавленную серную кислоту и цинк. Водород, образующийся в таких условиях, называют водород в момент выделения
туда добавляют разбавленную серную кислоту и цинк. Водород, образующийся в таких условиях, называют водород в момент выделения 
Ортоводород и параводород
Два протона в молекуле водорода  связаны между собой двумя
связаны между собой двумя  , находящимися на
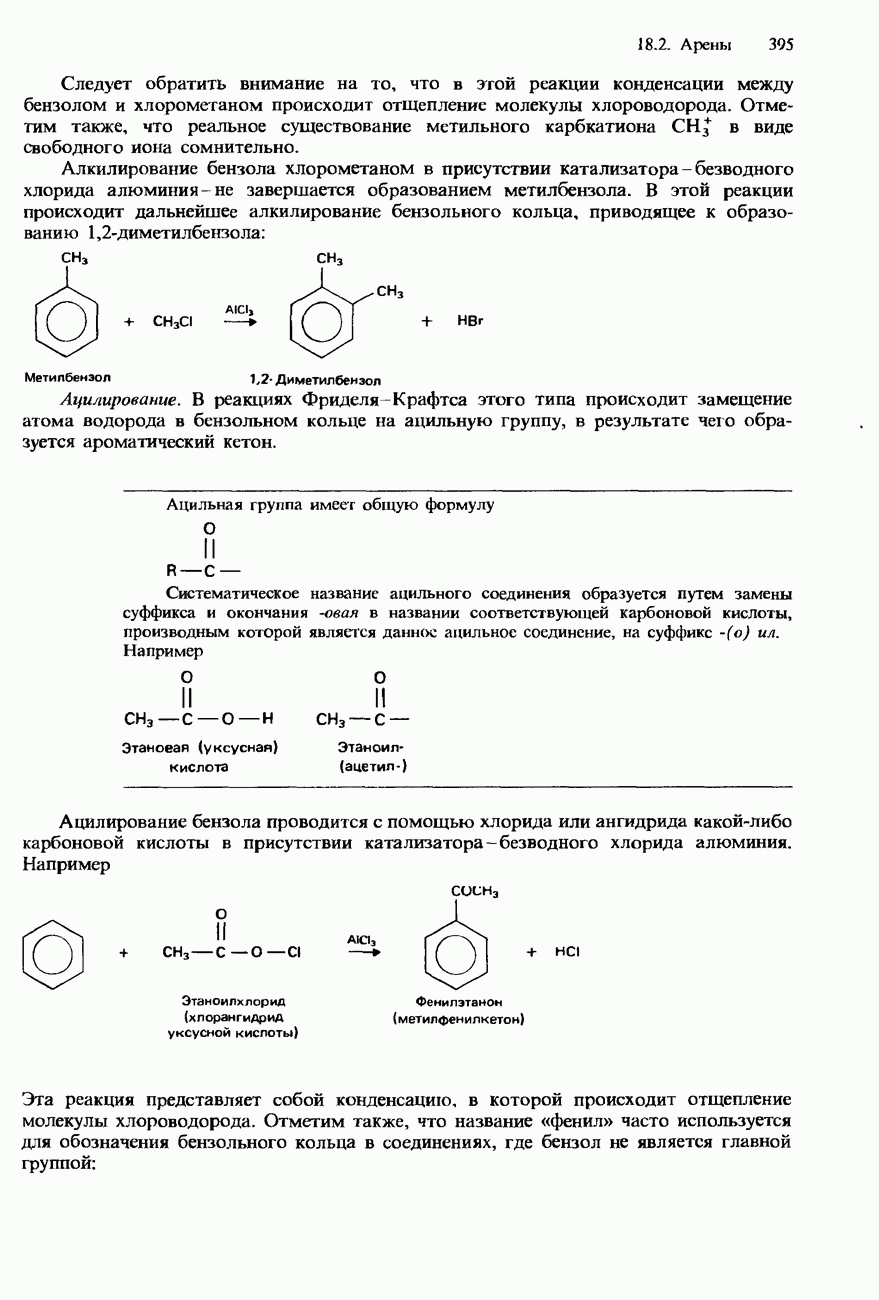
, находящимися на  -связывающей орбитали (см. разд. 2.1). Эти два электрона, находящиеся на указанной орбитали, должны иметь противоположно направленные спины. Однако в отличие от электронов два протона в молекуле водорода могут иметь либо параллельные, либо противоположно направленные спины. Разновидность молекулярного водорода с параллельными спинами протонов двух ядер называется ортоводородом, а разновидность с противоположно направленными спинами протонов двух ядер - параводородом (рис. 12.1).
-связывающей орбитали (см. разд. 2.1). Эти два электрона, находящиеся на указанной орбитали, должны иметь противоположно направленные спины. Однако в отличие от электронов два протона в молекуле водорода могут иметь либо параллельные, либо противоположно направленные спины. Разновидность молекулярного водорода с параллельными спинами протонов двух ядер называется ортоводородом, а разновидность с противоположно направленными спинами протонов двух ядер - параводородом (рис. 12.1).
Обычный водород представляет собой смесь ортоводорода и параводорода. При очень низких температурах в нем преобладает параводород. По мере повышения температуры доля ортоводорода возрастает, и при 25°С смесь содержит приблизительно 75% ортоводорода и 25% параводорода.
Параводород можно получать, пропуская обычный водород через трубку, наполненную древесным углем, а затем охлаждая его до температуры жидкого воздуха. Ортоводород и параводород совершенно одинаковы по своим химическим свойствам, но несколько различаются по температурам плавления и кипения (см. табл. 12.5).

Рис. 12.1. Ортоводород и параводород.
Таблица 12.5. Температуры плавления и кипения ортоводорода и параводорода

Ионы водорода
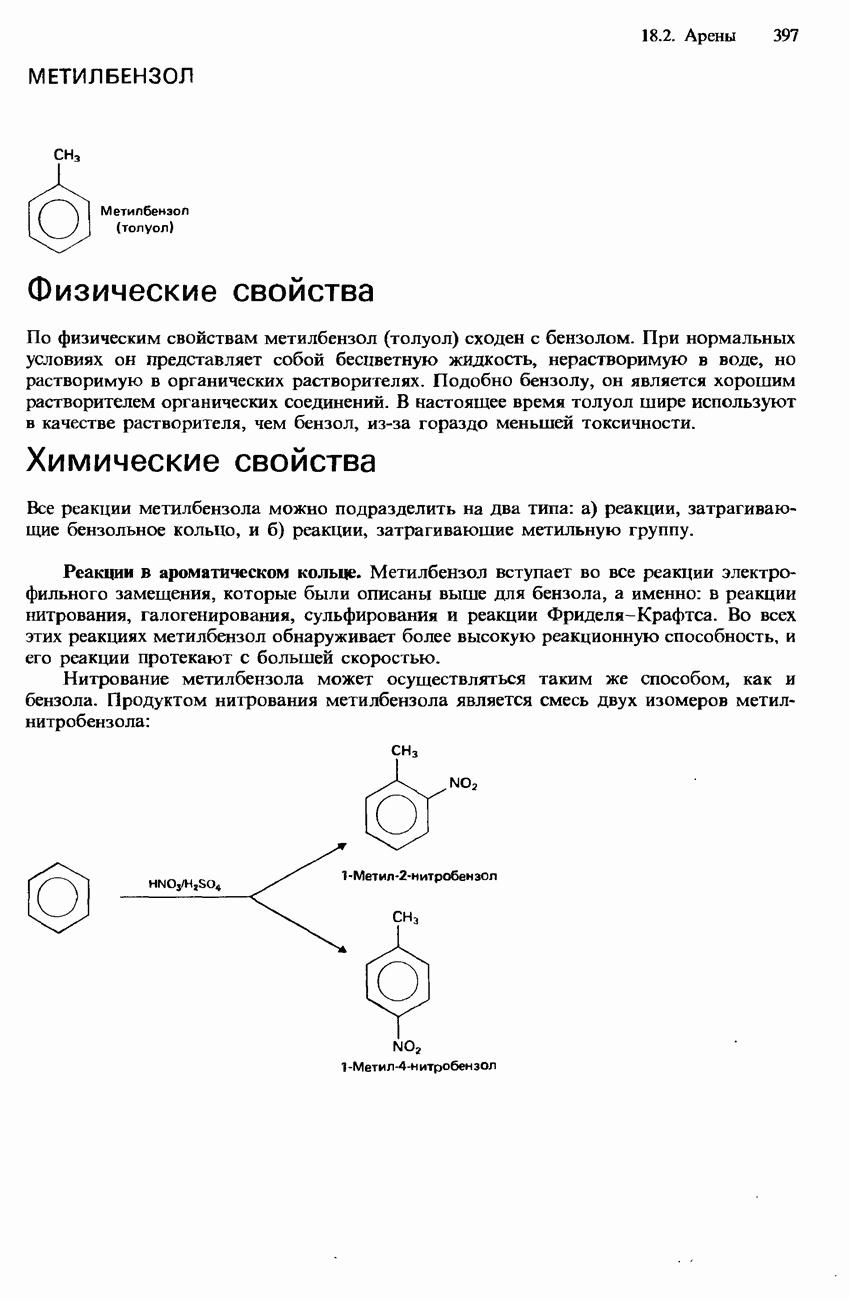
Оголенное ядро атома водорода представляет собой протон  Изолированный протон неустойчив и быстро соединяется с электроном, образуя атом водорода. Изолированные протоны можно получать в водородных газоразрядных трубках или в результате искусственных ядерных превращений (см. разд. 1.3), например бомбардируя атомы азота
Изолированный протон неустойчив и быстро соединяется с электроном, образуя атом водорода. Изолированные протоны можно получать в водородных газоразрядных трубках или в результате искусственных ядерных превращений (см. разд. 1.3), например бомбардируя атомы азота  -частицами:
-частицами:

В водном растворе протоны связаны с молекулами воды координационными связями, образуя гидратированные протоны, или ионы гидроксония  разд. 2.1).
разд. 2.1).
Водород образует еще два других положительно заряженных иона: молекулярный ион водорода  и ион трехатомного молекулярного водорода
и ион трехатомного молекулярного водорода  Ион
Ион  очень неустойчив. Ион
очень неустойчив. Ион  более устойчив и может обнаруживаться в газоразрядной трубке. Анион водорода, или гидрид-ион
более устойчив и может обнаруживаться в газоразрядной трубке. Анион водорода, или гидрид-ион  содержится в гидридах металлов I группы и в гидридах
содержится в гидридах металлов I группы и в гидридах  ниже). Он представляет собой протон, окруженный двумя электронами, которые находятся на
ниже). Он представляет собой протон, окруженный двумя электронами, которые находятся на  .
.
| << Предыдущий параграф | Следующий параграф >> |
- 11. ПЕРИОДИЧЕСКИЙ ЗАКОН
- 11.1 Периодичность
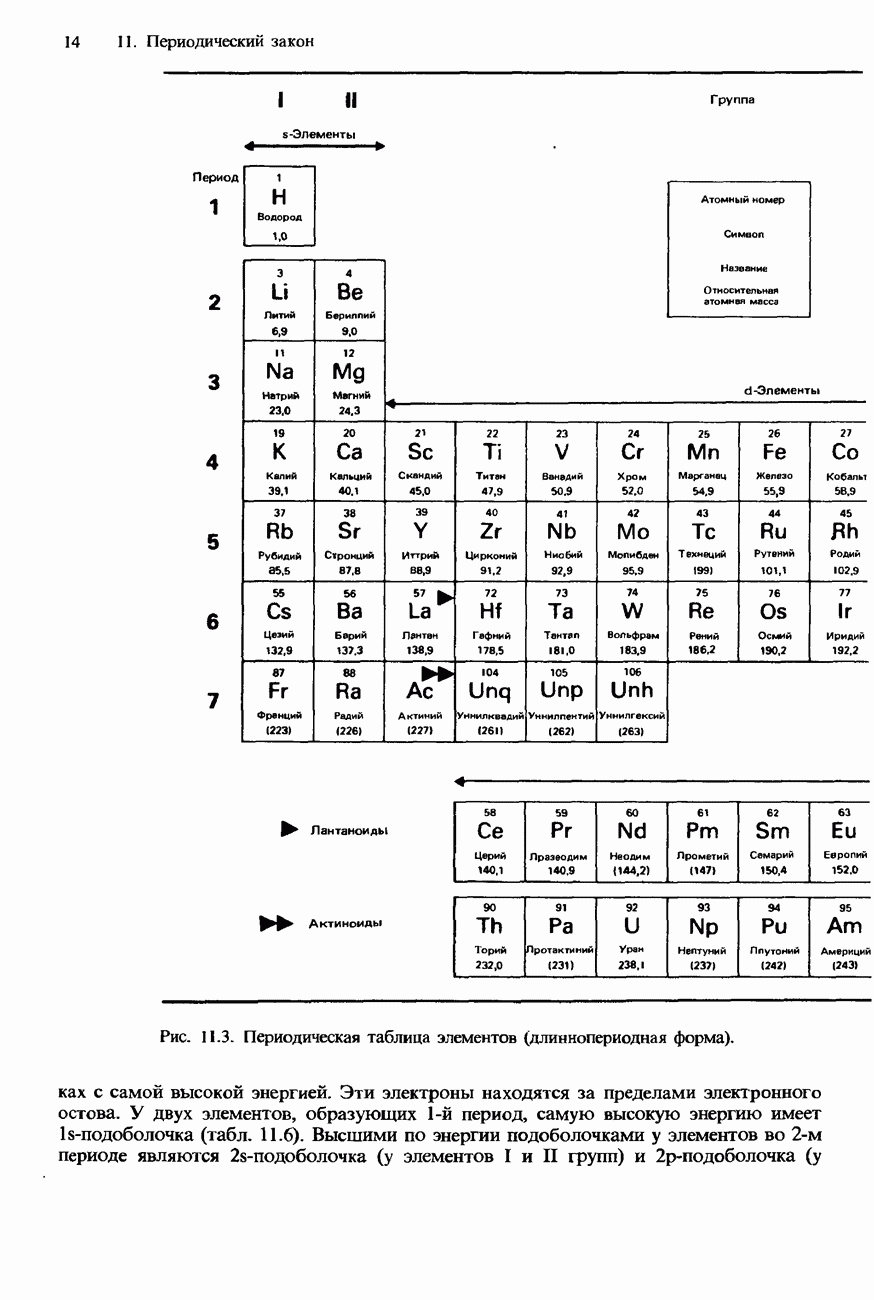
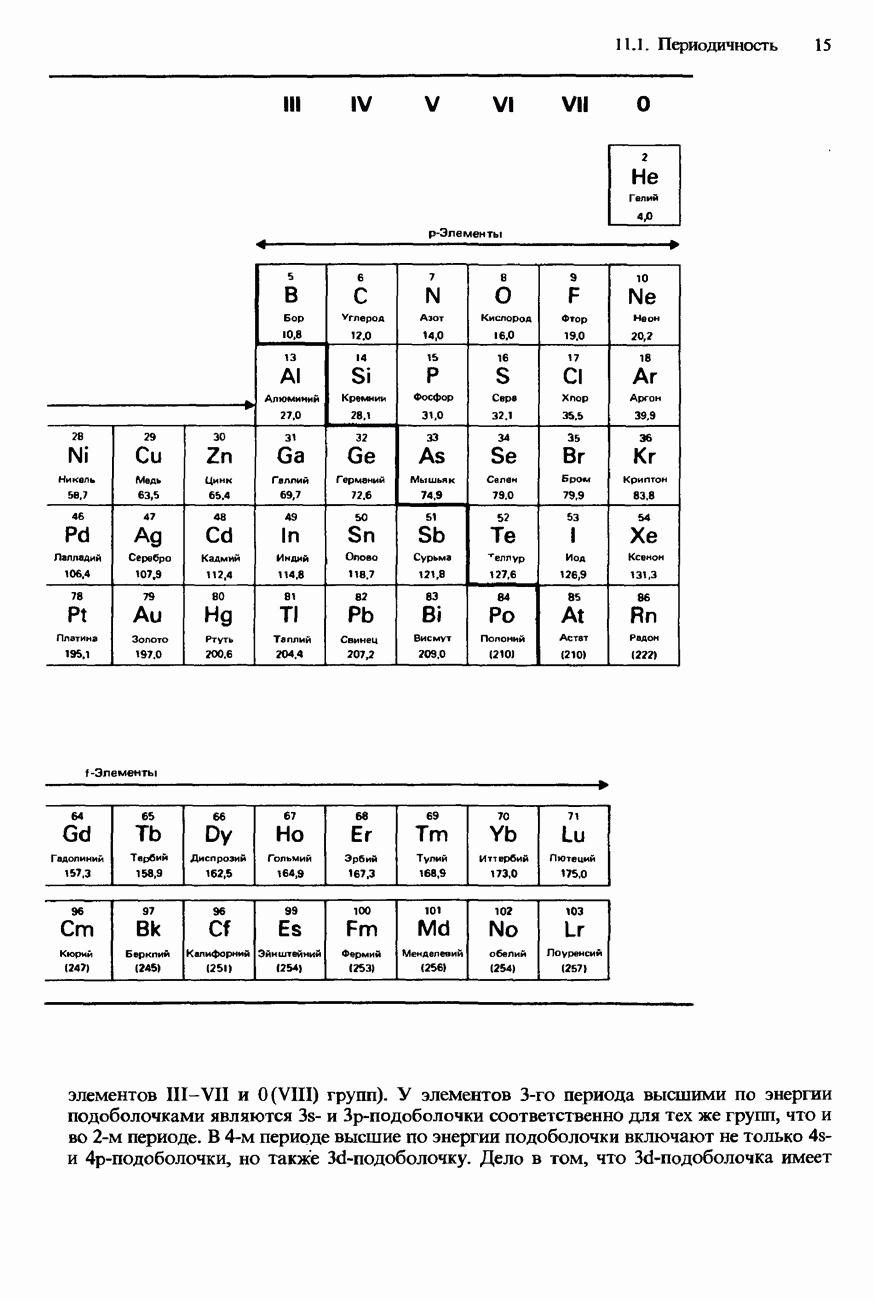
- СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
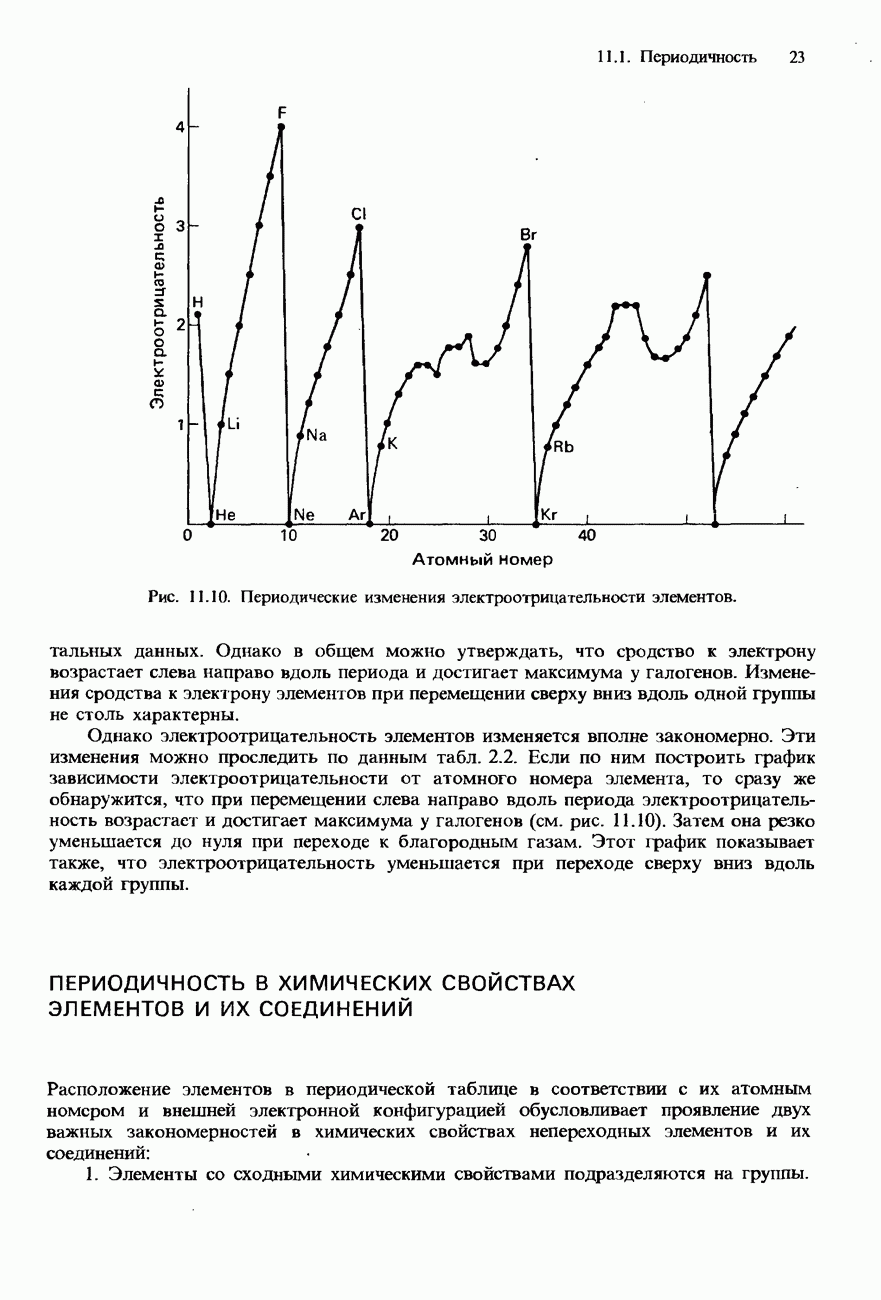
- ПЕРИОДИЧНОСТЬ
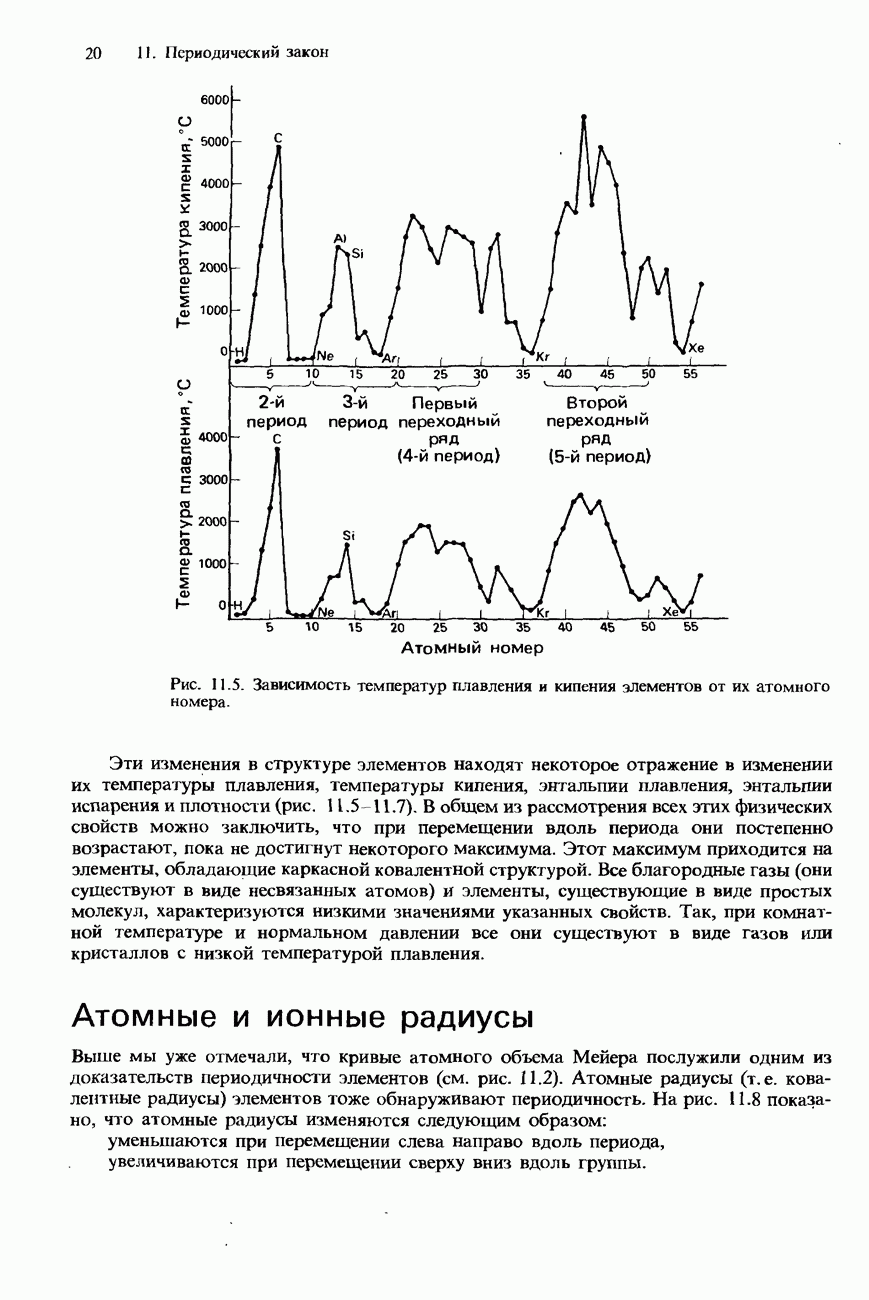
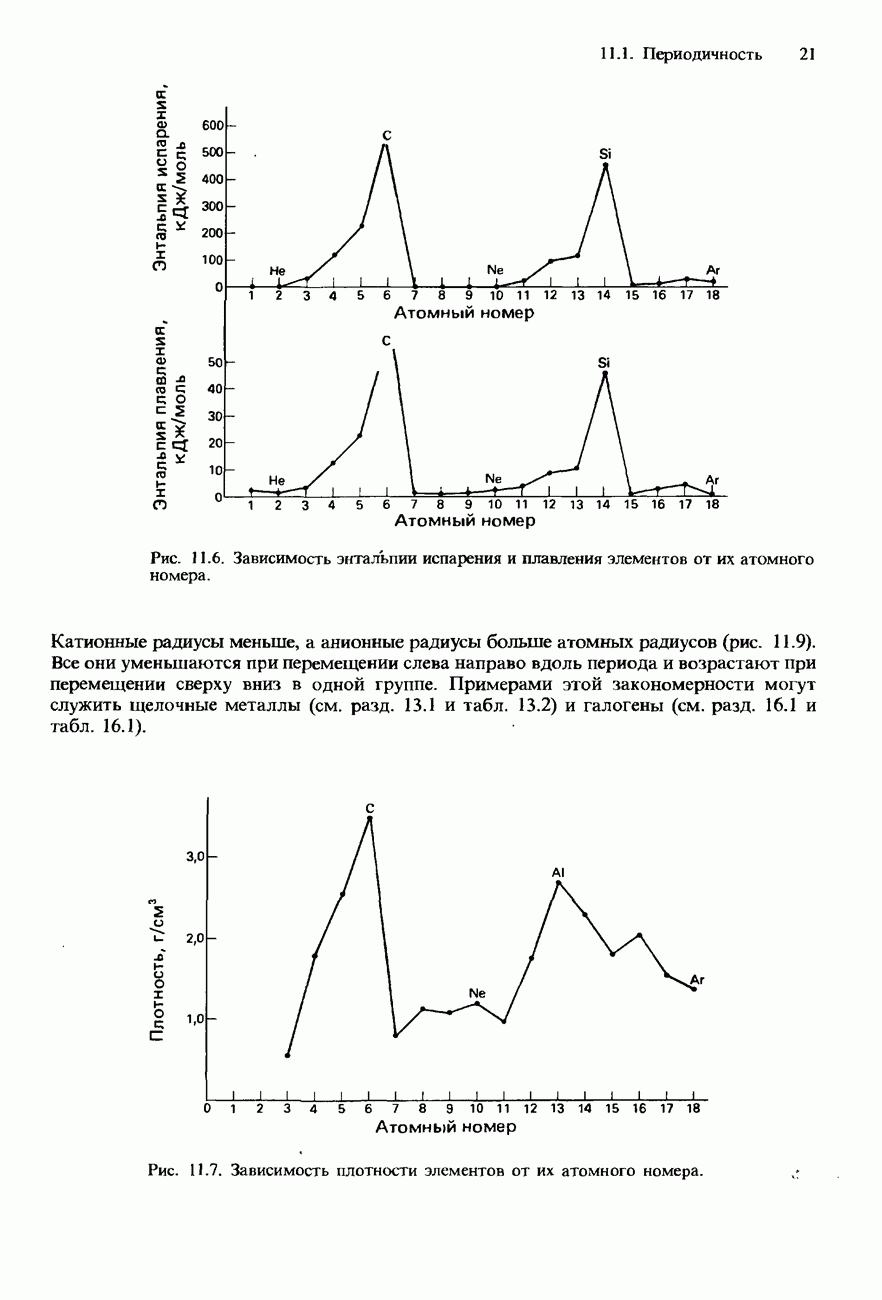
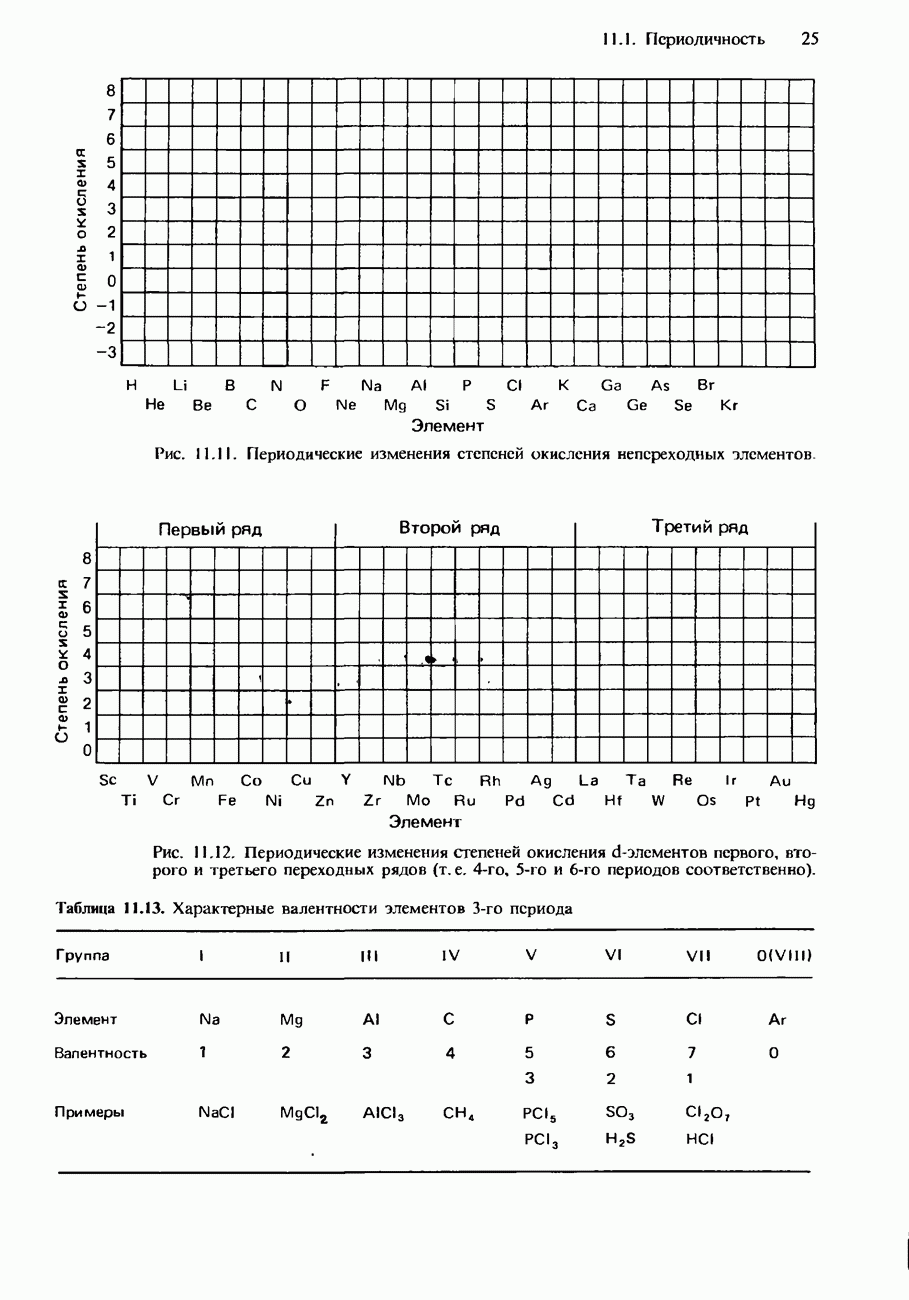
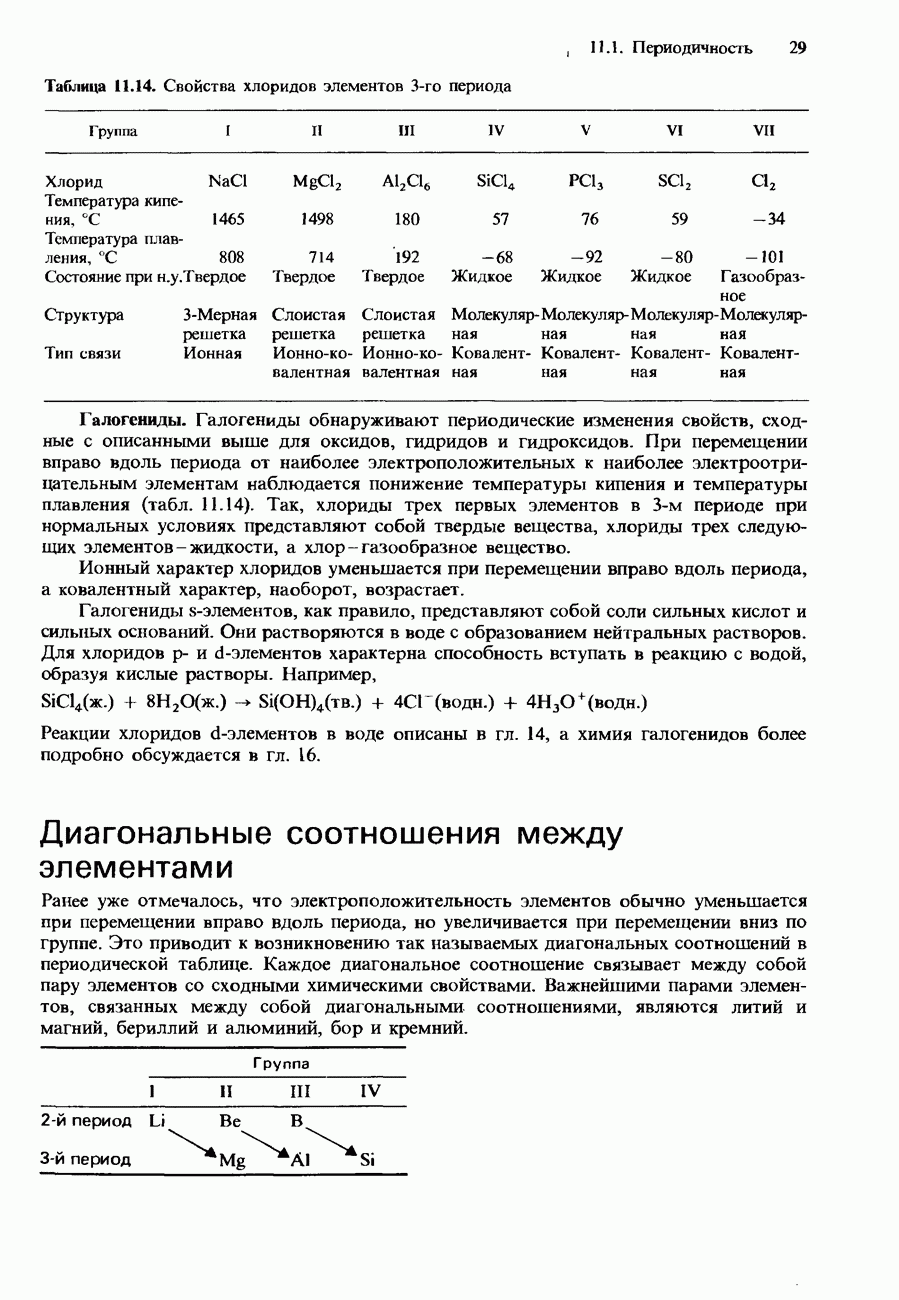
- ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 12. ВОДОРОД И ВОДА
- 12.1. ВОДОРОД
- ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ
- РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА
- ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА
- 12.2 Вода
- ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ
- ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ
- КАЧЕСТВО ВОДЫ
- ЗАГРЯЗНЕНИЕ ВОДЫ
- ОЧИСТКА И ПОДГОТОВКА ВОДЫ
- ОКЕАНЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 13. s-Металлы
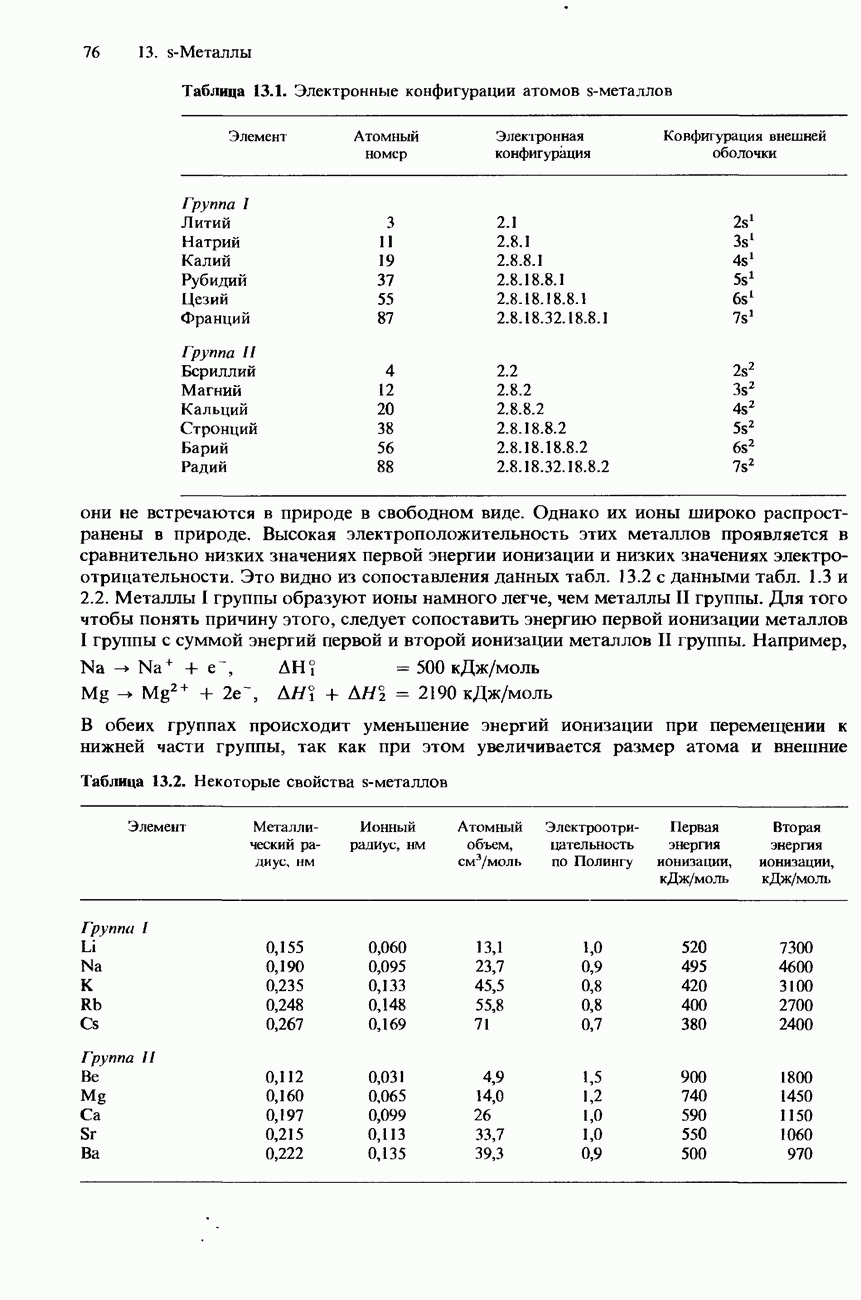
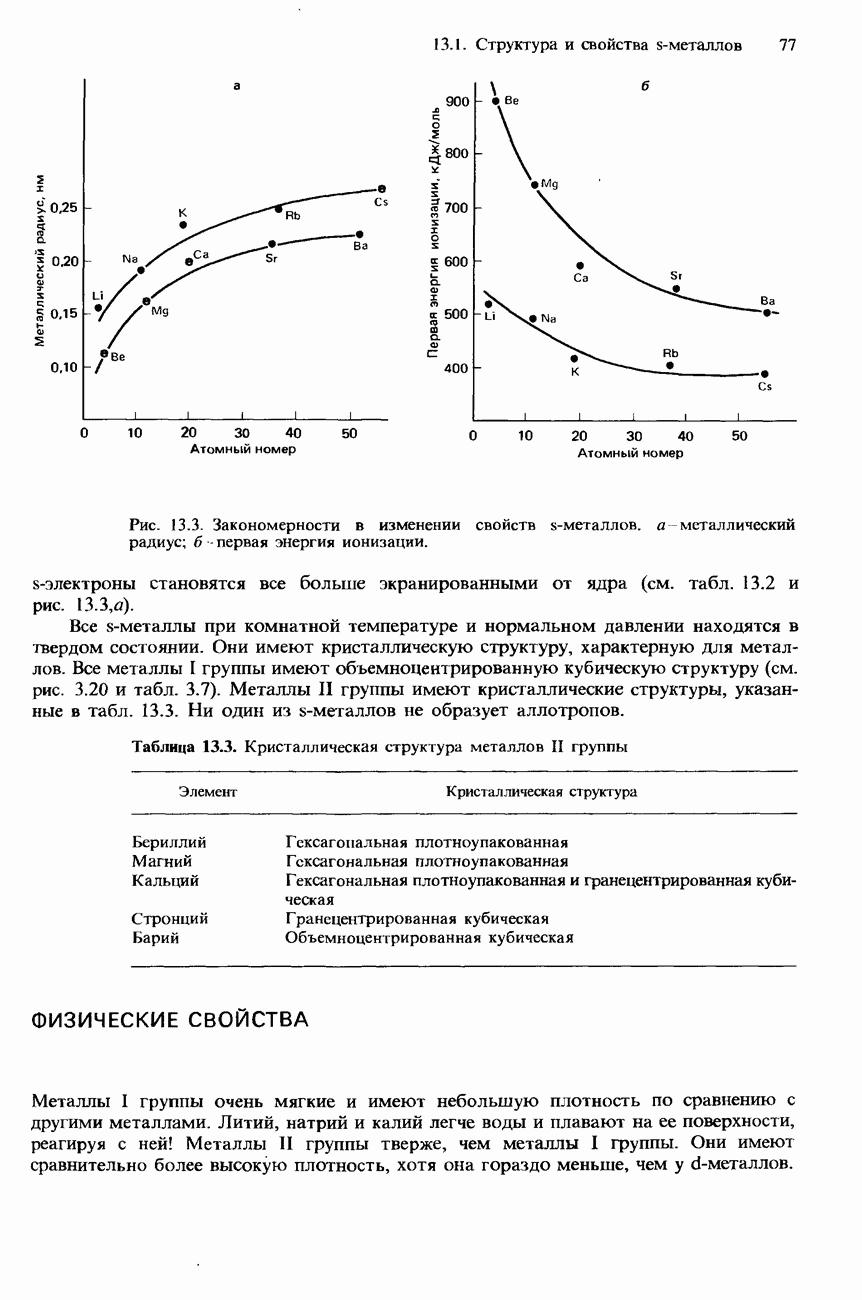
- 13.1 Структура и свойства s-металлов
- СТРУКТУРА
- ФИЗИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ
- 13.2 Соединения, образуемые s-металлами
- ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ
- ГИДРОКСИДЫ
- КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ
- РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ
- АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ
- 13.3. Распространенность в природе, получение и применение
- ПОЛУЧЕНИЕ S-МЕТАЛЛОВ
- ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ
- ПРИМЕНЕНИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 14. d-ЭЛЕМЕНТЫ
- 14.1. Структура и свойства d-элементов
- d-ЭЛЕМЕНТЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА
- ХИМИЧЕСКИЕ СВОЙСТВА
- 14.2 Химия семи d-элементов
- МАРГАНЕЦ
- ЖЕЛЕЗО
- КОБАЛЬТ
- НИКЕЛЬ
- МЕДЬ
- ЦИНК
- 14.3. Распространенность в природе, получение и применения
- ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ
- ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА
- ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 15. ЭЛЕМЕНТЫ III-VI ГРУПП
- 15.1. Алюминий и другие элементы III группы
- БОР
- ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ
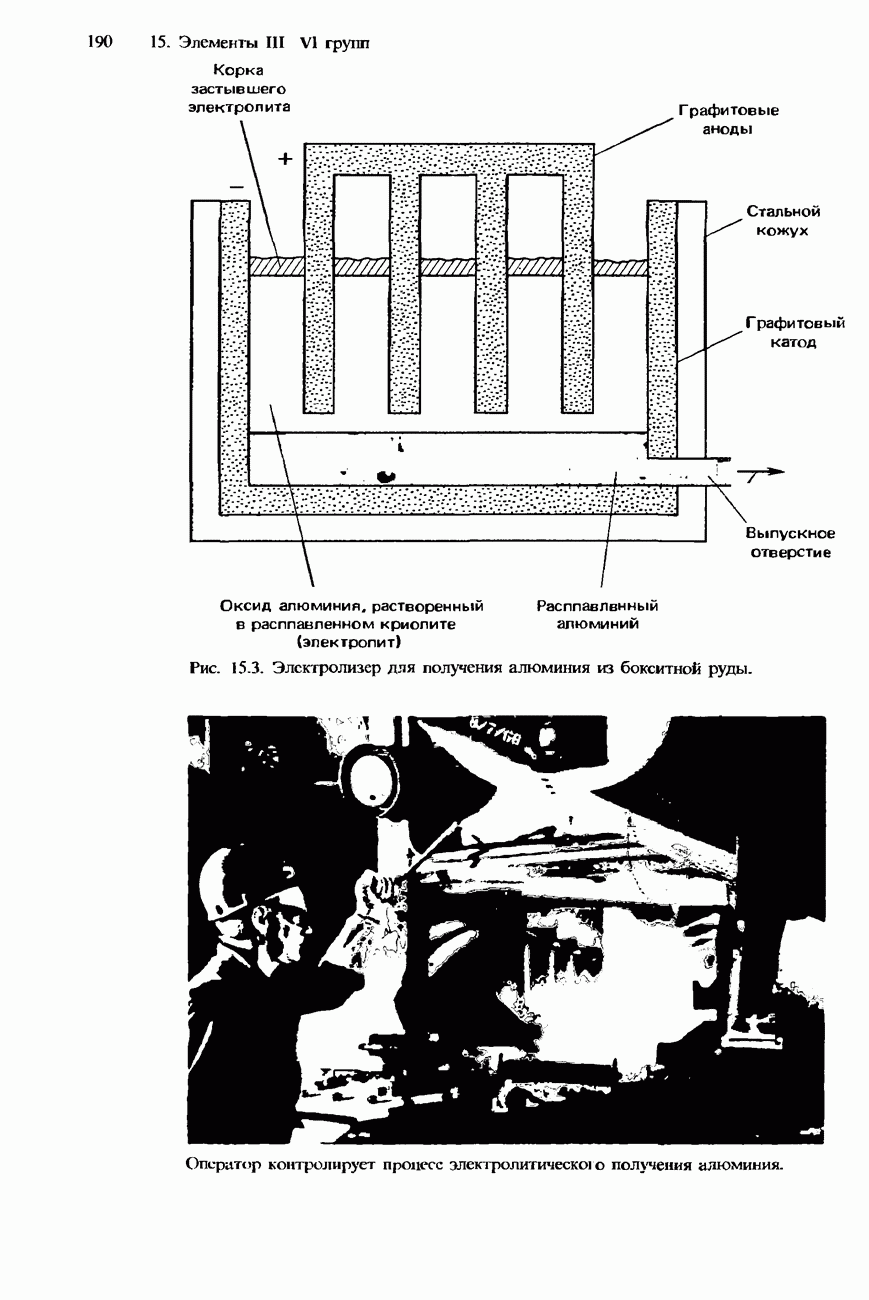
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ
- ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ
- 15.2. IV группа периодической системы
- СОЕДИНЕНИЯ
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД
- ПРИМЕНЕНИЯ УГЛЕРОДА
- ПРИМЕНЕНИЯ КРЕМНИЯ
- ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА
- 15.3. Элементы V группы
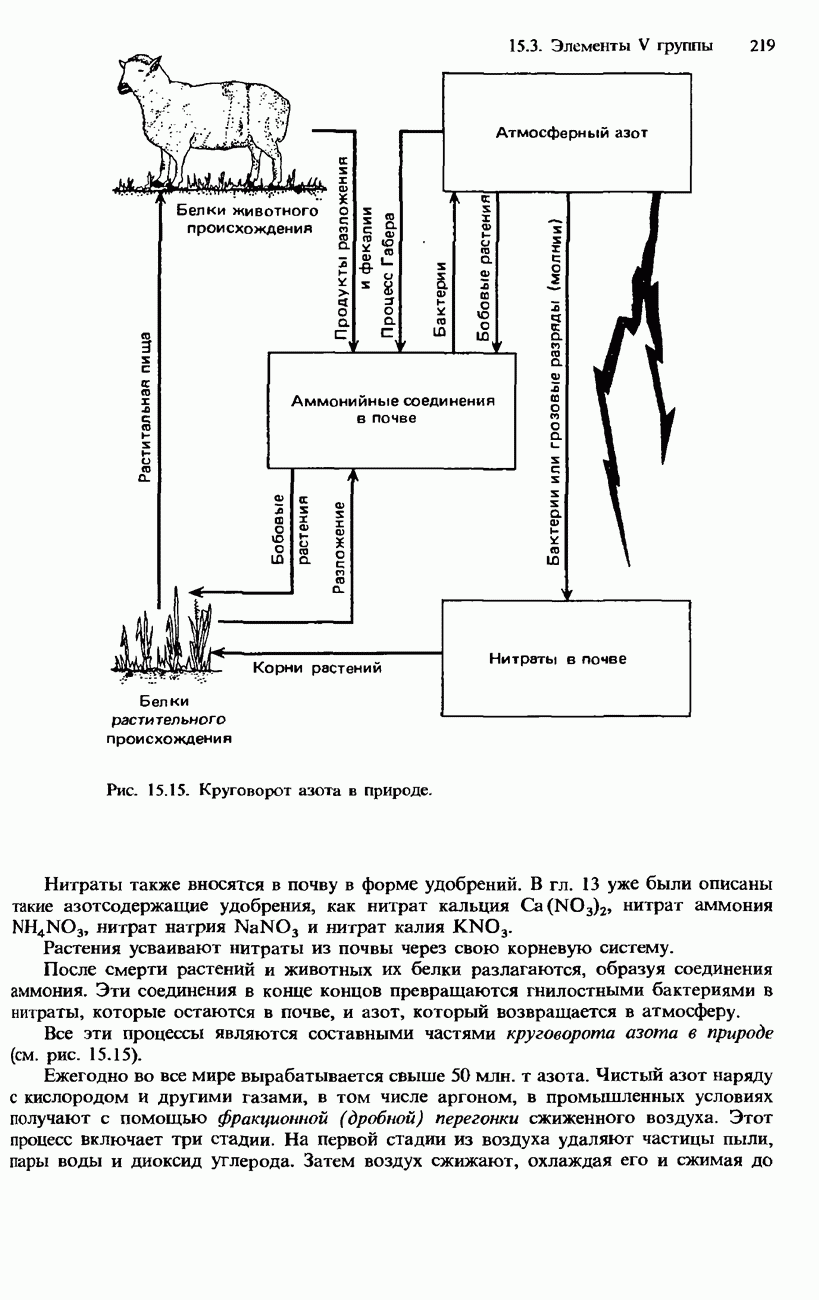
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА
- СОЕДИНЕНИЯ АЗОТА
- СОЕДИНЕНИЯ ФОСФОРА
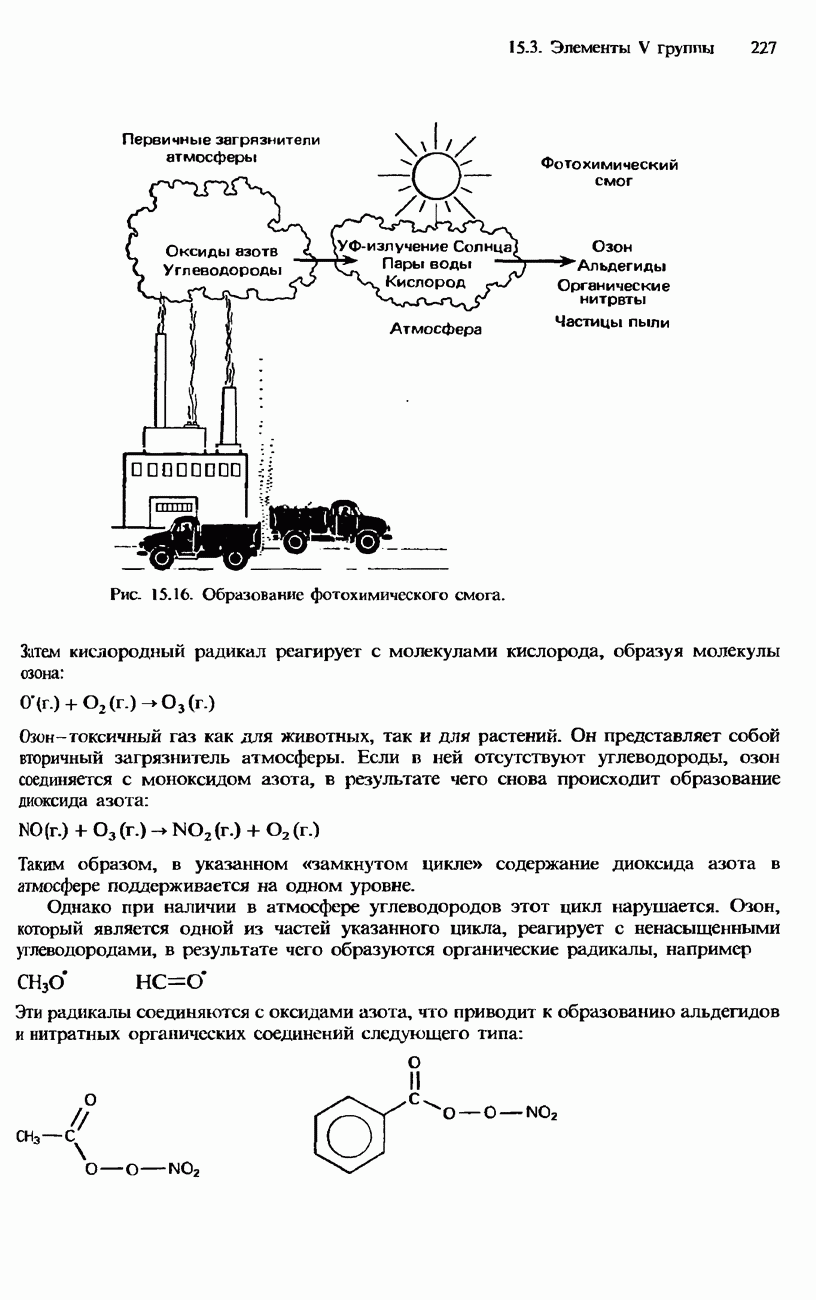
- 15.4. Элементы VI группы. Кислород и сера
- КИСЛОРОД
- СОЕДИНЕНИЯ КИСЛОРОДА
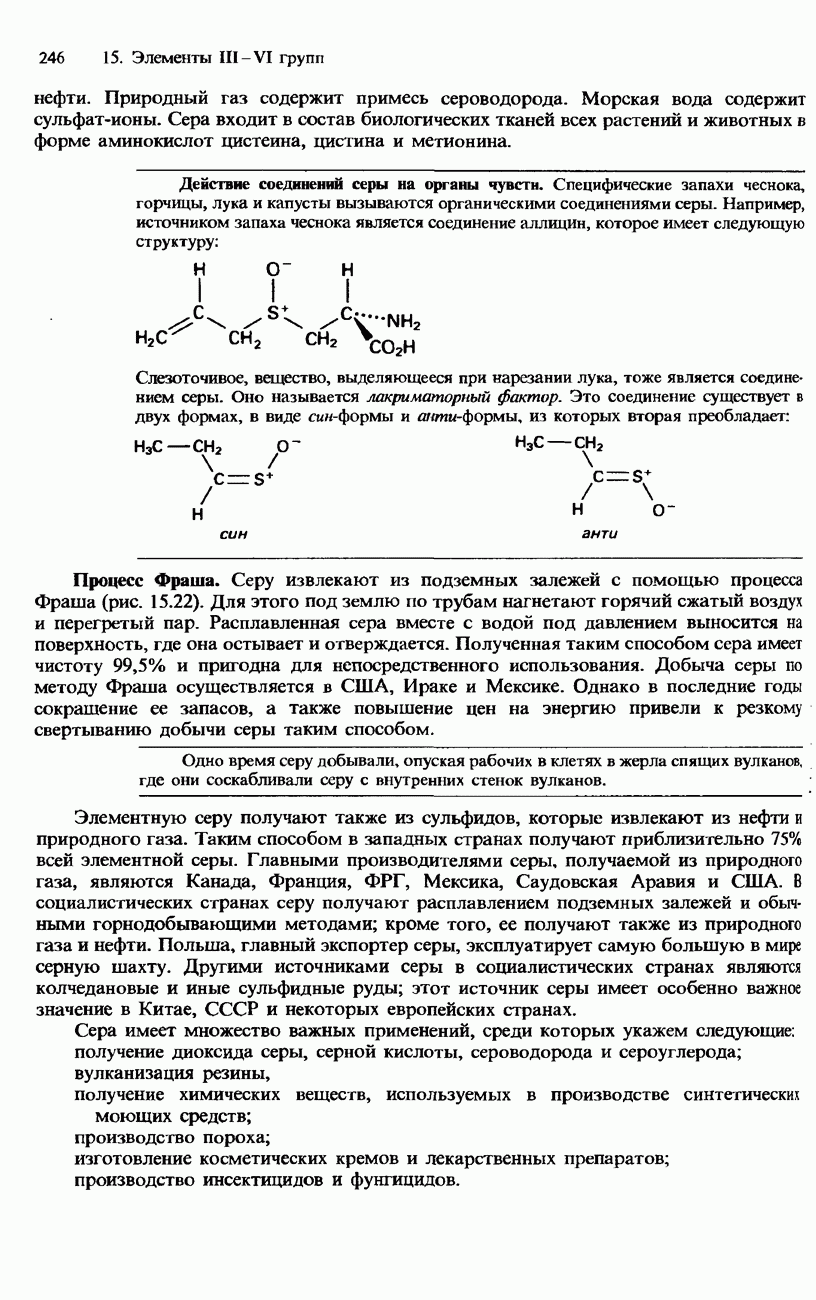
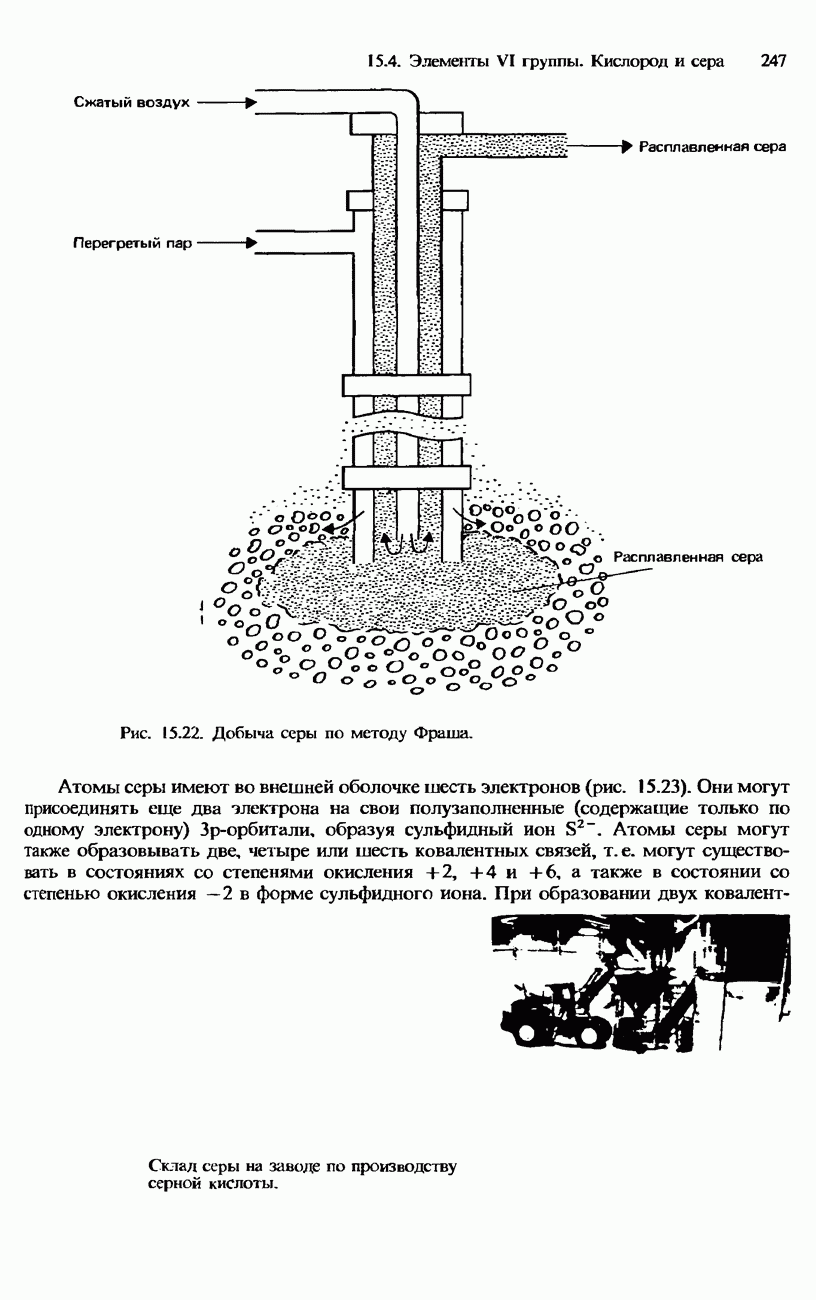
- СЕРА
- СОЕДИНЕНИЯ СЕРЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ
- 16.1. Галогены
- ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ
- ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ
- ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ
- 16.2. Соединения галогенов
- ГАЛОГЕНОВОДОРОДЫ
- КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ
- 16.3. Распространенность, получение и применение галогенов и их соединений
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА
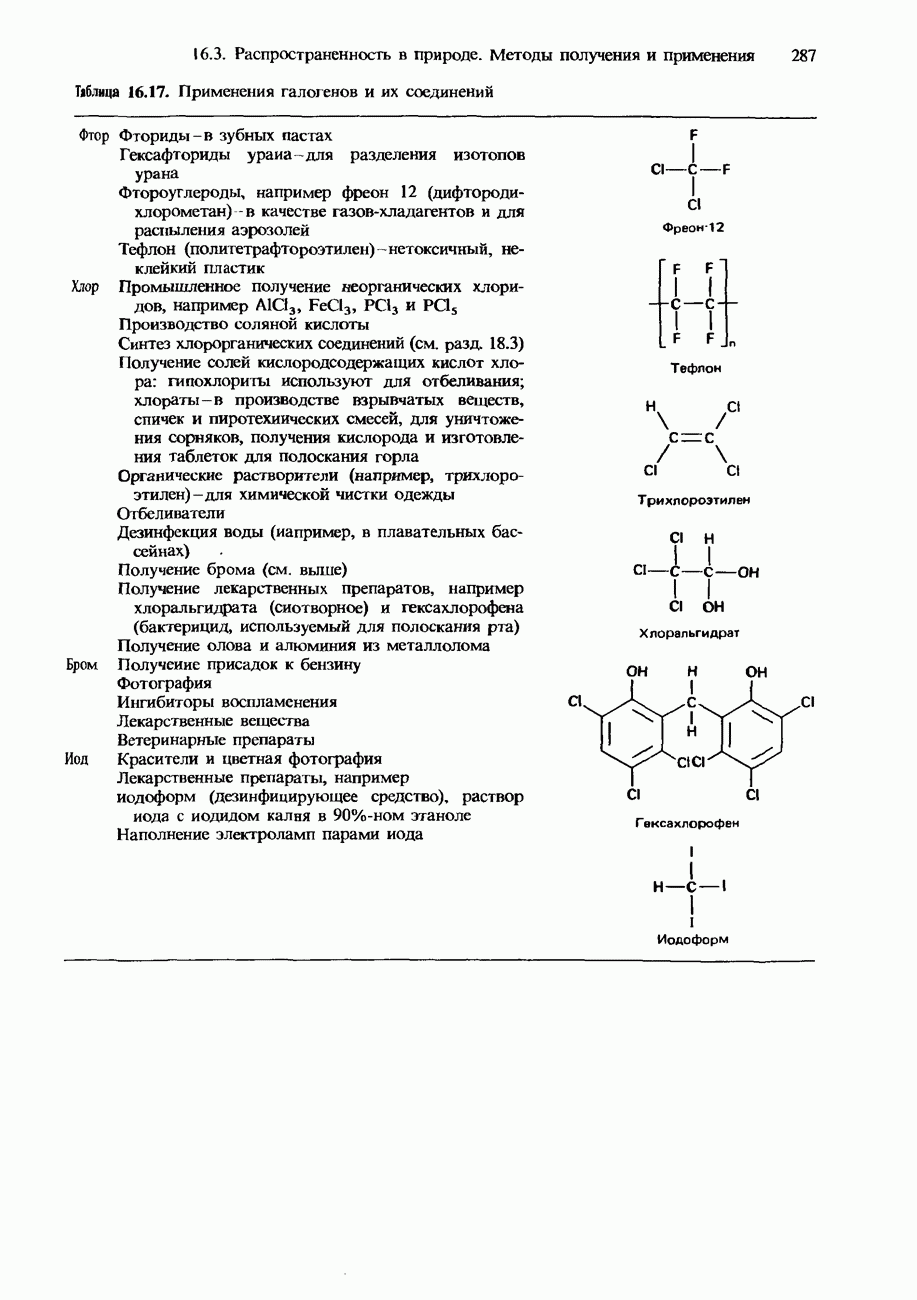
- ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ
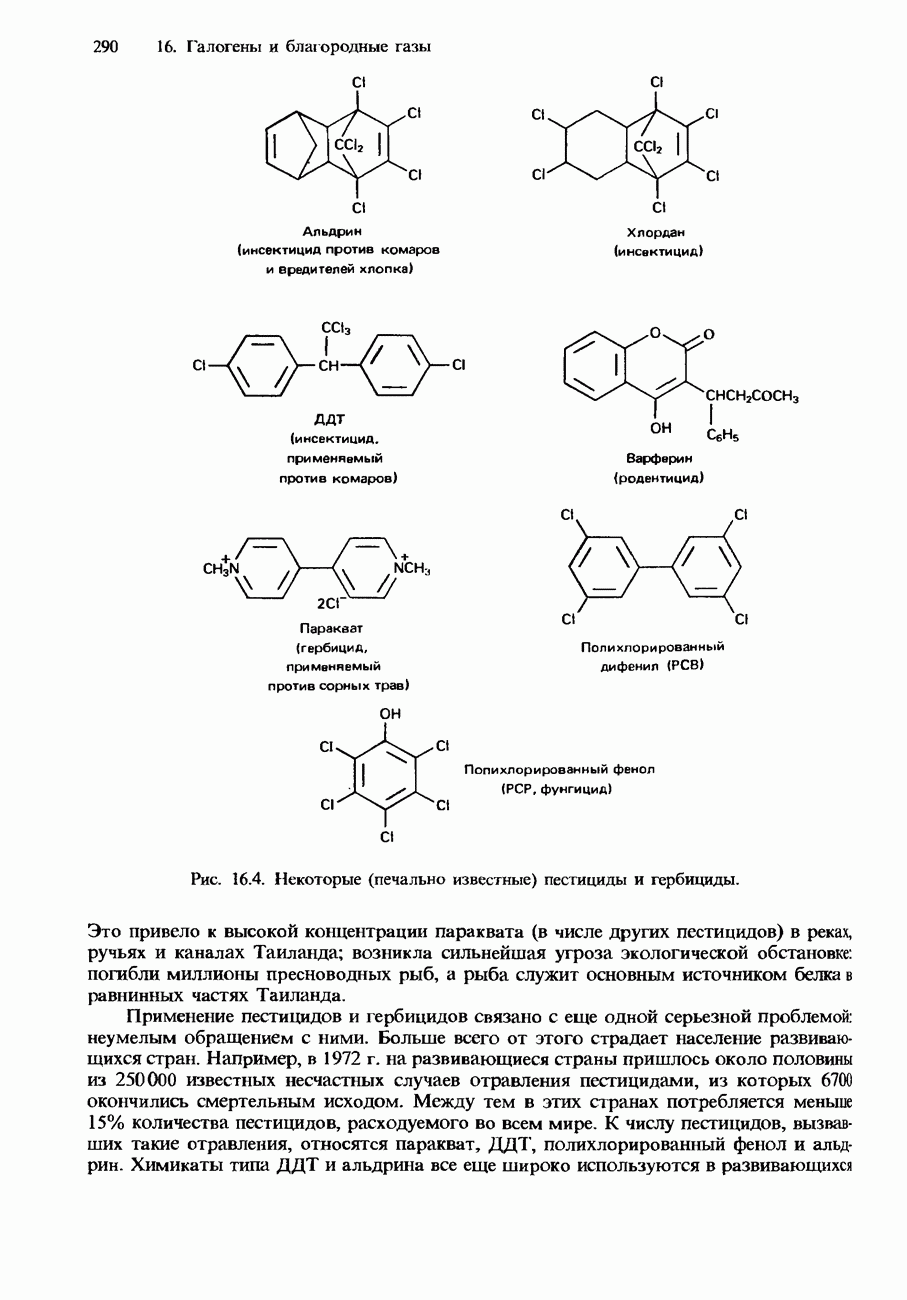
- ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ
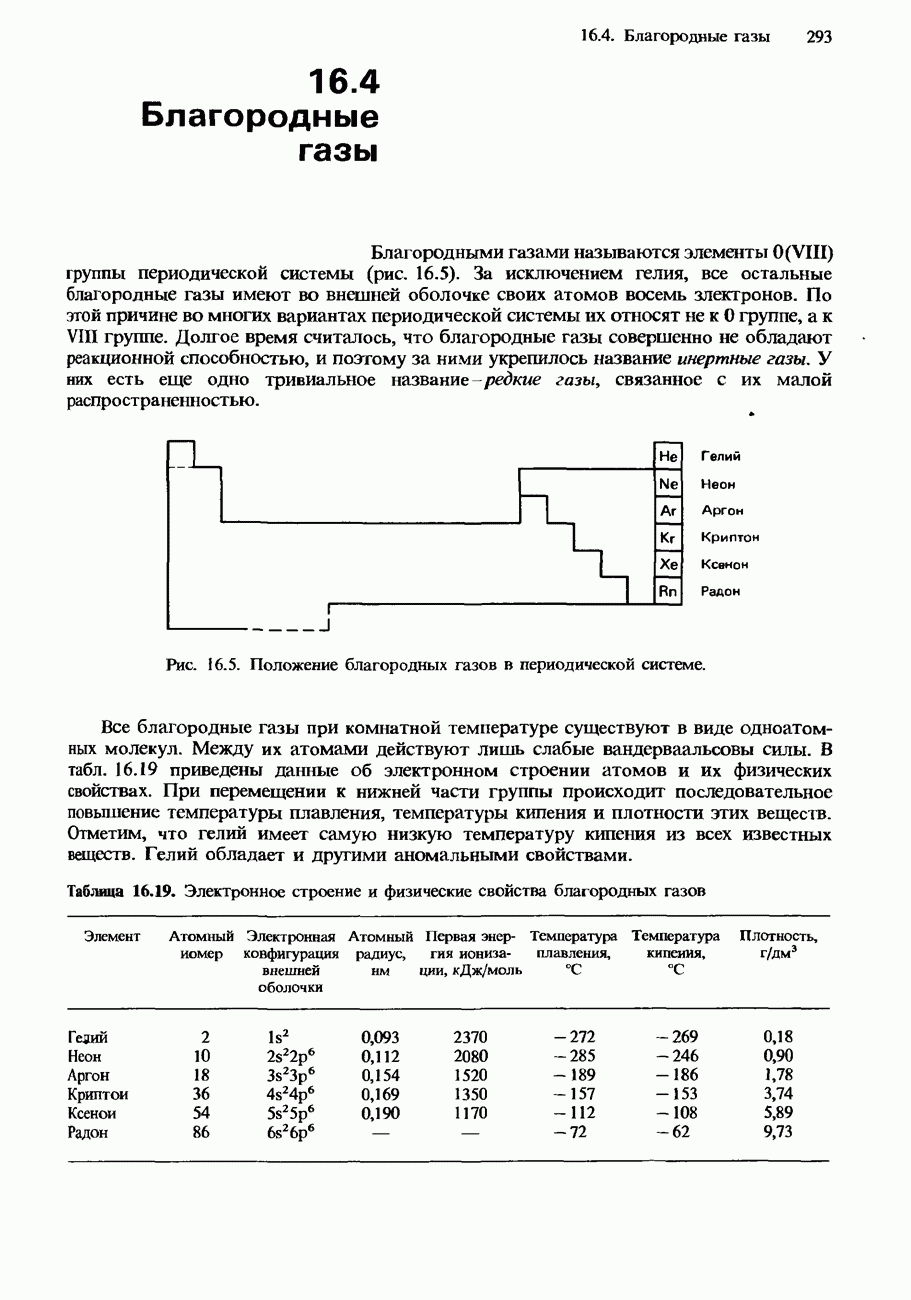
- 16.4. Благородные газы
- СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
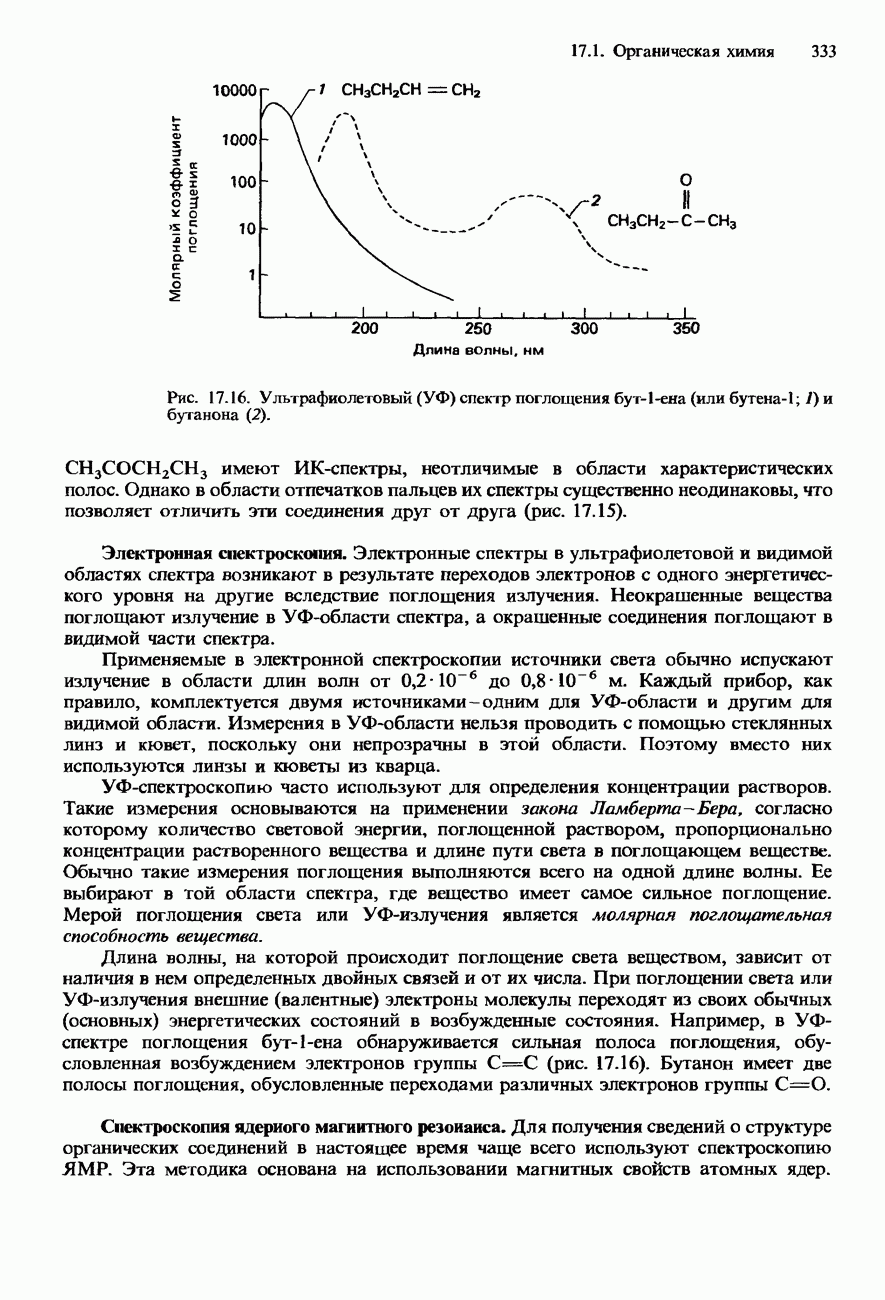
- 7.1. Органическая химия
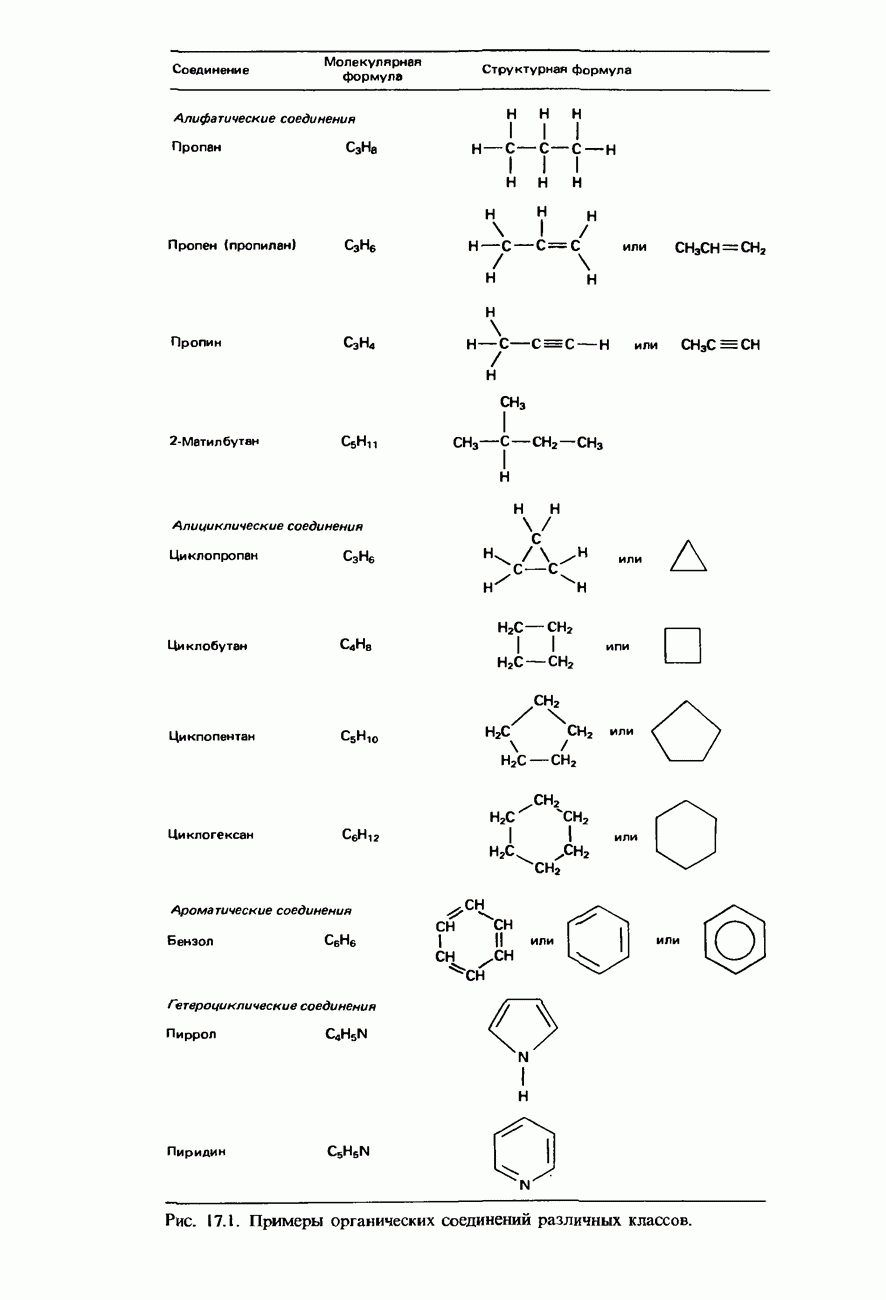
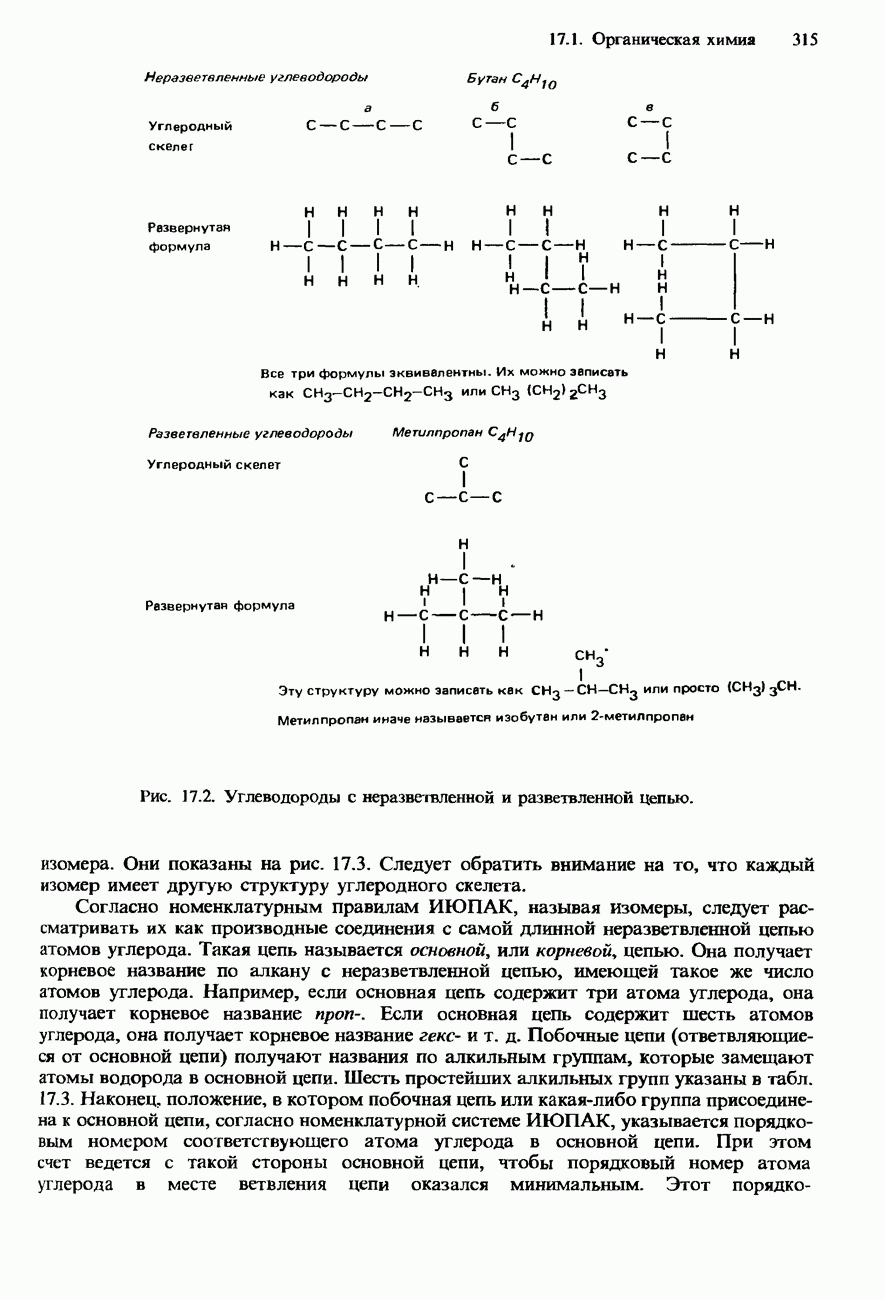
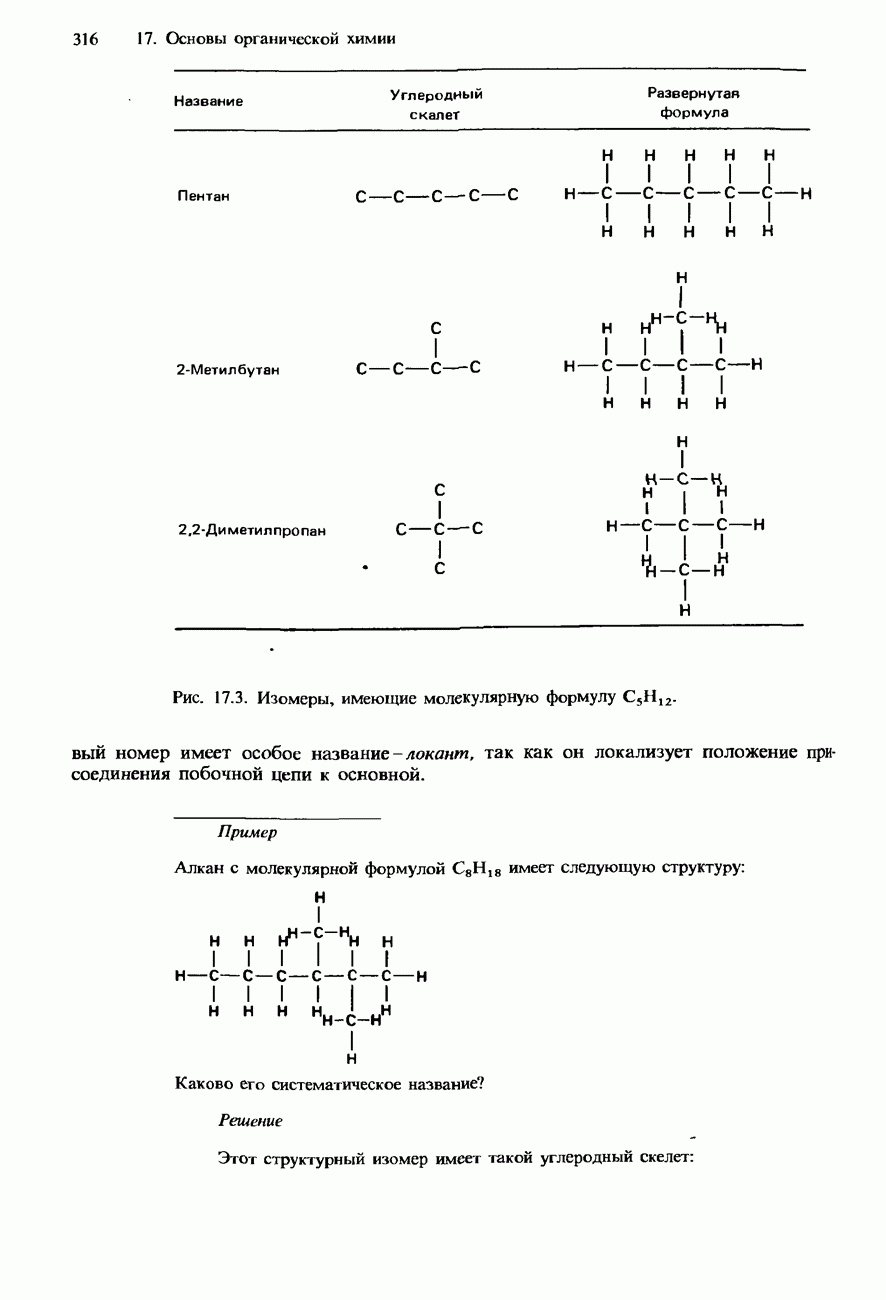
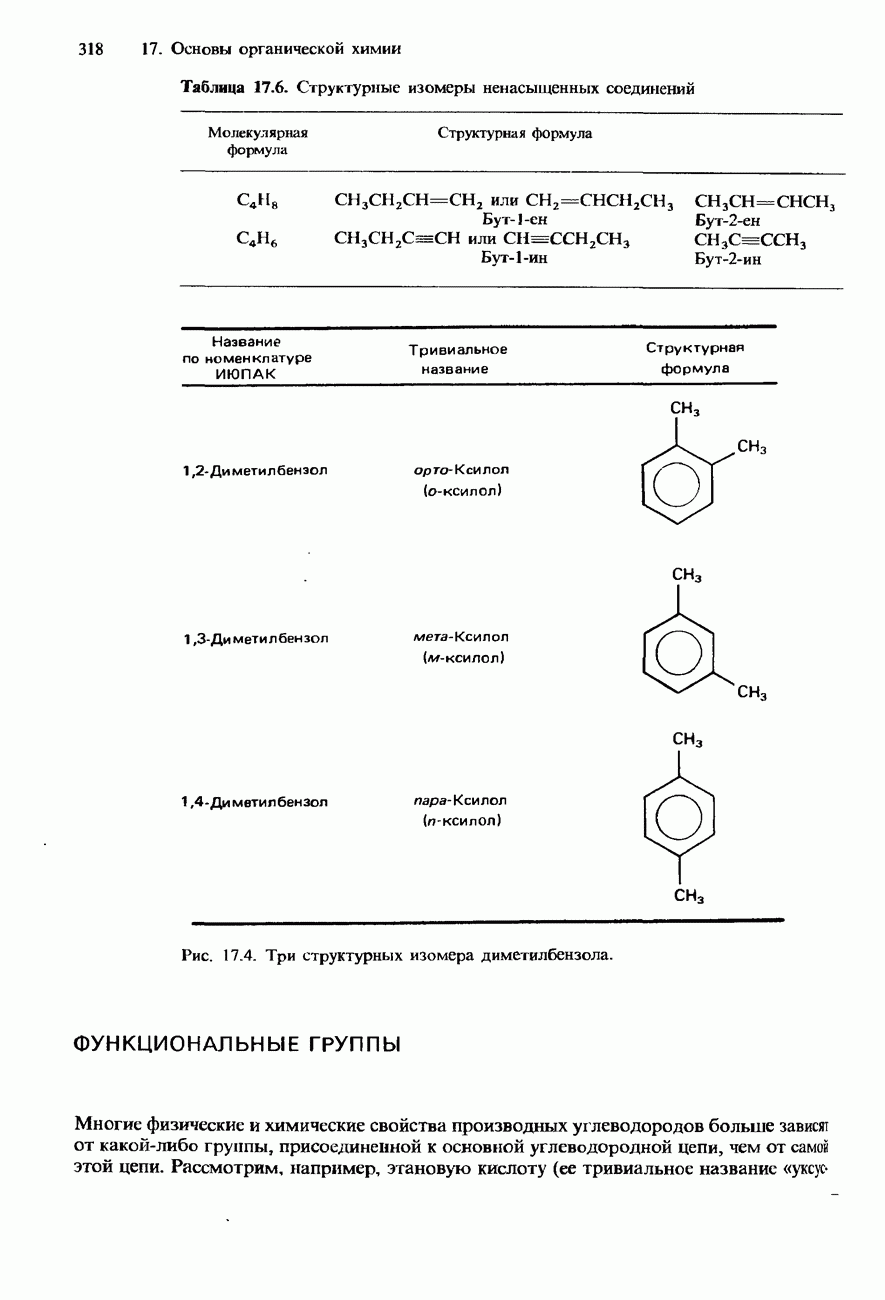
- НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- УГЛЕВОДОРОДЫ
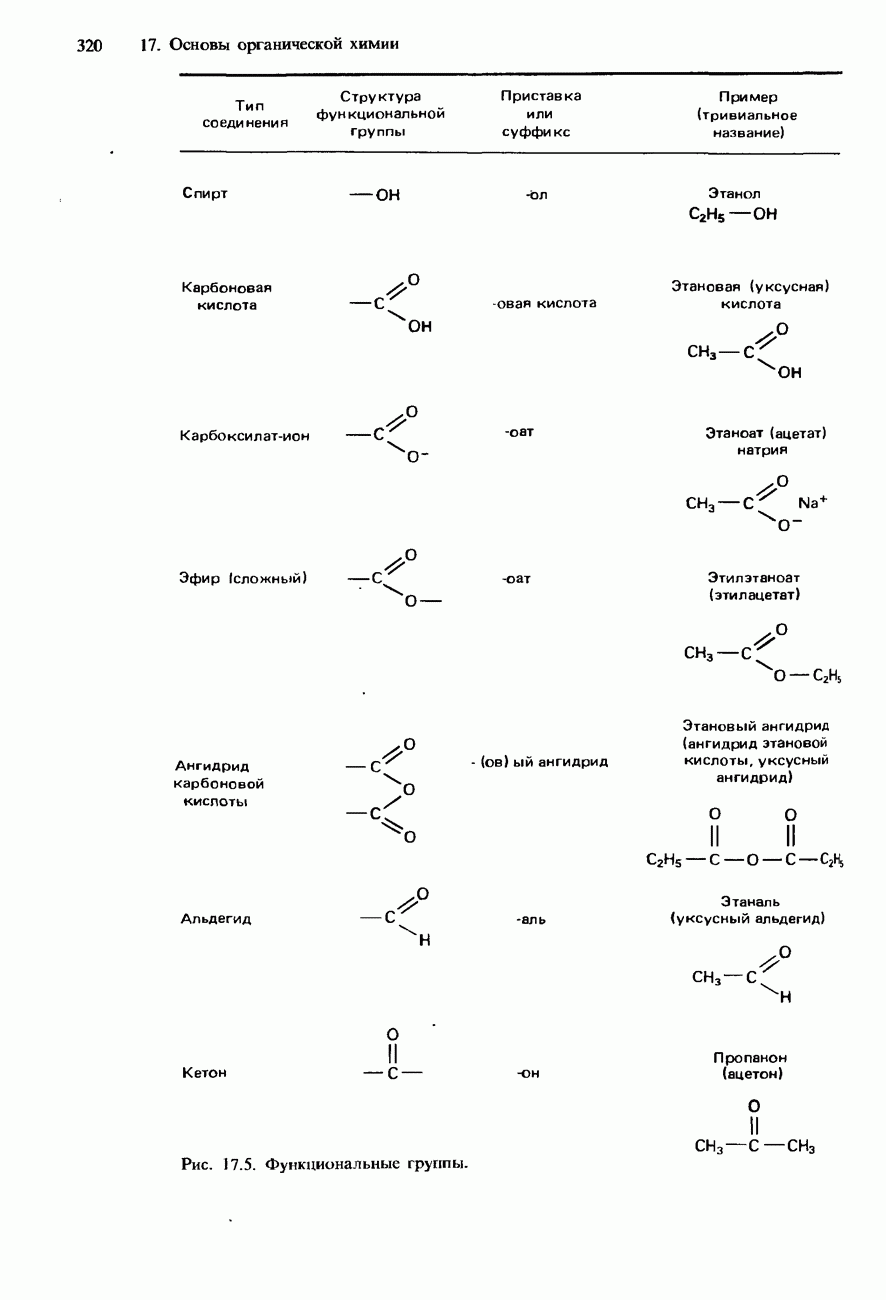
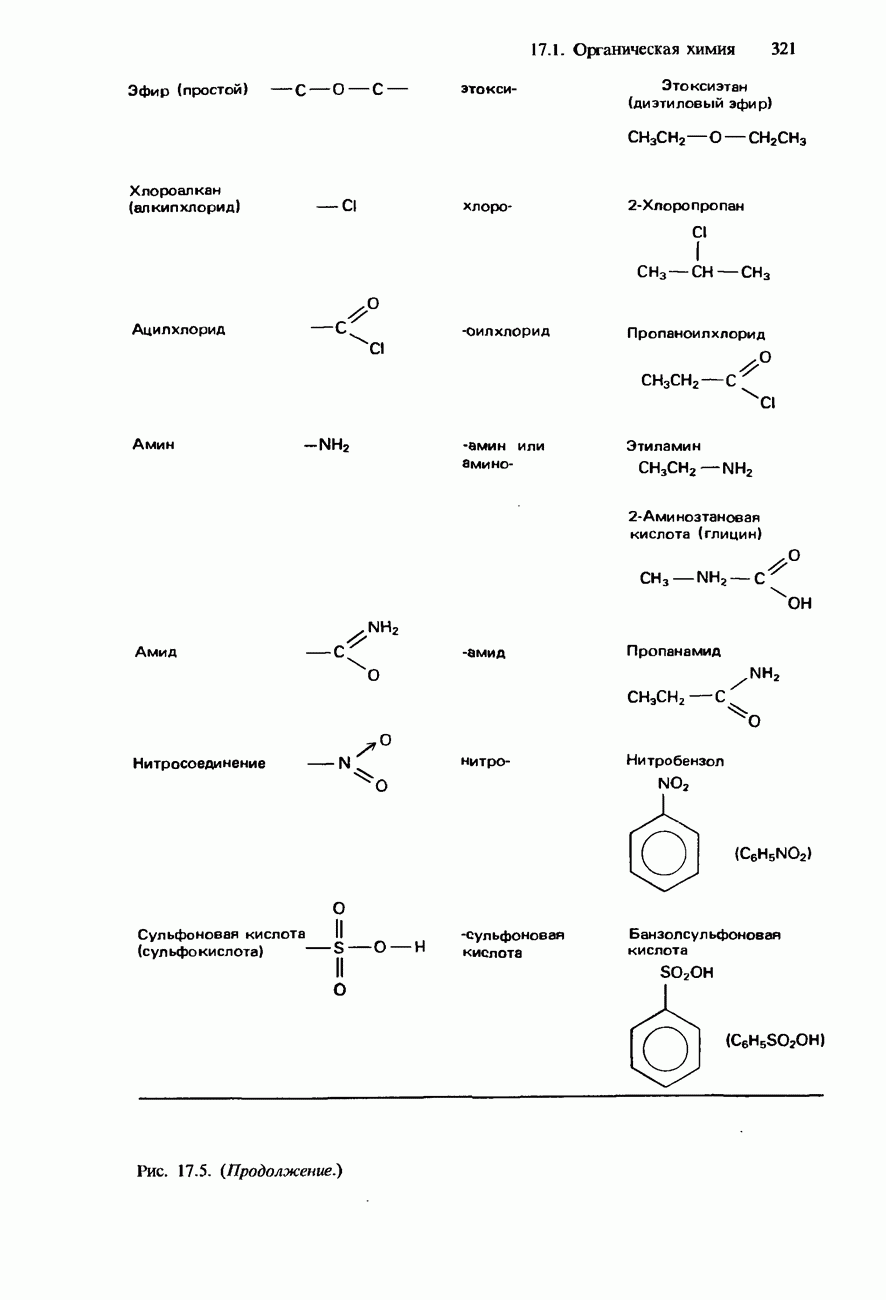
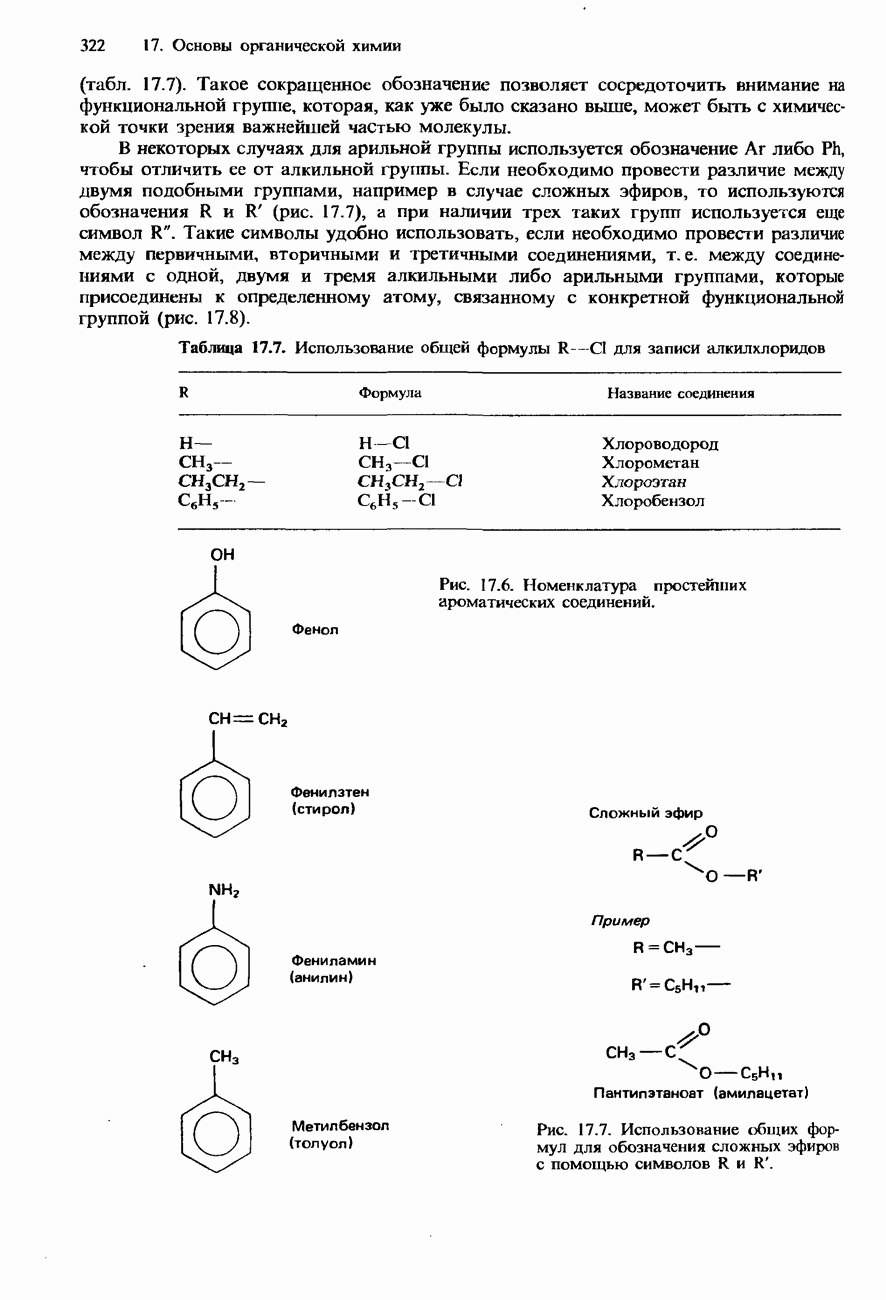
- ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
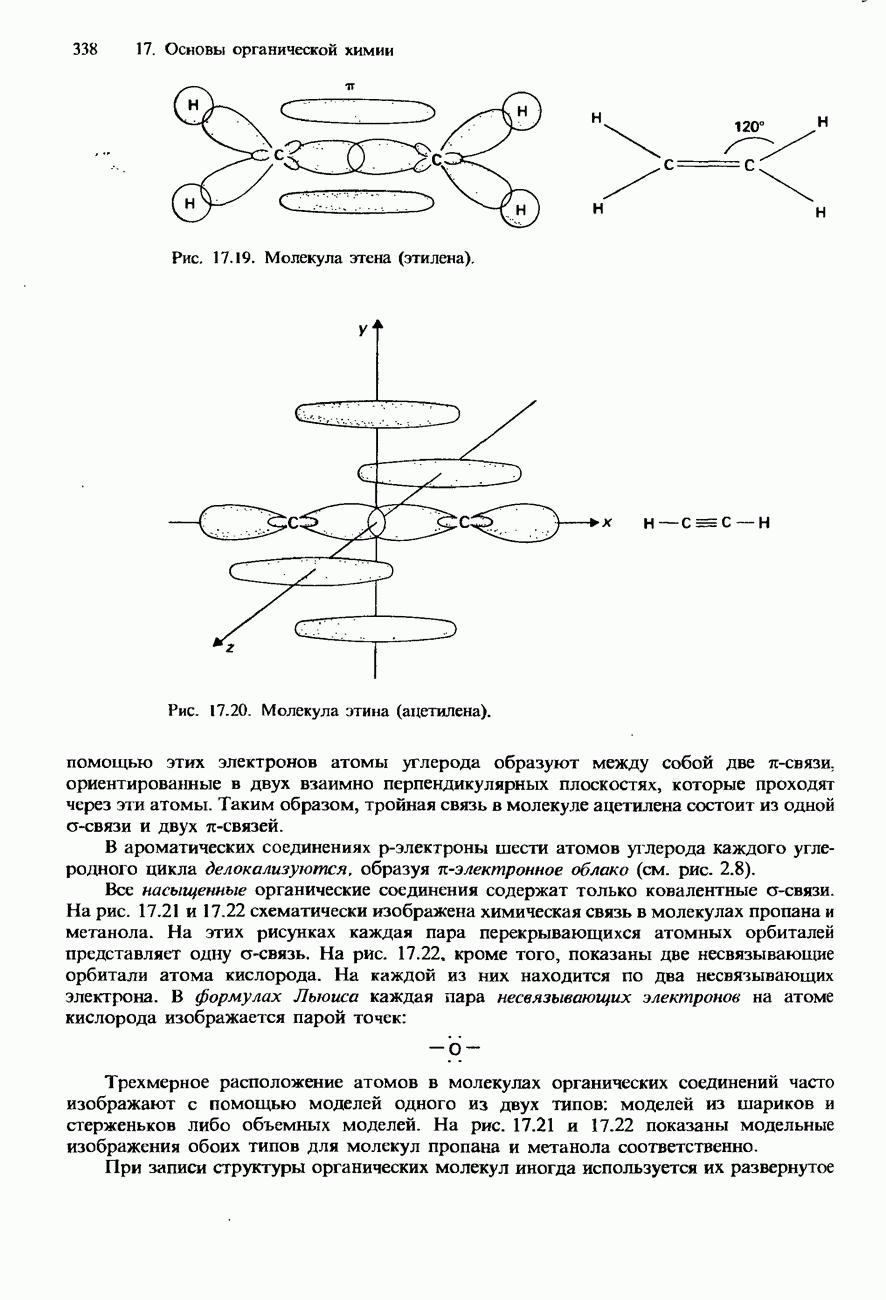
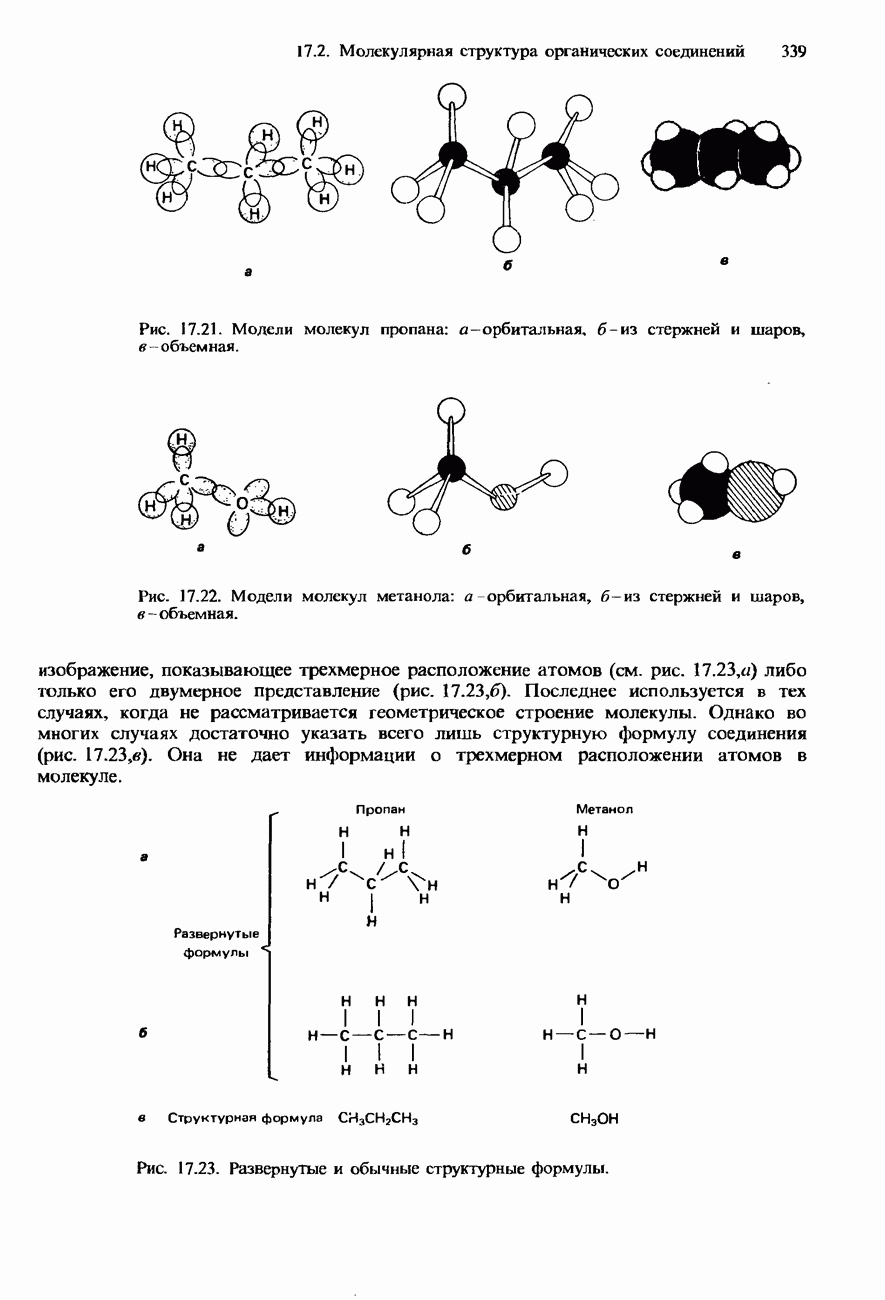
- 17.2. Молекулярная структура органических соединений
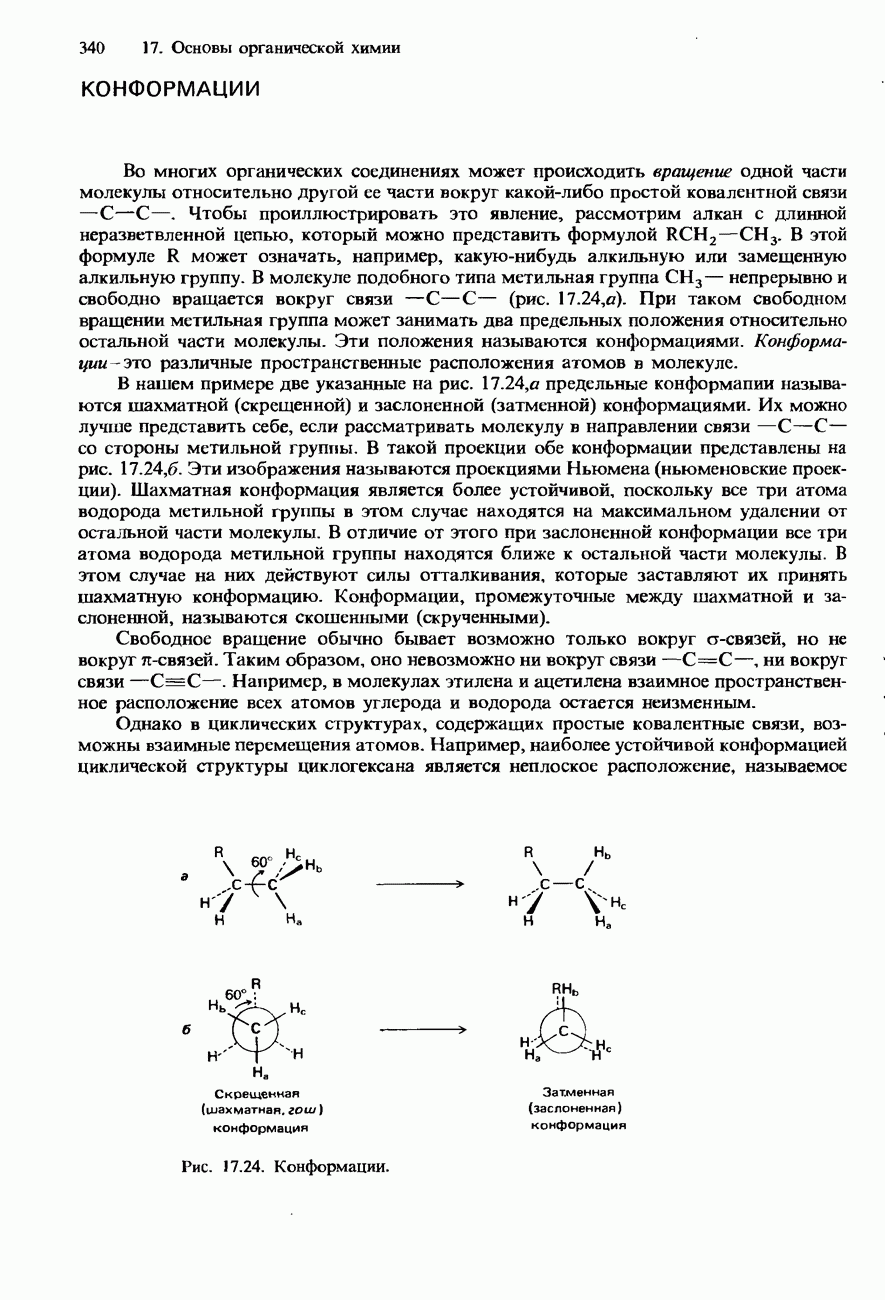
- КОНФОРМАЦИИ
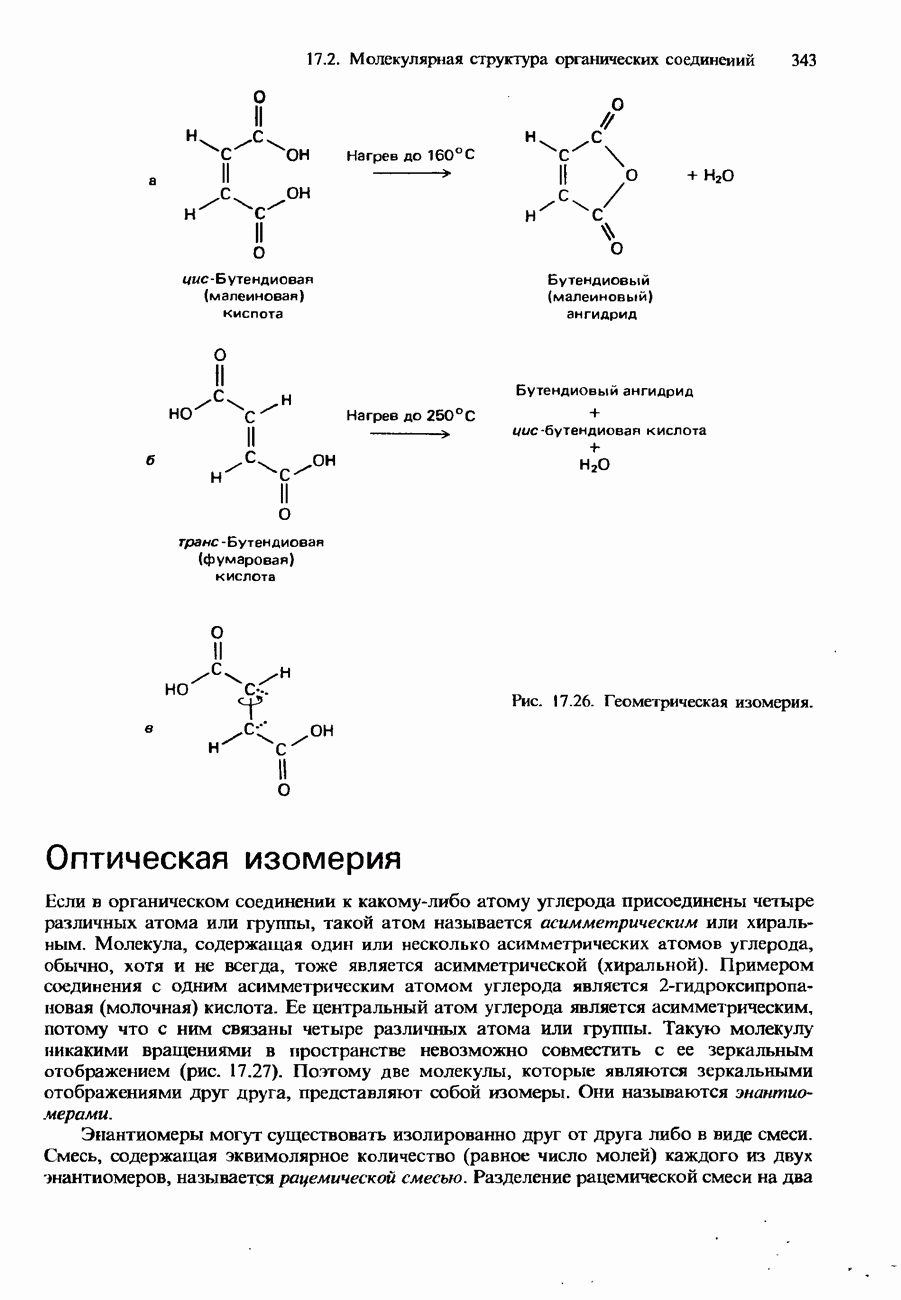
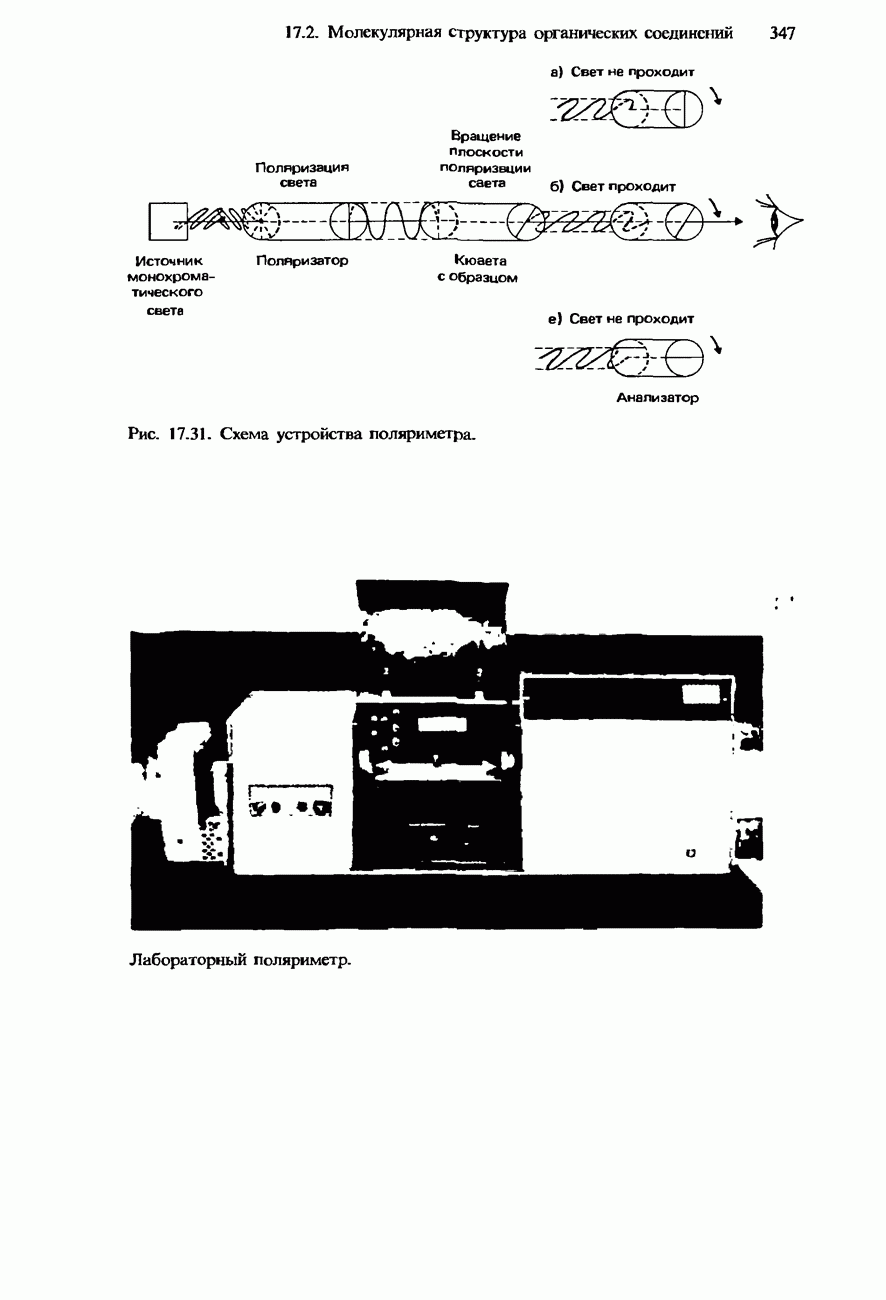
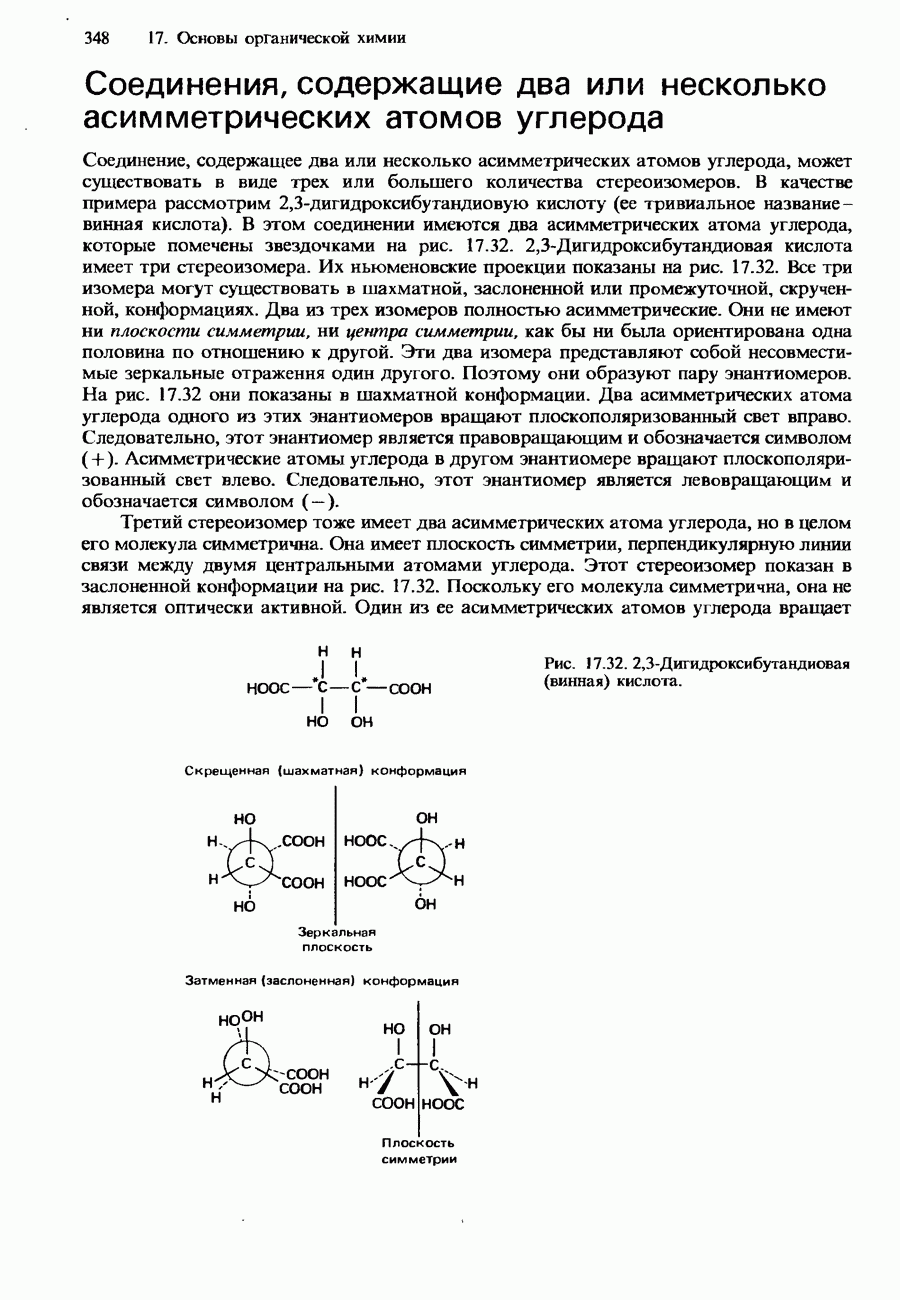
- СТЕРЕОИЗОМЕРИЯ
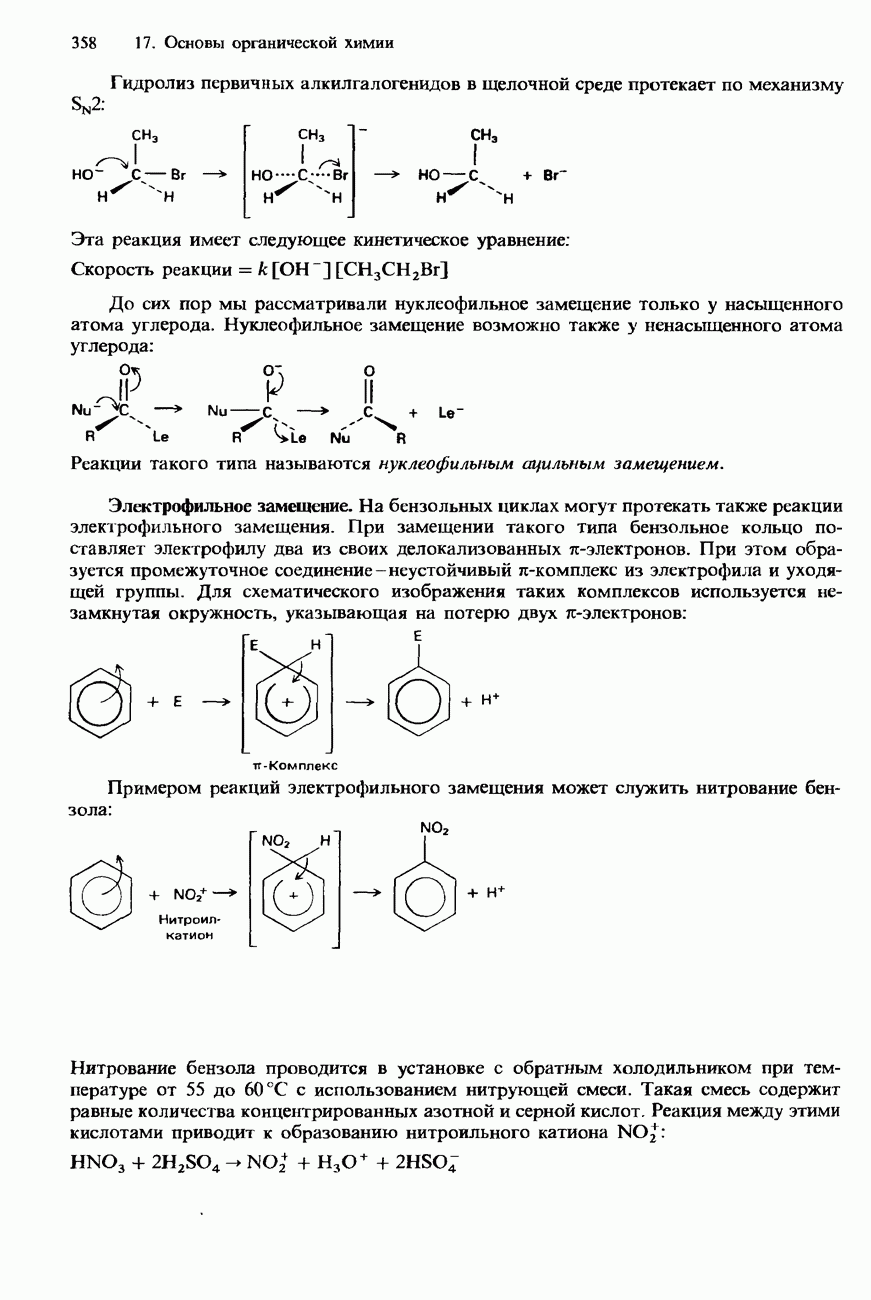
- 17.3. Механизмы органических реакций
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ
- ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 18. УГЛЕВОДОРОДЫ
- 18.1. Алифатические углеводороды
- АЛКАНЫ
- АЛКЕНЫ
- АЛКИНЫ
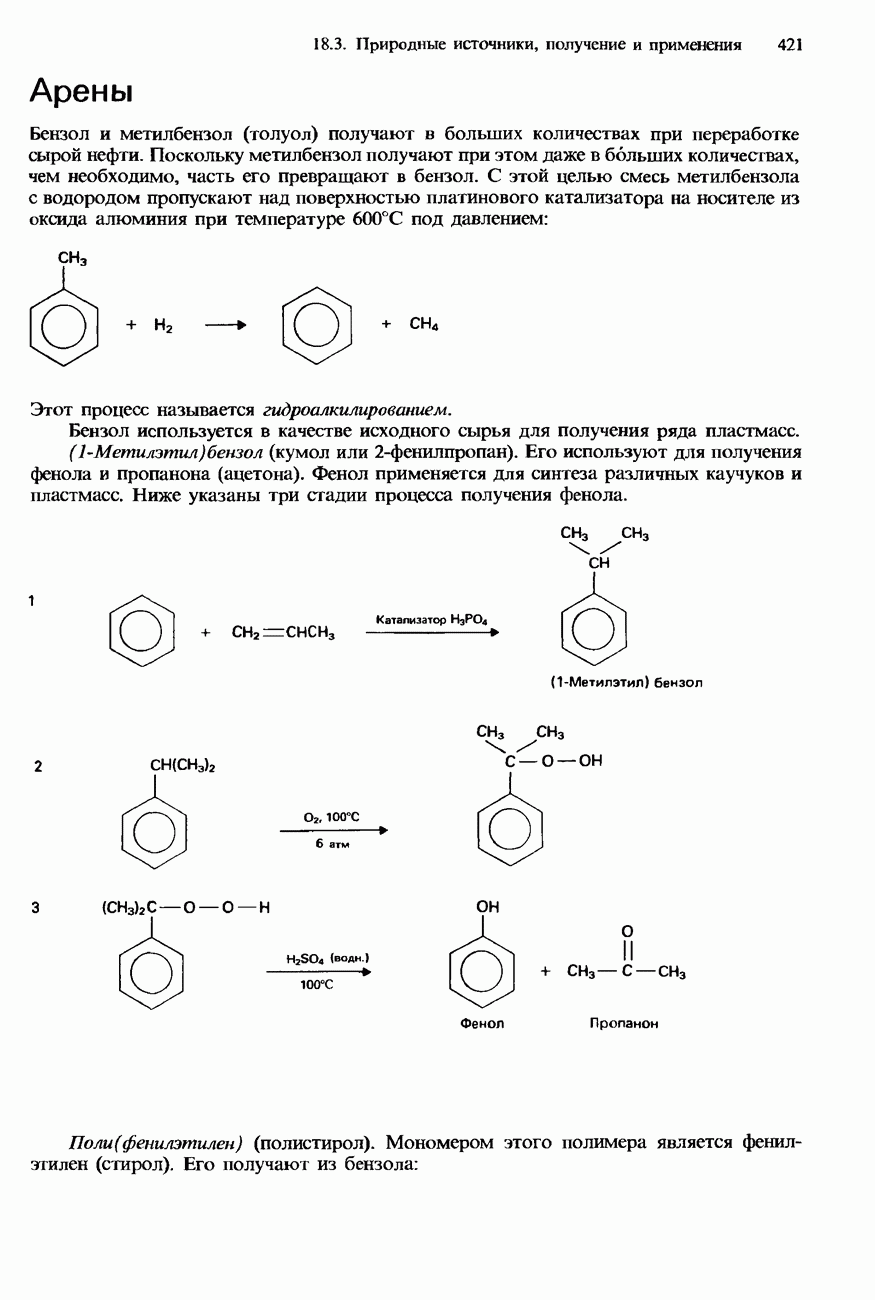
- 18.2. Арены
- БЕНЗОЛ
- МЕТИЛБЕНЗОЛ
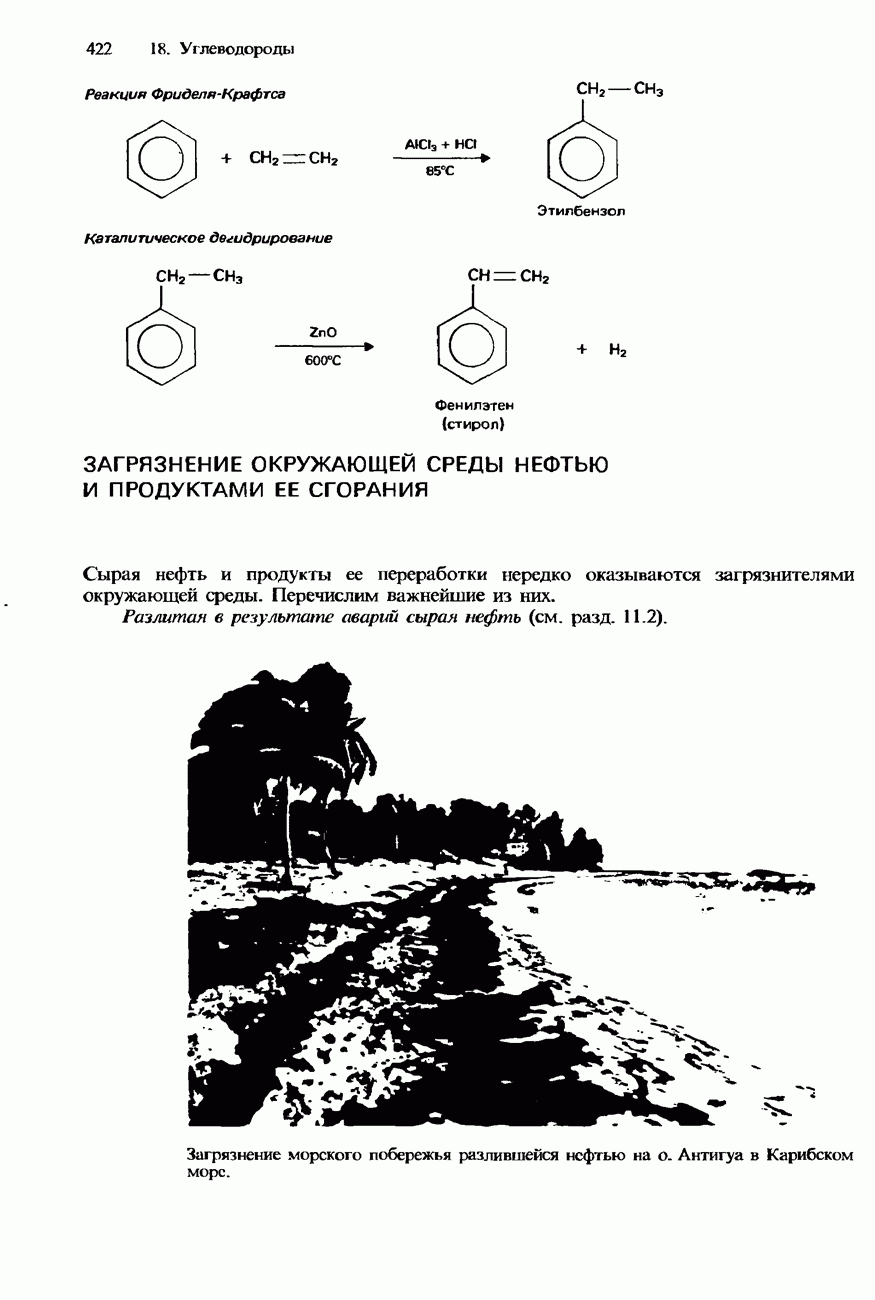
- 18.3. Природные источники, получение и применения
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ
- ПЕРЕРАБОТКА НЕФТИ
- ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ
- ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
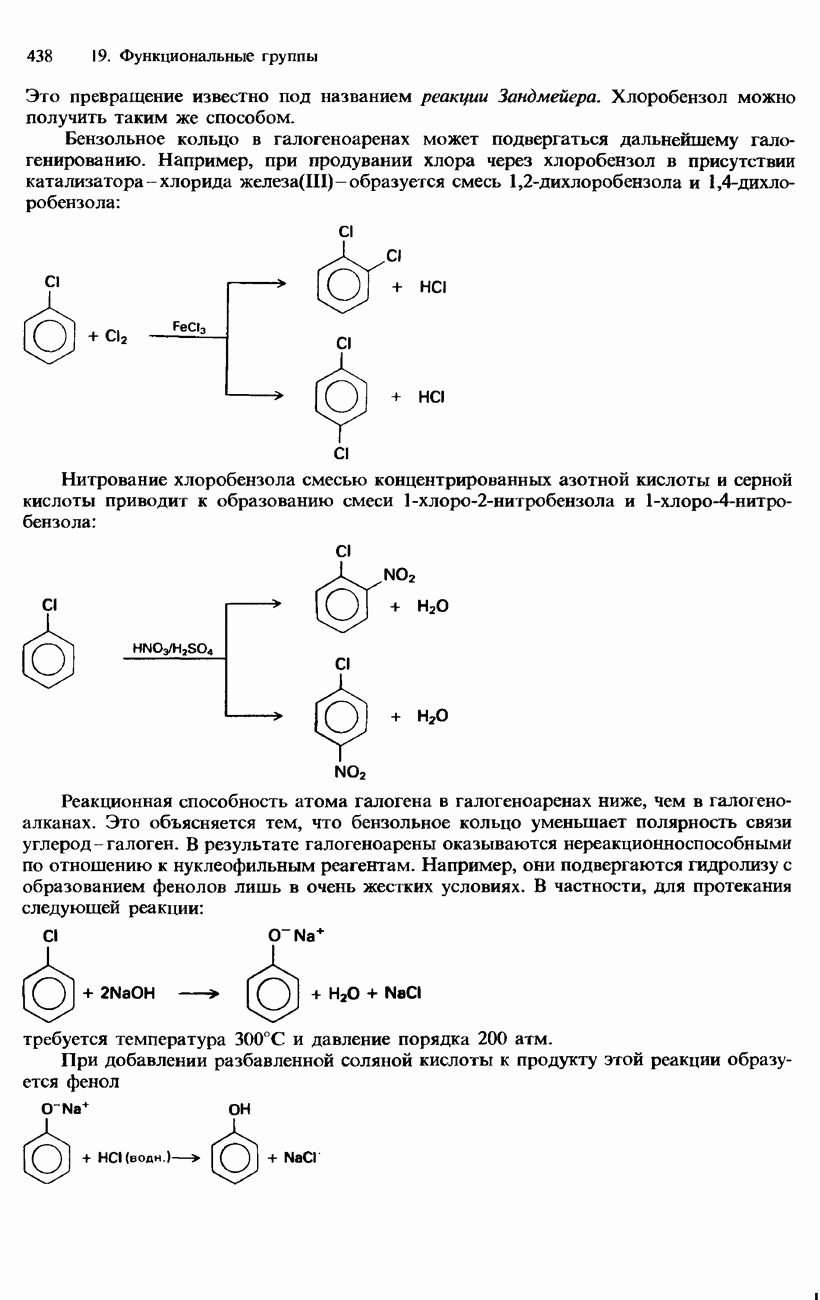
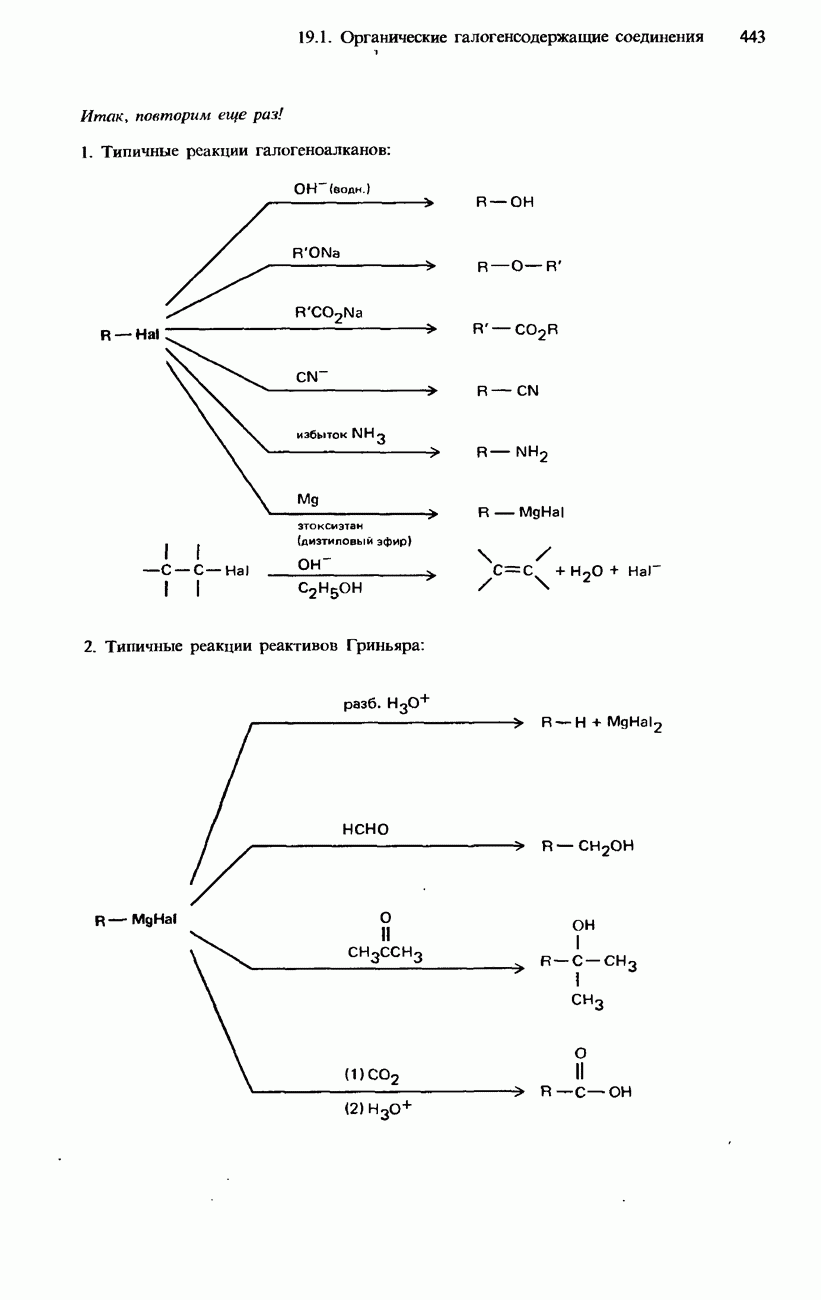
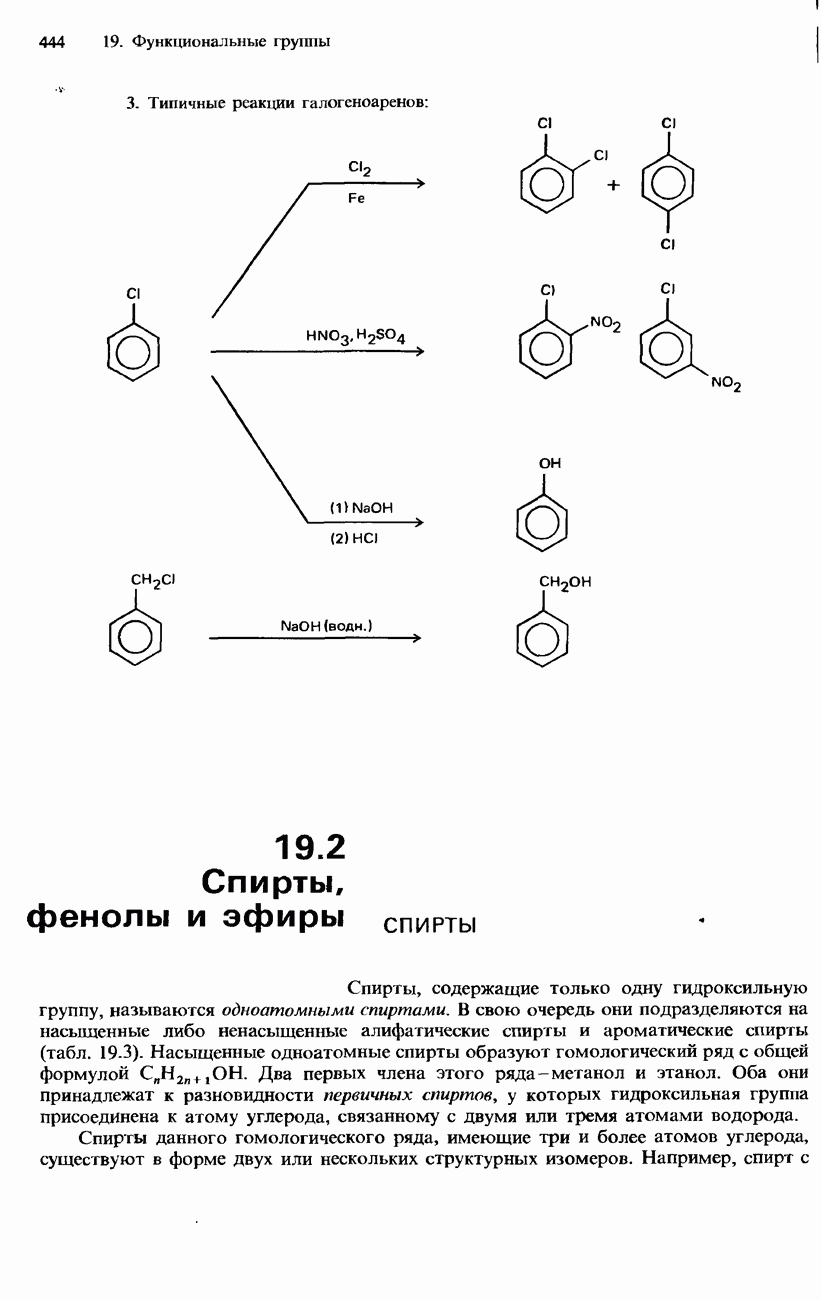
- 19.1. Органические галогенсодержащие соединения
- ГАЛОГЕНОАЛКЕНЫ
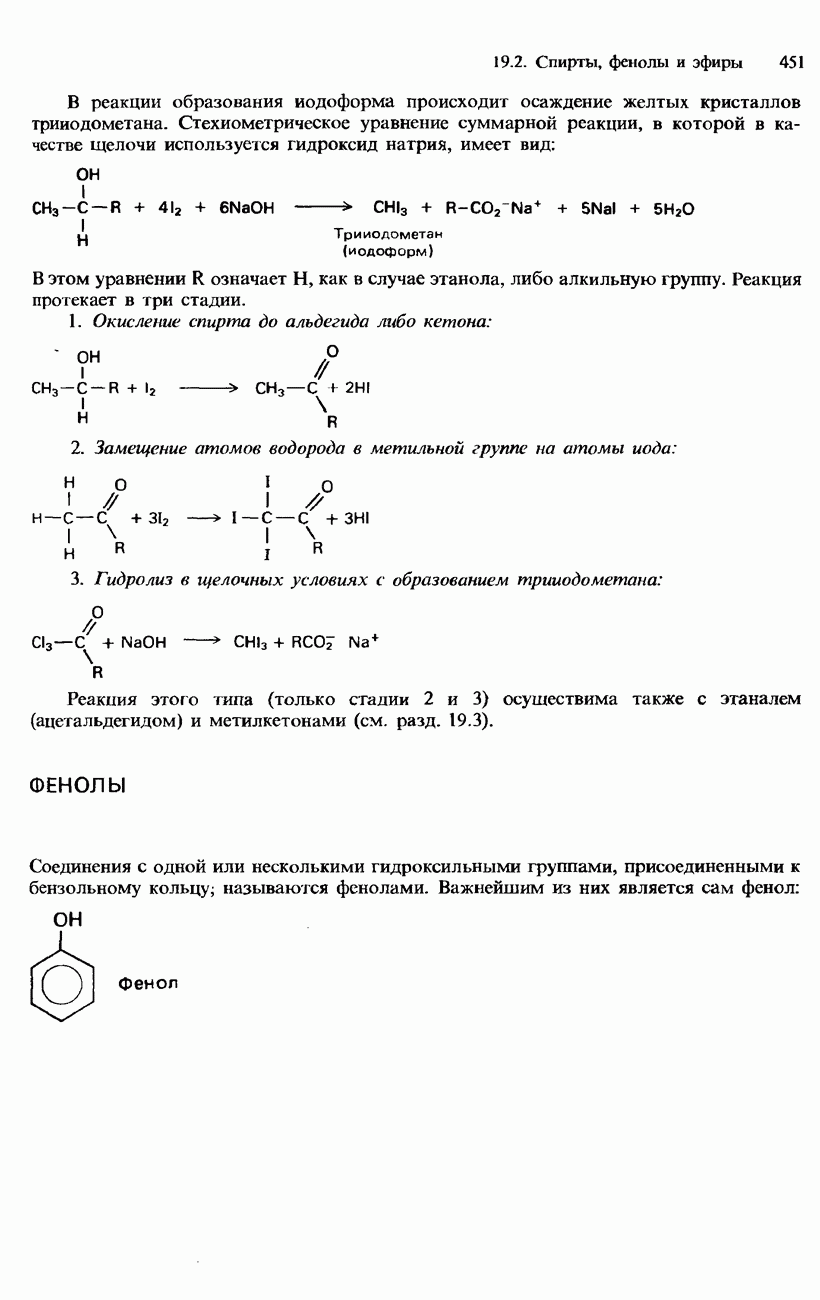
- ГАЛОГЕНОАРЕНЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
- 19.2. Спирты, фенолы и эфиры
- ФЕНОЛЫ
- ПРОСТЫЕ ЭФИРЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ
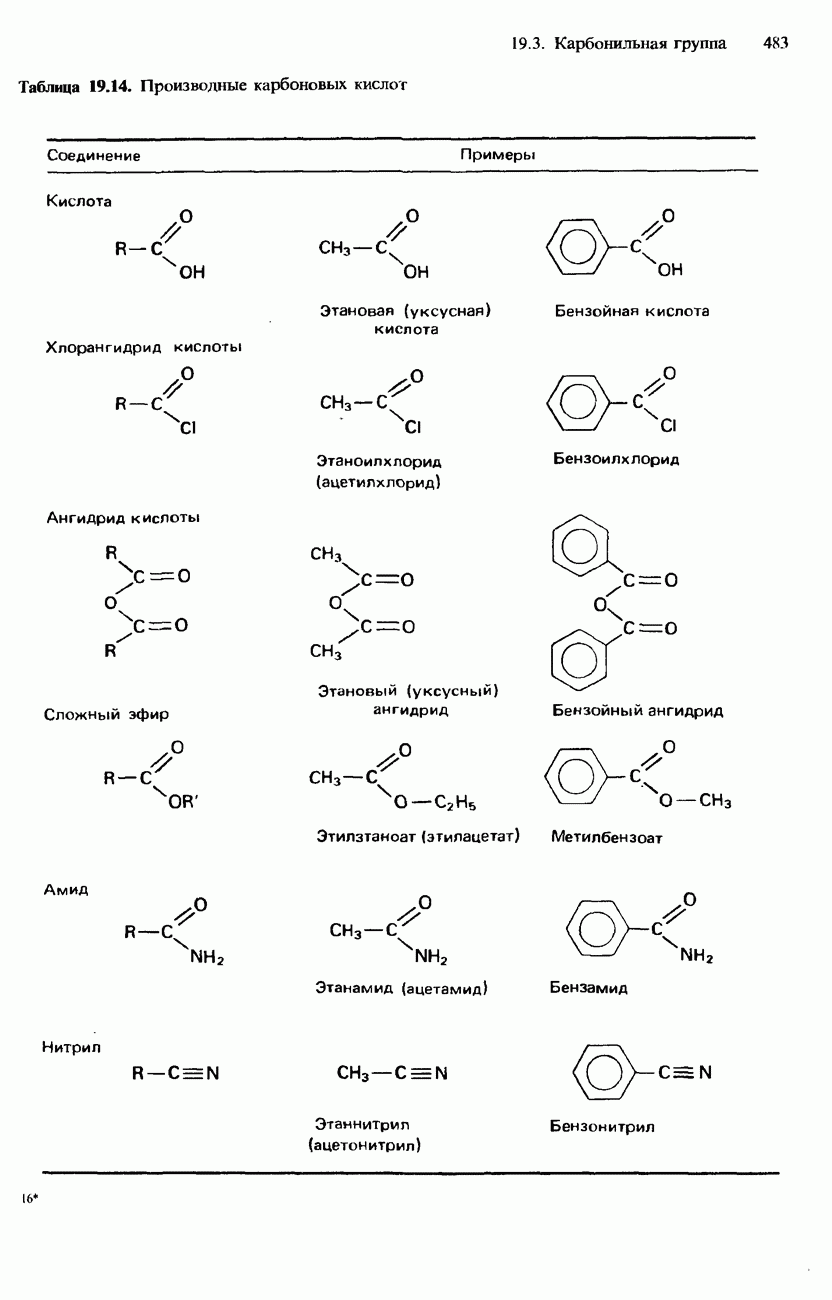
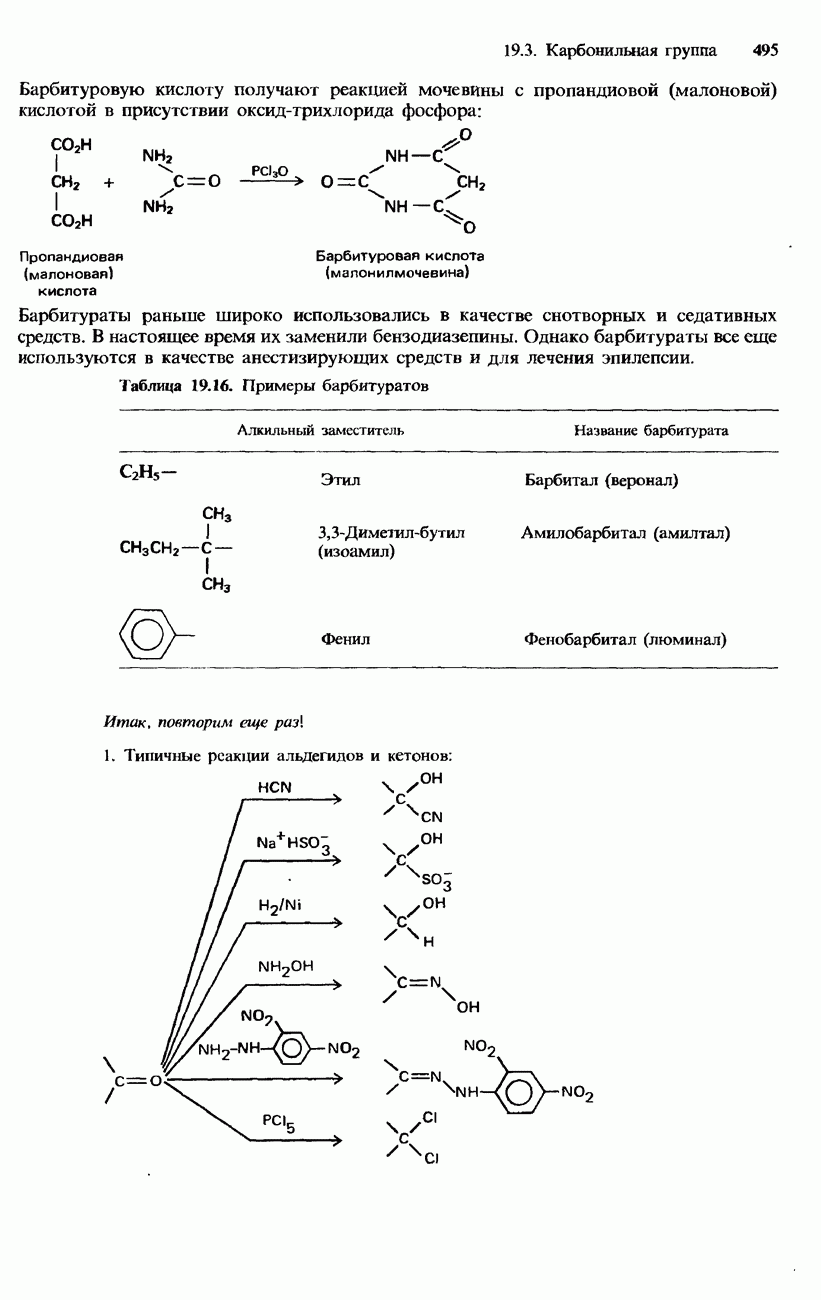
- 19.3. Карбонильная группа
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
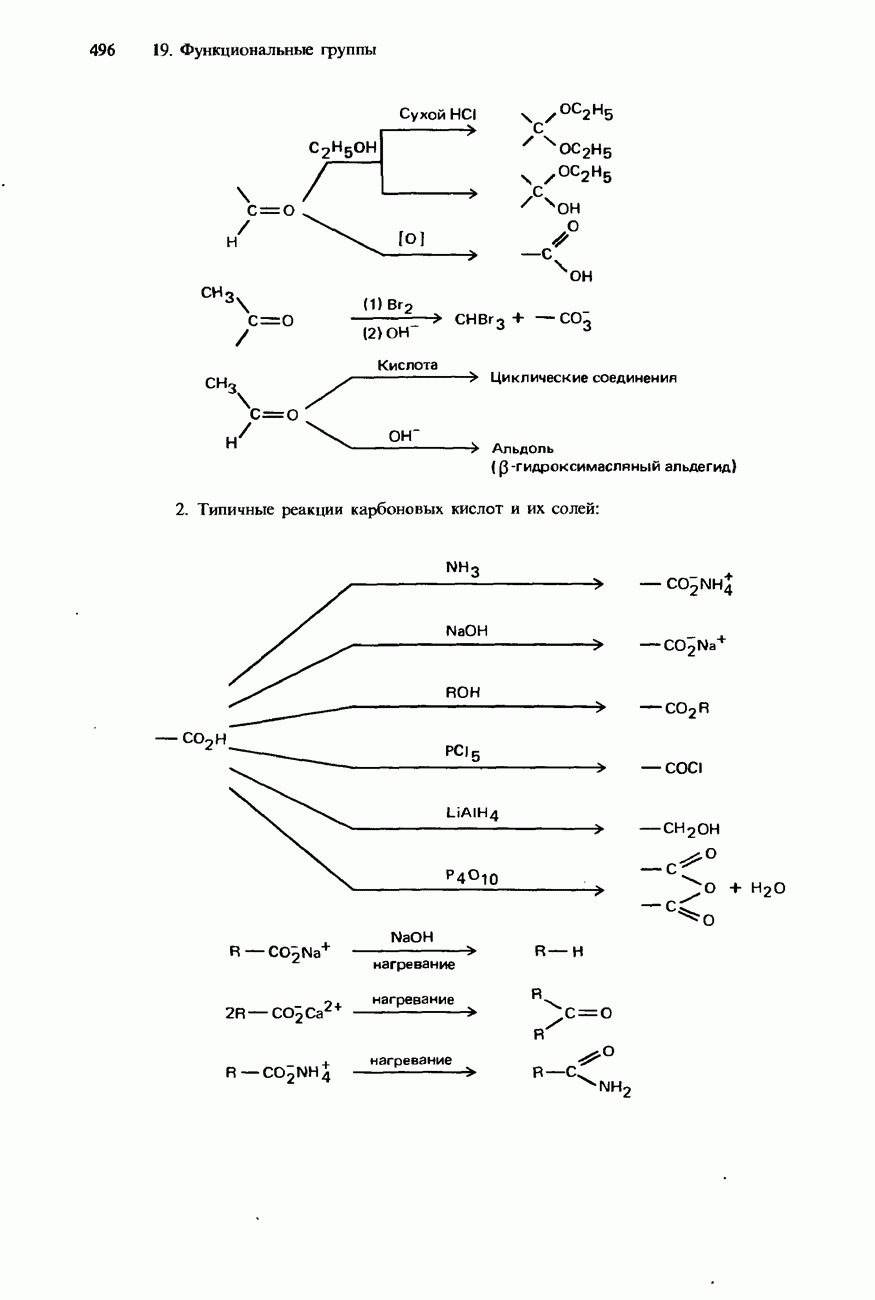
- КАРБОНОВЫЕ КИСЛОТЫ
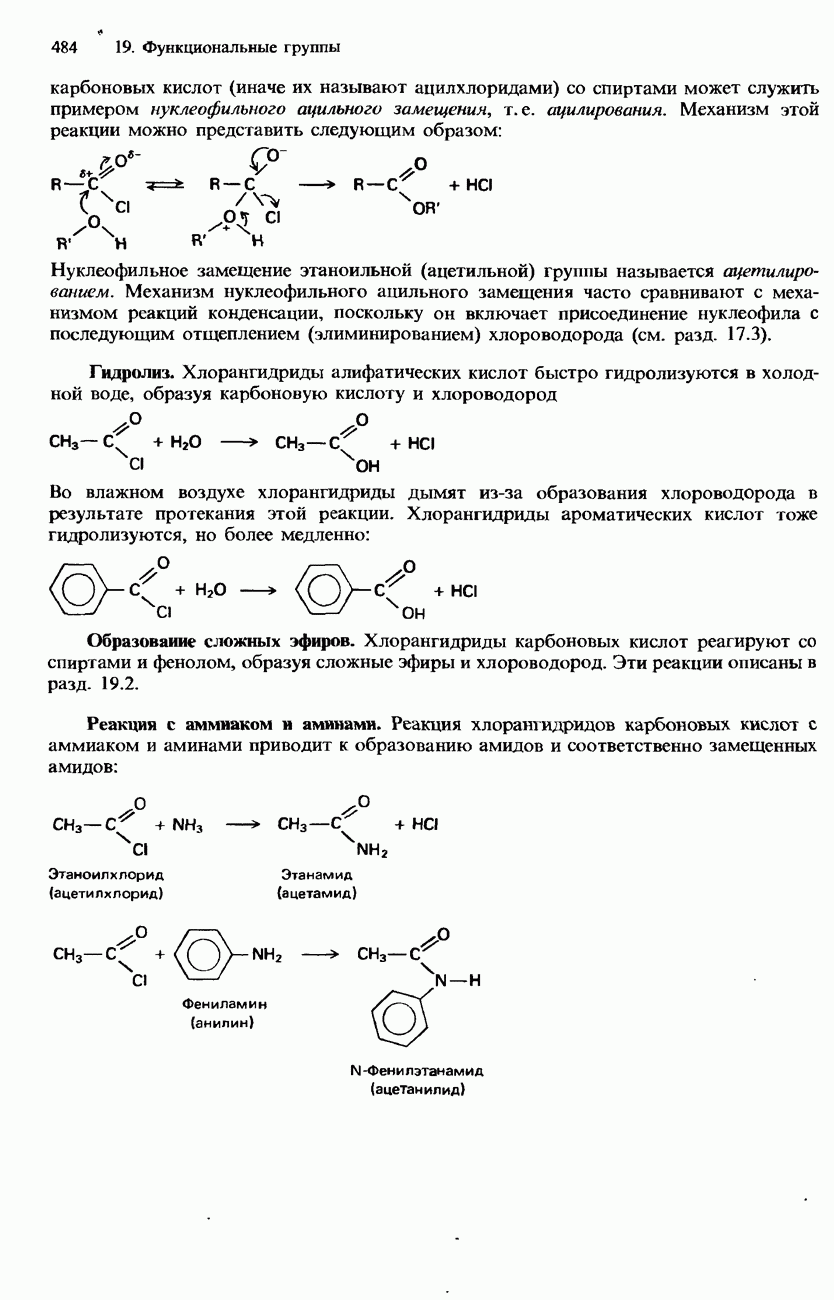
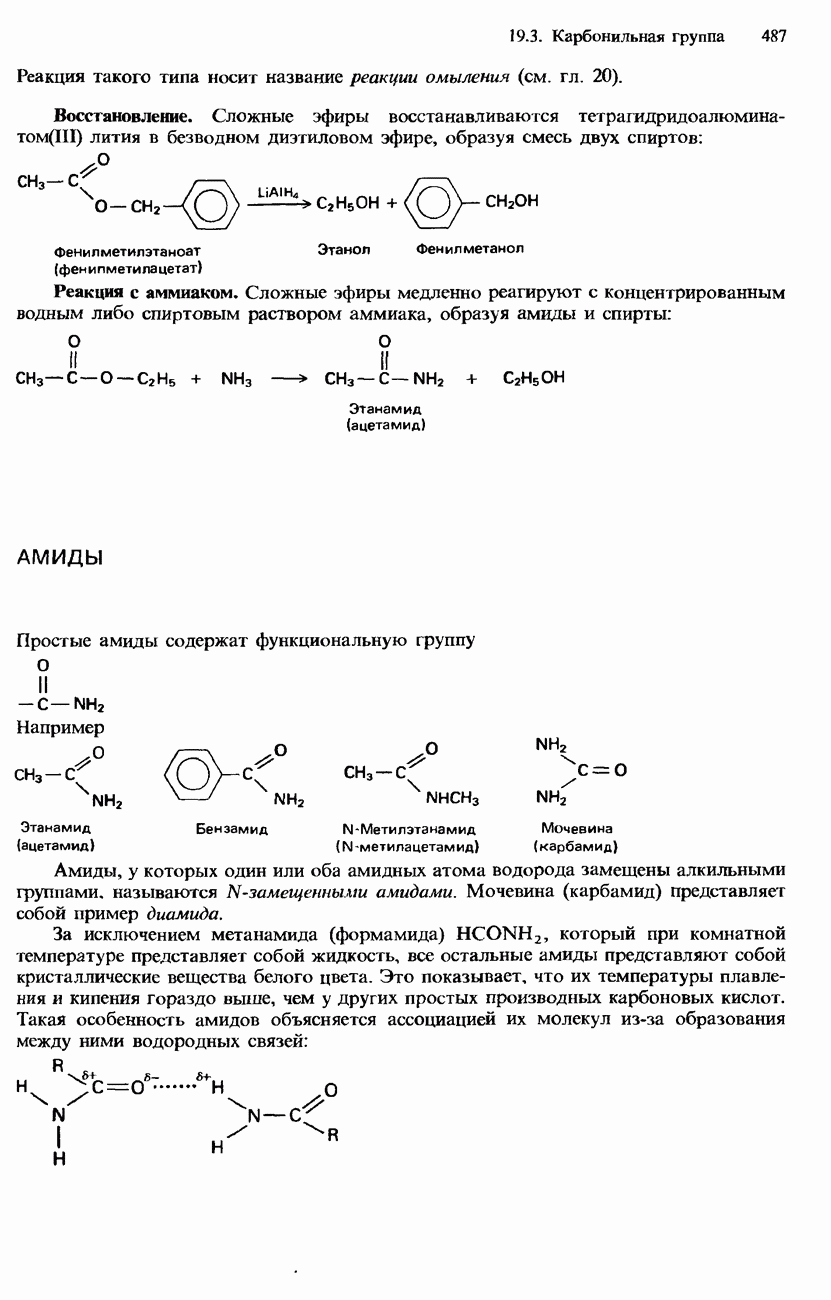
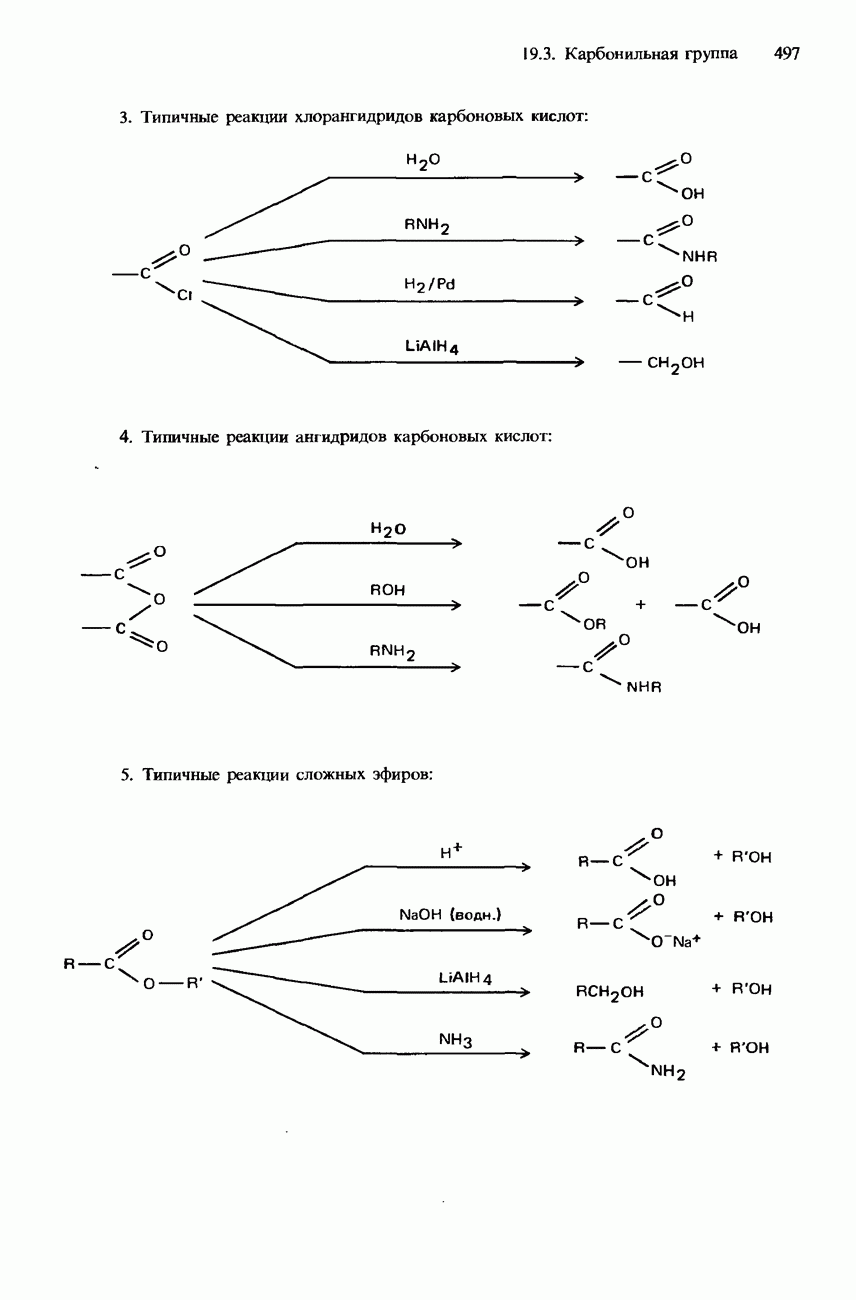
- ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
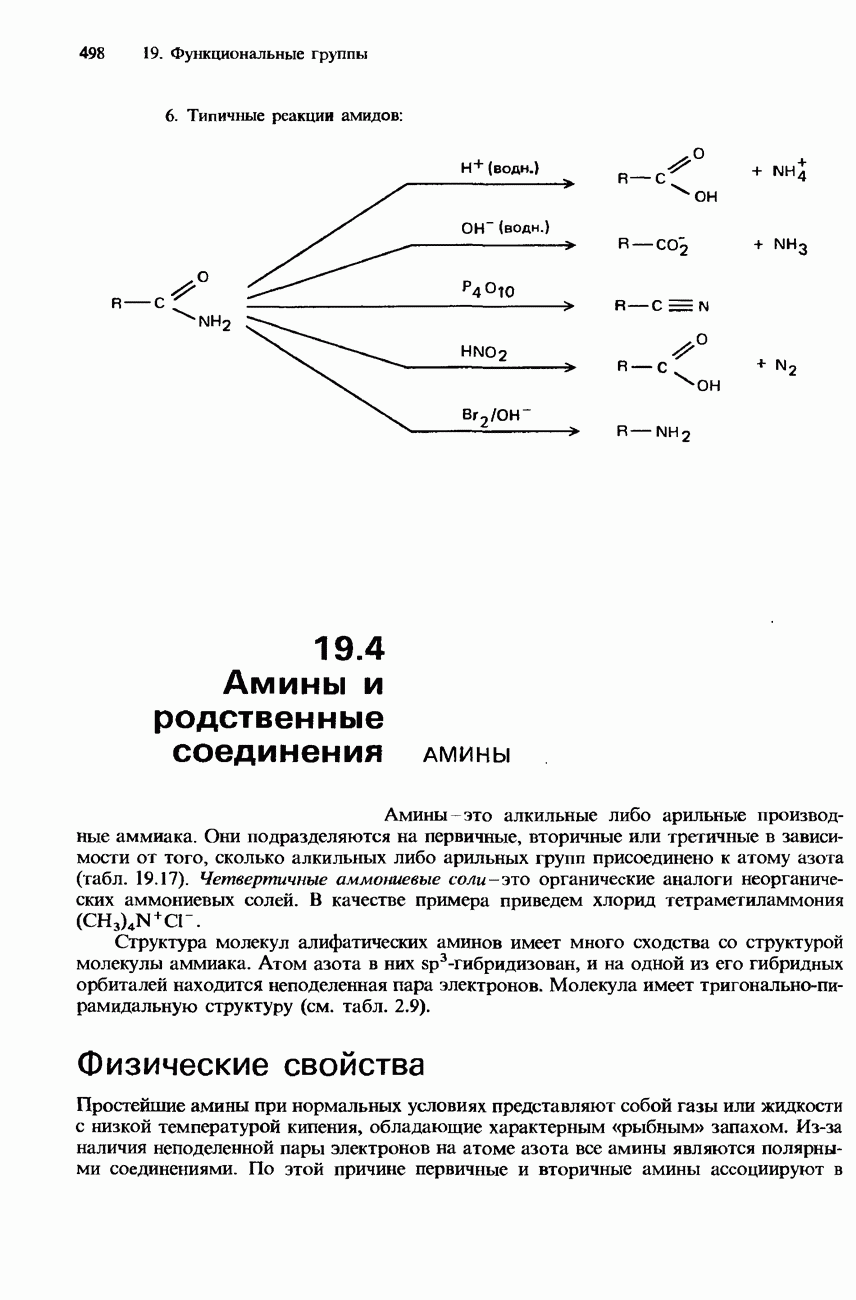
- АМИДЫ
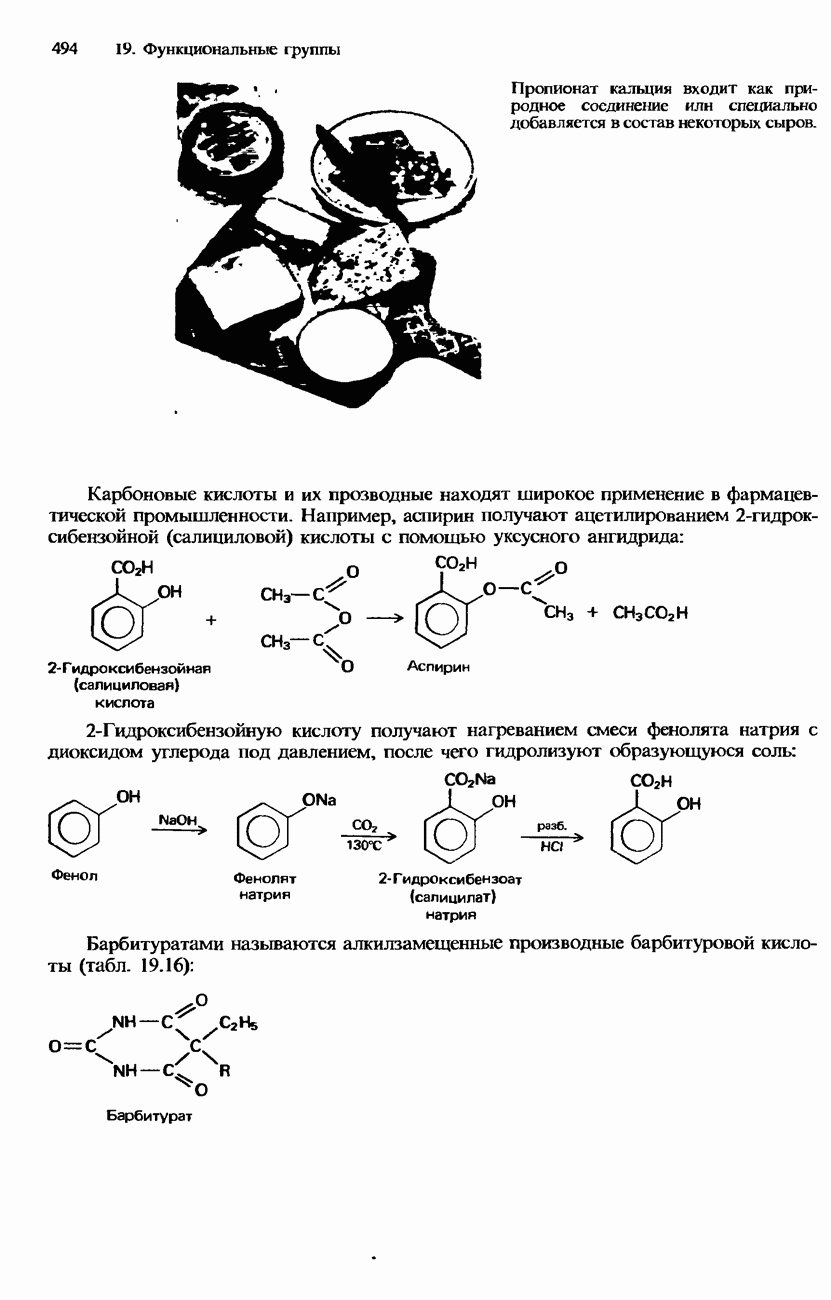
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ
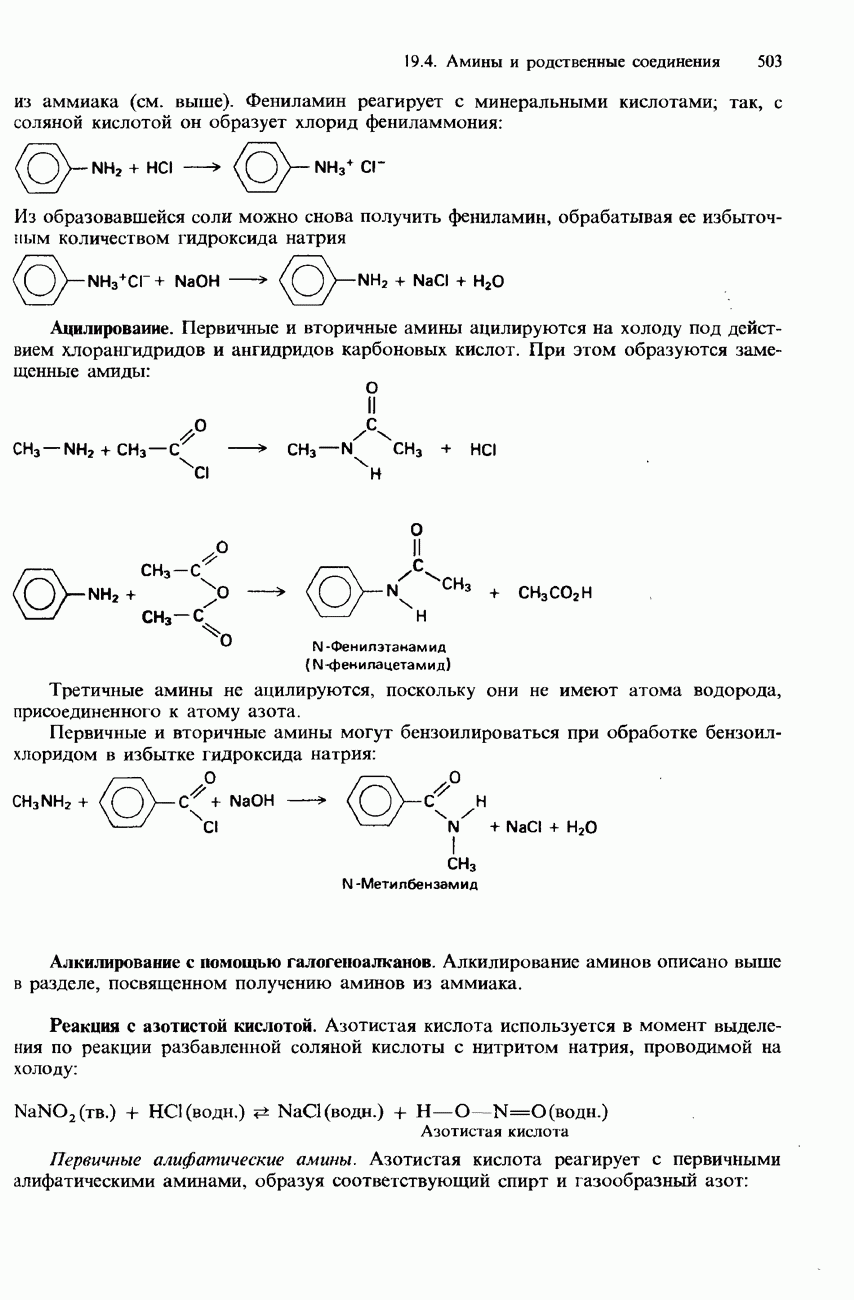
- 19.4 Амины и родственные соединения
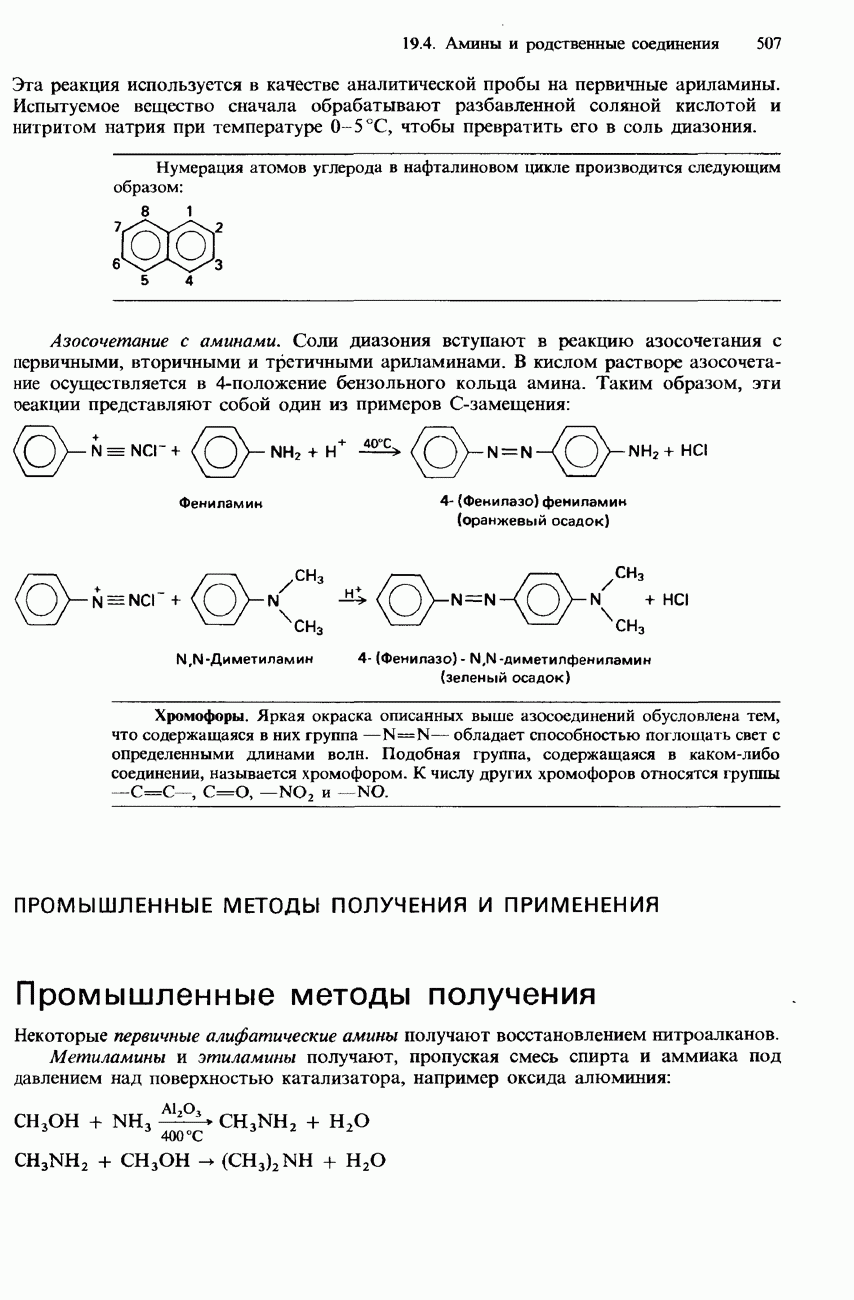
- СОЛИ ДИАЗОНИЯ
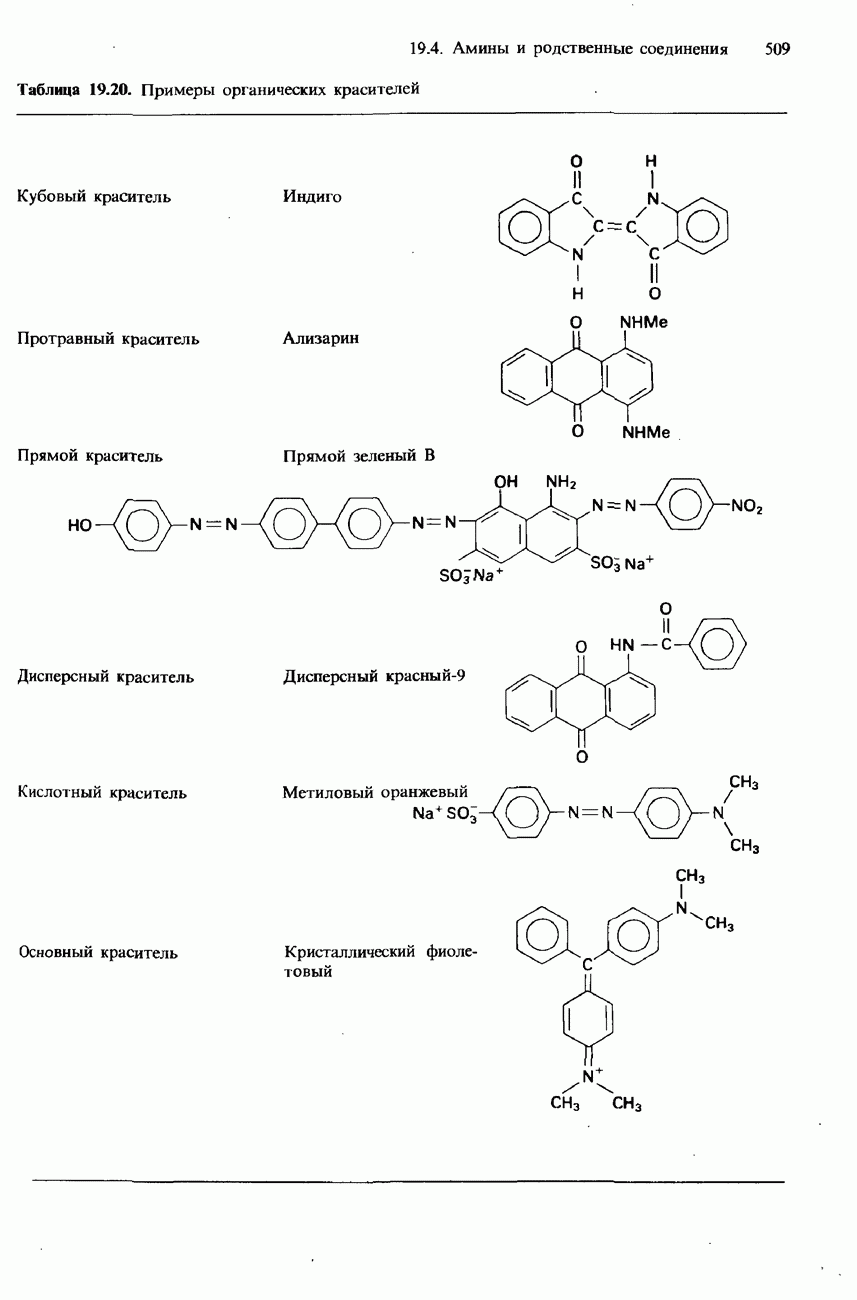
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ
- 20.1. Аминокислоты, пептиды и белки
- АМИНОКИСЛОТЫ
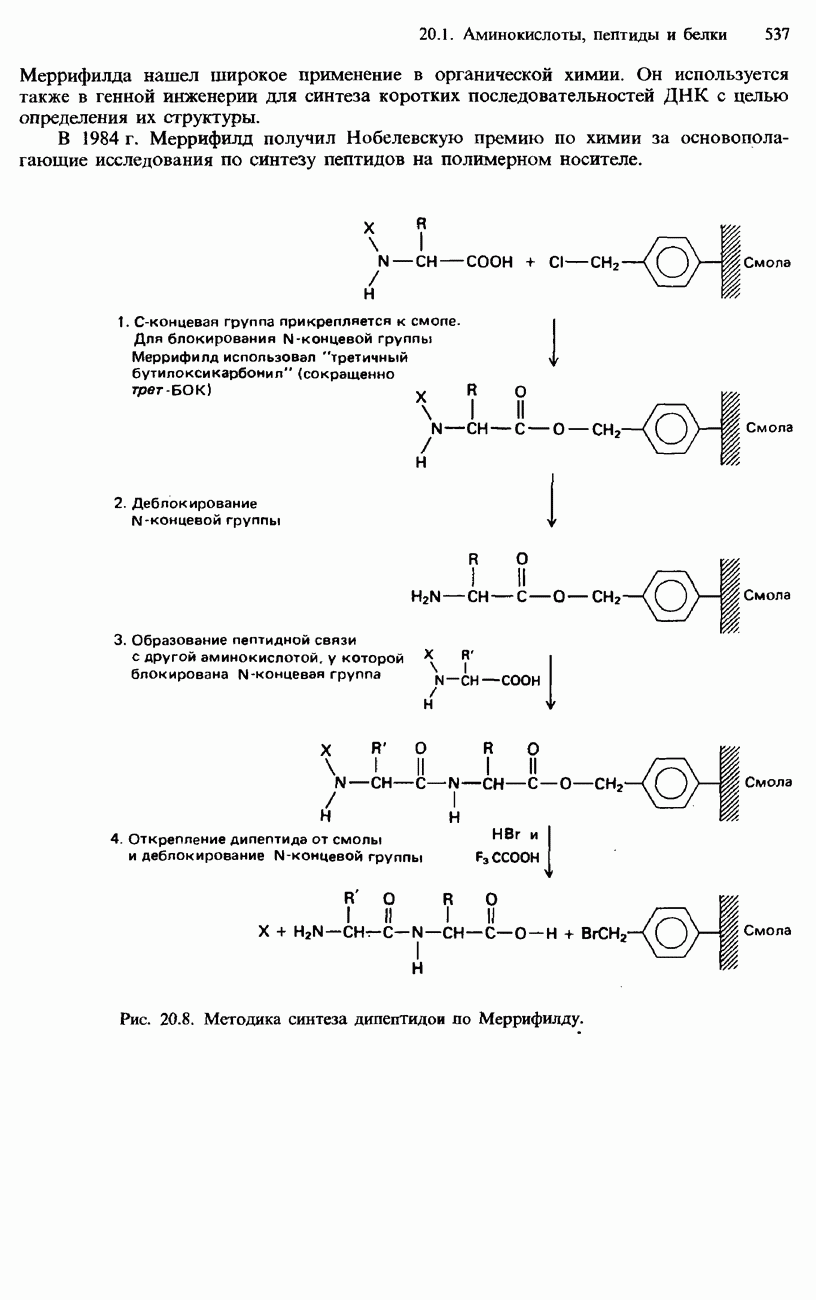
- ПЕПТИДЫ
- БЕЛКИ
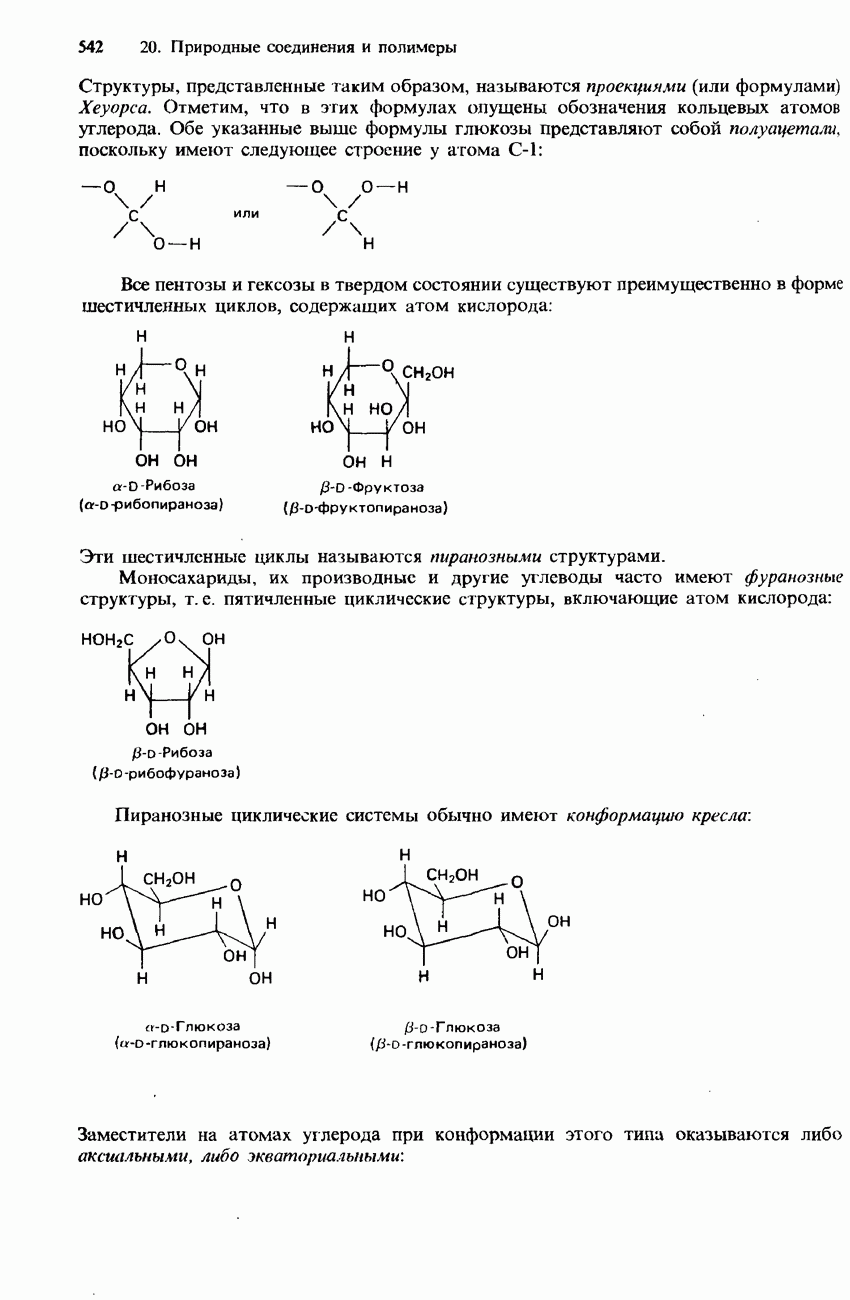
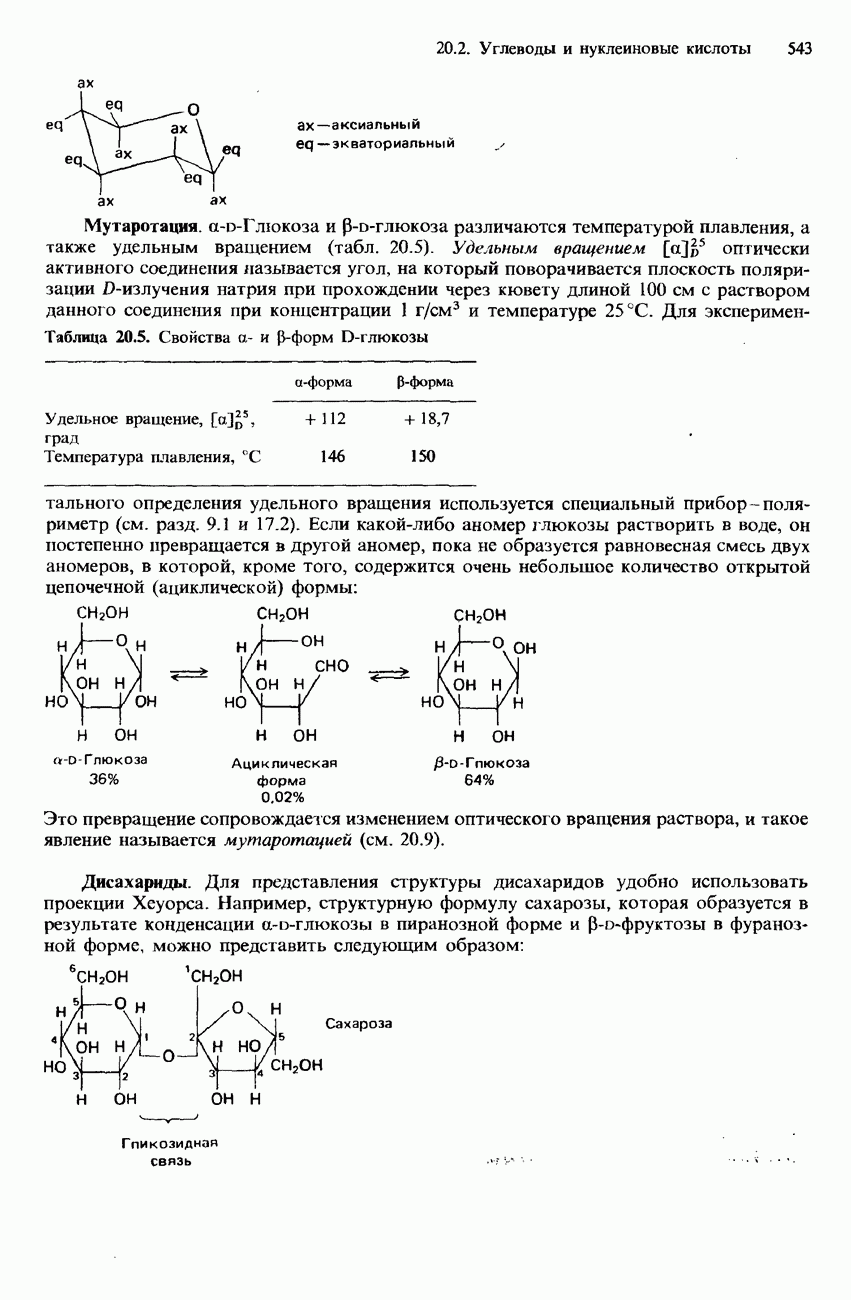
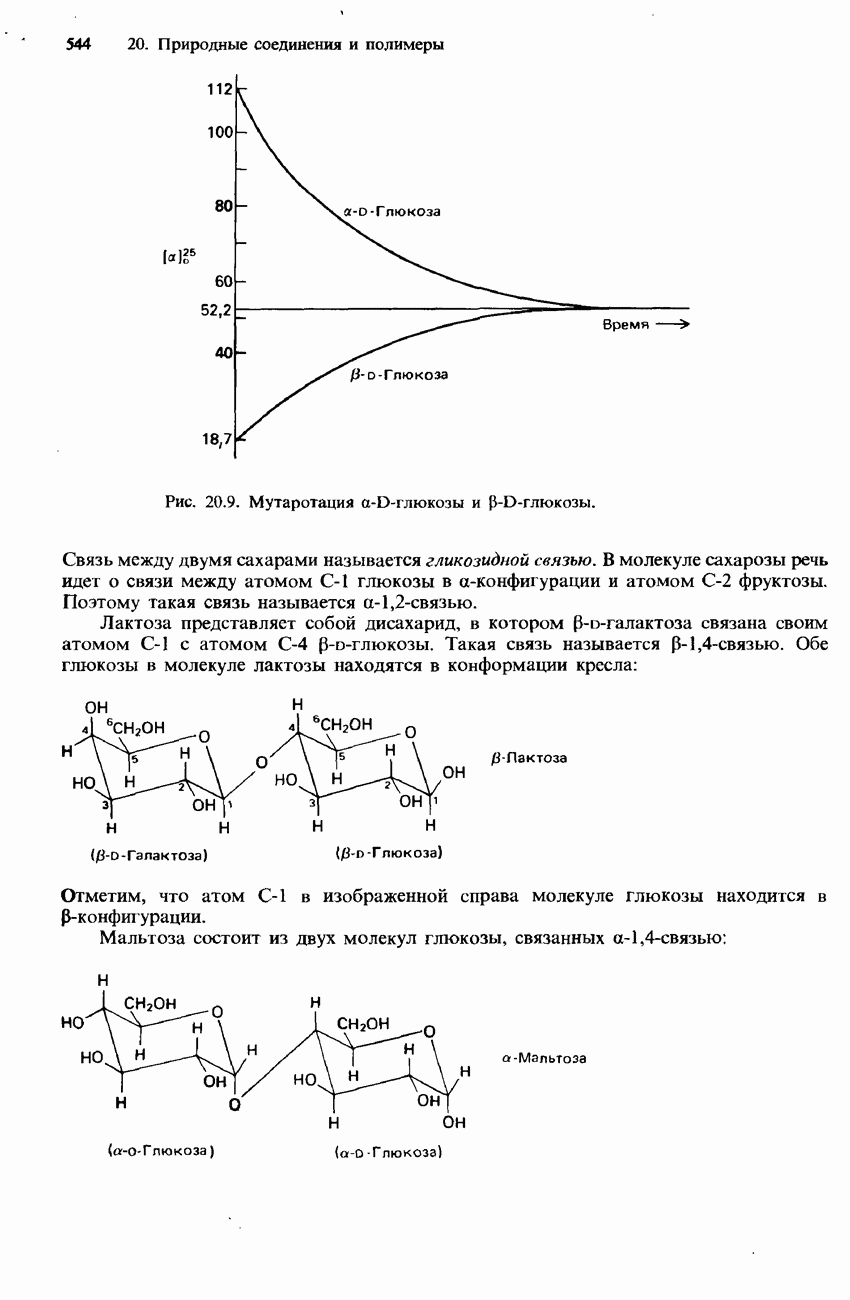
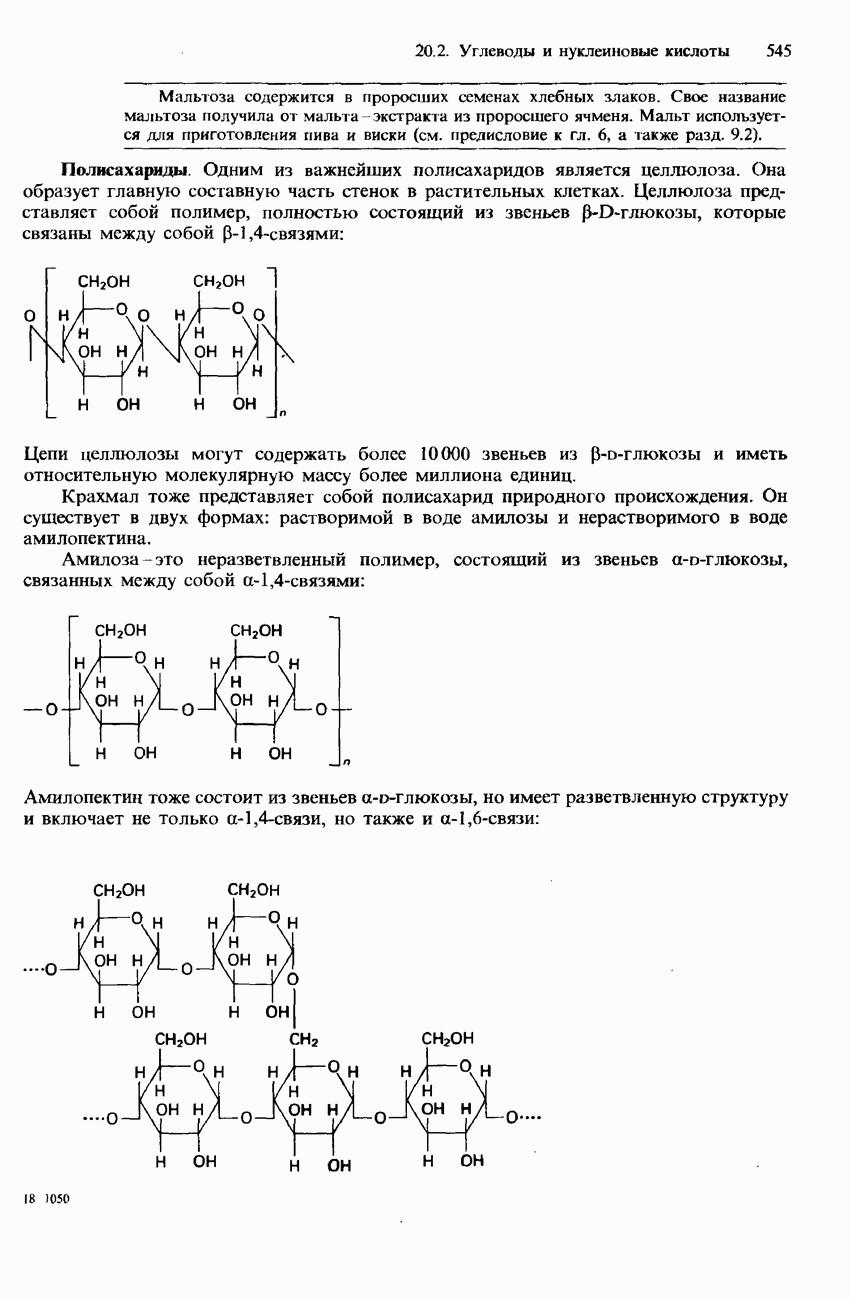
- 20.2. Углеводы и нуклеиновые кислоты
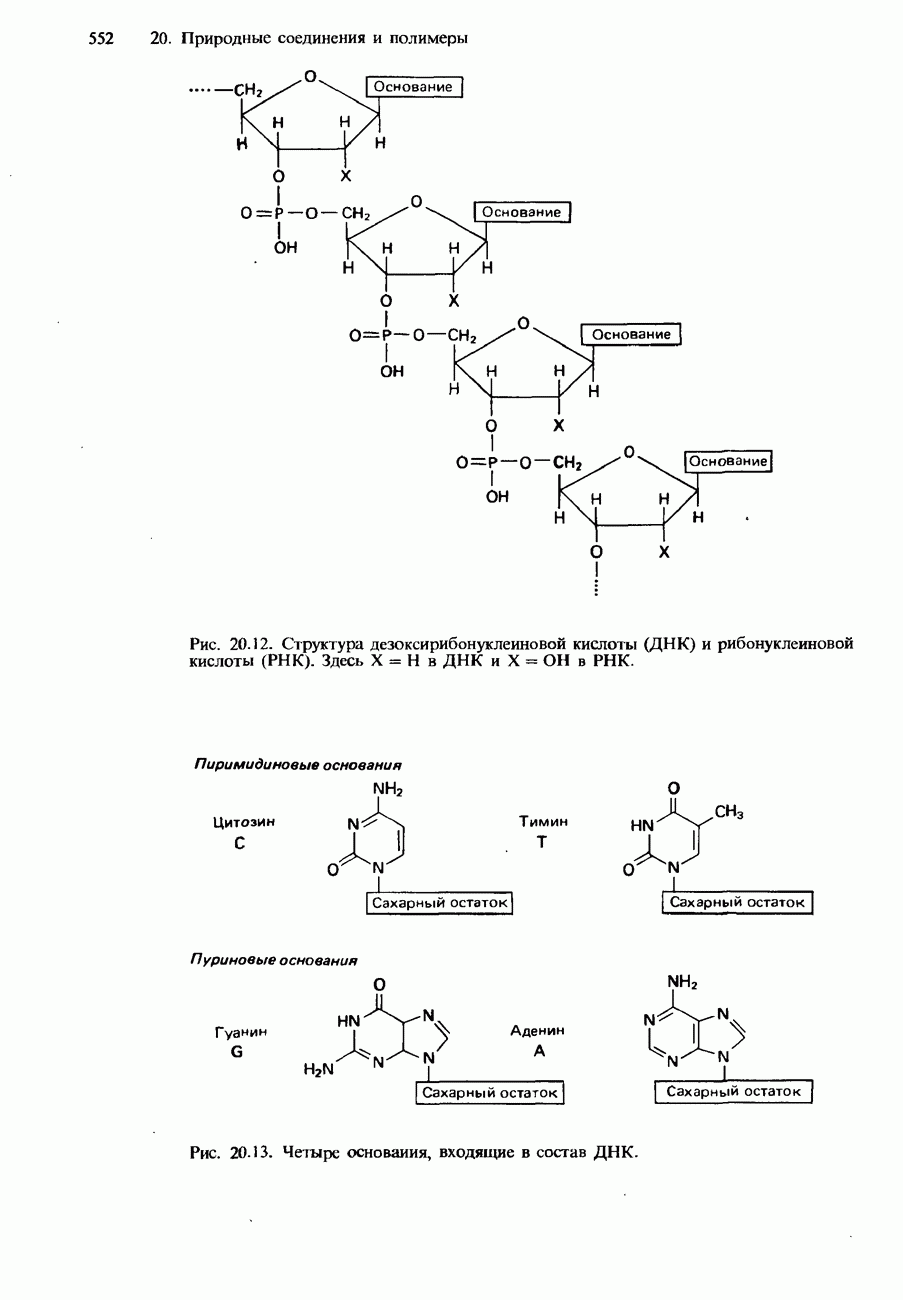
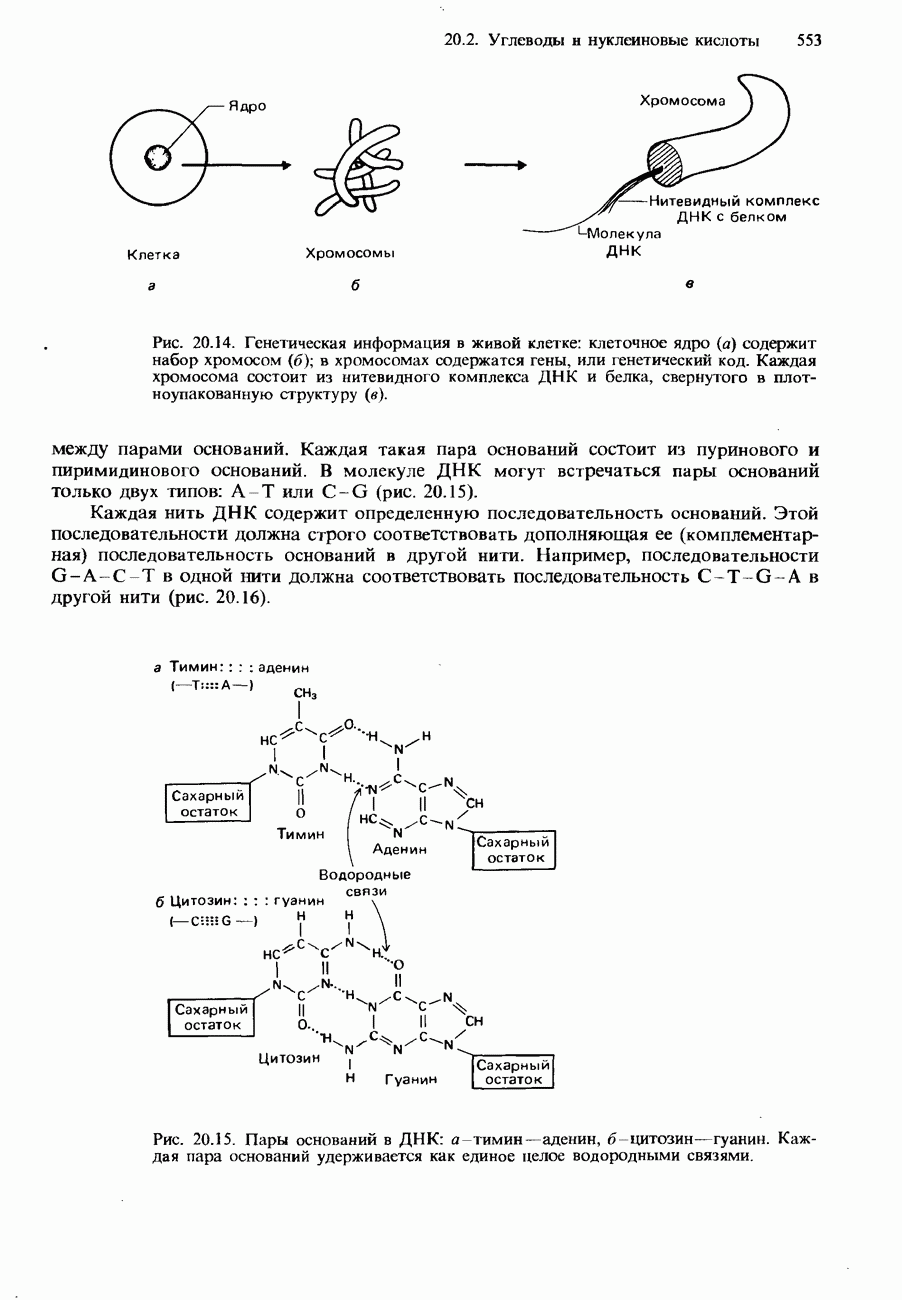
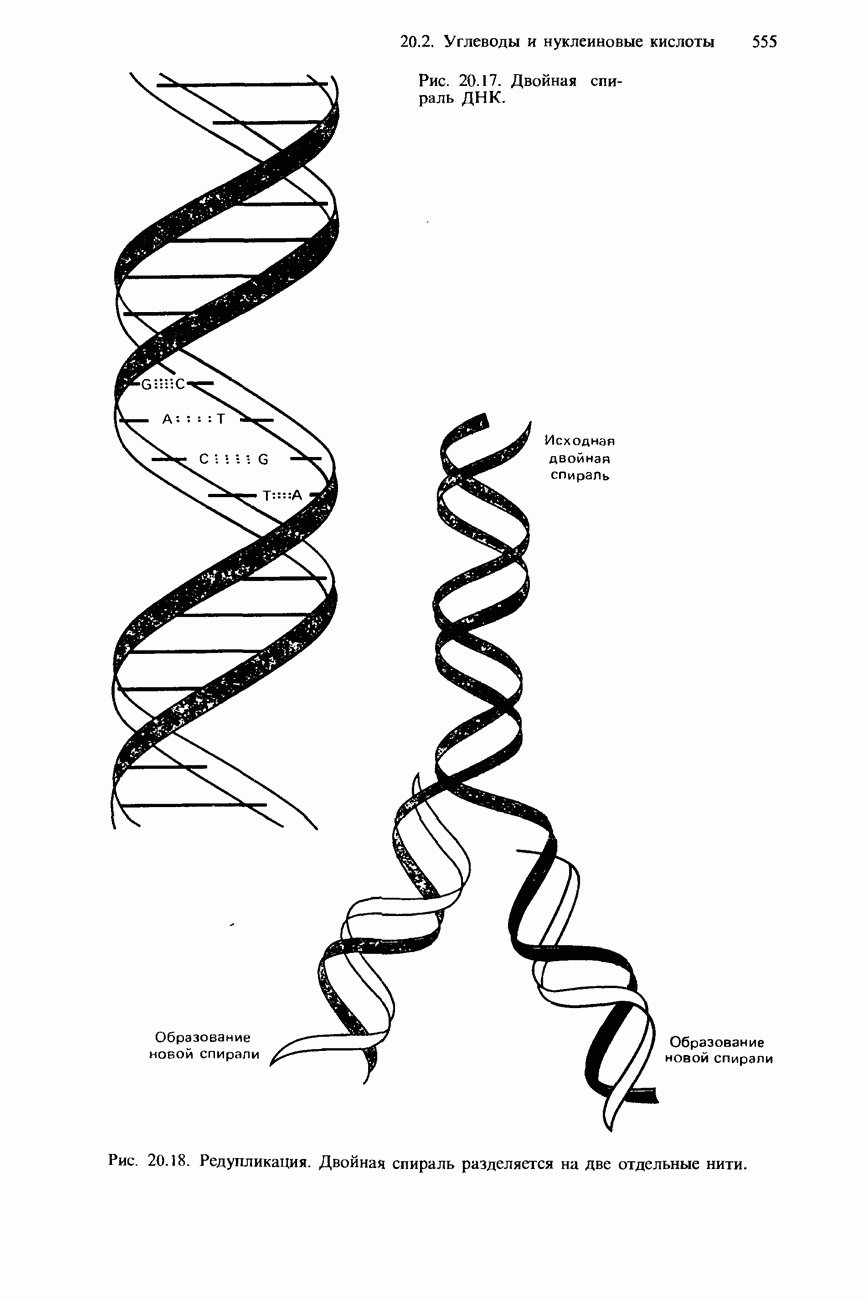
- НУКЛЕИНОВЫЕ КИСЛОТЫ
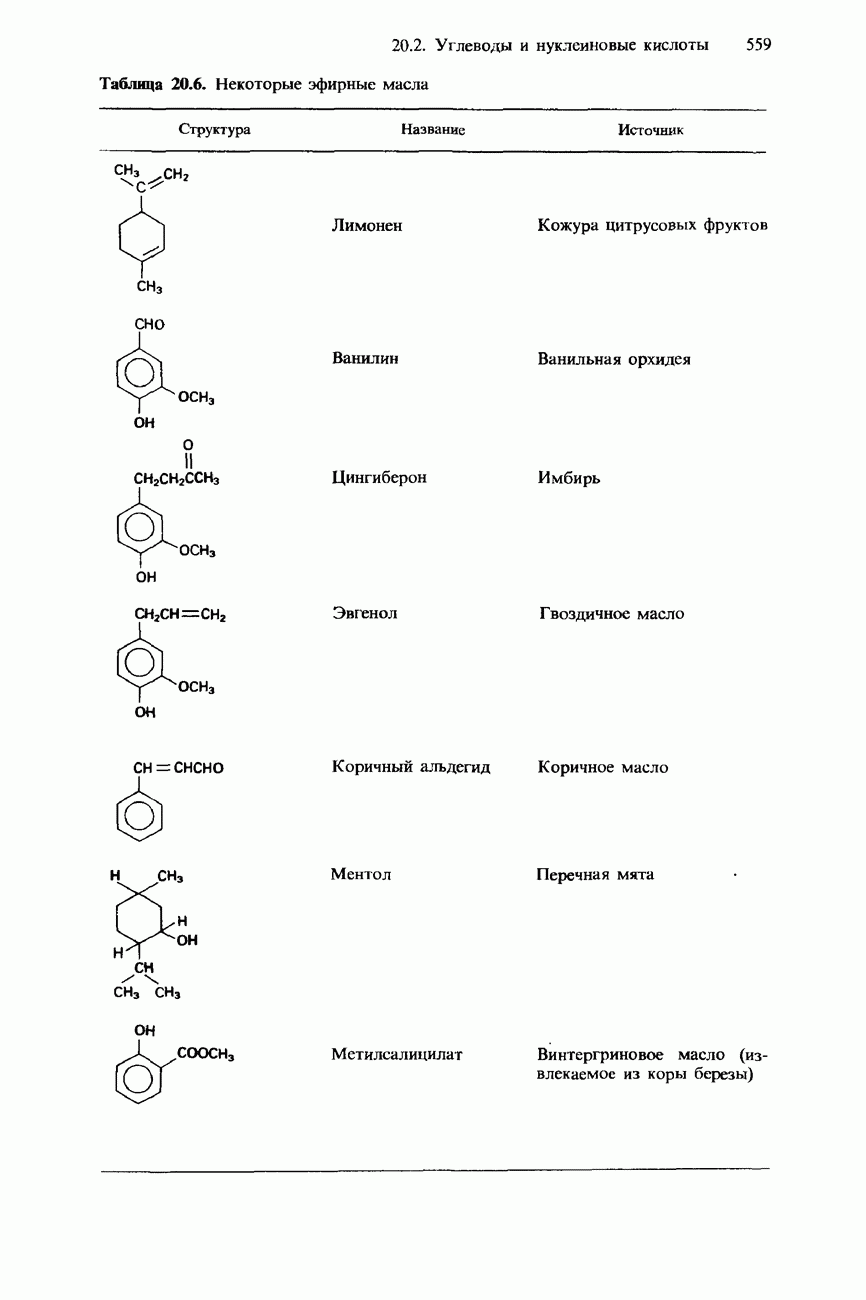
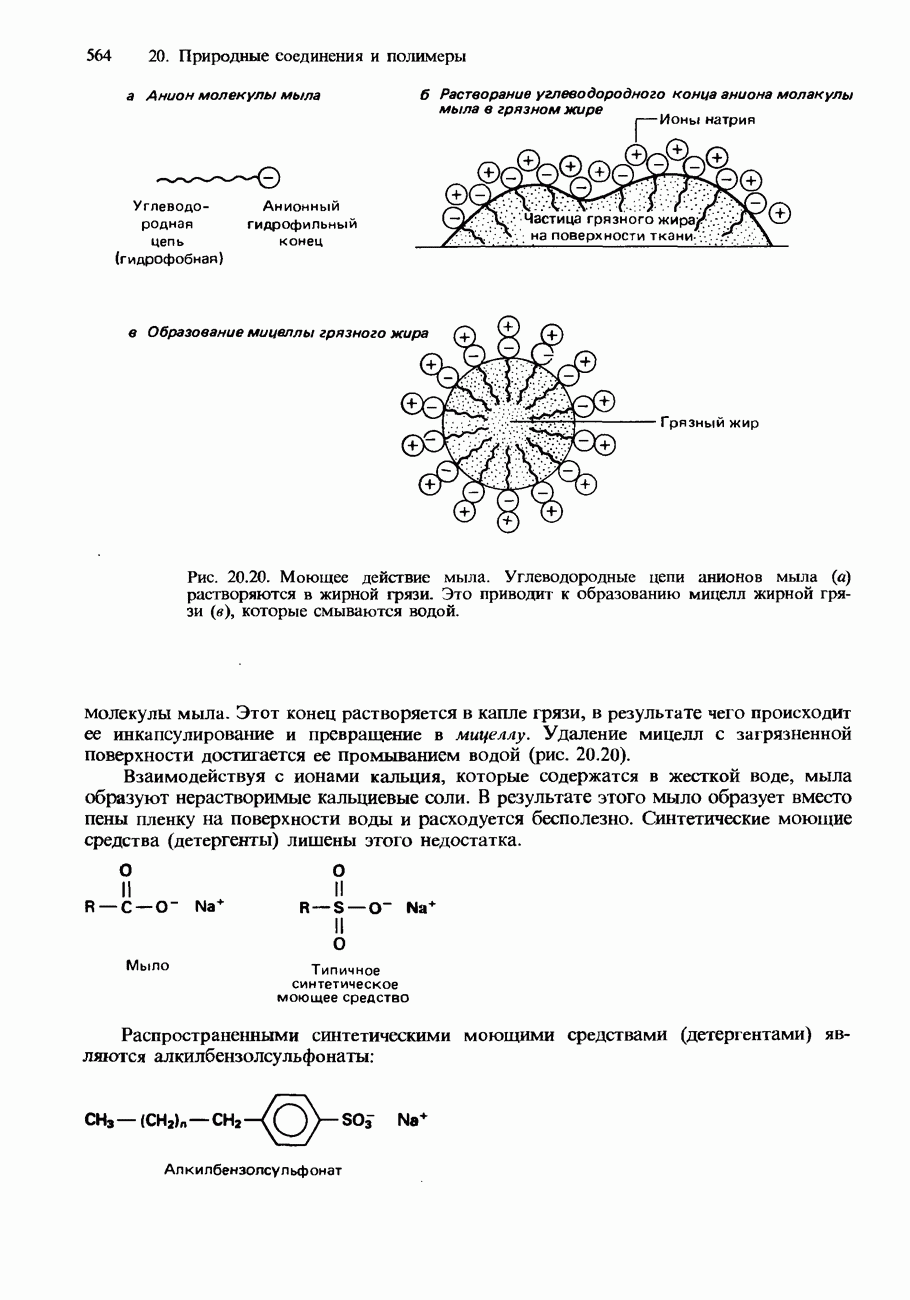
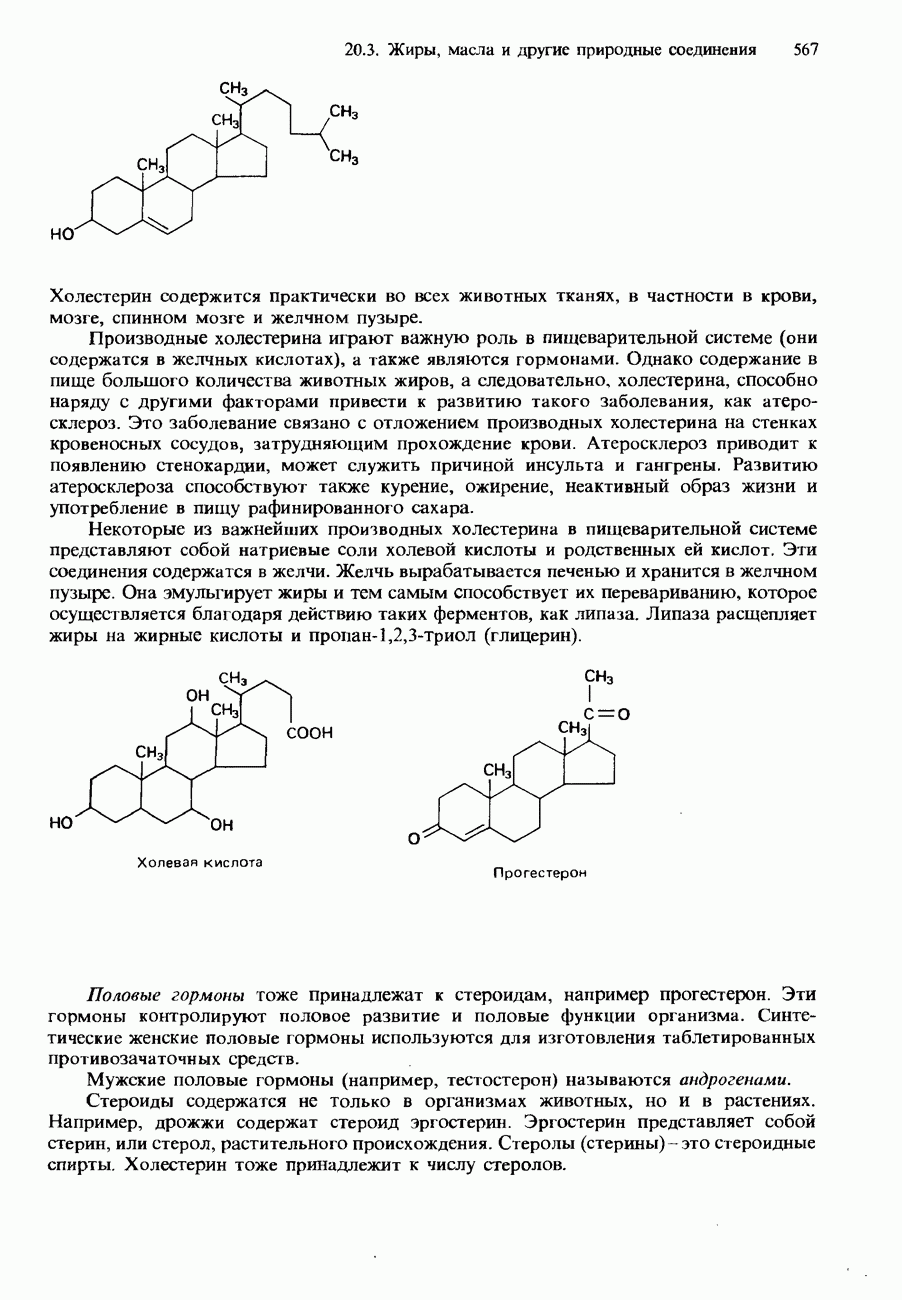
- 20.3. Жиры, масла и другие природные соединения
- ЖИРНЫЕ КИСЛОТЫ И ТРИГЛИЦЕРИДЫ
- ВОСКИ
- ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ
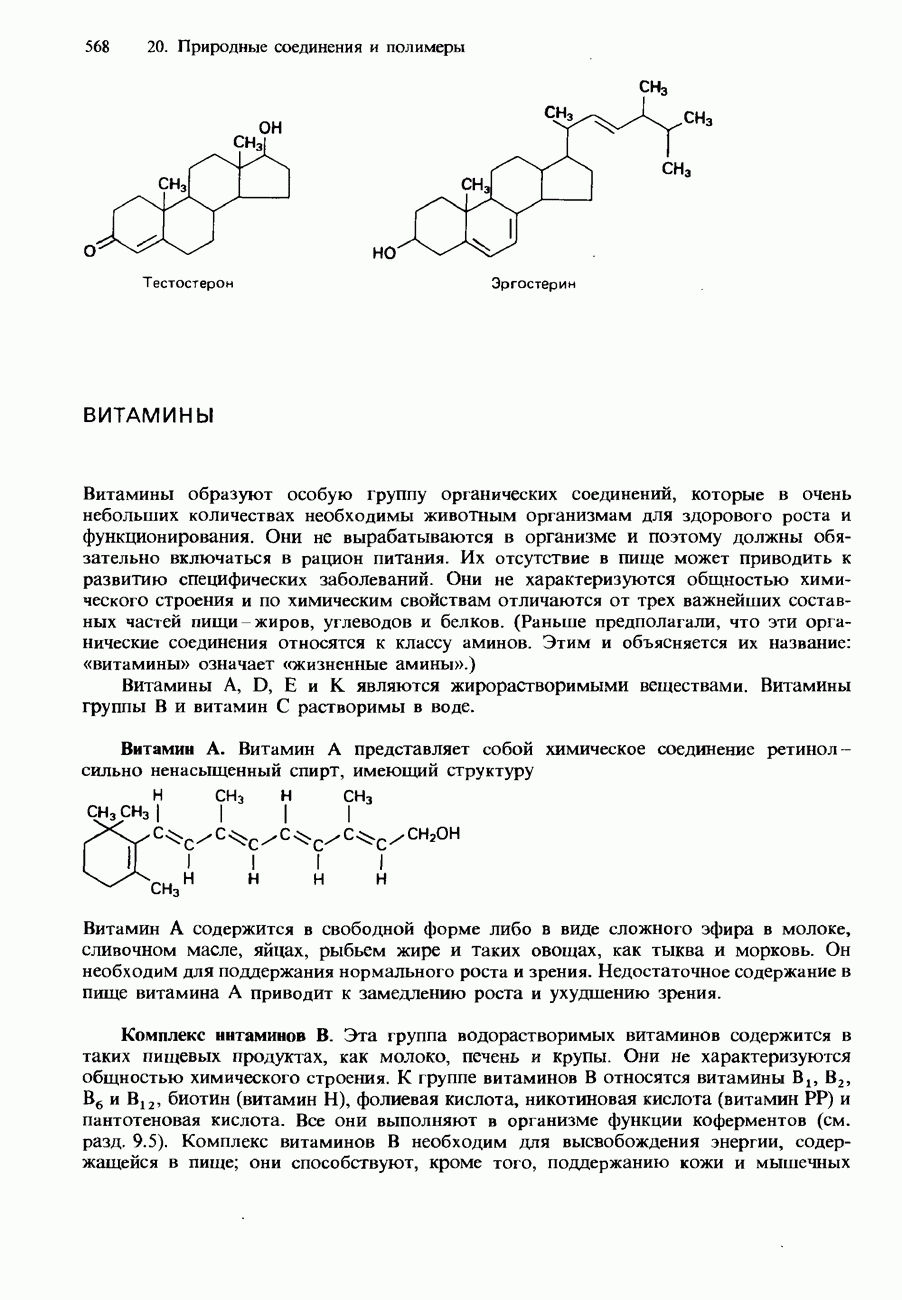
- ВИТАМИНЫ
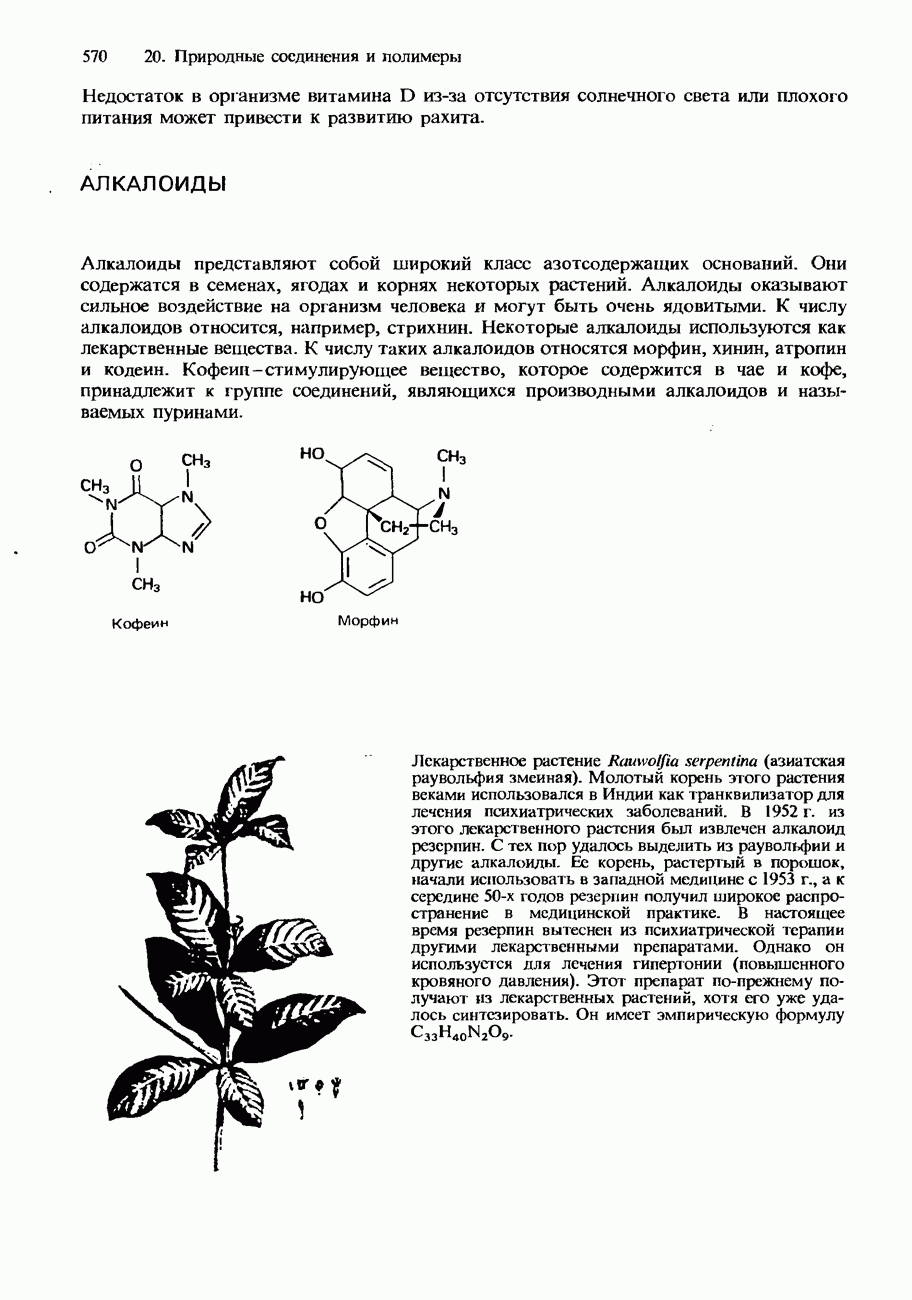
- АЛКАЛОИДЫ
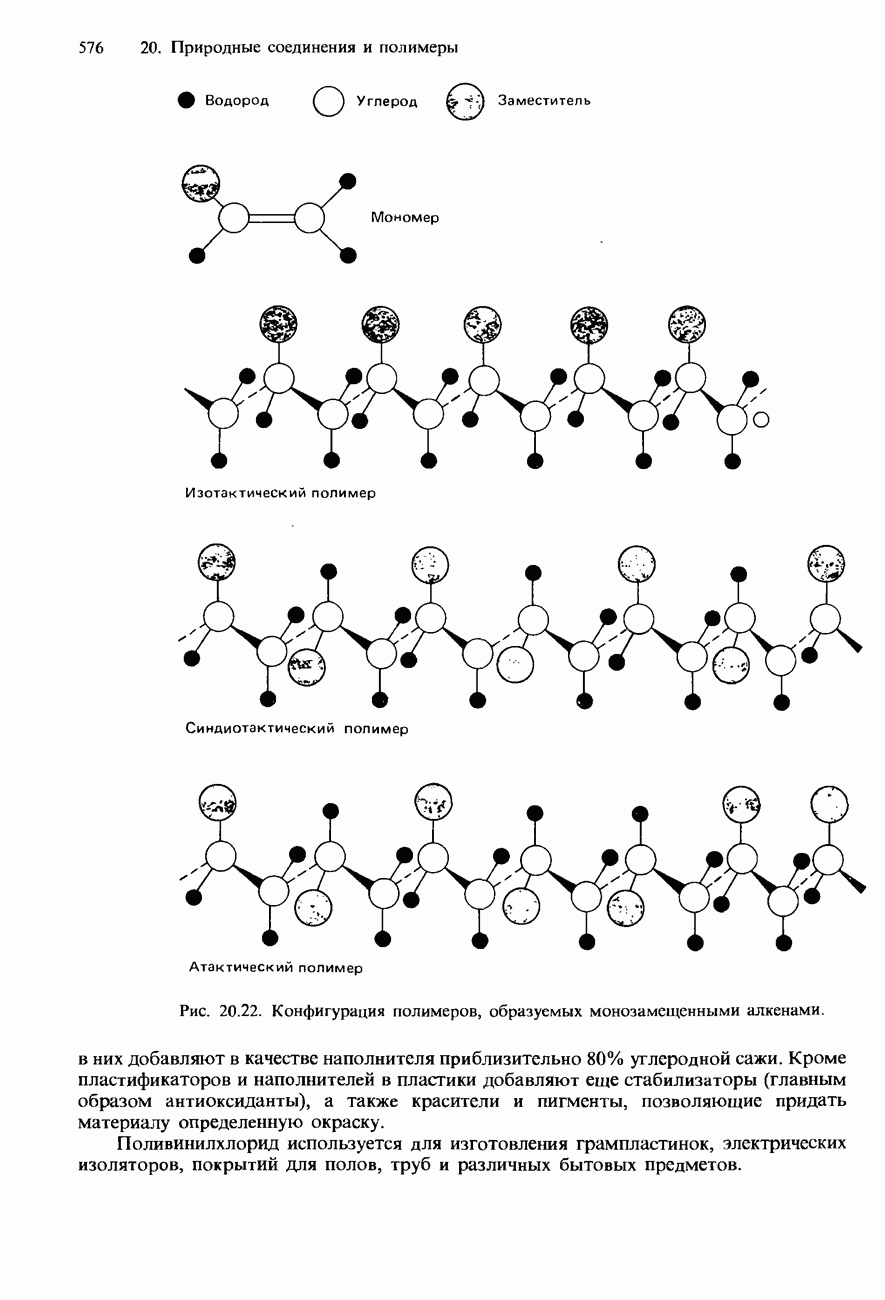
- 20.4. Полимеры
- ПОЛИМЕРИЗАЦИЯ
- НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ
- ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- ПРИЛОЖЕНИЯ