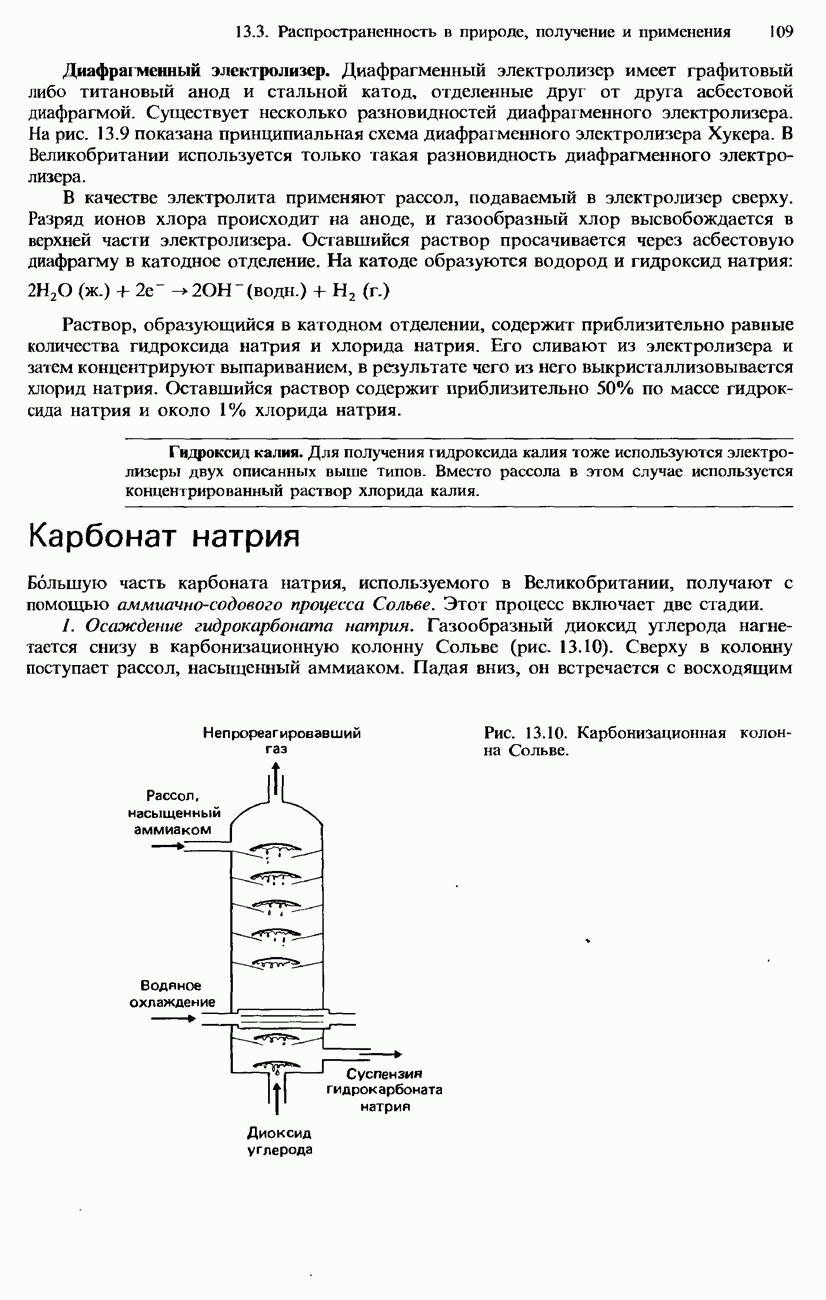
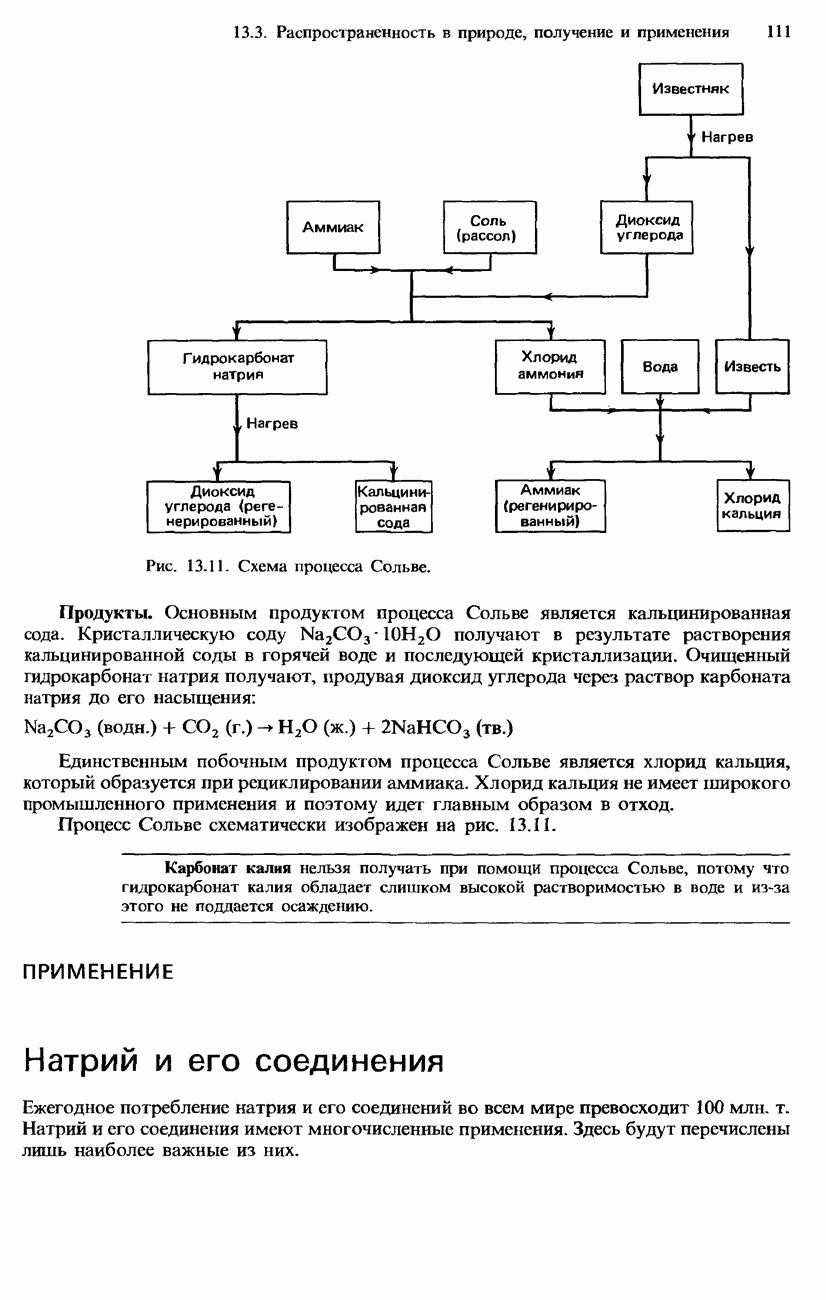
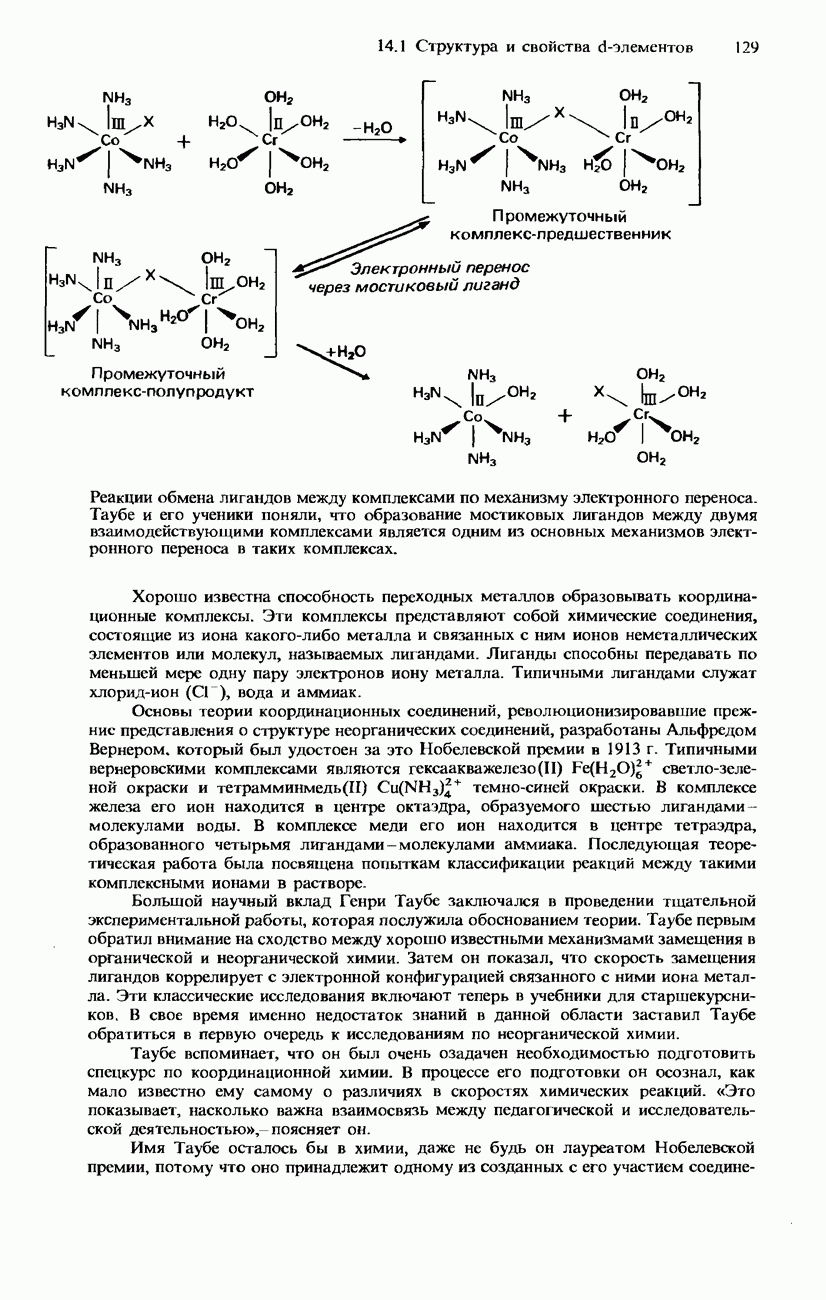
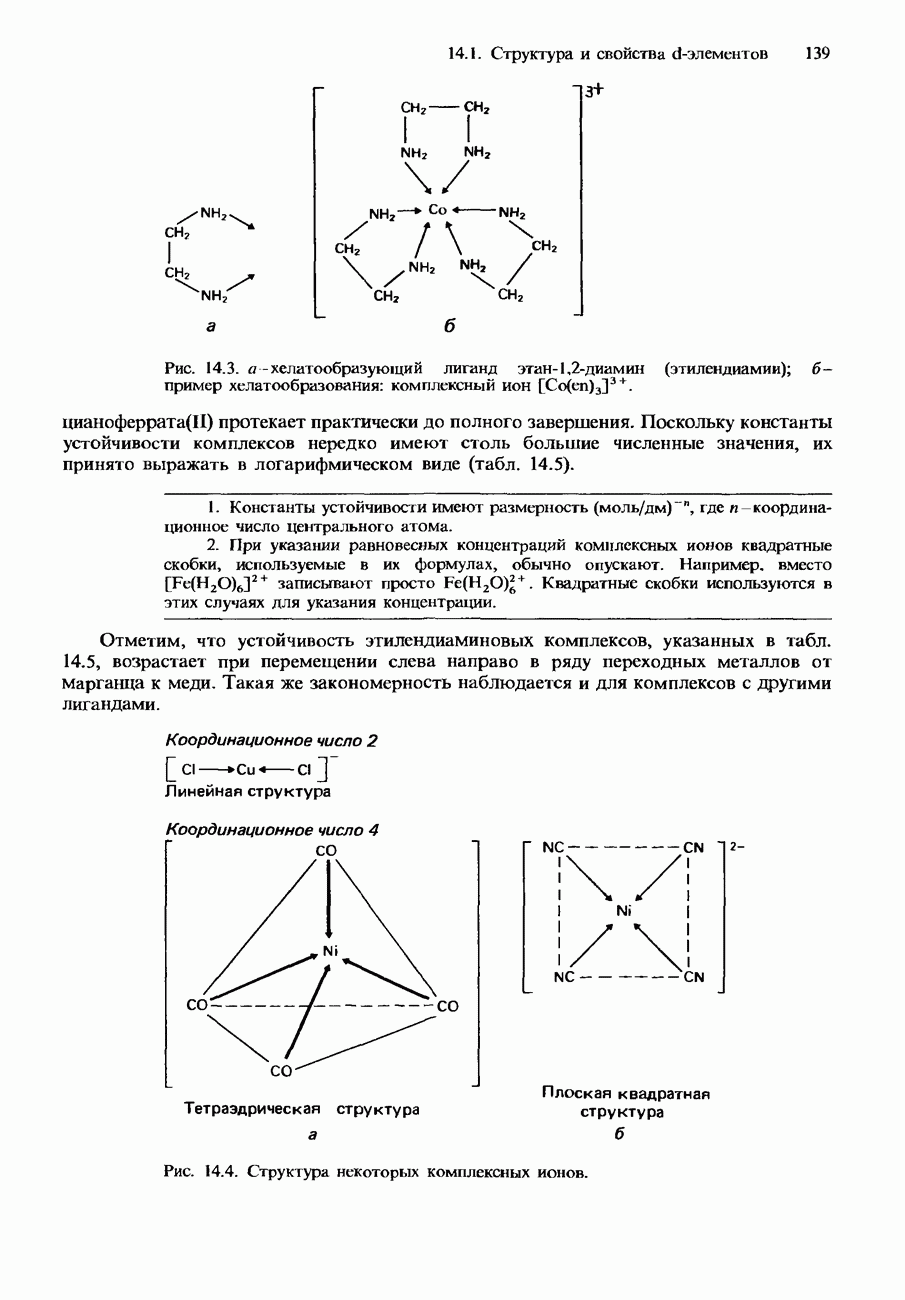
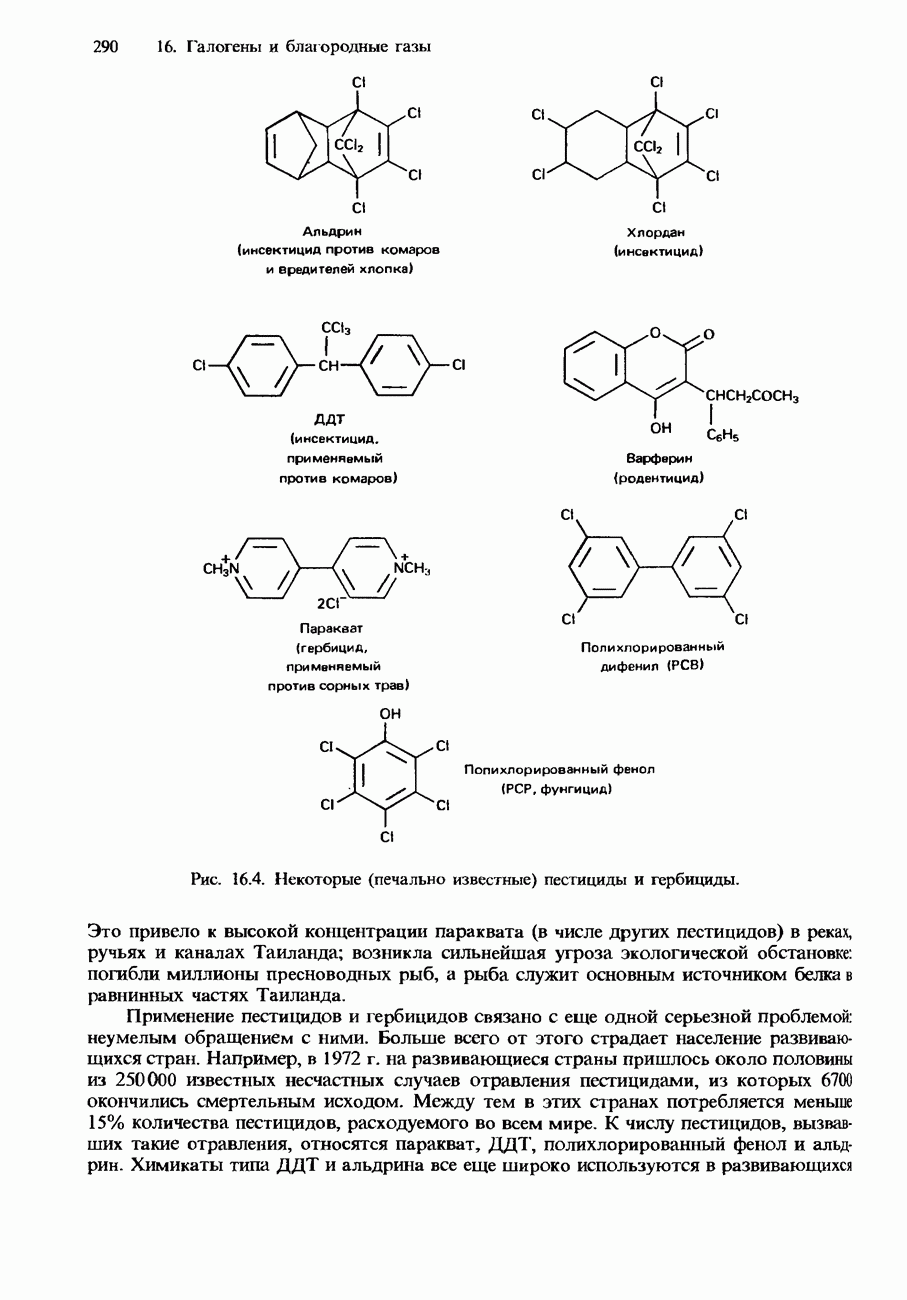
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ
Галогены представляют собой наиболее реакционноспособную группу элементов в периодической системе. Они состоят из молекул с очень низкими энергиями диссоциации связи (см. табл. 16.1), а их атомы имеют во внешней оболочке семь электронов и поэтому очень электроотрицательны. Фтор - наиболее электроотрицательный и наиболее реакционноспособный неметаллический элемент в периодической системе. Реакционная способность галогенов постепенно уменьшается при перемещении к нижней части группы. В следующем разделе будет рассмотрена способность галогенов окислять металлы и неметаллы и показано, как эта способность уменьшается в направлении от фтора к иоду.
Галогены как окислители
При пропускании газообразного сероводорода через хлорную воду происходит осаждение серы. Реакция протекает по уравнению

В этой реакции хлор окисляет сероводород, отнимая у него водород. Хлор окисляет также  до
до  Например, если перемешивать встряхиванием хлор с водным раствором сульфата
Например, если перемешивать встряхиванием хлор с водным раствором сульфата  образуется сульфат
образуется сульфат 

Происходящая при этом окислительная полуреакция описывается уравнением

В качестве другого примера окислительного действия хлора приведем синтез хлорида натрия при сжигании натрия в хлоре:

В этой реакции происходит окисление натрия, поскольку каждый атом натрия теряет электрон, образуя ион натрия:

Хлор присоединяет эти электроны, образуя хлорид-ионы:

Таблица 16.3. Стандартные электродные потенциалы галогенов

Таблица 16.4. Стандартные энтальпии образования галогенидов натрия

Окислителями являются все галогены, из них фтор - самый сильный окислитель. В табл. 16.3 указаны стандартные электродные потенциалы галогенов. Из этой таблицы видно, что окислительная способность галогенов постепенно уменьшается в направлении к нижней части группы. Эту закономерность можно продемонстрировать, добавляя раствор бромида калия в сосуд с газообразным хлором. Хлор окисляет бромид-ионы, в результате чего образуется бром; это приводит к появлению окраски у прежде бесцветного раствора:

Таким образом, можно убедиться, что хлор более сильный окислитель, чем бром. Точно так же, если смешать раствор иодида калия с бромом, образуется черный осадок из твердого иода. Это означает, что бром окисляет иодид-ионы:

Обе описанные реакции являются примерами реакций вытеснения (замещения). В каждом случае более реакционноспособный, то есть являющийся более сильным окислителем, галоген вытесняет из раствора менее реакционноспособный галоген.
Окисление металлов. Галогены легко окисляют металлы. Фтор легко окисляет все металлы, исключая золото и серебро. Мы уже упоминали о том, что хлор окисляет натрий, образуя с ним хлорид натрия. Приведем еще один пример: когда поток газообразного хлора пропускают над поверхностью нагретых железных опилок, образуется хлорид  твердое коричневое вещество:
твердое коричневое вещество:

Даже иод способен, хотя и медленно, окислять металлы, расположенные в электрохимическом ряду ниже его. Легкость окисления металлов различными галогенами уменьшается при перемещении к нижней части VII группы. В этом можно убедиться, сравнивая энергии образования галогенидов из исходных элементов. В табл. 16.4 указаны стандартные энтальпии образования галогенидов натрия в порядке перемещения к нижней части группы.
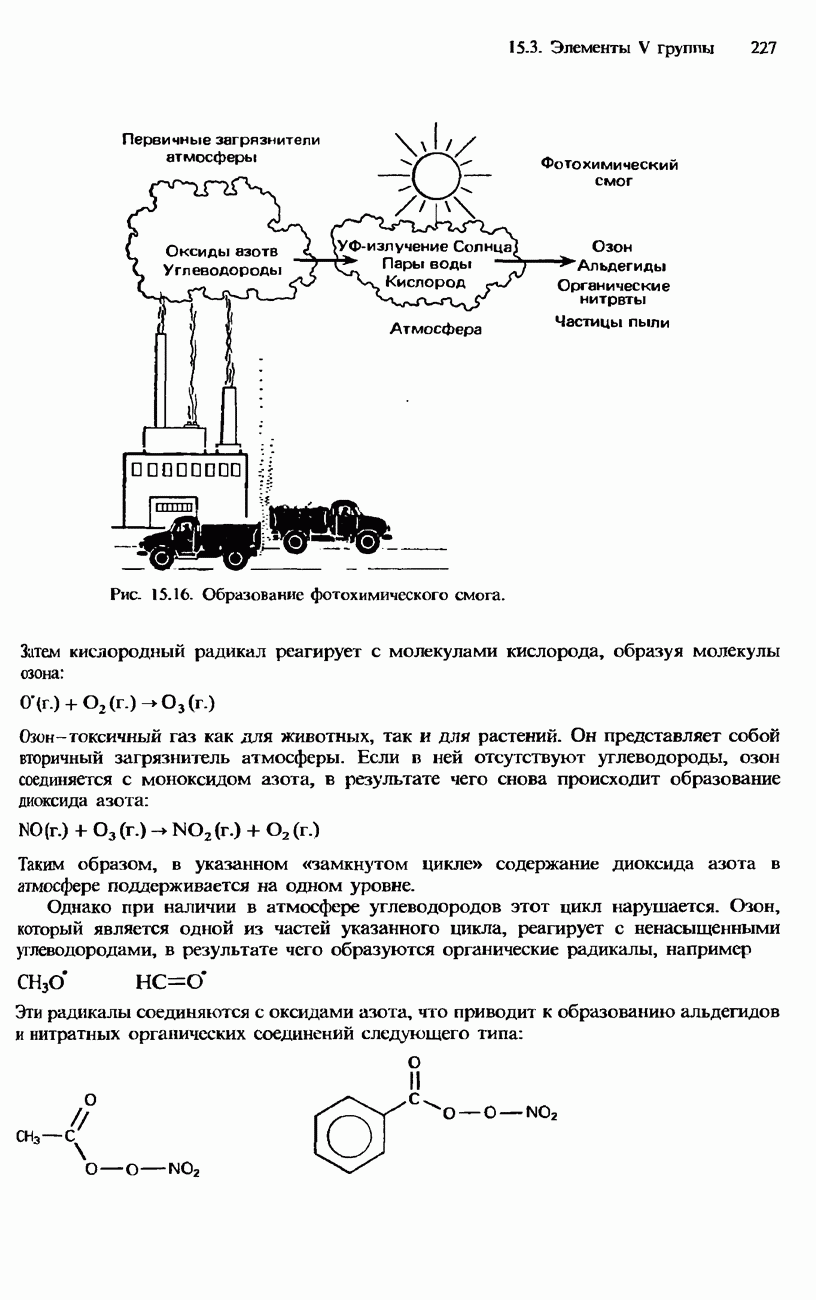
Окисление неметаллов. За исключением азота и большинства благородных газов, фтор окисляет все остальные неметаллы. Хлор реагирует с фосфором и серой. Углерод, азот и кислород не вступают в реакции непосредственно с хлором, бромом или иодом. Об относительной реакционной способности галогенов к неметаллам можно судить, сравнивая их реакции с водородом (табл. 16.5).
Окисление углеводородов. При определенных условиях галогены окисляют углеводороды.
Таблица 16.5. Реакции галогенов с водородом

дороды. Например, хлор полностью отщепляет водород от молекулы скипидара:

Окисление ацетилена может протекать со взрывом:

Реакции с водой и щелочами
Фтор реагирует с холодной водой, образуя фтороводород и кислород:

Хлор медленно растворяется в воде, образуя хлорную воду. Хлорная вода имеет небольшую кислотность вследствие того, что в ней происходит диспропорциошрованш (см. разд. 10.2) хлора с образованием соляной кислоты и хлорноватистой кислоты:

Бром и иод диспропорционируют в воде аналогичным образом, но степень диспропорционирования в воде уменьшается от хлора к иоду.
Хлор, бром и иод диспропорционируют также в щелочах. Например, в холодной разбавленной щелочи бром диспропорционирует на бромид-ионы и гипобромит-иоиы (бромат  -ионы):
-ионы):

При взаимодействии брома с горячими концентрированными щелочами диспропор-ционирование протекает дальше:

Иодат(I), или гипоиодит-ион, неустойчив даже в холодных разбавленных щелочах. Он самопроизвольно диспропорционирует с образованием иодид-иона и иодат(I)-иона.
Реакция фтора со щелочами, как и его реакция с водой, не похожа на аналогичные реакции других галогенов. В холодной разбавленной щелочи протекает следующая реакция:

В горячей концентрированной щелочи реакция с фтором протекает так:

Анализ на галогены и с участием галогенов
Качественный и количественный анализ на галогены обычно выполняется с помощью раствора нитрата серебра. Например

Для качественного и количественного определения иода может использоваться раствор крахмала. Поскольку иод очень мало растворим в воде, его обычно анализируют в присутствии иодида калия. Так поступают по той причине, что иод образует с иодид-ионом растворимый трииодидный ион 

Растворы иода с иодидами используются для аналитического определения различных восстановителей, например  а также некоторых окислителей, например
а также некоторых окислителей, например  Окислители смещают указанное выше равновесие влево, высвобождая иод. Иод затем титруют тиосульфатом (VI).
Окислители смещают указанное выше равновесие влево, высвобождая иод. Иод затем титруют тиосульфатом (VI).
Итак, повторим еще раз!
1. Атомы всех галогенов имеют во внешней оболочке семь электронов.
2. Для получения галогенов в лабораторных условиях может использоваться окисление соотвегствующих галогеноводородных кислот.
3. Галогены окисляют металлы, неметаллы и углеводороды.
4. Галогены диспропорционируют в воде и щелочах, образуя галогенидные ионы, гипогалогенитные  и галогенат (
и галогенат ( -ионы.
-ионы.
5. Закономерности изменения физических и химических свойств галогенов при перемещении к нижней части группы показаны в табл. 16.6.
Таблица 16.6. Закономерности изменения свойств галогенов по мере возрастания атомного номера

6. Фтор обладает аномальными свойствами среди других галогенов по следующим причинам:
а) он имеет низкую энергию диссоциации связи;
б) в соединениях фтора он существует только в одном состоянии окисления;
в) фтор является самым электроотрицательным и самым реакционноспособным среди всех неметаллических элементов;
г) его реакции с водой и щелочами отличаются от аналогичных реакций остальных галогенов.
| << Предыдущий параграф | Следующий параграф >> |
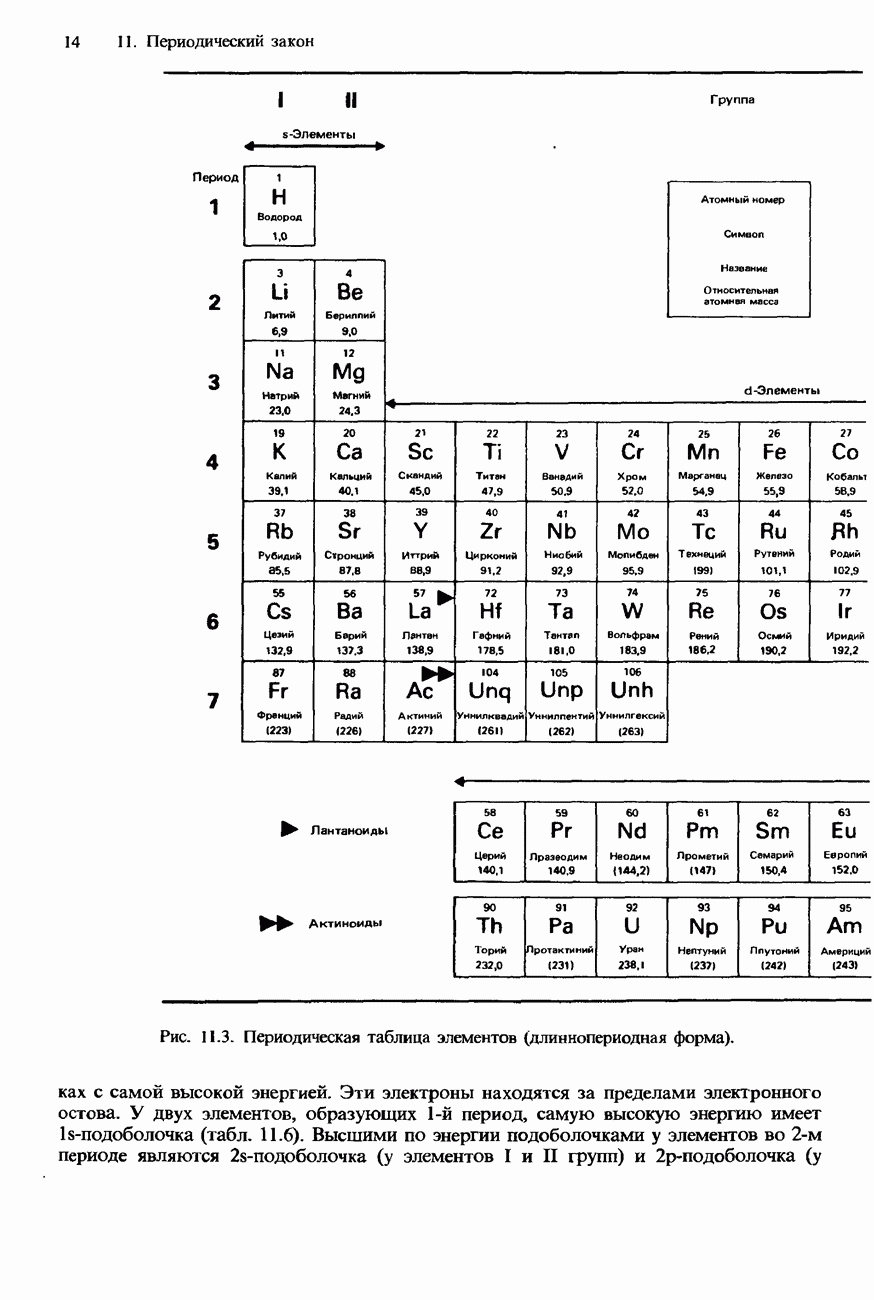
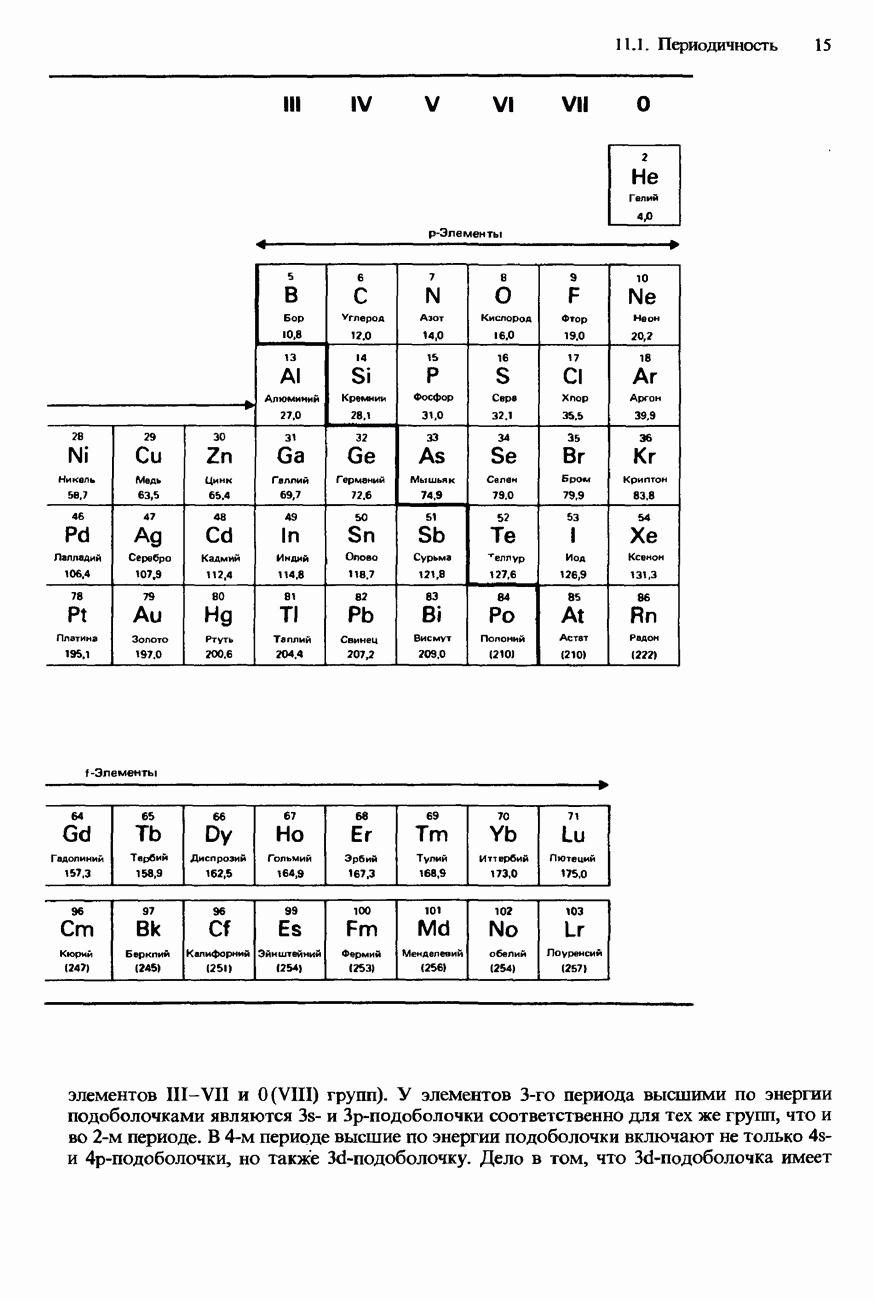
- 11. ПЕРИОДИЧЕСКИЙ ЗАКОН
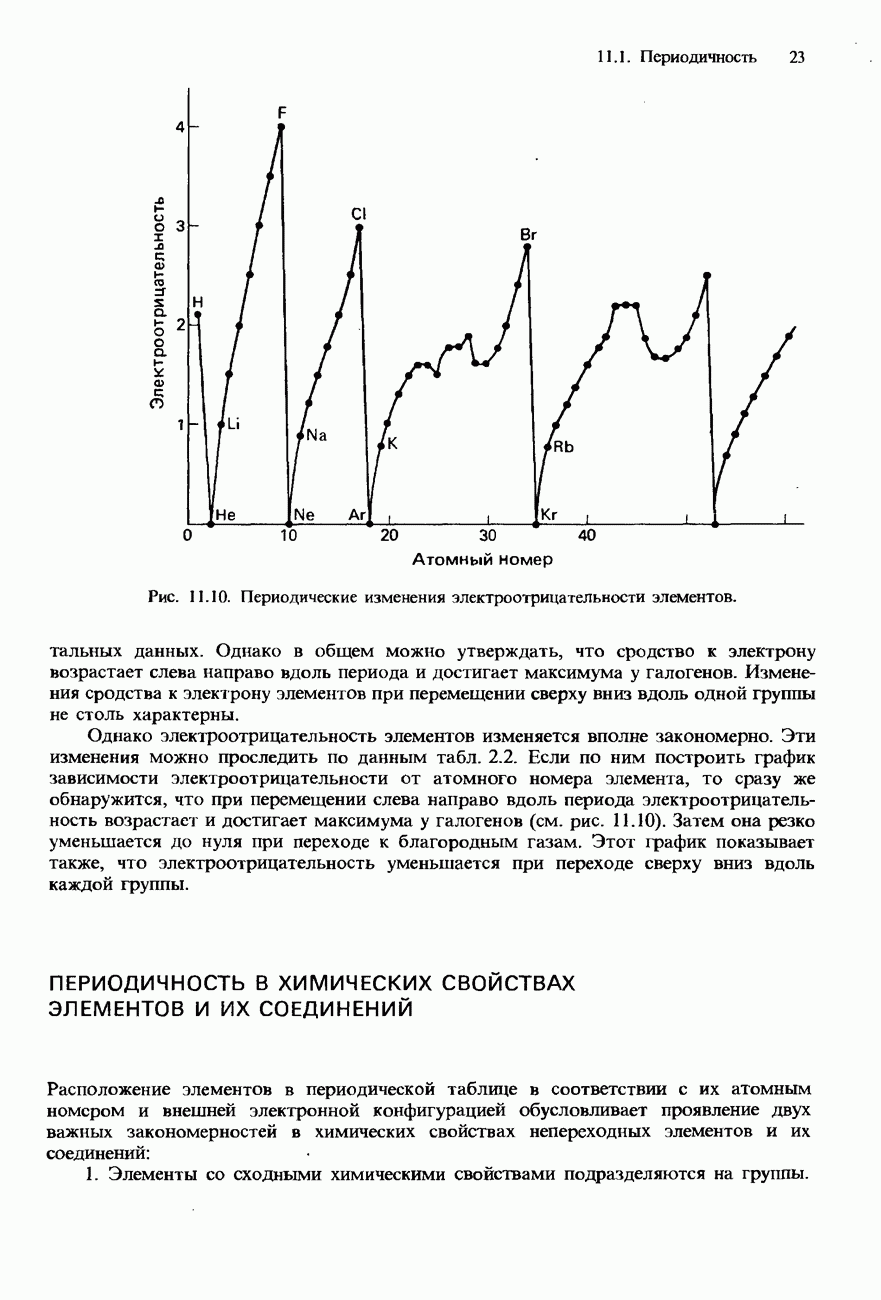
- 11.1 Периодичность
- СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
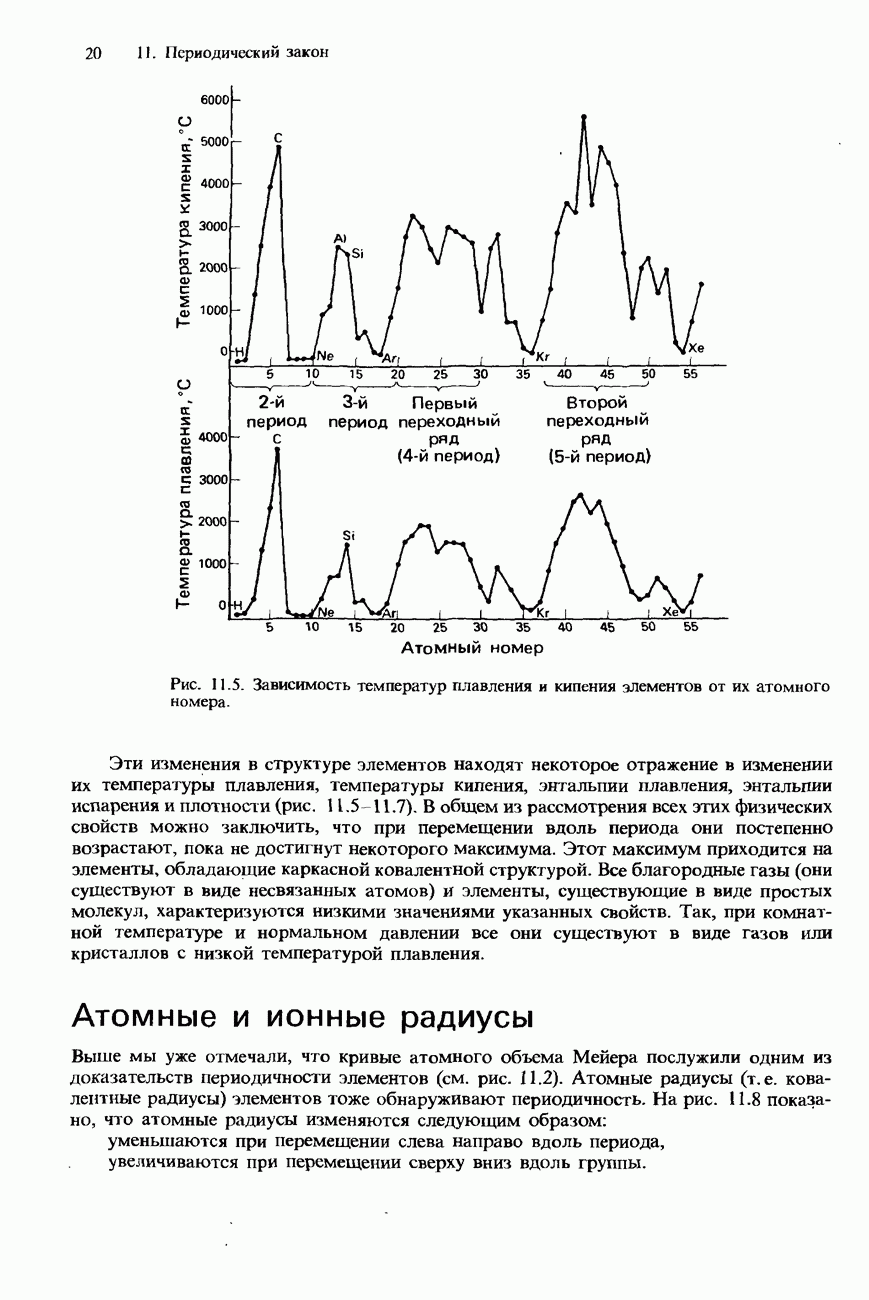
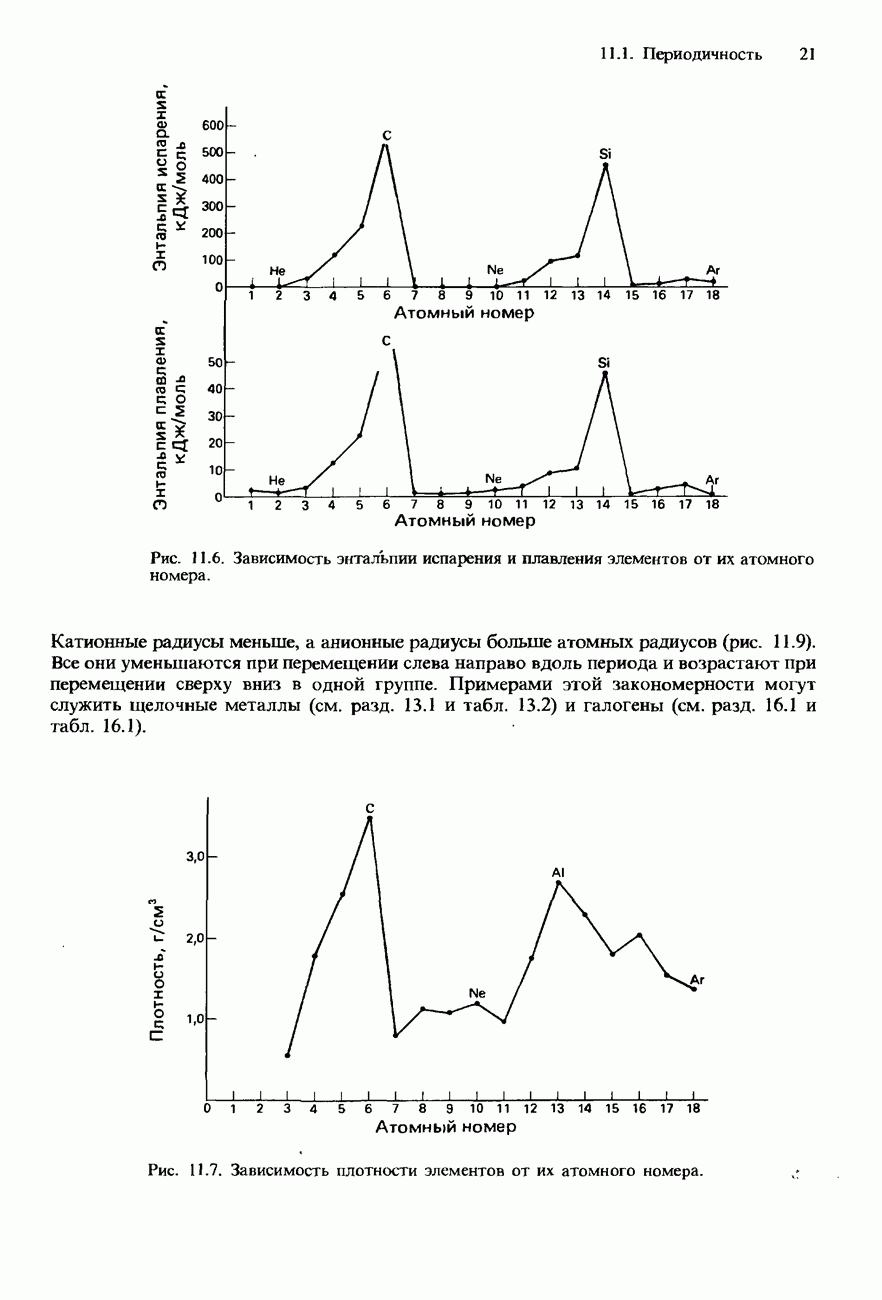
- ПЕРИОДИЧНОСТЬ
- ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 12. ВОДОРОД И ВОДА
- 12.1. ВОДОРОД
- ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ
- РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА
- ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА
- 12.2 Вода
- ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ
- ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ
- КАЧЕСТВО ВОДЫ
- ЗАГРЯЗНЕНИЕ ВОДЫ
- ОЧИСТКА И ПОДГОТОВКА ВОДЫ
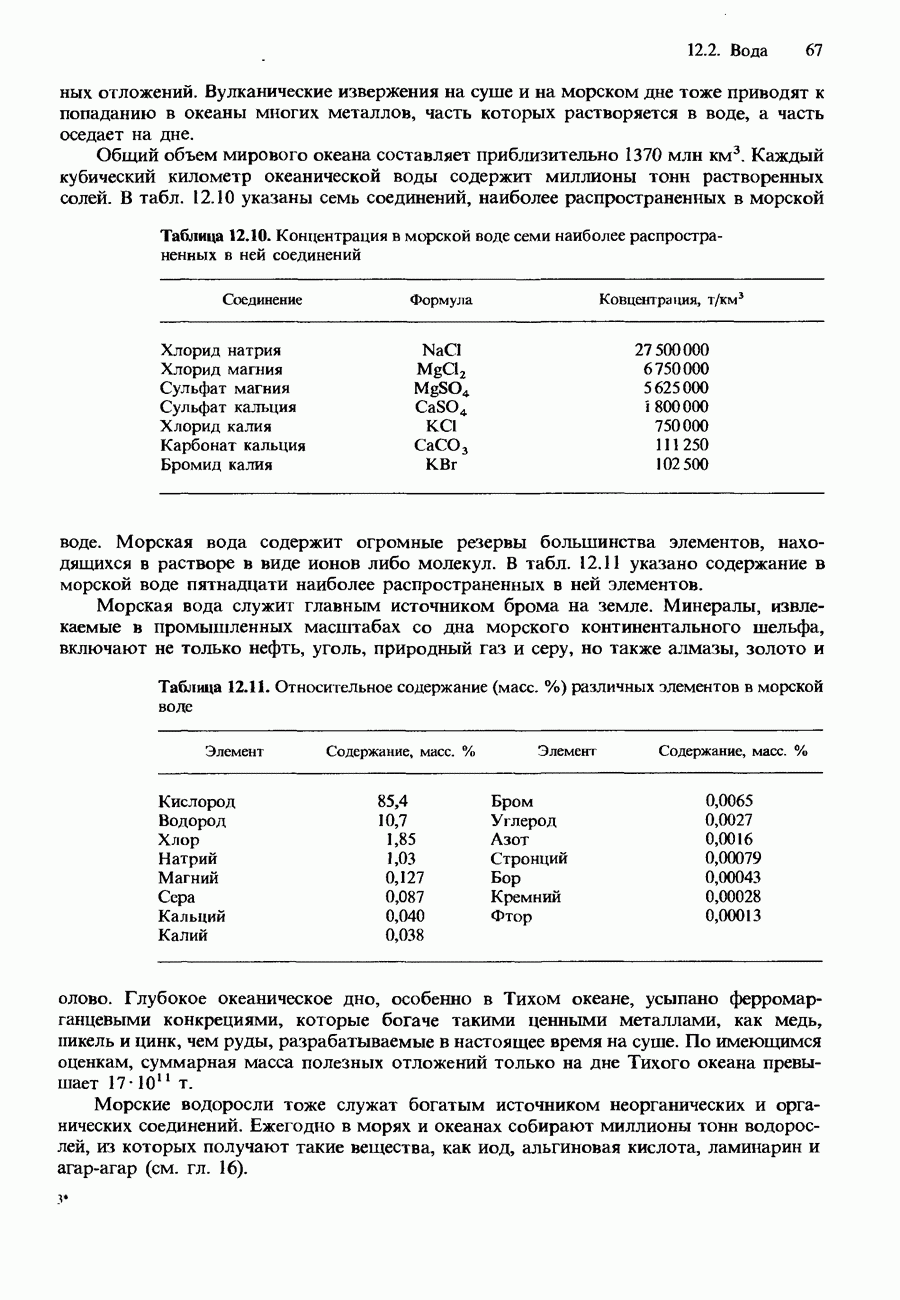
- ОКЕАНЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 13. s-Металлы
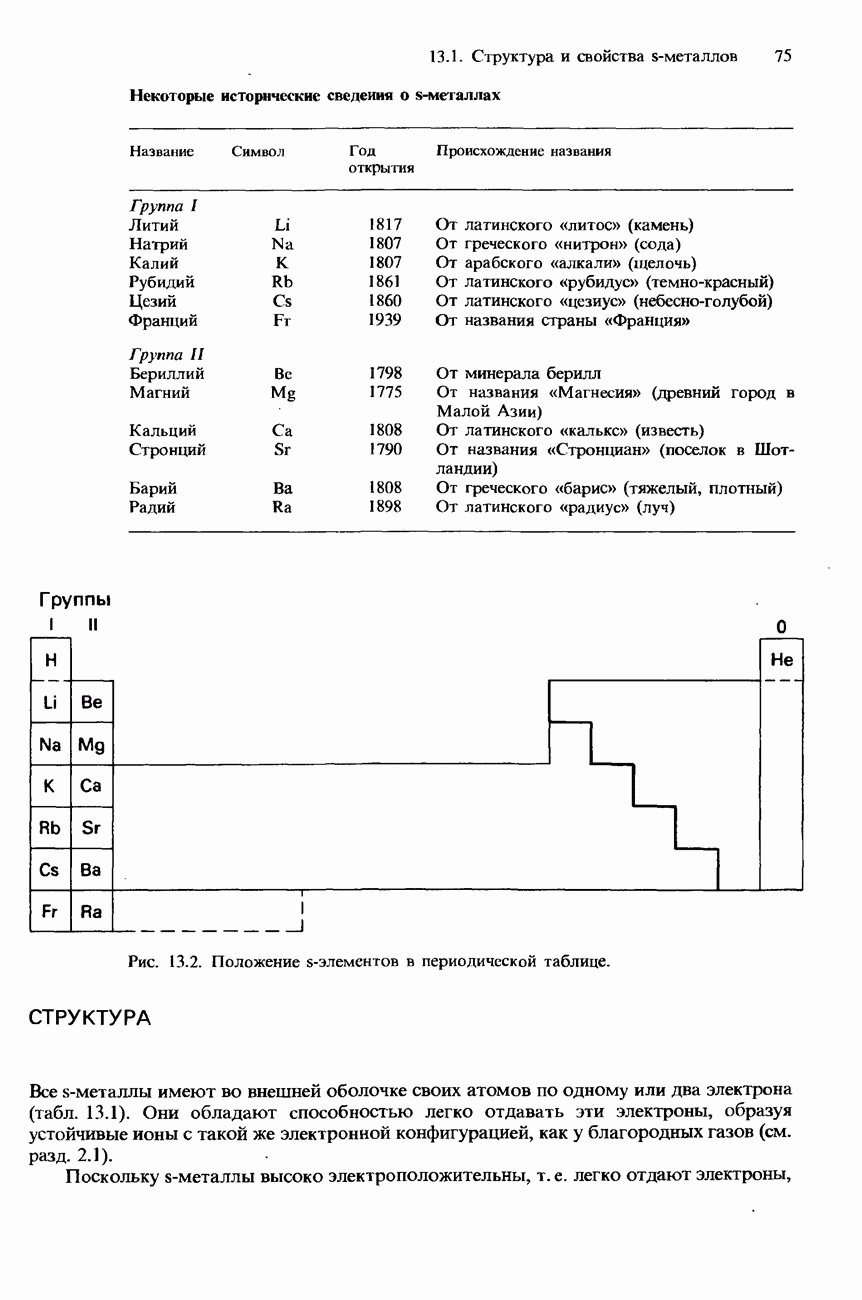
- 13.1 Структура и свойства s-металлов
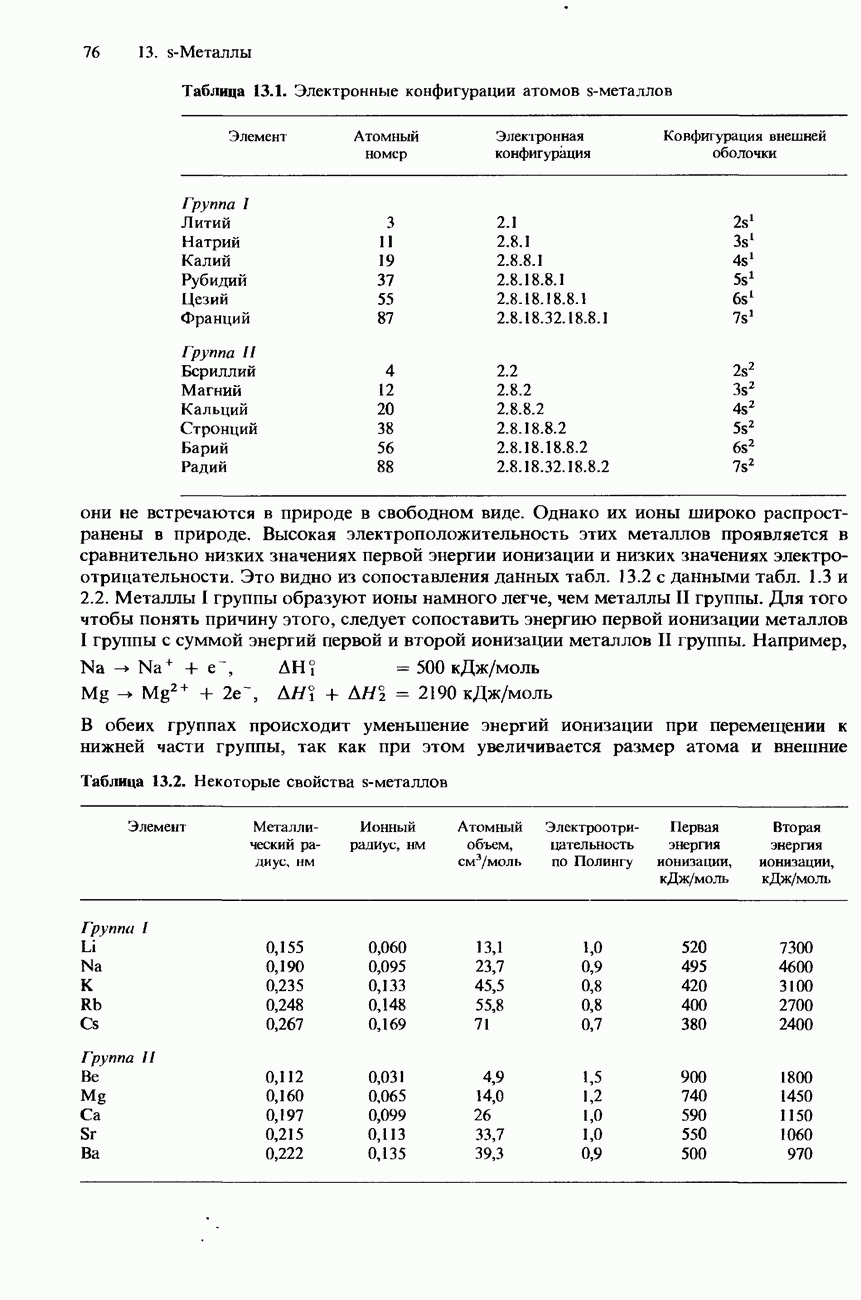
- СТРУКТУРА
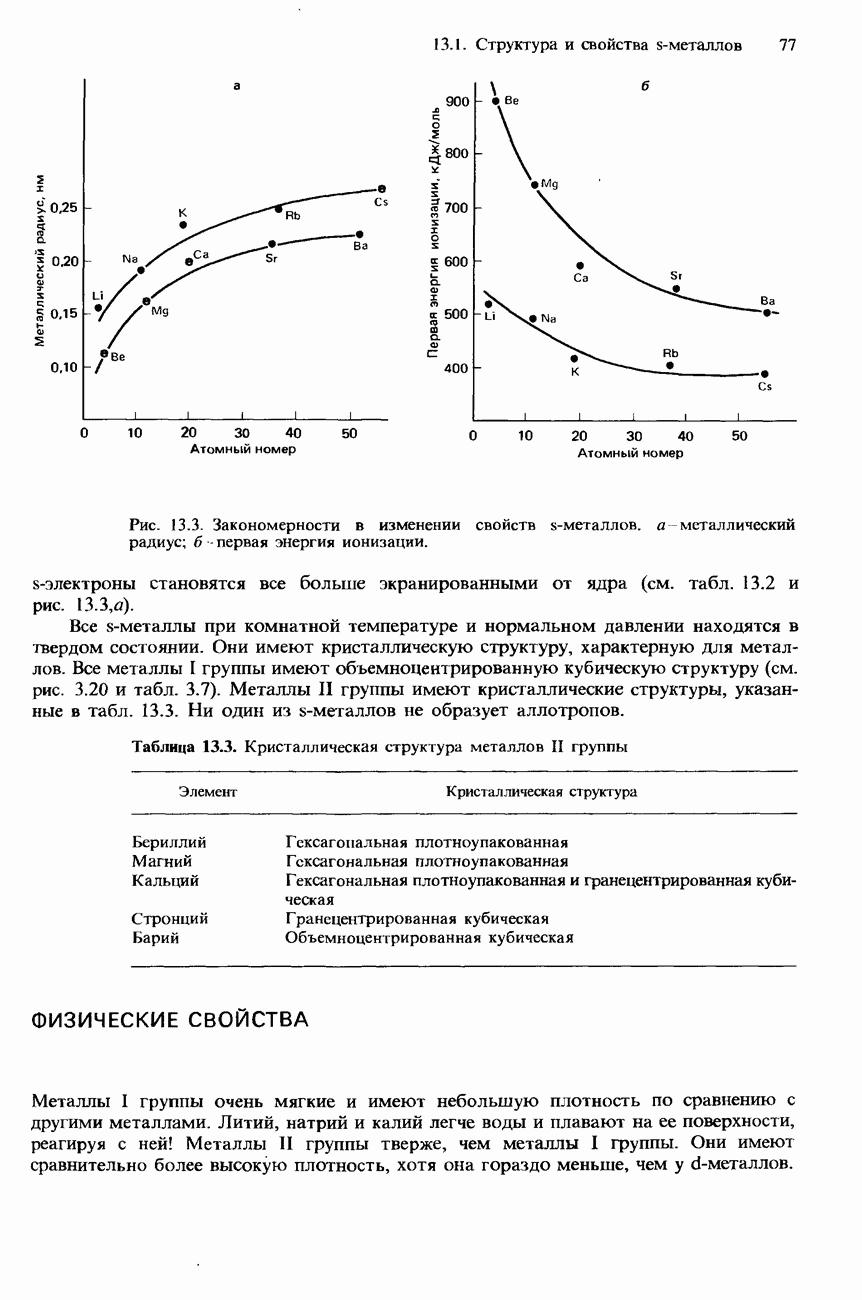
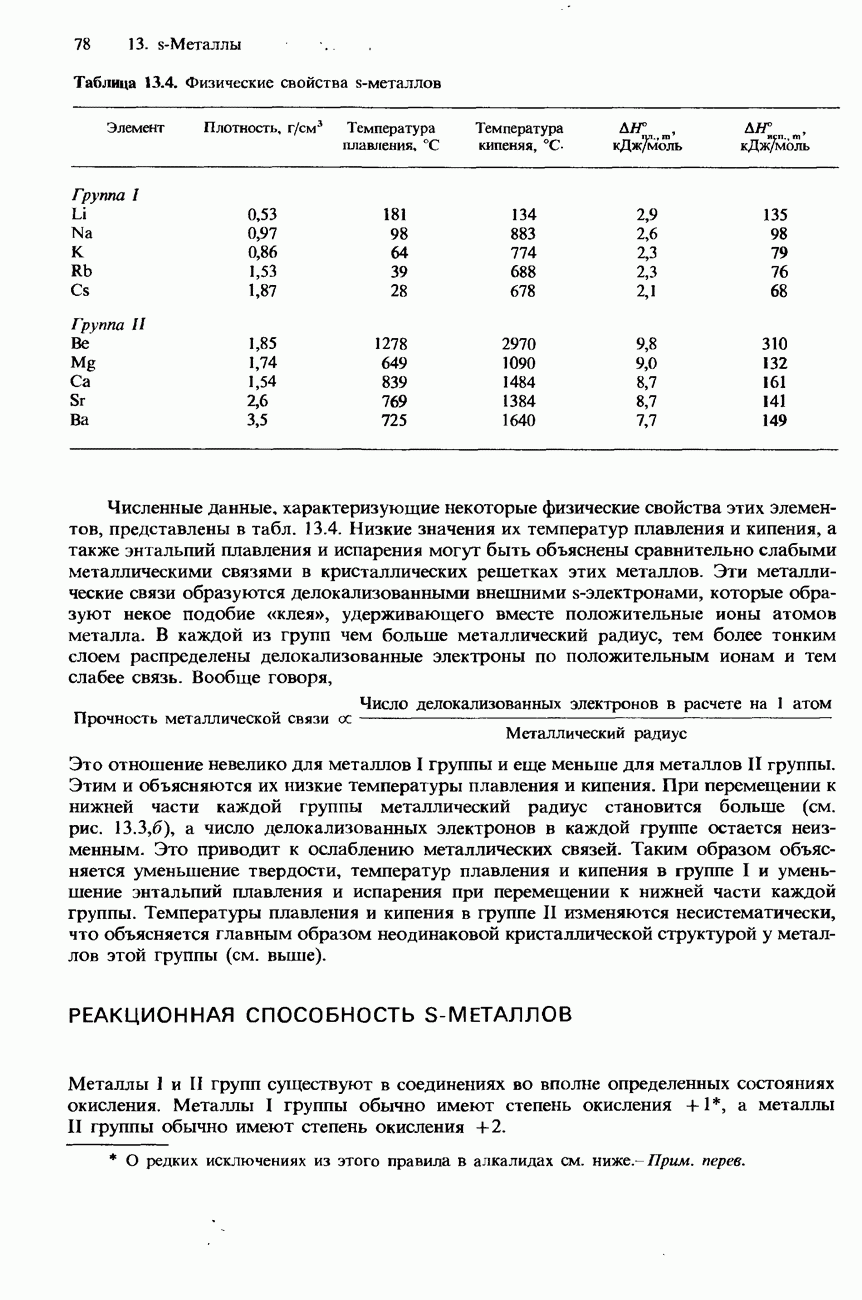
- ФИЗИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ
- 13.2 Соединения, образуемые s-металлами
- ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ
- ГИДРОКСИДЫ
- КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ
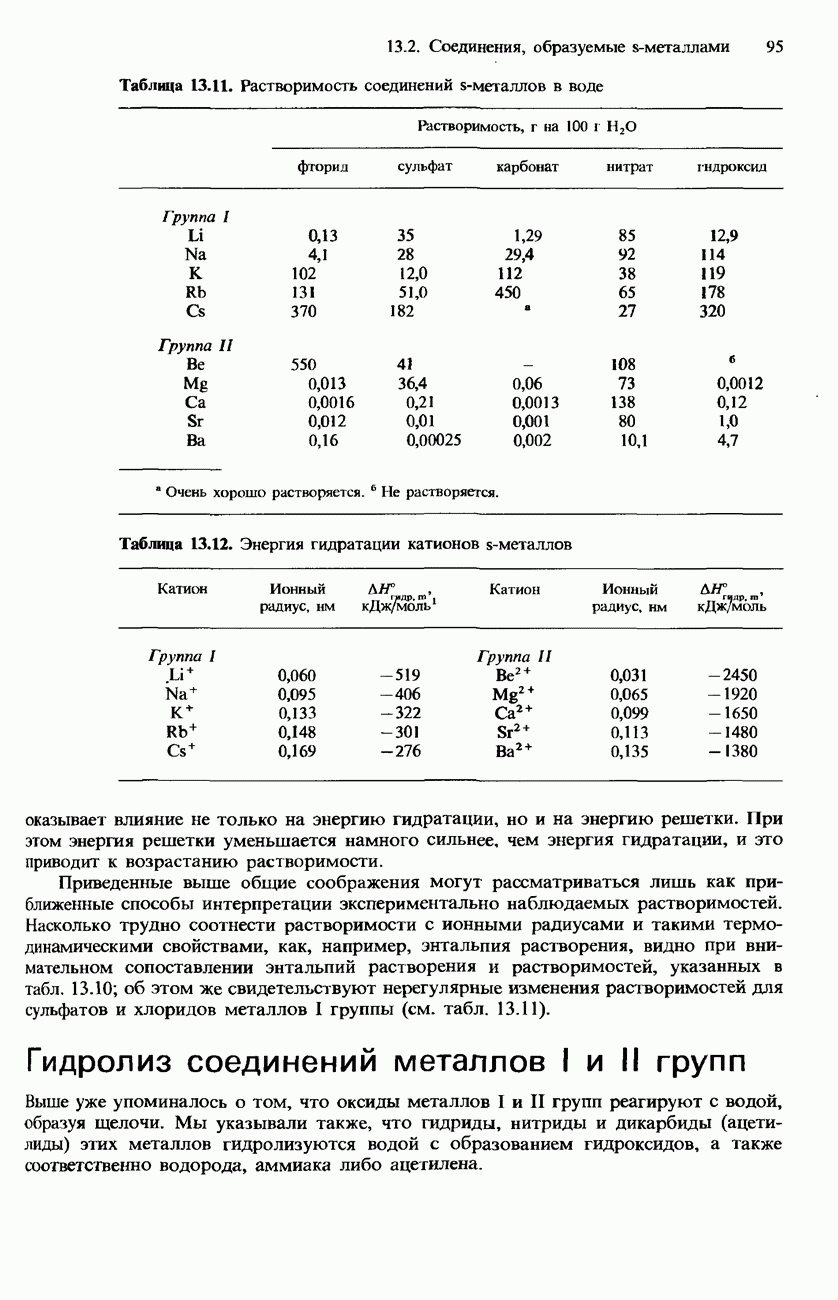
- РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ
- АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ
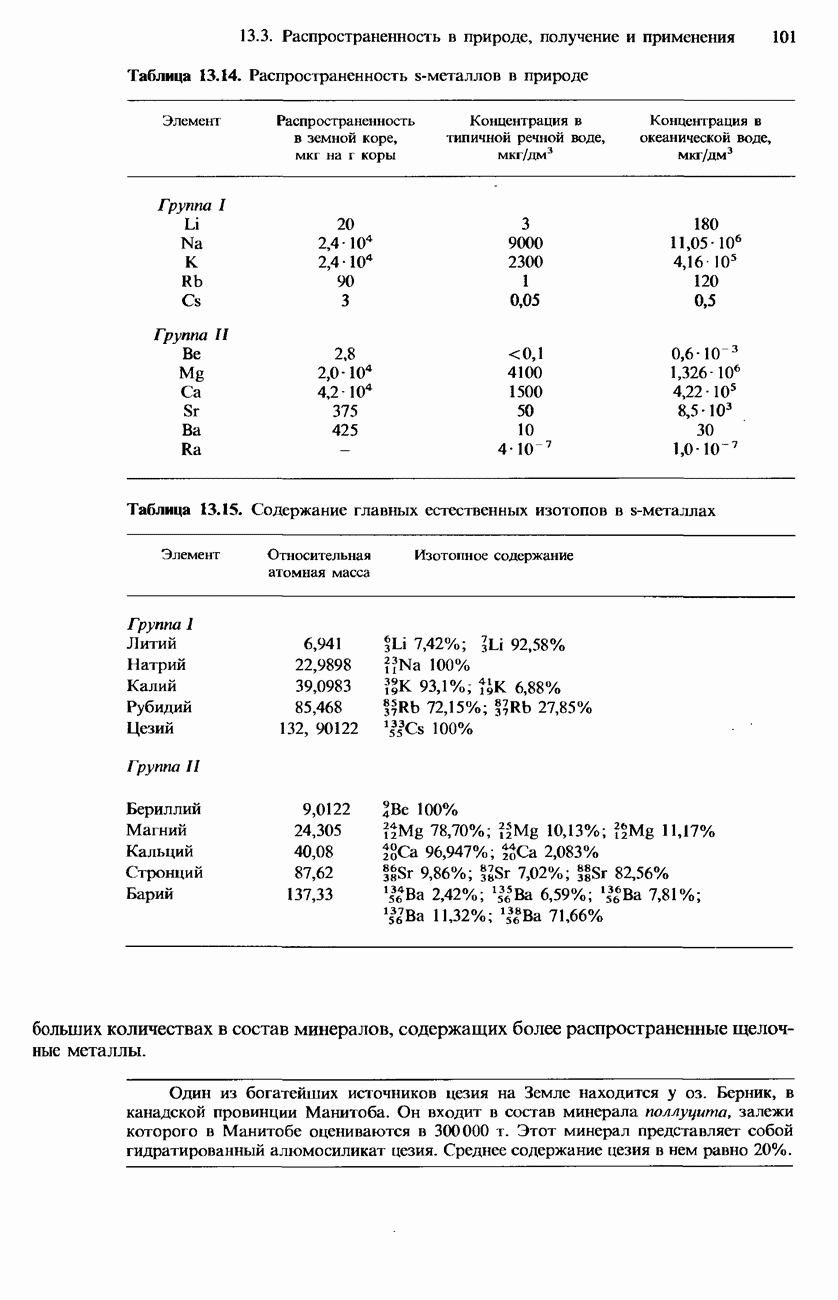
- 13.3. Распространенность в природе, получение и применение
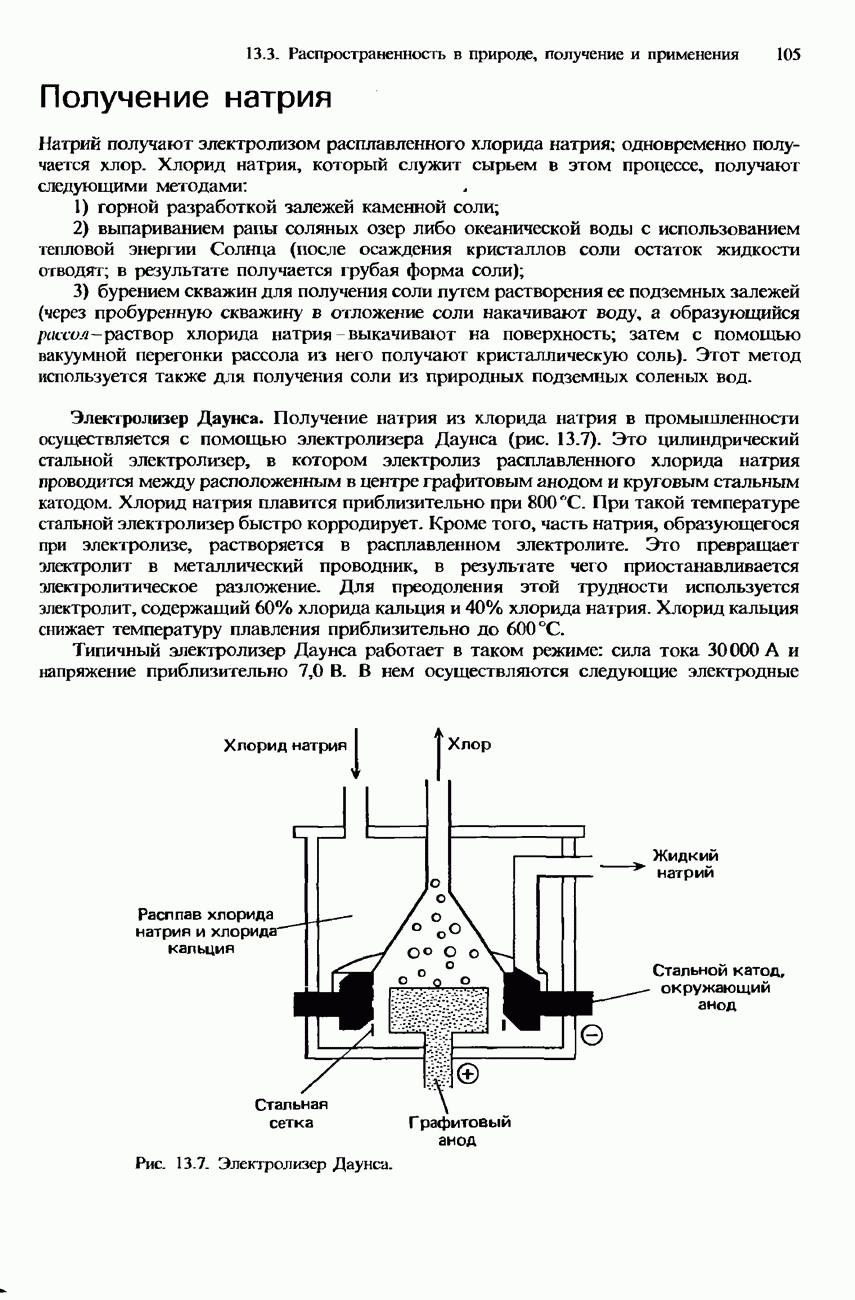
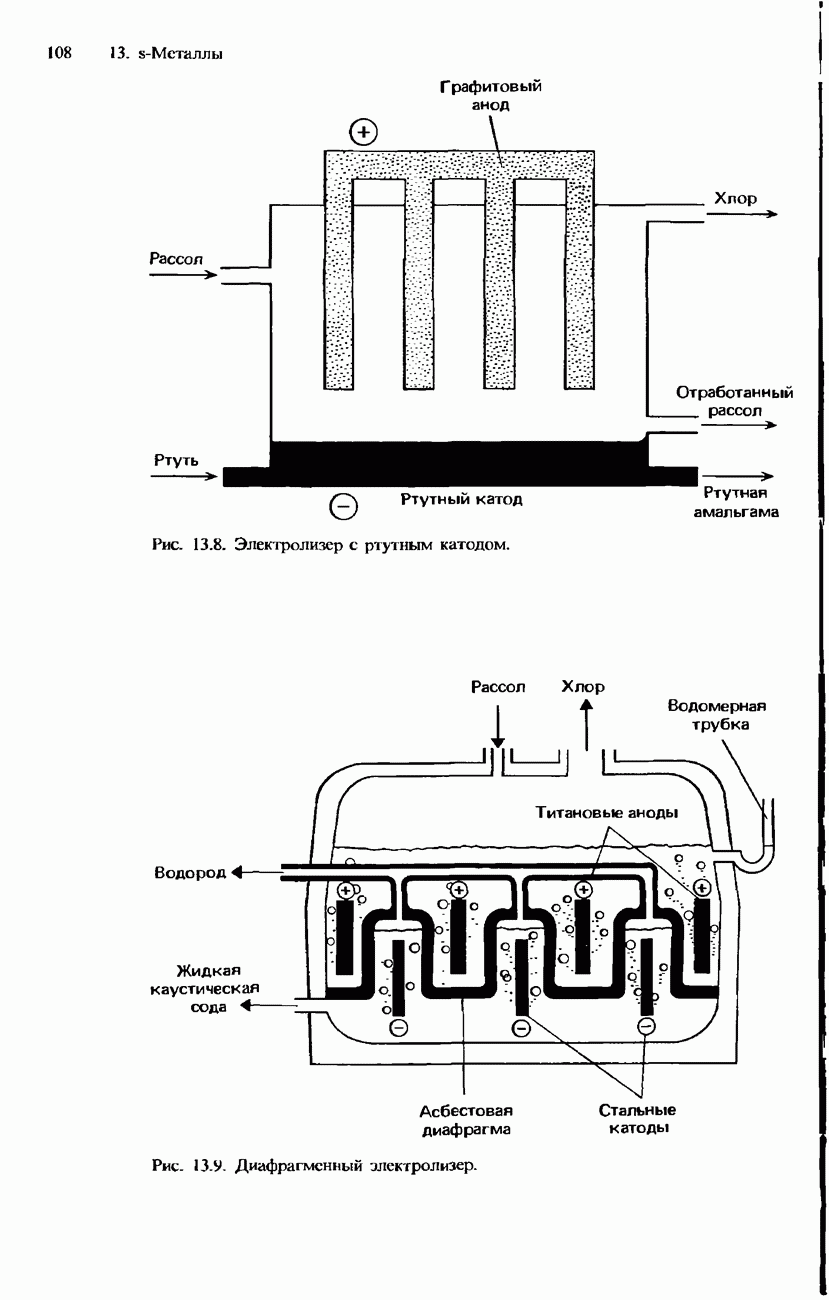
- ПОЛУЧЕНИЕ S-МЕТАЛЛОВ
- ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ
- ПРИМЕНЕНИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 14. d-ЭЛЕМЕНТЫ
- 14.1. Структура и свойства d-элементов
- d-ЭЛЕМЕНТЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА
- ХИМИЧЕСКИЕ СВОЙСТВА
- 14.2 Химия семи d-элементов
- МАРГАНЕЦ
- ЖЕЛЕЗО
- КОБАЛЬТ
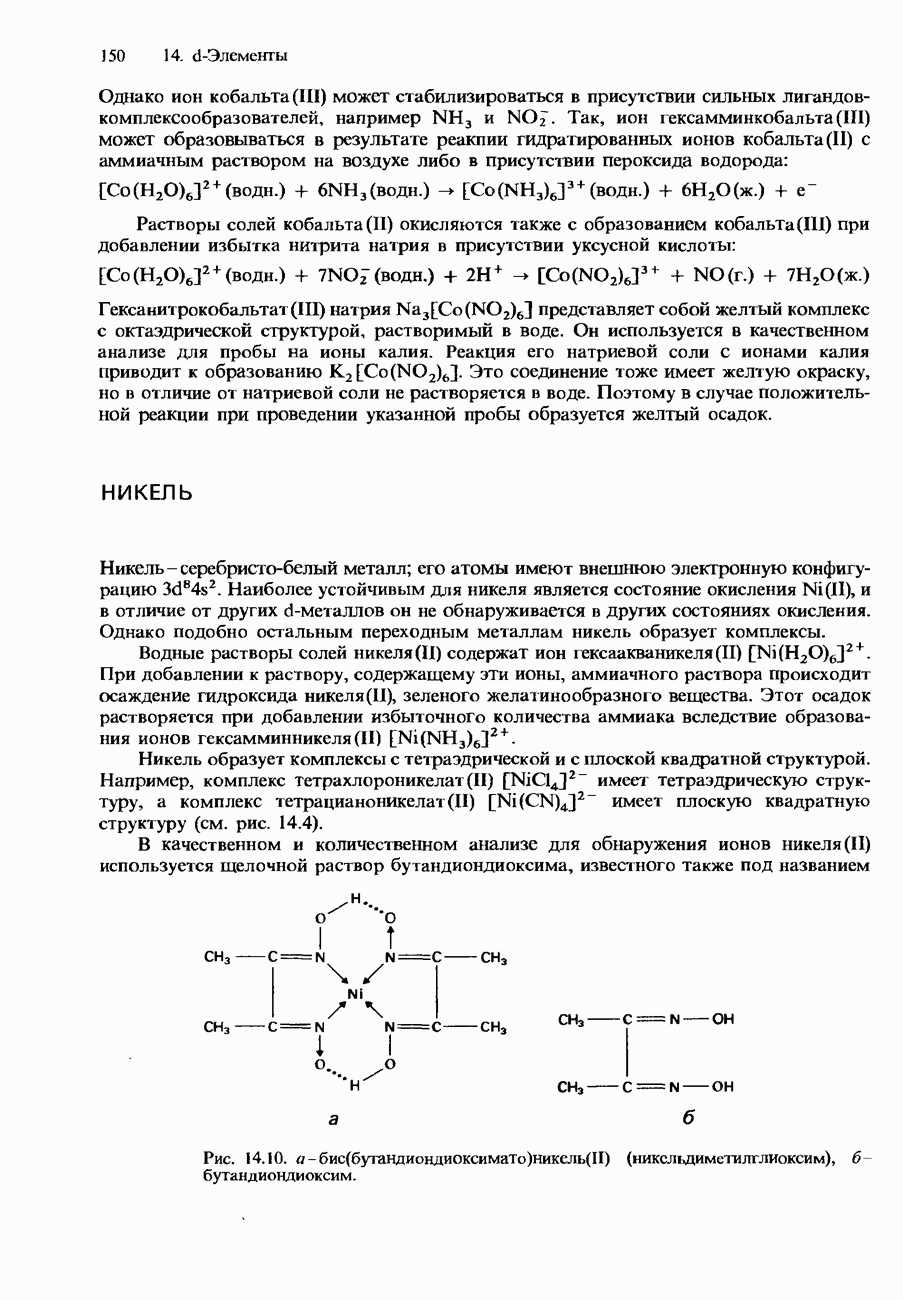
- НИКЕЛЬ
- МЕДЬ
- ЦИНК
- 14.3. Распространенность в природе, получение и применения
- ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ
- ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА
- ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 15. ЭЛЕМЕНТЫ III-VI ГРУПП
- 15.1. Алюминий и другие элементы III группы
- БОР
- ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ
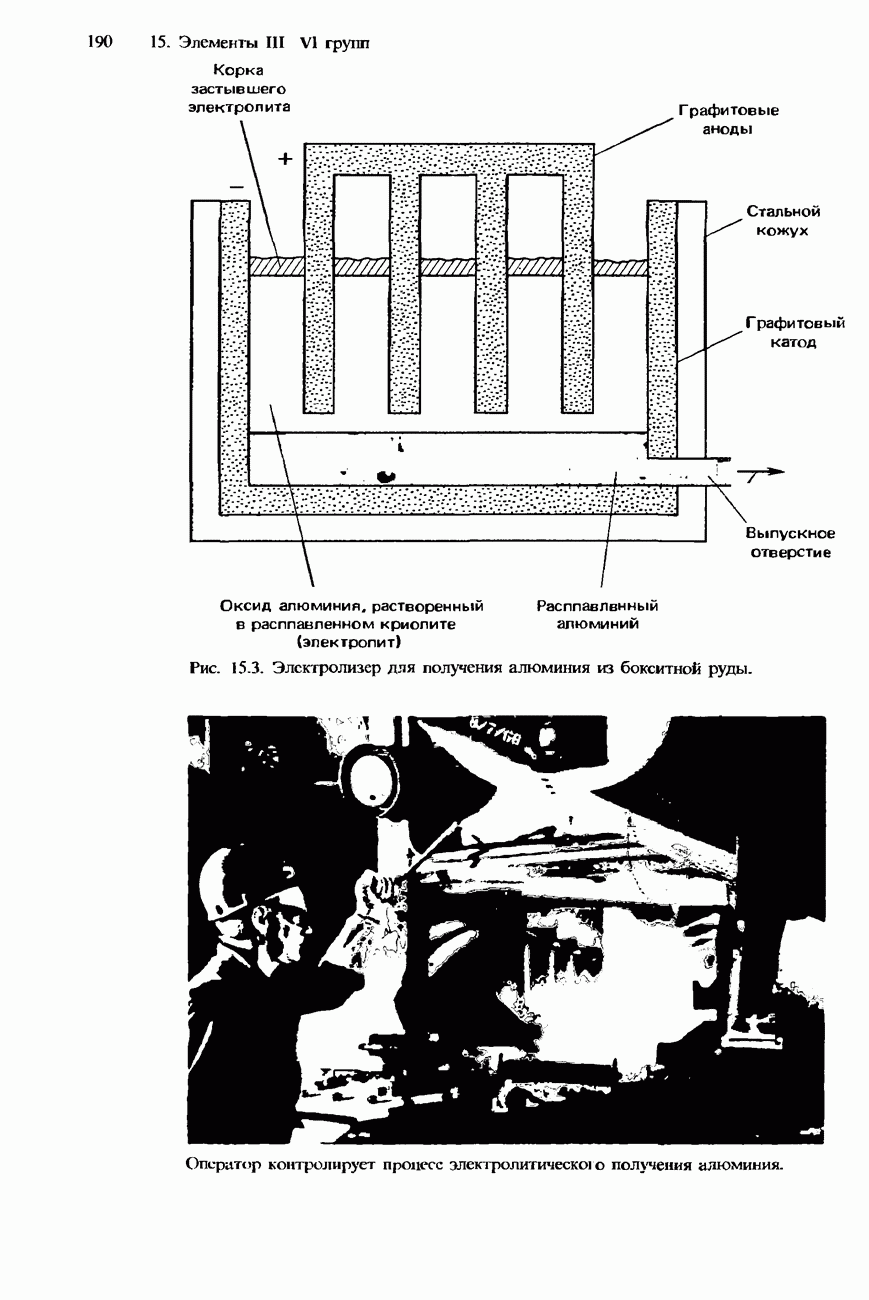
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ
- ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ
- 15.2. IV группа периодической системы
- СОЕДИНЕНИЯ
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД
- ПРИМЕНЕНИЯ УГЛЕРОДА
- ПРИМЕНЕНИЯ КРЕМНИЯ
- ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА
- 15.3. Элементы V группы
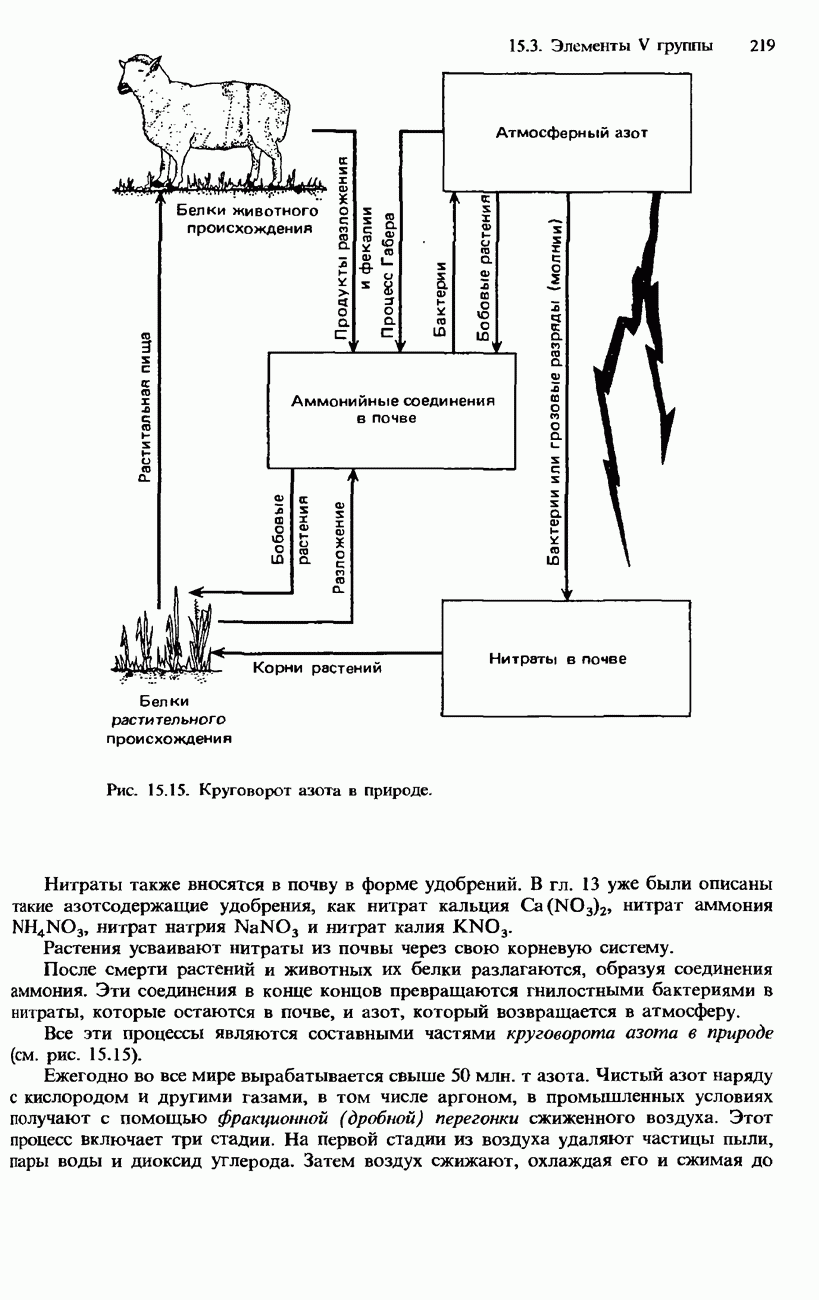
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА
- СОЕДИНЕНИЯ АЗОТА
- СОЕДИНЕНИЯ ФОСФОРА
- 15.4. Элементы VI группы. Кислород и сера
- КИСЛОРОД
- СОЕДИНЕНИЯ КИСЛОРОДА
- СЕРА
- СОЕДИНЕНИЯ СЕРЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ
- 16.1. Галогены
- ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ
- ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ
- ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ
- 16.2. Соединения галогенов
- ГАЛОГЕНОВОДОРОДЫ
- КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ
- 16.3. Распространенность, получение и применение галогенов и их соединений
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА
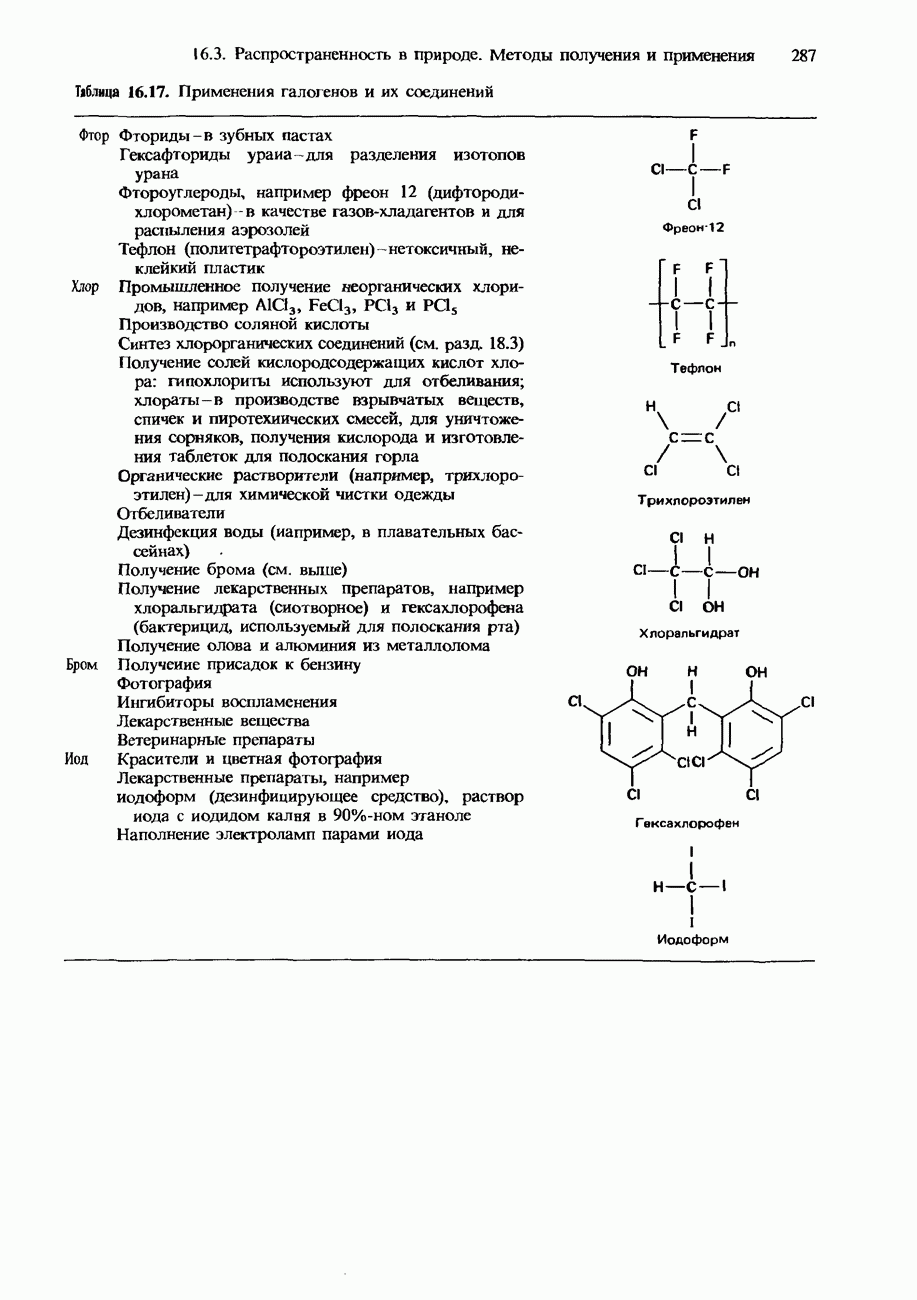
- ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ
- ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ
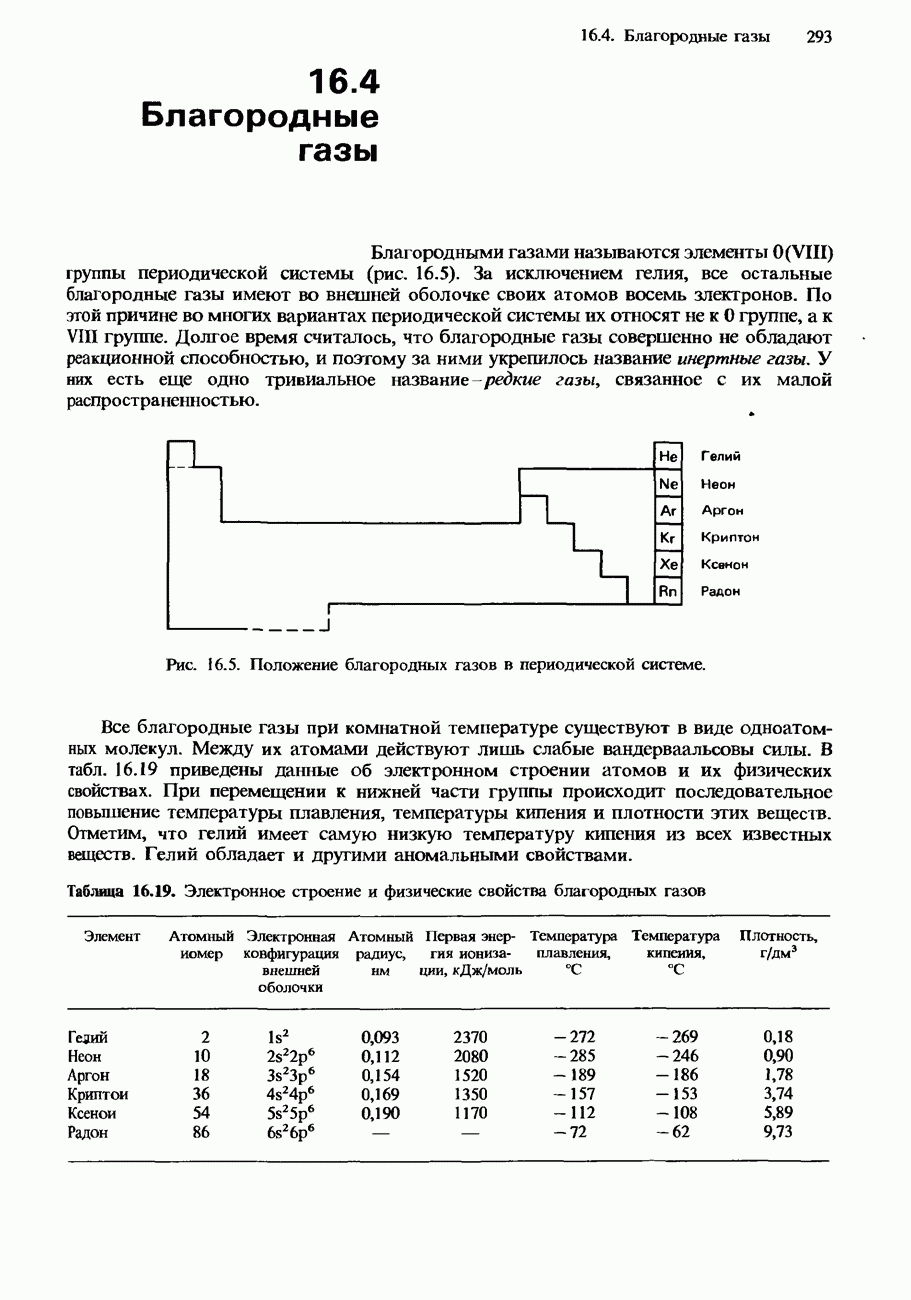
- 16.4. Благородные газы
- СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
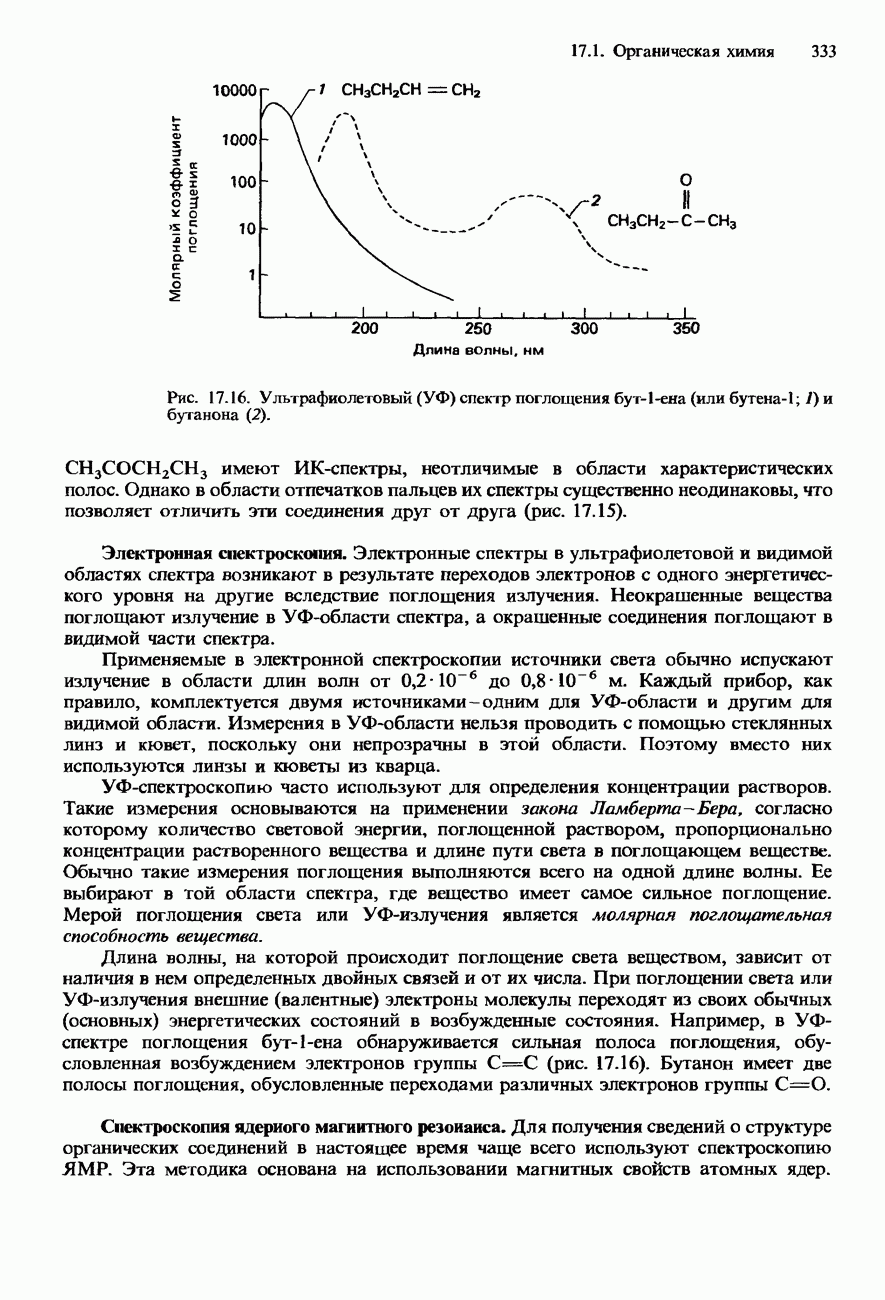
- 7.1. Органическая химия
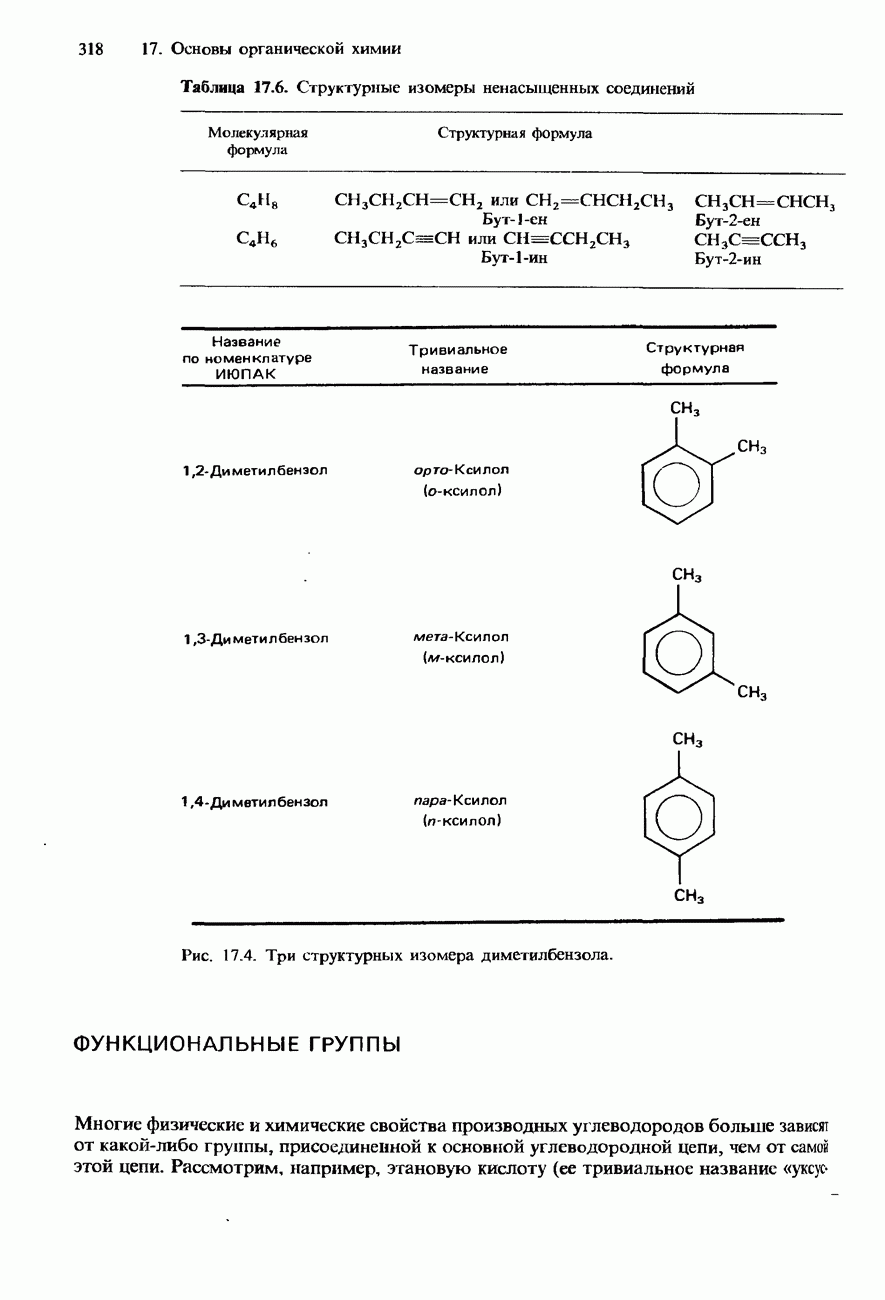
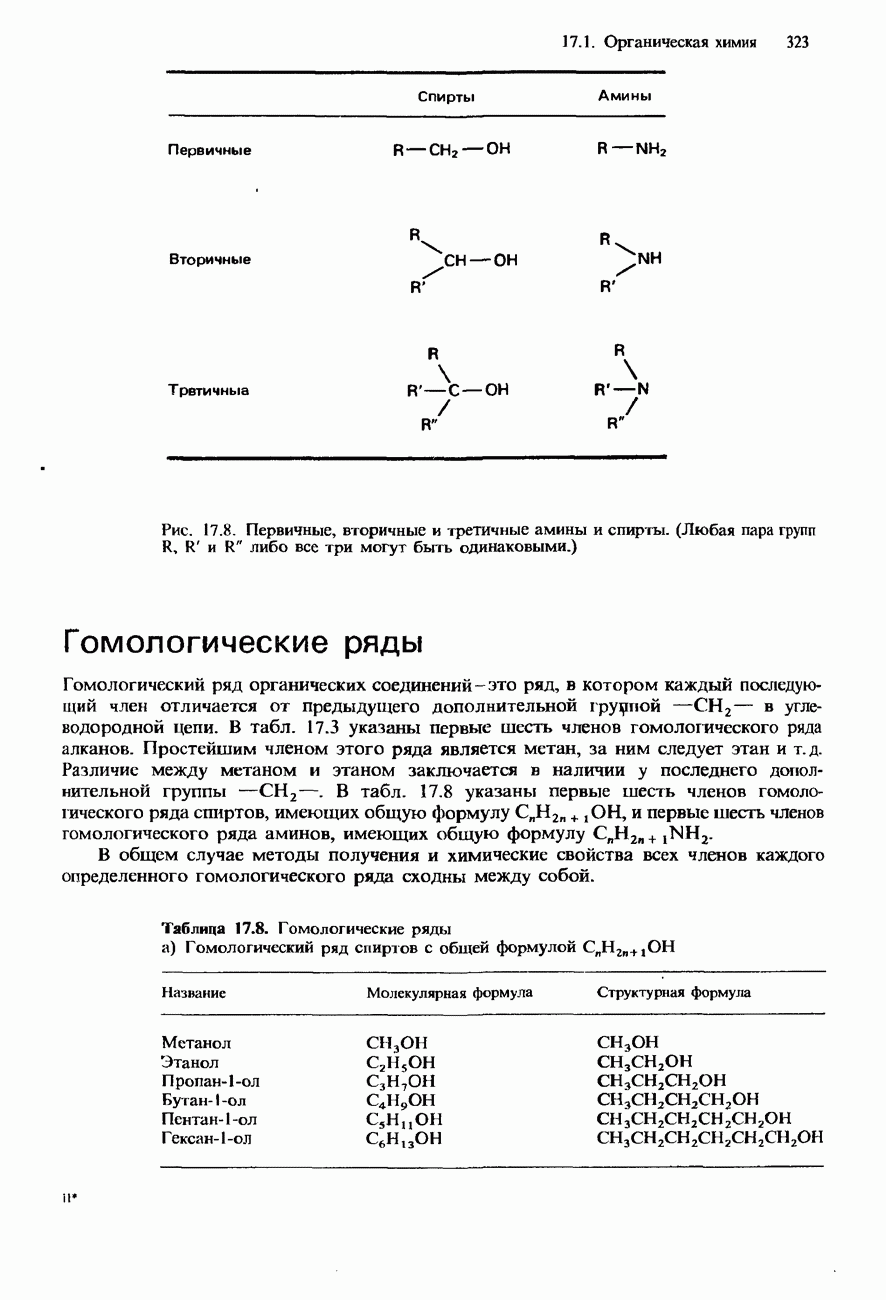
- НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- УГЛЕВОДОРОДЫ
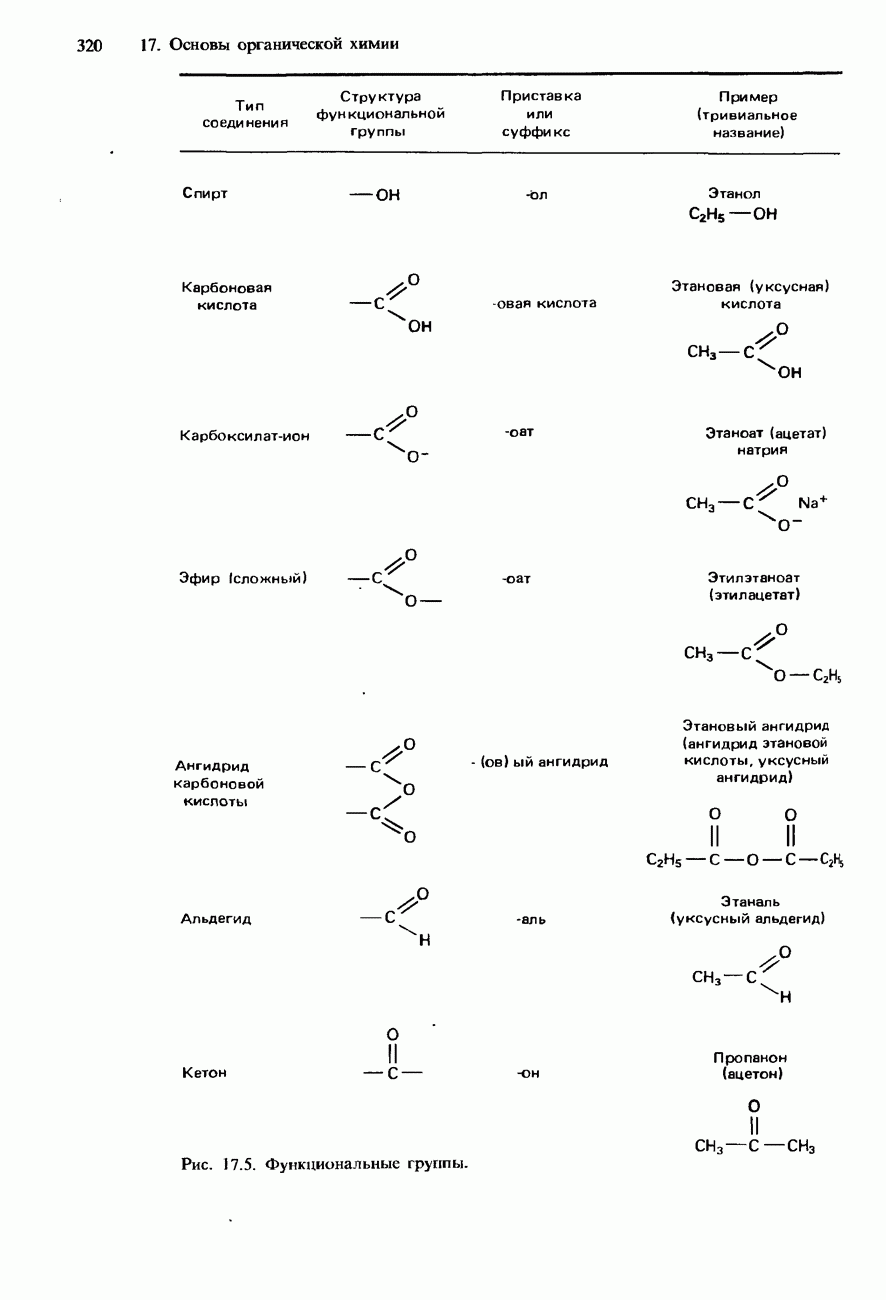
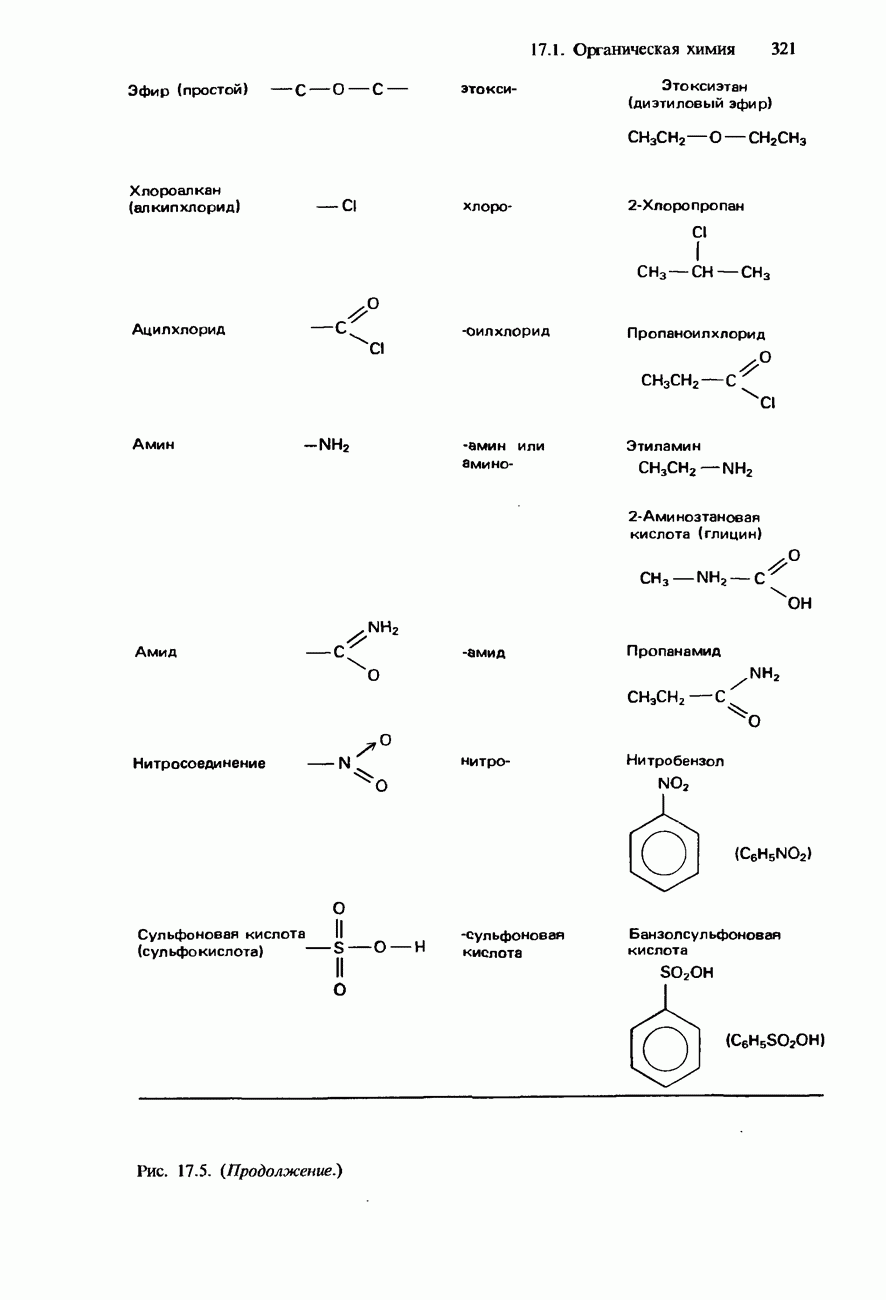
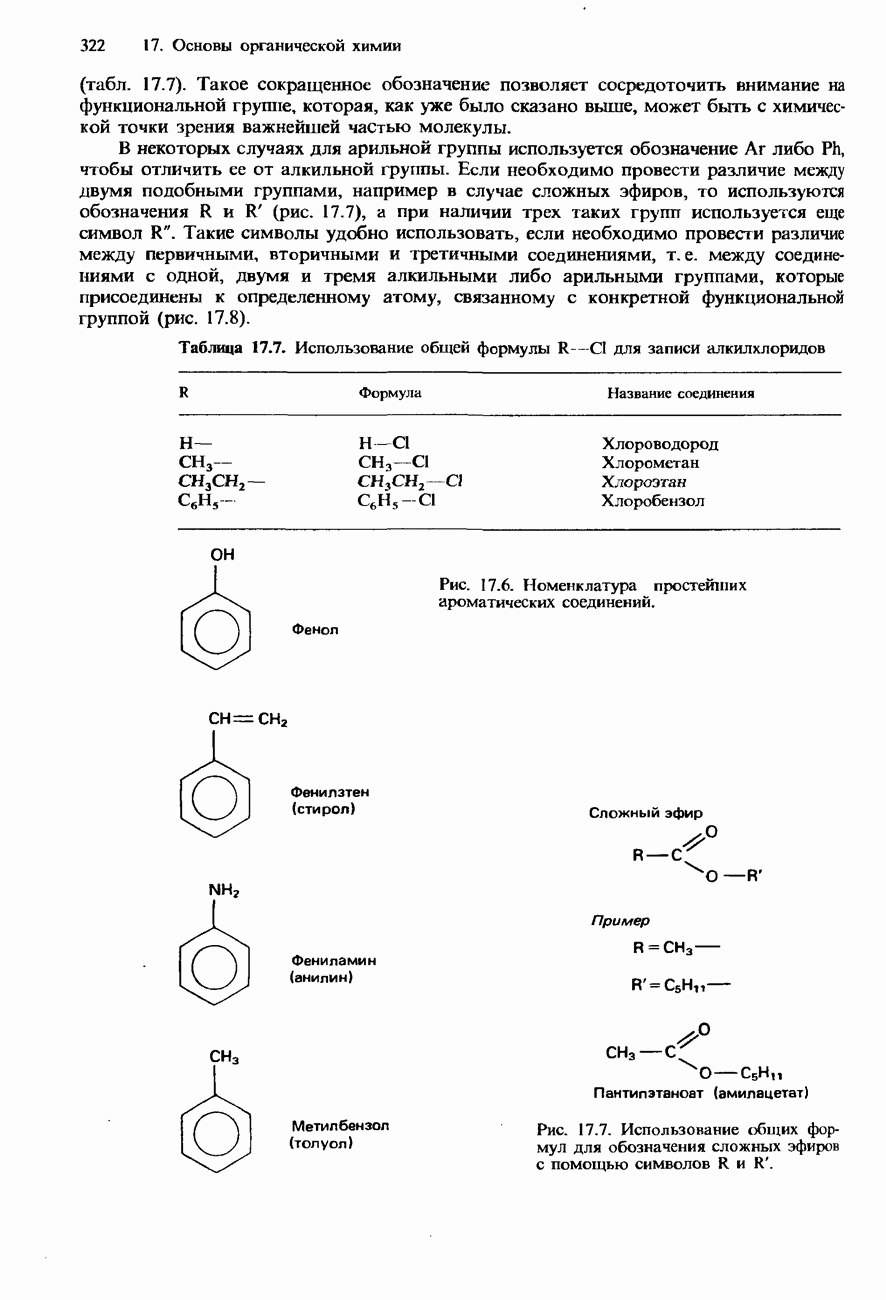
- ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
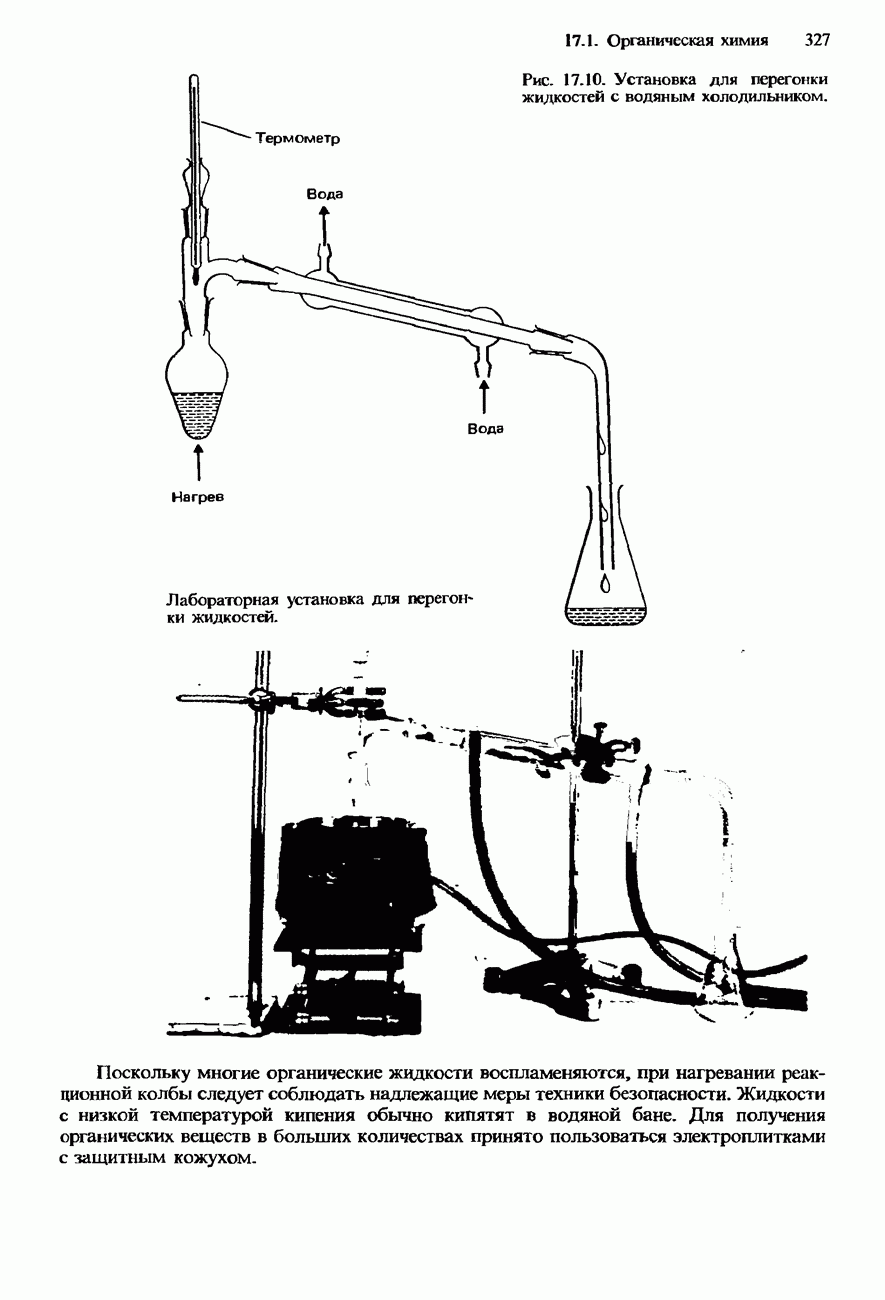
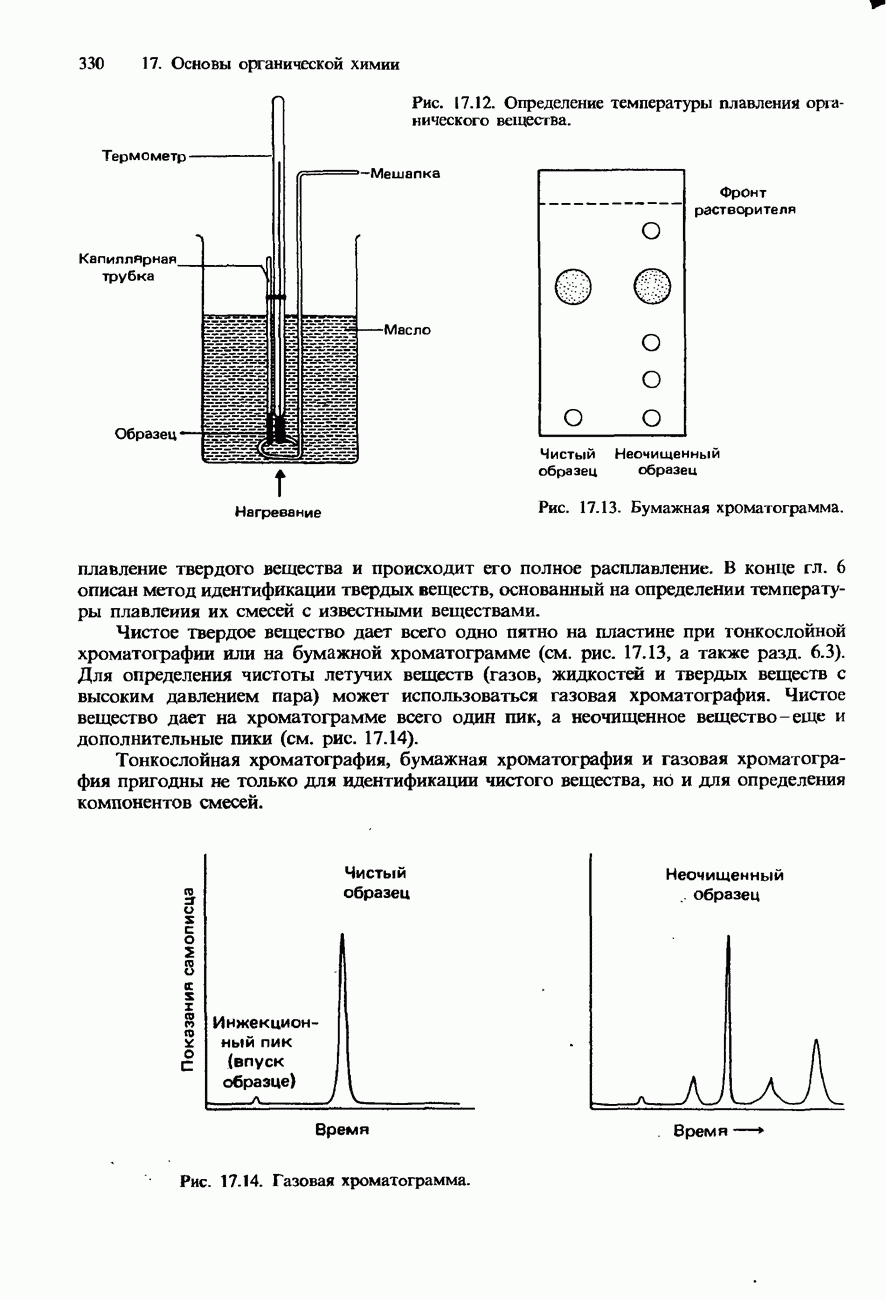
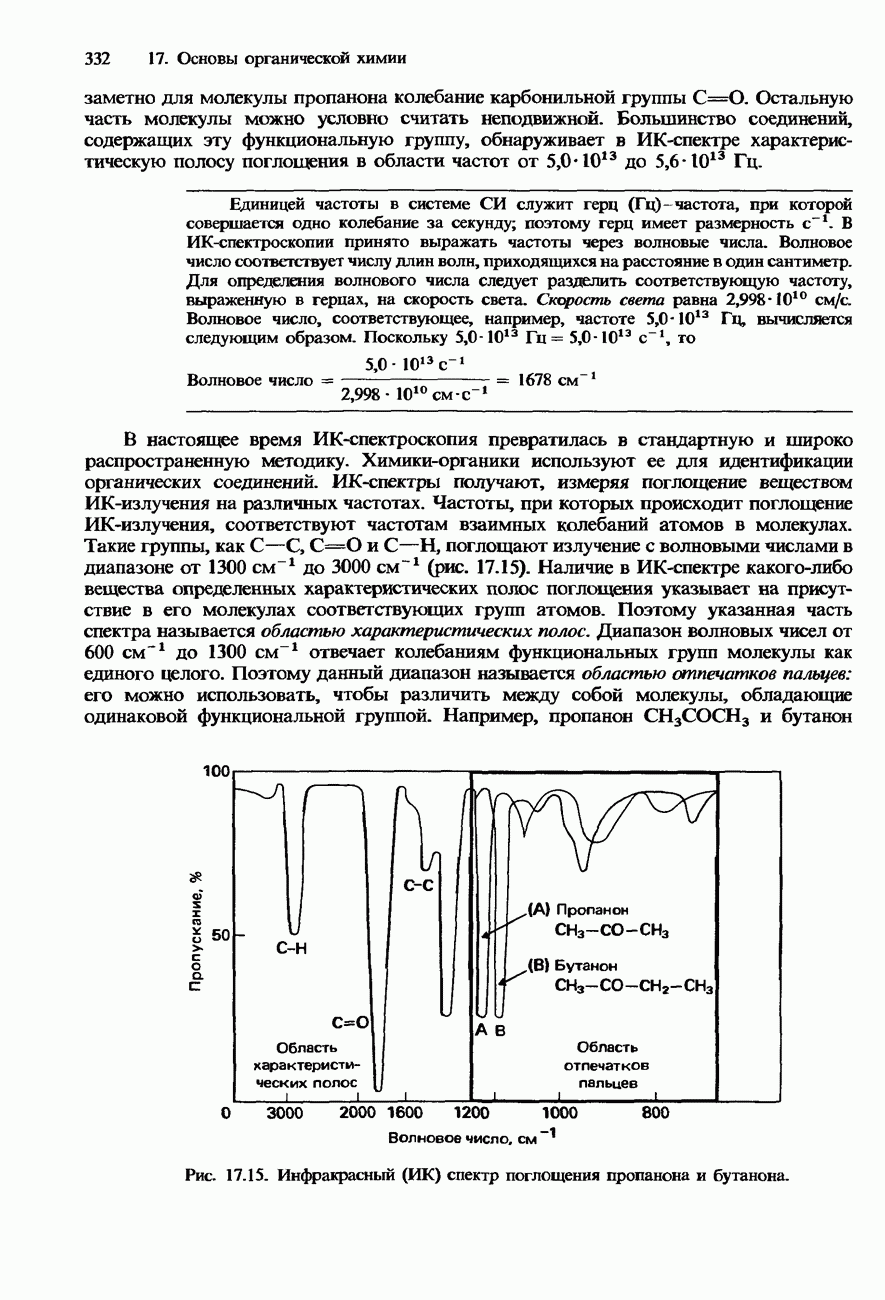
- ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
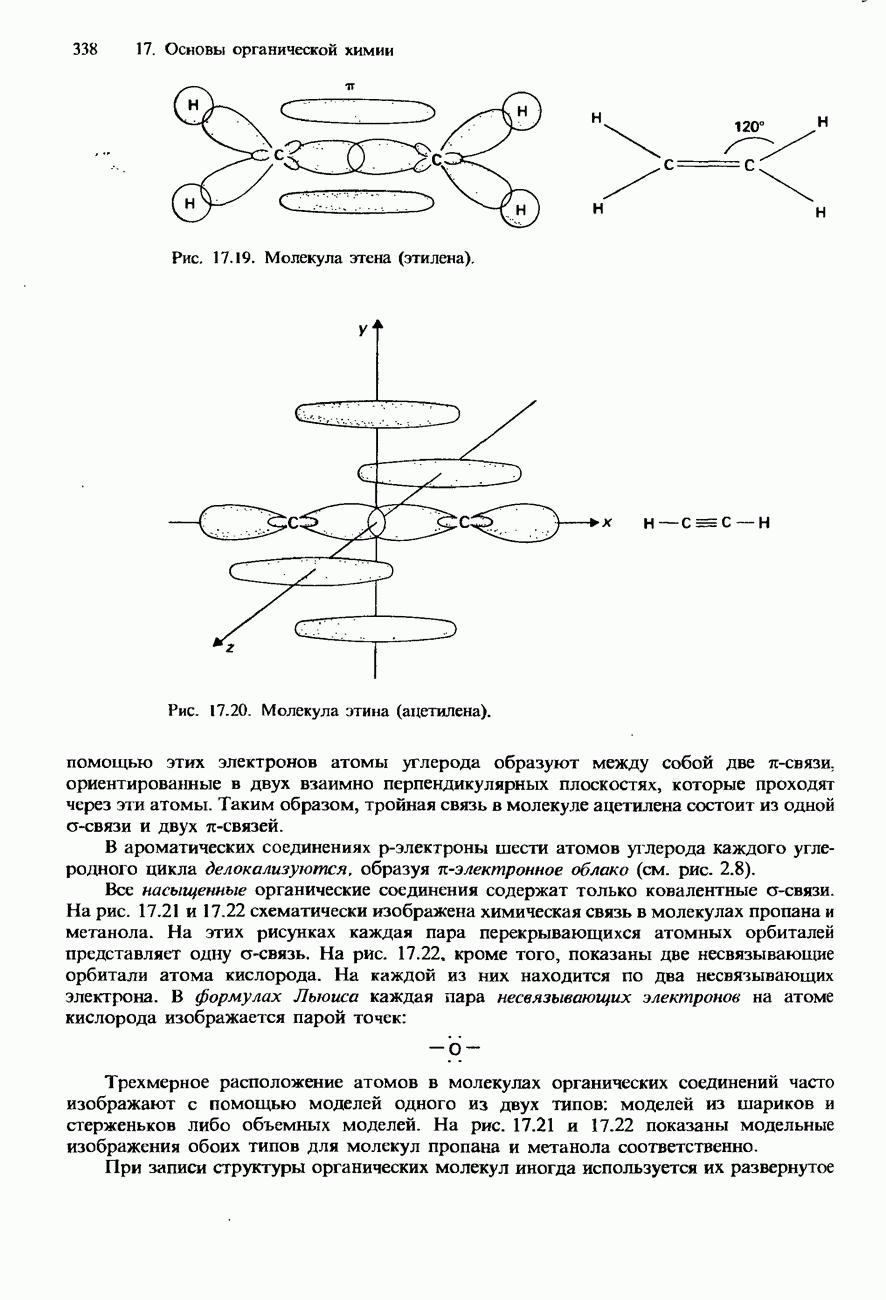
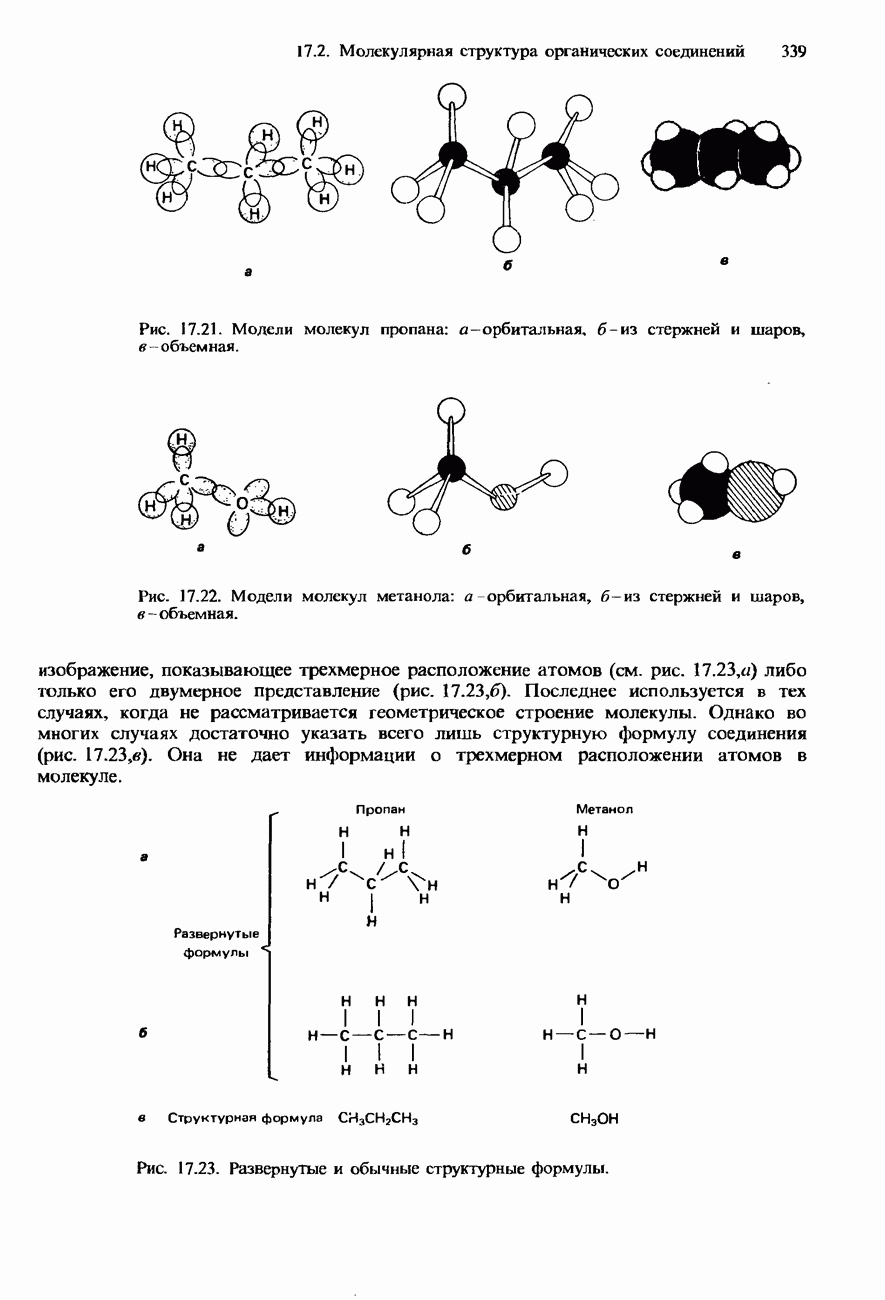
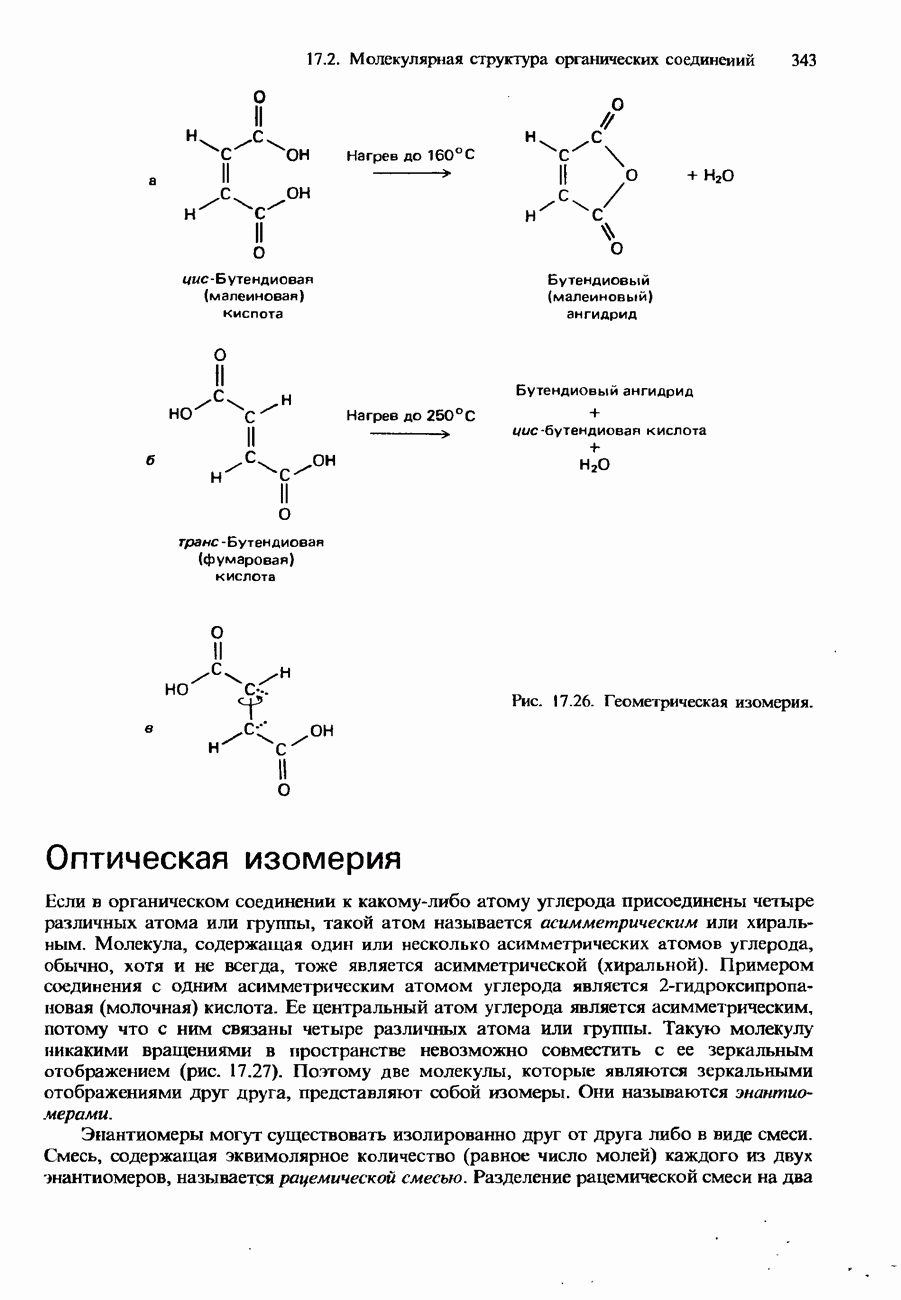
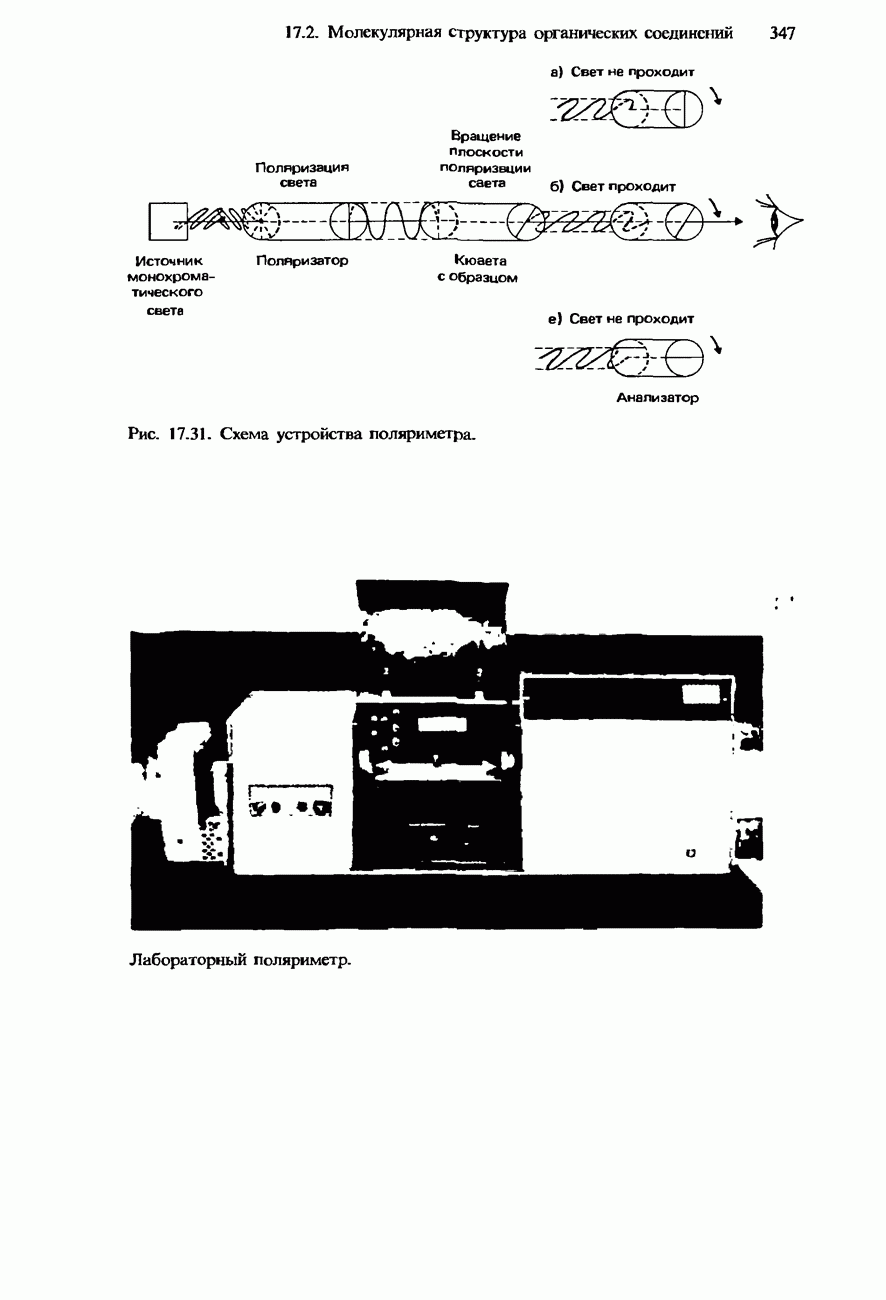
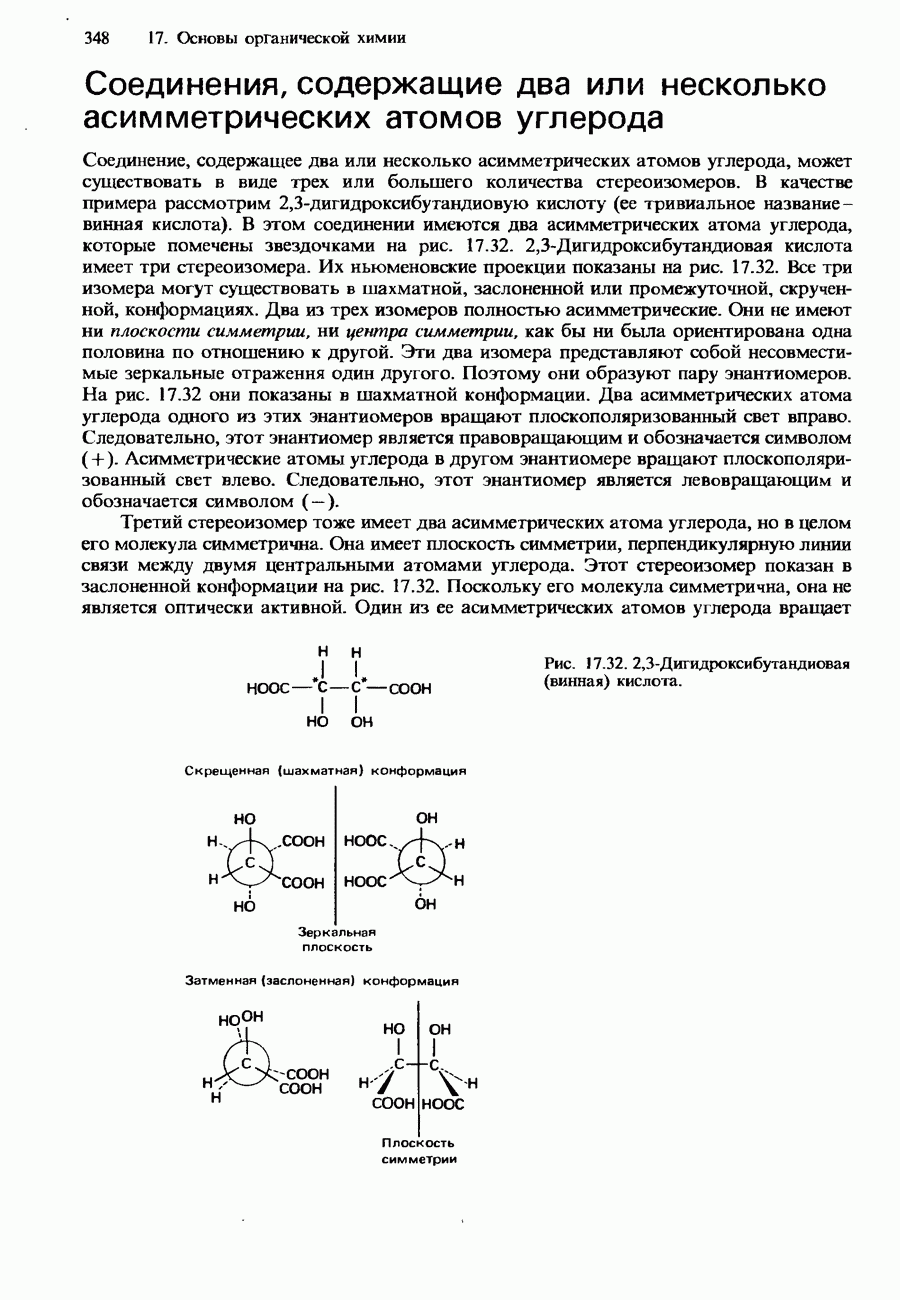
- 17.2. Молекулярная структура органических соединений
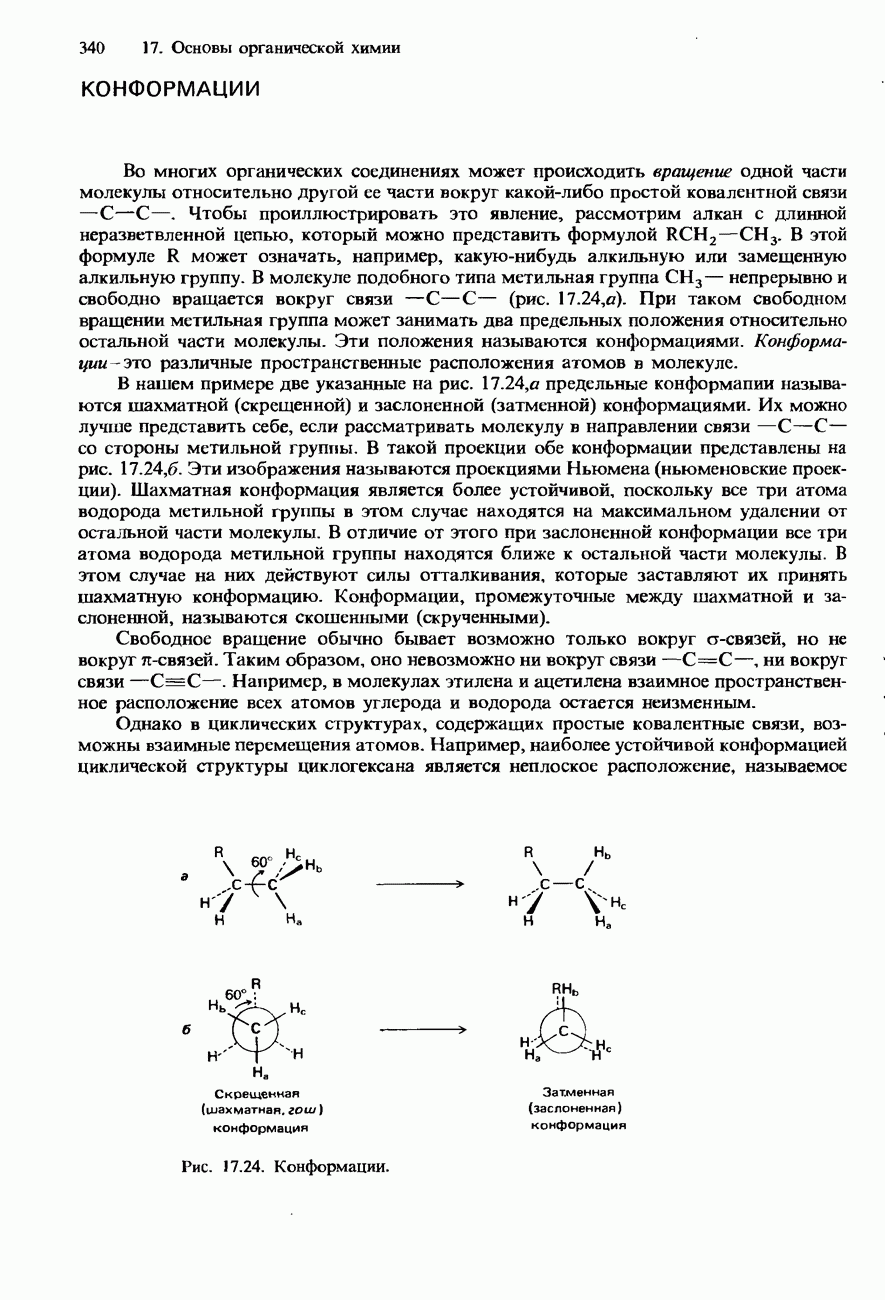
- КОНФОРМАЦИИ
- СТЕРЕОИЗОМЕРИЯ
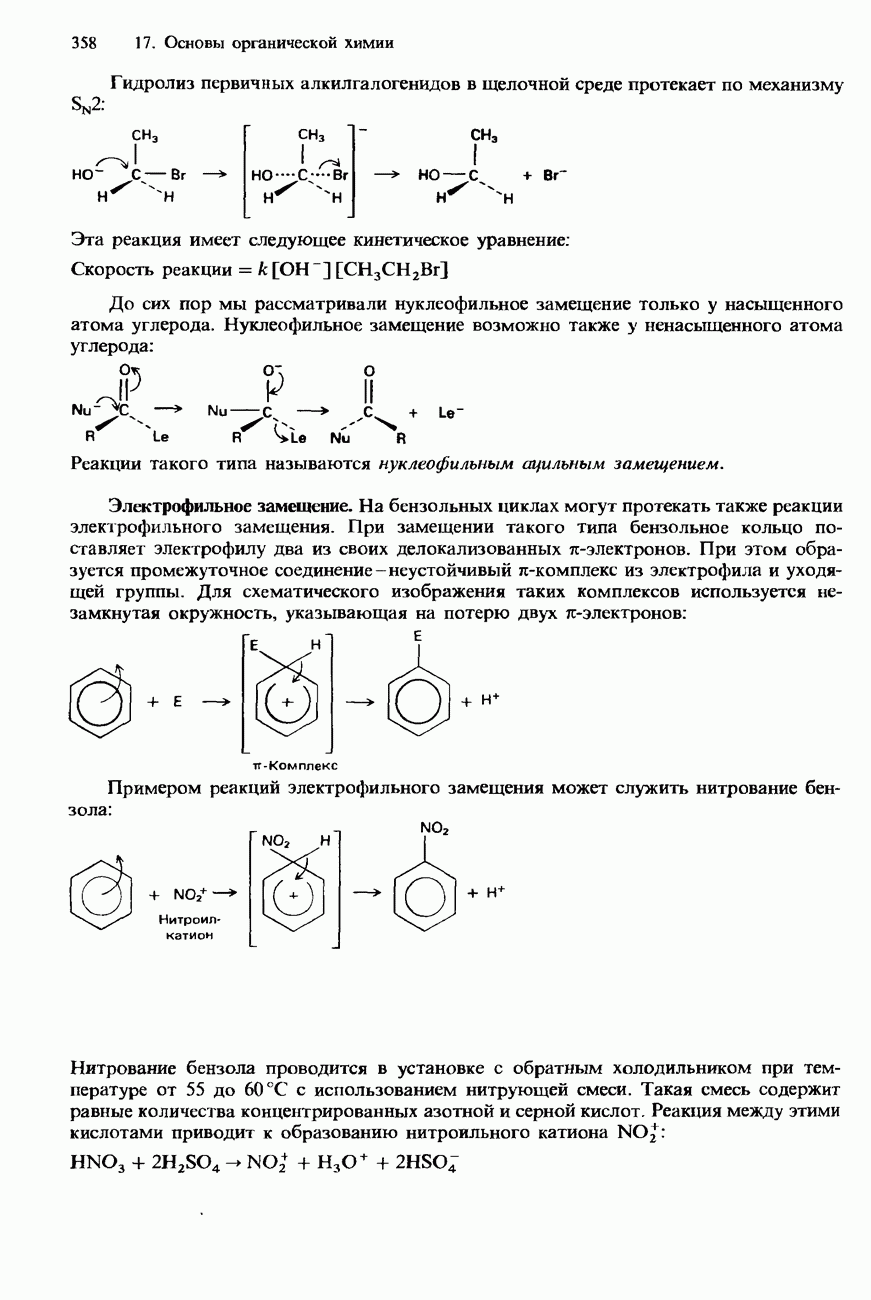
- 17.3. Механизмы органических реакций
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ
- ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 18. УГЛЕВОДОРОДЫ
- 18.1. Алифатические углеводороды
- АЛКАНЫ
- АЛКЕНЫ
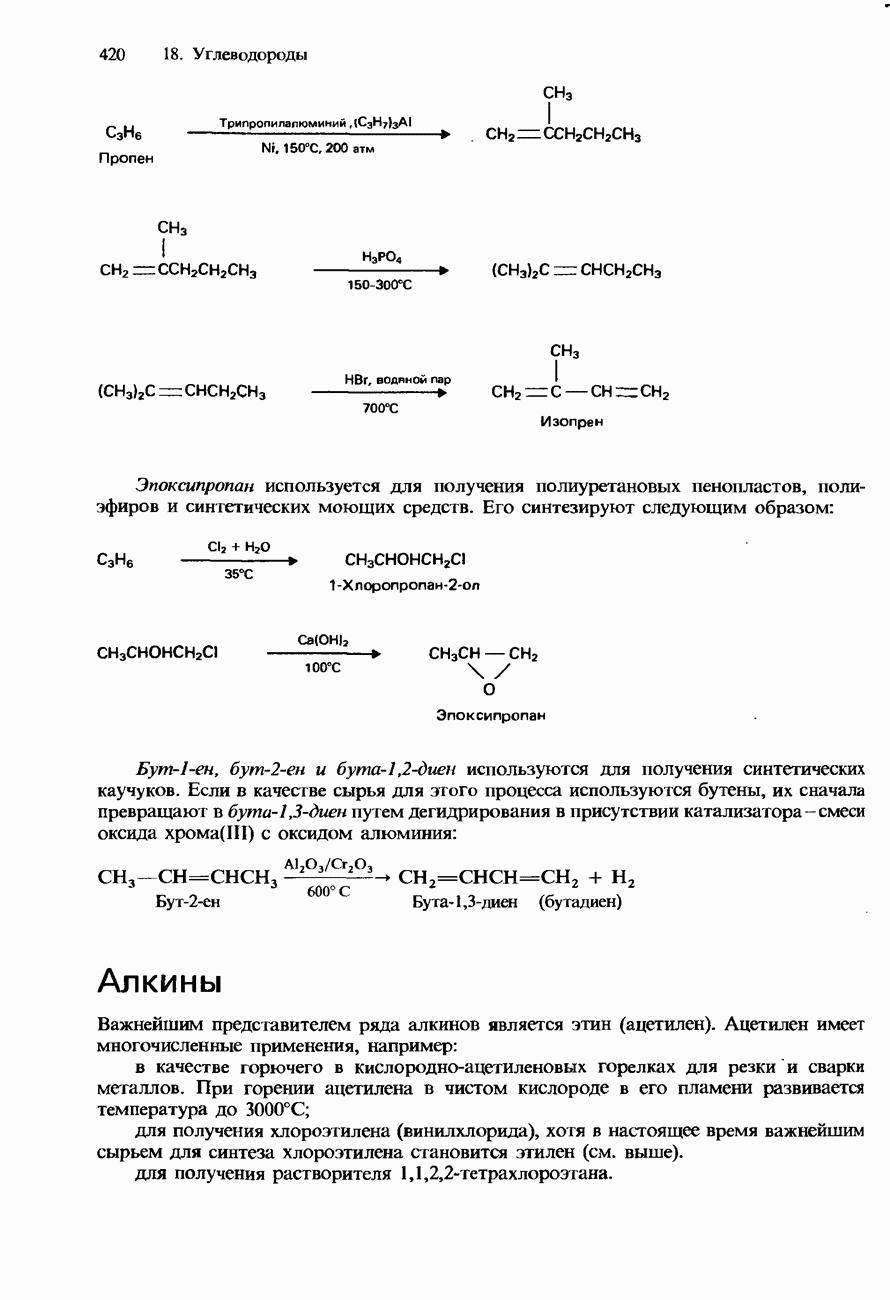
- АЛКИНЫ
- 18.2. Арены
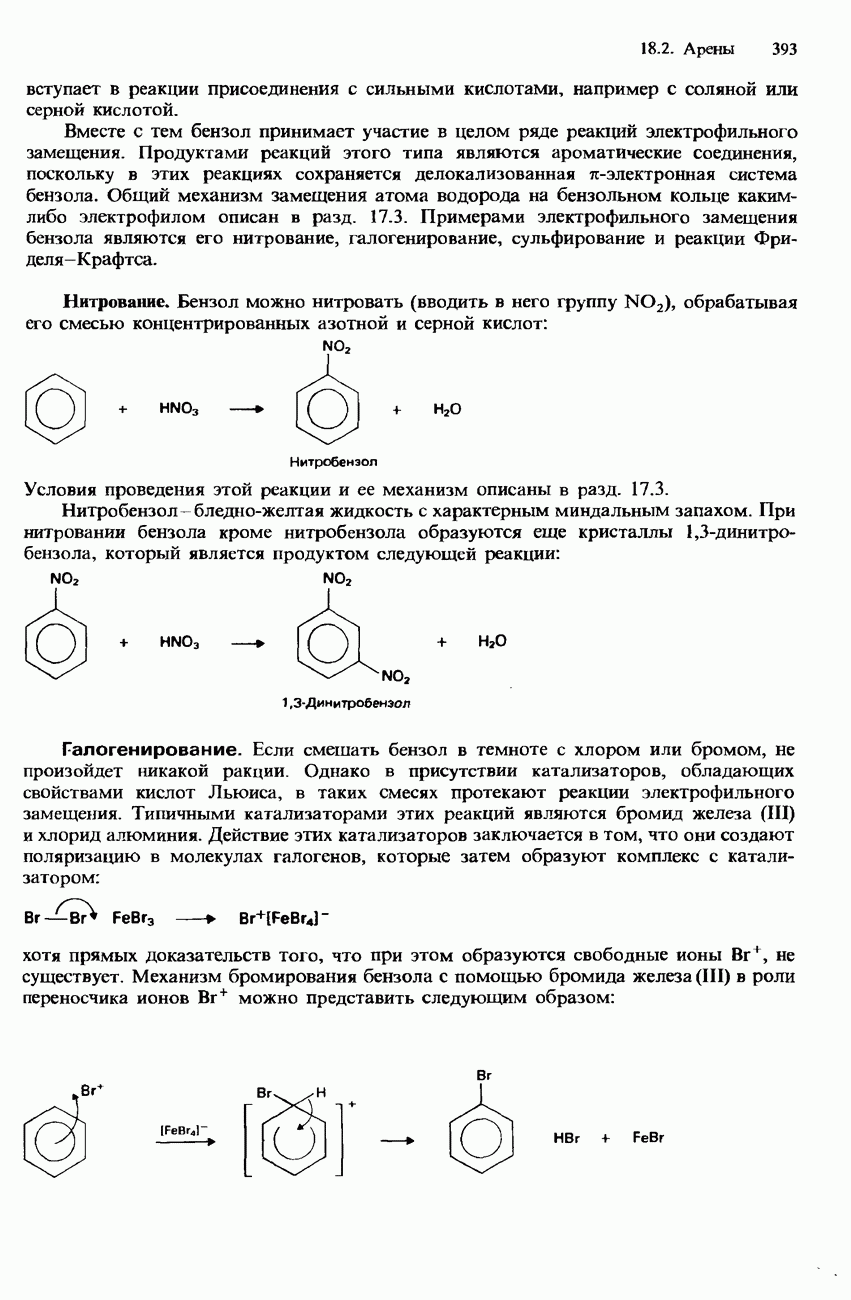
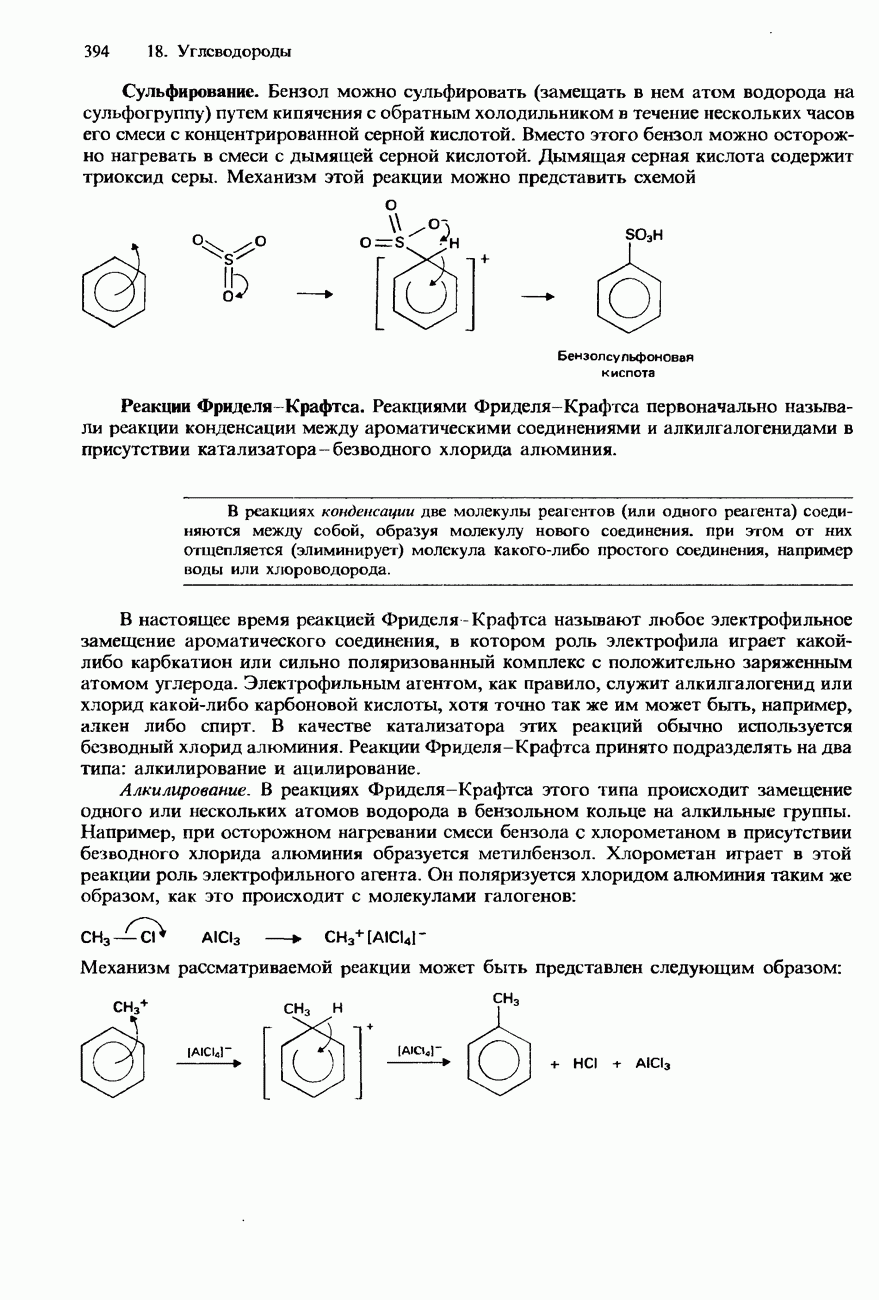
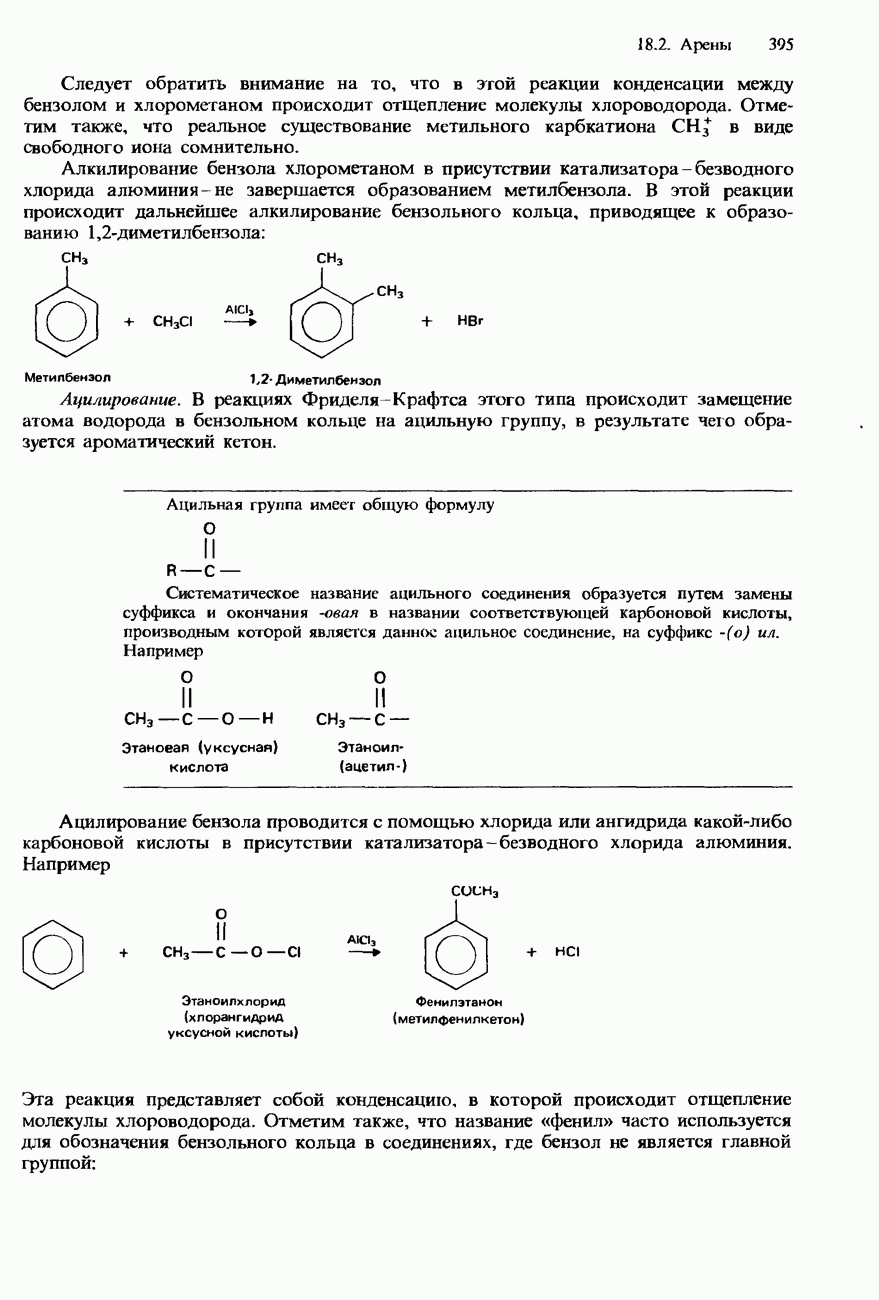
- БЕНЗОЛ
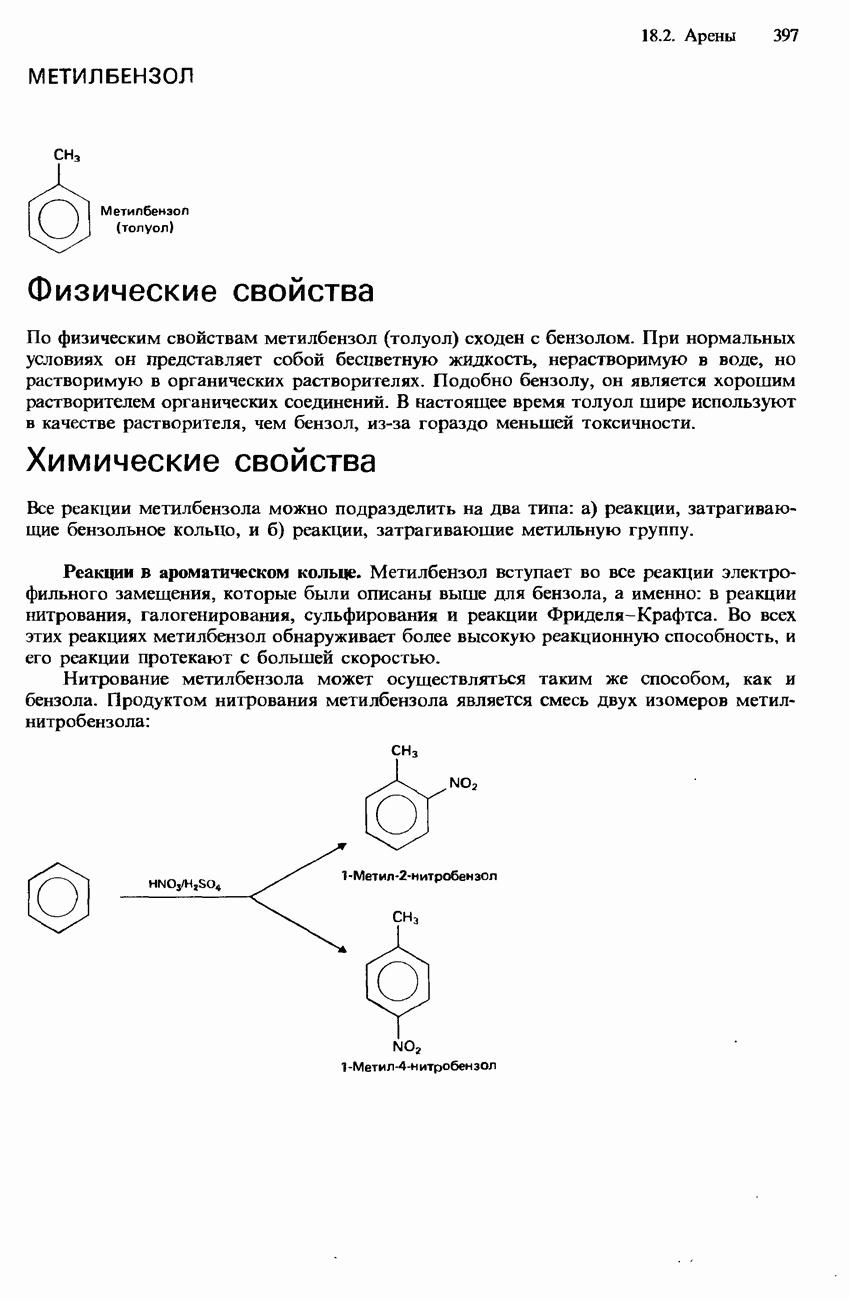
- МЕТИЛБЕНЗОЛ
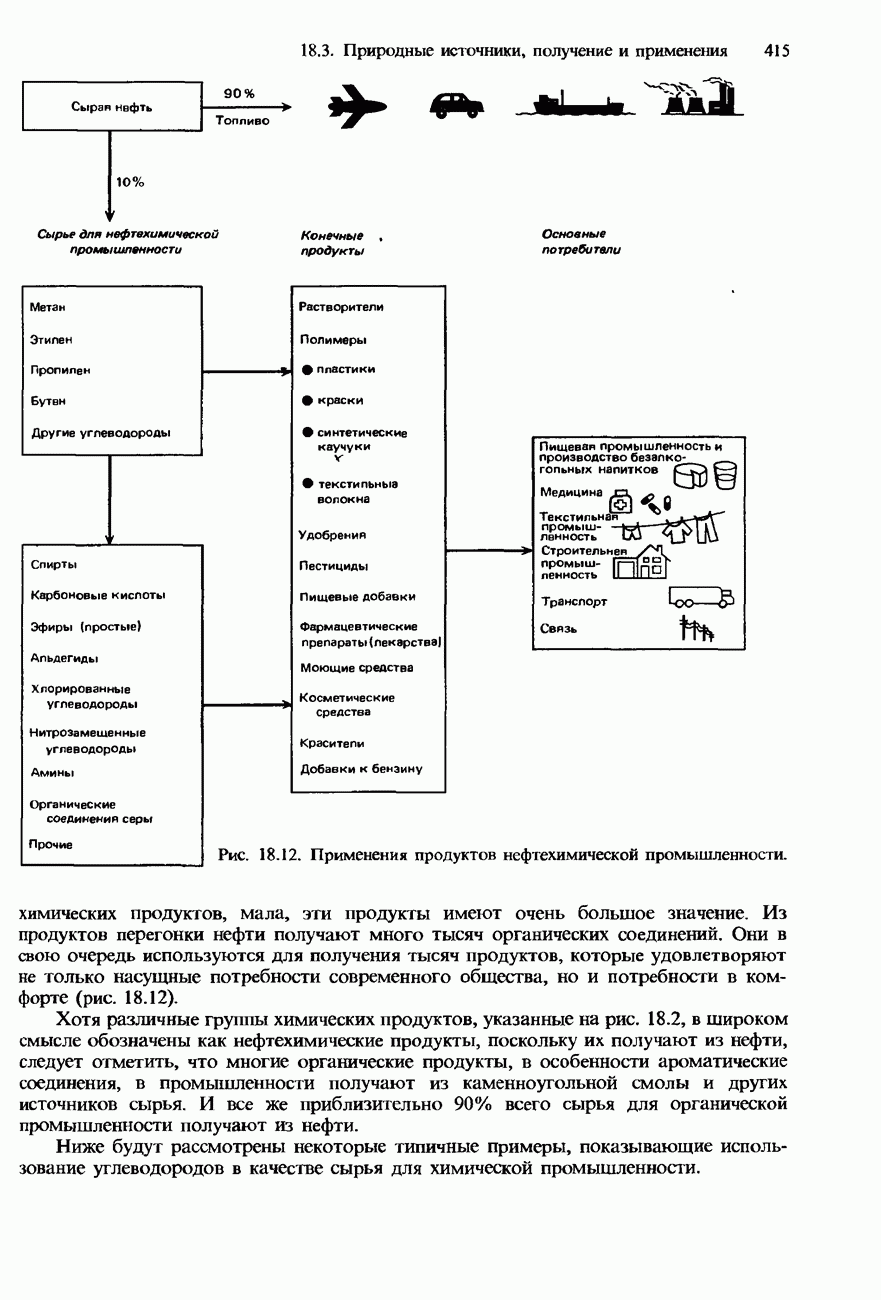
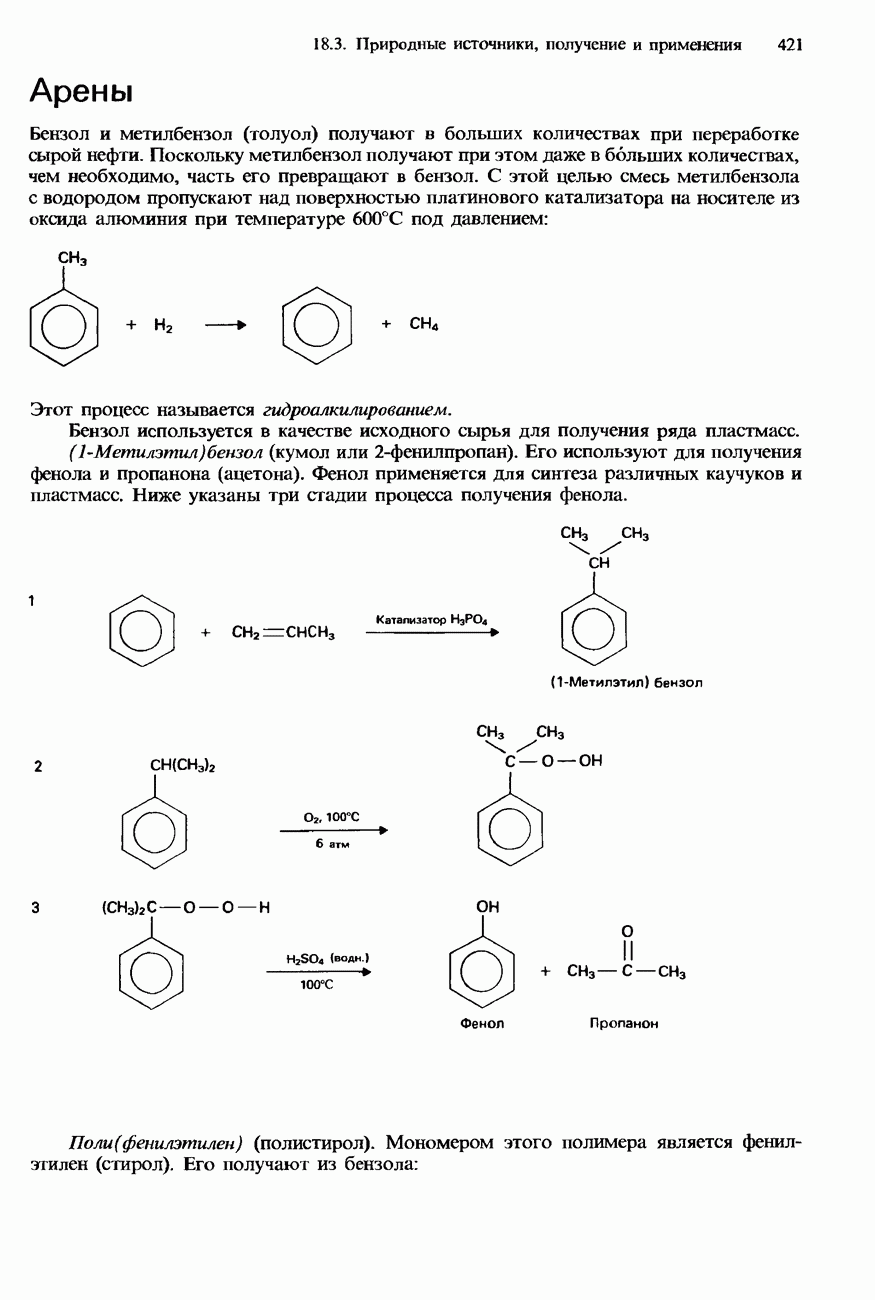
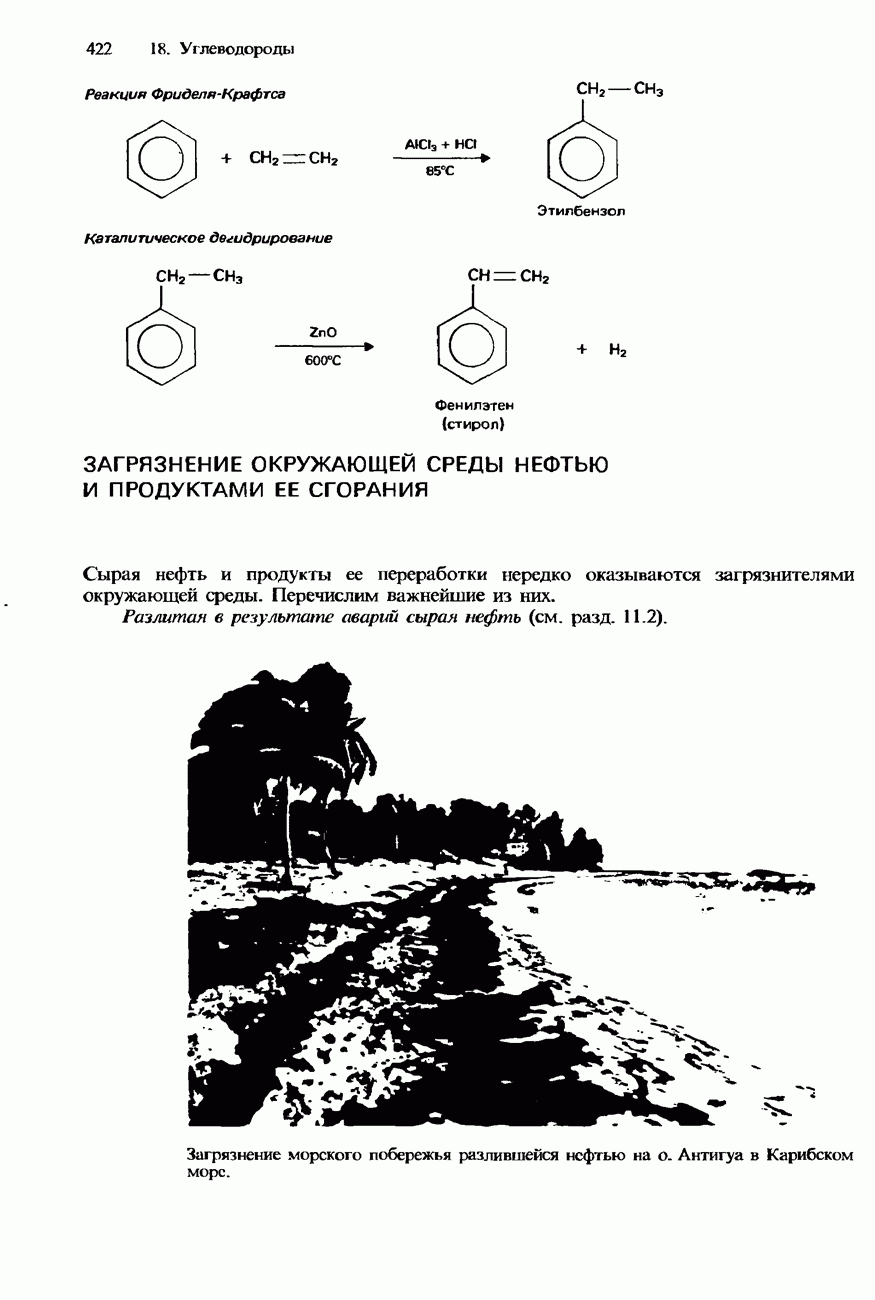
- 18.3. Природные источники, получение и применения
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ
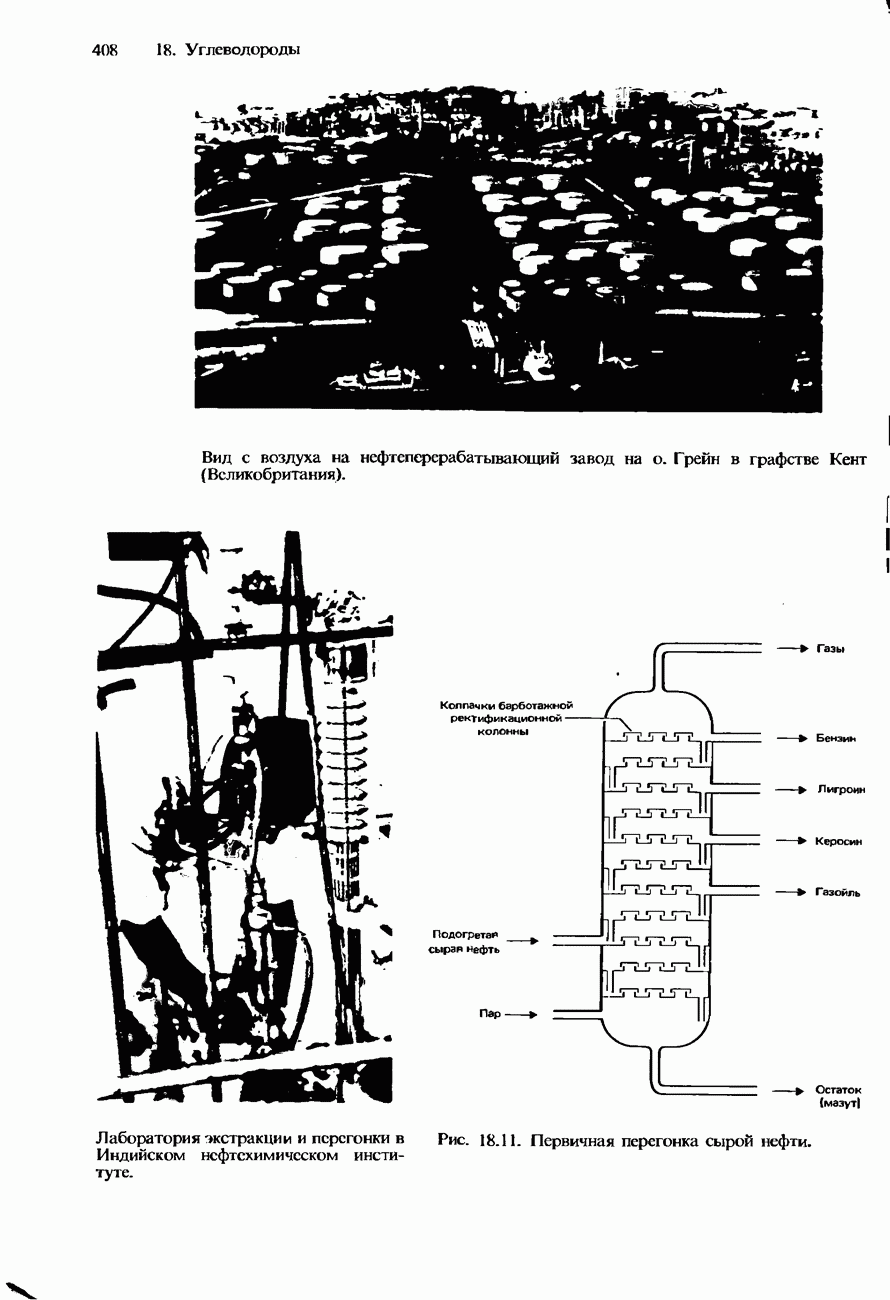
- ПЕРЕРАБОТКА НЕФТИ
- ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ
- ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
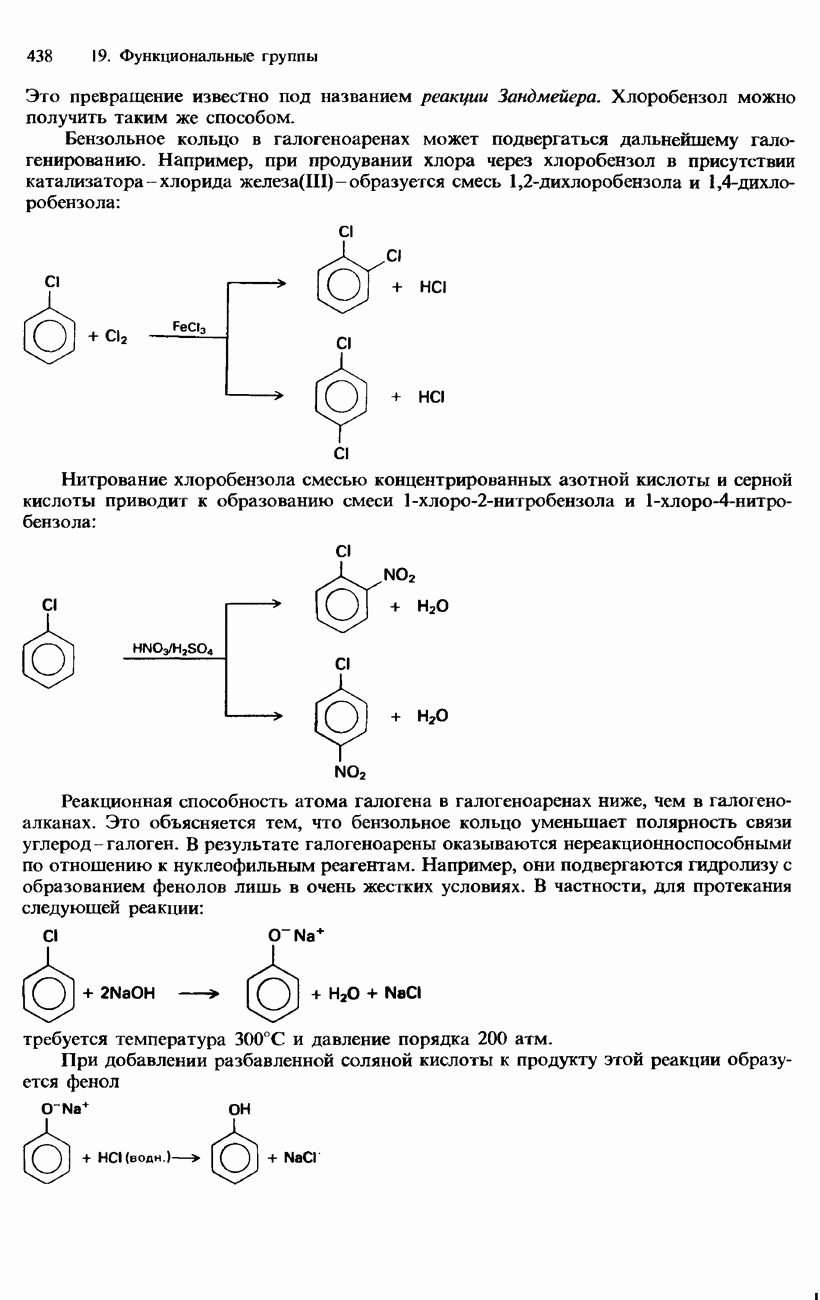
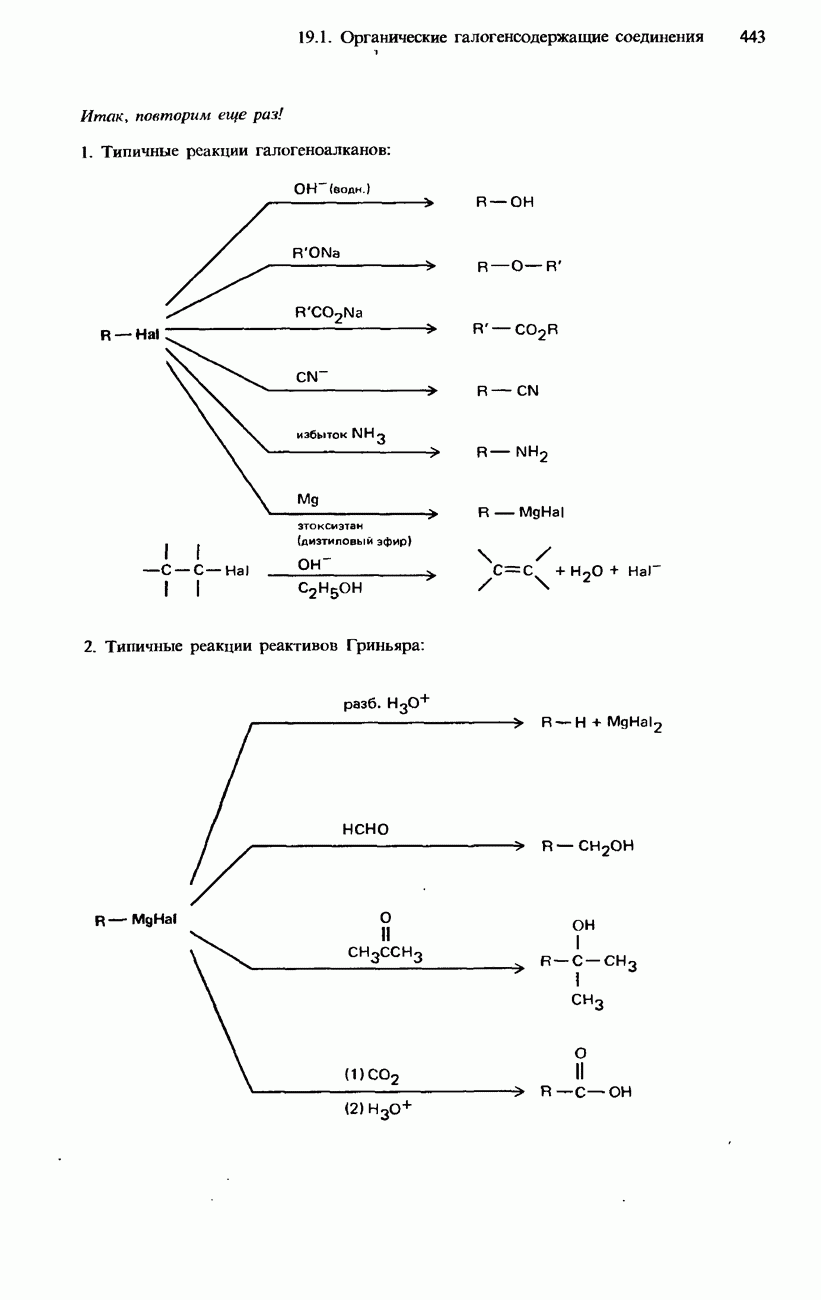
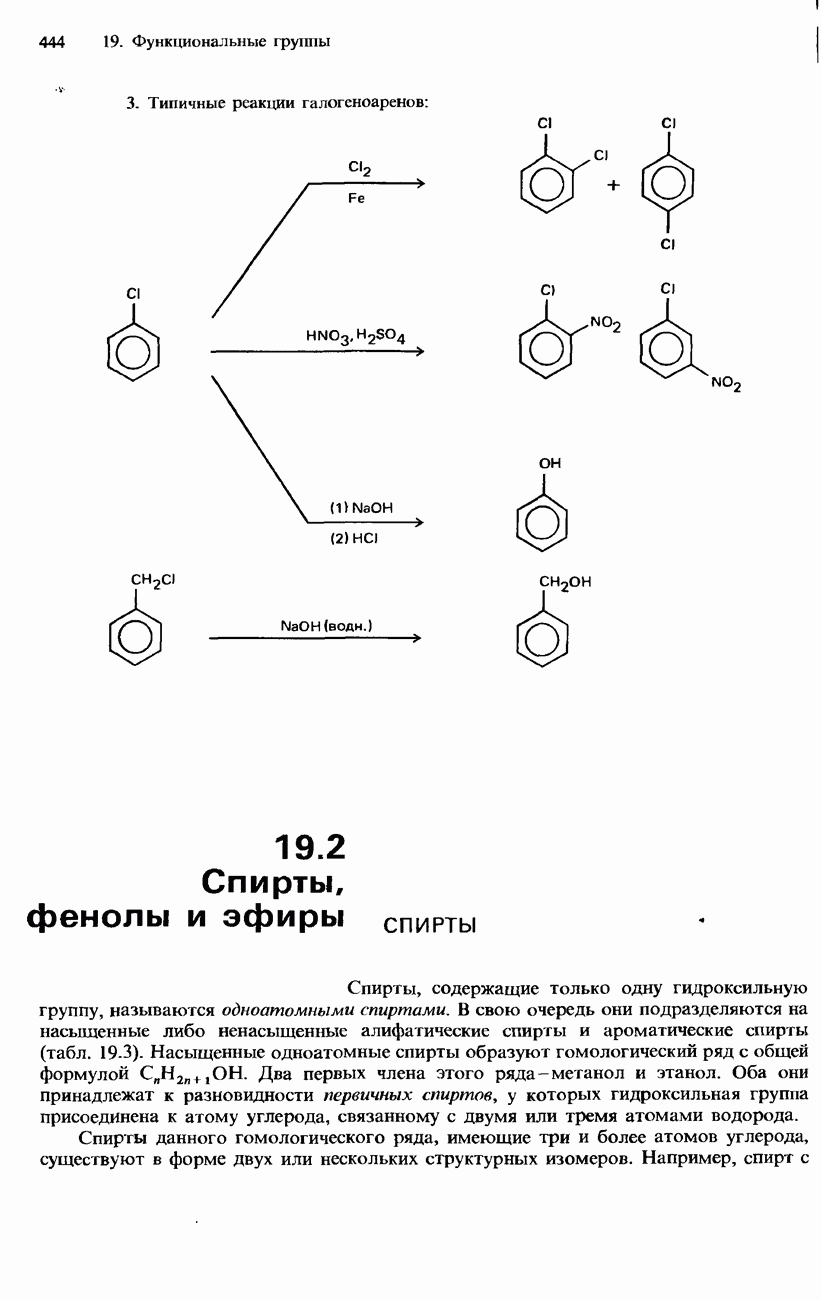
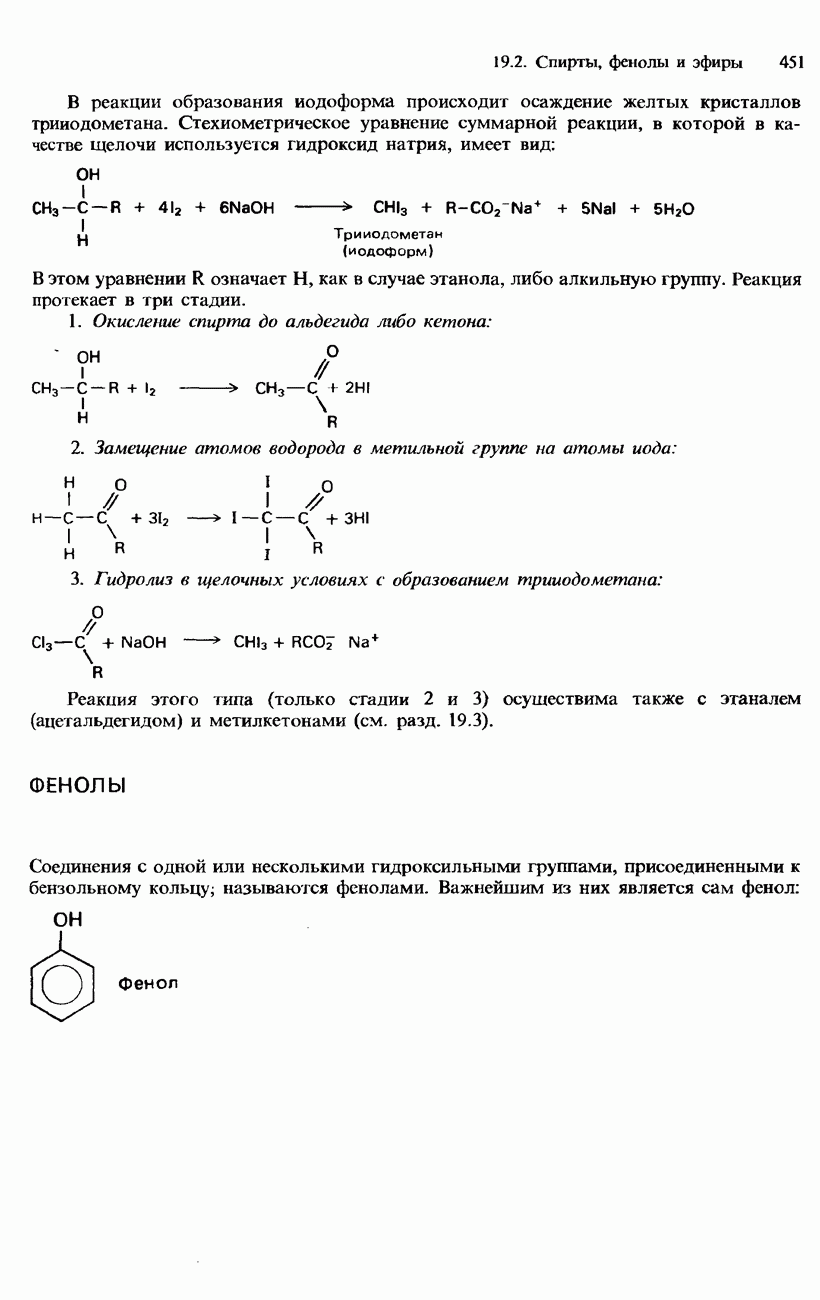
- 19.1. Органические галогенсодержащие соединения
- ГАЛОГЕНОАЛКЕНЫ
- ГАЛОГЕНОАРЕНЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
- 19.2. Спирты, фенолы и эфиры
- ФЕНОЛЫ
- ПРОСТЫЕ ЭФИРЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ
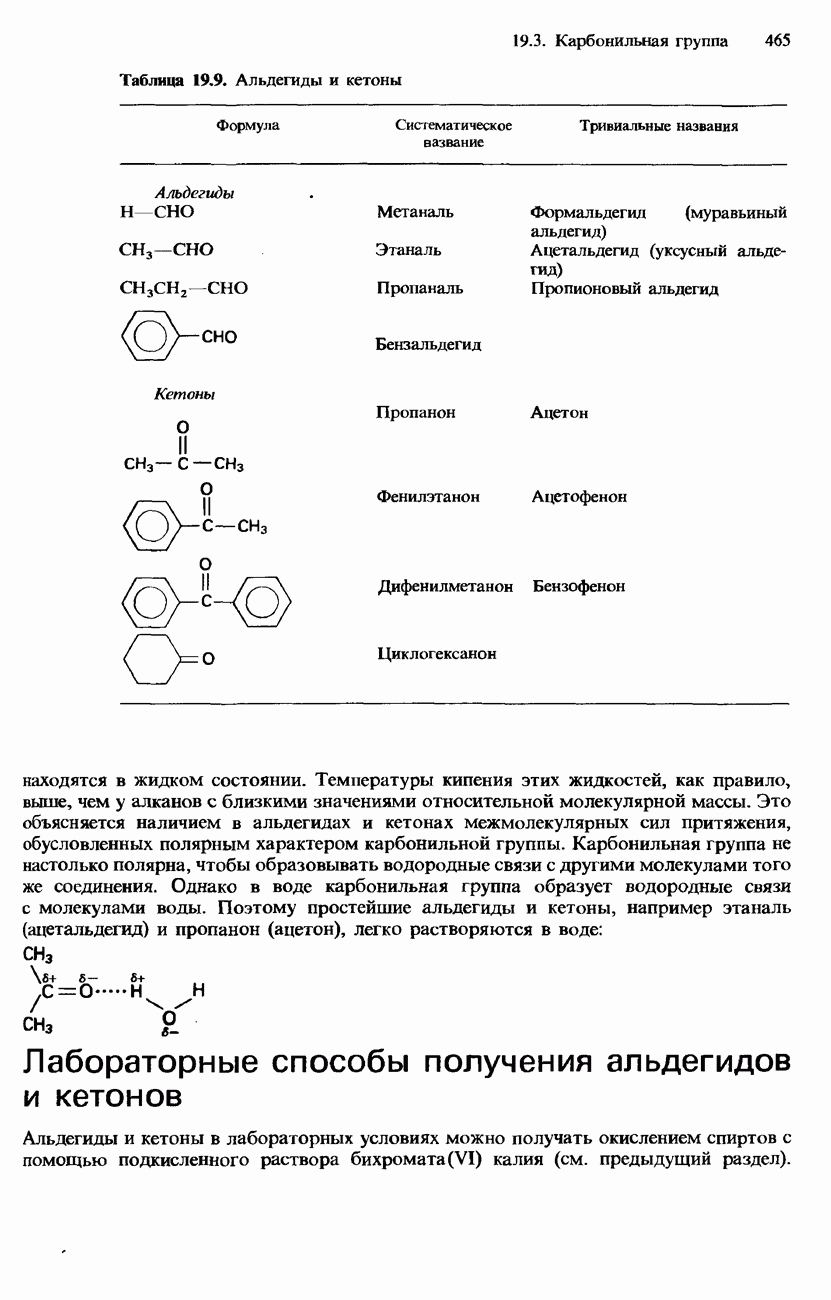
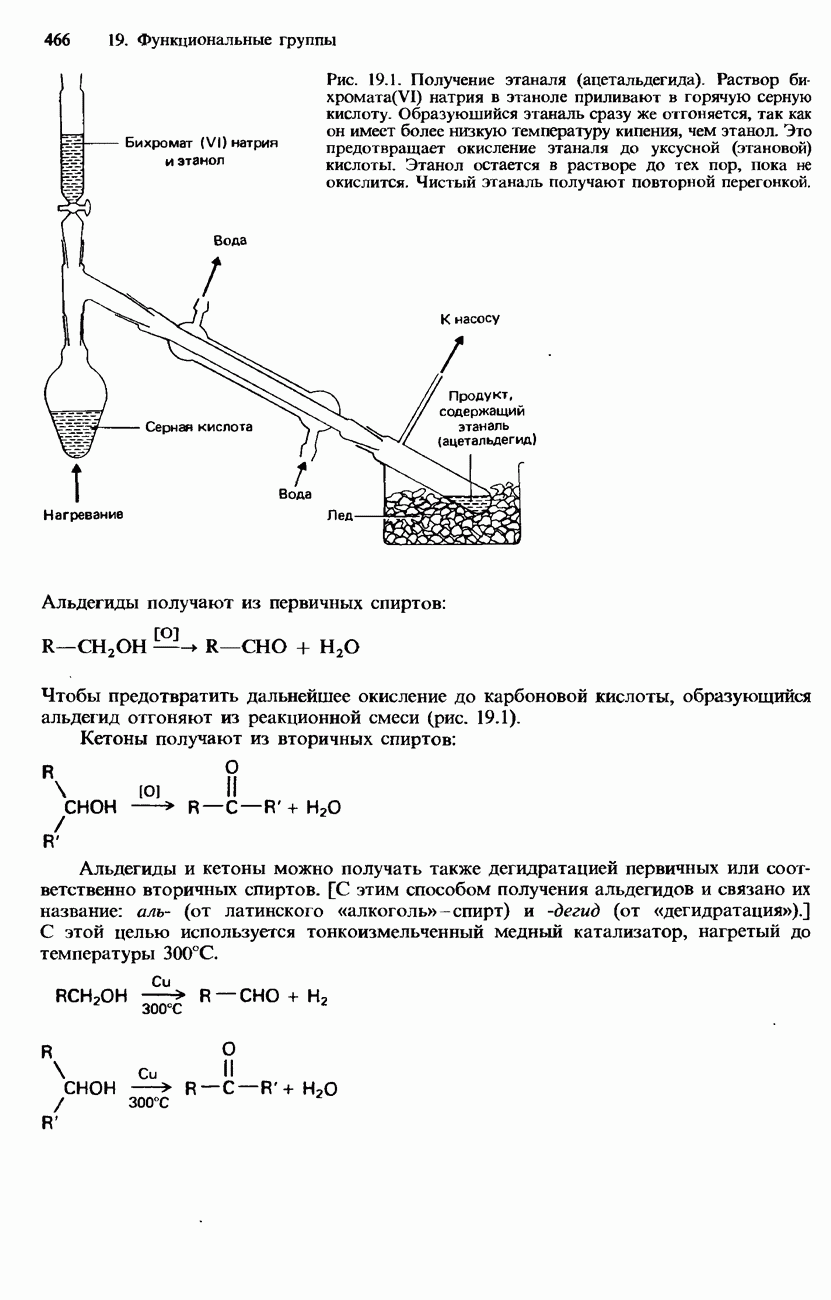
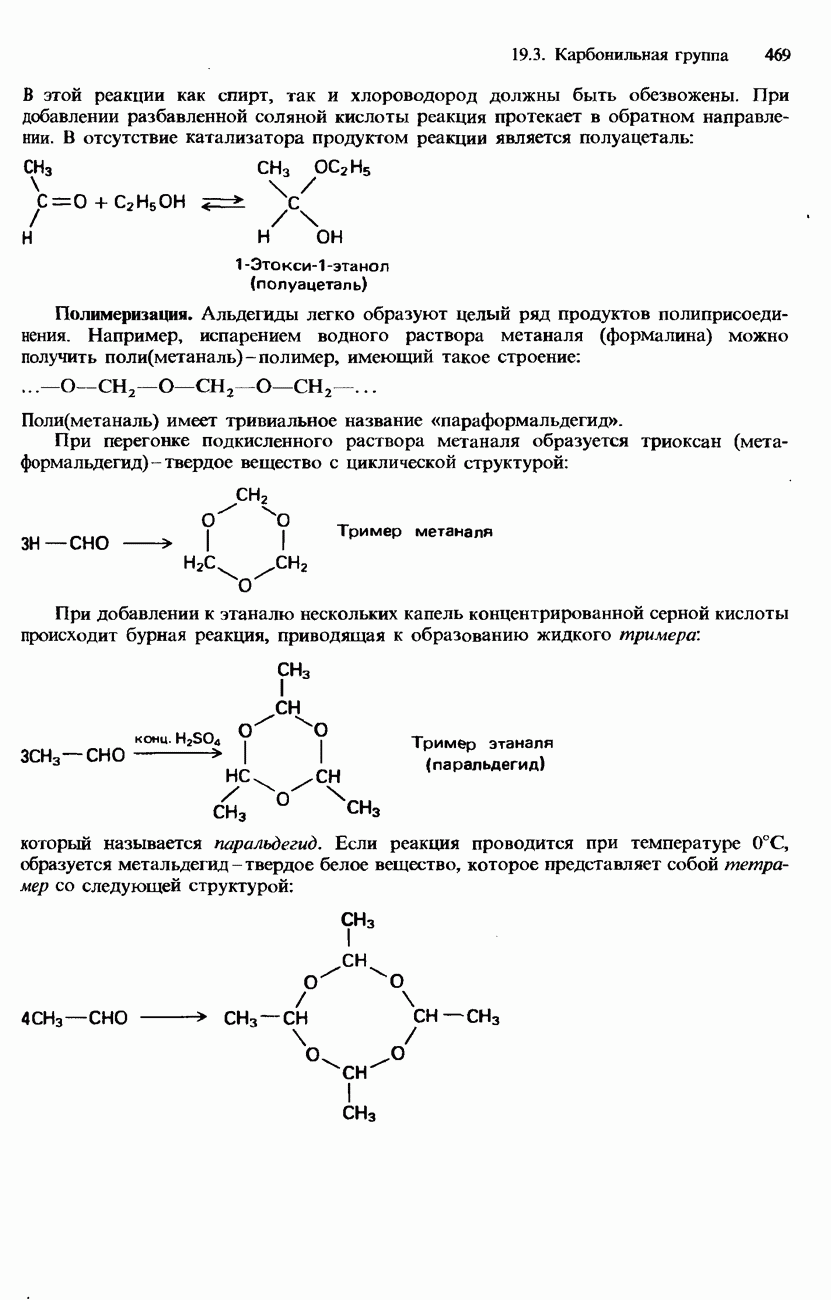
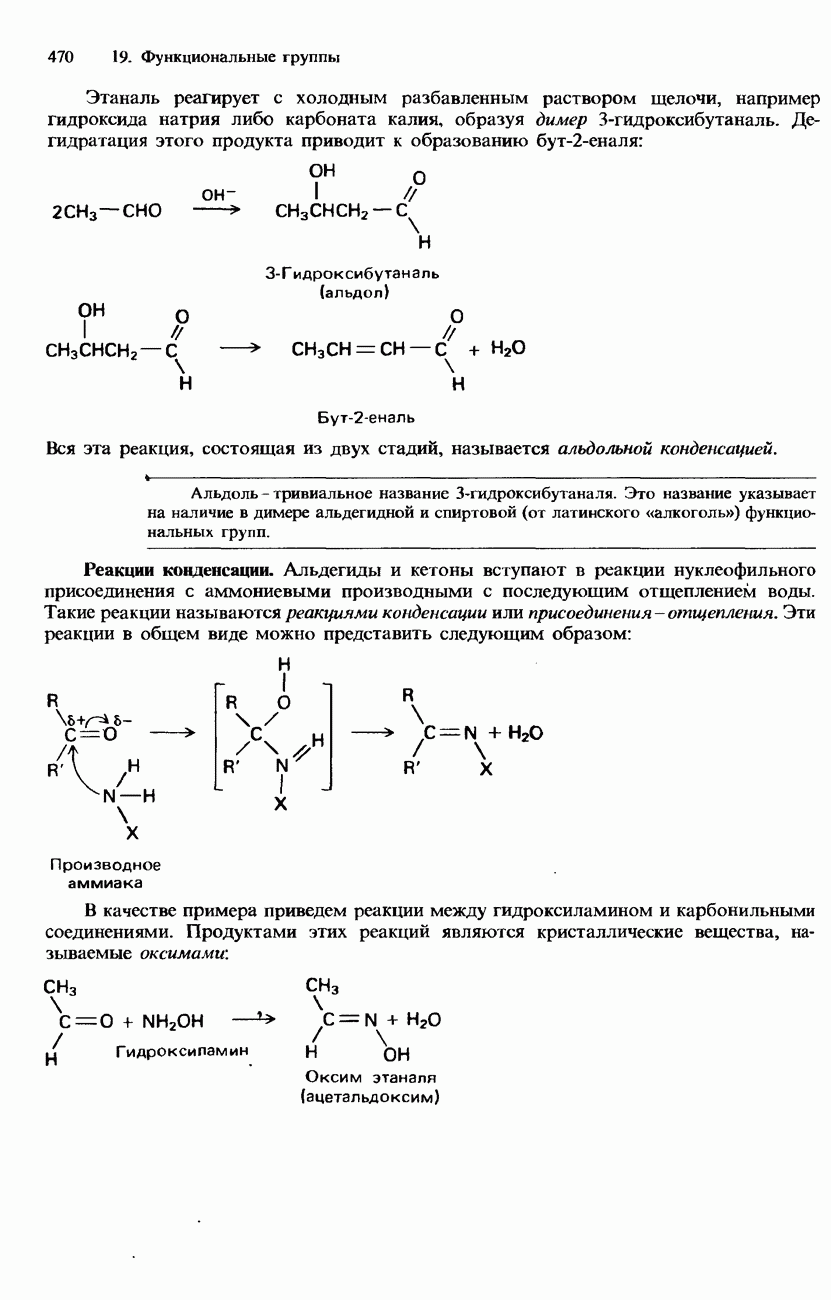
- 19.3. Карбонильная группа
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
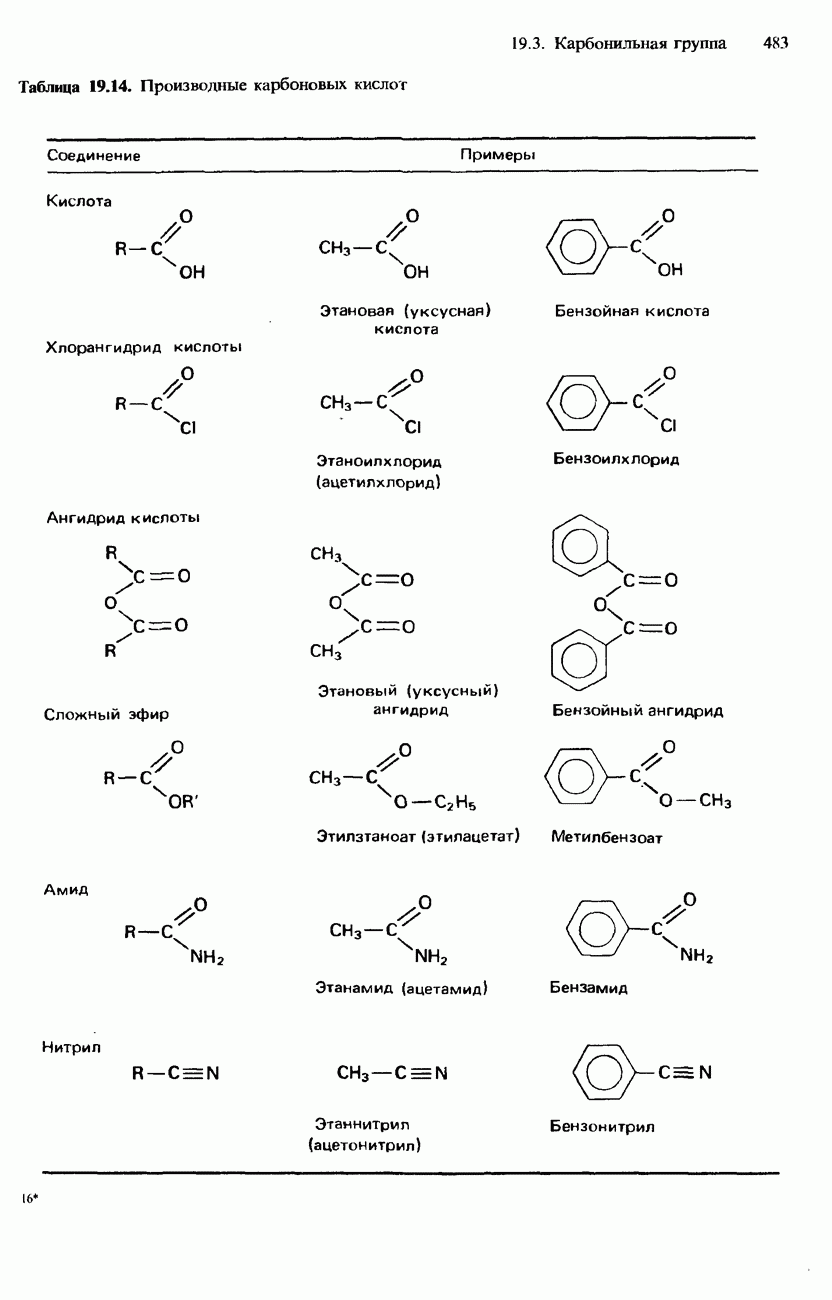
- КАРБОНОВЫЕ КИСЛОТЫ
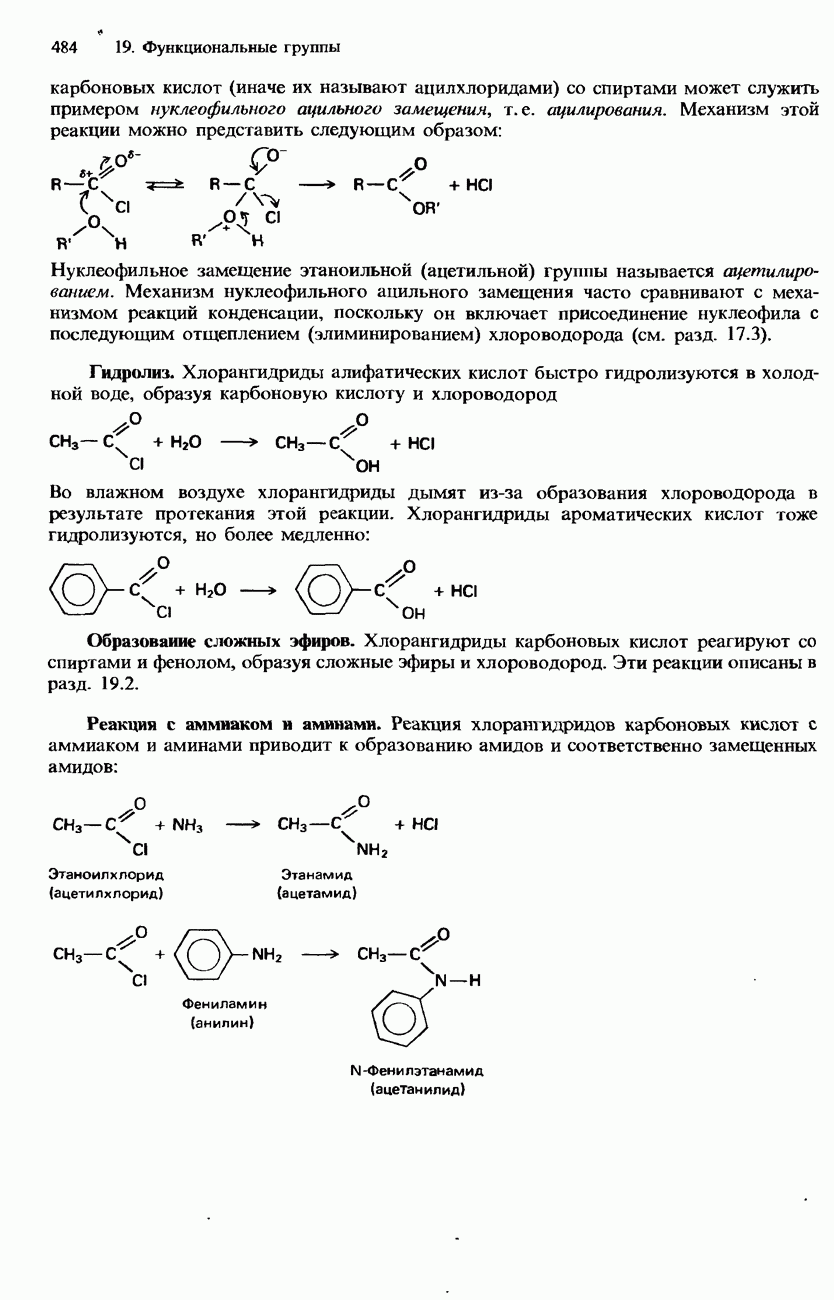
- ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
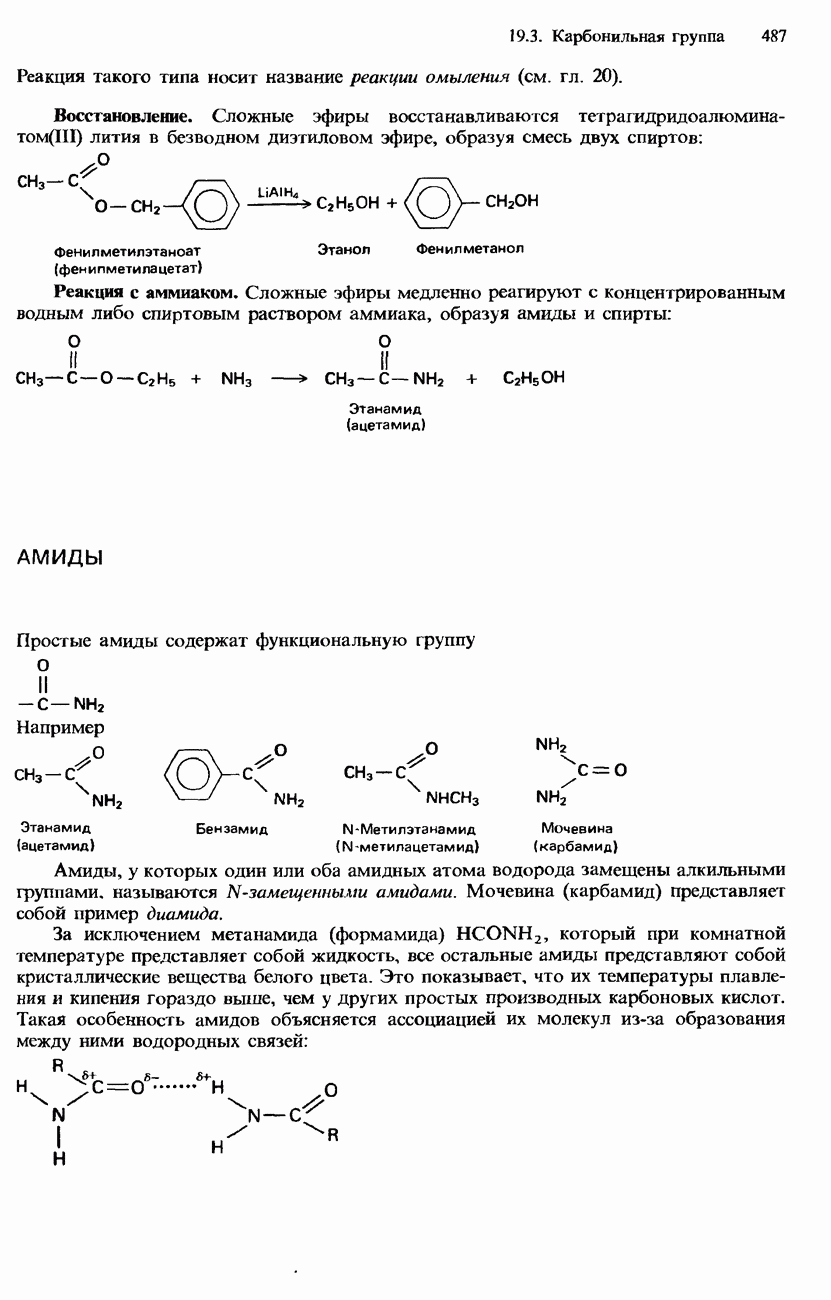
- АМИДЫ
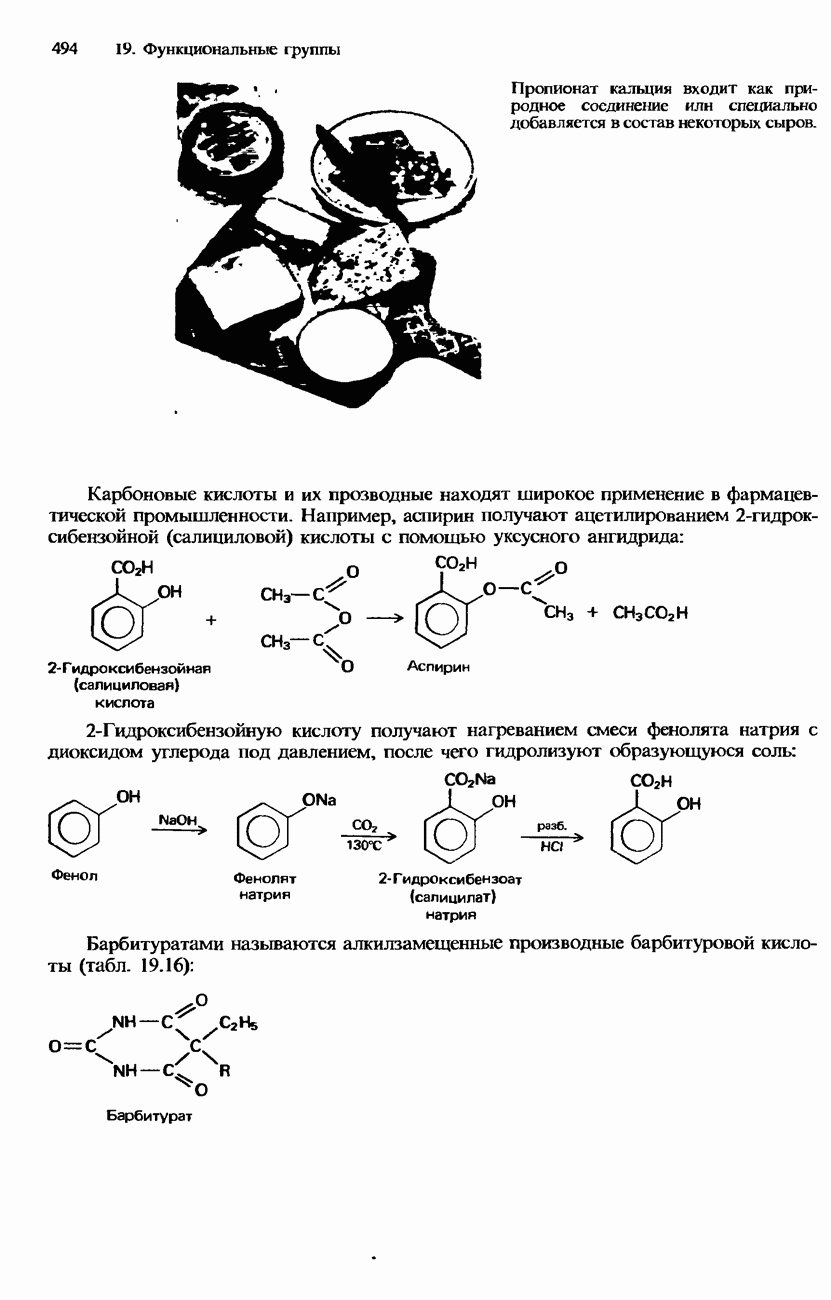
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ
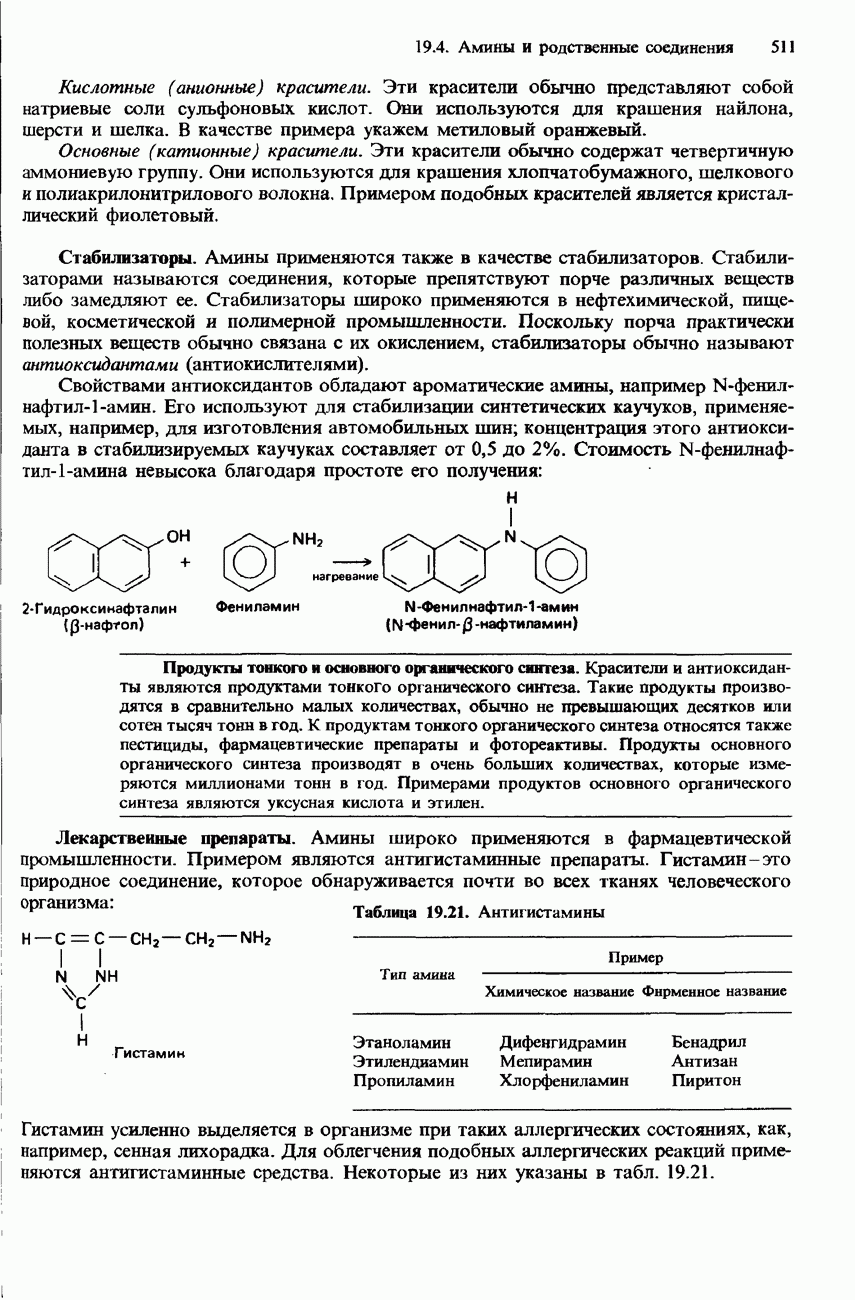
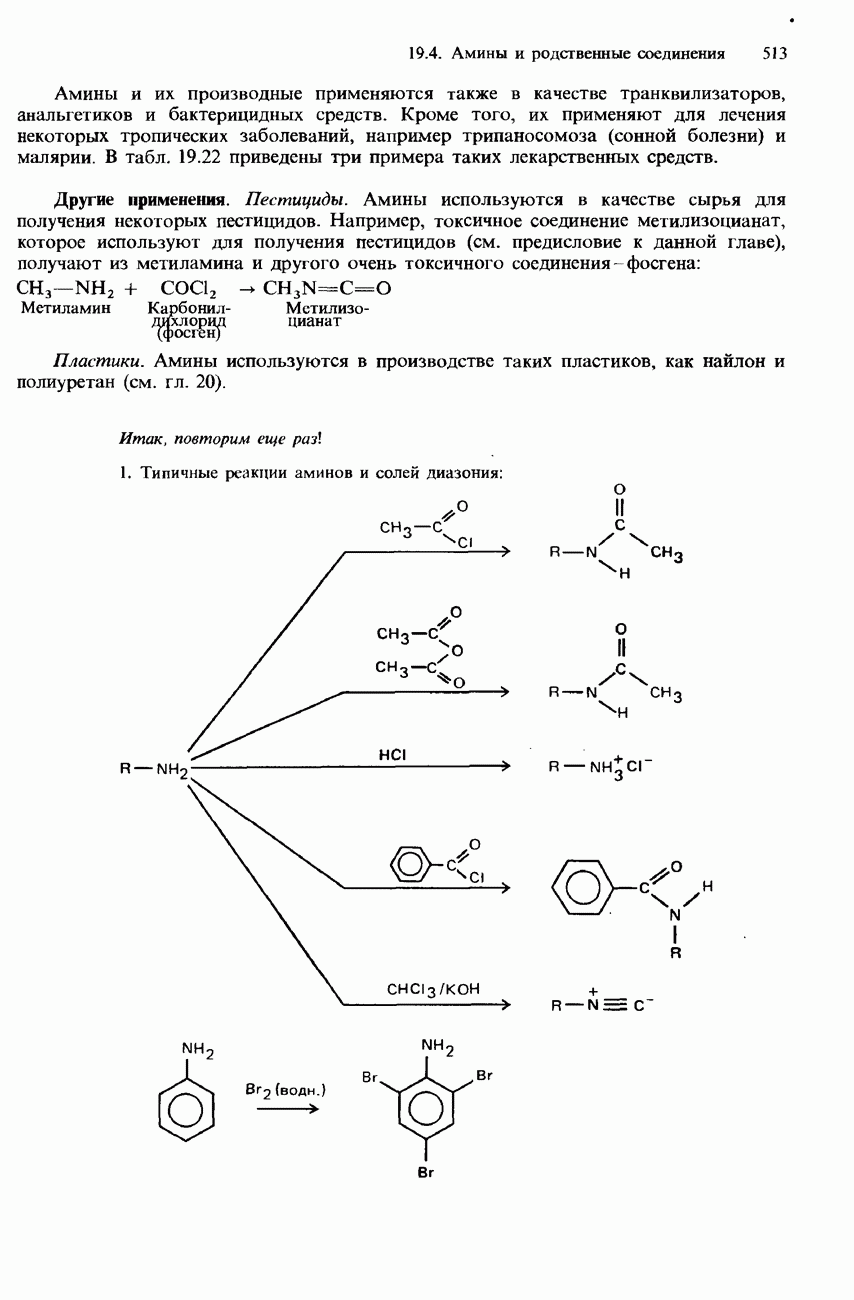
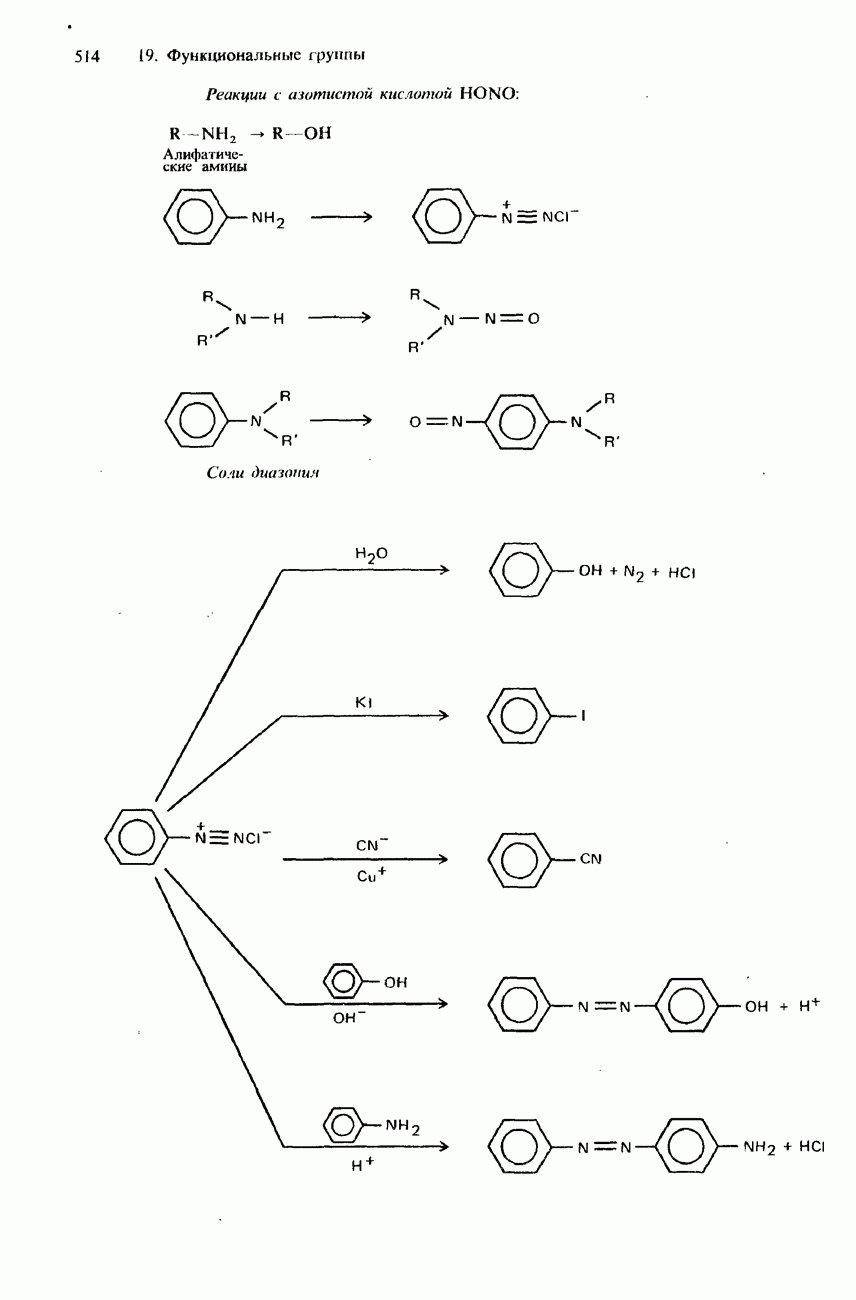
- 19.4 Амины и родственные соединения
- СОЛИ ДИАЗОНИЯ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ
- 20.1. Аминокислоты, пептиды и белки
- АМИНОКИСЛОТЫ
- ПЕПТИДЫ
- БЕЛКИ
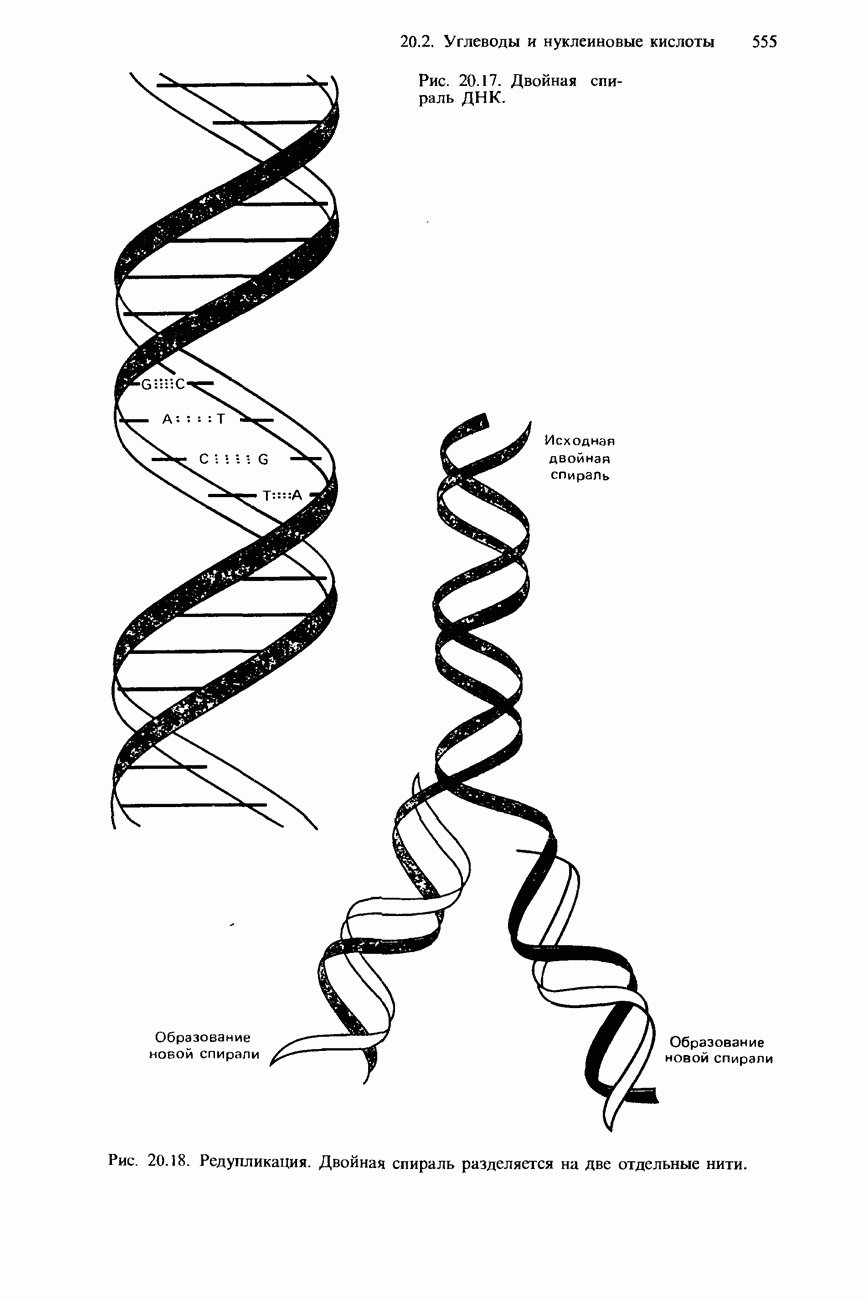
- 20.2. Углеводы и нуклеиновые кислоты
- НУКЛЕИНОВЫЕ КИСЛОТЫ
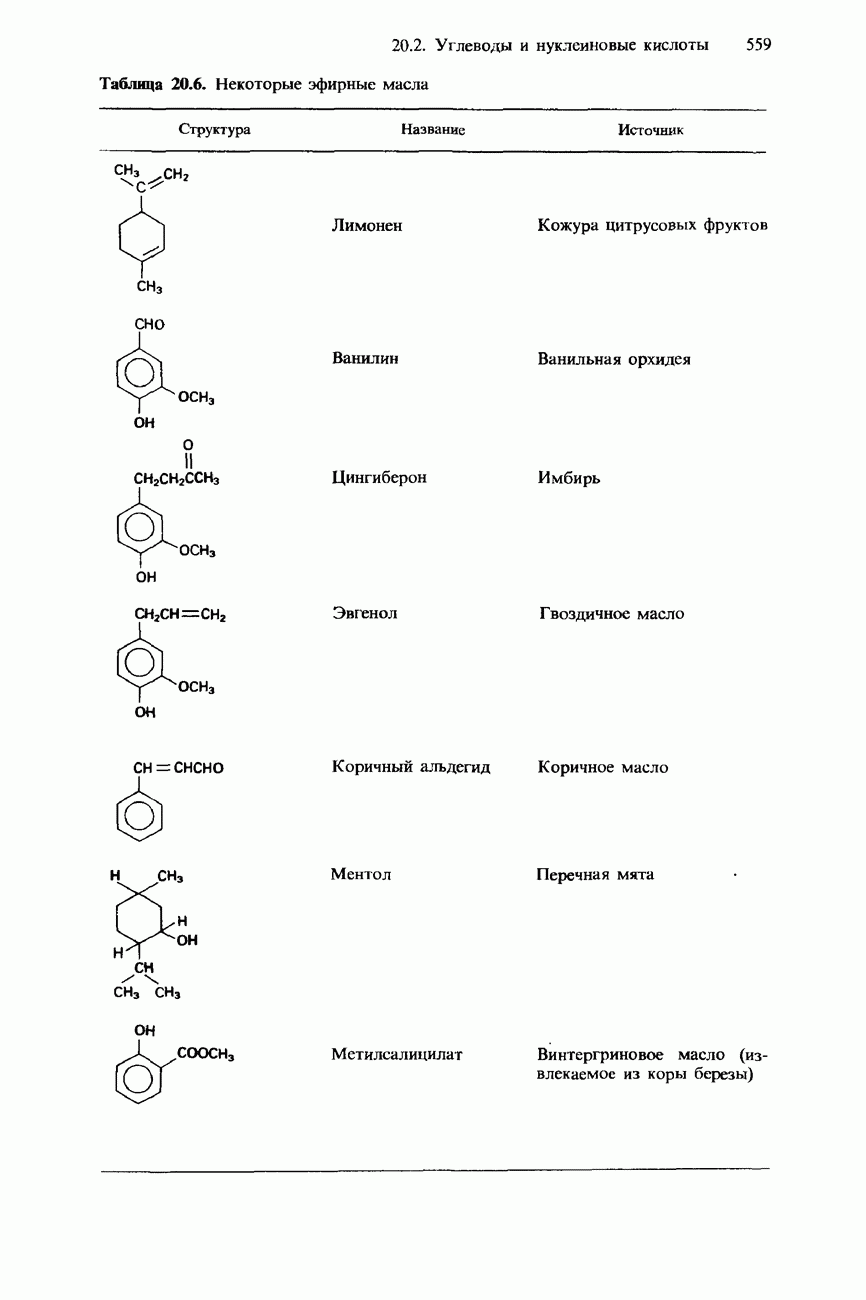
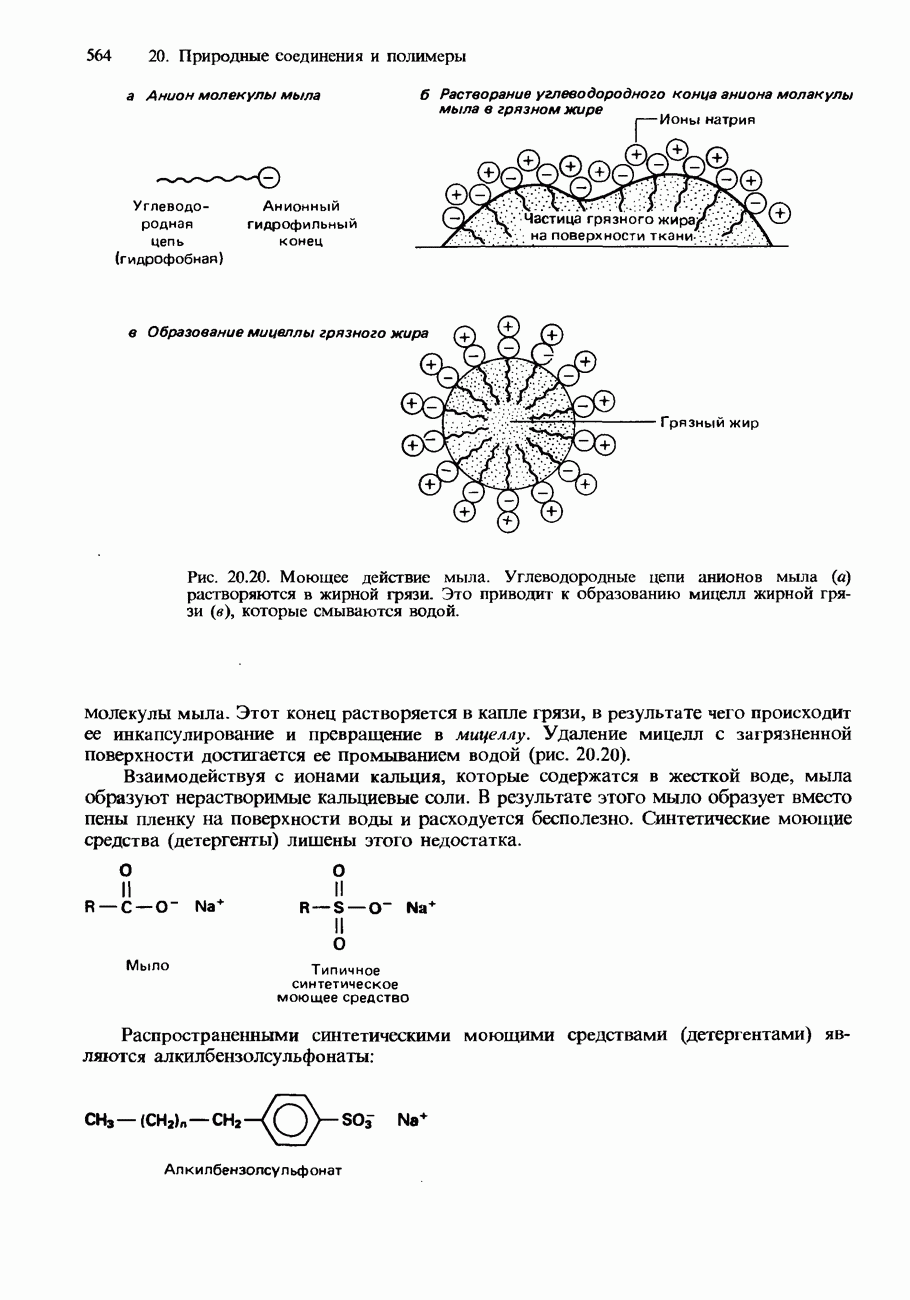
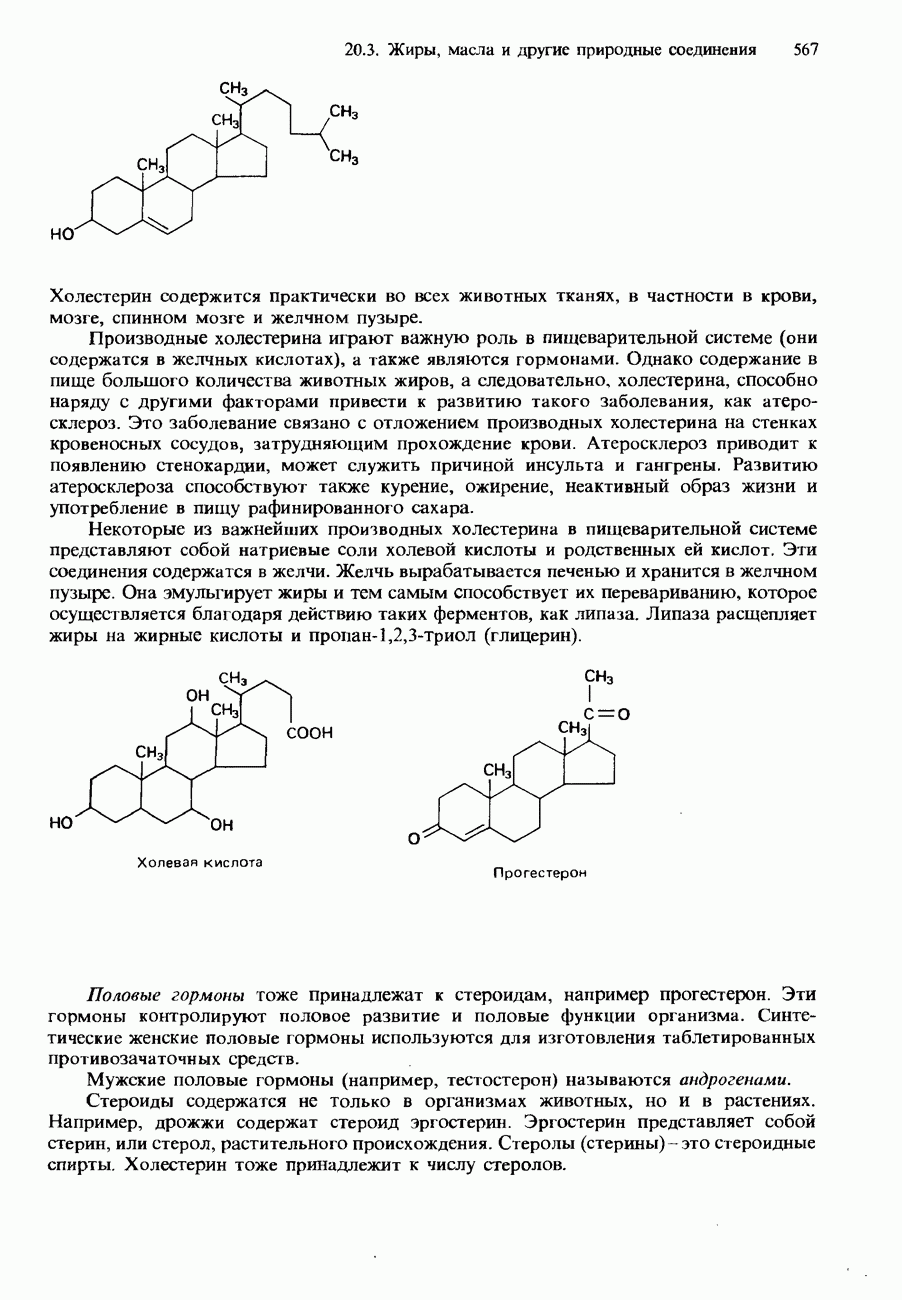
- 20.3. Жиры, масла и другие природные соединения
- ЖИРНЫЕ КИСЛОТЫ И ТРИГЛИЦЕРИДЫ
- ВОСКИ
- ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ
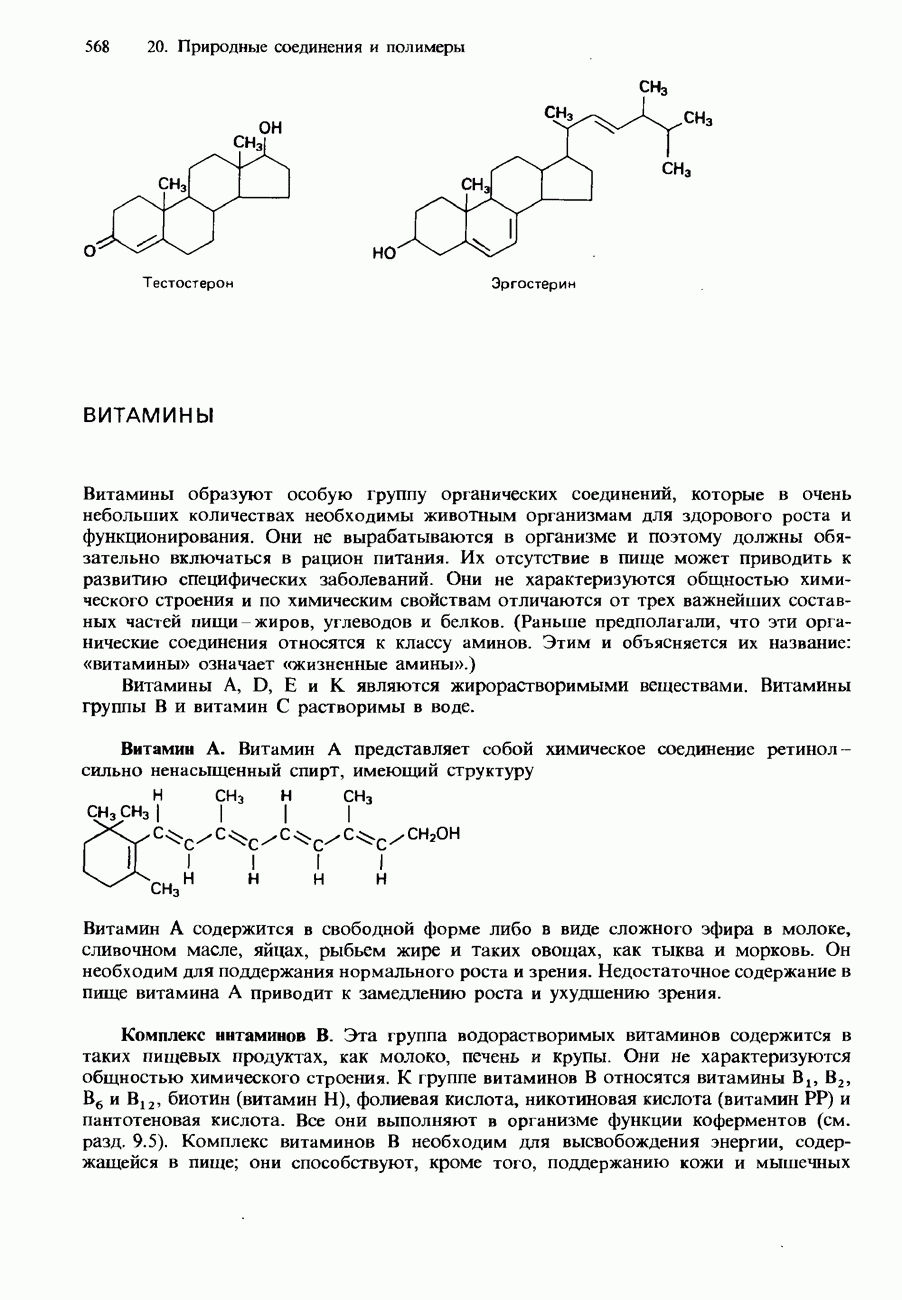
- ВИТАМИНЫ
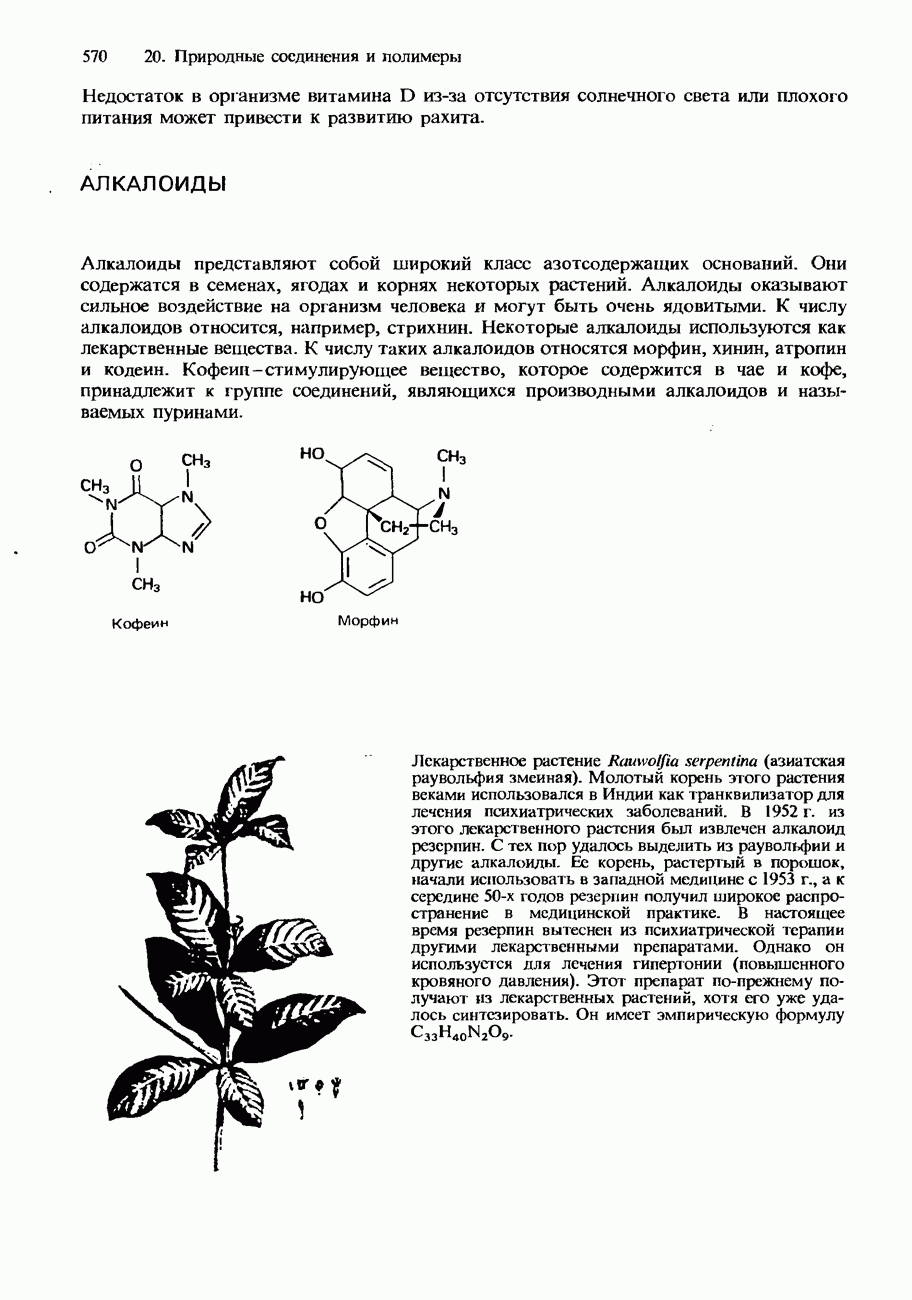
- АЛКАЛОИДЫ
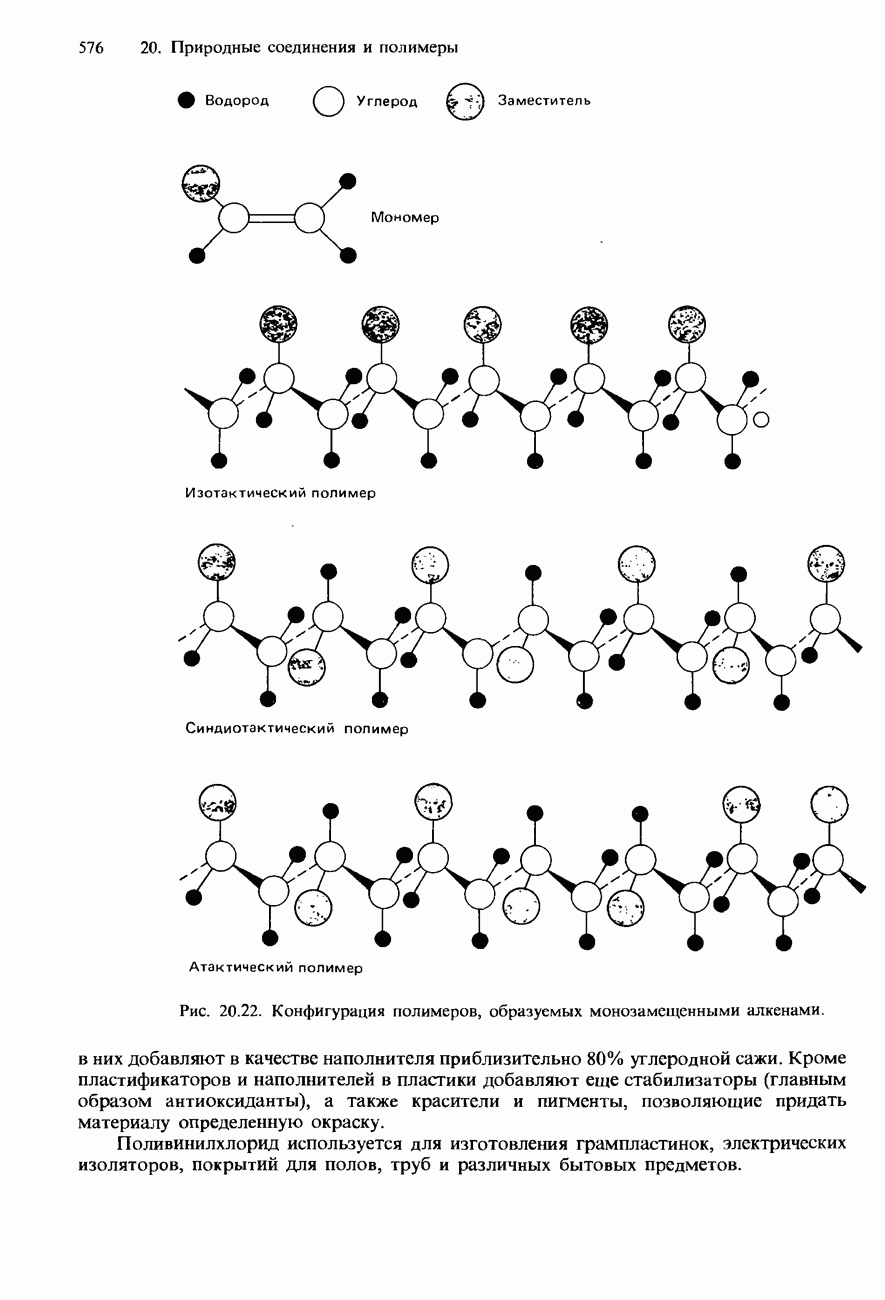
- 20.4. Полимеры
- ПОЛИМЕРИЗАЦИЯ
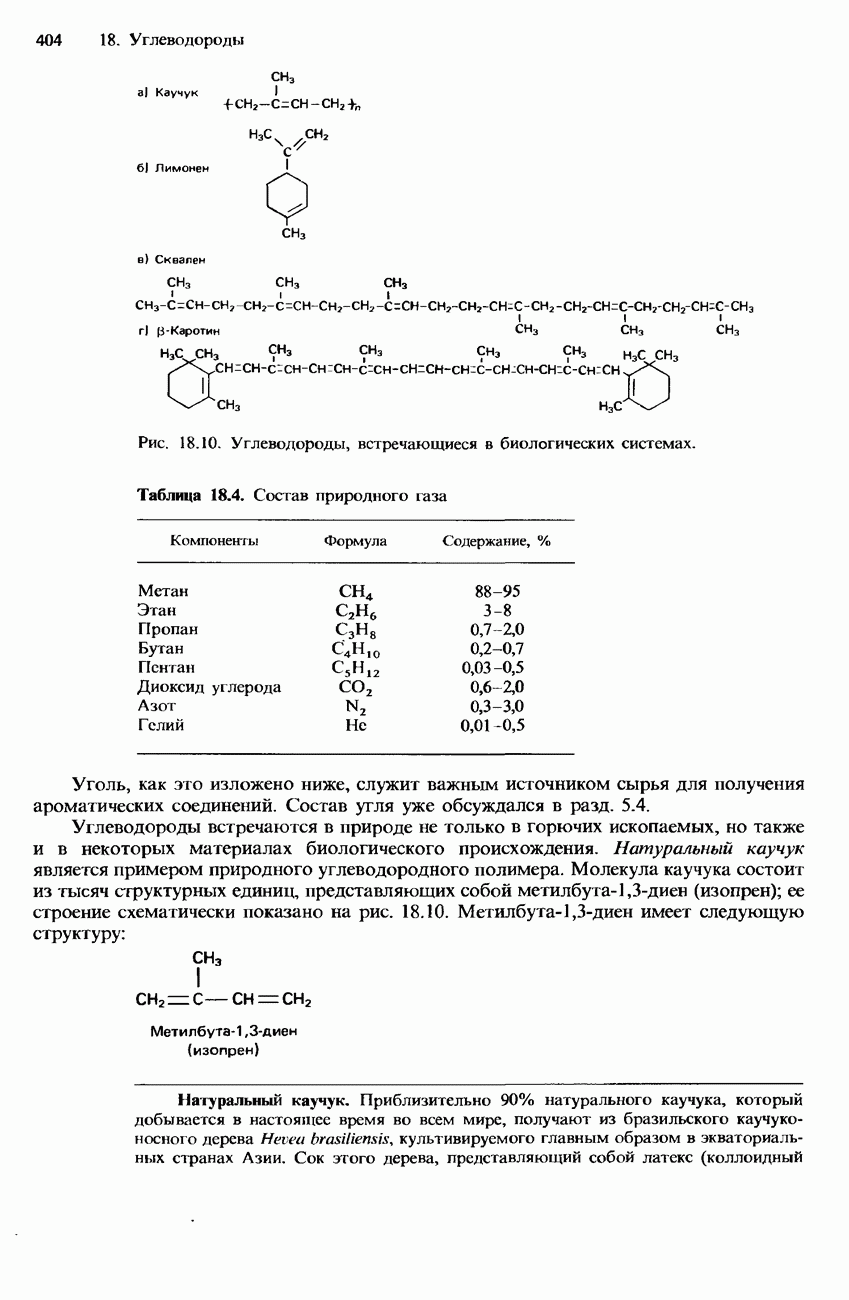
- НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ
- ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- ПРИЛОЖЕНИЯ