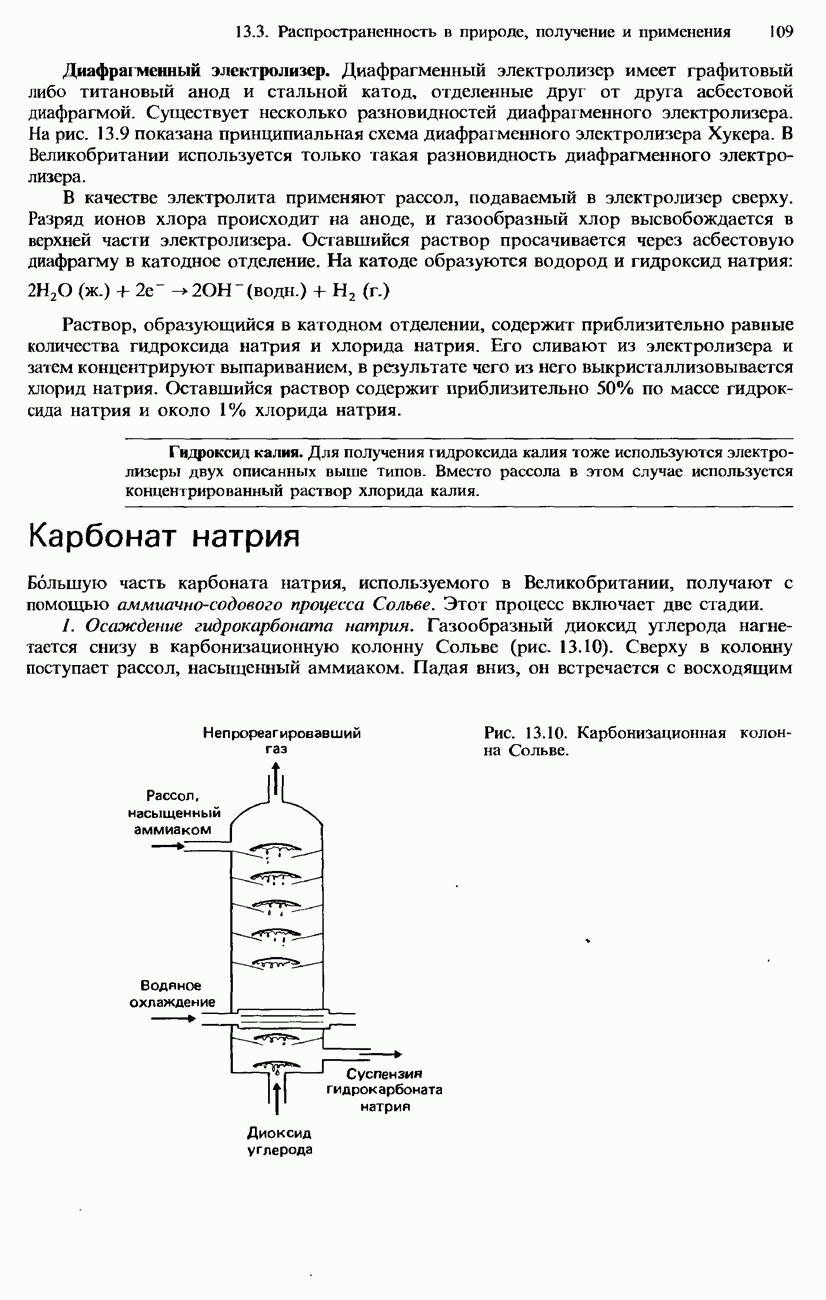
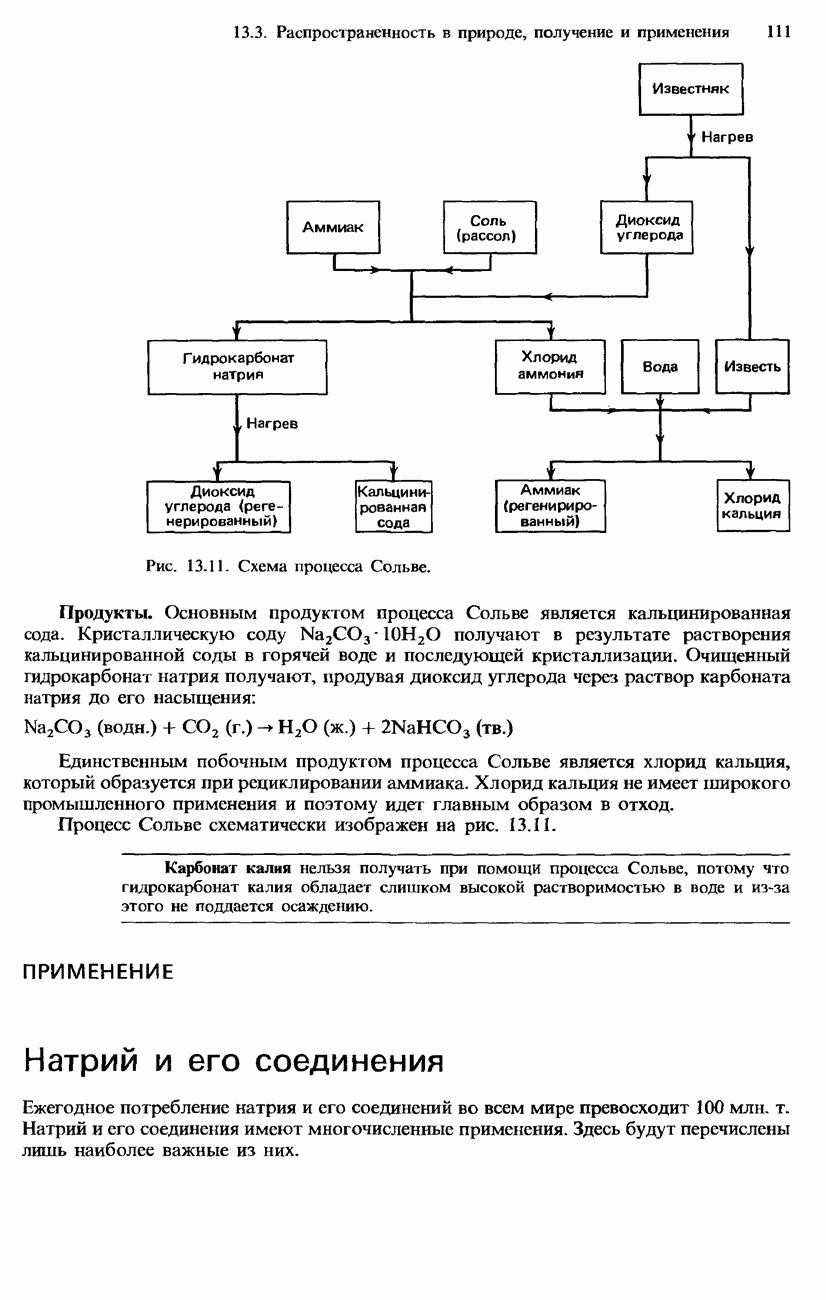
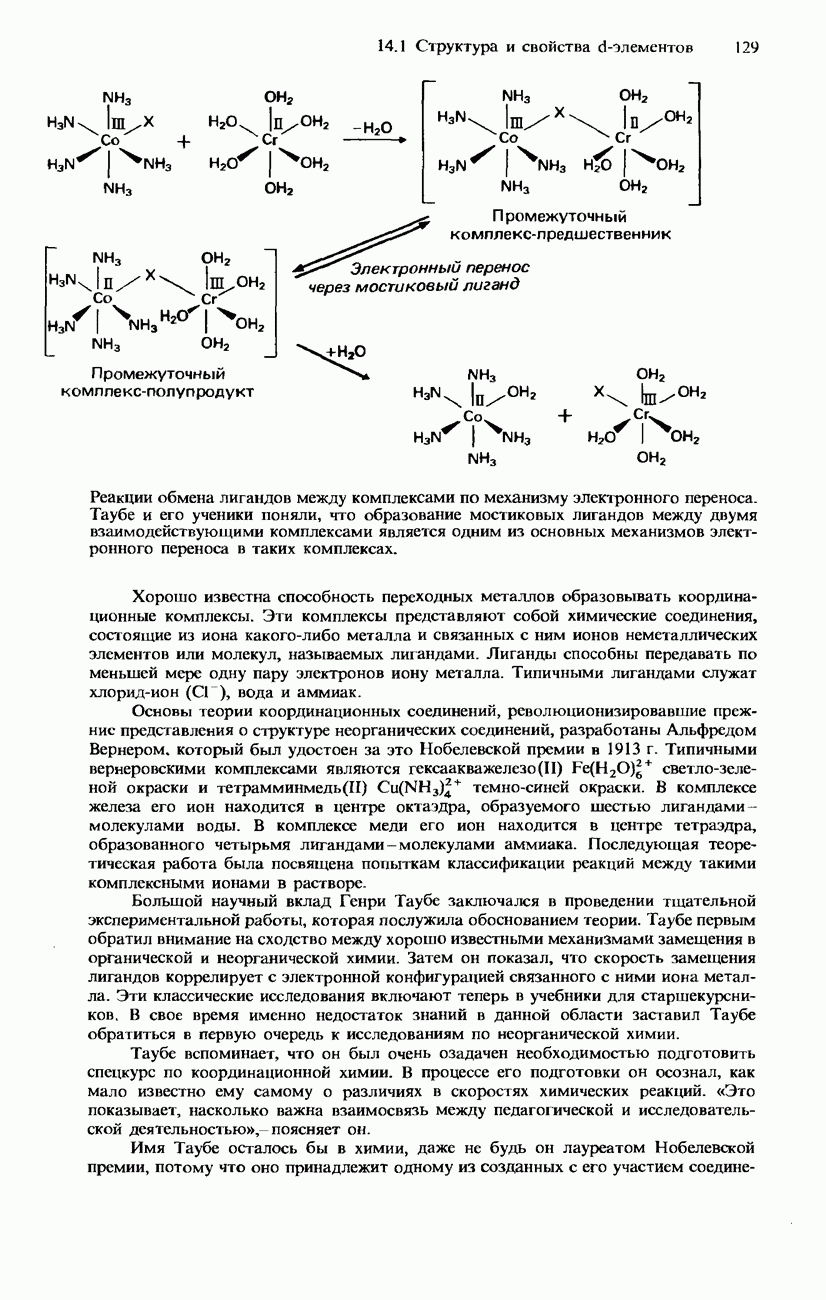
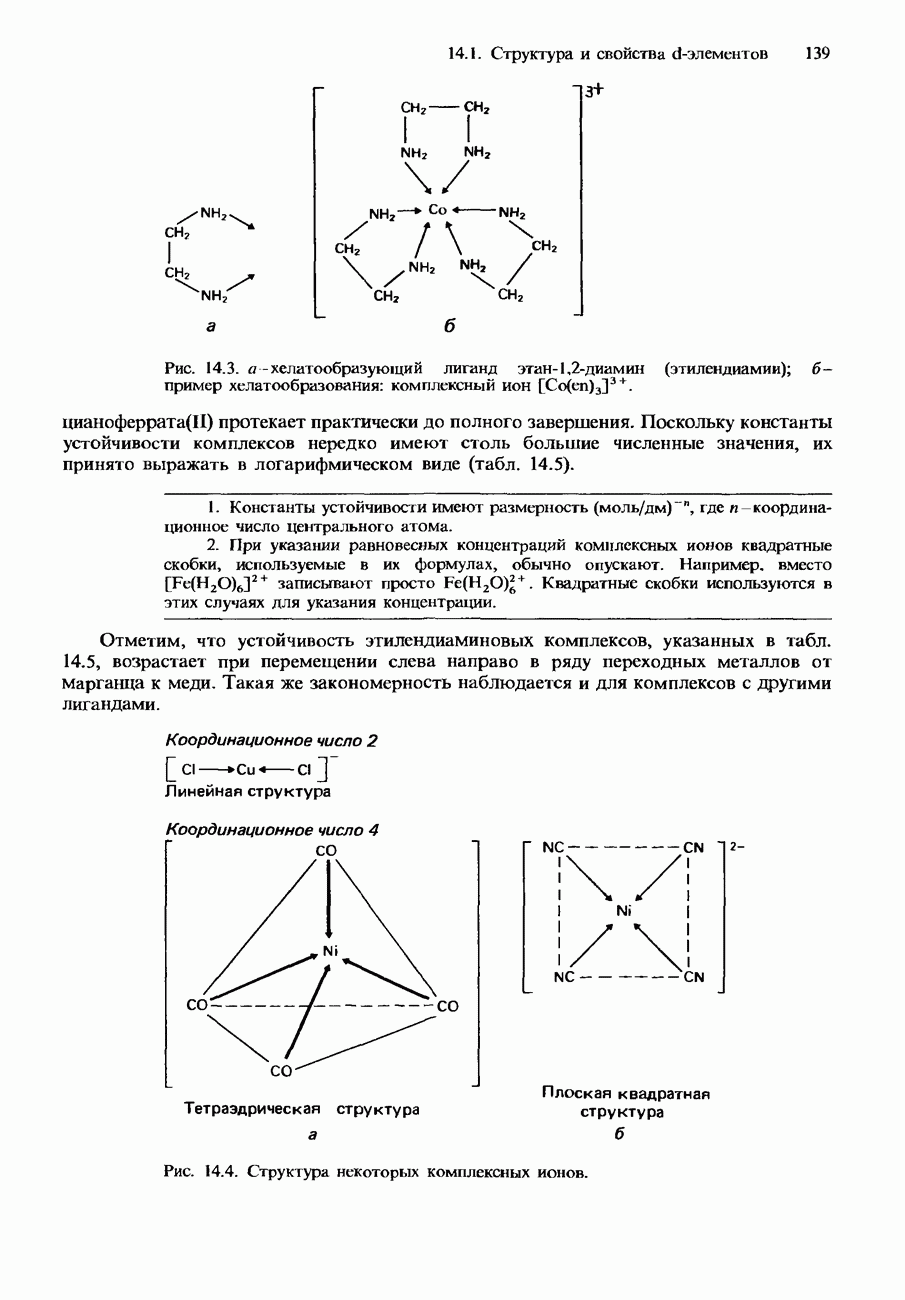
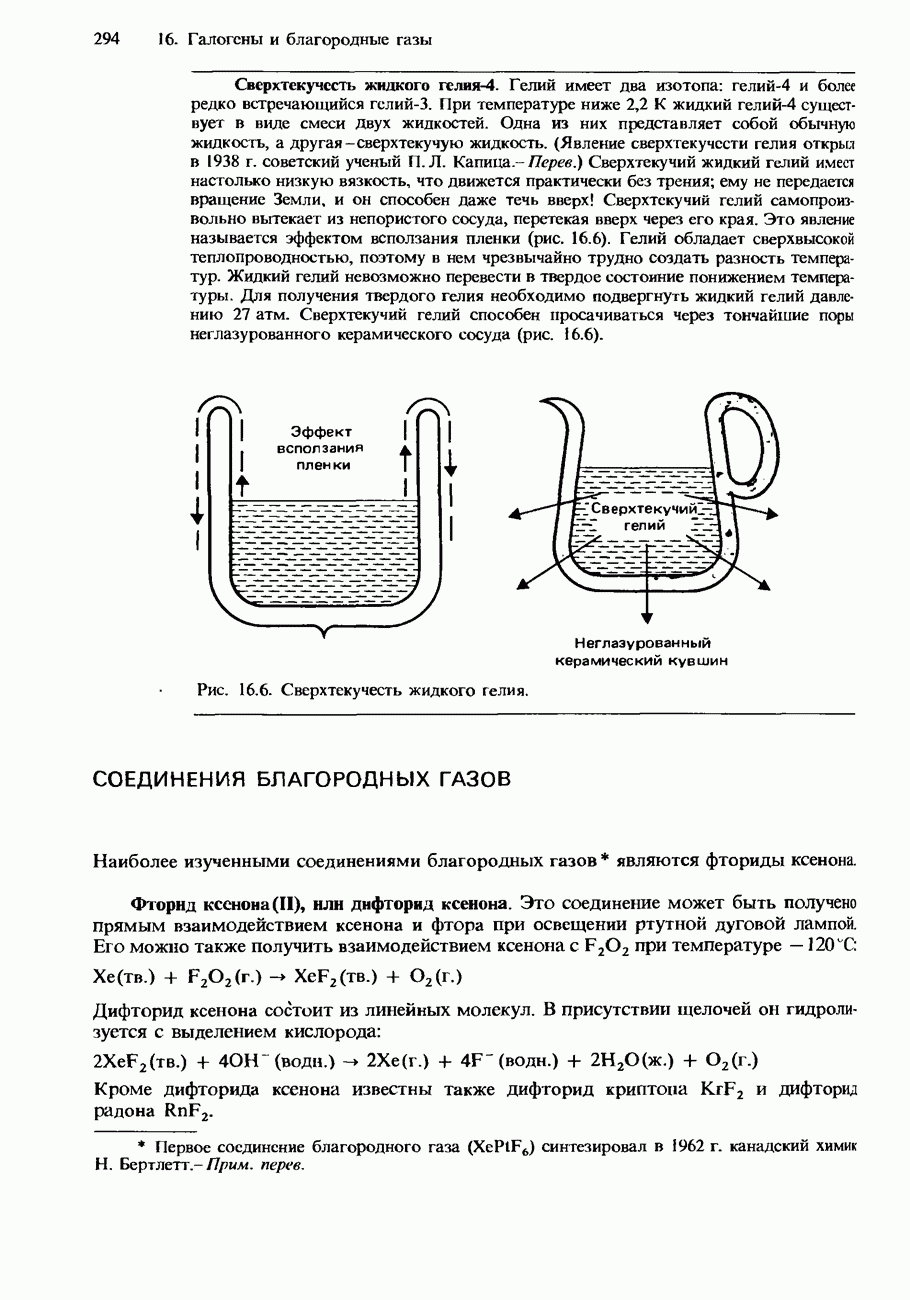
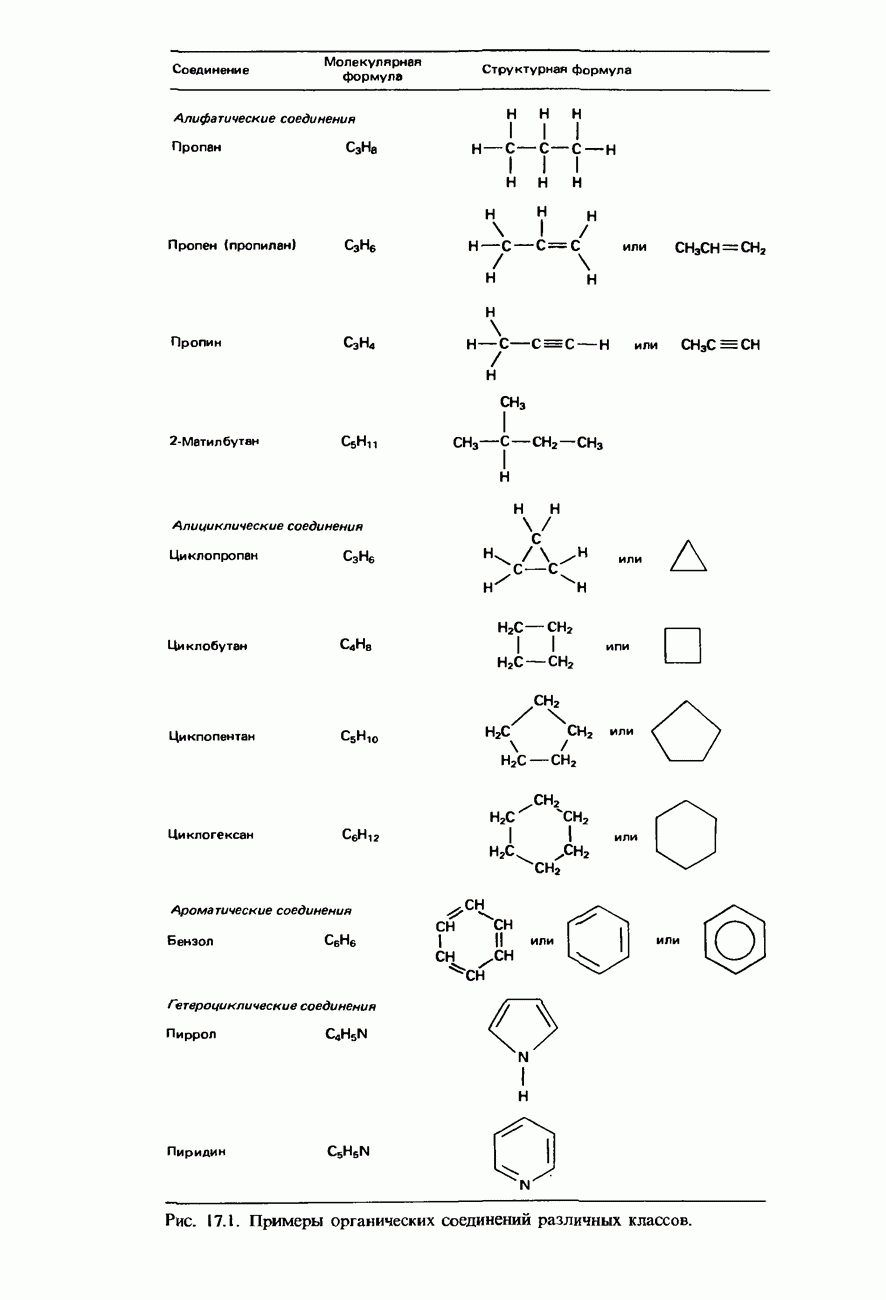
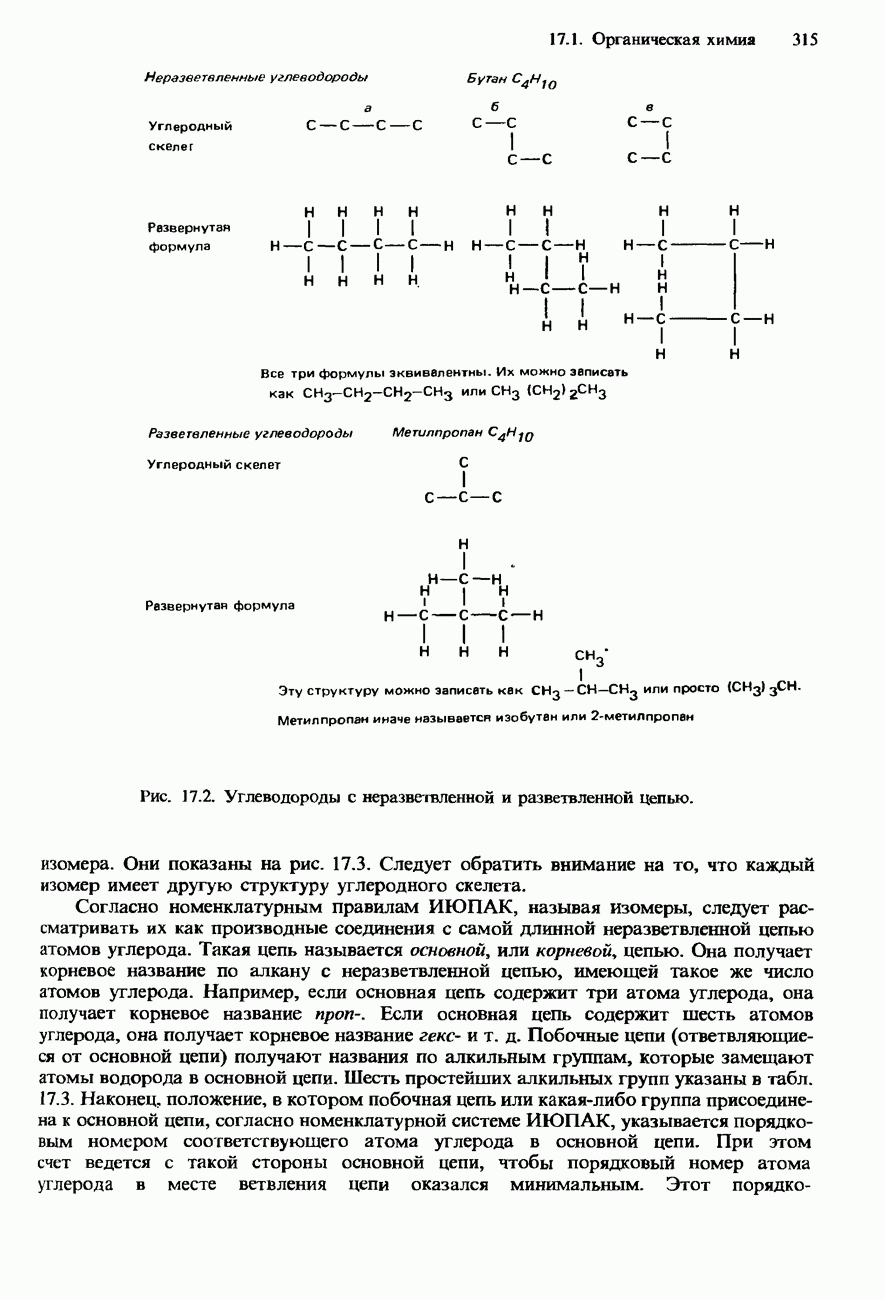
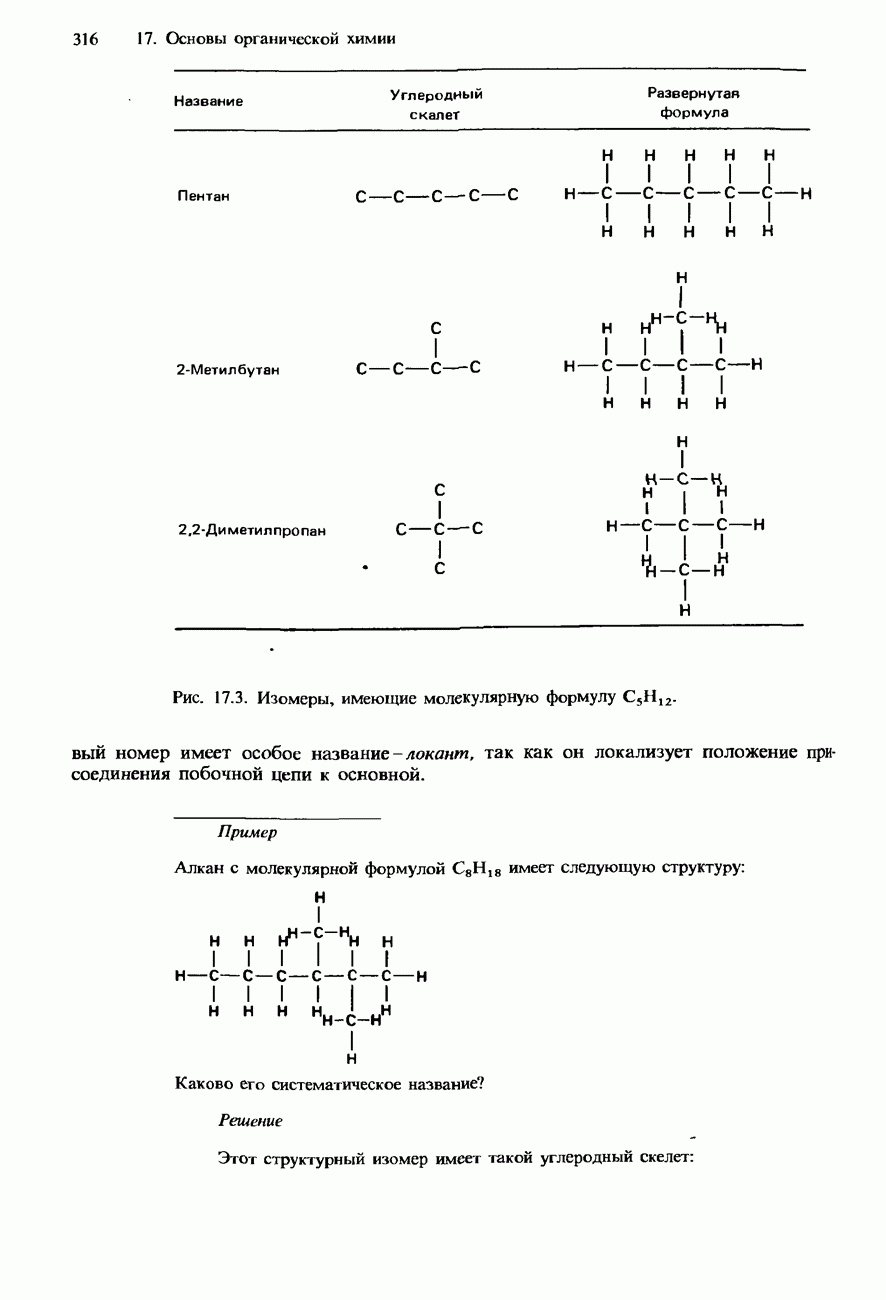
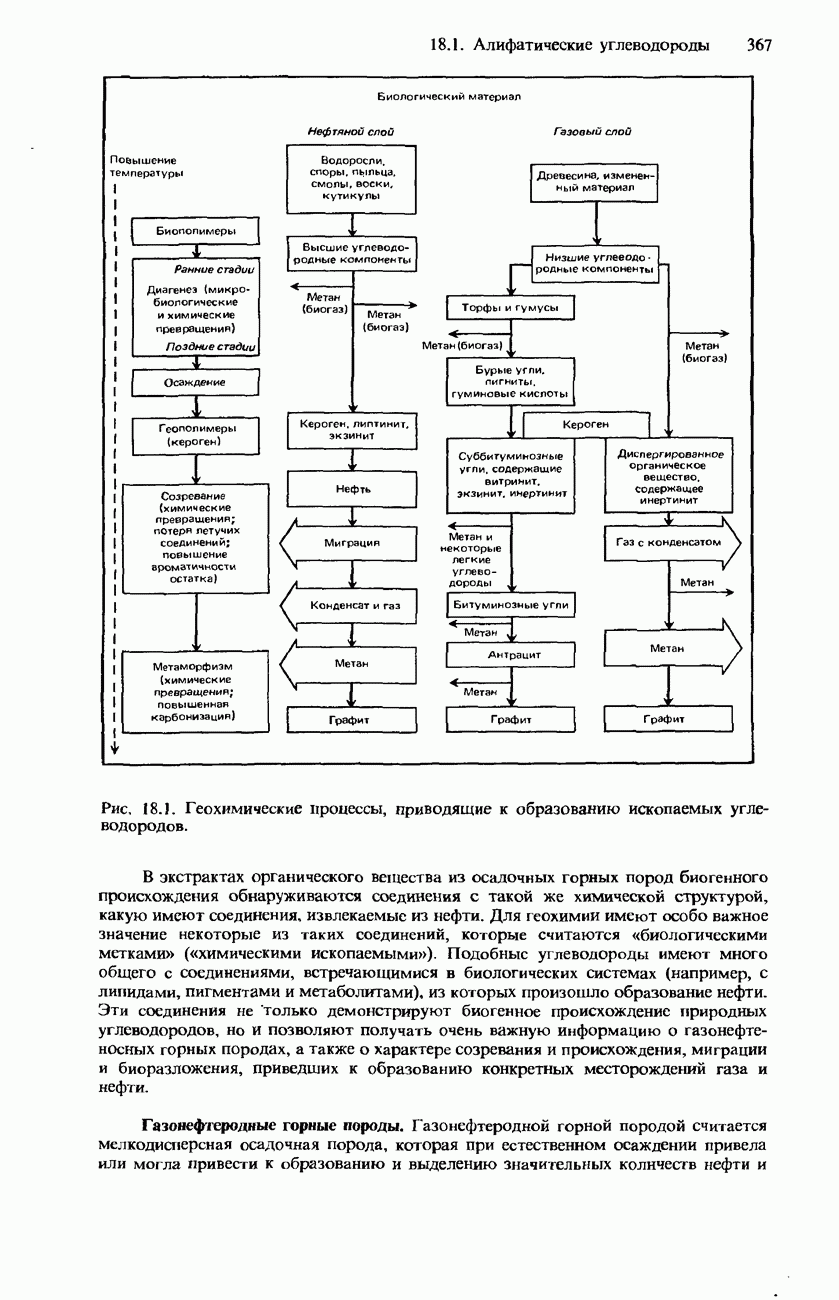
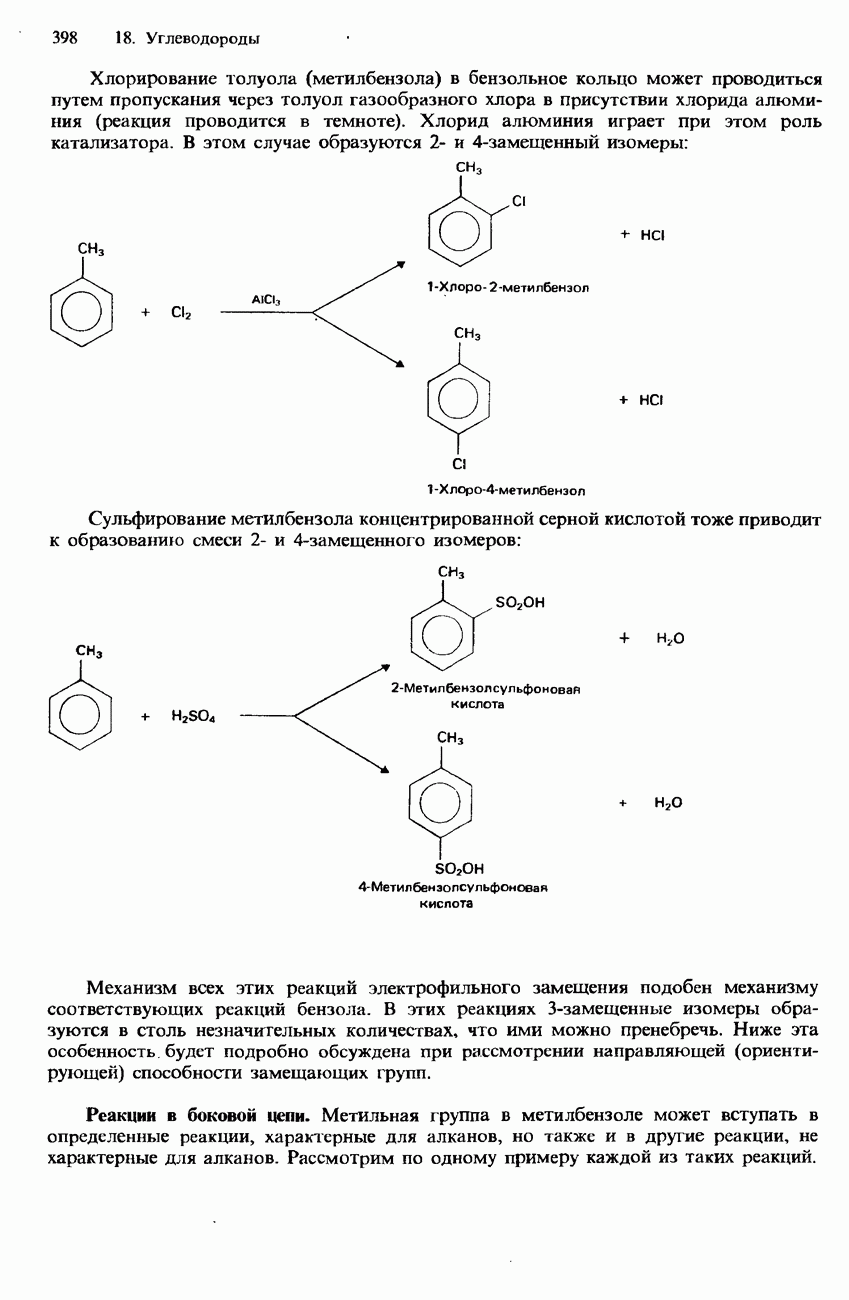
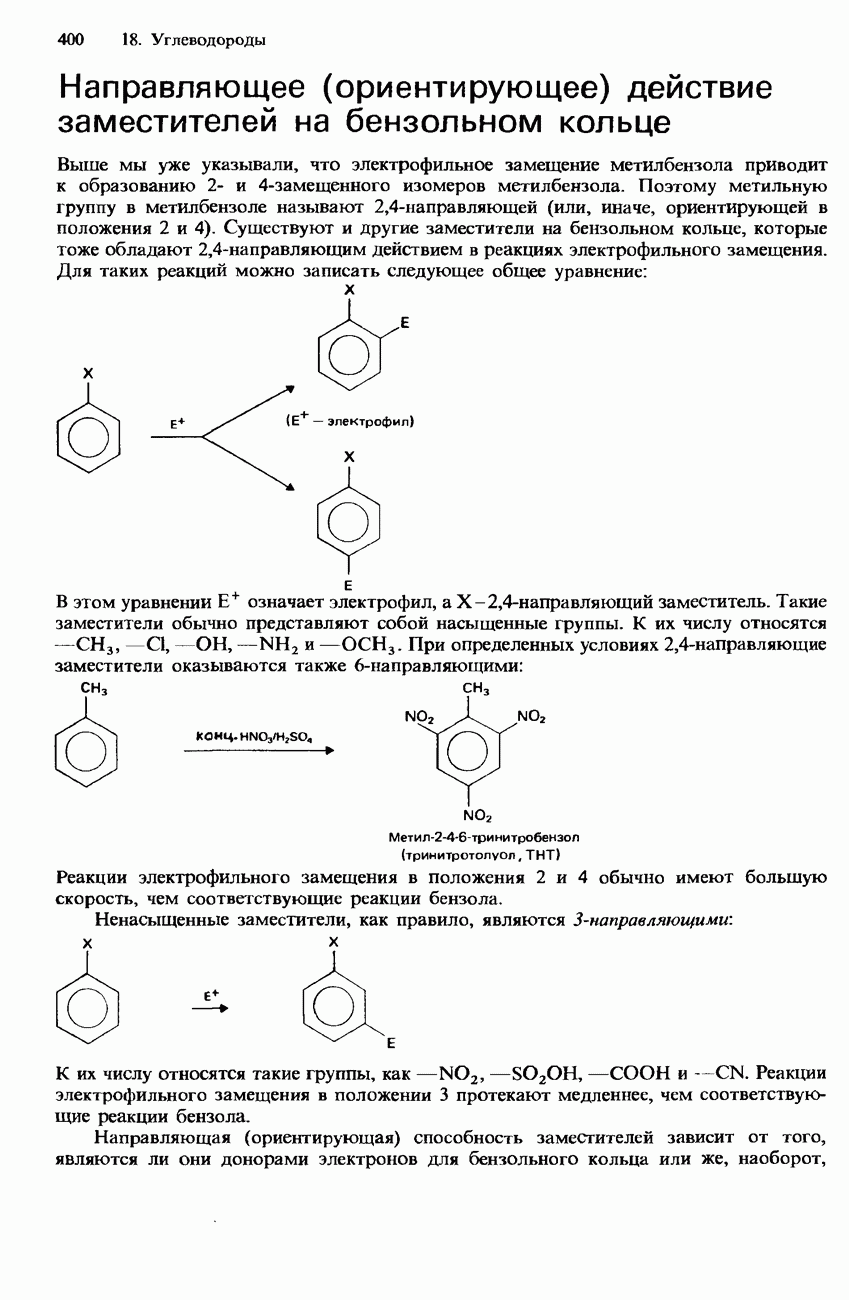
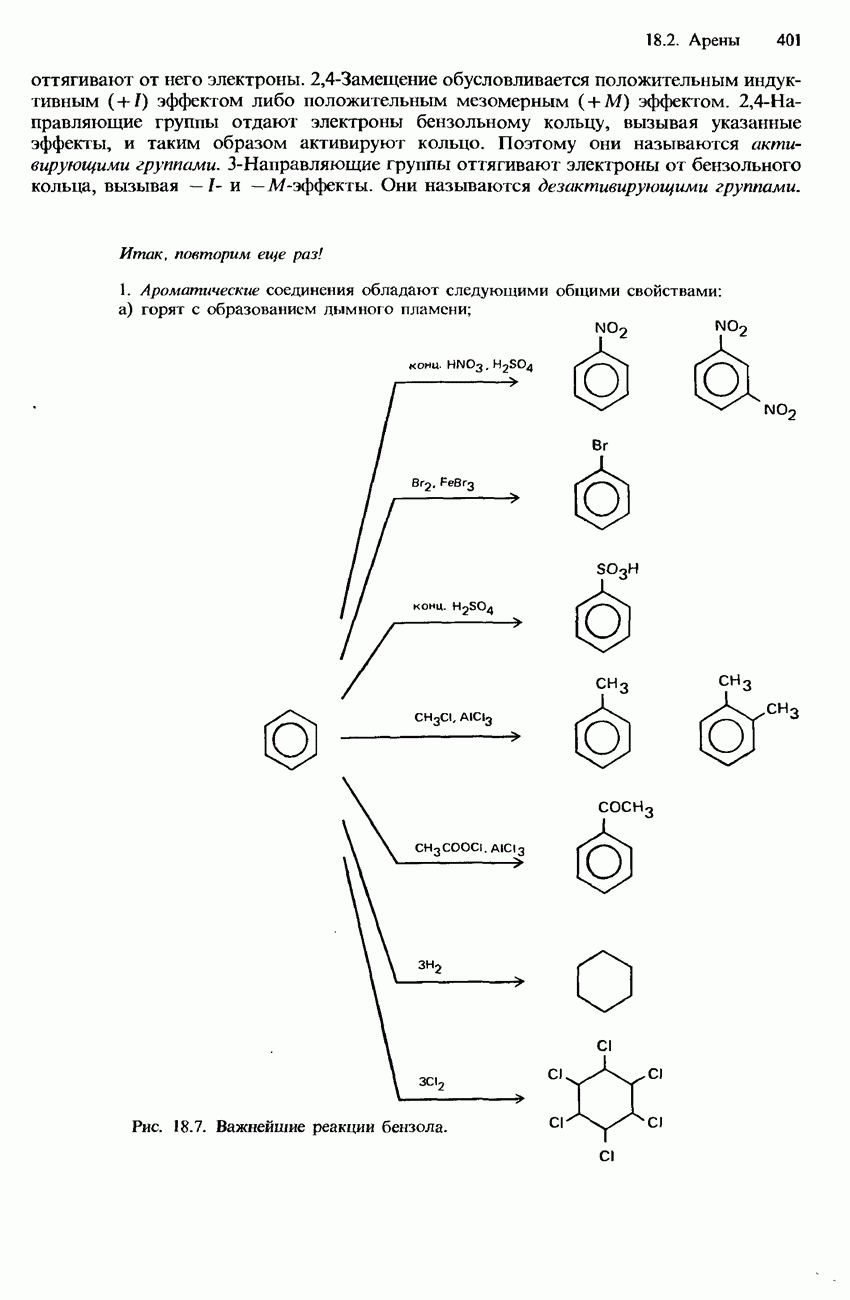
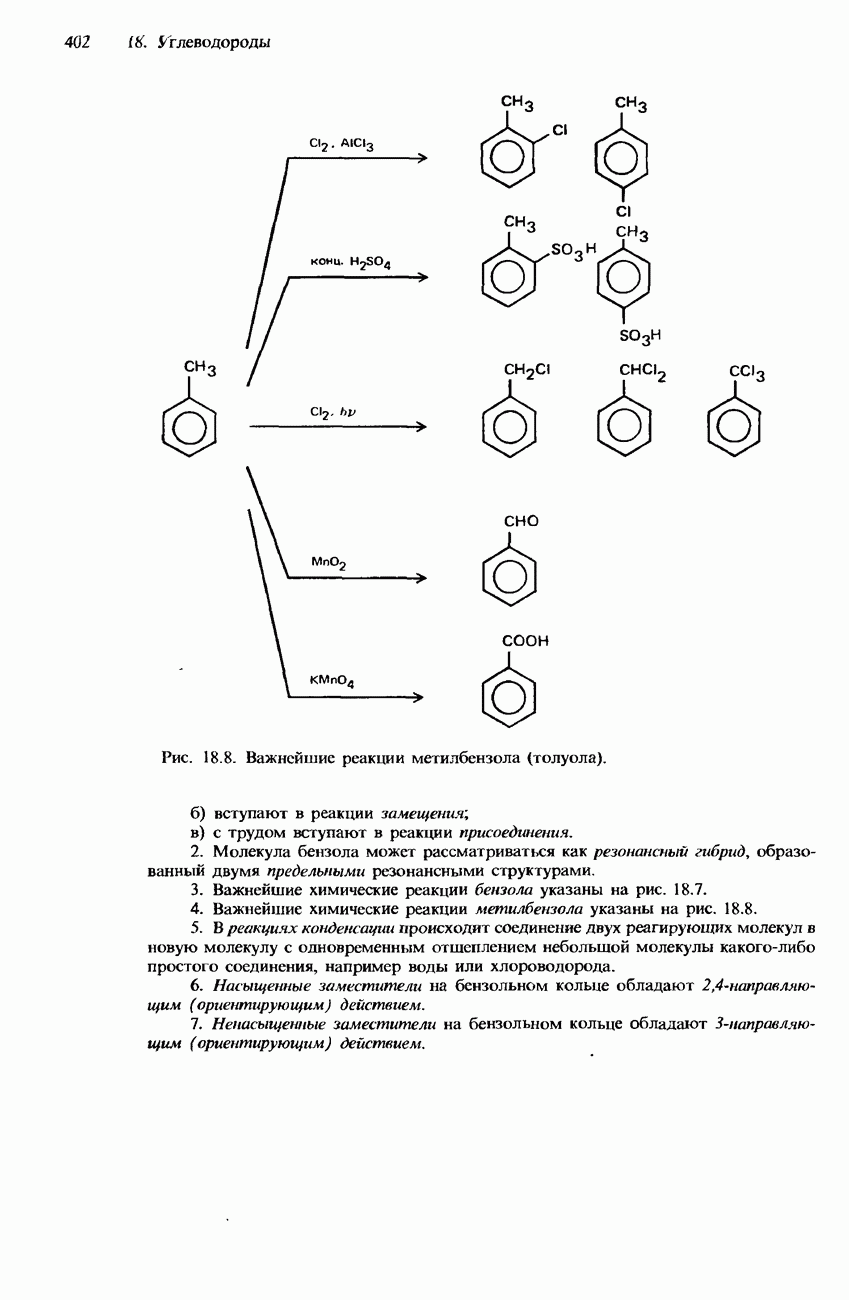
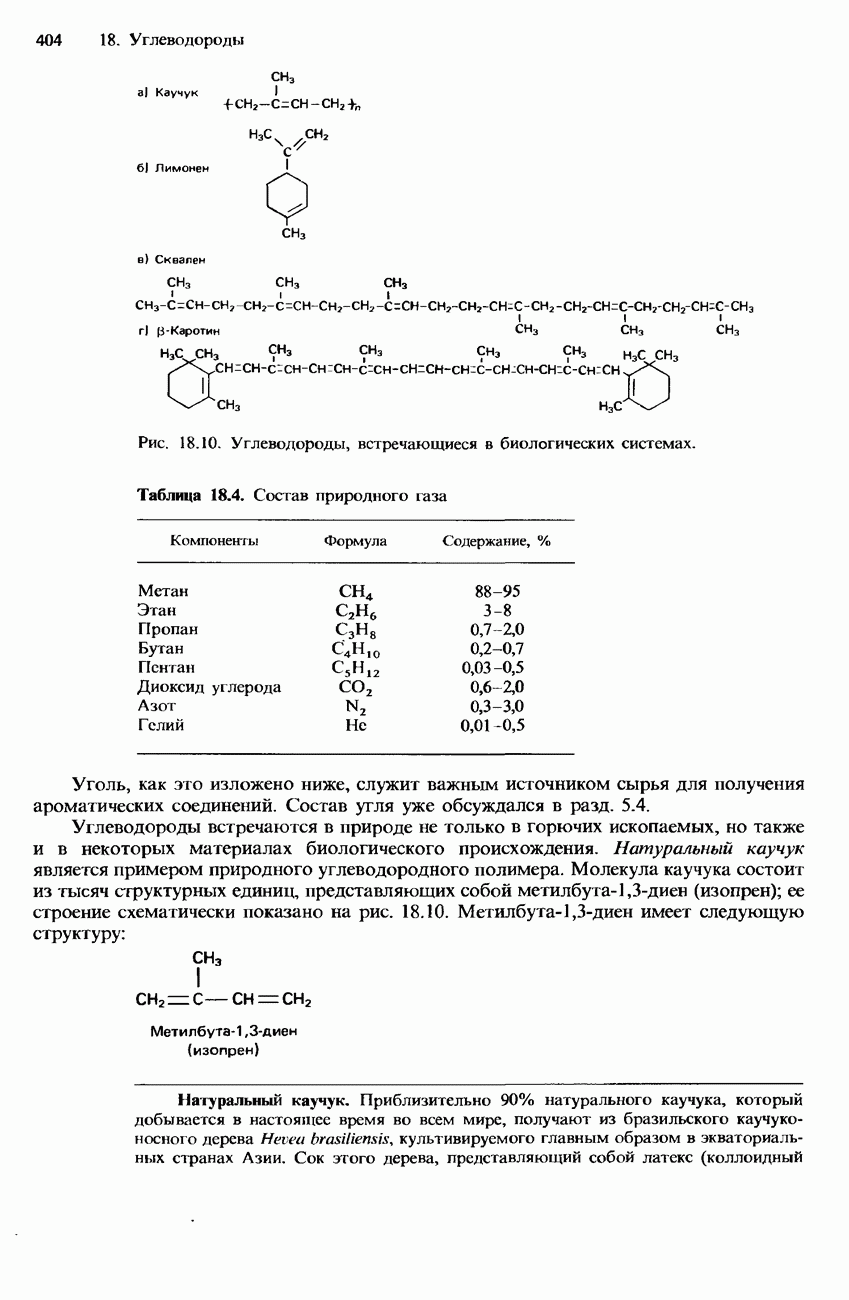
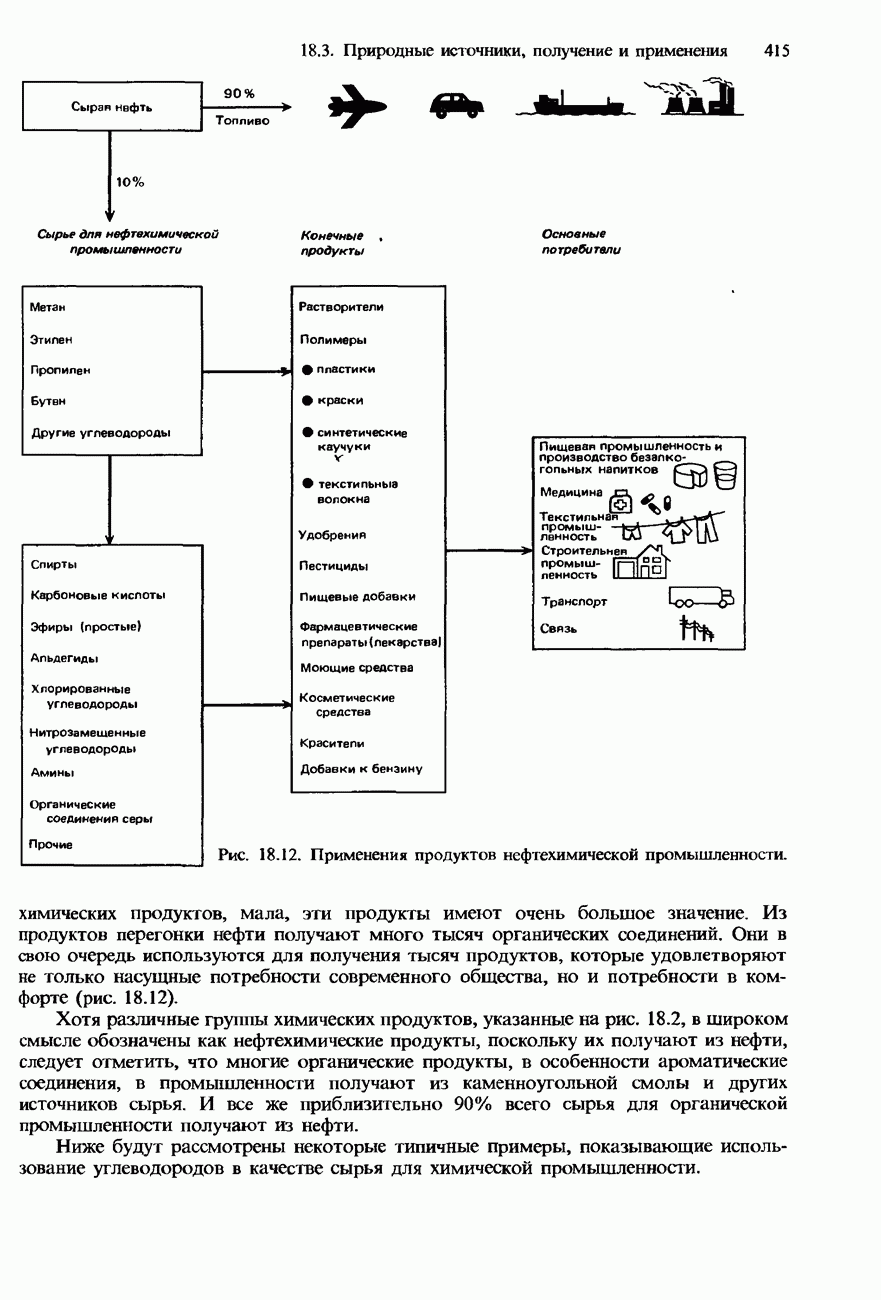
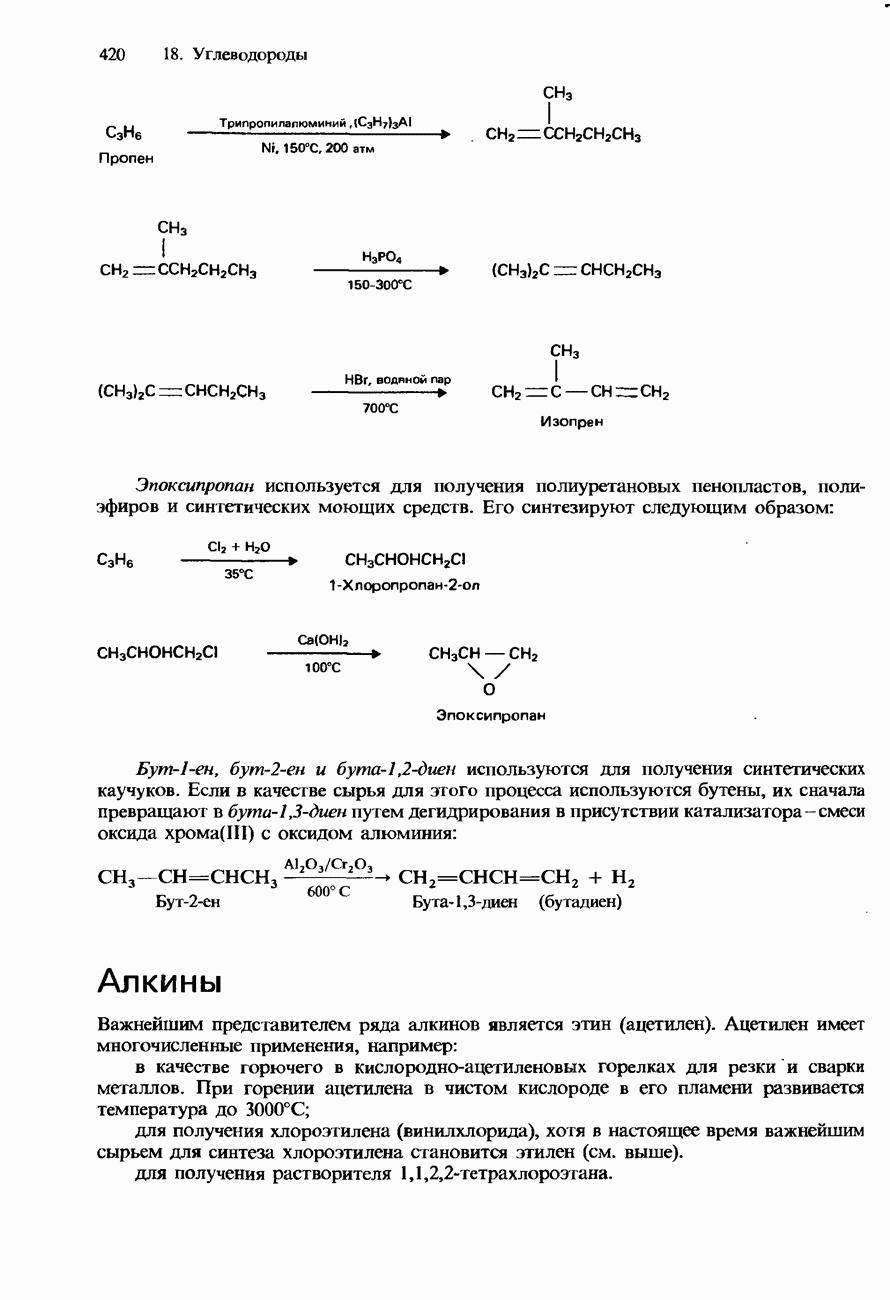
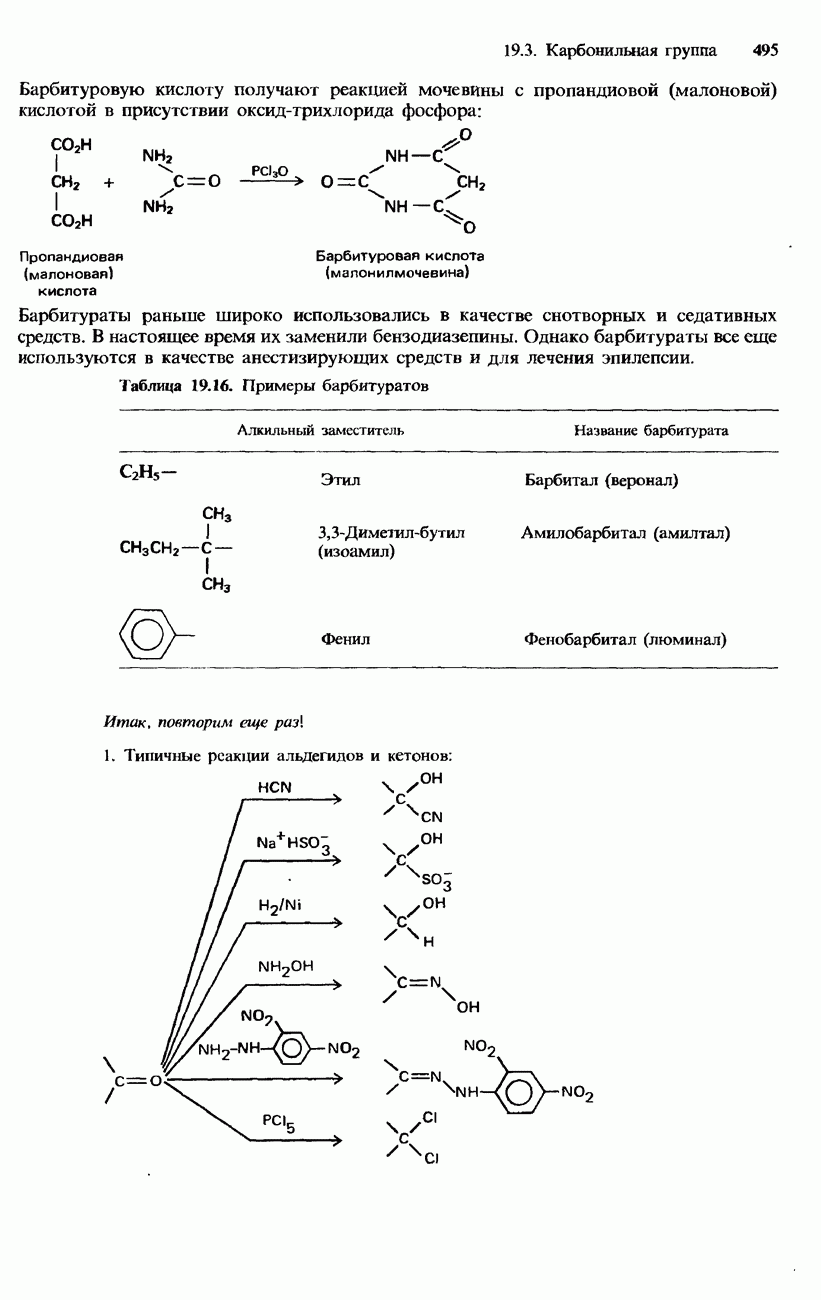
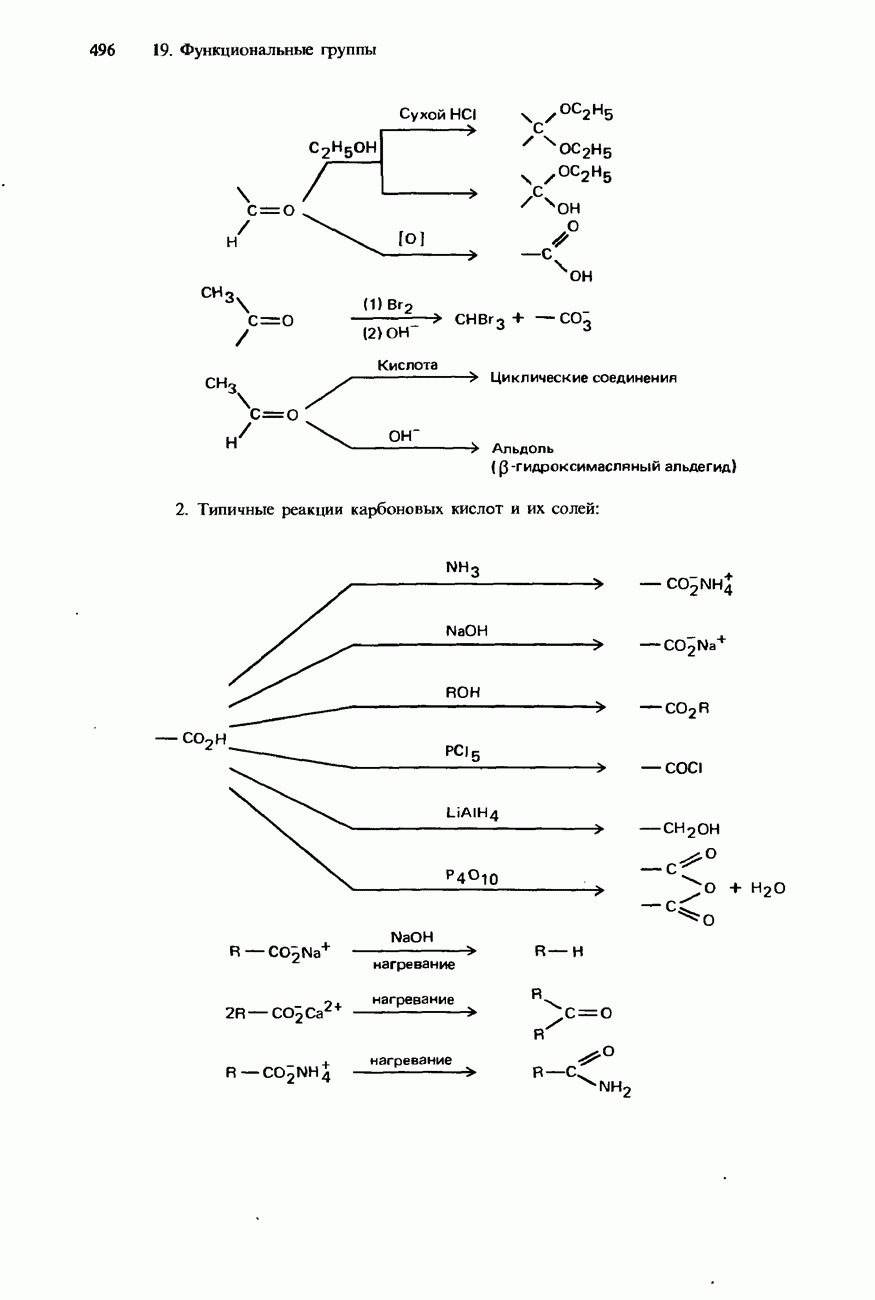
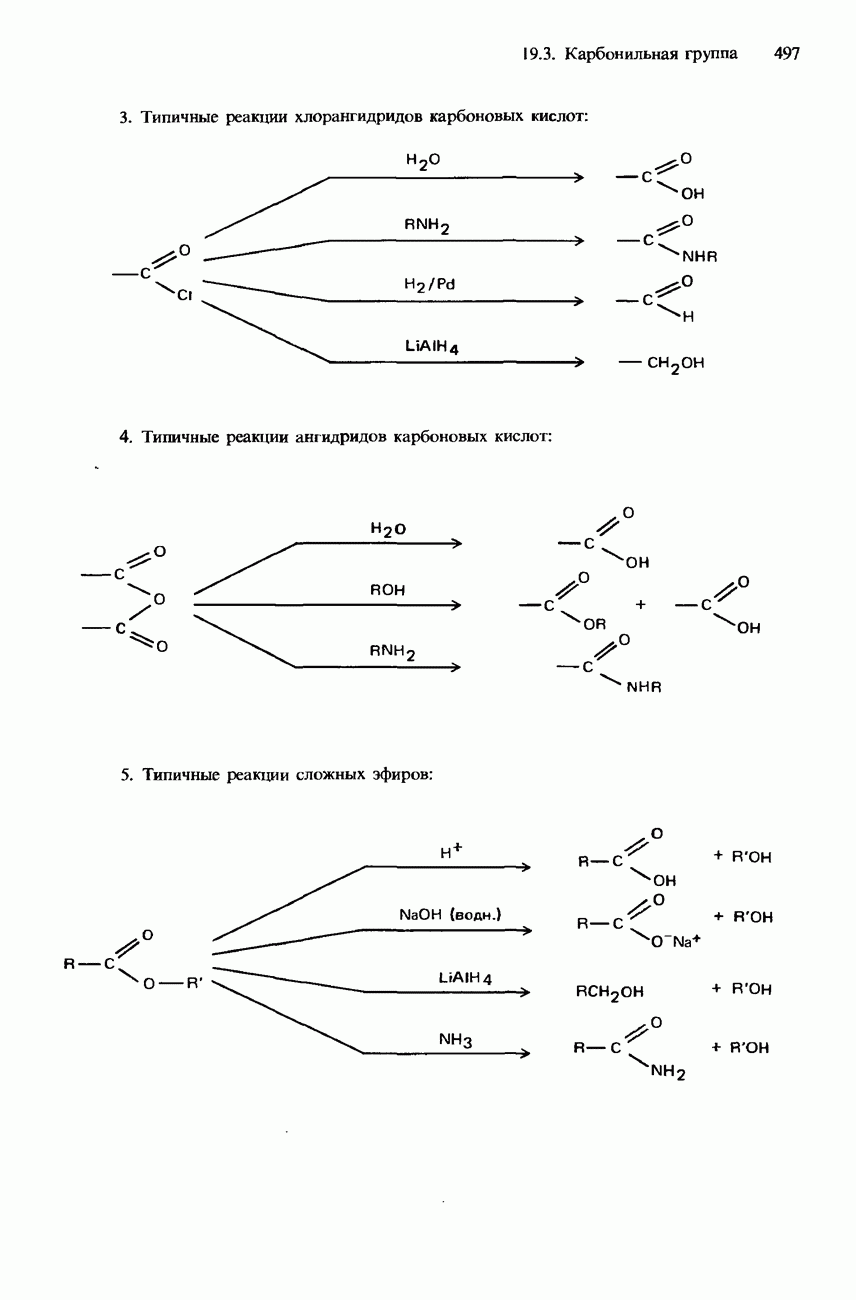
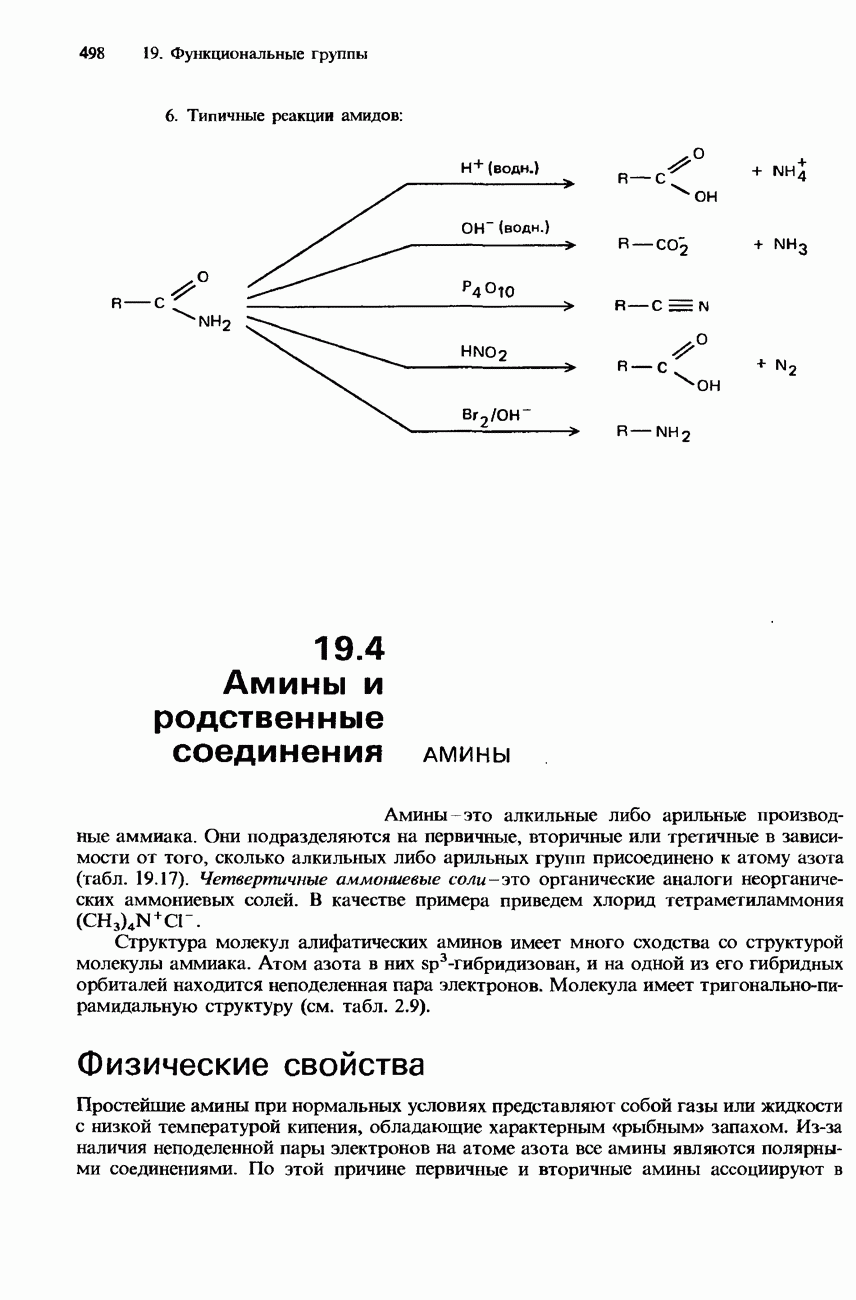
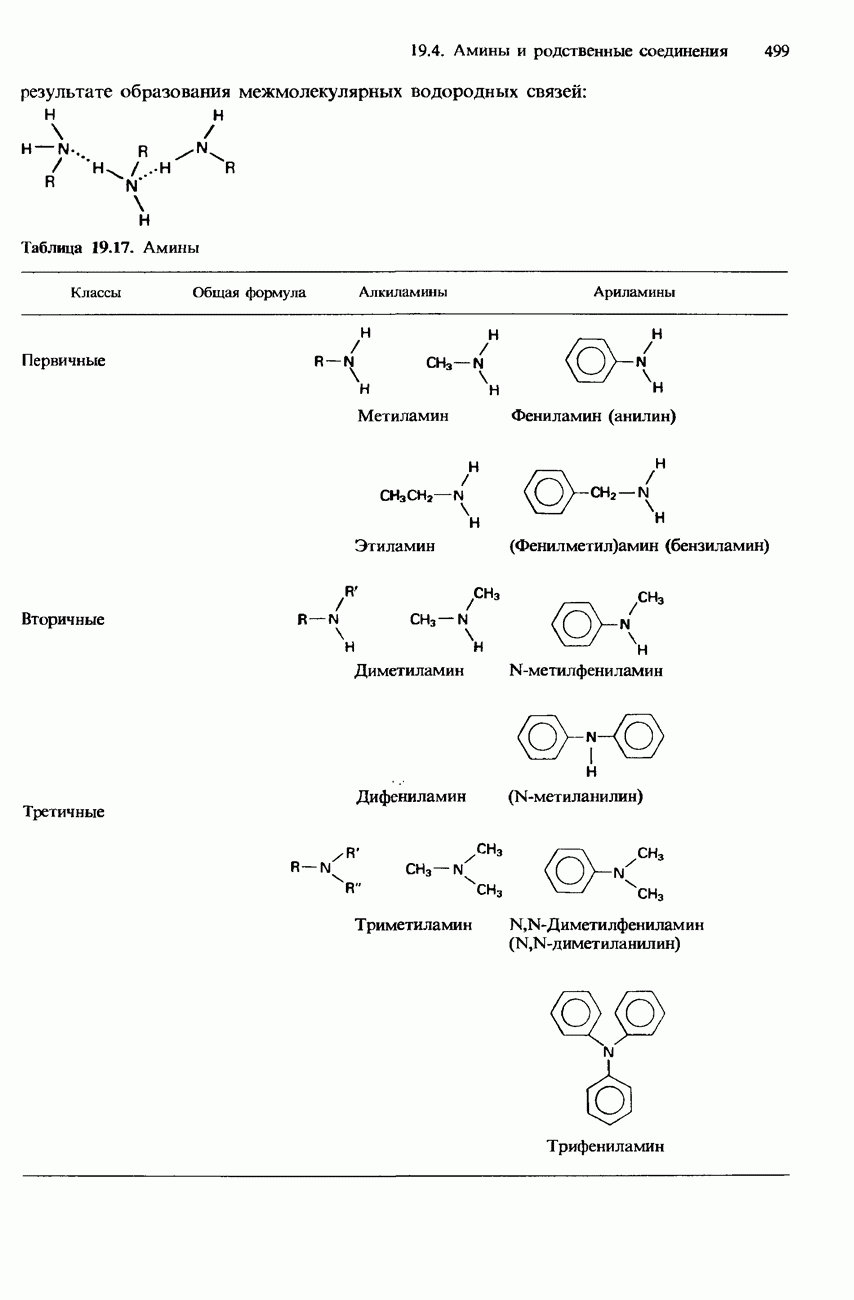
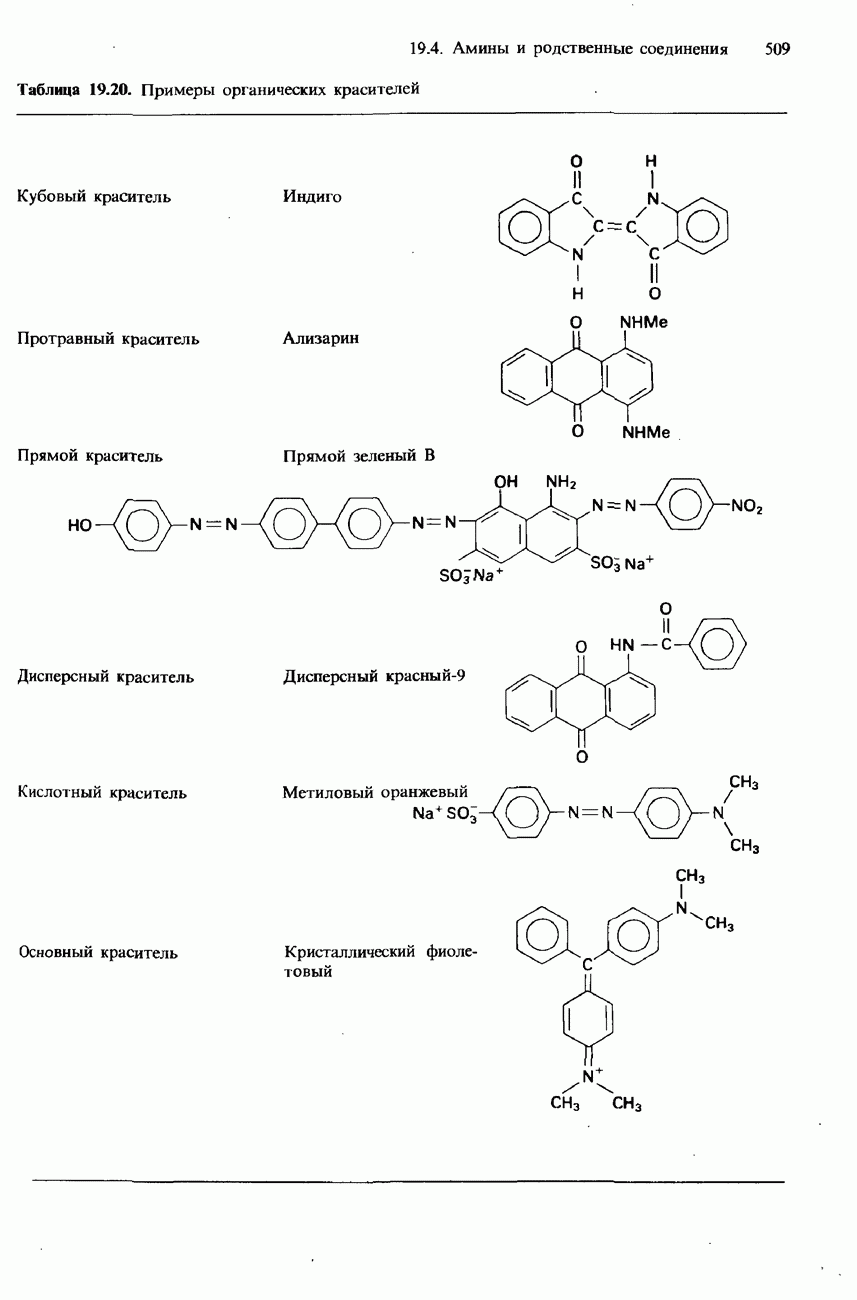
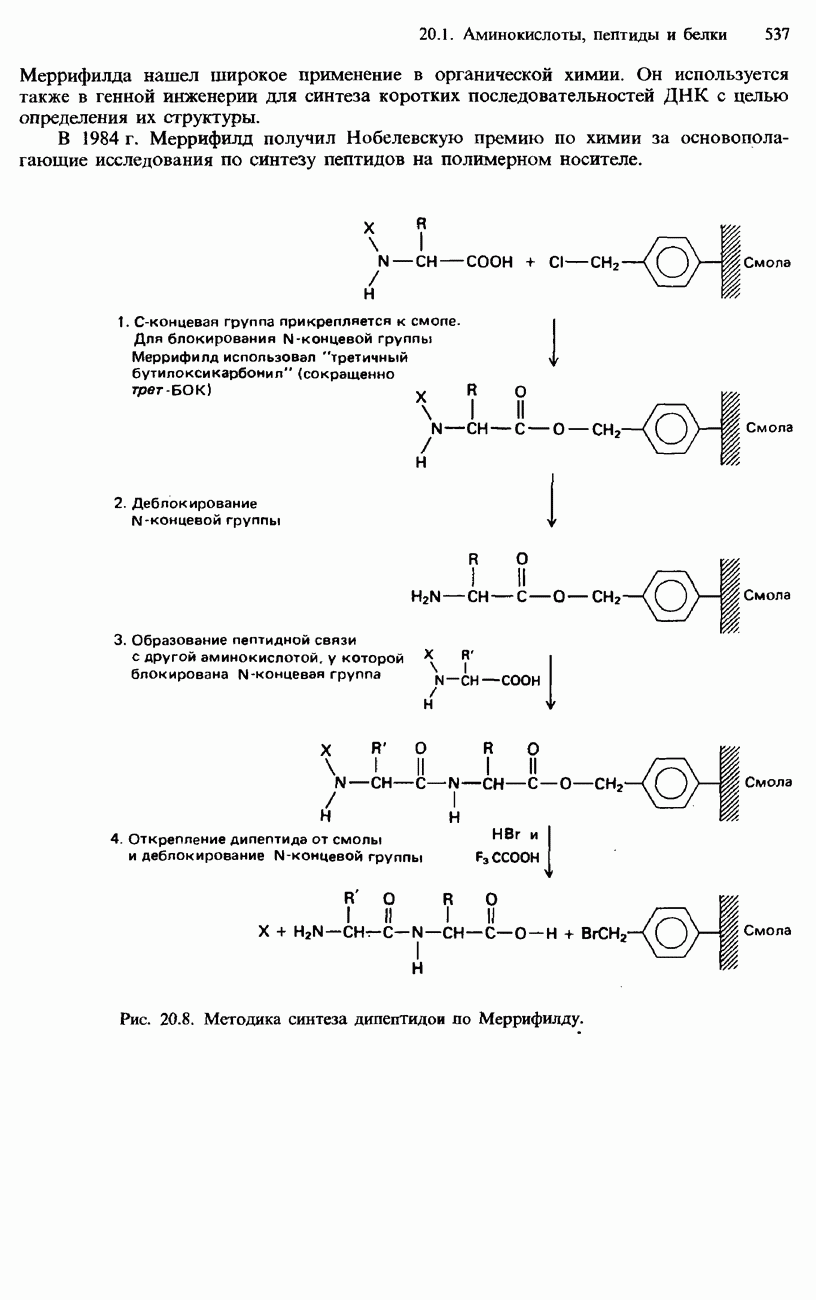
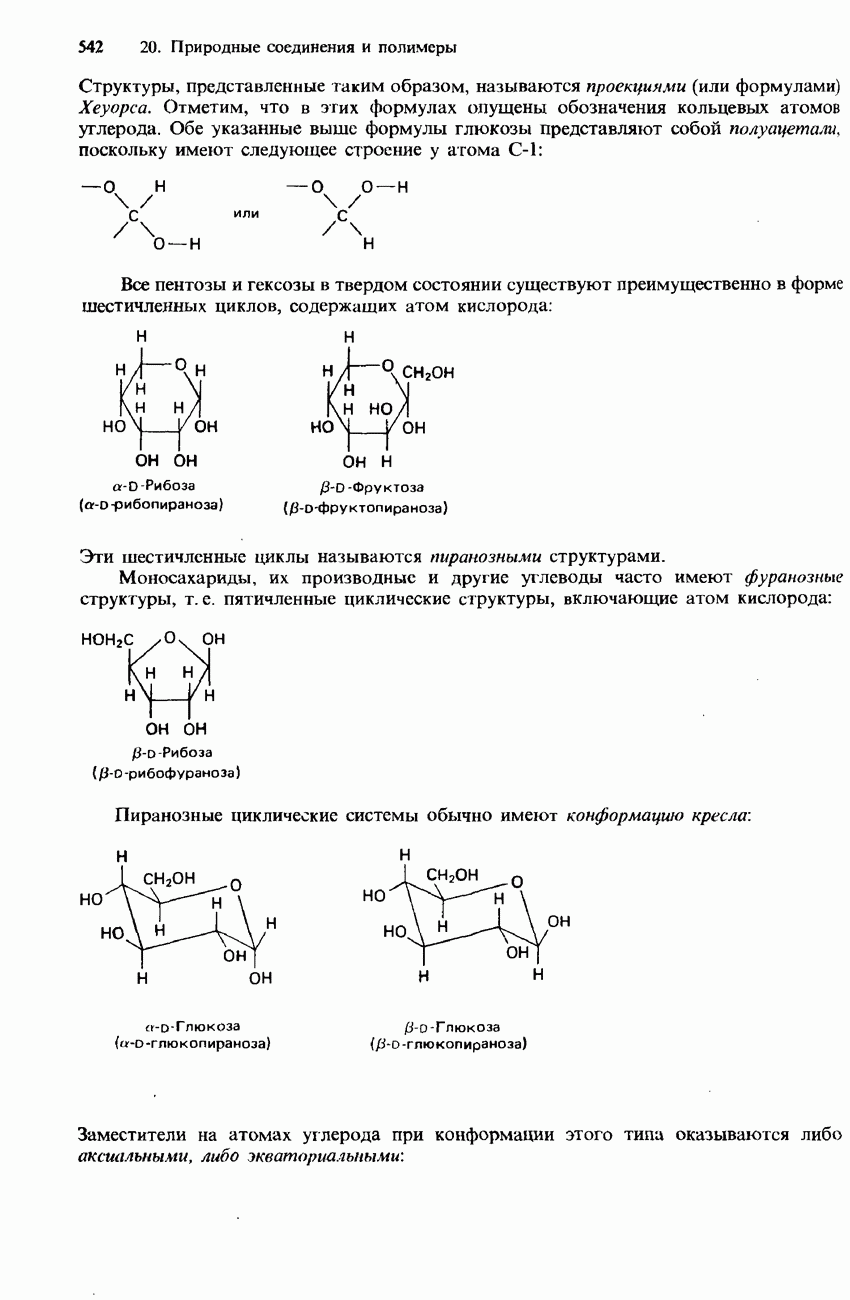
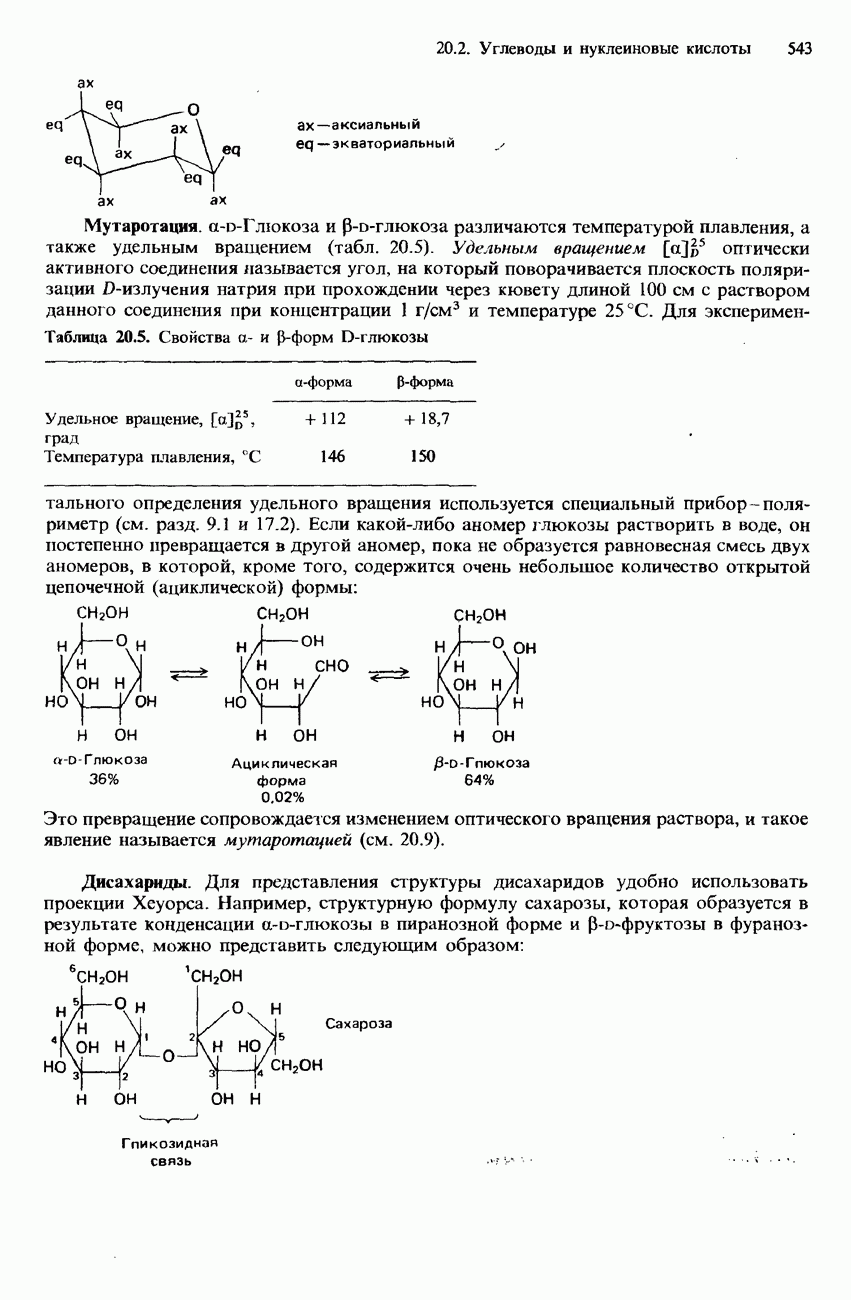
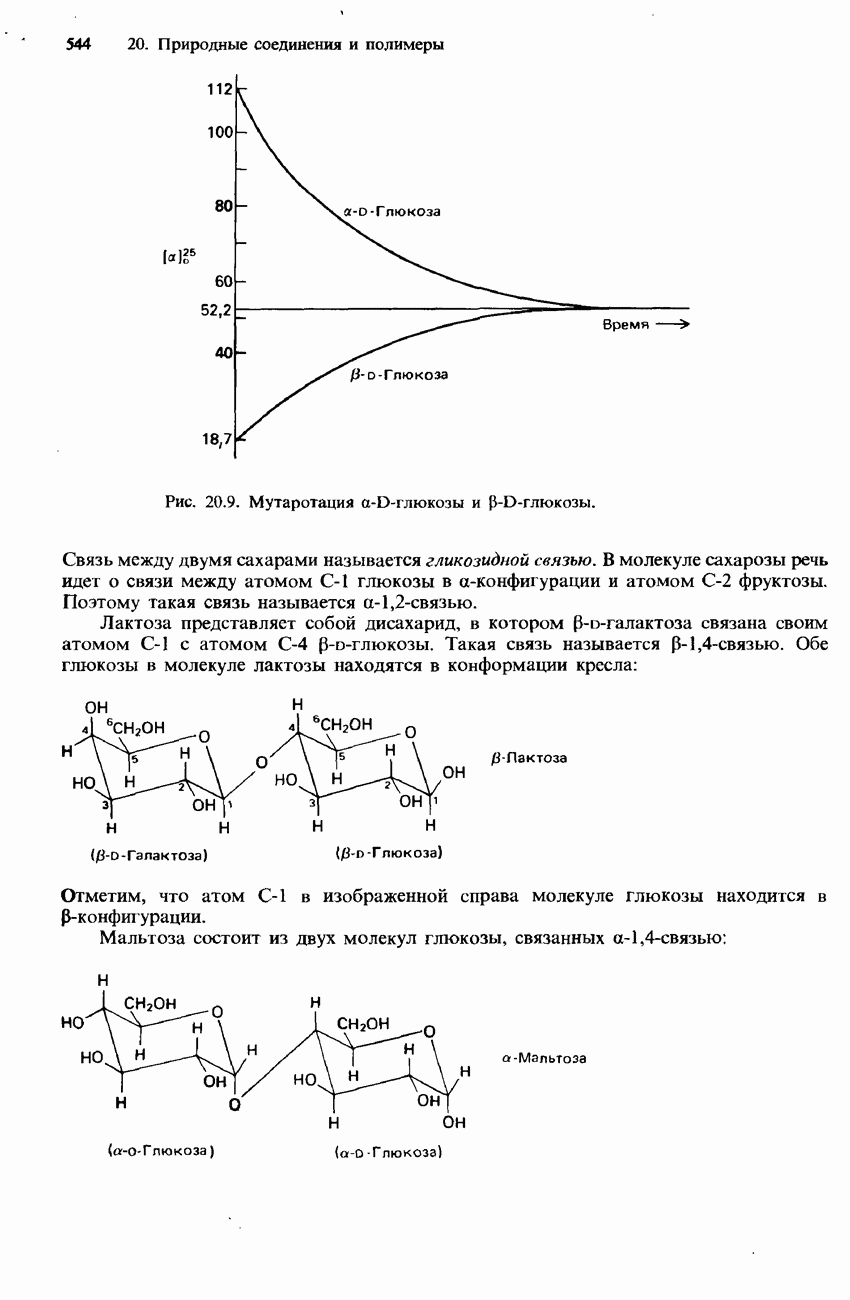
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
СОЕДИНЕНИЯ АЗОТА
Аммиак
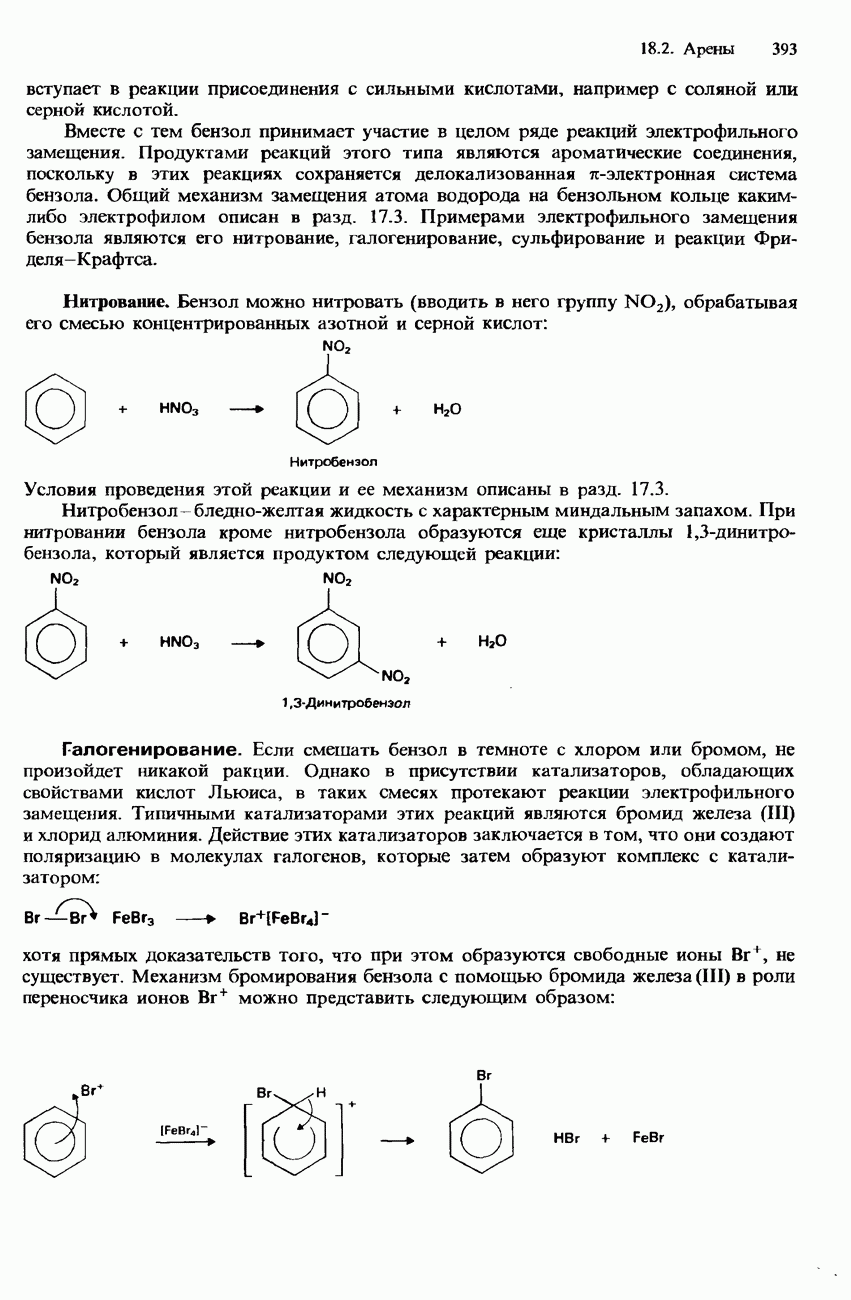
Аммиак - это ковалентное соединение, состоящее из молекул пирамидальной формы (см. разд. 2.2). Он имеет удушливый запах и при нормальных условиях представляет собой бесцветный газ, плотность которого меньше, чем у воздуха.
Для получения аммиака в лабораторных условиях обычно нагревают смесь хлорида аммония и гидроксида кальция, что приводит к реакции

Аммиак, полученный таким способом, сначала осушают, пропуская его через оксид кальция, а затем собирают в опрокинутый сосуд.
Молекула аммиака имеет неподеленную пару электронов на атоме азота и поэтому способна обобществлять ее с какой-либо электронно-акцепторной частицей, образуя с ней координационную (донорно-акцепторную) связь. Таким образом, аммиак обладает свойствами льюисова основания. Например

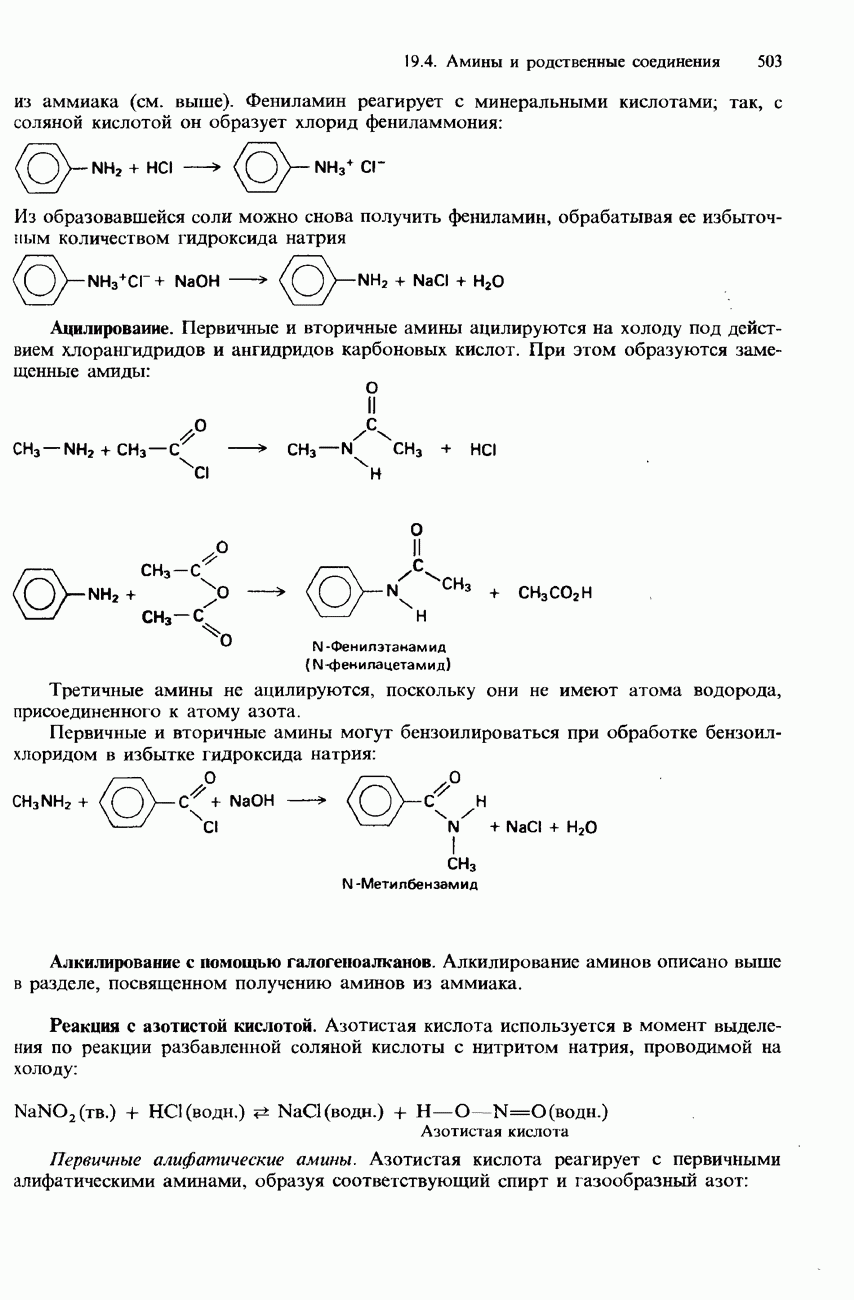
Эта реакция используется для проведения одной из аналитических проб на аммиак. При смешивании аммиака с газообразным хлороводородом образуются белый «дым» хлорида аммония:

Аммиак обладает самой большой растворимостью в воде среди всех газов. В его водном растворе устанавливается следующее равновесие:

Водный раствор аммиака иногда называют раствором гидроксида аммония. Однакс твердый гидроксид аммония выделить не удается. Раствор содержит частицы всех четырех типов, указанных в уравнении равновесия. Молекулы аммиака в этом растворе связаны водородными связями с молекулами воды. Кроме того, аммиак выступает в роли льюисова основания, присоединяя протон от молекул воды с образованием иона аммония  . Поэтому аммиачный раствор обладает слабыми щелочными свойствами. Он имеет
. Поэтому аммиачный раствор обладает слабыми щелочными свойствами. Он имеет  .
.
Добавление аммиачного раствора к растворам солей металлов приводит к
осаждению нерастворимых гидроксидов металлов. Например

Гидроксиды некоторых металлов растворяются в избыточном количестве аммиачного раствора, образуя комплексные анионы, например 
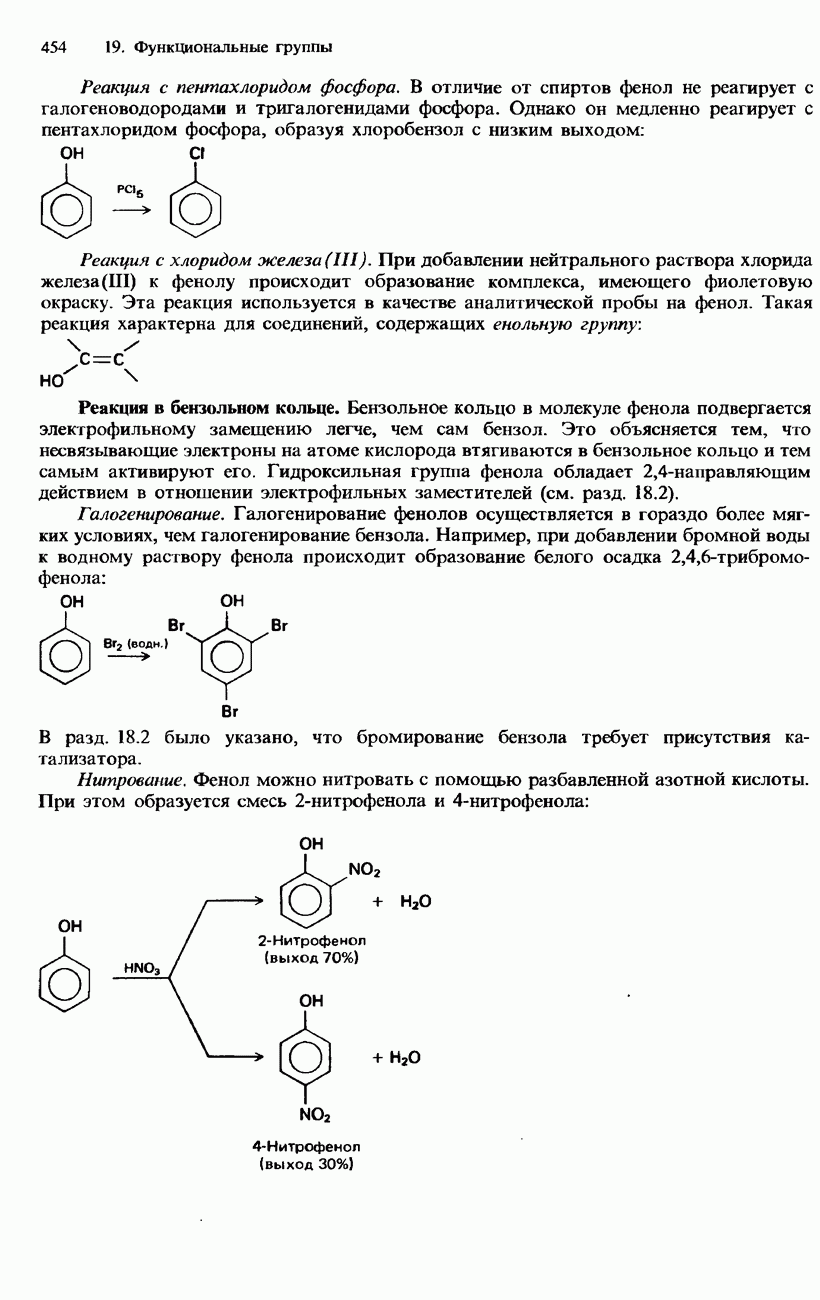
Аммиак обладает свойствами восстановителя, как это видно по его реакциям с хлором и нагретыми оксидами металлов:

Аммиак не горит в воздухе, но горит в чистом кислороде бледным желто-зеленым пламенем:

В присутствии нагретого платинового катализатора вместо этого протекает следующая реакция:

Эта реакция используется для промышленного получения азотной кислоты в процессе Оствальда (см. ниже).
Аммиак легко сжижается при охлаждении и повышении давления. Жидкий аммиак обладает свойствами, которые имеют много общего со свойствами воды. Молекулы в жидком аммиаке связаны между собой водородными связями, и поэтому его температура кипения оказывается выше, чем можно было бы ожидать (см. гл. 2). И аммиак, и вода являются плохими проводниками электрического тока, но прекрасными ионизирующими растворителями.
Натрий, калий, барий и кальций растворяются в аммиаке, образуя растворы характерного голубого цвета. Эти металлы можно снова извлечь из аммиачного раствора, испаряя его. Однако при длительном хранении этих растворов они постепенно обесцвечиваются вследствие образования в них амидов соответствующих металлов, например  Амиды металлов имеют ионное строение:
Амиды металлов имеют ионное строение: 
Соли аммония. Аммиак и его водные растворы легко реагируют с кислотами, образуя соли аммония. Эти соли имеют ионную природу и содержат ион аммония  Как правило, они растворяются в воде и подвергаются гидролизу с образованием слабокислых растворов:
Как правило, они растворяются в воде и подвергаются гидролизу с образованием слабокислых растворов:

Все аммониевые соли термически неустойчивы. Галогениды аммония при нагревании сублимируют (возгоняются):

Аммониевые соли кислородсодержащих кислот (оксокислот) при нагревании разлагаются, образуя азот или оксид диазота:

Все три указанные реакции могут протекать со взрывом, а последняя из них даже называется «вулканической реакцией».
Оксиды азота
Азот образует шесть оксидов (табл. 15.12), в которых он обнаруживает степени окисления от  до
до  представляет собой димер
представляет собой димер  ниже). Все остальные оксиды довольно устойчивы, за исключением
ниже). Все остальные оксиды довольно устойчивы, за исключением  который легко разлагается на NO и
который легко разлагается на NO и 
Все оксиды азота принадлежат к эндотермическим соединениям (см. гл. 5).
Таблица 15.12. Оксиды азота

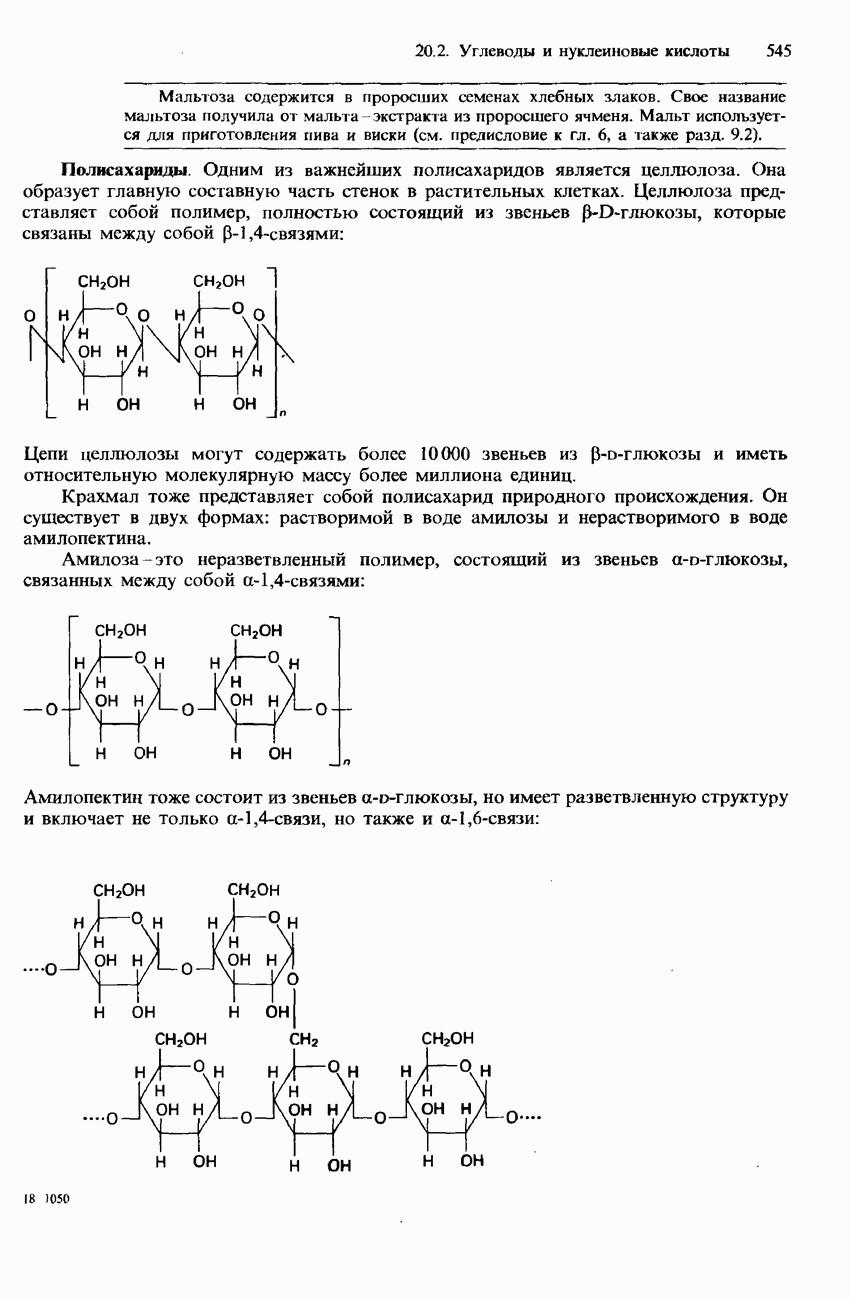
Оксид диазота  Другие названия этого соединения - закись азота, веселящий газ. Последнее название связано с тем, что вдыхание
Другие названия этого соединения - закись азота, веселящий газ. Последнее название связано с тем, что вдыхание  в небольших дозах вызывает конвульсивный смех.
в небольших дозах вызывает конвульсивный смех.  нашел применение в качестве анестезирующего средства. Для получения
нашел применение в качестве анестезирующего средства. Для получения  в лабораторных и промышленных условиях может использоваться тщательно контролируемое термическое разложение нитрата аммония:
в лабораторных и промышленных условиях может использоваться тщательно контролируемое термическое разложение нитрата аммония:

Поскольку эта реакция может протекать со взрывом, нитрат аммония лучше всего получать непосредственно на месте его использования. С этой целью нагревают смесь нитрата натрия и сульфата аммония. Это приводит к образованию нитрата аммония, который разлагается с такой же скоростью, с какой его получают.
Молекула  имеет электронное строение, которое рассматривается как резонансный гибрид двух асимметричных форм, обладающих линейной структурой:
имеет электронное строение, которое рассматривается как резонансный гибрид двух асимметричных форм, обладающих линейной структурой:

 имеет сладковатый запах и очень легко растворяется в воде, образуя нейтральный раствор. Он обладает свойствами окислителя и может, поддерживать горение, например углерода, серы и фосфора:
имеет сладковатый запах и очень легко растворяется в воде, образуя нейтральный раствор. Он обладает свойствами окислителя и может, поддерживать горение, например углерода, серы и фосфора:

Моноксид азота NO. Другое название этого соединения - оксид азота. В лабораторных и промышленных условиях его получают действием  -ного водного раствора азотной кислоты на медь:
-ного водного раствора азотной кислоты на медь:

 образуется при грозовых разрядах в атмосфере, а также при пропускании электрического разряда через газообразную смесь азота и кислорода:
образуется при грозовых разрядах в атмосфере, а также при пропускании электрического разряда через газообразную смесь азота и кислорода:

Кроме того, NO образуется как промежуточный продукт при каталитическом окислении аммиака в процессе Оствальда, используемом для получения азотной кислоты.
Электронное строение молекулы NO рассматривается как резонансный гибрид двух следующих форм:

Отметим, что обе резонансные формы имеют по неспаренному электрону. Это объясняет наличие у моноксида азота парамагнитных свойств (см. предыдущую главу).
Моноксид азота представляет собой при нормальных условиях бесцветный газ, который практически нерастворим в воде. В твердом и жидком состояниях NO обнаруживает тенденцию к димеризации с образованием  Он обладает восстановительными свойствами и в присутствии воздуха приобретает коричневую окраску из-за образования диоксида азота:
Он обладает восстановительными свойствами и в присутствии воздуха приобретает коричневую окраску из-за образования диоксида азота:

Соединяясь с сульфатом железа (II), NO образует комплекс коричневого цвета  Образование этого комплекса используется в аналитической коричневой кольцевой пробе на нитраты (см. рис. 15.18).
Образование этого комплекса используется в аналитической коричневой кольцевой пробе на нитраты (см. рис. 15.18).
Диоксид азота  Диоксид азота получают в лабораторных условиях нагреванием нитрата свинца (II) (см. гл. 6):
Диоксид азота получают в лабораторных условиях нагреванием нитрата свинца (II) (см. гл. 6):

 обычно существует в равновесии со своим димером
обычно существует в равновесии со своим димером  также разд. 7.1):
также разд. 7.1):

 имеет бледно-желтую окраску,
имеет бледно-желтую окраску,  бурую. При охлаждении этого газа происходит конденсация
бурую. При охлаждении этого газа происходит конденсация  с образованием жидкости зеленого цвета.
с образованием жидкости зеленого цвета.
Электронное строение молекулы  рассматривается как резонансный гибрид двух форм с изогнутой структурой:
рассматривается как резонансный гибрид двух форм с изогнутой структурой:

При димеризации  неспаренные электроны каждой их двух молекул обобществляются, образуя слабую связь
неспаренные электроны каждой их двух молекул обобществляются, образуя слабую связь  Образующийся димер
Образующийся димер  по своему электронному строению может рассматриваться как резонансный гибрид двух форм с плоской структурой:
по своему электронному строению может рассматриваться как резонансный гибрид двух форм с плоской структурой:

Диоксид азота - очень ядовитый газ. Он растворяется в воде с образованием азотистой и азотной кислот:

Этот газ изменяет синюю окраску лакмусовой бумаги на красную, чем отличается от брома, который тоже представляет собой коричневый газ, но обесцвечивает лакмусовую бумагу.
При нагревании  разлагается, образуя моноксид азота:
разлагается, образуя моноксид азота:

Загрязнение окружающей среды оксидами азота
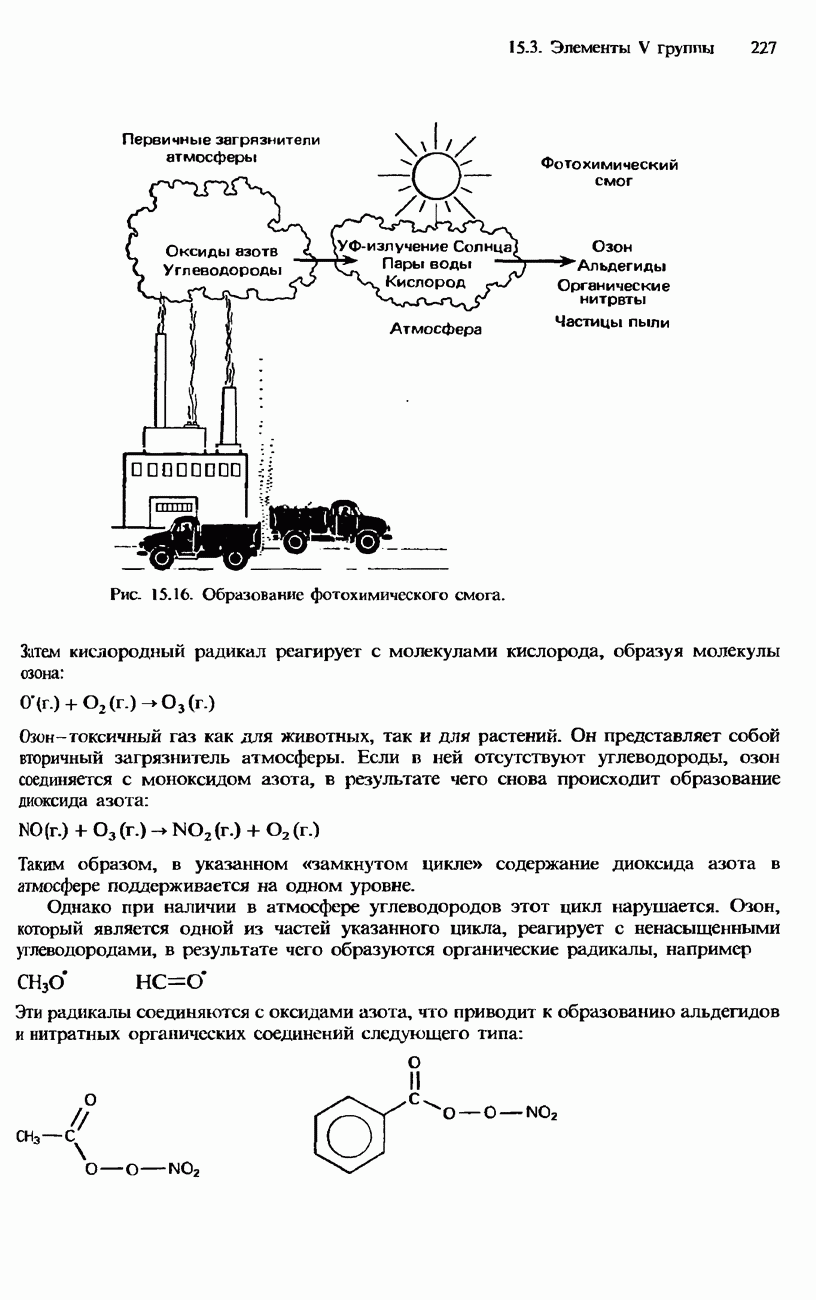
Оксиды азота считаются первичными загрязнителями атмосферы. Они попадают в воздух при сгорании различных топлив - горючих ископаемых. Такое загрязнение атмосферы вызывают тепловые электростанции, нефтеперерабатывающие заводы, дымовые газы промышленных предприятий и выхлопные газы автомобильного транспорта. Оксиды азота (все они вместе обозначаются общей формулой  ) способны вызывать двоякое загрязнение окружающей среды.
) способны вызывать двоякое загрязнение окружающей среды.
Во-первых, они растворяются в воде с образованием азотистой и азотной кислоты. Эти кислоты принадлежат к числу вторичных загрязнителей и наряду с сернистой и серной кислотами приводят к возникновению кислотных дождей (см. разд. 12.2).
Во-вторых, оксиды азота могут соединяться с углеводородами, что приводит к возникновению фотохимического смога. Углеводороды тоже попадают в атмосферу в результате сжигания горючих ископаемых и поэтому являются первичными загрязнителями. Фотохимический смог возникает в результате протекания сложной последовательности реакций, в которых принимают участие радикалы (см. гл. 17). Для протекания первой стадии этого сложного процесса необходимо наличие ультрафиолетового солнечного излучения. Такое излучение вызывает следующую фотохимическую реакцию:


Рис. 15.16. Образование фотохимического смога.
Затем кислородный радикал реагирует с молекулами кислорода, образуя молекулы шона:

Озон - токсичный газ как для животных, так и для растений. Он представляет собой вторичный загрязнитель атмосферы. Если в ней отсутствуют углеводороды, озон соединяется с моноксидом азота, в результате чего снова происходит образование диоксида азота:

Таким образом, в указанном «замкнутом цикле» содержание диоксида азота в атмосфере поддерживается на одном уровне.
Однако при наличии в атмосфере углеводородов этот цикл нарушается. Озон, который является одной из частей указанного цикла, реагирует с ненасыщенными углеводородами, в результате чего образуются органические радикалы, например

Эти радикалы соединяются с оксидами азота, что приводит к образованию альдегидов и нитратных органических соединений следующего типа:


Рис. 15.17. Атмосферные условия, благоприятствующие образованию фотохимического смога, а- отсутствие инверсионного слоя, б- наличие инверсионного слоя.
Наряду с озоном подобные соединения представляют собой вторичные загрязнители атмосферы, которые приводят к возникновению фотохимического смога (рис. 15.16).
Во многих городах мира эта проблема осложняется образованием в атмосфере та называемого инверсионного слоя (рис. 15.17). Он представляет собой слой нагретого воздуха, который располагается над городом и не дает выхода нижнему слою более холодного воздуха. Этот нагретый слой обычно не содержит влаги и обладает максимальной прозрачностью для солнечного излучения. В результате происходит накопление вторичных загрязнителей, удерживаемых в нижнем слое воздуха. Возникающий в таких условиях фотохимический смог нередко можно наблюдать как дымку, висящую над городом в жаркую погоду. Эта дымка обусловлена частицами смога.
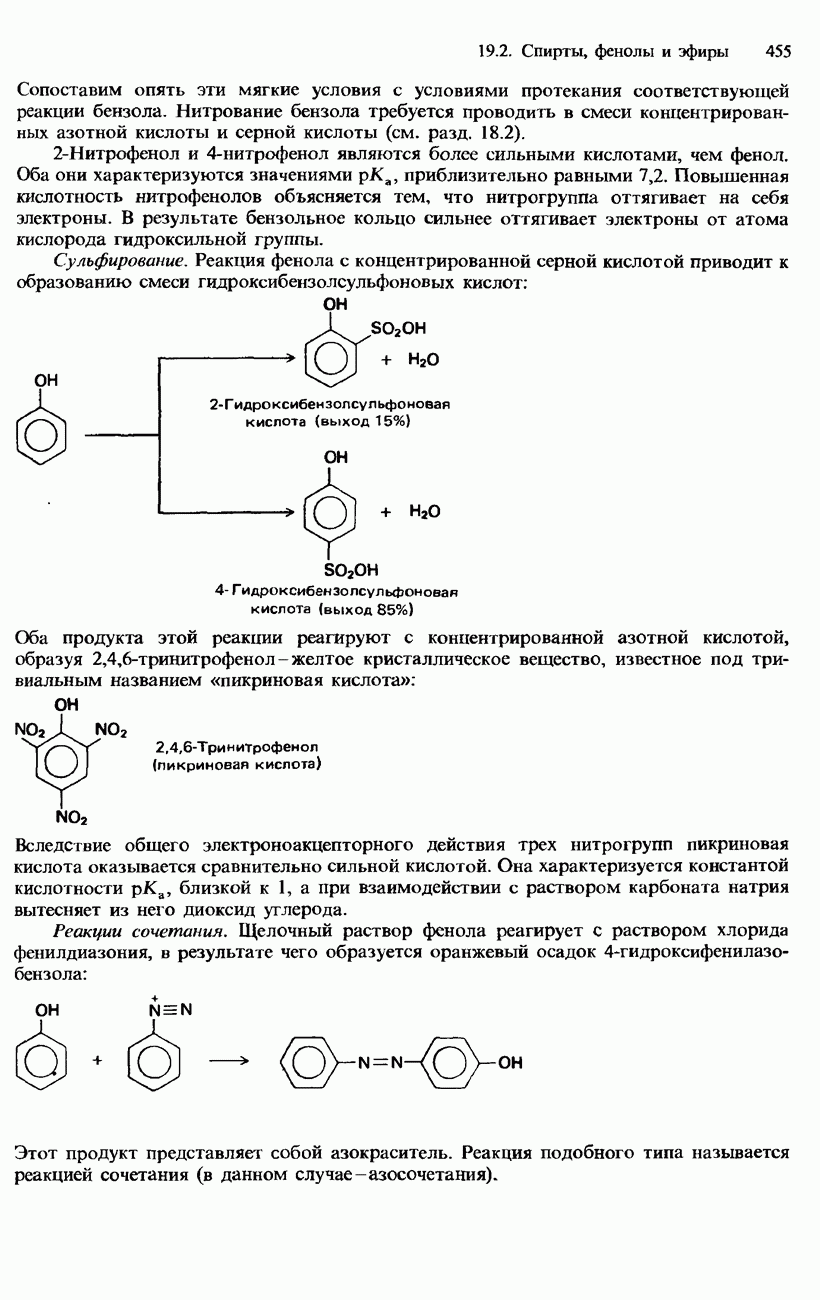
Азотистая кислота и нитриты
Водный раствор азотистой кислоты можно получить в лабораторных условиях, добавляя разбавленную соляную кислоту к холодному разбавленному раствору нитрита натрия:

(Раствор азотистой кислоты имеет голубую окраску.) Получить нитрит натрия можно сильным нагреванием нитрата натрия; лучше, если эта реакция происходит в присутствии какого-либо восстановителя, например свинца:

Нитрит натрия извлекают из полученной смеси растворением в воде.
Азотистая кислота слабая и неустойчивая. Она имеет  При комнатной температуре она диспропорционирует на азотную кислоту и моноксид азота:
При комнатной температуре она диспропорционирует на азотную кислоту и моноксид азота:

Азотистая кислота и кислые растворы нитритов являются окислителями, однако в присутствии более сильных окислителей, например подкисленного  калия, они ведут себя как восстановители. Подкисленные растворы нитрита натрия имеют особо важное значение в органической химии, где их используют для получения солей диазония (см. гл. 19).
калия, они ведут себя как восстановители. Подкисленные растворы нитрита натрия имеют особо важное значение в органической химии, где их используют для получения солей диазония (см. гл. 19).
Азотная кислота и нитраты
Чистая азотная кислота представляет собой бесцветную дымящую на воздухе жидкость. Для ее получения в лабораторных условиях нагревают нитрат натрия либо нитрат калия с концентрированной серной кислотой:

Продукт этой реакции обычно имеет желтую окраску, обусловленную присутствием в нем растворенного диоксида азота, который образуется в результате термического разложения азотной кислоты:

Водный раствор азотной кислоты обладает типичными свойствами сильной кислоты. Например, он реагирует с основаниями, образуя нитраты, и с карбонатами, образуя диоксид углерода.
Разбавленная и концентрированная азотная кислота являются окислителями. Концентрированная азотная кислота окисляет такие неметаллы, как углерод и серу:

Реакции азотной кислоты с металлами протекают по-разному. Кальций и магний реагируют с очень разбавленной азотной кислотой, вытесняя из нее водород. Цинк восстанавливает разбавленную азотную кислоту, в результате чего образуется оксид диазота. Однако для большинства металлов более характерна реакция с разбавленной азотной кислотой и образованием моноксида азота и реакция с концентрированной
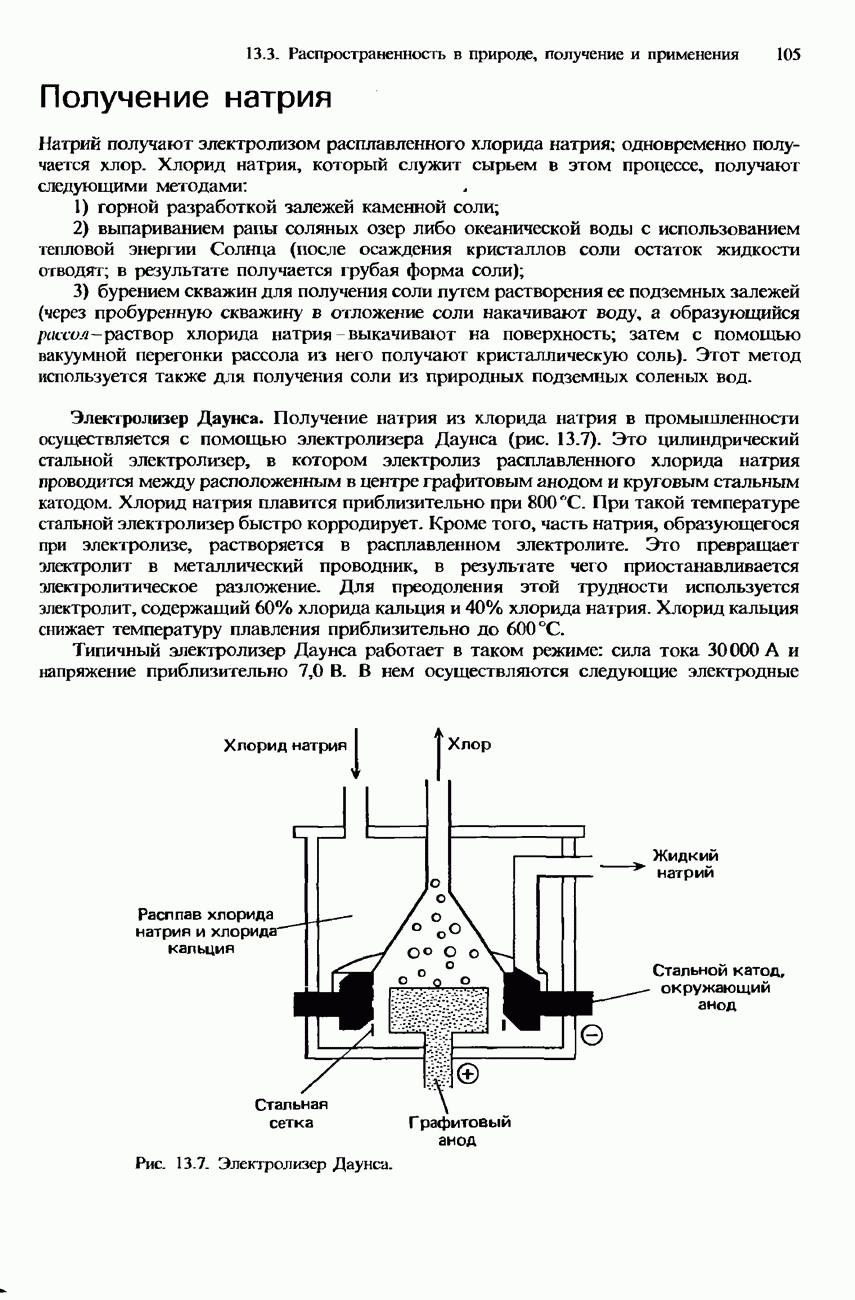
азотной кислотой, приводящая к образованию диоксида азота. В качестве примера приведем медь.
Реакция с 

Реакция с концентрированной  :
:

Следует отметить, что здесь приведены лишь суммарные стехиометрические уравнения рассматриваемых реакций. В действительности эти реакции представляют собой сложные многостадийные процессы.
Концентрированная азотная кислота реагирует с железом, хромом и алюминием, образуя на поверхности этих металлов защитный слой оксида, который делает эти металлы пассивными к дальнейшей реакции. Драгоценные металлы, например золото и платина, не реагируют с азотной кислотой.
Азотная кислота способна окислять некоторые катионы и анионы. Например, она окисляет ионы  до ионов
до ионов 

Иодидные ионы окисляются азотной кислотой до иода:

Сероводород и другие неорганические ковалентные соединения тоже окисляются азотной кислотой:

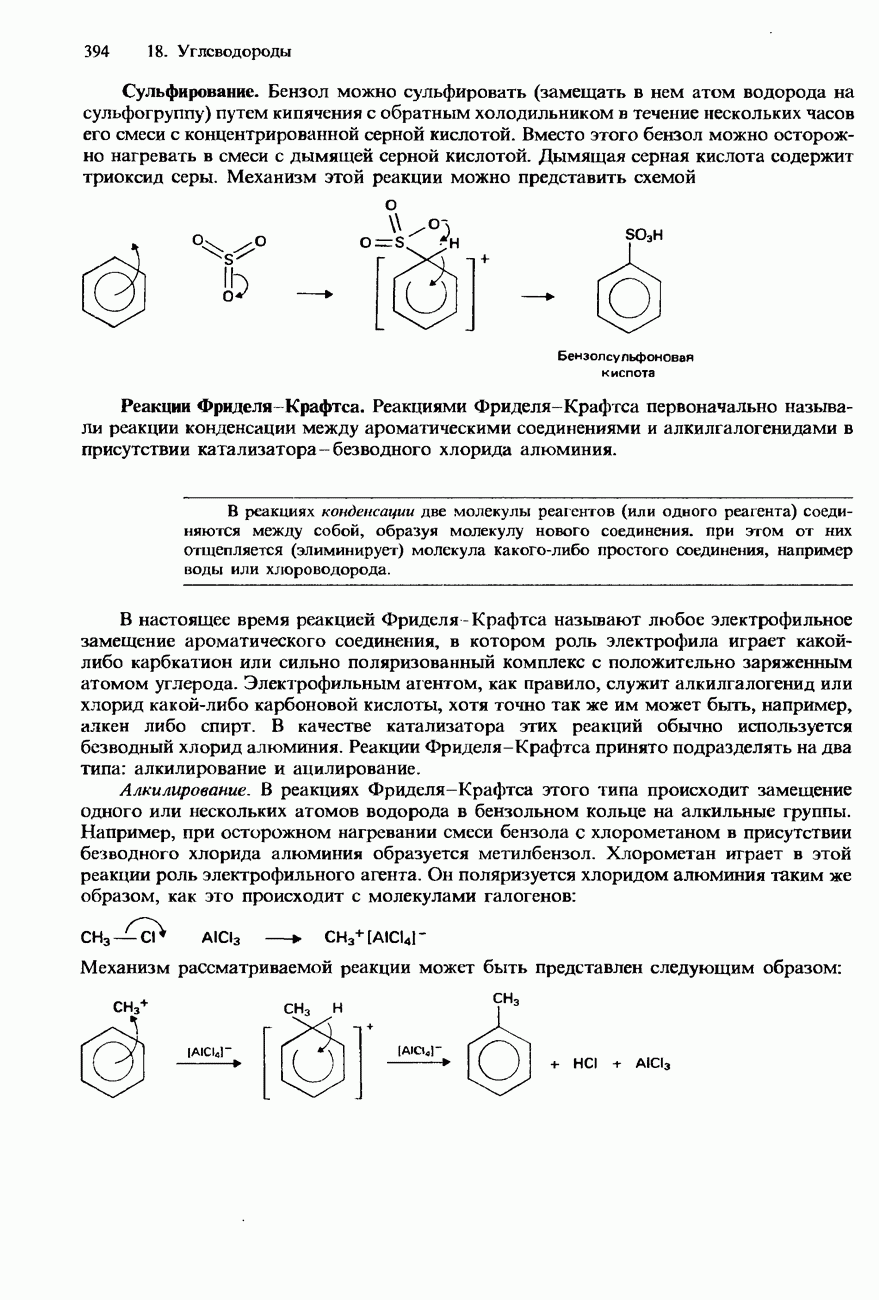
В органической химии азотная кислота используется в качестве нитрующего реагента. С этой целью используется смесь концентрированных азотной и серной кислот.
Нитраты. Для получения нитратов различных металлов могут использоваться реакции азотной кислоты с соответствующими металлами, их оксидами, гидридами либо карбонатами. Аналитическое обнаружение нитратов осуществляется с помощью коричневой кольцевой пробы (рис. 15.18).
Коричненая кольцевая проба на нитраты. Испытуемое вещество растворяют в воде и приливают к раствору сульфата  Затем осторожно, по каплям, добавляют в пробирку со смесью этих растворов концентрированную серную кислоту, так чтобы она стекала по стенкам пробирки и образовались бы два слоя жидкости (рис. 15.18). Если испытуемое вещество содержит какой-либо нитрат, он реагирует с серной кислотой, образуя азотную кислоту. Азотная кислота в свою очередь реагирует с сульфатом железа (II), образуя комплекс
Затем осторожно, по каплям, добавляют в пробирку со смесью этих растворов концентрированную серную кислоту, так чтобы она стекала по стенкам пробирки и образовались бы два слоя жидкости (рис. 15.18). Если испытуемое вещество содержит какой-либо нитрат, он реагирует с серной кислотой, образуя азотную кислоту. Азотная кислота в свою очередь реагирует с сульфатом железа (II), образуя комплекс  Это приводит к появлению коричневого кольца между двумя слоями жидкости в пробирке и, таким образом, указывает на присутствие нитрата в испытуемом веществе.
Это приводит к появлению коричневого кольца между двумя слоями жидкости в пробирке и, таким образом, указывает на присутствие нитрата в испытуемом веществе.
Все неорганические нитраты растворимы в воде и термически неустойчивы. Нитраты металлов разлагаются с образованием нитрита, оксида либо свободного металла в зависимости от положения конкретного металла в электрохимическом ряду:

Нитрат аммония при нагревании образует оксид диазота и воду:


Рис. 15.18. Коричневая кольцевая проба на нитраты.
Промышленное получение азотной кислоты и нитратов
Промышленное получение азотной кислоты основано на проведении процесса Оствальда. Этот процесс состоит из трех стадий.
1. Каталитическое окисление аммиака
Аммиак, получаемый с помощью процесса Габера (см. разд. 7.2), смешивают с воздухом и быстро пропускают над поверхностью платиново-родиевого катализатора, нагретого до температуры 900 °С, что приводит к реакции

Эта реакция настолько экзотермична, что поддерживает температуру 900 °С.
2. Получение диоксида азота
Газы, полученные на 1-й стадии, охлаждают и смешивают с воздухом. Это приводит к окислению моноксида азота до диоксида азота:

3. Получение разбавленной азотной кислоты
Диоксид азота, полученный на 2-й стадии, направляют в стальную поглотительную башню, где его пропускают навстречу струям воды. Здесь протекает реакция

Моноксид азота возвращается в цикл на вторую стадию. Получаемая таким образом азотная кислота имеет концентрацию около 50%. С помощью перегонки из нее получают 68%-ную азотную кислоту (азеотропную смесь, не поддающуюся дальнейшему концентрированию перегонкой).
Приблизительно 80% всей азотной кислоты, получаемой таким способом, нейтрализуют в избытке водного раствора аммиака с целью получения нитрата аммония:

Нитрат аммония используется в качестве удобрения (см. выше).
| << Предыдущий параграф | Следующий параграф >> |
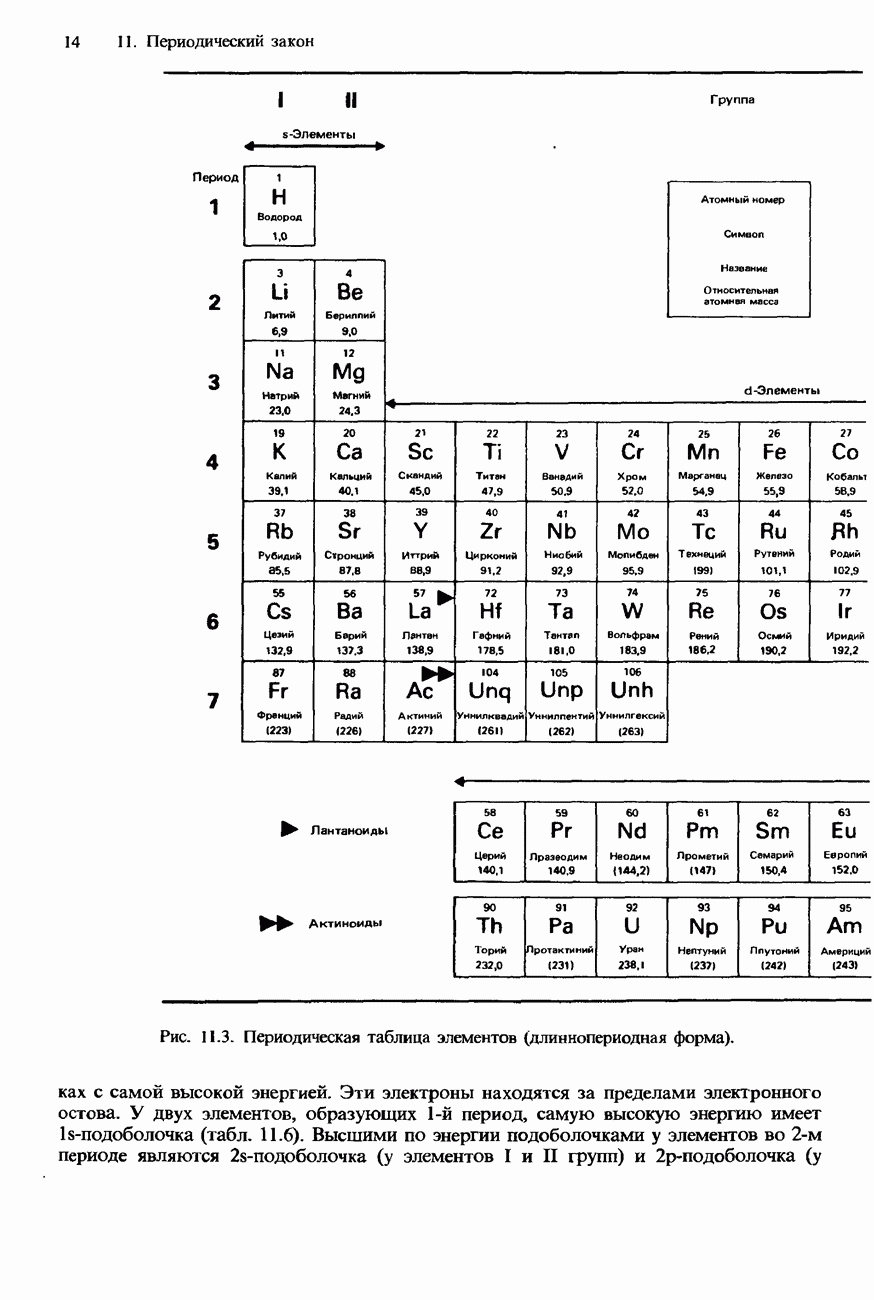
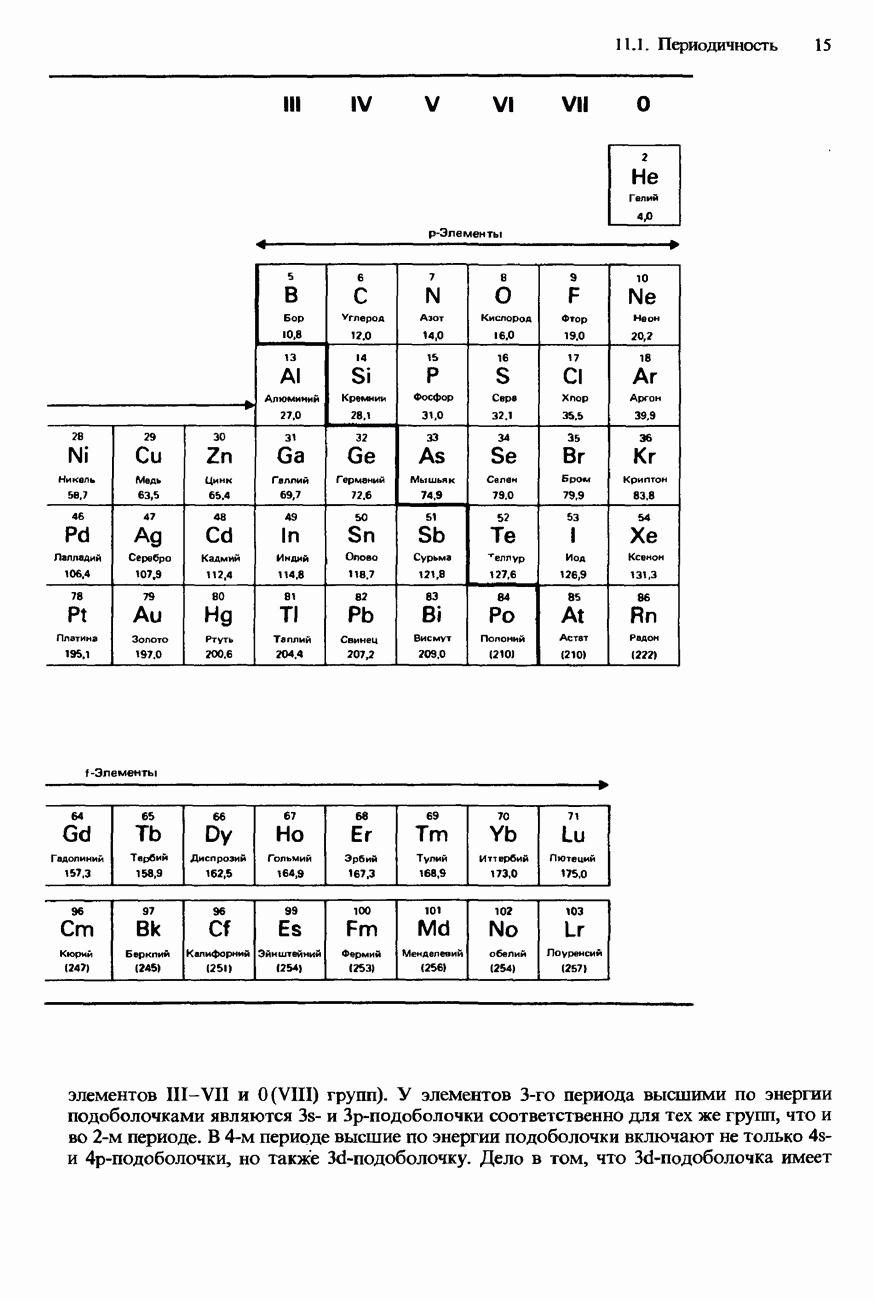
- 11. ПЕРИОДИЧЕСКИЙ ЗАКОН
- 11.1 Периодичность
- СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
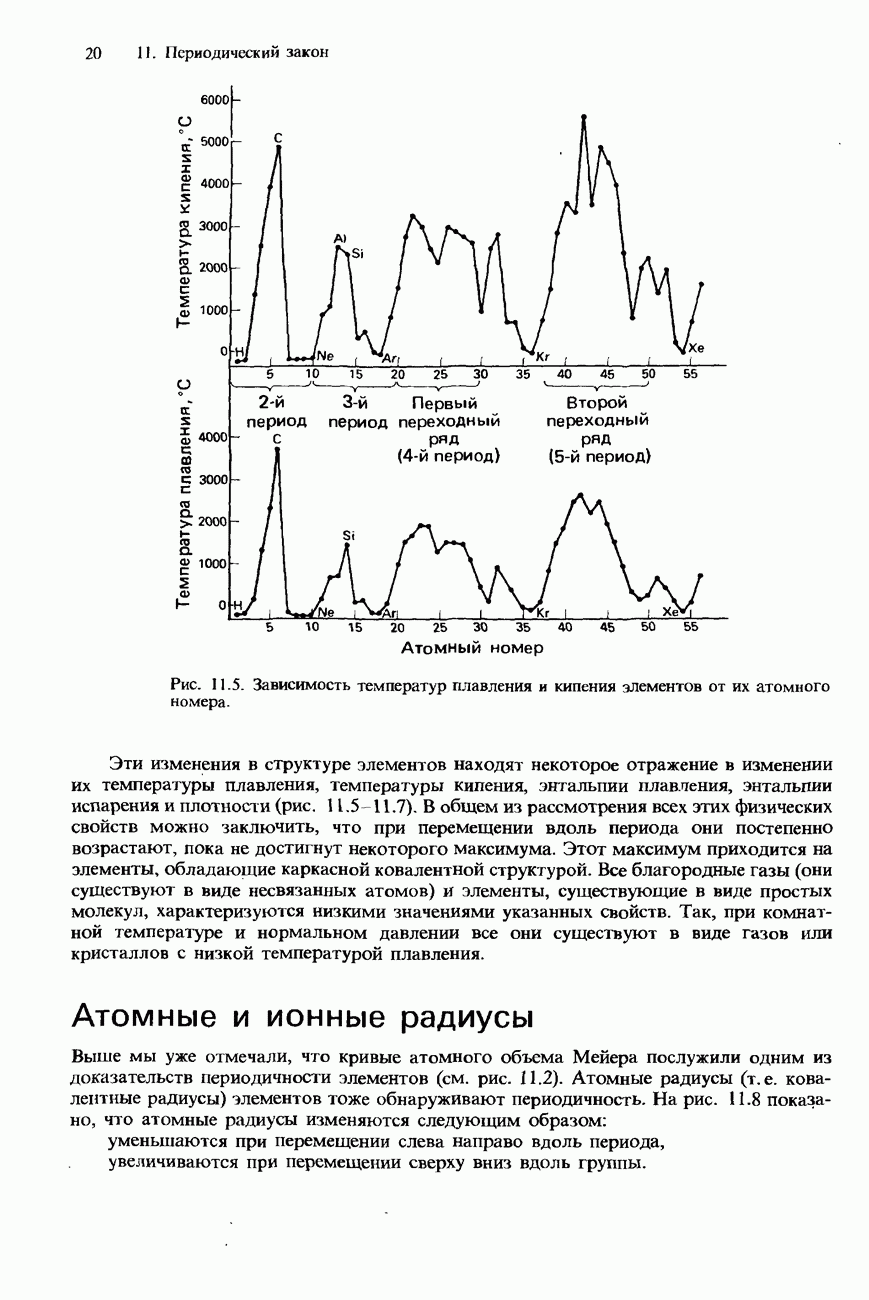
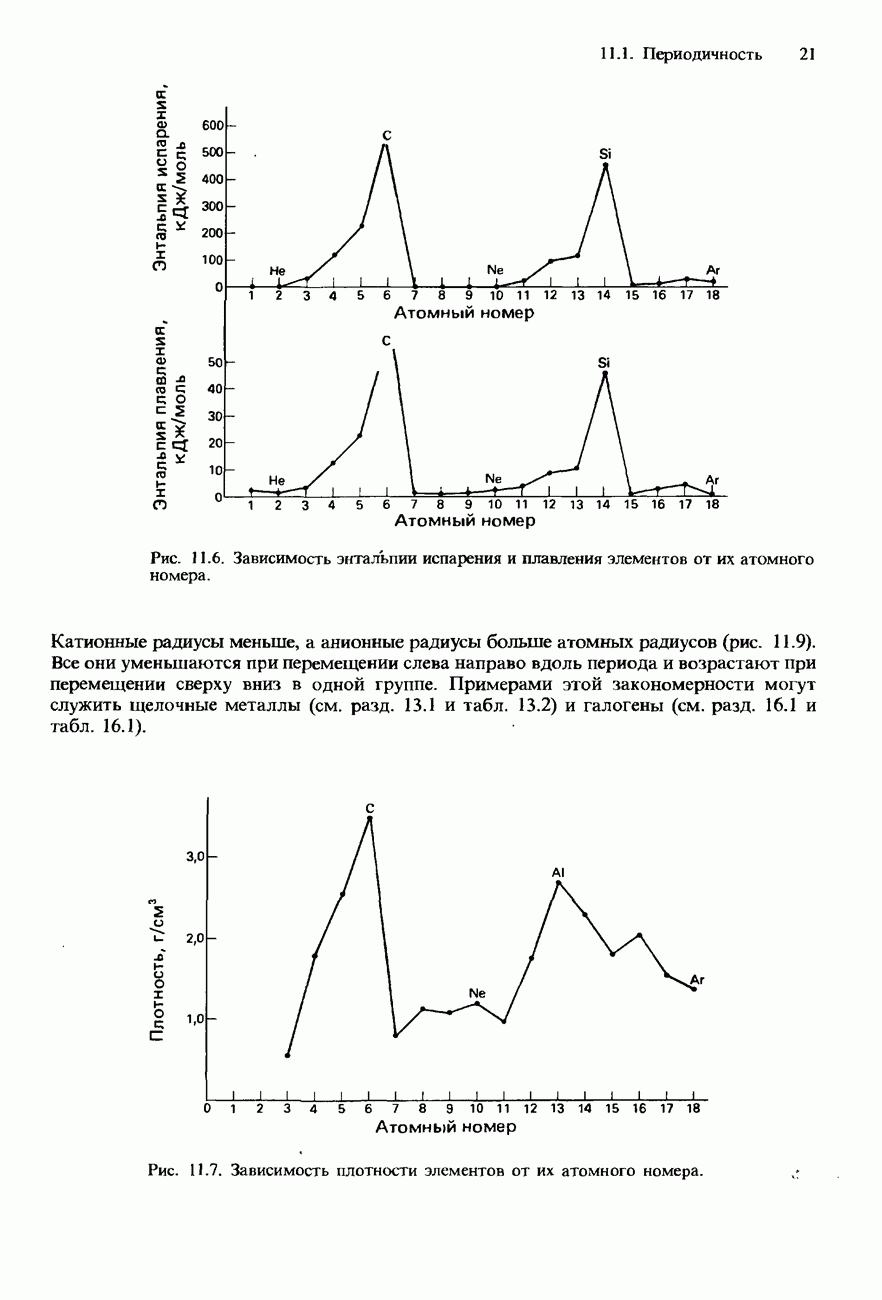
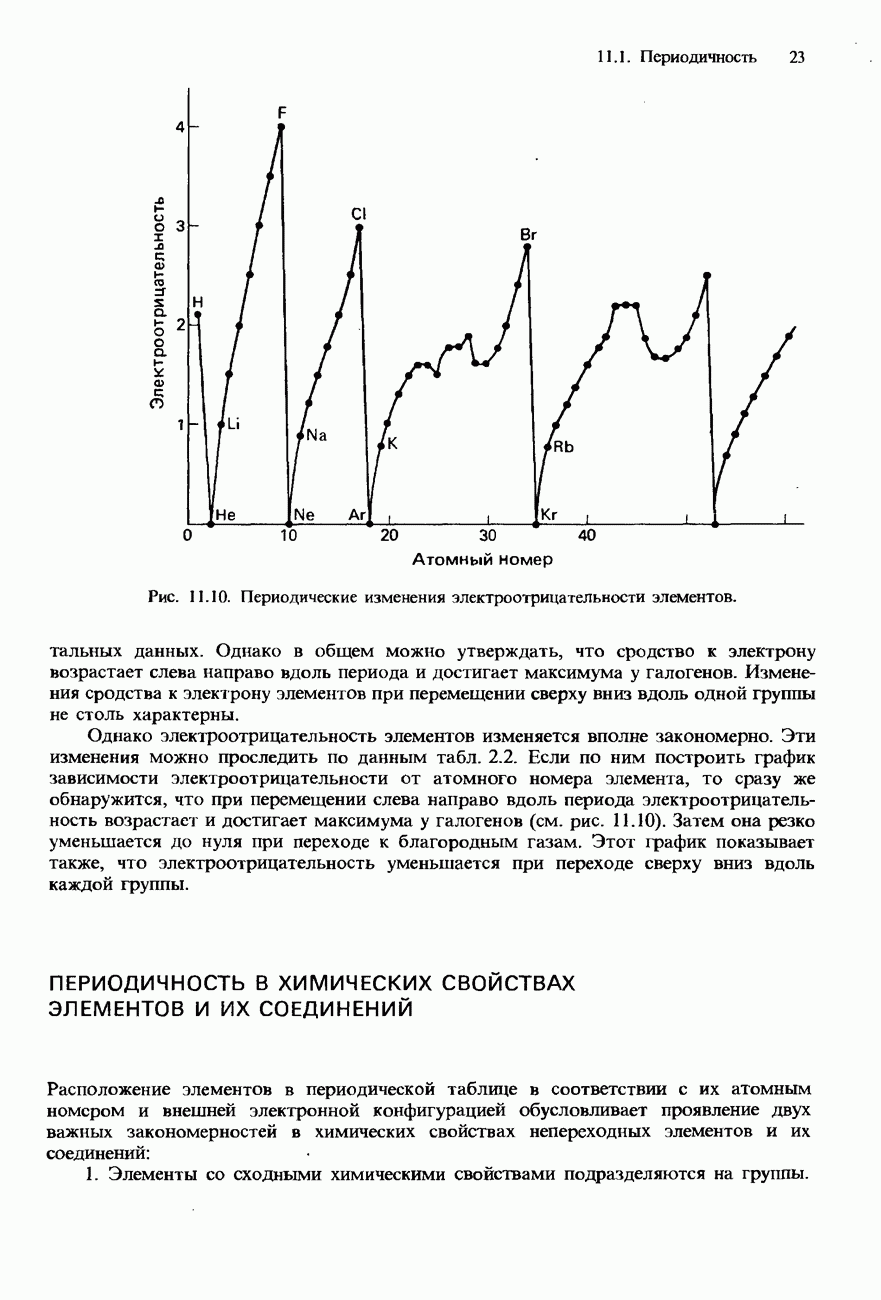
- ПЕРИОДИЧНОСТЬ
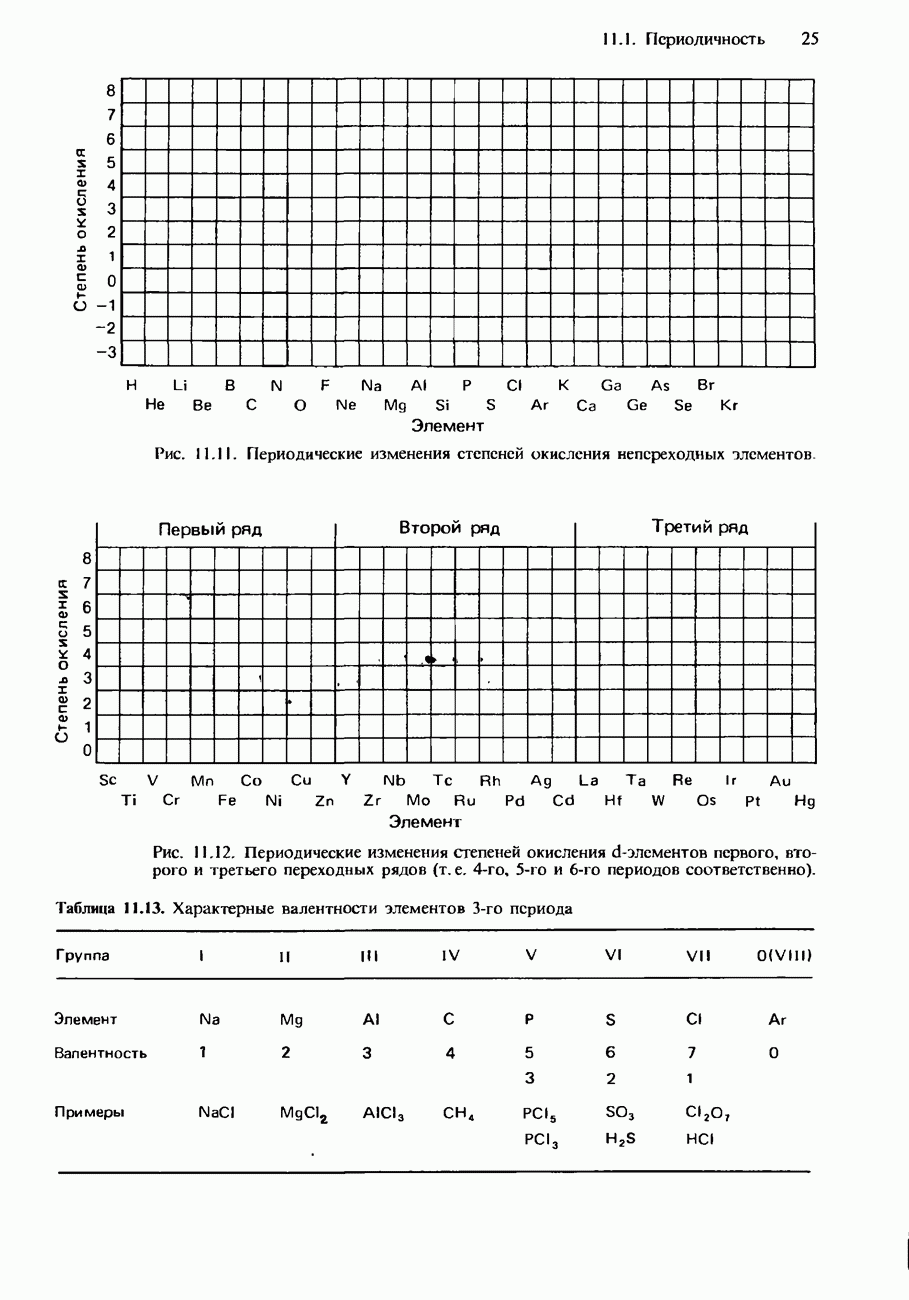
- ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 12. ВОДОРОД И ВОДА
- 12.1. ВОДОРОД
- ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ
- РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА
- ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА
- 12.2 Вода
- ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ
- ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ
- КАЧЕСТВО ВОДЫ
- ЗАГРЯЗНЕНИЕ ВОДЫ
- ОЧИСТКА И ПОДГОТОВКА ВОДЫ
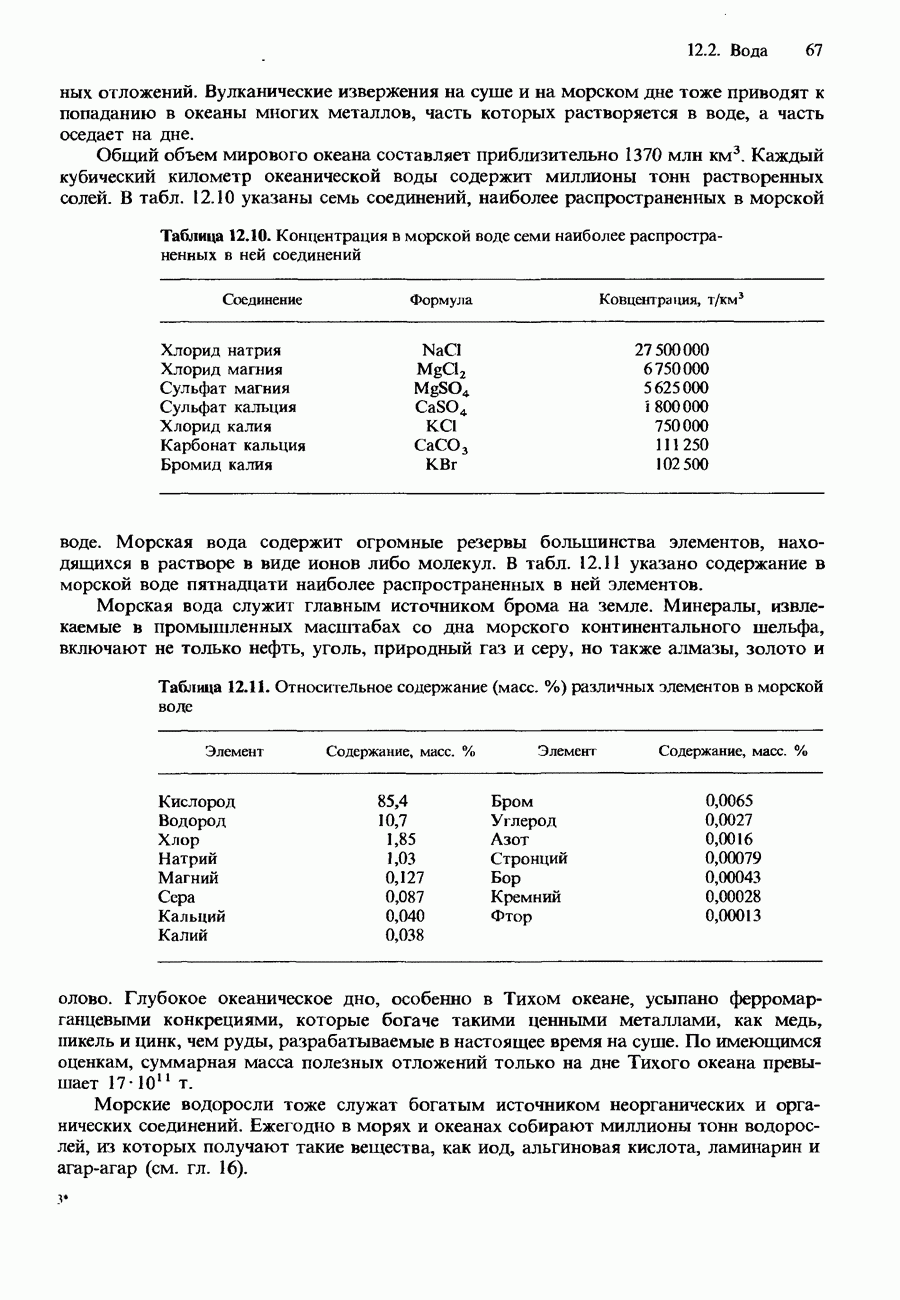
- ОКЕАНЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 13. s-Металлы
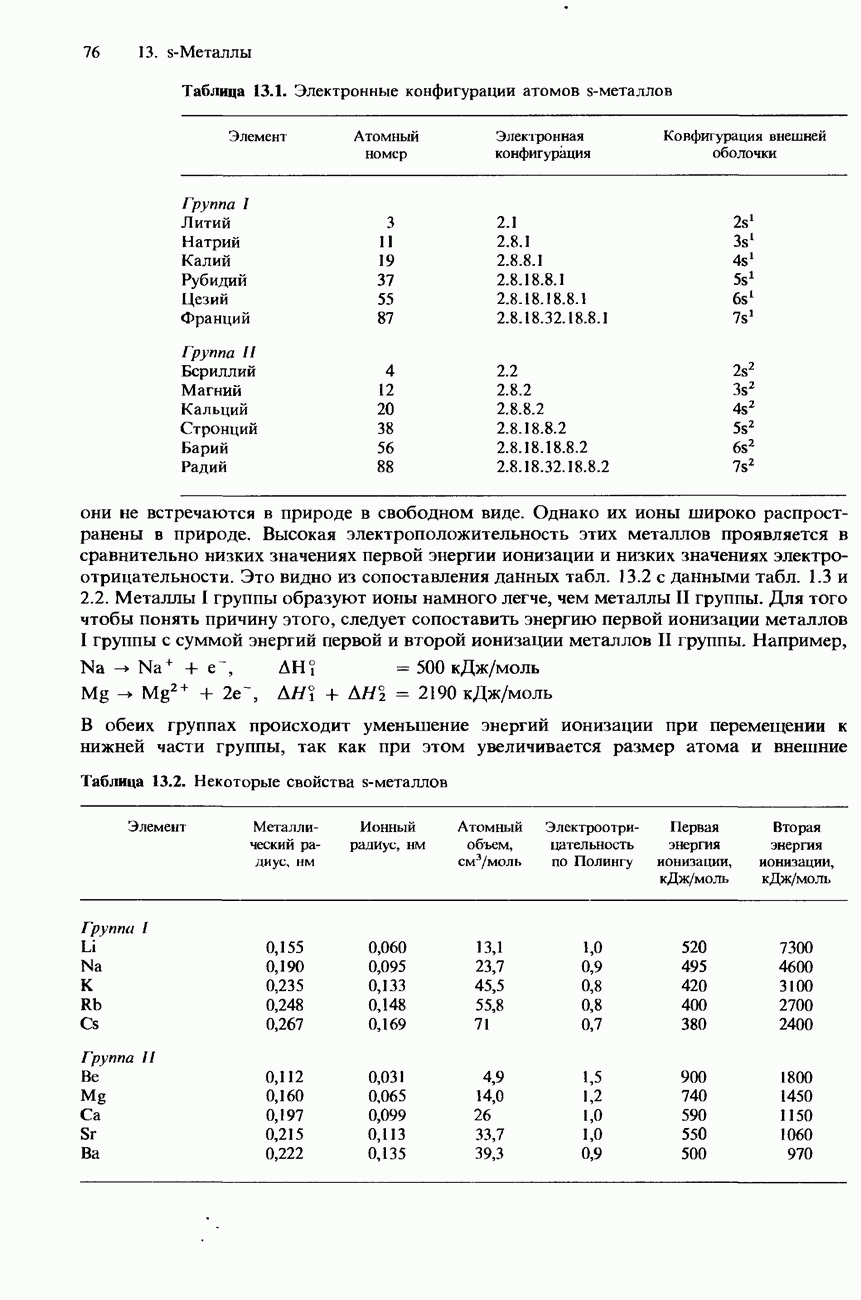
- 13.1 Структура и свойства s-металлов
- СТРУКТУРА
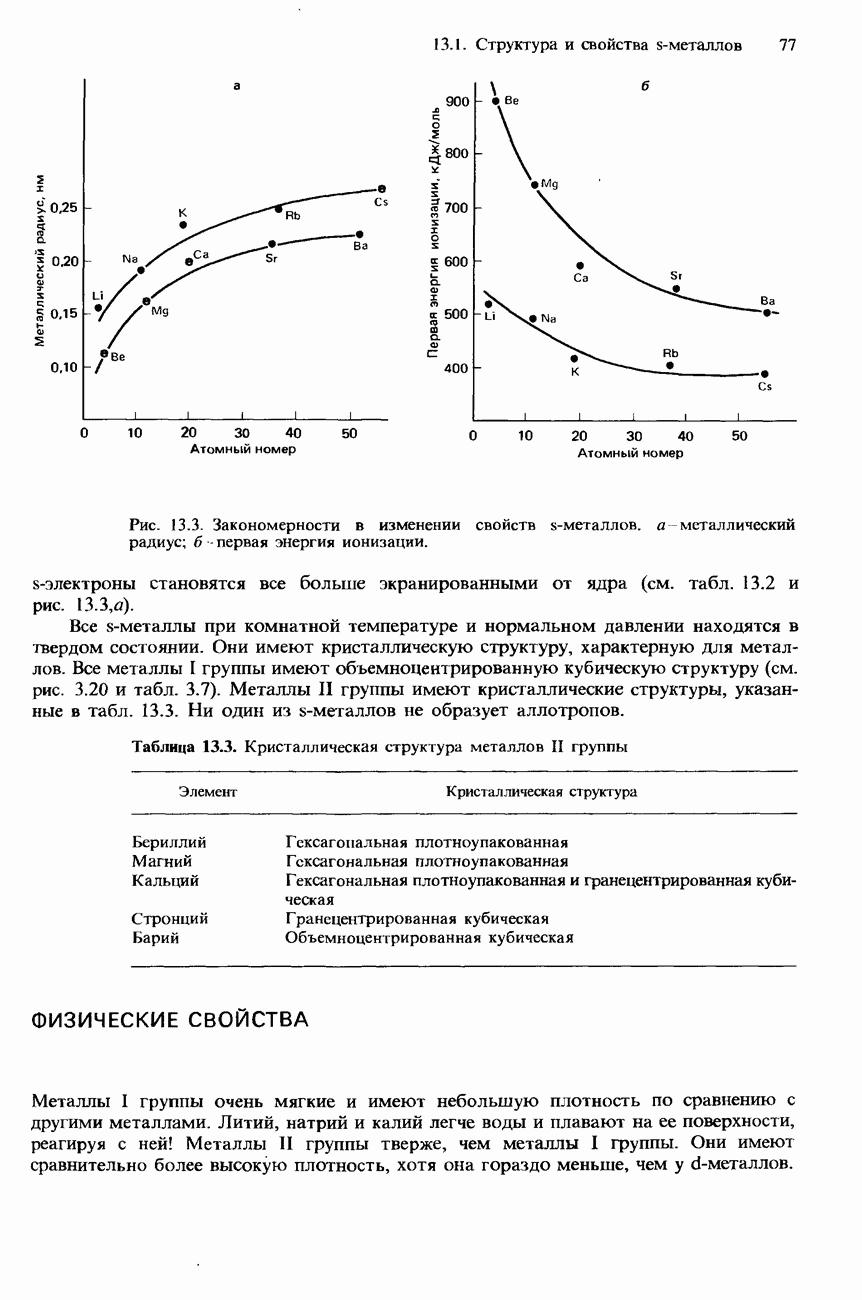
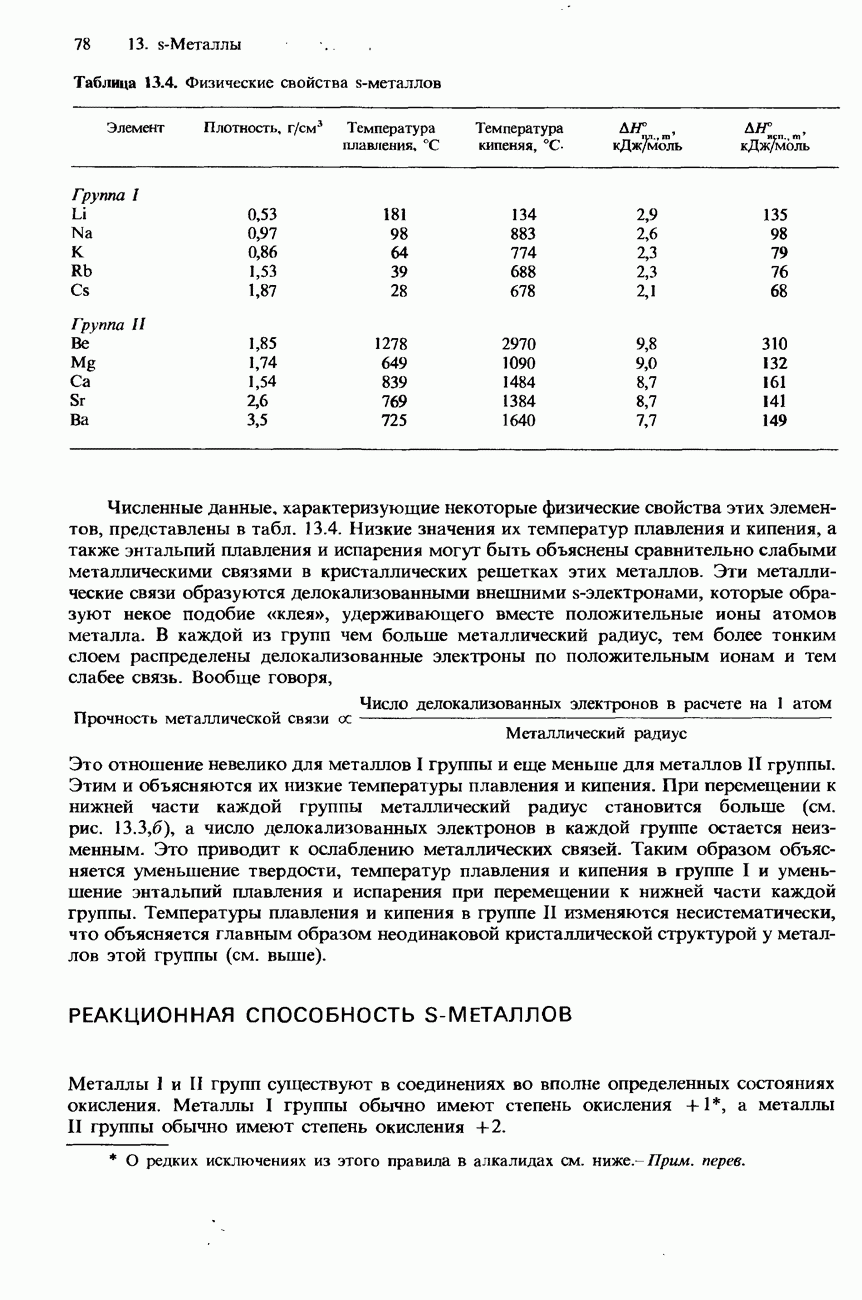
- ФИЗИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ
- 13.2 Соединения, образуемые s-металлами
- ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ
- ГИДРОКСИДЫ
- КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ
- РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ
- АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ
- 13.3. Распространенность в природе, получение и применение
- ПОЛУЧЕНИЕ S-МЕТАЛЛОВ
- ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ
- ПРИМЕНЕНИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 14. d-ЭЛЕМЕНТЫ
- 14.1. Структура и свойства d-элементов
- d-ЭЛЕМЕНТЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА
- ХИМИЧЕСКИЕ СВОЙСТВА
- 14.2 Химия семи d-элементов
- МАРГАНЕЦ
- ЖЕЛЕЗО
- КОБАЛЬТ
- НИКЕЛЬ
- МЕДЬ
- ЦИНК
- 14.3. Распространенность в природе, получение и применения
- ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ
- ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА
- ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 15. ЭЛЕМЕНТЫ III-VI ГРУПП
- 15.1. Алюминий и другие элементы III группы
- БОР
- ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ
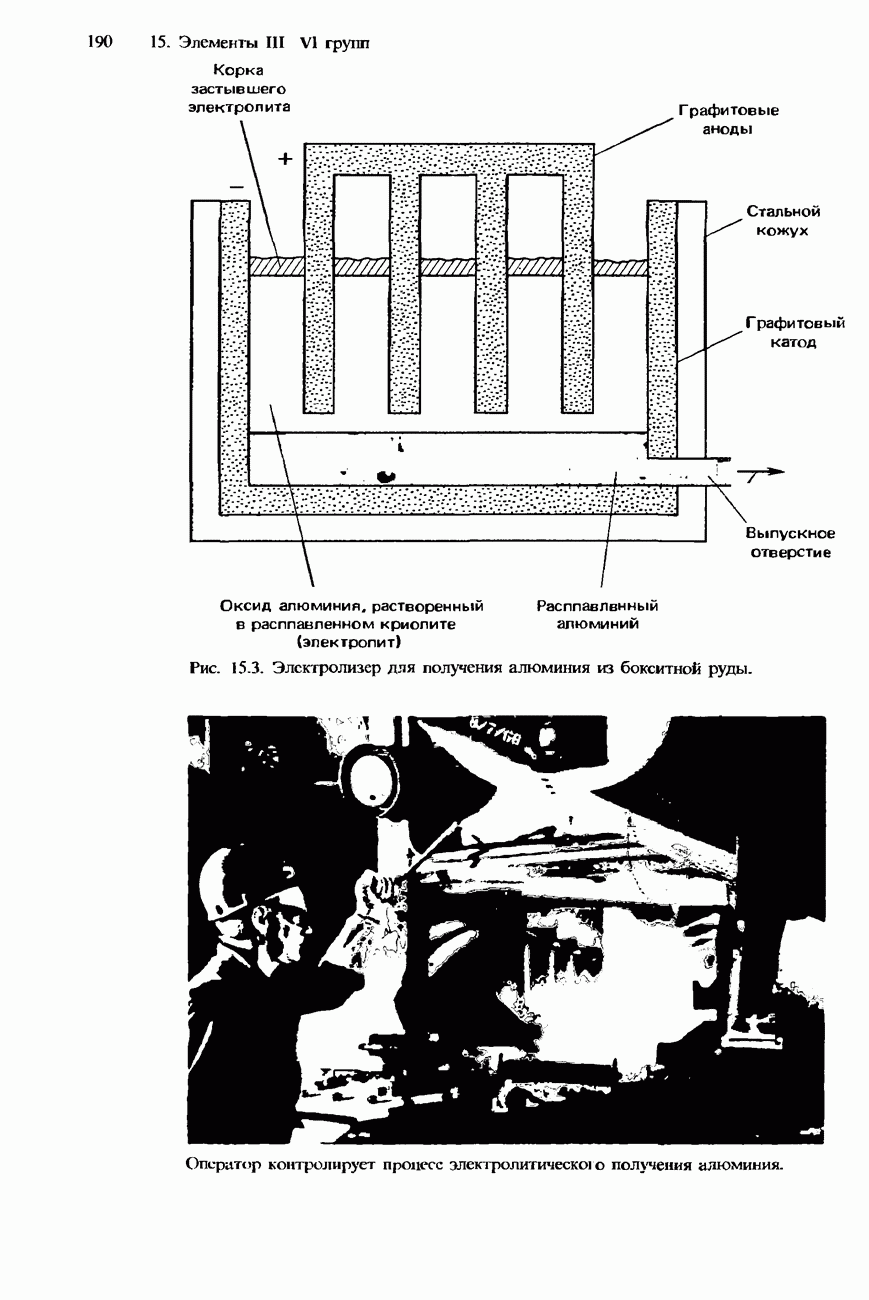
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ
- ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ
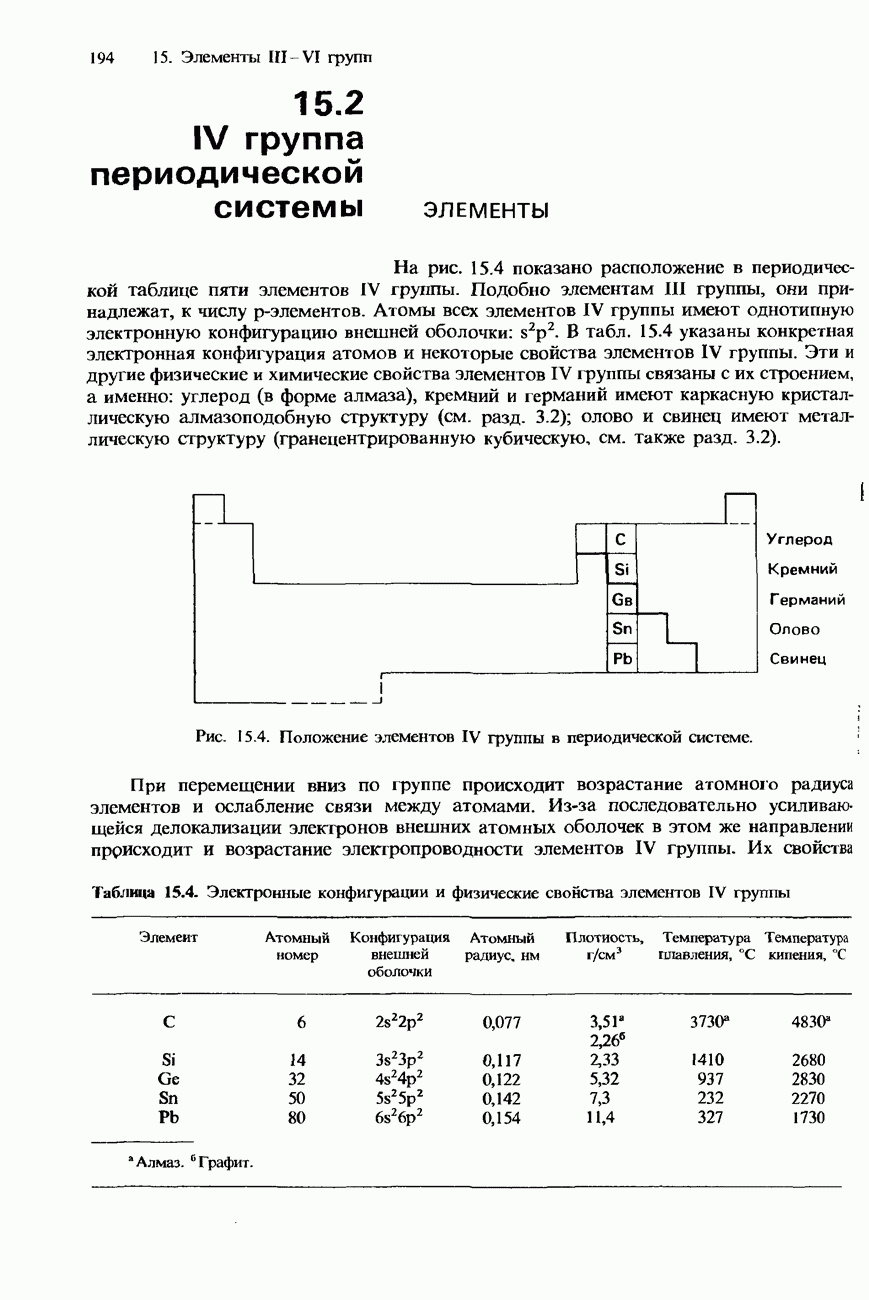
- 15.2. IV группа периодической системы
- СОЕДИНЕНИЯ
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД
- ПРИМЕНЕНИЯ УГЛЕРОДА
- ПРИМЕНЕНИЯ КРЕМНИЯ
- ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА
- 15.3. Элементы V группы
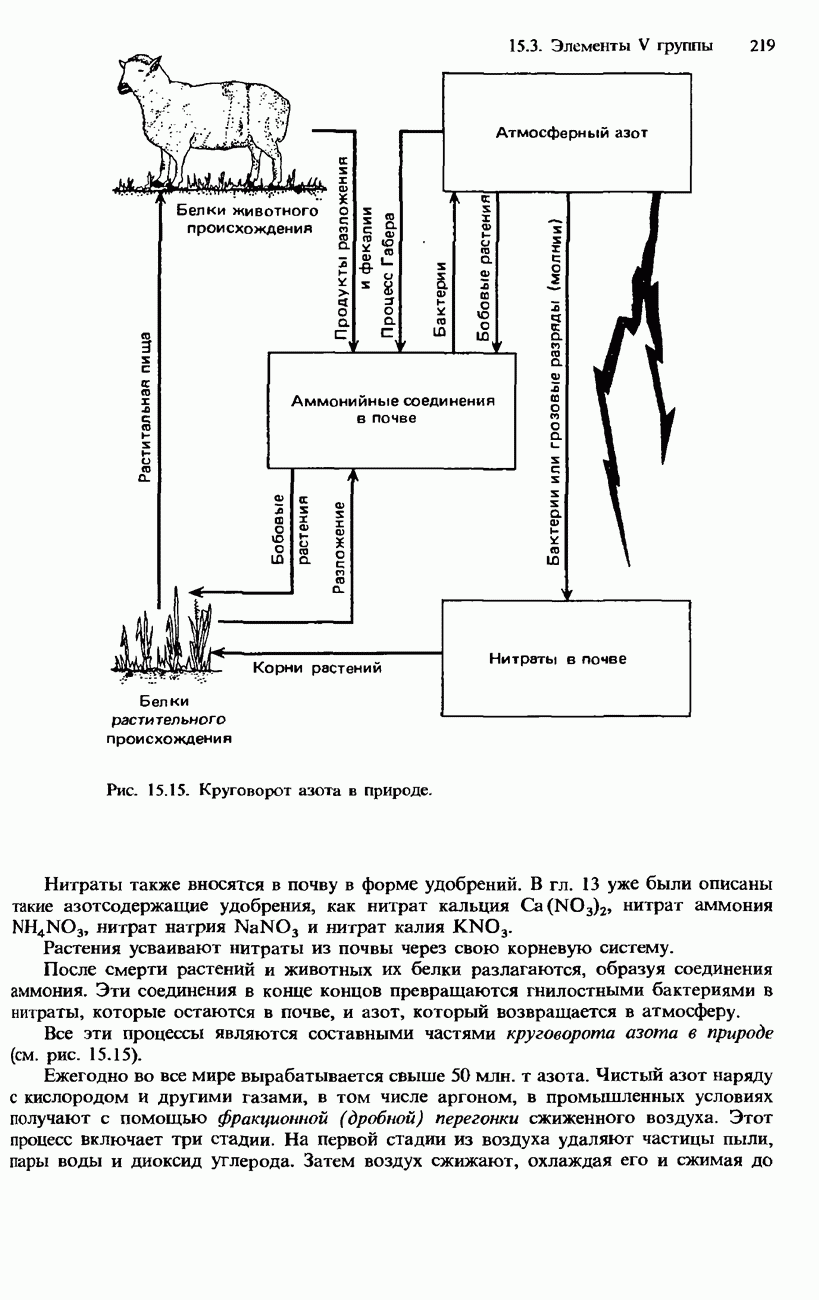
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА
- СОЕДИНЕНИЯ АЗОТА
- СОЕДИНЕНИЯ ФОСФОРА
- 15.4. Элементы VI группы. Кислород и сера
- КИСЛОРОД
- СОЕДИНЕНИЯ КИСЛОРОДА
- СЕРА
- СОЕДИНЕНИЯ СЕРЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ
- 16.1. Галогены
- ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ
- ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ
- ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ
- 16.2. Соединения галогенов
- ГАЛОГЕНОВОДОРОДЫ
- КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ
- 16.3. Распространенность, получение и применение галогенов и их соединений
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА
- ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ
- ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ
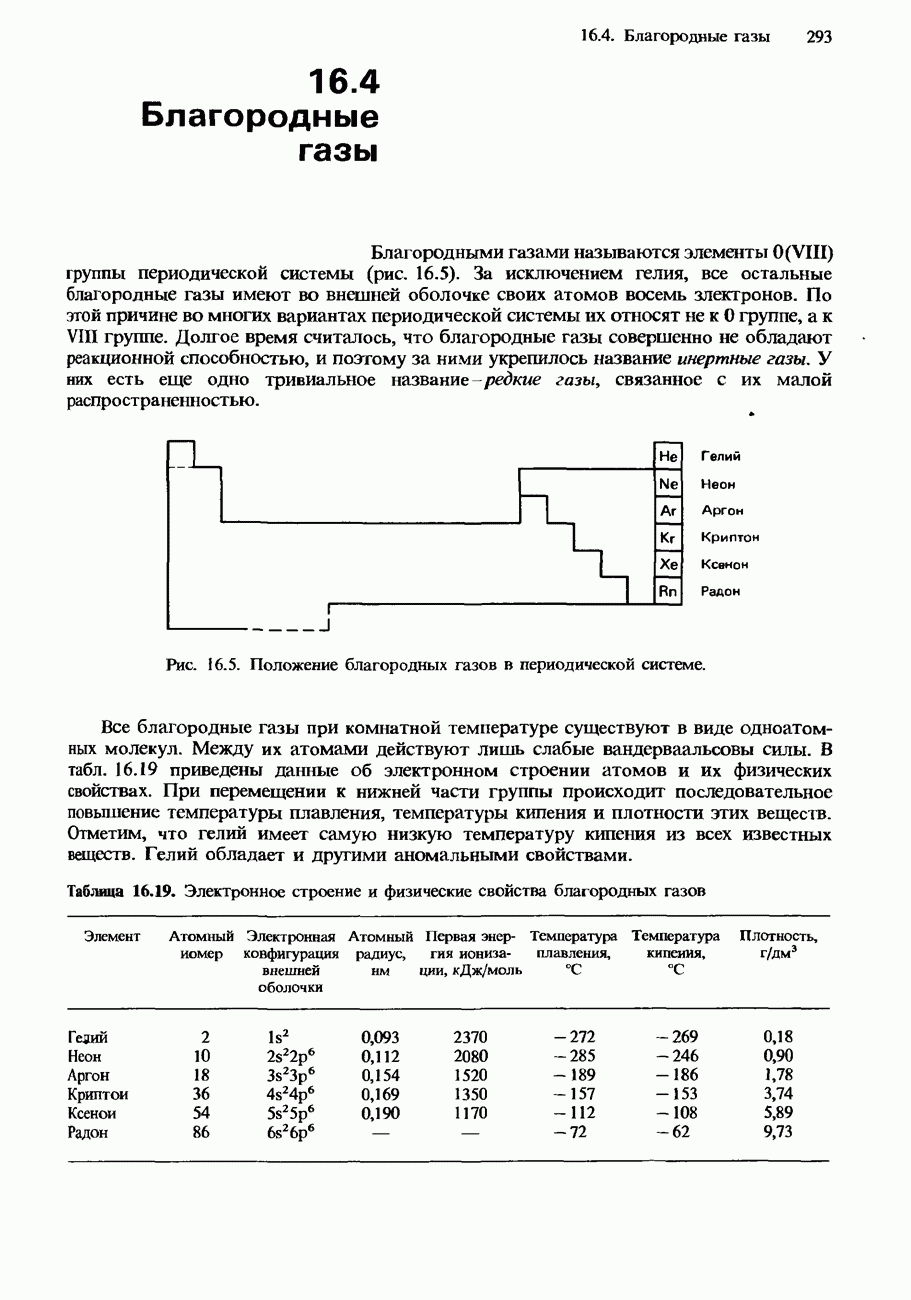
- 16.4. Благородные газы
- СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
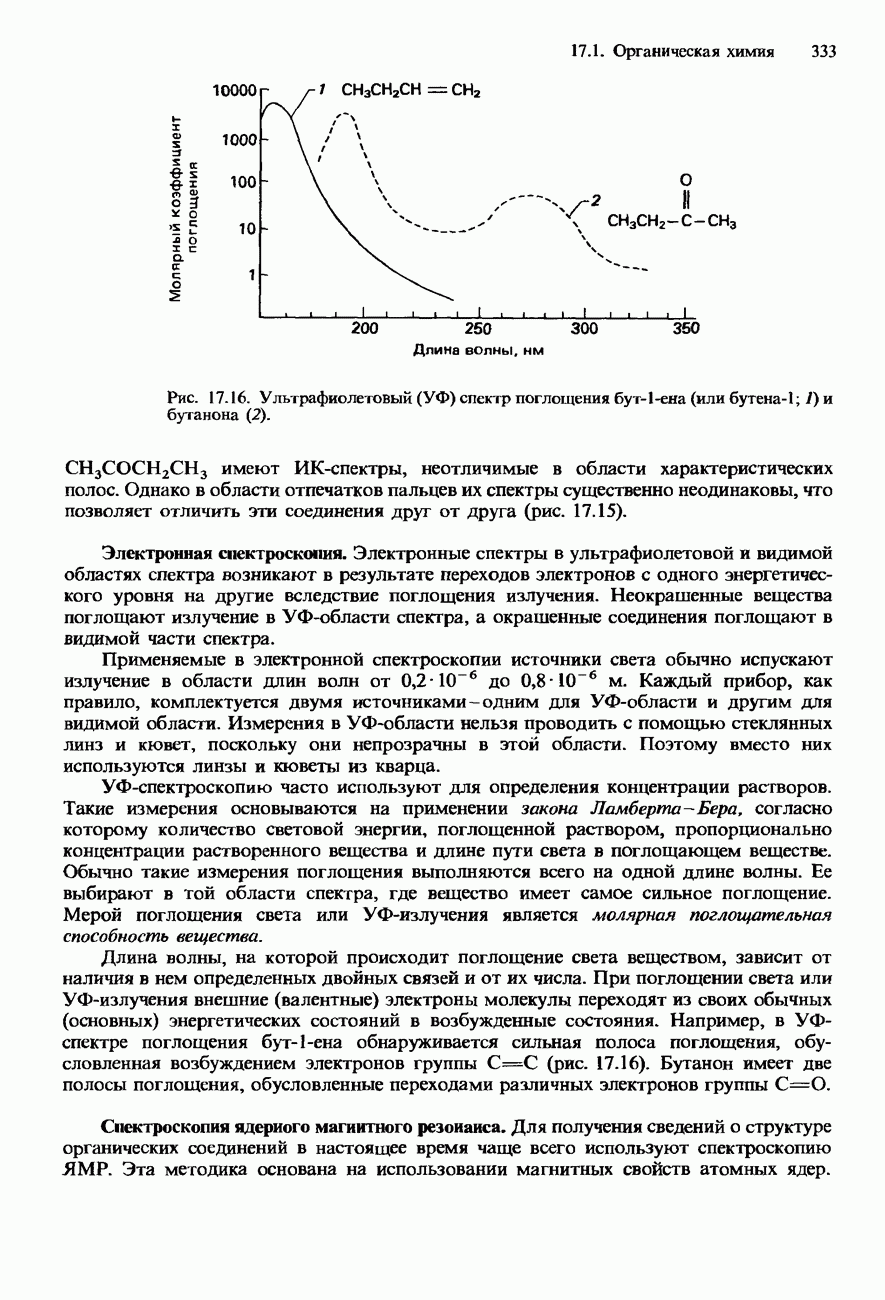
- 7.1. Органическая химия
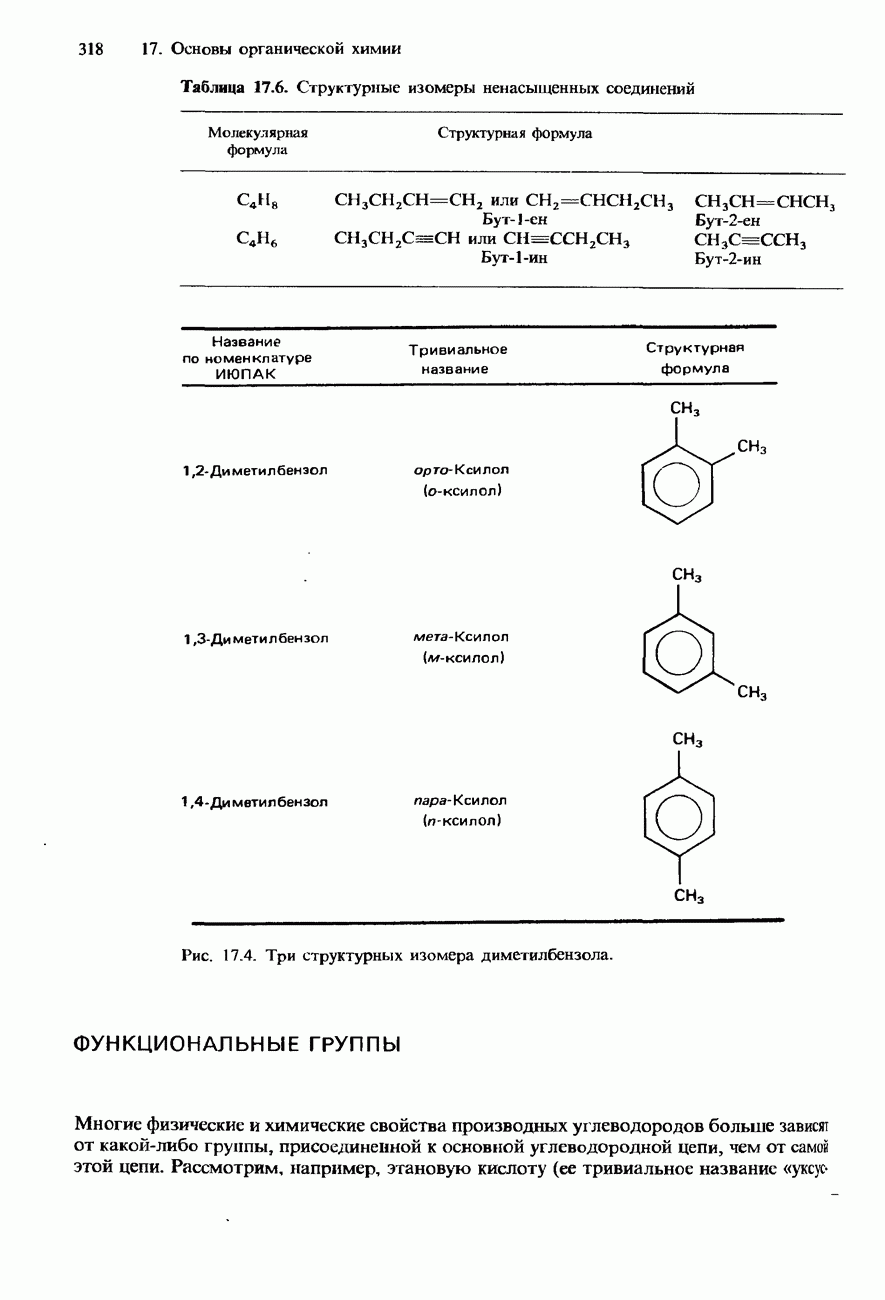
- НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- УГЛЕВОДОРОДЫ
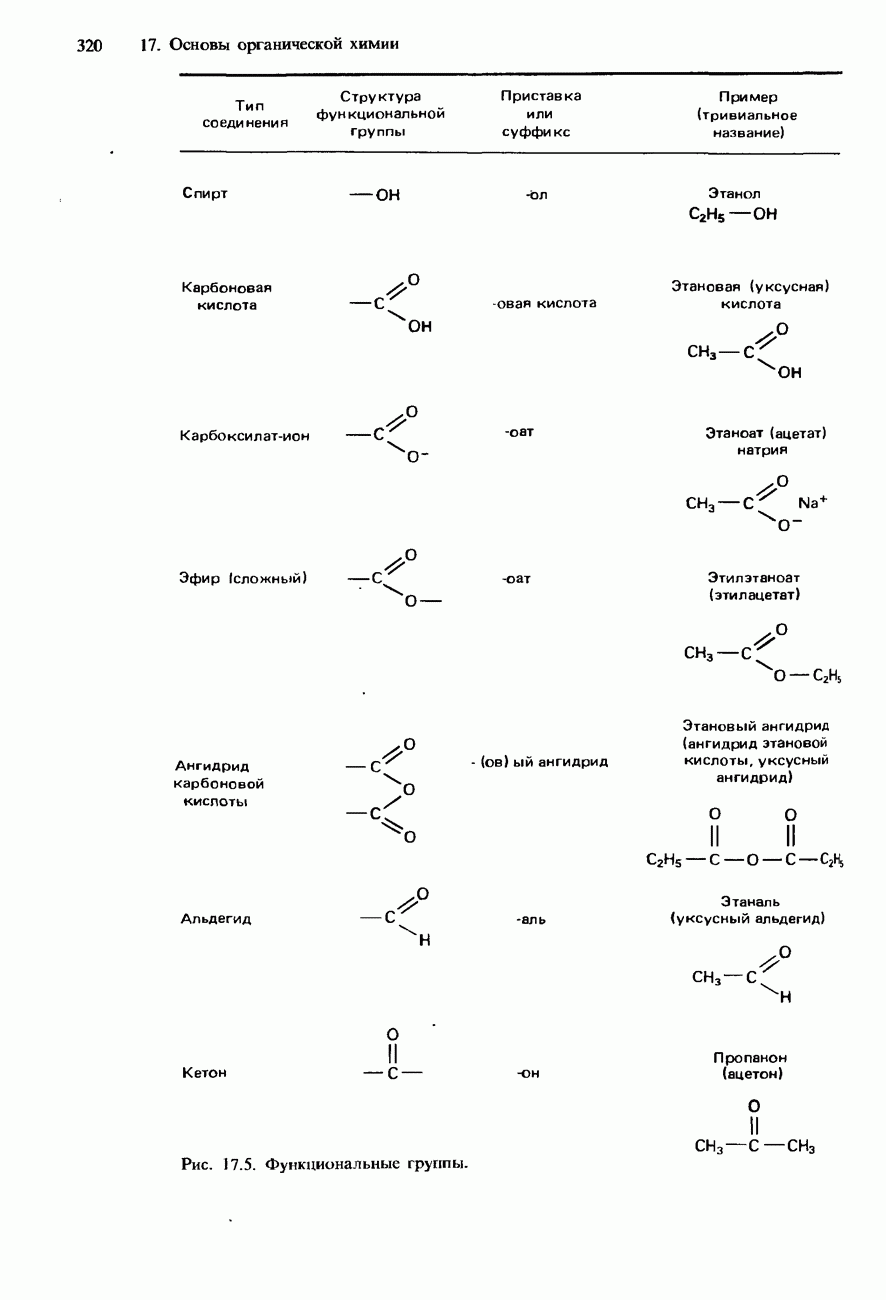
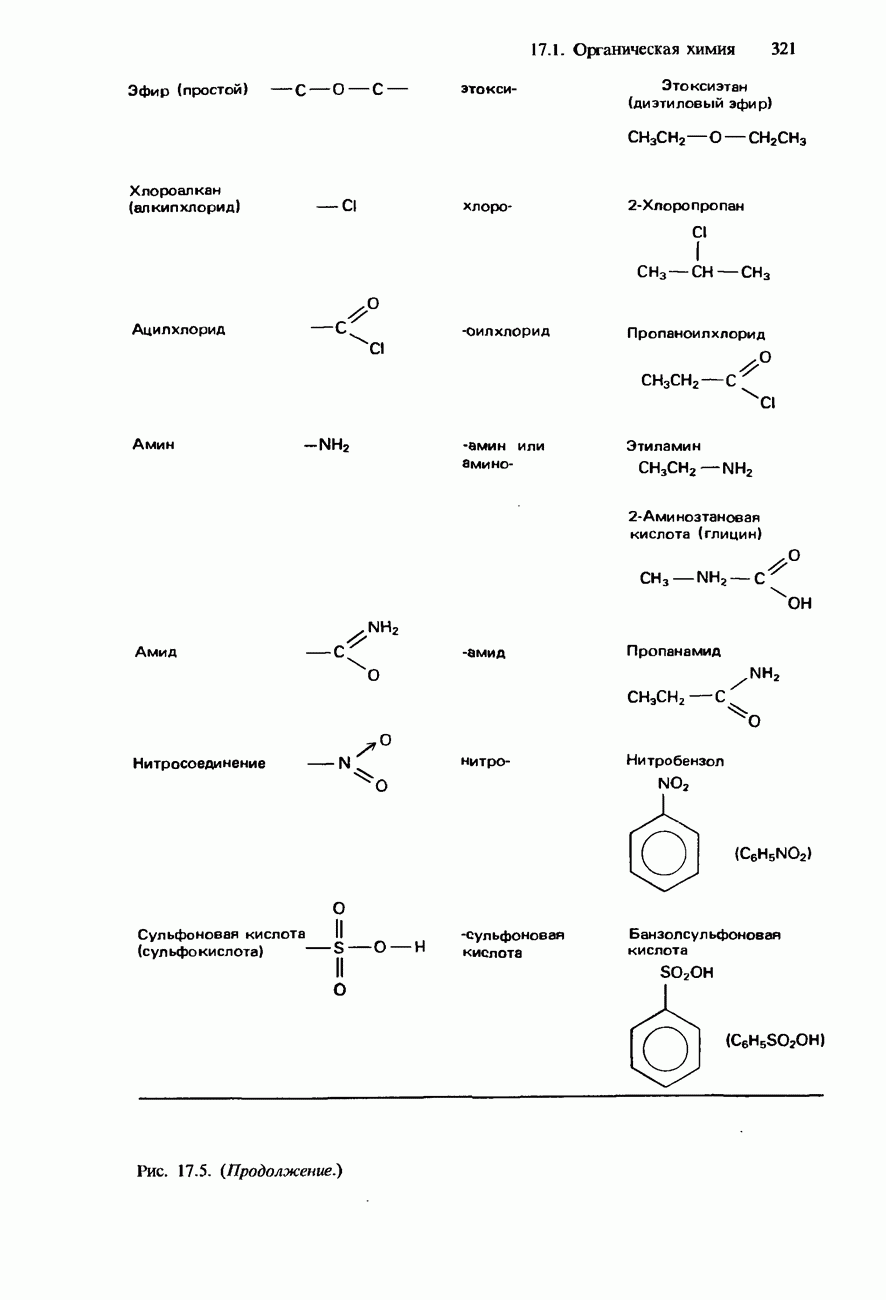
- ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
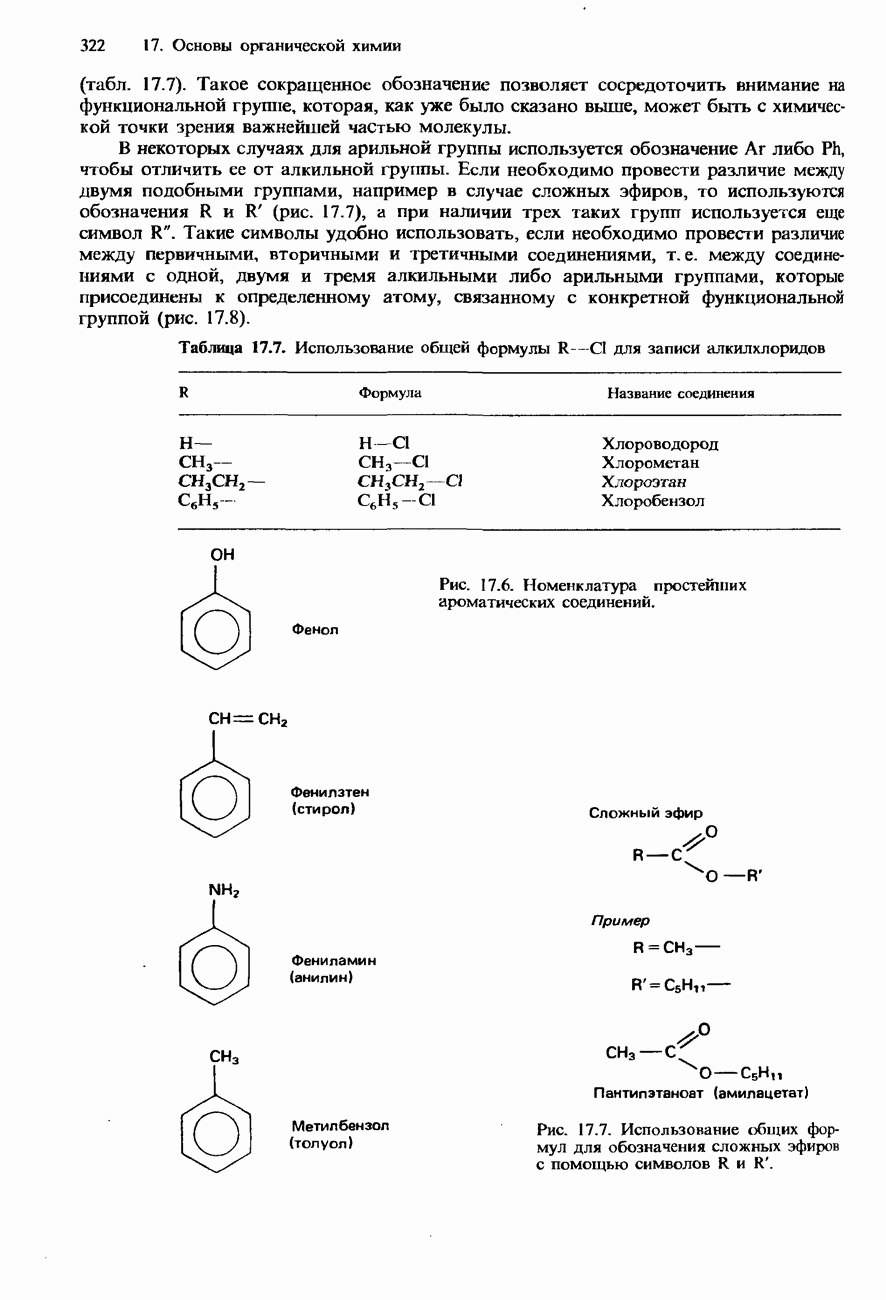
- ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
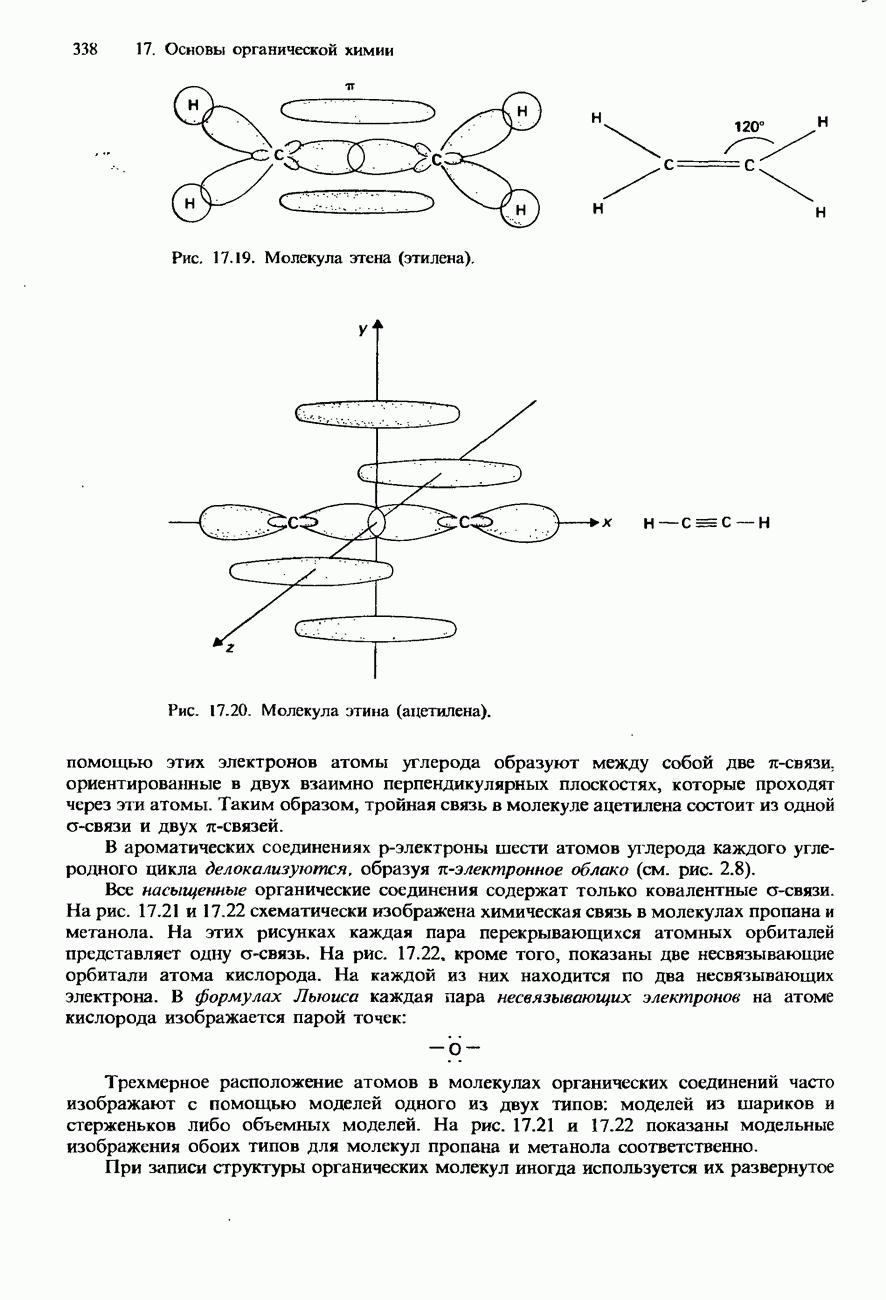
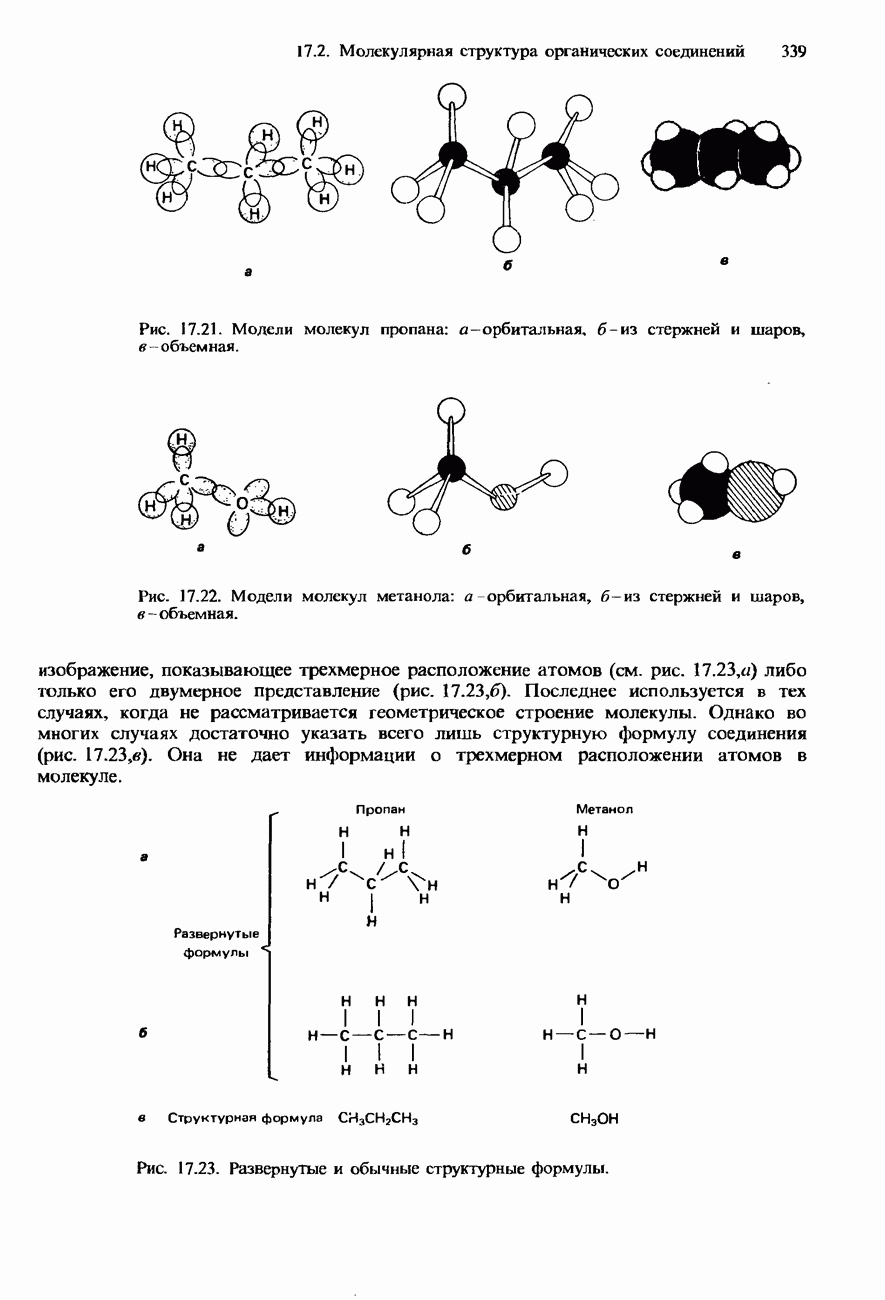
- 17.2. Молекулярная структура органических соединений
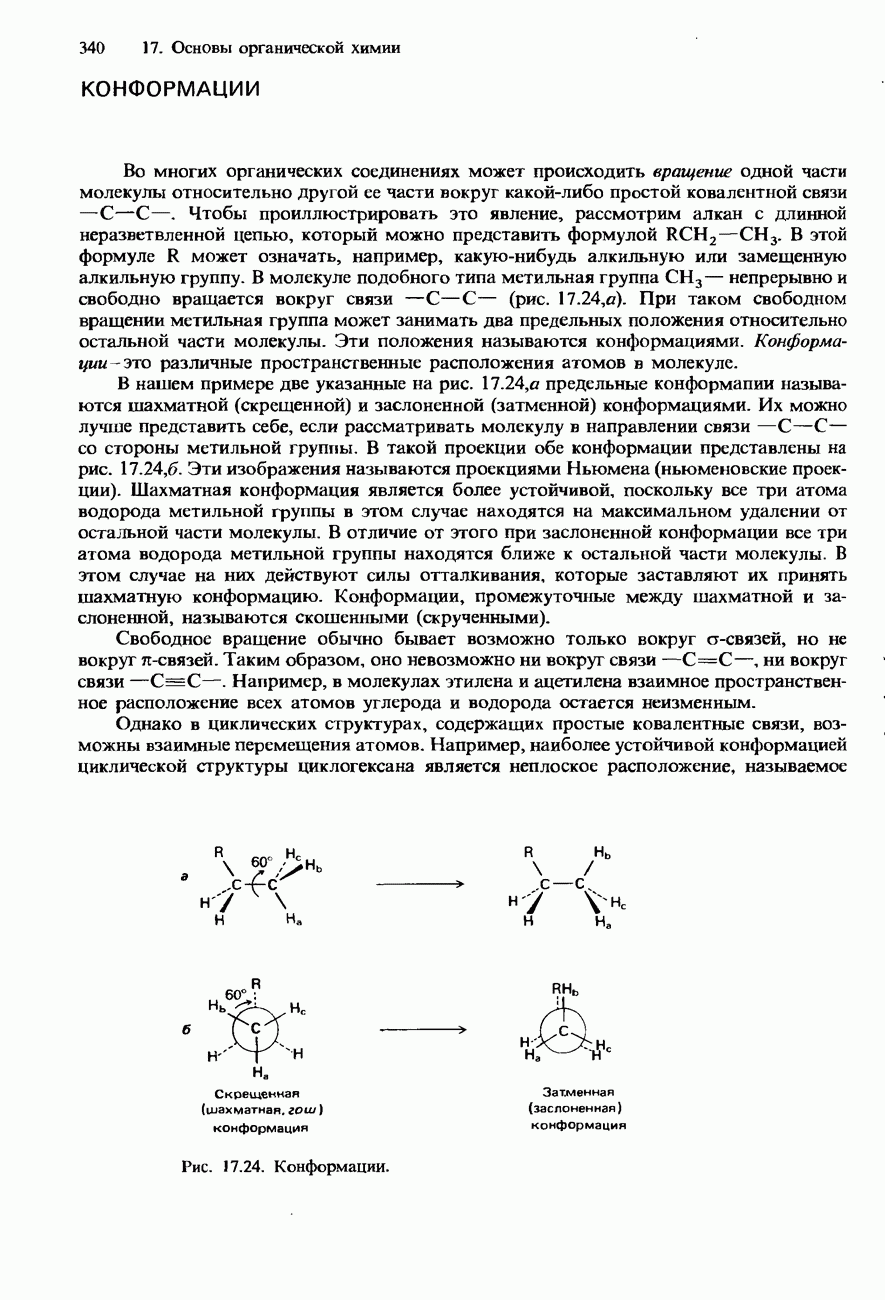
- КОНФОРМАЦИИ
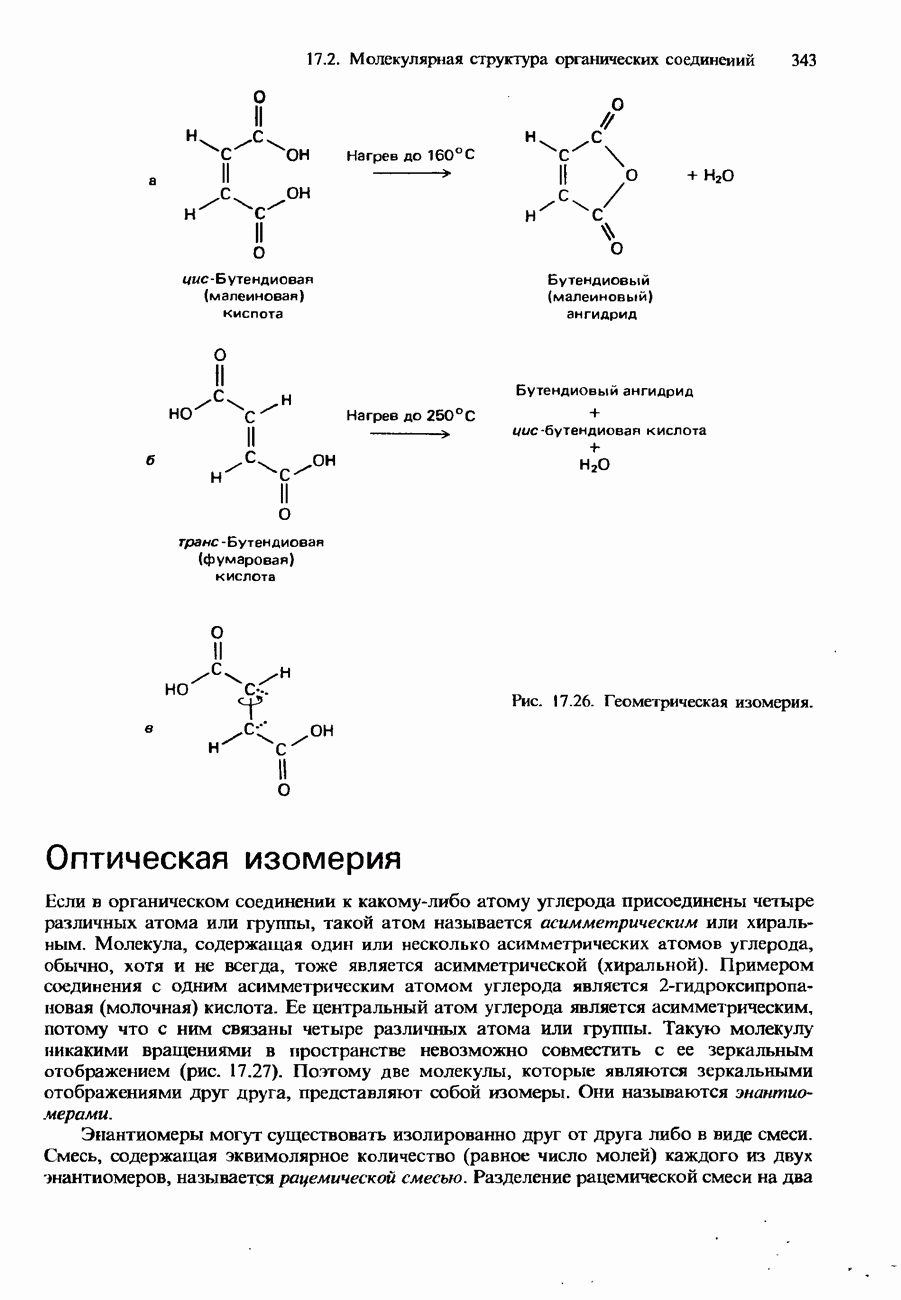
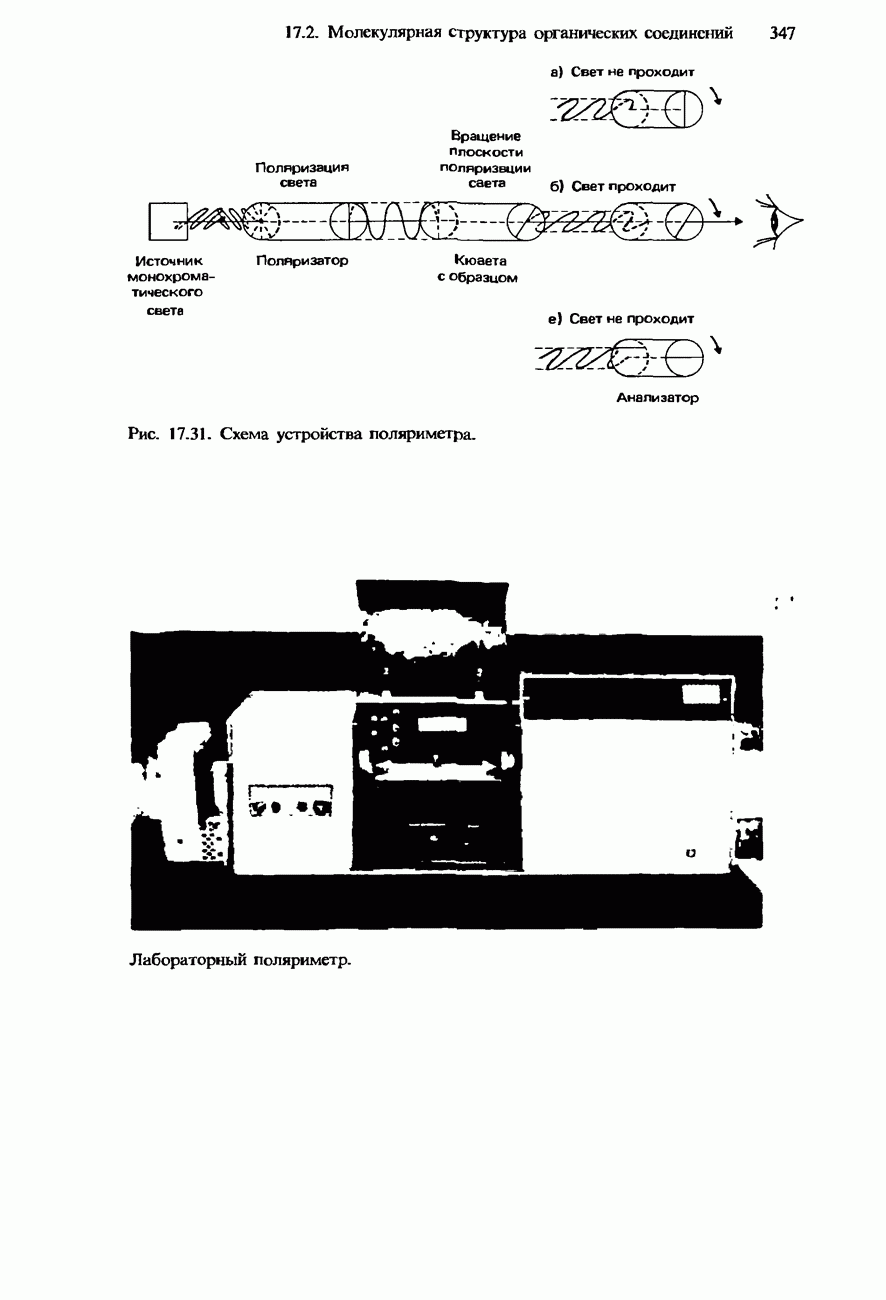
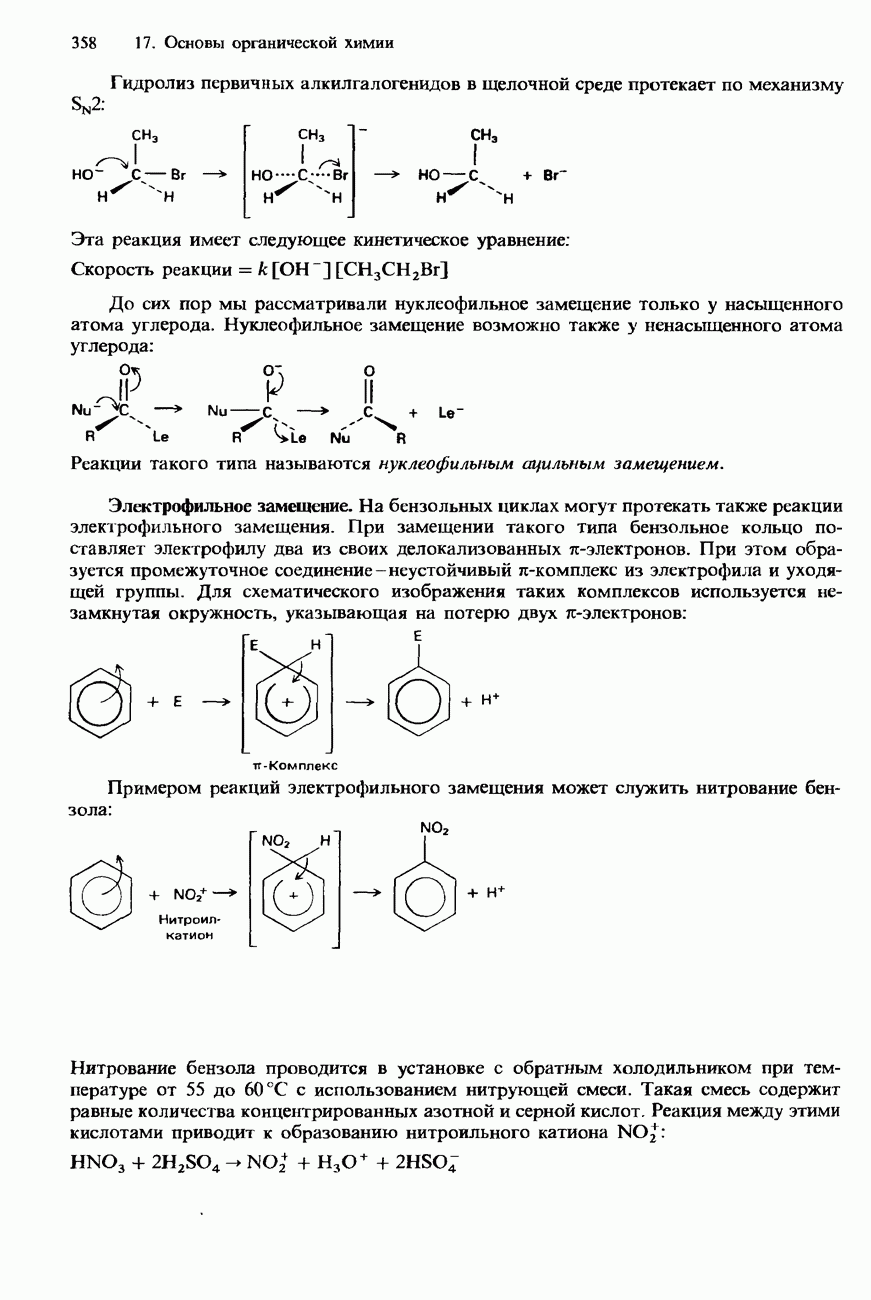
- СТЕРЕОИЗОМЕРИЯ
- 17.3. Механизмы органических реакций
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ
- ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 18. УГЛЕВОДОРОДЫ
- 18.1. Алифатические углеводороды
- АЛКАНЫ
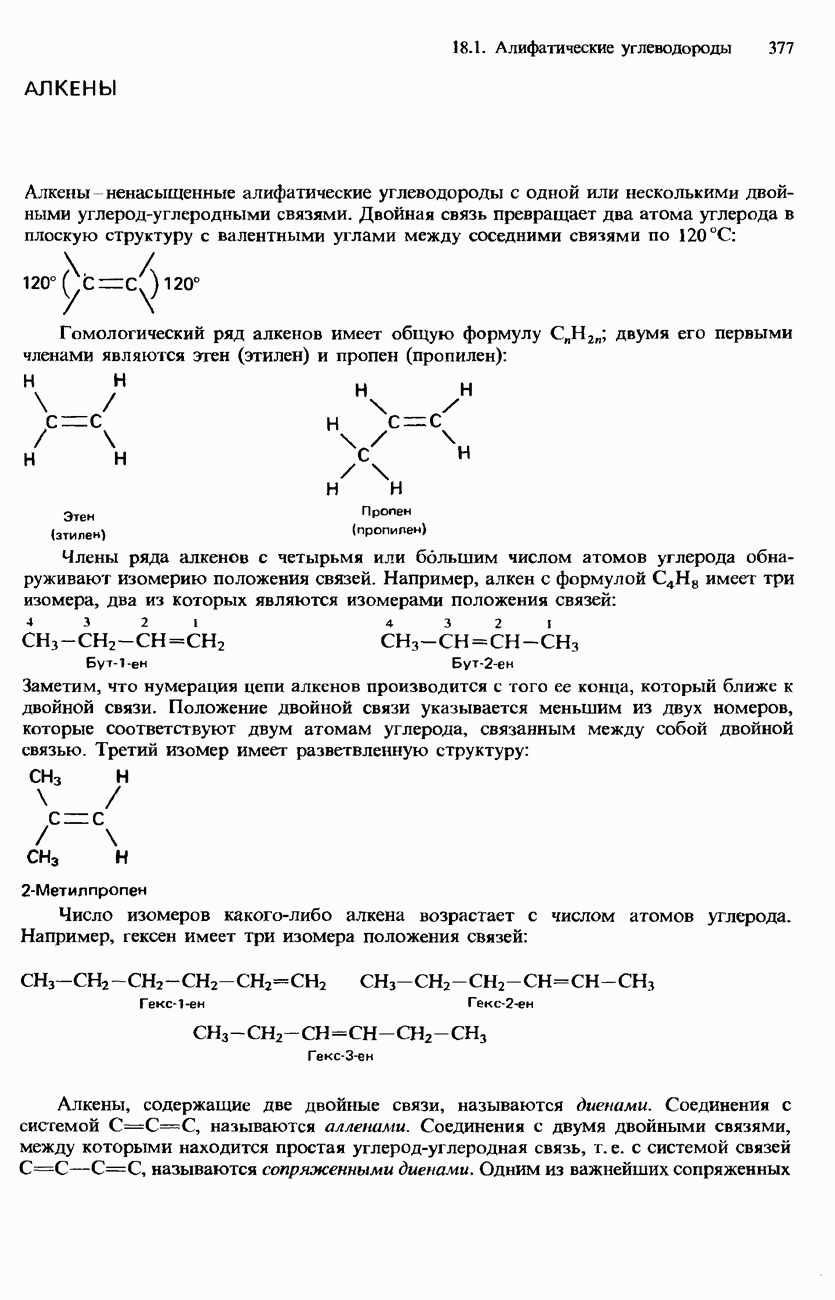
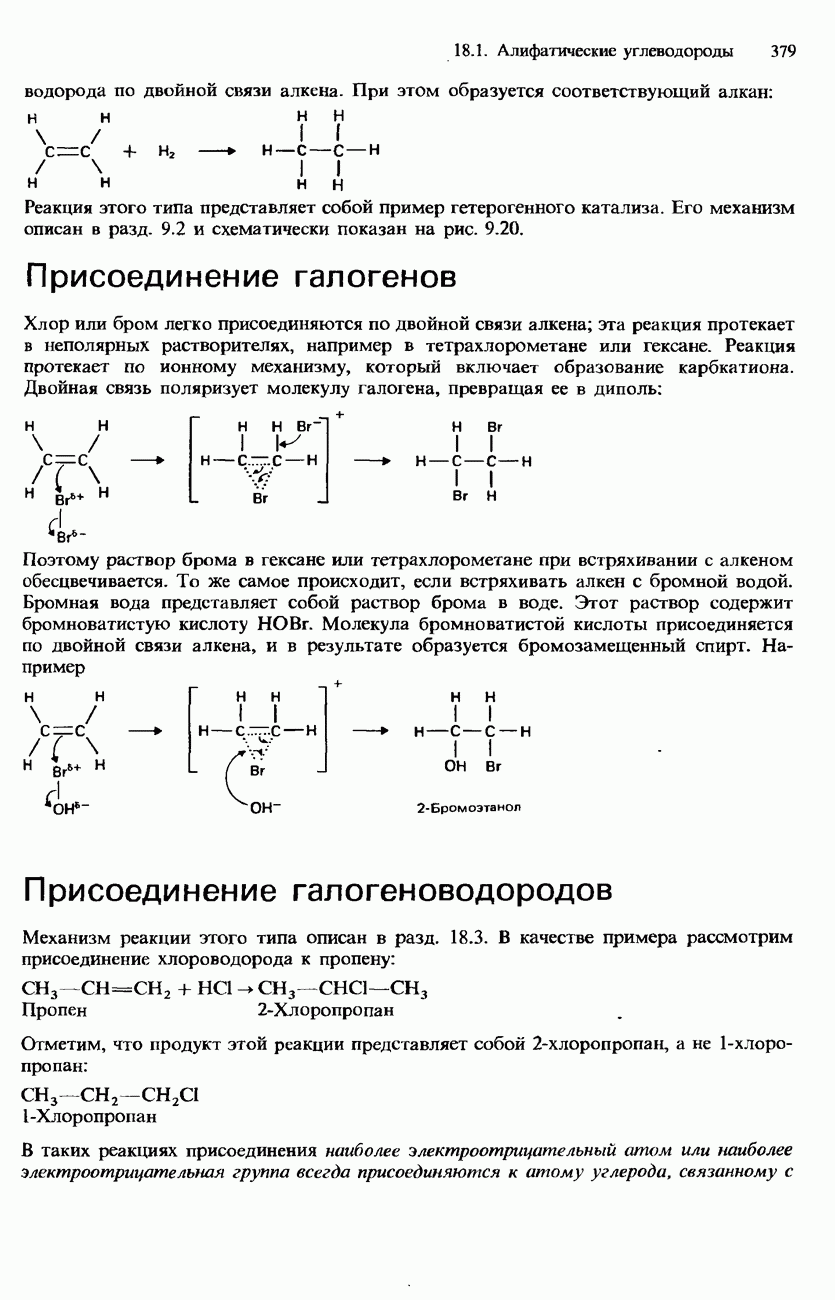
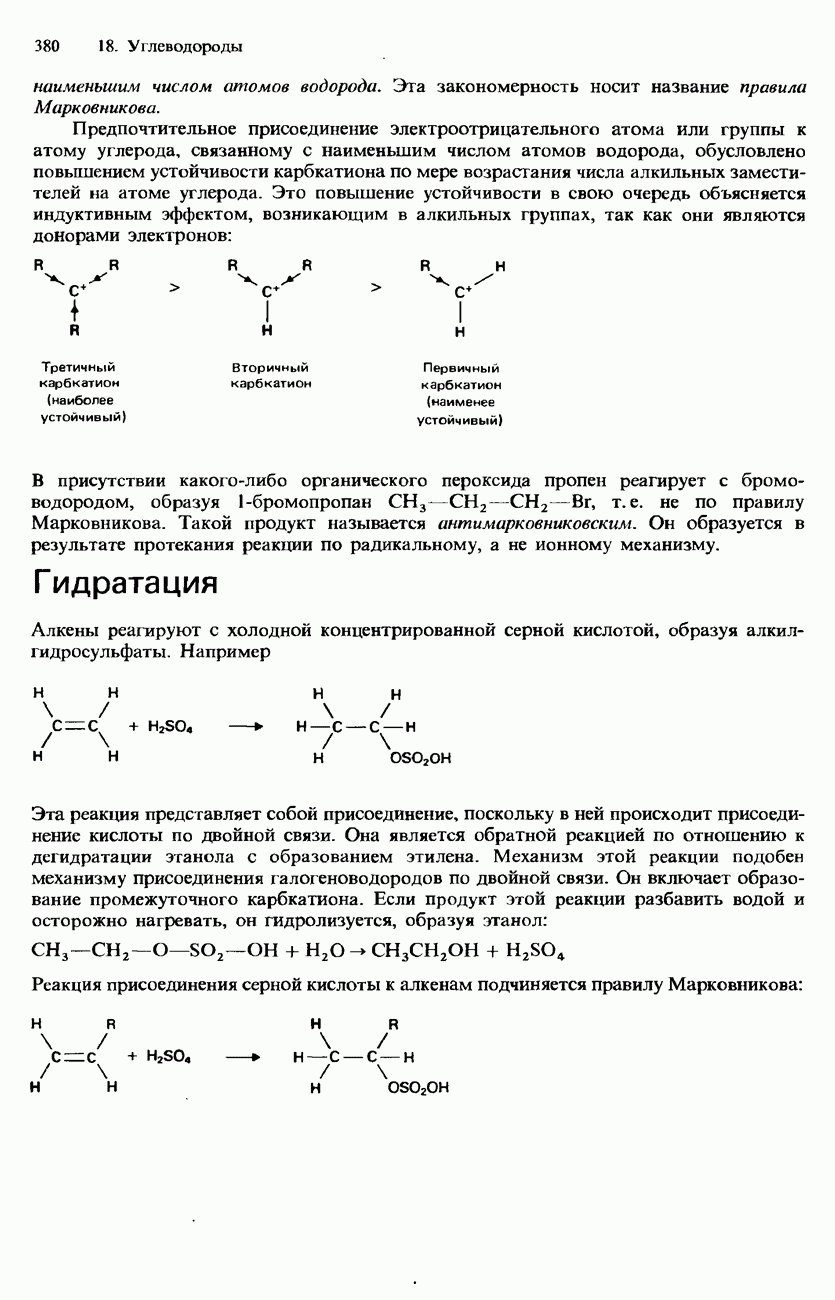
- АЛКЕНЫ
- АЛКИНЫ
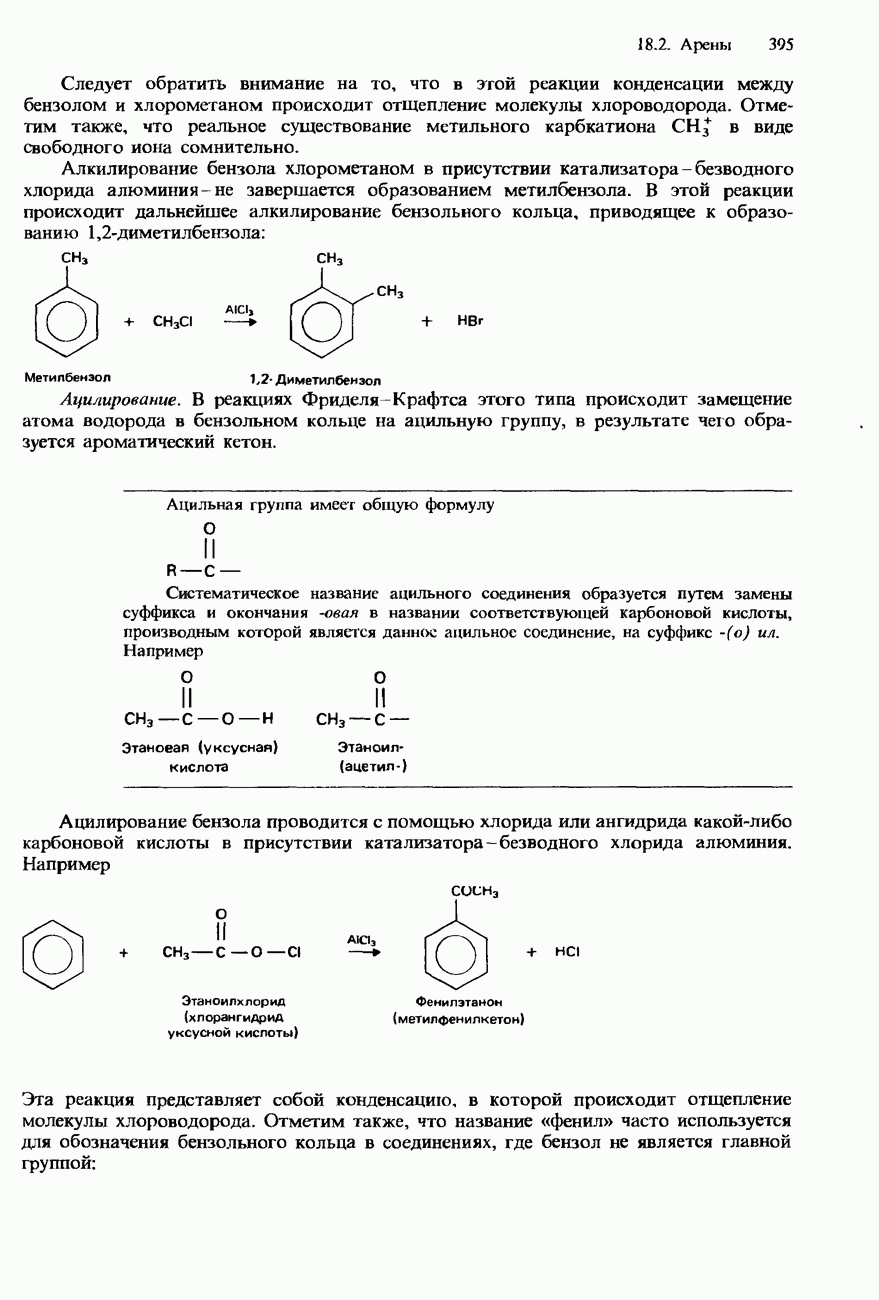
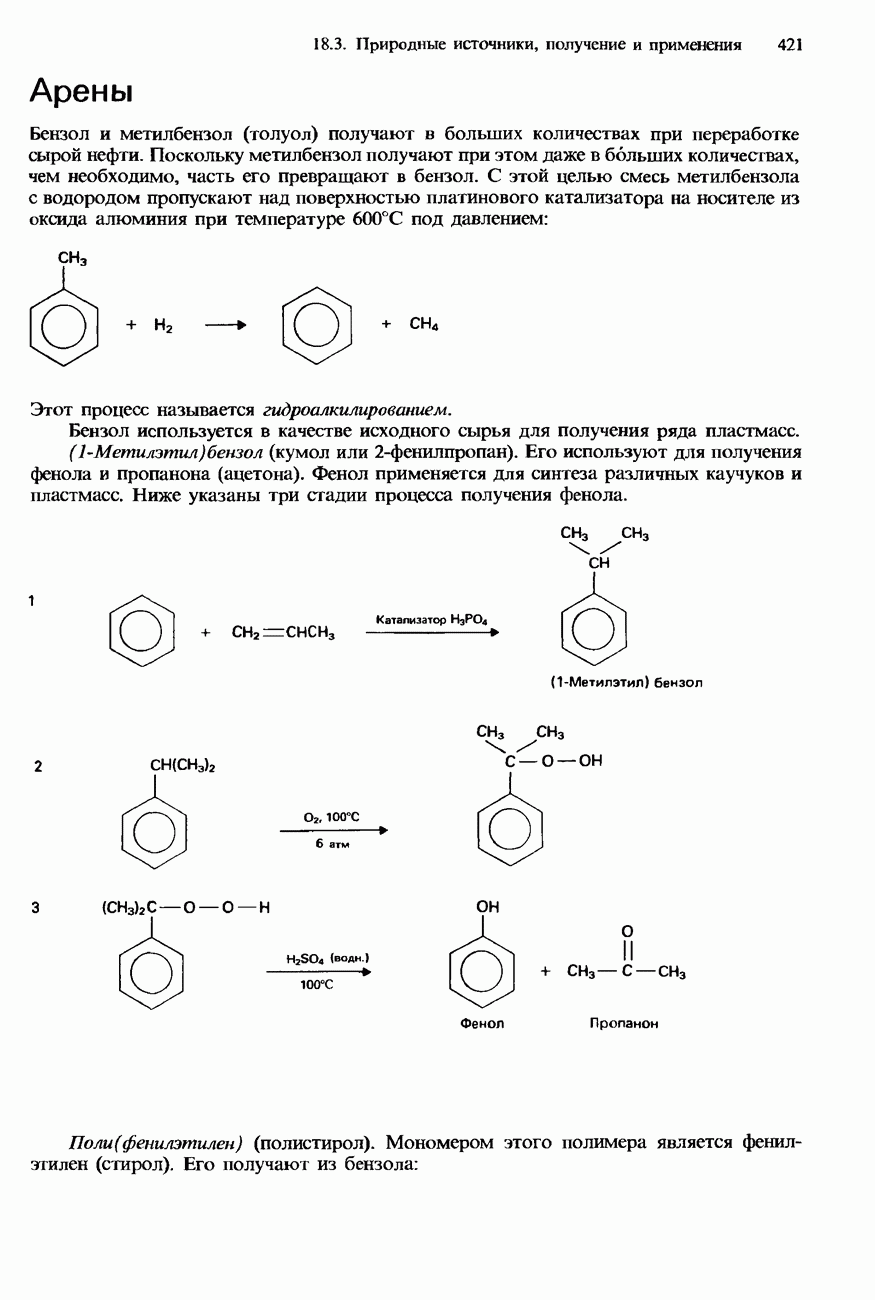
- 18.2. Арены
- БЕНЗОЛ
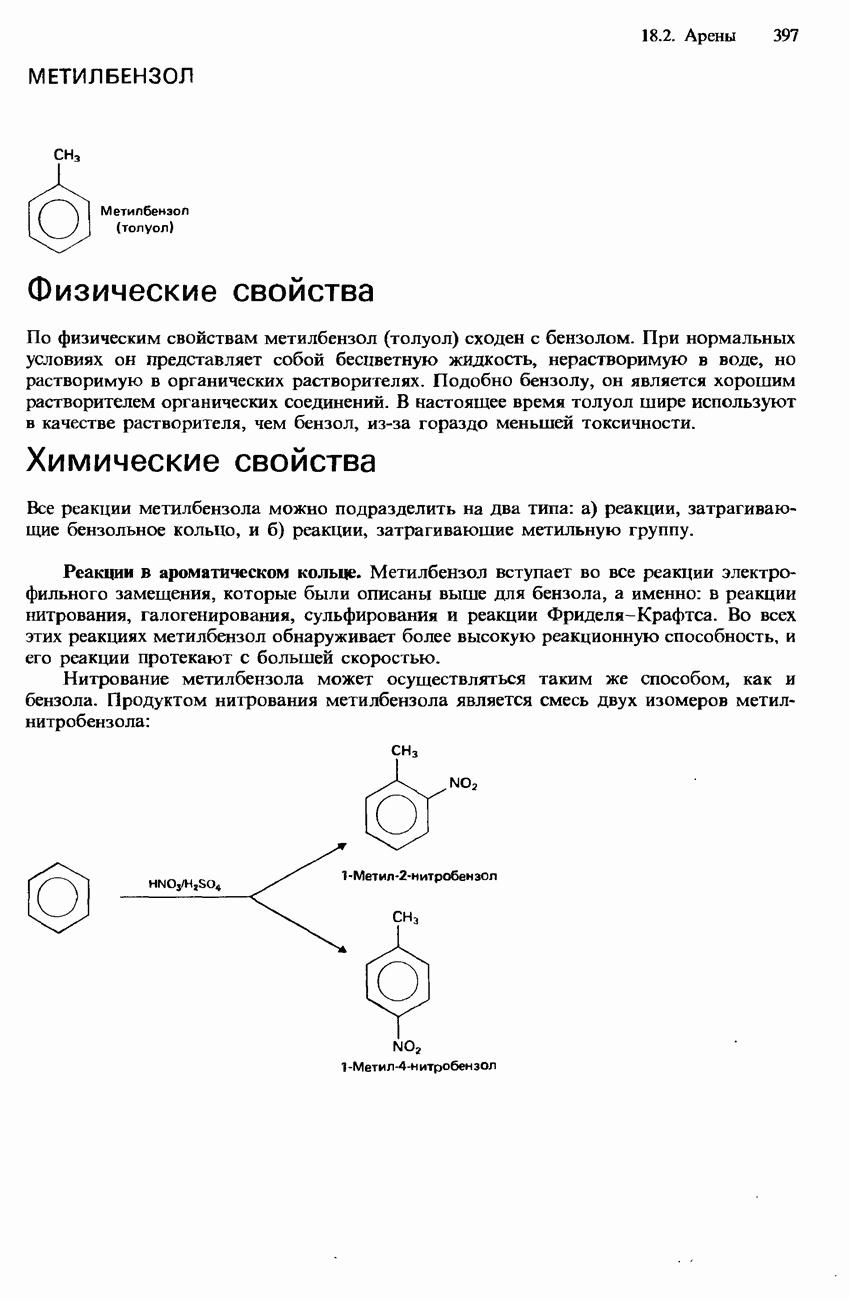
- МЕТИЛБЕНЗОЛ
- 18.3. Природные источники, получение и применения
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ
- ПЕРЕРАБОТКА НЕФТИ
- ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ
- ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
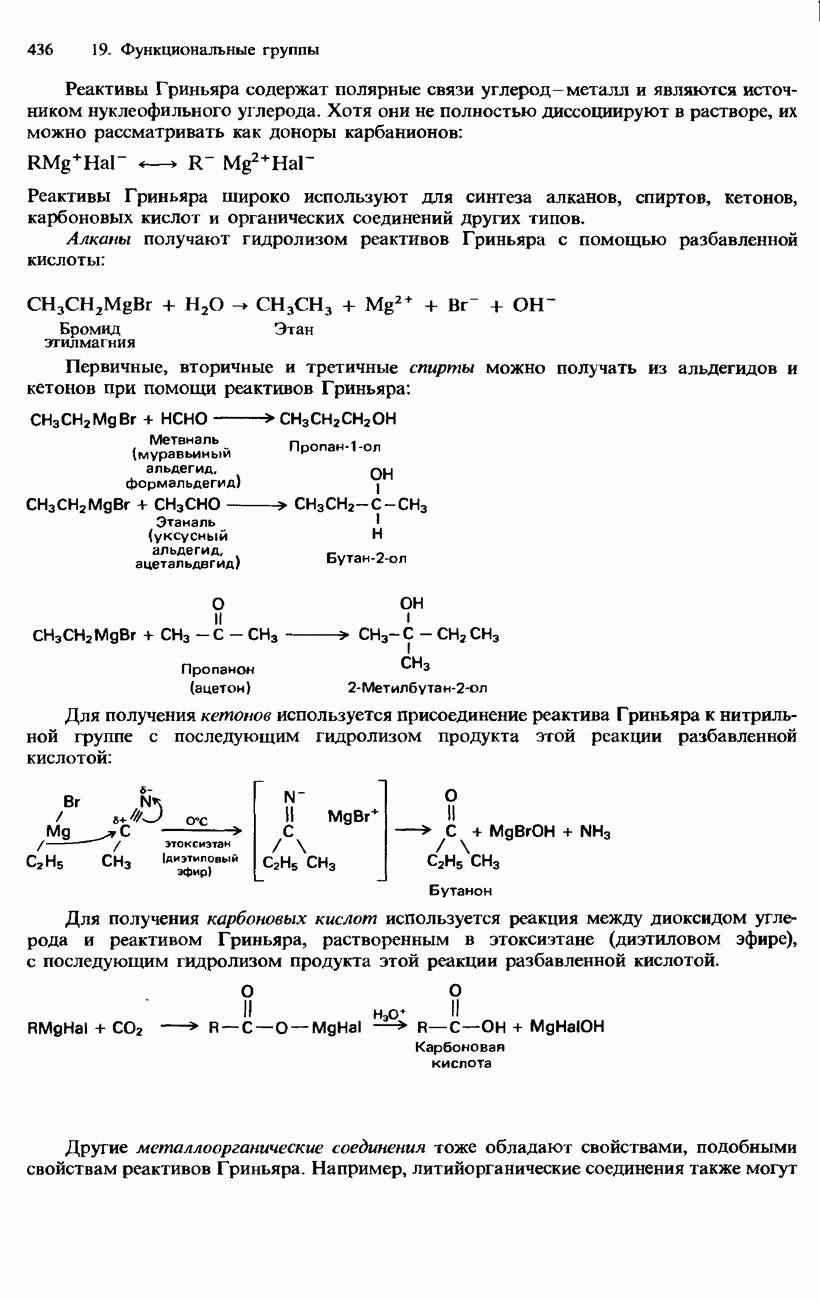
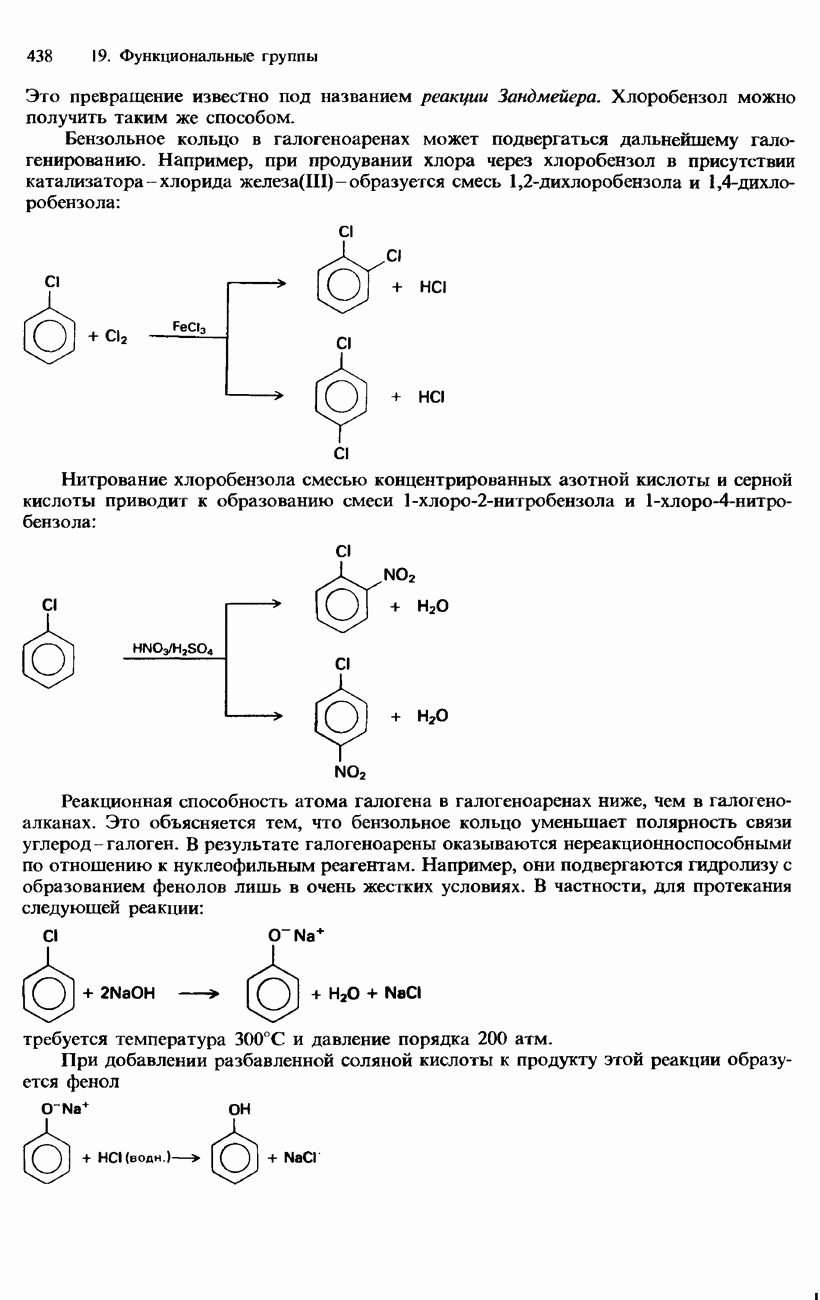
- 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
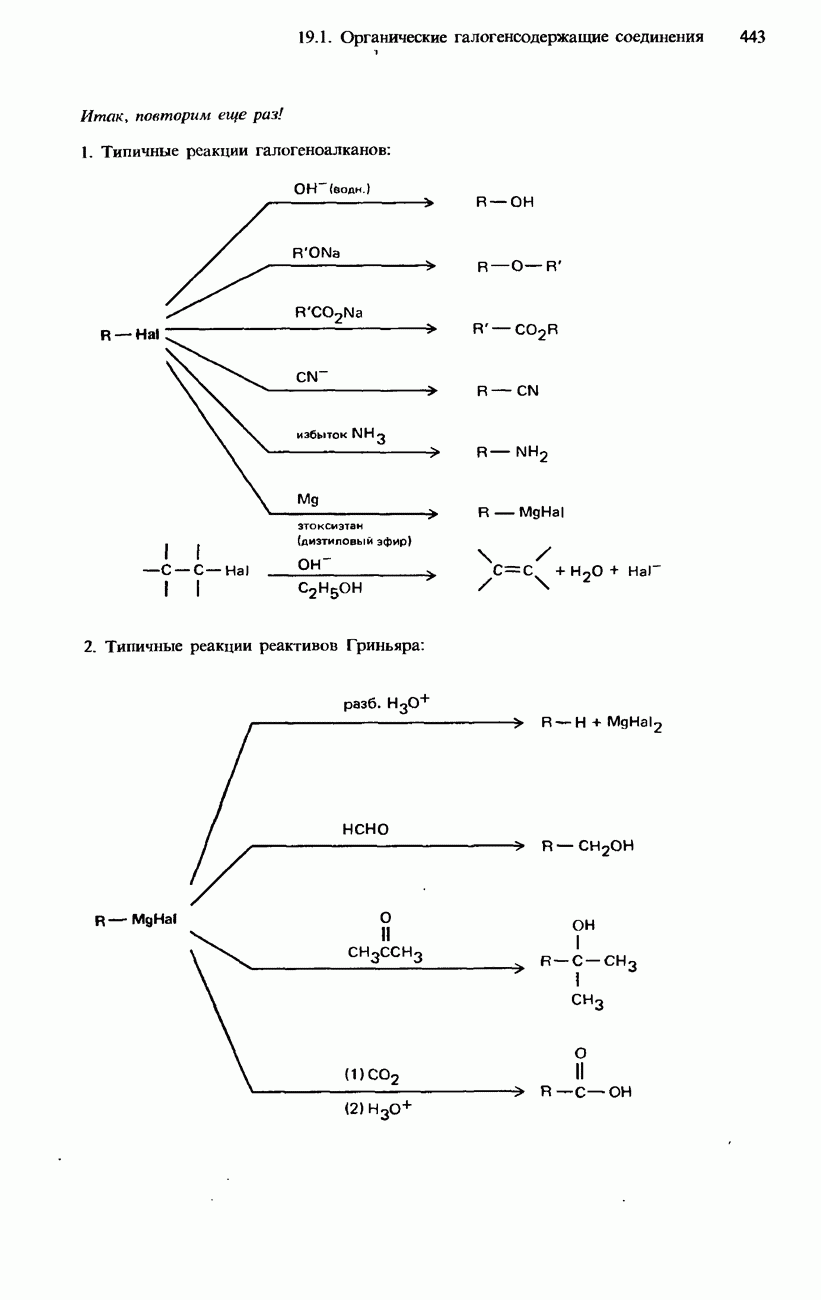
- 19.1. Органические галогенсодержащие соединения
- ГАЛОГЕНОАЛКЕНЫ
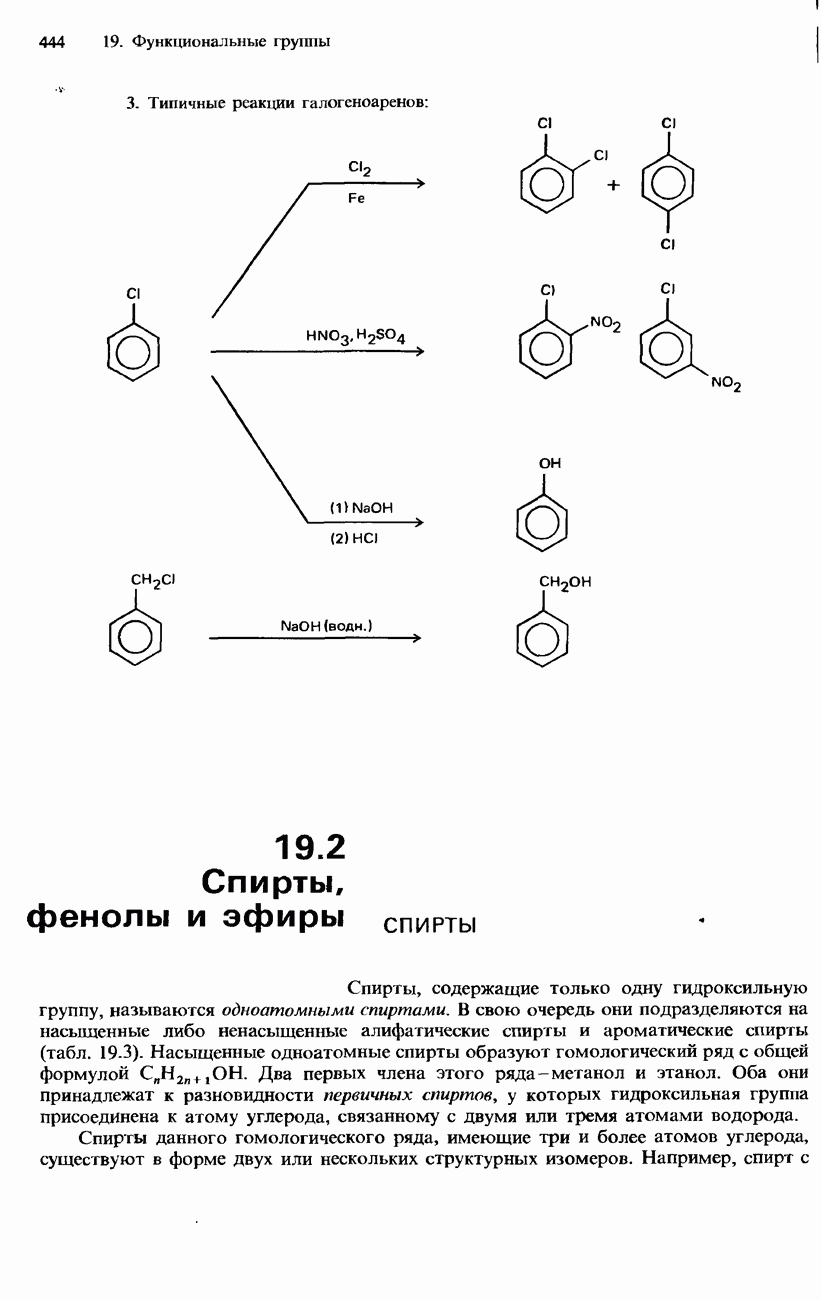
- ГАЛОГЕНОАРЕНЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
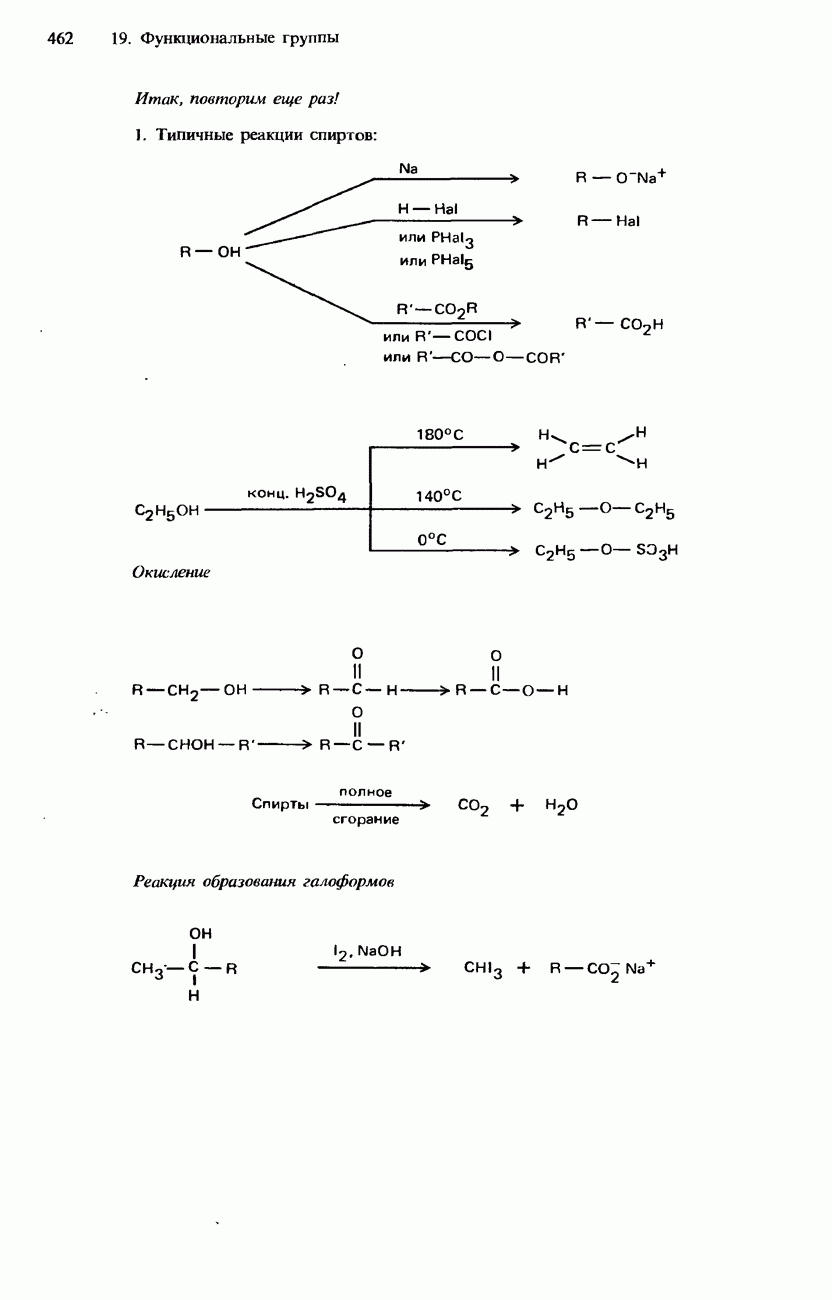
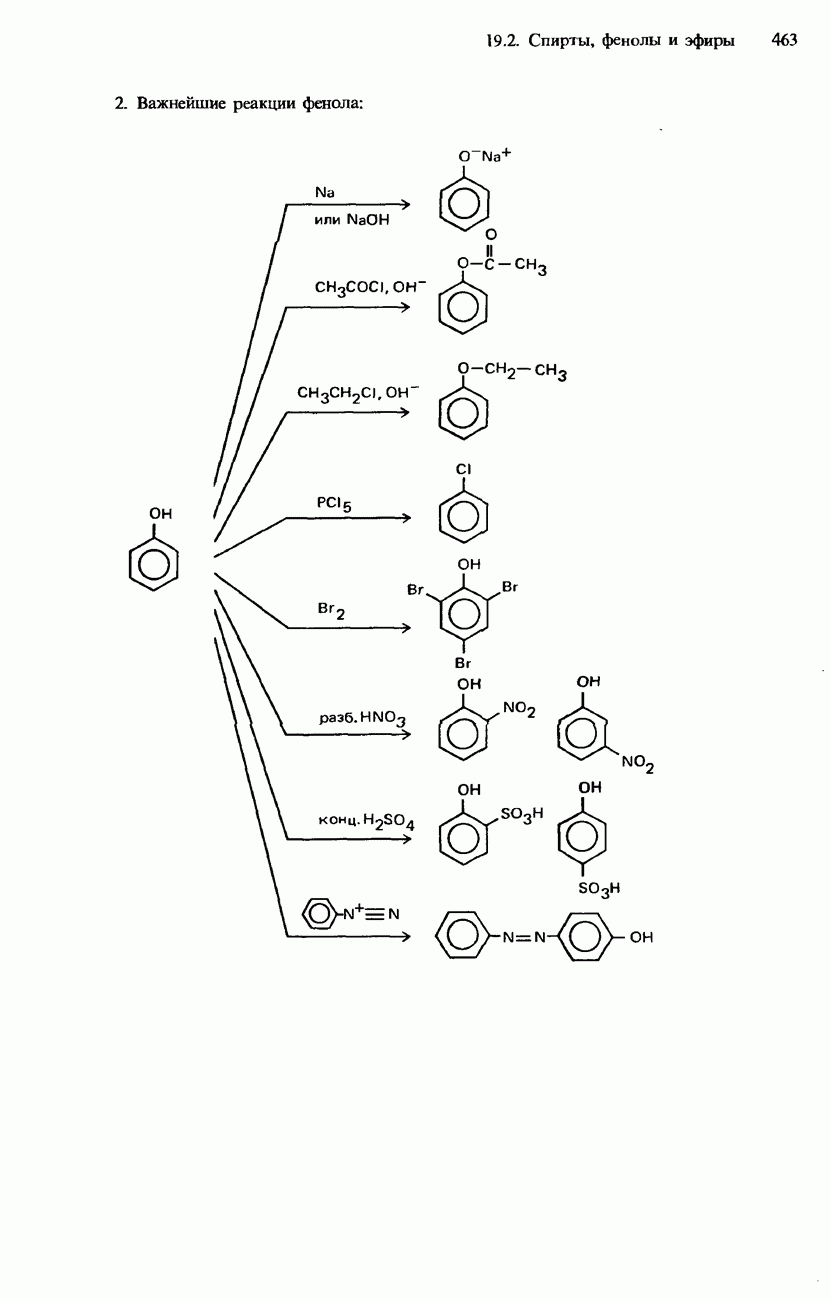
- 19.2. Спирты, фенолы и эфиры
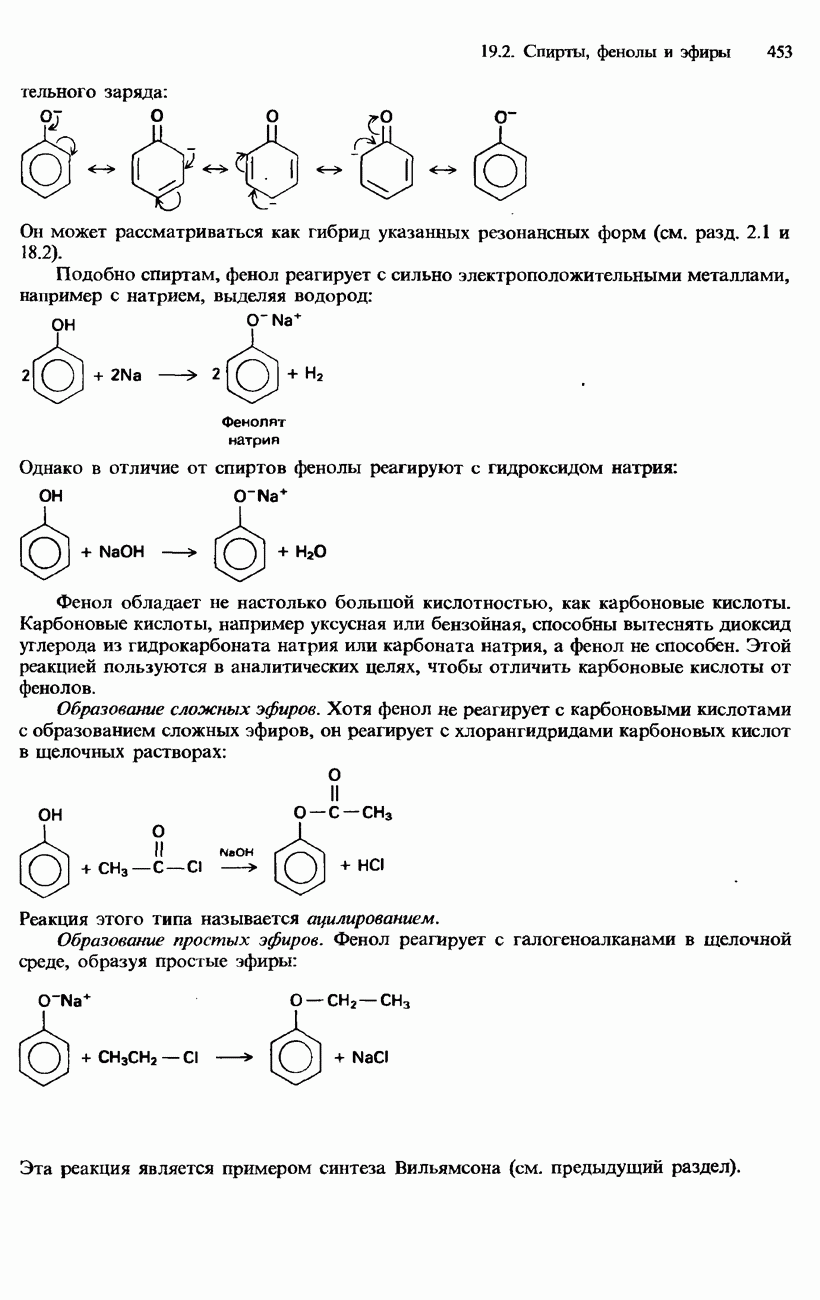
- ФЕНОЛЫ
- ПРОСТЫЕ ЭФИРЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ
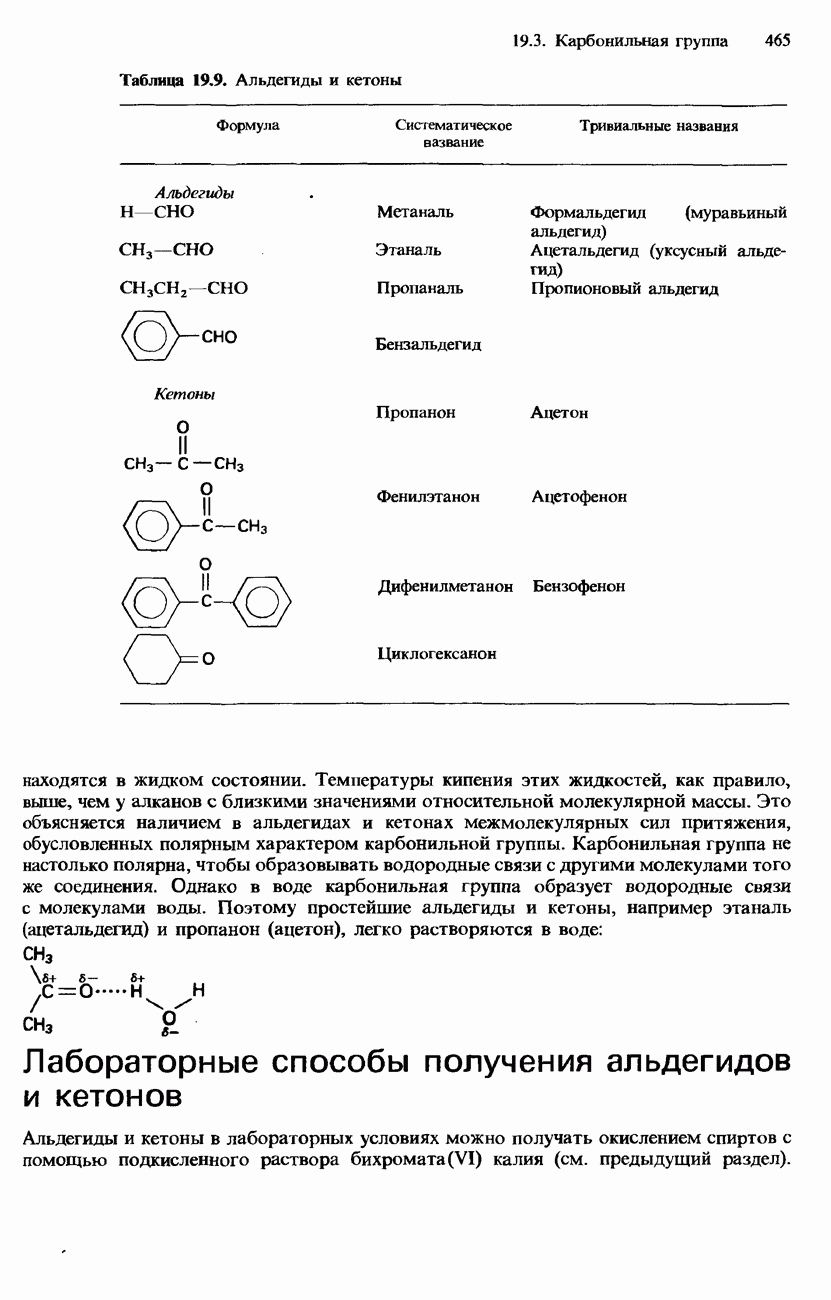
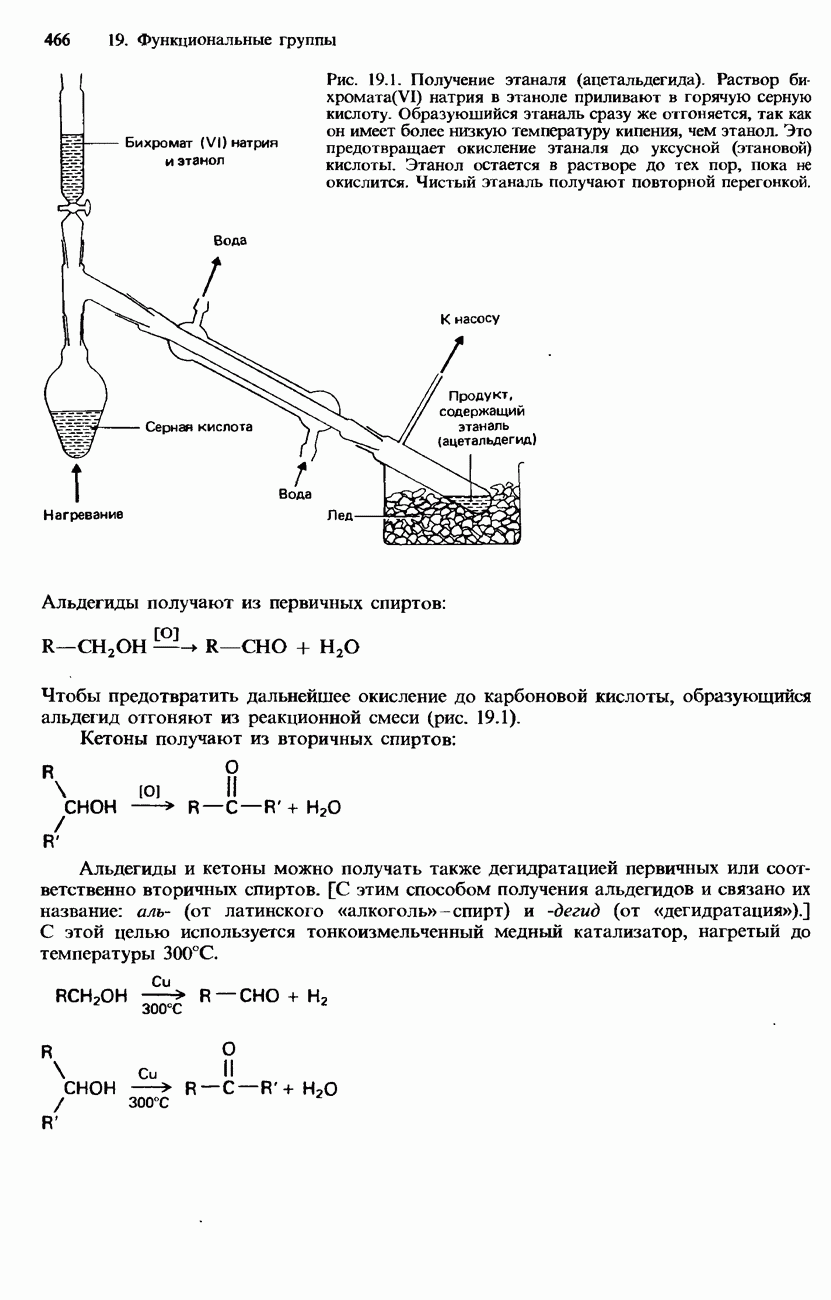
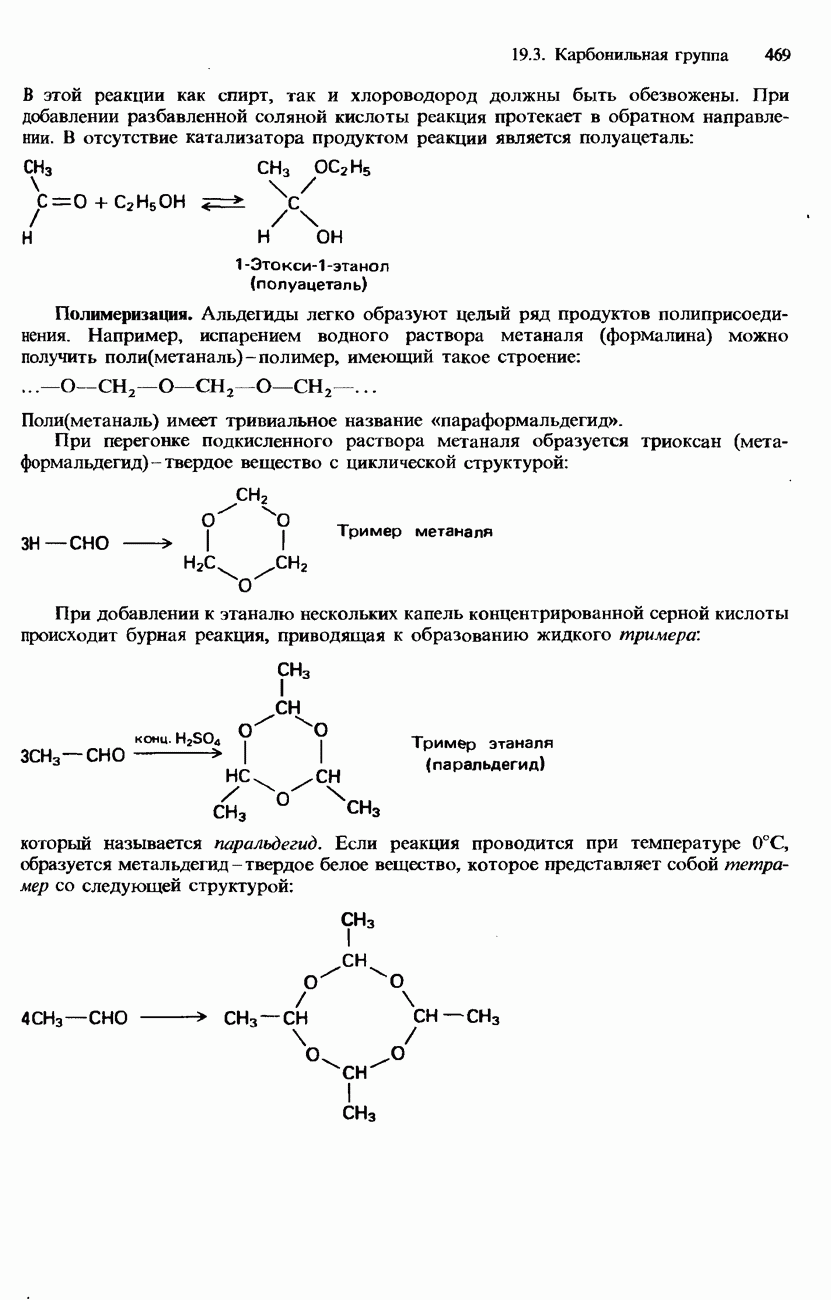
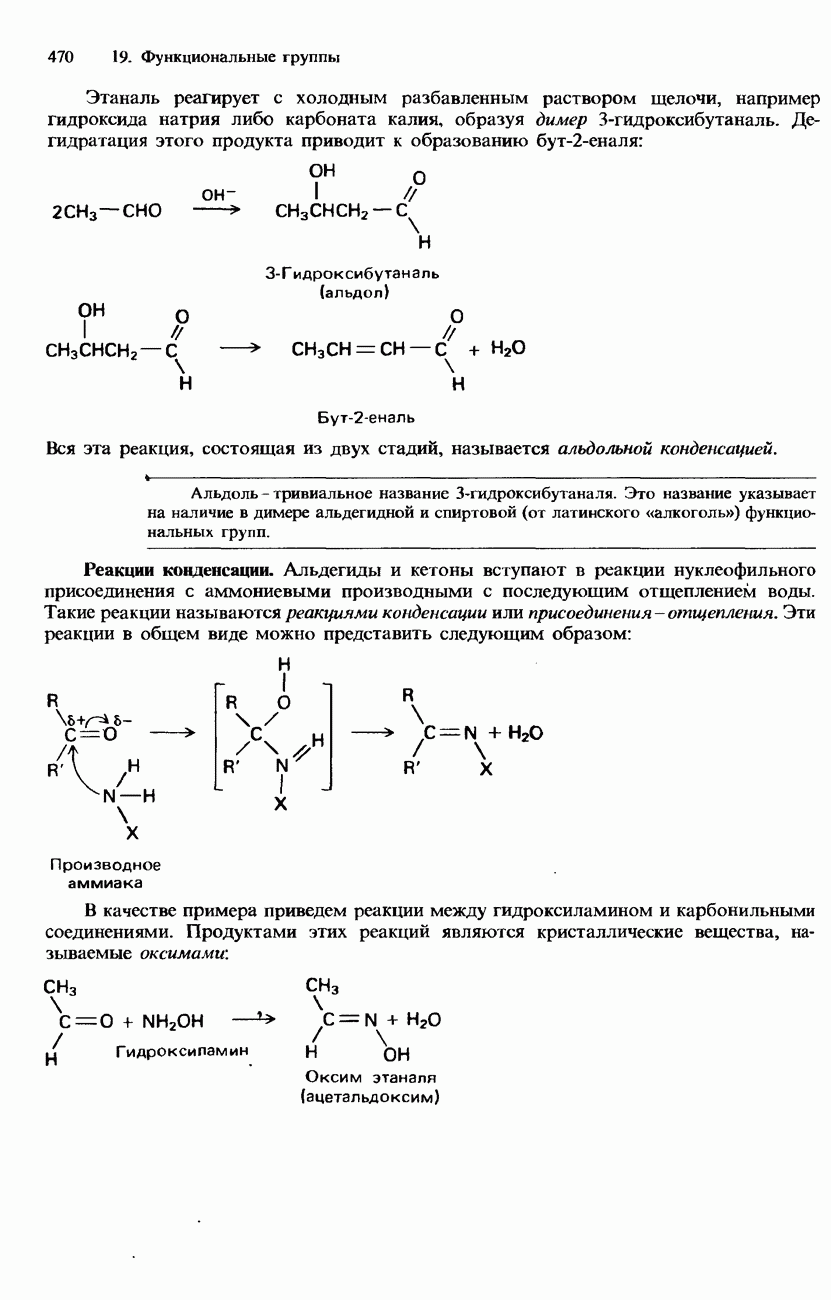
- 19.3. Карбонильная группа
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
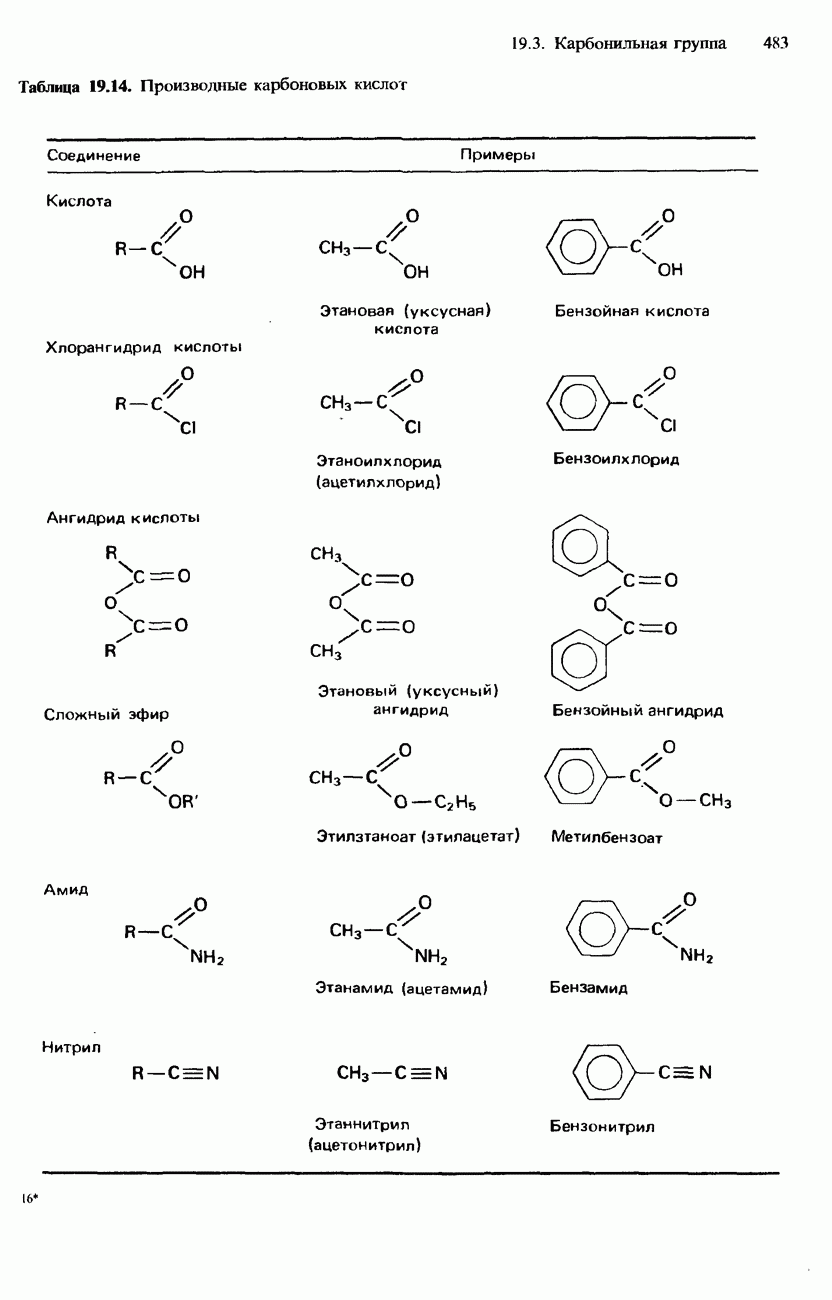
- КАРБОНОВЫЕ КИСЛОТЫ
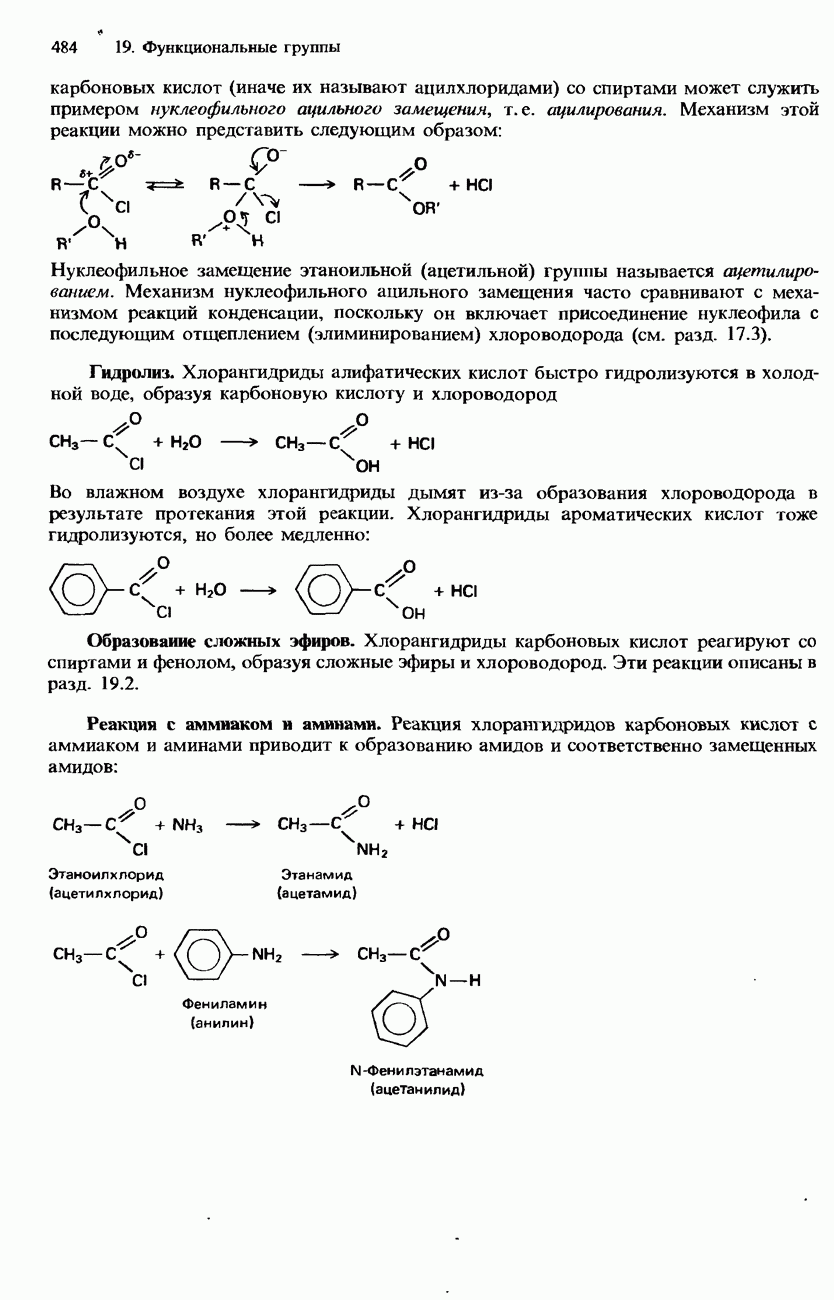
- ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
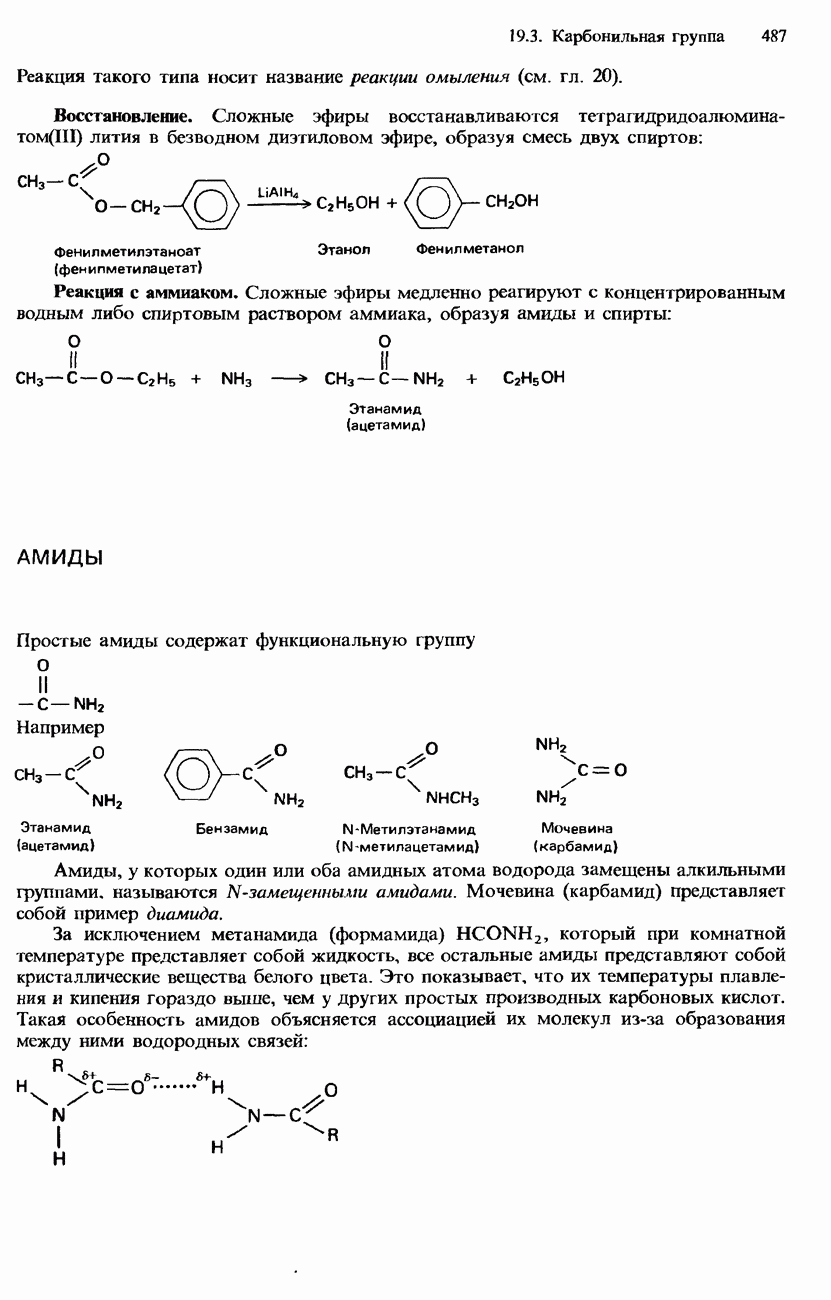
- АМИДЫ
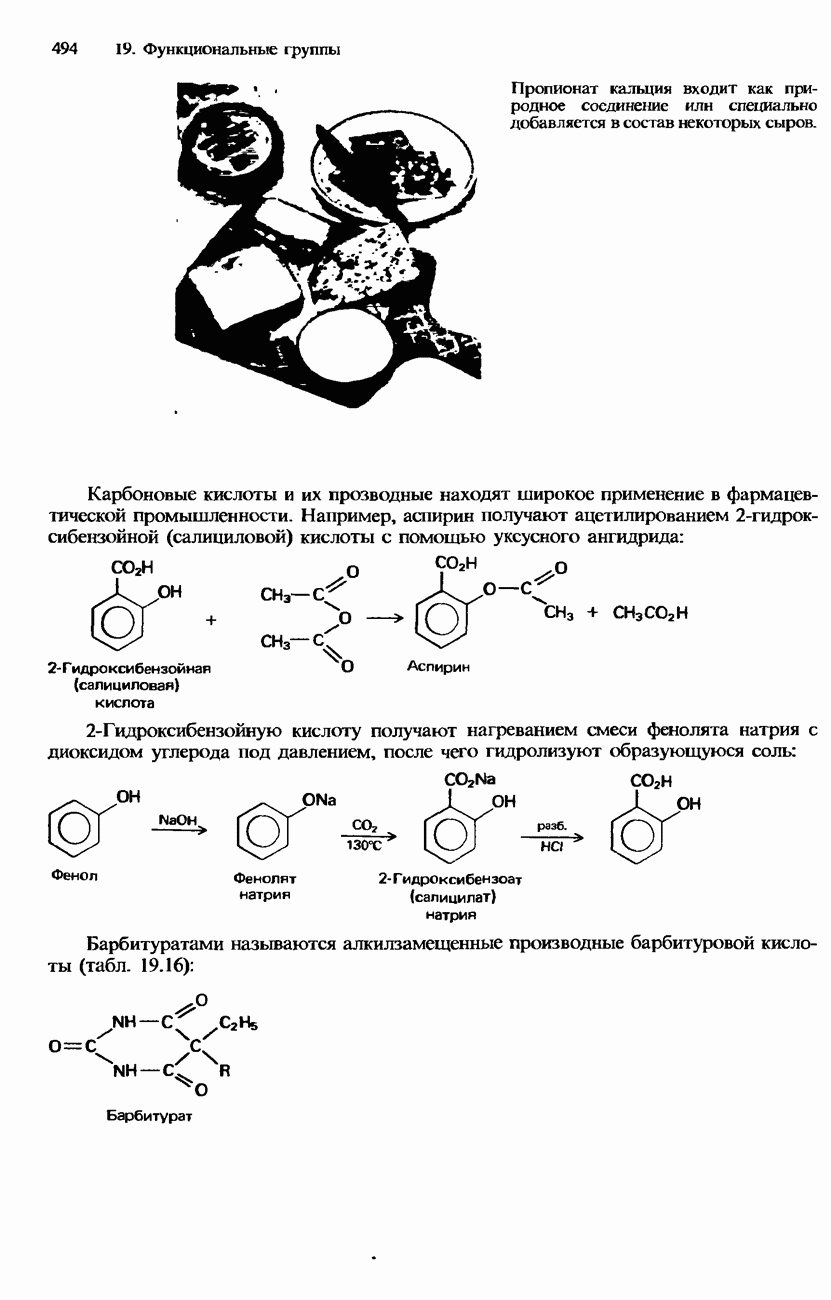
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ
- 19.4 Амины и родственные соединения
- СОЛИ ДИАЗОНИЯ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ
- 20.1. Аминокислоты, пептиды и белки
- АМИНОКИСЛОТЫ
- ПЕПТИДЫ
- БЕЛКИ
- 20.2. Углеводы и нуклеиновые кислоты
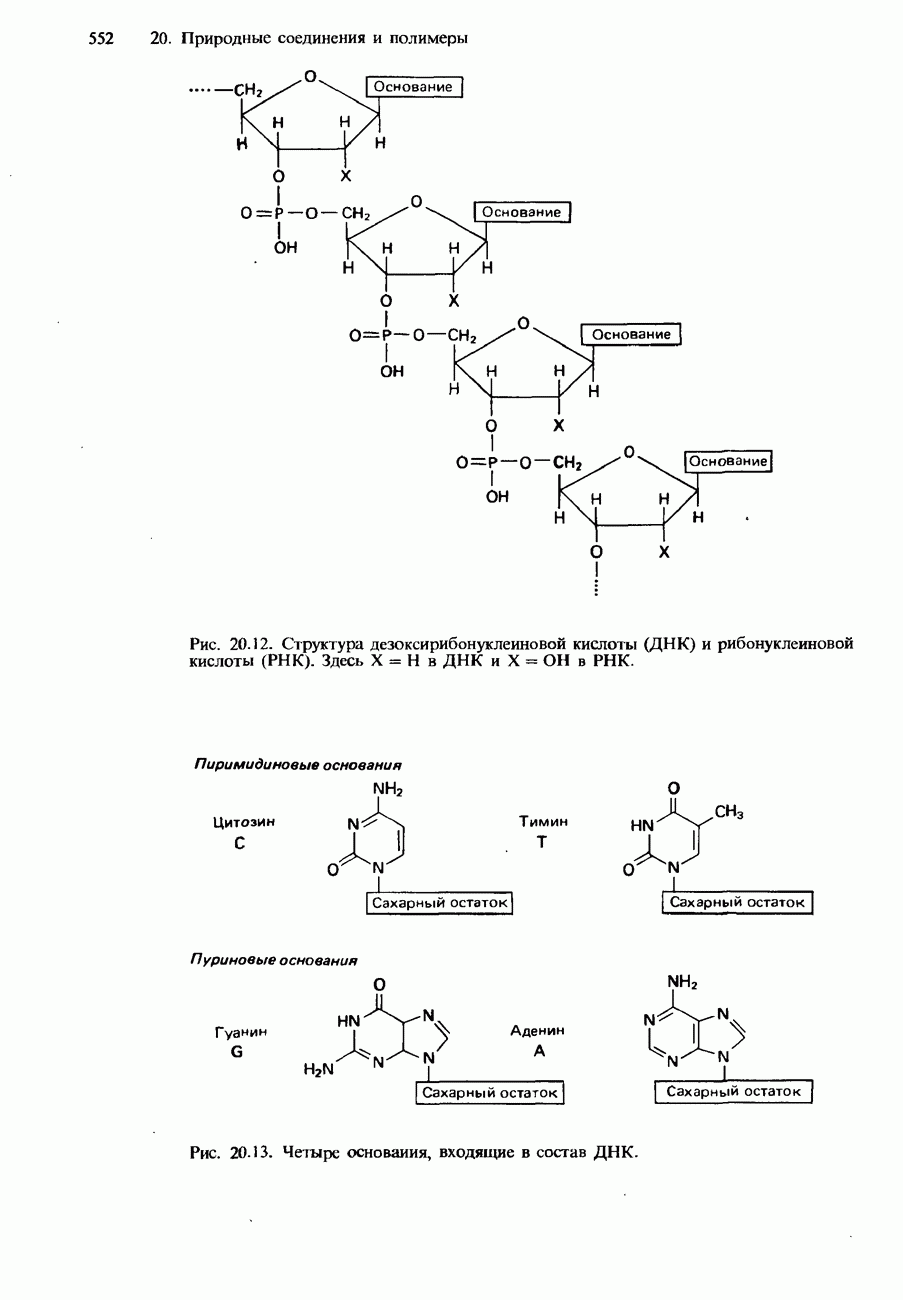
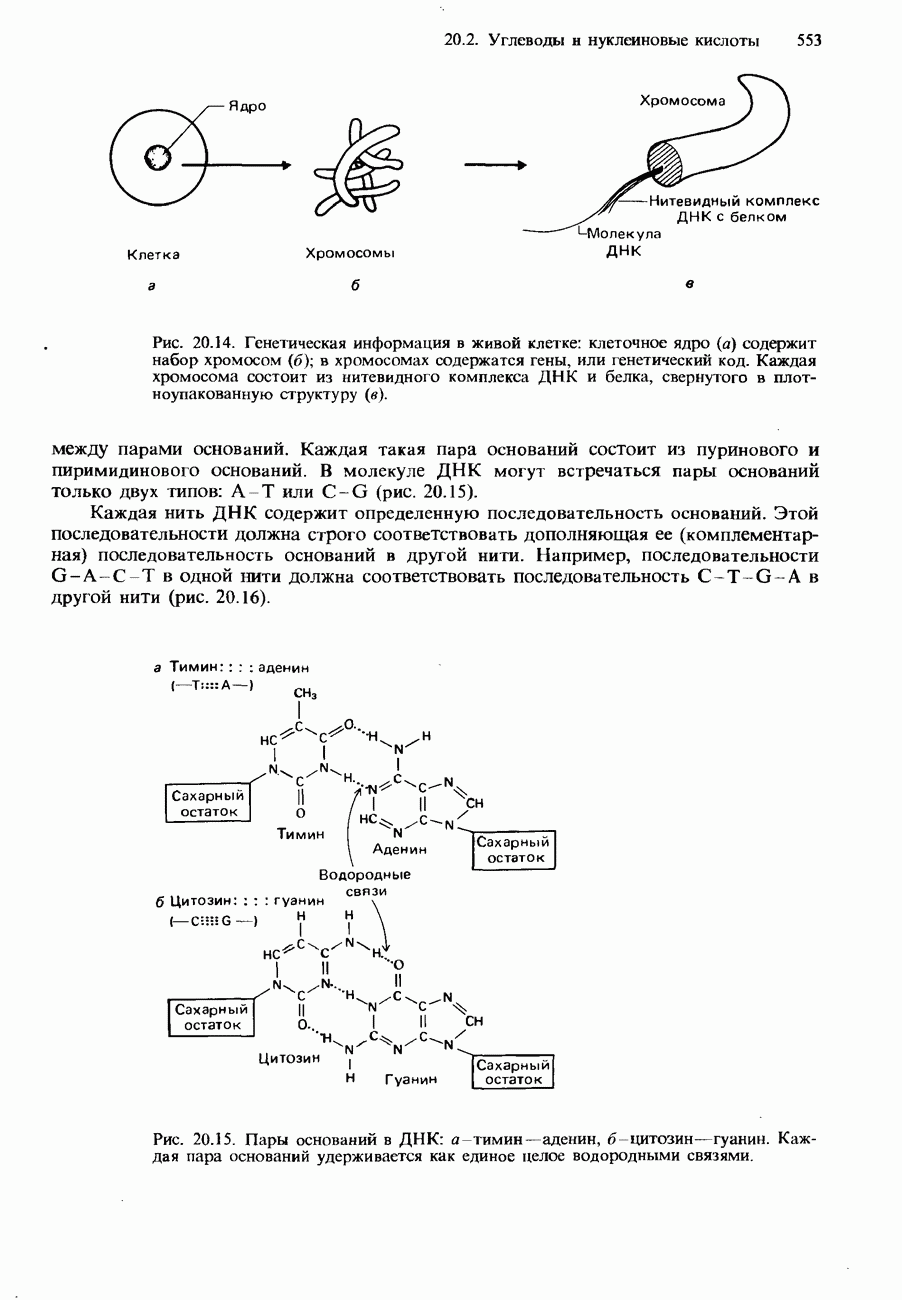
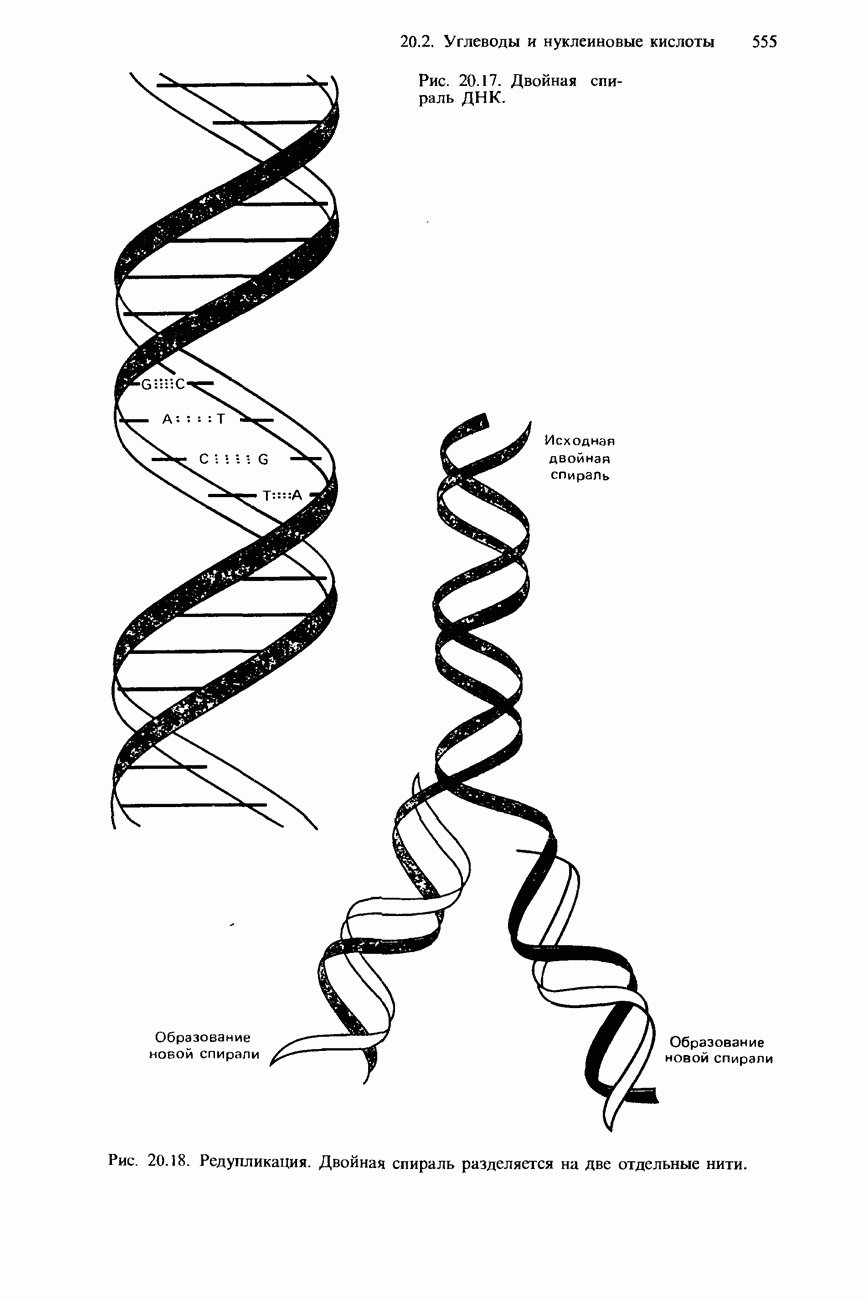
- НУКЛЕИНОВЫЕ КИСЛОТЫ
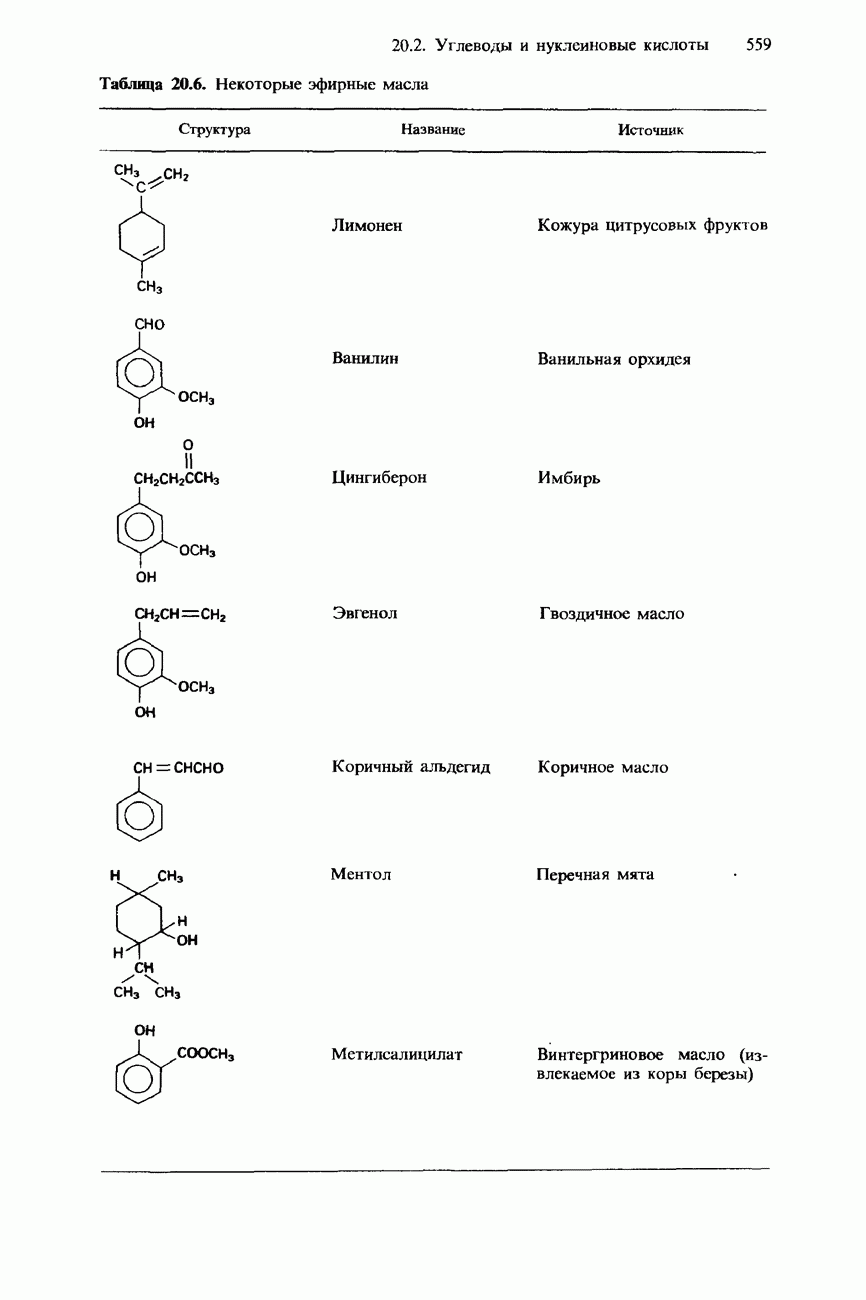
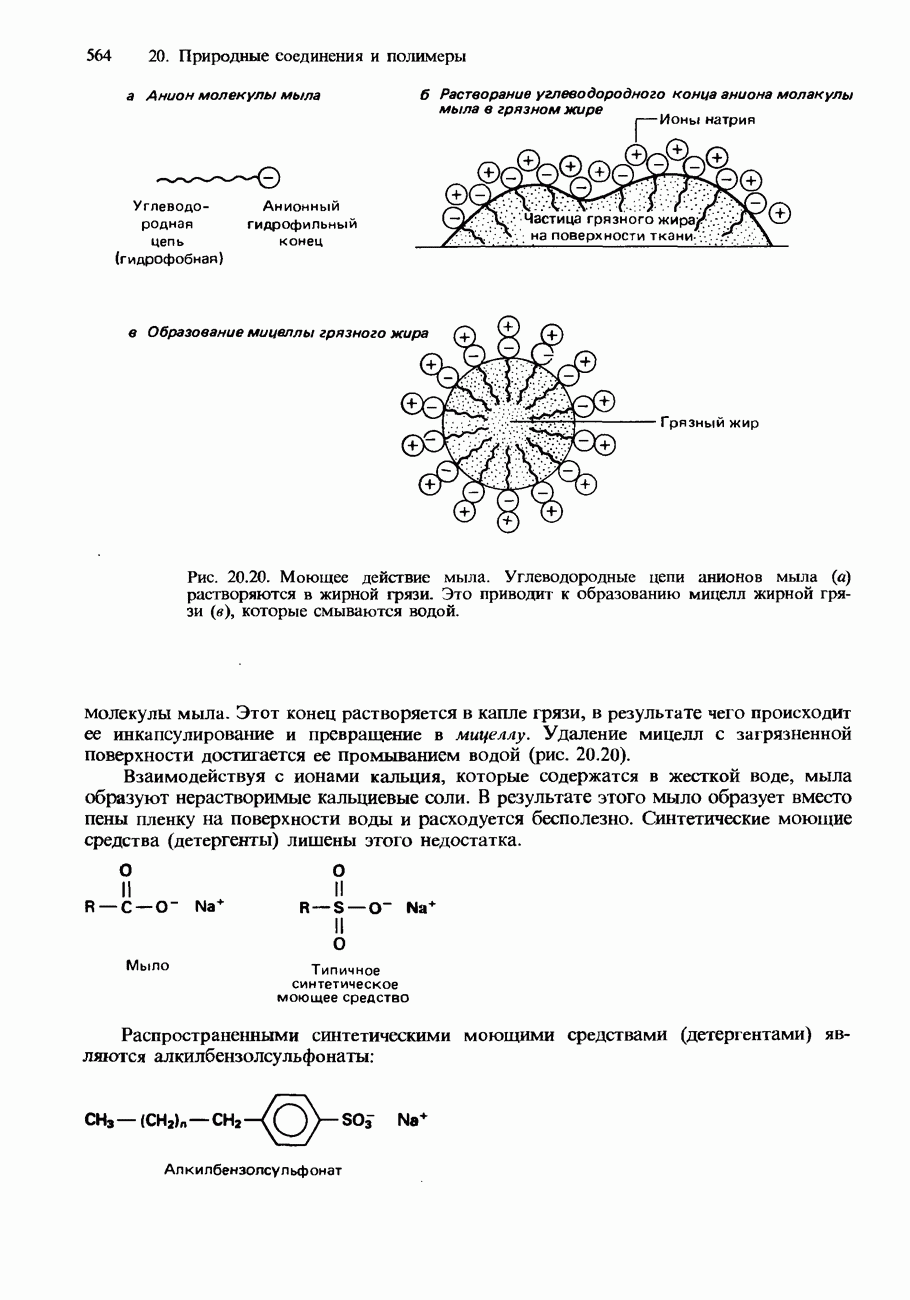
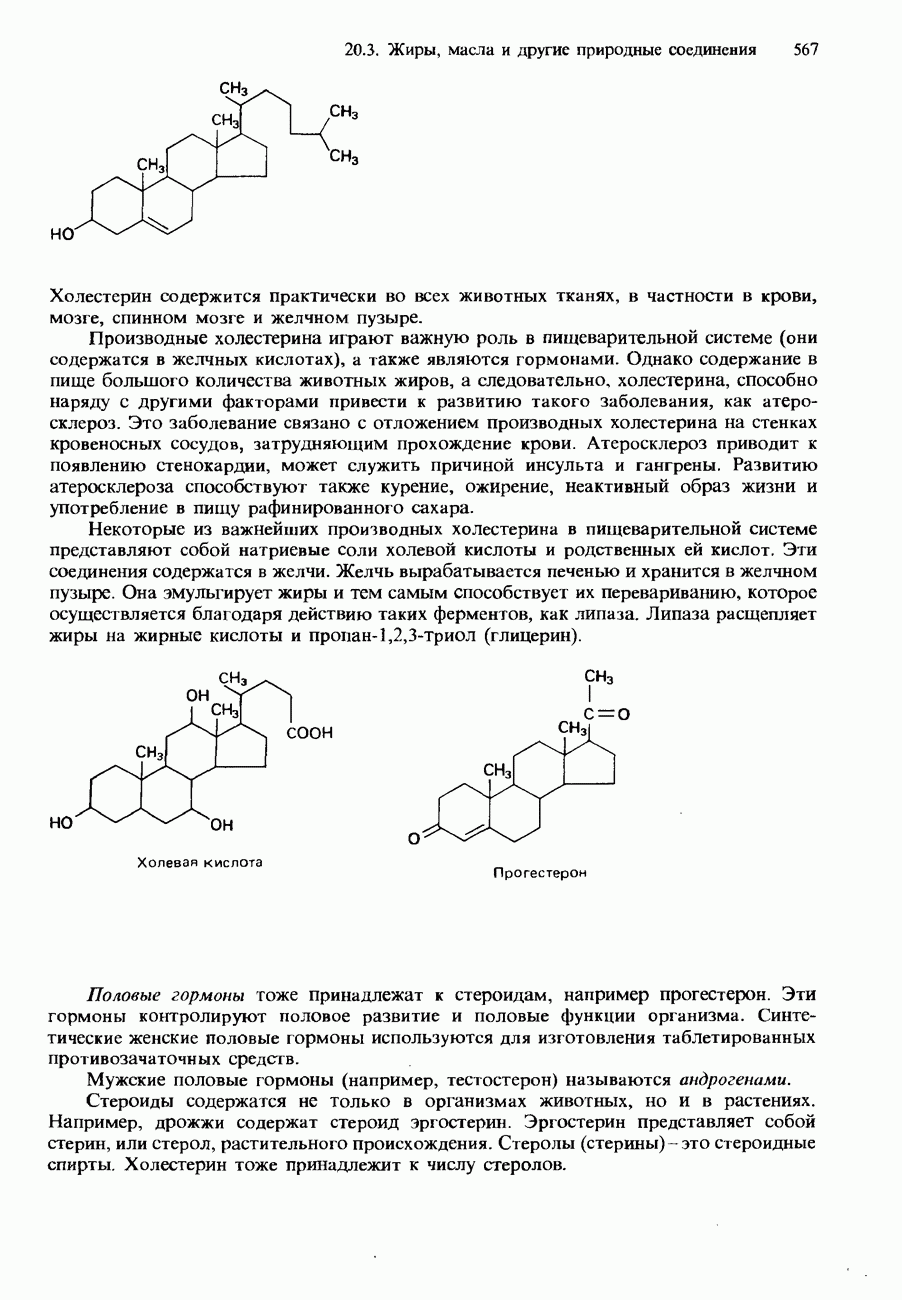
- 20.3. Жиры, масла и другие природные соединения
- ЖИРНЫЕ КИСЛОТЫ И ТРИГЛИЦЕРИДЫ
- ВОСКИ
- ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ
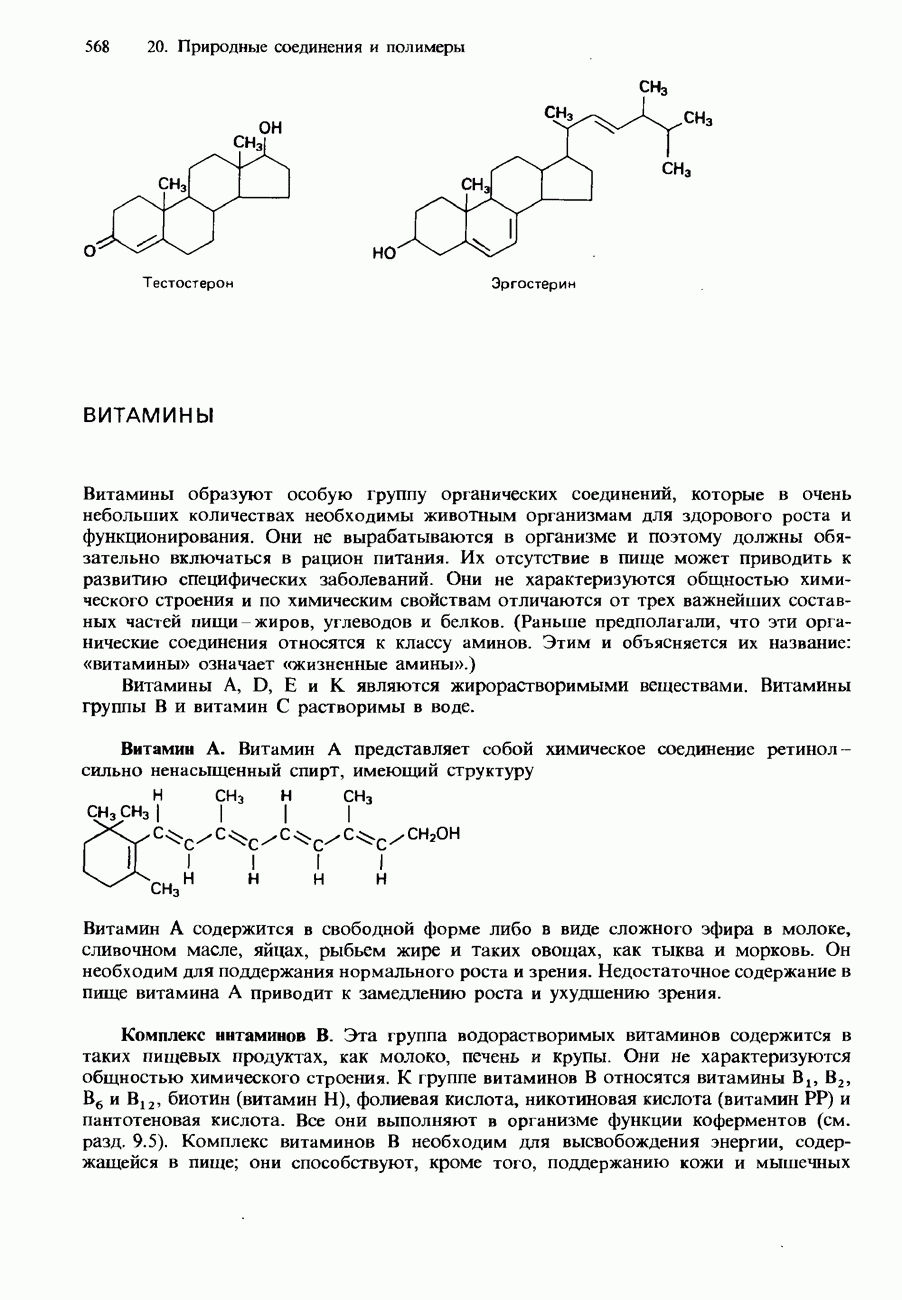
- ВИТАМИНЫ
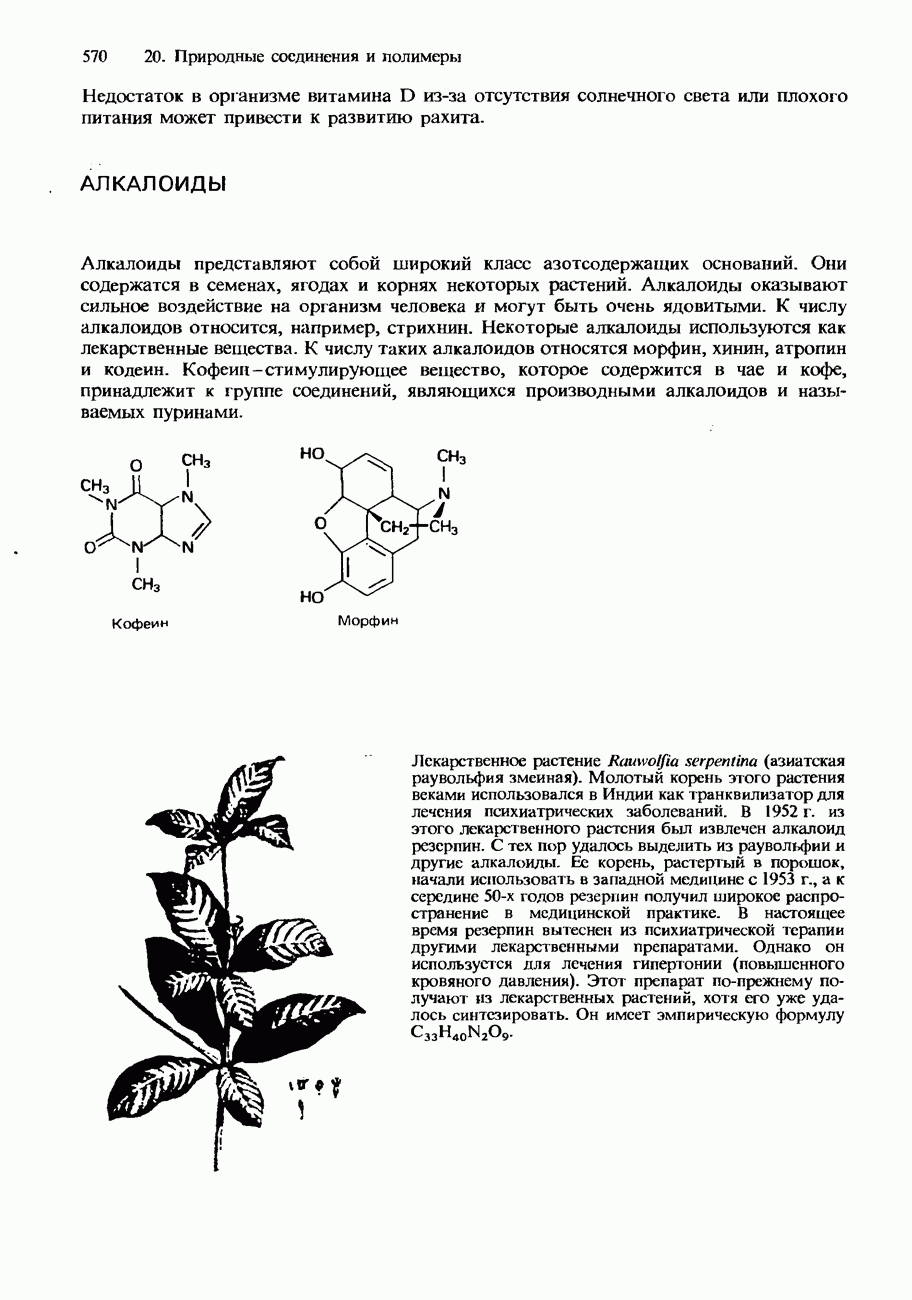
- АЛКАЛОИДЫ
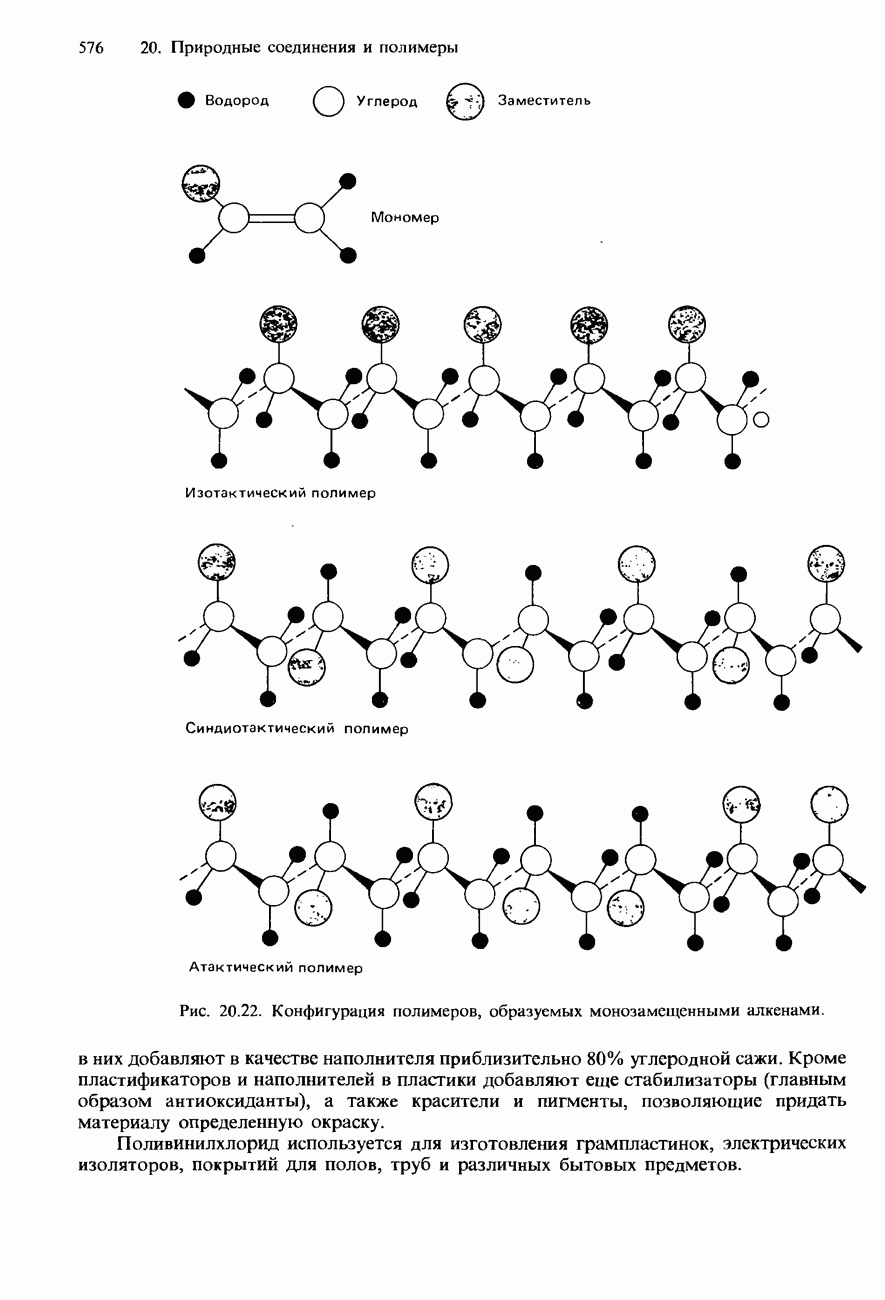
- 20.4. Полимеры
- ПОЛИМЕРИЗАЦИЯ
- НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ
- ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- ПРИЛОЖЕНИЯ