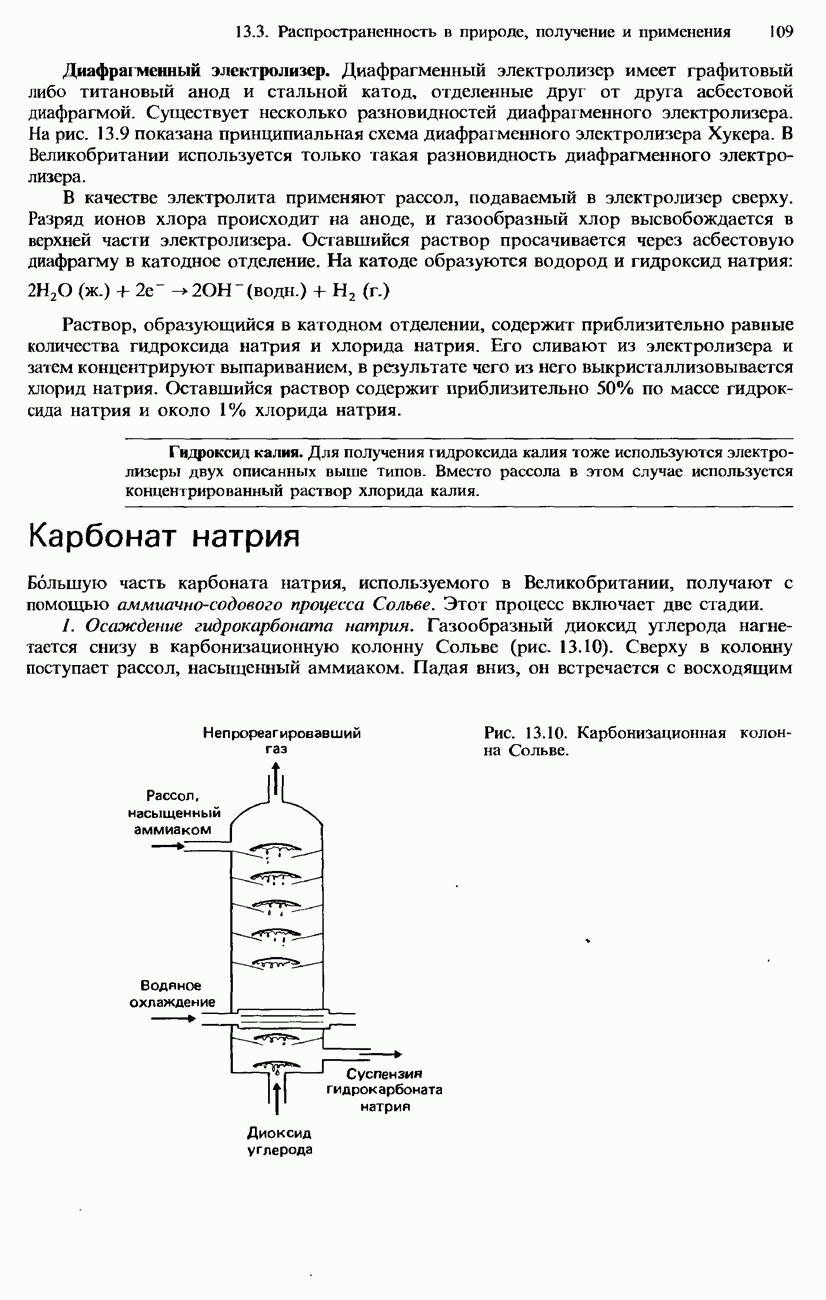
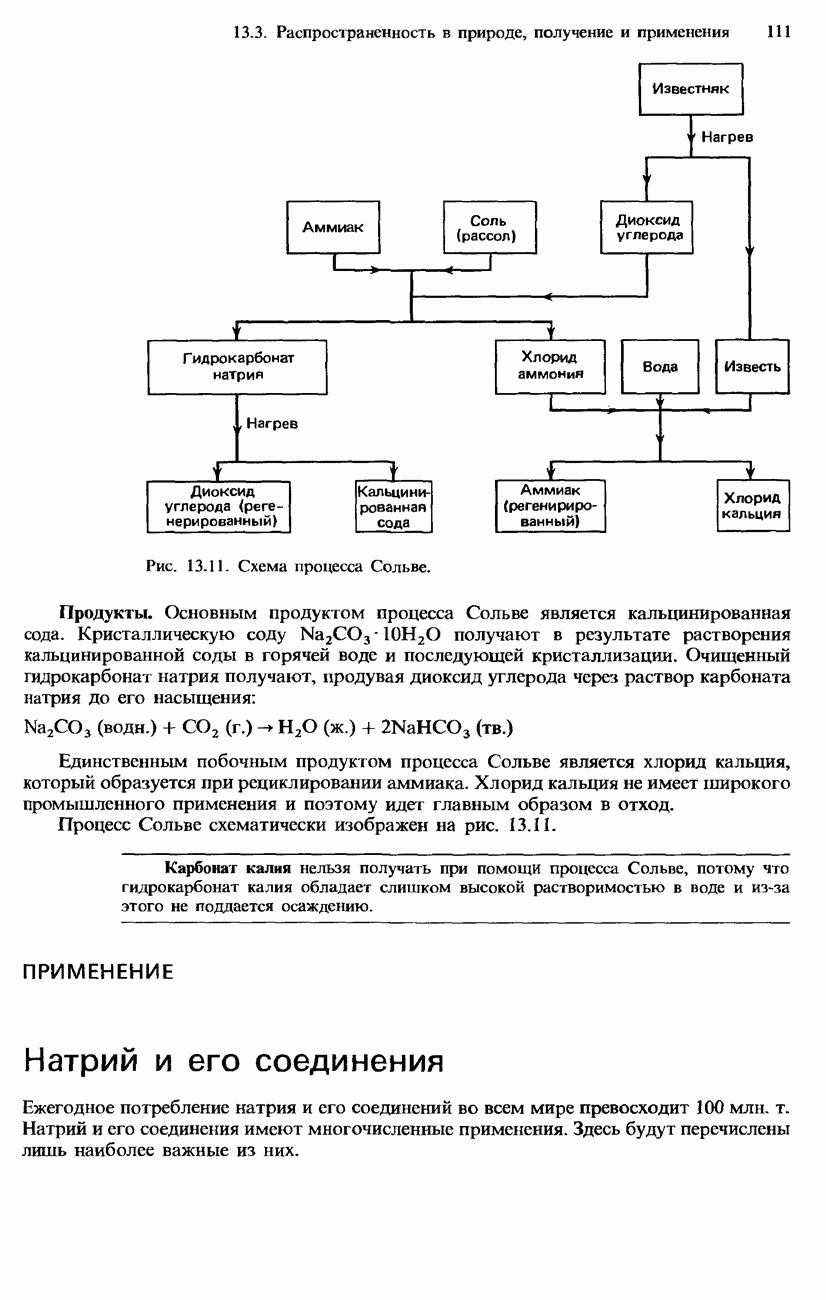
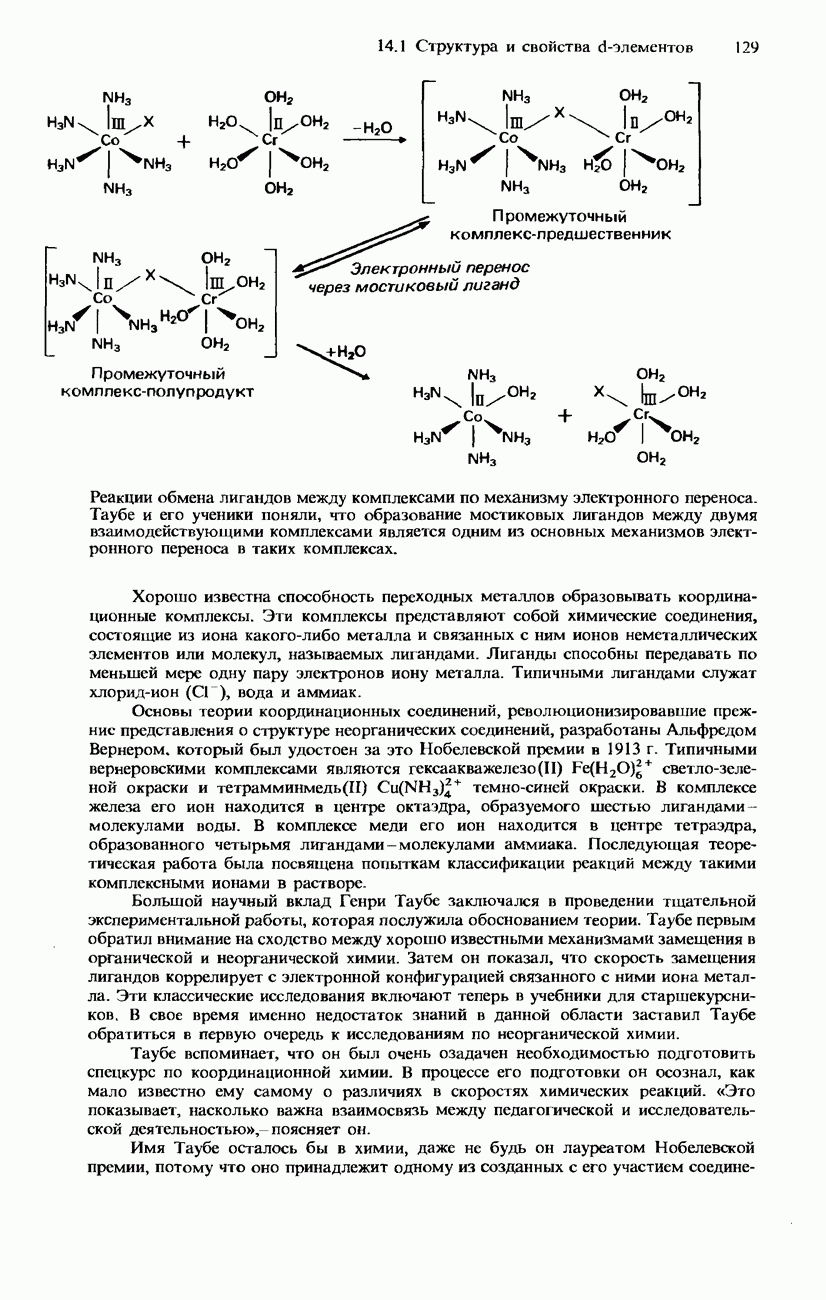
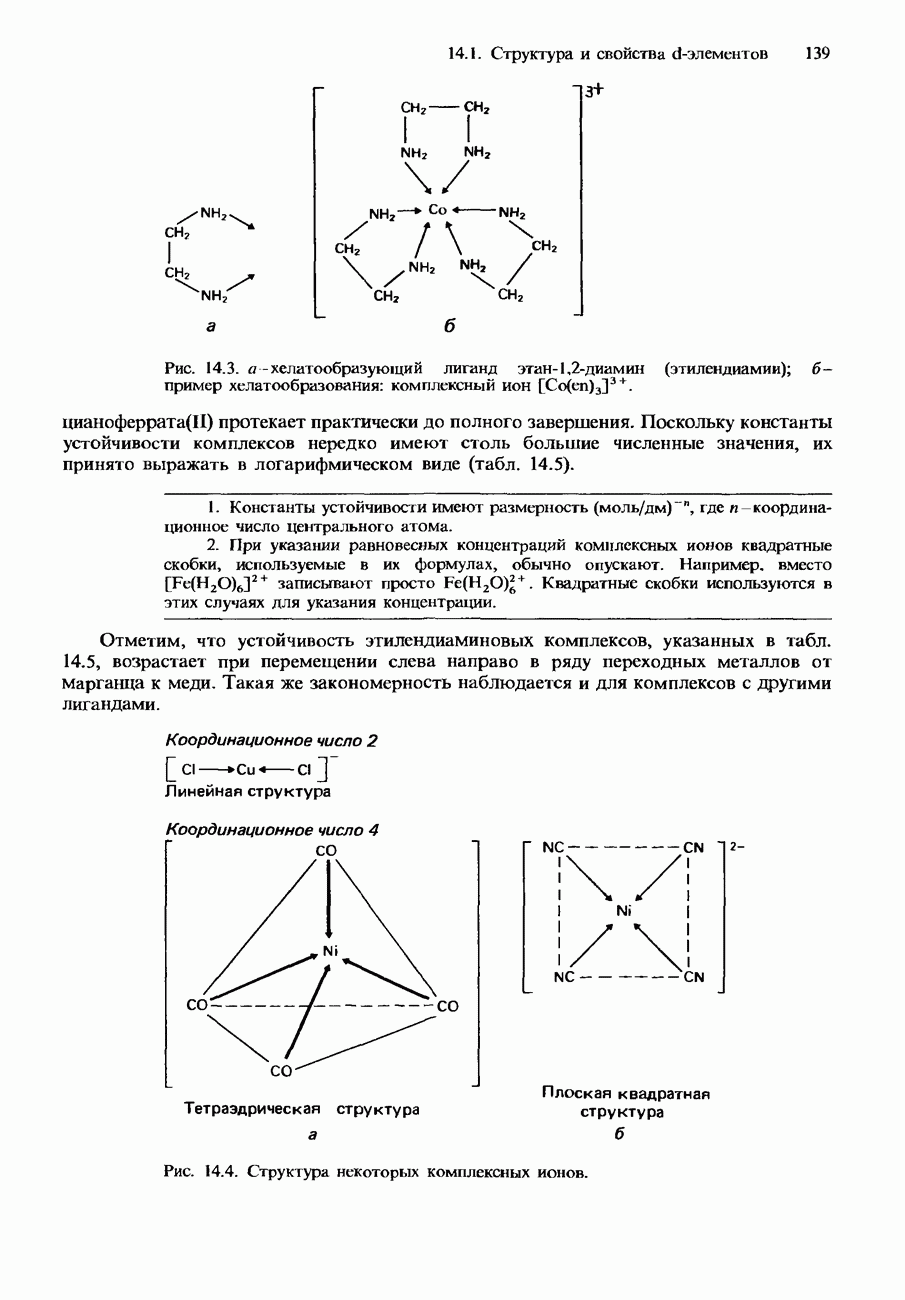
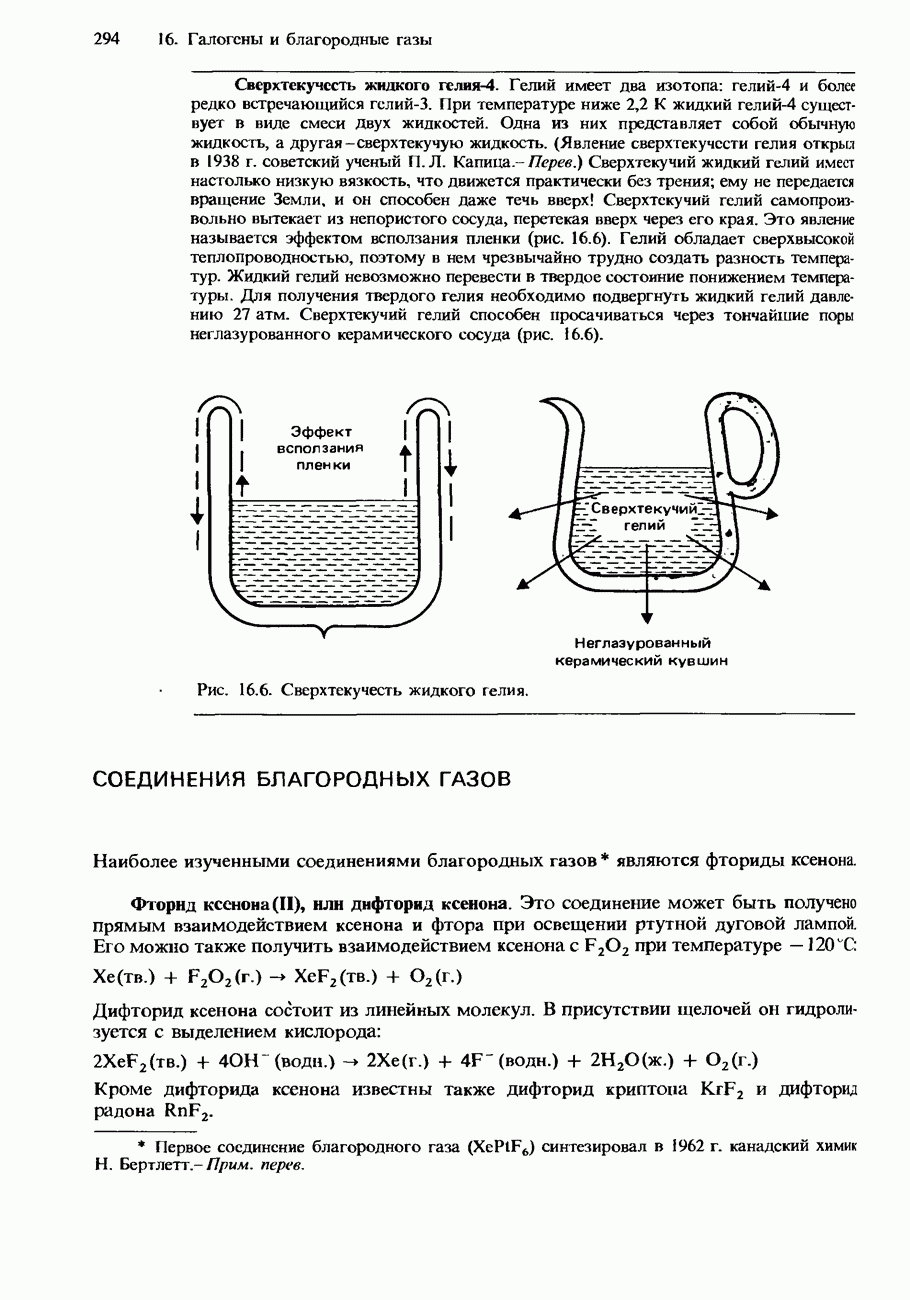
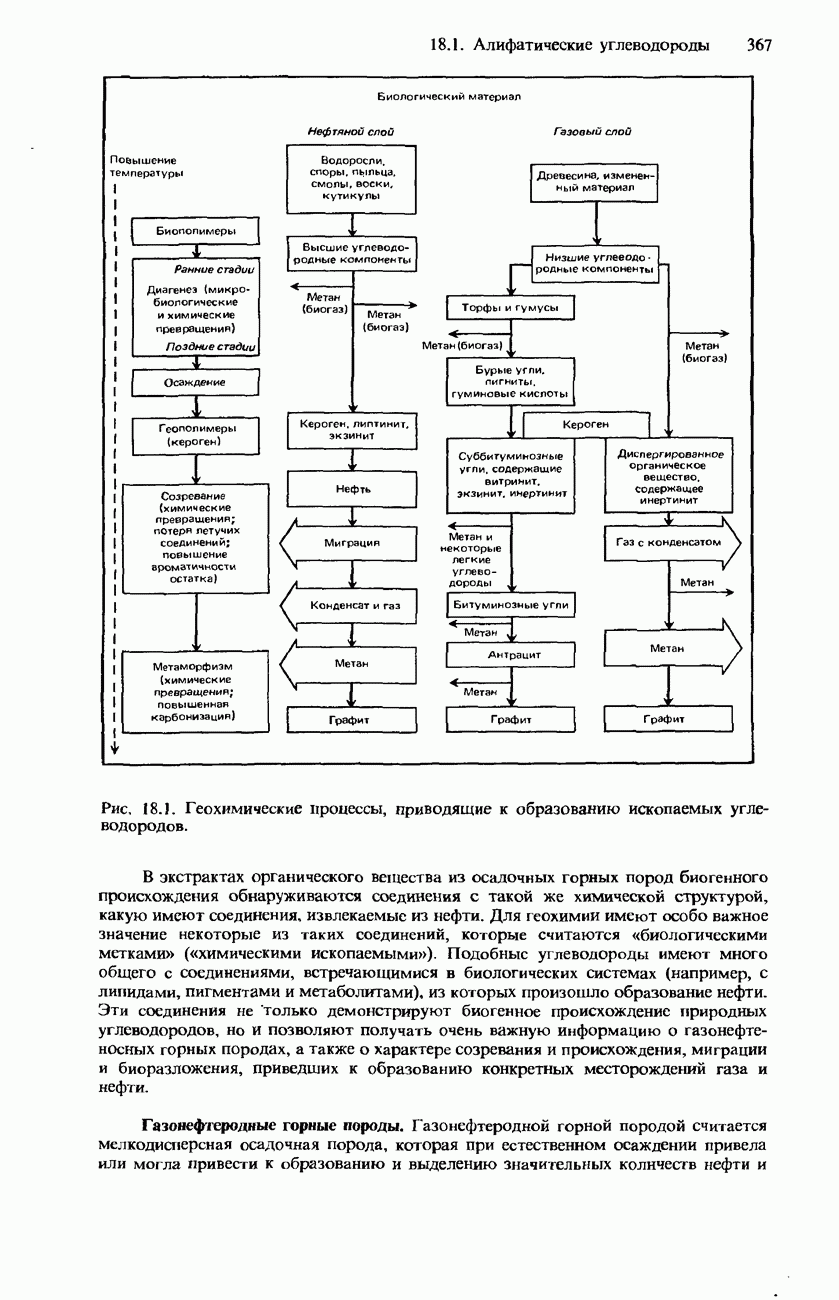
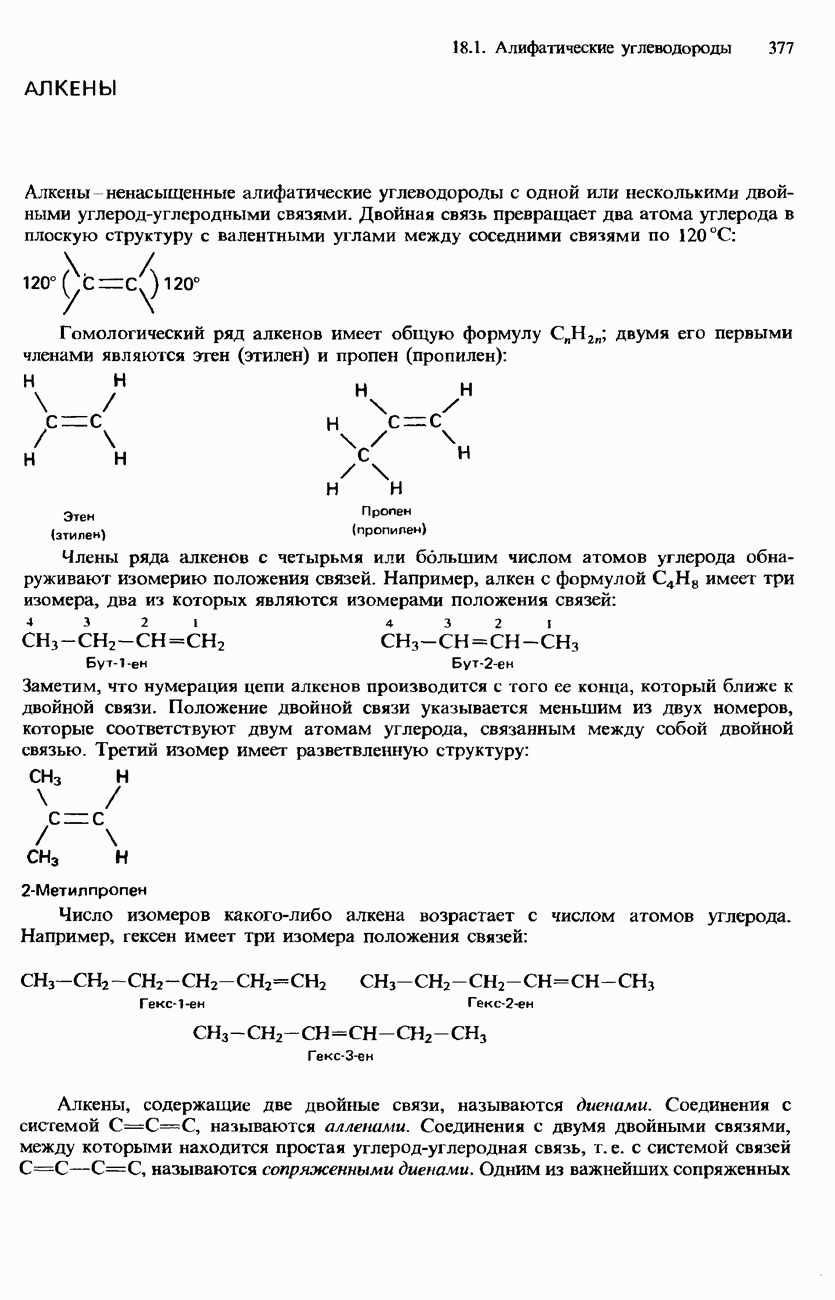
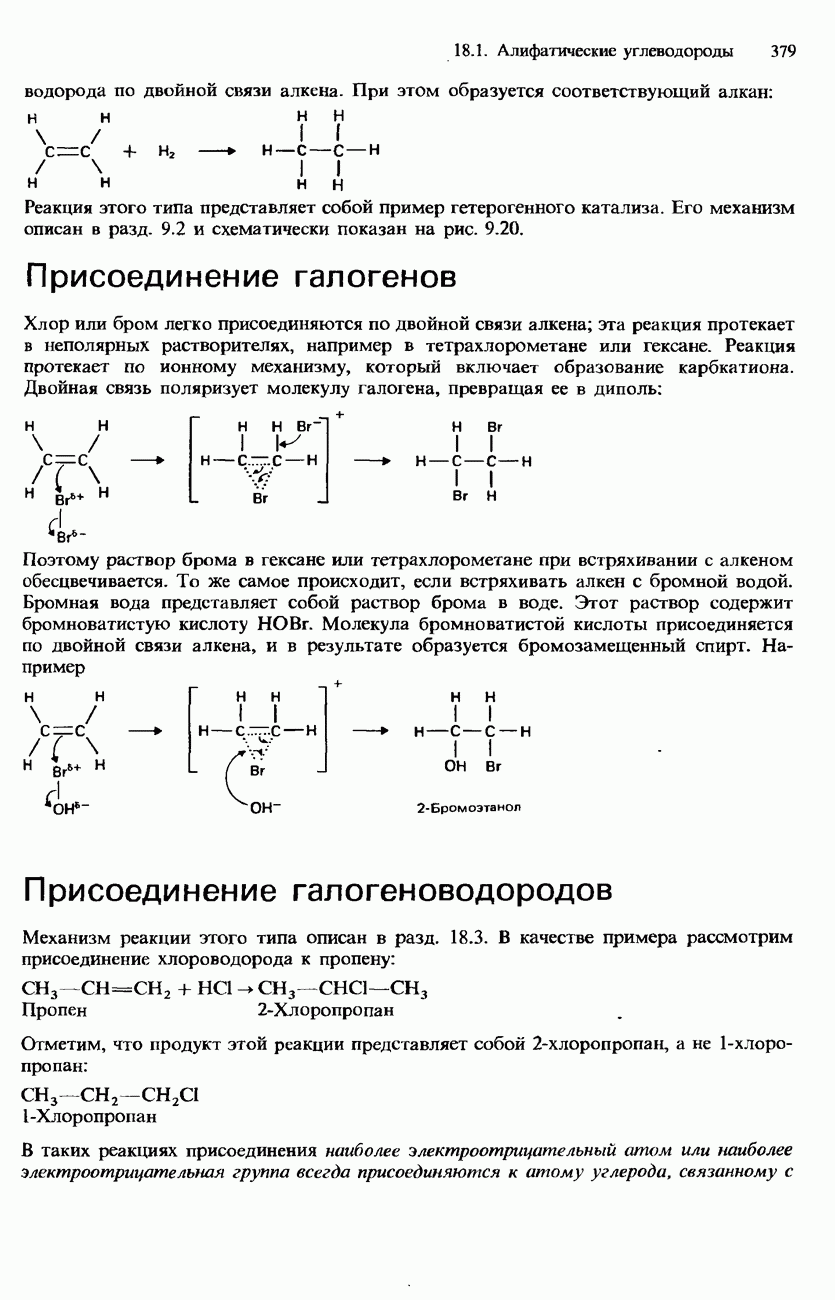
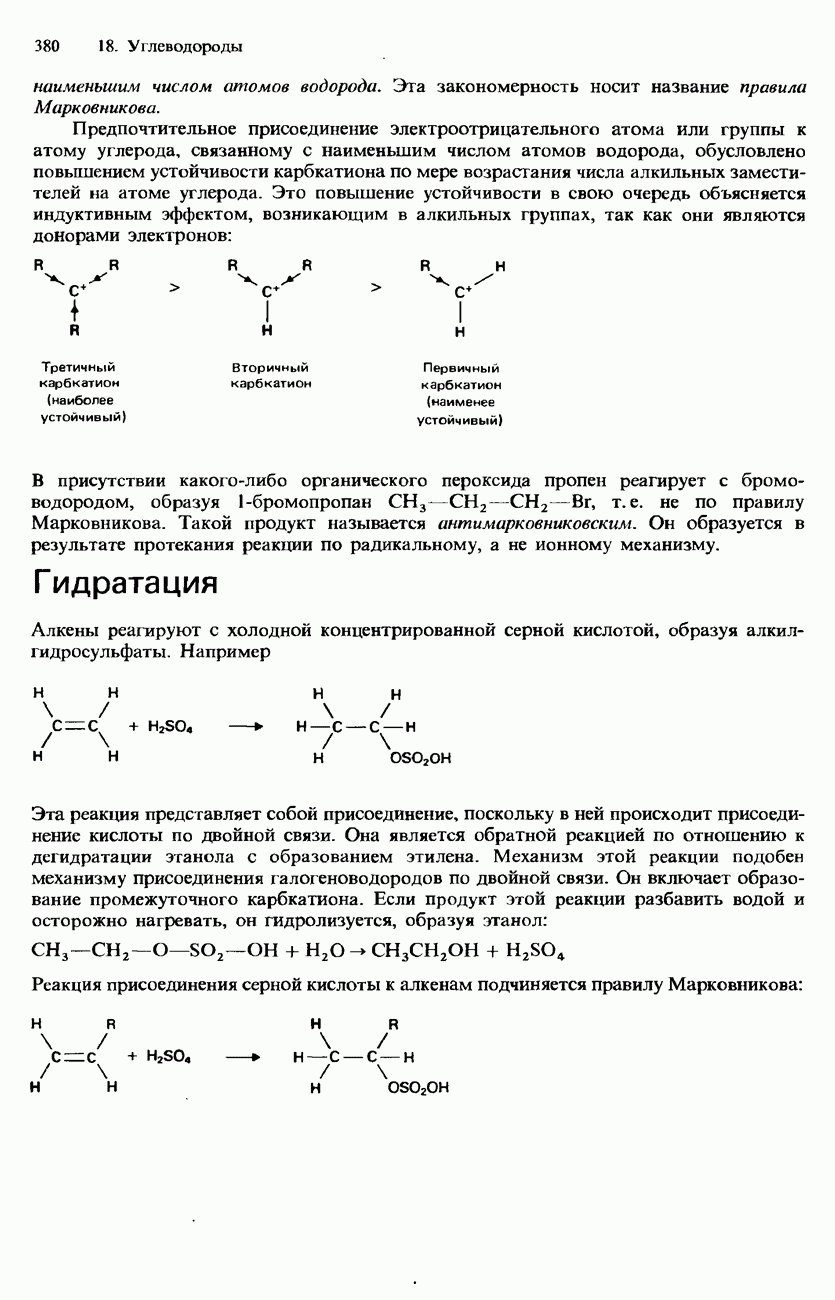
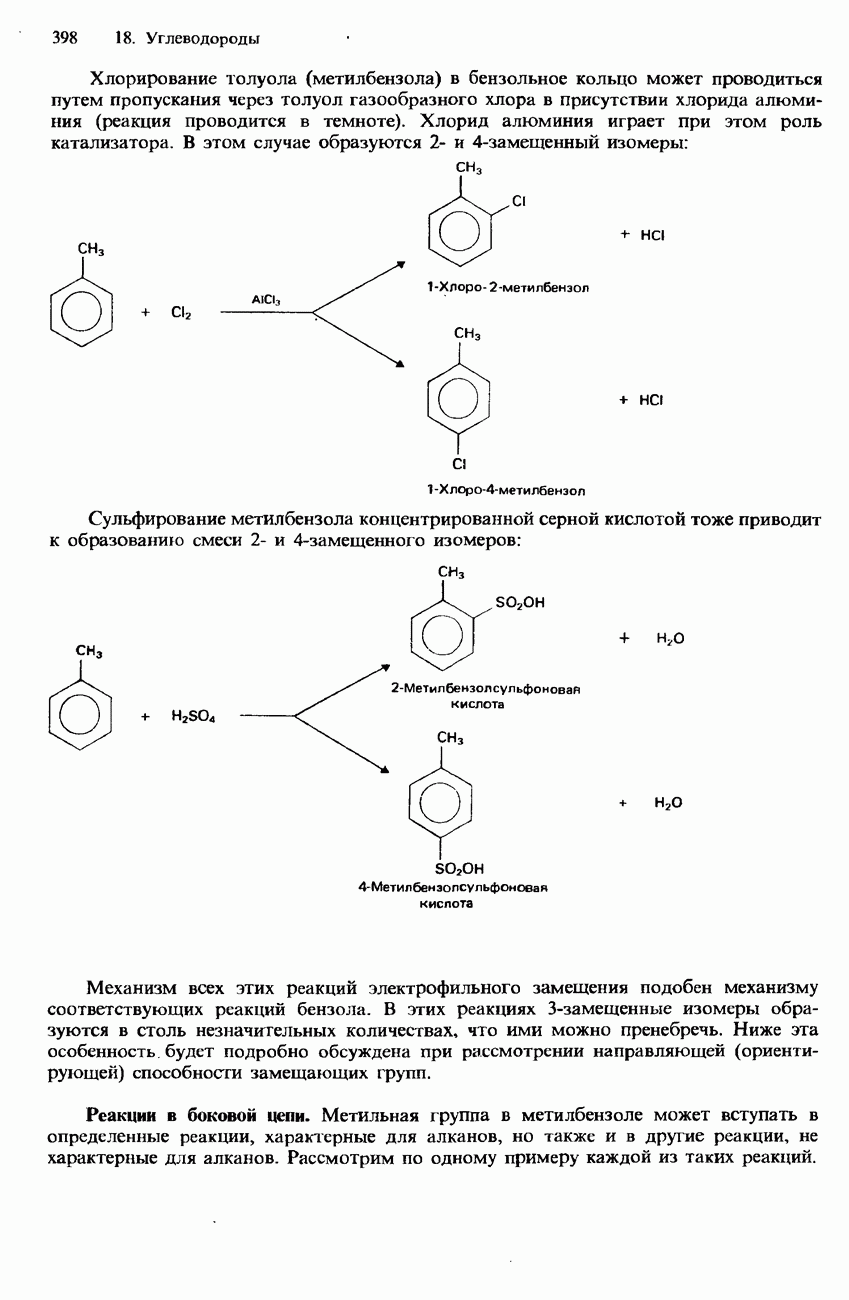
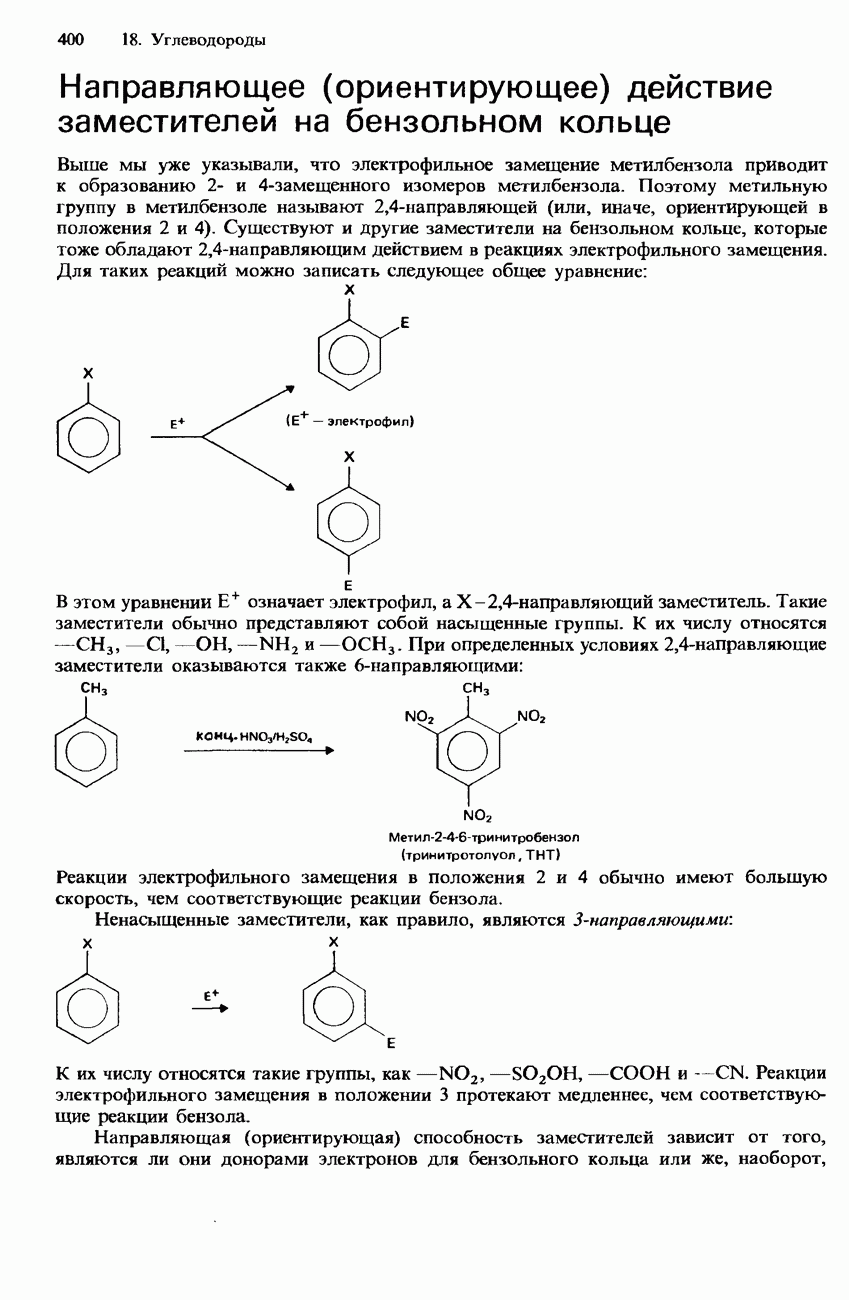
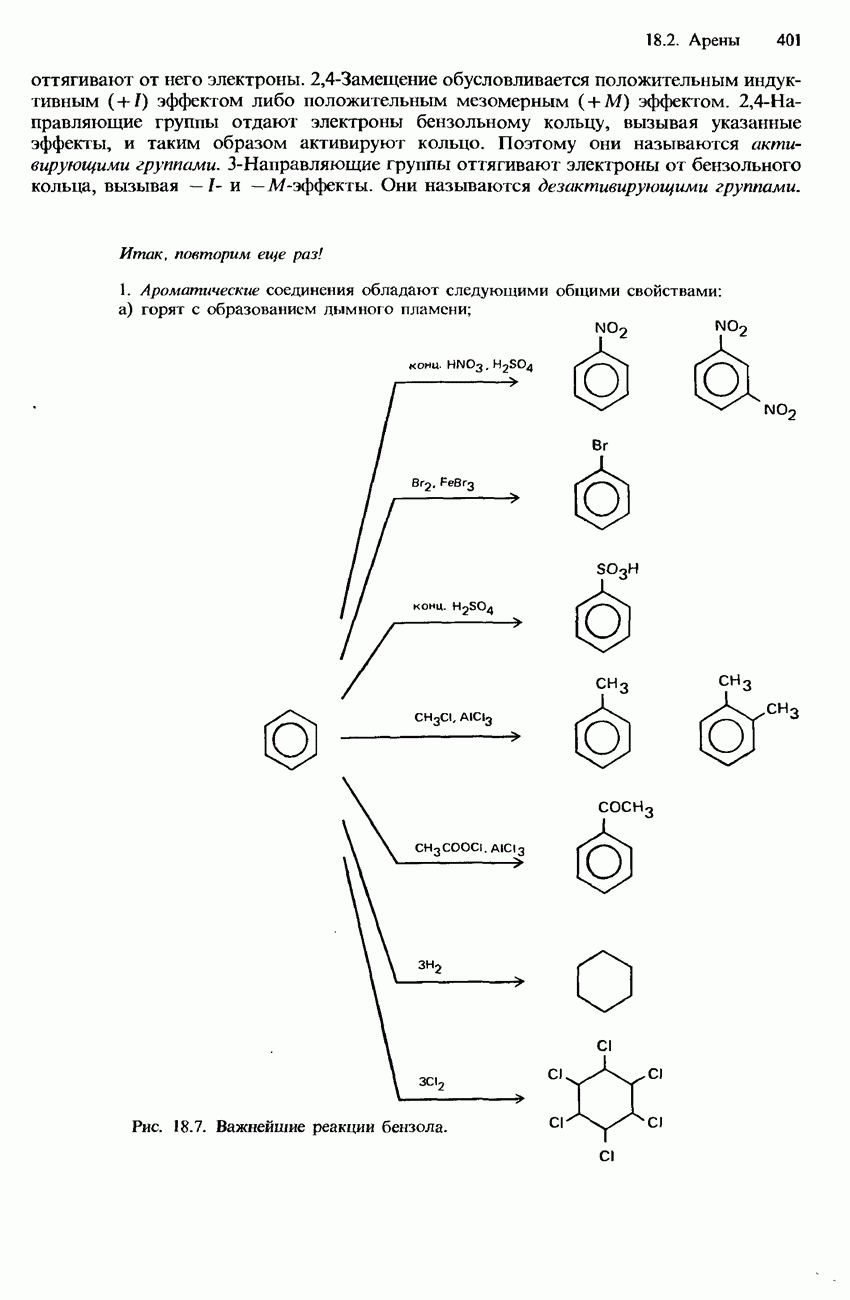
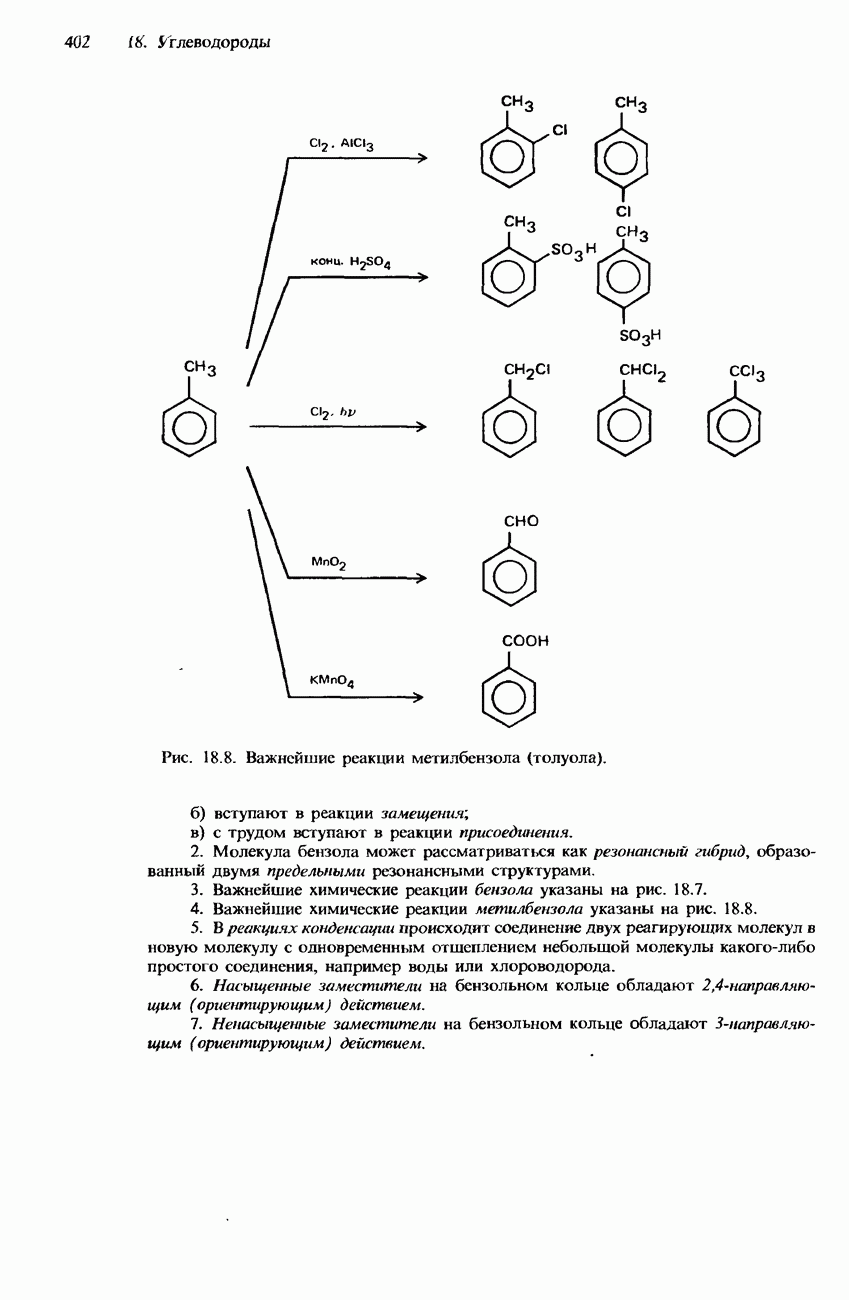
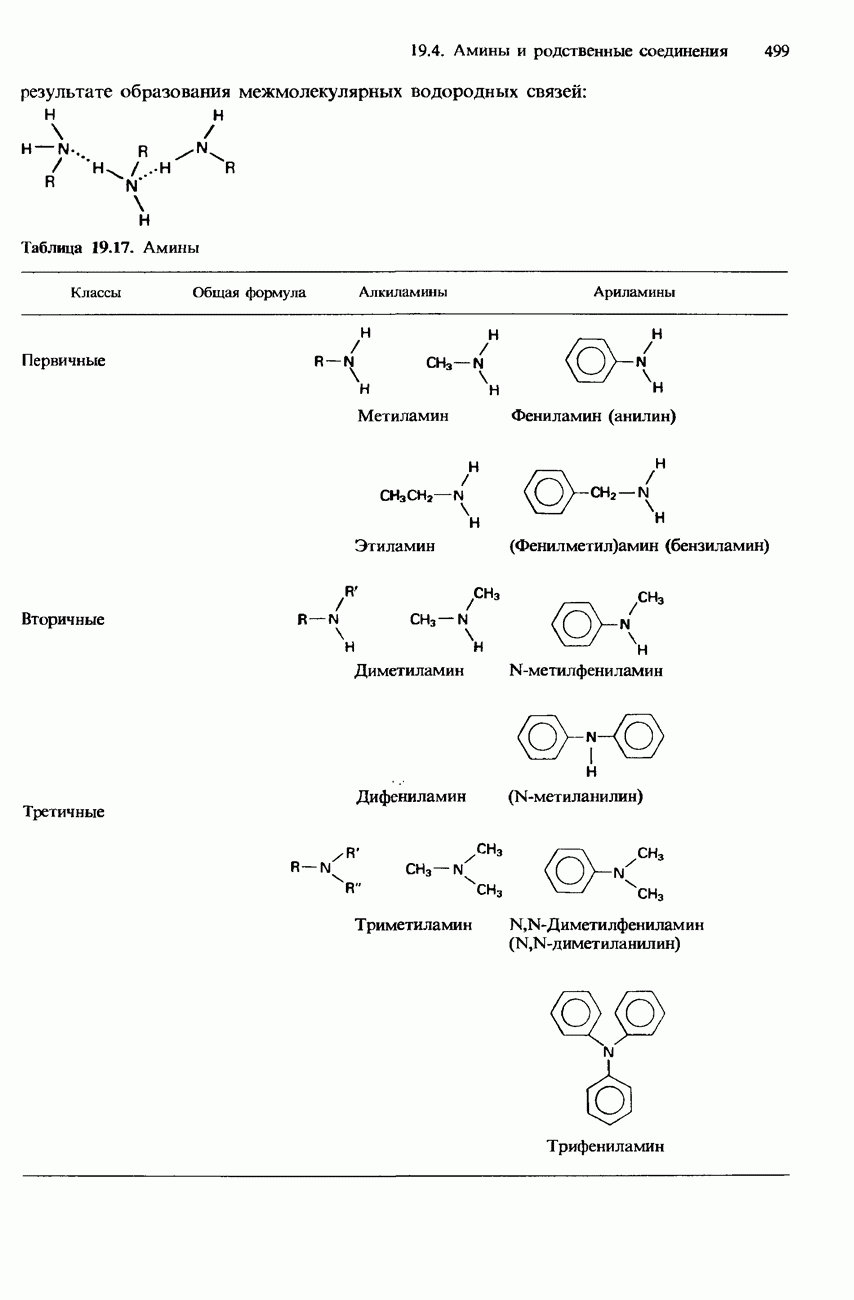
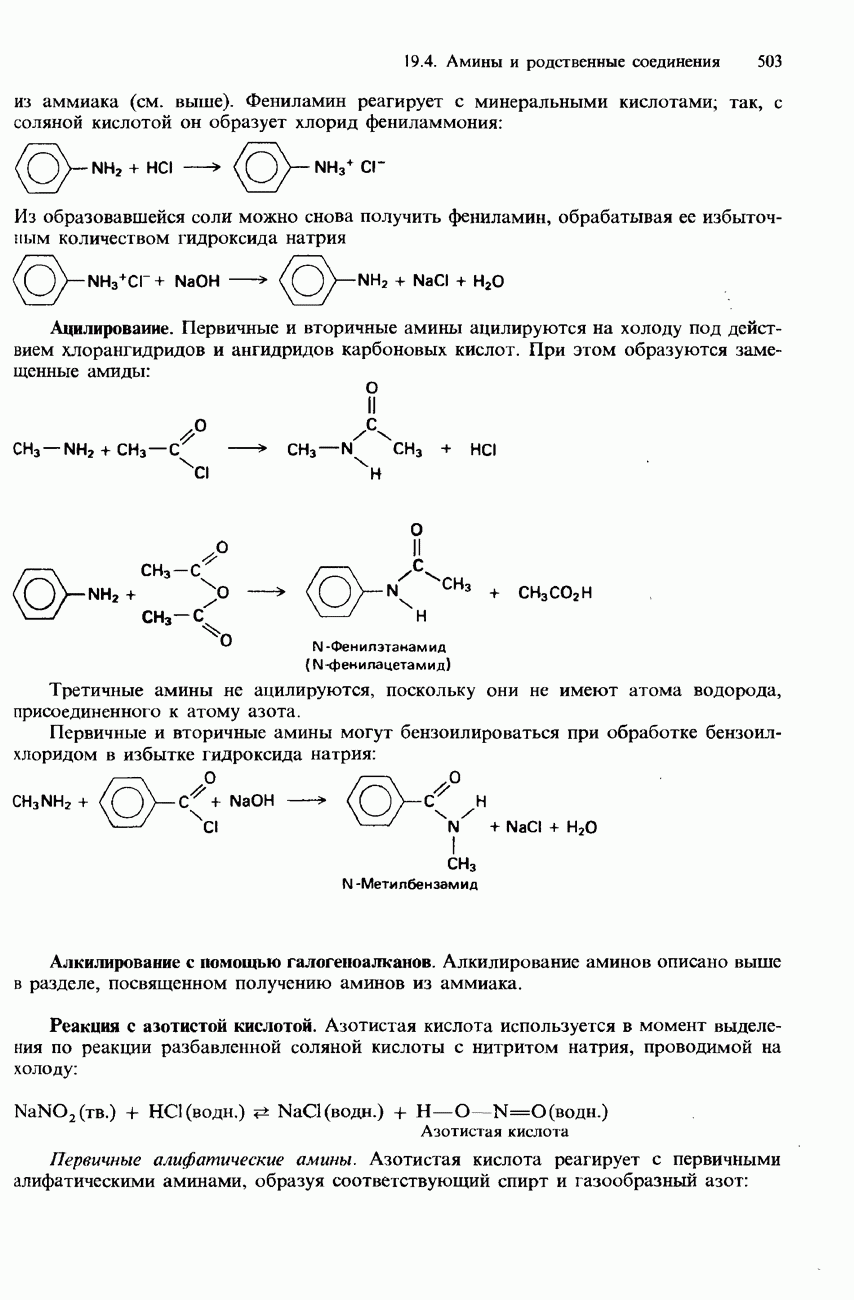
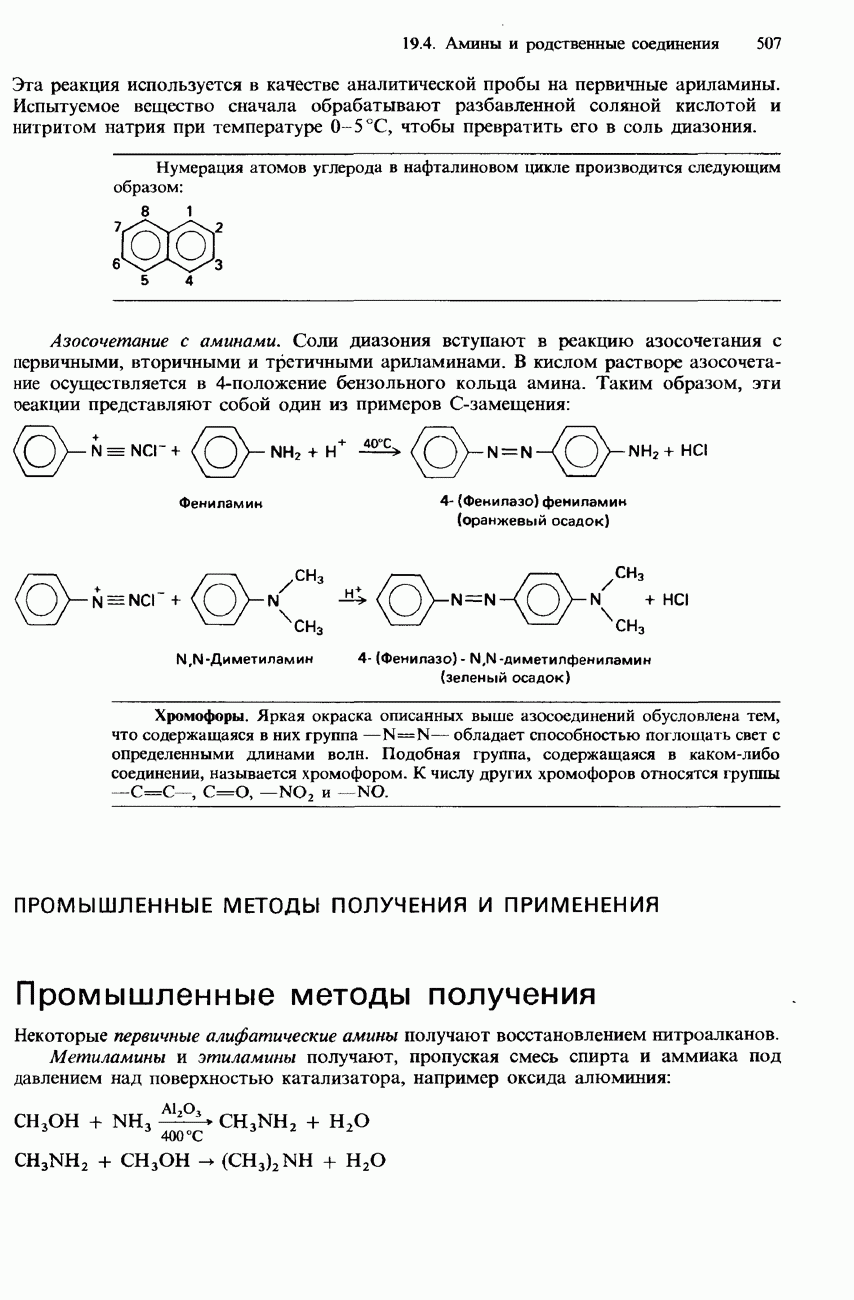
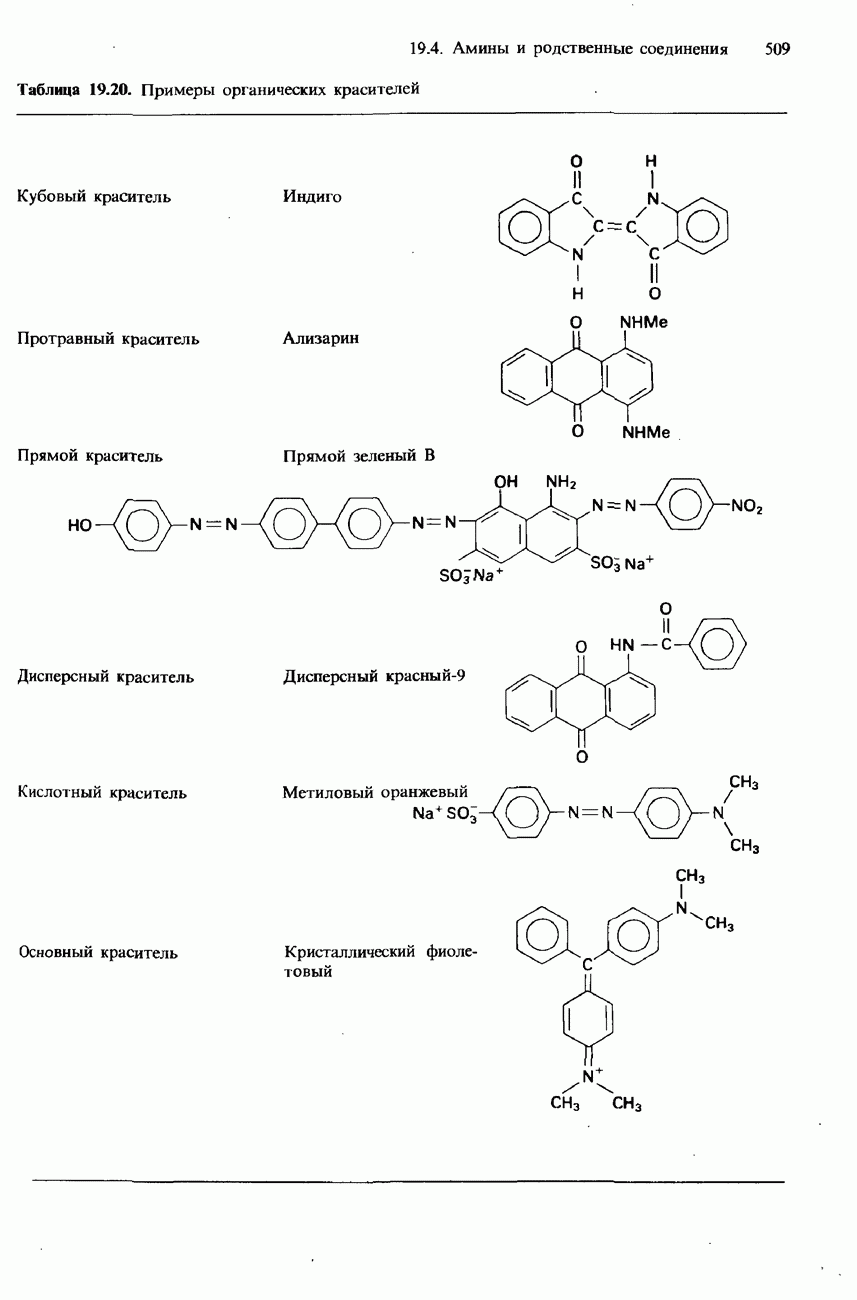
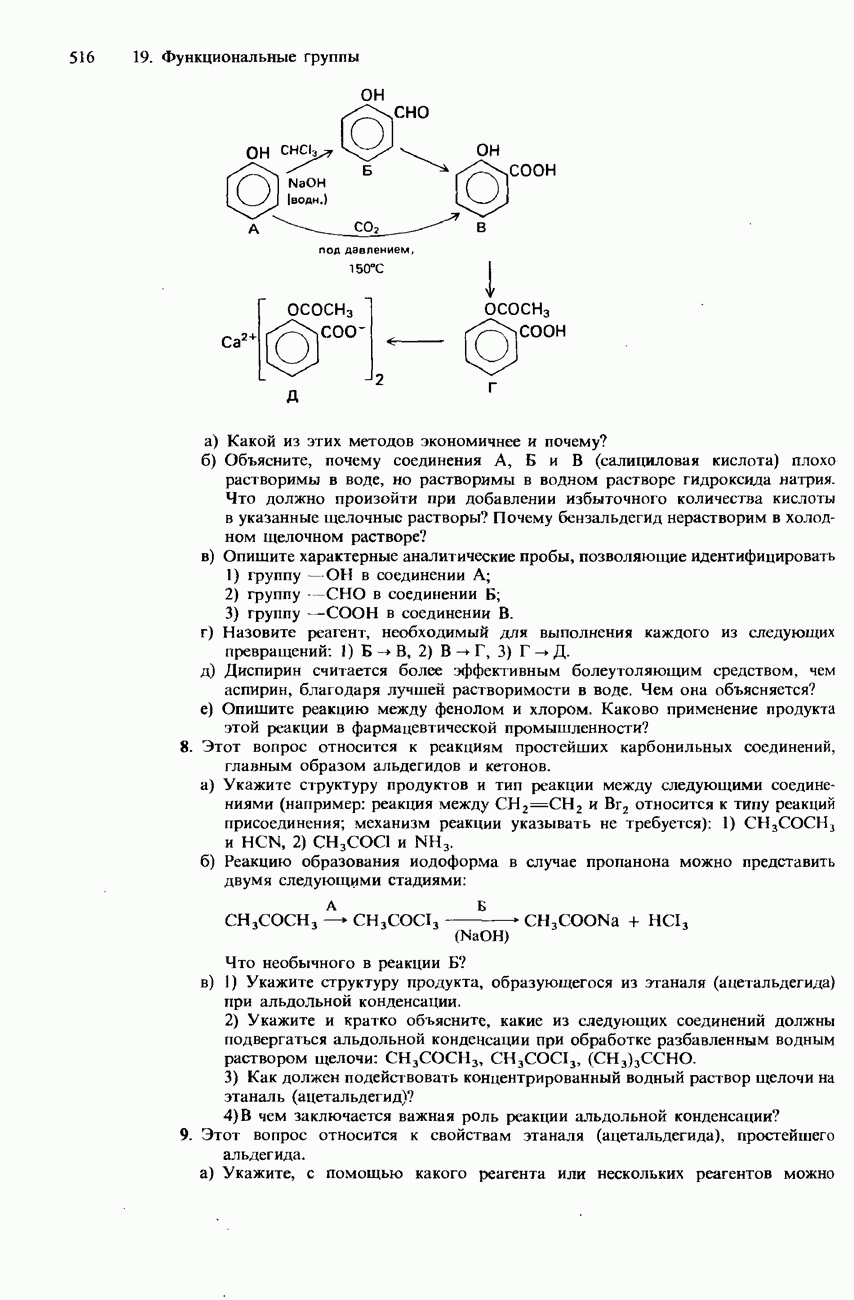
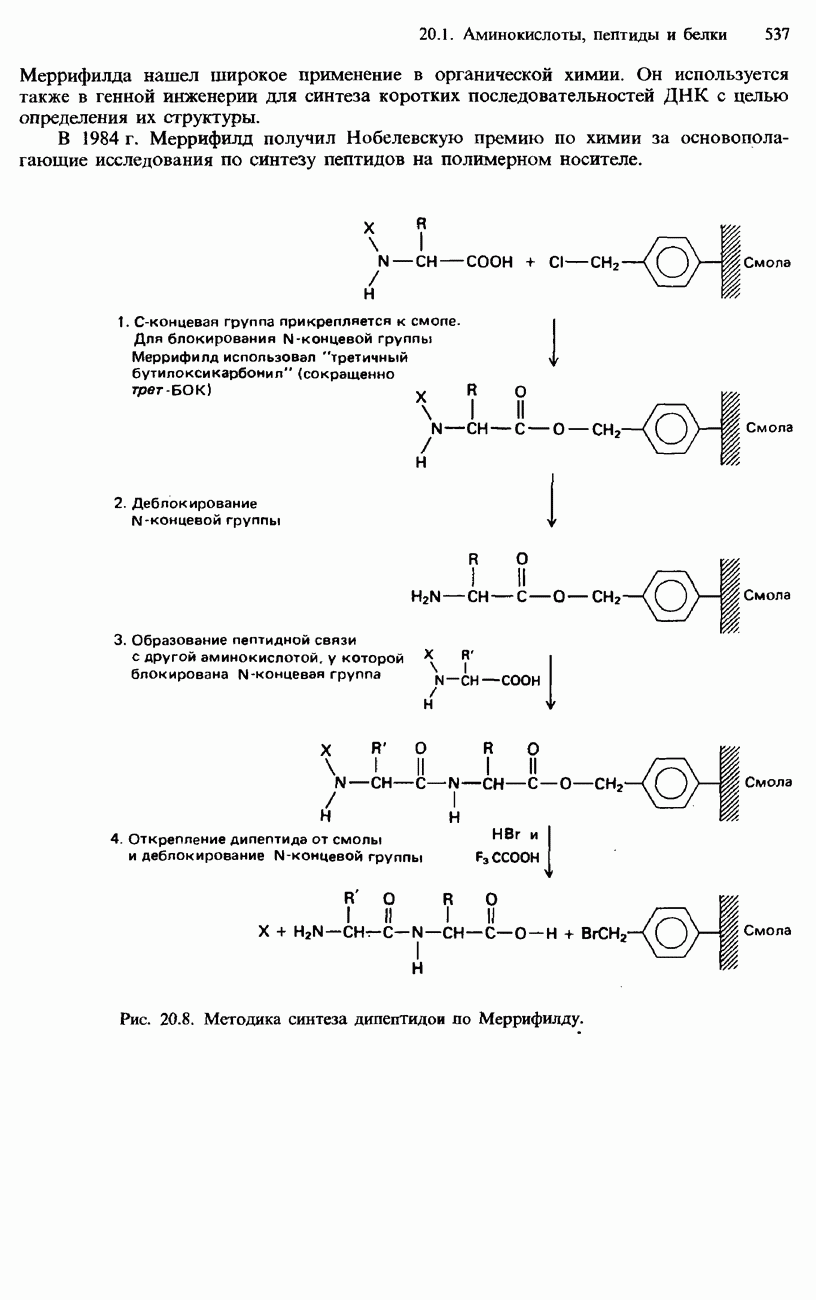
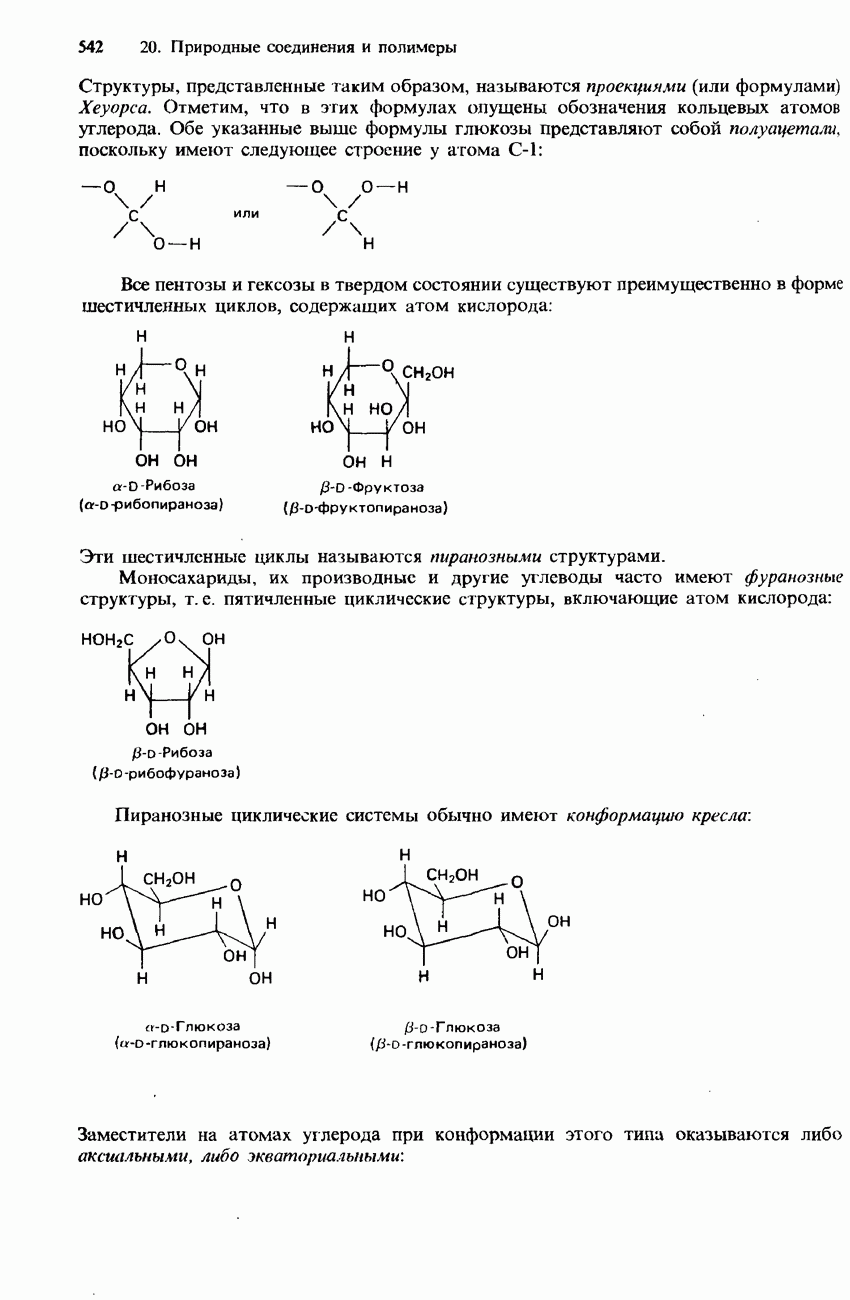
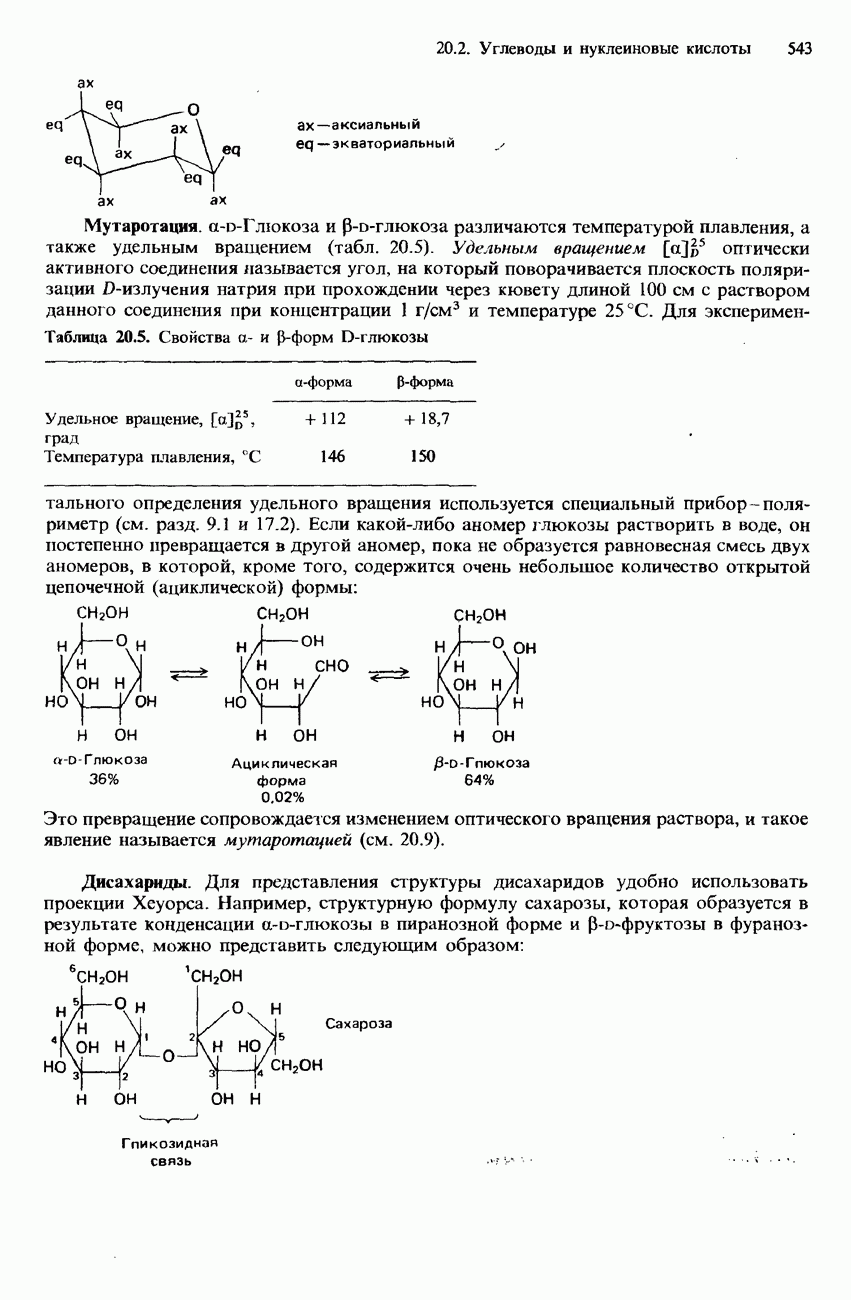
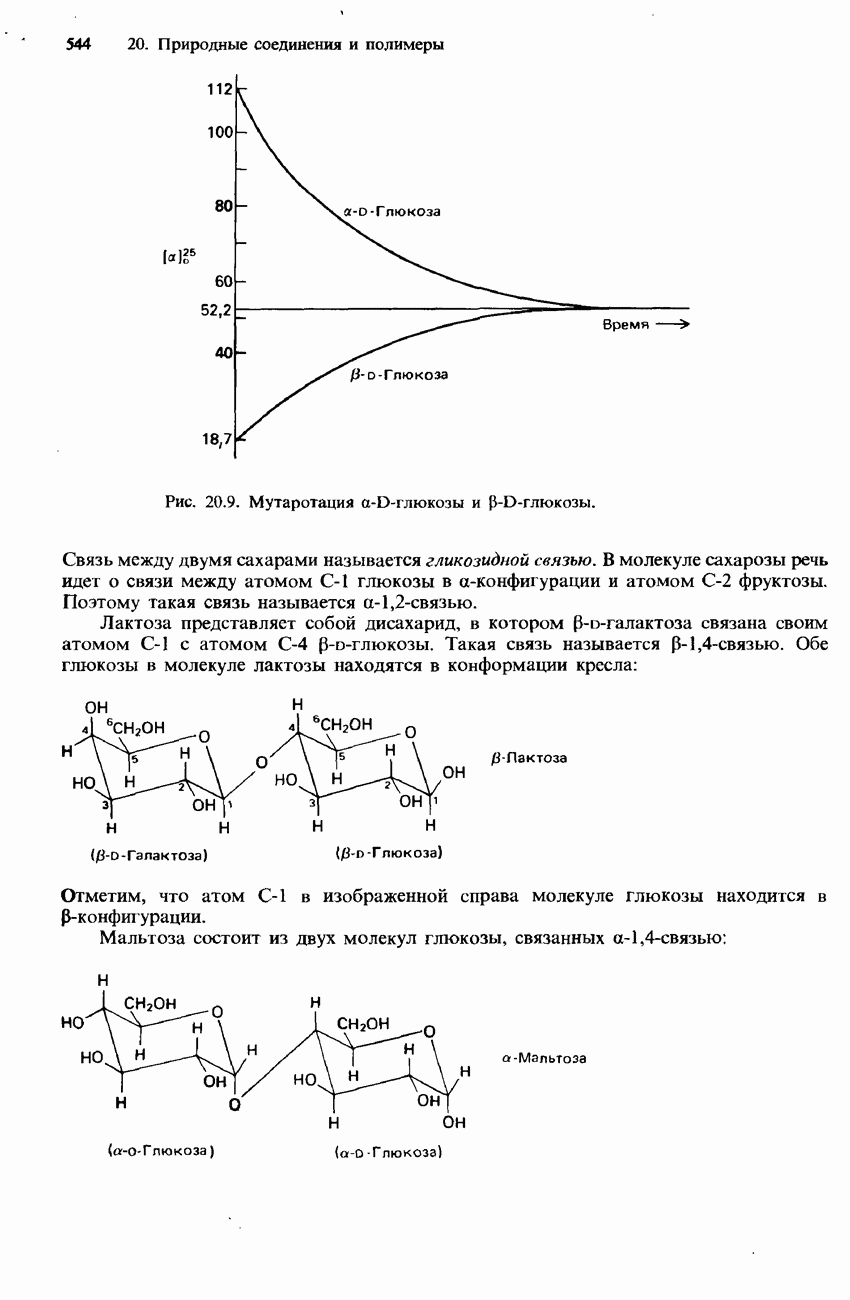
| << Предыдущий параграф | Следующий параграф >> |
Распознанный текст, спецсимволы и формулы могут содержать ошибки, поэтому с корректным вариантом рекомендуем ознакомиться на отсканированных изображениях учебника выше
Также, советуем воспользоваться поиском по сайту, мы уверены, что вы сможете найти больше информации по нужной Вам тематике
15.2. IV группа периодической системы
ЭЛЕМЕНТЫ
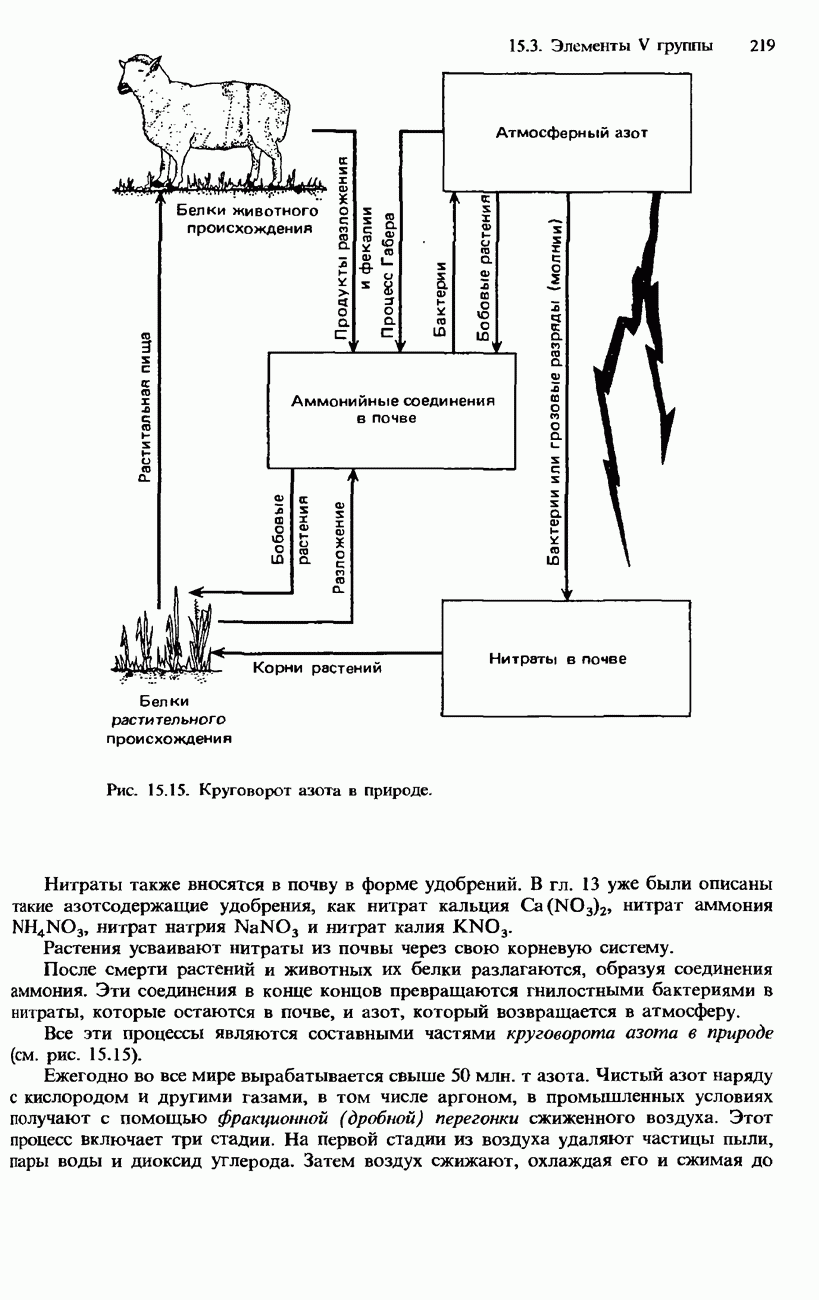
На рис. 15.4 показано расположение в периодической таблице пяти элементов IV группы. Подобно элементам III группы, они принадлежат, к числу p-элементов. Атомы всех элементов IV группы имеют однотипную электронную конфигурацию внешней оболочки:  . В табл. 15.4 указаны конкретная электронная конфигурация атомов и некоторые свойства элементов IV группы. Эти и другие физические и химические свойства элементов IV группы связаны с их строением, а именно: углерод (в форме алмаза), кремний и германий имеют каркасную кристаллическую алмазоподобную структуру (см. разд. 3.2); олово и свинец имеют металлическую структуру (гранецентрированную кубическую, см. также разд. 3.2).
. В табл. 15.4 указаны конкретная электронная конфигурация атомов и некоторые свойства элементов IV группы. Эти и другие физические и химические свойства элементов IV группы связаны с их строением, а именно: углерод (в форме алмаза), кремний и германий имеют каркасную кристаллическую алмазоподобную структуру (см. разд. 3.2); олово и свинец имеют металлическую структуру (гранецентрированную кубическую, см. также разд. 3.2).

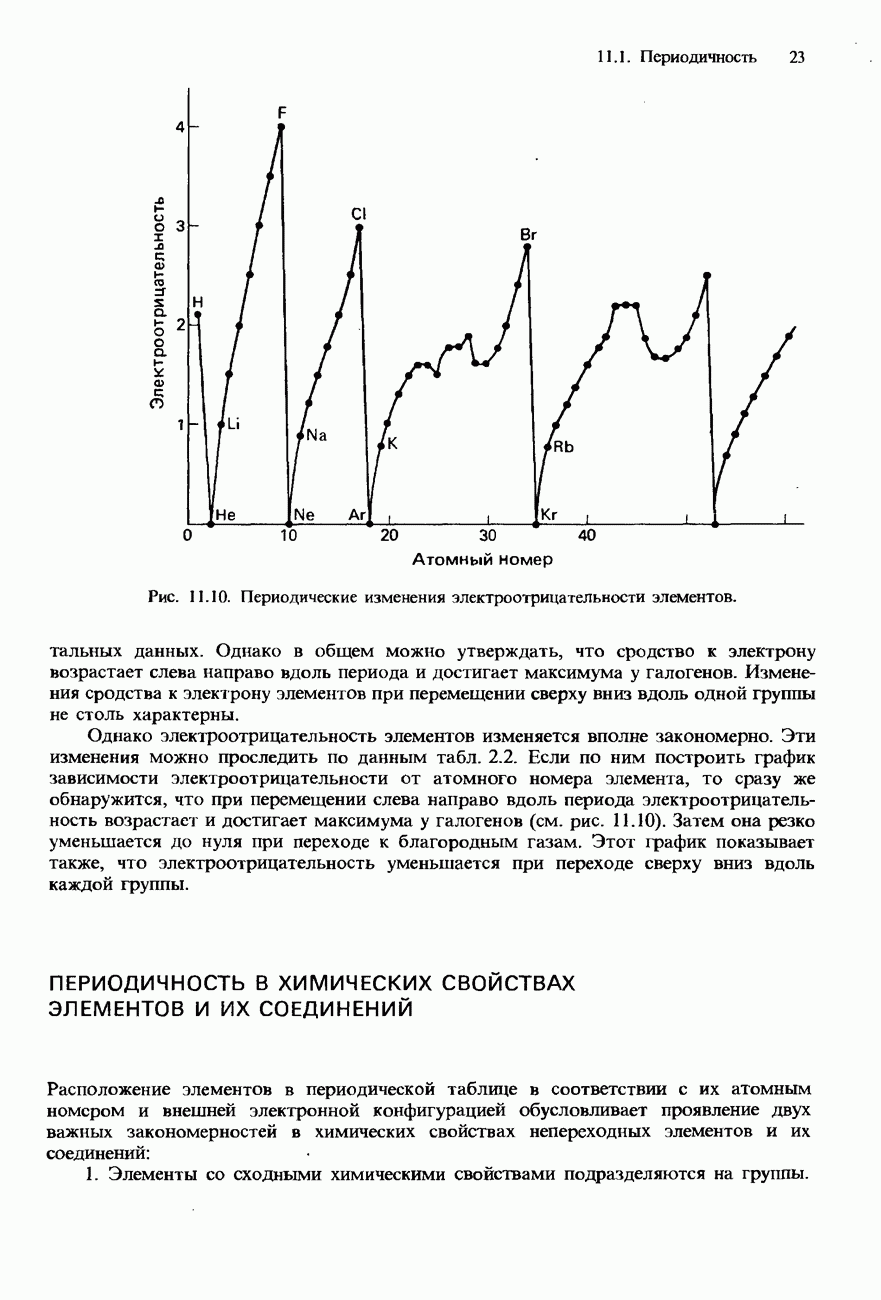
Рис. 15.4. Положение элементов IV группы в периодической системе.
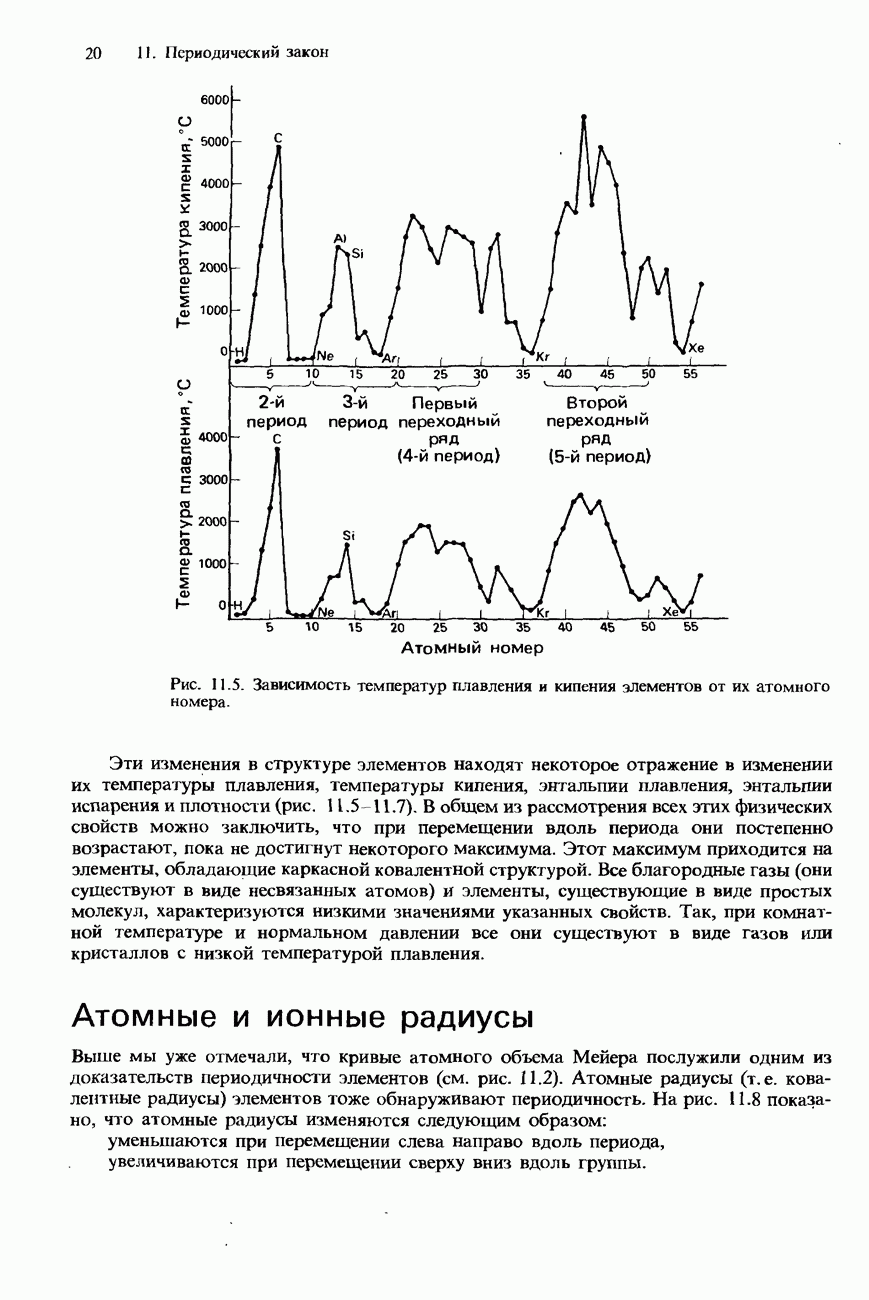
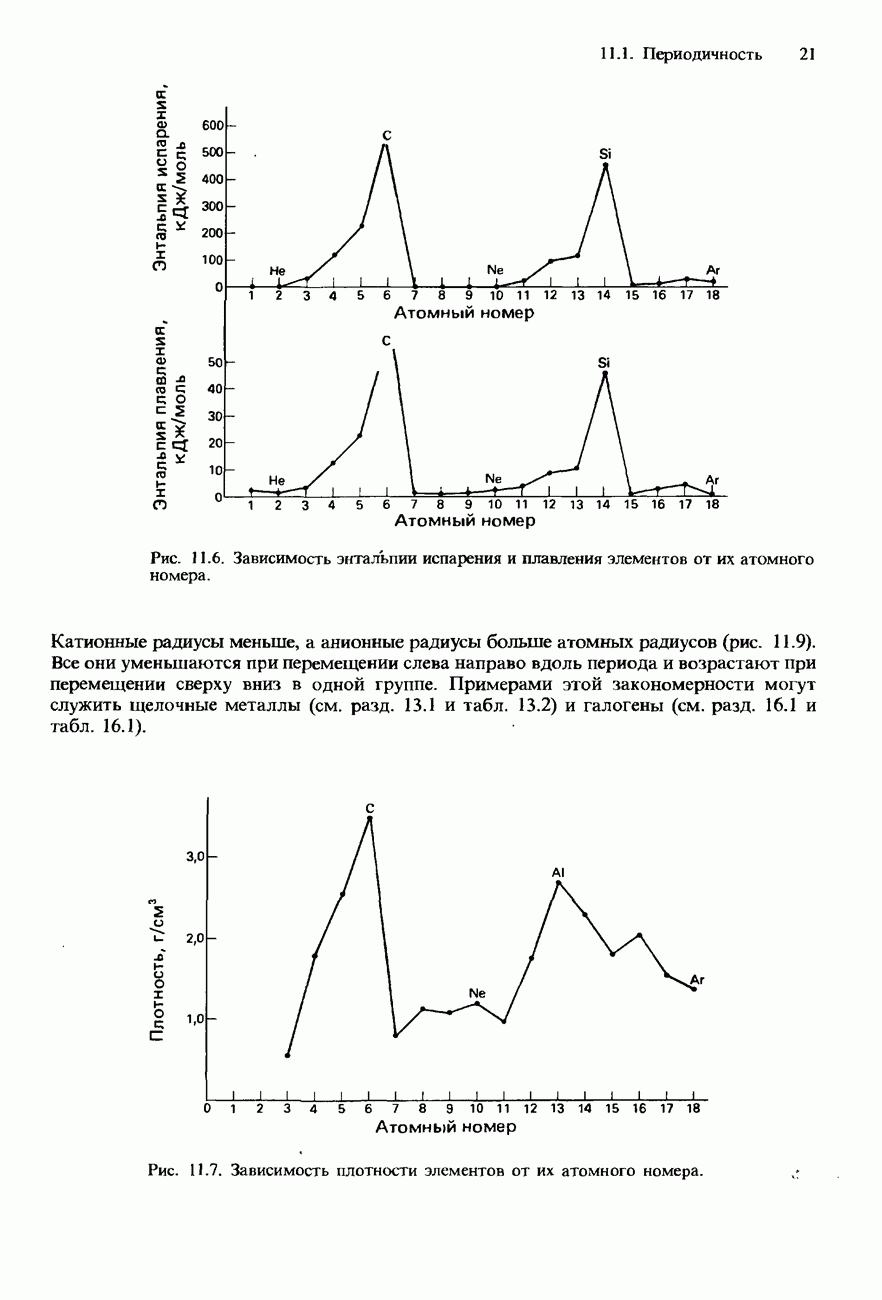
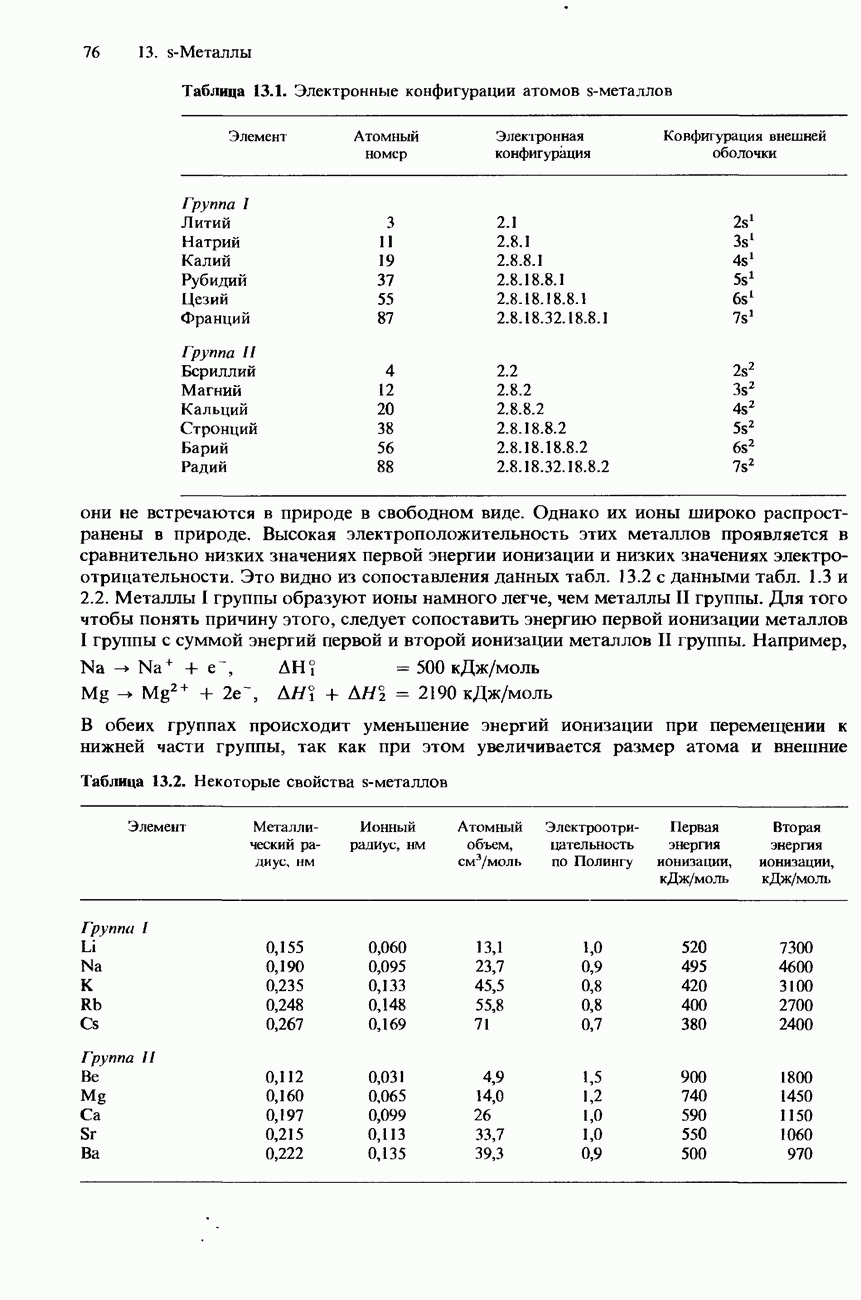
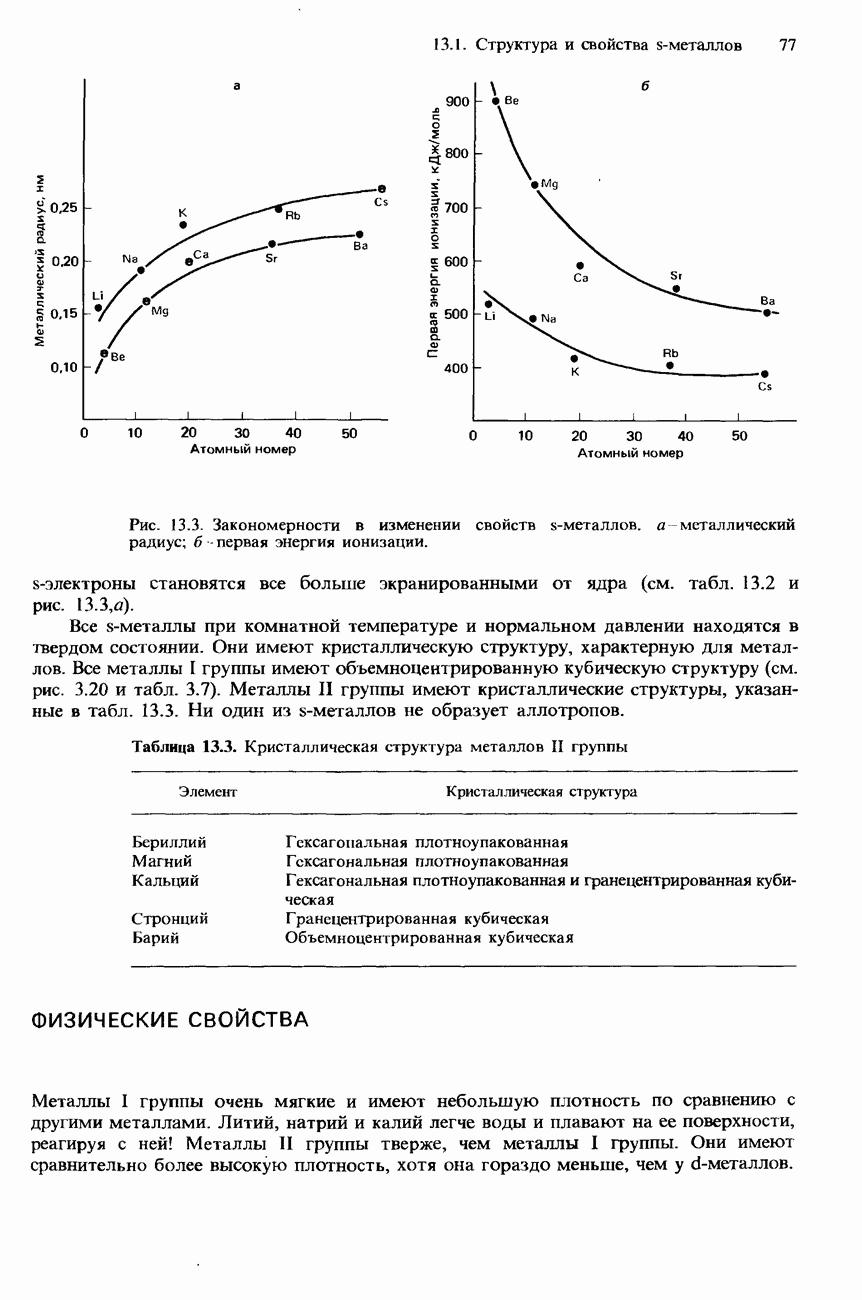
При перемещении вниз по группе происходит возрастание атомного радиуса элементов и ослабление связи между атомами. Из-за последовательно усиливающейся делокализации электронов внешних атомных оболочек в этом же направлении пррисходит и возрастание электропроводности элементов IV группы. Их свойства
Таблица 15.4. Электронные конфигурации и физические свойства элементов IV группы

постепенно изменяются от неметаллических к металлическим: углерод - неметаллический элемент и в форме алмаза является изолятором (диэлектриком); кремний и германий - полупроводники; олово и свинец - металлы и хорошие проводники.
Из-за возрастания размера атомов при переходе от элементов верхней части группы к элементам ее нижней части происходит последовательное ослабление связи между атомами и, соответственно этому, уменьшение температуры плавления и температуры кипения, а также твердости элементов.
Аллотропия
Кремний, германий и свинец существуют каждый лишь в одной структурной форме. Однако углерод и олово существуют в нескольких структурных формах. Различные структурные формы одного элемента называются аллотропами (см. разд. 3.2).
Углерод имеет два аллотропа: алмаз и графит. Их структура описана в разд. 3.2. Аллотропия углерода - пример монотропии, для которой характерны следующие особенности: 1) аллотропы могут существовать в определенном интервале температур и давлений (например, как алмаз, так и графит существуют при комнатной температуре и атмосферном давлении); 2) не существует температуры перехода, при которой один аллотроп превращается в другой; 3) один аллотроп более устойчив, чем другой. Например, графит обладает большей устойчивостью, чем алмаз. Менее устойчивые формы называются метастабилъными. Следовательно, алмаз представляет собой метастабильный аллотроп (или монотроп) углерода.
Углерод может еще существовать в других формах, к которым относятся древесный уголь, кокс и газовая сажа. Все они являются неочищенными формами углерода. Иногда их называют аморфными формами, а раньше считали, что они представляют собой третью аллотропную форму углерода. Термин аморфный означает бесформенный. В настоящее время установлено, что «аморфный» углерод-это не что иное, как микрокристаллический графит.
Олово существует в трех аллотропных формах. Они называются: серое олово (а-олово), белое олово (Р-олово) и ромбическое олово (у-олово). Аллотропия такого типа, как у олова, называется энантиотропией. Она характеризуется следующими особенностями: 1) превращение одного аллотропа в другой происходит при определенной температуре, называемой температурой перехода; например

Структура влмаза Металлическая (полупроводник) структура 2) каждый аллотроп устойчив только в определенном интервале температур.
Реакционная способность элементов IV группы
Реакционная способность элементов IV группы в целом возрастает при перемещении к нижней части группы, от углерода к свинцу. В электрохимическом ряду напряжений только олово и свинец расположены выше водорода (см. разд. 10.3). Свинец очень медленно реагирует с разбавленными кислотами, высвобождая водород. Реакция между оловом и разбавленными кислотами протекает с умеренной скоростью.
Углерод окисляется  орячими концентрированными кислотами, например концентрированной азотной кислотой и концентрированной серной кислотой:
орячими концентрированными кислотами, например концентрированной азотной кислотой и концентрированной серной кислотой:

Кремний не реагирует ни с какими кислотами, кроме плавиковой (фтороводородной) кислоты.
Все элементы IV группы, кроме углерода, реагируют со щелочами. Например, кремний реагирует с разбавленным раствором гидроксида натрия, образуя силикат натрия:

Олово и свинец реагируют с горячим концентрированным раствором гидроксида натрия, образуя  и
и  соответственно.
соответственно.
Все элементы IV группы, за исключением свинца, при нагревании реагируют с кислородом, образуя диоксиды. Например

Свинец соединяется с кислородом, образуя оксид  РЬО.
РЬО.
Углерод восстанавливает водяной пар (см. разд. 12.1) и оксиды многих металлов (см. разд. 5.3).
| << Предыдущий параграф | Следующий параграф >> |
- 11. ПЕРИОДИЧЕСКИЙ ЗАКОН
- 11.1 Периодичность
- СОВРЕМЕННАЯ ФОРМА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ
- ПЕРИОДИЧНОСТЬ
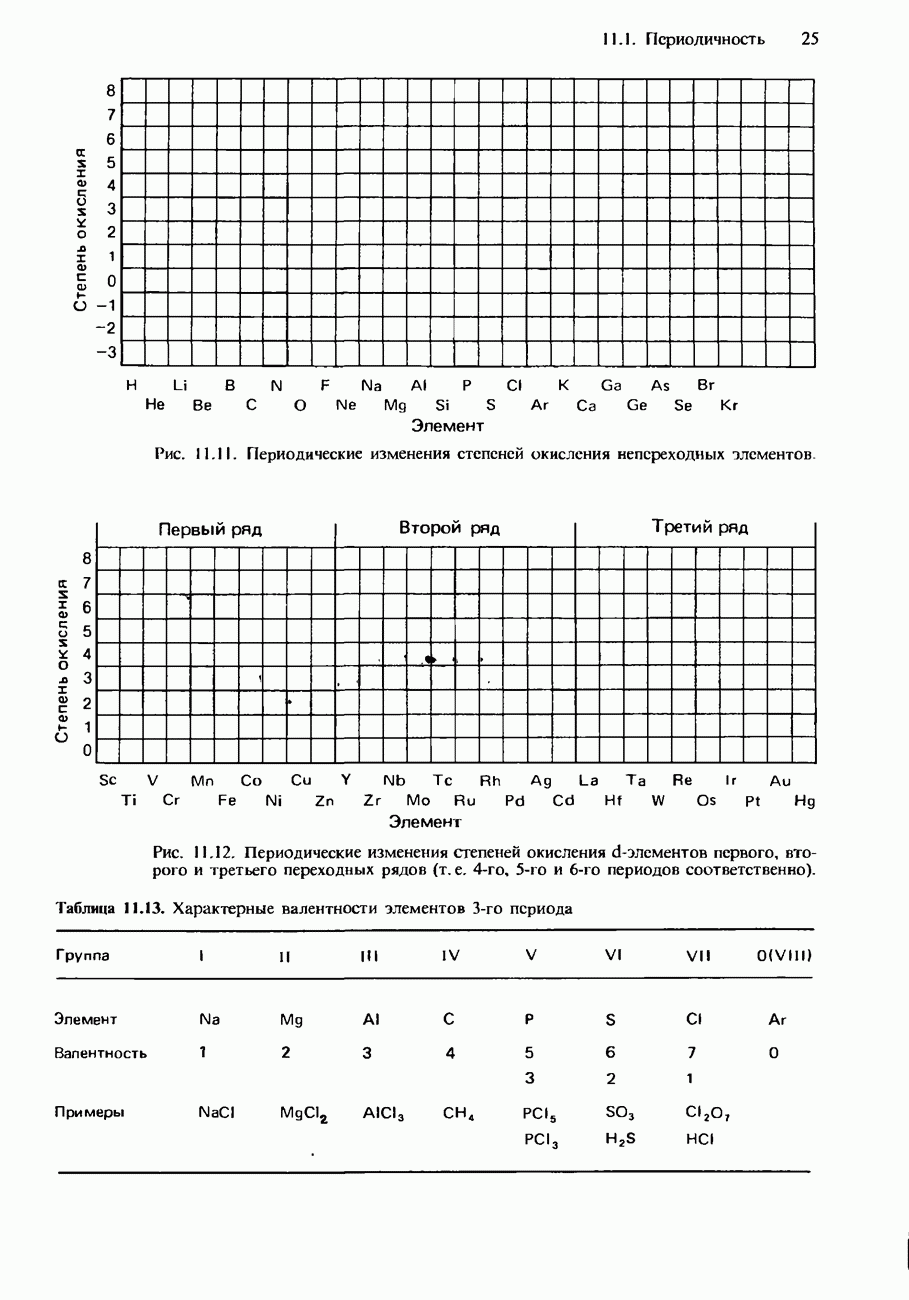
- ПЕРИОДИЧНОСТЬ В ХИМИЧЕСКИХ СВОЙСТВАХ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 12. ВОДОРОД И ВОДА
- 12.1. ВОДОРОД
- ПОЛУЧЕНИЕ ВОДОРОДА В ЛАБОРАТОРНЫХ УСЛОВИЯХ
- РАЗЛИЧНЫЕ ФОРМЫ ВОДОРОДА
- ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА
- ТИПЫ СОЕДИНЕНИЙ ВОДОРОДА
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПОЛУЧЕНИЕ И ИСПОЛЬЗОВАНИЕ ВОДОРОДА
- 12.2 Вода
- ХИМИЧЕСКИЕ РЕАКЦИИ С УЧАСТИЕМ ВОДЫ
- ИСТОЧНИКИ ПРЕСНОЙ ВОДЫ И ЕЕ ИСПОЛЬЗОВАНИЕ
- КАЧЕСТВО ВОДЫ
- ЗАГРЯЗНЕНИЕ ВОДЫ
- ОЧИСТКА И ПОДГОТОВКА ВОДЫ
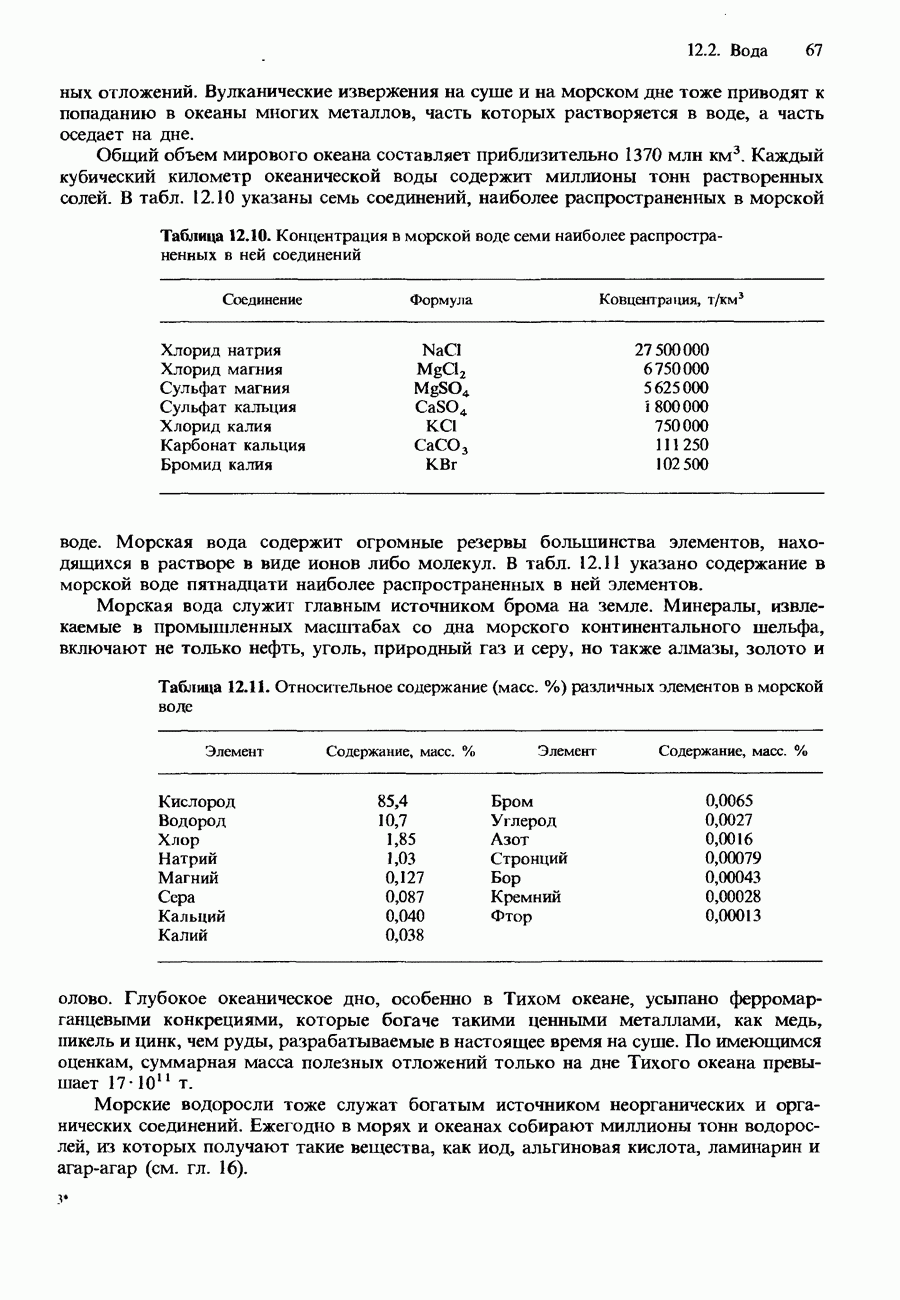
- ОКЕАНЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 13. s-Металлы
- 13.1 Структура и свойства s-металлов
- СТРУКТУРА
- ФИЗИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ S-МЕТАЛЛОВ
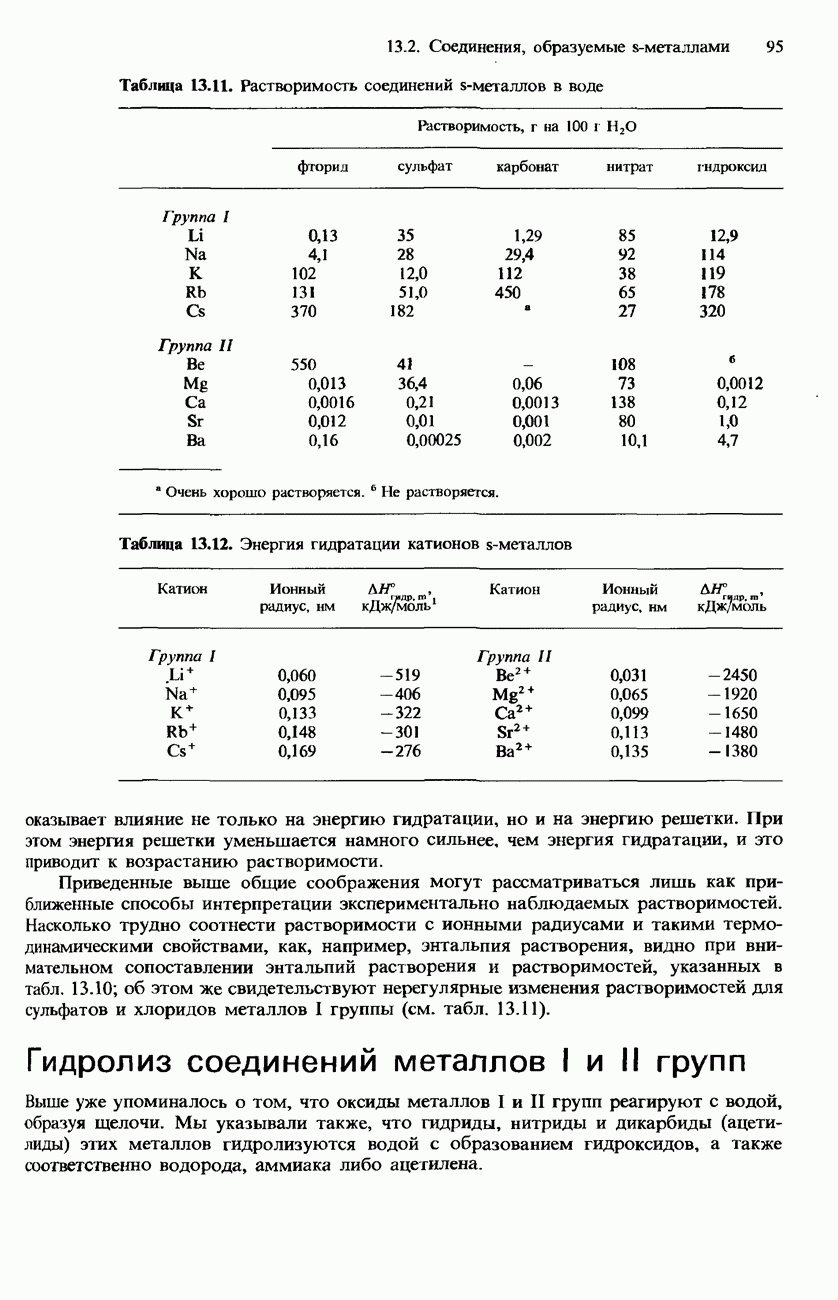
- 13.2 Соединения, образуемые s-металлами
- ДРУГИЕ БИНАРНЫЕ СОЕДИНЕНИЯ
- ГИДРОКСИДЫ
- КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
- ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
- ТЕРМИЧЕСКАЯ УСТОЙЧИВОСТЬ ОКСОСОЕДИНЕНИЙ S-МЕТАЛЛОВ
- РАСТВОРИМОСТЬ СОЛЕЙ И ГИДРОКСИДОВ МЕТАЛЛОВ I И II ГРУПП В ВОДЕ
- АНОМАЛЬНЫЕ СВОЙСТВА ЛИТИЯ И БЕРИЛЛИЯ, А ТАКЖЕ ИХ СОЕДИНЕНИЙ
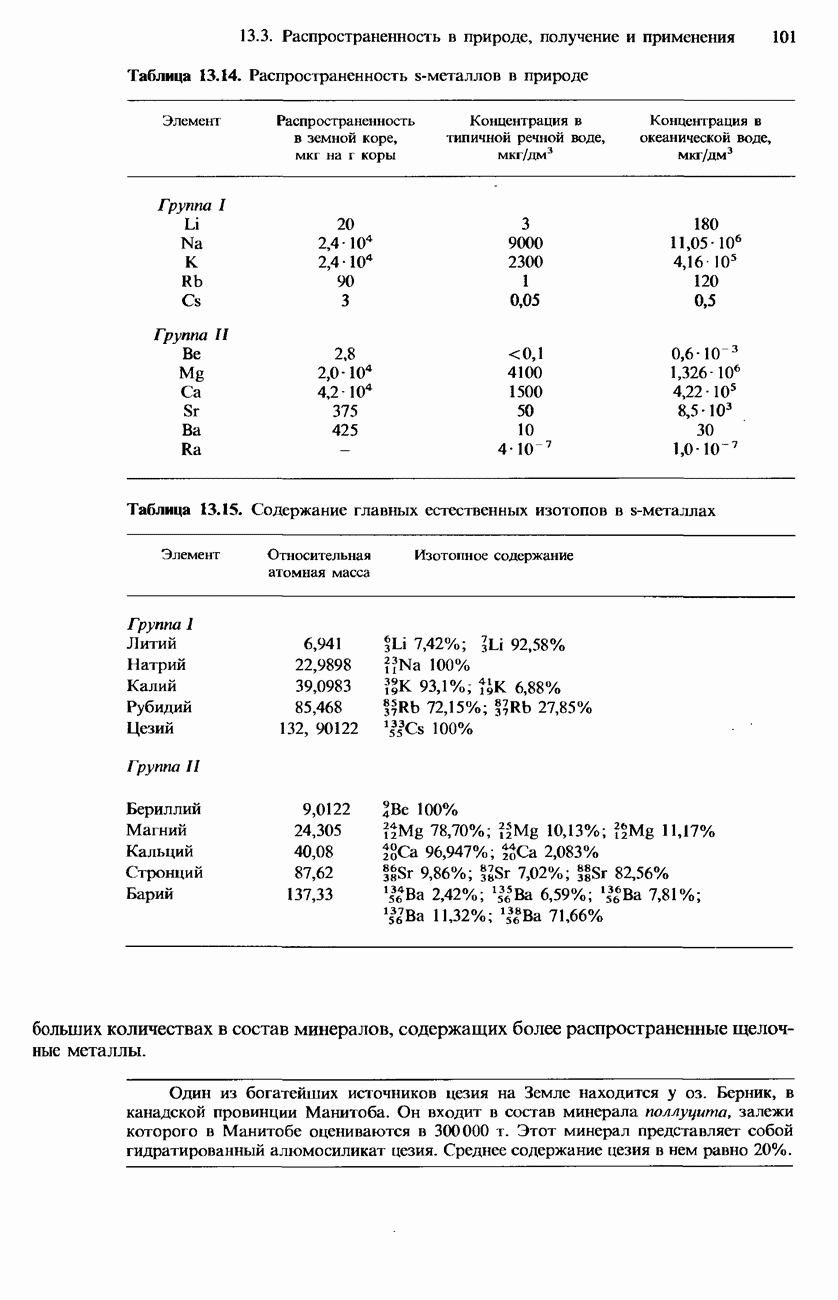
- 13.3. Распространенность в природе, получение и применение
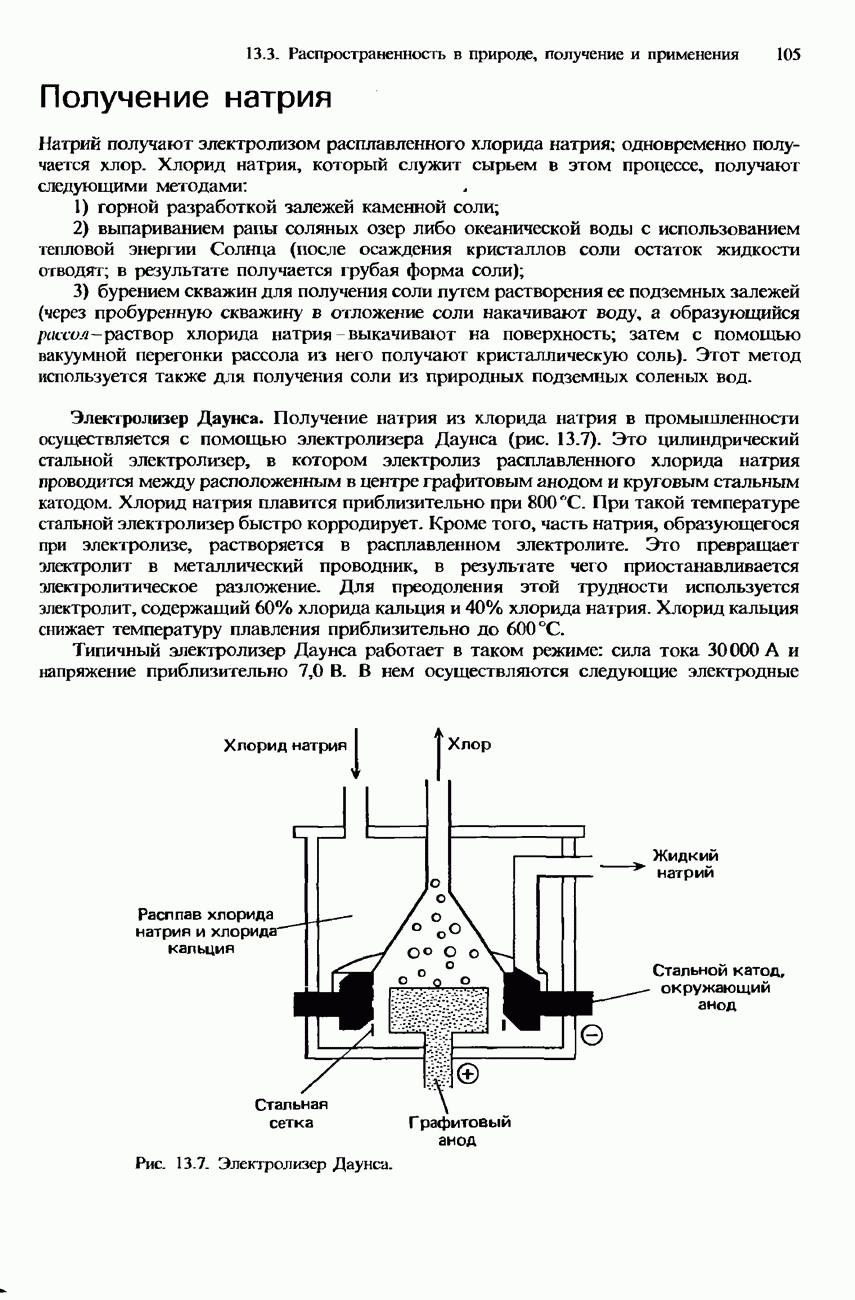
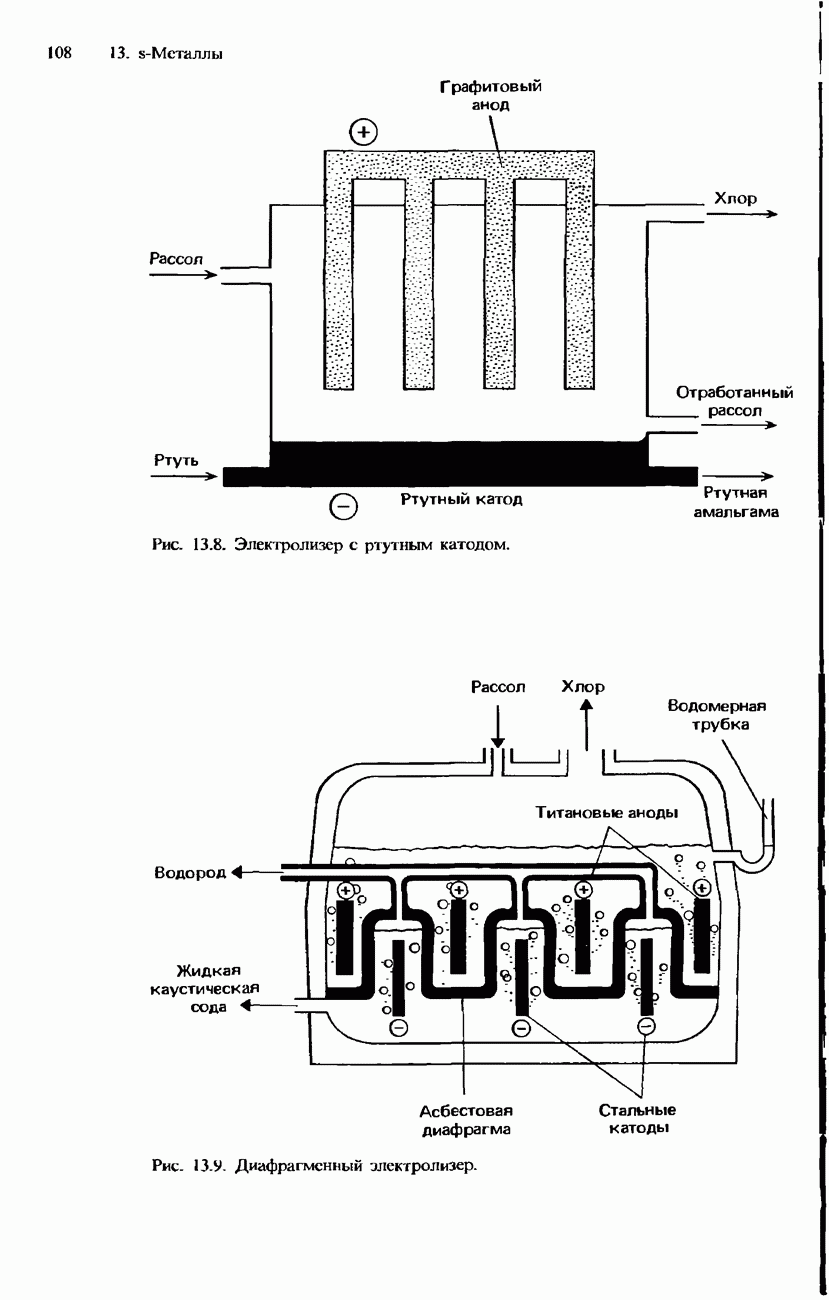
- ПОЛУЧЕНИЕ S-МЕТАЛЛОВ
- ПОЛУЧЕНИЕ СОЕДИНЕНИЙ S-МЕТАЛЛОВ
- ПРИМЕНЕНИЕ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 14. d-ЭЛЕМЕНТЫ
- 14.1. Структура и свойства d-элементов
- d-ЭЛЕМЕНТЫ
- ФИЗИЧЕСКИЕ СВОЙСТВА
- ХИМИЧЕСКИЕ СВОЙСТВА
- 14.2 Химия семи d-элементов
- МАРГАНЕЦ
- ЖЕЛЕЗО
- КОБАЛЬТ
- НИКЕЛЬ
- МЕДЬ
- ЦИНК
- 14.3. Распространенность в природе, получение и применения
- ПРОИЗВОДСТВО ЖЕЛЕЗА И СТАЛИ
- ПОЛУЧЕНИЕ ДРУГИХ МЕТАЛЛОВ ПЕРВОГО ПЕРЕХОДНОГО РЯДА
- ПРИМЕНЕНИЯ d-ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 15. ЭЛЕМЕНТЫ III-VI ГРУПП
- 15.1. Алюминий и другие элементы III группы
- БОР
- ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА АЛЮМИНИЯ
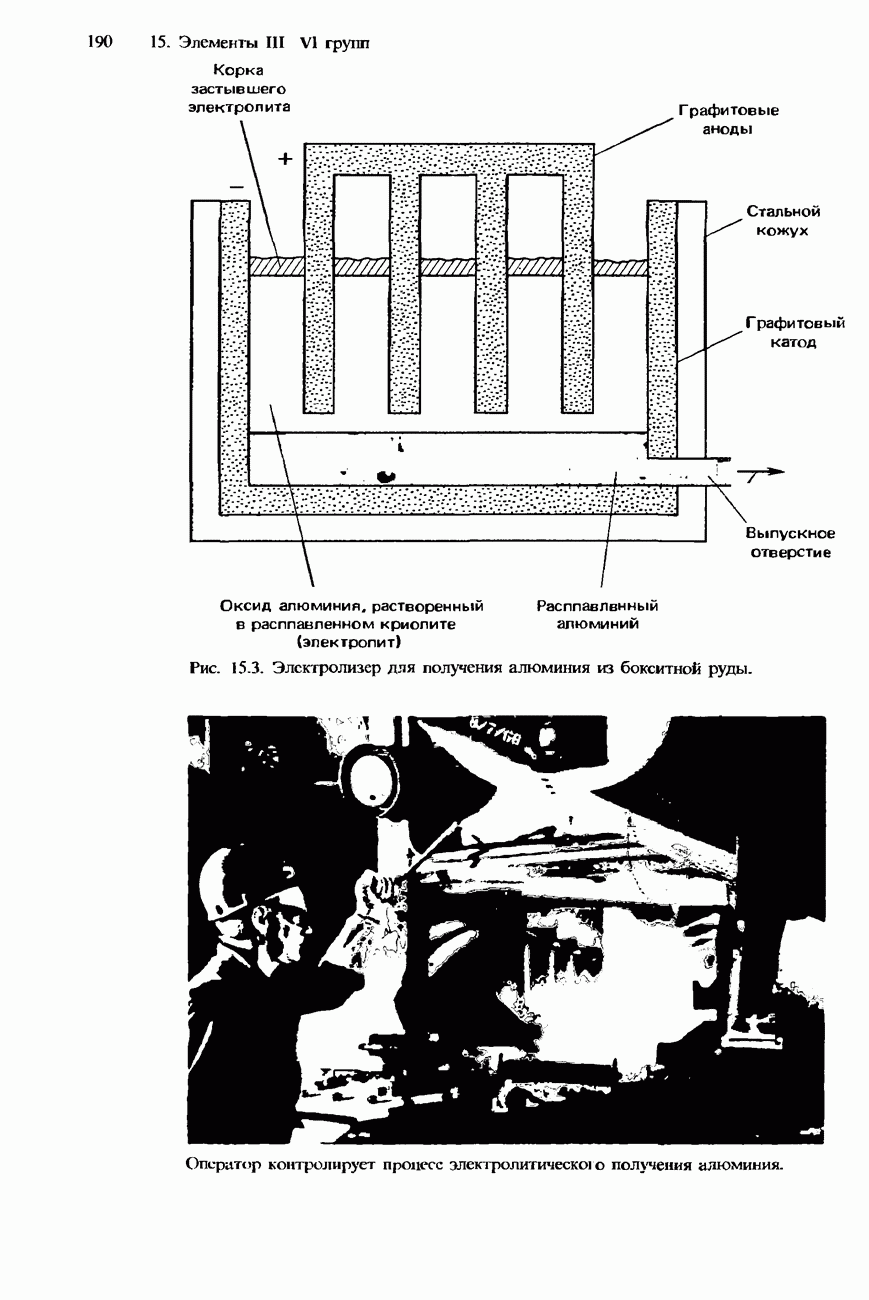
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ АЛЮМИНИЯ
- ПРИМЕНЕНИЯ АЛЮМИНИЯ И ЕГО СОЕДИНЕНИЙ
- 15.2. IV группа периодической системы
- СОЕДИНЕНИЯ
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ И ПОЛУЧЕНИЕ ИЗ РУД
- ПРИМЕНЕНИЯ УГЛЕРОДА
- ПРИМЕНЕНИЯ КРЕМНИЯ
- ПРИМЕНЕНИЯ ГЕРМАНИЯ, ОЛОВА И СВИНЦА
- 15.3. Элементы V группы
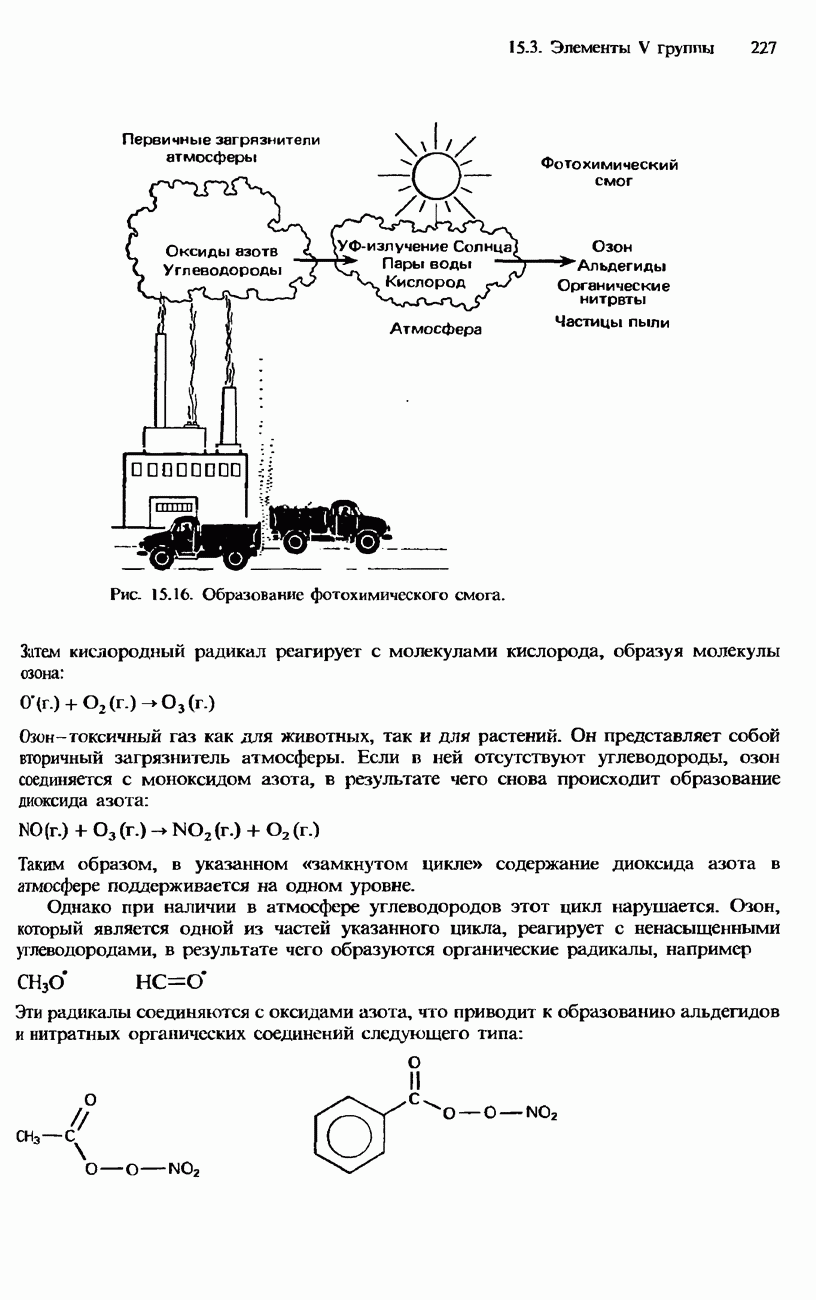
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ. ПОЛУЧЕНИЕ И ПРИМЕНЕНИЯ АЗОТА И ФОСФОРА
- СОЕДИНЕНИЯ АЗОТА
- СОЕДИНЕНИЯ ФОСФОРА
- 15.4. Элементы VI группы. Кислород и сера
- КИСЛОРОД
- СОЕДИНЕНИЯ КИСЛОРОДА
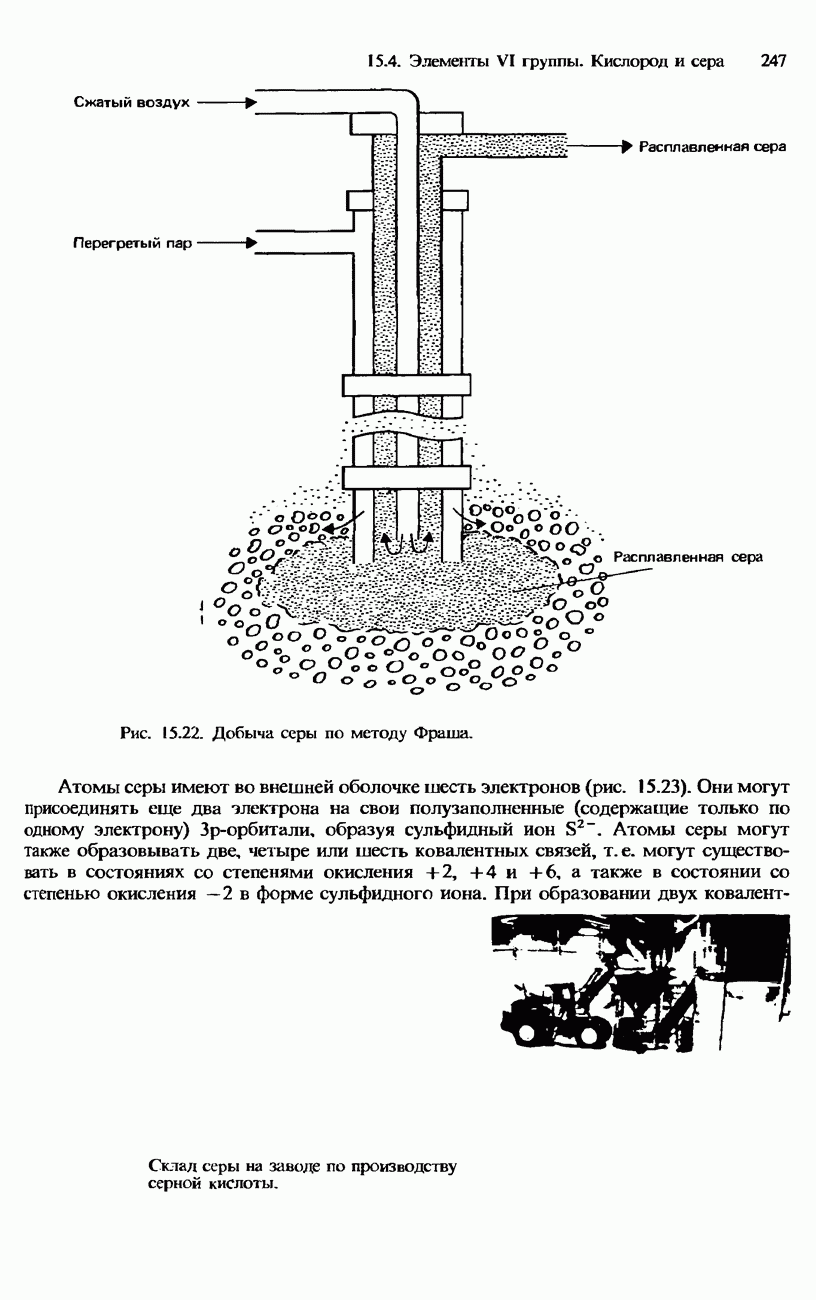
- СЕРА
- СОЕДИНЕНИЯ СЕРЫ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 16. ГАЛОГЕНЫ И БЛАГОРОДНЫЕ ГАЗЫ
- 16.1. Галогены
- ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ
- ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ
- ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА
- РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ
- 16.2. Соединения галогенов
- ГАЛОГЕНОВОДОРОДЫ
- КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ ГАЛОГЕНОВ
- 16.3. Распространенность, получение и применение галогенов и их соединений
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ХЛОРА
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ ДРУГИХ ГАЛОГЕНОВ
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ СОЕДИНЕНИЙ ХЛОРА
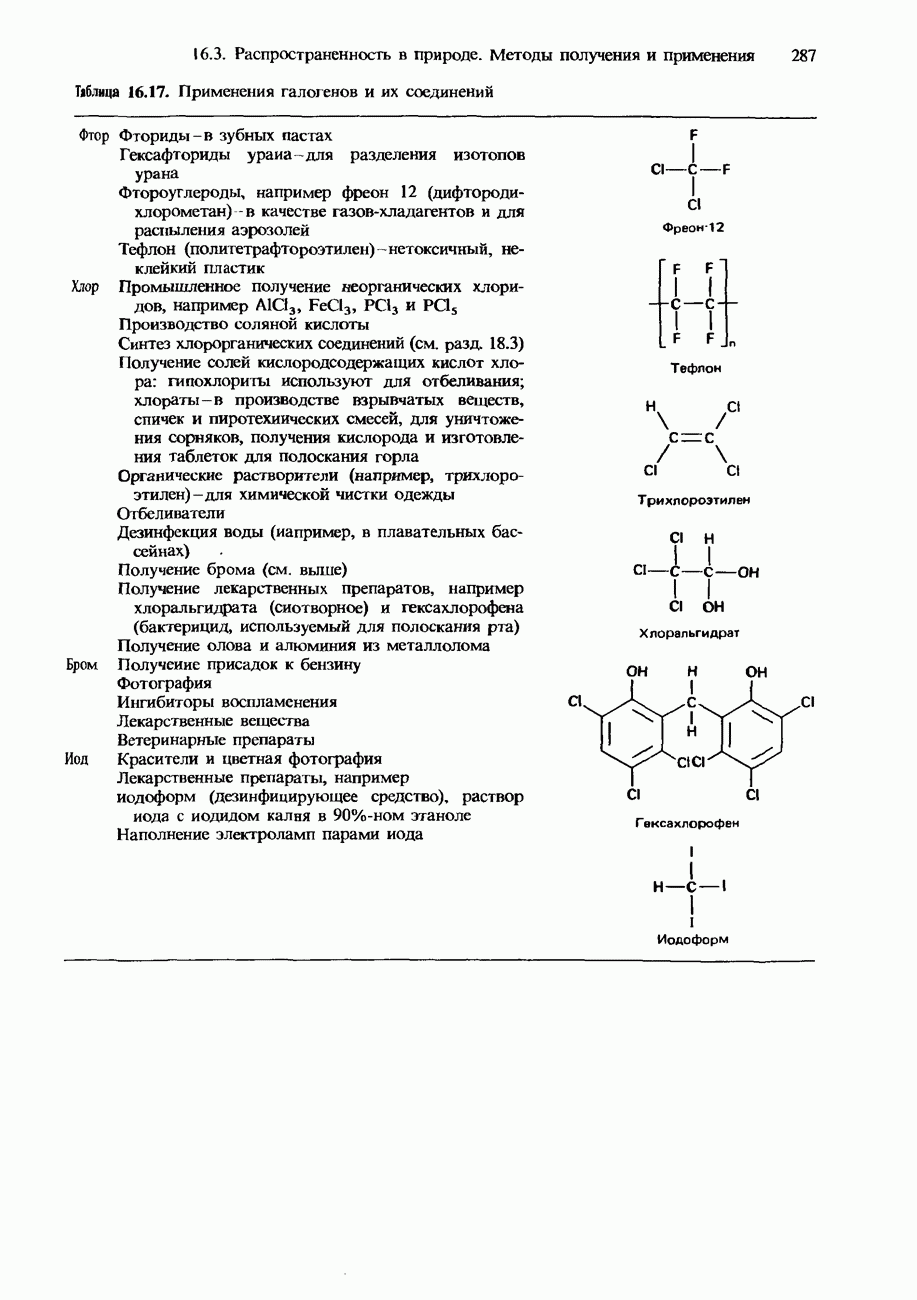
- ПРИМЕНЕНИЯ ГАЛОГЕНОВ И ИХ СОЕДИНЕНИЙ
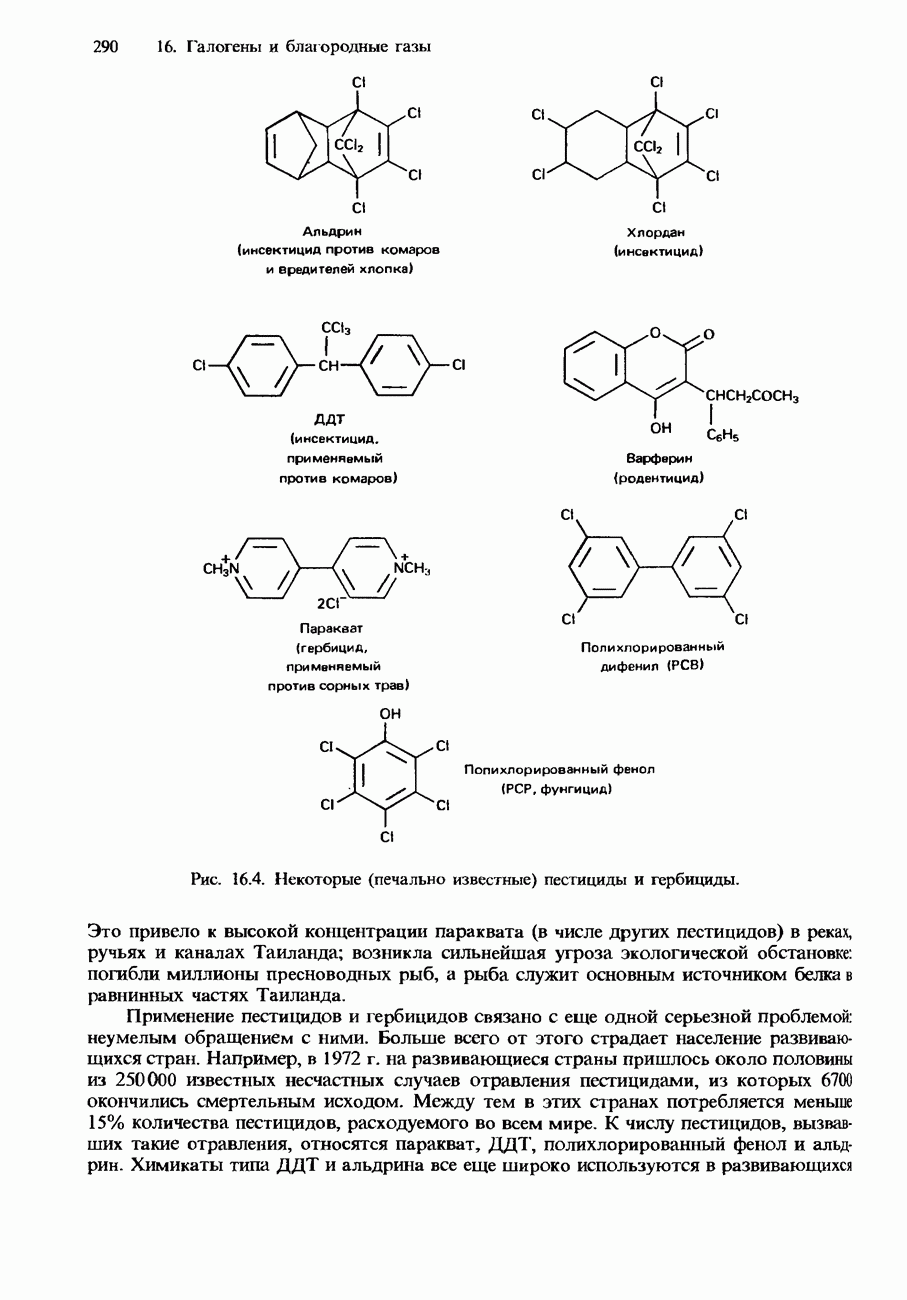
- ТОКСИЧНОСТЬ ХЛОРСОДЕРЖАЩИХ ПРОДУКТОВ
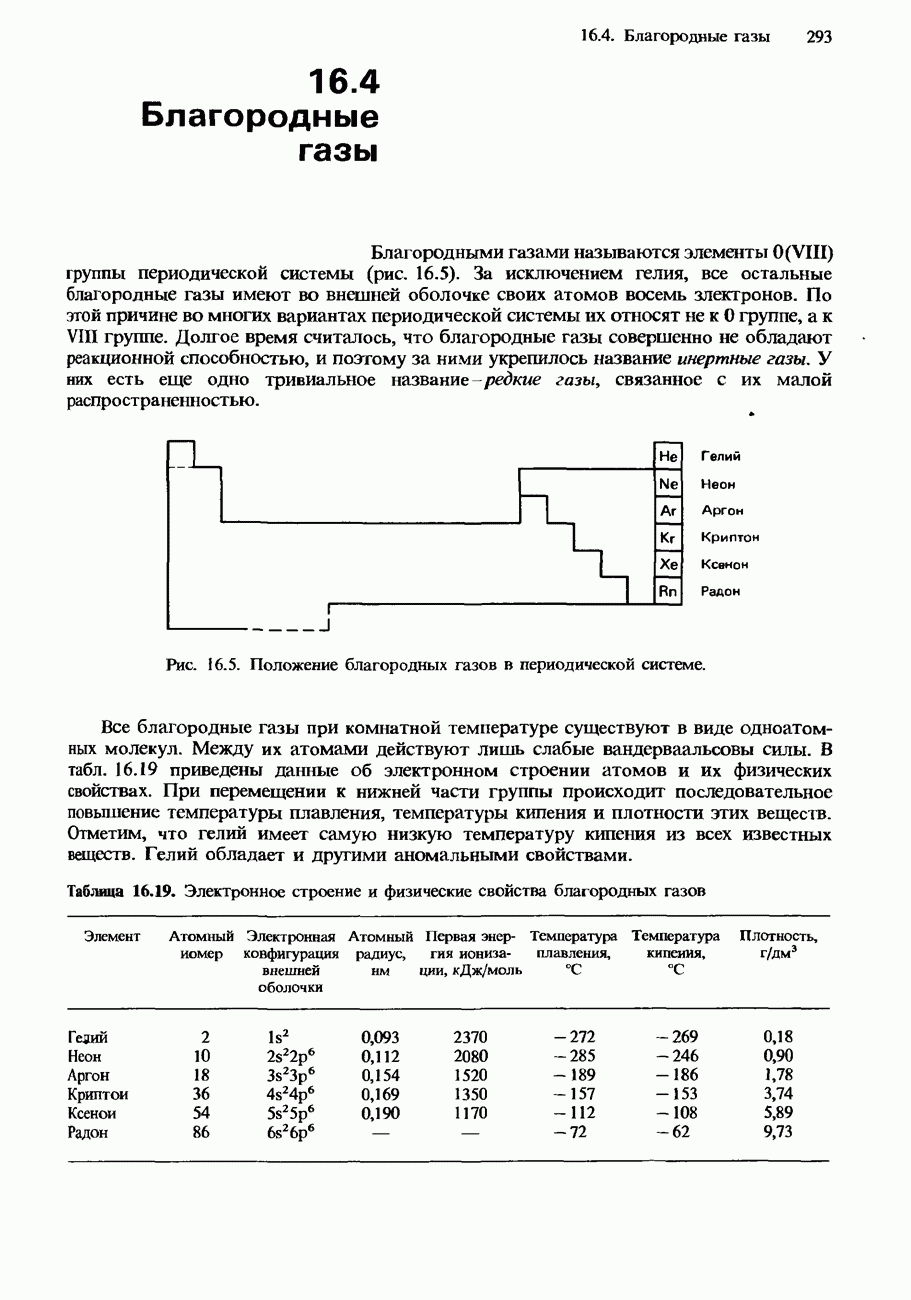
- 16.4. Благородные газы
- СОЕДИНЕНИЯ БЛАГОРОДНЫХ ГАЗОВ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 17. ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ
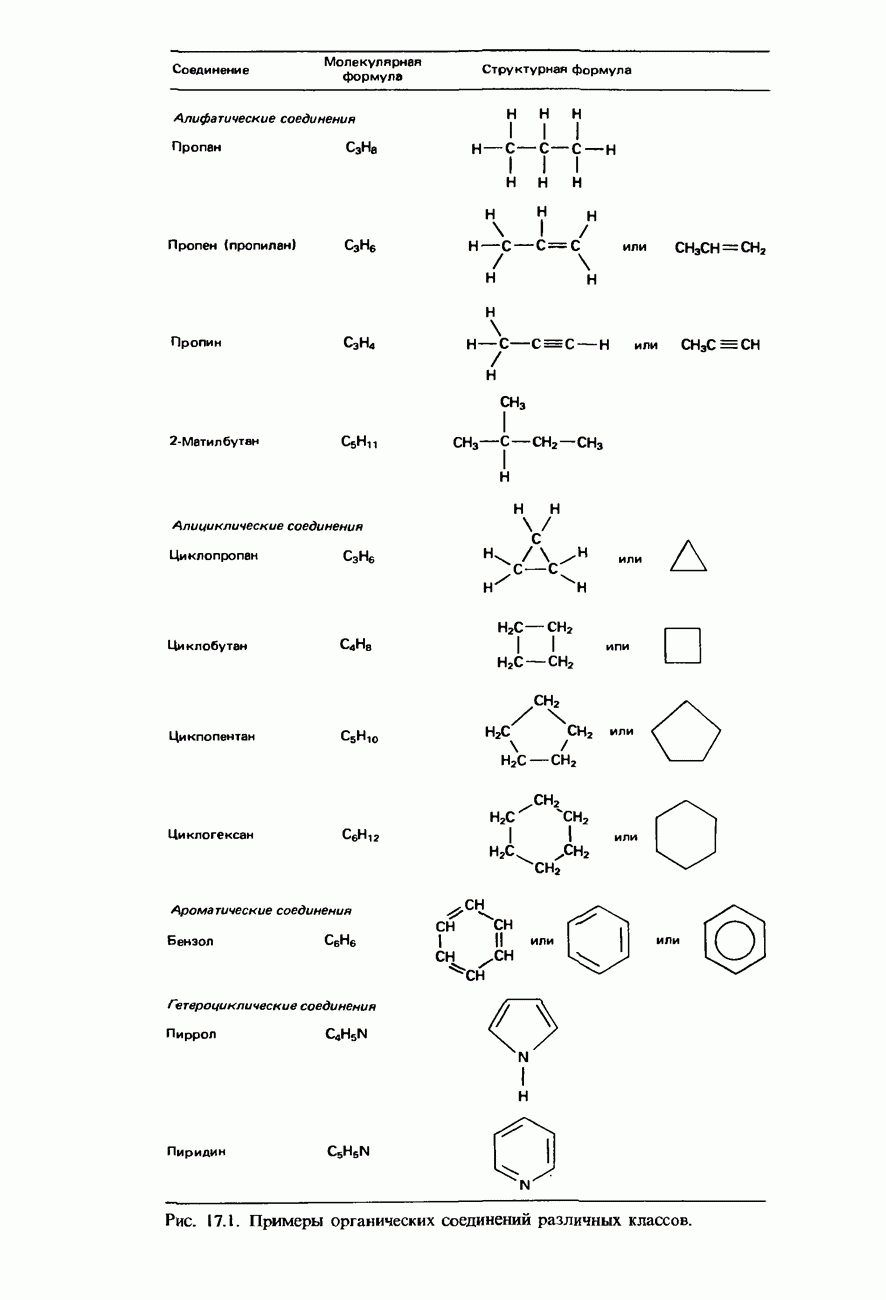
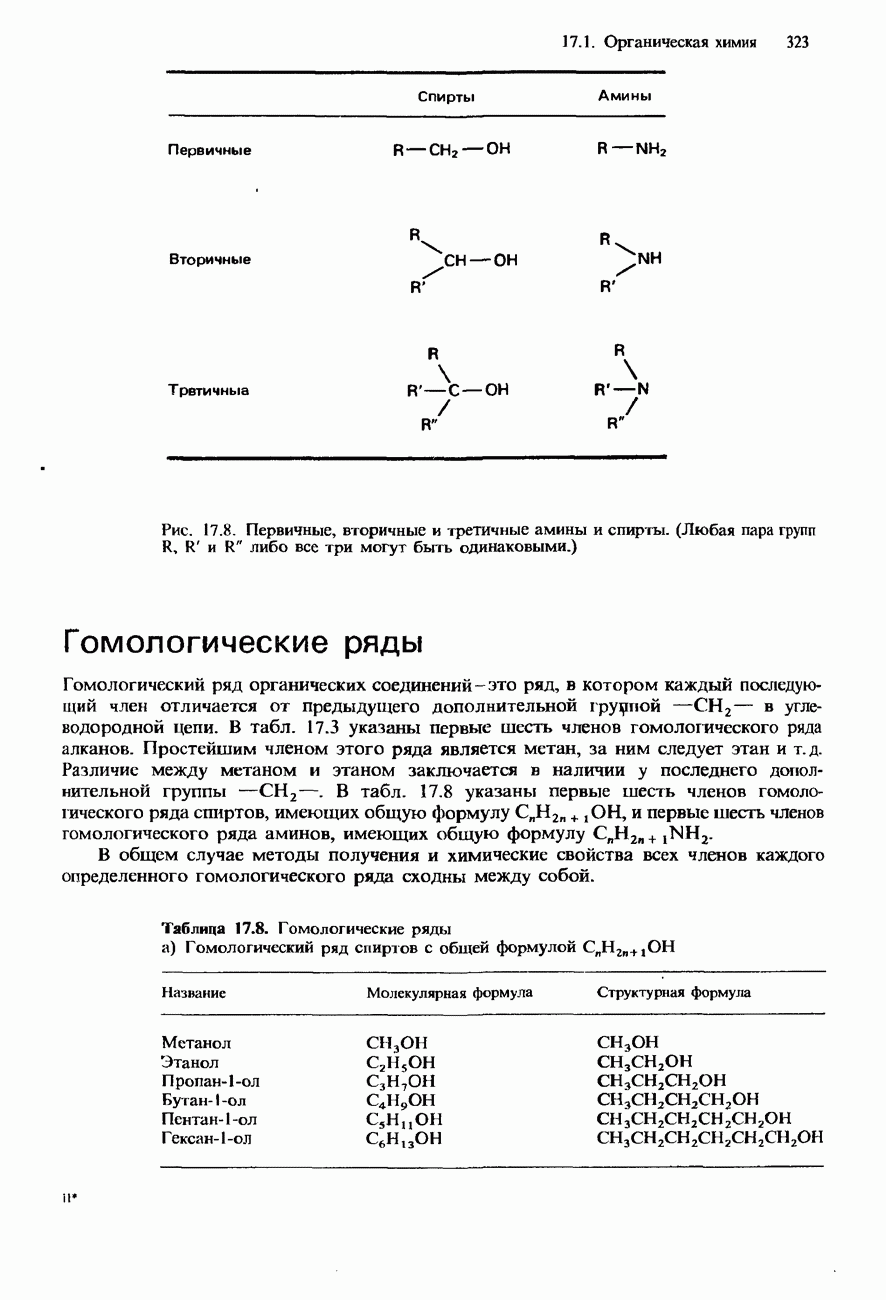
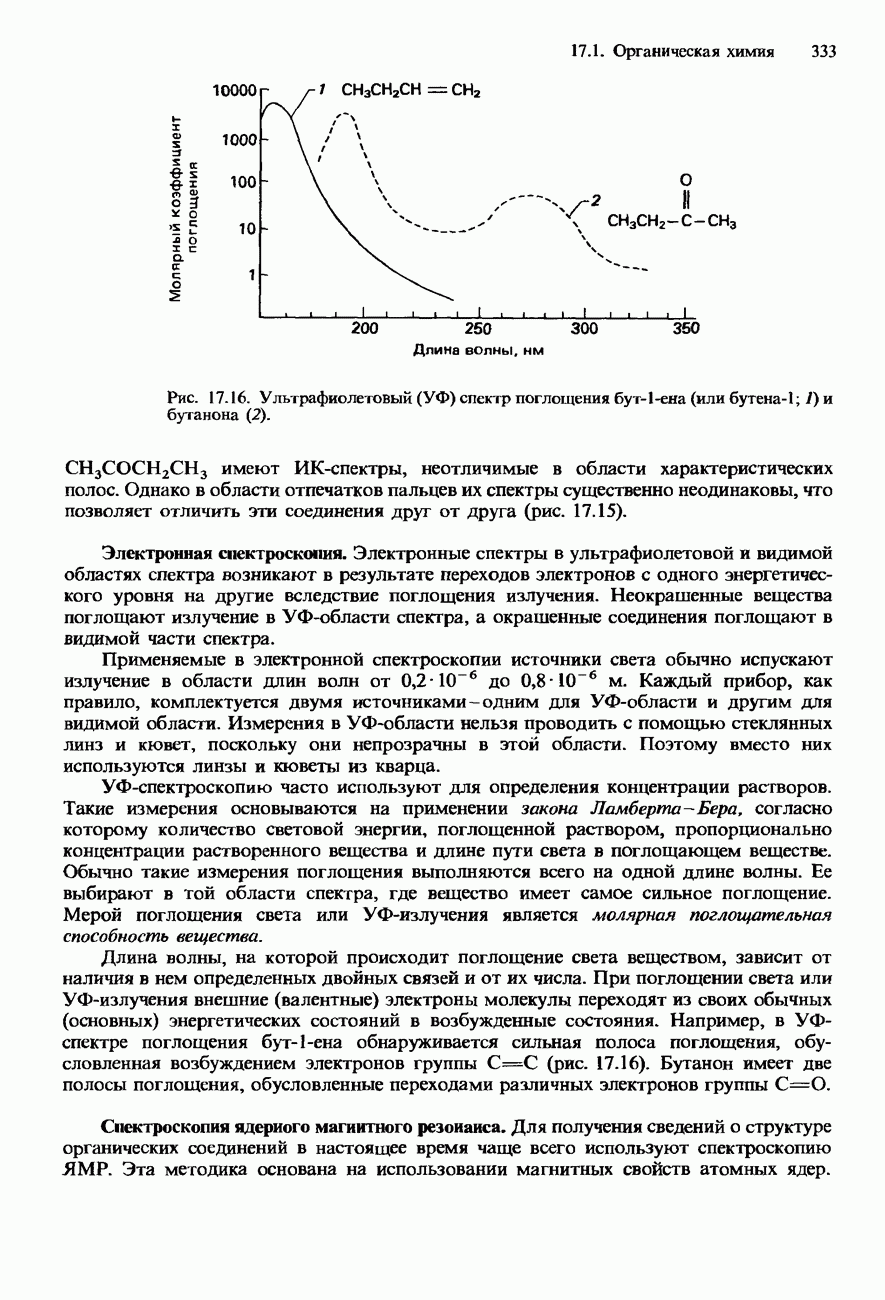
- 7.1. Органическая химия
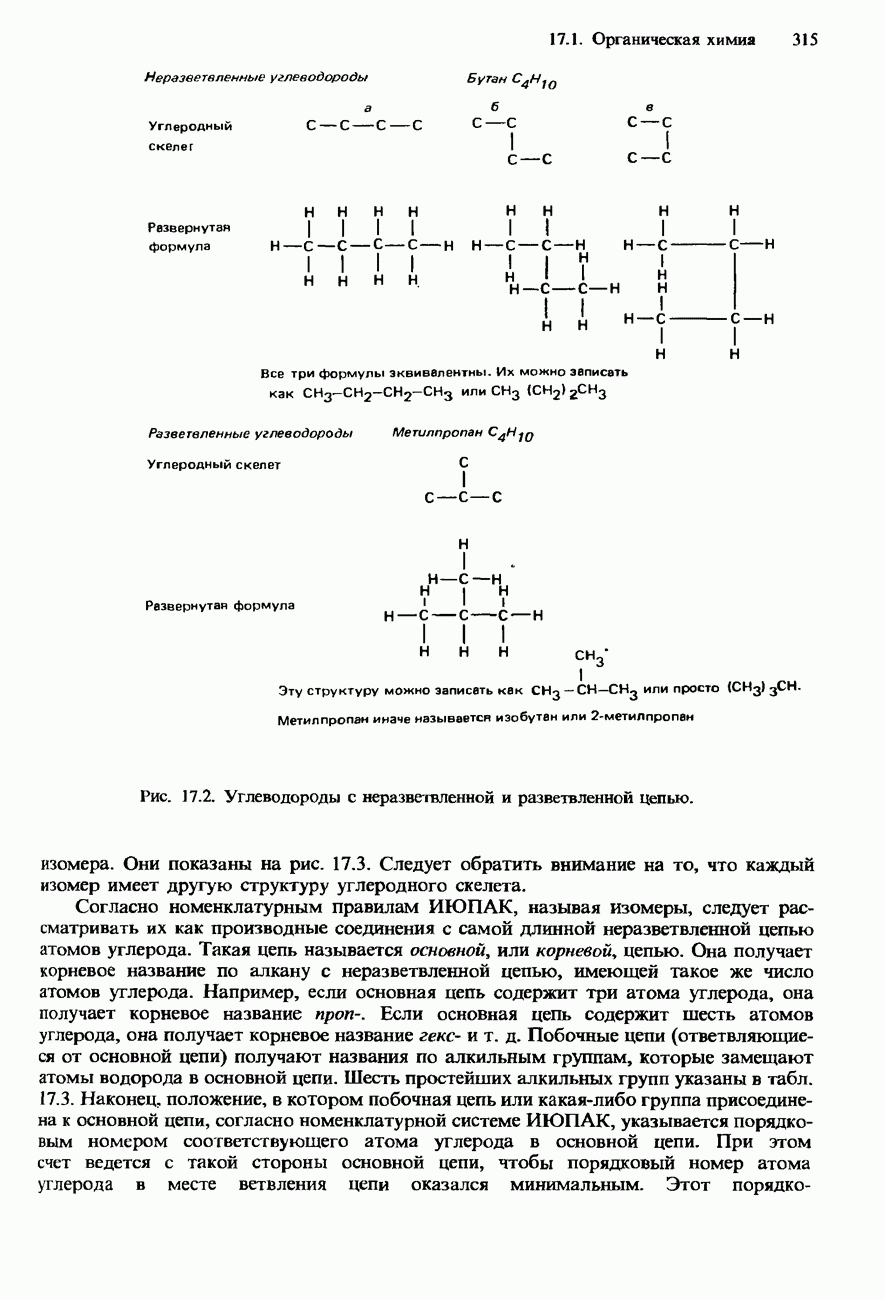
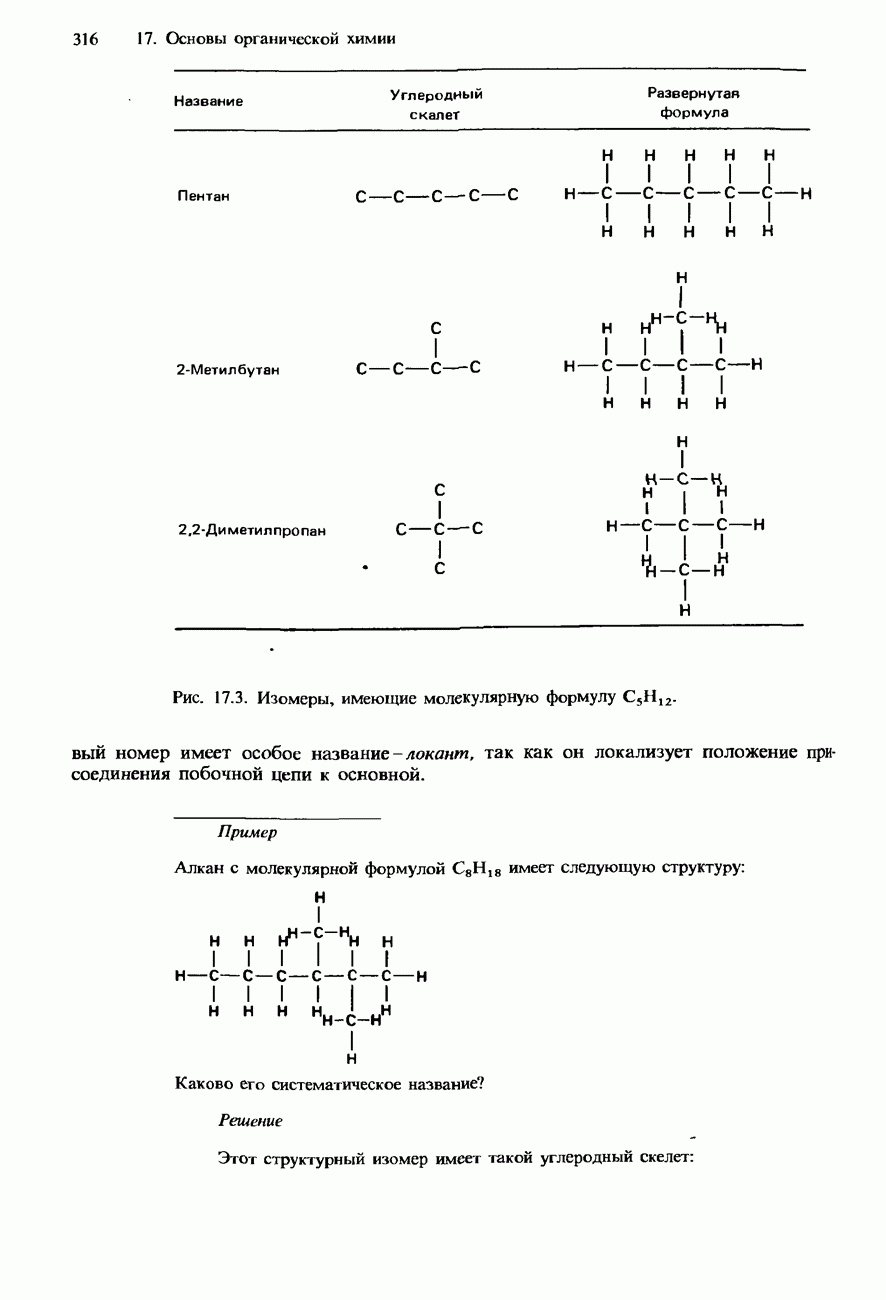
- НОМЕНКЛАТУРА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- УГЛЕВОДОРОДЫ
- ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
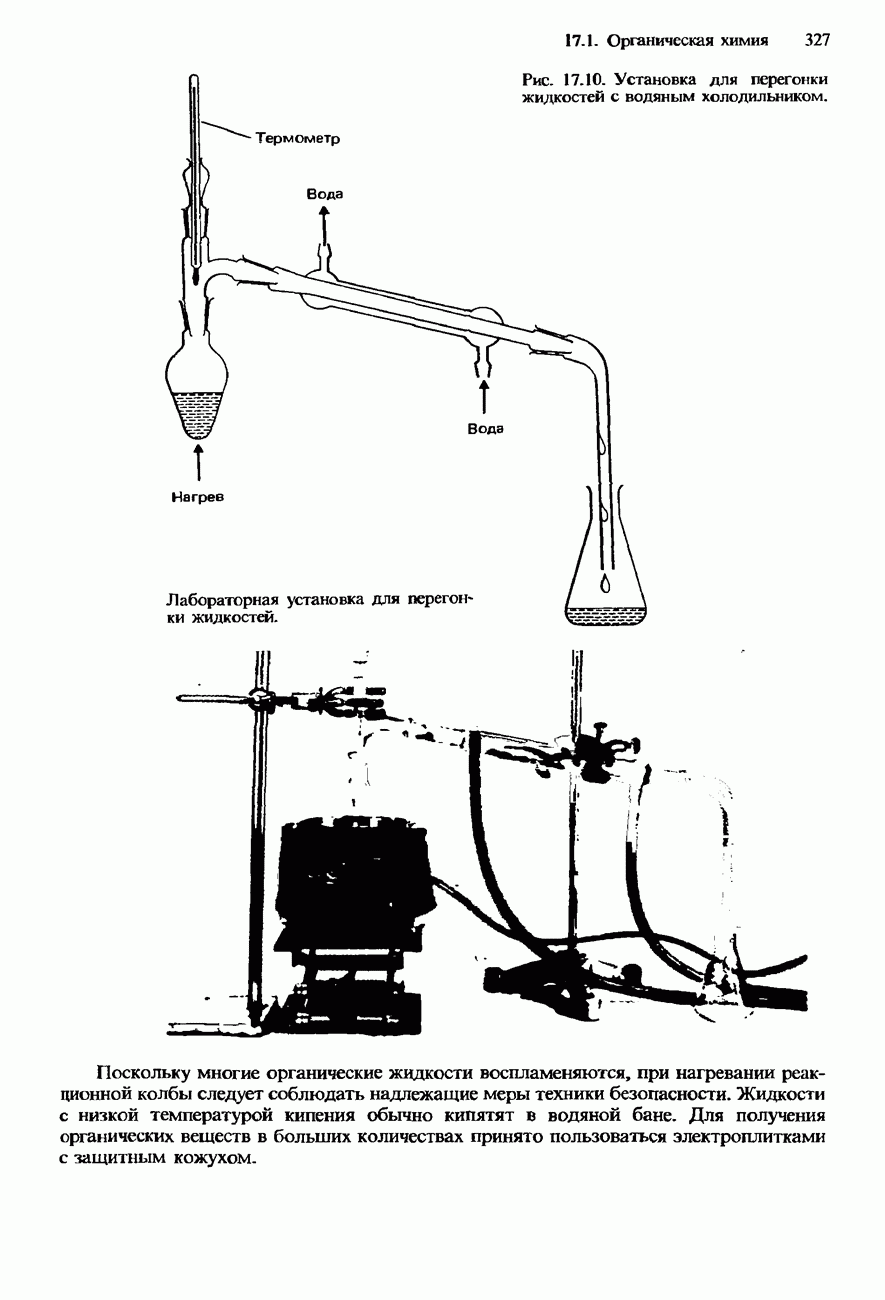
- ФИЗИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
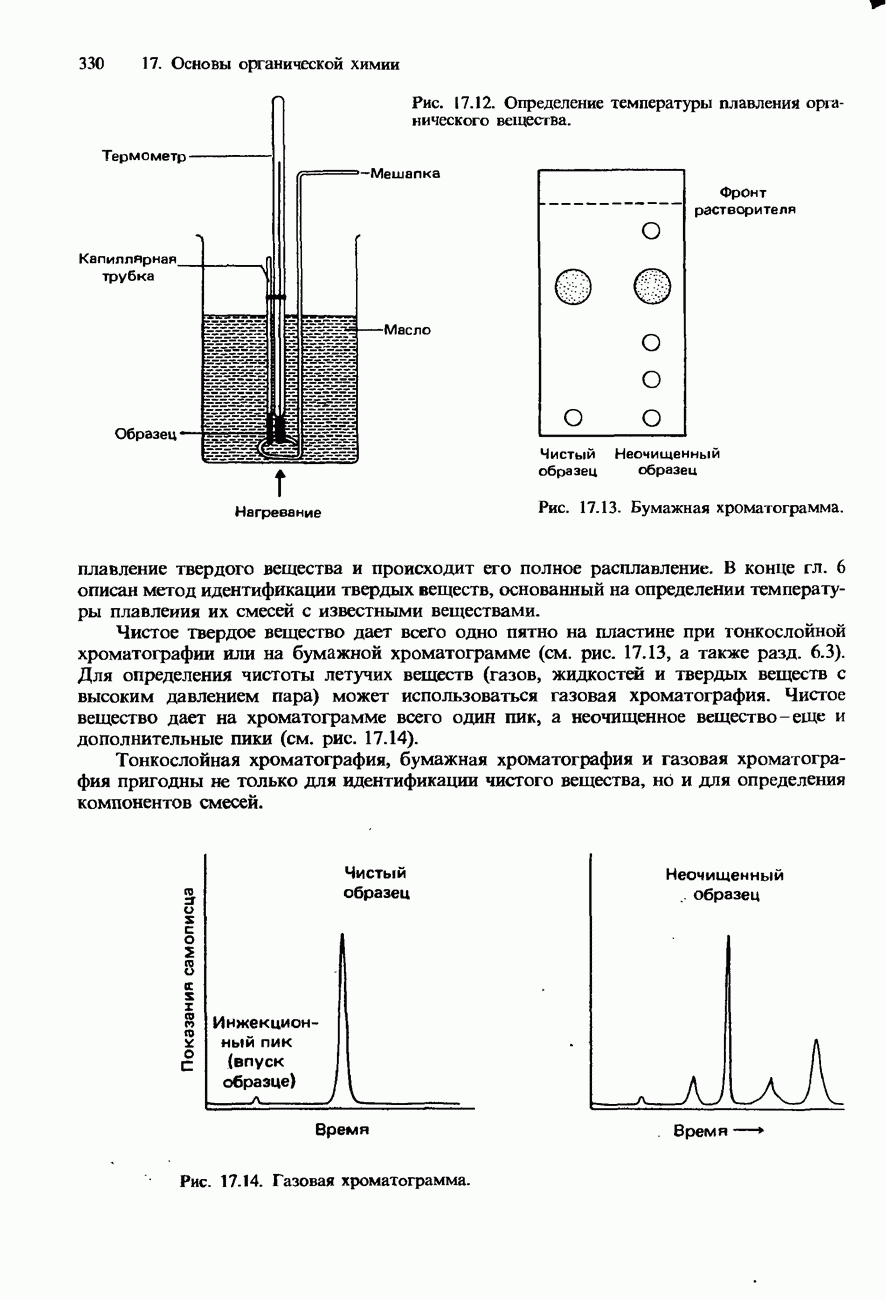
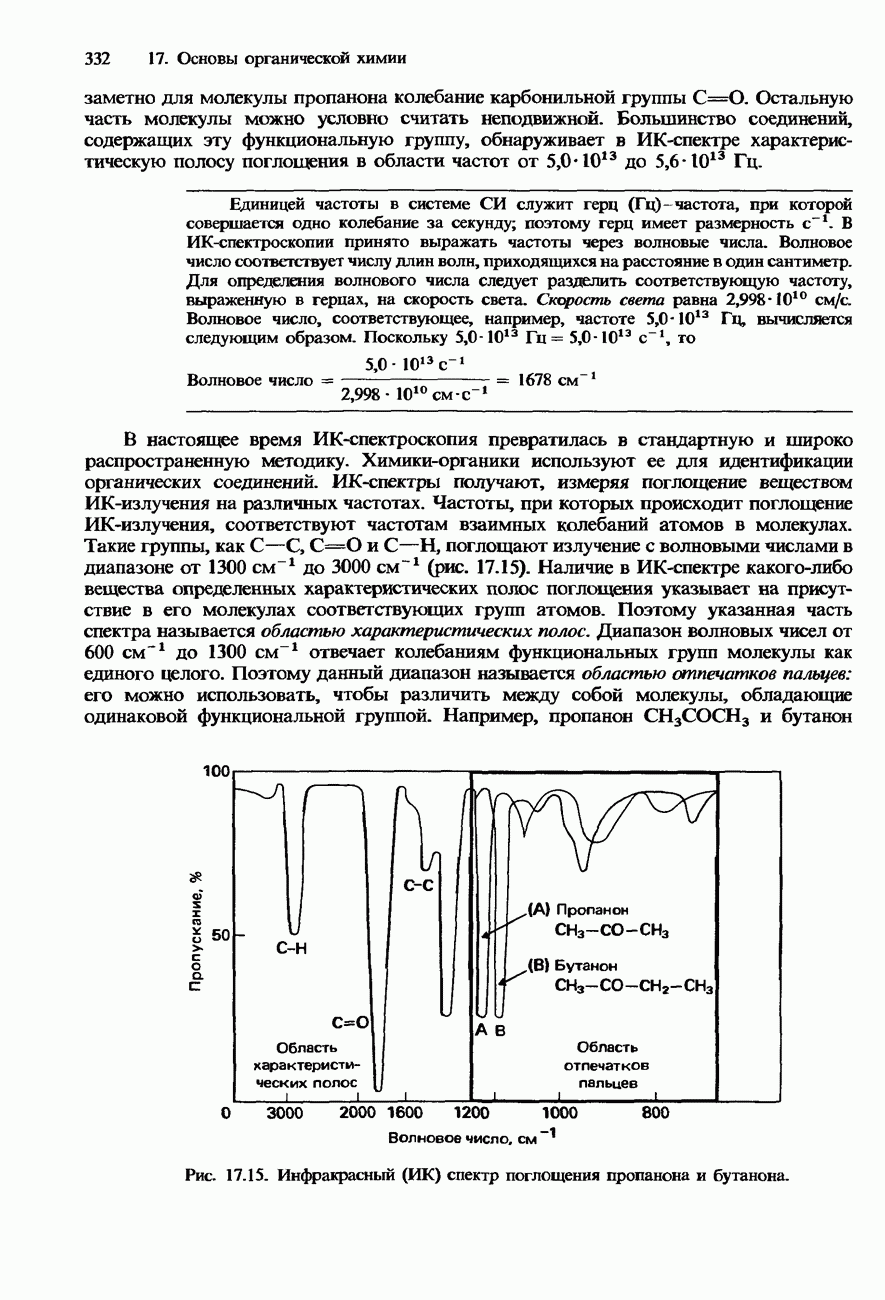
- ПОЛУЧЕНИЕ И ИДЕНТИФИКАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
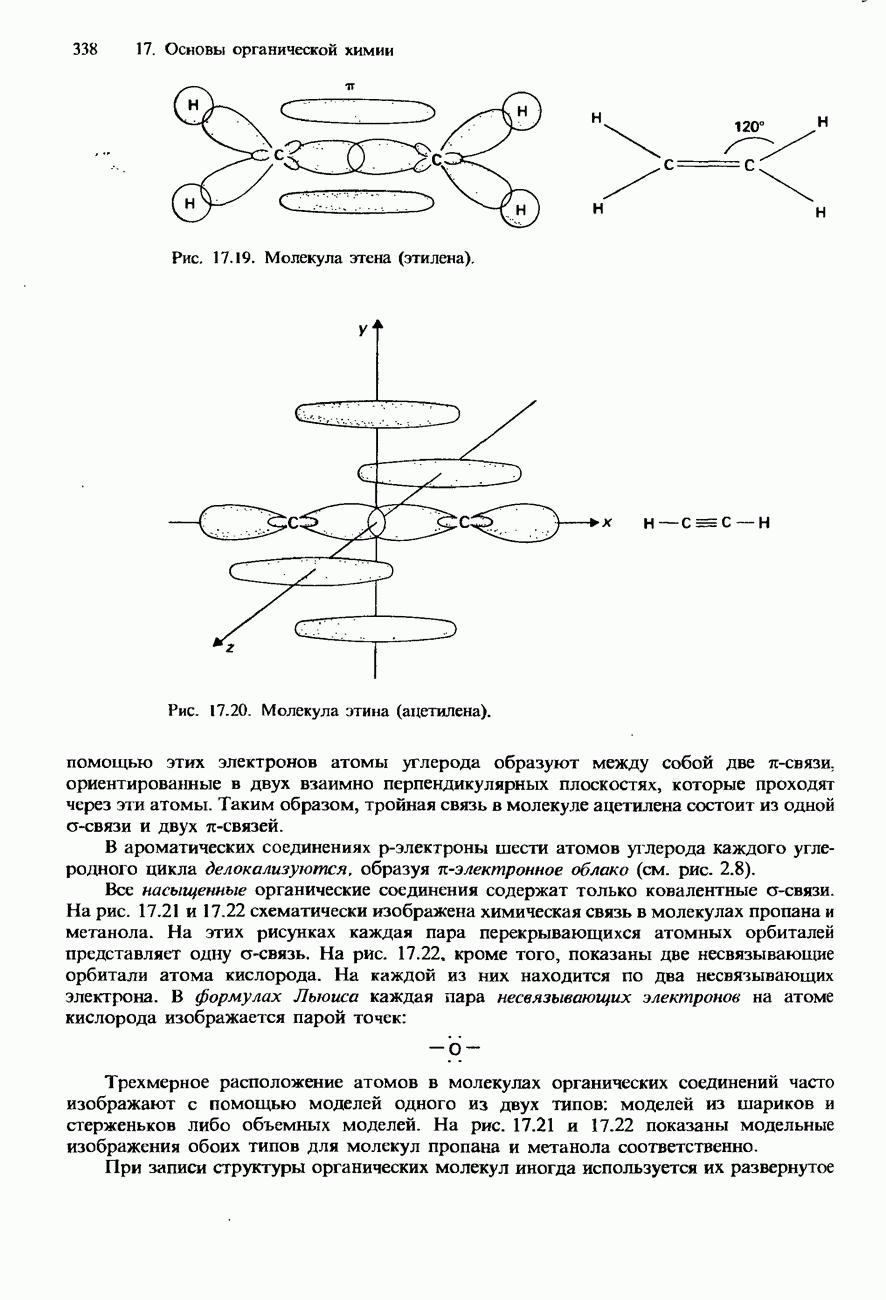
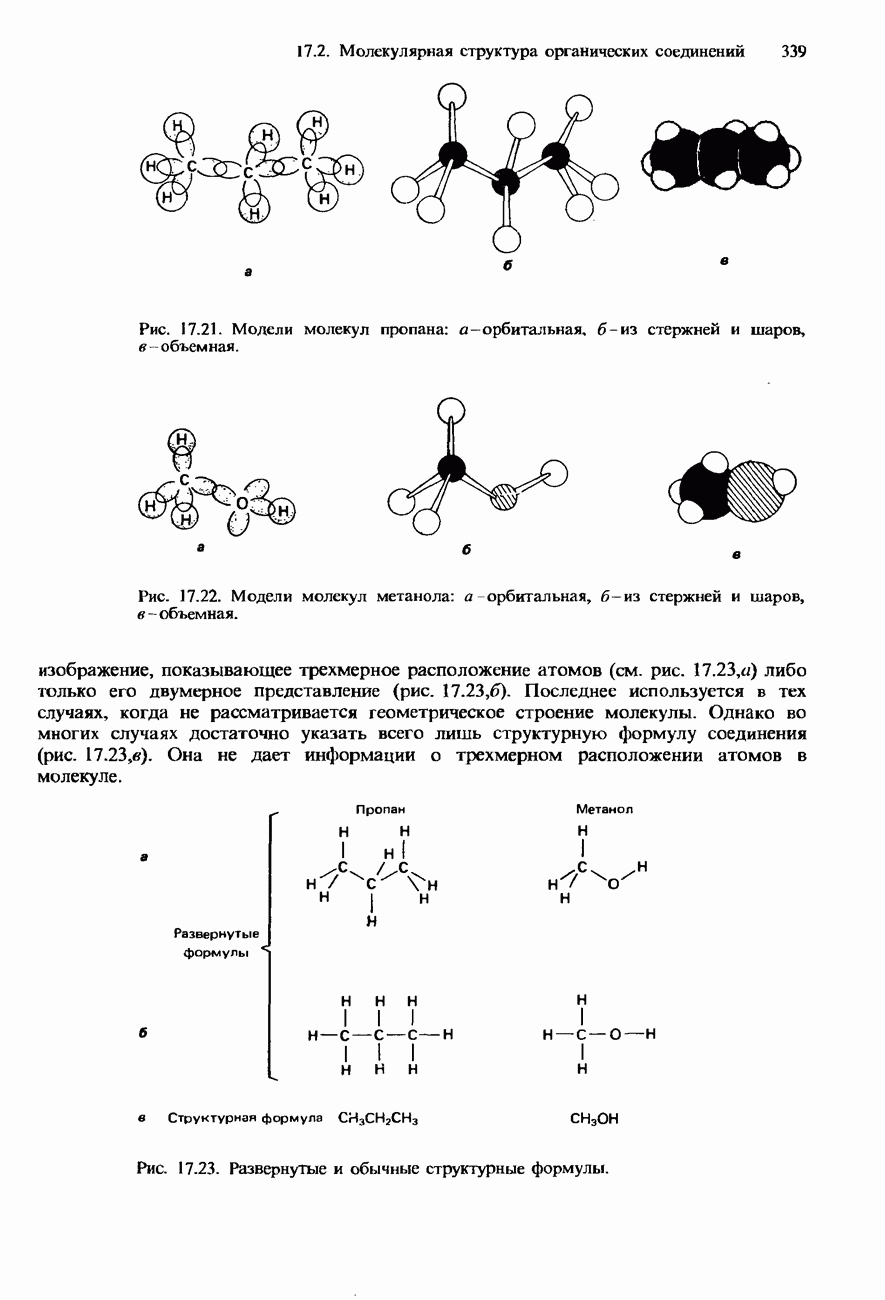
- 17.2. Молекулярная структура органических соединений
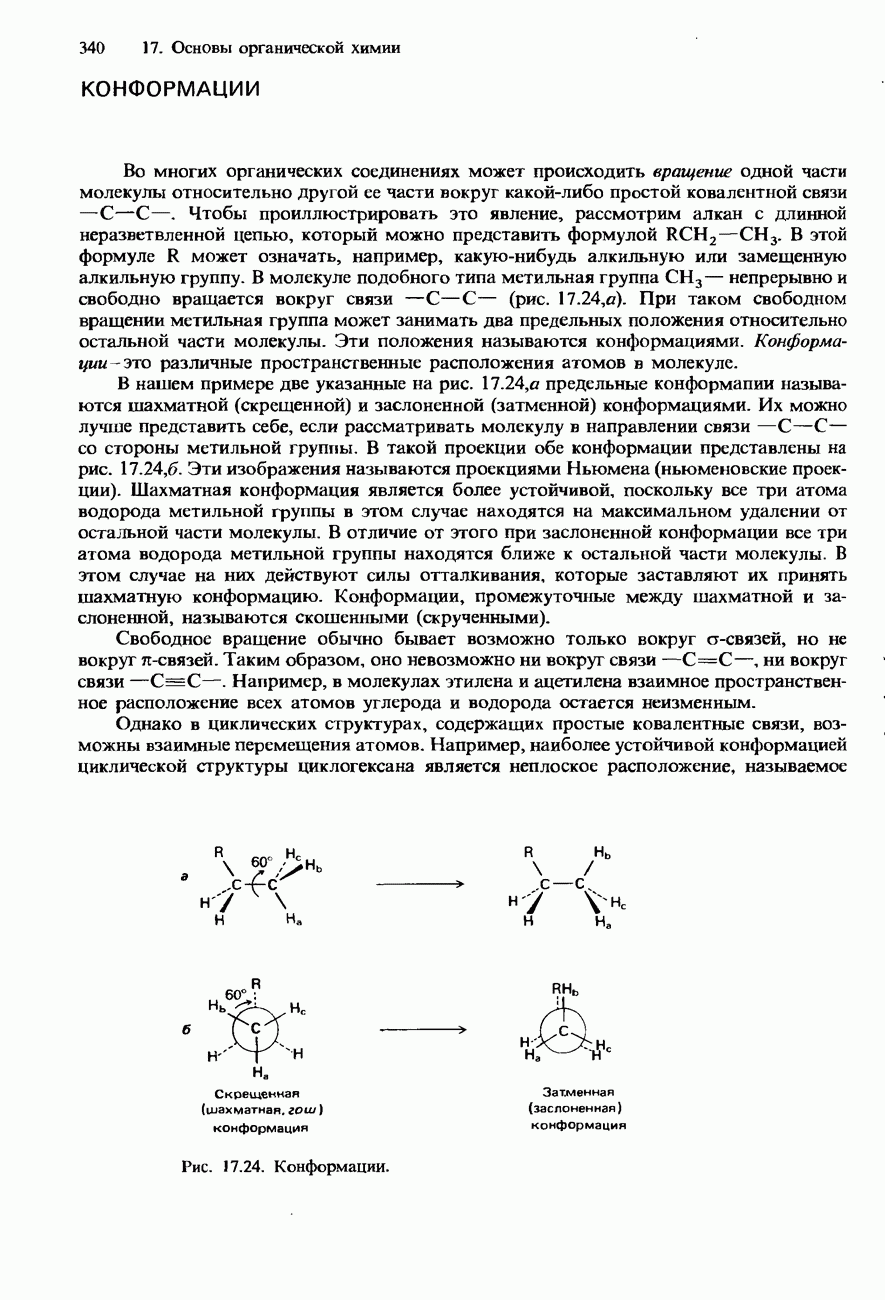
- КОНФОРМАЦИИ
- СТЕРЕОИЗОМЕРИЯ
- 17.3. Механизмы органических реакций
- ФАКТОРЫ, ВЛИЯЮЩИЕ НА РЕАКЦИОННУЮ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
- НУКЛЕОФИЛЫ И ЭЛЕКТРОФИЛЫ
- ТИПЫ ОРГАНИЧЕСКИХ РЕАКЦИЙ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 18. УГЛЕВОДОРОДЫ
- 18.1. Алифатические углеводороды
- АЛКАНЫ
- АЛКЕНЫ
- АЛКИНЫ
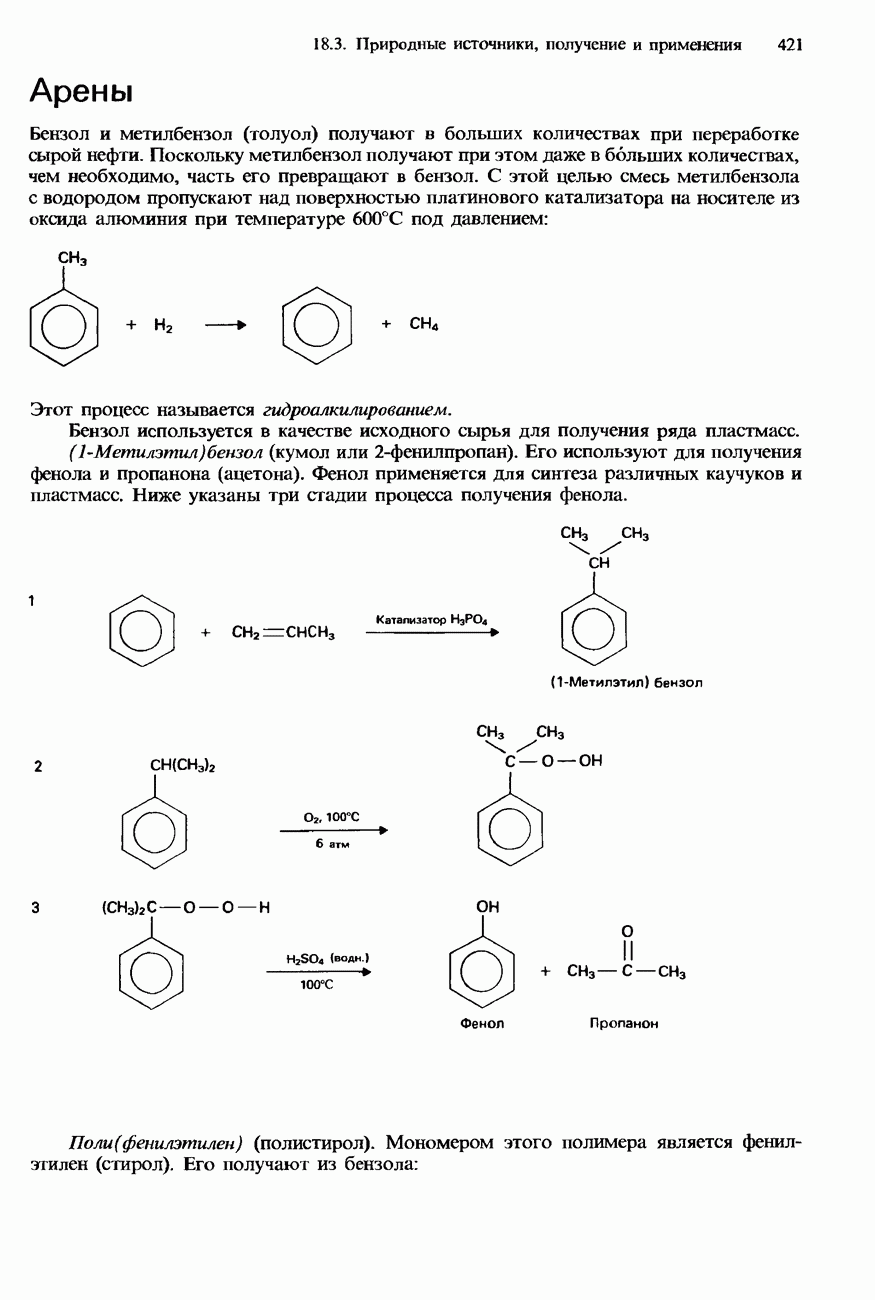
- 18.2. Арены
- БЕНЗОЛ
- МЕТИЛБЕНЗОЛ
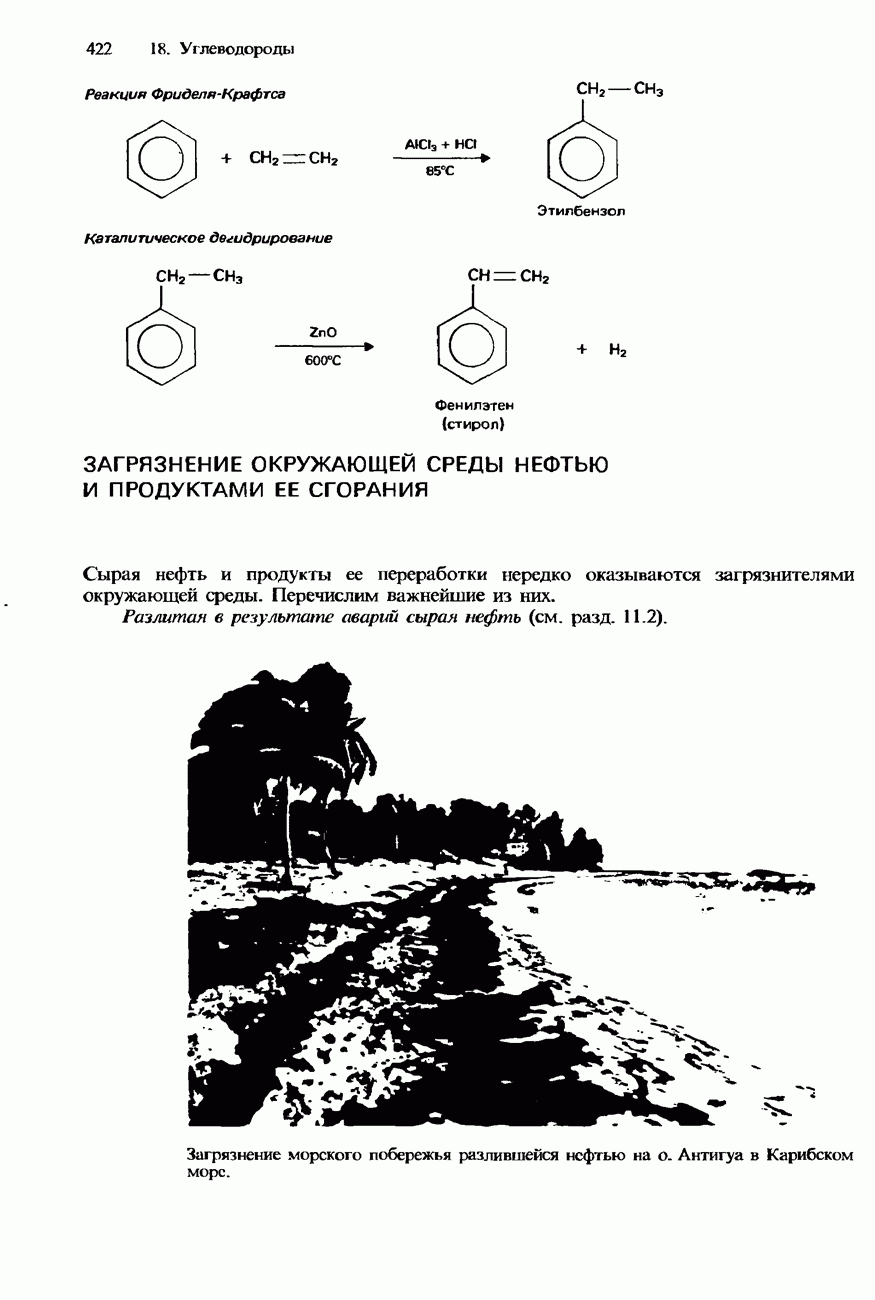
- 18.3. Природные источники, получение и применения
- ПРОМЫШЛЕННОЕ ПОЛУЧЕНИЕ УГЛЕВОДОРОДОВ
- ПЕРЕРАБОТКА НЕФТИ
- ПРИМЕНЕНИЯ УГЛЕВОДОРОДОВ
- ЗАГРЯЗНЕНИЕ ОКРУЖАЮЩЕЙ СРЕДЫ НЕФТЬЮ И ПРОДУКТАМИ ЕЕ СГОРАНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 19. ФУНКЦИОНАЛЬНЫЕ ГРУППЫ
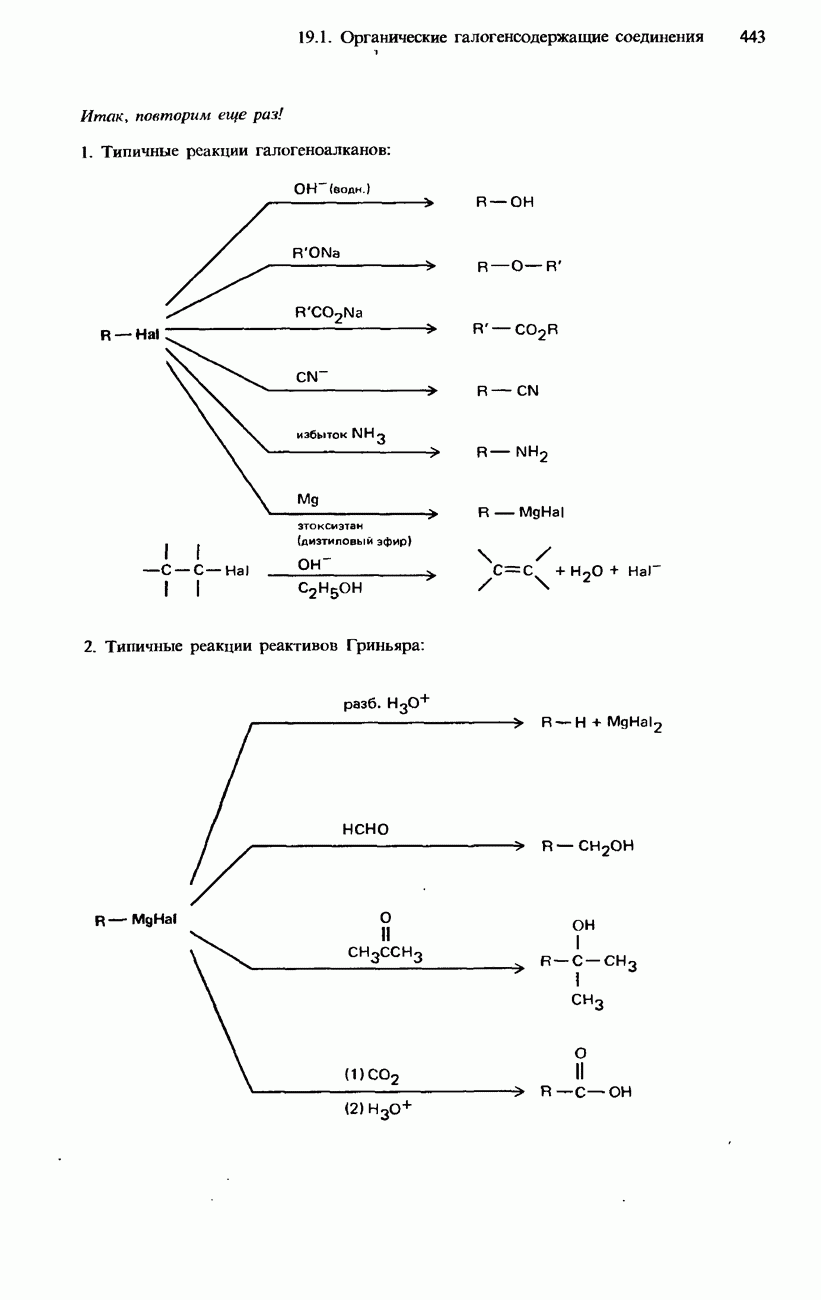
- 19.1. Органические галогенсодержащие соединения
- ГАЛОГЕНОАЛКЕНЫ
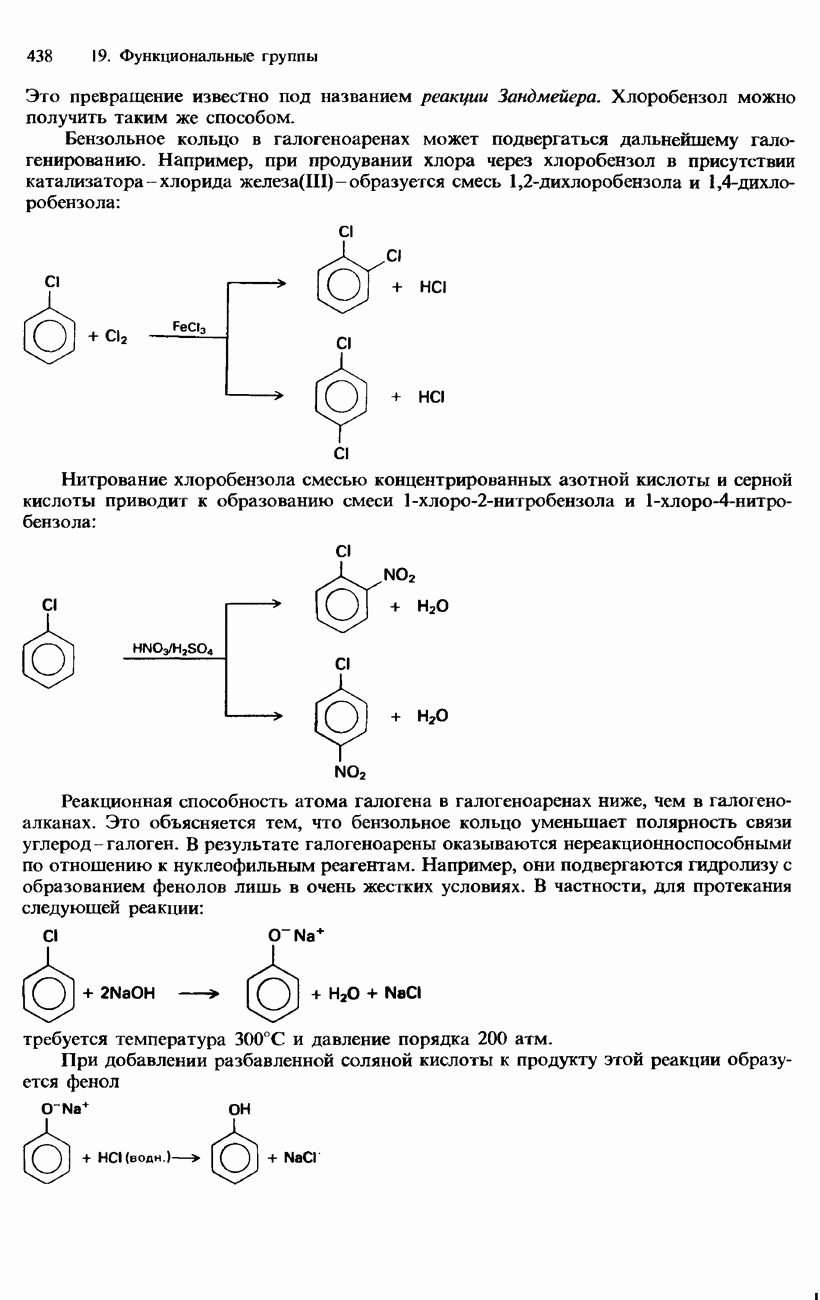
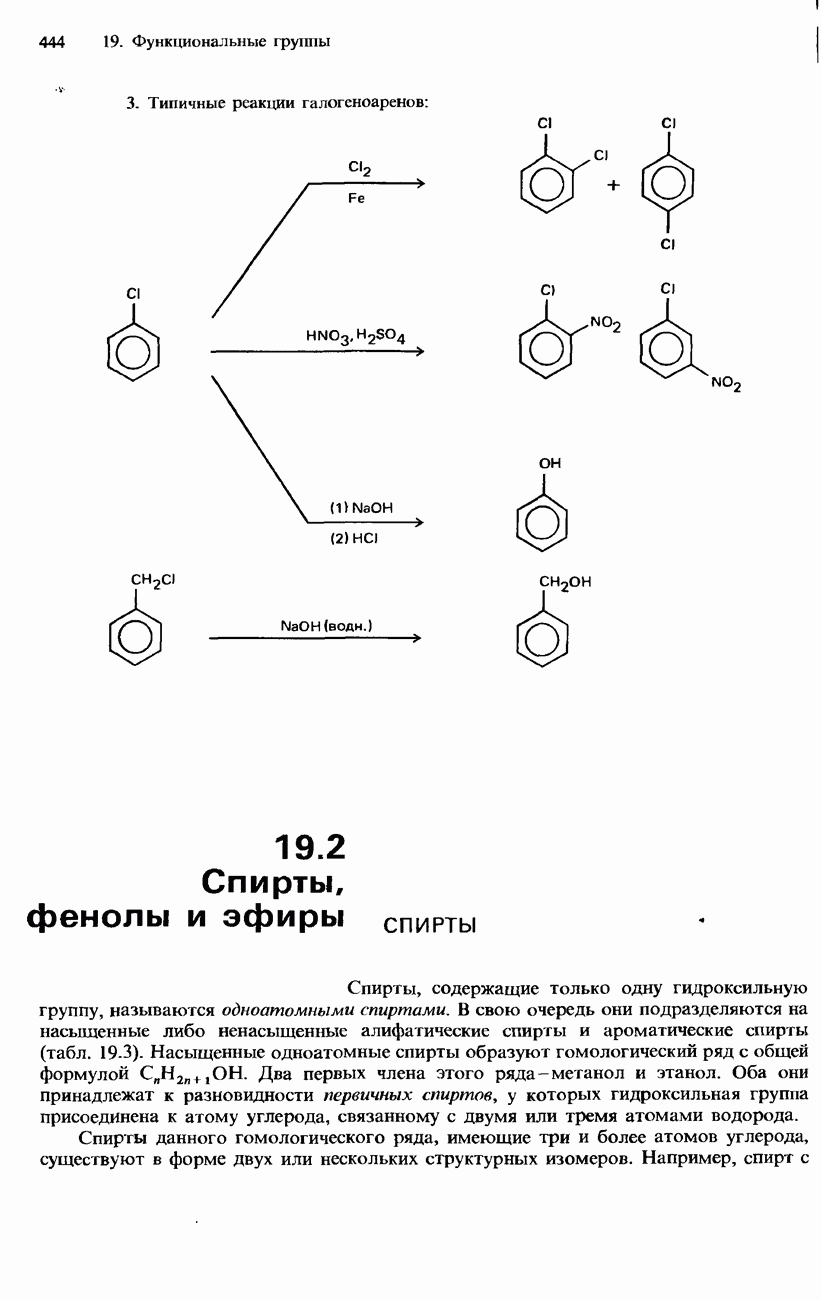
- ГАЛОГЕНОАРЕНЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ОРГАНИЧЕСКИХ ГАЛОГЕНСОДЕРЖАЩИХ СОЕДИНЕНИЙ
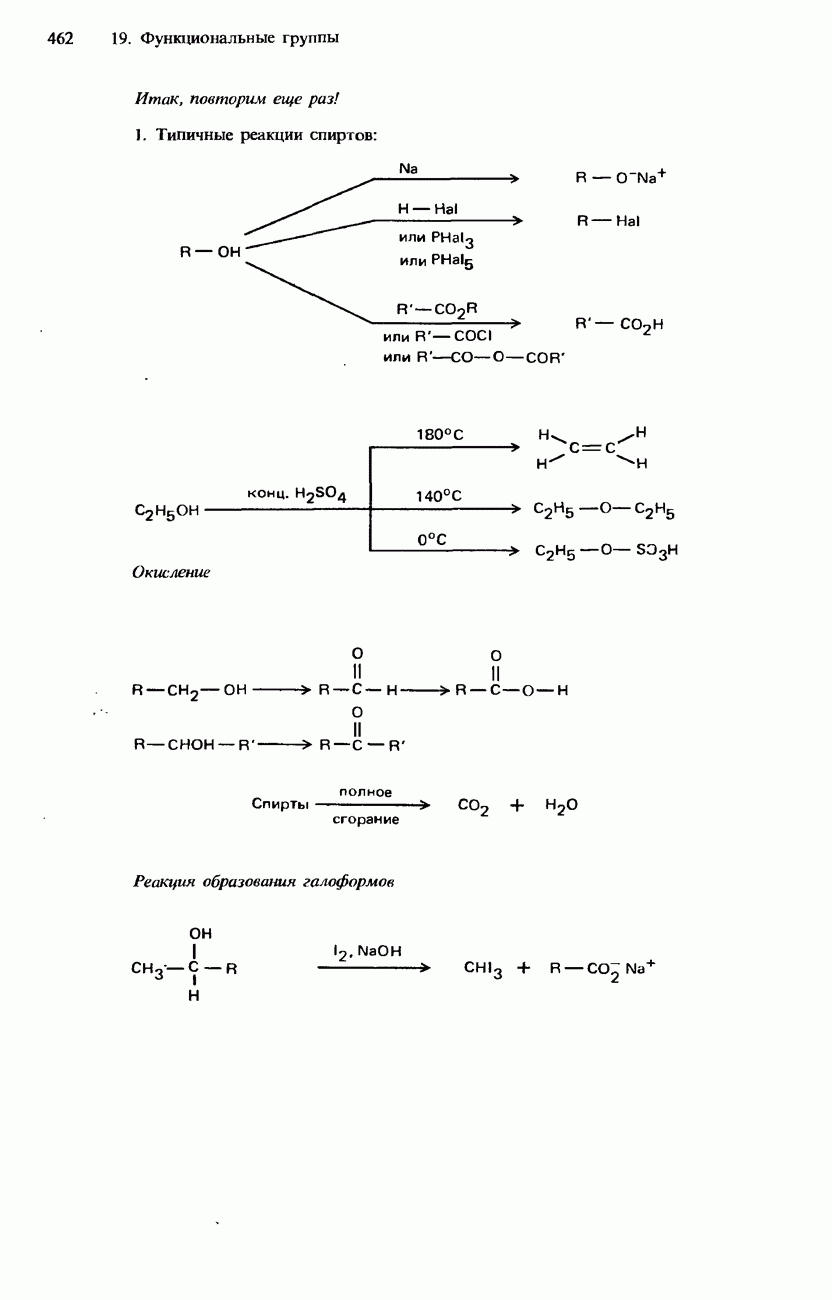
- 19.2. Спирты, фенолы и эфиры
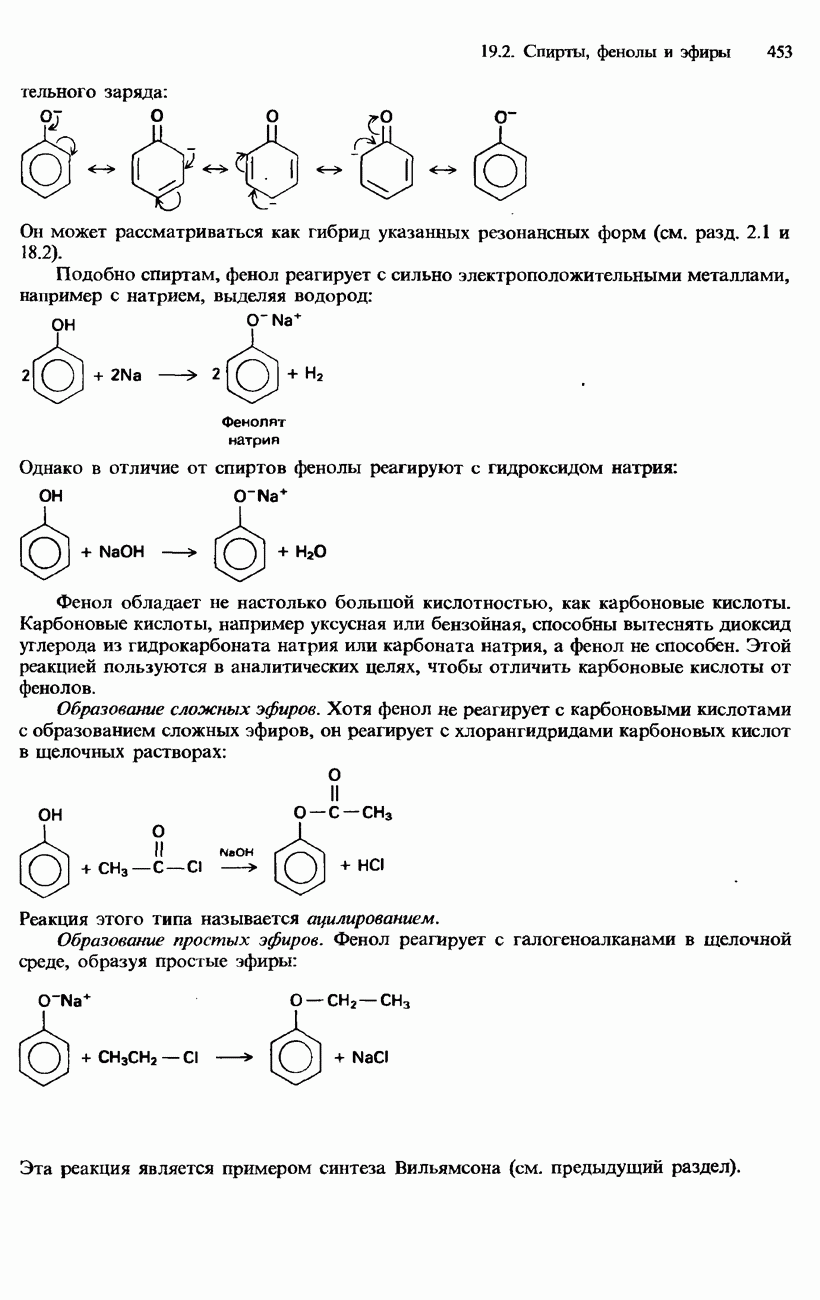
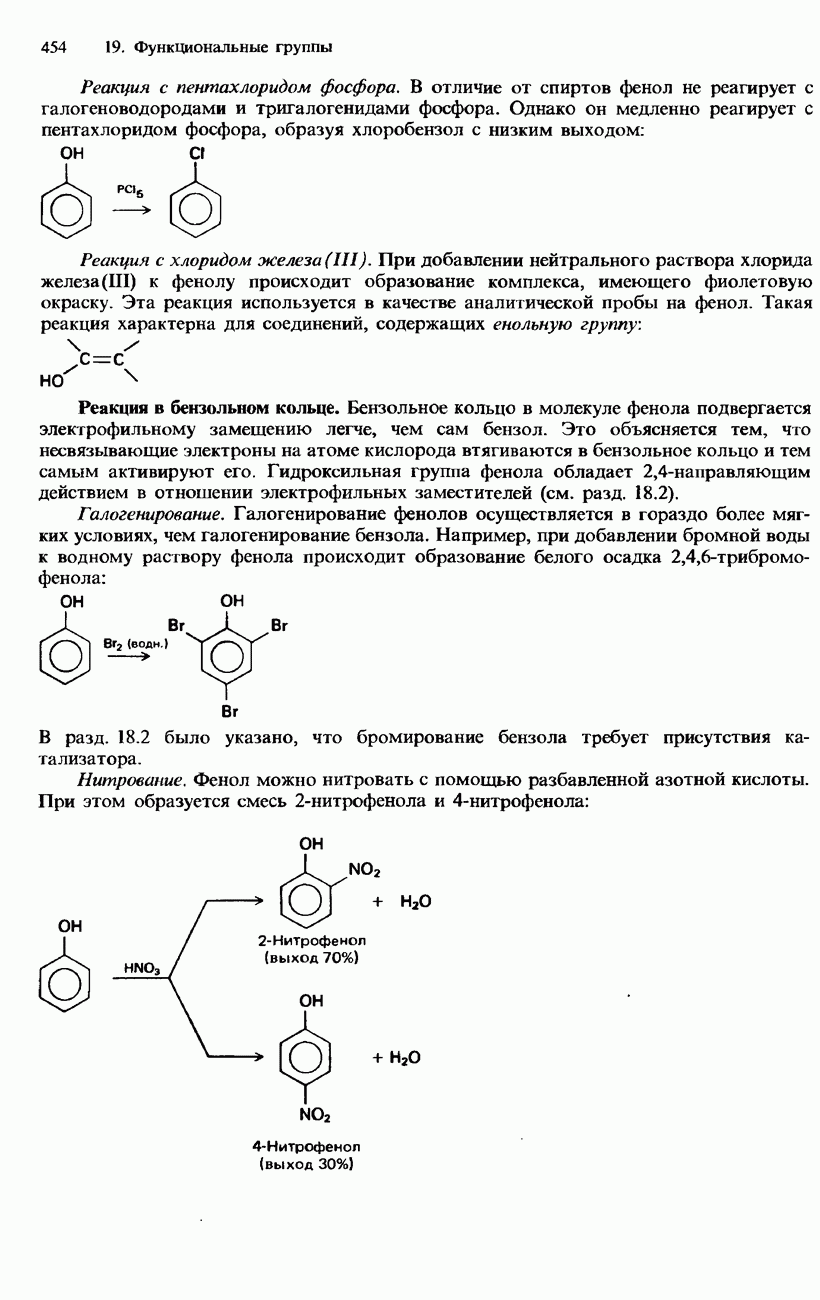
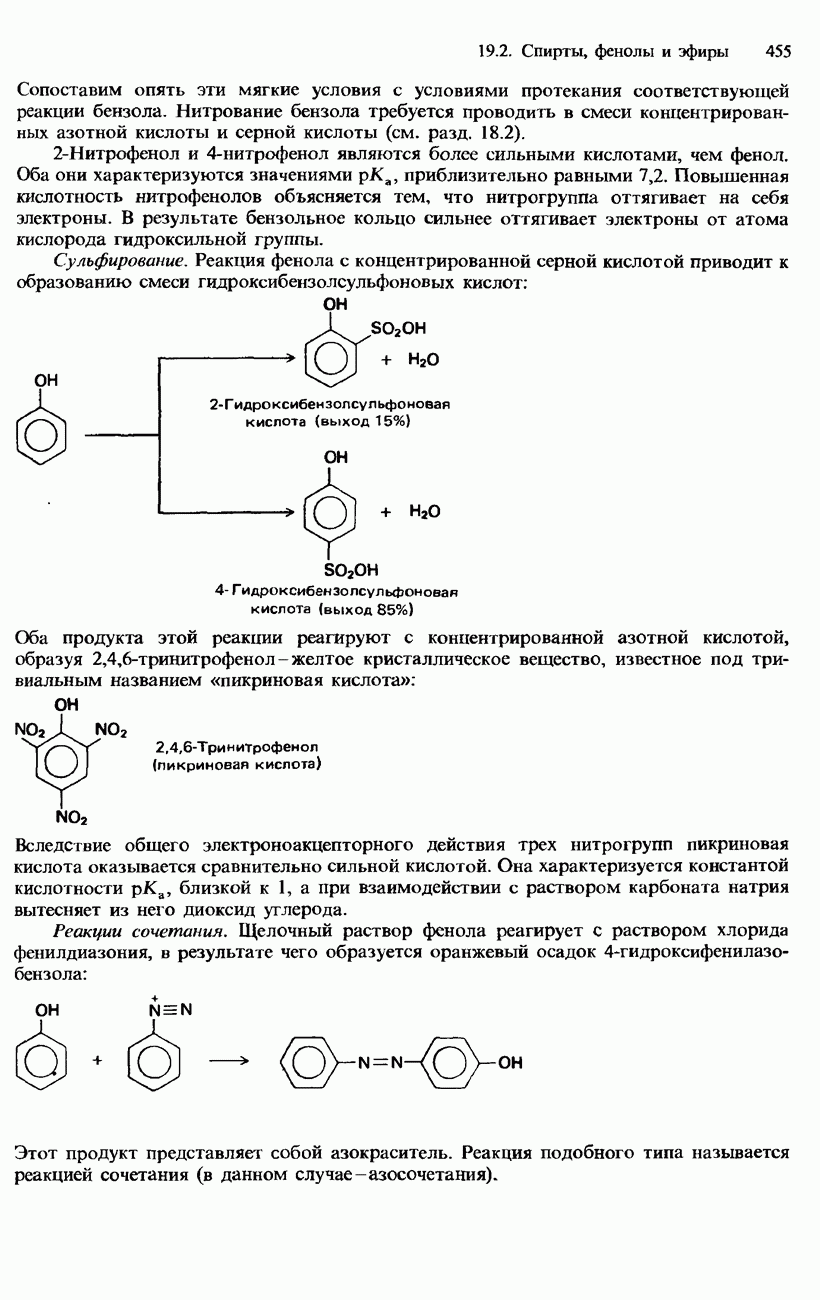
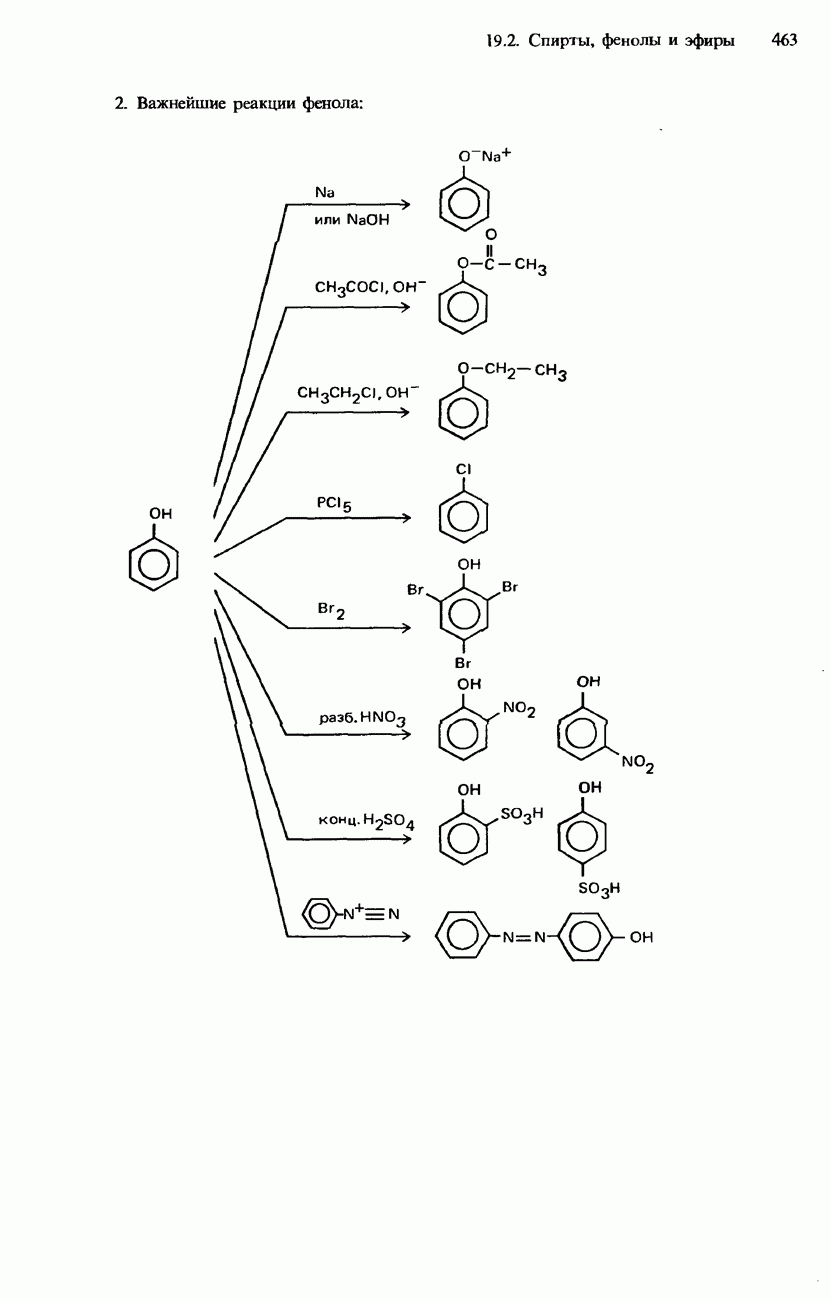
- ФЕНОЛЫ
- ПРОСТЫЕ ЭФИРЫ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ СПИРТОВ, ФЕНОЛОВ И ПРОСТЫХ ЭФИРОВ
- 19.3. Карбонильная группа
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНИЛЬНЫХ СОЕДИНЕНИЙ
- КАРБОНОВЫЕ КИСЛОТЫ
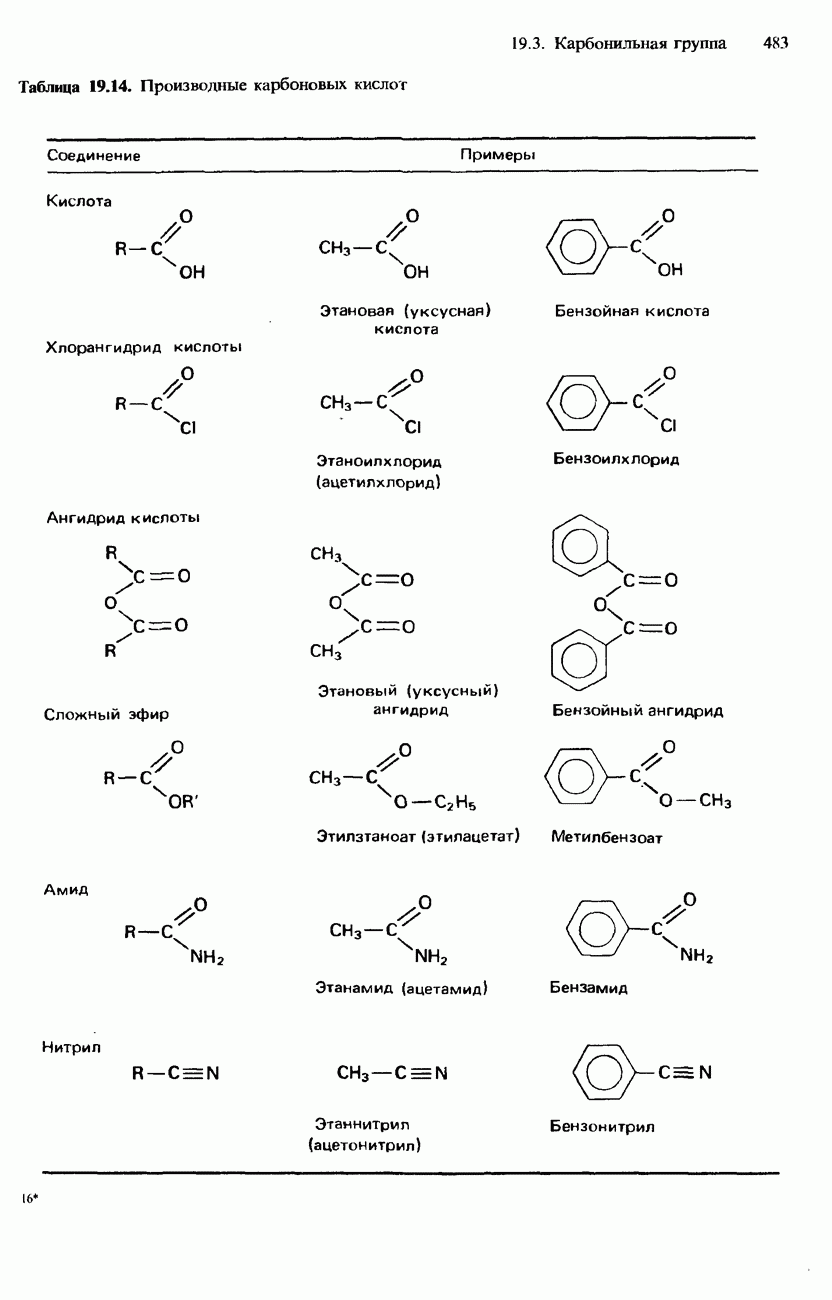
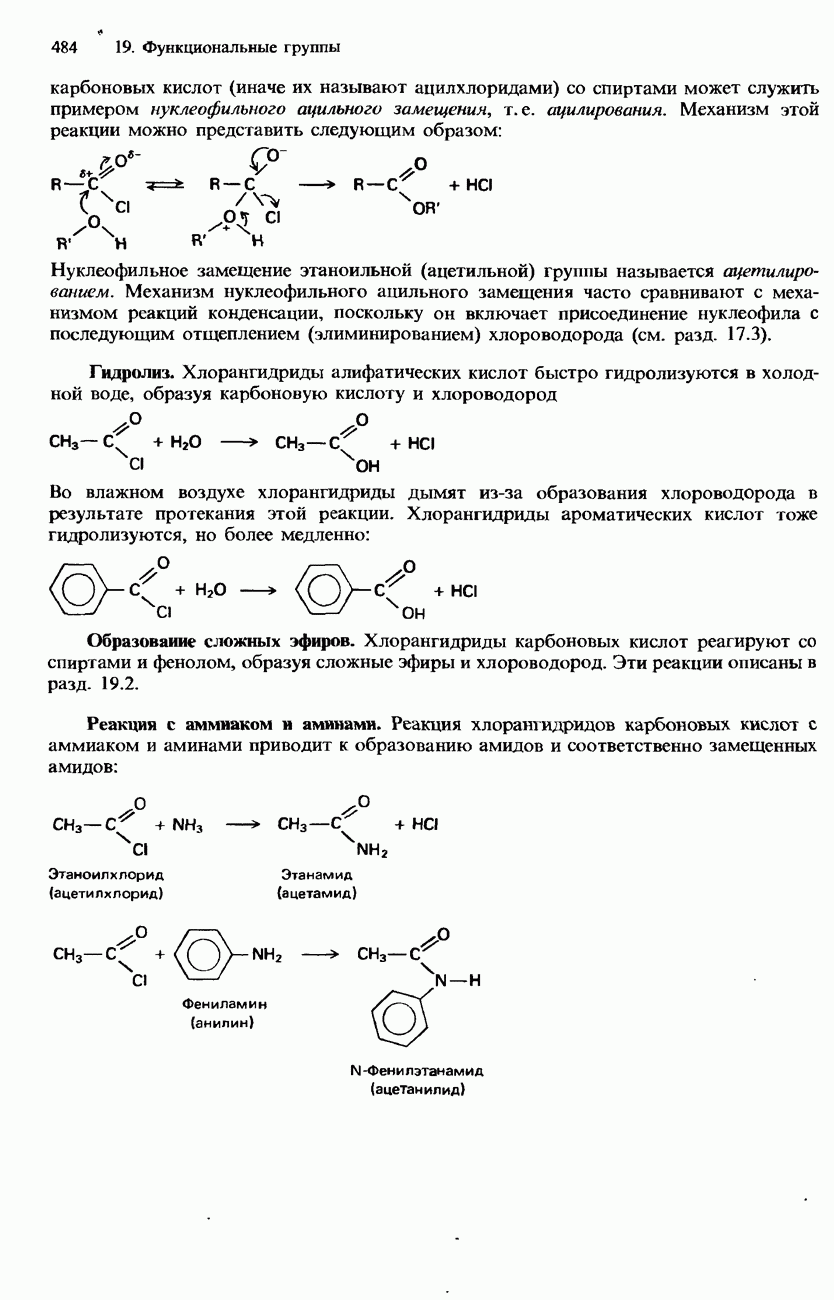
- ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ
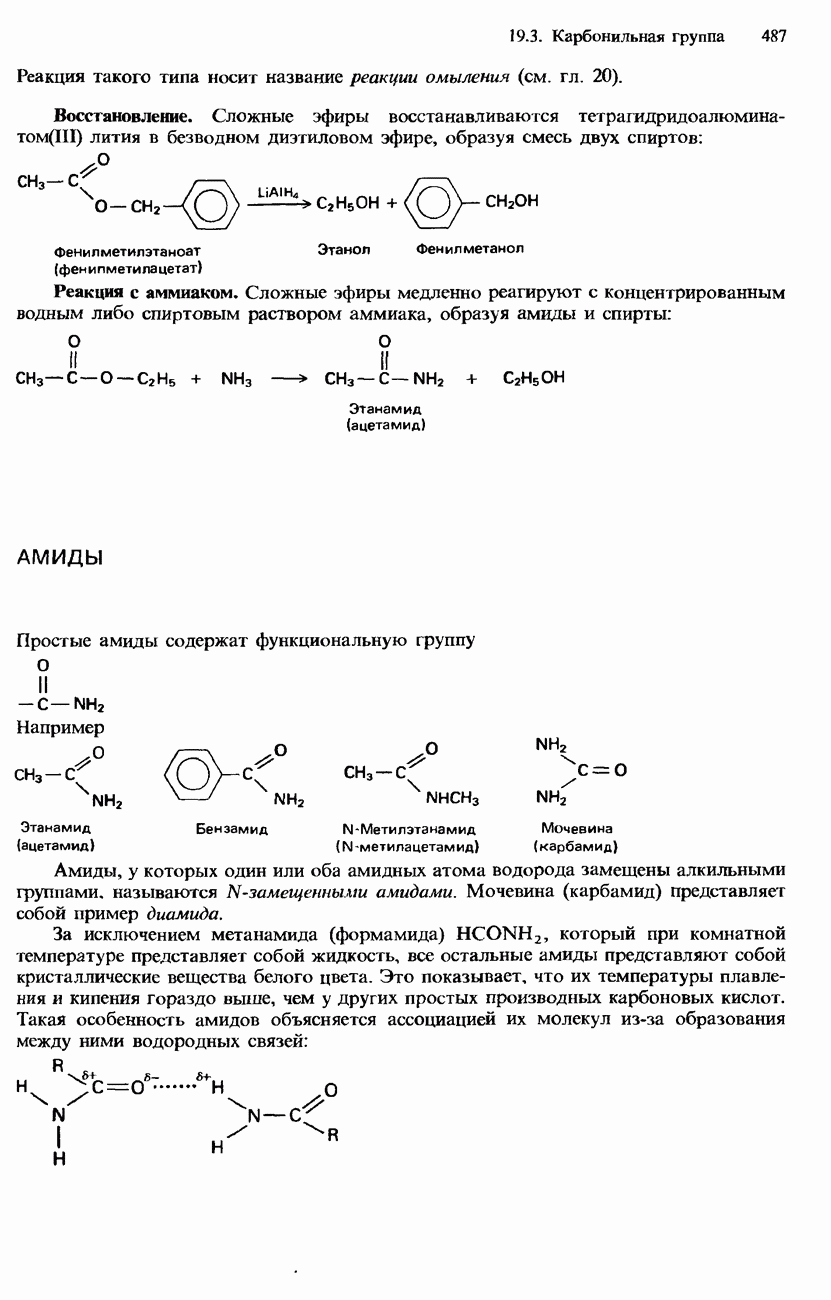
- АМИДЫ
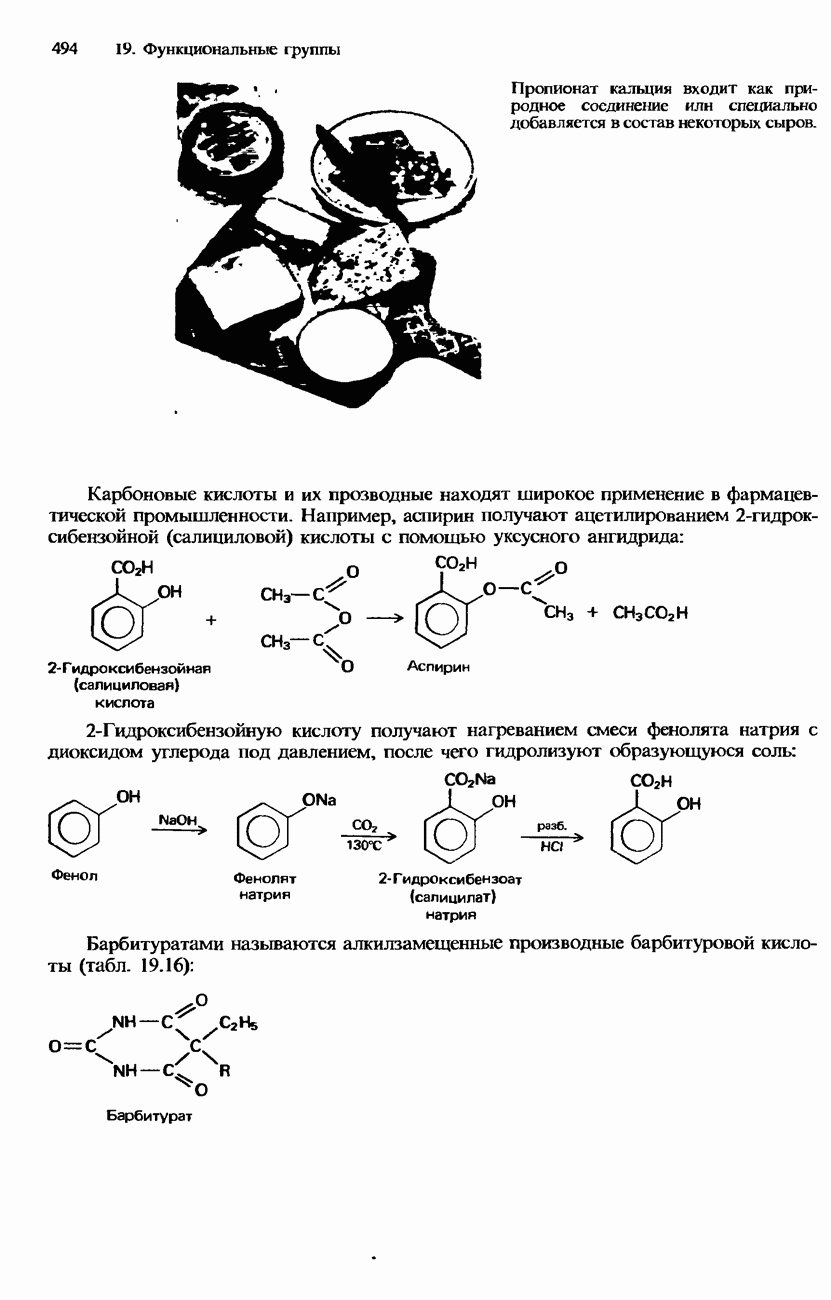
- РАСПРОСТРАНЕННОСТЬ В ПРИРОДЕ, ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ
- 19.4 Амины и родственные соединения
- СОЛИ ДИАЗОНИЯ
- ПРОМЫШЛЕННЫЕ МЕТОДЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- 20. ПРИРОДНЫЕ СОЕДИНЕНИЯ И ПОЛИМЕРЫ
- 20.1. Аминокислоты, пептиды и белки
- АМИНОКИСЛОТЫ
- ПЕПТИДЫ
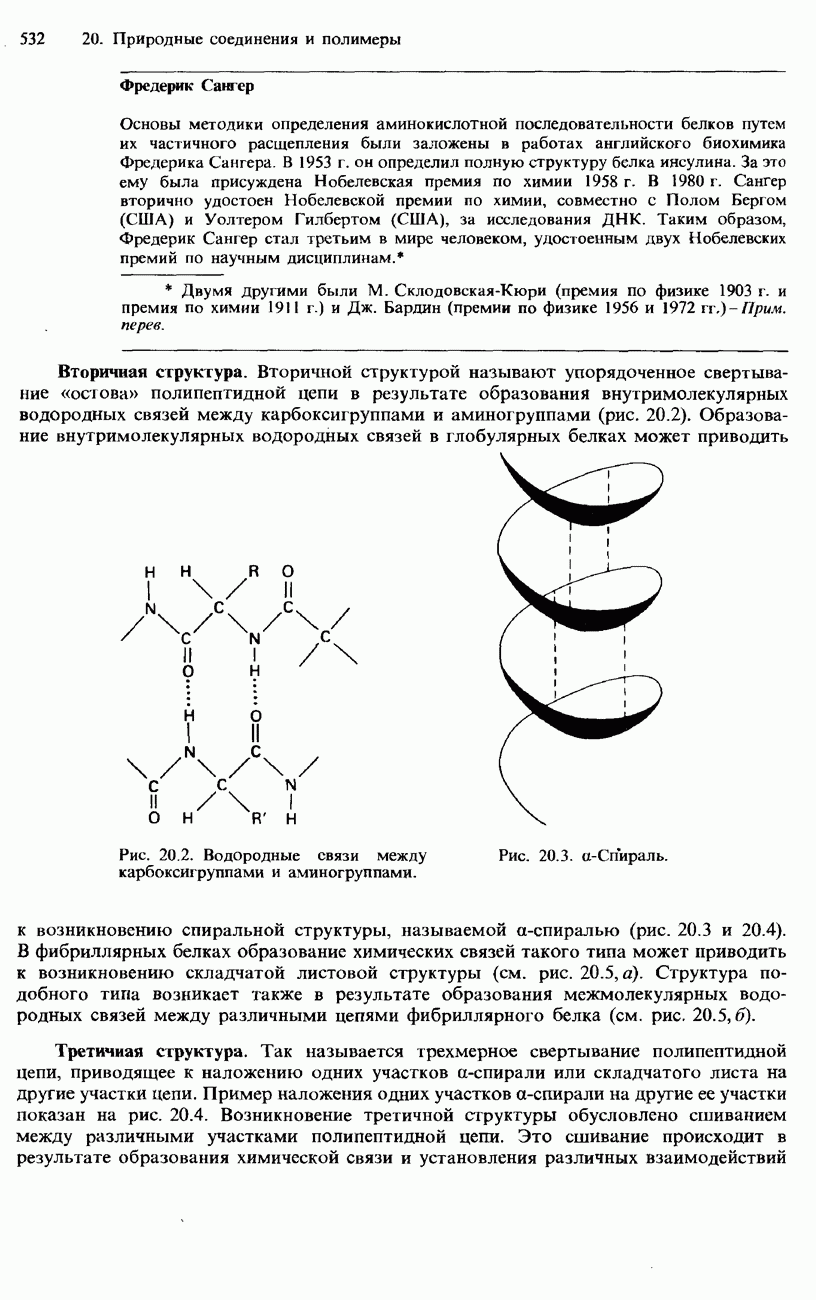
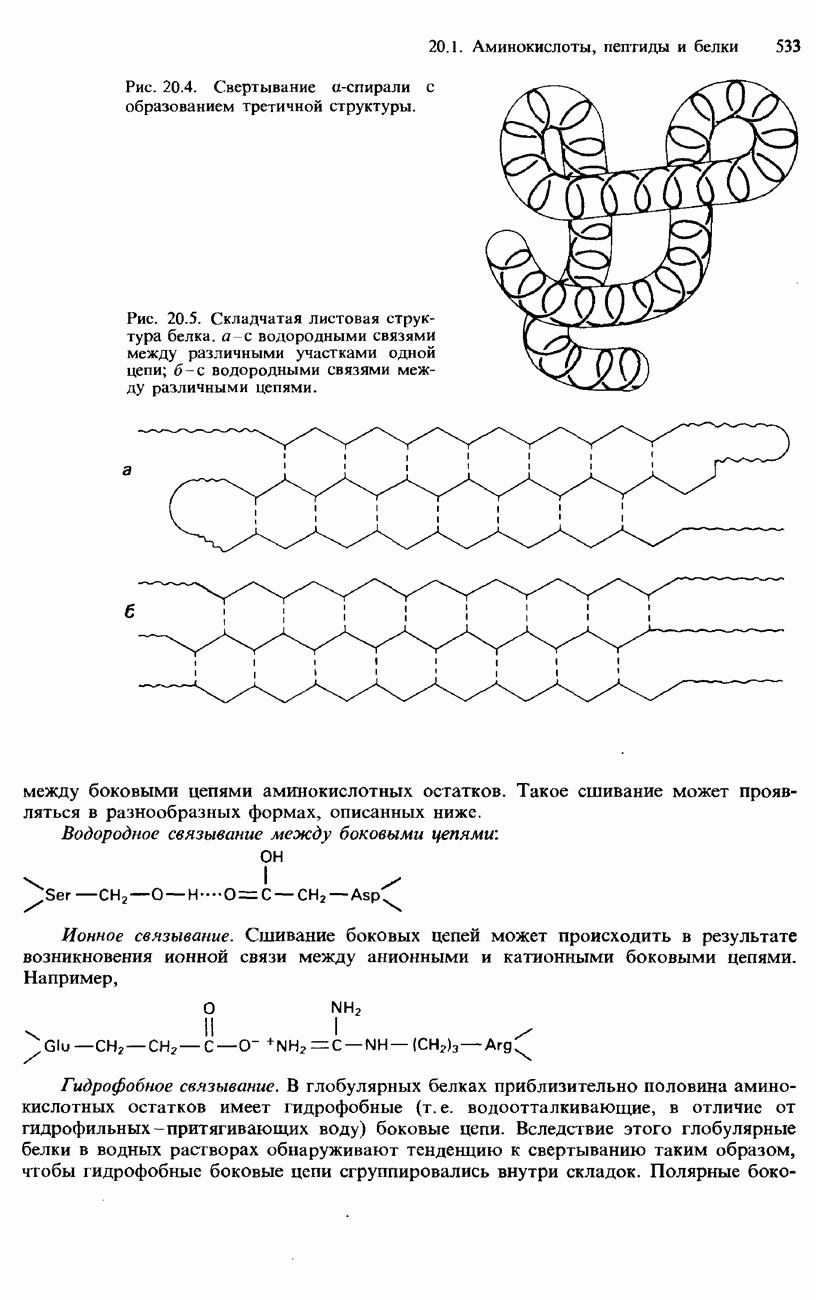
- БЕЛКИ
- 20.2. Углеводы и нуклеиновые кислоты
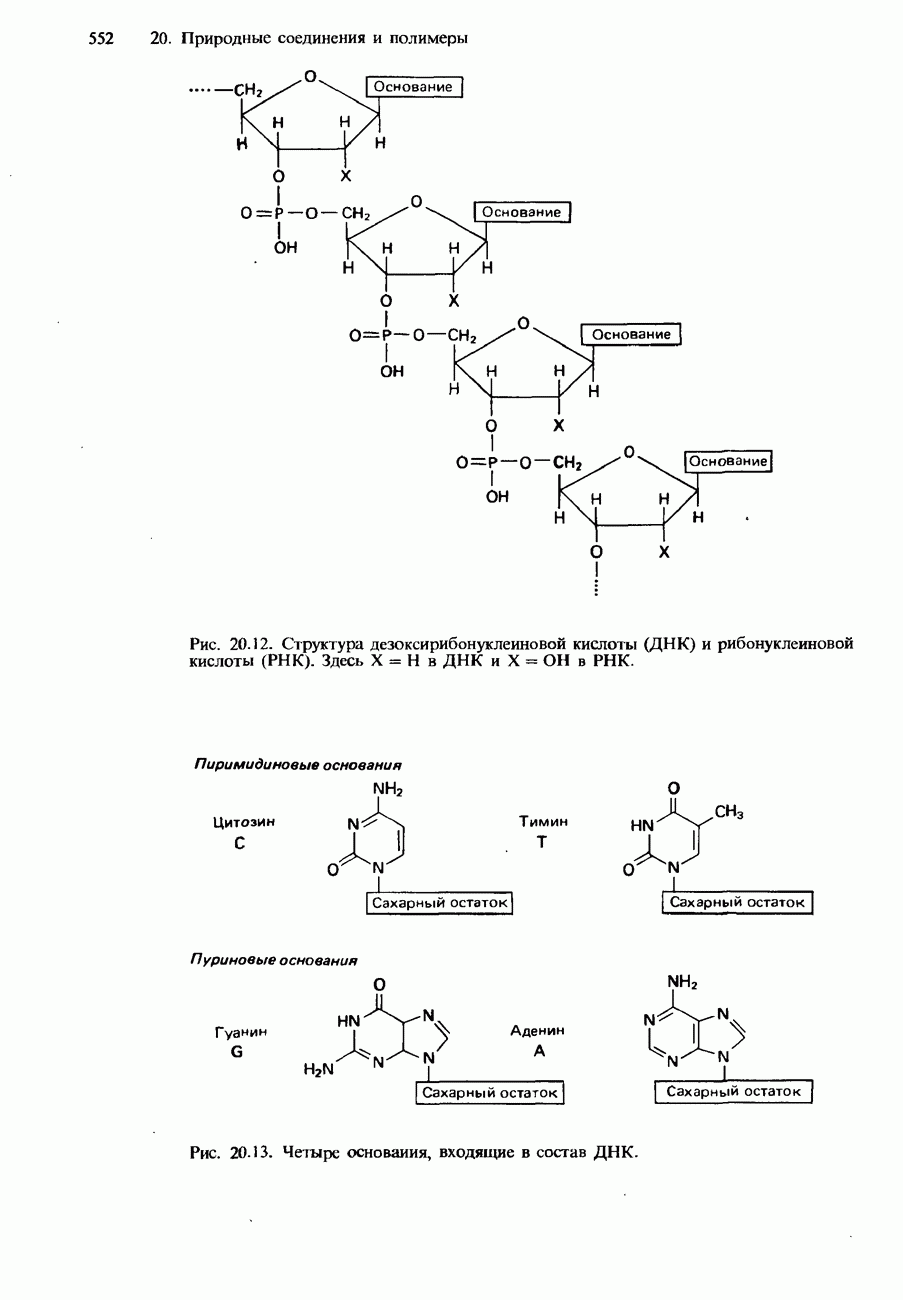
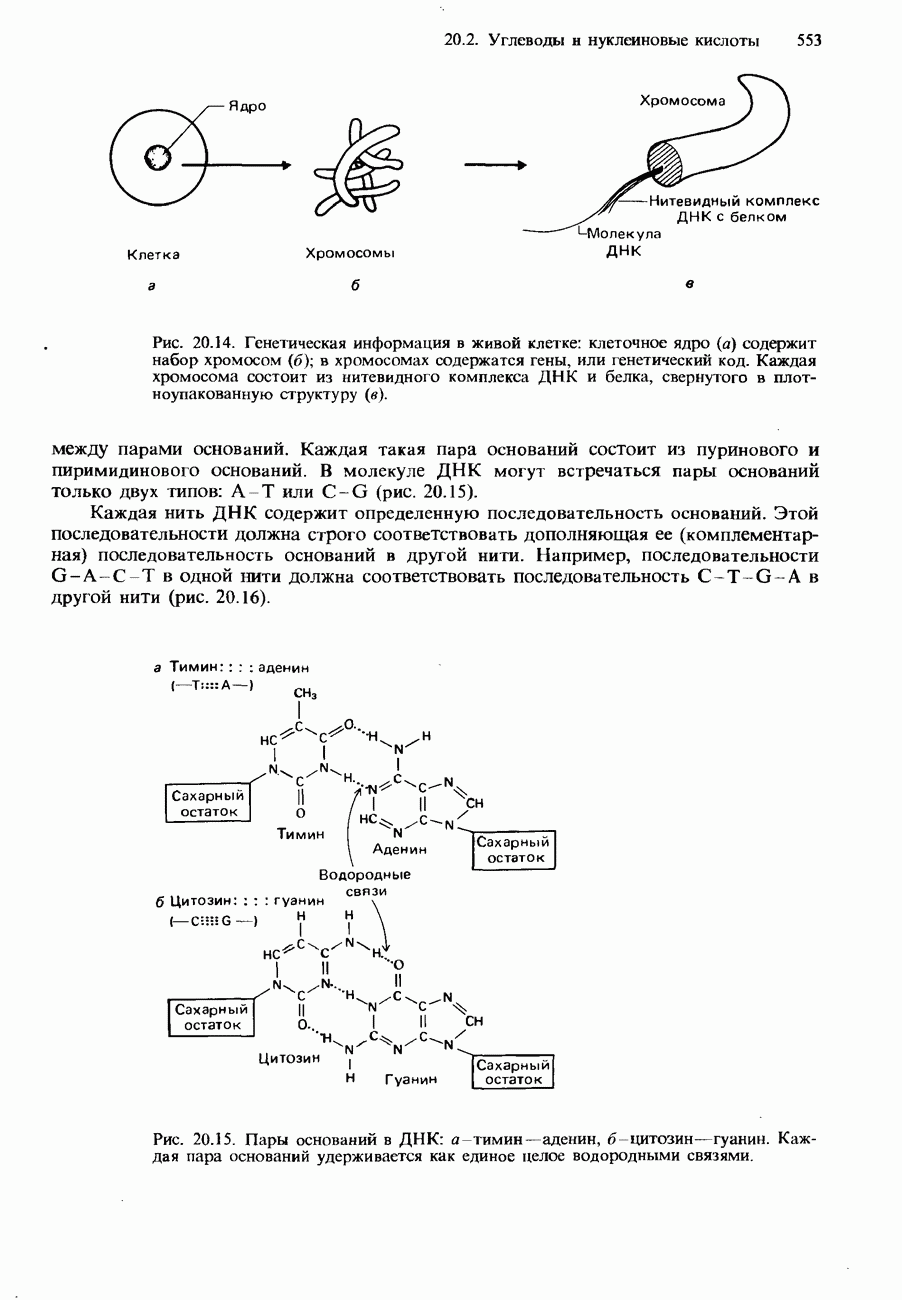
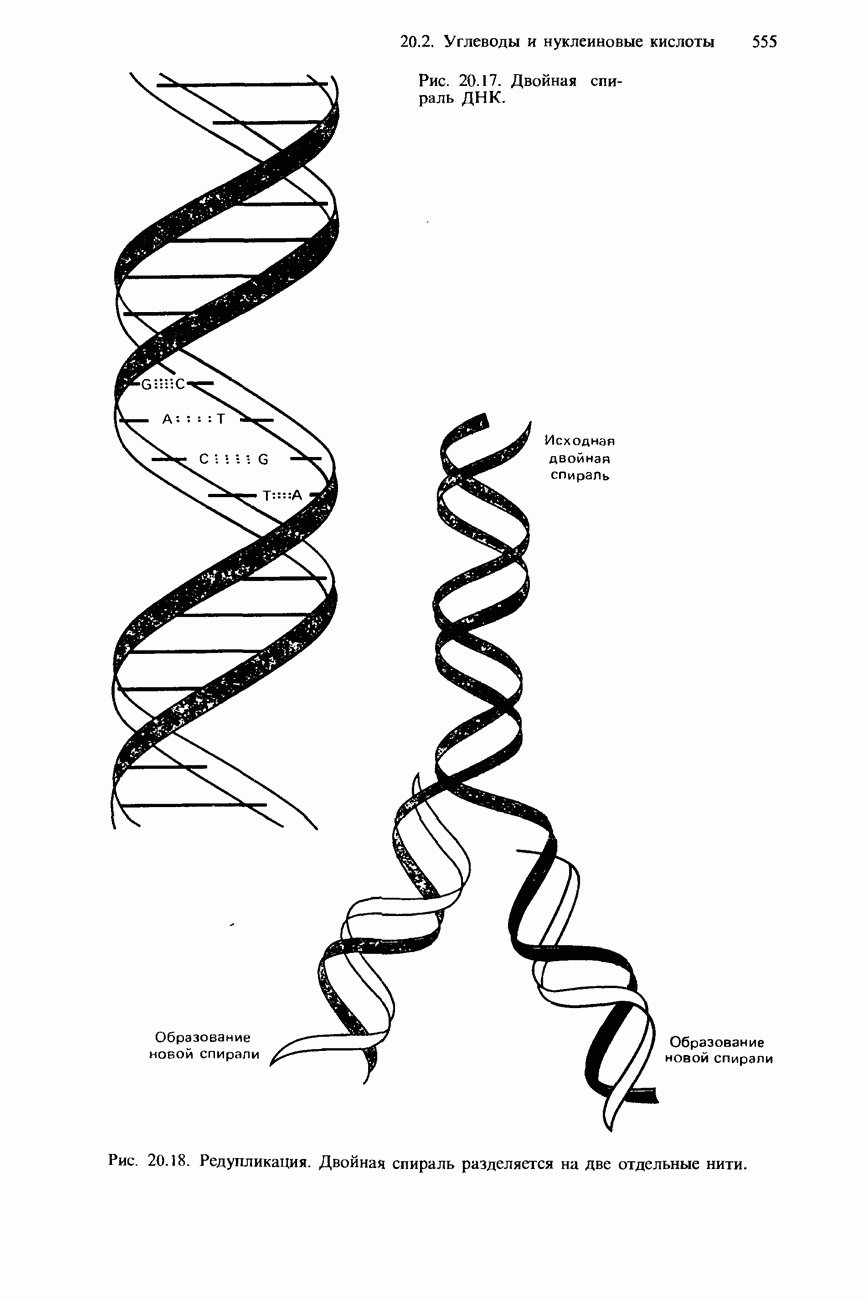
- НУКЛЕИНОВЫЕ КИСЛОТЫ
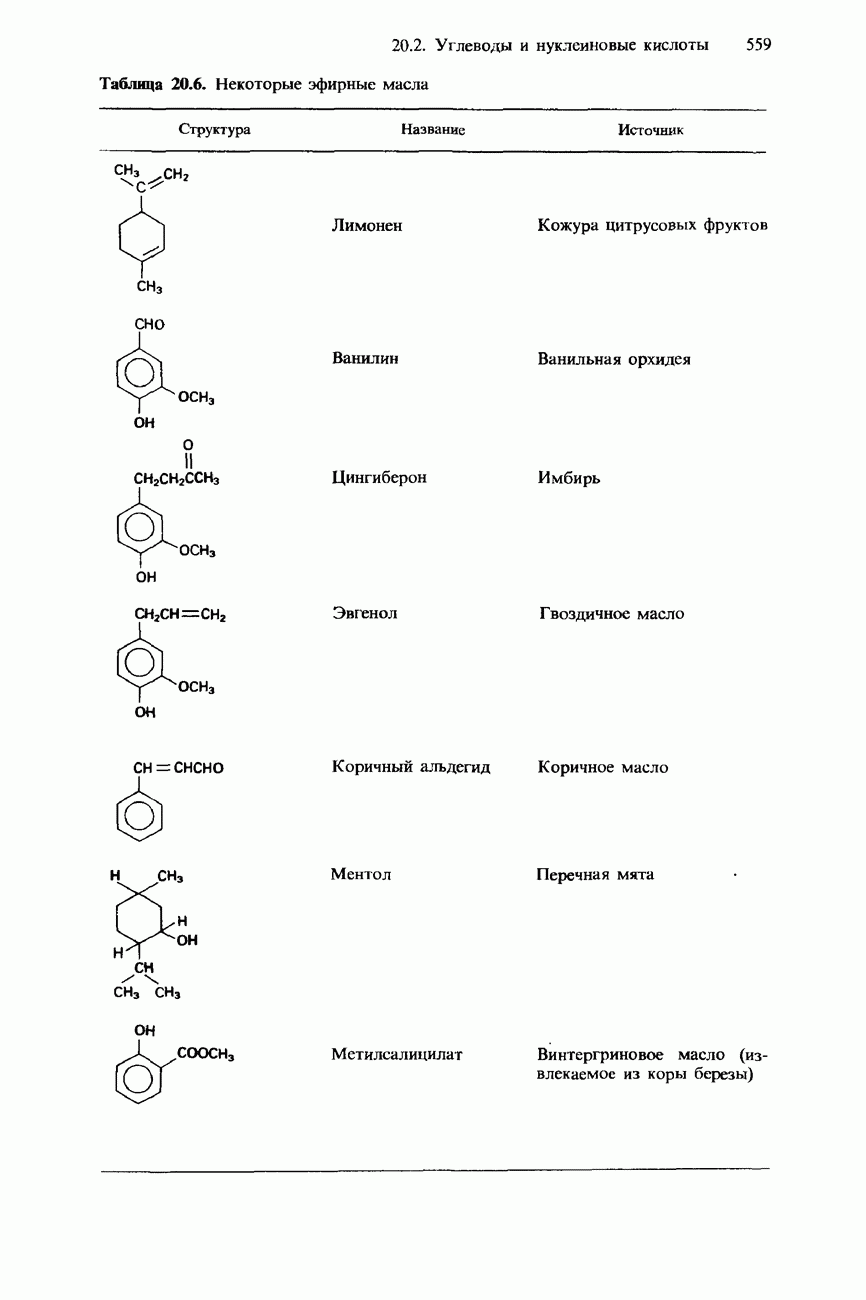
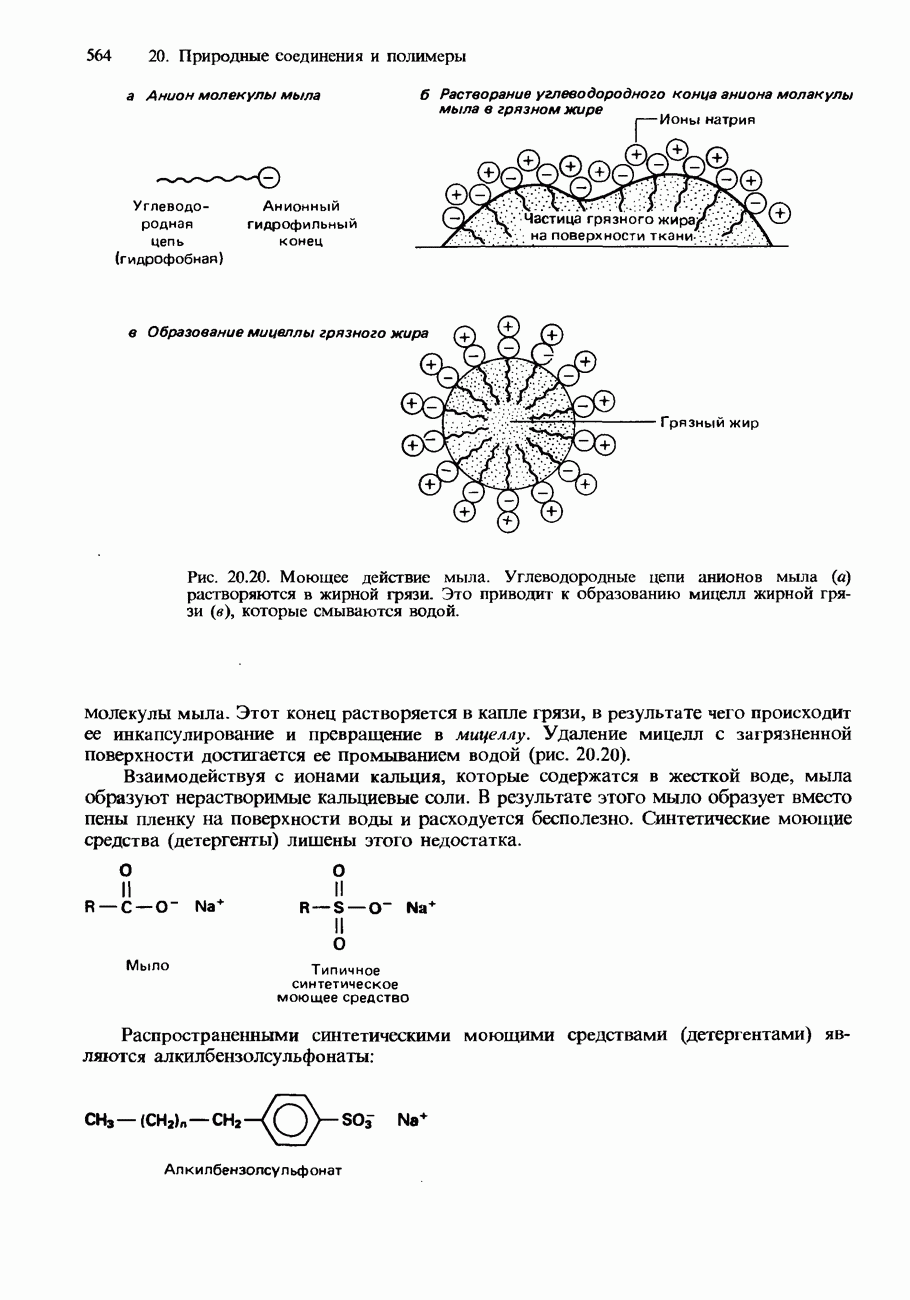
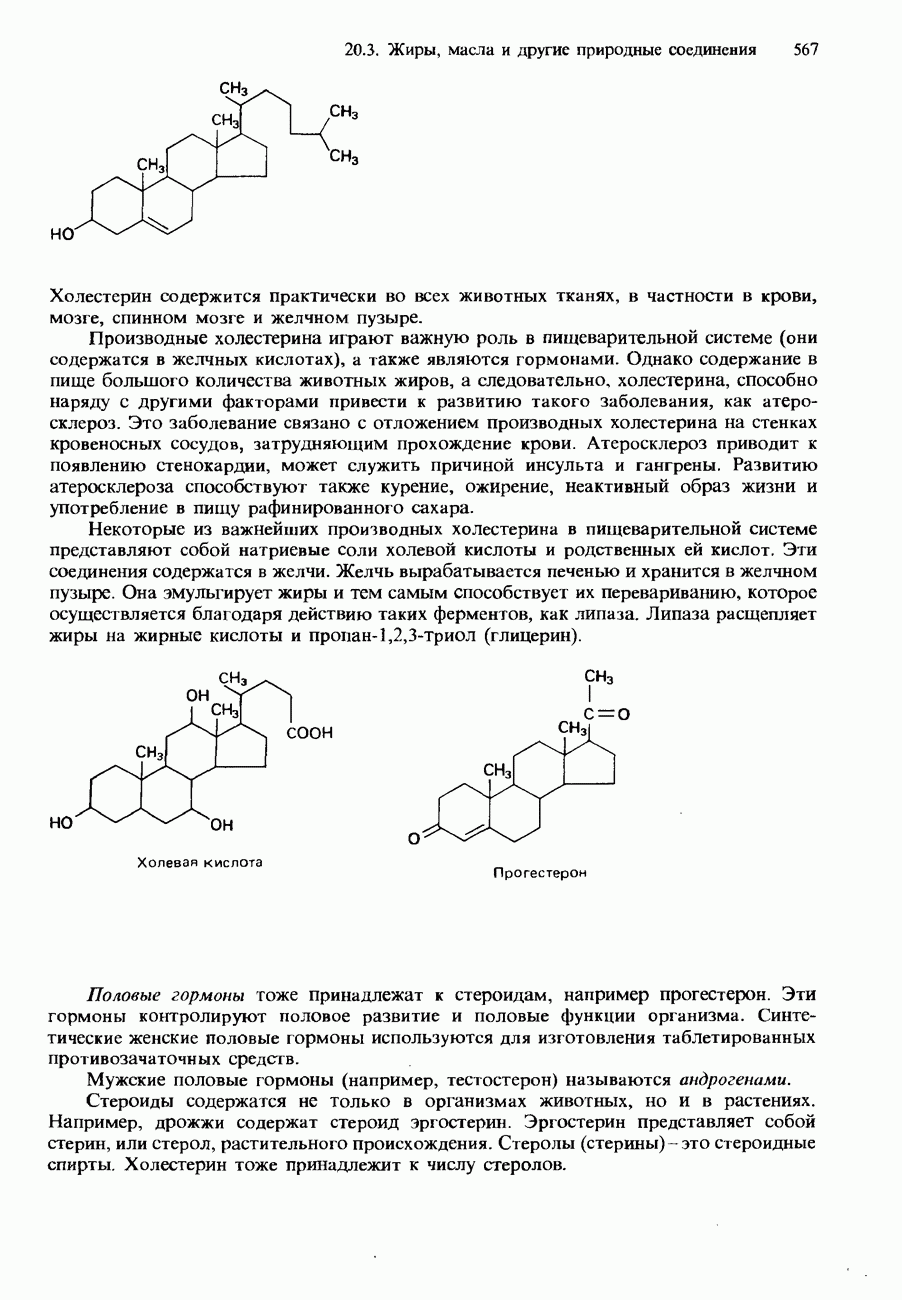
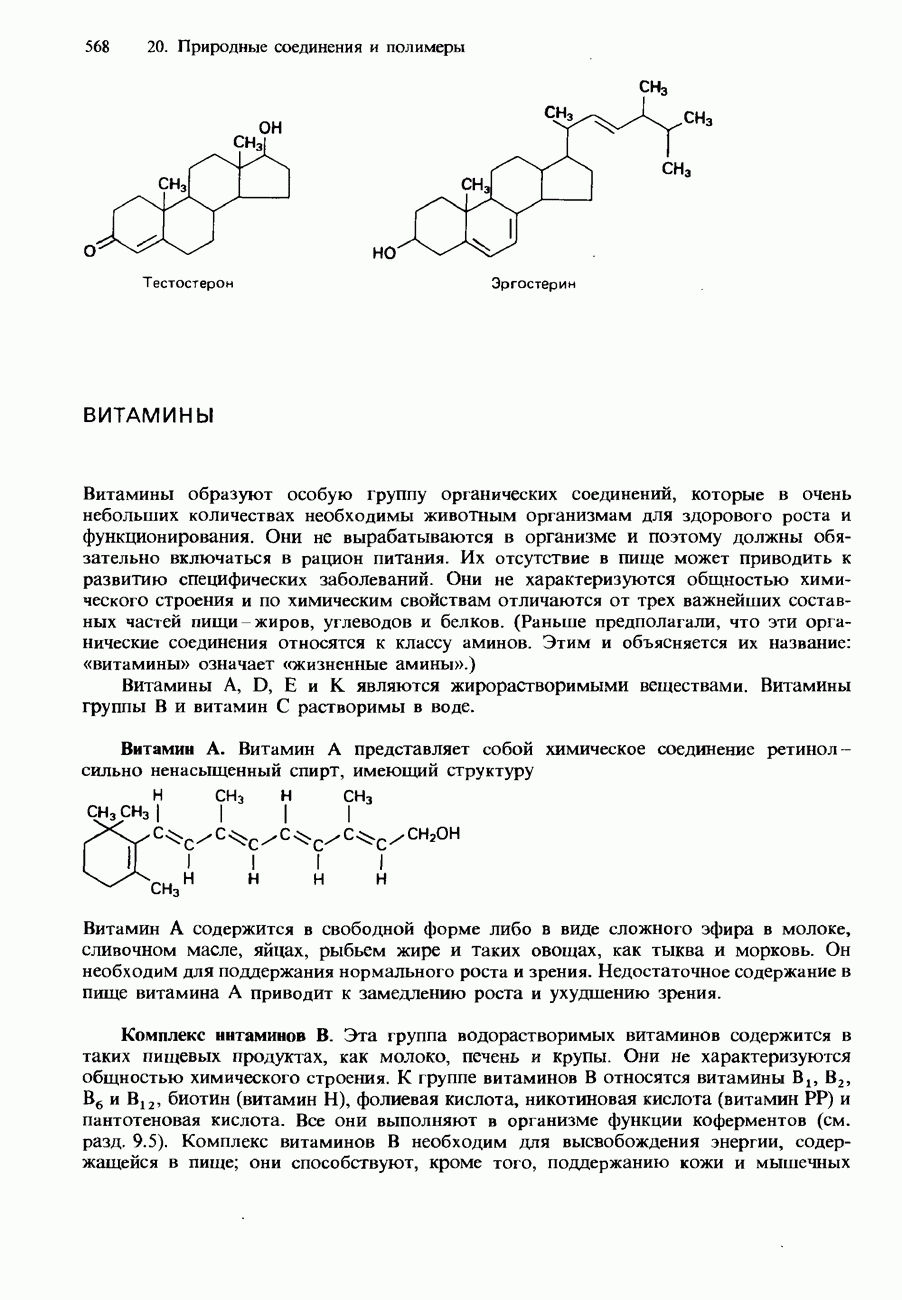
- 20.3. Жиры, масла и другие природные соединения
- ЖИРНЫЕ КИСЛОТЫ И ТРИГЛИЦЕРИДЫ
- ВОСКИ
- ФОСФОЛИПИДЫ И ГЛИКОЛИПИДЫ
- ВИТАМИНЫ
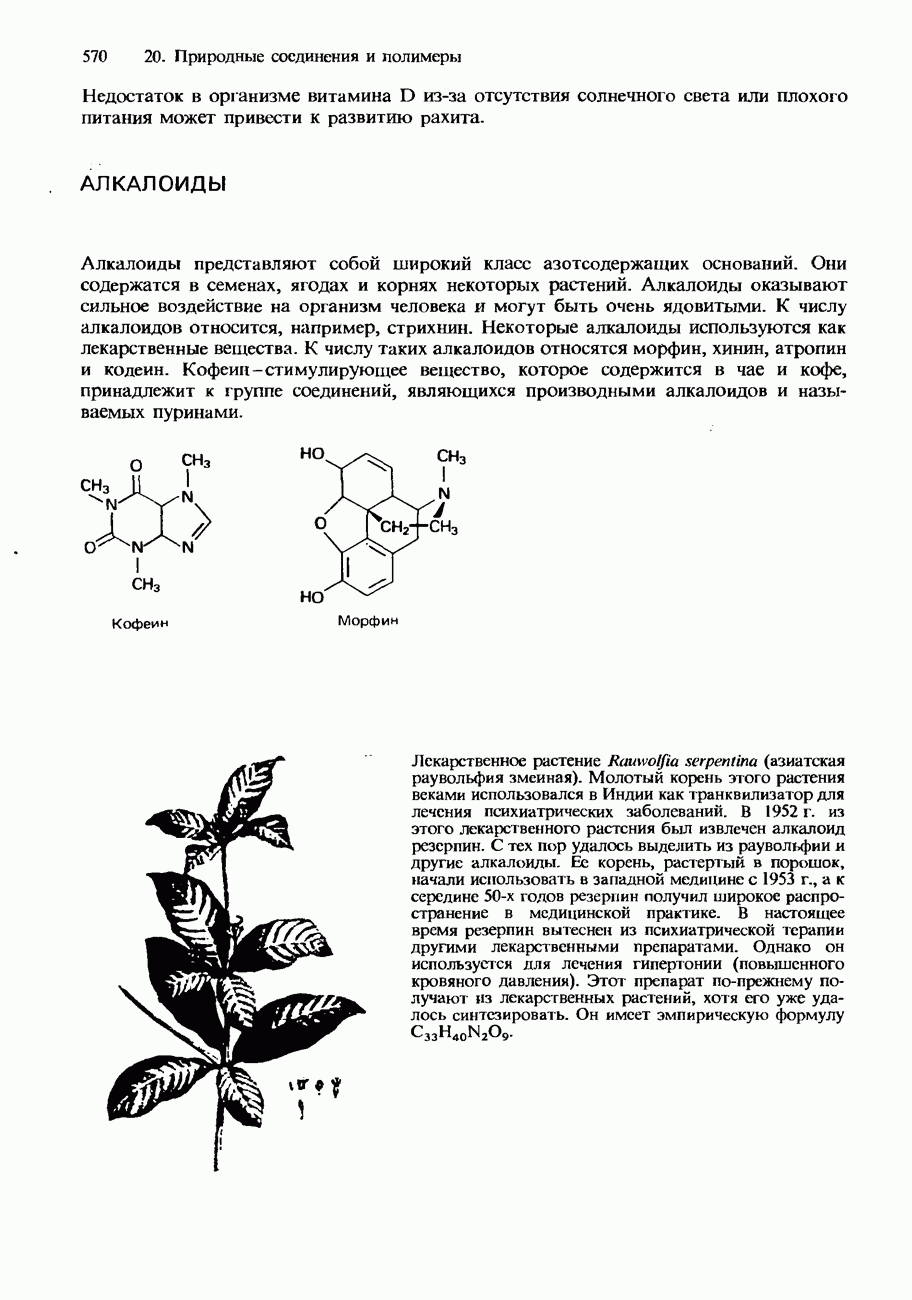
- АЛКАЛОИДЫ
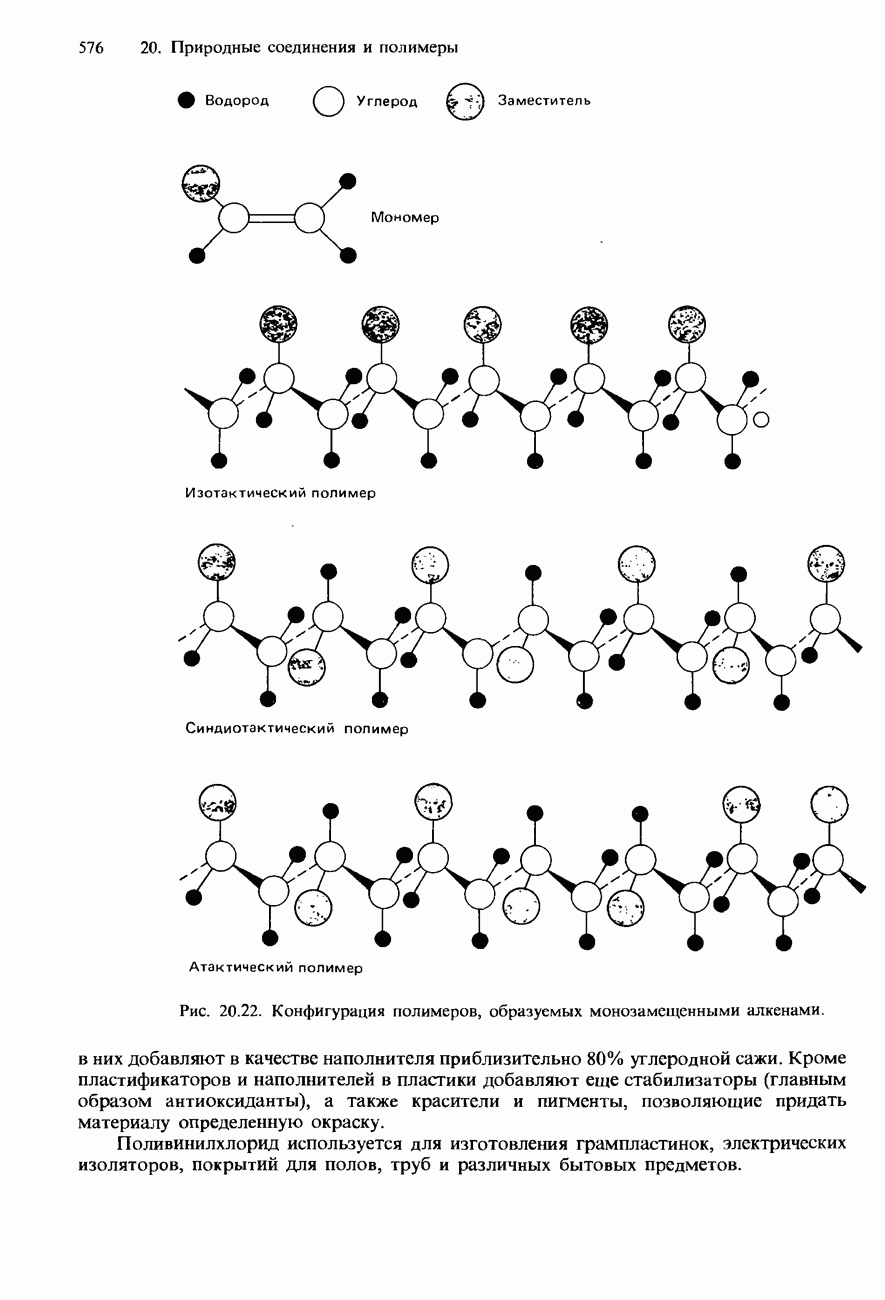
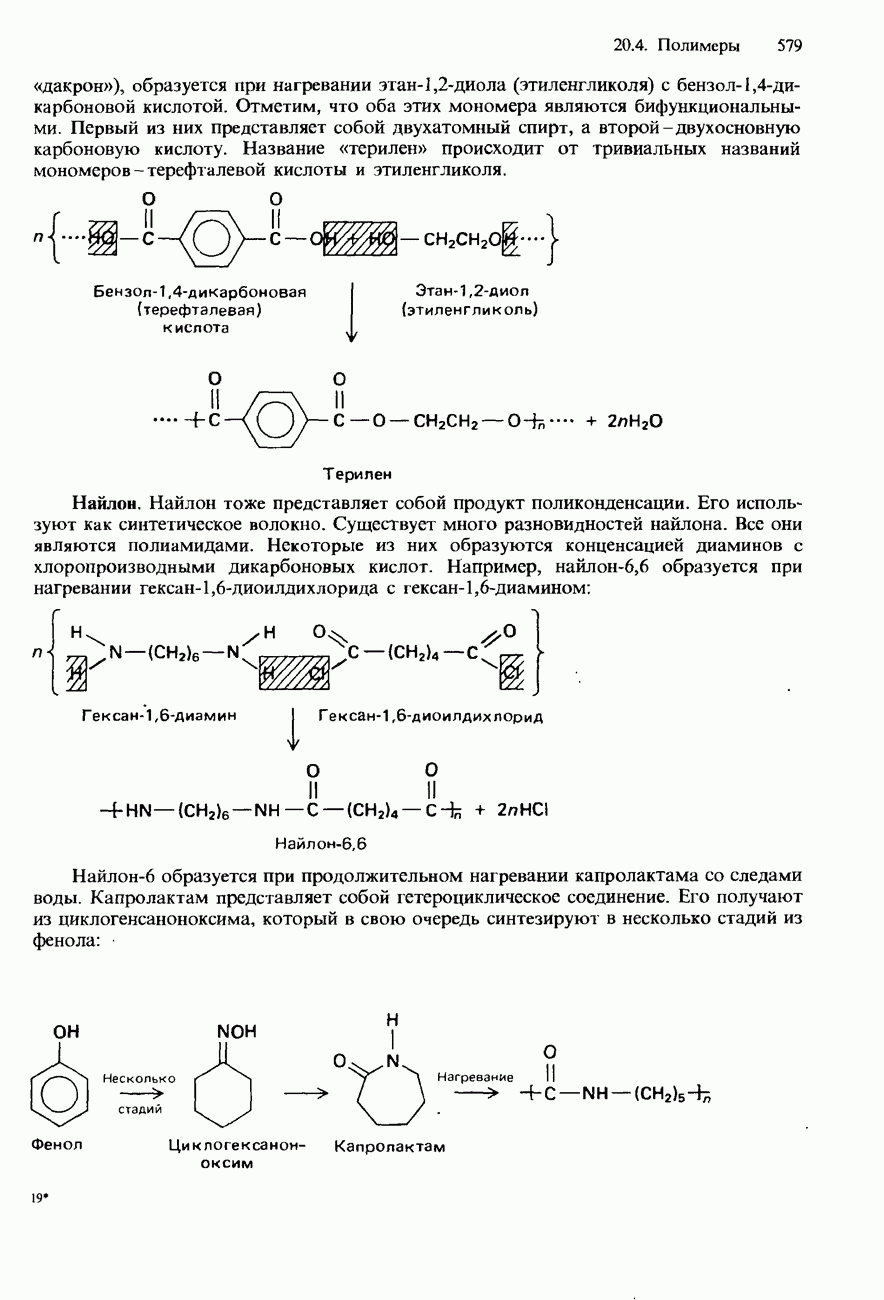
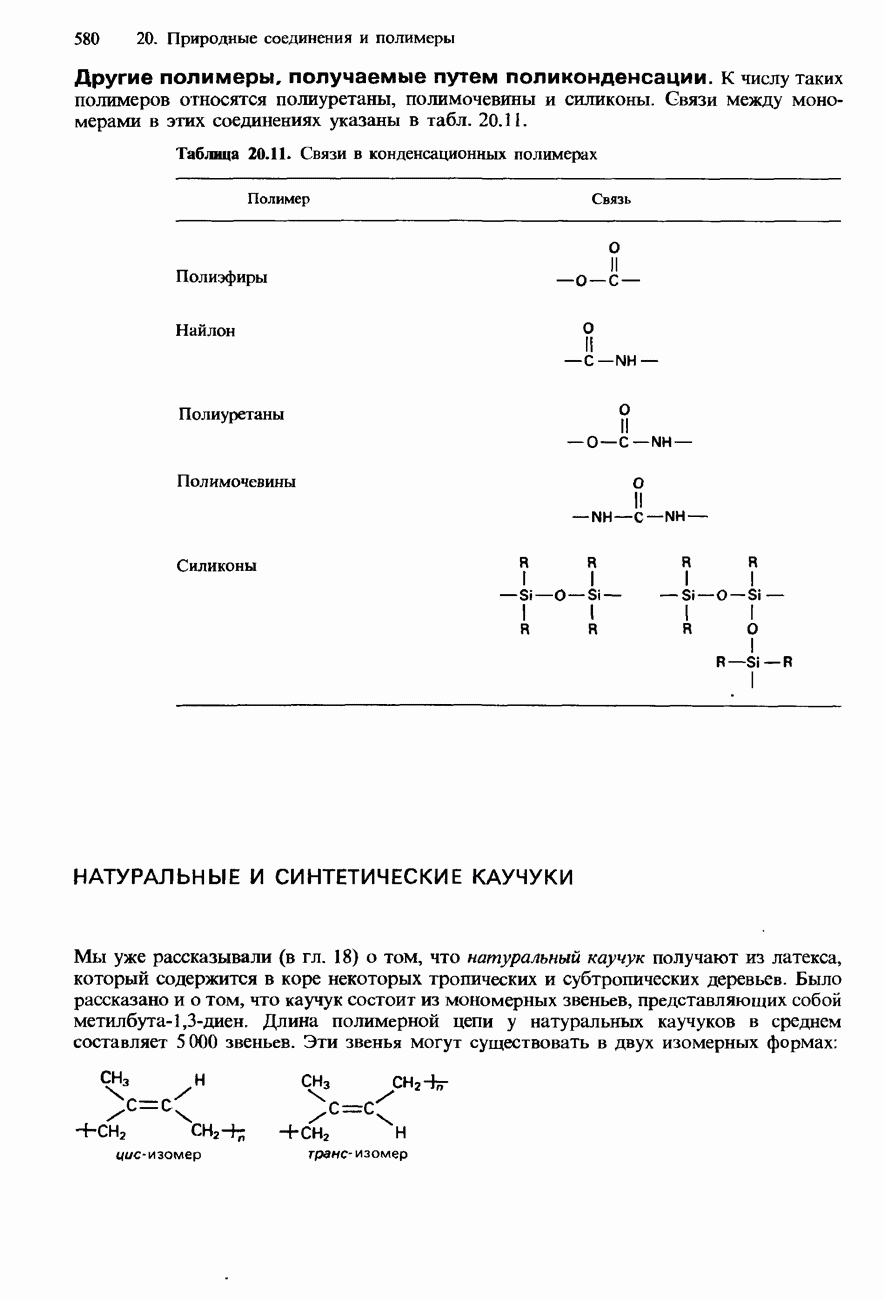
- 20.4. Полимеры
- ПОЛИМЕРИЗАЦИЯ
- НАТУРАЛЬНЫЕ И СИНТЕТИЧЕСКИЕ КАУЧУКИ
- ЦЕЛЛЮЛОЗНОЕ ВОЛОКНО
- ВОПРОСЫ ДЛЯ ПРОВЕРКИ
- ПРИЛОЖЕНИЯ